RU2157373C2 - Способ получения тетрафенилпорфина индия (iii) ацетата - Google Patents
Способ получения тетрафенилпорфина индия (iii) ацетата Download PDFInfo
- Publication number
- RU2157373C2 RU2157373C2 RU98123903A RU98123903A RU2157373C2 RU 2157373 C2 RU2157373 C2 RU 2157373C2 RU 98123903 A RU98123903 A RU 98123903A RU 98123903 A RU98123903 A RU 98123903A RU 2157373 C2 RU2157373 C2 RU 2157373C2
- Authority
- RU
- Russia
- Prior art keywords
- indium
- iii
- acetate
- tetraphenylporphine
- tetraphenylporfin
- Prior art date
Links
Images
Abstract
Изобретение относится к способам получения перспективных продуктов, например, в качестве сенсибилизаторов органических полупроводников. Синтез тетрафенилпорфина индия (III) ацетата ведут в ледяной уксусной кислоте при температуре кипения и перемешивании из эквимольных количеств тетрафенилпорфина и нанопорошка индия, полученного методом электрического взрыва проволоки в инертном газе. Технический результат - упрощение процесса и увеличение выхода основного продукта. 1 табл.
Description
Изобретение относится к способу получения тетрафенилпорфина индия (III) ацетата (ТФПInCH3COO), аналог которого хлорфталоцианин хлориндия известен как сенсибилизатор органических полупроводников [Appl. phys. hell 46 (2), январь 1985 г., p. 196-197, M. Kato, Y. Nishioka, K. Kaifu, K. Kawamura, S. Ohno].
Известен способ, по которому октаэтилпорфин индия (III) гидроксида (ОЭПInOH) получают из октаэтилпорфина (ОЭП) индия (III) хлорида в среде диметилформамида (ДМФА) при нагревании до 180-190oC в течение 4-6 часов. Выход 80% [J.H. Fuhrhop and K.M. Smith.- In: Porphyrins and metalloporphyrins./ Ed. K.M. Smith Amsterdam etc.: Elsever, 1975, p. 797].
Недостатками этого метода является высокая температура, длительность процесса и низкий выход конечного продукта.
Известен также способ получения тетрафенилпорфина индия (III) хлорида (ТФПInCl) из тетрафенилпорфина (ТФП) и InCl3 в феноле в течение 2-х часов [Ломова Т.Н., Березин Б.Д. Успехи в химии комплексных соединений порфиринов с высокозарядными катионами p-, d- и f-металлов. Координационная химия, 1993, Т. 19, N3, стр. 173].
По этому способу наряду с основным продуктом в больших количествах (≈ 50%) образуется примесь тетрафенилхлорина индия (III) хлорида (ТФХInCl), что затрудняет очистку основного продукта.
Задачей предлагаемого изобретения является разработка способа получения тетрафенилпорфина индия (III) ацетата (ТФПInCH3COO), позволяющего снизить температуру, сократить время реакции и увеличить выход основного продукта.
Технический результат достигается тем, что синтез ТФПInCH3COO ведут в ледяной уксусной кислоте при t = 118oC в течение 10 мин при взаимодействии эквимольных количеств нанопорошка (НП) индия, полученного методом электрического взрыва в среде азота или аргона, с ТФП, причем НП индия предварительно диспергируют на ультразвуковом диспергаторе в среде ледяной уксусной кислоты в течение 1 минуты.
Способ подтверждается следующими примерами.
Пример 1. К 0,12 г (0,001 моль) нанопорошка индия с Sуд= 4,5 м2•г, полученного методом электрического взрыва проводника в атмосфере азота, добавляют 20 мл ледяной уксусной кислоты. Смесь перемешивают, используя ультразвуковой диспергатор, в течение 1 мин. Нагревают до t = 118oC и при постоянном перемешивании добавляют 0,3 г (0,0005 моль) ТФП. Синтез ведут 10 мин до исчезновения полос поглощения ТФП в электронном спектре поглощения реакционной смеси.
Реакционную смесь охлаждают до комнатной температуры, экстрагируют полученный продукт хлороформом. Очистку продукта реакции проводят хроматографированием растворов комплексов на Al2O3, сушат при 50oC. Выход продукта 95%.
Пример 2. К 0,12 г (0,001 моль) нанопорошка индия с Sуд= 2,0 м2•г, полученного методом электрического взрыва проводника в атмосфере аргона, добавляют 20 мл ледяной уксусной кислоты. Смесь перемешивают, используя ультразвуковой диспергатор в течение 1 мин. Нагревают до t = 119oC и при постоянном перемешивании добавляют 0,3 г (0,0005 моль) ТФП. Синтез ведут 10 мин до исчезновения полос поглощения ТФП в электронном спектре поглощения реакционной смеси.
Реакционную смесь охлаждают до комнатной температуры, экстрагируют полученный продукт хлороформом. Очистку комплексов проводят хроматографированием растворов комплексов на Al2O3, сушат при 50oC. Выход продукта 95%.
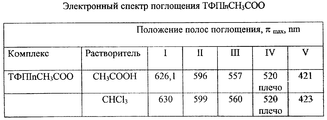
Положение полос электронного спектра поглощения (ЭСП) ТФПInCH3COO (см. таблицу) находится в соответствии с положением полос электронного спектра поглощения ЭСП ТФПInCl [Ломова Т.Н., Березин Б.Д. Успехи в химии комплексных соединений порфиринов с высокозарядными катионами p-, d- и f-металлов. Координационная химия, 1993, т. 19, N 3, с. 178].
Спектр полученного ТФПInCH3COO идентичен по количеству и положению частот колебаний литературным данным для тетрафенилпорфинов металлов [Г.Н. Гуринович, А. Н. Севченко, К.Н. Соловьев. Спектроскопия хлорофилла и родственных соединений, Минск, 1968, стр. 80-113].
Предлагаемый способ позволяет сократить время реакции в 10-12 раз и повысить выход конечного продукта.
Claims (1)
- Способ получения тетрафенилпорфина индия (III) ацетата, отличающийся тем, что нанопорошок индия, полученный методом электрического взрыва проволоки в инертном газе, диспергируют в ледяной уксусной кислоте, полученную смесь нагревают до температуры кипения уксусной кислоты и подвергают взаимодействию с эквимольным количеством тетрафенилпорфина при перемешивании.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU98123903A RU2157373C2 (ru) | 1998-12-29 | 1998-12-29 | Способ получения тетрафенилпорфина индия (iii) ацетата |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU98123903A RU2157373C2 (ru) | 1998-12-29 | 1998-12-29 | Способ получения тетрафенилпорфина индия (iii) ацетата |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU98123903A RU98123903A (ru) | 2000-09-27 |
| RU2157373C2 true RU2157373C2 (ru) | 2000-10-10 |
Family
ID=20214130
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU98123903A RU2157373C2 (ru) | 1998-12-29 | 1998-12-29 | Способ получения тетрафенилпорфина индия (iii) ацетата |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2157373C2 (ru) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1991010667A1 (fr) * | 1990-01-10 | 1991-07-25 | Cis Bio International | Derives de porphyrine et metalloporphyrines eventuellement couples a une molecule biologiquement active, et composition pharmaceutique les contenant |
| EP0811626A1 (en) * | 1996-06-04 | 1997-12-10 | Roche Diagnostics GmbH | Use of metallo-porphyrin conjugates for the detection of biological substances |
-
1998
- 1998-12-29 RU RU98123903A patent/RU2157373C2/ru active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1991010667A1 (fr) * | 1990-01-10 | 1991-07-25 | Cis Bio International | Derives de porphyrine et metalloporphyrines eventuellement couples a une molecule biologiquement active, et composition pharmaceutique les contenant |
| EP0811626A1 (en) * | 1996-06-04 | 1997-12-10 | Roche Diagnostics GmbH | Use of metallo-porphyrin conjugates for the detection of biological substances |
Non-Patent Citations (1)
| Title |
|---|
| ЛОМОВА Т.Н., БЕРЕЗИН Б.Д. Успехи в синтезе комплексных соединений порфиринов с высокозарядными катионами р-, d- и f-металлов. - Координационная химия, 1993, т.19, N 3, с.171 - 184. ЛОМОВА Т.Н., МОЖЖУХИНА Е.Г. и др. Состояние и механизмы диссоциации смешанолигандных ацидопорфириновых комплексов металлов в сернокислых растворах. - Общая химия, т.59, вып.10, с.2317. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Erdman et al. | Synthesis and properties of porphyrin vanadium complexes1 | |
| Chakraborti et al. | Zirconium (IV) chloride as a new, highly efficient, and reusable catalyst for acetylation of phenols, thiols, amines, and alcohols under solvent-free conditions | |
| Garner et al. | Preparation and characterization of chromium (II) molybdenum (II) tetraacetate. A compound containing a heteronuclear quadruple metal-metal bond | |
| KR870000311B1 (ko) | 6-알파-브로모-및 6,6-디브로모-페니실란산 1,1-디옥시드류의 제조방법 | |
| Mathias et al. | Simple syntheses of 1, 3-bis (perfluoroacyl) azulenes and 1, 3-azulenedicarboxylic acid | |
| RU2157373C2 (ru) | Способ получения тетрафенилпорфина индия (iii) ацетата | |
| Bag et al. | Bis-pocket porphyrins without meso-substituents: Tetramethyltetra (2, 4, 6-triisopropylphenyl) porphyrin I and tetramethyltetraterphenylporphyrin I | |
| JPS59212495A (ja) | 1,2,3,4−シクロブタンテトラカルボン酸−1,2「い」3,4−ジ無水物の製造方法 | |
| Kaźmierczak et al. | Application of α-Amino-β-fluorophosphonates in Construction of their Dipeptide Analogues | |
| Akcamur et al. | A Simple Synthesis of Some Novel Oxime Ethers | |
| RU2079499C1 (ru) | Способ получения комплексного соединения алюминия с тетракраунфталоцианином | |
| EP0410727A1 (en) | Processes for removing allyl groups | |
| Yashunsky et al. | Synthesis of meso-monosubstituted ethane-and trans-ethylenebis (porphyrins) | |
| CN115716799A (zh) | 有机硼氢化金属试剂还原制备顺式手性-3-氟-4-羟基哌啶及其衍生物的方法 | |
| SU507239A3 (ru) | Способ получени 2-гидразинобензотиазолов | |
| Kislyi et al. | Synthesis of α-functional nitro compounds by the nitration of activated carbonyl compounds in a two-phase system | |
| Ozawa et al. | Reactions of acyl (carbonyl) ruthenium (II) and acyl (carbonyl) iron (II) complexes with amines. Preparation of novel propionyl (carbamoyl) ruthenium (II) complexes | |
| SU1684284A1 (ru) | Способ получени оксифенилзамещенных порфиринов | |
| Zlotin et al. | Synthesis of 3, 4: 7, 8: 11, 12-trifurazano-1, 2, 5, 6, 9, 10-hexaazacyclododeca-1, 3, 5, 7, 9, 11-hexaene-1, 5, 9-trioxide | |
| JPH02111747A (ja) | 炭素13標識5‐アミノレブリン酸及びその誘導体の製造方法 | |
| Morozova et al. | Porphyrins. 40. Chemistry of oximes of metal complexes of meso-formyloctaalkylporphyrins. Synthesis, molecular and crystal structure of nickel complexes of “tripyrrolylisoxazoles” | |
| Lakhvich et al. | Stereochemistry of the hydrocyanation of hydroxypiperidin-4-ones | |
| Dziegielewski et al. | Preparation and spectroscopic characterization of [Re (NO) 2X2LL2](X= Cl, Br, I; L2= 2PPh3, dppe). application of [Re (NO) 2BBr2LL2] in oxidation of olefins | |
| Chou et al. | Bicyclo [2.2. 2] octene‐Based Molecular Tweezers and Cyclophanes | |
| JPS5921855B2 (ja) | マロン酸ジエステル類の製法 |