KR910004941B1 - 파라핀 및 시클릭 탄화수소를 포함하는 원료 스트림의 이성질체화 및 고리개방을 위한 이중 작용성 공정 - Google Patents
파라핀 및 시클릭 탄화수소를 포함하는 원료 스트림의 이성질체화 및 고리개방을 위한 이중 작용성 공정 Download PDFInfo
- Publication number
- KR910004941B1 KR910004941B1 KR1019880016789A KR880016789A KR910004941B1 KR 910004941 B1 KR910004941 B1 KR 910004941B1 KR 1019880016789 A KR1019880016789 A KR 1019880016789A KR 880016789 A KR880016789 A KR 880016789A KR 910004941 B1 KR910004941 B1 KR 910004941B1
- Authority
- KR
- South Korea
- Prior art keywords
- reaction zone
- weight
- isomerization
- feed stream
- hydrocarbons
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10G—CRACKING HYDROCARBON OILS; PRODUCTION OF LIQUID HYDROCARBON MIXTURES, e.g. BY DESTRUCTIVE HYDROGENATION, OLIGOMERISATION, POLYMERISATION; RECOVERY OF HYDROCARBON OILS FROM OIL-SHALE, OIL-SAND, OR GASES; REFINING MIXTURES MAINLY CONSISTING OF HYDROCARBONS; REFORMING OF NAPHTHA; MINERAL WAXES
- C10G45/00—Refining of hydrocarbon oils using hydrogen or hydrogen-generating compounds
- C10G45/58—Refining of hydrocarbon oils using hydrogen or hydrogen-generating compounds to change the structural skeleton of some of the hydrocarbon content without cracking the other hydrocarbons present, e.g. lowering pour point; Selective hydrocracking of normal paraffins
- C10G45/60—Refining of hydrocarbon oils using hydrogen or hydrogen-generating compounds to change the structural skeleton of some of the hydrocarbon content without cracking the other hydrocarbons present, e.g. lowering pour point; Selective hydrocracking of normal paraffins characterised by the catalyst used
- C10G45/62—Refining of hydrocarbon oils using hydrogen or hydrogen-generating compounds to change the structural skeleton of some of the hydrocarbon content without cracking the other hydrocarbons present, e.g. lowering pour point; Selective hydrocracking of normal paraffins characterised by the catalyst used containing platinum group metals or compounds thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C5/00—Preparation of hydrocarbons from hydrocarbons containing the same number of carbon atoms
- C07C5/22—Preparation of hydrocarbons from hydrocarbons containing the same number of carbon atoms by isomerisation
- C07C5/2206—Catalytic processes not covered by C07C5/23 - C07C5/31
- C07C5/226—Catalytic processes not covered by C07C5/23 - C07C5/31 with metals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C5/00—Preparation of hydrocarbons from hydrocarbons containing the same number of carbon atoms
- C07C5/02—Preparation of hydrocarbons from hydrocarbons containing the same number of carbon atoms by hydrogenation
- C07C5/13—Preparation of hydrocarbons from hydrocarbons containing the same number of carbon atoms by hydrogenation with simultaneous isomerisation
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10G—CRACKING HYDROCARBON OILS; PRODUCTION OF LIQUID HYDROCARBON MIXTURES, e.g. BY DESTRUCTIVE HYDROGENATION, OLIGOMERISATION, POLYMERISATION; RECOVERY OF HYDROCARBON OILS FROM OIL-SHALE, OIL-SAND, OR GASES; REFINING MIXTURES MAINLY CONSISTING OF HYDROCARBONS; REFORMING OF NAPHTHA; MINERAL WAXES
- C10G35/00—Reforming naphtha
- C10G35/04—Catalytic reforming
- C10G35/06—Catalytic reforming characterised by the catalyst used
- C10G35/085—Catalytic reforming characterised by the catalyst used containing platinum group metals or compounds thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2521/00—Catalysts comprising the elements, oxides or hydroxides of magnesium, boron, aluminium, carbon, silicon, titanium, zirconium or hafnium
- C07C2521/02—Boron or aluminium; Oxides or hydroxides thereof
- C07C2521/04—Alumina
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2523/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group C07C2521/00
- C07C2523/38—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group C07C2521/00 of noble metals
- C07C2523/40—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group C07C2521/00 of noble metals of the platinum group metals
- C07C2523/42—Platinum
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S585/00—Chemistry of hydrocarbon compounds
- Y10S585/929—Special chemical considerations
- Y10S585/94—Opening of hydrocarbon ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Crystallography & Structural Chemistry (AREA)
- Production Of Liquid Hydrocarbon Mixture For Refining Petroleum (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
Abstract
내용 없음.
Description
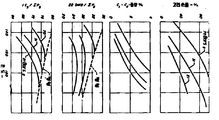
제 1 도 및 제 2 도는 반응온도의 함수로 구성된 본 발명의 공정에 대한 실행 변수들의 그래프이다.
본 발명은 저급 파라핀의 이성질체화 및 시클릭 탄화수소 고리의 개방후 얻어진 비고리형 생성물을 이성질체화 하여 이소파라핀 탄화수소내에 고농도의 고급 옥탄 생성물 스트림을 만드는 과정을 동시에 달성할 수 있는 신규의 이중 작용성 공정에 관한 것이다.
현재 가솔린 엔진에는 고급 옥탄 가솔린이 사용된다. 먼저 다양한 납함유 첨가제를 사용하여 옥탄수를 개선시키는 작업이 이룩되었다. 납이 환경 요인으로 인해 가솔린으로부터 제거됨에 따라 높은 옥탄 비율을 달성시키기 위해 가솔린 혼합물중에 사용된 탄화수소의 구조를 재 배열한 필요가 증가되고 있다. 촉매 재형성 및 촉매 이성질체화가 이런 개량을 위해 광범위하게 사용되는 두가지 공정이다.
가솔린 혼합 푸울은 C4및 대기압에서 205℃(395℉) 이하의 비등점을 갖는 고급 탄화수소를 포함한다. 이 범위의 탄화수소는 C4-C6파라핀을 포함하며 특히 비교적 낮은 옥탄수를 갖는 C5및 C6파라핀을 포함한다. C4-C6탄화수소는 납 첨가로 인한 옥탄 개량에 가장 큰 민감성을 나타내며, 이 방법에 의해 제일 먼저 개량된다. 옥탄 개량은 또한 파라핀성 탄화수소를 촉매적으로 개량화하여 파라핀성 탄화수소의 구조를 측쇄된 파라핀으로 재 배열하거나, C6및 더 고급 탄화수소를 방향족 화합물로 전환시켜 재 구성 함으로써 얻을 수 있다. C5탄화수소를 방향족으로 전환시키는 것은 쉽지 않기 때문에 통상의 실시법에서는 저급 탄화수소를 상응하는 측쇄 이소파라핀으로 이성질체화 시킨다. C6및 고급 탄화수소가 히드로 고리화에 의해 방향족으로 개량될수 있기는 하나, C6의 방향족으로의 전환은 더 높은 밀도의 것을 제조하며 액체 부피수율을 감소하면서 기체수율을 증가시키는 두가지 효과를 나타낸다. 따라서 C6이소파라핀 탄화수소를 얻기위해 C6파라핀을 이성질체화 유니트로 투입하는 것이 통상적인 실시법이다. 결과적으로 옥탄개량은 통상 C6및 저비등 탄화수소를 전환시키기 위한 이성질체화 및 C7및 고비등 탄화수소를 전환시켜 재형성하는 방법을 사용한다. C6을 방향족 대신 시클릭 탄화수소로 그리고 이를 이소파라핀으로 전환시킴으로서 전체 옥탄 등급을 개량시킬수 있다. 미합중국 및 타지역내의 옥탄 등급은 연구 및 자동차 옥탄수의 합으로 표시 된다. 때로는 옥탄 감도로 지칭되는 자동차 및 연구용 옥탄수들 간의 차이는 방향족 및 C6시클릭에 대해 높은데 자동차 옥탄수가 트레일링 연구용의 수보다 10배 정도 크다. 한편 이소헥산에 대한 옥탄 감도는 몇배 정도로 변화한다. 비교적 높은 자동차 옥탄수 및 감소된 옥탄 감도가 C6시클릭 파라핀을 이소파라핀으로 전환시키는데 유리하다.
파라핀의 이성질체화는 가역 일차반응이다. 이 반응은 열 역학 평형에 의해 제한된다. 반응을 실시하는데 사용되는 촉매 시스템의 기본 유형은 염산으로 촉진된 알루미늄 클로라이드 시스템 및 지지된 알루미늄 클로라이드 촉매이다. 촉매는 매우 반응성이며 동종간 주고받기 반응(disproportionation) 및 균열과 같은 바람직하지 못한 부반응을 일으킬수 있다. 이들 부반응은 생성물 수율을 감소시킬 뿐만아니라 촉매와 결합하여 그들의 수명을 단축시키는 올레핀성 단편을 형성할수 있다. 이들 바람직하지 못한 반응을 조절하는데 사용되는 통상의 방법은 수소 존재하에 반응을 실시하는 것이다.
C4-C6이성질체화 반응을 위한 원료원액으로 유용한 C4-C6분획분은 많은 퍼센테이지의 시클릭 탄화수소를 포함하고 있다. 이들 시클릭 탄화수소는 이성질체화 촉매상에 흡수되는 경향이 있다. 시클릭 화합물의 흡수는 촉매상의 활성부위를 차단하며 그로인해 이성질화 파라핀을 촉매로부터 배제시킨다. 이런 배제는 전체 전환 공정을 감소시킨다. 결과적으로 이성질체화 공정으로부터 시클릭 탄화수소를 제거하는 것은 더욱 고급의 측쇄 파라핀으로 파라핀을 전환시키는 정도를 증가시키며, 시클릭 탄화수소를 측쇄 파라핀으로 재배열 하는 것은 부피수율을 증가시킬것이다. 통상의 분리방법에 의해 시클릭 탄화수소를 완전히 제거하려는 노력은 C6파라핀 및 많은 시클릭 탄화수소 특히 헥산 및 메틸시클로펜탄의 비등점 때문에 이룩될수 없다.
미합중국 특허 제 2,915,571호는 일차반응대역내에서 철족금속을 포함한 고리 개방 촉매와 접촉시킴으로써 이성질체화 원료 분획분내에 나프탈렌이 감소되며, 계속하여 이성질체화 대역내에서 다른 촉매와 원료분획분을 접촉시켜 이성질체화 시키는 방법이 기술되어 있다. 시클릭 탄화수소의 개방은 촉매 오염을 일으킬 수 있는 시클릭 탄화수소를 제거하며, 동시에 생성물 수율을 증가시키며 저밀도 이성질체화 탄화수소의 부피를 증가시키는 두가지 장점을 갖게한다. 고리개방 및 이성질체화를 위해 다른 촉매를 사용하는 경우는 미합중국 특허 제 2,915,571호의 공정에서 최소한 한개의 부가적인 반응대역을 요구한다는 점에서 주요한 결합을 갖는다. 미합중국 특허 제 3,631,117호에는 매우 격렬한 조건에서 고리개방 촉매로서 Ⅷ족 금속으로 지지된 제올라이트 및 온화한 조건에서 이성질체화 촉매로 Ⅷ족 금속으로 지지된 제올라이트를 사용하여, 전환되지 않은 시클릭 탄화수소보다 고리당 최소한 한개정도의 탄소원자를 덜 갖는 시클릭 이성질체를 산출하는 시클릭 탄화수소의 히드로 이성질체화 공정을 기술하고 있다. 고리개방을 위해 격렬한 작업 조건이 사용될때 저급말단에 C4-C6탄화수소의 균열이 발생할 것이다. 따라서 C4-C6탄화수소 원료원액내에서 고리를 개방하기위해 격렬한 조건을 사용하는 것은 피해야 한다.
첨가적인 반응대역 및 저급 말단의 제조에 관한 이중 촉매 시스템의 불리한 점은 C4-C6탄화수소의 이성질체화 원료원액 내에서 시클릭 탄화수소의 전환을 어렵게 한다는 것이다.
시클릭 탄화수소는 온화한 조건에서 단일 촉매 시스템을 사용한 파라핀 이성질체화 공정내에서 축쇄 이성질체로 전환될수 있다는 것이 발견되었다.
따라서 시클릭 탄화수소 함유 원료 스트림을 사용하여 파라핀 이성질체화 공정에서 촉매의 고리 개방 활성을 증가시키는 것이 본 발명의 취지이다.
또한 본 발명은 파라핀 및 시클릭 탄화수소를 포함하는 원료 스트림을 사용하여 파라핀 이성질체화 공정에서 C4-C6 측쇄 파라핀의 수율을 증가시키는 것을 취지로 한다.
본 발명의 다른 취지는 산출 파라핀내의 탄소원자를 감소시키지 않고 시클릭 탄화수소를 절단 및 측쇄 파라핀으로 전환시키는 것이다.
본 발명의 또 다른 취지는 시클로헥산의 모우터 옥탄수를 개선시키는 것이다.
본 발명의 또 다른 취지는 단일 촉매 시스템을 사용한 C4-C6파라핀의 이성질체화 및 시클릭 탄화수소를 측쇄 파라핀으로 전환시키기 위한 병합공정을 제공하는 것이다.
본 발명은 주목할 정도의 사슬 감소 없이 시클릭 탄화수소의 고리를 개방함으로써 높은 전환 및 우수한 안정성을 이룩한, 4-6 탄소수와 최소한 2중량%의 시클릭 탄화수소로 구성된 원료원액을 이성질체화 시키고 고리개방시키기 위한 이중 작용성 공정에 관한 것이다. 본 발명은 상당한 활성의 염소화된 백금/알루미늄 촉매를 이성질체화 반응에 사용하여 개방된 고리의 균열에 의한 저급 기체를 발생시키지 않고 전형적인 이성질체화 온도 또는 그보다 약간 높은 온도에서 시클릭 탄화수소의 고리를 선택적으로 개방시키는 것에 관한것이다. 고리절단에 의해 시클릭 탄화수소를 제거함으로써 액체 부피수율을 증가시키는 동안 촉매의 활성과 안정성이 증가되는 두가지 유리한 점을 얻게된다.
본 발명의 한가지 구체화에는 C4-C6이성질체화 탄화수소 및 최소한 2중량%의 시클릭 탄화수소를 포함하는 원료 스트림의 이성질체화 공정이 있다. 이 공정은 원료 스트림을 반응대역으로 통과시키고 그안에서 이 원료 스트림을 백금 성분 0.1 내지 0.25중량%와 클로라이드 성분 2 내지 10중량%와 함께 조합된 알루미나를 포함하는 촉매 및 수소와 접촉시켜 온도범위 40-260℃(105-500℉), 압력 7 내지 70barsg 및 공간속도 0.5 내지 12/hr의 이성질체화 조건에서 상기 대역으로 유입하는 반응물내에 원료 스트립 30-300중량ppm에 상응하는 클로라이드 농도를 유지시키면서 반응시키는 단계로 구성되어 있다. 높은 옥탄 함량 유출액은 시클릭 탄화수소의 중량%가 상기 원료 스트림보다 최소한 40%이하인 상태로 상기 반응대역에서 회수된다.
본 발명의 다른 구체화에서는 C4-C6이성질체화 탄화수소와 최소한 2중량%의 시클릭 탄화수소로 구성된 원료 스트림의 이성질체화 공정이 있다. 이 공정은 원료 스트림을 일차 반응대역에 통과시키고 그안에서 원료 스트림 및 수소를 알루미나와 0.1 내지 0.25중량%의 백금성분 및 2 내지 10중량%의 클로라이드 성분을 조합상태로 포함하는 촉매와, 온도범위 100-260℃(160-500℉), 압력 7 내지 70barsg 및 공간속도 0.5내지 12/hr의 이성질체화 조건에서 반응대역으로 유입하는 반응물내에 원료 스트림 30 내지 300중량ppm과 동일한 클로라이드 농도를 유지시키면서 접촉시키는 단계로 구성된 공정이다. 감소된 농도의 시클릭 탄화수소를 포함하는 유출액은 일차 반응대역에서 회수되며 이차 반응대역을 통과하고 여기에서 유출액은 일차 반응대역에 사용된 것과 동일한 조성을 갖는 촉매를 온도범위 40-200℃(105-390℉), 압력 7 내지 70barsg 및 공간속도 0.1 내지 10/hr의 이성질체화 조건에서 이차 반응대역에 유입하는 유입액 30 내지 300중량 ppm에 상응하는 클로라이드 농도를 유지하면서 접촉시킨다. 상기 원료 스트림보다 최소한 40% 낮은 중량% 농도의 시클릭 탄화수소를 포함한 높은 옥탄 함유 유출액이 이차 반응대역에서 회수된다.
본 발명의 다른 취지는 원료 스트림 조성, 공정 처리조건, 반응대역 배열 및 촉매 세부에 관한 것이다.
본 발명에 사용될 수 있는 원료원액은 C4-C6파라핀에 고농도의 탄화수소 분획분을 포함한다. 상기 "고농도"란 용어는 상술된 성분 50% 이상을 포함하는 스트림을 의미한다. 본 발명의 유리한 점을 이해하려면 원료원액중의 시클릭의 농도를 최소한 촉매상에 시클릭이 흡착되어 이성질체화 촉매의 활성을 감소시킬 수 있을 정도 또는 측쇄 파라핀과는 대조적으로 시클릭의 높은 밀도로 인해 액체 부피수율의 상당한 손실을 나타낼수 있을 정도여야 한다. 본 발명의 공정이 일차적으로 시클릭 탄화수소로 구성된 원료원액을 처리하기 위해 사용될수 있기 때문에 원료내외 시클릭 탄화수소의 농도에 상한치는 없다. 그러나 원료원액은 시클릭탄화수소 2 내지 30중량%를 포함할 것이다. 원료내의 시클릭 탄화수소의 가능한 유형은 비고리형 및 방향족 탄화수소이다. 만일 벤젠 또는 벤젠 유도체를 포함하는 불포화 시클릭 탄화수소류가 공정에 투입되면, 이들은 그안에서 급속히 포화되어 첨가적인 시클로 알칸 성분으로 효과적으로 작용한다. 전형적으로 시클릭성분은 5 내지 7탄소원자를 갖는다. 원료성분은 항시 n-헥산 및 n-펜탄과 함께 대부분의 파라핀 성분을 제공하는 C4-C7시클릭 및 파라핀성 탄화수소류를 포함한다. 시클릭 성분을 포함할 유용한 원료원액은 저급 천연 가솔린, 저급 직쇄 나프타, 기체 유분 축합물, 저급 라피네이트, 저급 리포르메이트, 저급 탄화수소, 필드 부탄 및 약 77℃(170℉)의 증류 말단온도와 C4-C6파라핀을 어느정도 포함하는 직쇄 증류물로 구성되어 있다. 상술한 바대로 원료 스트림은 6탄소원자수 이상을 갖는 탄화수소 뿐아니라 다른 올레핀 또는 벤젠같은 저농도의 불포화 탄화수소를 또한 포함할수 있다. 이들 물질의 농도는 불포화 화합물 10중량% 및 고급 탄화수소 20중량%로 제한되어 수소소모 및 균열반응을 억제시켜야 한다.
수소는 수소 대 탄화수소의 몰비율이 이성질체화 영역으로부터 유출액내에 0.01: 1 내지 10: 1 정도를 제공할수 있을 정도의 양으로 원료와 혼합된다. 바람직하게는 수소 대 탄화수소의 비율이 0.05: 1 내지 5:1의 범위이다. 비록 이성질체화 대역내에서 소모되는 순 수소가 없을지라도 이성질체화 대역은 발생하는 부반응의 수와 연관된 입체 화학적 수소 요구도로 언급되는 순수소 소모량을 갖을 것이다. 이들 부반응은 올레핀 및 방향족의 포화, 균열 및 동종간 주고받기를 포함한다. 고농도의 불포화물을 갖는 원료에 대해 입체 화학적 수소를 만족하려면 이성질체화 대역의 주입구에서 원료에 대한 수소 대 탄화수소 비율이 높아야만 한다. 부반응에 대한 입체 화학적 양 이상의 수소는 입체 화학적 수소 요구도를 변화시키는 원료 스트림 조성내의 변화를 상층시킴으로써 우수한 안정성 및 전환을 제공하며, 균열 및 동종간 주고받기 같은 부반응을 억제함으로써 촉매 라이프를 지속시키기 위해 반응대역내에 존재한다. 만일 검사하지 않은 상태로 담아 있다면, 부반응은 전환을 감소시키며, 흔히 코크로 명명되는 촉매 오염 원인 탄소질 화합물의 형성을 초래한다.
수소 대 탄화수소 비율이 0.05: 1을 초과할때 수소를 이성질체화 대역으로 재순환시키지 않고 이성질체와 공정을 작동시키는 것은 경제적으로 바람직하지 않다. 따라서 유출액으로부터 수소를 회수하는 설비가 제공될 것이다.
수소는 수소량의 첨가를 조정하는 방법하에 원료 혼합물에 첨가될수 있다. 수소와 탄화수소 원료 혼합물을 반응대역 내에서 이성질체화 촉매와 접촉시킨다. 이성절체화 촉매는 백금성분을 포함하는 알루미나 기체상의 고농도 클로라이드 촉매로 구성된다. 알루미나는 고순도의 무수 감마 알루미나가 바람직하다. 촉매는 또한 다른 백금족 금속을 포함할수도 있다. 용어 백금족 금속은 백금, 팔라듐, 루테늄, 로듐, 오스뮴 및 이리듐으로 구성된 군으로부터 선택된 은 및 금을 제외한 신규 금속을 의미한다. 이들 금속은 활성 및 선택도의 차이를 나타내며, 현재 백금이 이 공정에 가장 적합한 것으로 밝혀졌다. 촉매는 백금성분 약 0.1 내지 0.25%를 포함할 것이다. 다른 백금족 금속은 0.1 내지 0.25중량% 농도로 존재할수 있다. 백금성분은 원소 금속으로 또는 옥사이드 또는 할라이드 같은 형태로 최종 촉매 복합물내에 존재할수 있다. 그 환원상태에서 백금성분의 존재는 이 공정에 가장 적절한 것으로 밝혀졌다.
또한 촉매는 클로라이드 성분을 포함한다. 본 기술의 "조합된 클로라이드"라는 용어의 클로라이드 성분은 건조 지지체 물질에 대해 약 2 내지 10중량% 정도 존재한다. 클로라이드를 5중량% 이상 사용하는 것이 본 공정에 가장 유리하다.
촉매 복합물을 제조하고 그 내부에 백금금속 및 클로라이드를 투입하는 다양한 방법이 있다. 본 발명에 가장 우수한 결과를 나타내는 방법은 캐리어 물질을 백금족 금속의 수용성 비분해성 화합물의 수용액과 접촉시켜 함칭시킴으로써 촉매를 제조하는 것이다. 가장 우수한 결과를 위해 함침은 캐리어 물질을 클로로플라틴산 용액에 침지시킴으로써 실시된다. 사용될 수도 있는 첨가적인 용액은 암모늄 클로로플라티네이트, 브로모플라틴산 또는 백금 디클로라이드등이 있다. 백금 클로라이드 화합물을 사용함으로써 촉매내에 백금성분 및 최소한 소량의 클로라이드를 투입하는 이중 작용을 가능케한다. 첨가량의 클로라이드는 백금-알루미늄 촉매 기제상 또는 그 기제에 알루미늄 클로라이드를 첨가 혹은 생성시킴으로써 촉매내에 투입되어야 한다. 최종 촉매 복합물내에 할로겐의 농도를 증가시키는 변형방법으로 알루미나 캐리어 물질을 제조하기 위해 알루미나 히드로졸을 사용하는 경우가 있으며, 이렇게 함으로써 캐리어 물질은 또한 최소한 일부의 클로라이드를 포함하게 된다. 할로겐은 또한 석회화된 캐리어 물질을 염화수소, 불화수소 또는 염화수소 같은 할로겐산의 수용액과 접촉시킴으로써 캐리어 물질에 첨가될 수 있다.
일반적으로 고농도의 클로라이드화된 이 형태의 백금-알루미나 촉매는 황 및 산소-함유 화합물에 상당히 민감하다는 것이 공지되어 있다. 따라서, 원료원액은 이러한 화합물이 거의 없어야한다. 0.5중량 ppm 이하의 황농도가 일반적으로 요구된다. 원료원액내의 황의 존재는 백금 포이즈닝에 의해 촉매를 순간적으로 비활성화 시키는 작용을 한다. 촉매의 활성은 촉매 복합물로부터 황을 뜨거운 수소에 의해 벗겨내거나 유입원료내의 황의 농도를 0.5중량 ppm 이하로 저하시켜 탄화수소가 촉매상에 흡착된 황을 탈착시키도록 함으로써 회복될수 있다. 물은 촉매로부터 고활성 클로라이드를 제거하고 그것을 비활성 알루미늄 하이드록사이드로 대체시킴으로써 촉매를 영구히 불활성 시키는 작용을 할수 있다. 따라서 물을 형성할수 있는 특히 C1-C5옥시게네이트인 옥시게네이트 뿐아니라 물 자체도 매우 낮은 농도에서만 별영향이 없다. 일반적으로 원료내의 옥시게네이트의 제한치는 약 0.1중량 ppm 또는 그이하일 필요가 있다, 원료원액은 물 및 황 화합물을 제거할수 있는 다른 방법에 의해 처리될 수 있다. 황은 원료 스트림을 수처리(hydrotreating)함으로써 제거될수 있다. 다양한 상품화된 건조제들이 원료 성분으로부터 물을 제거하는데 유용하다. 탄화수소 스트림으로부터 황 및 물을 제거하기 위한 흡착공정이 또한 본 기술에 숙련된 자에 의해 잘 공지되어 있다.
본 발명에 있어서, 또한 벤젠, 시클로헥산 및 메틸 시클로펜탄 같은 특히 C6시클릭류의 시클릭 탄화수소들이 파라핀 이성질체화 정도에 역영향을 준다는 사실을 알아야 한다. 역효과는 시클릭 탄화수소가 촉매 표면상에 바람직하게 흡착된다는 것으로 인한 것이며, 이로인해 결과적으로 촉매표면상에 파라핀성 탄화수소의 배제를 초래하게 된다. 본 발명의 공정은 선정된 작업조건에서 시클릭을 제거하기 위해 전술된 촉매를 시클릭과 접촉시켜 첨가적인 이성질체화 생성물을 제공하기 위해 시클릭을 전화시키는 방법을 사용한다. 본 발명의 유리한 점을 향유하기 위해서 고리 화합물류를 완전히 제거할 필요는 없다. 유입 원료 중의 단지 소량의 (중량%) 고리 화합물류의 전환이 이소파라핀 수율에 실질적인 증가를 제공할 것이다. 일반적으로 본 공정은 유입 원료중의 고리 화합물류 40중량%를 개방하도록 작용할 것이다. 원료의 시클릭 탄화수소 농도가 15중량% 를 초과할때는, 반응대역으로부티의 유출액내의 시클릭 탄화수소 농도가 7중량% 이하를 유지하도록 하기 위해서 더 큰 정도의 고리개방이 이루어져야 한다. 온도 및 압력조건은 직접 고리개방 정도에 영향을 준다.
이성질체화 대역내의 작업조건은 원료 성분으로부터 이소알칸 생성물의 제조를 최대화 하기위해 선택된다. 반응 영역내의 온도는 약 40-260℃(105-500℉)의 범위이다. 낮은 반옹온도가 이성질체화 전환 목적에 바람직한데, 이는 평형 혼합물중에서 이소알칸이 일반적인 알칸보다 전환이 유리하기 때문이다. 그러나, 때로는 고리개방의 최대화가 평형 입점에서 더 유리한 온도이상의 온도를 필요로 한다. 예를들면 원료 혼합물이 주로 C5및 C6알칸일 때, 60 내지 160℃범위내의 온도가 정상-이소알칸 평형입점으로부터 바람직하지만 고리개방을 고려해 보면 본 발명에 대한 바람직한 온도는 100-200℃사이이다. C4탄화수소 상당량을 이성질체화 하는 것이 바람직할때는 촉매활성을 유지하기 위해 높은 반응온도가 요구된다. 원료 혼합물이 상당량의 C4-C6알칸을 포함할때 고리개방 및 이소알칸 평형을 위한 가장 적절한 작업온도는 145 내지 225℃ 범위내에 있다. 이 반응대역은 광범위한 압력이 유지되고 있다.
C4-C6파라핀의 이성질체화에서 압력조건은 7barsg 내지 70barsg범위이다. 높은 압력이 고리개방에 유리하기 때문에 25barsg 내지 60barsg범위내의 압력이 본 공정에 바람직한 압력이다. 반응대역으로의 주입속도 또한 광범위하게 다양할 수 있다. 이들 조건은 시간당 액체 공간 속도가 0.5 내지 12/hr의 범위내인 것을 포함하지만 공간속도는 0.5 내지 3/hr사이가 바람직하다.
반응대역의 작동은 소량의 유기 클로라이드 프로모터 존재를 필요로 한다. 유기 클로라이드 프로모터는 소량의 클로라이드가 지속적으로 탄화수소 원료에 대한 촉매 잠식을 벗겨내도록 촉매상의 활성 클로라이드가 고농도로 유지되도록 하는 작용을 한다. 반응대역 내에 프로모터의 농도는 원료 약30 내지 300중량ppm에 상응하는 양으로 유지된다. 바람직한 프로모터 화합물은 사염화탄소이다. 다른 적절한 프로모터 화합물은 프로필 디클로라이드, 부틸 클로라이드 및 클로로포름 같은 몇몇 화합물로 명명되는 산소가 없는 상태에서 분해성인 유기 클로라이드가 해당된다. 부분적으로 염화수소로 전환되는 유기 클로라이드 화합물의 존재로 인해 반응물을 건조하게 유지시킬 필요가 증가되고 있다. 공정내의 스트림이 건조상태로 유지되는한 소량의 염화수소 존재로 인한 역효과는 거의 없을것이다. 공정을 조작하는 바람직한 방법은 두개의 반응기 또는 반응대역 시스템에 있다. 공정에 사용되는 촉매는 두개의 반응기 사이에 비율이 동등하게 분포되거나 비율을 변화시키면서 분포될 수 있다. 두 반응대역의 사용은 두 반응대역 간에 작업조건을 변화시켜 한 반응대역 내에서 시클릭 탄화수소 전환을 향상시키고 다른 대역에서 파라핀에 이성질체화를 향상시킬 수 있게 한다. 이 방법에서 일차 반응대역은 고리개방에 유리하며 단지 일부만을 이소파라핀으로 전환시킬수 있는 고온 및 고압조건에서 작동시킨다. 반응대역의 최초 부분에 발생하는 불포화물의 수소첨가와 같은 발열반응 같은 것들이 그 내부에서 고온 사용을 촉진시킨다. 일단 고리가 촉매와의 최초 접촉으로 개방되면, 최종 반응기 단계는 이소알칸 평형에 더 유리한 온도조건에서 작동될수 있다.
두개의 반응기를 사용하는 것이 유리한 점은 이성질체화 유니트를 스트림에서 제거해 내지 않고도 촉매 시스템을 부분적으로 대체할 수 있다는 점이다. 촉매 대체에 요구되는 짧은 시간동안 반응물의 전체 흐름은 한개의 반응 용기에서만 처리되는 반면 다른 용기에서는 촉매가 대체된다.
한개 또는 두개의 반응대역이 작동되면 공정의 유출액은 분리설비로 유입되어 고 옥탄 이소알칸 생성물이 회수된다. 최소한 분리설비는 반응대역 유출액을 C4및 고급 탄화수소를 포함한 생성물과 저급 탄화수소 및 수소로 구성된 기체 스트림으로 나누다. 정류 컬럼 및 분리용기에 적합한 고안품은 본 기술에 숙련된 자에게 공지된 것이다. 분리구획은 또한 노말 알칸의 회수용 설비를 포함하고 있다. 분리설비에서 회수된 노말 알칸은 이성질체화 반응대역으로 재순환되어 노말 알칸의 이소알칸으로의 전환을 증가시키게된다. 전형적인 분리설비는 안정제 구획을 포함하며, 이 구획은 반응 유출액을 수용하며 최소한 한개의 안정제 컬럼을 포함한다. 안정제 컬럼은 C4및 고급 탄화수소를 포함하는 저층 분획분과 C3, 탄화수소 및 낮은 비둥점을 갖는 화합물로 구성된 상층 분획분을 운반하는데 작용한다. 안정제 컬럼의 저층에서 회수되는 고급 탄화수소는 냉각되어 생성물 스트림 및 환류 스트림으로 더 분리된다. 안정제 컬럼의 상층으로부터 취해진 C3및 고급 탄화수소는 냉각되고 축합되어 환류 스트림으로 분리되면 공정 및 순기체 스트림으로 복귀된다. 순기체 스트림은 스크루버(기체 세척기) 구역으로 들어가, 여기에서 기체를 중화 및/또는 산성 성분 제거용 용액과 접촉시켜 적절히 처리하며, 상기 산성 성분은 이성질체화 대역에 첨가된 클로라이드에서 유래된 것으로 기체 스트림에 존재할 수 있다.
[실시예]
본 발명의 공정은 하기 실시예에서 알수있는 바와같은 고리개방, 고 전환, 높은 선택성 및 C3와 저급 기체류의 낮은 생산성을 특징으로 한다. 이들 실시예에서 반응은 0.25중량% 백금 및 5.5중량% 클로린으로 구성된 알루미나 촉매의 존재하에 실시되는데, 이 촉매는 알루미나 기체를 클로로플라탄산, 2% 염산 및 3.5% 질산으로 구성된 용액을 기제 10부에 대해 용액 9부의 부피 비율로 진공 합침시켜 백금 대 기제비율이 약 0.9인 물질을 얻도록하여 제조한 것이다. 얻어진 혼합물을 약 1시간동안 냉각 로울시키고 건조할때까지 증발시켰다. 그후 촉매를 산화시키고 클로라이드의 함량은 525℃에서 2시간동안 45cc/시간의 비율로 1M 염산 용액과 접촉시켜 일정하게 조정했다. 촉매는 565℃에서 1시간동안 전해질성 수소로 환원되며, 이는 약 0.25중량% 백금 및 약 1중량% 클로라이드를 포함하는 것으로 밝혀졌다. 활성 클로라이드를 약 5.5중량% 농도로 함침시키는 것은 염화 알루미늄을 수소로 승화시키고 촉매를 550℃에서 약 45분 동안 승화된 염화 알루미늄과 접촉시킴으로써 이룩된다.
[실시예 1]
표 1에 도시한 조성을 갖는 합성 원료원액을 제조했다. 원료원액은 전술된 촉매를 포함하고 있는 단일 반응대역을 시간당 액체 공간속도 2/hr 및 수소 대 탄화수소 몰비율이 2 : 1로 통과시켰다. 첫번째 일련의 런(run)에서 압력은 21barsg로 일정하게 유지시키고 온도는 140-200℃의 범위 이상으로 증가시켰다. 이 과정을 31barsg와 70barsg의 압력에서 반복시켰다. 각각 런의 반응대역 유출액을 분석하여 고리개방 퍼센테이지, 이소펜탄 대 C5탄화수소 비율, 2,2 디메틸부탄 대 C6탄화수소 비율 및 그 내부에 포함된 C1-C4탄화수소 농도를 측정했다.
여러가지 특성이 3개의 다른 압력상태에서 온도함수로 구성되어 제 1 도에 도시되었다. 먼저 고리개방에 관해 그래프를 살펴보면, 본 발명의 공정은 높은 정도의 고리개방을 나타낸다. 40%이상의 고리개방이 180℃온도에서 21바의 낮은 압력에서도 이루어졌으면 135℃정도의 낮은 온도에서는 70barsg정도의 압력에서 이루어졌다. C1-C4탄화수소 농도에 관한 그래프에서 나타난 바와같이 단지 소량의 저급물질이 고리개방 및 이성질체화 반응에서 발생되었다. 높은 온도와 압력은 저급 탄화수소에 대한 첨가적인 균열을 촉진시켰다. 그러나 70barsg와 180℃에서의 조건이 가장 높은 고리개방을 제공하며, 공정이 처리되는 상기 조건은 가장 바람직하고 C1-C4탄화수소의 유출액 농도가 4중량%을 초과하지 않았다. 나머지 두 그래프는 공정의 전체 능력이 C5및 C6탄화수소를 상응하는 이소파라핀으로 상당히 많이 전환시킬수 있음을 입증하고 있다.
[표 1]
[실시예 2]
실시예 1의 합성 원료원액은 다시 수소 대 탄화수소 몰비용이 2 : 1이고 시간당 액체 공간속도가 4/hr인 실시예 1의 반응대역을 통과했다. 대체로 실시예 1과 동일한 방법에 의해 반응대역의 온도는 주기적으로 21,31 및 70barsg의 압력 상태로 변화시켰다. 반응대역으로부터 유출액을 취해 모니터에서 제 2 도의 그래프를 위해 고리개방 퍼센테이지, C1-C4탄화수소 농도, 이스펜탄 대 C5탄화수소 비율 및 2,2 디메틸부탄 대 C 탄화수소 배율을 온도의 함수로 나타내었다. 제 1 도에 도시한 그래프는 본 공정이 고리개방에 우수한 능력을 갖으며 저급 탄화수소 과량을 발생시키지 않으면서 노말 파라핀을 이소파라핀으로 우수하게 전환시킨다는 것을 증명해 주고 있다. 고리개방 및 C1-C4탄화수소 농도에 대한 그래프를 상세히 검토해 보면 높은 공간속도가 제 1 도에 비해 실행능력 프로파일을 우측으로 전이시키는 작용을 하며 따라서 손율 및 전환율을 얻으려면 고온이 요구된다는 것을 나타내고 있다. 이소펜탄 및 디메틸부탄 전환에 대한 그래프는 실시예 1에 대한 실시예 2의 전환손율을 나타내고 있다.
[실시예 3-5]
이 실시예에서 상업 제품화된 원료원액을 전술된 촉매와 접촉시켰다. 이 원료원액은 두개의 반응대역을 통과시켰다. 각 반응단계후 원료 조성 및 유출액 특성을 표 2에서 표 4에 각 반응단계별 처리조건과 함께 기술했다. 본 공정의 고리개방에 대한 능력을 입증하는것 이외에 높은 본 자료는 본 공정이 높은 전환율을 이룩하였으며 과량의 저급물질을 제조하지 않으며 대다수의 고리개방이 일차단계에서 발생한다는 것을 입증하고 있다. 벤젠과 관련된 자료는 공정에 유입되는 다른 불포화물이 급속히 수소화 된다는 것을 나타내준다.
[실시예 6]
실시예 6은 단일 반응대역을 통한 C4탄화수소의 이성질체화에서 그 공정의 작업을 나타낸 것이다. C4탄화수소를 이성질체화 하기위해 평균 반응온도 220℃, 압력 31barsg 및 시간당 액체 공간속도 2/hr 정도의 다소 격한 조건에서 반응영역을 작동시킨다. 시험에서 수소 대 탄화수소 몰비율은 2를 유지시켰다. 이 시험의 원료조성 및 유출액 특성을 표 5에 나타내었다. 표 5는 격한 조건이 효율적으로 고리개방의 퍼센테이지를 향상시킴을 입증한 자료이다.
[표 2]
[표 3]
[표 4]
[표 5]
Claims (5)
- a) 원료 스트림을 반응대역으로 통과시키고 그 내부에서 상기 원료 스트림 및 수소를 0.1 내지 0.25 중량% 백금성분 및 2 내지 10중량%의 클로라이드 성분과 조합된 알루미나로 구성된 촉매와 이성질체화 및 고리개방 조건에서 접촉시키며, 이때 이 조건은 온도범위 40-260℃(105-500℉), 압력 7 내지 70barsg 및 공간속도 0.5 내지 12hr-1이며; b) 클로라이드는 상기 반응대역으로 들어가는 반응물내에 원료 스트림 30내지 300중량 ppm에 상당하는 농도로 유지되며 ; c) 상기 반응대역으로부터 원료 스트림에 비해 증가된 옥탄수와 시클릭 탄화수소가 상기 원료 스트림보다 최소한 40중량% 농도 이하로 존재하는 유출액을 회수하는 단계로 구성된 C4-C6의 이성질체화가 가능한 탄화수소 및 최소한 2중량%의 시클릭 탄화수소로 구성된 원료 스트림의 이성질체화 및 고리개방을 위한 이중 작용성 공정.
- 제 1 항에 있어서, 상기 반응영역은 최소한 연속된 2개의 반응기로 분할되며 이 반응기중 첫번째것은 두번째것에 비해 상기 온도범위 내의 더 높은 온도에서 작동되는 공정.
- 제 1 항에 있어서, 상기 원료 스트림은 C5-C6탄화수소로 구성되며 상기 이성질체화 조건은 온도범위 120-180℃(250-360℉), 압력범위 25 내지 60barsg 및 공간속도 0.1 내지 3hr-1인 공정.
- a) 원료 스프림 및 수소를 첫번째 반응영역으로 통과시키고, 그안에서 상기 원료 스트림을 0.1 내지 0.25중량%의 백금 성분 및 2 내지 10중량%의 클로라이드 성분이 조합된 알루미나로 구성된 촉매의 일차 일부분과 100-260℃(160-500℉)온도, 7 내지 70barsg의 압력 및 0.1 내지 10hr-1의 공간속도를 나타내는 고리개방 및 이성질체화 조건에서 접촉시키며 ; b) 클로라이드는 상기 반응영역으로 유입하는 반응물내의 원료 스트림 30 내지 300중량 ppm에 상당하는 농도를 유지하며 ; c) 상기 일차 반응대역으로부터 원료 스트림에 비해 감소된 농도의 시클릭 탄화수소를 갖는 일차 유출액을 회수하며 ; d) 상기 일차 유출액 스트림을 이차 반응대역으로 통과시키고 그안에서 이 유출액 스트림을 상기 촉매 이차 일부분과 40-200℃ (105-390℉)온도, 7 내지 70barsg 압력 및 0.1 내지 10hr-1의 공간속도인 이성질체화 조건에서 접촉시키며 ; e) 클로라이드는 상기 이차 반응대역으로 유입하는 유출액 30 내지 300중량 ppm에 상당하는 농도를 유지하며, f) 상기 이차 반응대역으로부터 원료 스트림에 비해 증가된 옥탄수와 상기 원료 스트림보다 최소한 40중량% 이하의 농도로 존재하는 시클릭 탄화수소를 갖는 이차 유출액을 회수하는 단계로 구성된 최소한 2중량%의 시클릭 탄화수소와 C4-C6의 이성질체화 가능한 탄화수소로 구성된 원료 스트림의 고리개방 및 이성질체화를 위한 이중 작용성 공정.
- 제 4 항에 있어서, 상기 반응대역내의 공간속도는 3hr-1이하이며, 상기 반응대역내의 압력은 최소한 30barsg이며, 상기 일차 반응대역내의 온도는 최소한 180℃(360℉)이며 상기 이차 반응대역내의 온도는 180℃이하(360℉)인 공정.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US07/134,622 US4783575A (en) | 1987-12-17 | 1987-12-17 | Isomerization with cyclic hydrocarbon conversion |
| US134,622 | 1987-12-17 | ||
| US134.622 | 1987-12-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR890010165A KR890010165A (ko) | 1989-08-07 |
| KR910004941B1 true KR910004941B1 (ko) | 1991-07-18 |
Family
ID=22464193
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019880016789A KR910004941B1 (ko) | 1987-12-17 | 1988-12-16 | 파라핀 및 시클릭 탄화수소를 포함하는 원료 스트림의 이성질체화 및 고리개방을 위한 이중 작용성 공정 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US4783575A (ko) |
| EP (1) | EP0321141B1 (ko) |
| JP (1) | JPH01279992A (ko) |
| KR (1) | KR910004941B1 (ko) |
| AU (1) | AU605659B2 (ko) |
| CA (1) | CA1292250C (ko) |
| DE (1) | DE3879644T2 (ko) |
| ES (1) | ES2039651T3 (ko) |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4783575A (en) * | 1987-12-17 | 1988-11-08 | Uop Inc. | Isomerization with cyclic hydrocarbon conversion |
| US4834866A (en) * | 1988-03-31 | 1989-05-30 | Uop | Process for converting normal and cyclic paraffins |
| US5004859A (en) * | 1989-11-13 | 1991-04-02 | Uop | Catalyst for the isomerization of alkanes |
| US5138112A (en) * | 1990-08-31 | 1992-08-11 | Uop | Process for converting a C2 -C6 aliphatic hydrocarbon to high octane transportable fuel |
| US5256277A (en) * | 1991-07-24 | 1993-10-26 | Mobil Oil Corporation | Paraffin isomerization process utilizing a catalyst comprising a mesoporous crystalline material |
| AU665965B2 (en) * | 1991-10-25 | 1996-01-25 | Mobil Oil Corporation | Combined paraffin isomerization/ring opening process |
| US5334792A (en) * | 1992-10-09 | 1994-08-02 | Mobil Oil Corporation | Combined paraffin isomerization/ring opening process for c5+naphtha |
| US5993643A (en) * | 1993-07-22 | 1999-11-30 | Mobil Oil Corporation | Process for naphtha hydrocracking |
| US5345026A (en) * | 1993-07-22 | 1994-09-06 | Mobil Oil Corp. | Ring opening process |
| US5543036A (en) * | 1993-07-22 | 1996-08-06 | Mobil Oil Corporation | Process for hydrotreating |
| US6224748B1 (en) | 1993-07-22 | 2001-05-01 | Mobil Oil Corporation | Process for hydrocracking cycle oil |
| DE69422814T2 (de) * | 1993-07-22 | 2000-10-12 | Mobil Oil Corp., Fairfax | Kombimirtes paraffin-isomerisierungs-/ringöffnungs-verfahren |
| US6080904A (en) * | 1993-07-22 | 2000-06-27 | Mobil Oil Corporation | Isomerization process |
| US5382731A (en) * | 1993-07-22 | 1995-01-17 | Mobil Oil Corp. | Combined paraffin isomerization/ring opening process |
| US5719097A (en) * | 1993-07-22 | 1998-02-17 | Chang; Clarence D. | Catalyst comprising a modified solid oxide |
| US5463155A (en) * | 1993-11-15 | 1995-10-31 | Uop | Upgrading of cyclic naphthas |
| US5770042A (en) * | 1993-11-15 | 1998-06-23 | Uop | Upgrading of cyclic naphthas |
| US5463166A (en) * | 1994-05-27 | 1995-10-31 | Phillips Petroleum Company | Reactivation of alkane isomerization catalysts |
| WO1997009290A1 (en) * | 1995-09-05 | 1997-03-13 | Exxon Research And Engineering Company | Process for selectively opening naphthenic rings |
| US5773383A (en) * | 1995-09-15 | 1998-06-30 | Suciu; George Dan | Method of making solid acid catalysts with metal cores |
| US5763713A (en) * | 1996-11-12 | 1998-06-09 | Uop Llc | Process for the isomerization of benzene containing feed streams |
| US5962755A (en) * | 1996-11-12 | 1999-10-05 | Uop Llc | Process for the isomerization of benzene containing feed streams |
| US6133496A (en) | 1999-03-09 | 2000-10-17 | Phillips Petroleum Company | Two-stage isomerization of saturated C.sub. 6 hydrocarbons |
| US6683020B2 (en) | 2000-07-21 | 2004-01-27 | Exxonmobil Research And Engineering Company | Naphthene ring opening over an iridium ring opening catalyst |
| US6623626B2 (en) | 2000-07-21 | 2003-09-23 | Exxonmobil Research And Engineering Company | Naphthene ring opening over a ring opening catalyst combination |
| US6589416B2 (en) | 2000-07-21 | 2003-07-08 | Exxonmobil Research And Engineering Company | Method and catalyst for opening naphthenic rings of naphthenic ring-containing compounds |
| US6586650B2 (en) | 2000-07-21 | 2003-07-01 | Exxonmobil Research And Engineering Company | Ring opening with group VIII metal catalysts supported on modified substrate |
| US6652737B2 (en) | 2000-07-21 | 2003-11-25 | Exxonmobil Research And Engineering Company | Production of naphtha and light olefins |
| US6623625B2 (en) | 2000-07-21 | 2003-09-23 | Exxonmobil Research And Engineering Company | Naphthene ring opening over group VIII metal catalysts containing cracking moderators |
| US6991687B2 (en) | 2001-07-27 | 2006-01-31 | Surface Combustion, Inc. | Vacuum carburizing with napthene hydrocarbons |
| US7033446B2 (en) * | 2001-07-27 | 2006-04-25 | Surface Combustion, Inc. | Vacuum carburizing with unsaturated aromatic hydrocarbons |
| US7345214B2 (en) * | 2005-10-03 | 2008-03-18 | Uop Llc | Modified PT/RU catalyst for ring opening and process using the catalyst |
| FR2908056B1 (fr) * | 2006-11-07 | 2009-06-26 | Inst Francais Du Petrole | Catalyseur bimetallique a base de platine et d'un second metal du groupe viii utilise pour l'ouverture de composes cycliques |
| US20130261358A1 (en) * | 2012-03-29 | 2013-10-03 | Uop Llc | Methods and apparatuses for isomerization of paraffins |
| US20150045602A1 (en) * | 2013-08-07 | 2015-02-12 | Uop Llc | Process for promoting disproportionation reactions and ring opening reactions within an isomerization zone |
| US11135542B2 (en) * | 2016-10-28 | 2021-10-05 | Uop Llc | Processes and apparatuses for removing contaminants from hydrogen streams |
| US20180215683A1 (en) * | 2017-01-27 | 2018-08-02 | Saudi Arabian Oil Company | Isomerization process using feedstock containing dissolved hydrogen |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA716555A (en) * | 1965-08-24 | Universal Oil Products Company | Process for producing jet fuel hydrocarbons | |
| US2915571A (en) * | 1957-11-13 | 1959-12-01 | Universal Oil Prod Co | Isomerization of saturated hydrocarbons |
| US3158662A (en) * | 1960-08-26 | 1964-11-24 | Exxon Research Engineering Co | Isomerization process |
| GB953189A (en) * | 1960-09-07 | 1964-03-25 | British Petroleum Co | Improvements relating to the isomerisation of paraffin hydrocarbons |
| US3449264A (en) * | 1961-11-27 | 1969-06-10 | Phillips Petroleum Co | Isomerization catalysts and their use |
| US3242228A (en) * | 1962-12-07 | 1966-03-22 | Texaco Inc | Hydrocarbon isomerization process and catalyst |
| US3457162A (en) * | 1967-06-30 | 1969-07-22 | Universal Oil Prod Co | Production of jet fuel |
| US3631117A (en) * | 1968-12-19 | 1971-12-28 | Ashland Oil Inc | Hydroisomerization of cyclic compounds with selective zeolite catalysts |
| CA1077527A (en) * | 1976-12-03 | 1980-05-13 | Chevron Research And Technology Company | Alternating reforming and isomerization process |
| US4113789A (en) * | 1977-03-03 | 1978-09-12 | Texaco Inc. | Hydroisomerization of normal paraffin with a catalyst of noble metal, alumina support and chlorine |
| US4457832A (en) * | 1983-01-19 | 1984-07-03 | Chevron Research Company | Combination catalytic reforming-isomerization process for upgrading naphtha |
| US4783575A (en) * | 1987-12-17 | 1988-11-08 | Uop Inc. | Isomerization with cyclic hydrocarbon conversion |
-
1987
- 1987-12-17 US US07/134,622 patent/US4783575A/en not_active Expired - Lifetime
-
1988
- 1988-11-29 CA CA000584454A patent/CA1292250C/en not_active Expired - Lifetime
- 1988-12-08 EP EP88311607A patent/EP0321141B1/en not_active Expired - Lifetime
- 1988-12-08 DE DE8888311607T patent/DE3879644T2/de not_active Expired - Fee Related
- 1988-12-08 ES ES198888311607T patent/ES2039651T3/es not_active Expired - Lifetime
- 1988-12-16 JP JP63318313A patent/JPH01279992A/ja active Granted
- 1988-12-16 AU AU27003/88A patent/AU605659B2/en not_active Ceased
- 1988-12-16 KR KR1019880016789A patent/KR910004941B1/ko not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| AU605659B2 (en) | 1991-01-17 |
| US4783575A (en) | 1988-11-08 |
| DE3879644D1 (de) | 1993-04-29 |
| EP0321141A2 (en) | 1989-06-21 |
| ES2039651T3 (es) | 1993-10-01 |
| EP0321141A3 (en) | 1989-11-29 |
| EP0321141B1 (en) | 1993-03-24 |
| DE3879644T2 (de) | 1993-07-01 |
| JPH01279992A (ja) | 1989-11-10 |
| JPH055879B2 (ko) | 1993-01-25 |
| AU2700388A (en) | 1989-06-22 |
| CA1292250C (en) | 1991-11-19 |
| KR890010165A (ko) | 1989-08-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR910004941B1 (ko) | 파라핀 및 시클릭 탄화수소를 포함하는 원료 스트림의 이성질체화 및 고리개방을 위한 이중 작용성 공정 | |
| EP0504510B1 (en) | Combination process for hydrogenation and isomerization of benzene and paraffin-containing feedstocks | |
| US4804803A (en) | Isomerization with once-through hydrogen | |
| US6927314B1 (en) | Fractionation and treatment of full boiling range gasoline | |
| US4834866A (en) | Process for converting normal and cyclic paraffins | |
| US5360534A (en) | Isomerization of split-feed benzene-containing paraffinic feedstocks | |
| US3791960A (en) | Isomerization of paraffin hydrocarbons | |
| US4950385A (en) | Reforming process for the catalytic conversion of petroleum fractions to a mixture of hydrocarbons rich in aromatics | |
| EP0520100B1 (en) | Integrated two reaction zone process for C4, C5 and C6 isomerization | |
| US5453552A (en) | Isomerization and adsorption process with benzene saturation | |
| US4202996A (en) | Hydrocarbon isomerization process | |
| US5326926A (en) | Isomerization with improved RVP and C4 recovery | |
| US4929794A (en) | Hydrotreatment-isomerization without hydrogen recycle | |
| US5663466A (en) | Mixed phase benzene saturation with controlled hydrogen addition | |
| US6320089B1 (en) | Paraffin-isomerization catalyst and process | |
| US4877919A (en) | Butane isomerization in the presence of C5 and C6 hydrocarbons | |
| US5763713A (en) | Process for the isomerization of benzene containing feed streams | |
| US5326925A (en) | Isomerization process for 2,3-dimethylbutane production | |
| US4814544A (en) | Isomerization of butane | |
| US4144282A (en) | Octane upgrading of light naphtha streams using a fluorosulfonic acid, hydrofluoric acid and antimony pentafluoride catalyst | |
| US6323382B1 (en) | C8 alkyl aromatic hydrocarbon isomerization process | |
| US5962755A (en) | Process for the isomerization of benzene containing feed streams | |
| US3291852A (en) | Isobutane production | |
| EP1243332A1 (en) | Paraffin-isomerization catalyst, preparation and use thereof | |
| KR910009001B1 (ko) | C_4 내지 c_6 탄화수소의 이성질화 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| G160 | Decision to publish patent application | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20060713 Year of fee payment: 16 |
|
| LAPS | Lapse due to unpaid annual fee |