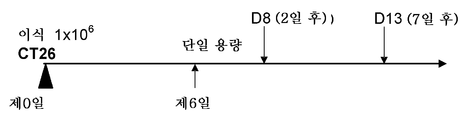
KR20200074214A - 암을 치료하는데 사용하기 위한 면역자극 효능작용 항체 - Google Patents
암을 치료하는데 사용하기 위한 면역자극 효능작용 항체 Download PDFInfo
- Publication number
- KR20200074214A KR20200074214A KR1020207015641A KR20207015641A KR20200074214A KR 20200074214 A KR20200074214 A KR 20200074214A KR 1020207015641 A KR1020207015641 A KR 1020207015641A KR 20207015641 A KR20207015641 A KR 20207015641A KR 20200074214 A KR20200074214 A KR 20200074214A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- cancer
- agonistic
- receptor
- administered
- Prior art date
Links
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 284
- 201000011510 cancer Diseases 0.000 title claims abstract description 114
- 102000005962 receptors Human genes 0.000 claims abstract description 276
- 108020003175 receptors Proteins 0.000 claims abstract description 276
- 230000001270 agonistic effect Effects 0.000 claims abstract description 247
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims abstract description 197
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims abstract description 193
- 238000000034 method Methods 0.000 claims abstract description 190
- 230000003308 immunostimulating effect Effects 0.000 claims abstract description 146
- 238000012544 monitoring process Methods 0.000 claims abstract description 5
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 97
- 238000011282 treatment Methods 0.000 claims description 81
- 230000027455 binding Effects 0.000 claims description 54
- 239000000556 agonist Substances 0.000 claims description 46
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 45
- -1 LIGHT Proteins 0.000 claims description 41
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 38
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 38
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 claims description 37
- 102000003298 tumor necrosis factor receptor Human genes 0.000 claims description 37
- 201000010099 disease Diseases 0.000 claims description 35
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 31
- 230000001965 increasing effect Effects 0.000 claims description 29
- 230000004614 tumor growth Effects 0.000 claims description 29
- 238000003556 assay Methods 0.000 claims description 28
- 108010074328 Interferon-gamma Proteins 0.000 claims description 25
- 230000001225 therapeutic effect Effects 0.000 claims description 24
- 230000028993 immune response Effects 0.000 claims description 23
- 102100037850 Interferon gamma Human genes 0.000 claims description 22
- 206010025323 Lymphomas Diseases 0.000 claims description 22
- 230000004044 response Effects 0.000 claims description 20
- 108010021064 CTLA-4 Antigen Proteins 0.000 claims description 19
- 206010009944 Colon cancer Diseases 0.000 claims description 19
- 238000011374 additional therapy Methods 0.000 claims description 19
- 206010033128 Ovarian cancer Diseases 0.000 claims description 18
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 17
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 17
- 230000002401 inhibitory effect Effects 0.000 claims description 17
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 16
- 108091008034 costimulatory receptors Proteins 0.000 claims description 16
- 230000002829 reductive effect Effects 0.000 claims description 16
- 101150013553 CD40 gene Proteins 0.000 claims description 15
- 108010002350 Interleukin-2 Proteins 0.000 claims description 15
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 15
- 230000007423 decrease Effects 0.000 claims description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims description 15
- 102000017578 LAG3 Human genes 0.000 claims description 14
- 101150030213 Lag3 gene Proteins 0.000 claims description 14
- 210000003289 regulatory T cell Anatomy 0.000 claims description 13
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 12
- 206010005003 Bladder cancer Diseases 0.000 claims description 11
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 11
- 208000032839 leukemia Diseases 0.000 claims description 11
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 11
- 238000010171 animal model Methods 0.000 claims description 10
- 230000009467 reduction Effects 0.000 claims description 10
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 9
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 claims description 9
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 9
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 claims description 9
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 9
- 201000010881 cervical cancer Diseases 0.000 claims description 9
- 201000010536 head and neck cancer Diseases 0.000 claims description 9
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 9
- 230000004936 stimulating effect Effects 0.000 claims description 9
- 210000004881 tumor cell Anatomy 0.000 claims description 9
- 238000001990 intravenous administration Methods 0.000 claims description 8
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 claims description 7
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 7
- 239000000090 biomarker Substances 0.000 claims description 7
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 7
- 201000003120 testicular cancer Diseases 0.000 claims description 7
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 7
- 101000795169 Homo sapiens Tumor necrosis factor receptor superfamily member 13C Proteins 0.000 claims description 6
- 102100025390 Integrin beta-2 Human genes 0.000 claims description 6
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 6
- 206010038389 Renal cancer Diseases 0.000 claims description 6
- 206010039491 Sarcoma Diseases 0.000 claims description 6
- 206010057644 Testis cancer Diseases 0.000 claims description 6
- 102100029690 Tumor necrosis factor receptor superfamily member 13C Human genes 0.000 claims description 6
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 6
- 230000001394 metastastic effect Effects 0.000 claims description 6
- 206010061289 metastatic neoplasm Diseases 0.000 claims description 6
- 102100024263 CD160 antigen Human genes 0.000 claims description 5
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 claims description 5
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 claims description 5
- 101000599852 Homo sapiens Intercellular adhesion molecule 1 Proteins 0.000 claims description 5
- 101000971538 Homo sapiens Killer cell lectin-like receptor subfamily F member 1 Proteins 0.000 claims description 5
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 claims description 5
- 101000633784 Homo sapiens SLAM family member 7 Proteins 0.000 claims description 5
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 claims description 5
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 claims description 5
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 5
- 102100021458 Killer cell lectin-like receptor subfamily F member 1 Human genes 0.000 claims description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 5
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 claims description 5
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 claims description 5
- 102100029198 SLAM family member 7 Human genes 0.000 claims description 5
- 102100027208 T-cell antigen CD7 Human genes 0.000 claims description 5
- 201000010982 kidney cancer Diseases 0.000 claims description 5
- 201000005202 lung cancer Diseases 0.000 claims description 5
- 208000020816 lung neoplasm Diseases 0.000 claims description 5
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 241000700605 Viruses Species 0.000 claims description 4
- 230000000779 depleting effect Effects 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 230000036961 partial effect Effects 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- 206010005949 Bone cancer Diseases 0.000 claims description 3
- 208000018084 Bone neoplasm Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 3
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 3
- 101000914496 Homo sapiens T-cell antigen CD7 Proteins 0.000 claims description 3
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 claims description 3
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 3
- 208000029742 colonic neoplasm Diseases 0.000 claims description 3
- 201000004101 esophageal cancer Diseases 0.000 claims description 3
- 201000007270 liver cancer Diseases 0.000 claims description 3
- 208000014018 liver neoplasm Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 150000003384 small molecules Chemical class 0.000 claims description 3
- 238000011269 treatment regimen Methods 0.000 claims description 3
- 206010046766 uterine cancer Diseases 0.000 claims description 3
- 102000008203 CTLA-4 Antigen Human genes 0.000 claims description 2
- 206010038111 Recurrent cancer Diseases 0.000 claims description 2
- 206010070308 Refractory cancer Diseases 0.000 claims description 2
- 208000025997 central nervous system neoplasm Diseases 0.000 claims description 2
- 201000003115 germ cell cancer Diseases 0.000 claims description 2
- 208000037819 metastatic cancer Diseases 0.000 claims description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 claims description 2
- 208000016691 refractory malignant neoplasm Diseases 0.000 claims description 2
- 208000015347 renal cell adenocarcinoma Diseases 0.000 claims description 2
- 102000008096 B7-H1 Antigen Human genes 0.000 claims 1
- 230000003902 lesion Effects 0.000 claims 1
- 230000009870 specific binding Effects 0.000 abstract description 2
- 210000004027 cell Anatomy 0.000 description 85
- 230000000694 effects Effects 0.000 description 65
- 229960003301 nivolumab Drugs 0.000 description 58
- 239000003814 drug Substances 0.000 description 56
- 241000699666 Mus <mouse, genus> Species 0.000 description 55
- 230000014509 gene expression Effects 0.000 description 52
- 241000699670 Mus sp. Species 0.000 description 51
- 239000000427 antigen Substances 0.000 description 50
- 108091007433 antigens Proteins 0.000 description 50
- 102000036639 antigens Human genes 0.000 description 50
- 229940079593 drug Drugs 0.000 description 43
- 239000003795 chemical substances by application Substances 0.000 description 42
- 238000002648 combination therapy Methods 0.000 description 41
- 238000009097 single-agent therapy Methods 0.000 description 40
- 229960005386 ipilimumab Drugs 0.000 description 34
- 230000000259 anti-tumor effect Effects 0.000 description 33
- 239000000203 mixture Substances 0.000 description 33
- 210000004369 blood Anatomy 0.000 description 31
- 239000008280 blood Substances 0.000 description 31
- 230000006044 T cell activation Effects 0.000 description 26
- 239000003446 ligand Substances 0.000 description 26
- 238000002560 therapeutic procedure Methods 0.000 description 25
- 230000037396 body weight Effects 0.000 description 24
- 230000000903 blocking effect Effects 0.000 description 23
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 22
- 102100040247 Tumor necrosis factor Human genes 0.000 description 22
- 230000005764 inhibitory process Effects 0.000 description 22
- 239000000523 sample Substances 0.000 description 22
- 150000001413 amino acids Chemical group 0.000 description 21
- 238000000338 in vitro Methods 0.000 description 21
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 20
- 239000005557 antagonist Substances 0.000 description 20
- 102000004127 Cytokines Human genes 0.000 description 19
- 108090000695 Cytokines Proteins 0.000 description 19
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 19
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 19
- 150000001875 compounds Chemical class 0.000 description 19
- 239000012636 effector Substances 0.000 description 19
- 230000001404 mediated effect Effects 0.000 description 19
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 18
- 108090000623 proteins and genes Proteins 0.000 description 18
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 17
- 108060003951 Immunoglobulin Proteins 0.000 description 17
- 102000018358 immunoglobulin Human genes 0.000 description 17
- 101000679851 Homo sapiens Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 16
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 15
- 241000880493 Leptailurus serval Species 0.000 description 15
- 230000003042 antagnostic effect Effects 0.000 description 15
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 14
- 102000000588 Interleukin-2 Human genes 0.000 description 14
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 14
- 235000001014 amino acid Nutrition 0.000 description 14
- 239000012634 fragment Substances 0.000 description 14
- 230000002093 peripheral effect Effects 0.000 description 14
- 229940024606 amino acid Drugs 0.000 description 13
- 230000006870 function Effects 0.000 description 13
- 235000018102 proteins Nutrition 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 13
- 206010027476 Metastases Diseases 0.000 description 12
- 102000050320 human TNFRSF4 Human genes 0.000 description 12
- 230000009401 metastasis Effects 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 12
- 230000006052 T cell proliferation Effects 0.000 description 11
- YOOAQCZYZHGUAZ-KATARQTJSA-N Thr-Leu-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YOOAQCZYZHGUAZ-KATARQTJSA-N 0.000 description 11
- 238000000684 flow cytometry Methods 0.000 description 11
- 230000028327 secretion Effects 0.000 description 11
- 230000008685 targeting Effects 0.000 description 11
- 238000001802 infusion Methods 0.000 description 10
- 150000003839 salts Chemical class 0.000 description 10
- 241000894007 species Species 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 208000003950 B-cell lymphoma Diseases 0.000 description 9
- 108010087819 Fc receptors Proteins 0.000 description 9
- 102000009109 Fc receptors Human genes 0.000 description 9
- OYTPNWYZORARHL-XHNCKOQMSA-N Gln-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N OYTPNWYZORARHL-XHNCKOQMSA-N 0.000 description 9
- 108010065920 Insulin Lispro Proteins 0.000 description 9
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 9
- 102000004473 OX40 Ligand Human genes 0.000 description 9
- 108010042215 OX40 Ligand Proteins 0.000 description 9
- 206010042971 T-cell lymphoma Diseases 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 230000000875 corresponding effect Effects 0.000 description 9
- 238000010790 dilution Methods 0.000 description 9
- 239000012895 dilution Substances 0.000 description 9
- 230000003828 downregulation Effects 0.000 description 9
- 239000003112 inhibitor Substances 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 230000002062 proliferating effect Effects 0.000 description 9
- 230000035755 proliferation Effects 0.000 description 9
- 229920006395 saturated elastomer Polymers 0.000 description 9
- 229940124597 therapeutic agent Drugs 0.000 description 9
- 241000282693 Cercopithecidae Species 0.000 description 8
- SZQCDCKIGWQAQN-FXQIFTODSA-N Cys-Arg-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O SZQCDCKIGWQAQN-FXQIFTODSA-N 0.000 description 8
- 238000002965 ELISA Methods 0.000 description 8
- 102000008166 Member 25 Tumor Necrosis Factor Receptors Human genes 0.000 description 8
- 108010060408 Member 25 Tumor Necrosis Factor Receptors Proteins 0.000 description 8
- 229930012538 Paclitaxel Natural products 0.000 description 8
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 8
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 8
- 230000004913 activation Effects 0.000 description 8
- 239000002246 antineoplastic agent Substances 0.000 description 8
- 231100000673 dose–response relationship Toxicity 0.000 description 8
- 239000003937 drug carrier Substances 0.000 description 8
- 210000004602 germ cell Anatomy 0.000 description 8
- 230000001506 immunosuppresive effect Effects 0.000 description 8
- 229960001592 paclitaxel Drugs 0.000 description 8
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 8
- 102100027207 CD27 antigen Human genes 0.000 description 7
- 102100032937 CD40 ligand Human genes 0.000 description 7
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 7
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 7
- 102100022339 Integrin alpha-L Human genes 0.000 description 7
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 7
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 7
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 7
- QYSFWUIXDFJUDW-DCAQKATOSA-N Ser-Leu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QYSFWUIXDFJUDW-DCAQKATOSA-N 0.000 description 7
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 7
- 102100022205 Tumor necrosis factor receptor superfamily member 21 Human genes 0.000 description 7
- 101710187751 Tumor necrosis factor receptor superfamily member 21 Proteins 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 238000002512 chemotherapy Methods 0.000 description 7
- 230000002596 correlated effect Effects 0.000 description 7
- 238000004132 cross linking Methods 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 230000018109 developmental process Effects 0.000 description 7
- 238000010494 dissociation reaction Methods 0.000 description 7
- 230000005593 dissociations Effects 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Natural products NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 7
- 210000000987 immune system Anatomy 0.000 description 7
- 229940045207 immuno-oncology agent Drugs 0.000 description 7
- 239000002584 immunological anticancer agent Substances 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 210000000822 natural killer cell Anatomy 0.000 description 7
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 7
- 108090000765 processed proteins & peptides Proteins 0.000 description 7
- 238000007920 subcutaneous administration Methods 0.000 description 7
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 7
- 108010044292 tryptophyltyrosine Proteins 0.000 description 7
- 102100032912 CD44 antigen Human genes 0.000 description 6
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 6
- HYIFFZAQXPUEAU-QWRGUYRKSA-N Leu-Gly-Leu Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC(C)C HYIFFZAQXPUEAU-QWRGUYRKSA-N 0.000 description 6
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- FQPDRTDDEZXCEC-SVSWQMSJSA-N Thr-Ile-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O FQPDRTDDEZXCEC-SVSWQMSJSA-N 0.000 description 6
- HTONZBWRYUKUKC-RCWTZXSCSA-N Val-Thr-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O HTONZBWRYUKUKC-RCWTZXSCSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 238000007792 addition Methods 0.000 description 6
- 108010069020 alanyl-prolyl-glycine Proteins 0.000 description 6
- 108010047495 alanylglycine Proteins 0.000 description 6
- 238000009175 antibody therapy Methods 0.000 description 6
- 238000013459 approach Methods 0.000 description 6
- 108010060035 arginylproline Proteins 0.000 description 6
- 210000003719 b-lymphocyte Anatomy 0.000 description 6
- 229940127089 cytotoxic agent Drugs 0.000 description 6
- 230000003111 delayed effect Effects 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 108010010147 glycylglutamine Proteins 0.000 description 6
- 102000048362 human PDCD1 Human genes 0.000 description 6
- 210000002865 immune cell Anatomy 0.000 description 6
- 108091008042 inhibitory receptors Proteins 0.000 description 6
- 230000037361 pathway Effects 0.000 description 6
- 230000002265 prevention Effects 0.000 description 6
- 108010090894 prolylleucine Proteins 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- ZDILXFDENZVOTL-BPNCWPANSA-N Ala-Val-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZDILXFDENZVOTL-BPNCWPANSA-N 0.000 description 5
- JSHWXQIZOCVWIA-ZKWXMUAHSA-N Asp-Ser-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O JSHWXQIZOCVWIA-ZKWXMUAHSA-N 0.000 description 5
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 5
- 102100027581 Forkhead box protein P3 Human genes 0.000 description 5
- FQCILXROGNOZON-YUMQZZPRSA-N Gln-Pro-Gly Chemical compound NC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O FQCILXROGNOZON-YUMQZZPRSA-N 0.000 description 5
- AVZHGSCDKIQZPQ-CIUDSAMLSA-N Glu-Arg-Ala Chemical compound C[C@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CCC(O)=O)C(O)=O AVZHGSCDKIQZPQ-CIUDSAMLSA-N 0.000 description 5
- INGJLBQKTRJLFO-UKJIMTQDSA-N Glu-Ile-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCC(O)=O INGJLBQKTRJLFO-UKJIMTQDSA-N 0.000 description 5
- PDUHNKAFQXQNLH-ZETCQYMHSA-N Gly-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)NCC(O)=O PDUHNKAFQXQNLH-ZETCQYMHSA-N 0.000 description 5
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 5
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 5
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 5
- 101000610605 Homo sapiens Tumor necrosis factor receptor superfamily member 10A Proteins 0.000 description 5
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 5
- 101000795167 Homo sapiens Tumor necrosis factor receptor superfamily member 13B Proteins 0.000 description 5
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 5
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 5
- PMGDADKJMCOXHX-UHFFFAOYSA-N L-Arginyl-L-glutamin-acetat Natural products NC(=N)NCCCC(N)C(=O)NC(CCC(N)=O)C(O)=O PMGDADKJMCOXHX-UHFFFAOYSA-N 0.000 description 5
- FEHQLKKBVJHSEC-SZMVWBNQSA-N Leu-Glu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 FEHQLKKBVJHSEC-SZMVWBNQSA-N 0.000 description 5
- LCNASHSOFMRYFO-WDCWCFNPSA-N Leu-Thr-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O LCNASHSOFMRYFO-WDCWCFNPSA-N 0.000 description 5
- FMDHKPRACUXATF-ACZMJKKPSA-N Ser-Gln-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O FMDHKPRACUXATF-ACZMJKKPSA-N 0.000 description 5
- YMTLKLXDFCSCNX-BYPYZUCNSA-N Ser-Gly-Gly Chemical compound OC[C@H](N)C(=O)NCC(=O)NCC(O)=O YMTLKLXDFCSCNX-BYPYZUCNSA-N 0.000 description 5
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 5
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 5
- MBLJBGZWLHTJBH-SZMVWBNQSA-N Trp-Val-Arg Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 MBLJBGZWLHTJBH-SZMVWBNQSA-N 0.000 description 5
- 102100040113 Tumor necrosis factor receptor superfamily member 10A Human genes 0.000 description 5
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 5
- 102100029675 Tumor necrosis factor receptor superfamily member 13B Human genes 0.000 description 5
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 5
- QOIKZODVIPOPDD-AVGNSLFASA-N Tyr-Cys-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(O)=O QOIKZODVIPOPDD-AVGNSLFASA-N 0.000 description 5
- PZTZYZUTCPZWJH-FXQIFTODSA-N Val-Ser-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PZTZYZUTCPZWJH-FXQIFTODSA-N 0.000 description 5
- 230000003213 activating effect Effects 0.000 description 5
- 108010008685 alanyl-glutamyl-aspartic acid Proteins 0.000 description 5
- 230000030741 antigen processing and presentation Effects 0.000 description 5
- 108010008355 arginyl-glutamine Proteins 0.000 description 5
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000011284 combination treatment Methods 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 239000006185 dispersion Substances 0.000 description 5
- 238000012377 drug delivery Methods 0.000 description 5
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 5
- 108010067216 glycyl-glycyl-glycine Proteins 0.000 description 5
- 201000005787 hematologic cancer Diseases 0.000 description 5
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 5
- 102000048776 human CD274 Human genes 0.000 description 5
- 229940072221 immunoglobulins Drugs 0.000 description 5
- 238000009169 immunotherapy Methods 0.000 description 5
- 230000006872 improvement Effects 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 238000007918 intramuscular administration Methods 0.000 description 5
- 201000011649 lymphoblastic lymphoma Diseases 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 201000001441 melanoma Diseases 0.000 description 5
- 210000003071 memory t lymphocyte Anatomy 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 210000005259 peripheral blood Anatomy 0.000 description 5
- 239000011886 peripheral blood Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 206010041823 squamous cell carcinoma Diseases 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 4
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 4
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 4
- 102100022089 Acyl-[acyl-carrier-protein] hydrolase Human genes 0.000 description 4
- WNHNMKOFKCHKKD-BFHQHQDPSA-N Ala-Thr-Gly Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O WNHNMKOFKCHKKD-BFHQHQDPSA-N 0.000 description 4
- YBZMTKUDWXZLIX-UWVGGRQHSA-N Arg-Leu-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YBZMTKUDWXZLIX-UWVGGRQHSA-N 0.000 description 4
- AOHKLEBWKMKITA-IHRRRGAJSA-N Arg-Phe-Ser Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N AOHKLEBWKMKITA-IHRRRGAJSA-N 0.000 description 4
- ANRZCQXIXGDXLR-CWRNSKLLSA-N Asn-Trp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CNC3=CC=CC=C32)NC(=O)[C@H](CC(=O)N)N)C(=O)O ANRZCQXIXGDXLR-CWRNSKLLSA-N 0.000 description 4
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 4
- 102000006942 B-Cell Maturation Antigen Human genes 0.000 description 4
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 4
- 101000964894 Bos taurus 14-3-3 protein zeta/delta Proteins 0.000 description 4
- 102100038078 CD276 antigen Human genes 0.000 description 4
- 108010029697 CD40 Ligand Proteins 0.000 description 4
- XMVZMBGFIOQONW-GARJFASQSA-N Cys-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CS)N)C(=O)O XMVZMBGFIOQONW-GARJFASQSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 229920001917 Ficoll Polymers 0.000 description 4
- JXFLPKSDLDEOQK-JHEQGTHGSA-N Gln-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O JXFLPKSDLDEOQK-JHEQGTHGSA-N 0.000 description 4
- PAQUJCSYVIBPLC-AVGNSLFASA-N Glu-Asp-Phe Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 PAQUJCSYVIBPLC-AVGNSLFASA-N 0.000 description 4
- NVTPVQLIZCOJFK-FOHZUACHSA-N Gly-Thr-Asp Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O NVTPVQLIZCOJFK-FOHZUACHSA-N 0.000 description 4
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 description 4
- 101000824278 Homo sapiens Acyl-[acyl-carrier-protein] hydrolase Proteins 0.000 description 4
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 4
- 101000861452 Homo sapiens Forkhead box protein P3 Proteins 0.000 description 4
- 101000610602 Homo sapiens Tumor necrosis factor receptor superfamily member 10C Proteins 0.000 description 4
- 101000610609 Homo sapiens Tumor necrosis factor receptor superfamily member 10D Proteins 0.000 description 4
- 101000801227 Homo sapiens Tumor necrosis factor receptor superfamily member 19 Proteins 0.000 description 4
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 4
- 101000597785 Homo sapiens Tumor necrosis factor receptor superfamily member 6B Proteins 0.000 description 4
- IITVUURPOYGCTD-NAKRPEOUSA-N Ile-Pro-Ala Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O IITVUURPOYGCTD-NAKRPEOUSA-N 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- HXWALXSAVBLTPK-NUTKFTJISA-N Leu-Ala-Trp Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(C)C)N HXWALXSAVBLTPK-NUTKFTJISA-N 0.000 description 4
- PVMPDMIKUVNOBD-CIUDSAMLSA-N Leu-Asp-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O PVMPDMIKUVNOBD-CIUDSAMLSA-N 0.000 description 4
- SBANPBVRHYIMRR-GARJFASQSA-N Leu-Ser-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N SBANPBVRHYIMRR-GARJFASQSA-N 0.000 description 4
- PDIDTSZKKFEDMB-UWVGGRQHSA-N Lys-Pro-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O PDIDTSZKKFEDMB-UWVGGRQHSA-N 0.000 description 4
- UGCIQUYEJIEHKX-GVXVVHGQSA-N Lys-Val-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O UGCIQUYEJIEHKX-GVXVVHGQSA-N 0.000 description 4
- 241000282567 Macaca fascicularis Species 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 4
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 4
- 108010032605 Nerve Growth Factor Receptors Proteins 0.000 description 4
- KLYYKKGCPOGDPE-OEAJRASXSA-N Phe-Thr-Leu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O KLYYKKGCPOGDPE-OEAJRASXSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- PRKWBYCXBBSLSK-GUBZILKMSA-N Pro-Ser-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O PRKWBYCXBBSLSK-GUBZILKMSA-N 0.000 description 4
- OBXVZEAMXFSGPU-FXQIFTODSA-N Ser-Asn-Arg Chemical compound C(C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N)CN=C(N)N OBXVZEAMXFSGPU-FXQIFTODSA-N 0.000 description 4
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 4
- ZIFYDQAFEMIZII-GUBZILKMSA-N Ser-Leu-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O ZIFYDQAFEMIZII-GUBZILKMSA-N 0.000 description 4
- ADJDNJCSPNFFPI-FXQIFTODSA-N Ser-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CO ADJDNJCSPNFFPI-FXQIFTODSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 230000005867 T cell response Effects 0.000 description 4
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 4
- BIBYEFRASCNLAA-CDMKHQONSA-N Thr-Phe-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=CC=C1 BIBYEFRASCNLAA-CDMKHQONSA-N 0.000 description 4
- 102100040115 Tumor necrosis factor receptor superfamily member 10C Human genes 0.000 description 4
- 102100040110 Tumor necrosis factor receptor superfamily member 10D Human genes 0.000 description 4
- 102100033725 Tumor necrosis factor receptor superfamily member 16 Human genes 0.000 description 4
- 102100033760 Tumor necrosis factor receptor superfamily member 19 Human genes 0.000 description 4
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 4
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 4
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 description 4
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 description 4
- 102100035284 Tumor necrosis factor receptor superfamily member 6B Human genes 0.000 description 4
- GAYLGYUVTDMLKC-UWJYBYFXSA-N Tyr-Asp-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 GAYLGYUVTDMLKC-UWJYBYFXSA-N 0.000 description 4
- QUILOGWWLXMSAT-IHRRRGAJSA-N Tyr-Gln-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O QUILOGWWLXMSAT-IHRRRGAJSA-N 0.000 description 4
- AGKDVLSDNSTLFA-UMNHJUIQSA-N Val-Gln-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N1CCC[C@@H]1C(=O)O)N AGKDVLSDNSTLFA-UMNHJUIQSA-N 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 210000000612 antigen-presenting cell Anatomy 0.000 description 4
- 239000003963 antioxidant agent Substances 0.000 description 4
- 235000006708 antioxidants Nutrition 0.000 description 4
- 108010043240 arginyl-leucyl-glycine Proteins 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 230000010261 cell growth Effects 0.000 description 4
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 4
- 238000011260 co-administration Methods 0.000 description 4
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 4
- HESCAJZNRMSMJG-HGYUPSKWSA-N epothilone A Natural products O=C1[C@H](C)[C@H](O)[C@H](C)CCC[C@H]2O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C HESCAJZNRMSMJG-HGYUPSKWSA-N 0.000 description 4
- 108010078144 glutaminyl-glycine Proteins 0.000 description 4
- 108010050848 glycylleucine Proteins 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 238000002513 implantation Methods 0.000 description 4
- 238000010348 incorporation Methods 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 238000007913 intrathecal administration Methods 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- 239000002502 liposome Substances 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 229950004563 lucatumumab Drugs 0.000 description 4
- 210000002540 macrophage Anatomy 0.000 description 4
- 208000025113 myeloid leukemia Diseases 0.000 description 4
- 230000003285 pharmacodynamic effect Effects 0.000 description 4
- 230000000144 pharmacologic effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 108010029020 prolylglycine Proteins 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 108010084932 tryptophyl-proline Proteins 0.000 description 4
- 230000002792 vascular Effects 0.000 description 4
- AADVCYNFEREWOS-UHFFFAOYSA-N (+)-DDM Natural products C=CC=CC(C)C(OC(N)=O)C(C)C(O)C(C)CC(C)=CC(C)C(O)C(C)C=CC(O)CC1OC(=O)C(C)C(O)C1C AADVCYNFEREWOS-UHFFFAOYSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- 102100026423 Adhesion G protein-coupled receptor E5 Human genes 0.000 description 3
- VKKYFICVTYKFIO-CIUDSAMLSA-N Arg-Ala-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N VKKYFICVTYKFIO-CIUDSAMLSA-N 0.000 description 3
- VUGWHBXPMAHEGZ-SRVKXCTJSA-N Arg-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CCCN=C(N)N VUGWHBXPMAHEGZ-SRVKXCTJSA-N 0.000 description 3
- UVTGNSWSRSCPLP-UHFFFAOYSA-N Arg-Tyr Natural products NC(CCNC(=N)N)C(=O)NC(Cc1ccc(O)cc1)C(=O)O UVTGNSWSRSCPLP-UHFFFAOYSA-N 0.000 description 3
- MKJBPDLENBUHQU-CIUDSAMLSA-N Asn-Ser-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O MKJBPDLENBUHQU-CIUDSAMLSA-N 0.000 description 3
- UGXYFDQFLVCDFC-CIUDSAMLSA-N Asn-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O UGXYFDQFLVCDFC-CIUDSAMLSA-N 0.000 description 3
- JBDLMLZNDRLDIX-HJGDQZAQSA-N Asn-Thr-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O JBDLMLZNDRLDIX-HJGDQZAQSA-N 0.000 description 3
- MNQMTYSEKZHIDF-GCJQMDKQSA-N Asp-Thr-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O MNQMTYSEKZHIDF-GCJQMDKQSA-N 0.000 description 3
- ZUNMTUPRQMWMHX-LSJOCFKGSA-N Asp-Val-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(O)=O ZUNMTUPRQMWMHX-LSJOCFKGSA-N 0.000 description 3
- 108091007065 BIRCs Proteins 0.000 description 3
- 102100038077 CD226 antigen Human genes 0.000 description 3
- 102100025221 CD70 antigen Human genes 0.000 description 3
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- PKNIZMPLMSKROD-BIIVOSGPSA-N Cys-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CS)N PKNIZMPLMSKROD-BIIVOSGPSA-N 0.000 description 3
- AADVCYNFEREWOS-OBRABYBLSA-N Discodermolide Chemical compound C=C\C=C/[C@H](C)[C@H](OC(N)=O)[C@@H](C)[C@H](O)[C@@H](C)C\C(C)=C/[C@H](C)[C@@H](O)[C@@H](C)\C=C/[C@@H](O)C[C@@H]1OC(=O)[C@H](C)[C@@H](O)[C@H]1C AADVCYNFEREWOS-OBRABYBLSA-N 0.000 description 3
- 231100000491 EC50 Toxicity 0.000 description 3
- 206010014733 Endometrial cancer Diseases 0.000 description 3
- 206010014759 Endometrial neoplasm Diseases 0.000 description 3
- 108010021472 Fc gamma receptor IIB Proteins 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- ZFBBMCKQSNJZSN-AUTRQRHGSA-N Gln-Val-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZFBBMCKQSNJZSN-AUTRQRHGSA-N 0.000 description 3
- FLQAKQOBSPFGKG-CIUDSAMLSA-N Glu-Cys-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@H](C(O)=O)CCCN=C(N)N FLQAKQOBSPFGKG-CIUDSAMLSA-N 0.000 description 3
- MIIVFRCYJABHTQ-ONGXEEELSA-N Gly-Leu-Val Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O MIIVFRCYJABHTQ-ONGXEEELSA-N 0.000 description 3
- WNZOCXUOGVYYBJ-CDMKHQONSA-N Gly-Phe-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)CN)O WNZOCXUOGVYYBJ-CDMKHQONSA-N 0.000 description 3
- HAOUOFNNJJLVNS-BQBZGAKWSA-N Gly-Pro-Ser Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O HAOUOFNNJJLVNS-BQBZGAKWSA-N 0.000 description 3
- KSOBNUBCYHGUKH-UWVGGRQHSA-N Gly-Val-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)CN KSOBNUBCYHGUKH-UWVGGRQHSA-N 0.000 description 3
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 3
- JBCLFWXMTIKCCB-UHFFFAOYSA-N H-Gly-Phe-OH Natural products NCC(=O)NC(C(O)=O)CC1=CC=CC=C1 JBCLFWXMTIKCCB-UHFFFAOYSA-N 0.000 description 3
- HYWZHNUGAYVEEW-KKUMJFAQSA-N His-Phe-Ser Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CC2=CN=CN2)N HYWZHNUGAYVEEW-KKUMJFAQSA-N 0.000 description 3
- 208000017604 Hodgkin disease Diseases 0.000 description 3
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 3
- 101000718243 Homo sapiens Adhesion G protein-coupled receptor E5 Proteins 0.000 description 3
- 101000884298 Homo sapiens CD226 antigen Proteins 0.000 description 3
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 3
- 101000868215 Homo sapiens CD40 ligand Proteins 0.000 description 3
- 101001068136 Homo sapiens Hepatitis A virus cellular receptor 1 Proteins 0.000 description 3
- 101001046683 Homo sapiens Integrin alpha-L Proteins 0.000 description 3
- 101000831286 Homo sapiens Protein timeless homolog Proteins 0.000 description 3
- 101000752245 Homo sapiens Rho guanine nucleotide exchange factor 5 Proteins 0.000 description 3
- 101000980827 Homo sapiens T-cell surface glycoprotein CD1a Proteins 0.000 description 3
- 101000716149 Homo sapiens T-cell surface glycoprotein CD1b Proteins 0.000 description 3
- 101000716124 Homo sapiens T-cell surface glycoprotein CD1c Proteins 0.000 description 3
- 101000798130 Homo sapiens Tumor necrosis factor receptor superfamily member 11B Proteins 0.000 description 3
- 101000648505 Homo sapiens Tumor necrosis factor receptor superfamily member 12A Proteins 0.000 description 3
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 102100034980 ICOS ligand Human genes 0.000 description 3
- 108010073807 IgG Receptors Proteins 0.000 description 3
- 102000009490 IgG Receptors Human genes 0.000 description 3
- TYYLDKGBCJGJGW-UHFFFAOYSA-N L-tryptophan-L-tyrosine Natural products C=1NC2=CC=CC=C2C=1CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 TYYLDKGBCJGJGW-UHFFFAOYSA-N 0.000 description 3
- AXZGZMGRBDQTEY-SRVKXCTJSA-N Leu-Gln-Met Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCSC)C(O)=O AXZGZMGRBDQTEY-SRVKXCTJSA-N 0.000 description 3
- GPICTNQYKHHHTH-GUBZILKMSA-N Leu-Gln-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O GPICTNQYKHHHTH-GUBZILKMSA-N 0.000 description 3
- YOKVEHGYYQEQOP-QWRGUYRKSA-N Leu-Leu-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YOKVEHGYYQEQOP-QWRGUYRKSA-N 0.000 description 3
- KIZIOFNVSOSKJI-CIUDSAMLSA-N Leu-Ser-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N KIZIOFNVSOSKJI-CIUDSAMLSA-N 0.000 description 3
- AIMGJYMCTAABEN-GVXVVHGQSA-N Leu-Val-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O AIMGJYMCTAABEN-GVXVVHGQSA-N 0.000 description 3
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 3
- GQZMPWBZQALKJO-UWVGGRQHSA-N Lys-Gly-Arg Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O GQZMPWBZQALKJO-UWVGGRQHSA-N 0.000 description 3
- XABXVVSWUVCZST-GVXVVHGQSA-N Lys-Val-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](N)CCCCN XABXVVSWUVCZST-GVXVVHGQSA-N 0.000 description 3
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 3
- 206010027145 Melanocytic naevus Diseases 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 3
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 3
- 208000007256 Nevus Diseases 0.000 description 3
- MCIXMYKSPQUMJG-SRVKXCTJSA-N Phe-Ser-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MCIXMYKSPQUMJG-SRVKXCTJSA-N 0.000 description 3
- FGWUALWGCZJQDJ-URLPEUOOSA-N Phe-Thr-Ile Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O FGWUALWGCZJQDJ-URLPEUOOSA-N 0.000 description 3
- XQLBWXHVZVBNJM-FXQIFTODSA-N Pro-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1 XQLBWXHVZVBNJM-FXQIFTODSA-N 0.000 description 3
- IHCXPSYCHXFXKT-DCAQKATOSA-N Pro-Arg-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(O)=O IHCXPSYCHXFXKT-DCAQKATOSA-N 0.000 description 3
- ZSKJPKFTPQCPIH-RCWTZXSCSA-N Pro-Arg-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O ZSKJPKFTPQCPIH-RCWTZXSCSA-N 0.000 description 3
- TUYWCHPXKQTISF-LPEHRKFASA-N Pro-Cys-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CS)C(=O)N2CCC[C@@H]2C(=O)O TUYWCHPXKQTISF-LPEHRKFASA-N 0.000 description 3
- 101710094000 Programmed cell death 1 ligand 1 Proteins 0.000 description 3
- QEDMOZUJTGEIBF-FXQIFTODSA-N Ser-Arg-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O QEDMOZUJTGEIBF-FXQIFTODSA-N 0.000 description 3
- PVDTYLHUWAEYGY-CIUDSAMLSA-N Ser-Glu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O PVDTYLHUWAEYGY-CIUDSAMLSA-N 0.000 description 3
- YUJLIIRMIAGMCQ-CIUDSAMLSA-N Ser-Leu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YUJLIIRMIAGMCQ-CIUDSAMLSA-N 0.000 description 3
- NNFMANHDYSVNIO-DCAQKATOSA-N Ser-Lys-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NNFMANHDYSVNIO-DCAQKATOSA-N 0.000 description 3
- RHAPJNVNWDBFQI-BQBZGAKWSA-N Ser-Pro-Gly Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O RHAPJNVNWDBFQI-BQBZGAKWSA-N 0.000 description 3
- OZPDGESCTGGNAD-CIUDSAMLSA-N Ser-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CO OZPDGESCTGGNAD-CIUDSAMLSA-N 0.000 description 3
- CUXJENOFJXOSOZ-BIIVOSGPSA-N Ser-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CO)N)C(=O)O CUXJENOFJXOSOZ-BIIVOSGPSA-N 0.000 description 3
- 102000008115 Signaling Lymphocytic Activation Molecule Family Member 1 Human genes 0.000 description 3
- 108010074687 Signaling Lymphocytic Activation Molecule Family Member 1 Proteins 0.000 description 3
- 102100024219 T-cell surface glycoprotein CD1a Human genes 0.000 description 3
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 3
- BVOVIGCHYNFJBZ-JXUBOQSCSA-N Thr-Leu-Ala Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O BVOVIGCHYNFJBZ-JXUBOQSCSA-N 0.000 description 3
- HOVLHEKTGVIKAP-WDCWCFNPSA-N Thr-Leu-Gln Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O HOVLHEKTGVIKAP-WDCWCFNPSA-N 0.000 description 3
- DXPURPNJDFCKKO-RHYQMDGZSA-N Thr-Lys-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)[C@@H](C)O)C(O)=O DXPURPNJDFCKKO-RHYQMDGZSA-N 0.000 description 3
- 102100032236 Tumor necrosis factor receptor superfamily member 11B Human genes 0.000 description 3
- 102100028786 Tumor necrosis factor receptor superfamily member 12A Human genes 0.000 description 3
- JWHOIHCOHMZSAR-QWRGUYRKSA-N Tyr-Asp-Gly Chemical compound OC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 JWHOIHCOHMZSAR-QWRGUYRKSA-N 0.000 description 3
- MQGGXGKQSVEQHR-KKUMJFAQSA-N Tyr-Ser-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 MQGGXGKQSVEQHR-KKUMJFAQSA-N 0.000 description 3
- MWUYSCVVPVITMW-IGNZVWTISA-N Tyr-Tyr-Ala Chemical compound C([C@@H](C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 MWUYSCVVPVITMW-IGNZVWTISA-N 0.000 description 3
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 3
- MYLNLEIZWHVENT-VKOGCVSHSA-N Val-Ile-Trp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](C(C)C)N MYLNLEIZWHVENT-VKOGCVSHSA-N 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 208000037844 advanced solid tumor Diseases 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 3
- 239000004037 angiogenesis inhibitor Substances 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 230000001028 anti-proliverative effect Effects 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 108010052670 arginyl-glutamyl-glutamic acid Proteins 0.000 description 3
- 108010062796 arginyllysine Proteins 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- 238000001574 biopsy Methods 0.000 description 3
- 230000008499 blood brain barrier function Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 3
- 229940127093 camptothecin Drugs 0.000 description 3
- 230000030833 cell death Effects 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 239000002612 dispersion medium Substances 0.000 description 3
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 210000003162 effector t lymphocyte Anatomy 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- HPAIKDPJURGQLN-UHFFFAOYSA-N glycyl-L-histidyl-L-phenylalanine Natural products C=1C=CC=CC=1CC(C(O)=O)NC(=O)C(NC(=O)CN)CC1=CN=CN1 HPAIKDPJURGQLN-UHFFFAOYSA-N 0.000 description 3
- 108010019832 glycyl-asparaginyl-glycine Proteins 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 229960002751 imiquimod Drugs 0.000 description 3
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 3
- 230000005934 immune activation Effects 0.000 description 3
- 229940127121 immunoconjugate Drugs 0.000 description 3
- 230000005847 immunogenicity Effects 0.000 description 3
- 239000007943 implant Substances 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000004073 interleukin-2 production Effects 0.000 description 3
- 239000007951 isotonicity adjuster Substances 0.000 description 3
- 239000000787 lecithin Substances 0.000 description 3
- 235000010445 lecithin Nutrition 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- 108010073472 leucyl-prolyl-proline Proteins 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 210000004324 lymphatic system Anatomy 0.000 description 3
- 108010064235 lysylglycine Proteins 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 230000000771 oncological effect Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 229960002621 pembrolizumab Drugs 0.000 description 3
- 108010025488 pinealon Proteins 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 108010093296 prolyl-prolyl-alanine Proteins 0.000 description 3
- 108010087846 prolyl-prolyl-glycine Proteins 0.000 description 3
- 108010070643 prolylglutamic acid Proteins 0.000 description 3
- 238000001959 radiotherapy Methods 0.000 description 3
- 230000000306 recurrent effect Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 201000006845 reticulosarcoma Diseases 0.000 description 3
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 3
- 229960004641 rituximab Drugs 0.000 description 3
- 238000005070 sampling Methods 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 229940104230 thymidine Drugs 0.000 description 3
- 238000011200 topical administration Methods 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 108010035534 tyrosyl-leucyl-alanine Proteins 0.000 description 3
- 108010071635 tyrosyl-prolyl-arginine Proteins 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- 238000010200 validation analysis Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- 108010027345 wheylin-1 peptide Proteins 0.000 description 3
- GJLXVWOMRRWCIB-MERZOTPQSA-N (2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-acetamido-5-(diaminomethylideneamino)pentanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanoyl]amino]-6-aminohexanamide Chemical compound C([C@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=C(O)C=C1 GJLXVWOMRRWCIB-MERZOTPQSA-N 0.000 description 2
- IESDGNYHXIOKRW-YXMSTPNBSA-N (2s)-2-[[(2s)-1-[(2s)-6-amino-2-[[(2s,3r)-2-amino-3-hydroxybutanoyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IESDGNYHXIOKRW-YXMSTPNBSA-N 0.000 description 2
- DIBLBAURNYJYBF-XLXZRNDBSA-N (2s)-2-[[(2s)-2-[[2-[[(2s)-6-amino-2-[[(2s)-2-amino-3-methylbutanoyl]amino]hexanoyl]amino]acetyl]amino]-3-phenylpropanoyl]amino]-3-(4-hydroxyphenyl)propanoic acid Chemical compound C([C@H](NC(=O)CNC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 DIBLBAURNYJYBF-XLXZRNDBSA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- IHWDSEPNZDYMNF-UHFFFAOYSA-N 1H-indol-2-amine Chemical compound C1=CC=C2NC(N)=CC2=C1 IHWDSEPNZDYMNF-UHFFFAOYSA-N 0.000 description 2
- 102000002627 4-1BB Ligand Human genes 0.000 description 2
- 108010082808 4-1BB Ligand Proteins 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- 206010000830 Acute leukaemia Diseases 0.000 description 2
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 2
- 208000036832 Adenocarcinoma of ovary Diseases 0.000 description 2
- LGQPPBQRUBVTIF-JBDRJPRFSA-N Ala-Ala-Ile Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O LGQPPBQRUBVTIF-JBDRJPRFSA-N 0.000 description 2
- WCBVQNZTOKJWJS-ACZMJKKPSA-N Ala-Cys-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(O)=O)C(O)=O WCBVQNZTOKJWJS-ACZMJKKPSA-N 0.000 description 2
- KXEVYGKATAMXJJ-ACZMJKKPSA-N Ala-Glu-Asp Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O KXEVYGKATAMXJJ-ACZMJKKPSA-N 0.000 description 2
- NBTGEURICRTMGL-WHFBIAKZSA-N Ala-Gly-Ser Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O NBTGEURICRTMGL-WHFBIAKZSA-N 0.000 description 2
- OBVSBEYOMDWLRJ-BFHQHQDPSA-N Ala-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@H](C)N OBVSBEYOMDWLRJ-BFHQHQDPSA-N 0.000 description 2
- FOHXUHGZZKETFI-JBDRJPRFSA-N Ala-Ile-Cys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](C)N FOHXUHGZZKETFI-JBDRJPRFSA-N 0.000 description 2
- FVNAUOZKIPAYNA-BPNCWPANSA-N Ala-Met-Tyr Chemical compound CSCC[C@H](NC(=O)[C@H](C)N)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 FVNAUOZKIPAYNA-BPNCWPANSA-N 0.000 description 2
- XQNRANMFRPCFFW-GCJQMDKQSA-N Ala-Thr-Asn Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](C)N)O XQNRANMFRPCFFW-GCJQMDKQSA-N 0.000 description 2
- HCBKAOZYACJUEF-XQXXSGGOSA-N Ala-Thr-Gln Chemical compound N[C@@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CCC(N)=O)C(=O)O HCBKAOZYACJUEF-XQXXSGGOSA-N 0.000 description 2
- GIVATXIGCXFQQA-FXQIFTODSA-N Arg-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N GIVATXIGCXFQQA-FXQIFTODSA-N 0.000 description 2
- PQWTZSNVWSOFFK-FXQIFTODSA-N Arg-Asp-Asn Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N)CN=C(N)N PQWTZSNVWSOFFK-FXQIFTODSA-N 0.000 description 2
- DXQIQUIQYAGRCC-CIUDSAMLSA-N Arg-Asp-Gln Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)CN=C(N)N DXQIQUIQYAGRCC-CIUDSAMLSA-N 0.000 description 2
- ZATRYQNPUHGXCU-DTWKUNHWSA-N Arg-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CCCN=C(N)N)N)C(=O)O ZATRYQNPUHGXCU-DTWKUNHWSA-N 0.000 description 2
- NMRHDSAOIURTNT-RWMBFGLXSA-N Arg-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N NMRHDSAOIURTNT-RWMBFGLXSA-N 0.000 description 2
- FOQFHANLUJDQEE-GUBZILKMSA-N Arg-Pro-Cys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CCCN=C(N)N)N)C(=O)N[C@@H](CS)C(=O)O FOQFHANLUJDQEE-GUBZILKMSA-N 0.000 description 2
- DNLQVHBBMPZUGJ-BQBZGAKWSA-N Arg-Ser-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O DNLQVHBBMPZUGJ-BQBZGAKWSA-N 0.000 description 2
- ZJBUILVYSXQNSW-YTWAJWBKSA-N Arg-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N)O ZJBUILVYSXQNSW-YTWAJWBKSA-N 0.000 description 2
- 102000004452 Arginase Human genes 0.000 description 2
- 108700024123 Arginases Proteins 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- VDCIPFYVCICPEC-FXQIFTODSA-N Asn-Arg-Ala Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O VDCIPFYVCICPEC-FXQIFTODSA-N 0.000 description 2
- WVCJSDCHTUTONA-FXQIFTODSA-N Asn-Asp-Arg Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O WVCJSDCHTUTONA-FXQIFTODSA-N 0.000 description 2
- FAEFJTCTNZTPHX-ACZMJKKPSA-N Asn-Gln-Ala Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O FAEFJTCTNZTPHX-ACZMJKKPSA-N 0.000 description 2
- RBOBTTLFPRSXKZ-BZSNNMDCSA-N Asn-Phe-Tyr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O RBOBTTLFPRSXKZ-BZSNNMDCSA-N 0.000 description 2
- BCADFFUQHIMQAA-KKHAAJSZSA-N Asn-Thr-Val Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O BCADFFUQHIMQAA-KKHAAJSZSA-N 0.000 description 2
- LGCVSPFCFXWUEY-IHPCNDPISA-N Asn-Trp-Tyr Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CC3=CC=C(C=C3)O)C(=O)O)NC(=O)[C@H](CC(=O)N)N LGCVSPFCFXWUEY-IHPCNDPISA-N 0.000 description 2
- SLHOOKXYTYAJGQ-XVYDVKMFSA-N Asp-Ala-His Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CNC=N1 SLHOOKXYTYAJGQ-XVYDVKMFSA-N 0.000 description 2
- NJIKKGUVGUBICV-ZLUOBGJFSA-N Asp-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O NJIKKGUVGUBICV-ZLUOBGJFSA-N 0.000 description 2
- YNQIDCRRTWGHJD-ZLUOBGJFSA-N Asp-Asn-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC(O)=O YNQIDCRRTWGHJD-ZLUOBGJFSA-N 0.000 description 2
- VZNOVQKGJQJOCS-SRVKXCTJSA-N Asp-Asp-Tyr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O VZNOVQKGJQJOCS-SRVKXCTJSA-N 0.000 description 2
- HSWYMWGDMPLTTH-FXQIFTODSA-N Asp-Glu-Gln Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O HSWYMWGDMPLTTH-FXQIFTODSA-N 0.000 description 2
- SNDBKTFJWVEVPO-WHFBIAKZSA-N Asp-Gly-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(O)=O SNDBKTFJWVEVPO-WHFBIAKZSA-N 0.000 description 2
- BKOIIURTQAJHAT-GUBZILKMSA-N Asp-Pro-Pro Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 BKOIIURTQAJHAT-GUBZILKMSA-N 0.000 description 2
- VNXQRBXEQXLERQ-CIUDSAMLSA-N Asp-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(=O)O)N VNXQRBXEQXLERQ-CIUDSAMLSA-N 0.000 description 2
- YIDFBWRHIYOYAA-LKXGYXEUSA-N Asp-Ser-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O YIDFBWRHIYOYAA-LKXGYXEUSA-N 0.000 description 2
- IWLZBRTUIVXZJD-OLHMAJIHSA-N Asp-Thr-Asp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O IWLZBRTUIVXZJD-OLHMAJIHSA-N 0.000 description 2
- 208000028564 B-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 description 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- 101710185679 CD276 antigen Proteins 0.000 description 2
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 2
- 241000699800 Cricetinae Species 0.000 description 2
- TVYMKYUSZSVOAG-ZLUOBGJFSA-N Cys-Ala-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O TVYMKYUSZSVOAG-ZLUOBGJFSA-N 0.000 description 2
- UPJGYXRAPJWIHD-CIUDSAMLSA-N Cys-Asn-Leu Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O UPJGYXRAPJWIHD-CIUDSAMLSA-N 0.000 description 2
- ZXCAQANTQWBICD-DCAQKATOSA-N Cys-Lys-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CS)N ZXCAQANTQWBICD-DCAQKATOSA-N 0.000 description 2
- FANFRJOFTYCNRG-JYBASQMISA-N Cys-Thr-Trp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CS)N)O FANFRJOFTYCNRG-JYBASQMISA-N 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 102100037354 Ectodysplasin-A Human genes 0.000 description 2
- 108091006020 Fc-tagged proteins Proteins 0.000 description 2
- 201000008808 Fibrosarcoma Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- JESJDAAGXULQOP-CIUDSAMLSA-N Gln-Arg-Ser Chemical compound C(C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)CN=C(N)N JESJDAAGXULQOP-CIUDSAMLSA-N 0.000 description 2
- UICOTGULOUGGLC-NUMRIWBASA-N Gln-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N)O UICOTGULOUGGLC-NUMRIWBASA-N 0.000 description 2
- DRDSQGHKTLSNEA-GLLZPBPUSA-N Gln-Glu-Thr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O DRDSQGHKTLSNEA-GLLZPBPUSA-N 0.000 description 2
- FGYPOQPQTUNESW-IUCAKERBSA-N Gln-Gly-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CCC(=O)N)N FGYPOQPQTUNESW-IUCAKERBSA-N 0.000 description 2
- NSORZJXKUQFEKL-JGVFFNPUSA-N Gln-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CCC(=O)N)N)C(=O)O NSORZJXKUQFEKL-JGVFFNPUSA-N 0.000 description 2
- MSHXWFKYXJTLEZ-CIUDSAMLSA-N Gln-Met-Asn Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)N)N MSHXWFKYXJTLEZ-CIUDSAMLSA-N 0.000 description 2
- JILRMFFFCHUUTJ-ACZMJKKPSA-N Gln-Ser-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O JILRMFFFCHUUTJ-ACZMJKKPSA-N 0.000 description 2
- OTQSTOXRUBVWAP-NRPADANISA-N Gln-Ser-Val Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O OTQSTOXRUBVWAP-NRPADANISA-N 0.000 description 2
- RSUVOPBMWMTVDI-XEGUGMAKSA-N Glu-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CCC(O)=O)C)C(O)=O)=CNC2=C1 RSUVOPBMWMTVDI-XEGUGMAKSA-N 0.000 description 2
- GLWXKFRTOHKGIT-ACZMJKKPSA-N Glu-Asn-Asn Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O GLWXKFRTOHKGIT-ACZMJKKPSA-N 0.000 description 2
- QPRZKNOOOBWXSU-CIUDSAMLSA-N Glu-Asp-Arg Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N QPRZKNOOOBWXSU-CIUDSAMLSA-N 0.000 description 2
- OXEMJGCAJFFREE-FXQIFTODSA-N Glu-Gln-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O OXEMJGCAJFFREE-FXQIFTODSA-N 0.000 description 2
- HNVFSTLPVJWIDV-CIUDSAMLSA-N Glu-Glu-Gln Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O HNVFSTLPVJWIDV-CIUDSAMLSA-N 0.000 description 2
- KASDBWKLWJKTLJ-GUBZILKMSA-N Glu-Glu-Met Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCSC)C(O)=O KASDBWKLWJKTLJ-GUBZILKMSA-N 0.000 description 2
- XMPAXPSENRSOSV-RYUDHWBXSA-N Glu-Gly-Tyr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O XMPAXPSENRSOSV-RYUDHWBXSA-N 0.000 description 2
- DMYACXMQUABZIQ-NRPADANISA-N Glu-Ser-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O DMYACXMQUABZIQ-NRPADANISA-N 0.000 description 2
- MFYLRRCYBBJYPI-JYJNAYRXSA-N Glu-Tyr-Lys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O MFYLRRCYBBJYPI-JYJNAYRXSA-N 0.000 description 2
- YQPFCZVKMUVZIN-AUTRQRHGSA-N Glu-Val-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O YQPFCZVKMUVZIN-AUTRQRHGSA-N 0.000 description 2
- PUUYVMYCMIWHFE-BQBZGAKWSA-N Gly-Ala-Arg Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N PUUYVMYCMIWHFE-BQBZGAKWSA-N 0.000 description 2
- VSVZIEVNUYDAFR-YUMQZZPRSA-N Gly-Ala-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)CN VSVZIEVNUYDAFR-YUMQZZPRSA-N 0.000 description 2
- KRRMJKMGWWXWDW-STQMWFEESA-N Gly-Arg-Phe Chemical compound NC(=N)NCCC[C@H](NC(=O)CN)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 KRRMJKMGWWXWDW-STQMWFEESA-N 0.000 description 2
- GGEJHJIXRBTJPD-BYPYZUCNSA-N Gly-Asn-Gly Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O GGEJHJIXRBTJPD-BYPYZUCNSA-N 0.000 description 2
- XCLCVBYNGXEVDU-WHFBIAKZSA-N Gly-Asn-Ser Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O XCLCVBYNGXEVDU-WHFBIAKZSA-N 0.000 description 2
- GRIRDMVMJJDZKV-RCOVLWMOSA-N Gly-Asn-Val Chemical compound [H]NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O GRIRDMVMJJDZKV-RCOVLWMOSA-N 0.000 description 2
- PMNHJLASAAWELO-FOHZUACHSA-N Gly-Asp-Thr Chemical compound [H]NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PMNHJLASAAWELO-FOHZUACHSA-N 0.000 description 2
- BYYNJRSNDARRBX-YFKPBYRVSA-N Gly-Gln-Gly Chemical compound NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O BYYNJRSNDARRBX-YFKPBYRVSA-N 0.000 description 2
- PABFFPWEJMEVEC-JGVFFNPUSA-N Gly-Gln-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)N)NC(=O)CN)C(=O)O PABFFPWEJMEVEC-JGVFFNPUSA-N 0.000 description 2
- BIRKKBCSAIHDDF-WDSKDSINSA-N Gly-Glu-Cys Chemical compound NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CS)C(O)=O BIRKKBCSAIHDDF-WDSKDSINSA-N 0.000 description 2
- UQJNXZSSGQIPIQ-FBCQKBJTSA-N Gly-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)CN UQJNXZSSGQIPIQ-FBCQKBJTSA-N 0.000 description 2
- SCWYHUQOOFRVHP-MBLNEYKQSA-N Gly-Ile-Thr Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SCWYHUQOOFRVHP-MBLNEYKQSA-N 0.000 description 2
- IUKIDFVOUHZRAK-QWRGUYRKSA-N Gly-Lys-His Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 IUKIDFVOUHZRAK-QWRGUYRKSA-N 0.000 description 2
- RVGMVLVBDRQVKB-UWVGGRQHSA-N Gly-Met-His Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)CN RVGMVLVBDRQVKB-UWVGGRQHSA-N 0.000 description 2
- NSVOVKWEKGEOQB-LURJTMIESA-N Gly-Pro-Gly Chemical compound NCC(=O)N1CCC[C@H]1C(=O)NCC(O)=O NSVOVKWEKGEOQB-LURJTMIESA-N 0.000 description 2
- JSLVAHYTAJJEQH-QWRGUYRKSA-N Gly-Ser-Phe Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 JSLVAHYTAJJEQH-QWRGUYRKSA-N 0.000 description 2
- ZZWUYQXMIFTIIY-WEDXCCLWSA-N Gly-Thr-Leu Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O ZZWUYQXMIFTIIY-WEDXCCLWSA-N 0.000 description 2
- DNVDEMWIYLVIQU-RCOVLWMOSA-N Gly-Val-Asp Chemical compound NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O DNVDEMWIYLVIQU-RCOVLWMOSA-N 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- WMKXFMUJRCEGRP-SRVKXCTJSA-N His-Asn-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)N WMKXFMUJRCEGRP-SRVKXCTJSA-N 0.000 description 2
- MWXBCJKQRQFVOO-DCAQKATOSA-N His-Cys-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CC1=CN=CN1)N MWXBCJKQRQFVOO-DCAQKATOSA-N 0.000 description 2
- TVMNTHXFRSXZGR-IHRRRGAJSA-N His-Lys-Val Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O TVMNTHXFRSXZGR-IHRRRGAJSA-N 0.000 description 2
- 102000003964 Histone deacetylase Human genes 0.000 description 2
- 108090000353 Histone deacetylase Proteins 0.000 description 2
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 description 2
- 101000884279 Homo sapiens CD276 antigen Proteins 0.000 description 2
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 2
- 101000880080 Homo sapiens Ectodysplasin-A Proteins 0.000 description 2
- 101001019455 Homo sapiens ICOS ligand Proteins 0.000 description 2
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- HOLOYAZCIHDQNS-YVNDNENWSA-N Ile-Gln-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N HOLOYAZCIHDQNS-YVNDNENWSA-N 0.000 description 2
- NZGTYCMLUGYMCV-XUXIUFHCSA-N Ile-Lys-Arg Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N NZGTYCMLUGYMCV-XUXIUFHCSA-N 0.000 description 2
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 2
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 2
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 102000055031 Inhibitor of Apoptosis Proteins Human genes 0.000 description 2
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 2
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 208000006404 Large Granular Lymphocytic Leukemia Diseases 0.000 description 2
- FGNQZXKVAZIMCI-CIUDSAMLSA-N Leu-Asp-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CS)C(=O)O)N FGNQZXKVAZIMCI-CIUDSAMLSA-N 0.000 description 2
- CQGSYZCULZMEDE-UHFFFAOYSA-N Leu-Gln-Pro Natural products CC(C)CC(N)C(=O)NC(CCC(N)=O)C(=O)N1CCCC1C(O)=O CQGSYZCULZMEDE-UHFFFAOYSA-N 0.000 description 2
- YFBBUHJJUXXZOF-UWVGGRQHSA-N Leu-Gly-Pro Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N1CCC[C@H]1C(O)=O YFBBUHJJUXXZOF-UWVGGRQHSA-N 0.000 description 2
- HYMLKESRWLZDBR-WEDXCCLWSA-N Leu-Gly-Thr Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O HYMLKESRWLZDBR-WEDXCCLWSA-N 0.000 description 2
- IAJFFZORSWOZPQ-SRVKXCTJSA-N Leu-Leu-Asn Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O IAJFFZORSWOZPQ-SRVKXCTJSA-N 0.000 description 2
- VCHVSKNMTXWIIP-SRVKXCTJSA-N Leu-Lys-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O VCHVSKNMTXWIIP-SRVKXCTJSA-N 0.000 description 2
- XOWMDXHFSBCAKQ-SRVKXCTJSA-N Leu-Ser-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC(C)C XOWMDXHFSBCAKQ-SRVKXCTJSA-N 0.000 description 2
- MVJRBCJCRYGCKV-GVXVVHGQSA-N Leu-Val-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O MVJRBCJCRYGCKV-GVXVVHGQSA-N 0.000 description 2
- YQFZRHYZLARWDY-IHRRRGAJSA-N Leu-Val-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCCCN YQFZRHYZLARWDY-IHRRRGAJSA-N 0.000 description 2
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 2
- 101710099301 Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- MPGHETGWWWUHPY-CIUDSAMLSA-N Lys-Ala-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN MPGHETGWWWUHPY-CIUDSAMLSA-N 0.000 description 2
- UWKNTTJNVSYXPC-CIUDSAMLSA-N Lys-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN UWKNTTJNVSYXPC-CIUDSAMLSA-N 0.000 description 2
- XNKDCYABMBBEKN-IUCAKERBSA-N Lys-Gly-Gln Chemical compound NCCCC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(N)=O XNKDCYABMBBEKN-IUCAKERBSA-N 0.000 description 2
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 2
- 101710150918 Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 2
- YKWHHKDMBZBMLG-GUBZILKMSA-N Met-Cys-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CCSC)N YKWHHKDMBZBMLG-GUBZILKMSA-N 0.000 description 2
- LBSWWNKMVPAXOI-GUBZILKMSA-N Met-Val-Ser Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O LBSWWNKMVPAXOI-GUBZILKMSA-N 0.000 description 2
- 208000034578 Multiple myelomas Diseases 0.000 description 2
- WUGMRIBZSVSJNP-UHFFFAOYSA-N N-L-alanyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)C)C(O)=O)=CNC2=C1 WUGMRIBZSVSJNP-UHFFFAOYSA-N 0.000 description 2
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 2
- 102000008299 Nitric Oxide Synthase Human genes 0.000 description 2
- 108010021487 Nitric Oxide Synthase Proteins 0.000 description 2
- YGACXVRLDHEXKY-WXRXAMBDSA-N O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 Chemical compound O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 YGACXVRLDHEXKY-WXRXAMBDSA-N 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 206010061328 Ovarian epithelial cancer Diseases 0.000 description 2
- 229940124060 PD-1 antagonist Drugs 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- 206010057249 Phagocytosis Diseases 0.000 description 2
- HXSUFWQYLPKEHF-IHRRRGAJSA-N Phe-Asn-Arg Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N HXSUFWQYLPKEHF-IHRRRGAJSA-N 0.000 description 2
- BWTKUQPNOMMKMA-FIRPJDEBSA-N Phe-Ile-Phe Chemical compound C([C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 BWTKUQPNOMMKMA-FIRPJDEBSA-N 0.000 description 2
- MSHZERMPZKCODG-ACRUOGEOSA-N Phe-Leu-Phe Chemical compound C([C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 MSHZERMPZKCODG-ACRUOGEOSA-N 0.000 description 2
- KAJLHCWRWDSROH-BZSNNMDCSA-N Phe-Phe-Asp Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(O)=O)C(O)=O)C1=CC=CC=C1 KAJLHCWRWDSROH-BZSNNMDCSA-N 0.000 description 2
- JDMKQHSHKJHAHR-UHFFFAOYSA-N Phe-Phe-Leu-Tyr Natural products C=1C=C(O)C=CC=1CC(C(O)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)CC1=CC=CC=C1 JDMKQHSHKJHAHR-UHFFFAOYSA-N 0.000 description 2
- YMIZSYUAZJSOFL-SRVKXCTJSA-N Phe-Ser-Asn Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O YMIZSYUAZJSOFL-SRVKXCTJSA-N 0.000 description 2
- QTDBZORPVYTRJU-KKXDTOCCSA-N Phe-Tyr-Ala Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C)C(O)=O QTDBZORPVYTRJU-KKXDTOCCSA-N 0.000 description 2
- GTMSCDVFQLNEOY-BZSNNMDCSA-N Phe-Tyr-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N GTMSCDVFQLNEOY-BZSNNMDCSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- VXCHGLYSIOOZIS-GUBZILKMSA-N Pro-Ala-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1 VXCHGLYSIOOZIS-GUBZILKMSA-N 0.000 description 2
- UTAUEDINXUMHLG-FXQIFTODSA-N Pro-Asp-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@@H]1CCCN1 UTAUEDINXUMHLG-FXQIFTODSA-N 0.000 description 2
- OLTFZQIYCNOBLI-DCAQKATOSA-N Pro-Cys-Lys Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCCN)C(=O)O OLTFZQIYCNOBLI-DCAQKATOSA-N 0.000 description 2
- XJROSHJRQTXWAE-XGEHTFHBSA-N Pro-Cys-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XJROSHJRQTXWAE-XGEHTFHBSA-N 0.000 description 2
- VPEVBAUSTBWQHN-NHCYSSNCSA-N Pro-Glu-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O VPEVBAUSTBWQHN-NHCYSSNCSA-N 0.000 description 2
- ULIWFCCJIOEHMU-BQBZGAKWSA-N Pro-Gly-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 ULIWFCCJIOEHMU-BQBZGAKWSA-N 0.000 description 2
- HAAQQNHQZBOWFO-LURJTMIESA-N Pro-Gly-Gly Chemical compound OC(=O)CNC(=O)CNC(=O)[C@@H]1CCCN1 HAAQQNHQZBOWFO-LURJTMIESA-N 0.000 description 2
- LEIKGVHQTKHOLM-IUCAKERBSA-N Pro-Pro-Gly Chemical compound OC(=O)CNC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 LEIKGVHQTKHOLM-IUCAKERBSA-N 0.000 description 2
- PCWLNNZTBJTZRN-AVGNSLFASA-N Pro-Pro-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 PCWLNNZTBJTZRN-AVGNSLFASA-N 0.000 description 2
- FDMKYQQYJKYCLV-GUBZILKMSA-N Pro-Pro-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 FDMKYQQYJKYCLV-GUBZILKMSA-N 0.000 description 2
- KWMZPPWYBVZIER-XGEHTFHBSA-N Pro-Ser-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KWMZPPWYBVZIER-XGEHTFHBSA-N 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 229940079156 Proteasome inhibitor Drugs 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- WTWGOQRNRFHFQD-JBDRJPRFSA-N Ser-Ala-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WTWGOQRNRFHFQD-JBDRJPRFSA-N 0.000 description 2
- WDXYVIIVDIDOSX-DCAQKATOSA-N Ser-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CCCN=C(N)N WDXYVIIVDIDOSX-DCAQKATOSA-N 0.000 description 2
- VGNYHOBZJKWRGI-CIUDSAMLSA-N Ser-Asn-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CO VGNYHOBZJKWRGI-CIUDSAMLSA-N 0.000 description 2
- CTLVSHXLRVEILB-UBHSHLNASA-N Ser-Asn-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N CTLVSHXLRVEILB-UBHSHLNASA-N 0.000 description 2
- GZFAWAQTEYDKII-YUMQZZPRSA-N Ser-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO GZFAWAQTEYDKII-YUMQZZPRSA-N 0.000 description 2
- GZSZPKSBVAOGIE-CIUDSAMLSA-N Ser-Lys-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O GZSZPKSBVAOGIE-CIUDSAMLSA-N 0.000 description 2
- PPCZVWHJWJFTFN-ZLUOBGJFSA-N Ser-Ser-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPCZVWHJWJFTFN-ZLUOBGJFSA-N 0.000 description 2
- OLKICIBQRVSQMA-SRVKXCTJSA-N Ser-Ser-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O OLKICIBQRVSQMA-SRVKXCTJSA-N 0.000 description 2
- NADLKBTYNKUJEP-KATARQTJSA-N Ser-Thr-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O NADLKBTYNKUJEP-KATARQTJSA-N 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 2
- 208000026651 T-cell prolymphocytic leukemia Diseases 0.000 description 2
- DWYAUVCQDTZIJI-VZFHVOOUSA-N Thr-Ala-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O DWYAUVCQDTZIJI-VZFHVOOUSA-N 0.000 description 2
- CAJFZCICSVBOJK-SHGPDSBTSA-N Thr-Ala-Thr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CAJFZCICSVBOJK-SHGPDSBTSA-N 0.000 description 2
- XSLXHSYIVPGEER-KZVJFYERSA-N Thr-Ala-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O XSLXHSYIVPGEER-KZVJFYERSA-N 0.000 description 2
- VASYSJHSMSBTDU-LKXGYXEUSA-N Thr-Asn-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CS)C(=O)O)N)O VASYSJHSMSBTDU-LKXGYXEUSA-N 0.000 description 2
- DSLHSTIUAPKERR-XGEHTFHBSA-N Thr-Cys-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(O)=O DSLHSTIUAPKERR-XGEHTFHBSA-N 0.000 description 2
- DIPIPFHFLPTCLK-LOKLDPHHSA-N Thr-Gln-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N1CCC[C@@H]1C(=O)O)N)O DIPIPFHFLPTCLK-LOKLDPHHSA-N 0.000 description 2
- GKWNLDNXMMLRMC-GLLZPBPUSA-N Thr-Glu-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N)O GKWNLDNXMMLRMC-GLLZPBPUSA-N 0.000 description 2
- SGAOHNPSEPVAFP-ZDLURKLDSA-N Thr-Ser-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O SGAOHNPSEPVAFP-ZDLURKLDSA-N 0.000 description 2
- BEZTUFWTPVOROW-KJEVXHAQSA-N Thr-Tyr-Arg Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N)O BEZTUFWTPVOROW-KJEVXHAQSA-N 0.000 description 2
- OGOYMQWIWHGTGH-KZVJFYERSA-N Thr-Val-Ala Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O OGOYMQWIWHGTGH-KZVJFYERSA-N 0.000 description 2
- AXEJRUGTOJPZKG-XGEHTFHBSA-N Thr-Val-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CS)C(=O)O)N)O AXEJRUGTOJPZKG-XGEHTFHBSA-N 0.000 description 2
- HDQJVXVRGJUDML-UBHSHLNASA-N Trp-Cys-Asn Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(=O)N)C(=O)O)N HDQJVXVRGJUDML-UBHSHLNASA-N 0.000 description 2
- SVGAWGVHFIYAEE-JSGCOSHPSA-N Trp-Gly-Gln Chemical compound C1=CC=C2C(C[C@H](N)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O)=CNC2=C1 SVGAWGVHFIYAEE-JSGCOSHPSA-N 0.000 description 2
- NLWCSMOXNKBRLC-WDSOQIARSA-N Trp-Lys-Val Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(O)=O NLWCSMOXNKBRLC-WDSOQIARSA-N 0.000 description 2
- 102100024587 Tumor necrosis factor ligand superfamily member 15 Human genes 0.000 description 2
- 102100031988 Tumor necrosis factor ligand superfamily member 6 Human genes 0.000 description 2
- SLCSPPCQWUHPPO-JYJNAYRXSA-N Tyr-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 SLCSPPCQWUHPPO-JYJNAYRXSA-N 0.000 description 2
- KGSDLCMCDFETHU-YESZJQIVSA-N Tyr-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)C(=O)O KGSDLCMCDFETHU-YESZJQIVSA-N 0.000 description 2
- UPODKYBYUBTWSV-BZSNNMDCSA-N Tyr-Phe-Cys Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CS)C(O)=O)C1=CC=C(O)C=C1 UPODKYBYUBTWSV-BZSNNMDCSA-N 0.000 description 2
- YYLHVUCSTXXKBS-IHRRRGAJSA-N Tyr-Pro-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O YYLHVUCSTXXKBS-IHRRRGAJSA-N 0.000 description 2
- RIVVDNTUSRVTQT-IRIUXVKKSA-N Tyr-Thr-Gln Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N)O RIVVDNTUSRVTQT-IRIUXVKKSA-N 0.000 description 2
- NUQZCPSZHGIYTA-HKUYNNGSSA-N Tyr-Trp-Gly Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N NUQZCPSZHGIYTA-HKUYNNGSSA-N 0.000 description 2
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 description 2
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 2
- FRUYSSRPJXNRRB-GUBZILKMSA-N Val-Cys-Arg Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N FRUYSSRPJXNRRB-GUBZILKMSA-N 0.000 description 2
- XTDDIVQWDXMRJL-IHRRRGAJSA-N Val-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](C(C)C)N XTDDIVQWDXMRJL-IHRRRGAJSA-N 0.000 description 2
- SYSWVVCYSXBVJG-RHYQMDGZSA-N Val-Leu-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)N)O SYSWVVCYSXBVJG-RHYQMDGZSA-N 0.000 description 2
- KRAHMIJVUPUOTQ-DCAQKATOSA-N Val-Ser-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N KRAHMIJVUPUOTQ-DCAQKATOSA-N 0.000 description 2
- TVGWMCTYUFBXAP-QTKMDUPCSA-N Val-Thr-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](C(C)C)N)O TVGWMCTYUFBXAP-QTKMDUPCSA-N 0.000 description 2
- GVNLOVJNNDZUHS-RHYQMDGZSA-N Val-Thr-Lys Chemical compound [H]N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(O)=O GVNLOVJNNDZUHS-RHYQMDGZSA-N 0.000 description 2
- OWFGFHQMSBTKLX-UFYCRDLUSA-N Val-Tyr-Tyr Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N OWFGFHQMSBTKLX-UFYCRDLUSA-N 0.000 description 2
- ZHWZDZFWBXWPDW-GUBZILKMSA-N Val-Val-Cys Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CS)C(O)=O ZHWZDZFWBXWPDW-GUBZILKMSA-N 0.000 description 2
- LLJLBRRXKZTTRD-GUBZILKMSA-N Val-Val-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(=O)O)N LLJLBRRXKZTTRD-GUBZILKMSA-N 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 208000016025 Waldenstroem macroglobulinemia Diseases 0.000 description 2
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 2
- 208000019790 abdominal distention Diseases 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 230000008484 agonism Effects 0.000 description 2
- 108010024078 alanyl-glycyl-serine Proteins 0.000 description 2
- 108010041407 alanylaspartic acid Proteins 0.000 description 2
- 108010087924 alanylproline Proteins 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 2
- 230000002491 angiogenic effect Effects 0.000 description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 230000000340 anti-metabolite Effects 0.000 description 2
- 230000009830 antibody antigen interaction Effects 0.000 description 2
- 239000000611 antibody drug conjugate Substances 0.000 description 2
- 229940049595 antibody-drug conjugate Drugs 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 229940100197 antimetabolite Drugs 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 229940034982 antineoplastic agent Drugs 0.000 description 2
- 230000005975 antitumor immune response Effects 0.000 description 2
- 108010009111 arginyl-glycyl-glutamic acid Proteins 0.000 description 2
- 108010091092 arginyl-glycyl-proline Proteins 0.000 description 2
- 108010092854 aspartyllysine Proteins 0.000 description 2
- 108010068265 aspartyltyrosine Proteins 0.000 description 2
- 229940120638 avastin Drugs 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229960000397 bevacizumab Drugs 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 235000020958 biotin Nutrition 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 229960001467 bortezomib Drugs 0.000 description 2
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 239000012876 carrier material Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 229940030156 cell vaccine Drugs 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 210000003679 cervix uteri Anatomy 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000004154 complement system Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 2
- 108010016616 cysteinylglycine Proteins 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 239000002254 cytotoxic agent Substances 0.000 description 2
- 231100000599 cytotoxic agent Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 229960002806 daclizumab Drugs 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 229940029030 dendritic cell vaccine Drugs 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 230000007783 downstream signaling Effects 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229940056913 eftilagimod alfa Drugs 0.000 description 2
- HESCAJZNRMSMJG-KKQRBIROSA-N epothilone A Chemical compound C/C([C@@H]1C[C@@H]2O[C@@H]2CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 HESCAJZNRMSMJG-KKQRBIROSA-N 0.000 description 2
- QXRSDHAAWVKZLJ-PVYNADRNSA-N epothilone B Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 QXRSDHAAWVKZLJ-PVYNADRNSA-N 0.000 description 2
- QAMYWGZHLCQOOJ-WRNBYXCMSA-N eribulin mesylate Chemical compound CS(O)(=O)=O.C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 QAMYWGZHLCQOOJ-WRNBYXCMSA-N 0.000 description 2
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 229950001109 galiximab Drugs 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 108010013768 glutamyl-aspartyl-proline Proteins 0.000 description 2
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 2
- 108010049041 glutamylalanine Proteins 0.000 description 2
- 108010000434 glycyl-alanyl-leucine Proteins 0.000 description 2
- 108010050475 glycyl-leucyl-tyrosine Proteins 0.000 description 2
- 108010074027 glycyl-seryl-phenylalanine Proteins 0.000 description 2
- 108010089804 glycyl-threonine Proteins 0.000 description 2
- 210000003128 head Anatomy 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 description 2
- 208000019691 hematopoietic and lymphoid cell neoplasm Diseases 0.000 description 2
- 210000003630 histaminocyte Anatomy 0.000 description 2
- 102000043321 human CTLA4 Human genes 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 230000003832 immune regulation Effects 0.000 description 2
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 2
- 238000002991 immunohistochemical analysis Methods 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 229960001438 immunostimulant agent Drugs 0.000 description 2
- 239000003022 immunostimulating agent Substances 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 238000005462 in vivo assay Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 229960003130 interferon gamma Drugs 0.000 description 2
- 230000000968 intestinal effect Effects 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 208000037393 large granular lymphocyte leukemia Diseases 0.000 description 2
- 108010044311 leucyl-glycyl-glycine Proteins 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 108010017391 lysylvaline Proteins 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 201000005962 mycosis fungoides Diseases 0.000 description 2
- 210000003739 neck Anatomy 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 238000011275 oncology therapy Methods 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 208000013371 ovarian adenocarcinoma Diseases 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 201000006588 ovary adenocarcinoma Diseases 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 230000008782 phagocytosis Effects 0.000 description 2
- 108010070409 phenylalanyl-glycyl-glycine Proteins 0.000 description 2
- 108010024654 phenylalanyl-prolyl-alanine Proteins 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920005862 polyol Polymers 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 2
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- 108010020755 prolyl-glycyl-glycine Proteins 0.000 description 2
- 108010031719 prolyl-serine Proteins 0.000 description 2
- 108010015796 prolylisoleucine Proteins 0.000 description 2
- 239000003207 proteasome inhibitor Substances 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000010187 selection method Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 108010069117 seryl-lysyl-aspartic acid Proteins 0.000 description 2
- 108010026333 seryl-proline Proteins 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 229940126625 tavolimab Drugs 0.000 description 2
- 208000001608 teratocarcinoma Diseases 0.000 description 2
- 229960003604 testosterone Drugs 0.000 description 2
- 230000004797 therapeutic response Effects 0.000 description 2
- 108010061238 threonyl-glycine Proteins 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 229960005267 tositumomab Drugs 0.000 description 2
- 231100000027 toxicology Toxicity 0.000 description 2
- 231100000041 toxicology testing Toxicity 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 229960000575 trastuzumab Drugs 0.000 description 2
- 229950007217 tremelimumab Drugs 0.000 description 2
- 229950005972 urelumab Drugs 0.000 description 2
- 108010052774 valyl-lysyl-glycyl-phenylalanyl-tyrosine Proteins 0.000 description 2
- 108010003885 valyl-prolyl-glycyl-glycine Proteins 0.000 description 2
- 108010009962 valyltyrosine Proteins 0.000 description 2
- 238000012795 verification Methods 0.000 description 2
- 229940055760 yervoy Drugs 0.000 description 2
- 229960005499 (+)-discodermolide Drugs 0.000 description 1
- FCCNKYGSMOSYPV-DEDISHTHSA-N (-)-Epothilone E Natural products O=C1[C@H](C)[C@H](O)[C@@H](C)CCC[C@H]2O[C@H]2C[C@@H](/C(=C\c2nc(CO)sc2)/C)OC(=O)C[C@H](O)C1(C)C FCCNKYGSMOSYPV-DEDISHTHSA-N 0.000 description 1
- UKIMCRYGLFQEOE-RLHMMOOASA-N (-)-Epothilone F Natural products O=C1[C@H](C)[C@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@@H](/C(=C\c2nc(CO)sc2)/C)OC(=O)C[C@H](O)C1(C)C UKIMCRYGLFQEOE-RLHMMOOASA-N 0.000 description 1
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 description 1
- TXXFZHIQMSBVAR-YGFYDDMGSA-N (1r,5s,6s,7r,10s,14s,16s)-14-[(e)-1-(2-ethyl-1,3-thiazol-4-yl)prop-1-en-2-yl]-6,10-dihydroxy-5,7,9,9-tetramethyl-13,17-dioxabicyclo[14.1.0]heptadecane-8,12-dione Chemical compound S1C(CC)=NC(\C=C(/C)[C@H]2OC(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)CCC[C@H]3O[C@H]3C2)=C1 TXXFZHIQMSBVAR-YGFYDDMGSA-N 0.000 description 1
- COEXAQSTZUWMRI-STQMWFEESA-N (2s)-1-[2-[[(2s)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound C([C@H](N)C(=O)NCC(=O)N1[C@@H](CCC1)C(O)=O)C1=CC=C(O)C=C1 COEXAQSTZUWMRI-STQMWFEESA-N 0.000 description 1
- JPSHPWJJSVEEAX-OWPBQMJCSA-N (2s)-2-amino-4-fluoranylpentanedioic acid Chemical compound OC(=O)[C@@H](N)CC([18F])C(O)=O JPSHPWJJSVEEAX-OWPBQMJCSA-N 0.000 description 1
- MYBGWENAVMIGMM-GIFXNVAJSA-N (2s)-4-(2,5-difluorophenyl)-n-[(3r,4s)-3-fluoro-1-methylpiperidin-4-yl]-2-(hydroxymethyl)-n-methyl-2-phenyl-2,5-dihydro-1h-pyrrole-1-carboxamide Chemical compound N1([C@](C=C(C1)C=1C(=CC=C(F)C=1)F)(CO)C=1C=CC=CC=1)C(=O)N(C)[C@H]1CCN(C)C[C@H]1F MYBGWENAVMIGMM-GIFXNVAJSA-N 0.000 description 1
- ZGEOSZCDHUVWOC-SSHVMUOYSA-N (2s)-6-amino-2-[[(2s)-5-amino-2-[[(2s)-2-[[(2s,3s)-2-[[(2s)-1-[(2s)-2-[[(2s)-2-aminopropanoyl]amino]-3-methylbutanoyl]pyrrolidine-2-carbonyl]amino]-3-methylpentanoyl]amino]propanoyl]amino]-5-oxopentanoyl]amino]hexanoic acid Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H](C)N)C(C)C ZGEOSZCDHUVWOC-SSHVMUOYSA-N 0.000 description 1
- OOKIODJYZSVHDO-QMYFOHRPSA-N (2s)-n-tert-butyl-1-[(2s)-1-[(2s)-2-[[(2s)-2-[[(2s)-2-(dimethylamino)-3-methylbutanoyl]amino]-3-methylbutanoyl]-methylamino]-3-methylbutanoyl]pyrrolidine-2-carbonyl]pyrrolidine-2-carboxamide;hydrochloride Chemical compound Cl.CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(=O)NC(C)(C)C)CCC1 OOKIODJYZSVHDO-QMYFOHRPSA-N 0.000 description 1
- YPBKTZBXSBLTDK-PKNBQFBNSA-N (3e)-3-[(3-bromo-4-fluoroanilino)-nitrosomethylidene]-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole Chemical compound NS(=O)(=O)NCCNC1=NON\C1=C(N=O)/NC1=CC=C(F)C(Br)=C1 YPBKTZBXSBLTDK-PKNBQFBNSA-N 0.000 description 1
- ONKCBKDTKZIWHZ-MRWFHJSOSA-N (4r)-4-[[(2r)-6-amino-2-[[(2r)-2-[[4-(aminocarbamothioylamino)benzoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]hexanoyl]amino]-5-[[(2r)-1-amino-6-[bis[2-[[4-[2-(1h-imidazol-5-yl)ethylamino]-4-oxobutanoyl]amino]acetyl]amino]-1-oxohexan-2-yl]amino]-5-oxope Chemical compound C([C@H](C(=O)N[C@H](CCCCN)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CCCCN(C(=O)CNC(=O)CCC(=O)NCCC=1NC=NC=1)C(=O)CNC(=O)CCC(=O)NCCC=1NC=NC=1)C(N)=O)NC(=O)C=1C=CC(NC(=S)NN)=CC=1)C1=CC=C(O)C=C1 ONKCBKDTKZIWHZ-MRWFHJSOSA-N 0.000 description 1
- XAYAKDZVINDZGB-BMVMHAJPSA-N (4s,7r,8s,9s,10e,13z,16s)-4,8-dihydroxy-5,5,7,9,13-pentamethyl-16-[(e)-1-(2-methyl-1,3-thiazol-4-yl)prop-1-en-2-yl]-1-oxacyclohexadeca-10,13-diene-2,6-dione Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)\C=C\C\C(C)=C/C[C@H]1C(\C)=C\C1=CSC(C)=N1 XAYAKDZVINDZGB-BMVMHAJPSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N (R)-alpha-Tocopherol Natural products OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
- FBFJOZZTIXSPPR-UHFFFAOYSA-N 1-(4-aminobutyl)-2-(ethoxymethyl)imidazo[4,5-c]quinolin-4-amine Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CCCCN)C3=C(N)N=C21 FBFJOZZTIXSPPR-UHFFFAOYSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- GCKMFJBGXUYNAG-UHFFFAOYSA-N 17alpha-methyltestosterone Natural products C1CC2=CC(=O)CCC2(C)C2C1C1CCC(C)(O)C1(C)CC2 GCKMFJBGXUYNAG-UHFFFAOYSA-N 0.000 description 1
- DBPWSSGDRRHUNT-CEGNMAFCSA-N 17α-hydroxyprogesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DBPWSSGDRRHUNT-CEGNMAFCSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- TXQAZWIBPGKHOX-UHFFFAOYSA-N 1H-indol-3-amine Chemical compound C1=CC=C2C(N)=CNC2=C1 TXQAZWIBPGKHOX-UHFFFAOYSA-N 0.000 description 1
- IZZYUABKZYIINT-UHFFFAOYSA-N 2-[3-[(4-cyanophenyl)methyl]indolizin-1-yl]-n-(3-methyl-1,2-thiazol-5-yl)-2-oxoacetamide Chemical compound S1N=C(C)C=C1NC(=O)C(=O)C1=C2C=CC=CN2C(CC=2C=CC(=CC=2)C#N)=C1 IZZYUABKZYIINT-UHFFFAOYSA-N 0.000 description 1
- VNPMDUDIDCXVCH-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]-3-(3-piperazin-1-ylpropyl)pyrazol-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound O=C(CN1C=C(C(CCCN2CCNCC2)=N1)C1=CN=C(NC2CC3=C(C2)C=CC=C3)N=C1)N1CCC2=C(C1)N=NN2 VNPMDUDIDCXVCH-UHFFFAOYSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- FJCDSQATIJKQKA-UHFFFAOYSA-N 2-fluoro-n-[[5-(6-methylpyridin-2-yl)-4-([1,2,4]triazolo[1,5-a]pyridin-6-yl)-1h-imidazol-2-yl]methyl]aniline Chemical compound CC1=CC=CC(C2=C(N=C(CNC=3C(=CC=CC=3)F)N2)C2=CN3N=CN=C3C=C2)=N1 FJCDSQATIJKQKA-UHFFFAOYSA-N 0.000 description 1
- OVSKGTONMLKNPZ-UHFFFAOYSA-N 3-(1-methylindol-3-yl)-4-(1-methyl-6-nitroindol-3-yl)pyrrole-2,5-dione Chemical compound C12=CC=CC=C2N(C)C=C1C1=C(C=2C3=CC=C(C=C3N(C)C=2)[N+]([O-])=O)C(=O)NC1=O OVSKGTONMLKNPZ-UHFFFAOYSA-N 0.000 description 1
- LKKMLIBUAXYLOY-UHFFFAOYSA-N 3-Amino-1-methyl-5H-pyrido[4,3-b]indole Chemical compound N1C2=CC=CC=C2C2=C1C=C(N)N=C2C LKKMLIBUAXYLOY-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- XGTQWEPDCQCNBF-UHFFFAOYSA-N 5-chloro-n-[2-chloro-5-(4-chlorophenyl)sulfonylphenyl]-2-hydroxy-3-iodobenzamide Chemical compound OC1=C(I)C=C(Cl)C=C1C(=O)NC1=CC(S(=O)(=O)C=2C=CC(Cl)=CC=2)=CC=C1Cl XGTQWEPDCQCNBF-UHFFFAOYSA-N 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 102000007471 Adenosine A2A receptor Human genes 0.000 description 1
- 108010085277 Adenosine A2A receptor Proteins 0.000 description 1
- 102100031934 Adhesion G-protein coupled receptor G1 Human genes 0.000 description 1
- 206010001413 Adult T-cell lymphoma/leukaemia Diseases 0.000 description 1
- YYSWCHMLFJLLBJ-ZLUOBGJFSA-N Ala-Ala-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YYSWCHMLFJLLBJ-ZLUOBGJFSA-N 0.000 description 1
- JAMAWBXXKFGFGX-KZVJFYERSA-N Ala-Arg-Thr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O JAMAWBXXKFGFGX-KZVJFYERSA-N 0.000 description 1
- BUDNAJYVCUHLSV-ZLUOBGJFSA-N Ala-Asp-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O BUDNAJYVCUHLSV-ZLUOBGJFSA-N 0.000 description 1
- BLIMFWGRQKRCGT-YUMQZZPRSA-N Ala-Gly-Lys Chemical compound C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCCN BLIMFWGRQKRCGT-YUMQZZPRSA-N 0.000 description 1
- HQJKCXHQNUCKMY-GHCJXIJMSA-N Ala-Ile-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](C)N HQJKCXHQNUCKMY-GHCJXIJMSA-N 0.000 description 1
- MNZHHDPWDWQJCQ-YUMQZZPRSA-N Ala-Leu-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O MNZHHDPWDWQJCQ-YUMQZZPRSA-N 0.000 description 1
- OYJCVIGKMXUVKB-GARJFASQSA-N Ala-Leu-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N OYJCVIGKMXUVKB-GARJFASQSA-N 0.000 description 1
- RGQCNKIDEQJEBT-CQDKDKBSSA-N Ala-Leu-Tyr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 RGQCNKIDEQJEBT-CQDKDKBSSA-N 0.000 description 1
- AJBVYEYZVYPFCF-CIUDSAMLSA-N Ala-Lys-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O AJBVYEYZVYPFCF-CIUDSAMLSA-N 0.000 description 1
- PMQXMXAASGFUDX-SRVKXCTJSA-N Ala-Lys-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CCCCN PMQXMXAASGFUDX-SRVKXCTJSA-N 0.000 description 1
- YCRAFFCYWOUEOF-DLOVCJGASA-N Ala-Phe-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=CC=C1 YCRAFFCYWOUEOF-DLOVCJGASA-N 0.000 description 1
- DYJJJCHDHLEFDW-FXQIFTODSA-N Ala-Pro-Cys Chemical compound C[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CS)C(=O)O)N DYJJJCHDHLEFDW-FXQIFTODSA-N 0.000 description 1
- IORKCNUBHNIMKY-CIUDSAMLSA-N Ala-Pro-Glu Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O IORKCNUBHNIMKY-CIUDSAMLSA-N 0.000 description 1
- WQLDNOCHHRISMS-NAKRPEOUSA-N Ala-Pro-Ile Chemical compound [H]N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(O)=O WQLDNOCHHRISMS-NAKRPEOUSA-N 0.000 description 1
- XWFWAXPOLRTDFZ-FXQIFTODSA-N Ala-Pro-Ser Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O XWFWAXPOLRTDFZ-FXQIFTODSA-N 0.000 description 1
- HOVPGJUNRLMIOZ-CIUDSAMLSA-N Ala-Ser-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](C)N HOVPGJUNRLMIOZ-CIUDSAMLSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 241000272814 Anser sp. Species 0.000 description 1
- OTOXOKCIIQLMFH-KZVJFYERSA-N Arg-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N OTOXOKCIIQLMFH-KZVJFYERSA-N 0.000 description 1
- MFAMTAVAFBPXDC-LPEHRKFASA-N Arg-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O MFAMTAVAFBPXDC-LPEHRKFASA-N 0.000 description 1
- NAARDJBSSPUGCF-FXQIFTODSA-N Arg-Cys-Asn Chemical compound C(C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(=O)N)C(=O)O)N)CN=C(N)N NAARDJBSSPUGCF-FXQIFTODSA-N 0.000 description 1
- AHPWQERCDZTTNB-FXQIFTODSA-N Arg-Cys-Cys Chemical compound C(C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CS)C(=O)O)N)CN=C(N)N AHPWQERCDZTTNB-FXQIFTODSA-N 0.000 description 1
- UABKKMXFBRQKKI-BJDJZHNGSA-N Arg-Cys-Ser-Arg Chemical compound N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O UABKKMXFBRQKKI-BJDJZHNGSA-N 0.000 description 1
- HPSVTWMFWCHKFN-GARJFASQSA-N Arg-Glu-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O HPSVTWMFWCHKFN-GARJFASQSA-N 0.000 description 1
- YQGZIRIYGHNSQO-ZPFDUUQYSA-N Arg-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N YQGZIRIYGHNSQO-ZPFDUUQYSA-N 0.000 description 1
- UULLJGQFCDXVTQ-CYDGBPFRSA-N Arg-Pro-Ile Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(O)=O UULLJGQFCDXVTQ-CYDGBPFRSA-N 0.000 description 1
- VRTWYUYCJGNFES-CIUDSAMLSA-N Arg-Ser-Gln Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(O)=O VRTWYUYCJGNFES-CIUDSAMLSA-N 0.000 description 1
- LRPZJPMQGKGHSG-XGEHTFHBSA-N Arg-Ser-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCN=C(N)N)N)O LRPZJPMQGKGHSG-XGEHTFHBSA-N 0.000 description 1
- QCTOLCVIGRLMQS-HRCADAONSA-N Arg-Tyr-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=C(C=C2)O)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O QCTOLCVIGRLMQS-HRCADAONSA-N 0.000 description 1
- YNDLOUMBVDVALC-ZLUOBGJFSA-N Asn-Ala-Ala Chemical compound C[C@@H](C(=O)N[C@@H](C)C(=O)O)NC(=O)[C@H](CC(=O)N)N YNDLOUMBVDVALC-ZLUOBGJFSA-N 0.000 description 1
- SLKLLQWZQHXYSV-CIUDSAMLSA-N Asn-Ala-Lys Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(O)=O SLKLLQWZQHXYSV-CIUDSAMLSA-N 0.000 description 1
- KXFCBAHYSLJCCY-ZLUOBGJFSA-N Asn-Asn-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O KXFCBAHYSLJCCY-ZLUOBGJFSA-N 0.000 description 1
- XVVOVPFMILMHPX-ZLUOBGJFSA-N Asn-Asp-Asp Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O XVVOVPFMILMHPX-ZLUOBGJFSA-N 0.000 description 1
- IYVSIZAXNLOKFQ-BYULHYEWSA-N Asn-Asp-Val Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O IYVSIZAXNLOKFQ-BYULHYEWSA-N 0.000 description 1
- OLVIPTLKNSAYRJ-YUMQZZPRSA-N Asn-Gly-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)N)N OLVIPTLKNSAYRJ-YUMQZZPRSA-N 0.000 description 1
- HPBNLFLSSQDFQW-WHFBIAKZSA-N Asn-Ser-Gly Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CO)C(=O)NCC(O)=O HPBNLFLSSQDFQW-WHFBIAKZSA-N 0.000 description 1
- SNYCNNPOFYBCEK-ZLUOBGJFSA-N Asn-Ser-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O SNYCNNPOFYBCEK-ZLUOBGJFSA-N 0.000 description 1
- AMGQTNHANMRPOE-LKXGYXEUSA-N Asn-Thr-Ser Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O AMGQTNHANMRPOE-LKXGYXEUSA-N 0.000 description 1
- ZAESWDKAMDVHLL-RCOVLWMOSA-N Asn-Val-Gly Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(O)=O ZAESWDKAMDVHLL-RCOVLWMOSA-N 0.000 description 1
- XBQSLMACWDXWLJ-GHCJXIJMSA-N Asp-Ala-Ile Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O XBQSLMACWDXWLJ-GHCJXIJMSA-N 0.000 description 1
- MRQQMVZUHXUPEV-IHRRRGAJSA-N Asp-Arg-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O MRQQMVZUHXUPEV-IHRRRGAJSA-N 0.000 description 1
- ATYWBXGNXZYZGI-ACZMJKKPSA-N Asp-Asn-Gln Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O ATYWBXGNXZYZGI-ACZMJKKPSA-N 0.000 description 1
- SVFOIXMRMLROHO-SRVKXCTJSA-N Asp-Asp-Phe Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 SVFOIXMRMLROHO-SRVKXCTJSA-N 0.000 description 1
- GHODABZPVZMWCE-FXQIFTODSA-N Asp-Glu-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O GHODABZPVZMWCE-FXQIFTODSA-N 0.000 description 1
- WSGVTKZFVJSJOG-RCOVLWMOSA-N Asp-Gly-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O WSGVTKZFVJSJOG-RCOVLWMOSA-N 0.000 description 1
- ODNWIBOCFGMRTP-SRVKXCTJSA-N Asp-His-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CN=CN1 ODNWIBOCFGMRTP-SRVKXCTJSA-N 0.000 description 1
- KTTCQQNRRLCIBC-GHCJXIJMSA-N Asp-Ile-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O KTTCQQNRRLCIBC-GHCJXIJMSA-N 0.000 description 1
- UZFHNLYQWMGUHU-DCAQKATOSA-N Asp-Lys-Arg Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O UZFHNLYQWMGUHU-DCAQKATOSA-N 0.000 description 1
- DPNWSMBUYCLEDG-CIUDSAMLSA-N Asp-Lys-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O DPNWSMBUYCLEDG-CIUDSAMLSA-N 0.000 description 1
- DONWIPDSZZJHHK-HJGDQZAQSA-N Asp-Lys-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(=O)O)N)O DONWIPDSZZJHHK-HJGDQZAQSA-N 0.000 description 1
- USNJAPJZSGTTPX-XVSYOHENSA-N Asp-Phe-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O USNJAPJZSGTTPX-XVSYOHENSA-N 0.000 description 1
- AHWRSSLYSGLBGD-CIUDSAMLSA-N Asp-Pro-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(O)=O AHWRSSLYSGLBGD-CIUDSAMLSA-N 0.000 description 1
- YUELDQUPTAYEGM-XIRDDKMYSA-N Asp-Trp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)NC(=O)[C@H](CC(=O)O)N YUELDQUPTAYEGM-XIRDDKMYSA-N 0.000 description 1
- SQIARYGNVQWOSB-BZSNNMDCSA-N Asp-Tyr-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O SQIARYGNVQWOSB-BZSNNMDCSA-N 0.000 description 1
- HTSSXFASOUSJQG-IHPCNDPISA-N Asp-Tyr-Trp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O HTSSXFASOUSJQG-IHPCNDPISA-N 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical class C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 description 1
- 206010003908 B-cell small lymphocytic lymphoma Diseases 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 239000012664 BCL-2-inhibitor Substances 0.000 description 1
- 229940125565 BMS-986016 Drugs 0.000 description 1
- 229940125431 BRAF inhibitor Drugs 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 229940122035 Bcl-XL inhibitor Drugs 0.000 description 1
- 229940123711 Bcl2 inhibitor Drugs 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- 206010006272 Breast mass Diseases 0.000 description 1
- 206010006298 Breast pain Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 108010046080 CD27 Ligand Proteins 0.000 description 1
- 102100036008 CD48 antigen Human genes 0.000 description 1
- 210000005236 CD8+ effector T cell Anatomy 0.000 description 1
- 101100315624 Caenorhabditis elegans tyr-1 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102000004091 Caspase-8 Human genes 0.000 description 1
- 108090000538 Caspase-8 Proteins 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 229930188224 Cryptophycin Natural products 0.000 description 1
- 101710093674 Cyclic nucleotide-gated cation channel beta-1 Proteins 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- QLCPDGRAEJSYQM-LPEHRKFASA-N Cys-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CS)N)C(=O)O QLCPDGRAEJSYQM-LPEHRKFASA-N 0.000 description 1
- NDUSUIGBMZCOIL-ZKWXMUAHSA-N Cys-Asn-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CS)N NDUSUIGBMZCOIL-ZKWXMUAHSA-N 0.000 description 1
- VZKXOWRNJDEGLZ-WHFBIAKZSA-N Cys-Asp-Gly Chemical compound SC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O VZKXOWRNJDEGLZ-WHFBIAKZSA-N 0.000 description 1
- HIPHJNWPLMUBQQ-ACZMJKKPSA-N Cys-Cys-Gln Chemical compound SC[C@H](N)C(=O)N[C@@H](CS)C(=O)N[C@H](C(O)=O)CCC(N)=O HIPHJNWPLMUBQQ-ACZMJKKPSA-N 0.000 description 1
- UFOBYROTHHYVGW-CIUDSAMLSA-N Cys-Cys-His Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC1=CNC=N1)C(O)=O UFOBYROTHHYVGW-CIUDSAMLSA-N 0.000 description 1
- VBPGTULCFGKGTF-ACZMJKKPSA-N Cys-Glu-Asp Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O VBPGTULCFGKGTF-ACZMJKKPSA-N 0.000 description 1
- SKSJPIBFNFPTJB-NKWVEPMBSA-N Cys-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CS)N)C(=O)O SKSJPIBFNFPTJB-NKWVEPMBSA-N 0.000 description 1
- OZHXXYOHPLLLMI-CIUDSAMLSA-N Cys-Lys-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O OZHXXYOHPLLLMI-CIUDSAMLSA-N 0.000 description 1
- KSMSFCBQBQPFAD-GUBZILKMSA-N Cys-Pro-Pro Chemical compound SC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 KSMSFCBQBQPFAD-GUBZILKMSA-N 0.000 description 1
- NRVQLLDIJJEIIZ-VZFHVOOUSA-N Cys-Thr-Ala Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C)C(=O)O)NC(=O)[C@H](CS)N)O NRVQLLDIJJEIIZ-VZFHVOOUSA-N 0.000 description 1
- SAEVTQWAYDPXMU-KATARQTJSA-N Cys-Thr-Leu Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O SAEVTQWAYDPXMU-KATARQTJSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102000003915 DNA Topoisomerases Human genes 0.000 description 1
- 108090000323 DNA Topoisomerases Proteins 0.000 description 1
- 239000012625 DNA intercalator Substances 0.000 description 1
- 239000012626 DNA minor groove binder Substances 0.000 description 1
- 208000019505 Deglutition disease Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 102100033189 Diablo IAP-binding mitochondrial protein Human genes 0.000 description 1
- 101710101225 Diablo IAP-binding mitochondrial protein Proteins 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 206010013975 Dyspnoeas Diseases 0.000 description 1
- 108010067668 E 7974 Proteins 0.000 description 1
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 208000002460 Enteropathy-Associated T-Cell Lymphoma Diseases 0.000 description 1
- 206010014950 Eosinophilia Diseases 0.000 description 1
- QXRSDHAAWVKZLJ-OXZHEXMSSA-N Epothilone B Natural products O=C1[C@H](C)[C@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C QXRSDHAAWVKZLJ-OXZHEXMSSA-N 0.000 description 1
- FBHLXXMDOGRQOQ-FCIKGTDHSA-N Epothilone B10 Natural products O=C1[C@H](C)[C@H](O)[C@H](C)CCC[C@@]2(C)O[C@H]2C[C@@H](/C(=C\c2nc(CC)sc2)/C)OC(=O)C[C@H](O)C1(C)C FBHLXXMDOGRQOQ-FCIKGTDHSA-N 0.000 description 1
- BEFZAMRWPCMWFJ-JRBBLYSQSA-N Epothilone C Natural products O=C1[C@H](C)[C@@H](O)[C@@H](C)CCC/C=C\C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C BEFZAMRWPCMWFJ-JRBBLYSQSA-N 0.000 description 1
- XOZIUKBZLSUILX-SDMHVBBESA-N Epothilone D Natural products O=C1[C@H](C)[C@@H](O)[C@@H](C)CCC/C(/C)=C/C[C@@H](/C(=C\c2nc(C)sc2)/C)OC(=O)C[C@H](O)C1(C)C XOZIUKBZLSUILX-SDMHVBBESA-N 0.000 description 1
- UKIMCRYGLFQEOE-UHFFFAOYSA-N Epothilone F Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC2(C)OC2CC1C(C)=CC1=CSC(CO)=N1 UKIMCRYGLFQEOE-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 101150089023 FASLG gene Proteins 0.000 description 1
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 1
- 101710088098 Forkhead box protein P3 Proteins 0.000 description 1
- 108010001498 Galectin 1 Proteins 0.000 description 1
- 102100021736 Galectin-1 Human genes 0.000 description 1
- 102100031351 Galectin-9 Human genes 0.000 description 1
- 101710121810 Galectin-9 Proteins 0.000 description 1
- 241000967808 Garra Species 0.000 description 1
- 208000021309 Germ cell tumor Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- DHNWZLGBTPUTQQ-QEJZJMRPSA-N Gln-Asp-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N DHNWZLGBTPUTQQ-QEJZJMRPSA-N 0.000 description 1
- NKCZYEDZTKOFBG-GUBZILKMSA-N Gln-Gln-Arg Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O NKCZYEDZTKOFBG-GUBZILKMSA-N 0.000 description 1
- RBWKVOSARCFSQQ-FXQIFTODSA-N Gln-Gln-Ser Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O RBWKVOSARCFSQQ-FXQIFTODSA-N 0.000 description 1
- HHQCBFGKQDMWSP-GUBZILKMSA-N Gln-Leu-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)N)N HHQCBFGKQDMWSP-GUBZILKMSA-N 0.000 description 1
- XZLLTYBONVKGLO-SDDRHHMPSA-N Gln-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(=O)N)N)C(=O)O XZLLTYBONVKGLO-SDDRHHMPSA-N 0.000 description 1
- DRNMNLKUUKKPIA-HTUGSXCWSA-N Gln-Phe-Thr Chemical compound C[C@@H](O)[C@H](NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@@H](N)CCC(N)=O)C(O)=O DRNMNLKUUKKPIA-HTUGSXCWSA-N 0.000 description 1
- WBYHRQBKJGEBQJ-CIUDSAMLSA-N Gln-Pro-Cys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CCC(=O)N)N)C(=O)N[C@@H](CS)C(=O)O WBYHRQBKJGEBQJ-CIUDSAMLSA-N 0.000 description 1
- XKPACHRGOWQHFH-IRIUXVKKSA-N Gln-Thr-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O XKPACHRGOWQHFH-IRIUXVKKSA-N 0.000 description 1
- SGVGIVDZLSHSEN-RYUDHWBXSA-N Gln-Tyr-Gly Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(O)=O SGVGIVDZLSHSEN-RYUDHWBXSA-N 0.000 description 1
- FITIQFSXXBKFFM-NRPADANISA-N Gln-Val-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O FITIQFSXXBKFFM-NRPADANISA-N 0.000 description 1
- CSMHMEATMDCQNY-DZKIICNBSA-N Gln-Val-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CSMHMEATMDCQNY-DZKIICNBSA-N 0.000 description 1
- ITYRYNUZHPNCIK-GUBZILKMSA-N Glu-Ala-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O ITYRYNUZHPNCIK-GUBZILKMSA-N 0.000 description 1
- CVPXINNKRTZBMO-CIUDSAMLSA-N Glu-Arg-Asn Chemical compound C(C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)CN=C(N)N CVPXINNKRTZBMO-CIUDSAMLSA-N 0.000 description 1
- CKOFNWCLWRYUHK-XHNCKOQMSA-N Glu-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)O)N)C(=O)O CKOFNWCLWRYUHK-XHNCKOQMSA-N 0.000 description 1
- XTZDZAXYPDISRR-MNXVOIDGSA-N Glu-Ile-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N XTZDZAXYPDISRR-MNXVOIDGSA-N 0.000 description 1
- GRHXUHCFENOCOS-ZPFDUUQYSA-N Glu-Ile-Met Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CCC(=O)O)N GRHXUHCFENOCOS-ZPFDUUQYSA-N 0.000 description 1
- QDMVXRNLOPTPIE-WDCWCFNPSA-N Glu-Lys-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QDMVXRNLOPTPIE-WDCWCFNPSA-N 0.000 description 1
- NNQDRRUXFJYCCJ-NHCYSSNCSA-N Glu-Pro-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(O)=O NNQDRRUXFJYCCJ-NHCYSSNCSA-N 0.000 description 1
- ALMBZBOCGSVSAI-ACZMJKKPSA-N Glu-Ser-Asn Chemical compound C(CC(=O)O)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(=O)N)C(=O)O)N ALMBZBOCGSVSAI-ACZMJKKPSA-N 0.000 description 1
- QOXDAWODGSIDDI-GUBZILKMSA-N Glu-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)O)N QOXDAWODGSIDDI-GUBZILKMSA-N 0.000 description 1
- BPCLDCNZBUYGOD-BPUTZDHNSA-N Glu-Trp-Glu Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O)=CNC2=C1 BPCLDCNZBUYGOD-BPUTZDHNSA-N 0.000 description 1
- ZALGPUWUVHOGAE-GVXVVHGQSA-N Glu-Val-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCC(=O)O)N ZALGPUWUVHOGAE-GVXVVHGQSA-N 0.000 description 1
- RMWAOBGCZZSJHE-UMNHJUIQSA-N Glu-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)O)N RMWAOBGCZZSJHE-UMNHJUIQSA-N 0.000 description 1
- JXYMPBCYRKWJEE-BQBZGAKWSA-N Gly-Arg-Ala Chemical compound [H]NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O JXYMPBCYRKWJEE-BQBZGAKWSA-N 0.000 description 1
- CIMULJZTTOBOPN-WHFBIAKZSA-N Gly-Asn-Asn Chemical compound NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CIMULJZTTOBOPN-WHFBIAKZSA-N 0.000 description 1
- CQZDZKRHFWJXDF-WDSKDSINSA-N Gly-Gln-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CN CQZDZKRHFWJXDF-WDSKDSINSA-N 0.000 description 1
- HQRHFUYMGCHHJS-LURJTMIESA-N Gly-Gly-Arg Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CCCN=C(N)N HQRHFUYMGCHHJS-LURJTMIESA-N 0.000 description 1
- GDOZQTNZPCUARW-YFKPBYRVSA-N Gly-Gly-Glu Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O GDOZQTNZPCUARW-YFKPBYRVSA-N 0.000 description 1
- HPAIKDPJURGQLN-KBPBESRZSA-N Gly-His-Phe Chemical compound C([C@H](NC(=O)CN)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CNC=N1 HPAIKDPJURGQLN-KBPBESRZSA-N 0.000 description 1
- BHPQOIPBLYJNAW-NGZCFLSTSA-N Gly-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN BHPQOIPBLYJNAW-NGZCFLSTSA-N 0.000 description 1
- PAWIVEIWWYGBAM-YUMQZZPRSA-N Gly-Leu-Ala Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O PAWIVEIWWYGBAM-YUMQZZPRSA-N 0.000 description 1
- CCBIBMKQNXHNIN-ZETCQYMHSA-N Gly-Leu-Gly Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O CCBIBMKQNXHNIN-ZETCQYMHSA-N 0.000 description 1
- FJWSJWACLMTDMI-WPRPVWTQSA-N Gly-Met-Val Chemical compound [H]NCC(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(O)=O FJWSJWACLMTDMI-WPRPVWTQSA-N 0.000 description 1
- IBYOLNARKHMLBG-WHOFXGATSA-N Gly-Phe-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=CC=C1 IBYOLNARKHMLBG-WHOFXGATSA-N 0.000 description 1
- QAMMIGULQSIRCD-IRXDYDNUSA-N Gly-Phe-Tyr Chemical compound C([C@H](NC(=O)C[NH3+])C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C([O-])=O)C1=CC=CC=C1 QAMMIGULQSIRCD-IRXDYDNUSA-N 0.000 description 1
- GGLIDLCEPDHEJO-BQBZGAKWSA-N Gly-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)CN GGLIDLCEPDHEJO-BQBZGAKWSA-N 0.000 description 1
- IXHQLZIWBCQBLQ-STQMWFEESA-N Gly-Pro-Phe Chemical compound NCC(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IXHQLZIWBCQBLQ-STQMWFEESA-N 0.000 description 1
- SOEGEPHNZOISMT-BYPYZUCNSA-N Gly-Ser-Gly Chemical compound NCC(=O)N[C@@H](CO)C(=O)NCC(O)=O SOEGEPHNZOISMT-BYPYZUCNSA-N 0.000 description 1
- FFJQHWKSGAWSTJ-BFHQHQDPSA-N Gly-Thr-Ala Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O FFJQHWKSGAWSTJ-BFHQHQDPSA-N 0.000 description 1
- CQMFNTVQVLQRLT-JHEQGTHGSA-N Gly-Thr-Gln Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O CQMFNTVQVLQRLT-JHEQGTHGSA-N 0.000 description 1
- LLWQVJNHMYBLLK-CDMKHQONSA-N Gly-Thr-Phe Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O LLWQVJNHMYBLLK-CDMKHQONSA-N 0.000 description 1
- SFOXOSKVTLDEDM-HOTGVXAUSA-N Gly-Trp-Leu Chemical compound C1=CC=C2C(C[C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)CN)=CNC2=C1 SFOXOSKVTLDEDM-HOTGVXAUSA-N 0.000 description 1
- OCRQUYDOYKCOQG-IRXDYDNUSA-N Gly-Tyr-Phe Chemical compound C([C@H](NC(=O)CN)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=C(O)C=C1 OCRQUYDOYKCOQG-IRXDYDNUSA-N 0.000 description 1
- 102000019058 Glycogen Synthase Kinase 3 beta Human genes 0.000 description 1
- 108010051975 Glycogen Synthase Kinase 3 beta Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 206010018852 Haematoma Diseases 0.000 description 1
- ZBLLGPUWGCOJNG-UHFFFAOYSA-N Halichondrin B Natural products CC1CC2(CC(C)C3OC4(CC5OC6C(CC5O4)OC7CC8OC9CCC%10OC(CC(C(C9)C8=C)C%11%12CC%13OC%14C(OC%15CCC(CC(=O)OC7C6C)OC%15C%14O%11)C%13O%12)CC%10=C)CC3O2)OC%16OC(CC1%16)C(O)CC(O)CO ZBLLGPUWGCOJNG-UHFFFAOYSA-N 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 208000000616 Hemoptysis Diseases 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 108010007712 Hepatitis A Virus Cellular Receptor 1 Proteins 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- MAABHGXCIBEYQR-XVYDVKMFSA-N His-Asn-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC1=CN=CN1)N MAABHGXCIBEYQR-XVYDVKMFSA-N 0.000 description 1
- HIAHVKLTHNOENC-HGNGGELXSA-N His-Glu-Ala Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O HIAHVKLTHNOENC-HGNGGELXSA-N 0.000 description 1
- TTYKEFZRLKQTHH-MELADBBJSA-N His-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC2=CN=CN2)N)C(=O)O TTYKEFZRLKQTHH-MELADBBJSA-N 0.000 description 1
- CCUSLCQWVMWTIS-IXOXFDKPSA-N His-Thr-Leu Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O CCUSLCQWVMWTIS-IXOXFDKPSA-N 0.000 description 1
- ALPXXNRQBMRCPZ-MEYUZBJRSA-N His-Thr-Phe Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O ALPXXNRQBMRCPZ-MEYUZBJRSA-N 0.000 description 1
- GYXDQXPCPASCNR-NHCYSSNCSA-N His-Val-Asn Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N GYXDQXPCPASCNR-NHCYSSNCSA-N 0.000 description 1
- 101000775042 Homo sapiens Adhesion G-protein coupled receptor G1 Proteins 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000716130 Homo sapiens CD48 antigen Proteins 0.000 description 1
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 1
- 101001021491 Homo sapiens HERV-H LTR-associating protein 2 Proteins 0.000 description 1
- 101000878602 Homo sapiens Immunoglobulin alpha Fc receptor Proteins 0.000 description 1
- 101001138062 Homo sapiens Leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 description 1
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 1
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 description 1
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 1
- 101001023712 Homo sapiens Nectin-3 Proteins 0.000 description 1
- 101100407307 Homo sapiens PDCD1LG2 gene Proteins 0.000 description 1
- 101001094545 Homo sapiens Retrotransposon-like protein 1 Proteins 0.000 description 1
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 description 1
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 101100207070 Homo sapiens TNFSF8 gene Proteins 0.000 description 1
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 1
- 101000764622 Homo sapiens Transmembrane and immunoglobulin domain-containing protein 2 Proteins 0.000 description 1
- 101000830596 Homo sapiens Tumor necrosis factor ligand superfamily member 15 Proteins 0.000 description 1
- 101000920026 Homo sapiens Tumor necrosis factor receptor superfamily member EDAR Proteins 0.000 description 1
- 208000008454 Hyperhidrosis Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 101710093458 ICOS ligand Proteins 0.000 description 1
- 230000005353 IP-10 production Effects 0.000 description 1
- MKWSZEHGHSLNPF-NAKRPEOUSA-N Ile-Ala-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)O)N MKWSZEHGHSLNPF-NAKRPEOUSA-N 0.000 description 1
- FADXGVVLSPPEQY-GHCJXIJMSA-N Ile-Cys-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(=O)N)C(=O)O)N FADXGVVLSPPEQY-GHCJXIJMSA-N 0.000 description 1
- PPSQSIDMOVPKPI-BJDJZHNGSA-N Ile-Cys-Leu Chemical compound N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(=O)O PPSQSIDMOVPKPI-BJDJZHNGSA-N 0.000 description 1
- HYLIOBDWPQNLKI-HVTMNAMFSA-N Ile-His-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N HYLIOBDWPQNLKI-HVTMNAMFSA-N 0.000 description 1
- JHNJNTMTZHEDLJ-NAKRPEOUSA-N Ile-Ser-Arg Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O JHNJNTMTZHEDLJ-NAKRPEOUSA-N 0.000 description 1
- PELCGFMHLZXWBQ-BJDJZHNGSA-N Ile-Ser-Leu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)O)N PELCGFMHLZXWBQ-BJDJZHNGSA-N 0.000 description 1
- PRTZQMBYUZFSFA-XEGUGMAKSA-N Ile-Tyr-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)NCC(=O)O)N PRTZQMBYUZFSFA-XEGUGMAKSA-N 0.000 description 1
- NXRNRBOKDBIVKQ-CXTHYWKRSA-N Ile-Tyr-Tyr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N NXRNRBOKDBIVKQ-CXTHYWKRSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229940126528 Immuno-Oncology Drug Drugs 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 102100038005 Immunoglobulin alpha Fc receptor Human genes 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102100027670 Islet amyloid polypeptide Human genes 0.000 description 1
- 229940121730 Janus kinase 2 inhibitor Drugs 0.000 description 1
- 206010023126 Jaundice Diseases 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- SITWEMZOJNKJCH-UHFFFAOYSA-N L-alanine-L-arginine Natural products CC(N)C(=O)NC(C(O)=O)CCCNC(N)=N SITWEMZOJNKJCH-UHFFFAOYSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 206010023804 Large intestine perforation Diseases 0.000 description 1
- QPRQGENIBFLVEB-BJDJZHNGSA-N Leu-Ala-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O QPRQGENIBFLVEB-BJDJZHNGSA-N 0.000 description 1
- KWTVLKBOQATPHJ-SRVKXCTJSA-N Leu-Ala-Lys Chemical compound C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CC(C)C)N KWTVLKBOQATPHJ-SRVKXCTJSA-N 0.000 description 1
- DQPQTXMIRBUWKO-DCAQKATOSA-N Leu-Ala-Met Chemical compound C[C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CC(C)C)N DQPQTXMIRBUWKO-DCAQKATOSA-N 0.000 description 1
- UCOCBWDBHCUPQP-DCAQKATOSA-N Leu-Arg-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O UCOCBWDBHCUPQP-DCAQKATOSA-N 0.000 description 1
- OIARJGNVARWKFP-YUMQZZPRSA-N Leu-Asn-Gly Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(O)=O OIARJGNVARWKFP-YUMQZZPRSA-N 0.000 description 1
- TWQIYNGNYNJUFM-NHCYSSNCSA-N Leu-Asn-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O TWQIYNGNYNJUFM-NHCYSSNCSA-N 0.000 description 1
- WIDZHJTYKYBLSR-DCAQKATOSA-N Leu-Glu-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O WIDZHJTYKYBLSR-DCAQKATOSA-N 0.000 description 1
- QJUWBDPGGYVRHY-YUMQZZPRSA-N Leu-Gly-Cys Chemical compound CC(C)C[C@@H](C(=O)NCC(=O)N[C@@H](CS)C(=O)O)N QJUWBDPGGYVRHY-YUMQZZPRSA-N 0.000 description 1
- KGCLIYGPQXUNLO-IUCAKERBSA-N Leu-Gly-Glu Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O KGCLIYGPQXUNLO-IUCAKERBSA-N 0.000 description 1
- VWHGTYCRDRBSFI-ZETCQYMHSA-N Leu-Gly-Gly Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)NCC(O)=O VWHGTYCRDRBSFI-ZETCQYMHSA-N 0.000 description 1
- DDEMUMVXNFPDKC-SRVKXCTJSA-N Leu-His-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CS)C(=O)O)N DDEMUMVXNFPDKC-SRVKXCTJSA-N 0.000 description 1
- KUIDCYNIEJBZBU-AJNGGQMLSA-N Leu-Ile-Leu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(O)=O KUIDCYNIEJBZBU-AJNGGQMLSA-N 0.000 description 1
- IFMPDNRWZZEZSL-SRVKXCTJSA-N Leu-Leu-Cys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(O)=O IFMPDNRWZZEZSL-SRVKXCTJSA-N 0.000 description 1
- KPYAOIVPJKPIOU-KKUMJFAQSA-N Leu-Lys-Lys Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(O)=O KPYAOIVPJKPIOU-KKUMJFAQSA-N 0.000 description 1
- AUNMOHYWTAPQLA-XUXIUFHCSA-N Leu-Met-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O AUNMOHYWTAPQLA-XUXIUFHCSA-N 0.000 description 1
- NJMXCOOEFLMZSR-AVGNSLFASA-N Leu-Met-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(O)=O NJMXCOOEFLMZSR-AVGNSLFASA-N 0.000 description 1
- CHJKEDSZNSONPS-DCAQKATOSA-N Leu-Pro-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O CHJKEDSZNSONPS-DCAQKATOSA-N 0.000 description 1
- LINKCQUOMUDLKN-KATARQTJSA-N Leu-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(C)C)N)O LINKCQUOMUDLKN-KATARQTJSA-N 0.000 description 1
- LJBVRCDPWOJOEK-PPCPHDFISA-N Leu-Thr-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O LJBVRCDPWOJOEK-PPCPHDFISA-N 0.000 description 1
- ILDSIMPXNFWKLH-KATARQTJSA-N Leu-Thr-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(O)=O ILDSIMPXNFWKLH-KATARQTJSA-N 0.000 description 1
- AIQWYVFNBNNOLU-RHYQMDGZSA-N Leu-Thr-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O AIQWYVFNBNNOLU-RHYQMDGZSA-N 0.000 description 1
- JGKHAFUAPZCCDU-BZSNNMDCSA-N Leu-Tyr-Leu Chemical compound CC(C)C[C@H]([NH3+])C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C([O-])=O)CC1=CC=C(O)C=C1 JGKHAFUAPZCCDU-BZSNNMDCSA-N 0.000 description 1
- QESXLSQLQHHTIX-RHYQMDGZSA-N Leu-Val-Thr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QESXLSQLQHHTIX-RHYQMDGZSA-N 0.000 description 1
- 102100020943 Leukocyte-associated immunoglobulin-like receptor 1 Human genes 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 206010052178 Lymphocytic lymphoma Diseases 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- NTSPQIONFJUMJV-AVGNSLFASA-N Lys-Arg-Val Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(O)=O NTSPQIONFJUMJV-AVGNSLFASA-N 0.000 description 1
- YKIRNDPUWONXQN-GUBZILKMSA-N Lys-Asn-Gln Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N YKIRNDPUWONXQN-GUBZILKMSA-N 0.000 description 1
- DGWXCIORNLWGGG-CIUDSAMLSA-N Lys-Asn-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O DGWXCIORNLWGGG-CIUDSAMLSA-N 0.000 description 1
- KWUKZRFFKPLUPE-HJGDQZAQSA-N Lys-Asp-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KWUKZRFFKPLUPE-HJGDQZAQSA-N 0.000 description 1
- RZHLIPMZXOEJTL-AVGNSLFASA-N Lys-Gln-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCCCN)N RZHLIPMZXOEJTL-AVGNSLFASA-N 0.000 description 1
- LLSUNJYOSCOOEB-GUBZILKMSA-N Lys-Glu-Asp Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O LLSUNJYOSCOOEB-GUBZILKMSA-N 0.000 description 1
- IMAKMJCBYCSMHM-AVGNSLFASA-N Lys-Glu-Lys Chemical compound NCCCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCCN IMAKMJCBYCSMHM-AVGNSLFASA-N 0.000 description 1
- ODUQLUADRKMHOZ-JYJNAYRXSA-N Lys-Glu-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCCCN)N)O ODUQLUADRKMHOZ-JYJNAYRXSA-N 0.000 description 1
- NNKLKUUGESXCBS-KBPBESRZSA-N Lys-Gly-Tyr Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O NNKLKUUGESXCBS-KBPBESRZSA-N 0.000 description 1
- AIRZWUMAHCDDHR-KKUMJFAQSA-N Lys-Leu-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O AIRZWUMAHCDDHR-KKUMJFAQSA-N 0.000 description 1
- YTJFXEDRUOQGSP-DCAQKATOSA-N Lys-Pro-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O YTJFXEDRUOQGSP-DCAQKATOSA-N 0.000 description 1
- WQDKIVRHTQYJSN-DCAQKATOSA-N Lys-Ser-Arg Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N WQDKIVRHTQYJSN-DCAQKATOSA-N 0.000 description 1
- CTJUSALVKAWFFU-CIUDSAMLSA-N Lys-Ser-Cys Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N CTJUSALVKAWFFU-CIUDSAMLSA-N 0.000 description 1
- IOQWIOPSKJOEKI-SRVKXCTJSA-N Lys-Ser-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O IOQWIOPSKJOEKI-SRVKXCTJSA-N 0.000 description 1
- DLCAXBGXGOVUCD-PPCPHDFISA-N Lys-Thr-Ile Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O DLCAXBGXGOVUCD-PPCPHDFISA-N 0.000 description 1
- CAVRAQIDHUPECU-UVOCVTCTSA-N Lys-Thr-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O CAVRAQIDHUPECU-UVOCVTCTSA-N 0.000 description 1
- FPQMQEOVSKMVMA-ACRUOGEOSA-N Lys-Tyr-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)NC(=O)[C@H](CCCCN)N)O FPQMQEOVSKMVMA-ACRUOGEOSA-N 0.000 description 1
- HMZPYMSEAALNAE-ULQDDVLXSA-N Lys-Val-Tyr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O HMZPYMSEAALNAE-ULQDDVLXSA-N 0.000 description 1
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000006662 Mastodynia Diseases 0.000 description 1
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 description 1
- 108010071463 Melanoma-Specific Antigens Proteins 0.000 description 1
- 102000007557 Melanoma-Specific Antigens Human genes 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- KQBJYJXPZBNEIK-DCAQKATOSA-N Met-Glu-Arg Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CCCNC(N)=N KQBJYJXPZBNEIK-DCAQKATOSA-N 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 206010050513 Metastatic renal cell carcinoma Diseases 0.000 description 1
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 1
- GCKMFJBGXUYNAG-HLXURNFRSA-N Methyltestosterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)CC2 GCKMFJBGXUYNAG-HLXURNFRSA-N 0.000 description 1
- 108091092878 Microsatellite Proteins 0.000 description 1
- 208000032818 Microsatellite Instability Diseases 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100519207 Mus musculus Pdcd1 gene Proteins 0.000 description 1
- 101100046559 Mus musculus Tnfrsf12a gene Proteins 0.000 description 1
- 101100153537 Mus musculus Tnfrsf4 gene Proteins 0.000 description 1
- 101100207071 Mus musculus Tnfsf8 gene Proteins 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- FBKMWOJEPMPVTQ-UHFFFAOYSA-N N'-(3-bromo-4-fluorophenyl)-N-hydroxy-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole-3-carboximidamide Chemical compound NS(=O)(=O)NCCNC1=NON=C1C(=NO)NC1=CC=C(F)C(Br)=C1 FBKMWOJEPMPVTQ-UHFFFAOYSA-N 0.000 description 1
- GUVMFDICMFQHSZ-UHFFFAOYSA-N N-(1-aminoethenyl)-1-[4-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[5-(4-amino-5-methyl-2-oxopyrimidin-1-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[hydroxy-[[3-[hydroxy-[[3-hydroxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy]phosphinothioyl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy]phosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(2-amino-6-oxo-1H-purin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(2-amino-6-oxo-1H-purin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxyoxolan-2-yl]methoxy-hydroxyphosphinothioyl]oxy-5-[[[2-[[[2-[[[5-(2-amino-6-oxo-1H-purin-9-yl)-2-[[[5-(4-amino-2-oxopyrimidin-1-yl)-2-[[hydroxy-[2-(hydroxymethyl)-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-3-yl]oxyphosphinothioyl]oxymethyl]oxolan-3-yl]oxy-hydroxyphosphinothioyl]oxymethyl]oxolan-3-yl]oxy-hydroxyphosphinothioyl]oxymethyl]-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-3-yl]oxy-hydroxyphosphinothioyl]oxymethyl]-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-3-yl]oxy-hydroxyphosphinothioyl]oxymethyl]oxolan-2-yl]-5-methylimidazole-4-carboxamide Chemical compound CC1=C(C(=O)NC(N)=C)N=CN1C1OC(COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)CO)C(OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(N=C(N)C=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C3=C(C(NC(N)=N3)=O)N=C2)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)OP(O)(=S)OCC2C(CC(O2)N2C(NC(=O)C(C)=C2)=O)O)C1 GUVMFDICMFQHSZ-UHFFFAOYSA-N 0.000 description 1
- XZFYRXDAULDNFX-UHFFFAOYSA-N N-L-cysteinyl-L-phenylalanine Natural products SCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XZFYRXDAULDNFX-UHFFFAOYSA-N 0.000 description 1
- PESQCPHRXOFIPX-UHFFFAOYSA-N N-L-methionyl-L-tyrosine Natural products CSCCC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 PESQCPHRXOFIPX-UHFFFAOYSA-N 0.000 description 1
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 102100035487 Nectin-3 Human genes 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000005890 Neuroma Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000012270 PD-1 inhibitor Substances 0.000 description 1
- 239000012668 PD-1-inhibitor Substances 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 description 1
- CDNPIRSCAFMMBE-SRVKXCTJSA-N Phe-Asn-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O CDNPIRSCAFMMBE-SRVKXCTJSA-N 0.000 description 1
- CUMXHKAOHNWRFQ-BZSNNMDCSA-N Phe-Asp-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 CUMXHKAOHNWRFQ-BZSNNMDCSA-N 0.000 description 1
- OWCLJDXHHZUNEL-IHRRRGAJSA-N Phe-Cys-Val Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(O)=O OWCLJDXHHZUNEL-IHRRRGAJSA-N 0.000 description 1
- CWFGECHCRMGPPT-MXAVVETBSA-N Phe-Ile-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O CWFGECHCRMGPPT-MXAVVETBSA-N 0.000 description 1
- JLLJTMHNXQTMCK-UBHSHLNASA-N Phe-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 JLLJTMHNXQTMCK-UBHSHLNASA-N 0.000 description 1
- WWPAHTZOWURIMR-ULQDDVLXSA-N Phe-Pro-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CC1=CC=CC=C1 WWPAHTZOWURIMR-ULQDDVLXSA-N 0.000 description 1
- IIEOLPMQYRBZCN-SRVKXCTJSA-N Phe-Ser-Cys Chemical compound N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O IIEOLPMQYRBZCN-SRVKXCTJSA-N 0.000 description 1
- HBXAOEBRGLCLIW-AVGNSLFASA-N Phe-Ser-Gln Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N HBXAOEBRGLCLIW-AVGNSLFASA-N 0.000 description 1
- VGTJSEYTVMAASM-RPTUDFQQSA-N Phe-Thr-Tyr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O VGTJSEYTVMAASM-RPTUDFQQSA-N 0.000 description 1
- ZYNBEWGJFXTBDU-ACRUOGEOSA-N Phe-Tyr-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CC=CC=C2)N ZYNBEWGJFXTBDU-ACRUOGEOSA-N 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 201000005746 Pituitary adenoma Diseases 0.000 description 1
- 206010061538 Pituitary tumour benign Diseases 0.000 description 1
- 208000007452 Plasmacytoma Diseases 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 206010036524 Precursor B-lymphoblastic lymphomas Diseases 0.000 description 1
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 208000017414 Precursor T-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 206010036711 Primary mediastinal large B-cell lymphomas Diseases 0.000 description 1
- OOLOTUZJUBOMAX-GUBZILKMSA-N Pro-Ala-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(O)=O OOLOTUZJUBOMAX-GUBZILKMSA-N 0.000 description 1
- VCYJKOLZYPYGJV-AVGNSLFASA-N Pro-Arg-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O VCYJKOLZYPYGJV-AVGNSLFASA-N 0.000 description 1
- KDIIENQUNVNWHR-JYJNAYRXSA-N Pro-Arg-Phe Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O KDIIENQUNVNWHR-JYJNAYRXSA-N 0.000 description 1
- UPJGUQPLYWTISV-GUBZILKMSA-N Pro-Gln-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O UPJGUQPLYWTISV-GUBZILKMSA-N 0.000 description 1
- UAYHMOIGIQZLFR-NHCYSSNCSA-N Pro-Gln-Val Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O UAYHMOIGIQZLFR-NHCYSSNCSA-N 0.000 description 1
- MGDFPGCFVJFITQ-CIUDSAMLSA-N Pro-Glu-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O MGDFPGCFVJFITQ-CIUDSAMLSA-N 0.000 description 1
- WFHYFCWBLSKEMS-KKUMJFAQSA-N Pro-Glu-Phe Chemical compound N([C@@H](CCC(=O)O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C(=O)[C@@H]1CCCN1 WFHYFCWBLSKEMS-KKUMJFAQSA-N 0.000 description 1
- LGSANCBHSMDFDY-GARJFASQSA-N Pro-Glu-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CCC(=O)O)C(=O)N2CCC[C@@H]2C(=O)O LGSANCBHSMDFDY-GARJFASQSA-N 0.000 description 1
- UUHXBJHVTVGSKM-BQBZGAKWSA-N Pro-Gly-Asn Chemical compound [H]N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CC(N)=O)C(O)=O UUHXBJHVTVGSKM-BQBZGAKWSA-N 0.000 description 1
- VYWNORHENYEQDW-YUMQZZPRSA-N Pro-Gly-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 VYWNORHENYEQDW-YUMQZZPRSA-N 0.000 description 1
- HAEGAELAYWSUNC-WPRPVWTQSA-N Pro-Gly-Val Chemical compound [H]N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O HAEGAELAYWSUNC-WPRPVWTQSA-N 0.000 description 1
- KLSOMAFWRISSNI-OSUNSFLBSA-N Pro-Ile-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]1CCCN1 KLSOMAFWRISSNI-OSUNSFLBSA-N 0.000 description 1
- CLJLVCYFABNTHP-DCAQKATOSA-N Pro-Leu-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O CLJLVCYFABNTHP-DCAQKATOSA-N 0.000 description 1
- DRKAXLDECUGLFE-ULQDDVLXSA-N Pro-Leu-Phe Chemical compound CC(C)C[C@H](NC(=O)[C@@H]1CCCN1)C(=O)N[C@@H](Cc1ccccc1)C(O)=O DRKAXLDECUGLFE-ULQDDVLXSA-N 0.000 description 1
- OFGUOWQVEGTVNU-DCAQKATOSA-N Pro-Lys-Ala Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O OFGUOWQVEGTVNU-DCAQKATOSA-N 0.000 description 1
- ZLXKLMHAMDENIO-DCAQKATOSA-N Pro-Lys-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLXKLMHAMDENIO-DCAQKATOSA-N 0.000 description 1
- KDBHVPXBQADZKY-GUBZILKMSA-N Pro-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 KDBHVPXBQADZKY-GUBZILKMSA-N 0.000 description 1
- RCYUBVHMVUHEBM-RCWTZXSCSA-N Pro-Pro-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O RCYUBVHMVUHEBM-RCWTZXSCSA-N 0.000 description 1
- KBUAPZAZPWNYSW-SRVKXCTJSA-N Pro-Pro-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 KBUAPZAZPWNYSW-SRVKXCTJSA-N 0.000 description 1
- GOMUXSCOIWIJFP-GUBZILKMSA-N Pro-Ser-Arg Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O GOMUXSCOIWIJFP-GUBZILKMSA-N 0.000 description 1
- OWQXAJQZLWHPBH-FXQIFTODSA-N Pro-Ser-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O OWQXAJQZLWHPBH-FXQIFTODSA-N 0.000 description 1
- GMJDSFYVTAMIBF-FXQIFTODSA-N Pro-Ser-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O GMJDSFYVTAMIBF-FXQIFTODSA-N 0.000 description 1
- SEZGGSHLMROBFX-CIUDSAMLSA-N Pro-Ser-Gln Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(O)=O SEZGGSHLMROBFX-CIUDSAMLSA-N 0.000 description 1
- MKGIILKDUGDRRO-FXQIFTODSA-N Pro-Ser-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H]1CCCN1 MKGIILKDUGDRRO-FXQIFTODSA-N 0.000 description 1
- HRIXMVRZRGFKNQ-HJGDQZAQSA-N Pro-Thr-Gln Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O HRIXMVRZRGFKNQ-HJGDQZAQSA-N 0.000 description 1
- GZNYIXWOIUFLGO-ZJDVBMNYSA-N Pro-Thr-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GZNYIXWOIUFLGO-ZJDVBMNYSA-N 0.000 description 1
- 102000014128 RANK Ligand Human genes 0.000 description 1
- 108010025832 RANK Ligand Proteins 0.000 description 1
- 102000018795 RELT Human genes 0.000 description 1
- 108010052562 RELT Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- BFZKMNSQCNVFGM-UCEYFQQTSA-N Sagopilone Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](CC=C)[C@@H](O)[C@@H](C)CCC[C@@]2(C)O[C@H]2C[C@H]1C1=CC=C(SC(C)=N2)C2=C1 BFZKMNSQCNVFGM-UCEYFQQTSA-N 0.000 description 1
- WTUJZHKANPDPIN-CIUDSAMLSA-N Ser-Ala-Lys Chemical compound C[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N WTUJZHKANPDPIN-CIUDSAMLSA-N 0.000 description 1
- YQHZVYJAGWMHES-ZLUOBGJFSA-N Ser-Ala-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YQHZVYJAGWMHES-ZLUOBGJFSA-N 0.000 description 1
- JJKSSJVYOVRJMZ-FXQIFTODSA-N Ser-Arg-Cys Chemical compound C(C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CO)N)CN=C(N)N JJKSSJVYOVRJMZ-FXQIFTODSA-N 0.000 description 1
- QVOGDCQNGLBNCR-FXQIFTODSA-N Ser-Arg-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O QVOGDCQNGLBNCR-FXQIFTODSA-N 0.000 description 1
- OYEDZGNMSBZCIM-XGEHTFHBSA-N Ser-Arg-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OYEDZGNMSBZCIM-XGEHTFHBSA-N 0.000 description 1
- UBRXAVQWXOWRSJ-ZLUOBGJFSA-N Ser-Asn-Asp Chemical compound C([C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CO)N)C(=O)N UBRXAVQWXOWRSJ-ZLUOBGJFSA-N 0.000 description 1
- MOVJSUIKUNCVMG-ZLUOBGJFSA-N Ser-Cys-Ser Chemical compound C([C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CO)C(=O)O)N)O MOVJSUIKUNCVMG-ZLUOBGJFSA-N 0.000 description 1
- RNMRYWZYFHHOEV-CIUDSAMLSA-N Ser-Gln-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O RNMRYWZYFHHOEV-CIUDSAMLSA-N 0.000 description 1
- CDVFZMOFNJPUDD-ACZMJKKPSA-N Ser-Gln-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O CDVFZMOFNJPUDD-ACZMJKKPSA-N 0.000 description 1
- ZOHGLPQGEHSLPD-FXQIFTODSA-N Ser-Gln-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O ZOHGLPQGEHSLPD-FXQIFTODSA-N 0.000 description 1
- XWCYBVBLJRWOFR-WDSKDSINSA-N Ser-Gln-Gly Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O XWCYBVBLJRWOFR-WDSKDSINSA-N 0.000 description 1
- VQBCMLMPEWPUTB-ACZMJKKPSA-N Ser-Glu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O VQBCMLMPEWPUTB-ACZMJKKPSA-N 0.000 description 1
- SFTZWNJFZYOLBD-ZDLURKLDSA-N Ser-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO SFTZWNJFZYOLBD-ZDLURKLDSA-N 0.000 description 1
- XXXAXOWMBOKTRN-XPUUQOCRSA-N Ser-Gly-Val Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O XXXAXOWMBOKTRN-XPUUQOCRSA-N 0.000 description 1
- DJACUBDEDBZKLQ-KBIXCLLPSA-N Ser-Ile-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(O)=O DJACUBDEDBZKLQ-KBIXCLLPSA-N 0.000 description 1
- JIPVNVNKXJLFJF-BJDJZHNGSA-N Ser-Ile-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N JIPVNVNKXJLFJF-BJDJZHNGSA-N 0.000 description 1
- IUXGJEIKJBYKOO-SRVKXCTJSA-N Ser-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CO)N IUXGJEIKJBYKOO-SRVKXCTJSA-N 0.000 description 1
- JWOBLHJRDADHLN-KKUMJFAQSA-N Ser-Leu-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O JWOBLHJRDADHLN-KKUMJFAQSA-N 0.000 description 1
- FPCGZYMRFFIYIH-CIUDSAMLSA-N Ser-Lys-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O FPCGZYMRFFIYIH-CIUDSAMLSA-N 0.000 description 1
- HHJFMHQYEAAOBM-ZLUOBGJFSA-N Ser-Ser-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O HHJFMHQYEAAOBM-ZLUOBGJFSA-N 0.000 description 1
- XQJCEKXQUJQNNK-ZLUOBGJFSA-N Ser-Ser-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O XQJCEKXQUJQNNK-ZLUOBGJFSA-N 0.000 description 1
- VGQVAVQWKJLIRM-FXQIFTODSA-N Ser-Ser-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O VGQVAVQWKJLIRM-FXQIFTODSA-N 0.000 description 1
- PCJLFYBAQZQOFE-KATARQTJSA-N Ser-Thr-Lys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N)O PCJLFYBAQZQOFE-KATARQTJSA-N 0.000 description 1
- VLMIUSLQONKLDV-HEIBUPTGSA-N Ser-Thr-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O VLMIUSLQONKLDV-HEIBUPTGSA-N 0.000 description 1
- BDMWLJLPPUCLNV-XGEHTFHBSA-N Ser-Thr-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O BDMWLJLPPUCLNV-XGEHTFHBSA-N 0.000 description 1
- AXKJPUBALUNJEO-UBHSHLNASA-N Ser-Trp-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC(N)=O)C(O)=O AXKJPUBALUNJEO-UBHSHLNASA-N 0.000 description 1
- PIQRHJQWEPWFJG-UWJYBYFXSA-N Ser-Tyr-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C)C(O)=O PIQRHJQWEPWFJG-UWJYBYFXSA-N 0.000 description 1
- GSCVDSBEYVGMJQ-SRVKXCTJSA-N Ser-Tyr-Asp Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CO)N)O GSCVDSBEYVGMJQ-SRVKXCTJSA-N 0.000 description 1
- HKHCTNFKZXAMIF-KKUMJFAQSA-N Ser-Tyr-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CC1=CC=C(O)C=C1 HKHCTNFKZXAMIF-KKUMJFAQSA-N 0.000 description 1
- OQSQCUWQOIHECT-YJRXYDGGSA-N Ser-Tyr-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OQSQCUWQOIHECT-YJRXYDGGSA-N 0.000 description 1
- IAOHCSQDQDWRQU-GUBZILKMSA-N Ser-Val-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IAOHCSQDQDWRQU-GUBZILKMSA-N 0.000 description 1
- RCOUFINCYASMDN-GUBZILKMSA-N Ser-Val-Met Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCSC)C(O)=O RCOUFINCYASMDN-GUBZILKMSA-N 0.000 description 1
- HSWXBJCBYSWBPT-GUBZILKMSA-N Ser-Val-Val Chemical compound CC(C)[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CO)C(C)C)C(O)=O HSWXBJCBYSWBPT-GUBZILKMSA-N 0.000 description 1
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 208000004346 Smoldering Multiple Myeloma Diseases 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 208000000277 Splenic Neoplasms Diseases 0.000 description 1
- 230000020385 T cell costimulation Effects 0.000 description 1
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 description 1
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000037913 T-cell disorder Diseases 0.000 description 1
- 102100039367 T-cell immunoglobulin and mucin domain-containing protein 4 Human genes 0.000 description 1
- 101710174757 T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 1
- 208000020982 T-lymphoblastic lymphoma Diseases 0.000 description 1
- 108700002718 TACI receptor-IgG Fc fragment fusion Proteins 0.000 description 1
- 229940124613 TLR 7/8 agonist Drugs 0.000 description 1
- 108010014401 TWEAK Receptor Proteins 0.000 description 1
- 102000016946 TWEAK Receptor Human genes 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- IGROJMCBGRFRGI-YTLHQDLWSA-N Thr-Ala-Ala Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(O)=O IGROJMCBGRFRGI-YTLHQDLWSA-N 0.000 description 1
- LMMDEZPNUTZJAY-GCJQMDKQSA-N Thr-Asp-Ala Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(O)=O LMMDEZPNUTZJAY-GCJQMDKQSA-N 0.000 description 1
- ASJDFGOPDCVXTG-KATARQTJSA-N Thr-Cys-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(O)=O ASJDFGOPDCVXTG-KATARQTJSA-N 0.000 description 1
- KWQBJOUOSNJDRR-XAVMHZPKSA-N Thr-Cys-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)N1CCC[C@@H]1C(=O)O)N)O KWQBJOUOSNJDRR-XAVMHZPKSA-N 0.000 description 1
- WLDUCKSCDRIVLJ-NUMRIWBASA-N Thr-Gln-Asp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC(=O)O)C(=O)O)N)O WLDUCKSCDRIVLJ-NUMRIWBASA-N 0.000 description 1
- UHBPFYOQQPFKQR-JHEQGTHGSA-N Thr-Gln-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O UHBPFYOQQPFKQR-JHEQGTHGSA-N 0.000 description 1
- VGYBYGQXZJDZJU-XQXXSGGOSA-N Thr-Glu-Ala Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O VGYBYGQXZJDZJU-XQXXSGGOSA-N 0.000 description 1
- QQWNRERCGGZOKG-WEDXCCLWSA-N Thr-Gly-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O QQWNRERCGGZOKG-WEDXCCLWSA-N 0.000 description 1
- FIFDDJFLNVAVMS-RHYQMDGZSA-N Thr-Leu-Met Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(O)=O FIFDDJFLNVAVMS-RHYQMDGZSA-N 0.000 description 1
- NCXVJIQMWSGRHY-KXNHARMFSA-N Thr-Leu-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N)O NCXVJIQMWSGRHY-KXNHARMFSA-N 0.000 description 1
- BDGBHYCAZJPLHX-HJGDQZAQSA-N Thr-Lys-Asn Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O BDGBHYCAZJPLHX-HJGDQZAQSA-N 0.000 description 1
- JLNMFGCJODTXDH-WEDXCCLWSA-N Thr-Lys-Gly Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)NCC(O)=O JLNMFGCJODTXDH-WEDXCCLWSA-N 0.000 description 1
- LHNNQVXITHUCAB-QTKMDUPCSA-N Thr-Met-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N)O LHNNQVXITHUCAB-QTKMDUPCSA-N 0.000 description 1
- HSQXHRIRJSFDOH-URLPEUOOSA-N Thr-Phe-Ile Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HSQXHRIRJSFDOH-URLPEUOOSA-N 0.000 description 1
- MROIJTGJGIDEEJ-RCWTZXSCSA-N Thr-Pro-Pro Chemical compound C[C@@H](O)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 MROIJTGJGIDEEJ-RCWTZXSCSA-N 0.000 description 1
- DOBIBIXIHJKVJF-XKBZYTNZSA-N Thr-Ser-Gln Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCC(N)=O DOBIBIXIHJKVJF-XKBZYTNZSA-N 0.000 description 1
- YRJOLUDFVAUXLI-GSSVUCPTSA-N Thr-Thr-Asp Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(O)=O YRJOLUDFVAUXLI-GSSVUCPTSA-N 0.000 description 1
- DIHPMRTXPYMDJZ-KAOXEZKKSA-N Thr-Tyr-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N2CCC[C@@H]2C(=O)O)N)O DIHPMRTXPYMDJZ-KAOXEZKKSA-N 0.000 description 1
- LVRFMARKDGGZMX-IZPVPAKOSA-N Thr-Tyr-Thr Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)O)C(O)=O)CC1=CC=C(O)C=C1 LVRFMARKDGGZMX-IZPVPAKOSA-N 0.000 description 1
- FYBFTPLPAXZBOY-KKHAAJSZSA-N Thr-Val-Asp Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O FYBFTPLPAXZBOY-KKHAAJSZSA-N 0.000 description 1
- QNXZCKMXHPULME-ZNSHCXBVSA-N Thr-Val-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N)O QNXZCKMXHPULME-ZNSHCXBVSA-N 0.000 description 1
- MNYNCKZAEIAONY-XGEHTFHBSA-N Thr-Val-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O MNYNCKZAEIAONY-XGEHTFHBSA-N 0.000 description 1
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 1
- 102100025946 Transforming growth factor beta activator LRRC32 Human genes 0.000 description 1
- 101710169732 Transforming growth factor beta activator LRRC32 Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 102100026224 Transmembrane and immunoglobulin domain-containing protein 2 Human genes 0.000 description 1
- UKINEYBQXPMOJO-UBHSHLNASA-N Trp-Asn-Ser Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CO)C(=O)O)N UKINEYBQXPMOJO-UBHSHLNASA-N 0.000 description 1
- DQDXHYIEITXNJY-BPUTZDHNSA-N Trp-Gln-Gln Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N DQDXHYIEITXNJY-BPUTZDHNSA-N 0.000 description 1
- VTHNLRXALGUDBS-BPUTZDHNSA-N Trp-Gln-Glu Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N VTHNLRXALGUDBS-BPUTZDHNSA-N 0.000 description 1
- UHXOYRWHIQZAKV-SZMVWBNQSA-N Trp-Pro-Arg Chemical compound O=C([C@H](CC=1C2=CC=CC=C2NC=1)N)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O UHXOYRWHIQZAKV-SZMVWBNQSA-N 0.000 description 1
- HHPSUFUXXBOFQY-AQZXSJQPSA-N Trp-Thr-Asn Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N)O HHPSUFUXXBOFQY-AQZXSJQPSA-N 0.000 description 1
- YXSSXUIBUJGHJY-SFJXLCSZSA-N Trp-Thr-Phe Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)[C@H](O)C)C(O)=O)C1=CC=CC=C1 YXSSXUIBUJGHJY-SFJXLCSZSA-N 0.000 description 1
- PKZIWSHDJYIPRH-JBACZVJFSA-N Trp-Tyr-Gln Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O PKZIWSHDJYIPRH-JBACZVJFSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100024584 Tumor necrosis factor ligand superfamily member 12 Human genes 0.000 description 1
- 101710097155 Tumor necrosis factor ligand superfamily member 12 Proteins 0.000 description 1
- 108090000138 Tumor necrosis factor ligand superfamily member 15 Proteins 0.000 description 1
- 108050002568 Tumor necrosis factor ligand superfamily member 6 Proteins 0.000 description 1
- 102100032100 Tumor necrosis factor ligand superfamily member 8 Human genes 0.000 description 1
- 102100022203 Tumor necrosis factor receptor superfamily member 25 Human genes 0.000 description 1
- 102100030810 Tumor necrosis factor receptor superfamily member EDAR Human genes 0.000 description 1
- 206010054094 Tumour necrosis Diseases 0.000 description 1
- 102000007537 Type II DNA Topoisomerases Human genes 0.000 description 1
- 108010046308 Type II DNA Topoisomerases Proteins 0.000 description 1
- BURPTJBFWIOHEY-UWJYBYFXSA-N Tyr-Ala-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 BURPTJBFWIOHEY-UWJYBYFXSA-N 0.000 description 1
- SCCKSNREWHMKOJ-SRVKXCTJSA-N Tyr-Asn-Ser Chemical compound N[C@@H](Cc1ccc(O)cc1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O SCCKSNREWHMKOJ-SRVKXCTJSA-N 0.000 description 1
- WZQZUVWEPMGIMM-JYJNAYRXSA-N Tyr-Gln-Lys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCCCN)C(=O)O)N)O WZQZUVWEPMGIMM-JYJNAYRXSA-N 0.000 description 1
- GULIUBBXCYPDJU-CQDKDKBSSA-N Tyr-Leu-Ala Chemical compound [O-]C(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]([NH3+])CC1=CC=C(O)C=C1 GULIUBBXCYPDJU-CQDKDKBSSA-N 0.000 description 1
- HSBZWINKRYZCSQ-KKUMJFAQSA-N Tyr-Lys-Asp Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O HSBZWINKRYZCSQ-KKUMJFAQSA-N 0.000 description 1
- SINRIKQYQJRGDQ-MEYUZBJRSA-N Tyr-Lys-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 SINRIKQYQJRGDQ-MEYUZBJRSA-N 0.000 description 1
- WURLIFOWSMBUAR-SLFFLAALSA-N Tyr-Phe-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=CC=C2)NC(=O)[C@H](CC3=CC=C(C=C3)O)N)C(=O)O WURLIFOWSMBUAR-SLFFLAALSA-N 0.000 description 1
- NHOVZGFNTGMYMI-KKUMJFAQSA-N Tyr-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 NHOVZGFNTGMYMI-KKUMJFAQSA-N 0.000 description 1
- PWKMJDQXKCENMF-MEYUZBJRSA-N Tyr-Thr-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O PWKMJDQXKCENMF-MEYUZBJRSA-N 0.000 description 1
- 102000003425 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 206010046431 Urethral cancer Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 206010046788 Uterine haemorrhage Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 201000003761 Vaginal carcinoma Diseases 0.000 description 1
- 206010046910 Vaginal haemorrhage Diseases 0.000 description 1
- AZSHAZJLOZQYAY-FXQIFTODSA-N Val-Ala-Ser Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O AZSHAZJLOZQYAY-FXQIFTODSA-N 0.000 description 1
- COYSIHFOCOMGCF-UHFFFAOYSA-N Val-Arg-Gly Natural products CC(C)C(N)C(=O)NC(C(=O)NCC(O)=O)CCCN=C(N)N COYSIHFOCOMGCF-UHFFFAOYSA-N 0.000 description 1
- VMRFIKXKOFNMHW-GUBZILKMSA-N Val-Arg-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CO)C(=O)O)N VMRFIKXKOFNMHW-GUBZILKMSA-N 0.000 description 1
- GNWUWQAVVJQREM-NHCYSSNCSA-N Val-Asn-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N GNWUWQAVVJQREM-NHCYSSNCSA-N 0.000 description 1
- LIQJSDDOULTANC-QSFUFRPTSA-N Val-Asn-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](C(C)C)N LIQJSDDOULTANC-QSFUFRPTSA-N 0.000 description 1
- JLFKWDAZBRYCGX-ZKWXMUAHSA-N Val-Asn-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CO)C(=O)O)N JLFKWDAZBRYCGX-ZKWXMUAHSA-N 0.000 description 1
- QHDXUYOYTPWCSK-RCOVLWMOSA-N Val-Asp-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)NCC(=O)O)N QHDXUYOYTPWCSK-RCOVLWMOSA-N 0.000 description 1
- SCBITHMBEJNRHC-LSJOCFKGSA-N Val-Asp-Val Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](C(C)C)C(=O)O)N SCBITHMBEJNRHC-LSJOCFKGSA-N 0.000 description 1
- JXGWQYWDUOWQHA-DZKIICNBSA-N Val-Gln-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N JXGWQYWDUOWQHA-DZKIICNBSA-N 0.000 description 1
- WDIGUPHXPBMODF-UMNHJUIQSA-N Val-Glu-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N1CCC[C@@H]1C(=O)O)N WDIGUPHXPBMODF-UMNHJUIQSA-N 0.000 description 1
- RKIGNDAHUOOIMJ-BQFCYCMXSA-N Val-Glu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)C(C)C)C(O)=O)=CNC2=C1 RKIGNDAHUOOIMJ-BQFCYCMXSA-N 0.000 description 1
- UEHRGZCNLSWGHK-DLOVCJGASA-N Val-Glu-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O UEHRGZCNLSWGHK-DLOVCJGASA-N 0.000 description 1
- DJEVQCWNMQOABE-RCOVLWMOSA-N Val-Gly-Asp Chemical compound CC(C)[C@@H](C(=O)NCC(=O)N[C@@H](CC(=O)O)C(=O)O)N DJEVQCWNMQOABE-RCOVLWMOSA-N 0.000 description 1
- LAYSXAOGWHKNED-XPUUQOCRSA-N Val-Gly-Ser Chemical compound CC(C)[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O LAYSXAOGWHKNED-XPUUQOCRSA-N 0.000 description 1
- ZIGZPYJXIWLQFC-QTKMDUPCSA-N Val-His-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](C(C)C)N)O ZIGZPYJXIWLQFC-QTKMDUPCSA-N 0.000 description 1
- WNZSAUMKZQXHNC-UKJIMTQDSA-N Val-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](C(C)C)N WNZSAUMKZQXHNC-UKJIMTQDSA-N 0.000 description 1
- VHRLUTIMTDOVCG-PEDHHIEDSA-N Val-Ile-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)O)NC(=O)[C@H](C(C)C)N VHRLUTIMTDOVCG-PEDHHIEDSA-N 0.000 description 1
- HGJRMXOWUWVUOA-GVXVVHGQSA-N Val-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](C(C)C)N HGJRMXOWUWVUOA-GVXVVHGQSA-N 0.000 description 1
- HPANGHISDXDUQY-ULQDDVLXSA-N Val-Lys-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N HPANGHISDXDUQY-ULQDDVLXSA-N 0.000 description 1
- SBJCTAZFSZXWSR-AVGNSLFASA-N Val-Met-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N SBJCTAZFSZXWSR-AVGNSLFASA-N 0.000 description 1
- VCIYTVOBLZHFSC-XHSDSOJGSA-N Val-Phe-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N2CCC[C@@H]2C(=O)O)N VCIYTVOBLZHFSC-XHSDSOJGSA-N 0.000 description 1
- YTNGABPUXFEOGU-SRVKXCTJSA-N Val-Pro-Arg Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCN=C(N)N)C(O)=O YTNGABPUXFEOGU-SRVKXCTJSA-N 0.000 description 1
- VHIZXDZMTDVFGX-DCAQKATOSA-N Val-Ser-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)N VHIZXDZMTDVFGX-DCAQKATOSA-N 0.000 description 1
- ZLNYBMWGPOKSLW-LSJOCFKGSA-N Val-Val-Asp Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLNYBMWGPOKSLW-LSJOCFKGSA-N 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 239000002487 adenosine deaminase inhibitor Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000010100 anticoagulation Effects 0.000 description 1
- 239000003080 antimitotic agent Substances 0.000 description 1
- 229940045719 antineoplastic alkylating agent nitrosoureas Drugs 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 239000010425 asbestos Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- 108010036999 aspartyl-alanyl-histidyl-lysine Proteins 0.000 description 1
- 108010047857 aspartylglycine Proteins 0.000 description 1
- 229950009925 atacicept Drugs 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 108010010804 beta2 Heterotrimer Lymphotoxin alpha1 Proteins 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000010256 biochemical assay Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 208000027503 bloody stool Diseases 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000004611 cancer cell death Effects 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- IQXIUTMSTALSFW-VJFOLWCZSA-N carboplatin paclitaxel Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1.O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 IQXIUTMSTALSFW-VJFOLWCZSA-N 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000011748 cell maturation Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 208000019065 cervical carcinoma Diseases 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- WMRQHSFWMFGIFW-SGNBTFORSA-N chembl1242194 Chemical compound C([C@@]([C@@H]1C[C@H]2C(C)=C[C@H]3[C@@H](O)[C@@H]([C@H]([C@@H]3[C@H]2[C@@H]11)O)C)(C)O2)C[C@H]3OC(=O)C1=C2[C@@H]3C WMRQHSFWMFGIFW-SGNBTFORSA-N 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 238000009104 chemotherapy regimen Methods 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 208000013116 chronic cough Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000024207 chronic leukemia Diseases 0.000 description 1
- 238000011278 co-treatment Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 201000010897 colon adenocarcinoma Diseases 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 108010006226 cryptophycin Proteins 0.000 description 1
- PSNOPSMXOBPNNV-VVCTWANISA-N cryptophycin 1 Chemical compound C1=C(Cl)C(OC)=CC=C1C[C@@H]1C(=O)NC[C@@H](C)C(=O)O[C@@H](CC(C)C)C(=O)O[C@H]([C@H](C)[C@@H]2[C@H](O2)C=2C=CC=CC=2)C/C=C/C(=O)N1 PSNOPSMXOBPNNV-VVCTWANISA-N 0.000 description 1
- 108010083340 cryptophycin 52 Proteins 0.000 description 1
- PSNOPSMXOBPNNV-UHFFFAOYSA-N cryptophycin-327 Natural products C1=C(Cl)C(OC)=CC=C1CC1C(=O)NCC(C)C(=O)OC(CC(C)C)C(=O)OC(C(C)C2C(O2)C=2C=CC=CC=2)CC=CC(=O)N1 PSNOPSMXOBPNNV-UHFFFAOYSA-N 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960002433 cysteine Drugs 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 229960001305 cysteine hydrochloride Drugs 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 102000003675 cytokine receptors Human genes 0.000 description 1
- 108010057085 cytokine receptors Proteins 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 229950007409 dacetuzumab Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 229930184531 desoxyepothilone Natural products 0.000 description 1
- BEFZAMRWPCMWFJ-UHFFFAOYSA-N desoxyepothilone A Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC=CCC1C(C)=CC1=CSC(C)=N1 BEFZAMRWPCMWFJ-UHFFFAOYSA-N 0.000 description 1
- XOZIUKBZLSUILX-UHFFFAOYSA-N desoxyepothilone B Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC(C)=CCC1C(C)=CC1=CSC(C)=N1 XOZIUKBZLSUILX-UHFFFAOYSA-N 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- MCWXGJITAZMZEV-UHFFFAOYSA-N dimethoate Chemical compound CNC(=O)CSP(=S)(OC)OC MCWXGJITAZMZEV-UHFFFAOYSA-N 0.000 description 1
- FSXRLASFHBWESK-UHFFFAOYSA-N dipeptide phenylalanyl-tyrosine Natural products C=1C=C(O)C=CC=1CC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FSXRLASFHBWESK-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- NOTIQUSPUUHHEH-UXOVVSIBSA-N dromostanolone propionate Chemical compound C([C@@H]1CC2)C(=O)[C@H](C)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](OC(=O)CC)[C@@]2(C)CC1 NOTIQUSPUUHHEH-UXOVVSIBSA-N 0.000 description 1
- 229950004683 drostanolone propionate Drugs 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 229950009791 durvalumab Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000007937 eating Effects 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- XOPYFXBZMVTEJF-PDACKIITSA-N eleutherobin Chemical compound C(/[C@H]1[C@H](C(=CC[C@@H]1C(C)C)C)C[C@@H]([C@@]1(C)O[C@@]2(C=C1)OC)OC(=O)\C=C\C=1N=CN(C)C=1)=C2\CO[C@@H]1OC[C@@H](O)[C@@H](O)[C@@H]1OC(C)=O XOPYFXBZMVTEJF-PDACKIITSA-N 0.000 description 1
- XOPYFXBZMVTEJF-UHFFFAOYSA-N eleutherobin Natural products C1=CC2(OC)OC1(C)C(OC(=O)C=CC=1N=CN(C)C=1)CC(C(=CCC1C(C)C)C)C1C=C2COC1OCC(O)C(O)C1OC(C)=O XOPYFXBZMVTEJF-UHFFFAOYSA-N 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 201000003914 endometrial carcinoma Diseases 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 229950006370 epacadostat Drugs 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- BEFZAMRWPCMWFJ-QJKGZULSSA-N epothilone C Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)CCC\C=C/C[C@H]1C(\C)=C\C1=CSC(C)=N1 BEFZAMRWPCMWFJ-QJKGZULSSA-N 0.000 description 1
- XOZIUKBZLSUILX-GIQCAXHBSA-N epothilone D Chemical compound O1C(=O)C[C@H](O)C(C)(C)C(=O)[C@H](C)[C@@H](O)[C@@H](C)CCC\C(C)=C/C[C@H]1C(\C)=C\C1=CSC(C)=N1 XOZIUKBZLSUILX-GIQCAXHBSA-N 0.000 description 1
- FCCNKYGSMOSYPV-UHFFFAOYSA-N epothilone E Natural products O1C(=O)CC(O)C(C)(C)C(=O)C(C)C(O)C(C)CCCC2OC2CC1C(C)=CC1=CSC(CO)=N1 FCCNKYGSMOSYPV-UHFFFAOYSA-N 0.000 description 1
- 150000003883 epothilone derivatives Chemical class 0.000 description 1
- FCCNKYGSMOSYPV-OKOHHBBGSA-N epothilone e Chemical compound C/C([C@@H]1C[C@@H]2O[C@@H]2CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(CO)=N1 FCCNKYGSMOSYPV-OKOHHBBGSA-N 0.000 description 1
- UKIMCRYGLFQEOE-RGJAOAFDSA-N epothilone f Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(CO)=N1 UKIMCRYGLFQEOE-RGJAOAFDSA-N 0.000 description 1
- 229960000439 eribulin mesylate Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 201000001343 fallopian tube carcinoma Diseases 0.000 description 1
- 238000005206 flow analysis Methods 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229950000456 galunisertib Drugs 0.000 description 1
- 231100000024 genotoxic Toxicity 0.000 description 1
- 230000001738 genotoxic effect Effects 0.000 description 1
- 238000003881 globally optimized alternating phase rectangular pulse Methods 0.000 description 1
- 108010075431 glycyl-alanyl-phenylalanine Proteins 0.000 description 1
- 108010015792 glycyllysine Proteins 0.000 description 1
- 108010037850 glycylvaline Proteins 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 229950005277 gossypol Drugs 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 208000035474 group of disease Diseases 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- FXNFULJVOQMBCW-VZBLNRDYSA-N halichondrin b Chemical compound O([C@@H]1[C@@H](C)[C@@H]2O[C@@H]3C[C@@]4(O[C@H]5[C@@H](C)C[C@@]6(C[C@@H]([C@@H]7O[C@@H](C[C@@H]7O6)[C@@H](O)C[C@@H](O)CO)C)O[C@H]5C4)O[C@@H]3C[C@@H]2O[C@H]1C[C@@H]1C(=C)[C@H](C)C[C@@H](O1)CC[C@H]1C(=C)C[C@@H](O1)CC1)C(=O)C[C@H](O2)CC[C@H]3[C@H]2[C@H](O2)[C@@H]4O[C@@H]5C[C@@]21O[C@@H]5[C@@H]4O3 FXNFULJVOQMBCW-VZBLNRDYSA-N 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- 208000035861 hematochezia Diseases 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 208000006750 hematuria Diseases 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 108010092114 histidylphenylalanine Proteins 0.000 description 1
- 229940121372 histone deacetylase inhibitor Drugs 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 1
- 230000005745 host immune response Effects 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 150000002433 hydrophilic molecules Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960002899 hydroxyprogesterone Drugs 0.000 description 1
- 230000037315 hyperhidrosis Effects 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 230000005965 immune activity Effects 0.000 description 1
- 230000005746 immune checkpoint blockade Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000008088 immune pathway Effects 0.000 description 1
- 102000027596 immune receptors Human genes 0.000 description 1
- 108091008915 immune receptors Proteins 0.000 description 1
- 230000008629 immune suppression Effects 0.000 description 1
- 230000037451 immune surveillance Effects 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 208000014136 immunodeficiency 16 Diseases 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 229940027941 immunoglobulin g Drugs 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000013388 immunohistochemistry analysis Methods 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000015266 indolent plasma cell myeloma Diseases 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000016507 interphase Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 108010027338 isoleucylcysteine Proteins 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 238000009533 lab test Methods 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- 108010034529 leucyl-lysine Proteins 0.000 description 1
- 108010057821 leucylproline Proteins 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 229950011263 lirilumab Drugs 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 238000000464 low-speed centrifugation Methods 0.000 description 1
- 201000008443 lung non-squamous non-small cell carcinoma Diseases 0.000 description 1
- 201000010453 lymph node cancer Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 108010003700 lysyl aspartic acid Proteins 0.000 description 1
- 108010044348 lysyl-glutamyl-aspartic acid Proteins 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 150000008146 mannosides Chemical class 0.000 description 1
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 description 1
- 208000021937 marginal zone lymphoma Diseases 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 229960004616 medroxyprogesterone Drugs 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 229960001566 methyltestosterone Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 238000001471 micro-filtration Methods 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000033607 mismatch repair Effects 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 229960003816 muromonab-cd3 Drugs 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- PGXYIBJJCLWJST-MUUNZHRXSA-N n-(3-aminopropyl)-n-[(1r)-1-(3-benzyl-7-chloro-4-oxochromen-2-yl)-2-methylpropyl]-4-methylbenzamide Chemical compound NCCCN([C@H](C(C)C)C1=C(C(=O)C2=CC=C(Cl)C=C2O1)CC=1C=CC=CC=1)C(=O)C1=CC=C(C)C=C1 PGXYIBJJCLWJST-MUUNZHRXSA-N 0.000 description 1
- KWQWWUXRGIIBAS-UHFFFAOYSA-N n-[2-(4-hydroxyanilino)pyridin-3-yl]-4-methoxybenzenesulfonamide;hydrochloride Chemical compound Cl.C1=CC(OC)=CC=C1S(=O)(=O)NC1=CC=CN=C1NC1=CC=C(O)C=C1 KWQWWUXRGIIBAS-UHFFFAOYSA-N 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 229950004847 navitoclax Drugs 0.000 description 1
- JLYAXFNOILIKPP-KXQOOQHDSA-N navitoclax Chemical compound C([C@@H](NC1=CC=C(C=C1S(=O)(=O)C(F)(F)F)S(=O)(=O)NC(=O)C1=CC=C(C=C1)N1CCN(CC1)CC1=C(CCC(C1)(C)C)C=1C=CC(Cl)=CC=1)CSC=1C=CC=CC=1)CN1CCOCC1 JLYAXFNOILIKPP-KXQOOQHDSA-N 0.000 description 1
- 230000014399 negative regulation of angiogenesis Effects 0.000 description 1
- 208000025189 neoplasm of testis Diseases 0.000 description 1
- 210000002445 nipple Anatomy 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 230000025308 nuclear transport Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 229940047091 other immunostimulants in atc Drugs 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 229950007460 patupilone Drugs 0.000 description 1
- 229940121655 pd-1 inhibitor Drugs 0.000 description 1
- NETARJWZTMGMRM-KJHLVSCNSA-N peloruside A Natural products CC[C@@H](CO)C=C(C)[C@@H]1C[C@H](C[C@H](O)C(C)(C)[C@@]2(O)O[C@@H](C[C@@H](OC)[C@H](O)C(=O)O1)C[C@@H](OC)[C@H]2O)OC NETARJWZTMGMRM-KJHLVSCNSA-N 0.000 description 1
- NETARJWZTMGMRM-JRTPPQMASA-N peloruside A Chemical compound C1[C@H](OC)[C@@H](O)C(=O)O[C@@H](C(\C)=C/[C@@H](CO)CC)C[C@H](OC)C[C@@H](O)C(C)(C)[C@@]2(O)[C@@H](O)[C@@H](OC)C[C@@H]1O2 NETARJWZTMGMRM-JRTPPQMASA-N 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 108010012581 phenylalanylglutamate Proteins 0.000 description 1
- 108010073025 phenylalanylphenylalanine Proteins 0.000 description 1
- 108010051242 phenylalanylserine Proteins 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 229950010773 pidilizumab Drugs 0.000 description 1
- 208000021310 pituitary gland adenoma Diseases 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 108700002563 poly ICLC Proteins 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 208000017805 post-transplant lymphoproliferative disease Diseases 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 201000006037 primary mediastinal B-cell lymphoma Diseases 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108010077112 prolyl-proline Proteins 0.000 description 1
- 108010053725 prolylvaline Proteins 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 201000005825 prostate adenocarcinoma Diseases 0.000 description 1
- 229940121649 protein inhibitor Drugs 0.000 description 1
- 239000012268 protein inhibitor Substances 0.000 description 1
- 239000003197 protein kinase B inhibitor Substances 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 201000010174 renal carcinoma Diseases 0.000 description 1
- 229950010550 resiquimod Drugs 0.000 description 1
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 1
- 229910052895 riebeckite Inorganic materials 0.000 description 1
- 230000036186 satiety Effects 0.000 description 1
- 235000019627 satiety Nutrition 0.000 description 1
- 238000013391 scatchard analysis Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 108010048397 seryl-lysyl-leucine Proteins 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 229940075439 smac mimetic Drugs 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 208000010721 smoldering plasma cell myeloma Diseases 0.000 description 1
- 108010047846 soblidotin Proteins 0.000 description 1
- DZMVCVHATYROOS-ZBFGKEHZSA-N soblidotin Chemical compound CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)NCCC1=CC=CC=C1 DZMVCVHATYROOS-ZBFGKEHZSA-N 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 1
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 1
- 229940100996 sodium bisulfate Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 229940001482 sodium sulfite Drugs 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 208000037959 spinal tumor Diseases 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 201000002471 spleen cancer Diseases 0.000 description 1
- 206010062113 splenic marginal zone lymphoma Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000012414 sterilization procedure Methods 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 108010033090 surfactant protein A receptor Proteins 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 229940120982 tarceva Drugs 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 108010029464 tasidotin Proteins 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- ISIJQEHRDSCQIU-UHFFFAOYSA-N tert-butyl 2,7-diazaspiro[4.5]decane-7-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CCCC11CNCC1 ISIJQEHRDSCQIU-UHFFFAOYSA-N 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 208000030901 thyroid gland follicular carcinoma Diseases 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- AOBORMOPSGHCAX-DGHZZKTQSA-N tocofersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-DGHZZKTQSA-N 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 239000003970 toll like receptor agonist Substances 0.000 description 1
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 1
- 229940044655 toll-like receptor 9 agonist Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 231100000816 toxic dose Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000759 toxicological effect Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- 150000003648 triterpenes Chemical class 0.000 description 1
- 108010080629 tryptophan-leucine Proteins 0.000 description 1
- 108010038745 tryptophylglycine Proteins 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 230000005760 tumorsuppression Effects 0.000 description 1
- 230000002100 tumorsuppressive effect Effects 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 108010051110 tyrosyl-lysine Proteins 0.000 description 1
- 230000004222 uncontrolled growth Effects 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 108010073969 valyllysine Proteins 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 229940121351 vopratelimab Drugs 0.000 description 1
- 201000004916 vulva carcinoma Diseases 0.000 description 1
- 208000013013 vulvar carcinoma Diseases 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/04—Screening involving studying the effect of compounds C directly on molecule A (e.g. C are potential ligands for a receptor A, or potential substrates for an enzyme A)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Abstract
약 80% 미만의 수용체 점유율, 예를 들어, 약 20% 내지 약 80%의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 및/또는 빈도로 항체가 투여되는, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 사용하여 암을 치료하는 방법이 본원에서 제공된다. 이같은 효능작용 항체에 대한 인간 용량을 결정하는 방법, 및 예를 들어 인간 환자에서, 유효한 항체 수준을 유지하기 위해 효능작용 항체의 수용체 점유율을 모니터링하는 방법이 또한 제공된다. 대상체에서 가용성 OX40를 측정하는 방법이 또한 제공된다. 대상체에게 항-OX40 항체 및 항-PD-1 항체 각각의 유효량을 투여하는 것을 포함하는, 암을 치료하는 방법이 또한 제공된다.
Description
관련 출원에 대한 상호 참조
본 PCT 출원은 미국 가출원 번호 62/580,346 (2017년 11월 1일 출원); 62/581,441 (2017년 11월 3일 출원); 62/581,905 (2017년 11월 6일 출원); 62/583,808 (2017년 11월 9일 출원); 62/628,207 (2018년 2월 8일 출원); 및 62/657,616 (2018년 4월 13일 출원)을 우선권 주장하며, 이들 각각은 그 전문이 본원에 참조로 포함된다
전자 제출된 서열 목록에 대한 언급
본 출원과 함께 출원된 ASCII 텍스트 파일 (파일명: 3338.115PC06_ST25.txt; 크기: 30,589 바이트; 및 생성일: 2018년 10월 30일)의 전자 제출된 서열 목록의 내용은 전문이 본원에 참조로 포함된다.
다수의 면역억제 수용체가 암 요법에서 성공적으로 표적화되었지만, 면역 세포, 예컨대 조절 T 세포, 이펙터 세포 (예를 들어, T 세포), 및 항원-제시 세포 상에서 발현되는 조절 수용체와 억제 수용체 사이의 복잡한 상호작용이 특정한 면역 수용체를 표적화하는 항체가 효과적일지 여부의 예측을 어렵게 한다. 면역억제 수용체를 표적화하는 길항작용 항체 (예를 들어, 니볼루맙, 이필리무맙)의 최근의 성공에 비교하여, 예를 들어, 효능 결여 및/또는 독성으로 인해, 면역자극 수용체를 표적화하는 효능작용 항체는 임상 환경에서 거의 성공적지 않았다. 이러한 항체들은 개발되지 않은 잠재력을 나타내고, 이들의 효능 결여/독성의 기저를 이루는 이유가 해결될 수 있고, 이들의 사용이 최적화될 수 있다면, 종양학적 적응증에 대항하는데 이용가능한 치료제 풀을 실질적으로 증가시킬 가능성이 있다. 예를 들어, 면역 반응 예컨대 T 세포 반응을 증진시키는 것을 통해, 암과 같은 질환을 치료하기 위한 개선된 전략에 대한 요구가 진행 중인 것을 고려하여, 면역자극 수용체를 활성화시키는 방법을 최적화하는 것이 치료적으로 이로울 것이다.
한 측면에서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 암을 가진 대상체의 종양에서 T 조절 세포의 수를 감소시키거나 또는 고갈시키는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 암을 가진 대상체에서 T 세포에서의 IL-2 및/또는 IFN-γ 생산을 증가시키는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 암을 가진 대상체에서 면역 반응을 자극하는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 암을 가진 대상체에서 종양 세포의 성장을 억제하는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 암을 가진 대상체의 치료를 위해 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 유효한 용량 또는 항체 투여 스케줄을 선택하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 제공된다:
(a) 동물 모델에게 효능작용 항체를 투여하는 단계;
(b) 동물 모델로부터 샘플을 수득하는 단계;
(c) 샘플에서 효능작용 항체의 수용체 점유율 또는 수용체 점유율 범위를 결정하는 단계;
(d) 단계 (c)로부터 수득된 수용체 점유율 또는 수용체 점유율 범위를 사용하여, 대상체에서의 예상 수용체 점유율 또는 수용체 점유율 범위를 추정하는 단계; 및
(e) 단계 (d)에서 수득된 예상 수용체 점유율을 기반으로 대상체에서 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 효능작용 항체의 용량 또는 항체 투여 스케줄을 선택하는 단계.
또 다른 측면에서, 대상체에서 암을 치료하는 방법으로서, 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체 또는 이러한 항체를 포함하는 제약 조성물의 유효량을 대상체에게 투여하는 것을 포함하며, 여기서 투여되는 항체의 유효량은 본원에 기재된 방법에 따라 선택되는 것인 방법 본원에서 제공된다.
또 다른 측면에서, 암에 대해 치료 중인 대상체에서 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 수준을 모니터링하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 제공된다:
(a) 대상체로부터 샘플을 수득하는 단계;
(b) 샘플에서 효능작용 항체의 수용체 점유율을 결정하는 단계;
(c) 수용체 점유율이 약 80% (예를 들어, 70%, 60%, 50%)를 초과하면 대상체에게 투여되고 있는 효능작용 항체의 양 또는 빈도를 감소시키거나, 또는 수용체 점유율이 약 20% (예를 들어, 30%, 40%, 50%, 또는 60%) 미만이면 항체의 양 또는 빈도를 증가시키는 단계;
(d) 임의적으로, 약 20% 내지 약 80% (예를 들어, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%)의 수용체 점유율이 달성되고/되거나 유지될 때까지 단계 (a)-(c)를 반복하는 단계.
또 다른 측면에서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 추가적인 요법을 투여하는 것을 포함하며, 여기서 추가적인 요법은 고정 빈도로 투여되고, 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 용량 및 빈도로 투여되는 것인 방법이 본원에서 제공된다.
또 다른 측면에서, 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체를 투여받은 대상체에서 암에 대한 치료의 유효성을 결정하는 방법으로서, 대상체 (예를 들어, 대상체로부터의 샘플)에서 가용성 OX40의 수준을 측정하는 것을 포함하는 방법이 본원에서 제공된다.
본원에 개시된 방법의 일부 실시양태에서, 효능작용 항체는 약 20% 내지 약 80%, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 용량 또는 빈도로 투여된다. 일부 실시양태에서, 수용체 점유율 및/또는 수용체 점유율 범위는 치료 레지멘의 사이클 1 후의 제1일에 측정된다.
본원에 개시된 방법의 특정 실시양태에서, 효능작용 항체는 공동-자극 수용체와 같은 면역자극 수용체에 결합한다. 일부 실시양태에서, 항체는 종양 괴사 인자 수용체 수퍼패밀리의 구성원, ICOS, LFA-1 (CD11a/CD18), CD2, CD7, CD30, CD40, CD54, CD160, BAFFR, HVEM, LIGHT, NKG2C, SLAMF7, 및 NKp80에 결합한다. 한 실시양태에서, 효능작용 항체는 OX40에 결합한다.
본원에 개시된 방법의 일부 실시양태에서, 효능작용 항체는 IgG1, IgG2, IgG3, IgG4, 또는 그의 변이체로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 효능작용 항체는 활성화 FcγR에 대한 증진된 결합을 갖는 Fc를 포함한다. 일부 실시양태에서, 효능작용 항체는 인간, 인간화 또는 키메라 항체이다. 일부 실시양태에서, 효능작용 항체는 이중특이적 항체이다.
본원에 개시된 방법의 일부 실시양태에서, 치료될 암은 방광암, 유방암, 자궁/자궁경부암, 난소암, 전립선암, 고환암, 식도암, 위장암, 췌장암, 결장직장암, 결장암, 신장암, 두경부암, 폐암, 위암, 배세포암, 골암, 간암, 갑상선암, 피부암, 중추 신경계의 신생물, 림프종, 백혈병, 골수종, 육종, 비-소세포 폐암, 및 바이러스-관련 암으로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 암은 전이성, 불응성, 또는 재발성이다.
본원에 기재된 방법의 일부 실시양태에서, 하나 이상의 추가적인 요법 (예를 들어, 항-PD1 항체, 항-PDL1 항체, 항-LAG3 항체, 항-CTLA4 항체, 항-TGFβ 항체)가 대상체 (예를 들어, 인간 환자)에게 추가로 투여된다. 이같은 하나 이상의 추가적인 요법은 효능작용 항체 전에, 효능작용 항체 후에, 또는 효능작용 항체와 공동으로 투여될 수 있다.
일부 실시양태에서, 효능작용 항체 및 임의적인 하나 이상의 추가적인 요법은 제약 조성물로서 제형된다.
도 1a 및 1b는 지시된 용량 (mg/kg)의 IgG 및 리간드-차단 OX40.23 (도 1a) 및 리간드 비-차단 OX40.3 (도 1b)으로 처리된 CT26 마우스 종양 모델의 종양 성장 곡선이다.
도 2a 및 2b는 지시된 용량 (mg/kg)에서의 OX40.3 처리 마우스의 평균 및 중앙값 종양 부피를 각각 제시한다. 도 2c 및 2d는 지시된 용량 (mg/kg)에서의 OX40.23 처리 마우스의 평균 및 중앙값 종양 부피를 각각 제시한다.
도 3a는 OX40.23 + 항-PD1 항체의 조합으로 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다. 도 3b는 다양한 용량의 OX40.23 항체의 조합 처리의 퍼센트 종양 성장 억제를 제시하는 그래프이다.
도 4는 OX40.3 + 항-PD1 항체의 조합으로 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다.
도 5는 항-PD-1 항체와 공동으로 또는 순차적으로 (지연되어) 지시된 농도의 OX40.23으로 종양 이식 후 제5일 및 제12일에 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다. 공동 투여의 경우, 항-PD1 항체는 제5일, 제9일, 및 제13일에 투여되었다. 지연 투여의 경우, 항-PD1 항체는 제10일, 제14일, 및 제18일에 투여되었다.
도 6a는 단독요법으로 또는 항-PD1 항체와의 조합 요법으로 투여된 OX40.23에 대한 투약 및 샘플링 스케줄에 대한 개략도이다. 도 6b는 혈액 및 종양 샘플에서의 IgG, PD1, OX40.23 (0.3, 3, 및 10 mg/kg), 및 항-PD1 항체 + OX40.23 (0.03, 0.3, 3, 및 10 mg/kg)로 처리된 마우스에서의 OX40 수용체 점유율 (RO)의 그래프를 제시한다. 도 6c는 제8일 및 제13일의 종양에서의 OX40 수용체의 총 및 점유 수준의 그래프를 제시한다. 도 6d는 OX40 RO의 함수로서의 퍼센트 종양 성장 억제를 제시하는 그래프이다.
도 7a는 20 mg, 40 mg, 80 mg, 160 mg, 및 320 mg의 OX40.21이 투여된 인간 환자로부터의 말초 CD4+ T 세포 및 Treg 세포에서의 %OX40 RO를 제시하는 일련의 그래프이다. 2주 사이클의 C1D1, C1D8, 및 C2D1에 RO를 측정하였다. CD4+ Treg에서의 관찰된 말초 OX40 RO는 20 mg에서 80%였고, ≥ 40 mg의 용량에서 포화였다. 도 7b는 20 mg 내지 320 mg 범위의 OX40.21 용량에서 니볼루맙과 조합된 OX40.21의 노출을 제시하는 그래프이다.
도 8a는 관찰된 OX40.21 농도 데이터를 기재하기 위한 집단 PK (PPK) 모델이다. 도 8b는 RO의 중앙값 (선) 및 95% 신뢰 구간 (음영 면적)과 함께, OX40.21로 치료된 인간 환자로부터의 C2D1의 약물 농도 (Cmin1: 제1 용량 후의 최저 농도)와 CD4+ T 세포 상에서의 말초혈 RO 사이의 관계를 기재하기 위한 수학적 PK-PD 모델이다.
도 9는 다양한 OX40.21 용량 및 빈도에서의 CD4+ T 세포 상에서의 예측 혈액 RO (중앙값 및 90% 예측 구간)를 제시한다.
도 10a 및 10b는 다양한 투약 레지멘에 대한 예상 인간 종양 RO를 제시한다. 도 10a는 평균 종양 투과 및 평균 표적 로드를 제공한다. 도 10b는 낮은 종양 투과 및 높은 표적 로드를 제공한다.
도 11a는 OX40의 표면 발현 (OX40.21 (총))에 대한 수용체 점유율 (OX40.21 (결합))에 대한 OX40.21의 상이한 농도들의 효과를 제시하는 그래프이다. 도 11b는 OX40의 총 표면 발현에 대한 %OX40 RO의 영향을 요약하는 그래프이다.
도 12a 및 12b는 각각 이소타입 및 OX40.21 항체의 지시된 농도에서의 다양한 날 (제1일, 제2일, 제3일 및 제4일)의 OX40 표면 발현의 경과를 제시하는 그래프이다.
도 13a 및 13b는 총 표면 OX40 발현에 대한 OX40.21 (도 13a) 또는 CD28 (도 13b) 농도의 효과를 제시하는 그래프이다.
도 14는 OX40 RO (y-축), 및 OX40.21 농도 (x-축)의 함수로서 IFN-γ 수준에 의해 반영된 바와 같은 T 세포의 활성화를 제시하는 그래프이다.
도 15a는 OX40 RO (y-축), 및 OX40.21 농도 (x-축)의 함수로서 3[H]-티미딘 혼입에 의해 반영된 바와 같은 T 세포의 증식을 제시하는 그래프이다. 도 15b 및 15c는 각각 %OX40 RO의 척도로서 CD25+ T 세포 및 증식 중인 T 세포의 수를 제시하는 그래프이다.
도 16은 가용성 OX40 (sOX40) 수준을 측정하기 위한 ELISA의 개략도이다.
도 17은 세포가 지시된 농도의 OX40.21로 처리되었을 때의 세포 상에서의 표면 OX40 발현의 수준을 제시하는 그래프이다.
도 18은 세포가 지시된 농도의 OX40.21로 처리되었을 때의 가용성 OX40의 수준을 제시하는 그래프이다.
도 19는 인간 환자가 OX40.21 단독요법 또는 OX40.21 + 니볼루맙 조합 요법으로 치료되었을 때의 sOX40의 C1D1 대비 배수 증가를 제시하는 일련의 그래프이고, OX40.21은 20 mg, 40 mg, 80 mg, 160 mg, 및 320 mg으로 투여되었다.
도 20a는 세포가 이소타입, OX40.21, 또는 항-CD28 항체로 처리되었을 때의 제1일, 제2일, 제3일 및 제4일의 sOX40의 총 수준을 제시하는 그래프이다. 도 20b는 세포가 이소타입, OX40.21, 또는 항-CD28 항체로 처리되었을 때의 제1일, 제2일, 제3일 및 제4일의 결합된 sOX40의 수준을 제시하는 그래프이다.
도 21a는 세포를 OX40.21 및 항-CD28 항체로 공동-자극했을 때의 sOX40 수준에 대한 부가 효과를 제시하는 그래프이다. 도 21b는 배양에서 제3일에 OX40.21이 CD28에 부가된 후의 제4일 sOX40 수준에 대한 효과를 제시하는 그래프이다.
도 22는 OX40 내재화 검정을 제시하는 개략도이다.
도 23은 CD3/CD28로 활성화되고, 이어서 IgG1, DT, OX40.21 (리간드 차단 항체), 또는 OX40.8 (리간드 비-차단 항체)로 처리된 Treg에서의 OX40의 내재화를 제시하는 그래프이다.
도 24는 OX40.21의 효능작용 활성에 대한 FcγR-매개 가교의 효과를 제시하는 일련의 그래프이다.
도 25는 말초 약역학 마커의 평가를 위한, CT26 마우스 종양 모델을 단독요법으로서 또는 항-PD1 항체와 조합하여 OX40.23으로 처리하기 위한 투약 및 샘플링 스케줄을 제시하는 그래프이다.
도 26a는 CD4+ T 세포 및 CD8+ T 세포 내의 ICOS, Ki67, 및 CD44의 수준에 대한 OX40.23 단독요법 또는 항-PD1 항체와의 조합 요법의 효과를 제시하는 일련의 그래프이다. OX40 단독요법 패널에서, x-축 표지는 왼쪽에서 오른쪽으로 IgG, 90mpk, 30mpk, 10mpk, 3mpk, 1mpk, 0.3mpk, 0.1mpk, 및 0.03mpk이다. OX40/PD-1 조합 패널에서, x-축 표지는 왼쪽에서 오른쪽으로 IgG, PD1, PD1 + 90mpk, PD1 + 30mpk, PD1 + 10mpk, PD1 + 3mpk, PD1 + 1mpk, PD1 + 0.3mpk, PD1 + 0.1mpk, PD1 + 0.03mpk, 및 PD1 + 0.01mpk이다. 도 26b는 OX40.21 (20, 40, 80, 160, 또는 320 mg) + 니볼루맙의 조합물로 치료된 인간 환자의 종양 기질 내의 Ki67+인 CD8+ 세포의 백분율을 제시한다. 도 26c는 OX40.21 (20, 40, 80, 160, 또는 320 mg) + 니볼루맙으로 치료된 인간 환자의 종양 기질 내의 FOXP3+ 세포의 백분율을 제시한다. 도 26d는 OX40.21 (320 mg) + 니볼루맙 (240 mg)으로 치료된 자궁내막암을 가진 인간 환자의 종양 샘플로부터의 Ki67+CD8+ T 세포의 면역조직화학 분석을 제시한다. 도 26e는 장액성 난소 암종 (상부 패널) 및 난소 선암종 (하부 패널)을 가진 인간 환자의 종양 샘플로부터의 FOXP3+ 세포의 면역조직화학 분석을 제시한다.
도 27a 및 27b는 비-반응자 (종양 부피 >100 ㎣) 또는 반응자 (종양 부피 ≤100 ㎣) 상태를 기반으로, CD44 (도 27a) 및 Ki67 (도 27b)에 대해 양성인 CD8+ T 세포의 백분율의 그래프를 제시한다. 도 27c는 항종양 활성에 의한 % Ki67+CD8+ T 세포의 절대 변화 (종양 부담에서의 최대 퍼센트 감소)를 제시하는 그래프이다. 도 27d는 항종양 활성에 의한 Ki67+CD8+ T 세포의 변화 (종양 부담에서의 퍼센트 감소)를 제시하는 그래프이다. PR: 부분 반응, PD: 진행성 질환, SD: 안정적 질환.
도 28은 마우스 모델에서의 종양 성장 억제에 대한 항-ICOS + 항-PD1 조합 요법에서 항-ICOS 항체의 용량을 증가시키는 것의 효과를 제시하는 그래프이다.
도 29는 마우스 MC38 종양 모델에서의 mIgG1 및 mIgG2a 모노클로날 항-OX40 항체의 노출-반응 관계를 제시하는 일련의 그래프이다.
도 30은 OX-40에 대한 OX-40 효능제 항체 (BMS-986178 대용물 마우스 항체)의 작용 메카니즘을 실연한다. FcγR = Fcγ 수용체; FoxP3 = 포크헤드 박스 단백질 P3; NK = 천연 킬러; BMS-986178: OX40 모노클로날 항체.
도 31은 OX-40 효능제 항체 (BMS-986178 대용물 마우스 항체) 또는 이소타입 항체로 처리된 CD4+ T 세포 상에서의 CD25의 기하 평균 형광 강도 [GMFI]에 의해 측정된 바와 같은 T 세포 활성화를 나타낸다.
도 32a 및 32b는 이소타입 항체 대조군에 비교된 CHO 세포를 CD137 모노클로날 항체 (도 32a) 또는 CD28 모노클로날 항체 (도 32b)로 처리한 후의 OX40의 총 표면 발현에 대한 %OX40 RO의 영향을 요약하는 그래프이다.
도 33a-33i는 CHO 세포가 OX-40 효능제 항체로 처리되었을 때의 Treg 억제 검정에서의 후크 효과 및 용량 의존성을 제시한다. 도 33a는 Treg 억제 검정의 개략도이다. 도 33b는 Treg의 존재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33c는 Treg의 부재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33d는 Treg의 존재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33e는 Treg의 부재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33f는 Treg의 존재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33g는 Treg의 부재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33h는 Treg의 존재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33i는 Treg의 부재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다.
도 34a는 0.03 mg/kg, 0.3 mg/kg, 3.0 mg/kg, 10 mg/kg의 BMS-986178 (BMS-986178 대용물 마우스 항체) 또는 대조군 IgG로의 처리 7일 후의 종양 Treg 상에서의 OX40 RO 발현이다. 도 34b는 0.03 mg/kg, 0.3 mg/kg, 3.0 mg/kg, 10 mg/kg의 BMS-986178 (BMS-986178 대용물 마우스 항체) 또는 대조군 IgG로의 처리 7일 후의 종양 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 RO 발현이다. 도 34c는 0.5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 또는 대조군 PD-1 모노클로날 항체로의 처리 10일 후, 17일 후, 및 22일 후의 종양 Treg 상에서의 OX40 RO 발현이다. 도 34d는 0.5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 또는 대조군 PD-1 모노클로날 항체로의 처리 10일 후, 17일 후, 및 22일 후의 종양 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 RO 발현이다.
도 35a는 세포가 지시된 농도의 CD28 모노클로날 항체 또는 이소타입 항체 대조군으로 처리되었을 때의 가용성 OX40의 수준을 제시하는 그래프이다. 도 35b는 세포가 지시된 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)로 처리되었을 때의 총 및 약물-결합 가용성 OX40의 수준을 제시하는 그래프이다.
도 36은 세포가 0.01 nM 및 100 nM의 BMS-986178로 처리되었을 때의 Treg 및 CD4+ T 세포에 내재화된 OX40-결합-BMS-986178 (BMS-986178 대용물 마우스 항체)의 내재화를 제시한다.
도 37은 BMS-986178 (BMS-986178 대용물 마우스 항체) 용량, OX40 RO, OX40 발현, 및 PD 조정 사이의 관계의 개략적인 모델이다.
도 38은 대조군 모노클로날 항체 (mIgG1), BMS-986178 (BMS-986178 대용물 마우스 항체), 항-PD-1, 항-CTLA-4, BMS-986178 (BMS-986178 대용물 마우스 항체) 및 항-PD-1의 조합물 또는 BMS-986178 (BMS-986178 대용물 마우스 항체) 및 항-CTLA-4의 조합물로 처리된 CT26 마우스 종양 모델에서의 종양 부피 및 무종양 마우스의 수를 제시한다. mIgG = 마우스 면역글로불린 G; TF = 무종양; 항-PD-1 = 4H2 mIgG1 D265A, 항-CTLA-4 = 9D9 mIgG2b. 종양 부피 ± 표준 편차를 이식 (처리 시작) 후 제6일에 시작하여 매주 2회 측정하였다.
도 39는 단독요법 용량 증량 (BMS-986178 단독) 대 조합물 (BMS-986178 + 니볼루맙 또는 이필리무맙)에 대한 연구 디자인을 제시한다. DLT = 용량-제한 독성; ECOG PS = 동부 협동 종양학 그룹(Eastern Cooperative Oncology Group) 수행 상태; IV = 정맥내; MTD = 최대 허용 용량; Q2W = 2주마다; Q3W = 3주마다; RECIST = 고형 종양에서의 반응 평가 기준(Response Evaluation Criteria in Solid Tumors); RP2D = 권장 2기 용량. 도 40은 BMS-986178 ± 니볼루맙 또는 이필리무맙에서의 약동학을 제시한다.
도 41은 20 mg, 40 mg, 80 mg, 160 mg 또는 320 mg의 OX-40.21로의 처리 후의 C1D1, C1D8, C2D1, 또는 C5D1의 표면 마커를 사용한 말초 Treg 상에서의 말초 OX40 RO를 제시한다.
도 42는 20 mg, 40 mg, 80 mg, 160 mg 또는 320 mg의 OX-40.21로의 처리 후의 C1D1, C1D8, C2D1, 또는 C5D1의 표면 마커를 사용하여 말초 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 발현이다.
도 43a는 다양한 용량에서의 개별적인 환자 샘플에서의 경시적인 sOX40의 배수 변화를 제시한다. 도 43b는 다양한 용량의 sOX40의 정규화된 AUC를 제시한다. sOX40의 정규화된 AUC는 (AUC0-T 최종 / T l최종 )를 사용하여 계산되었고, 이는 추적 시간이 상이한 환자를 해명하였다; AUC0-T 최종 = 0시부터 최종 추적까지의 곡선하 면적; T 최종 = 최종 추적 시간.
도 44a 및 44b는 BMS-986178 ± 니볼루맙 또는 이필리무맙이 IFN-γ (도 44a) 및 IP-10 (도 44b)의 생산을 자극하였음을 제시한다.
도 45a 및 45b는 BMS-986178 ± 니볼루맙 또는 이필리무맙이 증식 중인 (Ki67+) CD4+ (도 45a) 및 CD8+ (도 45b) 이펙터 기억 T 세포의 수준을 증가시켰음을 제시한다.
도 46a 내지 46h는 인간 혈청에서의 총 가용성 OX40 수준을 측정하기 위해 개발된 인간 총 가용성 OX40 바이오마커 검정의 검증 결과를 제시한다. 도 46a는 BMS-986178과 2개의 상이한 OX40 단백질 (OX40-His_Sino 및 OX40-Fc_R&D) 사이의 교정 곡선을 제시한다. 도 46b는 2개의 항체 쌍 사이의 혈청 OX40 상관관계를 제시한다. 도 46c 및 46d는 각각 희석 평행성 및 선형성을 나타낸다. 도 46e는 BMS-986178의 선택성을 제시한다. 도 46f 및 46g는 약물 간섭 데이터를 제시한다. 도 46h는 5가지 상이한 조건에서의 BMS-986178의 보관 및 냉동-해동 안정성을 제시한다.
도 47은 정상적인 건강한 개체 및 3명의 상이한 암 대상체 (두경부, 난소, 및 자궁경부)에서의 인간 총 가용성 OX40 바이오마커 검정을 사용하여 측정된 바와 같은 가용성 OX40 수준을 제시한다.
도 48은 OX40.8 항체에 대한 약물 간섭 데이터를 제시한다.
도 2a 및 2b는 지시된 용량 (mg/kg)에서의 OX40.3 처리 마우스의 평균 및 중앙값 종양 부피를 각각 제시한다. 도 2c 및 2d는 지시된 용량 (mg/kg)에서의 OX40.23 처리 마우스의 평균 및 중앙값 종양 부피를 각각 제시한다.
도 3a는 OX40.23 + 항-PD1 항체의 조합으로 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다. 도 3b는 다양한 용량의 OX40.23 항체의 조합 처리의 퍼센트 종양 성장 억제를 제시하는 그래프이다.
도 4는 OX40.3 + 항-PD1 항체의 조합으로 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다.
도 5는 항-PD-1 항체와 공동으로 또는 순차적으로 (지연되어) 지시된 농도의 OX40.23으로 종양 이식 후 제5일 및 제12일에 처리된 CT26 마우스 종양 모델의 일련의 종양 성장 곡선이다. 공동 투여의 경우, 항-PD1 항체는 제5일, 제9일, 및 제13일에 투여되었다. 지연 투여의 경우, 항-PD1 항체는 제10일, 제14일, 및 제18일에 투여되었다.
도 6a는 단독요법으로 또는 항-PD1 항체와의 조합 요법으로 투여된 OX40.23에 대한 투약 및 샘플링 스케줄에 대한 개략도이다. 도 6b는 혈액 및 종양 샘플에서의 IgG, PD1, OX40.23 (0.3, 3, 및 10 mg/kg), 및 항-PD1 항체 + OX40.23 (0.03, 0.3, 3, 및 10 mg/kg)로 처리된 마우스에서의 OX40 수용체 점유율 (RO)의 그래프를 제시한다. 도 6c는 제8일 및 제13일의 종양에서의 OX40 수용체의 총 및 점유 수준의 그래프를 제시한다. 도 6d는 OX40 RO의 함수로서의 퍼센트 종양 성장 억제를 제시하는 그래프이다.
도 7a는 20 mg, 40 mg, 80 mg, 160 mg, 및 320 mg의 OX40.21이 투여된 인간 환자로부터의 말초 CD4+ T 세포 및 Treg 세포에서의 %OX40 RO를 제시하는 일련의 그래프이다. 2주 사이클의 C1D1, C1D8, 및 C2D1에 RO를 측정하였다. CD4+ Treg에서의 관찰된 말초 OX40 RO는 20 mg에서 80%였고, ≥ 40 mg의 용량에서 포화였다. 도 7b는 20 mg 내지 320 mg 범위의 OX40.21 용량에서 니볼루맙과 조합된 OX40.21의 노출을 제시하는 그래프이다.
도 8a는 관찰된 OX40.21 농도 데이터를 기재하기 위한 집단 PK (PPK) 모델이다. 도 8b는 RO의 중앙값 (선) 및 95% 신뢰 구간 (음영 면적)과 함께, OX40.21로 치료된 인간 환자로부터의 C2D1의 약물 농도 (Cmin1: 제1 용량 후의 최저 농도)와 CD4+ T 세포 상에서의 말초혈 RO 사이의 관계를 기재하기 위한 수학적 PK-PD 모델이다.
도 9는 다양한 OX40.21 용량 및 빈도에서의 CD4+ T 세포 상에서의 예측 혈액 RO (중앙값 및 90% 예측 구간)를 제시한다.
도 10a 및 10b는 다양한 투약 레지멘에 대한 예상 인간 종양 RO를 제시한다. 도 10a는 평균 종양 투과 및 평균 표적 로드를 제공한다. 도 10b는 낮은 종양 투과 및 높은 표적 로드를 제공한다.
도 11a는 OX40의 표면 발현 (OX40.21 (총))에 대한 수용체 점유율 (OX40.21 (결합))에 대한 OX40.21의 상이한 농도들의 효과를 제시하는 그래프이다. 도 11b는 OX40의 총 표면 발현에 대한 %OX40 RO의 영향을 요약하는 그래프이다.
도 12a 및 12b는 각각 이소타입 및 OX40.21 항체의 지시된 농도에서의 다양한 날 (제1일, 제2일, 제3일 및 제4일)의 OX40 표면 발현의 경과를 제시하는 그래프이다.
도 13a 및 13b는 총 표면 OX40 발현에 대한 OX40.21 (도 13a) 또는 CD28 (도 13b) 농도의 효과를 제시하는 그래프이다.
도 14는 OX40 RO (y-축), 및 OX40.21 농도 (x-축)의 함수로서 IFN-γ 수준에 의해 반영된 바와 같은 T 세포의 활성화를 제시하는 그래프이다.
도 15a는 OX40 RO (y-축), 및 OX40.21 농도 (x-축)의 함수로서 3[H]-티미딘 혼입에 의해 반영된 바와 같은 T 세포의 증식을 제시하는 그래프이다. 도 15b 및 15c는 각각 %OX40 RO의 척도로서 CD25+ T 세포 및 증식 중인 T 세포의 수를 제시하는 그래프이다.
도 16은 가용성 OX40 (sOX40) 수준을 측정하기 위한 ELISA의 개략도이다.
도 17은 세포가 지시된 농도의 OX40.21로 처리되었을 때의 세포 상에서의 표면 OX40 발현의 수준을 제시하는 그래프이다.
도 18은 세포가 지시된 농도의 OX40.21로 처리되었을 때의 가용성 OX40의 수준을 제시하는 그래프이다.
도 19는 인간 환자가 OX40.21 단독요법 또는 OX40.21 + 니볼루맙 조합 요법으로 치료되었을 때의 sOX40의 C1D1 대비 배수 증가를 제시하는 일련의 그래프이고, OX40.21은 20 mg, 40 mg, 80 mg, 160 mg, 및 320 mg으로 투여되었다.
도 20a는 세포가 이소타입, OX40.21, 또는 항-CD28 항체로 처리되었을 때의 제1일, 제2일, 제3일 및 제4일의 sOX40의 총 수준을 제시하는 그래프이다. 도 20b는 세포가 이소타입, OX40.21, 또는 항-CD28 항체로 처리되었을 때의 제1일, 제2일, 제3일 및 제4일의 결합된 sOX40의 수준을 제시하는 그래프이다.
도 21a는 세포를 OX40.21 및 항-CD28 항체로 공동-자극했을 때의 sOX40 수준에 대한 부가 효과를 제시하는 그래프이다. 도 21b는 배양에서 제3일에 OX40.21이 CD28에 부가된 후의 제4일 sOX40 수준에 대한 효과를 제시하는 그래프이다.
도 22는 OX40 내재화 검정을 제시하는 개략도이다.
도 23은 CD3/CD28로 활성화되고, 이어서 IgG1, DT, OX40.21 (리간드 차단 항체), 또는 OX40.8 (리간드 비-차단 항체)로 처리된 Treg에서의 OX40의 내재화를 제시하는 그래프이다.
도 24는 OX40.21의 효능작용 활성에 대한 FcγR-매개 가교의 효과를 제시하는 일련의 그래프이다.
도 25는 말초 약역학 마커의 평가를 위한, CT26 마우스 종양 모델을 단독요법으로서 또는 항-PD1 항체와 조합하여 OX40.23으로 처리하기 위한 투약 및 샘플링 스케줄을 제시하는 그래프이다.
도 26a는 CD4+ T 세포 및 CD8+ T 세포 내의 ICOS, Ki67, 및 CD44의 수준에 대한 OX40.23 단독요법 또는 항-PD1 항체와의 조합 요법의 효과를 제시하는 일련의 그래프이다. OX40 단독요법 패널에서, x-축 표지는 왼쪽에서 오른쪽으로 IgG, 90mpk, 30mpk, 10mpk, 3mpk, 1mpk, 0.3mpk, 0.1mpk, 및 0.03mpk이다. OX40/PD-1 조합 패널에서, x-축 표지는 왼쪽에서 오른쪽으로 IgG, PD1, PD1 + 90mpk, PD1 + 30mpk, PD1 + 10mpk, PD1 + 3mpk, PD1 + 1mpk, PD1 + 0.3mpk, PD1 + 0.1mpk, PD1 + 0.03mpk, 및 PD1 + 0.01mpk이다. 도 26b는 OX40.21 (20, 40, 80, 160, 또는 320 mg) + 니볼루맙의 조합물로 치료된 인간 환자의 종양 기질 내의 Ki67+인 CD8+ 세포의 백분율을 제시한다. 도 26c는 OX40.21 (20, 40, 80, 160, 또는 320 mg) + 니볼루맙으로 치료된 인간 환자의 종양 기질 내의 FOXP3+ 세포의 백분율을 제시한다. 도 26d는 OX40.21 (320 mg) + 니볼루맙 (240 mg)으로 치료된 자궁내막암을 가진 인간 환자의 종양 샘플로부터의 Ki67+CD8+ T 세포의 면역조직화학 분석을 제시한다. 도 26e는 장액성 난소 암종 (상부 패널) 및 난소 선암종 (하부 패널)을 가진 인간 환자의 종양 샘플로부터의 FOXP3+ 세포의 면역조직화학 분석을 제시한다.
도 27a 및 27b는 비-반응자 (종양 부피 >100 ㎣) 또는 반응자 (종양 부피 ≤100 ㎣) 상태를 기반으로, CD44 (도 27a) 및 Ki67 (도 27b)에 대해 양성인 CD8+ T 세포의 백분율의 그래프를 제시한다. 도 27c는 항종양 활성에 의한 % Ki67+CD8+ T 세포의 절대 변화 (종양 부담에서의 최대 퍼센트 감소)를 제시하는 그래프이다. 도 27d는 항종양 활성에 의한 Ki67+CD8+ T 세포의 변화 (종양 부담에서의 퍼센트 감소)를 제시하는 그래프이다. PR: 부분 반응, PD: 진행성 질환, SD: 안정적 질환.
도 28은 마우스 모델에서의 종양 성장 억제에 대한 항-ICOS + 항-PD1 조합 요법에서 항-ICOS 항체의 용량을 증가시키는 것의 효과를 제시하는 그래프이다.
도 29는 마우스 MC38 종양 모델에서의 mIgG1 및 mIgG2a 모노클로날 항-OX40 항체의 노출-반응 관계를 제시하는 일련의 그래프이다.
도 30은 OX-40에 대한 OX-40 효능제 항체 (BMS-986178 대용물 마우스 항체)의 작용 메카니즘을 실연한다. FcγR = Fcγ 수용체; FoxP3 = 포크헤드 박스 단백질 P3; NK = 천연 킬러; BMS-986178: OX40 모노클로날 항체.
도 31은 OX-40 효능제 항체 (BMS-986178 대용물 마우스 항체) 또는 이소타입 항체로 처리된 CD4+ T 세포 상에서의 CD25의 기하 평균 형광 강도 [GMFI]에 의해 측정된 바와 같은 T 세포 활성화를 나타낸다.
도 32a 및 32b는 이소타입 항체 대조군에 비교된 CHO 세포를 CD137 모노클로날 항체 (도 32a) 또는 CD28 모노클로날 항체 (도 32b)로 처리한 후의 OX40의 총 표면 발현에 대한 %OX40 RO의 영향을 요약하는 그래프이다.
도 33a-33i는 CHO 세포가 OX-40 효능제 항체로 처리되었을 때의 Treg 억제 검정에서의 후크 효과 및 용량 의존성을 제시한다. 도 33a는 Treg 억제 검정의 개략도이다. 도 33b는 Treg의 존재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33c는 Treg의 부재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33d는 Treg의 존재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33e는 Treg의 부재 하의 CD4+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33f는 Treg의 존재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33g는 Treg의 부재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 IL-2 발현을 제시한다. 도 33h는 Treg의 존재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다. 도 33i는 Treg의 부재 하의 CD8+에서의 다양한 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)의 처리에 걸친 상응하는 배양물로부터의 Treg 상에서의 OX40 발현을 제시한다.
도 34a는 0.03 mg/kg, 0.3 mg/kg, 3.0 mg/kg, 10 mg/kg의 BMS-986178 (BMS-986178 대용물 마우스 항체) 또는 대조군 IgG로의 처리 7일 후의 종양 Treg 상에서의 OX40 RO 발현이다. 도 34b는 0.03 mg/kg, 0.3 mg/kg, 3.0 mg/kg, 10 mg/kg의 BMS-986178 (BMS-986178 대용물 마우스 항체) 또는 대조군 IgG로의 처리 7일 후의 종양 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 RO 발현이다. 도 34c는 0.5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 또는 대조군 PD-1 모노클로날 항체로의 처리 10일 후, 17일 후, 및 22일 후의 종양 Treg 상에서의 OX40 RO 발현이다. 도 34d는 0.5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 5 mg/kg BMS-986178 (BMS-986178 대용물 마우스 항체), 또는 대조군 PD-1 모노클로날 항체로의 처리 10일 후, 17일 후, 및 22일 후의 종양 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 RO 발현이다.
도 35a는 세포가 지시된 농도의 CD28 모노클로날 항체 또는 이소타입 항체 대조군으로 처리되었을 때의 가용성 OX40의 수준을 제시하는 그래프이다. 도 35b는 세포가 지시된 농도의 BMS-986178 (BMS-986178 대용물 마우스 항체)로 처리되었을 때의 총 및 약물-결합 가용성 OX40의 수준을 제시하는 그래프이다.
도 36은 세포가 0.01 nM 및 100 nM의 BMS-986178로 처리되었을 때의 Treg 및 CD4+ T 세포에 내재화된 OX40-결합-BMS-986178 (BMS-986178 대용물 마우스 항체)의 내재화를 제시한다.
도 37은 BMS-986178 (BMS-986178 대용물 마우스 항체) 용량, OX40 RO, OX40 발현, 및 PD 조정 사이의 관계의 개략적인 모델이다.
도 38은 대조군 모노클로날 항체 (mIgG1), BMS-986178 (BMS-986178 대용물 마우스 항체), 항-PD-1, 항-CTLA-4, BMS-986178 (BMS-986178 대용물 마우스 항체) 및 항-PD-1의 조합물 또는 BMS-986178 (BMS-986178 대용물 마우스 항체) 및 항-CTLA-4의 조합물로 처리된 CT26 마우스 종양 모델에서의 종양 부피 및 무종양 마우스의 수를 제시한다. mIgG = 마우스 면역글로불린 G; TF = 무종양; 항-PD-1 = 4H2 mIgG1 D265A, 항-CTLA-4 = 9D9 mIgG2b. 종양 부피 ± 표준 편차를 이식 (처리 시작) 후 제6일에 시작하여 매주 2회 측정하였다.
도 39는 단독요법 용량 증량 (BMS-986178 단독) 대 조합물 (BMS-986178 + 니볼루맙 또는 이필리무맙)에 대한 연구 디자인을 제시한다. DLT = 용량-제한 독성; ECOG PS = 동부 협동 종양학 그룹(Eastern Cooperative Oncology Group) 수행 상태; IV = 정맥내; MTD = 최대 허용 용량; Q2W = 2주마다; Q3W = 3주마다; RECIST = 고형 종양에서의 반응 평가 기준(Response Evaluation Criteria in Solid Tumors); RP2D = 권장 2기 용량. 도 40은 BMS-986178 ± 니볼루맙 또는 이필리무맙에서의 약동학을 제시한다.
도 41은 20 mg, 40 mg, 80 mg, 160 mg 또는 320 mg의 OX-40.21로의 처리 후의 C1D1, C1D8, C2D1, 또는 C5D1의 표면 마커를 사용한 말초 Treg 상에서의 말초 OX40 RO를 제시한다.
도 42는 20 mg, 40 mg, 80 mg, 160 mg 또는 320 mg의 OX-40.21로의 처리 후의 C1D1, C1D8, C2D1, 또는 C5D1의 표면 마커를 사용하여 말초 Treg 상에서의 평균 형광 강도에 의해 측정된 바와 같은 총 OX40 발현이다.
도 43a는 다양한 용량에서의 개별적인 환자 샘플에서의 경시적인 sOX40의 배수 변화를 제시한다. 도 43b는 다양한 용량의 sOX40의 정규화된 AUC를 제시한다. sOX40의 정규화된 AUC는 (AUC0-T 최종 / T l최종 )를 사용하여 계산되었고, 이는 추적 시간이 상이한 환자를 해명하였다; AUC0-T 최종 = 0시부터 최종 추적까지의 곡선하 면적; T 최종 = 최종 추적 시간.
도 44a 및 44b는 BMS-986178 ± 니볼루맙 또는 이필리무맙이 IFN-γ (도 44a) 및 IP-10 (도 44b)의 생산을 자극하였음을 제시한다.
도 45a 및 45b는 BMS-986178 ± 니볼루맙 또는 이필리무맙이 증식 중인 (Ki67+) CD4+ (도 45a) 및 CD8+ (도 45b) 이펙터 기억 T 세포의 수준을 증가시켰음을 제시한다.
도 46a 내지 46h는 인간 혈청에서의 총 가용성 OX40 수준을 측정하기 위해 개발된 인간 총 가용성 OX40 바이오마커 검정의 검증 결과를 제시한다. 도 46a는 BMS-986178과 2개의 상이한 OX40 단백질 (OX40-His_Sino 및 OX40-Fc_R&D) 사이의 교정 곡선을 제시한다. 도 46b는 2개의 항체 쌍 사이의 혈청 OX40 상관관계를 제시한다. 도 46c 및 46d는 각각 희석 평행성 및 선형성을 나타낸다. 도 46e는 BMS-986178의 선택성을 제시한다. 도 46f 및 46g는 약물 간섭 데이터를 제시한다. 도 46h는 5가지 상이한 조건에서의 BMS-986178의 보관 및 냉동-해동 안정성을 제시한다.
도 47은 정상적인 건강한 개체 및 3명의 상이한 암 대상체 (두경부, 난소, 및 자궁경부)에서의 인간 총 가용성 OX40 바이오마커 검정을 사용하여 측정된 바와 같은 가용성 OX40 수준을 제시한다.
도 48은 OX40.8 항체에 대한 약물 간섭 데이터를 제시한다.
면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양으로 사용하여 면역 반응을 증진시키는 방법이 본원에서 제공되며, 여기서 항체는 단독으로 또는 다른 면역자극제 및/또는 암 요법과 조합되어 투여된다. 본원에 기재된 방법은 광범위한 종양학적 용도에, 예를 들어, 암을 치료하거나 또는 종양 성장을 억제하는데 사용될 수 있다.
정의
본 명세서가 더욱 쉽게 이해될 수 있기 위하여, 특정 용어가 먼저 정의된다. 추가적인 정의가 상세한 설명 전반에 걸쳐 기재된다.
본원에서 사용된 바와 같이, "면역자극 수용체"는 면역 반응을 자극하는데 수반되는 수용체를 지칭한다. 이같은 수용체는, 예를 들어, 공동-자극 수용체를 포함한다.
본원에서 사용된 바와 같이, "공동-자극 수용체"는 공동-자극 신호를 면역 세포에 전송하는 수용체를 지칭한다. 공동-자극 수용체의 예는 종양 괴사 인자 수용체 수퍼패밀리 (TNFRSF)의 구성원, ICOS (CD278), CD28, LIGHT, CD40L, TIM1, SLAM, CD1, CD2, CD226, LFA-1 (CD11A, CD18), CD2, CD5, CD7, CD30, CD54, CD97, CD154, CD160, LIGHT, NKG2C, SLAMF7, 및 NKp80을 포함하지만, 이에 제한되지 않는다.
본원에서 사용된 바와 같이, "효능제 항체" 또는 "효능작용 항체"는 면역자극 수용체의 효능제인 항체, 예를 들어, 차례로 면역 세포를 자극하는 단백질의 활성을 자극함으로써 대상체의 면역계 (또는 면역 반응)를 부스팅할 수 있는 항체를 지칭한다.
본원에서 사용된 바와 같이, "면역자극 수용체에 결합하는 효능작용 항체" 또는 동의적 표현은 면역자극 수용체 (예를 들어, 공동-자극 수용체 예컨대 종양 괴사 인자 수용체 수퍼패밀리의 구성원)에 특이적으로 결합하고, 이러한 수용체 및/또는 그의 하류 신호전달 경로(들)를 활성화시키는 항체를 지칭한다.
본원에서 사용된 바와 같이, "종양 괴사 인자 수용체 수퍼패밀리" 또는 "TNFRSF"는 동족 리간드에 결합하는 이들의 세포외 도메인에 시스테인-풍부 도메인이 있는 시토카인 수용체의 단백질 수퍼패밀리를 지칭하며, TNFR1, TNFR2, HVEM, LTβR, OX40, CD27, CD40, FAS, DCR3, CD30, 4-1BB, TRAILR1, TRAILR2, TRAILR3, TRAILR4, OPG, RANK, FN14, TACI, BAFFR, BCMA, GITR, TROY, DR3 (사멸 수용체 3), DR6 (사멸 수용체 6), XEDAR (엑토디스플라신 A2 수용체), 및 NGFR과 같은 구성원을 포함한다 (예를 들어, 문헌 [Croft et al., Nat Rev Drug Discov 2013;12:147-168] 참조).
본원에서 사용된 바와 같은 용어 "OX40"은 OX40 리간드 (OX40-L)에 결합하는, TNFRSF의 구성원인 수용체를 지칭한다. OX40은 종양 괴사 인자 수용체 수퍼패밀리, 구성원 4 (TNFRSF4), ACT35, IMD16, TXGP1L, 및 CD134로도 지칭된다. 용어 "OX40"은 세포에 의해 천연적으로 발현되는 OX40의 임의의 변이체 또는 이소형을 포함한다.
인간 OX40 전구체 (수탁 번호 NP_003318.1)의 아미노산 서열이 서열식별번호(SEQ ID NO): 1에 기재된다. 성숙 인간 OX40의 세포외 도메인의 아미노산 서열이 서열식별번호: 2에 기재된다. 시노몰구스 OX40의 아미노산 서열이 서열식별번호: 3에 기재된다. 인간 OX40-L의 아미노산 서열이 서열식별번호: 4에 기재된다.
용어 "프로그래밍된 사멸 1", "프로그래밍된 세포 사멸 1", "단백질 PD-1", "PD-1", PD1", "PDCD1", "hPD-1" 및 "hPD-I"는 CD28 패밀리에 속하는 면역억제 수용체를 지칭한다. PD-1은 생체 내의 이전에 활성화된 T 세포 상에서 우세하게 발현되고, 2개의 리간드 PD-L1 및 PD-L2에 결합한다. 본원에서 사용된 바와 같은 용어 "PD-1"은 인간 PD-1 (hPD-1), hPD-1의 변이체, 이소형 및 종 호모로그, 및 적어도 하나의 hPD-1과 공통적인 에피토프를 갖는 유사체를 포함한다. 완전한 hPD-1 서열을 진뱅크(GenBank) 수탁 번호 U64863 하에 확인할 수 있다.
"프로그래밍된 사멸 리간드-1 (PD-L1)"은 PD-1에 결합 시 T 세포 활성화 및 시토카인 분비를 하향조절하는 PD-1에 대한 2개의 세포 표면 당단백질 리간드 중 하나이다 (다른 하나는 PD-L2임). 본원에서 사용된 바와 같은 용어 "PD-L1"은 인간 PD-L1 (hPD-L1), hPD-L1의 변이체, 이소형 및 종 호모로그, 및 적어도 하나의 hPD-L1과 공통적인 에피토프를 갖는 유사체를 포함한다. 완전한 hPD-L1 서열을 진뱅크 수탁 번호 Q9NZQ7 하에 확인할 수 있다.
용어 "세포독성 T 림프구-연관 항원-4", "CTLA-4", "CTLA4", "CTLA-4 항원" 및 "CD152" (예를 들어, 문헌 [Murata (1999) Am. J. Pathol. 155:453-460] 참조)는 상호교환가능하게 사용되고, 인간 CTLA-4의 변이체, 이소형 및 종 호모로그, 및 적어도 하나의 CTLA-4과 공통적인 에피토프를 갖는 유사체를 포함한다 (예를 들어, 문헌 [Balzano (1992) Int. J. Cancer Suppl. 7:28-32] 참조). 인간 CTLA-4의 완전한 서열이 진뱅크 수탁 번호 Ll 5006에 기재되어 있다.
본원에서 사용된 바와 같은 용어 "항체"는 전체 항체, 및 그의 임의의 항원 결합 단편 (즉, "항원-결합 부분") 또는 단일쇄를 포함할 수 있다. "항체"는, 한 실시양태에서, 디술피드 결합에 의해 상호-연결된 적어도 2개의 중쇄 (H) 및 2개의 경쇄 (L)를 포함하는 당단백질, 또는 그의 항원 결합 부분을 지칭한다. 각각의 중쇄는 중쇄 가변 영역 (본원에서 VH로 약칭됨) 및 중쇄 불변 영역으로 구성된다. 특정한 천연 발생 IgG, IgD, 및 IgA 항체에서, 중쇄 불변 영역은 3개의 도메인 CH1, CH2 및 CH3으로 구성된다. 특정한 천연 발생 항체에서, 각각의 경쇄는 경쇄 가변 영역 (본원에서 VL로 약칭됨) 및 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 1개의 도메인 CL로 구성된다. VH 및 VL 영역은 프레임워크 영역 (FR)으로 칭해지는 더욱 보존된 영역이 산재되어 있는, 상보성 결정 영역 (CDR)로 칭해지는 초가변성의 영역으로 추가로 세분될 수 있다. 각각의 VH 및 VL은 아미노-말단에서 카르복시-말단으로 하기 순서로 배열된 3개의 CDR 및 4개의 FR로 구성된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 중쇄 및 경쇄의 가변 영역은 항원과 상호작용하는 결합 도메인을 함유한다. 항체의 불변 영역은 면역글로불린이 면역계의 다양한 세포 (예를 들어, 이펙터 세포) 및 고전적 보체 시스템의 제1 성분 (C1q)를 포함하는 숙주 조직 또는 인자에 결합하는 것을 매개할 수 있다.
전형적으로 항체는 10-7 내지 10-11 M 이하의 해리 상수 (KD)에 의해 반영되는 높은 친화도로 그의 동족 항원에 특이적으로 결합한다. 일반적으로, 약 10-6 M을 초과하는 임의의 KD가 비-특이적 결합을 지시하는 것으로 간주된다. 본원에서 사용된 바와 같이, 항원에 "특이적으로 결합하는" 항체는 KD가 10-7 M 이하, 바람직하게는 10-8 M 이하, 더욱 더 바람직하게는 5 x 10-9 M 이하, 가장 바람직하게는 10-8 M 내지 10-10 M 이하인 것을 의미하는 높은 친화도로 항원 및 실질적으로 동일한 항원에 결합하지만, 관련되지 않은 항원에는 높은 친화도로 결합하지 않는 항체를 지칭한다. 항원이 소정의 항원에 대해 고도의 서열 동일성을 나타내면, 예를 들어, 소정의 항원의 서열에 대해 적어도 80%, 적어도 90%, 바람직하게는 적어도 95%, 더욱 바람직하게는 적어도 97%, 또는 더욱 더 바람직하게는 적어도 99%의 서열 동일성을 나타내면, 이는 소정의 항원과 "실질적으로 동일"하다. 예를 들어, 인간 OX40에 특이적으로 결합하는 항체는 특정한 비-인간 영장류 종 (예를 들어, 시노몰구스 원숭이)으로부터의 OX40과 교차-반응할 수 있지만, 다른 종으로부터의 OX40 (예를 들어, 뮤린 OX40), 또는 OX40 이외의 항원과는 교차-반응하지 않을 수 있다.
면역글로불린은 IgA, 분비형 IgA, IgG 및 IgM을 포함하지만 이에 제한되지 않는, 통상적으로 공지된 이소타입 중 임의의 것으로부터의 것일 수 있다. IgG 이소타입은 특정 종에서 서브클래스로 나뉜다: 인간에서의 IgG1, IgG2, IgG3 및 IgG4, 및 마우스에서의 IgG1, IgG2a, IgG2b 및 IgG3. 특정 실시양태에서, 본원에 기재된 항-OX40 항체는 IgG1 또는 IgG2 서브타입의 것이다. 면역글로불린, 예를 들어, IgG1은 여러 동종이형으로 존재하고, 이들은 최대 몇 개의 아미노산에서 서로 상이하다. "항체"는, 예를 들어, 천연 발생 및 비-천연 발생 항체 둘 다; 모노클로날 및 폴리클로날 항체; 키메라 및 인간화 항체; 인간 및 비-인간 항체; 완전 합성 항체; 및 단일쇄 항체를 포함할 수 있다.
항체의 "항원-결합 부분" 또는 "항원-결합 단편"이라는 용어는, 본원에서 사용된 바와 같이, 항원 (예를 들어, 인간 OX40)에 특이적으로 결합하는 능력을 유지하는 항체의 하나 이상의 단편을 지칭한다. 항체의 항원-결합 기능이 전장 항체의 단편에 의해 수행될 수 있는 것으로 제시된 바 있다. 항체의 "항원-결합 부분"이라는 용어에 포괄되는 결합 단편의 예는 (i) VL, VH, CL 및 CH1 도메인으로 이루어진 1가 단편인 Fab 단편; (ii) 힌지 영역에서 디술피드 다리에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편인 F(ab')2 단편; (iii) VH 및 CH1 도메인으로 이루어진 Fd 단편; (iv) 항체의 단일 아암의 VL 및 VH 도메인으로 이루어진 Fv 단편, (v) VH 도메인으로 이루어진 dAb 단편 (Ward et al., (1989) Nature 341:544-546); 및 (vi) 단리된 상보성 결정 영역 (CDR) 또는 (vii) 임의적으로 합성 링커에 의해 연결될 수 있는, 2개 이상의 단리된 CDR의 조합물을 포함한다. 또한, Fv 단편의 2개의 도메인인 VL 및 VH가 별도의 유전자에 의해 코딩되지만, 이들을 VL 및 VH 영역이 쌍을 이루어 1가 분자를 형성하는 단일 단백질 사슬로서 만들어지게 할 수 있는 합성 링커에 의해, 재조합 방법을 사용하여, 이들이 연결될 수 있다 (단일쇄 Fv (scFv)로 공지됨; 예를 들어, 문헌 [Bird et al. (1988) Science 242:423-426]; 및 [Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883] 참조). 이같은 단일쇄 항체 또한 항체의 "항원-결합 부분"이라는 용어 내에 포괄되도록 의도된다. 이러한 구축물 및 다른 잠재적인 구축물이 문헌 [Chan & Carter (2010) Nat. Rev. Immunol. 10:301]에 기재되어 있다. 관련 분야의 기술자에게 공지된 통상적인 기술을 사용하여 이러한 항체 단편들이 수득되고, 무손상 항체와 동일한 방식으로 유용성에 대해 단편이 스크리닝된다. 항원-결합 부분은 재조합 DNA 기술에 의해, 또는 무손상 면역글로불린의 효소적 또는 화학적 절단에 의해 생산될 수 있다.
"이중특이적" 또는 "이관능성 항체"는 2개의 상이한 중쇄/경쇄 쌍 및 2개의 상이한 결합 부위가 있는 인공적인 하이브리드 항체이다. 하이브리도마의 융합 또는 Fab' 단편의 연결을 포함하는 다양한 방법에 의해 이중특이적 항체가 생산될 수 있다. 예를 들어, 문헌 [Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990)]; [Kostelny et al., J. Immunol. 148, 1547-1553 (1992)]을 참조한다.
용어 "모노클로날 항체"는, 본원에서 사용된 바와 같이, 특정한 에피토프에 대한 단일 결합 특이성 및 친화성을 나타내는 항체, 또는 모든 항체가 특정한 에피토프에 대한 단일 결합 특이성 및 친화성을 나타내는 항체들의 조성물을 지칭한다. 전형적으로, 이같은 모노클로날 항체는 항체를 코딩하는 단일 세포 또는 핵산으로부터 유래될 것이고, 임의의 서열 변경을 의도적으로 도입하지 않으면서 증식될 것이다. 따라서, 용어 "인간 모노클로날 항체"는 인간 생식계열 면역글로불린 서열로부터 유래된 가변 영역 및 임의적인 불변 영역이 있는 모노클로날 항체를 지칭한다. 한 실시양태에서, 인간 모노클로날 항체는 하이브리도마에 의해 생산되고, 이는, 예를 들어, 트랜스제닉 또는 트랜스크로모조말 비-인간 동물 (예를 들어, 인간 중쇄 트랜스진 및 경쇄를 포함하는 게놈이 있는 트랜스제닉 마우스)로부터 수득된 B 세포를 불멸화 세포에 융합시킴으로써 수득된다.
용어 "재조합 인간 항체"는, 본원에서 사용된 바와 같이, 재조합 수단에 의해 제조, 발현, 생성 또는 단리된 모든 인간 항체, 예컨대 (a) 인간 면역글로불린 유전자에 대해 트랜스제닉 또는 트랜스크로모조말인 동물 (예를 들어, 마우스) 또는 이로부터 제조된 하이브리도마로부터 단리된 항체, (b) 항체를 발현하도록 형질전환된 숙주 세포, 예를 들어, 트랜스펙토마로부터 단리된 항체, (c) 조합형의 재조합 인간 항체 라이브러리로부터 단리된 항체, 및 (d) 인간 면역글로불린 유전자 서열이 다른 DNA 서열로 스플라이싱되는 것을 수반하는 임의의 다른 수단에 의해 제조, 발현, 생성 또는 단리된 항체를 포함한다. 이같은 재조합 인간 항체는 생식계열 유전자에 의해 코딩되지만, 후속 재배열 및 돌연변이 (예를 들어, 항체 성숙 동안 발생함)를 포함하는 특정한 인간 생식계열 면역글로불린 서열을 이용하는 가변 및 불변 영역을 포함한다. 관련 분야에 공지된 바와 같이 (예를 들어, 문헌 [Lonberg (2005) Nature Biotech. 23(9):1117-1125] 참조), 가변 영역은 외래 항원에 대해 특이적인 항체를 형성하도록 재배열되는 다양한 유전자에 의해 코딩되는 항원 결합 도메인을 함유한다. 재배열에 더하여, 가변 영역은 외래 항원에 대한 항체의 친화성을 증가시키기 위한 다수의 단일 아미노산 변화 (체세포 돌연변이 또는 과돌연변이로 지칭됨)에 의해 추가로 변형될 수 있다. 항원에 대한 추가 반응에서 불변 영역이 변화될 것이다 (즉, 이소타입 스위치). 따라서, 항원에 반응하여 경쇄 및 중쇄 면역글로불린 폴리펩티드를 코딩하는 재배열되고 체세포 돌연변이된 핵산 서열은 원래의 생식계열 서열과 동일하지 않을 수 있지만, 대신 실질적으로 동일하거나 또는 유사할 것이다 (즉, 동일성이 적어도 80%일 것임).
"인간" 항체 (HuMAb)는 프레임워크 및 CDR 영역 둘 다가 인간 생식계열 면역글로불린 서열로부터 유래되는 가변 영역을 갖는 항체를 지칭한다. 또한, 항체가 불변 영역을 함유하면, 불변 영역 또한 인간 생식계열 면역글로불린 서열로부터 유래된다. 본원에 기재된 항체는 인간 생식계열 면역글로불린 서열에 의해 코딩되지 않는 아미노산 잔기 (예를 들어, 시험관 내에서의 무작위 또는 부위-특이적 돌연변이유발에 의해 또는 생체 내에서의 체세포 돌연변이에 의해 도입된 돌연변이)를 포함할 수 있다. 그러나, 용어 "인간 항체"는, 본원에서 사용된 바와 같이, 또 다른 포유동물 종, 예컨대 마우스의 생식계열로부터 유래된 CDR 서열이 인간 프레임워크 서열 상에 그래프팅된 항체를 포함하도록 의도되지 않는다. 용어 "인간" 항체 및 "완전히 인간형인" 항체는 동의적으로 사용된다.
"인간화" 항체는 비-인간 항체의 CDR 도메인 외부의 아미노산 중 일부, 대부분 또는 모두가 인간 면역글로불린으로부터 유래되는 상응하는 항미노산으로 교체된 항체를 지칭한다. 인간화 형태의 항체의 한 실시양태에서, CDR 도메인 외부의 아미노산 중 일부, 대부분 또는 모두가 인간면역글로불린으로부터의 아미노산으로 교체된 반면, 하나 이상의 CDR 영역 내의 아미노산 중 일부, 대부분 또는 모두는 변화되지 않는다. 특정 항원에 결합하는 항체의 능력을 폐기하지 않는 한 아미노산의 소규모의 부가, 결실, 삽입, 치환 또는 변형이 허용가능하다. "인간화" 항체는 원래의 항체의 것과 유사한 항원 특이성을 유지한다.
"키메라 항체"는 하나의 종으로부터 가변 영역이 유래되고, 또 다른 종으로부터 불변 영역이 유래되는 항체, 예컨대 마우스 항체로부터 가변 영역이 유래되고, 인간 항체로부터 불변 영역이 유래되는 항체를 지칭한다.
본원에서 사용된 바와 같이, "이소타입"은 중쇄 불변 영역 유전자에 의해 코딩되는 항체 클래스 (예를 들어, IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD, 및 IgE 항체)를 지칭한다.
"항원을 인식하는 항체" 및 "항원에 대해 특이적인 항체"는 본원에서 용어 "항원에 특이적으로 결합하는 항체"와 상호교환가능하게 사용된다.
"단리된 항체"는, 본원에서 사용된 바와 같이, 항원 특이성이 상이한 다른 항체가 실질적으로 없는 항체를 지칭하도록 의도된다.
본원에서 사용된 바와 같이, "OX40-L이 OX40에 결합하는 것을 억제하는" 항체는 OX40-L이 OX40에 결합하는 것을 억제하는 항체를 지칭하도록 의도된다.
"이펙터 기능"은 항체 Fc 영역과 Fc 수용체 또는 리간드의 상호작용, 또는 이로부터 초래되는 생화학적 이벤트를 지칭한다. 예시적인 "이펙터 기능"은 C1q 결합, 보체 의존적 세포독성 (CDC), Fc 수용체 결합, FcγR-매개 이펙터 기능 예컨대 ADCC 및 항체 의존적 세포-매개 포식작용 (ADCP), 및 세포 표면 수용체 (예를 들어, B 세포 수용체; BCR)의 하향조절을 포함한다. 이같은 이펙터 기능은 일반적으로 Fc 영역이 결합 도메인 (예를 들어, 항체 가변 도메인)과 조합되는 것을 필요로 한다.
"Fc 수용체" 또는 "FcR"은 면역글로불린의 Fc 영역에 결합하는 수용체이다. IgG 항체에 결합하는 FcR은 FcγR 패밀리의 수용체를 포함하고, 이러한 수용체의 대립유전자 변이체 및 대안적으로 스플라이싱된 형태를 포함한다. FcγR 패밀리는 3개의 활성화 수용체 (마우스의 FcγRI, FcγRIII, 및 FcγRIV; 인간의 FcγRIA, FcγRIIA, 및 FcγRIIIA) 및 1개의 억제성 수용체 (FcγRIIB)로 이루어진다. 인간 FcγR의 다양한 특성이 표 1에서 요약된다. 대다수의 선천적 이펙터 세포 유형은 하나 이상의 활성화 FcγR 및 억제성 FcγRIIB를 공동-발현하는 반면, 천연 킬러 (NK) 세포는 1개의 활성화 Fc 수용체 (마우스의 FcγRIII 및 인간의 FcγRIIIA)를 선택적으로 발현하지만, 마우스 및 인간에서 억제성 FcγRIIB를 발현하지 않는다. 인간 IgG1은 대부분의 인간 Fc 수용체에 결합하고, 자신이 결합하는 활성화 Fc 수용체의 유형과 관련하여 뮤린 IgG2a와 등가인 것으로 간주된다.
표 1. 인간 FcγR의 특성
"Fc 영역" (결정화가능한 영역 단편) 또는 "Fc 도메인" 또는 "Fc"는 면역계의 다양한 세포 (예를 들어, 이펙터 세포) 상에 위치하는 Fc 수용체 또는 고전적 보체 시스템의 제1 성분 (C1q)에 결합하는 것을 포함하여 면역글로불린이 숙주 조직 또는 인자에 결합하는 것을 매개하는 항체의 중쇄의 C-말단 영역을 지칭한다. 따라서, Fc 영역은 제1 불변 영역 면역글로불린 도메인 (예를 들어, CH1 또는 CL)을 제외한 항체의 불변 영역을 포함한다. IgG, IgA 및 IgD 항체 이소타입에서, Fc 영역은 항체의 2개의 중쇄 각각 내의 CH2 및 CH3 불변 도메인을 포함하고; IgM 및 IgE Fc 영역은 각각의 폴리펩티드 사슬 내에 3개의 중쇄 불변 도메인 (CH 도메인 2-4)을 포함한다. IgG의 경우, Fc 영역은 면역글로불린 도메인 Cγ2 및 Cγ3, 및 Cγ1과 Cγ2 사이의 힌지를 포함한다. 면역글로불린 중쇄의 Fc 영역의 경계가 다양할 수 있지만, 일반적으로 인간 IgG 중쇄 Fc 영역은 위치 C226 또는 P230의 아미노산 잔기 (또는 이러한 2개의 아미노산 사이의 아미노산)에서 중쇄의 카르복시-말단까지 신장되는 것으로 정의되며, 여기서 넘버링은 카바트에서와 같은 EU 인덱스에 따른다. 문헌 [Kabat et al. (1991) Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, MD]; 미국 특허 출원 공개 번호 2008/0248028의 도 3c-3f를 또한 참조한다. 인간 IgG Fc 영역의 CH2 도메인은 대략적인 아미노산 231에서 대략적인 아미노산 340까지 걸쳐지는 반면, CH3 도메인은 Fc 영역 내의 CH2 도메인의 C-말단 측 상에 위치하고, 즉, 이는 IgG의 대략적인 아미노산 341에서 대략적인 아미노산 447까지 걸쳐진다. 본원에서 사용된 바와 같이, Fc 영역은 임의의 동종이형 변이체를 포함하는 천연 서열 Fc, 또는 변이체 Fc (예를 들어, 비-천연 발생 Fc)일 수 있다. 또한 Fc는 단리된 이러한 영역 또는 "Fc 융합 단백질"로도 지칭되는 Fc-포함 단백질 폴리펩티드 예컨대 "Fc 영역을 포함하는 결합 단백질" (예를 들어, 항체 또는 면역부착소)의 환경에 있는 이러한 영역을 또한 지칭할 수 있다.
본원에서 사용된 바와 같이, "특이적 결합", "선택적 결합", "선택적으로 결합한다", 및 "특이적으로 결합한다"라는 용어는 미리 정해진 항원 상의 에페토프에 결합하지만, 다른 항원에는 결합하지 않는 항체를 지칭한다. 전형적으로, 항체는 (i) 예를 들어, 미리 정해진 항원을 분석물로서, 항체를 리간드로 사용하여 BIACORE 2000 표면 플라즈몬 공명 (SPR) 기구에서 표면 플라즈몬 공명 (SPR) 기술 에 의해 결정되었을 때, 약 10-7 M 미만, 예컨대 약 10-8 M, 10-9 M 또는 10-10 M 미만 또는 이보다 더 낮은 값의 평형 해리 상수 (KD)로 결합하고, (ii) 미리 정해진 항원 또는 밀접하게 관련된 항원 이외의 비-특이적 항원 (예를 들어, BSA, 카세인)에 결합하는 것에 대한 그의 친화도보다 적어도 2-배 더 큰 친화도로 미리 정해진 항원에 결합한다.
용어 "kassoc" 또는 "ka"는, 본원에서 사용된 바와 같이, 특정한 항체-항원 상호작용의 회합 속도 상수를 지칭하도록 의도되는 반면, 용어 "kdis" 또는 "kd"는, 본원에서 사용된 바와 같이, 특정한 항체-항원 상호작용의 해리 속도 상수를 지칭하도록 의도된다. 용어 "KD"는, 본원에서 사용된 바와 같이, 평형 해리 상수를 지칭하도록 의도되고, 이는 kd 대 ka의 비 (즉,. kd/ka)로부터 수득되고, 몰 농도 (M)로서 표현된다. 관련 분야에 잘 확립되어 있는 방법을 사용하여 항체에 대한 KD 값을 결정할 수 있다. 항체의 KD를 결정하는 바람직한 방법은 표면 플라즈몬 공명을 사용하는 것, 바람직하게는 바이오센서 시스템 예컨대 비아코어(Biacore)® SPR 시스템 또는 유동 세포측정법 및 스캐차드(Scatchard) 분석을 사용하는 것에 의한 방법이다.
본원에서 사용된 바와 같이, IgG 항체에 대한 "높은 친화도"라는 용어는 표적 항원에 대한 KD가 10-8 M 이하, 더욱 바람직하게는 10-9 M 이하, 더욱 더 바람직하게는 10-10 M 이하인 항체를 지칭한다. 그러나, "높은 친화도" 결합은 다른 항체 이소타입에 경우 변할 수 있다. 예를 들어, IgM 이소타입에 대한 "높은 친화도" 결합은 KD가 10-7 M 이하, 더욱 바람직하게는 10-8 M 이하인 항체를 지칭한다.
항체를 사용하는 시험관내 또는 생체내 검정의 맥락에서의 용어 "EC50"은 최대 반응의 50%, 즉 최대 반응과 기준선의 절반인 반응을 유도하는 항체의 농도를 지칭한다.
"수용체 점유율" 또는 "수용체의 점유율"은, 본원에서 사용된 바와 같이, 면역자극 수용체에 결합된 효능작용 항체의 양을 지칭한다. "% 수용체 점유율" 또는 "수용체의 % 점유율"을 하기 식을 사용하여 계산할 수 있다: ([테스트의 ΔMFI] / [총의 ΔMFI]) x 100. ΔMFI는 이소타입 대조군 항체로의 배경 염색의 평균 형광 강도 (MFI)를 결합된 효능작용 항체로부터의 MFI로부터 차감함으로써 계산된다. 총 수용체 수준은 특정 면역자극 수용체의 최대 발현, 따라서 MFI를 결정하기 위해 포화량의 효능작용 항체를 첨가함으로써 결정된다. 총 수용체 발현을 계산하기 위한 대안적인 수단은 수용체 점유율이 계산되고 있는 효능작용 항체와 경쟁하지 않는 동일한 면역자극 수용체에 대한 항체를 사용하는 것이다.
"면역 반응"은 외래 작용제 및 이에 의해 야기되는 질환에 대해 생물을 보호하는, 외래 작용제에 대한 척추동물에서의 생물학적 반응을 지칭한다. 면역 반응은 침습성 병원체, 병원체로 감염된 세포 또는 조직, 암성 또는 기타 비정상 세포, 또는 자가면역 또는 병리학적 염증의 경우의 정상적인 인간 세포 또는 조직을 선택적 표적화하는 것, 이에 결합하는 것, 이를 손상시키는 것, 이를 파괴하는 것 및/또는 이를 척추동물의 신체로부터 제거하는 것을 초래하는, 면역계의 세포 (예를 들어, T 림프구, B 림프구, 천연 킬러 (NK) 세포, 대식세포, 호산구, 비만 세포, 수지상 세포 또는 호중구) 및 이러한 세포 중 임의의 것 또는 간에 의해 생산된 가용성 거대분자 (항체, 시토카인 및 보체 포함)의 작용에 의해 매개된다. 면역 반응은, 예를 들어, T 세포, 예를 들어, 이펙터 T 세포 또는 Th 세포, 예컨대 CD4+ 또는 CD8+ T 세포의 활성화 또는 억제, 또는 Treg 세포의 억제를 포함한다.
"면역요법"은 면역 반응을 유도하거나, 증진시키거나, 억제하거나 또는 다른 방식으로 변형시키는 것을 포함하는 방법에 의한 질환에 걸렸거나 또는 질환에 걸리거나 질환이 재발할 위험이 있는 대상체의 치료를 지칭한다.
"T 이펙터" ("Teff") 세포는 세포용해 활성이 있는 T 세포 (예를 들어, CD4+ 및 CD8+ T 세포), 뿐만 아니라 시토카인을 분비하고 다른 면역 세포를 활성화시키고 지시하지만, 조절 T 세포 (Treg 세포)를 포함하지 않는 T 헬퍼 (Th) 세포를 지칭한다.
면역 반응 또는 면역계를 자극하는 능력의 증가는 T 세포 공동-자극 수용체의 증진된 효능제 활성 및/또는 억제 수용체의 증진된 길항제 활성으로부터 초래될 수 있다. 면역 반응 또는 면역계를 자극하는 능력의 증가는 면역 반응을 측정하는 검정, 예를 들어, 시토카인 또는 케모카인 방출, 세포용해 활성 (표적 세포 상에서 직접적으로 또는 CD107a 또는 그랜자임을 검출하는 것을 통해 간접적으로 결정됨) 및 증식의 변화를 측정하는 검정에서 활성의 최대 수준 또는 EC50의 배수 증가에 의해 반영될 수 있다. 면역 반응 또는 면역계 활성을 자극하는 능력은 적어도 10%, 30%, 50%, 75%, 2배, 3배, 5배 또는 이를 초과하는 값만큼 증진될 수 있다.
본원에서 사용된 바와 같이, "투여하는 것"은 관련 분야의 기술자에게 공지된 다양한 방법 및 전달 시스템 중 임의의 것을 사용하여 치료제를 포함하는 조성물을 대상체에게 물리적으로 도입하는 것을 지칭한다. 본원에 기재된 항체에 대한 바람직한 투여 경로는 정맥내, 복강내, 근육내, 피하, 척수 또는 다른 비경구 투여 경로, 예컨대 주사 또는 주입을 포함한다. 본원에 사용된 바와 같은 "비경구 투여"라는 구절은 장 및 국소 투여 이외의 투여 방식, 통상적으로는 주사에 의한 투여 방식을 의미하고, 정맥내, 복강내, 근육내, 동맥내, 척추강내, 림프내, 병변내, 관절낭내, 안와내, 심장내, 피내, 경기관, 피하, 표피하, 관절내, 피막하, 지주막하, 척수내, 경막외 및 흉골내 주사 및 주입, 뿐만 아니라 생체내 전기천공을 비제한적으로 포함한다. 대안적으로, 본원에 기재된 항체는 비경구가 아닌 경로, 예컨대 국소, 표피 또는 점막 투여 경로를 통하여, 예를 들어 비강내, 경구, 질내, 직장내, 설하 또는 국소 투여로 투여될 수 있다. 또한 투여는, 예를 들어, 1번으로, 여러 번으로, 및/또는 하나 이상의 연장된 기간 전반에 걸쳐 수행될 수 있다.
본원에서 사용된 바와 같이, 용어 "T 세포-매개 반응"은 이펙터 T 세포 (예를 들어, CD8+ 세포) 및 헬퍼 T 세포 (예를 들어, CD4+ 세포)를 포함하는 T 세포에 의해 매개되는 반응을 지칭한다. T 세포 매개 반응은, 예를 들어, T 세포 세포독성 및 증식을 포함한다.
본원에서 사용된 바와 같이, 용어 "세포독성 T 림프구 (CTL) 반응"은 세포독성 T 세포에 의해 유도되는 면역 반응을 지칭한다. CTL 반응은 주로 CD8+ T 세포에 의해 매개된다.
본원에서 사용된 바와 같이, 용어 "억제하다" 또는 "차단하다" (예를 들어, OX40-L이 세포 상의 OX40에 결합하는 것의 억제/차단)는 상호교환가능하게 사용되고, 부분적 및 완전 억제/차단 둘 다를 포괄한다. 유사하게, "차단 항체"는 리간드가 그의 수용체에 결합하는 것을 차단하는 항체를 지칭하며, 예를 들어, OX40.21은 OX40이 그의 리간드에 결합하는 것을 억제하며, 따라서 차단 항체로 지칭된다. 역으로, 리간드가 그의 수용체에 결합하는 것을 차단하지 않는 항체, 예를 들어, OX40.8은 "비-차단 항체"로 지칭된다.
본원에서 사용된 바와 같이, 종양의 "성장을 억제한다"는 용어는 종양 성장의 임의의 측정가능한 감소, 예를 들어, 적어도 약 10%, 예를 들어, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 적어도 약 99%, 또는 100%만큼의 종양 성장의 억제를 포함한다.
본원에서 사용된 바와 같이, "암"은 신체 내에서의 비정상적인 세포의 제어되지 않은 성장을 특징으로 하는 광범위한 질환 군을 지칭한다. 조절되지 않은 세포 분열로 인해, 이웃 조직을 침범하고, 림프계 또는 혈류를 통해 신체의 원위부로 전이될 수 있는 악성 종양 또는 세포의 형성이 초래될 수 있다.
용어 "치료하다", "치료하는" 및 "치료"는 본원에서 사용된 바와 같이, 질환과 연관된 증상, 합병증, 병태 또는 생화학적 징후의 진행, 발달, 중증도 또는 재발을 역전시키거나, 경감시키거나, 완화시키거나, 억제하거나, 또는 느리게 하거나 또는 방지하려는 목적으로 대상체에서 수행되는 임의 유형의 개입 또는 프로세스, 또는 대상체에게 활성 작용제를 투여하는 것을 지칭한다. 예방은 질환 발생을 방지하거나 또는 질환이 발생하는 경우 그의 효과를 최소화하기 위해 질환을 가지지 않은 대상체에게 투여하는 것을 지칭한다.
"혈액학적 악성종양"은 림프종, 백혈병, 골수종 또는 림프성 악성종양, 뿐만 아니라 비장 및 림프절의 암을 포함한다. 예시적인 림프종은 B 세포 림프종 (B-세포 혈액암) 및 T 세포 림프종 둘 다를 포함한다. B-세포 림프종은 호지킨 림프종 및 대부분의 비-호지킨 림프종 둘 다를 포함한다. B 세포 림프종의 비제한적인 예는 광범위 대형 B-세포 림프종, 소포 림프종, 점막-연관 림프 조직 림프종, 소세포 림프구성 림프종 (만성 림프구성 백혈병과 중첩됨), 외투 세포 림프종 (MCL), 버킷 림프종, 종격 대형 B 세포 림프종, 발덴스트롬 마크로글로불린혈증, 결절성 변연부 B 세포 림프종, 비장 변연부 림프종, 혈관내 대형 B-세포 림프종, 원발성 삼출 림프종, 림프종모양 육아종증을 포함한다. T 세포 림프종의 비제한적인 예는 림프절외 T 세포 림프종, 피부 T 세포 림프종, 악성 대형 세포 림프종, 및 혈관면역모세포성 T 세포 림프종을 포함한다. 혈액학적 악성 종양은 이차 백혈병, 만성 림프구성 백혈병, 급성 골수성 백혈병, 만성 골수성 백혈병, 및 급성 림프모구성 백혈병과 같은, 그러나 이에 제한되지 않는 백혈병을 또한 포함한다. 혈액학적 악성 종양은 다발성 골수종 및 무증상 다발성 골수종과 같은, 그러나 이에 제한되지 않는 골수종을 추가로 포함한다. 다른 혈액학적 및/또는 B 세포- 또는 T-세포-연관 암이 용어 혈액학적 악성 종양에 포괄된다.
용어 "유효한 용량" 또는 "유효한 투여량" 또는 "충분한 용량"은 원하는 효과를 달성하는데 또는 적어도 부분적으로 달성하는데 충분한 약물 (예를 들어, 면역자극 수용체에 결합하는 효능작용 항체)의 양으로서 정의된다. 약물 또는 치료제의 "치료적 유효량" 또는 "치료적 유효 투여량"은 단독으로 또는 또 다른 치료제와 조합되어 사용되었을 때, 질환 증상의 중증도의 감소, 질환 증상이 없는 기간의 빈도 및 지속기간의 증가, 또는 질환 고통으로 인한 장애 또는 곤란의 방지에 의해 증명되는 질환 퇴행을 촉진하는 약물의 임의의 양이다.
고형 종양의 언급에서, 유효량은 종양이 축소되게 하고/거나 종양의 성장 속도를 감소시키는데 (예컨대 종양 성장을 억제하는데) 또는 다른 원치 않는 세포 증식을 방지하거나 지연시키는데 충분한 양을 포함한다. 특정 실시양태에서, 유효량은 종양 발달을 지연시키는데 충분한 양이다. 일부 실시양태에서, 유효량은 종양 재발을 방지하거나 지연시키는데 충분한 양이다. 유효량은 1회 이상의 투여에 의해 투여될 수 있다. 약물 또는 조성물의 유효량은 (i) 암 세포의 수를 감소시킬 수 있고/있거나; (ii) 종양 크기를 감소시킬 수 있고/있거나; (iii) 말초 기관 내로의 암 세포 침윤을 억제하고, 지연시키고, 어느 정도 늦추고, 이를 정지시킬 수 있고/있거나; (iv) 종양 전이를 억제하고, 즉 어느 정도 늦추고, 이를 정지시킬 수 있고/있거나; (v) 종양 성장을 억제할 수 있고/있거나; (vi) 종양의 발생 및/또는 재발을 방지하거나 지연시킬 수 있고/있거나; (vii) 암과 연관된 증상 중 하나 이상을 어느 정도 해소시킬 수 있다.
본원에서 사용된 바와 같이, 용어 "고정 용량", "균일 용량" 및 "균일-고정 용량"은 상호교환가능하게 사용되고, 환자의 체중 또는 체표면적 (BSA)과 관계없이 환자에게 투여되는 용량을 지칭한다. 따라서, 고정 또는 균일 용량은 mg/kg 용량으로서 제공되지 않고, 그보다는 작용제의 절대량으로서 제공된다.
약물의 "예방적 유효량" 또는 "예방적 유효 투여량"은 질환이 발달될 위험이 있거나 또는 질환이 재발할 위험이 있는 대상체에게 단독으로 또는 또 다른 치료제와 조합되어 투여되었을 때, 질환의 발달 또는 재발을 억제하는 약물의 양이다. 질환 퇴행을 촉진하거나 또는 질환의 발달 또는 재발을 억제하는 치료제 또는 예방제의 능력을 숙련된 실무자에게 공지되어 있는 다양한 방법을 사용하여, 예컨대 임상 시험 중인 인간 대상체에서, 인간에서의 효능을 예보하는 동물 모델 시스템에서, 또는 시험관내 검정에서 작용제의 활성을 검정함으로써 평가할 수 있다.
예를 들어, 항암제는 대상체에서 암 진행을 느리게 하거나 또는 암 퇴행을 촉진하는 약물이다. 바람직한 실시양태에서, 치료적 유효량의 약물은 암을 제거하는 지점까지 암 퇴행을 촉진한다. "암 퇴행을 촉진하는 것"은 유효량의 약물을 단독으로 또는 항-신생물 작용제와 조합하여 투여하는 것이 환자에서 종양 성장 또는 크기의 감소, 종양 괴사, 적어도 하나의 질환 증상의 중증도의 감소, 질환 증상이 없는 기간의 빈도 및 지속기간의 증가, 질환 고통으로 인한 곤란 또는 장애의 방지, 또는 질환 증상의 다른 방식의 호전을 초래한다는 것을 의미한다. 약리학적 유효성은 환자에서 암 퇴행을 촉진하는 약물의 능력을 지칭한다. 생리학적 안전성은 약물의 투여로부터 초래되는 세포, 기관 및/또는 생물 수준에서의 허용가능하게 낮은 수준의 독성 또는 다른 유해한 생리학적 효과 (유해 효과)를 지칭한다.
예를 들어 종양의 치료를 위해, 바람직하게는 치료적 유효량 또는 유효 투여량의 약물은 치료되지 않은 대상체에 비교하여 세포 성장 또는 종양 성장을 적어도 약 20%, 더욱 바람직하게는 적어도 약 40%, 더욱 더 바람직하게는 적어도 약 60%, 더더욱 바람직하게는 적어도 약 80%만큼 억제한다. 가장 바람직한 실시양태에서, 치료적 유효량 또는 유효 투여량의 약물은 세포 성장 또는 종양 성장을 완전히 억제하고, 즉, 바람직하게는 세포 성장 또는 종양 성장을 100%만큼 억제한다. 화합물이 종양 성장을 억제하는 능력을 하기에 기재된 검정을 사용하여 평가할 수 있다. 대안적으로, 화합물이 세포 성장을 억제하는 능력을 검사함으로써 조성물의 이러한 특성을 평가할 수 있고, 이같은 억제를 숙련된 실무자에게 공지되어 있는 검정에 의해 시험관 내에서 측정할 수 있다. 본원에 기재된 다른 바람직한 실시양태에서, 종양 퇴행이 관찰될 수 있고, 적어도 약 20일, 더욱 바람직하게는 적어도 약 40일, 또는 더욱 더 바람직하게는 적어도 약 60일의 기간 동안 계속될 수 있다.
용어 "환자" 및 "대상체"는 예방적 또는 치료적 처치를 받는 임의의 인간 또는 비-인간 동물을 지칭한다. 예를 들어, 본원에 기재된 방법 및 조성물은 암을 가진, 예컨대 진행성 고형 종양이 있는 대상체 또는 환자를 치료하는데 사용될 수 있다.
대안 ((예를 들어, "또는")의 사용은 대안들 중 하나, 둘 다, 또는 그의 임의의 조합을 의미하는 것으로 이해되어야 한다.
본원에서 사용된 바와 같이, 부정 관사 "a" 또는 "an"은 "하나 이상"의 임의의 언급되거나 열거된 성분을 지칭하는 것으로 이해되어야 한다.
본원에서 사용된 바와 같이, 용어 "약"은, 수치 또는 범위의 맥락에서, 수치 또는 범위의 ±10%를 의미한다.
본원에 기재된 임의의 농도 범위, 백분율 범위, 비 범위, 또는 정수 범위는, 달리 지시되지 않는 한, 언급된 범위 내의 임의의 정수의 값 및 적합한 경우의 그의 분율 (예컨대 정수의 1/10 또는 1/100)을 포함하는 것으로 이해되어야 한다.
본원에 기재된 다양한 측면이 하기의 하위 섹션에서 추가로 상세하게 기재된다.
I. 사용 방법
비-포화 수용체 점유율 (RO)을 달성하고/거나 유지하는데 충분한 양 (용량) 또는 빈도 (항체 투여 스케줄)로 면역자극 수용체에 결합하는 효능작용 항체를 사용하여 암을 치료하는 방법이 본원에서 제공된다. 실시예에서 제시된 바와 같이, 면역자극 수용체에 결합하는 효능작용 항체의 포화 또는 포화-근접 용량 (>80% RO를 초래하는 용량)은, 비-포화 용량 (약 80% 미만의 RO를 초래하는 용량)에 비교하여, T 세포 활성화 및 증식의 마커에서 반영되는 바와 같이, 항종양 효능 감소를 초래한다. 이는 면역자극 수용체에 결합하는 효능작용 항체를 포화-미만 용량으로 투여함으로써 암을 가진 대상체를 치료하는 것이 항체가 포화 용량으로 투여되었을 때보다 더 큰 치료 이익을 제공할 수 있다는 것을 시사한다.
따라서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체 (예를 들어, 인간 환자)에게 면역자극 수용체에 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 면역자극 수용체에 결합하는 효능작용 항체의 양 또는 빈도가 결정된 대상체 (예를 들어, 인간 환자)에서 암을 치료하는 방법으로서, 대상체에게 충분한 양의 항체를 투여하는 것을 포함하는 방법이 본원에서 또한 제공된다.
암을 가진 대상체의 종양에서 T 조절 세포의 수를 감소시키거나 또는 고갈시키는 방법으로서, 대상체에게 면역자극 수용체에 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 또한 제공된다.
암을 가진 대상체에서 T 세포에서의 IL-2 및/또는 IFN-γ 생산을 증가시키는 방법으로서, 대상체에게 면역자극 수용체에 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 또한 제공된다.
암을 가진 대상체에서 면역 반응을 자극하는 방법으로서, 대상체에게 면역자극 수용체에 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 또한 제공된다.
암을 가진 대상체에서 종양 또는 종양 세포의 성장을 억제하는 방법으로서, 대상체에게 면역자극 수용체에 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 항체는 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 또한 제공된다.
일부 실시양태에서, 효능작용 항체는 약 70% 미만, 예를 들어, 약 60% 미만, 약 50% 미만, 약 40% 미만, 또는 약 30% 미만의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여된다. 일부 실시양태에서, 효능작용 항체는 약 20% 내지 약 80%, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 약 20% 내지 약 30%, 약 30% 내지 약 70%, 약 40% 내지 약 70%, 약 50% 내지 약 70%, 약 60% 내지 약 70%, 약 30% 내지 약 60%, 또는 약 30% 내지 약 50%의 RO 범위를 달성하고/거나 유지하는데 충분한 양으로 투여된다.
본원에 기재된 방법의 특정 실시양태에서, 효능작용 항체는 약 20% 미만, 예를 들어, 약 15% 미만, 약 10% 미만, 약 5% 미만, 또는 약 5% 내지 약 20%, 약 10% 내지 약 20%, 또는 약 15% 내지 약 20%의 RO를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여된다. 일부 실시양태에서, 20%-미만 RO는 대상체 (예를 들어, 인간 환자)의 간헐적 또는 펄스 투약으로 달성되고/되거나 유지된다. 예를 들어, 펄스 투약은 효능작용 항체 및 추가적인 작용제의 조합 요법을 수반할 수 있고, 여기서 효능작용 항체는 8주 또는 12주마다 투여되고, 추가적인 작용제 (예를 들어, 항-PD1 항체)는 4주마다 투여된다.
일부 실시양태에서, RO는 항체 요법 레지멘의 사이클 1 후의 제1일에 측정된다. 일부 실시양태에서, RO는 항체 요법 레지멘에서 사이클 중반에 측정된다. 일부 실시양태에서, RO는 항체 요법 레지멘의 사이클을 시작할 때 측정된다. 일부 실시양태에서, RO는 항체 요법 레지멘의 사이클 또는 사이클들에서 여러 날에 측정된다. 예를 들어, 한 실시양태에서, RO는 14일 사이클의 제1일, 제7일 및/또는 제14일, 및 그 후의 설정된 간격 (예를 들어, 2주마다)에 측정된다. 특정 실시양태에서, RO는 항체 농도가 Cmax, Cmin, 및/또는 C최저에 근접할 때 및/또는 면역자극 수용체의 발현이 최고일 것으로 예측되는 때 (예를 들어, 투약 후 제7일-제14일)인 면역 반응 유도가 피크일 때 측정된다.
RO를 측정하는 방법은 관련 분야에 널리 공지되어 있다. 예를 들어, 실시예 7A에 기재된 바와 같이, 예를 들어, 형광-표지 버전의 관심 항체로 유동 세포측정법을 사용하여 생물학적 샘플 (예를 들어, 혈액)에서 RO를 측정할 수 있다. 수용체 점유율을 측정하는 방법이, 예를 들어, 문헌 [Liang et al., Cytometry B Clin Cytom 2016;90:117-27], [Ciccimaro et al. Anal Chem 2017;89:5115-512]에서 상세하게 검토되었다. 효능작용 항체의 총 수준, 관심 면역자극 수용체의 총 수준, 뿐만 아니라 복합체를 평가함으로써 친화성 추출 액체 크로마토그래피-질량 분광법 (AE LC-MS) 또한 말초 혈액으로부터, 뿐만 아니라 조직에서 RO를 측정하는데 사용될 수 있다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체의 RO를 인간 용량 선택을 통지하는데 사용할 수 있다. 예를 들어, 암을 치료하는 방법으로서, (a) 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 항체를 투여하는 단계, (b) 대상체로부터의 샘플에서 RO를 측정하는 단계, 및 (c) 측정된 RO 및/또는 RO 범위를 기반으로 대상체에게 투여할 항체의 양 또는 항체 투여 스케줄을 결정하는 단계를 포함하는 방법이 본원에서 제공된다.
일부 실시양태에서, 암을 가진 대상체의 치료를 위해 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 유효한 양 또는 항체 투여 스케줄을 선택하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 제공된다:
(a) 대상체에게 항체를 투여하는 단계;
(b) 대상체로부터 샘플 (예를 들어, 혈액)을 수득하는 단계;
(c) 샘플에서 세포 상의 RO를 결정하는 단계; 및
(d) 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 또는 RO 범위를 달성하고/거나 유지하는데 충분한 항체의 양 또는 항체 투여 스케줄을 선택하는 단계.
효능작용 항체의 RO를 초기에 임상전 동물 모델에서 결정하여 다른 포유동물, 예를 들어 인간에서의 투약을 통지할 수 있다. 예를 들어, 일부 실시양태에서, 암을 가진 대상체의 치료를 위해 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 유효한 양 또는 항체 투여 스케줄을 선택하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 제공된다:
(a) 동물 모델 (예를 들어, 마우스 종양 모델, 원숭이 종양 모델)에게 항체를 투여하는 단계;
(b) 동물 모델로부터 샘플 (예를 들어, 혈액)을 수득하는 단계;
(c) 샘플에서 항체의 RO를 결정하는 단계;
(d) 단계 (c)로부터 수득된 RO를 사용하여, 대상체에서의 예상 RO를 추정/예측하는 단계; 및
(e) 대상체에게 투여하기 위한 약 80% 미만의 RO 또는 RO 범위 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%의 RO)를 달성하고/거나 유지하는데 충분한 항체의 양 또는 항체 투여 스케줄을 선택하는 단계.
특정 실시양태에서, 항체의 유효량은 항체가 치료 효능 (예를 들어, 항종양 활성)을 나타내는 RO 범위를 기반으로 정의된다. 따라서, 항체가 치료 효과, 예를 들어, 항종양 활성을 달성하는 면역자극 수용체에 특이적으로 결합하는 효능작용 항체의 유효한 RO 범위를 결정하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 또한 제공된다:
(a) 상이한 양 또는 상이한 빈도로 항체를 예를 들어 동물 모델 (예를 들어, 마우스 종양 모델)에게 투여하는 단계;
(b) 동물로부터 샘플 (예를 들어, 혈액)을 수득하는 단계;
(c) 샘플에서 항체의 RO를 측정하여 용량-반응 RO 곡선을 수득하는 단계;
(d) 치료 효과 (예를 들어, 항종양 활성)를 초래하는 항체의 양 또는 투여 빈도를 결정하고, 이를 RO의 범위와 상호관련시키는 단계.
일부 실시양태에서, 방법은 단계 (d)에서 결정된 RO 범위를 기반으로 대상체 (예를 들어, 인간 환자)에 대한 효능작용 항체의 예상 RO 범위를 추정/예측하는 단계를 추가로 포함한다.
일부 실시양태에서, 암을 가진 대상체의 치료를 위해 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 유효한 양 또는 항체 투여 스케줄을 선택하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 제공된다:
(a) 항체로 치료된 환자로부터 샘플 (예를 들어, 종양 생검 샘플)을 수득하는 단계;
(b) 샘플에서 항체의 RO를 결정하는 단계;
(c) 단계 (b)로부터 수득된 RO를 사용하여, 대상체에서의 예상 RO를 결정하는 단계; 및
(d) 대상체에게 투여하기 위한 약 80% 미만의 RO (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%의 RO)를 달성하고/거나 유지하는데 충분한 항체의 양 또는 항체 투여 스케줄을 선택하는 단계.
일부 실시양태에서, 후향 분석에 의해 또는 임상전 데이터로부터 치료 효능 (예를 들어, 항종양 활성)과 연관된 RO 및/또는 RO 범위를 기반으로 인간 환자에서의 예상 RO 및/또는 RO 범위를 추정/예측할 수 있다.
임상전 환경에서, 예를 들어, 시험관내 인간 세포주로부터 수득된 결합 EC50 또는 표면 플라즈몬 공명으로부터 결정된 해리 상수 Kd를 사용하여, 인간 RO를 결정할 수 있다 (Muller PY and Brennan FR, Clin Pharmacol Ther. 2009;85:247-58; Saber H et al., Regul Toxicol Pharmacol. 2016;81:448-56). 그러나, 다양한 시험관내 시스템의 제약 (예를 들어, 경쟁 리간드의 결여)으로 인해, 동물 종에서의 시험관내 RO가 이러한 종에서 관찰되는 생체내 RO와 얼마나 잘 상호연관되는지를 평가하는 것에 의해 인간 RO 예측이 실현될 수 있다 (Yang Z et al., J Pharmacol Exp Ther. 2015;355:506-515). 임상적으로, 집단 약동학-약역학 (PK-PD) 모델링을 구축하여 약물 농도와 RO 데이터 사이의 관계를 결정할 수 있고 (Rosario MC et al., Br J Clin Pharmacol. 2008;65:86-94), 이로부터 상이한 투여량 레지멘들에서의 인간 RO 데이터를 예측할 수 있다. 그 후, 예측/추정 RO를 사용하여, 효능작용 치료용 항체의 유효한 인간 용량 또는 항체 투여 스케줄, 예를 들어, 암을 가진 인간 환자에서 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 또는 RO 범위를 달성하고/거나 유지하는데 충분한 용량 또는 빈도를 결정할 수 있다.
면역자극 수용체에 결합하는 효능작용 항체의 예상 RO 및/또는 RO 범위를 추정하는데 사용하기 위한 적절한 임상전 동물 모델은 마우스 종양 모델 (예를 들어, CT26 마우스 동계 종양 모델), 마우스 백신접종 모델, 원숭이 백신접종 모델, 및 1차 인간 백혈구 집단을 이용하는 시험관내 자극 모델 시스템을 포함하지만, 이에 제한되지 않는다.
후향 분석의 경우, 면역자극 수용체에 결합하는 효능작용 항체로 치료된 환자로부터 수득된 샘플에서 RO를 결정할 수 있다. 환자로부터의 샘플은, 예를 들어, 종양 생검, 혈액, 및 단리된 말초혈 단핵 세포일 수 있다. 그 후, 후향 분석으로부터 수득된 RO를 사용하여, 암을 가진 인간 환자에게 투여하기 위한 용량 또는 투여 스케줄 (예를 들어, 약 80% 미만의 RO를 달성하고/거나 유지하는데 충분한 용량 또는 빈도)을 통지할 수 있다.
일부 실시양태에서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체를 유효한 양 또는 항체 투여 스케줄로 투여하는 것을 포함하며, 여기서 투여하려는 항체의 양 또는 항체 투여 스케줄은 상기 기재된 용량 선택 방법에 따라 선택되는 것인 방법이 본원에서 제공된다.
일부 실시양태에서, 대상체에 대한 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 및/또는 RO 범위를 달성하고/거나 유지하는데 충분한 치료용 효능작용 항체의 양 또는 항체 투여 스케줄이 본원에 기재된 방법을 사용하여 결정된 대상체 (예를 들어, 인간 환자)에서 암을 치료하는 방법으로서, 충분한 양 또는 투여 스케줄의 치료용 효능작용 항체를 대상체에게 투여하는 것을 포함하는 방법이 본원에서 제공된다.
암에 대해 치료 중인 대상체에서 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 수준을 모니터링하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 또한 제공된다:
(a) 대상체로부터 샘플 (예를 들어, 혈액)을 수득하는 단계;
(b) 샘플에서 RO (즉, 항체에 의한 수용체의 점유율)를 결정하는 단계;
(c) RO가 약 80%를 초과하면 항체 투여의 용량 또는 빈도를 감소시키거나, 또는 RO가 약 20% 미만이면 항체의 용량 또는 빈도를 증가시키는 단계;
(d) 임의적으로, 약 20% 내지 약 80%, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%의 RO를 달성하고/거나 유지하는데 충분한 항체의 용량 또는 항체 투여 스케줄이 달성될 때까지 단계 (a)-(c)를 반복하는 단계.
또 다른 실시양태에서, 암에 대해 치료 중인 대상체에서 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 수준을 모니터링하는 방법으로서, 하기 단계를 포함하는 방법이 본원에서 또한 제공된다:
(a) 대상체로부터 샘플 (예를 들어, 혈액)을 수득하는 단계;
(b) 샘플에서 RO (즉, 항체에 의한 수용체의 점유율)를 결정하는 단계;
(c) 용량 레지멘 및/또는 용량 빈도의 RO를 예측하기 위해 항체 농도와 RO 사이의 PK-PD 관계를 확립하는 단계;
(d) 약 20% 내지 약 80%, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%의 RO 및/또는 RO 범위를 달성하고/거나 유지할 용량 및/또는 항체 투여 스케줄을 선택하는 단계.
암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 추가적인 요법을 투여하는 것을 포함하며, 여기서 추가적인 요법은 고정 빈도로 투여되고, 효능작용 항체는 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 및/또는 RO 범위를 달성하고/거나 유지하는데 충분한 빈도로 투여되는 것인 방법이 본원에서 또한 제공된다. 일부 실시양태에서, 효능작용 항체의 투약 빈도는 상기 기재된 용량 선택 방법을 사용하여 결정된다.
본원에 기재된 방법의 일부 실시양태에서, 면역자극 수용체는 공동-자극 수용체, 예를 들어, 종양 괴사 인자 수용체 수퍼패밀리 (TNFRSF)의 구성원, ICOS (CD278), CD28, LIGHT, CD40L, TIM1, SLAM, CD1, CD2, CD226, LFA-1 (CD11A, CD18), CD2, CD5, CD7, CD30, CD54, CD97, CD154, CD160, LIGHT, NKG2C, SLAMF7, 및 NKp80으로 이루어진 군으로부터 선택되는 수용체이다.
일부 실시양태에서, 공동-자극 수용체는 종양 괴사 인자 수용체 수퍼패밀리 (TNFRSF)의 구성원이다. 따라서, 일부 실시양태에서, 본원에 기재된 방법에서 사용되는 효능작용 항체는 TNFR1, TNFR2, HVEM, LTβR, OX40, CD27, CD40, FAS, DCR3, CD30, 4-1BB, TRAILR1, TRAILR2, TRAILR3, TRAILR4, OPG, RANK, FN14, TACI, BAFFR, BCMA, GITR, TROY, DR3 (사멸 수용체 3), DR6 (사멸 수용체 6), XEDAR (엑토디스플라신 A2 수용체), 또는 NGFR에 결합한다.
특정 실시양태에서, 면역자극 수용체는 OX40이다. 따라서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 OX40에 특이적으로 결합하는 효능작용 항체 (예를 들어, OX40.21)을 투여하는 것을 포함하고, 여기서 효능작용 항체는 대상체에서 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 및/또는 RO 범위를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
일부 실시양태에서, 본원에 기재된 암을 치료하는 방법은 암의 치료를 필요로 하는 대상체에게 항-OX40 항체 및 항-PD-1 항체 각각의 유효량을 투여하는 것을 포함하며, 여기서 항-OX40 및 항-PD-1 항체는 적어도 1회의 투여 사이클 동안 투여되고, 이러한 사이클은 12주 기간이며, 적어도 1회의 사이클 각각에 대해, 적어도 1회의 용량의 항-OX40 항체가 약 1, 3, 10, 20, 40, 50, 80, 100, 130, 150, 180, 200, 240 또는 280 mg의 고정 용량으로 투여되고, 적어도 3회의 용량의 항-PD-1 항체가 약 50, 80, 100, 120, 150, 180, 200, 240, 480, 720, 또는 960 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 20, 40, 또는 80 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 20 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 40 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 80 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480의 고정 용량으로 투여된다. 한 실시양태에서, 항-PD-1 항체는 각각의 사이클의 제1일, 제29일 및 제57일에 투여된다. 한 실시양태에서, 항-OX40 항체는 각각의 사이클의 제1일에 투여된다. 한 실시양태에서, 항-PD-1 항체는 각각의 사이클의 제1일, 제29일 및 제57일에 투여되고, 항-OX40 항체는 각각의 사이클의 제1일에 투여된다. 한 실시양태에서, 필요하다면, 12주 투여 사이클이 반복될 수 있다. 한 실시양태에서, 투여는 9회 이하의 사이클로 이루어진다. 한 실시양태에서, 투여는 1, 2, 3, 4, 5, 6, 7, 8, 또는 9회의 사이클로 이루어진다. 한 실시양태에서, OX-40 항체는 OX40.21을 포함한다. 한 실시양태에서, 항-PD-1 항체는 니볼루맙을 포함한다. 한 실시양태에서, 암은 방광암, 자궁경부암, 신세포암, 고환암, 결장직장암, 폐암, 두경부암 및 난소암으로부터 선택된다. 한 실시양태에서, 암은 방광암이다. 한 실시양태에서, 대상체는 인간 대상체이다.
면역자극 수용체에 결합하는 효능작용 항체 및 추가적인 작용제로의 조합 요법이 또한 제공된다. 이같은 실시양태에서, 효능작용 항체 (예를 들어, 항-OX40 항체)의 유효량은 효능작용 항체가 단독으로 (즉, 단독요법에서) 사용되는 경우보다 실질적으로 더 낮을 수 있다.
따라서, 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 OX40에 특이적으로 결합하는 효능작용 항체 (예를 들어, MEDI6469, MEDI0562, PF-04518600, MOXR0916, GSK3174998, 및 WO2016/196228에 기재된 항체 (예를 들어, OX40.21)) 및 추가적인 요법 (비-제한적인 예는 항-PD1 항체, 항-PDL1 항체, 항-LAG3 항체, 항-CTLA4 항체, 및 -TGFβ 항체를 포함함)를 투여하는 것을 포함하고, 여기서 효능작용 항체는 대상체에서 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 및/또는 RO 범위를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법이 본원에서 제공된다.
일부 실시양태에서, 항-OX40 항체는 추가적인 요법과 상이한 빈도로 투여된다. 예를 들어, 추가적인 요법은 고정 빈도로 투여되고, 항-OX40 항체는 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO 및/또는 RO 범위를 달성하는데 충분한 용량 및/또는 빈도로 투여된다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체 (예를 들어, 항-OX40 항체 예컨대 OX40.21)는 추가적인 요법 (예를 들어, 니볼루맙)과 조합되어 사용되는 경우 펄스 투여된다. 일부 실시양태에서, 효능작용 항체는 약 80% 미만 (또는 약 70% 미만, 약 60% 미만, 약 50% 미만, 약 40% 미만, 약 50% 미만, 약 20% 내지 약 70%, 약 20% 내지 약 60%, 약 20% 내지 약 50%, 약 20% 내지 약 40%, 또는 약 20% 내지 약 30%)의 RO를 달성하고/거나 유지하기 위해 펄스 투여된다. 예를 들어, 한 실시양태에서, 펄스 투여는 효능작용 항체 및 추가적인 작용제의 조합 요법을 수반하고, 여기서 효능작용 항체는 8주 또는 12주 마다 투여되고, 추가적인 작용제 (예를 들어, 항-PD1 항체)는 4주마다 투여된다.
유효한 용량 또는 빈도의 효능작용 항체가 투여되고 있는지를 확증하기 위해 면역자극 수용체에 결합하는 효능작용 항체로 치료 중인 대상체에서 T 세포 활성화의 마커를 모니터링할 수 있다. 모니터링될 수 있는 (그리고, "후크 효과"를 나타내는) T 세포 활성화의 추가적인 마커의 예는 면역자극 수용체 (예를 들어, OX40), ICOS, CD44, 및 Ki67의 표면 발현, 뿐만 아니라 면역 반응 동안 상향조절되는 것으로 공지된 시토카인 (예를 들어, IFN-γ, IL-2)을 포함하지만, 이에 제한되지 않는다. 상기 마커의 수준을 측정하는 방법은 관련 분야이 널리 공지되어 있다 (예를 들어, ELISA). 예를 들어, 3[H]-티미딘 혼입 검정에 의해 T 세포 증식을 모니터링할 수 있다.
본원에 기재된 방법에서 표적화되는 면역자극 수용체가 OX40인 경우, 가용성 OX40 (sOX40)이 효능작용 항체 치료의 치료 효능을 모니터링하기 위한 마커로서 사용될 수 있는데, sOX40이 높은 RO 수준에서 소위 "후크 효과"를 또한 나타내기 때문이다 (예를 들어, 실시예 8 참조). sOX40 수준을 결정하기 위한 예시적인 방법 (ELISA)이 실시예 8에서 제공된다.
본원에 기재된 방법으로 성장을 치료하거나 모니터링할 수 있는 암은 전형적으로 면역요법에 반응성인 암 및 전형적으로 면역요법에 반응성이지 않은 암을 포함한다. 암은 고형 종양 또는 혈액 악성종양 (액상 종양)의 암일 수 있다. 치료하기 위한 암의 비제한적인 예는 편평 세포 암종, 소세포 폐암, 비-소세포 폐암, 편평 비-소세포 폐암 (NSCLC), 비-편평 NSCLC, 신경아교종, 위장암, 신장암 (예를 들어 투명 세포 암종), 난소암, 간암, 결장직장암, 자궁내막암, 신장암 (예를 들어, 신세포 암종 (RCC)), 전립선암 (예를 들어 호르몬 불응성 전립선 선암종), 갑상선암, 신경모세포종, 췌장암, 교모세포종 (다형성 교모세포종), 자궁경부암, 위암, 방광암, 간세포암, 유방암, 결장 암종, 및 두경부암 (또는 암종), 위암, 생식 세포 종양, 소아 육종, 비부비동 천연 킬러, 흑색종 (예를 들어, 전이성 악성 흑색종, 예컨대 피부 또는 안내 악성 흑색종), 골암, 피부암, 자궁암, 항문 영역의 암, 고환암, 나팔관의 암종, 자궁내막의 암종, 자궁경부의 암종, 질의 암종, 외음부암종, 식도암, 소장 암, 내분비계 암, 부갑상선암, 부신암, 연질 조직의 육종, 요도암, 남근암, 아동기의 고형 종양, 수뇨관의 암, 신우의 암종, 중추 신경계 (CNS)의 신생물, 원발성 CNS 림프종, 종양 혈관형성, 척추 종양, 뇌암, 뇌간 신경아교종, 뇌하수체 선종, 카포시 육종, 유표피암, 편평세포암, T-세포 림프종, 석면에 의해 유도된 암을 포함하는 환경적으로 유도된 암, 바이러스 관련 암 또는 바이러스 기원의 암 (예를 들어, 인간 유두종 바이러스 (HPV)-관련 또는 -기원 종양), 및 2개의 주요 혈액 세포 계통, 즉 골수성 세포주 (과립구, 적혈구, 혈소판, 대식세포 및 비만 세포를 생산함) 또는 림프성 세포주 (B, T, NK 및 혈장 세포를 생산함) 중 하나로부터 유래된 혈액학적 악성 종양, 예컨대 모든 유형의 백혈병, 림프종, 및 골수종, 예를 들어, 급성, 만성, 림프구성 및/또는 골수성 백혈병, 예컨대 급성 백혈병 (ALL), 급성 골수성 백혈병 (AML), 만성 림프구성 백혈병 (CLL), 및 만성 골수성 백혈병 (CML), 미분화 AML (M0), 골수모구성 백혈병 (M1), 골수모구성 백혈병 (M2; 세포 성숙이 있음), 전골수구성 백혈병 (M3 또는 M3 변이체 [M3V]), 골수단핵구성 백혈병 (M4 또는 호산구 증가증이 있는 M4 변이체 [M4E]), 단핵구성 백혈병 (M5), 적백혈병 (M6), 거핵모구성 백혈병 (M7), 단리된 과립구성 육종, 및 녹색종; 림프종, 예컨대 호지킨 림프종 (HL), 비-호지킨 림프종 (NHL), B 세포 혈액학적 악성종양, 예를 들어, B-세포 림프종, T-세포 림프종, 림프혈장세포양 림프종, 단핵구모양 B-세포 림프종, 점막-연관 림프 조직 (MALT) 림프종, 역형성 (예를 들어, Ki 1+) 대형-세포 림프종, 성인 T-세포 림프종/백혈병, 외투 세포 림프종, 혈관 면역모구성 T-세포 림프종, 혈관중심성 림프종, 장 T-세포 림프종, 원발성 종격 B-세포 림프종, 전구체 T-림프모구성 림프종, T-림프모구성; 및 림프종/백혈병 (T-Lbly/T-ALL), 말초 T-세포 림프종, 림프모구성 림프종, 이식후 림프증식성 장애, 진성 조직구성 림프종, 원발성 중추 신경계 림프종, 원발성 삼출 림프종, B 세포 림프종, 림프모구성 림프종 (LBL), 림프 계통의 조혈 종양, 급성 림프모구성 백혈병, 광범위 대형 B-세포 림프종, 버킷 림프종, 소포 림프종, 광범위 조직구성 림프종 (DHL), 면역모세포성 대형 세포 림프종, 전구체 B-림프모구성 림프종, 피부 T-세포 림프종 (CTLC) [균상식육종 또는 세자리 증후군으로도 칭해짐], 및 발덴스트롬 마크로글로불린혈증이 동반된 림프형질세포양 림프종 (LPL); 골수종, 예컨대 IgG 골수종, 경쇄 골수종, 비-분비성 골수종, 무증상 골수종 (무통성 골수종으로도 칭해짐), 단발성 형질세포종, 및 다발성 골수종, 만성 림프구성 백혈병 (CLL), 모발상 세포 림프종; 골수 계통의 조혈 종양, 섬유육종 및 횡문근육종을 포함하는 중간엽 기원의 종양; 고환종, 기형암종, 중추 및 말초 신경의 종양 (성상세포종, 신경초종 포함); 섬유육종, 횡문근육종, 및 골육종을 포함하는 중간엽 기원의 종양; 및 흑색종, 색소성 건피증, 각질가시세포종, 고환종, 갑상선 소포성 암 및 기형암종, 림프 계통의 조혈 종양, 예를 들어 T-세포 장애 예컨대 T-전림프구성 백혈병 (T-PLL) (소세포 및 대뇌모양 세포 유형 포함)을 포함하지만 이에 제한되지 않는 T-세포 및 B-세포 종양을 포함하는 기타 종양; 대형 과립 림프구 백혈병 (LGL), 바람직하게는 T-세포 유형; a/d T-NHL 간비장 림프종; 말초/흉선 후 T 세포 림프종 (다형성 및 면역모세포성 아유형); 혈관중심성 (비내) T-세포 림프종; 두경부암, 신장암, 직장암, 갑상선암; 급성 골수성 림프종, 뿐만 아니라 상기 암의 임의의 조합을 포함한다.
본원에 기재된 방법은 전이성 암, 절제불능성, 및/또는 불응성 암 (예를 들어, 이전의 면역요법, 예를 들어, 차단 CTLA-4 또는 PD-1 항체로의 요법에 불응성인 암), 및 재발성 암을 치료하는데 또한 사용될 수 있다.
일부 실시양태에서, 본원에 개시된 방법으로 치료될 환자는 진행성 고형 종양이 있다. 예를 들어, 한 실시양태에서, 환자는 자궁경부암을 가진다. 또 다른 실시양태에서, 환자는 결장직장암 (CRC)을 가진다. 또 다른 실시양태에서, 환자는 방광암 (예를 들어, 절제불능성의 국소 진행성 또는 전이성 방광암)을 가진다. 또 다른 실시양태에서, 환자는 난소암 (예를 들어, 절제불능성의 국소 진행성 또는 전이성 난소암)을 가진다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 비-소세포 폐암 (NSCLC)을 가진다. 또 다른 실시양태에서, 환자는 두경부의 편평세포 암종 (SCCHN)을 가진다. 또 다른 실시양태에서, 환자는 B-세포 비-호지킨 림프종 (B-NHL)을 가진다. 또 다른 실시양태에서, 환자는 골수종을 가진다. 또 다른 실시양태에서, 환자는 흑색종을 가진다. 또 다른 실시양태에서, 환자는 광범위 대형 B-세포 림프종 (DLBCL)을 가진다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 자궁경부암을 가진다. 한 실시양태에서, 자궁경부암은 질환 진행이 문서화되어 있으면서 절제불능성, 전이성, 또는 재발성이다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 신세포 암종을 가진다. 한 실시양태에서, 신세포 암종은 전이성 신세포 암종이다. 한 실시양태에서, 신세포 암종은 투명-세포 성분이 있는 신세포 암종이다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 고환암을 가진다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 결장직장암을 가진다. 한 실시양태에서, 결장직장암은 고도의 현미부수체 불안정성 (MSI-H) 결장직장암이다. 한 실시양태에서, 결장직장암은 현미부수체 안정적 결장직장암이다. 한 실시양태에서, 결장직장암은 미스매치 복구-결핍성 결장직장암이다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 폐암을 가진다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 두경부암을 가진다. 한 실시양태에서, 두경부암은 편평세포 암종이다.
한 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 난소암을 가진다. 한 실시양태에서, 난소암은 절제불능성의 국소 진행성 난소암이다. 한 실시양태에서, 난소암은 전이성 난소암이다. 한 실시양태에서, 난소암은 재발성 백금-민감성 난소암이다.
일부 실시양태에서, 본원에 기재된 방법으로 치료 중인 환자는 선행 치료, 예를 들어, 면역-종양학 약물로의 선행 치료에 부적합한 반응을 나타낸 암을 가지거나, 또는 환자는 불응성이거나 저항성 (내인성으로 불응성 또는 저항성이거나, 또는 저항성 또는 불응성 상태가 후천적임)인 암을 가진다. 일부 실시양태에서, 환자는 이전에 면역-종양학 작용제, 예를 들어, PD-1 경로 길항제가 제공되지 않았다 (즉, 이러한 작용제로 치료되지 않았음).
일부 실시양태에서, 본원에 기재된 방법은 표준 관리 치료 (예를 들어, 수술, 방사선조사 및 화학요법)를 추가로 포함할 수 있다. 다른 실시양태에서, 방법은 유지 요법, 예를 들어, 종양의 발생 또는 재발을 방지하도록 의도되는 요법으로서 수행될 수 있다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 결합하는 효능작용 항체는 아주반트 요법으로서 대상체에게 제공된다. 일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 결합하는 효능작용 항체는 1선, 2선 또는 3선 치료로서 사용된다.
일부 실시양태에서, 다른 실시양태에서,면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 결합하는 효능작용 항체는 단독요법으로서, 또는 유일한 면역자극 요법으로서 투여될 수 있다.
다른 실시양태에서, 다른 실시양태에서,면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 결합하는 효능작용 항체는, 하기 기재된 바와 같이, 조합 요법의 일부로서 투여될 수 있다.
면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 면역-종양학 작용제, 예를 들어, 둘 다 면역 반응, 예컨대 항원-특이적 T 세포 반응을 증폭시키는 것을 초래하는, 면역 세포, 예컨대 T 세포 상의 (i) 면역자극 (예를 들어, 공동-자극) 분자 (예를 들어, 수용체 또는 리간드)의 효능제 및/또는 (ii) 면역억제 분자 (예를 들어, 수용체 또는 리간드)의 길항제와 조합될 수 있다. 특정 측면에서, 면역-종양학 작용제는 선천 면역에서 수반되는 세포, 예를 들어, NK 세포 상에 존재하는 (i) 면역자극 (공동-자극 포함) 분자 (예를 들어, 수용체 또는 리간드)의 효능제 또는 (ii) 면역억제 (공동-억제 포함) 분자 (예를 들어, 수용체 또는 리간드)의 길항제이다. 이같은 면역-종양학 작용제는 종종 면역 체크포인트 조절제, 예를 들어, 면역 체크포인트 억제제 또는 면역 체크포인트 자극제로 지칭된다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 면역글로불린 수퍼 패밀리 (IgSF)의 구성원인 자극 또는 억제 분자를 표적화하는 작용제와 함께 투여된다. 일부 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체는 B7-1, B7-2, B7-H1 (PD-L1), B7-DC (PD-L2), B7-H2 (ICOS-L), B7-H3, B7-H4, B7-H5 (VISTA), 및 B7-H6을 포함하는 막-결합 리간드의 B7 패밀리의 구성원을 표적화하는 (또는 이에 특이적으로 결합하는) 작용제, 또는 B7 패밀리에 특이적으로 결합하는 공동-자극 또는 공동-억제 수용체와 함께 투여될 수 있다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 TNF 및 TNFR 패밀리의 구성원인 분자 (리간드 또는 수용체), 예컨대 CD40 및 CD40L, GITR, GITR-L, CD70, CD27L, CD30, CD30L, 4-1BBL, CD137, TRAIL/Apo2-L, TRAILR1/DR4, TRAILR2/DR5, TRAILR3, TRAILR4, OPG, RANK, RANKL, TWEAKR/Fn14, TWEAK, BAFFR, EDAR, XEDAR, TACI, APRIL, BCMA, LTβR, LIGHT, DcR3, HVEM, VEGI/TL1A, TRAMP/DR3, EDA1, EDA2, TNFR1, 림포톡신 α/TNFβ, TNFR2, TNFα, LTβR, 림포톡신 α1β2, FAS, FASL, RELT, DR6, TROY, 및 NGFR (예를 들어, 문헌 [Tansey (2009) Drug Discovery Today 00:1] 참조)을 표적화하는 작용제와 함께 투여될 수도 있다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 하기 작용제 중 하나 이상과 함께 투여된다:
(1) T 세포 활성화를 억제하는 단백질 (예를 들어, 면역 체크포인트 억제제), 예컨대 상기 기재된 바와 같은 CTLA-4, PD-1, PD-L1, PD-L2, 및 LAG-3, 및 하기 단백질: TIM-3, 갈렉틴(Galectin) 9, CEACAM-1, BTLA, CD69, 갈렉틴-1, TIGIT, CD113, GPR56, VISTA, B7-H3, B7-H4, 2B4, CD48, GARP, PD1H, LAIR1, TIM-1, 및 TIM-4 단백질 중 임의의 것의 길항제 (억제제 또는 차단제); 및/또는
(2) T 세포 활성화를 자극하는 단백질, 예컨대 B7-1, B7-2, CD28, 4-1BB (CD137), 4-1BBL, ICOS, ICOS-L, GITR, GITR-L, CD70, CD27, CD40, DR3 및 CD28H의 효능제.
암을 치료하기 위한 상기 단백질 중 하나를 조정하는 예시적인 작용제는 예르보이(Yervoy)™ (이필리무맙(ipilimumab)) 또는 트레멜리무맙(Tremelimumab) (CTLA-4에 대한 것), 갈릭시맙(galiximab) (B7.1에 대한 것), BMS-936558 (PD-1에 대한 것), MK-3475 (PD-1에 대한 것), AMP224 (B7DC에 대한 것), BMS-936559 (B7-H1에 대한 것), MPDL3280A (B7-H1에 대한 것), MEDI-570 (ICOS에 대한 것), AMG557 (B7H2에 대한 것), MGA271 (B7H3에 대한 것), IMP321 (LAG-3에 대한 것), BMS-663513 (CD137에 대한 것), PF-05082566 (CD137에 대한 것), CDX-1127 (CD27에 대한 것), 아타시셉트(Atacicept) (TACI에 대한 것), CP-870893 (CD40에 대한 것), 루카투무맙(Lucatumumab) (CD40에 대한 것), 다세투주맙(Dacetuzumab) (CD40에 대한 것), 무로모납(Muromonab)-CD3 (CD3에 대한 것), 이필리무맙(Ipilumumab) (CTLA-4에 대한 것)을 포함한다. 일부 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체는 피딜리주맙 (CT-011)과 함께 투여된다.
암 치료를 위해 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체와 조합될 수 있는 기타 분자는 NK 세포 상의 억제 수용체의 길항제 또는 NK 세포 상의 활성하 수용체의 효능제, 예를 들어, KIR의 길항제 (예를 들어, 리릴루맙(lirilumab))를 포함한다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 T 세포 활성화를 억제하는 시토카인의 길항제 또는 T 세포 활성화를 자극하는 시토카인의 효능제와 함께 투여될 수 있다.
특정 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는, 면역 반응을 자극하기 위해, 예를 들어, 증식성 질환, 예컨대 암을 치료하기 위해, (i) T 세포 활성화를 억제하는 IgSF 패밀리 또는 B7 패밀리 또는 TNF 패밀리의 단백질의 길항제 (또는 억제제 또는 차단제) 또는 T 세포 활성화를 억제하는 시토카인 (예를 들어, IL-6, IL-10, TGF-ß, VEGF; "면역억제 시토카인")의 길항제 및/또는 (ii) T 세포 활성화를 자극하는 IgSF 패밀리, B7 패밀리 또는 TNF 패밀리 또는 시토카인의 효능제와 조합되어 사용될 수 있다.
조합 요법을 위한 또 다른 작용제는 RG7155 (WO11/70024, WO11/107553, WO11/131407, WO13/87699, WO13/119716, WO13/132044) 또는 FPA-008 (WO11/140249; WO13169264; WO14/036357)를 포함하는 CSF-1R 길항제 예컨대 CSF-1R 길항제 항체를 포함하지만 이에 제한되지 않는, 대식세포 또는 단핵구를 억제하거나 고갈시키는 작용제를 포함한다.
면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 TGF-β 신호전달을 억제하는 작용제와 함께 투여될 수도 있다.
조합 요법을 위한 추가적인 작용제는 종양 항원 제시를 증진시키는 작용제, 예를 들어, 수지상 세포 백신, GM-CSF를 분비하는 세포 백신, CpG 올리고뉴클레오티드, 및 이미퀴모드, 또는 종양 세포의 면역원성을 증진시키는 요법 (예를 들어, 안트라사이클린)을 포함한다.
조합 요법에서 사용하기 위한 또 다른 요법은 Treg 세포를 고갈시키거나 차단하는 요법, 예를 들어, CD25에 특이적으로 결합하는 작용제를 포함한다.
면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체와 조합될 수 있는 또 다른 요법은 대사 효소 예컨대 인돌아민 디옥시게나제 (IDO), 디옥시게나제, 아르기나제, 또는 산화질소 신쎄타제를 억제하는 요법이다.
면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체와 함께 사용될 수 있는 작용제의 또 다른 클래스는 아데노신 형성을 억제하거나 또는 아데노신 A2A 수용체를 억제하는 작용제를 포함한다.
조합 요법에서 사용하기 위한 기타 요법은 T 세포 무반응 또는 소진을 역전시키는/방지하는 요법 및 종양 부위에서의 염증 및/또는 선천 면역 활성화를 촉발하는 요법을 포함한다.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 1개를 초과하는 면역-종양학 작용제와 조합될 수 있고, 예를 들어, 면역 경로의 다중 요소를 표적화하는 조합형 접근법, 예컨대 하기 중 하나 이상과 조합될 수 있다: 종양 항원 제시를 증진시키는 요법 (예를 들어, 수지상 세포 백신, GM-CSF를 분비하는 세포 백신, CpG 올리고뉴클레오티드, 이미퀴모드); 예를 들어, CTLA-4 및/또는 PD1/PD-L1/PD-L2 경로를 억제하고/거나 Treg 또는 다른 면역 억제 세포를 고갈시키거나 차단함으로써, 음성 면역 조절을 억제하는 요법; 양성 면역 조절을 자극하는 요법, 예를 들어, CD-137 및/또는 GITR 경로를 자극하고/거나 T 세포 이펙터 기능을 자극하는 효능제; 전신적으로 항종양 T 세포의 빈도를 증가시키는 요법; 예를 들어, CD25의 길항제 (예를 들어, 다클리주맙)를 사용하여, 또는 생체외 항-CD25 비드 고갈에 의해, Treg, 예컨대 종양 내의 Treg을 고갈시키거나 억제하는 요법; 종양 내의 억제인자 골수 세포의 기능에 영향을 미치는 요법; 종양 세포의 면역원성을 증진시키는 요법 (예를 들어, 안트라사이클린); 유전자 변형 세포, 예를 들어 키메라 항원 수용체에 의해 변형된 세포 (CAR-T 요법)를 포함하는 입양 T 세포 또는 NK 세포 전달; 대사 효소 예컨대 인돌아민 디옥시게나제 (IDO), 디옥시게나제, 아르기나제 또는 산화질소 신쎄타제를 억제하는 요법; T 세포 무반응 또는 소진을 역전시키는/방지하는 요법; 종양 부위에서의 염증 및/또는 선천 면역 활성화를 촉발하는 요법; 면역 자극 시토카인의 투여; 또는 면역 억제 시토카인의 차단.
일부 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 양성 공동-자극 수용체를 결찰시키는 효능작용 작용제, 억제 수용체를 통한 신호전달을 약화시키는 차단제, 길항제, 및 전신적으로 항종양 T 세포의 빈도를 증가시키는 하나 이상의 작용제, 종양 미세환경 내에서의 별도의 면역 억제 경로를 극복하는 (예를 들어, 억제 수용체 결속 (예를 들어, PD-L1/PD-1 상호작용)을 차단하거나, Treg를 고갈시키거나 억제하거나 (예를 들어, 항-CD25 모노클로날 항체 (예를 들어, 다클리주맙)를 사용하여 또는 생체외 항-CD25 비드 고갈에 의해), 대사 효소 예컨대 IDO를 억제하거나, 또는 T 세포 무반응 또는 소진을 역전시키는/방지하는) 작용제, 종양 부위에서의 염증 및/또는 선천 면역 활성화를 촉발하는 작용제 중 하나 이상과 함께 사용될 수 있다.
특정 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 대상체가 BRAF V600 돌연변이 양성인 경우 BRAF 억제제와 함께 대상체에게 투여된다.
특정 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 또 다른 면역자극 항체, 예컨대 길항작용 항-PD1 항체, 길항작용 항-PDL1 항체, 길항작용 항-CTLA4 항체, 길항작용 항-LAG3 항체와 함께 투여되고, 항-OX40 항체는 또 다른 면역자극 항체와 함께 투여된다. 특정 실시양태에서, 조합 요법은 효능작용 항-OX40 항체 및 길항작용 항-PD1 항체를 포함한다.
본원에 기재된 방법에서 사용하기 위한 적절한 PD-1 길항제는, 비제한적으로, 리간드, 항체 (예를 들어, 모노클로날 항체 및 이중특이적 항체), 및 다가 작용제를 포함한다. 한 실시양태에서, PD-1 길항제는 융합 단백질, 예를 들어, Fc 융합 단백질, 예컨대 AMP-244이다. 한 실시양태에서, PD-1 길항제는 항-PD-1 또는 항-PD-L1 항체이다. 예시적인 항-PD-1 항체는 니볼루맙 (BMS-936558) 또는 WO 2006/121168에 기재된 항체 17D8, 2D3, 4H1, 5C4, 7D3, 5F4 및 4A11 중 하나의 CDR 또는 가변 영역을 포함하는 항체이다. 특정 실시양태에서, 항-PD1 항체는 WO2012/145493에 기재된 MK-3475 (람브롤리주맙(Lambrolizumab)); 및 WO 2012/145493에 기재된 AMP-514이다. 추가의 공지된 PD-1 항체 및 기타 PD-1 억제제는 WO 2009/014708, WO 03/099196, WO 2009/114335, WO 2011/066389, WO 2011/161699, WO 2012/145493, 미국 특허 번호 7,635,757 및 8,217,149, 및 미국 특허 공개 번호 2009/0317368에 기재된 것들을 포함한다. WO2013/173223에 개시된 항-PD-1 항체 중 임의의 것이 또한 사용될 수 있다. 이러한 항체들 중 하나와 PD-1 상의 동일한 에피토프에 결합하고/거나 결합에 대해 경쟁하는 항-PD-1 항체 또한 조합 치료에서 사용될 수 있다. PD-1 수용체를 표적화하는 또 다른 접근법은 AMP-224로 칭해지는, IgG1의 Fc 부분에 융합된 PD-L2 (B7-DC)의 세포외 도메인으로 구성된 재조합 단백질이다. 특정 실시양태에서, 항체는 상기 언급된 항체와의 가변 영역 아미노산 서열 동일성이 적어도 약 90%이다.
특정 실시양태에서, 면역자극 수용체 예컨대 TNF 및 TNFR 패밀리 분자 (예를 들어, OX40)에 특이적으로 결합하는 효능작용 항체는 각각 서열식별번호: 16 및 17에 제시된 서열을 포함하는 중쇄 및 경쇄를 포함하는 니볼루맙, 또는 그의 항원 결합 단편 및 변이체와 조합되어 사용된다. 특정 실시양태에서, 항체는 니볼루맙의 중쇄 및 경쇄 CDR 또는 가변 영역을 갖는다. 따라서, 한 실시양태에서, 항체는 서열식별번호: 18에 기재된 서열을 갖는 니볼루맙의 VH의 CDR1, CDR2, 및 CDR3 도메인, 및 서열식별번호: 19에 기재된 서열을 갖는 니볼루맙의 VL의 CDR1, CDR2 및 CDR3 도메인을 포함한다. 특정 실시양태에서, 항체는 각각 서열식별번호: 20-22에 기재된 서열을 포함하는 CDR1, CDR2 및 CDR3 도메인, 및 각각 서열식별번호: 23-25에 기재된 서열을 포함하는 CDR1, CDR2 및 CDR3 도메인을 포함한다. 특정 실시양태에서, 항체는 각각 서열식별번호: 18 및/또는 서열식별번호: 19에 기재된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함한다. 특정 실시양태에서, 항체는 서열식별번호: 18 및/또는 서열식별번호: 19와의 가변 영역 동일성이 적어도 약 90%, 예를 들어, 적어도 약 90%, 95%, 또는 99%이다.
예시적인 항-PD-L1 항체는 BMS-936559 (WO 2007/005874 및 미국 특허 번호 7,943,743에서 12A4로 지칭됨), 또는 PCT 공개 WO 07/005874 및 미국 특허 번호 7,943,743에 기재된 3G10, 12A4, 10A5, 5F8, 10H10, 1B12, 7H1, 11E6, 12B7 및 13G4의 CDR 또는 가변 영역을 포함하는 항체를 포함한다. 특정 실시양태에서, 항-PD-L1 항체는 MEDI4736 (일명 항-B7-H1), MPDL3280A (일명 RG7446), MSB0010718C (WO2013/79174), 또는 rHigM12B7이다. WO2013/173223, WO2011/066389, WO2012/145493, 미국 특허 번호 7,635,757 및 8,217,149 및 미국 공개 번호 2009/145493에 개시된 항-PD-L1 항체 중 임의의 것이 또한 사용될 수 있다.
예시적인 항-CTLA-4 항체는 예르보이™ (이필리무맙 또는 항체 10D1 - PCT 공개 WO 01/14424에 기술됨), 트레멜리무맙 (기존의 티실리무맙(ticilimumab), CP-675,206), 또는 간행물 WO 98/42752; WO 00/37504; 미국 특허 번호 6,207,156; 문헌 [Hurwitz et al. (1998) Proc. Natl. Acad. Sci. USA 95(17):10067-10071]; [Camacho et al. (2004) J. Clin. Oncology 22(145): Abstract No. 2505] (항체 CP-675206); 및 [Mokyr et al. (1998) Cancer Res. 58:5301-5304] 중 임의의 것에 기재된 항-CTLA-4 항체를 포함한다. WO2013/173223에 개시된 항-CTLA-4 항체 중 임의의 것이 또한 사용될 수 있다.
특정 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체는 이필리무맙과 조합되어 사용된다. 특정 실시양태에서, 항체는 이필리무맙의 중쇄 및 경쇄 CDR 또는 가변 영역을 갖는다. 따라서, 한 실시양태에서, 항체는 서열식별번호: 26에 기재된 서열을 갖는 이필리무맙의 VH의 CDR1, CDR2, 및 CDR3 도메인, 및 서열식별번호: 27에 기재된 서열을 갖는 이필리무맙의 VL의 CDR1, CDR2 및 CDR3 도메인을 포함한다. 특정 실시양태에서, 항체는 각각 서열식별번호: 28-30에 기재된 서열을 갖는 CDR1, CDR2 및 CDR3 도메인, 및 각각 서열식별번호: 31-33에 기재된 서열을 포함하는 CDR1, CDR2 및 CDR3 도메인을 포함한다. 특정 실시양태에서, 항체는 각각 서열식별번호: 26 및/또는 서열식별번호: 27에 기재된 아미노산 서열을 포함하는 VH 및/또는 VL 영역을 포함한다. 특정 실시양태에서, 항체는 서열식별번호: 26 또는 서열식별번호: 27에 대한 가변 영역 동일성이 적어도 약 90%, 예를 들어, 적어도 약 90%, 95%, 또는 99%이다.
예시적인 항-LAG3 항체는 미국 특허 공개 번호 US2011/0150892, WO10/19570 및 WO2014/008218에 기재된 항체 25F7, 26H10, 25E3, 8B7, 11F2 또는 17E5의 CDR 또는 가변 영역을 포함하는 항체를 포함한다. 한 실시양태에서, 항-LAG-3 항체는 BMS-986016이다. 관련 분야에서 인식되는 사용될 수 있는 다른 항-LAG-3 항체는 US 2011/007023, WO08/132601, 및 WO09/44273에 기재된 IMP731 및 IMP-321을 포함한다.
특정 실시양태에서, 본원에서 논의된 치료 항체의 조합물은 제약상 허용되는 담체 내의 단일 조성물로서 공동으로, 또는 각각의 항체가 제약상 허용되는 담체 내에 있는 별도의 조성물들로서 공동으로 투여될 수 있다. 또 다른 실시양태에서, 치료 항체의 조합물은 순차적으로 투여될 수 있다. 또한, 조합 요법의 1회 초과의 용량이 순차적으로 투여되는 경우, 순차적 투여의 순서는 각각의 투여 시점에 역전되거나 또는 동일한 순서로 유지될 수 있고, 순차적 투여는 공동 투여 또는 그의 임의의 조합과 조합될 수 있다.
특정 실시양태에서, 면역계의 자극이 이로울 수 있는 질환, 예를 들어, 암 또는 감염성 질환을 가진 대상체가 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 면역-종양학 작용제의 투여에 의해 치료된다. 예시적인 면역-종양학 작용제는 CD137 (4-1BB) 효능제 (예를 들어, 효능작용 CD137 항체 예컨대 우렐루맙 또는 PF-05082566 (WO12/32433)); GITR 효능제 (예를 들어, 효능작용 항-GITR 항체), CD40 효능제 (예를 들어, 효능작용 CD40 항체); CD40 길항제 (예를 들어, 길항작용 CD40 항체 예컨대 루카투무맙 (HCD122), 다세투주맙 (SGN-40), CP-870,893 또는 카이 롭(Chi Lob) 7/4); CD27 효능제 (예를 들어, 효능작용 CD27 항체 예컨대 바를리루맙 (CDX-1127)), MGA271 (B7H3에 대한 것) (WO11/109400)); KIR 길항제 (예를 들어, 리릴루맙); IDO 길항제 (예를 들어, INCB-024360 (WO2006/122150, WO07/75598, WO08/36653, WO08/36642), 인독시모드, NLG-919 (WO09/73620, WO09/1156652, WO11/56652, WO12/142237) 또는 F001287); 톨(Toll)-유사 수용체 효능제 (예를 들어, TLR2/4 효능제 (예를 들어, 바실루스 칼메트-게랑); TLR7 효능제 (예를 들어, 힐토놀(Hiltonol) 또는 이미퀴모드(Imiquimod)); TLR7/8 효능제 (예를 들어, 레시퀴모드(Resiquimod)); 또는 TLR9 효능제 (예를 들어, CpG7909)); 및 TGF-β 억제제 (예를 들어, GC1008, LY2157299, TEW7197, 또는 IMC-TR1)를 포함한다.
임의적으로, 단독 면역치료제로서의 면역자극 수용체에 특이적으로 결합하는 효능작용 항체, 또는 효능작용 항체 및 하나 이상의 추가적인 면역치료 항체 (예를 들어, 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 차단)의 조합물이 면역원성 작용제, 예컨대 암성 세포, 정제된 종양 항원 (재조합 단백질, 펩티드 및 탄수화물 분자 포함), 세포, 및 면역 자극 시토카인을 코딩하는 유전자로 형질감염된 세포와 추가로 조합될 수 있다 (He et al. (2004) J. Immunol. 173:4919-28). 사용될 수 있는 종양 백신의 비-제한적인 예는 흑색종 항원의 펩티드, 예컨대 gp100, MAGE 항원, Trp-2, MART1 및/또는 티로시나제의 펩티드, 또는 시토카인 GM-CSF를 발현하도록 형질감염된 종양 세포 (하기에 추가로 논의됨)를 포함한다. 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 하나 이상의 추가적인 항체 (예를 들어, CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단)의 조합물은 추가로 표준 암 치료와 조합될 수도 있다. 예를 들어, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 하나 이상의 추가적인 항체 (예를 들어, CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단)의 조합물은 화학요법 레지멘와 효과적으로 조합될 수 있다. 이러한 예에서, 조합물과 함께 투여되는 다른 화학요법 시약의 용량이 감소될 수 있다 (Mokyr et al. (1998) Cancer Research 58: 5301-5304). 예를 들어, 흑색종의 치료를 위해 이같은 조합물은 추가적인 항체 (예를 들어, 항-CTLA-4 항체 및/또는 항-PD-1 항체 및/또는 항-PD-L1 항체 및/또는 항-LAG-3 항체)의 존재 또는 부재 하에 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 추가로 데카르바진 또는 인터루킨-2 (IL-2)와 조합하여 포함할 수 있다. 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 + CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단을 화학요법과 조합하는 것의 과학적 근거는 대부분의 화학요법 화합물의 세포독성 작용의 결과인 세포 사멸이 항원 제시 경로에서 종양 항원의 수준 증가를 초래하여야 한다는 것이다. 세포 사멸을 통해 CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단의 존재 또는 부재 하에 면역자극 수용체에 특이적으로 결합하는 효능작용 항체의 조합물과의 상승작용을 초래할 수 있는 다른 조합 요법은 방사선 조사, 수술, 또는 호르몬 고갈을 포함한다. 이러한 프로토콜 각각은 숙주에서 종양 항원의 공급원을 생성시킨다. 혈관형성 억제제 또한 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단의 조합물과 조합될 수 있다. 혈관형성의 억제는 숙주 항원 제시 경로 내로 공급된 종양 항원의 공급원일 수 있는 종양 세포 사멸에 이른다.
특정 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체가 단독 면역치료제로서 사용될 수 있거나, 또는 항-OX40 항체 및 CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단 항체의 조합물이 Fcα 또는 Fcγ 수용체-발현 이펙터 세포를 종양 세포에 표적화하는 이중특이적 항체와 조합되어 사용될 수도 있다 (예를 들어, 미국 특허 번호 5,922,845 및 5,837,243 참조). 이중특이적 항체는 2개의 별도의 항원을 표적화하는데 사용될 수 있다. 이러한 반응의 T 세포 아암이 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단의 조합물을 사용하는 것에 의해 증대될 것이다.
또 다른 예에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체가 단독 면역치료제로서 이용될 수 있거나, 또는 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 추가적인 면역자극제, 예를 들어, 길항작용 항-CTLA-4 항체 및/또는 길항작용 항-PD-1 항체 및/또는 길항작용 항-PD-L1 항체 및/또는 길항작용 LAG-3 작용제 (예를 들어, 항체)의 조합물이 항-신생물 항체, 예컨대 리툭산(Rituxan)® (리툭시맙), 헤르셉틴(Herceptin)® (트라스투주맙), 벡사르(Bexxar)® (토시투모맙), 제발린(Zevalin)® (이브리투모맙), 캄파스(Campath)® (알렘투주맙), 림포사이드(Lymphocide)® (에프르투주맙), 아바스틴(Avastin)® (베바시주맙), 및 타르세바(Tarceva)® (에를로티닙) 등과 함께 사용될 수 있다. 예를 들어, 그리고 이론에 의해 제한되기를 원치 않으면셔, 항암 항체 또는 독소에 접합된 항암 항체로의 치료는 암세포 사멸 (예를 들어, 종양 세포)에 이를 수 있고, 이는 면역자극제 (예를 들어, 길항작용 CTLA-4, PD-1, PD-L1 또는 LAG-3 작용제, 예를 들어, 항체)에 의해 매개되는 면역 반응을 강화할 것이다. 예시적인 실시양태에서, 과다증식성 질환 (예를 들어, 암 종양)의 치료는 공동으로 또는 순차적으로 또는 그의 임의의 조합으로 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 임의적으로는 추가적인 면역자극제, 예를 들어, 길항작용 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 작용제 (예를 들어, 항체)와 조합된 항암제 (예를 들어, 항체)를 포함할 수 있고, 이는 숙주에 의한 항종양 면역 반응을 강화할 수 있다.
종양은 광범위한 메카니즘에 의해 숙주의 면역 감시를 피한다. 종양에 의해 발현되고 면역억제성인 단백질의 불활성화에 의해 이러한 메카니즘 중 다수가 극복될 수 있다. 이는, 특히, TGF-β (Kehrl et al. (1986) J. Exp. Med. 163: 1037-1050), IL-10 (Howard & O'Garra (1992) Immunology Today 13: 198-200), 및 Fas 리간드 (Hahne et al. (1996) Science 274: 1363-1365)를 포함한다. 면역억제제의 효과에 대항하고, 숙주에 의한 항종양 면역 반응에 유리하도록 이러한 엔티티 각각에 대한 항체를 추가적인 면역자극제, 예를 들어, 길항작용 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 작용제, 예컨대 항체의 존재 또는 부재 하에 면역자극 수용체에 특이적으로 결합하는 효능작용 항체와 추가로 조합할 수 있다.
숙주 면역 반응을 활성화하는데 사용될 수 있는 다른 작용제 (예를 들어, 항체)가 추가적인 면역자극제, 예컨대 길항작용 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 항체의 존재 또는 부재 하에 면역자극 수용체에 특이적으로 결합하는 효능작용 항체와 조합되어 추가로 사용될 수 있다. 이는 DC 기능 및 항원 제시를 활성화하는 수지상 세포의 표면 상의 분자를 포함한다. 항-CD40 항체 (상기 문헌 [Ridge et al.])가 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 임의적으로는 추가적인 면역자극제, 예를 들어, 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 작용제, 예를 들어, 항체와 조합되어 사용될 수 있다. T 세포 공동-자극에 대한 다른 활성화 항체 (상기 문헌 [Weinberg et al.], 상기 문헌 [Melero et al.], 상기 문헌 [Hutloff et al.]) 또한 증가된 수준의 T 세포 활성화를 제공할 수 있다.
상기 논의된 바와 같이, 조혈 기원의 다양한 종양을 치료하기 위해 골수 이식이 현재 사용되고 있다. 단독이거나 또는 CTLA-4 및/또는 PD-1 및/또는 PD-L1 및/또는 LAG-3 차단과 조합된 면역자극 수용체에 특이적으로 결합하는 효능작용 항체가 공여자의 생착된 종양 특이적 T 세포의 유효성을 증가시키는데 사용될 수 있다.
여러 실험적 치료 프로토콜이 종양에 대한 항원-특이적 T 세포를 위해 항원 특이적 T 세포의 생체외 활성화 및 확장 및 이러한 세포의 수용자 내로의 입양 전달을 수반한다 (상기 문헌 [Greenberg & Riddell]). 이러한 방법은 감염체 예컨대 CMV에 대한 T 세포 반응을 활성화시키는데 또한 사용될 수 있다. 추가적인 면역자극 요법, 예를 들어, 길항작용 항-CTLA-4 및/또는 항-PD-1 및/또는 항-PD-L1 및/또는 항-LAG-3 항체가 수반된 또는 수반되지 않은 면역자극 수용체에 특이적으로 결합하는 효능작용 항체의 존재 하의 생체외 활성화는 입양 전달된 T 세포의 빈도 및 활성을 증가시킬 것으로 예상될 수 있다.
본원에 기재된 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 조합 항체 항체 요법은 추가적인 치료, 예컨대 방사선 조사, 화학요법 (예를 들어, 캄프토테신 (CPT-11), 5-플루오로우라실 (5-FU), 시스플라틴, 독소루비신, 이리노테칸, 파클리탁셀, 젬시타빈, 시스플라틴, 파클리탁셀, 카르보플라틴-파클리탁셀 (탁솔(Taxol)), 독소루비신, 5-fu, 또는 캄프토테신 + apo2l/TRAIL (6X 콤보)을 사용함), 하나 이상의 프로테아솜 억제제 (예를 들어, 보르테조밉 또는 MG132), 하나 이상의 Bcl-2 억제제 (예를 들어, BH3I-2' (bcl-xl 억제제), 인돌아민 디옥시게나제-1 억제제 (예를 들어, INCB24360, 인독시모드, NLG-919, 또는 F001287), AT-101 (R-(-)-고시폴 유도체), ABT-263 (소형 분자), GX-15-070 (오바토클락스), 또는 MCL-1 (골수성 백혈병 세포 분화 단백질-1) 길항제), iAP (아폽토시스 단백질의 억제제) 길항제 (예를 들어, smac7, smac4, 소형 분자 smac 모방체, 합성 smac 펩티드 (문헌 [Fulda et al., Nat Med 2002;8:808-15] 참조), ISIS23722 (LY2181308), 또는 AEG-35156 (GEM-640)), HDAC (히스톤 데아세틸라제) 억제제, 항-CD20 항체 (예를 들어, 리툭시맙), 혈관형성 억제제 (예를 들어, 베바시주맙), VEGF 및 VEGFR을 표적화하는 항-혈관형성 작용제 (예를 들어, 아바스틴(Avastin)), 합성 트리테르페노이드 (문헌 [Hyer et al., Cancer Research 2005;65:4799-808] 참조), c-FLIP (세포성 FLICE-억제 단백질) 조정제 (예를 들어, PPARγ (퍼옥시솜 증식제-활성화 수용체 γ)의 천연 및 합성 리간드, 5809354 또는 5569100), 키나제 억제제 (예를 들어, 소라페닙(Sorafenib)), 트라스투주맙(Trastuzumab), 세툭시맙(Cetuximab), 템시롤리무스(Temsirolimus), mTOR 억제제, 예컨대 라파마이신 및 템시롤리무스, 보르테조밉(Bortezomib), JAK2 억제제, HSP90 억제제, PI3K-AKT 억제제, 레날릴도미드(Lenalildomide), GSK3β 억제제, IAP 억제제 및/또는 유전자독성 약물과 조합되어 (예를 들어, 동시에 또는 별도로) 사용될 수 있다.
본원에 기재된 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 조합 항체 요법은 추가로 하나 이상의 항-증식 세포독성제와 조합되어 사용될 수 있다. 항-증식 세포독성제로서 사용될 수 있는 화합물의 클래스는 하기를 포함하지만, 이에 제한되지 않는다:
알킬화제 (비제한적으로, 질소 머스타드, 에틸렌이민 유도체, 알킬 술포네이트, 니트로소우레아 및 트리아젠을 포함함): 우라실 머스타드, 클로르메틴, 시클로포스파미드 (시톡산(CYTOXAN)™) 포스파미드, 멜팔란, 클로람부실, 피포브로만, 트리에틸렌멜라민, 트리에틸렌티오포스포르아민, 부술판, 카르무스틴, 로무스틴, 스트렙토조신, 데카르바진, 및 테모졸로미드.
항대사물질 (비제한적으로, 엽산 길항제, 피리미딘 유사체, 퓨린 유사체 및 아데노신 데아미나제 억제제를 포함함): 메토트렉세이트, 5-플루오로우라실, 플록수리딘, 시타라빈, 6-메르캅토퓨린, 6-티오구아닌, 플루다라빈 포스페이트, 펜토스타틴, 및 젬시타빈.
항증식제: 관련 분야에 공지되어 있는 다른 마이크로튜불린 안정화제에 더하여, 탁산, 파클리탁셀 (파클리탁셀은 탁솔(TAXOL)™로서 상업적으로 입수가능함), 도세탁셀, 디스코데르몰리드 (DDM), 딕티오스타틴 (DCT), 펠로루시드(Peloruside) A, 에포틸론, 에포틸론 A, 에포틸론 B, 에포틸론 C, 에포틸론 D, 에포틸론 E, 에포틸론 F, 푸라노에포틸론 D, 데스옥시에포틸론 Bl, [17]-데히드로데스옥시에포틸론 B, [18]데히드로데스옥시에포틸론 B, C12,13-시클로프로필-에포틸론 A, C6-C8 가교 에포틸론 A, 트랜스-9,10-데히드로에포틸론 D, 시스-9,10-데히드로에포틸론 D, 16-데스메틸에포틸론 B, 에포틸론 B10, 디스코데로몰리드, 파투필론 (EPO-906), KOS-862, KOS-1584, ZK-EPO, ABJ-789, XAA296A (디스코데르몰리드(Discodermolide)), TZT-1027 (소블리도틴), ILX-651 (타시도틴 히드로클로라이드), 할리콘드린(Halichondrin) B, 에리불린(Eribulin) 메실레이트 (E-7389), 헤미아스테를린(Hemiasterlin) (HTI-286), E-7974, 크립토피신(Cyrptophycin), LY-355703, 메이탄시노이드(Maytansinoid) 면역접합체 (DM-1), MKC-1, ABT-751, T1-38067, T-900607, SB-715992 (이스피네십), SB-743921, MK-0731, STA-5312, 엘레우테로빈, 17베타-아세톡시-2-에톡시-6-옥소-B-호모-에스트라-1,3,5(10)-트리엔-3-올, 시클로스트렙틴, 이소라울리말리드, 라울리말리드, 4-에피-7-데히드록시-14,16-디데메틸-(+)-디스코데르몰리드, 및 크립토틸론 1을 비제한적으로 포함함.
면역자극 수용체에 특이적으로 결합하는 효능작용 항체로의 치료와 함께 또는 이러한 치료 전에, 비정상적으로 증식성인 세포를 휴지기로 만드는 것이 바람직한 경우에, 호르몬 및 스테로이드 (합성 유사체 포함), 예컨대 17a-에티닐에스트라디올, 디에틸스틸베스트롤, 테스토스테론, 프레드니손, 플루옥시메스테론, 드로모스타놀론 프로피오네이트, 테스토락톤, 메게스트롤아세테이트, 메틸프레드니솔론, 메틸-테스토스테론, 프레드니솔론, 트리암시놀론, 클로로트리아니센, 히드록시프로게스테론, 아미노글루테티미드, 에스트라무스틴, 메드록시프로게스테론아세테이트, 류프롤리드, 플루타미드, 테레미펜, 졸라덱스(ZOLADEX)™를 환자에게 투여할 수도 있다. 본원에 기재된 방법 또는 조성물을 이용할 때, 임상 환경에서 종양 성장 또는 전이의 조정에서 사용되는 다른 작용제, 예컨대 항-모방체를 원하는대로 투여할 수도 있다.
특정 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 (예를 들어, 항-OX40 항체 예컨대 OX40.21)는 암, 예를 들어, 결장직장암 또는 방광암을 가진 환자를 치료하기 위해 니볼루맙과 조합되어 (공동으로 또는 별도로) 투여된다.
특정 실시양태에서, 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 (예를 들어, 항-OX40 항체 예컨대 OX40.21)는 암, 예를 들어, 난소암, 방광암 또는 전립선암을 가진 환자를 치료하기 위해 이필리무맙과 조합되어 (공동으로 또는 별도로) 투여된다.
화학요법제의 안전하고 효과적인 투여를 위한 방법이 관련 분야의 기술자에게 공지되어 있다. 추가적으로, 이들의 투여가 표준 문헌에 기재되어 있다. 예를 들어, 다수의 화학요법제의 투여가 문헌 [Physicians' Desk Reference (PDR), (Medical Economics Company, Montvale, N.J. 07645-1742, USA)], 예를 들어, 1996판에 기재되어 있으며; 그의 개시내용은 본원에 참조로 포함된다.
화학요법제(들) 및/또는 방사선 요법은 관련 분야에 널리 공지되어 있는 치료 프로토콜에 따라 투여될 수 있다. 화학요법제(들) 및/또는 방사선 요법의 투여가 치료 중인 질환 및 이러한 질환에 대한 화학요법제(들) 및/또는 방사선 요법의 공지된 효과에 따라 변할 수 있다는 것이 관련된 분야의 기술자에게 명백할 것이다. 또한, 숙련된 실무자의 지식에 따라, 치료 프로토콜 (예를 들어, 투여량의 양 및 투여 시간)이 환자 상에서의 투여된 치료제의 관찰된 효과의 관점에서, 그리고 투여된 치료제에 대한 질환의 관찰된 반응의 관점에서 변할 수 있다.
II. 면역자극 수용체에 결합하는 효능작용 항체
본원에 기재된 방법 (조합 요법 포함)에서 사용하기에 적절한 면역자극 수용체에 결합하는 효능작용 항체는 새롭게 개발된 효능작용 항체, 뿐만 아니라 관련 분야에 공지되어 있는 효능작용 항체 (이러한 항체와 경쟁하거나 또는 이와 동일한 에피토프에 결합하는 항체 포함)를 포함한다. 면역자극 수용체를 표적화하는 새로운 효능작용 항체를 표준 항체 생산 및 스크리닝 기술을 사용하여 수득할 수 있고, 관련 분야에서 인정되는 검정을 사용하여 효능제 활성에 대해 테스트할 수 있다.
특정 실시양태에서,본원에 기재된 방법에서 사용하기 위한 적절한 효능작용 항체는 면역자극 수용체에 결합하여 면역자극 수용체 및 그의 하류 신호전달 경로(들)를 활성화시키고, 이에 의해 면역 반응을 자극한다. 일부 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 면역자극 수용체에 결합하는 효능작용 항체는 항체의 포화-근접 또는 포화 농도 (예를 들어, >80% RO를 초래하는 농도)가 기능적인 시험관내 (예를 들어, 시토카인 생산, 증식 검정, 수용체의 표면 발현) 및/또는 생체내 검정 (예를 들어, 항종양 효능)에서 80%-미만 RO를 초래하는 농도에 비교하여 효능 감소를 초래하는 "후크 효과"를 나타낸다.
일부 실시양태에서, 효능작용 항체는 공동-자극 수용체, 예를 들어, 종양 괴사 인자 수용체 수퍼패밀리 (TNFRSF)의 구성원, ICOS (CD278), CD28, LIGHT, CD40L, TIM1, SLAM, CD1, CD2, CD226, LFA-1 (CD11A, CD18), CD5, CD7, CD30, CD54, CD97, CD154, CD160, LIGHT, NKG2C, SLAMF7, NKp80, 및 TGF-β로 이루어진 군으로부터 선택된 공동-자극 수용체에 결합한다. 일부 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 공동-자극 수용체에 결합하는 효능작용 항체는 "후크 효과"를 나타낸다.
일부 실시양태에서, 효능작용 항체는 TNFRSF의 구성원, 예를 들어, TNFR1, TNFR2, HVEM, LTβR, OX40 (CD134/TNFRSF4), CD27 (TNFRSF7), CD40, FAS, DCR3, CD30, 4-1BB, TRAILR1, TRAILR2, TRAILR3, TRAILR4, OPG, RANK, FN14, TACI, BAFFR, BCMA, GITR, TROY, DR3 (사멸 수용체 3), DR6 (사멸 수용체 6), XEDAR (엑토디스플라신 A2 수용체), 및 NGFR로 이루어진 군으로부터 선택된 수용체에 결합한다. 일부 실시양태에서, 본원에 기재된 방법에서 사용하기 위한 TNFRSF의 구성원에 결합하는 효능작용 항체는 "후크 효과"를 나타낸다.
일부 실시양태에서, OX40에 특이적으로 결합하는 효능작용 항체, 예를 들어, 효능작용 항-OX40 항체는 "후크 효과"를 나타낸다. 예시적인 효능작용 항-OX40 항체는 MEDI6469, MEDI0562, PF-04518600, MOXR0916, GSK3174998, RG-7888 (본레롤리주맙), INCAGN-1949, 및 WO2016/196228 (예를 들어, OX40.21); WO/1995/012673; WO199942585; WO/2014/148895; WO15153513; WO15153514; WO/2013/038191; WO2016057667; WO03106498; WO12027328; WO13028231; WO2016200836; WO 17063162; WO17134292; WO 17096179; WO 17096281; WO 17096182 (각각의 내용은 전문이 본원에 참조로 포함됨)에 기재된 항체이다. 일부 실시양태에서, 효능작용 항-OX40 항체는 하기 특성을 나타낸다:
(a) 막-결합 인간 OX40에 결합하고, 예를 들어, FACS에 의해 측정 시, 예를 들어, 1 nM 이하 (예를 들어, 0.01 nM 내지 1 nM)의 EC50으로 결합함;
(b) 시노몰구스 OX40에 결합하고, 예를 들어, FACS에 의해 측정 시, 예를 들어, 10 nM 이하 (예를 들어, 0.01 nM 내지 10 nM)의 EC50으로 막-결합 시노몰구스 OX40에 결합함;
(c) 가용성 인간 OX40에 결합하고, 예를 들어, BIACORE® SPR 분석에 의해 측정 시, 예를 들어, 10 nM 이하 (예를 들어, 0.01 nM 내지 10 nM)의 KD로 결합함;
(d) (i) OX40-발현 T 세포에서의 IL-2 및/또는 IFN-γ 생산 증가 및/또는 (ii) 증진된 T 세포 증식에 의해 증명되는 바와 같이, T 세포 활성화를 유도하거나 또는 증진시킴; 및
(e) OX40 리간드가 OX40에 결합하는 것을 억제하고, 예를 들어, hOX40-293 세포로의 검정에서, 예를 들어, FACS에 의해 측정 시 1 nM 이하의 EC50으로 억제함.
일부 실시양태에서, 효능작용 항-OX40 항체는 Fc 수용체, 예를 들어, Fcγ 수용체에 결합한다.
일부 실시양태에서, 효능작용 항-OX40 항체는 다가 가교를 통해 T 세포 활성화를 유도하거나 또는 증진시킨다.
일부 실시양태에서, 효능작용 항-OX40 항체는, 예를 들어, 종양에서, 예를 들어, Teff 세포를 활성화시킴으로써, Treg 세포에 의한 T-이펙터 세포의 억제를 제한함으로써, 종양 Treg 세포를 고갈시키고/거나 억제함으로써, 및/또는 NK 세포를 활성화시킴으로써, 면역 반응을 자극하거나 또는 증진시킬 수 있다. 예를 들어, 효능작용 항-OX40 항체는, 예를 들어, 증진된 시토카인 (예를 들어, IL-2 및 IFN-γ) 분비 및/또는 증진된 증식에 의해 증명되는 바와 같이 Teff 세포를 활성화시키거나 또는 공동-자극할 수 있다. 특정 실시양태에서, 효능작용 항-OX40 항체는, 예를 들어, 1차 인간 T 세포 또는 인간 OX40을 발현하는 T 세포 상에서 측정 시, IL-2 분비를 50%, 100% (즉, 2배), 3배, 4배, 5배 이상의 인자만큼, 임의적으로는 10배, 30배, 100배 이하의 최대값으로 증가시킨다. 특정 실시양태에서, 효능작용 항-OX40 항체는, 예를 들어, 1차 인간 T 세포 또는 인간 OX40을 발현하는 T 세포 상에서 측정 시, IFN-γ 분비를 50%, 100% (즉, 2배), 3배, 4배, 5배 이상의 인자만큼, 임의적으로는 10배, 30배, 100배 이하의 최대값으로 증가시킨다.
일부 실시양태에서, 효능작용 항-OX40 항체는 인간 보체의 C1q 성분에 결합한다. 일부 실시양태에서, 효능작용 항-OX40 항체는 활성화된 CD4+ T 세포의 NK 세포-매개 용해를 유도한다. 일부 실시양태에서, 효능작용 항-OX40 항체는 OX40 발현 세포의 대식세포-매개 포식작용을 촉진한다. 일부 실시양태에서, 효능작용 항-OX40 항체는 CD4+ T 세포 증식의 조절 T 세포-매개 억제를 억제한다.
일부 실시양태에서, 효능작용 항-OX40 항체는 인간 및 시노몰구스 OX40 둘 다에 결합한다.
일부 실시양태에서, 효능작용 항-OX40 항체는 인간 OX40 내의 서열 DVVSSKPCKPCTWCNLR (서열식별번호: 15) 전체 또는 그의 일부분에 결합한다.
특정 실시양태에서, 본원에 기재된 방법에서 사용되는 효능작용 항-OX40 항체는 OX40.21이다. OX40.21의 중쇄 및 경쇄 서열, 가변 영역 서열, 및 CDR 서열이 하기에서 제공된다.
표 2. OX40.21 서열의 요약
따라서, 일부 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 11 및 12의 가변 중쇄 및 가변 경쇄 내에 있는 3개의 가변 중쇄 CDR 및 3개의 가변 경쇄 CDR을 포함한다.
일부 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 5-7을 포함하는 중쇄 CDR1, CDR2, 및 CDR3 서열, 및/또는 각각 서열식별번호: 8-10을 포함하는 경쇄 CDR1, CDR2, 및 CDR3 서열을 포함한다.
일부 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 5-7로 이루어지는 중쇄 CDR1, CDR2, 및 CDR3 서열, 및/또는 각각 서열식별번호: 8-10로 이루어지는 경쇄 CDR1, CDR2, 및 CDR3 서열을 포함한다.
일부 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 11 및 12에 기재된 중쇄 및 경쇄 가변 영역 서열을 포함한다.
일부 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 13 및 14에 기재된 중쇄 및 경쇄 서열을 포함한다.
면역자극 수용체에 결합하는 예시적인 효능작용 항체는 항-4-1BB 항체 (예를 들어, 우렐루맙 (BMS-663513) 및 PF-05082566), 항-GITR 항체 (예를 들어, TRX518, MK-4166, MK-1248, GWN323, 및 WO2017087678 (이의 내용은 전문이 본원에 참고로 포함됨)에 개시된 항체), 항-CD27 항체 (예를 들어, 바를리루맙 (CDX-1127)), 항-ICOS 항체 (예를 들어, MEDI-570, GSK3359609, JTX-2011), 항-DR3 항체 (예를 들어, PTX-25), 및 항-CD40 항체 (예를 들어, CP-870,893, 다세투주맙, 카이 롭 7/4, 루카투무맙, APX005M, ADC-1013, JNJ-64457107, SEA-CD40), 뿐만 아니라 이러한 항체와 경쟁하고/거나 이러한 항체와 동일한 에피토프에 결합하는 항체를 포함한다.
바람직하게는, 효능작용 항체는 면역자극 수용체에 높은 친화도로, 예를 들어, 10-7 M 이하, 10-8 M 이하, 10-9 M 이하, 10-10 M 이하, 10-11 M 이하, 10-12 M 이하, 10-12 M 내지 10-7 M, 10-11 M 내지 10-7 M, 10-10 M 내지 10-7 M, 또는 10-9 M 내지 10-7 M의 KD로 결합한다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 IgG1, IgG2, IgG3, IgG4, 또는 그의 변이체로 이루어진 군으로부터 선택된 항체이다. 특정 실시양태에서, 항체는 IgG1 항-OX40 항체, 예를 들어, OX40.21이다.
특정 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 항체의 특성을 변경시키는 변형된 중쇄 불변 영역을 포함한다. 예를 들어, 효능작용 항체는 변형되지 않은 중쇄 불변 영역이 있는 항체에 비교하여 항체의 활성을 변경시키는 변형된 중쇄 불변 영역을 포함할수 있다. 따라서, 일부 실시양태에서, 효능작용 항체는 이펙터 기능을 증진시키는 중쇄 불변 영역 내의 변형이 있다. 다른 실시양태에서, 효능작용 항체는 이펙터 기능을 감소시키는 중쇄 불변 영역 내의 변형이 있다. 예를 들어, (a) 항체-의존적 세포-매개 세포독성 (ADCC)을 증가 또는 감소시키고/거나, (b) 보체 매개 세포독성 (CDC)을 증가 또는 감소시키고/거나, (c) C1q에 대한 친화도를 증가 또는 감소시키고/거나, (d) 모체 Fc에 비교하여 Fc 수용체에 대한 친화도를 증가 또는 감소시키고/시키기 위해, Fc 영역에서의 변형이 이루어질 수 있다. 이러한 특색이 있는 변이체 Fc 영역을 생성시키도록 이루어질 수 있는 구체적인 변형 (예를 들어, 아미노산 치환(들))이 관련 분야에 널리 공지되어 있고, 예를 들어, WO2016/196228에 요약되어 있다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 인간, 인간화, 또는 키메라 항체이다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 이중특이적 항체이다.
일부 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 검출가능한 표지 (예를 들어, 방사성 동위원소, 형광 표지, 효소 및 다른 적절한 항체 태그) 또는 항암제 (예를 들어, 항-대사산물, 알킬화제, DNA 마이너 그루브 결합제, DNA 인터칼레이터, DNA 가교제, 히스톤 데아세틸라제 억제제, 핵 외수송 억제제, 프로테아솜 억제제, 토포이소머라제 I 또는 II 억제제, 열 충격 단백질 억제제, 티로신 키나제 억제제, 항생제, 및 항-유사분열제)와 같은 모이어티에 접합된 면역접합체이다. 일부 실시양태에서, 면역접합체는 항체-약물 접합체 (ADC)이다.
III. 조성물
본원에 기재된 방법에서 사용하기 위한, 제약상 허용되는 담체와 함께 제형된 면역자극 수용체 (예를 들어, OX40)에 결합하는 효능작용 항체를 함유하는 조성물, 예를 들어, 제약 조성물이 본원에서 또한 제공된다.
본원에 기재된 제약 조성물은 단독요법으로서, 또는 조합 요법, 예를 들어, 본원에 기재된 조합 요법으로서 투여될 수 있다. 예를 들어, 조합 요법은 적어도 하나의 다른 항암 및/또는 T-세포 자극 (예를 들어, 활성화) 작용제와 조합된 면역자극 수용체에 결합하는 효능작용 항체의 투여를 포함할 수 있다. 조합 요법에서 사용될 수 있는 치료제의 예는 상기에 상세하게 기재되어 있다.
본원에서 사용된 바와 같이, "제약상 허용되는 담체"는 생리학적으로 상용성인 임의의 모든 용매, 분산 매질, 코팅, 항균 및 항진균 작용제, 등장성 및 흡수 지연 작용제 등을 포함한다. 바람직하게는, 담체는 정맥내, 근육내, 피하, 비경구, 척수 또는 표피 투여 (예를 들어, 주사 또는 주입에 의한 투여)에 적절하다. 투여 경로에 따라, 활성 화합물, 즉, 항체, 면역접합체, 또는 이중특이적 분자는 화합물을 불활성화시킬 수 있는 산 및 다른 천연 조건의 작용으로부터 화합물을 보호하는 물질 내에 코팅될 수 있다.
본원에 기재된 제약 조성물은 하나 이상의 제약상 허용되는 염을 포함할 수 있다. "제약상 허용되는 염"은 모체 화합물의 원하는 생물학적 활성을 유지하고 어떠한 원치 않는 독성학적 효과도 부여하지 않는 염을 지칭한다 (예를 들어, 문헌 [Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19] 참조). 이같은 염의 예는 산 부가염 및 염기 부가염을 포함한다. 산 부가염은 비독성 무기 산, 예컨대 염산, 질산, 인산, 황산, 브로민화수소산, 아이오딘화수소산, 아인산 등으로부터 유래된 것, 뿐만 아니라 비독성 유기 산 예컨대 지방족 모노- 및 디카르복실산, 페닐-치환 알칸산, 히드록시 알칸산, 방향족 산, 지방족 및 방향족 술폰산 등으로부터 유래된 것을 포함한다. 염기 부가염은 알칼리 토금속, 예컨대 나트륨, 칼륨, 마그네슘, 칼슘 등으로부터 유래된 것, 뿐만 아니라 비독성 유기 아민, 예컨대 N,N'-디벤질에틸렌디아민, N-메틸글루카민, 클로로프로카인, 콜린, 디에탄올아민, 에틸렌디아민, 프로카인 등으로부터 유래된 것을 포함한다.
본원에 기재된 제약 조성물은 제약상 허용되는 항산화제를 또한 포함할 수 있다. 제약상 허용되는 항산화제의 예는 (1) 수용성 항산화제, 예컨대 아스코르브산, 시스테인 히드로클로라이드, 중황산나트륨, 메타중아황산나트륨, 아황산나트륨 등; (2) 유용성 항산화제, 예컨대 아스코르빌 팔미테이트, 부틸화 히드록시아니솔 (BHA), 부틸화 히드록시톨루엔 (BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등; 및 (3) 금속 킬레이팅제, 예컨대 시트르산, 에틸렌디아민 테트라아세트산 (EDTA), 소르비톨, 타르타르산, 인산 등을 포함한다.
본원에 기재된 제약 조성물에 사용될 수 있는 적절한 수성 및 비수성 담체의 예는 물, 에탄올, 폴리올 (예컨대, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 및 그의 적절한 혼합물, 식물성 오일, 예컨대 올리브 오일, 및 주사가능한 유기 에스테르, 예컨대 에틸 올레에이트를 포함한다. 예를 들어, 코팅 물질, 예컨대 레시틴의 사용, 분산액의 경우에는 요구되는 입자 크기의 유지, 및 계면활성제의 사용에 의해, 적합한 유동성이 유지될 수 있다.
이러한 조성물은 또한 아주반트 예컨대 보존제, 습윤화제, 유화제 및 분산제를 함유할 수 있다. 상기의 멸균 절차, 및 다양한 항균 및 항진균 작용제, 예를 들어 파라벤, 클로로부탄올, 페놀 소르브산 등을 포함시키는 것 둘 다에 의해 미생물 존재의 방지가 보장될 수 있다. 등장성 작용제, 예컨대 당, 염화나트륨 등을 조성물 내에 포함하는 것이 또한 바람직할 수 있다. 추가적으로, 흡수를 지연시키는 작용제 예컨대 알루미늄 모노스테아레이트 및 젤라틴을 포함함으로써, 주사가능한 제약 형태의 장기간의 흡수가 달성될 수 있다.
제약상 허용되는 담체는 무균성 수용액 또는 분산액, 및 무균성 주사가능 용액 또는 분산액의 즉석 제조를 위한 무균성 분말을 포함한다. 제약상 활성인 물질을 위해 이같은 매질 및 작용제를 사용하는 것이 관련 분야에 공지되어 있다. 임의의 통상적인 매질 또는 작용제가 활성 화합물과 비-상용성인 경우를 제외하고, 본원에 술된 제약 조성물에서의 그의 사용이 구상된다. 제약 조성물은 보존제를 포함할 수 있거나 또는 보존제가 없을 수 있다. 보충 활성 화합물이 조성물 내로 혼입될 수 있다.
전형적으로 치료 조성물은 제작 및 보관 조건 하에 무균성이고 안정적이어야 한다. 조성물은 용액, 마이크로에멀션, 리포솜, 또는 높은 약물 농도에 적절한 다른 정렬된 구조물로서 제형될 수 있다. 담체는 물, 에탄올, 폴리올 (예를 들어, 글리세롤, 프로필렌 글리콜, 및 액체 폴리에틸렌 글리콜 등), 및 그의 적절한 혼합물을 예를 들어 함유하는 용매 또는 분산 매질일 수 있다. 예를 들어, 코팅 예컨대 레시틴의 사용, 분산액의 경우에는 요구되는 입자 크기의 유지, 및 계면활성제의 사용에 의해, 적합한 유동성이 유지될 수 있다. 다수의 경우에, 등장성 작용제, 예를 들어, 당, 폴리알콜 예컨대 만니톨, 소르비톨, 또는 염화나트륨을 조성물 내에 포함하는 것이 바람직할 것이다. 흡수를 지연시키는 작용제, 예를 들어 모노스테아레이트 염 및 젤라틴을 조성물에 포함함으로써, 주사가능한 조성물의 장기간의 흡수가 달성될 수 있다.
필요에 따라 상기 열거된 성분 중 하나 또는 그의 조합물과 함께, 필요한 양의 활성 화합물을 적합한 용매 내에 혼입시킨 후의 멸균 미세여과에 의해 무균성 주사가능 용액을 제조할 수 있다. 일반적으로, 기본 분산 매질 및 본원에 열거된 것으로부터의 필요한 다른 성분을 함유하는 무균성 비히클 내로 활성 화합물을 혼입함으로써 분산액이 제조된다. 무균성 주사가능 용액의 제조를 위한 무균성 분말의 경우, 바람직한 제조 방법은 활성 성분 + 임의의 추가적인 원하는 성분의 분말이 그의 이전에 멸균-여과된 용액으로부터 산출되는 진공 건조 및 냉동-건조 (동결건조)이다.
단일 투여량 형태를 생산하기 위해 담체 물질과 조합될 수 있는 활성 성분의 양은 치료 중인 대상체, 및 특정한 투여 방식에 좌우될 것이다. 일반적으로, 단일 투여량 형태를 생산하기 위해 담체 물질과 조합될 수 있는 활성 성분의 양은 치료 효과를 생성하는 조성물의 양일 것이다. 일반적으로, 100 퍼센트 중에서, 이러한 양은 제약상 허용되는 담체와 조합된 약 0.01 퍼센트 내지 약 99퍼센트의 활성 성분, 바람직하게는 약 0.1 퍼센트 내지 약 70 퍼센트, 가장 바람직하게는 약 1 퍼센트 내지 약 30 퍼센트의 활성 성분의 범위일 것이다.
투여량 레지멘은 최적의 원하는 반응 (예를 들어, 치료 반응)을 제공하도록 조정된다. 예를 들어, 단일 볼루스가 투여될 수 있거나, 여러 분할 용량이 경시적으로 투여될 수 있거나, 또는 용량이 치료 상황의 긴급성에 의해 지시되는 바와 같이 비례적으로 감소 또는 증가될 수 있다. 투여의 용이성 및 투여량의 균일성을 위해 비경구 조성물을 투여량 단위 형태로 제형하는 것이 특히 유리하다. 본원에 사용된 바와 같은 투여량 단위 형태는 치료될 대상체에 대한 단일 투여량으로서 적합한 물리적으로 이산된 단위를 지칭하며, 각각의 단위는 필요한 제약 담체와 함께 원하는 치료 효과를 생성하도록 계산된 미리 정해진 양의 활성 화합물을 함유한다. 본원에 기재된 투여량 단위 형태에 대한 상세사항은 (a) 활성 화합물의 독특한 특징 및 달성하려는 특정한 치료 효과, 및 (b) 개체에서의 감수성의 치료를 위해 이같은 활성 화합물을 배합하는 분야에 고유한 제한사항에 의해 지시되고, 이에 직접적으로 의존적이다. 면역자극 수용체에 결합하는 효능작용 항체 (예를 들어, 항-OX40 항체)의 적절한 투여량이 본원에 기재된 방법을 사용하여 결정될 수 있다.
항-OX40 항체 (예를 들어, OX40.21)의 투여의 경우, 투여량은 약 0.0001 내지 100 mg/kg, 약 0.01 내지 10 mg/kg, 약 0.01 내지 5 mg/kg, 약 0.1 내지 1 mg/kg, 약 0.1 내지 0.5 mg/kg, 또는 약 0.5 내지 0.8 mg/kg 숙주 체중의 범위이다. 예를 들어, 투여량은 0.2 mg/kg 체중, 0.3 mg/kg 체중, 0.5 mg/kg 체중, 1 mg/kg 체중, 3 mg/kg 체중, 5 mg/kg 체중 또는 10 mg/kg 체중, 또는 1-10 mg/kg의 범위 내일 수 있다. 특정 실시양태에서, 투여량은 0.2 mg/kg이다. 일부 실시양태에서, 투여량은 0.25 mg/kg이다. 다른 실시양태에서, 투여량은 0.5 mg/kg이다.
특정 실시양태에서, 항-OX40 항체 및 항-PD-1 또는 항-CTLA-4 항체로의 조합 치료의 경우, 항체는 고정 용량으로 투여될 수 있다. 따라서, 일부 실시양태에서, 항-OX40 항체는 약 25 내지 약 320 mg, 예를 들어, 약 25 내지 약 160 mg, 약 25 내지 약 80 mg, 약 25 내지 약 40 mg, 약 40 내지 약 320 mg, 약 40 내지 약 160 mg, 약 40 내지 약 80 mg, 약 80 내지 약 320 mg, 약 30 내지 약 160 mg, 또는 약 160 내지 약 320 mg의 고정 용량으로 투여된다. 한 실시양태에서, 항-OX40 항체는 20 mg 또는 약 20 mg의 용량으로 투여된다. 또 다른 실시양태에서, 항-OX40 항체는 40 mg 또는 약 40 mg의 용량으로 투여된다. 또 다른 실시양태에서, 항-OX40 항체는 80 mg 또는 약 80 mg의 용량으로 투여된다. 또 다른 실시양태에서, 항-OX40 항체는 160 mg 또는 약 160 mg의 용량으로 투여된다. 또 다른 실시양태에서, 항-OX40 항체는 320 mg 또는 약 320 mg의 용량으로 투여된다. 예시적인 치료 레지멘은 1주에 한 번, 2주에 한 번, 3주에 한 번, 4주에 한 번, 1개월에 한 번, 3개월에 한 번, 4개월에 한 번, 또는 3 내지 6개월에 한 번의 투여를 수반한다.
일부 실시양태에서, 항-PD-1 항체는 약 100 내지 300 mg의 고정 용량으로 투여된다. 예를 들어, 면역-종양학 작용제의 투여량은 240 mg 또는 약 240 mg, 360 mg 또는 약 360 mg, 또는 480 mg 또는 약 480 mg일 수 있다. 특정 실시양태에서, 항-PD1 항체의 용량은 약 0.0001 내지 100 mg/kg, 더욱 일반적으로는0.01 내지 5 mg/kg 숙주 체중의 범위이다. 예를 들어 투여량은 0.3 mg/kg 체중 또는 약 0.3 mg/kg 체중, 1 mg/kg 체중 또는 약 1 mg/kg 체중, 3 mg/kg 체중 또는 약 3 mg/kg 체중, 5 mg/kg 체중 또는 약 5 mg/kg 체중, 또는 10 mg/kg 체중 또는 약 10 mg/kg 체중, 또는 1-10 mg/kg의 범위 내일 수 있다. 일부 실시양태에서, 항-PD-1 항체의 투여량은 2주에 한 번 (Q2W)으로 투여되는 240 mg 또는 약 240 mg이다. 이러한 투여량은 더 긴 기간 또는 더 짧은 기간에 대해 비례적으로 (주당 120 mg으로) 조정될 수 있고, 예를 들어, 3주에 한 번 (Q3W)으로 투여되는 360 mg 또는 4주에 한 번 (Q4W)으로 투여되는 480 mg이다.
일부 실시양태에서, 항-OX40 항체 및 항-PD-1 항체로의 조합 치료의 경우, 항체는 고정 용량으로 투여될 수 있다. 한 실시양태에서, 항-OX40 및 항-PD-1 항체는 적어도 1회의 투여 사이클에 대해 투여되고, 여기서 사이클은 12주의 기간이고, 적어도 1회의 사이클 각각에 대해, 적어도 1회의 용량의 항-OX40 항체가 약 1, 3, 10, 20, 40, 50, 80, 100, 130, 150, 180, 200, 240 또는 280 mg의 고정 용량으로 투여되고, 적어도 3회의 용량의 항-PD-1 항체가 약 50, 80, 100, 120, 150, 180, 200, 240, 480, 720, 또는 960 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 20, 40, 또는 80 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 20 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480 mg의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 40 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480의 고정 용량으로 투여된다. 한 실시양태에서, 적어도 1회의 사이클 각각에 대해, 1회 용량의 항-OX40 항체가 약 80 mg의 고정 용량으로 투여되고, 3회 용량의 항-PD-1 항체가 약 480의 고정 용량으로 투여된다. 한 실시양태에서, 항-PD-1 항체는 각각의 사이클의 제1일, 제29일 및 제57일에 투여된다. 한 실시양태에서, 항-OX40 항체는 각각의 사이클의 제1일에 투여된다. 한 실시양태에서, 항-PD-1 항체는 각각의 사이클의 제1일, 제29일 및 제57일에 투여되고, 항-OX40 항체는 각각의 사이클의 제1일에 투여된다. 한 실시양태에서, 필요하다면, 12주 투여 사이클이 반복될 수 있다. 한 실시양태에서, 투여는 9회 이하의 사이클로 이루어진다. 한 실시양태에서, 투여는 1, 2, 3, 4, 5, 6, 7, 8, 또는 9회의 사이클로 이루어진다. 한 실시양태에서, 항-OX40 항체는 각각 서열식별번호: 5-7을 포함하는 중쇄 CDR1, CDR2, 및 CDR3 서열, 및 각각 서열식별번호: 8-10을 포함하는 경쇄 CDR1, CDR2, 및 CDR3 서열을 포함한다. 한 실시양태에서, OX-40 항체는 OX40.21을 포함한다. 한 실시양태에서, 항-PD-1 항체는 니볼루맙을 포함한다.
일부 실시양태에서, 항-CTLA-4 항체는 약 0.1 mg/kg 내지 약 10 mg/kg의 용량으로 투여된다. 예를 들어, 투여량은 1 mg/kg 또는 약 1 mg/kg 또는 3 mg/kg 또는 약 3 mg/kg 숙주 체중일 수 있다.
특정 실시양태에서, 동일한 날에 투여되는 경우, 항-OX40 항체는 항-PD-1 또는 항-CTLA-4 항체 전에 투여된다. 특정 실시양태에서, 동일한 날에 투여되는 경우, 항-OX40 항체는 항-PD-1 또는 항-CTLA-4 항체 후에 투여된다. 특정 실시양태에서, 동일한 날에 투여되는 경우, 항-OX40 항체는 항-PD-1 또는 항-CTLA-4 항체와 동시에 투여된다.
일부 경우에, 투여되는 각각의 항체의 투여량이 상기 범위 내에 속하도록, 결합 특이성이 상이한 2개 이상의 모노클로날 항체가 동시에 투여된다. 추가적으로, 항체는 일반적으로 여러 번 투여된다. 단일 투여량 사이의 간격은, 예를 들어, 매주, 매월, 3개월마다, 또는 매년일 수 있다. 환자 내의 표적 항원에 대한 항체의 혈액 수준을 측정함으로써 지시되는 바와 같이, 간격이 불규칙할 수도 있다. 일부 방법에서, 투여량은 약 1-1000 μg/ml의 항체 농도를 달성하도록 조정되고, 일부 방법에서는 약 25-300 μg/ml이다.
항체는 지속 방출 제형으로서 투여될 수 있고, 이러한 경우 덜 빈번한 투여가 요구된다. 투여량 및 빈도는 환자에서의 항체의 반감기에 따라 변한다. 일반적으로, 인간 항체가 가장 긴 반감기를 나타내고, 인간화 항체, 키메라 항체 및 비-인간 항체가 뒤를 잇는다. 투여량 및 투여 빈도는 치료가 예방적인지 또는 치료적인지 여부에 따라 변할 수 있다. 예방 용도에서는, 비교적 낮은 투여량이 비교적 덜 빈번한 간격으로 장기간에 걸쳐 투여된다. 일부 환자는 남은 생애 동안 계속 치료를 받는다. 치료 용도에서는, 질환 진행이 감소되거나 또는 종결될 때까지, 바람직하게는 환자가 질환 증상의 부분적 또는 완전한 호전을 나타낼 때까지, 비교적 짧은 간격의 비교적 높은 투여량이 때대로 요구된다. 그 후, 환자에게 예방 레지멘이 투여될 수 있다.
본원에 기재된 제약 조성물 내의 활성 성분의 실제 투여량 수준은 환자에게 독성이지 않으면서 특정 환자, 조성물 및 투여 방식에 대해 원하는 치료 반응을 달성하는데 효과적인 활성 성분의 양을 수득하도록 변할 수 있다. 선택된 투여량 수준은 사용된 본원에 기재된 특정 조성물, 또는 그의 에스테르, 염 또는 아미드의 활성, 투여 경로, 투여 시간, 사용 중인 특정 화합물의 배출 속도, 치료의 지속기간, 사용된 특정 조성물과 조합되어 사용되는 다른 약물, 화합물 및/또는 물질, 치료 중인 환자의 연령, 성별, 체중, 상태, 전반적인 건강 및 이전의 병력, 및 의학 분야에 널리 공지되어 있는 유사한 요인을 포함하는 다양한 약동학 인자에 좌우될 것이다.
본원에 기재된 항체의 "치료적 유효 투여량"은 바람직하게는 질환 상태의 중증도의 감소, 질환 증상이 없는 기간의 빈도 및 지속기간의 증가, 또는 질환 고통으로 인한 장애 또는 곤란의 방지를 초래한다. 암의 맥락에서, 치료적 유효 용량은 바람직하게는 생존 증가, 및/또는 암과 연관된 신체 증상의 추가 악화의 방지를 초래한다. 암의 증상은 관련 분야에 널리 공지되어 있고, 예를 들어, 비통상적 모반 특색, 비대칭성, 경계, 색상 및/또는 직경을 포함하는 모반 외관의 변화, 새롭게 착색된 피부 영역, 비정상적 모반, 손발톱 아래의 거무스름한 영역, 유방 종괴, 유두 변화, 유방 낭, 유방 통증, 사망, 체중 감소, 쇠약, 과도한 피로, 섭식 곤란, 식욕 상실, 만성 기침, 호흡곤란 악화, 객혈, 혈뇨, 혈변, 오심, 구토, 간 전이, 폐 전이, 골 전이, 복부 포만감, 복부팽창, 복강 내의 체액, 질 출혈, 변비, 복부 팽만, 결장 천공, 급성 복막염 (감염, 열, 통증), 통증, 토혈, 다한, 열, 고혈압, 빈혈, 설사, 황달, 어지럼증, 오한, 근육 연축, 결장 전이, 폐 전이, 방광 전이, 간 전이, 골 전이, 신장 전이, 및 췌장 전이, 연하 곤란 등을 포함한다.
치료적 유효 용량은 암의 발병을 방지하거나 지연시킬 수 있고, 예컨대 질환의 초기 또는 예비 징후가 존재하는 경우에 바람직할 수 있다. 암 진단에서 이용되는 실험실 테스트는 화학, 혈액학, 혈청학 및 방사선학을 포함한다. 따라서, 상기 중 임의의 것을 모니터링하는 임의의 임상 또는 생화학 검정이 특정 치료가 암을 치료하기 위한 치료적 유효 용량인지 여부를 결정하는데 사용될 수 있다. 관련 분야의 통상의 기술자는 대상체의 크기, 대상체의 증상의 중증도, 및 선택된 특정한 조성물 또는 투여 경로와 같은 요인들을 기반으로 이같은 양을 결정할 수 있을 것이다.
본원에 기재된 항체 및 조성물은 관련 분야에 공지되어 있는 다양한 방법 중 하나 이상을 사용하여 하나 이상의 투여 경로를 통해 투여될 수 있다. 숙련된 기술자가 이해할 바와 같이, 투여 경로 및/또는 방식은 원하는 결과에 따라 변할 것이다. 본원에 기재된 항체에 대한 바람직한 투여 경로는 정맥내, 근육내, 피내, 복막내, 피하, 척수 또는 기타 비경구 투여 경로, 예를 들어 주사 또는 주입에 의한 것을 포함한다. 본원에서 사용된 바와 같은 "비경구 투여"라는 구절은 일반적으로 주사에 의한, 장 및 국소 투여 이외의 투여 방식을 의미하고, 비제한적으로, 정맥내, 근육내, 동맥내, 척추강내, 피막내, 안와내, 심장내, 피내, 복강내, 경기관, 피하, 각피하, 관절내, 피막하, 지주막하, 척수내, 경막외 및 흉골내 주사 및 주입을 포함한다.
대안적으로, 항체는 비경구가 아닌 경로, 예컨대 국소, 표피 또는 점막 투여 경로를 통해, 예를 들어 비강내, 경구, 질내, 직장, 설하 또는 국소 투여될 수 있다.
활성 화합물은 급속한 방출에 대해 화합물을 보호할 담체와 함께, 예컨대 이식물, 경피 패치 및 마이크로캡슐화 전달 시스템을 포함하는 제어 방출 제형으로 제조될 수 있다. 생분해성, 생체적합성 중합체, 예컨대 에틸렌 비닐 아세테이트, 폴리안히드리드, 폴리글리콜산, 콜라겐, 폴리오르토에스테르, 및 폴리락트산이 사용될 수 있다. 이같은 제형의 제조를 위한 다수의 방법이 특허를 받았거나 또는 일반적으로 관련 분야의 통상의 기술자에게 공지되어 있다. 예를 들어, 문헌 [Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978]을 참조한다.
관련 분야에 공지되어 있는 의료 장치를 사용하여 항체 조성물을 투여할 수 있다. 예를 들어, 한 실시양태에서, 무바늘 피하 주사 장치, 예컨대 미국 특허 번호 5,399,163; 5,383,851; 5,312,335; 5,064,413; 4,941,880; 4,790,824; 또는 4,596,556에 개시된 장치로 조성물이 투여된다. 항체를 투여하는데 사용하기 위한 널리 공지되어 있는 이식물 및 모듈의 예는 의약을 제어된 속도로 분배하기 위한 이식가능한 마이크로-주입 펌프가 개시되어 있는 미국 특허 번호 4,487,603; 피부를 통해 의약을 투여하기 위한 치료 장치가 개시되어 있는 미국 특허 번호 4,486,194; 정확한 주입 속도로 의약을 전달하기 위한 의약 주입 펌프가 개시되어 있는 미국 특허 번호 4,447,233; 연속 약물 전달을 위한 가변 유동 이식가능 주입 장치가 개시되어 있는 미국 특허 번호 4,447,224; 다중-챔버 구획이 있는 삼투 약물 전달 시스템이 개시되어 있는 미국 특허 번호 4,439,196; 및 삼투 약물 전달 시스템이 개시되어 있는 미국 특허 번호 4,475,196을 포함한다. 이러한 특허들은 본원에 참조로 포함된다. 다수의 다른 이같은 이식물, 전달 시스템 및 모듈이 관련 분야의 기술자에게 공지되어 있다.
특정 실시양태에서, 면역자극 수용체에 결합하는 효능작용 항체는 생체 내에서의 적합한 분포를 보장하도록 제형된다. 예를 들어, 혈액-뇌 장벽 (BBB)은 다수의 고도로 친수성인 화합물을 배제한다. 항체가 BBB를 가로지르는 것을 보장하기 위해 (원한다면, 예를 들어, 뇌암의 경우), 이는, 예를 들어, 리포솜에서 제형될 수 있다. 리포솜을 제작하는 방법에 대해, 예를 들어, 미국 특허 번호 4,522,811; 5,374,548; 및 5,399,331을 참조한다. 리포솜은 특정한 세포 또는 기관 내로 선택적으로 운반되는 하나 이상의 모이어티를 포함할 수 있고, 따라서 표적화된 약물 전달을 증진시킬 수 있다 (예를 들어, 문헌 [V.V. Ranade (1989) J. Clin. Pharmacol. 29:685] 참조). 예시적인 표적화 모이어티는 폴레이트 또는 비오틴 (예를 들어, 로우(Low) 등의 미국 특허 5,416,016 참조); 만노시드 (Umezawa et al., (1988) Biochem. Biophys. Res. Commun. 153:1038); 항체 (P.G. Bloeman et al. (1995) FEBS Lett. 357:140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39:180); 계면활성제 단백질 A 수용체 (Briscoe et al. (1995) Am. J. Physiol. 1233:134); p120 (Schreier et al. (1994) J. Biol. Chem. 269:9090)을 포함하고, 문헌 [K. Keinanen; M.L. Laukkanen (1994) FEBS Lett. 346:123]; [J.J. Killion; I.J. Fidler (1994) Immunomethods 4:273]을 또한 참조한다.
IV. 키트 및 단위 투여량 형태
예를 들어, 암을 치료하는데 사용하기 위한, 본원에 기재된 방법을 사용하여 결정된 양으로 면역자극 수용체에 결합하는 효능작용 항체 (예를 들어, 항-OX40 항체) 및 제약상 허용되는 담체를 함유하는 제약 조성물을 포함하는 키트가 본원에서 또한 제공된다. 키트는 적어도 하나의 추가적인 작용제 (예를 들어, 본원에 기재된 조합 요법에 적절한 작용제, 예컨대 또 다른 치료제)를 추가로 함유할 수 있다. 임의적으로 키트는 암 (예를 들어, 고형 종양)을 가진 환자에게 조성물을 투여하기 위해 실무자 (예를 들어, 의사, 간호사, 또는 환자)가 키트 내에 함유된 조성물을 투여하게 하는 설명서를 또한 포함할 수 있으며, 이는, 예를 들어, 투여 스케줄을 포함한다. 키트는 또한 주사기를 포함할 수 있다.
임의적으로, 키트는 상기에서 제공된 방법에 따른 단일 투여를 위한 유효량의 항체를 각각 함유하는 단일-용량 제약 조성물의 다중 패키지를 포함한다. 제약 조성물(들)을 투여하는데 필요한 기구 또는 장치가 또한 키트에 포함될 수 있다. 예를 들어, 키트는 소정량의 항체를 함유하는 하나 이상의 미리 충전된 주사기를 제공할 수 있다.
전형적으로 키트는 키트의 내용물의 의도되는 용도를 지시하는 표지를 포함한다. 용어 표지는 키트 상에 또는 키트와 함께 공급되거나 또는 다른 방식으로 키트에 동반되는 임의의 문서 또는 기록 물질을 포함한다.
실시예
OX-40은 T 세포 활성화 시 상향조절되는 공동-자극 수용체이다. 이는 CD4+ 및 CD8+ 이펙터 T 세포 (Teff)의 활성화, 증식 및 생존을 증가시키는 한편, T 세포 (Treg) 억제를 억제한다. OX-40에 높은 친화력으로 결합하여, Teff 증식을 증진시키고 Treg 억제를 억제하는, 완전히 인간형인 인간 IgG1 효능작용 모노클로날 항체의 예가 본원에서 기재된다. 도 30은 효능작용 모노클로날 항체와 OX-40의 작용 메카니즘을 도시한다.
실시예 1: 다양한 용량의 리간드 차단 및 리간드 비-차단 항-OX40 항체의 항종양 활성
본 실시예는 CT26 마우스 종양 모델에서의 다양한 용량의 OX40.23-mIgG1 (리간드 차단제 효능작용 항체) 및 OX40.3-mIgG1 (리간드 비-차단제)의 효과를 기재한다.
BalbC 마우스에 1 x 106개의 CT26 세포를 이식하였다. 이식 후 제6일에, CT26 종양 (75-150 ㎣)이 확립된 마우스를 0.03, 0.1, 0.3, 1, 3, 및 10 mg/kg의 용량의 OX40.23 mIgG1 또는 OX40.3 mIgG1로 처리하였다 (Q7D x 2, d6).
처리 군당 평균 및 중앙값 종양 성장 곡선이 도 1a (IgG 대조군 및 OX40.23) 및 도 1b (OX40.3)에 제시되고, OX40.23-mIgG1 및 OX40.3-mIgG1 처리 마우스에 대한 평균 및 중앙값 종양 부피가 도 2a-2d에 제시된다. 처리 군당 평균 및 중앙값 종양 부피, TGI, 및 연구 종료 시의 무종양 마우스의 수가 표 3에서 요약된다.
표 3: 단독요법으로서의 OX40.23 및 OX40.3에 대한 처리군별 종양 부피, TGI, 및 무종양 마우스의 수의 요약
1 mg/kg, 3 mg/kg 및 10 mg/kg으로 투약된 OX40.3은 이소타입 대조군 처리 군에 비교하여 76%, 93% 및 98% 중앙값 TGI를 초래하여 제20일에 유의한 종양 억제를 실연였하고, 뿐만 아니라 연구 종료 시 (제66일)에 각각 1/10, 2/10 및 6/10마리의 무종양 마우스를 실연하였다. 0.3 mg/kg, 1 mg/kg, 3 mg/kg, 및 10 mg/kg으로 투약된 OX40.23은 이소타입 대조군 처리 군에 비교하여 59%, 91%, 88% 및 73% 중앙값 TGI를 초래하여 제20일에 유의한 종양 억제를 실연하였고, 뿐만 아니라 연구 종료 시 (제66일)에 각각 2/10, 1/10, 3/10 및 6/10마리의 무종양 마우스를 실연하였다. 0.3 mg/kg 이상의 용량의 OX40.23가 제공된 모든 군이 종양 부피가 감소되었지만, 10 mg/kg의 처리가 1 mg/kg 및 3 mg/kg에 비교하여 덜 활성이었다. 높은 용량 (10 mg/kg)에서의 감소된 항종양 활성 ("후크" 효과)가 OX40.3에 의해 처리된 군에서는 관찰되지 않았고, 이는 최고 용량에서 최대 TGI 및 무종양 마우스의 최대 마릿수를 나타냈다. OX40.23은 OX40-OX40L 상호작용을 차단하지만, OX40.3은 그렇지 않기 때문에, 이러한 데이터는 OX40L의 결속이 높은 용량에서의 OX40.23에 의한 항종양 효능 약화에 기여할 수 있다는 것을 시사하였다.
실시예 2: 항-OX40 항체 + 항-PD1 항체 조합 요법으로의 항종양 효능의 전환
본 실시예는 항-PD1 항체와 조합된 다양한 용량의 OX40.23-mIgG1의 효과를 기재한다.
실험 조건은 실시예 1에 기재된 것과 본질적으로 동일하였다. OX40.23 (Q7D x 2) + 항-PD1 항체 (IgG1 D265A; Q4D x 3) 처리 마우스에 대한 개별적인 종양 성장 곡선이 도 3a 및 3b에 제시되고, OX40.3 + 항-PD1 항체 처리 마우스에 대한 곡선이 도 4에 제시된다. OX40.23 + 항-PD1 처리 마우스에 대한 처리 군당 평균 및 중앙값 종양 부피, TGI, 및 연구 종료 시의 무종양 (TF) 마우스의 수가 표 4에서 요약되고, OX40.3 + 항-PD1 처리 마우스에 대한 것이 표 5에서 요약된다.
표 4: 항-PD-1 항체와 조합된 OX40.23에 대한 처리군별 종양 부피, TGI 및 무종양 마우스의 수의 요약
표 5: 항-PD-1 항체와 조합된 OX40.3에 대한 처리군별 종양 부피, TGI 및 무종양 마우스의 수의 요약
표 4에 제시된 바와 같이, 항-PD1 항체와 조합되었을 때, 1/10마리의 무종양 마우스에 이른 항-PD-1 항체 단독요법에 비교하여, 연구 종료 시에 무종양 마우스가 80%를 초과하면서, 0.1 mg/kg 내지 3 mg/kg의 투여량의 OX40.23이 항종양 효능의 유의한 개선을 실연하였다. 그러나, OX40.23의 최고 용량 (10 mg/kg)에서, 평균 및 중앙값 종양 부피 둘 다가 더 낮은 용량 군보다 더 높았고, 연구 종료 시에 10마리 중 6마리만 무종양이었으며, 이는 실시예 1에서의 OX40.23 단독요법에서 관찰된 현상 ("후크" 효과)와 유사한, 높은 용량에서의 항종양 활성 감소를 시사한다.
항-PD1 항체와 조합된 OX40.23-mIgG1의 유효한 용량은 0.1-0.3 mg/kg이고, 이는 OX40.23-mIgG1 단독요법의 유효한 용량 (1-3 mg/kg)보다 약 10배 더 낮다.
표 5에 제시된 바와 같이, 제124일의 4/10마리의 TF 마우스 및 제19일의 32% 중앙값 TGI에 이른 항-PD1 항체 단독요법에 비교하여, 항-PD1 항체와 조합된 3 mg/kg 및 10 mg/kg으로 투약된 OX40.3은 연구 종료 시 (제124일)에 각각 8/10 및 7/10마리의 TF 마우스를 초래하였고, 제19일의 중앙값 TGI가 70%를 초과하면서 더욱 강력하게 CT26 종양의 성장을 억제하였다. OX40.23으로 나타난 것과 유사한 항-PD1 항체와 조합되었을 때의 더 낮은 용량에서의 배수-전환이 OX40.3으로 또한 관찰되었다 (도 4).
실시예 3: 항-OX40 및 항-PD1 항체의 공동 또는 순차 투약으로의 항종양 활성
본 실시예는 항종양 활성에 대한 항-OX40 및 항-PD1 항체의 공동 투약 대 순차 투약의 비교를 기재한다.
이러한 실험에서 사용된 마우스 종양 모델은 본질적으로 실시예 1 및 2에 기재된 바와 동일하였다. OX40.23을 종양 이식 후 제5일 및 제12일에 0.03 mg/kg, 0.3 mg/kg, 또는 3 mg/kg으로 마우스에게 투여하였고, 제5일, 제9일 및 제13일에 항-PD-1을 공동 투여하거나, 또는 제10일, 제14일 및 제18일에 항-PD-1를 지연 투여하여 순차 처리를 제공하였다.
도 5에 제시된 바와 같이, CT26 종양의 급속한 진행으로 인해, 10마리 중 3마리의 무종양 마우스에 이른 제5일에 시작된 처리에 비교하여, 제10일에 시작된 지연된 항-PD-1 항체 단독은 종양 퇴행 없이 더 적은 활성을 나타냈다. OX40.23 + 공동 항-PD-1 항체 처리는 각각 0.03 mg/kg, 0.3 mg/kg, 및 3 mg/kg의 OX40.23에서의 8/10, 6/10, 및 10/10마리의 무종양 마우스로 항종양 활성의 유의한 개선을 초래하였다. OX40.23 + 지연된 항-PD-1은 0.3 mg/kg 및 3 mg/kg의 OX40.23에서의 6/10 및 7/10마리의 무종양 마우스로 공동 치료와 필적하는 항종양 활성에 이르렀다. 0.03 mg/kg의 OX40.23과 지연된 항-PD-1 처리의 조합은 상응하는 OX40.23 또는 항-PD-1 단독요법에 비교하여 더 양호한 항종양 활성을 나타내지 않았다. 이러한 결과들은 공동 투약이 항종양 활성의 관점에서 순차 투여와 유사하였음을 시사한다.
추가적으로, 항-PD-1 또는 항-CTLA-4와 조합된 항-OX40 효능제를 실시예 1 및 2에서 기재된 것과 본질적으로 동일한 마우스 종양 모델을 이러한 실험에서 사용하여 테스트하였다. BMS-986178을 단독으로 또는 항-PD1 또는 항-CTLA와 공동으로 마우스에게 투여하였다.
도 38에 제시된 바와 같이, 항-PD-1 또는 항-CTLA-4와 조합된 항-OX40 효능제가 증진된 항종양 활성을 나타냈다. 항-PD-1 및 BMS-986178로 처리된 10마리 중 10마리의 마우스가 무종양이었고, 항-CTLA-4 및 BMS-986178로 처리된 10마리 중 8마리의 마우스가 무종양이었다.
총괄적으로, 실시예 1-3은 OX40.23 (리간드 차단 효능작용 항체)의 최대 활성이 단독요법에서는 3 mg/kg에서, 항-PD1 항체와의 조합 요법으로는 0.3 mg/kg에서 달성되었음을 실연한다. 단독요법에서는 10 mg/kg에서, 항-PD1 항체와의 조합 요법으로는 3 mg/kg에 최대 활성이 달성되면서, 더 낮은 용량에 대한 유사한 배수-전환이 리간드 비-차단 항체 OX40.3으로 관찰되었다. 단독요법 및 조합 요법 둘 다에서 OX40.23이 10 mg/kg으로 투여되었을 때 "후크" 효과 (활성 감소)가 관찰되었다. 그러나, 단독으로 또는 항-PD-1 항체와 조합하여 OX40.3으로 처리된 마우스에서는 이러한 "후크" 효과가 관찰되지 않았고, 이는 OX40.23으로 관찰된 더 높은 용량에서의 효능 감소가 OX40L-OX40 상호작용에 의존적이었음을 지시한다. 추가로, 조합 처리의 경우, 공동 투약이 엇갈린 레지멘에 필적하는 항종양 활성을 초래하였다.
실시예 4: 단일 작용제로서 또는 항-PD1 항체와 조합되어 투여된 OX40.23의 수용체 점유율
단독요법 또는 항-PD1 항체와의 조합 요법으로 고용량 (10 mg/kg)의 항-OX40 항체가 투여된 마우스에서 관찰된 항종양 효능의 "후크" 효과의 기반을 이루는 잠재적인 메카니즘(들)을 더 잘 이해하기 위해, 혈액 및 종양 미세환경 내의 CD4+ T 세포 상에서의 OX40 수용체 점유율 (RO) 및 OX40 발현을 평가하였다.
투약 및 샘플링 스케줄이 도 6a에 제시된다. 간략하게, BalbC 마우스에게 1 x 106개의 CT26 세포를 이식하였다. 이식 후 제6일에, CT26 종양 (75-150 ㎣)이 확립된 마우스를 지시된 용량의 지시된 단독요법 또는 조합 요법으로 처리하였고, 항-PD1 항체는 10 mg/kg으로 투여되었다.
이식 후 제8일 및 제13일의 종양 및 혈액에서의 수용체 점유율을 평가하여, OX40.23 단독요법 및 항-PD-1 항체와의 조합 요법에 의한 CD4 서브세트에서의 OX40 수용체 점유율 및 OX40 표면 발현의 동역학 변화를 평가하였다. 에틸렌디아민테트라아세트산 (EDTA)을 함유하는 주사기 내로의 심장 천자를 통해 혈액을 수득하였다. 히스토파크(Histopaque)®-1083 (시그마-알드리치(Sigma-Aldrich)) 구배 분리에 의해 생육성 백혈구를 회수하였다. 2 ml의 히스토오파크-1083을 15 ml 원뿔형 원심분리 튜브 내에 첨가하고, 항-응고 전혈을 히스토오파크 매질의 상부에 조심스럽게 적층시켰다. 원심분리 동안, 적혈구 및 호중구가 폴리수크로스에 의해 응집되고, 신속하게 침강되었다. PBMC는 혈장-히스토파크 1083 계면에 남아 있었다. 세정 단계 동안 저속 원심분리에 의해 대부분의 외래 혈소판을 제거하였다. 종양을 제거하고, 칭량하고, 젠틀맥스 옥토 디소시에이터(gentleMACS Octo Dissociator)™ (밀테니이(Miltenyi)) 상에서 프로세싱하였다; 마우스 종양 해리 키트 (밀테니이)를 종양 프로세싱에 사용하였다. 해리 후, 세포 현탁액을 세정하고, 여과하고, 계수하였다.
개별적인 마우스의 혈액 및 종양으로부터의 단일 세포 현탁액을 점유 및 총 수용체를 별도로 테스트하기 위해 2개의 플레이트 내로 이중화하였다. 총 수용체를 테스트하기 위해, FACS 완충제 (PBS 내의 2% FBS 및 2 mM EDTA)에서 제조된 과량의 OX40.23-비오틴 항체를 10 μg/ml의 최종 농도로 첨가하고, 30분 동안 4℃에서 염색하였다. 그 후, 샘플을 FACS 완충제로 3회 세정하였고, 30분 동안의 0.5 μg/ml로의 PE-스트렙타비딘 염색이 이어졌다. 점유 수용체를 테스트하기 위해, PE-스트렙타비딘만 첨가하고, 0.5 μg/ml으로 30분 동안 염색하였다. 그 후, 총 및 점유 샘플 둘 다를 3회 세정하고, 유동 세포측정법 항체를 사용하여 면역 세포 마커에 대해 염색하였다. 1 μg/ml의 DAPI를 첨가하여 생세포 및 죽은 세포를 구별한 후, 유동 세포측정법을 실행하였다. 항체 형광을 포르테사(Fortessa) (BD 바이오사이언시즈(BD Biosciences)) 상에서 유동 세포측정법에 의해 검출하고, 결과를 플로우조(FlowJo) 소프트웨어 (플로우조 엘엘씨(FlowJo, LLC))를 사용하여 분석하였다. 하기 등식에 따라 각각의 동물에 대해 수용체 점유율을 계산하였다: % RO = ([테스트의 ΔMFI] / [총의 ΔMFI])x100 [식 중, 테스트는 생체 외에서 직접적으로 평가되었을 때 OX40.23에 의해 점유된 수용체의 양이고, 총은 이러한 샘플에 첨가된 과량의 OX40.23-비오틴의 첨가로부터 결정된 바와 같은 존재하는 수용체의 총량이다].
도 6b에 제시된 바와 같이, 수용체 점유율은 종양 및 말초 혈액에서 더 높은 용량에서 유사한 점유율이 관찰되면서 항체 용량-의존적이었다. 수용체 점유율 프로파일이 단독요법과 조합 요법 사이에서 유사하였다. 또한, 제8일에 비교하여, 제13일에 OX40 수용체 점유율이 말초 혈액에서 감소하였지만, 종양에서는 증가하였고, 특히 3 mg/kg 및 10 mg/kg 용량에서 그러하였으며, 이는 혈액에서의 항-OX40 항체의 클리어런스 및 종양에서의 항-OX40 항체의 축적을 시사한다.
OX40 수용체 점유율의 조절을 추가로 검사하기 위해, OX40 수용체의 총 및 점유 수준을 독립적으로 평가하였다. 용량 증량에 걸쳐, 세포 표면 상의 점유된 OX40 수용체의 분율이 계속 증가하였고, 제8일과 제13일 사이에 명확한 차이를 나타내지 않았다 (도 6c). 그러나, 세포 표면 상에 존재하는 OX40 수용체의 총량은 제8일 (투약 2일 후)에 0.3 mg/kg 용량 (0.3 mg/kg에서의 약 40% 수용체 점유율) 이상에서 급속한 하향조절을 나타냈고, 연구 제13일까지 계속 낮았다. 이러한 데이터는 3 mg/kg 및 10 mg/kg 용량의 OX40.23에서 관찰된 높은 계산된 수용체 점유율이, 점유 수용체의 수의 증가와 대조적으로, 총 OX40 수용체의 하향조절에 의해 구동될 가능성이 있다는 것을 시사한다.
퍼센트 종양 성장 억제 및 OX40 수용체 점유율 사이의 관계는 OX40.23 + 항-PD1의 조합에 대해 20 내지 80% 수용체 점유율에서 최대 종양 성장 억제가 달성되는 반면, OX40 수용체 점유율이 80%를 초과할 때 종양 성장 억제 감소가 관찰되었음을 실연한다 (도 6d).
유사한 실험에서, CT26 종양-보유 마우스를 BMS-986178 또는 이소타입 항체 IgG 대조군으로 처리하였다. OX40 RO 및 총 표면 OX40을 처리 후의 지시된 시점에 종양 샘플에서 유동 세포측정법에 의해 평가하였다.
도 34a-34d에 제시된 바와 같이, BMS-986178 처리 7일 후의 CT26 종양-보유 마우스로부터의 종양 샘플은 종양 Treg 상에서의 OX40 RO가 BMS-986178의 용량과 상호관련된 반면 (도 34a), 종양 Treg 상에서의 총 OX40 발현은 ≥0.3 mg/kg 용량의 BMS-986178에서 감소하였음 (도 34b)을 나타냈다. 그리고, mAb-점유 OX40이 경시적으로 감소함에 따라 (BMS-986178 처리 후 제10일 이후; 도 34c), OX40 표면 발현이 복구되었다 (도 34d). 따라서, 종양 Treg 상에서의 OX40 발현이 CT26 마우스에서 더 높은 용량의 항-BMS-986178로 감소하였다.
종합하면, 이러한 데이터들은 효능작용 항-OX40 항체와 항-PD1 항체의 조합이 항-PD-1 항체 단독요법에 비해 치료 효능의 유의한 증진에 이르렀다는 것을 실연하고, 이때 조합물의 최대 항종양 활성은 100% 미만의 OX40 수용체 점유율에서 잘 달성된다. 수용체 점유율이 약 40%에 접근함에 따라, 표면 OX40의 극심한 하향조절이 항체 투약 2일 후에 관찰되었고, 투약 후 적어도 7일에 걸쳐 유지되었다. OX40의 이러한 하향조절이 10 mg/kg 항-OX40 용량에서의 조합물의 더 낮은 치료 활성을 설명할 수 있다. 따라서, 효능작용 항-OX40 항체의 높은 용량 (예를 들어, 10 mg/kg)에서의 항종양 활성 감소를 최소화하거나 방지하기 위해 항체 용량 및 적용 빈도의 적합한 선택이 필요하다.
실시예 5: OX40.21이 투여된 인간 환자에서의
수용체 점유율, OX40의 표면 발현, 및 약물 노출
본 실시예는 인간 환자에서 수용체 점유율이 증가함에 따른 OX40의 표면 발현의 상실 사이의 상관관계를 실연한다.
실시예 4에 기재된 방법을 사용하여 20 mg , 40 mg, 80 mg, 160 mg, 또는 320 mg의 OX40.21 (효능작용 항-OX40 항체)이 투여된 인간 환자에서 CD4+ T 세포 또는 Treg에서의 수용체 점유율 및 표면 OX40 발현을 결정하였다 (RO를 결정하기 위한 테스트 vs. 총 기반 등식은 실시예 4와 동일하지만, 인간 환자에서의 OX40.21 RO의 계산에 대해 개조됨). 사이클 1 제 8일 및 사이클 2 제1일에 각각의 용량 코호트에 대해 CD4+ T 세포 및 Treg에서 수용체 점유율이 80 내지 100%였다. 도 7a에 제시된 바와 같이, 그리고 실시예 4의 결과와 일관되게, 인간 환자에서 OX40.21의 수용체 점유율이 증가함에 따라 OX40의 표면 발현이 감소하는 경향이 있었다. CD4+ T 세포 및 Treg와 같이, 유사한 수용체 점유율이 코호트에 걸쳐 말초 혈액에서 관찰되었고, 이때 >20 mg의 용량 및 제2 사이클의 제1 용량 (C2D1) 후의 플래토에 >80% 수용체 점유율이 관찰되었다.
약물 노출과 관련하여, 도 7b에 제시된 바와 같이, 니볼루맙과 조합된 OX40.21이 20-320 mg 범위의 노출에서 용량-관련 증가로 선형 PK를 나타냈다.
실시예 6: 대안적 투약 스케줄에서 수용체 점유율을 예측하기 위한 PK-PD 모델
본 실시예는 인간 환자에서의 수용체 점유율을 예측하기 위한 PK-PD 모델을 기재한다. 집단 PK 분석을 사용하여 선형 2-구획 PK 모델에 의해 약물 농도-시간 프로파일이 기재되었다. 도 8a 및 40에 제시된 바와 같이, PPK 모델은 관찰된 농도 데이터의 합리적인 설명을 제공하는 것으로 보인다. 대안적인 용량 스케줄에서의 개별적인 약물 노출 (Cmin1: 제1 용량 후의 최저 농도)이 PPK 모델을 기반으로 예측되었고, 이는 후속 PK-PD 모델 개발에서 사용되었다. 20-320 mg 범위의 용량의 OX40.21이 투여된 16명의 암 환자로부터의 RO 데이터를 기반으로, Emax 모델 (하기에서 제공된 등식)이 약물 농도 (Cmin1: 제1 용량 후의 최저 농도)와 C2D1의 혈액 RO 사이의 관계를 기재하는데 사용되었다.
여기서 약물 농도는 제1 용량 후의 최저 농도인 Cmin1이고, ROmax는 혈액 RO의 최대 백분율이며, EC50은 ROmax의 50%에 상응하는 약물 농도이다. 이러한 분석으로부터, 약물 EC50이 0.094 μg/mL인 것으로 추산되었다 (도 8b). 확립된 PK-PD 관계 (Emax 모델)을 사용함으로써, 뿐만 아니라 PK 및 PD의 대상체간 가변성을 고려하여, 대안적인 투약 스케줄에서의 혈액 RO를 예측하기 위해 시험 자극을 수행하였다 (도 9).
여러 암 유형 (두경부암, 자궁경부암, 요로상피암, 및 결장직장암)에 걸친 인간 종양 생검 샘플 (N = 5)로부터 생성된 데이터를 기반으로 종양 RO가 또한 예측되었고 (도 10a 및 10b), 여기서 종양 균질화물에서의 총 약물 및 총 OX40 농도가 20-320 mg의 OX40.21 용량에서 측정되었다. 다양한 용량 및 투약 레지멘에서의 종양 RO를 예측하기 위해 하기의 가정이 이루어졌다: 1) 종양 RO EC50은 혈청에서의 것과 동일하고; 2) 종양 약물 수준은 혈청에서의 것과 평형을 이루며; 3) 평균의 관찰된 종양-대-혈청 농도 비는 0.20 (범위 = 0.07-0.47)이고; 4) 평균의 관찰된 OX40 수준은 0.15 nM (범위 = 0.02-0.47 nM)이다. 예측된 종양 RO (도 10a)는 사용된 시나리오 하에 혈액 RO와 일관되었다. 그러나, 종양 RO 예측을 위해 0.47 nM의 높은 OX40 수준 및 0.07의 낮은 종양 약물 투과율이 사용되었을 때, 종양 RO가 혈액 RO로부터 벗어났다 (도 10b).
모델-기반 시뮬레이션은 40 mg q4w, 40 mg q8w, 40 mg q12w, 및 80 mg q12w의 OX40.21 용량으로부터 생성된 노출이 혈액 (예를 들어, 약 20% 내지 약 90%의 RO, 도 9) 및 종양 (예를 들어, 0.15 nM의 평균 표적 수준 및 0.20의 평균 종양 투과율 하의 약 10% 내지 약 90%의 RO, 도 10a 및 10b) 둘 다에서의 광범위한 수용체 점유율을 초래할 수 있다는 것을 나타냈고, 따라서 덜 빈번한 투약으로 등가이거나 또는 우월한 PD 반응이 달성될 수 있는지 여부를 이해할 기회를 제공한다.
실시예 7: OX40.21 농도와 수용체 점유율 사이의 관계의 시험관내 평가
본 실시예는 T 세포에서 시험관 내에서 OX40.21의 농도를 상이하게 하는 것을 기반으로 수용체 점유율의 평가를 기재한다.
간략하게, 총 T 세포를 피콜(Ficoll) 구배 원심분리를 사용하여 인간 전혈로부터 정제하였다. CD4+ T 세포를 밀테니이 CD4+ 단리 키트를 사용하여 PBMC로부터 단리하였다. 단리된 T 세포를 방사선이 조사된 CHO-OKT3-CD32A (인공적인 항원 제시 세포)의 존재 하에, 그리고 OX40.21 또는 이소타입 대조군의 단계 희석물의 존재 하에 배양하였다. 유동 세포측정법을 사용하여, 결합된 OX40 항체 대 총 표면 OX40의 비로서 수용체 점유율을 결정하였다. T 세포를 세정한 후 형광 접합된 항-인간 Fc를 첨가함으로써, 결합된 항체를 평가하였다. 포화량의 OX40 항체를 T 세포에 첨가함으로써 총 OX40을 결정하였다. 인큐베이션 후, 세포를 세정하고, 형광 접합된 항-인간 Fc를 첨가함으로써 염색하였다.
도 11a 및 11b에 제시된 바와 같이, (>1 nM의 OX40.21에서) 완전한 수용체 점유율이 총 표면 OX40의 하향조절과 상호관련되었고, 이는 "후크" 효과를 반영한다. 또한 증가되는 농도의 OX40.21이 CD4+ T 세포의 표면 상에서 OX40을 유도하였고, 이때 더 높은 농도는 OX40을 하향조절하였다. 경시적인 OX40 표면 발현은 OX40.21에 의해 유도된 "후크" 효과가 제4일의 최고 수준의 OX40 발현과 상호관련되었음을 나타냈다 (도 12a (이소타입 대조군) 및 도 12b (OX40.21)).
이러한 효과가 OX40.21에 대해 특이적인지 여부를 결정하기 위해, 표면 OX40의 수준에 대한 CD28 항체의 효과를 또한 평가하였다. 간략하게, 총 T 세포를 피콜 구배 원심분리를 사용하여 인간 전혈로부터 정제하였다. CD4 T 세포를 밀테니이 CD4+ 단리 키트를 사용하여 PBMC로부터 단리하였다. 단리된 T 세포를 방사선이 조사된 CHO-OKT3-CD32A (인공적인 항원 제시 세포)의 존재 하에, 그리고 효능작용 항-OX40 항체, 이소타입 대조군, 또는 항-CD28 항체 (클론 CD28.2)의 단계 희석물의 존재 하에 배양하였다. 유동 세포측정법에 의해 총 표면 OX40 대 결합된 OX40 항체에 의해 수용체 점유율을 결정하였다. T 세포를 세정한 후 형광 접합된 항-인간 Fc를 첨가함으로써, 결합된 항체를 평가하였다. 포화량의 항-OX40 항체를 T 세포에 첨가함으로써 총 OX40을 결정하였다. 인큐베이션 후, 세포를 세정하고, 형광 접합된 항-인간 Fc를 첨가함으로써 염색하였다.
도 13a, 13b, 32a, 및 32b에 제시된 바와 같이, 항-CD28 항체로의 T 세포의 공동-자극이 더 높은 농도에서 상실되지 않는 높은 수준의 OX40 발현을 유도하기 때문에, 총 표면 OX40 발현에 대한 OX40.21의 효과는 OX40.21에 대해 특이적이었다. 여기서, CD137 (도 13a 및 32a) 및 CD28 (도 13b 및 32b)에 대한 모노클로날 항체는 "후크" 효과와 연관된 총 표면 OX40의 하향조절을 나타내지 않았다. 여기서, CD4+ T 세포가 다른 공동-자극 효능제 항체로 처리되었을 때, OX40 표면 발현의 상실이 관찰되지 않았다.
인터페론-감마 (IFN-γ) 분비 (T 세포 활성화의 판독물) 및 그의 수용체 점유율과의 관계를 평가하기 위해 추가 실험을 수행하였다. 4일 동안 세포를 배양한 후, 상청액을 수집한 것을 제외하고는, 실험 조건은 상기 기재된 바와 동일하였다. IFN-γ의 분비를 표준 ELISA (BD 바이오사이언시즈) 또는 균일 시간 분해 형광 (HTRF) (시스바이오스(Cisbios))을 사용하여 정량하였다.
도 14에 제시된 바와 같이, OX40.21은 IFN-γ의 분비에 의해 반영되는 바와 같이 T 세포 활성화를 유도하였다. 최대 IFN-γ가 약 20%의 수용체 점유율에서 수득되었다. "후크" 효과와 일관되게, IFN-γ 분비가 100% 수용체 점유율에서 감소되었다.
T 세포 증식과 수용체 점유율 사이의 관계를 또한 평가하였다. 4일 동안의 세포 배양 후, 16시간 동안 세포에 3[H]-티미딘 혼입을 첨가하여 세포 증식을 테스트하고, 섬광을 카운팅한 것을 제외하고는, 실험 조건은 상기 기재된 바와 같았다.
도 15a-15c에 제시된 바와 같이, 최대 증식이 20-50% 수용체 점유율에서 수득되면서 OX40.21이 T 세포 증식을 유도하였다. T-세포 활성화 (CD4+ T 세포 상에서의 CD25의 기하 평균 형광 강도 [GMFI]에 의해 측정된 바와 같음)가 BMS-986178의 최저 용량에서 달성되었고, 40% OX40 RO에서 플래토에 도달하였다. 도 31. 총괄적으로, 이러한 데이터는 OX40 표면 발현, T 세포 증식, 및 시토카인 생산의 관점에서의 OX40.21의 최대 활성이 약 20% 수용체 점유율로부터 수득된다는 것을 시사한다. 100% 수용체 점유율에서, T 세포의 기능성/활성화가 감소되는 "후크" 효과가 관찰된다.
BMS-986178로 처리된 T 세포에서의 Treg의 억제를 평가하기 위해 추가 실험을 수행하였다. 다이나비드(Dynabead) (αCD3/αCD28; 써모 피셔 사이언티픽(Thermo Fisher Scientific)), 라파마이신, 및 인터루킨 (IL)-2을 사용하여 인간 CD4+ T 세포가 Treg로 분화되었고 확장되었다. 도 33a는 Treg 억제 검정을 도시한다. 본원에 기재된 바와 같이 유동 세포측정법에 의해 Treg 표현형이 확증되었다. 정제된 CD4+ T 세포 및 CD8+ T 세포를 ± Treg (5:1) + BMS-986178로 배양하였다. 그 후, IL-2 분비를 세포측정 비드 어레이 검정에 의해 측정하였다.
도 33b 및 33f에 제시된 바와 같이, BMS-986178-처리 CD4+ 및 CD8+ T 세포는 Treg의 존재 하에 IL-2를 생산하여, BMS-986178을 통한 OX40 효능작용이 Treg 억제를 완화하였음을 실연한다. Treg의 존재 하에서의 CD4+ T 세포 (도 33b) 또는 CD8+ T 세포 (도 33f)에 의한 IL-2 생산은 후크 효과를 실연하였다. 한편, 상응하는 배양물로부터의 Treg 상에서의 OX40 발현 (도 33d 및 33h)은 약 1 μg/mL BMS-986178에서 최대값에 도달하였고, > 1 μg/mL의 BMS-986178은 감소된 OX40 표면 발현을 초래하였다.
추가적으로, CD4+ T 세포 단독에 의해 자극된 IL-2 생산 (도 33c) 또한 후크 효과를 실연하였다. 또한, 단독으로 배양된 CD4+ T 세포 (도 33e) 및 CD8+ T 세포 (도 33i)가 0.37 μg/mL의 BMS-986178에서 최대 OX40 표면 발현을, >1 μg/mL의 BMS-986178에서 감소된 OX40 발현을 나타냈다. 반면에, 자극된 CD8+ T 세포는 BMS-986178 용량과 관계 없이 최대 IL-2 생산을 나타냈다 (도 33g).
이러한 데이터들은 BMS-986178가 용량 대비 후크 효과로 CD4+ 및 CD8+ T 세포의 Treg 억제를 완화하였다는 것을 실연한다
실시예 8: 가용성 OX40과 수용체 점유율 사이의 관계의 시험관내 평가
가용성 OX40 (sOX40)에 대해 특이적인 ELISA가 개발되었다 (도 16). 간략하게, 이러한 검정에서, 비-차단 OX40 모노클로날 항체 (OX40.8)를 먼저 메조 스케일 디스커버리(meso scale discovery) (MSD) 플레이트 상에 고정한다. 플레이트를 0.5% BSA를 함유하는 PBS로 차단한 후, 배양 상청액을 플레이트에 적용하고, 인큐베이션한다. 세정 후, 포획된 sOX40을 미리 최적화된 농도의 OX40에 대한 비오틴 접합된 양 폴리클로날 항체 (R&D 시스템(R&D System))을 사용하여 검출한다. 인큐베이션 및 세정 후, 술포-태그 스트렙타비딘을 첨가하여, 플레이트 상에 고정된 sOX40-항체 복합체를 전기화학발광에 의해 검출한다. 이러한 검정을 사용하여 sOX40 수준과 수용체 점유율 사이의 관계를 평가하였다. 4일의 배양 후, 상청액을 수집한 것을 제외하고는 실시예 7에서 기재된 것과 동일한 조건 하에 세포를 배양하고, 검정을 사용하여 sOX40을 정량하였다.
도 17 및 18에 제시된 바와 같이, OX40.21의 농도를 증가시키는 것이 CD4+ T 세포의 표면 상에서의 OX40 발현 및 상청액 내의 sOX40을 유도하였다. sOX40의 상실이 100% 수용체 점유율에서의 세포 표면 OX40의 상실 ("후크" 효과)과 상호연관되었다. 이러한 데이터는 sOX40이 OX40 효능작용 및/또는 T 세포 활성화에 대한 판독물로서 사용될 수 있다는 것을 시사한다. 인간 환자에서도, OX40.21 단독요법 및 OX40.21 + 니볼루맙으로의 치료 시 sOX40 수준이 증가하였다 (도 19).
항-CD28-처리 CD4+ T 세포에 의해 방출된 가용성 OX40 (sOX40)를 상기 기재된 바와 같은 맞춤-개발된 ELISA를 사용하여 측정하였다. 도 35a에 제시된 바와 같이, 항-CD28은 더 높은 용량에서 최대값에 도달한 후 용량-의존적 방식으로 sOX40 방출을 유도하였기 때문에, BMS-986178로 처리된 세포에서 관찰된 이러한 후크 효과가 독특하였다. 추가로, 도 35b에 제시된 바와 같이, CD4+ T 세포에 의해 방출된 대다수의 sOX40이 BMS-986178에 결합하였다. 따라서, BMS-986178-매개 T-세포 활성화가 sOX40 방출을 유도하였고, 이는 OX40 RO가 100%에 접근함에 따라 감소하였다.
총 sOX40 및 OX40.21에 의해 결합된 sOX40을 또한 결정하였다. 간략하게, 총 T 세포를 피콜 구배 원심분리를 사용하여 인간 전혈로부터 정제하였다. CD4+ T 세포를 밀테니이 CD4+ 단리 키트를 사용하여 PBMC로부터 단리하였다. 단리된 T 세포를 방사선이 조사된 CHO-OKT3-CD32A (인공적인 항원 제시 세포)의 존재 하에 배양하고, 효능작용 항-OX40 항체, 이소타입 대조군, 또는 항-CD28 (클론 28.2)의 단계 희석물로 테스트하였다. 미리 정의된 시점에, 상청액을 수집하였다. 가용성 OX40을 상기 기재된 ELISA를 사용하여 정량하였다.
도 20a 및 20b에 제시된 바와 같이, sOX40의 수준이 OX40의 세포 표면 발현과 상호관련되었고, OX40의 절단이 세포 활성화-의존적이지만, OX40 효능제에 대해 특이적이지 않고, OX40.21에 결합된 완전한 sOX40이 총 가용성 OX40 수준의 감소와 상호관련된다 (즉, sOX40에 대한 "후크" 효과가 검출될 때 100% sOX40이 결합됨).
다음으로, sOX40 수준에 대한 OX40.21-매개 "후크" 효과를 구제하는 항-CD28 항체의 능력을 테스트하였다. 총 T 세포를 피콜 구배 원심분리를 사용하여 인간 전혈로부터 정제하였다. CD4+ T 세포를 밀테니이 CD4+ 단리 키트를 사용하여 PBMC로부터 단리하였다. 단리된 T 세포를 방사선이 조사된 CHO-OKT3-CD32A의 존재 하에, 그리고 단독이거나 또는 일정한 농도의 항-CD28 항체 (클론 CD28.2)와 조합된 효능작용 항-OX40 항체, 이소타입 대조군의 단계 희석물의 존재 하에 배양하였다. 또 다른 사례에서, 일정한 농도의 항-CD28 항체를 단독으로 사용하였고, OX40.21 또는 이소타입 대조군의 단계 희석물을 72시간 (3일) 후에 18시간 동안 첨가하였다. 미리 정의된 시간 (D4)에 상청액을 수집하였다. 상기 기재된 MSD ELISA를 사용하여 가용성 OX40을 정량하였다.
도 21a 및 21b에 제시된 바와 같이, OX40.21 및 항-CD28 항체로의 세포의 공동-자극이 sOX40 수준에 대한 부가적인 효과가 있었다. 그러나, CD28 공동-자극은 sOX40에 대한 OX40.21-유도 "후크" 효과를 구제하지 않았다. 항-CD28 항체에 의해 예비-활성화된 세포를 OX40.21로 처리하는 것이 sOX40 방출을 유도하고 sOX40 수준에 대한 "후크" 효과를 관찰하는데 충분하였다. 종합적으로, 이러한 데이터는 sOX40이 시험관 내 및 체크포인트 차단과 조합된 면역자극 효능제로 치료된 환자 둘 다에서 1차 인간 T 세포 활성화의 바이오마커로서 사용될 수 있다는 것을 가리킨다. sOX40 측정이 면역자극 수용체에 결합하는 효능작용 항체가 단독요법으로서 또는 체크포인트 차단과 조합되어 제공된 환자에서 최적의 용량 및 스케줄을 결정하기 위한 임상 바이오마커로서 사용될 수 있다. 또한, 최적의 20-80% 범위를 초과하는 RO에 이르는 농도에서도 sOX40이 상실되기 때문에, sOX40의 생성은 20-40% RO 초과의 OX40.21에서의 세포 표면으로부터의 OX40의 상실을 설명할 수 있는 메카니즘이 아니다. 이는 세포 표면 및 sOX40이 유사한 방식으로 조절된다는 것을 시사한다.
실시예 9: OX40 내재화의 시험관내 평가
본 실시예는 차단 (OX40.21) 및 비-차단 (OX40.8) 항체로의 처리 후의 OX40의 내재화를 평가하였다. 검정의 일반적인 개략도가 도 22에 제시된다.
더욱 구체적으로, 시험관 내에서 생성된 CD4+ Treg를 48시간 동안 CD3/CD28 다이나비드로 활성화시켰다. OX40.21, 비-차단제 OX40.8, 및 이소타입 대조군의 단계 희석물을 얼음 상에서 2시간 동안 세포와 함께 인큐베이션한 후, pH-민감성 접합된 항-인간 Fc를 2시간 동안 37℃에서 첨가하였다. 고정 후, 내재화에 대해 어레이스캔(ArrayScan)에 의해 세포를 분석하였다.
도 23에 제시된 바와 같이, OX40.21 및 OX40.8이 가교 시 Treg에 내재화되었다.
추가적으로, 2가지 상이한 용량 (0.01 nM 및 100 nM)의 BMS-986178에 반응하여 OX40이 내재화되는 것이 측정되었다. 이러한 검정에서, 활성화된 Treg 또는 CD4+ T 세포를 이소타입 대조군 mAb 또는 BMS-986178과 함께 인큐베이션하였다. 그 후, pH-민감성 염료 (pHrodo)-접합된 항-Fc를 첨가하였다. 그 후, 어레이스캔 VTI (써모 피셔 사이언티픽) 상에서의 판독을 위해 세포를 고정하였다.
도 36에 제시된 바와 같이, 0.01 또는 100 nM의 BMS-986178로 처리된 Treg 또는 CD4+ T 세포가 BMS-986178 농도-의존적 방식으로 약물-결합된 OX40을 내재화하였다.
실시예 10: OX40.21의 효능작용 활성에 대한 FcγR-매개 가교의 효과
본 실시예는 OX40.21의 효능작용 활성에 대한 FcγR-매개 가교의 효과를 실연한다. 간략하게, CHO 세포를 각각 OKT3scFv 및 hFcγR로 표시된 인간 FcγRIIa의 H131 대립유전자 (CD32a-H131)의 존재 (+ FcγR) 또는 부재 (- FcγR) 하에 세포막-결합 scFv 버전의 항-인간 효능제 CD3 클론, OKT3을 발현하도록 조작하였다. CHO 세포에 방사선을 조사하여 그의 증식을 제한하고, 다양한 양의 OX40.21과 함께 1차 인간 CD4 T 세포와 함께 배양하였다. T 세포 증식 및 일차 인간 CD4 T 세포에 의한 IFN-γ 분비를 4일 기간에 걸쳐 평가하였다.
도 24에 제시된 바와 같이, BMS-986178 처리가 용량 의존적 및 가교 의존적 방식으로 CD4+ T 세포 증식 및 IFN-γ 생산을 유도하였다. FcγR-매개 가교가 IFN-γ 분비 및 T 세포 증식 둘 다에서 BMS-986178-매개 증가를 촉진하였다. 그러나, CHO 세포에 CD32a (CD32a-H131)가 결여되었을 때 증식 및 IFN-γ가 부재하였고, 이는 BMS-986178 활성이 FcγR-매개 가교를 필요로 한다는 것을 시사한다.
실시예 11: 항-OX40 항체 단독요법 및 항-PD1 조합 요법에 의해 유도된 말초 약역학 마커의 특징화
본 실시예는 OX40.23 단독요법 또는 OX40.23 및 항-PD1 항체의 조합물로 처리된 마우스, 및 항-PD1 항체 (니볼루맙)와 조합된 OX40.21로 치료된 인간 환자에서의 특정 약역학 마커의 유도를 실연한다.
CT26 종양이 확립된 마우스를 OX40.23 단독요법으로 또는 항-PD-1 항체와 조합하여 처리하였다. OX40.23 용량 증량을 90 mg/kg까지의 3배 증가로 0.01 mg/kg에서 시작하였다. 항-PD-1 항체를 10 mg/kg (또는 200 ug/마우스 균일 용량)으로 투약하였다. OX40.23 및 항-PD1 항체를 제6일, 제13일 및 제20일에 동일한 스케줄으로 투여하였다. 개별적인 마우스로부터 50 ul의 전혈을 제8일, 제12일, 제15일 및 제19일에 수집하였다. OX40.23-mIgG1 ± 항-PD-1으로의 처리 후 CD4+ 및 CD8+ T 세포에서의 말초 약역학 마커 (ICOS, FOXP3, Ki67, 및 CD44)의 유도를 결정하기 위해 유동 분석을 수행하였다. 도 25는 투약 스케줄의 개략도를 제시한다.
도 26a에 제시된 바와 같이, CD4+ T 세포 및 CD8+ T 세포 둘 다 CD4 이펙터 T 세포 (Foxp3-) 및 CD8+ T 세포 둘 다에서의 활성화 마커 (ICOS, CD44, Ki67)의 용량-의존적 상향조절, 및 더 높은 용량에서의 하향조절 ("후크" 효과)을 나타냈다.
유사하게, OX40.21 + 항-PD1 항체 (니볼루맙)으로 치료된 인간 환자에서, 조합 치료가 증식 중인 (Ki67+) CD8+ T 세포를 증가시켰고 (도 26b), 종양 기질 내의 FOXP3+ 세포를 감소시켰다 (도 26c).
환자 종양 샘플의 면역조직화학 분석로부터의 결과가 일관적이었다. 예를 들어, 도 26d에 제시된 바와 같이, 3가지 계통의 선행 요법 (메드록시프로게스테론, 레트로졸, 및 카르보플라틴 및 파클리탁셀)이 제공되었고, OX40.21 (320 mg) + 니볼루맙 (240 mg)으로 부분 반응이 달성된 68세의 여성 자궁내막암 환자로부터의 샘플이 Ki67+ CD8+ T 세포 수의 증가를 나타냈다. 또한 조합 요법은 안정적 질환을 달성한 난소암 환자로부터의 종양 샘플에서 FoxP3+ 세포를 감소시켰다. 도 26e에 제시된 바와 같이, FoxP3+ 세포 감소가 선행 수술 및 화학요법 (카르보플라틴 및 파클리탁섹)이 제공된 59세의 여성 장액성 난소암 환자 (상부 패널), 및 선행 수술 및 화학요법 (카르보플라틴 및 파클리탁셀)이 제공된 72세의 난소 선암종 환자 (하부 패널)에서 관찰되었다.
실시예 12: 초기 T 세포 활성화 마커와 항-OX40 및 항-PD1 조합 요법에 대한 종양 반응 사이의 상관관계
본 실시예는 초기 T 세포 활성화 마커와 항-OX40 (OX40.23) 및 항-PD1 조합 요법에 대한 종양 반응 사이의 상관관계를 평가하였다.
제20일의 종양 진행 상태를 기반으로 마우스를 2개의 군으로 분리하였다. 종양 부피가 >100 ㎣인 마우스는 비-반응자로 간주되었고, 종양 부피가 ≤100 ㎣인 마우스는 반응자로 간주되었다.
도 27a 및 27b에 제시된 바와 같이, 종양 부피의 명확한 분리가 없었던 제12일의 CD44+ CD8+ 및 Ki67+ CD8+ T 세포의 백분율이 후속 종양 반응과 양의 상관관계가 있었고, 이는 조합 요법에 대한 최적의 용량 및 스케줄을 규정하게 할 수 있다. 종양 부담에서의 최대 % 감소에 의해 % Ki67+CD8+ T 세포의 최대 변화로서 플롯팅된 데이터도 또한 종양 부담의 감소와 증식 중인 CD8+ T 세포 사이의 양의 상관관계를 나타냈다 (도 27c). 유사하게, OX40.21 + 항-PD1 항체 (니볼루맙)로 치료된 인간 환자에서, 항종양 활성이 증식 중인 Ki67+CD8+ T 세포 증가와 상호관련되었다 (도 27d).
실시예 13: 종양 성장에 대한 항-ICOS 항체의 용량을 증가시키는 것의 효과
본 실시예는 항-ICOS + 항-PD1 조합 요법에서 효능작용 항-ICOS 항체가 더 높은 용량에서의 효능 감소 (즉, "후크 효과")를 나타낸다는 것을 실연한다.
간략하게, CT26 종양이 확립된 마우스 (평균 체중 약 20 mg)를 항-PD-1 단독요법으로 또는 항-ICOS 항체와 조합하여 처리하였다. 항-ICOS 용량 증량을 10 mg/kg (또는 약 200 μg/마우스 균일 용량의 최대 용량)까지의 3배 증가로 0.1 mg/kg에서 시작하였다. 항-PD-1 항체를 10 mg/kg (또는 약 200 μg/마우스 균일 용량의 최대 용량)으로 투약하였다. 항-ICOS 및 항-PD1 항체를 종양 이식 후 동일한 스케줄으로 (즉, 제7일에 시작하여 4일마다) 투여하였다.
도 28에 제시된 바와 같이, 항-ICOS + 항-PD1 조합 요법에서의 최대 종양 성장 억제 (TGI)가 테스트된 최대 용량 (10 mg/kg)보다 더 낮은 용량의 항-ICOS 항체 (3 mg/kg)에서 관찰되어, 3 mg/kg 초과의 용량에서의 TGI 감소를 실연하였다. 이는, 효능작용 항-OX40 항체와 유사하게, 다른 면역자극 수용체, 예컨대 ICOS를 표적화하는 효능작용 항체가 "후크 효과"를 나타내고, 포화-미만 용량에서 최대 효능을 달성한다는 것을 시사한다.
실시예 14: 약동학/약역학 (PK/PD)-기반 접근법을 사용한 OX40.21의 최초 인간 대상 출발 용량의 선택
종양학적 작용제의 최초 인간 (FIH) 용량은 통상적으로 국제 조화 회의 가이드라인 (International Conference on Harmonisation Guideline)을 기반으로 하고, 이는 면역 효능작용 특성이 있는 생물제약에 대해 적합한 FIH 출발 용량이 비-설치류로부터의 최고 비-중증 독성 용량 (HNSTD)의 1/6, 또는 최소 예상 생물학적 효과 수준 (MABEL)일 것을 권장한다. 그러나, MABEL-기반 접근법은 환자에게 임상 이점을 제공하지 못한다. 본 실시예는 항종양 효능, 즉, 의도되는 약리학적 효과를 기반으로 FIH 출발 용량을 선택하기 위한 PK/PD-기반 접근법을 기재한다.
간략하게, 유동 세포측정법을 사용하여 인간 및 뮤린 활성화 T 세포에서의 시험관내 결합 절반 최대 유효 농도 (EC50) 값을 결정하였다. 마우스에서의 PK/PD 결정을 위해, OX40.21이 마우스 OX40에 결합하지 않기 때문에 마우스 대용물 항체 (마우스 IgG1 (mIgG1) 및 IgG2a (mIgG2a) 이소타입으로 재설정된 햄스터 항-마우스 OX40 효능제 모노클로날 항체)를 사용하였다. 항종양 효능에 대해, 마우스 MC38 및 CT26 결장 선암종 모델을 사용하여 처리군 및 대조군에서의 종양 성장 곡선의 곡선하 면적의 중앙값으로부터 퍼센트 종양 성장 억제 (%TGI)를 결정하였다. 대용물 항체 및 OX40.21을 사용하여 시노몰구스 원숭이에서 PK 연구를 수행하였다. 클리어런스 및 정상 상태 분포 부피 (Vss)에 대해 각각 0.85 및 1의 세기 지수로 단순 알로메트리를 사용하여 원숭이 데이터로부터 인간 PK를 예측하였다. 시험관내 시토카인 방출을 드라이 코트 양식을 사용하여 평가하였다 (예를 들어, 문헌 [Finco et al. Cytokine 2014;66:143-55] 참조). 제1일 및 제28일에 투약하면서, 시노몰구스 원숭이에서 OX40.21로 아데노바이러스 혈청형 5-유인원 면역결핍증 바이러스 (Ad5-SIV) 백신접종 연구를 수행하였다. 5주 동안 주 1회로 30 mg/kg, 60 mg/kg, 및 120 mg/kg의 OX40.21을 30분 정맥내 (iv) 주입으로 원숭이에게 투여하여, 1개월 반복-투약 독성학 연구를 시노몰구스 원숭이에서 수행하였다.
표 6에 제시된 바와 같이, 마우스 대용물 항체가 OX40.21의 것과 유사한 결합 EC50 값을 나타냈다.
표 6
다음으로, 제1주 동안의 최대 약물 농도 (Cmax(제1주)) 또는 곡선하 면적 (AUC0-제1주)을 항종양 효능과 상호관련시키기 위해 PK/PD 분석을 수행하였다. 인간 유효 용량을 추정하고, 광범위한 환자 범위에 대해 더욱 보존적이기 위해, CT26 모델에 비교하여 항-OX40 치료에 대한 더 낮은 민감성으로 인해 MC38 모델에서의 항종양 효능에 대해 분석을 집중하였다. 햄스터에서 기원하는 것으로 인해 마우스 대용물의 PK가 제2주의 면역원성에 유의하게 영향을 받았기 때문에, 효능제의 약리학적 작용이 Cmax 또는 초기 약물 노출에 의해 구동되는 것으로 가정하여, 효능 테스트에 사용된 다양한 레지멘 하에 제1주 Cmax 및 AUC 데이터를 시뮬레이션하였다. 마우스 MC38 종양 모델에서의 mIgG1 및 mIgG2 모노클로날 항체의 노출-반응 관계가 도 29에 제시된다.
상응하는 PK 실험을 시노몰구스 원숭이에서 또한 수행하였으며, 그의 결과는 표 7에서 요약된다.
표 7
상기 마우스 및 원숭이 데이터를 기반으로, 예상 인간 T1/2은 9일이었다. 마우스에서의 것과 동일한 인간에서의 AUC0-제1주 및 Cmax(제1주)를 달성함으로써, OX40.21의 인간 유효 용량이 1 mg/kg인 것으로 추정되었다. 임상적으로 관련된 용량에 더욱 효율적으로 도달하기 위해 추정 유효 용량의 4-배 아래이도록 인간 출발 용량을 선택하였다 (즉, 0.25 mg/kg, 또는 80 kg 체중에 대해 20 mg).
하기와 같이, FIH 출발 용량 선택을 통지하기 위해 추가적인 지지 데이터가 수득되었다:
ㆍ 제1일 및 제28일에 원숭이에게 투여되었을 때의 OX40.21로의 Ad5-SIV 백신접종 연구에서, 4 mg/kg의 IV 용량에서 백신-유도 T-세포 반응의 최소 증진이 밝혀졌다.
ㆍ 테스트된 최고 농도 (10 μg/웰 또는 0.3 mL의 인큐베이션 부피를 사용하여 어림된 33 μg/mL)에서 드라이-코트 양식을 사용한 인간 말초혈 단핵 세포에서 OX40.21이 시토카인 방출을 유도하거나 발현 마커의 활성화를 증가시키지 않았다.
ㆍ 원숭이에서의 1개월 반복-용량 독성학 연구로부터의 HNSTD 또는 비-유해-사례 수준이 120 mg/kg/주인 것으로 결정되었고, 1/6 HNSTD 용량은 17 mg/kg (노출 기반) 또는 20 mg/kg (체중 기반)인 것으로 계산되었다.
ㆍ 테스트된 최고 용량 (2 mg/kg)의 인간에서의 약물 농도 (40 μg/mL)가 투약 첫주 전반에 걸쳐 잘 유지되었다는 사실에도 불구하고, 문헌에 보고된 또 다른 마우스 항-인간 OX40 효능제 mAb로의 임상 경험은 암 환자에서 급성 독성을 나타내지 않았다 (문헌 [Curti et al., Cancer Res 2013;73:7189-98] 참조). 2 mg/kg에서, 인간 Cmax는 약 80 μg/mL, 또는 보고된 시험관내 결합 EC50 (48 ng/mL 또는 0.3 nM)에 비해 >1,500-배였다.
표 8은 PK/PD-기반 FIH 출발 용량에서의 Cmax 한계 및 상기 언급된 추가적인 지지 데이터를 요약한다.
표 8
요약하면, 의도되는 약리학적 효과로서의 항종양 효능에 초점을 맞춘 PK/PD-기반 접근법이 효능작용 항-OX40 항체 OX40.21의 FIH 출발 용량을 선택 및 정당화하는데 효과적으로 사용되었다. 선택된 FIH 출발 용량 (80 kg의 체중을 가정하여 20 mg)이 임상전 시험관내 및 생체내 독성학 데이터에 의해 지지되었다. 시험관내 및 생체내 독성학 소견과 함께, FIH 출발 용량 선택을 위한 PK/PD-기반 전략은 치료 용량 미만의 용량이 제공되는 암 환자의 수를 최소화하면서 적합한 안전성을 보장하려는 의도를 반영한다.
실시예 15: OX40.21 단독요법 및 OX40.21 + 니볼루맙 용량-증량 시험에서의 환자 특징 및 치료-관련 유해 사례
본 실시예는 용량-증량 시험에서 OX40.21 단독요법 (n=20) Q2W 및 OX40.21 + 니볼루맙 조합 요법 (n=39) Q2W을 받고 있는 환자에서의 기준선 인구 통계, 선행 요법, 및 종양 유형 및 유해 사례를 요약한다. 환자 특징이 표 9에서 요약되고, 유해 사례가 표 10에서 요약된다.
표 9.
표 10.
최대-허용 용량에 도달되지 않았고, 치료-관련 사망이 발생하지 않았다. OX40.21 + 니볼루맙의 안전성 프로파일이 니볼루맙 단독요법의 것과 유사하였다.
진행성 고형 종양이 있는 환자에서의 OX40 공동자극 효능제 BMS-986178 ± 니볼루맙 (NIVO) 또는 이필리무맙 (IPI)의 1/2a상 연구에서의 OX40 수용체 조정
실시예 16: 조합 요법에 비교된 단독요법의 약동학
하기 실시예는 도 39에 제시된 바와 같은 연구 디자인의 개략도를 따른다. 인간에게 단독요법 용량의 BMS-986178, 조합 용량 증량의 BMS-986178 및 240 mg의 니볼루맙 (IV Q2W), 또는 조합 용량 증량의 BMS-986178 및 1 mg/kg의 이필리무맙 (IV Q3W)을 제공하였다. 도 39의 기준을 충족시키는 환자가 연구에 적격이었다.
조합 요법에 비교하여 단독요법의 약동학을 평가하기 위해, 환자 혈액 샘플을 사이토-첵스(Cyto-Chex) BCT (스트렉(Streck))에서 수집하였다. 적혈구 용해 후, 표면 마커에 대해 특이적인 형광 표지 항체를 사용하여 세포를 염색하였다. 표면 염색 후, 샘플을 고정하고, 투과시키고, 세포내 마커에 대한 항체로 염색하였다. 염색된 샘플을 베크만 쿨터 사이토플렉스(Beckman Coulter CytoFlex) S 유동 세포측정기 상에서 획득하고, 생성된 데이터를 플로우조 소프트웨어를 사용하여 분석하였다.
이러한 연구에서, 90명의 환자가 치료되었다 (BMS-986178 단독요법, n = 20; BMS-986178 + NIVO, n = 38; BMS-986178 + IPI, n = 32). 도 40에 제시된 바와 같이, BMS-986178 단독 또는 니볼루맙 또는 이필리무맙과의 조합물의 PK가 20 내지 320 mg의 BMS-986178 용량에 대해 선형이었다. 따라서, BMS-986178의 농도-시간 프로파일이 1차 제거로 선형, 2-구획 0차 IV 주입 모델에 의해 잘 기재되었다.
실시예 17: 단독요법 및 조합 (효능제 BMS-986178 ± 니볼루맙 (NIVO) 또는 이필리무맙 (IPI)) 요법의 전혈 OX40 수용체 점유율 (RO) 평가
전혈 OX40 수용체 점유율 (RO) 평가를 평가하기 위해, 환자 혈액 샘플을 포화 용량의 BMS-986178과 함께 인큐베이션하여 총 OX40 발현을 측정하거나 또는 BMS-986178 없이 인큐베이션하여 결합된 약물을 측정한 후, C1D1, C1D8, C2D1, 또는 C5D1의 표면 마커에 대한 염색 및 유동 세포측정법 분석이 이어졌다.
도 41에 제시된 바와 같이, Treg 상에서의 말초 OX40 RO가 BMS-986178 20 mg으로 처리된 환자에서 포화에 근접하였고, ≥40 mg의 용량에서 포화되었다.
다음으로, ≥ 40 mg BMS-986178으로 처리된 환자에서 말초 Treg의 하향조절이 있는지 여부를 평가하였다. 말초 Treg에서의 총 OX40를 테스트하기 위해, 환자 혈청 내의 총 sOX40를 측정하는 검정이 메조 스케일 디스커버리(Meso Scale Discovery) (MSD) 플랫폼을 사용하여 개발 및 검증되었다. MSD 금 96웰 스트렙타비딘 플레이트를 비오틴화 포획 항체로 코팅한 후, 환자 혈청 인큐베이션이 이어졌다. 포획된 sOX40을 루테닐화 검출 항체를 사용하여 검출하고, MSD SECTOR 기구를 통해 전기화학발광을 측정하였다.
도 42에 제시된 바와 같이, RO가 포화에 근접한 ≥40 mg의 BMS-986178로 치료된 환자에서 Treg의 표면 상에서의 OX40 발현의 하향조절이 관찰되었다.
다음으로, BMS-986178 단독요법으로 또는 BMS-986178 및 니볼루맙 또는 이필리무맙의 조합물로 치료된 개별적인 환자에서 이러한 경향이 또한 관찰되었는지 여부를 결정하였다. 도 43a 및 43b에 제시된 바와 같이, T-세포 활성화의 마커인 sOX40이 BMS-986178 ± 니볼루맙 또는 이필리무맙으로 치료된 환자에서 시간- 및 용량-의존적 조정을 나타내어, BMS-986178에 의한 OX40 결속이 확증되었다. RO 결과 (도 42) 및 임상전 관찰 (데이터는 제시되지 않음)과 일관되게, ≥ 160 mg BMS-986178으로 치료된 환자에서의 sOX40 수준이 거의 포화가 되었다.
실시예 18: 단독요법 및 조합 (효능제 BMS-986178 ± 니볼루맙 (NIVO) 또는 이필리무맙 (IPI)) 요법의 혈청 시토카인 발현
인터페론-감마 (IFN-γ) 및 IP-10을 BMS-986178 단독요법 및 조합 요법으로 치료된 환자에서 측정하였다. 간략하게, 환자 혈청 내의 IFN-γ 및 IP-10을 루미넥스(Luminex)-기반 기술 (여러 인간 염증성 MAP 패널이 조합된 맞춤형 다중-분석물 프로파일 [MAP] 패널 [미리어드 RBM(Myriad RBM)])을 사용하여 측정하였다. 도 44a 및 44b에 제시된 바와 같이, BMS-986178 ± NIVO 또는 IPI가 TH1-연관 시토카인 IFN-γ (도 44a) 및 염증유발성 시토카인 10kDa IFN-γ 유도 단백질 IP-10 (도 44b)의 생산을 자극하였고, 이는 말초 T-세포 활성화를 시사한다. 추가로, 더 많은 명수의 BMS-986178 + NIVO 또는 IPI가 제공된 환자가 IFN-γ 및 IP-10 생산의 강건한 증가를 나타냈다.
BMS-986178 ± NIVO 또는 IPI가 증식 중인 (Ki67+) CD4+ 및 CD8+ 이펙터 기억 T 세포의 수준을 증가시켰다는 것이 또한 관찰되었다. 도 45a 및 45b에 제시된 바와 같이, BMS-986178 ± NIVO 또는 IPI로 치료된 환자가 증식 중인 (Ki67+) CD4+ 이펙터 기억 T 세포 (도 45a) 및 CD8+PD-1+ 말단 이펙터 기억 T 세포 (도 45b) 증가를 나타냈다. 따라서, BMS-986178 + NIVO 또는 IPI는 BMS-986178 단독보다 더 많은 명수의 환자에서 증식 중인 CD4+ 및 CD8+ 이펙터 기억 T 세포의 더욱 극심한 증가를 나타냈다.
상기 제시된 데이터를 기반으로, 특정 메카니즘에 제한되지 않으면서, BMS-986178 용량, OX40 RO, OX40 발현, 및 PD 조정 사이의 관계의 개략적인 모델이 도 37에 제시된다.
실시예 19: 인간 총 가용성 OX40 바이오마커 검정의 개발 및 검증
실시예 17에 기재된 바와 같이, 환자 혈청에서 총 sOX40을 측정하는 검정이 메조 스케일 디스커버리 (MSD) 플랫폼을 사용하여 개발 및 검증되었다. 정확도 및 정밀도, 희석 선형성/평행성, 특이성 (매트릭스 효과 및 약물 간섭), 안정성 및 선택성을 포함하여, 목적에 맞는 바이오마커 검증을 사용하여 검증된 검정을 수행하였다.
검증 결과가 도 46a 내지 46h 및 표 11-12에서 제공된다. 제시된 바와 같이, 인간 혈청 총 sOX40의 검정 범위는 25 - 20,000 pg/mL였다. 7개의 표준 곡선 지점 (n = 20)의 정확도는 98-103% 내였고, CV는 ≤ 8%였다. QC 성능은 허용가능한 한도 내였고, CV는 LQC, MQC, HQC, 및 ULOQ에 대해 14% 미만이었다 (LLOQ는 26% CV). 표 11 및 12. 검정 교정물은 BMS-986178과 시판 교정물 (즉, OX40-His_Sino 및 OX40-Fc_R&D) 사이의 평행성을 실연하였다. 도 46a. 2개의 상이한 항체 쌍 사이의 혈청 OX40 상관관계 또한 양호하였다. 도 46b. 희석 선형성/평행성, 특이성, 안정성 및 선택성 모두가 예상 농도의 ± 25% 내에서 회수되었다. 도 46c 내지 46e. OX40의 보관 및 냉동-해동 안정성 또한 성능 기대치 내였다. 도 H. 마지막으로, 항-OX40 항체, OX40L 융합 단백질, 니볼루맙, 및 이필리무맙으로부터의 최소 간섭이 관찰되었다. 도 46f, 46G, 및 48. 이러한 결과들은 임상 샘플의 분석을 위한 검정의 높은 정밀도, 감도 및 적절성을 실연한다.
표 11: 교정 곡선 검증 데이터의 요약
표 12: QC 성능
검증되었으면, 검정을 사용하여 건강한 지원자 및 암 대상체에서 혈청 sOX40 수준을 측정하였다. 도 47에 제시된 바와 같이, sOX40 수준이 정상적인 건강한 개체에 비교하여 암 환자 (두경부, 난소, 또는 자궁경부)에서 유의하게 상승되었다. 이러한 결과는 암을 치료하기 위해 항-OX40 항체 (예를 들어, BMS-986178)를 단독으로 또는 다른 치료제, 예컨대 니볼루맙 및 이필리무맙과 조합하여 사용하는 것을 지지한다.
표 13: 서열 요약
등가물:
관련 분야의 기술자는 본원에 개시된 구체적 실시양태의 다수의 등가물을 인지하거나 또는 일상적일 뿐인 실험을 사용하여 이를 확인할 수 있을 것이다. 이같은 등가물은 하기에 의해 포괄되는 것으로 의도된다.
SEQUENCE LISTING
<110> BRISTOL-MYERS SQUIBB COMPANY
<120> IMMUNOSTIMULATORY AGONISTIC ANTIBODIES FOR USE IN TREATING CANCER
<130> 3338.115PC06
<150> 62/657,616
<151> 2018-04-13
<150> 62/628,207
<151> 2018-02-08
<150> 62/583,808
<151> 2017-11-09
<150> 62/581,905
<151> 2017-11-06
<150> 62/581,441
<151> 2017-11-03
<150> 62/580,346
<151> 2017-11-01
<160> 33
<170> PatentIn version 3.5
<210> 1
<211> 277
<212> PRT
<213> Artificial Sequence
<220>
<223> Human OX40 precursor
<400> 1
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Val Thr Gly Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ser Lys Pro
65 70 75 80
Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Ala Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Gly Gly Arg Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Val
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Ile Leu Leu Ala Leu Tyr Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Thr Leu Ala Lys Ile
275
<210> 2
<211> 189
<212> PRT
<213> Artificial Sequence
<220>
<223> Extracellular domain of mature human OX40
<400> 2
Leu His Cys Val Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His
1 5 10 15
Glu Cys Arg Pro Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln
20 25 30
Asn Thr Val Cys Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val
35 40 45
Ser Ser Lys Pro Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly
50 55 60
Ser Glu Arg Lys Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg
65 70 75 80
Cys Arg Ala Gly Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp
85 90 95
Cys Ala Pro Cys Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala
100 105 110
Cys Lys Pro Trp Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln
115 120 125
Pro Ala Ser Asn Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro
130 135 140
Ala Thr Gln Pro Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr
145 150 155 160
Val Gln Pro Thr Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr
165 170 175
Arg Pro Val Glu Val Pro Gly Gly Arg Ala Val Ala Ala
180 185
<210> 3
<211> 277
<212> PRT
<213> Artificial Sequence
<220>
<223> Cynomolgus OX40
<400> 3
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Thr Ala Lys Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys Gln Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Asn Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ala Lys Pro
65 70 75 80
Cys Lys Ala Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Pro Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Pro Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Thr Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Arg Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Arg Gly Pro Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Ala
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Met Leu Leu Ala Leu Leu Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala Pro Lys Ala Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Ala Leu Ala Lys Ile
275
<210> 4
<211> 183
<212> PRT
<213> Artificial Sequence
<220>
<223> Human OX40 L
<400> 4
Met Glu Arg Val Gln Pro Leu Glu Glu Asn Val Gly Asn Ala Ala Arg
1 5 10 15
Pro Arg Phe Glu Arg Asn Lys Leu Leu Leu Val Ala Ser Val Ile Gln
20 25 30
Gly Leu Gly Leu Leu Leu Cys Phe Thr Tyr Ile Cys Leu His Phe Ser
35 40 45
Thr Leu Gln Val Ser His Arg Tyr Pro Arg Ile Gln Ser Ile Lys Val
50 55 60
Gln Phe Thr Glu Tyr Lys Lys Glu Lys Gly Phe Ile Leu Thr Ser Gln
65 70 75 80
Lys Glu Asp Glu Ile Met Lys Val Gln Asn Asn Ser Val Ile Ile Asn
85 90 95
Cys Asp Gly Phe Tyr Leu Ile Ser Leu Lys Gly Tyr Phe Ser Gln Glu
100 105 110
Val Asn Ile Ser Leu His Tyr Gln Lys Asp Glu Glu Pro Leu Phe Gln
115 120 125
Leu Lys Lys Val Arg Ser Val Asn Ser Leu Met Val Ala Ser Leu Thr
130 135 140
Tyr Lys Asp Lys Val Tyr Leu Asn Val Thr Thr Asp Asn Thr Ser Leu
145 150 155 160
Asp Asp Phe His Val Asn Gly Gly Glu Leu Ile Leu Ile His Gln Asn
165 170 175
Pro Gly Glu Phe Cys Val Leu
180
<210> 5
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> VHCDR1
<400> 5
Ser Tyr Ala Met Tyr
1 5
<210> 6
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> VHCDR2
<400> 6
Ala Ile Asp Thr Asp Ala Gly Thr Phe Tyr Ala Asp Ser Val Arg Gly
1 5 10 15
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VHCDR3
<400> 7
Leu Gly Glu Gly Tyr Phe Phe Asp Tyr
1 5
<210> 8
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> VLCDR1
<400> 8
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VLCDR2
<400> 9
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VLCDR3
<400> 10
Gln Gln Arg Ser Asn Trp Pro Pro Thr
1 5
<210> 11
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH
<400> 11
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asp Thr Asp Ala Gly Thr Phe Tyr Ala Asp Ser Val Arg
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala
85 90 95
Arg Leu Gly Glu Gly Tyr Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL
<400> 12
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 13
<211> 446
<212> PRT
<213> Artificial Sequence
<220>
<223> HC
<400> 13
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Asp Thr Asp Ala Gly Thr Phe Tyr Ala Asp Ser Val Arg
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys Ala
85 90 95
Arg Leu Gly Glu Gly Tyr Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 14
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> LC
<400> 14
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 15
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic
<400> 15
Asp Val Val Ser Ser Lys Pro Cys Lys Pro Cys Thr Trp Cys Asn Leu
1 5 10 15
Arg
<210> 16
<211> 440
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain nivolumab
<400> 16
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 17
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain nivolumab
<400> 17
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 18
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region nivolumab
<400> 18
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 19
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region nivolumab
<400> 19
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 20
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 nivolumab
<400> 20
Asn Ser Gly Met His
1 5
<210> 21
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 nivolumab
<400> 21
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 22
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 nivolumab
<400> 22
Asn Asp Asp Tyr
1
<210> 23
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1 nivolumab
<400> 23
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 24
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2 nivolumab
<400> 24
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3 nivolumab
<400> 25
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1 5
<210> 26
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region ipilimumab
<400> 26
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 27
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 27
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 28
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 ipilimumab
<400> 28
Ser Tyr Thr Met His
1 5
<210> 29
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 ipilimumab
<400> 29
Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 30
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 ipilimumab
<400> 30
Thr Gly Trp Leu Gly Pro Phe Asp Tyr
1 5
<210> 31
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1 ipilimumab
<400> 31
Arg Ala Ser Gln Ser Val Gly Ser Ser Tyr Leu Ala
1 5 10
<210> 32
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2 ipilimumab
<400> 32
Gly Ala Phe Ser Arg Ala Thr
1 5
<210> 33
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3 ipilimumab
<400> 33
Gln Gln Tyr Gly Ser Ser Pro Trp Thr
1 5
Claims (75)
- 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 암을 가진 대상체의 종양에서 T 조절 세포의 수를 감소시키거나 또는 고갈시키는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 암을 가진 대상체에서 T 세포에서의 IL-2 및/또는 IFN-γ 생산을 증가시키는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 암을 가진 대상체에서 면역 반응을 자극하는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 암을 가진 대상체에서 종양 세포의 성장을 억제하는 방법으로서, 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체를 투여하는 것을 포함하며, 여기서 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 효능작용 항체가 약 20% 내지 약 80%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 양 또는 빈도로 투여되는 것인 방법.
- 제5항에 있어서, 효능작용 항체가 약 20% 내지 약 70%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 양으로 투여되는 것인 방법.
- 제5항에 있어서, 효능작용 항체가 약 20% 내지 약 60%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 양으로 투여되는 것인 방법.
- 제5항에 있어서, 효능작용 항체가 약 20% 내지 약 50%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 양으로 투여되는 것인 방법.
- 제5항에 있어서, 효능작용 항체가 약 20% 내지 약 40%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 양으로 투여되는 것인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 수용체 점유율 및/또는 수용체 점유율 범위가 효능작용 항체로의 치료 레지멘의 사이클 1 후의 제1일에 측정되는 것인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 면역자극 수용체가 LFA-1 (CD11a/CD18), CD2, CD7, CD30, CD40, CD54, CD160, BAFFR, HVEM, LIGHT, NKG2C, SLAMF7, 및 NKp80으로 이루어진 군으로부터 선택되는 것인 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 면역자극 수용체가 공동-자극 수용체인 방법.
- 제13항에 있어서, 공동-자극 수용체가 종양 괴사 인자 수용체 수퍼패밀리의 구성원인 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 효능작용 항체가 IgG1, IgG2, IgG3, IgG4, 또는 그의 변이체로 이루어진 군으로부터 선택되는 것인 방법.
- 제15항에 있어서, 효능작용 항체가 IgG1 항체인 방법.
- 제16항에 있어서, 효능작용 항체가 활성화 FcγR에 대한 증진된 결합을 갖는 Fc를 포함하는 것인 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 효능작용 항체가 인간, 인간화 또는 키메라 항체인 방법.
- 제1항 내지 제18항 중 어느 한 항에 있어서, 효능작용 항체가 이중특이적 항체인 방법.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 암이 방광암, 유방암, 자궁/자궁경부암, 난소암, 전립선암, 고환암, 식도암, 위장암, 췌장암, 결장직장암, 결장암, 신장암, 두경부암, 폐암, 위암, 배세포암, 골암, 간암, 갑상선암, 피부암, 중추 신경계의 신생물, 림프종, 백혈병, 골수종, 육종, 비-소세포 폐암, 및 바이러스-관련 암으로 이루어진 군으로부터 선택되는 것인 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 암이 전이성 암, 불응성 암, 또는 재발성 암인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 하나 이상의 추가적인 요법을 투여하는 것을 추가로 포함하는 방법.
- 제22항에 있어서, 하나 이상의 추가적인 요법이 항체 또는 소형 분자를 포함하는 것인 방법.
- 제23항에 있어서, 하나 이상의 추가적인 요법이 항-PD1 항체, LAG-3 항체, CTLA-4 항체, PD-L1 항체, 또는 항-TGFβ 항체를 포함하는 것인 방법.
- 제1항 내지 제24항 중 어느 한 항에 있어서, 효능작용 항체가 하나 이상의 추가적인 요법의 투여 전에 투여되는 것인 방법.
- 제1항 내지 제25항 중 어느 한 항에 있어서, 효능작용 항체가 하나 이상의 추가적인 요법의 투여 후에 투여되는 것인 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 효능작용 항체가 하나 이상의 추가적인 요법과 공동으로 투여되는 것인 방법.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 효능작용 항체가 제약 조성물로서 제형화되는 것인 방법.
- 암을 가진 대상체의 치료를 위해 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 유효한 용량 또는 항체 투여 스케줄을 선택하는 방법으로서, 하기 단계를 포함하는 방법:
(a) 동물 모델에게 효능작용 항체를 투여하는 단계;
(b) 동물 모델로부터 샘플을 수득하는 단계;
(c) 샘플에서 효능작용 항체의 수용체 점유율 또는 수용체 점유율 범위를 결정하는 단계;
(d) 단계 (c)로부터 수득된 수용체 점유율 또는 수용체 점유율 범위를 사용하여, 대상체에서의 예상 수용체 점유율 또는 수용체 점유율 범위를 예측 또는 추정하는 단계; 및
(e) 단계 (d)에서 수득된 예상 수용체 점유율을 기반으로 대상체에서 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 효능작용 항체의 용량 또는 항체 투여 스케줄을 선택하는 단계. - 제29항에 있어서, 약 20% 내지 약 80%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 효능작용 항체의 양이 선택되는 것인 방법.
- 제29항에 있어서, 약 20% 내지 약 70%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 효능작용 항체의 양이 선택되는 것인 방법.
- 제29항에 있어서, 약 20% 내지 약 60%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 효능작용 항체의 양이 선택되는 것인 방법.
- 제29항에 있어서, 약 20% 내지 약 50%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 효능작용 항체의 양이 선택되는 것인 방법.
- 제29항에 있어서, 약 20% 내지 약 40%의 수용체 점유율 범위를 달성하고/거나 유지하는데 충분한 효능작용 항체의 양이 선택되는 것인 방법.
- 대상체에서 암을 치료하는 방법으로서, 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체 또는 이러한 항체를 포함하는 제약 조성물의 유효량을 투여하는 것을 포함하며, 여기서 투여되는 효능작용 항체의 양은 제29항 내지 제34항 중 어느 한 항의 방법에 따라 선택되는 것인 방법.
- 암에 대해 치료 중인 대상체에서 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체의 수준을 모니터링하는 방법으로서, 하기 단계를 포함하는 방법:
(a) 대상체로부터 샘플을 수득하는 단계;
(b) 샘플에서 효능작용 항체의 수용체 점유율을 결정하는 단계;
(c) 수용체 점유율이 약 80%를 초과하면 대상체에게 투여되고 있는 효능작용 항체의 양 또는 빈도를 감소시키거나, 또는 수용체 점유율이 약 20% 미만이면 효능작용 항체의 양 또는 빈도를 증가시키는 단계;
(d) 임의적으로, 약 20% 내지 약 80%의 수용체 점유율이 달성되고/되거나 유지될 때까지 단계 (a)-(c)를 반복하는 단계. - 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 70%를 초과하면 효능작용 항체의 양 또는 빈도가 감소되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 60%를 초과하면 효능작용 항체의 양 또는 빈도가 감소되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 50%를 초과하면 효능작용 항체의 양 또는 빈도가 감소되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 40%를 초과하면 효능작용 항체의 양 또는 빈도가 감소되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 30% 미만이면 효능작용 항체의 양 또는 빈도가 증가되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 40% 미만이면 효능작용 항체의 양 또는 빈도가 증가되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 50% 미만이면 효능작용 항체의 양 또는 빈도가 증가되는 것인 방법.
- 제36항에 있어서, 단계 (c)에서, 수용체 점유율이 약 60% 미만이면 효능작용 항체의 양 또는 빈도가 증가되는 것인 방법.
- 제36항에 있어서, 단계 (d)에서, 약 20% 내지 약 70%의 수용체 점유율이 달성되고/되거나 유지될 때까지 효능작용 항체의 양 또는 빈도가 조정되는 것인 방법.
- 제36항에 있어서, 단계 (d)에서, 약 20% 내지 약 60%의 수용체 점유율이 달성되고/되거나 유지될 때까지 효능작용 항체의 양 또는 빈도가 조정되는 것인 방법.
- 제36항에 있어서, 단계 (d)에서, 약 20% 내지 약 50%의 수용체 점유율이 달성되고/되거나 유지될 때까지 효능작용 항체의 양 또는 빈도가 조정되는 것인 방법.
- 제36항에 있어서, 단계 (d)에서, 약 20% 내지 약 40%의 수용체 점유율이 달성되고/되거나 유지될 때까지 효능작용 항체의 양 또는 빈도가 조정되는 것인 방법.
- 암을 치료하는 방법으로서, 암의 치료를 필요로 하는 대상체에게 면역자극 수용체에 특이적으로 결합하는 효능작용 항체 및 추가적인 요법을 투여하는 것을 포함하며, 여기서 추가적인 요법은 고정 빈도로 투여되고, 효능작용 항체는 약 80% 미만의 수용체 점유율을 달성하고/거나 유지하는데 충분한 용량 및 빈도로 투여되는 것인 방법.
- 제49항에 있어서, 효능작용 항체의 용량 또는 빈도가 제29항의 방법을 사용하여 결정되는 것인 방법.
- 제29항 내지 제50항 중 어느 한 항에 있어서, 면역자극 수용체가 공동-자극 수용체인 방법.
- 제51항에 있어서, 공동-자극 수용체가 종양 괴사 인자 수용체 수퍼패밀리의 구성원인 방법.
- 면역자극 수용체에 특이적으로 결합하는 치료용 효능작용 항체를 투여받은 대상체에서 암에 대한 치료의 유효성을 결정하는 방법으로서, 대상체에서 가용성 OX40의 수준을 측정하는 것을 포함하는 방법.
- 제53항에 있어서, 가용성 OX40의 수준이, 예를 들어, 메조 스케일 디스커버리(Meso Scale Discovery) 플랫폼 상에서, 총 가용성 OX40 바이오마커 검정에 의해 측정되는 것인 방법.
- 대상체에서 암을 치료하는 방법으로서, 하기 각각의 유효량을 대상체에게 투여하는 것을 포함하며:
(a) 서열식별번호: 11에 기재된 서열을 갖는 중쇄 가변 영역의 CDR1, CDR2 및 CDR3 도메인, 및 서열식별번호: 12에 기재된 서열을 갖는 경쇄 가변 영역의 CDR1, CDR2 및 CDR3 도메인을 포함하는 항-OX40 항체, 및
(b) 서열식별번호: 18에 기재된 서열을 갖는 중쇄 가변 영역의 CDR1, CDR2 및 CDR3 도메인, 및 서열식별번호: 19에 기재된 서열을 갖는 경쇄 가변 영역의 CDR1, CDR2 및 CDR3 도메인을 포함하는 항-PD-1 항체,
여기서 방법은 적어도 1회의 투여 사이클을 포함하고, 여기서 사이클은 12주의 기간이며, 여기서 적어도 1회의 사이클 각각에 대해, 항-OX40 항체의 1회 용량은 20, 40, 또는 80 mg의 용량으로 투여되고, 항-PD-1 항체의 3회 용량은 480 mg의 용량으로 투여되는 것인
방법. - 제55항에 있어서, 항-OX40 항체 및 항-PD-1 항체가 하기 용량으로 투여되는 것인 방법:
(a) 20 mg 항-OX40 항체 및 480 mg의 항-PD-1 항체;
(b) 40 mg 항-OX40 항체 및 480 mg의 항-PD-1 항체; 또는
(c) 80 mg 항-OX40 항체 및 480 mg의 항-PD-1 항체. - 제55항 또는 제56항에 있어서, 항-PD-1 및 항-OX40 항체가 정맥내 투여용으로 제형화되는 것인 방법.
- 제55항 내지 제57항 중 어느 한 항에 있어서, 항-PD-1 및 항-OX40 항체가 함께 제형화되는 것인 방법.
- 제55항 내지 제57항 중 어느 한 항에 있어서, 항-PD-1 및 항-OX40 항체가 별도로 제형화되는 것인 방법.
- 제55항 내지 제59항 중 어느 한 항에 있어서, 항-OX40 항체가 항-PD-1 항체의 투여 전에 투여되는 것인 방법.
- 제60항에 있어서, 항-OX40 항체가 항-PD-1 항체의 투여 전 약 30분 이내에 투여되는 것인 방법.
- 제55항 내지 제59항 중 어느 한 항에 있어서, 항-OX40 항체가 항-PD-1 항체의 투여 후에 투여되는 것인 방법.
- 제55항 내지 제59항 중 어느 한 항에 있어서, 항-OX40 항체가 항-PD-1 항체와 공동으로 투여되는 것인 방법.
- 제55항 내지 제63항 중 어느 한 항에 있어서, 치료가 9회 이하의 사이클로 이루어지는 것인 방법.
- 제55항 내지 제64항 중 어느 한 항에 있어서, 항-OX40 항체가 각각의 사이클의 제1일에 투여되는 것인 방법.
- 제55항 내지 제65항 중 어느 한 항에 있어서, 항-PD-1 항체가 각각의 사이클의 제1일, 제29일 및 제57일에 투여되는 것인 방법.
- 제55항 내지 제66항 중 어느 한 항에 있어서, 치료가 종양의 크기에서의 감소, 경시적인 전이성 병변의 수에서의 감소, 완전 반응, 부분 반응 및 안정 질환으로부터 선택된 적어도 하나의 치료 효과를 생성하는 것인 방법.
- 제55항 내지 제67항 중 어느 한 항에 있어서, 암이 방광암, 자궁경부암, 신세포암, 고환암, 결장직장암, 폐암, 두경부암, 및 난소암으로부터 선택되는 것인 방법.
- 제68항에 있어서, 암이 방광암인 방법.
- 제55항 내지 제69항 중 어느 한 항에 있어서, 항-OX40 항체가 하기를 포함하는 것인 방법:
(a) 서열식별번호: 5에 기재된 서열을 포함하는 중쇄 가변 영역 CDR1;
(b) 서열식별번호: 6에 기재된 서열을 포함하는 중쇄 가변 영역 CDR2;
(c) 서열식별번호: 7에 기재된 서열을 포함하는 중쇄 가변 영역 CDR3;
(d) 서열식별번호: 8에 기재된 서열을 포함하는 경쇄 가변 영역 CDR1;
(e) 서열식별번호: 9에 기재된 서열을 포함하는 경쇄 가변 영역 CDR2; 및
(f) 서열식별번호: 10에 기재된 서열을 포함하는 경쇄 가변 영역 CDR3. - 제70항에 있어서, 항-OX40 항체가 각각 서열식별번호: 11 및 12에 기재된 서열을 포함하는 중쇄 및 경쇄 가변 영역을 포함하는 것인 방법.
- 제71항에 있어서, 항-OX40 항체가 각각 서열식별번호: 13 및 14에 기재된 서열을 포함하는 중쇄 및 경쇄를 포함하는 것인 방법.
- 제55항 내지 제72항 중 어느 한 항에 있어서, 항-PD-1 항체가 하기를 포함하는 것인 방법:
(a) 서열식별번호: 20에 기재된 서열을 포함하는 중쇄 가변 영역 CDR1;
(b) 서열식별번호: 21에 기재된 서열을 포함하는 중쇄 가변 영역 CDR2;
(c) 서열식별번호: 22에 기재된 서열을 포함하는 중쇄 가변 영역 CDR3;
(d) 서열식별번호: 23에 기재된 서열을 포함하는 경쇄 가변 영역 CDR1;
(e) 서열식별번호: 24에 기재된 서열을 포함하는 경쇄 가변 영역 CDR2; 및
(f) 서열식별번호: 25에 기재된 서열을 포함하는 경쇄 가변 영역 CDR3. - 제73항에 있어서, 항-PD-1 항체가 각각 서열식별번호: 18 및 19에 기재된 서열을 포함하는 중쇄 및 경쇄 가변 영역을 포함하는 것인 방법.
- 제74항에 있어서, 항-PD-1 항체가 각각 서열식별번호: 16 및 17에 기재된 서열을 포함하는 중쇄 및 경쇄를 포함하는 것인 방법.
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762580346P | 2017-11-01 | 2017-11-01 | |
| US62/580,346 | 2017-11-01 | ||
| US201762581441P | 2017-11-03 | 2017-11-03 | |
| US62/581,441 | 2017-11-03 | ||
| US201762581905P | 2017-11-06 | 2017-11-06 | |
| US62/581,905 | 2017-11-06 | ||
| US201762583808P | 2017-11-09 | 2017-11-09 | |
| US62/583,808 | 2017-11-09 | ||
| US201862628207P | 2018-02-08 | 2018-02-08 | |
| US62/628,207 | 2018-02-08 | ||
| US201862657616P | 2018-04-13 | 2018-04-13 | |
| US62/657,616 | 2018-04-13 | ||
| PCT/US2018/058704 WO2019089921A1 (en) | 2017-11-01 | 2018-11-01 | Immunostimulatory agonistic antibodies for use in treating cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200074214A true KR20200074214A (ko) | 2020-06-24 |
Family
ID=64607296
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207015641A KR20200074214A (ko) | 2017-11-01 | 2018-11-01 | 암을 치료하는데 사용하기 위한 면역자극 효능작용 항체 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US11603410B2 (ko) |
| EP (1) | EP3704159A1 (ko) |
| JP (1) | JP2021501801A (ko) |
| KR (1) | KR20200074214A (ko) |
| CN (1) | CN111542544A (ko) |
| WO (1) | WO2019089921A1 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3704159A1 (en) | 2017-11-01 | 2020-09-09 | Bristol-Myers Squibb Company | Immunostimulatory agonistic antibodies for use in treating cancer |
| WO2021098748A1 (en) * | 2019-11-21 | 2021-05-27 | Beigene (Beijing) Co., Ltd. | Methods of cancer treatment with anti-ox40 antibody in combination with chemotherapeutic agents |
| KR20220103708A (ko) * | 2019-11-21 | 2022-07-22 | 베이진 엘티디 | 항-pd1 또는 항-pdl1 항체와의 병용물 형태로 항-ox40 항체를 사용하는 암 치료의 방법 |
| EP4061846A4 (en) * | 2019-11-21 | 2023-12-20 | BeiGene, Ltd. | METHODS OF TREATING CANCER USING ANTI-OX40 ANTIBODIES IN COMBINATION WITH ANTI-TIGIT ANTIBODIES |
| US20230002501A1 (en) * | 2019-11-21 | 2023-01-05 | Beigene, Ltd. | Methods of cancer treatment using anti-ox40 antibodies in combination with anti-tim3 antibodies |
| PE20230682A1 (es) * | 2020-04-17 | 2023-04-21 | Hutchison Medipharma Ltd | Anticuerpo anti-ox40 y usos del mismo |
Family Cites Families (83)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4475196A (en) | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4522811A (en) | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| US4447224A (en) | 1982-09-20 | 1984-05-08 | Infusaid Corporation | Variable flow implantable infusion apparatus |
| US4487603A (en) | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| US4486194A (en) | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US5374548A (en) | 1986-05-02 | 1994-12-20 | Genentech, Inc. | Methods and compositions for the attachment of proteins to liposomes using a glycophospholipid anchor |
| MX9203291A (es) | 1985-06-26 | 1992-08-01 | Liposome Co Inc | Metodo para acoplamiento de liposomas. |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US5108921A (en) | 1989-04-03 | 1992-04-28 | Purdue Research Foundation | Method for enhanced transmembrane transport of exogenous molecules |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| US5821332A (en) | 1993-11-03 | 1998-10-13 | The Board Of Trustees Of The Leland Stanford Junior University | Receptor on the surface of activated CD4+ T-cells: ACT-4 |
| US6410690B1 (en) | 1995-06-07 | 2002-06-25 | Medarex, Inc. | Therapeutic compounds comprised of anti-Fc receptor antibodies |
| US5922845A (en) | 1996-07-11 | 1999-07-13 | Medarex, Inc. | Therapeutic multispecific compounds comprised of anti-Fcα receptor antibodies |
| WO1998042752A1 (en) | 1997-03-21 | 1998-10-01 | Brigham And Women's Hospital Inc. | Immunotherapeutic ctla-4 binding peptides |
| AU2873999A (en) | 1998-02-24 | 1999-09-06 | Sisters Of Providence In Oregon | Compositions containing an OX-40 receptor binding agent or nucleic acid encoding the same and methods for enhancing antigen-specific immune response |
| NZ512553A (en) | 1998-12-23 | 2004-02-27 | Pfizer | Human monoclonal antibodies to cytotoxic T lymphocyte antigen 4 (CTLA-4) |
| PL362804A1 (en) | 1999-08-23 | 2004-11-02 | Dana-Farber Cancer Institute | Novel b7-4 molecules and uses therefor |
| KR100942863B1 (ko) | 1999-08-24 | 2010-02-17 | 메다렉스, 인코포레이티드 | 인간 씨티엘에이-4 항체 및 그의 용도 |
| ES2629683T3 (es) | 1999-11-30 | 2017-08-14 | Mayo Foundation For Medical Education And Research | B7-H1, una nueva molécula inmunorreguladora |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| CA2489004C (en) | 2002-06-13 | 2013-01-08 | Crucell Holland B.V. | Agonistic binding molecules to the human ox40 receptor |
| US7393531B2 (en) * | 2003-01-21 | 2008-07-01 | Arius Research Inc. | Cytotoxicity mediation of cells evidencing surface expression of MCSP |
| WO2005092925A2 (en) | 2004-03-24 | 2005-10-06 | Xencor, Inc. | Immunoglobulin variants outside the fc region |
| GB2436472B (en) | 2004-11-23 | 2009-11-25 | Pip Co Ltd | Built-in wall water service box |
| AU2006244885B2 (en) | 2005-05-09 | 2011-03-31 | E. R. Squibb & Sons, L.L.C. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| PL2559690T3 (pl) | 2005-05-10 | 2016-09-30 | Modulatory 2,3-dioksygenazy indoloaminy i sposoby ich zastosowania | |
| HUE026039T2 (en) | 2005-07-01 | 2016-05-30 | Squibb & Sons Llc | Human monoclonal antibodies programmed for death ligand 1 (PD-L1) |
| WO2007075598A2 (en) | 2005-12-20 | 2007-07-05 | Incyte Corporation | N-hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase |
| CL2007002650A1 (es) | 2006-09-19 | 2008-02-08 | Incyte Corp | Compuestos derivados de heterociclo n-hidroxiamino; composicion farmaceutica, util para tratar cancer, infecciones virales y desordenes neurodegenerativos entre otras. |
| EP2064207B1 (en) | 2006-09-19 | 2013-11-06 | Incyte Corporation | N-hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| WO2009014708A2 (en) | 2007-07-23 | 2009-01-29 | Cell Genesys, Inc. | Pd-1 antibodies in combination with a cytokine-secreting cell and methods of use thereof |
| EP2044949A1 (en) | 2007-10-05 | 2009-04-08 | Immutep | Use of recombinant lag-3 or the derivatives thereof for eliciting monocyte immune response |
| US10047066B2 (en) | 2007-11-30 | 2018-08-14 | Newlink Genetics Corporation | IDO inhibitors |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| CN114835812A (zh) | 2008-12-09 | 2022-08-02 | 霍夫曼-拉罗奇有限公司 | 抗-pd-l1抗体及它们用于增强t细胞功能的用途 |
| US20110007023A1 (en) | 2009-07-09 | 2011-01-13 | Sony Ericsson Mobile Communications Ab | Display device, touch screen device comprising the display device, mobile device and method for sensing a force on a display device |
| ES2601226T3 (es) | 2009-10-28 | 2017-02-14 | Newlink Genetics Corporation | Derivados de imidazol como inhibidores de IDO |
| HUE037159T2 (hu) | 2009-11-24 | 2018-08-28 | Medimmune Ltd | Targetált kötõdõ ágensek B7-H1 ellen |
| DK2949670T3 (da) | 2009-12-10 | 2019-05-13 | Hoffmann La Roche | Antistoffer, der fortrinsvis binder humant ekstracellulært CSF1R-domæne 4 og anvendelse deraf |
| PE20130479A1 (es) | 2010-03-04 | 2013-05-12 | Macrogenics Inc | Anticuerpos reactivos con b7-h3, fragmentos inmulogicamente activos de los mismos y usos de los mismos |
| EP2542587A1 (en) | 2010-03-05 | 2013-01-09 | F. Hoffmann-La Roche AG | Antibodies against human csf-1r and uses thereof |
| MX336682B (es) | 2010-03-05 | 2016-01-27 | Hoffmann La Roche | Anticuerpos contra csf-1r humanos y usos de los mismos. |
| NZ603193A (en) | 2010-05-04 | 2014-07-25 | Five Prime Therapeutics Inc | Antibodies that bind csf1r |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| PE20131403A1 (es) | 2010-08-23 | 2014-01-10 | Univ Texas | Anticuerpos anti-ox40 y metodos de uso de los mismos |
| MY162737A (en) | 2010-09-09 | 2017-07-14 | Pfizer | 4-1bb binding molecules |
| NO2694640T3 (ko) | 2011-04-15 | 2018-03-17 | ||
| RU2625034C2 (ru) | 2011-04-20 | 2017-07-11 | МЕДИММЬЮН, ЭлЭлСи | Антитела и другие молекулы, которые связывают в7-н1 и pd-1 |
| KR101685262B1 (ko) | 2011-08-23 | 2016-12-21 | 보드 오브 리전츠, 더 유니버시티 오브 텍사스 시스템 | 항-ox40 항체 및 이의 사용 방법 |
| GB201116092D0 (en) | 2011-09-16 | 2011-11-02 | Bioceros B V | Antibodies and uses thereof |
| AU2012344260B2 (en) | 2011-11-28 | 2017-09-07 | Merck Patent Gmbh | Anti-PD-L1 antibodies and uses thereof |
| JP6242804B2 (ja) | 2011-12-15 | 2017-12-06 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | ヒトcsf−1rに対する抗体及びその使用 |
| RU2014136332A (ru) | 2012-02-06 | 2016-03-27 | Дженентек, Инк. | Композиции и способы применения ингибиторов csf1r |
| AR090263A1 (es) | 2012-03-08 | 2014-10-29 | Hoffmann La Roche | Terapia combinada de anticuerpos contra el csf-1r humano y las utilizaciones de la misma |
| JP2015517490A (ja) | 2012-05-11 | 2015-06-22 | ファイブ プライム セラピューティックス インコーポレイテッド | コロニー刺激因子1受容体(csf1r)を結合させる抗体を用いて状態を治療する方法 |
| SG11201407190TA (en) | 2012-05-15 | 2014-12-30 | Bristol Myers Squibb Co | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| AR091649A1 (es) | 2012-07-02 | 2015-02-18 | Bristol Myers Squibb Co | Optimizacion de anticuerpos que se fijan al gen de activacion de linfocitos 3 (lag-3) y sus usos |
| AU2013308635A1 (en) | 2012-08-31 | 2015-03-12 | Five Prime Therapeutics, Inc. | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (CSF1R) |
| MD20180107A2 (ro) | 2013-03-18 | 2019-06-30 | Biocerox Products B.V. | Anticorpi anti-CD134 (OX40) umanizaţi şi utilizarea acestora |
| JP6588461B2 (ja) | 2014-03-31 | 2019-10-09 | ジェネンテック, インコーポレイテッド | 抗血管新生剤及びox40結合アゴニストを含む併用療法 |
| DK3126394T3 (da) * | 2014-03-31 | 2020-01-13 | Hoffmann La Roche | Anti-OX40-antistoffer og fremgangsmåder til anvendelse |
| TW201619200A (zh) * | 2014-10-10 | 2016-06-01 | 麥迪紐有限責任公司 | 人類化抗-ox40抗體及其用途 |
| AU2015343339A1 (en) * | 2014-11-03 | 2017-06-15 | Genentech, Inc. | Methods and biomarkers for predicting efficacy and evaluation of an OX40 agonist treatment |
| EP3221360A1 (en) * | 2014-11-17 | 2017-09-27 | F. Hoffmann-La Roche AG | Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists |
| JP6797137B2 (ja) * | 2015-05-29 | 2020-12-09 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | Ox40に対する抗体およびその使用 |
| WO2016200836A1 (en) | 2015-06-08 | 2016-12-15 | Genentech, Inc. | Methods of treating cancer using anti-ox40 antibodies |
| BR112017028353A2 (pt) * | 2015-06-29 | 2018-09-04 | The Rockfeller University | anticorpos para cd40 com atividade agonista melhorada |
| CA2994635A1 (en) * | 2015-08-04 | 2017-02-09 | Glaxosmithkline Intellectual Property Development Limited | Combination treatments and uses and methods thereof |
| CN114380908B (zh) | 2015-10-15 | 2023-03-17 | 苏州丁孚靶点生物技术有限公司 | 抗ox40抗体及其应用 |
| EA201891121A1 (ru) | 2015-11-19 | 2018-12-28 | Бристол-Майерс Сквибб Компани | Антитела к глюкокортикоид-индуцированному рецептору фактора некроза опухоли (gitr) и их применения |
| US11447557B2 (en) | 2015-12-02 | 2022-09-20 | Agenus Inc. | Antibodies and methods of use thereof |
| EP3383914A4 (en) | 2015-12-02 | 2019-10-30 | Agenus Inc. | ANTI-OX40 ANTIBODIES AND METHODS OF USE |
| CA3006963A1 (en) | 2015-12-03 | 2017-06-08 | Ludwig Institute For Cancer Research Ltd. | Anti-ox40 antibodies and methods of use thereof |
| WO2017134292A1 (en) | 2016-02-04 | 2017-08-10 | Glenmark Pharmaceuticals S.A. | Anti-ox40 antagonistic antibodies for the treatment of atopic dermatitis |
| EP3704159A1 (en) | 2017-11-01 | 2020-09-09 | Bristol-Myers Squibb Company | Immunostimulatory agonistic antibodies for use in treating cancer |
-
2018
- 2018-11-01 EP EP18815061.9A patent/EP3704159A1/en not_active Withdrawn
- 2018-11-01 KR KR1020207015641A patent/KR20200074214A/ko not_active Application Discontinuation
- 2018-11-01 US US16/760,776 patent/US11603410B2/en active Active
- 2018-11-01 WO PCT/US2018/058704 patent/WO2019089921A1/en unknown
- 2018-11-01 CN CN201880085048.3A patent/CN111542544A/zh active Pending
- 2018-11-01 JP JP2020543734A patent/JP2021501801A/ja active Pending
-
2023
- 2023-03-10 US US18/181,661 patent/US20230357423A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019089921A1 (en) | 2019-05-09 |
| JP2021501801A (ja) | 2021-01-21 |
| CN111542544A (zh) | 2020-08-14 |
| US20230357423A1 (en) | 2023-11-09 |
| US20200369777A1 (en) | 2020-11-26 |
| US11603410B2 (en) | 2023-03-14 |
| EP3704159A1 (en) | 2020-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230235060A1 (en) | Neutralization of inhibitory pathways in lymphocytes | |
| US20230111786A1 (en) | Compositions comprising a combination of an anti-lag-3 antibody, a pd-1 pathway inhibitor, and an immunotherapeutic agent | |
| US20230357423A1 (en) | Immunostimulatory agonistic antibodies for use in treating cancer | |
| EP2699598B1 (en) | Combinations of anti-4-1bb antibodies and adcc-inducing antibodies for the treatment of cancer | |
| KR20180088907A (ko) | Pd-1에 대한 항체 분자 및 그의 용도 | |
| JP6970099B2 (ja) | ガンの処置のための方法及び医薬組成物 | |
| JP7351845B2 (ja) | Micaおよび/またはmicbに対する抗体ならびにそれらの使用 | |
| US11230598B2 (en) | Antibodies and methods for depleting regulatory bio cells and use in combination with immune checkpoint inhibitors | |
| RU2692248C2 (ru) | Улучшенные способы лечения васкуляризированных злокачественных опухолей | |
| US20210155703A1 (en) | Anti-cd27 antibodies and uses thereof | |
| KR20200142542A (ko) | Cd73 길항제 항체 및 pd-1/pd-l1 축 길항제 항체에 의한 항암 조합 요법 | |
| KR20210031479A (ko) | Cd137 및 ox40에 결합하는 항체 분자 | |
| JP2023517794A (ja) | 抗tnfr2抗体及びその使用 | |
| CA3125962A1 (en) | Antibodies specific to human nectin-2 | |
| JP7280387B2 (ja) | 抗原結合タンパク質 | |
| JP2020512357A (ja) | 抗gitr抗体を使用した癌の併用療法 | |
| RU2788092C2 (ru) | Молекулы антител к pd-1 и их применения | |
| CN117980336A (en) | Anti-TNFR2 antibodies and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal |