KR20200059272A - 안구 질환의 치료에서의 사용을 위한 라타노프로스트를 포함하는 안과적 조성물 - Google Patents
안구 질환의 치료에서의 사용을 위한 라타노프로스트를 포함하는 안과적 조성물 Download PDFInfo
- Publication number
- KR20200059272A KR20200059272A KR1020207011983A KR20207011983A KR20200059272A KR 20200059272 A KR20200059272 A KR 20200059272A KR 1020207011983 A KR1020207011983 A KR 1020207011983A KR 20207011983 A KR20207011983 A KR 20207011983A KR 20200059272 A KR20200059272 A KR 20200059272A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- latanoprost
- eye
- administered
- use according
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 237
- GGXICVAJURFBLW-CEYXHVGTSA-N latanoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1CC[C@@H](O)CCC1=CC=CC=C1 GGXICVAJURFBLW-CEYXHVGTSA-N 0.000 title claims abstract description 181
- 229960001160 latanoprost Drugs 0.000 title claims abstract description 164
- 208000022873 Ocular disease Diseases 0.000 title description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 88
- 239000007788 liquid Substances 0.000 claims abstract description 84
- 230000004410 intraocular pressure Effects 0.000 claims abstract description 77
- 150000001335 aliphatic alkanes Chemical class 0.000 claims abstract description 60
- 208000010412 Glaucoma Diseases 0.000 claims abstract description 48
- 208000024891 symptom Diseases 0.000 claims abstract description 43
- 206010030043 Ocular hypertension Diseases 0.000 claims abstract description 42
- 230000002265 prevention Effects 0.000 claims abstract description 12
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical group CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 124
- 239000002904 solvent Substances 0.000 claims description 27
- 239000003755 preservative agent Substances 0.000 claims description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 14
- XXJWXESWEXIICW-UHFFFAOYSA-N diethylene glycol monoethyl ether Chemical compound CCOCCOCCO XXJWXESWEXIICW-UHFFFAOYSA-N 0.000 claims description 11
- 229940075557 diethylene glycol monoethyl ether Drugs 0.000 claims description 9
- 229940057917 medium chain triglycerides Drugs 0.000 claims description 3
- 210000001508 eye Anatomy 0.000 description 142
- 238000000034 method Methods 0.000 description 50
- 239000006196 drop Substances 0.000 description 34
- 239000000243 solution Substances 0.000 description 26
- WRYIIOKOQSICTB-UHFFFAOYSA-N 1,1,1,2,2,3,3,4,4,5,5,6,6-tridecafluorotetradecane Chemical compound CCCCCCCCC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F WRYIIOKOQSICTB-UHFFFAOYSA-N 0.000 description 16
- 229940002639 xalatan Drugs 0.000 description 16
- 241001465754 Metazoa Species 0.000 description 14
- 239000007864 aqueous solution Substances 0.000 description 13
- GYDMBTYTWYNRGO-UHFFFAOYSA-N 1,1,1,2,2,3,3,4,4-nonafluorononane Chemical compound CCCCCC(F)(F)C(F)(F)C(F)(F)C(F)(F)F GYDMBTYTWYNRGO-UHFFFAOYSA-N 0.000 description 10
- 238000009472 formulation Methods 0.000 description 10
- -1 prostamides Chemical class 0.000 description 10
- 230000009467 reduction Effects 0.000 description 9
- 210000001742 aqueous humor Anatomy 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 239000012530 fluid Substances 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 150000003180 prostaglandins Chemical class 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 7
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 210000001328 optic nerve Anatomy 0.000 description 7
- 239000002953 phosphate buffered saline Substances 0.000 description 7
- 210000004087 cornea Anatomy 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 239000003889 eye drop Substances 0.000 description 6
- 210000000744 eyelid Anatomy 0.000 description 6
- 150000002430 hydrocarbons Chemical group 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 208000028389 Nerve injury Diseases 0.000 description 5
- AQOKCDNYWBIDND-FTOWTWDKSA-N bimatoprost Chemical compound CCNC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)CCC1=CC=CC=C1 AQOKCDNYWBIDND-FTOWTWDKSA-N 0.000 description 5
- 229960002470 bimatoprost Drugs 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 230000004406 elevated intraocular pressure Effects 0.000 description 5
- 206010023332 keratitis Diseases 0.000 description 5
- 230000008764 nerve damage Effects 0.000 description 5
- 229960004458 tafluprost Drugs 0.000 description 5
- WSNODXPBBALQOF-VEJSHDCNSA-N tafluprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\C(F)(F)COC1=CC=CC=C1 WSNODXPBBALQOF-VEJSHDCNSA-N 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 241000282472 Canis lupus familiaris Species 0.000 description 4
- 210000000795 conjunctiva Anatomy 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 230000003285 pharmacodynamic effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 230000009885 systemic effect Effects 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- MKPLKVHSHYCHOC-AHTXBMBWSA-N travoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)COC1=CC=CC(C(F)(F)F)=C1 MKPLKVHSHYCHOC-AHTXBMBWSA-N 0.000 description 4
- 229960002368 travoprost Drugs 0.000 description 4
- 201000004569 Blindness Diseases 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010020649 Hyperkeratosis Diseases 0.000 description 3
- 208000001126 Keratosis Diseases 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 230000002335 preservative effect Effects 0.000 description 3
- 229940127293 prostanoid Drugs 0.000 description 3
- 150000003814 prostanoids Chemical class 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- TVHAZVBUYQMHBC-SNHXEXRGSA-N unoprostone Chemical compound CCCCCCCC(=O)CC[C@H]1[C@H](O)C[C@H](O)[C@@H]1C\C=C/CCCC(O)=O TVHAZVBUYQMHBC-SNHXEXRGSA-N 0.000 description 3
- 229960004317 unoprostone Drugs 0.000 description 3
- 210000003462 vein Anatomy 0.000 description 3
- 230000004393 visual impairment Effects 0.000 description 3
- 208000006820 Arthralgia Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000008035 Back Pain Diseases 0.000 description 2
- 206010006784 Burning sensation Diseases 0.000 description 2
- 206010008479 Chest Pain Diseases 0.000 description 2
- 206010051625 Conjunctival hyperaemia Diseases 0.000 description 2
- 206010012434 Dermatitis allergic Diseases 0.000 description 2
- 206010012689 Diabetic retinopathy Diseases 0.000 description 2
- 208000003556 Dry Eye Syndromes Diseases 0.000 description 2
- 206010013774 Dry eye Diseases 0.000 description 2
- 208000005189 Embolism Diseases 0.000 description 2
- 206010015150 Erythema Diseases 0.000 description 2
- 206010015958 Eye pain Diseases 0.000 description 2
- 206010015993 Eyelid oedema Diseases 0.000 description 2
- 206010059208 Eyelid pain Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 206010020565 Hyperaemia Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 2
- 208000000112 Myalgia Diseases 0.000 description 2
- 206010034960 Photophobia Diseases 0.000 description 2
- 102000000471 Prostaglandin F receptors Human genes 0.000 description 2
- 108050008995 Prostaglandin F receptors Proteins 0.000 description 2
- 208000003251 Pruritus Diseases 0.000 description 2
- 206010057190 Respiratory tract infections Diseases 0.000 description 2
- 206010038848 Retinal detachment Diseases 0.000 description 2
- 206010046851 Uveitis Diseases 0.000 description 2
- 208000034698 Vitreous haemorrhage Diseases 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000004509 aqueous humor production Effects 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 229960000686 benzalkonium chloride Drugs 0.000 description 2
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 210000005252 bulbus oculi Anatomy 0.000 description 2
- 210000004240 ciliary body Anatomy 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 231100000321 erythema Toxicity 0.000 description 2
- 150000002148 esters Chemical group 0.000 description 2
- 210000004709 eyebrow Anatomy 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 229920001903 high density polyethylene Polymers 0.000 description 2
- 239000004700 high-density polyethylene Substances 0.000 description 2
- 230000007803 itching Effects 0.000 description 2
- 229940110775 latanoprost ophthalmic solution Drugs 0.000 description 2
- 208000018769 loss of vision Diseases 0.000 description 2
- 231100000864 loss of vision Toxicity 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 208000013465 muscle pain Diseases 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 230000019612 pigmentation Effects 0.000 description 2
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229940068968 polysorbate 80 Drugs 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 208000020029 respiratory tract infectious disease Diseases 0.000 description 2
- 230000004264 retinal detachment Effects 0.000 description 2
- 230000002207 retinal effect Effects 0.000 description 2
- 230000035807 sensation Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- PXGPLTODNUVGFL-BRIYLRKRSA-N (E,Z)-(1R,2R,3R,5S)-7-(3,5-Dihydroxy-2-((3S)-(3-hydroxy-1-octenyl))cyclopentyl)-5-heptenoic acid Chemical compound CCCCC[C@H](O)C=C[C@H]1[C@H](O)C[C@H](O)[C@@H]1CC=CCCCC(O)=O PXGPLTODNUVGFL-BRIYLRKRSA-N 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000006734 Beta-Globulins Human genes 0.000 description 1
- 108010087504 Beta-Globulins Proteins 0.000 description 1
- 101000862089 Clarkia lewisii Glucose-6-phosphate isomerase, cytosolic 1A Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 235000011511 Diospyros Nutrition 0.000 description 1
- 244000055850 Diospyros virginiana Species 0.000 description 1
- 206010059284 Epidermal necrosis Diseases 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 206010015946 Eye irritation Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 1
- 101000988802 Homo sapiens Hematopoietic prostaglandin D synthase Proteins 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 201000002287 Keratoconus Diseases 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 206010030348 Open-Angle Glaucoma Diseases 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102000008866 Prostaglandin E receptors Human genes 0.000 description 1
- 108010088540 Prostaglandin E receptors Proteins 0.000 description 1
- 102000015433 Prostaglandin Receptors Human genes 0.000 description 1
- 108010050183 Prostaglandin Receptors Proteins 0.000 description 1
- 206010042033 Stevens-Johnson syndrome Diseases 0.000 description 1
- 102000003938 Thromboxane Receptors Human genes 0.000 description 1
- 108090000300 Thromboxane Receptors Proteins 0.000 description 1
- 206010044223 Toxic epidermal necrolysis Diseases 0.000 description 1
- 231100000087 Toxic epidermal necrolysis Toxicity 0.000 description 1
- 206010046306 Upper respiratory tract infection Diseases 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 210000002159 anterior chamber Anatomy 0.000 description 1
- 229940053200 antiepileptics fatty acid derivative Drugs 0.000 description 1
- 239000013011 aqueous formulation Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000004397 blinking Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 238000009530 blood pressure measurement Methods 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 description 1
- 229960002986 dinoprostone Drugs 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 150000002066 eicosanoids Chemical class 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 231100000013 eye irritation Toxicity 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 229910001410 inorganic ion Inorganic materials 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 230000003780 keratinization Effects 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229920001684 low density polyethylene Polymers 0.000 description 1
- 239000004702 low-density polyethylene Substances 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000011169 microbiological contamination Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000004493 normal intraocular pressure Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 150000003815 prostacyclins Chemical class 0.000 description 1
- BHMBVRSPMRCCGG-OUTUXVNYSA-N prostaglandin D2 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](C\C=C/CCCC(O)=O)[C@@H](O)CC1=O BHMBVRSPMRCCGG-OUTUXVNYSA-N 0.000 description 1
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 description 1
- 150000003169 prostaglandin F2α derivatives Chemical class 0.000 description 1
- KAQKFAOMNZTLHT-OZUDYXHBSA-N prostaglandin I2 Chemical compound O1\C(=C/CCCC(O)=O)C[C@@H]2[C@@H](/C=C/[C@@H](O)CCCCC)[C@H](O)C[C@@H]21 KAQKFAOMNZTLHT-OZUDYXHBSA-N 0.000 description 1
- BHMBVRSPMRCCGG-UHFFFAOYSA-N prostaglandine D2 Natural products CCCCCC(O)C=CC1C(CC=CCCCC(O)=O)C(O)CC1=O BHMBVRSPMRCCGG-UHFFFAOYSA-N 0.000 description 1
- 102000017953 prostanoid receptors Human genes 0.000 description 1
- 108050007059 prostanoid receptors Proteins 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- 210000001747 pupil Anatomy 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 235000021391 short chain fatty acids Nutrition 0.000 description 1
- 235000019997 soju Nutrition 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000002636 symptomatic treatment Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940126703 systemic medication Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 239000012815 thermoplastic material Substances 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 150000003595 thromboxanes Chemical class 0.000 description 1
- 229940126702 topical medication Drugs 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/5575—Eicosanoids, e.g. leukotrienes or prostaglandins having a cyclopentane, e.g. prostaglandin E2, prostaglandin F2-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
Abstract
본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물을 제공하고, 여기서
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
상기 조성물은 대상체의 눈에 투여되고; 및
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이다.
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
상기 조성물은 대상체의 눈에 투여되고; 및
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이다.
Description
본 발명은 약물 치료의 분야에 관한 것이다. 더욱 특히, 본 발명은 눈에 영향을 미치는 질환 및 병태 가령 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료에 관한 것이다.
안압 상승은 종종 시신경 손상과 관련된 눈의 빈번한 장애이며,이 경우 질병은 녹내장이다. 시신경 손상이 없으면 이 병태는 안구 고혈압이라고 한다.
정상 안내압은 일반적으로 10 내지 21 mmHg 범위로 정의된다. 압력은 주로 눈 속의 수양액의 생성 속도와 배수 속도 사이의 균형에서 비롯된다. 또한 각막 두께와 강도에 영향을 받는다. 안내압은 전형적으로 약 6 mmHg의 진폭으로 약 15 내지 16 mmHg 정도로 변동한다. 예를 들어, 일반적으로 수양액 생성 감소로 인해 안내압은 밤에 감소한다. 또한 특정 유형의 전신 또는 국소 약물뿐만 아니라 운동, 심박수, 호흡, 체액 섭취와 같은 다양한 생리적 요인에 반응한다.
수양액은 눈의 섬모체에 의해 생성되어 뒤쪽 챔버로 흘러 들어간다. 수양액의 조성은 혈장의 조성과 매우 유사하지만 단백질 함량이 낮다는 점에서 후자와 다르다. 주요 구성 성분은 물 (99 %), 전해질 (생리적 pH를 유지하기위한 무기 이온), 적은 양의 알부민 및 β- 글로불린, 아스 코르 베이트, 포도당, 젖산염 및 아미노산이다.
후방 챔버로부터, 수양액은 홍채 동공을 통해 눈의 전방 챔버로 분배된다. 여기에서 수양액은 소위 섬유주대를 통해 흐른다. 섬유주대는 수양액이 혈액 순환계로 들어가는 곳인 쉴렘관이라고 불리는 관으로 수양액을 배출하는 소주세포가 늘어선 해면 조직 영역이다. 섬유주대에서 쉴렘관으로의 수양액 흐름은 두 가지 다른 경로를 통해 발생한다 : 수성 정맥을 통해 상피 정맥으로 직접 또는 수집기 채널을 통해 경골 내 신경총에 의해 상피 정맥으로 간접적으로. 이 배출 유출 경로는 배출된 수양액의 주요 분율을 설명한다. 또한, 포도막 유출인 제 2 주요 배수 경로가 존재하는데, 이는 안내압과 비교적 독립적이며, 건강한 인간에서 수양액 배출의 5 내지 10 %만을 차지한다.
섬유주대 및 포도공막 조직 둘 다에서, 다양한 프로스타노이드 수용체가 발견되었으며, 이는 프로스타노이드가 수양액 생성 및/또는 배출의 조절에 관여하여 안압에 영향을 준다는 것을 나타낸다. 섬유주대에서, EP, FP, IP, DP 및 TP 수용체 패밀리를 인코딩하는 유전자가 발현되는 반면, EP 및 FP 수용체 패밀리는 포도공막 조직에서 우세하다 (Toris et al., Surv Ophthalmol. 2008; 53, Suppl. 1, S107-S120).
프로스타노이드는 에이코사노이드의 서브클래스를 나타내는 생리학적 지방산 유도체이다. 이들은 프로스타글란딘, 프로스타미드, 트롬복산 및 프로스타사이클린을 포함하며, 이들 화합물은 모두 수많은 생리학적 과정에 관여하는 매개체이다. PGF2α, PGE2, PGD2 및 PGI2와 같은 천연 프로스타글란딘은 이들의 각각의 수용체 (FP, EP, DP, IP)에 대해 특정 친화력을 나타내지만, 다른 프로스타글란딘 수용체 (ibid.)에 대해서는 일부 비선택적 친화도를 갖는다. 프로스타글란딘은 또한 매트릭스 메탈로프로티나제에 직접적인 영향을 미친다. 이들은 세포외 매트릭스를 분해함으로써 체액 유출 저항성을 제어하는 역할을 하는 섬유주대에서 발현된 중성 단백질 분해 효소이다.
라타노프로스트, 비마토프로스트, 타플루프로스트, 트라보프로스트 및 우노프로스톤과 같은 안내압을 감소시키는데 국소 투여되는 약물로서 여러 프로스타글란딘 유사체가 효과적인 것으로 밝혀졌다. 일부 전문가에 의해, 비마토프로스트는 프로스타글란딘 유도체가 아닌 프로스타미드로 이해된다.
라타노프로스트, 트라보프로스트, 타플루프로스트 및 아마도 비마토프로스트는 강력하고 선택적인 PGF2α 작용제이다. 이들의 순 효과는 안내압의 감소이며, 이는 주로 포도공막 경로를 통한 수양액 배수의 실질적인 증가에 의해 야기된다. 아마도 이들은 또한 어느 정도까지 유출을 증가시킨다.
프로스타글란딘 유사체를 포함하는 다양한 점안 제제가 개발되어 시판되고 있다. 라타노프로스트 및 트라보프로스트는 각각 50 ㎍/mL (0.005 %) 및 40 ㎍/mL (0.004 %)의 강도를 갖는 다중 용량 병에서 완충, 등장성, 보존된 수용액으로 제공된다. 타플루프로스트는 유사한 보존된 제형뿐만 아니라 단일 용량 용기의 비-보존 제형으로 이용 가능하다. 타플루프로스트 제제는 15 ㎍/mL (0.0015 %)의 강도를 가지며 계면 활성제, 폴리소르베이트 80을 추가로 함유한다. 비마토프로스트는 또한 완충, 등장성 및 보존된 수용액으로서 시판되고; 강도는 0.3 mg/mL (0.03 %)이다. 시판 우노프로스톤 제제의 강도는 1.5 mg/mL (0.15 %)이다. 완충제, 방부제, 등장화제 및 폴리소르베이트 80을 함유한다.
그러나, 안과용으로 보존된 수성 제형은 특히 녹내장 요법에서와 같이 장기간 사용시, 자극성 또는 과민 반응을 생성할 수 있다는 점에서 불리하다. 상기 언급된 제형에서 가장 일반적인 보존제는 빈번한 자극성 독성 반응과 관련된 4 급 암모늄 화합물인 벤즈알코늄 클로라이드이다. 보존되지 않은 일회용 용기는 이러한 단점을 피할 수 있지만 비용이 많이 든다. 이들은 각각의 단일 용량에 대한 용기를 필요로 할 뿐만 아니라 제제의 과충진도 필요로 하는데, 이는 실제 의약품의 상당 부분 (대부분은 아니지만)이 용기에 남아 폐기물로 배출됨을 의미한다. 눈에 실제로 투여되는 점안액의 약물을 고려할 때, 눈물 주머니의 제한된 부피 용량으로 인해 그 일부만이 효과적이다. 투여된 액체 부피의 상당 부분이 눈꺼풀이 깜박거림으로써 방출된다. 또 다른 분획은 비강관을 통해 전신적으로 취해져 잠재적으로 약물 효과를 저하시킨다.
라타노프로스트의 현재 이용가능한 제제에 함유된 보존제에도 불구하고, 추정컨대 환자 자신에 의한 제품의 미생물학적 오염에 의해 야기된 세균성 각막염의 보고가 있으며, 이는 제품의 미생물학적 안전성이 단지 상대적이라는 것을 나타낸다.
Xalatan® (라타노프로스트) 0.005 % 점안액 및 관련 명칭은 1996 년부터 여러 EU 회원국에서 개방 각 녹내장 및 안구 고혈압 성인 환자의 안압 상승 감소에 대해 승인되었다. Xalatan은 라타노프로스트의 멸균, 등장성 완충 완충액으로서 50 ㎍/mL의 농도이다. 한 방울의 수용액은 대략 1.5 ㎍의 라타노프로스트를 함유하고 눈에 국소 투여하기 위한 것이다. Xalatan은 약 80 방울의 용액에 해당하는 2.5mL의 Xalatan을 포함하는 5mL 플라스틱 안과용 디스펜서 병에 공급된다. Xalatan의 각 mL는 50 μg의 라타노프로스트를 함유하고, 주사용수 및 방부제로서의 염화 벤잘 코늄을 추가로 포함한다. 성인에게 권장되는 일일 복용량은 병에 걸린 눈 (들)에 투여되는 1 개의 점안액 (약 1.5 ㎍ 라타노프로스트에 해당)이며, 저녁에 투여하면 최적의 효과를 얻을 수 있다.
WO2011/113855 A2는 넓은 범위의 활성 성분의 담체로서 유용한 부분불소화 알칸에 기초한 증가된 안내압의 치료를 위한 약제학적 조성물을 개시한다. 바람직한 활성 성분은 난용성 프로스타글란딘 유사체, 예를 들어 라타노프로스트, 비마토프로스트, 타플루프로스트, 트라보프로스트 및 우노프로스톤을 포함한다. 조성물은 눈에 국소적으로 투여될 수 있다.
본 발명의 목적은 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 예방 또는 치료 방법에 유용한 신규한 약제학적 조성물을 제공하는데, 이는 종래 기술의 제형과 관련된 제한 또는 단점 중 하나 이상을 극복한다. 특이적 양상에서, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 관리에 유용한 실질적으로 다량의 난용성 약물 물질을 혼입시키는 능력을 갖는 안과용 조성물을 제공하는 것이 본 발명의 목적이다. 본 발명의 다른 목적은 다음의 설명, 실시예 및 특허 청구 범위에 기초하여 명백해질 것이다.
발명의 요약
제 1 양상에서, 본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물에 관한 것이고, 여기서
-
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
-
상기 조성물은 대상체의 눈에 투여되고; 및
-
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이다.
추가 양상에서, 본 발명은 본 발명의 제 1 양상에 따르는 상기 사용을 위한 약제학적 조성물을 포함하는 키트를 제공하고, 여기서 키트는 상기 약제학적 조성물을 수용하기 위한 용기 및 상기 조성물을 투여하기 위한 점적 디스페서를 포함한다.
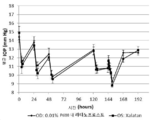
도 1은 아래에 추가로 설명된 실험적 동물 연구 (개)의 두 개의 시험의 결과를 나타내고, 여기서 라타노프로스트의 반복 외용 안구 투여 후 안내압 (IOP)에 대한 약력학이 연구되었다.
도 2는 아래에 추가로 설명된 바와 같이 시험 동물의 오른쪽 눈 (OD)에 투여된 F6H8 내 라타노프로스트를 포함하는 조성물 대 동일 시험 동물의 왼쪽 눈 (OS)에 투여된 Xalatan®의 헤드 대 헤드 비교의 결과를 나타낸다.
도 2는 아래에 추가로 설명된 바와 같이 시험 동물의 오른쪽 눈 (OD)에 투여된 F6H8 내 라타노프로스트를 포함하는 조성물 대 동일 시험 동물의 왼쪽 눈 (OS)에 투여된 Xalatan®의 헤드 대 헤드 비교의 결과를 나타낸다.
제 1 양상에서, 본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물에 관한 것이고, 여기서
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
상기 조성물은 대상체의 눈에 투여되고; 및
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이다.
본 발명에 따르는 약제학적 조성물은 녹내장 및/또는 이와 관련된 증상, 예를 들어 가령 아래 기술된 증상의 치료 또는 예방에 유용하다. 본원에서 이해되는 녹내장은 시신경을 손상시키고 시력 상실을 초래할 수 있는 눈 병태에 대한 용어이다. 상이한 유형의 녹내장을 분류하는데 있어서 주요 구분은 개방 각 및 폐쇄 각 (또는 폐쇄 각) 녹내장이다. 개방 각은 홍채가 제대로 넓고 개방되어 각막을 만나서, 눈 안쪽의 유체가 배출되어 내부 압력을 완화시키는 것을 허용하는 각도를 지칭한다. 이 각도가 좁아지거나 닫히면 압력이 상승하여 시신경을 손상시켜 시력을 잃을 수 있다.
본 발명에 따른 약제학적 조성물은 또한 안압 상승 (IOP) 및/또는 이와 관련된 증상, 예를 들어 하기 기재된 증상의 치료 또는 예방에 유용하다. 본원에서 이해되는 IOP는 녹내장 발생의 주요 위험 인자를 구성한다. IOP는 시신경 손상의 주요 원인이며 눈 속의 과도한 유체 압력을 특징으로 하고, 이는 배수관 막힘, 홍채와 각막 사이의 각도가 좁아지거나 닫히는 등 여러 가지 이유로 발생할 수 있다. 높은 IOP는 녹내장 전장 손실의 주요 위험 요소를 나타낸다. IOP 수준이 높을수록 시신경 손상 및 시야 손실 가능성이 높아진다.
또한, 본 발명에 따른 약제학적 조성물은 예를 들어 아래에 기술된 증상과 같은 안구 고혈압 및/또는 이와 관련된 증상의 치료 또는 예방에 유용하다. 본원에서 이해되는 안구 고혈압이라는 용어는 일반적으로 시신경 손상 또는 시야 손실이 없는 눈 내부의 높은 수압의 존재를 의미한다. 안압 상승은 녹내장의 중요한 위험 요소이다. 대부분의 개인에 있어서, 안압의 정상 범위는 10 mmHg 내지 21 mmHg이다. 특히 다른 위험 요소가 있는 경우, 안압이 21mmHg보다 높은 대부분의 개인은 진행 중인 안구 고혈압으로 인한 녹내장으로 인한 시력 손실을 방지하기 위해 일반적으로 치료된다. 눈의 고혈압은 섬모체를 통해 눈으로 들어가는 유체와 섬유주대를 통해 눈을 빠져 나가는 유체 사이의 불균형의 결과로 간주될 수 있다.
본 발명에 따른 사용을 위한 조성물은 실험식 C26H40O5 및 분자량 432.593 g/mol (CAS 번호 130209-82-4)을 갖는 활성 성분 라타노프로스트를 포함한다. 라타노프로스트는 각막의 유리 산에 활성화되는 에스테르 프로드러그이다. 이는 프로스타글란딘 F2- 알파 유사체, 보다 구체적으로는 수성 유제의 유출을 증가시킴으로써 안압 (IOP)을 감소시키는 것으로 여겨지는 프로스타노이드 선택적 FP 수용체 작용제이다. 동물과 사람에 대한 연구에 따르면 주요 작용 메커니즘은 포도막 유출 증가이다.
바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 약 0.005 % 내지 약 0.015 % (w/v) 라타노프로스트, 더욱 바람직하게는 약 0.008 % 내지 약 0.015 % (w/v) 및 가장 바람직하게는 약 0.008 % 내지 약 0.012% (w/v)의 활성 화합물 라타노프로스트를 포함한다. 또다른 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 약 0.010 % (w/v)의 활성 성분 라타노프로스트를 포함한다.
달리 지시되지 않는 한, 본 약제학적 조성물과 관련하여 본원에 사용된 용어 "% (w/v)"는 조성물의 총 부피 (무게를 나타내는 'w'및 부피를 나타내는 'v')에 대한 조성물의 성분의 양 (예를 들어, 라타노프로스트)을 중량 백분율로 나타낸다. 예를 들어, 0.05 % (w/v)는 조성물 1mL 중의 성분 0.5mg에 관한 것으로 이해될 수 있고, 0.1 % (w/v)는 조성물 1mL 중의 성분 1.0mg에 상응할 것이다. 달리 지시되지 않는 한, 용어 "% (w/w)"는 조성물의 총중량에 대한 조성물의 성분의 양을 중량 백분율로 지칭한다 ( 'w'는 중량을 나타냄).
예를 들어, 조성물에 용해된 라타노프로스트의 농도 또는 조성물의 단일 용량으로 특징지어지는 라타노프로스트의 양과 같은 파라미터와 관련하여 또는 본원에서 사용되는 용어 "약"은 정의된 정확한 값을 포함하고, 뿐만 아니라 당 업계 및 공지의 표준 기술 및 장비를 사용하여 이들 파라미터를 측정 또는 결정하는데 일반적으로 관찰되는 편차 정도 내에 속하는 임의의 값을 포함한다.
본 발명에 따르는 약제학적 조성물은 부분불소화 알칸을 포함하는 액체 비히클을 추가로 포함한다. 활성 성분 라타노프로스트는 아래 기술된 바와 같이 상기한 부분불소화 알칸을 포함하는 액체 비히클 내에 용해 또는 현탁, 바람직하게는 용해될 수 있다. 여기서 전체를 통해 동의어로 사용된 용어 "부분불소화 알칸" 또는 "SFA"는 비-불소화 탄화수소 부분에 부착된 과불소화 탄화수소 부분으로 이루어진 화합물을 지칭한다. 두 부분은 모두 분지 또는 선형일 수 있다. 그러나 바람직하게는, 두 부분은 모두 비분지, 선형 부분이다.
바람직한 구체예에서, 본 약제학적 조성물의 액체 비히클은 부분불소화 알칸 또는 두 개 이상의 상이한 부분불소화 알칸의 혼합물을 포함한다. 바람직하게는, 그러나, 본 약제학적 조성물의 액체 비히클은 단지 하나의 부분불소화 알칸을 포함한다.
본 발명에서, 바람직한 부분불소화 알칸은 일반식 (I)을 가지고
CF3(CF2)n(CH2)mCH3
(I),
여기서 지수 n은 3 내지 5로부터 선택된 정수이고, 그리고 m은 4 내지 7로부터 선택된 정수이다.
하기 괄호에 언급되고 본원에 추가로 사용될 수 있는 특정 부분불소화 알칸에 대한 대안적인 명명법은 일반식 FnHm을 기초로 하며, 여기서 F는 선형 퍼 플루오르화 탄화수소 세그먼트를 의미하고, H는 선형 비-불소화 탄화수소 세그먼트를 의미하고, n, m은 각각의 세그먼트의 탄소 원자의 수이다. 예를 들어, F4H5 는1-퍼플루오로부틸-펜탄 또는 CF3(CF2)3-(CH2)4CH3를 지칭하도록 사용될 수 있다 (이는 또한, 4 탄소 (n = 4)를 갖는 선형 과불소화 부분 F 및 9 탄소 (m = 5)를 갖는 선형 비-불소화 탄화수소 부분을 가지는 식 F(CF2)4(CH2)5H)로 다르게 표현될 수 있다. 또한, F6H8는 1-퍼플루오로헥실-옥탄 또는 CF3(CF2)5-(CH2)7CH3를 지칭하도록 사용될 수 있다 (이는 또한 6 탄소 (n = 6)를 갖는 선형 과불소화 부분 F 및 8 탄소 (m = 8)를 갖는 선형 비-불소화 탄화수소 부분을 가지는 식 F(CF2)6(CH2)8H)로 다르게 표현될 수 있다.
따라서, 본 발명의 조성물에서 사용된 상기 부분불소화 알칸은 CF3(CF2)3-(CH2)4CH3 (F4H5), CF3(CF2)3-(CH2)5CH3 (F4H6), CF3(CF2)3-(CH2)6CH3 (F4H7), CF3(CF2)3-(CH2)7CH3 (F4H8), CF3(CF2)4-(CH2)4CH3 (F5H5), CF3(CF2)4-(CH2)5CH3 (F5H6), CF3(CF2)4-(CH2)6CH3 (F5H7), CF3(CF2)4-(CH2)7CH3 (F5H8), CF3(CF2)5-(CH2)4CH3 (F6H5), CF3(CF2)5-(CH2)5CH3 (F6H6), CF3(CF2)5-(CH2)6CH3 (F6H7) 및 CF3(CF2)5-(CH2)7CH3 (F6H8)로부터 선택될 수 있다. 더욱 바람직하게는, 상기 부분불소화 알칸은 CF3(CF2)3-(CH2)4CH3 (F4H5) 및 CF3(CF2)5-(CH2)7CH3 (F6H8)로부터 선택될 수 있다.
바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 1-퍼플루오로부틸-펜탄 (CF3(CF2)3-(CH2)4CH3 (F4H5))로부터 선택되는 식 (I)의 부분불소화 알칸을 포함한다. 본 발명의 특정의 바람직한 구체예에서, 상기 식 (I)의 부분불소화 알칸은 1-퍼플루오로헥실-옥탄 (CF3(CF2)5(CH2)7CH3, (F6H8))이다.
전술한 바와 같은 액체 SFA는 화학적으로 생리학적으로 불활성이며 무색이며 안정하다. 전형적인 밀도는 1.1 ~ 1.7 g/cm3 이며 표면 장력은 19 mN/m 정도로 낮을 수 있다. FnHm 타입의 SFA는 물에 불용성이지만 다소 양친매성이며, 비-불소화 세그먼트의 크기가 커질수록 친유성이 증가한다.
SFA가 안과용 조성물에서 담체 또는 비히클로서 특히 적합하다는 것이 본 발명자들에 의해 밝혀졌다. 이것은 전임상 테스트에서 볼 수 있듯이 SFA가 눈에 예기치 않게 잘 견디기 때문이다. 유성 화합물을 제외하고 유기 또는 비 수성 용매가 일반적으로 눈에 투여될 때 매우 자극적이거나 심지어 매우 손상되기 때문에 이는 매우 놀라운 일이다.
"어느" 부분불소화 알칸을 포함하는 본 발명의 약제학적 조성물 또는 액체 비히클은 상기한 적어도 하나의 식 (I)의 부분불소화 알칸을 포함한다고 여기서 이해되어야 한다. 임의로, 그러나, 상기 조성물 또는 액체 비히클은 식 (I), 즉 상기한 상기 부분불소화 알칸 종 중 어느 하나의 하나 초과, 예를 들어 두 개 이상의 부분불소화 알칸의 혼합물을 포함할 수 있다.
여전히 추가의 구체예에서, 본 약제학적 조성물의 액체 비히클은 위에서 특정된 식 (I)의 부분불소화 알칸으로 이루어질 수 있다. 이 문맥에서, 용어 "어느" 부분불소화 알칸은 하나 이상의 부분불소화 알칸으로 이해되어야하지만, 하나 이상의, 또는 복수의 부분불소화 알칸 화합물의 옵션을 포함할 수도 있다. 따라서, 하나의 구체예에서, 상기 액체 비히클은 하나 초과의, 위에서 특정된 식 (I)의 부분불소화 알칸으로 이루어질 수 있다.
본 명세서에서 사용된 용어 "구성되는"및 관련 용어 "구성되는"또는 "구성되는"은 그 용어에 의해 시작된 것 이외의 다른 특징이 존재하지 않음을 의미하는 것으로 이해되어야 한다. 조성물의 맥락에서, 임의의 다른 구성 성분 또는 성분이 그러한 용어에 의해 제시된 것 이외의 조성물에 존재하는 경우, 이는 단지 목적 또는 기술적 측면에서 기술적 이점 또는 관련성을 부여하지 않는 미량 또는 잔류량으로만 존재한다. 본 발명은 이러한 용어와 함께 사용되는 용어 "본질적으로"또는 "실질적으로"(예를 들어, "본질적으로 이루어진")에 의해 더 이해될 수 있다. 반 불소화된 알칸의 합성에서 유래하고 미량 또는 잔류량으로 존재하여 정제시 정량적으로 제거될 수 없고, 대상과 관련하여 기술적 이점 또는 관련성을 부여하지 않는 이성질체 또는 올레핀성 불순물은 본 발명의 다른 구성 요소 또는 구성 요소의 상기 정의에 속하는 것으로 이해되어야 한다. 대조적으로, 본 조성물의 맥락에서 용어 "포함하는" 또는 관련 용어 "포함하는"또는 "포함하는"은 용어에 의해 제시된 것 이외의 다른 특징이 조성물에 존재할 수 있음을 의미하는 것으로 이해되어야 한다.
추가 구체예에서, 위에서 기술된 이전의 구체예에서 정의된 본 약제학적 조성물의 액체 비히클은, 바람직하게는 액체 비히클의 총중량에 대해 적어도 70 % (w/w), 75 % (w/w), 85 % (w/w), 90 % (w/w), 95 % (w/w), 98 % (w/w), 98.5 % (w/w), 99 %(w/w), 99.5 % (w/w), 99.8 % (w/w) 또는 적어도 99.9 % (w/w)의 양으로 부분불소화 알칸 또는, 임의로, 부분불소화 알칸의 혼합물을 포함한다. 본 발명의 바람직한 구체예에서, 상기 액체 비히클은 액체 비히클의 총중량에 대해 적어도 97.5 % (w/w)의 부분불소화 알칸을 포함한다.
본원에서 사용된 용어 "% (w/w)"는 달리 지시되지 않는 한 본 발명의 약제학적 조성물의 액체 비히클의 총중량에 대한 중량 백분율로서 조성물의 성분의 양을 지칭한다 ( 'w'는 무게를 나타냄).
본 발명의 여전히 추가의 구체예에서, 상기 액체 비히클은 바람직하게는 액체 비히클의 총중량에 대해 약 90 % (w/w) 내지 약 99.9 % (w/w), 더욱 바람직하게는 약 95 % (w/w) 또는 97 % (w/w) 또는 97.5 % (w/w) 내지 약 99.5 % (w/w)의 양으로 상기한 부분불소화 알칸 또는, 임의로, 부분불소화 알칸의 혼합물을 포함한다. 본 발명의 가장 바람직한 구체예에서, 상기 액체 비히클은 액체 비히클의 총중량에 대해 약 97.5 % (w/w) 내지 약 99.5% (w/w)의 양으로 부분불소화 알칸을 포함한다.
추가의 구체예에서, 본 약제학적 조성물, 보다 구체적으로, 본 약제학적 조성물의 액체 비히클은 가용화제를 추가로 포함할 수 있다. 본원에 사용된 용어 "가용화제"는 상기 기재된 바와 같은 부분불소화 알칸을 포함하는 선택된 액체 비히클에서 활성 성분 라타노프로스트의 용해도를 향상 시키거나 촉진시키는 화합물 또는 화합물의 조합을 의미한다. 바람직한 구체예에서, 상기 이미 언급된 바와 같이, 라타노프로스트는 부분불소화된 알칸 및 임의로 가용화제를 포함하는 액체 비히클에 완전히 용해된다.
본 발명의 약제학적 조성물의 액체 비히클에 의해 임의로 포함될 수 있는 가용화제는 바람직하게는 액체 비히클의 총중량에 대하여 최대 3 % (w/w) 또는 바람직하게는 2.5 % (w/w)의 양으로 존재할 수 있다. 바람직한 구체예에서, 액체 비히클은 액체 비히클의 총중량에 대해 1 % 이하 (w/w), 바람직하게는 0.5 % (w/w) 이하의 가용화제를 포함한다. 다른 바람직한 구체예에서, 액체 비히클은 약 2.5% 내지 0.5% (w/w), 바람직하게는 약 1% 내지 0.5% (w/w의 양으로)가용화제를 추가로 포함한다.
일부 구체예에서, 가용화제는 액체 부형제, 예를 들어 유기 공용매 및/또는 글리세라이드 오일, 액체 왁스 및 액체 파라핀으로부터 선택된 오일, 또는 높은 생체 적합성을 나타내는 유기 용매일 수 있다.
잠재적으로 유용한 액체 부형제의 예는 하나 이상의 SFA와 조합하여 사용될 수 있는 유성 부형제를 포함하고 트리글리세리드 오일, 미네랄 오일, 중쇄 트리글리세리드 (MCT), 유성 지방산 이소프로필 미리스테이트, 유성 지방 알코올, 소르비톨 및 지방산, 유성수크로스 에스테르 또는 눈에 의해 생리적으로 허용되는 다른 물질을 포함한다. 바람직한 구체예 중 하나에서, 액체 비히클은 액체 부형제 형태의 가용화제를 포함한다. 이 경우, 액체 부형제는 MCT, 바람직하게는 액체 비히클의 총중량에 대해 최대 3 % (w/w), 보다 바람직하게는 최대 2.5 % (w/w) 농도의 MCT인 것이 더욱 바람직하다.
본원에서 사용되는 잠재적으로 유용한 가용화제의 추가의 예는 유기 용매이다. 바람직한 유기 용매는 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 및 에탄올을 포함한다. 바람직한 구체예에서, 본 조성물의 액체 비히클은 가용화제로서 디 에틸렌 글리콜 모노 에틸 에테르 (DEGEE)를 바람직하게는 본 약제학적 조성물의 액체 비히클에 대해 최고 1.5 % (w/w), 보다 바람직하게는 최고 1 % (w/ w)의 양으로 포함할 수 있다.
또 다른 바람직한 구체예에서, 본 약제학적 조성물의 액체 비히클은 가용화제로서 에탄올을, 바람직하게는 최대 1 % (w/w), 보다 바람직하게는 0.8 % (w/w)의 양으로 포함할 수 있고; 본 약제학적 조성물의 액체 비히클의 중량에 대해 최대 0.5 % (w/w) 이하가 가장 바람직하다.
따라서, 바람직한 구체예에서, 본 약제학적 조성물의 액체 비히클은 가용화제를 추가로 포함한다. 바람직하게는 가용화제는 에탄올, MCT 및 DEGEE로부터 선택된다.
본 발명에 따른 사용을 위한 약제학적 조성물은 또한 추가로 부형제, 가령, 예를 들어, 보존제, 보다 구체적으로는 보존제 및/또는 계면활성제를 포함하거나 포함하지 않을 수 있다. 바람직한 구체예에서, 그러나, 본 발명에 따르는 약제학적 조성물은 보존제가 실질적으로 없다.
바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 물이 실질적으로 없다. 여기서 이해되는 바와 같이, 조성물과 관련하여 용어 '실질적으로 없는', 또는 다르게 '본질적으로 없는'은 상기 성분이 미량으로 존재하는 것을 의미하며, 미량으로 존재하는 경우 성분은 상기 조성물에 기술적 기여를 제공하지 않는다.
여전히 추가의 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 물 및 보존제가 실질적으로 없다.
특히 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 액체 비히클의 총중량에 대해 적어도 99 % (w/w)의 1-퍼플루오로부틸-펜탄 (CF3(CF2)3-(CH2)4CH3 (F4H5)) 또는 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 1 % (w/w)의 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트를 포함한다.
추가로 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 액체 비히클의 총중량에 대해 적어도 99.5 % (w/w)의 1-퍼플루오로부틸-펜탄 (CF3(CF2)3-(CH2)4CH3 (F4H5)) 또는 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 0.5 % (w/w)의 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트를 포함한다.
추가로 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 액체 비히클의 총중량에 대해 적어도 99.5 % (w/w)의 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 0.5 % (w/w)의 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트를 포함한다.
더욱 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물 액체 비히클의 총중량에 대해 적어도 99.5 % (w/w)의 1- 퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 0.5 % (w/w)의 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트로 본질적으로 이루어진다.
상술한 바와 같이, 본 발명의 사용을 위한 조성물은 바람직하게는 투명한 용액으로서 제공되며, 여기서 라타노프로스트는 선택된 액체 비히클에 완전히 용해된다. 또한, 본 발명에 따른 사용을 위한 조성물은 바람직하게는 멸균 형태로 제공된다.
라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하는 본 발명에 따르는 사용을 위한 약제학적 조성물은 외용적으로 대상체의 눈에 투여될 수 있거나 또는 대상체의 눈에 결막하 주사에 의해 투여될 수 있다. 바람직한 구체예에서, 그러나, 본 발명에 따르는 사용을 위한 약제학적 조성물은 외용적으로 대상체의 눈에 투여된다.
본원에 사용된 용어 " 외용적으로 투여"는 본 액체 약제학적 조성물이 대상체의 눈의 표면과 접촉하게하는 모든 가능한 투여 방법을 포함한다. 전형적으로, 본 발명의 약제학적 조성물은 대상의 눈에 단일 방울 또는 복수의 방울 형태로 투여될 수 있다. 점적은 눈의 표면, 바람직하게는 국소 투여 또는 주입, 예를 들어 각막 또는 결막에 접근 가능한 눈의 임의의 표면 영역 또는 조직에 투여될 수 있다. 조성물의 액적 또는 액적은 눈의 각막 표면과 같은 눈의 표면에 직접 또는 대안적으로 눈의 눈꺼풀을 아래로 당겨서 형성된 공간, 즉 주머니에 주입될 수 있다.
본원에 사용된 용어 "결막 하 주사"는 대상체의 눈의 결막 아래에 본 발명의 약제학적 조성물의 임의의 형태의 주사를 의미한다. 이는 적합한 주사기에 의해 본 약제학적 조성물의 주사를 포함할 수 있다. 결막 하 주사라는 용어는 또한 결막 아래에, 예를 들어 결막에서 생성된 개구부를 통해 삽입될 의료 장치 또는 삽입물에 의한 주사를 포함할 수 있다.
본원에 사용된 용어 "눈으로의 투여"또는 "눈당"은, 대상의 개별 눈에 본 발명에 사용하기위한 약제학적 조성물의 주어진 용량, 예를 들어 단일 용량의 투여를 지칭한다. 본원에 기재된 안구 질환, 즉 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상은 대상체에서 단일 눈의 치료에 제한되지 않고, 또한, 본 발명에 따른 사용을 위한 조성물을 상기 질환에 걸린 대상체의 각각의 눈에 투여하는 것을 포함하는 요법을 포함한다고 이해되어야 한다.
본원에 사용된 용어 "대상체"는 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상을 겪거나, 진단 받거나 이로 인해 위험한 인간 또는 동물, 바람직하게는 인간을 의미한다.
라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하는 본 발명에 따르는 사용을 위한 약제학적 조성물은 추가로 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양이 약 0.5 내지 1.4 μg의 범위 내인 것을 특징으로 한다. 바람직한 구체예에서, 그러나, 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.7 내지 1.4 μg, 바람직하게는 약 1.0 내지 1.2 μg, 심지어 더욱 바람직하게는 약 1.1 μg의 범위 내이다.
본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 작은 점적 (점적)을 형성한다. 본 발명의 바람직한 구체예에서, 여기서 조성물 "눈 당 표적 투여량 부피"로 언급된, 단일 투여량으로 투여되는 눈 당 상기 조성물의 부피는 적절한 점적 디스페서로부터 투여된 때 약 6 내지 28 μl의 범위 내, 더욱 바람직하게는 약 6 내지 24 μl의 범위 내, 및 가장 바람직하게는 약 6 내지 15 μl의 범위 내이다. 본 발명의 또다른 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 약 8 내지 15 μl의 범위 내, 바람직하게는 약 9 내지 14 μl의 범위 내, 가장 바람직하게는 약 10 내지 12 μl의 범위 내 눈 당 조성물 표적 투여량 부피를 가진다. 본 발명의 가장 바람직한 구체예에서, 상기 눈 당 조성물 표적 투여량 부피는 약 11 μl이다. 이는 약 30 μl의 점적 크기를 특징으로 하는 수상 라타노프로스트 조성물 가령, 예를 들어, Xalatan로부터 본 발명의 조성물을 더욱 차별화시킨다.
따라서, 바람직한 구체예에서, 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 상기 약제학적 조성물, 여기서 상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및 여기서 상기 조성물은 대상체의 눈에 투여되고; 및 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이고, 단일 투여량으로 투여되는 눈 당 라타노프로스트의 양은 상기 약제학적 조성물의 정의된 부피 (이하로 언급된 "눈 당 조성물 표적 투여량 부피")로 제공된다. 추가로 바람직한 구체예에서, 상기 눈 당 조성물 표적 투여량 부피 (눈 당 단일 투여량으로 투여되는 라타노프로스트의 양를 함유하는)는 30 μl 이하, 바람직하게는 25 μl 이하, 더욱 바람직하게는 15 μl 이하이다.
본 발명의 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 약 0.005 % 내지 0.015 % (w/v) 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 상기 조성물은 대상체의 눈에 투여되고; 및 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 1.2 μg의 범위 내이다.
본 발명의 또다른 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 약 0.008 % 내지 0.015 % (w/v) 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 상기 조성물은 대상체의 눈에 투여되고; 및 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 1.2 μg의 범위 내이다.
본 발명의 또다른 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 약 0.008 % 내지 0.012 % (w/v) 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 상기 조성물은 대상체의 눈에 투여되고; 및 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 1.2 μg의 범위 내이다.
특히 바람직한 구체예에서, 본 발명에 따른 사용을 위한 약제학적 조성물은 약 0.008 % 내지 약 0.012 % (w/v) 라타노프로스트를 포함하고, 그리고 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이다.
또다른 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 약 0.010 % (w/v) 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고, 여기서 상기 조성물은 대상체의 눈에 투여되고, 그리고 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이고 그리고 눈 당 표적 투여량 부피는 약 11 μl이다.
가장 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고, 여기서 상기 조성물은 대상체의 눈에 투여되고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 약 1.2 μg의 범위 내이고 눈 당 표적 투여량 부피는 약 6 내지 24 μl, 바람직하게는 약 6 내지 15 μl, 더욱 바람직하게는 약 8 내지 15 μl, 심지어 더욱 바람직하게는 약 10 내지 12 μl, 가장 바람직하게는 11 μl의 범위 내이다.
따라서, 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 매일 1회 투여된다. 추가로 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물의 단일 투여량은 하나의 단일 점안제로서 대상체의 눈에 투여된다.
놀랍게도, 액체 비히클의 성분으로서 상기 기재된 바와 같은 SFA의 존재는 단일 용량의 라타노프로스트와 상기 기재된 바와 같은 공지된 수성 조성물과 비교하여 유리한 조성물 표적 용량의 유리한 조합으로 본 약제학적 조성물을 제조할 수 있다는 것을 발견하였다. 구체적으로, 시판 조성물 Xalatan을 투여함으로써 달성되는 감소와 비교할 수 있는 안내압의 감소를 달성할 수 있는데, 이는 눈당 목표 용량 1.5 ㎍ 및 눈당 목표 용량 부피 30 μl로 특징지워진다. 도 2에 도시된 바와 같이, 예를 들어 눈당 목표 용량이 1.1 ㎍인 조성물은 Xalatan의 그것과 필적하는 안내압의 감소를 나타낸다. 또한, 본 발명에 따른 사용을 위한 약제학적 조성물의 다른 이점은 조성물이 Xalatan의 목표 용량 부피와 비교하여 상당히 적은 목표 용량 부피로 투여될 수 있다는 것이다.
예시로서, 바람직한 구체예에서, 본 발명에 따르는 상기 사용을 위한 약제학적 조성물은 눈 당 단일 투여량으로 투여되는 조성물의 비교적 낮은 부피 (조성물 표적 투여량 부피), 가령 약 8 μl 내지 약 15 μl, 바람직하게는 약 10 μl 내지 약 12 μl, 더욱 바람직하게는 약 11 μl를 특징으로 한다.
또한, 상당히 큰 방울 크기를 갖는 수성 조성물의 투여와 관련된 하나의 합병증은 보통 눈의 표면에 국소적으로 투여되는 수성 조성물의 양의 일부만이 실제로 거기에 머무르는 것이다. 많은 경우에, 비교적 큰 부피의 수성 조성물 중 일부는 눈의 표면으로부터 즉시 누출되어 종종 닦아진다. 따라서, 치료적으로 유효한 양의 라타노프로스트가 실제로 눈에 도달하도록 보장하기 위해 잉여 조성물이 종종 필요하다.
이를 기초로, 본 발명의 사용을 위한 약제학적 조성물은 이와 관련된 액적 크기 및 표적 용량 부피의 상당한 감소를 허용하며, 따라서 상기한 바와 같이 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료에서의 사용을 위해 투여되는 라타노프로스트의 총 매일 투여량의 상당한 감소를 허용한다.
제 2 양상에서, 본 발명은 본 발명의 제 1 양상에 따르는, 즉 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물을 포함하는 키트를 제공하고, 여기서
-
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
-
상기 조성물은 대상체의 눈에 투여되고; 및
-
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이고,
여기서 키트는 상기 약제학적 조성물을 수용하기 위한 용기 및 상기 조성물을 투여하기 위한 점적 디스페서를 포함한다.
본 발명의 제 1 양상에 따르는 상기 사용을 위한 약제학적 조성물과 관련하여 위에서 상세히 기술된 바와 같은 모든 구체예가 본 발명의 이 제 2 양상에 따르는 키트에 포함될 수 있음이 이해되어야 한다.
여기서 이해되는 바와 같이, 점적 디스페서는 상기 약제학적 조성물을 수용하기 위한 용기에 장착, 고정 또는 연결될 수 있는 디스페서 또는 애플러케이터 수단일 수 있다. 바람직하게는, 점적 디스페서는 본 발명의 제 1 양상에 따르는 상기 약제학적 조성물의 단일 점적제의 형태인 단일 투여량을 분배하기에 적당하다. 더욱 바람직하게는, 점적 디스페서는 약 8 μl 내지 약 15 μl 부피, 바람직하게는 약 10 μl 내지 약 12 μl 부피의 단일 투여량을 분배하기에 적당하고 또는 심지어 더욱 바람직하게는 약 11 μl 부피의 단일 투여량을 분배하기에 적당하다.
여기서 이해되는 바와 같이 상기 약제학적 조성물을 수용하기 위한 용기는 바람직하게는 상기 조성물의 단일 투여량을 보유하는, 더욱 바람직하게는 다중 또는 다수의 투여량을 보유할 수 있는 부피이다.
상기 용기 및/또는 점적 디스페서는 바람직하게는 열가소성 물질 또는 중합체로부터 제조될 수 있다. 하나의 구체예에서, 상기 용기 및/또는 점적 디스페서는 폴리에틸렌 및 폴리프로필렌으로부터 선택된 열가소성 물질로부터 제조될 수 있다.
특정의 구체예에서, 점적 디스페서는, 바람직하게는 저밀도 폴리에틸렌 및 고밀도 폴리에틸렌로부터 선택된 폴리에틸렌 물질로부터 제조, 및 더욱 바람직하게는 고-밀도 폴리에틸렌으로부터 제조된다. 또다른 구체예에서, 용기는 폴리프로필렌 또는 폴리에틸렌 물질로부터 제조, 및 더욱 바람직하게는 폴리프로필렌으로부터 제조된다.
바람직하게는, 용기은 본 발명에 따르는 상기 사용을 위한 약제학적 조성물로 적어도 부분적으로 충전되는 부피, 또는 내부 공간를 가진다. 추가 구체예에서, 용기의 총 부피에 대한 용기 내 상기 약제학적 조성물의 부피의 비는 0.4 및 0.7 사이이다. 본원에서 이해되는 바와 같이, 용기의 총 부피는 용기의 내부 치수에 의해 형성된 총 내부 부피를 지칭한다. 용기 내 약제학적 조성물의 부피는 충전 부피, 즉 용기에 보유된 약제학적 조성물의 부피를 지칭한다. 예를 들어, 총 부피가 3.0 ml인 용기를 포함하는 키트에서, 용기는 본 발명에 따른 약제학적 조성물 2.0 ml의 부피를 보유하는 것이 바람직하다. 여기서, 용기의 총 부피에 대한 용기 내의 약제학적 조성물의 부피의 비는 약 0.7일 것이다.
이들 구체예에 따라 제공된 이러한 키트는 본 발명의 제 1 측면에 따른 약제학적 조성물의 저장 및 분배성 (즉, 분배의 용이성 및 일관성)을 향상시킬 수 있다.
제 3 양상에서, 본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상을 치료 또는 예방 하는 방법에 관한 것이고, 이 방법은 대상체의 눈에, 바람직하게는 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상에 걸린 사람에게, 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하는 조성물을 투여하는 것을 포함하고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg이고, 그리고 여기서 상기 방법은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료에서 치료적으로 유효하다.
제 4 양상에서, 본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료 방법에서의 사용을 위한 약제학적 조성물을 제공하고, 여기서 상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고, 여기서 상기 조성물은 약 0.5 내지 1.4 μg 라타노프로스트의 눈 당 단일 투여량으로 투여된 때 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료 또는 예방에서 치료적으로 유효하다.
제 5 양상에서, 본 발명은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하는 조성물, 바람직하게는 SFA 내에 용해시킨 라타노프로스트를 포함하는 조성물을 매일 1회 사람의 눈에 투여하는 것을 포함하고, 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법에 관한 것이고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg이고 여기서 상기 방법은 총 일일 투여량 당 라타노프로스트의 양을 약 67% 내지 7 % 만큼 감소시키고 그리고 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 0.005 % (w/v) 라타노프로스트를 포함하는 수성 용액의 눈 당 단일 점적의 매일 투여와 비교하여 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료에서 적어도 동등하게 치료적으로 유효하다.
본 발명의 이 제 5 양상에 따르는 방법의 바람직한 구체예에서, 상기 조성물의 단일 점적은 약 11 μl의 점적 부피를 가지는 상기 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적은 약 30 μl의 점적 부피를 가진다.
이 제 5 양상에 따르는 방법의 추가로 바람직한 구체예에서, 라타노프로스트에 대한 전신 노출은 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적의 매일 투여와 비교하여 감소된다.
이 제 5 양상에 따르는 방법의 여전히 추가의 바람직한 구체예에서, 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적의 매일 투여와 비교하여 하나 이상의 부작용이 감소된다. 여기서 사용된 용어 "부작용"은 일반적 의미에 따라서, 약제로부터 유발된, 이 특정의 경우에서 라타노프로스트의 외용 안구 투여로부터 유발된 바람직하지 않은 유해한 효과, 가령, 예를 들어, 몽롱, 작열감 및 통렬감, 결막 충혈, 이물감, 가려움, 홍채 유발의 증가된 (갈색) 색소 (이색증), 눈썹의 길어짐 및 두꺼워짐, 반점 상피 각막증, 냉각 또는 상기도 감염, 감기-유사 증후군, 안구건조증, 눈물 과다, 눈 통증, 눈꺼풀 각화, 눈꺼풀 부종, 눈꺼풀 홍반 (충혈), 눈꺼풀 통증, 광선공포증, 가슴 통증, 알레르기 피부 반응, 관절통, 등 통증, 근육통, 천식, 헤르페스 각막염, 홍채염, 각막염, 망막 동막 색전, 망막 박리, 독성 표피 괴사 용해, 포도막염, 당뇨병성 망막증으로 인한 유리체 출혈, 및/또는 원추 각막을 의미한다.
제 6 양상에서, 본 발명은 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법을 제공하고, 이 방법은 매일 1회 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상에 걸린 사람의 눈에 F6H8 또는 F4H5 내에 용해된 약 0.01 % (w/v) 라타노프로스트를 포함하는 조성물의 단일 점적제를 투여하는 것을 포함하고, 여기서 상기 조성물은 물이 실질적으로 없고 그리고 보존제가 실질적으로 없고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.1 μg이고, 그리고 여기서 상기 방법은 총 일일 투여량 당 라타노프로스트의 양을 약 27%만큼 감소시키고 그리고 여기서 상기 방법은 0.005 % (w/v) 라타노프로스트를 포함하는 수성 용액의 단일 점적의 눈 당 매일 1회 투여와 비교하여 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 치료에서 적어도 동등하게 치료적으로 유효하다.
본 발명의 제 1 양상에 따르는 상기 사용을 위한 약제학적 조성물과 관련하여 위에서 상세히 기술된 바와 같은 모든 구체예는 본 발명의 제 3 내지 제 7 양상에 따르는 방법에 적용될 수 있음이 이해되어야 한다.
바람직한 구체예의 상세한 설명
도 1은 아래에 추가로 설명된 실험적 동물 연구 (개)의 결과를 나타내고, F4H5 또는 F6H8 내 라타노프로스트 (0.005 % (w/v)) 대 상응하는 부분불소화 알칸 단독의 반복 외용 안구 투여 후 안내압 (IOP)에 대한 약력학이 연구되었다. 그래프는 시간 경과시 mmHg인 평균 안내압 (IOP)의 경과를 나타낸다.
도 2는 아래에 추가로 설명된 바와 같이 시험 동물의 오른쪽 눈 (OD)에 투여된 F6H8 내 라타노프로스트 (0.01 % (w/v))를 포함하는 조성물 대 to the the 동일 시험 동물의 왼쪽 눈 (OS)에 투여된 Xalatan®의 헤드 대 헤드 비교의 결과를 나타낸다. 그래프는 시간 경과시 mmHg인 평균 안내압 (IOP)의 경과를 나타낸다.
번호를 매긴 항목의 다음 리스트는 본 발명에 포함되는 구체예이다:
1.
녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물, 여기서
-
상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
-
상기 조성물은 대상체의 눈에 투여되고; 및
-
눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내이다.
2.
항목 1에 있어서, 부분불소화 알칸은 F6H8 및 F4H5로부터 선택되는 상기 사용을 위한 조성물.
3.
항목 1 또는 2에 있어서, 부분불소화 알칸은 F6H8인 상기 사용을 위한 조성물.
4.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 대상체의 눈에 외용적으로 또는 결막하 주사에 의해 투여되는 상기 사용을 위한 조성물.
5.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 외용적으로 대상체의 눈에 투여되는 상기 사용을 위한 조성물.
6.
항목 1 내지 4중 어느 하나에 있어서, 상기 조성물은 대상체의 눈에 결막하 주사에 의해 투여되는 상기 사용을 위한 조성물.
7.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 가용화제를 추가로 포함하는 상기 사용을 위한 조성물.
8.
항목7에 있어서, 가용화제는 에탄올, MCT 및 DEGEE로부터 선택되는 상기 사용을 위한 조성물.
9.
항목 7 또는 8에 있어서, 가용화제는 액체 비히클의 총중량에 대해 최고 2.5 % (w/w)의 양으로 포함되는 상기 사용을 위한 조성물.
10.
항목7 내지 9 중 어느 하나에 있어서, 가용화제는 에탄올인 상기 사용을 위한 조성물.
11.
항목 10에 있어서, 에탄올의 양은 액체 비히클의 총중량에 대해 최고 0.5 % (w/w)인 상기 사용을 위한 조성물.
12.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 물 및 보존제가 실질적으로 없는 상기 사용을 위한 조성물.
13.
선행하는 항목 중 어느 하나에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 8 내지 15 μl인 상기 사용을 위한 조성물.
14.
선행하는 항목 중 어느 하나에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 10 내지 12 μl인 상기 사용을 위한 조성물.
15.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 약 0.005 내지 0.015 % (w/v), 바람직하게는 약 0.008 내지 0.012 % (w/v) 라타노프로스트를 포함하는 상기 사용을 위한 조성물.
16.
선행하는 항목 중 어느 하나에 있어서, 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 1.2 μg의 범위 내인 상기 사용을 위한 조성물.
17.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 약 0.01% (w/v) 라타노프로스트를 포함하고, 그리고 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이고 그리고 여기서 상기 눈 당 조성물 표적 투여량 부피는 약 11 μl인 상기 사용을 위한 조성물.
18.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 액체 비히클의 총중량에 대해 적어도 99 % (w/w)의 1-퍼플루오로부틸-펜탄 (CF3(CF2)3-(CH2)4CH3 (F4H5)) 및/또는 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 1 % (w/w)의 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트로 본질적으로 이루어지는 상기 사용을 위한 약제학적 조성물.
19.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물은 매일 1회 투여되는 상기 사용을 위한 조성물.
20.
선행하는 항목 중 어느 하나에 있어서, 상기 조성물의 단일 투여량은 대상체의 눈에 하나의 단일 점안제로서 투여되는 상기 사용을 위한 약제학적 조성물.
21.
녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 예방 또는 치료 방법에서의 사용을 위한 약제학적 조성물, 여기서 상기 조성물은 부분불소화 알칸을 포함하는 액체 비히클 내에 용해시킨 라타노프로스트를 포함하고 그리고 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 약 1.4 μg 사이 범위 내임.
22.
항목 21에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 8 내지 약 15 μl인 상기 사용을 위한 조성물.
23.
항목 21 또는 22에 있어서, 상기 조성물은 약 0.005 내지 0.015 % (w/v), 바람직하게는 약 0.008 내지 0.012 % (w/v) 라타노프로스트를 포함하는 상기 사용을 위한 조성물.
24.
항목21 내지 23 중 어느 하나에 있어서, 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.0 내지 1.2 μg인 상기 사용을 위한 조성물.
25.
항목 21 내지 24중 어느 하나에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 10 내지 12 μl인 상기 사용을 위한 조성물.
26.
항목 21 내지 25중 어느 하나에 있어서, 상기 조성물은, 바람직하게는 에탄올, MCT 및 DEGEE로부터 선택된 가용화제를 추가로 포함하는 상기 사용을 위한 조성물.
27.
항목 26에 있어서, 가용화제는 액체 비히클의 총중량에 대해 최고 2.5 % (w/w)의 양으로 포함되는 상기 사용을 위한 조성물.
28.
항목 26에 있어서, 가용화제는 에탄올인 상기 사용을 위한 조성물.
29.
항목 28에 있어서, 에탄올의 양은 액체 비히클의 총중량에 대해 최고 1.0 % (w/w), 바람직하게는 최고 0.5 % (w/w)인 상기 사용을 위한 조성물.
30.
항목 21 내지 29중 어느 하나에 있어서, 상기 조성물은 약 0.01 % (w/v) 라타노프로스트를 포함하고; 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이고 그리고 눈 당 표적 투여량 부피는 약 11 μl인 상기 사용을 위한 조성물.
31.
항목 21 내지 30중 어느 하나에 있어서, SFA는 F6H8 및 F4H5로부터 선택되는 것인 상기 사용을 위한 조성물.
32.
항목 31에 있어서, SFA는 F6H8인 상기 사용을 위한 조성물.
33.
항목 21 내지 32중 어느 하나에 있어서, 상기 조성물은 매일 1회 투여되는 상기 사용을 위한 조성물.
34.
항목 21 내지 33중 어느 하나에 있어서, 상기 조성물은 물 및 보존제가 실질적으로 없는 상기 사용을 위한 조성물.
35.
선행하는 항목 중 어느 하나에 있어서의 상기 사용을 위한 약제학적 조성물을 포함하는 키트, 여기서 키트는 상기 약제학적 조성물을 수용하기 위한 용기 및 상기 조성물을 투여하기 위한 점적 디스페서를 포함함.
36.
항목 35에 있어서, 상기 약제학적 조성물을 수용하기 위한 용기 및 점적 디스페서는 점적 당 약 8 내지15 μl의 부피의 상기 조성물, 바람직하게는 점적 당 10 내지 12 μl의 부피의 상기 조성물, 더욱 바람직하게는 점적 당 11 μl의 부피의 상기 조성물을 투여하기에 적당한 키트.
37.
녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상에 걸린 사람의 눈에, 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하는 조성물을 투여하는 것을 포함하고, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상을 치료하는 방법, 여기서 라타노프로스트는 바람직하게는 상기 액체 비히클 내에 용해되고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 약 1.4 μg이고, 그리고 여기서 상기 방법은 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상 치료에서 치료적으로 유효함.
38.
항목 37에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 8 내지 약 15 μl인 방법.
39.
항목 37 또는 38에 있어서, 상기 조성물은 약 0.005 내지 0.015 % (w/v), 바람직하게는 약 0.008 내지 0.012 % (w/v) 라타노프로스트를 포함하는 방법.
40.
항목 37 내지 39중 어느 하나에 있어서, 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.0 내지 1.2 μg인 방법.
41.
선행하는 항목 37 내지 40중 어느 하나에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 10 내지 약 12 μl, 바람직하게는 약 11 μl인 방법.
42.
선행하는 항목 37 내지 41중 어느 하나에 있어서, 상기 조성물은 바람직하게는 에탄올, MCT 및 DEGEE로부터 선택된 가용화제를 추가로 포함하는 방법.
43.
항목 37 내지 42중 어느 하나에 있어서, 가용화제는 액체 비히클의 총중량에 대해 최고 2.5 % (w/w)의 양으로 포함되는 방법.
44.
항목 42에 있어서, 가용화제는 에탄올인 방법.
45.
항목44에 있어서, 여기서 에탄올의 양은 액체 비히클의 총중량에 대해 최고 1 % (w/w), 바람직하게는 최고 0.5 % (w/w)인 방법.
46.
항목 37 내지 45중 어느 하나에 있어서, 여기서 상기 조성물은 약 0.01 % w/v 라타노프로스트를 포함하고; 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이고 그리고 눈 당 표적 투여량 부피는 약 11 μl인 방법.
47.
항목 37 내지 46중 어느 하나에 있어서, 부분불소화 알칸은 F6H8 및 F4H5로부터 선택되는 것인 방법.
48.
항목 47에 있어서, 부분불소화 알칸은 F6H8인 방법.
49.
항목37 내지 48 중 어느 하나에 있어서, 상기 조성물은 매일 1회 투여되는 방법.
50.
항목 37 내지 49중 어느 하나에 있어서, 상기 조성물은 물 및 보존제가 실질적으로 없는 방법.
51.
항목 37에 있어서, 상기 조성물은 최고 약 1 % (w/w) 에탄올을 추가로 포함하는 방법.
52.
항목 37에 있어서, 상기 조성물은 약 99 % (w/w) F4H5 또는 F6H8 및 약 1% (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 방법.
53.
항목 37에 있어서, 상기 조성물은 적어도 약 99 % (w/w) F4H5 또는 F6H8 및 최고 약 1 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 방법.
54.
항목 37에 있어서, 상기 조성물은 최고 약 0.5 % (w/w) 에탄올을 추가로 포함하는 방법.
55.
항목 37에 있어서, 상기 조성물은 약 99.5 % (w/w) F4H5 또는 F6H8 및 약 0.5 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 방법.
56.
항목37에 있어서, 상기 조성물은 적어도 약 99.5 % (w/w) F4H5 또는 F6H8 및 최고 약 0.5 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 방법.
57.
녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 예방 또는 치료 방법에서의 사용을 위한 약제학적 조성물, 여기서 상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고, 여기서 라타노프로스트는 바람직하게는 상기 부분불소화 알칸 내에 용해되고, 여기서 상기 조성물은 눈 당 약 0.5 내지 1.4 μg 라타노프로스트의 단일 투여량으로 투여된 때 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료 또는 예방에서 치료적으로 유효함.
58.
항목 57에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 8 내지 15 μl인 상기 사용을 위한 조성물.
59.
항목 57에 있어서, 상기 조성물은 약 0.005 내지 0.015 % (w/v), 바람직하게는 약 0.008 내지 0.012 % (w/v) 라타노프로스트를 포함하는 상기 사용을 위한 조성물.
60.
항목 57에 있어서, 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.0 내지 1.2 μg인 상기 사용을 위한 조성물.
61.
항목 57에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 10 내지 12 μl인 상기 사용을 위한 조성물.
62.
항목 57에 있어서, 상기 조성물은 최고 약 0.5 % (w/w) 에탄올을 포함하는 상기 사용을 위한 조성물.
63.
항목 57에 있어서, 상기 조성물은 약 99.5 % (w/w) F4H5 또는 F6H8 및 약 0.5 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
64.
항목 57에 있어서, 상기 조성물은 적어도 약 99.5 % (w/w) F4H5 또는 F6H8 및 최고 약 0.5% (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
65.
항목 57에 있어서, 상기 조성물은 최고 약 1 % (w/w) 에탄올을 추가로 포함하는 상기 사용을 위한 조성물.
66.
항목 57에 있어서, 상기 조성물은 약 99% (w/w) F4H5 또는 F6H8 및 약 1% (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
67.
항목 57에 있어서, 상기 조성물은 적어도 약 99% (w/w) F4H5 또는 F6H8 및 최고 약 1% (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
68.
항목 57에 있어서, 상기 라타노프로스트는 약 0.008 % 내지 0.012% (w/v)의 농도로 포함되고 눈 당 단일 투여량은 약 1.0 내지 1.2 μ
g, 바람직하게는 1.1 μg 라타노프로스트이고 그리고 여기서 상기 조성물은 물이 실질적으로 없고 그리고 보존제가 실질적으로 없는 상기 사용을 위한 조성물.
69.
항목 68에 있어서, 상기 조성물은 최고 약 0.5 % (w/w) 에탄올을 포함하는 상기 사용을 위한 조성물.
70.
항목 68에 있어서, 상기 조성물은 약 99.5 % (w/w) F4H5 또는 F6H8 및 약 0.5 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
71.
항목 68에 있어서, 상기 조성물은 적어도 약 99.5 % (w/w) F4H5 또는 F6H8 및 최고 약 0.5% (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
72.
항목 68에 있어서, 상기 조성물은 최고 약 1 % (w/w) 에탄올을 추가로 포함하는 상기 사용을 위한 조성물.
73.
항목 68에 있어서, 상기 조성물은 약 99 % (w/w) F4H5 또는 F6H8 및 약 1 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
74.
항목 68에 있어서, 상기 조성물은 적어도 약 99 % (w/w) F4H5 또는 F6H8 및 최고 약 1 % (w/w) 에탄올의 용액 내에 용해시킨 라타노프로스트로 이루어지는 상기 사용을 위한 조성물.
75.
매일 1회 사람의 눈에 부분불소화 알칸을 포함하는 액체 비히클내에 용해시킨 라타노프로스트를 포함하는 조성물을 투여하는 것을 포함하는, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg이고 여기서 상기 방법은 총 일일 투여량 당 라타노프로스트의 양을 약 67 내지 7 %만큼 감소시키고 0.005 % (w/v) 라타노프로스트 수성 용액의 눈 당 단일 점적의 매일 투여와 비교하여 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상 치료에서 적어도 동등하게 치료적으로 유효함.
76.
항목 75에 있어서, 상기 조성물의 단일 점적은 약 11 μl의 점적 부피를 가지는 상기 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적은 약 30 μl의 점적 부피를 가지고, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법.
77.
75 또는 76항목에 있어서, 라타노프로스트에 대한 전신 노출은 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적의 매일 투여와 비교하여 감소되는, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법.
78.
항목 75 내지 77중 어느 하나에 있어서, 0.005 % (w/v) 라타노프로스트 수성 용액의 단일 점적의 매일 투여와 비교하여 하나 이상의 부작용이 감소되는, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법.
79.
항목 78에 있어서, 하나 이상의 부작용이 몽롱, 작열감 및 통렬감, 결막 충혈, 이물감, 가려움, 홍채 유발 의 증가된 (갈색) 색소(이색증), 눈썹 의 길어짐 및 두꺼워짐, 반점 상피 각막증, 냉각 또는 상기도 감염, 감기-유사 증후군, 안구건조증, 눈물 과다, 눈 통증, 눈꺼풀 각화, 눈꺼풀 부종, 눈꺼풀 홍반 (충혈), 눈꺼풀 통증, 광선공포증, 가슴 통증, 알레르기 피부 반응, 관절통, 등 통증, 근육통, 천식, 헤르페스 각막염, 홍채염, 각막염, 망막 동막 색전, 망막 박리, 독성 표피 괴사 용해, 포도막염, 당뇨병성 망막증으로 인한 유리체 출혈, 및 원추 각막로 이루어진 부작용의 그룹으로부터 선택되는, 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법.
80.
녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상의 치료를 위해 사람에게 투여되는 라타노프로스트의 총 일일 양을 감소시키는 방법, 상기 방법은 매일 1회 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상에 걸린 사람의 눈에 F6H8 또는 F4H5 내에 용해된 약 0.01 % (w/v) 라타노프로스트를 포함하는 조성물의 단일 점적제를 투여하는 것을 포함하고, 여기서 상기 조성물은 물이 실질적으로 없고 그리고 보존제가 실질적으로 없고, 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.1 μg 라타노프로스트이고, 그리고 여기서 상기 방법은 총 일일 투여량 당 라타노프로스트의 양을 약 27%만큼 감소시키고 0.005 % (w/v) 라타노프로스트 수성 용액의 눈 당 단일 점적의 매일 1회 투여와 비교하여 녹내장, 안압 상승, 안구 고혈압 또는 이와 관련된 증상 치료에서 적어도 동등하게 치료적으로 유효함.
다음 실시예는 본 발명을 예시하지만, 본 발명의 범위를 제한하는 것으로 이해되어서는 안된다.
실시예
실시예 1
정상 혈압 개에서 퍼플루오로부틸펜탄 (F4H5) 및 퍼플루오로헥실옥탄 (F6H8) 각각 내 다음 반복 라타노프로스트 외용 안구 투여량 이후의 라타노프로스트의 약력학 (안내압, IOP)을 평가하기 위해 및 수양액 내 라타노프로스트 산의 약물동력학을 평가하기 위해 아래 기술된 연구를 수행하였다. 개는 프로스타글란딘 유사체의 안구 분포 및 약력학을 평가하기 위해 적절한 종이고; 이 모델은 또한 정량적 약물동력학 데이터를 제공할 수 있다.
연구 설정:
동물을 전체 건강, 체중, 안과적 검사의 결과, IOP 도전에 대한 반응, 및 다음 기준에 기초한 연구에서의 참여에 대해 선택하였다:
건강한, 정상 안구 표면;
연구 이전 적어도 1개월 동안 침습적 안구 절차 없음; 특히 일반적으로 각막 또는 안구 전방 부분을 수반하는 절차;
적어도 1개월 동안 외용 또는 전신 코르티코스테로이드 처리 없음;
임상 연구에 사용된 전형적 세척 기간 (적어도 1주)에 적합한 이전 외용 안구 연구 약제로부터 세척
연구 설계:
아래 표 1에 요약된 계획에 따라서 연구을 수행하였다. 외용 안구 투여량 (11 또는 30 μl, 각각)을 마이크로피펫를 통해 각막의 중심 또는 상부에 투여하고 눈 표면을 통해 확산하도록 방치하였다. 투여량을 투여 후, 눈을 자연적으로 감도록 하였다. 눈 문지름를 방지하기 위해 대략 1 분 동안 각각의 동물을 결박시켰다.
라타노프로스트를 상기 부분불소화 알칸을 포함하는 액체 비히클 내에 용해시킴에 의해 상 1 내지 14에서 사용된 약제학적 조성물을 제조하였다.
14 상에서 사용된 조성물의 제조의 예로서, 상기 0.5% (w/w) 에탄올을 함유하는 F6H8 내 라타노프로스트 0.005% (w/v)를 포함하는 조성물의 제제가 여기서 기술되고: 1,625 g 에탄올 (Seccosolv, Merck, 최대 0.01 % H2O)를 324.3 g F6H8 (99.888%, Lomapharm, GmbH)와 혼합하여 0.5 % (w/w) 에탄올을 갖는 용액을 얻는다. 이후 2.558 mg 라타노프로스트 (99.5% Yonsung, South Korea)를 0.5% (w/w) 에탄올을 함유하는 50 mL의 F6H8 용액 내에 용해하여
0.005 % (w/v) 라타노프로스트를 포함하는 용액을 얻는다.
예비연구에서 및 각각 상 내 투여된 조성물이 여기서 기술된다:
예비연구 1:
OD: 0.005% (w/v) 라타노프로스트 용액;
OS: 포스페이트-완충된 식염수 (PBS)
예비연구 2:
OD: 0.005% (w/v) 라타노프로스트 용액;
OS: 0.005% (w/v) 라타노프로스트 용액;
상 1:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄
OS: PBS
상 2:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄 내 0.00125% (w/v) 라타노프로스트
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄
상 3:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄 내 0.0025% (w/v) 라타노프로스트
상 4:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄 내0.005% (w/v) 라타노프로스트
상 5:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.005% (w/v) 라타노프로스트
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄
상 6:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄
OS: PBS
상 7:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄 내 0.005% (w/v) 라타노프로스트
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로부틸펜탄
상 8:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄
상 9:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.015% (w/v) 라타노프로스트
상 10:
OD: 2.5% (w/w) 중간-사슬 트리글리세리드 (MCT)를 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
OS: 2.5% (w/w) MCT를 함유하는 퍼플루오로헥실옥탄
상 11:
OD: 2.5% (w/w) MCT를 함유하는 퍼플루오로헥실옥탄
OS: PBS
상 12:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
OS: Xalatan [0.005% (w/v) 라타노프로스트 용액]
상 13:
OD: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
OS: 0.5% (w/w) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
상 14:
OD: 1.0% (w/w) 2-(2-에톡시에톡시) 에탄올 (DEGEE)를 함유하는 퍼플루오로헥실옥탄
OS: 1.0% (w/w) 2(2에톡시에톡시) 에탄올을 함유하는 퍼플루오로헥실옥탄 내 0.010% (w/v) 라타노프로스트
상 1의 2주 전에, 안내 효능 예비연구 1 번 (표 1, 예비연구 1 참조)에서, 안내 효능 도전을 위해 각각의 동물의 30 μl의 라타노프로스트 안과적 용액 0.005% (w/v)의 단일 투여량을 오른쪽 눈 (OD)에 및 포스페이트 완충된 식염수를 (PBS) 왼쪽 눈 (OS)에 투여하였다. -1, 0 (즉시 투여전), 투여후 1, 2, 4, 6, 24 및 48 시간에서 안압계 TonoVet를 사용하여 얻어진 IOP을 측정하였다.
상 1의 1주 전에, 예비연구 안내 효능 도전 2 번 (표 1, 예비연구 2 참조)에서, 30 μl의 라타노프로스트 안과적 용액 0.005% (w/v)의 단일 투여량을 각각의 동물의 두 눈에 투여하였다. 상응하는 IOP을 -1, 0 (즉시 투여전), 투여후 4 및 6 시간에서 TonoVet를 사용하여 측정하였다.
IOP 반응 (예비연구 1) 및 눈 사이의 유사성(예비연구 2)을 평가하기 위해 예비연구 1 및 2을 수행하였다. 이를 IOP에 반응성이고 처리에 대한 반응에서 눈 사이의 유사성을 나타낸 동물을 표 1에 개괄된 연구의 14 상에 대해 선택하였다. 동물 선택에 대한 부가적 기준은 적어도 13 mmHg의 기준 안내압, Xalatan®으로 처리 후 기준으로부터 IOP의 적어도 15% 감소의 반응 및 IOP 측정 동안 동물의 거동이었다.
상기 두 예비연구 효능 상 후, 동물을 표 1에서 기술된 바와 같은 연구의 14 상으로 처리하였다. 상 1 내지 14 동안의 안내압 측정은, 0 (즉시 투여전)에서 1, 2, 3 및 6일에, 투여후 4 및 6 시간 또한 -1, 0 (즉시 투여전)에서 7 일에, 투여후 1, 2, 4, 6, 24, 및 48 시간에서 행해졌다. TonoVet를 사용하여3 판독/눈을 취하였다.
상 1 내지 14 동안 투여전 (투여 이전 최대 2 일)에, IOP 측정 후 0 (즉시 투여전), 투여후 4, 6, 24 및 48 시간에서 1, 2, 3 및 6일에;, 다음 IOP 측정 후 투여후 0 (즉시 투여전), 4 및 6 시간에서 7 일에 안구 자극 채점을 행하였다. IOP 측정 후 변형된 Hackett-McDonald 스케일 기술을 사용하여 두 눈을 모두 채점하였다. 투여 세션 동안 산발적 자극 발견이 존재했지만; 투여 그룹 또는 상 사이의 명백한 차이가 없었다.
연구 분석:
도 1에 도시된 바와 같이, 각각 F4H5 및 F6H8에서의 라타노프로스트 용액의 투여는 안내압의 감소를 초래하였다. F4H5 및 F6H8의 라타노프로스트 용액은 0.5 % (w/w)의 에탄올을 추가로 포함하였다.
도 2는 표 1에 요약된 바와 같이 연구의 12 상을 지칭하고, F6H8 대 Xalatan® 내 라타노프로스트를 포함하는 조성물의 헤드 대 헤드 비교를 도시하며, 여기서 1.1 ㎍/눈의 표적 용량 수준 및 11 ㎕/눈의 표적 용량 부피를 갖는 F6H8 내 라타노프로스트 용액의 투여는 1.5 ㎍/눈의 목표 용량 수준 및 30 ㎕/눈의 표적 용량 부피를 갖는 Xalatan®을 주입함으로써 달성되는 것에 비해 IOP의 감소를 나타낸다. 실험 데이터는 본 발명에 따른 조성물을 사용함으로써 활성 성분의 보다 적은 표적 용량을 사용하더라도 최적 표준 Xalatan174에 필적하는 IOP의 감소를 달성할 수 있음을 보여준다. 또한, 보다 낮은 표적 용량이 예를 들어 11 ㎕의 부피, 즉 30 ㎕보다 상당히 낮은 부피로 투여될 수 있어서, 방출되거나 전신적으로 흡수되는 조성물의 양의 감소를 허용한다.
Claims (15)
- 녹내장, 안압 상승, 안구 고혈압 및/또는 이와 관련된 증상의 예방 또는 치료에서의 사용을 위한 약제학적 조성물, 여기서
- 상기 조성물은 라타노프로스트 및 부분불소화 알칸을 포함하는 액체 비히클을 포함하고; 및
- 상기 조성물은 대상체의 눈에 투여되고; 및
- 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 0.5 내지 1.4 μg의 범위 내임. - 제 1항에 있어서, 부분불소화 알칸은 F6H8 및 F4H5로부터 선택되고, 바람직하게는 여기서 부분불소화 알칸은 F6H8인 상기 사용을 위한 조성물.
- 제 1 또는 2항에 있어서, 상기 조성물은 외용적으로 대상체의 눈에 투여되는 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 가용화제를 추가로 포함하는 상기 사용을 위한 조성물.
- 제 4항에 있어서, 가용화제는 에탄올, 중간 사슬 트리글리세리드 (MCT) 및 디에틸렌 글리콜 모노에틸 에테르 (DEGEE)로부터 선택되는 상기 사용을 위한 조성물.
- 제 4 또는 5항에 있어서, 가용화제는 액체 비히클의 총중량에 대해 최고 2.5 % (w/w)의 양으로 포함되는 상기 사용을 위한 조성물.
- 제 항 4 내지 6중 어느 한 항에 있어서, 가용화제는 에탄올인 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 물 및 보존제가 실질적으로 없는 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 눈 당 조성물 표적 투여량 부피는 약 8 내지 15 μl, 바람직하게는 약 10 내지 12 μl인 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 약 0.005 내지 0.015 % (w/v), 바람직하게는 약 0.008 내지 0.012 % (w/v) 라타노프로스트를 포함하는 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 눈 당 단일 투여량으로 투여되는 라타노프로스트의 양은 약 1.0 내지 1.2 μg의 범위 내인 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 약 0.01% (w/v) 라타노프로스트를 포함하고, 그리고 여기서 눈 당 단일 투여량으로 투여되는 라타노프로스트는 약 1.1 μg이고 그리고 여기서 상기 눈 당 조성물 표적 투여량 부피는 약 11 μl인 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 액체 비히클의 총중량에 대해 적어도 99 % (w/w)의 1-퍼플루오로부틸-펜탄 (CF3(CF2)3-(CH2)4CH3 (F4H5)) 또는 1-퍼플루오로헥실-옥탄 (CF3(CF2)5-(CH2)7CH3 (F6H8)) 및 최고 1 % (w/w) 에탄올로 본질적으로 이루어진 액체 비히클 내에 용해시킨 라타노프로스트를 포함하는 상기 사용을 위한 약제학적 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서, 상기 조성물은 매일 1회 투여되는 상기 사용을 위한 조성물.
- 선행하는 청구항 중 어느 한 항에 있어서의 상기 사용을 위한 약제학적 조성물을 포함하는 키트, 여기서 키트는 상기 약제학적 조성물을 수용하기 위한 용기 및 상기 조성물을 투여하기 위한 점적 디스페서를 포함함.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17193364.1 | 2017-09-27 | ||
| EP17193364 | 2017-09-27 | ||
| PCT/EP2018/075974 WO2019063551A1 (en) | 2017-09-27 | 2018-09-25 | OPHTHALMIC COMPOSITIONS COMPRISING LATANOPROST FOR USE IN THE TREATMENT OF OCULAR DISEASES |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200059272A true KR20200059272A (ko) | 2020-05-28 |
Family
ID=60037366
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207011983A KR20200059272A (ko) | 2017-09-27 | 2018-09-25 | 안구 질환의 치료에서의 사용을 위한 라타노프로스트를 포함하는 안과적 조성물 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US11723861B2 (ko) |
| EP (1) | EP3687496A1 (ko) |
| JP (1) | JP2020535156A (ko) |
| KR (1) | KR20200059272A (ko) |
| CN (1) | CN111372566A (ko) |
| BR (1) | BR112020006072A2 (ko) |
| CA (1) | CA3076776A1 (ko) |
| IL (1) | IL273531B1 (ko) |
| MX (1) | MX2020003534A (ko) |
| SG (1) | SG11202002640YA (ko) |
| WO (1) | WO2019063551A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116172987A (zh) | 2016-09-22 | 2023-05-30 | 诺瓦利克有限责任公司 | 用于治疗睑缘炎的药物组合物 |
| US10813976B2 (en) | 2016-09-23 | 2020-10-27 | Novaliq Gmbh | Ophthalmic compositions comprising ciclosporin |
| SG11202007858VA (en) | 2018-03-02 | 2020-09-29 | Novaliq Gmbh | Pharmaceutical compositions comprising nebivolol |
| WO2021028328A1 (en) * | 2019-08-09 | 2021-02-18 | Novaliq Gmbh | Topical composition comprising a prostaglandin analogue |
Family Cites Families (159)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2616927A (en) | 1950-05-12 | 1952-11-04 | Minnesota Mining & Mfg | Fluorocarbon tertiary amines |
| JPS5721312A (en) | 1980-07-12 | 1982-02-04 | Green Cross Corp:The | Breathable ointment |
| US4452818A (en) | 1982-03-19 | 1984-06-05 | Haidt Sterling J | Extraocular method of treating the eye with liquid perfluorocarbons |
| US5077036A (en) | 1986-01-14 | 1991-12-31 | Alliance Pharmaceutical Corp. | Biocompatible stable fluorocarbon emulsions for contrast enhancement and oxygen transport comprising 40-125% wt./volume fluorocarbon combined with a phospholipid |
| JPH0764702B2 (ja) | 1986-04-23 | 1995-07-12 | 鐘紡株式会社 | 多相乳化型化粧料 |
| JPS6452722A (en) | 1987-05-01 | 1989-02-28 | Anjierini Pharmaceut Inc | Ophthalmic composition |
| JP3046346B2 (ja) | 1990-03-12 | 2000-05-29 | 昭和電工株式会社 | 外用剤基剤又は補助剤とそれを含有する人又は動物の外用剤 |
| US6458376B1 (en) | 1990-09-27 | 2002-10-01 | Allergan, Inc. | Nonaqueous fluorinated drug delivery suspensions |
| US5518731A (en) | 1990-09-27 | 1996-05-21 | Allergan, Inc. | Nonaqueous fluorinated drug delivery vehicle suspensions |
| US5152997A (en) | 1990-12-11 | 1992-10-06 | Theratech, Inc. | Method and device for transdermally administering testosterone across nonscrotal skin at therapeutically effective levels |
| US5326566A (en) | 1991-05-17 | 1994-07-05 | Bristol-Myers Squibb Company | Use of dibutyl adipate and isopropyl myristate in topical and transdermal products |
| GB9114374D0 (en) | 1991-07-03 | 1991-08-21 | Smithkline Beecham Plc | Novel process |
| FR2679150A1 (fr) | 1991-07-17 | 1993-01-22 | Atta | Preparations comprenant un fluorocarbure ou compose hautement fluore et un compose organique lipophile-fluorophile, et leurs utilisations. |
| US6602900B2 (en) | 1992-09-21 | 2003-08-05 | Allergan, Inc. | Cyclopentane heptan(ENE)oic acid, 2-heteroarylalkenyl derivatives as therapeutic agents |
| US5336175A (en) | 1992-10-29 | 1994-08-09 | Mames Robert N | Method for the treatment of retinal detachments |
| US5370313A (en) | 1994-01-10 | 1994-12-06 | Beard; Walter C. | Sterile liquid dispenser |
| DE4405627A1 (de) | 1994-02-22 | 1995-08-24 | Hoechst Ag | Fluorkohlenwasserstoffe enthaltende Ölemulsionen |
| FR2720943B1 (fr) | 1994-06-09 | 1996-08-23 | Applic Transferts Technolo | Emulsions inverses stables à forte concentration en composé(s) fluoré(s) et leur utilisation pour l'administration pulmonaire de médicaments et pour la fabrication d'émulsions multiples. |
| US6294563B1 (en) | 1994-10-27 | 2001-09-25 | Allergan Sales, Inc. | Combinations of prostaglandins and brimonidine or derivatives thereof |
| US5696164A (en) | 1994-12-22 | 1997-12-09 | Johnson & Johnson Consumer Products, Inc. | Antifungal treatment of nails |
| US5667809A (en) | 1995-06-07 | 1997-09-16 | Alliance Pharmaceutical Corp. | Continuous fluorochemical microdispersions for the delivery of lipophilic pharmaceutical agents |
| US5874481A (en) | 1995-06-07 | 1999-02-23 | Alliance Pharmaceutical Corp. | Fluorochemical solutions for the delivery of lipophilic pharmaceutical agents |
| DE19536504C2 (de) | 1995-09-29 | 1999-09-23 | H Meinert | Verwendung fluorierter Alkane |
| US5874469A (en) | 1996-01-05 | 1999-02-23 | Alcon Laboratories, Inc. | Fluoroalkyl hydrocarbons for administering water insoluble or unstable drugs |
| RU2111738C1 (ru) | 1996-06-24 | 1998-05-27 | Акционерное общество "НИЗАР" | Средство для усиления солнцезащитной активности фотозащитных агентов |
| FR2752161B1 (fr) | 1996-08-07 | 1998-09-25 | Atta | Emulsions multiples de type hydrocarbure-dans-eau-dans- fluorocarbone pour le transport de substances medicamenteuses hydrophiles et/ou lipophiles |
| US5863560A (en) | 1996-09-11 | 1999-01-26 | Virotex Corporation | Compositions and methods for topical application of therapeutic agents |
| IN184589B (ko) | 1996-10-16 | 2000-09-09 | Alza Corp | |
| DE19709704C2 (de) | 1997-03-10 | 1999-11-04 | Michael Georgieff | Verwendung einer flüssigen Präparation von Xenon zur intravenösen Verabreichung bei Einleitung und/oder Aufrechterhaltung der Anaesthesie |
| US5980936A (en) | 1997-08-07 | 1999-11-09 | Alliance Pharmaceutical Corp. | Multiple emulsions comprising a hydrophobic continuous phase |
| US6335335B2 (en) | 1997-11-05 | 2002-01-01 | Senju Pharmaceutical Co., Ltd. | Prolonged-action eye drop |
| US5851544A (en) | 1997-12-18 | 1998-12-22 | Chesebrough-Pond's Usa Co., Division Of Conopco, Inc. | Cosmetic skin or hair care compositions containing fluorocarbons infused with carbon dioxide |
| US5981607A (en) | 1998-01-20 | 1999-11-09 | Allergan | Emulsion eye drop for alleviation of dry eye related symptoms in dry eye patients and/or contact lens wearers |
| ATE238751T1 (de) | 1998-02-09 | 2003-05-15 | Macrochem Corp | Antimykotischer nagellack |
| DE19861012A1 (de) | 1998-03-18 | 1999-09-30 | Pharm Pur Gmbh | Behandlungsmittel für die Ophthalmologie |
| ES2211151T3 (es) | 1998-08-19 | 2004-07-01 | Skyepharma Canada Inc. | Dispersiones acuosas inyectables de propofol. |
| US6140374A (en) | 1998-10-23 | 2000-10-31 | Abbott Laboratories | Propofol composition |
| US6159977A (en) | 1998-11-16 | 2000-12-12 | Astan, Inc. | Therapeutic anti-fungal nail preparation |
| NZ513441A (en) | 1999-02-08 | 2004-01-30 | Alza Corp | Stable non-aqueous single phase viscous drug delivery vehicles comprising a polymer a solvent and a surfactant |
| US7258869B1 (en) | 1999-02-08 | 2007-08-21 | Alza Corporation | Stable non-aqueous single phase viscous vehicles and formulations utilizing such vehicle |
| EP1124416A1 (en) | 1999-03-15 | 2001-08-22 | John Claude Krusz | Treatment of acute headaches and chronic pain using rapidly-cleared anesthetic drug at sub-anesthetic dosages |
| US6177477B1 (en) | 1999-03-24 | 2001-01-23 | American Home Products Corporation | Propofol formulation containing TRIS |
| US6239113B1 (en) | 1999-03-31 | 2001-05-29 | Insite Vision, Incorporated | Topical treatment or prevention of ocular infections |
| DE19926890C1 (de) | 1999-06-12 | 2000-07-27 | Pharm Pur Gmbh | Verwendung eines hochfluorierten oligomeren Alkans in der Ophthalmologie |
| DE19938668B4 (de) | 1999-08-14 | 2006-01-26 | Bausch & Lomb Inc. | Tränenersatzmittel |
| US6528086B2 (en) | 1999-09-28 | 2003-03-04 | Zars, Inc. | Methods and apparatus for drug delivery involving phase changing formulations |
| JP2001158734A (ja) | 1999-12-02 | 2001-06-12 | Lion Corp | 眼科用組成物及びソフトコンタクトレンズに対する吸着抑制方法 |
| AU2603301A (en) | 1999-12-22 | 2001-07-03 | Alcon Universal Limited | 6-keto prostaglandin F1alpha and analogs for treating dry eye |
| US20030018044A1 (en) | 2000-02-18 | 2003-01-23 | Peyman Gholam A. | Treatment of ocular disease |
| DE10024413A1 (de) | 2000-05-19 | 2001-12-06 | Mika Pharma Gmbh | Pharmazeutische und/oder kosmetische Zubereitung |
| DE10042412B4 (de) | 2000-08-30 | 2005-12-22 | Lts Lohmann Therapie-Systeme Ag | Transdermales therapeutisches System zur Abgabe von Venlafaxin, und seine Verwendung |
| US6399087B1 (en) | 2000-12-20 | 2002-06-04 | Amphastar Pharmaceuticals, Inc. | Propofol formulation with enhanced microbial inhibition |
| CA2446060A1 (en) | 2001-05-07 | 2002-11-14 | Corium International | Compositions and delivery systems for administration of a local anesthetic agent |
| TWI298257B (en) | 2001-05-31 | 2008-07-01 | Allergan Inc | Hypotensive lipid and timolol compositions and methods of using same |
| RU2302857C2 (ru) | 2001-09-04 | 2007-07-20 | Тромсдорф ГмбХ унд Ко.КГ Арцнаймиттель | Способ и пластырь для профилактики и/или лечения дисфункции и/или нарушения роста ногтей |
| CA2481394A1 (en) | 2002-05-24 | 2003-12-04 | Dr. Gerhard Mann Chem.-Pharm. Fabrik Gmbh | Drop-forming ophthalmic gel preparation comprising diclofenamide and timolol |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| US7074827B2 (en) | 2002-10-24 | 2006-07-11 | Sucampo Ag (Usa) Inc. | Method for treating ocular hypertension and glaucoma |
| EP2977043A3 (en) | 2003-08-25 | 2016-04-06 | Foamix Pharmaceuticals Ltd. | Penetrating pharmaceutical foam |
| US20050079210A1 (en) | 2003-10-09 | 2005-04-14 | Gupta Shyam K. | Liposomal delivery system for topical pharmaceutical, cosmeceutical, and cosmetic ingredients |
| PT1670433E (pt) | 2003-10-10 | 2012-02-08 | Ferring Bv | Fórmula farmacológica transdérmica para a minimização de resíduos na pele |
| EP1684724A4 (en) | 2003-11-19 | 2008-04-02 | Barnes Jewish Hospital | IMPROVED DRUG DELIVERY |
| GB0408164D0 (en) | 2004-04-13 | 2004-05-19 | Immune Targeting Systems Ltd | Antigen delivery vectors and constructs |
| EP1740189B1 (en) | 2004-04-19 | 2012-06-13 | Centre National De La Recherche Scientifique -Cnrs- | Lung surfactant supplements |
| US20050288196A1 (en) | 2004-06-08 | 2005-12-29 | Ocularis Pharma, Inc. | Silicone polymer contact lens compositions and methods of use |
| US7063241B2 (en) | 2004-06-10 | 2006-06-20 | Allergan, Inc. | Dispensing tip |
| NZ552481A (en) | 2004-07-01 | 2008-12-24 | Schepens Eye Res | Compositions and methods for treating eye disorders and conditions |
| US20060078580A1 (en) | 2004-10-08 | 2006-04-13 | Mediquest Therapeutics, Inc. | Organo-gel formulations for therapeutic applications |
| US7740875B2 (en) | 2004-10-08 | 2010-06-22 | Mediquest Therapeutics, Inc. | Organo-gel formulations for therapeutic applications |
| EP1688161A1 (en) | 2004-11-02 | 2006-08-09 | Switch Biotech Aktiengesellschaft | Use of pirlindole for the treatment of diseases which are characterized by proliferation of t-lymphocytes and/or hyperproliferation of keratinocytes in particular atopic dermatitis and psoriasis |
| US7851504B2 (en) | 2005-03-16 | 2010-12-14 | Allergan, Inc. | Enhanced bimatoprost ophthalmic solution |
| GB0511499D0 (en) | 2005-06-06 | 2005-07-13 | Medpharm Ltd | Topical ungual formulations |
| US7687445B2 (en) | 2005-06-22 | 2010-03-30 | Chevron U.S.A. Inc. | Lower ash lubricating oil with low cold cranking simulator viscosity |
| WO2007008666A2 (en) | 2005-07-08 | 2007-01-18 | Ocularis Pharma, Inc. | Compositions and methods for improving vision using adherent thin films |
| MX2008001746A (es) | 2005-08-05 | 2008-04-07 | Bharat Serums & Vaccines Ltd | Composiciones de emulsion de propofol intravenosas que tienen eficacia de conservacion. |
| FR2892023B1 (fr) | 2005-10-14 | 2009-09-25 | Galderma Sa | Composition pharmaceutique a base d'amorolfine et d'agent filmogene hydrosoluble pour application ungueale et peri-ungueale |
| DE102005050431A1 (de) | 2005-10-21 | 2007-04-26 | Lts Lohmann Therapie-Systeme Ag | Transdermales therapeutisches System zur Verabreicherung lipophiler und/oder wenig hautpermeabler Wirkstoffe |
| DE102005055811A1 (de) | 2005-11-23 | 2007-05-31 | Novaliq Gmbh | Verwendung einer Zusammensetzung zur Konservierung von Organen und Gliedmaßen |
| TWI376239B (en) | 2006-02-01 | 2012-11-11 | Andrew Xian Chen | Vitamin e succinate stabilized pharmaceutical compositions, methods for the preparation and the use thereof |
| US20070238732A1 (en) | 2006-04-10 | 2007-10-11 | Allergan, Inc. | Brimonidine and timolol compositions |
| AR062046A1 (es) | 2006-07-25 | 2008-08-10 | Osmotica Pharmaceutical Argentina S A | Soluciones oftalmicas |
| CN101516333A (zh) | 2006-08-04 | 2009-08-26 | 英西斯治疗学股份有限公司 | 水性屈大麻酚制剂 |
| JP5694664B2 (ja) | 2006-09-29 | 2015-04-01 | サーモディクス,インコーポレイティド | 生分解性眼用インプラント及び眼の病気を治療する方法 |
| US9000048B2 (en) | 2006-11-28 | 2015-04-07 | Wisconsin Alumni Research Foundation | Fluoropolymer-based emulsions for the intravenous delivery of fluorinated volatile anesthetics |
| KR20090087917A (ko) | 2006-12-07 | 2009-08-18 | 썬 파마 어드밴스트 리서치 컴패니 리미티드 | 마이크로리터량의 액체를 방울의 형태로 분배하기 위한 계량된 방울 병 |
| CN200977281Y (zh) | 2006-12-08 | 2007-11-21 | 陈宇 | 带助滴器的滴眼瓶 |
| ITMI20070890A1 (it) | 2007-05-04 | 2008-11-05 | Sifi Spa | Composizioni oftalmiche per il trattamento della ipertensione oculare e del glaucoma |
| US8492334B2 (en) | 2007-06-21 | 2013-07-23 | Yale University | Sustained intraocular delivery of drugs from biodegradable polymeric microparticles |
| FR2918891B1 (fr) | 2007-07-20 | 2009-09-25 | Thea Sa Lab | Solution ophtalmique a base de prostaglandines sans conservateur |
| US8222292B2 (en) | 2007-08-06 | 2012-07-17 | Insys Therapeutics, Inc. | Liquid cannabinoid formulations |
| DE102007055046A1 (de) | 2007-11-19 | 2009-05-28 | Fluoron Gmbh | Infusionslösung |
| US20090136430A1 (en) | 2007-11-27 | 2009-05-28 | Dugger Harry A | Antihistamine/Corticosteroid preparations for the treatment of atopic dermatitis |
| WO2009072007A2 (en) | 2007-12-07 | 2009-06-11 | Foamix Ltd. | Carriers, formulations, methods for formulating unstable active agents for external application and uses thereof |
| PL2110126T3 (pl) | 2008-04-18 | 2012-04-30 | Novaliq Gmbh | Zastosowanie do inhalacji i zakraplania semifluorowanych alkanów jako nośników substancji aktywnych w strefie wewnątrzpłucnej |
| US20100006600A1 (en) | 2008-07-14 | 2010-01-14 | Dascanio Gustavo A | Fluid dispenser including hydrophobic ring |
| CA2741862C (en) | 2008-10-31 | 2017-10-17 | Mahmoud A. Elsohly | Compositions containing delta-9-thc-amino acid esters and process of preparation |
| EP2367527A2 (en) | 2008-11-26 | 2011-09-28 | SurModics, Inc. | Implantable ocular drug delivery device and methods |
| WO2010064636A1 (ja) | 2008-12-02 | 2010-06-10 | ロート製薬株式会社 | 眼科用組成物 |
| US8501800B2 (en) | 2009-03-05 | 2013-08-06 | Insite Vision Incorporated | Controlled-release ophthalmic vehicles |
| IT1393419B1 (it) | 2009-03-19 | 2012-04-20 | Medivis S R L | Composizioni oftalmiche a base di acidi grassi polinsaturi omega-3 e omega-6. |
| WO2010146536A1 (en) | 2009-06-18 | 2010-12-23 | Koninklijke Philips Electronics N.V. | Suspension of particles with drug |
| JP5736635B2 (ja) | 2009-06-25 | 2015-06-17 | ライオン株式会社 | ドライアイ治療剤 |
| US9012503B2 (en) | 2009-06-25 | 2015-04-21 | Lion Corporation | Ophthalmic composition |
| PL2387391T3 (pl) | 2009-07-24 | 2017-09-29 | Mika Pharma Gesellschaft Für Die Entwicklung Und Vermarktung Pharmazeutischer Produkte Mbh | Sposób otrzymywania ciekłej kompozycji stosowalnej w postaci piany na skórę oraz kompozycja do aplikowania miejscowego |
| JP2011024841A (ja) | 2009-07-28 | 2011-02-10 | 健太 ▲浜崎▼ | 点眼補助具 |
| EP2332525A1 (en) | 2009-11-23 | 2011-06-15 | Novaliq GmbH | Pharmaceutical composition comprising propofol |
| EP2335735A1 (en) | 2009-12-14 | 2011-06-22 | Novaliq GmbH | Pharmaceutical composition for treatment of dry eye syndrome |
| US20110223208A1 (en) | 2010-03-09 | 2011-09-15 | Beth Hill | Non-Aqueous High Concentration Reduced Viscosity Suspension Formulations |
| KR101656121B1 (ko) | 2010-03-17 | 2016-09-08 | 노바리크 게엠베하 | 안압 증가를 치료하기 위한 약학 조성물 |
| DE102010022567A1 (de) | 2010-06-02 | 2011-12-08 | Fluoron Gmbh | Zubereitung |
| HUP1000362A2 (en) | 2010-07-12 | 2012-11-28 | Egis Gyogyszergyar Nyrt | Antiseptic and disinfecting compositions having reduced iodine content |
| EP2444063A1 (en) | 2010-10-20 | 2012-04-25 | Novaliq GmbH | Liquid pharmaceutical compositions for the delivery of active ingredients |
| EP2462921A1 (en) | 2010-11-11 | 2012-06-13 | Novaliq GmbH | Liquid pharmaceutical compositions for the treatment of a posterior eye disease |
| AU2012204932B2 (en) | 2011-01-04 | 2017-02-23 | Novaliq Gmbh | O/w-emulsions comprising semifluorinated alkanes |
| PL2714010T3 (pl) | 2011-05-25 | 2017-08-31 | Novaliq Gmbh | Kompozycja farmaceutyczna do miejscowego stosowania oparta na semifluorowanych alkanach |
| EP2714008B1 (en) | 2011-05-25 | 2016-12-14 | Novaliq GmbH | Pharmaceutical composition for administration to nails |
| CN202136470U (zh) | 2011-06-08 | 2012-02-08 | 天津市金亿达药用包装材料有限公司 | 便于滴药的眼药瓶 |
| US8758826B2 (en) | 2011-07-05 | 2014-06-24 | Wet Inc. | Cannabinoid receptor binding agents, compositions, and methods |
| AU2013208002B2 (en) | 2012-01-10 | 2017-11-30 | Allergan, Inc. | Topical treatment for chemotherapy induced eyelash loss or hypotrichosis using prostamide F2 alpha agonists |
| WO2013110621A1 (en) | 2012-01-23 | 2013-08-01 | Novaliq Gmbh | Stabilised protein compositions based on semifluorinated alkanes |
| US9549966B2 (en) | 2012-02-21 | 2017-01-24 | Massachusetts Eye & Ear Infirmary | Inflammatory eye disorders |
| US9878000B2 (en) | 2012-06-20 | 2018-01-30 | University Of Waterloo | Mucoadhesive nanoparticle composition comprising immunosuppresant and methods of use thereof |
| CN113679697A (zh) | 2012-09-12 | 2021-11-23 | 诺瓦利克有限责任公司 | 包含半氟化烷烃的混合物的组合物 |
| JP6039152B2 (ja) | 2012-09-12 | 2016-12-07 | ノバリック ゲーエムベーハー | 半フッ素化アルカン組成物 |
| PL2708228T3 (pl) | 2012-09-12 | 2018-11-30 | Novaliq Gmbh | Kompozycje do przemywania oczu |
| TW201427989A (zh) | 2012-12-18 | 2014-07-16 | Novartis Ag | 長效性蛋白質之組合物及方法 |
| EP2968650B1 (en) | 2013-03-14 | 2019-01-16 | PanOptica, Inc. | Ocular formulations for drug-delivery to the posterior segment of the eye |
| EP2783703A1 (en) | 2013-03-25 | 2014-10-01 | B. Braun Melsungen AG | Semifluorocarbon compound containing contrast agent |
| KR102272568B1 (ko) | 2013-07-23 | 2021-07-05 | 노바리크 게엠베하 | 안정화 항체 조성물 |
| CN106061490A (zh) | 2013-10-09 | 2016-10-26 | 列奥尼达斯·A·约翰逊 | 一种治疗和预防眼部疾病症状或体征的方法及组合物 |
| CN203524843U (zh) | 2013-10-20 | 2014-04-09 | 吕相瑜 | 自助滴眼液辅助支架 |
| CA2931039C (en) | 2013-11-20 | 2022-07-12 | Mary Lynch | Compositions and methods for treatment of ocular inflammation and pain |
| MX2016012684A (es) | 2014-03-31 | 2017-05-01 | Amcor Ltd | Recipiente de liberacion controlada. |
| EP2944324A1 (de) | 2014-05-13 | 2015-11-18 | LTS LOHMANN Therapie-Systeme AG | Verwendung von semifluorierten Alkanen in transdermalen therapeutischen Systemen |
| GB2544213B (en) | 2014-08-13 | 2017-09-27 | Univ Florida | Preservative removal from eye drops |
| WO2016082644A1 (en) | 2014-11-26 | 2016-06-02 | The University Of Hong Kong | A semifluorinated alkane based cleaner for removing emulsified droplets in the eye to reduce the complications associated with the emulsification of silicone oil |
| MA41299A (fr) | 2014-12-30 | 2017-11-07 | Axim Biotechnologies Inc | Solutions ophtalmiques pour le traitement du glaucome et de la conjonctivite |
| WO2016108130A1 (en) | 2014-12-30 | 2016-07-07 | Sun Pharmaceutical Industries Limited | Topical pharmaceutical compositions comprising nebivolol for the treatment of diabetic wounds |
| DE202016008738U1 (de) | 2015-09-30 | 2019-04-09 | Novaliq Gmbh | Semifluorierte Verbindungen und ihre Zusammensetzungen |
| CN108349855B (zh) | 2015-09-30 | 2021-07-20 | 诺瓦利克有限责任公司 | 用于眼部给药的半氟化化合物 |
| CA3026053A1 (en) | 2016-06-01 | 2017-12-07 | Harold Richard Hellstrom | Treatment of dry eye disease with parasympathetic and anti-sympathetic agents |
| ES2763121T3 (es) | 2016-06-23 | 2020-05-27 | Novaliq Gmbh | Método de administración tópica |
| CN106176937A (zh) | 2016-08-24 | 2016-12-07 | 刘艺鹏 | 湿疹、痤疮软膏 |
| CN116172987A (zh) | 2016-09-22 | 2023-05-30 | 诺瓦利克有限责任公司 | 用于治疗睑缘炎的药物组合物 |
| US10813976B2 (en) | 2016-09-23 | 2020-10-27 | Novaliq Gmbh | Ophthalmic compositions comprising ciclosporin |
| CA3036313A1 (en) | 2016-09-28 | 2018-04-05 | Novaliq Gmbh | Compositions comprising a cannabinoid receptor binding ligand |
| BR112019012568A2 (pt) | 2016-12-22 | 2019-11-26 | Novaliq Gmbh | composições compreendendo tacrolimus para o tratamento de doenças intraoculares inflamatórias |
| WO2018115097A1 (en) | 2016-12-23 | 2018-06-28 | Novaliq Gmbh | Ophthalmic composition for treatment of dry eye disease |
| CN110678207A (zh) | 2017-04-21 | 2020-01-10 | 诺瓦利克有限责任公司 | 碘组合物 |
| EP3618782B1 (en) | 2017-05-06 | 2021-05-26 | Novaliq GmbH | Drop dispenser |
| US11278503B2 (en) | 2017-05-12 | 2022-03-22 | Novaliq Gmbh | Pharmaceutical compositions comprising semifluorinated alkanes for the treatment of contact lense-related conditions |
| CN111182893A (zh) | 2017-10-04 | 2020-05-19 | 诺瓦利克有限责任公司 | 包含f6h8的眼用组合物 |
| SG11202007858VA (en) | 2018-03-02 | 2020-09-29 | Novaliq Gmbh | Pharmaceutical compositions comprising nebivolol |
| MX2020010078A (es) | 2018-03-28 | 2021-02-26 | Novaliq Gmbh | Composicion farmaceutica que comprenden timolol. |
| WO2019206956A1 (en) | 2018-04-27 | 2019-10-31 | Novaliq Gmbh | Ophthalmic compositions comprising tafluprost for the treatment of glaucoma |
| EP3852734A1 (en) | 2018-09-22 | 2021-07-28 | Novaliq GmbH | Ophthalmic compositions for treatment of ocular surface damage and symptoms of dryness |
| SG11202102820VA (en) | 2018-10-12 | 2021-04-29 | Novaliq Gmbh | Ophthalmic composition for treatment of dry eye disease |
| AU2019390645A1 (en) | 2018-11-27 | 2021-06-10 | Novaliq Gmbh | Semifluorinated alkane compositions comprising omega-3 fatty acid ethyl esters |
| CN113518619A (zh) | 2019-01-21 | 2021-10-19 | 诺瓦利克有限责任公司 | 用于治疗眼部新生血管形成的药物组合物 |
-
2018
- 2018-09-25 CN CN201880075180.6A patent/CN111372566A/zh active Pending
- 2018-09-25 WO PCT/EP2018/075974 patent/WO2019063551A1/en unknown
- 2018-09-25 MX MX2020003534A patent/MX2020003534A/es unknown
- 2018-09-25 IL IL273531A patent/IL273531B1/en unknown
- 2018-09-25 EP EP18773453.8A patent/EP3687496A1/en active Pending
- 2018-09-25 US US16/651,298 patent/US11723861B2/en active Active
- 2018-09-25 KR KR1020207011983A patent/KR20200059272A/ko not_active Application Discontinuation
- 2018-09-25 JP JP2020517321A patent/JP2020535156A/ja active Pending
- 2018-09-25 BR BR112020006072-0A patent/BR112020006072A2/pt unknown
- 2018-09-25 SG SG11202002640YA patent/SG11202002640YA/en unknown
- 2018-09-25 CA CA3076776A patent/CA3076776A1/en active Pending
-
2023
- 2023-06-12 US US18/333,095 patent/US20230398065A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019063551A1 (en) | 2019-04-04 |
| SG11202002640YA (en) | 2020-04-29 |
| US20200268648A1 (en) | 2020-08-27 |
| US11723861B2 (en) | 2023-08-15 |
| CA3076776A1 (en) | 2019-04-04 |
| BR112020006072A2 (pt) | 2020-10-06 |
| EP3687496A1 (en) | 2020-08-05 |
| JP2020535156A (ja) | 2020-12-03 |
| IL273531A (en) | 2020-05-31 |
| IL273531B1 (en) | 2024-01-01 |
| CN111372566A (zh) | 2020-07-03 |
| MX2020003534A (es) | 2020-07-29 |
| US20230398065A1 (en) | 2023-12-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11324757B2 (en) | Pharmaceutical composition for treatment of increased intraocular pressure | |
| AU2017200608B2 (en) | Liquid pharmaceutical composition for the treatment of a posterior eye disease | |
| US20230398065A1 (en) | Ophthalmic compositions comprising latanoprost for use in the treatment of ocular diseases | |
| US20210228595A1 (en) | Ophthalmic compositions comprising tafluprost for the treatment of glaucoma | |
| JP2021518352A (ja) | チモロールを含む医薬組成物 | |
| JP7353292B2 (ja) | ネビボロールを含む医薬組成物 | |
| WO2018033854A1 (en) | Ophthalmic composition and a method for treating ocular hypertension and glaucoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |