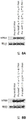KR20200057766A - 페닐케톤뇨증을 치료하기 위한 프로모터 및 인핸서 조합을 포함하는 벡터 - Google Patents
페닐케톤뇨증을 치료하기 위한 프로모터 및 인핸서 조합을 포함하는 벡터 Download PDFInfo
- Publication number
- KR20200057766A KR20200057766A KR1020207012276A KR20207012276A KR20200057766A KR 20200057766 A KR20200057766 A KR 20200057766A KR 1020207012276 A KR1020207012276 A KR 1020207012276A KR 20207012276 A KR20207012276 A KR 20207012276A KR 20200057766 A KR20200057766 A KR 20200057766A
- Authority
- KR
- South Korea
- Prior art keywords
- sequence
- pah
- seq
- promoter
- vector
- Prior art date
Links
- 239000013598 vector Substances 0.000 title claims abstract description 328
- 239000003623 enhancer Substances 0.000 title claims description 201
- 201000011252 Phenylketonuria Diseases 0.000 title abstract description 51
- 102100038223 Phenylalanine-4-hydroxylase Human genes 0.000 claims abstract description 247
- 239000002245 particle Substances 0.000 claims abstract description 57
- 230000001225 therapeutic effect Effects 0.000 claims abstract description 47
- 101710125939 Phenylalanine-4-hydroxylase Proteins 0.000 claims abstract description 13
- 102100027378 Prothrombin Human genes 0.000 claims description 172
- 229940039716 prothrombin Drugs 0.000 claims description 172
- 108010094028 Prothrombin Proteins 0.000 claims description 171
- 210000004027 cell Anatomy 0.000 claims description 160
- 102000008088 Hepatocyte Nuclear Factors Human genes 0.000 claims description 88
- 108010049606 Hepatocyte Nuclear Factors Proteins 0.000 claims description 88
- 239000004055 small Interfering RNA Substances 0.000 claims description 54
- 108091005904 Hemoglobin subunit beta Proteins 0.000 claims description 50
- 102100021519 Hemoglobin subunit beta Human genes 0.000 claims description 49
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 49
- 210000004185 liver Anatomy 0.000 claims description 47
- 238000000034 method Methods 0.000 claims description 43
- 239000013603 viral vector Substances 0.000 claims description 38
- 241000713666 Lentivirus Species 0.000 claims description 26
- 108091032955 Bacterial small RNA Proteins 0.000 claims description 25
- 238000011144 upstream manufacturing Methods 0.000 claims description 25
- 108020004999 messenger RNA Proteins 0.000 claims description 21
- 108091036066 Three prime untranslated region Proteins 0.000 claims description 20
- 101710091045 Envelope protein Proteins 0.000 claims description 14
- 101710188315 Protein X Proteins 0.000 claims description 14
- 241000700605 Viruses Species 0.000 claims description 12
- 230000000295 complement effect Effects 0.000 claims description 11
- 238000003745 diagnosis Methods 0.000 claims description 8
- 238000000338 in vitro Methods 0.000 claims description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 6
- 210000003958 hematopoietic stem cell Anatomy 0.000 claims description 6
- 210000005229 liver cell Anatomy 0.000 claims description 5
- 210000000056 organ Anatomy 0.000 claims description 5
- 239000002243 precursor Substances 0.000 claims description 5
- 239000007787 solid Substances 0.000 claims description 4
- 210000002798 bone marrow cell Anatomy 0.000 claims description 3
- 210000003890 endocrine cell Anatomy 0.000 claims description 3
- 210000002889 endothelial cell Anatomy 0.000 claims description 3
- 210000002919 epithelial cell Anatomy 0.000 claims description 3
- 230000003394 haemopoietic effect Effects 0.000 claims description 3
- 210000004698 lymphocyte Anatomy 0.000 claims description 3
- 210000000663 muscle cell Anatomy 0.000 claims description 3
- 210000004412 neuroendocrine cell Anatomy 0.000 claims description 3
- 210000002569 neuron Anatomy 0.000 claims description 3
- 238000009609 prenatal screening Methods 0.000 claims description 3
- 102100021696 Syncytin-1 Human genes 0.000 claims description 2
- 210000004291 uterus Anatomy 0.000 claims description 2
- 230000002596 correlated effect Effects 0.000 claims 1
- 210000000130 stem cell Anatomy 0.000 claims 1
- 230000014509 gene expression Effects 0.000 abstract description 99
- 108010069013 Phenylalanine Hydroxylase Proteins 0.000 description 234
- 101000604901 Homo sapiens Phenylalanine-4-hydroxylase Proteins 0.000 description 136
- 108020004414 DNA Proteins 0.000 description 99
- 239000013612 plasmid Substances 0.000 description 89
- 241000283973 Oryctolagus cuniculus Species 0.000 description 53
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 44
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 43
- 108090000623 proteins and genes Proteins 0.000 description 36
- 238000004806 packaging method and process Methods 0.000 description 35
- 239000000203 mixture Substances 0.000 description 29
- 206010064911 Pulmonary arterial hypertension Diseases 0.000 description 27
- 108091026890 Coding region Proteins 0.000 description 26
- 230000002068 genetic effect Effects 0.000 description 25
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 25
- 241000282414 Homo sapiens Species 0.000 description 24
- 239000013607 AAV vector Substances 0.000 description 22
- 210000004369 blood Anatomy 0.000 description 22
- 239000008280 blood Substances 0.000 description 22
- 230000037430 deletion Effects 0.000 description 22
- 238000012217 deletion Methods 0.000 description 22
- 102100034349 Integrase Human genes 0.000 description 21
- 102000004169 proteins and genes Human genes 0.000 description 21
- 230000001105 regulatory effect Effects 0.000 description 21
- 238000011282 treatment Methods 0.000 description 21
- 102000013918 Apolipoproteins E Human genes 0.000 description 20
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 20
- 238000003119 immunoblot Methods 0.000 description 19
- 239000002773 nucleotide Substances 0.000 description 19
- 125000003729 nucleotide group Chemical group 0.000 description 19
- 241000714474 Rous sarcoma virus Species 0.000 description 18
- 230000035772 mutation Effects 0.000 description 18
- 108010025628 Apolipoproteins E Proteins 0.000 description 17
- 239000012634 fragment Substances 0.000 description 17
- 102100028709 Thyroxine-binding globulin Human genes 0.000 description 16
- 201000010099 disease Diseases 0.000 description 16
- 238000003780 insertion Methods 0.000 description 16
- 230000037431 insertion Effects 0.000 description 16
- 239000011159 matrix material Substances 0.000 description 16
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 108010000259 Thyroxine-Binding Globulin Proteins 0.000 description 15
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 15
- 101000899111 Homo sapiens Hemoglobin subunit beta Proteins 0.000 description 14
- 108091028043 Nucleic acid sequence Proteins 0.000 description 14
- 238000007792 addition Methods 0.000 description 14
- 239000003814 drug Substances 0.000 description 14
- 238000001802 infusion Methods 0.000 description 14
- 150000007523 nucleic acids Chemical class 0.000 description 14
- 101150036331 pah gene Proteins 0.000 description 14
- 238000001712 DNA sequencing Methods 0.000 description 13
- 241000699670 Mus sp. Species 0.000 description 13
- 239000002552 dosage form Substances 0.000 description 13
- 108020005345 3' Untranslated Regions Proteins 0.000 description 12
- 241000702423 Adeno-associated virus - 2 Species 0.000 description 12
- 102000007469 Actins Human genes 0.000 description 11
- 108010085238 Actins Proteins 0.000 description 11
- 102000006754 Hepatocyte Nuclear Factor 1 Human genes 0.000 description 11
- 108010086512 Hepatocyte Nuclear Factor 1 Proteins 0.000 description 11
- 108091027981 Response element Proteins 0.000 description 11
- 239000008194 pharmaceutical composition Substances 0.000 description 11
- 101000834253 Gallus gallus Actin, cytoplasmic 1 Proteins 0.000 description 10
- 201000009030 Carcinoma Diseases 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 230000009467 reduction Effects 0.000 description 8
- 108700004030 rev Genes Proteins 0.000 description 8
- 241000702421 Dependoparvovirus Species 0.000 description 7
- 101100190273 Homo sapiens PAH gene Proteins 0.000 description 7
- 102000018146 globin Human genes 0.000 description 7
- 108060003196 globin Proteins 0.000 description 7
- 210000003494 hepatocyte Anatomy 0.000 description 7
- 238000011068 loading method Methods 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 102000039446 nucleic acids Human genes 0.000 description 7
- 108020004707 nucleic acids Proteins 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 238000010361 transduction Methods 0.000 description 7
- 230000026683 transduction Effects 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 241000713813 Gibbon ape leukemia virus Species 0.000 description 6
- 102000006752 Hepatocyte Nuclear Factor 4 Human genes 0.000 description 6
- 108010061833 Integrases Proteins 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 241000283923 Marmota monax Species 0.000 description 6
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 6
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 239000013592 cell lysate Substances 0.000 description 6
- 238000010276 construction Methods 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 108700004026 gag Genes Proteins 0.000 description 6
- 239000000499 gel Substances 0.000 description 6
- 108091008634 hepatocyte nuclear factors 4 Proteins 0.000 description 6
- 201000007270 liver cancer Diseases 0.000 description 6
- 208000014018 liver neoplasm Diseases 0.000 description 6
- 108700004029 pol Genes Proteins 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 101000823116 Homo sapiens Alpha-1-antitrypsin Proteins 0.000 description 5
- 102000011755 Phosphoglycerate Kinase Human genes 0.000 description 5
- 102100037935 Polyubiquitin-C Human genes 0.000 description 5
- 101001099217 Thermotoga maritima (strain ATCC 43589 / DSM 3109 / JCM 10099 / NBRC 100826 / MSB8) Triosephosphate isomerase Proteins 0.000 description 5
- 108010056354 Ubiquitin C Proteins 0.000 description 5
- 102000051631 human SERPINA1 Human genes 0.000 description 5
- 208000015181 infectious disease Diseases 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 239000007909 solid dosage form Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 241001115402 Ebolavirus Species 0.000 description 4
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 4
- 108700011259 MicroRNAs Proteins 0.000 description 4
- 229920002873 Polyethylenimine Polymers 0.000 description 4
- 238000011529 RT qPCR Methods 0.000 description 4
- 108020004459 Small interfering RNA Proteins 0.000 description 4
- 102000004142 Trypsin Human genes 0.000 description 4
- 108090000631 Trypsin Proteins 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 239000000443 aerosol Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000007547 defect Effects 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 108010030074 endodeoxyribonuclease MluI Proteins 0.000 description 4
- 210000003754 fetus Anatomy 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 239000002679 microRNA Substances 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 108091008146 restriction endonucleases Proteins 0.000 description 4
- 101150098213 rev gene Proteins 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- 239000012588 trypsin Substances 0.000 description 4
- 210000003462 vein Anatomy 0.000 description 4
- 241000710929 Alphavirus Species 0.000 description 3
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 101710121417 Envelope glycoprotein Proteins 0.000 description 3
- 101000771674 Homo sapiens Apolipoprotein E Proteins 0.000 description 3
- 101000651439 Homo sapiens Prothrombin Proteins 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- 108020005198 Long Noncoding RNA Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 208000014252 Mild phenylketonuria Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 241000711798 Rabies lyssavirus Species 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 229960000723 ampicillin Drugs 0.000 description 3
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 210000000234 capsid Anatomy 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000006186 oral dosage form Substances 0.000 description 3
- 230000001124 posttranscriptional effect Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- FNKQXYHWGSIFBK-RPDRRWSUSA-N sapropterin Chemical compound N1=C(N)NC(=O)C2=C1NC[C@H]([C@@H](O)[C@@H](O)C)N2 FNKQXYHWGSIFBK-RPDRRWSUSA-N 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 238000011200 topical administration Methods 0.000 description 3
- 238000002627 tracheal intubation Methods 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 241001430294 unidentified retrovirus Species 0.000 description 3
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 101710095339 Apolipoprotein E Proteins 0.000 description 2
- 102100029470 Apolipoprotein E Human genes 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 101710205625 Capsid protein p24 Proteins 0.000 description 2
- 108010078791 Carrier Proteins Proteins 0.000 description 2
- 208000014249 Classic phenylketonuria Diseases 0.000 description 2
- 102000012410 DNA Ligases Human genes 0.000 description 2
- 108010061982 DNA Ligases Proteins 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 241000714162 Feline endogenous virus Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 108010002459 HIV Integrase Proteins 0.000 description 2
- 208000021124 Heritable pulmonary arterial hypertension Diseases 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 239000006137 Luria-Bertani broth Substances 0.000 description 2
- 241000712899 Lymphocytic choriomeningitis mammarenavirus Species 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 2
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241001504519 Papio ursinus Species 0.000 description 2
- 101710177166 Phosphoprotein Proteins 0.000 description 2
- 108091007412 Piwi-interacting RNA Proteins 0.000 description 2
- 241001428754 Rat leukemia virus Species 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 101710149279 Small delta antigen Proteins 0.000 description 2
- 108091046869 Telomeric non-coding RNA Proteins 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 102100022563 Tubulin polymerization-promoting protein Human genes 0.000 description 2
- 108091023045 Untranslated Region Proteins 0.000 description 2
- 108091034131 VA RNA Proteins 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 238000000246 agarose gel electrophoresis Methods 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 102000015395 alpha 1-Antitrypsin Human genes 0.000 description 2
- 108010050122 alpha 1-Antitrypsin Proteins 0.000 description 2
- 229940024142 alpha 1-antitrypsin Drugs 0.000 description 2
- 150000001413 amino acids Chemical group 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 201000006824 bubonic plague Diseases 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- -1 coatings Substances 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000000378 dietary effect Effects 0.000 description 2
- 235000020805 dietary restrictions Nutrition 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 108700004025 env Genes Proteins 0.000 description 2
- 101150030339 env gene Proteins 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000003197 gene knockdown Methods 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000037797 influenza A Diseases 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000008297 liquid dosage form Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- YNCODRLFXWRMSN-YVLHZVERSA-N n-[(z)-(4-methoxyphenyl)methylideneamino]phthalazin-1-amine Chemical compound C1=CC(OC)=CC=C1\C=N/NC1=NN=CC2=CC=CC=C12 YNCODRLFXWRMSN-YVLHZVERSA-N 0.000 description 2
- 239000012457 nonaqueous media Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 108010089520 pol Gene Products Proteins 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 210000003240 portal vein Anatomy 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 230000000644 propagated effect Effects 0.000 description 2
- 230000016917 protein folding in endoplasmic reticulum Effects 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 2
- 230000004043 responsiveness Effects 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 230000035939 shock Effects 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000002463 transducing effect Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 241000712461 unidentified influenza virus Species 0.000 description 2
- 210000002845 virion Anatomy 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 238000011179 visual inspection Methods 0.000 description 2
- 239000002023 wood Substances 0.000 description 2
- 241001164825 Adeno-associated virus - 8 Species 0.000 description 1
- 108010057856 Adenovirus E2 Proteins Proteins 0.000 description 1
- 108010056962 Adenovirus E4 Proteins Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101710081722 Antitrypsin Proteins 0.000 description 1
- 241000712891 Arenavirus Species 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 206010012305 Demyelination Diseases 0.000 description 1
- 241000725619 Dengue virus Species 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 201000011001 Ebola Hemorrhagic Fever Diseases 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000714165 Feline leukemia virus Species 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 241000710831 Flavivirus Species 0.000 description 1
- 101710177291 Gag polyprotein Proteins 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 101000820777 Homo sapiens Syncytin-1 Proteins 0.000 description 1
- 101000837639 Homo sapiens Thyroxine-binding globulin Proteins 0.000 description 1
- 241000005822 Human endogenous retrovirus W Species 0.000 description 1
- 241001213909 Human endogenous retroviruses Species 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- 206010020565 Hyperaemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 201000006347 Intellectual Disability Diseases 0.000 description 1
- XUIIKFGFIJCVMT-LBPRGKRZSA-N L-thyroxine Chemical compound IC1=CC(C[C@H]([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-LBPRGKRZSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 239000004909 Moisturizer Substances 0.000 description 1
- 208000005647 Mumps Diseases 0.000 description 1
- NSTPXGARCQOSAU-VIFPVBQESA-N N-formyl-L-phenylalanine Chemical compound O=CN[C@H](C(=O)O)CC1=CC=CC=C1 NSTPXGARCQOSAU-VIFPVBQESA-N 0.000 description 1
- 206010060860 Neurological symptom Diseases 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091005461 Nucleic proteins Chemical group 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 102000009572 RNA Polymerase II Human genes 0.000 description 1
- 108010009460 RNA Polymerase II Proteins 0.000 description 1
- 102000014450 RNA Polymerase III Human genes 0.000 description 1
- 108010078067 RNA Polymerase III Proteins 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108010034546 Serratia marcescens nuclease Proteins 0.000 description 1
- 241000710960 Sindbis virus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000710771 Tick-borne encephalitis virus Species 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 101150044878 US18 gene Proteins 0.000 description 1
- 101900059419 Vesicular stomatitis Indiana virus Glycoprotein Proteins 0.000 description 1
- 241000711975 Vesicular stomatitis virus Species 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000001475 anti-trypsic effect Effects 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 231100000871 behavioral problem Toxicity 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 150000003943 catecholamines Chemical class 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 210000003161 choroid Anatomy 0.000 description 1
- 239000013611 chromosomal DNA Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ULFHSQLFQYTZLS-UHFFFAOYSA-N difluoroamine Chemical compound FNF ULFHSQLFQYTZLS-UHFFFAOYSA-N 0.000 description 1
- 229910001882 dioxygen Inorganic materials 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 235000013345 egg yolk Nutrition 0.000 description 1
- 210000002969 egg yolk Anatomy 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 238000002641 enzyme replacement therapy Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 101150098622 gag gene Proteins 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 238000010448 genetic screening Methods 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- GVVPGTZRZFNKDS-JXMROGBWSA-N geranyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CO[P@](O)(=O)OP(O)(O)=O GVVPGTZRZFNKDS-JXMROGBWSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 238000000703 high-speed centrifugation Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 230000032630 lymph circulation Effects 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000001333 moisturizer Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 208000010805 mumps infectious disease Diseases 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 229940097496 nasal spray Drugs 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 108091027963 non-coding RNA Proteins 0.000 description 1
- 102000042567 non-coding RNA Human genes 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 239000000668 oral spray Substances 0.000 description 1
- 229940041678 oral spray Drugs 0.000 description 1
- 239000007935 oral tablet Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 101150088264 pol gene Proteins 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 239000012474 protein marker Substances 0.000 description 1
- 230000018883 protein targeting Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 229960004617 sapropterin Drugs 0.000 description 1
- 239000008299 semisolid dosage form Substances 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 239000004017 serum-free culture medium Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000006190 sub-lingual tablet Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 239000006208 topical dosage form Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 210000003606 umbilical vein Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 108700001624 vesicular stomatitis virus G Proteins 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- A61K48/0058—Nucleic acids adapted for tissue specific expression, e.g. having tissue specific promoters as part of a contruct
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/795—Porphyrin- or corrin-ring-containing peptides
- C07K14/805—Haemoglobins; Myoglobins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/81—Protease inhibitors
- C07K14/8107—Endopeptidase (E.C. 3.4.21-99) inhibitors
- C07K14/811—Serine protease (E.C. 3.4.21) inhibitors
- C07K14/8121—Serpins
- C07K14/8125—Alpha-1-antitrypsin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0071—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y114/00—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14)
- C12Y114/16—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14) with reduced pteridine as one donor, and incorporation of one atom of oxygen (1.14.16)
- C12Y114/16001—Phenylalanine 4-monooxygenase (1.14.16.1)
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/035—Animal model for multifactorial diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
- C12N2310/531—Stem-loop; Hairpin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15031—Uses of virus other than therapeutic or vaccine, e.g. disinfectant
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15042—Use of virus, viral particle or viral elements as a vector virus or viral particle as vehicle, e.g. encapsulating small organic molecule
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16041—Use of virus, viral particle or viral elements as a vector
- C12N2740/16043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2810/00—Vectors comprising a targeting moiety
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/008—Vector systems having a special element relevant for transcription cell type or tissue specific enhancer/promoter combination
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/42—Vector systems having a special element relevant for transcription being an intron or intervening sequence for splicing and/or stability of RNA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/48—Vector systems having a special element relevant for transcription regulating transport or export of RNA, e.g. RRE, PRE, WPRE, CTE
Abstract
렌티바이러스 입자를 발현시키기 위한 렌티바이러스 벡터 시스템이 개시되어 있다. 렌티바이러스 벡터 시스템은 치료적 벡터를 포함한다. 렌티바이러스 벡터 시스템은 페닐케톤뇨증 (PKU) 에 걸린 대상체의 세포에서 PAH 발현을 상향조절하기 위한 렌티바이러스 입자를 생산한다.
Description
관련 출원의 상호 참조
본 출원은 2017 년 10 월 2 일에 출원된, 표제 "페닐케톤뇨증을 치료하기 위한 프로모터 및 인핸서 조합을 포함하는 벡터" 의, 미국 가 특허 출원 No. 62/566,979 에 대해 우선권을 주장하며, 상기 출원의 공개가 그 전문이 본원에 참조로 포함된다.
기술분야
본 공개의 양태는 페닐케톤뇨증 (phenylketonuria) (PKU) 을 치료하기 위한 유전 의약에 관한 것이다. 더욱 구체적으로, 본 공개의 양태는 발현이 다양한 프로모터 및 인핸서 조합에 의해 제어되는, PAH-함유 렌티바이러스 벡터를 포함하는, 렌티바이러스 벡터에 관한 것이다.
페닐케톤뇨증 (PKU) 은 치료받지 않은 채로 있다면 지적 장애, 발작, 행동 문제, 및 영향을 받는 어린이에서 손상된 성장 및 발달을 초래할 수 있는 장애의 이종 군을 나타낸다. 고페닐알라닌 혈증이 지적 장애를 초래하는 메커니즘은 고용량 페닐알라닌의 놀라운 독성을 반영하며 신경계 조직의 저수초화 또는 탈수초화를 포함한다. PKU는 북미에서 12,000 건 중 1 건의 평균 보고 발생률을 가지며, 남성과 여성에게 동일하게 영향을 준다. 이 장애는 유럽인 또는 아메리카 원주민 조상에서 가장 흔하며 동부 지중해 지역에서 훨씬 높은 수준에 이른다.
PKU 환자의 신경학적 변화는 생후 1 개월 이내에 입증되었으며, 성인 PKU 환자의 자기 공명 영상 (MRI) 은 뇌에서의 백질 병변을 보여주었다. 이러한 병변의 크기와 수는 혈액 페닐알라닌 농도와 직접적으로 관련된다. 대조군 대상체과 비교하여 PKU 를 갖는 청소년 및 성인의 인지 프로파일은 현저하게 감소된 IQ, 처리 속도, 운동 제어 및 억제 능력, 및 주의력 시험에서의 수행 감소를 포함할 수 있다.
PKU 의 대부분은 간 페닐알라닌 히드록실라아제 (PAH) 의 결핍으로 인해 야기된다. PAH 는 분자 산소 및 촉매량의 테트라히드로바이오프테린 (BH4), 그의 비단백질 보조인자의 존재 하에 페닐알라닌 (Phe) 의 티로신 (Tyr) 으로의 히드록실화를 촉매화하는 다량체성 간 효소이다. PAH 의 충분한 발현의 부재 하에, 혈액 내 페닐알라닌 수치가 증가하여 PKU 환자에서 고페닐알라닌혈증 및 유해한 부작용을 일으킨다. PAH 활성의 감소 또는 부재는 티로신, 및 멜라닌, l-티록신 및 카테콜아민 신경전달물질 (도파민을 포함) 을 포함하는 그의 다운스트림 생성물의 결핍을 유발할 수 있다.
PKU 는 PAH 에서의 돌연변이 및/또는 PAH 보조인자 (즉, BH4) 의 합성 또는 재생 결함에 의해 유발될 수 있다. 특히, 몇몇 PAH 돌연변이는 소포체에서의 단백질 폴딩에 영향을 미치는 것으로 나타났으며, 이는 효소 촉매 활성을 약화시키거나 크게 철폐시키는 단백질 구조에서의 미스센스 돌연변이 (63%) 및 작은 결실 (13%) 로 인한 가속화된 분해 및/또는 응집을 초래한다.
일반적으로, 혈장 Phe 수준, Phe 에 대한 식이 내성 및 치료요법에 대한 잠재적 반응성을 기반으로 하여 PKU 를 분류하기 위해 3 개의 주요 표현형 군이 사용된다. 이들 군은 고전적 PKU (Phe > 1200 μM), 비정형 또는 경증 PKU (Phe 가 600 - 1200 μM 임) 및 영구적인 경증 고페닐알라닌혈증 (HPA, Phe 120 - 600 μM) 을 포함한다.
PKU 의 검출은 보편적 신생아 스크리닝 (NBS) 에 의존한다. 힐 스틱 (heel stick) 으로부터 채취한 혈액 1 점적을 미국의 모든 50 개 주에서 필수인 스크린에서 페닐알라닌 수치에 대해 검사한다.
현재, Phe 및 BH4 보충의 평생 식이 제한은 PKU 에 대해 유일하게 이용가능한 두 가지 치료 옵션이며, 영향받은 영아에서 최적의 임상 결과를 보장하기 위해 조기 치료 개입이 중요하다. 그러나, 고가의 약물 치료와 특수 저-단백 식품은, 특히 이들 제품이 민감 의료 보험에 의해 완전히 커버되지 않는 경우, 영양결핍, 심리사회적 또는 신경인지적 합병증으로 이어질 수 있는 환자에 대한 큰 부담을 부과한다. 또한, BH4 치료요법은 BH4 생합성에서의 결함과 관련된 바에 따라 경증 고페닐알라닌혈증의 치료에 주로 효과적인 반면, 경증 또는 고전적 PKU 를 갖는 환자의 오직 20-30% 만이 반응성이다. 따라서, 과도한 Phe-제한 식단에 대한 대안으로서 PKU 를 위한 새로운 치료 방식이 절실히 필요하다. 따라서, 페닐케톤뇨증의 치료를 위한 대안적 방법을 개발하는 것이 바람직할 것이다.
유전 의약은 PKU 를 효과적으로 치료하는 잠재성을 갖는다. 유전 의약은 질환 요법 또는 예방의 목적을 위해 유전적 구축물의 전달 및 발현을 수반할 수 있따. 유전적 구축물의 발현은 다양한 프로모터, 인핸서, 및/또는 그의 조합에 의해 조정될 수 있다.
본 공개의 양태에서, 바이러스 벡터는 치료적 카고 부분을 포함하며, 치료적 카고 부분은 PAH 서열 또는 그의 변이체, 프로모터, 및 간-특이적 인핸서를 포함하며, PAH 서열 또는 그의 변이체는 프로모터 및 간-특이적 인핸서 둘 모두에 의해 작동적으로 제어된다.
실시형태에서, 간-특이적 인핸서는 프로트롬빈 인핸서를 포함한다. 실시형태에서, 프로모터는 간-특이적 프로모터이다. 실시형태에서, 간-특이적 프로모터는 hAAT 프로모터를 포함한다. 실시형태에서, 치료적 카고 부분은 베타 글로빈 인트론을 추가로 포함한다. 실시형태에서, 치료적 카고 부분은 적어도 하나의 간세포 핵 인자 결합 자리를 추가로 포함한다. 실시형태에서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 업스트림에 배치되어 있다. 실시형태에서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 다운스트림에 배치되어 있다.
실시형태에서, PAH 서열 또는 그의 변이체는 절두되어 있다. 실시형태에서, PAH 서열 또는 그의 변이체의 절두된 부분은 PAH 서열 또는 그의 변이체의 3' 미번역 영역 (UTR) 이다.
실시형태에서, PAH 서열 또는 그의 변이체는 하기 서열과 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함한다:
실시형태에서, PAH 서열 또는 그의 변이체는 하기 서열을 포함한다: SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; 또는 SEQ ID NO: 4.
실시형태에서, 프로트롬빈 인핸서는 하기 서열과 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함한다:
실시형태에서, 프로트롬빈 인핸서의 서열은 SEQ ID NO: 5 를 포함한다.
실시형태에서, hAAT 프로모터의 서열은 SEQ ID NO: 6 을 포함한다. 실시형태에서, 베타 글로빈 인트론의 서열은 SEQ ID NOs: 7 또는 8 중 하나를 포함한다. 실시형태에서, 간세포 핵 인자 결합 자리의 서열은 SEQ ID NOs: 9-12 중 임의의 하나를 포함한다.
실시형태에서, 치료적 카고 부분은 적어도 하나의 예정된 상보적 mRNA 서열에 결합할 수 있는 적어도 하나의 작은 RNA 서열을 추가로 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 전장 UTR 를 함유하는 상보적 mRNA 서열을 표적화한다. 실시형태에서, 적어도 하나의 예정된 상보적 mRNA 서열은 PAH mRNA 서열이다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 내인성 PAH 의 생산을 저해한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 shRNA 를 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 제 1 프로모터의 제어 하에 있고, PAH 서열 또는 그의 변이체는 제 2 프로모터의 제어 하에 있다. 실시형태에서, 제 1 프로모터는 H1 프로모터를 포함한다. 실시형태에서, 제 2 프로모터는 간-특이적 프로모터를 포함한다. 실시형태에서, 간-특이적 프로모터는 hAAT 프로모터를 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 하기 서열과 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함한다:
실시형태에서, 적어도 하나의 작은 RNA 서열은 SEQ ID NO: 13; 또는 SEQ ID NO: 14 를 포함한다.
실시형태에서, 바이러스 벡터는 렌티바이러스 벡터이다. 실시형태에서, 바이러스 벡터는 AAV 벡터이다.
본 공개의 양태에서, 표적 세포를 감염시킬 수 있는 렌티바이러스 입자는 표적 세포를 감염시키기 위해 최적화된 외피 단백질, 및 본 공개의 임의의 실시형태에 따른 바이러스 벡터를 포함한다. 실시형태에서, 표적 세포는 간 세포, 근육 세포, 상피 세포, 내피 세포, 신경 세포, 신경내분비 세포, 내분비 세포, 림프구, 골수 세포, 고형 기관 내에 존재하는 세포, 또는 조혈 계통의 세포, 조혈 줄기 세포, 또는 전구체 조혈 줄기 세포이다.
본 공개의 양태에서, 대상체에서 PKU 을 치료하는 방법이 개시되어 있다. 방법은 대상체에게 치료 유효량의 본원에서 기재되는 렌티바이러스 입자를 투여하는 것을 포함한다. 본 공개의 양태에서, 대상체에서 PKU 을 예방하는 방법은 대상체에게 치료 유효량의 본원에서 기재되는 렌티바이러스 입자를 투여하는 것을 포함한다. 실시형태에서, 방법은 대상체에서 PKU 표현형과 상관관계가 있는 PKU 유전자형을 진단하는 것을 추가로 포함한다. 실시형태에서, 대상체는 자궁 내에 (in utero) 있다. 실시형태에서, 진단은 대상체의 태아기 스크리닝 동안 이루어진다. 실시형태에서, 진단은 시험관 내에서 (in vitro) 이루어진다. 실시형태에서, 치료 유효량의 렌티바이러스 입자는 복수의 단일 용량의 렌티바이러스 입자를 포함한다. 실시형태에서, 치료 유효량의 렌티바이러스 입자는 단일 용량의 렌티바이러스 입자를 포함한다.
도 1 은 원형화된 형태의 예시적 3-벡터 렌티바이러스 벡터 시스템을 도시한다.
도 2 는 원형화된 형태의 예시적 4-벡터 렌티바이러스 벡터 시스템을 도시한다.
도 3 은 프로트롬빈 인핸서의 변이 및 PAH 의 발현을 조절하기 위한 hAAT 프로모터를 함유하는 여덟 가지 예시적 렌티바이러스 벡터의 선형 맵을 도시한다.
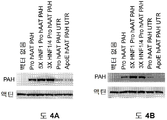
도 4A 및 4B 는 (도 4A) Hepa1-6 및 (도 4B) 293T 세포에서 3' UTR 의 존재 또는 부재 하에 상이한 인핸서 요소에 의한 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
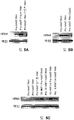
도 5A-5C 는 Hepa1-6 세포에서 (도 5A) 토끼 베타 글로빈 인트론, (도 5B) 코돈-최적화된 PAH 서열, 및 (도 5C) 업스트림 또는 다운스트림에 HNF1 또는 HNF1/4 결합 자리가 있는 프로트롬빈 인핸서의 존재 또는 부재 하에 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 6 은 프로트롬빈 인핸서에서의 변이를 통해 PAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포에서의 PAH RNA 발현을 도시한다.
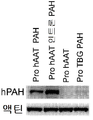
도 7 은 Hepa1-6 세포에서 항-알파 1 트립신 (hAAT) 또는 티록신-결합 글로불린 (TBG) 프로모터에 의한 PAH 발현의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 8A 및 8B 는 Hepa1-6 세포 (도 8A) 또는 Hep3B 세포 (도 8B) 에서 토끼 또는 인간 베타 글로빈 인트론의 존재 또는 부재 하에 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 9 는 PAH 를 발현하는 렌티바이러스 벡터에 의한 인간 일차 간세포에서 PAH 발현의 면역블롯 데이타를 도시한다.
도 10A-10C 는 PAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포의 (도 10A 및 10C) 세포 배지 또는 (도 10B) 용해물의 페닐알라닌 수준의 검출 및 세피아프테린, BH4 보조인자 전구체에 의한 처리에 의한 PAH 활성을 도시한다.
도 11 은 PAH 를 함유하는 렌티바이러스 벡터로 처리한 후에 Pahenu2 마우스의 혈액에서 Phe 의 감소된 수준을 도시한다.
도 12 는 LV-Pro-hAAT-PAH 에 의한 혈액 페닐알라닌 억제를 도시한다.
도 13A-13D 는 다양한 DJ 또는 AAV/2 혈청형 벡터에 의한 293 세포에서 PAH 의 AAV-전달되는 발현 후에 PAH 단백질 발현 (도 13A) 및 PAH RNA 발현 (도 13D) 을 도시한다; AAV/DJ 벡터 (도 13B) 및 AAV/2 벡터 (도 13C) 의 전달 후에 PAH 단백질 발현의 배수 변화를 또한 분석했다.
도 14 는 PKU 에 관해 LV-Pro-hAAT-PAH 렌티바이러스 벡터 요법으로 치료된 신생아 enu2/enu2 마우스에서 Phe 의 감소된 수준을 도시한다.
도 15 는 프로트롬빈-hAAT-PAH-PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 프로트롬빈-hAAT-PAH-PAH shRNA 서열 #2 (SEQ ID NO: 14) (이들 각각은 내인성 Pah 유전자에 의해 발현되는 mRNA 의 3'UTR 를 표적화하고 PAH 단백질의 발현을 저해한다) 을 인코딩하는 렌티바이러스 벡터로 처리한 후에 PAH 발현을 보이는 Hep3B 세포로부터의 데이타를 도시한다.
도 2 는 원형화된 형태의 예시적 4-벡터 렌티바이러스 벡터 시스템을 도시한다.
도 3 은 프로트롬빈 인핸서의 변이 및 PAH 의 발현을 조절하기 위한 hAAT 프로모터를 함유하는 여덟 가지 예시적 렌티바이러스 벡터의 선형 맵을 도시한다.
도 4A 및 4B 는 (도 4A) Hepa1-6 및 (도 4B) 293T 세포에서 3' UTR 의 존재 또는 부재 하에 상이한 인핸서 요소에 의한 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 5A-5C 는 Hepa1-6 세포에서 (도 5A) 토끼 베타 글로빈 인트론, (도 5B) 코돈-최적화된 PAH 서열, 및 (도 5C) 업스트림 또는 다운스트림에 HNF1 또는 HNF1/4 결합 자리가 있는 프로트롬빈 인핸서의 존재 또는 부재 하에 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 6 은 프로트롬빈 인핸서에서의 변이를 통해 PAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포에서의 PAH RNA 발현을 도시한다.
도 7 은 Hepa1-6 세포에서 항-알파 1 트립신 (hAAT) 또는 티록신-결합 글로불린 (TBG) 프로모터에 의한 PAH 발현의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 8A 및 8B 는 Hepa1-6 세포 (도 8A) 또는 Hep3B 세포 (도 8B) 에서 토끼 또는 인간 베타 글로빈 인트론의 존재 또는 부재 하에 PAH 의 수준을 비교하는 면역블롯 데이타를 도시한다.
도 9 는 PAH 를 발현하는 렌티바이러스 벡터에 의한 인간 일차 간세포에서 PAH 발현의 면역블롯 데이타를 도시한다.
도 10A-10C 는 PAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포의 (도 10A 및 10C) 세포 배지 또는 (도 10B) 용해물의 페닐알라닌 수준의 검출 및 세피아프테린, BH4 보조인자 전구체에 의한 처리에 의한 PAH 활성을 도시한다.
도 11 은 PAH 를 함유하는 렌티바이러스 벡터로 처리한 후에 Pahenu2 마우스의 혈액에서 Phe 의 감소된 수준을 도시한다.
도 12 는 LV-Pro-hAAT-PAH 에 의한 혈액 페닐알라닌 억제를 도시한다.
도 13A-13D 는 다양한 DJ 또는 AAV/2 혈청형 벡터에 의한 293 세포에서 PAH 의 AAV-전달되는 발현 후에 PAH 단백질 발현 (도 13A) 및 PAH RNA 발현 (도 13D) 을 도시한다; AAV/DJ 벡터 (도 13B) 및 AAV/2 벡터 (도 13C) 의 전달 후에 PAH 단백질 발현의 배수 변화를 또한 분석했다.
도 14 는 PKU 에 관해 LV-Pro-hAAT-PAH 렌티바이러스 벡터 요법으로 치료된 신생아 enu2/enu2 마우스에서 Phe 의 감소된 수준을 도시한다.
도 15 는 프로트롬빈-hAAT-PAH-PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 프로트롬빈-hAAT-PAH-PAH shRNA 서열 #2 (SEQ ID NO: 14) (이들 각각은 내인성 Pah 유전자에 의해 발현되는 mRNA 의 3'UTR 를 표적화하고 PAH 단백질의 발현을 저해한다) 을 인코딩하는 렌티바이러스 벡터로 처리한 후에 PAH 발현을 보이는 Hep3B 세포로부터의 데이타를 도시한다.
상세한 설명
본 공개의 개관
이 공개는 치료적 벡터 및 세포로의 치료적 벡터의 전달에 관한 것이다. 실시형태에서, 치료적 벡터는 PAH 서열 또는 그의 변이체, 및 간-특이적 인핸서를 포함한다. 실시형태에서, 치료적 벡터는 숙주 (즉, 내인성) PAH 단백질 발현을 조절하는 작은 RNA 를 또한 포함한다.
정의 및 해석
본원에서 달리 정의되지 않는 한, 본 공개와 관련하여 사용된 과학 및 기술 용어는 당업자에게 일반적으로 이해되는 의미를 가질 것이다. 또한, 문맥에서 달리 요구되지 않는 한, 단수형 용어는 복수형을 포함할 것이고, 복수형 용어는 단수형을 포함할 것이다. 일반적으로, 본원에 기재된 세포 및 조직 배양, 분자 생물학, 면역학, 미생물학, 유전학 및 단백질 및 핵산 화학 및 하이브리드화와 관련하여 사용된 명명법 및 이의 기법은 당업계에 잘 공지되어 있으며 통상적으로 사용되는 것들이다. 본 공개의 방법 및 기법은 일반적으로 당업계에 잘 공지된 종래의 방법에 따라, 그리고 달리 지시되지 않는 한 본 명세서 전반에 걸쳐 인용되고 논의된 다양한 일반적이고 보다 구체적인 참고문헌에 기재된 바와 같이 수행된다. 예를 들어, 다음을 참조한다: Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); 및 Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). 임의의 효소 반응 또는 정제 기법은 당업계에서 일반적으로 달성되거나 본원에 기재된 바와 같이 제조사의 사양에 따라 수행된다. 본원에 기재된 분석 화학, 합성 유기 화학, 및 의학 및 제약 화학과 관련하여 사용된 명명법 및 이의 실험실 절차 및 기법은 당업계에 잘 공지되며 통상적으로 사용되는 것들이다.
상세한 설명 및 첨부된 청구범위에 사용되는 바와 같이, 단수형 형태는 문맥에서 명백하게 달리 나타내지 않는 한, 복수형 형태와 상호교환가능하게 사용되며 복수형 형태를 포함하는 것 뿐만 아니라 각각의 의미 내에 포함되는 것으로 의도된다. 또한, 본원에서 사용되는 바와 같이, "및/또는" 은 하나 이상의 열거된 항목의 임의의 및 모든 가능한 조합 뿐만 아니라 대안으로 해석될 때의 조합 부족 ("또는") 을 나타내며 포함한다.
모든 숫자 지정, 예를 들어 범위를 포함하는, pH, 온도, 시간, 농도 및 분자량은 0.1 씩 증가하여 (+) 또는 (-) 로 변동되는 근사치이다. 항상 명확하게 언급되지 않더라도, 모든 수치 지정은 용어 "약" 이 선행된다는 것이 이해된다. 용어 "약" 은 "X + 0.1" 또는 "X - 0.1" 와 같은 "X" 의 작은 증분에 더하여 정확한 값 "X" 를 또한 포함한다. 항상 명확하게 언급되지 않더라도, 본원에서 기재되는 시약은 단지 예시적이며 이들의 등가물이 당업계에 공지되어 있다는 것이 이해된다.
본원에서 사용되는 바와 같이, 용어 "약" 은 당업자에 의해 이해될 것이며 사용되는 문맥에 따라서 어느 정도 가변적일 것이다. 사용되는 문맥을 고려했을 때 당업자에게 분명하지 않은 용어가 사용되는 경우, "약" 은 특정한 용어의 10% 까지를 더하거나 뺀 것을 의미할 것이다.
용어 활성제의 "투여" 또는 활성제를 "투여하는" 은 개인의 신체에 치료적으로 유용한 형태 및 치료적 유효량으로 도입될 수 있는 형태로 치료를 필요로 하는 대상체에게 활성제를 제공하는 것을 의미하는 것으로 이해되어야 한다.
본원에서 사용되는 바와 같이, 용어 "포함하는" 은 조성물 및 방법이 열거된 요소를 포함하지만 다른 것은 배제하지 않는다는 것을 의미하는 것으로 의도된다. 조성물 및 방법을 정의하는데 사용되는 경우 "~로 본질적으로 이루어지는" 은 조성물 또는 방법에 임의의 필수적인 중요한 다른 요소를 배제하는 것을 의미할 것이다. "~로 이루어지는" 은 청구된 조성물 및 실질적인 방법 단계에 대한 다른 구성성분의 미량 초과의 요소를 배제하는 것을 의미할 것이다. 이들 전환 용어 각각에 의해 정의되는 실시형태는 본 공개의 범주 내에 있다. 따라서, 방법 및 조성물이 추가의 단계 및 성분을 포함할 수 있거나 (포함하는), 대안적으로, 중요하지 않은 단계 또는 조성물을 포함하거나 (본질적으로 이루어지는), 또는 대안적으로, 오직 언급된 방법 단계 및 조성물을 의도하는 (이루어지는) 것으로 의도된다.
본원에서 사용되는 바와 같이, 용어 "발현", "발현된" 또는 "인코딩하는" 은 폴리뉴클레오티드가 mRNA 로 전사되는 과정 및/또는 전사된 mRNA 가 이후 펩티드, 폴리펩티드 또는 단백질로 번역되는 과정을 지칭한다. 발현은 진핵생물 세포에서 mRNA 의 스플라이싱 또는 전사후 변형 또는 번역후 변형의 다른 형태를 포함할 수 있다.
본원에서 사용되는 바와 같이, 용어 "아데노-연관 바이러스 벡터" 는 아데노-연관 바이러스의 담체 또는 수송체를 지칭한다. 용어 "아데노-연관 바이러스 벡터" 는 또한 본원에서 "AAV 벡터" 로서 지칭될 수 있다.
본원에서 사용되는 바와 같이, 용어 "아데노-연관 바이러스" 는 숙주 세포 게놈 내로 통합될 수 있고 병원성이 아닌, 약한 면역 응답을 발생시키는 작은 바이러스를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "AAV/DJ" (또한 본원에서 "AAV-DJ" 로서 언급됨) 는 야생형 AAV 혈청형보다 더 높은 형질도입율 및 감염율을 매개하는, 상이한 AAV 혈청형으로부터 조작된 AAV 벡터의 혈청형이다.
본원에서 사용되는 바와 같이, 용어 "AAV2" (또한 본원에서 로서 언급됨 "AAV/2" 또는 "AAV-2") 는 자연적으로 존재하는 AAV 혈청형이다.
본원에서 사용되는 바와 같이, 용어 "AAV-Pro-hAAT-PAH" 는 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열을 포함하는 AAV 벡터를 지칭한다.
본원에서 사용되는 바와 같이, 약어 "ApoE 인핸서" 는 Apolipo단백질 E 인핸서를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "유전 의약" 또는 "유전 의약들" 은 일반적으로 임상적 질환 또는 징후를 치료하기 위해 유전적 표적에 초점을 두는 치료제 및 치료 전략을 지칭한다. 용어 "유전 의약" 은 유전자 요법 등을 포함한다.
본원에서 사용되는 바와 같이, 약어 "hAAT" 는 hAAT 프로모터를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "hAAT-hPAH-3'UTR289" 는 또한 본원에서 U289 로서, 또는 일반적으로 이식유전자-발현되는 절두된 hPAH 3'UTR, 또는 일반적으로 절두된 3' UTR 로서 지칭될 수 있다.
본원에서 사용되는 바와 같이, 용어 "간세포 핵 인자" 는 간에서 우세하게 발현되는 전사 인자를 지칭한다. 간세포 핵 인자의 유형은 간세포 핵 인자 1, 간세포 핵 인자 2, 간세포 핵 인자 3, 및 간세포 핵 인자 4 를 포함하나 그에 제한되지 않는다.
본원에서 사용되는 바와 같이, 약어 "HNF" 는 간세포 핵 인자를 지칭한다. 따라서 HNF1 는 간세포 핵 인자 1 을 지칭하고, HNF2 는 간세포 핵 인자 2 를 지칭하고, HNF3 은 간세포 핵 인자 3 을 지칭하고, HNF4 는 간세포 핵 인자 4 를 지칭한다.
본원에서 사용되는 바와 같이, 구절 "HNF 결합 자리" 는 HNF 전사 인자가 결합할 수 있는 DNA 의 영역을 지칭한다. 따라서, HNF1 결합 자리는 HNF1 이 결합할 수 있는 DNA 의 영역이고, HNF4 결합 자리는 HNF4 가 결합할 수 있는 DNA 의 영역이다.
본원에서 사용되는 바와 같이, 용어 "개체", "대상체" 및 "환자" 는 본원에서 상호교환가능하게 사용되며, 임의의 개별 포유동물 대상체, 예를 들어, 쥐, 돼지, 소, 개, 고양이, 말, 비인간 영장류 또는 인간 영장류를 지칭한다.
본원에서 사용되는 바와 같이, 구절 "토끼 베타 글로빈 인트론" 는 RNA 성숙 동안 스플라이싱되지 않고, 단백질에 대해 코딩하지 않는 토끼 베타 글로빈 유전자 내의 핵산 분절을 지칭한다.
본원에서 사용되는 바와 같이, 구절 "인간 베타 글로빈 인트론" 은 RNA 성숙 동안 스플라이싱되지 않고, 단백질에 대해 코딩하지 않는 인간 베타 글로빈 유전자 내의 핵산 분절을 지칭한다.
본원에서 사용되는 바와 같이, 용어 "LV" 는 일반적으로 "렌티바이러스" 를 지칭한다. 비제한적 예로서, "LV-PAH" 에 대한 언급은 PAH 서열을 함유하고 PAH 를 발현하는 렌티바이러스에 대한 언급이다.
본원에서 사용되는 바와 같이, 용어 "LV-Pro-hAAT-PAH" 는 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열을 포함하는 렌티바이러스를 지칭한다. LV-Pro-hAAT-PAH 벡터는 또한 AGT323 벡터로 지칭된다.
본원에서 사용되는 바와 같이, 용어 "LV-HNF-Pro-hAAT-PAH" 는 HNF 결합 자리, 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열을 포함하는 렌티바이러스를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "LV-Pro-인트론-PAH" 는 프로트롬빈 인핸서, 인트론, 및 PAH 서열을 포함하는 렌티바이러스를 지칭하며, 인트론은 인간 베타 글로빈 인트론이다.
본원에서 사용되는 바와 같이, 용어 "LV-Pro-hAAT" 는 프로트롬빈 인핸서 및 hAAT 프로모터를 포함하는 렌티바이러스를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "LV-Pro-TBG-PAH" 는 프로트롬빈 인핸서, 티록신 결합 글로불린, 및 PAH 서열을 포함하는 렌티바이러스를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "LV-ApoE-hAAT-PAH-UTR" 는 아포지방단백질 E 인핸서, hAAT 프로모터, PAH 서열, 및 유전자의 미번역 영역을 포함하는 렌티바이러스를 지칭하며, 미번역 영역은 PAH 유전자의 3'UTR 이다.
본원에서 사용되는 바와 같이, 용어 "LV-Pro-hAAT-PAH-shPAH" 는 프로트롬빈 인핸서, hAAT 프로모터, PAH 서열 및 shPAH 서열을 포함하는 렌티바이러스를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "패키징 세포주" 는 렌티바이러스 입자를 발현하는데 사용될 수 있는 임의의 세포주를 지칭한다.
본원에서 사용되는 바와 같이, 2 개 이상의 핵산 또는 폴리펩티드 서열의 문맥에서 용어 "동일성 %" 는, 하기 기재된 서열 비교 알고리즘 중 하나 (예를 들어 BLASTP 및 BLASTN 또는 기타 숙련자가 이용가능한 기타 알고리즘) 또는 육안 검사에 의해 측정된 바와 같은, 최대 상응성을 위해 비교되고 정렬될 때 동일한 특정 백분율의 뉴클레오티드 또는 아미노산 잔기를 갖는 2 개 이상의 서열 또는 하위서열을 지칭한다. 적용에 따라, "동일성 %" 는 비교되는 서열의 부위에 걸쳐, 예를 들어, 기능적 도메인에 걸쳐 존재할 수 있거나, 대안적으로, 비교될 2 개 서열의 전체 길이에 걸쳐 존재한다. 서열 비교를 위해, 통상적으로 하나의 서열은 시험 서열을 그에 대해 비교하는 참조 서열로서 역할한다. 서열 비교 알고리즘을 사용하는 경우, 시험 및 참조 서열이 컴퓨터에 입력되고, 필요하다면 하위서열 좌표가 지정되며, 서열 알고리즘 프로그램 매개변수가 지정된다. 이후, 서열 비교 알고리즘은 지정된 프로그램 매개변수를 기반으로 하여, 참조 서열에 대한 시험 서열(들) 의 서열 동일성 % 를 계산한다.
본원에서 사용되는 바와 같이, 용어 "약학적으로 허용가능한" 은 타당한 의료적 판단의 범주 내에서, 과도한 독성, 자극, 알레르기 반응, 또는 기타 문제점 또는 합병증이 합당한 이익/위험 비에 비례하지 않으면서, 인간 및 동물의 조직, 기관 및/또는 체액과 접촉하여 사용하기에 적합한 이러한 화합물, 물질, 조성물 및/또는 투약 형태를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "약학적으로 허용가능한 담체" 는 생리적으로 양립가능한 임의의 및 모든 용매, 분산 매질, 코팅물, 항균 및 항진균제, 등장제 및 흡수 지연제 등을 지칭하며 포함한다. 조성물은 약학적으로 허용가능한 염, 예를 들어, 산 부가염 또는 염기 부가염을 포함할 수 있다 (예를 들어, Berge et al. (1977) J Pharm Sci 66:1-19 참조).
용어 "페닐알라닌 히드록실라아제" 는 또한 본원에서 PAH 로서 지칭될 수 있다. 용어 페닐알라닌 히드록실라아제는 뉴클레오티드 및 펩티드 서열 둘 모두를 포함하는 모든 야생형 및 변이체 PAH 서열을 포함한다. 제한 없이, 용어 페닐알라닌 히드록실라아제는 SEQ ID NOs: 1-4 에 대한 언급을 포함하고, 그와 적어도 약 80% 동일성을 갖는 변이체를 추가로 포함한다. 인간 PAH 는 또한 본원에서 hPAH 로서 지칭될 수 있다. 인간 PAH 는 또한 본원에서 hPAH 로서 지칭될 수 있다.
본원에서 사용되는 바와 같이, 용어 "야생형 hPAH" 는 또한 본원에서 내인성 PAH 또는 "전장 PAH" 로서 지칭될 수 있다.
본원에서 사용되는 바와 같이, 본원에서 "PKU" 로도 나타내는 용어 "페닐케톤뇨증" 은 페닐알라닌 히드록실라아제의 만성적 결핍 뿐만 아니라 경증 및 고전적 형태의 질환을 포함하여 이와 관련된 모든 증상을 지칭한다. 따라서, "페닐케톤뇨증" 의 치료는 PKU 와 관련된 모든 또는 일부 증상의 치료에 관한 것일 수 있다.
본원에서 사용되는 바와 같이, 용어 "프로트롬빈 인핸서" 는 프로트롬빈 유전자의 전사를 초래하는, 단백질에 의해 결합될 수 있는 프로트롬빈 유전자 상의 영역이다.
본원에서 사용되는 바와 같이, 약어 "Pro" 는 프로트롬빈 인핸서를 지칭한다.
본원에서 사용되는 바와 같이, "작은 RNA" 는 일반적으로 약 200 개 이하의 뉴클레오티드 길이이며 침묵 또는 간섭 기능을 갖는 비-코딩 RNA 를 지칭한다. 다른 실시형태에서, 작은 RNA 는 약 175 개 이하의 뉴클레오티드, 약 150 개 이하의 뉴클레오티드, 약 125 개 이하의 뉴클레오티드, 약 100 개 이하의 뉴클레오티드, 또는 약 75 개 이하의 뉴클레오티드 길이이다. 이러한 RNA 는 microRNA (miRNA), 작은 간섭 RNA (siRNA), 이중가닥 RNA (dsRNA) 및 짧은 헤어핀 RNA (shRNA) 를 포함한다. 공개의 "작은 RNA" 는 일반적으로 표적 유전자 mRNA 의 파괴를 초래하는 경로를 통해 표적 유전자의 유전자 발현을 억제 또는 녹다운시킬 수 있어야 한다.
본원에서 사용되는 바와 같이, 용어 "shPAH" 는 PAH 를 표적화하는 작은 헤어핀 RNA 를 지칭한다.
본원에서 사용되는 바와 같이, 약어 "lncRNA" 는 긴 비-코딩 RNA 를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "SEQ ID NO" 는 용어 "서열 ID No" 와 동의어이다.
본원에서 사용되는 바와 같이, 용어 "티록신 결합 글로불린" 은 혈류에서 티로이드 호르몬을 운반하는 책임을 지는 수송 단백질이다. 본원에서 사용되는 바와 같이, 약어 "TBG" 는 티록신 결합 글로불린을 지칭한다.
본원에서 사용되는 바와 같이, 용어 "치료적 유효량" 은 특정한 질병, 상해, 질환 또는 병상을 앓고 있는 환자에서 보이는 합병증의 증상, 진행 또는 개시를 치료하거나 예방하기 위한, 적합한 조성물, 및 적합한 투약 형태 중 본 공개의 활성제의 충분한 양을 지칭한다. 치료적 유효량은 환자의 병상의 상태 또는 이의 중증도, 및 치료하려는 대상체의 연령, 체중 등에 따라 가변적일 것이다. 치료적 유효량은 예를 들어 투여 경로, 대상체의 병상 뿐만 아니라 당업자에 의해 이해되는 기타 인자를 포함하는, 임의의 수많은 인자에 따라 가변적일 수 있다.
본원에서 사용되는 바와 같이, 용어 "치료적 벡터" 는 비제한적으로, 렌티바이러스 벡터 또는 아데노-관련 바이러스 (AAV) 벡터에 대한 언급을 포함한다. 추가로, 렌티바이러스 벡터 시스템과 관련하여 본원에서 사용되는 바와 같이, 용어 "벡터" 는 용어 "플라스미드" 와 동의어이다. 예를 들어, 2-벡터 및 3-벡터 패키징 시스템을 포함하는 3-벡터 및 4-벡터 시스템은 또한, 3-플라스미드 및 4-플라스미드 시스템으로도 지칭될 수 있다.
본원에서 사용되는 바와 같이, 용어 "치료" 또는 "치료하는" 은 일반적으로 치료하는 대상체의 자연적 과정을 변경시키려고 시도하는 중재술을 지칭하며, 예방을 위해 또는 임상 병리학 과정 동안 수행될 수 있다. 바람직한 효과는 비제한적으로, 질환의 발생 또는 재발의 예방, 증상의 완화, 질환의 임의의 직접적 또는 간접적 병리학적 결과의 저해, 감소 또는 억제, 질환 상태의 경감 또는 일시적 완화, 및 차도의 야기 또는 개선된 예후를 포함한다.
"치료" 는 질환 상태를 대상으로 삼아서 그것과 싸우는 것, 즉, 질환 상태를 완화 또는 예방하는 것이 의도된다. 특정 치료는 따라서 대상이 되는 질환 상태 및 약물 요법 및 치료적 접근법의 현재 또는 미래의 상태에 따라 좌우된다. 치료는 연관 독성을 가질 수 있다.
본원에서 사용되는 바와 같이, 용어 "절두된" 은 또한 본원에서 "단축된" 또는 "없이" 로 지칭될 수 있다.
본원에서 사용되는 바와 같이, 용어 "UTR" 는 유전자의 코딩 영역의 5' 또는 3' 에 있는 유전자의 영역에 관한 것이다.
본원에서 사용되는 바와 같이, 용어 "3' UTR" 는 유전자의 코딩 영역의 3' 에 있는 "UTR" 이다.
본원에서 사용되는 바와 같이, 용어 "변이체" 는 또한 본원에서 유사체 또는 변이로서 지칭될 수 있다. 변이체는 뉴클레오티드 서열에 대한 임의의 치환, 결실, 또는 부가를 지칭한다.
비교를 위한 최적의 서열 정렬을 예를 들어 Smith & Waterman, Adv. Appl. Math. 2:482 (1981) 의 국부적 상동성 알고리즘에 의해, Needleman & Wunsch, J. Mol. Biol. 48:443 (1970) 의 상동성 정렬 알고리즘에 의해, Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988) 의 유사성 방법에 대한 검색에 의해, 이들 알고리즘의 컴퓨터화된 실행 (Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wis. 에서의 GAP, BESTFIT, FASTA 및 TFASTA) 에 의해, 또는 육안 검사에 의해 (일반적으로, 상기 Ausubel et al. 참조) 실시할 수 있다.
서열 동일성 % 및 서열 유사성을 측정하기에 적합한 알고리즘의 한 예는 BLAST 알고리즘이며 이는 Altschul et al., J. Mol. Biol. 215:403-410 (1990) 에 기재되어 있다. BLAST 분석을 수행하기 위한 소프트웨어는 국립생물정보센터 (National Center for Biotechnology Information) 웹사이트로부터 공개적으로 입수가능하다.
본 공개의 핵산 및 단백질 서열은 또한, 예를 들어, 관련된 서열을 확인하기 위해 공개적 데이터베이스에 대한 검색을 수행하기 위한 "질의 서열 (query sequence)" 로서 사용될 수 있다. 이러한 검색은 Altschul, et al. (1990) J. Mol. Biol. 215:403-10 의 NBLAST 및 XBLAST 프로그램 (version 2.0) 을 사용하여 수행될 수 있다. BLAST 뉴클레오티드 검색은 공개에서 제공된 핵산 분자와 상동인 뉴클레오티드 서열을 수득하기 위해 NBLAST 프로그램, 스코어 = 100, 단어 길이 = 12 로 수행될 수 있다. BLAST 단백질 검색은 공개의 단백질 분자와 상동인 아미노산 서열을 수득하기 위해 XBLAST 프로그램, 스코어 = 50, 단어 길이 = 3 으로 수행될 수 있다. 비교 목적을 위한 갭화된 정렬 (gapped alignment) 을 수득하기 위해, Gapped BLAST 를 Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402 에서 기재된 바와 같이 이용할 수 있다. BLAST 및 Gapped BLAST 프로그램을 이용하는 경우, 각각의 프로그램 (예를 들어 XBLAST 및 NBLAST) 의 디폴트 매개변수를 사용할 수 있다. http://www.ncbi.nlm.nih.gov 를 참조한다.
본 공개의 양태 및 실시형태의 설명
본 공개의 양태에서, 바이러스 벡터는 치료적 카고 부분을 포함하며, 치료적 카고 부분은 PAH 서열 또는 그의 변이체, 프로모터, 및 간-특이적 인핸서를 포함하며, PAH 서열 또는 그의 변이체는 프로모터 및 간-특이적 인핸서 둘 모두에 의해 작동적으로 제어된다.
실시형태에서, 간-특이적 인핸서는 프로트롬빈 인핸서를 포함한다. 실시형태에서, 프로모터는 간-특이적 프로모터이다. 실시형태에서, 간-특이적 프로모터는 hAAT 프로모터를 포함한다. 실시형태에서, 치료적 카고 부분은 베타 글로빈 인트론을 추가로 포함한다. 실시형태에서, 치료적 카고 부분은 적어도 하나의 간세포 핵 인자 결합 자리를 추가로 포함한다. 실시형태에서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 업스트림에 배치되어 있다. 실시형태에서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 다운스트림에 배치되어 있다.
실시형태에서, 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열 (LV-Pro-hAAT-PAH) 을 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, HNF 결합 자리, 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열 (LV-HNF-Pro-hAAT-PAH) 을 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, HNF 결합 자리는 HNF1 또는 HNF1/4 결합 자리이다. 실시형태에서, 프로트롬빈 인핸서, hAAT 프로모터, 인트론, 및 PAH 서열 (LV-Pro-인트론-PAH) 을 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, 인트론은 토끼 글로빈 인트론이다. 실시형태에서, 인트론은 인간 글로빈 인트론이다. 실시형태에서, 프로트롬빈 인핸서 및 hAAT 프로모터 (LV-Pro-hAAT) 를 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, 프로트롬빈 인핸서, 티록신 결합 글로불린, 및 PAH 서열 (LV-Pro-TBG-PAH) 을 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, ApoE 인핸서, hAAT 프로모터, PAH 서열, 및 PAH 의 3'UTR (LV-ApoE-hAAT-PAH-UTR) 을 포함하는 렌티바이러스 벡터가 제공된다.
실시형태에서, PAH 서열 또는 그의 변이체는 절두되어 있다. 실시형태에서, 절두되어 있는 PAH 서열 또는 그의 변이체의 부분은 PAH 서열 또는 그의 변이체의 3' 미번역 영역 (UTR) 이다.
실시형태에서, 3'UTR 에서의 PAH 절두는 3'UTR 에 대한 특정 조절 RNA 의 결합을 방지한다. 실시형태에서, 조절 RNA 는 lncRNA 이다. 실시형태에서, 조절 RNA 는 microRNA 이다. 실시형태에서, 조절 RNA 는 piRNA 이다. 실시형태에서, 조절 RNA 는 shRNA 이다. 실시형태에서, 조절 RNA 는 19 내지 25 뉴클레오티드 길이의 siRNA 이다. 실시형태에서, 조절 RNA 는 SEQ ID NOs: 13 또는 14 와 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95% 또는 그보다 높은 퍼센트 동일성을 갖는 서열을 포함하는 작은 RNA 서열이다.
실시형태에서, PAH 서열은 SEQ ID NO: 1 을 포함한다. 실시형태에서, PAH 서열은 코돈 최적화된 PAH 서열 (SEQ ID NO: 2) 을 포함한다. 실시형태에서, PAH 서열 또는 그의 변이체는 절두된 3' UTR (289 개 뉴클레오티드) (SEQ ID NO: 4) 를 포함한다. 실시형태에서, PAH 서열 또는 그의 변이체는 5' UTR (897 개 뉴클레오티드) (SEQ ID NO: 3) 를 포함한다.
실시형태에서, PAH 서열 또는 그의 변이체는 SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; 또는 SEQ ID NO: 4 와 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95% 또는 그보다 높은 퍼센트 동일성을 갖는 서열을 포함한다.
실시형태에서, 변이체는 임의의 위에서 기재된 서열로 만들어질 수 있다. 실시형태에서, PAH 서열 또는 그의 변이체는 SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; 또는 SEQ ID NO: 4 를 포함한다.
실시형태에서, 프로트롬빈 인핸서는 SEQ ID NO: 5 와 적어도 80%, 또는 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95% 또는 그보다 높은 퍼센트 동일성을 갖는 서열을 포함한다.
실시형태에서, 변이체는 위에서 기재된 서열로 만들어질 수 있다. 실시형태에서, 프로트롬빈 인핸서의 서열은 SEQ ID NO: 5 를 포함한다.
실시형태에서, hAAT 프로모터의 서열은 SEQ ID NO: 6 을 포함한다. 실시형태에서, 베타 글로빈 인트론의 서열은 SEQ ID NOs: 7 또는 8 중 하나를 포함한다. 실시형태에서, 간세포 핵 인자 결합 자리의 서열은 SEQ ID NOs: 9-12 중 임의의 하나를 포함한다.
실시형태에서, 치료적 카고 부분은 적어도 하나의 예정된 상보적 mRNA 서열에 결합할 수 있는 적어도 하나의 작은 RNA 서열을 추가로 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 전장 UTR 를 함유하는 상보적 mRNA 서열을 표적화한다. 실시형태에서, 적어도 하나의 예정된 상보적 mRNA 서열은 PAH mRNA 서열이다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 shRNA 를 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 제 1 프로모터의 제어 하에 있고, PAH 서열 또는 그의 변이체는 제 2 프로모터의 제어 하에 있다. 실시형태에서, 제 1 프로모터는 H1 프로모터를 포함한다. 실시형태에서, 제 2 프로모터는 간-특이적 프로모터를 포함한다. 실시형태에서, 간-특이적 프로모터는 hAAT 프로모터를 포함한다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 SEQ ID NO: 13; 또는 SEQ ID NO: 14 와 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95% 또는 그보다 높은 퍼센트 동일성을 갖는 서열을 포함한다.
실시형태에서, 변이체는 임의의 위에서 기재된 서열로 만들어질 수 있다. 실시형태에서, 적어도 하나의 작은 RNA 서열은 SEQ ID NO: 13; 또는 SEQ ID NO: 14 를 포함한다.
실시형태에서, 프로트롬빈 인핸서, hAAT 프로모터, PAH 서열, 및 내인성 PAH 를 표적화하는 shRNA (LV-Pro-hAAT-PAH-shPAH) 를 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, shRNA 는 내인성 PAH 의 3'UTR 를 표적화한다. 실시형태에서, shPAH 를 SEQ ID NO: 13 을 포함한다. 실시형태에서, shPAH 는 SEQ ID NO: 14 를 포함한다.
본 공개의 양태에서, 표적 세포를 감염시킬 수 있는 렌티바이러스 입자는 표적 세포를 감염시키기 위해 최적화된 외피 단백질, 및 본원에서 개시되는 임의의 바이러스 벡터를 포함한다. 실시형태에서, 표적 세포는 간 세포, 근육 세포, 상피 세포, 내피 세포, 신경 세포, 신경내분비 세포, 내분비 세포, 림프구, 골수 세포, 고형 기관 내에 존재하는 세포, 또는 조혈 계통의 세포, 조혈 줄기 세포, 또는 전구체 조혈 줄기 세포이다.
본 공개의 양태에서, 대상체에서 PKU 을 치료하는 방법은 대상체에게 치료 유효량의 본원에서 개시되는 임의의 렌티바이러스 입자를 투여하는 것을 포함한다. 본 공개의 양태에서, 대상체에서 PKU 을 예방하는 방법은 대상체에게 치료 유효량의 본원에서 개시되는 임의의 렌티바이러스 입자를 투여하는 것을 포함한다. 본 공개의 또다른 양태에서, 대상체에서 PKU 을 치료하기 위한 치료 유효량의 본원에서 개시되는 임의의 렌티바이러스 입자의 용도가 개시되어 있다. 실시형태에서, 방법은 대상체에서 PKU 표현형과 상관관계가 있는 PKU 유전자형을 진단하는 것을 추가로 포함한다. 실시형태에서, 대상체는 자궁 내에 있다. 실시형태에서, 진단은 대상체의 태아기 스크리닝 동안 또는 부모의 유전적 스크리닝 후에 이루어진다. 실시형태에서, 진단은 시험관 내에서 이루어진다. 실시형태에서, 치료 유효량의 렌티바이러스 입자는 복수의 단일 용량의 렌티바이러스 입자를 포함한다. 실시형태에서, 치료 유효량의 렌티바이러스 입자는 단일 용량의 렌티바이러스 입자를 포함한다.
본 공개의 양태에서, PAH 의 돌연변이체 형태를 갖는 대상체를 외인성 PAH 를 포함하는 렌티바이러스 벡터의 치료 유효량으로 처리하는 것을 포함하는 대상체에서 PKU 을 치료하는 방법이 제공된다. 실시형태에서, 대상체는 포유동물이다. 실시형태에서, 포유동물은 인간이다. 실시형태에서, 포유동물은 설치류이다. 실시형태에서, 설치류는 마우스 또는 랫트이다. 실시형태에서, 포유동물은 돼지이다.
실시형태에서, 대상체는 렌티바이러스 벡터로 처리된다. 실시형태에서, 렌티바이러스 벡터는 PAH 서열 또는 그의 변이체를 포함한다. 실시형태에서, PAH 서열은 본원에서 기재되는 임의의 PAH 서열 또는 변이체이다.
실시형태에서, 렌티바이러스 벡터는 본원에서 기재되는 PAH 또는 변이체를 포함하는 임의의 렌티바이러스 벡터이다. 실시형태에서, PAH 를 포함하는 렌티바이러스 벡터는 도 1 및 2 에 도시된 바와 같은 PAH 를 발현하는 렌티바이러스 벡터이다. 실시형태에서, PAH 를 포함하는 렌티바이러스 벡터는 도 3 에 도시된 바와 같은 PAH 를 발현하는 렌티바이러스 벡터이다.
실시형태에서, 바이러스 벡터는 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열 (또한 본원에서 LV-Pro-hAAT-PAH 또는 AGT323 로서 언급됨) 을 포함한다. 실시형태에서, 프로트롬빈 인핸서 서열은 본원에서 기재되는 임의의 프로트롬빈 서열 또는 변이체이다. 실시형태에서, hAAT 프로모터는 본원에서 기재되는 임의의 hAAT 프로모터 서열 또는 변이체이다. 실시형태에서, PAH 서열은 본원에서 기재되는 임의의 PAH 서열 또는 변이체이다.
실시형태에서, 렌티바이러스 벡터는 통합된 렌티바이러스 벡터로 구성된다. 실시형태에서, 통합된 렌티바이러스 벡터는 렌티바이러스 벡터 시스템에서 유래한다. 실시형태에서, 렌티바이러스 벡터 시스템은 rev 유전자 및 env 유전자를 인코딩하는 별개의 플라스미드를 포함한다. 실시형태에서, 통합된 렌티바이러스 벡터는 3-벡터 렌티바이러스 시스템에서 유래한다. 실시형태에서, 3-벡터 렌티바이러스 시스템은 도 1 에 예시되어 있다. 실시형태에서, 통합된 렌티바이러스 벡터는 4-벡터 렌티바이러스 시스템에서 유래한다. 실시형태에서, 4-벡터 렌티바이러스 벡터 시스템은 도 2 에 예시되어 있다.
실시형태에서, 대상체는 아데노-연관 바이러스 (AAV) 벡터로 처리된다. 실시형태에서, AAV 벡터는 본원에서 개시되는 임의의 AAV 벡터를 포함한다. 실시형태에서, AAV 벡터는 PAH 서열 또는 그의 변이체를 포함한다. 실시형태에서, PAH 서열은 본원에서 기재되는 임의의 PAH 서열 또는 변이체이다.
실시형태에서, 주입은 피내 주입이다. 실시형태에서, 주입은 근육내 주입이다. 실시형태에서, 주입은 피하 주입이다. 실시형태에서, 주입은 정맥내 주입이다.
실시형태에서, 본원에서 기재되는 방법은 대상체를 렌티바이러스 입자로 처리하기에 앞서 통합된 렌티바이러스 벡터의 비역가 (specific titer) 를 생성하는 것을 추가로 포함한다. 비역가는 시험관 내에서 세포 표적 및 렌티바이러스 벡터 형질도입, 그에 뒤이어 형질도입된 세포의 빈도 및 세포 당 통합된 벡터 카피의 수를 측정하기 위한 형질도입된 세포로부터의 염색체 DNA 의 정량적 PCR 분석을 이용하는 시험 시스템에서 확인된다. 역가는 적당한 칼럼의 렌티바이러스 벡터를 적당한 수의 세포 내로 형질도입하여 초래될 통합된 카피의 수로서 표현된다. 실시형태에서, 역가는 1 x 105 내지 1 x 1015 개 통합된 벡터 카피, 예를 들어, 1 x 107 내지 1 x 1013 개 통합된 벡터 카피, 또는 1 x 109 내지 1 x 1011 개 통합된 벡터 카피이다. 실시형태에서, 역가는 1 x 1010 개 통합된 벡터 카피이다.
실시형태에서, 통합된 렌티바이러스 벡터의 비역가의 생성은 벡터 시스템을 하나 이상의 세포에 첨가하는 것을 포함한다. 실시형태에서, 하나 이상의 세포는 세포주이다. 실시형태에서, 세포주는 293T 세포주이다. 실시형태에서, 세포주는 HeLa 세포주이다. 실시형태에서, 세포주는 CHO 세포주이다. 실시형태에서, 세포주는 Hep3B 세포주이다. 당업자는 또한 다른 실시형태에서, 세포주가 당업계에 알려진 임의의 적합한 세포주일 수 있다는 것을 이해할 것이다.
실시형태에서, 방법은 PAH 를 포함하는 렌티바이러스 벡터의 주입 후에 혈액에서 Phe 의 수준을 측정하는 것을 추가로 포함한다.
본 공개의 양태에서, 인간 PAH 는 AAV-전달되는 발현 시스템을 사용하여 세포에서 발현된다. 실시형태에서 AAV-2 혈청형이 사용된다. 실시형태에서, AAV-DJ 혈청형이 사용된다. 실시형태에서, AAV 벡터는 GFP 를 함유한다. 실시형태에서, AAV 벡터는 임의의 혈청형을 나타낼 수 있거나 또는 재조합 DNA 또는 인간 간세포의 형질도입을 개선하기 위해 디자인된 다른 합성 접근법에 의해 생성될 수 있다.
실시형태에서, 인간 PAH 가 AAV 벡터 내로 도입된다. 실시형태에서, 프로트롬빈 인핸서가 AAV 벡터 내로 도입된다. 실시형태에서, hAAT 프로모터가 AAV 벡터 내로 도입된다. 실시형태에서, 토끼 글로빈 인트론이 AAV 벡터 내로 도입된다. 실시형태에서, 인간 PAH, 프로트롬빈 인핸서, hAAT 프로모터, 및 토끼 글로빈 인트론 중 어느 하나 또는 그 이상이 AAV 벡터 내로 도입된다. 실시형태에서 바이러스 벡터는 프로트롬빈 인핸서, hAAT 프로모터, 및 PAH 서열 (AAV-Pro-hAAT-PAH; AGT323) 을 포함한다.
실시형태에서, 프로트롬빈 인핸서 서열은 본원에서 개시되는 임의의 프로트롬빈 서열 또는 변이체이다. 실시형태에서, PAH 서열은 본원에서 기재되는 임의의 PAH 서열 또는 변이체이다. 실시형태에서, hAAT 서열은 본원에서 개시되는 임의의 hAAT 서열 또는 변이체이다. 실시형태에서, 인트론 서열은 본원에서 개시되는 임의의 인트론 서열 또는 변이체이다.
본 공개의 양태에서, 렌티바이러스 벡터 요법은 돌연변이체 PAH 유전자를 갖는 대상체의 치료에서 사용된다. 실시형태에서, 대상체는 인간이다. 다른 실시형태에서, 본원에서 실험적으로 보여지는 바와 같이, 대상체는 Pah 돌연변이체 마우스 라인에서 유래하는 신생아 마우스이다. 실시형태에서, 돌연변이체 마우스 라인은 Pahenu1 이다. 실시형태에서, 돌연변이체 마우스 라인은 Pahenu2 이다. 실시형태에서, 돌연변이체 마우스 라인은 Pahenu3 이다.
실시형태에서, 렌티바이러스 벡터 내의 PAH 서열은 본원에서 기재되고 www.biopku.org 에서 발견되는 PAHvdb, BIODEF, BIOPKU, JAKE 또는 PNDdb 데이타베이스에서 열거된 것들을 포함하는 임의의 PAH 서열 또는 변이체이다.
실시형태에서, 렌티바이러스 벡터는 통합된 렌티바이러스 벡터로 구성된다. 실시형태에서, 통합된 렌티바이러스 벡터는 렌티바이러스 벡터 시스템에서 유래한다. 실시형태에서, 렌티바이러스 벡터 시스템은 rev 유전자 및 외피 유전자를 인코딩하는 별개의 플라스미드를 포함한다. 실시형태에서, 통합된 렌티바이러스 벡터는 3-벡터 렌티바이러스 시스템에서 유래한다. 실시형태에서, 3-벡터 렌티바이러스 시스템은 도 1 에 예시되어 있다. 실시형태에서, 통합된 렌티바이러스 벡터는 4-벡터 렌티바이러스 시스템에서 유래한다. 실시형태에서, 4-벡터 렌티바이러스 벡터 시스템은 도 2 에 예시되어 있다.
본 공개의 양태에서, shRNA 및 PAH 를 함유하는 세포에서 렌티바이러스의 발현은 내인성 PAH 의 발현을 억제하지만, 렌티바이러스 벡터로부터 발현되는 외인성 PAH 의 발현은 억제하지 않는다.
실시형태에서, shRNA 및 PAH 를 함유하는 렌티바이러스는 본원에서 기재되는 바와 같이 대상체에서 생체 내에서 (in vivo) 발현된다. 실시형태에서, 대상체는 포유동물이다. 실시형태에서, 포유동물은 인간이다.
실시형태에서, shRNA 및 PAH 를 함유하는 렌티바이러스는 시험관 내에서 또는 생체 내에서 발현된다. 실시형태에서, 렌티바이러스는 시험관 내에서, 예를 들어 세포주에서 발현된다. 실시형태에서, 세포주는 본원에서 기재되는 임의의 세포주 또는 당업자에게 공지된 세포주이다. 실시형태에서, 세포주는 Hep3B 세포주이다.
실시형태에서, 프로트롬빈 인핸서, hAAT 프로모터, PAH 서열, 및 내인성 PAH 를 표적화하는 shRNA (임의로 본원에서 LV-Pro-hAAT-PAH-shPAH 로서 언급됨) 을 포함하는 렌티바이러스 벡터가 제공된다. 실시형태에서, shRNA 는 내인성 PAH 의 3'UTR 를 표적화한다.
실시형태에서, 프로트롬빈 인핸서 서열은 본원에서 개시되는 임의의 프로트롬빈 서열 또는 변이체를 포함한다. 실시형태에서, hAAT 프로모터는 본원에서 개시되는 임의의 hAAT 프로모터 서열 또는 변이체를 포함한다. 실시형태에서, PAH 서열은 본원에서 기재되는 임의의 PAH 서열 또는 변이체를 포함한다. 실시형태에서, 렌티바이러스 벡터의 shRNA 서열은 SEQ ID NO: 13 을 포함한다. 실시형태에서, 렌티바이러스 벡터의 shRNA 서열은 SEQ ID NO: 14 를 포함한다.
본원에서 기재되는 본 발명의 다른 양태 및 이점은, 본 발명의 양태를 예로서 설명하는, 첨부된 도면과 함께 고려하여 하기 상세한 설명으로부터 명백해질 것이다.
페닐케톤뇨증
PKU 는 PAH 의 돌연변이 및/또는 PAH 보조인자 (즉, BH4) 의 합성 또는 재생 결함에 의해 유발된다고 여겨진다. 특히, 몇몇 PAH 돌연변이는 소포체에서의 단백질 폴딩에 영향을 미치는 것으로 나타났으며, 이는 효소 촉매 활성을 약화시키거나 크게 철폐시키는 단백질 구조에서의 미스센스 돌연변이 (63%) 및 작은 결실 (13%) 로 인한 가속화된 분해 및/또는 응집을 초래한다. PAH 의 기능성에 영향을 줄 수 있는 수많은 돌연변이가 존재하므로, PKU 를 치료하기 위한 효과적인 치료적 접근방식은 비정상 PAH 및/또는 대체 PAH 가 투여될 수 있는 방식을 다루는 것이 필요할 수 있다.
일반적으로, 3 가지 주요 표현형 군은 진단시 측정된 Phe 수준, Phe 에 대한 식이 내성 및 치료요법에 대한 잠재적 반응성을 기반으로 하여 PKU 에서 분류된다. 이들 군은 고전적 PKU (Phe > 1200 μM), 비정형 또는 경증 PKU (Phe 가 600 - 1200 μM 임) 및 영구적인 경증 고페닐알라닌혈증 (HPA, Phe 120 - 600 μM) 을 포함한다.
PKU 의 검출은 보편적 신생아 스크리닝 (NBS) 에 의존한다. 힐 스틱으로부터 수집한 1 점적의 혈액을 USA 의 모든 50 개 주에서 의무적이고 대부분의 개발도상국에서 통상적으로 사용되는 스크린에서 페닐알라닌 수준에 대해 검사한다.
유전 의약
유전 의약은 질환 치료 또는 예방의 목적으로 숙주 세포에 유전적 구축물을 전달하는데 사용되는 바이러스 벡터에 대한 언급을 포함한다.
유전적 구축물은 비제한적으로, 존재하는 결함을 교정하거나 보완하기 위한 기능적 유전자 또는 유전자의 일부, 조절 단백질을 인코딩하는 DNA 서열, 안티센스, 짧은 헤어핀 RNA, 짧은 상동성 RNA, 긴 비-코딩 RNA, 작은 간섭 RNA 또는 기타의 것들을 포함하는 조절 RNA 분자를 인코딩하는 DNA 서열, 및 질환 상태를 변경하기 위해 중요한 세포 인자에 대해 경쟁하도록 디자인된 RNA 또는 단백질을 인코딩하는 디코이 서열 (decoy sequence) 을 포함할 수 있다. 유전 의약은 특징 질환의 치료 또는 완화를 제공하기 위해 이러한 치료적 유전적 구축물을 표적 세포에 전달하는 것을 포함한다.
기능적 PAH 유전자를 간에 생체내 전달함으로써, PAH 활성이 재구성될 수 있어, 혈액 내 Phe 의 정상적인 청소를 초래하여 따라서 식이 제한 또는 빈번한 효소 대체 치료요법에 대한 필요성을 제거한다. 이러한 치료적 접근방식의 효과는 내인성 PAH 에 대한 shRNA 의 표적화에 의해 개선될 수 있다. 본 공개의 하나의 양태에서, 기능적 PAH 유전자 또는 이의 변이체는, 태아가 PKU 유전자형에 대한 위험성이 있는 것으로 확인된 경우 자궁 내에 전달될 수 있다. 실시형태에서, 진단 단계는 태아가 PKU 표현형에 대한 위험성이 있는지 여부를 결정하기 위해 실행될 수 있다. 진단 단계에서 태아가 PKU 표현형에 대한 위험성이 있는 것으로 결정되는 경우, 태아는 본원에 상세히 나타낸 유전 의약로 치료될 수 있다. 치료는 자궁 내에서 또는 시험관 내에서 이루어질 수 있다.
치료적 벡터
본원의 다양한 양태 및 실시형태에 따른 렌티바이러스 비리온 (입자) 은 비리온 (바이러스 입자) 를 생성하기 위해 필요한 바이러스 단백질을 인코딩하는 벡터 시스템에 의해 발현된다. 다양한 실시형태에서, 프로모터에 작동가능하게 연결된, 렌티바이러스 pol 단백질을 인코딩하는 핵산 서열을 함유하는 하나의 벡터가 역전사 및 통합을 위해 제공된다. 또 다른 실시형태에서, pol 단백질은 다수의 벡터에 의해 발현된다. 다른 실시형태에서, 프로모터에 작동가능하게 연결된, 바이러스 캡시드를 형성하기 위한 렌티바이러스 Gag 단백질을 인코딩하는 핵산 서열을 함유하는 벡터가 제공된다. 실시형태에서, 이러한 gag 핵산 서열은 적어도 일부의 pol 핵산 서열 외에 별개의 벡터 상에 존재한다.
야생형 복귀 돌연변이체 (revertant) 를 수득하는 가능성을 더 최소화하기 위해, 입자 생성에 사용되는 본원의 벡터에 수많은 변형이 이루어질 수 있다. 이들은 비제한적으로, LTR 의 U3 부위의 결실, tat 결실 및 매트릭스 (MA) 결실을 포함한다. 실시형태에서, gag, pol 및 env 벡터(들)는 렌티바이러스 패키징 서열로 지칭되는, 렌티바이러스 RNA 를 패키징하는 렌티바이러스 게놈으로부터의 뉴클레오티드를 함유하지 않는다.
입자를 형성하는 벡터(들)는 바람직하게는 외피 단백질을 발현하는 렌티바이러스 게놈으로부터의 핵산 서열을 함유하지 않는다. 바람직하게는, 프로모터에 작동가능하게 연결된 외피 단백질을 인코딩하는 핵산 서열을 함유하는 별개의 벡터가 사용된다. 이러한 env 벡터는 또한 렌티바이러스 패키징 서열을 함유하지 않는다. 한 실시형태에서 env 핵산 서열은 렌티바이러스 외피 단백질을 인코딩한다.
또다른 실시형태에서 외피 단백질은 렌티바이러스로부터가 아니라 상이한 바이러스로부터 유래된다. 생성된 입자는 위형 입자 (pseudotyped particle) 로 지칭된다. 외피 단백질을 적절히 선택함으로써 사실상 임의의 세포를 "감염" 시킬 수 있다. 예를 들어, 인플루엔자 바이러스, VSV-G 또는 인간 및 비-인간 랩도바이러스 단리물로부터의 유사한 외피 단백질, 알파 바이러스 (셈리키 삼림열바이러스, 신드비스 바이러스), 아레나바이러스 (림프구성 맥락수막염 바이러스), 플라비바이러스 (진드기 매개 뇌염 바이러스, 뎅기 바이러스, C 형 간염 바이러스, GB 바이러스), 랍도바이러스 (수포성 구내염 바이러스, 광견병 바이러스), 파라믹소바이러스 (볼거리 또는 홍역) 및 오르토믹소바이러스 (인플루엔자 바이러스) 의 것과 같은 세포내이입성 구획을 표적으로 하는 외피 단백질을 인코딩하는 env 유전자를 사용할 수 있다. 바람직하게 사용될 수 있는 다른 외피 단백질은 고양이 백혈병 바이러스 및 고양이 내인성 레트로바이러스, 몰로니 백혈병 바이러스 예컨대 MLV-E, MLV-A, 긴팔 원숭이 백혈병 바이러스 GALV, 및 개코 원숭이 내인성 레트로바이러스로부터의 것들을 포함한다. 이들 후자의 외피 단백질은 숙주 세포가 일차 세포인 경우에 특히 바람직하다. 원하는 숙주 세포에 따라 다른 외피 단백질이 선택될 수 있다.
본원에서 제공된 바와 같은 렌티바이러스 벡터 시스템은 전형적으로 gag, pol 또는 rev 유전자 중 적어도 하나를 포함하는 적어도 하나의 헬퍼 플라스미드를 포함한다. 각각의 gag, pol 및 rev 유전자는 개별 플라스미드 상에 제공될 수 있거나, 하나 이상의 유전자가 동일한 플라스미드 상에 함께 제공될 수 있다. 한 실시형태에서, gag, pol 및 rev 유전자는 동일한 플라스미드 상에 제공된다 (예를 들어, 도 1). 또다른 실시형태에서, gag 및 pol 유전자는 제 1 플라스미드 상에 제공되며 rev 유전자는 제 2 플라스미드 상에 제공된다 (예를 들어, 도 2). 따라서, 3-벡터 및 4-벡터 시스템 둘 모두가 본원에 기재된 바와 같은 렌티바이러스를 생성하는데 사용될 수 있다. 실시형태에서, 치료적 벡터, 적어도 하나의 외피 플라스미드 및 적어도 하나의 헬퍼 플라스미드는 패키징 세포, 예를 들어, 패키징 세포주에 트랜스펙션된다. 패키징 세포주의 비제한적인 예는 293T/17 HEK 세포주이다. 치료적 벡터, 외피 플라스미드 및 적어도 하나의 헬퍼 플라스미드가 패키징 세포주에 트랜스펙션되는 경우, 렌티바이러스 입자가 궁극적으로 생성된다.
또다른 양태에서, 렌티바이러스 입자를 발현시키기 위한 렌티바이러스 벡터 시스템이 개시되어 있다. 시스템은 본원에서 기재되는 렌티바이러스 벡터; 세포를 감염시키기 위해 최적화된 외피 단백질을 발현시키기 위한 외피 플라스미드; 및 gag, pol, 및 rev 유전자를 발현시키기 위한 적어도 하나의 헬퍼 플라스미드를 포함하며, 렌티바이러스 벡터, 외피 플라스미드, 및 적어도 하나의 헬퍼 플라스미드가 패키징 세포주 내로 트랜스펙션될 때, 패키징 세포주에 의해 렌티바이러스 입자가 생산되며, 렌티바이러스 입자는 PAH 의 생산을 저해할 수 있고/있거나 내인성 PAH 의 발현을 저해할 수 있다.
또다른 양태에서, 또한 본원에서 치료적 벡터로서 언급되는, 렌티바이러스 벡터는 하기 요소를 포함한다: 하이브리드 5' 장 말단 반복부 (RSV/5' LTR) (SEQ ID NOs: 15-16), Psi 서열 (RNA 패키징 자리) (SEQ ID NO: 17), RRE (Rev-응답 요소) (SEQ ID NO: 18), cPPT (폴리퓨린 구역 (tract)) (SEQ ID NO: 19), 항 알파 트립신 프로모터 (hAAT) (SEQ ID NO: 6), 페닐알라닌 히드록실라아제 (PAH) (SEQ ID NOs: 1-4, 우드척 전사후 조절 요소 (Woodchuck Post-Transcriptional Regulatory Element) (WPRE) (SEQ ID NOs: 20), 및 ΔU3 3' LTR (SEQ ID NO: 21). 실시형태에서, 또한 본원에서 치료적 벡터로서 언급되는, 렌티바이러스 벡터는 하기 요소를 포함한다: 하이브리드 5' 장 말단 반복부 (RSV/5' LTR) (SEQ ID NOs: 15-16), Psi 서열 (RNA 패키징 자리) (SEQ ID NO: 17), RRE (Rev-응답 요소) (SEQ ID NO: 18), cPPT (폴리퓨린 구역) (SEQ ID NO: 19), H1 프로모터 (SEQ ID NO: 22), PAH shRNA (SEQ ID NOs: 1-4), 항 알파 트립신 프로모터 (hAAT) (SEQ ID NO: 6), PAH shRNA (SEQ ID NOs: 1-4), 우드척 전사후 조절 요소 (WPRE) (SEQ ID NO: 20), 및 ΔU3 3' LTR (SEQ ID NO: 21). 실시형태에서, 치환, 결실, 부가, 또는 돌연변이에 의한 서열 변이는 본원에서 서열 레퍼런스를 변형시키는데 사용될 수 있다.
또다른 양태에서, 헬퍼 플라스미드는 하기 요소를 포함한다: CMV 인핸서/닭 베타 액틴 인핸서 (SEQ ID NO: 23); HIV 성분 gag (SEQ ID NO: 24); HIV 성분 pol (SEQ ID NO: 25); HIV Int (SEQ ID NO: 26); HIV RRE (SEQ ID NO: 27); 및 HIV Rev (SEQ ID NO: 28). 또다른 양태에서, 헬퍼 플라스미드는 gag 및 pol 유전자를 발현하기 위한 제 1 헬퍼 플라스미드, 및 rev 유전자를 발현하기 위한 제 2 및 별개의 플라스미드를 포함하도록 변형될 수 있다. 실시형태에서, 치환, 결실, 부가, 또는 돌연변이에 의한 서열 변이는 본원에서 서열 레퍼런스를 변형시키는데 사용될 수 있다.
또다른 양태에서, 외피 플라스미드는 하기 요소를 포함한다: RNA 폴리머라아제 II 프로모터 (CMV) (SEQ ID NO: 29) 및 수포성 구내염 바이러스 G 당단백질 (VSV-G) (SEQ ID NO: 30). 실시형태에서, 치환, 결실, 부가, 또는 돌연변이에 의한 서열 변이는 본원에서 서열 레퍼런스를 변형시키는데 사용될 수 있다.
다양한 양태에서, 렌티바이러스 패키징에 사용된 플라스미드는 벡터 기능의 상실 없이 다양한 요소의 치환, 부가, 결실 또는 돌연변이에 의해 변형된다. 예를 들어, 비제한적으로, 하기 요소는 패키징 시스템을 포함하는 플라스미드 내의 유사한 요소를 대체할 수 있다: 신장 인자-1 (EF-1), 포스포글리세레이트 키나아제 (PGK) 및 유비퀴틴 C (UbC) 프로모터는 CMV 또는 CAG 프로모터를 대체할 수 있다. SV40 poly A 및 bGH poly A 는 토끼 베타 글로빈 poly A 를 대체할 수 있다. 헬퍼 플라스미드 내 HIV 서열은 상이한 HIV 균주 또는 클레이드로부터 구축될 수 있다. VSV-G 당단백질은 HERV-W 를 포함하는 인간 내인성 레트로바이러스, 개코 원숭이 내인성 레트로바이러스 BaEV, 고양이 내인성 바이러스 (RD114), 긴팔 원숭이 백혈병 바이러스 (GALV), 광견병 바이러스 (FUG), 림프구성 맥락 뇌막염 바이러스 (LCMV), 인플루엔자 A 조류 흑사병 바이러스 (FPV), 로스 리버 알파바이러스 (RRV), 쥐 백혈병 바이러스 10A1 (MLV) 또는 에볼라 바이러스 (EboV) 로부터의 멤브레인 당단백질로 치환될 수 있다.
다양한 렌티바이러스 패키징 시스템은 상업적으로 구입할 수 있으며 (예를 들어 OriGene Technologies, Inc., Rockville, MD 로부터의 Lenti-vpak 패키징 키트), 또한 본원에 기재된 바와 같이 디자인될 수 있다. 더욱이, 렌티바이러스 입자의 생성 효율을 포함하여 임의의 수의 관련 인자를 개선하기 위해 렌티바이러스 패키징 시스템의 양태를 치환하거나 변형시키는 것은 당업자의 기술 내에 있다.
또다른 양태에서, 아데노-관련 바이러스 (AAV) 벡터가 또한 사용될 수 있다. 실시형태에서, AAV 벡터는 AAV-DJ 혈청형이다. 실시형태에서, AAV 벡터는 혈청형 1-11 중 임의의 혈청형이다. 실시형태에서, AAV 혈청형은 AAV-2 이다. 실시형태에서, AAV 벡터는 인간 간세포의 최적 형질도입을 위해 조작된 비-천연 유형이다.
AAV 벡터 구축.
본 공개의 양태에서, PAH 코딩 서열 (SEQ ID NOs: 1-4) 및 프로트롬빈 인핸서 (SEQ ID NO: 5) 와 hAAT 프로모터 (SEQ ID NO: 6) 를 pAAV 플라스미드 (Cell Biolabs, San Diego, CA) 내로 삽입한다. PAH 코딩 서열과 측면 EcoRI 및 SalI 제한 자리는 Eurofins Genomics (Louisville, KY) 에 의해 합성된다. pAAV 플라스미드 및 PAH 서열을 EcoRI 및 SalI 효소로 소화시키고 함께 결찰시킨다. PAH 서열의 삽입을 서열분석에 의해 확인한다. 다음으로, 프로트롬빈 인핸서 및 hAAT 프로모터와 측면 MluI 및 EcoRI 제한 자리는 Eurofins Genomics (Louisville, KY) 에 의해 합성된다. PAH 코딩 서열 및 프로트롬빈 인핸서/hAAT 프로모터 서열을 함유하는 pAAV 플라스미드를 MluI 및 EcoRI 효소로 소화시키고 함께 결찰시킨다. 프로트롬빈 인핸서/hAAT 프로모터의 삽입을 서열분석에 의해 확인한다.
나아가, PAH 를 발현시키기 위한 대표적인 AAV 플라스미드 시스템은 AAV 헬퍼 플라스미드, AAV 플라스미드, 및 AAV Rev/Cap 플라스미드를 포함할 수 있다. AAV 헬퍼 플라스미드는 좌측 ITR (SEQ ID NO: 31), 프로트롬빈 인핸서 (SEQ ID NO: 5), 인간 항 알파 트립신 프로모터 (SEQ ID NO: 6), PAH 요소 (SEQ ID NOs: 1-4), PolyA 요소 (SEQ ID NO: 32), 및 우측 ITR (SEQ ID NO: 33) 를 함유할 수 있다. AAV 플라스미드는 적합한 프로모터 요소 (SEQ ID NO: 23 또는 SEQ ID NO: 29), E2A 요소 (SEQ ID NO: 34), E4 요소 (SEQ ID NO: 35), VA RNA 요소 (SEQ ID NO: 36), 및 PolyA 요소 (SEQ ID NO: 32) 를 함유할 수 있다. AAV Rep/Cap 플라스미드는 적합한 프로모터 요소, Rep 요소 (SEQ ID NO: 37), Cap 요소 (SEQ ID NO: 38), 및 PolyA 요소 (SEQ ID NO: 32) 를 함유할 수 있다.
실시형태에서, 프로트롬빈 인핸서 및 PAH 서열을 포함하는 AAV/DJ 플라스미드가 제공된다 (AAV/DJ-Pro-PAH). 실시형태에서, 프로트롬빈 인핸서, 인트론, 및 PAH 서열을 포함하는 AAV/DJ 플라스미드가 제공된다 (AAV/DJ-Pro-인트론-PAH). 실시형태에서, 인트론은 인간 베타 글로빈 인트론이다. 실시형태에서, 인트론은 토끼 베타 글로빈 인트론이다. 실시형태에서, GFP 를 포함하는 AAV/DJ 플라스미드가 제공된다 (AAV/DJ-GFP).
실시형태에서, 프로트롬빈 인핸서 및 PAH 서열을 포함하는 AAV2 플라스미드가 제공된다 (AAV2-Pro-PAH). 실시형태에서, 프로트롬빈 인핸서, 인트론, 및 PAH 서열을 포함하는 AAV2 플라스미드가 제공된다 (AAV2-Pro-인트론-PAH). 실시형태에서, 인트론은 인간 베타 글로빈 인트론이다. 실시형태에서, 인트론은 토끼 베타 글로빈 인트론이다. 실시형태에서, GFP 를 포함하는 AAV2 가 제공된다 (AAV2-GFP).
실시형태에서, 본원에서 개시되는 임의의 AAV 벡터는 조절 RNA 를 발현하는 서열을 함유할 수 있다. 실시형태에서, 조절 RNA 는 lncRNA 이다. 실시형태에서, 조절 RNA 는 microRNA 이다. 실시형태에서, 조절 RNA 는 piRNA 이다. 실시형태에서, 조절 RNA 는 shRNA 이다. 실시형태에서, 조절 RNA 는 SEQ ID NOs: 13 또는 14 와 적어도 80%, 적어도 81%, 적어도 82%, 적어도 83%, 적어도 84%, 적어도 85%, 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95% 또는 그보다 높은 퍼센트 동일성을 갖는 서열을 포함하는 작은 RNA 서열이다.
AAV 입자의 생산. AAV-PAH 플라스미드는 플라스미드 pAAV-RC2 (Cell Biolabs) 및 pHelper (Cell Biolabs) 와 조합된다. pAAV-RC2 플라스미드는 Rep 및 AAV-2 캡시드 유전자를 함유하고, pHelper 는 아데노바이러스 E2A, E4, 및 VA 유전자를 함유한다. AAV 캡시드는 또한 AAV-8 (SEQ ID NO: 39) 또는 AAV-DJ (SEQ ID NO: 40) 서열로 이루어질 수 있다. AAV 입자를 생산하기 위해서, 이들 플라스미드는 1:1:1 (pAAV-PAH: pAAV-RC2: pHelper) 비로 293T 세포 내로 트랜스펙션된다. 150 ㎜ 디쉬 (BD Falcon) 에서 세포의 트랜스펙션을 위해, 10 ㎍ 의 각각의 플라스미드를 1 ㎖ 의 DMEM 중에 함께 첨가한다. 또다른 튜브에서, 60 ㎕ 의 트랜스펙션 시약 PEI (1 ㎍/㎖) (Polysciences) 를 1 ㎖ 의 DMEM 에 첨가한다. 2 개의 튜브를 함께 혼합하여 15 분 동안 인큐베이션한다. 그런 다음, 트랜스펙션 혼합물을 세포에 첨가하고, 세포를 3 일 후 수집한다. 세포를 드라이 아이스/이소프로판올 중 동결/해동 용해 (lysis) 에 의해 용해한다. 벤조나아제 뉴클레아제 (Sigma) 를 37℃ 에서 30 분 동안 세포 용해물에 첨가한다. 그런 다음, 세포 용해물을 4℃ 에서 15 분 동안 12,000 rpm 에서 원심분리에 의해 펠렛한다. 상청액을 수집한 다음, 표적 세포에 첨가한다.
투약량 및 투약 형태
개시된 벡터 시스템은 개시된 벡터의 에피솜 유지 및 관심 유전자 또는 서열의 단기간, 중간 기간 또는 장기간 발현을 가능하게 한다. 따라서, 용량 용법은 치료되는 병상 및 투여 방법을 기반으로 가변적일 수 있다.
실시형태에서, 벡터 조성물은 가변적 용량으로 이를 필요로 하는 대상체에게 투여될 수 있다. 특히, 대상체는 약 ≥ 106 감염 용량 (여기서 1 용량이 1 표적 세포를 형질도입시키는데 평균적으로 필요함) 이 투여될 수 있다. 보다 특히, 대상체는 약 ≥ 107, 약 ≥ 108, 약 ≥ 109, 약 ≥ 1010, 약 ≥ 1011, 또는 약 ≥ 1012 감염 용량/체중 ㎏, 또는 이들 값 사이의 임의 수의 용량을 투여받을 수 있다. 용량의 상한치는 각각의 질환 징후에 대해 결정될 것이며, 각각의 개별 제품 또는 제품 로트에 대한 독성/안전성 프로파일에 따라 좌우될 것이다.
부가적으로, 본 공개의 벡터 조성물은 1 일 1 회 또는 2 회와 같이 주기적으로, 또는 임의의 다른 적합한 시간으로 투여될 수 있다. 예를 들어, 벡터 조성물은 이를 필요로 하는 대상체에게 1 주에 1 회, 2 주에 1 회, 3 주에 1 회, 1 개월에 1 회, 2 개월마다, 3 개월마다, 6 개월마다, 9 개월마다, 1 년에 1 회, 18 개월마다, 2 년마다, 30 개월마다, 또는 3 년마다 투여될 수 있다.
실시형태에서, 개시된 벡터 조성물은 약학적 조성물로서 투여된다. 실시형태에서, 약학적 조성물은 임상 적용을 위한 코, 폐, 경구, 국소 또는 비경구 투약 형태를 비제한적으로 포함하는 광범위한 투약 형태로 제형화될 수 있다. 각각의 투약 형태는 다양한 가용화제, 붕해제, 계면활성제, 충전제, 증점제, 결합제, 희석제 예컨대 습윤제 또는 다른 약학적으로 허용가능한 부형제를 포함할 수 있다. 약학적 조성물은 또한 주입, 흡입, 주입 또는 피내 노출을 위해 제형화될 수 있다. 예를 들어, 주입가능 제형은 적합한 pH 및 등장성에서 수성 또는 비-수성 용액 중에 개시된 벡터를 포함할 수 있다.
개시된 벡터 조성물은 대상체에게 유도 주입으로 간 내로 직접 주입을 통해 투여될 수 있다. 일부 실시형태에서, 벡터는 동맥 또는 정맥 순환을 통해 전신 투여될 수 있다. 일부 실시형태에서, 벡터 조성물은 유도 삽관을 통해 비장 또는 췌장을 포함하는 간을 바로 둘러싼 조직에 투여될 수 있다. 일부 실시형태에서, 벡터 조성물은 문맥 또는 문맥동 내로 주입에 의해 전달될 수 있고, 탯줄 정맥 내로 주입에 의해 전달될 수 있다.
개시된 벡터 조성물은 임의의 약학적으로 허용가능한 방법, 예컨대 비내, 구강, 설하, 경구, 직장, 안구, 비경구 (정맥내, 피부내, 근육내, 피하, 복강내), 폐, 질내, 국부 투여, 국소 투여, 난절 이후 국소 투여, 점막 투여를 사용하여, 에어로졸을 통해, 반고체 매질 예컨대 아가로오스 또는 젤라틴에서, 또는 구강 또는 코 스프레이 제형을 통해 투여될 수 있다.
또한, 개시된 벡터 조성물은 임의의 약학적으로 허용가능한 투약 형태, 예컨대 고체 투약 형태, 정제, 알약, 로젠지, 캡슐, 액체 분산액, 겔, 에어로졸, 폐 에어로졸, 코 에어로졸, 연고, 크림, 반고체 투약 형태, 용액, 에멀젼 및 현탁액으로 제형화될 수 있다. 또한, 약학적 조성물은 제어 방출 제형, 지속 방출 제형, 즉시 방출 제형 또는 이의 임의 조합일 수 있다. 또한, 약학적 조성물은 경피 전달 시스템일 수 있다.
실시형태에서, 약학적 조성물은 경구 투여용 고체 투약 형태로 제형화될 수 있고, 고체 투약 형태는 분말, 과립, 캡슐, 정제 또는 알약일 수 있다. 실시형태에서, 고체 투약 형태는 하나 이상의 부형제 예컨대 칼슘 카르보네이트, 전분, 수크로오스, 락토오스, 미세결정질 셀룰로오스 또는 젤라틴을 포함할 수 있다. 또한, 고체 투약 형태는 부형제에 추가로, 윤활제 예컨대 탈크 또는 마그네슘 스테아레이트를 포함할 수 있다. 일부 실시형태에서, 경구 투약 형태는 즉시 방출 또는 변형 방출 형태일 수 있다. 변형 방출 투약 형태는 제어 또는 연장 방출, 장 방출 등을 포함한다. 변형 방출 투약 형태에서 사용되는 부형제는 일반적으로 당업자에게 공지되어 있다.
실시형태에서, 약학적 조성물은 설하 또는 구강 투약 형태로서 제형화될 수 있다. 이러한 투약 형태는 혀 아래에 투여되는 설하 정제 또는 용액 조성물 및 뺨과 잇몸 사이에 놓여지는 구강 정제를 포함한다.
실시형태에서, 약학적 조성물은 코 투약 형태로서 제형화될 수 있다. 본 공개의 이러한 투약 형태는 코 전달을 위한 용액, 현탁액 및 겔 조성물을 포함한다.
실시형태에서, 약학적 조성물은 경구 투여용 액체 투약 형태, 예컨대 현탁액, 에멀젼 또는 시럽으로 제형화될 수 있다. 실시형태에서, 액체 투약 형태는 통용되는 단순한 희석제 예컨대 물 및 액체 파라핀에 추가로, 다양한 부형제 예컨대 보습제, 감미제, 방향제 또는 보존제를 포함할 수 있다. 실시형태에서, 조성물은 소아과 환자에게 투여하기 적합하도록 제형화될 수 있다.
실시형태에서, 약학적 조성물은 비경구 투여용 투약 형태, 예컨대 멸균 수용액, 현탁액, 에멀젼, 비-수용액 또는 좌제로 제형화될 수 있다. 실시형태에서, 용액 또는 현탁액은 프로필렌글리콜, 폴리에틸렌글리콜, 식물성 오일 예컨대 올리브 오일 또는 주입가능 에스테르 예컨대 에틸 올레에이트를 포함할 수 있다.
약학적 조성물의 투약량은 환자의 체중, 연령, 성별, 투여 시기 및 방식, 배설률, 및 질환의 중증도에 따라 가변적일 수 있다.
실시형태에서, PKU 의 치료는 바늘, 또는 혈관내 삽관을 사용하여 간 내로 개시된 벡터 구축물의 유도 직접 주입에 의해 달성된다. 실시형태에서, 벡터 조성물은 정맥 또는 동맥 삽관 또는 주입, 피내 전달, 근육내 전달 또는 간 근처의 배수 기관 내로의 주입에 의해 뇌척수액, 혈액 또는 림프 순환에 투여된다.
하기 실시예는 본 발명의 양태를 예시하기 위해 제공된다. 그러나, 본 발명은 이들 실시예에서 기재되는 특정 조건또는 세부사항에 제한되지 않는다고 이해될 것이다. 본원에서 참조하는 모든 인쇄된 공개물은 명확하게 참조로 통합된다.
실시예
실시예 1. 렌티바이러스 벡터 시스템의 개발
렌티바이러스 벡터 시스템을 도 1 (원형화된 형태) 에서 요약한 바와 같이 개발했다. 렌티바이러스 입자를 293T/17 HEK 세포 (American Type Culture Collection, Manassas, VA 로부터 구입) 에서 생성시킨 후, 치료적 벡터, 외피 플라스미드 및 헬퍼 플라스미드로 트랜스펙션했다. 기능적 바이러스 입자를 생성한 293T/17 HEK 세포의 트랜스펙션에는 시약 폴리(에틸렌이민) (PEI) 을 이용하여 플라스미드 DNA 흡수 효율을 증가시켰다. 플라스미드 및 DNA 를 초기에 3:1 의 비 (PEI 대 DNA 의 질량비) 로, 혈청 없는 배양 배지에서 별도로 첨가했다. 2-3 일 후, 세포 배지를 수집하고 렌티바이러스 입자를 고속 원심분리 및/또는 여과에 의해 정제한 후, 음이온 교환 크로마토그래피를 수행했다. 렌티바이러스 입자의 농도는 형질도입 단위/㎖ (TU/㎖) 로 표현될 수 있다. TU 의 결정은 배양액 (p24 단백질이 렌티바이러스 입자에 통합됨) 중 HIV p24 수준을 측정함으로써, 정량 PCR 에 의해 형질도입된 세포 당 바이러스 DNA 카피수를 측정함으로써, 또는 세포를 감염시키고 광을 사용하여 (벡터가 루시퍼라아제 또는 형광 단백질 마커를 인코딩하는 경우) 달성되었다.
상기 언급한 바와 같이, 3-벡터 시스템 (즉, 2-벡터 렌티바이러스 패키징 시스템을 포함함) 은 렌티바이러스 입자의 생성을 위해 디자인되었다. 3-벡터 시스템의 개략도를 도 1 에 나타낸다. 간략하게, 도 1 을 참조하면, 최상부 벡터는 헬퍼 플라스미드이며, 이러한 경우, 이는 Rev 를 포함한다. 도 1 의 중앙에 나타나는 벡터는 외피 플라스미드이다. 최하부 벡터는 본원에 기재된 바와 같은 치료용 벡터이다.
도 1 을 참조하면, 헬퍼 + Rev 플라스미드는 CMV 인핸서와 닭 베타 액틴 프로모터 (SEQ ID NO: 23); 닭 베타 액틴 인트론 (SEQ ID NO: 41); HIV Gag (SEQ ID NO: 24); HIV Pol (SEQ ID NO: 25); HIV 인테그라아제 (SEQ ID NO: 26); HIV RRE (SEQ ID NO: 27); HIV Rev (SEQ ID NO: 28); 및 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 포함한다.
외피 플라스미드는 CMV 프로모터 (SEQ ID NO: 29); 베타 글로빈 인트론 (SEQ ID NO: 7 또는 8); VSV-G 외피 당단백질 (SEQ ID NO: 30); 및 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 포함한다.
헬퍼 (+ Rev) 및 외피 플라스미드로 이루어지는 2-벡터 렌티바이러스 패키징 시스템을 포함하는 3-벡터 시스템의 합성이 개시되어 있다.
물질 및 방법:
헬퍼 플라스미드의 구축: Gag, Pol, 및 인테그라아제 유전자를 함유하는 pNL4-3 HIV 플라스미드 (NIH Aids Reagent Program) 로부터 DNA 단편의 초기 PCR 증폭에 의해 헬퍼 플라스미드를 구축했다. 프라이머는, pCDNA3 플라스미드 (Invitrogen) 에서의 동일한 자리에 삽입하는데 사용될 수 있는 EcoRI 및 NotI 제한 자리가 있는 단편을 증폭하도록 디자인되었다. 정방향 프라이머는 (5'-TAAGCAGAATTCATGAATTTGCCAGGAAGAT-3') (SEQ ID NO: 43) 이었고, 역방향 프라이머는 (5'-CCATACAATGAATGGACACTAGGCGGCCGCACGAAT-3') (SEQ ID NO: 44) 이었다.
Gag, Pol, 인테그라아제 단편에 대한 서열은 다음과 같았다:
다음으로, RRE, Rev, 및 토끼 베타 글로빈 poly A 서열과 XbaI 및 XmaI 측면 (flanking) 제한 자리를 함유하는 DNA 단편은 Eurofins Genomics 에 의해 합성되었다. DNA 단편을 그 후 플라스미드 내로 XbaI 및 XmaI 제한 자리에서 삽입했다. DNA 서열은 다음과 같았다:
마지막으로, pCDNA3.1 의 CMV 프로모터를 CAG 프로모터 (CMV 인핸서, 닭 베타 액틴 프로모터 + 닭 베타 액틴 인트론 서열) 로 대체했다. CAG 인핸서/프로모터/인트론 서열과 MluI 및 EcoRI 측면 제한 자리를 함유하는 DNA 단편은 Eurofins Genomics 에 의해 합성되었다. DNA 단편을 그 후 플라스미드 내로 MluI 및 EcoRI 제한 자리에서 삽입했다. DNA 서열 다음과 같았다:
VSV-G 외피 플라스미드의 구축:
수포성 구내염 인디아나 바이러스 당단백질 (VSV-G) 서열과 측면 EcoRI 제한 자리는 Eurofins Genomics 에 의해 합성되었다. DNA 단편을 그 후 pCDNA3.1 플라스미드 (Invitrogen) 내로 EcoRI 제한 자리에서 삽입하고, CMV 특이적 프라이머를 사용하여 서열분석에 의해 올바른 배향을 확인했다.
DNA 서열은 다음과 같았다:
3-벡터 렌티바이러스 패키징 시스템을 포함하는 4-벡터 시스템을 또한 본원에서 기재되는 방법 및 물질을 사용하여 디자인 및 생산했다. 4-벡터 시스템의 도해가 도 2 에서 보여진다. 간략히, 도 2 를 참조하면, 최상부 벡터는 헬퍼 플라스미드이며, 이는, 이 경우에, Rev 를 포함하지 않는다. 제 2 벡터는 별개의 Rev 플라스미드이다. 제 3 벡터는 외피 플라스미드이다. 최하부 벡터는 본원에서 기재되는 치료적 벡터이다.
도 2 를 참조하면, 헬퍼 플라스미드는 CMV 인핸서 및 닭 베타 액틴 프로모터 (SEQ ID NO: 23); 닭 베타 액틴 인트론 (SEQ ID NO: 41); HIV Gag (SEQ ID NO: 24); HIV Pol (SEQ ID NO: 25); HIV 인테그라아제 (SEQ ID NO: 26); HIV RRE (SEQ ID NO: 27); 및 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 포함한다.
Rev 플라스미드는 RSV 프로모터 및 HIV Rev (SEQ ID NO: 48); 및 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 포함한다.
외피 플라스미드는 CMV 프로모터 (SEQ ID NO: 29); 베타 글로빈 인트론 (SEQ ID NO: 7 또는 8); VSV-G 외피 당단백질 (SEQ ID NO: 30); 및 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 포함한다.
하나의 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 A 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 B 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 C 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 D 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 E 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 F 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 G 에서 보여지는 요소 전부를 포함한다. 또다른 양태에서, PAH 를 발현하는 치료적 렌티바이러스 벡터는 도 3 의 벡터 H 에서 보여지는 요소 전부를 포함한다.
헬퍼, Rev, 및 외피 플라스미드로 이루어지는 3-벡터 렌티바이러스 패키징 시스템을 포함하는 4-벡터 시스템의 합성이 개시되어 있다.
물질 및 방법:
Rev 가 없는 헬퍼 플라스미드의 구축:
RRE 및 토끼 베타 글로빈 poly A 서열을 함유하는 DNA 단편을 삽입하여, Rev 가 없는 헬퍼 플라스미드를 구축했다. 이 서열과 측면 XbaI 및 XmaI 제한 자리는 Eurofins Genomics 에 의해 합성되었다. RRE/토끼 poly A 베타 글로빈 서열을 그 후 헬퍼 플라스미드 내로 XbaI 및 XmaI 제한 자리에서 삽입했다.
DNA 서열은 다음과 같다:
Rev 플라스미드의 구축:
RSV 프로모터 및 HIV Rev 서열은 단일 DNA 단편으로서 측면 MfeI 및 XbaI 제한 자리와 Eurofins Genomics 에 의해 합성되었다. DNA 단편을 그 후 pCDNA3.1 플라스미드 (Invitrogen) 내로 MfeI 및 XbaI 제한 자리에서 삽입했으며, CMV 프로모터는 RSV 프로모터로 대체되어 있다. DNA 서열 다음과 같았다:
패키징 시스템에서 사용되는 플라스미드는 유사한 요소로 변형될 수 있고, 인트론 서열은 벡터 기능의 상실 없이 잠재적으로 제거될 수 있다. 예를 들어, 하기 요소는 패키징 시스템에서 유사한 요소를 대체할 수 있다:
프로모터: 신장 인자-1 (EF-1) (SEQ ID NO: 49), 포스포글리세레이트 키나아제 (PGK) (SEQ ID NO: 50), 및 유비퀴틴 C (UbC) (SEQ ID NO: 51) 는 CMV (SEQ ID NO: 29) 또는 CMV 인핸서/닭 베타 액틴 프로모터 (SEQ ID NO: 23) 를 대체할 수 있다. 이들 서열은 또한 부가, 치환, 결실 또는 돌연변이에 의해 추가로 달라질 수 있다.
Poly A 서열: SV40 poly A (SEQ ID NO: 52) 및 bGH poly A (SEQ ID NO: 53) 는 토끼 베타 글로빈 poly A (SEQ ID NO: 42) 를 대체할 수 있다. 이들 서열은 또한 부가, 치환, 결실 또는 돌연변이에 의해 추가로 달라질 수 있다.
HIV Gag, Pol, 및 인테그라아제 서열: 헬퍼 플라스미드에서의 HIV 서열은 상이한 HIV 균주 또는 클레이드로부터 구축될 수 있다. 예를 들어, Bal 균주으로부터의 HIV Gag (SEQ ID NO: 24); HIV Pol (SEQ ID NO: 25); 및 HIV Int (SEQ ID NO: 26) 는 본원에서 개요서술되는 헬퍼/헬퍼 + Rev 플라스미드에 함유된 gag, pol, 및 int 서열과 상호교환될 수 있다. 이들 서열은 또한 부가, 치환, 결실 또는 돌연변이에 의해 추가로 달라질 수 있다.
외피: VSV-G 당단백질은 고양이 내인성 바이러스 (RD114) (SEQ ID NO: 54), 긴팔 원숭이 백혈병 바이러스 (GALV) (SEQ ID NO: 55), 광견병 바이러스 (FUG) (SEQ ID NO: 56), 림프구성 맥락 뇌막염 바이러스 (LCMV) (SEQ ID NO: 57), 인플루엔자 A 조류 흑사병 바이러스 (FPV) (SEQ ID NO: 58), 로스 리버 알파바이러스 (RRV) (SEQ ID NO: 59), 쥐 백혈병 바이러스 10A1 (MLV) (SEQ ID NO: 60), 또는 에볼라 바이러스 (EboV) (SEQ ID NO: 61) 로부터의 막 당단백질로 치환될 수 있다. 이들 외피에 관한 서열은 본원에서 서열 부분에서 식별된다. 추가로, 이들 서열은 또한 부가, 치환, 결실 또는 돌연변이에 의해 추가로 달라질 수 있다.
요약하면, 3-벡터 vs. 4-벡터 시스템이 비교될 수 있고, 다음과 같이 대비될 수 있다. 3-벡터 렌티바이러스 벡터 시스템은 다음을 포함한다: 1. 헬퍼 플라스미드: HIV Gag, Pol, 인테그라아제, RRE, 및 Rev; 2. 외피 플라스미드: VSV-G 외피; 및 3. 치료적 벡터: RSV, 5'LTR, Psi 패키징 신호, RRE, cPPT, 프로트롬빈 인핸서, 알파 1 항-트립신 프로모터, 페닐알라닌 히드록실라아제, WPRE, 및 3'델타 LTR. 4-벡터 렌티바이러스 벡터 시스템은 다음을 포함한다: 1. 헬퍼 플라스미드: HIV Gag, Pol, 인테그라아제, 및 RRE; 2. Rev 플라스미드: Rev; 3. 외피 플라스미드: VSV-G 외피; 및 4. 치료적 벡터: RSV, 5'LTR, Psi 패키징 신호, RRE, cPPT, 프로트롬빈 인핸서, 알파 1 항-트립신 프로모터, 페닐알라닌 히드록실라아제, WPRE, 및 3'델타 LTR. 상기 요소에 상응하는 서열은 본원에서 서열 목록 부분에서 식별된다.
실시예 2. 치료적 벡터
예시적 치료적 벡터를, 예를 들어, 도 3 에서 보여지는 바와 같이 디자인 및 개발했다.
첫째로 도 3 의 벡터 A 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서, hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 B 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서의 업스트림에 HNF1 (간세포 핵 인자) 결합 자리, hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 C 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서의 업스트림에 HNF1/4 (간세포 핵 인자) 결합 자리, hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 D 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서, HNF1 (간세포 핵 인자), hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 E 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서, HNF1/4 (간세포 핵 인자), hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 F 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서의 업스트림에 다섯 개의 HNF1 (간세포 핵 인자) 결합 자리, hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
다음으로 도 3 의 벡터 G 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서의 업스트림에 세 개의 HNF1/HNF4 (간세포 핵 인자) 결합 자리, hAAT 프로모터, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
첫째로 도 3 의 벡터 H 를 참조하면, 좌측에서 우측으로, 핵심 유전적 요소는 다음과 같다: 하이브리드 5' 장 말단 반복부 (RSV/LTR), Psi 서열 (RNA 패키징 자리), RRE (Rev-응답 요소), cPPT (폴리퓨린 구역), 프로트롬빈 인핸서, hAAT 프로모터, 토끼 베타 글로빈 인트론, 본원에서 상세히 기재되는, PAH 서열 및 그의 변이체를 포함하는 PAH 서열, 우드척 전사후 조절 요소 (WPRE), 및 U3 영역에 결실이 있는 LTR.
도 3 에 일반적으로 나타낸 벡터를 생산하기 위해서, 본원에서 기재되는 바와 같고 그 외에는 당업자에게 이해되는 바와 같은 방법 및 물질을 이용했다.
저해성 RNA 디자인: 호모 사피엔스 (Homo sapiens) 페닐알라닌 히드록실라아제 (PAH) (NM_000277.1) mRNA 의 서열을 사용하여 인간 세포에서 PAH 수준을 녹다운시키는 잠재적 shRNA 후보에 대해 검색했다. 잠재적 RNA shRNA 서열을 siRNA 또는 shRNA 디자인 프로그램에 의해 선별된 후보로부터 예컨대 Broad Institute (portals.broadinstitute.org/gpp/public/) 에 의해 관리되는 GPP 웹 포털 또는 Thermo Scientific (https://rnaidesigner.thermofisher.com/rnaiexpress/) 의 BLOCK-iT RNAi Designer 로부터 선택했다. 개별 선별된 shRNA 서열을 렌티바이러스 벡터 내로 shRNA 발현을 조절하기 위한 RNA 폴리머라아제 III 프로모터 H1 (SEQ ID NO: 22) 의 바로 3 프라임에 삽입했다. 이들 렌티바이러스 shRNA 구축물을 사용하여 세포를 형질도입하고 특이적 mRNA 수준의 변화를 측정했다.
벡터 구축: PAH shRNA 에 관해, BamHI 및 EcoRI 제한 자리를 함유하는 올리고뉴클레오티드 서열을 Eurofins MWG Operon 에 의해 합성했다. 중첩하는 센스 및 안티센스 올리고뉴클레오티드 서열을 혼합하고 70 ℃ 로부터 실온으로의 냉각 동안 어닐링했다. 렌티바이러스 벡터를 제한 효소 BamHI 및 EcoRI 로 1 시간 동안 37 ℃ 에서 소화시켰다. 소화된 렌티바이러스 벡터를 아가로스 겔 전기영동에 의해 정제하고, ThermoFisher 로부터의 DNA 겔 추출 키트를 사용하여 겔로부터 추출했다. DNA 농도를 확인하고, 벡터 대 올리고 (3:1 비) 를 혼합하고, 어닐링되게 두고, 결찰시켰다. 결찰 반응을 T4 DNA 리가아제로 30 분 동안 실온에서 수행했다. 2.5 ㎕ 의 결찰 믹스를 25 ㎕ 의 STBL3 적격 박테리아 세포에 첨가했다. 형질전환을 42 ℃ 에서 열충격 후에 수행했다. 박테리아 세포를 암피실린을 함유하는 아가 플레이트 상에 스프레딩하고, 약물-내성 콜로니 (암피실린-내성 플라스미드의 존재를 시사함) 를 회수하고, LB 브로쓰에서 증식시켰다. 올리고 서열의 삽입을 체크하기 위해서, 수확된 박테리아 배양물로부터 Thermo Scientific DNA 미니 프렙 키트로 플라스미드 DNA 를 추출했다. shRNA 발현을 조절하기 위해 사용되는 프로모터에 대한 특이적 프라이머를 사용하여 DNA 서열분석에 의해 렌티바이러스 벡터 내의 shRNA 서열의 삽입을 확인했다. 하기 표적 서열을 사용하여, 예시적 shRNA 서열이 PAH 를 녹다운시키는지를 확인했다.
PAH shRNA 서열 #1:
PAH shRNA 서열 #2:
실시예 3. 간- 특이적 프로트롬빈 인핸서/hAAT 프로모터
Hepa1-6 마우스 간종양 세포를 간-특이적 프로트롬빈 인핸서 (SEQ ID NO: 5), 및 인간 알파-1 항-트립신 프로모터 (SEQ ID NO: 6) 를 함유하는 렌티바이러스 벡터로 형질도입했다. 결과로서 얻어지는 DNA 서열은 다음과 같다:
이들 감염에 관한 결과는 본원에서 추가의 실시예에서 상세히 기재된다.
실시예 4. hAAT 프로모터와 프로트롬빈 인핸서 및 간세포 핵 인자 (HNF) 결합 자리
Hepa1-6 마우스 간종양 세포를 간-특이적 프로트롬빈 인핸서 (SEQ ID NO: 5), 인간 알파-1 항-트립신 프로모터 (SEQ ID NO: 6), 및 하나 이상의 간세포 핵 인자 (HNF) 결합 자리를 함유하는 렌티바이러스 벡터로 형질도입했다. 다섯 개의 HNF1 결합 자리 (밑줄진 서체로 표시됨) 를 포함하는 결과적인 DNA 서열은 다음과 같았다:
세 개의 HNF1/HNF4 결합 자리 (HNF1 밑줄진 서체로 표시됨; HNF4 굵은 서체로 표시됨) 를 포함하는 결과적인 DNA 서열은 다음과 같다:
이들 벡터로부터의 PAH 의 발현은 본원의 추가의 실시예에서 상세히 기술된다.
실시예 5. PAH 에 관한 물질 및 방법
호모 사피엔스 (Homo sapiens) 페닐알라닌 히드록실라아제 (hPAH) mRNA (Gen Bank: NM_000277.1) 의 서열을 Eurofins Genomics (Louisville, KY) 에 의해 유전자의 원위 및 근위 말단에 위치하는 EcoRI 및 SalI 제한 효소 자리로 화학적으로 합성했다. EcoRI 및 SalI 제한 효소로 처리된 hPAH 를 ApoE (NM_000001.11, U35114.1) 또는 프로트롬빈 (AF478696.1) 및 hAAT (HG98385.1) 좌위 제어 영역의 부분을 포함하는 하이브리드 프로모터의 제어 하에 pCDH 렌티바이러스 플라스미드 (System Biosciences, Palo Alto, CA) 내로 결찰시켰다. 부가적으로, 3' 미번역 영역 (UTR) 의 289 개 뉴클레오티드를 포함하는 인간 PAH 를 합성했다.
렌티바이러스 벡터 및 hPAH 서열을 제한 효소 BamHI 및 EcoRI (NEB, Ipswich, MA) 로 두 시간 동안 37 ℃ 에서 소화시켰다. 소화된 렌티바이러스 벡터를 아가로스 겔 전기영동에 의해 정제하고, ThermoFisher (Waltham, MA) 로부터의 DNA 겔 추출 키트를 사용하여 겔로부터 추출했다. DNA 농도를 확인하고, 그 후 3:1 의 인서트 대 벡터 비를 사용하여 PAH 서열 (hPAH) 와 혼합했다. 혼합물을 T4 DNA 리가아제 (NEB) 로 30 분 동안 실온에서 결찰시켰다. 2.5 ㎕ 의 결찰 믹스를 25 ㎕ 의 STBL3 적격 박테리아 세포 (ThermoFisher) 에 첨가했다. 형질전환을 열충격에 의해 42 ℃ 에서 수행했다. 박테리아 세포를 암피실린을 함유하는 아가 플레이트 상에 스트리킹하고, 그 후 콜로니를 LB 브로쓰에서 증식시켰다. PAH 서열의 삽입을 체크하기 위해서, 수확된 박테리아 배양물로부터 ThermoFisher DNA 미니 프렙 키트로 플라스미드 DNA 를 추출했다. 렌티바이러스 벡터 (LV) 내의 PAH 서열의 삽입을 DNA 서열분석에 의해 확인했다. 다음으로, ClaI 및 EcoRI 제한 자리가 있는 ApoE 인핸서/hAAT 프로모터 또는 프로트롬빈 인핸서/hAAT 프로모터 서열은 Eurofins Genomics 에 의해 합성되었다. PAH 코딩 서열 및 하이브리드 프로모터를 함유하는 렌티바이러스 벡터를 ClaI 및 EcoRI 효소로 소화시키고, 함께 결찰시켰다. 하이브리드 프로모터를 함유하는 플라스미드를 DNA 서열분석에 의해 확인했다. hPAH 및 하이브리드 프로모터 서열을 함유하는 렌티바이러스 벡터를 그 후 사용하여, 형질도입된 세포에서 PAH 를 발현하는 능력에 관해 시험하기 위해서 렌티바이러스 입자를 포장했다. 포유동물 세포에 렌티바이러스 입자를 형질도입했다. 3 일 후에 세포를 수집하고, 단백질을 면역블롯에 의해 PAH 발현에 관해 분석했다.
hPAH 서열의 변형:
ApoE 인핸서/hAAT 프로모터에 의해 조절되는 세포 발현 수준을 개선하기 위해 hPAH 서열의 여러 변형을 통합시켰다. 첫째로, hPAH 3' 미번역 영역 (UTR) 의 289 개 뉴클레오티드를 PAH 코딩 영역 후에 및 mRNA 말단 전에 삽입했다. 이는 LV-ApoE/hAAT-hPAH-UTR 를 생성했다.
다음으로, 간-특이적 ApoE 인핸서를 간-특이적 프로트롬빈 인핸서로 교환했다. PAH 의 발현을 ApoE 또는 프로트롬빈 인핸서/hAAT 프로모터 조합과 hPAH 코딩 서열 및 UTR 의 289 개 뉴클레오티드로 분석했다. 다음으로, PAH 의 발현을 UTR 영역의 부재 하에 프로트롬빈 인핸서/hAAT 프로모터 및 hPAH 코딩 서열로 평가했다. 프로트롬빈 인핸서/hAAT 프로모터의 조합은 ApoE 인핸서/hAAT 프로모터 조합에서는 요구되었던 UTR 영역의 필요를 제거했다. 그러므로, 프로트롬빈 인핸서/hAAT 프로모터 조합은 UTR 영역의 요구 없이 간-특이적 방식으로 높은 수준의 PAH 발현을 조절할 수 있다. 이러한 hPAH 유전자를 조절하는 간-특이적 조절 요소에 대한 이해의 중요한 진전은 간 조직에서의 특이적 발현을 위한 구축물의 생성을 허용하는 한편 여전히 hPAH 의 높은 수준 생산을 달성한다. 이식유전자 발현을 간 세포로 제한하는 것은 페닐케톤뇨증을 위한 유전 의약에서 벡터 안전성 및 표적 특이성을 위한 중요한 고려이다.
실시예 6. Hepa1-6 세포 및 293T 세포에서 프로트롬빈 인핸서의 변이의 존재 하에 및 3' UTR 영역의 존재 또는 부재 하에 hPAH 의 렌티바이러스-전달되는 발현
이 실시예는 ApoE 인핸서와 비교하여 프로트롬빈 인핸서와의 조합으로 hAAT 프로모터를 함유하는 렌티바이러스 벡터로 Hepa1-6 암종 세포 및 293T 인간 배아 신장 세포에서 인간 PAH 의 발현이 증가된다는 것을 보여주며, 이는 도 4A 및 4B 각각에서 보여지는 바와 같다. 프로트롬빈 인핸서가 hAAT 프로모터와 조합될 때 3' UTR 은 hPAH 발현에 요구되지 않는다. 3' UTR 은 프로트롬빈 함유 벡터에서 PAH 발현을 실제로 감소시키며, 이는 도 4A 및 4B 각각에서 보여지는 바와 같다. 이 실시예는 또한 프로트롬빈 인핸서와의 조합으로 간세포 핵 인자 1 및 4 (HNF1/4) 결합 자리를 발현하는 렌티바이러스 벡터가 Hepa1-6 세포 및 293T 세포에서 PAH 단백질의 수준을 증가시킨다는 것을 보여주며, 이는 도 4A 및 4B 각각에서 보여지는 바와 같다.
인간 PAH, 프로트롬빈 및 ApoE 인핸서, 및 hAAT 프로모터를 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 또는 293T 인간 배아 신장 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 유전자를 그것의 3' UTR 의 존재 또는 부재 하에 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간 특이적 프로트롬빈 또는 ApoE 인핸서를 함유하는 hAAT 프로모터에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 단백질을 면역블롯에 의해 hPAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (SigmaMillipore, Billerica, MA) 를 로딩 대조군에 사용했다.
도 4A 및 4B 에서 보여지는 바와 같이, 여섯 개의 군이 비교된다: Hepa 1-6 세포 또는 293T 세포 단독을 포함하는 대조군 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 2), 프로트롬빈 인핸서의 업스트림에 있는 5X HNF1 결합 자리를 함유하는 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 3), 프로트롬빈 인핸서의 업스트림에 3X HNF1 및 3X HNF4 결합 자리를 함유하는 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 4), 프로트롬빈 인핸서/hAAT 프로모터에 의해 3' UTR 의 존재 하에 hPAH 를 발현하는 렌티바이러스 벡터 (레인 5), 및 ApoE 인핸서/hAAT 프로모터에 의해 3' UTR 의 존재 하에 hPAH 를 발현하는 렌티바이러스 벡터 (레인 6). 도 4A 및 4B 는 ApoE 인핸서와 비교하여 프로트롬빈 인핸서가 hAAT 프로모터와 조합될 때 Hepa1-6 암종 세포 및 293T 세포 둘 모두에서 PAH 의 발현이 증가된다는 것을 입증한다. 부가적으로, 프로트롬빈 인핸서가 벡터에 포함될 때 PAH 3' UTR 가 hPAH 발현에 요구되지 않는다.
실시예 7. Hepa1-6 세포에서 인트론 서열, 코돈 최적화된 PAH 서열, 및 HNF-1 또는 HNF1/4 결합 자리를 함유하는 프로트롬빈 인핸서에 의한 hPAH 의 렌티바이러스-전달되는 발현
이 실시예는 프로트롬빈 인핸서 및 토끼 베타 글로빈 인트론 서열과의 조합으로 hAAT 프로모터를 함유하는 렌티바이러스 벡터에 의해 Hepa1-6 암종 세포에서 인간 PAH 의 발현이 증가된다는 것을 보여주며, 이는 도 5A 에서 보여지는 바와 같다. 인트론 서열이 역방향으로 삽입되어 있을 때 hPAH 는 발현되지 않는다. 도 5B 에서, 이는 코돈-최적화된 버전의 hPAH 코딩 서열이 비-최적화된 hPAH 코딩 영역 서열보다 더 적게 발현된다는 것을 보여준다. 이 실시예는 또한 프로트롬빈 인핸서와의 조합으로 간세포 핵 인자-1 및 -4 (HNF1 및 HNF1/4) 결합 자리를 발현하는 렌티바이러스 벡터가 Hepa1-6 세포에서 hPAH 단백질의 수준을 증가시킨다는 것을 보여주며, 이는 도 5C 에서 보여지는 바와 같다.
인간 PAH (최적화된 및 비-최적화된), 프로트롬빈 인핸서, hAAT 프로모터, 및 토끼 베타 글로빈 서열을 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 유전자를 토끼 베타 글로빈 인트론의 존재 또는 부재 하에 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 프로트롬빈 인핸서의 업스트림 또는 다운스트림에 HNF1 또는 HNF1/4 결합 자리의 존재 하에 간-특이적 프로트롬빈 인핸서를 함유하는 hAAT 프로모터에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 단백질을 면역블롯에 의해 PAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (SigmaMillipore, Billerica, MA) 를 로딩 대조군에 사용했다.
도 5A 에서 보여지는 바와 같이, 네 개의 군이 비교된다: Hepa 1-6 세포 단독을 포함하는 대조군 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 2), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하고 정방향으로 토끼 베타 글로빈 인트론을 함유하는 렌티바이러스 벡터 (레인 3), 및 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하고 역방향으로 토끼 베타 글로빈 인트론을 함유하는 렌티바이러스 벡터 (레인 4). 도 5B 에서 보여지는 바와 같이, 세 개의 군이 비교된다: Hepa 1-6 세포 단독을 포함하는 대조군 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 오직 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 2 및 3), 및 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코돈-최적화된 서열을 발현하는 렌티바이러스 벡터 (레인 4). 도 5C 에서 보여지는 바와 같이, 여섯 개의 군이 비교된다: Hepa 1-6 세포 단독을 포함하는 대조군 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 오직 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 2 및 3), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하고 토끼 베타 글로빈 인트론을 함유하는 렌티바이러스 벡터 (레인 4), 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 HNF1 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 5), 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 다운스트림에 HNF1 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 6), 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 HNF1/4 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 7), 및 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 다운스트림에 HNF1/4 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 8). 도 5A-5C 는 토끼 베타 글로빈 인트론 서열이 hPAH 코딩 서열의 업스트림에 첨가되었을 때 Hepa1-6 암종 세포에서 hPAH 의 발현이 증가된다는 것을 입증한다. 부가적으로, 코돈-최적화된 hPAH 코딩 서열은 비-최적화된 서열보다 더 적게 발현된다. 마지막으로, 오직 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 렌티바이러스 벡터와 비교하여, 프로트롬빈 인핸서의 업스트림에 HNF1 또는 HNF1/4 결합 자리의 부가는 hPAH 의 발현을 증가시키지만 프로트롬빈 인핸서의 다운스트림에 HNF1 또는 HNF1/4 결합 자리의 부가는 hPAH 의 발현을 증가시키지 않는다.
실시예 8. Hepa1-6 세포에서 hAAT 프로모터 및 HNF-1 및 HNF-1/4 결합 자리를 함유하는 프로트롬빈 인핸서에 의한 hPAH 의 렌티바이러스-전달되는 발현 RNA
도 6 에서 보여지는 바와 같이, 이 실시예는 프로트롬빈 인핸서 및 HNF1 및 HNF1/4 에 대한 결합 자리와의 조합으로 hAAT 프로모터를 함유하는 렌티바이러스 벡터로 감염 다중도 (MOI) 1 및 5 로 형질도입된 Hepa1-6 암종 세포에서 인간 PAH RNA 의 발현이 증가된다는 것을 보여준다.
인간 PAH, 프로트롬빈 인핸서, 및 hAAT 프로모터를 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 유전자를 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 HNF1 또는 HNF1/4 결합 자리의 업스트림에 간-특이적 프로트롬빈 인핸서를 함유하는 hAAT 프로모터에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 RNA 를 RNeasy 키트 (Qiagen, Germantown, MD) 로 추출하고, TaqMan 프로브 (5'-TCGTGAAAGCTCATGGACAGTGGC-3') (SEQ ID NO: 66) 및 프라이머 세트 Fwd: 5'- AGATCTTGAGGCATGACATTGG-3' (SEQ ID NO: 67) 및 Rev: 5'-GTCCAGCTCTTGAATGGTTCTT-3' (SEQ ID NO: 68) 를 이용하여 qPCR 분석에 의해 hPAH 에 관해 분석했다. 총 RNA (100 ng) 를 액틴 프로브 (5'-AGCGGGAAATCGTGCGTGAC-3') (SEQ ID NO: 69) 및 프라이머 세트 (Fwd: 5'-GGACCTGACTGACTACCTCAT-3' (SEQ ID NO: 70) 및 Rev: 5'- CGTAGCACAGCTTCTCCTTAAT-3') (SEQ ID NO: 71) 로 정규화시켰다.
도 6 에서 보여지는 바와 같이, 네 개의 군이 비교된다: Hepa 1-6 세포 단독을 포함하는 대조군 (막대 1), 1 MOI (막대 2) 및 5 MOI (막대 5) 에서 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터, MOI (막대 3) 및 5 MOI (막대 6) 에서 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 HNF1 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터, 및 1 MOI (막대 4) 및 5 MOI (막대 7) 에서 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 HNF1/4 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터. 도 6 은 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 벡터로 PAH RNA 의 발현이 1 내지 4.7 pg (1-5 MOI) 로 증가된다는 것을 입증한다. HNF1 결합 자리가 프로트롬빈 인핸서의 업스트림에 포함되어 있을 때 2.3 으로부터 10.7 pg (1-5 MOI) 로의 증가 및 HNF1/4 결합 자리가 프로트롬빈 인핸서의 업스트림에 삽입되어 있을 때 3 으로부터 17.8 pg (1-5 MOI) 로의 증가가 존재한다.
실시예 9. Hepa1-6 세포에서 프로트롬빈 인핸서 및 hAAT 또는 티록신 결합 글로불린 (TBG) 프로모터에 의한 hPAH 의 렌티바이러스-전달되는 발현
이 실시예는 TBG 프로모터 (SEQ ID NO: 62) 와 비교하여 hAAT 프로모터와의 조합으로 프로트롬빈 인핸서를 함유하는 렌티바이러스 벡터에 의해 Hepa1-6 암종 세포에서 인간 PAH 의 발현이 증가된다는 것을 보여주며, 이는 도 7 에서 보여지는 바와 같다.
인간 PAH, 프로트롬빈 인핸서, 및 hAAT 및 TBG 프로모터를 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 유전자를 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간-특이적 hAAT 또는 TBG 프로모터에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 단백질을 면역블롯에 의해 PAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (SigmaMillipore, Billerica, MA) 를 로딩 대조군에 사용했다.
도 7 에서 보여지는 바와 같이, 네 개의 군이 비교된다: 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하고 토끼 베타 글로빈 인트론을 함유하는 렌티바이러스 벡터 (레인 2), 오직 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 렌티바이러스 벡터를 사용하는 대조군 (레인 3), 및 프로트롬빈 인핸서/TBG 프로모터에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 4). 도 7 은 TBG 프로모터와 비교하여 프로트롬빈 인핸서가 hAAT 프로모터와 조합될 때 Hepa1-6 암종 세포에서 PAH 의 발현이 상당히 증가된다는 것을 입증한다.
실시예 10. Hepa1-6 세포 또는 Hep3B 세포에서 PAH 유전자의 업스트림에 있는 토끼 또는 인간 베타 글로빈 인트론 서열에 의한 hPAH 의 렌티바이러스-전달되는 발현.
이 실시예는 hAAT 프로모터 및 토끼 또는 인간 베타 글로빈 인트론과의 조합으로 프로트롬빈 인핸서를 함유하는 렌티바이러스 벡터에 의해 Hepa1-6 및 Hep3B 암종 세포에서 인간 PAH 의 발현이 인간 베타 글로빈 인트론에 의해 증가되지 않는다는 것을 보여주며, 이는 도 8A 및 8B 에서 보여지는 바와 같다.
인간 PAH, 프로트롬빈 인핸서, hAAT 프로모터, 및 토끼 또는 인간 베타 글로빈 인트론을 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 또는 Hep3B 인간 간세포 암종 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 유전자를 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간-특이적 hAAT 프로모터 및 토끼 또는 인간 베타 글로빈 인트론에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 단백질을 면역블롯에 의해 PAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (SigmaMillipore, Billerica, MA) 를 로딩 대조군에 사용했다.
도 8A 및 8B 에서 보여지는 바와 같이, 네 개의 군이 비교된다: 렌티바이러스 없음 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 2), 프로트롬빈 인핸서/hAAT 프로모터 및 토끼 베타 글로빈 인트론 서열에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 3), 및 프로트롬빈 인핸서/hAAT 프로모터 및 인간 베타 글로빈 인트론에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 4). 도 8A 및 8B 는 프로트롬빈 인핸서 및 hAAT 프로모터에 의해 Hepa1-6 및 Hep3B 암종 세포에서 PAH 의 발현이 증가된다는 것을 입증한다. 토끼 베타 글로빈 인트론의 부가는 Hepa1-6 세포에서 발현을 개선하지만 Hep3B 세포에서는 발현을 개선하지 않는다. 인간 베타 글로빈 인트론은 Hepa1-6 또는 Hep3B 세포에서 발현을 개선하지 않는다.
실시예 11. 일차 인간 간세포에서 프로트롬빈 인핸서/hAAT 프로모터에 의한 hPAH 의 렌티바이러스-전달되는 발현
이 실시예는 hAAT 프로모터와의 조합으로 프로트롬빈 인핸서를 함유하는 렌티바이러스 벡터에 의해 일차 인간 간세포에서 인간 PAH 의 발현이 상당히 증가된다는 것을 보여주며, 이는 도 9 에서 보여지는 바와 같다.
인간 PAH, 프로트롬빈 및 ApoE 인핸서, 및 hAAT 프로모터를 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 일차 인간 간세포 (Triangle Research Labs, North Carolina) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 의 코딩 서열 또는 코딩 서열 및 3' UTR 를 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간-특이적 프로트롬빈 또는 ApoE 인핸서 및 hAAT 프로모터에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 4 일 후에 단백질을 면역블롯에 의해 PAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (SigmaMillipore, Billerica, MA) 를 로딩 대조군에 사용했다.
도 9 에서 보여지는 바와 같이, 다섯 개의 군이 비교된다: 오직 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 렌티바이러스 벡터를 사용하는 대조군 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터 (레인 2), 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 있는 5X HNF1 결합 자리에 의해 hPAH 를 발현하는 렌티바이러스 벡터 (레인 3), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하고 토끼 베타 글로빈 인트론을 함유하는 렌티바이러스 벡터 (레인 4), 및 ApoE/hAAT 프로모터에 의해 3' UTR 를 함유하는 hPAH 를 발현하는 렌티바이러스 벡터 (레인 5). 도 9 는 ApoE 인핸서와 비교하여 프로트롬빈 인핸서가 hAAT 프로모터와 조합될 때 일차 인간 간세포에서 PAH 의 발현이 증가된다는 것을 입증한다. 또한, hPAH 코딩 서열의 업스트림에 토끼 베타 글로빈 인트론 서열의 포함은 hPAH 발현을 향상시킨다.
실시예 12. Hepa1-6 세포에서 렌티바이러스-전달되는 hPAH 의 효소적 활성
이 실시예는 Hepa1-6 세포에서 hPAH 가 발현될 때 세포 배지 및 세포 용해물에서 페닐알라닌 (Phe) 수준의 감소에 의해 나타나는 바와 같이 렌티바이러스-전달되는 인간 PAH 가 효소적으로 활성이라는 것을 보여주며, 이는 도 10A 및 10C, 및 10B, 각각에서 보여지는 바와 같다. Hepa1-6 세포에서 PAH 활성에 보조인자 BH4 의 전구체, 세피아프테린이 요구되었다.
인간 PAH, 프로트롬빈 및 ApoE 인핸서, hAAT 프로모터, 및 토끼 베타 글로빈 인트론을 합성하고, 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 그 후 확인된 hPAH 서열을 함유하는 렌티바이러스 벡터를 사용하여 Hepa1-6 마우스 간암 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. 렌티바이러스 벡터는 인간 PAH 의 코딩 서열을 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간-특이적 프로트롬빈 인핸서/hAAT 프로모터 및 포함된 토끼 베타 글로빈 인트론 서열에 의해 추진되었다. 세포에 렌티바이러스 입자를 형질도입하고, 4 일 후에 페닐알라닌 어세이 키트 (SigmaMillipore, Billerica, MA) 를 사용하여 세포 배지 또는 세포 용해물로부터 페닐알라닌 수준을 측정했다.
도 10A 및 10B 에서 보여지는 바와 같이, 도 10A 에서 세포 배지로부터 또는 도 10B 에서 세포 용해물로부터 네 개의 군이 비교된다: 세피아프테린의 부재 하에 (막대 1) 또는 세피아프테린의 존재 하에 (막대 3) 오직 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 렌티바이러스 벡터를 사용하는 대조군, 세피아프테린의 부재 하에 (막대 2) 또는 세피아프테린의 존재 하에 (막대 4) 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하고 토끼 베타 글로빈 인트론 서열을 함유하는 렌티바이러스 벡터. 도 10C 에서 보여지는 바와 같이, 세포 배지로부터 열 개의 군이 비교된다: 세피아프테린의 부재 하에 (막대 1) 또는 세피아프테린의 존재 하에 (막대 6) 오직 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 렌티바이러스 벡터를 사용하는 대조군, 세피아프테린의 부재 하에 (막대 2) 또는 세피아프테린의 존재 하에 (막대 7) 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터, 세피아프테린의 부재 하에 (막대 3) 또는 세피아프테린의 존재 하에 (막대 8) 프로트롬빈 인핸서/hAAT 프로모터 및 프로트롬빈 인핸서의 업스트림에 있는 5X HNF1 결합 자리에 의해 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터, 세피아프테린의 부재 하에 (막대 4) 또는 세피아프테린의 존재 하에 (막대 9) 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 의 코딩 영역을 발현하고 토끼 베타 글로빈 인트론 서열을 함유하는 렌티바이러스 벡터, 세피아프테린의 부재 하에 (막대 5) 또는 세피아프테린의 존재 하에 (막대 10) ApoE 인핸서/hAAT 프로모터에 의해 3' UTR 를 포함하는 hPAH 의 코딩 영역을 발현하는 렌티바이러스 벡터. 도 10A 및 10B 는 세피아프테린의 존재 하에 Hepa1-6 세포에서 hPAH 가 효소적으로 활성이라는 것을 보여준다. hPAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포에서 세포 배지 페닐알라닌 수준에서 38% 감소가 있었으며, 이는 도 10A 에서 보여지는 바와 같다. 세포 용해물에서, hPAH 를 발현하는 렌티바이러스 벡터로 형질도입된 Hepa1-6 세포에서 페닐알라닌 수준에서 88% 감소가 있었으며, 이는 도 10B 에서 보여지는 바와 같다. 도 10C 는 상이한 간-특이적 프로모터 요소를 함유하는 벡터에서 hPAH 가 효소적으로 활성이라는 것을 보여준다. 프로트롬빈 인핸서/hAAT 프로모터 및 hPAH 를 함유하는 벡터에 의해 Phe 수준에서 41% 감소, 프로트롬빈 인핸서의 업스트림에 있는 5X HNF1 결합 자리/hAAT 프로모터 및 hPAH 를 함유하는 벡터에 의해 Phe 수준에서 43% 감소, 토끼 베타 글로빈 인트론 및 hPAH 를 포함하는 프로트롬빈 인핸서/hAAT 프로모터를 함유하는 벡터에 의해 Phe 수준에서 48% 감소, 및 3' UTR 를 포함하는 ApoE 인핸서/hAAT 프로모터 및 hPAH 를 함유하는 벡터에 의해 Phe 수준에서 36% 감소가 있었다.
실시예 13. PAH 돌연변이체 마우스의 혈액에서 렌티바이러스 전달되는 PAH 는 혈액 페닐알라닌 수준을 감소시킨다
이 실시예는 Pahenu2 돌연변이체 마우스의 혈액에서 렌티바이러스-전달되는 PAH 가 페닐알라닌 수준을 감소시킨다는 것을 보여준다. Pahenu2 돌연변이체 마우스는 전문이 본원에 참조로 포함되는 Shedlovsky et al. (Mouse Models of Human Phenylketonuria, Genetics 134: 1205-1210 (August, 1993)) 에서 기술 및 특성분석되어 있다. Pahenu2 돌연변이체 마우스 (n=4) 에게 꼬리 정맥을 통해 150 ㎕ 부피의 LV-Pro-hAAT-PAH (AGT323) 벡터를 주입했다. 대조군 처리된 동물에게 꼬리 정맥을 통해 렌티바이러스 벡터를 함유하지 않는 식염수를 주입했다. 형질도입된 293T 세포에서 통합된 벡터 카피수의 qPCR 검출에 의해 확인되는 LV-Pro-hAAT-PAH (AGT323) 의 역가는 1x1010 이었다. 주입시에, 마우스는 6-8 주령이었다. 벡터 주입 전에 (T=0) 및 주입 후 제 1 주 및 제 2 주에 혈액을 수집했다.
페닐알라닌 수준의 측정을 위해, 얼굴 정맥을 통해 혈액을 수집했다. 랜싯을 사용하여 뺨에 구멍을 내고, 400 ㎕ 의 전혈을 혈청 튜브에 수집했다. 혈액을 1 시간 동안 정치시키고, 그 후 튜브를 원심분리했다. 혈장/혈청이 상층에서 분리되고, 수집되었다. 혈장을 그 후 임상 아미노산 분석기 장비에서 분석하기 전까지 동결시켰다.
LV-Pro-hAAT-PAH (AGT323) 벡터의 도입은 주입 후 제 1 주 및 제 2 주 둘 모두에서 혈액 페닐알라닌 수준의 감소를 야기했다. 표 1 및 도 11 에서 보여지는 바와 같이, 1-주 및 2-주 시점에 혈액 페닐알라닌의 평균 마이크로-몰 수준은 각각 1674.7 및 1890 이었다. 이는 ~2400 내지 ~2500 의 대조군 처리된 마우스의 평균 마이크로-몰 혈액 페닐알라닌 수준과 비교된다 (표 1 및 도 11).
게다가, LV-Pro-hAAT-PAH (AGT 323) 벡터의 도입은 간 세포의 유전자 변형을 초래했다. 부검 동안 수집된 간에 대한 벡터 카피수 연구는 이들 연구에서 렌티바이러스 벡터 카피수가 세포 당 대략 0.2 였다는 것을 보여줬다. 도 12 에서 보여지는 바와 같이, 간에서의 증가하는 벡터 카피수와 페닐알라닌의 감소하는 수준 사이에 대략 선형 관계가 존재한다 (피어슨 적률 상관계수 = -0.326).
≥ 20% 의 혈액 페닐알라닌 수준의 감소는 페닐케톤뇨증 질환이 있는 인간 환자에게 치료적 유익을 제공할 것이며, 그들의 진단을 고전적 PKU 으로부터 경도 페닐알란혈증으로 잠재적으로 이동시킨다.
표 1
어린 enu2 마우스에서 AGT323 의 꼬리 정맥 주입에 의한 혈액 페닐알라닌 억제
실시예 14. HEK293T 세포에서 DJ 또는 AAV2 혈청형에 의한 hPAH 의 AAV-전달되는 발현
이 실시예는 토끼 베타 글로빈 인트론을 포함하거나 포함하지 않고 hAAT 프로모터와의 조합으로 프로트롬빈 인핸서를 함유하는 AAV 벡터에 의해 HEK293T 세포에서 인간 PAH 가 발현된다는 것을 보여준다.
인간 PAH, 프로트롬빈 인핸서, hAAT 프로모터, 및 토끼 베타 글로빈 인트론을 Eurofins Genomics (Louisville, KY) 에 의해 합성하고, AAV 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. 확인된 hPAH 서열을 함유하는 AAV 벡터를 그 후 사용하여 HEK293T 세포 (American Type Culture Collection, Manassas, VA) 를 형질도입했다. AAV 벡터는 본원에서 개시되는 인간 PAH 유전자를 통합시켰다. 게다가, 이들 구축물에서의 hPAH 발현은 간-특이적 hAAT 프로모터 및 토끼 베타 글로빈 인트론에 의해 추진되었다. 세포를 AAV 입자로 형질도입하고, 3 일 후에, 단백질 또는 RNA 를 면역블롯 또는 qPCR 에 의해 PAH 발현에 관해 분석했다. 인간 PAH 단백질의 발현을 항-PAH 항체 (Abcam, Cambridge, MA) 를 사용하여 면역블롯에 의해 검출하고, 항-베타 액틴 항체 (MilliporeSigma, Billerica, MA) 를 로딩 대조군에 사용했다. TaqMan Fam-라벨링된 프로브 (SEQ ID NO: 66) 및 PAH 프라이머 (Fwd: SEQ ID NO: 67; Rev: SEQ ID NO: 68) 를 사용하여 qPCR 에 의해 PAH RNA 발현을 검출했다.
도 13A 는 여섯 개의 그룹의 비교를 보여준다: AAV/DJ-GFP 벡터 (레인 1), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 AAV/DJ 벡터 (레인 2), 프로트롬빈 인핸서/hAAT 프로모터 및 토끼 베타 글로빈 인트론 서열에 의해 hPAH 를 발현하는 AAV/DJ 벡터 (레인 3), AAV2-GFP 벡터 (레인 4), 프로트롬빈 인핸서/hAAT 프로모터에 의해 hPAH 를 발현하는 AAV2 벡터 (레인 5), 프로트롬빈 인핸서/hAAT 프로모터 및 토끼 베타 글로빈 인트론 서열에 의해 hPAH 를 발현하는 AAV2 벡터 (레인 6).
도 13B 및 13C 는 도 13A 에서의 PAH 밴드의 증가된 노출 후의 블롯을 보여준다. 밴드 밀도가 정량적 이미지화에 의해 분석될 범위 내로 오도록 노출을 증가시켰다. AAV/DJ 혈청형 벡터에 의한 처리를 보여주는 블롯에 상대적으로 AAV/2 혈청형 벡터에 의한 처리를 보여주는 블롯에서 원래의 밴드 강도는 훨씬 더 낮았다. 그 결과, PAH 단백질의 정량적 측정을 하기 위해서, AAV/DJ 혈청형 블롯에 상대적으로 AAV/2 혈청형 블롯에서 더 긴 노출 시간이 필요했다.
정량적 이미지화의 결과는 토끼 베타 글로빈 인트론을 포함하는 AAV/DJ 벡터 또는 토끼 베타 글로빈 인트론을 결여하는 AAV/DJ 벡터를 사용하여 PAH 단백질 발현이 2-배 만큼 증가되었다는 거을 보여줬다 (도 13B; 밴드 아래의 숫자는 상대 배수 증가를 보여준다). 토끼 베타 글로빈 인트론을 함유하는 AAV/2 벡터의 사용은 PAH 의 발현을 억제했지만, 토끼 베타 글로빈 인트론을 함유하지 않는 AAV2 벡터의 사용은 PAH 의 50-배 증가를 초래했다 (도 13C; 밴드 아래의 숫자는 상대 배수 증가를 보여준다). AAV 혈청형 사이의 PAH 발현의 비교는 AAV2 PAH 벡터를 사용하는 경우에 상대적으로 AAV/DJ PAH 벡터의 사용이 PAH 단백질의 더 높은 발현을 초래한다는 것을 밝혔다.
도 13D 는 AAV2 PAH 벡터와 비교하여 AAV/DJ PAH 벡터에서 PAH RNA 발현이 더 높고, 토끼 베타 글로빈 인트론의 존재 및 부재 하에 유사한 발현이 존재한다는 것을 입증한다.
실시예 15. 신생아 enu2/enu2 마우스에서 PKU 에 관한 렌티바이러스 벡터 요법
신생아 enu2/enu2 마우스 (생후 제 3 일) 를 간 내로 직접 주입을 통해 10 ㎕ 의 벡터 스톡 LV-Pro-hAAT-PAH 으로 처리했다. 미치료 동물은 벡터를 함유하지 않는 식염수를 받았다 (가짜 대조군). 최종 용량 ~5 x 106 형질도입 단위/마우스 (~109 형질도입 단위/kg) 의 경우에, 벡터 스톡은 대략 5 x 108 형질도입 단위 (transducing unit)/mL 멸균 식염수 (HEK293 세포에서 측정됨) 였다.
표 2 및 도 14 에서 보여지는 바와 같이, 미치료 enu2/enu2 마우스 (2063 +/- 185) 에 상대적으로 LV-Pro-hAAT-PAH 처리된 enu2/enu2 마우스 (1390 +/- 127) 에서 혈액 페닐알라닌 수준의 마이크로-몰 농도가 유의하게 감소되었다.
표 2
실시예 16. PAH 유전자의 3'UTR 을 표적화하는 shPAH 의 발현은 Hep3B 세포에서 LV-H1-shPAH-프로트롬빈-hAAT-hPAH 에 의한 PAH 발현을 억제하지 않는다
이 실시예는 shPAH 가 Hep3B 세포에서 렌티바이러스 벡터, LV-Pro-hAAT-PAH-shPAH 서열 # 1 (SEQ ID NO: 13) 로부터, 또는 렌티바이러스 벡터, LV-Pro-hAAT-PAH-shPAH 서열 # 2 (SEQ ID NO: 14) 로부터 PAH 발현을 억제하지 않는다는 것을 보여준다.
본원에서 개시되는 인간 PAH 를 합성하고, PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 PAH shRNA 서열 #2 (SEQ ID NO: 14) 을 함유하는 렌티바이러스 벡터 내로 삽입했다. 서열의 삽입을 DNA 서열분석에 의해 확인했다. PAH 를 단독으로 또는 PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 PAH shRNA 서열 #2 (SEQ ID NO: 14) 과의 조합으로 함유하는 렌티바이러스 벡터를 그 후 사용하여 인간 Hep3B 세포 (American Type Culture Collection, Manassas, VA 로부터 구입) 를 형질도입했다. 세포에 렌티바이러스 입자를 형질도입하고, 3 일 후에 단백질을 웨스턴 블롯에 의해 PAH 발현에 관해 분석했다. 인간 PAH 의 상대 발현을 항-PAH 항체 (Abcam) 및 로딩 대조군 베타-액틴를 사용하여 면역블롯에 의해 검출했다. hPAH 발현은 프로트롬빈 인핸서 및 hAAT 프로모터에 의해 추진되었다. 렌티바이러스 벡터는, 다양한 경우에, 인간 PAH 유전자 및 PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 PAH shRNA 서열 #2 (SEQ ID NO: 14) 를 통합시켰다. shPAH-2 발현을 조절하기 위해 사용되는 프로모터에 상보적인 프라이머를 사용하여 DNA 서열분석에 의해 렌티바이러스 벡터 (LV) 내의 shRNA 서열의 삽입을 확인했다. 이 경우에, H1 프로모터를 사용하여 PAH shRNA 발현을 조절했다. shPAH-(PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 PAH shRNA 서열 # 2 (SEQ ID NO: 14))-에 대한 표적 서열은 LV-PAH 벡터에 존재하지 않는 PAH 3'UTR 에 있다.
도 15 에서 보여지는 바와 같이, 렌티바이러스에서 유래하는 PAH 의 발현은 PAH shRNA 서열 #1 (SEQ ID NO: 13) 또는 PAH shRNA 서열 # 2 (SEQ ID NO: 14) 로 억제되지 않는다.
서열 목록
SEQUENCE LISTING
<110> American Gene Technologies International Inc.
<120> VECTORS WITH PROMOTER AND ENHANCER COMBINATIONS FOR TREATING
PHENYLKETONURIA
<130> 70612.02516
<140> PCT/US18/53919
<141> 2018-10-02
<150> US 62/566,979
<151> 2017-10-02
<160> 71
<170> Notepad
<210> 1
<211> 1359
<212> DNA
<213> Artificial Sequence
<220>
<223> PAH
<400> 1
atgtccactg cggtcctgga aaacccaggc ttgggcagga aactctctga ctttggacag 60
gaaacaagct atattgaaga caactgcaat caaaatggtg ccatatcact gatcttctca 120
ctcaaagaag aagttggtgc attggccaaa gtattgcgct tatttgagga gaatgatgta 180
aacctgaccc acattgaatc tagaccttct cgtttaaaga aagatgagta tgaatttttc 240
acccatttgg ataaacgtag cctgcctgct ctgacaaaca tcatcaagat cttgaggcat 300
gacattggtg ccactgtcca tgagctttca cgagataaga agaaagacac agtgccctgg 360
ttcccaagaa ccattcaaga gctggacaga tttgccaatc agattctcag ctatggagcg 420
gaactggatg ctgaccaccc tggttttaaa gatcctgtgt accgtgcaag acggaagcag 480
tttgctgaca ttgcctacaa ctaccgccat gggcagccca tccctcgagt ggaatacatg 540
gaggaagaaa agaaaacatg gggcacagtg ttcaagactc tgaagtcctt gtataaaacc 600
catgcttgct atgagtacaa tcacattttt ccacttcttg aaaagtactg tggcttccat 660
gaagataaca ttccccagct ggaagacgtt tctcaattcc tgcagacttg cactggtttc 720
cgcctccgac ctgtggctgg cctgctttcc tctcgggatt tcttgggtgg cctggccttc 780
cgagtcttcc actgcacaca gtacatcaga catggatcca agcccatgta tacccccgaa 840
cctgacatct gccatgagct gttgggacat gtgcccttgt tttcagatcg cagctttgcc 900
cagttttccc aggaaattgg ccttgcctct ctgggtgcac ctgatgaata cattgaaaag 960
ctcgccacaa tttactggtt tactgtggag tttgggctct gcaaacaagg agactccata 1020
aaggcatatg gtgctgggct cctgtcatcc tttggtgaat tacagtactg cttatcagag 1080
aagccaaagc ttctccccct ggagctggag aagacagcca tccaaaatta cactgtcacg 1140
gagttccagc ccctgtatta cgtggcagag agttttaatg atgccaagga gaaagtaagg 1200
aactttgctg ccacaatacc tcggcccttc tcagttcgct acgacccata cacccaaagg 1260
attgaggtct tggacaatac ccagcagctt aagattttgg ctgattccat taacagtgaa 1320
attggaatcc tttgcagtgc cctccagaaa ataaagtaa 1359
<210> 2
<211> 1359
<212> DNA
<213> Artificial Sequence
<220>
<223> Codon optimized PAH (Opt2)
<400> 2
atgagtacgg ctgtgctcga gaatccaggt ttgggccgaa agctgtctga ttttggacag 60
gagacatctt atattgaaga caactgcaac cagaatggtg cgatatccct tattttttct 120
ctgaaagaag aagtaggtgc gctggcaaag gtcttgcggc tgtttgaaga gaacgatgtt 180
aatcttactc atattgagtc cagaccatca cggctgaaaa aagacgagta cgaatttttt 240
actcacttgg acaaacgaag cttgccggct cttactaata tcattaagat cctccggcat 300
gacatagggg cgacagtgca tgagctttca agggataaaa agaaagatac cgtcccctgg 360
tttccaagga ccatacaaga actcgaccga ttcgcgaacc agatcctttc atatggtgct 420
gagttggatg ctgaccaccc cggcttcaaa gacccggtct accgagcgcg gcggaaacaa 480
tttgctgaca tcgcatacaa ttacaggcat ggccagccaa ttcctagagt agaatacatg 540
gaagaagaga aaaaaacctg gggtaccgtc ttcaagacgc tgaaatcatt gtataaaact 600
catgcatgtt acgaatataa ccatattttt ccgttgctcg agaaatattg cgggttccac 660
gaagataaca tcccacaact cgaggatgta tctcagttcc tccagacctg tacggggttt 720
cgacttaggc ctgtcgcggg tttgctcagt tctcgagact tcctgggtgg attggcgttt 780
cgggtattcc attgcacgca gtatatccga cacggaagta agccaatgta cacgccagaa 840
cccgatatct gtcacgaatt gcttggacac gttcctctgt tttctgatcg atcattcgct 900
cagttttcac aggaaatcgg cctggcatct ttgggagcgc cggatgaata tattgagaag 960
ctcgctacaa tttactggtt cacggtagaa tttgggttgt gcaagcaggg tgatagtatt 1020
aaagcatacg gtgcgggatt gctgtcctca ttcggggagc ttcagtattg cctgtccgag 1080
aaacccaagc tgttgccgtt ggaattggaa aaaaccgcta tccaaaatta cacagtaacg 1140
gagttccaac ctttgtacta cgtagccgag tcatttaacg atgcaaagga gaaggtcaga 1200
aattttgctg cgacgatacc cagaccgttc tcagtaaggt acgatcctta cactcagagg 1260
attgaagtcc tggataatac gcaacagctc aagatcctgg cagactccat aaattctgaa 1320
atcggcatct tgtgttcagc actgcaaaag ataaaataa 1359
<210> 3
<211> 897
<212> DNA
<213> Artificial Sequence
<220>
<223> PAH 3'UTR sequence (897 nucleotides)
<400> 3
agccatggac agaatgtggt ctgtcagctg tgaatctgtt gatggagatc caactatttc 60
tttcatcaga aaaagtccga aaagcaaacc ttaatttgaa ataacagcct taaatccttt 120
acaagatgga gaaacaacaa ataagtcaaa ataatctgaa atgacaggat atgagtacat 180
actcaagagc ataatggtaa atcttttggg gtcatctttg atttagagat gataatccca 240
tactctcaat tgagttaaat cagtaatctg tcgcatttca tcaagattaa ttaaaatttg 300
ggacctgctt cattcaagct tcatatatgc tttgcagaga actcataaag gagcatataa 360
ggctaaatgt aaaacccaag actgtcatta gaattgaatt attgggctta atataaatcg 420
taacctatga agtttatttt ttattttagt taactatgat tccaattact actttgttat 480
tgtacctaag taaattttct ttaagtcaga agcccattaa aatagttaca agcattgaac 540
ttctttagta ttatattaat ataaaaacat ttttgtatgt tttattgtaa tcataaatac 600
tgctgtataa ggtaataaaa ctctgcacct aatccccata acttccagta tcattttcca 660
attaattatc aagtctgttt tgggaaacac tttgaggaca tttatgatgc agcagatgtt 720
gactaaaggc ttggttggta gatattcagg aaatgttcac tgaataaata agtaaataca 780
ttattgaaaa gcaaatctgt ataaatgtga aatttttatt tgtattagta ataaaacatt 840
agtagtttaa acaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaactcgact ctagatt 897
<210> 4
<211> 289
<212> DNA
<213> Artificial Sequence
<220>
<223> PAH 3'UTR sequence (289 nucleotides)
<400> 4
agccatggac agaatgtggt ctgtcagctg tgaatctgtt gatggagatc caactatttc 60
tttcatcaga aaaagtccga aaagcaaacc ttaatttgaa ataacagcct taaatccttt 120
acaagatgga gaaacaacaa ataagtcaaa ataatctgaa atgacaggat atgagtacat 180
actcaagagc ataatggtaa atcttttggg gtcatctttg atttagagat gataatccca 240
tactctcaat tgagttaaat cagtaatctg tcgcatttca tcaagatta 289
<210> 5
<211> 120
<212> DNA
<213> Artificial Sequence
<220>
<223> Prothrombin enhancer (Pro)
<400> 5
gcgagaactt gtgcctcccc gtgttcctgc tctttgtccc tctgtcctac ttagactaat 60
atttgccttg ggtactgcaa acaggaaatg ggggagggac aggagtaggg cggagggtag 120
<210> 6
<211> 397
<212> DNA
<213> Artificial Sequence
<220>
<223> Human alpha-1 antitrypsin promoter (hAAT)
<400> 6
gatcttgcta ccagtggaac agccactaag gattctgcag tgagagcaga gggccagcta 60
agtggtactc tcccagagac tgtctgactc acgccacccc ctccaccttg gacacaggac 120
gctgtggttt ctgagccagg tacaatgact cctttcggta agtgcagtgg aagctgtaca 180
ctgcccaggc aaagcgtccg ggcagcgtag gcgggcgact cagatcccag ccagtggact 240
tagcccctgt ttgctcctcc gataactggg gtgaccttgg ttaatattca ccagcagcct 300
cccccgttgc ccctctggat ccactgctta aatacggacg aggacagggc cctgtctcct 360
cagcttcagg caccaccact gacctgggac agtgaat 397
<210> 7
<211> 573
<212> DNA
<213> Artificial Sequence
<220>
<223> Rabbit beta globin intron
<400> 7
gtgagtttgg ggacccttga ttgttctttc tttttcgcta ttgtaaaatt catgttatat 60
ggagggggca aagttttcag ggtgttgttt agaatgggaa gatgtccctt gtatcaccat 120
ggaccctcat gataattttg tttctttcac tttctactct gttgacaacc attgtctcct 180
cttattttct tttcattttc tgtaactttt tcgttaaact ttagcttgca tttgtaacga 240
atttttaaat tcacttttgt ttatttgtca gattgtaagt actttctcta atcacttttt 300
tttcaaggca atcagggtat attatattgt acttcagcac agttttagag aacaattgtt 360
ataattaaat gataaggtag aatatttctg catataaatt ctggctggcg tggaaatatt 420
cttattggta gaaacaacta caccctggtc atcatcctgc ctttctcttt atggttacaa 480
tgatatacac tgtttgagat gaggataaaa tactctgagt ccaaaccggg cccctctgct 540
aaccatgttc atgccttctt ctctttccta cag 573
<210> 8
<211> 544
<212> DNA
<213> Artificial Sequence
<220>
<223> Human beta globin intron
<400> 8
ggatcctgag aacttcaggg tgagtctatg ggacgcttga tgttttcttt ccccttcttt 60
tctatggtta agttcatgtc ataggaaggg gataagtaac agggtacaca tattgaccaa 120
atcagggtaa ttttgcattt gtaattttaa aaaatgcttt cttcttttaa tatacttttt 180
tgtttatctt atttctaata ctttccctaa tctctttctt tcagggcaat aatgatacaa 240
tgtatcatgc ctctttgcac cattctaaag aataacagtg ataatttctg ggttaaggca 300
atagcaatat ttctgcatat aaatatttct gcatataaat tgtaactgat gtaagaggtt 360
tcatattgct aatagcagct acaatccagc taccattctg cttttatttt atggttggga 420
taaggctgga ttattctgag tccaagctag gcccttttgc taatcatgtt catacctctt 480
atcttcctcc cacagctcct gggcaacgtg ctggtctgtg tgctggccca tcactttggc 540
aaag 544
<210> 9
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> 1X Hepatocyte Nuclear Factor 1 (1XHNF1)
<400> 9
gttaatcatt aac 13
<210> 10
<211> 65
<212> DNA
<213> Artificial Sequence
<220>
<223> 5X Hepatocyte Nuclear Factor 1 (5XHNF1)
<400> 10
gttaatcatt aacgttaatc attaacgtta atcattaacg ttaatcatta acgttaatca 60
ttaac 65
<210> 11
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> 1X Hepatocyte Nuclear Factor 1/4 (1XHNF1/4)
<400> 11
gttaatcatt aacgcttgta ctttggtaca 30
<210> 12
<211> 90
<212> DNA
<213> Artificial sequence
<220>
<223> 3X Hepatocyte Nuclear Factor 1/4 (3XHNF1/4)
<400> 12
gttaatcatt aacgcttgta ctttggtaca gttaatcatt aacgcttgta ctttggtaca 60
gttaatcatt aacgcttgta ctttggtaca 90
<210> 13
<211> 53
<212> DNA
<213> Artificial sequence
<220>
<223> PAH shRNA sequence #1
<400> 13
tcgcatttca tcaagattaa tctcgagatt aatcttgatg aaatgcgatt ttt 53
<210> 14
<211> 53
<212> DNA
<213> Artificial sequence
<220>
<223> PAH shRNA sequence #2
<400> 14
actcataaag gagcatataa gctcgagctt atatgctcct ttatgagttt ttt 53
<210> 15
<211> 228
<212> DNA
<213> Artificial sequence
<220>
<223> Rous Sarcoma virus (RSV) promoter
<400> 15
gtagtcttat gcaatactct tgtagtcttg caacatggta acgatgagtt agcaacatgc 60
cttacaagga gagaaaaagc accgtgcatg ccgattggtg gaagtaaggt ggtacgatcg 120
tgccttatta ggaaggcaac agacgggtct gacatggatt ggacgaacca ctgaattgcc 180
gcattgcaga gatattgtat ttaagtgcct agctcgatac aataaacg 228
<210> 16
<211> 180
<212> DNA
<213> Artificial sequence
<220>
<223> 5' Long terminal repeat (LTR)
<400> 16
ggtctctctg gttagaccag atctgagcct gggagctctc tggctaacta gggaacccac 60
tgcttaagcc tcaataaagc ttgccttgag tgcttcaagt agtgtgtgcc cgtctgttgt 120
gtgactctgg taactagaga tccctcagac ccttttagtc agtgtggaaa atctctagca 180
<210> 17
<211> 41
<212> DNA
<213> Artificial sequence
<220>
<223> Psi Packaging signal
<400> 17
tacgccaaaa attttgacta gcggaggcta gaaggagaga g 41
<210> 18
<211> 233
<212> DNA
<213> Artificial sequence
<220>
<223> Rev response element (RRE)
<400> 18
aggagctttg ttccttgggt tcttgggagc agcaggaagc actatgggcg cagcctcaat 60
gacgctgacg gtacaggcca gacaattatt gtctggtata gtgcagcagc agaacaattt 120
gctgagggct attgaggcgc aacagcatct gttgcaactc acagtctggg gcatcaagca 180
gctccaggca agaatcctgg ctgtggaaag atacctaaag gatcaacagc tcc 233
<210> 19
<211> 118
<212> DNA
<213> Artificial sequence
<220>
<223> Central polypurine tract (cPPT)
<400> 19
ttttaaaaga aaagggggga ttggggggta cagtgcaggg gaaagaatag tagacataat 60
agcaacagac atacaaacta aagaattaca aaaacaaatt acaaaattca aaatttta 118
<210> 20
<211> 590
<212> DNA
<213> Artificial sequence
<220>
<223> Long WPRE sequence
<400> 20
aatcaacctc tgattacaaa atttgtgaaa gattgactgg tattcttaac tatgttgctc 60
cttttacgct atgtggatac gctgctttaa tgcctttgta tcatgctatt gcttcccgta 120
tggctttcat tttctcctcc ttgtataaat cctggttgct gtctctttat gaggagttgt 180
ggcccgttgt caggcaacgt ggcgtggtgt gcactgtgtt tgctgacgca acccccactg 240
gttggggcat tgccaccacc tgtcagctcc tttccgggac tttcgctttc cccctcccta 300
ttgccacggc ggaactcatc gccgcctgcc ttgcccgctg ctggacaggg gctcggctgt 360
tgggcactga caattccgtg gtgttgtcgg ggaaatcatc gtcctttcct tggctgctcg 420
cctgtgttgc cacctggatt ctgcgcggga cgtccttctg ctacgtccct tcggccctca 480
atccagcgga ccttccttcc cgcggcctgc tgccggctct gcggcctctt ccgcgtcttc 540
gccttcgccc tcagacgagt cggatctccc tttgggccgc ctccccgcct 590
<210> 21
<211> 250
<212> DNA
<213> Artificial sequence
<220>
<223> delta U3 3'LTR
<400> 21
tggaagggct aattcactcc caacgaagat aagatctgct ttttgcttgt actgggtctc 60
tctggttaga ccagatctga gcctgggagc tctctggcta actagggaac ccactgctta 120
agcctcaata aagcttgcct tgagtgcttc aagtagtgtg tgcccgtctg ttgtgtgact 180
ctggtaacta gagatccctc agaccctttt agtcagtgtg gaaaatctct agcagtagta 240
gttcatgtca 250
<210> 22
<211> 217
<212> DNA
<213> Artificial sequence
<220>
<223> H1 Promoter
<400> 22
gaacgctgac gtcatcaacc cgctccaagg aatcgcgggc ccagtgtcac taggcgggaa 60
cacccagcgc gcgtgcgccc tggcaggaag atggctgtga gggacagggg agtggcgccc 120
tgcaatattt gcatgtcgct atgtgttctg ggaaatcacc ataaacgtga aatgtctttg 180
gatttgggaa tcttataagt tctgtatgag accactt 217
<210> 23
<211> 642
<212> DNA
<213> Artificial sequence
<220>
<223> CMV enhancer/chicken beta actin promoter
<400> 23
tagttattaa tagtaatcaa ttacggggtc attagttcat agcccatata tggagttccg 60
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 120
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca 180
atgggtggac tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc 240
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta 300
catgacctta tgggactttc ctacttggca gtacatctac gtattagtca tcgctattac 360
catgggtcga ggtgagcccc acgttctgct tcactctccc catctccccc ccctccccac 420
ccccaatttt gtatttattt attttttaat tattttgtgc agcgatgggg gcgggggggg 480
ggggggcgcg cgccaggcgg ggcggggcgg ggcgaggggc ggggcggggc gaggcggaga 540
ggtgcggcgg cagccaatca gagcggcgcg ctccgaaagt ttccttttat ggcgaggcgg 600
cggcggcggc ggccctataa aaagcgaagc gcgcggcggg cg 642
<210> 24
<211> 1503
<212> DNA
<213> Artificial sequence
<220>
<223> HIV Gag
<400> 24
atgggtgcga gagcgtcagt attaagcggg ggagaattag atcgatggga aaaaattcgg 60
ttaaggccag ggggaaagaa aaaatataaa ttaaaacata tagtatgggc aagcagggag 120
ctagaacgat tcgcagttaa tcctggcctg ttagaaacat cagaaggctg tagacaaata 180
ctgggacagc tacaaccatc ccttcagaca ggatcagaag aacttagatc attatataat 240
acagtagcaa ccctctattg tgtgcatcaa aggatagaga taaaagacac caaggaagct 300
ttagacaaga tagaggaaga gcaaaacaaa agtaagaaaa aagcacagca agcagcagct 360
gacacaggac acagcaatca ggtcagccaa aattacccta tagtgcagaa catccagggg 420
caaatggtac atcaggccat atcacctaga actttaaatg catgggtaaa agtagtagaa 480
gagaaggctt tcagcccaga agtgataccc atgttttcag cattatcaga aggagccacc 540
ccacaagatt taaacaccat gctaaacaca gtggggggac atcaagcagc catgcaaatg 600
ttaaaagaga ccatcaatga ggaagctgca gaatgggata gagtgcatcc agtgcatgca 660
gggcctattg caccaggcca gatgagagaa ccaaggggaa gtgacatagc aggaactact 720
agtacccttc aggaacaaat aggatggatg acacataatc cacctatccc agtaggagaa 780
atctataaaa gatggataat cctgggatta aataaaatag taagaatgta tagccctacc 840
agcattctgg acataagaca aggaccaaag gaacccttta gagactatgt agaccgattc 900
tataaaactc taagagccga gcaagcttca caagaggtaa aaaattggat gacagaaacc 960
ttgttggtcc aaaatgcgaa cccagattgt aagactattt taaaagcatt gggaccagga 1020
gcgacactag aagaaatgat gacagcatgt cagggagtgg ggggacccgg ccataaagca 1080
agagttttgg ctgaagcaat gagccaagta acaaatccag ctaccataat gatacagaaa 1140
ggcaatttta ggaaccaaag aaagactgtt aagtgtttca attgtggcaa agaagggcac 1200
atagccaaaa attgcagggc ccctaggaaa aagggctgtt ggaaatgtgg aaaggaagga 1260
caccaaatga aagattgtac tgagagacag gctaattttt tagggaagat ctggccttcc 1320
cacaagggaa ggccagggaa ttttcttcag agcagaccag agccaacagc cccaccagaa 1380
gagagcttca ggtttgggga agagacaaca actccctctc agaagcagga gccgatagac 1440
aaggaactgt atcctttagc ttccctcaga tcactctttg gcagcgaccc ctcgtcacaa 1500
taa 1503
<210> 25
<211> 1872
<212> DNA
<213> Artificial sequence
<220>
<223> HIV Pol
<400> 25
atgaatttgc caggaagatg gaaaccaaaa atgatagggg gaattggagg ttttatcaaa 60
gtaggacagt atgatcagat actcatagaa atctgcggac ataaagctat aggtacagta 120
ttagtaggac ctacacctgt caacataatt ggaagaaatc tgttgactca gattggctgc 180
actttaaatt ttcccattag tcctattgag actgtaccag taaaattaaa gccaggaatg 240
gatggcccaa aagttaaaca atggccattg acagaagaaa aaataaaagc attagtagaa 300
atttgtacag aaatggaaaa ggaaggaaaa atttcaaaaa ttgggcctga aaatccatac 360
aatactccag tatttgccat aaagaaaaaa gacagtacta aatggagaaa attagtagat 420
ttcagagaac ttaataagag aactcaagat ttctgggaag ttcaattagg aataccacat 480
cctgcagggt taaaacagaa aaaatcagta acagtactgg atgtgggcga tgcatatttt 540
tcagttccct tagataaaga cttcaggaag tatactgcat ttaccatacc tagtataaac 600
aatgagacac cagggattag atatcagtac aatgtgcttc cacagggatg gaaaggatca 660
ccagcaatat tccagtgtag catgacaaaa atcttagagc cttttagaaa acaaaatcca 720
gacatagtca tctatcaata catggatgat ttgtatgtag gatctgactt agaaataggg 780
cagcatagaa caaaaataga ggaactgaga caacatctgt tgaggtgggg atttaccaca 840
ccagacaaaa aacatcagaa agaacctcca ttcctttgga tgggttatga actccatcct 900
gataaatgga cagtacagcc tatagtgctg ccagaaaagg acagctggac tgtcaatgac 960
atacagaaat tagtgggaaa attgaattgg gcaagtcaga tttatgcagg gattaaagta 1020
aggcaattat gtaaacttct taggggaacc aaagcactaa cagaagtagt accactaaca 1080
gaagaagcag agctagaact ggcagaaaac agggagattc taaaagaacc ggtacatgga 1140
gtgtattatg acccatcaaa agacttaata gcagaaatac agaagcaggg gcaaggccaa 1200
tggacatatc aaatttatca agagccattt aaaaatctga aaacaggaaa atatgcaaga 1260
atgaagggtg cccacactaa tgatgtgaaa caattaacag aggcagtaca aaaaatagcc 1320
acagaaagca tagtaatatg gggaaagact cctaaattta aattacccat acaaaaggaa 1380
acatgggaag catggtggac agagtattgg caagccacct ggattcctga gtgggagttt 1440
gtcaataccc ctcccttagt gaagttatgg taccagttag agaaagaacc cataatagga 1500
gcagaaactt tctatgtaga tggggcagcc aatagggaaa ctaaattagg aaaagcagga 1560
tatgtaactg acagaggaag acaaaaagtt gtccccctaa cggacacaac aaatcagaag 1620
actgagttac aagcaattca tctagctttg caggattcgg gattagaagt aaacatagtg 1680
acagactcac aatatgcatt gggaatcatt caagcacaac cagataagag tgaatcagag 1740
ttagtcagtc aaataataga gcagttaata aaaaaggaaa aagtctacct ggcatgggta 1800
ccagcacaca aaggaattgg aggaaatgaa caagtagatg ggttggtcag tgctggaatc 1860
aggaaagtac ta 1872
<210> 26
<211> 867
<212> DNA
<213> Artificial sequence
<220>
<223> HIV Int
<400> 26
tttttagatg gaatagataa ggcccaagaa gaacatgaga aatatcacag taattggaga 60
gcaatggcta gtgattttaa cctaccacct gtagtagcaa aagaaatagt agccagctgt 120
gataaatgtc agctaaaagg ggaagccatg catggacaag tagactgtag cccaggaata 180
tggcagctag attgtacaca tttagaagga aaagttatct tggtagcagt tcatgtagcc 240
agtggatata tagaagcaga agtaattcca gcagagacag ggcaagaaac agcatacttc 300
ctcttaaaat tagcaggaag atggccagta aaaacagtac atacagacaa tggcagcaat 360
ttcaccagta ctacagttaa ggccgcctgt tggtgggcgg ggatcaagca ggaatttggc 420
attccctaca atccccaaag tcaaggagta atagaatcta tgaataaaga attaaagaaa 480
attataggac aggtaagaga tcaggctgaa catcttaaga cagcagtaca aatggcagta 540
ttcatccaca attttaaaag aaaagggggg attggggggt acagtgcagg ggaaagaata 600
gtagacataa tagcaacaga catacaaact aaagaattac aaaaacaaat tacaaaaatt 660
caaaattttc gggtttatta cagggacagc agagatccag tttggaaagg accagcaaag 720
ctcctctgga aaggtgaagg ggcagtagta atacaagata atagtgacat aaaagtagtg 780
ccaagaagaa aagcaaagat catcagggat tatggaaaac agatggcagg tgatgattgt 840
gtggcaagta gacaggatga ggattaa 867
<210> 27
<211> 234
<212> DNA
<213> Artificial sequence
<220>
<223> HIV RRE
<400> 27
aggagctttg ttccttgggt tcttgggagc agcaggaagc actatgggcg cagcgtcaat 60
gacgctgacg gtacaggcca gacaattatt gtctggtata gtgcagcagc agaacaattt 120
gctgagggct attgaggcgc aacagcatct gttgcaactc acagtctggg gcatcaagca 180
gctccaggca agaatcctgg ctgtggaaag atacctaaag gatcaacagc tcct 234
<210> 28
<211> 351
<212> DNA
<213> Artificial sequence
<220>
<223> HIV Rev
<400> 28
atggcaggaa gaagcggaga cagcgacgaa gaactcctca aggcagtcag actcatcaag 60
tttctctatc aaagcaaccc acctcccaat cccgagggga cccgacaggc ccgaaggaat 120
agaagaagaa ggtggagaga gagacagaga cagatccatt cgattagtga acggatcctt 180
agcacttatc tgggacgatc tgcggagcct gtgcctcttc agctaccacc gcttgagaga 240
cttactcttg attgtaacga ggattgtgga acttctggga cgcagggggt gggaagccct 300
caaatattgg tggaatctcc tacaatattg gagtcaggag ctaaagaata g 351
<210> 29
<211> 615
<212> DNA
<213> Artificial sequence
<220>
<223> CMV Promoter
<400> 29
acattgatta ttgactagtt attaatagta atcaattacg gggtcattag ttcatagccc 60
atatatggag ttccgcgtta cataacttac ggtaaatggc ccgcctggct gaccgcccaa 120
cgacccccgc ccattgacgt caataatgac gtatgttccc atagtaacgc caatagggac 180
tttccattga cgtcaatggg tggagtattt acggtaaact gcccacttgg cagtacatca 240
agtgtatcat atgccaagta cgccccctat tgacgtcaat gacggtaaat ggcccgcctg 300
gcattatgcc cagtacatga ccttatggga ctttcctact tggcagtaca tctacgtatt 360
agtcatcgct attaccatgg tgatgcggtt ttggcagtac atcaatgggc gtggatagcg 420
gtttgactca cggggatttc caagtctcca ccccattgac gtcaatggga gtttgttttg 480
gcaccaaaat caacgggact ttccaaaatg tcgtaacaac tccgccccat tgacgcaaat 540
gggcggtagg cgtgtacggt gggaggtcta tataagcaga gctctctggc taactagaga 600
acccactgct tactg 615
<210> 30
<211> 1536
<212> DNA
<213> Artificial sequence
<220>
<223> VSV-G Envelope Glycoprotein
<400> 30
atgaagtgcc ttttgtactt agccttttta ttcattgggg tgaattgcaa gttcaccata 60
gtttttccac acaaccaaaa aggaaactgg aaaaatgttc cttctaatta ccattattgc 120
ccgtcaagct cagatttaaa ttggcataat gacttaatag gcacagcctt acaagtcaaa 180
atgcccaaga gtcacaaggc tattcaagca gacggttgga tgtgtcatgc ttccaaatgg 240
gtcactactt gtgatttccg ctggtatgga ccgaagtata taacacattc catccgatcc 300
ttcactccat ctgtagaaca atgcaaggaa agcattgaac aaacgaaaca aggaacttgg 360
ctgaatccag gcttccctcc tcaaagttgt ggatatgcaa ctgtgacgga tgccgaagca 420
gtgattgtcc aggtgactcc tcaccatgtg ctggttgatg aatacacagg agaatgggtt 480
gattcacagt tcatcaacgg aaaatgcagc aattacatat gccccactgt ccataactct 540
acaacctggc attctgacta taaggtcaaa gggctatgtg attctaacct catttccatg 600
gacatcacct tcttctcaga ggacggagag ctatcatccc tgggaaagga gggcacaggg 660
ttcagaagta actactttgc ttatgaaact ggaggcaagg cctgcaaaat gcaatactgc 720
aagcattggg gagtcagact cccatcaggt gtctggttcg agatggctga taaggatctc 780
tttgctgcag ccagattccc tgaatgccca gaagggtcaa gtatctctgc tccatctcag 840
acctcagtgg atgtaagtct aattcaggac gttgagagga tcttggatta ttccctctgc 900
caagaaacct ggagcaaaat cagagcgggt cttccaatct ctccagtgga tctcagctat 960
cttgctccta aaaacccagg aaccggtcct gctttcacca taatcaatgg taccctaaaa 1020
tactttgaga ccagatacat cagagtcgat attgctgctc caatcctctc aagaatggtc 1080
ggaatgatca gtggaactac cacagaaagg gaactgtggg atgactgggc accatatgaa 1140
gacgtggaaa ttggacccaa tggagttctg aggaccagtt caggatataa gtttccttta 1200
tacatgattg gacatggtat gttggactcc gatcttcatc ttagctcaaa ggctcaggtg 1260
ttcgaacatc ctcacattca agacgctgct tcgcaacttc ctgatgatga gagtttattt 1320
tttggtgata ctgggctatc caaaaatcca atcgagcttg tagaaggttg gttcagtagt 1380
tggaaaagct ctattgcctc ttttttcttt atcatagggt taatcattgg actattcttg 1440
gttctccgag ttggtatcca tctttgcatt aaattaaagc acaccaagaa aagacagatt 1500
tatacagaca tagagatgaa ccgacttgga aagtga 1536
<210> 31
<211> 141
<212> DNA
<213> Artificial sequence
<220>
<223> Left ITR
<400> 31
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc 60
gggcgacctt tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggcca 120
actccatcac taggggttcc t 141
<210> 32
<211> 228
<212> DNA
<213> Artificial sequence
<220>
<223> PolyA
<400> 32
gactgtgcct tctagttgcc agccatctgt tgtttgcccc tcccccgtgc cttccttgac 60
cctggaaggt gccactccca ctgtcctttc ctaataaaat gaggaaattg catcgcattg 120
tctgagtagg tgtcattcta ttctgggggg tggggtgggg caggacagca agggggagga 180
ttgggaagac aatagcaggc atgctgggga tgcggtgggc tctatggc 228
<210> 33
<211> 141
<212> DNA
<213> Artificial sequence
<220>
<223> Right ITR
<400> 33
aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg 60
ccgggcgacc aaaggtcgcc cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc 120
gagcgcgcag ctgcctgcag g 141
<210> 34
<211> 1470
<212> DNA
<213> Artificial sequence
<220>
<223> E2A
<400> 34
ttaaaagtcg aaggggttct cgcgctcgtc gttgtgcgcc gcgctgggga gggccacgtt 60
gcggaactgg tacttgggct gccacttgaa ctcggggatc accagtttgg gcactggggt 120
ctcggggaag gtctcgctcc acatgcgccg gctcatctgc agggcgccca gcatgtcagg 180
cgcggagatc ttgaaatcgc agttggggcc ggtgctctgc gcgcgcgagt tgcggtacac 240
tgggttgcag cactggaaca ccatcagact ggggtacttc acactagcca gcacgctctt 300
gtcgctgatc tgatccttgt ccaggtcctc ggcgttgctc aggccgaacg gggtcatctt 360
gcacagctgg cggcccagga agggcacgct ctgaggcttg tggttacact cgcagtgcac 420
gggcatcagc atcatccccg cgccgcgctg catattcggg tagagggcct tgacgaaggc 480
cgcgatctgc ttgaaagctt gctgggcctt ggccccctcg ctgaaaaaca ggccgcagct 540
cttcccgctg aactgattat tcccgcaccc ggcatcatgg acgcagcagc gcgcgtcatg 600
gctggtcagt tgcaccacgc tccgtcccca gcggttctgg gtcaccttgg ccttgctggg 660
ttgctccttc agcgcacgct gcccgttctc actggtcaca tccatctcca ccacgtggtc 720
cttgtggatc atcaccgtcc catgcagaca cttgagctgg ccttccacct cggtgcagcc 780
gtggtcccac agggcactgc cggtgcactc ccagttcttg tgcgcgatcc cgctgtggct 840
gaagatgtaa ccttgcaaca ggcgacccat gatggtgcta aagctcttct gggtggtgaa 900
ggtcagttgc agaccgcggg cctcctcgtt catccaggtc tggcacatct tttggaagat 960
ctcggtctgc tcgggcatga gcttgtaagc atcgcgcagg ccgctgtcga cgcggtagcg 1020
ttccatcagc acattcatgg tatccatgcc cttctcccag gacgagacca gaggcagact 1080
cagggggttg cgcacgttca ggacaccggg ggtcgcgggc tcgacgatgc gttttccgtc 1140
cttgccttcc ttcaacagaa ccggcggctg gctgaatccc actcccacga tcacggcttc 1200
ttcctggggc atctcttcgt ctgggtctac cttggtcaca tgcttggtct ttctggcttg 1260
cttctttttt ggagggctgt ccacggggac cacgtcctcc tcggaagacc cggatcccac 1320
ccgctgatac tttcggcgct tggttggcag aggaggtggc ggcgaggggc tcctctcctg 1380
ctccggcgga tagcgcgctg aaccgtggcc ccggggcgga gtggcctctc ggtccatgaa 1440
ccggcgcacg tcctgactgc cgccggccat 1470
<210> 35
<211> 393
<212> DNA
<213> Artificial sequence
<220>
<223> E4
<400> 35
tcatgtatct ttattgattt ttacaccagc acgggtagtc agtctcccac caccagccca 60
tttcacagtg taaacaattc tctcagcacg ggtggcctta aatagggcaa tattctgatt 120
agtgcgggaa ctggacttgg ggtctataat ccacacagtt tcctggcgag ccaaacgggg 180
gtcggtgatt gagatgaagc cgtcctctga aaagtcatcc aagcgagcct cacagtccaa 240
ggtcacagta ttatgataat ctgcatgatc acaatcgggc aacaggggat gttgttcagt 300
cagtgaagcc ctggtttcct catcagatcg tggtaaacgg gccctgcgat atggatgatg 360
gcggagcgag ctggattgaa tctcggtttg cat 393
<210> 36
<211> 162
<212> DNA
<213> Artificial sequence
<220>
<223> VA RNA
<400> 36
agcgggcact cttccgtggt ctggtggata aattcgcaag ggtatcatgg cggacgaccg 60
gggttcgagc cccgtatccg gccgtccgcc gtgatccatg cggttaccgc ccgcgtgtcg 120
aacccaggtg tgcgacgtca gacaacgggg gagtgctcct tt 162
<210> 37
<211> 2208
<212> DNA
<213> Artificial sequence
<220>
<223> AAV2 Rep
<400> 37
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgcggagttt 300
caggagcgcc ttaaagaaga tacgtctttt gggggcaacc tcggacgagc agtcttccag 360
gcgaaaaaga gggttcttga acctctgggc ctggttgagg aacctgttaa gacggctccg 420
ggaaaaaaga ggccggtaga gcactctcct gtggagccag actcctcctc gggaaccgga 480
aaggcgggcc agcagcctgc aagaaaaaga ttgaattttg gtcagactgg agacgcagac 540
tcagtacctg acccccagcc tctcggacag ccaccagcag ccccctctgg tctgggaact 600
aatacgatgg ctacaggcag tggcgcacca atggcagaca ataacgaggg cgccgacgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caaacaaatt 780
tccagccaat caggagcctc gaacgacaat cactactttg gctacagcac cccttggggg 840
tattttgact tcaacagatt ccactgccac ttttcaccac gtgactggca aagactcatc 900
aacaacaact ggggattccg acccaagaga ctcaacttca agctctttaa cattcaagtc 960
aaagaggtca cgcagaatga cggtacgacg acgattgcca ataaccttac cagcacggtt 1020
caggtgttta ctgactcgga gtaccagctc ccgtacgtcc tcggctcggc gcatcaagga 1080
tgcctcccgc cgttcccagc agacgtcttc atggtgccac agtatggata cctcaccctg 1140
aacaacggga gtcaggcagt aggacgctct tcattttact gcctggagta ctttccttct 1200
cagatgctgc gtaccggaaa caactttacc ttcagctaca cttttgagga cgttcctttc 1260
cacagcagct acgctcacag ccagagtctg gaccgtctca tgaatcctct catcgaccag 1320
tacctgtatt acttgagcag aacaaacact ccaagtggaa ccaccacgca gtcaaggctt 1380
cagttttctc aggccggagc gagtgacatt cgggaccagt ctaggaactg gcttcctgga 1440
ccctgttacc gccagcagcg agtatcaaag acatctgcgg ataacaacaa cagtgaatac 1500
tcgtggactg gagctaccaa gtaccacctc aatggcagag actctctggt gaatccgggc 1560
ccggccatgg caagccacaa ggacgatgaa gaaaagtttt ttcctcagag cggggttctc 1620
atctttggga agcaaggctc agagaaaaca aatgtggaca ttgaaaaggt catgattaca 1680
gacgaagagg aaatcaggac aaccaatccc gtggctacgg agcagtatgg ttctgtatct 1740
accaacctcc agagaggcaa cagacaagca gctaccgcag atgtcaacac acaaggcgtt 1800
cttccaggca tggtctggca ggacagagat gtgtaccttc aggggcccat ctgggcaaag 1860
attccacaca cggacggaca ttttcacccc tctcccctca tgggtggatt cggacttaaa 1920
caccctcctc cacagattct catcaagaac accccggtac ctgcgaatcc ttcgaccacc 1980
ttcagtgcgg caaagtttgc ttccttcatc acacagtact ccacgggaca ggtcagcgtg 2040
gagatcgagt gggagctgca gaaggaaaac agcaaacgct ggaatcccga aattcagtac 2100
acttccaact acaacaagtc tgttaatgtg gactttactg tggacactaa tggcgtgtat 2160
tcagagcctc gccccattgg caccagatac ctgactcgta atctgtaa 2208
<210> 38
<211> 1866
<212> DNA
<213> Artificial sequence
<220>
<223> AAV2 Cap
<400> 38
atgccggggt tttacgagat tgtgattaag gtccccagcg accttgacga gcatctgccc 60
ggcatttctg acagctttgt gaactgggtg gccgagaagg aatgggagtt gccgccagat 120
tctgacatgg atctgaatct gattgagcag gcacccctga ccgtggccga gaagctgcag 180
cgcgactttc tgacggaatg gcgccgtgtg agtaaggccc cggaggccct tttctttgtg 240
caatttgaga agggagagag ctacttccac atgcacgtgc tcgtggaaac caccggggtg 300
aaatccatgg ttttgggacg tttcctgagt cagattcgcg aaaaactgat tcagagaatt 360
taccgcggga tcgagccgac tttgccaaac tggttcgcgg tcacaaagac cagaaatggc 420
gccggaggcg ggaacaaggt ggtggatgag tgctacatcc ccaattactt gctccccaaa 480
acccagcctg agctccagtg ggcgtggact aatatggaac agtatttaag cgcctgtttg 540
aatctcacgg agcgtaaacg gttggtggcg cagcatctga cgcacgtgtc gcagacgcag 600
gagcagaaca aagagaatca gaatcccaat tctgatgcgc cggtgatcag atcaaaaact 660
tcagccaggt acatggagct ggtcgggtgg ctcgtggaca aggggattac ctcggagaag 720
cagtggatcc aggaggacca ggcctcatac atctccttca atgcggcctc caactcgcgg 780
tcccaaatca aggctgcctt ggacaatgcg ggaaagatta tgagcctgac taaaaccgcc 840
cccgactacc tggtgggcca gcagcccgtg gaggacattt ccagcaatcg gatttataaa 900
attttggaac taaacgggta cgatccccaa tatgcggctt ccgtctttct gggatgggcc 960
acgaaaaagt tcggcaagag gaacaccatc tggctgtttg ggcctgcaac taccgggaag 1020
accaacatcg cggaggccat agcccacact gtgcccttct acgggtgcgt aaactggacc 1080
aatgagaact ttcccttcaa cgactgtgtc gacaagatgg tgatctggtg ggaggagggg 1140
aagatgaccg ccaaggtcgt ggagtcggcc aaagccattc tcggaggaag caaggtgcgc 1200
gtggaccaga aatgcaagtc ctcggcccag atagacccga ctcccgtgat cgtcacctcc 1260
aacaccaaca tgtgcgccgt gattgacggg aactcaacga ccttcgaaca ccagcagccg 1320
ttgcaagacc ggatgttcaa atttgaactc acccgccgtc tggatcatga ctttgggaag 1380
gtcaccaagc aggaagtcaa agactttttc cggtgggcaa aggatcacgt ggttgaggtg 1440
gagcatgaat tctacgtcaa aaagggtgga gccaagaaaa gacccgcccc cagtgacgca 1500
gatataagtg agcccaaacg ggtgcgcgag tcagttgcgc agccatcgac gtcagacgcg 1560
gaagcttcga tcaactacgc agacaggtac caaaacaaat gttctcgtca cgtgggcatg 1620
aatctgatgc tgtttccctg cagacaatgc gagagaatga atcagaattc aaatatctgc 1680
ttcactcacg gacagaaaga ctgtttagag tgctttcccg tgtcagaatc tcaacccgtt 1740
tctgtcgtca aaaaggcgta tcagaaactg tgctacattc atcatatcat gggaaaggtg 1800
ccagacgctt gcactgcctg cgatctggtc aatgtggatt tggatgactg catctttgaa 1860
caataa 1866
<210> 39
<211> 1608
<212> DNA
<213> Artificial sequence
<220>
<223> AAV8 Cap
<400> 39
atggctgcag gcggtggcgc accaatggca gacaataacg aaggcgccga cggagtgggt 60
agttcctcgg gaaattggca ttgcgattcc acatggctgg gcgacagagt catcaccacc 120
agcacccgaa cctgggccct gcccacctac aacaaccacc tctacaagca aatctccaac 180
gggacatcgg gaggagccac caacgacaac acctacttcg gctacagcac cccctggggg 240
tattttgact ttaacagatt ccactgccac ttttcaccac gtgactggca gcgactcatc 300
aacaacaact ggggattccg gcccaagaga ctcagcttca agctcttcaa catccaggtc 360
aaggaggtca cgcagaatga aggcaccaag accatcgcca ataacctcac cagcaccatc 420
caggtgttta cggactcgga gtaccagctg ccgtacgttc tcggctctgc ccaccagggc 480
tgcctgcctc cgttcccggc ggacgtgttc atgattcccc agtacggcta cctaacactc 540
aacaacggta gtcaggccgt gggacgctcc tccttctact gcctggaata ctttccttcg 600
cagatgctga gaaccggcaa caacttccag tttacttaca ccttcgagga cgtgcctttc 660
cacagcagct acgcccacag ccagagcttg gaccggctga tgaatcctct gattgaccag 720
tacctgtact acttgtctcg gactcaaaca acaggaggca cggcaaatac gcagactctg 780
ggcttcagcc aaggtgggcc taatacaatg gccaatcagg caaagaactg gctgccagga 840
ccctgttacc gccaacaacg cgtctcaacg acaaccgggc aaaacaacaa tagcaacttt 900
gcctggactg ctgggaccaa ataccatctg aatggaagaa attcattggc taatcctggc 960
atcgctatgg caacacacaa agacgacgag gagcgttttt ttcccagtaa cgggatcctg 1020
atttttggca aacaaaatgc tgccagagac aatgcggatt acagcgatgt catgctcacc 1080
agcgaggaag aaatcaaaac cactaaccct gtggctacag aggaatacgg tatcgtggca 1140
gataacttgc agcagcaaaa cacggctcct caaattggaa ctgtcaacag ccagggggcc 1200
ttacccggta tggtctggca gaaccgggac gtgtacctgc agggtcccat ctgggccaag 1260
attcctcaca cggacggcaa cttccacccg tctccgctga tgggcggctt tggcctgaaa 1320
catcctccgc ctcagatcct gatcaagaac acgcctgtac ctgcggatcc tccgaccacc 1380
ttcaaccagt caaagctgaa ctctttcatc acgcaataca gcaccggaca ggtcagcgtg 1440
gaaattgaat gggagctgca gaaggaaaac agcaagcgct ggaaccccga gatccagtac 1500
acctccaact actacaaatc tacaagtgtg gactttgctg ttaatacaga aggcgtgtac 1560
tctgaacccc gccccattgg cacccgttac ctcacccgta atctgtaa 1608
<210> 40
<211> 2214
<212> DNA
<213> Artificial sequence
<220>
<223> AAV DJ Cap
<400> 40
atggctgccg atggttatct tccagattgg ctcgaggaca ctctctctga aggaataaga 60
cagtggtgga agctcaaacc tggcccacca ccaccaaagc ccgcagagcg gcataaggac 120
gacagcaggg gtcttgtgct tcctgggtac aagtacctcg gacccttcaa cggactcgac 180
aagggagagc cggtcaacga ggcagacgcc gcggccctcg agcacgacaa agcctacgac 240
cggcagctcg acagcggaga caacccgtac ctcaagtaca accacgccga cgccgagttc 300
caggagcggc tcaaagaaga tacgtctttt gggggcaacc tcgggcgagc agtcttccag 360
gccaaaaaga ggcttcttga acctcttggt ctggttgagg aagcggctaa gacggctcct 420
ggaaagaaga ggcctgtaga gcactctcct gtggagccag actcctcctc gggaaccgga 480
aaggcgggcc agcagcctgc aagaaaaaga ttgaattttg gtcagactgg agacgcagac 540
tcagtcccag accctcaacc aatcggagaa cctcccgcag ccccctcagg tgtgggatct 600
cttacaatgg ctgcaggcgg tggcgcacca atggcagaca ataacgaggg cgccgacgga 660
gtgggtaatt cctcgggaaa ttggcattgc gattccacat ggatgggcga cagagtcatc 720
accaccagca cccgaacctg ggccctgccc acctacaaca accacctcta caagcaaatc 780
tccaacagca catctggagg atcttcaaat gacaacgcct acttcggcta cagcaccccc 840
tgggggtatt ttgactttaa cagattccac tgccactttt caccacgtga ctggcagcga 900
ctcatcaaca acaactgggg attccggccc aagagactca gcttcaagct cttcaacatc 960
caggtcaagg aggtcacgca gaatgaaggc accaagacca tcgccaataa cctcaccagc 1020
accatccagg tgtttacgga ctcggagtac cagctgccgt acgttctcgg ctctgcccac 1080
cagggctgcc tgcctccgtt cccggcggac gtgttcatga ttccccagta cggctaccta 1140
acactcaaca acggtagtca ggccgtggga cgctcctcct tctactgcct ggaatacttt 1200
ccttcgcaga tgctgagaac cggcaacaac ttccagttta cttacacctt cgaggacgtg 1260
cctttccaca gcagctacgc ccacagccag agcttggacc ggctgatgaa tcctctgatt 1320
gaccagtacc tgtactactt gtctcggact caaacaacag gaggcacgac aaatacgcag 1380
actctgggct tcagccaagg tgggcctaat acaatggcca atcaggcaaa gaactggctg 1440
ccaggaccct gttaccgcca gcagcgagta tcaaagacat ctgcggataa caacaacagt 1500
gaatactcgt ggactggagc taccaagtac cacctcaatg gcagagactc tctggtgaat 1560
ccgggcccgg ccatggcaag ccacaaggac gatgaagaaa agttttttcc tcagagcggg 1620
gttctcatct ttgggaagca aggctcagag aaaacaaatg tggacattga aaaggtcatg 1680
attacagacg aagaggaaat caggacaacc aatcccgtgg ctacggagca gtatggttct 1740
gtatctacca acctccagag aggcaacaga caagcagcta ccgcagatgt caacacacaa 1800
ggcgttcttc caggcatggt ctggcaggac agagatgtgt accttcaggg gcccatctgg 1860
gcaaagattc cacacacgga cggacatttt cacccctctc ccctcatggg tggattcgga 1920
cttaaacacc ctccgcctca gatcctgatc aagaacacgc ctgtacctgc ggatcctccg 1980
accaccttca accagtcaaa gctgaactct ttcatcaccc agtattctac tggccaagtc 2040
agcgtggaga tcgagtggga gctgcagaag gaaaacagca agcgctggaa ccccgagatc 2100
cagtacacct ccaactacta caaatctaca agtgtggact ttgctgttaa tacagaaggc 2160
gtgtactctg aaccccgccc cattggcacc cgttacctca cccgtaatct gtaa 2214
<210> 41
<211> 960
<212> DNA
<213> Artificial sequence
<220>
<223> Chicken beta actin intron
<400> 41
ggagtcgctg cgttgccttc gccccgtgcc ccgctccgcg ccgcctcgcg ccgcccgccc 60
cggctctgac tgaccgcgtt actcccacag gtgagcgggc gggacggccc ttctcctccg 120
ggctgtaatt agcgcttggt ttaatgacgg ctcgtttctt ttctgtggct gcgtgaaagc 180
cttaaagggc tccgggaggg ccctttgtgc gggggggagc ggctcggggg gtgcgtgcgt 240
gtgtgtgtgc gtggggagcg ccgcgtgcgg cccgcgctgc ccggcggctg tgagcgctgc 300
gggcgcggcg cggggctttg tgcgctccgc gtgtgcgcga ggggagcgcg gccgggggcg 360
gtgccccgcg gtgcgggggg gctgcgaggg gaacaaaggc tgcgtgcggg gtgtgtgcgt 420
gggggggtga gcagggggtg tgggcgcggc ggtcgggctg taaccccccc ctgcaccccc 480
ctccccgagt tgctgagcac ggcccggctt cgggtgcggg gctccgtgcg gggcgtggcg 540
cggggctcgc cgtgccgggc ggggggtggc ggcaggtggg ggtgccgggc ggggcggggc 600
cgcctcgggc cggggagggc tcgggggagg ggcgcggcgg ccccggagcg ccggcggctg 660
tcgaggcgcg gcgagccgca gccattgcct tttatggtaa tcgtgcgaga gggcgcaggg 720
acttcctttg tcccaaatct ggcggagccg aaatctggga ggcgccgccg caccccctct 780
agcgggcgcg ggcgaagcgg tgcggcgccg gcaggaagga aatgggcggg gagggccttc 840
gtgcgtcgcc gcgccgccgt ccccttctcc atctccagcc tcggggctgc cgcaggggga 900
cggctgcctt cgggggggac ggggcagggc ggggttcggc ttctggcgtg tgaccggcgg 960
<210> 42
<211> 448
<212> DNA
<213> Artificial sequence
<220>
<223> Rabbit beta globin poly A
<400> 42
agatcttttt ccctctgcca aaaattatgg ggacatcatg aagccccttg agcatctgac 60
ttctggctaa taaaggaaat ttattttcat tgcaatagtg tgttggaatt ttttgtgtct 120
ctcactcgga aggacatatg ggagggcaaa tcatttaaaa catcagaatg agtatttggt 180
ttagagtttg gcaacatatg ccatatgctg gctgccatga acaaaggtgg ctataaagag 240
gtcatcagta tatgaaacag ccccctgctg tccattcctt attccataga aaagccttga 300
cttgaggtta gatttttttt atattttgtt ttgtgttatt tttttcttta acatccctaa 360
aattttcctt acatgtttta ctagccagat ttttcctcct ctcctgacta ctcccagtca 420
tagctgtccc tcttctctta tgaagatc 448
<210> 43
<211> 31
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 43
taagcagaat tcatgaattt gccaggaaga t 31
<210> 44
<211> 36
<212> DNA
<213> Artificial sequence
<220>
<223> Primer
<400> 44
ccatacaatg aatggacact aggcggccgc acgaat 36
<210> 45
<211> 2745
<212> DNA
<213> Artificial sequence
<220>
<223> Gag, Pol, Integrase fragment
<400> 45
gaattcatga atttgccagg aagatggaaa ccaaaaatga tagggggaat tggaggtttt 60
atcaaagtaa gacagtatga tcagatactc atagaaatct gcggacataa agctataggt 120
acagtattag taggacctac acctgtcaac ataattggaa gaaatctgtt gactcagatt 180
ggctgcactt taaattttcc cattagtcct attgagactg taccagtaaa attaaagcca 240
ggaatggatg gcccaaaagt taaacaatgg ccattgacag aagaaaaaat aaaagcatta 300
gtagaaattt gtacagaaat ggaaaaggaa ggaaaaattt caaaaattgg gcctgaaaat 360
ccatacaata ctccagtatt tgccataaag aaaaaagaca gtactaaatg gagaaaatta 420
gtagatttca gagaacttaa taagagaact caagatttct gggaagttca attaggaata 480
ccacatcctg cagggttaaa acagaaaaaa tcagtaacag tactggatgt gggcgatgca 540
tatttttcag ttcccttaga taaagacttc aggaagtata ctgcatttac catacctagt 600
ataaacaatg agacaccagg gattagatat cagtacaatg tgcttccaca gggatggaaa 660
ggatcaccag caatattcca gtgtagcatg acaaaaatct tagagccttt tagaaaacaa 720
aatccagaca tagtcatcta tcaatacatg gatgatttgt atgtaggatc tgacttagaa 780
atagggcagc atagaacaaa aatagaggaa ctgagacaac atctgttgag gtggggattt 840
accacaccag acaaaaaaca tcagaaagaa cctccattcc tttggatggg ttatgaactc 900
catcctgata aatggacagt acagcctata gtgctgccag aaaaggacag ctggactgtc 960
aatgacatac agaaattagt gggaaaattg aattgggcaa gtcagattta tgcagggatt 1020
aaagtaaggc aattatgtaa acttcttagg ggaaccaaag cactaacaga agtagtacca 1080
ctaacagaag aagcagagct agaactggca gaaaacaggg agattctaaa agaaccggta 1140
catggagtgt attatgaccc atcaaaagac ttaatagcag aaatacagaa gcaggggcaa 1200
ggccaatgga catatcaaat ttatcaagag ccatttaaaa atctgaaaac aggaaagtat 1260
gcaagaatga agggtgccca cactaatgat gtgaaacaat taacagaggc agtacaaaaa 1320
atagccacag aaagcatagt aatatgggga aagactccta aatttaaatt acccatacaa 1380
aaggaaacat gggaagcatg gtggacagag tattggcaag ccacctggat tcctgagtgg 1440
gagtttgtca atacccctcc cttagtgaag ttatggtacc agttagagaa agaacccata 1500
ataggagcag aaactttcta tgtagatggg gcagccaata gggaaactaa attaggaaaa 1560
gcaggatatg taactgacag aggaagacaa aaagttgtcc ccctaacgga cacaacaaat 1620
cagaagactg agttacaagc aattcatcta gctttgcagg attcgggatt agaagtaaac 1680
atagtgacag actcacaata tgcattggga atcattcaag cacaaccaga taagagtgaa 1740
tcagagttag tcagtcaaat aatagagcag ttaataaaaa aggaaaaagt ctacctggca 1800
tgggtaccag cacacaaagg aattggagga aatgaacaag tagataaatt ggtcagtgct 1860
ggaatcagga aagtactatt tttagatgga atagataagg cccaagaaga acatgagaaa 1920
tatcacagta attggagagc aatggctagt gattttaacc taccacctgt agtagcaaaa 1980
gaaatagtag ccagctgtga taaatgtcag ctaaaagggg aagccatgca tggacaagta 2040
gactgtagcc caggaatatg gcagctagat tgtacacatt tagaaggaaa agttatcttg 2100
gtagcagttc atgtagccag tggatatata gaagcagaag taattccagc agagacaggg 2160
caagaaacag catacttcct cttaaaatta gcaggaagat ggccagtaaa aacagtacat 2220
acagacaatg gcagcaattt caccagtact acagttaagg ccgcctgttg gtgggcgggg 2280
atcaagcagg aatttggcat tccctacaat ccccaaagtc aaggagtaat agaatctatg 2340
aataaagaat taaagaaaat tataggacag gtaagagatc aggctgaaca tcttaagaca 2400
gcagtacaaa tggcagtatt catccacaat tttaaaagaa aaggggggat tggggggtac 2460
agtgcagggg aaagaatagt agacataata gcaacagaca tacaaactaa agaattacaa 2520
aaacaaatta caaaaattca aaattttcgg gtttattaca gggacagcag agatccagtt 2580
tggaaaggac cagcaaagct cctctggaaa ggtgaagggg cagtagtaat acaagataat 2640
agtgacataa aagtagtgcc aagaagaaaa gcaaagatca tcagggatta tggaaaacag 2700
atggcaggtg atgattgtgt ggcaagtaga caggatgagg attaa 2745
<210> 46
<211> 1586
<212> DNA
<213> Artificial Sequence
<220>
<223> DNA Fragment
<400> 46
tctagaatgg caggaagaag cggagacagc gacgaagagc tcatcagaac agtcagactc 60
atcaagcttc tctatcaaag caacccacct cccaatcccg aggggacccg acaggcccga 120
aggaatagaa gaagaaggtg gagagagaga cagagacaga tccattcgat tagtgaacgg 180
atccttggca cttatctggg acgatctgcg gagcctgtgc ctcttcagct accaccgctt 240
gagagactta ctcttgattg taacgaggat tgtggaactt ctgggacgca gggggtggga 300
agccctcaaa tattggtgga atctcctaca atattggagt caggagctaa agaatagagg 360
agctttgttc cttgggttct tgggagcagc aggaagcact atgggcgcag cgtcaatgac 420
gctgacggta caggccagac aattattgtc tggtatagtg cagcagcaga acaatttgct 480
gagggctatt gaggcgcaac agcatctgtt gcaactcaca gtctggggca tcaagcagct 540
ccaggcaaga atcctggctg tggaaagata cctaaaggat caacagctcc tagatctttt 600
tccctctgcc aaaaattatg gggacatcat gaagcccctt gagcatctga cttctggcta 660
ataaaggaaa tttattttca ttgcaatagt gtgttggaat tttttgtgtc tctcactcgg 720
aaggacatat gggagggcaa atcatttaaa acatcagaat gagtatttgg tttagagttt 780
ggcaacatat gccatatgct ggctgccatg aacaaaggtg gctataaaga ggtcatcagt 840
atatgaaaca gccccctgct gtccattcct tattccatag aaaagccttg acttgaggtt 900
agattttttt tatattttgt tttgtgttat ttttttcttt aacatcccta aaattttcct 960
tacatgtttt actagccaga tttttcctcc tctcctgact actcccagtc atagctgtcc 1020
ctcttctctt atgaagatcc ctcgacctgc agcccaagct tggcgtaatc atggtcatag 1080
ctgtttcctg tgtgaaattg ttatccgctc acaattccac acaacatacg agccggaagc 1140
ataaagtgta aagcctgggg tgcctaatga gtgagctaac tcacattaat tgcgttgcgc 1200
tcactgcccg ctttccagtc gggaaacctg tcgtgccagc ggatccgcat ctcaattagt 1260
cagcaaccat agtcccgccc ctaactccgc ccatcccgcc cctaactccg cccagttccg 1320
cccattctcc gccccatggc tgactaattt tttttattta tgcagaggcc gaggccgcct 1380
cggcctctga gctattccag aagtagtgag gaggcttttt tggaggccta ggcttttgca 1440
aaaagctaac ttgtttattg cagcttataa tggttacaaa taaagcaata gcatcacaaa 1500
tttcacaaat aaagcatttt tttcactgca ttctagttgt ggtttgtcca aactcatcaa 1560
tgtatcttat cagcggccgc cccggg 1586
<210> 47
<211> 1614
<212> DNA
<213> Artificial sequence
<220>
<223> DNA fragment
<400> 47
acgcgttagt tattaatagt aatcaattac ggggtcatta gttcatagcc catatatgga 60
gttccgcgtt acataactta cggtaaatgg cccgcctggc tgaccgccca acgacccccg 120
cccattgacg tcaataatga cgtatgttcc catagtaacg ccaataggga ctttccattg 180
acgtcaatgg gtggactatt tacggtaaac tgcccacttg gcagtacatc aagtgtatca 240
tatgccaagt acgcccccta ttgacgtcaa tgacggtaaa tggcccgcct ggcattatgc 300
ccagtacatg accttatggg actttcctac ttggcagtac atctacgtat tagtcatcgc 360
tattaccatg ggtcgaggtg agccccacgt tctgcttcac tctccccatc tcccccccct 420
ccccaccccc aattttgtat ttatttattt tttaattatt ttgtgcagcg atgggggcgg 480
gggggggggg ggcgcgcgcc aggcggggcg gggcggggcg aggggcgggg cggggcgagg 540
cggagaggtg cggcggcagc caatcagagc ggcgcgctcc gaaagtttcc ttttatggcg 600
aggcggcggc ggcggcggcc ctataaaaag cgaagcgcgc ggcgggcggg agtcgctgcg 660
ttgccttcgc cccgtgcccc gctccgcgcc gcctcgcgcc gcccgccccg gctctgactg 720
accgcgttac tcccacaggt gagcgggcgg gacggccctt ctcctccggg ctgtaattag 780
cgcttggttt aatgacggct cgtttctttt ctgtggctgc gtgaaagcct taaagggctc 840
cgggagggcc ctttgtgcgg gggggagcgg ctcggggggt gcgtgcgtgt gtgtgtgcgt 900
ggggagcgcc gcgtgcggcc cgcgctgccc ggcggctgtg agcgctgcgg gcgcggcgcg 960
gggctttgtg cgctccgcgt gtgcgcgagg ggagcgcggc cgggggcggt gccccgcggt 1020
gcgggggggc tgcgagggga acaaaggctg cgtgcggggt gtgtgcgtgg gggggtgagc 1080
agggggtgtg ggcgcggcgg tcgggctgta acccccccct gcacccccct ccccgagttg 1140
ctgagcacgg cccggcttcg ggtgcggggc tccgtgcggg gcgtggcgcg gggctcgccg 1200
tgccgggcgg ggggtggcgg caggtggggg tgccgggcgg ggcggggccg cctcgggccg 1260
gggagggctc gggggagggg cgcggcggcc ccggagcgcc ggcggctgtc gaggcgcggc 1320
gagccgcagc cattgccttt tatggtaatc gtgcgagagg gcgcagggac ttcctttgtc 1380
ccaaatctgg cggagccgaa atctgggagg cgccgccgca ccccctctag cgggcgcggg 1440
cgaagcggtg cggcgccggc aggaaggaaa tgggcgggga gggccttcgt gcgtcgccgc 1500
gccgccgtcc ccttctccat ctccagcctc ggggctgccg cagggggacg gctgccttcg 1560
ggggggacgg ggcagggcgg ggttcggctt ctggcgtgtg accggcggga attc 1614
<210> 48
<211> 884
<212> DNA
<213> Artificial sequence
<220>
<223> RSV promoter and HIV Rev
<400> 48
caattgcgat gtacgggcca gatatacgcg tatctgaggg gactagggtg tgtttaggcg 60
aaaagcgggg cttcggttgt acgcggttag gagtcccctc aggatatagt agtttcgctt 120
ttgcataggg agggggaaat gtagtcttat gcaatacact tgtagtcttg caacatggta 180
acgatgagtt agcaacatgc cttacaagga gagaaaaagc accgtgcatg ccgattggtg 240
gaagtaaggt ggtacgatcg tgccttatta ggaaggcaac agacaggtct gacatggatt 300
ggacgaacca ctgaattccg cattgcagag ataattgtat ttaagtgcct agctcgatac 360
aataaacgcc atttgaccat tcaccacatt ggtgtgcacc tccaagctcg agctcgttta 420
gtgaaccgtc agatcgcctg gagacgccat ccacgctgtt ttgacctcca tagaagacac 480
cgggaccgat ccagcctccc ctcgaagcta gcgattaggc atctcctatg gcaggaagaa 540
gcggagacag cgacgaagaa ctcctcaagg cagtcagact catcaagttt ctctatcaaa 600
gcaacccacc tcccaatccc gaggggaccc gacaggcccg aaggaataga agaagaaggt 660
ggagagagag acagagacag atccattcga ttagtgaacg gatccttagc acttatctgg 720
gacgatctgc ggagcctgtg cctcttcagc taccaccgct tgagagactt actcttgatt 780
gtaacgagga ttgtggaact tctgggacgc agggggtggg aagccctcaa atattggtgg 840
aatctcctac aatattggag tcaggagcta aagaatagtc taga 884
<210> 49
<211> 1104
<212> DNA
<213> Artificial sequence
<220>
<223> Elongation Factor-1 alpha (EF1-alpha) promoter
<400> 49
ccggtgccta gagaaggtgg cgcggggtaa actgggaaag tgatgtcgtg tactggctcc 60
gcctttttcc cgagggtggg ggagaaccgt atataagtgc agtagtcgcc gtgaacgttc 120
tttttcgcaa cgggtttgcc gccagaacac aggtaagtgc cgtgtgtggt tcccgcgggc 180
ctggcctctt tacgggttat ggcccttgcg tgccttgaat tacttccacg cccctggctg 240
cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg ggtgggagag ttcgaggcct 300
tgcgcttaag gagccccttc gcctcgtgct tgagttgagg cctggcctgg gcgctggggc 360
cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg ctgctttcga taagtctcta 420
gccatttaaa atttttgatg acctgctgcg acgctttttt tctggcaaga tagtcttgta 480
aatgcgggcc aagatctgca cactggtatt tcggtttttg gggccgcggg cggcgacggg 540
gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc tgcgagcgcg gccaccgaga 600
atcggacggg ggtagtctca agctggccgg cctgctctgg tgcctggcct cgcgccgccg 660
tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg caccagttgc gtgagcggaa 720
agatggccgc ttcccggccc tgctgcaggg agctcaaaat ggaggacgcg gcgctcggga 780
gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct ttccgtcctc agccgtcgct 840
tcatgtgact ccacggagta ccgggcgccg tccaggcacc tcgattagtt ctcgagcttt 900
tggagtacgt cgtctttagg ttggggggag gggttttatg cgatggagtt tccccacact 960
gagtgggtgg agactgaagt taggccagct tggcacttga tgtaattctc cttggaattt 1020
gccctttttg agtttggatc ttggttcatt ctcaagcctc agacagtggt tcaaagtttt 1080
tttcttccat ttcaggtgtc gtga 1104
<210> 50
<211> 511
<212> DNA
<213> Artificial sequence
<220>
<223> Promoter; PGK
<400> 50
ggggttgggg ttgcgccttt tccaaggcag ccctgggttt gcgcagggac gcggctgctc 60
tgggcgtggt tccgggaaac gcagcggcgc cgaccctggg tctcgcacat tcttcacgtc 120
cgttcgcagc gtcacccgga tcttcgccgc tacccttgtg ggccccccgg cgacgcttcc 180
tgctccgccc ctaagtcggg aaggttcctt gcggttcgcg gcgtgccgga cgtgacaaac 240
ggaagccgca cgtctcacta gtaccctcgc agacggacag cgccagggag caatggcagc 300
gcgccgaccg cgatgggctg tggccaatag cggctgctca gcagggcgcg ccgagagcag 360
cggccgggaa ggggcggtgc gggaggcggg gtgtggggcg gtagtgtggg ccctgttcct 420
gcccgcgcgg tgttccgcat tctgcaagcc tccggagcgc acgtcggcag tcggctccct 480
cgttgaccga atcaccgacc tctctcccca g 511
<210> 51
<211> 1162
<212> DNA
<213> Artificial sequence
<220>
<223> Promoter; UbC
<400> 51
gcgccgggtt ttggcgcctc ccgcgggcgc ccccctcctc acggcgagcg ctgccacgtc 60
agacgaaggg cgcaggagcg ttcctgatcc ttccgcccgg acgctcagga cagcggcccg 120
ctgctcataa gactcggcct tagaacccca gtatcagcag aaggacattt taggacggga 180
cttgggtgac tctagggcac tggttttctt tccagagagc ggaacaggcg aggaaaagta 240
gtcccttctc ggcgattctg cggagggatc tccgtggggc ggtgaacgcc gatgattata 300
taaggacgcg ccgggtgtgg cacagctagt tccgtcgcag ccgggatttg ggtcgcggtt 360
cttgtttgtg gatcgctgtg atcgtcactt ggtgagttgc gggctgctgg gctggccggg 420
gctttcgtgg ccgccgggcc gctcggtggg acggaagcgt gtggagagac cgccaagggc 480
tgtagtctgg gtccgcgagc aaggttgccc tgaactgggg gttgggggga gcgcacaaaa 540
tggcggctgt tcccgagtct tgaatggaag acgcttgtaa ggcgggctgt gaggtcgttg 600
aaacaaggtg gggggcatgg tgggcggcaa gaacccaagg tcttgaggcc ttcgctaatg 660
cgggaaagct cttattcggg tgagatgggc tggggcacca tctggggacc ctgacgtgaa 720
gtttgtcact gactggagaa ctcgggtttg tcgtctggtt gcgggggcgg cagttatgcg 780
gtgccgttgg gcagtgcacc cgtacctttg ggagcgcgcg cctcgtcgtg tcgtgacgtc 840
acccgttctg ttggcttata atgcagggtg gggccacctg ccggtaggtg tgcggtaggc 900
ttttctccgt cgcaggacgc agggttcggg cctagggtag gctctcctga atcgacaggc 960
gccggacctc tggtgagggg agggataagt gaggcgtcag tttctttggt cggttttatg 1020
tacctatctt cttaagtagc tgaagctccg gttttgaact atgcgctcgg ggttggcgag 1080
tgtgttttgt gaagtttttt aggcaccttt tgaaatgtaa tcatttgggt caatatgtaa 1140
ttttcagtgt tagactagta aa 1162
<210> 52
<211> 120
<212> DNA
<213> Artificial sequence
<220>
<223> Poly A; SV40
<400> 52
gtttattgca gcttataatg gttacaaata aagcaatagc atcacaaatt tcacaaataa 60
agcatttttt tcactgcatt ctagttgtgg tttgtccaaa ctcatcaatg tatcttatca 120
<210> 53
<211> 227
<212> DNA
<213> Artificial sequence
<220>
<223> Poly A; bGH
<400> 53
gactgtgcct tctagttgcc agccatctgt tgtttgcccc tcccccgtgc cttccttgac 60
cctggaaggt gccactccca ctgtcctttc ctaataaaat gaggaaattg catcgcattg 120
tctgagtagg tgtcattcta ttctgggggg tggggtgggg caggacagca agggggagga 180
ttgggaagac aatagcaggc atgctgggga tgcggtgggc tctatgg 227
<210> 54
<211> 1695
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; RD114
<400> 54
atgaaactcc caacaggaat ggtcatttta tgtagcctaa taatagttcg ggcagggttt 60
gacgaccccc gcaaggctat cgcattagta caaaaacaac atggtaaacc atgcgaatgc 120
agcggagggc aggtatccga ggccccaccg aactccatcc aacaggtaac ttgcccaggc 180
aagacggcct acttaatgac caaccaaaaa tggaaatgca gagtcactcc aaaaaatctc 240
acccctagcg ggggagaact ccagaactgc ccctgtaaca ctttccagga ctcgatgcac 300
agttcttgtt atactgaata ccggcaatgc agggcgaata ataagacata ctacacggcc 360
accttgctta aaatacggtc tgggagcctc aacgaggtac agatattaca aaaccccaat 420
cagctcctac agtccccttg taggggctct ataaatcagc ccgtttgctg gagtgccaca 480
gcccccatcc atatctccga tggtggagga cccctcgata ctaagagagt gtggacagtc 540
caaaaaaggc tagaacaaat tcataaggct atgcatcctg aacttcaata ccacccctta 600
gccctgccca aagtcagaga tgaccttagc cttgatgcac ggacttttga tatcctgaat 660
accactttta ggttactcca gatgtccaat tttagccttg cccaagattg ttggctctgt 720
ttaaaactag gtacccctac ccctcttgcg atacccactc cctctttaac ctactcccta 780
gcagactccc tagcgaatgc ctcctgtcag attatacctc ccctcttggt tcaaccgatg 840
cagttctcca actcgtcctg tttatcttcc cctttcatta acgatacgga acaaatagac 900
ttaggtgcag tcacctttac taactgcacc tctgtagcca atgtcagtag tcctttatgt 960
gccctaaacg ggtcagtctt cctctgtgga aataacatgg catacaccta tttaccccaa 1020
aactggacag gactttgcgt ccaagcctcc ctcctccccg acattgacat catcccgggg 1080
gatgagccag tccccattcc tgccattgat cattatatac atagacctaa acgagctgta 1140
cagttcatcc ctttactagc tggactggga atcaccgcag cattcaccac cggagctaca 1200
ggcctaggtg tctccgtcac ccagtataca aaattatccc atcagttaat atctgatgtc 1260
caagtcttat ccggtaccat acaagattta caagaccagg tagactcgtt agctgaagta 1320
gttctccaaa ataggagggg actggaccta ctaacggcag aacaaggagg aatttgttta 1380
gccttacaag aaaaatgctg tttttatgct aacaagtcag gaattgtgag aaacaaaata 1440
agaaccctac aagaagaatt acaaaaacgc agggaaagcc tggcatccaa ccctctctgg 1500
accgggctgc agggctttct tccgtacctc ctacctctcc tgggacccct actcaccctc 1560
ctactcatac taaccattgg gccatgcgtt ttcaatcgat tggtccaatt tgttaaagac 1620
aggatctcag tggtccaggc tctggttttg actcagcaat atcaccagct aaaacccata 1680
gagtacgagc catga 1695
<210> 55
<211> 2013
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; GALV
<400> 55
atgcttctca cctcaagccc gcaccacctt cggcaccaga tgagtcctgg gagctggaaa 60
agactgatca tcctcttaag ctgcgtattc ggagacggca aaacgagtct gcagaataag 120
aacccccacc agcctgtgac cctcacctgg caggtactgt cccaaactgg ggacgttgtc 180
tgggacaaaa aggcagtcca gcccctttgg acttggtggc cctctcttac acctgatgta 240
tgtgccctgg cggccggtct tgagtcctgg gatatcccgg gatccgatgt atcgtcctct 300
aaaagagtta gacctcctga ttcagactat actgccgctt ataagcaaat cacctgggga 360
gccatagggt gcagctaccc tcgggctagg accaggatgg caaattcccc cttctacgtg 420
tgtccccgag ctggccgaac ccattcagaa gctaggaggt gtggggggct agaatcccta 480
tactgtaaag aatggagttg tgagaccacg ggtaccgttt attggcaacc caagtcctca 540
tgggacctca taactgtaaa atgggaccaa aatgtgaaat gggagcaaaa atttcaaaag 600
tgtgaacaaa ccggctggtg taaccccctc aagatagact tcacagaaaa aggaaaactc 660
tccagagatt ggataacgga aaaaacctgg gaattaaggt tctatgtata tggacaccca 720
ggcatacagt tgactatccg cttagaggtc actaacatgc cggttgtggc agtgggccca 780
gaccctgtcc ttgcggaaca gggacctcct agcaagcccc tcactctccc tctctcccca 840
cggaaagcgc cgcccacccc tctacccccg gcggctagtg agcaaacccc tgcggtgcat 900
ggagaaactg ttaccctaaa ctctccgcct cccaccagtg gcgaccgact ctttggcctt 960
gtgcaggggg ccttcctaac cttgaatgct accaacccag gggccactaa gtcttgctgg 1020
ctctgtttgg gcatgagccc cccttattat gaagggatag cctcttcagg agaggtcgct 1080
tatacctcca accatacccg atgccactgg ggggcccaag gaaagcttac cctcactgag 1140
gtctccggac tcgggtcatg catagggaag gtgcctctta cccatcaaca tctttgcaac 1200
cagaccttac ccatcaattc ctctaaaaac catcagtatc tgctcccctc aaaccatagc 1260
tggtgggcct gcagcactgg cctcaccccc tgcctctcca cctcagtttt taatcagtct 1320
aaagacttct gtgtccaggt ccagctgatc ccccgcatct attaccattc tgaagaaacc 1380
ttgttacaag cctatgacaa atcacccccc aggtttaaaa gagagcctgc ctcacttacc 1440
ctagctgtct tcctggggtt agggattgcg gcaggtatag gtactggctc aaccgcccta 1500
attaaagggc ccatagacct ccagcaaggc ctaaccagcc tccaaatcgc cattgacgct 1560
gacctccggg cccttcagga ctcaatcagc aagctagagg actcactgac ttccctatct 1620
gaggtagtac tccaaaatag gagaggcctt gacttactat tccttaaaga aggaggcctc 1680
tgcgcggccc taaaagaaga gtgctgtttt tatgtagacc actcaggtgc agtacgagac 1740
tccatgaaaa aacttaaaga aagactagat aaaagacagt tagagcgcca gaaaaaccaa 1800
aactggtatg aagggtggtt caataactcc ccttggttta ctaccctact atcaaccatc 1860
gctgggcccc tattgctcct ccttttgtta ctcactcttg ggccctgcat catcaataaa 1920
ttaatccaat tcatcaatga taggataagt gcagtcaaaa ttttagtcct tagacagaaa 1980
tatcagaccc tagataacga ggaaaacctt taa 2013
<210> 56
<211> 1530
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; FUG
<400> 56
atggttccgc aggttctttt gtttgtactc cttctgggtt tttcgttgtg tttcgggaag 60
ttccccattt acacgatacc agacgaactt ggtccctgga gccctattga catacaccat 120
ctcagctgtc caaataacct ggttgtggag gatgaaggat gtaccaacct gtccgagttc 180
tcctacatgg aactcaaagt gggatacatc tcagccatca aagtgaacgg gttcacttgc 240
acaggtgttg tgacagaggc agagacctac accaactttg ttggttatgt cacaaccaca 300
ttcaagagaa agcatttccg ccccacccca gacgcatgta gagccgcgta taactggaag 360
atggccggtg accccagata tgaagagtcc ctacacaatc cataccccga ctaccactgg 420
cttcgaactg taagaaccac caaagagtcc ctcattatca tatccccaag tgtgacagat 480
ttggacccat atgacaaatc ccttcactca agggtcttcc ctggcggaaa gtgctcagga 540
ataacggtgt cctctaccta ctgctcaact aaccatgatt acaccatttg gatgcccgag 600
aatccgagac caaggacacc ttgtgacatt tttaccaata gcagagggaa gagagcatcc 660
aacgggaaca agacttgcgg ctttgtggat gaaagaggcc tgtataagtc tctaaaagga 720
gcatgcaggc tcaagttatg tggagttctt ggacttagac ttatggatgg aacatgggtc 780
gcgatgcaaa catcagatga gaccaaatgg tgccctccag atcagttggt gaatttgcac 840
gactttcgct cagacgagat cgagcatctc gttgtggagg agttagttaa gaaaagagag 900
gaatgtctgg atgcattaga gtccatcatg accaccaagt cagtaagttt cagacgtctc 960
agtcacctga gaaaacttgt cccagggttt ggaaaagcat ataccatatt caacaaaacc 1020
ttgatggagg ctgatgctca ctacaagtca gtccggacct ggaatgagat catcccctca 1080
aaagggtgtt tgaaagttgg aggaaggtgc catcctcatg tgaacggggt gtttttcaat 1140
ggtataatat tagggcctga cgaccatgtc ctaatcccag agatgcaatc atccctcctc 1200
cagcaacata tggagttgtt ggaatcttca gttatccccc tgatgcaccc cctggcagac 1260
ccttctacag ttttcaaaga aggtgatgag gctgaggatt ttgttgaagt tcacctcccc 1320
gatgtgtaca aacagatctc aggggttgac ctgggtctcc cgaactgggg aaagtatgta 1380
ttgatgactg caggggccat gattggcctg gtgttgatat tttccctaat gacatggtgc 1440
agagttggta tccatctttg cattaaatta aagcacacca agaaaagaca gatttataca 1500
gacatagaga tgaaccgact tggaaagtaa 1530
<210> 57
<211> 1497
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; LCMV
<400> 57
atgggtcaga ttgtgacaat gtttgaggct ctgcctcaca tcatcgatga ggtgatcaac 60
attgtcatta ttgtgcttat cgtgatcacg ggtatcaagg ctgtctacaa ttttgccacc 120
tgtgggatat tcgcattgat cagtttccta cttctggctg gcaggtcctg tggcatgtac 180
ggtcttaagg gacccgacat ttacaaagga gtttaccaat ttaagtcagt ggagtttgat 240
atgtcacatc tgaacctgac catgcccaac gcatgttcag ccaacaactc ccaccattac 300
atcagtatgg ggacttctgg actagaattg accttcacca atgattccat catcagtcac 360
aacttttgca atctgacctc tgccttcaac aaaaagacct ttgaccacac actcatgagt 420
atagtttcga gcctacacct cagtatcaga gggaactcca actataaggc agtatcctgc 480
gacttcaaca atggcataac catccaatac aacttgacat tctcagatcg acaaagtgct 540
cagagccagt gtagaacctt cagaggtaga gtcctagata tgtttagaac tgccttcggg 600
gggaaataca tgaggagtgg ctggggctgg acaggctcag atggcaagac cacctggtgt 660
agccagacga gttaccaata cctgattata caaaatagaa cctgggaaaa ccactgcaca 720
tatgcaggtc cttttgggat gtccaggatt ctcctttccc aagagaagac taagttcttc 780
actaggagac tagcgggcac attcacctgg actttgtcag actcttcagg ggtggagaat 840
ccaggtggtt attgcctgac caaatggatg attcttgctg cagagcttaa gtgtttcggg 900
aacacagcag ttgcgaaatg caatgtaaat catgatgccg aattctgtga catgctgcga 960
ctaattgact acaacaaggc tgctttgagt aagttcaaag aggacgtaga atctgccttg 1020
cacttattca aaacaacagt gaattctttg atttcagatc aactactgat gaggaaccac 1080
ttgagagatc tgatgggggt gccatattgc aattactcaa agttttggta cctagaacat 1140
gcaaagaccg gcgaaactag tgtccccaag tgctggcttg tcaccaatgg ttcttactta 1200
aatgagaccc acttcagtga tcaaatcgaa caggaagccg ataacatgat tacagagatg 1260
ttgaggaagg attacataaa gaggcagggg agtacccccc tagcattgat ggaccttctg 1320
atgttttcca catctgcata tctagtcagc atcttcctgc accttgtcaa aataccaaca 1380
cacaggcaca taaaaggtgg ctcatgtcca aagccacacc gattaaccaa caaaggaatt 1440
tgtagttgtg gtgcatttaa ggtgcctggt gtaaaaaccg tctggaaaag acgctga 1497
<210> 58
<211> 1692
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; FPV
<400> 58
atgaacactc aaatcctggt tttcgccctt gtggcagtca tccccacaaa tgcagacaaa 60
atttgtcttg gacatcatgc tgtatcaaat ggcaccaaag taaacacact cactgagaga 120
ggagtagaag ttgtcaatgc aacggaaaca gtggagcgga caaacatccc caaaatttgc 180
tcaaaaggga aaagaaccac tgatcttggc caatgcggac tgttagggac cattaccgga 240
ccacctcaat gcgaccaatt tctagaattt tcagctgatc taataatcga gagacgagaa 300
ggaaatgatg tttgttaccc ggggaagttt gttaatgaag aggcattgcg acaaatcctc 360
agaggatcag gtgggattga caaagaaaca atgggattca catatagtgg aataaggacc 420
aacggaacaa ctagtgcatg tagaagatca gggtcttcat tctatgcaga aatggagtgg 480
ctcctgtcaa atacagacaa tgctgctttc ccacaaatga caaaatcata caaaaacaca 540
aggagagaat cagctctgat agtctgggga atccaccatt caggatcaac caccgaacag 600
accaaactat atgggagtgg aaataaactg ataacagtcg ggagttccaa atatcatcaa 660
tcttttgtgc cgagtccagg aacacgaccg cagataaatg gccagtccgg acggattgat 720
tttcattggt tgatcttgga tcccaatgat acagttactt ttagtttcaa tggggctttc 780
atagctccaa atcgtgccag cttcttgagg ggaaagtcca tggggatcca gagcgatgtg 840
caggttgatg ccaattgcga aggggaatgc taccacagtg gagggactat aacaagcaga 900
ttgccttttc aaaacatcaa tagcagagca gttggcaaat gcccaagata tgtaaaacag 960
gaaagtttat tattggcaac tgggatgaag aacgttcccg aaccttccaa aaaaaggaaa 1020
aaaagaggcc tgtttggcgc tatagcaggg tttattgaaa atggttggga aggtctggtc 1080
gacgggtggt acggtttcag gcatcagaat gcacaaggag aaggaactgc agcagactac 1140
aaaagcaccc aatcggcaat tgatcagata accggaaagt taaatagact cattgagaaa 1200
accaaccagc aatttgagct aatagataat gaattcactg aggtggaaaa gcagattggc 1260
aatttaatta actggaccaa agactccatc acagaagtat ggtcttacaa tgctgaactt 1320
cttgtggcaa tggaaaacca gcacactatt gatttggctg attcagagat gaacaagctg 1380
tatgagcgag tgaggaaaca attaagggaa aatgctgaag aggatggcac tggttgcttt 1440
gaaatttttc ataaatgtga cgatgattgt atggctagta taaggaacaa tacttatgat 1500
cacagcaaat acagagaaga agcgatgcaa aatagaatac aaattgaccc agtcaaattg 1560
agtagtggct acaaagatgt gatactttgg tttagcttcg gggcatcatg ctttttgctt 1620
cttgccattg caatgggcct tgttttcata tgtgtgaaga acggaaacat gcggtgcact 1680
atttgtatat aa 1692
<210> 59
<211> 1266
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; RRV
<400> 59
agtgtaacag agcactttaa tgtgtataag gctactagac catacctagc acattgcgcc 60
gattgcgggg acgggtactt ctgctatagc ccagttgcta tcgaggagat ccgagatgag 120
gcgtctgatg gcatgcttaa gatccaagtc tccgcccaaa taggtctgga caaggcaggc 180
acccacgccc acacgaagct ccgatatatg gctggtcatg atgttcagga atctaagaga 240
gattccttga gggtgtacac gtccgcagcg tgctccatac atgggacgat gggacacttc 300
atcgtcgcac actgtccacc aggcgactac ctcaaggttt cgttcgagga cgcagattcg 360
cacgtgaagg catgtaaggt ccaatacaag cacaatccat tgccggtggg tagagagaag 420
ttcgtggtta gaccacactt tggcgtagag ctgccatgca cctcatacca gctgacaacg 480
gctcccaccg acgaggagat tgacatgcat acaccgccag atataccgga tcgcaccctg 540
ctatcacaga cggcgggcaa cgtcaaaata acagcaggcg gcaggactat caggtacaac 600
tgtacctgcg gccgtgacaa cgtaggcact accagtactg acaagaccat caacacatgc 660
aagattgacc aatgccatgc tgccgtcacc agccatgaca aatggcaatt tacctctcca 720
tttgttccca gggctgatca gacagctagg aaaggcaagg tacacgttcc gttccctctg 780
actaacgtca cctgccgagt gccgttggct cgagcgccgg atgccaccta tggtaagaag 840
gaggtgaccc tgagattaca cccagatcat ccgacgctct tctcctatag gagtttagga 900
gccgaaccgc acccgtacga ggaatgggtt gacaagttct ctgagcgcat catcccagtg 960
acggaagaag ggattgagta ccagtggggc aacaacccgc cggtctgcct gtgggcgcaa 1020
ctgacgaccg agggcaaacc ccatggctgg ccacatgaaa tcattcagta ctattatgga 1080
ctataccccg ccgccactat tgccgcagta tccggggcga gtctgatggc cctcctaact 1140
ctggcggcca catgctgcat gctggccacc gcgaggagaa agtgcctaac accgtacgcc 1200
ctgacgccag gagcggtggt accgttgaca ctggggctgc tttgctgcgc accgagggcg 1260
aatgca 1266
<210> 60
<211> 1938
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; MLV 10A1
<400> 60
atggaaggtc cagcgttctc aaaacccctt aaagataaga ttaacccgtg gaagtcctta 60
atggtcatgg gggtctattt aagagtaggg atggcagaga gcccccatca ggtctttaat 120
gtaacctgga gagtcaccaa cctgatgact gggcgtaccg ccaatgccac ctccctttta 180
ggaactgtac aagatgcctt cccaagatta tattttgatc tatgtgatct ggtcggagaa 240
gagtgggacc cttcagacca ggaaccatat gtcgggtatg gctgcaaata ccccggaggg 300
agaaagcgga cccggacttt tgacttttac gtgtgccctg ggcataccgt aaaatcgggg 360
tgtggggggc caagagaggg ctactgtggt gaatggggtt gtgaaaccac cggacaggct 420
tactggaagc ccacatcatc atgggaccta atctccctta agcgcggtaa caccccctgg 480
gacacgggat gctccaaaat ggcttgtggc ccctgctacg acctctccaa agtatccaat 540
tccttccaag gggctactcg agggggcaga tgcaaccctc tagtcctaga attcactgat 600
gcaggaaaaa aggctaattg ggacgggccc aaatcgtggg gactgagact gtaccggaca 660
ggaacagatc ctattaccat gttctccctg acccgccagg tcctcaatat agggccccgc 720
atccccattg ggcctaatcc cgtgatcact ggtcaactac ccccctcccg acccgtgcag 780
atcaggctcc ccaggcctcc tcagcctcct cctacaggcg cagcctctat agtccctgag 840
actgccccac cttctcaaca acctgggacg ggagacaggc tgctaaacct ggtagaagga 900
gcctatcagg cgcttaacct caccaatccc gacaagaccc aagaatgttg gctgtgctta 960
gtgtcgggac ctccttatta cgaaggagta gcggtcgtgg gcacttatac caatcattct 1020
accgccccgg ccagctgtac ggccacttcc caacataagc ttaccctatc tgaagtgaca 1080
ggacagggcc tatgcatggg agcactacct aaaactcacc aggccttatg taacaccacc 1140
caaagtgccg gctcaggatc ctactacctt gcagcacccg ctggaacaat gtgggcttgt 1200
agcactggat tgactccctg cttgtccacc acgatgctca atctaaccac agactattgt 1260
gtattagttg agctctggcc cagaataatt taccactccc ccgattatat gtatggtcag 1320
cttgaacagc gtaccaaata taagagggag ccagtatcgt tgaccctggc ccttctgcta 1380
ggaggattaa ccatgggagg gattgcagct ggaataggga cggggaccac tgccctaatc 1440
aaaacccagc agtttgagca gcttcacgcc gctatccaga cagacctcaa cgaagtcgaa 1500
aaatcaatta ccaacctaga aaagtcactg acctcgttgt ctgaagtagt cctacagaac 1560
cgaagaggcc tagatttgct cttcctaaaa gagggaggtc tctgcgcagc cctaaaagaa 1620
gaatgttgtt tttatgcaga ccacacggga ctagtgagag acagcatggc caaactaagg 1680
gaaaggctta atcagagaca aaaactattt gagtcaggcc aaggttggtt cgaagggcag 1740
tttaatagat ccccctggtt taccacctta atctccacca tcatgggacc tctaatagta 1800
ctcttactga tcttactctt tggaccctgc attctcaatc gattggtcca atttgttaaa 1860
gacaggatct cagtggtcca ggctctggtt ttgactcaac aatatcacca gctaaaacct 1920
atagagtacg agccatga 1938
<210> 61
<211> 2030
<212> DNA
<213> Artificial sequence
<220>
<223> Envelope; Ebola
<400> 61
atgggtgtta caggaatatt gcagttacct cgtgatcgat tcaagaggac atcattcttt 60
ctttgggtaa ttatcctttt ccaaagaaca ttttccatcc cacttggagt catccacaat 120
agcacattac aggttagtga tgtcgacaaa ctggtttgcc gtgacaaact gtcatccaca 180
aatcaattga gatcagttgg actgaatctc gaagggaatg gagtggcaac tgacgtgcca 240
tctgcaacta aaagatgggg cttcaggtcc ggtgtcccac caaaggtggt caattatgaa 300
gctggtgaat gggctgaaaa ctgctacaat cttgaaatca aaaaacctga cgggagtgag 360
tgtctaccag cagcgccaga cgggattcgg ggcttccccc ggtgccggta tgtgcacaaa 420
gtatcaggaa cgggaccgtg tgccggagac tttgccttcc acaaagaggg tgctttcttc 480
ctgtatgacc gacttgcttc cacagttatc taccgaggaa cgactttcgc tgaaggtgtc 540
gttgcatttc tgatactgcc ccaagctaag aaggacttct tcagctcaca ccccttgaga 600
gagccggtca atgcaacgga ggacccgtct agtggctact attctaccac aattagatat 660
caagctaccg gttttggaac caatgagaca gagtatttgt tcgaggttga caatttgacc 720
tacgtccaac ttgaatcaag attcacacca cagtttctgc tccagctgaa tgagacaata 780
tatacaagtg ggaaaaggag caataccacg ggaaaactaa tttggaaggt caaccccgaa 840
attgatacaa caatcgggga gtgggccttc tgggaaacta aaaaaacctc actagaaaaa 900
ttcgcagtga agagttgtct ttcacagctg tatcaaacag agccaaaaac atcagtggtc 960
agagtccggc gcgaacttct tccgacccag ggaccaacac aacaactgaa gaccacaaaa 1020
tcatggcttc agaaaattcc tctgcaatgg ttcaagtgca cagtcaagga agggaagctg 1080
cagtgtcgca tctgacaacc cttgccacaa tctccacgag tcctcaaccc cccacaacca 1140
aaccaggtcc ggacaacagc acccacaata cacccgtgta taaacttgac atctctgagg 1200
caactcaagt tgaacaacat caccgcagaa cagacaacga cagcacagcc tccgacactc 1260
cccccgccac gaccgcagcc ggacccctaa aagcagagaa caccaacacg agcaagggta 1320
ccgacctcct ggaccccgcc accacaacaa gtccccaaaa ccacagcgag accgctggca 1380
acaacaacac tcatcaccaa gataccggag aagagagtgc cagcagcggg aagctaggct 1440
taattaccaa tactattgct ggagtcgcag gactgatcac aggcgggagg agagctcgaa 1500
gagaagcaat tgtcaatgct caacccaaat gcaaccctaa tttacattac tggactactc 1560
aggatgaagg tgctgcaatc ggactggcct ggataccata tttcgggcca gcagccgagg 1620
gaatttacat agaggggctg atgcacaatc aagatggttt aatctgtggg ttgagacagc 1680
tggccaacga gacgactcaa gctcttcaac tgttcctgag agccacaacc gagctacgca 1740
ccttttcaat cctcaaccgt aaggcaattg atttcttgct gcagcgatgg ggcggcacat 1800
gccacatttt gggaccggac tgctgtatcg aaccacatga ttggaccaag aacataacag 1860
acaaaattga tcagattatt catgattttg ttgataaaac ccttccggac cagggggaca 1920
atgacaattg gtggacagga tggagacaat ggataccggc aggtattgga gttacaggcg 1980
ttataattgc agttatcgct ttattctgta tatgcaaatt tgtcttttag 2030
<210> 62
<211> 218
<212> DNA
<213> Artificial sequence
<220>
<223> Thyroxin binding globulin promoter (TBG)
<400> 62
ctttctcttt tgttttacat gaagggtctg gcagccaaag caatcactca aagttcaaac 60
cttatcattt tttgctttgt tcctcttggc cttggttttg tacatcagct ttgaaaatac 120
catcccaggg ttaatgctgg ggttaattta taactaagag tgctctagtt ttgcaataca 180
ggacatgcta taaaaatgga aagatgttgc tttctgag 218
<210> 63
<211> 523
<212> DNA
<213> Artificial sequence
<220>
<223> DNA fragment containing prothrombin enhancer and human alpha-1
anti-trypsin promoter
<400> 63
gcgagaactt gtgcctcccc gtgttcctgc tctttgtccc tctgtcctac ttagactaat 60
atttgccttg ggtactgcaa acaggaaatg ggggagggac aggagtaggg cggagggtag 120
cccggggatc ttgctaccag tggaacagcc actaaggatt ctgcagtgag agcagagggc 180
cagctaagtg gtactctccc agagactgtc tgactcacgc caccccctcc accttggaca 240
caggacgctg tggtttctga gccaggtaca atgactcctt tcggtaagtg cagtggaagc 300
tgtacactgc ccaggcaaag cgtccgggca gcgtaggcgg gcgactcaga tcccagccag 360
tggacttagc ccctgtttgc tcctccgata actggggtga ccttggttaa tattcaccag 420
cagcctcccc cgttgcccct ctggatccac tgcttaaata cggacgagga cagggccctg 480
tctcctcagc ttcaggcacc accactgacc tgggacagtg aat 523
<210> 64
<211> 558
<212> DNA
<213> Artificial sequence
<220>
<223> DNA fragment containing prothrombin enhancer, human alpha-1
anti-trypsin promoter, and five HNF1 binding sites
<400> 64
gttaatcatt aacgttaatc attaacgtta atcattaacg ttaatcatta acgttaatca 60
ttaacatcga tgcgagaact tgtgcctccc cgtgttcctg ctctttgtcc ctctgtccta 120
cttagactaa tatttgcctt gggtactgca aacaggaaat gggggaggga caggagtagg 180
gcggagggta ggattctgca gtgagagcag agggccagct aagtggtact ctcccagaga 240
ctgtctgact cacgccaccc cctccacctt ggacacagga cgctgtggtt tctgagccag 300
gtacaatgac tcctttcggt aagtgcagtg gaagctgtac actgcccagg caaagcgtcc 360
gggcagcgta ggcgggcgac tcagatccca gccagtggac ttagcccctg tttgctcctc 420
cgataactgg ggtgaccttg gttaatattc accagcagcc tcccccgttg cccctctgga 480
tccactgctt aaatacggac gaggacaggg ccctgtctcc tcagcttcag gcaccaccac 540
tgacctggga cagtgaat 558
<210> 65
<211> 589
<212> DNA
<213> Artificial sequence
<220>
<223> DNA fragment containing prothrombin enhancer, human alpha-1,
anti-trypsin promoter, and three HNF1/HNF4 binding sites
<400> 65
gttaatcatt aacgcttgta ctttggtaca gttaatcatt aacgcttgta ctttggtaca 60
gttaatcatt aacgcttgta ctttggtaca atcgatgcga gaacttgtgc ctccccgtgt 120
tcctgctctt tgtccctctg tcctacttag actaatattt gccttgggta ctgcaaacag 180
gaaatggggg agggacagga gtagggcgga gggtagcccg gggattctgc agtgagagca 240
gagggccagc taagtggtac tctcccagag actgtctgac tcacgccacc ccctccacct 300
tggacacagg acgctgtggt ttctgagcca ggtacaatga ctcctttcgg taagtgcagt 360
ggaagctgta cactgcccag gcaaagcgtc cgggcagcgt aggcgggcga ctcagatccc 420
agccagtgga cttagcccct gtttgctcct ccgataactg gggtgacctt ggttaatatt 480
caccagcagc ctcccccgtt gcccctctgg atccactgct taaatacgga cgaggacagg 540
gccctgtctc ctcagcttca ggcaccacca ctgacctggg acagtgaat 589
<210> 66
<211> 24
<212> DNA
<213> Artificial sequence
<220>
<223> Taqman Probe
<400> 66
tcgtgaaagc tcatggacag tggc 24
<210> 67
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Taqman Forward Primer
<400> 67
agatcttgag gcatgacatt gg 22
<210> 68
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Taqman Reverse Primer
<400> 68
gtccagctct tgaatggttc tt 22
<210> 69
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Actin Probe
<400> 69
agcgggaaat cgtgcgtgac 20
<210> 70
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Actin Forward Primer
<400> 70
ggacctgact gactacctca t 21
<210> 71
<211> 22
<212> DNA
<213> Artificial sequence
<220>
<223> Actin Reverse Primer
<400> 71
cgtagcacag cttctcctta at 22
Claims (38)
- 치료적 카고 부분을 포함하는 바이러스 벡터로서, 치료적 카고 부분은 하기를 포함하는 바이러스 벡터:
PAH 서열 또는 그의 변이체;
프로모터; 및
간-특이적 인핸서,
여기에서 PAH 서열 또는 그의 변이체는 프로모터 및 간-특이적 인핸서 둘 모두에 의해 작동적으로 제어됨. - 제 1 항에 있어서, 간-특이적 인핸서는 프로트롬빈 인핸서를 포함하는 바이러스 벡터.
- 제 2 항에 있어서, 프로모터는 간-특이적 프로모터를 포함하는 바이러스 벡터.
- 제 3 항에 있어서, 간-특이적 프로모터는 hAAT 프로모터를 포함하는 바이러스 벡터.
- 제 1 항에 있어서, PAH 서열 또는 그의 변이체는 절두된 것인 바이러스 벡터.
- 제 5 항에 있어서, PAH 서열 또는 그의 변이체의 절두된 부분은 PAH 서열 또는 그의 변이체의 3' 미번역 영역 (UTR) 인 바이러스 벡터.
- 제 1 항에 있어서, 치료적 카고 부분은 베타 글로빈 인트론을 추가로 포함하는 바이러스 벡터.
- 제 1 항에 있어서, 치료적 카고 부분은 적어도 하나의 간세포 핵 인자 결합 자리를 추가로 포함하는 바이러스 벡터.
- 제 8 항에 있어서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 업스트림에 배치되어 있는 바이러스 벡터.
- 제 8 항에 있어서, 적어도 하나의 간세포 핵 인자 결합 자리는 프로트롬빈 인핸서의 다운스트림에 배치되어 있는 바이러스 벡터.
- 제 1 항에 있어서, PAH 서열 또는 그의 변이체는 SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; 또는 SEQ ID NO: 4 와 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함하는 바이러스 벡터.
- 제 11 항에 있어서, PAH 서열 또는 그의 변이체는 SEQ ID NO: 1; SEQ ID NO: 2; SEQ ID NO: 3; 또는 SEQ ID NO: 4 를 포함하는 바이러스 벡터.
- 제 2 항에 있어서, 프로트롬빈 인핸서는 SEQ ID NO: 5 와 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함하는 바이러스 벡터.
- 제 2 항에 있어서, 프로트롬빈 인핸서의 서열은 SEQ ID NO: 5 를 포함하는 바이러스 벡터.
- 제 4 항에 있어서, hAAT 프로모터의 서열은 SEQ ID NO: 6 을 포함하는 바이러스 벡터.
- 제 5 항에 있어서, 베타 글로빈 인트론의 서열은 SEQ ID NOs: 7 또는 8 을 포함하는 바이러스 벡터.
- 제 6 항에 있어서, 간세포 핵 인자 결합 자리의 서열은 SEQ ID NOs: 9-12 중 어느 하나를 포함하는 바이러스 벡터.
- 제 1 항에 있어서, 치료적 카고 부분은 적어도 하나의 예정된 상보적 mRNA 서열에 결합할 수 있는 적어도 하나의 작은 RNA 서열을 추가로 포함하는 바이러스 벡터.
- 제 18 항에 있어서, 적어도 하나의 작은 RNA 서열은 전장 UTR 를 함유하는 상보적 mRNA 서열을 표적화하는 바이러스 벡터.
- 제 18 항에 있어서, 적어도 하나의 예정된 상보적 mRNA 서열은 PAH mRNA 서열인 바이러스 벡터.
- 제 18 항에 있어서, 적어도 하나의 작은 RNA 서열은 shRNA 를 포함하는 바이러스 벡터.
- 제 18 항에 있어서, 적어도 하나의 작은 RNA 서열은 제 1 프로모터의 제어 하에 있고, PAH 서열 또는 그의 변이체는 제 2 프로모터의 제어 하에 있는 바이러스 벡터.
- 제 20 항에 있어서, 제 1 프로모터는 H1 프로모터를 포함하는 바이러스 벡터.
- 제 20 항에 있어서, 제 2 프로모터는 간-특이적 프로모터를 포함하는 바이러스 벡터.
- 제 24 항에 있어서, 간-특이적 프로모터는 hAAT 프로모터를 포함하는 바이러스 벡터.
- 제 18 항에 있어서, 적어도 하나의 작은 RNA 서열은 SEQ ID NO: 13 또는 SEQ ID NO: 14 와 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95% 퍼센트 동일성을 갖는 서열을 포함하는 바이러스 벡터.
- 제 21 항에 있어서, 적어도 하나의 작은 RNA 서열은 SEQ ID NO: 13 또는 SEQ ID NO: 14 를 포함하는 바이러스 벡터.
- 제 1 항에 있어서, 바이러스 벡터는 렌티바이러스 벡터인 바이러스 벡터.
- 표적 세포를 감염시킬 수 있는 렌티바이러스 입자로서, 하기를 포함하는 렌티바이러스 입자:
표적 세포를 감염시키기 위해 최적화된 외피 단백질; 및
제 1 항에 따른 바이러스 벡터. - 제 29 항에 있어서, 표적 세포는 간 세포, 근육 세포, 상피 세포, 내피 세포, 신경 세포, 신경내분비 세포, 내분비 세포, 림프구, 골수 세포, 고형 기관 내에 존재하는 세포, 또는 조혈 계통의 세포, 조혈 줄기 세포, 또는 전구체 조혈 줄기 세포인 렌티바이러스 입자.
- 대상체에서 PKU 을 치료하는 방법으로서, 대상체에게 치료 유효량의 제 29 항 또는 제 30 항의 렌티바이러스 입자를 투여하는 것을 포함하는 방법.
- 대상체에서 PKU 을 예방하는 방법으로서, 대상체에게 치료 유효량의 제 29 항 또는 제 30 항의 렌티바이러스 입자를 투여하는 것을 포함하는 방법.
- 제 31 항 또는 제 32 항에 있어서, 대상체에서 PKU 표현형과 상관관계가 있는 PKU 유전자형을 진단하는 것을 추가로 포함하는 방법.
- 제 31 항 또는 제 32 항에 있어서, 대상체는 자궁 내에 (in utero) 있는 방법.
- 제 33 항에 있어서, 진단은 대상체의 태아기 스크리닝 동안 이루어지는 방법.
- 제 33 항에 있어서, 진단은 시험관 내에서 (in vitro) 이루어지는 방법.
- 제 31 항 또는 제 32 항에 있어서, 치료 유효량의 렌티바이러스 입자는 복수의 단일 용량의 렌티바이러스 입자를 포함하는 방법.
- 제 31 항 또는 제 32 항에 있어서, 치료 유효량의 렌티바이러스 입자는 단일 용량의 렌티바이러스 입자를 포함하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762566979P | 2017-10-02 | 2017-10-02 | |
| US62/566,979 | 2017-10-02 | ||
| PCT/US2018/053919 WO2019070674A2 (en) | 2017-10-02 | 2018-10-02 | VECTORS COMPRISING PROMOTER AND ACTIVATOR COMBINATIONS FOR THE TREATMENT OF PHENYLCETONURIA |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200057766A true KR20200057766A (ko) | 2020-05-26 |
Family
ID=65994855
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207012276A KR20200057766A (ko) | 2017-10-02 | 2018-10-02 | 페닐케톤뇨증을 치료하기 위한 프로모터 및 인핸서 조합을 포함하는 벡터 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20200318081A1 (ko) |
| EP (1) | EP3692157A4 (ko) |
| JP (2) | JP2020535828A (ko) |
| KR (1) | KR20200057766A (ko) |
| CN (1) | CN111433368A (ko) |
| AU (1) | AU2018345745A1 (ko) |
| BR (1) | BR112020006672A2 (ko) |
| CA (1) | CA3077355A1 (ko) |
| IL (1) | IL273670A (ko) |
| WO (1) | WO2019070674A2 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010045659A1 (en) | 2008-10-17 | 2010-04-22 | American Gene Technologies International Inc. | Safe lentiviral vectors for targeted delivery of multiple therapeutic molecules |
| WO2017123918A1 (en) | 2016-01-15 | 2017-07-20 | American Gene Technologies International Inc. | Methods and compositons for the activation of gamma-delta t-cells |
| US10137144B2 (en) | 2016-01-15 | 2018-11-27 | American Gene Technologies International Inc. | Methods and compositions for the activation of gamma-delta T-cells |
| EP3413926A4 (en) | 2016-02-08 | 2019-10-09 | American Gene Technologies International, Inc. | HIV VACCINATION AND IMMUNOTHERAPY |
| US10767183B2 (en) | 2016-03-09 | 2020-09-08 | American Gene Technologies International Inc. | Combination vectors and methods for treating cancer |
| WO2018009246A1 (en) | 2016-07-08 | 2018-01-11 | American Gene Technologies International Inc. | Hiv pre-immunization and immunotherapy |
| EP3487507A4 (en) | 2016-07-21 | 2020-04-08 | American Gene Technologies International, Inc. | VIRAL VECTORS FOR THE TREATMENT OF PARKINSON'S DISEASE |
| WO2018187231A2 (en) | 2017-04-03 | 2018-10-11 | American Gene Technologies International Inc. | Compositions and methods for treating phenylketonuria |
| JP2022535745A (ja) * | 2019-05-31 | 2022-08-10 | アメリカン ジーン テクノロジーズ インターナショナル インコーポレイテッド | 最適化されたフェニルアラニンヒドロキシラーゼ発現 |
| TW202208632A (zh) * | 2020-05-27 | 2022-03-01 | 美商同源醫藥公司 | 用於恢復pah基因功能的腺相關病毒組成物及其使用方法 |
| WO2023225569A1 (en) * | 2022-05-17 | 2023-11-23 | Umoja Biopharma, Inc. | Manufacturing viral particles |
| CN115772503B (zh) * | 2022-08-16 | 2023-10-17 | 广东省南山医药创新研究院 | 一种表达pah的基因修饰细胞药物及其制备方法与应用 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU1920201A (en) * | 1999-11-16 | 2001-05-30 | Genzyme Corporation | Improved regulatory elements for delivery to the liver |
| US20030198620A1 (en) * | 2002-04-16 | 2003-10-23 | Keiya Ozawa | Method of treating amino acid metabolic disorders using recombinant adeno-associated virus virions |
| US20050138677A1 (en) * | 2003-09-16 | 2005-06-23 | Pfister Herbert J. | Transgenic animal model for the treatment of skin tumors |
| EP2008656A1 (en) * | 2007-06-28 | 2008-12-31 | Bergen Teknologioverforing AS | Compositions for the treatment of hyperphenylalaninemia |
| SG10201609345QA (en) * | 2012-02-07 | 2017-01-27 | Global Bio Therapeutics Inc | Compartmentalized method of nucleic acid delivery and compositions and uses thereof |
| US10471132B2 (en) * | 2014-04-25 | 2019-11-12 | Genethon | Treatment of hyperbilirubinemia |
| WO2017100551A1 (en) * | 2015-12-09 | 2017-06-15 | Alexion Pharmaceuticals, Inc. | HETEROLOGOUS UTR SEQUENCES FOR ENHANCED mRNA EXPRESSION |
| WO2018187231A2 (en) * | 2017-04-03 | 2018-10-11 | American Gene Technologies International Inc. | Compositions and methods for treating phenylketonuria |
| CA3077651A1 (en) * | 2017-10-03 | 2019-04-11 | Joseph Lillegard | Vectors and methods of use |
| CA3099704A1 (en) * | 2018-05-09 | 2019-11-14 | Biomarin Pharmaceutical Inc. | Methods of treating phenylketonuria |
-
2018
- 2018-10-02 WO PCT/US2018/053919 patent/WO2019070674A2/en active Application Filing
- 2018-10-02 BR BR112020006672-9A patent/BR112020006672A2/pt unknown
- 2018-10-02 EP EP18864047.8A patent/EP3692157A4/en active Pending
- 2018-10-02 JP JP2020518812A patent/JP2020535828A/ja active Pending
- 2018-10-02 US US16/652,867 patent/US20200318081A1/en active Pending
- 2018-10-02 CN CN201880077904.0A patent/CN111433368A/zh active Pending
- 2018-10-02 CA CA3077355A patent/CA3077355A1/en active Pending
- 2018-10-02 AU AU2018345745A patent/AU2018345745A1/en active Pending
- 2018-10-02 KR KR1020207012276A patent/KR20200057766A/ko not_active Application Discontinuation
-
2020
- 2020-03-29 IL IL273670A patent/IL273670A/en unknown
-
2023
- 2023-06-21 JP JP2023101880A patent/JP2023115125A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CN111433368A (zh) | 2020-07-17 |
| AU2018345745A1 (en) | 2020-04-30 |
| JP2023115125A (ja) | 2023-08-18 |
| US20200318081A1 (en) | 2020-10-08 |
| EP3692157A4 (en) | 2021-06-23 |
| IL273670A (en) | 2020-05-31 |
| WO2019070674A2 (en) | 2019-04-11 |
| CA3077355A1 (en) | 2019-04-11 |
| JP2020535828A (ja) | 2020-12-10 |
| WO2019070674A3 (en) | 2019-05-23 |
| EP3692157A2 (en) | 2020-08-12 |
| BR112020006672A2 (pt) | 2020-09-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20200057766A (ko) | 페닐케톤뇨증을 치료하기 위한 프로모터 및 인핸서 조합을 포함하는 벡터 | |
| KR20190136048A (ko) | 페닐케톤뇨증을 치료하기 위한 조성물 및 방법 | |
| KR20220068954A (ko) | 최적화된 페닐알라닌 히드록실라아제 발현 | |
| CN107438671B (zh) | 变体RNAi | |
| US7226780B2 (en) | Lentivirus vector system | |
| US5650309A (en) | Viral vectors | |
| US20230285480A1 (en) | Viral vectors for treating parkinson's disease | |
| DK2986635T3 (en) | EFFECTIVE DELIVERY OF BIG GENES THROUGH DUAL-AAV VECTORS | |
| CN111569090A (zh) | 用于活化γ-δ T细胞的方法和组合物 | |
| TW201920679A (zh) | 眼部疾病之細胞模式及用於眼部疾病的療法 | |
| KR20200018586A (ko) | 인간 감마-델타 t-세포를 통한 종양 세포독성의 활성화를 위한 방법 및 조성물 | |
| AU2024201392A1 (en) | HIV immunotherapy with no pre-immunization step | |
| JP2002510199A (ja) | レンチウイルスをベースにした遺伝子転移ベクター | |
| KR20210119416A (ko) | 폐쇄-말단 dna (cedna), 및 유전자 또는 핵산 치료 관련 면역 반응을 감소시키는 방법에서의 이의 용도 | |
| KR20220066225A (ko) | 선택적 유전자 조절을 위한 조성물 및 방법 | |
| KR20220155981A (ko) | 미성숙 종결 코돈-매개 장애를 치료하기 위한 방법 및 조성물 | |
| KR20220140537A (ko) | Cdkl5 결핍 장애를 치료하기 위한 유전자 요법 | |
| WO2000040741A9 (en) | Lentivirus vector system | |
| CN117545842A (zh) | SMN1和miR-23a在治疗脊髓性肌萎缩中的协同效应 | |
| KR20220007601A (ko) | 치료제 투여를 위한 조성물 및 방법 | |
| CN116171325A (zh) | 用于eEF1A2的基因疗法载体及其用途 | |
| KR20230003478A (ko) | 비-바이러스성 dna 벡터 및 고셰 치료제 발현을 위한 이의 용도 | |
| Salani et al. | Newborn liver gene transfer by an HIV-2-based lentiviral vector | |
| CN113755524B (zh) | 用于治疗脊髓性肌萎缩的腺相关病毒载体及其用途 | |
| CN115244181A (zh) | 阿司匹林化合物在增加核酸表达中的新型用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal |