KR20180116359A - 인터루킨-6의 길항제 제제 및 이의 용도 - Google Patents
인터루킨-6의 길항제 제제 및 이의 용도 Download PDFInfo
- Publication number
- KR20180116359A KR20180116359A KR1020187027338A KR20187027338A KR20180116359A KR 20180116359 A KR20180116359 A KR 20180116359A KR 1020187027338 A KR1020187027338 A KR 1020187027338A KR 20187027338 A KR20187027338 A KR 20187027338A KR 20180116359 A KR20180116359 A KR 20180116359A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- formulation
- ser
- val
- seq
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/248—IL-6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Ophthalmology & Optometry (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Dermatology (AREA)
- Endocrinology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Inorganic Chemistry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Steroid Compounds (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
Abstract
본 명세서는 개체에 투여하도록 만들어진 인터루킨-6(interleukin-6, IL-6) 길항제, 예를 들면, IL-6 항체 분자를 포함하는 약학적 조성물 및 제제를 특징으로 한다. 본 명세서에서 제공하는 약학적 조성물 및 제제는 IL-6 관련 질병, 예를 들면, IL-6의 높아진 수준과 관련된 안구 질병을 가진 개체를 치료하는 의약품 제조 또는 방법에 사용하기 적합하다.
Description
관련 출원
본 출원은 2016년 2월 23일 출원된 미국 가특허출원 번호 62/298,774의 우선권을 주장하고, 상기 명세서의 내용은 본 명세서에 참조로 통합된다.
본 발명은 치료용 조성물 제제에 관한 것으로, 예를 들면, 인터루킨-6(interleukin-6, IL-6) 길항제에 관한 것이다.
IL-6는 다면발현성(pleiotropic) 사이토카인(cytokine)으로서, 염증, 혈액 생성, 혈관신생, 세포 분화 및 신경 세포 생존에 관여하는 것으로 알려져 있다.
요약
본 명세서는 IL-6 길항제(WO2014/074905에 기술된 바와 같이, 예를 들면, IL-6 항체 분자, 예를 들면, IL-6 항체 또는 그의 단편), 그 중에서도, IL-6 패밀리 사이토카인, 및 그의 단백질 복합체, 및/또는 그의 각각의 수용체(예를 들면, IL-6 수용체)를 조절하기 위해, 질환을 치료하기 위해, 및 IL-6를 검출하기 위해, 및/또는 IL-6에 결합하기 위해 사용되는 것을 포함하는 제제(예를 들면, 약학적 조성물, 예를 들면, 안정한 수성 제제)를 특징으로 한다. 본 명세서는 1 mg/ml 내지 100 mg/ml의 IL-6 길항제, 예를 들면, 항-IL-6 항체 또는 그의 단편을 포함하는 약학적 조성물을 기술한다. 실시예에서, 약학적 조성물은 5 mg/ml 내지 50 mg/ml의 IL-6 항체, 예를 들면, IL-6 항체 또는 그의 단편; 및 하나 이상의, 또는 모든, 버퍼(예를 들면, 완충제), 계면활성제(surfactant), 및 두개의 강장제(tonicity agent)(예를 들면, 당 및 염)를 포함한다.
제제
한 측면에서, 본 발명은 1 내지 100 mg/ml의 IL-6 길항제를 포함하는 제제, 예를 들면, 약학적 제제를 특징으로 한다. 일 실시예에서, 제제는 5 내지 50 mg/ml의 IL-6 길항제를 포함한다. 일 실시예에서, 제제는 약 5 mg/ml의 IL-6 길항제를 포함한다. 일 실시예에서, 제제는 약 50 mg/ml의 그의 IL-6 길항제를 포함한다. 본 명세서에 기술된 어느 제제에 있어서, IL-6 항체는 IL-6 항체 분자, 예를 들면, IL-6 항체 분자 또는 그의 단편일 수 있다.
한 측면에서, 본 발명은 1 내지 100 mg/ml의 IL-6 항체 또는 그의 단편을 포함하는 제제, 예를 들면, 약학적 제제를 특징으로 한다. 일 실시예에서, 제제는 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 1 내지 10 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 2 내지 3 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 3 내지 4 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 4 내지 5 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 5 내지 6 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 6 내지 7 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 7 내지 8 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 8 내지 9 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 9 내지 10 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 5 mg/ml, +/-10%의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 5 mg/ml, +/-20%의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 5 mg/ml, +/-30%의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 5 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 10 내지 100 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 20 내지 80 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 40 내지 60 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 20 내지 30 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 30 내지 40 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 40 내지 50 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 50 내지 60 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 60 내지 70 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 70 내지 80 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 80 내지 90 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 90 내지 100 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 50 mg/ml의 IL-6 항체 또는 그의 단편을 포함한다. 본 명세서는 전형적인 IL-6 항체 분자, 예를 들면, IL-6 항체 및 그의 단편을 제공한다. 일 실시예에서 본 발명에 개시된 IL-6 항체 분자 농도의 적어도 10% 낮은 농도 내지 10% 높은 농도의 IL-6 항체 분자, 예를 들면, IL-6 항체 또는 그의 단편의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 50 mg/mL +/-10%의 IL-6 분자, 예를 들면, IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 50 mg/mL +/-20%의 IL-6 항체 또는 그의 단편을 포함한다. 일 실시예에서, 제제는 50 mg/mL +/-30%의 IL-6 항체 또는 그의 단편을 포함한다.
일 실시예에서, 제제는 1 내지 50 mM의 히스티딘 버퍼(histidine buffer), 예를 들면, 5 내지 40 mM의 히스티딘 버퍼, 10 내지 30 mM의 히스티딘 버퍼, 또는 15 내지 25 mM의 히스티딘 버퍼를 더 포함한다. 일 실시예에서, 제제는 1 내지 10 mM의 히스티딘 버퍼, 10 내지 20 mM의 히스티딘 버퍼, 20 내지 30 mM의 히스티딘 버퍼, 30 내지 40 mM의 히스티딘 버퍼, 40 내지 50 mM의 히스티딘 버퍼, 5 내지 10 mM의 히스티딘 버퍼, 10 내지 15 mM의 히스티딘 버퍼, 15 내지 20 mM의 히스티딘 버퍼, 20 내지 25 mM의 히스티딘 버퍼, 25 내지 30 mM의 히스티딘 버퍼, 30 내지 35 mM의 히스티딘 버퍼, 35 내지 40 mM의 히스티딘 버퍼, 40 내지 45 mM의 히스티딘 버퍼, 또는 45 내지 50 mM의 히스티딘 버퍼를 더 포함한다. 일 실시예에서, 제제는 1 mM, 5 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 35 mM, 40 mM, 45 mM, 또는 50 mM의 히스티딘 버퍼를 더 포함한다. 일 실시예에서, 제제는 본 발명에 개시된 버퍼 농도의 적어도 10% 낮은 농도 내지 10% 높은 농도의 버퍼, 예를 들면, 히스티딘 버퍼의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 20 mM +/-10%의 히스티딘 버퍼를 포함한다. 일 실시예에서, 제제는 20 mM +/-30%의 히스티딘 버퍼를 포함한다.
일 실시예에서, 제제는 0.01% 내지 1% w/v(weight per volume)의 폴리소르베이트-20(polysorbate-20, 트윈-20(tween-20)), 폴리소르베이트-80(polysorbate-80, 트윈-80(tween-80)), 또는 폴록사머 188(poloxamer 188), 예를 들면, 0.01% 내지 0.5%, 0.01% 내지 0.1%, 0.01% 내지 0.05%, 0.02% 내지 0.04% w/v의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 더 포함한다. 일 실시예에서, 제제는 0.01% 내지 0.02%, 0.02% 내지 0.03%, 0.03% 내지 0.04%, 0.04% 내지 0.05%, 0.05% 내지 0.06%, 0.06% 내지 0.07%, 0.07% 내지 0.08%, 0.08% 내지 0.09%, 또는 0.09% 내지 0.1% w/v의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 더 포함한다. 일 실시예에서, 제제는 0.01%, 0.02%, 0.03%, 0.04%, 0.05%, 0.1%, 0.15%, 0.2%, 0.5%, 또는 1% w/v의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 더 포함한다. 일 실시예에서, 제제는 본 발명에 개시된 계면 활성제 농도의 적어도 10% 낮은 농도 내지 10% 높은 농도의 계면 활성제, 예를 들면, 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 0.03% +/-0.003%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 포함한다. 일 실시예에서, 제제는 0.03% +/-0.006%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 더 포함한다. 일 실시예에서, 제제는 0.03% +/-0.01%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 더 포함한다. 본 명세서에 기술된 어느 제제에 있어서, 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 및 폴록사머 188은 교환될 수 있다.
일 실시예에서, 제제는 1 내지 150 mM, 예를 들면, 1 내지 50 mM, 1 내지 25mM, 5 내지 100 mM, 10 내지 75 mM, 10 내지 50 mM, 10 내지 30 mM, 또는 15 내지 25 mM의 염화나트륨(sodium chloride)을 더 포함한다. 일 실시예에서, 제제는 1 내지 10 mM, 1 내지 20 mM, 5 내지 15 mM, 5 내지 25 mM, 10 내지 20 mM, 10 내지 30 mM, 15 내지 25 mM, 15 내지 35 mM, 20 내지 30 mM, 30 내지 40 mM, 40 내지 50 mM, 50 내지 60 mM, 70 내지 80 mM, 80 내지 90 mM, 90 내지 100 mM, 100 내지 110 mM, 110 내지 120 mM, 120 내지 130 mM, 130 내지 140 mM, 또는 140 내지 150 mM의 염화나트륨을 더 포함한다. 일 실시예에서, 제제는 약 1 mM, 5 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 50 mM, 100 mM, 또는 150 mM의 염화나트륨을 더 포함한다. 일 실시예에서, 제제는 본 발명에 개시된 염화나트륨 농도의 적어도 10% 낮은 농도 내지 10% 높은 농도의 염화나트륨 농도를 포함한다. 일례로, 일 실시예에서, 제제는 20 mM +/-10%의 염화나트륨을 포함한다. 일 실시예에서, 제제는 20 mM +/-20%의 염화나트륨을 더 포함한다. 일 실시예에서, 제제는 20 mM +/-30%의 염화나트륨을 더 포함한다.
일 실시예에서, 제제는 1% 내지 10%, 예를 들면, 1% 내지 8%, 1% 내지 6%, 2% 내지 5%, 또는 3% 내지 5%의 소르비톨(sorbitol)을 더 포함한다. 일 실시예에서, 제제는 1% 내지 10%의 소르비톨, 2% 내지 12%, 3% 내지 13%, 4% 내지 14%, 5% 내지 15%, 1% 내지 2%, 2%, 내지 3%, 3% 내지 4%, 4% 내지 5%, 5% 내지 6%, 6% 내지 7%, 7% 내지 8%, 8% 내지 9%, 또는 9% 내지 10%의 소르비톨을 더 포함한다. 일 실시예에서, 제제는 약 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 또는 10%의 소르비톨을 더 포함한다. 일 실시예에서, 제제는 본 발명에 개시된 소르비톨 농도의 적어도 10% 낮은 농도 내지 10% 높은 농도의 소르비톨 농도를 포함한다. 일례로, 일 실시예에서, 제제는 4% +/-0.4%의 소르비톨을 포함한다. 일 실시예에서, 제제는 4% +/-0.8%의 소르비톨을 포함한다. 일 실시예에서, 제제는 4% +/-1.2%의 소르비톨을 포함한다.
실시예에서, 제제의 pH는 약 5.5 내지 약 7.5, 예를 들면, 약 5.5 내지 약 7.0, 약 6.0 내지 약 7.0, 약 6.2 내지 약 6.8이다. 일 실시예에서, 제제의 pH는 약 5.5, 약 5.6, 약 5.7, 약 5.8, 약 5.9, 약 6.0, 약 6.1, 약 6.2, 약 6.3, 약 6.4, 약 6.5, 약 6.6, 약 6.7, 약 6.8, 약 6.9, 또는 약 7.0이다. 일 실시예에서, 제제의 pH는 약 6.5이다.
한 측면에서, 본 발명은 본 명세서에 기술된 1 내지 100 mg/ml 또는 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편, 10 내지 50 mM의 히스티딘 버퍼; 0.01% 내지 0.1%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 1 내지 150 mM의 염화나트륨; 및 1% 내지 10%의 소르비톨을 포함하고; 5.5 내지 7.5의 pH, 예를 들면, 6.5의 pH인 제제, 예를 들면, 약학적 제제를 특징으로 한다. 다른 측면에서, 본 발명은 본 명세서에 기술된 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편, 10 내지 30 mM의 히스티딘 버퍼; 0.01% 내지 0.05%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 10 내지 30 mM의 염화나트륨; 및 1% 내지 6%의 소르비톨을 포함하고; 6 내지 7의 pH, 예를 들면, 6.5의 pH인 제제, 예를 들면, 약학적 제제를 특징으로 한다. 또 다른 측면에서, 본 발명은 본 명세서에 기술된 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편, 15 내지 25 mM의 히스티딘 버퍼; 0.02% 내지 0.04%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 15 내지 25 mM의 염화나트륨; 및 3% 내지 5%의 소르비톨을 포함하고; 6.2 내지 6.8의 pH, 예를 들면, 6.5의 pH인 제제, 예를 들면, 약학적 제제를 특징으로 한다.
다른 측면에서, 본 발명은 본 명세서에 기술된 약 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20); 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고; 5.5의 pH인 제제, 예를 들면, 약학적 제제를 특징으로 한다. 일 실시예에서, 제제는 약 5 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고, pH는 5.5이다. 일 실시예에서, 제제는 약 50 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고, pH는 5.5이다.
다른 측면에서, 본 발명은 본 명세서에 기술된 약 5 내지 50 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고; 5.5의 pH인 제제, 예를 들면, 약학적 제제를 특징으로 한다. 일 실시예에서, 제제는 약 5 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고, pH는 5.5이다. 일 실시예에서, 제제는 약 50 mg/ml의 IL-6 항체 또는 그의 단편; 20 mM의 히스티딘 버퍼, 예를 들면, 히스티딘 HCl ; 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188; 20 mM의 염화나트륨; 및 4%의 소르비톨을 포함하고, pH는 5.5이다.
본 명세서에 기술된 어느 제제에 있어서, 제제는 하나 이상의, 또는 모든, 킬레이트제(chelating agent), 보존제(preserving agent), 점도제(viscosity agent), 침투 증진제(penetration enhancer) 또는 생체접착제(bioadhesive), 안정화제(stabilizer) 및/또는 항산화제(antioxidant)를 더 포함할 수 있다.
본 명세서에 기술된 어느 제제에 있어서, 제제는 제 2 치료제를 더 포함한다. 일 실시예에서, 제 2 치료제는 항-혈관내피 성장인자제(anti-vascular endothelial growth factor agent, anti-VEGF agent), 항-혈소판유래 성장인자제(anti-platelet derived growth factor agent, anti-PDGF agent), 또는 스테로이드, 예를 들면, 코르티코스테로이드(corticosteroid)이다. 본 명세서에 사용되는 항-혈관내피 성장인자제, 또는 항-혈소판유래 성장인자제는 혈관내피 성장인자 경로의 활성을 억제하거나 감소시키는 작은 분자, 펩타이드, 항체, 또는 핵산일 수 있다. 일 실시예에서, 항-혈관내피 성장인자제는 혈관내피 성장인자 경로의 구성성분, 예를 들면, 혈관내피 성장인자 또는 혈관내피 성장인자 수용체의 활성을 억제하거나 감소시키는 항체이다. 일 실시예에서, 항-혈소판유래 성장인자제는 혈소판유래 성장인자 경로의 구성성분, 예를 들면, 혈소판유래 성장인자 또는 혈소판유래 성장인자 수용체의 활성을 억제하거나 감소시키는 항체이다.
본 명세서에 기술된 어느 제제에 있어서, 제제는 실온 이하, 예를 들면, 약 20℃ 이하의 온도에서 안정하다. 일 실시예에서, 제제는 20℃ 이하, 10℃ 이하, 8℃ 이하, 4℃ 이하, 2℃ 이하, 영하 20℃ 이하, 영하 65℃ 이하, 영하 80℃ 이하, 또는 영하 100℃ 이하에서 안정하다. 일 실시예에서, 제제는 2 내지 20℃, 예를 들면, 2 내지 8℃에서 안정하다. 일 실시예에서, 제제는 적어도 1주일, 적어도 2주일, 적어도 1개월, 적어도 2개월, 적어도 4개월, 적어도 6개월, 적어도 12개월, 적어도 16개월, 적어도 20개월, 적어도 24개월, 또는 적어도 36개월 동안 안정하다. 일 실시예에서, 제제는 영하 65℃ 이하에서 적어도 1 또는 2년 동안 안정하다. 일 실시예에서, 제제는 2 내지 8℃에서 적어도 6개월 동안 안정하다.
IL-6 항체
본 명세서에 기술된 어느 제제에 있어서, IL-6 항체 분자, 예를 들면, 항체 또는 그의 단편은 표 1 또는 도 1a 또는 도 1b에서 제공되는 서열 또는 그의 부분을 포함한다. 일 실시예에서, IL-6 항체 분자, 예를 들면, 항체 또는 그의 단편은 서열번호 19의 서열을 포함하는 중쇄 가변 영역(heavy chain variable region, VH) 상보성 결정부위(complementarity determining region, CDR) 1, 서열번호 20의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 2, 및 서열번호 21의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 3을 포함한다. 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 22의 서열을 포함하는 경쇄 가변 영역(light chain variable region, VL) 상보성 결정부위 1, 서열번호 23의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 2, 및 서열번호 24의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 3을 더 포함한다. 다른 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 19의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 1, 서열번호 20의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 2, 및 서열번호 21의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 3; 및 서열번호 22의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 1, 서열번호 23의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 2, 및 서열번호 24의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 3을 포함한다.
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 28 또는 서열번호 29와 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 상동성을 가지는 불변영역(constant region) 서열을 포함한다(예를 들면, 서열로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 28 또는 서열번호 29를 포함하는 불변영역 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 17과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 상동성을 가지는 중쇄 가변 영역 서열을 포함한다(예를 들면, 서열로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 17을 포함하는 중쇄 가변 영역 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 13과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 상동성을 가지는 중쇄 서열을 포함한다(예를 들면, 서열로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 13을 포함하는 중쇄 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 18과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 상동성을 가지는 경쇄 가변 영역 서열을 포함한다(예를 들면, 서열로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 18, 또는 을 포함하는 경쇄 가변 영역 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 14와 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 상동성을 가지는 경쇄 서열을 포함한다(예를 들면, 서열로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 14를 포함하는 경쇄 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 17을 포함하는 중쇄 가변 영역 및 서열번호 18을 포함하는 경쇄 가변 영역을 포함한다(예를 들면, 영역으로 구성된다.). 일 실시예에서, IL-6 항체 또는 그의 단편은 서열번호 13을 포함하는 중쇄 서열 및 서열번호 14를 포함하는 경쇄 서열을 포함한다(예를 들면, 서열로 구성된다.).
일 실시예에서, 항-IL-6 항체는 IgG2 항체이다. 일 실시예에서, Il-6 항체는 전장(full-length) 항체이다. 본 명세서에 더 기술된 바와 같이, IgG2 항체는 항체의 중쇄와 경쇄 사이의 선택적인 이황화물 결합(disulfide bonding)으로 인해 상이한 구조적 아형(isoform), 예를 들면, 아형 IgG2-A, 아형 IgG2-A/B, 및 아형 IgG2-B, 또한 본 명세서에 참조된 바와 같이 아형 A, 아형 A/B, 또는 아형 B로 존재할 수 있다. 아형의 구조는 또한 도 11에 도시된다.
일 실시예에서, 제제에 존재하는 항체의 적어도 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%는 총괄하여 아형 A 또는 아형 A/B이다. 일 실시예에서, 제제에 존재하는 항체의 적어도 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 또는 90%는 총괄하여 아형 A이다. 일 실시예에서, 제제에 존재하는 항체는 아형 B가 5%, 4%, 3%, 2%, 1%, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 또는 0.1% 미만이다. 일 실시예에서, 제제에 존재하는 항체는 아형 B가 거의 없는, 예를 들면, 5% 미만, 4% 미만, 3% 미만, 2% 미만, 1% 미만, 또는 0.5% 미만이다. 제제에 존재하는 항체의 아형 A, A/B, 및/또는 B의 백분율, 양, 또는 수량은 고성능 액체 크로마토그래피(High performance liquid chromatography, HPLC), 예를 들면, 역상 고성능 액체 크로마토그래피(Reverse phase-HPLC, RP-HPLC), 또는 비환원 조건하에서 펩타이드 맵핑(peptide mapping), 이후 질량 분석기(mass spectrometry, MS) 분석으로 결정된다.
치료적 적용(Therapeutic Application)
본 명세서는 또한 IL-6 관련 질병 또는 질환을 갖는 개체를 치료하기 위한 조성물 및 방법을 제공한다. 방법은 개체에 본 명세서에 기술된 제제를 포함하는 약학적으로 유효한 양의 조성물을 투여하는 것을 포함한다. 실시예에서, 방법은 본 명세서에 기술된 IL-6 관련 질병 또는 질환을 갖는 개체를 확인하는 것; 및 개체에 본 명세서에 기술된 제제를 포함하는 약학적으로 유효한 양의 조성물을 투여하는 것을 포함한다.
본 명세서는 또한 개체의 IL-6 활성을 억제하는 방법을 기술한다. 방법은 개체에 본 명세서에 기술된 제제를 투여하는 것을 포함한다. 실시예에서, 개체는 본 명세서에 기술된 IL-6 관련 질병 또는 질환을 갖는다.
본 명세서는 또한 개체의 IL-6 관련 질병 또는 질환을 치료하거나 예방하기 위한 의약품 제조, 예를 들면, 개체의 IL-6 관련 질병 또는 질환을 치료하거나 예방하기 위해 개체에 투여하기 적합한 의약품 제조에서, 본 명세서에 기술된 조성물의 용도를 개시한다. 실시예에서, 의약품은 눈에 투여, 예를 들면, 안구 투여를 위한 것이다.
본 명세서에 기술된 IL-6 관련 질병 또는 질환, 예를 들면, 조성물 또는 제제를 투여하여 치료하기 위한 것은, 증가되거나 높아진 IL-6 발현 또는 활성과 관련될 수 있다. 일 실시예에서, IL-6 관련 질병 또는 질환의 하나 이상의 증상은 증가되거나 높아진 IL-6 발현 또는 활성과 관련될 수 있다. 증가되거나 높아진 IL-6 발현은 질병 발병 이전의 IL-6 발현 수준 또는 질병의 증상을 비교하여 개체에서 결정될 수 있다. 증가되거나 높아진 IL-6 발현은 IL-6 관련 질병 또는 질환을 갖지 않는 다른 개체와 비교하여 개체에서 결정될 수 있다. IL-6 관련 질병의 예로는 당뇨성 황반부종(diabetic macular edima, DME), 당뇨 망막증(diabetic retinopathy), 안구 건조(dry eye)(예를 들면, 안구 건조 질병(dry eye disease) 또는 안구 건조증(dry eye syndrome)), 알레르기성 결막염(allergic conjunctivitis), 포도막염(uveitis), 나이관련 황반변성(age-related macular degeneration, AMD)(예를 들면, 습성(삼출성)(wet(exudative)) 또는 건성(위축성)(dry(atrophic)) 나이관련 황반변성), 증식성 당뇨 망막증(proliferative diabetic retinopathy, PDR), 열공 망막 박리(Rhegmatogenous retinal detachment, RRD), 망막 정맥 폐색(retinal vein occlusion, RVO), 시신경 척수염(neuromyelitis optica, NMO), 각막 이식(corneal transplant), 각막 찰과상(corneal abrasion), 근시성 맥락막 신생혈관(myopic choroidal neovascularization), 안구암(ocular cancer)(예를 들면, 눈 또는 눈 주위의 영역, 예를 들면, 안와(eye socket) 및/또는 눈꺼풀(eyelids)에 영향을 미치는 암), 또는 눈의 물리적 손상이 있으나, 이에 한정되지 않는다.
몇가지 실시예에서, 제 2 치료제는 본 명세서에 기술된 제제와 함께 개체에 투여된다. 일 실시예에서, 제 2 치료제는 본 명세서에 기술된 제제와는 별도의 조성물로 투여된다. 일 실시예에서, 본 명세서에 기술된 제제는 제 2 치료제를 포함한다. 적합한 제 2 치료제는 본 명세서에 기술된 IL-6 관련 질병 또는 질환을 치료하기 위해 시판되거나 공지된 모든 치료제를 포함한다. 일 실시예에서, 제 2 치료제는 항-혈관내피 성장인자제, 항-혈소판유래 성장인자제, 또는 스테로이드이다.
일반적으로, 본 명세서에 기술된 바와 같이 치료되는 개체는 사람, 또는 개 또는 고양이와 같은 다른 포유동물이다. 몇가지 실시예에서, 개체는 이전에 항-혈관내피 성장인자제 또는 스테로이드로 치료받은 적이 있다. 몇가지 실시예에서, 개체는 항-혈관내피 성장인자제 또는 스테로이드 치료에 내성 또는 저항이 있는, 예를 들면, 개체는 항-혈관내피 성장인자제 또는 스테로이드에 치료반응을 나타내지 않았던 개체이다. 실시예에서, 주어진 치료에 반응을 나타내지 않는 개체는 주어진 치료를 투여한 후 질병 또는 질환, 예를 들면, IL-6 관련 질병의 하나 이상의 증상이 호전되거나 감소되지 않는다.
다른 측면에서, 본 발명은 본 명세서에 기술된 제제를 포함하는 장치, 예를 들면, 약물 전달 장치(drug delivery device)를 특징으로 한다.
다른 측면에서, 본 발명은 본 명세서에 기술된 제제를 포함하는 용기(container) 또는 장치를 특징으로 한다. 일 실시예에서, 용기는 다회용량(multidose) 용기이다. 일 실시예에서, 용기는 0.1 ml, 0.2 ml, 0.3 ml, 0.4 ml, 0.5 ml, 0.6 ml, 0.7 ml, 0.8 ml, 0.9 ml, 또는 1.0 ml의 부피를 유지한다.
다른 측면에서, 본 발명은 본 명세서에 기술된 제제, 및 선택적으로 사용 지침을 포함하는 키트를 특징으로 한다. 일 실시예에서, 키트는 본 명세서에 기술된 제제를 포함하는 하나 이상의 용기 또는 장치, 및 선택적으로 사용 지침을 포함한다.
달리 정의되지 않는 한, 본 명세서에 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 기술 분야의 당업자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다.
용어 "a" 및 "an"은 글의 문법적 대상의 하나 또는 하나 이상(즉, 적어도 하나)을 의미한다. 예로서, "하나의 요소(an element)"는 하나의 요소 또는 하나 이상의 요소를 의미한다.
양, 일시적 지속 기간 등과 같은 측정 가능한 값을 언급 할 때 용어 "약(about)"은 특정 값으로부터 ±20% 또는 일부 경우 ±10%, 또는 일부 경우 ±5%, 또는 일부 경우 ±1%, 또는 일부 경우 ±0.1%의 변화를 포함하는 것을 의미하는 데, 이는 상기 변화가 개시된 방법을 수행하기에 적절하기 때문이다.
본 명세서에 인용 된 모든 특허, 공개된 특허 출원, 및 공개된 참고 문헌은 모든 목적을 위해 참고 문헌으로 포함된다.
도 1a는 EBI-029(서열번호 1), EBI-030(서열번호 13), 및 EBI-031(EBI-031은 본 명세서에서 EBI-030-H311A로도 지칭됨)(서열 번호 25)의 중쇄 서열에서 프레임워크 영역(framework regions, FR) 1, 상보성 결정부위(complementarity determining region, CDR) 1, FR2, CDR2, FR3, CDR3, FR4, 중쇄 불변영역(constant heavy chain domain, CH) 1, 힌지(hinge), CH2 및 CH3의 위치를 나타낸다.
도 1b는 경쇄 서열(EBI-029, EBI-030 및 EBI-031은 동일한 경쇄 서열을 갖는다)(서열 번호 3)에서 FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4, 및 CK의 위치를 나타낸다.
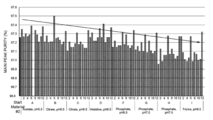
도 2a 및 2b는 테스트된 서로 다른 버퍼에 따라 증가된 pH(도 2a), 또는 테스트된 서로 다른 부형제(excipient)(도 2b)와 크기 배제 초 고성능 액체 크로마토 그래피(Size-Exclusion Ultra Performance Liquid Chromatography, SE-UPLC) 분석으로 결정되는 주 피크 순도(main peak purity)(%)간의 관계를 도시한 도이다.
도 3a, 3b, 3c, 3d, 및 3e는 실시예 3에 기술된 바와 같이, 7일 째에 수행된 SE-UPLC 분석의 결과를 도시한다.
도 4는 테스트된 서로 다른 버퍼에 따라 증가된 pH와 SE-UPLC 분석으로 결정되는 주 피크 순도(%)간의 관계를 도시한 도이다. 각각의 테스트된 버퍼는 도 4에 보이는 바와 같이 96 웰 플레이트(well plate) 배치(layout)의 웰 지정(designation)에 의해 x축에 표시된다.
도 5는 테스트된 서로 다른 버퍼에 따라 증가된 pH와 SE-UPLC 분석으로 결정되는 고 분자량(high molecular weight, HMW) 피크간의 관계를 도시한 도이다. 각각의 테스트된 버퍼는 도 4에 보이는 바와 같이 96 웰 플레이트 배치의 웰 지정에 의해 x축에 표시된다.
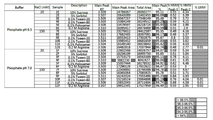
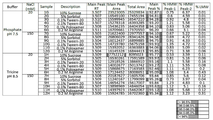
도 6은 히스티딘 버퍼를 포함하는 시료의 서로 다른 염 농도 및 부형제에 관한 주요 피크 순도(%)를 도시한 도이다. x축에서, 1 내지 12의 숫자는 도 4에 열거된 1 내지 12열에 있는 염 농도 및 부형제를 나타낸다.
도 7은 SE-UPLC 분석에 의해 결정되고, 실시예 4에 기술된 첫 번째 교반 연구의 결과를 요약한다.
도 8a, 8b, 및 8c는 SE-UPLC 분석에 의해 결정되고, 실시예 4에 기술된 두 번째 교반 연구의 결과를 요약한다.
도 9a, 9b, 9c 및 9d는 서로 다르게 사용된 교반 조건 하에서 테스트된 각각의 부형제에 관한 총 피크 영역(total peak area)(도 9a), IgG 주 피크 순도(도 9b), 고 분자량 종(species)(도 9c), 및 저 분자량(low molecular weight, LMW) 종(도 9d)을 도시한 도이다.
도 10은 이황화물 셔플링(disulfide shuffling)에 의한 IgG2 항체의 서로 다른 3개의 구조적 아형(structural isoform)의 개략도를 도시한다.
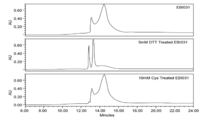
도 11은 EBI-031 시료의 RP-HPLC 크로마토그램(chromatogram)을 도시한다: 무처리(상부 패널), 5 mM의 DTT(중간 패널), 10 mM의 시스테인(cysteine)(하부 패널).
도 12는 서로 다른 EBI-031 세포주로부터 채취된 EBI-031 시료의 RP-HPLC 크로마토그램을 도시한다: 클론 세포주(clonal cell line)의 200L 규모 배양(상부 패널), 부모 세포주(parental cell line)의 10L 규모 배양(중간 패널), 및 안정적으로 트렌스펙션된 세포 풀(pool)(하부 패널).
도 13은 클론 세포주의 200L 규모 배양으로부터 채취된 EBI-031의 RP-HPLC 크로마토그램을 도시하고, 크로마토그램에서 각 피크가 나타내는 아형을 지정하고 정량화한다.
도 1b는 경쇄 서열(EBI-029, EBI-030 및 EBI-031은 동일한 경쇄 서열을 갖는다)(서열 번호 3)에서 FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4, 및 CK의 위치를 나타낸다.
도 2a 및 2b는 테스트된 서로 다른 버퍼에 따라 증가된 pH(도 2a), 또는 테스트된 서로 다른 부형제(excipient)(도 2b)와 크기 배제 초 고성능 액체 크로마토 그래피(Size-Exclusion Ultra Performance Liquid Chromatography, SE-UPLC) 분석으로 결정되는 주 피크 순도(main peak purity)(%)간의 관계를 도시한 도이다.
도 3a, 3b, 3c, 3d, 및 3e는 실시예 3에 기술된 바와 같이, 7일 째에 수행된 SE-UPLC 분석의 결과를 도시한다.
도 4는 테스트된 서로 다른 버퍼에 따라 증가된 pH와 SE-UPLC 분석으로 결정되는 주 피크 순도(%)간의 관계를 도시한 도이다. 각각의 테스트된 버퍼는 도 4에 보이는 바와 같이 96 웰 플레이트(well plate) 배치(layout)의 웰 지정(designation)에 의해 x축에 표시된다.
도 5는 테스트된 서로 다른 버퍼에 따라 증가된 pH와 SE-UPLC 분석으로 결정되는 고 분자량(high molecular weight, HMW) 피크간의 관계를 도시한 도이다. 각각의 테스트된 버퍼는 도 4에 보이는 바와 같이 96 웰 플레이트 배치의 웰 지정에 의해 x축에 표시된다.
도 6은 히스티딘 버퍼를 포함하는 시료의 서로 다른 염 농도 및 부형제에 관한 주요 피크 순도(%)를 도시한 도이다. x축에서, 1 내지 12의 숫자는 도 4에 열거된 1 내지 12열에 있는 염 농도 및 부형제를 나타낸다.
도 7은 SE-UPLC 분석에 의해 결정되고, 실시예 4에 기술된 첫 번째 교반 연구의 결과를 요약한다.
도 8a, 8b, 및 8c는 SE-UPLC 분석에 의해 결정되고, 실시예 4에 기술된 두 번째 교반 연구의 결과를 요약한다.
도 9a, 9b, 9c 및 9d는 서로 다르게 사용된 교반 조건 하에서 테스트된 각각의 부형제에 관한 총 피크 영역(total peak area)(도 9a), IgG 주 피크 순도(도 9b), 고 분자량 종(species)(도 9c), 및 저 분자량(low molecular weight, LMW) 종(도 9d)을 도시한 도이다.
도 10은 이황화물 셔플링(disulfide shuffling)에 의한 IgG2 항체의 서로 다른 3개의 구조적 아형(structural isoform)의 개략도를 도시한다.
도 11은 EBI-031 시료의 RP-HPLC 크로마토그램(chromatogram)을 도시한다: 무처리(상부 패널), 5 mM의 DTT(중간 패널), 10 mM의 시스테인(cysteine)(하부 패널).
도 12는 서로 다른 EBI-031 세포주로부터 채취된 EBI-031 시료의 RP-HPLC 크로마토그램을 도시한다: 클론 세포주(clonal cell line)의 200L 규모 배양(상부 패널), 부모 세포주(parental cell line)의 10L 규모 배양(중간 패널), 및 안정적으로 트렌스펙션된 세포 풀(pool)(하부 패널).
도 13은 클론 세포주의 200L 규모 배양으로부터 채취된 EBI-031의 RP-HPLC 크로마토그램을 도시하고, 크로마토그램에서 각 피크가 나타내는 아형을 지정하고 정량화한다.
본 명세서는 IL-6 길항제, 예를 들면, IL-6 항체 또는 그의 단편을 그러한 제제로 치료할 필요가 있는 개체에 제공하는 데 유용한 제제를 제공한다. 실시예에서, 개체는 IL-6 관련 질병 또는 질환, 예를 들면, 높아진 또는 증가된 IL-6 발현 및/또는 활성과 관련된 질병을 가지거나 가질 위험이 있다. 또한, 본 명세서는 상기 제제를 제조하고 투여하는 방법을 개시한다.
본 명세서에 기술된 제제는 환자에게 투여하기 적합하고, 온도 변화 및 연장된 기간에 대해 개선된 안전성을 제공하도록 제제화되고 최적화되었다.
특히, IgG2 항체로부터 유래된 불변영역, 예를 들면, 본 명세서에 기술된 IgG2 불변영역을 포함하는 IL-6 항체를 포함하는 본 명세서에 기술된 제제에서, 제제는 서로 다른 IgG2 구조적 아형, 예를 들면, 주로 아형 A 및 아형 A/B, 및 매우 적은 또는 무시할만한 양의 아형 B의 최적 분포를 포함한다. 구조적 아형 B는 항체의 응집, 감소된 기능, 및 감소된 안정성과 관련될 수 있다. 따라서, 본 발명의 항체를 포함하는 조성물 및 제제는 당업계에 알려진 IgG2 항체를 포함하는 다른 조성물 또는 제제보다 덜 이질적(heterogeneous)이다.
IL-6 항체
본 발명은 본 명세서에 IL-6a로도 지칭되는 IL-6 항체의 전달을 위한 제제를 제공한다. 일반적으로, 본 명세서에 기술된 IL-6 항체(IL-6a)는 IL-6와 결합할 수 있고, 적어도 하나의 IL-6 활성을 억제하거나 감소시킨다. IL-6 활성은 다음 중 하나 이상을 포함할 수 있다: gp130에의 결합; IL-6 신호 전달 경로의 활성화; JAK 키나아제(kinase)의 활성화, 예를 들면, JAK 키나아제 표적의 인산화; STAT 단백질의 활성화, 예를 들면, STAT 단백질의 인산화; 및/또는 STAT 표적 유전자의 발현
일 실시예에서, 본 명세서에 기술된 IL-6a는 IL-6의 부위(site) II(부위 2)에 특이적으로 결합하고 IL-6 관련 질병, 예를 들면, IL-6 관련 눈 질병 및 본 명세서에 기술된 특정 다른 질병을 치료하는데 유용하다.
몇가지 실시예에서, IL-6a는 다음 중 하나 이상의 특성을 특징으로 한다: 유리 IL-6(예를 들면, 가용성(soluble) IL-6) 또는 결합된 IL-6(예를 들면, IL-6 수용체에 결합된 IL-6) 또는 유리 및 결합된 IL-6 모두에 높은 친화성(affinity)을 가짐; 생체내에서 상대적으로 안정함; IL-6R에 결합된 IL-6(본 명세서에서 IL-6/IL-6R 복합체 또는 IL-6/IL-6R로 지칭됨)의 gp130에 대한 결합을 저해할 수 있음; 및/또는 약학적 효과를 가질 수 있음.
일 실시예에서, IL-6a는 항체 또는 항체로부터 유래된 단편이다. 예를 들면, IL-6a는 IL-6의 부위 II에 특이적으로 결합할 수 있는 높은 친화성의 인체화된 Fab이고, 시스 및 트랜스 IL-6 신호 전달을 모두 강력히 차단 한다. 다른 예시로, IL-6a는 전장 항체, 예를 들면, IgG1 또는 IgG2 항체이다.
일 실시예에서, IL-6a는 IL-6의 부위 II에 선택적으로 결합하고, IL-6 신호 전달의 광범위한 억제를 제공하는데, 이는 상기 분자가 IL-6가 유리 상태인지, 또는 막 IL-6R 또는 sIL-6R에 결합한 상태인지와 관계없이, gp130이 IL-6에 결합하는 것을 억제할 수 있기 때문이다. 또한, IL-6 수용체와는 대조적으로, 리간드(IL-6)를 표적으로 하는 것은 항체 의존성 세포 매개 세포 독성(antibody-dependent cell-mediated cytotoxicity, ADCC))으로 인한 수용체 매개 클리어런스(clearance) 및 독성을 회피할 수 있다.
IL-6는 질병에서 병리학적 및 보호적 역할을 하기 때문에, 증가된 IL-6와 관련된 질병을 치료하기 위한 IL-6 길항제(IL-6a)의 사용은 특정 상태의 증상을 개선시킬 수 있으나, 또한 심각한 부작용, 예를 들면, 전신 작용(systemic effects)을 유발할 수 있다. IL-6 경로의 이러한 이중성(즉, 바람직한 및/또는 바람직하지 않은 효과를 갖는 능력)은 IL-6 관련 질환을 전신 억제제로 치료하는 것을 바람직하지 않게 만들 수 있다. 따라서, 본 명세서에서 제공된 조성물 및 방법은 적어도 하나의 IL-6 활성을 억제하는 치료에 유용하지만, IL-6의 양성 활성에 과도한 영향을 미치지 않는데, 이는 상기 조성물이 국소 전달, 예를 들면, 눈에 국부적으로 전달되기 위해 제제화되기 때문이다. 예를 들면, 특정 측면에서, IL-6a는 특정 부위에 전달되기 적합한 크기로 설계된다. 몇가지 실시예에서, IL-6a는 전장 항체이다. 몇가지 실시예에서, IL-6a는 항체로부터 유래되고, 눈의 특정 구획, 예를 들면, 눈의 유리체에서 더 긴 체류(residency) 및 제한된 전신 누출(systemic leakage)을 갖는 형태이다. 몇가지 실시예에서, IL-6a는 상응하는 비변형 항체에 비해 눈의 유리체에서 더 긴 체류 및/또한 더 제한된 전신 누출을 갖는 변형된 항체(예를 들면, 변형된 Fc 영역을 갖는 항체)이다. 몇가지 실시예에서, IL-6a는 IgG2 항체이다.
몇가지 측면에서, IL-6a는 IL-6 항체의 단편 또는 전장 항체보다 작은 항체의 유도체, 예를 들면, IL-6 항체로부터 유래된 Fab와 같은 상대적으로 작은 IL-6a이다. 몇가지 경우에서, IL-6a는 상응하는 전장 IL-6 항체에 비해 증가된 동역학(kinetics)으로 조직의 한 부분에서 다른 부분으로 통과할 수 있는 형태이다. 몇가지 실시예에서, IL-6a는 더 큰 분자가 되도록 조작된 Fab이고, 이는 Fab 단독 보다 전달된 위치에서 증가된 체류를 가지기 쉬우며, 예를 들면, IL-6a는 Fc 영역을 통해 이량체화(dimerized) 된다. 특정 실시예에서, Fc 영역은 야생형 Fc를 포함하는 동일한 IL-6 결합 독립체(entity)에 비해, Fc 부분(moiety)이 전신 축적을 감소시킬 수 있는 FcRn 결합을 제거하거나 감소시키도록 조작되었다. 조작된 Fc 영역은 예를 들면, IgG1 영역 또는 IgG2 영역일 수 있다.
전형적으로, 본 명세서에 기술된 IL-6 길항제는 적어도 하나의 바람직하지 않은 IL-6 효과를 개선시키는데 효과적일 정도로 그 표적인 IL-6에 충분히 높은 친화성을 갖고, 치료제로서 유용할 정도로 충분히 안정적이다.
일반적으로, IL-6a, 예를 들면, 눈에 사용하기 적합한 IL-6a의 PK는 전달 부위, 예를 들면, 유리체에서 치료 효과를 제공할 정도로 충분히 긴 반감기를 가진다. 한정적이지 않은 예에서, PK는 적어도 8일, 10일, 14일, 21일, 28일, 또는 30일의 반감기일 수 있다.
부위 II에 결합하는 IL-6 길항제의 확인(identification)
일반적으로, IL-6에 결합할 수 있는 분자를 만들기 위해 당업계에 공지된 모든 방법이 사용될 수 있고, 예를 들면, IL-6에 결합하는 폴리펩타이드(polypeptide) 또는 화합물의 능력에 대한 분석에서 후보 화합물을 위해 폴리펩타이드 라이브러리(library) 또는 분자 라이브러리가 스크리닝될 수 있다. 상기 후보 화합물이 확인되면, 화합물의 결합 부위는 당업계에 공지된 방법을 이용해 결정될 수 있다. 예를 들면, 분자는 부위 I, 부위 II, 또는 부위 III에서 돌연변이 된 IL-6에 결합하는 화합물의 능력과 비교한, 야생형 IL-6에 결합하는 능력 및 결합을 위해 시험될 수 있다. 몇가지 실시예에서, 본 명세서에 기술된 IL-6a는 IL-6/IL-6Rα 복합체 및 IL-6에 결합하는 능력을 보유하고, IL-6/IL-6Rα가 gp130에 결합하는 것을 방지한다. 몇가지 실시예에서, 본 명세서에 기술된 IL-6a는 IL-6/IL-6Rα 복합체에 결합하기 위해, 예를 들면, IL-6의 부위 II에 결합함으로써 gp130과 경쟁할 수 있다. 상기 결합 능력은 당업계에 공지된 방법을 이용해 분석될 수 있다.
IL-6a 후보물질은 예를 들면, HEK-Blue™ IL-6 분석 시스템(InvivoGen, San Diego)을 이용해 시험할 수 있다. HEK-Blue™ IL-6 세포는 사람 IL-6R 및 STAT-3 유도성 SEAP 리포터 유전자로 안정적으로 형질감염된 HEK293 세포이다. IL-6 존재 하에서, STAT-3가 활성화되고 SEAP가 분비된다. SEAP는 예를 들면, QUANTI-Blue™(InvivoGen, San Diego)을 이용해 평가할 수 있다. 세포에 IL-6 길항제를 첨가하면 IL-6에 결합하는 유리 및 가용성 수용체 모두를 억제함으로써 분비를 방지하거나 SEAP 수준을 감소시킨다.
KD는 특정 항체-항원 상호작용 또는 항체 단편-항원 상호작용의 결합 친화성 평형상수를 의미한다. 몇가지 실시예에서, 본 명세서에 기술된 항체 또는 항원 결합 단편은 250 pM 이하, 예를 들면, 225 pM, 220 pM, 210 pM, 205 pM, 150 pM, 100 pM, 50 pM, 20 pM, 10 pM, 또는 1 pM 이하의 KD로 항원(예를 들면, IL-6)에 결합한다. KD는 당업계에 공지된 방법, 예를 들면, 표면 플라스몬 공명(surface plasmon resonance), 예를 들면, BiaCore™ 시스템을 이용해 결정될 수 있다.
Koff는 특정 항체-항원 상호작용 또는 항체 단편-항원 복합체의 해리 속도상수를 의미한다. 해리 속도상수는 표면 플라스몬 공명(surface plasmon resonance), 예를 들면, BiaCore™ 시스템을 이용해 결정될 수 있다. 상대적으로 느린 Koff는 치료제의 바람직한 특징에 기여할 수 있고, 예를 들면, 이러한 치료를 필요로하는 개체에 억제제를 덜 빈번하게 투여하게할 수 있다.
특이성(specificity)
몇가지 실시예에서, 본 명세서에 기술된 IL-6a는 표적, 예를 들면, IL-6에 특이적으로 결합한다. 일반적으로, 본 명세서에 사용되는 "특이적인 결합"은 분자가 선택된 분자에 우선적으로 결합하는 것, 및 하나 이상의 다른 분자에 대해 훨씬 낮은 결합 친화성을 보이는 것을 나타낸다. 몇가지 실시예에서, 다른 분자에 대한 결합 친화성은 표적에 대한 결합 친화성보다 1, 2, 3배 이상 더 낮다.
상기 논의된 바와 같이, IL-6는 유리 IL-6 및 가용성 IL-6Rα에 결합한 IL-6로서 존재할 수 있다. 본 출원인은 IL-6의 부위 I에 결합하는 억제제에 비해 IL-6 길항제의 최적의 표적으로서 IL-6의 부위 II를 확인하였다. 부위 I의 억제제는 유리 IL-6가 IL-6Rα에 결합하는 것을 억제할 수 있다. 그러나, 상기 억제제는 복합체의 Koff에 의해 제한된 대체를 제외하고는 기존에 존재하는 IL-6/IL-6R 복합체에 의해 개시되는 활성을 방지할 수 없다. 또 다른 대안인 IL-6Rα에 결합하는 억제제는 그것이 포화 농도로 존재하지 않는 한 IL-6 활성을 방지하는 데 제한된 능력을 가질 수 있기 때문에 덜 적합하다. IL-6 수용체의 양은 일반적으로 IL-6에 비해 상당히 높기 때문에, 이 접근법은 수용체에 결합함으로써 IL-6 활성을 방지하는 조성물의 바람직하지 못한 많은 양의 투여를 요구할 수 있다. 몇가지 실시예에서, 본 명세서에 기술된 IL-6 길항제(예를 들면, 본 명세서에 기술된 항체 및 그의 단편 및 그의 유도체)는 IL-6가 IL-6R에 결합될지라도 IL-6의 활성을 차단할 수 있다. 따라서, 본 명세서에 기술된 IL-6a의 이점은 IL-6 수용체를 표적으로하는 억제제에 비해 치료 효과를 달성하기 위해 상대적으로 적은 양의 화합물 투여가 필요할 수 있다는 것이다. 항-수용체 항체는 그들의 PK를 상당히 제한하는 수용체 매개 클리어런스에 신속히 제거되는 것으로 보고되었고, 따라서 더 많은 용량, 더 빈번한 투여, 또는 두가지 모두를 필요로 한다. 또한, 항-수용체 및 항- 부위 I IL-6 항체 모두는 리간드의 정상적인 수용체 매개 클리어런스 경로를 방해함으로써 IL-6의 조직 농도를 상당히 증가시키고, 이로 인해 피험자를 조직에서 잠재적으로 바람직하지 않은 수준의 IL-6에 노출시키는 문제점을 제기한다. 또한, IL-6Rα를 표적으로하는 억제제의 사용은 억제가 요구되는 부위 및 그것이 바람직하지 않은 부위, 예를 들면, 전신 치료 부위 모두의 근처에서 억제제의 존재를 필요로 할 수 있다. gp130이 결합하는 부위인 부위 II에 결합하는 IL-6의 사용은 유리 IL-6 뿐만 아니라, IL-6R에 결합하지만 아직 gp130을 통한 IL-6 경로를 활성화시키지 않은 IL-6를 통한 억제를 가능하게 한다. 따라서, 이론에 얽매이지 않고, 본 명세서에 기술된 IL-6 길항제는 IL-6의 두가지 형태(가용성 및 수용체 결합)에 결합하도록 설계되고, 구체적으로 IL-6 길항제는 IL-6의 부위 II에 결합하고, 두가지 형태 모두에 접근 가능하다. 본 명세서에 기술된 IL-6a를 함유하는 조성물은 IL-6에 의한 시스(cis) 및 트랜스(trans) 신호를 모두 억제할 수 있다.
몇가지 경우에서, 본 명세서에 제공된 화합물 및 방법은 IL-6 관련 질환의 적어도 하나의 징후 또는 증상, 예를 들면, 혈관 신생 및/또는 염증을 억제할 정도로 충분히 효과적인 IL-6 차단을 제공하도록 설계된다.
본 명세서에 기술된 화합물은 예를 들면, 유리체에서, 바람직하지 않게 높은 수준의 IL-6를 특징으로하는 안 질환을 치료하기에 유용하다(Yuuki et al., J Diabetes Compl, 15:257, 2001; Funatsu et al., Ophthalmology, 110:1690, 2003; Oh et al., Curr Eye Res, 35:1116, 2010; Noma et al., Eye, 22:42, 2008; Kawashima et al., Jpn J Ophthalmol, 51:100, 2007; Kauffman et al., Invest Ophthalmol Vis Sci, 35:900, 1994; Miao et al., Molec Vis, 18:574, 2012).
일반적으로, 본 명세서에 기술된 IL-6a는 IL-6 신호의 강력한 길항제이다. 몇가지 실시예에서, 본 명세서에 기술된 IL-6a는 IL-6에 높은 친화성을 가지는데, 예를 들면, 10 pM의 IL-6을 사용하는 HEK-Blue IL-6 분석에서 100 pM 이하의 IC50을 갖는다. IL-6a의 높은 친화성은 IL-6a의 KD, 예를 들면, 1 nM 이하, 500 pM 이하, 400 pM 이하, 300 pM 이하, 240 pM 이하 또는 200 pM 이하의 KD에 기초하여 결정될 수 있다.
증가된 IL-6 발현 또는 활성과 관련된 질환을 치료하는데 유용한 생물학적 IL-6a(예를 들면, 항체, 그의 단편 또는 그의 유도체와 같은 단백질 또는 폴리펩타이드)를 생산하기 위해, 전형적으로 생물학적 IL-6a는 높은 생산성을 갖는 것이 바람직하다. 예를 들면, 적합한 생산성은 1 g/L 이상(예를 들면, 2 g/L 이상, 5 g/L 이상, 또는 10 g/L 이상)이다.
IL-6 길항제를 효과적으로 투여하기 위해, 억제제는 투여될 농도와 양립할 수 있는 용해도를 갖는 것이 필요하다. 예를 들면, 전장 항체 IL-6a의 경우, 용해도는 20 mg/ml 이상, 10 mg/ml 이상, 5 mg/ml 이상 또는 1 mg/ml 이상이다.
또한, 실행 가능한 치료법으로서, 억제제는 전달 및 활성 부위의 체온에서 높은 안정성 뿐만 아니라 저장 안정성을 가져야 한다. 몇가지 실시예에서, 억제제는 60℃ 이상(예를 들면, 60℃ 이상, 62.5℃ 이상, 65℃ 이상, 70℃ 이상, 73℃ 이상, 또는 75℃ 이상)의 Tm을 가진다. 몇가지 실시예에서, 억제제는 45℃ 이상, 예를 들면, 50℃ 이상, 51℃ 이상, 55℃ 이상, 또는 60℃ 이상의 Tonset을 가진다. Tm 및 Tonset을 결정하는 방법은 당업계에 공지된 방법을 이용해 결정될 수 있다.
원하는 특징을 갖는 길항제는 당업계에 공지된 적합한 유형의 분자, 예를 들면, 모체 IL-6 항체의 충분한 특징(예를 들면, 원하는 결합 특성)을 일반적으로 보유하거나 유지하는 IL-6 부위 II를 표적으로하는 항체의 단편 및 유도체를 포함하는 항체에서 선택될 수 있다. 상기 길항제는 Fc 부분을 포함하도록 조작된 Fab 단편, scFvs, Fab 단편, 및 모체 IL-6 부위 II를 표적하는 항체와 다른 프레임워크(framework)을 갖도록 조작된 전장 항체를 포함한다.
몇가지 측면에서, 본 명세서에 개시된 IL-6a는 IL-6의 부위 II에 결합할 수 있는 항체 또는 그의 단편과 경쟁하거나 교차 경쟁할 수 있는 인간 항체 항원 결합 부위를 포함한다. 예를 들면, 항체 또는 그의 단편은 본 명세서에 개시된 VH 영역 및 VL 영역으로 구성될 수 있고, VH 및 VL 영역은 본 명세서에 개시된 IL-6/부위 II에 결합하는 항체의 CDRs 세트를 포함한다.
IL-6a에 의해 결합된 영역 및/또는 항원 결정기(epitope)를 결정하기 위해, 예를 들면, IL-6상의 다양한 부위를 돌연변이시킴으로써, 모든 적합한 방법을 사용할 수 있다.
돌연변이가 IL-6a 및 IL-6 리간드의 결합을 방지 또는 감소시키는 부위는 IL-6a와의 결합에 직접적으로 관여하거나, 간접적으로, 예를 들면, IL-6의 형태에 영향을 미침으로써 결합 부위에 영향을 미친다. IL-6a에 의해 결합된 아미노산을 결정하기 위해 다른 방법이 사용될 수 있다. 예를 들면, PEPSCAN 기반 효소 결합 면역 측정법(ELISA)과 같은 펩타이드 결합 스캔(peptide-binding scan)이 사용될 수 있다. 이 유형의 펩타이드 결합 스캔에서, 항원으로부터 유래된 짧은 중첩(overlapping) 펩타이드는 결합 멤버(binding member)에 대한 결합을 위해 체계적으로 스크리닝된다. 펩타이드는 지지체 표면에 공유결합되어 펩티드 어레이(array)를 형성할 수 있다. 펩타이드는 선형 또는 제한된 형태일 수 있다. 제한된 형태는 펩타이드 서열의 각 말단에 말단 시스테인(cys) 잔기를 갖는 펩타이드를 사용하여 생성될 수 있다. cys 잔기가 지지체 표면에 직접적으로 또는 간접적으로 공유결합되어, 펩타이드가 루프(loop) 형태로 유지될 수 있다. 따라서, 상기 방법에 사용되는 펩타이드는 항원의 단편에 상응하는 펩타이드 서열의 각 말단에 cys 잔기가 부가되어있을 수 있다. cys 잔기가 펩타이드 서열의 중간 또는 그 부근에 추가적으로 위치하는 이중 루프 펩타이드도 사용될 수 있다. cys 잔기가 지지체 표면에 직접적으로 또는 간접적으로 공유결합되어, 펩타이드가 중앙 시스 잔기의 각 측면에 하나의 루프를 갖는 이중 루프 형태를 형성할 수 있다. 펩타이드는 합성적으로 생성될 수 있으므로, IL-6 부위 II 서열에서 자연적으로 발생하지 않음에도 불구하고 원하는 위치에서 cys 잔기는 조작 될 수 있다. 선택적으로, 선형 및 제한된 펩타이드는 모두 펩타이드-결합 분석법으로 스크리닝될 수 있다. 펩타이드-결합 스캔은 결합 멤버가 결합하는 펩타이드의 세트를 확인하는 것(예를 들면, ELISA를 사용하여)을 포함할 수 있고, 상기 펩타이드는 IL-6a의 단편에 상응하는 아미노산 서열을 가진다(예를 들면, IL-6a의 약 5, 10 또는 15개의 인접한 잔기를 포함하는 펩타이드). 그리고 펩타이드-결합 스캔은 결합 멤버에 의해 결합된 잔기의 풋프린트(footprint)를 결정하기 위해 펩타이드를 정렬하는 것을 포함할 수 있고, 여기서 풋프린트는 중첩 펩타이드에 공통인 잔기를 포함한다. 펩타이드-결합 스캔은 IL-6a가 적어도 선택된 신호:노이즈 비율을 가지고 결합한 펩타이드를 확인하기 위해 선택적으로 또는 부가적으로 사용될 수 있다. 항체에 의해 결합된 잔기를 결정하기 위해, 및/또는 펩타이드-결합 스캔 결과, 예를 들면, 위치지정 돌연변이(site directed mutagenesis)(예를 들면, 본 명세서에 기술된 바와 같은), 수소 중수소 교환(hydrogen deuterium exchange), 질량 분광법(mass spectrometry), NMR, 및 X-선 결정학(X-ray crystallography)을 포함하는 결과를 확인하기 위해 당업계에 공지된 다른 방법이 사용될 수 있다.
전형적으로, 본 명세서에 기술된 바와 같이 유용한 IL-6a는 인간 항체 분자, 인간화(humanized) 항체 분자, 또는 그의 결합 단편이다. 일반적으로, 항체는 단클론 항체(monoclonal antibody)이다. 상기 항체의 기원은 사람, 쥐, 랫트, 낙타, 토끼, 양, 돼지, 또는 소일 수 있고, 당업계에 공지된 방법에 따라 생성될 수 있다.
본 명세서에 사용된 "항체 분자" 용어는 항원과 특이적으로 결합하는 면역글로불린(immunoglobulin) 분자로부터 유래된 단백질 또는 폴리펩타이드 서열을 의미한다. 항체 분자는 전장 항체 또는 그의 단편, 예를 들면, 그의 항원 결합 단편일 수 있다. 항체는 단클론 또는 다중클론, 다중 또는 단일 사슬, 또는 손상되지 않은 면역글로불린일 수 있고, 천연 원료 또는 재조합 원료로부터 유래될 수 있다. 항체는 면역글로불린 분자의 사량체(tetramer)일 수 있다. 항체 단편 또는 항원 결합 단편은 손상되지 않은 항체의 적어도 한 부분 또는 그의 재조합 변이체를 의미하고, 항체 단편에 항원과 같은 표적에 대한 인식 및 특이적 결합을 부여하기에 충분한 항원 결합 영역, 예를 들면, 손상되지 않은 항체의 항원 결정 가변 영역을 의미한다. 항체 단편의 예로는 Fab, Fab', F(ab')2 및 Fv 단편, scFv 항체 단편, 선형 항체, sdAb(VL 또는 VH)와 같은 단일 영역 항체, 낙타 VHH 영역, 및 힌지 영역에서 이황화 다리(disulfide bridge)에 의해 연결된 2개의 Fab 단편을 포함하는 2가(bivalent) 단편과 같은 항체 단편으로부터 형성된 다중 특이적 항체, 및 단리 된 CDR 또는 항체의 다른 항원 결정기 결합 단편을 포함하나, 이에 한정되지 않는다. 항원 결합 단편은 또한 단일 영역 항체, 맥시바디(maxibodies), 미니바디(minibodies), 나노바디(nanobodies), 인트라바디(intrabodies), 디아바디(diabodies), 트리아바디(triabodies), 테트라바디(tetrabodies), v-NAR 및 bis-scFv로 혼입될 수 있다(예를 들면, Hollinger and Hudson, Nature Biotechnology, 23:1126-1136, 2005). 항원 결합 단편은 또한 피브로넥틴(fibronectin) III형(Fn3)과 같은 폴리펩타이드를 기초로한 스캐폴드(scaffold)에 접목될 수 있다(피브로넥틴 폴리펩타이드 미니바디를 기술한 미국 특허 번호: 6,703,199).
예시적인 IL-6 항체
일반적으로, IL-6a는 적어도 IL-6(예를 들면, 인간 IL-6), 예를 들면 IL-6의 부위 II에 특이적으로 결합 할 수 있는 항체의 CDR을 포함한다. 본 발명의 CDR 또는 CDR 세트를 운반하기위한 구조는 재배열된 면역글로불린 유전자에 의해 암호화되는 자연적으로 발생하는 VH 및 VL 항체 가변 영역의 CDR 또는 CDR 세트에 상응하는 위치에 있는 CDR 또는 CDR 세트에서 항체 중쇄 또는 경쇄 서열 또는 이의 실질적인 부분일 수 있다. 면역글로불린 가변 영역의 구조 및 위치는 Kabat, et al., 1983(National Institutes of Health) 및 모든 인터넷 검색 엔진을 사용하여 "Kabat"에서 찾을 수 있는 그의 업데이트를 참조하여 결정될 수 있다.
본 명세서에 개시된 IL-6a는 전형적으로 항체 VH 영역 및/또는 VL 영역을 일반적으로 포함하는 항체 분자이다. VH 영역은 중쇄 CDR 세트(VHCDRs)를 포함하고, VL 영역은 경쇄 CDR 세트(VLCDRs)를 포함한다. 상기 CDRS는 본 명세서의 실시예에서 제공된다. 항체 분자는 VHCDR1, VHCDR2 및 VHCDR3 및 프레임워크를 포함하는 항체 VH 영역을 포함할 수 있다. VLCDR1, VLCDR2 및 VLCDR3 및 프레임워크를 포함하는 항체 VL 영역을 선택적으로 또는 추가적으로 포함할 수 있다.
본 명세서에 개시된 IL-6 억제제는 본 명세서에 개시된 바와 같은 VHCDR1 및/또는 VHCDR2 및/또는 VHCDR3, 및/또는 본 명세서에 개시된 바와 같은 VLCDR1 및/또는 VLCDR2 및/또는 VLCDR3을 포함한다. IL-6a는 본 명세서에 기술된 모든 항체, 단편, 또는 유도체의 1개 이상, 예를 들면, 1, 2, 또는 3개의 CDRs를 포함할 수 있다. IL-6a는 VHCDRs 세트(예를 들면, VHCDR1, VHCDR2 및/또는 VHCDR3)를 포함할 수 있고, 선택적으로 또한 VLCDRS 세트(예를 들면, VLCDR1, VLCDR2 및/또는 VLCDR3)를 포함할 수 있다. CDRs는 본 명세서에 기술된 하나 이상의 항체, 단편, 또는 유도체로부터 유래할 수 있다. 예를 들면, VLCDRs는 VHCDRs와 같거나 다른 항체로부터 유래될 수 있다.
일반적으로, VH 영역은 VL 영역과 쌍을 이루어 항체 항원-결합 부위를 제공한다. 예를 들면, 서열번호 1, 서열번호 13, 또는 서열번호 25의 HC 영역은 서열번호 3의 LC 영역과 쌍을 이룬다. 몇가지 경우에서, VH 또는 VL 영역 단독은 IL-6a로서 사용될 수 있다.
본 명세서에 제공된 한가지 측면에서. 하기를 포함하는 중쇄 가변 영역을 포함하는 단리된 항체 또는 항원 결합 단편이 제공된다:
(i) GYX1LX2NYLIE(서열번호 30)을 포함하는 VH CDR1,
(ii) VX3TPGX4GTIN(서열번호 31)을 포함하는 VH CDR2, 및
(ii) VH CDR3.
여기서 다음 중 하나 이상(예를 들면, 하나, 둘, 셋, 또는 모두)이 참이다: X1은 A가 아니다, X2는 S가 아니다, X3는 I가 아니다, 및 X4는 S가 아니다. 몇가지 실시예에서, X1은 A가 아니고, X2는 S가 아니며, X3는 I가 아니고, X4는 S가 아니다.
몇가지 실시예에서, X1은 V 또는 V에 대한 보존적 치환(conservative substitution)이다. 몇가지 실시예에서, X2는 P 또는 P에 대한 보전적 치환이다. 몇가지 실시예에서, X3은 T 또는 T에 대한 보전적 치환이다. 몇가지 실시예에서, X4는 G 또는 G에 대한 보전적 치환이다. 몇가지 실시예에서, 다음 중 하나, 둘, 셋, 또는 모두가 참이다: X1은 V 또는 V에 대한 보존적 치환이다, X2는 P 또는 P에 대한 보전적 치환이다, X3은 T 또는 T에 대한 보전적 치환이다, 및 X4는 G 또는 G에 대한 보전적 치환이다. 몇가지 실시예에서, X1은 V 또는 V에 대한 보존적 치환이고, X2는 P 또는 P에 대한 보전적 치환이며, X3은 T 또는 T에 대한 보전적 치환이고, X4는 G 또는 G에 대한 보전적 치환이다.
몇가지 실시예에서, X1은 V, I, L, 및 M 중에서 선택된다. 몇가지 실시예에서, X1은 V, I, 및 L 중에서 선택된다. 몇가지 실시예에서, X2는 P, G, 및 A 중에서 선택된다. 몇가지 실시예에서, X2는 P 및 G 중에서 선택된다. 몇가지 실시예에서, X3은 T 및 S 중에서 선택된다. 몇가지 실시예에서, X4는 G 및 P 중에서 선택된다.
몇가지 실시예에서, 다음 중 하나 이상(예를 들면, 하나, 둘, 셋, 또는 모두)이 참이다: X1은 V이다, X2는 P이다, X3는 T이다, 및 X4는 G이다. 몇가지 실시예에서, X1은 V이고, X2는 P이며, X3는 T이고, X4는 G이다.
몇가지 실시예에서, VH CDR3는 서열번호 21의 서열을 포함한다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 인간 IL-6에 대한 증가된 친화성 및/또는 증가된 효능을 갖는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 다음 중 하나 이상(예를 들면, 하나, 둘, 셋, 또는 모두)이 참인 서열을 포함하는 항체 또는 항원 결합 단편(예를 들면, 그 외에는 동일한 항체 항원 결합 단편)에 비해 인간 IL-6에 대한 증가된 친화성 및/또는 증가된 효능을 갖는다: X1은 A이다, X2는 S이다, X3는 I이다, 및 X4는 S이다.
몇가지 실시예에서, 단리된 항체 분자, 예를 들면, 항체 또는 그의 항원 결합 단편은 서열번호 7의 서열을 포함하는 VH CDR1, 서열번호 8의 서열을 포함하는 VH CDR2, 및 선택적으로 서열번호 9의 서열을 포함하는 VH CDR3를 포함한다. 일 실시예에서, 단리된 항체 또는 그의 항체 단편은 하나, 둘 또는 모두의 CDRs 각각에서, 예를 들면, 서열번호 7, 서열번호 8 또는 서열번호 9에서, 3개, 2개 또는 1개 이하의 아미노산에 의해 상이하다.
몇가지 실시예에서, 단리된 항체 분자, 예를 들면, 항체 또는 그의 항원 결합 단편은 서열번호 19의 서열을 포함하는 VH CDR1, 서열번호 20의 서열을 포함하는 VH CDR2, 및 선택적으로 서열번호 21의 서열을 포함하는 VH CDR3를 포함한다. 일 실시예에서, 단리된 항체 또는 그의 항체 단편은 하나, 둘 또는 모두의 CDRs 각각에서, 예를 들면, 서열번호 19, 서열번호 20 또는 서열번호 21에서, 3개, 2개 또는 1개 이하의 아미노산에 의해 상이하다.
몇가지 실시예에서, 단리된 항체 분자, 예를 들면, 항체 또는 그의 항원 결합 단편은 서열번호 9 또는 22의 서열을 포함하는 VL CDR1, 서열번호 10 또는 23의 서열을 포함하는 VL CDR2, 및 서열번호 11 또는 24의 서열을 포함하는 VL CDR3를 포함한다. 일 실시예에서, 단리된 항체 또는 그의 항체 단편은 하나, 둘 또는 모두의 CDRs 각각에서, 예를 들면, 서열번호 22, 서열번호 23 또는 서열번호 24에서, 3개, 2개 또는 1개 이하의 아미노산에 의해 상이하다.
몇가지 실시예에서, 중쇄 가변 영역은 서열번호 5와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 중쇄 가변 영역은 서열번호 5와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열로 구성되거나, 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 5와 상이하다. 몇가지 실시예에서, 중쇄 가변 영역은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 5와 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 중쇄 가변 영역은 1 내지 5개의 아미노산에 의해 서열번호 5와 상이하다.
몇가지 실시예에서, 중쇄 가변 영역은 서열번호 17과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 중쇄 가변 영역은 서열번호 17과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열로 구성된다. 몇가지 실시예에서, 중쇄 가변 영역은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 17과 상이하다. 몇가지 실시예에서, 중쇄 가변 영역은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 17과 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 17을 포함하는 중쇄 가변 영역 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 17로 구성되는 중쇄 가변 영역 서열을 포함한다.
몇가지 실시예에서, 경쇄 가변 영역은 서열번호 18과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 경쇄 가변 영역은 서열번호 18과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열로 구성되거나, 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 18과 상이하다. 몇가지 실시예에서, 경쇄 가변 영역은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 18과 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 경쇄 가변 영역은 1 내지 5개의 아미노산에 의해 서열번호 18과 상이하다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 서열번호 15와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 15와 상이한 서열을 포함하다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 15와 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 15를 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 Fab이다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 서열번호 16과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 16과 상이한 서열을 포함하다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 16과 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 16을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 Fab이다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 scFv이다. 몇가지 실시예에서, 항체 또는 항원 결합은 서열번호 26 또는 서열번호 27에서 제공되는 scFv 서열을 포함하거나 그로 구성된다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 26 또는 서열번호 27과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 26 또는 27과 상이하다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 26 또는 27과 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 26 또는 서열번호 27을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 scFv이다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 서열번호 13과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 중쇄 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 13과 상이한 중쇄 서열을 포함한다. 몇가지 실시예에서, 중쇄 서열은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 13과 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 13을 포함하는 중쇄 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 13으로 구성되는 중쇄 서열을 포함한다.
몇가지 실시예에서, 항체 분자, 예를 들면, 항체 또는 항원 결합 단편은 서열번호 14와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 경쇄 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 14와 상이한 경쇄 서열을 포함한다. 몇가지 실시예에서, 경쇄 서열은 20, 15, 10, 5, 4, 3, 2, 또는 1개 이하의 아미노산에 의해 서열번호 14와 상이하고, 상기 아미노산 변화는 모든 CDRs에서 존재하지 않는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 14를 포함하는 경쇄 서열을 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 서열번호 14로 구성되는 경쇄 서열을 포함한다.
몇가지 실시예에서, 항체 분자, 예를 들면 항체 또는 항원 결합 단편은 표 1에 개시된 EBI-029, EBI-030, 또는 EBI-031의 서열을 하나 이상 포함한다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 도 1에 나타낸 EBI-029, EBI-030, 또는 EBI-031의 영역을 하나 이상 포함한다(예를 들면, 하나 이상의 중쇄 서열의 FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4, CH1, 힌지, CH2, 및 CH3, 및/또는 경쇄 서열의 FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4, 및 CK). 몇가지 실시예에서, 항체 또는 항원 결합 단편은 중쇄 및 경쇄를 포함한다. 몇가지 실시예에서, 중쇄 및 경쇄는 하나 이상의 이황화 결합에 의해 연결된다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 Fab이다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 scFv이다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 Fab, Fab', F(ab')2, scFv 또는 Fv 단편이다.
몇가지 실시예에서, 항체 또는 항원 결합 단편은 EBI-029, 또는 본 명세서에 그 전체가 참조로 인용된 WO2014/074905에 기술된 항체의 서열에 상응하는 하나 이상의 서열을 포함하는 항체 또는 항원 결합 단편에 비해 인간 IL-6에 대한 증가된 친화성 및/또는 증가된 효능을 갖는다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 tocilizumab에 비해 인간 IL-6에 대한 증가된 친화성 및/또는 증가된 효능을 갖는다.
| 명칭 | 서열번호 | 서열 |
| EBI-029 HC(IgG2) 아미노산(aa) 서열 | 서열번호 1 | QVQLVQSGAE VKKPGSSVKV SCKASGYALS NYLIEWVRQA PGQGLEWMGV ITPGSGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPCSRST SESTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSNFGT QTYTCNVDHK PSNTKVDKTV ERKCCVECPP CPAPPVAGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSHE DPEVQFNWYV DGVEVHNAKT KPREEQFNST FRVVSVLTVV HQDWLNGKEY KCKVSNKGLP APIEKTISKT KGQPREPQVY TLPPSREEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPMLD SDGSFFLYSK LTVDKSRWQQ GNVFSCSVMH EALHNHYTQK SLSLSPGK |
| EBI-029 HC H311A | 서열번호 2 | QVQLVQSGAE VKKPGSSVKV SCKASGYALS NYLIEWVRQA PGQGLEWMGV ITPGSGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPCSRST SESTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSNFGT QTYTCNVDHK PSNTKVDKTV ERKCCVECPP CPAPPVAGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSHE DPEVQFNWYV DGVEVHNAKT KPREEQFNST FRVVSVLTVV AQDWLNGKEY KCKVSNKGLP APIEKTISKT KGQPREPQVY TLPPSREEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPMLD SDGSFFLYSK LTVDKSRWQQ GNVFSCSVMH EALHNHYTQK SLSLSPGK |
| EBI-029 LC 아미노산 서열 | 서열번호 3 | DIVMTQSPDS LAVSLGERAT INCRASESVD NYGIPFMNWY QQKPGQPPKL LIYAASNRGS GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSEEVPL TFGQGTKLEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV THQGLSSPVT KSFNRGEC |
| EBI-029(IgG1) Fab HC 아미노산 서열 | 서열번호 4 | QVQLVQSGAE VKKPGSSVKV SCKASGYALS NYLIEWVRQA PGQGLEWMGV ITPGSGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPSSKST SGGTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSSLGT QTYICNVNHK PSNTKVDKKV EPKSCDKTHT |
| EBI-029 VH 아미노산 서열 | 서열번호 5 | QVQLVQSGAEVKKPGSSVKVSCKASGYALSNYLIE WVRQAPGQGLEWMGVITPGSGTINYAQKFQGRVTIT ADESTSTAYMELSSLRSEDTAVYYCARSRWDPLYYYALEY WGQGTTVTVSS |
| EBI-029 VL 아미노산 서열 | 서열번호 6 | DIVMTQSPDSLAVSLGERATINCRASESVDNYGIPFMNWYQQ KPGQPPKLLIYAASNRGSGVPDRFSGSGSGTDFTLTISSLQAE DVAVYYCQQSEEVPLTFGQGTKLEIKRTV |
| EBI-029 HC CDR1 | 서열번호 7 | GYALSNYLIE |
| EBI-029 HC CDR2 | 서열번호 8 | VITPGSGTIN |
| EBI-029 HC CDR3 | 서열번호 9 | SRWDPLYYYALEY |
| EBI-029 LC CDR1 | 서열번호 10 | RASESVDNYGIPFMN |
| EBI-029 LC CDR2 | 서열번호 11 | AASNRGS |
| EBI-029 LC CDR3 | 서열번호 12 | QQSEEVPLT |
| EBI-030 HC(IgG2) 아미노산 서열 | 서열번호 13 | QVQLVQSGAE VKKPGSSVKV SCKASGYVLP NYLIEWVRQA PGQGLEWMGVTTPGGGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSRWDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPCSRST SESTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSNFGT QTYTCNVDHK PSNTKVDKTV ERKCCVECPP CPAPPVAGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSHE DPEVQFNWYV DGVEVHNAKT KPREEQFNST FRVVSVLTVV HQDWLNGKEY KCKVSNKGLP APIEKTISKT KGQPREPQVY TLPPSREEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPMLD SDGSFFLYSK LTVDKSRWQQ GNVFSCSVMH EALHNHYTQK SLSLSPGK |
| EBI-030 LC 아미노산 서열 | 서열번호 14 | DIVMTQSPDS LAVSLGERAT INCRASESVD NYGIPFMNWY QQKPGQPPKL LIYAASNRGS GVPDRFSGSG SGTDFTLTIS SLQAEDVAVY YCQQSEEVPLTFGQGTKLEI KRTVAAPSVF IFPPSDEQLK SGTASVVCLL NNFYPREAKV QWKVDNALQS GNSQESVTEQ DSKDSTYSLS STLTLSKADY EKHKVYACEV THQGLSSPVT KSFNRGEC |
| EBI-030(IgG1) Fab HC 아미노산 서열 | 서열번호 15 | QVQLVQSGAE VKKPGSSVKV SCKASGYVLP NYLIEWVRQA PGQGLEWMGV TTPGGGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPSSKST SGGTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSSLGT QTYICNVNHK PSNTKVDKKV EPKSCDKTHT |
| EBI-030(IgG2) Fab HC 아미노산 서열 | 서열번호 16 | QVQLVQSGAEVKKPGSSVKVSCKASGYVLPNYLIEWVRQAPGQGLEWMGVTTPGGGTINYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARSRWDPLYYYALEYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERK |
| EBI-030 VH 아미노산 서열 | 서열번호 17 | QVQLVQSGAE VKKPGSSVKV SCKASGYVLP NYLIEWVRQA PGQGLEWMGV TTPGGGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SS |
| EBI-030 VL 아미노산 서열 | 서열번호 18 | DIVMTQSPDSLAVSLGERATINCRASESVDNYGIPFMNWYQQKPGQPPKLLIYAASNRGSGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSEEVPLTFG QGTKLEIKRTV |
| EBI-030 HC CDR1 | 서열번호 19 | GYVLPNYLIE |
| EBI-030 HC CDR2 | 서열번호 20 | VTTPGGGTIN |
| EBI-030 HC CDR3 | 서열번호 21 | SRWDPLYYYALEY |
| EBI-030 LC CDR1 | 서열번호 22 | RASESVDNYGIPFMN |
| EBI-030 LC CDR2 | 서열번호 23 | AASNRGS |
| EBI-030 LC CDR3 | 서열번호 24 | QQSEEVPLT |
| EBI-031 IgG2 HC 아미노산 서열 | 서열번호 25 | QVQLVQSGAE VKKPGSSVKV SCKASGYVLP NYLIEWVRQA PGQGLEWMGV TTPGGGTINY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCARSR WDPLYYYALE YWGQGTTVTV SSASTKGPSV FPLAPCSRST SESTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSNFGT QTYTCNVDHK PSNTKVDKTV ERKCCVECPP CPAPPVAGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSHE DPEVQFNWYV DGVEVHNAKT KPREEQFNST FRVVSVLTVV AQDWLNGKEY KCKVSNKGLP APIEKTISKT KGQPREPQVY TLPPSREEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPMLD SDGSFFLYSK LTVDKSRWQQ GNVFSCSVMH EALHNHYTQK SLSLSPGK |
| scFv VH-VL 아미노산 서열 | 서열번호 26 | QVQLVQSGAEVKKPGSSVKVSCKASGYVLPNYLIEWVRQAPGQGLEWMGVTTPGGGTINYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARSRWDPLYYYALEYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSPDSLAVSLGERATINCRASESVDNYGIPFMNWYQQKPGQPPKLLIYAASNRGSGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSEEVPLTFGQGTKLEIKRTV |
| scFv VL-VH 아미노산 서열 | 서열번호 27 | DIVMTQSPDSLAVSLGERATINCRASESVDNYGIPFMNWYQQKPGQPPKLLIYAASNRGSGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSEEVPLTFGQGTKLEIKRTVGGGGSGGGGSGGGGSQVQLVQSGAEVKKPGSSVKVSCKASGYVLPNYLIEWVRQAPGQGLEWMGVTTPGGGTINYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARSRWDPLYYYALEYWGQGTTVTVSS |
| 030 IgG2 불변영역 | 서열번호 28 | ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 031 IgG2 불변영역 | 서열번호 29 | ASTKGPSV FPLAPCSRST SESTAALGCL VKDYFPEPVT VSWNSGALTS GVHTFPAVLQ SSGLYSLSSV VTVPSSNFGT QTYTCNVDHK PSNTKVDKTV ERKCCVECPP CPAPPVAGPS VFLFPPKPKD TLMISRTPEV TCVVVDVSHE DPEVQFNWYV DGVEVHNAKT KPREEQFNST FRVVSVLTVV AQDWLNGKEY KCKVSNKGLP APIEKTISKT KGQPREPQVY TLPPSREEMT KNQVSLTCLV KGFYPSDIAV EWESNGQPEN NYKTTPPMLD SDGSFFLYSK LTVDKSRWQQ GNVFSCSVMH EALHNHYTQK SLSLSPGK |
EBI-029, EBI-030 및 EBI-031의 서열 개요
aa=아미노산(amino acid); na=핵산(nucleic acid); HC=중쇄(heavy chain); LC=경쇄(light chain); VH=중쇄 가변 영역(heavy chain variable region); VL=경쇄 가변 영역(light chain variable region)
몇가지 측면에서, IL-6a는 (i) 본 명세서에 기술된 VH 영역(예를 들면, 서열번호 17)과 적어도 60, 70, 80, 85, 90, 95, 98 또는 99%의 아미노산 서열 동일성을 가지는 VH 영역 서열, 또는 (ii) VH 영역 서열로부터의 VHCDRs 세트(예를 들면, VHCDR1, VHCDR2, 및/또는 VHCDR3)를 포함하는 항체 분자, 그의 단편, 또는 그의 유도체이다. 몇가지 실시예에서, 항체 분자, 그의 단편, 또는 그의 유도체는 서열번호 17의 VHCDR1, VHCDR2, 및 VHCDR3을 포함한다. 몇가지 실시예에서, 항체 분자, 그의 단편, 또는 그의 유도체는 1개 이하, 2개 이하, 3개 이하, 4개 이하, 또는 5개 이하의 아미노산에 의해 서열번호 17의 VHCDR1, VHCDR2, 및 VHCDR3와 총괄적으로 상이한 VHCDR1, VHCDR2, 및 VHCDR3을 포함한다.
항체 분자, 그의 단편, 또는 그의 유도체는 선택적으로 또한 (i) 본 명세서에 기술된 VL 영역, 예를 들면, 서열번호 18의 VL 영역과 적어도 60, 70, 80, 85, 90, 95, 98 또는 99%의 아미노산 서열 동일성을 가지는 VL 영역 서열, 또는 (ii) VL 영역으로부터의 VLCDRs 세트(예를 들면, VLCDR1, VLCDR2, 및/또는 VLCDR3)를 포함할 수 있다. 몇가지 실시예에서, 항체 분자, 그의 단편, 또는 그의 유도체는 서열번호 18의 VLCDR1, VLCDR2, 및 VLCDR3을 포함한다. 몇가지 실시예에서, 항체 분자, 그의 단편, 또는 그의 유도체는 1개 이하, 2개 이하, 3개 이하, 4개 이하, 또는 5개 이하의 아미노산에 의해 서열번호 18의 VLCDR1, VLCDR2, 및 VLCDR3와 총괄적으로 상이한 VLCDR1, VLCDR2, 및 VLCDR3을 포함한다. 2개의 아미노산 서열의 동일성 백분율을 계산하는 데 사용될 수 있는 알고리즘은 예를 들면, BLAST, FASTA, 또는 스미스-워터만 알고리즘(Smith-Waterman algorithm)을 포함하는데, 이는 예를 들면, 기본 매개 변수를 사용한다.
본 명세서에 기술된 IL-6a는 항체 불변영역 또는 그의 일부, 예를 들면, 인간 항체 불변영역 또는 그의 일부를 포함할 수 있다. 예를 들면, VL 영역은 그의 C-말단에서 인간 CK 또는 CL 사슬을 포함하는 항체 경쇄 불변영역에 부착될 수 있다. 유사하게, VH 영역에 기초한 IL-6a는 그의 C-말단에서 모든 항체 아이소타입(isotype), 예를 들면, IgG, IgA, IgE 및 IgM, 및 모든 아이소타입의 하위 분류(sub-class), 특히 IgG1, IgG2, IgG3 및 IgG4로부터 유래된 면역글로불린 중쇄의 전부 또는 일부(예를 들면, CH1 영역)에 부착될 수 있다. 몇가지 실시예에서, 항체 또는 항원 결합 단편은 ADCC 활성을 감소시키거나 제거하기 위해 조작된다.
몇가지 실시예에서, 본 발명의 항체는 IgG2 항체이다. 일 실시예에서, 본 발명의 항체는 본 명세서에 기술된 IgG2 프레임워크, IgG2 불변영역, 또는 IgG2 Fc 영역을 포함한다.
IgG2 항체는 3개의 주요 구조적 아형으로 존재할 수 있다: IgG2-A, IgG2-B, 및 IgG2-A/B(Wypych J. et al. Journal of Biological Chemistry. 2008, 283:16194-16205). 이러한 구조적 이질성은 Fab 팔(arm)을 중쇄 힌지 영역에 연결시키는 이황화 결합의 상이한 구성에서 기인한다. IgG2-A 아형에서, Fab 팔을 중쇄 힌지 영역에 연결시키는 이황화 결합은 없다. IgG2-B 아형에서, Fab 팔은 모두 중쇄 및 경쇄를 힌지 영역에 연결시키는 이황화 결합을 가진다. IgG2-A/B 아형은 IgG2-A 및 IgG2-B 아형 사이의 잡종(hybrid)이고, 하나의 Fab 팔의 중쇄 및 경쇄를 힌지 영역에 연결시키는 이황화 결합을 갖는 Fab 팔이 하나 뿐이다. 2개의 또는 모든 상이한 구조적 아형 사이에서 IgG2 항체의 변환은, 또한 이황화물 셔플링을 의미하는데, 자연적인 발생 및 재조합 항체 모두에 대해 생체내(in vivo) 및 생체외(in vitro)에서 자연적으로 발생한다. 결과적으로, 당업계의 IgG2 항체 제제는 IgG2-A, IgG2-B 및 IgG2-A/B 아형의 이종 혼합물을 포함한다. 다른 IgG2 아형은 안정성, 응집, 점도, Fc 수용체 결합 또는 효능의 차이와 같은 독특하고 상이한 기능적 특성을 가질 수 있다. 다수의 아형의 존재 또는 IgG2 항체 제제에서 특정 아형의 증가된 수준은 안정성, 응집 또는 효능에 부정적인 영향을 미칠 수 있다. 여전히 이황화 셔플링을 거칠 수 있고, 모든 구조적인 아형 A, A/B, 및/또는 B에서 존재할 수 있는 IgG2 항체의 몇가지 단편, 예를 들면, 셔플링 이황화 결합에 참여하는 잔기를 보유하는 단편(예를 들면, 도 10에 도시된 바와 같이), 예를 들면, 적어도 IgG2 힌지 영역을 포함하는 단편이 쉽게 구상될 수 있다.
본 발명은 IgG2-A 또는 IgG2-A/B 아형으로 주로 존재하는 이점을 가진 항체 또는 그의 단편을 포함하는 제제를 제공한다. 항체 또는 그의 단편은 IgG2-B 아형으로 존재하지 않거나, IgG2-B 아형으로 상당한 시간동안 존재하지 않으므로, 주어진 시간 동안 제제 조성물 또는 제제에서 IgG2-B 아형은 매우 낮은 수준을 야기한다. 따라서, 본 명세서에 기술된 항체를 포함하는 조성물 및 제제는 당업계에 공지된 다른 IgG2 항체보다 덜 이질적이고, 따라서 치료용으로 사용하기에 더 바람직하다.
항체를 포함하는 조성물 및 제제는 항체의 IgG2-A 및/또는 IgG2-A/B 아형을 주로 포함한다. 일 실시예에서, 본 명세서에 기술된 항체를 포함하는 조성물은 항체의 IgG2-A 또는 IgG2-A/B 아형을 적어도 50, 60, 70, 80, 90, 95, 96, 97, 98, 또는 99% 포함한다. 일 실시예에서, 본 명세서에 기술된 항체를 포함하는 조성물은 항체의 IgG2-A 및 IgG2-A/B 아형을 총괄적으로 적어도 60, 70, 80, 90, 95, 96, 97, 98, 또는 99% 포함한다. 상기 실시예에서, 본 명세서에 기술된 항체를 포함하는 조성물은 항체의 상당한 양의 IgG2-B 아형을 포함하지 않는다. 예를 들면, 조성물은 항체의 IgG2-B 아형을 10%, 5%, 2%, 1%, 0.5%, 또는 0.1% 미만으로 포함한다.
몇가지 경우에서, 본 발명의 항체는 특정 알로타입(allotype), 예를 들면, 특정한 지리적 기원을 갖는 집단에서 우세한 알로타입을 갖는 서열을 생성하기 위해 당업계에 공지된 방법을 사용하여 추가로 변형된다. 몇가지 경우에서, 인간 중쇄 불변영역은 이와 같은 목적으로 변형된다.
IL-6a는 항체 분자, 그의 결합 단편, 또는 변이체일 수 있고, 항체 프레임워크 내에 하나 이상의 CDRs, 예를 들면, CDRs 세트를 가질 수 있다. 예를 들면, 하나 이상의 CDRs 또는 항체(예를 들면, 본 명세서에 기술된 항체 또는 그의 단편 또는 그의 유도체)의 CDRs 세트는 항체를 제공하기 위해 프레임워크(예를 들면, 사람 프레임워크)에 접목될 수 있다. 프레임워크 영역은 인간 생식세포 유전자 서열로부터 유래되거나, 비 생식세포계일 수 있다.
VH 및/또는 VL 프레임워크 잔기는 본 명세서에서 논의되고 예시된 바와 같이, 예를 들면, 위치지정 돌연변이를 사용하여 변형될 수 있다.
아미노산 변화는 하나 이상의 프레임워크 영역 및/또는 IL-6(본 명세서에 "참조 IL-6 항체"로 명명된)의 부위 II를 표적으로 하는 항체 IL-6a로부터 유래된 하나 이상의 CDRs에서 당업계에 공지된 방법 및 변수(parameter)를 이용하여 이루어질 수 있다. 또한, 본 명세서에 포함된 IL-6 길항제는 IL-6의 부위 II(예를 들면, 인간 IL-6의 부위 II)에 결합을 보유하고, 참조 IL-6 항체에 비해 적어도 같은 결합 또는 증가된 친화성을 전형적으로 갖는다. 몇가지 경우에서, 안정성과 같은 변수를 향상시키기 위해, 참조 IL-6a(예를 들면, 참조 항체)에 비해 유도된 IL-6a의 결합 친화성의 감소를 야기하는 변화가 유용한 IL-6a를 생성하기 위해 도입될 수 있다. 몇가지 실시예에서, 예를 들면, FcRn 결합, 또는 유리체에서의 반감기 또는 전신 반감기(예를 들면, 혈액, 혈장, 혈청, 림프, 간, 신장, 다른 조직, 또는 체액에서)와 같은 약동학(pharmacokinetic, PK) 매개변수와 관련된 참조의 몇가지 경우에서, 참조 항체는 IL-6에 특이적으로 결합하지 않는 항체일 수 있다.
IL-6a 폴리펩타이드의 아미노산 서열 변화는 하나 이상의 아미노산 잔기(들)를 비자연발생 또는 비표준 아미노산으로 치환(substituting), 하나 이상의 아미노산 잔기를 비자연 발생 또는 비표준 형태로 변형(modifying), 또는 하나 이상의 비자연발생 또는 비표준 아미노산을 서열에 삽입(inserting)하는 것을 포함한다. 본 발명의 서열에서 개수 및 위치의 변경 예시는 본 명세서의 다른 곳에 기술된다. 자연발생 아미노산은 단일 문자 코드에 의해 G, A, V, L, I, M, P, F, W, S, T, N, Q, Y, C, K, R, H, D, E로 식별되는 20개의 "표준" L-아미노산을 포함한다. 비표준 아미노산은 폴리펩타이드 백본(backbone)에 혼입될 수 있거나, 기존의 아미노산 잔기의 변형으로부터 야기된 모든 다른 잔기를 포함한다. 비표준 아미노산은 자연적으로 발생하거나 비자연적으로 발생할 수 있다. 4-히드록시프롤린(4-hydroxyproline), 5-히드록시류신(5-hydroxylysine), 3- 메틸히스티딘(3-methylhistidine) 및 N-아세틸세린(N-acetylserine)과 같은 몇몇의 자연발생 비표준 아미노산은 당업계에 공지된다. 그들의 N-알파(N-alpha) 위치에서 유도체화된(derivatized) 이러한 아미노산 잔기는 아미노산 서열의 N-말단에만 위치할 것이다. 아미노산은 전형적으로 L-아미노산이다. 몇몇의 경우에서, 아미노산은 D-아미노산이다. 따라서, 변경은 L-아미노산을 D-아미노산으로 변형시키거나 D-아미노산으로 치환시키는 것을 포함할 수 있다. 메틸화, 아세틸화 및/또는 인산화된 형태의 아미노산은 또한 공지되어 있고, 본 발명의 아미노산은 그러한 변형을 겪을 수 있다.
본 발명의 항체 영역 및 결합 멤버에서 아미노산 서열은, 본 명세서에 논의된 바와 같이, 비자연적 또는 비표준 아미노산을 포함할 수 있다. 비표준 아미노산(예를 들면, D-아미노산)은 당업계에 공지된 방법, 예를 들면, 분자의 합성, 또는 합성 후 변형(post-synthesis modification), 또는 아미노산 치환을 사용하여 아미노산 서열에 혼입될 수 있다.
본 발명의 CDR-유래 서열을 보유하는 신규한 VH 또는 VL 영역은 전체 가변 영역 내에서 돌연변이를 생성하기 위해, 하나 이상의 선택된 VH 및/또는 VL 핵산 서열의 무작위 돌연변이 유발(random mutagenesis)을 사용하여 생성될 수 있다. 예를 들면, 오류가 발생하기 쉬운 PCR이 사용될 수 있다(Chao et al., Nature Protocols, 1:755-768, 2006). 몇가지 실시예에서, 하나 또는 둘의 아미노산 치환은 전체 가변 영역 또는 CDRs 세트내에서 이루어질 수 있다. 전형적으로 하나 이상의 CDRs에서 돌연변이, 예를 들면, 위치지정 돌연변이를 생성하기 위해 당업계에 공지된 다른 방법이 사용될 수 있다.
항체 IL-6a를 생산하기 위한 하나의 방법은 하나 이상의 아미노산을 첨가, 결실, 치환 또는 삽입함으로써 본 명세서에 개시된 바와 같은 VH영역을 변경시키는 것이다. 변경된 VH 영역은 본 명세서에 기재된 바와 같이 당업계에 공지된 방법을 사용하여 변경될 수 있는 VL 영역(예를 들면, 본 명세서에 기술된 VL 영역)과 결합될 수 있다. 상기 변경된 분자는 IL-6의 부위 II에 결합하는 능력, 및 선택적으로, 참조 분자에 비해 증가된 친화성과 같은 다른 원하는 특성에 대해 시험될 수 있다. 몇가지 경우에서, 변이 VH 및 VL 영역은 1, 2, 3, 4, 또는 5개의 그러한 변경(예를 들면, 1, 2, 3, 4 또는 5개의 아미노산 치환)을 가질 수 있다.
몇가지 실시예에서, 본 발명의 IL-6는 IL-6의 부위 II에 결합하는 항체의 단편이고, 항원 결합 부위, 예를 들면, IL-6의 부위 II에 결합할 수 있는 부위를 포함한다. 본 발명의 항체 단편은 일반적으로 서열번호 13 및 서열번호 14를 포함하는 항체 분자와 같은 참조(모체) 항체 분자로 시작하여 얻어진다. 항체 단편은 재조합 DNA, 효소 절단(예를 들면, 펩신(pepsin) 또는 파파인(papain)을 사용), 항체의 화학적 절단(예를 들면, 이황화 다리의 화학적 환원)과 같은 당업계에 공지된 방법을 사용하여 생성될 수 있다. 항체 항원-결합 부위를 포함하는 항체 단편은 Fab, Fab', Fab'-SH, scFv, Fv, dAb, Fd, 및 이황화 안정화된 가변 영역(disulfide stabilized variable region, dsFv)과 같은 분자를 포함하나, 이에 한정되지 않는다. 하나 이상의 항체 항원-결합 부위를 포함하는 다양한 다른 항체 분자는 예를 들면, F(ab')2, F(ab)3, 디아바디, 트리아바디, 테트라바디, 및 미니바디를 포함하여 조작될 수 있다. 항체 분자, 및 그의 제조 및 사용 방법의 예시는 Holliger and Hudson, 2005, Nat Biotechnol, 23:1126-1136에 기술되어 있다. 결합 단편의 비제한적인 예시로는, VL, VH, 불변 경쇄 영역(CL) 및 불변 중쇄 영역1(CH1)으로 구성된 Fab 단편; VH 및 CH1 영역으로 구성된 Fd 단편; 단일 항체의 VL 및 VH 영역으로 구성된 Fv 단편; VH 또는 VL 영역으로 구성된 dAb 단편; 단리된 CDR 영역; F(ab') 2 단편, 2개의 연결된 Fab 단편을 포함하는 2가 단편; VH 영역 및 VL 영역이 2개의 영역이 결합하여 항원 결합 부위를 형성하게 하는 펩타이드 링커(peptide linker)에 의해 연결된 단일 사슬 Fv 분자(scFv); 이중 특이적인(bispecific) 단일 사슬 Fv 이합체(예를 들면, WO1993/011161에 개시된 바와 같은) 및 유전자 융합(예를 들면, WO94/13804에 개시된 바와 같은)을 사용하여 제조된 다가의(multivalent) 또는 다중 특이적인(multispecific) 단편인 디아바디가 있다. Fv, scFv 또는 디아바디 분자는 VH 및 VL 영역을 연결하는 이황화 다리의 혼입에 의해 안정화될 수 있다. CH3 영역에 결합된 scFv를 포함하는 미니바디는 또한 IL-6a로서 사용될 수 있다. IL-6a로서 사용될 수 있는 항체의 다른 단편 및 유도체는 중쇄 CH1 영역의 카르복실(carboxyl) 말단에서 수 개의 아미노산 잔기의 첨가에 의해 Fab 단편과 상이하고, 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 Fab', 및 불변 영역의 시스테인 잔기(들)가 자유 티올(thiol) 그룹을 갖는 Fab'단편 인 Fab'-SH를 포함한다.
몇가지 경우에서, 항체의 단편인 IL-6a는 바람직한 특성을 향상시키고 도입하기 위해 화학적으로 변형되는데, 예를 들면, 반감기 또는 혼입을 증가시키기 위해 페길화(PEGylation)된다.
dAb(domain antibody)는 항체(항체 중쇄 또는 경쇄 가변 영역)의 작은 단량체 항원-결합 단편이다. VH dAb는 낙타(예를 들면, 낙타 및 라마)에서 자연적으로 발생하고, 표적 항원으로 낙타를 면역화, 항원 특이적 B 세포를 단리, 및 개별 B 세포로부터 dAb 유전자를 직접 클로닝함으로써 생산될 수 있다. 본 발명의 IL-6a는 실질적으로 본 명세서에 설명된 VH 또는 VL 영역, 또는 실질적으로 본 명세서에 설명된 CDRs 세트를 포함하는 VH 또는 VL 영역을 포함하는 dAb일 수 있다.
본 발명의 항체는 두개의 상이한 가변 영역이 동일한 분자내에서 결합된 이중 특이적인 항체를 포함한다. IL-6a는 당업계에 공지된 방법을 사용하여 제조된, 예를 들면, 화학적으로 또는 혼성 융합 세포(hybrid hybridoma)로부터 제조된 이중 특이적인 항체의 부분으로 혼입될 수 있다. 상기 분자는 상기에서 논의된 유형의 이중 특이적인 항체 단편일 수 있다. 이중 특이적인 항체를 생성하기 위한 방법의 하나의 비제한적인 예시는, 상이한 특이성을 가진 2개 항체의 결합 영역이 사용되어 짧은 신축성있는(flexible) 펩타이드를 통해 직접적으로 결합되는 BiTE™ 기술이다. 이것은 짧은 단일 폴리펩타이드 사슬에 2개의 항체를 결합시킨다. 디아바디 및 scFv는 Fc 영역 없이, 가변 영역만을 사용하여 구성될 수 있고, 잠재적으로 항-이디오타입 반응(anti-idiotypic reaction)의 효과를 감소시킨다. 이중 특이적인 항체는 전체 IgG, 이중 특이적인 Fab'2, Fab'PEG, 디아바디 또는 이중 특이적인 scFV로서 구성될 수 있다. 또한, 2개의 이중 특이적인 항체는 당업계에 공지된 통상적인 방법을 사용하여 결합되어 4가 항체를 형성할 수 있다.
이중 특이적인 디아바디는 E.coli에서 구성되고 발현될 수 있기 때문에 이중 특이적인 전체 항체와는 대조적으로 부분적으로 유용하다. 적절한 결합 특이성을 갖는 디아바디(및 항체 단편과 같은 많은 다른 폴리펩타이드)는 라이브러리의 파지 디스플레이(phage display)(WO 1994/13804)를 사용하여 쉽게 선택될 수 있다. 만약 예를 들면, IL-6의 부위 II에 대해 특이성을 가진 디아바디의 한 팔이 일정하게 유지되어야 한다면, 다른 팔이 변하고 적당한 특이성의 항체가 선택되는 라이브러리가 만들어질 수 있다.
이중 특이적인 전체 항체는 WO 1996/27011, WO 1998/50431 및 WO 2006/028936에 기술된 바와 같은 대체 조작 방법에 의해 만들어질 수 있다.
몇가지 경우에서, 본 발명의 IL-6a는 예를 들면, 하기 논의되는 바와 같이, 하나 이상의 CDRs, 예를 들면, CDRs 세트의 비항체 단백질 스캐폴드로의 혼입에 의해, 비항체 분자내의 항원-결합 부위를 포함한다. 몇가지 경우에서, CDRs는 비항체 스캐폴드에 혼입된다. IL-6 부위 II 결합 부위는 피브로넥틴 또는 사이토크롬 B(cytochrome B)와 같은 비항체 단백질 스캐폴드 상의 CDRs의 배열에 의해, 또는 IL-6 부위 II에 결합 특이성을 부여하기 위해 단백질 스캐폴드 내 루프의 아미노산 잔기를 무작위화(randomizing) 또는 돌연변이시킴으로써 제공될 수 있다. 단백질에서 신규한 결합 부위를 조작하기 위한 스캐폴드는 당업계에 공지되어 있다. 예를 들면, 항체 모방체(mimics)의 단백질 스캐폴드는 적어도 하나의 무작위화된 루프를 가진 피브로넥틴 III형 영역을 포함하는 단백질(항체 모방체)을 기술한 WO 200034784에 개시되어 있다. 면역글로불린 유전자 슈퍼패밀리(superfamily)의 어떤 영역 멤버에 의해 하나 이상의 CDR, 예를 들면, 한 세트의 HCDR을 이식하는 적합한 스캐폴드가 제공될 수 있다. 스캐폴드는 인간 또는 비인간 단백질일 수 있다. 비항체 단백질 스캐폴드의 장점은 적어도 몇몇의 항체 분자보다 더 작은, 및/또는 제조하기 더 쉬운 스캐폴드 분자의 항원-결합 부위를 제공할 수 있다는 것이다. 작은 크기의 결합 멤버는 세포에 들어가거나, 조직 깊숙이 침투하거나, 다른 구조내의 표적에 도달하거나, 표적 항원의 단백질 캐비티(cavity) 내에서 결합하는 것과 같은 유용한 생리학적 특성을 부여할 수 있다. 전형적인 것은 루프 또는 루프들의 아미노산 서열이 표적 항원에 결합하는 항원-결합 부위를 생성하기 위해 특이적으로 또는 무작위적으로 돌연변이 되는, 안정한 백본 및 하나 이상의 가변 루프를 갖는 단백질이다. 상기 단백질은 S.aureus, 트렌스페린(transferrin), 테트라넥틴(tetranectin), 피브로넥틴(예를 들면, 10번째 피브로넥틴 III형 영역 사용), 리포칼린(lipocallin), 뿐만 아니라 감마-결정질(gamma-crystalline) 및 다른 Affilin ™ 스캐폴드(Scil Proteins, Halle, 독일)의 단백질 A의 IgG-결합 영역을 포함한다. 다른 접근법의 예시는 사이클로티드(cyclotides)에 기초한 합성 미소체(microbodies)-분자내 이황화 결합을 갖는 작은 단백질, 마이크로 단백질(microprotein)(예를 들면, VersabodiesTM, Amunix Inc., Mountain View, CA), 및 안키린(ankyrin) 반복 단백질(DARPins, 예를 들면, Molecular Partners AG, Zurich-Schlieren, Switzerland)을 포함한다. 상기 단백질은 또한, 예를 들면, 면역 영역(immuno-domains)과 같은 작고 조작된 단백질 영역을 포함한다(예를 들면, 미국 특허 공개번호. 2003/082630 및 2003/157561 참조) 면역 영역은 적어도 하나의 항체의 상보성 결정영역(complementarity determining region, CDR)을 포함한다.
IL-6a는 예를 들면, 항원에 결합하는 능력 이외에 또 다른 기능적 특징을 분자에 부여 하기 위해 추가적인 아미노산을 포함할 수 있다.
몇가지 경우에서, IL-6a는 검출 가능한 표지를 지니거나, 또는 독소 또는 표적 부분 또는 효소(예를 들면, 펩티딜(peptidyl) 결합 또는 링커를 통해)에 접합된다. 예를 들면, IL-6a는 촉매 부위(예를 들면, 효소 부위) 뿐만 아니라 항원 결합 부위(예를 들면, IL-6의 부위 II에 대한 결합 부위)를 포함할 수 있고, 항원 결합 부위는 항원에 결합하여 촉매 부위를 IL-6 또는 IL-6/IL-6R 복합체로 표적화 한다. 몇가지 경우에서, 촉매 부위는 예를 들면, IL-6a/IL-6 복합체와 관련된 IL-6, IL-6R, 또는 다른 분자를 절단함으로써, IL-6의 생물학적 기능을 추가로 억제할 수 있다.
몇가지 측면에서, 본 발명은 IL-6a의 생물학적 효과 기능을 변경, 예를 들면, 증가, 감소, 또는 제거하기 위해 참조 항체에 비해 변형된 항체 IL-6a를 포함한다. 일례로, 변형되지 않은 모체에 비해 변형된 IL-6a의 약동학을 변경하기 위해 Fc 영역이 변형되거나, 모체의 Fc 영역이 변형된 Fc 영역으로 치환된다. 몇가지 실시예에서, IL-6a는 IgG2 프레임워크를 갖도록 조작된다. 또 다른 실시예에서, IL-6a는 IgG1 또는 IgG2의 프레임워크에 존재하고, pH 6.0에서 IL-6a의 결합 친화성을 증가시키는 변형된 Fc를 가지며, 모체 또는 다른 참조 IL-6a에 비해 pH 7.0에서 결합 친화성을 실질적으로 변경시키지 않는다. 몇가지 실시예에서, Fc 영역은 변형되고, IL-6a는 모체 또는 다른 참조 IL-6a에 비해 감소된 전신 축적, 감소된 반감기, 및/또는 증가된 전신 클리어런스를 가진다.
몇가지 실시예에서, 항체 IL-6a는 보체 고정 및 보체-의존적 세포 독성(complement-dependent cytotoxicity)을 증가시키도록 변형된다. 다른 측면에서, 항체 IL-6a는 참조 항체에 비해 효과기 세포를 활성화시키고, 항체-의존적 세포 독성(antibody-dependent cytotoxicity, ADCC)에 관여하는 항체의 능력을 증가시키도록 변형된다. 몇가지 경우에서, 본 명세서에 기술된 항체는 효과기 세포를 활성화 시키고 항체-의존적 세포 독성(ADCC)에 관여하는 그들의 능력을 향상시키는 것, 및 보체를 고정하고 보체-의존적 세포 독성(CDC)에 관여하는 그들의 능력을 향상시키는 것 모두를 위해 변형될 수 있다.
몇가지 실시예에서, 본 명세서에 기술된 항체는 보체를 고정하고 보체-의존적 세포독성(CDC)에 관여하는 그들의 능력을 감소시키기 위해 변형된다. 다른 실시예에서, 항체는 효과기 세포를 활성화시키고 항체-의존적 세포독성(ADCC)에 관여하는 그들의 능력을 감소시키기 위해 변형된다. 또 다른 실시예에서, 본 명세서에 기술된 항체는 효과기 세포를 활성화시키고 항체-의존적 세포독성(ADCC)에 관여하는 그들의 능력을 감소시키는 것, 및 보체를 고정하고 보체-의존적 세포독성(CDC)에 관여하는 그들의 능력을 감소시키는 것 모두를 위해 변형될 수 있다.
제제
본 명세서에 개시된 제제는 제제에 0.1 mg/ml 내지 100 mg/ml, 0.1 mg/ml 내지 80 mg/ml, 0.1 mg/ml 내지 50 mg/ml, 0.1 mg/ml 내지 20 mg/ml, 0.1 mg/ml 내지 5 mg/ml, 0.1 mg/ml 내지 1 mg/ml, 1 mg/ml 내지 100 mg/ml; 5 mg/ml 내지 100 mg/ml; 5 mg/ml 내지 30 mg/ml; 10 mg/ml 내지 100 mg/ml; 10 mg/ml 내지 30 mg/ml; 20 mg/ml 내지 100 mg/ml; 30 mg/ml 내지 100 mg/ml; 40 mg/ml 내지 100 mg/ml; 50 mg/ml 내지 100 mg/ml; 60 mg/ml 내지 100 mg/ml; 1 mg/ml 내지 80 mg/ml; 5 mg/ml 내지 80 mg/ml; 10 mg/ml 내지 80 mg/ml; 20 mg/ml 내지 80 mg/ml; 40 mg/ml 내지 80 mg/ml; 50 mg/ml 내지 80 mg/ml; 60 mg/ml 내지 80 mg/ml; 1 mg/ml 내지 60 mg/ml; 5 mg/ml 내지 60 mg/ml; 10 mg/ml 내지 60 mg/ml; 20 mg/ml 내지 60 mg/ml; 30 mg/ml 내지 60 mg/ml; 40 mg/ml 내지 60 mg/ml;또는 50 mg/l 내지 60 mg/ml의 농도로 존재하는 IL-6 길항제, 예를 들면, IL-6 항체, 또는 그의 단편을 함유한다. 예를 들면, 제제는 약 1 mg/ml, 2 mg/ml, 5 mg/ml, 10 mg/ml, 20 mg/ml, 25 mg/ml, 30 mg/ml, 40 mg/ml, 50 mg/ml, 또는 55 mg/ml의 IL-6 길항제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 단편을 함유한다.
IL-6 길항제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편은 다른 약학적으로 효과적인 부형제와 함께 제제화 된다. 일 실시예에서, IL-6 길항제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편은 다음 중 하나 이상 또는 모두와 함꼐 제제화 된다: 버퍼, 계면활성제 및 강장제(예를 들면, 당 및/또는 염). 일 실시예에서, 제제는 IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편, 및 하나 이상의 버퍼(예를 들면, 완충제)를 포함한다. 일 실시예에서, 제제는 하나 이상의 계면활성제를 추가로 포함한다. 일 실시예에서, 제제는 하나 이상의 강장제를 추가로 포함한다. 일 실시예에서, 제제는 둘 이상의 강장제, 예를 들면 염 및 당을 포함한다. 일 실시예에서, 제제는 하나 이상의 킬레이트제, 하나 이상의 보존제, 하나 이상의 항산화제, 및/또는 하나 이상의 아미노산을 추가로 포함한다. 일 실시예에서, 제제는 하나 이상의 추가적인 치료제, 예를 들면, 제 2 치료제를 추가로 포함한다. 예시적인 부형제 및 추가적인 치료제는 본 명세서에 추가로 기재된다.
버퍼
개체에 투여하기 적합한 상이한 버퍼가 당업계에 공지되어 있다. 일반적으로, 적합한 버퍼는, 목적하는 폴리펩타이드, 예를 들면, IL-6a, 예를 들면, IL-6 길항제 또는 그의 단편을 다양한 pH, 농도, 온도, 및 다양한 기간 동안의 다양한 버퍼에 노출시키는 안정성 연구를 수행함으로써 선택된다.
버퍼는 예를 들면, 목적하는 폴리펩타이드, 예를 들면, IL-6a, 예를 들면, IL-6 항체 또는 그의 단편을 버퍼에 넣고, 시료를 높은 온도(가속된 안정성 시험)에 노출시켜 물리적 안정성(육안 검사에 의한 침전) 또는 화학적 안정성을 시험하거나, 예를 들면, 약한 양이온 교환 크로마토그래피(cation exchange chromatography)에 의한 탈아미드화(deamidation), 또는 역상 크로마토그래피(reversed phase chromatography)에 의한 산화를 모니터링함으로써 선택될 수 있다. 추가적인 분석은 A280, SDS-PAGE, pH 및 삼투압의 모니터링을 포함할 수 있다. 최고의 물리적 및 화학적 안정성을 제공하는 버퍼가 선택된다. 몇가지 실시예에서, 버퍼는 목적하는 pH와 가까운 액체 조성물을 제공하고, 또한 향상된 항체 안정성, 및 응집, 산화 및 단편화에 대한 저항성을 제공한다.
완충제의 예시는 아세트산염(acetate), 숙신산염(succinate), 글루코네이트(gluconate), 시트르산염(citrate), 히스티딘(histidine), 아세트산(acetic acid), 인산염(phosphate), 인산(phosphoric acid), 아스코르브산(ascorbate), 타르타르산(tartartic acid), 말레산(maleic acid), 글리신(glycine), 젖산염(lactate), 젖산(lactic acid), 아스코르브산(ascorbic acid), 이미다졸(imidazole), 중탄산(bicarbonate) 및 탄산(carbonic acid), 숙신산(succinic acid), 벤조산나트륨(sodium benzoate), 벤조산(benzoic acid), 글루코네이트, 에데테이트(edetate), 아세트산염, 말산염(malate), 이미다졸, 트리스(트리신)(tris(tricine)), 인산, 및 이들의 혼합물을 포함하나, 이에 한정되지 않는다. 일 실시예에서, 완충제는 아세트산염, 시트르산염, 히스티딘, 인산염, 및 트리스(트리신)으로 구성된 군에서 선택된다.
몇가지 실시예에서, 완충제는 약 1 mM 내지 약 50 mM, 약 5 mM 내지 약 40 mM, 약 5 mM 내지 약 30 mM, 약 5 mM 내지 약 20 mM, 약 10 mM 내지 약 50 mM, 약 10 mM 내지 약 40mM, 약 10mM 내지 약 30mM, 약 15mM 내지 약 50mM, 약 15mM 내지 약 40mM, 약 15mM 내지 약 30mM, 약 15mM 내지 약 25mM, 약 18 mM 내지 약 22 mM의 양으로 존재한다. 몇가지 실시예에서, 완충제는 약 10 mM, 약 15 mM, 약 16 mM, 약 17 mM, 약 18 mM, 약 19 mM, 약 20 mM, 약 21 mM, 약 22 mM, 약 23 mM, 약 24 mM, 약 25 mM, 약 30 mM, 약 35 mM, 약 40 mM, 약 45 mM 또는 50 mM의 양으로 존재한다. 일 실시예에서, 제제는 본 명세서에 개시된 버퍼의 적어도 10% 낮은 농도 내지 10% 높은 농도인 버퍼, 예를 들면, 히스티딘 버퍼의 농도를 포함한다. 예로서, 일 실시예에서, 제제는 20 mM +/- 10%의 버퍼를 포함한다. 일 실시예에서, 제제는 20 mM +/- 20%의 버퍼를 추가로 포함한다. 일 실시예에서, 제제는 20 mM +/- 30%의 버퍼를 추가로 포함한다.
일 실시예에서, 완충제는 히스티딘이고, 상기 히스티딘은 L-히스티딘 또는 D-히스티딘, 히스티딘의 용매화된 형태, 히스티딘의 수화된 형태(예를 들면, 일수화물(monohydrate)), 또는 히스티딘의 무수(anhydrous) 형태, 또는 이들의 혼합물을 포함할 수 있다. 일 실시예에서, 완충제는 염산 히스티딘(histidine hydrochloride(HCl))이다. 일 실시예에서, 히스티딘 버퍼는 약 의 농도로 존재한다.
계면활성제
또 다른 측면에서, 본 명세서에 제공된 제제는 하나 이상의 계면활성제를 포함한다. 이론에 얽매이지 않고, 계면활성제의 사용은 예를 들면, 용기에 대한 분자의 부착을 감소시키거나, 특히 교반 조건하에서 단백질의 응집을 감소시키기 위해 유용할 수 있다. 적합한 계면활성제 및 그러한 계면활성제의 농도는 계면활성제가 교반 연구에서 응집을 방지하는지 여부를 시험함으로써 결정될 수 있다. 상기 연구를 수행하는 방법은 당업계에 공지되어 있다. 예를 들면, 교반 스트레스로부터 침전을 방지하기 위해 계면활성제가 필요한지 여부가 결정될 수 있다. 상기 실험에서, 전형적으로, 교반 및 분석을 사용하여 스크리닝이 수행된다. 상기 연구를 위해 사용된 농도의 예시는 0.01%, 0.02%, 0.06%, 및 0.1% w/v의 계면활성제, 예를 들면 폴록사머 188이다. 몇가지 실시예에서, 응집 및/또는 침전은 분광광도법(spectrophotometry)(A280), 육안 검사, 크기 배제 크로마토그래피(size exclusion chromatography, SEC), 광차폐방식(light obscuration)(예를 들면, HIAC 장치를 사용하여), 또는 마이크로-플로우 이미징(Micro-Flow Imaging ™)(MFI, ProteinSimple, Santa Clara, CA)의 분석을 이용하여 평가된다. 계면활성제는 일반적으로 최소량의 침전, 예를 들면, 눈에 보이지 않는 침전, 또는 주사 중 미립자 물질에 대한 지침(예를 들면, USP <788>), 또는 안과용 미립자 물질에 대한 지침(예를 들면, USP <789>)을 충족하는 입자 수와 관련된 제제에 사용하기 위해 선택된다.
개시된 제제에 사용하기 적합한 계면활성제는 하기를 포함할 수 있으나, 이에 제한되지 않는다: 폴리소르베이트(예를 들면, 폴리소르베이트 20, 폴리소르베이트 21, 폴리소르베이트 40, 폴리소르베이트 60, 폴리소르베이트 61, 폴리소르베이트 65, 폴리소르베이트 80, 폴리소르베이트 81, 폴리소르베이트 85 및 이들의 혼합물), 폴록사머(예를 들면, 폴록사머 P188), 트리톤(tritons)(트리톤 X100 또는 트리톤 X405), 도데실황산나트륨(sodium dodecyl sulfate), 라우릴황산나트륨(sodium laurel sulfate), 소듐 옥틸 글리코사이드(sodium octyl glycoside), 라우릴-설포베타인(lauryl-sulfobetaine), 미리스틸-설포베타인(myristyl-sulfobetaine), 리놀레일-설포베타인(linoleyl-sulfobetaine), 스테아릴-설포베타인(stearyl-sulfobetaine), 라우릴-사르코신(lauryl-sarcosine), 미리스틸-사르코신(myristyl-sarcosine), 리놀레일-사르코신(linoleyl-sarcosine), 스테아릴-사르코신(stearyl-sarcosine), 리놀레일-베타인(linoleyl-betaine), 미리스틸-베타인(myristyl-betaine), 세틸-베타인(cetyl-betaine), 라우로아미도프로필-베타인(lauroamidopropyl-betaine), 코카미도프로필-베타인(cocamidopropyl-betaine), 리놀레아미도프로필-베타인(linoleamidopropyl-betaine), 미리스타미도프로필-베타인(myristamidopropyl-betaine), 팔미도프로필-베타인(palmidopropyl-betaine), 이소스테아라미도프로필-베타인(isostearamidopropyl-betaine), 미리스타미도프로필-디메틸아민(myristamidopropyl-dimethylamine), 팔미도프로필-디메틸아민(palmidopropyl-dimethylamine), 이소스테아라미도프로필-디메틸아민(isostearamidopropyl-dimethylamine), 소듐 메틸 코코일-타우레이트(sodium methyl cocoyl-taurate,) 디소듐 메틸 올레일-타우레이트(disodium methyl oleyl-taurate), 디하이드록시프로필 PEG 5 리놀레암모늄 클로라이드(dihydroxypropyl PEG 5 linoleammonium chloride), 폴리에틸렌 글리콜(polyethylene glycol), 폴리프로필렌 글리콜(polypropylene glycol), 크레모포 EL(Cremophor® EL), 틸록사폴(tyloxapol), 옥토시놀 40(octoxynol 40), 및 폴리옥실 40 스테아레이트(polyoxyl 40 stearate) 및 이들의 혼합물. 일 실시예에서, 계면활성제는 폴리소르베이트 20(본 명세서에서 또한 트윈 20으로 지칭됨), 폴리소르베이트 80(본 명세서에서 또한 트윈 80으로 지칭됨), 및 폴록사머 P188로 구성되는 군으로부터 선택된다.
특정 실시예에서, 제제는 약 0.001% 내지 약 10%, 약 0.005% 내지 약 5%, 약 0.01% 내지 약 1%, 약 0.05% 내지 약 0.5%, 약 0.05% 내지 약 0.1%, 약 0.01% 내지 약 0.8%, 약 0.01% 내지 약 0.05%, 약 0.02% 내지 약 0.08%, 약 0.02% 내지 약 0.05%, 또는 약 0.02% 내지 약 0.05% w/v 농도의 계면활성제(예를 들면, 폴리소르베이트 20 또는 트윈 20)를 함유한다. 일 실시예에서, 제제는 약 0.01%, 약 0.02%, 약 0.03%, 약 0.04%, 약 0.05%, 약 0.06%, 약 0.07%, 약 0.08%, 약 0.09%, 약 0.1%, 약 0.2%, 약 0.3%, 약 0.4%, 약 0.5% 또는 약 1% w/v 농도의 계면활성제를 함유한다. 일 실시예에서, 제제는 본 명세서에 개시된 계면활성제의 적어도 10% 낮은 농도 내지 10% 높은 농도인 계면활성제의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 0.03% +/- 0.003%의 계면활성제를 포함한다. 일 실시예에서, 제제는 0.03% +/- 0.006%의 계면활성제를 추가로 포함한다. 일 실시예에서, 제제는 0.03% +/- 0.01%의 계면활성제를 추가로 포함한다.
몇가지 실시예에서, 계면활성제는 폴리소르베이트 20(예를 들면, 트윈 20), 폴리소르베이트 80(예를 들면, 트윈 80), 또는 폴록사머 188이다. 상기 실시예에서, 폴리소르베이트 20, 폴리소르베이트 80, 또는 폴록사머 188은 제제에 약 0.01% 내지 약 0.2%, 약 0.01% 내지 약 0.1%, 0.01% 내지 약 0.05%, 0.01% 내지 약 0.03%, 0.02% 내지 약 0.8%, 0.02% 내지 약 0.05%, 0.02% 내지 약 0.04% w/v의 농도로 존재한다. 일 실시예에서, 폴리소르베이트 20, 폴리소르베이트 80, 또는 폴록사머 188은 제제에 약 0.01%, 0.02%, 0.03%, 0.04%, 또는 0.05% w/v의 농도, 예를 들면, 0.03% w/v의 농도로 존재한다. 본 명세서에 기술된 모든 제제에서, 폴리소르베이트 20, 폴리소르베이트 80, 또는 폴록사머 188은 교환될 수 있다.
강장제
또다른 측면에서, 본 명세서에 기술된 제제는 하나 이상의 강장제를 포함한다. 예를 들면, 본 명세서에 기술된 제제는 두개의 강장제를 함유할 수 있다. 강장제는 제제의 삼투압을 제제가 신체 조직의 세포 또는 개체의 기관과 생리학적으로 양립할 수 있도록 등장성으로 조절할 수 있는 부형제를 의미한다. 몇가지 실시예에서, 강장제는 당(예를 들면, 당류(saccharide)), 탄수화물, 염, 또는 이들의 혼합물과 같은 폴리올(polyop)일 수 있다. 어떤 이론에 굴하지 않고, 상기 물질은 IL-6 길항제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편의 안정성에 기여할 수 있다.
일 실시예에서, 강장제는 폴리올이다. 본 명세서에 사용된 폴리올은 다수의 하이드록실기를 갖는 부형제를 의미하고, 당(환원 및 비환원 당), 당 알코올 및 당산(sugar acids)을 포함한다. 일 실시예에서, 폴리올은 약 600 kD 미만의 분자량(예를 들면, 약 120 내지 약 400 kD 범위)을 가진다. 적합한 폴리올은 만니톨(mannitol), 트레할로스(trehalose), 소르비톨(sorbitol), 에리스리톨(erythritol), 아이소말트(isomalt), 락티톨(lactitol), 말티톨(maltitol), 자일리톨(xylitol), 글리세롤(glycerol), 락티톨, 프로필렌 글리콜(propylene glycol), 폴리에틸렌 글리콜(polyethylene glycol), 이노시톨(inositol), 또는 이들의 혼합물을 포함하나, 이에 한정되지 않는다. 몇가지 실시예에서, 적합한 당 및 탄수화물은 단당류, 이당류, 및 다당류, 또는 이들의 혼합물을 포함한다. 적합한 당(예를 들면, 당류) 또는 탄수화물은 프럭토스(fructose), 글루코스(glucose), 만노스(mannose), 수크로스(sucrose), 소르보스(sorbose), 자일로스(xylose), 락토스(lactose), 말토스(maltose), 수크로스, 덱스트란(dextran), 풀루란(pullulan), 덱스트린(dextrin), 사이클로덱스트린(cyclodextrins), 가용성 전분(soluble starch), 하이드록시에틸 전분(hydroxyethyl starch), 수용성 글루칸(water-soluble glucans), 및 이들의 혼합물을 포함하나, 이에 한정되지 않는다.
몇가지 실시예에서, 제제는 본 명세서에 기술된 폴리올, 당, 또는 탄수화물을 약 0.1% 내지 약 20%, 약 1% 내지 약 10%, 약 1% 내지 약 8%, 약 1% 내지 약 5 %, 약 2% 내지 약 10%, 약 2% 내지 약 8%, 약 2% 내지 약 5%, 약 3% 내지 약 10%, 약 3 내지 약 8%, 약 3% 내지 약 5%의 농도로 포함한다. 일 실시예에서, 제제는 폴리올, 당, 또는 탄수화물을 약 1%, 약 2%, 약 3%, 약 4%, 약 5%, 약 6%, 약 7%, 약 8%, 약 9%, 또는 약 10%의 농도로 함유한다. 일 실시예에서, 제제는 본 명세서에 개시된 폴리올의 적어도 10% 낮은 농도 내지 10% 높은 농도인 폴리올의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 4% +/- 0.4%의 폴리올을 포함한다. 일 실시예에서, 제제는 % +/- 0.8%의 소르비톨을 추가로 포함한다. 일 실시예에서, 제제는 4% +/- 1.2%의 폴리올을 추가로 포함한다.
일 실시예에서, 제제는 강장제를 포함하고, 상기 강장제는 소르비톨 또는 트레할로스로부터 선택된다. 일 실시예에서, 제제는 소르비톨을 함유한다. 일 실시예에서, 제제의 소르비톨 농도는 약 1% 내지 약 10%, 약 1% 내지 약 5%, 약 2% 내지 5%, 또는 약 4%이다.
특정 실시예에서, 강장제는 염이다. 이론에 얽매이지 않고, 염, 예를 들면, 염화나트륨(sodium chloride)의 포함은 단백질을 탈아미노화로부터 보호함으로써 항체의 안정성을 또한 향상시킬 수 있다. 적합한 염은 염화나트룸, 숙신산 나트륨(sodium succinate), 황산 나트륨(sodium sulfate), 염화 칼륨(potassium chloride), 염화 마그네슘(magnesium chloride), 황산 마그네슘(magnesium sulfate), 및 염화 칼륨calcium chloride)을 포함하나, 이에 한정되지 않는다.
몇가지 실시예에서, 제제는 약 1 mM 내지 약 200 mM, 약 10 mM 내지 약 150 mM, 약 20 mM 내지 약 150 mM, 약 50 mM 내지 약 150 mM, 약 100 mM 내지 약 150 mM, 약 10 mM 내지 약 100 mM, 약 10 mM 내지 약 50 mM, 약 10 mM 내지 약 40 mM, 약 10 mM 내지 약 30 mM, 약 15 mM 내지 약 50 mM, 약 15 mM 내지 약 30 mM, 또는 약 15 mM 내지 약 25 mM 농도의 염을 포함한다. 일 실시예에서, 제제는 약 10 mM, 15 mM, 20 mM, 25 mM, 50 mM, 또는 150 mM, 예를 들면, 20 mM 농도의 염을 함유한다. 일 실시예에서, 제제는 본 명세서에 개시된 염의 적어도 10% 낮은 농도 내지 10% 높은 농도인 염의 농도를 포함한다. 일례로, 일 실시예에서, 제제는 20 mM +/- 10%의 염을 포함한다. 일 실시예에서, 제제는 20 mM +/- 20%의 염을 추가로 포함한다. 일 실시예에서, 제제는 20 mM +/- 30%의 염을 추가로 포함한다.
일 실시예에서, 제제는 염을 포함하고, 상기 염은 염화나트륨이다. 일 실시예에서, 제제는 약 10 mM 내지 약 150 mM, 약 10 mM 내지 약 50 mM, 약 10 mM 내지 약 30 mM, 약 15 mM 내지 약 25 mM, 또는 약 10 mM, 약 15 mM, 약 20 mM, 또는 약 25 mM 농도의 염화나트륨을 포함한다.
특정 실시예에서, 제제는 두개의 강장제, 예를 들면, 폴리올(당) 및 염을 포함한다. 일 실시예에서, 제제는 소르비톨 및 염화나트륨을 포함한다.
특정 실시예에서, 본 명세서에서 제공되는 제제는 눈과 등장성이다(예를 들면, 약 270 내지 330 mOsm/kg의 삼투압을 가짐). 몇가지 실시예에서, 제제는 약 250 내지 약 450 mOsm/kg, 300 내지 400 mOsm/kg, 350 내지 400 mOsm/kg, 200 내지 375 mOsm/kg, 또는 350 내지 375 mOsm/kg의 삼투압을 가진다. 몇가지 실시예에서, 제제는 270 내지 330 mOsm/kg, 예를 들면, 약 320 mOsm/kg의 삼투압을 가진다.
다른 부형제
본 발명의 특징적인 제제는 다른 약학적인 허용가능한 부형제를 또한 함유할 수 있다. 예를 들면, Gennaro(ed.), Remington: The Science and Practice of Pharmacy, 20th ed., Lippincott, Williams & Wilkins(2000)(ISBN: 0683306472); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Ed., Lippincott Williams & Wilkins Publishers(1999)(ISBN: 0683305727); Kibbe(ed.), Handbook of Pharmaceutical Excipients, 3rd ed.(2000)(ISBN: 091733096X); Protein Formulation and Delivery, McNally and Hastedt(eds.), Informa Health Care(ISBN: 0849379490)(2007)를 참조한다. 첨가될 수 있는 부형제 중에는, 킬레이트제, 아미노산, 방부제(예를 들면, 보존제), 침투 증진제, 생체접착제, 안정화제, 항산화제,및 점도제가 있다.
제제는 하나 이상의 침투 증진제 및/또는 생체접착제를 포함할 수 있다. 침투 증진제 및 생체접착제는 예를 들면, 키토산(chitosan), 시토칼리신 B(cytochalasin B), 아미네이티드 젤라틴(aminated gelatin), 폴리-ε-카프로락톤(poly-ε-caprolactone)(카르보폴(carbopol) 941P); 폴리(부틸시아노아크릴레이트)(poly(butylcyanoacrylate)); 폴리-L-아르기닌(poly-L-arginine); 사이클로덱스트린(cyclodextrins); 젤란(gellan); 폴리(아크릴 산)(poly(acrylic acid)); 히알루론 산(hyaluronic acid); 뮤신(mucin); 알지네이트(alginate); 카보필(carbophil), 및 폴록사머(예를 들면, Nagarwal et al., J Controlled Release, 136:2-13, 2009; Ding, PSTT 1:328-35, 1998; 및 Sahoo et al., Drug Discovery Today, 13:144-51, 2008을 참조한다)를 포함할 수 있다. 다른 부형제는 안정제로서 유용할 수 있고, 예를 들면,
글리세린(glycerin), 염화 칼륨(potassium chloride), 인산 칼륨(potassium phosphate), 프로필렌 글리콜(propylene glycol), 아세트산 나트륨(sodium acetate), 아황산 수소 나트륨(sodium bisulfite), 붕산 나트륨(sodium borate), 붕산 나트륨 수화물(sodium borate decahydrate), 염화 나트륨(sodium chloride), 시트르산 나트륨(sodium citrate), 인산 나트륨(sodium phosphate), 인산 나트륨(인산 나트륨 일염기 및 이염기 포함)(sodium phosphate (including sodium phosphate monobasic and dibasic)); 염화 아연(zinc chloride), 페놀(phenol), 벤조산염(benzoate), 피마자유의 유도체(derivatives of castor oil), 및 에틸렌 옥사이드(ethylene oxides), 및 크레모포(Cremophor®, BASF Corp., Germany)를 포함할 수 있다.
제제는 하나 이상의 킬레이트제를 포함할 수 있다. 킬레이트제는 본 발명의 조성물에서 환원된 산소종의 형성을 낮추고, 산성종(예를 들면, 탈아미노화) 형성을 감소시키며, 항체 응집을 감소시키고, 및/또는 항체 단편화를 감소시키고, 및/또는 항체 산화를 감소시킬 수 있다. 상기 킬레이트제는 킬레이트제의 보호 없는 항체에 비해 제제화된 항체의 분해를 감소 또는 방지할 수 있다.
적합한 킬레이트제는 아미노폴리카르복실 산(aminopolycarboxylic acids), 하이드로아미노카르복실 산(hydroxyaminocarboxylic acids), N-치환된 글리신(N-substituted glycines), 2-(2-아미노-2-옥소에틸) 아미노에탄 설폰산(2-(2-amino-2-oxoethyl) aminoethane sulfonic acid, BES), 데페록사민(deferoxamine, DEF), 시트르산(citric acid), 나이아신아마이드(niacinamide), 및 데스옥시콜레이트(desoxycholates) 및 이들의 혼합물을 포함하나, 이에 한정되지 않는다. 더 바람직하게는, 킬레이트제는 에틸렌 디아민 테트라 아세트산(ethylenediaminetetraacetic acid, EDTA), 디에틸렌 트리 아민 펜타 아세트산 5(diethylenetriamine pentaacetic acid 5, DTPA), 니트릴로 트리 아세트산(nitrilotriacetic acid, NTA), N-2-아세트아미도-2-이미노 디아세트산(N-2-acetamido-2-iminodiacetic acid, ADA), 비스(아미노에틸)글리콜에테르(bis(aminoethyl)glycolether), N, N, 1ST, IST-테트라 아세트산(N, N, 1ST, IST-tetraacetic acid, EGTA), 트랜스-디아미노 시클로 헥산 테트라 아세트산(trans-diaminocyclohexane tetraacetic acid, DCTA), 글루탐산(glutamic acid), 및 아스파라긴산(aspartic acid), N-히드록시 에틸 이미노 디아세트산(N- hydroxyethyliminodiacetic acid, HIMDA), N, N-비스-하이드록시에틸렌글리신(비신)(N, N-bis-hydroxyethylglycine(bicine)) 및 N-(트리스 히드록시 메틸 메틸) 10 글리신(트리신)(N-(trishydroxymethylmethyl) 10 glycine (tricine)), 글리실글리신(glycylglycine), 쇼듐 데스옥시콜레이트(sodium desoxycholate), 에틸렌디아민(ethylenediamine); 프로필렌디아민(propylenediamine); 디에틸렌트리아민(diethylenetriamine); 트리에틸렌테트라아민(트리엔)(triethylenetetraamine (trien)), 에틸렌디아민테트라아세토 EDTA(ethylenediaminetetraaceto EDTA); 디소듐 EDTA(disodium EDTA), 칼슘 EDTA 옥살산(calcium EDTA oxalic acid), 말산염(malate), 시트르산(citric acid), 시트르산 일수화물(citric acid monohydrate), 및 트리소듐 시트르산-이수화물(trisodium citrate-dihydrate), 8-하이드록시 퀴놀레이트(8-hydroxyquinolate), 아미노산, 히스티딘(histidine), 시스테인(cysteine), 메티오닌(methionine), 펩타이드, 폴리펩타이드, 및 단백질 및 이들의 혼합물로 구성된 군으로부터 선택된다. 더 바람직하게는, 킬레이트제는 디칼륨 에데테이트(dipotassium edetate), 디소듐 에데테이트(disodium edetate), 에데테이트 칼슘 디소듐(edetate calcium disodium), 소듐 에데테이트(sodium edetate), 트리소듐 에데테이트(trisodium edetate), 및 칼륨 에데테이트(potassium edetate); 및 데페록사민(DEF)의 적합한 염인 데페록사민 메실레이트(deferoxamine mesylate, DFM), 또는 이들의 혼합물을 포함하는 EDTA의 염으로 구성된 군으로부터 선택된다. 본 발명에 사용된 킬레이트제는 가능한 곳에서, 화합물의 유리산, 또는 유리 염기 형태, 또는 염 형태로서, 또는 화합물 또는 상응하는 염의 무수물, 용매화물 또는 수화물 형태로 존재할 수 있다.
제제는 하나 이상의 아미노산을 포함할 수 있다. 적합한 아미노산은 아르기닌(arginine), 글루탐산(glutamic acid), 히스티딘(histidine), 또는 메티오닌(methionine)을 포함하나, 이에 한정되지 않는다. 아미노산은 전형적으로 단백질의 안정성 및/또는 용해도를 향상시키기 위해 선택된다. 상기 아미노산을 확인하는 방법은 당업계에 공지되어 있다. 몇가지 실시예에서, 제제는 아르기닌을 함유한다.
제제는 하나 이상의 점도제를 포함할 수 있다. 점도제는, 점도제가 포함되지 않으면 일반적으로 깜빡임(blinking) 및 배액(drainage)에 의해 결막낭을 통해 신속하게 제거될, 안과용 치료제의 체류 시간을 증가시키기 위해 안과 제제에 포함된다.
적합한 점도제는 소듐 카복시메틸 셀룰로스(sodium carboxymethyl cellulose)(본 명세서에 또한 카복시메틸 셀룰로스 또는 CMC로 지칭됨)를 포함하는 메틸 셀룰로스, 에틸 셀룰로스(ethyl cellulose)를 포함하는 하이드록시 셀룰로스(hydroxy celluloses), 하이드록시프로필 메틸 셀룰로스(하이프로멜로스); 934P, 971P 및 974P과 같은 카르보머(carbomers); 폴리비닐 알코올(polyvinyl alcohol); 잔탄검(xanthan gum); 구아검(guar gum); 젤란검(gellan gum); 및 글리세린(glycerin)을 포함하나 이에 한정되지 않는다.
제제는 하나 이상의 항산화제를 포함할 수 있다. 적합한 항산화제는 메티오닌(methionine), 티오황산나트륨(sodium thiosulfate), 카탈라아제(catalase), 및 백금(platinum)을 포함하나 이에 한정되지 않는다.
제제는 예를 들면, 사용하는 동안 미생물 및 곰팡이 오염을 방지하기 위해 하나 이상의 보존제를 포함할 수 있고, 및/또는 예를 들면, 단백질을 용해시키기 위해 세제 또는 계면활성제를 포함할 수 있다. 적합한 보존제는 염화 벤잘코늄(benzalkonium chloride), 염화 벤제토늄(benzethonium chloride), 벤질 알코올(benzyl alcohol), 클로로부탄올(chlorobutanol), 벤조도데시니움 브로마이드(benzododecinium bromide), 메틸 파라벤(methyl paraben), 프로필 파라벤(propyl paraben), 페닐에틸 알코올(phenylethyl alcohol), 페녹시에탄올(phenoxyethanol), 페놀(phenol), m-크레졸(m-cresol), 에데테이트 디소듐(edetate disodium), 소르브산(sorbic acid) 및 폴리쿼터늄-1(polyquaternium-1)을 포함하나, 이에 한정되지 않고, 0.001 w/v 내지 1.0% w/v의 농도로 포함될 수 있다. 전형적으로, 본 명세서에 기술된 치료용 단백질을 함유하는 제제는 멸균되었지만 방부제가 없다.
제제는 또한 윤활제 또는 습윤제로서 작용하는 다른 화합물을 포함할 수 있다. 이들은 글리세롤(glycerol), 프로필렌 글리콜(propylene glycol), 에틸렌 글리콜(ethylene glycol)과 같은 단량체; 폴리에틸렌 글리콜(polyethylene glycol), 셀룰로스 패밀리의 다양한 중합체와 같은 중합체의 폴리올(polymeric polyols): 하이드록시 프로필 메틸 셀룰로스(hydroxypropylmethyl cellulose,“HPMC”), 소듐 카르복시메틸 셀룰로스(sodium carboxymethyl cellulose), 하이드록시 프로필셀룰로스(hydroxy propylcellulose,“HPC”), 덱스트란 70(dextran 70)과 같은 덱스트란; 젤라틴과 같은 수용성 단백질; 및 폴리비닐 알코올(polyvinyl alcohol), 폴리비닐피롤리돈(polyvinylpyrrolidone), 포비돈(povidone)과 같은 비닐 중합체(vinyl polymers), 및 카르보머 934P(carbomer 934P), 카르보머 941; 카르보머 940, 카르보머 974P와 같은 카르보머와 같은 점도제를 포함한다. 또 다른 추가적인 예는, 히알루론산(hyaluronic acid) 및 그의 염, 및 콘드로이틴 황산(chondroitin sulfate) 및 그의 염, 및 아크릴산 중합체(acrylic acid polymers)와 같은 다당류를 포함한다. 특정 실시예에서, 제제는 1 cP 내지 400 cP의 점도를 갖는다.
pH
또 다른 측면에서, 본 명세서에 제공된 제제는 약 5.0 내지 약 7.5, 약 5.5 내지 약 7.5, 약 6.0 내지 약 7.5, 약 6.5 내지 약 7.5, 약 5.0 내지 약 7.0, 약 5.5 내지 약 7.0, 약 6.0 내지 약 7.0, 또는 약 6.2 내지 약 6.8의 pH를 갖는다. 일 실시예에서, 본 명세서에 제공된 제제는 7.5 미만, 7.0 미만, 6.9 미만, 6.8 미만, 6.6 미만, 6.5 미만, 6.4 미만, 6.3 미만, 6.2 미만, 또는 6.0 미만의 pH를 갖는다. 일 실시예에서, 본 명세서에 제공된 제제는 약 6.5 또는 6.5의 pH를 갖는다.
본 명세서에 기술된 조성물 또는 제제의 pH 수준은 당업계에 공지된 모든 방법으로 제제화 공정 중 조정될 수 있다. 일 실시예에서, 고농축 산, 예를 들면, 염산(HCl), 또는 고농축 염기, 예를 들면, 수산화나트륨(NaCl)은 원하는 pH에 도달할때까지 첨가될 수 있다.
안정성
당업계에 공지된 바와 같이, 단백질, 예를 들면, 항체는 작은 분자보다 교반 및 온도에 더 민감하다. 교반 스트레스는 침전으로 이어질 수 있고, 열 스트레스는 침전 및 화학적 분해로 이어질 수 있다. 또한, 전달 장치에 화합물을 로딩하는 동안, 열 스트레스에 노출될 수 있다. 본 출원인은 교반 스트레스 및 열에 노출되었을 때 우수한 안정성을 성공적으로 제공하는 제제를 달성하였다.
몇가지 실시예에서, 본 명세서에 기술된 제제는 안정적이다. 몇가지 실시예에서, 제제는 본 명세서에 기술된 환경(예를 들면, 특정 온도에서 보관, 또는 교반 스트레스)하에서 안정성을 나타낸다. 몇가지 실시예에서, 안정성은 본 명세서에 기술된 하나 이상의 방법(예를 들면, 육안 검사에 기초하여, 분광광도계(spectrophotometry)(A280)에 의한 내용, SDS-PAGE 비환원, SDS-PAGE 환원; 크기 배제 HPLC(SE HPLC) 또는 SE-UPLC; 역상 HPLC(RP-HPLC); 약한 음이온 교환 HPLC (WAEX-HPLC); 효능(potency); 광차폐방식(light obscuration) 입자 수 검사(particle count test)(예를 들면, USP <789>에 기술된 바와 같은 광차폐방식 입자 수 검사); 또는 현미경 입자 수 검사(예를 들면, USP <789>에 기술된 바와 같은 현미경 입자 수 검사)), 및/또는 당업계에 공지된 방법을 사용하여 평가된다.
안정성은 육안 검사에 기초하여 평가될 수 있다. 몇가지 실시예에서, 제제는 가시적인 입자가 본질적으로 없는 투명 내지 약간 유백색의 무색 용액인 경우 안정하다.
몇가지 실시예에서, 제제는 약 25℃ 내지 40℃, 예를 들면, 약 27℃, 약 28℃, 약 29℃, 약 30℃, 약 31℃, 약 32℃, 약 33℃, 약 34℃, 약 35℃, 약 36℃, 약 37℃, 약 38℃, 약 39℃ 또는 약 40℃의 온도에서, 적어도 2일; 3일; 5일; 1주; 10일, 2주, 3주, 4주, 5주, 6주, 8주, 16주, 20주, 25주, 30주, 35주, 40주, 45주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 또는 그 이상 동안 안정하다.
몇가지 실시예에서, 제제는 약 4℃, 약 5℃, 약 6℃와 같은 약 2℃ 내지 약 8℃, 2℃ 내지 8℃, 4℃, 5℃, 또는 6℃의 온도에서 보관되는 장기간동안 안정하다. 예를 들면, 제제는 상기 보관 온도에서 적어도 2주; 4주; 6주; 2개월; 3개월; 6개월, 1년, 2년, 3년, 또는 4년 동안 안정하다.
제제의 안정성은 예를 들면, 적어도 2, 4, 6, 8, 12, 또는 18개월 동안, 예를 들면 2 내지 8℃에서 보관된 후에, 또는 주변 조건, 예를 들면, 실온(room temperature, RT), 예를 들면, 약 25℃에서, 적어도 2주, 1개월, 2개월, 3개월, 5개월, 6개월, 12개월, 또는 18개월 동안 보관된 후에 평가될 수 있다. 몇가지 실시예에서, 제제는 2 내지 8℃에서 적어도 8개월동안 보관된 후에 안정하다. 몇가지 실시예에서, 제제는 실온에서 적어도 5개월동안 노출된 후에 안정하다. 몇가지 상기 실시예에서, 제제는 BFS 용기에서 적어도 5개월 동안 보관된 후에 안정하다.
안정성은 예를 들면, 본 명세서에 기술된, 또는 당업계에 알려진 방법 및 기준에 기초하여 평가될 수 있다. 예를 들면, 안정성은 물리적인 순도(예를 들면, 응집력 부족, 예를 들면, 본 명세서에 크기 배제로도 지칭된, 크기 배제 HPLC, SE HPLC, 또는 SEC HPLC를 이용하여 평가되는), 화학적인 순도(예를 들면, 약한 음이온 교환 HPLC, 역상 HPLC, 및/또는 SDS PAGE(예를 들면, 환원 또는 비환원 SDS-PAGE를 이용하여 평가되는), 및/또는 입자 수준(예를 들면, 육안으로 또는 액체 입자 수 측정기(Beckman Coulter, Brea, CA)를 사용한 입자 수 측정에 의해 평가되는)에 기초하여 평가될 수 있다.
몇가지 실시예에서, 안정성은 예를 들면, USP <789>(U.S. Pharmacopeia, Particulate Matter in Opthalmic Solutions)에 기술된 바와 같이, 안 용액의 입자 물질에 대한 가이드라인을 따르는 것에 기초하여 입증된다.
몇가지 실시예에서, 제제는 예를 들면, 광차폐방식 입자 수 검사(예를 들면, USP <789>에 기술된 바와 같은 광차폐방식 입자 수 검사)를 사용하여 평가한 바와 같이, 10 μm 이상의 입자에 대하여 1 ml당 50 입자 이하, 및/또는 25 μm 이상의 입자에 대하여 1 ml당 5 입자 이하를 가진다.
몇가지 실시예에서, 제제는 예를 들면, 현미경 입자 수 검사(예를 들면, USP <789>에 기술된 바와 같은 현미경 입자 수 검사)를 사용하여 평가한 바와 같이, 10 μm 이상의 입자에 대하여 1 ml당 50 입자 이하, 및/또는 25 μm 이상의 입자에 대하여 1 ml당 5 입자 이하, 및/또는 50 μm 이상의 입자에 대하여 1 ml당 2 입자 이하를 가진다.
몇가지 실시예에서, 안정성은 예를 들면, USP <789>(U.S. Pharmacopeia, Particulate Matter in Injections)에 기재된 바와 같이, 주사 중 입자 물질에 대한 가이드라인을 따르는 것에 기초하여 입증된다.
몇가지 실시예에서, 제제는 예를 들면, 광차폐방식 입자 수 검사(예를 들면, USP <789>에 기술된 바와 같은 광차폐방식 입자 수 검사)를 사용하여 평가한 바와 같이, 10 μm 이상의 입자에 대하여 용기당(100 ml 이하의 부피를 가진 용기) 6000 입자 이하, 및/또는 25 μm 이상의 입자에 대하여 용기당(100 ml 이하의 부피를 가진 용기) 600 입자 이하를 가진다.
몇가지 실시예에서, 제제는 예를 들면, 현미경 입자 수 검사(예를 들면, USP <789>에 기술된 바와 같은 현미경 입자 수 검사)를 사용하여 평가한 바와 같이, 10 μm 이상의 입자에 대하여 5 ml당 3000 입자 이하, 및/또는 25 μm 이상의 입자에 대하여 5 ml당 300 입자 이하를 가진다.
몇가지 실시예에서, 제제 내의 단백질은, 예를 들면, 실온(RT)에서 1 내지 8시간 동안, 예를 들면, 실온에서 4시간 동안, 예를 들면, 단백질 용액을 볼텍싱 한 후 응집의 부족(응집의 부족은 예를 들면, 제제가 응집된 형태에 비해 단량체 형태의 단백질을 90% 초과, 91% 초과, 92% 초과, 93% 초과, 94% 초과, 95% 초과, 96% 초과, 97% 초과, 98% 초과, 또는 99% 초과하여 포함하는지 여부로 입증될 수 있다)에 의해 입증된 바와 같이, 교반 스트레스로부터 보호된다. 응집은 예를 들면, 본 명세서에 기술된 방법 또는 당업계에 공지된 방법을 사용하여 평가될 수 있다. 예를 들면, 응집은 초원심분리(ultracentrifugation), 크기 배제 크로마토그래피, 겔 전기영동, 동적 광산란(dynamic light scattering), 및/또는 혼탁도 측정을 사용하여 평가될 수 있다.
몇가지 측면에서, 안정성은 당업계에 공지된 물리적 또는 화학적 방법에 의해 평가된다. 예를 들면, 물리적 순도 또는 응집의 부족은 크기 배제 HPLC, 또는 제제 내의 단량체 폴리펩타이드의 상대적인 양을 결정하는 다른 방법을 사용하여 결정될 수 있다. 전형적으로, 수용가능한 안정성을 가진 제제는 단백질의 응집된 형태에 비해 치료용 단백질(예를 들면, IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편)의 단량체 형태를 90% 초과하여 함유한다. 몇가지 실시예에서, 제제는 단백질의 응집된 형태에 비해 치료용 단백질(예를 들면, IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편)의 단량체 형태를 90% 초과하여(예를 들면, 91% 초과, 92% 초과, 93% 초과, 94% 초과, 95% 초과, 96% 초과, 97% 초과, 98% 초과, 또는 99% 초과하여) 함유한다.
화학적 순도는 예를 들면, 약한 양이온 교환 HPLC 또는 역상 HPLC를 사용하여 결정될 수 있다. 전형적으로, 수용가능한 안정성을 가진 제제는 분자의 화학적으로 변형된 형태에 비해 천연 분자를, 예를 들면, 약한 양이온 교환 HPLC를 사용하여 평가된 바와 같이, 80% 초과하여 함유한다. 몇가지 실시예에서, 제제는 분자의 화학적으로 변형된 형태(예를 들면, 산화 또는 아세틸화된 형태)에 비해 천연 분자를 80% 초과하여(예를 들면, 85% 초과, 87% 초과, 90% 초과, 또는 95% 초과하여) 함유한다.
입자는 시각적으로 확인될 수 있다. 몇가지 실시예에서, 제제는 시각적으로 확인될 수 있는 입자가 본질적으로 없는 것이다.
생물학적 치료제는 상대적으로 짧은 유통기한을 가질 수 있고, 보관, 운송, 및 환자에의 사용 뿐만 아니라 생물학적 제제의 충분한 공급 확보에 장애가 될 수 있는 특수한 보관 조건을 요구할 수 있기 때문에 투여하기에 문제가 될 수 있다. 본 명세서에 제공된 특정 제제의 장점은 제제가 냉장 조건하에서 뿐만 아니라 실온(예를 들면, 25℃)및 그 이상(예를 들면, 40℃)에 따른 온도에서 대단히 안정하다는 것이다. 따라서, 사이토카인 단백질 또는 폴리펩타이드 제제(예를 들면, 이종성의(heterologous) 사이토카인 단백질 또는 폴리펩타이드 제제), 예를 들면, 본 명세서에 기술된 제제는, 몇가지 실시예에서, 실온(예를 들면 25℃)에서 적어도 3일, 5일, 1주, 10일, 2주, 3주, 6주, 8주, 16주, 20주, 25주, 30주, 35주, 40주, 45주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 12개월, 또는 그 이상의 기간 동안 안정한 액체형태로 제공된다. 몇가지 실시예에서, 개월은 날짜에 기초하여, 예를 들면, 첫번째 월의 1일부터 두번째 월의 1일까지로 결정된다.
다른 측면에서, 제제는 약 25℃ 내지 약 40℃, 예를 들면, 약 27℃, 약 28℃, 약 29℃, 약 30℃, 약 31℃, 약 32℃, 약 33℃, 약 34℃, 약 35℃, 약 36℃, 약 37℃, 약 38℃, 약 39℃ 또는 약 40℃에서 적어도 2일; 3일; 5일; 1주; 10일, 2주, 3주, 4주, 5주, 6주, 8주, 16주, 20주, 25주, 30주, 35주, 40주, 45주, 1개월, 2개월, 3개월, 4개월, 5개월, 6개월, 7개월, 8개월, 또는 그 이상의 기간 동안 안정하다.
투여
형태
본 명세서에 기술된 약학적 조성물 및 제제는 다양한 형태로 제제화될 수 있다. 이들은 예를 들면, 액체 용액(예를 들면, 주사 및 주입 가능한 용액), 나노입자 및 리포좀(liposome)을 포함하는 분산액(dispersion) 또는 현탁액(suspension)과 같은 액체, 반고체 및 고형 제형을 포함한다. 형태는 일반적으로 의도된 투여방식 및 치료적 적용에 의존할 것이다. 본 명세서에 기술된 물질의 조성물은 전형적으로 주사 또는 주입가능한 용액의 형태이거나, 또는 국소 전달, 예를 들면 국소적 안구 전달을 위해 제제화 된다.
몇가지 실시예에서, 본 명세서에 기술된 약학적 조성물은 제조 및 보관 조건 하에서 멸균이고 안정하다. 약학적 조성물은 또한 그것이 투여를 위한 규제 및 산업 표준을 만족시키는지 보장하기 위해 시험될 수 있다. 조성물은 용액, 마이크로 에멀젼(microemulsion), 분산액, 리포솜, 또는 높은 약물(예를 들면, 생물학적 제제)농도에 적합한 다른 정돈된 구조로서 제제화될 수 있다. 멸균 주사 용액은, 상기 열거된 성분 중 하나 또는 조합물을 갖는 적절한 용매에, 필요에 따라 본 명세서에 기술된 물질을 필요한 양으로 혼입하고 여과 멸균함으로써 제조할 수 있다. 일반적으로, 분산액은 본 명세서에 기술된 작용제를 염기성 분산 매질 및 상기 열거된 것들로부터 필요한 다른 성분을 함유하는 멸균 비히클(vehicle)에 혼입시킴으로써 제조된다. 멸군 주사 용액을 제조하기 위한 멸균 파우더의 경우, 예시적인 제조방법은 진공건조 및 동결건조를 포함하고, 이는 본 명세서에 기재된 물질과, 사전에 멸균 여과된 그의 용액으로부터 모든 추가적인 원하는 성분의 파우더를 생성한다. 용액의 적절한 유동성은 예를 들면, 레시틴(lecithin)과 같은 코팅의 사용, 분산제의 경우 요구되는 입자 크기의 유지, 및 계면활성제의 사용에 의해 유지될 수 있다. 주사용 조성물의 장기적인 흡수는 흡수를 지연시키는 물질, 예를 들면 모노 스테아린산 염(monostearate salts) 및 젤라틴을 포함시킴으로써 조작될 수 있다. 상기 물질은 저용량 제제에 특히 유용할 수 있다. 몇가지 실시예에서, 제제는 1 mg/ml 이하의 치료용 단백질(예를 들면, IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편)을 포함하고, 젤라틴이 제제에 포함된다.
특정 실시예에서, 제제는 담체(carrier)와 함께 제조된다. 상기 실시예에서, 제제는 예를 들면, 제제의 방출이 제어된, 임플란트(implant) 또는 마이크로 캡슐화된 전달 시스템에 의해 전달될 수 있다. 에틸렌 비닐 아세테이트(ethylene vinyl acetate), 폴리산 무수물(polyanhydrides), 폴리글리콜산(polyglycolic acid), 콜라겐, 폴리오르토에스테르(polyorthoesters) 및 폴리락트산(polylactic acid)과 같은 생분해성, 생체 적합성 중합체가 사용될 수 있다. 예를 들면, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978을 참조한다.
안과용 팩은 안과용 제제를 눈에 장기간 접촉시키는데 사용될 수 있다. 면 거즈(cotton pledget)를 제제로 적시고, 이를 원개(fornix)의 위 또는 아래에 삽입한다. 제제는 또한 이온삼투압(iontophoresis) 방법으로 투여될 수 있다. 이 절차는 용액이 전극을 가진 아이컵(eyecup)에서 각막과 접촉하도록 한다. 약물의 확산은 전위의 차이에 의해 영향을 받는다. 사용된 이온영동(iontophoretic) 시스템은 Ocuphor®1(Iomed Inc., USA); Eyegate® II Delivery System1(EyeGate Pharma, USA); 및 Visulex®1(Aciont Inc., USA)를 포함한다. Amo and Urtti, Drug Discovery Today, 13:143, 2008을 참조한다.
지속적인 안구 전달을 위한 또 다른 전략은 겔화제(gelifying agents)의 사용이다. 이 물질은 점안액 또는 안내 주사로 액체 형태로 전달될 수 있다. 점적(instillation) 후, 중합체는 상변화를 겪고, 장기간에 걸쳐 약물을 방출하는 반고체 또는 고체 매트릭스를 형성한다. 상 전이는 온도, 이온 농도 또는 pH 변화에 의해 유도될 수 있다.
국소적인 안약 사용을 위해, Gelite®(젤란검으로부터 정제된 음이온성 헤테로 다당류(heteropolysaccharide))를 함유하는 Timoptic®-XE1(Merck and Co. Inc., USA)과 같은 겔 형성 용액; 폴리(아크릴산)이 함유된 Pilogel®1(Alcon, Inc., Switzerland) 점안액; 및 Azasite®1(Insite Vision, USA)이 임상적으로 시험되었다. 이 물질은 기존의 점안액에 비해 약물 보유력을 향상시키고, 안구내 증가된 약물 흡수 및 감소된 투약 빈도를 유도한다. Amo and Urtti, Drug Discovery Today, 13:135-143, 2008을 참조한다.
본 발명의 특징적인 제제는 주사, 예를 들면, 유리체내(intravitreal), 눈주위(periocular), 또는 결막하(subconjunctival) 주사로 전달될 수 있다. 제제는 결막 아래에 주사되어 단순 확산에 의한 공막(sclera)을 통한 눈으로의 이동을 가능하게 할 수 있다. 또한, 제제는 물질을 섬모체(ciliary body), 맥락막(choroid), 및 망막(retina)에 전달하기 위해, 결막 및 눈의 더 후방 부분에 있는 테논 캡슐(tenon's capsule) 아래에 주사될 수 있다. 제제는 또한 교후부 주사(retrobulbar injection)에 의해 투여될 수 있다.
일반적으로, 본 명세서에 기술된 제제는 볼러스(bolus)로 정맥 내 투여, 또는 일정 기간 동안 계속적인 주입, 근육내(intramuscular), 동맥내(intraarterial), 뇌척수액내(intrathecal), 캡슐내(intracapsular), 안와내(intraorbital), 심장내(intracardiac), 피내(intradermal), 복강내(intraperitoneal), 활맥내(intrasynovial), 경기관내(transtracheal), 피하(subcutaneous), 피하조직하(subcuticular), 관절내(intraarticular), 피낭하(subcapsular), 지주막하(subarachnoid), 척수내(intraspinal), 경막외(epidural) 주사, 흉골내(intrasternal) 주사 및 주입과 같은 모든 적합한 방법에 의해 개체에 투여될 수 있다. 다른 적합한 투여 방식은 국소(예를 들면, 진피 또는 점막) 또는 흡입(비내(intranasal) 또는 폐내(intrapulmonary)) 경로를 포함한다. 특정 적용을 위해, 투여 경로는 다음 중 하나이다: 정맥내 주사 또는 주입, 피하 주사 또는 근육내 주사. 눈으로의 투여를 위해, 몇가지 실시예에서, 특징적인 제제의 투여 방식은 눈으로의 국소 투여, 예를 들면, 방울 형태 투여이다. 제제를 함유할 수 있고, 및/또는 제제의 투여를 위해 사용될 수 있는 예시적인 장치는 단순한 점안기(eye dropper), 계량(metering) 기능이 있거나 없는 짜내는 플라스틱 병(squeeze bottle), 및 Catalent(Somerset, NJ)에 의해 제조된 것과 같은 블로우/필/씰(blow/fill/seal, BFS) 장치, 다중 사용 장치(multiuse device), 예를 들면, 팁-씰 기술(tip-seal technology), 은/올리고다이나믹 기술(silver/oligodynamic technology), 멸균 필터, 허탈된 1차 용기(collapsing primary containers) 등을 포함한다.
용기에 대한 추가적인 고려사항은 그것이 일단 채워지면 수용가능한 유통기간을 제공하는지, 예를 들면, 수용가능한 낮은 수준의 증발이 있는지, 및/또는 제제가 방출 분석 규격(release assay specifications), 예를 들면, 본 명세서에 기술된 규격을 만족하는지이다. 몇가지 실시예에서, 용기는 예를 들면, 5℃에서, 적어도 2년, 예를 들면, 적어도 3년, 적어도 4년, 또는 적어도 5년의 유통기한을 제공하기에 적합하다. 몇가지 실시예에서, 용기는 예를 들면, 5℃에서, 적어도 3년의 유통기한을 제공하기에 적합하다. 몇가지 실시예에서, 용기는 실온에서 적어도 2개월, 3개월, 4개월, 5개월, 6개월, 8개월, 10개월, 또는 12개월의 유통기한을 제공하기에 적합하다. 몇가지 실시예에서, 용기는 실온에서 적어도 5개월의 유통기한을 제공하기에 적합하다. 예를 들면, 특정 플라스틱, 예를 들면, 저밀도 폴리에틸렌(low density polyethylene, LDPE), 고밀도 폴리에틸렌(high density polyethylene, HDPE), 또는 폴리 프로필렌(polypropylene)의 다양한 적합한 용기의 재료가 당업계에 공지되어 있다.
제제는 용기에서의 일회용 적용을 위해 제조되거나, 다중 용기(multiuse container)에서의 사용을 위해 제조될 수 있다.
본 명세서의 특징적인 제제는 예를 들면, 눈의 후방 분절과 관련된, 예를 들면, 질환을 치료하기 위해 유리체내로 전달될 수 있다. 유리체내 투여 방법은 당업계에 공지되어 있고, 예를 들면, 안내 주사, 이식 가능한 장치를 포함한다.
몇가지 실시예에서, 제제는 이식 가능한 장치를 사용하여 유리체내로 투여된다. 몇가지 실시예에서, 제제는 소르비톨과 같은 열 안정제를 포함한다. 몇가지 실시예에서, 소르비톨은 5% w/v 이상의 농도로 존재한다.
이식 가능한 장치는, 예를 들면, 폴리비닐 알코올-에틸렌 비닐 아세테이트 중합체(polyvinyl alcohol-ethylene vinyl acetate polymers) 및 폴리설폰 모세관 섬유(polysulfone capillary fibers)와 같은 비생분해성 장치, 폴리락트산(polylactic acid), 폴리글리콜산(polyglycolic acid), 및 폴리락트-코-글리콜산(polylactic-co-glycolic acid), 폴리카프로락톤(polycaprolactones), 및 폴리산 무수물(polyanhydrides)과 같은 생분해성장치일 수 있다. 장치는 나노입자, 리포솜, 또는 마이크로스피어(microsphere)의 형태로 전달될 수 있다.
복용량(dosing)
본 발명의 특징적인 제제는 고정 투여량, 중량 결정 투여량(예를 들면, mg/kg), 또는 연령 결정 투여량으로 투여될 수 있다. 본 명세서에 기술된 제제는 예를 들면, 하루에 4번; 하루에 3번; 하루에 2번; 하루에 1번; 하루 걸러 하루마다; 매 3, 4, 또는 5일마다; 매주마다 ; 매 2주마다; 매 3주마다; 매 4주마다; 매 5주마다; 매달마다; 매 2달마다; 매 3달마다; 매 4달마다; 매 6달마다; 또는 필요에 따라(임의로) 투여될 수 있다.
약학적 조성물은 본 명세서에 기술된 물질의 "치료적으로 유효한 양(therapeutically effective amount)"을 포함할 수 있다. 물질의 치료적으로 유효한 양은 개인의 질병 상태, 나이, 성별, 및 체중, 및 개체에서 원하는 반응을 유도하는 화합물의 능력, 예를 들면, 적어도 하나의 질환 파라미터(예를 들면, 징후(sign))의 개선, 또는 적어도 하나의 질환 증상(symptom)(및 선택적으로 투여되는 어떤 추가적인 물질의 효과)의 개선과 같은 요소에 따라 다양할 수 있다. 치료적으로 유효한 양은 또한, 치료학적으로 유익한 효과가 조성물의 어떤 독성 또는 유해한 효과보다 큰 것이다. 몇가지 실시예에서, "치료적으로 유효한 양"은 개체 집단에서 결정되고, 그 양은 사이토카인 관련 질환, 예를 들면, IL-6 관련 질환의 적어도 하나의 증상 또는 지표(indication)를, 적어도 5%, 10%, 25%, 50%, 70%, 75%, 80%, 85%, 90%, 95%, 또는 100%의 병이 있는 집단에서 개선시키는 데 효과적이다. 제제는 전형적으로 치료적으로 유효한 양으로 투여된다. 몇가지 경우에서, 치료적으로 유효한 제제는 비히클 제제이다. 몇가지 경우에서, 치료적으로 유효한 제제는 치료용 단백질을 포함한다.
약학적 조성물은 본 명세서에 기술된 바 및 당업계에 공지된 바, 예를 들면, 임플란트, 주입 펌프, 피하 주사바늘, 및 무바늘 피하 주사 장치와 같은 의료 장치를 사용해 투여된다. 장치는 예를 들면, 약학적 조성물을 보관하기 위한 하나 이상의 하우징을 포함할 수 있고, IL-6a의 단위 투여량, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편, 및 선택적으로 제 2 치료제를 전달하도록 구상될 수 있다. 복용량은 고정 투여량, 즉, 치료될 개체에 단일 투여량으로 적합한 물리적으로 분리된 단위일 수 있는데; 각 단위는 미리 정해진 양의 IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편을 함유할 수 있고, 약학적 담체와 관련된, 및 선택적으로 다른 물질, 예를 들면, 카운터를 통해 사용가능하거나, 처방된 제품과 같은 물질과 관련된 원하는 치료 효과를 생성하도록 계산될 수 있다.
몇가지 실시예에서, IL-6 관련 질환과 같은 본 명세서에 기술된 질환을 치료하기 위해, 제제는 질환을 가진 개체에, 질환의 적어도 하나의 징후 또는 증상에 대해 지속적인 개선을 유도하기에 충분한 양으로, 충분한 시간 동안 투여된다. 개체가 장기간, 예를 들면, 1 내지 4주의 간격으로 적어도 2번, 개선을 보일 경우, 개선은 "지속(sustained)"된 것으로 간주된다. 개선의 정도는 징후 또는 증상에 기초하여 결정될 수 있고, 또한, 삶의 질 설문지와 같은 개체에게 적용되는 설문지가 사용될 수 있다.
개체가 선택된 징후 및/또는 증상에 대해 기준 이상의 개선을 나타낼 때까지 제제의 투여량을 반복적으로 투여함으로써 개선이 유도될 수 있다. 만성 질환의 치료에서, 개선의 양은 적어도 1개월 이상, 예를 들면, 1, 2, 또는 3개월 또는 이상 또는 무기한의 기간 이상으로 반복적으로 투여함으로써 평가될 수 있다. 급성 질환의 치료에서, 물질은 1 내지 6주의 기간 동안, 또는 단일용량으로 투여될 수 있다.
초기 또는 간헐적 치료 후 질환의 정도가 하나 이상의 징후 또는 증상에 따라 개선될 수 있으나, 치료는 동일한 수준, 또는 감소된 투여량 또는 빈도로 무기한 계속될 수 있다. 치료는 예를 들면, 징후 또는 증상의 개선 또는 소멸에 따라 중단될 수 있다. 일단 치료가 감소 또는 중단되고 증상이 다시 나타나면, 치료가 재개될 수 있다.
치료
본 발명의 IL-6a로 치료할 수 있는 질병은 IL-6 발현, 예를 들면, 높아진 IL-6 발현이 질병 상태와 관련되거나, 질병 상태에 대한 전제조건인 질병을 포함한다. 상기 질병은 IL-6에 의해 유도된 혈관 신생 및 염증이 질병 병리에 기여하는 질병을 포함한다. 이는 IL-6가 정상 수준에 비해 높아진 질병, 예를 들면, 유리체(예를 들면, 당뇨성 황반부종, 당뇨 망막증, 및 포도막염과 같은) 또는 눈의 조직에서 IL-6가 높아진 질병을 포함한다. 본 명세서에서 그 전체가 참고로 인용된 WO2014/074905에 기술된 바와 같이, 많은 IL-6 관련 질병, 예를 들면, DME에서, 병리학적 과정을 재현하는 마우스 및 렛트 맥락막 신생 혈관 형성 모델에서 IL-6 항체의 투여에 의한 IL-6 경로의 차단이 신생 혈관 형성을 항-VFGF 양성 대조군과 유사한 수준까지 감소시킨다는 것이 이전에 나타났다. 이러한 생체내 결과는 IL-6의 국소적인 억제가 IL-6 발현과 관련된 안질환, 및 혈관 누출을 수반하는 안질환, 예를 들면, 황반부종을 치료하는 데 유용할 수 있음을 입증한다.
IL-6 관련 질병의 예시는 안구 건조(예를들면, 안구 건조 질병 또는 안구 건조증), 알레르기성 결막염, 포도막염, 나이관련 황반변성(AMD)(예를 들면, 습성(삼출성) AMD, 건성(위축성) AMD), 증식성 당뇨 망막증(PDR), 당뇨성 황반부종(DME), 열공 망막 박리(RRD), 망막 정맥 폐색(RVO), 시신경 척수염(NMO), 또는 근시성 맥락막 신생혈관을 포함하는 특정 눈의 질병을 제한 없이 포함한다. 다른 치료될 수 있는 안질환은 각막 이식, 각막 마모, 또는 눈에 대한 기타 신체적 상해와 같은 외상으로 인한 것을 포함한다. 다른 치료될 수 있는 안질환은 안구암, 예를 들면, 눈 및 눈 주위, 예를 들면, 안와 또는 눈꺼풀에 영향을 미치는 암을 포함한다. 따라서, 본 발명은 IL-6 관련 질병을 갖는 개체를 본 명세서에 기술된 IL-6a로 치료하는 것을 포함한다.
본 명세서에 사용된 바와 같이, "치료하다(treat)"라는 용어는 질환, 예를 들면, 본 명세서에 기술된 질환과 관련된 상태, 증상 또는 파라미터를 개선하거나, 질환의 발병 또는 진행을 통계적으로 유의적인 정도로 또는 당업자에게 감지될 수 있는 정도로 예방하는 데 효과적인 양, 방법, 및/또는 방식으로 본 명세서에 기술된 물질을 개체, 예를 들면, 환자에게 투여하는 것을 의미한다. 치료는 질환, 질환의 증상, 또는 질환에 대한 경향을 치료(cure), 치유(heal), 완화(alleviate), 경감(relieve), 변경(alter), 구제(remedy), 개선(ameliorate), 완화(palliate), 개선(improve)하거나 그에 영향을 미칠 수 있다. 효과적인 양, 방법, 또는 방식은 개체에 따라 다양할 수 있고, 개체에 맞춰질 수 있다. 예시적인 개체는 사람, 영장류, 및 다른 인간이 아닌 포유류를 포함한다. 또한, 본 발명의 특징적인 제제는 질환 또는 그의 증상 또는 그의 징후의 발병 위험을 감소시키기 위해 예방적으로 투여될 수 있다.
몇가지 실시예에서, IL-6 관련 질병은 염증성 질병이다. 몇가지 실시예에서, 질병은 녹내장(glaucoma)이다.
몇가지 실시예에서, 질병은 안 통증(ocular pain), 예를 들면, 안 질병 또는 안 질환과 관련된 통증이다.
또한, 몇가지 실시예에서, 개체의 치료는 개체가 IL-6 관련 질병을 갖는지, 및 선택적으로, 개체가 스테로이드 또는 항-VEGF 물질과 같은 다른 비 IL-6 억제성 치료에 저항성이 있는지를 결정하는 것을 포함한다.
본 명세서에 기술된 제제는 상기 IL-6 관련 질병을 갖거나 가질 위험이 있는 개체에 투여될 수 있다. IL-6 관련 질병 또는 질환은 하기 기술된 바와 같은 염증성 질환일 수 있다. 본 명세서에 기술된 제제는 상기 IL-6 매개 염증성 질환을 갖거나 가질 위험이 있는 개체에 투여될 수 있다.
본 발명의 특징적인 제제는 안 질환, 예를 들면, IL-6 길항제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편을, 눈에 직접적으로, 또는 눈의 영역에 국소적으로 투여하는 것이 바람직한 안질환에 사용하기에 특히 적합하다.
안구 건조 질환을 가진 개체는 눈의 염증을 나타낼 수 있고, 따가움(scratchy), 날카로움(stingy), 가려움(itchy), 화끈거림(burning) 또는 압박감, 자극, 통증, 및 발적을 겪을 수 있다. 안구 건조 질환은 과도한 눈의 배수 및 불충분한 눈물 생성과 관련될 수 있다. 본 발명의 특징적인 제제는 하나 이상의 상기 증상의 발병 또는 악화를 개선 또는 예방하기 위해 상기 개체에 투여될 수 있다. 또한, 본 발명의 특징적인 제제는 통증, 예를 들면, 신경 염증으로 인한 통증과 같은 안 통증을 완화시키기 위해 사용될 수 있다.
본 명세서에 기술된 몇가지 실시예는 IL-6 관련 질환, 예를 들면, 안구 건조 질환을 가진 동물을 치료하는 방법을 포함한다. 안구 건조는 예를 들면, 개과 동물(canines)에서 심각한 질환일 수 있다. 개에서 안구 건조와 관련된 질환의 제한되지 않은 예시는 선천적 질환, 감염(예를 들면, 개과 디스템퍼 바이러스(canine distemper virus)), 약물 유도(예를 들면, 설파 항생제(sulfa antibiotics)에 의해), 및 제 3 안검의 눈물샘 제거(체리 눈(cherry eye))를 포함한다. 또한, 안구 건조 질환은 특정 개의 종, 예를 들면, 코커 스패니엘(Cocker Spaniel), 시추(Shih Tzu), 라사압소(Lhasa Apso), 불독(Bulldog), 슈나우저(Schnauzer), 및 웨스트 하이랜드 화이트 테리어(West Highland White Terrier)에서 일반적으로 나타난다. 치료될 수 있는 동물의 다른 비제한적 예시는 고양이 및 말을 포함한다.
본 발명의 제제는 눈에 영향을 주는 알레르기 반응을 가진 개체, 예를 들면, 심각한 알레르기성(아토피성) 안 질병, 예를 들면, 알레르기성 결막염과 같은 질병을 겪는 개체에 투여될 수 있다. 예를 들면, 제제는 국소적으로 투여될 수 있다. Keane-Myers et al., (1999)Invest Ophthalmol Vis Sci, 40(12): 3041-6가 또한 참조된다.
본 발명의 특징적인 제제는 당뇨 망막증을 갖거나 가질 위험이 있는 개체에 투여될 수 있다. 예를 들면, Demircan et al., (2006)Eye, 20:1366-1369, 및 Doganay et al., (2006)Eye, 16:163-170이 참조된다.
포도막염
포도막염은 급성 및 만성 형태를 포함하고, 하나 이상의 홍채, 섬모체, 및 맥락막의 염증을 포함한다. 만성 형태는 전신 자가면역 질병, 예를 들면, 베체트 병(Behcet’s syndrome), 강직성 척추염(ankylosing spondylitis), 소아 류마티스 관절염(juvenile rheumatoid arthritis), 라이터 증후군(Reiter’s syndrome), 및 염증성 장 질병(inflammatory bowel disease)과 관련될 수 있다. 전방 포도막염(anterior uveitis)에서, 염증은 주로 홍채(또한 홍채염)에 있다. 전방 포도막염은 전신 자가면역 질병을 가진 개체뿐만 아니라 전신 자가면역 질병을 가지지 않은 개체에도 영향을 줄 수 있다. 중간 포도막염(intermediate uveitis)은 종종 전방 또는 맥락망막 염증이 거의 없이, 전방 유리체, 말초 망막, 및 섬모체의 염증을 수반한다. 평면부염(pan-planitis)은 홍채와 맥락막 사이의 섬모체 평면부(pars plana)의 염증으로 발생한다. 후방 포도막염(posterior uveitis)은 포도막(uveal tract)과 주로 맥락막을 수반하고, 또한, 맥락막염(choroiditis)이라고도 한다. 후방 포도막염은 전신 염증 또는 자가면역 질병과 관련될 수 있다. 이는 몇 개월 또는 몇 년 동안 지속될 수 있다. 본 발명의 특징적인 제제는 포도막염의 모든 전술한 형태를 치료하기 위해 개체에 투여될 수 있다. 또한, 예를 들면, Tsai et al., (2009)Mol Vis, 15:1542-1552, 및 Trittibach et al., (2008)Gene Ther., 15(22): 1478-88가 참조된다.
몇가지 실시예에서, 본 발명의 특징적인 제제는 나이관련 황반변성(AMD), 예를 들면 습성(삼출성) AMD 또는 건성(위축성) AMD를 갖거나 가질 위험이 있는 개체를 치료하기 위해 사용될 수 있다. 제제는 눈에 국소적으로 적용되거나, 전신적으로 주사(예를 들면, 유리체내) 또는 제공될 수 있다. 예를 들면, Olson et al., (2009)Ocul Immunol Inflamm, 17(3):195-200가 참조된다.
당뇨성 황반부종(DME)
당뇨성 황반부종(DME)은 시력 감소 및 잠재적인 실명을 유발하는 망막 혈관의 폐색 및 누출을 수반한다. DME의 표준 치료는 스테로이드 또는 항-VEGF 항체의 국소 투여를 포함한다. 그러나, 많은 환자들이 이러한 치료에 반응하지 않는다. 당뇨성 황반부종의 병인은 혈관 신생, 염증, 및 산화적 스트레스 요소를 수반한다. IL-6는 저산소증 및 교혈당에 의해 유도되고, 혈관 염증, 혈관 투과성, 및 병리학적 혈관 신생을 증가시킬 수 있다. IL-6는 직접적으로 VEFG 발현을 유도할 수 있고, 동물모델에서 맥락막 혈관 신생을 촉진할 수 있다. DME 환자에서, 안구 내 IL-6 수준은 황반 두께 및 질병의 심각성과 양의(positively) 상관관계가 있다. IL-6 수준은 항-VEGF 치료에 실패한 환자에서 증가하는 반면, 항-VEGF에 반응하는 환자에서는 감소한 것으로 보고되었다. 따라서, 본 명세서에 기술된 바와 같은 IL-6a의 투여는 항-VEGF 치료에 반응하지 않는 환자를 포함하여, 항-VEGF 치료제와 함께 또는 항-VEGF 치료제의 대안으로서 당뇨병을 치료하는 데 유용하다. 또한, IL-6a로 황반부종을 치료하는 것은 병리를 억제하기 위한 어떤 기전을 완전히 억제할 필요성을 제거함으로써 안전성을 향상시킬 수 있고, 따라서 각 사이토카인의 원하는, 생리학적 역할의 일부를 보존한다. 따라서, VEGF 억제와 함께 국소적 IL-6a 치료는 투여 빈도를 감소시키고, 치료의 부작용을 감소시킬 수 있다.
DME에서 유리체의 IL-6 수준과, 질병의 중증도 및 VEGF에 반응하지 않는 개체간에 양의 상관관계가 있다. 따라서, 본 명세서에 기술된 바와 같은 IL-6a는 스테로이드 치료, 항-VEGF 치료, 또는 둘다에 반응하지 않는 DME 개체를 치료하는 데 사용될 수 있다. 주어진 치료, 예를 들면, 스테로이드 치료, 또는 항-VEGF 치료, 또는 둘다에 반응하지 않는 개체는 선택된 증상에 호전, 감소 또는 개선을 나타내지 않는다. 몇가지 경우에서, IL-6a, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편은 예를 들면, DME를 치료하기 위해 항-VEGF 치료 또는 스테로이드 치료와 함께 사용된다. 따라서, 몇가지 실시예에서, 본 명세서에 제공된 제제는 항-VEGF 물질 또는 스테로이드를 포함한다.
본 명세서에 기술된 제제는 안 질병을 치료하기 위한 모든 방식에 의해 투여될 수 있다. 물질은 비경구 방식으로 전달될 수 있다. 택일적으로 또는 부가적으로, 제제는 눈에 직접적으로, 또는 눈 주변으로 전달될 수 있다. 예를 들면, 제제는 국소, 안내, 유리체내, 예를 들면, 유리체내 주사, 또는 결막하로 투여될 수 있다.
또한, 본 명세서에 기술된 제제, 예를 들면, 본 명세서에 기술된 IL-6 항체 또는 그의 단편을 포함하는 제제는 암, 예를 들면, 안 암(눈 또는 눈 주변의 암), 전립선암, 백혈병, 다발성 골수종(multiple myeloma), 염증성(만성 염증성 증식성 질병과 같은) 및 자가면역 질병, 예를 들면, 류마티스 관절염, 캐슬만병(Castleman’s disease)(거대 또는 혈관 여포성(angiofollicular) 림프절 과형성, 림프성 과오종(hamartoma), 혈관 여포성 림프절 과형성), 소아 류마티스 관절염(다관절성(polyarticular) 소아 특발성 관절염 및 전신성 소아 특발성 관절염을 포함하는), 스틸병(Still’s disease)(소아 특발성 관절염 및 성인 발병 스틸병을 포함하는), 성인 발병 스틸병, 아밀로이드 A 아밀로이드증(amyloid A amyloidosis), 류마티스성 다발근통(polymyalgia rheumatica), 요흔성 부종을 가진 경감된 혈청 반응 음성의 대칭성 윤활막염(remitting seronegative symmetrical synovitis with pitting edema), 척추관절염(spondyloarthritides), 베체트병(Behcet’s disease)(안구 징후의 치료를 포함하는), 죽상동맥경화증(atherosclerosis), 건선(psoriasis), 전신성 홍반성 낭창(systemic lupus erythematosis), 다발근염(polymyositis)(염증성 근육병증(inflammatory myopathy)), 재발성 다발 연골염(relapsing polychondritis), 후천적 A형 혈우병(acquired hemophilia A), 다발성 경화증(multiple sclerosis), 염증에 의한 빈혈, 및 크론병(Crohn’s disease)과 같은 질환을 치료하기 위해 사용될 수 있다.
또한, IL-6 길항제는 특정 신경 질병의 치료에 유용하다. 따라서, 몇가지 경우에서, 본 명세서에 기술된 제제는 우울증 및 알츠하이머 병(Alzheimer’s disease)의 치료에 사용될 수 있다.
본 명세서에 기술된 제제로 치료될 수 있는 다른 질병은 전신 경화증(systemic sclerosis), 다카야수 동맥염(Takayasu arteritis), 거대세포성 동맥염(giant cell arteritis), 이식편대숙주질병(graft versus host disease) 및 TNF-수용체-관련 주기성 증후군(TNF-receptor-associated periodic syndrome, TRAPS)을 제한 없이 포함한다.
동등물(Equivalents)
모든 기술적 특징은 상기 특징의 모든 가능한 조합에서 개별적으로 결합될 수 있다.
본 발명은 그의 사상 또는 본질적인 특징을 벗어나지 않고 다른 특정 형태로 구현될 수 있다. 따라서, 전술한 실시예들은 본 명세서에 기술된 본 발명을 제한하기 보다는 모든 측면에서 예시적으로 고려되어야 한다.
본 명세서에 인용된 모든 참고 문헌의 전체 내용은 그 전체가 본 명세서에 포함된다.
이하의 비 한정적인 예시는 본 명세서에 기술된 본 발명의 실시예를 추가로 예시한다.
실험예
실험예 1: kD에 의한 제제 시험
IL-6 항체, EBI-031에 대한 유망한 부형제 및 제제를 확인하기 위해 각 제제에서 항체의 kD를 평가하여 초기 스크리닝을 수행하였다. 확산 상호작용 파라미터인 kD는 자유 용액에서 나노 입자의 확산 계수를 측정하는 Wyatt DyanPro 플레이트 판독기를 사용하여 결정되었다. 농축된 EBI-031을 제제 버퍼에서 연속적으로 희석하여 원하는 농도를 달성하였다. EB-031 단량체에 대한 확산 계수는 다중 반복을 사용하여 측정되었다. 평균 확산 계수는 EBI-031 농도에 대해 나타냈다. 확산 계수인 kD는 그래프의 기울기를 y 값으로 나누어 측정하였다.
시험된 제제는 시트르산염, 히스티딘, 또는 인산염에서 선택되는 20 mM의 버퍼, 및 다음 중 하나를 함유한다: 5% 수크로스, 5% 트레할로스, 5% 소르비톨, 또는 150 mM NaCl. 시트르산염 버퍼를 함유하는 시험된 제제는 pH 6.0 또는 pH 6.5를 가지고, 히스티딘 또는 인산염 버퍼를 함유하는 제제는 6.0, 6.5, 또는 7.0의 pH를 갖는다. 하기 나타낸 표 2는 kD 제제 스크리닝의 결과를 요약한다.
이 스크리닝의 결과에 기초하여, 용해도는 pH 6.5에서 양호하나, pH 6.0, 또는 pH 7.0에서 양호하지 않고, 이는 pH 6.5가 최적임을 제시한다. 결과의 요약은 표 2에 나타냈다. 이 스크리닝은 또한 염화나트륨과 같은 염이 모든 제제에 양호함을 나타냈다.
| 버퍼 | pH | 부형제 | 번호 | 선 방정식 | kD |
| 시트르산염 | 6 | 염화나트륨 | 1 | -6E-09x + 4E-07 | -0.015 |
| 수크로스 | 2 | -1E-08x + 4E-07 | -0.025 | ||
| 트레할로스 | 3 | -2E-09x + 3E-07 | -0.00667 | ||
| 소르비톨 | 4 | -4E-09x + 3E-07 | -0.01333 | ||
| 시트르산염 | 6.5 | 염화나트륨 | 5 | -2E-09x + 4E-07 | -0.005 |
| 수크로스 | 6 | -4E-09x + 4E-07 | -0.01 | ||
| 트레할로스 | 7 | -1E-09x + 3E-07 | -0.00333 | ||
| 소르비톨 | 8 | -1E-09x + 3E-07 | -0.0033 | ||
| 시트르산염 | 6 | 염화나트륨 | 9 | -5E-09x + 4E-07 | -0.0125 |
| 수크로스 | 10 | -8E-09x + 4E-07 | -0.02 | ||
| 트레할로스 | 11 | -8E-09x + 4E-07 | -0.02 | ||
| 소르비톨 | 12 | -1E-08x + 4E-07 | -0.025 | ||
| 히스티딘 | 6.5 | 염화나트륨 | 13 | -4E-09x + 4E-07 | -0.01 |
| 수크로스 | 14 | -4E-09x + 4E-07 | -0.01 | ||
| 트레할로스 | 15 | -5E-09x + 4E-07 | -0.0125 | ||
| 소르비톨 | 16 | -5E-09x + 4E-07 | -0.0125 | ||
| 히스티딘 | 7 | 염화나트륨 | 17 | -6E-09x + 5E-07 | -0.012 |
| 수크로스 | 18 | -9E-09x + 4E-07 | -0.0225 | ||
| 트레할로스 | 19 | -5E-09x + 4E-07 | -0.0125 | ||
| 소르비톨 | 20 | -3E-09x + 4E-07 | -0.0075 | ||
| 히스티딘 | 6 | 염화나트륨 | 21 | -1E-08x + 5E-07 | -0.02 |
| 수크로스 | 22 | -2E-09x + 3E-07 | -0.00667 | ||
| 트레할로스 | 23 | -1E-08x + 4E-07 | -0.025 | ||
| 소르비톨 | 24 | -7E-09x + 4E-07 | -0.0175 | ||
| 인산염 | 6.5 | 염화나트륨 | 25 | -3E-09x + 4E-07 | -0.0075 |
| 수크로스 | 26 | -1E-09x + 3E-07 | -0.00333 | ||
| 트레할로스 | 27 | -2E-09x + 3E-07 | -0.00667 | ||
| 소르비톨 | 28 | -1E-09x + 3E-07 | -0.00333 | ||
| 인산염 | 7 | 염화나트륨 | 29 | -5E-09x + 4E-07 | -0.0125 |
| 수크로스 | 30 | -9E-09x + 4E-07 | -0.0225 | ||
| 트레할로스 | 31 | -1E-09x + 3E-07 | -0.00333 | ||
| 소르비톨 | 32 | -7E-10x + 3E-07 | -0.00233 |
kD 제제 스크리닝 요약
실험예 2: 다른 버퍼 및 부형제의 동적 광산란(Dynamic Light Scattering, DLS) 스크리닝
EBI-031에 대한 다른 버퍼 및 부형제를 스크리닝하기 위해 가속된 안정성 연구를 수행하였다. 시험된 제제는 1 mg/ml의 EBI-031, 20 mM의 버퍼, 및 시험된 부형제(강장제 또는 아미노산과 같은) 함유하였다. 사용된 버퍼는: pH 7.5의 트리스 버퍼, pH 6.5 또는 pH 7.5의 인산염 버퍼, pH 6.5의 히스티딘 버퍼, pH 5.5의 시트르산염 버퍼 또는 pH 5.5의 아세트산염 버퍼로부터 선택 하였다. 시험된 부형제는: 5% 소르비톨, 10% 수크로스, 5% 트레할로스, 5% 자일리톨, 150 mM 염화나트륨, 0.2 M 아르기닌 또는 0.2 M 글리신으로부터 선택 하였다. 시험된 특정 제제를 하기 표 3에 나타냈다. 시료는 38℃에서 인큐베이션(incubation)하였고, 안정성은 1 및 6주 후에 평가되었다.
동적 광산란(DLS)은 용액 중의 단백질 분자에 의한 응집체 형성을 측정하는 데 이용된다. 시료를 Wyatt miniDAWN TREOS에 넣고, 기기가 브라운 운동(brownian motion)을 기반으로 확산 계수(Diffusion codfficient, Dt)를 측정한다. 유체 역학 반경(hydrodynamic radius, Rh)은 확산 계수에 반비례하고, 증가된 유체 역학 반경은 응집을 나타낸다. DLS 스크리닝의 결과는 하기 표 3에 요약되었다.
| 38℃ | ||||
| 0주 | 1주 | 6주 | ||
| 트리스 pH 7.5 | 소르비톨 | 7 | 5.7 | 5.6 |
| 자일리톨 | 6.6 | 5.7 | 5.6 | |
| 아르기닌 | 5.6 | 5.4 | 6.5 | |
| 인산염 pH 7.5 | 아르기닌 | 5.3 | 5.5 | 5.2 |
| 글리신 | 6.8 | 5.6 | 5.6 | |
| 염화나트륨 | 6.3 | 5.6 | 5.6 | |
| 인산염 pH 6.5 | 염화나트륨 | 6.1 | 5.6 | 5.6 |
| 아르기닌/염화나트륨 | 6 | 5.5 | 5.4 | |
| 히스티딘 pH 6.5 | 글리신 | 6.3 | 5.5 | 6 |
| 염화나트륨 | 7 | 6.1 | 235.3 | |
| 아르기닌/염화나트륨 | 5.6 | 5.4 | 163.3 | |
| 글리신/염화나트륨 | 6.3 | 5.9 | 5.8 | |
| 시트르산염 pH 5.5 | 수크로스 | 8.3 | 7.6 | 7.1 |
| 트레할로스 | 6.7 | 5.6 | 5.6 | |
| 소르비톨 | 6.6 | 5.9 | 19.2 | |
| 자일리톨 | 6.9 | 6.2 | 73.2 | |
| 아르기닌 | 4.9 | 4.7 | 4.7 | |
| 글리신 | 6.2 | 5.7 | 8.9 | |
| 아세트산염 pH 5.5 | 소르비톨 | 5.8 | 5.6 | 5.6 |
| 자일리톨 | 6.2 | 5.5 | 42.2 | |
| 아르기닌 | 5.5 | 5.5 | 19.6 | |
| 글리신 | 6.2 | 5.7 | 9.3 | |
EBI-031에 대한 가속된 안정성 연구
스트레스가 가해진 1 mg/ml의 EBI-031에 대한 Rh의 DLS 측정
실험예 3: 0 및 7일째의 제품 순도 제제 실험
다양한 부형제를 EBI-031 항체를 함유하는 상이한 제제에서 시험하였다. 상이한 제제를 시료 회수, 생성물 순도 및 외관에 대해 0 및 7일째에 시험하였다. 시험된 제제는 20 mM의 버퍼를 함유하는 데, 버퍼는 아세트산염(pH 5.5), 시트르산염(pH 6.0 또는 pH 6.5), 히스티딘(pH 6.5), 인산염(pH 6.5, pH 7.0 또는 pH 7.5) 및 트리신(pH 8.5)이고; 20 mM 및 150 mM의 염화나트륨 중 하나; 및 다음 부형제 중 하나를 함유한다: 10% 수크로스, 5% 소르비톨, 0.1% 폴리소르베이트-20, 0.1% 폴리소르베이트-80, 0.1% 폴록사머 P188 및 0.2 M 아르기닌.
시험된 제제를 96 웰 미세투석 플레이트(microdialysis plate)에서 제조하였다. 미세투석 플레이트 웰을 스톡 버퍼(stock buffer)(20 mM의 버퍼) 및 2x 최종농도의 부형제 용액(예를 들면, 900 μl 2x 버퍼 + 900 μl 2x 부형제 용액)으로 채웠다. 시료를 첨가하기 전에 확실히 혼합하기 위해 플레이트 진탕기에서 플레이트를 혼합시켰다. 단백질 시료을 적절한 웰에 첨가하였다. 플레이트 상의 제제 구성을 표 4에 나타냈다. 시료는 2시간 동안 실온에서 플레이트 진탕기에서 투석되었다. 새로운 용액에서 밤새 투석하기 위해, 시료 웰 삽입물을 제 2 버퍼/완충액 플레이트로 옮겼다.
밤새 투석한 후, 각각의 시료를 회수하여 투명한 300 μl 유리병(glass vial)으로 옮겼다. 모든 시료는 투명하고 무색이었다. 각각의 투석 카세트에서 회수된 부피는 특정 버퍼 조건에서 다양했다(특히 10% 수크로스 버퍼)
각각의 시료 농도를 NANODROP® Spectrophotomer(Thermo Scientific)를 이용하여 분석하였다.; 그러나 측정은 가변적이었고, 아마도 높은 점도/고 단백질 농도 때문일 수 있다. 이어서 각각의 시료 일부를 크기 배제-UPLC(SE-UPLC) 이동상 버퍼로 약 0.994 mg/ml(개시 농도 기준)로 100배 희석하고, NANODROP® Spectrophotomer로 분석하였다. 회수 결과는 표 4에 나타냈다.
| 0일 | 20 mM 염화나트륨 | 150 mM 염화나트륨 | |||||||||||
| 1 - 10% 수크로스 2 - 5% 소르비톨 3 - 0.1% 폴리소르베이트-20 4 - 0.1% 폴리소르베이트-80 5 - 0.1% 폴록사머 P188 6 - 0.2M 아르기닌 |
1 - 10% 수크로스 2 - 5% 소르비톨 3 - 0.1% 폴리소르베이트-20 4 - 0.1% 폴리소르베이트-80 5 - 0.1% 폴록사머 P188 6 - 0.2M 아르기닌 |
||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
| 아세트산염 pH 5.5 | A | 0.97 | 1.49 | 1.04 | 0.98 | 0.98 | 1.08 | X | 1.05 | 1.08 | 1.10 | 1.01 | 1.10 |
| 시트르산염 pH 6.0 | B | 1.40 | 1.20 | 1.13 | 1.06 | 1.19 | 0.46 | 1.38 | 1.34 | 1.10 | 1.06 | 0.99 | 1.10 |
| 시트르산염 pH 6.5 | C | 1.32 | 1.09 | 1.03 | 1.06 | 1.03 | 1.18 | 1.29 | 1.15 | 1.07 | 0.98 | 1.06 | 1.05 |
| 히스티딘 pH 6.5 | D | 1.40 | 1.09 | 0.95 | 0.98 | 1.01 | 0.97 | 1.48 | 1.06 | 1.11 | 0.97 | 0.98 | 1.01 |
| 인산염 pH 6.5 | E | 1.44 | 1.11 | 1.06 | 0.93 | 1.00 | 1.05 | 1.25 | 1.04 | 1.04 | 0.96 | 0.99 | 1.07 |
| 인산염 pH 7.0 | F | 1.39 | 0.99 | 1.07 | 0.25 | 0.97 | 1.02 | 1.46 | 1.04 | 1.19 | 0.94 | 0.99 | 1.04 |
| 인산염 pH 7.5 | G | 1.55 | 1.02 | 1.08 | 0.90 | 1.01 | 1.05 | 1.29 | 1.14 | 1.10 | 1.03 | 1.02 | 1.04 |
| 트리신 pH 8.5 | H | 0.58 | 1.05 | 0.97 | 0.99 | 0.95 | 1.04 | 1.31 | 0.93 | 0.99 | 1.02 | 1.02 | 1.02 |
10% 수크로스를 함유한 모든 조건에서 증가된 단백질 농도가 관찰되었는데, 이는 대부분 회수량의 감소로 인한 것이었다. SE-UPLC에 의해 얻어진 크로마토그램의 크로마토그램 오버레이(overlay)에 의한 분석에 의해 시료간에 실질적인 차이가 없었다. NANODROP® Spectrophotomer를 사용하여 결정된 단백질 농도와 SE-UPLC 피크 면적으로부터 예측한 바의 비교는 표 5에 나타낸 바와 같이 양호하였다.
농도 결정은 NANODROP® 및 SE-UPLC 예측 사이에서 호환된다.
주요 IgG 피크 순도는 SE-UPLC에 의해 결정되었다. pH에 대한 주요 IgG 피크 순도를 분석 할 때, 주요 IgG 피크는 기본 버퍼의 pH가 증가함에 따라 약간 감소하였다(도 2a). 이러한 결과는 EBI-031이 낮은 pH에서 더 안정한 상태, 예를 들면, pH 8.5 보다 pH 5.5에 대해 더 안정한 상태로 유지됨을 나타낸다. 각 부형제에 대한 주요 IgG 피크 순도를 분석할 때, 부형제인 아르기닌은 제품 순도에 긍정적인 영향을 미쳤다(그림 2b). 이 효과는 고농도 및 저농도의 염 모두에서 관찰되었다. 다른 부형제는 제품 안정성에 장기간 영향을 줄 수 있다.
40℃에서 7 일간 인큐베이션한 후, 외관, 회수, UV 함량(NANODROP® Spectrophotomer 측정에 의해), SE-UPLC 및 SDS-PAGE에 대해 시료를 분석하였다. 외관 분석에서 대부분의 시료가 투명하고 무색으로 나타났다. 대략적인 부피는 15 내지 100 μl 사이에서 다양했고, 대부분의 시료는 예상 값(25 내지 40 μl)(대부분의 시료에서, x100 희석에서 분석을 허용하는 적절한 부피 회수)에 가까운 양으로 회수되었으며, 시료 중 일부는 추가 분석을 하기에는 너무 점성이 높았다.
7일째 시료의 농도를 SEC 이동상 A(NANODROP® Spectrophotomer)로 100 배 희석하여 분석하였다. 100배 희석 후의 예상 단백질 농도 = 0.994 mg/mL. 대부분의 시료는 평가 결과, 개시 농도보다 약간 높은 함량 값을 생성했다. NANODROP® Spectrophotomer의 결과는 표 6에 나타나 있다.
SE-UPLC 분석은 또한, 7일째에 수행되었다. SE-UPLC 크로마토그램을 버퍼에 따라 오버레이하여 상이한 염 농도 및 부형제가 시료의 순도에 미치는 영향을 평가 하였다. SE-UPLC 분석의 결과는 도 3a 내지 도 3e에 요약되어 있다. 이 데이터는 또한, pH가 증가함에 따라 주요 피크 백분율이 감소하고, HMW 피크가 증가하는 경향을 나타낸다. 순도는 또한, 낮은 pH에서 비교적 일관성이 있다(도 4). 히스티딘 버퍼는 모든 부형제에 대해 최적의 완충액으로 나타났다. 또한 소르비톨은 pH 6.5에서 히스티딘 버퍼를 함유한 제제에서 두 번째로 최적의 부형제로 나타났다(도 5).
도 6은 히스티딘 버퍼를 함유하는 시료에 대한 상이한 염 농도 및 부형제에 대한 주요 피크 순도(%)를 나타내는 그래프이다. X축에서, 숫자 1 내지 12는 표 6의 열 1 내지 12에 있는 염 농도 및 부형제를 나타낸다.
실험예 4: 교반 실험
교반 실험은 EBI-031을 함유하는 제제에 대해 최적의 세제 조건을 확인하기 위해 수행되었다. 첫 번째 실험에서, 폴리소르베이트 20, 폴리소르베이트 80 및 폴록사머 188을 비교했다(0.1% 에서). 두 번째 실험에서, 서로 다른 농도의 폴리소르베이트 20 및 폴리소르베이트 80을 비교했다(0.1% 및 0.03 %).
첫 번째 실험에서, pH 6.5에서 20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨 내의 50 및 5 mg/ml의 EBI-031: 0.1% 폴리소르베이트-20, 0.1% 폴리소르베이트-80 또는 0.1% 폴록사머를 188을 함유. 실험의 시작과 끝에서 병의 육안 검사가 수행되었다. 실험의 시작에 있어서, 모든 시료는 육안 검사에서 투명하게 보였다. 시료를 4시간 동안 볼텍싱(vortexing) 하였다. NANODROP® Spectrophotomer 및 SE-HPLC 분석은 교반에 의해 유발된 응집이 세제에 의해 효과적으로 방지되었음을 나타냈다. 첫 번째 교반 연구의 결과는 도 7에 요약되어 있다. SE-UPLC 분석에 의해, 폴리소르베이트는 버퍼 조건에서 저농도의 생산물에서 폴록사머보다 약간 양호한 것으로 보였다. 이러한 결과는, SE-UPLC를 사용하여 평가한 바와 같이, 모든 세제가 교반 유발 응집으로부터의 보호를 제공함을 나타낸다. 세제가 없는 경우 생산물 농도가 낮을 때 상당한 응집이 발생한다.
두 번째 실험에서, pH 6.5에서 20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨 내의 50 및 5 mg/ml의 EBI-031을 함유하고, 다음을 함유하는 시료를 준비했다: A) 세제 없음, B) 0.1% 트윈-20, C) 0.1 % 트윈-80, D) 0.03% 트윈-20, 또는 E) 0.03 % 트윈-80. 실험의 시작과 끝에서 병의 육안 검사가 수행되었다. 실험의 시작에 있어서, 모든 시료는 육안 검사에서 투명하게 보였다. 대조군은 2 내지 8℃에서 교반하지 않은 시료였다(200 μl 시료). 시료(800 μl)를 Thermomixer로 2 내지 8℃에서 400 rpm으로 교반하고, 시료 일부를 SE-UPLC를 사용한 분석을 위해 1 mg/ml로 희석하였다. SE-UPLC 및 삼투압에 대한 물질을 제거한 후 남은 시료(500 μl)를 Thermomixer로 2 내지 8℃에서 1000 rpm으로 4시간 동안 재교반하였고, 시료 일부를 SE-UPLC에 의한 분석을 위해 1 mg/ml로 희석하였다. 남은 시료를 Thermomixer로 25℃에서 1000 rpm으로 3시간 동안 재교반하였고, 시료 일부를 SE-UPLC에 의한 분석을 위해 1 mg/ml로 희석하였다. 남은 시료를 Thermomixer로 25℃에서 1000 rpm으로 밤새 재교반하였다.
두 번째 교반 실험에서, SE-UPLC 분석 결과는 도 8a 내지 8c에 요약되어 있다. 결과는 총 피크 면적(도 9a), IgG 주요 피크 순도(도 9b), 고 분자량 종(도 9c) 및 저 분자량 종(도 9d)의 분석에 의해 그래프 형식으로 나타냈다. 농도 분석은 또한 Solo VPE(표 7b) 및 NANODROP®Spectrophotomer 분석(표 7c)의 결과를 SE-UPLC 총 피크 면적으로부터 추정된 함량과 비교함으로써 시료에 대해 수행되었다. SE-UPLC 총 피크 면적으로부터 추정된 함량을 평균 Ref Std와 비교하고, 희석 인자를 곱하여 표 7a에 나타낸 함량 값(mg/ml)을 얻었다. SE-UPLC 및 UV 함량 측정 결과의 상관 관계는 320 nm 또는 600 nm에서의 실질적인 광산란을 나타내지 않고, 생산물 함량의 실질적인 손실을 나타내지 않으므로, 응집이 최소화된다. 동시에, 두 번째 교반 실험의 결과는, 생산물 항체가 함량, 주요 피크 순도 또는 HMW 종에 대한 최소한의 변화로 양호한 안정성을 보여줌을 나타냈다. 세제의 사용은 시험된 조건에서 해롭지 않았다. 0.03% 및 0.1% 농도의 트윈-20 및 트윈-80 모두, 제제에 포함되기에 동등하게 적합한 것으로 나타났다.
[표 7B]
[표 7C]
실험예 5: 예시적 제제의 제조
GMP 제조
GMP 제조 동안 최종 제제 버퍼 R(20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨, 0.03% 트윈-20)은 최종 0.2 μm 필터를 세척하기 위해 제조될 것이다. 이를 위해 9 L의 버퍼 R이 만들어지고 1 L의 버퍼 Q가 추가될 것이다(자세한 내용은 표 8 참조). GMP 제조에 사용되는 물질은 표 9에 자세히 나와 있다.
| 버퍼문자/ 타이틀/ 액체 |
성분 | pH (18 ± 2℃에서) |
전도도 (18 ± 2℃에서, mS/cm |
|||
| 물질/ 농도(g/L) |
물질/ 농도(g/L) |
물질/ 농도(g/L) |
물질/ 농도(g/L) |
타겟 | 타겟 | |
| Q Spike Buffer 20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨 0.3% 폴리소르베이트 20 (트윈 20) pH 6.5 |
L-히스티딘 염산염 4.19 |
염화나트륨 1.17 |
D-소르비톨 40 |
폴리소르베이트 20 (트윈 20) 3.33 |
6.5 ± 0.1 | 3.5 ± 0.5 |
| R DF Buffer 20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨 pH 6.5 |
L-히스티딘 염산염 4.19 |
염화나트륨 1.17 |
D-소르비톨 40 |
6.5 ± 0.1 | 3.5 ± 0.5 | |
| U Final Filtration Formulation Buffer Flush 20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨 0.03% 폴리소르베이트 20 (트윈 20) pH 6.5 |
버퍼 R 910.44 (900 ml) |
버퍼 Q 101.32 (100 ml) |
6.5 ± 0.1 | 3.5 ± 0.5 | ||
- 버퍼 Q 및 버퍼 R의 pH는 수산화 나트륨 25% 용액으로 조정한다.
- 표 3의 버퍼의 실온 저장기간은 3일이다.
- 버퍼 Q: 1.7 mL/L의 수산화 나트륨(25 %)이 필요하다. 역 적정은 허용되지 않는다. 최종 버퍼 밀도 = 1.0132 kg/L. 삼투압 사양 = 300 내지 340 mOsm/kg.
- 버퍼 R: 1.7mL/L의 수산화 나트륨(25 %)이 필요하다. 역 적정은 허용되지 않는다. 최종 버퍼 밀도 = 1.01160 kg/L. 삼투압 사양 = 300 내지 340 mOsm/kg.
- 버퍼 U: 이 버퍼는 버퍼 R 및 버퍼 Q를 9:1로 혼합하여 만들어진다. 지정된 부피의 버퍼 R이 만들어지고, 필요한 부피의 버퍼 Q가 추가될 것이다.
| FFDB 번호 | 물질 설명 | 분자량 | 공급자 | 공급자 번호 |
| 850275 | D-소르비톨 | 182.17 | Merck KGaA |
111597 |
| 812693 | L-히스티딘 염산염 |
209.63 | Avantor | 2081 |
| 812270 | 폴리소르베이트 20 (트윈 20) |
명시되지 않음 | Avantor | 4116 |
| 630261 | 염화나트륨 | 58.44 | Merck KGaA |
116224 |
| 811428 | 수산화나트륨 25% 용액 |
40.00 | Avantor | 2613 |
독성 실험 물질의 희석 세부사항
개시 물질은 70.3 g/L 였다. 이 물질을 버퍼 R(20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨)로 55.5 g/L를 타겟으로 희석하였다. 이어서, 50.6 g/L의 최종 EBI-031 농도 및 0.03%의 최종 트윈-20 농도를 달성하기 위해, 생성물 및 버퍼Q(20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨, 0.3% 트윈-20)를 9:1의 비율로 하여 생성물을 희석하였다. 50.6 g/L 시료의 일부를 25.3 g/L의 최종 농도를 달성하기 위해, 생성물 및 버퍼 U(20 mM 히스티딘, 20 mM 염화나트륨, 4% 소르비톨, 0.03% 트윈-20)를 1:1의 비율로 하여 희석하였다.
25.3 g/L 물질의 일부를 5.1 g/L의 최종 농도를 달성하기 위해, 생성물 및 버퍼 U를 1:4의 비율로 하여 희석하였다. 모든 농도는 A320 교정을 통해 A280에 의해 결정되었다.
실험예 6: IgG2 IL-6 항체의 구조적 아형의 특성
EBI-031은 IgG2 항체이다(서열은 표 1에 제공됨). 앞서 논의한 바와 같이, IgG2 항체는 세 가지 상이한 구조적 아형, IgG2-A, IgG2-B 및 IgG2-A/B 아형으로 존재한다(도 10). 이 실험예에서, EBI-031 시료에서 구조적 아형, 및 상이한 시료 소스(source)로부터 그의 분포, 및 환원제 존재하에서 구조적 아형을 확인하기 위해 실험이 수행되었다.
RP-HPLC 분석
EBI-031의 다양한 구조적 아형을 분석하기 위해 역상 고성능 액체 크로마토그래피(RP-HPLC)가 사용되었다. 이전에, IgG2 이황화 매개 구조적 아형(Dillon et al., Journal of Chromatography A, 2006, 1120:112-120 참조)을 분석하기 위해 사용된 향상된 분석적 RP-HPLC 방법은 EBI-031 분석을 위해 최적화되었다.
약 30 μg을 함유하는 EBI-031 시료를 Zorbax 300SB-C8 컬럼(150 mm × 2.1 mm, 5.0 μm, 300 A)상에 로딩하였다. 컬럼 온도는 75℃로 설정하였다. 이동상 A는 0.1% TFA를 함유하는 물이었고, 이동상 B는 55% IPA, 40% ACN, 4.9% 물 및 0.1% TFA였다. 유속은 0.5 mL/min이었다. 컬럼을 초기에 90% 이동상 A 및 10% 이동상 B로 2분 동안 평형시킨 후, 10 내지 25% B의 2분 단계 구배(gradient)를 수행하였다. 용출은 21분 동안 25 내지 32% B의 선형 구배로 달성되었다. 214 nm 및/또는 280 nm에서 UV흡광도를 모니터링하였다.
분리(resolution)가 이황화물과 관련이 있는지를 결정하기 위해, 실온에서 2분 동안 시료에 5 mM DTT 및 10 mM 시스테인을 처리한 후, RP-HPLC 방법으로 분석하였다(도 11). 강력한 환원제인 DTT를 처리하면 IgG2 항체가 감소되어 초기 피크 (피크 0 및 피크 1)로 용출된다(도 11, 중간 패널). DTT에 비해 약한 환원제인 시스테인을 처리하면, DTT를 처리한 시료에서 볼 수 없었던 초기 피크(피크 0 및 피크 1)로 아형 분포가 이동된다(도 11, 하단 패널).
상기 데이터는 RP-HPLC 방법이 상이한 이황화 연결성을 갖는 구조적 아형을 분리함을 보여준다. 비-환원 펩타이드 맵핑 및 질량 분석법 분석을 통해 상이한 이황화 결합 구조가 확인되었다: 초기 용출 피크(피크 1)는 IgG2-A/B 아형을 포함하고, 후기 용출 피크(피크 2)는 IgG2-A 아형을 포함한다. 중요한 것은, EBI-031 시료에서 IgG2-B 아형 B(피크 0)가 검출되지 않았다는 점이다(도 11, 상부 패널)
상이한 EBI-031 시료에서 아형 이종성(heterogeneity)
상기에서 기술된 RP-HPLC 분석을 사용하여, 상이한 EBI-031-발현 세포주로부터 수집된 EBI-031 시료를 분석하여 생성된 항체의 아형 분포를 비교하였다. EBI-031 시료는 클론 세포주의 200L 규모의 배양액, 부모 세포주의 10L 규모의 배양액 및 안정적으로 형질 주입된((transfected) 세포 풀(pool)에서 수집하였다. EBI-031은 클론 및 부모 EBI-031 발현 세포주로부터 3-단계 크로마토그래피 방법을 사용하여 정제 하였다. EBI-031은 단백질 A 정제를 사용하여 안정적으로 형질 주입된 세포 풀로부터 정제 하였다. 상기 시료들은 상기 기술한 방법으로 분석 하였다.
도 12에 나타낸 결과는 3가지 EBI-031 시료 모두 아형 IgG2-A 및 IgG2-A/B를 함유하지만, 실질적인 양의 IgG2-B는 함유하지 않음을 나타낸다. 이 데이터는 EBI-031 IgG2 항체가 클론 EBI-031-발현 세포주, 부모 EBI-031-발현 세포주 또는 EBI-031을 안정적으로 발현하는 이종 세포 집단, 어디에서 유래하든, 다른 IgG2 항체보다 덜 이종적인 혼합물에서 생성됨을 보여준다. 도 13은 클론 EBI-031 발현 세포주의 200L 규모의 배양액으로부터의 EBI-031 시료의 아형 분포, 예를 들면, 도 12의 상부 패널을 나타낸다. 곡선 아래 영역 또한 측정되었고, 아형 중의 분포는 도면 아래 표에 나타나 있다.
다른 실시예는 다음의 청구범위 범주 내에 있다.
<110> Zarbis-Papastoitsis, Gregory
<120> IL-6 Antagonist Formulations and Uses Thereof
<130> 2018FPI-07-006US
<150> PCT/US 2017/019131
<151> 2017-02-23
<150> US 62/298774
<151> 2016-02-23
<160> 31
<170> PatentIn version 3.5
<210> 1
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 HC (IgG2)
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Leu Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Thr Pro Gly Ser Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 2
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 HC -H311A
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Leu Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Thr Pro Gly Ser Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 3
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 LC
<400> 3
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Pro Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Glu
85 90 95
Glu Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 4
<211> 230
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 (IgG1) Fab HC
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Leu Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Thr Pro Gly Ser Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr
225 230
<210> 5
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 VH
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Leu Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Thr Pro Gly Ser Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 6
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 VL
<400> 6
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Pro Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Glu
85 90 95
Glu Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val
<210> 7
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 HC CDR1
<400> 7
Gly Tyr Ala Leu Ser Asn Tyr Leu Ile Glu
1 5 10
<210> 8
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 HC CDR2
<400> 8
Val Ile Thr Pro Gly Ser Gly Thr Ile Asn
1 5 10
<210> 9
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 HC CDR3
<400> 9
Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr
1 5 10
<210> 10
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 LC CDR1
<400> 10
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Pro Phe Met Asn
1 5 10 15
<210> 11
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 LC CDR2
<400> 11
Ala Ala Ser Asn Arg Gly Ser
1 5
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-029 LC CDR3
<400> 12
Gln Gln Ser Glu Glu Val Pro Leu Thr
1 5
<210> 13
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 HC (IgG2)
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 14
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 LC
<400> 14
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Pro Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Glu
85 90 95
Glu Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 15
<211> 230
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 (IgG1) Fab HC
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr
225 230
<210> 16
<211> 223
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 (IgG2) Fab HC
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys
210 215 220
<210> 17
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 VH
<400> 17
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 18
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 VL
<400> 18
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Pro Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Glu
85 90 95
Glu Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 HC CDR1
<400> 19
Gly Tyr Val Leu Pro Asn Tyr Leu Ile Glu
1 5 10
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 HC CDR2
<400> 20
Val Thr Thr Pro Gly Gly Gly Thr Ile Asn
1 5 10
<210> 21
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030- HC CDR3
<400> 21
Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr
1 5 10
<210> 22
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 LC CDR1
<400> 22
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Pro Phe Met Asn
1 5 10 15
<210> 23
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 LC CDR2
<400> 23
Ala Ala Ser Asn Arg Gly Ser
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-030 LC CDR3
<400> 24
Gln Gln Ser Glu Glu Val Pro Leu Thr
1 5
<210> 25
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> EBI-031 IgG2 HC
<400> 25
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 26
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv VH-VL
<400> 26
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser
130 135 140
Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys
145 150 155 160
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Pro Phe Met Asn Trp
165 170 175
Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ala Ala
180 185 190
Ser Asn Arg Gly Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val
210 215 220
Ala Val Tyr Tyr Cys Gln Gln Ser Glu Glu Val Pro Leu Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val
245 250
<210> 27
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv VL-VH
<400> 27
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Pro Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Arg Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Glu
85 90 95
Glu Val Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
130 135 140
Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Leu Pro Asn
145 150 155 160
Tyr Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
165 170 175
Met Gly Val Thr Thr Pro Gly Gly Gly Thr Ile Asn Tyr Ala Gln Lys
180 185 190
Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala
195 200 205
Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Ser Arg Trp Asp Pro Leu Tyr Tyr Tyr Ala Leu Glu Tyr
225 230 235 240
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 28
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<223> 030 IgG2 constant region
<400> 28
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 29
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<223> 031 IgG2 constant region
<400> 29
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val Ala Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 30
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VH CDR1
<220>
<221> UNSURE
<222> (3)
<223> Xaa is not A, Xaa is V or a conservative substitution for V, Xaa
is selected from V, I L, and M, Xaa is selected from V, I, and L,
Xaa is V, Xaa is A.
<220>
<221> UNSURE
<222> (5)
<223> Xaa is not S, Xaa is P or a conservative substitution for P, Xaa
is selected from P, G and A, Xaa is selected from G and P, Xaa is
V, Xaa is S.
<400> 30
Gly Tyr Xaa Leu Xaa Asn Tyr Leu Ile Glu
1 5 10
<210> 31
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VH CDR2
<220>
<221> UNSURE
<222> (2)
<223> Xaa is not I, Xaa is T or a conservative substitution for T, Xaa
is selected from T and S, Xaa is T, Xaa is I.
<220>
<221> UNSURE
<222> (6)
<223> Xaa is not S, Xaa is G or a conservative substitution for G, Xaa
is selected from G and P, Xaa is G, Xaa is S.
<400> 31
Val Xaa Thr Pro Gly Xaa Gly Thr Ile Asn
1 5 10
Claims (65)
1 내지 100 mg/ml의 항-IL-6 항체 또는 그의 단편;
10 내지 50 mM의 히스티딘(histidine);
0.01% 내지 0.1%의 폴리소르베이트-20(polysorbate-20, 트윈-20(tween-20)), 폴리소르베이트-80(polysorbate-80, 트윈-80(tween-80)), 또는 폴록사머 188(poloxamer 188);
1 내지 150 mM의 염화나트륨(sodium chloride); 및
1 내지 10%의 소르비톨(sorbitol)을 포함하는 약학적 제제, 여기서 제제의 pH는 5.5 내지 7.5임.
10 내지 50 mM의 히스티딘(histidine);
0.01% 내지 0.1%의 폴리소르베이트-20(polysorbate-20, 트윈-20(tween-20)), 폴리소르베이트-80(polysorbate-80, 트윈-80(tween-80)), 또는 폴록사머 188(poloxamer 188);
1 내지 150 mM의 염화나트륨(sodium chloride); 및
1 내지 10%의 소르비톨(sorbitol)을 포함하는 약학적 제제, 여기서 제제의 pH는 5.5 내지 7.5임.
제 1항에 있어서, 상기 제제는 5 내지 50 mg/ml의 항-IL-6 항체 또는 그의 단편을 포함하는 제제.
제 2항 또는 제 3항에 있어서, 상기 제제는 5 mg/ml의 항-IL-6 항체 또는 그의 단편을 포함하는 제제.
제 2항 또는 제 3항에 있어서, 상기 제제는 50 mg/ml의 항-IL-6 항체 또는 그의 단편을 포함하는 제제.
제 1항 내지 제 4항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 19의 서열을 포함하는 중쇄 가변 영역(heavy chain variable region, VH) 상보성 결정부위(complementarity determining region, CDR) 1, 서열번호 20의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 2, 및 서열번호 21의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 3을 포함하는 제제.
제 1항 내지 제 5항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 22의 서열을 포함하는 경쇄 가변 영역(light chain variable region, VL) 상보성 결정부위 1, 서열번호 23의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 2, 및 서열번호 24의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 3을 포함하는 제제.
제 1항 내지 제 6항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 28 또는 서열번호 29를 포함하는 불변영역(constant region) 서열, 또는
(ii) 서열번호 28 또는 과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 불변영역 서열.
(i) 서열번호 28 또는 서열번호 29를 포함하는 불변영역(constant region) 서열, 또는
(ii) 서열번호 28 또는 과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 불변영역 서열.
제 1항 내지 제 7항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 17을 포함하는 중쇄 가변 영역 서열, 또는
(ii) 서열번호 17과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 중쇄 가변 영역 서열.
(i) 서열번호 17을 포함하는 중쇄 가변 영역 서열, 또는
(ii) 서열번호 17과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 중쇄 가변 영역 서열.
제 1항 내지 제 8항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 13을 포함하는 중쇄 서열, 또는
(ii) 서열번호 13과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 중쇄 서열.
(i) 서열번호 13을 포함하는 중쇄 서열, 또는
(ii) 서열번호 13과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 중쇄 서열.
제 1항 내지 제 9항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 18을 포함하는 경쇄 가변 영역 서열, 또는
(ii) 서열번호 18과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 경쇄 가변 영역 서열.
(i) 서열번호 18을 포함하는 경쇄 가변 영역 서열, 또는
(ii) 서열번호 18과 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 경쇄 가변 영역 서열.
제 1항 내지 제 10항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 14를 포함하는 경쇄 서열, 또는
(ii) 서열번호 14와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 경쇄 서열.
(i) 서열번호 14를 포함하는 경쇄 서열, 또는
(ii) 서열번호 14와 적어도 90, 91, 92, 93, 94, 95, 96, 97, 98, 또는 99%의 상동성을 가지는 경쇄 서열.
제 1항 내지 제 11항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 17을 포함하는 중쇄 가변 영역 및 서열번호 18을 포함하는 경쇄 가변 영역을 포함하는 제제.
제 1항 내지 제 12항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 13을 포함하는 중쇄 서열 및 서열번호 14를 포함하는 경쇄 서열을 포함하는 제제.
제 1항 내지 제 13항 중 어느 한 항에 있어서, 상기 제제는 10 내지 30 mM의 히스티딘 버퍼(buffer)를 포함하는 제제.
제 1항 내지 제 14항 중 어느 한 항에 있어서, 상기 제제는 20 mM의 히스티딘 버퍼를 포함하는 제제.
제 1항 내지 제 15항 중 어느 한 항에 있어서, 상기 제제는 0.01% 내지 0.05%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 포함하는 제제.
제 1항 내지 제 16항 중 어느 한 항에 있어서, 상기 제제는 0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188을 포함하는 제제.
제 1항 내지 제 17항 중 어느 한 항에 있어서, 상기 제제는 10 내지 50 mM의 염화나트륨을 포함하는 제제.
제 1항 내지 제 18항 중 어느 한 항에 있어서, 상기 제제는 10 내지 30 mM의 염화나트륨을 포함하는 제제.
제 1항 내지 제 19항 중 어느 한 항에 있어서, 상기 제제는 20 mM의 염화나트륨을 포함하는 제제.
제 1항 내지 제 20항 중 어느 한 항에 있어서, 상기 제제는 2 내지 6%의 소르비톨을 포함하는 제제.
제 1항 내지 제 21항 중 어느 한 항에 있어서, 상기 제제는 4%의 소르비톨을 포함하는 제제.
제 1항 내지 제 22항 중 어느 한 항에 있어서, 상기 제제의 pH는 6.0 내지 7.0인 제제.
제 1항 내지 제 23항 중 어느 한 항에 있어서, 상기 제제의 pH는 6.2 내지 6.8인 제제.
제 1항 내지 제 24항 중 어느 한 항에 있어서, 상기 제제의 pH는 약 6.5인 제제.
5 내지 50 mg/ml, 예를 들면, 5 mg/ml 또는 50 mg/ml의 항-IL-6 항체 또는 그의 단편;
20 mM의 히스티딘;
0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188;
20 mM의 염화나트륨; 및
4%의 소르비톨을 포함하는 약학적 제제, 여기서 제제의 pH는 6.5임.
20 mM의 히스티딘;
0.03%의 폴리소르베이트-20(트윈-20), 폴리소르베이트-80(트윈-80), 또는 폴록사머 188;
20 mM의 염화나트륨; 및
4%의 소르비톨을 포함하는 약학적 제제, 여기서 제제의 pH는 6.5임.
제 26항에 있어서, 상기 제제는 5 mg/ml의 항-IL-6 항체 또는 그의 단편을 포함하는 제제.
제 26항에 있어서, 상기 제제는 50 mg/ml의 항-IL-6 항체 또는 그의 단편을 포함하는 제제.
제 26항 내지 제 28항 중 어느 한 항에 있어서, 상기 항-IL-6 항체 또는 그의 단편은 하기를 포함하는 제제:
(i) 서열번호 19의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 1, 서열번호 20의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 2, 및 서열번호 21의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 3; 및
(ii) 서열번호 22의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 1, 서열번호 23의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 2, 및 서열번호 24의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 3.
(i) 서열번호 19의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 1, 서열번호 20의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 2, 및 서열번호 21의 서열을 포함하는 중쇄 가변 영역 상보성 결정부위 3; 및
(ii) 서열번호 22의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 1, 서열번호 23의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 2, 및 서열번호 24의 서열을 포함하는 경쇄 가변 영역 상보성 결정부위 3.
제 26항 내지 제 29항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 17을 포함하는 중쇄 가변 영역 및 서열번호 18을 포함하는 경쇄 가변 영역을 포함하는 제제.
제 26항 내지 제 30항 중 어느 한 항에 있어서, 상기 IL-6 항체 또는 그의 단편은 서열번호 13을 포함하는 중쇄 서열 및 서열번호 14를 포함하는 경쇄 서열을 포함하는 제제.
제 1항 내지 제 31항 중 어느 한 항에 있어서, 상기 항-IL-6 항체는 IgG2 항체인 제제.
제 1항 내지 제 32항 중 어느 한 항에 있어서, 상기 IL-6 항체는 전장(full-length) 항체인 제제.
제 1항 내지 제 33항 중 어느 한 항에 있어서, 상기 제제에 존재하는 항체는 총괄하여 아형(isoform) A 또는 A/B가 적어도 95%, 예를 들면, 적어도 96%, 97%, 98%, 또는 99%인 제제.
제 1항 내지 제 34항 중 어느 한 항에 있어서, 상기 제제에 존재하는 항체는 아형 A가 적어도 85%, 예를 들면, 적어도 86%, 87%, 88%, 89% 또는 90%인 제제.
제 1항 내지 제 35항 중 어느 한 항에 있어서, 상기 제제에 존재하는 항체는 아형 B가 1% 미만, 예를 들면, 0.9%, 0.8%, 0.7%, 0.6%, 0.5%, 0.4%, 0.3%, 0.2%, 또는 0.1% 미만인 제제.
제 1항 내지 제 36항 중 어느 한 항에 있어서, 상기 제제에 존재하는 항체는 아형 B가 거의 없는, 예를 들면, 5%, 4%, 3%, 2%, 또는 1% 미만인 제제.
제 34항 내지 제 37항 중 어느 한 항에 있어서, 상기 제제에 존재하는 항체의 아형 A, A/B, 및/또는 B의 백분율은 고성능 액체 크로마토그래피(High performance liquid chromatography, HPLC), 예를 들면, 역상 고성능 액체 크로마토그래피(Reverse phase-HPLC, RP-HPLC), 또는 펩타이드 맵핑(peptide mapping), 예를 들면, 비환원 조건하에서, 이후 질량 분석기(mass spectrometry, MS) 분석으로 결정되는 제제.
제 1항 내지 제 38항 중 어느 한 항에 있어서, 상기 제제는 하나 또는 그 이상의 킬레이트제(chelating agent), 보존제 또는 항산화제를 더 포함하는 제제.
제 1항 내지 제 39항 중 어느 한 항에 있어서, 제 2 치료제를 더 포함하는 제제.
제 1항 내지 제 40항 중 어느 한 항에 있어서, 상기 제제는 눈에 투여하기 적합한 제제.
제 1항 내지 제 41항 중 어느 한 항에 있어서, 상기 제제는 유리체내(intravitreally), 안구내(intraocularly), 또는 결막하(subcunjunctivally)로 투여하기 적합한 제제.
제 1항 내지 제 42항 중 어느 한 항에 있어서, 상기 제제는 영하 65℃ 또는 그 미만의 온도에서 적어도 1년 또는 2년 동안 안정적인 제제.
제 1항 내지 제 42항 중 어느 한 항에 있어서, 상기 제제는 2 내지 8℃에서 적어도 6개월 동안 안정적인 제제.
제 1항 내지 제 44항 중 어느 한 항의 제제의 IL-6 관련 질병을 갖는 개체를 치료하기 위한 용도.
제 45항에 있어서, 상기 IL-6 관련 질병은 당뇨성 황반부종(diabetic macular edima, DME), 당뇨 망막증(diabetic retinopathy), 안구 건조(dry eye)(예를 들면, 안구 건조 질병(dry eye disease) 또는 안구 건조증(dry eye syndrome)), 알레르기성 결막염(allergic conjunctivitis), 포도막염(uveitis), 나이관련 황반변성(age-related macular degeneration, AMD)(예를 들면, 습성 나이관련 황반변성(wet AMD) 또는 건성 나이관련 황반변성(dry AMD)), 증식성 당뇨 망막증(proliferative diabetic retinopathy, PDR), 열공 망막 박리(Rhegmatogenous retinal detachment, RRD), 망막 정맥 폐색(retinal vein occlusion, RVO), 시신경 척수염(neuromyelitis optica, NMO), 근시성 맥락막 신생혈관(myopic choroidal neovascularization), 안구암(ocular cancer), 각막 이식(corneal transplant), 각막 찰과상(corneal abrasion) 또는 눈의 물리적 손상으로 이루어진 군으로부터 선택되는 용도.
제 45항 또는 제 46항에 있어서, 상기 IL-6 관련 질병은 당뇨성 황반부종(DME)인 용도.
제 46항 내지 제 47항 중 어느 한 항에 있어서, 상기 제제는 개체의 눈에 투여되는 용도.
제 46항 내지 제 48항 중 어느 한 항에 있어서, 상기 제제는 유리체내로 투여되는 용도.
제 1항 내지 제 44항 중 어느 한 항의 제제를 포함하는 용기(container) 또는 장치.
제 50항에 있어서, 상기 제제의 부피는 적어도 0.1, 0.5, 1, 2, 또는 5 ml인 용기.
제 50항 또는 제 51항 중 어느 한 항에 있어서, 상기 용기는 다회용량(multidose) 용기인 용기.
제 1항 내지 제 44항 중 어느 한 항의 제제를 포함하는 약물 전달 장치(drug delivery device).
제 1항 내지 제 44항 중 어느 한 항의 제제를 포함하는 용기 또는 장치, 및 선택적으로 사용 지침을 포함하는 키트.
제 1항 내지 제 44항 중 어느 한 항의 약학적 제제를 개체에 투여하는 것을 포함하는, IL-6 관련 질병, 예를 들면, IL-6 발현 증가 관련 질병을 갖는 개체를 치료하는 방법.
제 55항에 있어서, 상기 제제는 눈에 투여되는 방법.
제 56항에 있어서, 상기 제제는 유리체내로, 예를 들면, 유리체강내 주사(intravitreal injection)에 의해 투여되는 방법.
제 55항 내지 제 57항 중 어느 한 항에 있어서, 상기 IL-6 관련 질병은 당뇨성 황반부종, 당뇨 망막증, 안구 건조(예를 들면, 안구 건조 질병 또는 안구 건조증), 알레르기성 결막염, 포도막염, 나이관련 황반변성(예를 들면, 습성 또는 건성 나이관련 황반변성), 증식성 당뇨 망막증, 열공 망막 박리, 망막 정맥 폐색, 시신경 척수염, 근시성 맥락막 신생혈관, 안구암, 각막 이식, 각막 찰과상 또는 눈의 물리적 손상으로 이루어진 군으로부터 선택되는 방법.
제 55항 내지 제 58항 중 어느 한 항에 있어서, 상기 IL-6 관련 질병은 당뇨성 황반부종인 방법.
제 55항 내지 제 59항 중 어느 한 항에 있어서, 제 2 치료제를 개체에 투여하는 것을 더 포함하는 방법.
제 60항에 있어서, 상기 제 2 치료제는 항-혈관내피 성장인자제(anti-vascular endothelial growth factor agent, anti-VEGF agent), 스테로이드, 예를들면, 코르티코스테로이드(corticosteroid), 또는 항-혈소판유래 성장인자제(anti-platelet derived growth factor agent, anti-PDGF agent)인 방법.
제 55항 내지 제 51항에 있어서, 상기 개체는 이전에 항-혈관내피 성장인자제, 스테로이드, 또는 항-혈소판유래 성장인자제로 치료받은 적이 있는 방법.
제 52항에 있어서, 상기 개체는 항-혈관내피 성장인자제, 스테로이드, 또는 항-혈소판유래 성장인자제에 치료반응을 나타내지 않았던 방법.
제 55항 내지 제 63항에 있어서, 상기 개체는 포유동물인 방법.
제 55항 내지 제 64항에 있어서, 상기 개체는 사람인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662298774P | 2016-02-23 | 2016-02-23 | |
| US62/298,774 | 2016-02-23 | ||
| PCT/US2017/019131 WO2017147293A1 (en) | 2016-02-23 | 2017-02-23 | Il-6 antagonist formulations and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180116359A true KR20180116359A (ko) | 2018-10-24 |
Family
ID=59685584
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187027338A KR20180116359A (ko) | 2016-02-23 | 2017-02-23 | 인터루킨-6의 길항제 제제 및 이의 용도 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US20190046642A1 (ko) |
| EP (1) | EP3419599A4 (ko) |
| JP (2) | JP2019510078A (ko) |
| KR (1) | KR20180116359A (ko) |
| CN (1) | CN108718522A (ko) |
| AR (1) | AR107708A1 (ko) |
| AU (1) | AU2017223687A1 (ko) |
| BR (1) | BR112018017031A2 (ko) |
| CA (1) | CA3012350A1 (ko) |
| MX (1) | MX2018010032A (ko) |
| WO (1) | WO2017147293A1 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109350740B (zh) * | 2017-11-30 | 2023-06-20 | 百奥泰生物制药股份有限公司 | 一种治疗il-6相关疾病的人源化抗体的液体制剂 |
| JP7407723B2 (ja) * | 2018-09-14 | 2024-01-04 | 田辺三菱製薬株式会社 | ヒト抗il-33モノクローナル抗体含有医薬用組成物 |
| CA3117245A1 (en) * | 2018-10-31 | 2020-05-07 | Richter Gedeon Nyrt. | Aqueous pharmaceutical formulations |
| IL300245A (en) * | 2020-07-31 | 2023-03-01 | Alamab Therapeutics Inc | Anti-connexin antibody formulations |
| EP4199965A1 (en) * | 2020-08-19 | 2023-06-28 | Bio-Thera Solutions, Ltd. | Liquid formulations comprising high concentrations humanized antibodies for treating il-6 related diseases |
| KR20220028972A (ko) * | 2020-08-31 | 2022-03-08 | (주)셀트리온 | 안정한 약제학적 제제 |
| US20230073821A1 (en) * | 2021-08-27 | 2023-03-09 | International Business Machines Corporation | Antigen-binding proteins targeting coronavirus (cov) variants |
| CN116554298A (zh) * | 2022-02-25 | 2023-08-08 | 南京工业大学 | 一种强化细菌卷曲菌毛提高人表皮生长因子分泌生产效率的方法 |
| WO2024073718A1 (en) * | 2022-09-30 | 2024-04-04 | Sonnet BioTherapeutics, Inc. | Low dose il-6 formulations and methods of use thereof |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100913714B1 (ko) * | 2001-11-08 | 2009-08-24 | 패시트 바이오테크 코포레이션 | Igg 항체의 안정한 액상 약학 제형물 |
| US20040191243A1 (en) * | 2002-12-13 | 2004-09-30 | Bei Chen | System and method for stabilizing antibodies with histidine |
| CA2699435A1 (en) * | 2007-09-14 | 2009-03-19 | Sanofi Pasteur Biologics Co. | Pharmaceutical compositions containing clostridium difficile toxoids a and b |
| US20120005773A1 (en) * | 2008-10-01 | 2012-01-05 | Aasen Eric D | Transgenic plants with enhanced agronomic traits |
| US8992920B2 (en) * | 2008-11-25 | 2015-03-31 | Alderbio Holdings Llc | Anti-IL-6 antibodies for the treatment of arthritis |
| SG172354A1 (en) * | 2009-01-29 | 2011-07-28 | Medimmune Llc | Human anti-il-6 antibodies with extended in vivo half-life and their use in treatment of oncology, autoimmune diseases and inflammatory diseases |
| JO3417B1 (ar) * | 2010-01-08 | 2019-10-20 | Regeneron Pharma | الصيغ المستقرة التي تحتوي على الأجسام المضادة لمضاد مستقبل( interleukin-6 (il-6r |
| AR082205A1 (es) * | 2010-07-12 | 2012-11-21 | Covx Technologies Ireland Ltd | Conjugados de anticuerpos multifuncionales |
| US20140371427A1 (en) * | 2011-12-07 | 2014-12-18 | Amgen Inc. | IgG2 DISULFIDE ISOFORM SEPARATION |
| WO2013181495A2 (en) * | 2012-06-01 | 2013-12-05 | Ophthotech Corporation | Compositions comprising an anti-pdgf aptamer and a vegf antagonist |
| PE20191815A1 (es) * | 2012-09-07 | 2019-12-27 | Coherus Biosciences Inc | Formulaciones acuosas estables de adalimumab |
| KR20150070384A (ko) * | 2012-10-25 | 2015-06-24 | 메디뮨 엘엘씨 | 안정한 저점도 항체 제제 |
| SG10201608703SA (en) * | 2012-11-08 | 2016-12-29 | Eleven Biotherapeutics Inc | Il-6 antagonists and uses thereof |
| US20150017163A1 (en) * | 2013-07-12 | 2015-01-15 | Ophthotech Corporation | Methods for Treating or Preventing Ophthalmological Conditions |
| EP2898896A1 (en) * | 2014-01-22 | 2015-07-29 | Université Pierre et Marie Curie (Paris 6) | Agents for use in the treatment of retinal inflammation |
| MA51554A (fr) * | 2014-11-07 | 2020-11-18 | Sesen Bio Inc | Anticorps il-6 améliorés |
-
2017
- 2017-02-23 WO PCT/US2017/019131 patent/WO2017147293A1/en active Application Filing
- 2017-02-23 AR ARP170100456A patent/AR107708A1/es unknown
- 2017-02-23 MX MX2018010032A patent/MX2018010032A/es unknown
- 2017-02-23 EP EP17757207.0A patent/EP3419599A4/en active Pending
- 2017-02-23 BR BR112018017031A patent/BR112018017031A2/pt not_active IP Right Cessation
- 2017-02-23 KR KR1020187027338A patent/KR20180116359A/ko unknown
- 2017-02-23 AU AU2017223687A patent/AU2017223687A1/en not_active Abandoned
- 2017-02-23 CA CA3012350A patent/CA3012350A1/en not_active Abandoned
- 2017-02-23 CN CN201780013039.9A patent/CN108718522A/zh active Pending
- 2017-02-23 JP JP2018563405A patent/JP2019510078A/ja active Pending
- 2017-02-23 US US16/078,671 patent/US20190046642A1/en not_active Abandoned
-
2021
- 2021-08-31 US US17/462,654 patent/US20220241414A1/en active Pending
-
2022
- 2022-03-31 JP JP2022058898A patent/JP2022084922A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3419599A1 (en) | 2019-01-02 |
| CN108718522A (zh) | 2018-10-30 |
| AU2017223687A1 (en) | 2018-08-09 |
| WO2017147293A1 (en) | 2017-08-31 |
| EP3419599A4 (en) | 2019-09-11 |
| CA3012350A1 (en) | 2017-08-31 |
| US20220241414A1 (en) | 2022-08-04 |
| JP2022084922A (ja) | 2022-06-07 |
| AR107708A1 (es) | 2018-05-23 |
| BR112018017031A2 (pt) | 2019-01-22 |
| US20190046642A1 (en) | 2019-02-14 |
| MX2018010032A (es) | 2019-03-11 |
| JP2019510078A (ja) | 2019-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220241414A1 (en) | Il-6 antagonist formulations and uses thereof | |
| US11459386B2 (en) | IL-6 antagonists and uses thereof | |
| US20220169719A1 (en) | Il-6 antibodies | |
| TWI782397B (zh) | 重組全人源抗tigit單株抗體製劑及其製備方法和用途 | |
| US11723955B1 (en) | VEGFR fusion protein pharmaceutical composition | |
| TW202228790A (zh) | 用於長效經眼遞送之非共價蛋白質-玻尿酸結合物 | |
| CN115812079A (zh) | 使用白细胞介素-17(il-17)拮抗剂治疗甲状腺眼病和格雷夫斯眼眶病的方法 |