KR20180098282A - 압축 성형 제제 - Google Patents
압축 성형 제제 Download PDFInfo
- Publication number
- KR20180098282A KR20180098282A KR1020187018556A KR20187018556A KR20180098282A KR 20180098282 A KR20180098282 A KR 20180098282A KR 1020187018556 A KR1020187018556 A KR 1020187018556A KR 20187018556 A KR20187018556 A KR 20187018556A KR 20180098282 A KR20180098282 A KR 20180098282A
- Authority
- KR
- South Korea
- Prior art keywords
- polymer
- granules
- manufactured
- drug
- coated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
- A61K9/2081—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets with microcapsules or coated microparticles according to A61K9/50
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0056—Mouth soluble or dispersible forms; Suckable, eatable, chewable coherent forms; Forms rapidly disintegrating in the mouth; Lozenges; Lollipops; Bite capsules; Baked products; Baits or other oral forms for animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/501—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5015—Organic compounds, e.g. fats, sugars
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5026—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
본 발명은 불쾌한 맛의 마스킹 등의 기능을 갖는 고분자 피막으로 피복이 입혀진 과립을 사용하면서, 붕해성이 우수하며, 또한 용이하게 제조 가능한 압축 성형 제제를 제공하는 것을 과제로 한다. 당해 과제를 해결한 압축 성형 제제는 약물을 함유하는 조립물이 고분자 피막으로 피복된 고분자 피복 조립물을 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 탤크 및 규산으로 이루어진 군으로부터 선택되는 1종 또는 2종 이상의 첨가제로 피복하여 이루어지는 과립을 함유하는 것을 특징으로 한다.
Description
본 발명은 고분자 피막으로 피복된 약물을 함유하는 조립물을 추가로 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 탤크 및 규산으로 이루어진 군으로부터 선택되는 1종 또는 2종 이상의 첨가제(이하, 「특정 첨가제」라 함)로 피복한 과립을 사용함으로써 얻어지고, 약물의 불쾌한 맛의 마스킹이나 용출 제어 등의 기능을 구비하면서, 붕해성이 우수한 압축 성형 제제에 관한 것이다.
압축 성형 제제를 제조하는 방법으로서, 일반적으로 약제에 부형제 등의 첨가제를 첨가하여 균등하게 혼화한 혼합 분체를 직접 압축 성형하는 직접법이나 혼합 분체를 일단 과립상으로 한 후 압축 성형하는 과립 압축법 등이 사용된다.
압축 성형 제제에는 각종 약물이 사용되는데, 예를 들면 해열진통제 등의 약물을 사용한 제제에서는 속효성이 요구되는 경우가 있어, 붕해시간을 짧게 하여 신속하게 약제를 용출시키는 것이 필요해진다. 또한 최근 들어 고령자나 소아 등 삼킴이 곤란한 환자에게 있어서도 복용하는 것이 용이한 제형으로서 구강내 붕해정의 연구 개발이 행하여지고 있다. 이러한 구강내 붕해정을 직접법에 의해 제조하기 위해, 약제를 경질 무수규산으로 표면 개질하여 그 유동성을 향상시킨 후에 부형제를 혼합하여, 이를 타정하는 방법이 개시되어 있다(특허문헌 1). 또한 압축 성형 제제는 제조나 수송 과정에서 손상 등이 발생하지 않을 정도의 경도가 필요한데, 과립 압축법에 있어서 압축처리 전에 활택제를 함유시킴으로써 붕해성을 유지하면서 경도를 증강시키는 방법이 개시되어 있다(특허문헌 2).
한편, 약물의 대부분은 수렴성, 자극성, 쓴맛, 떫은맛이나 쓴맛 등의 불쾌한 맛을 나타내, 그대로는 복용이 곤란한 경우가 많다. 또한, 약효가 유효한 발현이나 부작용의 경감 등을 목적으로, 약물에 대해 장용성이나 서방성, 지속성, 내위액성 등의 기능을 부가하는 경우가 있다. 이와 같이 약물의 불쾌한 맛의 마스킹이나 용출 제어 등의 기능을 부가하기 위해, 약물을 함유하는 과립에 위용성 고분자, 장용성 고분자, 수불용성 고분자 등으로 피복을 입힌 후에 제제화된다.
예를 들면 펙소페나딘 염산염 등의 약제의 불쾌한 맛을 마스킹하기 위해, 약제를 포함하는 과립의 표면을 아미노알킬메타크릴레이트 코폴리머 등으로 피복하고, 타정한 구강내 붕해정이 개시되어 있다(특허문헌 3). 또한 풍미의 마스킹 및 습기로부터 보호하기 위해, 메틸메타크릴레이트/디에틸아미노에틸메타크릴레이트 등을 사용한 코팅재료가 개시되어, 이를 과립 등에 코팅하는 것이 기재되어 있다(특허문헌 4).
그러나, 고분자 피막으로 피복된 과립을 사용하여 제조되는 압축 성형 제제는 그 붕해시간이 대폭으로 증가하게 되기 때문에, 붕해성을 개선하기 위해서는 저압에서 타정하는 등 제조상 커다란 제약을 수반하여 안정적인 생산이 곤란하다.
본 발명의 과제는 불쾌한 맛의 마스킹 등의 기능을 갖는 고분자 피막으로 피복이 입혀진 과립을 사용하면서, 붕해성이 우수하며, 또한 용이하게 제조 가능한 압축 성형 제제 및 그의 제조방법을 제공하는 것에 있다.
본 발명자들은 상기 과제를 해결하기 위해 예의 검토를 행하고 있던 바, 압축 성형을 행함에 있어서 고분자 피막으로 피복된 약물을 포함하는 조립물(granulated substance)을 사전에 특정 첨가제와 혼합하여, 당해 조립물을 특정 첨가제로 피복함으로써 제제의 붕해시간(disintegration time)을 현저히 단축하여, 광범위한 타정압에 있어서 양호한 붕해성을 갖는 제제가 얻어지는 것을 발견하고, 본 발명을 완성하기에 이르렀다.
즉 본 발명은 약물을 함유하는 조립물이 고분자 피막으로 피복된 고분자 피복 조립물을 특정 첨가제로 피복하여 이루어지는 과립을 함유하는 압축 성형 제제이다.
또한 본 발명은 약물을 함유하는 조립물을 고분자 피막으로 피복하여 고분자 피복 조립물을 얻어, 그 고분자 피복 조립물을 특정 첨가제로 피복하여 얻어지는 과립을 압축 성형하는 것을 특징으로 하는 압축 성형 제제의 제조방법이다.
또한 본 발명은 약물을 함유하는 조립물이 고분자 피막으로 피복된 고분자 피복 조립물을 특정 첨가제로 피복하여 이루어지는 과립이다.
본 발명에 의하면, 고분자 피막을 입힌 과립을 사용하여 압축 성형하더라도, 붕해시간을 대폭으로 단축시키는 것이 가능하다. 따라서, 불쾌한 맛의 마스킹 등 고분자 피막에 의한 다양한 기능을 구비하며, 또한 붕해성이 우수한 압축 성형 제제를 얻을 수 있다.
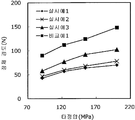
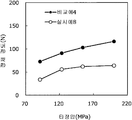
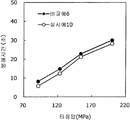
도 1은 실시예 1~3 및 비교예 1의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
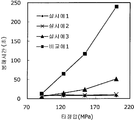
도 2는 실시예 1~3 및 비교예 1의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
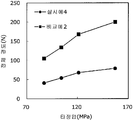
도 3은 실시예 4 및 비교예 2의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
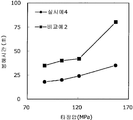
도 4는 실시예 4 및 비교예 2의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
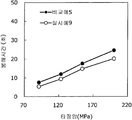
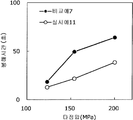
도 5는 실시예 5~7 및 비교예 3의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 6은 실시예 5~7 및 비교예 3의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
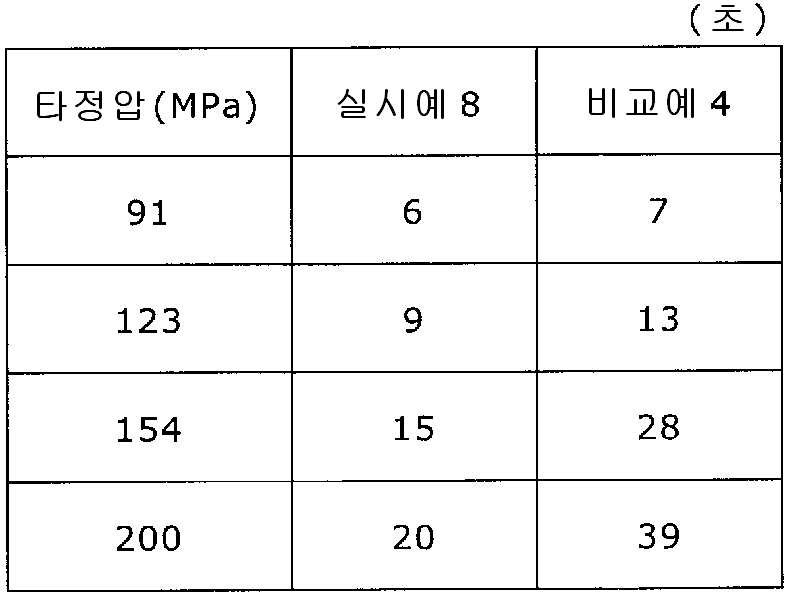
도 7은 실시예 8 및 비교예 4의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 8은 실시예 8 및 비교예 4의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
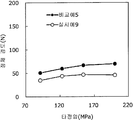
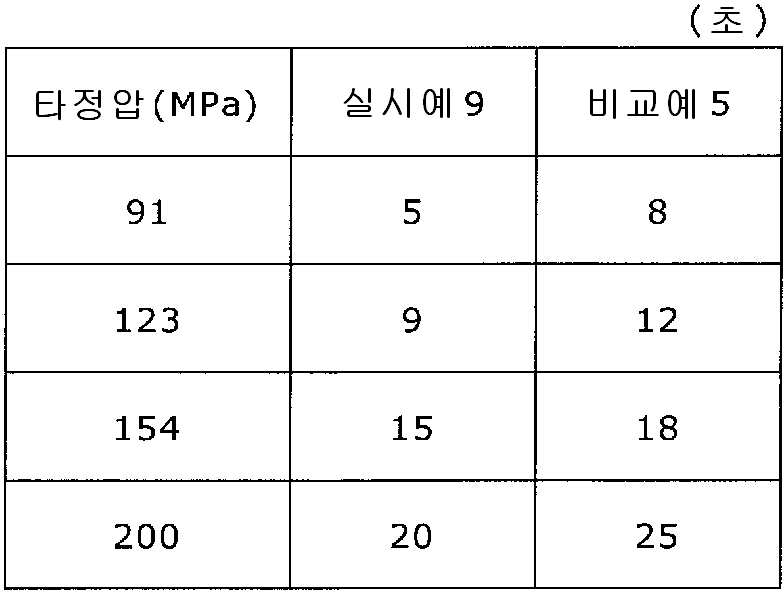
도 9는 실시예 9 및 비교예 5의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 10은 실시예 9 및 비교예 5의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
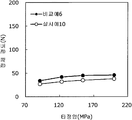
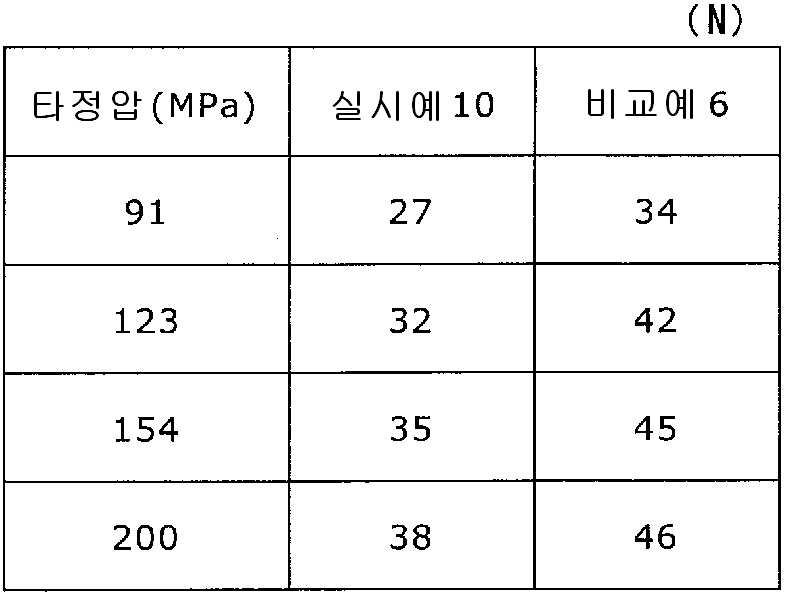
도 11은 실시예 10 및 비교예 6의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
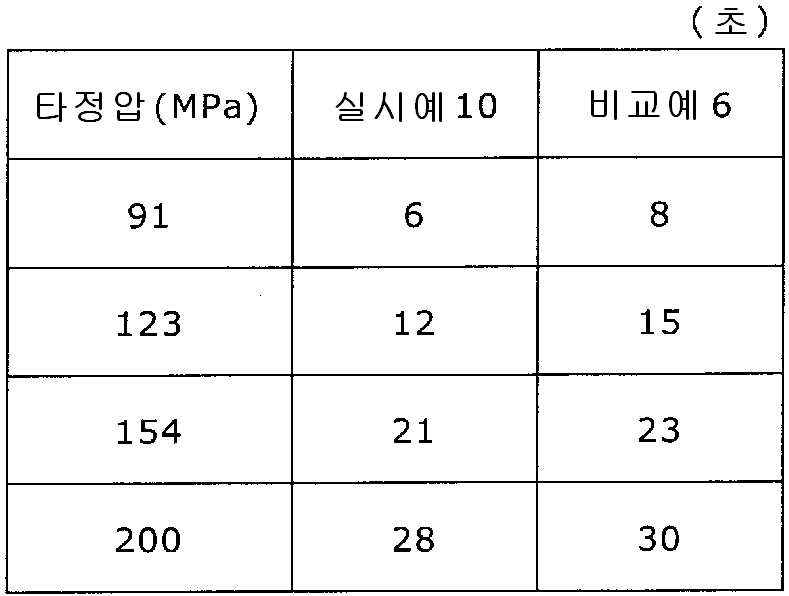
도 12는 실시예 10 및 비교예 6의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
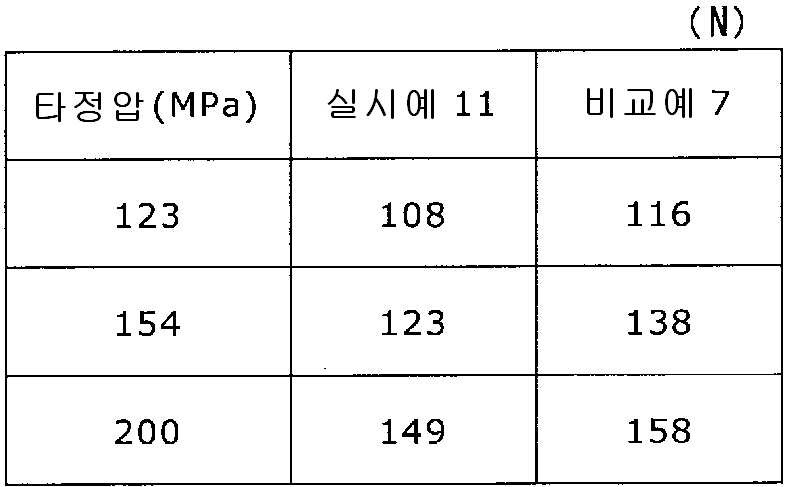
도 13은 실시예 11 및 비교예 7의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
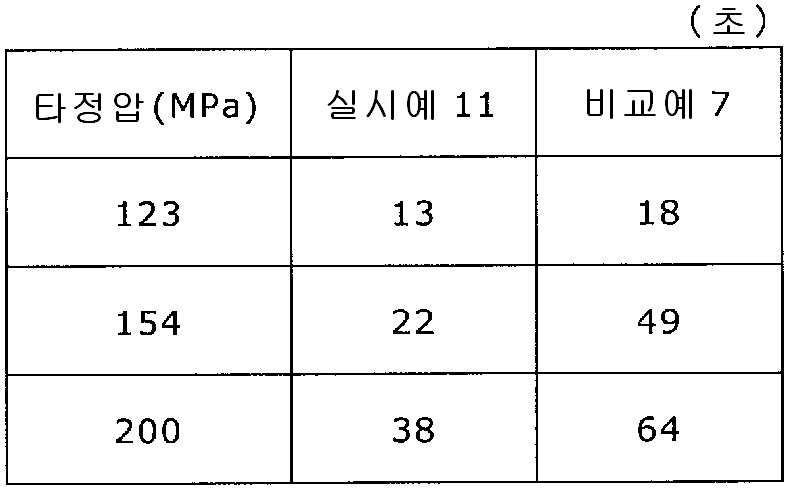
도 14는 실시예 11 및 비교예 7의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
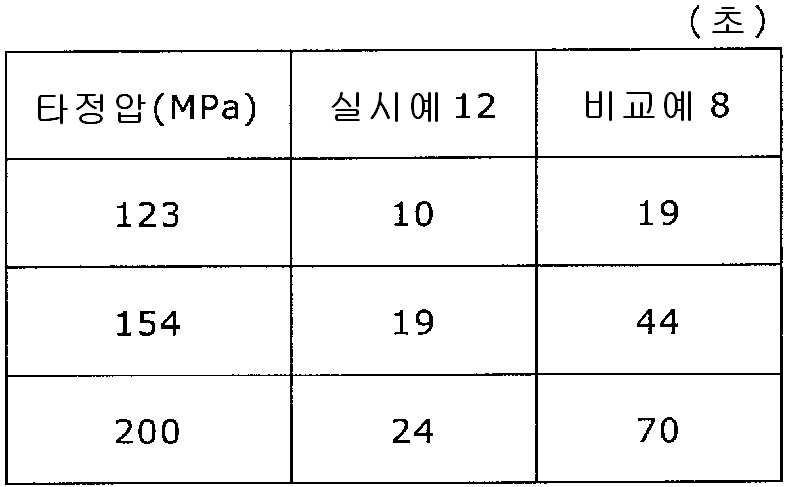
도 15는 실시예 12 및 비교예 8의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 16은 실시예 12 및 비교예 8의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
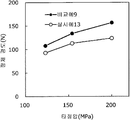
도 17은 실시예 13 및 비교예 9의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 18은 실시예 13 및 비교예 9의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 2는 실시예 1~3 및 비교예 1의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 3은 실시예 4 및 비교예 2의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 4는 실시예 4 및 비교예 2의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 5는 실시예 5~7 및 비교예 3의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 6은 실시예 5~7 및 비교예 3의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 7은 실시예 8 및 비교예 4의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 8은 실시예 8 및 비교예 4의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 9는 실시예 9 및 비교예 5의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 10은 실시예 9 및 비교예 5의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 11은 실시예 10 및 비교예 6의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 12는 실시예 10 및 비교예 6의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 13은 실시예 11 및 비교예 7의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 14는 실시예 11 및 비교예 7의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 15는 실시예 12 및 비교예 8의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 16은 실시예 12 및 비교예 8의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
도 17은 실시예 13 및 비교예 9의 정제의 각 타정압에 대한 정제 경도를 나타내는 그래프이다.
도 18은 실시예 13 및 비교예 9의 정제의 각 타정압에 대한 붕해시간을 나타내는 그래프이다.
본 발명에 있어서 사용되는 약물로서 특별히 한정되지 않으나, 예를 들면 불쾌한 맛을 가져 마스킹할 필요가 있는 약물, 장용성 또는 위용성을 부여할 필요가 있는 약물, 내산성을 부여할 필요가 있는 약물, 서방성을 부여할 필요가 있는 약물 등이 예시된다. 이러한 약물의 구체적인 예로서는, 아세트아미노펜, 무수 카페인, 푸마르산클레마스틴, 염산프로메타진, 메퀴타진, 염산디펜히드라민, dl-말레산클로르페니라민, 염산페닐레프린, 이부프로펜나트륨, 록소프로펜나트륨, 디클로페낙칼륨, 디클로페낙나트륨, 나프록센나트륨, 염산메틸에페드린, 염산에페드린, 덱스트로메토르판, 염산노스카핀, 염산메틸에페드린, 염산브롬헥신, 살리실아미드 또는 그의 수화물 등을 들 수 있고, 이들의 1종 또는 2종 이상을 사용할 수 있다.
이중에서도 이부프로펜나트륨, 록소프로펜나트륨, 디클로페낙칼륨, 디클로페낙나트륨, 나프록센나트륨 또는 그의 수화물 등이 바람직하고, 특히 바람직하게는 록소프로펜나트륨이다.
본 발명에 있어서 약물의 함유량은 특별히 제한되는 것은 아니며, 각 약물의 경구 투여로의 허용 투여량 등에 따라 적절히 결정할 수 있다. 예를 들면 약제가 록소프로펜나트륨인 경우, 제제 중의 약물 함유량은 1~98 질량%(이하, 간단히 「%」라 함)인 것이 바람직하고, 2~90%가 더욱 바람직하다.
본 발명에 있어서 약물의 쓴맛이나 자극성 등의 불쾌한 맛의 마스킹이나 용출 제어 등의 목적으로 사용되는 고분자로서는 특별히 한정되는 것은 아니며, 예를 들면 셀룰로오스계 또는 메타크릴계 등의 수용성 고분자, 수불용성 고분자, 위용성 고분자, 장용성 고분자 등을 들 수 있고, 이들의 1종 또는 2종 이상을 사용할 수 있다.
수용성 고분자로서는 메틸셀룰로오스, 하이프로멜로스, 히드록시프로필셀룰로오스, 폴리에틸렌글리콜, 폴리비닐알코올(부분 비누화물), 폴리비닐피롤리돈 등을 들 수 있다.
수불용성 고분자로서는, 예를 들면 아크릴산에틸-메타크릴산메틸 공중합체(예를 들면 아크릴산에틸-메타크릴산메틸 코폴리머 분산액(유드라짓 NE30D)), 아크릴산에틸-메타크릴산메틸-메타크릴산 염화트리메틸암모늄에틸 공중합체(예를 들면 아미노알킬메타크릴레이트 코폴리머 RS(유드라짓 RS100, 유드라짓 RSPO, 유드라짓 RL, 유드라짓 RLPO) 및 아미노알킬메타크릴레이트 코폴리머 RS 수분산액(유드라짓 RS30D, 유드라짓 RL30D)) 등의 수불용성 메타크릴산계 고분자 화합물, 에틸셀룰로오스(예를 들면 에토셀, 아쿠아코트) 등의 수불용성 셀룰로오스계 고분자 화합물을 들 수 있다.
위용성 고분자로서는, 예를 들면 폴리비닐아세탈디에틸아미노아세테이트(예를 들면 AEA) 등의 폴리비닐아세탈계 고분자, 메타크릴산메틸-메타크릴산부틸-메타크릴산디메틸아미노에틸 공중합체(예를 들면 아미노알킬메타크릴레이트 코폴리머 E(유드라짓 EPO, 유드라짓 E100)), 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체(예를 들면 콜리코트 스마트실 30D) 등의 위용성 메타크릴산계 고분자 화합물을 들 수 있다.
장용성 고분자로서는, 예를 들면 메타크릴산-아크릴산에틸 공중합체(예를 들면 메타크릴산 코폴리머 LD(유드라짓 L30D-55, 유드라짓 L100-55)), 메타크릴산-메타크릴산메틸 공중합체(예를 들면 메타크릴산 코폴리머 L(유드라짓 L100), 메타크릴산 코폴리머 S(유드라짓 S100)), 아크릴산메틸-메타크릴산메틸-메타크릴산 코폴리머(예를 들면 유드라짓 FS30D) 등의 장용성 메타크릴산계 고분자 화합물, 초산프탈산셀룰로오스(예를 들면 CAP,셀룰로오스아세테이트프탈레이트), 하이프로멜로스프탈레이트(예를 들면 HP-55), 예를 들면 하이프로멜로스아세테이트숙시네이트, 폴리비닐아세테이트프탈레이트, 카르복시메틸에틸셀룰로오스 등의 장용성 셀룰로오스계 고분자 화합물을 들 수 있다.
이들 중에서도 메타크릴계 고분자가 바람직하고, 구체적으로는 예를 들면 메타크릴산메틸-메타크릴산부틸-메타크릴산디메틸아미노에틸 공중합체(예를 들면 아미노알킬메타크릴레이트 코폴리머 E(유드라짓 EPO, 유드라짓 E100)), 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체(콜리코트 스마트실 30D) 등의 위용성 메타크릴산계 고분자;아크릴산에틸-메타크릴산메틸 공중합체(예를 들면 아크릴산에틸-메타크릴산메틸 코폴리머 분산액(유드라짓 NE30D)), 아크릴산에틸-메타크릴산메틸-메타크릴산 염화트리메틸암모늄에틸 공중합체(예를 들면 아미노알킬메타크릴레이트 코폴리머 RS(유드라짓 RS100, 유드라짓 RSPO, 유드라짓 RL, 유드라짓 RLPO), 및 아미노알킬메타크릴레이트 코폴리머 RS 수분산액(유드라짓 RS30D, 유드라짓 RL30D)) 등의 수불용성 메타크릴산계 고분자;메타크릴산·아크릴산에틸 공중합체(예를 들면 메타크릴산 코폴리머 LD(유드라짓 L30D-55), 건조 메타크릴산 코폴리머 LD(유드라짓 L100-55)), 메타크릴산-메타크릴산메틸 공중합체(예를 들면 메타크릴산 코폴리머 L(유드라짓 L100), 메타크릴산 코폴리머 S(유드라짓 S100), 아크릴산메틸-메타크릴산메틸-메타크릴산 코폴리머(예를 들면 유드라짓 FS30D) 등의 장용성 메타크릴산계 고분자 등이 적합하고, 특히 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체, 아크릴산에틸-메타크릴산메틸 공중합체 등이 마스킹효과 등이 높고, 붕해성도 우수하기 때문에 바람직하다.
본 발명에 있어서의 고분자의 함유량은 고분자의 종류에 따라서도 다르나, 통상 약물 100 질량부에 대해 0.5~2,000 질량부 함유하는 것이 바람직하고, 더욱이 1~500 질량부 함유하는 것이 바람직하며, 특히 5~200 질량부 함유하는 것이 바람직하다.
상기 고분자의 피막으로 피복한 고분자 피복 조립물을 피복하는 특정 첨가제로서는, 예를 들면 스테아르산마그네슘, 스테아르산칼슘, 스테아르산알루미늄, 스테아르산아연 등의 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 규산, 폴리에틸렌글리콜, 탤크 등으로부터 선택되는 1종 또는 2종 이상의 조합을 들 수 있다. 이들 중에서도 스테아르산마그네슘, 스테아르산칼슘, 스테아르산, 자당 지방산 에스테르, 규산, 탤크 등이 붕해성 개선효과가 우수하기 때문에 바람직하고, 스테아르산마그네슘, 스테아르산칼슘, 자당 지방산 에스테르, 탤크가 더욱 바람직하다.
본 발명에 있어서는 상기 성분 외에, 필요에 따라 통상의 경구 의약품에 사용되는 성분을 적절히 그 목적에 따라 배합해도 된다.
통상의 경구 의약품에 사용되는 성분으로서는, 예를 들면 부형제, 가소제, 결합제, 붕해제, 교미제, 향료, 유동 개선제, 감미제 등의 첨가제를 들 수 있다. 이들 첨가제는 약식심사발 1204 제1호(약사행정법령), 의약품 첨가물 사전 2007(일본 의약품 첨가제 협회 편집, 약사일보사) 및 제8판 식품 첨가물 공정서(일본 식품 첨가물 협회)에 기재되어 있다.
상기 제제 첨가제 중 부형제로서는, 젖당, 전분류, 알파화전분, 결정 셀룰로오스, 저치환도 히드록시프로필셀룰로오스, 히드록시프로필셀룰로오스, 정제 백당, 당알코올류, 경질 무수규산, 규산칼슘, 산화티탄, 침강 탄산칼슘 등을 들 수 있다. 이들 부형제는 1종 또는 2종 이상을 사용할 수 있다.
가소제로서는 구연산트리에틸, 글리세린, 트리아세틴, 프로필렌글리콜, 모노스테아르산글리세린, 폴리에틸렌글리콜류 등을 들 수 있다.
결합제로서는 젤라틴, 아라비아고무가루, 메틸셀룰로오스, 카르복시메틸셀룰로오스, 카르복시메틸셀룰로오스나트륨, 히드록시프로필셀룰로오스, 하이프로멜로스, 폴리비닐피롤리돈, 폴리비닐알코올, 폴리비닐알코올·아크릴산·메타크릴산메틸 공중합체, 폴리비닐알코올·폴리에틸렌글리콜·그래프트 코폴리머, 플루란, 덱스트린, 카르복시메틸셀룰로오스칼슘, 카르복시메틸셀룰로오스나트륨, 쉘락, 카르복시비닐 폴리머, 카르복시메틸스타치나트륨, 카르복시메틸에틸셀룰로오스, 초산프탈산셀룰로오스 등을 들 수 있다. 이들 결합제는 1종 또는 2종 이상을 사용할 수 있다.
붕해제로서는 크로스카르멜로오스나트륨, 크로스포비돈, 카르멜로오스, 카르멜로오스칼슘, 카르멜로오스나트륨, 카르복시메틸스타치나트륨, 저치환도 히드록시프로필셀룰로오스, 감자전분, 콘스타치, 알파화전분 등을 들 수 있다. 이들 붕해제는 1종 또는 2종 이상을 사용할 수 있다.
교미제로서는 말산, 구연산, 타르타르산 등을 들 수 있다.
향료로서는 오렌지 향료, 스피어민트 향료, 페퍼민트 향료, 요구르트 향료, 레몬 향료 등을 들 수 있다.
유동 개선제로서는 함수 이산화규소, 경질 무수규산, 탤크, 메타규산알루민산마그네슘 등을 들 수 있다.
감미제로서는 아스파탐, 말티톨, 사카린, 글리시리진산 금속염 등을 들 수 있다.
본 발명의 압축 성형 제제를 제조함에 있어서는, 먼저 상기 약물과, 필요에 따라 부형제 등의 첨가제를 사용하고, 고속 교반 조립법, 유동층 조립법 등 공지의 조립법에 따라 조립하고, 약물을 함유하는 조립물(이하, 「약물 함유 조립물」이라 하는 경우가 있음)을 조제한다. 예를 들면 상기 약물의 분말에 필요에 따라 부형제, 결합제 등을 혼합하여, 이 혼합 분말에 물을 첨가하여 교반 조립 등에 의해 조립하고, 추가로 유동층 건조기 등을 사용하여 건조함으로써 약물 함유 조립물이 얻어진다.
다음으로, 이 약물 함유 조립물의 표면을 상기 고분자의 피막에 의해 피복하여 고분자 피복 조립물을 얻는다. 고분자 피막은 통상의 방법에 따라 약물 함유 조립물 표면에 형성할 수 있고, 예를 들면 유동층 중에서 약물 함유 조립물에 상기 고분자를 포함하는 코팅액을 분무하여 피복하면 된다.
코팅액으로서는, 예를 들면 상기 고분자를 포함하는 용액 또는 분산액 등을 사용할 수 있고, 용매로서는 물, 저급 알코올 또는 이들의 혼합액 등이 사용된다. 저급 알코올로서는, 예를 들면 에탄올, 이소프로판올 등의 탄소수 1~3의 제1급 알코올이 예시된다. 2종 이상의 고분자를 사용하는 경우는, 이들을 합하여 용매에 용해 또는 분산시켜서 분무해도 되고, 각 고분자를 각각 단독으로 용매에 용해 또는 분산시켜 복수 회에 나눠 분무를 행해도 된다. 코팅액에는 필요에 따라 상기 첨가제를 배합해도 된다.
본 발명에 있어서 고분자 피막에 의한 피복이란, 약물 함유 조립물 표면의 전부 또는 일부가 고분자 피막에 의해 피복되어 있는 것을 의미하는데, 마스킹효과 등 고분자 피막에 의한 기능 발현이나 특정 첨가제에 의한 피복 효율 등의 관점에서, 약물 함유 조립물 표면의 전부가 피복되어 있는 것이 바람직하다.
이와 같이 하여 얻어진 고분자 피복 조립물은 추가로 체질(sieving) 등에 의해 정립(sizing)해도 된다. 이 고분자 피복 조립물은 평균 입자경이 바람직하게는 20~1,000 ㎛ 정도이고, 보다 바람직하게는 50~700 ㎛이다. 또한 고분자 피복 조립물의 평균 입자경은 질량·체적 분포에 의해 측정한 값이다.
또한, 고분자 피복 조립물을 특정 첨가제로 피복함으로써 본 발명의 과립을 얻을 수 있다. 특정 첨가제로 피복함에 있어서는 고분자 피복 조립물과 특정 첨가제 입자를 통상의 방법에 따라 혼합하면 되고, 예를 들면 보레 콘테이너 믹서, V형 혼합기, 리본 블렌더, 교반기 등의 통상의 혼합기를 사용할 수 있다. 혼합에 있어서는 충분한 붕해성 개선효과를 얻기 위해 고분자 피복 조립물과 특정 첨가제만을 혼합하는 것이 바람직하다. 특정 첨가제의 피복량은 고분자 피복 조립물 100 질량부에 대해, 예를 들면 0.01~5 질량부가 바람직하고, 0.15~0.25 질량부가 보다 바람직하다. 본 발명에 있어서 특정 첨가제에 의한 피복이란, 적어도 약물 함유 조립물에 형성된 고분자 피막의 표면 일부에 특정 첨가제의 입자가 존재하는 것을 의미한다.
본 발명의 과립은 필요에 따라 체질 등에 의해 정립해도 된다. 이 과립의 평균 입자경은 바람직하게는 20~1,000 ㎛ 정도이고, 보다 바람직하게는 50~700 ㎛이다. 또한 과립의 평균 입자경은 질량·체적 분포에 의해 측정한 값이다.
본 발명의 압축 성형 제제는 상기 과립에 필요에 따라 각종 첨가제를 첨가, 혼합하여 단발식 타정기, 회전식 타정기 등을 사용하여 압축 성형함으로써 제조된다. 첨가제로서 유동 개선제를 사용하는 것도 가능하다. 본 발명의 압축 성형 제제에 있어서의 고분자 피복 조립물을 피복하는 특정 첨가제의 함유량은, 예를 들면 0.01~5%가 바람직하고, 0.15~0.25%가 보다 바람직하다. 또한 압축 성형 시의 압력은, 예를 들면 20~600 ㎫가 바람직하고, 보다 바람직하게는 60~350 ㎫이며, 더욱 바람직하게는 170~300 ㎫이다. 이러한 범위면, 실용상 문제없는 경도와 양호한 붕해성을 구비한 제제가 얻어진다. 또한 그 붕해시간은 1분 이내인 것이 바람직하고, 30초 이내인 것이 보다 바람직하다. 또한 붕해시간은 제16 개정 일본 약국방에 기재된 붕해시험법에 따라 측정되는 값이다.
이렇게 하여 얻어지는 본 발명의 압축 성형 제제는, 메타크릴계 고분자 등의 피막에 의해 피복된 조립물을 사용하고 있기 때문에, 약물의 쓴맛 등을 마스킹하는 효과 등이 우수한 동시에 양호한 붕해성을 갖는 것이다. 또한 타정압을 높게 해도 정제 경도나 붕해성의 변동이 작아, 광범위한 타정압의 범위에 있어서 적당한 경도와 양호한 붕해성이 얻어지기 때문에, 타정 장애 등이 발생하기 어려운 조건에서 용이하고 안정적인 생산이 가능하다.
또한 본 발명의 과립은 압축 성형해도 우수한 붕해성을 나타내는 것으로부터, 구강내 붕해정제 등 압축 성형 제제용 과립으로서 적합하나, 과립제나 캡슐에 충전한 캡슐제 등으로서도 이용 가능하다.
이상 설명한 본 발명의 압축 성형 제제의 특히 바람직한 태양으로서는 아래에 나타내는 것을 들 수 있다.
약물
15~90 질량%
메타크릴계 고분자
1~50 질량%
특정 첨가제
0.01~5 질량%
실시예
다음으로 실시예 및 비교예를 나타내 본 발명을 더욱 구체적으로 설명하나, 본 발명은 이들에 조금도 제약되는 것은 아니다.
실시예 1
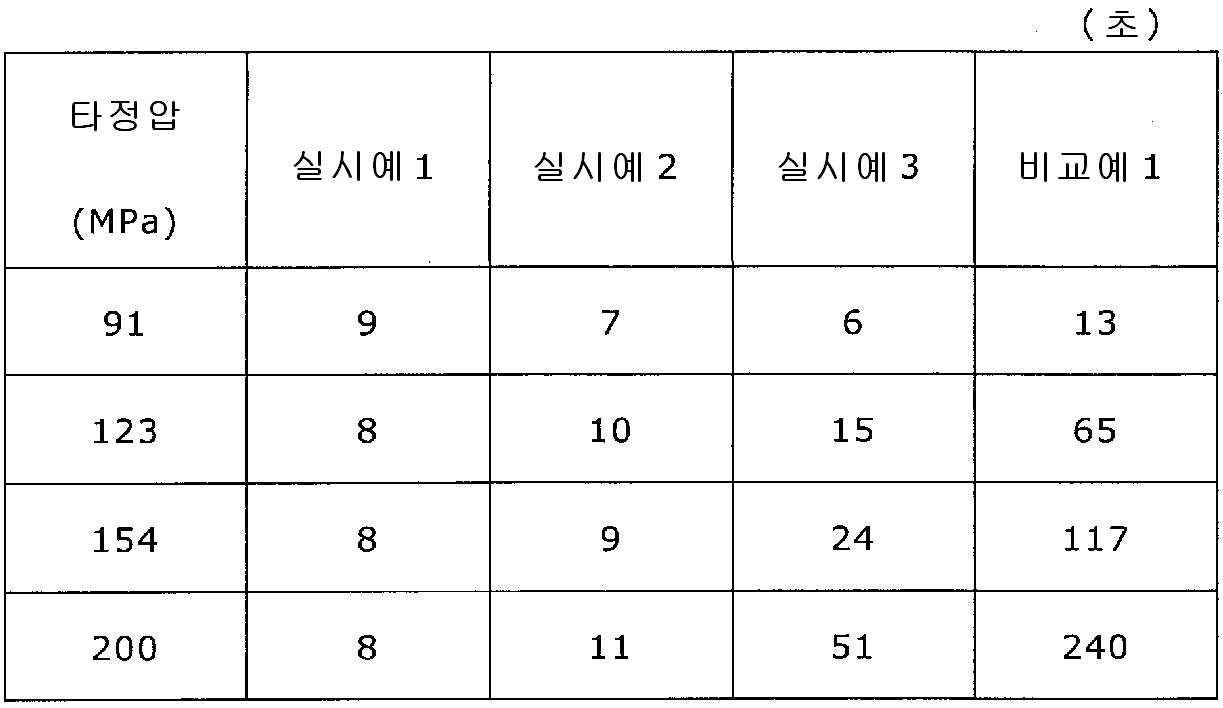
록소프로펜나트륨 수화물 681 g(다이와 약품공업 제조), 결정 셀룰로오스 85 g(아사히 가세이 케미컬즈사 제조), 저치환도 히드록시프로필셀룰로오스 200 g(신에츠 화학공업 제조), 경질 무수규산 20 g(닛폰 에어로실 제조), 폴리비닐알코올(부분 비누화물) 14 g(닛폰 합성화학 제조)을 고속 교반식 혼합 조립기를 사용하여 혼합하였다. 이 혼합물에 정제수 250 g을 첨가하여 조립하였다. 계속해서, 조립물을 유동층 건조기를 사용하여 건조하고, 정립기를 사용하여 정립하였다. 이 건조 조립물 200 g을 취하여, 유동층 중에서 콜리코트 스마트실 30D(고형분 30%) 488 g(BASF 제조), 구연산트리에틸 22 g(모리무라 상사 제조), 경질 무수규산 7.3 g(닛폰 에어로실 제조), 카르복시메틸셀룰로오스나트륨 4.4 g(DKS 제조), 정제수 595.3 g을 균일하게 혼합한 코팅액을 조립물의 질량 증가가 30%가 될 때까지 분무하여 고분자 피복 조립물을 얻었다.
당해 고분자 피복 조립물 130 g과 스테아르산마그네슘 0.65 g(다이헤이 화학산업 제조)을 보레 콘테이너 믹서로 10분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 81.9 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 재팬 제조), 아스파탐 2.6 g(아지노모토 제조), 아세설팜칼륨 2.6 g(기린 교와 푸즈 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조), 스테아르산마그네슘 0.65 g(다이헤이 화학산업 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 아래에 나타내는 방법으로 정제 경도 및 붕해시간을 측정하였다.
(정제 경도의 측정방법)
본 명세서에 있어서의 정제 경도란, 로드셀식 정제 경도계(제품명:포터블 체커 PC-30, 오카다 세이코(주) 제조)를 사용하여 측정되는 값이다.
(붕해시간의 측정방법)
본 명세서에 있어서의 붕해시간은 제16 개정 일본 약국방의 붕해 시험법에 따라 측정되는 값이다. 시험액은 일본 약국방 규정의 정제수를 사용하고, 디스크를 사용하지 않는 경우에 있어서의 붕해시간을 측정하였다.
실시예 2
실시예 1에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 0.325 g(다이헤이 화학산업 제조)을 보레 콘테이너 믹서로 10분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 81.9 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 재팬 제조), 아스파탐 2.6 g(아지노모토 제조), 아세설팜칼륨 2.6 g(기린 교와 푸즈 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조), 스테아르산마그네슘 0.975 g(다이헤이 화학산업 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
실시예 3
실시예 1에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 0.13 g(다이헤이 화학산업 제조)을 보레 콘테이너 믹서로 10분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 81.9 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 재팬 제조), 아스파탐 2.6 g(아지노모토 제조), 아세설팜칼륨 2.6 g(기린 교와 푸즈 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조), 스테아르산마그네슘 1.17 g(다이헤이 화학산업 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 1
상기 실시예 1에서 얻어진 고분자 피복 조립물 130 g과, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 81.9 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 재팬 제조), 아스파탐 2.6 g(아지노모토 제조), 아세설팜칼륨 2.6 g(기린 교와 푸즈 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조), 스테아르산마그네슘 1.3 g(다이헤이 화학산업 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
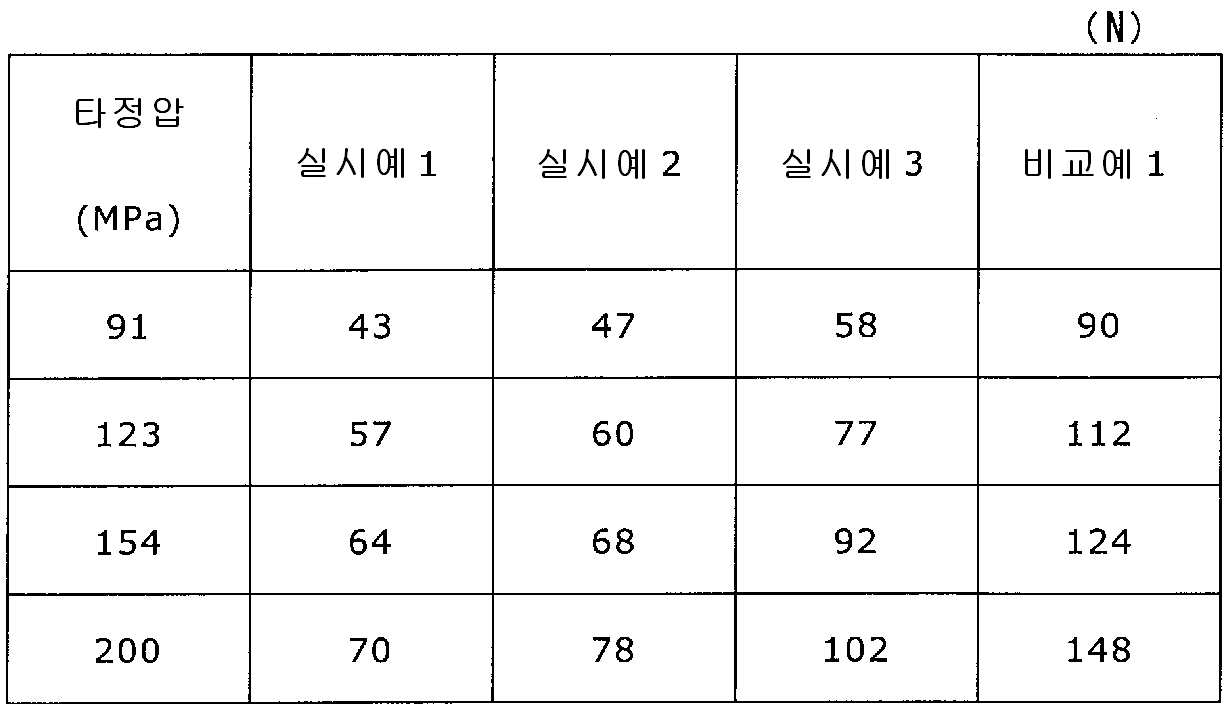
실시예 1~3 및 비교예 1의 정제에 대해서 정제 경도의 결과를 표 1 및 도 1에, 붕해시간의 결과를 표 2 및 도 2에 나타낸다.
실시예 4
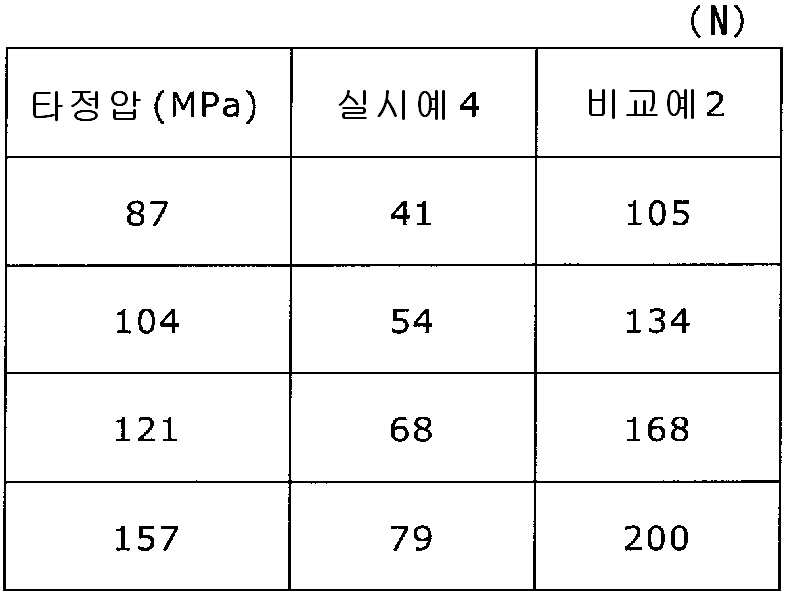
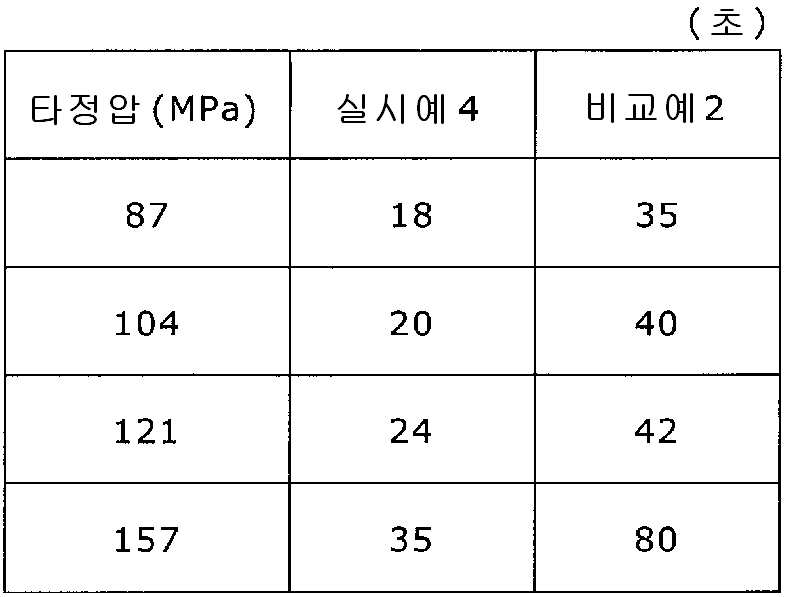
이부프로펜나트륨 600 g(BASF 제조), 결정 셀룰로오스 330 g(아사히 가세이 케미컬즈사 제조), 폴리비닐아세탈디에틸아미노아세테이트 24 g(미츠비시-케미컬 푸즈 제조), 유드라짓 L30D-55(고형분 30%) 39.9 g(EVONIK사 제조), DL-말산 12 g(후소 화학공업 제조), 폴리비닐알코올(부분 비누화물) 12 g(닛폰 합성화학 제조)에 정제수 320 g을 첨가하여 고속 교반식 혼합 조립기를 사용하여 조립하였다. 계속해서, 조립물을 유동층 건조기를 사용하여 건조하고, 정립기를 사용하여 정립하였다. 이 건조 조립물 330 g을 취하여, 유동층 중에서 메타크릴산 코폴리머 LD(고형분 30%) 100 g(EVONIK사 제조), 구연산트리에틸 3 g(모리무라 상사 제조), 경질 무수규산 3 g(닛폰 에어로실 제조), 정제수 197 g을 균일하게 혼합한 코팅액을 조립물의 질량 증가가 10%가 될 때까지 분무하여 고분자 피복 조립물을 얻었다.
당해 고분자 피복 조립물 366 g과 스테아르산마그네슘 1.83 g(다이헤이 화학산업 제조)을 보레 콘테이너 믹서로 10분간 혼합한 후, 결정 셀룰로오스 120 g(아사히 가세이 케미컬즈사 제조), 옥수수전분 76 g(일본 콘스타치 제조), 아세설팜칼륨 6 g(기린 교와 푸즈 제조), 아스파탐 6 g(아지노모토 제조), 경질 무수규산 6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 87, 104, 121, 157 ㎫에서 1정당 581.8 ㎎이 되도록 타정하여 정제 직경 12 ㎜의 정제를 얻었다. 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 2
상기 실시예 4에서 얻어진 고분자 피복 조립물 130 g과, 결정 셀룰로오스 120 g(아사히 가세이 케미컬즈사 제조), 옥수수전분 76 g(일본 콘스타치 제조), 아세설팜칼륨 6 g(기린 교와 푸즈 제조), 아스파탐 6 g(아지노모토 제조), 경질 무수규산 6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 10분간 혼합하였다. 이 과립을 회전 타정기로 타정압 87, 104, 121, 157 ㎫에서 1정당 581.8 ㎎이 되도록 타정하여 정제 직경 12 ㎜의 정제를 얻었다. 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 4 및 비교예 2에 대해서 정제 경도를 표 3 및 도 3에, 붕해시간을 표 4 및 도 4에 나타낸다.
실시예 5
록소프로펜나트륨 수화물 681 g(다이와 약품공업 제조), 결정 셀룰로오스 85 g(아사히 가세이 케미컬즈사 제조), 저치환도 히드록시프로필셀룰로오스 200 g(신에츠 화학공업 제조), 경질 무수규산 20 g(닛폰 에어로실 제조), 폴리비닐알코올(부분 비누화물) 14 g(닛폰 합성화학 제조)을 고속 교반식 혼합 조립기를 사용하여 혼합하였다. 이 혼합물에 정제수 250 g을 첨가하여 조립하였다. 계속해서, 조립물을 유동층 건조기를 사용하여 건조하고, 정립기를 사용하여 정립하였다. 이 건조 조립물 200 g을 취하여, 유동층 중에서 콜리코트 스마트실 30D(고형분 30%) 488 g(BASF 제조), 구연산트리에틸 22 g(모리무라 상사 제조), 경질 무수규산 7.3 g(닛폰 에어로실 제조), 카르복시메틸셀룰로오스나트륨 4.4 g(DKS 제조), 정제수 595.3 g을 균일하게 혼합한 코팅액을 조립물의 질량 증가가 30%가 될 때까지 분무하여 고분자 피복 조립물을 얻었다.
당해 고분자 피복 조립물 130 g과 스테아르산마그네슘 1.30 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
실시예 6
실시예 5에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 3.90 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 154, 200 ㎫에서 1정당 262.6 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
실시예 7
실시예 5에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 6.5 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 154, 200 ㎫에서 1정당 265.2 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 3
실시예 5에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 5~7 및 비교예 3에 대해서, 각 타정압에 있어서의 스테아르산마그네슘의 첨가량에 대한 정제 경도를 표 5 및 도 5에, 붕해시간을 표 6 및 도 6에 나타낸다.
실시예 5~7 및 비교예 3의 정제에 대해서 정제 경도의 결과를 표 5 및 도 5에, 붕해시간의 결과를 표 6 및 도 6에 나타낸다.
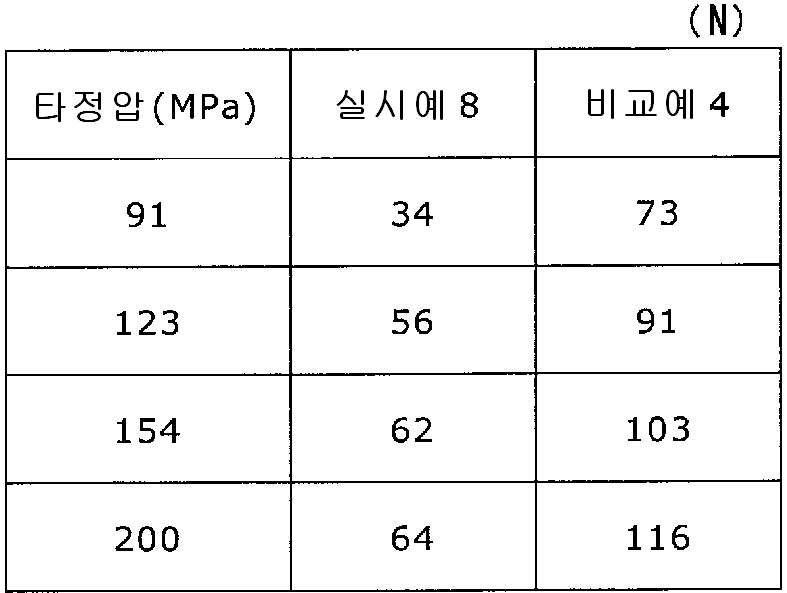
실시예 8
록소프로펜나트륨 수화물 681 g(다이와 약품공업 제조), 결정 셀룰로오스 85 g(아사히 가세이 케미컬즈사 제조), 저치환도 히드록시프로필셀룰로오스 200 g(신에츠 화학공업 제조), 경질 무수규산 20 g(닛폰 에어로실 제조), 폴리비닐알코올(부분 비누화물) 14 g(닛폰 합성화학 제조)을 고속 교반식 혼합 조립기를 사용하여 혼합하였다. 이 혼합물에 정제수 250 g을 첨가하여 조립하였다. 계속해서, 조립물을 유동층 건조기를 사용하여 건조하고, 정립기를 사용하여 정립하였다. 이 건조 조립물 200 g을 취하여, 유동층 중에서 콜리코트 스마트실 30D(고형분 30%) 488 g(BASF 제조), 구연산트리에틸 22 g(모리무라 상사 제조), 경질 무수규산 7.3 g(닛폰 에어로실 제조), 카르복시메틸셀룰로오스나트륨 4.4 g(DKS 제조), 정제수 595.3 g을 균일하게 혼합한 코팅액을 조립물의 질량 증가가 30%가 될 때까지 분무하여 고분자 피복 조립물을 얻었다.
당해 고분자 피복 조립물 130 g과 스테아르산마그네슘 1.30 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 4
실시예 8에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 스테아르산마그네슘 1.30 g(다이헤이 화학산업 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 8 및 비교예 4에 대해서 정제 경도를 표 7 및 도 7에, 붕해시간을 표 8 및 도 8에 나타낸다.
실시예 9
실시예 8에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 3.9 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 262.6 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 5
실시예 8에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 스테아르산마그네슘 3.9 g(다이헤이 화학산업 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 9 및 비교예 5에 대해서 정제 경도를 표 9 및 도 9에, 붕해시간을 표 10 및 도 10에 나타낸다.
실시예 10
실시예 8에서 얻어진 고분자 피복 조립물 130 g과 스테아르산마그네슘 6.5 g(다이헤이 화학산업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 265.2 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 6
실시예 8에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 스테아르산마그네슘 6.5 g(다이헤이 화학산업 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 91, 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 10 및 비교예 6에 대해서 정제 경도를 표 11 및 도 11에, 붕해시간을 표 12 및 도 12에 나타낸다.
실시예 11
록소프로펜나트륨 수화물 681 g(다이와 약품공업 제조), 결정 셀룰로오스 85 g(아사히 가세이 케미컬즈사 제조), 저치환도 히드록시프로필셀룰로오스 200 g(신에츠 화학공업 제조), 경질 무수규산 20 g(닛폰 에어로실 제조), 폴리비닐알코올(부분 비누화물) 14 g(닛폰 합성화학 제조)을 고속 교반식 혼합 조립기를 사용하여 혼합하였다. 이 혼합물에 정제수 250 g을 첨가하여 조립하였다. 계속해서, 조립물을 유동층 건조기를 사용하여 건조하고, 정립기를 사용하여 정립하였다. 이 건조 조립물 200 g을 취하여, 유동층 중에서 콜리코트 스마트실 30D(고형분 30%) 488 g(BASF 제조), 구연산트리에틸 22 g(모리무라 상사 제조), 경질 무수규산 7.3 g(닛폰 에어로실 제조), 카르복시메틸셀룰로오스나트륨 4.4 g(DKS 제조), 정제수 595.3 g을 균일하게 혼합한 코팅액을 조립물의 질량 증가가 30%가 될 때까지 분무하여 고분자 피복 조립물을 얻었다.
당해 고분자 피복 조립물 130 g과 탤크 1.30 g(후지 탤크 공업 제조)을 폴리에틸렌 봉지에서 2분간 혼합한 후, 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 첨가하여, 추가로 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 7
실시예 11에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 탤크 1.3 g(후지 탤크 공업 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 11 및 비교예 7에 대해서 정제 경도를 표 13 및 도 13에, 붕해시간을 표 14 및 도 14에 나타낸다.
실시예 12
탤크 1.3 g(후지 탤크 공업 제조)을 스테아르산칼슘 1.3 g(다이헤이 화학산업 제조)으로 대체한 것 이외는 실시예 11과 동일하게 하여 정제를 조제하였다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 8
실시예 11에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 스테아르산칼슘 1.30 g(다이헤이 화학산업 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 12 및 비교예 8에 대해서 정제 경도를 표 15 및 도 15에, 붕해시간을 표 16 및 도 16에 나타낸다.
실시예 13
탤크(후지 탤크 공업 제조)를 자당 지방산 에스테르(미츠비시-케미컬 푸즈 제조)로 대체한 것 이외는 실시예 11과 동일하게 하여 정제를 조제하였다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다.
비교예 9
실시예 11에서 얻어진 고분자 피복 조립물 130 g을 옥수수전분 26 g(일본 콘스타치 제조), 결정 셀룰로오스 87.1 g(아사히 가세이 케미컬즈사 제조), 크로스포비돈 13 g(BASF 제조), 자당 지방산 에스테르 1.3 g(미츠비시-케미컬 푸즈 제조), 경질 무수규산 2.6 g(닛폰 에어로실 제조)을 폴리에틸렌 봉지에서 2분간 혼합하였다. 이 과립을 회전 타정기로 타정압 123, 154, 200 ㎫에서 1정당 260 ㎎이 되도록 타정하여 정제 직경 9 ㎜의 정제를 얻었다. 얻어진 각 정제에 대해서 실시예 1과 동일하게 하여 정제 경도 및 붕해시간을 측정하였다. 실시예 10 및 비교예 9에 대해서 정제 경도를 표 17 및 도 17에, 붕해시간을 표 18 및 도 18에 나타낸다.
상기 표 1~18 및 도 1~18에 나타내는 바와 같이, 특정 첨가제로 피복한 과립을 사용한 압축 성형 제제는 피복하지 않은 과립을 함유하는 압축 성형 제제에 비해 붕해시간이 단축되는 것은 명확하다.
본 발명의 과립을 사용한 압축 성형 제제는 불쾌한 맛을 갖는 약물의 쓴맛 등을 마스킹하는 효과 등이 우수한 동시에 양호한 붕해성을 갖기 때문에, 구강내 붕해정 등으로서 적합하게 이용할 수 있다.
Claims (28)
- 약물을 함유하는 조립물이 고분자 피막으로 피복된 고분자 피복 조립물을 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 탤크 및 규산으로 이루어진 군으로부터 선택되는 1종 또는 2종 이상의 첨가제로 피복하여 이루어지는 과립을 함유하는 압축 성형 제제.
- 제1항에 있어서,
상기 첨가제가 스테아르산마그네슘, 스테아르산칼슘, 자당 지방산 에스테르, 또는 탤크인 압축 성형 제제. - 제1항 또는 제2항에 있어서,
약물이 불쾌한 맛을 갖는 약물인 압축 성형 제제. - 제3항에 있어서,
불쾌한 맛을 갖는 약물이 록소프로펜나트륨, 이부프로펜나트륨, 디클로페낙칼륨, 디클로페낙나트륨 및 나프록센나트륨 또는 그의 수화물로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 압축 성형 제제. - 제1항 내지 제4항 중 어느 한 항에 있어서,
고분자가 메타크릴계 고분자인 압축 성형 제제. - 제5항에 있어서,
메타크릴계 고분자가 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체, 아크릴산에틸-메타크릴산메틸 공중합체, 메타크릴산-아크릴산에틸 공중합체 및 아크릴산메틸-메타크릴산메틸-메타크릴산 코폴리머로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 압축 성형 제제. - 제1항 내지 제6항 중 어느 한 항에 있어서,
고분자의 함유량이 약물 100 질량부에 대해 0.5~2,000 질량부인 압축 성형 제제. - 제1항 내지 제7항 중 어느 한 항에 있어서,
고분자 피복 조립물을 피복하는 첨가제의 함유량이 고분자 피복 조립물 100 질량부에 대해 0.01~5 질량부인 압축 성형 제제. - 제1항 내지 제8항 중 어느 한 항에 있어서,
압축 성형 제제가 구강내 붕해정제인 압축 성형 제제. - 약물을 함유하는 조립물을 고분자 피막으로 피복하여 고분자 피복 조립물을 얻어, 그 고분자 피복 조립물을 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 탤크 및 규산으로 이루어진 군으로부터 선택되는 1종 또는 2종 이상의 첨가제로 피복하여 얻어지는 과립을 압축 성형하는 것을 특징으로 하는 압축 성형 제제의 제조방법.
- 제10항에 있어서,
상기 첨가제가 스테아르산마그네슘, 스테아르산칼슘, 자당 지방산 에스테르, 또는 탤크인 압축 성형 제제의 제조방법. - 제10항 또는 제11항에 있어서,
약물이 불쾌한 맛을 갖는 약물인 압축 성형 제제의 제조방법. - 제12항에 있어서,
불쾌한 맛을 갖는 약물이 록소프로펜나트륨, 이부프로펜나트륨, 디클로페낙칼륨, 디클로페낙나트륨 및 나프록센나트륨 또는 그의 수화물로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 압축 성형 제제의 제조방법. - 제10항 내지 제13항 중 어느 한 항에 있어서,
고분자가 메타크릴계 고분자인 압축 성형 제제의 제조방법. - 제14항에 있어서,
메타크릴계 고분자가 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체, 아크릴산에틸-메타크릴산메틸 공중합체, 메타크릴산-아크릴산에틸 공중합체 및 아크릴산메틸-메타크릴산메틸-메타크릴산 코폴리머로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 압축 성형 제제의 제조방법. - 제10항 내지 제15항 중 어느 한 항에 있어서,
고분자 피복 조립물의 상기 첨가제에 의한 피복이 고분자 피복 조립물과 그 첨가제만을 혼합함으로써 행하여지는 것인 압축 성형 제제의 제조방법. - 제10항 내지 제16항 중 어느 한 항에 있어서,
상기 과립이 고분자 피복 조립물 100 질량부에 대해 상기 첨가제 0.01~5 질량부로 피복하는 것인 압축 성형 제제의 제조방법. - 제10항 내지 제17항 중 어느 한 항에 있어서,
압축 성형 제제가 구강내 붕해정제인 압축 성형 제제의 제조방법. - 약물을 함유하는 조립물이 고분자 피막으로 피복된 고분자 피복 조립물을 스테아르산 금속염, 스테아르산, 자당 지방산 에스테르, 탤크 및 규산으로 이루어진 군으로부터 선택되는 1종 또는 2종 이상의 첨가제로 피복하여 이루어지는 과립.
- 제19항에 있어서,
상기 첨가제가 스테아르산마그네슘, 스테아르산칼슘, 자당 지방산 에스테르, 또는 탤크인 과립. - 제18항 또는 제19항에 있어서,
약물이 불쾌한 맛을 갖는 약물인 과립. - 제21항에 있어서,
불쾌한 맛을 갖는 약물이 록소프로펜나트륨, 이부프로펜나트륨, 디클로페낙칼륨, 디클로페낙나트륨 및 나프록센나트륨 또는 그의 수화물로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 과립. - 제19항 내지 제22항 중 어느 한 항에 있어서,
고분자가 메타크릴계 고분자인 과립. - 제23항에 있어서,
메타크릴계 고분자가 메타크릴산메틸-메타크릴산디에틸아미노에틸 공중합체, 아크릴산에틸-메타크릴산메틸 공중합체, 메타크릴산-아크릴산에틸 공중합체 및 아크릴산메틸-메타크릴산메틸-메타크릴산 코폴리머로 이루어진 군으로부터 선택되는 1종 또는 2종 이상인 과립. - 제19항 내지 제24항 중 어느 한 항에 있어서,
고분자의 함유량이 약물 100 질량부에 대해 0.5~2,000 질량부인 과립. - 제19항 내지 제25항 중 어느 한 항에 있어서,
고분자 피복 조립물을 피복하는 상기 첨가제의 함유량이 0.01~5 질량부인 과립. - 제19항 내지 제26항 중 어느 한 항에 있어서,
상기 과립이 압축 성형 제제용인 과립. - 제19항 내지 제27항 중 어느 한 항에 있어서,
상기 과립이 구강내 붕해정제용인 과립.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2015-255828 | 2015-12-28 | ||
| JP2015255828 | 2015-12-28 | ||
| PCT/JP2016/088787 WO2017115764A1 (ja) | 2015-12-28 | 2016-12-26 | 圧縮成型製剤 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180098282A true KR20180098282A (ko) | 2018-09-03 |
Family
ID=59225665
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187018556A Withdrawn KR20180098282A (ko) | 2015-12-28 | 2016-12-26 | 압축 성형 제제 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20190000765A1 (ko) |
| EP (1) | EP3398588A4 (ko) |
| JP (1) | JP6866153B2 (ko) |
| KR (1) | KR20180098282A (ko) |
| CN (1) | CN108472256A (ko) |
| CA (1) | CA3007577A1 (ko) |
| WO (1) | WO2017115764A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020105173A (ja) * | 2018-12-27 | 2020-07-09 | 日本ケミファ株式会社 | 2種以上の薬物を含有する口腔内崩壊錠及びその製造方法 |
| JP7792195B2 (ja) * | 2019-12-24 | 2025-12-25 | アリナミン製薬株式会社 | 医薬組成物 |
| JP7776260B2 (ja) * | 2020-02-28 | 2025-11-26 | 第一三共ヘルスケア株式会社 | 錠剤、その製造方法、および医薬品 |
| JP7742738B2 (ja) * | 2020-08-26 | 2025-09-22 | 第一三共ヘルスケア株式会社 | イブプロフェンとトラネキサム酸を含有する錠剤及びその製造方法 |
| EP4255495A4 (en) | 2020-12-03 | 2025-10-08 | Battelle Memorial Institute | COMPOSITIONS OF POLYMERIC NANOPARTICLES AND DNA NANOSTRUCTURES AND METHODS FOR NON-VIRAL DELIVERY |
| CN114306252A (zh) * | 2020-12-17 | 2022-04-12 | 山东裕欣药业有限公司 | 一种解热镇痛消炎组合物及其制备方法 |
| WO2022216977A1 (en) | 2021-04-07 | 2022-10-13 | Batelle Memorial Institute | Rapid design, build, test, and learn technologies for identifying and using non-viral carriers |
| JP2023102928A (ja) * | 2022-01-13 | 2023-07-26 | 健栄製薬株式会社 | 非ステロイド性消炎鎮痛薬を含む錠剤 |
| WO2025072751A1 (en) | 2023-09-29 | 2025-04-03 | Battelle Memorial Institute | Polymer nanoparticle compositions for in vivo expression of polypeptides |
| US12441996B2 (en) | 2023-12-08 | 2025-10-14 | Battelle Memorial Institute | Use of DNA origami nanostructures for molecular information based data storage systems |
| WO2025237808A1 (en) * | 2024-05-14 | 2025-11-20 | Zambon S.P.A. | Orodispersible pharmaceutical compositions comprising an amino acid salt of ibuprofen |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000054752A1 (fr) | 1999-03-15 | 2000-09-21 | Kaken Pharmaceutical Co., Ltd. | Comprimes a delitement rapide et procede de fabrication |
| JP2006265242A (ja) | 2005-02-28 | 2006-10-05 | Dai Ichi Seiyaku Co Ltd | 口腔内速崩壊性医薬用組成物およびその製造方法 |
| JP2013509368A (ja) | 2009-10-28 | 2013-03-14 | ビーエーエスエフ ソシエタス・ヨーロピア | 医薬剤形用の安定な保護コーティング |
| JP2013147470A (ja) | 2012-01-20 | 2013-08-01 | Nipro Corp | 口腔内崩壊錠 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5567389A (en) * | 1995-07-07 | 1996-10-22 | United Technologies Corporation | Method for controlled dispensing of extended-release chemical formulation in tablet form |
| AU2001248751A1 (en) * | 2000-04-12 | 2001-10-23 | Banyu Pharmaceutical Co. Ltd. | Compositions disintegrating in oral cavity and preparations disintegrating in oral cavity |
| KR101099176B1 (ko) * | 2003-01-21 | 2011-12-27 | 니뽄 신야쿠 가부시키가이샤 | 구강내 속붕성 정제 |
| RU2382637C2 (ru) * | 2004-04-30 | 2010-02-27 | Астеллас Фарма Инк. | Фармацевтическая композиция для перорального введения в форме частиц с рассчитанным временем высвобождения и быстро распадающиеся таблетки, содержащие указанную композицию |
| JP5228359B2 (ja) * | 2007-04-12 | 2013-07-03 | ニプロ株式会社 | 主薬粒子及びその製造方法ならびに口腔内崩壊錠 |
| CN101983054B (zh) * | 2008-01-31 | 2013-08-14 | 杏林制药株式会社 | 含有咪达那新的口腔内迅速崩解性片剂 |
| JP4706785B2 (ja) * | 2008-09-30 | 2011-06-22 | アステラス製薬株式会社 | 経口投与用粒子状医薬組成物 |
| JP5973347B2 (ja) * | 2010-08-31 | 2016-08-23 | 協和発酵キリン株式会社 | 口腔内崩壊錠 |
| JP4803686B2 (ja) * | 2010-08-31 | 2011-10-26 | 協和発酵キリン株式会社 | 苦味を呈する薬物を含有する顆粒および口腔内崩壊錠 |
| CN102885791B (zh) * | 2012-09-24 | 2015-03-04 | 浙江万晟药业有限公司 | 一种制备盐酸非索非那定口腔崩解片的方法 |
| JP2014114280A (ja) * | 2012-11-14 | 2014-06-26 | Ohara Yakuhin Kogyo Kk | 印刷に適した錠剤の製造法 |
| JP6086798B2 (ja) * | 2013-04-25 | 2017-03-01 | 小林製薬株式会社 | 錠剤の製造方法 |
-
2016
- 2016-12-26 CA CA3007577A patent/CA3007577A1/en not_active Abandoned
- 2016-12-26 EP EP16881739.3A patent/EP3398588A4/en not_active Withdrawn
- 2016-12-26 CN CN201680076477.5A patent/CN108472256A/zh active Pending
- 2016-12-26 US US16/066,497 patent/US20190000765A1/en not_active Abandoned
- 2016-12-26 KR KR1020187018556A patent/KR20180098282A/ko not_active Withdrawn
- 2016-12-26 JP JP2016251172A patent/JP6866153B2/ja active Active
- 2016-12-26 WO PCT/JP2016/088787 patent/WO2017115764A1/ja not_active Ceased
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000054752A1 (fr) | 1999-03-15 | 2000-09-21 | Kaken Pharmaceutical Co., Ltd. | Comprimes a delitement rapide et procede de fabrication |
| JP2006265242A (ja) | 2005-02-28 | 2006-10-05 | Dai Ichi Seiyaku Co Ltd | 口腔内速崩壊性医薬用組成物およびその製造方法 |
| JP2013509368A (ja) | 2009-10-28 | 2013-03-14 | ビーエーエスエフ ソシエタス・ヨーロピア | 医薬剤形用の安定な保護コーティング |
| JP2013147470A (ja) | 2012-01-20 | 2013-08-01 | Nipro Corp | 口腔内崩壊錠 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3398588A1 (en) | 2018-11-07 |
| EP3398588A4 (en) | 2019-10-02 |
| US20190000765A1 (en) | 2019-01-03 |
| CN108472256A (zh) | 2018-08-31 |
| WO2017115764A1 (ja) | 2017-07-06 |
| JP2017119692A (ja) | 2017-07-06 |
| CA3007577A1 (en) | 2017-07-06 |
| JP6866153B2 (ja) | 2021-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5537927B2 (ja) | 口腔内崩壊錠 | |
| JP6866153B2 (ja) | 圧縮成型製剤 | |
| JP6014044B2 (ja) | 迅速分散顆粒、口腔内崩壊錠、および方法 | |
| JP2025100927A (ja) | シロドシンの苦味をマスキングした経口投与製剤 | |
| JP2017125049A (ja) | 速崩性の固体被覆剤形 | |
| CN106913553A (zh) | 口腔崩解片及其制造方法 | |
| JP5405752B2 (ja) | 被覆された薬物含有粒子および該粒子を含む固形製剤 | |
| JP6919119B2 (ja) | 3位が置換されたγ−アミノ酪酸誘導体を含有する圧縮固形医薬組成物。 | |
| US20050175689A1 (en) | Coated fine particles containing drug for intrabuccally fast disintegrating tablet | |
| EP1679066A1 (en) | Drug-containing coated microparticle for orally disintegrating tablet | |
| JP5664225B2 (ja) | 不快味マスキング粒子及びこれを含有する経口製剤 | |
| JP2019019113A (ja) | メマンチン塩酸塩含有口腔内崩壊錠 | |
| JP4257865B1 (ja) | 口腔内速崩錠の製造方法 | |
| KR101680925B1 (ko) | 불쾌미 마스킹 입자 및 이것을 함유하는 경구제제 | |
| JP5828280B2 (ja) | 錠剤及びその製造方法 | |
| JP6812104B2 (ja) | 経口固形組成物 | |
| JP7308022B2 (ja) | 速溶性薬物の苦味が抑制された口腔内崩壊錠 | |
| JP6150564B2 (ja) | 口腔内速崩壊性錠剤 | |
| JP2020105173A (ja) | 2種以上の薬物を含有する口腔内崩壊錠及びその製造方法 | |
| WO2017115745A1 (ja) | 圧縮成型製剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20180629 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20211103 Comment text: Request for Examination of Application |
|
| PC1202 | Submission of document of withdrawal before decision of registration |
Comment text: [Withdrawal of Procedure relating to Patent, etc.] Withdrawal (Abandonment) Patent event code: PC12021R01D Patent event date: 20221228 |
|
| WITB | Written withdrawal of application |