KR20180012749A - 교아세포종에 대한 egfr-지시된 car 요법 - Google Patents
교아세포종에 대한 egfr-지시된 car 요법 Download PDFInfo
- Publication number
- KR20180012749A KR20180012749A KR1020177031930A KR20177031930A KR20180012749A KR 20180012749 A KR20180012749 A KR 20180012749A KR 1020177031930 A KR1020177031930 A KR 1020177031930A KR 20177031930 A KR20177031930 A KR 20177031930A KR 20180012749 A KR20180012749 A KR 20180012749A
- Authority
- KR
- South Korea
- Prior art keywords
- cells
- cell
- egfr
- car
- isolated
- Prior art date
Links
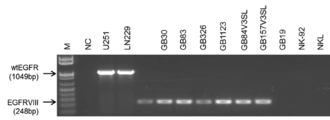
- 208000005017 glioblastoma Diseases 0.000 title claims description 126
- 238000002560 therapeutic procedure Methods 0.000 title claims description 21
- 210000004027 cell Anatomy 0.000 claims abstract description 670
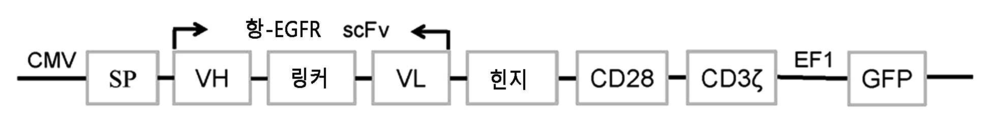
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims abstract description 150
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 143
- 238000000034 method Methods 0.000 claims abstract description 115
- 201000011510 cancer Diseases 0.000 claims abstract description 52
- 206010006187 Breast cancer Diseases 0.000 claims abstract description 43
- 208000026310 Breast neoplasm Diseases 0.000 claims abstract description 41
- 210000004556 brain Anatomy 0.000 claims abstract description 39
- 239000000203 mixture Substances 0.000 claims abstract description 27
- 208000003174 Brain Neoplasms Diseases 0.000 claims abstract description 23
- 206010027476 Metastases Diseases 0.000 claims abstract description 12
- 230000009401 metastasis Effects 0.000 claims abstract description 12
- 238000009396 hybridization Methods 0.000 claims abstract description 9
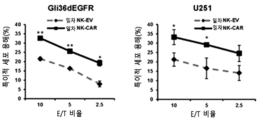
- 210000000822 natural killer cell Anatomy 0.000 claims description 92
- 239000013598 vector Substances 0.000 claims description 90
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 74
- 108090000623 proteins and genes Proteins 0.000 claims description 71
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 65
- 229920001184 polypeptide Polymers 0.000 claims description 59
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 58
- 210000000130 stem cell Anatomy 0.000 claims description 58
- 150000001413 amino acids Chemical class 0.000 claims description 48
- 102000004169 proteins and genes Human genes 0.000 claims description 48
- 150000007523 nucleic acids Chemical class 0.000 claims description 46
- 241000282414 Homo sapiens Species 0.000 claims description 43
- 239000000427 antigen Substances 0.000 claims description 41
- 102000036639 antigens Human genes 0.000 claims description 41
- 108091007433 antigens Proteins 0.000 claims description 41
- 102000040430 polynucleotide Human genes 0.000 claims description 40
- 108091033319 polynucleotide Proteins 0.000 claims description 40
- 239000002157 polynucleotide Substances 0.000 claims description 40
- 230000027455 binding Effects 0.000 claims description 37
- 230000011664 signaling Effects 0.000 claims description 35
- 239000012634 fragment Substances 0.000 claims description 31
- 102000039446 nucleic acids Human genes 0.000 claims description 31
- 108020004707 nucleic acids Proteins 0.000 claims description 31
- 210000004881 tumor cell Anatomy 0.000 claims description 29
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 28
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 28
- 238000004519 manufacturing process Methods 0.000 claims description 25
- 239000013612 plasmid Substances 0.000 claims description 19
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 18
- 230000001177 retroviral effect Effects 0.000 claims description 18
- 238000002347 injection Methods 0.000 claims description 17
- 239000007924 injection Substances 0.000 claims description 17
- 241000282326 Felis catus Species 0.000 claims description 16
- 241000282472 Canis lupus familiaris Species 0.000 claims description 15
- 241000700584 Simplexvirus Species 0.000 claims description 15
- 230000003834 intracellular effect Effects 0.000 claims description 15
- 239000013603 viral vector Substances 0.000 claims description 15
- 241000713666 Lentivirus Species 0.000 claims description 14
- 238000007917 intracranial administration Methods 0.000 claims description 14
- 239000003550 marker Substances 0.000 claims description 14
- 230000000295 complement effect Effects 0.000 claims description 13
- 210000003527 eukaryotic cell Anatomy 0.000 claims description 12
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 claims description 10
- 239000000872 buffer Substances 0.000 claims description 10
- 241001529936 Murinae Species 0.000 claims description 9
- 241000124008 Mammalia Species 0.000 claims description 8
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 8
- 230000002401 inhibitory effect Effects 0.000 claims description 8
- 210000004962 mammalian cell Anatomy 0.000 claims description 8
- 102100027207 CD27 antigen Human genes 0.000 claims description 7
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 7
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 7
- 230000012010 growth Effects 0.000 claims description 7
- 238000011534 incubation Methods 0.000 claims description 7
- 241001529453 unidentified herpesvirus Species 0.000 claims description 7
- 241000283073 Equus caballus Species 0.000 claims description 6
- 206010059282 Metastases to central nervous system Diseases 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 6
- 238000009093 first-line therapy Methods 0.000 claims description 6
- 238000000746 purification Methods 0.000 claims description 6
- 239000000243 solution Substances 0.000 claims description 6
- 241000700588 Human alphaherpesvirus 1 Species 0.000 claims description 5
- 210000004102 animal cell Anatomy 0.000 claims description 5
- 238000001990 intravenous administration Methods 0.000 claims description 5
- 210000001236 prokaryotic cell Anatomy 0.000 claims description 5
- 102000009465 Growth Factor Receptors Human genes 0.000 claims description 4
- 108010009202 Growth Factor Receptors Proteins 0.000 claims description 4
- 238000002512 chemotherapy Methods 0.000 claims description 4
- 230000008472 epithelial growth Effects 0.000 claims description 4
- 239000007787 solid Substances 0.000 claims description 4
- 206010055113 Breast cancer metastatic Diseases 0.000 claims description 3
- 241000283086 Equidae Species 0.000 claims description 3
- 230000001394 metastastic effect Effects 0.000 claims description 3
- 206010061289 metastatic neoplasm Diseases 0.000 claims description 3
- 238000001356 surgical procedure Methods 0.000 claims description 3
- 238000001959 radiotherapy Methods 0.000 claims description 2
- 241000701161 unidentified adenovirus Species 0.000 claims description 2
- 241000283690 Bos taurus Species 0.000 claims 4
- 210000005260 human cell Anatomy 0.000 claims 4
- 238000011319 anticancer therapy Methods 0.000 claims 1
- 230000000973 chemotherapeutic effect Effects 0.000 claims 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims 1
- 238000009094 second-line therapy Methods 0.000 claims 1
- 238000009095 third-line therapy Methods 0.000 claims 1
- 238000011282 treatment Methods 0.000 abstract description 30
- 238000013459 approach Methods 0.000 abstract description 16
- 210000002865 immune cell Anatomy 0.000 abstract description 13
- 238000012546 transfer Methods 0.000 abstract description 6
- 230000001093 anti-cancer Effects 0.000 abstract description 2
- 230000036210 malignancy Effects 0.000 abstract description 2
- 238000010837 poor prognosis Methods 0.000 abstract description 2
- 102000001301 EGF receptor Human genes 0.000 description 243
- 108060006698 EGF receptor Proteins 0.000 description 242
- 230000014509 gene expression Effects 0.000 description 73
- 241000699670 Mus sp. Species 0.000 description 63
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 57
- 235000001014 amino acid Nutrition 0.000 description 51
- 229940024606 amino acid Drugs 0.000 description 47
- 235000018102 proteins Nutrition 0.000 description 44
- 102100025884 Zinc finger protein GLIS2 Human genes 0.000 description 34
- 210000001519 tissue Anatomy 0.000 description 32
- 241000700605 Viruses Species 0.000 description 28
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 27
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 26
- 238000003556 assay Methods 0.000 description 26
- 230000004083 survival effect Effects 0.000 description 24
- 241000699666 Mus <mouse, genus> Species 0.000 description 23
- 239000012636 effector Substances 0.000 description 23
- 125000003275 alpha amino acid group Chemical group 0.000 description 21
- 230000000694 effects Effects 0.000 description 21
- 230000003013 cytotoxicity Effects 0.000 description 20
- 231100000135 cytotoxicity Toxicity 0.000 description 20
- 238000001727 in vivo Methods 0.000 description 20
- 238000002474 experimental method Methods 0.000 description 19
- 208000032839 leukemia Diseases 0.000 description 19
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 18
- 238000000684 flow cytometry Methods 0.000 description 17
- 125000003729 nucleotide group Chemical group 0.000 description 17
- 201000010099 disease Diseases 0.000 description 16
- -1 ICOS Proteins 0.000 description 15
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 15
- 239000005089 Luciferase Substances 0.000 description 14
- 238000005516 engineering process Methods 0.000 description 14
- 238000000338 in vitro Methods 0.000 description 14
- 238000004806 packaging method and process Methods 0.000 description 14
- 239000006228 supernatant Substances 0.000 description 14
- 230000008685 targeting Effects 0.000 description 14
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 13
- 238000002965 ELISA Methods 0.000 description 13
- 208000032612 Glial tumor Diseases 0.000 description 13
- 206010018338 Glioma Diseases 0.000 description 13
- 108060001084 Luciferase Proteins 0.000 description 13
- 208000015181 infectious disease Diseases 0.000 description 13
- 239000012528 membrane Substances 0.000 description 13
- 108020004999 messenger RNA Proteins 0.000 description 13
- 239000002773 nucleotide Substances 0.000 description 13
- 210000000056 organ Anatomy 0.000 description 13
- 230000004913 activation Effects 0.000 description 12
- 230000008827 biological function Effects 0.000 description 12
- 230000001472 cytotoxic effect Effects 0.000 description 12
- 230000006870 function Effects 0.000 description 12
- 230000028327 secretion Effects 0.000 description 12
- 241001430294 unidentified retrovirus Species 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 241000894007 species Species 0.000 description 11
- 210000002784 stomach Anatomy 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 238000003501 co-culture Methods 0.000 description 10
- 239000003623 enhancer Substances 0.000 description 10
- 238000003364 immunohistochemistry Methods 0.000 description 10
- 230000019491 signal transduction Effects 0.000 description 10
- 238000010361 transduction Methods 0.000 description 10
- 230000004614 tumor growth Effects 0.000 description 10
- 102000001708 Protein Isoforms Human genes 0.000 description 9
- 108010029485 Protein Isoforms Proteins 0.000 description 9
- 210000003719 b-lymphocyte Anatomy 0.000 description 9
- 210000001185 bone marrow Anatomy 0.000 description 9
- 210000004698 lymphocyte Anatomy 0.000 description 9
- 230000035515 penetration Effects 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 230000001225 therapeutic effect Effects 0.000 description 9
- 230000003612 virological effect Effects 0.000 description 9
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 8
- 108091012583 BCL2 Proteins 0.000 description 8
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 8
- 238000004113 cell culture Methods 0.000 description 8
- 239000011651 chromium Substances 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 238000011081 inoculation Methods 0.000 description 8
- 230000000670 limiting effect Effects 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 239000002953 phosphate buffered saline Substances 0.000 description 8
- 238000010186 staining Methods 0.000 description 8
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 8
- 230000026683 transduction Effects 0.000 description 8
- 241000283707 Capra Species 0.000 description 7
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 7
- 241000725303 Human immunodeficiency virus Species 0.000 description 7
- 206010035226 Plasma cell myeloma Diseases 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 238000003757 reverse transcription PCR Methods 0.000 description 7
- 238000001890 transfection Methods 0.000 description 7
- 108090000331 Firefly luciferases Proteins 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 6
- 102100034343 Integrase Human genes 0.000 description 6
- 108010076504 Protein Sorting Signals Proteins 0.000 description 6
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 6
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 230000009089 cytolysis Effects 0.000 description 6
- 238000004090 dissolution Methods 0.000 description 6
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 6
- 201000000050 myeloid neoplasm Diseases 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 238000013518 transcription Methods 0.000 description 6
- 230000035897 transcription Effects 0.000 description 6
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 6
- 108091035707 Consensus sequence Proteins 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 108020004511 Recombinant DNA Proteins 0.000 description 5
- 108091093126 WHP Posttrascriptional Response Element Proteins 0.000 description 5
- 108010004469 allophycocyanin Proteins 0.000 description 5
- 238000005415 bioluminescence Methods 0.000 description 5
- 230000029918 bioluminescence Effects 0.000 description 5
- 239000007975 buffered saline Substances 0.000 description 5
- 150000001720 carbohydrates Chemical class 0.000 description 5
- 235000014633 carbohydrates Nutrition 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 230000001086 cytosolic effect Effects 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 108700004025 env Genes Proteins 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 210000000265 leukocyte Anatomy 0.000 description 5
- 244000005700 microbiome Species 0.000 description 5
- 210000000440 neutrophil Anatomy 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- 206010061598 Immunodeficiency Diseases 0.000 description 4
- 208000029462 Immunodeficiency disease Diseases 0.000 description 4
- 108060003951 Immunoglobulin Proteins 0.000 description 4
- 108010038807 Oligopeptides Proteins 0.000 description 4
- 102000015636 Oligopeptides Human genes 0.000 description 4
- 229930182555 Penicillin Natural products 0.000 description 4
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000000259 anti-tumor effect Effects 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 229910000389 calcium phosphate Inorganic materials 0.000 description 4
- 235000011010 calcium phosphates Nutrition 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 231100000433 cytotoxic Toxicity 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 4
- 230000008029 eradication Effects 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 4
- 239000010931 gold Substances 0.000 description 4
- 229910052737 gold Inorganic materials 0.000 description 4
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 4
- 230000007813 immunodeficiency Effects 0.000 description 4
- 102000018358 immunoglobulin Human genes 0.000 description 4
- 238000011503 in vivo imaging Methods 0.000 description 4
- 230000004068 intracellular signaling Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 229940049954 penicillin Drugs 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 229920001282 polysaccharide Polymers 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 210000000952 spleen Anatomy 0.000 description 4
- 229960005322 streptomycin Drugs 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 150000008163 sugars Chemical class 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 231100000057 systemic toxicity Toxicity 0.000 description 4
- 239000012096 transfection reagent Substances 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- 238000002054 transplantation Methods 0.000 description 4
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 4
- 230000002747 voluntary effect Effects 0.000 description 4
- 101710094648 Coat protein Proteins 0.000 description 3
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 241000713730 Equine infectious anemia virus Species 0.000 description 3
- 241000206602 Eukaryota Species 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 208000009889 Herpes Simplex Diseases 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 3
- 102000008100 Human Serum Albumin Human genes 0.000 description 3
- 108091006905 Human Serum Albumin Proteins 0.000 description 3
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102100034353 Integrase Human genes 0.000 description 3
- 102100037850 Interferon gamma Human genes 0.000 description 3
- 108010074328 Interferon-gamma Proteins 0.000 description 3
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 3
- 229930195725 Mannitol Natural products 0.000 description 3
- 241000714177 Murine leukemia virus Species 0.000 description 3
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 3
- 230000007402 cytotoxic response Effects 0.000 description 3
- 101150030339 env gene Proteins 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 210000002443 helper t lymphocyte Anatomy 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 230000002147 killing effect Effects 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 238000002826 magnetic-activated cell sorting Methods 0.000 description 3
- 239000000594 mannitol Substances 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 210000000581 natural killer T-cell Anatomy 0.000 description 3
- 229920001542 oligosaccharide Polymers 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 230000001124 posttranscriptional effect Effects 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 230000005855 radiation Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 150000005846 sugar alcohols Polymers 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 239000004474 valine Substances 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 2
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- 244000105975 Antidesma platyphyllum Species 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 2
- 241000167854 Bourreria succulenta Species 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- VYZAMTAEIAYCRO-BJUDXGSMSA-N Chromium-51 Chemical compound [51Cr] VYZAMTAEIAYCRO-BJUDXGSMSA-N 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 238000007399 DNA isolation Methods 0.000 description 2
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 2
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 2
- 108700024394 Exon Proteins 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 2
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 2
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 2
- 108010061833 Integrases Proteins 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 238000000719 MTS assay Methods 0.000 description 2
- 231100000070 MTS assay Toxicity 0.000 description 2
- 238000000636 Northern blotting Methods 0.000 description 2
- 238000010222 PCR analysis Methods 0.000 description 2
- 241000233805 Phoenix Species 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 108091008874 T cell receptors Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- 241001492404 Woodchuck hepatitis virus Species 0.000 description 2
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 2
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 2
- 210000000612 antigen-presenting cell Anatomy 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 210000005013 brain tissue Anatomy 0.000 description 2
- 210000000234 capsid Anatomy 0.000 description 2
- 230000020411 cell activation Effects 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000006037 cell lysis Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 235000019693 cherries Nutrition 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 238000002784 cytotoxicity assay Methods 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 2
- 108010078428 env Gene Products Proteins 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 238000012239 gene modification Methods 0.000 description 2
- 230000005017 genetic modification Effects 0.000 description 2
- 235000013617 genetically modified food Nutrition 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- KWIUHFFTVRNATP-UHFFFAOYSA-N glycine betaine Chemical compound C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 235000009424 haa Nutrition 0.000 description 2
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 238000001325 log-rank test Methods 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- VXYRWKSIAWIQMG-UHFFFAOYSA-K manganese(2+) N-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate triphenylstannyl acetate Chemical compound [Mn++].[S-]C(=S)NCCNC([S-])=S.CC(=O)O[Sn](c1ccccc1)(c1ccccc1)c1ccccc1 VXYRWKSIAWIQMG-UHFFFAOYSA-K 0.000 description 2
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 2
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 2
- 238000007431 microscopic evaluation Methods 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 230000003472 neutralizing effect Effects 0.000 description 2
- 238000007899 nucleic acid hybridization Methods 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 239000013600 plasmid vector Substances 0.000 description 2
- 108700004029 pol Genes Proteins 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 239000002336 ribonucleotide Substances 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- 102200033501 rs387907005 Human genes 0.000 description 2
- 238000007873 sieving Methods 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 210000001541 thymus gland Anatomy 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000012762 unpaired Student’s t-test Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- 239000000811 xylitol Substances 0.000 description 2
- 235000010447 xylitol Nutrition 0.000 description 2
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 2
- 229960002675 xylitol Drugs 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- CZWUESRDTYLNDE-UHFFFAOYSA-N (2z)-2-[(2e,4e,6e)-7-[1-(5-carboxypentyl)-3,3-dimethyl-5-sulfoindol-1-ium-2-yl]hepta-2,4,6-trienylidene]-1-ethyl-3,3-dimethylindole-5-sulfonate Chemical compound CC1(C)C2=CC(S([O-])(=O)=O)=CC=C2N(CC)\C1=C/C=C/C=C/C=C/C1=[N+](CCCCCC(O)=O)C2=CC=C(S(O)(=O)=O)C=C2C1(C)C CZWUESRDTYLNDE-UHFFFAOYSA-N 0.000 description 1
- 102000010400 1-phosphatidylinositol-3-kinase activity proteins Human genes 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- 125000001917 2,4-dinitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C(=C1*)[N+]([O-])=O)[N+]([O-])=O 0.000 description 1
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 1
- 125000000972 4,5-dimethylthiazol-2-yl group Chemical group [H]C([H])([H])C1=C(N=C(*)S1)C([H])([H])[H] 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- LIZDKDDCWIEQIN-UHFFFAOYSA-N 6-[2-[5-(3-ethyl-1,1-dimethyl-6,8-disulfobenzo[e]indol-2-ylidene)penta-1,3-dienyl]-1,1-dimethyl-6,8-disulfobenzo[e]indol-3-ium-3-yl]hexanoate Chemical compound C1=CC2=C(S(O)(=O)=O)C=C(S(O)(=O)=O)C=C2C(C2(C)C)=C1N(CC)\C2=C\C=C\C=C\C1=[N+](CCCCCC([O-])=O)C2=CC=C(C(=CC(=C3)S(O)(=O)=O)S(O)(=O)=O)C3=C2C1(C)C LIZDKDDCWIEQIN-UHFFFAOYSA-N 0.000 description 1
- 102100031126 6-phosphogluconolactonase Human genes 0.000 description 1
- 108010029731 6-phosphogluconolactonase Proteins 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 101500002116 Agrotis ipsilon Tachykinin-related peptide 6 Proteins 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- NTTIDCCSYIDANP-UHFFFAOYSA-N BCCP Chemical compound BCCP NTTIDCCSYIDANP-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 101710201279 Biotin carboxyl carrier protein Proteins 0.000 description 1
- 101710180532 Biotin carboxyl carrier protein of acetyl-CoA carboxylase Proteins 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 102100035793 CD83 antigen Human genes 0.000 description 1
- 102100037904 CD9 antigen Human genes 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 102100025466 Carcinoembryonic antigen-related cell adhesion molecule 3 Human genes 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 241000254173 Coleoptera Species 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 102100031673 Corneodesmosin Human genes 0.000 description 1
- 206010011732 Cyst Diseases 0.000 description 1
- GUBGYTABKSRVRQ-CUHNMECISA-N D-Cellobiose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-CUHNMECISA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 101100278318 Dictyostelium discoideum dohh-2 gene Proteins 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 101150039808 Egfr gene Proteins 0.000 description 1
- 102000009024 Epidermal Growth Factor Human genes 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 101710177291 Gag polyprotein Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 206010056740 Genital discharge Diseases 0.000 description 1
- 241000713813 Gibbon ape leukemia virus Species 0.000 description 1
- 101100118916 Gibbon ape leukemia virus env gene Proteins 0.000 description 1
- 101100282052 Gibbon ape leukemia virus gag gene Proteins 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- 108010018962 Glucosephosphate Dehydrogenase Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000700586 Herpesviridae Species 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 description 1
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 description 1
- 101000914337 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 3 Proteins 0.000 description 1
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101001032602 Homo sapiens Homeobox protein goosecoid Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000617823 Homo sapiens Solute carrier organic anion transporter family member 6A1 Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 1
- 241000282620 Hylobates sp. Species 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 235000003332 Ilex aquifolium Nutrition 0.000 description 1
- 241000209027 Ilex aquifolium Species 0.000 description 1
- 101710203526 Integrase Proteins 0.000 description 1
- 102100025390 Integrin beta-2 Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 238000010824 Kaplan-Meier survival analysis Methods 0.000 description 1
- 238000012313 Kruskal-Wallis test Methods 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 101710125418 Major capsid protein Proteins 0.000 description 1
- 229920002774 Maltodextrin Polymers 0.000 description 1
- 239000005913 Maltodextrin Substances 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102100024193 Mitogen-activated protein kinase 1 Human genes 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 101000946846 Mus musculus T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 230000006051 NK cell activation Effects 0.000 description 1
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 241000772415 Neovison vison Species 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 1
- 241001195348 Nusa Species 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 108091007960 PI3Ks Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000002151 Pleural effusion Diseases 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000713711 Primate lentivirus group Species 0.000 description 1
- 229940096437 Protein S Drugs 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 238000011530 RNeasy Mini Kit Methods 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 101000946847 Rattus norvegicus T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 108091081062 Repeated sequence (DNA) Proteins 0.000 description 1
- 206010038997 Retroviral infections Diseases 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 241000713880 Spleen focus-forming virus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 206010042971 T-cell lymphoma Diseases 0.000 description 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- GYDJEQRTZSCIOI-UHFFFAOYSA-N Tranexamic acid Chemical compound NCC1CCC(C(O)=O)CC1 GYDJEQRTZSCIOI-UHFFFAOYSA-N 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108700029229 Transcriptional Regulatory Elements Proteins 0.000 description 1
- 101710195626 Transcriptional activator protein Proteins 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 108091023045 Untranslated Region Proteins 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 108010031318 Vitronectin Proteins 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 230000009831 antigen interaction Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 238000000594 atomic force spectroscopy Methods 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- CXQCLLQQYTUUKJ-ALWAHNIESA-N beta-D-GalpNAc-(1->4)-[alpha-Neup5Ac-(2->8)-alpha-Neup5Ac-(2->3)]-beta-D-Galp-(1->4)-beta-D-Glcp-(1<->1')-Cer(d18:1/18:0) Chemical compound O[C@@H]1[C@@H](O)[C@H](OC[C@H](NC(=O)CCCCCCCCCCCCCCCCC)[C@H](O)\C=C\CCCCCCCCCCCCC)O[C@H](CO)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@]2(O[C@H]([C@H](NC(C)=O)[C@@H](O)C2)[C@H](O)[C@@H](CO)O[C@]2(O[C@H]([C@H](NC(C)=O)[C@@H](O)C2)[C@H](O)[C@H](O)CO)C(O)=O)C(O)=O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](CO)O1 CXQCLLQQYTUUKJ-ALWAHNIESA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004791 biological behavior Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002737 cell proliferation kit Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000007969 cellular immunity Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000012707 chemical precursor Substances 0.000 description 1
- 108700010039 chimeric receptor Proteins 0.000 description 1
- 102000021178 chitin binding proteins Human genes 0.000 description 1
- 108091011157 chitin binding proteins Proteins 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000012881 co-culture medium Substances 0.000 description 1
- 238000012761 co-transfection Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 238000007398 colorimetric assay Methods 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 238000011443 conventional therapy Methods 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000013501 data transformation Methods 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 231100000676 disease causative agent Toxicity 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 231100000276 dose-dependent cytotoxicity Toxicity 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 206010014599 encephalitis Diseases 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 238000000574 gas--solid chromatography Methods 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 230000004022 gliogenesis Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 208000035474 group of disease Diseases 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 210000002861 immature t-cell Anatomy 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 230000000297 inotrophic effect Effects 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 101150066555 lacZ gene Proteins 0.000 description 1
- 239000000832 lactitol Substances 0.000 description 1
- 235000010448 lactitol Nutrition 0.000 description 1
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 1
- 229960003451 lactitol Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 239000000845 maltitol Substances 0.000 description 1
- 235000010449 maltitol Nutrition 0.000 description 1
- VQHSOMBJVWLPSR-WUJBLJFYSA-N maltitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-WUJBLJFYSA-N 0.000 description 1
- 229940035436 maltitol Drugs 0.000 description 1
- 229940035034 maltodextrin Drugs 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 210000001806 memory b lymphocyte Anatomy 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000037230 mobility Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 230000016864 negative regulation of biological process Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 230000007171 neuropathology Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 238000012858 packaging process Methods 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 230000003071 parasitic effect Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 108010089520 pol Gene Products Proteins 0.000 description 1
- 101150088264 pol gene Proteins 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000016919 positive regulation of biological process Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 208000030266 primary brain neoplasm Diseases 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 210000003370 receptor cell Anatomy 0.000 description 1
- 239000013074 reference sample Substances 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 108020004418 ribosomal RNA Proteins 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 102220192602 rs145106685 Human genes 0.000 description 1
- 235000002020 sage Nutrition 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000008054 signal transmission Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- JGVWCANSWKRBCS-UHFFFAOYSA-N tetramethylrhodamine thiocyanate Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=C(SC#N)C=C1C(O)=O JGVWCANSWKRBCS-UHFFFAOYSA-N 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 239000003106 tissue adhesive Substances 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000005641 tunneling Effects 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- OPUPHQHVRPYOTC-UHFFFAOYSA-N vgf3hm1rrf Chemical compound C1=NC(C(=O)C=2C3=CC=CN=2)=C2C3=NC=CC2=C1 OPUPHQHVRPYOTC-UHFFFAOYSA-N 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000012447 xenograft mouse model Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001103—Receptors for growth factors
- A61K39/001104—Epidermal growth factor receptors [EGFR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4613—Natural-killer cells [NK or NK-T]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464403—Receptors for growth factors
- A61K39/464404—Epidermal growth factor receptors [EGFR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0646—Natural killers cells [NK], NKT cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/80—Vaccine for a specifically defined cancer
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Mycology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Hematology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Oncology (AREA)
- Dermatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- Developmental Biology & Embryology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
교아종(GB)은 가장 적극적 원발성 뇌 악성종양이고; 뇌 전이, 예를 들면, 유방암 뇌 전이(BCBM)는 또한 공격적이고 불량한 예후와 연관되어 있다. 키메라 항원 수용체(CAR)-변형된 면역 세포의 양자 전이는 유망한 항암 접근법으로 부상되었지만, 여전히 뇌암을 치료하기 위한 CAR-조작된 세포의 잠재적 유용성은 검토되어 있지 않았다. 본 발명은 뇌암, 예를 들면, GB 및 BCBM을 포함하는 다양한 암의 치료에서 CAR 발현 세포를 사용하는 조성물 및 방법을 제공한다.
Description
관련 출원의 상호-참조
본 출원은 2015년 4월 6일자로 출원된 미국 가출원 제62/143,744호에 대한 35 U.S.C. § 119(e) 하의 우선권을 주장하고, 이의 내용은 이의 전체가 본원에서 참조로서 도입된다.
배경기술
뇌암은 위험하고 치료가 곤란하다. 교아세포종(glioblastoma: GB)은 가장 통상적 및 가장 적극적 원발성 뇌 종양이다. 뇌의 암은 또한 또 다른 공급원으로부터 전이의 결과인 경우에 위험을 갖고; 예를 들면, 유방암뇌 전이(BCBM)은 전이성 유방암을 갖는 환자에서 통상적이다. 화학요법, 방사선 및 외과수술 절제에 의해서도, GB 환자의 전체 중앙 생존기간은 단지 14.6개월이다[참조: Morgan, R.A. et al. (2012) Hum Gene Ther. 23:1043-1053]. BCBM은 또한 이용가능한 치료에 대해 고도로 내성이고, 환자의 불량한 예후를 나타낸다. 종래의 치료법은 일반적으로 특이성을 결여하고, 주변 뇌 실질 및 전신 조직에 대한 손상, 이들의 사용을 제한하는 인자를 유발할 수 있다[참조: Imperato, J.P. et al. (1990) Ann Neurol. 28:818-822]. GB에 대한 면역-기반 요법은 국재화된 및 종양 침윤 세포 둘 다를 표적화할 가능성이 있는, 지속가능한 항-종양 반응의 잠재적 장기간 잇점이 있는 종래 치료법에 대한 유망한 대체물이다[참조: Mellman, I. et al. (2011) Nature 480:480-489]. 상피 성장 인자 수용체(Epidermal Growth Factor Receptor: EGFR)는 GB를 포함하는 다양한 종양에서 중요한 역할을 담당한다. EGFR은 GB에서 가장 빈번하게 증폭된 유전자이고, 정상 뇌 조직에서 이의 발현은 검출 불가능하거나 극히 낮다[참조: Parsons, D.W. et al. (2008) Science 321:1807-1812; Salomon, D.S. et al. (1995) Crit. Rev Oncol Hematol. 19:183-232]. EGFR에 대한 리간드의 결합은 수용체 호모- 및 헤테로이량체 형성을 유도하고, 몇몇 중요한 티로신 잔기의 자가포스포릴화는 Ras/Raf/MEK/ERK 경로, PLCγ-PKC 경로 및 PI3K/AKT 경로를 포함하는 몇몇 세포내 하류 신호전달 경로의 활성화를 유도하여 세포 증식, 운동성 및 생존을 제공한다[참조: Zandi, R. et al. (2007) Cell Signal 19:2013-2023]. 대략 20-40%의 EGFR-증폭된 종양은 EGFR 변이체 III 돌연변이체(EGFRvIII)를 포함하고, 이는 세포외 리간드-결합 도메인에서 엑손 2-7의 결실을 함유한다[참조: Aldape, K.D. et al. (2004) Journal of Neuropathology and Experimental Neurology 63:700-707; Biernat, W. et al. (2004) Brain Pathol. 14:131-136; Fan, Q.W. et al. (2013) Cancer Cell 24:438-449; Sugawa, N. et al. (1990) Proc Natl Acad Sci. USA 87:8602-8606]. 이러한 돌연변이체 형태는 종양-촉진 신호전달 경로를 활성화하는 리간드의 부재하에 구조적 활성화를 나타낸다[참조: Ohno, M. et al. (2010) Cancer Sci. 101:2518-2524].
교아세포종(GB)은 가장 적극적 원발성 뇌 악성종양이다. 키메라 항원 수용체(CAR)-변형된 면역 세포의 양자 전이는 유망한 항암 접근법으로 부상하고 있지만, GB를 치료하기 위한 CAR-조작된 천연 킬러(NK) 세포의 잠재적 유용성은 연구되어 있지 않다. 대략 50%의 GB 환자의 종양은 야생형 EGFR(wt EGFR)을 발현하고, 소수의 경우에는 wtGFFR 및 돌연변이체 형태 EGFRvIII을 발현하지만; 이전에 보고된 CAR T 세포는 단지 EGFRvIII의 표적화에 초점을 맞추고 있다.
본 발명의 양태는, (a) 항원 결합 도메인; (b) 힌지 도메인; (c) 막관통 도메인; 및 (d) 세포내 도메인을 포함하는 키메라 항원 수용체(CAR)에 관한 것이다. 이러한 발명은, (a) 야생형 및/또는 돌연변이체 상피 성장 인자 수용체(EGFR)("wt EGFR 및 돌연변이체 EGFR") 둘 다를 인식하는 항-EGFR 항체의 항원 결합 도메인; (b) 힌지 도메인 폴리펩티드; (c) 공자극 폴리펩티드; 및 (d) CD3 제타(zeta) 신호전달 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어지는, 신규한 CAR-상피 성장 인자 수용체("EGFR") 키메라 항원 수용체(CAR)를 제공한다. 한 가지 양태에서, 공자극 분자는 세포내 도메인 및 막관통 도메인을 포함한다. 비-제한적 예는 CD8, 4-1BB 공자극 신호전달 영역, CD28 공자극 분자, OX40, ICOS 및 CD27을 포함한다. 한 가지 양태에서, 항-EGFR 항체의 항원 결합 도메인은 항-EGFR 중쇄(HC) 가변 영역 및 항-EGFR 경쇄(LC) 가변 영역을 포함한다. 추가의 양태에서, EGFR CAR은 항-EGFR HC 가변 영역 및 항-EGFR LC 가변 영역 사이에 위치된 링커 폴리펩티드를 추가로 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다.
EGFR CAR을 코딩하는 폴리뉴클레오티드 및 이들의 상보체 및 각각의 등가물이 추가로 본원에 개시되어 있다. 폴리뉴클레오티드 및/또는 EGFR CAR을 함유하는 벡터 및 숙주 세포가 본원에서 제공된다. 벡터는 플라스미드 또는 벡터이다. 세포는 원핵세포 또는 진핵세포일 수 있다. 한 가지 양태에서, 세포는 T 세포 또는 NK 세포이다. 세포는 확장될 수 있고, 따라서 세포의 확장된 모집단이 본원에서 추가로 제공된다. 세포는, 한 가지 양태에서, T 세포 등의 세포의 활성화된 모집단이다.
이들 조성물의 진단적 및 치료적 용도가 본원에서 추가로 제공된다. 예를 들면, 이들 세포를 본원에 기재된 바와 같은 EGFR CAR을 포함하는 유효량의 단리된 세포와 접촉시킴으로써 wt EGFR 또는 돌연변이체 EGFR, 또는 wt EGFR 및 돌연변이체 EGFR을, EGFR을 발현하는 세포 또는 줄기 세포의 표면 상에서 발현하는 세포 및/또는 종양의 하나 이상의 성장을 억제시키는 방법이 제공된다. 세포는 종양 세포, 예를 들면, 교아세포종 또는 암 줄기 세포, 예를 들면, 교아세포종 줄기 세포일 수 있다. 접촉은 시험관내 또는 생체내일 수 있다. 시험관내에서 실시하는 경우, 상기 방법은 신규한 요법 또는 병용 요법을 위한 스크리닝에 유용하다. 생체내에서, 상기 방법은 EGFR을 발현하는 암, 예를 들면, 뇌암, 예를 들면, 교아세포종 또는 뇌에서 또 다른 암(예: 유방암)의 전이를 앓고 있는 환자의 치료에 유용하다.
또 다른 양태에서, 본 발명은, EGFR 또는 돌연변이체 EGFR, 또는 wt EGFR 및 돌연변이체 EGFR을 이를 필요로 하는 대상체의 세포 표면 상에서 발현하는 하나 이상의 세포의 성장을 억제시키는 방법을 제공한다. 이 방법은, 본원에 기재된 바와 같은 EGFR CAR을 포함하는 유효량의 단리된 세포를 대상체에게 투여하는 것을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다. EGFR을 발현하는 세포는 종양 세포 또는 암 줄기 세포, 예를 들면, 교아세포종 또는 교아세포종 줄기 세포일 수 있다. EGFR CAR을 발현하는 단리된 세포는 상기 세포를 수용하는 대상체에 대해 자기유래(autologous)일 수 있다. 추가로, 본원에 기재된 바와 같은 EGFR CAR을 포함하는 유효량의 단리된 세포를 대상체에게 투여함으로써, 이를 필요로 하는 대상체에서 암을 치료하는 방법(여기서, 상기 암 세포는 wt EGFR 또는 돌연변이체 EGFR, 또는 wt EGFR 및 돌연변이체 EGFR을 발현한다)이 제공된다. 이들 방법의 단리된 세포는 NK 세포 및/또는 T-세포일 수 있고, 치료되는 대상체에 대해 자기유래일 수 있다. 추가의 양태에서, 세포는, 치료하는 의사에 의해 결정되는 임의의 적절한 경로에 의해 투여되고, 제한 없이, 두개내 주사, 정맥내 투여를 포함한다.
추가로, 본원에 기재된 EGFR CAR 및 EGFR 단백질 또는 이의 단편 및/또는 돌연변이체 EGFR 단백질 또는 이의 단편을 포함하는 단리된 복합체가 제공된다. 또 다른 양태에서, 본원에 기재된 바와 같은 EGFR CAR을 포함하는 단리된 복합체, 및 wt EGFR 또는 돌연변이체 EGFR, 또는 wt EGFR 및 돌연변이체 EGFR을 발현하는 세포가 제공된다.
본 발명의 추가의 양태는, 본원에 기재된 EGFR CAR 발현 세포, 예를 들면, T 세포 또는 NK 세포, 및 종양용해성 단순 헤르페스 바이러스를 사용한 조성물 및 병용 암 요법에 관한 것이다. 일부 실시형태는, EGFR CAR 발현 세포 및 종양용해성 헤르페스 심플렉스 둘 다를 이를 필요로 하는 환자에게 투여하는, 종양 또는 암의 치료 방법에 관한 것이다. 일부 실시형태에서, EGFR CAR 발현 세포는 종양용해성 단순 헤르페스 바이러스와 동시에 투여되고; 다른 실시형태에서, EGFR CAR 발현 세포는 종양용해성 단순 헤르페스 바이러스의 투여 전후에 투여된다.
하나 이상의 상기 조성물을 포함하는 키트가 추가로 제공된다. 이들을 진단학적으로 또는 치료학적으로 사용하는 지침이 추가로 제공된다.
도 1A-1B는 GB 및 GB 줄기 세포 상에서 EGFR의 발현을 나타낸다. (도 1A) 신경교종(glioma) 세포주(U251, LN229 및 Gli36dEGFR) 및 신경교종 줄기 세포(GB30, GB83, GB326, GB1123, GB84V3SL, GB157V3SL 및 GB19) 상에서 표면 EGFR 발현은 유세포 계수법에 의해 모니터링했다. NK 세포주 NKL 및 NK-92를 음성 대조군으로 사용한다. (도 1B) 도 1A에 명시된 신경교종 세포주 및 신경교종 줄기 세포에서 RT-PCR에 의한 EGFR mRNA 발현의 측정. 유동 플롯 및 데이터는 3개 독립적 실험의 대표예이다.
도 2A-2B는 EGFR-특이적 CAR의 생성 및 CAR-형질도입된 NK 세포 상에서 이의 발현의 검출을 나타낸다. (도 2A) EGFR-CAR 렌티바이러스 작제물의 모식도. (도 2B) EGFR-CAR 작제물(각각 NK-92-EGFR-CAR 및 NKL-EGFR-CAR) 또는 공 벡터 작제물(EV)로 형질도입된 NK-92 및 NKL 세포의 표면 상에서 키메라 EGFR scFv의 발현. 세포를 GFP 발현에 의해 FACS-분류하고, 이어서 세포를 항-마우스 Fab 항체(실선) 또는 IgG 이소형 대조군(점선)으로 염색한 후에 유세포 계수에 의해 분석했다. SP, 신호 펩티드; VH, 중쇄; VL, 경쇄; ScFv, 단일 사슬 가변 단편. 유동 플롯 및 데이터는 3개 독립적 실험의 대표예이다.
도 3A-3B는 EGFR-CAR-변형된 NK-92 및 NKL 세포가 EGFR+ GB 세포주 세포를 인식하고 사멸시키는 것을 나타낸다. (도 3A) 표준 크롬-51 방출 검정을 사용하여 Gli36dEGFR, LN229 또는 U251에 대한 공 벡터(EV)-형질도입된 NK-92 및 NKL 세포의 세포독성 활성. (도 3B) ELISA 검정을 사용하여 Gli36dEGFR, LN229 또는 U251 세포의 부재 또는 존재하에 공 벡터 EV-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 및 NKL 세포의 IFN-γ 방출. 3개 독립적 실험의 대표적 데이터가 제시되어 있다. *p < 0.05; **p < 0.01.
도 4A-4B는 EGFR-CAR-변형된 NK-92 및 NKL 세포가 EGFR+ GB 줄기 세포의 증강된 용해를 나타냄을 보여준다. (도 4A) 크롬-51 방출 검정을 사용하여 GB1123, GB30, GB157V3SL 및 GB84V3SL GB 줄기 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR 세포(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR 세포(하부 패널)의 세포독성 활성. (도 4B) GB 줄기 세포와 공-배양하는 경우, NK-92-EGFR-CAR 또는 NK-92-EV 세포(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR 세포(하부 패널)에 의한 IFN-γ 분비의 ELISA 분석. 3개 독립적 실험의 대표적 데이터가 제시되어 있다. *p < 0.05; **p < 0.01.
도 5A-5C는 NK-92-EGFR-CAR 세포의 증강된 표적 인식이 세포 표면 상에서 EGFR의 발현에 의존적임을 나타낸다. (도 5A) 공 벡터 또는 wt EGFR 또는 EGFRvIII을 함유하는 벡터로 형질감염시킨 GB19 세포의 표면 상에서 EGFR 발현을 검출하기 위해 항-EGFR 항체(실선) 또는 IgG 이소형 대조군(점선)을 사용한 유세포 계수. (도 5B) 도 5A에 제시된 GB19, GB19-wt EGFR 및 GB19-EGFRvIII 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR(하부 패널)의 세포독성. GB19 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율로 NK-92 또는 NKL 세포와 함께 배양했다. 종양 용해는 크롬-51 방출 검정을 사용하여 측정했다. (도 5C) NKL-EV 또는 NKL-EGFR-CAR(좌측) 및 NK-92-EGFR-CAR 또는 NK-92-EV 세포(우측)을 24시간 동안 동일한 수의 GB19-벡터 또는 GB19-EGFR 세포와 함께 배양했다. 이어서, 상청액은 ELISA를 사용하여 IFN-γ 분비의 측정을 위해 수집했다. 유동 플롯 및 데이터는 3개 독립적 실험의 대표예이다. *p < 0.05, **p < 0.01.
도 6A-6E는 NK-92-EGFR-CAR 세포가 동소성 인간 신경교종 줄기 세포의 생체내 성장을 억제하고 교아세포종-함유 마우스의 생존을 연장시키고 기타 기관 및 조직으로 이행하지 않고서 뇌에서 국지화하는 것을 나타낸다. (도 6A) GB30 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스를 정립 주사에 의해 루시퍼라제-발현 GB30 세포로 접종시켰다(0일). 접종 7일 후, 마우스를 공 벡터-형질도입된 NK-92 세포(NK-92-EV), EGFR-CAR-형질도입된 NK-92 세포(NK-92-EGFR-CAR) 또는 행크 평형 염 용액(HBSS; 음성 대조군)으로 1회 두개내 주입했다. (도 6B) 도 6A의 마우스당 초당 양자 단위의 정량화 요약. *는 p < 0.05를 나타낸다. (도 6C) NK-92-EGFR-CAR 세포로 처리된 GB30-담지 마우스는, 카플란-마이어(Kaplan-Meier) 생존 곡선에 의해 측정하는 경우, NK-92-EV 세포 또는 HBSS(** p < 0.01)와 비교하여 현저히 증가된 전체 생존을 나타냈다(각 그룹에 대해 n = 5). (도 6D) GB30-담지 마우스 내로 CAR NK 세포의 두개내 주사 3일 후에 간, 폐, 혈액, 비장, 골수(BM) 및 뇌에서 유세포 계수법에 의해 CD56+CD3- 인간 EGFR-CAR NK-92 세포의 존재의 측정. (도 6E) GB30-담지 마우스 내로 CAR NK 세포의 두개내 주사 3일 후에 간, 폐, 혈액, 비장, 골수(BM) 및 뇌에서 RT-PCR에 의해 EGFR-CAR 발현의 측정. NC = 음성 대조군(DNA 주형을 첨가하지 않음); PC = 양성 대조군, EGFR-CAR NK-92 세포. *p < 0.05, **p < 0.01.
도 7A-7C는 EGFR-CAR-형질도입된 NK-92 세포가 wt EGFR-발현 GB 종양 성장을 억제시키고 동소성 이종이식 GB 모델에서 종양-담지 마우스의 생존을 연장시키는 것을 나타낸다. (도 7A) U251 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스에게 정립 주사(0일)에 의해 105 루시퍼라제-발현 U251 세포를 두개내 이식했다. 접종 10일, 40일 및 70일 후, 마우스에게 NK-92-EV 세포, NK-92-EGFR-CAR 세포 또는 음성 대조군으로서 HBSS를 두개내 주입했다. 마우스의 뇌 생물발광 이미지를 100일에 촬영했다. (도 7B) 도 7A로부터의 마우스당 초당 양자 단위의 정량화 요약. **는 p < 0.01을 나타낸다. (도 7C) NK-92-EGFR-CAR 세포로 처리된 U251-담지 마우스는, 카플란-마이어 생존 곡선에 의해 측정하는 경우, EK-92-EV 세포(* p < 0.05) 또는 HBSS(** p < 0.01)로 처리한 마우스와 비교하여 현저히 증가된 전체 생존을 나타낸다(각 그룹에 대해 n = 5).
도 8A-8B는 EGFR-CAR 일차 NK 세포가 EGFR+ GB 세포 및 환자-유래 GB 줄기 세포의 증강된 근절을 나타냄을 보여준다. (도 8A) 위-형질도입된 일차 NK 세포(일차 NK-EV)와 비교하여 EGFR+ Gli36dEGFR 및 U251 GB 세포주에 대해 증가된 세포독성 활성을 나타낸 EGFR-CAR-변형된 일차 NK 세포(일차 NK-CAR). (도 8B) 위-형질도입된 일차 NK 세포(일차 NK-EV)와 비교하여 EGFR+-환자-유래된 GB30 및 GB157V3SL 줄기 세포에 대해 증강된 세포독성을 나타낸 EGFR-CAR-변형된 NK 세포(일차 NK-CAR). 제시된 데이터는, 상이한 건강한 공여체로부터 단리한 NK 세포를 조사한, 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01.
도 9A-9C는 NK-92-EGFR-CAR 세포의 증강된 표적 인식이 세포 표면 상에서 EGFR의 발현에 의존적임을 나타낸다. (도 9A) 공 벡터(EV; 좌측), wt EGFR(중앙) 또는 EGFRvIII(우측)으로 형질도입된 293T 세포의 항-EGFR 항체(실선) 또는 IgG 이소형 대조군(점선)을 사용한 유세포 계수 분석. (도 9B) 293T-EV(좌측), 293T-EGFR(중앙) 및 293T-EGFRvIII(우측) 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR(하부 패널)의 세포독성. 293T 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율에서 NK 세포와 함께 배양했다. 종양 용해는 크롬-51 방출 검정을 사용하여 측정했다. (도 9C) 24시간 동안 표적 세포 및 효과기 세포의 공배양 후, 공-배양물로부터의 상청액은 ELISA를 사용하여 IFN-γ 분비에 대해 측정했다. 제시된 데이터는 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01.
도 10A-10B는 NK-92-EGFR-CAR 세포의 효과가 EGFR 차단 항체(Ab)에 의해 둔화되는 것을 나타낸다. (도 10A) EGFR-특이적 모노클로날 항체 528 또는 IgG-정합 이소형 대조군 항체로 전처리한 GB30 세포(좌측) 또는 U251 세포(우측)에 대한 NK-92-EV 또는 NK-92-EGFR-CAR의 세포독성. 표적 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율에서 전처리된 NK-92-EV 또는 NK-92-EGFR-CAR 세포와 함께 배양했다. (도 10B) 24시간 동안 표적 세포 및 효과기 세포의 공-배양 후, 공-배양물로부터의 상청액은 ELISA를 사용하여 IFN-γ 분비에 대해 측정했다. 제시된 데이터는 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01. Ab= EGFR-특이적 모노클로날 항체 528; 이소= IgG-정합된 이소형 대조군 항체.
도 11은 NK-92-EGFR-CAR 세포가 종양내 주사 후에 종양 영역에 위치되어 있음을 나타낸다. NK-92-EGFR-CAR 세포를 GB30 이식 7일 후에 마우스 뇌에 종양내 주사했다. 마우스 뇌를 3일 후에 수거하고, 파라핀으로 매립하고, 헤마톡실린 및 에오신(H&E) 염색을 위해 처리했다. H&E 염색은 NK-92-EGFR-CAR 세포가 유일하게 종양 영역 내부에 존재했음을 나타냈다. 20×, 40× 및 100×의 확대가 제시되었다(물체: 2×, 4× 또는 10×; 접안렌즈: 10X).
도 12A-12B는 유방암 세포주 및 조직에서 EGFR의 발현을 나타낸다. 유방암 세포주(MDA-MB-231, MDA-MB-468 및 MCF-7)의 세포 표면 상에서 EGFR의 발현은 유세포 계수에 의해 검출했다(도 12A). 헤마톡실린 및 에오신(HE) 염색 및 EGFR 발현의 면역조직화학(IHC)은 일차 유방암 및 뇌 전이를 갖는 환자의 종양 조직에 대해 수행했다(도 12B).
도 13A-13E은 EGFR-CAR NK-92 세포가 유방암 세포주의 EGFR 양성 세포를 인식하고 이를 용해하는 것을 입증한다. EGFR-CAR-형질도입된 NK-92 세포 상에서 EGFR scFv의 발현은 염소 항-마우스 F(ab')2 폴리클로날 항체를 사용한 유세포 계수법에 의해 측정했다(도 13A). MDA-MB-231, MDA-MB-468 또는 MCF-7 세포의 부재 또는 존재하에 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 세포에 의한 IFN-γ 방출은 표준 ELISA 검정을 사용하여 측정했다. **P < 0.01 (도 13B). MDA-MB-231(도 13C), MDA-MB-468(도 13D) 또는 MCF-7(도 13E) 세포에 대한 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 세포의 세포독성 활성은 표준 크롬-51 방출 검정을 사용하여 수행했다. (E, 효과 세포; T, 표적 세포)
도 14A-14D는, EGFR+ 유방암 세포로 자극시키는 경우, EGFR-CAR 일차 NK 세포의 증강된 세포독성 및 INF-γ 생성을 나타낸다. MDA-MB-231, MDA-MB-468 또는 MCF-7 세포의 부재 또는 존재하에 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 일차 NK 세포에 의한 IFN-γ 방출은 표준 ELISA 검정을 사용하여 측정했다(도 14A). MDA-MB-231(도 14B), MDA-MB-468(도 14C) 또는 MCF-7(도 14D) 세포에 대한 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 일차 NK 세포의 세포독성 활성은 표준 크롬-51 방출 검정을 사용하여 수행했다. (E, 효과 세포; T, 표적 세포)
도 15A-15C는, oHSV-1 단독이 유방암 세포주 종양 세포를 용해 및 근절시킬 수 있음을 나타낸다. 48시간 동안 공-배양 후, 유방암 세포주(MDA-MB-231, MDA-MB-468 또는 MCF-7)에 대한 oHSV-1의 용량-의존적 세포독성은 MTS에 의해 검출되었다. *P < 0.05; **P < 0.01(도 15A). 도 15B는, 상이한 기간 동안 이들의 공-배양 후, 유방암 세포주, 즉 MDA-MB-231, MDA-MB-468 또는 MCF-7에 대한 oHSV-1 세포독성의 MTS 검정을 나타낸다. 도 15C는 MDA-MB-231-CBRluc-EGFP 세포 및 oHSV-1의 공-배양 배지에서 루시퍼라제 수준의 측정을 나타낸다.
도 16A-16B는 EGFR-CAR NK-92 세포 및 oHSV-1의 병용 치료가 시험관내에서 유방암 종양 세포의 보다 효율적 근절을 제공하는 것을 나타낸다. 종양 세포를 CAR 세포 단독, oHSV-1 단독, 4시간 동안 EGFR-CAR NK-92 세포, 이어서 oHSV-1(CAR + oHSV), 또는 4시간 동안 oHSV, 이어서 EGFR-CAR NK-92 세포(oHSV + CAR)로 처리했다. CBRluc-EGFP를 발현하는 MDA-MB-231 종양 세포의 근절은 상이한 시점에서 상청액으로 루시퍼라제 방출에 의해 측정했다(도 16A). 순서와 무관하게, oHSV-1(CAR + oHSV 또는 oHSV + CAR)와 조합된 EGFR-CAR NK-92 세포는, 공-배양 4일 후에 MDA-MB-231-CBRluc-EGFP 세포에 잔류하는 루시퍼라제의 상대 광 단위에 의해 측정된 바와 같이, EGFR-CAR NK-92 세포 단독(CAR) 또는 oHSV-1 단독(oHSV)보다 많은 MDA-MB-231 종양 세포를 근절시켰다. **P < 0.01(도 16B). 데이터는 3개 독립적 실험의 대표예이다.
도 17A-17B는 EGFR-CAR 형질도입된 NK-92 세포가 종양-담지 마우스의 연장된 생존과 함께 MDA-MB-231 종양 성장을 억제시키는 것을 나타낸다. BCBN 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스에게 정립 주사에 의해 MDA-MB-231-CBRluc-EGFP 세포를 접종시켰다(0일). 접종 10일 후, 마우스에게 EGFR-CAR NK-92, oHSV-1, NK-92-EV 또는 HBSS를 1회 두개내 주입했다. 조합 처리 그룹의 마우스에게 15일에 oHSV-1을 주사했다. MDA-MB-231-CBRluc-EGFP 세포를 사용한 접종 4주 후에, 마우스에게 D-루시페린을 복강내 주입하고, 생체내 이미지 시스템을 사용하여 이미지화했다(도 17A). MDA-MB-231-CBRluc-EGFP 종양-담지 마우스에게 EGFR-CAR NK-92 세포, 이어서 oHSV-1 주사(CAR + oHSV), EGFR-CAR NK-92 세포 단독(CAR), oHSV-1 단독 또는 HBSS 대조군으로 종양내 처리했다. 그 결과, oHSV-1 주사를 수반한 EGFR-CAR NK-92 세포는, 카플란-마이어 생존 곡선에 의해 측정된 바와 같이, 나머지 처리보다 현저히 증가된 전체 생존을 나타냈다(각 그룹에 대해 n = 5)(도 17B).
도 18은 인간 일차 NK 세포에서 렌티바이러스의 형질도입 효율을 나타낸다. GFP(+) 세포의 비율은, 인간 일차 NK 세포를 EGFR-CAR 렌티바이러스로 감염시킨 후, 유세포 계수에 의해 측정했다.
도 19는 유방암 세포에 대한 반응으로 EGFR-CAR NK-92 세포 상에서 활성화 마커의 발현의 변화를 나타낸다. EGFR-CAR NK-92 세포에서 CD27 및 CD69의 표면 발현은 밤새 유방암 세포(MDA-MB-231, MDA-MB-468 및 MCF-7)와의 공-배양 후에 유세포 계수에 의해 측정했다.
도 20A-20B은 oHSV 단독에 의한 유방암 세포의 용해를 입증한다. 4일 동안 공-배양 후에 oHSV에 의한 유방암 세포주(MDA-MB-231)의 용해는 현미경하에 밝은 이미지에 의해 입증되었다(도 20A). EGFR-CAR NK92 세포를 4일 동안 oHSV-1으로 처리하고, 현미경 조사는 oHSV-1이 EGFR-CAR NK-92 세포의 증식 및 생존능에 명백한 효과가 없었음을 나타냈다(도 20B).
도 21은 oHSV, EGFR-CAR NK-92 세포 및 이들의 조합에 의한 유방암 세포주(MDA-MB-231)의 용해를 나타낸다. "MDA-MB-231+CAR+oHSV"는 4시간 동안 EGFR-CAR NK-92 세포의 처리, 이어서 oHSV-1 처리를 나타낸다. "MDA-MB-231+oHSV+CAR"는 4시간 동안 oHSV-1의 처리, 이어서 EGFR-CAR NK-92 세포의 처리를 나타낸다.
도 22는 비히클, NK-92 세포, oHSV, EGFR-CAR NK-92 세포, 및 oHSV와 EGFR-CAR NK-92 세포의 조합으로 처리한 두개내 이종이식 GB 종양으로부터 방출된 광자의 정량화를 나타낸다.
도 2A-2B는 EGFR-특이적 CAR의 생성 및 CAR-형질도입된 NK 세포 상에서 이의 발현의 검출을 나타낸다. (도 2A) EGFR-CAR 렌티바이러스 작제물의 모식도. (도 2B) EGFR-CAR 작제물(각각 NK-92-EGFR-CAR 및 NKL-EGFR-CAR) 또는 공 벡터 작제물(EV)로 형질도입된 NK-92 및 NKL 세포의 표면 상에서 키메라 EGFR scFv의 발현. 세포를 GFP 발현에 의해 FACS-분류하고, 이어서 세포를 항-마우스 Fab 항체(실선) 또는 IgG 이소형 대조군(점선)으로 염색한 후에 유세포 계수에 의해 분석했다. SP, 신호 펩티드; VH, 중쇄; VL, 경쇄; ScFv, 단일 사슬 가변 단편. 유동 플롯 및 데이터는 3개 독립적 실험의 대표예이다.
도 3A-3B는 EGFR-CAR-변형된 NK-92 및 NKL 세포가 EGFR+ GB 세포주 세포를 인식하고 사멸시키는 것을 나타낸다. (도 3A) 표준 크롬-51 방출 검정을 사용하여 Gli36dEGFR, LN229 또는 U251에 대한 공 벡터(EV)-형질도입된 NK-92 및 NKL 세포의 세포독성 활성. (도 3B) ELISA 검정을 사용하여 Gli36dEGFR, LN229 또는 U251 세포의 부재 또는 존재하에 공 벡터 EV-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 및 NKL 세포의 IFN-γ 방출. 3개 독립적 실험의 대표적 데이터가 제시되어 있다. *p < 0.05; **p < 0.01.
도 4A-4B는 EGFR-CAR-변형된 NK-92 및 NKL 세포가 EGFR+ GB 줄기 세포의 증강된 용해를 나타냄을 보여준다. (도 4A) 크롬-51 방출 검정을 사용하여 GB1123, GB30, GB157V3SL 및 GB84V3SL GB 줄기 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR 세포(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR 세포(하부 패널)의 세포독성 활성. (도 4B) GB 줄기 세포와 공-배양하는 경우, NK-92-EGFR-CAR 또는 NK-92-EV 세포(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR 세포(하부 패널)에 의한 IFN-γ 분비의 ELISA 분석. 3개 독립적 실험의 대표적 데이터가 제시되어 있다. *p < 0.05; **p < 0.01.
도 5A-5C는 NK-92-EGFR-CAR 세포의 증강된 표적 인식이 세포 표면 상에서 EGFR의 발현에 의존적임을 나타낸다. (도 5A) 공 벡터 또는 wt EGFR 또는 EGFRvIII을 함유하는 벡터로 형질감염시킨 GB19 세포의 표면 상에서 EGFR 발현을 검출하기 위해 항-EGFR 항체(실선) 또는 IgG 이소형 대조군(점선)을 사용한 유세포 계수. (도 5B) 도 5A에 제시된 GB19, GB19-wt EGFR 및 GB19-EGFRvIII 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR(하부 패널)의 세포독성. GB19 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율로 NK-92 또는 NKL 세포와 함께 배양했다. 종양 용해는 크롬-51 방출 검정을 사용하여 측정했다. (도 5C) NKL-EV 또는 NKL-EGFR-CAR(좌측) 및 NK-92-EGFR-CAR 또는 NK-92-EV 세포(우측)을 24시간 동안 동일한 수의 GB19-벡터 또는 GB19-EGFR 세포와 함께 배양했다. 이어서, 상청액은 ELISA를 사용하여 IFN-γ 분비의 측정을 위해 수집했다. 유동 플롯 및 데이터는 3개 독립적 실험의 대표예이다. *p < 0.05, **p < 0.01.
도 6A-6E는 NK-92-EGFR-CAR 세포가 동소성 인간 신경교종 줄기 세포의 생체내 성장을 억제하고 교아세포종-함유 마우스의 생존을 연장시키고 기타 기관 및 조직으로 이행하지 않고서 뇌에서 국지화하는 것을 나타낸다. (도 6A) GB30 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스를 정립 주사에 의해 루시퍼라제-발현 GB30 세포로 접종시켰다(0일). 접종 7일 후, 마우스를 공 벡터-형질도입된 NK-92 세포(NK-92-EV), EGFR-CAR-형질도입된 NK-92 세포(NK-92-EGFR-CAR) 또는 행크 평형 염 용액(HBSS; 음성 대조군)으로 1회 두개내 주입했다. (도 6B) 도 6A의 마우스당 초당 양자 단위의 정량화 요약. *는 p < 0.05를 나타낸다. (도 6C) NK-92-EGFR-CAR 세포로 처리된 GB30-담지 마우스는, 카플란-마이어(Kaplan-Meier) 생존 곡선에 의해 측정하는 경우, NK-92-EV 세포 또는 HBSS(** p < 0.01)와 비교하여 현저히 증가된 전체 생존을 나타냈다(각 그룹에 대해 n = 5). (도 6D) GB30-담지 마우스 내로 CAR NK 세포의 두개내 주사 3일 후에 간, 폐, 혈액, 비장, 골수(BM) 및 뇌에서 유세포 계수법에 의해 CD56+CD3- 인간 EGFR-CAR NK-92 세포의 존재의 측정. (도 6E) GB30-담지 마우스 내로 CAR NK 세포의 두개내 주사 3일 후에 간, 폐, 혈액, 비장, 골수(BM) 및 뇌에서 RT-PCR에 의해 EGFR-CAR 발현의 측정. NC = 음성 대조군(DNA 주형을 첨가하지 않음); PC = 양성 대조군, EGFR-CAR NK-92 세포. *p < 0.05, **p < 0.01.
도 7A-7C는 EGFR-CAR-형질도입된 NK-92 세포가 wt EGFR-발현 GB 종양 성장을 억제시키고 동소성 이종이식 GB 모델에서 종양-담지 마우스의 생존을 연장시키는 것을 나타낸다. (도 7A) U251 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스에게 정립 주사(0일)에 의해 105 루시퍼라제-발현 U251 세포를 두개내 이식했다. 접종 10일, 40일 및 70일 후, 마우스에게 NK-92-EV 세포, NK-92-EGFR-CAR 세포 또는 음성 대조군으로서 HBSS를 두개내 주입했다. 마우스의 뇌 생물발광 이미지를 100일에 촬영했다. (도 7B) 도 7A로부터의 마우스당 초당 양자 단위의 정량화 요약. **는 p < 0.01을 나타낸다. (도 7C) NK-92-EGFR-CAR 세포로 처리된 U251-담지 마우스는, 카플란-마이어 생존 곡선에 의해 측정하는 경우, EK-92-EV 세포(* p < 0.05) 또는 HBSS(** p < 0.01)로 처리한 마우스와 비교하여 현저히 증가된 전체 생존을 나타낸다(각 그룹에 대해 n = 5).
도 8A-8B는 EGFR-CAR 일차 NK 세포가 EGFR+ GB 세포 및 환자-유래 GB 줄기 세포의 증강된 근절을 나타냄을 보여준다. (도 8A) 위-형질도입된 일차 NK 세포(일차 NK-EV)와 비교하여 EGFR+ Gli36dEGFR 및 U251 GB 세포주에 대해 증가된 세포독성 활성을 나타낸 EGFR-CAR-변형된 일차 NK 세포(일차 NK-CAR). (도 8B) 위-형질도입된 일차 NK 세포(일차 NK-EV)와 비교하여 EGFR+-환자-유래된 GB30 및 GB157V3SL 줄기 세포에 대해 증강된 세포독성을 나타낸 EGFR-CAR-변형된 NK 세포(일차 NK-CAR). 제시된 데이터는, 상이한 건강한 공여체로부터 단리한 NK 세포를 조사한, 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01.
도 9A-9C는 NK-92-EGFR-CAR 세포의 증강된 표적 인식이 세포 표면 상에서 EGFR의 발현에 의존적임을 나타낸다. (도 9A) 공 벡터(EV; 좌측), wt EGFR(중앙) 또는 EGFRvIII(우측)으로 형질도입된 293T 세포의 항-EGFR 항체(실선) 또는 IgG 이소형 대조군(점선)을 사용한 유세포 계수 분석. (도 9B) 293T-EV(좌측), 293T-EGFR(중앙) 및 293T-EGFRvIII(우측) 세포에 대한 NK-92-EV 또는 NK-92-EGFR-CAR(상부 패널) 및 NKL-EV 또는 NKL-EGFR-CAR(하부 패널)의 세포독성. 293T 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율에서 NK 세포와 함께 배양했다. 종양 용해는 크롬-51 방출 검정을 사용하여 측정했다. (도 9C) 24시간 동안 표적 세포 및 효과기 세포의 공배양 후, 공-배양물로부터의 상청액은 ELISA를 사용하여 IFN-γ 분비에 대해 측정했다. 제시된 데이터는 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01.
도 10A-10B는 NK-92-EGFR-CAR 세포의 효과가 EGFR 차단 항체(Ab)에 의해 둔화되는 것을 나타낸다. (도 10A) EGFR-특이적 모노클로날 항체 528 또는 IgG-정합 이소형 대조군 항체로 전처리한 GB30 세포(좌측) 또는 U251 세포(우측)에 대한 NK-92-EV 또는 NK-92-EGFR-CAR의 세포독성. 표적 세포를 4시간 동안 다양한 효과기/표적(E/T) 비율에서 전처리된 NK-92-EV 또는 NK-92-EGFR-CAR 세포와 함께 배양했다. (도 10B) 24시간 동안 표적 세포 및 효과기 세포의 공-배양 후, 공-배양물로부터의 상청액은 ELISA를 사용하여 IFN-γ 분비에 대해 측정했다. 제시된 데이터는 유사한 결과를 갖는 3개 실험의 대표예이다. *p < 0.05; **p < 0.01. Ab= EGFR-특이적 모노클로날 항체 528; 이소= IgG-정합된 이소형 대조군 항체.
도 11은 NK-92-EGFR-CAR 세포가 종양내 주사 후에 종양 영역에 위치되어 있음을 나타낸다. NK-92-EGFR-CAR 세포를 GB30 이식 7일 후에 마우스 뇌에 종양내 주사했다. 마우스 뇌를 3일 후에 수거하고, 파라핀으로 매립하고, 헤마톡실린 및 에오신(H&E) 염색을 위해 처리했다. H&E 염색은 NK-92-EGFR-CAR 세포가 유일하게 종양 영역 내부에 존재했음을 나타냈다. 20×, 40× 및 100×의 확대가 제시되었다(물체: 2×, 4× 또는 10×; 접안렌즈: 10X).
도 12A-12B는 유방암 세포주 및 조직에서 EGFR의 발현을 나타낸다. 유방암 세포주(MDA-MB-231, MDA-MB-468 및 MCF-7)의 세포 표면 상에서 EGFR의 발현은 유세포 계수에 의해 검출했다(도 12A). 헤마톡실린 및 에오신(HE) 염색 및 EGFR 발현의 면역조직화학(IHC)은 일차 유방암 및 뇌 전이를 갖는 환자의 종양 조직에 대해 수행했다(도 12B).
도 13A-13E은 EGFR-CAR NK-92 세포가 유방암 세포주의 EGFR 양성 세포를 인식하고 이를 용해하는 것을 입증한다. EGFR-CAR-형질도입된 NK-92 세포 상에서 EGFR scFv의 발현은 염소 항-마우스 F(ab')2 폴리클로날 항체를 사용한 유세포 계수법에 의해 측정했다(도 13A). MDA-MB-231, MDA-MB-468 또는 MCF-7 세포의 부재 또는 존재하에 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 세포에 의한 IFN-γ 방출은 표준 ELISA 검정을 사용하여 측정했다. **P < 0.01 (도 13B). MDA-MB-231(도 13C), MDA-MB-468(도 13D) 또는 MCF-7(도 13E) 세포에 대한 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 NK-92 세포의 세포독성 활성은 표준 크롬-51 방출 검정을 사용하여 수행했다. (E, 효과 세포; T, 표적 세포)
도 14A-14D는, EGFR+ 유방암 세포로 자극시키는 경우, EGFR-CAR 일차 NK 세포의 증강된 세포독성 및 INF-γ 생성을 나타낸다. MDA-MB-231, MDA-MB-468 또는 MCF-7 세포의 부재 또는 존재하에 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 일차 NK 세포에 의한 IFN-γ 방출은 표준 ELISA 검정을 사용하여 측정했다(도 14A). MDA-MB-231(도 14B), MDA-MB-468(도 14C) 또는 MCF-7(도 14D) 세포에 대한 공 벡터(EV)-형질도입된 또는 EGFR-CAR-형질도입된 일차 NK 세포의 세포독성 활성은 표준 크롬-51 방출 검정을 사용하여 수행했다. (E, 효과 세포; T, 표적 세포)
도 15A-15C는, oHSV-1 단독이 유방암 세포주 종양 세포를 용해 및 근절시킬 수 있음을 나타낸다. 48시간 동안 공-배양 후, 유방암 세포주(MDA-MB-231, MDA-MB-468 또는 MCF-7)에 대한 oHSV-1의 용량-의존적 세포독성은 MTS에 의해 검출되었다. *P < 0.05; **P < 0.01(도 15A). 도 15B는, 상이한 기간 동안 이들의 공-배양 후, 유방암 세포주, 즉 MDA-MB-231, MDA-MB-468 또는 MCF-7에 대한 oHSV-1 세포독성의 MTS 검정을 나타낸다. 도 15C는 MDA-MB-231-CBRluc-EGFP 세포 및 oHSV-1의 공-배양 배지에서 루시퍼라제 수준의 측정을 나타낸다.
도 16A-16B는 EGFR-CAR NK-92 세포 및 oHSV-1의 병용 치료가 시험관내에서 유방암 종양 세포의 보다 효율적 근절을 제공하는 것을 나타낸다. 종양 세포를 CAR 세포 단독, oHSV-1 단독, 4시간 동안 EGFR-CAR NK-92 세포, 이어서 oHSV-1(CAR + oHSV), 또는 4시간 동안 oHSV, 이어서 EGFR-CAR NK-92 세포(oHSV + CAR)로 처리했다. CBRluc-EGFP를 발현하는 MDA-MB-231 종양 세포의 근절은 상이한 시점에서 상청액으로 루시퍼라제 방출에 의해 측정했다(도 16A). 순서와 무관하게, oHSV-1(CAR + oHSV 또는 oHSV + CAR)와 조합된 EGFR-CAR NK-92 세포는, 공-배양 4일 후에 MDA-MB-231-CBRluc-EGFP 세포에 잔류하는 루시퍼라제의 상대 광 단위에 의해 측정된 바와 같이, EGFR-CAR NK-92 세포 단독(CAR) 또는 oHSV-1 단독(oHSV)보다 많은 MDA-MB-231 종양 세포를 근절시켰다. **P < 0.01(도 16B). 데이터는 3개 독립적 실험의 대표예이다.
도 17A-17B는 EGFR-CAR 형질도입된 NK-92 세포가 종양-담지 마우스의 연장된 생존과 함께 MDA-MB-231 종양 성장을 억제시키는 것을 나타낸다. BCBN 종양을 갖는 마우스의 뇌 생물발광 이미지. NSG 마우스에게 정립 주사에 의해 MDA-MB-231-CBRluc-EGFP 세포를 접종시켰다(0일). 접종 10일 후, 마우스에게 EGFR-CAR NK-92, oHSV-1, NK-92-EV 또는 HBSS를 1회 두개내 주입했다. 조합 처리 그룹의 마우스에게 15일에 oHSV-1을 주사했다. MDA-MB-231-CBRluc-EGFP 세포를 사용한 접종 4주 후에, 마우스에게 D-루시페린을 복강내 주입하고, 생체내 이미지 시스템을 사용하여 이미지화했다(도 17A). MDA-MB-231-CBRluc-EGFP 종양-담지 마우스에게 EGFR-CAR NK-92 세포, 이어서 oHSV-1 주사(CAR + oHSV), EGFR-CAR NK-92 세포 단독(CAR), oHSV-1 단독 또는 HBSS 대조군으로 종양내 처리했다. 그 결과, oHSV-1 주사를 수반한 EGFR-CAR NK-92 세포는, 카플란-마이어 생존 곡선에 의해 측정된 바와 같이, 나머지 처리보다 현저히 증가된 전체 생존을 나타냈다(각 그룹에 대해 n = 5)(도 17B).
도 18은 인간 일차 NK 세포에서 렌티바이러스의 형질도입 효율을 나타낸다. GFP(+) 세포의 비율은, 인간 일차 NK 세포를 EGFR-CAR 렌티바이러스로 감염시킨 후, 유세포 계수에 의해 측정했다.
도 19는 유방암 세포에 대한 반응으로 EGFR-CAR NK-92 세포 상에서 활성화 마커의 발현의 변화를 나타낸다. EGFR-CAR NK-92 세포에서 CD27 및 CD69의 표면 발현은 밤새 유방암 세포(MDA-MB-231, MDA-MB-468 및 MCF-7)와의 공-배양 후에 유세포 계수에 의해 측정했다.
도 20A-20B은 oHSV 단독에 의한 유방암 세포의 용해를 입증한다. 4일 동안 공-배양 후에 oHSV에 의한 유방암 세포주(MDA-MB-231)의 용해는 현미경하에 밝은 이미지에 의해 입증되었다(도 20A). EGFR-CAR NK92 세포를 4일 동안 oHSV-1으로 처리하고, 현미경 조사는 oHSV-1이 EGFR-CAR NK-92 세포의 증식 및 생존능에 명백한 효과가 없었음을 나타냈다(도 20B).
도 21은 oHSV, EGFR-CAR NK-92 세포 및 이들의 조합에 의한 유방암 세포주(MDA-MB-231)의 용해를 나타낸다. "MDA-MB-231+CAR+oHSV"는 4시간 동안 EGFR-CAR NK-92 세포의 처리, 이어서 oHSV-1 처리를 나타낸다. "MDA-MB-231+oHSV+CAR"는 4시간 동안 oHSV-1의 처리, 이어서 EGFR-CAR NK-92 세포의 처리를 나타낸다.
도 22는 비히클, NK-92 세포, oHSV, EGFR-CAR NK-92 세포, 및 oHSV와 EGFR-CAR NK-92 세포의 조합으로 처리한 두개내 이종이식 GB 종양으로부터 방출된 광자의 정량화를 나타낸다.
본 개시는 기재된 특정 양태로 한정되지 않고, 이는 물론 달라질 수 있는 것으로 이해되어야 한다. 또한, 본원에서 사용되는 용어는 특정 양태를 단지 기재하기 위한 것으로 이해되어야 하고, 본 발명의 범위가 첨부된 특허청구범위에 의해서만 한정될 것이기 때문에 한정하는 것을 의도하는 것은 아니다.
달리 정의하지 않는 한, 본원에 사용된 모든 기술적 및 과학적 용어는 본 기술이 속하는 기술분야의 통상의 지식을 가진 자에 의해 통상 이해되는 것과 동일한 의미를 갖는다. 본원에 기재된 것들과 유사하거나 동등한 임의의 방법 및 재료가 본 기술의 실시 또는 시험에 사용될 수 있지만, 바람직한 방법, 장치 및 재료가 이제 기재된다. 본원에 인용된 모든 기술적 및 특허 간행물은 이들의 전체가 참조로서 본원에 도입된다. 본원의 어떠한 것도, 본 발명이 선행 발명에 의해 이러한 개시보다 선행하는 자격을 부여하는 것을 인정하는 것으로 해석되어서는 않된다.
본 기술의 실시는, 달리 명시하지 않는 한, 당업자의 범위 내에 있는, 조직 배양, 면역학, 분자 생물학, 미생물학, 세포 생물학 및 재조합 DNA의 종래 기술을 사용할 것이다. 예를 들면, 문헌[참조: Sambrook and Russell eds. (2001) Molecular Cloning: A Laboratory Manual, 3rd edition; the series Ausubel et al. eds. (2007) Current Protocols in Molecular Biology; the series Methods in Enzymology (Academic Press, Inc., N.Y.); MacPherson et al. (1991) PCR 1: A Practical Approach (IRL Press at Oxford University Press); MacPherson et al. (1995) PCR 2: A Practical Approach; Harlow and Lane eds. (1999) Antibodies, A Laboratory Manual; Freshney (2005) Culture of Animal Cells: A Manual of Basic Technique, 5th edition; Gait ed. (1984) Oligonucleotide Synthesis; U.S. Patent No. 4,683,195; Hames and Higgins eds. (1984) Nucleic Acid Hybridization; Anderson (1999) Nucleic Acid Hybridization; Hames and Higgins eds. (1984) Transcription and Translation; Immobilized Cells and Enzymes (IRL Press (1986)); Perbal (1984) A Practical Guide to Molecular Cloning; Miller and Calos eds. (1987) Gene Transfer Vectors for Mammalian Cells (Cold Spring Harbor Laboratory); Makrides ed. (2003) Gene Transfer and Expression in Mammalian Cells; Mayer and Walker eds. (1987) Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); and Herzenberg et al. eds (1996) Weir’s Handbook of Experimental Immunology].
모든 수치 표시, 예를 들면, 범위를 포함하는 pH, 온도, 시간, 농도 및 분자량은, 경우에 따라, 1.0 또는 0.1의 증분으로 (+) 또는 (-)로 달라지거나, 또는 +/-15%, 또는 10%, 또는 5%, 또는 2%의 변화로 달라지는 근사치이다. 명시적으로 언급되지 않더라도, 모든 수치 표시는 용어 "약"이 선행되는 것으로 이해되어야 한다. 또한, 명시적으로 언급되지 않더라도, 본원에 기재된 시약은 단순히 예시이고, 이의 등가물은 당해 기술분야에 공지되어 있는 것으로 이해되어야 한다.
명시적 인용이 없고 달리 의도하지 않는 한, 본 기술이 폴리펩티드, 단백질, 폴리뉴클레오티드 또는 항체와 관련되는 경우, 이의 등가물 또는 생물학적 등가물도 본 기술의 범위 내인 것으로 의도된다.
정의
명세서 및 특허청구범위에 사용된 바와 같이, 단수형 "a", "an" 및 "the"는, 문맥이 달리 지시하지 않는 한, 복수의 언급을 포함한다. 예를 들면, 용어 "세포"는 이의 혼합물을 포함하여 복수의 세포를 포함한다.
본원에 사용된 바와 같이, 용어 "동물"은 살아있는 다세포 척추 생물체, 예를 들면, 포유동물 및 조류를 포함하는 범주를 지칭한다. 용어 "포유동물"은 인간 및 비-인간 포유동물 둘 다를 포함한다.
용어 "대상체", "숙주", "개체" 및 "환자"는 인간 및 척추 대상체, 예를 들면, 인간, 동물, 비-인간 영장류, 개, 고양이, 양, 마우스, 말 및 소를 지칭하기 위해 본원에서 호환적으로 사용된다.
본원에 사용된 바와 같이, "항체"는, 집합적으로, 예를 들면 및 제한 없이, IgA, IgD, IgE, IgG 및 IgM을 포함하는 면역글로불린 또는 면역글로불린-유사 분자, 이들의 조합, 및 임의의 척추동물, 예를 들면, 포유동물(예: 인간, 염소, 래빗 및 마우스), 및 비-포유동물 종(예: 상어 면역글로불린)에서 면역 반응 동안 생성된 유사한 분자를 지칭한다. 달리 구체적으로 언급하지 않는 한, 용어 "항체"는, 다른 분자(예를 들면, 생물학적 샘플에서 다른 분자에 대한 결합 상수보다 적어도 103 M-1 큰, 적어도 104 M-1 큰 또는 적어도 105 M-1 큰 목적하는 분자에 대한 결합 상수를 갖는 항체 및 항체 단편)에 대한 결합의 실질적 배제로 목적하는 분자(또는 목적하는 고도의 유사한 분자의 그룹)에 특이적으로 결합하는 무손상 면역글로불린 및 "항체 단편" 또는 "항체 결합 단편"을 포함한다. 용어 "항체"는 또한 유전적으로 조작된 형태, 예를 들면, 키메라 항체(예를 들면, 인간화된 뮤린 항체), 이종접합체 항체(예를 들면, 이중특이적 항체)를 포함한다[참조: Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Rockford, Ill.); Kuby, J., Immunology, 3rd Ed., W.H. Freeman & Co., New York, 1997].
항체 구조의 관점에서, 면역글로불린은 디설파이드 결합에 의해 상호접속된 중(H)쇄 및 경(L)쇄를 갖는다. 2개 타입의 경쇄, 즉 람다(λ) 및 카파(λ)가 있다. 항체 분자의 기능적 활성을 결정하는 5개의 주요 중쇄 부류(또는 이소형)가 있다: IgM, IgD, IgG, IgA 및 IgE. 각각의 중쇄 및 경쇄는 불변 영역 및 가변 영역(상기 영역은 또한 "도메인"으로 공지되어 있다)을 함유한다. 조합하여, 중쇄 및 경쇄 가변 영역은 항원에 특이적으로 결합한다. 경쇄 및 중쇄 가변 영역은, 또한 "상보성-결정 영역" 또는 "CDR"로서 불리우는 3개의 초가변 영역에 의해 차단된 "프레임워크" 영역을 함유한다. 프레임워크 영역 및 CDR의 범위는 정의되어 있다[참조: Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1991, 이는 본원에서 참조로서 도입됨]. 카뱃 데이터베이스는 온라인으로 관리되고 있다. 상이한 경쇄 또는 중쇄의 프레임워크 영역의 서열은 종 내에서 비교적 보존되어 있다. 항체의 프레임워크 영역, 즉 구성 경쇄 및 중쇄의 조합된 프레임워크 영역은 주로 β-시트 구조를 채용하고, CDR은 β-시트 구조의 일부를 연결하고 일부 경우에 이를 형성하는 루프를 형성한다. 따라서, 프레임워크 영역은, 쇄내, 비공유 상호작용에 의해 정확한 배향으로 CDR을 위치시키는 스캐폴드를 형성하도록 작용한다.
CDR은 항원의 에피토프에 대한 결합에 주로 관여한다. 각 쇄의 CDR은 전형적으로 CDR1, CDR2 및 CDR3로서 지칭되고, N-말단으로부터 순차로 넘버링되고, 또한 전형적으로 특정 CDR이 위치되어 있는 쇄에 의해 동정된다. 따라서, VH CDR3은 이것이 발견되는 항체의 중쇄의 가변 도메인에 위치되어 있고, VL CDR1은 이것이 발견되는 항체의 경쇄의 가변 도메인으로부터의 CDR1이다. EGFR에 결합하는 항체는 특이적 VH 영역 및 VL 영역 서열, 및 따라서 특이적 CDR 서열을 가질 것이다. 상이한 특이성(즉, 상이한 항원에 대한 상이한 조합 부위)를 갖는 항체는 상이한 CDR을 갖는다. 항체마다 상이한 CDR이 있지만, CDR 내의 제한된 수의 아미노산 위치만이 항원 결합에 직접 관여한다. CDR 내의 이들 위치는 특이성 결정 잔기(SDR)로서 불리운다.
본원에 사용된 바와 같이, 용어 "항원"은 특정 체액 또는 세포 면역의 생성물, 예를 들면, 항체 분자 또는 T-세포 수용체에 의해 특이적으로 결합될 수 있는 화합물, 조성물 또는 물질을 지칭한다. 항원은, 예를 들면, 합텐, 단순한 중간 대사물, 당(예: 올리고당), 지질 및 호르몬, 및 거대분자, 예를 들면, 복합 탄수화물(예: 다당류), 인지질 및 단백질을 포함하는 임의 타입의 분자일 수 있다. 항원의 일반적 카테고리는, 이로써 한정되지 않지만, 바이러스 항원, 세균 항원, 진균 항원, 원생동물 및 기타 기생충 항원, 종양 항원, 자가면역 질환, 알러지 및 이식편 거부, 독소 및 기타 다양한 항원을 포함한다.
본원에 사용된 바와 같이, 용어 "항원 결합 도메인"은, 항원 표적에 특이적으로 결합할 수 있는 임의의 단백질 또는 폴리펩티드 도메인을 지칭한다.
용어 "키메라 항원 수용체"(CAR)는, 본원에 사용된 바와 같이, 항원에 결합할 수 있는 세포외 도메인, 세포외 도메인이 유래되는 폴리펩티드와는 상이한 폴리펩티드로부터 유래된 막관통 도메인, 및 적어도 하나의 세포내 도메인을 포함하는 융합된 단백질을 지칭한다. "키메라 항원 수용체(CAR)"는 종종 "키메라 수용체", "T-바디" 또는 "키메라 면역 수용체(CIR)"로 불리운다. "항원에 결합할 수 있는 세포외 도메인"은 특정 항원에 결합할 수 있는 임의의 올리고펩티드 또는 폴리펩티드를 의미한다. "세포내 도메인"은 세포에서 생물학적 프로세스의 활성화 또는 억제를 유발하는 신호를 전달하는 도메인으로 기능하는 것으로 공지된 임의의 올리고펩티드 또는 폴리펩티드를 의미한다. "막관통 도메인"은, 세포외 및 신호전달 도메인을 연결하도록 기능할 수 있는 세포 막을 신장시키는 것으로 공지된 임의의 올리고펩티드 또는 폴리펩티드를 의미한다. 키메라 항원 수용체는, 세포외 및 막관통 도메인 사이에서 링커로 작용하는 "힌지 도메인"을 임의로 포함할 수 있다. 각각의 도메인의 성분을 코딩하는 비제한적 예시적 폴리뉴클레오티드 서열은 본원에 개시되어 있다. 예를 들면:
힌지 도메인: IgG1 중쇄 힌지 서열: CTCGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCG
막관통 도메인: CD28 막관통 영역: TTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTG
세포내 도메인: 4-1BB 공자극 신호전달 영역: AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
세포내 도메인: CD28 공자극 신호전달 영역: AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC
세포내 도메인: CD3 제타 신호전달 영역: AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAA
각 예시적 도메인 성분의 추가 실시형태는, 상기 개시된 핵산 서열에 의해 코딩된 단백질과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 기타 단백질을 포함한다. 추가로, 이러한 도메인의 비-제한적 예는 본원에 제공되어 있다.
약어 "EGFR"은 상피 성장 인자 수용체를 나타낸다. EGFR은 또한 ErbB-1 및 HER1로서 공지되어 있다. 이는 세포 표면 수용체의 상피 성장 인자 계열의 세포 표면 수용체이다. 용어 "EGFR"은 또한 이러한 명칭과 연관된 특정 단백질 단편 및 본원에 개시된 EGFR의 임의의 이소형과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 아미노산 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. 이소형 1은 정식 서열이고; 따라서, 다음과 같은 모든 위치 정보는 하기 개시된 아미노산 서열을 지칭한다.
EGFR 이소형 1, 유니프롯(Uniprot) P00533-1: SPSTSRTPLLSSLSATSNNSTVACIDRNGLQSCPIKEDSFLQRYSSDPTGALTEDSIDDTFLPVPEYINQSVPKRPAGSVQNPVYHNQPLNPAPSRDPHYQDPHSTAVGNPEYLNTVQPTCVNSTFDSPAHWAQKGSHQISLDNPDYQQDFFPKEAKPNGIFKGSTAENAEYLRVAPQSSEFIGA
결합 부위는, 이로써 한정되지 않지만, 위치 745 및 855를 포함하고; 활성 부위는, 이로써 한정되지 않지만, 위치 837을 포함하고; 목적하는 기타 부위는, 이로써 한정되지 않지만, 위치 1016을 포함한다. EGFR 이소형 2(유니프롯 P00533-2)는 위치 404 내지 405에서 FL의 LS로의 치환을 갖고, 위치 406 내지 1210의 영역을 결여한다. EGFR 이소형 4(유니프롯 P00533-4)는 위치 628에서 C의 S로의 치환을 갖고, 위치 629 내지 1210의 영역을 결여한다. EGFR 이소형 3(유니프롯 P00533-3)은 위치 628 내지 705에서 상이하고, 하기 서열에 따라, 위치 706 내지 1210의 영역을 결여한다.
EGFR 이소형 3, 유니프롯 P00533-3:
MRPSGTAGAALLALLAALCPASRALEEKKVCQGTSNKLTQLGTFEDHFLSLQRMFNNCEVVLGNLEITYVQRNYDLSFLKTIQEVAGYVLIALNTVERIPLENLQIIRGNMYYENSYALAVLSNYDANKTGLKELPMRNLQEILHGAVRFSNNPALCNVESIQWRDIVSSDFLSNMSMDFQNHLGSCQKCDPSCPNGSCWGAGEENCQKLTKIICAQQCSGRCRGKSPSDCCHNQCAAGCTGPRESDCLVCRKFRDEATCKDTCPPLMLYNPTTYQMDVNPEGKYSFGATCVKKCPRNYVVTDHGSCVRACGADSYEMEEDGVRKCKKCEGPCRKVCNGIGIGEFKDSLSINATNIKHFKNCTSISGDLHILPVAFRGDSFTHTPPLDPQELDILKTVKEITGFLLIQAWPENRTDLHAFENLEIIRGRTKQHGQFSLAVVSLNITSLGLRSLKEISDGDVIISGNKNLCYANTINWKKLFGTSGQKTKIISNRGENSCKATGQVCHALCSPEGCWGPEPRDCVSCRNVSRGRECVDKCNLLEGEPREFVENSECIQCHPECLPQAMNITCTGRGPDNCIQCAHYIDGPHCVKTCPAGVMGENNTLVWKYADAGHVCHLCHPNCTYGPGNESLKAMLFCLFKLSSCNQSNDGSVSHQSGSPAAQESCLGWIPSLLPSEFQLGWGGCSHLHAWPSASVIITASSCH
EGFRvIII은 교아세포종 다형태(GB)를 갖는 상당한 비율의 환자에서 발현되는 것으로 보고된 EGFR의 돌연변이 형태이다. 문헌[참조: Gan et al. 205350-5370]은 돌연변이 형태가 또한 다른 종양에서 발현되는 것을 보고한다. 용어 "돌연변이체 EGFR"은 이러한 명칭과 연관된 EGFRvIII 또는 특정의 단백질 단편, 본원에 제시된 EGFRvIII 또는 본원에 추가로 정의된 이의 등가물과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 95% 아미노산 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 분자를 지칭할 수도 있다.
EGFRvIII, 유니프롯 P00533[30-297]:
MRPSGTAGAA LLALLAALCP ASRALEEKKV CQGTSNKLTQ LGTFEDHFLS LQRMFNNCEV VLGNLEITYV QRNYDLSFLK TIQEVAGYVL IALNTVERIPLENLQIIRGN MYYENSYALA VLSNYDANKT GLKELPMRNL QEILHGAVRF SNNPALCNVE SIQWRDIVSS DFLSNMSMDF QNHLGSCQKC DPSCPNGSCWGAGEENCQKL TKIICAQQCS GRCRGKSPSD CCHNQCAAGC TGPRESDCLV CRKFRDEATC KDTCPPLMLY NPTTYQMDVN PEGKYSFGAT CVKKCPRNYV VTDHGSCVRA CGADSYEMEE DGVRKCKKCE GPCRKVCNGI GIGEFKDSLS INATNIKHFK NCTSISGDLH ILPVAFRGDS FTHTPPLDPQ ELDILKTVKE ITGFLLIQAW PENRTDLHAF ENLEIIRGRT KQHGQFSLAV VSLNITSLGL RSLKEISDGD VIISGNKNLC YANTINWKKL FGTSGQKTKI ISNRGENSCK ATGQVCHALC SPEGCWGPEP RDCVSCRNVS RGRECVDKCN LLEGEPREFV ENSECIQCHP ECLPQAMNIT CTGRGPDNCI QCAHYIDGPH CVKTCPAGVM GENNTLVWKY ADAGHVCHLC HPNCTYGCTG PGLEGCPTNG PKIPSIATGM VGALLLLLVV ALGIGLFMRR RHIVRKRTLR RLLQERELVE PLTPSGEAPN QALLRILKET EFKKIKVLGS GAFGTVYKGL WIPEGEKVKI PVAIKELREATSPKANKEIL DEAYVMASVD NPHVCRLLGI CLTSTVQLIT QLMPFGCLLDYVREHKDNIG SQYLLNWCVQ IAKGMNYLED RRLVHRDLAA RNVLVKTPQHVKITDFGLAK LLGAEEKEYH AEGGKVPIKW MALESILHRI YTHQSDVWSYGVTVWELMTF GSKPYDGIPA SEISSILEKG ERLPQPPICT IDVYMIMVKC WMIDADSRPK FRELIIEFSK MARDPQRYLV IQGDERMHLPLMDEEDMDDV VDADEYLIPQ QGFFSSPSTS RTPLLSSLSA TSNNSTVACIDRNGLQSCPI KEDSFLQRYS SDPTGALTED SIDDTFLPVP EYINQSVPKRPAGSVQNPVY HNQPLNPAPS RDPHYQDPHS TAVGNPEYLN TVQPTCVNSTFDSPAHWAQK GSHQISLDNP DYQQDFFPKE AKPNGIFKGS TAENAEYLRVAPQSSEFIGA
용어 "돌연변이체 EGFR"은 또한, 이로써 한정되지 않지만, 하기 돌연변이 중의 하나 이상을 갖는 변이체를 포함하는 EGFR의 임의의 이소형의 천연 변이체를 지칭할 수 있다: 위치 98에서 R에서 Q로, 위치 266에서 P에서 R로, 위치 428에서 G에서 D로, 위치 521에서 R에서 K로, 위치 674에서 V에서 I로, 위치 709에서 E에서 A로, 위치 709에서 E에서 G로, 위치 709에서 E에서 K로, 위치 719에서 G에서 A로, 위치 719에서 G에서 C로, 위치 719에서 G에서 D로, 위치 719에서 G에서 S로, 위치 724에서 G에서 S로, 위치 734에서 E에서 K로, 위치 746 내지 752에서 ELREATS에서 D로, 위치 746 내지 751에서 ELREAT에서 A로, 위치 746 내지 750에서 결실, 위치 746에서 결실, 위치 747 내지 751에서 결실, 위치 747 내지 749에서 결실, 위치 747에서 L에서 F로, 위치 748에서 R에서 P로, 위치 752 내지 759에서 결실, 위치 768에서 S에서 I로, 위치 769에서 V에서 M으로, 위치 787에서 Q에서 R로, 위치 790에서 T에서 M으로, 위치 833에서 L에서 V로, 위치 834에서 V에서 L로, 위치 835에서 H에서 L로, 위치 838에서 L에서 V로, 위치 858에서 L에서 M으로, 위치 858에서 L에서 R로, 위치 861에서 L에서 Q로, 위치 873에서 G에서 E로, 위치 962에서 R에서 G로, 위치 988에서 H에서 P로, 위치 1034에서 L에서 R로, 위치 1210에서 A에서 V로, 및/또는 특정 위치 중의 임의의 하나에서 상이한 아미노산 치환 또는 결실.
"조성물"은 전형적으로 활성제, 예를 들면, 화합물 또는 조성물, 및 천연-존재 또는 비-천연-존재 담체, 불활성(예를 들면, 검출가능한 시약 또는 표지) 또는 활성제, 예를 들면, 애주번트, 희석제, 결합제, 안정화제, 완충제, 염, 친지성 용매, 보존제, 애주번트 등의 조합을 의도하고, 약제학적으로 허용되는 담체를 포함한다. 담체는 또한, 단독으로 1 내지 99중량% 또는 용적%의 조합으로 포함하는, 단독으로 또는 조합하여 존재할 수 있는, 약제학적 부형제 및 첨가제 단백질, 펩티드, 아미노산, 지질 및 탄수화물(예: 단당류, 디-, 트리-, 테트라-올리고사카라이드 및 올리고사카라이드를 포함하는 당; 유도체화된 당, 예를 들면, 알디톨, 알돈산, 에스테르화된 당 등; 및 다당류 또는 당 고분자)를 포함한다. 예시적 단백질 부형제는 혈청 알부민, 예를 들면, 인간 혈청 알부민(HSA), 재조합 인간 알부민(rHa), 젤라틴, 카세인 등을 포함한다. 완충 성능으로 또한 기능할 수 있는 대표적 아미노산/항체 성분은 알라닌, 아르기닌, 글리신, 아르기닌, 베타인, 히스티딘, 글루탐산, 아스파르트산, 시스테인, 리신, 류신, 이소류신, 발린, 메티오닌, 페닐알라닌, 아스파르탐 등을 포함한다. 탄수화물 부형제는 또한 이러한 기술의 범주 내에 있는 것으로 의도되고, 이의 예는, 이로써 한정되지 않지만, 단당류, 예를 들면, 프럭토즈, 말토즈, 갈락토즈, 글루코즈, D-만노즈, 소보즈 등; 이당류, 예를 들면, 락토즈, 수크로즈, 트레할로즈, 셀로비오즈 등; 다당류, 예를 들면, 라피노즈, 멜레지토즈, 말토덱스트린, 덱스트란, 전분 등; 및 알디톨, 예를 들면, 만니톨, 크실리톨, 말티톨, 락티톨, 크실리톨, 솔비톨(글루시톨) 및 미오이노시톨을 포함한다.
본원에 사용된 용어 "컨센서스 서열"은, 복수 서열의 시리즈를 정렬시킴으로써 결정되고 복수 서열의 상응하는 각각의 위치에 아미노산 또는 염기의 우세한 선택을 나타내는 이상화된 서열을 정의하는 아미노산 또는 핵산 서열을 지칭한다. 복수 서열 시리즈의 서열에 따라, 시리즈를 위한 컨센서스 서열은 0, 1, 소수 또는 보다 많은 치환에 의해 각각의 서열이 상이할 수 있다. 또한, 복수 서열의 시리즈의 서열에 따라, 하나 이상의 컨센서스 서열이 시리즈에 대해 결정될 수 있다. 컨센서스 서열의 생성은 집중 수학적 분석으로 수행되었다. 다양한 소프트웨어 프로그램을 사용하여 컨센서스 서열을 결정할 수 있다.
본원에 사용된 바와 같이, 용어 "CD8 α 힌지 도메인"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 CD8 α 힌지 도메인 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. 인간, 마우스 및 기타 종에 대한 CD8 α 힌지 도메인의 예시적 서열은 문헌[참조: Pinto, R.D. et al. (2006) Vet. Immunol. Immunopathol. 110:169-177]에 제공되어 있다. CD8 α 힌지 도메인과 연관된 서열은 문헌[참조: Pinto, R.D. et al. (2006) Vet. Immunol. Immunopathol. 110:169-177]에 제공되어 있다. 이의 비제한적 예는 다음을 포함한다:
인간 CD8 α 힌지 도메인, PAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIY
마우스 CD8 α 힌지 도메인, KVNSTTTKPVLRTPSPVHPTGTSQPQRPEDCRPRGSVKGTGLDFACDIY
고양이 CD8 α 힌지 도메인, PVKPTTTPAPRPPTQAPITTSQRVSLRPGTCQPSAGSTVEASGLDLSCDIY
본원에 사용된 바와 같이, 용어 "CD8 α 막관통 도메인"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 CD8 α 막관통 도메인 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. 인간-T-세포 표면 당단백질 CD8 α 쇄(NCBI 참조 서열: NP_001759.3)의 아미노산 위치 183 내지 203, 또는 마우스 T-세포 표면 당단백질 CD8 α 쇄(NCBI 참조 서열: NP_001074579.1)의 아미노산 위치 197 내지 217, 및 랫트 T-세포 표면 당단백질 CD8 α 쇄(NCBI 참조 서열: NP_ 113726.1)의 아미노산 위치 190 내지 210과 연관된 단편 서열은 CD8 α 막관통 도메인의 추가의 예시적 서열을 제공한다. 각각의 수록된 NCBI와 연관된 서열은 다음과 같이 제공된다:
인간 CD8 α 막관통 도메인: IYIWAPLAGTCGVLLLSLVIT
마우스 CD8 α 막관통 도메인: IWAPLAGICVALLLSLIITLI
랫트 CD8 α 막관통 도메인: IWAPLAGICAVLLLSLVITLI
본원에 사용된 바와 같이, 용어 "4-1BB 공자극 신호전달 영역"은, 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 4-1BB 공자극 신호전달 영역과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. 4-1BB 공자극 신호전달 영역의 예시적 서열은 미국 공보 제20130266551A1호(미국 특허출원 제13/826,258호로 출원됨)에 제공되어 있다. 미국 특허출원 제13/826,258호에 개시된 연관된 4-1BB 공자극 신호전달 영역의 서열은 다음과 같이 개시되어 있다:
4-1BB 공자극 신호전달 영역: KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
본원에 사용된 바와 같이, 용어 "CD28 막관통 도메인"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 CD28 막관통 도메인 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 적어도 90% 서열 동일성, 또는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. GenBank 수탁 번호: XM_006712862.2 and XM_009444056.1과 연관된 단편 서열은 CD28 막관통 도메인의 추가의 비제한적 예시적 서열을 제공한다. 각각의 수록된 수탁 번호와 연관된 서열은 상기 본원에 언급된 서열을 다음과 같이 제공한다.
본원에 사용된 바와 같이, 용어 "CD28 공자극 신호전달 영역"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 CD28 공자극 신호전달 영역 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. CD28 공자극 영역은 막관통 도메인 및 세포내 도메인을 포함한다. CD28 공자극 신호전달 도메인의 예시적 서열은 문헌[참조: 미국 특허 제5,686,281호; Geiger, T. L. et al., Blood 98: 2364-2371 (2001); Hombach, A. et al., J Immunol 167: 6123-6131 (2001); Maher, J. et al. Nat Biotechnol 20: 70-75 (2002); Haynes, N. M. et al., J Immunol 169: 5780-5786 (2002); Haynes, N. M. et al., Blood 100: 3155-3163 (2002)]에 제공되어 있다. 비제한적 예는 하기 CD28 서열의 잔기 114-220 및 이의 등가물을 포함한다: MLRLLLALNL FPSIQVTGNK ILVKQSPMLV AYDNAVNLSC KYSYNLFSRE FRASLHKGLDSAVEVCVVYG NYSQQLQVYS KTGFNCDGKL GNESVTFYLQ NLYVNQTDIY FCKIEVMYPPPYLDNEKSNG TIIHVKGKHL CPSPLFPGPS KPFWVLVVVG GVLACYSLLVTVAFIIFWVR SKRSRLLHSD YMNMTPRRPG PTRKHYQPYA PPRDFAAYRS.
본원에 사용된 바와 같이, 용어 "ICOS 공자극 신호전달 영역"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 ICOS 공자극 신호전달 영역 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. ICOS 공자극 신호전달 영역의 비제한적 예시적 서열은 미국 특허공보 제2015/0017141A1호에 제공되어 있고, 예시적 폴리뉴클레오티드 서열은 하기 제공된다.
ICOS 공자극 신호전달 영역:
acaaaaaaga agtattcatc cagtgtgcac gaccctaacg gtgaatacat gttcatgaga gcagtgaaca cagccaaaaa atccagactc acagatgtga cccta
본원에 사용된 바와 같이, 용어 "OX40 공자극 신호전달 영역"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 OX40 공자극 신호전달 영역 서열과 적어도 70%, 또는 적어도 80% 아미노산 서열 동일성, 또는 달리는 90% 서열 동일성, 또는 달리는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. OX40 공자극 신호전달 영역의 비제한적 예시적 서열은 미국 특허공보 제2012/20148552A1호에 개시되어 있고, 하기 제공된 예시적 서열을 포함한다.
OX40 공자극 신호전달 영역, 서열번호 72:
AGGGACCAG AGGCTGCCCC CCGATGCCCA CAAGCCCCCT GGGGGAGGCA GTTTCCGGAC CCCCATCCAA GAGGAGCAGG CCGACGCCCA CTCCACCCTG GCCAAGATC
본원에 사용된 바와 같이, 용어 "CD3 제타 신호전달 도메인"은 이러한 명칭과 연관된 특정의 단백질 단편, 및 본원에 제시된 CD3 제타 신호전달 도메인 서열과 적어도 70%, 또는 달리는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. CD3 제타 신호전달 도메인의 예시적 서열은 미국 특허공보 제US 13/826,258호에 제공되어 있다. CD3 제타 신호전달 도메인과 연관된 서열은 다음과 같이 수록되어 있다:
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
본원에 사용된 바와 같이, 용어 "B 세포"는 양자 면역계의 체액 면역성에서 림파구의 타입을 지칭한다. B 세포는 원칙적으로 항체를 제조하도록 기능하고, 항원 제시 세포로서 작용하고, 사이토킨을 방출하고, 항원 상호작용에 의한 활성화 후에 기억 B 세포를 발달시킨다. B 세포는 세포 표면 상에 B-세포 수용체의 존재에 의해 기타 림파구, 예를 들면, T 세포와 구별된다. B 세포는 상업적으로 입수가능한 공급원으로부터 단리 또는 수득할 수 있다. 상업적으로 이용가능한 B 세포주의 비제한적 예는 세포주 AHH-1(ATCC® CRL-8146™), BC-1(ATCC® CRL-2230™), BC-2(ATCC® CRL-2231™), BC-3(ATCC® CRL-2277™), CA46(ATCC® CRL-1648™), DG-75 [D.G.-75](ATCC® CRL-2625™), DS-1(ATCC® CRL-11102™), EB-3 [EB3](ATCC® CCL-85™), Z-138(ATCC #CRL-3001), DB(ATCC CRL-2289), Toledo(ATCC CRL-2631), Pfiffer(ATCC CRL-2632), SR(ATCC CRL-2262), JM-1(ATCC CRL-10421), NFS-5 C-1(ATCC CRL-1693); NFS-70 C10(ATCC CRL-1694), NFS-25 C-3(ATCC CRL-1695) 및 SUP-B15(ATCC CRL-1929)를 포함한다. 추가의 예는, 이로써 한정되지 않지만, 미분화 및 거대 세포 림프종으로부터 유래된 세포주, 예를 들면, DEL, DL-40, FE-PD, JB6, Karpas 299, Ki-JK, Mac-2A Ply1, SR-786, SU-DHL-1, -2, -4,-5,-6,-7,-8,-9,-10 및 -16, DOHH-2, NU-DHL-1, U-937, Granda 519, USC-DHL-1, RL; 호지킨 림프종, 예를 들면, DEV, HD-70, HDLM-2, HD-MyZ, HKB-1, KM-H2, L 428, L 540, L1236, SBH-1, SUP-HD1, SU/RH-HD-l을 포함한다. 이러한 상업적으로 이용가능한 세포주의 비제한적 예시적 공급원은 아메리칸 타입 컬쳐 컬렉션(The American Type Culture Collection, 또는 ATCC, (www.atcc.org/)) 및 미생물 및 세포 배양물의 독일 컬렉션(the German Collection of Microorganisms and Cell Cultures (https://www.dsmz.de/))을 포함한다.
본원에 사용된 바와 같이, 용어 "T 세포"는 흉선에서 성숙하는 림파구의 타입을 지칭한다. T 세포는 세포-매개된 면역성에 중요한 역할을 담당하고, 세포 표면 상에 T-세포 수용체의 존재에 의해 기타 림파구, 예를 들면, B 세포와 구별된다. T-세포는 상업적으로 이용가능한 공급원으로부터 단리되거나 수득될 수 있다. "T 세포"는, T-헬퍼 세포(CD4+ 세포), 세포독성 T-세포(CD8+ 세포), 천연 킬러 T-세포, T-조절 세포(Treg) 및 감마-델타 T 세포를 포함하여 CD3을 발현하는 모든 타입의 면역 세포를 포함한다. "세포독성 세포"는, 세포독성 반응을 매개할 수 있는, CD8+ T 세포, 천연-킬러(NK) 세포 및 호중구를 포함한다. 상업적으로 이용가능한 T-세포주의 비제한적 예는 세포주 BCL2 (AAA) Jurkat(ATCC® CRL-2902™), BCL2 (S70A) Jurkat(ATCC® CRL-2900™), BCL2 (S87A) Jurkat(ATCC® CRL-2901™), BCL2 Jurkat(ATCC® CRL-2899™), Neo Jurkat(ATCC® CRL-2898™), TALL-104 세포독성 인간 T 세포주(ATCC # CRL-11386)를 포함한다. 추가의 예는, 이로써 한정되지 않지만, 성숙 T-세포주, 예를 들면, 데글리스(Deglis), EBT-8, HPB-MLp-W, HUT 78, HUT 102, Karpas 384, Ki 225, My-La, Se-Ax, SKW-3, SMZ-1 및 T34; 및 미성숙 T-세포주, 예를 들면, ALL-SIL, Be13, CCRF-CEM, CML-T1, DND-41, DU.528, EU-9, HD-Mar, HPB-ALL, H-SB2, HT-1, JK-T1, Jurkat, Karpas 45, KE-37, KOPT-K1, K-T1, L-KAW, Loucy, MAT, MOLT-1, MOLT 3, MOLT-4, MOLT 13, MOLT-16, MT-1, MT-ALL, P12/Ichikawa, Peer, PER0117, PER-255, PF-382, PFI-285, RPMI-8402, ST-4, SUP-T1 내지 T14, TALL-1, TALL-101, TALL-103/2, TALL-104, TALL-105, TALL-106, TALL-107, TALL-197, TK-6, TLBR-1, -2, -3 및 -4, CCRF-HSB-2(CCL-120.1), J.RT3-T3.5(ATCC TIB-153), J45.01(ATCC CRL-1990), J.CaM1.6(ATCC CRL-2063), RS4;11(ATCC CRL-1873), CCRF-CEM(ATCC CRM-CCL-119); 및 피부 T-세포 림프종 세포주, 예를 들면, HuT78(ATCC CRM-TIB-161), MJ[G11](ATCC CRL-8294), HuT102(ATCC TIB-162)를 포함한다. 이로서 한정되지 않지만, REH, NALL-1, KM-3, L92-221을 포함하는 눌 백혈병 세포주는 기타 백혈병 및 림프종, 예를 들면, K562 적백혈병, THP-1 단핵구 백혈병, U937 백혈병, HEL 적백혈병, HL60 백혈병, HMC-1 백혈병, KG-1 백혈병, U266 골수종으로부터 유래된 세포주이다. 이러한 상업적으로 입수가능한 세포주에 대한 비제한적 예시적 공급원은 아메리칸 타입 컬쳐 컬렉션(The American Type Culture Collection, 또는 ATCC, (www.atcc.org/)) 및 미생물 및 세포 배양물의 독일 컬렉션(the German Collection of Microorganisms and Cell Cultures (https://www.dsmz.de/))을 포함한다.
본원에 사용된 바와 같이, 천연 킬러 세포로서 또한 공지된 용어 "NK 세포"는 골수에서 기원하고 자연 면역계에서 중요한 역할을 담당하는 림파구의 종류를 지칭한다. NK 세포는, 세포 표면 상에 항체 및 주요 조직접합성 복합체의 부재하에도 바이러스-감염된 세포, 종양 세포 또는 기타 스트레스 세포에 대하여 신속한 면역 반응을 제공한다. NK-92(ATCC, CRL-2407) 및 NKL(문헌[참조: Robertson et al. (1996) 24(3):406-414]에 기재됨)은 NK 세포의 구체적 예이다. NK 세포는 상업적으로 이용가능한 공급원으로부터 단리하거나 수득할 수 있다. 상업적 NK 세포주의 비-제한적 예는 세포주 NK-92(ATCC® CRL-2407™), NK-92MI(ATCC® CRL-2408™)를 포함한다. 추가의 예는, 이로써 한정되지 않지만, NK 세포주 HANK1, KHYG-1, NKL, NK-YS, NOI-90 및 YT를 포함한다. 이러한 상업적으로 이용가능한 세포주에 대한 비제한적 예시적 공급원은 아메리칸 타입 컬쳐 컬렉션(The American Type Culture Collection, 또는 ATCC, (www.atcc.org/)) 및 미생물 및 세포 배양물의 독일 컬렉션(the German Collection of Microorganisms and Cell Cultures (https://www.dsmz.de/))을 포함한다.
본원에 사용된 바와 같이, 용어 "핵산 서열" 및 "폴리뉴클레오티드"는 임의 길이의 뉴클레오티드의 고분자 형태, 리보뉴클레오티드 또는 데옥시리보뉴클레오티드를 지칭하기 위해 호환적으로 사용된다. 따라서, 이 용어는, 이로써 한정되지 않지만, 단일-, 이중- 또는 다중-사슬 DNA 또는 RNA, 게놈 DNA, cDNA, DNA-RNA 하이브리드, 또는 퓨린 및 피리미딘 염기 또는 기타 천연, 화학적 또는 생화학적으로 변형된, 비-천연 또는 유도체화된 뉴클레오티드 염기를 포함하는 고분자를 포함한다.
핵산 서열에 적용되는 용어 "코딩하는"은, 이의 천연 상태에서 또는 당해 기술분야의 숙련가에게 공지된 방법에 의해 조작되는 경우, 폴리펩티드 및/또는 이의 단편에 대해 mRNA를 생성하도록 전사 및/또는 번역될 수 있는 폴리펩티드를 "코딩"하는 것으로 언급되는 폴리뉴클레오티드를 지칭한다. 안티센스 사슬은 이러한 핵산의 상보체이고, 코딩 서열은 이로부터 추정될 수 있다.
본원에 사용된 바와 같이, 용어 신호 펩티드 또는 신호 폴리펩티드는 새롭게 합성된 분비 또는 막 폴리펩티드 또는 단백질의 N-말단 단부에 통상 존재하는 아미노산 서열을 의도한다. 이는 세포 막을 가로질로 또는 세포 막 내로 폴리펩티드를 지시하도록 작용하고, 이어서 후속적으로 제거된다. 이의 예는 당해 기술분야에 공지되어 있다. 비-제한적 예는 미국 특허 제8,853,381호 및 제5,958,736호에 기재된 것들이다.
본원에 사용된 바와 같이, 용어 "벡터"는, 이로써 한정되지 않지만, 플라스미드, 바이러스, 코스미드, 파지, BAC, YAC 등을 포함하는, 상이한 숙주 사이의 전송을 위해 설계된 핵산 작제물을 지칭한다. 일부 실시형태에서, 플라스미드 벡터는 상업적으로 이용가능한 벡터로부터 제조할 수 있다. 기타 실시형태에서, 바이러스 벡터는 바쿨로바이러스, 레트로바이러스, 아데노바이러스, AAV 등으로부터 당해 기술분야에 공지된 기술에 따라 생성할 수 있다. 한 가지 실시형태에서, 바이러스 벡터는 렌티바이러스 벡터이다.
본원에 사용된 용어 "프로모터"는 유전자 등의 코딩 서열의 발현을 조절하는 임의의 서열을 지칭한다. 프로모터는, 예를 들면, 구성적, 유도성, 억제성 또는 조직-특이적일 수 있다. "프로모터"는, 전사 개시 및 속도가 조절되는 폴리뉴클레오티드 서열의 영역인 조절 서열이다. 이는, 조절 단백질 및 분자가 결합할 수 있는 유전적 요소, 예를 들면, RNA 폴리머라제 및 기타 전사 인자를 함유할 수 있다.
본원에 사용된 바와 같이, 용어 "단리된 세포"는 일반적으로 조직의 다른 세포로부터 실질적으로 분리되는 세포를 지칭한다. "면역 세포"는, 예를 들면, 골수에서 생성된 조혈 줄기 세포(HSC)로부터 유래하는 백혈구 세포(백혈구), 림파구(T 세포, B 세포, 천연 킬러(NK) 세포) 및 골수-유래 세포(호중구, 호산구, 호염기구, 단핵구, 마크로파지, 수지상 세포)를 포함한다. "T 세포"는 T-헬퍼 세포(CD4+ 세포), 세포독성 T-세포(CD8+ 세포), 천연 킬러 T-세포, T-조절 세포(Treg) 및 감마-델타 T 세포를 포함하여 CD3을 발현하는 모든 타입의 면역 세포를 포함한다. "세포독성 세포"는, 세포가 세포독성 반응을 매개할 수 있는 CD8+ T 세포, 천연-킬러(NK) 세포 및 호중구를 포함한다.
본원에 사용된 바와 같이, 용어 "단리된 세포"는 일반적으로 조직의 다른 세포로부터 실질적으로 분리되는 세포를 지칭한다. 이 용어는 원핵세포 및 진핵세포를 포함한다.
"면역 세포"는, 예를 들면, 골수에서 생성된 조혈 줄기 세포(HSC)로부터 유래하는 백혈구 세포(백혈구), 림파구(T 세포, B 세포, 천연 킬러(NK) 세포) 및 골수-유래 세포(호중구, 호산구, 호염기구, 단핵구, 마크로파지, 수지상 세포)를 포함한다. "T 세포"는 T-헬퍼 세포(CD4+ 세포), 세포독성 T-세포(CD8+ 세포), 천연 킬러 T-세포, T-조절 세포(Treg) 및 감마-델타 T 세포를 포함하여 CD3을 발현하는 모든 타입의 면역 세포를 포함한다. "세포독성 세포"는, 세포가 세포독성 반응을 매개할 수 있는 CD8+ T 세포, 천연-킬러(NK) 세포 및 호중구를 포함한다.
키메라 항원 수용체 세포의 생성에 적용되는 용어 "형질도입하다" 또는 "형질도입"은 외래 뉴클레오티드 서열을 세포 내로 도입하는 프로세스를 지칭한다. 일부 실시형태에서, 이러한 형질도입은 벡터를 통해 수행된다.
본원에 사용된 바와 같이, 세포와 관련하여, 용어 "자기유래"는, 단리되고 동일한 대상체(수용자 또는 숙주)로 다시 주입되는 세포를 지칭한다. "동종"은 비-자기유래 세포를 지칭한다.
"유효량" 또는 "유효한 양"은, 포유동물 또는 기타 대상체의 치료를 위해 투여되는 경우, 질환에 대한 이러한 치료를 달성하기에 충분한 약제의 양 또는 2개 이상의 약제의 조합된 양을 지칭한다. "유효량"은 약제(들), 질환 및 이의 중증도 및 치료되는 대상체의 연령, 체중 등에 따라 달라질 것이다.
본원에 사용된 바와 같이, 용어 "암"은, 신체의 다른 부분으로 침입 또는 확산할 가능성을 갖는 이상 세포를 수반하는 질환 그룹 중의 어느 하나를 지칭한다. 암은 대상체 신체의 상이한 부분에 영향을 미칠 수 있다. 암의 비-제한적 예는 유방암, 난소암, 백혈병, 림프종, 교아세포종 및 성상세포종을 포함한다. 특정 실시형태에서, 뇌에서 발생하는 신체의 다른 부분으로부터 뇌 및/또는 암의 전이에서 기원하는 암은 본 발명과 관련된다. 예를 들면, "교아세포종"(GB)은 고도로 악성인 성상세포로부터 발생하는 종양이고, 이는 세포와 혈관신생의 신속한 재생 때문인 것으로 의심된다. "고형 종양"은 낭포 또는 액체 영역을 통상 함유하지 않는 조직의 이상 매쓰이다. 고형 종양은 양성 또는 악성일 수 있다. 고형 종양의 상이한 타입은 이들을 형성하는 세포의 타입에 대해 명명된다. 고형 종양의 예는 육종, 암종 및 림파종을 포함한다.
본원에 사용된 바와 같이, 용어 "포함하는"은 조성물 및 방법이 인용된 요소를 포함하는 것을 의미하는 것으로 의도되지만, 다른 것을 배제하는 것은 아니다. 조성물 및 방법을 정의하기 위해 사용되는 경우, "본질적으로 이루어지는"은 의도된 사용을 위한 조합에 대해 임의의 중요한 기타 필수 요소를 배제하는 것을 의미한다. 예를 들면, 본원에 정의된 요소로 본질적으로 이루어진 조성물은 단리 및 정제 방법으로부터 미량의 오염물 및 약제학적으로 허용되는 담체, 예를 들면, 인산염 완충된 염수, 보존제 등을 배제하지 않는다. "이루어진"은 본원에 개시된 조성물을 투여하기 위한 기타 성분 및 실질적 방법 단계의 미량 원소 이상을 배제하는 것을 의미한다. 이들 이행 용어의 각각에 의해 정의된 양태는 본 발명의 범위 내이다.
본원에 사용된 바와 같이, 용어 "검출가능한 마커"는 검출가능한 신호를 직접 또는 간접적으로 생성할 수 있는 적어도 하나의 마커를 지칭한다. 이러한 마커의 비-망라적 목록은, 예를 들면, 비색, 형광, 발광에 의해 검출가능한 신호를 생성하는 효소, 예를 들면, 호세라디쉬 퍼옥시다제, 알칼리 포스파타제, β-갈라토시다제, 글루코즈-6-포스페이트 데하이드로게나제, 발색단, 예를 들면, 형광, 발광 염료, 전자 현미경 또는 전자적 특성, 예를 들면, 전도도, 전류계, 전압전류, 임피던스에 의해 검출되는 전자 밀도를 갖는 그룹, 검출가능한 분자, 예를 들면, 이들의 물리적 및/또는 화학적 특성에서 검출가능한 변형을 유도하기에 충분한 크기를 갖는 분자를 포함하고, 이러한 검출은 광학적 방법, 예를 들면, 회절, 표면 플라스몬 공명, 표면 변화, 접촉각 변화 또는 물리적 방법, 예를 들면, 원자간력 분광법, 터널 효과, 또는 방사선활성 분자, 예를 들면, 32P, 35S 또는 125I에 의해 달성할 수 있다.
본원에 사용된 바와 같이, 용어 "정제 마커"는 정제 또는 동정에 유용한 적어도 하나의 마커를 지칭한다. 이러한 마커의 비-망라적 목록은 His, lacZ, GST, 말토즈-결합 단백질, NusA, BCCP, c-myc, CaM, FLAG, GFP, YFP, 체리, 티오레독신, 폴리(NANP), V5, Snap, HA, 키틴-결합 단백질, Softag 1, Softag 3, Strep 또는 S-단백질을 포함한다. 적합한 직접 또는 간접 형광 마커는 FLAG, GFP, YFP, RFP, dTomato, 체리, Cy3, Cy 5, Cy 5.5, Cy 7, DNP, AMCA, 비오틴, 디곡시게닌, 탐라(Tamra), 텍사스 레드(Texas Red), 로다민, 알렉사 플루오르(Alexa fluors), FITC, TRITC 또는 임의의 기타 형광 염료 또는 합텐을 포함한다.
본원에 사용된 바와 같이, 용어 "발현"은 폴리뉴클레오티드를 mRNA로 전사시키는 프로세스 및/또는 전사된 mRNA를 후속적으로 펩티드, 폴리펩티드 또는 단백질로 번역하는 프로세스를 지칭한다. 폴리뉴클레오티드가 게놈 DNA로부터 유래하는 경우, 발현은 진핵세포에서 mRNA의 스플라이싱을 포함할 수 있다. 유전자의 발현 수준은 세포 또는 조직 샘플에서 mRNA 또는 단백질의 양을 측정함으로써 결정할 수 있다. 한 가지 양태에서, 하나의 샘플로부터 유전자의 발현 수준은 대조군 또는 참조 샘플로부터 유전자의 발현 수준과 직접 비교할 수 있다. 또 다른 양태에서, 하나의 샘플로부터 유전자의 발현 수준은 화합물의 투여 후에 동일한 샘플로부터 유전자의 발현 수준과 직접 비교할 수 있다.
본원에 사용된 바와 같이, "상동성" 또는 "동일한", 퍼센트 "동일성" 또는 "유사성"은, 2개 이상의 핵산 또는 폴리펩티드 서열의 문맥에서 사용되는 경우, 동일하거나 특정한 비율의 동일한 뉴클레오티드 또는 아미노산 잔기를 갖는, 예를 들면, 특정한 영역에 걸쳐 적어도 60% 동일성, 바람직하게는 적어도 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 그 이상의 동일성을 갖는 2개 이상의 서열 또는 아서열을 지칭한다(예를 들면, 본원에 기재된 항체를 코딩하는 뉴클레오티드 서열 또는 본원에 기재된 항체의 아미노산 서열). 상동성은 비교 목적을 위해 정렬시킬 수 있는 각각의 서열에서 위치를 비교함으로써 결정할 수 있다. 비교된 서열 중의 위치가 동일한 염기 또는 아미노산에 의해 점유되는 경우, 분자는 당해 위치에서 상동성이다. 서열 사이의 상동성 정도는 서열에 의해 공유된 정합 또는 상동성 위치의 수의 함수이다. 정렬 및 퍼센트 상동성 또는 서열 동일성은 당해 기술분야에 공지된 소프트웨어 프로그램, 예를 들면, 문헌[참조: Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) Supplement 30, section 7.7.18, Table 7.7.1]에 기재된 것들을 사용하여 측정할 수 있다. 바람직하게는, 디펄트 파라미터가 정렬에 사용된다. 바람직한 정렬 프로그램은 디펄트 파라미터를 사용하는 BLAST이다. 특히, 바람직한 프로그램은 하기 디펄트 파라미터를 사용하는 BLASTN 및 BLASTP이다: 유전 코드 = 표준; 필터 = 없음; 사슬 = 양방; 컷오프 = 60; 예상 = 10; 매트릭스 = BLOSUM62; 기재 = 50 서열; 분류 = HIGH SCORE; 데이터베이스 = 비-중복, GenBank + EMBL + DDBJ + PDB + GenBank CDS 번역 + SwissProtein + SPupdate + PIR. 이들 프로그램의 상세는 하기 인터넷 주소에서 발견할 수 있다: ncbi.nlm.nih.gov/cgi-bin/BLAST. 용어 "상동성" 또는 "동일성", 퍼센트 "동일성" 또는 "유사성"은 또한 시험 서열의 상보체를 지칭하거나 이에 적용될 수 있다. 이 용어는 또한 치환을 갖는 것들 뿐만 아니라 결실 및/또는 부가를 갖는 서열을 포함한다. 본원에 기재된 바와 같이, 바람직한 알고리즘은 갭 등을 고려할 수 있다. 바람직하게는, 동일성은 적어도 약 25개 아미노산 또는 뉴클레오티드 길이의 영역, 보다 바람직하게는 적어도 50 내지 100개 아미노산 또는 뉴클레오티드 길이의 영역에 걸쳐 존재한다. "무관계" 또는 "비-상동성" 서열은 본원에 개시된 서열 중의 하나와 40% 미만의 동일성, 또는 25% 미만의 동일성을 공유한다.
문구 "제1 선택" 또는 제2 선택" 또는 "제3 선택"은 환자에 의해 수용된 치료 순서를 지칭한다. 제1 라인 요법(line therapy) 섭생은 최초로 제공된 치료이고, 제2 또는 제3 라인 요법은 각각 제1 라인 요법 또는 제2 라인 요법 후에 제공된다. 국립 암 연구소는 제1 라인 요법을 "질환 또는 병태에 대한 제1 치료"로서 정의한다. 암을 갖는 환자에서, 1차 치료는 수술, 화학요법, 방사선 요법 또는 이들 요법의 조합일 수 있다. 제1 라인 요법은 또한 당해 기술분야의 숙련가에게 "1차 요법 및 1차 치료"로서 지칭된다[참조: National Cancer Institute website at www.cancer.gov, last visited on May 1, 2008]. 전형적으로, 환자는, 환자가 제1 라인 요법에 대해 양성 임상적 또는 부임상적 반응을 나타내지 않거나 제1 라인 요법이 중단되었기 때문에 후속 화학요법이 제공된다.
한 가지 양태에서, 항체 또는 이의 단편의 용어 "등가물" 또는 "생물학적 등가물"은 ELISA 또는 기타 적합한 방법에 의해 측정된 바와 같이 이의 에피토프 단백질 또는 이의 단편에 선택적으로 결합하는 항체의 능력을 의미한다. 생물학적 등가물 항체는, 이로써 한정되지 않지만, 참조 항체와 동일한 에피토프에 결합하는 항체, 펩티드, 항체 단편, 항체 변이체, 항체 유도체 및 항체 모방체를 포함한다.
이는, 명시적 인용 없이 추측되고 달리 의도되지 않는 한, 본 발명이 폴리펩티드, 단백질, 폴리뉴클레오티드 또는 항체와 관련되는 경우, 등가물 또는 이의 생물학적 등가물은 본 발명의 범위 내인 것으로 의도된다. 본원에 사용된 바와 같이, 용어 "이의 생물학적 등가물"은, 참조 단백질, 항체, 폴리펩티드 또는 핵산을 지칭하는 경우, "이의 등가물"과 동의어인 것으로 의도되고, 목적하는 구조 또는 기능을 여전히 유지하면서 최소 상동성을 갖는 것들을 의도한다. 본원에서 구체적으로 열거하지 않는 한, 이는 본원에 언급된 임의의 폴리뉴클레오티드, 폴리펩티드 또는 단백질이 또한 이의 등가물을 포함하는 것으로 의도된다. 예를 들면, 등가물은 적어도 약 70% 상동성 또는 동일성, 또는 적어도 80% 상동성 또는 동일성, 및 달리는 적어도 약 85% 또는 달리는 적어도 약 90%, 또는 달리는 적어도 약 95%, 또는 달리는 98% 퍼센트 상동성 또는 동일성을 의도하고, 참조 단백질, 폴리펩티드 또는 핵산에 대해 실질적으로 등가의 생물학적 활성을 나타낸다. 또는, 폴리뉴클레오티드를 지칭하는 경우, 이의 등가물은 참조 폴리뉴클레오티드 또는 이의 상보체에 대해 엄격한 조건하에 하이브리드화하는 폴리뉴클레오티드이다.
또 다른 서열에 대한 "서열 동일성"의 특정 퍼센트(예를 들면, 80%, 85%, 90% 또는 95%)를 갖는 폴리뉴클레오티드 또는 폴리뉴클레오티드 영역(또는 폴리펩티드 또는 폴리펩티드 영역)은, 정렬되는 경우, 염기(또는 아미노산)의 퍼센트가 2개 서열을 비교할 때에 동일한 것을 의미한다. 정렬 및 퍼센트 상동성 또는 서열 동일성은 당해 기술분야에 공지된 소프트웨어 프로그램, 예를 들면, 문헌[참조: Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) Supplement 30, section 7.7.18, Table 7.7.1]에 기재된 것들을 사용하여 결정할 수 있다. 바람직하게는, 디펄트 파라미터가 정렬에 사용된다. 바람직한 정렬 파라미터는 디펄트 파라미터를 사용하는 BLAST이다. 특히, 바람직한 프로그램은 하기 디펄트 파라미터를 사용하는 BLASTN 및 BLASTP이다: 유전 코드 = 표준; 필터 = 없음; 사슬 = 양방; 컷오프 = 60; 예상 = 10; 매트릭스 = BLOSUM62; 기재 = 50 서열; 분류 = HIGH SCORE; 데이터베이스 = 비-중복, GenBank + EMBL + DDBJ + PDB + GenBank CDS 번역 + SwissProtein + SPupdate + PIR. 이들 프로그램의 상세는 하기 인터넷 주소에서 발견할 수 있다: ncbi.nlm.nih.gov/cgi-bin/BLAST.
"하이브리드화"는, 하나 이상의 폴리뉴클레오티드가 반응하여 뉴클레오티드 잔기의 염시 사이의 수소 결합을 통해 안정화되는 복합체를 형성하는 반응을 지칭한다. 수소 결합은 왓슨-크릭 염기 짝짓기, 호그스타인 결합 또는 임의의 기타 서열-특이적 방식으로 발생할 수 있다. 복합체는 이중쇄 구조를 형성하는 2개의 사슬, 복수-사슬 복합체를 형성하는 3개 이상의 사슬, 단일-자가 하이브리드화 사슬, 또는 이들의 임의의 조합을 포함할 수 있다. 하이브리드화 반응은 보다 광범위한 프로세스의 단계, 예를 들면, PCR 반응의 개시, 또는 리보자임에 의한 폴리뉴클레오티드의 효소적 절단을 구성할 수 있다.
엄격한 하이브리드화 조건의 예는 약 25℃ 내지 약 37℃의 인큐베이션 온도; 약 6× SSC 내지 약 10× SSC의 하이브리드화 완충액 농도; 약 0% 내지 약 25%의 포름아미드 농도; 및 약 4× SSC 내지 약 8× SSC의 세척 용액을 포함한다. 중간 하이브리드화 조건의 예는 약 40℃ 내지 약 50℃의 인큐베이션 온도; 약 9× SSC 내지 약 2× SSC의 완충액 농도; 약 30% 내지 약 50%의 포름아미드 농도; 및 약 5× SSC 내지 약 2× SSC의 세척 용액을 포함한다. 고 엄격성 조건의 예는 약 55℃ 내지 약 68℃의 인큐베이션 온도; 약 1× SSC 내지 약 0.1× SSC의 완충액 농도; 약 55% 내지 약 75%의 포름아미드 농도; 및 약 1× SSC, 0.1× SSC 또는 탈이온수의 세척 용액을 포함한다. 일반적으로, 하이브리드화 인큐베이션 시간은 1, 2 또는 그 이상의 세척 단계와 함께 5분 내지 24시간이고, 세척 인큐베이션 시간은 약 1, 2 또는 15분이다. SSC는 0.15M NaCl 및 15mM 시트레이트 완충액이다. 기타 완충 시스템을 사용한 SSC의 등가물이 사용될 수 있는 것으로 이해된다.
"종양 조직 타입에 상응하는 정상 세포"는 종양 조직과 동일한 조직 타입의 정상 세포를 지칭한다. 비-제한적 예는 폐 종양을 갖는 환자의 정상 폐 세포, 또는 결장 종양을 갖는 환자의 정상 결장 세포이다.
본원에 사용된 용어 "단리된"은 기타 물질을 실질적으로 포함하지 않는 분자 또는 생물 또는 세포 물질을 지칭한다. 한 가지 양태에서, 용어 "단리된"은, 천연 공급원에 존재하는 다른 DNA 또는 RNA, 또는 단배질 또는 폴리펩티드, 또는 세포 또는 세포 기관, 또는 조직 또는 기관으로부터 각각 분리된, 핵산, 예를 들면, DNA 또는 RNA, 또는 단백질 또는 폴리펩티드(예를 들면, 항체 또는 이의 유도체), 또는 세포 또는 세포 기관, 또는 조직 또는 기관을 지칭한다. 용어 "단리된"은 또한, 재조합 DNA 기술에 의해 생성되는 경우, 세포 물질, 바이러스 물질 또는 배양 배지, 또는 화학적으로 합성되는 경우, 화학적 전구체 또는 기타 화학물질을 실질적으로 함유하지 않는 핵산 또는 펩티드를 지칭한다. 더욱이, "단리된 핵산"은, 단편으로서 천연에 존재하지 않고 천연 상태로 발견되지 않는 핵산 단편을 포함하는 것을 의미한다. 용어 "단리된"은 기타 세포 단백질로부터 단리되는 폴리펩티드를 지칭하기 위해 본원에서 사용되고, 정제된 및 재조합 폴리펩티드를 포함하는 것을 의미한다. 용어 "단리된"은 또한 다른 세포 또는 조직으로부터 단리되는 세포 또는 조직을 지칭하기 위해 본원에서 사용되고, 배양된 및 조작된 세포 또는 조직을 포하하는 것을 의미한다.
본원에 사용된 바와 같이, 용어 "모노클로날 항체"는, B-림파구의 단일 클론에 의해, 또는 단일 항체의 경쇄 및 중쇄 유전자가 형질감염된 세포에 의해 생성된 항체를 지칭한다. 모노클로날 항체는 당해 기술분야의 숙련가에게 공지된 방법, 예를 들면, 골수종 세포와 면역 비장 세포와의 융합으로부터 하이브리드 항체-형성 세포를 제조함으로써 생성된다. 모노클로날 항체는 인간화된 모노클로날 항체를 포함한다.
용어 "단백질", "펩티드" 및 "폴리펩티드"는 2개 이상의 아단위 아미노산, 아미노산 유사체 또는 펩티드모방체의 화합물을 지칭하기 위해 호환적으로 및 이들의 최광의로 사용된다. 아단위는 펩티드 결합에 의해 연결될 수 있다. 또 다른 양태에서, 아단위는 다른 결합, 예를 들면, 에스테르, 에테르 등에 의해 연결될 수 있다. 단백질 또는 펩티드는 적어도 2개의 아미노산을 함유해야 하고, 단백질 또는 펩티드 서열을 포함할 수 있는 아미노산의 최대 수에는 제한이 없다. 본원에 사용된 바와 같이, 용어 "아미노산"은, 글리신 및 D 및 L 광학 이성체, 아미노산 유사체 및 펩티드모방체를 포함하는 천연 및/또는 비천연 또는 합성 아미노산을 지칭한다.
용어 "폴리뉴클레오티드" 및 "올리고뉴클레오티드"는 호환적으로 사용되고, 임의 길이의 뉴클레오티드의 고분자 형태, 데옥시리보뉴클레오티드 또는 리보뉴클레오티드 또는 이의 유사체를 지칭한다. 폴리뉴클레오티드는 임의의 3차원 구조를 가질 수 있고, 공지되거나 미지의 임의의 기능을 수행할 수 있다. 다음은 폴리뉴클레오티드의 비제한적 예이다: 유전자 또는 유전자 단편(예를 들면, 프로브, 프라이머, EST 또는 SAGE 태그), 엑손, 인트론, 메신저 RNA(mRNA), 전이 RNA, 리보솜 RNA, RNAi, 리보자입, cDNA, 재조합 폴리뉴클레오티드, 분지된 폴리뉴클레오티드, 플라스미드, 벡터, 임의 서열의 단리된 DNA, 임의 서열의 단리된 RNA, 핵산 프로브 및 프라이머. 폴리뉴클레오티드는 변형된 뉴클레오티드, 예를 들면, 메틸화된 뉴클레오티드 및 뉴클레오티드 유사체를 포함할 수 있다. 존재하는 경우, 뉴클레오티드 구조에 대한 변형은 폴리뉴클레오티드의 조립 전후에 부여할 수 있다. 뉴클레오티드의 서열은 비-뉴클레오티드 성분에 의해 차단될 수 있다. 폴리뉴클레오티드는 중합 후에, 예를 들면, 표지 성분과의 접합에 의해 추가로 변형시킬 수 있다. 이 용어는 또한 이중 및 단일 쇄 분자 둘 다를 지칭한다. 달리 명시되거나 요구되지 않는 한, 폴리뉴클레오티드인 이러한 기술의 임의의 양태는 이중 쇄 형태를 구성하는 것으로 공지되거나 예측된 이중-쇄 형태 및 각각의 2개 상보성 단일-쇄 형태 둘 다를 포함한다.
본원에 사용된 바와 같이, 용어 "정제된"은 절대적 순도를 필요로 하지 않고; 오히려, 이는 상대적 용어로서 의도된다. 따라서, 예를 들면, 정제된 핵산, 펩티드, 단백질, 생물학적 복합체 또는 기타 활성 화합물은 단백질 또는 기타 오염물로부터 완전히 또는 부분적으로 단리된 것이다. 일반적으로, 본 발명 내에서 사용하기 위한 실질적으로 정제된 펩티드, 단백질, 생물학적 복합체 또는 기타 활성 화합물은, 치료학적 투여를 위한 완전한 약제학적 제형으로 약제학적 담체, 부형제, 완충액, 흡수 증강제, 안정화제, 보존제, 애주번트 또는 기타 보조-성분과 함께 펩티드, 단백질, 생물학적 복합체 또는 기타 활성 화합물의 혼합 또는 제형화 전에 제제에 존재하는 모든 거대분자 종의 80% 이상을 포함한다. 보다 전형적으로, 펩티드, 단백질, 생물학적 복합체 또는 기타 활성 화합물은 기타 제형 성분과의 혼합 전에 정제된 제제에 존재하는 모든 거대분자 종의 90% 초과, 종종 95% 초과를 나타내도록 정제된다. 다른 경우에, 정제된 제제는 본질적으로 균질할 수 있고, 여기서 다른 거대분자 종은 통상의 기술에 의해 검출할 수 없다.
본원에 사용된 바와 같이, 용어 "특이적 결합"은 적어도 106M의 결합 친화도를 갖는 항체와 항원 사이의 접촉을 의미한다. 특정 양태에서, 항체는 적어도 약 107M, 및 바람직하게는 108M, 109M, 1010M, 1011M 또는 1012M의 친화도로 결합한다.
본원에 사용된 바와 같이, 용어 "재조합 단백질"은 재조합 DNA 기술에 의해 생성되는 폴리펩티드를 지칭하고, 여기서, 일반적으로, 폴리펩티드를 코딩하는 DNA는, 이종성 단백질을 생성하기 위해 숙주 세포의 형질전환에 또한 사용되는 적합한 발현 벡터 내로 삽입된다.
본원에 사용된 바와 같이, 대상체에서 질환의 "치료하는" 또는 "치료"는 (1) 소인이 있거나 질환의 증상을 나타내지 않는 대상체에서 증상 또는 질환이 발생하는 것을 예방하는 것; (2) 질환을 억제하거나 이의 진행을 저지하는 것; 또는 (3) 질환 또는 질환 증상을 개선하거나 이의 퇴행을 유도하는 것을 포함한다. 당해 기술분야에서 이해되는 바와 같이, "치료"는 임상 결과를 포함하는 유익한 또는 목적하는 결과를 수득하는 접근법이다. 본 발명의 목적을 위해, 유익한 또는 목적하는 결과는, 검출가능하거나 검출불가능하든지, 이로써 한정되지 않지만, 하나 이상의 증상의 경감 또는 개선, 병태(질환 포함) 정도의 감소, 병태(질환 포함)의 안정화된(즉, 악화되지 않음) 상태, 병태(질환 포함)의 지연 또는 감속, 병태(질환 포함)의 진행, 관해 또는 완화, 상태 및 관해(부부적 또는 전체) 중의 하나 이상을 포함한다.
본원에 사용된 바와 같이, 세포, 조직 또는 기관과 관련하여 용어 "과발현하다"는 대조군 세포, 대조군 조직 또는 기관에서 생성되는 양보다 큰 양으로 단백질을 발현한다. 과발현되는 단백질은 숙주 세포에 대해 내인성이거나 숙주 세포에 대해 외인성일 수 있다.
본원에 사용된 바와 같이, 용어 "링커 서열"은, 1 내지 10회, 또는 달리는 약 8회, 또는 달리는 약 6회, 또는 달리는 약 5회, 또는 4회 또는 달리는 3회, 또는 달리는 2회 반복될 수 있는, 1 내지 10개 또는 달리는 8개 아미노산, 또는 달리는 6개 아미노산, 또는 달리는 5개 아미노산을 포함하는 임의의 아미노산 서열에 관한 것이다. 링커 서열의 비제한적 예는 당해 기술분야에 공지되어 있고, 예를 들면, GGGGSGGGGSGGGG; 트리펩티드 EFM; 또는 Glu-Phe-Gly-Ala-Gly-Leu-Val-Leu-Gly-Gly-Gln-Phe-Met이다.
본원에 사용된 바와 같이, 용어 "인핸서"는 발현되는 핵산 서열과 관련하여 이의 위치 및 배향과 무관하게 핵산 서열의 전사를 증대, 개선 또는 개량하는 서열 요소를 나타낸다. 인핸서는 단일 프로모터로부터 또는 동시에 하나 이상의 프로모터로부터 전사를 증강시킬 수 있다. 전사를 개선시키는 이러한 기능이 유지 또는 실질적으로 유지(예를 들면, 야생형 활성, 즉 전장 서열의 활성의 적어도 70%, 적어도 80%, 적어도 90% 또는 적어도 95%)되는 한, 야생형 인핸서 서열의 임의의 절단된, 돌연변이된 또는 달리 변형된 변이체도 또한 상기 정의 내에 있다.
본원에 사용된 바와 같이, 용어 "WPRE" 또는 "우드척 간염 바이러스(WHP) 전사후 조절 요소"는 이러한 명칭과 연관된 특정의 뉴클레오티드 단편, 및 본원에 제시된 WPRE 서열과 적어도 70%, 또는 달리는 적어도 80% 아미노산 서열 동일성, 바람직하게는 90% 서열 동일성, 보다 바람직하게는 적어도 95% 서열 동일성을 공유하는 유사한 생물학적 기능을 갖는 임의의 기타 분자를 지칭한다. 예를 들면, WPRE는 우드척 간염 바이러스 게놈 서열(GenBank Accession No. J04514)에 존재하는 인간 간염 B 바이러스 전사후 조절 요소(HBVPRE)와 유사한 영역을 지칭하고, 이러한게놈 서열의 위치 1093 내지 1684의 592개 뉴클레오티드는 전사후 조절 영역에 상응한다[참조: Journal of Virology, Vol. 72, p.5085-5092, 1998]. 레트로바이러스 벡터를 사용한 분석은 목적하는 유전자의 3'-말단 비번역된 영역 내로 삽입된 WPRE가 생성된 단백질의 양을 5 내지 8배 증가시키는 것을 나타냈다. 또한, WPRE의 도입은 mRNA 분해를 억제하는 것이 보고되었다[참조: Journal of Virology, Vol. 73, p.2886-2892, 1999]. 광의에서, mRNA를 안정화시킴으로써 아미노산 번역의 효율을 증가시키는 WPRE 등의 요소는 또한 인핸서인 것으로 생각된다.
바이러스와 관련하여 사용된 용어 "종양용해성"은 암 세포를 우선적으로 감염시키고 사멸시키는 바이러스를 기재한다. "헤르페스 바이러스"는, 이로써 한정되지 않지만, 단순 헤르페스 바이러스(HSV-1 및 HSV-2와 같음)를 포함하는 헤르페스비리다에(herpesviridae) 과의 임의의 멤버를 지칭한다. 비제한적 예시적 종양용해성 헤르페스 바이러스 및 이의 용도는 본원에 기재되어 있다. 예를 들면, G207, HSV1716, NV1020, 탈리모겐 라헤르파르벡(Talimogene laherparvec)("T-VEC" 또는 "Oncovex-GMCSF")은 모두 임상 시험에서 검증되어 있다[참조: Varghese et al. (2002) Cancer Gene Therapy. 9(12):967-978].
약어의 목록
CAR: 키메라 항원 수용체
IRES: 내부 리보솜 도입 부위
MFI: 평균 형광 강도
MOI: 감염 중복도
PBMC: 말초 혈액 단핵구 세포
PBS: 인산염 완충액 염수
scFv: 단일 사슬 가변 단편
GB: 교아세포종
BCBM: 유방암 뇌 전이
oHSV: 종양용해성 단순 헤르페스 바이러스
발명을 실시하는 방법
키메라
항원 수용체 및 이의 용도
조성물
본 발명은, 세포외 및 세포내 도메인을 포함하거나, 또는 이들로 본질적으로 이루어지거는, 야생형 및/또는 돌연변이체 EGFR에 결합하는 키메라 항원 수용체(CAR)을 제공한다. 세포외 도메인은, 달리는 항원 결합 도메인으로 지칭되는 표적-특이적 결합 요소를 포함한다. 세포내 도메인 또는 세포질 도메인은 공자극 신호전달 영역 및 제타 쇄 부분을 포함한다. CAR은 최대 300개 아미노산, 바람직하게는 10 내지 100개 아미노산, 보다 바람직하게는 25 내지 50개 아미노산의 스페이서 도메인을 임의로 추가로 포함할 수 있다. 한 가지 양태에서, 본 발명은, (a) 야생형 및/또는 돌연변이체 상피 성장 인자 수용체(EGFR)("wt EGFR 및/또는 돌연변이체 EGFR") 중의 어느 하나 또는 둘 다를 인식하는 항-EGFR 항체의 항원 결합 도메인; (b) 힌지 도메인 폴리펩티드; (c) 공자극 분자 또는 폴리펩티드; 및 (d) CD3 제타 신호전달 도메인을 포함하거나 또는 이들로 본질적으로 이루어지는 키메라 항원 수용체(CAR)를 제공한다.
항원 결합 도메인. 특정 양태에서, 본 발명은, 야생형 및/또는 돌연변이체 EGFR에 특이적인 항원 결합 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어지는, CAR을 제공한다. 한 가지 양태에서, 돌연변이체 EGFR은 EGFRvIII이다. 일부 실시형태에서, 항원 결합 도메인은 wt 및/또는 돌연변이체 EGFR 항체를 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어진다. 추가의 실시형태에서, 항원 결합 도메인은, 항원 결합 도메인 및 항-EGFR 항체를 또한 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들을 포함하는, 항-EGFR 항체의 중쇄 가변 영역 및 경쇄 가변 영역을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들을 포함한다. 항-EGFR 항체를 위한 경쇄 및 중쇄 가변 영역은 당해 기술분야에 공지되어 있고, 상기 기재되어 있다.
일부 실시형태에서, 항체의 중쇄 가변 영역은,
Q V Q L Q Q S G S E M A R P G A S V K L P C K A S G D T F T S Y W M H W V K Q R H G H G P E W I G N I Y P G S G G T N Y A E K F K N K V T L T V D R S S R T V Y M H L S R L T S E D S A V Y Y C T R S G G P Y F F D Y W G Q G T T L T V S S, 또는 이의 등가물, 또는
폴리펩티드:
gacattctaatgacccaatctccactctccctgcctgtcagtcttggagatcaagcctcctacctgcaaaggccaggccagtctccaaagctcctgatctacaaagtttccgaccgattttacctgcaaaggccaggccagtctccaaagctcctgatctacaaagtttccgaccgattttctggggtcccagacaggttcagtggcagtggatcagggacagatttcacactcaagatcagcagagtagaggctgaggatctgggaatttattactgctttcaaggttcacatattcctcccacgttcggaggggggaccaagctggaaatcaaacgtgcggcc에 의해 코딩된 폴리뉴클레오티드 또는 이의 등가물을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어진다.
폴리펩티드 또는 이의 각각의 등가물은 카복시 말단에서 추가의 50개 아미노산, 또는 달리는 약 40개 아미노산, 또는 달리는 약 30개 아미노산, 또는 달리는 약 20개 아미노산, 또는 달리는 약 10개 아미노산, 또는 달리는 약 5개 아미노산, 또는 달리는 약 4, 또는 3, 또는 2 또는 1개 아미노산을 수반할 수 있다.
다른 양태에서, LC 가변 영역은,
D I L M T Q S P L S L P V S L G D Q A S I S C R S S Q N I V H N N G I T Y L E W Y L Q R P G Q S P K L L I Y K V S D R F S G V P D R F S G S G S G T D F T L K I S R V E A E D L G I Y Y C F Q G S H I P P T F G G G T K L E I K R A A, 또는 이의 등가물, 또는
폴리뉴클레오티드:
caggtccagctgcagcagtctgggtctgagatggcgaggcctggagcttcagtgaagctgccctgcaaggcttctggcgacacattcaccagttactggatgcactgggtgaagcagaggcatggacatggccctgagtggatcggaaatatttatccaggtagtggtggtactaactacgctgagaagttcaagaacaaggtcactctgactgtagacaggtcctcccgcacagtctacatgcacctcagcaggctgacatctgaggactctgcggtctattattgtacaagatcggggggtccctacttctttgactactggggccaaggcaccactctcacagtctcctcc에 의해 코딩된 폴리펩티드, 또는 이의 등가물을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어진다.
폴리펩티드 또는 이의 각각의 등가물은 카복시-말단에서 추가의 50개 아미노산, 또는 달리는 약 40개 아미노산, 또는 달리는 약 30개 아미노산, 또는 달리는 약 20개 아미노산, 또는 달리는 약 10개 아미노산, 또는 달리는 약 5개 아미노산, 또는 달리는 약 4개, 3개, 또는 2개 또는 1개 아미노산을 수반할 수 있다.
이의 등가물은, CAR에 대해 적어도 80% 아미노산 동일성을 갖는 폴리펩티드, 또는 CAR을 코딩하는 폴리뉴클레오티드의 상보체에 대해 고 엄격성의 조건하에 하이브리드화하는 폴리뉴클레오티드에 의해 코딩된 폴리펩티드를 포함하고, 여기서 고 엄격성의 조건은 약 55℃ 내지 약 68℃의 인큐베이션 온도; 약 1× SSC 내지 약 0.1× SSC의 완충액 농도; 약 55% 내지 약 75%의 포름아미드 농도; 및 약 1×SSC, 0.1× SSC 또는 탈이온수의 세척 용액을 포함한다.
대안적 실시형태는 다른 EGFR 항체 CDR로부터의 적절한 CDR과 함께 LC 가변 영역으로부터의 하나 이상의 CDR(예: CDR1, CDR2, CDR3) 및 이의 각각의 등가물을 포함한다. 따라서 및 일례로서, LC 가변 영역으로부터의 CDR1 및 CDR2는 또 다른 항-EGFR 항체의 LC 가변 영역으로부터의 CDR3과 조합될 수 있고, 일부 양태에서 카복시-말단에서 추가의 50개 아미노산, 또는 달리는 약 40개 아미노산, 또는 달리는 약 30개 아미노산, 또는 달리는 약 20개 아미노산, 또는 달리는 약 10개 아미노산, 또는 달리는 약 5개 아미노산, 또는 달리는 약 4개, 또는 3개, 또는 2개 또는 1개 아미노산을 포함할 수 있다.
막관통 도메인. 막관통 도메인은 천연 공급원 또는 합성 공급원으로부터 유래할 수 있다. 공급원이 천연인 경우, 도메인은 임의의 막-결합된 또는 막관통 단백질로부터 유래할 수 있다. 본 발명에서 특정 용도의 막관통 영역은 CD8, CD28, CD3, CD45, CD4, CD5, CDS, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, TCR로부터 유래할 수 있다. 달리는, 막관통 도메인은 합성적일 수 있고, 이 경우에는 류신 및 발린 등의 주로 소수성 잔기를 포함할 것이다. 바람직하게는, 페닐알라닌, 트립토판 및 발린의 트리플렛은 합성 막관통 도메인의 각 말단에서 발견할 수 있다. 임의로, 바람직하게는 2 내지 10개 아미노산 길이의 짧은 올리고- 또는 폴리펩티드 링커는 CAR의 막관통 도메인과 세포질 신호전달 도메인 사이의 결합을 형성할 수 있다. 글리신-세린 더블렛은 특히 적합한 링커를 제공한다. 한 가지 양태에서, 막관통 도메인은 CD28 막관통 도메인이고, 이의 비-제한적 예는 상기 기재되어 있다. 또 다른 양태에서, 막관통 도메인은, CD8α 힌지 도메인에 연결되는 CD8α 막관통 도메인이다.
세포질 도메인. CAR의 세포질 도메인 또는 세포내 신호전달 도메인은 CAR이 위치되어 있는 면역 세포의 종래의 효과기 기능 중의 적어도 하나의 활성화에 관여한다. 세포내 신호전달 도메인은, 효과기 기능 신호를 전달하고 면역 세포가 이의 특정 기능을 실행하도록 지시하는 단백질의 부분을 지칭한다. 전체 신호전달 도메인 또는 이의 절단된 부분은, 절단된 부분이 효과기 기능 신호를 전달하기에 충분한 한 사용할 수 있다. 이의 유도체 또는 변이체 뿐만 아니라 TCR 및 공-수용체의 세포질 서열은 CAR에서 사용하기 위한 세포내 신호전달 도메인으로 기능할 수 있다. 본 발명에서 특정 용도의 세포내 신호전달 도메인은 CD8α, CD28, FcR, TCR, CD3, CDS, CD22, CD79a, CD79b, CD66d로부터 유래할 수 있다. TCR을 통해 생성된 신호는 T 세포의 전체 활성화를 위해 단독으로 불충분하기 때문에, 제2 또는 공-자극 신호가 요구될 수 있다. 따라서, 이로써 한정되지 않지만, CD8α, CD27, CD28, 4- IBB(CD137), OX40, CD30, CD40, PD-1, ICOS, 림파구 기능-연관 항원-1(LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3, 또는 CD83과 특이적으로 결합하는 리간드를 포함하는 공-자극 신호전달 분자의 세포내 영역이 CAR의 세포질 도메인에 또한 포함될 수 있다. 한 가지 양태에서, 세포내 도메인은 CD28 세포내 도메인이다. 또 다른 양태에서, 이는 CD8α 세포내 도메인이다.
일부 실시형태에서, 키메라 항원 수용체의 세포 활성화 모이어티는, CD8 단백질, CD28 단백질, 4-1BB 단백질 및 CD3-제타 단백질로 이루어진 그룹으로부터 선택된 하나 이상의 단백질 또는 이의 단편을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진 T-세포 신호전달 도메인이다.
특정 실시형태에서, CAR은 EGFR에 결합하는 항체의 항원 결합 도메인, 힌지 도메인, 공자극 신호전달 영역 및 CD3 제타 신호전달 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 이들로 이루어진다. 추가의 실시형태에서, 공자극 신호전달 영역은 CD28 공자극 신호전달 영역 및/또는 4-1BB 공자극 신호전달 영역 중의 어느 하나 또는 둘 다를 포함한다. CAR은 신호 폴리펩티드를 추가로 포함할 수 있다.
일부 실시형태에서, CAR은 검출가능한 마커 또는 정제 마커를 추가로 포함할 수 있다.
또한, 본원에는 EGFR CAR 및 EGFR 단백질 또는 이의 단편 및/또는 돌연변이체 EGFR 단백질 또는 이의 단편을 포함하는 단리된 복합체가 제공된다. 추가로, 본원에 기재된 바와 같은 CAR을 포함하는 단리된 복합체, wt EGFR 및/또는 돌연변이체 EGFR을 발현하는 세포가 제공된다.
폴리뉴클레오티드 및 숙주 세포
본 발명은 또한 상기 기재된 바와 같은 EGFR CAR을 코딩하는 단리된 핵산 및 이들 서열의 상보체를 제공한다. 핵산은 DNA, RNA 또는 변형된 핵산일 수 있다. 핵산은 벡터, 예를 들면, 플라스미드 또는 바이러스 벡터, 예를 들면, 렌티바이러스 벡터, 아데노바이러스 벡터, 또는 아데노-연관된 바이러스 벡터에 도입될 수 있다. 한 가지 양태에서, 벡터는 pCDH 벡터이다.
본 발명은 또한 본원에 기재된 바와 같은 EGFR CAR 또는 상기 CAR을 코딩하는 폴리뉴클레오티드 또는 이들의 상보체 또는 상기 폴리뉴클레오티드 또는 이들의 상보체를 포함하는 벡터를 포함하는 단리된 숙주 세포(원핵 또는 진핵)를 제공한다. 원핵세포의 비제한적 예는 T 세포, NK 세포, 줄기 세포, 293 T 세포, NK-92 세포 및 NKL 세포를 포함한다. 세포는 임의의 종, 예를 들면, 동물, 포유동물, 인간, 뮤린, 말, 소, 고양이 또는 개로부터 유래할 수 있다. 세포는 치료되는 환자로부터 단리될 수 있다. 따라서, 이들은 자기유래 또는 동종이계일 수 있다. 형질전환된 단리된 세포는 진단 또는 치료학적으로 사용될 수 있다.
단리된 핵산은 검출가능한 마커 또는 정제 마커를 추가로 포함할 수 있다. 핵산은 담체, 예를 들면, 고체 지지체 또는 약제학적으로 허용되는 담체와 조합될 수 있다. 이들은 본원에 기재된 CAR을 제조하는데 유용하다.
CAR을 제조하는 방법
본 발명의 양태는 EGFR CAR을 포함하는 단리된 세포 및 이러한 세포를 생산하는 방법에 관한 것이다. 세포는 원핵세포 또는 진핵세포이다. 한 가지 양태에서, 세포는 T 세포 또는 NK 세포이다. 진핵세포는 임의의 바람직한 종, 예를 들면, 동물 세포, 포유동물 세포, 예를 들면, 인간, 말, 고양이 또는 개 세포로부터 유래할 수 있다.
특정의 실시형태에서, 단리된 세포는, 야생형 EGFR 및/또는 돌연변이체 EGFR을 특이적으로 인식하는 항체의 항원 결합 도메인, 힌지 도메인, 공자극 분자(예: CD28 공자극 신호전달 영역 및/또는 4-1BB 공자극 신호전달 영역) 및 CD3 제타 신호전달 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어지는 외인성 CAR을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다. 특정 실시형태에서, 단리된 세포는 T-세포, 예를 들면, 동물 T-세포, 포유동물 T-세포, 고양이 T-세포, 개 T-세포 또는 인간 T-세포이다. 특정 실시형태에서, 단리된 세포는 NK-세포, 예를 들면, 동물 NK-세포, 포유동물 NK-세포, 고양이 NK-세포, 개 NK-세포 또는 인간 NK-세포이다.
특정 실시형태에서, EGFR CAR 발현 세포를 생산하는 방법은 (i) 세포 또는 단리된 세포의 모집단을 항-EGFR CAR을 코딩하는 핵산 서열로 형질도입하는 것을 포함하거나, 또는 달리는 이들로 본질적으로 이루어진다. 세포는 본원에 기재된 바이러스 벡터를 사용하거나 문헌[참조: Riet, et al. (2103) Meth. Mol. Biol. 969:187-201 entitled "Nonviral RNA transfection to transiently modify T cell with chimeric antigen receptors for adoptive therapy"]에 기재된 기술을 사용하여 형질도입시킬 수 있다. 추가의 양태에서, 상기 방법은 EGFR 결합 도메인을 발현하는 선택된 세포에 의해 CAR을 발현하는 세포를 선택하는 것을 추가로 포함한다. 선택은 세포 표면 상에서 발현된 EGFR 결합 도메인을 선택적으로 인식하고 이에 결합하는 항-EGFR 항체의 사용에 의해 달성할 수 있다. 일부 실시형태에서, 단리된 세포는, EGFR CAR T-세포를 생성하는, T-세포, 동물 T-세포, 포유동물 T-세포, 고양이 T-세포, 개 T-세포 또는 인간 T-세포이다. 특정 실시형태에서, 단리된 세포는, EGFR CAR NK-세포를 생성하는, NK-세포, 예를 들면, 동물 NK-세포, 포유동물 NK-세포, 고양이 NK-세포, 개 NK-세포 또는 인간 NK-세포이다.
T 또는 NK 세포의 공급원. 본 발명의 T 세포의 확장 및 유전적 변형 전에, T 세포의 공급원을 대상체 또는 배양물로부터 수득할 수 있다. T 세포는, 말초 혈액 단핵 세포, 골수, 림프절 조직, 제대혈, 흉선 조직, 감염 부위의 조직, 복수, 흉수, 비장 조직 및 종양을 포함하는, 대상체의 다수의 공급원으로부터 수득할 수 있다.
관련 세포를 단리하는 방법은 당해 기술분야에 공지되어 있고, 본 발명에 용이하게 적용할 수 있다. 예시적 방법은 하기 실시예에 기재되어 있다. 본 발명과 관련하여 사용하는 단리 방법은, 이로서 한정되지 않지만, Life Technologies Dynabeads® 시스템; STEMcell Technologies EasySep™, RoboSep™, RosetteSep™, SepMate™; Miltenyi Biotec MACS™ 세포 분리 키트, 및 기타 상업적으로 이용가능한 분리 및 단리 키트를 포함한다. 면역 세포의 특정 아집단은 비드, 또는 고유 세포 표면 마커에 특이적인 이러한 키트에서 이용가능한 기타 결합제의 사용을 통해 단리할 수 있다. 예를 들면, MACS™ CD4+ 및 CD8+ MicroBeads를 사용하여 CD4+ 및 CD8+ T-세포를 단리할 수 있다.
또는, 세포는, 이로써 한정되지 않지만, T-세포의 경우, 세포주 BCL2 (AAA) Jurkat(ATCC® CRL-2902™), BCL2 (S70A) Jurkat(ATCC® CRL-2900™), BCL2 (S87A) Jurkat(ATCC® CRL-2901™), BCL2 Jurkat(ATCC® CRL-2899™), Neo Jurkat(ATCC® CRL-2898™); 및 NK 세포의 경우, 세포주 NK-92(ATCC® CRL-2407™), NK-92MI(ATCC® CRL-2408™)를 포함하는 상업적으로 이용가능한 세포 배양에 의해 수득할 수 있다.
벡터. CAR은 벡터를 사용하여 제조할 수 있다. 예시적 벡터의 제조 및 상기 벡터를 사용한 CAR 발현 세포의 생성은 하기 실시예에 상세히 언급되어 있다. 요약하면, CAR을 코딩하는 천연 또는 합성 핵산의 발현은 CAR 폴리펩티드 또는 이의 일부를 코딩하는 핵산을 프로모터에 작동적으로 연결시키고 작제물을 발현 벡터에 도입함으로써 전형적으로 달성된다. 벡터는 복제 및 통합 진핵생물에 적합할 수 있다.
벡터 및/또는 핵산을 포함하는 세포를 생산하는 방법은 당해 기술분야에 공지되어 있다[참조: Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York)]. 외인성 핵산을 숙주 세포에 도입하거나 달리는 세포를 본 발명의 억제제에 노출시키는데 사용된 방법과 무관하게, 숙주 세포에서 재조합 DNA 서열의 존재를 확인하기 위해 다양한 검정을 수행할 수 있다. 이러한 검정은, 예를 들면, 당해 기술분야의 숙련가에게 공지된 "분자 생물학" 검정, 예를 들면, 서던 및 노던 블롯팅, RT-PCR 및 PCR; "생화학적" 검정, 예를 들면, 면역학적 수단(ELISA 및 웨스턴 블롯)에 의해 또는 본 발명의 범위 내에 포함되는 약제를 동정하기 위해 본원에 기재된 검정에 의해 특정 펩티드의 존재 또는 부재의 검출을 포함한다.
일부 실시형태에서, 단리된 핵산 서열은, wt 및 돌연변이체 EGFR 중의 어느 하나 또는 둘 다를 인식하는 항-EGFR 항체의 항원 결합 도메인, CD28 공자극 신호전달 영역 및/또는 4-1BB 공자극 신호전달 영역 및 CD3 제타 신호전달 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어지는 CAR을 코딩한다. 특정한 실시형태에서, 단리된 핵산 서열은, 항-EGFR 항체의 항원 결합 도메인을 코딩하는 서열, 이어서, 힌지 영역, CD28 공자극 신호전달 영역 및/또는 4-1BB 공자극 신호전달 영역, 이어서 CD3 제타 신호전달 도메인을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다. 추가의 양태에서, 항원 결합 도메인은, 링커 폴리펩티드에 의해 임의로 연결되는 HC 가변 영역 및 LC 가변 영역을 포함한다.
일부 실시형태에서, 단리된 핵산은 항생제 내성을 부여하는 폴리뉴클레오티드를 포함한다.
일부 실시형태에서, 단리된 핵산 서열은 벡터에 포함된다. 특정 실시형태에서, 벡터는 플라스미드이다. 다른 실시형태에서, 벡터는 바이러스 벡터이다. 특정 실시형태에서, 벡터는 렌티바이러스 벡터이다.
예시적 벡터의 제조 및 상기 벡터를 사용한 CAR 발현 세포의 생성은 하기 실시예에 상세히 기재되어 있다. 요약하면, CAR을 코딩하는 천연 또는 합성 핵산의 발현은, CAR 폴리펩티드 또는 이의 일부를 코딩하는 핵산을 프로모터에 작동적으로 연결시키고 상기 작제물을 발현 벡터에 도입함으로써 전형적으로 달성된다. 벡터는 복제 및 통합 진핵생물에 적합할 수 있다. 벡터 및/또는 외인성 핵산을 포함하는 세포를 생산하는 방법은 당해 기술분야에 공지되어 있다[참조: Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York)].
한 가지 양태에서, 용어 "벡터"는, 비-분화 및/또는 느린-분화 세포를 감염 및 형질전환시키고 표적 세포 게놈 내로 통합시키는 능력을 보유하는 재조합 벡터를 의도한다. 몇몇 양태에서, 벡터는 야생형 바이러스로부터 유래하거나 이에 기반한다. 추가의 양태에서, 벡터는 야생형 렌티바이러스로부터 유래하거나 이에 기반한다. 이의 예는, 제한 없이, 인간 면역결핍 바이러스(HIV), 말 전염성 빈혈 바이러스(EIAV), 유인원 면역결핍 바이러스(SIV) 및 고양이 면역결핍 바이러스(FIV)를 포함한다. 또는, 기타 레트로바이러스도 벡터 골격, 이러한 뮤린 백혈병 바이러스(MLV)를 위한 기초로서 사용될 수 있음이 의도된다. 본 발명에 따르는 바이러스 벡터는 특정 바이러스의 성분으로 한정될 필요는 없는 것이 명백하다. 바이러스 벡터는 2개 이상의 상이한 바이러스로부터 유래하는 성분들을 포함할 수 있고, 또한 합성 성분을 포함할 수 있다. 벡터 성분을 조작하여, 표적 세포 특이성 등의 목적하는 특성을 수득할 수 있다.
본 발명의 재조합 바이러스 벡터는 영장류 및 비-영장류로부터 유래한다. 영장류 렌티바이러스의 예는 인간 면역결핍 바이러스(HIV), 인간 후천성 면역결핍 증후군(AIDS) 및 유인원 면역결핍 바이러스(SIV)의 원인 물질을 포함한다. 비-영장류 렌티바이러스 그룹은 원형 "슬로우 바이러스" 비스나/마에디 바이러스(VMV), 또한 관련된 염소 관절염-뇌염 바이러스(CAEV), 말 감염성 빈혈 바이러스(EIAV) 및 보다 최근에 기재된 고양이 면역결핍 바이러스(FIV) 및 소 면역결핍 바이러스(BIV)를 포함한다. 종래 기술의 재조합 렌티바이러스 벡터는 당해 기술분야에 공지되어 있다[참조: 미국 특허 제6,924,123호; 제7,056,699호; 제7,07,993호; 제7,419,829호 및 제7,442,551호, 본원에서 참조로서 도입됨].
미국 특허 제6,924,123호는, 특정 레트로바이러스 서열이 표적 세포 게놈 내로의 통합을 촉진하는 것을 개시한다. 이 특허는 각 레트로바이러스 게놈이 비리온 단백질 및 효소를 코딩하는 gag, pol 및 env라 불리우는 유전자를 포함하는 것을 교시한다. 이들 유전자는 긴 말단 반복체(LTR)로 불리우는 영역에 의해 양 말단에서 인접하고 있다. LTR은 프로바이러스 통합 및 전사에 관여한다. 이들은 또한 인핸서-프로모터 서열로서 작용한다. 달리 말하면, LTR은 바이러스 유전자의 발현을 조절할 수 있다. 레트로바이러스 RNA의 캡시드형성은 바이러스 게놈의 5' 말단에 위치된 psi 서열에 의해 발생한다. LTR 자체는 U3, R 및 U5로 불리우는 3개 요소로 분할될 수 있는 동일한 서열이다. U3은 RNA의 3' 말단에 특유한 서열로부터 유래한다. R은 RNA의 양 말단에서 반복된 서열로부터 유래하고, U5는 RNA의 5' 말단에 특유한 서열로부터 유래한다. 3개 요소의 크기는 상이한 레트로바이러스 중에서 상당히 달라질 수 있다. 바이러스 게놈의 경우, 폴리 (A) 부가(종결)의 부위는 우측 측면 LTR 중의 R과 U5 사이의 경계에 존재한다. U3은 레트로바이러스의 대부분의 전사 조절 요소를 함유하고, 이는 세포에 대해 반응성인 프로모터 및 다중 인핸서 서열 및 일부 경우에 바이러스 전사 활성화인자 단백질을 포함한다.
구조 유전자 gag, pol 및 env 자체와 관련하여, gag는 바이러스의 내부 구조 단백질을 코딩한다. gag 단백질은 성숙 단백질 MA(매트릭스), CA(캡시드) 및 NC(뉴클레오캡시드)로 단백질분해에 의해 처리된다. pol 유전자는 역전사효소(RT)를 코딩하고, 이는 게놈의 복제를 매개하는 DNA 폴리머라제, 연관된 RNase H 및 인테그라제(IN)를 함유한다.
바이러스 벡터 입자를 생성하기 위해, 벡터 RNA 게놈을 숙주 세포에서 이를 코딩하는 DNA 작제물로부터 발현시킨다. 벡터 게놈에 의해 코딩되지 않은 입자의 성분은 숙주 세포에서 발현된 추가의 핵산 서열(gag/pol 및 env 유전자 중의 어느 하나 또는 둘 다를 통상 포함하는 "팩키징 시스템")에 의해 일시적으로 제공된다. 바이러스 벡터 입자의 생성에 요구된 서열의 세트는 일시적 형질감염에 의해 숙주 세포에 도입될 수 있거나, 이들은 숙주 세포 게놈 내로 통합될 수 있거나, 이들은 혼합 방식으로 제공될 수 있다. 수반된 기술은 당해 기술분야의 숙련가에게 공지되어 있다.
본 발명에서 사용하기 위한 레트로바이러스 벡터는, 이로써 한정되지 않지만, 하기를 포함한다: Invitrogen’s pLenti 시리즈 버젼 4, 6 및 6.2 "ViraPower" 시스템. Lentigen Corp.사 제조; pHIV-7-GFP, City of Hope Research Institute사에 의해 형성 및 사용된 lab; "Lenti-X" 렌티바이러스 벡터, pLVX, Clontech사에 의해 제조; pLKO.1-puro, Sigma-Aldrich사에 의해 제조; pLemiR, Open Biosystems사에 의해 제조; 및 pLV, Charite Medical School사에 의해 형성 및 사용된 lab, Institute of Virology (CBF), Berlin, Germany.
외인성 핵산을 숙주 세포에 도입하거나 달리는 세포를 본 발명의 억제제에 노출시키는데 사용된 방법과 무관하게, 숙주 세포에서 재조합 DNA 서열의 존재를 확인하기 위해, 다양한 검정을 수행할 수 있다. 이러한 검정은, 예를 들면, 당해 기술분야의 숙련가에게 공지된 "분자 생물학" 검정, 예를 들면, 서던 및 노던 블롯팅, RT-PCR 및 PCR; "생화학적" 검정, 예를 들면, 면역학적 수단(ELISA 및 웨스턴 블롯)에 의해 또는 본 발명의 범위 내에 포함되는 약제를 동정하기 위해 본원에 기재된 검정에 의해 특정 펩티드의 존재 또는 부재의 검출을 포함한다.
팩키징 벡터 및 세포주. CAR은 팩키징 벡터 및 세포주를 사용하여 레트로바이러스 팩키징 시스템 내로 팩키징될 수 있다. 팩키징 플라스미드는, 이로써 한정되지 않지만, 레트로바이러스 벡터, 렌티바이러스 벡터, 아데노바이러스 벡터 및 아데노-연관된 바이러스 벡터를 포함한다. 팩키징 벡터는, 세포 내로 유전 물질의 전달을 촉진시키는 요소 및 서열을 함유한다. 예를 들면, 레트로바이러스 작제물은, 복제 부적격 레트로바이러스를 팩키징하는데 요구되는 모든 비리온 단백질을 일시적으로 코딩하고, 복제-적격 헬퍼 바이러스의 생성 없이, 복제-부적격 레트로바이러스 벡터를 높은 역가로 팩키징할 수 있는 비리온 단백질을 생성하기 위한 복제-부적격 레트로바이러스 게놈으로부터 유래된 적어도 하나의 레트로바이러스 헬퍼 DNA 서열을 포함하는 팩키징 플라스미드이다. 레트로바이러스 DNA 서열은 바이러스의 바이러스 5' LTR의 천연 인핸서 및/또는 프로모터를 코딩하는 영역을 결여하고, 헬퍼 게놈의 팩키징에 관여하는 psi 기능 서열 및 3' LTR 둘 다를 결여하지만, 외래 폴리아데닐화 부위, 예를 들면, SV40 폴리아데닐화 부위, 및 바이러스 생성이 요구되는 세포 타입에서 효율적 전사를 지시하는 외래 인핸서 및/또는 프로모터를 코딩한다. 레트로바이러스는 백혈병 바이러스, 예를 들면, 몰로니 뮤린 백혈병 바이러스(MMLV), 인간 면역결핍 바이러스(HIV) 또는 긴팔 원숭이 백혈병 바이러스(GALV)이다. 외래 인핸서 및 프로모터는 인간 사이토메갈로바이러스(HCMV) 즉시 초기(IE) 인핸서 및 프로모터, 몰로니 뮤린 육종 바이러스(MMSV)의 인핸서 및 프로모터(U3 영역), 라우스 육종 바이러스(FSV)의 U3 영역, 비장 포커스 형성 바이러스(SFFV)의 U3 영역, 또는 천연 몰로니 뮤린 백혈병 바이러스(MMLV) 프로모터에 연결된 HCMV IE 인핸서일 수 있다. 레트로바이러스 팩키징 플라스미드는, 예를 들면, 제1 헬퍼 서열이 에코트로픽 MMLV 또는 GALV의 gag 및 pol 단백질을 코딩하는 cDNA를 함유하고 제2 헬퍼 서열이 env 단백질을 코딩하는 cDNA를 함유하는 경우, 플라스미드 기반 발현 벡터에 의해 코딩된 2개의 레트로바이러스 헬퍼 DNA 서열로 이루어질 수 있다. 숙주 범위를 결정하는 env 유전자는 이종영양성, 암포트로픽, 에코트로픽, 폴리트로픽 (밍크 포커스 형성) 또는 10A1 뮤린 백혈병 바이러스 env 단백질, 또는 긴팔 원숭이 백혈병 바이러스(GALV env 단백질), 인간 면역결핍 바이러스 env (gp160) 단백질, 수포성 구내염 바이러스(VSV) G 단백질, 인간 T 세포 백혈병(HTLV) 타입 I 및 II env 유전자 생성물, 상술된 env 유전자의 하나 이상의 조합물로부터 유래된 키메라 엔벨로프 유전자, 또는 상술된 env 유전자 생성물의 세포질 및 막관통 및 목적하는 표적 세포 상에서 특이적 표면 분자에 대해 지시된 모노클로날 항체를 코딩하는 키메라 엔벨로프 유전자로부터 유래할 수 있다.
팩키징 프로세스에서, EGFR을 발현하는 팩키징 플라스미드 및 레트로바이러스 벡터는, 고역가 재조합 레트로바이러스-함유 상청액을 생성하기 위해, 바이러스를 생성할 수 있는 포유동물 세포의 제1 모집단, 예를 들면, 인간 배아 신장 세포, 예를 들면, 293 세포(ATCC No. CRL1573, ATCC, Rockville, Md.) 내로 일시적으로 공-형질감염시킨다. 본 발명의 또 다른 방법에서, 이러한 일시적으로 형질감염된 제1 세포 모집단은, 이어서, 표적 세포에 높은 효율로 외래 유전자를 형질도입하기 위해, 포유동물 표적 세포, 예를 들면, 인간 림파구와 함께 공-배양한다. 본 발명의 또 다른 방법에서, 상술된 일시적으로 형질감염된 제1 세포 모집단으로부터의 상청액은, 표적 세포에 외래 유전자를 높은 효율로 형질도입하기 위해, 포유동물 표적 세포, 예를 들면, 인간 림파구 또는 조혈 줄기 세포와 함께 배양한다.
또 다른 양태에서, 팩키징 플라스미드는, 바이러스를 생성할 수 있는 포유동물 세포의 제1 모집단, 예를 들면, 인간 배아 신장 세포(예: 293 세포)에서 안정하게 발현된다. 레트로바이러스 또는 렌티바이러스 벡터는 선택가능한 마커를 사용한 공-형질감염 또는 슈도타입 바이러스를 사용한 감염에 의해 세포 내로 도입된다. 두 경우에, 벡터가 통합된다. 달리는, 벡터는 에피좀으로 유지된 플라스미드에 도입될 수 있다. 고역가 재조합 레트로바이러스-함유 상청액이 생성된다.
T 또는 NK 세포의 활성화 및 확장. 목적하는 CAR을 발현시키기 위해 T 세포 또는 NK 세포의 유전자 변형 전후에, T 세포 또는 NK 세포는 문헌[참조: 미국 특허 제6,352,694호; 제6,534,055호; 제6,905,680호; 제6,692,964호; 제5,858,358호; 제6,887,466호; 제6,905,681호; 제7,144,575호; 제7,067,318호; 제7,172,869호; 제7,232,566호; 제7,175,843호; 제5,883,223호; 제6,905,874호; 제6,797,514호; 제6,867,041호]에 기재된 것과 같은 일반적으로 공지된 방법을 사용하여 일반적으로 활성화 및 확장시킬 수 있다. 관련 T 세포를 활성화시키는 방법은 당해 기술분야에 공지되어 있고, 본 발명에 용이하게 적용할 수 있고; 예시적 방법은 하기 실시예에 기재되어 있다. 생체외에서 EGFR 항원을 사용한 자극은 선택된 CAR 발현 T-세포 모집단을 활성화 및 확장시킬 수 있다. 또는, T-세포는 EGFR 항원과의 상호작용에 의해 생체내에서 활성화시킬 수 있다. 따라서, 추가의 양태에서, 본 발명은 EGFR CAR을 발현하는 세포의 단리된 확장된 모집단을 제공한다.
본 발명과 관련하여 사용하기 위한 단리 방법은, 이로써 한정되지 않지만, Life Technologies Dynabeads® 시스템 활성화 및 확장 키트; BD Biosciences Phosflow™ 활성화 키트, Miltenyi Biotec MACS™ 활성화/확장 키트, 및 관련 세포의 활성화 모이어티에 특이적인 기타 상업적으로 이용가능한 세포 키트를 포함한다. 면역 세포의 특정 아모집단은 이러한 키트에서 이용가능한 비드 또는 기타 약제의 사용을 통해 활성화 또는 확장시킬 수 있다. 예를 들면, α-CD3/α-CD28 Dynabeads®를 사용하여 단리된 T-세포를 활성화 및 확장시킬 수 있다.
상기 개시된 바와 같이, 키메라 항원 수용체는 항원 인식 모이어티 및 세포 활성화 모이어티를 포함한다. 본 발명의 양태는 야생형 및 돌연변이체 EGFR에 특이적인 항원 결합 도메인을 포함하는 키메라 항원 수용체(CAR)에 관한 것이다.
사용 방법
치료 적용. 본 발명의 CAR T-세포 및 NK 세포는 EGFR을 발현하는 종양 및 암, 예를 들면, 교아세포종을 치료하기 위해 사용할 수 있다. 본 발명의 EGFR CAR 세포는 단독으로 또는 희석제, 공지된 항암 치료제(화학치료제, 수술 및/또는 방사선) 및/또는 기타 성분, 예를 들면, 면역자극성인 사이토킨 또는 기타 세포 모집단과 조합하여 투여할 수 있다. 본 발명의 방법은 제1-선택, 제2-선택, 제3-선택 또는 제4-라인 요법일 수 있다.
본 발명의 방법 양태는 이를 필요로 하는 대상체에서 종양의 성장을 치료하고/하거나 이를 필요로 하는 암 환자를 치료하는 방법에 관한 것이다. 일부 실시형태에서, 종양은 고형 종양이다. 일부 실시형태에서, 종양/암은 교아세포종 또는 교아세포종 줄기 세포이다. 특정 실시형태에서, 이들 방법은 본원에 기재된 유효량의 단리된 세포, 예를 들면, EGFR CAR을 포함하는 단리된 세포를 대상체 또는 환자에게 투여하는 것을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다. 추가의 실시형태에서, 단리된 세포는 T-세포 또는 NK 세포이다. 일부 실시형태에서, 단리된 세포는 치료되는 대상체 또는 환자에 대해 자기유래이다. 추가의 양태에서, 종양은 EGFR 항원을 발현하고, 대상체는 본원에 기재된 것과 같은 진단에 의한 요법을 위해 선택되었다. 추가의 양태에서, 단리된 세포는 교아세포종 또는 교아세포종 줄기 세포의 성장을 억제하기 위해 대상체의 뇌에 직접 주사 또는 주입된다.
본 발명의 EGFR CAR을 포함하는 약제학적 조성물은 치료 또는 예방되는 질환에 적절한 방식으로 투여할 수 있다. 임의의 적절한 투여 방법, 예를 들면, 직접 주사 및/또는 정맥내 주사 등의 전신으로 사용할 수 있다. 적절한 용량이 임상 시험에 의해 결정될 수 있지만, 투여 양 및 빈도는 환자의 상태 및 환자 질환의 타입 및 중증도와 같은 요인에 의해 결정될 것이다. 종양의 성장을 억제하는 방법은, 이로서 한정되지 않지만, 인간, 개, 고양이, 말 및 기타 종을 포함하는 대상체에 적용할 수 있다.
한 가지 실시형태에서, 본 발명은 환자로부터 단리된 종양 샘플을 유효량의 EGFR 항체와 접촉시키는 단계, 종양 샘플에 결합된 임의의 항체의 존재를 검출하는 단계(여기서, 종양 샘플에 결합된 항체의 존재는 환자가 EGFR CAR 요법에 반응할 가능성이 있음을 나타내고 종양 샘플에 결합된 항체의 부재는 환자가 EGFR CAR 요법에 반응할 가능성이 없음을 나타낸다.)를 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어지는, 환자가 EGFR CAR 요법에 반응할 가능성이 있는지 또는 없는지를 결정하는 방법을 제공한다. 또 다른 실시형태에서, 상기 방법은 유효량의 EGFR CAR 요법을, EGFR CAR 요법에 반응할 가능성이 있는 것으로 측정된 환자에게 투여하는 것을 추가로 포함한다. 이 방법에서, 환자는 뇌암을 앓고 있을 수 있다. 일부 실시형태에서, 이러한 뇌암은 교아세포종 또는 또 다른 암(예: 유방암)의 전이이다. 한 가지 양태에서, 샘플은 암을 갖거나, 암을 갖는 것으로 의심되거나, 암을 가질 위험에 있는 대상체로부터 수득된다.
한 가지 양태에서, 검출은 면역조직화학(IHC), 웨스턴 블롯팅, 유세포 분석법 또는 ELISA 중의 하나 이상을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다.
한 가지 양태에서, 상기 방법은 생물학적 샘플을 대상체로부터 단리하는 것을 포함하거나, 또는 달리는 이들로 본질적으로 이루어지거나, 또는 추가로 이들로 이루어진다. 추가의 양태에서, T 세포 또는 NK 세포는 EGFR CAR을 코딩하는 단리된 핵산으로 형질도입된 대상체로부터 단리되고, 형질도입된 세포의 확장된 모집단은 본원에 기재된 방법을 사용하여 대상체에게 투여하기 위해 제조된다.
한 가지 양태에서, 대상체는 포유동물, 예를 들면, 인간 환자이다.
조성물 및 담체
본 발명의 추가의 양태는 담체 및 하나 이상의 생성물, 예를 들면, EGFR CAR, EGFR CAR을 포함하는 단리된 세포, EGFR CAR을 코딩하는 단리된 핵산 또는 이들의 상보체 및/또는 단리된 핵산을 포함하는 벡터를 포함하는 조성물에 관한 것이다. 담체는 고체 담체 또는 액체 담체, 예를 들면, 약제학적으로 허용되는 담체일 수 있다.
요약하면, 본 발명의 약제학적 조성물은, 이로써 한정되지 않지만, 한 가지 양태에서, 본원에 기재된 세포 모집단을 하나 이상의 약제학적으로 또는 생리학적 허용되는 담체, 희석제 또는 부형제 또는 고체 지지체와 함께 포함하는 청구된 조성물 중의 어느 하나를 포함한다. 이러한 조성물은 완충액, 예를 들면, 중성 완충 식염수, 인산염 완충 식염수 등; 탄수화물, 예를 들면, 글루코즈, 만노즈, 수크로즈 또는 덱스트란, 만니톨; 단백질; 폴리펩티드 또는 아미노산, 예를 들면, 글리신; 항산화제; 킬레이트제, 예를 들면, EDTA 또는 글루타티온; 애주번트(예: 수산화알루미늄); 및 보존제를 포함할 수 있다. 본 발명의 조성물은 경구, 정맥내, 국소, 장용 및/또는 비경구 투여를 위해 제형화할 수 있다. 특정 실시형태에서, 본 발명의 조성물은 정맥내 투여를 위해 제형화된다.
요약하면, 본 발명의 약제학적 조성물은, 이로써 한정되지 않지만, 본원에 기재된 청구된 조성물 중의 어느 하나를 하나 이상의 약제학적으로 또는 생리학적으로 허용되는 담체, 희석제 또는 부형제와 함께 포함한다. 이러한 조성물은 완충액, 예를 들면, 중성 완충 식염수, 인산염 완충 염수 등; 탄수화물, 예를 들면, 글루코즈, 만노즈, 수크로즈 또는 덱스트란, 만니톨; 단백질; 폴리펩티드 또는 아미노산, 예를 들면, 글리신; 항산화제; 킬레이트제, 예를 들면, EDTA 또는 글루타티온; 애주번트(예: 수산화알루미늄); 및 보존제를 포함할 수 있다. 본 발명의 조성물은 바람직하게는 정맥내 투여를 위해 제형화된다.
본 발명의 약제학적 조성물은 치료 또는 예방되는 질환에 적절한 방식으로 투여할 수 있다. 적절한 용량은 임상 시험에 의해 결정될 수 있지만, 투여 양 및 빈도는 환자의 상태 및 환자 질환의 타입 및 중증도 등의 요인에 의해 결정될 것이다.
병용 요법
본 발명의 양태는 본원에 개시된 EGFR CAR 발현 세포 및 종양용해성 단순 헤르페스 바이러스를 수반하는 병용 요법에 관한 것이다. 임상 연구는, 종양 용해성 헤르페스 바이러스가, 단독으로 투여하는 경우, 제한된 효과로 작용하는 것을 입증했다. 본원에 개시된 실험 및 방법은 EGFR CAR 발현 세포에 대한 유망한 결과를 입증한다. 본 출원인은 EGFR CAR 발현 세포 및 종양용해성 헤르페스 심플렉스 둘 다의 투여가 상승작용 효과를 갖는 것을 밝혀냈다. 이론에 구속되는 것은 아니지만, EGFR CAR 발현 세포는 암 세포가 종양용해성 헤르페스 바이러스에 의한 감염 및 파괴에 더욱 접근가능하게 하는 종양 조직 구조의 파괴를 촉진시킬 수 있다.
일부 실시형태에서, 병용 요법에서 사용하기 위해 의도되는 EGFR CAR 발현 세포는, T 세포 또는 NK 세포로부터 임의로 선택된 단리된 면역 세포이다. 일부 실시형태에서, 이들 EGFR CAR 발현 세포는 조사된다. 일부 실시형태에서, EGFR CAR 발현 세포는 1 내지 10000 cGy, 예를 들면, (이로써 한정되지 않지만), 약 1 cGy, 5 cGy, 10 cGy, 50 cGy, 100 cGy, 500 cGy, 1000 cGy, 5000 cGy 또는 10000 cGy 초과 또는 이하의 선량으로 조사된다. 일부 실시형태에서, 조사 선량은 EGFR CAR 발현 세포의 증식을 최적화하고, 동시에 이들의 전체 활성을 약 12, 24, 36, 48, 60, 72, 84, 96시간 또는 그 이상 유지한다. 일부 실시형태에서, EGFR CAR 발현 세포는 oHSV를 근절 또는 제거하지 않도록 변형된다(조사 또는 기타 수단을 통해).
일부 실시형태에서, 종양용해성 단순 헤르페스 바이러스는 임상 시험을 수행하고 상기 본원에 개시되어 있는 하나 이상의 종양용해성 헤르페스 바이러스이다. 일부 실시형태에서, 종양용해성 단순 헤르페스 바이러스는 HSV-1 또는 HSV-1로부터 유래한다.
일부 실시형태에서, EGFR CAR 발현 세포는 종양용해성 단순 헤르페스 바이러스의 투여와 동시에, 전에 또는 후에 투여된다. 일부 실시형태에서, EGFR CAR 발현 세포는 최초로 투여된다. 다른 실시형태에서, 종양용해성 단순 헤르페스 바이러스는 최초로 투여된다. 일부 실시형태에서, EGFR CAR 발현 세포는 단일 또는 복수 용량으로 투여된다. 일부 실시형태에서, 종양용해성 단순 헤르페스 바이러스는 단일 또는 복수 용량으로 투여된다. 한 가지 실시형태에서, EGFR CAR 발현 세포는 최초로 투여되고, 이어서 1일 이상에 걸쳐 종양용해성 단순 헤르페스 바이러스가 투여된다.
키트
추가로, 본원에는 본원에 기재된 하나 이상의 EGFR CAR, EGFR CAR을 코딩하는 단리된 핵산 또는 이들의 상보체, 상기 핵산을 포함하는 벡터, 본원에 기재된 단리된 세포, 또는 본원에 기재된 단리된 복합체를 포함하는 키트가 제공된다.
하기 실시예는 본 발명을 예시하기 위한 것이고 한정하는 것을 의도하지 않는다.
실시예 1 EGFR CAR 발현 세포의 생성 및 특성화
세포 배양
인간 GB 세포주[Gli36DeltaEGFR (Gli36dEGFR), U251 및 LN229] 및 인간 환자-유래된 GB 줄기 세포(GB1123, GB30, GB83, and GB326)[참조: Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649]를 이 연구에 사용했다. GB84V3SL, GB157V3SL 및 GB19는 또한 동일한 프로토콜을 사용하여 GB 환자로부터 확립되었다[참조: Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649]. 모든 GB 세포주, 293T 세포 및 푀닉스(Phoenix) 세포는 10% FBS, 페니실린(100U/ml) 및 스트렙토마이신(100㎍/ml)이 보충된 DMEM(Invitrogen, Grand Island, NY)에서 배양했다. GB 줄기 세포는 bFGF(20ng/ml), EGF(20ng/ml), Glutamax(1:100), B27(1:100), 헤파린(5㎍/ml), 페니실린(100U/ml) 및 스트렙토마이신(100㎍/ml)이 보충된 DMEM-F-12 배지에서 배양했다. 상기 항체 및 사이토킨 스톡의 모든 스톡은 인비트로겐(Invitrogen)으로부터 구입했다. 인간 NK 세포주 NK-92 및 NKL은 20% FBS, 페니실린(100U/ml), 스트렙토마이신(100㎍/ml) 및 150IU/mL 재조합 인간 (rh) IL-2(Hoffman-La Roche Inc., Nutley, NJ)이 보충된 RPMI-1640(Invitrogen)에서 유지했다.
마우스
6 내지 8주령 NOD.Cg-Prkdc scid Il2rg tm1Wjl /SzJ 마우스(NSG) 마우스는 잭슨 라보라토리즈(Jackson Laboratories)(Bar Harbor, ME)로부터 수득했다. 모든 동물 작업은 오하이오 주립대 동물 관리 및 실험 위원회(The Ohio State University Animal Care and Use Committee)에 의해 승인되었고, 방법은 승인된 가이드라인에 따라 수행했다. 마우스는 GB 질환 진행에 대해 빈번하게 모니터링하고, 이들이 신경학적 손상 및 명백한 체중 감량과 함께 빈사 상태로 되는 경우에 희생시켰다.
항-EGFR CAR 렌티바이러스 작제물의 생성
항-EGFR 단일 사슬 가변 단편(scFv)는, wt EGFR 및 EGFRvIII 둘 다를 인식하는 마우스 모노클로날 항체 528을 생성하는 하이브리도마 세포주로부터 유래했다[참조: Hayashi, H. et al. (2004) Cancer Immunology, Immuno요법:CII 53:497-509; Humphrey, P.A. et al. (1990) Proc Natl Acad Sci. USA 87:4207-4211]. 중쇄(VH) 및 경쇄(VL)의 가변 영역을 위한 코딩 도메인 서열을 별도로 증폭시키고, PCR 반응을 중첩시킴으로써 링커를 사용하여 조립했다. VH-링커-VL 단편은 레트로바이러스 벡터로부터 절개된 CD28-CD3ζ 부분과 프레임으로 도입했다[참조: Pule, M.A. et al. (2005) Mol Ther. 12:933-941]. 이어서, 전체 항-EGFR-scFv-CD28-CD3ζ 단편은 pCDH-EGFR-scFv-CD28-CD3ζ(pCDH-EGFR-CAR) 작제물을 생성하기 위해 pCDH-CMV-MCS-EF1-copGFP(pCDH, System Biosciences, Mountain View, CA)로 명명된 렌티바이러스 벡터에 연결시켰다.
렌티바이러스 생성 및 NK 세포의 형질도입
NK 세포(NK-92 및 NKL)의 감염을 위한 렌티바이러스를 생성하기 위해, 293T 세포는 인산칼슘 형질감염 시약(Promega, Madison, WI)을 사용하여 팩키징 작제물 pCMV-VSVG 및 pCMV-DR9와 함께 상술한 pCDH-EGFR-scFv-CD28-CD3ζ 플라스미드 또는 위 pCDH 벡터로 공-형질감염시켰다. 형질감염 및 감염 절차는 사전에 공개된 프로토콜로부터 변형시켰다[참조: Chu, J. et al. (2014) Leukemia 28:917-927].
wt EGFR 또는 EGFRvIII을 안정하게 발현하는 GB19 줄기 세포의 생성
푀닉스(Phoenix) 세포는 인산칼슘 형질감염 시약(Promega, Madison, WI)을 사용하여 Sara3 팩키징 플라스미드와 함께 pBABE-wt EGFR(wt EGFR 발현 작제물), 또는 pBABE-EGFRvIII(EGFRvIII 발현 작제물) 또는 pBABE 공 벡터로 공-형질감염시켰다. 형질감염 2일 후, 감염성 상청액을 수거하여 폴리브렌(8㎍/mL)의 존재하에 GB19 줄기 세폴르 감염시켰다. 레트로바이러스는 GB19 줄기 세포의 감염을 위해 혈청-비함유 DMEM-F12 배지에서 생성했고, 이어서 GFP 양성 GB19-wt EGFR 또는 GB19-EGFRvIII 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA)를 사용하여 선별했다.
유세포 분석법
EGFR-CAR의 NK 세포 표면 발현을 평가하기 위해, 형질도입된 NK 세포를 4% BSA를 함유하는 PBS로 세척하고, 문헌[참조: Chu, J. et al. (2014) Leukemia 28:917-927]에 기재된 바와 같이, 비오틴-표지된 염소 항-마우스 F(ab')2 폴리클로날 항체, 또는 이소형 대조군으로서 정상 폴리클로날 염소 IgG 항체(Jackson ImmunoResearch, West Grove, PA)로 배양했다. 이어서, 세포를 다시 세척하고, 알로피코시아닌 (APC)-접합된 스트렙트아비딘(Jackson ImmunoResearch, West Grove, PA)으로 염색했다. GB 세포의 표면 상에서 wt EGFR 및/또는 EGFRvIII 발현을 측정하기 위해, 세포는, 야생형 EGFR 및 이의 돌연변이체 형태(EGFRvIII) 둘 다를 인식하는 마우스 모노클로날 항-인간 EGFR(클론 H11, DAKO, Carpinteria, CA)로 배양한 다음, APC 접합된 염소 항-마우스 IgG 이차 항체로 염색시켰다.
역전사 PCR
신경교종 세포에서 EGFR mRNA 발현을 검출하기 위해, RNA를 RNeasy 미니 키트(Qiagen, Hilden, Germany)로 세포주로부터 추출하고, NanoDrop(Thermo Fisher, Wilmington, DE)로 정량화했다. 역전사물은 M-MLV 역전사 효소(Invitrogen, Grand Island, NY)를 사용하여 생성하고, PCR은 GoTaq® Flexi DNA 폴리머라제(Promega, Madison, WI)로 수행했다. 전방 프라이머는 TGACTCCGTCCAGTATTGATCG이고, 역방 프라이머는 GCCCTTCGCACTTCTTACACTT이다. PCR 반응 파라미터는 95℃ 5분, 95℃ 40초에서 35사이클, 50℃ 40초, 72℃ 1분, 및 10분 동안 72℃에서 최종 신장.
세포독성 검정
표준 4-h 51Cr 방출 검정은 이전에 기재된 바와 같이 수행했다[참조: Yu, J. et al. (2010) Blood 115:274-281]. 요약하면, 표적 세포를 51Cr로 표지하고, 4시간 동안 37℃에서 96-웰 V-하부 플레이트의 웰에서 다양한 효과기/표적 비율(E/T)로 변형된 NK 세포와 공-배양했다. 상청액을 수거하고, 액체 신틸레이션 칵테일을 함유하는 신틸레이션 바이얼에 옮기고(Fisher Scientific, Waltham, MA), 51Cr의 방출을 베크만 액체 신틸레이션 계수기 LS-6500로 측정했다. 완전 배지 또는 1% SDS에서 배양한 표적 세포를 사용하여 각각 자발적 또는 최대 51Cr 방출을 측정했다. 특이적 세포 용해의 퍼센트는 하기 표준 식을 사용하여 계산했다: 100 × (cpm 실험 방출 - cpm 자발적 방출) / (cpm 최대 방출 - cpm 자발적 방출).
IFN-γ 방출 검정
1×106 표적 세포를 24시간 동안 96-웰 V-하부 플레이트에서 동일한 수의 NK 효과기 세포로 배양했다. 세포-비함유 상청액은 제조업자의 프로토콜에 따라 R&D 시스템즈(Minneapolis, MN)의 키트를 사용하여 효소-연결된 면역흡착 검정(ELISA)에 의해 IFN-γ 분비에 대해 검정했다. 도면에 도시된 데이터는 유사한 결과를 갖는 3개 대표적 실험 중의 하나로부터 삼중 웰의 평균 값을 나타낸다.
NSG 마우스에서 동소성 인간 GB30 이종이식편의 치료
GB30 GB 줄기 세포는 이전에 기재된 바와 같이 Pinco-pGL3-luc/GFP 바이러스 발현 반딧불 루시퍼라제(FFL)로 레트로바이러스에 형질도입했다[참조: He, S. et al. (2013) Blood 121:4663-4671]. GFP 양성 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA)를 사용하여 선별하고, "GB30-FFL" 세포로 명명했다. NSG 마우스를 마취시키고, 정위 장치에 고정시키고, 버 홀을 3.25mm의 깊이로 브레그마으로부터 2mm 측면 및 1mm 전방에서 천공하고, 2㎕ 행크 완충된 염 용액(HBSS) 중의 5×104 GB30-FFL 세포를 이식했다. 7일에서, 마우스에게 2×106 효과기 세포(비-조사됨), 즉 5㎕ BHSS 중의 EGFR-CAR-형질도입된 NK-92 세포(NK-92-EGFR-CAR) 또는 위-형질도입된 NK-92 세포(NK-92-EV)를 두개내 주사했다. 5㎕ HBSS 단독으로 처리한 마우스를 대조군으로 사용했다. 마우스를 매일 모니터링하고, 나환율의 징후를 나타낼 때에 안락사시켰다. GB30-FFL 세포 접종 2주 후, 마우스에게 D-루시페린(150mg/체중 kg; Gold Biotechnology, St. Louis, MO)을 복강내(i.p) 주입하고, 이소플루란으로 마취시키고, 리빙 이미지 소프트웨어(PerkinElmer)로 생체내 이미지 시스템(IVIS-100, PerkinElmer, Waltham, MA)를 사용하여 이미지화했다.
NSG 마우스에서 동소성 인간 U251 이종이식편의 치료
U251 GB 세포를 이전에 기재된 바와 같이 Pinco-pGL3-luc/GFP 바이러스 발현 반딧불 루시퍼라제(FFL)로 레트로바이러스에 형질도입했다[참조: He, S. et al. (2013) Blood 121:4663-4671]. GFP 양성 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA)를 사용하여 선별하고, "U251-FFL" 세포로 명명했다. NSG 마우스를 마취시키고, 정위 장치에 고정시키고, 버 홀을 3.25mm의 깊이로 브레그마으로부터 2mm 측면 및 1mm 전방에서 천공하고, 2㎕ 행크 완충된 염 용액(HBSS) 중의 105 U251-FFL 세포를 0일에 접종했다. 10일, 40일, 70일에서, 마우스에게 2×106 효과기 세포, 즉 5㎕ HBSS 중의 EGFR-CAR-형질도입된 NK-92 세포(NK-92-EGFR-CAR) 또는 위-형질도입된 NK-92 세포(NK-92-EV)를 두개내 주입했다. 5㎕ HBSS 단독으로 처리한 마우스를 대조군으로 사용했다. 마우스를 매일 모니터링하고, 나환율의 징후를 나타내는 경우에 안락사시켰다. U251-FFL 세포 접종 100일에서, 마우스에게 D-루시퍼라제(150mg/체중 kg; Gold Biotechnology, St. Louis, MO)를 복강내(i.p.) 주입하고, 이소플루란으로 마취시키고, 리빙 이미지 소프트웨어(PerkinElmer)로 생체내 이미징 시스템(IVIS-100, PerkinElmer, Waltham Massachusetts, USA)을 사용하여 이미지화했다.
NK-92-EGFR-CAR 세포의 기관 및 조직 분포 검정
2×106 NK-92 EGFR-CAR 세포는 종양 이식 7일 후에 3개 GB30-담지 마우스에게 두개내 주사했다. 3일 후, 모든 마우스를 희생시키고, 간, 폐, 비장, 골수, 혈액 및 뇌를 수거했다. 기관 또는 조직의 절반은 DNA 단리 키트(Invitrogen, Carlsbad, CA)를 사용한 게놈 DNA 단리에 사용하고, PCR을 프라이머로 수행하여 EGFR-CAR scFv 영역을 증폭시켰다. PCR 전방 프라이머는 AGGTCACTCTGACTGTAGACA이었고, 역방 프라이머는 GTTCATGTAGTCACTGTGCAG이었다. PCR 반응 파라미터는 95℃ 5분, 95℃ 40초에서 35사이클, 55℃ 40초, 72℃ 1분, 및 10분 동안 72℃에서 최종 신장이었다.
기관 또는 조직의 다른 절반을 사용하여, 퍼콜(GE Healthcare, Pittsburgh, PA)에서 밀도 구배 원심분리를 사용하여 단핵 면역 세포를 단리했다. 수집된 면역 세포를 V450 마우스 항-인간 CD3e 및 APC 마우스 항-인간 CD56 항체(eBioscience, San Diego, CA)로 표면 염색하여 특이적 기관 또는 조직 중의 NK-92-EGFR-CAR 세포의 존재를 측정했다.
통계학적 분석
언페어드(Unpaired) 스튜던트 t 시험을 사용하여, 정규 분포된 연속 종점에 대해 2개 독립적 그룹을 비교했다. 일방향 ANOVA는 3개 이상의 독립적 그룹이 비교되는 경우에 사용했다. 비-정규 분포된 종점, 예를 들면, 생체내 생물발광 강도에 대해, 크루스칼-발리스(Kruskal-Wallis) 시험을 사용하여 NK-92-EGFR-CAR 그룹의 중앙치를 NK-92-EV 및 HBSS-처리된 그룹과 비교했다. 생존 데이터를 위해, 카플란-마이어(Kaplan-Meier) 곡선을 플롯팅하고, 로그-랭크 시험을 사용하여 비교했다. 모든 시험은 양면이다. P 값은 본페로니 방법을 사용하여 복수의 비교를 위해 조정했다. 0.05 미만의 P 값은 유의한 것으로 간주했다.
wT EGFR 또는 EGFRvIII을 발현하는 293T 세포주의 생성. 푀닉스 세포는 인산칼슘 형질감염 시약(Promega, Madison, WI, USA)을 사용하여 Sara3 팩키징 플라스미드와 함께 pBABE-wt EGFR(wt EGFR 발현 작제물), pBABE-EGFRvIII(EGFRvIII 발현 작제물), 또는 pBABE 공 벡터로 공-형질감염시켰다. 형질감염 2일 후, 상청액을 수거하여, 폴리브렌(8㎍/mL)의 존재하에 293T 세포를 감염시켰다. GFP 양성 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA, USA)를 사용하여 선별했다.
일차 NK 세포의 렌티바이러스 생성 및 형질도입. 렌티바이러스를 이전에 기재된 바와 같이 생성하고[참조: Chu, J. et al. (2014) Leukemia 28:917-927], 90분 동안 4℃에서 20,000g으로 초원심분리에 의해 농축시키고, 1×PBS로 재현탁시켰다. 인간 일차 NK 세포는, 이전에 기재된 바와 같이(He, S. et al. (2013) Blood 121:4663-4671), 건강한 공여체의 말초 혈액 백혈구로부터 단리하고(American Red Cross, Columbus, Ohio), 2시간 동안 2000rpm 및 32℃에서 연속 3회 원심분리에 의해 렌티바이러스(MOI = 2.5)로 감염시키고(회차 사이에 온화한 재현탁), GFP 양성 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA, USA)로 선별했다. 표준 4-h 51Cr 방출 검정을 수앵하여 U251 및 Gli36dEGFR GB 세포주 및 GB30 및 GB157V3SL 환자-유래된 GB 줄기 세포에 대해 EGFR-CAR 플라스미드 또는 대조군 벡터로 형질도입된 일차 NK 세포의 세포독성을 평가했다.
항체 차단 검정. GB30 줄기 세포 및 U251 세포주를 30분 동안 37℃에서 10㎍/ml EGFR 중화 항체(클론 528, EMD Millipore, Billerica, MA) 또는 이소형-정합된 항체로 전처리했다. 이어서, 표준 4-h 51Cr 방출 검정을 수행하여, 528 항체- 또는 IgG-전처리된 표적 세포에 대한 NK-92-EGFR-CAR 세포 및 대조군 세포의 세포독성을 평가했다. IFN-γ 분비는 또한, 528 항체- 또는 IgG로 전처리한 1×106 표적 세포를 24시간 동안 96-웰 V-하부 플레이트에서 동일한 수의 NK-92-EGFR-CAR 세포 또는 대조군 세포로 배양했다.
GB30-담지 마우스의 뇌 절편의 헤마톡실린 및 에오신(H&E) 염색. NSG 마우스에게 0일에 5×104 GB30 세포를 두개내 주사했다. 7일에서, 마우스에게 5㎕ HBSS 중의 2×106 NK-92-EGFR-CAR 세포를 두개내 주사했다. 10일에서, 마우스를 희생시키고, 뇌 조직을 수거하고, 24시간 동안 10% 포르말린에 침지시키고, 이어서 뇌를 파라핀에 매립하고, H&E 염색을 위해 처리했다.
결과
GB 세포주 및 환자-유래된 GB 줄기 세포 상에서 EGFR 또는 EGFRvIII의 발현
GB 세포주 및 환자-유래된 GB 줄기 세포의 패널 상에서 wt EGFR 또는 EGFRvIII의 표면 발현을 평가하기 위해, 무손상 세포는 wt EGFR 및 EGFRvIII 둘 다를 인식하는 EGFR-특이적 항체로 염색하고, 이어서, 유세포 계수 분석을 수행했다. 도 1A에 제시된 바와 같이, EGFR은 GB 세포주(Gli36dEGFR, U251, and LN229), 환자-유래된 GB 간엽(MES) 줄기 세포(GB30, GB83, GB1123 및 GB326) 및 GB 전신경(PN) 줄기 세포(GB84V3S and GB157V3SL)의 표면 상에서 발현되었다. wt EGFR 또는 EGFRvIII 전사물이 이들 세포에서 발현되는지를 추가로 평가하기 위해, 출원인은 특이적 프라이머로 RT-PCR을 수행했고, wt EGFR mRNA가 2개의 GB 세포주, 즉 U251 및 LN229에서 발현되는 것을 관찰했다. EGFRvIII mRNA는 GB 세포주 Gli36dEGFR, 및 출원인 영국 환자로부터 생성한 6개 GB 줄기 세포(Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649): GB30, GB83, GB1123, GB326, GB84V3SL 및 GB157V3SL에서 검출할 수 있었다(도 1B). 대조적으로, 하나의 GB 줄기 세포, GB19(전신경), 및 2개의 NK 세포주, NK-92 및 NKL은 유세포 계수 분석 또는 RT-PCR에 의해 검출가능한 EGFR 발현을 갖지 않았다(도 1A, 1B).
EGFR-CAR을 발현하는 NK-92 및 NKL NK 세포의 생성
2세대 EGFR-특이적 CAR 작제물은 pCDH 렌티바이러스 벡터 골격에서 생성했다. 이 작제물은 순차로 신호 펩티드(SP), 중쇄 가변 영역(VH), 링커, 경쇄 가변 영역(VL), 힌지, CD28 막관통 및 세포내 도메인, 및 CD3ζ 신호전달 모이어티를 함유한다(도 2A). NK-92 및 NKL 세포주를 EGFR-CAR 작제물로 형질도입하여 각각 NK-92 EGFR-CAR 및 NKL EGFR-CAR 세포를 생성했다. 형질도입된 세포는 벡터에 의해 발현된 GFP의 발현에 대해 선별했다. 형질도입된 NK-92 및 NKL 세포 상에서 EGFR-CAR의 세포 표면 발현을 검증하기 위해, 유세포 계수 분석은 항-EGFR의 scFv 부분을 인식하는 염소 항-마우스 F(ab')2 항체를 사용하여 수행했다. 도 2B의 데이터는 공 벡터로 형질도입된 것들과 비교하여 EGFR-CAR-형질도입된 NK-92 및 NKL 세포에서 세포 표면 EGFR-CAR 발현의 명백한 증가를 나타냈고, 후자는 검출 불가능한 EGFR-CAR 발현을 가졌다.
EGFR
+
GB 세포주에 대한 EGFR-CAR-변형된 NK 세포 세포독성 및 IFN-γ 생성의 효력
EGFR-CAR- 및 위-형질도입된 NK 세포의 세포독성은 효과기 세포 대 표적 세포의 상이한 비율에서 표준 크롬 방출 검정을 사용하여 GB 세포에 대해 평가했다. 도 3A-3B는 대조군 NK-92-EV 세포와 비교하여 EGFR+ Gli36dEGFR, U251 및 LN229 세포에 대해 NK-92 EGFR-CAR 세포의 현저히 증강된 세포독성을 나타낸다(도 3A, 상부 패널). 유사한 데이터는 EGFR-CAR로 형질도입된 NKL 세포를 사용한 실험에서 관찰되었다(도 3A, 하부 패널). 또한, EGFR-CAR로 형질도입된 인간 일차 NK 세포는 EGFR+ Gli36dEGFR 및 U251 GB 세포주에 대해 대조군 세포보다 현저히 보다 강력한 세포독성을 나타냈다(도 8A). 관찰된 증강된 세포용해 활성이 IFN-γ 분비의 유사한 현저한 증가를 수반하는지를 측정하기 위해, 출원인은 24시간 동안 EGFR-CAR NK-92 세포를 EGFR+ 신경교종 세포(Gli36dEGFR, U251 및 LN229) 세포와 공배양했고, ELISA에 의해 IFN-γ 생성을 측정했다. 도 3B에 제시된 바와 같이, EGFR-CAR-변형된 및 위-형질도입된 NK-92 또는 NKL 세포는, 단독 배양하는 경우, 낮거나 무시할 수 있는 수준의 IFN-γ를 자발적으로 생성했다. 이들 세포를 EGFR+ 신경교종 세포(Gli36dEGFR, U251 및 LN229)와 함께 배양하는 것은 EGFR-CAR 및 위-형질도입된 NK-92 또는 NKL 세포주에서 IFN-γ를 유도했고, 유의적으로 높은 수준의 IFN-γ는 각각 위-형질도입된 NK-92 또는 NKL 세포보다 EGFR-CAR-변형된 NK-92 또는 NKL 세포에 의해 생성되었다(도 3B). 이들 결과는 상술된 세포독성 데이터와 일치하고, EGFR-CAR를 사용한 변형은 EGFR+ 신경교종 세포에 반응하여 NK 세포 효과기 기능을 유의적으로 증강시킬 수 있음을 함께 나타낸다.
GB 환자로부터 유래된 EGFR
+
GB 줄기 세포에 대한 EGFR-CAR-변형된 NK 세포 세포독성 및 IFN-γ 생성의 효력
이어서, 출원인은 내인성 EGFR 단백질의 표면 발현을 갖는 환자-유래된 GB 줄기 세포를 용해시키는 EGFR-CAR-변형된 NK-92 및 NKL 세포의 능력을 평가했다. EGFR-CAR-형질도입된 NK-92 세포는, 위-형질도입된 NK 세포와 비교하는 경우, EGFR+ GB 간엽 줄기 세포(GB1123 및 GB30) 및 GB 전신경 줄기 세포(GB157V3SL 및 GB84V3SL)를 사멸시키는 유의적으로 증강된 능력을 입증했다(도 4A, 상부 패널). 유사한 데이터는 EGFR-CAR로 형질도입된 NKL 세포를 사용하여 반복한 실험에서 관찰되었다(도 4A, 하부 패널). EGFR-CAR로 형질도입된 일차 NK 세포는 또한, EGFRvIII를 발현하는, 환자-유래된 줄기 세포 GB30 및 GB157V3SL에 대해 대조군 세포보다 유의적으로 보다 강력한 세포독성을 나타냈다(도 8B). 마찬가지로, EGFR-CAR-형질도입된 NK-92 및 NKL 세포는, EGFR+ GB 줄기 세포와 공-배양하고 위-형질도입된 NK-92(도 4B, 상부 패널) 및 NKL 세포(도 4B, 하부 패널)과 비교하는 경우, 유의적으로 많은 IFN-γ를 생성했다. 이들 결과는 EGFR-CAR에 의한 NK 세포의 변형이, 비변형된 NK 세포 대조군과 비교하여, EGFR+ GB 줄기 세포에 대해 NK 세포 세포독성 및 IFN-γ 생성을 유의적으로 증강시킬 수 있음을 나타낸다.
NK-92-EGFR-CAR 세포의 증강된 세포독성 및 IFN-γ 생성은 표적 세포 상에서 EGFR 표면 발현에 의존한다.
이어서, 본 출원인은 GB 세포에 의해 유발된 EGFR-CAR-형질도입된 NK-92 또는 NKL 세포에서 증강된 세포용해 활성 및 IFN-γ 생성이 세포 표면 EGFR 항원 발현에 의존하는지를 조사했다. 시험된 GB 세포 중에서, GMB19 줄기 세포만이 이들의 표면 상에서 EGFR 또는 EGFRvIII을 발현하지 않았다. 따라서, 본 출원인은 이러한 세포주를 사용하여, GB19 세포에서 강제된 wt EGFR 또는 EGFRvII 과발현이 EGFR-CAR-형질도입된 NK-92 또는 NKL 세포에 대한 이들의 감수성을 변화시키기에 충분한지를 조사했다. 이러한 목적을 위해, 본 출원인은 레트로바이러스 감염에 의해 GB19 세포 상에서 wt EGFR 또는 EGFRvIII을 과발현시켰고, 유세포 계수 분석에 의해 확인했다(도 5A). EGFR 발현을 결여하는 표적 GB19 세포 또는 위-형질도입된 NK-92 및 NKL 효과기 세포와 비교하는 경우, EGFR 또는 EGFRvIII을 외인적으로 과발현하는 GB19 세포에 대해 EGFR-CAR-변형된 NK-92 및 -NKL 세포의 세포독성 활성의 유의한 증가가 있었다(도 5B). 마찬가지로, EGFR-CAR-형질도입된 NK-92 및 NKL 세포는, EGFR- 또는 EGFRvIII-과발현 GB19 세포와 공-배양하고 EGFR의 과발현을 결여하는 표적 세포 또는 위-형질도입된 NK-92 세포 및 NKL 효과기 세포와 비교하는 경우, 유의적으로 높은 수준의 IFN-γ를 분비했다(도 5C). 이들 결과는 NK-92-EGFR-CAR 세포에 의한 wt EGFR- 또는 EGFRvIII-과발현 GB 세포의 증가된 인식 및 제거가 EGFR-의존적 방식으로 발생하는 것을 시사한다. 또한, 이들 결과는, 293T 세포에서 강제된 EGFR 발현이 공 벡터로 형질도입된 NK-92 세포와 비교하여 NK-92-EGFR-CAR 세포의 증가된 세포독성 및 IFN-γ 생성을 제공했음을 나타내는 확인 실험과 일치했다(도 9A-9C). 더욱이, 본 출원인은 EGFR 중화 항체(scFv 기원과 동일한 클론)으로 GB30 및 U251 세포를 전처리하고, 이어서 전처리된 종양 세포를 위 세포 또는 NK-92-EGFR-CAR 세포와 공-배양했다. 크롬-51 방출 검정은 EGFR 차단 항체가, 이소형-정합된 대조군 항체와 비교하는 경우, NK-92-EGFR-CAR에서 세포독성 및 IFN-γ 생성 둘다의 증강을 둔화시켰음을 나타냈고, 본 출원인이 NK-92-EGFR-CAR 세포에 대해 동정한 효과가 EGFR-의존적임을 추가로 확인시켜 준다.
NK-92-EGFR-CAR 세포는 GB 종양 성장을 억제하고, 2개 동소성 이종이식편 GB 모델에서 종양-담지 마우스의 생존을 연장시킨다.
NK-92-EGFR-CAR 세포의 잠재적 치료 적용을 추가로 평가하기 위해, 본 출원인은 생체내에서 이들의 항종양 활성을 조사했다. 본 출원인은, NSG 마우스의 뇌 내로 반딧불 루시퍼라제(GB30-FFL)을 발현하도록 유전자 조작된 EGFRvIII-발현 GB30 신경교종 줄기 세포를 두개내 이식함으로써 동소성 신경교종을 확립했다. 반딧불 루시퍼라제의 발현은 생체내 생물발광 이미지화를 통해 종양 성장을 모니터링하는 것을 가능하게 했다. 잠재적 전신 독성을 최소화하기 위해, 본 출원인은 종양 세포 이식 7일 후에 NK-92-EGFR-CAR을 종양내 주사했다. 도 6A-6B에 제시된 바와 같이, EGFR-CAR- 또는 위-형질도입된 NK-92 세포를 제공받은 마우스는, HBSS로 주사한 것들과 비교하여 생물발광 이미지화에 의해 측정된 바와 같이, 유의적으로 감소된 종양 성장을 가졌다. 그러나, 중요하게는, 종양 성장의 감소는 위-형질도입된 NK-92 세포로 처리한 것들보다 NK-92-EGFR-CAR 세포로 처리한 마우스에서 유의적으로 보다 컸다. 이들 데이터와 일치하여, NK-92-EGFR-CAR 세포로 처리한 마우스는, 위-형질도입된 NK-92 세포 또는 HBSS로 처리한 마우스보다 유의적으로 장기간 생존했다(NK-92-EGFR-CAR- 및 NK-92-EV-처리된 마우스 사이에서 38일 대 23일의 중앙 생존기간, p < 0.01; NK-92-EGFR-CAR- 및 HBSS-처리딘 마우스 사이에서 38일 대 17일의 중앙 생존기간, p < 0.01)(도 6C). wt EGFR-발현 GB 종양에 대한 NK-92-EGFR-CAR 세포의 치료 효력을 추가로 평가하기 위해, 본 출원인은 wt EGFR-발현 U251-FFL 세포를 NSG 마우스 내로 두개내 이식함으로써 동소성 GB 모델을 확립했다. 본 출원인은 종양 세포 이식 10일, 40일 및 70일 후에 NK-92-EGFR-CAR 세포, NK-92-EV 세포 또는 비히클 대조군으로서 HBSS를 종양내 주사했다. 도 7A-7B에 제시된 바와 같이, EGFR-CAR 세포를 종양내 주사한 마우스는, HBSS 또는 NK-92-EV 세포를 주입한 것들과 비교하여, 유의적으로 감소된 종양 양(burden)을 가졌다. 더욱이, NK-92-EGFR-CAR 세포로 처리한 마우스는 NK-92-EV 세포 또는 BHSS를 제공받은 것들보다 유의적으로 장기간 생존했다(NK-92-EGFR-CAR- 및 NK-92-EV 세포-처리된 마우스 사이에서 187일 대 150일의 중앙 생존기간, p < 0.05; NK-92-EGFR-CAR- 및 HBSS-처리된 마우스 사이에서 187일 대 138일의 중앙 생존기간, p < 0.01)(도 7C). 함께 고려하면, NK-92-EGFR-CAR 세포는 생체내에서 wt EGFR- 또는 EGFRvIII-발현 GB를 효율적으로 표적화하고 제거할 수 있다.
두개내 주사 후에 NK-92-EGFR-CAR 세포 이동의 평가
NK-92-EGFR-CAR 세포의 두개내 주사의 안전성을 평가하기 위해, 본 출원인은 먼저 두개내 주사 후의 전신 세포 분포를 분석했다. 본 출원인은, GB30-담지 마우스 내로 이들의 두개내 주사 3일 후에 수거한 다양한 기관 및 조직에서 NK-92-EGFR-CAR 세포의 분포를 평가하기 위해 유세포 계수 분석 및 보다 감수성 PCR 접근법을 수행했다. 도 6D에 제시된 바와 같이, CD56+ 세포는 뇌에서 단독으로 동정될 수 있고, 뇌에서 전체 면역 침윤 세포의 10.2%만을 구성할 수 있다. 유사하게는, PCR 분석은 뇌 이외에 시험된 임의의 기관 부위에서 EGFR-CAR 발현을 검출할 수 없었다(도 6E). 함께, 이들 데이터는 인간 GB의 동소성 마우스 모델에서 NK-92-EGFR-CAR 세포의 두개내 투여가 효과기 세포의 두개외 이동 없이 수행될 수 있음을 시사한다. 이어서, 본 출원인은, NK-92-EGFR-CAR 세포를 종양내 주입한 GB30-담지 마우스의 뇌 절편의 헤마톡실린 및 에오신(H&E) 염색을 수행했다. 이 결과는 NK-92-EGFR-CAR 세포가 종양 내부에만 분포함을 나타냈다(도 11).
논의
본 연구에서, 본 출원인은, 인간 GB를 두개내 표적화하기 위해 EGFR-CAR-변형된 인간 NK-92 세포를 사용하는 GB에 대한 신규한 및 유망한 전략을 개발했다. GB 환자의 종양은 wt EGFR 또는 wt EGFR과 EGFRvIII 둘 다를 발현하고[참조: Fan, Q.W. et al. (2013) Cancer Cell 24:438-449), 이는 이러한 표면 단백질의 두 형태를 표적화하는 것이 보다 광범위한 적용을 가질 수 있거나 단지 하나를 표적화하는 것보다 더욱 효과적일 수 있음을 시사한다. 본 출원인은 또한 본 출원인의 동소성 임상전 모델에서 EGFR-CAR-변형된 NK-92 세포의 두개내 주사의 생체내 효력 및 안전성을 입증했다.
CAR T 세포는 난치성 만성 림파구성 백혈병 및 급성 림프아구성 백혈병의 치료에 효과적으로 사용되어 왔고, 이들 고도로 약물-내성 종양을 위한 강력한 신규 치료법을 나타낸다[참조: Porter, D.L. et al. (2011) N Engl J Med. 365:725-733; Grupp, S.A. et al. (2013) N Engl J Med. 368:1509-1518; Brentjens, R.J. et al. (2013) Sci Transl Med. 5:177ra138; Papapetrou, E.P. et al. (2011) Nature Biotechnology 29:73-78]. 또한, 몇몇 연구는 GB를 치료하기 위해 CAR T 세포의 사용을 입증했다[참조: Morgan, R.A. et al. (2012) Hum Gene Ther. 23:1043-1053; Ohno, M. et al. (2010) Cancer Sci. 101:2518-2524; Ahmed, N. et al. (2010) Clin Cancer Res. 16:474-485]. 그러나, 이들 연구는 EGFRvIII의 표적화에 단지 초점을 맞추었다. 더욱이, CAR T 세포는 사이토킨-관련된 부작용 및 종양 용해 증후군을 유발할 수 있고[참조: Grupp, S.A. et al. (2013) N Engl J Med. 368:1509-1518; Morgan, R.A. et al. (2010) Mol Ther. 18:843-851], 이는 실질적 독성 및 환자의 사망을 일으킬 수 있다. 또한, 자기유래 CAR T 세포의 생성은 고가의 시간-소모적 접근법이다. 따라서, GB 치료를 위해 wt EGFR 및 EGFRvIII 둘 다를 표적화하기 위한 CAR NK 세포의 이용은 우수한 대체 접근법이다.
CAR-조작된 NK 세포주(예를 들면, 본 연구에 사용된 NK-92)는 상이한 GB 환자를 광범위하게 치료하기 위한 기성품, 재생가능한 생성물을 잠재적으로 제공할 수 있다. 본 출원인의 본 연구는 GB에 대한 CAR-변형된 NK-92 세포의 이용을 조사하는 최초의 것이다. CAR-변형된 NK-92 세포는 기타 암을 효과적으로 표적화하는 것으로 밝혀졌다. 예를 들면, 에세르 등(Esser et al.)은 디시알로강글리오시드 GD2에 대해 CAR을 안정하게 발현시키기 위해 NK-92 세포를 조작했고, 이는 교아세포종(NB) 세포에서 고도로 발현된다[참조: Esser, R. et al. (2012) J Cell Mol Med. 16:569-581]. NK-92 세포 상에서 GD2-CAR의 발현은, 모체 NK-92 세포에 의한 사멸에 대해 내성이 있는 GD2-발현 NB 세포의 특이적 제거를 증강시켰고, 이는 NB에 대한 GD2-CAR NK 세포의 잠재적 임상 유용성을 입증한다. 본 출원인은 다발성 골수종(MM) 세포를 표적화하기 위해 CS1-CAR-발현 NK-92 세포를 개발했고, 이들 조작된 NK-92 세포가, 시험관내에서 MM 세포와 공-배양되는 경우, 증강된 세포용해 및 IFN-γ 생성을 나타낼 수 있음을 입증했다[참조: Chu, J. et al. (2014) Leukemia 28:917-927]. 중요하게는, 적극적 동소성 MM 이종이식편 모델에서, CS1-CAR-변형된 NK-92 세포의 양자 전이는 생체내에서 인간 IM9 MM 세포의 파종을 효율적으로 방해했고, 또한 IM9-담지 마우스의 전체 생존기간을 유의적으로 연장시켰다[참조: Chu, J. et al. (2014) Leukemia 28:917-927.
본 출원인의 지식으로, 이는 GB 치료용으로 wt EGFR 및 EGFRvIII 둘 다를 표적화하는 CAR 면역 세포의 가능성을 조사하는 최초의 연구이다. 본 출원인은, wt EGFR 또는 EGFRvIII 중의 어느 하나를 발현하는 GB 세포를 시험관내에서 효율적으로 용해하는 일차 NK 세포 뿐만 아니라, EGFR-CAR-조작된 NK-92 및 NKL 세포를 생성했다. 두 분자는 신경교형성에 기여 역할을 담당한다. EGFRvIII-발현 세포는 전형적으로 동일한 환자에서 wt EGFR-발현 세포와 공존한다. 비에르나트(Biernat)는 EGFR+ GB 생검의 40%(20개 중의 8개)가 EGFRvIII에 대해 양성을 나타냈지만, 우성 EGFRvIII 증폭으로는 단지 15%(20개 중의 8개)만을 나타냈음을 보고했고, 이는 제한된 효과가 EGFRvIII의 선택적 표적화에 기반한 치료 접근법에 대해 유일하게 달성될 수 있음을 시사한다[참조: Biernat, W. et al. (2004) Brain Pathol. 14:131-136]. 또 다른 연구에서, 58개 GB 종양 중에서, 83%(48/58)는 IHC에 의해 wt EGFR의 경우에 염색되었다. 추가로, 이들 샘플의 19%(11/58)는 wt EGFR 및 EGFRvIII에 대해 이중 양성이었다[참조: Fan, Q.W. et al. (2013) Cancer Cell 24:438-449]. 이들 2개 연구는 실질적 부분의 GB 환자가 wt EGFR-발현 및 EGFRvIII-발현 세포를 갖는 것을 입증한다. 따라서, wt EGFR 및 EGFRvIII을 선택적으로 표적화하는 GB를 치료하기 위한 치료 접근법과 비교하여, 본원에 기재된 EGFR-CAR NK 요법은 wt EGFR 및 EGFRvIII 둘 다를 표적화한다. 상술한 바와 같이, EGFRvIII-특이적 CAR T 세포는 시험관내 및 생체내 모두에서 EGFRvIII 발현 GB에 대해 우수한 항-종양 활성을 나타낸다[참조: Morgan, R.A. et al. (2012) Hum Gene Ther. 23:1043-1053; Ohno, M. et al. (2010) Cancer Sci. 101:2518-2524; Sampson, J.H. et al. (2014) Clin Cancer Res. 20:972-984]. 본 출원인은 wt EGFR 및 EGFRvIII 둘 다를 표적화하는 접근법이 wt EGFR-발현 종양 세포 단독을 갖는 GB 환자 뿐만 아니라 EGFR 발현 종양 세포 및 EGFRvIII-발현 종양 세포 둘 다를 갖는 GB 환자를 치료하는데 효과적이라고 생각한다. 이러한 목적을 위해, 본 출원인은 wt EGFR 및 EGFRvIII 둘 다를 표적화하는 EGFR-CAR을 발현하도록 NK-92 세포를 조작했고, wt EGFR 또는 EGFRvIII을 발현하는 GB 세포가 시험관내 및/또는 생체내에서 효율적으로 제거될 수 있음을 입증했다.
신경교종 세포 상에서 EGFRvIII 뿐만 아니라 wt EGFR을 표적화하는 잠재적 과제는 정상 조직 상에 wt EGFR의 존재이다. EGFRvIII-특이적 CAR T 세포의 전신 주입은, EGFRvIII이 wt EGFR을 고도로 발현할 수 있는 정상 상피 세포 상에서 발현되지 않기 때문에, 비교적 안전한 것으로 생각된다. 그러나, NK-92-EGFR-CAR 또는 일차 NK 세포의 전신 투여는 정상 wt EGFR-발현 세포에 대한 이들의 영향에 기인하여 심각한 전신 독성을 일으킬 수 있다. 이러한 위험을 최소화하기 위해, 본 출원인은 이들의 이동성을 제한하기 위해 NK-92-EGFR-CAR 세포를 두개내에 주사했고, 이들 CAR 세포가 뇌 이외의 조직에서 검출 불가능한 상태로 유지됨을 입증했다. 이러한 전략의 추가의 지지에서, 최근의 연구는 wt EGFR 및 EGFRvIII 둘 다를 표적화하는 EGFR 항체로부터의 독소-접합된 scFv의 두개내 전달이 wt EGFR을 발현하거나 wt EGFR 및 EGFRvIII을 공발현하는 두개내 교아세포종 이종이식편에 대해 강력한-항종양 효과를 제공하는 것을 나타낸다. 이러한 국소 투여는 명백한 전신 독성을 유발하지 않았다[참조: Chandramohan, V. et al. (2013) Clin Cancer Res. 19:4717-4727]. 또한, 본 출원인의 H&E 염색은 또한 뇌 중의 이식된 종양 내에 주사된 NK-92-EGFR-CAR 세포가 종양 영역에 존재하는 것을 나타냈다. 그러나, NK-92 세포는 림프종 세포주이기 때문에, 장래 임상 적용을 위해, CAR로 무장된 NK-92 세포는 환자 내로의 주입 전에 조사되어야 한다. 몇몇 임상전 연구는 10 Gy 조사를 제공받은 NK-92-CAR 세포가, 비-조사된 세포와 비교하는 경우, 시험관내 및 생체내에서 유사한 효과를 나타냈음을 입증했다[참조: Uherek, C. et al. (2002) Blood 100:1265-1273; Schonfeld, K. et al. (2015) Mol Ther. 23:330-338]. 또는, EGFR-CAR 일차 NK 세포는, 이들이 또한 GB 세포를 근절하는데 강력하다는 것을 본 출원인이 밝힌 바와 같이, 고려되어야 한다. 중요하게는, 막-결합된 IL-15(mbIL15) 또는 막-결합된 IL-21(mbIL21)을 발현하는 유전자-조작된 인공 항원-제시 세포(aAPC)는 일차 NK 세포를 성공적으로 확장하기 위해 최근에 사용되어 왔다[참조: Jordan, C.T. (2009) Cell Stem Cell 4:203-205; Brennan, C. et al. (2009) PLoS One 4:e7752].
중요하게는, 본 출원인의 연구에서, 본 출원인은 시험된 대부분의 환자-유래된 GB 줄기 세포에 대한 내인성 EGFRvIII의 고도 발현을 관찰했고, 이는 대조군 벡터로 형질도입된 NK-92 세포에 의한 것보다 NK-92-EGFR-CAR 세포에 의한 용해에 대해 이들을 더욱 감수성이게 한다. GB 줄기 세포는, 일차 GB의 생물학적 및 병리학적 특성을 반영하고 전체 종양 모집단의 자가-재생, 복수-계대 분화 및 재생을 받는 능력을 유지하는 종양 세포의 아모집단이다[참조: Jordan, C.T. (2009) Cell Stem Cell 4:203-205]. GB 줄기 세포는 죵양의 개시, 전파, 재발 및 화학적- 및 방사선-내성에 관여하는 것으로 생각된다. GB 줄기 세포를 표적화하는 것은 GB 재발의 예방에 중요한 양태인 것으로 생각된다. 실제로, 본 출원인의 생체내 데이터는 NK-92-EGFR-CAR 세포의 1회 투여가 EGFRvIII을 발현하는 환자-유래된 GB 줄기 세포로 이식된 마우스의 생존기간을 유의적으로 연장시키는 것을 나타낸다. 따라서, 본 출원인은, 시험관내 및 2개의 이종이식편 마우스 모델에서 GB 세포 및 GB 줄기 세포를 표적화하기 위해 NK-92-EGFR-CAR 세포의 사용을 입증하는 본 출원인의 연구가 임상에서 재발된 인간 GB의 잠재적 치료와 매우 관련될 것으로 생각한다.
GB는 상이한 분자 아형으로 구성되어 있다. 간엽(MES) 및 전신경(PN) GB는 GB의 가장 중요한 아형으로 동정되어 있다[참조: Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649; Brennan, C. et al. (2009) PLoS One 4:e7752; Phillips, H.S. et al. (2006) Cancer Cell 9:157-173; Verhaak, R.G. et al. (2010) Cancer Cell 17:98-110]. 본 출원인의 실험에서, 본 출원인이 시험한 모든 MES 및 3개 PN GB 줄기 세포(GSC) 중의 2개는 유세포 계수에 의해 EGFR 발현에 대해 양성이었다. PCR 분석은 이들 GB 줄기 세포 모두가 EGFRvIII을 발현하고 GB 비-줄기 세포주가 통상 wt EGFR(Gli36dEGFR에서 EGFRvIII의 이소성 과발현 제외)만을 발현하는 것을 추가로 입증했다. 이들 발견과 일치하여, 본 출원인의 시험관내 데이터는 EGFR-CAR NK 세포가, 시험관내에서 PN 또는 MES EGFR+ GSC로 배양하는 경우, 증강된 IFN-γ 분비 및 세포독성을 나타내는 것을 입증한다. MES GSC는 시험관내에서 보다 적극적이고, 생체내에서 두개내 이종이식편을 신속하게 생성시킬 수 있다[참조: Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649]. MES GSC는 또한, PN GSC와 비교하여, 조사에 대해 현저한 내성을 나타낸다[참조: Mao, P. et al. (2013) Proc Natl Acad Sci. USA 110:8644-8649]. 본 출원인의 생체내 데이터는 NK-92-EGFR-CAR 세포가 공격적 GB30 MES GSC 이종이식편 모델에서 유효성을 나타냈음을 입증했다.
결론적으로, 본 출원인은 GB에서 wt EGFR 및 EGFRvIII 둘 다를 표적화하는 CAR NK 세포를 성공적으로 생성했다. 이러한 EGFR-CAR로 무장한 NK 세포는 시험관내 및/또는 생체내에서 GB 세포 및/또는 이들의 줄기 세포를 효율적으로 및 특이적으로 인식하고 근절시킨다. 본 출원인의 연구는 재발된 GB의 치료를 위한 EGFR-CAR-변형된 NK-92 세포의 임상적 적용을 지지하고, 이는 단독으로 또는 다른 접근법과 조합하여 국소 투여할 수 있다.
실험 2 EGFR CAR 발현 세포 및 oHSV의 조합
세포 배양
인간 유방암 세포주 MDA-MB-231, MDA-MB-468 및 MCF-7, 또한 293T 및 푀닉스 세포를 DMEM(Invitrogen, Grand Island, NY)에서 배양하고, 10% FBS, 페니실린(100U/ml) 및 스트렙토마이신(100㎍/ml)(모두 Invitrogen사 제조)을 보충했다. 인간 NK 세포주 NK-92 및 일차 NK 세포(컬럼부스의 아메리칸 적십자로부터 수득)를 20% FBS, 페니실린(100U/ml), 스트렙토마이신(100㎍/ml) 및 200IU/mL 재조합 인간 (rh) IL-2(Gold Biotechnology, MO)가 보충된 RPMI-1640(Invitrogen)에 유지시켰다.
마우스
6 내지 8주령 NOD.Cg-Prkdc scid Il2rg tm1Wjl /SzJ (NSG) 마우스는 잭슨 라보라토리즈(Jackson Laboratories)(Bar Harbor, ME)로부터 수득했다. 모든 동물 작업은 오하이오 주립 동물 관리 및 실험 위원회에 의해 승인되었다. 마우스는 질환 진행에 대해 매일 모니터링하고, 이들이 신경학적 장애를 가져 빈사 상태로 되거나 명백한 체중 감량을 나타낸 경우에 희생시켰다.
EGFR-CAR 렌티바이러스 작제물의 생성
항-EGFR 일본 쇄 가변 단편(scFv)은, wt EGFR 및 EGFRvIII 둘 다에 대한 특이적 모노클로날 항체를 코딩하는 DNA 서열로부터 유래했다[참조: Soffietti et al. (2002) J. Neurol. 249(10):1357-1369]. VH-링커-VL 단편은 레트로바이러스 벡터로부터 절개된 CD28-CD3ζ 부분과 프레임으로 도입했다. 이어서, 전체 항-EGFR-scFv-CD28-CD3ζ 단편은 pCDH-EGFR-scFv-CD28-CD3ζ(pCDH-EGFR-CAR) 작제물을 생성하기 위해 pCDH-CMV-MCS-EF1-copGFP(System Biosciences, Mountain View, CA)로서 명명된 렌티바이러스 벡터에 연결시켰다.
렌티바이러스 생성 및 NK-92 세포의 형질도입:
NK-92 세포의 감염을 위한 렌티바이러스를 생성하기 위해, 293T 세포는 인산칼슘 형질감염 시약(Promega, Madison, WI)을 사용하여 팩키징 작제물 pCMV-VSVG 및 pCMV-DR9와 함께 상술한 pCDH-EGFR-scFv-CD28-CD3ζ 플라스미드 또는 모 pCDH 벡터로 공-형질감염시켰다. 형질감염 및 감염 절차는 문헌[참조: Chu et al. (2014) Official Journal of the AACR, 20(15):3989-4000]의 프로토콜로부터 변형시켰다.
CBRluc-EGFP를 안정하게 발현하는 MDA-MB-231 세포의 생성:
CBRluc-EGFP를 안정하게 발현하는 MDA-MB-231 세포는 문헌[참조: Chu etl al. (2014)]의 프로토콜에 따라 ΔU3CBRluc-EGFP 벡터(JF DiPersio 박사로부터의 관대한 기증물)를 사용한 레트로바이러스 형질감염에 의해 생성했다. 이어서, EGFP 양성 유방암 세포는 FACS Aria II 세포 선별기(BD Biosciences, San Jose, CA)를 사용하여 선별하고, 확장시켜, MDA-MB-231-CBRluc-EGFP 세포를 수득했다.
유세포 계수 분석:
유방암 세포의 표면 상에서 EGFR 발현을 측정하기 위해, 세포는 마우스 모노클로날 항-인간 EGFR(클론 H11, DAKO) 항체로 배양한 다음, APC-접합된 염소 항-마우스 IgG 이차 항체로 염색시켰다. EGFR-CAR의 표면 발현은 문헌[참조: Chu et al. (2014)]에 기재된 유세포 계수에 의해 평가했다.
헤마톡실린 및 에오신(HE) 염색 및 면역조직화학(IHC) 검정:
일차 유방암 및 뇌 전이를 갖는 환자로부터 종양 조직의 파라핀-매립된 절편을 IHC를 위해 HE 또는 항-야생형-EGFR 항체(1:2000, DAK-H1-WT; Agilent Technologies, Santa Clara, CA)로 염색시켰다. 자동화 면역염색기(BenchMark XT, Ventana Medical Systems, Tucson, AZ)를 제조업자의 지시에 따라 사용했다. 절편을 가시화하고, 레이카 레이저 공초점 현미경(SP5Wetzlar, Germany)으로 사진 촬영했다.
세포독성 검정
표준 4-h 51Cr 방출 검정은 이전에 기재된 바와 같이 수행했다[참조: Yu, J. et al. (2010) Blood 115:274-281]. 특이적 세포 용해의 퍼센트는 하기 표준 식을 사용하여 게산했다: 100 × (cpm 실험 방출 - cpm 자발적 방출) / (cpm 최대 방출 - cpm 자발적 방출).
IFN-γ 방출 검정
1×106 표적 세포를 24시간 동안 96-웰 V-하부 플레이트에서 동일한 수의 NK 효과기 세포로 배양했다. 세포-비함유 상청액은 제조업자의 프로토콜에 따라 R&D 시스템즈(Minneapolis, MN)의 키트를 사용하여 효소-연결된 면역흡착 검정(ELISA)에 의해 IFN-γ 분비에 대해 검정했다. 도면에 도시된 데이터는 유사한 결과는 갖는 3개 대표적 실험 중의 하나로부터 삼중 웰의 평균 값을 나타낸다.
MTS 검정
유방암 세포주 세포(5×103)를 96웰 평저 배양 플레이트에 씨딩하고, 10% FBS를 함유하는 DMEM 배지에서 37℃로 배양했다. 처리 말기에, 세포 생존능은 제조업자의 지시에 따라 신속한 테르라졸ㄹ리움 기반 MTS(3-(4,5-디메틸티아졸-2-일)-5-(3-카복시메톡시페닐)-2-(4-설포페닐)-2H-테트라졸리움, 내부 염) 비색 검정(CellTiter 96 세포 증식 검정 키트; Promega, Madison, WI)를 사용하여 측정했다[참조: Hayon et al. (2003) Leuk. Lymphoma 44(11):1957-1962]. 모든 실험은 3개 별개의 경우에 대해 적어도 삼중으로 수행했다.
루시퍼라제 검정
MDA-MB-231-CBRluc-EGFP 세포(5×103)를 96웰 평저 배양 플레이트에 씨딩하고, 상이한 처리로 10% FBS를 함유하는 DMEM 배지에서 37℃로 배양했다. 상이한 시점에서, 20μL의 배양 배지는 문헌[참조: Fu et al. (2010) PLoS One. 5(7):e11867]에 기재된 바오 같이 듀얼-글로 루시퍼라제 검정 시스템(Promega)를 사용한 루시퍼라제 검정을 위해 직접 수집했다. 4일에서, 세포 펠렛을 PBS로 2회 세정하고, 이어서 30μL의 1× 수동 용해 완충액(Promega)으로 용해시켰다. 용해물은 원심분리(13,000rpm, 1분)에 의해 펠렛화하고, 상청액을 수집하여 루시퍼라제 활성을 측정했다.
NSG 마우스에서 유방암 뇌 침윤의 치료
NSG 마우스를 마취시키고, 정위 장치에서 고정시키고, 2 μL 행크 완충된 염 용액(HBSS) 중의 1×105 MDA-MB-231-CBRluc-EGFP 세포를 0일에 마우스 뇌에 주사하고, 버 홀을 3.25mm의 깊이로 우측 브레그마으로부터 2mm 측면 및 1mm 전방에서 천공했다. 10일에서, 마우스에게 2×106 효과기 세포, 즉 5μL HBSS 중의 EGFR-CAR-형질도입된 NK-92 세포(NK-92-EGFR-CAR) 또는 공 벡터-형질도입된 NK-92 세포(NK-92-EV)를 종양내 주사했다. oHSV-1 단독 그룹은 5μL HBSS 중의 2×105 플라크-형성 단위(pfu) oHSV-1(rQNestin34.5)을 종양내 주사했다[참조: Kambara et al. (2005) Cancer Res. 65(7):2832-2839]. 5μl HBSS로 처리한 마우스를 대조군으로 사용했다. 15일에서, CAR + oHSV-1 처리 그룹 중의 마우스에게 2×105 pfu oHSV-1을 종양내 주사했다. 마우스를 매일 모니터링하고, 이들이 나환율의 징후를 나타낸 경우에 안락사시켰다. MDA-MB-231-CBRluc-EGFP 세포를 사용한 접종 4주 후에, 마우스에게 D-루시페린(150mg/체중 kg; Gold Biotechnology, St. Louis, MO, USA)을 복강내(i.p) 주입하고, 이소플루란으로 마취시키고, 리빙 이미지 소프트웨어(PerkinElmer)를 갖는 생체내 이미징 시스템(IVIS-100, PerkinElmer, Waltham Massachusetts, USA)을 사용하여 이미지화했다.
통계
언페어드(Unpaired) 스튜던트 t 시험을 사용하여, 데이터 변환의 존재 또는 부재하에 정규 분포된 연속 종점에 대해 2개 독립적 그룹을 비교했다. 일방향 ANOVA는 3개 이상의 독립적 그룹을 비교하기 위해 사용했다. 생존 데이터를 위해, 카플란-마이어(Kaplan-Meier) 분석을 상요하여 생존 함수를 평가하고, 로그-랭크 시험을 사용하여 2개 그룹 사이의 생존기간을 비교했다. 모든 시험은 양면이다. P 값은 홀름(Holm) 절차를 사용하여 복수의 비교를 위해 조정했다. 0.05 미만의 P 값은 통계학적으로 유의한 것으로 간주했다.
결과
유방암 세포주 및 원발성 및 전이성 조직에서 EGFR의 발현
유방암 세포주에서 EGFR의 표면 발현을 평가하기 위해, 세포를 EGFR-특이적 항체로 염색하고, 이어서 유세포 계수 분석을 수행했다. 도 12A에 제시된 바와 같이, EGFR은, 수준이 MCF-7 세포 상에서 명확하게 낮았지만, MDA-MB-231, MDA-MB-468 및 MCF-7 세포주의 표면 상에서 발현되었다. 이어서, EGFR 발현은, 헤마톡실린 및 에오신(HE) 염색에 의해 종양 세포의 존재를 확인한 후, 일차 종양 조직 및 전이성 유방암으로 진단된 환자의 2개 사례로부터 상응하는 뇌 전이 병변에서 면역조직화학(IHC)에 의해 평가했다(도 12B, 상부 2개 열). 표면 EGFR 발현은 일차 병변으로부터의 종양 세포 뿐만 아니라 뇌 전이로부터의 종양 세포 상에서 관찰되었다(도 12B, 하부 2개 열).
EGFR-CAR NK-92 및 일차 NK 세포의 증강된 세포독성 및 IFN-γ 생성
본 출원인은 pCHD 렌티바이러스 골격에서 2세대 EGFR-CAR 작제물을 생성했다. 이 작제물은 순차로 신호 펩티드, EGFR scFv, 힌지 영역, CD28 및 CD3ζ를 함유한다. 건강한 공체로부터 NK-92 및 일차 NK 세포를 CAR-발현 렌티바이러스로 형질도입하고, 벡터에 의한 GFP의 발현에 기반하여 선별했다. 본 출원인은, 항-EGFR의 scFv 부분을 인식하는 염소 항-마우스 F(ab')2 항체를 사용하여 유세포 계수 분석을 수행했다. 도 13A는 EGFR-CAR-형질도입된 NK-92 세포의 표면 상에서 EGFR-CAR의 발현을 나타내고, 이는 NK-92-EV 세포(공 벡터 pCDH로 형질도입된 NK-92 세포) 상에서 검출할 수 없었다. 이어서, 본 출원인은 EGFR-CAR 발현이 증강된 IFN-γ 생성 및 세포용액 활성을 NK-92 및 일차 NK 세포에 부여할 수 있는지를 조사했다. 본 출원인은 EGFR-CAR-형질도입된 NK-92 및 일차 NK 세포(도 18)가, 공 벡터로 형질도입된 이들의 상응하는 효과기 세포와 비교하여, MDA-MB-231 세포 또는 MDA-MB-468 세포와 함께 공-배양하는 경우, 유의적으로 높은 수준의 IFN-γ를 분비했음을 관찰했다(도 13B, 14A). 흥미롭게도, IFN-γ 분비의 이러한 변화는 보다 낮은 수준의 EGFR 발현을 갖는 MCF-7 세포가 표적으로 사용된 경우에 보다 덜 식별가능했다. 더욱이, 이들 3개 세포주와 공-배양하는 경우, 본 출원인은, 각각 위-형질도입된 NK-92 효과기 세포(도 13C-13E) 또는 일차 NK 세포(도 14B-14D)와 비교하여, EGFR-CAR-형질도입된 NK-92 및 일차 공여체 유래된 NK 세포의 세포독성 활성의 유의한 증가를 관찰했다. 효과기 세포 활성화를 측정하기 위해 CD69 표면 발현을 사용하여, 본 출원인은 EGFR 발현을 갖는 종양 세포가 EGFR-CAR-형질도입된 NK-92 세포를 활성화시킬 수 있음을 또한 관찰했고, MDA-MB-231 및 MDA-MB-468 세포를 사용한 경우의 활성화가 MCF-7 세포를 사용한 경우보다 높았다. 본 출원인은 또한 CD27, 또 다른 NK 세포 활성화 마커의 발현을 검출했고, CD27이 EGFR-CAR NK-92 세포의 표면 상에서 발현되지 않음을 관찰했다(도 19).
oHSV-1에 의한 유방암 세포주의 용해
본 출원인은 oHSV-1 단독이, 전이성 뇌 종양을 형성하기 위해 뇌 내로 전달될 가능성을 갖는, 유방암 세포를 용해 및 파괴할 수 있는지를 조사했다. 도 15A에 제시된 바와 같이, oHSV-1는 48시간 동안 공-배양한 후에 용량-의존적 방식으로 MDA-MB-231, MDA-MB-468 및 MCF-7 세포의 생존율을 감소시켰고, 이러한 효과는 상이한 시점에서 관찰되었다(도 15B). 현미경 분석은 oHSV-1 단독이 4일 동안 공-배양 후에 이들 유방암 세포주를 용해시킬 수 있음을 나타냈다(도 20A). 이는 루시퍼라제-발현 MDA-MB-231 세포(MDA-MB-231-CBRluc-EGFP)를 사용하여 확인했고, 여기서 보다 높은 수준의 루시퍼라제는 위-감염된 그룹과 비교하여 oHSV-1 감염을 갖는 그룹으로부터의 상청액에서 검출되었다(4일에서 P <0.01)(도 15C). 반면, oHSV-1은, 현미경 검사에 의해 측정된 바와 같이, EGFR-CAR NK-92 효과기 세포의 아폽토시스를 용해 또는 유도하지 않았다(도 20B).
oHSV-1과 조합된 EGFR-CAR NK-92 세포는 생체내에서 암 세포의 보다 효율적 근절을 제공한다.
MDA-MB-231 세포를 EGFR-CAR NK-92 세포 단독 또는 oHSV-1과 조합하여 처리하는 경우(4시간 동안 EGFR-CAR NK-92 세포를 사용한 처리, 이어서 oHSV-1 처리, 또는 그 반대), MTS 검정은 MDA-MB-231 세포주가 모든 환경하에 효율적으로 사멸되었음을 나타냈지만, EGFR-CAR NK-92 세포와 oHSV-1와의 조합이 보다 효율적 사멸을 제공했다(데이터는 제시하지 않음). 이어서, 본 출원인은 상이한 처리 후에 MDA-MB-231-CBRluc-EGFP 세포의 상청액에서 루시퍼라제 활성을 측정함으로써 사멸을 평가했다. 루시퍼라제는 신속하게 분해되는 것으로 밝혀졌고(제시되지 않음), 따라서 루시퍼라제 검정은 누적 사멸이 아닌 동적 실시간 사멸을 측정하게 했다. 이에 기초하여, 본 출원인은 EGFR-CAR NK-92 세포 단독 및 oHSV-1와 조합된 EGFR-CAR NK-92 세포가 oHSV-1 단독보다 더욱 신속한 용해를 유발했음을 관찰했다(도 5A). 4일 동안 공-배양한 후에 잔류하는 MDA-MB-231-CBRluc-EGFP 세포(세포 펠렛)에서 루시퍼라제 활성을 측정하는 경우, 본 출원인은 EGFR-CAR NK-92 세포 단독, oHSV-1 단독, 또는 oHSV-1와 조합된 EGFR-CAR NK-92 세포가 모두 MDA-MB-231-CBRluc-EGFP 세포의 실질적 사멸을 유도했고, oHSV-1와 조합된 EGFR-CAR NK-92 세포가 순서에 상관 없이 단일요법보다 더욱 효과적이었음을 밝혀냈다(도 16B). 유사한 결과는 현미경 조사에 의해 관찰되었다(도 21). EGFR-CAR NK-92 세포는 MDA-MB-231 세포의 일부를 신속하게 파괴했지만, 이들 세포의 서브세트는 5일 후에도 이들의 본래 세포 형상 및 통합성을 여전히 유지했다. oHSV-1는 먼저 표적 암 세포를 응집시킨 다음, 세포를 서서히 용해시켰다(도 21). 그러나, EGFR-CAR NK-92 세포와 oHSV-1의 조합은 특히 CAR NK-92 세포, 이어서 oHSV-1 처리 그룹에서 보다 강력한 세포 사멸을 제공했다(열 5, 도 21). 참고조, 51Cr 방출 검정(도 13C) 및 루시퍼라제 데이터(도 16B)와 일치하여, 현미경 분석은 MDA-MB-231 세포가 NK-92-EV 세포에 의한 사멸에 대해 내성이 있음을 입증했다.
oHSV-1와 조합된 EGFR-CAR NK-92 세포는 두개내 모델에서 MDA-MB-231 종양 세포의 보다 효율적 사멸을 유도했다.
EGFR-CAR NK-92 세포, oHSV-1 단독 또는 이들의 조합의 잠재적 치료 적용을 추가로 지지하기 위해, 본 출원인은 생체내에서 이들의 항종양 활성을 조사했다. 본 출원인은 NSG 마우스의 뇌 내로 MDA-MB-231-CBRluc-EGFP 세포를 이식함으로써 유방암의 두개내 모델을 확립했다. 세포에서 갑충(beetle) 적색 루시퍼라제의 발현은 생체내 생물발광 이미지화를 통해 종양 성장을 모니터링하는 것을 가능하게 했다. 잠재적 전신 독성을 최소화하기 위해, 본 출원인은 종양 세포 이식 10일 후에 비-조사된 EGFR-CAR NK-92 세포 또는 oHSV-1를 종양내 주사하고, oHSV-1과 조합된 EGFR-CAR NK-92의 그룹에 대해 15일에 oHSV-1을 주사했다. 도 17A 및 도 22에 제시된 바와 같이, EGFR-CAR NK-92, oHSV-1 또는 이들의 조합을 제공받은 마우스는 위-형질도입된 NK-92-EV 또는 비히클(HBSS)로 주사한 것들과 비교하여 유의적으로 감소된 종양 성장을 가졌다. 중요하게는, 종양 성장의 감소는 EGFR-CAR NK-92 단독 또는 oHSV-1 단독으로 처리한 것들보다 oHSV-1과 조합된 EGFR-CAR NK-92로 처리한 마우스에서 더욱 명백했다. 이들 데이터와 일치하여, EGFR-CAR NK-92 + oHSV-1로 처리한 마우스는 oHSV-1 단독(P < 0.01), 위-형질도입된 NK-92(P < 0.001) 또는 HBSS(P < 0.001)으로 처리한 것들보다 유의적으로 장기간 생존했고, EGFR-CAR NK-92 + oHSV-1 그룹 및 EGFR-CAR NK-92 단독 사이의 차이는 동일한 경향을 나타냈고, 유의성 역치(P = 0.0757)의 경계에 존재했다. oHSV-1와 조합된 EGFR-CAR NK-92, EGFR-CAR NK-92, oHSV-1, NK-92-EV 및 HBSS의 5개 그룹의 중앙 생존 시간은 각각 80, 61, 55, 43 및 42일이었다(도 17B).
논의
이들 데이터는 MDA-MB-231 세포로 예비-접종된 마우스 내로 EGFR-CAR NK-92 세포, oHSV-1 또는 이들의 조합의 두개내 투여가 항종양 효과를 유도했고, 이들의 조합이 종양 성장의 보다 효율적 억제 및 종양-담지 마우스의 유의적으로 장기간 생존을 제공했음을 입증한다.
본 출원인은 이러한 조합이 표적 암에 대한 효과적 접근법이라고 생각한다. 이론에 구속되는 것은 아니지만, 본 출원인은 이러한 조합 접근법의 표적이 암 줄기 세포(CSC), 모든 암은 아니지만 대부분의 암에서 재발, 치료 내성 및 전이에 관여하는 세포 모집단인 것으로 의심한다. 추가로, 본 출원인은 개시된 접근법이 이종성 종양 모집단을 수용할 수 있다고 판정한다.
즉, (상기 본원에 개시된 유방암의 예를 고려하여) EGFR-발현 세포는 EGFR-CAR NK 세포에 의해 표적화되지만, oHSV-1은 또한 EGFR-음성 종양 세포를 사멸시킬 수 있다. 유방암은 EGFR, PR 및 HER2 발현에 대해 이종성이다. 본 출원인의 실험에 사용된 유방암 세포주는 야생형 EGFR을 발현하지만, 각각은 상이한 정도로 이를 발현한다. 한편, 이들은 상이한 유전자 발현 프로파일[MDA-MB-231 및 MDA-MB-468: ER-, PR-, HER2-(삼중 음성); MCF-7: ER+, PR+/-, HER2-] 및 상이한 생물학적 거동을 갖는다. 삼중-음성 유방암(TNBC)은 전이에 대한 증가된 감수성 뿐만 아니라 적극적 자연사와 연관되어 있다. TNBC를 갖는 환자는 "전통적" 치료 표적을 결여하고, 다른 타입의 유방암보다 불량한 예후를 갖는다. 실제로, TNBC에 대한 중앙 생존기간은 단지 4.9개월이다. 상기 본원에 기재된 조합 접근법은, oHSV가 일반 BCBM 모집단에 대해 효과적이기 때문에, 비-TNBC 및 TNBC 둘 다의 BCBM을 표적화하고, EGFR-CAR NK 세포는 EGFR+ 모집단을 표적화하는데 더욱 효과적이다. 이러한 결론은 본질적으로 모든 타입의 암에 대해 추가로 일반화된다.
이들 데이터는 EGFR-CAR NK-92 세포가 유방암 세포를 신속하게 표적화하고 공결할 수 있는 반면, oHSV-1는 느리지만 일정하게 암세포를 감염 및 파괴할 수 있음을 추가로 나타냈다. EGFR-CAR NK-92 세포는 통상 수시간 내에 표적 세포를 인식 및 공격할 수 있지만, 이들은 세포주가 본래 비-호지킨 림프종을 갖는 환자로부터 확립되어 조사되어야 하기 때문에, 단지 수일만 생존할 수 있다. 1000cGy의 조사 선량은, 조사한지 최대 48시간 후에 완전한 세포독성 활성을 유지하면서 NK-92 세포의 증식을 억제하도록 최적화되었다. 대조적으로, 이의 효과가 장기간 지속될 수 있지만, oHSV가 표적 세포 내로 유입하고 복제하고 종양 세포를 파괴하는 데는 약 4일이 걸릴 수 있다. 또한, CAR-변형된 NK 세포는 종양 조직 구조를 파괴할 수 있고, 종양 세포 사이의 연결을 감소시킬 수 있고, 암 세포 막의 투과능을 증가시킬 수 있고, 따라서 oHSV-1과 조합되는 경우, 암 세포에서 바이러스 분포 및 복제를 증강시킬 수 있다.
균등물
달리 정의되지 않는 한, 본원에 사용된 모든 기술적 및 과학적 용어는 본 기술이 속하는 당해 기술분야의 숙련가에 의해 통상 이해되는 것과 동일한 의미를 갖는다.
본원에 예시적으로 기재된 본 기술은, 본원에서 구?l거으로 개시되지 않은, 임의의 요소 또는 요소들, 한정 또는 한정들의 주재하에 적합하게 실시될 수 있다. 따라서, 예를 들면, 용어 "포함하는", "포함한", "함유하는" 등은 제한 없이 확장적으로 해석해야 한다. 추가로, 본원에 사용된 용어 및 표현은 기재의 비한정 용어로서 사용되었고, 이러한 용어 및 표현의 사용에서 제시 및 기재된 특징 또는 이의 일부의 임의의 등가물을 배제하는 의도는 아니며, 다양한 변형이 특허청구된 본 기술의 범위 내에서 가능한 것으로 인식된다.
따라서, 본원에 제공된 재료, 방법 및 실시예는 바람직한 양태를 대표하는 것이고, 예시적이며, 본 기술의 범위를 한정하는 것은 아닌 것으로 이해되어야 한다.
본 기술은 본원에서 광범위하게 및 일반적으로 기재되어 있다. 일반적 개시에 속하는 보다 좁은 종 및 아속의 그룹 각각은 또한 본 기술의 일부를 형성한다. 이는, 적출된 재료가 본원에서 구체적으로 열거되는지에 상관 없이, 속으로부터 임의의 주제를 제거하는 단서 또는 부정적 제한을 갖는 본 기술의 일반적 기재를 포함한다.
또한, 본 기술의 특징 또는 양태가 마르쿠쉬 그룹의 측면에서 기재되는 경우, 당해 기술분야의 숙련가는 본 기술이 또한 마르쿠쉬 그룹의 임의의 개개 멤버 또는 멤버 아그룹의 측면에서 기재되어 있는 것을 인식할 것이다.
본원에 언급된 모든 간행물, 특허원, 특허 및 기타 참고문헌은, 각각이 개별적으로 참조로서 도입되는 것과 동일한 정도로, 이들의 전체가 참조로서 명시적으로 도입된다. 모순되는 경우, 정의를 포함하는 본 명세서가 지배한다.
다른 양태는 하기 특허청구범위에 기재되어 있다.
Claims (72)
- (a) 야생형 및/또는 돌연변이체 상피 성장 인자 수용체(EGFR)("wt EGFR 및/또는 돌연변이체 EGFR") 중의 어느 하나 또는 둘 다를 인식하는 항-EGFR 항체의 항원 결합 도메인; (b) 힌지 도메인 폴리펩티드; (c) 공자극 분자 또는 폴리펩티드; 및 (d) CD3 제타 신호전달 도메인 또는 이의 각각의 등가물을 포함하는, 키메라 항원 수용체(CAR).
- 제1항에 있어서, 상기 공자극 분자가, 4-1BB 공자극 신호전달 영역, CD28 공자극 분자, OX40, ICOS 및 CD27로 이루어진 그룹으로부터 선택된 분자 또는 폴리펩티드, 또는 이의 각각의 등가물을 포함하는, CAR.
- 제1항에 있어서, 상기 항-EGFR 항체의 항원 결합 도메인이 항-EGFR 중쇄(HC) 가변 영역 및 항-EGFR 경쇄(LC) 가변 영역, 또는 이의 각각의 등가물을 포함하는, CAR.
- 제3항에 있어서, 상기 HC 가변 영역이
Q V Q L Q Q S G S E M A R P G A S V K L P C K A S G D T F T S Y W M H W V K Q R H G H G P E W I G N I Y P G S G G T N Y A E K F K N K V T L T V D R S S R T V Y M H L S R L T S E D S A V Y Y C T R S G G P Y F F D Y W G Q G T T L T V S S, 또는 이의 등가물을 포함하는, CAR. - 제3항 또는 제4항에 있어서, 상기 LC 가변 영역이
D I L M T Q S P L S L P V S L G D Q A S I S C R S S Q N I V H N N G I T Y L E W Y L Q R P G Q S P K L L I Y K V S D R F S G V P D R F S G S G S G T D F T L K I S R V E A E D L G I Y Y C F Q G S H I P P T F G G G T K L E I K R A A, 또는 이의 등가물을 포함하는, CAR. - 제3항에 있어서, 항-EGFR HC 가변 영역 및 항-EGFR LC 가변 영역 사이에 위치하는 링커 폴리펩티드를 추가로 포함하는, CAR.
- 제6항에 있어서, 상기 링커 폴리펩티드가 GGGGSGGGGSGGGG 또는 이의 등가물을 포함하는, CAR.
- 제1항 내지 제3항 중의 어느 한 항에 있어서, EGFR 결합 도메인의 아미노 말단에 신호 폴리펩티드를 추가로 포함하는, CAR.
- 제1항 내지 제3항 중의 어느 한 항에 있어서, 상기 힌지 폴리펩티드가 CTCGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCG 또는 이의 등가물을 포함하는, CAR.
- 제2항에 있어서, 상기 CD28 공자극 분자가 CD28 막관통 도메인 및 CD28 세포내 도메인, 또는 이의 각각의 등가물을 포함하는, CAR.
- 제1항 내지 제3항 중의 어느 한 항에 있어서, CAR에 부착된 검출가능한 마커 및/또는 정제 마커를 추가로 포함하는, CAR.
- 제1항 내지 제3항, 제5항 또는 제6항 중의 어느 한 항에 있어서, 등가 폴리펩티드가 상기 폴리펩티드와 적어도 80% 아미노산 동일성을 갖거나, 상기 폴리펩티드를 코딩하는 폴리뉴클레오티드 또는 이의 상보체와 적어도 80% 동일하거나, 상기 폴리뉴클레오티드 또는 이의 상보체와 고 엄격성의 조건하에 하이브리드화하는 폴리뉴클레오티드에 의해 코딩되고, 상기 고 엄격성의 조건이 약 25℃ 내지 약 37℃의 인큐베이션 온도; 약 6×SSC 내지 약 10×SSC의 하이브리드화 완충액 농도; 약 0% 내지 약 25%의 포름아미드 농도; 및 약 4×SSC 내지 약 8×SSC의 세척 용액을 포함하는, CAR.
- 제1항 내지 제3항, 제5항 또는 제6항 중의 어느 한 항의 CAR을 코딩하는 단리된 핵산.
- 제13항의 단리된 핵산 서열을 포함하는 벡터.
- 제14항에 있어서, 상기 벡터가 플라스미드인, 벡터.
- 제14항에 있어서, 상기 벡터가 바이러스 벡터인, 벡터.
- 제14항에 있어서, 상기 바이러스 벡터가, 레트로바이러스 벡터, 렌티바이러스 벡터, 아데노바이러스 벡터 및 아데노-연관된 바이러스 벡터로 이루어진 그룹으로부터 선택되는, 벡터.
- 제14항에 있어서, 상기 벡터가 렌티바이러스 벡터인, 벡터.
- 제14항 내지 제18항 중의 어느 한 항에 있어서, 검출가능한 표지 및/또는 저제 마커를 추가로 포함하고, 상기 검출가능한 표지가 임의로 천연에 존재하는 폴리뉴클레오티드가 아닌 것인, 벡터.
- 제1항 내지 제3항, 제5항 또는 제6항 중의 어느 한 항의 CAR을 포함하는 단리된 세포.
- 제13항의 단리된 핵산을 포함하는 단리된 세포.
- 제14항의 벡터를 포함하는 단리된 세포.
- 제20항에 있어서, 상기 세포가 원핵세포 또는 진핵세포인, 단리된 세포.
- 제21항에 있어서, 상기 세포가 원핵세포 또는 진핵세포인, 단리된 세포.
- 제22항에 있어서, 상기 세포가 원핵세포 또는 진핵세포인, 단리된 세포.
- 제23항에 있어서, 상기 세포가 진핵세포인, 단리된 세포.
- 제24항에 있어서, 상기 세포가 진핵세포인, 단리된 세포.
- 제25항에 있어서, 상기 세포가 진핵세포인, 단리된 세포.
- 제26항에 있어서, 상기 진핵세포가 동물 세포, 포유동물 세포, 소 세포, 고양이 세포, 개 세포, 뮤린 세포, 말 세포 또는 인간 세포로부터 선택되는, 단리된 세포.
- 제27항에 있어서, 상기 진핵세포가 동물 세포, 포유동물 세포, 소 세포, 고양이 세포, 개 세포, 뮤린 세포, 말 세포 또는 인간 세포로부터 선택되는, 단리된 세포.
- 제28항에 있어서, 상기 진핵세포가 동물 세포, 포유동물 세포, 소 세포, 고양이 세포, 개 세포, 뮤린 세포, 말 세포 또는 인간 세포로부터 선택되는, 단리된 세포.
- 제29항에 있어서, 상기 세포가 T-세포 및 천연 킬러(NK) 세포의 그룹으로부터 선택되는, 단리된 세포.
- 제30항에 있어서, 상기 세포가 T-세포 및 천연 킬러(NK) 세포의 그룹으로부터 선택되는, 단리된 세포.
- 제31항에 있어서, 상기 세포가 T-세포 및 천연 킬러(NK) 세포의 그룹으로부터 선택되는, 단리된 세포.
- 제1항 내지 제3항 중의 어느 한 항의 CAR 및 EGFR 단백질 또는 이의 단편 및/또는 돌연변이체 EGFR 단백질 또는 이의 단편을 포함하는, 단리된 복합체.
- 제1항 내지 제3항 중의 어느 한 항의 CAR 및 wt EGFR 및/또는 돌연변이체 EGFR을 발현하는 세포를 포함하는, 단리된 복합체.
- 담체 및 제1항 내지 제3항 중의 어느 한 항의 하나 이상의 CAR을 포함하는, 조성물.
- 제37항에 있어서, 상기 담체가 약제학적으로 허용되는 담체 또는 고체 지지체인, 조성물.
- 제1항 내지 제3항 중의 어느 한 항의 CAR을 코딩하는 핵산 서열을 세포에 도입하는 것을 포함하는, EGFR CAR 세포를 제조하는 방법.
- 제39항에 있어서, EGFR CAR에 의해 형질도입된 세포를 단리하는 것을 추가로 포함하는, 방법.
- 제39항에 있어서, 상기 세포가 포유동물 세포, 개 세포, 소 세포, 뮤린 세포, 고양이 세포, 말 세포 또는 인간 세포 및 임의로 T 세포 또는 NK 세포로 이루어진 그룹의 세포인, 방법.
- 제40항 또는 제41항의 방법에 의해 생성된 단리된 CAR 세포.
- GFR 및/또는 돌연변이체 EGFR을 세포 표면 상에서 발현하는 세포를 제42항의 유효량의 단리된 세포와 접촉시키는 것을 포함하는, 상기 세포의 성장을 억제하는 방법.
- 제43항에 있어서, 상기 세포가 종양 세포 또는 암 줄기 세포인, 방법.
- 제44항에 있어서, 상기 종양 세포가 뇌암의 세포, 임의로 (i) 교아세포종 또는 교아세포종 줄기 세포 및/또는 (ii) 유방암 뇌 전이 또는 유방암 뇌 전이 줄기 세포로부터 선택되는 뇌암의 세포인, 방법.
- 제42항의 유효량의 단리된 세포를 대상체에게 투여하는 것을 포함하는, EGFR 및/또는 돌연변이체 EGFR을 세포 표면 상에서 발현하는 세포의 성장 억제를 필요로 하는 대상체에서 상기 세포의 성장을 억제하는 방법.
- 제46항에 있어서, 상기 세포가 종양 세포 또는 줄기 세포인, 방법.
- 제47항에 있어서, 상기 종양 세포가 뇌암의 세포, 임의로 (i) 교아세포종 또는 교아세포종 줄기 세포 및/또는 (ii) 유방암 뇌 전이 또는 유방암 뇌 전이 줄기 세포로부터 선택되는 뇌암의 세포인, 방법.
- 제46항에 있어서, 상기 단리된 세포가 세포를 제공받은 대상체에 대해 자기유래인, 방법.
- 제42항의 유효량의 단리된 세포를 대상체에게 투여하는 것을 포함하는, 암 치료를 필요로 하는 대상체에서 암을 치료하는 방법으로서, 암 세포가 EGFR 및/또는 돌연변이체 EGFR을 발현하는 것인, 방법.
- 제50항에 있어서, 상기 단리된 세포가 치료되는 대상체에 대해 자기유래인, 방법.
- 제50항에 있어서, 상기 세포가 두개내 주사 또는 정맥내 투여에 의해 투여되는, 방법.
- 제50항에 있어서, 상기 대상체가 포유동물, 뮤린, 개, 소, 뮤린, 고양이, 말 또는 인간의 그룹으로부터 선택되는 방법.
- 환자로부터 단리된 암 세포를 유효량의 항-EGFR 항체 및 돌연변이체 EGFR 항체와 접촉시키는 단계, 암 세포에 결합된 임의의 항체의 존재를 검출하는 단계를 포함하고, 여기서 암 세포에 결합된 항체의 존재는 대상체가 항-EGFR CAR 요법에 반응할 가능성이 있음을 나타내고 암 세포에 결합된 항체의 부재는 대상체가 항-EGFR CAR 요법에 반응할 가능성이 없음을 나타내는 것인, 대상체가 항-EGFR CAR 요법에 반응할 가능성이 있는지 또는 없는지를 결정하는 방법.
- 제54항에 있어서, 제26항의 유효량의 세포를, 항-EGFR CAR 요법에 반응할 가능성이 있는 것으로 결정된 대상체에게 투여하는 것을 추가로 포함하는, 방법.
- 제54항 또는 제55항에 있어서, 상기 암 세포가 뇌암의 세포, 임의로 (i) 교아세포종 세포 또는 교아세포종 줄기 세포 및/또는 (ii) 유방암 전이 또는 유방암 전이 줄기 세포로부터 선택되는 뇌암의 세포인, 방법.
- 제54항 또는 제55항에 있어서, 상기 대상체가 포유동물, 말, 고양이, 개, 소, 뮤린 또는 인간의 그룹으로부터 선택되는, 방법.
- 제54항 또는 제55항에 있어서, 유효량의 항암 요법을 투여하는 것을 추가로 포함하는, 방법.
- 제58항에 있어서, 상기 항암 요법이 방사선 요법, 외과수술 또는 화학요법 중의 하나 이상을 포함하는, 방법.
- 제50항에 있어서, 상기 항-EGFR CAR 요법이 제1 라인 요법, 제2 라인 요법, 제3 라인 요법 및 제4 라인 요법의 그룹으로부터 선택되는, 방법.
- 제1항 내지 제3항 중의 어느 한 항의 하나 이상의 CAR 및 임의로 사용 지침서를 포함하는, 키트.
- 제61항에 있어서, 종양용해성 단순 헤르페스 바이러스를 추가로 포함하는, 키트.
- 제42항의 유효량의 단리된 세포, 유효량의 종양용해성 단순 헤르페스 바이러스, 또는 이의 각각의 등가물을 대상체에게 투여하는 것을 포함하는, 암의 치료를 필요로 하는 대상체에서 암을 치료하는 방법.
- 제63항에 있어서, 상기 단리된 세포가 NK 세포인, 방법.
- 제63항 또는 제64항에 있어서, 상기 단리된 세포가 조사된 것인, 방법.
- 제55항에 있어서, 상기 단리된 세포가 1000 cGy의 선량으로 조사된 것인, 방법.
- 제63항에 있어서, 상기 종양용해성 단순 헤르페스 바이러스가 HSV-1로부터 유래하는, 방법.
- 제63항에 있어서, 상기 유효량의 단리된 세포가 상기 유효량의 종양용해성 단순 헤르페스 바이러스의 투여 전에 투여되는, 방법.
- 제68항에 있어서, 상기 유효량의 종양용해성 단순 헤르페스 바이러스가 복수일에 걸쳐 투여되는, 방법.
- 제63항에 있어서, 상기 암이 뇌암인, 방법.
- 제70항에 있어서, 상기 뇌암이 교아세포종 또는 유방암 뇌 전이로부터 선택되는, 방법.
- 제42항의 상기 단리된 세포 및 사용 지침서를, 임의로 종양용해성 헤르페스 바이러스와 함께 포함하는, 암을 치료하기 위한 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562143744P | 2015-04-06 | 2015-04-06 | |
| US62/143,744 | 2015-04-06 | ||
| PCT/US2016/026057 WO2016164370A1 (en) | 2015-04-06 | 2016-04-05 | Egfr-directed car therapy for glioblastoma |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180012749A true KR20180012749A (ko) | 2018-02-06 |
Family
ID=57073323
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177031930A KR20180012749A (ko) | 2015-04-06 | 2016-04-05 | 교아세포종에 대한 egfr-지시된 car 요법 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US11045543B2 (ko) |
| EP (1) | EP3280437A4 (ko) |
| JP (2) | JP6879932B2 (ko) |
| KR (1) | KR20180012749A (ko) |
| CN (1) | CN108367057B (ko) |
| AU (1) | AU2016246457B2 (ko) |
| CA (1) | CA2981979A1 (ko) |
| HK (1) | HK1250918A1 (ko) |
| WO (1) | WO2016164370A1 (ko) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK3143134T3 (da) | 2014-05-15 | 2021-01-04 | Nat Univ Singapore | Modificerede, naturlige dræberceller og anvendelser deraf |
| US11230577B2 (en) * | 2015-10-13 | 2022-01-25 | City Of Hope | Chimeric antigen receptors containing a chlorotoxin domain |
| CN108261426B (zh) * | 2017-01-04 | 2019-04-05 | 杭州康万达医药科技有限公司 | 药物组合物及其在治疗肿瘤和/或癌症的药物中的应用 |
| AU2018245749A1 (en) | 2017-03-27 | 2019-10-03 | National University Of Singapore | Stimulatory cell lines for ex vivo expansion and activation of natural killer cells |
| CN107354199A (zh) * | 2017-07-04 | 2017-11-17 | 武汉波睿达生物科技有限公司 | 一种检测靶向cd30的cart细胞中car表达的荧光定量试剂盒 |
| CN107759701B (zh) * | 2017-10-27 | 2021-07-02 | 杭州优善生物科技有限公司 | 嵌合抗原受体、其修饰的NK细胞、编码DNA、mRNA、表达载体、制备方法和应用 |
| CN109836497A (zh) * | 2017-11-25 | 2019-06-04 | 深圳宾德生物技术有限公司 | 一种靶向egfr的单链抗体、嵌合抗原受体t细胞及其制备方法和应用 |
| CN108315305B (zh) * | 2017-12-26 | 2020-11-06 | 沣潮医药科技(上海)有限公司 | 携带嵌合抗原受体的免疫细胞外泌体的制备方法及其应用 |
| CN109568351B (zh) * | 2018-11-30 | 2020-02-21 | 武汉波睿达生物科技有限公司 | 溶瘤病毒和car-t联合应用针对实体肿瘤的治疗 |
| CN111378046B (zh) * | 2018-12-27 | 2024-03-15 | 上海细胞治疗集团有限公司 | 一种免疫效应细胞转换受体 |
| CN110592024A (zh) * | 2019-09-12 | 2019-12-20 | 广东食品药品职业学院 | 以tEGFR与CD19为双靶点的CAR-NK细胞制备方法及其应用 |
| CN110845623B (zh) * | 2019-10-11 | 2021-07-09 | 厦门大学 | 一种egfr特异性嵌合抗原受体及其应用 |
| CN111925448B (zh) * | 2020-08-03 | 2022-06-21 | 山东大学 | 在体生成car-巨噬细胞的制备方法及肿瘤免疫治疗中的应用 |
| US20220072043A1 (en) * | 2020-09-10 | 2022-03-10 | Mustang Bio, Inc. | Combination therapy comprising cancer-targeted car-t cells and a method of using same for a treatment for cancer |
| WO2023034758A1 (en) * | 2021-08-30 | 2023-03-09 | Cytoimmune Therapeutics, Inc. | Methods and compositions for cell expansion |
| WO2024151777A1 (en) * | 2023-01-11 | 2024-07-18 | The Trustees Of The University Of Pennsylvania | Hydrogels for intratumoral delivery of cellular immunotherapies |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL358215A1 (en) | 2000-03-24 | 2004-08-09 | Micromet Ag | Multifunctional polypeptides comprising a binding site to an epitope of the nkg2d receptor complex |
| AU2003258060B2 (en) * | 2002-03-27 | 2007-07-12 | Baylor College Of Medicine | Potent oncolytic herpes simplex virus for cancer therapy |
| JP3803790B2 (ja) * | 2003-02-17 | 2006-08-02 | 株式会社東北テクノアーチ | 新規なダイアボディ型二重特異性抗体 |
| JP2005333993A (ja) * | 2005-08-03 | 2005-12-08 | Tohoku Techno Arch Co Ltd | 新規なダイアボディ型二重特異性抗体 |
| US20110052570A1 (en) * | 2005-10-26 | 2011-03-03 | Children's Medical Center Corporation | Method to prognose response to anti-egfr therapeutics |
| CA2654317A1 (en) | 2006-06-12 | 2007-12-21 | Trubion Pharmaceuticals, Inc. | Single-chain multivalent binding proteins with effector function |
| WO2009018386A1 (en) | 2007-07-31 | 2009-02-05 | Medimmune, Llc | Multispecific epitope binding proteins and uses thereof |
| PT3006459T (pt) | 2008-08-26 | 2021-11-26 | Hope City | Método e composições para funcionamento melhorado de efetores antitumorais de células t |
| ES2754394T3 (es) | 2010-09-08 | 2020-04-17 | Chemotherapeutisches Forschungsinstitut Georg Speyer Haus | Receptores de antígenos quiméricos con una región bisagra optimizada |
| SG190997A1 (en) | 2010-12-09 | 2013-07-31 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| JP6076963B2 (ja) * | 2011-04-08 | 2017-02-15 | アメリカ合衆国 | 抗上皮成長因子受容体変異体iiiキメラ抗原受容体及び癌の治療のためのその使用 |
| JP2015527869A (ja) | 2011-08-26 | 2015-09-24 | メリマック ファーマシューティカルズ インコーポレーティッド | タンデムFc二重特異性抗体 |
| WO2013051718A1 (ja) | 2011-10-07 | 2013-04-11 | 国立大学法人三重大学 | キメラ抗原受容体 |
| AP2014007638A0 (en) | 2011-11-16 | 2014-05-31 | Amgen Inc | Methods of treating epidermal growth factor deletion mutant VIII related disorders |
| JP6850528B2 (ja) | 2012-02-13 | 2021-03-31 | シアトル チルドレンズ ホスピタル ドゥーイング ビジネス アズ シアトル チルドレンズ リサーチ インスティテュート | 二重特異性キメラ抗原受容体およびその治療的使用 |
| JP2015509717A (ja) | 2012-02-22 | 2015-04-02 | ザ トラスティーズ オブ ザ ユニバーシティ オブ ペンシルバニア | 抗腫瘍活性およびcar存続性を強化するためのicosベースのcarの使用 |
| CN103483452B (zh) * | 2012-06-12 | 2021-08-13 | 上海细胞治疗集团有限公司 | 双信号独立的嵌合抗原受体及其用途 |
| CN103113470B (zh) | 2013-02-27 | 2015-04-22 | 四川大学 | 靶向人egfr的基因工程化淋巴细胞及其制备方法和用途 |
| EP3241897B1 (en) * | 2013-03-07 | 2018-10-03 | Baylor College of Medicine | Targeting cd138 in cancer |
| US20140302037A1 (en) | 2013-03-15 | 2014-10-09 | Amgen Inc. | BISPECIFIC-Fc MOLECULES |
| AU2014259675B2 (en) | 2013-05-03 | 2019-05-02 | Ohio State Innovation Foundation | CS1-specific chimeric antigen receptor engineered immune effector cells |
| US9517276B2 (en) * | 2013-06-04 | 2016-12-13 | Cytomx Therapeutics, Inc. | Compositions and methods for conjugating activatable antibodies |
| ES2845924T3 (es) | 2013-10-15 | 2021-07-28 | Scripps Research Inst | Interruptores de células T con receptores de antígenos quiméricos peptídicos y usos de los mismos |
| ES2661132T3 (es) | 2013-10-25 | 2018-03-27 | Psioxus Therapeutics Limited | Adenovirus oncolíticos armados con genes heterólogos |
| EP3593812A3 (en) | 2014-03-15 | 2020-05-27 | Novartis AG | Treatment of cancer using chimeric antigen receptor |
| MY181834A (en) | 2014-07-21 | 2021-01-08 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| CN107530424A (zh) | 2015-02-20 | 2018-01-02 | 俄亥俄州国家创新基金会 | 针对nkg2d和肿瘤相关抗原的二价抗体 |
| US10744157B2 (en) | 2015-03-26 | 2020-08-18 | The Trustees Of Dartmouth College | Anti-MICA antigen binding fragments, fusion molecules, cells which express and methods of using |
| MA44314A (fr) | 2015-11-05 | 2018-09-12 | Juno Therapeutics Inc | Récepteurs chimériques contenant des domaines induisant traf, et compositions et méthodes associées |
| SG10201913583QA (en) | 2016-08-23 | 2020-02-27 | Univ California | Proteolytically cleavable chimeric polypeptides and methods of use thereof |
-
2016
- 2016-04-05 AU AU2016246457A patent/AU2016246457B2/en not_active Ceased
- 2016-04-05 US US15/564,166 patent/US11045543B2/en active Active
- 2016-04-05 KR KR1020177031930A patent/KR20180012749A/ko not_active Application Discontinuation
- 2016-04-05 JP JP2017553189A patent/JP6879932B2/ja active Active
- 2016-04-05 CA CA2981979A patent/CA2981979A1/en active Pending
- 2016-04-05 EP EP16777143.5A patent/EP3280437A4/en not_active Withdrawn
- 2016-04-05 CN CN201680025143.5A patent/CN108367057B/zh not_active Expired - Fee Related
- 2016-04-05 WO PCT/US2016/026057 patent/WO2016164370A1/en active Application Filing
-
2018
- 2018-08-13 HK HK18110330.8A patent/HK1250918A1/zh unknown
-
2020
- 2020-07-03 JP JP2020115454A patent/JP2020156522A/ja active Pending
-
2021
- 2021-03-12 US US17/200,322 patent/US20210308261A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| HK1250918A1 (zh) | 2019-01-18 |
| AU2016246457B2 (en) | 2020-10-15 |
| US20180117146A1 (en) | 2018-05-03 |
| WO2016164370A1 (en) | 2016-10-13 |
| JP6879932B2 (ja) | 2021-06-02 |
| US20210308261A1 (en) | 2021-10-07 |
| CN108367057B (zh) | 2022-11-22 |
| JP2020156522A (ja) | 2020-10-01 |
| AU2016246457A1 (en) | 2017-10-26 |
| EP3280437A4 (en) | 2018-09-12 |
| JP2018513687A (ja) | 2018-05-31 |
| US11045543B2 (en) | 2021-06-29 |
| CN108367057A (zh) | 2018-08-03 |
| CA2981979A1 (en) | 2016-10-13 |
| EP3280437A1 (en) | 2018-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210308261A1 (en) | Egfr-directed car therapy for glioblastoma | |
| US20210269534A1 (en) | Flt3 directed car cells for immunotherapy | |
| US20210301024A1 (en) | Compositions and methods for immunotherapy targeting flt3, pd-1, and/or pd-l1 | |
| CN112118850A (zh) | 双特异性抗体car细胞免疫疗法 | |
| US20200016201A1 (en) | Chimeric antigen receptors and compositions and methods of use thereof | |
| JP2018518151A (ja) | B7−h4発現充実性腫瘍を処置するためのcar t細胞 | |
| US11667715B2 (en) | Lym-1 and Lym-2 antibody compositions and improved car constructs |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |