KR20170044172A - 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 조성물을 사용하여 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법 - Google Patents
티에노트리아졸로디아제핀 화합물을 함유하는 약학적 조성물을 사용하여 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법 Download PDFInfo
- Publication number
- KR20170044172A KR20170044172A KR1020177007647A KR20177007647A KR20170044172A KR 20170044172 A KR20170044172 A KR 20170044172A KR 1020177007647 A KR1020177007647 A KR 1020177007647A KR 20177007647 A KR20177007647 A KR 20177007647A KR 20170044172 A KR20170044172 A KR 20170044172A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- solid dispersion
- formula
- pharmaceutically acceptable
- alkyl
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
- A61K31/5517—1,4-Benzodiazepines, e.g. diazepam or clozapine condensed with five-membered rings having nitrogen as a ring hetero atom, e.g. imidazobenzodiazepines, triazolam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- Y10S514/908—
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dispersion Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은, 하기 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물 또는 용매화물의 약학적으로 허용가능한 양을 투여하는 것을 포함하는, 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법에 관한 것이다:
(1)
상기 식에서, R1은 1-4의 탄소수를 갖는 알킬이고; R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며; R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 -NR7―CO―(CH2)n―R8(여기서 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고; R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬임); 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 또는 ―(CH2)b―COOR10(여기서 b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)에 의해 임의로 치환된 페닐 또는 피리딜이다.
(1)
상기 식에서, R1은 1-4의 탄소수를 갖는 알킬이고; R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며; R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 -NR7―CO―(CH2)n―R8(여기서 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고; R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬임); 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 또는 ―(CH2)b―COOR10(여기서 b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)에 의해 임의로 치환된 페닐 또는 피리딜이다.
Description
본 개시내용은 치료 방법, 특히 티에노트리아졸로디아제핀 화합물을 이용하여 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법에 관한 것이다.
급성 골수성 및 급성 림프구성 백혈병(AML 및 ALL)은 성숙 정지, 비정상 조혈 전구 세포의 확장 및 염색질의 비정상적 리모델링과 관련된 유전적으로 복잡하고 이질적인 종양군을 구성한다.
일 양태에서, 본 발명은 본원에 기재된 티에노트리아졸로디아제핀 화합물을 이용하여 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법을 제공한다. 일부 구현예에서, 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법은 식 (1)의 티에노트리아졸로디아제핀 화합물로 표시되는 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물 또는 용매화물의 약학적으로 허용가능한 양을 투여하는 것을 포함한다:
상기 식에서, R1은 1-4의 탄소수를 갖는 알킬이고,
R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며,
R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서, R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 ―NR7―CO―(CH2)n―R8 (여기서, R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고,
R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬; 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기에 의해 임의로 치환된 페닐 또는 피리딜임) 또는 ―(CH2)b―COOR10(여기서, b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)이다. 일부 상기 구현예에서, HEXIM1의 발현은 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물의 투여 후 상향 조절된다.
일부 구현예에서, 식 (1)은 식 (1A), 이의 약학적으로 허용가능한 염 또는 이의 수화물로부터 선택된다:
상기 식에서, X는 할로겐이고, R1은 C1-C4 알킬이며, R2는 C1-C4 알킬이고, a는 1-4의 정수이며, R3은 C1-C4 알킬, C1-C4 하이드록시알킬, C1-C4 알콕시, 식 (1)에서 R9에 대해 정의된 바와 같은 치환체(들)를 임의로 갖는 페닐, 또는 식 (1)에서 R9에 대해 정의된 바와 같은 치환체(들)를 임의로 갖는 헤테로아릴이다.
급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법의 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 고체 분산물로서 형성된다. 본 발명의 추가 구현예에서, 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물과 약학적으로 허용가능한 중합체를 포함하는 고체 분산물로서 제제화된다.
일부 구현예에서, 본 개시내용은 급성 골수성 백혈병을 치료하는 데 사용하기 위한, 식 (1)의 화합물, 특히 식 (1A)의 화합물을 제공한다. 일부 구현예에서, 본 개시내용은 급성 림프구성 백혈병을 치료하는 데 사용하기 위한, 식 (1)의 화합물, 특히 식 (1A)의 화합물을 제공한다. 본 발명의 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 고체 분산물로서 형성된다. 본 발명의 추가 구현예에서, 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물과 약학적으로 허용가능한 중합체를 포함하는 고체 분산물로서 제제화된다.
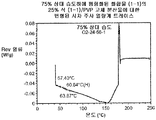
하나의 상기 구현예에서, 티에노트리아졸로디아제핀 화합물은 비정질 티에노트리아졸로디아제핀 화합물과 약학적으로 허용가능한 중합체를 포함하는 고체 분산물로서 제제화된다. 하나의 상기 구현예에서, 고체 분산물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물의 비정질 티에노트리아졸로디아제핀 화합물, 이의 약학적으로 허용가능한 염, 또는 이의 수화물; 및 약학적으로 허용가능한 중합체를 포함한다. 또 다른 상기 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 또 다른 상기 구현예에서, 고체 분산물은 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물, 이의 약학적으로 허용가능한 염 또는 이의 수화물; 및 약학적으로 허용가능한 중합체를 포함한다. 하나의 상기 구현예에서, 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS) 중량비를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트이다. 또 다른 구현예에서, 고체 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타낸다.
급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법의 일 구현예에서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은: (a) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 이의 이수화물, (b) 메틸 (S)-{4-(3'-시아노바이페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (c) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (d) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 선택된다.
급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법의 일 구현예에서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물이다.
일 구현예에서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드이다.
본원에 기재된 식 (1)에 따른 화합물의 임의의 구현예는 달리 나타내지 않는 한 본원에 기재된 약학적 조성물의 임의의 구현예에서 사용될 수 있는 것으로 이해되어야 한다. 더욱이, 본 발명의 구현예로서 본원에 기재된 임의의 화합물 또는 약학적 조성물은 달리 나타내지 않는 한 특히 본원의 구현예에서 기재된 바와 같은 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하기 위한 약제로서 사용될 수 있다.
전술한 요약뿐만 아니라, 티에노트리아졸로디아제핀 제제를 포함하는 약학적 조성물 및 본 발명의 방법의 구현예의 하기 상세한 설명은 예시적인 구현예의 첨부된 도면과 함께 읽혀질 때 더 잘 이해될 것이다. 그러나, 본 발명은 표시된 정확한 배열 및 수단에 한정되지 않는 것으로 이해되어야 한다.
도면에서:
도 1a는 25% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고체 분산물을 포함하는 비교 제제의 용해 프로파일을 예시한다.
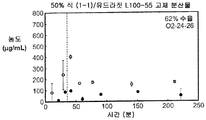
도 1b는 50% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고체 분산물을 포함하는 비교 제제의 용해 프로파일을 예시한다.
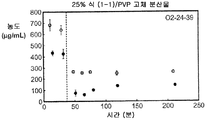
도 1c는 25% 화합물 (1-1) 및 폴리비닐피롤리돈(PVP)을 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1d는 50% 화합물 (1-1) 및 PVP를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1e는 25% 화합물 (1-1) 및 PVP-비닐 아세테이트(PVP-VA)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
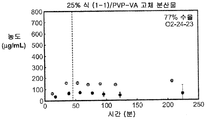
도 1f는 50% 화합물 (1-1) 및 PVP-VA를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
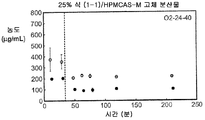
도 1g는 25% 화합물 (1-1) 및 히프로멜로스 아세테이트 석시네이트(HPMCAS-M)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
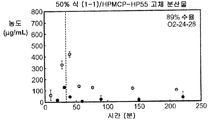
도 1h는 50% 화합물 (1-1) 및 HPMCAS-M을 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1i는 25% 화합물 (1-1) 및 히프로멜로스 프탈레이트(HPMCP-HP55)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
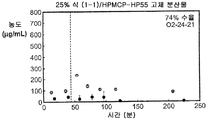
도 1j는 50% 화합물 (1-1) 및 HPMCP-HP55를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
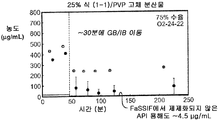
도 2a는 25% 화합물 (1-1) 및 PVP의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
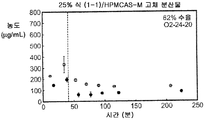
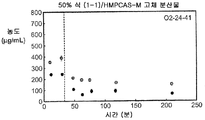
도 2b는 25% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
도 2c는 50% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
도 3은 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
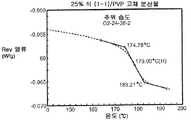
도 4a는 주변 조건 하에 평형화된 25% 화합물 (1-1) 및 PVP의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
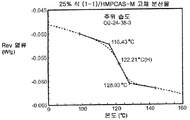
도 4b는 주변 조건 하에 평형화된 25% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
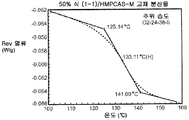
도 4c는 주변 조건 하에 평형화된 50% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 5는 25% 화합물 (1-1) 및 PVP 또는 HMPCAS-M 및 50% 화합물 (1-1) 및 HPMCAS-MG의 고체 분산물에 대한 유리 전이 온도(Tg) 대 상대 습도(RH)의 플롯을 예시한다.
도 6은 75% 상대 습도 하에 평형화된 25% 화합물 (1-1) 및 PVP의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 7의 7A 및 7B는 1 mg/kg 정맥내 투여(흑색 사각형) 및 25% 화합물 (1-1):PVP(백색 원), 25% 화합물 (1-1):HPMCAS-MG(백색 삼각형), 및 50% 화합물 (1-1):HPMCAS-MG(백색의 역전된 삼각형)으로서 3 mg/kg 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 예시한다. 삽도는 세미로그 규모로 플롯팅된 동일한 데이터를 묘사한다.
도 8의 8A 및 8B는 25% 화합물 (1-1): PVP(백색 원), 25% 화합물 (1-1):HPMCAS-MG(백색 삼각형), 및 50% 화합물 (1-1):HPMCAS-MG(백색의 역전된 삼각형)로서 3 mg/kg 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 예시한다. 삽도는 세미로그 규모로 플롯팅된 동일한 데이터를 묘사한다.
도 9는 안정성 시험의 0시간에 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 10은 40℃ 및 75% 상대 습도에서 1개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 11은 40℃ 및 75% 상대 습도에서 2개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 12는 40℃ 및 75% 상대 습도에서 3개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 13a는 급성 백혈병 세포주의 패널에서 기저 c-MYC 유전자 발현을 예시한다.
도 13b는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 BRD2/3/4 단백질 및 mRNA 발현을 예시한다.
도 13c는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 c-MYC 유전자 발현을 예시한다.
도 13d는 급성 백혈병 세포주의 패널에서 BRD2, BRD3, 및 BRD4의 유전자 발현 수준을 예시한다.
도 13e는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 BRD2, BRD3, 및 BRD4 mRNA 발현의 상대적 수준을 예시한다.
도 13f는 화합물 (1-1)로 처리 후 급성 백혈병 세포주의 패널에서 HEXIM1 mRNA 발현의 상대적 수준을 예시한다.
도 14a는 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 500nM 화합물 (1-1)의 효과를 예시한다.
도 14b는 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 500nM 화합물 (1-1)의 효과를 예시한다.
도 14c는 72시간 동안 500nM 화합물 (1-1)에의 노출에 의한 AML 세포주(HEL, NB4, NOMO-1, OCI-AML-3, KASUMI) 및 ALL 세포주(JURKAT 및 RS4-11) 환자에서 아폽토시스의 유도를 예시한다.
도 14d는 500nM 화합물 (1-1)에의 72시간 노출이 카스파아제-3을 활성화시키고 사이토크롬 c 방출을 유도하였음을 예시하며, 이는 BET 억제가 미토콘드리아 촉발 아폽토시스를 적어도 일부 야기한다는 것을 제시한다.
도 15a는 72시간 동안 500nM 화합물 (1-1)에의 노출에 의한 급성 백혈병 환자에서 세포자멸자의 유도를 예시한다.
도 15b는 AML 환자 샘플에서 화합물 (1-1)에 의한 카스파아제-3의 유도된 활성화 및 미토콘드리아 사이토크롬 c 방출을 예시한다.
도 15c는 AML 및 ALL 환자 샘플에서 48시간 동안 500nM 화합물 (1-1)로 처리 후 c-MYC mRNA 발현을 예시한다.
도 15d는 500nM 화합물 (1-1)로 72시간 처리 후 3명의 AML 환자 샘플에서 c-MYC, BRD2, 및 GAPDH 단백질 발현을 예시한다.
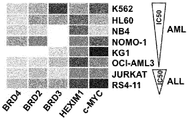
도 15e는 다양한 하위유형의 AML 및 ALL 환자 샘플에서 BRD2/3/4 유전자 발현을 예시한다.
도 16aa는 24시간, 48시간, 및 72시간에 500nM 화합물 (1-1)에 노출 후 AML 세포주(K562) 및 ALL 세포주(RS4-11)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16ab는 24시간, 48시간, 및 72시간에 500nM 화합물 (1-1)에 노출 후 AML 세포주(NB4, NOMO-1, 및 HL60)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16ba는 24시간, 48시간, 및 72시간에 500nM JQ1에 노출 후 AML 세포주(OCI-AML3 및 K562) 및 ALL 세포주(JURKAT, 및 RS4-11)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16bb는 24시간, 48시간, 및 72시간에 500nM JQ1에 노출 후 AML 세포주(NB4, NOMO-1, 및 HL60)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16c는 JQ1에 노출 후 AML 세포주(K562, HL60, NB4, KG1, OCI-AML3) 및 ALL 세포주(JURKAT, RS4-11)의 패널에서 c-MYC 유전자 발현을 예시한다.
도 17은 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 25nM, 100nM, 250nM 및 500nM 화합물 (1-1)의 효과를 예시한다.
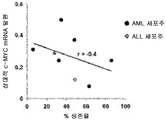
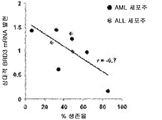
도 18a는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 c-MYC mRNA 발현을 예시한다.
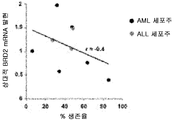
도 18b는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD4 mRNA 발현을 예시한다.
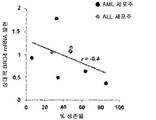
도 18c는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD2 mRNA 발현을 예시한다.
도 18d는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD3 mRNA 발현을 예시한다.
도 18e는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 HEXIM1 mRNA 발현을 예시한다.
도 19는 다양한 하위유형의 AML 및 ALL 환자 샘플에서 BRD2/3/4 유전자 발현을 예시한다.
도 20a는 AML 세포주(K562, HL60, NB4, MONO-1, KG1, OCI-AML3) 및 ALL 세포주(JURKAT, RS4-11)에 대한 세포 생존율 또는 아폽토시스의 감소 및 화합물 (1-1)에 노출된 세포주에서 cMYC, BRD2/3/4 및 HEXIM1 발현 수준을 예시한다.
도 20b는 도 20a에 대한 음영 키(shade key)를 예시한다.
도면에서:
도 1a는 25% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고체 분산물을 포함하는 비교 제제의 용해 프로파일을 예시한다.
도 1b는 50% 화합물 (1-1) 및 유드라짓 L100-55를 포함하는 고체 분산물을 포함하는 비교 제제의 용해 프로파일을 예시한다.
도 1c는 25% 화합물 (1-1) 및 폴리비닐피롤리돈(PVP)을 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1d는 50% 화합물 (1-1) 및 PVP를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1e는 25% 화합물 (1-1) 및 PVP-비닐 아세테이트(PVP-VA)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1f는 50% 화합물 (1-1) 및 PVP-VA를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1g는 25% 화합물 (1-1) 및 히프로멜로스 아세테이트 석시네이트(HPMCAS-M)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1h는 50% 화합물 (1-1) 및 HPMCAS-M을 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1i는 25% 화합물 (1-1) 및 히프로멜로스 프탈레이트(HPMCP-HP55)를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 1j는 50% 화합물 (1-1) 및 HPMCP-HP55를 포함하는 고체 분산물을 포함하는 예시적인 제제의 용해 프로파일을 예시한다.
도 2a는 25% 화합물 (1-1) 및 PVP의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
도 2b는 25% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
도 2c는 50% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물을 포함하는 예시적인 제제의 생체내 스크리닝의 결과를 예시한다.
도 3은 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 4a는 주변 조건 하에 평형화된 25% 화합물 (1-1) 및 PVP의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 4b는 주변 조건 하에 평형화된 25% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 4c는 주변 조건 하에 평형화된 50% 화합물 (1-1) 및 HPMCAS-M의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 5는 25% 화합물 (1-1) 및 PVP 또는 HMPCAS-M 및 50% 화합물 (1-1) 및 HPMCAS-MG의 고체 분산물에 대한 유리 전이 온도(Tg) 대 상대 습도(RH)의 플롯을 예시한다.
도 6은 75% 상대 습도 하에 평형화된 25% 화합물 (1-1) 및 PVP의 고체 분산물에 대한 변형된 시차 주사 열량계 트레이스를 예시한다.
도 7의 7A 및 7B는 1 mg/kg 정맥내 투여(흑색 사각형) 및 25% 화합물 (1-1):PVP(백색 원), 25% 화합물 (1-1):HPMCAS-MG(백색 삼각형), 및 50% 화합물 (1-1):HPMCAS-MG(백색의 역전된 삼각형)으로서 3 mg/kg 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 예시한다. 삽도는 세미로그 규모로 플롯팅된 동일한 데이터를 묘사한다.
도 8의 8A 및 8B는 25% 화합물 (1-1): PVP(백색 원), 25% 화합물 (1-1):HPMCAS-MG(백색 삼각형), 및 50% 화합물 (1-1):HPMCAS-MG(백색의 역전된 삼각형)로서 3 mg/kg 경구 투여 후 화합물 (1-1)에 대한 혈장 농도 대 시간 곡선을 예시한다. 삽도는 세미로그 규모로 플롯팅된 동일한 데이터를 묘사한다.
도 9는 안정성 시험의 0시간에 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 10은 40℃ 및 75% 상대 습도에서 1개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 11은 40℃ 및 75% 상대 습도에서 2개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 12는 40℃ 및 75% 상대 습도에서 3개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다.
도 13a는 급성 백혈병 세포주의 패널에서 기저 c-MYC 유전자 발현을 예시한다.
도 13b는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 BRD2/3/4 단백질 및 mRNA 발현을 예시한다.
도 13c는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 c-MYC 유전자 발현을 예시한다.
도 13d는 급성 백혈병 세포주의 패널에서 BRD2, BRD3, 및 BRD4의 유전자 발현 수준을 예시한다.
도 13e는 화합물 (1-1)에 노출 후 급성 백혈병 세포주의 패널에서 BRD2, BRD3, 및 BRD4 mRNA 발현의 상대적 수준을 예시한다.
도 13f는 화합물 (1-1)로 처리 후 급성 백혈병 세포주의 패널에서 HEXIM1 mRNA 발현의 상대적 수준을 예시한다.
도 14a는 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 500nM 화합물 (1-1)의 효과를 예시한다.
도 14b는 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 500nM 화합물 (1-1)의 효과를 예시한다.
도 14c는 72시간 동안 500nM 화합물 (1-1)에의 노출에 의한 AML 세포주(HEL, NB4, NOMO-1, OCI-AML-3, KASUMI) 및 ALL 세포주(JURKAT 및 RS4-11) 환자에서 아폽토시스의 유도를 예시한다.
도 14d는 500nM 화합물 (1-1)에의 72시간 노출이 카스파아제-3을 활성화시키고 사이토크롬 c 방출을 유도하였음을 예시하며, 이는 BET 억제가 미토콘드리아 촉발 아폽토시스를 적어도 일부 야기한다는 것을 제시한다.
도 15a는 72시간 동안 500nM 화합물 (1-1)에의 노출에 의한 급성 백혈병 환자에서 세포자멸자의 유도를 예시한다.
도 15b는 AML 환자 샘플에서 화합물 (1-1)에 의한 카스파아제-3의 유도된 활성화 및 미토콘드리아 사이토크롬 c 방출을 예시한다.
도 15c는 AML 및 ALL 환자 샘플에서 48시간 동안 500nM 화합물 (1-1)로 처리 후 c-MYC mRNA 발현을 예시한다.
도 15d는 500nM 화합물 (1-1)로 72시간 처리 후 3명의 AML 환자 샘플에서 c-MYC, BRD2, 및 GAPDH 단백질 발현을 예시한다.
도 15e는 다양한 하위유형의 AML 및 ALL 환자 샘플에서 BRD2/3/4 유전자 발현을 예시한다.
도 16aa는 24시간, 48시간, 및 72시간에 500nM 화합물 (1-1)에 노출 후 AML 세포주(K562) 및 ALL 세포주(RS4-11)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16ab는 24시간, 48시간, 및 72시간에 500nM 화합물 (1-1)에 노출 후 AML 세포주(NB4, NOMO-1, 및 HL60)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16ba는 24시간, 48시간, 및 72시간에 500nM JQ1에 노출 후 AML 세포주(OCI-AML3 및 K562) 및 ALL 세포주(JURKAT, 및 RS4-11)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16bb는 24시간, 48시간, 및 72시간에 500nM JQ1에 노출 후 AML 세포주(NB4, NOMO-1, 및 HL60)에서 BRD2/3/4, c-MYC, 및 GAPDH 단백질 발현을 예시한다.
도 16c는 JQ1에 노출 후 AML 세포주(K562, HL60, NB4, KG1, OCI-AML3) 및 ALL 세포주(JURKAT, RS4-11)의 패널에서 c-MYC 유전자 발현을 예시한다.
도 17은 AML 세포주(K562, KG1a, HL60, HEL, NB4, NOMO-1, KG1, OCI-AML3, KASUMI) 및 ALL 세포주(JURKAT, BV-173, TOM-1, 및 RS4-11)에서 세포 주기에 대한 48시간 동안 25nM, 100nM, 250nM 및 500nM 화합물 (1-1)의 효과를 예시한다.
도 18a는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 c-MYC mRNA 발현을 예시한다.
도 18b는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD4 mRNA 발현을 예시한다.
도 18c는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD2 mRNA 발현을 예시한다.
도 18d는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 BRD3 mRNA 발현을 예시한다.
도 18e는 화합물 (1-1) 유도된 생존율 손실의 함수로서 AML 세포주 및 ALL 세포주에서 상대적 HEXIM1 mRNA 발현을 예시한다.
도 19는 다양한 하위유형의 AML 및 ALL 환자 샘플에서 BRD2/3/4 유전자 발현을 예시한다.
도 20a는 AML 세포주(K562, HL60, NB4, MONO-1, KG1, OCI-AML3) 및 ALL 세포주(JURKAT, RS4-11)에 대한 세포 생존율 또는 아폽토시스의 감소 및 화합물 (1-1)에 노출된 세포주에서 cMYC, BRD2/3/4 및 HEXIM1 발현 수준을 예시한다.
도 20b는 도 20a에 대한 음영 키(shade key)를 예시한다.
본 발명의 요지는 대표적인 구현예가 나타난 첨부된 도면 및 실시예를 참조하여 이하에서 보다 충분히 설명될 것이다. 그러나, 본 발명의 요지는 상이한 형태로 구현될 수 있고, 본원에 제시된 구현예에 한정되는 것으로 해석되지 않아야 한다. 오히려, 이들 구현예는 설명하고 본 발명의 숙련자를 가능하게 하기 위해 제공된다. 달리 정의되지 않는 한, 본원에 사용된 모든 기술적 및 과학적 용어는 상기 요지가 속하는 기술 분야에서 통상의 기술을 가진 자에게 일반적으로 이해되는 것과 동일한 의미를 갖는다. 본원에 언급된 모든 간행물, 특허 출원, 특허 및 기타 참고 문헌은 그 전체가 참고로 포함된다.
I. 정의:
본원에 사용된 바와 같이 용어 "알킬기"는 포화된 직쇄 또는 분지쇄 탄화수소를 지칭한다.
용어 "치환된 알킬기"는 탄화수소 백본 중 수소 또는 하나 이상의 탄소를 대체하는 하나 이상의 치환체를 갖는 알킬 모이어티를 지칭한다.
단독으로 또는 치환기의 일부로서 사용되는지에 관계없이 용어 "알케닐기", 예를 들어, "C1- 4알케닐(아릴)"은 적어도 하나의 탄소-탄소 이중 결합을 갖는 부분적으로 불포화된 분지쇄 또는 직쇄 1가 탄화수소 라디칼을 지칭하며, 상기 이중 결합은 모 알킬 분자의 2개의 인접한 탄소 원자 각각으로부터 하나의 수소 원자를 제거함으로써 유래되고 상기 라디칼은 단일 탄소 원자로부터 하나의 수소 원자를 제거함으로써 유래된다. 원자들은 시스(Z) 또는 트랜스(E) 형태로 이중 결합에 대해 배향될 수 있다. 전형적인 알케닐 라디칼은, 비제한적으로, 에테닐, 프로페닐, 알릴(2-프로페닐), 부테닐 등을 포함한다. 예는 C1-4알케닐 또는 C2- 4알케닐기를 포함한다.
용어 "C(j-k)"(여기서, j 및 k는 지정된 수의 탄소 원자를 지칭하는 정수임)는 알킬, 알케닐, 알키닐, 알콕시 또는 사이클로알킬 라디칼을 지칭하거나 또는 j 내지 k 탄소 원자를 함유하는 접두사 어간으로서 나타나는 라디칼의 알킬 부분을 지칭한다. 예를 들어, C(1-4)는 1, 2, 3 또는 4개의 탄소 원자를 함유하는 라디칼을 가리킨다.
본원에 사용된 바와 같은 용어 "할로" 또는 "할로겐"은 F, Cl, Br, 또는 I를 지칭한다.
용어 "약학적으로 허용가능한 염"은 당해 분야에 인식되어 있고 예를 들어, 본 발명의 조성물에 함유된 것을 포함하는 화합물의 상대적으로 비독성인 무기 및 유기산 부가염, 또는 무기 또는 유기 염기 부가염을 지칭한다.
본원에 사용된 바와 같은 용어 "고체 분산물"은 적어도 2개의 상이한 성분, 일반적으로 친수성 캐리어 및 소수성 약물(활성 성분)로 이루어지는 고체 생성물의 그룹을 지칭한다.
용어 "키랄"은 당해 분야에 인식되어 있고 거울 상 파트너의 비-중첩가능성(non-superimposability)의 특성을 갖는 분자를 지칭하는 반면, 용어 "비키랄"은 이들의 거울 상 파트너 상에 중첩되지 않는 분자를 지칭한다. "프로키랄 분자"는 특정 공정에서 키랄 분자로 전환될 잠재성을 가진 분자이다.
본원에 사용된 바와 같은 용어 "거울상이성질체", 및 거울상이성질체를 나타내는 구조식은 그의 광학 이성질체가 없는 "순수한" 거울상이성질체 뿐만 아니라 거울상이성질체가 거울상이성질체 과잉, 예컨대, 적어도 10%, 25%, 50%, 75%, 90%, 95%, 98%, 또는 99% 거울상이성질체 과잉으로 존재하는 거울상이성질체 및 그의 광학 이성질체의 혼합물을 포함하는 것을 의미한다.
본원에서 사용될 때 용어 "입체이성질체"는 모든 기하학적 이성질체, 거울상이성질체 또는 부분입체이성질체로 이루어진다. 본 발명은 이들 화합물의 다양한 입체이성질체 및 이의 혼합물을 포함한다. 개시된 화합물의 형태 이성질체 및 회전이성질체가 또한 고려된다.
본원에 사용된 바와 같은 용어 "입체선택적 합성"은 단일 반응물이 새로운 입체중심의 생성 동안 또는 기존 입체중심의 변형 동안 입체이성질체의 불균등 혼합물을 형성하는 화학적 또는 효소적 반응을 가리키며, 본 기술분야에 널리 알려져 있다. 입체선택적 합성은 거울상이성질체 선택적 및 부분입체이성질체 선택적 변형 모두를 포함한다. 예를 들어, 문헌[Carreira, E. M. and Kvaerno, L., Classics in Stereoselective Synthesis, Wiley-VCH: Weinheim, 2009]을 참고한다.
용어 "분무 건조"는 공급물 현탁액 또는 용액을 작은 액적으로 분무화하고 증발하기 위한 강한 추진력(즉, 고온의 건조 기체 또는 부분 진공 또는 이의 조합)이 있는 처리기 챔버에서 상기 혼합물로부터 용매를 빠르게 제거하는 것을 포함하는 공정을 지칭한다.
본원에 사용된 바와 같이, 용어 "유효량"은, 예를 들어 연구자 또는 임상의 또는 의료 제공자에 의해 의도된, 조직, 생물학적 시스템, 동물 또는 인간의 표적화된 생물학적 또는 의학적 반응을 유발할 본 발명의 티에노트리아졸로디아제핀 화합물 또는 임의의 다른 약학적 활성제의 양을 지칭한다. 일부 구현예에서, 용어 "유효량"은 정상적인 생리학적 기능을 향상시키는 데 효과적인 본 발명의 티에노트리아졸로디아제핀 또는 임의의 다른 약학적 활성 제제의 임의의 양을 지칭하기 위해 사용된다.
본원에 사용된 바와 같은 용어 "치료적 유효량"은 티에노트리아졸로디아제핀 또는 다른 약학적 활성제의 상기 양을 투여받지 않은 해당 환자와 비교하여, 질환, 장애, 또는 부작용의 개선된 치료, 치유, 예방, 또는 개선, 또는 질환 또는 장애의 진행 속도의 감소를 야기하는, 본 발명의 티에노트리아졸로디아제핀 화합물 또는 임의의 다른 약학적 활성제의 양을 지칭한다.
용어 "약"은 +/- 10%를 의미한다. 일 구현예에서, 그것은 +/- 5%를 의미한다.
본 출원 전반에 그리고 뒤따르는 청구범위에서, 문맥이 달리 요구하지 않는 한, 단어 "포함하다", 또는 변형, 예컨대 "포함하는"은 언급된 정수 단계 또는 정수 또는 단계의 그룹을 포함하지만 임의의 다른 정수 또는 단계 또는 정수 또는 단계의 그룹을 배제하지 않는 것을 암시하는 것으로 이해되어야 한다. 더욱이, 단어 "포함하다"는 "이루어지다"를 암시하는 것으로 이해되어야 한다.
II. 사용 방법:
본원에 기재된 본 발명은 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법을 제공한다. 상세한 설명은 다양한 부분에서 개시 내용을 기술한다: III. 티에노트리아졸로디아제핀 화합물; IV. 제제; V. 투여 형태; VI. 투여량; VII. 공정; 및 VIII. 실시예. 당업자는 치료 방법의 다양한 구현예 각각이 본원에 기재된 티에노트리아졸로디아제핀 화합물, 제제, 투여 형태, 투여량 및 공정의 다양한 구현예를 포함한다는 것을 이해할 것이다.
일부 구현예에서, 본 발명은 식 (1)의 화합물, 특히 식 (1A)의 화합물로 표시되는 티에노트리아졸로디아제핀 화합물, 또는 이의 약학적으로 허용가능한 염, 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태의 약학적으로 허용가능한 양을 투여하는 것을 포함하는, 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법을 제공한다.
일부 구현예에서, 본 개시내용은 본원에 기재된 섹션 III, IV, V 및 VI에 기재된 임의의 조성물에 따른 고체 분산물을 포함하는 조성물의 약학적으로 허용가능한 양을 이를 필요로 하는 환자에게 투여하는 것을 포함하는, 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법을 제공한다.
일부 구현예에서, 본 개시내용은 본원에 기재된 섹션 III, IV, V 및 VI에 기재된 임의의 조성물에 따른 약학적 제제를 포함하는 조성물의 약학적으로 허용가능한 양을 이를 필요로 하는 환자에게 투여하는 것을 포함하는, 포유동물에서 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법을 제공한다.
일부 구현예에서, 본 개시내용은 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 데 사용하기 위한, 식 (1)의 화합물, 특히 식 (1A)의 화합물을 제공한다.
일부 구현예에서, 본 개시내용은 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 데 사용하기 위한 본원에 기재된 섹션 III, IV, V 및 VI에 기재된 임의의 조성물에 따른 고체 분산물을 제공한다.
일부 구현예에서, 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법은 식 (1)의 티에노트리아졸로디아제핀 화합물을 투여하는 것을 포함한다:
상기 식에서,
R1은 1-4의 탄소수를 갖는 알킬이고,
R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며,
R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 -NR7―CO―(CH2)n―R8(여기서 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고,
R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬임); 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 또는 ―(CH2)b―COOR10(여기서 b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)에 의해 임의로 치환된 페닐 또는 피리딜이며,
이는 이의 임의의 염, 이성질체, 거울상이성질체, 라세미체, 수화물, 용매화물, 대사물, 및 다형체를 포함한다.
일부 구현예에서, 식 (1)은 식 (1A), 이의 약학적으로 허용가능한 염 또는 이의 수화물로부터 선택된다:
상기 식에서, X는 할로겐이고, R1은 C1-C4 알킬이며, R2는 C1-C4 알킬이고, a는 1-4의 정수이며, R3은 C1-C4 알킬, C1-C4 하이드록시알킬, C1-C4 알콕시, 식 (1)에서 R9에 대해 정의된 바와 같은 치환체(들)를 임의로 갖는 페닐, 또는 식 (1)에서 R9에 대해 정의된 바와 같은 치환체(들)를 임의로 갖는 헤테로아릴이다.
일부 구현예에서, 본 개시내용은 급성 골수성 백혈병을 치료하는 데 사용하기 위한, 식 (1)의 화합물, 특히 식 (1A)의 화합물을 제공한다. 일부 구현예에서, 본 개시내용은 급성 림프구성 백혈병을 치료하는 데 사용하기 위한, 식 (1)의 화합물, 특히 식 (1A)의 화합물을 제공한다.
일부 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 고체 분산물로서 제제화된다. 그러한 고체 분산물의 다양한 구현예가 본원에 기재되어 있으며 그에 따라 사용될 수 있다.
일부 구현예에서, 본 개시내용은 급성 골수성 백혈병을 치료하는 데 사용하기 위한 본원에 기재된 섹션 III, IV, V 및 VI에 기재된 임의의 조성물에 따른 고체 분산물을 제공한다. 일부 구현예에서, 본 개시내용은 급성 림프구성 백혈병을 치료하는 데 사용하기 위한 본원에 기재된 섹션 III, IV, V 및 VI에 기재된 임의의 조성물에 따른 고체 분산물을 제공한다.
본 발명에 따른 급성 골수성 백혈병을 치료하는 방법의 일부 구현예에서, c-MYC RNA 수준은 하향 조절된다. 본 발명에 따른 급성 골수성 백혈병을 치료하는 방법의 일부 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 상향 조절된다. 본 발명에 따른 급성 골수성 백혈병을 치료하는 방법의 다른 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 하향 조절된다 일 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 AML이 투여되는 티에노트리아졸로디아제핀 화합물에 내성인 경우 하향 조절된다. 본 발명에 따른 급성 골수성 백혈병을 치료하는 방법의 일부 구현예에서, HEXIM1 발현은 상향 조절된다. 일 구현예에서, HEXIM1 수준은 AML이 투여되는 티에노트리아졸로디아제핀 화합물에 민감한 경우 상향 조절된다.
본 발명에 따른 급성 림프구성 백혈병을 치료하는 방법의 일부 구현예에서, c-MYC RNA 수준은 하향 조절된다. 본 발명에 따른 급성 림프구성 백혈병을 치료하는 방법의 일부 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 상향 조절된다. 본 발명에 따른 급성 림프구성 백혈병을 치료하는 방법의 다른 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 하향 조절된다. 일 구현예에서, BRD2, BRD3, 및/또는 BRD4 mRNA 수준은 ALL이 투여되는 티에노트리아졸로디아제핀 화합물에 내성인 경우 하향 조절된다. 본 발명에 따른 급성 림프구성 백혈병을 치료하는 방법의 일부 구현예에서, HEXIM1 발현은 상향 조절된다. 일 구현예에서, HEXIM1 수준은 ALL이 투여되는 티에노트리아졸로디아제핀 화합물에 민감한 경우 상향 조절된다.
본원에 사용된 바와 같은 포유동물 대상은 임의의 포유동물일 수 있다. 일 구현예에서, 포유동물 대상은 비제한적으로 인간; 비-인간 영장류; 설치류, 예컨대 마우스, 랫트, 또는 기니어 피그; 애완 동물, 예컨대 고양이 또는 개; 말, 소, 돼지, 양, 염소, 또는 토끼를 포함한다. 일 구현예에서, 포유동물 대상은 비제한적으로 조류, 예컨대 오리, 거위, 닭, 또는 칠면조를 포함한다. 일 구현예에서, 포유동물 대상은 인간이다. 일 구현예에서, 포유동물 대상은 임의의 성일 수 있고 임의의 연령일 수 있다.
III.
티에노트리아졸로디아제핀
화합물:
일 구현예에서, 본 발명의 제제에서 사용되는 티에노트리아졸로디아제핀 화합물은 식 (1)로 표시된다:
상기 식에서,
R1은 1-4의 탄소수를 갖는 알킬이고,
R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며,
R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 -NR7―CO―(CH2)n―R8(여기서 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고,
R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬임); 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 또는 ―(CH2)b―COOR10(여기서 b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)에 의해 임의로 치환된 페닐 또는 피리딜이며,
이는 이의 임의의 염, 이성질체, 거울상이성질체, 라세미체, 수화물, 용매화물, 대사물, 및 다형체를 포함한다.
일 구현예에서, 적합한 알킬기는 1개의 탄소 원자부터 최대 4개의 탄소 원자를 포함하는 선형 또는 분지형 알킬 라디칼을 포함한다. 일 구현예에서, 적합한 알킬기는 1개의 탄소 원자부터 최대 3개의 탄소 원자를 포함하는 선형 또는 분지형 알킬 라디칼을 포함한다. 일 구현예에서, 적합한 알킬기는 1개의 탄소 원자부터 최대 2개의 탄소 원자를 포함하는 선형 또는 분지형 알킬 라디칼을 포함한다. 일 구현예에서, 예시적인 알킬 라디칼은, 비제한적으로, 메틸, 에틸, 프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, tert-부틸을 포함한다. 일 구현예에서, 예시적인 알킬기는, 비제한적으로, 메틸, 에틸, 프로필, 이소프로필, 2-메틸-1-프로필, 및 2-메틸-2-프로필을 포함한다.
일부 구현예에서, 본 발명은 본원에 기재된 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 및 동위원소로 표지된 형태를 제공한다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염은 무기산을 이용하여 형성된 산 부가염을 포함한다. 일 구현예에서, 티에노트리아졸로디아제핀의 약학적으로 허용가능한 무기산 부가염은 염산, 브롬화수소산, 요오드화수소산, 인산, 메타인산, 질산 및 황산의 염을 포함한다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 염은 유기산을 이용하여 형성된 산 부가염을 포함한다. 일 구현예에서, 티에노트리아졸로디아제핀의 약학적으로 허용가능한 유기산 부가염은 타르타르산, 아세트산, 트리플루오로아세트산, 시트르산, 말산, 락트산, 푸마르산, 벤조산, 포름산, 프로피온산, 글리콜산, 글루콘산, 말레산, 숙신산, 캄포르황산, 이소티온산, 점액산, 젠티스산, 이소니코틴산, 사카르산, 글루쿠론산, 푸로산, 글루탐산, 아스코브산, 안트라닐산, 살리실산, 페닐아세트산, 만델산, 엠본산(파모산), 메타설폰산, 에탄설폰산, 판토텐산, 스테아르산, 설피닐산, 알긴산, 갈락투론산 및 아릴설폰산, 예를 들어 벤젠설폰산 및 4-메틸 벤젠설폰산을 포함한다.
본 발명은 본원에 기재된 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 동위원소로 표지된 형태를 제공하며, 여기서 하나 이상의 원자가 동일한 원자 번호를 갖지만 자연상에서 일반적으로 발견되는 원자량 또는 질량수와 상이한 원자량 또는 질량수를 갖는 원자로 대체된다. 티에노트리아졸로디아제핀 화합물에 포함되기 적합한 동위원소의 예는 수소의 동위원소, 예컨대, 2H 및 3H, 탄소의 동위원소, 예컨대, 11C, 13C 및 14C, 염소의 동위원소, 예컨대, 36Cl, 불소의 동위원소, 예컨대, 18F, 요오드의 동위원소, 예컨대, 123I 및 125I, 질소의 동위원소, 예컨대, 13N 및 15N, 산소의 동위원소, 예컨대, 15O, 17O 및 18O, 및 황의 동위원소, 예컨대, 35S를 포함한다. 티에노트리아졸로디아제핀 화합물의 동위원소로 표지된 형태는 일반적으로 본 기술분야의 숙련가에게 알려진 종래 기술에 의해 제조될 수 있다.
식 (1)의 화합물의 특정 동위원소로 표지된 형태, 예를 들어 방사성 동위원소를 포함하는 것은 약물 및/또는 기질 조직 분포 연구에 유용하다. 방사성 동위원소 삼중수소(3H) 및 탄소-14(14C)는 이의 혼입 용이성 및 용이한 검출 수단의 관점에서 이 목적에 특히 유용하다. 중수소(2H)와 같은 더 무거운 동위원소로의 대체는 더 큰 대사 안정성으로부터 비롯되는 특정한 치료 이점, 예를 들어 증가된 생체내 반감기 또는 감소된 투여량 요구를 제공할 수 있으며, 따라서 일부 경우에 바람직할 수 있다. 양성자 방출 동위원소, 예컨대 11C, 18F, 15O, 및 13N으로의 대체는 기질 수용체 점유를 조사하기 위한 양성자 방출 단층촬영(PET) 연구에 사용될 수 있다.
일부 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 약학적으로 허용가능한 용매와 함께 용매화된 형태 뿐만 아니라 용매화되지 않은 형태로 존재할 수 있다. 본 기술분야의 숙련가는 용매화물이 용질(이 경우, 본원에 기재된 티에노트리아졸로디아제핀 화합물) 및 용매에 의해 형성된 가변 화학량론의 복합체(complex)임을 이해할 것이다. 이러한 용매가 용질(티에노트리아졸로디아제핀 화합물)의 생물학적 활성을 방해하지 않는 것이 바람직하다. 용매화물 형성을 위한 적합한 용매의 예는, 비제한적으로, 물, 메탄올, 디메틸설폭사이드, 에탄올 및 아세트산을 포함한다. 적합하게는 사용되는 용매는 약학적으로 허용가능한 용매이다. 적합하게는 사용되는 용매는 물이다. 일 구현예에서, 본원에 기재된 티에노트리아졸로디아제핀 화합물의 약학적으로 허용가능한 용매화물은 에탄올 용매화물, 이소프로판올 용매화물, 디옥솔란 용매화물, 테트라하이드로퓨란 용매화물, 디메틸 설폭사이드 용매화물, tert-부탄올 용매화물, 2-부탄올 용매화물, 디옥솔란 용매화물, 1,3-디메틸-3,4,5,6-테트라하이드로-2(1H)-피리미디논("DMPU") 용매화물, 1,3-디메틸이미다졸리디논("DMI") 용매화물, 및 1,3-디메틸이미다졸리디논("DMP") 용매화물, 또는 이의 혼합물을 포함한다.
일부 구현예에서, 본원에 기재된 티에노트리아졸로디아제핀 화합물은 하나 이상의 키랄 중심 및/또는 이중 결합을 함유할 수 있고, 따라서 기하학적 이성질체, 거울상이성질체 또는 부분입체이성질체로서 존재할 수 있다. 티에노트리아졸로디아제핀 화합물의 거울상이성질체 및 부분입체이성질체는 각각의 입체중심(때때로 키랄 중심으로도 지칭됨)에 "R" 또는 "S" 서술자를 할당하고, 각각의 탄소-탄소 이중 결합(기하학적 이성질체를 지정하기 위함)에 E 또는 Z 서술자를 할당하여 그의 체계적 이름에 상기 서술자들을 포함함으로써 전체 분자의 구성을 구성을 독특하게 특정될 수 있게 하는 칸-잉골드-프리로그 규약에 따라 지정될 수 있다.
일부 구현예에서, 본원에 기재된 티에노트리아졸로디아제핀 화합물은 라세믹 혼합물, 또는 라세미체로서 존재할 수 있고, 이는 키랄 분자의 좌- 및 우 거울상이성질체의 동일한 양을 포함한다. 그러한 라세믹 혼합물은 우선성 및 좌선성 이성질체의 동등한(1:1) 혼합물을 나타내는 접두사 (±)- 또는 dl-로 표시될 수 있다. 또한, 접두사 rac-(또는 racem-) 또는 기호 RS 및 SR이 라세믹 혼합물을 지정하는 데 사용될 수 있다.
탄소-탄소 이중 결합 주위의 치환체의 배열 또는 사이클로알킬 또는 헤테로사이클릭 고리 주위의 치환체의 배열로부터 비롯되는 기하학적 이성질체가 또한 본 발명의 화합물에 존재할 수 있다. 일부 구현예에서, 기호 가 단일, 이중 또는 삼중 결합일 수 있는 결합을 가리키기 위해 사용될 수 있다. 탄소-탄소 이중 결합 주위의 치환체는 "Z" 또는 "E" 배열인 것으로 지정되며, 용어 "Z" 및 "E"는 IUPAC 표준에 따라 사용된다. 달리 명시되지 않는 한, 이중 결합을 나타내는 구조는 "E" 및 "Z" 이성질체 모두를 포함한다. 탄소-탄소 이중 결합 주위의 치환체는 대안적으로 "시스" 또는 "트랜스"로 지칭될 수 있는데, 여기서 "시스"는 이중 결합의 동일 측면 상의 치환체를 나타내고 "트랜스"는 이중 결합의 반대 측면 상의 치환체를 나타낸다. 카보사이클릭 고리 주위의 치환체의 배열 역시 은 또한 "시스" 또는 "트랜스"로 지정될 수 있다. 용어 "시스"는 고리의 면의 동일한 측면 상의 치환체를 나타내고 용어 "트랜스"는 고리의 면의 반대 측면 상의 치환체를 나타낸다. 치환체가 고리의 면의 동일한 측면 및 반대 측면 모두에 배치된 화합물의 혼합물은 "시스/트랜스" 또는 "Z/E"로 지정된다.
일부 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 단일 또는 다중 결정질 형태 또는 다형체로 존재할 수 있다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 이의 비정질 형태를 포함한다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 이의 단일 다형체를 포함한다. 또 다른 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 이의 다형체의 혼합물을 포함한다. 또 다른 구현예에서, 상기 화합물은 결정질 형태이다.
일부 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 단일 거울상이성질체로서 또는 거울상이성질체적으로 풍부한 형태로 존재할 수 있다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 80% 초과의 거울상이성질체 과잉으로 존재한다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 90% 초과의 거울상이성질체 과잉으로 존재한다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 98% 초과의 거울상이성질체 과잉으로 존재한다. 일 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 99% 초과의 거울상이성질체 과잉으로 존재한다. 일부 구현예에서, 본원에 개시된 티에노트리아졸로디아제핀 화합물은 적어도 10%, 적어도 25%, 적어도 50%, 적어도 75%, 적어도 90%, 적어도 95%, 적어도 98% 및 적어도 99% 거울상이성질체 과잉으로 이루어진 군으로부터 선택되는 거울상이성질체 과잉으로 존재한다.
한 쌍의 거울상이성질체의 경우, 거울상이성질체 E2에 대한 거울상이성질체 E1의 거울상이성질체 과잉(ee)은 하기 방정식 (1)을 이용하여 계산될 수 있다:
E1 및 E2의 상대적 양은 키랄 고성능 액체 크로마토그래피(HPLC), 핵 자기 공명 (NMR) 또는 임의의 다른 적합한 방법에 의해 결정될 수 있다. 일부 구현예에서, 거울상이성질체 화합물의 순도는 특히 부산물 및/또는 반응하지 않은 반응물 또는 시약을 포함할 수 있는 다른 물질의 양 대비 거울상이성질체 E1 및 E2의 양을 지칭할 수 있다.
식 (1)의 대표적인 티에노트리아졸로디아제핀 화합물은, 비제한적으로, 티에노트리아졸로디아제핀 화합물 (1-1) 내지 (1-18)을 포함하며, 이는 하기 표 A에 열거되어 있다. 표 A의 화합물 (1-1)은 또한 OTX-015, OTX015 또는 Y-803으로 본원에서 지칭될 것이다.
표 A: 본 발명에서 사용된 예시적인 화합물:
일부 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 이의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노바이페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트를 포함한다.
일부 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물을 포함한다.
일부 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드를 포함한다.
IV. 제제:
식 (1)의 화합물은 약물 생체이용률 및 환자간 및 환자내 용량 반응의 가변성의 특정 문제를 포함하는, 일반적으로 투여 및 특히 생약 조성물의 제조와 관련하여 매우 특정한 어려움을 나타내어, 화합물의 실질적으로 불용성 성질에 관한 비통상적인 투여 형태의 개발을 필요하게 만든다.
이전에, 식 (1)의 화합물이 캐리어 에틸 아크릴레이트-메틸 메타크릴레이트-트리메틸암모니오에틸 메타크릴레이트 클로라이드 공중합체(유드라짓 RS, Rohm사 제조)를 갖는 고체 분산물로서 제제화되어 염증성 장 질환, 예컨대 궤양성 대장염 및 크론병의 치료를 위해 하부 장 내의 약학적 성분을 우선적으로 방출한 경구 제제를 제공할 수 있음이 확인되었다(미국 특허출원 제20090012064호 A1, 2009년 1월 8일 공개됨). 동물 시험을 포함하는 다양한 실험을 통해, 염증성 장 질환에서, 병변에서의 약물 방출 및 염증성 병변에 대한 그의 직접적 작용이 위장관으로부터 순환으로의 약물의 흡수보다 더 중요하다는 것이 확인되었다.
식 (1)에 따른 티에노트리아졸로디아제핀 화합물, 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 및 동위원소로 표지된 형태는 약학적으로 허용가능한 중합체를 갖는 고체 분산물로서 제제화되어 염증성 장 질환 이외의 질환의 치료를 위해 위장관으로부터 순환 내로의 약학적 성분의 높은 흡수를 제공하는 경구 제제를 제공할 수 있다. 개 및 동물에서의 연구는 염증성 장 질환의 치료를 위해 종래 개발된 유드라짓 고체 분산물 제제와 비교하여 이들 고체 분산물의 높은 경구 생체이용률을 확인시켜 주었다.
고체 분산물은 난용성 약물의 경구 생체이용률을 개선하기 위한 전략이다.
본원에 사용된 바와 같이 용어 "고체 분산물"은 적어도 2개의 상이한 성분, 일반적으로 친수성 캐리어 및 소수성 약물, 식 (1)에 따른 티에노트리아졸로디아제핀 화합물을 포함하는 고체 생성물의 그룹을 지칭한다. 분산물 내의 약물의 분자 배열을 기초로 하여, 6개의 상이한 유형의 고체 분산물이 구별될 수 있다. 일반적으로, 고체 분산물은 단순한 공융 혼합물, 고용체, 유리 용액 및 현탁액, 및 결정질 캐리어 내의 비정질 침전물로서 분류된다. 더욱이, 특정 조합이 발생할 수 있고, 예를 들어, 동일한 샘플 내에서, 일부 분자는 클러스터 내에 존재할 수 있는 반면 일부는 분자적으로 분산될 수 있다.
일 구현예에서, 식 (1)에 따른 티에노트리아졸로디아제핀 화합물은 비정질 입자 (클러스터) 내에 분자적으로 분산될 수 있다. 또 다른 구현예에에서, 식 (1)에 따른 티에노트리아졸로디아제핀 화합물은 결정질 입자로서 분산될 수 있다. 일 구현예에서, 캐리어는 결정질일 수 있다. 또 다른 구현예에서, 캐리어는 비정질일 수 있다.
일 구현예에서, 본 발명은 식 (1)에 따른 티에노트리아졸로디아제핀 화합물, 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태의 고체 분산물; 및 약학적으로 허용가능한 중합체를 포함하는 약학적 조성물을 제공한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트(하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트 또는 HPMCAS로도 불림)이다. 일 구현예에서, 분산물은 1:3 내지 1:1의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS) 중량비를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다. 일부 구현예에서, 하이드록시프로필메틸 셀룰로오스 아세테이트 석시네이트(HPMCAS)는 9% 아세틸/11% 석시노일을 갖는 M 등급(예컨대, 5 μm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-MF, 미세 분말 등급) 또는 1 mm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-MG, 과립 등급)), 12% 아세틸/6% 석시노일을 갖는 H 등급(예컨대, 5 μm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-HF, 미세 분말 등급) 또는 1 mm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-HG, 과립 등급)), 및 8% 아세틸/15% 석시노일을 갖는 L 등급(예컨대, 5 μm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-LF, 미세 분말 등급) 또는 1 mm의 평균 입자 크기를 갖는 HPMCAS(즉, HPMCAS-LG, 과립 등급))를 포함할 수 있다.
일 구현예에서, 본 발명은 약학적으로 허용가능한 중합체 내의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태의 고체 분산물을 포함하는 약학적 조성물을 제공한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈(포비돈 또는 PVP로도 불림)이다. 일 구현예에서, 분산물은 1:3 내지 1:1의 티에노트리아졸로디아제핀 화합물 대 PVP 중량비를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 약 185℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 179℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다. 일부 구현예에서, 폴리비닐 피롤리돈은 약 2,500(Kollidon?12 PF, 2,000 내지 3,000의 중량-평균 분자량), 약 9,000(Kollidon? 17 PF, 7,000 내지 11,000의 중량-평균 분자량), 약 25,000(Kollidon? 25, 28,000 내지 34,000의 중량-평균 분자량), 약 50,000(Kollidon? 30, 44,000 내지 54,000의 중량-평균 분자량), 및 약 1,250,000(Kollidon? 90 또는 Kollidon? 90F, 1,000,000 내지 1,500,000의 중량-평균 분자량)의 분자량을 가질 수 있다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 비정질 형태의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 석시네이트의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 약 185℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 179℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 석시네이트의 중량비는 1:3 내지 1:1의 범위이다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1의 범위이다.
일부 구현예에서, 고체 분산물을 포함하는 약학적 조성물은 분무 건조에 의해 제조된다.
일 구현예에서, 본 발명의 약학적 조성물은 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트이다. 일 구현예에서, 화합물 (1) 대 히프로멜로스 아세테이트 석시네이트의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 일부 다른 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 일 구현예에서, 화합물 (1) 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 185℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 179℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 석시네이트의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 다른 상기 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1의 범위이다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물 고체 분산물에 균일하게 분산된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 185℃에서 일어난다. 일부 상기 구현예에서, 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 다른 상기 구현예에서, 단일 Tg는 약 179℃에서 일어난다. 일부 구현예에서, 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 히프로멜로스 아세테이트 석시네이트이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 히프로멜로스 아세테이트 석시네이트의 중량비는 1:3 내지 1:1의 범위이다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 분무 건조된 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 폴리비닐피롤리돈이다. 일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀 화합물 대 폴리비닐피롤리돈의 중량비는 1:3 내지 1:1의 범위이다.
일 바람직한 구현예에서, 본 발명은 2-[(6S)-4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f]-[1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물, 화합물 (1-1):
또는 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함하는 약학적 조성물을 제공한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 일 구현예에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일 구현예에서, 고체 분산물은 분무 건조된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1-1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
또 다른 구현예에서, 약학적 조성물은 고체 분산물 화합물 (1-1) 또는 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 약학적으로 허용가능한 중합체를 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 PVP이다. 일 구현예에서, 분산물은 중량비 1:3 내지 1:1로 화합물 (1-1) 및 PVP를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물 고체 분산물에 균일하게 분산된다. 일 구현예에서, 고체 분산물은 분무 건조된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 185℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 179℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1-1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 티에노트리아졸로디아제핀 화합물 (1-1) 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 일 구현예에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일 구현예에서, 고체 분산물은 분무 건조된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 130℃ 내지 140℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 135℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1-1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 비정질 형태의 티에노트리아졸로디아제핀 화합물 (1-1) 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 PVP이다. 일 구현예에서, 분산물은 중량비 1:3 내지 1:1로 화합물 (1-1) 및 PVP를 갖는다. 일 구현예에서, 티에노트리아졸로디아제핀 화합물의 적어도 일부 부분은 고체 분산물에 균일하게 분산된다. 또 다른 구현예에서, 티에노트리아졸로디아제핀 화합물은 고체 분산물에 균일하게 분산된다. 일 구현예에서, 고체 분산물은 분무 건조된다. 일부 구현예에서, 고체 분산물은 유리 전이 온도(Tg)에 대해 단일 변곡을 나타낸다. 일부 구현예에서, 단일 Tg는 175℃ 내지 185℃에서 일어난다. 다른 상기 구현예에서, 단일 Tg는 약 189℃에서 일어난다. 일부 상기 구현예에서, 고체 분산물은 적어도 1개월 동안 40℃에서 75%의 상대 습도에 노출되었다. 일부 구현예에서, 고체 분산물은 결정질 티에노트리아졸로디아제핀 화합물 (1-1)과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타낸다. 본 출원의 목적상, "실질적으로 없는"은 식 (1-1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 약 21°2-쎄타에서, 비정질 할로를 초과하는, 회절선의 부재를 의미할 것이다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 티에노트리아졸로디아제핀 화합물 (1-1) 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 HPMCAS이다. 일 구현예에서, 분산물은 1:3 내지 1:1의 중량비로 화합물 (1-1) 및 HPMCAS를 갖는다. 일 구현예에서, 고체 분산물은 분무 건조된다.
일 구현예에서, 본 발명의 약학적 조성물은 결정질 형태의 티에노트리아졸로디아제핀 화합물 (1-1) 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 약학적으로 허용가능한 중합체의 고체 분산물을 포함한다. 일 구현예에서, 약학적으로 허용가능한 중합체는 PVP이다. 일 구현예에서, 분산물은 중량비 1:3 내지 1:1로 화합물 (1-1) 및 PVP를 갖는다. 일 구현예에서, 고체 분산물은 분무 건조된다.
본원에 기재된 본 발명의 고체 분산물은 경구 투여될 때 특히 유리한 특성을 나타낸다. 고체 분산물의 유리한 특성의 예는, 비제한적으로, 동물 또는 인간에서 표준 생체이용률 시험에서 투여될 때 일정하고 높은 수준의 생체이용률을 포함한다. 본 발명의 고체 분산물은 식 (1)의 티에노트리아졸로디아제핀 화합물과 중합체 및 첨가제를 포함하는 고체 분산물을 포함할 수 있다. 일부 구현예에서, 고체 분산물은 식 (1)의 티에노트리아졸로디아제핀 화합물을 첨가제와 단순히 혼합함으로써 수득될 수 없는 식 (1)의 티에노트리아졸로디아제핀 화합물의 혈류 내로의 흡수를 달성할 수 있는데, 식 (1)의 티에노트리아졸로디아제핀 화합물 약물이 물과 대부분의 수성 매질에서 무시할만한 용해도를 가지기 때문이다. 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 생체이용률은 다양한 시험관내 및/또는 생체내 연구를 이용하여 측정될 수 있다. 생체내 연구는, 예를 들어, 랫트, 개 또는 인간을 이용하여 수행될 수 있다.
생체이용률은 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 혈청 또는 혈장 농도를 가로좌표(X-축)을 따라 시간에 대한 세로좌표(Y-축)를 따라 플롯팅함으로써 수득된 곡선하면적(AUC) 값에 의해 측정될 수 있다. 그리고 나서, 고체 분산물로부터의 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 AUC 값은, 중합체가 없는 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물 또는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)의 동등한 농도의 AUC 값과 비교된다. 일부 구현예에서, 고체 분산물은 개에게 정맥내로 투여된 대조군 조성물에 의해 제공된 상응하는 AUC 값의 적어도 0.4배, 0.5배, 0.6배, 0.8배, 1.0배로부터 선택되는, 개에게 경구 투여될 때의 곡선하면적(AUC) 값을 제공하며, 여기서 상기 대조군 조성물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물의 동등한 양을 포함한다.
생체이용률은 위 환경 및 장 환경의 pH 값을 모사하는 시험관내 시험에 의해 측정될 수 있다. 상기 측정은 1.0 내지 2.0의 pH를 갖는 수성 시험관내 시험 매질에 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 고체 분산물을 현탁시킴으로써 수행될 수 있고, 이후 대조군 시험관내 시험 매질에서, pH를 5.0 내지 7.0의 pH로 조절한다. 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 pH 조절 후 처음 2시간 동안 어느 시점에 측정될 수 있다. 일부 구현예에서, 고체 분산물은 중합체가 없는 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물 또는 결정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도와 비교하여, 적어도 5배 더 큰, 적어도 6배 더 큰, 적어도 7배 더 큰, 적어도 8배 더 큰, 적어도 9배 더 큰 또는 적어도 10배 더 큰 것으로부터 선택되는, 5.0 내지 7.0의 pH의 수성 시험관내 시험 매질에서, 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도를 제공한다.
다른 구현예에서, 1.0 내지 2.0의 pH를 갖는 수성 시험관내 매질에 놓여진 고체 분산물로부터의 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 중합체가 없는 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물의 농도보다 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%; 적어도 80% 더 높다. 일부 상기 구현예에서, 고체 분산물의 중합체는 HPMCAS이다. 일부 상기 구현예에서, 고체 분산물의 중합체는 PVP이다.
다른 구현예에서, 고체 분산물로부터의 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는, 식 (1)의 티에노트리아졸로디아제핀 화합물 및 히프로멜로스 프탈레이트 및 에틸 아크릴레이트-메틸 메타크릴레이트-트리메틸암모니오에틸 메타크릴레이트 클로라이드 공중합체로 이루어진 군으로부터 선택되는 약학적으로 허용가능한 중합체의 고체 분산물로부터의 식 (1)의 티에노트리아졸로디아제핀 화합물의 농도와 비교하여 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%; 적어도 80% 더 높으며, 여기서 각각의 고체 분산물은 1.0 내지 2.0의 pH를 갖는 수성 시험관내 시험 매질에 놓여졌다. 일부 상기 구현예에서, 고체 분산물의 중합체는 HPMCAS이다. 일부 상기 구현예에서, 고체 분산물의 중합체는 PVP이다.
일부 구현예에서, 본원에 기재된 고체 분산물은 시간 경과에 따른 습도 및 온도에 노출될 때 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 티에노트리아졸로디아제핀 화합물 (1-1)의 재결정화에 대해 안정성을 나타낸다. 일 구현예에서, 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물 또는 비정질을 유지하는 티에노트리아졸로디아제핀 화합물 (1-1)의 농도는 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98% 및 적어도 99%로부터 선택된다.
V. 투여 형태:
본 발명의 고체 분산물과 함께 사용될 수 있는 적합한 투여 형태는, 비제한적으로, 캡슐, 정제, 미니-정제, 비드, 비드렛(beadlet), 펠렛, 과립, 알갱이, 및 분말을 포함한다. 적합한 투여 형태는, 예를 들어 장용성 코팅을 이용하여 코팅될 수 있다. 적합한 코팅은 비제한적으로 셀룰로오스 아세테이트 프탈레이트, 하이드록시프로필메틸셀룰로오스(HPMC), 하이드록시프로필메틸셀룰로오스 프탈레이트, 폴리메틸아크릴산 공중합체, 또는 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS)를 포함할 수 있다. 일부 구현예에서, 특정 조합이 발생할 수 있으며, 예를 들어, 동일한 샘플에서, 본 발명의 티에노트리아졸로디아제핀의 일부 분자는 클러스터 내에 존재할 수 있는 반면 일부는 캐리어와 함께 분자적으로 분산된다.
일부 구현예에서, 본 발명의 고체 분산물은 정제, 카프렛(caplet), 또는 캡슐로서 제제화될 수 있다. 하나의 일부 구현예에서, 본 발명의 고체 분산물은 미니-정제 또는 입안에 부어먹는(pour-into-mouth) 과립, 또는 재구성을 위한 경구 분말로서 제제화될 수 있다. 일부 구현예에서, 본 발명의 고체 분산물은 다른 부형제(예컨대, 재-결정화/침전 억제 중합체, 맛 차폐 성분 등)와 조합된 적합한 희석제에 분산되어 즉시 사용 현탁액 제제를 제공한다. 일부 구현예에서, 본 발명의 고체 분산물은 소아 치료용으로 제제화될 수 있다.
일 구현예에서, 본 발명의 약학적 조성물은 경구 투여용으로 제제화된다. 일 구현예에서, 약학적 조성물은 식 (1)의 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태; 및 중합체 캐리어를 포함하는, 본원에 기재된 다양한 구현예에 따른 고체 분산물을 포함한다. 일 구현예에서, 약학적 조성물은 하나 이상의 첨가제, 예컨대 붕해제, 윤활제, 활택제, 결합제, 및 충전제를 추가로 포함한다.
약학적 조성물과 함께 사용하기 위한 적합한 약학적으로 허용가능한 윤활제 및 약학적으로 허용가능한 활택제의 예는, 비제한적으로, 콜로이드성 실리카, 마그네슘 트리실리케이트, 전분, 탈크, 삼염기성 칼슘 포스페이트, 마그네슘 스테아레이트, 알루미늄 스테아레이트, 칼슘 스테아레이트, 탄산 마그네슘, 산화 마그네슘, 폴리에틸렌 글리콜, 분말화된 셀룰로오스, 글리세릴 베헤네이트, 스테아르산, 수소첨가된 피마자유, 글리세릴 모노스테아레이트, 및 소디움 스테아릴 푸마레이트를 포함한다.
약학적 조성물과 함께 사용하기 위한 적합한 약학적으로 허용가능한 결합제의 예는, 비제한적으로 전분; 셀룰로오스 및 이의 유도체, 예컨대, 미세결정질 셀룰로오스(예컨대, FMC사의 AVICEL PH), 하이드록시프로필 셀룰로오스, 하이드록시에틸 셀룰로오스, 및 하이드록시프로필메틸셀룰로오스(HPMC, 예컨대, 다우 케미컬사의 METHOCEL); 수크로스, 덱스트로스, 옥수수 시럽; 다당류; 및 젤라틴을 포함한다.
약학적 조성물과 함께 사용하기 위한 적합한 약학적으로 허용가능한 충전제 및 약학적으로 허용가능한 희석제의 예는, 비제한적으로, 제과용 설탕, 압축성 설탕, 덱스트레이트, 덱스트린, 덱스트로스, 탁토스, 만니톨, 미세 결정질 셀룰로오스(MCC), 분말화된 셀룰로오스, 솔비톨을 포함한다.
일부 구현예에서, 부형제는 약학적 조성물에서 하나를 초과하는 기능을 할 수 있다. 예를 들어, 충전제 또는 결합제는 또한 붕해제, 활택제, 부착방지제, 윤활제, 감미제 등일 수 있다.
일부 구현예에서, 본 발명의 약학적 조성물은 첨가제 또는 성분, 예컨대 항산화제(예컨대, 아스코빌 팔미테이트, 부틸레이티드 하이드록실아니솔(BHA), 부틸레이티드 하이드록시톨루엔(BHT), α-토코페롤, 프로필 갈레이트, 및 푸마르산), 항미생물제, 효소 억제제, 안정화제(예컨대, 말론산), 및/또는 보존제를 추가로 포함할 수 있다.
일반적으로, 본 발명의 약학적 조성물은 임의의 적합한 고체 투여 형태로 제제화될 수 있다. 일부 구현예에서, 본 발명의 고체 분산물은, 예컨대, 투여를 위해, 캡슐, 또는 정제, 또는 다중-입자 시스템, 예컨대 과립 또는 알갱이 또는 분말과 같이 단위 투여 형태로 배합된다.
일 구현예에서, 약학적 조성물은 본원에 기재된 고체 분산물의 다양한 구현예에 따른 식 (1)의 티에노트리아졸로디아제핀 화합물, 및 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS)의 고체 분산물을 포함하며, 여기서 티에노트리아졸로디아제핀 화합물은 고체 분산물 내에서 비정질이고 1:3 내지 1:1의 중량비의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS); 45-50 중량%의 락토스 일수화물; 35-40 중량%의 미세결정질 셀룰로오스; 4-6 중량%의 크로스카르멜로스 소디움; 0.8-1.5 중량%의 콜로이드성 이산화실리콘; 및 0.8-1.5 중량%의 마그네슘 스테아레이트를 갖는다.
VI. 투여량:
일 구현예에서, 본 발명은 임의의 적합한 고체 투여 형태로 제제화될 수 있는 약학적 조성물을 제공한다. 일 구현예에서, 본 발명에 따른 약학적 조성물은 약 10 mg 내지 약 100 mg 범위의 투여량으로 본원에 기재된 바와 같은 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상을 포함한다. 일 구현예에서, 본 발명의 약학적 조성물은 약 10 mg 내지 약 100 mg, 약 10 mg 내지 약 90 mg, 약 10 mg 내지 약 80 mg, 약 10 mg 내지 약 70 mg, 약 10 mg 내지 약 60 mg, 약 10 mg 내지 약 50 mg, 약 10 mg 내지 약 40 mg, 약 10 mg 내지 약 30 mg, 및 약 10 mg 내지 약 20 mg으로 이루어진 군으로부터 선택되는 투여량으로 본원에 기재된 바와 같은 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상을 포함한다. 일 구현예에서, 본 발명의 약학적 조성물은 약 10 mg, 약 50 mg, 약 75 mg, 약 100 mg으로 이루어진 군으로부터 선택되는 투여량으로 본원에 기재된 바와 같은 식 (1)의 티에노트리아졸로디아제핀의 하나 이상의 다양한 구현예를 포함한다.
일부 구현예에서, 본 발명의 방법은 약 1 mg, 약 2 mg, 약 2.5 mg, 약 3 mg, 약 4 mg, 약 5 mg, 약 7.5 mg, 약 10 mg, 약 15 mg, 약 20 mg, 약 25 mg, 약 30 mg, 약 35 mg, 약 40 mg, 약 45 mg, 약 50 mg, 약 55 mg, 약 60 mg, 약 65 mg, 약 70 mg, 약 75 mg, 약 80 mg, 약 85 mg, 약 90 mg, 약 95 mg, 약 100 mg, 약 110 mg, 약 120 mg, 약 130 mg, 약 140 mg, 및 약 150 mg으로 이루어진 군으로부터 선택되는 투여량, 및 매주 1회, 6일마다 매일 1회, 5일마다 매일 1회, 4일마다 매일 1회, 3일마다 매일 1회, 2일마다 매일 1회, 매일 1회, 매일 2회, 매일 3회, 매일 4회, 및 매일 5회로 이루어진 군으로부터 선택되는 투여 형태로, 본원에 기재된 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상을 이를 필요로 하는 대상에게 투여하는 것을 포함한다. 또 다른 구현예에서, 전술한 투여량 또는 투여 형태 중 어느 것은 주기적으로 감소하거나 주기적으로 증가한다.
일부 구현예에서, 본 발명의 방법은 약 1 mg, 약 2 mg, 약 2.5 mg, 약 3 mg, 약 4 mg, 약 5 mg, 약 7.5 mg, 약 10 mg, 약 15 mg, 약 20 mg, 약 25 mg, 약 30 mg, 약 35 mg, 약 40 mg, 약 45 mg, 약 50 mg, 약 55 mg, 약 60 mg, 약 65 mg, 약 70 mg, 약 75 mg, 약 80 mg, 약 85 mg, 약 90 mg, 약 95 mg, 약 100 mg, 약 110 mg, 약 120 mg, 약 130 mg, 약 140 mg, 및 약 150 mg으로 이루어진 군으로부터 선택되는 투여량, 및 매주 1회, 6일마다 매일 1회, 5일마다 매일 1회, 4일마다 매일 1회, 3일마다 매일 1회, 2일마다 매일 1회, 매일 1회, 매일 2회, 매일 3회, 매일 4회, 및 매일 5회로 이루어진 군으로부터 선택되는 투여 형태로, 화합물 (1-1), (1 -2), (1-3), (1-4), (1 -5), (1-6), (1-7), (1-8), (1-9), (1-10), (1-11), (1-12), (1-13), (1-14), (1-15), (1-16), (1-17), 및 (1-18)로 이루어진 군으로부터 선택되는 티에노트리아졸로디아제핀을 이를 필요로 하는 대상에게 투여하는 것을 포함한다. 또 다른 구현예에서, 전술한 투여량 또는 투여 형태 중 어느 것은 주기적으로 감소하거나 주기적으로 증가한다.
그러한 단위 투여 형태는 요법의 특정 목적, 요법의 단계 등에 따라 매일 1 내지 5회 투여하는 데 적합하다. 일 구현예에서, 투여 형태는 적어도 2일 연속으로 매일 적어도 1회로 이를 필요로 하는 대상에게 투여될 수 있다. 일 구현예에서, 투여 형태는 격일에 매일 적어도 1회로 이를 필요로 하는 대상에게 투여될 수 있다. 일 구현예에서, 투여 형태는 적어도 매주 이를 필요로 하는 대상에게 투여될 수 있고 동일하고/거나 동일하지 않은 용량으로 분할될 수 있다. 일 구현예에서, 투여 형태는 3일 격일로 및/또는 주당 6회로 제공되는, 매주 이를 필요로 하는 대상에게 투여될 수 있다. 일 구현예에서, 투여 형태는 격일에, 3일마다, 4일마다, 5일마다, 6일마다 및/또는 매주마다, 분할된 용량으로 이를 필요로 하는 대상에게 투여될 수 있다. 일 구현예에서, 투여 형태는 한달에 2회 이상의 동등하거나 동등하지 않게 분할된 용량으로 이를 필요로 하는 대상에게 투여될 수 있다.
예컨대, 캡슐, 정제, 미니-정제, 비드, 비드렛, 펠렛, 과립, 알갱이, 또는 분말로 사용되는 투여 형태는, 예를 들어 장용성 코팅을 이용하여 코팅될 수 있다. 적합한 코팅은 비제한적으로 셀룰로오스 아세테이트 프탈레이트, 하이드록시프로필메틸셀룰로오스(HPMC), 하이드록시프로필메틸셀룰로오스 프탈레이트, 폴리메틸아크릴산 공중합체, 또는 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS)를 포함할 수 있다.
VII. 공정:
본원에 개시된 티에노트리아졸로디아제핀 화합물은, 본원에 그 전체가 참고로 포함된 미국 특허출원 공보 제2010/0286127호에 기재되거나 또는 본 출원에 기재된 과정에 따라 수득될 수 있는 산 부가염으로서 존재할 수 있거나 또는 유리 염기로서 존재할 수 있다. 본 발명의 티에노트리아졸로디아제핀 화합물의 개별적인 거울상이성질체 및 부분입체이성질체는 비대칭 또는 입체 중심을 함유하는 상업적으로 이용가능한 출발 물질로부터 합성에 의해 제조될 수 있거나 또는 라세믹 혼합물을 제조한 후 본 기술분야의 숙련가에게 널리 알려진 분해 방법에 의해 제조될 수 있다.
이러한 분해 방법은 (1) 거울상이성질체의 혼합물의 키랄 보조제에의 부착, 수득된 부분입체이성질체의 혼합물의 재결정 또는 크로마토그래피에 의한 분리 및 보조제로부터 광학적으로 순수한 생성물의 유리, (2) 광학적으로 활성인 분해제를 이용하는 염 형성, (3) 키랄 액체 크로마토그래피 컬럼 상에서 광학 거울상 이성질체의 혼합물의 직접적인 분리 또는 (4) 입체선택적 화학 또는 효소 시약을 이용한 동역학적 분해에 의해 예시된다. 라세믹 혼합물은 또한 널리 공지된 방법, 예컨대 키랄-상 기체 크로마토그래피에 의해 또는 키랄 용매 중에서 화합물을 결정화시킴으로써 그들의 성분 거울상이성질체로 분해될 수 있다.
원하는 경우, 본원에 개시된 티에노트리아졸로디아제핀 화합물의 특정 거울상이성질체는 비대칭 합성에 의해, 또는 키랄 보조제를 이용한 유도체화에 의해 제조될 수 있고, 여기서 수득한 부분입체이성질체 혼합물은 분리되고 보조 그룹이 절단되어 순수한 원하는 거울상이성질체를 제공한다. 대안적으로 분자가 염기성 작용기, 예컨대 아미노, 또는 산성 작용기, 예컨대 카복실을 함유하는 경우, 부분입체이성질체 염은 적절한 광학 활성 산 또는 염기로 형성된 후, 본 기술분야에서 널리 알려진 분별 결정화 또는 크로마토그래피 수단에 형성된 부분입체이성질체가 분리되고, 이후 순수한 거울상이성질체가 회수된다. 본 기술분야에서 널리 알려진 다양한 방법은 일반적으로 약 80%를 초과하는 거울상이성질체 과잉을 갖는 식 (1)의 티에노트리아졸로디아제핀 화합물을 제조하는 데 사용될 수 있다. 유리하게도, 바람직한 거울상이성질체 과잉은 80% 초과, 바람직하게는 90% 초과, 더욱 바람직하게는 95% 초과, 및 가장 바람직하게는 99% 이상이다.
본 발명의 고체 분산물은 용융 및 용매 증발을 포함하는 많은 방법에 의해 제조될 수 있다. 본 발명의 고체 분산물은 또한 문헌[Chiou WL, Riegelman S: "Pharmaceutical applications of solid dispersion systems", J. Pharm. Sci . 1971; 60:1281-1302; Serajuddin ATM: "Solid dispersion of poorly water-soluble drugs: early promises, subsequent problems, and recent breakthroughs", J. Pharm . Sci . 1999; 88:1058-1066; Leuner C, Dressman J: "Improving drug solubility for oral delivery using solid dispersions", Eur . J. Pharm . Biopharm . 2000; 50:47-60; and Vasconcelos T, Sarmento B, Costa P: "Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs", Drug Discovery Today 2007; 12:1068-1075]에 기재된 과정에 따라 제조될 수 있으며, 이들 모두는 그 전체가 참고로 본원에 포함되어 있다.
일 구현예에서, 본 발명의 고체 분산물은 용융 공정에 의해 제조된다. 일 구현예에서, 용융 공정은 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상을 캐리어에서 용융시키는 것을 포함한다. 일 구현예에서, 용융 공정은 용융된 본 발명의 화합물 및 캐리어를 냉각시키는 것을 포함한다. 일 구현예에서, 용융 공정은 용융된 화합물 및 캐리어의 분쇄를 포함한다. 일 구현예에서, 용융된 본 발명의 화합물 및 캐리어는 냉각 단계 후 분쇄된다.
식 (1)의 티에노트리아졸로디아제핀 또는 이의 약학적으로 허용가능한 염, 수화물을 포함하는 용매화물, 라세미체, 거울상이성질체, 이성질체, 또는 동위원소로 표지된 형태 및 캐리어가 양립가능하지 않은 일부 구현예에서, 가열된 혼합물에서 두 가지 액체상 또는 현탁액의 형성을 방지하기 위하여 계면활성제가 용융 단계 동안 첨가될 수 있다. 일부 구현예에서, 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상은 용융된 상태의 약물 및 캐리어를 모두 사용하는 대신 이전에 용융된 캐리어에 현탁되며, 이로써 공정 온도를 낮춘다. 일 구현예에서, 용융된 약물 및 캐리어 혼합물은 얼음 수조 진탕으로 냉각된다. 일 구현예에서, 용융된 약물 및 캐리어 혼합물은 냉각되고 분무 건조(대안적으로 분무 응고)에 의해 고형화된다.
일 구현예에서, 용융된 약물 및 캐리어 혼합물은 주변 또는 냉각된, 저온 공기가 통과하는 냉각 챔버 내로 용융물을 분무하여 용융물을 입자로 형성함으로써 냉각되고 고형화된다. 일 구현예에서, 용융된 약물 및 캐리어 혼합물은 적합한 유동층 처리기에서 용융 분산물의 미립화 및 재고형화에 의해 냉각되고 고형화된다. 일 구현예에서, 용융된 약물 및 캐리어 혼합물은 가열가능한 고전단 믹서에서 용융-과립화에 의해 냉각되고 고형화된다.
일부 구현예에서, 약물의 용융 한계를 피하기 위해 열간 압출 또는 용융 응집이 사용될 수 있다. 열간 압출은 단시간 동안 용융 온도에서, 이전에 혼합된, 약물 및 캐리어의 높은 회전 속도에서의 압출로 이루어지며, 수득된 생성물은 실온에서 냉각 후 수집되고 분쇄된다.
일 구현예에서, 식 (1)의 티에노트리아졸로디아제핀의 다양한 구현예 중 하나 이상은 임의의 열에 불안정한 화합물의 분해를 피하기 위해 감소된 가공 온도에서 가공된다. 일 구현예에서, 감소된 가공 온도는 열간 압출을 이산화탄소와 같은 임시 가소제와 결합함으로써 달성된다. 일 구현예에서, 용융 응집은 종래의 고전단 믹서 또는 회전 처리기에서 본 발명에 따른 고체 분산물의 제조에 사용된다. 일 구현예에서, 본 발명에 따른 고체 분산물은 본 발명에 따른 티에노트리아졸로디아제핀 화합물을 함유하는 용융된 캐리어를 가열된 부형제에 첨가함으로써 제조된다. 일 구현예에서, 본 발명에 따른 고체 분산물은 용융된 캐리어를 본 발명에 따른 티에노트리아졸로디아제핀 및 하나 이상의 부형제의 가열된 혼합물에 첨가함으로써 제조된다. 일 구현예에서, 본 발명에 따른 고체 분산물은 본 발명에 따른 티에노트리아졸로디아제핀 화합물, 캐리어 및 하나 이상의 부형제의 혼합물을 캐리어의 용융 범위 내 또는 이를 초과하는 온도로 가열함으로써 제조된다.
일부 구현예에서, 식 (1)에 따른 티에노트리아졸로디아제핀의 제제의 다양한 구현예 중 하나 이상은 용매 증발 방법에 의해 제조된다. 일 구현예에서, 용매 증발 방법은 식 (1)에 다른 티에노트리아졸로디아제핀 화합물, 캐리어를 휘발성 용매에 가용화 후 용매를 증발시키는 것을 포함한다. 일 구현예에서, 휘발성 용매는 하나 이상의 부형제일 수 있다. 일 구현예에서, 하나 이상의 부형제는, 비제한적으로 부착방지제, 불활성 충전제, 계면활성제 습윤제, pH 개질제 및 첨가제를 포함한다. 일 구현예에서, 부형제는 휘발성 용매에 용해되거나 휘발성 용매에 현탁되거나 팽윤된 상태일 수 있다.
일 구현예에서, 본 발명에 따른 고체 분산물의 제조는 휘발성 용매에 현탁된 하나 이상의 부형제를 건조시키는 것을 포함한다. 일 구현예에서, 건조는 진공 건조, 저온에서 휘발성 용매의 느린 증발, 회전 증발기의 사용, 분무 건조, 분무 과립화, 동결 건조, 또는 초임계유체의 사용을 포함한다.
일 구현예에서, 식 (1)에 따른 티에노트리아졸로디아제핀 조성물을 위한 제제의 분무 건조 제조가 사용되며, 이는 조성물의 현탁액 또는 액체를 작은 액적으로 미립화한 후, 상기 제제로부터 용매를 빠르게 제거하는 것을 포함한다. 일 구현예에서, 본 발명에 따른 제제의 제조는 용매 중의 조성물의 용액 또는 현탁액이 적합한 화학적으로 및/또는 물리적으로 불활성인 충전제, 예컨대 락토스 또는 만니톨 상에 분무되는 분무 과립화를 포함한다. 일 구현예에서, 조성물의 용액 또는 현탁액의 분무 과립화는 2원 또는 3원 노즐을 통해 달성된다.
일부 구현예에서, 본 발명에 따른 고체 분산물의 제조는 초임계 유체의 사용을 포함한다. 용어 "초임계 유체"는 이들의 임계 온도 및 임계 압력을 초과하여 단일 유체상으로서 존재하는 물질을 지칭한다. 일 구현예에서, 본 발명에 따른 제제의 제조는 초임계 이산화탄소 유체의 사용을 포함한다. 일 구현예에서, 초임계 유체 기술을 이용하는 본 발명에 따른 제제의 제조는 식 (1)에 따른 티에노트리아졸로디아제핀 화합물, 및 캐리어를 이산화탄소와 동시에, 노즐을 통해 입자 형성 용기 내로 도입되는 일반적인 용매에 용해시키는 것; 및 상기 용액을 분무하여 용매가 초임계 유체에 의해 빠르게 추출되도록 함으로써, 용기의 벽에 고체 분산물의 침전을 야기하는 것을 포함한다.
일부 구현예에서, 본 발명에 따른 고체 분산물의 제조는 공-침전 방법의 사용을 포함한다. 일 구현예에서, 비-용매는 일정한 교반 하에 식 (1)에 따른 티에노트리아졸로디아제핀 조성물, 및 캐리어 용액에 적가된다. 일 구현예에서, 식 (1)에 따른 티에노트리아졸로디아제핀 조성물 및 캐리어는 비-용매의 첨가 동안 공-침전되어 미립자를 형성한다. 일 구현예에서, 수득된 미립자는 여과되고 건조되어 원하는 고체 분산물을 제공한다.
본 발명은 하기 비제한적인 실시예에서 예시된다.
VIII.
실시예
:
실시예
1: 화합물 (1-
1)의
고체
분산물의
시험관내
스크리닝
화합물 (1-1) 및 히프로멜로스 아세테이트 석시네이트(HPMCAS-M), 히프로멜로스 프탈레이트(HPMCP-HP55), 폴리비닐피롤리돈(PVP), PVP-비닐 아세테이트(PVP-VA), 및 유드라짓 L100-55를 포함하는 5개 중합체 중 하나를 이용하여, 각 중합체에 대하여 25% 및 50%의 화합물 (1-1) 로딩으로, 10개의 고체 분산물을 제조하였다. 고체 분산물을 분무 건조 후 저온 대류식 오븐에서 2차 건조하는 것을 이용하는 용매 증발 방법에 의해 제조하였다. 각 고체 분산물의 성능을 약물의 총량 및 시간 경과에 따라 용액 중에 존재하는 유리 약물의 양을 측정한 비싱크(non-sink) 용해 성능 시험을 통해 평가하였다. 비싱크 용해는 낮은 가용성 화합물에 대한 생체내 상황을 가장 잘 대표하기 때문에 선택하였다. 이 시험은 생체내 조건을 모사하여, 분산물을 시험 매질에 도입 후 약 30분 내지 40분에 위 pH(0.1N NaCl, pH 1.0)로부터 장 pH(FaFSSIF, pH 6.5)로의 분산물의 "위 이동"을 포함하였다. [FaFSSIF는 3 mM 소디움 타우로콜레이트, 0.75 mM 레시틴, 0.174 g NaOH 펠렛, 1.977 g NaH2P04·H20, 3.093 g NaCl, 및 정제수 qs 500 mL로 구성된, 공복 상태 모사 장액임.] 용해된 약물의 양을 고성능 액체 크로마토그래피(HPLC) 방법 및 Agilent 1100 시리즈 HPLC를 이용하여 정량하였다. 제제의 용해 프로파일(도 1a-1j)은 동일한 매질 중의 제제화되지 않은 화합물과 비교하여 모든 분산물 후보에서 약물 용해도의 상당한 증가를 나타내었다. 고체 분산물 중에서, PVP 중의 25% 화합물 (1-1), HPMCAS-M 중의 25% 화합물 (1-1), 및 HPMCAS-M 분산물 중의 50% 화합물 (1-1)이, 더 높은 수준의 유리 약물이 장내 pH에서 방출되었다는 발견에 기초하여, 제제화되지 않은 화합물과 비교하여 향상된 경구 흡수를 위한 가장 유망한 후보였다.
실시예
2: 화합물 (1-
1)의
고체
분산물의
생체내
스크리닝
상기 3가지 가장 유망한 화합물 (1-1)의 고체 분산물, 즉 PVP 중의 25% 화합물 (1-1), HPMCAS-MG 중의 25% 화합물 (1-1), 및 HPMCAS-M 중의 50% 화합물 (1-1) 분산물들을 생체내 연구를 위해 더 큰 규모로 제조하였다. 각 제제를 실시예 1에 기재된 시험관내 용해 시험에서 평가하였다. 이들 분산물이 비정질이며 균일하였음을 확실하게 하기 위해, 각각의 분산물을 분말 x-선 회절(PXRD) 및 변조 시차 주사 열량계(mDSC)에 의해 평가하였다. 또한, 각 분산물의 유리 전이 온도(Tg)에 대한 물의 영향을 이해하기 위해, 설정된 상대 습도(즉, 25%, 50%, 및 75% RH)에서 적어도 18시간 동안 처음 평형화된 샘플에 대해 mDSC를 수행하였다. [물은 고체 분산물을 위한 가소제로서 작용할 수 있고, 활성 화합물 또는 중합체로 인한 시스템의 흡습성은 이들 시스템에 의한 물 흡수량에 영향을 미칠 수 있음.]
비싱크 용해 결과(도 2a-2c)는 실시예 1에서의 분산물에 대해 확인된 결과와 대등하였다. PXRD 결과(도 3)는 어느 분산물에서도 결정질 화합물의 증거를 나타내지 않았고, mDSC 결과(도 4a-4c)는 각 분산물에 대해 단일 유리 전이 온도(Tg)를 나타내었으며, 이는 각 분산물이 균일하였음을 나타낸다. x-선 회절기는 Bruker D-2 Phaser였다. Tg 및 상대 습도 간의 역관계가 각각에 대해 관찰되었다(도 5). 특히, 75% RH에서 평형화된 PVP 고체 분산물 중의 25% 화합물 (1-1)의 경우, 2개의 Tg가 나타났으며, 이는 상 분리가 일어나고 있었음을 나타내며, 이 분산물은 또한 75% RH에서 용융 사건을 나타내었고, 이는 RH 평형 중에 결정화가 일어났음을 제시한다(도 6). 이 발견은 PVP 분산물 중의 25% 화합물 (1-1)이 HPMCAS-M 분산물보다 덜 안정할 수 있음을 제시한다.
3가지 분산물의 생체이용률을 평가하기 위해, 수컷 비이글 개의 그룹(그룹당 3마리)에게 경구 위관영양법에 의해 화합물 (1-1)의 고체 분산물의 수성 현탁액 3 mg/kg 용량을 투여하거나 또는 요골측피부 정맥 내로 정맥내 볼루스로서 물:에탄올:폴리에틸렌 글리콜(PEG) 400(60:20:20)에 용해된 화합물 (1-1)의 1 mg/kg 용량을 투여하였다. 정맥내 투여 후 0(투여전), 5, 15, 및 30분 및 1, 2, 4, 8, 12, 및 24시간에 그리고 경구 위관영양법 투여 후 0(투여전), 15 및 30분 및 1, 2, 4, 8, 12, 및 24시간에 각 동물의 경정맥으로부터 혈액 샘플을 수집하였다. 각 샘플에 존재하는 화합물 (1-1)의 양을 0.5 ng/mL의 정량 하한을 갖는 정격 LC-MS/MS 방법을 이용하여 검출하였다. 혈장 농도-시간 곡선 하 면적(AUC)을 최종 소실기(terminal elimination phase)를 무한대까지 외삽하지 않고 마지막 측정가능한 농도까지 선형 사다리꼴 규칙을 이용하여 결정하였다. 소실 반감기(t1/2)는 로그 농도-시간 곡선의 최종 선형 부분의 최소-제곱 회귀 분석에 의해 계산하였다. 최대 혈장 농도(Cmax) 및 Cmax까지의 시간(tmax)을 혈장 농도 데이터로부터 직접 유도하였다. 경구 생체이용률(F)은 경구 투여 후 용량 정규화된 정맥내 투여 후 용량 정규화된 AUC로 나눔으로써 계산하였고 이를 백분율 (%)로 보고하였다. 하기 표 1에 요약된 결과는 PVP 중의 25% 화합물 (1-1), HPMCAS-M 중의 25% 화합물 (1-1) 및 HPMCAS-M 고체 분산물 중의 50% 화합물 (1-1)의 각각 58%, 49%, 및 74%의 평균 경구 생체이용률을 제시하였다.
| 화합물 (1-1) 제제 |
용량 & 경로 | Cmax (ng/L) |
tmax (hr) |
AUC (ng·min/mL) |
t1 /2 (hr) |
F (%) |
| 물:에탄올: PEG400 (60:20:20) 중의 용액 | 1 mg/kg IV |
769 | 0.083 | 53,312 | 1.5 | ---- |
| 25% 화합물 (1-1)/PVP 고체 분산물의 수성 현탁액 | 3 mg/kg PO |
487 | 1.0 | 93,271 | 1.6 | 58 |
| 25% 화합물 (1-1)/HPMCAS-M 고체 분산물의 수성 현탁액 | 3 mg/kg PO |
228 | 0.5 | 78,595 | 2.0 | 49 |
| 50% 화합물 (1-1)/HPMCAS-M 고체 분산물의 수성 현탁액 | 3 mg/kg PO | 371 | 1.0 | 118,174 | 1.5 | 74 |
AUC: 혈장 농도-시간 곡선하면적; Cmax: 최대 혈장 농도; F: 생체이용률; HPMCAS: 히프로멜로스 아세테이트 소디움; IV: 정맥내; PEG: 폴리에틸렌 글리콜; PO; 입으로(per os), 경구; PVP: 폴리비닐피롤리돈; tmax: Cmax의 시간; t1 /2: 혈장 제거 반감기
실시예
3: 화합물 (1-
1)의
고체
분산물을
함유하는 캡슐의 제조 및 임상학적 용도
혈액암 환자에서의 초기 임상 연구를 위해 10 mg 강도의 젤라틴 캡슐을 제조하였다. 실시예 1 및 2에 기재된 바와 같이, 화합물 (1-1)의 고체 분산물의 시험관내 및 생체내 시험의 결과를 기초로, HPMCAS-M 고체 분산물 중의 50% 화합물 (1-1)을 캡슐 개발을 위해 선택하였다. 캡슐 개발은 크기 3 경질 젤라틴 캡슐 내에 190 mg의 충전 중량을 목표로 개시하였는데, 이 구성이 약학적 조성물을 유지하면서 더 큰 크기의 캡슐을 충전함으로써 캡슐 강도를 증가시키는 것을 잠재적으로 허용할 것이기 때문이다. 경험에 기초하여, 4개의 캡슐을 상이한 양의 붕해제를 포함하고 습윤제를 포함하거나 포함하지 않도록 설계하였다. 4개의 모든 제제는 유사한 붕해 시험 및 용해 시험 결과를 나타내었으므로, 제조를 위해 가장 간단한 제제(습윤제가 없고 최소의 붕해제를 가짐)를 선택하였다. 제조 공정 개발 및 규모 확장 연구를 수행하여 고체 분산물에 대한 분무 건조 공정 및 건조후 시간; 혼합 파라미터; 약 0.60 g/cc의 목표 벌크 밀도를 달성하기 위한 혼합물의 롤러 압축 및 밀링; 및 캡슐 충전 조건을 확인하였다.
결정질 화합물 (1-1) 및 중합체 히프로멜로스 아세테이트 석시네이트 (HPMCAS-M)를 아세톤에 용해시키고 분무 건조하여 50% 화합물 (1-1) 로딩을 함유하는 고체 분산물 중간체(SDI) 과립을 생산하였다. SDI는 PXRD 분석에 의해 비정질인 것으로 나타났고 mDSC 분석에 의해 균일한(즉, 주변 조건 하에 단일 Tg) 것으로 나타났다. HPMCAS-M 고체 분산물 중의 50% 화합물 (1-1)(1000 g) 및 미세결정질 셀룰로오스 충전제-결합제(4428 g), 크로스카르멜로스 소디움 붕해제(636 g), 콜로이드성 이산화실리콘 붕해제/윤활제 156 g), 마그네슘 스테아레이트 분산제/윤활제(156 g), 및 락토스 일수화물 충전제(5364 g)를 포함하는 부형제를 V-블렌더에서 단계적으로 혼합하였다. 그리고 나서, 상기 블렌드를 압축 및 과립화하여 약 0.6 g/mL의 벌크 밀도를 얻었다. 상기 블렌드를 자동 충전기를 이용하여 크기 3 경질 젤라틴 캡슐(목표 충전 중량: 190 mg) 내로 분배하고 캡슐 연마기를 사용하여 완성된 캡슐을 연마하였다.
HPMCAS 고체 분산물 중의 50% 화합물 (1-1)을 함유하는 10 mg 캡슐을 경구 투여한 후 약동학적 평가를 수행하였고, 결과를 화합물 (1-1)의 유드라짓 고체 분산물을 함유하는 4 x 10 mg 캡슐을 건강한 지원자에게 경구 투여한 후 수행된 약동학적 평가와 비교하였다.
2가지 약학적 조성물의 비교가 하기 표 2A 및 2B에 제공되어 있다. 유드라짓 제제는 2009년 1월 8일에 공개된 미국 특허출원 제2009/0012064호 A1의 실시예 5에 앞서 기재되었다. 상기 출원은 식 (A)의 티에노트리아졸로디아제핀 및 메타크릴레이트 공중합체 유형 B(유드라짓 RS), 메타크릴산 공중합체 유형 C(유드라짓 L100-55), 탈크, 및 마그네슘 알루미노실리케이트를 포함하는 코팅 부형제를 물과 에탄올의 혼합물에 용해시키고/거나 분산시킴으로써 유드라짓 고체 분산물 제제가 제조되었음을 언급하였다. 그리고 나서, 이 불균일 혼합물을 원심분리 유동층 과립화기를 이용하여 미세 결정질 셀룰로오스 구(Nonpareil 101, Freund)에 적용하여 크기 2 하이드록시프로필 메틸셀룰로오스 캡슐 내로 분산된 과립을 생산하였다.
두 가지 임상 연구에서, 검증된 LC-MS/MS 방법을 이용하여 화합물 (1-1)의 혈액 수준을 결정하였고, 캡슐 투여 후 24시간 동안 다양한 시점에 측정된 화합물 (1-1)의 혈장 농도에 기초하여 약동학 분석을 수행하였다. 하기 표 3에 요약된 결과는 HPMCAS-M 고체 분산물 제제가 AUC에 기초하여 유드라짓 고체 분산물 제제보다 인간에서 3배 이상 높은 생체이용률을 가지고 있었음을 보여주었다(924*4 / 1140, 투여된 용량 차이에 대해 조정). 또한, 관찰된 Tmax에 기초하여, HPMCAS 제제는 유드라짓 제제보다 더 빠르게 흡수된다(1시간 대 4-6시간의 Tmax). HPMCAS-M 고체 분산물 제제를 이용한 전신 노출의 현저한 개선은 예기치 못한 것이다.
[표 2A]
임상학적 사용을 위한 화합물 (1-1)의 고체
분산물
캡슐
화합물 (1-1)의 50% HPMCAS 고체 분산물을 함유하는 약학적 조성물:
10 mg 강도, 크기 3 경질 젤라틴 캡슐
[표 2B]
화합물 (1-1)의
유드라짓
L100
-55 고체
분산물을
함유하는 약학적 조성물: 10 mg 강도, 크기 2 경질 젤라틴 캡슐
* 수화물로서
| 화합물 (1-1) 제제 | # 환자 | 용량 및 경로 | Cmax (ng/mL) |
Tmax (hr) |
AUC0 -24h (ng·h/mL) |
| 유드라짓 고체 분산물 제제 | 7 | 40 mg PO | 83 | 4 내지 6 | 1140 |
| 50% HMPCAS-M 고체 분산물 제제 | 7 | 10 mg PO | 286 | 1 | 925 |
AUCo -24h: 24시간 동안 OTX015 혈장 농도 대 시간 곡선 하 면적
Cmax: 혈장에서의 최대 농도
hr: 시간
HPMCAS: 히프로멜로스 아세테이트 석시네이트
mL: 밀리리터
ng: 나노그램
PO: 입으로, 경구
Tmax: Cmax의 시간
실시예
4.
랫트에서
경구 노출
화합물 (1-1)의 고체 분산물의 3가지 제제의 경구 생체이용률을 랫트에서 결정하였다. 선택된 상기 3가지 분산물은 PVP 중의 화합물 (1-1)의 25% 분산물, HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물, 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물이었다. 상기 연구에 사용된 동물은 핀란드 투르쿠 대학교의 중앙 동물 실험실에서 얻은 특정 병원체 부재:스프라구에 다울리 랫트였다. 랫트는 원래 네덜란드 할런으로부터 구입하였다. 랫트는 암컷이었고 10주령이었으며, 12마리의 랫트를 연구에 사용하였다. 동물을 폴리카보네이트 Makrolon II 우리(우리 당 3마리의 동물)에서 사육하였고, 동물 실내 온도는 21 +/- 3℃였으며, 동물 실내 상대 습도는 55 +/- 15%였고, 동물 실내 조명은 인공적이었고 12시간 명암 주기(18:00 및 06:00시 사이에 암주기를 가짐)로 반복되었다. 아스펜 칩(Tapvei Oy, Estonia)을 침구로 사용하였고, 침구를 일주일 당 적어도 1회 바꾸어주었다. 음식과 물은 투여 전에 제공하였지만 투여 후 처음 2시간 동안은 제거하였다.
미리 계산된 양의 주사용 멸균수를 0.75 mg/mL의 화합물 (1-1)의 농도를 얻기 위한 적절한 양을 이용하여 분산물을 보유하는 용기에 부가하여 PVP 중의 화합물 (1-1)의 25% 분산물, HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물, 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물을 함유하는 경구 투여용 용액을 제조하였다. 상기 경구 투여용 용액을 각 투여 전에 20초간 볼텍스 혼합하였다. 정맥 투여를 위한 투여용 용액은 0.25 mg/mL의 화합물 (1-1)을 함유하였고 4 mL의 400 Da의 평균 분자량을 갖는 폴리에틸렌 글리콜(PEG400), 4 mL의 에탄올(96% 순도), 및 12 mL의 주사용 멸균수를 함유하는 혼합물에 5 mg의 화합물 (1-1)을 용해시킴으로써 제조하였다. PVP 중의 화합물 (1-1)의 25% 분산물을 함유하는 투여 용액은 물을 첨가한 후 30분 이내에 사용하였다. HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 및 HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물을 함유하는 투여 용액은 물을 첨가한 후 60분 이내에 사용하였다. 4 mL/kg의 투여 용량을 사용하여 정맥내 투여를 위한 1 mg/kg 및 경구 투여를 위한 3 mg/kg의 화합물 (1-1)의 용량 수준을 제공하였다. 투여 계획이 표 4에 제시되어 있다.
| 랫트 | 체중 | 용량 (mL) | 시험 품목 | 경로 |
| 1 | 236.5 | 0.95 | 화합물 (1-1) | 정맥내 |
| 2 | 221 | 0.88 | 화합물 (1-1) | 정맥내 |
| 3 | 237.5 | 0.95 | 화합물 (1-1) | 정맥내 |
| 4 | 255.5 | 1.02 | PVP 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 5 | 224.2 | 0.90 | PVP 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 6 | 219.2 | 0.88 | PVP 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 7 | 251.6 | 1.01 | HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 8 | 240.4 | 0.96 | HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 9 | 238 | 0.95 | HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 | 경구 |
| 10 | 226.6 | 0.91 | HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물 | 경구 |
| 11 | 228.4 | 0.91 | HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물 | 경구 |
| 12 | 228.5 | 0.91 | HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물 | 경구 |
투여 후 0.25, 0.5, 1, 2, 4, 8, 12, 및 24시간의 시점에 5 μL의 에틸렌디아민테트라아세트산(EDTA) 용액을 함유하는 에펜도르프 튜브에 약 50 μl의 혈액 샘플을 수집하였고, 각 샘플은 지정된 시간에 5분의 윈도우 내에 수집하였다. 각 샘플로부터, 20 μL의 혈장을 수득하고, 분석을 위해 드라이아이스 온도에서 보관하였다. 화합물 (1-1)의 농도에 대한 각 샘플의 분석은 0.5 ng/mL의 정량 하한을 갖는 검증된 액체 크로마토그래피 탠덤 질량 분석(LC-MS/MS) 방법을 이용하여 수행하였다.
약동학적 파라미터를 표준 비구획적 방법으로 피닉스 윈논린(Phoenix WinNonlin) 소프트웨어 패키지(버전 6.2.1, Pharsight Corp., CA, USA)를 이용하여 계산하였다. 제거 상 반감기(t1/2)를 로그 농도-시간 곡선의 말단 선형 부분의 최소 제곱 회귀 분석에 의해 계산하였다. 혈장 농도-시간 곡선하면적(AUC)을 마지막 측정가능한 농도까지 직선 사다리꼴 규칙을 사용하고 이후 말단 제거 단계를 무한대까지 외삽하여 결정하였다. 화합물이 구획 또는 시스템에 남아있는 시간의 평균양을 나타내는 평균 체류 시간(MRT)을 약물 농도 프로파일을 무한대까지 외삽하여 계산하였다. 최대 혈장 농도(Cmax) 및 Cmax까지의 시간(tmax)은 혈장 농도 데이터로부터 직접 유도되었다. 하였다. 잠정적인 생체이용률(F)은 경구 투여 후 용량 정규화된 AUC를 정맥내 투여 후 용량 정규화된 AUC로 나눔으로써, 즉 F = (AUC(경구)/용량(경구))/(AUC(정맥내)/용량(정맥내))]에 의해 계산하였고, 백분율(%)로서 보고한다.
약동학적 파라미터가 표 5에 제시되어 있으며, 혈장 농도 대 시간 플롯이 도 7의 7A, 7B, 도 8의 8A, 및 8B에 나타나 있다.
| 화합물 | 파라미터 | 1 mg/kg 정맥내 | 3 mg/kg 경구 | F(%) |
| 화합물 (1-1) 물:에탄올:PEG 400 (60:20:20) | AUC (min*ng/ml) Cmax (ng/ml) Tmax (hr) t1 /2 (hr) 8.5 CI/F (ml/min/kg) MRT (hr) |
74698 730 0.25 8.5 13.4 7.4 |
||
| PVP 중의 화합물 (1-1)의 25% 분산물 | AUC (min*ng/ml) Cmax (ng/ml) Tmax (hr) t1 /2 (hr) 8.5 CI/F (ml/min/kg) MRT (hr) |
39920 77.9 1 13.8 75.2 18.0 |
18 | |
| HPMCAS-MG 중의 화합물 (1-1)의 25% 분산물 | AUC (min*ng/ml) Cmax (ng/ml) Tmax (hr) t1 /2 (hr) 8.5 CI/F (ml/min/kg) MRT (hr) |
35306 48.3 0.5 11.0 85.0 17.1 |
16 | |
| HPMCAS-MG 중의 화합물 (1-1)의 50% 분산물 | AUC (min*ng/ml) Cmax (ng/ml) Tmax (hr) t1 /2 (hr) 8.5 CI/F (ml/min/kg) MRT (hr) |
40238 67.0 2 9.5 74.6 12.8 |
18 |
실시예
5. 분무 건조된
분산물의
제조.
화합물 (1-1)의 분무 건조된 분산물을 하기 5개의 선택된 중합체를 이용하여 제조하였다: HPMCAS-MG(Shin Etsu Chemical Co., Ltd.), HPMCP-HP55(Shin Etsu Chemical Co., Ltd.), PVP (ISP, a division of Ashland, Inc.), PVP-VA(BASF Corp.), 및 유드라짓 L100-55(Evonik Industries AG). 모든 분무 건조된 용액은 각각의 중합체를 이용하여 25 중량% 및 50 중량%로 제조하였다. 모든 용액은 에탄올 중에서 제조된 PVP 용액을 제외하고, 아세톤 중에서 제조하였다. 각 용액의 경우, 1.0 g의 고형물(중합체 및 화합물 (1-1))을 10 g의 용매 중에서 제조하였다. 용액을 1.5 mm 노즐 및 Buechi B-295, P-002 응축기를 갖는 Buechi B-290, PE-024 분무 건조기를 이용하여 분무 건조하였다. 분무 건조기 노즐 압력을 80 psi로 설정하고, 목표 출구 온도를 40℃로 설정하고, 냉각기 온도를 -20℃로 설정하고, 펌프 속도를 100%로 설정하고, 흡인기는 100%로 설정하였다. 분무 건조 후, 고체 분산물을 수집하고 저온 대류 오븐에서 밤새 건조시켜 잔류 용매를 제거하였다.
실시예
6. 습도 및 온도 안정성.
HPMCAS-MG 중의 화합물 (1-1)의 분무 건조된 고체 분산물을 상승된 온도에서 수분에 노출시킴으로써 안정성을 평가하였다. 상대 습도의 함수로서 유리 전이 온도(Tg)를 1, 2 및 3개월 동안 75% 상대 습도, 40℃에서 결정하였다. 분무 건조된 분산물을 HDPE 병 내부의 LDPE 백에 보관하여 벌크 제품 패키징을 시뮬레이션하였다. 데이터가 표 6에 요약되어 있다. 시간 0에서, Tg는 134℃였고, 1개월에 Tg는 134℃였으며, 2개월에 Tg는 135℃였고 3개월에 Tg는 134℃였으며, 각 측정에 대해 단일 변곡점이 관찰되었다. 각 샘플에 대해 또한 X-선 회절 패턴을 수득하였다. 도 9는 안정성 시험의 시간 0에 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다. 도 10, 11 및 12는 40℃ 및 75% 상대 습도에서 노출 후, 각각 1개월, 2개월 및 3개월 후 HPMCAS-MG 중의 화합물 (1-1)의 고체 분산물의 분말 X-선 회절 프로파일을 예시한다. 상기 패턴은 화합물 (1-1)과 관련된 어떠한 회절선을 나타내지 않았다.
실시예
7: 화합물 (1-1) 및 c-
MYC
및
HEXIM1의
발현
방법: c-MYC, BRD2/3/4 및 HEXIM1 발현을 500 nM 화합물 (1-1)의 노출 후 6개의 급성 골수성 백혈병(AML; K562, HL-60, NB4, NOMO-1, KG1, OCI-AML3) 및 2개의 급성 림프구성 백혈병(ALL; JURKAT 및 RS4-11) 세포주에서 평가하였다. 정량적 RT-PCR 및 웨스턴 블랏팅을 상이한 시점(24-72시간)에 수행하였다. 히트맵을 R-소프트웨어로 계산하였다.
결과: 화합물 (1-1)에 24시간 노출 후 모든 AML 및 ALL 세포주에서 c-MYC RNA 수준이 편재적으로 하향조절되었다(도 13). c-MYC 단백질 수준은 KG1 이외의 모든 세포주에서 24-72시간에 가변적인 정도로 감소하였다. BRD2, BRD3 및 BRD4 mRA 발현은 화합물 (1-1)에 48시간 노출 후 K562 세포(화합물 (1-1)-내성인 것으로 알려짐)에서 유의하게 감소하였지만, HL60 및 NOMO-1 세포에서 증가한 한편, 다른 세포주에서는 최소 증가 내지 증가가 관찰되지 않았다. 화합물 (1-1)은 대부분의 세포주에서 BRD2 단백질 발현의 감소를 유도하였으나, K562 세포에서는 유도하지 않았다. 반면, 감소된 BRD4 단백질 발현은 OCI-AML3, NB4 및 K562 세포주에서만 나타났다. BRD3 단백질 수준은 KG1 외외의 평가된 모든 세포주에서 화합물 (1-1) 노출 후 변형되지 않았다. HEXIM1 mRNA 발현은 화합물 (1-1) 내성 K562 세포를 제외한 모든 세포주에서 500 nM 화합물 (1-1)에 24시간 노출 후 증가하였고, 상기 증가는 유의하지 않은 것으로 간주되었다(2배 미만). HEXIM1 단백질 수준의 증가는 24-72시간에 OCI-AML3, JURKAT 및 RS4-11 세포주에서 관찰되었으나 K562 세포에서는 관찰되지 않았다.
종합하면, 이들 결과는 화합물 (1-1)에 의한 BRD 억제가 c-MYC 감소 및 BRD 변화 외에도, HEXIM1의 유전자 및 단백질 발현을 조절한다는 것을 보여준다. HEXIM1 상향조절은 화합물 (1-1) 민감성 세포주에 제한되는 것으로 보이며 화합물 (1-1)-내성 K562 세포에서 유의하게 영향을 받지 않았다. BRD 억제제의 항백혈병 활성에서 HEXIM1의 역할을 명확하게 하기 위해 추가 연구가 필요하다.
실시예
8: 급성 백혈병 세포주에서 c-
MYC
.
BRD2
/3/4 및
HEXIM1에
대한 화합물 (1-1)의 효과
AL 세포주의 패널에서 c-MYC 단백질 및 mRNA 발현에 대한 4, 24, 48 또는 72시간 동안 500nM 화합물 (1-1)의 효과를 평가하였다. 기저 c-MYC 유전자 발현은 BCR-ABL+ K562 세포에서 가장 낮은 수준 및 PML-RARα 재배열 NB4에서 가장 높은 수준으로, 세포주 간에 다양하였다(도 13a). 화합물 (1-1)에 노출 후, c-MYC 단백질 및 mRNA 발현을 분석하였다. c-MYC 단백질의 감소는 AML 세포주(NPM1 돌연변이된 OCI-AML3, BCR-ABL+ K562, PML-RARα 재배열 NB4, MLL-AF9 융합된 NOMO 1 및 NRAS-주도된 HL60), 및 ALL 세포주(T-ALL JURKAT 및 MLL-AF4 융합된 B-ALL RS4-11 세포)를 포함하는 시험된 모든 세포주에서 치료 후 24시간만큼 일찍 가변적인 정도로 관찰되었다(도 13b, 도 16aa, 도 16ab). 이러한 결과에 따라, c-MYC 유전자 발현은 이들 세포주뿐만 아니라 OP2-FGFR1 재배열 KG1 AML 세포주에서 4시간 및 24시간 화합물 (1-1) 노출 후 보편적으로 감소되었다(도 13c). 이들 세포주를 500nM JQ1으로 처리하는 것은 24, 48 및 72시간에 화합물 (1-1)로 관찰된 것과 유사한 c-MYC 단백질뿐만 아니라, 시험된 모든 세포주에서 48시간에 c-MYC 유전자 발현을 감소시켰다(각각 도 16ba, 도 16bb 및 도 16c).
BRD의 유전자 및 단백질 발현에 대한 화합물 (1-1) 노출의 효과를 또한 결정하였다. AML 세포주 중에서, BRD의 기저 유전자 발현 수준은 BCR-ABL+ K562 세포주에서 가장 낮았고 PML-RARα 재배열 NB4에서 가장 높았다(도 13d). 48시간 동안 500nM 화합물 (1-1)에 노출 후, BRD2, BRD3 및 BRD4 mRNA 발현은 K562 및 NB4 세포주에서 급격하게 감소하였지만 HL60 및 NOMO-1 세포에서는 증가하였다(도 13e). KG1, OCI-AML3, JURKAT, BV-173 및 RS4-11에서는 BRD2, BRD3 및 BRD4 mRNA 발현의 단지 경미한 차이가 관찰되었다. 화합물 (1-1)은 OCI-AML3, JURKAT T-ALL, RS4-11, NB4, NOMO-1 및 HL60 세포를 포함하는 대부분의 세포주에서 BRD2 단백질 발현의 감소를 유도하였으나, K562 세포에서는 유도하지 않았다(도 13b 및 도 16aa, 도 16ab). 반면, 화합물 (1-1) 처리 후 BRD4 단백질의 감소된 단백질 발현은 OCI-AML3, NB4 및 K562 세포주에서만 나타났다. 마지막으로, BRD3 단백질 수준은 분석된 모든 세포주에서 화합물 (1-1) 노출 후 변형되지 않았다(도 13b 및 도 16aa, 도 16ab). 화합물 (1-1)과 비교하여, JQ1 처리는 BRD2, BRD3 및 BRD4 단백질 조절의 유사한 프로파일을 유도하였다(도 16ba, 도 16bb).
HEXIM1 발현에 대한 화합물 (1-1)의 효과를 평가하였다. HEXIM1 mRNA 발현은 시험된 모든 세포주(K562, HL-60, NB4, NOMO-1, KG1, OCI-AML3, JURKAT 및 RS4-11; 도 13f)에서 500nM에서 4 및 24시간 화합물 (1-1) 노출 후 증가하였다. 화합물 (1-1) 노출 후 HEXIM1 상향조절은 OCI-AML3 및 RS4-11 세포주에서 가장 높았다. 500nM에서 화합물 (1-1) 또는 JQ1 처리(24-72시간)는 OCI-AML3, JURKAT 및 RS4-11 세포주에서 24, 48 및 72시간 후 HEXIM1 단백질 수준의 유사한 증가를 야기하였지만 K562 세포에서는 그렇지 않았다(도 13b 및 도 16aa, 도 16ab, 도 16ba, 및 도 16bb).
실시예
9: 백혈병 세포주에서 세포 증식, 세포 주기 및
아폽토시스에
대한 화합물 (1-1)의 효과
다양한 급성 백혈병 하위유형에서 화합물 (1-1)의 세포 효과를 평가하였다. 화합물 (1-1) 노출 후 세포 생존율을 9개의 AML 및 4개의 ALL 세포주에서 MTT 분석으로 평가하였다. 마이크로몰 이하의 IC50으로 정의되는 유의한 성장 억제가 9개의 AML 세포주 중 6개 및 시험된 4개의 모든 ALL 세포주에서 발견되었다. K562, KG1a 및 HL60 AML 세포주는 화합물 (1-1)에 내성이었다.
세포 주기에 대한 48시간 동안 500nM 화합물 (1-1)의 효과는 13개의 모든 세포주에서 G1에서 S기로의 전이를 감소시키고 KG1a, KG1, HEL, KASUMI 및 JURKAT 세포주에서 서브-G1 기에서 세포의 유의한 증가를 야기하였다(도 14a, 14b 및 17).
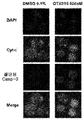
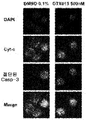
72시간 동안 25 내지 500nM의 용량의 화합물 (1-1) 처리는 아넥신 V 염색 및 PI 흡수에 의해 검출된 바와 같이, 유의한 아폽토시스를 유도하였다. 500nM 화합물 (1-1)에서, 9개의 AML 세포주 중 5개(HEL, NB4, NOMO-1, OCI-AML3, KASUMI)에서 세포의 30-90%가 세포자멸적이었고, 4개의 ALL 세포주 중 2개(JURKAT 및 RS4-11; 도 14c)에서 50-90%가 세포자멸적이었다. 최종적으로, 500nM 화합물 (1-1)에 72시간 노출은 카스파아제-3을 활성화시켰고 사이토크롬 c 방출을 유도하였으며, 이는 BET 억제가 미토콘드리아 촉발 아폽토시스를 적어도 일부 야기한다는 것을 제시한다(도 14d).
주목할만하게도, c-MYC, BRD2, BHD3, BRD4 및 HEXIM1의 기저 mRNA 발현 수준은 분석된 AML 또는 ALL 세포주 중 어느 것에서도 화합물 (1-1)-유도된 생존율 상실과 유의한 상관관계가 없었다(도 18a-18e).
흥미롭게도, 화합물 (1-1)에 노출된 세포주에서 세포 생존율의 감소 또는 아폽토시스의 유도와 c-MYC, BRD2/3/4 및 HEXIM1 발현 수준 사이에 어떠한 상관관계를 확인할 수 없었다. 화합물 (1-1)에 의해 유도된 유일하게 일관된 유전자 발현 조절은 다른 BET 억제제에서 보고된 바와 같이 c-MYC 하향 조절 및 HEXIM1 상향 조절(도 20)이었다.
실시예
10: 백혈병 환자 유래 샘플에서 화합물 (1-
1)의
생체외
효과
화합물 (1-1)을 이용한 진행중인 lb기 연구의 문맥에서 치료되었고 충분한 분석 물질이 이용가능한, 대표적인 새롭게 진단되거나 재발된 ALL 및 AML 환자(표 7 참고)로부터 수득된 BM 단핵 세포에서 아폽토시스, mRNA 및 단백질 발현을 평가하였다. 72시간 동안 500nM 화합물 (1-1)에의 노출에 의한 세포자멸자 유도는 시험된 환자 샘플 간에 가변적이었다(도 15a). 14명의 AML 환자 중 8명으로부터의 BM 세포는 대조군 처리된 세포와 비교하여 화합물 (1-1)로 35-90% 범위의 증가된 아폽토시스를 나타낸 반면(환자 3, 15, 17, 26, 27, 28, 31 및 38), 14명의 환자 중 6명(환자 4, 8, 9, 14, 16 및 18)에서 화합물 (1-1) 노출 후 세포자멸자의 증가가 전혀 관찰되지 않았거나 약간 관찰되었다. 시험된 2명의 ALL 환자로부터의 BM 세포는 아폽토시스의 증가가 전혀 없거나 약간 나타내었다(환자 40 및 43). 세포주에서의 본 발명자들의 관찰에 따라, 화합물 (1-1)은 또한 3명의 AML 환자로부터 분석된 샘플에서 카스파아제-3의 활성화 및 미토콘드리아 사이토크롬 c 방출을 유도하였다(도 15b).
500nM 화합물 (1-1)로 48시간 동안 처리한 후, c-MYC mRNA 발현은 평가된 7개의 AML 샘플 및 2개의 ALL 샘플(도 15c)에서 하향조절되었다. 3개의 주요 AML 샘플에서, c-MYC 단백질 발현은 BRD2 단백질 발현과 마찬가지로, 500nM 화합물 (1-1)로 72시간 후 분명하게 감소하였다(도 15d).
기저 BRD2/3/4 유전자 발현을 다양한 하위유형의 38개 AML 및 14개 ALL 환자 샘플에서 연구하였다. 세포주에서 관찰된 바와 같이, 유전자 발현 수준은 AML 및 ALL 하위유형에 걸쳐 매우 가변적이었고 bcr-abl 재배열 ALL 샘플에서 가장 낮은 발현을 가지고 있었다(도 15e, 19).
[표 7]
ALL 및 AML 환자 특징
F: 여성; M: 남성; ND (결정되지 않음)
본 발명의 숙련가는 상기에 나타내고 기술된 예시적인 구현예가 이의 광범위한 발명 개념을 벗어나지 않으면서 변경될 수 있음을 이해할 것이다. 따라서, 본 발명은 나타내고 기재된 예시적인 구현예에 한정되는 것이 아니라, 청구범위에 의해 정의된 바와 같은 본 발명의 사상 및 범위 내에 속하는 변형들을 포함하고자 하는 것으로 이해된다. 예를 들어, 예시적인 구현예의 특정 특징은 청구된 발명의 일부일 수도 아닐 수도 있으며, 개시된 구현예의 특징들은 조합될 수 있다. 본원에서 구체적으로 제시되지 않는 한, 용어 부정관사 및 정관사는 하나의 요소에 한정되지 않고 "적어도 하나"를 의미하는 것으로 해석되어야 한다.
본 발명의 도면 및 설명 중 적어도 일부는 본 발명의 명확한 이해를 위해 관련된 요소들에 집중하고자 간소화된 한편, 본 기술분야의 숙련가가 이해할 다른 요소를 명확성을 위해 제거하는 것 역시 본 발명의 일부를 포함할 수 있다. 명확하게하기 위해, 당업자는 또한 본 발명의 일부를 포함할 수 있음을 이해할 것이다. 그러나, 그러한 요소는 당해 기술 분야에서 잘 알려져 있고, 이들이 반드시 발명의 더 나은 이해를 촉진하는 것은 아니기 때문에, 그러한 요소에 대한 설명은 여기에 제공되지 않는다.
또한, 본 방법이 본원에 제시된 단계들의 특정 순서에 의존하지 않는 한, 단계들의 특정 순서는 청구범위에 대한 한정으로 해석되어서는 안된다. 본 발명의 방법에 관한 청구항은 서술된 순서로 그들의 단계를 수행하는 것으로 한정되어서는 안되며, 본 기술분야의 숙련가는 상기 단계가 다양할 수 있고 본 발명의 사상 및 범위 내에 여전히 속할 것임을 쉽게 이해할 수 있다.
Claims (32)
- 하기 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물 또는 용매화물의 약학적으로 허용가능한 양을 투여하는 것을 포함하는, 포유동물에서의 급성 골수성 백혈병 또는 급성 림프구성 백혈병의 치료 방법으로서, HEXIM1의 발현이 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물의 투여 후 상향 조절되는 것인 치료 방법:
(1)
상기 식에서,
R1은 1-4의 탄소수를 갖는 알킬이고,
R2는 수소 원자; 할로겐 원자; 또는 할로겐 원자 또는 하이드록실기에 의해 임의로 치환된 1-4의 탄소수를 갖는 알킬이며,
R3은 할로겐 원자; 할로겐 원자, 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시 또는 시아노에 의해 임의로 치환된 페닐; ―NR5―(CH2)m―R6(여기서 R5는 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, m은 0-4의 정수이며, R6은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임); 또는 -NR7―CO―(CH2)n―R8(여기서 R7은 수소 원자 또는 1-4의 탄소수를 갖는 알킬이고, n은 0-2의 정수이며, R8은 할로겐 원자에 의해 임의로 치환된 페닐 또는 피리딜임)이고,
R4는 ―(CH2)a―CO―NH―R9(여기서 a는 1-4의 정수이고, R9는 1-4의 탄소수를 갖는 알킬임); 1-4의 탄소수를 갖는 하이드록시알킬; 1-4의 탄소수를 갖는 알콕시; 또는 1-4의 탄소수를 갖는 알킬, 1-4의 탄소수를 갖는 알콕시, 아미노 또는 하이드록실기 또는 ―(CH2)b―COOR10(여기서 b는 1-4의 정수이고, R10은 1-4의 탄소수를 갖는 알킬임)에 의해 임의로 치환된 페닐 또는 피리딜이다. - 제1항에 있어서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은 (i) (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 또는 이의 이수화물, (ii) 메틸 (S)-{4-(3'-시아노바이페닐-4-일)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트, (iii) 메틸 (S)-{2,3,9-트리메틸-4-(4-페닐아미노페닐)-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트; 및 (iv) 메틸 (S)-{2,3,9-트리메틸-4-[4-(3-페닐프로피오닐아미노)페닐]-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일}아세테이트로 이루어진 군으로부터 선택되는 것인 치료 방법.
- 제1항에 있어서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물인 치료 방법.
- 제1항에 있어서, 식 (1)로 표시되는 티에노트리아졸로디아제핀 화합물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드인 치료 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 티에노트리아졸로디아제핀 화합물은 고체 분산물로서 형성되는 것인 치료 방법.
- 제5항에 있어서, 상기 고체 분산물은 식 (1)의 비정질 티에노트리아졸로디아제핀 화합물, 이의 약학적으로 허용가능한 염 또는 이의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 것인 치료 방법.
- 제5항 또는 6항에 있어서, 상기 고체 분산물은 식 (1)의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타내는 것인 치료 방법.
- 제6항 또는 제7항에 있어서, 상기 약학적으로 허용가능한 중합체는 1:3 내지 1:1의 티에노트리아졸로디아제핀 화합물 대 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트(HPMCAS) 중량비를 갖는 하이드록시프로필메틸셀룰로오스 아세테이트 석시네이트인 치료 방법.
- 제5항 내지 제8항 중 어느 한 항에 있어서, 상기 고체 분산물은 약 130℃ 내지 약 140℃ 범위의 단일 유리 전이 온도(Tg) 변곡점을 나타내는 것인 치료 방법.
- 제5항 내지 제9항 중 어느 한 항에 있어서, 상기 고체 분산물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물의 비정질 티에노트리아졸로디아제핀 화합물, 이의 약학적으로 허용가능한 염 또는 이의 수화물; 및 약학적으로 허용가능한 중합체를 포함하는 것인 치료 방법.
- 제10항에 있어서, 상기 고체 분산물은 (S)-2-[4-(4-클로로페닐)-2,3,9-트리메틸-6H-티에노[3,2-f][1,2,4]트리아졸로[4,3-a][1,4]디아제핀-6-일]-N-(4-하이드록시페닐)아세트아미드 이수화물의 결정질 티에노트리아졸로디아제핀 화합물과 관련된 회절선이 실질적으로 없는 X-선 분말 회절 패턴을 나타내는 것인 치료 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, c-MYC RNA 수준이 하향 조절되는 것인 치료 방법.
- 제1항 내지 제12항 중 어느 한 항에 있어서, BRD2 mRNA 수준이 하향 조절되는 것인 치료 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, BRD4 mRNA 수준이 하향 조절되는 것인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 급성 림프구성 백혈병은 MLL 재배열 급성 림프구성 백혈병(ALL)인 치료 방법.
- 제15항에 있어서, 상기 MLL 재배열 ALL은 MLL 유전자의 AF4(MLLT3) 유전자에의 융합을 특징으로 하는 것인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병은 MLL 재배열 급성 골수성 백혈병(AML)인 치료 방법.
- 제17항에 있어서, 상기 MLL 재배열 AML은 MLL 유전자의 AF9(MLLT3) 유전자에의 융합을 특징으로 하는 것인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병(AML)은 NPM1 돌연변이된 AML인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병(AML)은 BCR-ABL 관련된 급성 골수성 백혈병(AML)인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 림프구성 백혈병(ALL)은 BCR-ABL 관련된 급성 림프구성 백혈병(ALL)인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병(AML)은 PML-RARα 융합 유전자를 갖는 것인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병(AML)은 NRAS 돌연변이된 AML인 치료 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 급성 골수성 백혈병(AML)은 OP2-FGFR1 융합 유전자를 갖는 것인 치료 방법.
- 급성 골수성 백혈병을 치료하는 데 사용하기 위한 식 (1)의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물 또는 용매화물.
- 제25항에 있어서, 식 (1)의 화합물은 HEXIM1의 발현을 상향 조절하는 것인 화합물.
- 급성 림프구성 백혈병을 치료하는 데 사용하기 위한 식 (1)의 화합물 또는 이의 약학적으로 허용가능한 염 또는 이의 수화물 또는 용매화물.
- 제27항에 있어서, 식 (1)의 화합물은 HEXIM1의 발현을 상향 조절하는 것인 화합물.
- 제25항 내지 제28항 중 어느 한 항에 있어서, 상기 화합물은 식 (1A)인 화합물.
- 제25항 내지 제29항 중 어느 한 항에 있어서, 상기 화합물은 고체 분산물로서 제제화되는 것인 화합물.
- 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 데 사용하기 위한 식 (1)의 화합물과 약학적으로 허용가능한 중합체의 고체 분산물.
- 제31항에 있어서, 상기 식 (1)의 화합물의 고체 분산물은 HEXIM1의 발현을 상향 조절하는 것인 고체 분산물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462043063P | 2014-08-28 | 2014-08-28 | |
| US62/043,063 | 2014-08-28 | ||
| PCT/EP2015/069754 WO2016030509A1 (en) | 2014-08-28 | 2015-08-28 | Methods of treating acute myeloid leukemia or acute lymphoid leukemia using pharmaceutical compositions containing thienotriazolodiazepine compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170044172A true KR20170044172A (ko) | 2017-04-24 |
Family
ID=54012215
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177007647A KR20170044172A (ko) | 2014-08-28 | 2015-08-28 | 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 조성물을 사용하여 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20170281642A1 (ko) |
| EP (1) | EP3185871A1 (ko) |
| JP (1) | JP2017529332A (ko) |
| KR (1) | KR20170044172A (ko) |
| CN (1) | CN107427524A (ko) |
| WO (1) | WO2016030509A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210106156A (ko) * | 2020-02-20 | 2021-08-30 | 한국과학기술원 | Ash1l 히스톤 메틸화 효소 활성을 억제하는 벤조퓨란-피라졸 유도체 화합물을 포함하는 백혈병의 예방 또는 치료용 조성물 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015168621A1 (en) * | 2014-05-02 | 2015-11-05 | Oncoethix Sa | Method of treating acute myeloid leukemia and/or acute lymphoblastic leukemia using thienotriazolodiazepine compounds |
| CA3002560A1 (en) | 2015-10-23 | 2017-04-27 | Array Biopharma, Inc. | 2-aryl- and 2-heteroaryl-substituted 2-pyridazin-3(2h)-one compounds as inhibitors of fgfr tyrosine kinases |
| US10159660B2 (en) * | 2016-07-29 | 2018-12-25 | Oncternal Therapeutics, Inc. | Uses of indolinone compounds |
| EP4085055A1 (en) | 2019-12-30 | 2022-11-09 | Tyra Biosciences, Inc. | Aminopyrimidine compounds |
| WO2021138391A1 (en) | 2019-12-30 | 2021-07-08 | Tyra Biosciences, Inc. | Indazole compounds |
| US20240109865A1 (en) | 2020-12-30 | 2024-04-04 | Tyra Biosciences, Inc. | Indazole compounds as kinase inhibitors |
| CA3211124A1 (en) | 2021-02-26 | 2022-09-01 | Tyra Biosciences, Inc. | Aminopyrimidine compounds and methods of their use |
| WO2024006883A1 (en) | 2022-06-29 | 2024-01-04 | Tyra Biosciences, Inc. | Polymorphic compounds and uses thereof |
| WO2024006897A1 (en) | 2022-06-29 | 2024-01-04 | Tyra Biosciences, Inc. | Indazole compounds |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4875277B2 (ja) * | 2000-06-16 | 2012-02-15 | 田辺三菱製薬株式会社 | 放出pH域及び/又は速度制御組成物 |
| CN101910182B (zh) * | 2007-12-28 | 2013-07-17 | 田边三菱制药株式会社 | 抗癌剂 |
| BR112012029005A2 (pt) * | 2010-05-14 | 2016-07-26 | Dana Farber Cancer Inst Inc | composições e métodos de tratamento de neoplasia, doença inflamatória e outros distúrbios |
| WO2011143660A2 (en) * | 2010-05-14 | 2011-11-17 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for treating leukemia |
| DE102011082013A1 (de) * | 2011-09-01 | 2013-03-07 | Bayer Pharma AG | 6H-Thieno[3,2-f][1,2,4]triazolo[4,3-a][1,4]diazepine |
| CN104968334B (zh) * | 2012-09-28 | 2018-09-14 | 翁科埃斯克斯有限公司 | 包含噻吩并三唑并二氮杂卓化合物的药物制剂 |
| JP6453877B2 (ja) * | 2013-08-01 | 2019-01-16 | オンコエシックス ゲーエムベーハー | チエノトリアゾロジアゼピン化合物を含む医薬製剤 |
| US9757385B2 (en) * | 2013-11-27 | 2017-09-12 | Merck Sharp & Dohme Corp. | Method of treating leukemia using pharmaceutical formulation containing thienotriazolodiazepine compounds |
-
2015
- 2015-08-28 EP EP15756648.0A patent/EP3185871A1/en not_active Withdrawn
- 2015-08-28 JP JP2017511200A patent/JP2017529332A/ja not_active Withdrawn
- 2015-08-28 WO PCT/EP2015/069754 patent/WO2016030509A1/en active Application Filing
- 2015-08-28 US US15/507,496 patent/US20170281642A1/en not_active Abandoned
- 2015-08-28 CN CN201580046616.5A patent/CN107427524A/zh active Pending
- 2015-08-28 KR KR1020177007647A patent/KR20170044172A/ko unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210106156A (ko) * | 2020-02-20 | 2021-08-30 | 한국과학기술원 | Ash1l 히스톤 메틸화 효소 활성을 억제하는 벤조퓨란-피라졸 유도체 화합물을 포함하는 백혈병의 예방 또는 치료용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3185871A1 (en) | 2017-07-05 |
| WO2016030509A1 (en) | 2016-03-03 |
| US20170281642A1 (en) | 2017-10-05 |
| JP2017529332A (ja) | 2017-10-05 |
| CN107427524A (zh) | 2017-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20170044172A (ko) | 티에노트리아졸로디아제핀 화합물을 함유하는 약학적 조성물을 사용하여 급성 골수성 백혈병 또는 급성 림프구성 백혈병을 치료하는 방법 | |
| AU2013340483B2 (en) | Pharmaceutical formulation containing thienotriazolodiazepine compounds | |
| US9757385B2 (en) | Method of treating leukemia using pharmaceutical formulation containing thienotriazolodiazepine compounds | |
| WO2015018522A1 (en) | Bet-bromodomain inhibitor shows synergism with several anti-cancer agents in pre-clinical models of diffuse large b-cell lymphoma (dlbcl) | |
| KR20160037201A (ko) | Bet-브로모도메인 억제제를 사용한 미만성 거대 b-세포 림프종 (dlbcl)의 치료 방법 | |
| KR20170002550A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 내성 비호지킨 림프종, 수아세포종, 및/또는 alk+ 비소세포 폐암의 치료 방법 | |
| KR20160145833A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 급성 골수성 백혈병 및/또는 급성 림프아구성 백혈병의 치료 방법 | |
| KR20170002610A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 삼중 음성 유방암의 치료 방법 | |
| WO2015169953A1 (en) | Method of treating glioma using thienotriazolodiazepine compounds | |
| US9795612B2 (en) | Pharmaceutical formulation containing thienotriazolodiazepine compounds | |
| WO2015168587A1 (en) | Method of treating resistant multiple myeloma and mantle cell lymphoma using thienotriazolodiazepine compounds | |
| KR20170037670A (ko) | 티에노트리아졸로디아제핀 화합물을 사용한 림프종의 치료 방법 |