KR20160023839A - 간질성 방광염/방광통증 증후군과 관련된 통증의 예방 및 치료를 위한 시그마 리셉터 리간드들의 용도 - Google Patents
간질성 방광염/방광통증 증후군과 관련된 통증의 예방 및 치료를 위한 시그마 리셉터 리간드들의 용도 Download PDFInfo
- Publication number
- KR20160023839A KR20160023839A KR1020167001865A KR20167001865A KR20160023839A KR 20160023839 A KR20160023839 A KR 20160023839A KR 1020167001865 A KR1020167001865 A KR 1020167001865A KR 20167001865 A KR20167001865 A KR 20167001865A KR 20160023839 A KR20160023839 A KR 20160023839A
- Authority
- KR
- South Korea
- Prior art keywords
- dichlorophenyl
- pyrazol
- yloxy
- substituted
- methyl
- Prior art date
Links
- 208000002193 Pain Diseases 0.000 title claims abstract description 100
- 208000005615 Interstitial Cystitis Diseases 0.000 title claims abstract description 60
- 238000011282 treatment Methods 0.000 title claims abstract description 25
- 230000002265 prevention Effects 0.000 title claims abstract description 15
- 239000003982 sigma receptor ligand Substances 0.000 title claims description 18
- 239000003446 ligand Substances 0.000 claims abstract description 38
- 150000001875 compounds Chemical class 0.000 claims description 61
- 125000004189 3,4-dichlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(Cl)C([H])=C1* 0.000 claims description 42
- 239000003814 drug Substances 0.000 claims description 42
- 125000003118 aryl group Chemical group 0.000 claims description 34
- 208000004454 Hyperalgesia Diseases 0.000 claims description 33
- -1 1- (3,4-Dichlorophenyl) -5-methyl-1H-pyrazol-3- yloxy Chemical group 0.000 claims description 30
- 239000005557 antagonist Substances 0.000 claims description 29
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 claims description 26
- 150000003839 salts Chemical class 0.000 claims description 26
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 22
- 125000000217 alkyl group Chemical group 0.000 claims description 19
- 208000035154 Hyperesthesia Diseases 0.000 claims description 18
- 238000000034 method Methods 0.000 claims description 17
- 208000004296 neuralgia Diseases 0.000 claims description 16
- 229940002612 prodrug Drugs 0.000 claims description 15
- 239000000651 prodrug Substances 0.000 claims description 15
- 208000000094 Chronic Pain Diseases 0.000 claims description 13
- 125000003342 alkenyl group Chemical group 0.000 claims description 13
- 125000004122 cyclic group Chemical group 0.000 claims description 13
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 13
- 229910052736 halogen Inorganic materials 0.000 claims description 13
- 150000002367 halogens Chemical class 0.000 claims description 13
- 229960005181 morphine Drugs 0.000 claims description 13
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 12
- 125000000623 heterocyclic group Chemical group 0.000 claims description 12
- 208000021722 neuropathic pain Diseases 0.000 claims description 12
- 229910052757 nitrogen Inorganic materials 0.000 claims description 12
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 11
- 229910052739 hydrogen Inorganic materials 0.000 claims description 11
- 239000001257 hydrogen Substances 0.000 claims description 11
- 239000012453 solvate Substances 0.000 claims description 11
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 claims description 10
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 9
- 125000004415 heterocyclylalkyl group Chemical group 0.000 claims description 9
- 230000036961 partial effect Effects 0.000 claims description 9
- 229940125425 inverse agonist Drugs 0.000 claims description 8
- 201000001119 neuropathy Diseases 0.000 claims description 7
- 230000007823 neuropathy Effects 0.000 claims description 7
- 230000007935 neutral effect Effects 0.000 claims description 7
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 7
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims description 6
- 206010053552 allodynia Diseases 0.000 claims description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 6
- 125000004104 aryloxy group Chemical group 0.000 claims description 5
- SHRYQZBTQDMGLZ-UHFFFAOYSA-N 4-[2-(5-methyl-1-naphthalen-2-ylpyrazol-3-yl)oxyethyl]morpholine;hydrochloride Chemical compound Cl.N=1N(C=2C=C3C=CC=CC3=CC=2)C(C)=CC=1OCCN1CCOCC1 SHRYQZBTQDMGLZ-UHFFFAOYSA-N 0.000 claims description 4
- 206010029240 Neuritis Diseases 0.000 claims description 4
- 125000003545 alkoxy group Chemical group 0.000 claims description 4
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 4
- 235000005911 diet Nutrition 0.000 claims description 4
- 230000037213 diet Effects 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- HZJLMGJUIYTSMU-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxyethyl]-4-methylpiperazine Chemical compound C1CN(C)CCN1CCOC1=NN(C=2C=C(Cl)C(Cl)=CC=2)C(C)=C1 HZJLMGJUIYTSMU-UHFFFAOYSA-N 0.000 claims description 3
- JLIOGNLMAGIFJN-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxyethyl]piperazine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCN1CCNCC1 JLIOGNLMAGIFJN-UHFFFAOYSA-N 0.000 claims description 3
- XKGSRQAKFXSURB-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxyethyl]piperidine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCN1CCCCC1 XKGSRQAKFXSURB-UHFFFAOYSA-N 0.000 claims description 3
- IZCFYFTZCBGMLV-UHFFFAOYSA-N 2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxy-n,n-diethylethanamine Chemical compound N1=C(OCCN(CC)CC)C=C(C)N1C1=CC=C(Cl)C(Cl)=C1 IZCFYFTZCBGMLV-UHFFFAOYSA-N 0.000 claims description 3
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 claims description 3
- HLAPBHGJHLAYSD-UHFFFAOYSA-N 4-[2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxyethyl]morpholine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCN1CCOCC1 HLAPBHGJHLAYSD-UHFFFAOYSA-N 0.000 claims description 3
- 230000000069 prophylactic effect Effects 0.000 claims description 3
- 238000001356 surgical procedure Methods 0.000 claims description 3
- 230000001225 therapeutic effect Effects 0.000 claims description 3
- NWFCYGKUUJSQBC-GASCZTMLSA-N (2r,6s)-4-[4-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxybutyl]-2,6-dimethylmorpholine Chemical compound C1[C@@H](C)O[C@@H](C)CN1CCCCOC1=NN(C=2C=C(Cl)C(Cl)=CC=2)C=C1 NWFCYGKUUJSQBC-GASCZTMLSA-N 0.000 claims description 2
- WZWRZEMDVNTYDE-UHFFFAOYSA-N 1-(3,4-dichlorophenyl)-3-(2-pyrrolidin-1-ylethoxy)pyrazole Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCN2CCCC2)C=C1 WZWRZEMDVNTYDE-UHFFFAOYSA-N 0.000 claims description 2
- WBERJAVNUCODIT-UHFFFAOYSA-N 1-(3,4-dichlorophenyl)-3-(3-pyrrolidin-1-ylpropoxy)pyrazole Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCCN2CCCC2)C=C1 WBERJAVNUCODIT-UHFFFAOYSA-N 0.000 claims description 2
- SMFVSSIDEBMGKS-UHFFFAOYSA-N 1-(3,4-dichlorophenyl)-3-(4-pyrrolidin-1-ylbutoxy)pyrazole Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCCCN2CCCC2)C=C1 SMFVSSIDEBMGKS-UHFFFAOYSA-N 0.000 claims description 2
- TYQPLZVNSCAIFI-UHFFFAOYSA-N 1-[2-(5-methyl-1-naphthalen-2-ylpyrazol-3-yl)oxyethyl]piperidine Chemical compound N=1N(C=2C=C3C=CC=CC3=CC=2)C(C)=CC=1OCCN1CCCCC1 TYQPLZVNSCAIFI-UHFFFAOYSA-N 0.000 claims description 2
- BDZJQOPZDLUPID-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-4,5-dimethylpyrazol-3-yl]oxyethyl]piperidine Chemical compound CC1=C(C)N(C=2C=C(Cl)C(Cl)=CC=2)N=C1OCCN1CCCCC1 BDZJQOPZDLUPID-UHFFFAOYSA-N 0.000 claims description 2
- NHRAAWXMMGSTHI-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-5-phenylpyrazol-3-yl]oxyethyl]piperidine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1C(C=2C=CC=CC=2)=CC(OCCN2CCCCC2)=N1 NHRAAWXMMGSTHI-UHFFFAOYSA-N 0.000 claims description 2
- ZRKJSQZRBMJLSH-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)-5-propan-2-ylpyrazol-3-yl]oxyethyl]piperidine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C(C)C)=CC=1OCCN1CCCCC1 ZRKJSQZRBMJLSH-UHFFFAOYSA-N 0.000 claims description 2
- PUZILSCHNRFUBL-UHFFFAOYSA-N 1-[2-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxyethyl]piperidine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCN2CCCCC2)C=C1 PUZILSCHNRFUBL-UHFFFAOYSA-N 0.000 claims description 2
- UJVRCYKFYBUMPY-UHFFFAOYSA-N 1-[2-[1-(4-methoxyphenyl)-5-methylpyrazol-3-yl]oxyethyl]piperidine Chemical compound C1=CC(OC)=CC=C1N1C(C)=CC(OCCN2CCCCC2)=N1 UJVRCYKFYBUMPY-UHFFFAOYSA-N 0.000 claims description 2
- RGFIAPCESXOYMJ-UHFFFAOYSA-N 1-[4-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxybutyl]-4-methylpiperazine Chemical compound C1CN(C)CCN1CCCCOC1=NN(C=2C=C(Cl)C(Cl)=CC=2)C(C)=C1 RGFIAPCESXOYMJ-UHFFFAOYSA-N 0.000 claims description 2
- PKBREWIOYKTNBB-UHFFFAOYSA-N 1-[4-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxybutyl]-4-phenylpiperidine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCCCN(CC1)CCC1C1=CC=CC=C1 PKBREWIOYKTNBB-UHFFFAOYSA-N 0.000 claims description 2
- XKEZHFHUXSUJGC-UHFFFAOYSA-N 1-[4-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxybutyl]piperidine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCCCN1CCCCC1 XKEZHFHUXSUJGC-UHFFFAOYSA-N 0.000 claims description 2
- GPJDXYIXLDTRMO-UHFFFAOYSA-N 1-[4-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxybutyl]piperidine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCCCN2CCCCC2)C=C1 GPJDXYIXLDTRMO-UHFFFAOYSA-N 0.000 claims description 2
- 125000000586 2-(4-morpholinyl)ethoxy group Chemical group [H]C([H])(O*)C([H])([H])N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 claims description 2
- CESIREDMWGMYGW-UHFFFAOYSA-N 2-[1-(3,4-dichlorophenyl)-4,5-dimethylpyrazol-3-yl]oxy-n,n-diethylethanamine Chemical compound CC1=C(C)C(OCCN(CC)CC)=NN1C1=CC=C(Cl)C(Cl)=C1 CESIREDMWGMYGW-UHFFFAOYSA-N 0.000 claims description 2
- OAOLNHZAEJOOKR-UHFFFAOYSA-N 2-[1-(3,4-dichlorophenyl)-5-propan-2-ylpyrazol-3-yl]oxy-n,n-diethylethanamine Chemical compound N1=C(OCCN(CC)CC)C=C(C(C)C)N1C1=CC=C(Cl)C(Cl)=C1 OAOLNHZAEJOOKR-UHFFFAOYSA-N 0.000 claims description 2
- OUSQOQYBXVCFBD-UHFFFAOYSA-N 2-[2-[1-(3,4-dichlorophenyl)-5-phenylpyrazol-3-yl]oxyethyl]-3,4-dihydro-1h-isoquinoline Chemical compound C1=C(Cl)C(Cl)=CC=C1N1C(C=2C=CC=CC=2)=CC(OCCN2CC3=CC=CC=C3CC2)=N1 OUSQOQYBXVCFBD-UHFFFAOYSA-N 0.000 claims description 2
- PPRYPHBDCCNNFF-UHFFFAOYSA-N 2-[2-[1-(3,4-dichlorophenyl)-5-propan-2-ylpyrazol-3-yl]oxyethyl]-3,4-dihydro-1h-isoquinoline Chemical compound CC(C)C1=CC(OCCN2CC3=CC=CC=C3CC2)=NN1C1=CC=C(Cl)C(Cl)=C1 PPRYPHBDCCNNFF-UHFFFAOYSA-N 0.000 claims description 2
- BXKUTCWIZMNQHG-UHFFFAOYSA-N 2-[4-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxybutyl]-3,4-dihydro-1h-isoquinoline Chemical compound CC1=CC(OCCCCN2CC3=CC=CC=C3CC2)=NN1C1=CC=C(Cl)C(Cl)=C1 BXKUTCWIZMNQHG-UHFFFAOYSA-N 0.000 claims description 2
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 claims description 2
- DGPGXHRHNRYVDH-UHFFFAOYSA-N 4-[2-(5-methyl-1-naphthalen-2-ylpyrazol-3-yl)oxyethyl]morpholine Chemical compound N=1N(C=2C=C3C=CC=CC3=CC=2)C(C)=CC=1OCCN1CCOCC1 DGPGXHRHNRYVDH-UHFFFAOYSA-N 0.000 claims description 2
- DDCOJLWCGGUJJE-UHFFFAOYSA-N 4-[2-[1-(3,4-dichlorophenyl)-4,5-dimethylpyrazol-3-yl]oxyethyl]morpholine Chemical compound CC1=C(C)N(C=2C=C(Cl)C(Cl)=CC=2)N=C1OCCN1CCOCC1 DDCOJLWCGGUJJE-UHFFFAOYSA-N 0.000 claims description 2
- UFMLSFNIQLSGBU-UHFFFAOYSA-N 4-[2-[1-(3,4-dichlorophenyl)-5-phenylpyrazol-3-yl]oxyethyl]morpholine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1C(C=2C=CC=CC=2)=CC(OCCN2CCOCC2)=N1 UFMLSFNIQLSGBU-UHFFFAOYSA-N 0.000 claims description 2
- FDCUMMFFJKZKJA-UHFFFAOYSA-N 4-[2-[1-(3,4-dichlorophenyl)-5-propan-2-ylpyrazol-3-yl]oxyethyl]morpholine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C(C)C)=CC=1OCCN1CCOCC1 FDCUMMFFJKZKJA-UHFFFAOYSA-N 0.000 claims description 2
- XAQPFZYOGVVUAR-UHFFFAOYSA-N 4-[2-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxyethyl]morpholine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCN2CCOCC2)C=C1 XAQPFZYOGVVUAR-UHFFFAOYSA-N 0.000 claims description 2
- MLMSXMUNOAHWMJ-UHFFFAOYSA-N 4-[2-[1-(4-methoxyphenyl)-5-methylpyrazol-3-yl]oxyethyl]morpholine Chemical compound C1=CC(OC)=CC=C1N1C(C)=CC(OCCN2CCOCC2)=N1 MLMSXMUNOAHWMJ-UHFFFAOYSA-N 0.000 claims description 2
- BJADKWSRAOXZQM-UHFFFAOYSA-N 4-[4-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxybutyl]morpholine Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCCCN1CCOCC1 BJADKWSRAOXZQM-UHFFFAOYSA-N 0.000 claims description 2
- MANNXHNTCUQPLH-UHFFFAOYSA-N 4-[4-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxybutyl]morpholine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCCCN2CCOCC2)C=C1 MANNXHNTCUQPLH-UHFFFAOYSA-N 0.000 claims description 2
- PEFMCPQSHLLKBV-UHFFFAOYSA-N 4-[4-[1-(3,4-dichlorophenyl)pyrazol-3-yl]oxybutyl]thiomorpholine Chemical compound C1=C(Cl)C(Cl)=CC=C1N1N=C(OCCCCN2CCSCC2)C=C1 PEFMCPQSHLLKBV-UHFFFAOYSA-N 0.000 claims description 2
- FKYVVHMDNYMWPI-UHFFFAOYSA-N 5-methyl-1-naphthalen-2-yl-3-(2-pyrrolidin-1-ylethoxy)pyrazole Chemical compound N=1N(C=2C=C3C=CC=CC3=CC=2)C(C)=CC=1OCCN1CCCC1 FKYVVHMDNYMWPI-UHFFFAOYSA-N 0.000 claims description 2
- 208000001387 Causalgia Diseases 0.000 claims description 2
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 claims description 2
- 229940122490 Sigma receptor antagonist Drugs 0.000 claims description 2
- 230000001154 acute effect Effects 0.000 claims description 2
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 claims description 2
- 239000012230 colorless oil Substances 0.000 claims description 2
- 208000014439 complex regional pain syndrome type 2 Diseases 0.000 claims description 2
- QIDBLHIQPFHHSN-UHFFFAOYSA-N ethyl 4-[2-[1-(3,4-dichlorophenyl)-5-methylpyrazol-3-yl]oxyethyl]piperazine-1-carboxylate Chemical compound C1CN(C(=O)OCC)CCN1CCOC1=NN(C=2C=C(Cl)C(Cl)=CC=2)C(C)=C1 QIDBLHIQPFHHSN-UHFFFAOYSA-N 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims description 2
- NMMACGGEHONAMP-UHFFFAOYSA-N n,n-diethyl-2-(5-methyl-1-naphthalen-2-ylpyrazol-3-yl)oxyethanamine Chemical compound N1=C(OCCN(CC)CC)C=C(C)N1C1=CC=C(C=CC=C2)C2=C1 NMMACGGEHONAMP-UHFFFAOYSA-N 0.000 claims description 2
- 150000002431 hydrogen Chemical class 0.000 claims 5
- 206010065952 Hyperpathia Diseases 0.000 claims 1
- 108090000137 Opioid Receptors Proteins 0.000 claims 1
- 102000003840 Opioid Receptors Human genes 0.000 claims 1
- 208000005298 acute pain Diseases 0.000 claims 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 claims 1
- 238000002955 isolation Methods 0.000 claims 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 claims 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 51
- 229960004397 cyclophosphamide Drugs 0.000 description 51
- 229940079593 drug Drugs 0.000 description 38
- 108020003175 receptors Proteins 0.000 description 35
- 102000005962 receptors Human genes 0.000 description 35
- 241001465754 Metazoa Species 0.000 description 33
- 230000000694 effects Effects 0.000 description 30
- 239000002904 solvent Substances 0.000 description 26
- 241000699670 Mus sp. Species 0.000 description 24
- 125000004432 carbon atom Chemical group C* 0.000 description 24
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 22
- 239000011780 sodium chloride Substances 0.000 description 22
- 230000006399 behavior Effects 0.000 description 20
- 238000012360 testing method Methods 0.000 description 20
- 102000003896 Myeloperoxidases Human genes 0.000 description 17
- 108090000235 Myeloperoxidases Proteins 0.000 description 17
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 14
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 238000000540 analysis of variance Methods 0.000 description 11
- 229940108605 cyclophosphamide injection Drugs 0.000 description 11
- 201000010099 disease Diseases 0.000 description 11
- 230000004044 response Effects 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 210000005036 nerve Anatomy 0.000 description 10
- 108010085082 sigma receptors Proteins 0.000 description 10
- 210000001015 abdomen Anatomy 0.000 description 9
- 239000000556 agonist Substances 0.000 description 9
- 229940090044 injection Drugs 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 150000003254 radicals Chemical class 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 239000000546 pharmaceutical excipient Substances 0.000 description 8
- 230000000638 stimulation Effects 0.000 description 8
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 7
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 7
- 229960000905 indomethacin Drugs 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 6
- 201000003146 cystitis Diseases 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 208000011580 syndromic disease Diseases 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- 206010005063 Bladder pain Diseases 0.000 description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 206010061218 Inflammation Diseases 0.000 description 5
- 102100028656 Sigma non-opioid intracellular receptor 1 Human genes 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- 230000027455 binding Effects 0.000 description 5
- 125000004093 cyano group Chemical group *C#N 0.000 description 5
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 5
- 230000004054 inflammatory process Effects 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 230000002093 peripheral effect Effects 0.000 description 5
- 230000001953 sensory effect Effects 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- RQHKZUBCUZVZEF-UHFFFAOYSA-N 1-phenyl-1-cyclohexanecarboxylic acid 2-(4-morpholinyl)ethyl ester Chemical compound C1CCCCC1(C=1C=CC=CC=1)C(=O)OCCN1CCOCC1 RQHKZUBCUZVZEF-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 4
- ZHGMDXSHODHWHV-UHFFFAOYSA-N N-{2-[4-methoxy-3-(2-phenylethoxy)phenyl]ethyl}-N-propylpropan-1-amine hydrochloride Chemical compound Cl.CCCN(CCC)CCC1=CC=C(OC)C(OCCC=2C=CC=CC=2)=C1 ZHGMDXSHODHWHV-UHFFFAOYSA-N 0.000 description 4
- 230000003444 anaesthetic effect Effects 0.000 description 4
- 150000001450 anions Chemical class 0.000 description 4
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 4
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 4
- 150000001768 cations Chemical class 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 239000013256 coordination polymer Substances 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- 239000002207 metabolite Substances 0.000 description 4
- 125000001624 naphthyl group Chemical group 0.000 description 4
- 210000000653 nervous system Anatomy 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- WNZBBTJFOIOEMP-UHFFFAOYSA-N Hydroxyhaloperidol Chemical compound C=1C=C(F)C=CC=1C(O)CCCN(CC1)CCC1(O)C1=CC=C(Cl)C=C1 WNZBBTJFOIOEMP-UHFFFAOYSA-N 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 238000000692 Student's t-test Methods 0.000 description 3
- 239000009975 Urodyn Substances 0.000 description 3
- 208000027418 Wounds and injury Diseases 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 125000002252 acyl group Chemical group 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 208000026935 allergic disease Diseases 0.000 description 3
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 3
- 230000003110 anti-inflammatory effect Effects 0.000 description 3
- 239000001961 anticonvulsive agent Substances 0.000 description 3
- 230000003542 behavioural effect Effects 0.000 description 3
- 210000005068 bladder tissue Anatomy 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000009610 hypersensitivity Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 238000011813 knockout mouse model Methods 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000003607 modifier Substances 0.000 description 3
- 210000004877 mucosa Anatomy 0.000 description 3
- 230000001473 noxious effect Effects 0.000 description 3
- 229940005483 opioid analgesics Drugs 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000001301 oxygen Chemical group 0.000 description 3
- 210000001428 peripheral nervous system Anatomy 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 108010080097 sigma-1 receptor Proteins 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 208000019206 urinary tract infection Diseases 0.000 description 3
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- LZAYOZUFUAMFLD-UHFFFAOYSA-N 4-(4-chlorophenyl)-4-hydroxypiperidine Chemical compound C=1C=C(Cl)C=CC=1C1(O)CCNCC1 LZAYOZUFUAMFLD-UHFFFAOYSA-N 0.000 description 2
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 206010005052 Bladder irritation Diseases 0.000 description 2
- 229920001287 Chondroitin sulfate Polymers 0.000 description 2
- 206010011796 Cystitis interstitial Diseases 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 229940122957 Histamine H2 receptor antagonist Drugs 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 2
- 229930064664 L-arginine Natural products 0.000 description 2
- 235000014852 L-arginine Nutrition 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 101710104750 Sigma non-opioid intracellular receptor 1 Proteins 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 229940123445 Tricyclic antidepressant Drugs 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 229960000836 amitriptyline Drugs 0.000 description 2
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000000730 antalgic agent Substances 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 239000000043 antiallergic agent Substances 0.000 description 2
- 229940125681 anticonvulsant agent Drugs 0.000 description 2
- 239000000739 antihistaminic agent Substances 0.000 description 2
- 229940125715 antihistaminic agent Drugs 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 229940059329 chondroitin sulfate Drugs 0.000 description 2
- 208000037976 chronic inflammation Diseases 0.000 description 2
- 230000006020 chronic inflammation Effects 0.000 description 2
- CCGSUNCLSOWKJO-UHFFFAOYSA-N cimetidine Chemical compound N#CNC(=N/C)\NCCSCC1=NC=N[C]1C CCGSUNCLSOWKJO-UHFFFAOYSA-N 0.000 description 2
- 229960001380 cimetidine Drugs 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 238000001647 drug administration Methods 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 229960002870 gabapentin Drugs 0.000 description 2
- 229960003878 haloperidol Drugs 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229920002674 hyaluronan Polymers 0.000 description 2
- 229960003160 hyaluronic acid Drugs 0.000 description 2
- 229960003444 immunosuppressant agent Drugs 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 230000002427 irreversible effect Effects 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 229940126701 oral medication Drugs 0.000 description 2
- 229960005434 oxybutynin Drugs 0.000 description 2
- 208000035824 paresthesia Diseases 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 125000005561 phenanthryl group Chemical group 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 229940044551 receptor antagonist Drugs 0.000 description 2
- 239000002464 receptor antagonist Substances 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000035807 sensation Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 229960004045 tolterodine Drugs 0.000 description 2
- OOGJQPCLVADCPB-HXUWFJFHSA-N tolterodine Chemical compound C1([C@@H](CCN(C(C)C)C(C)C)C=2C(=CC=C(C)C=2)O)=CC=CC=C1 OOGJQPCLVADCPB-HXUWFJFHSA-N 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 229960005294 triamcinolone Drugs 0.000 description 2
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 2
- 239000003029 tricyclic antidepressant agent Substances 0.000 description 2
- 230000002485 urinary effect Effects 0.000 description 2
- BDIAUFOIMFAIPU-UHFFFAOYSA-N valepotriate Natural products CC(C)CC(=O)OC1C=C(C(=COC2OC(=O)CC(C)C)COC(C)=O)C2C11CO1 BDIAUFOIMFAIPU-UHFFFAOYSA-N 0.000 description 2
- 210000001835 viscera Anatomy 0.000 description 2
- VOKSWYLNZZRQPF-CCKFTAQKSA-N (+)-pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@]2(C)[C@H](C)[C@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-CCKFTAQKSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- SVRATFOTJLMBDJ-UHFFFAOYSA-N 1-(3,4-dichlorophenyl)-5-methyl-3-(2-pyrrolidin-1-ylethoxy)pyrazole Chemical compound N=1N(C=2C=C(Cl)C(Cl)=CC=2)C(C)=CC=1OCCN1CCCC1 SVRATFOTJLMBDJ-UHFFFAOYSA-N 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- 125000006018 1-methyl-ethenyl group Chemical group 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- JRBJSXQPQWSCCF-UHFFFAOYSA-N 3,3'-Dimethoxybenzidine Chemical compound C1=C(N)C(OC)=CC(C=2C=C(OC)C(N)=CC=2)=C1 JRBJSXQPQWSCCF-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- 0 C*(N(*)*)Oc(c(*)c1*)n[n]1C1=CI=C=CC=C1 Chemical compound C*(N(*)*)Oc(c(*)c1*)n[n]1C1=CI=C=CC=C1 0.000 description 1
- PXKSSCDBRRIYNR-UHFFFAOYSA-N C1CN(CCC1(C2=CC=C(C=C2)F)O)CCCCO Chemical compound C1CN(CCC1(C2=CC=C(C=C2)F)O)CCCCO PXKSSCDBRRIYNR-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 101150049660 DRD2 gene Proteins 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010052804 Drug tolerance Diseases 0.000 description 1
- 208000030453 Drug-Related Side Effects and Adverse reaction Diseases 0.000 description 1
- 206010013886 Dysaesthesia Diseases 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 206010013975 Dyspnoeas Diseases 0.000 description 1
- 201000009273 Endometriosis Diseases 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108010093008 Kinins Proteins 0.000 description 1
- 102000002397 Kinins Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- UCHDWCPVSPXUMX-TZIWLTJVSA-N Montelukast Chemical compound CC(C)(O)C1=CC=CC=C1CC[C@H](C=1C=C(\C=C\C=2N=C3C=C(Cl)C=CC3=CC=2)C=CC=1)SCC1(CC(O)=O)CC1 UCHDWCPVSPXUMX-TZIWLTJVSA-N 0.000 description 1
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 108090000590 Neurotransmitter Receptors Proteins 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 208000000450 Pelvic Pain Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 229940124264 Sigma 1 receptor antagonist Drugs 0.000 description 1
- 102100028662 Sigma intracellular receptor 2 Human genes 0.000 description 1
- 229940127318 Sigma-1 Receptor Antagonists Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010070863 Toxicity to various agents Diseases 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 206010046543 Urinary incontinence Diseases 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 201000005661 acute cystitis Diseases 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 230000003281 allosteric effect Effects 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 230000002460 anti-migrenic effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229960003965 antiepileptics Drugs 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 229940005530 anxiolytics Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 150000005840 aryl radicals Chemical class 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- XYOVOXDWRFGKEX-UHFFFAOYSA-N azepine Chemical compound N1C=CC=CC=C1 XYOVOXDWRFGKEX-UHFFFAOYSA-N 0.000 description 1
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 1
- 238000009227 behaviour therapy Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000005518 carboxamido group Chemical group 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 208000013507 chronic prostatitis Diseases 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical group C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 230000003291 dopaminomimetic effect Effects 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 230000036267 drug metabolism Effects 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229940013688 formic acid Drugs 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 229960002598 fumaric acid Drugs 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000026781 habituation Effects 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 235000015220 hamburgers Nutrition 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 230000009191 jumping Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 229940099690 malic acid Drugs 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 210000002418 meninge Anatomy 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- NBTOZLQBSIZIKS-UHFFFAOYSA-N methoxide Chemical compound [O-]C NBTOZLQBSIZIKS-UHFFFAOYSA-N 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 229960005127 montelukast Drugs 0.000 description 1
- 229960005195 morphine hydrochloride Drugs 0.000 description 1
- XELXKCKNPPSFNN-BJWPBXOKSA-N morphine hydrochloride trihydrate Chemical compound O.O.O.Cl.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O XELXKCKNPPSFNN-BJWPBXOKSA-N 0.000 description 1
- 229940068938 morphine injection Drugs 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 125000000449 nitro group Chemical class [O-][N+](*)=O 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 229940116315 oxalic acid Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- HFHZKZSRXITVMK-UHFFFAOYSA-N oxyphenbutazone Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=C(O)C=C1 HFHZKZSRXITVMK-UHFFFAOYSA-N 0.000 description 1
- 230000008058 pain sensation Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000036285 pathological change Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 210000003903 pelvic floor Anatomy 0.000 description 1
- 208000013823 pelvic organ prolapse Diseases 0.000 description 1
- 210000004197 pelvis Anatomy 0.000 description 1
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 1
- 229960005301 pentazocine Drugs 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- RGCLLPNLLBQHPF-HJWRWDBZSA-N phosphamidon Chemical compound CCN(CC)C(=O)C(\Cl)=C(/C)OP(=O)(OC)OC RGCLLPNLLBQHPF-HJWRWDBZSA-N 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 201000007094 prostatitis Diseases 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 150000003217 pyrazoles Chemical class 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 239000002287 radioligand Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000006748 scratching Methods 0.000 description 1
- 230000002393 scratching effect Effects 0.000 description 1
- 230000035909 sensory irritation Effects 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 108010040167 sigma-2 receptor Proteins 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 229910052717 sulfur Chemical group 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 229940032330 sulfuric acid Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000008399 tap water Substances 0.000 description 1
- 235000020679 tap water Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229960001367 tartaric acid Drugs 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 230000001228 trophic effect Effects 0.000 description 1
- 238000007492 two-way ANOVA Methods 0.000 description 1
- 230000036269 ulceration Effects 0.000 description 1
- 210000001170 unmyelinated nerve fiber Anatomy 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 210000003741 urothelium Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000004018 waxing Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Emergency Medicine (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Urology & Nephrology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Peptides Or Proteins (AREA)
Abstract
Description
본 발명은 간질성 방광염/방광통증 증후군(IC/BPS)과 관련된 통증의 치료 및/또는 예방에 있어서 시그마 리셉터 리간드들의 용도, 및 더욱 특별하게는 몇몇 피라졸 유도체, 뿐만 아니라 그들을 포함하는 약학 조성물에 관한 것이다.
통증 조건들의 치료는 의약에서 매우 중요하다. 현재 세계적으로 추가적인 통증 치료의 요청이 있다. 각 통증 조건의 특이적 치료의 긴급한 요구는 응용된 진통제 분야에서 최근에 나타난 많은 과학적 작업들에 기록되어 있다. 통증은 통증 연구 국제 연합(IASP)에 의해 "실제의 또는 잠재의 조직 손상과 연관된 불편한 감각적 및 정신적 경험 또는 그러한 손상의 면에서 설명됨" (IASP, 만성 통증의 분류, 2nd Edition, IASP Press (2002), 210)로 정의되었다. 그것이 생리학적 및 정신적 인자들 모두에 의해 영향을 받는 복잡한 과정이고 주관적이라 하더라도, 그 원인 또는 증상은 분류될 수 있다. 통증은 일시적, 병인학적, 또는 생리학적 경계에 근거하여 분류될 수 있다. 통증이 시간에 의해 분류되는 때, 급성 또는 만성일 수 있다. 통증의 병인학적 분류는 악성 또는 비악성이다. 세번째 분류는 생리학적이며, 이는 아픈 자극에 반응하는 통증 (Α-델타 및 C-섬유에 부착된 조직에서 특수화된 형질도입제(transducer)에 의한 검출에서 기인함)을 포함하며, 이는 육체의 및 내장의 유형의 및 신경병성 통증으로(신경계에의 자극 또는 손상에서 기인함) 나눌 수 있고, 이는 말초 및 중추 신경병증 통증으로 나누어질 수 있다.
통증은 개인에게 실질적 또는 잠재적 조직 손상을 경계하는 유해한 자극에 대한 감각신경의 정상적인 생리학적 반응이다.
이는 우리에게 부상 또는 질환을 알려주는 보호 기능을 제공하고, 일반적으로 치유가 완전하거나, 질환이 치료된 경우 일반적으로 늦춰진다. 그러나, 통증은 하기 중 하나 이상에 의하여 특징된 병적인 상태에 기인할 수 있다: 통증 유해한 자극의 부재 (자발적 통증), 짧은 자극에 대한 반응의 증가된 기간(진행 통증 또는 과통증), 감소된 통증 최저한계 (이질통), 최저한계보다 높은(suprathreshold) 자극에 대해 증가된 반응성(통각과민), 비손상된 조직으로의 통증 및 통각과민의 확산(연관통 및 2차적 통각과민), 및 비정상적 감각 (예를 들어, 불유쾌한 이상감각(dysesthesia), 이상감각(paresthesia)).
방광염 또는 방광의 염증은 방광 기능에 직접적인 효과를 가진다. 이는 전염성의 (그램-음성 미생물들, 그램-양성 미생물들 또는 그룹 B 연쇄상구균과 같은) 뿐만 아니라 비-전염성의 (약, 방사선, 화학약품 등) 병인들 모두로 인해 발생한다. 이는 간질성 방광염(IC)과 같이 자연적에서 특발성(idiopathic)일 수 있고 또는 다른 질환들에 관련하여 발생할 수 있다. 원인과 상관없이, 방광염은 모욕 동안에 따라서 또는 만성일 수 있다.
어떠한 유해한 자극 또는 상처에 대한 최초의 및 초기 반응은 중재자들(사이토카인, 히스타민, 키닌들 등과 같은)의 방출을 야기하는 감염의 형태로 발생한다. 급성 방광염의 경우 이들 중재자들은 홍반성 종창(erythematous swelling) 및 방광점막의 궤양(ulceration of the bladder mucosa)을 야기하고, 이는 쉽게 피가난다. 일반적으로, 이들 중재자들은 짧은 반감기를 가지고 빨리 분해되며, 따라서상기 유해 자극이 제거되자마자 염증의 급속한 해소를 가능하게 한다. 그러나, 만일 상기 자극이 제거되지 않는다면, IC 에서 보여진 바와 같이 만성 염증이 뒤따른다.
이는, 다른 것들 가운데서, 만성적으로 증가하고 감소하는(waxing and waning) 통증의 증상들에 원인이 있는 통각과민 및 낮은 요로 감염 증상들로 특징된다. 간질성 방광염 (IC)은 6개월 이상의 지속기간의 방광 통증 및 자극성의 증상들로 특징되는 증후군이다. IC 증후군의 일단(constellation)은 다른 이름들이 주어졌다. The International Continence Society named the disease 간질성 ㅂ바방rs광titial cystitis/painful bladder syndrome (IC/PBS) in 2002 (Abrahams et al.; Neurol . Urodyn .; 2002; 21; 167-178), 국제 요실금 학회는 2002년에 상기 질병들을 간질성 방광염/방광통증 증후군(IC/PBS)이라 명명하였고(Abrahams et al.; Neurol. Urodyn .; 2002; 21; 167-178), 반면 다국적 요실금 연합은 이를 방광통증 증후군/간질성 방광염(PBS/IC)으로 표시하였다.(Hanno et al.; Int . Urogynecol . J. Pelvic Floor Dysfunct.; 2005; 16 (suppl. 1); S2-S34). 간질성 방광염 연구를 위한 유럽 학회(ESSIC)는 방광에 관련되어 자각된 만성 골반경사 통증, 압력 또는 불편감과 비도록 지속적인 재촉 또는 빈뇨와 같은 적어도 하나의 다른 배뇨 증상을 수반하는 것으로 IC 를 정의하면서 이름 "방광 통증 증후군 신트롬(BPS)"을 제안하였다.(van de Merwe et al.; Eur. Urol.; 2005; 53; 60-67).
IC 이면의 발병을 예시하기 위해 많은 이론들이 제시되었다. 그러나 염증의 중심 역할은 전자 현미경 및 면역 조직화학적 착색 기법들을 사용하여 인간 및 동물 연구 모두에서 확정되었다. 병인학과 상관없이, 만일 유해 자극들이 더 긴 기간 지속시간을 계속된다면, 이는 만성 염증을 이끈다. 결과로서, 서로 밀접한 연관을 가지는 캐스캐이드 사건들이 개시되고, 방광 상피에 지속적 염증의 사납고, 자기 강화 사이클 및 재발되는 부상을 초래한다(Sant, G.R. et al.; Urology; 2007; 69 (4 suppl.); 34-40). 부가적으로, 연구들은 요로상피는 이 경로 동안 구심성 신경들 및 비만세포를 활성화시키는 많은 물질들을 방출하고 IC 를 가진 환자에게서 통각과민을 초래한다는 것을 제안하고 있다.(Theoharides, T.C. et al.; Urology; 2001; 57(6 Suppl.); 47-55).
IC 는 또한 골반, 척수 및 뇌에서 신경들의 상향 조정에 의해 매개된 신경병증성 통증 증후군을 나타낸다고 믿어져 왔다. 방광 감각성 구심성(bladder sensory afferents)의 증가된 민감도는 따라서 또한 증가된 통증 감각 또는 통각과민의 원인이 된다.(Dmitrieva,N. et al.; Neuroscience; 1997; 78; 449-459).
현재 IC 의 진단은 골반통, 요로 감염(UTI), 이스트 감염, 자궁내막증, 골반장기탈출증, 부인과적 또는 비뇨기암, 과민성 방광 및 만성 전립선염과 같은 증상들과 같은 유사하지만 다른 질환들을 배제하면서 증상등에 기초하여야 하는 것으로 널리 받아들여지고 있다.
IC/BPS 관련된 통증 치료를 위한 현재의 접근방법 중 하나는 (Sonal, G. et al.; Ther . Adv . Urol.; 2011; 3(1); 19-33) 하기와 함께 다양한 치료 요법을 주장한다.
- 방광 점막의 보호제(펜토산 폴리설페이트(Elmiron));항히스타민제와 같은 항-알레르기 제제(H1 차단제들 (염산 히드록시진) 뿐만 아니라 H2 차단제들(시메티딘));류코트리엔(ukotriene)-D4 리셉터 안타고니스트 몬테루카스트; 트리시클릭 항우울제 (아미트립틸린) 또는 항경련제 (가바펜틴)로서의 통증 조절제 ; 호르몬 조절제(류프롤리드 아세테이트); 항-TNF 로서 항염증제; 마취제; 통증 경감제(오피오이드, 몰핀, 트라마돌); 면역억제제(프레드니손, 트리암시놀론); L-아르기닌; 옥시부티닌; 또는 톨테로딘;과 같은 경구 약물
- 통증 조절제(디메틸설폭시드 또는 바실러스 칼메트-게랭(BCG)), 방광 점막의 보호제(히알루론산), 또는 황산 콘드로이틴과 같은 방광내 치료들;및
- 수술 치료; 또는
- 항염증, 신경의, 마취의 및 행동 물질들(agents)을 이용하는 상보적 치료들
요약하면, IC/BPS 와 관련된 통증은 또한 다른 것들 중에서 통각과민에 의해 특징될 수 있는 내장의 신경병적 통증 증후군을 나타내며 표준 치료는 알려지지 않았고, IC/BPS 관련된 통증 특히 IC/BPS 이후의 및/또는 동안 발달된 특히 신경병성 통증, 이질통, 통각과민 및 말초신경병증에 대한 새로운 형태의 치료를 제공할 필요가 있다.
본 발명의 발명자들은 시그마 리간드들이 간질성 방광염/방광통증 증후군(IC/BPS) 관련된 통증의 치료에 유용할 수 있다는 것을 발견하고 증명하였다.
따라서, 본 발명의 한 측면은 IC/BPS 와 관련된 통증의 치료 및/또는 예방에서의 이용을 위한 시그마 리셉터 리간드에 관한 것이다.
이러한 본 발명의 장점은 시그마 리간드가 특별히 시그마-1 리셉터 안타고니스트(antagonist)인때, 바람직하게는 중립의 안타고니스트, 역작용제(inverse agonist) 또는 부분 안타고니스트(partial antagonist) 형태로인 경우 더욱 명백하다.
바람직한 실시예에서, 상기 시그마 리간드는 일반 화학식 (I) 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물을 가진다:
식중
R 1 은 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 선택되고;
R 2 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 선택되고;
R 3 및 R 4 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 독립적으로 선택되거나; 또는 페닐과 함께 임의로 치환된 축합 고리 시스템을 형성하며;
R 5 및 R 6 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 독립적으로 선택되거나; 또는 그들이 접착하는 질소 원자와 함께 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴 기를 형성하며;
n 은 1, 2, 3, 4, 5, 6, 7 및 8 로부터 선택되며;
t 는 0, 1 또는 2 이며;
R 8 및 R 9 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 알콕시, 치환된 또는 비치환된 아릴옥시, 및 할로겐으로 구성되는 군으로부터 각각 독립적으로 선택된다.
본 발명의 또 다른 측면은 시그마 리셉터 리간드, 바람직하게는 일반 화학식 (I)의 시그마 리간드, 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물의 IC/BPS 관련된 통증의 치료 및/또는 예방을 위한 의약의 제조에 있어서의 용도에 관한 것이다.
본 발명의 또다른 측면은 IC/BPS 와 관련된 통증을 겪고 있거나 겪을 가능성이 있는 환자의 치료방법이며, 이는 그러한 치료 또는 예방이 필요한 환자에게 치료적으로 유효량의 시그마 리셉터 리간드, 바람직하게는 일반 화학식 (I)의 시그마 리간드, 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물을 투여하는 것을 포함한다.
본 발명의 또다른 측면은 IC/BPS 관련된 통증의 치료 및/또는 예방용 의약 또는 적어도 하나의 시그마 리셉터 리간드 및 적어도 하나의 약학적으로 허용가능한 부형제를 포함하는 약학 조성물에 관한 것이다.
본 발명의 또다른 측면은 IC/BPS 관련된 통증의 치료 및/또는 예방에 이용을 위한 적어도 하나의 시그마 리셉터 리간드 및 적어도 하나의 추가의 활성 물질의 조합에 관한 것이다.
이러한 측면들 및 그의 바람직한 실시예들이 발명의 상세한 설명 뿐 아니라 청구항에서 또한 추가적으로 정의된다.
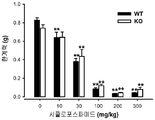
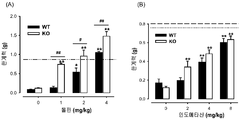
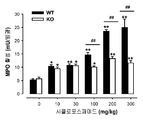
도 1: 야생형 (WT) 및 σ1 리셉터 넉아웃 (KO) 생쥐들에서의, 다른 복용량의 시클로포스파미드(10-300 mg/kg) 또는 그의 용매(0)의 i.p. 투여에 의해 유도된 통증 관련된 행동들. 통증 행동 반응들은 시클로포스파미드 또는 그의 용매 주사 후 4시간 관찰 주기에 걸쳐 30분 간격으로 기록되었다. 각 막대기 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 시클로포스파미드- 및 용매-처리된 동물들에서 얻은 값들의 통계적으로 중요한 차이점들 : * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이: ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
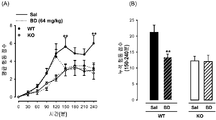
도 2: 야생형 (WT) 및 σ1 리셉터 넉아웃 (KO) 생쥐들에서 시클로포스파미드 (CP 300 mg/kg) 또는 그의 용매의 i.p. 투여에 의해 유도된 통증 관련된 행동들. (A) 시클로포스파미드 주사 후 4시간 관찰 주기에 걸쳐 30분 간격으로 통증 행동의 시간-경과 기록 (B) 완전한 관찰 주기(0-240 분)에 걸쳐 30분 간격으로 통증 행동 반응들을 나타내는 전체 행동 점수. 각 점 또는 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 시클로포스파미드- 및 용매-처리된 동물들에서 얻은 값들 사이의 통계적으로 중요한 차이점들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이: (A) ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA). (B) ## p < 0.01 (학생 t 테스트).
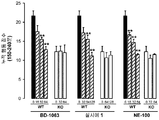
도 3: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 BD-1063 (BD; 64 mg/kg) 또는 식염수(Sal)의 s.c. 투여의 효과. (A) 240분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응의 시간-경과 기록 (B) 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들을 나타내는 누계의 행동 점수. BD-1063 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 후 120분에 주사되었다. 각 점 또는 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. BD-1063- 및 식염수 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: (A) ** p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA); (B) ** p < 0.01 (학생 t 테스트).
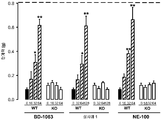
도 4: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 BD-1063 (16-64 mg/kg), 실시예 1 (화합물 63·HCl (32-128 mg/kg), NE-100 (16-64 mg/kg), 또는 식염수 (0)의 s.c. 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 시클로포스파미드 주사 후 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들이 기록되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 약물- 및 식염수- 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들 :** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 5: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 몰핀(1-8 mg/kg) 또는 인도메타신(2-8 mg/kg) 의 s.c. 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 시클로포스파미드 주사 후 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들이 기록되었다. 각 점 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 약물- 및 비히클-주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: ** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 6: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 다른 복용량의 시클로포스파미드(10-300 mg/kg) 또는 그의 용매(0)의 i.p. 투여에 의해 유도된 관련된 기계적 통각과민. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 시클로포스파미드- 및 용매-주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: ** p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 7: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(100 mg/kg) 의 i.p. 투여에 의해 유도된 관련된 기계적 통각과민에 있어서의 BD-1063 (16-64 mg/kg), 실시예 1 (32-128 mg/kg), NE-100 (16-64 mg/kg), 또는 식염수 (0)의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 120분 후에 주사되었다. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선 및 점선들은 시클로포스파미드 용매-처리된 WT 및 KO 생쥐들 각각에서 50% 한계의 힘을 나타낸다. 약물- 및 식염수- 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들 :* p < 0.05; ** p < 0.01(본페로니 시험에 잇따른 일원 ANOVA).
도 8: 야생형 (WT) 및 σ1 리셉터 넉아웃 (KO) 생쥐들에서 시클로포스파미드(100 mg/kg) 의 i.p. 투여에 의해 유발된 관련된 기계적 통각과민에서의 몰핀 (1-4 mg/kg) (A) 및 인도메타신 (2-8 mg/kg) (B) 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 후 120분에 주사되었다. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선 및 점선들은 시클로포스파미드 용매-처리된 WT 및 KO 생쥐들 각각에서 50% 한계의 힘을 나타낸다. 고용량의 몰핀은 기계적 한계점을 대조군 값 이상으로 증가시키는 것을 주목하여야 한다.(즉, 진통 효과를 가함)약물- 및 비히클 - 주사된 생쥐들에서 얻은 값들 사이의 통계적으로 중요한 차이점들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이의 통계적으로 중요한 차이점들: # p < 0.05; ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 9: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들의 방광에서 다른 복용량의 시클로포스파미드(10-300 mg/kg) 또는 그의 용매(0)의 i.p. 투여에 의해 유도된 미엘로퍼옥시다아제 활성(MPO)의 변화들. 방광조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 시클로포스파미드- 및 용매-처리된 동물들에서 얻은 값들 사이의 통계학적으로 중요한 차이들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이의 통계학적으로 중요한 차이들: ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 10: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들에서 BD-1063 (64 mg/kg), 실시예 1 (화합물 63·HCl, 128 mg/kg), NE-100 (64 mg/kg), 또는 식염수 (0)의 s.c. 투여의 미엘로퍼옥시다아제 활성(MPO)에 있어서의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 방광 조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 어떠한 주사도 없는 순수한 돌물들에서의 MPO 활성을 나타낸다. 약물- 및 식염수- 주사된 생쥐들에서 얻은 값들의 통계적으로 중용한 차이들: * p < 0.05(t-학생 테스트)
도 11: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들에서 시클로포스파미드 (300 mg/kg)의 i.p. 투여에 의해 유도된 미엘로퍼옥시다아제 활성 (MPO)에 대한 몰핀 (1-4 mg/kg) 및 인도메타신 (2-8 mg/kg) 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 120분 후에 주사되었다. 방광 조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 어떠한 주사도 없는 순수한 돌물들에서의 MPO 활성을 나타낸다. 한 그룹의 생쥐들(8+8)이 8 mg/kg 의 인도메타신으로 두번(시클로포스파미드의 투여 30분 전 및 120분 후) 처리되었다는 것을 주목하여야 한다. 약물- 및 비히클- 주사된 생쥐들에서 얻은 값들 사이의 통계적으로 중요한 차이점들 : * p < 0.05; ** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 12: 야생형 생뒤들에서 시클로포스파미드(100 mg/kg)의 i.p. 투여에 의해 유발된 관련된 기계적 통각과민에 있어서의 실시예 1 (화합물 63·HCl. 32 mg/kg) 및 몰핀 (1 mg/kg) 및 그의 PRE-084 (32 mg/kg)와의 연계의 s.c. 투여의 효과들. 약물 또는 홀로 투여된 식염수는 시클로포스파미드 및 그의 용매의 투여 120분 후에 주사되었다. 연관 실험들에서, 실시예 1 또는 식염수는 몰핀 또는 식염수 전 5분에 그리고 PRE-084 또는 식염수의 5분 후에 투여되었다. 관련된 기계적 통각과민 (폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 8-10 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 시클로포스파미드 용매-처리된 생쥐들에서 50% 한계의 힘을 나타낸다. 실시예 1 + 몰핀-주사된 생쥐들 및 상기 그룹들의 나머지들에서 얻은 값들 사이의 통계적으로 중요한 차이들 : **p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 2: 야생형 (WT) 및 σ1 리셉터 넉아웃 (KO) 생쥐들에서 시클로포스파미드 (CP 300 mg/kg) 또는 그의 용매의 i.p. 투여에 의해 유도된 통증 관련된 행동들. (A) 시클로포스파미드 주사 후 4시간 관찰 주기에 걸쳐 30분 간격으로 통증 행동의 시간-경과 기록 (B) 완전한 관찰 주기(0-240 분)에 걸쳐 30분 간격으로 통증 행동 반응들을 나타내는 전체 행동 점수. 각 점 또는 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 시클로포스파미드- 및 용매-처리된 동물들에서 얻은 값들 사이의 통계적으로 중요한 차이점들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이: (A) ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA). (B) ## p < 0.01 (학생 t 테스트).
도 3: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 BD-1063 (BD; 64 mg/kg) 또는 식염수(Sal)의 s.c. 투여의 효과. (A) 240분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응의 시간-경과 기록 (B) 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들을 나타내는 누계의 행동 점수. BD-1063 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 후 120분에 주사되었다. 각 점 또는 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. BD-1063- 및 식염수 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: (A) ** p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA); (B) ** p < 0.01 (학생 t 테스트).
도 4: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 BD-1063 (16-64 mg/kg), 실시예 1 (화합물 63·HCl (32-128 mg/kg), NE-100 (16-64 mg/kg), 또는 식염수 (0)의 s.c. 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 시클로포스파미드 주사 후 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들이 기록되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 약물- 및 식염수- 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들 :** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 5: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(CP; 300 mg/kg)의 i.p. 투여에 의해 유발된 통증-관련된 행동들에 있어서 몰핀(1-8 mg/kg) 또는 인도메타신(2-8 mg/kg) 의 s.c. 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 시클로포스파미드 주사 후 150-240 분 관찰 주기에 걸쳐 30분 간격으로 통증 행동 반응들이 기록되었다. 각 점 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 약물- 및 비히클-주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: ** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 6: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 다른 복용량의 시클로포스파미드(10-300 mg/kg) 또는 그의 용매(0)의 i.p. 투여에 의해 유도된 관련된 기계적 통각과민. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ± SEM을 나타낸다. 시클로포스파미드- 및 용매-주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들: ** p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 7: 야생형 (WT;) 및 σ1 리셉터 넉아웃 (KO;) 생쥐에서 시클로포스파미드(100 mg/kg) 의 i.p. 투여에 의해 유도된 관련된 기계적 통각과민에 있어서의 BD-1063 (16-64 mg/kg), 실시예 1 (32-128 mg/kg), NE-100 (16-64 mg/kg), 또는 식염수 (0)의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 120분 후에 주사되었다. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선 및 점선들은 시클로포스파미드 용매-처리된 WT 및 KO 생쥐들 각각에서 50% 한계의 힘을 나타낸다. 약물- 및 식염수- 주사된 생쥐에서 얻은 값들 사이의 통계적으로 중요한 차이점들 :* p < 0.05; ** p < 0.01(본페로니 시험에 잇따른 일원 ANOVA).
도 8: 야생형 (WT) 및 σ1 리셉터 넉아웃 (KO) 생쥐들에서 시클로포스파미드(100 mg/kg) 의 i.p. 투여에 의해 유발된 관련된 기계적 통각과민에서의 몰핀 (1-4 mg/kg) (A) 및 인도메타신 (2-8 mg/kg) (B) 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 후 120분에 주사되었다. 관련된 기계적 통각과민(폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 10-12 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선 및 점선들은 시클로포스파미드 용매-처리된 WT 및 KO 생쥐들 각각에서 50% 한계의 힘을 나타낸다. 고용량의 몰핀은 기계적 한계점을 대조군 값 이상으로 증가시키는 것을 주목하여야 한다.(즉, 진통 효과를 가함)약물- 및 비히클 - 주사된 생쥐들에서 얻은 값들 사이의 통계적으로 중요한 차이점들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이의 통계적으로 중요한 차이점들: # p < 0.05; ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 9: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들의 방광에서 다른 복용량의 시클로포스파미드(10-300 mg/kg) 또는 그의 용매(0)의 i.p. 투여에 의해 유도된 미엘로퍼옥시다아제 활성(MPO)의 변화들. 방광조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 시클로포스파미드- 및 용매-처리된 동물들에서 얻은 값들 사이의 통계학적으로 중요한 차이들: * p < 0.05; ** p < 0.01; 및 동일한 복용량의 시클로포스파미드에서 야생형 (WT) 및 σ1 리셉터 넉아웃 동물들에서 얻어진 값들 사이의 통계학적으로 중요한 차이들: ## p < 0.01 (본페로니 시험에 잇따른 이원 ANOVA).
도 10: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들에서 BD-1063 (64 mg/kg), 실시예 1 (화합물 63·HCl, 128 mg/kg), NE-100 (64 mg/kg), 또는 식염수 (0)의 s.c. 투여의 미엘로퍼옥시다아제 활성(MPO)에 있어서의 효과들. 약물 또는 식염수는 시클로포스파미드 투여 120분 후에 주사되었다. 방광 조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 어떠한 주사도 없는 순수한 돌물들에서의 MPO 활성을 나타낸다. 약물- 및 식염수- 주사된 생쥐들에서 얻은 값들의 통계적으로 중용한 차이들: * p < 0.05(t-학생 테스트)
도 11: 야생형 (WT) 및 σ1 리셉터 넉아웃 생쥐들에서 시클로포스파미드 (300 mg/kg)의 i.p. 투여에 의해 유도된 미엘로퍼옥시다아제 활성 (MPO)에 대한 몰핀 (1-4 mg/kg) 및 인도메타신 (2-8 mg/kg) 투여의 효과들. 약물 또는 식염수는 시클로포스파미드 또는 그의 용매의 투여 120분 후에 주사되었다. 방광 조직들은 시클로포스파미드 주사 후 5시간에 제거되었다. 각 막대기 및 수직선은 5-7 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 어떠한 주사도 없는 순수한 돌물들에서의 MPO 활성을 나타낸다. 한 그룹의 생쥐들(8+8)이 8 mg/kg 의 인도메타신으로 두번(시클로포스파미드의 투여 30분 전 및 120분 후) 처리되었다는 것을 주목하여야 한다. 약물- 및 비히클- 주사된 생쥐들에서 얻은 값들 사이의 통계적으로 중요한 차이점들 : * p < 0.05; ** p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
도 12: 야생형 생뒤들에서 시클로포스파미드(100 mg/kg)의 i.p. 투여에 의해 유발된 관련된 기계적 통각과민에 있어서의 실시예 1 (화합물 63·HCl. 32 mg/kg) 및 몰핀 (1 mg/kg) 및 그의 PRE-084 (32 mg/kg)와의 연계의 s.c. 투여의 효과들. 약물 또는 홀로 투여된 식염수는 시클로포스파미드 및 그의 용매의 투여 120분 후에 주사되었다. 연관 실험들에서, 실시예 1 또는 식염수는 몰핀 또는 식염수 전 5분에 그리고 PRE-084 또는 식염수의 5분 후에 투여되었다. 관련된 기계적 통각과민 (폰 프뢰이 필라멘트로 복부의 자극에 의해 평가되었다)은 시클로포스파미드 주사 후 240분에서 측정되었다. 각 막대 및 수직선은 8-10 동물들에서 얻은 값들의 평균 ±SEM을 나타낸다. 파선은 시클로포스파미드 용매-처리된 생쥐들에서 50% 한계의 힘을 나타낸다. 실시예 1 + 몰핀-주사된 생쥐들 및 상기 그룹들의 나머지들에서 얻은 값들 사이의 통계적으로 중요한 차이들 : **p < 0.01 (본페로니 시험에 잇따른 일원 ANOVA).
본 발명의 내용에서, 다음의 용어들은 하기의 자세한 의미를 가진다.
"알킬" 은 직쇄형 또는 가지형 탄화수소 사슬 라디칼 불포화를 포함하지 않고, 단일 결합에 의해 나머지 분자에 부착된 직쇄형 또는 가지형 탄화수소 사슬 라디칼을 의미한다. 대표적인 알킬기들은 1 내지 약 12, 1 내지 약 8, 또는 1 내지 약 6개의 탄소 원자들을 가지며, 예로서, 메틸, 에틸, n-프로필, i-프로필, n-부틸, t-부틸, n-펜틸, 등. 만일 시클로알킬에 의해 치환된다면, 시클로프로필 메틸과 같은 "시클로알킬알킬" 라디칼에 해당한다. 아릴에 의해 치환된다면, 벤질, 벤즈히드릴 또는 페네틸과 같은 "아릴알킬" 라디칼에 해당한다. 헤테로시클릴에 의해 치환된다면, "헤테로시클릴알킬" 라디칼에 해당한다.
"알케닐"은 적어도 두개의 탄소 원자들 및 적어도 하나의 불포화를 포함하는 직쇄형 또는 가지형 탄화수소 사슬 라디칼을 나타내며, 단일 결합에 의해 나머지 분자에 부착된다. 일반적인 알케닐 라디칼들은 2 내지 약 12, 2 내지 약 8, 또는 2 내지 약 6 개의 탄소 원자들을 가진다. 특별한 실시형태에서, 상기 알케닐 기는 비닐, 1-메틸-에테닐, 1-프로페닐, 2-프로페닐, 또는 부테닐이다.
"알키닐"은 적어도 2개의 탄소 원자들 및 적어도 하나의 탄소-탄소삼중 결합을 포함하는 직쇄형 또는 가지형 탄화수소 사슬 라디칼을 나타내며, 그리고 이는 단일 결합에 의해 나머지 분자들에 부착된다. 일반적 알키닐 라디칼들은 2 내지 약 12, 2 내지 약 8 또는 2 내지 약 6 개의 탄소 원자들을 가진다. 특별한 실시예에서, 상기 알키닐 기는 에티닐, 프로피닐 (예를들면. 1-프로피닐, 2-프로피닐), 또는 부티닐 (예를들면. 1-부티닐, 2- 부티닐, 3- 부티닐) 이다.
"시클로알킬"은 알리시클릭 탄화수소를 나타낸다. 일반적 시클로알킬 라디칼들은 1 내지 4개의 분리된 및/또는 융합된 고리들 및 3 내지 약 18 개의 탄소 원자들, 바람직하게는 시클로프로필, 시클로헥실 또는 아다만틸과 같은 3 내지 10 탄소 원자들을 포함한다. 특별한 실시형태에서, 상기 시클로알킬 라디칼은 3 내지 약 6 개의 탄소 원자들을 포함한다.
"아릴"은 분리된 및/또는 융합된 아릴기들을 포함하는 복수의 라디칼들을 포함하는 단일의 및 복수의 고리 라디칼들을 나타낸다. 일반적 아릴기들은 1 내지 3의 분리된 및/또는 융합된 고리들 및 6 내지 약 18의 탄소 고리 원자들, 바람직하게는 페닐, 나프틸, 비페닐, 인데닐, 페난트릴 또는 안트라실 라디칼과 같은 6 내지 약 14 개의 탄소 고리 원자들을 포함한다.
"헤테로시클릴"은 탄소 원자 및 질소, 산소 및 황을 포함하는 군으로부터 선택된 1에서 5개의 헤테로원자를 포함하는 안정된 3에서 10개 부분으로 이루어진 고리 라디칼, 바람직하게는 하나 또는 그 이상의 헤테로원자로 구성된 4에서 8개 부분으로 이루어진 고리, 더욱 바람직하게는 하나 또는 그 이상의 헤테로원자로 구성된 5 또는 6개 부분으로 이루어진 고리를 나타낸다. 이것은 방향성일 수 있으며 또는 방향성이 아닐 수도 있다. 본 발명의 목적을 위해, 헤테로사이클은 한고리, 융합된 고리시스템이 포함될 수 있는 두고리 또는 세고리 시스템일 수 있다; 그리고 헤테로시클릴 라디칼 내의 질소, 탄소 또는 황 원자들은 선택적으로 산화될 수 있다; 질소원자는 선택적으로 4기화(quaternize)될 수 있다; 그리고 헤테로시클릴 라디칼은 부분적으로 또는 완전히 포화되거나 또는 방향성일 수 있다. 각각의 헤테로사이클의 예들을 포함하지만 아제핀, 벤지미다졸, 벤조티아졸, 푸란, 이소티아졸, 이미다졸, 인돌, 피페리딘, 피페라진, 푸린, 퀴놀린, 티아디아졸, 테트라히드로푸란, 쿠마린, 모르폴린,; 피롤, 피라졸, 옥사졸, 이속사졸, 트리아졸, 이미다졸 등에 제한되지는 않는다.
"알콕시"는, 하나 이상 (예로서, 1, 2, 3 또는 4)의 산소 연결 및 전형적으로 1 내지 약 12, 1 내지 약 8 또는 1 내지 약 6 개의 탄소 원자, 예로서 메톡시, 에톡시, 프로폭시 등을 갖는 화학식 -ORa [식 중, Ra는 상기 정의된 바와 같은 알킬 라디칼]의 라디칼을 지칭한다.
"아릴옥시"는 화학식 -O-아릴의 라디칼을 지칭하며, 여기에서 아릴은 앞서 정의된 바와 같다. 아릴옥시 화합물의 일부 예로는 -O-페닐, -O-p-톨릴, -O-m-톨릴, -O-o-톨릴 또는 -O-나프틸이 있다.
"아미노"는 임의로 4차화된, 화학식 -NH2, -NHRa 또는 -NRaRb의 라디칼을 지칭한다. 본 발명의 실시형태에서, 각 Ra 및 Rb는 수소 및 상기 정의된 것과 같은 알킬 라디칼로부터 독립적으로 선택되며, 예로서 메틸아미노, 에틸아미노, 다이메틸아미노, 다이에틸아미노, 프로필아미노, 등이 있다.
"할로겐", "할로" 또는 "할(hal)"은 브로모, 클로로, 요오도 또는 플루오로를 지칭한다.
"축합 고리계"는 축합 고리를 함유하는 폴리시클릭 고리 시스템을 지칭한다. 전형적으로, 축합 고리 시스템은 2 또는 3 개의 고리 및/또는 18 개 이하의 고리 원자를 함유한다. 상기 정의된 바와 같이, 시클로알킬 라디칼, 아릴 라디칼 및 헤테로시클릴 라디칼은 축합 고리계를 형성할 수 있다. 따라서, 축합 고리 시스템은 방향족, 부분적으로 방향족 또는 방향족이 아닐 수 있고, 헤테로원자를 함유할 수 있다. 스피로(spiro) 고리계는 이 정의에 의한 축합-폴리시클릭은 아니지만, 본 발명의 축합된 폴리시클릭 고리 시스템 자체는 시스템의 단일 고리 원자를 통하여 그에 부착된 스피로 고리를 가질 수 있다. 축합 고리 시스템의 예로는, 이에 제한되지 않지만, 아다만틸, 나프틸 (예로서, 2-나프틸), 인데닐, 페난트릴, 안트라실, 파이레닐, 벤지미다졸, 벤조티아졸 등이 있다.
본 명세서에서 특정적으로 달리 언급되지 않는 한, 적용가능한 경우, 모든 기는 임의 치환될 수 있다. 본 발명의 화합물 중 치환된 기에 대한 본 명세서에서의 참조는 하나 이상 (예로서, 1, 2, 3 또는 4)의 가능한 위치에 다음의 하나 이상의 적합한 기에 의해 치환될 수 있는 특정 부분(moiety)이다: 예로서 플루오로, 클로로, 브로모 및 요오도와 같은 할로겐; 시아노; 하이드록실; 니트로; 아지도; 알카노일 예로서 C1-6 알카노일 기 등과 같은 아실; 카르복스아미도; 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자 및 바람직하게는 1 내지 3 개의 탄소 원자를 갖는 기들을 포함하는 알킬 기; 하나 이상의 (예로서, 1, 2, 3, 또는 4) 불포화된 결합 및 2 내지 약 12 개의 탄소 또는 2 내지 약 6개의 탄소 원자를 갖는 기를 포함하는 알케닐 및 알키닐 기; 하나 이상 (예로서, 1, 2, 3 또는 4)의 산소 연결 및 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자를 갖는 알콕시 기; 페녹시와 같은 아릴옥시; 하나 이상 (예로서, 1, 2, 3 또는 4)의 티오에테르 연결 및 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자를 갖는 부분들을 포함하는 알킬티오 기; 하나 이상 (예로서, 1, 2, 3 또는 4)의 술피닐 연결 및 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자를 갖는 부분들을 포함하는 알킬술피닐 기; 하나 이상 (예로서, 1, 2, 3 또는 4)의 술포닐 연결 및 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자를 갖는 부분들을 포함하는 알킬술포닐 기; 하나 이상 (예로서, 1, 2, 3 또는 4)의 N 원자 및 1 내지 약 12 개의 탄소 원자 또는 1 내지 약 6 개의 탄소 원자를 갖는 기와 같은 아미노알킬 기; 6 개 이상의 탄소를 갖는 카보시클릭 아릴, 구체적으로 페닐 또는 나프틸 및 벤질과 같은 아르알킬. 달리 나타내지 않는 한, 임의 치환된 기는 기의 각 치환가능한 위치에서 치환체를 가질 수 있고, 각 치환은 다른 것에 대해 독립적이다.
용어 "염"은 본 발명에 따라서 사용된 화합물의 어떠한 형태로 이해되어야 하며, 상기 화합물은 이온 형태 내에 있거나 또는 대전되거나 반대이온(양이온 또는 음이온)과 결합되거나 또는 용액에 있다. 이 정의는 또한 제4(급) 암모늄 염들 및 분자의 다른 분자들 및 이온들과의 복합체들을 포함한다. 특별히, 복합체들은 이온 상호작용들을 통하여 형성되었다. 상기 정의는 특히 생리학적으로 하용가능한 염들을 포함하며; 이 용어는 "약물학적으로 허용가능한 염들" 또는 "약학적으로 허용가능한 염들"과 동등하게 이해되어야 한다.
본 발명의 내용에서 상기 용어 "약학적으로 허용가능한 염들"은 치료에 적합한 방식으로 사용된 때 특별히, 인간 및/또는 포유동물들에서 적용되거나 또는 사용된 때 생리학적으로 내성인 임의의 염을 의미한다(보통 의미로 특별히, 상대이온의 결과로서 유독성이지 않음을 의미함). 이러한 생리학적으로 허용가능한 염들은 양이온들 또는 염기들과 함께 형성될 수 있고, 본 발명의 맥락에서, 본 발명에 따라서 사용된 적어도 하나의 화합물에 의해 형성된 염-보통 (탈양자화된)산-인것으로 이해되며, 특히 인간들 및/또는 포유동물들에 사용된 경우, 음이온 및 적어도 하나의 생리학적으로 내성인 양이온으로 바람직하게는 무기물이다. 알칼리 및 알칼리 토금속과의 염들 및 특히 암모늄 양이온들(NH4 +)과 함께 형성된 것들이 특히 바람직하다. 바람직한 염들은 (모노) 또는 (디)나트륨, (모노) 또는 (디)칼륨, 마그네슘 또는 칼슘과 함께 형성된 것들이다. 이러한 생리학적으로 허용가능한 염들은 또한 음이온들 또는 산들과 함께 형성될 수 있고, 본 발명의 맥락에서, 본 발명에 따라 사용된 적어도 하나의 화합물에 의해 형성된 -예로서 질소내에서 보통 탈양성자화된- 염들로서 이해되며, 특히 인간들 및/또는 포유동물들에서 사용된 경우, 예컨대 양이온 및 적어도 하나의 생리학적으로 내성인 음이온이다. 이 정의는 특별히 본 발명의 내용에서 생리학적으로 용인된 산에 의해 형성된 염, 즉, 특히 인간들 및/또는 포유동물들에 사용된때 생리학적으로 용인된 유기 또는 무기산들과의 특정 활성의 화합물의 염을 포함한다. 이 형태의 염들의 예는 하기의 염산, 브롬화수소산, 황산, 메탄술폰산, 포름산, 아세트산, 옥살산, 숙신산, 말산, 타르타르산, 만델산, 푸마르산, 젖산 또는 시트르산과 함께 형성된 염들이다.
본 발명에 따른 용어 "용매 화합물"은 본 발명에 따른 화합물들의 어떠한 형태로서 이해되어야 할 것이며 여기서, 상기 화합물은 다른 분자(보통 극성 용매)와 비공유결합에 의해 결합되며, 특히 수화물들 및 예를들면 메탄올레이트(methanolate)같은 알코올레이트들을 포함한다. 바람직한 용매화합물은 수화물이다.
화학식 (I) 의 화합물의 전구약물인 어떠한 화합물 또한 본 발명의 범위내에 있다. 용어 "전구약물" 이 넓은 의미로서 사용되며 생체내에서 (in vivo) 본 발명의 화합물들로 전환되는 유도체들을 포함한다. 전구약물들의 예들은, 생가수분해가능한 아미드들, 생가수분해가능한 에스테르들, 생가수분해가능한 카바메이트들, 생가수분해가능한 카보네이트들, 생가수분해가능한 우레이드들, 및 생가수분해가능한 인산염 유사물질들과 같은 생가수분해가능한 일부분들(moieties)을 포함하는 화학식(I) 의 화합물들의 유도체들 및 대사산물들을 포함하나 이에 한정되지 않는다. 바람직하게는, 카복실 작용기들을 가지는 화합물들의 전구약물들은 카복실산의 저급 알킬 에스테르들이다. 카복실레이트 에스테르들은 분자에 존재하는 어떠한 카복실산 일부분들(moieties)를 에스테르화함으로써 편리하게 형성된다. 전구약물은 일반적으로 Burger "Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) 및 "Design and Applications of Prodrugs" (H. Bundgaard ed., 1985, Harwood Academic Publishers)에 의해 설명된 것과 같이 잘 알려진 방법들을 이용하여 제조될 수 있다.
여기서 언급된 화합물은 그러한 특정의 화합물 뿐만이 아니라 특정의 변형들 또는 형태들을 나타내기 위함이다. 특히, 여기서 언급된 화합물들은 비대칭의 중심들을 가질수 있으며 따라서 다른 거울상이성질체의 또는 부분입체이성질체의 형태들로서 존재한다. 따라서 여기서 언급된 어떤 화합물은 어떤 하나의 라세미화합물, 하나 이상의 거울상이성질체의 형태들, 하나 이상의 부분입체이성질체 형태, 및 그의 혼합물들을 나타내고자 한다. 또한, 이중 결합에 대한 입체 이성(stereoisomerism) 또는 기하 이성(geometric isomerism) 역시 가능하며, 따라서 일부 경우들에서 상기 분자는 E)-이성질체 또는 (Z)- 이성질체(트랜스 및 시스 이성질체들)로서 존재할 수 있다. 만일 상기 분자가 몇 개의 이중결합들을 포함한다면, 각 이중결합은 그 자신의 입체이성을 가질 것이며, 상기 분자의 다른 이중 결합들의 입체이성과 동일하거나 또는 다를 수 있다.
또한 여기서 언급된 화합물들은 아트로프 이성질체(atropisomers)로서 존재할 수 있다. 여기서 언급된 화합물들의 거울상이성질체, 부분입체이성질체, 기하 이성질체 및 아트로프 이성질체를 포함하는 모든 입체 이성질체 및 그의 혼합물들은 본 발명의 범위 내인 것으로 생각된다.
또한, 여기서 언급된 어떠한 화합물은 호변체(tautomers)로서 존재할 수 있다. 특별히, 상기 용어 호변체(tautomers)는 균형이 이뤄져 존재하는 화합물의 하나 또는 둘 또는 그 이상의 구조적 이성질체들을 나타내며, 하나의 이성질체 형태에서 다른 하나로 손쉽게 전환된다. 공통의 호변체 쌍들은 에나민-이민, 아미드-이미드산, 케토-에놀, 락탐-락팀, 등이다.
다른 명시가 없다면, 본 발명의 화합물들은 또한 동위원소-표지된 형태들 즉 오직 하나 이상의 동위원소-풍부한 원자들의 존재에 있어서 다른 화합물들을 포함하는 것을 의미한다. 예를 들면, 듀테륨 또는 트리튬에 의한 적어도 하나의 수소 원자의 대체 또는 13C- 또는 14C-풍부한 탄소에 의한 적어도 하나의 탄소의 대체 또는 15N-풍부한 질소에 의한 적어도 하나의 질소의 대체를 제외한 본 구조들을 갖는 화합물들은 본 발명의 범위내에 있다.
본 발명에서 사용된 화합물들 또는 그들의 염들 또는 용매화합물들은 바람직하게는 약학적으로 허용가능한 또는 실질적으로 순수한 형태이다. 약학적으로 허용가능한 형태에 의하여는 그 중에서도, 희석제 및 캐리어들과 같은 보통의 약학적 첨가물들을 제외한 약학적으로 혀용가능한 수준의 순도를 가지며, 보통의 투여량 수준에서 독성으로 생각되는 물질을 포함하지 않는 것을 의미한다. 약물 물질에 대한 순도 수준은 바람직하게는 50% 이상, 더욱 바람직하게는 70% 이상, 가장 바람직하게는 90% 이상이다. 바람직한 실시형태에서 화학식(I) 의 화합물, 또는 그의 염들, 용매 화합물들 또는 전구약물들의 95% 이상이다.
여기에 사용된 바와 같이, 용어들 "치료하다", "치료하는" 및 "치료" 는 질환 또는 질병의 시작 이후 IC/BPS와 관련된 통증의 박멸, 제거, 회귀, 경감, 변경, 또는 조절을 포함한다.
여기 사용된 바와 같이, 용어들 "예방(prevention)", "예방하는", "예방적인" "예방하다" 및 "예방(prophylaxis)" 은 질환 또는 질병의 시작 이전에 IC/BPS와 관련된 통증의 회피, 최소화 또는 시작 또는 성장이 어렵게 하는 치료적 능력을 나타낸다.
따라서, "치료하는" 또는 "치료" 및/또는 "예방하는" 또는 "예방" 에 의함은, 전체로서, 적어도 환자를 괴롭히는 질환과 관련된 증상들의 억제 또는 경감을 의미하며, 억제 및 경감은 넓은 의미로 적어도 파라미터의 규모, 예로서, 치료될 질환들과 관련된 증상, 즉 IC/BPS와 관련된 통증에 있어서의 감소로서 사용된다. 그로서, 본 발명의 방법은 또한 상 기 질환이 완전히 저해된, 예를들면, 발병으로부터 예방된, 또는 정지된, 예를 들면 종결된, 따라서 환자는 더 이상 질환을 경험하지 않는 상태들을 포함한다.
본 출원에서 사용된 "시그마 리셉터/들"은 잘 알려진 것이며 다음의 인용을 이용하여 정의된다: 이 결합 부위는 오피오이드, NMDA, 도파민작동성(dopaminergic), 및 다른 알려진 신경전달물질 또는 호르몬 리셉터 패밀리들과 상이한 대표적인 단백질을 나타낸다(G. Ronsisvalle et al. Pure Appl. Chem. 73, 1499-1509 (2001)). 리간드 결합 연구, 해부학상 분배 및 생화학적 특징들에 기초한 약리학적 데이터는 적어도 2가지 아형의 시그마(σ) 리셉터들로 구별한다 (R. Quiron et al., Trends Pharmacol. Sci. 13, 85-86 (1992); M.L.Leitner, Eur. J. Pharmacol. 259, 65-69 (1994); S.B. Hellewell and W.D. Bowen, Brain Res. 527, 244-253 (1990); G. Ronsisvalle et al. Pure Appl. Chem. 73, 1499-1509 (2001)).
시그마-1 리셉터 (σ1)의 단백질 서열은 종래기술에서 알려져 있다(e.g. Prasad, P.D. et al., J. Neurochem. 70 (2), 443-451 (1998)). 그들은 다양한 진통제들(예. 펜타조신)에 대하여 매우 높은 친화도를 보인다.
여기에서 사용된 바와 같이, 용어 "시그마 리간드" 또는 "시그마 리셉터 리간드"는 어떠한 "시그마 리셉터에 결합하는 화합물"을 의미한다. 시그마 리셉터에 결합하는 화합물들은 중래 기술에서 잘 알려져 있다. 본 출원에서 사용된 "시그마 리셉터에 결합하는 화합물/들" 또는 "시그마 리간드" 는 바람직하게는 시그마 리셉터 상에서 ≤ 5000 nM, 더욱 바람직하게는 ≤ 1000 nM, 더욱 바람직하게는 ≤ 500 nM 의 IC50 값을 가지는 화합물로서 정의된다. 더욱 바람직하게는, 상기 IC50 값은 ≤ 250 nM 이다. 더욱 바람직하게는, 상기 IC50 값은 ≤ 100 nM 이다. 가장 바람직하게는 상기 IC50 값은 ≤ 50 nM 이다. 반 최대한 저해 농도(IC50) 생물학적 또는 생화학적 작용을 저해하는데 있어서 화합물의 효과의 평가이다. 상기 IC50 는 방사성 리간드(radioligand)의 특정 결합의 50% 를 대체하는 경쟁 리간드의 농도이다.
또한, "시그마 리셉터에 결합하는 화합물/들"은 본 출원에서 사용된 바와 같이 시그마 리셉터 (예. 바람직하게는 [3H]-(+) 펜타조신) 에 대해 특이적인 10 nM 방사성 리간드를 사용하여 바람직하게는 적어도 >50% 대체를 가지는 것으로 정의되며 따라서 상기 시그마 리셉터는 어떠한 시그마 리셉터 아형일 수 있다. 바람직하게는 상기 화합물들은 상기 시그마-1 리셉터 아형에 결합한다.
나아가, 여기에서 정의된 시그마 리셉터에 결합하는 상기 화합물들은, (중립)안타고니스트, 역 안타고니스트, 작용물질, 부분적 안타고니스트 및/또는 부분적 작용물질들일 수 있다.
본 발명에 따른 상기 시그마 리간드는 바람직하게는 (중립)안타고니스트, 역 안타고니스트 또는 부분 안타고니스트의 형태의 시그마 리셉터 안타고니스트이다.
본 발명의 바람직한 실시예에서 상기 시그마 리셉터 리간드는 선택적 시그마-1 안타고니스트, 바람직하게는 (중립) 안타고니스트, 역 작용물질또는 부분 안타고니스트 형태의, 더욱 바람직하게는 선택적 시그마 -1 (중립) 안타고니스트이다.
"작용물질(agonist)"은 리셉터에 결합하고 본질적인 효과를 가지는 화합물로써 정의되며, 따라서 작용 물질이 리셉터에 접촉할 때 리셉터의 기초활성이 증가한다.
"안타고니스트(antagonist)"는 리셉터와 결합하는 동안 작용물질 또는 역 작용물질과 경쟁하는 화합물로써 정의되며, 그러므로 리셉터에서 작용물질 또는 역 작용물질의 활동을 저지한다. 그러나, 안타고니스트(또는 "중립" 안타고니스트로서 알려진)은 리셉터 활성 구성요소에 영향을 미치진 않는다. 안타고니스트는 활성 위치 또는 리셉터의 알로스테릭(allosteric)한 위치에 결합함으로써 그들의 효과를 조정하며, 또한 그들은 리셉터 활성의 생물학적 규제에 일반적으로 포함되지 않은 특별한 결합 위치에 상호작용할 수 있다. 안타고니스트 활성은 교대로 안타고니스트 리셉터 결합의 성격에 달려있는 안타고니스트-리셉터 복합체의 지속에 따라 가역 또는 비가역적이 될 수 있다.
"부분 안타고니스트"은 리셉터에 결합하고 안타고니스트 반응을 발생시키는 화합물로써 정의된다; 그러나, 부분 안타고니스트가 모든 안타고니스트 반응을 발생시키는 것은 아니다. 부분 안타고니스트는 안타고니스트를 약화시키므로 리셉터에서 작용물질 또는 역 작용물질의 부분적인 활동을 저지한다.
"역 작용물질(inverse agonist)"은 동일한 리셉터를 차지함으로써 작용물질에 대해 반대의 영향을 만드는 화합물로써 정의되며, 따라서 리셉터(즉, 리셉터에 의해 조절되는 신호)의 기초활성을 감소시킨다. 그러한 화합물은 또한 음의 작용물질로써 알려져 있다. 역작용물질은 리셉터에 대한 리간드이며, 이것은 리셉터가 임의의 리간드의 부재로 인해 발생하는 기초 상태와 관련된 비활성 상태를 채택하도록 유도한다. 따라서, 안타고니스트는 작용물질의 활성을 억제할 수 있으며, 역 작용물질은 작용물질의 부재 상태에서 리셉터의 형태를 바꿀 수 있는 리간드이다.
항정신병제, 항불안제, 항우울제, 발작 치료제, 항간질제 및 항-편두통 및 일반적인 통증을 포함한 많은 다른 징후들과 같이 시그마 리간드에 대해 알려진 많은 용도들이 있지만, IC/BPS 관련된 통증의 치료에 유용한 이들 화합물들은 해당 기술분야에 언급되어 있지 않다.
표 1은 해당 기술에서 알려진 몇 가지 시그마 리간드를 나열한다 (즉, IC50 ≤ 5000 nM).
이 화합물들 중 몇 가지는 시그마-1 및/또는 시그마-2 리셉터에 결합할 수 있다. 이 시그마 리간드들은 또한 그들 각각의 염, 염기 및 산을 포함한다.
바람직하게는, 상기 표는 또한 할로페리돌, 할로페리돌 대사산물 I (4-(4-클로로페닐)-4-히드록시피페리딘) 및 할로페리돌 대사산물 II (4-(4-클로로페닐)-a-(4-플루오로페닐)-4-히드록시-1-피페리딘부탄올)을 포함하며 설치류 뇌막 및 인간 신경아세포종 세포들에서 수행된 감소된 할로페리돌 연구들은 할로페리돌의 대사산물 I 및 II 은 할로페리돌보다 적은 친화도로 σ1 리셉터 에 결합하는 것을 나타내었으나 D2 리셉터에 대하여는 매우 낮은(대사산물 II) 또는 친화도 없는(대사산물 I) 것을 나타내었다. 인간에서 생산된 감소된 할로페리돌 또는 대사산물 II, 할로페리돌의 활성 대사산물은 시그마-1 리셉터에 대하여 높은 친화도(낮은 나노몰의 범위로)를 보이고 실험 동물 및 인간 세포들 모두에서 시그마-1 리셉터의 비가역적 봉쇄(blockade)를 생산한다.
바람직한 실시예에서, 본 발명의 내용 중 상기 시그마 리셉터 리간드는 상기 묘사된 일반 화학식 (I)을 가진다.
바람직한 실시예에서, 화학식(I)의 화합물들에서 R1 은 H, -COR8, 및 치환된 또는 비치환된 알킬로부터 선택된다.
더욱 바람직하게는, R1 은 H, 메틸 및 아세틸로부터 선택된다. 더욱 바람직한 실시예에서, R1은 H이다.
또 다른 구체예에서, 화학식(I) 화합물들에서 R2는 H 또는 치환된 또는 비치환된 알킬, 더욱 바람직하게는 메틸을 나타낸다.
또한 본 발명의 또 다른 구체예에서, 화학식 (I) 화합물의 R3 및 R4는 페닐기의 메타 및 파라 자리에 위치되었으며, 바람직하게는 할로겐 및 치환 또는 비치환된 알킬로부터 독립적으로 선택된다.
본 발명의 특정한 구체예에서, 화학식(I) 화합물의 R3 및 R4 모두는 페닐기와 함께 임의로 치환된 축합 고리 시스템을 형성한다. 더욱 바람직하게는, 상기 축합 고리 시스템은 치환된 또는 비치환된 축합된 아릴기 및 치환된 또는 비치환된 방향족 또는 부분적으로 방향족 축합된 헤테로시클릴 기로부터 선택된다. 상기 축합 고리 시스템은 바람직하게는 2개의 고리 및/또는 9 내지 약 18개의 고리 원자들, 더욱 바람직하게는 9 또는 10 고리 원자들을 포함한다. 한층 더 바람직하게는, 상기 축합 고리 시스템은 나프틸이고, 특히 2-나프틸 고리 시스템이다.
또한 화학식(I)의 화합물에서, n이 2,3,4로부터 선택된 구체예는 본 발명의 문맥 안에서 선호되며, 더욱 바람직하게 n은 2이다.
마지막으로, 또 다른 구체예에서 화학식(I)의 화합물에서 R5 및 R6는 각각 독립적으로 C1-6 알킬, 또는 그들이 부착한 질소 원자와 함께 치환된 또는 비치환된 헤테로시클릴기, 특히 모노폴리닐, 피페리디닐 및 피롤리디닐기로부터 사이에서 선택된 기를 형성한다. 더욱 바람직하게 R5 및 R6은 함께 모노폴린-4-일 기를 형성한다.
추가의 바람직한 구체예에서, 다른 치환기들에 대한 상기 설명된 참조가 조합되었다. 본 발명은 또한 상기 화학식 (I)에서의 바람직한 치환들의 조합을 목적으로 한다.
본 발명의 다양한 변형들에서, 상기 일반 화학식 (I) 의 시그마 리간드는 하기 및 그의 약학적으로 허용가능한 염들, 용매화합물 또는 전구약물들로부터 선택된다.
[1] 4-{2-(1-(3,4-디클로로페닐)-5-메틸-1H 피라졸-3-일옥시)에틸} 모르폴린,
[2] 2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[3] 1-(3,4-디클로로페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[4] 1-(3,4-디클로로페닐)-5-메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[5] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피페리딘,
[6] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[7] 3-{1-[2-(1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시)에틸]피페리딘-4-일}-3H-이미다조[4,5-b]피리딘,
[8]1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-4-메틸피페라진,
[9] 에틸 4-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸} 피페라진 카복실레이트,
[10] 1-(4-(2-(1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시)에틸)피페라진-1-일)에탄온,
[11] 4-{2-[1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}모르폴린,
[12] 1-(4-메톡시페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[13] 1-(4-메톡시페닐)-5-메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[14] 1-[2-(1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시)에틸]피페리딘,
[15]1-{2-[1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[16] 4-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸} 모르폴린,
[17] 1-(3,4-디클로로페닐)-5-페닐-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[18] 1-(3,4-디클로로페닐)-5-페닐-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[19] 1-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}피페리딘,
[20] 1-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[21]2-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}-1,2,3,4-테트라하이드로이소퀴놀린,
[22] 4-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸} 모르폴린,
[23] 1-(3,4-디클로로페닐)-5-메틸-3-[4-(피롤리딘-1-일)부톡시]-1H-피라졸,
[24] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}피페리딘,
[25]1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-4-메틸피페라진,
[26] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-1H-이미다졸,
[27] 4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]-N,N-디에틸부탄-1-아민,
[28]1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-4-페닐피페리딘,
[29] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-6,7-디하이드로-1H-인돌-4(5H)-온,
[30] 2-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-1,2,3,4-테트라하이드로이소퀴놀린,
[31] 4-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸}모르폴린,
[32]2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[33] 1-(3,4-디클로로페닐)-5-이소프로필-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[34] 1-(3,4-디클로로페닐)-5-이소프로필-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[35] 1-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸} 피페리딘,
[36] 2-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸}-1,2,3,4-테트라하이드로이소 퀴놀린,
[37] 4-{2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]에틸}모르폴린,
[38] 2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시] N,N-디에틸에탄아민,
[39] 1-(3,4-디클로로페닐)-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[40] 1-{2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]에틸}피페리딘,
[41] 1-(3,4-디클로로페닐)-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[42]1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피페라진,
[43] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피롤리딘-3-아민,
[44]4-{2-[1-(3,4-디클로로페닐)-4,5-디메틸-1H-피라졸-3-일옥시]에틸} 모르폴린,
[46]2-[1-(3,4-디클로로페닐)-4,5-디메틸-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[47] 1-(3,4-디클로로페닐)-4,5-di메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[48] 1-(3,4-디클로로페닐)-4,5-di메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[49] 1-{2-[1-(3,4-디클로로페닐)-4,5-디메틸-1H-피라졸-3-일옥시]에틸} 피페리딘,
[50] 4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}모르폴린,
[51](2S,6R)-4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}-2,6-디메틸모르폴린,
[52] 1-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}피페리딘,
[53] 1-(3,4-디클로로페닐)-3-[4-(피롤리딘-1-일)부톡시]-1H-피라졸,
[55] 4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N,N-디에틸부탄-1-아민,
[56] N-벤질-4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N-메틸부탄-1-아민,
[57]4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N-(2-메톡시에틸)-N-메틸부탄-1-아민,
[58] 4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}티오모르폴린,
[59] 1-[1-(3,4-디클로로페닐)-5-메틸-3-(2-모르폴리노에톡시)-1H-피라졸-4-일]에탄온,
[60] 1-{1-(3,4-디클로로페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸-4-일}에탄온,
[61] 1-{1-(3,4-디클로로페닐)-5-메틸-3-[2-(피페리딘-1-일)에톡시]-1H-피라졸-4-일}에탄온,
[62] 1-{1-(3,4-디클로로페닐)-3-[2-(diethylamino)에톡시]-5-메틸-1H-피라졸-4-일}에탄온,
[63] 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린,
[64] N,N-디에틸-2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시] 에탄아민,
[65] 1-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}피페리딘,
[66] 5-메틸-1-(나프탈렌-2-일)-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸.
본 발명의 바람직한 변형에서, 일반 화학식 (I)의 시그마 리간드는 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸} 모르폴린 또는 그의 염이다.
바람직하게는, 사용된 일반 화학식 (I)의 화합물은 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린 하이드로클로라이드이다.
이들 특별한 화합물들은 본 발명의 실시예들에서 화합물 63 및 화합물 63·HCl 로서 지정되었다.
일반 화학식(I)의 화합물들 및 그들의 염들 또는 용매화합물들은 이전의 출원 WO2006/021462에서 기재된 대로 제조될 수 있다.
본 발명의 추가적인 측면은 적어도 하나의 시그마 리셉터 리간드 (바람직하게는 화학식(I)의 화합물) 및 적어도 하나의 약학적으로 허용 가능한 부형제를 포함하는 다른 약학적 형태의 IC/BPS 관련된 통증의 치료 및/또는 예방 용도의 의약 또는 조성물에 관한 것이다.
상기 조성물은 병용요법을 제공하기 위하여 적어도 다른 하나의 약물과 함께 사용될 수 있다. 이러한 다른 약물 또는 약물들은 동일한 조성물의 일부가 될 수 있고, 또는 별개의 조성물로서 제공될 수 있으며 동시에 또는 이시에 투여될 수 있다.
특별한 구체예에 따르면, 본 발명의 상기 약학 조성물 적어도 하나의 시그마 리간드(바람직하게는 화학식(I)의 화합물)와 IC/BPS 치료법 관련된 통증에 현재 사용되는 적어도 하나의 약물의 조합에 관한 것이다. IC/BPS 관련된 통증에 현재 사용되는 약물은 하기를 포함한다:
- 방광 점막의 보호제(펜토산 폴리설페이트(Elmiron));항히스타민제와 같은 항-알레르기 제제(H1 차단제들 (염산 히드록시진) 뿐만 아니라 H2 차단제들(시메티딘));유코트리엔(ukotriene)-D4 리셉터 안타고니스트 몬테루카스트; 트리시클릭 항우울제 (아미트립틸린) 또는 항경련제 (가바펜틴)로서의 통증 조절제 ; 호르몬 조절제(류프롤리드 아세테이트); 항-TNF 로서 항염증제; 마취제; 통증 경감제(오피오이드, 몰핀, 트라마돌); 면역억제제(프레드니손, 트리암시놀론); L-아르기닌; 옥시부티닌; 또는 톨테로딘;과 같은 경구 약물
- 통증 조절제(디메틸설폭시드 또는 바실러스 칼메트-게랭(BCG)), 방광 점막의 보호제(히알루론산), 또는 황산 콘드로이틴과 같은 방광내 약물들;및
- 항염증, 신경의, 마취의 및 행동 물질들(agents)을 이용하는 상보적 약물들
또한, 상기 시그마 리셉터 리간드는 외과치료와 함께 투여될 수 있다.
상기 조합은 그의 동시의, 분리된, 또는 순차적인 투여를 위하여, 적어도 하나의 약학적으로 허용가능한 부형제와 함께 제형화될 수 있다.
이는 시그마 리셉터 리간드 및 다른 약물(IC/BPS 에 대하여 현재 사용된 하나의 약물과 같은)의 조합이 투여될 수 있다는 의미를 갖는다 :
a) 동일한 의약 조성물의 일부이고 이들 모두는 그 후 항상 동시에 투여되는 조합으로서,
b) 이들 각각은 그들 중 하나 각각과 함께 동시에, 순차적으로 또는 분리된 투여의 가능성을 일으키는 두 단위의 조합으로서.
특별한 구체예에서, 상기 시그마 리셉터 리간드는 다른 약물들(즉, 2개의 유닛들에서)로부터 독립적으로 투여되지만 동시에 투여된다. 또다른 특별한 구체예에서, 상기 시그마 리셉터 리간드가 첫번째로 투여되고, 그리고 나서 다른 약물이 분리되어 또는 순차적으로 투여된다. 또 다른 특별한 구체예에서, 다른 약물이 첫번째로 투여되고, 그리고 나서 상기 시그마 리셉터 리간드가 정의된 바와 같이 분리되어 또는 순차적으로 투여된다.
본 발명의 바람직한 구체예에서 상기 조합은 적어도 하나의 시그마 리셉터 리간드 및 적어도 하나의 오피오이드를 포함한다. 더욱 바람직한 구체예에서 상기 조합은 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린 하이드로클로라이드 및 몰핀을 포함한다.
용어 "부형제"는 활성 성분 외의 약물 화합물의 성분을 지칭한다 (미국 의약국(European Medicines Agency-EMA)으로부터 수득된 정의). 이들은 바람직하게는 "담체, 보조제 및/또는 비히클"을 포함한다. 담체는 약물의 전달 및 효능을 개선시키기 위하여 성분이 그에 통합되는 형태이다. 약물 담체는 생체 내 약물 작용 연장, 약물 대사 감소, 및 약물 독성 감소를 위하여 제어된 방출 기술과 같은 약물-전달계에서 사용된다. 담체는 또한 약리학적 작용의 타겟(target) 자리로 약물 전달의 효능을 증가시키기 위한 설계에서 사용된다 (미국 국립 의학 도서관. 미국 국립 보건원). 보조제는 활성 성분의 작용에 예측가능한 방식으로 영향을 미치는 약품 제형에 첨가되는 성분이다. 비히클은 바람직하게는 치료 작용이 없고, 약물의 투여를 위한 부피(bulk)를 제공하기 위해 매질로서 사용되는, 부형제 또는 성분이다 (Stedman's Medical Spellchecker, ⓒ2006 Lippincott Williams & Wilkins). 그러한 약학 담체, 보조제 또는 비히클은 땅콩유, 대두유, 광유, 참깨유 등과 같은, 석유, 동물, 채소 또는 합성 기원의 것들을 포함하는 물 및 오일과 같은 멸균 액체, 부형제, 분산제(disgregant), 습윤제 또는 희석제일 수 있다. 적합한 약학적 담체는 E.W. Martin에 의해 "Remington's Pharmaceutical Sciences" 기재되어 있다. 이들 부형제 및 사용되는 양의 선택은 약학 조성물의 적용 형태에 따라 달라질 것이다.
본 발명에 따라 사용되는 약학 조성물은, 이를 경구적으로 또는 비경구적으로, 예로서 폐, 코, 직장 및/또는 혈관내 투여를 위한 임의의 형태로 조절될 수 있다. 따라서, 본 발명에 따른 제형은 국소 또는 전신 적용, 특히 피부, 피하, 근육내, 관절내, 복강내, 폐, 구강, 설하, 코, 경피, 질, 경구 또는 비경구 적용을 위해 조절될 수 있다. 직장 적용의 바람직한 형태는 좌약을 이용한다.
경구 적용에 적합한 제조는 정제, 알약, 검, 캡슐, 과립, 드롭(drop) 또는 시럽이다. 비경구 적용에 적합한 제조는 용액, 현탁액, 재구성 가능한 (reconstitutable) 건조 제제 또는 스프레이(spray)이다.
본 발명의 약학 조성물은 경피 적용을 위하여, 용해된 형태 또는 패치 내의 저장물(deposits)로서 제형화될 수 있다.
본 발명의 구체예에서, 통증은 말초 신경병증 통증, 이질통, 작열통, 통각과민, 감각과민, 과통증, 신경통, 신경염 또는 신경병증으로부터 선택된다.
"신경병증 통증" IASP에 의해 "신경계에서의 1차 병소 또는 기능이상에 의해 개시 또는 유발된 통증" (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210)으로서 정의된다.
본 발명의 목적에 있어서, 이 용어는, IASP에 의해 "말초 또는 중추 신경계에서의 1차 병소, 기능이상 또는 일시적 동요에 의해 개시 또는 유발된 통증"으로서 정의되는 "신경성 통증"과 동의어로서 취급된다. 본 발명에 따른 신경병증 통증은 수술결과 초래된 신졍병증 통증에 국한된다.
IASP에 의하면, "말초 신경병증 통증"은 "말초 신경계에서의 1차 병소 또는 기능이상에 의해 개시 또는 유발된 통증"으로서 정의되고, "말초 신경성 통증"은 "말초 신경계에서 1차 병소, 기능이상 또는 일시적 동요에 의해 개시 또는 유발된 통증"으로서 정의된다 (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 213).
IASP에 의하면, "이질통"은 "정상적으로는 통증으로 야기하지 않는 자극으로 인한 통증"으로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
IASP에 의하면, "작열통"은 "외상성 신경 병소, 종종 혈관운동신경 및 한선(sudomotor dysfunction) 기능이상 및 이후의 영양 (trophic) 변화와 결합된, 지속된 타는듯한 통증, 이질통 및 과통증의 증후군"으로서 정의된다 (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 210).
IASP에 의하면, "통각과민"은 "정상적으로 고통스러운 자극에 대해 증가된 반응"으로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
IASP에 의하면, "감각과민"은 "감각을 제외하고, 자극에 대한 증가된 민감도"로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 211).
IASP에 의하면, "과통증"은 "자극, 특히 반복적 자극에 대해 비정상적으로 고통스러운 반응, 및 증가된 최저한계에 의해 특징되는 통증성 증후군"으로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
IASP는 "이질통", "통각과민", "과통증" 간의 하기 차이점을 도출하였다 (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212):
IASP에 의하면, "신경통"은 "신경 또는 신경(들)의 분포에서의 통증"으로서 정의된다 (IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
IASP에 의하면, "신경염"은 "신경 또는 신경(들)의 염증"으로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
IASP에 의하면, "신경병증/신경염"은 "신경에서 기능의 장애 또는 병리학적 변화로: 하나의 신경에서 단발신경병증, 수 개의 신경에서 단발신경병증 다중성, 분산 또는 양쪽성인 경우, 다발신경병증"으로서 정의된다(IASP, Classification of chronic pain, 2nd Edition, IASP Press (2002), 212).
본 발명의 또다른 측면은, IC/BPS 관련된 통증으로 고통받는 환자, 또는 통증으로 고통받기 쉬운 환자의 치료 및/또는 예방 방법으로서, 치료 유효량의 시그마 리간드, 바람직하게는 화학식 (I)의 시그마 리간드 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물을 그러한 치료 또는 예방을 필요로 하는 환자에게 투여하는 것을 포함하는 방법이다.
일반적으로 본 발명에서 사용된 화합물의 유효 투여량은 선택된 화합물의 상대적 효능, 치료될 증상의 심각도, 또는 연령, 몸무게 또는 투여 방식에 의존할 것이다.
그러나, 활성의 화합물들은 일반적으로 하루에 1회 이상, 예를들면 매일 1, 2, 3 또는 4회 투여될 것이며, 일반적인 일일 총 투여량은 0.1 내지 500 mg/kg/일 범위이다.
이상 본 발명을 일반적인 맥락으로 기재하였으며, 이는 하기 실시예를 참조하여 더욱 용이하게 이해될 것이며, 실시예들은 예시로서 제시된 것이지 본 발명을 제한하는 것으로 의도되지 않는다.
실시예
실시예
1: 4
-{2-[5-
메틸
-1-(나프탈렌-2-일)-1H-
피라졸
-3-
일옥시
]에틸} 모르폴린 하이드로클로라이드 (화합물 63·HCl) 의 합성
화합물 63 은 이전의 출원 WO2006/021462 에서 기재된 대로 제조될 수 있다. 그의 하이드로클로라이드는 다음의 절차에 따라 얻을 수 있다:
화합물 63 (6.39 g) HCl 로 포화된 에탄올에 용해되었다. 상기 혼합물은 몇분 동안 교반되고 증발되어 건조되었다. 잔여물은 이소프로판올로부터 결정화되었다. 첫번째 결정화로부터의 모액은 농축에 의해 두번째 결정화를 할 수 있다. 두가지 결정화는 함께 5.24 g (63 %)의 해당 하이드로클로라이드 염(m.p. = 197-199℃)을 얻었다.
1H-NMR (DMSO-d6) δ ppm: 10,85 (bs, 1H), 7,95 (m, 4H), 7,7 (dd, J=2,2, 8,8 Hz, 1H), 7,55 (m, 2H), 5,9 (s, 1H), 4,55 (m, 2H), 3,95 (m, 2H), 3,75 (m, 2H), 3,55-3,4 (m, 4H), 3,2 (m, 2H), 2,35 (s, 3H).
HPLC 순도: 99.8%
실시예
2:
시클로포스파미드
유도된 방광염에서 시그마-1
리셉터의
역할
생쥐에서 내장통증이 존재하는 동물 모델은 그들은 내장 특이적이 아니기 때문에 제한된 실용적인 유용성이다. 시클로포스파미드-유도된 방광염의 동물 모델은 방광에 제한된 염증 특징들을 유지하며 그 결과 방광통증 증후군(IC/PBS)으로서 방광통증의 유전적 및 생리적 근거들을 조사하기 위한 매력적인 모델이 된다.. (Elsa Anton, 2002; Bon et al., 2003; J Urol. Sep;170(3):1008-12).
2.1 재료 및 방법
2.1.1 동물
실험들은 25-30 g 무게의 암컷 야생형(WT, Charles River, Barcelona, Spain) 및 σ1 리셉터 넉아웃(knockout) (σ1-KO, Laboratorios Esteve, Barcelona, Spain) CD-1 생쥐에서 수행하였다. σ1-KO 생쥐들을 이전에 기재된 CD-1 백그라운드(background)(Entrena et al., 2009) 상에서 생성되었다. 동물들은 테스팅 전 적어도 1주일 동안 우리의 동물 시설들에서 익숙해졌고 온도 및 빛-조절된 룸들에서 콜로니 케이지(22 ± 1 ℃, 08.00 h 에서 빛 켜지고 20.00 h에서 꺼짐, 20 분 마다 공기 교체)에서 수용되었다. 일반적인 실험실 식이(Harlan Teklad Research diet, Madison, USA) 및 수돗물은 실험의 시작까지 임의로(ad libitum) 이용가능하였다. 테스트는 빛 상(9.00 h 내지 15.00 h) 동안에 실시하였다. 생쥐들은 유럽 연합 이사회 지침 (24 November 1986 (86/609/ECC))에 따라 다뤄졌고 실험 규약은 그라나다 대학교 연구 윤리 위원회에 의해 승인되었다.
2.1.2 약물 및 약물 투여
선택적 시그마-1 리셉터 안타고니스트 BD-1063 (1-[2-(3,4-디클로로페닐)에틸]-4-메틸피페라진) (Tocris Cookson Ltd(Bristol, UK) 에서 제공됨), NE-100 (N, N-디프로필-2-[4-메톡시-3-(2-페닐에톡시)페닐]에틸아민 하이드로클로라이드)(이전에 보고된(Nakazato et al., 1999), 실시예 1 (화합물 63·HCl)에 따라 합성됨) 및 선택적 σ1 리셉터 작용제(agonist) PRE-084 [2-(4-모르폴린에틸)1- 페닐시클로헥산카복실레이트)하이드로클로라이드] (Tocris Cookson Ltd. (Bristol, UK) 에 의해 제공됨)이 테스트 화합물들로서 사용되었다. 몰핀 하이드로클로라이드(General Directorate of Pharmacy and Drugs, Spanish Ministry of Health) 및 인도메타신(Sigma-Aldrich Quimica S.A., Madrid, Spain)이 각각 오피오이드, 비-스테로이드성 항-염증 조절 약물들로서 사용되었다. 모든 약물들은 인도메타신을 제외하고는 살균 생리 식염수에 용해되었고 인도메타신은 5% 탄산수소나트륨(Panreac Quimica S.L.U., Barcelona, Spain)에 용해되었다. 약물 용액은 실험의 시작 전에 즉시 제조되었고, 5 ml/kg 의 약물 용액 또는 그의 용매가 견갑골 사이의 영역 내부로 피하로(s.c.) 주사되었다. 방광염 유도에 사용된 시클로포스파미드(Sigma-Aldrich)는 식염수에 용해되었고 10 ml/kg 부피로 복강내(i.p.) 주사되었다. 대조군 동물들은 동일한 부피의 용매들로 주사되었다.
2.2
시클로포스파미드
-유발된
방광통증
및 관련된
통각과민을
평가하기 위한 일반 절차들
시클로포스파미드에 의해 유도된 자발적 통증-관련된 행동들 및 관련된 기계적 통각과민은 작은 변형들을 가지고 이전에 설명된 프로토콜(Olivar and Laird, 1999; Laird et al., 2002; Wantuch et al., 2007)에 따라서 테스트 되었다.
생쥐들은 와이어 메쉬 플로어(뒤에 작은 거울들 및 아래에 동물들 집중 관찰 챔버들)를 가지는 높은 단 상의 개별의 투명 플라스틱 박스들(7 × 7 ×13 cm)에 수용되었다. 40분 습관화 주기 이후, 동물들은 구분된 칸들로부터 제거되고 시클로포스파미드 용액(또는 그의 용매)으로 주사되었다. 동물들은 즉시 분리된 칸으로 되돌아가고, 거기에서 시클로포스파미드 주사 이후 4-h 관찰 주기를 지나 매 30분마다 2분 동안 관찰되었다. 기록된 통증-관련된 행동들은 다음의 스케일에 따라 코드화되었다: 0 = 정상, 1 = 털세움, 2 = 강력한 털세움, 3 = 호흡곤란 4 = 복부의 리킹 및 5 = 복부의 스트레칭 및 축소. 만일 이들 행동들의 하나 이상이 하나의 관찰 주기에서 감지되었다면, 다른 유형들의 행동에 대한 해당 포인트의 합이 할당되었다 즉., 만일 2회 스트레팅 및 축소들(각각 5 점) 그리고 1회 복부 리킹(4 점)이 관찰 주기 동안 발생했다면, 최종 점수는 14 대신에 9이다. 최종 점수는 각 시간 포인트에 할당된 점수들을 합하여 얻었다. 4-h 관찰 주기 마지막에, 관련된 통각과민은 오목한 복부의 기계적 자극에 대한 반응의 철회를 측정함으로써 결정되었다. 0.02 내지 2 g (0.19-19.6 mN) 범위의 힘이 일련의 눈금이 매겨진 폰 프뢰이 필라멘트(von Frey filaments) (Touch-Test Sensory Evaluators, North Coast Medical Inc., CA USA) 를 가지고 업-다운 페러다임 (Chaplan et al., 1994)을 이용하여 복부에 적용되었다. 필라멘트들은 각각은 5 s 의 적용들 간의 간격으로 2-3 s 동안 3회 적용되었다. 테스트는 0.4 g (3.92 mN) 폰 프뢰이 필라멘트로 즉, 중범위로 시작되었다. 각 연이은 테스트에서, 만일 필라멘트에 대한 반응이 없었다면, 더 강력한 자극이 그리고 나서 선택되었고; 만일 양성 반응이 있었다면 더 약한 것이 그리고나서 사용되었다. 적용 부위의 즉각적 리킹/스크래칭, 복부의 날카로운 수축, 또는 점핑이 관찰되었다면 필라멘트에 대한 반응은 양성으로 고려되었다. 행동적 반응들을 평가한 실험자들은 실험 대상들의 상기 처리 및 유전자형은 알지 못하게 하였다.
모든 경우에서, WT 또는 σ1-KO 그룹들, 용매- 또는 시클로포스파미드-처리된 그룹들, 및 식염수- 또는 약물-처리 그룹들에서의 실험은 동시에 실시되었다. 각 동물은 오직 한번만 사용되었고 시클로포스파미드(또는 그의 용매)의 단일 집중 및 하나의 약물(또는 그의 용매)의 1회 투여를 받았다.
2.3
미엘로페록시다아제
활성 결정
미엘로페록시다아제(MPO) 활성에서 변화는 다핵형 백혈구 침윤의 믿을 수 있는 지수를 나타낸다. (Rouleau et al., 2000). 따라서, 시클로포스파미드의 주사 5 시간 후, 방광은 절개되었고 스프링 가위를 사용하여 섬세하게 썰려졌다. 그리고 나서 0.5% 헥사데실트리메틸암모늄 브로마이드(HTAB; Sigma-Aldrich)를 함유하는 0.4 ml 의 포스페이트 버퍼(50 mM, pH 6)에서 균질화되었다. 그 후, 3회 동결융해 되었고 원심분리되어(6000 g, 10 분) 상청액을 채집하고 이는 96-웰 플래이트 포맷에 적합한 MPO활성 분석을 위해 사용되었다. 간단하게, 50 ml 의 상청액 또는 인간 호중성 백혈구 MPO 스탠다드(Sigma-Aldrich) 가 96-웰 플레이트에 추가되었다. 0.167 mg/ml o-디아니시딘(Sigma-Aldrich)을 포함하는 150 ml의 포스페이트 버퍼 및 0.0005% 과산화수소 (Sigma-Aldrich)의 첨가에 의해 반응은 시작되었고 흡수는 5분 후 450 nm 에서 측정되었다 (Microplate Spectrophotometer PowerWave X, Bio-tek instruments. Inc).
2.4 순진한
WT
및 시그마-1 KO 생쥐에서
시클로포스파미드의
다른 농도들의 효과 비교
WT 및 시그마-1-KO 생쥐들은 다른 투여량들의 시클로포스파미드(10-300 mg/kg) 로 투여되었고, 상기 설명한 절차들에 따라서 통증-관련 행동들, 복부의 기계적 자극들에 대한 관련된 통각과민 및 각 농도에 의해 유도된 MPO 활성이 동일 동물들에서 연속적으로 기록되었다. 이는 용량 반응 곡선(용량 vs. 통증 점수, 기계적 임계값 또는 MPO 활성)의 구축 및 약리적 연구를 위한 시클로포스파미드의 최적의 복용량의 확인을 가능케 하였다. 그 결과들은 도 1 및 도 2 ((A) 및 (B))에 나타내었다.
2.5
WT
및
σ
1
KO 생쥐에서
시클로포스파미드에
의해 유도된
방광통증
및 MPO 증가에 대한 약물의 효과들의 비교
시클로포스파미드-유도된 방광 통증에 대한, 약물들의 효과를 평가하기 위하여 다양한 시그마-1 리셉터 안타고니스트들의 몇가지 복용량의 효과 (도 4) 및 대조군 약물들 효과(도 5)가 통증 행동 점수, 관련된 통각과민 및 MPO 활성으로 테스트되었다. 따라서, 다른 복용량의 BD-1063 (16-64 mg/kg) (도 4), 실시예 1 (32-128 mg/kg) (도 4), NE-100 (16-64 mg/kg) (도 4), 몰핀 (1-8 mg/kg) (도 5), 인도메타신(2-8 mg/kg) (도 5) 또는 그들의 용매들이 i.p. 시클로포스파미드의 주사 후 2시간에서 s.c.로 투여되었고, 통증 행동 점수가 2시간동안 30분 마다 기록되었다. 통증-관련된 행동들에 대한 약물의 효과들을 테스트 하기 위하여 300 mg/kg 농도의 시클로포스파미드가 투여되었다. 이 농도의 시클로포스파미드는 WT 생쥐들에서 최대 통증 점수를 생산하고(see 도 1) 따라서 이 반응에서 어떠한 감소들의 관찰을 위한 최대 윈도우(maximum window)를 제공하기 때문에 선택되었다. 분리된 실험들에서, 우리는 시클로포스파미드에 의해 유도된 관련된 통각과민에 대한 동일 복용량의 σ1 리셉터 안타고니스트 및 대조군 약물의 효과를 테스트하였다. 이들 실험들에 대하여 100 mg/kg 의 시클로포스파미드 투여량이 선택되었고이는 WT 및 σ1 -KO 생쥐들에서 관련된 통각과민을 위한 기계적 한계점에서의 최대 감소에 도달하기 때문이다.(도 6 참조). 이들 실험들에서, 연구하의 약물 또는 그 용매는 시클로포스파미드의 i.p. 투여 후 2시간에서 s.c. 주사되었고, 2시간 후 (즉, 시클로포스파미드 주사 후 4시간) 폰 프뢰이 필라멘트로 복부 자극에 대한 동물의 반응이 일반 절차들에서 설명된 바와 같이 (도 7 및 도 8) 업-다운 방법을 이용하여 테스트되었다. 상기 행동 테스트들이 완료시 (시클로포스파미드 투여 후 5 시간), MPO 활성의 결정을 위하여 동물들을 죽이고 방광들은 제거되었다.(도 9, 도 10 및 도 11). 관련된 통각과민 상의 몰핀 효과인 실시예 1에 의해 가능한 변형을 평가하기 위하여 동물들은 시클로포스파미드 100 mg/kg 의 ip 주사를 받았고 15분 후에는 실시예 1 (32 mg/kg, s.c.) 또는 식염수로 주사되었고, 5분 후에는 상기 동물은 몰핀(1 mg/kg, s.c.) 또는 식염수로 주사되었고 이 주사 후 2시간 후에는 관련된 통각과민은 이전에 설명된 대로 평가되었다. 실시예 1-몰핀 주사에서 σ1-리셉터의 포함을 테스트하기 위하여, PRE-084 (32 mg/kg, s.c.) 가 실시예 1 주사 5분 전에 주사되었다 (도 12)
2.6 통계적 분석
50% 의 반응을 생산하는 기계적 한계점으로 표현되는 관련된 통증의 정도는 Dixon 식을 이용하여 계산되었다 (1980): 50% 기계적 한계점 (g) = [(10 ( Xf + Kδ )) /10.000], 식중 Xf = 사용된 최종 폰 프뢰이 필라멘드 값 (대수 단위로); k = 양성/음성 반응들의 패턴에 대한 표의 값(tabular value); 및 δ = 자극들 사이의 평균 차이(로그 단위로)
2가지 방법(means) 사이의 비교를 위하여 SigmaPlot 12.0 프로그램을 이용하여(Systat Software Inc., San Jose, CA, USA). 폰 프뢰이 테스트 또는 학생 t-test 에 잇달아 일원 또는 이원 변량분석(ANOVA)으로 실험 그룹들 간에 평균값은 비교되었다. P< 0.05 는 통계학적으로 중요한 것으로 고려되었다.
참조:
Abrahams, P. et al.; "The standardization of terminology of lower urinary tract function: report from the Standardization Sub-committee of the International Continence Society" ; Neurol. Urodyn.; 2002; 21; 167-178.
Anton, E., "Delayed toxicity of cyclophosphamide on the bladder of DBA/2 and C57BL /6 female mouse " ; Int. J. Exp. Path.; 2002; 83; 47-53
Bon, K. et al.; "Characterization of cyclophosphamide cystitis , a model of visceral and referred pain, in the mouse: species and strain differences."; J Urol.; 2003; 170(3); 1008-1012
Burger "Medicinal Chemistry and Drug Discovery" 6th ed. (Donald J. Abraham ed., 2001, Wiley)
Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL; "Quantitative assessment of tactile allodynia in the rat paw". J. Neurosci. Methods; 1994; 53; 55-63.
"Design and Applications of Prodrugs" (H. Bundgaard ed., 1985, Harwood Academic Publishers
Dixon WJ; "Efficient analysis of experimental observations". Annu. Rev. Pharmacol. Toxicol.; 1980; 20; 441-62.
Dmitrieva,N. et al.; "The role of nerve growth factor in a model of visceral inflammation"; Neuroscience; 1997; 78; 449-459.
Entrena JM, Cobos EJ, Nieto FR, Cendan CM, Gris G, Del Pozo ED, Zamanillo D, Baeyens JM; "Sigma-1 receptor are essential for capsaicin -induced mechanical hypersensitivity: Studies with selective sigma-1 ligands and sigma-1 knockout mice"; Pain; 2009; 143; 252-61.
Hanno,P. et al.; "International Consultation on IC-Rome, Forging an International Consensus: progress in painful bladder syndrome/interstitial cystitis". Report and Abstracts. Int. Urogynecol. J Pelvic Floor Dysfunct.; 2005; 16(suppl. 1); S2-S34
Hellewell, S.B. and Bowen, W.D.; Brain Res. ; 1990 ; 527, 244-253
IASP , Classification of chronic pain, 2 nd Edition, IASP Press (2002), 210-213
Laird JM, Souslova V, Wood JN, Cervero F; "Deficits in visceral pain and referred hyperalgesia in Nav1 .8 ( SNS /PN3)-null mice"; J. Neurosci.; 2002; 22; 8352-6.
Leitner, M.L. ; Eur . J. Pharmacol . ; 1994 ; 259 ; 65-69
Nakazato A, Kumagai T, Ohta K, Chaki S, Okuyama S, Tomisawa K; "Synthesis and SAR of 1- 알킬 -2- phenylethylamine 유도체 designed from N,Ndipropyl-4-methoxy-3-(2-phenylethoxy)phenylethylamine to discover " σ 1 ligands"; J. Med. Chem.; 1999; 42; 3965-70.
Olivar T, Laird JM.; "Cyclophosphamide cystitis in mice: behavioural characterisation and correlation with bladder inflammation"; Eur. J. Pain.;1999; 3;141-49.
Prasad, P.D. et al. ; J. Neurochem. ; 1998 ; 70 (2) ; 443-451
Quiron, R. et al. ; Trends Pharmacol . Sci . ; 1992 ; 13 : 85-86
Ronsisvalle, G. et al. ; Pure Appl . Chem . ; 2001 ; 73 ; 1499-1509
Rouleau A, Stark H, Schunack W, Schwartz JC; "Anti-inflammatory and antinociceptive properties of BP 2-94, a histamine H 3 -receptor agonist prodrug"; J. Pharmacol. Exp. Ther.; 2000; 295; 219-25.
Sant,G.R. et al.; "The mast cell in interstitial cyctitis : role in pathophysiology and pathogenesis"; Urology; 2007; 69(4 suppl.); 34-40.
Sonal, G. et al.; Ther . Adv . Urol .; 2011; 3(1); 19-33
Theoharides,T.C.; "Mast cell involvement in interstitial cystitis: a review of human experimental evidence"; Urology; 2001; 57 (6 suppl.); 47-55.
Van de Merwe,J.P.; "Diagnostic criteria, classification and nomenclature for painful bladder syndrome/interstitial cystitis: an ESSIC proposal"; Eur. Urol.; 2008; 53; 60-67.
Wantuch C, Piesla M, Leventhal L.; "Pharmacological validation of a model of cystitis pain in the mouse"; Neurosci. Lett.; 2007; 421; 250-2.
Claims (15)
- 간질성 방광염/방광통증 증후군(IC/BPS) 관련된 통증의 치료 및/또는 예방용 시그마 리셉터 리간드.
- 제1항에 있어서, 상기 통증은 IC/BPS 때문에 발달된 급성 및/또는 만성 통증, 특히 신경병성 통증, 신경통, 이질통, 작열통(causalgia), 통각과민(hyperalgesia), 감각과민(hyperesthesia), 과통증(hyperpathia), 신경염 또는 수술절차 다음의 신경병증으로부터 선택되는 것을 특징으로 하는 시그마 리간드.
- 제1항 또는 제2항 중 어느 한 항에 있어서, 시그마 리셉터 안타고니스트, 바람직하게는 중립의 안타고니스트(neutral antagonist), 역 작용물질(inverse agonist) 및 부분 안타고니스트(partial antagonist)로부터 선택되는 시그마 리간드.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 하기의 일반 화학식 (I) 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물을 가지는 시그마 리간드.
식중
R 1 은 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 선택되고;
R 2 은 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 선택되며;
R 3 및 R 4 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8, -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 독립적으로 선택되거나 또는 페닐과 함께 임의로 치환된 축합 고리 시스템을 형성하며;
R 5 는 R 6 는 수소, 치환된 또는 비치환된 알킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된 아릴알킬, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 헤테로시클릴알킬, -COR8, -C(O)OR8, -C(O)NR8R9, -CH=NR8, -CN, -OR8, -OC(O)R8, -S(O)t-R8 , -NR8R9, -NR8C(O)R9, -NO2, -N=CR8R9, 및 할로겐으로 구성되는 군으로부터 독립적으로 선택되거나 또는 그들이 부착되는 질소 원자와 함께, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴 기를 형성하며;
n 은 1, 2, 3, 4, 5, 6, 7 및 8 로부터 선택되며;
t 는 0, 1 또는 2 이며;
R 8 및 R 9 은 각각 수소, 치환된 또는 비치환된 알al킬, 치환된 또는 비치환된 시클로알킬, 치환된 또는 비치환된 알케닐, 치환된 또는 비치환된 아릴, 치환된 또는 비치환된, 방향족 또는 비방향족 헤테로시클릴, 치환된 또는 비치환된 알콕시, 치환된 또는 비치환된 아릴옥시, 및 할로겐으로부터 독립적으로 선택됨. - 제4항에 있어서, R1 은 H, -COR8 및 치환된 또는 비치환된 알킬로부터 선택되는 시그마 리간드.
- 제4항 또는 제5항에 있어서, R2 는 H 또는 치환된 또는 비치환된 알킬인 시그마 리간드.
- 제4항 내지 제6항 중 어느 한 항에 있어서, R3 및 R4 는 치환된 또는 비치환된 축합 나프틸 고리 시스템을 함께 형성하는 것을 특징으로 하는 시그마 리간드.
- 제4항 내지 제7항 중 어느 한 항에 있어서, R5 및 R6 는 치환된 또는 비치환된 모르폴린-4-일 기를 함께 형성하는 것을 특징으로 하는 시그마 리간드.
- 제4항에 있어서, 하기 또는 그의 약학적으로 허용가능한 염, 전구약물 또는 용매화합물로 구성되는 군으로부터 선택되는 시그마 리간드.
[1] 4-{2-(1-(3,4-디클로로페닐)-5-메틸-1H 피라졸-3-일옥시)에틸} 모르폴린,
[2] 2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[3] 1-(3,4-디클로로페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[4] 1-(3,4-디클로로페닐)-5-메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[5] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피페리딘,
[6] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[7] 3-{1-[2-(1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시)에틸]피페리딘-4-일}-3H-이미다조[4,5-b]피리딘,
[8] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-4-메틸피페라진,
[9] 에틸 4-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸} 피페라진 카복실레이트,
[10] 1-(4-(2-(1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시)에틸)피페라진-1-일)에탄온,
[11] 4-{2-[1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}모르폴린,
[12] 1-(4-메톡시페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[13] 1-(4-메톡시페닐)-5-메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[14] 1-[2-(1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시)에틸]피페리딘,
[15] 1-{2-[1-(4-메톡시페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[16] 4-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸} 모르폴린,
[17] 1-(3,4-디클로로페닐)-5-페닐-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[18] 1-(3,4-디클로로페닐)-5-페닐-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[19] 1-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}피페리딘,
[20] 1-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}-1H-이미다졸,
[21] 2-{2-[1-(3,4-디클로로페닐)-5-페닐-1H-피라졸-3-일옥시]에틸}-1,2,3,4-테트라히드로이소퀴놀린,
[22] 4-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸} 모르폴린,
[23] 1-(3,4-디클로로페닐)-5-메틸-3-[4-(피롤리딘-1-일)부톡시]-1H-피라졸,
[24] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}피페리딘,
[25]1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-4-메틸피페라진,
[26] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-1H-이미다졸,
[27] 4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]-N,N-디에틸부탄-1-아민,
[28] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-4-페닐피페리딘,
[29] 1-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-6,7-ㄷ디히드로-1H-인돌-4(5H)-온,
[30] 2-{4-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]부틸}-1,2,3,4-테트라히드로이소퀴놀린,
[31] 4-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸} 모르폴린,
[32] 2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[33] 1-(3,4-디클로로페닐)-5-이소프로필-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[34] 1-(3,4-디클로로페닐)-5-이소프로필-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[35] 1-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸} 피페리딘,
[36] 2-{2-[1-(3,4-디클로로페닐)-5-이소프로필-1H-피라졸-3-일옥시]에틸}-1,2,3,4-테트라히드로이소퀴놀린,
[37] 4-{2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]에틸}모르폴린,
[38] 2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시] N,N-디에틸에탄아민,
[39] 1-(3,4-디클로로페닐)-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[40] 1-{2-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]에틸}피페리딘,
[41] 1-(3,4-디클로로페닐)-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[42]1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피페라진,
[43] 1-{2-[1-(3,4-디클로로페닐)-5-메틸-1H-피라졸-3-일옥시]에틸}피롤리딘-3-아민,
[44] 4-{2-[1-(3,4-디클로로페닐)-4,5-di메틸-1H-피라졸-3-일옥시]에틸} 모르폴린,
[46] 2-[1-(3,4-디클로로페닐)-4,5-디메틸-1H-피라졸-3-일옥시]-N,N-디에틸에탄아민,
[47] 1-(3,4-디클로로페닐)-4,5-디메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸,
[48] 1-(3,4-디클로로페닐)-4,5-디메틸-3-[3-(피롤리딘-1-일)프로폭시]-1H-피라졸,
[49] 1-{2-[1-(3,4-디클로로페닐)-4,5-디메틸-1H-피라졸-3-일옥시]에틸} 피페리딘,
[50] 4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}모르폴린,
[51] (2S,6R)-4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}-2,6-디메틸모르폴린,
[52] 1-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}피페리딘,
[53] 1-(3,4-디클로로페닐)-3-[4-(피롤리딘-1-일)부톡시]-1H-피라졸,
[55] 4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N,N-디에틸부탄-1-아민,
[56] N-벤질-4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N-메틸부탄-1-아민,
[57] 4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]-N-(2-메톡시에틸)-N-메틸부탄-1-아민,
[58] 4-{4-[1-(3,4-디클로로페닐)-1H-피라졸-3-일옥시]부틸}티오모르폴린,
[59] 1-[1-(3,4-디클로로페닐)-5-메틸-3-(2-모르폴리노에톡시)-1H-피라졸-4-일]에탄온,
[60] 1-{1-(3,4-디클로로페닐)-5-메틸-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸-4-일}에탄온,
[61] 1-{1-(3,4-디클로로페닐)-5-메틸-3-[2-(피페리딘-1-일)에톡시]-1H-피라졸-4-일}에탄온,
[62] 1-{1-(3,4-디클로로페닐)-3-[2-(디에틸아미노)에톡시]-5-메틸-1H-피라졸-4-일}에탄온,
[63] 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린,
[64] N,N-디에틸-2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시] 에탄아민,
[65] 1-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}피페리딘,
[66] 5-메틸-1-(나프탈렌-2-일)-3-[2-(피롤리딘-1-일)에톡시]-1H-피라졸. - 제4항 내지 제9항 중 어느 한 항에 있어서, 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린, 또는 그의 약학적으로 허용가능한 염, 이성질체, 전구약물 또는 용매화합물인 시그마 리간드.
- 제10항에 있어서, 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린 하이드로클로라이드인 시그마 리간드.
- 제1항 내지 제11항 중 어느 한 항에서 정의된 시그마 리간드의 IC/BPS 관련 통증의 치료 및/또는 예방을 위한 의약의 제조를 위한 용도.
- IC/BPS 관련된 통증의 치료 또는 예방이 필요한 환자에게 치료적으로 유효량의 제1항 내지 제11항 중 어느 한 항에서 정의된 시그마 리간드를 투여하는 것을 포함하는 IC/BPS 관련된 통증의 치료 및/또는 예방 방법.
- 적어도 하나의 제1항 내지 제11항 중 어느 한 항에서 정의된 시그마 리간드와 오피오이드 리셉터 리간드의, 간질성 방광염/방광통증 증후군(IC/BPS) 관련 통증의 치료 및/또는 예방 용도의 동시, 분리된 또는 순차적 투여를 위한 조합.
- 제14항에 있어서, 상기 시그마 리간드는 4-{2-[5-메틸-1-(나프탈렌-2-일)-1H-피라졸-3-일옥시]에틸}모르폴린 하이드로클로라이드이며 상기 오피오이드는 몰핀인 조합.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13382246.0A EP2818166A1 (en) | 2013-06-26 | 2013-06-26 | Use of sigma receptor ligands for the prevention and treatment of pain associated to interstitial cystitis/bladder pain syndrome (IC/BPS) |
| EP13382246.0 | 2013-06-26 | ||
| PCT/EP2014/063360 WO2014207024A1 (en) | 2013-06-26 | 2014-06-25 | Use of sigma receptor ligands for the prevention and treatment of pain associated to interstitial cystitis/bladder pain syndrome (ic/bps) |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160023839A true KR20160023839A (ko) | 2016-03-03 |
Family
ID=48700506
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167001865A KR20160023839A (ko) | 2013-06-26 | 2014-06-25 | 간질성 방광염/방광통증 증후군과 관련된 통증의 예방 및 치료를 위한 시그마 리셉터 리간드들의 용도 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US20160151377A1 (ko) |
| EP (2) | EP2818166A1 (ko) |
| JP (1) | JP2016523276A (ko) |
| KR (1) | KR20160023839A (ko) |
| CN (1) | CN105377257A (ko) |
| AR (1) | AR096709A1 (ko) |
| AU (1) | AU2014301220A1 (ko) |
| BR (1) | BR112015032343A8 (ko) |
| CA (1) | CA2916568A1 (ko) |
| HK (1) | HK1221656A1 (ko) |
| IL (1) | IL243362A0 (ko) |
| MA (1) | MA38711A1 (ko) |
| MX (1) | MX2015017761A (ko) |
| PH (1) | PH12015502815A1 (ko) |
| RU (1) | RU2016102149A (ko) |
| SG (1) | SG11201510408XA (ko) |
| TN (1) | TN2015000558A1 (ko) |
| TW (1) | TWI629984B (ko) |
| WO (1) | WO2014207024A1 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2116539A1 (en) | 2008-04-25 | 2009-11-11 | Laboratorios Del. Dr. Esteve, S.A. | 1-aryl-3-aminoalkoxy-pyrazoles as sigma ligands enhancing analgesic effects of opioids and attenuating the dependency thereof |
| EP2353591A1 (en) | 2010-02-04 | 2011-08-10 | Laboratorios Del. Dr. Esteve, S.A. | Sigma ligands for potentiating the analgesic effect of opioids and opiates in post-operative pain and attenuating the dependency thereof |
| EP2353598A1 (en) | 2010-02-04 | 2011-08-10 | Laboratorios Del. Dr. Esteve, S.A. | Sigma ligands for use in the prevention and/or treatment of postoperative pain |
| EP2388005A1 (en) | 2010-05-21 | 2011-11-23 | Laboratorios Del. Dr. Esteve, S.A. | Sigma ligands for the prevention and/or treatment of emesis induced by chemotherapy or radiotherapy |
| EP2415471A1 (en) | 2010-08-03 | 2012-02-08 | Laboratorios Del. Dr. Esteve, S.A. | Use of sigma ligands in opioid-induced hyperalgesia |
| EP2524694A1 (en) | 2011-05-19 | 2012-11-21 | Laboratorios Del. Dr. Esteve, S.A. | Use of sigma ligands in diabetes type-2 associated pain |
| KR20160097366A (ko) | 2013-12-17 | 2016-08-17 | 라보라토리오스 델 드라. 에스테브.에스.에이. | 세로토닌-노르에피네프린 재흡수 억제제들(SNRIs) 및 시그마 리셉터 리간드들 조합 |
| WO2015091505A1 (en) * | 2013-12-17 | 2015-06-25 | Laboratorios Del Dr. Esteve, S.A. | Gabapentinoids and sigma receptor ligands combinations |
| CA3121202A1 (en) | 2018-11-30 | 2020-06-04 | Nuvation Bio Inc. | Pyrrole and pyrazole compounds and methods of use thereof |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1270708C (zh) * | 2001-07-10 | 2006-08-23 | 安斯泰来制药有限公司 | 间质性膀胱炎治疗用医药组合物 |
| BRPI0514692A (pt) | 2004-08-27 | 2008-06-17 | Esteve Labor Dr | inibidores do receptor sigma |
| TWI356699B (en) * | 2004-11-10 | 2012-01-21 | Kissei Pharmaceutical | Agent for treating interstitial cystitis and agent |
| WO2007025613A2 (en) * | 2005-07-15 | 2007-03-08 | Laboratorios Del Dr. Esteve, S.A. | Use of compounds binding to the sigma receptor for the treatment of diabetes-associated pain |
| MX2008011016A (es) * | 2006-03-01 | 2008-09-08 | Esteve Labor Dr | Inhibidores de receptor sigma. |
| CN101395157A (zh) * | 2006-03-01 | 2009-03-25 | 伊斯特芬博士实验室有限公司 | 作为西格玛受体抑制剂的吡唑衍生物 |
| EP2113501A1 (en) * | 2008-04-25 | 2009-11-04 | Laboratorios Del. Dr. Esteve, S.A. | 5-Methyl-1-(naphthalen-2-YL)-1H-Pyrazoles useful as sigma receptor inhibitors |
| EP2116539A1 (en) * | 2008-04-25 | 2009-11-11 | Laboratorios Del. Dr. Esteve, S.A. | 1-aryl-3-aminoalkoxy-pyrazoles as sigma ligands enhancing analgesic effects of opioids and attenuating the dependency thereof |
| EP2353591A1 (en) * | 2010-02-04 | 2011-08-10 | Laboratorios Del. Dr. Esteve, S.A. | Sigma ligands for potentiating the analgesic effect of opioids and opiates in post-operative pain and attenuating the dependency thereof |
| EP2353598A1 (en) * | 2010-02-04 | 2011-08-10 | Laboratorios Del. Dr. Esteve, S.A. | Sigma ligands for use in the prevention and/or treatment of postoperative pain |
| EP2460804A1 (en) * | 2010-12-03 | 2012-06-06 | Laboratorios Del Dr. Esteve, S.A. | 5-methyl-1-(naphthalen-2-yl)-1h-pyrazole derivatives and their use in potentiating the effect of opioid analgesics |
| EP2460519A1 (en) * | 2010-12-03 | 2012-06-06 | Laboratorios Del. Dr. Esteve, S.A. | Use of sigma ligands in bone cancer pain |
| RU2606131C2 (ru) * | 2011-05-13 | 2017-01-10 | Эррэй Биофарма Инк. | СОЕДИНЕНИЯ ПИРРОЛИДИНИЛМОЧЕВИНЫ И ПИРРОЛИДИНИЛТИОМОЧЕВИНЫ КАК ИНГИБИТОРЫ КИНАЗЫ TrkA |
| EP2524694A1 (en) * | 2011-05-19 | 2012-11-21 | Laboratorios Del. Dr. Esteve, S.A. | Use of sigma ligands in diabetes type-2 associated pain |
-
2013
- 2013-06-26 EP EP13382246.0A patent/EP2818166A1/en not_active Withdrawn
-
2014
- 2014-06-24 TW TW103121723A patent/TWI629984B/zh not_active IP Right Cessation
- 2014-06-24 AR ARP140102374A patent/AR096709A1/es unknown
- 2014-06-25 MX MX2015017761A patent/MX2015017761A/es unknown
- 2014-06-25 AU AU2014301220A patent/AU2014301220A1/en not_active Abandoned
- 2014-06-25 SG SG11201510408XA patent/SG11201510408XA/en unknown
- 2014-06-25 TN TN2015000558A patent/TN2015000558A1/en unknown
- 2014-06-25 CA CA2916568A patent/CA2916568A1/en not_active Abandoned
- 2014-06-25 CN CN201480040098.1A patent/CN105377257A/zh active Pending
- 2014-06-25 JP JP2016522457A patent/JP2016523276A/ja active Pending
- 2014-06-25 EP EP14734099.6A patent/EP3013338A1/en not_active Withdrawn
- 2014-06-25 WO PCT/EP2014/063360 patent/WO2014207024A1/en active Application Filing
- 2014-06-25 KR KR1020167001865A patent/KR20160023839A/ko not_active Application Discontinuation
- 2014-06-25 MA MA38711A patent/MA38711A1/fr unknown
- 2014-06-25 RU RU2016102149A patent/RU2016102149A/ru not_active Application Discontinuation
- 2014-06-25 BR BR112015032343A patent/BR112015032343A8/pt not_active Application Discontinuation
- 2014-06-25 US US14/900,786 patent/US20160151377A1/en not_active Abandoned
-
2015
- 2015-12-17 PH PH12015502815A patent/PH12015502815A1/en unknown
- 2015-12-27 IL IL243362A patent/IL243362A0/en unknown
-
2016
- 2016-08-17 HK HK16109869.1A patent/HK1221656A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| TWI629984B (zh) | 2018-07-21 |
| US20160151377A1 (en) | 2016-06-02 |
| SG11201510408XA (en) | 2016-01-28 |
| BR112015032343A8 (pt) | 2018-01-23 |
| IL243362A0 (en) | 2016-02-29 |
| EP3013338A1 (en) | 2016-05-04 |
| TN2015000558A1 (en) | 2017-04-06 |
| PH12015502815A1 (en) | 2016-03-21 |
| MA38711A1 (fr) | 2017-12-29 |
| RU2016102149A3 (ko) | 2018-05-25 |
| HK1221656A1 (zh) | 2017-06-09 |
| WO2014207024A1 (en) | 2014-12-31 |
| BR112015032343A2 (pt) | 2017-09-26 |
| EP2818166A1 (en) | 2014-12-31 |
| JP2016523276A (ja) | 2016-08-08 |
| AR096709A1 (es) | 2016-01-27 |
| CN105377257A (zh) | 2016-03-02 |
| MX2015017761A (es) | 2016-07-06 |
| RU2016102149A (ru) | 2017-08-02 |
| TW201536295A (zh) | 2015-10-01 |
| AU2014301220A1 (en) | 2016-02-18 |
| CA2916568A1 (en) | 2014-12-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160023839A (ko) | 간질성 방광염/방광통증 증후군과 관련된 통증의 예방 및 치료를 위한 시그마 리셉터 리간드들의 용도 | |
| TWI585083B (zh) | 用於預防及/或治療手術後疼痛的σ配子 | |
| RU2608943C2 (ru) | Применение сигма лигандов при боли, связанной с диабетом 2 типа | |
| KR101855358B1 (ko) | 골암통증에서의 시그마 리간드의 용도 | |
| KR101855357B1 (ko) | 오피오이드 유도성 통각과민에서의 시그마 리간드의 용도 | |
| KR20160054547A (ko) | 비스테로이드성 항염증 약물 및 시그마 리셉터 리간드 조합들 | |
| JP2017503765A (ja) | ガバペンチノイドおよびシグマ受容体の組み合わせ | |
| JP2016540771A (ja) | セロトニン−ノルアドレナリン再取り込み阻害薬(snri)およびシグマ受容体リガンドの組み合わせ | |
| NZ617590B2 (en) | Use of sigma ligands in diabetes type-2 associated pain |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |