KR20150089004A - 선택적 마커가 없는 클로닝된 비-인간 동물 - Google Patents
선택적 마커가 없는 클로닝된 비-인간 동물 Download PDFInfo
- Publication number
- KR20150089004A KR20150089004A KR1020157012263A KR20157012263A KR20150089004A KR 20150089004 A KR20150089004 A KR 20150089004A KR 1020157012263 A KR1020157012263 A KR 1020157012263A KR 20157012263 A KR20157012263 A KR 20157012263A KR 20150089004 A KR20150089004 A KR 20150089004A
- Authority
- KR
- South Korea
- Prior art keywords
- promoter
- site
- gene
- recombination site
- cell
- Prior art date
Links
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 203
- 210000001082 somatic cell Anatomy 0.000 claims abstract description 113
- 239000003550 marker Substances 0.000 claims abstract description 108
- 210000004027 cell Anatomy 0.000 claims abstract description 98
- 230000014509 gene expression Effects 0.000 claims abstract description 96
- 108090000790 Enzymes Proteins 0.000 claims abstract description 91
- 108010052160 Site-specific recombinase Proteins 0.000 claims abstract description 90
- 210000000287 oocyte Anatomy 0.000 claims abstract description 42
- 108010091086 Recombinases Proteins 0.000 claims abstract description 40
- 102000018120 Recombinases Human genes 0.000 claims abstract description 22
- 210000002459 blastocyst Anatomy 0.000 claims abstract description 19
- 238000004519 manufacturing process Methods 0.000 claims abstract description 16
- 230000009261 transgenic effect Effects 0.000 claims abstract description 11
- 210000004291 uterus Anatomy 0.000 claims abstract description 5
- 230000006798 recombination Effects 0.000 claims description 159
- 238000005215 recombination Methods 0.000 claims description 159
- 108700028369 Alleles Proteins 0.000 claims description 84
- 102000004190 Enzymes Human genes 0.000 claims description 71
- 238000011144 upstream manufacturing Methods 0.000 claims description 66
- 238000000034 method Methods 0.000 claims description 60
- 102000039446 nucleic acids Human genes 0.000 claims description 47
- 108020004707 nucleic acids Proteins 0.000 claims description 47
- 150000007523 nucleic acids Chemical class 0.000 claims description 47
- 239000002773 nucleotide Substances 0.000 claims description 36
- 125000003729 nucleotide group Chemical group 0.000 claims description 36
- 210000002950 fibroblast Anatomy 0.000 claims description 34
- 210000001778 pluripotent stem cell Anatomy 0.000 claims description 32
- 238000013518 transcription Methods 0.000 claims description 24
- 230000035897 transcription Effects 0.000 claims description 24
- 210000001161 mammalian embryo Anatomy 0.000 claims description 22
- 241000282898 Sus scrofa Species 0.000 claims description 18
- 241000283707 Capra Species 0.000 claims description 13
- 241001494479 Pecora Species 0.000 claims description 11
- 101710135898 Myc proto-oncogene protein Proteins 0.000 claims description 10
- 102100038895 Myc proto-oncogene protein Human genes 0.000 claims description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 claims description 10
- 101100247004 Rattus norvegicus Qsox1 gene Proteins 0.000 claims description 10
- 101710150448 Transcriptional regulator Myc Proteins 0.000 claims description 10
- 101150111214 lin-28 gene Proteins 0.000 claims description 10
- 244000309715 mini pig Species 0.000 claims description 7
- 241000283074 Equus asinus Species 0.000 claims description 5
- 210000001789 adipocyte Anatomy 0.000 claims description 5
- 210000000601 blood cell Anatomy 0.000 claims description 5
- 210000002449 bone cell Anatomy 0.000 claims description 5
- 210000005229 liver cell Anatomy 0.000 claims description 5
- 210000000663 muscle cell Anatomy 0.000 claims description 5
- 210000002569 neuron Anatomy 0.000 claims description 5
- 210000004927 skin cell Anatomy 0.000 claims description 5
- 230000003213 activating effect Effects 0.000 claims description 4
- 238000003259 recombinant expression Methods 0.000 claims description 4
- 238000012258 culturing Methods 0.000 claims description 3
- 230000000392 somatic effect Effects 0.000 claims description 3
- 210000003292 kidney cell Anatomy 0.000 claims description 2
- 206010041662 Splinter Diseases 0.000 claims 1
- 230000008685 targeting Effects 0.000 abstract description 60
- 238000000338 in vitro Methods 0.000 abstract description 10
- 239000000203 mixture Substances 0.000 abstract description 6
- 241001465754 Metazoa Species 0.000 description 44
- 108700008625 Reporter Genes Proteins 0.000 description 29
- 241000283690 Bos taurus Species 0.000 description 27
- 108700019146 Transgenes Proteins 0.000 description 26
- 108010051219 Cre recombinase Proteins 0.000 description 25
- 210000004940 nucleus Anatomy 0.000 description 20
- 239000013598 vector Substances 0.000 description 16
- 108010077850 Nuclear Localization Signals Proteins 0.000 description 15
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 14
- 108091023040 Transcription factor Proteins 0.000 description 14
- 102000040945 Transcription factor Human genes 0.000 description 14
- 108091081024 Start codon Proteins 0.000 description 12
- 230000001605 fetal effect Effects 0.000 description 12
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 12
- 238000010374 somatic cell nuclear transfer Methods 0.000 description 12
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 11
- 241000282887 Suidae Species 0.000 description 11
- 210000004436 artificial bacterial chromosome Anatomy 0.000 description 11
- 244000144972 livestock Species 0.000 description 11
- 235000013336 milk Nutrition 0.000 description 11
- 239000008267 milk Substances 0.000 description 11
- 210000004080 milk Anatomy 0.000 description 11
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 10
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 10
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 10
- 239000005090 green fluorescent protein Substances 0.000 description 10
- 210000003205 muscle Anatomy 0.000 description 10
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 10
- 108020003589 5' Untranslated Regions Proteins 0.000 description 8
- 241000700584 Simplexvirus Species 0.000 description 8
- 108010082025 cyan fluorescent protein Proteins 0.000 description 8
- 238000011161 development Methods 0.000 description 8
- 230000018109 developmental process Effects 0.000 description 8
- 238000001890 transfection Methods 0.000 description 8
- CXNPLSGKWMLZPZ-GIFSMMMISA-N (2r,3r,6s)-3-[[(3s)-3-amino-5-[carbamimidoyl(methyl)amino]pentanoyl]amino]-6-(4-amino-2-oxopyrimidin-1-yl)-3,6-dihydro-2h-pyran-2-carboxylic acid Chemical compound O1[C@@H](C(O)=O)[C@H](NC(=O)C[C@@H](N)CCN(C)C(N)=N)C=C[C@H]1N1C(=O)N=C(N)C=C1 CXNPLSGKWMLZPZ-GIFSMMMISA-N 0.000 description 7
- 102000007469 Actins Human genes 0.000 description 7
- 108010085238 Actins Proteins 0.000 description 7
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 7
- 108020004705 Codon Proteins 0.000 description 7
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 7
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 7
- 102000018251 Hypoxanthine Phosphoribosyltransferase Human genes 0.000 description 7
- 108010025815 Kanamycin Kinase Proteins 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 108010056852 Myostatin Proteins 0.000 description 7
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 7
- 102000006601 Thymidine Kinase Human genes 0.000 description 7
- 108020004440 Thymidine kinase Proteins 0.000 description 7
- 108010027570 Xanthine phosphoribosyltransferase Proteins 0.000 description 7
- CXNPLSGKWMLZPZ-UHFFFAOYSA-N blasticidin-S Natural products O1C(C(O)=O)C(NC(=O)CC(N)CCN(C)C(N)=N)C=CC1N1C(=O)N=C(N)C=C1 CXNPLSGKWMLZPZ-UHFFFAOYSA-N 0.000 description 7
- 238000012239 gene modification Methods 0.000 description 7
- 230000005017 genetic modification Effects 0.000 description 7
- 235000013617 genetically modified food Nutrition 0.000 description 7
- 108010045647 puromycin N-acetyltransferase Proteins 0.000 description 7
- 229940075420 xanthine Drugs 0.000 description 7
- 208000035240 Disease Resistance Diseases 0.000 description 6
- 102000002265 Human Growth Hormone Human genes 0.000 description 6
- 108010000521 Human Growth Hormone Proteins 0.000 description 6
- 239000000854 Human Growth Hormone Substances 0.000 description 6
- 102000008100 Human Serum Albumin Human genes 0.000 description 6
- 108091006905 Human Serum Albumin Proteins 0.000 description 6
- 102000004877 Insulin Human genes 0.000 description 6
- 108090001061 Insulin Proteins 0.000 description 6
- 102000004472 Myostatin Human genes 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 108091036066 Three prime untranslated region Proteins 0.000 description 6
- 239000003114 blood coagulation factor Substances 0.000 description 6
- 238000002744 homologous recombination Methods 0.000 description 6
- 230000006801 homologous recombination Effects 0.000 description 6
- 229940125396 insulin Drugs 0.000 description 6
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 5
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 5
- 102000003839 Human Proteins Human genes 0.000 description 5
- 108090000144 Human Proteins Proteins 0.000 description 5
- 102000004407 Lactalbumin Human genes 0.000 description 5
- 108090000942 Lactalbumin Proteins 0.000 description 5
- 229930193140 Neomycin Natural products 0.000 description 5
- 102000004338 Transferrin Human genes 0.000 description 5
- 108090000901 Transferrin Proteins 0.000 description 5
- 229940019700 blood coagulation factors Drugs 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000004520 electroporation Methods 0.000 description 5
- 108010021843 fluorescent protein 583 Proteins 0.000 description 5
- 230000001976 improved effect Effects 0.000 description 5
- 229960004927 neomycin Drugs 0.000 description 5
- 239000011574 phosphorus Substances 0.000 description 5
- 229910052698 phosphorus Inorganic materials 0.000 description 5
- 235000018102 proteins Nutrition 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 210000000130 stem cell Anatomy 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 239000012581 transferrin Substances 0.000 description 5
- 235000021241 α-lactalbumin Nutrition 0.000 description 5
- 241000271566 Aves Species 0.000 description 4
- 241000283086 Equidae Species 0.000 description 4
- 238000009395 breeding Methods 0.000 description 4
- 230000001488 breeding effect Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 210000002257 embryonic structure Anatomy 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 101150066555 lacZ gene Proteins 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 238000003753 real-time PCR Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 108020005345 3' Untranslated Regions Proteins 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108010060309 Glucuronidase Proteins 0.000 description 3
- 102000053187 Glucuronidase Human genes 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000003975 animal breeding Methods 0.000 description 3
- 108010005774 beta-Galactosidase Proteins 0.000 description 3
- 102000005936 beta-Galactosidase Human genes 0.000 description 3
- 244000309466 calf Species 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 235000013601 eggs Nutrition 0.000 description 3
- 210000001671 embryonic stem cell Anatomy 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 238000010363 gene targeting Methods 0.000 description 3
- 238000010353 genetic engineering Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 210000002894 multi-fate stem cell Anatomy 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 241000272517 Anseriformes Species 0.000 description 2
- 101150004446 Cow gene Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 206010059866 Drug resistance Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 101000946384 Homo sapiens Alpha-lactalbumin Proteins 0.000 description 2
- 101000798114 Homo sapiens Lactotransferrin Proteins 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 101710087237 Whey acidic protein Proteins 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 235000020247 cow milk Nutrition 0.000 description 2
- 235000013365 dairy product Nutrition 0.000 description 2
- 235000006694 eating habits Nutrition 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 238000001476 gene delivery Methods 0.000 description 2
- 102000050459 human LTF Human genes 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 238000000520 microinjection Methods 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 230000000644 propagated effect Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000008672 reprogramming Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- 229910000497 Amalgam Inorganic materials 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101000886576 Bos taurus Growth/differentiation factor 8 Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 241000711573 Coronaviridae Species 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 241000991587 Enterovirus C Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 241000710960 Sindbis virus Species 0.000 description 1
- 108091027544 Subgenomic mRNA Proteins 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- 229910052770 Uranium Inorganic materials 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- HMNZFMSWFCAGGW-XPWSMXQVSA-N [3-[hydroxy(2-hydroxyethoxy)phosphoryl]oxy-2-[(e)-octadec-9-enoyl]oxypropyl] (e)-octadec-9-enoate Chemical compound CCCCCCCC\C=C\CCCCCCCC(=O)OCC(COP(O)(=O)OCCO)OC(=O)CCCCCCC\C=C\CCCCCCCC HMNZFMSWFCAGGW-XPWSMXQVSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 229920006317 cationic polymer Polymers 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 210000001771 cumulus cell Anatomy 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 235000020997 lean meat Nutrition 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000002122 magnetic nanoparticle Substances 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000037257 muscle growth Effects 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000003234 polygenic effect Effects 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- JFALSRSLKYAFGM-UHFFFAOYSA-N uranium(0) Chemical compound [U] JFALSRSLKYAFGM-UHFFFAOYSA-N 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 210000004340 zona pellucida Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61D—VETERINARY INSTRUMENTS, IMPLEMENTS, TOOLS, OR METHODS
- A61D19/00—Instruments or methods for reproduction or fertilisation
- A61D19/04—Instruments or methods for reproduction or fertilisation for embryo transplantation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/873—Techniques for producing new embryos, e.g. nuclear transfer, manipulation of totipotent cells or production of chimeric embryos
- C12N15/877—Techniques for producing new mammalian cloned embryos
- C12N15/8771—Bovine embryos
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0273—Cloned vertebrates
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/873—Techniques for producing new embryos, e.g. nuclear transfer, manipulation of totipotent cells or production of chimeric embryos
- C12N15/877—Techniques for producing new mammalian cloned embryos
- C12N15/8778—Swine embryos
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/20—Animal model comprising regulated expression system
- A01K2217/203—Animal model comprising inducible/conditional expression system, e.g. hormones, tet
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/101—Bovine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/108—Swine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/01—Animal expressing industrially exogenous proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/30—Vector systems comprising sequences for excision in presence of a recombinase, e.g. loxP or FRT
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/008—Vector systems having a special element relevant for transcription cell type or tissue specific enhancer/promoter combination
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2840/00—Vectors comprising a special translation-regulating system
- C12N2840/007—Vectors comprising a special translation-regulating system cell or tissue specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2999/00—Further aspects of viruses or vectors not covered by groups C12N2710/00 - C12N2796/00 or C12N2800/00
- C12N2999/007—Technological advancements, e.g. new system for producing known virus, cre-lox system for production of transgenic animals
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Environmental Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Veterinary Medicine (AREA)
- Wood Science & Technology (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Developmental Biology & Embryology (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Animal Husbandry (AREA)
- Biodiversity & Conservation Biology (AREA)
- Molecular Biology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Transplantation (AREA)
- Reproductive Health (AREA)
- Public Health (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 유전자 조작된, 비-인간 동물의 유전자 변형된 체세포가 제공된다. 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생산하기 위한 조성물 및 방법이 제공되되, ES 세포-특이적 프로모터에 작동가능하게 연결된 자가-절단가능한 재조합효소 유전자를 포함하는 표적화 작제물은 분화된 체세포 내로 도입된다. 체세포의 유전자 변형된 게놈은 제핵 숙주 난모세포 내로 전달된다. 이어서, 인공적으로 생성된 접합자는 배반포 배아기까지 시험관내에서 배양되고, 후속적으로 대리모의 자궁 내로 이식되어 선택적 마커 및 재조합 효소가 없는 유전자 변형 및 클로닝된 비-인간 동물을 형성한다.
Description
관련 출원과의 상호참조
본 출원은 모든 목적을 위해 전문이 참조로서 포함된 2012년 11월 28일 출원된 미국 특허 제61/730,771호의 정규출원이다.
본 발명의 기술분야
선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물. ES 세포-특이적 프로모터에 작동가능하게(operably) 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 유전자 조작된 비-인간 동물의 분화된 체세포로서, ES 세포-특이적 프로모터는 미분화된 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 발현을 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는, 분화된 체세포. 선택적 마커 및 부위-특이적 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생성하기 위한 조성물 및 방법.
유전자 변형 기법, 예를 들어, 유전자 이식, 녹-인, 녹-아웃, 삽입 돌연변이유발, 및 결실은 성공적인 유전자 변형을 확인하기 위해 필연적으로 숙주 게놈 내 선택적 마커 유전자의 삽입을 필요로 한다. 그러나, 일단 성공적인 유전자 변형이 확인되고 선택적 마커를 함유하는 동물로부터 유래된 제품의 사용에 있어 안전성 문제를 상승시킬 수 있다면, 숙주 게놈에 남아있는 선택적 마커 유전자는 불필요하게 된다.
이런 이유로, 유전자 변형 후에 숙주 세포 또는 숙주 동물로부터 선택적 마커 및 재조합효소 유전자를 제거하기 위한 많은 노력이 있었다. 예를 들어, 재조합효소 유전자는, 재조합 부위, 예를 들어 loxP 또는 FRT에 측접(flanking)되는 선택적 마커 유전자를 제거하기 위해, 예를 들어, 미세주사, 형질감염을 통해, 또는 바이러스 입자를 사용하는 형질 도입을 통해 ES 세포 또는 수정란 내로 도입된다. 대안적으로, 선택 카세트를 운반하는 동물은 동일한 효과를 달성하기 위해 부위-특이적 재조합효소를 발현시키는 제거자(deleter) 균주로 번식된다. 그러나, 이들 기법은 ES 세포 내의 저수준의 형질감염 효율; 연장된 시험관내 배양에 기인하는 ES 세포 다능성의 감소; 및 추가 번식 단계를 위한 추가적인 인간 및 재원에 대한 필요를 포함하는, 다수의 문제점이 있다.
따라서, 유전자 변형된 동물로부터 선택적 마커 및 재조합효소 유전자를 효과적으로 제거하기 위한 조성물 및 방법에 대한 필요가 있다.
선택적 마커 유전자 및 부위-특이적 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생성하기 위한 조성물 및 방법.
선택적 마커 유전자 및 부위-특이적 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물, 예를 들어, 미니 돼지 및 젖소가 제공되되, 유전자 변형 및 클로닝된 비-인간 동물의 게놈은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 함유하는 자가-절단가능한 재조합효소 발현 카세트를 포함하도록 유전자 조작된 체세포, 예를 들어, 섬유아세포로부터 전달되었다. ES 세포-특이적 프로모터는, ES 세포-특이적 전사 인자가 발현되고 활성인 경우, 미분화 다능성 줄기 세포 내, 예를 들어, 배반포-단계 배아의 내부 세포 덩어리에서 ES 세포 내 부위-특이적 재조합효소의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다. 따라서, 유전자 변형 동안 도입된 선택적 마커 유전자 및 재조합효소 유전자는 클로닝된 배아의 발생 동안 다능성 줄기 세포의 게놈으로부터 제거될 수 있다.
자가-절단가능한 재조합효소 발현 작제물을 함유하도록 유전자 변형된 비-인간 동물의 분화된 체세포가 제공되되, 체세포는 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하고, 작제물은, 재조합효소 유전자가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포, 예를 들어, ES 세포 내 부위-특이적 재조합효소 유전자의 발현을 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다. 제핵 숙주 난모세포(enucleated host oocyte) 내로 또는 다능성 줄기 세포 내로 분화된 체세포의 유전자 변형된 게놈을 전달함으로써, ES 세포-특이적 전사 인자가 발현되고 활성인 경우, 선택적 마커 및 재조합효소 유전자는 발생 중인 클로닝된 배아 내 다능성 줄기 세포로부터 또는 다능성이 되도록 재프로그래밍한 체세포(예를 들어, 유발된 다능성(iPS 세포))를 포함하는 임의의 다능성 줄기 세포로부터 제거될 수 있다.
선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생성하는 방법이 제공되되, 상기 방법은, (a) 비-인간 동물의 분화된 체세포 내로 핵산 작제물을 도입하여 유전자 변형된 게놈을 생성하는 단계; (b) (a)의 유전자 변형된 게놈을 제핵 숙주 난모세포 내로 전달하는 단계; (c) (b)의 난모세포를 융합 및 활성화하여 인공 접합자를 형성하는 단계; (d) 접합자가 배반포 배아기로 발생될 때까지 시험관내에서 (c)의 인공 접합자를 배양시키는 단계; 및 (e) (d)의 배반포를 대리모의 자궁 내로 이식하여 선택적 마커 유전자 및 부위-특이적 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 형성하는 단계를 포함하되, 핵산 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하고, 재조합효소 발현 카세트는, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다. 따라서, 일단 분화된 체세포의 유전자 변형된 게놈이 제핵 숙주 난모세포 내로 전달되고, 인공적으로 생성된 접합자가 배아 내로 발생되게 한다면, ES 세포-특이적 전사 인자가 발현되고 활성인 경우, 선택적 마커 및 재조합효소 유전자는 발생 중인 클로닝된 배아 내 다능성 줄기 세포의 게놈으로부터 제거되게 된다. 이 방법으로, 본 발명은 ES 세포의 조작 또는 선택적 마커 및 재조합효소 유전자를 제거하는데 필요한 임의의 추가 번식 단계를 회피할 수 있다. 다양한 실시형태에서, 핵산 작제물은 표적화 작제물이다. 일 실시형태에서, 표적화 작제물은 넉아웃 대립유전자를 포함한다. 일 실시형태에서, 표적화 작제물은 녹-인 대립유전자를 포함한다. 일 실시형태에서, 핵산 작제물은 전이유전자를 포함한다.
선택적 마커 유전자 및 재조합효소 유전자가 없는 비-인간 동물의 유전자 변형 및 클로닝된 다능성 줄기 세포의 생성방법이 제공되며: (a) 비-인간 동물의 분화된 체세포 내로 핵산 작제물을 도입하여 유전자 변형된 게놈을 생성하는 단계; 및 (b) (a)의 유전자 변형된 게놈을 다능성 줄기 세포 내로 전달하여 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 다능성 줄기 세포를 생성하는 단계를 포함하되, 핵산 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하고, 재조합효소 발현 카세트는, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다. 다양한 실시형태에서, 핵산 작제물은 표적화 작제물이다. 일 실시형태에서, 표적화 작제물은 넉아웃 대립유전자를 포함한다. 일 실시형태에서, 표적화 작제물은 녹-인 대립유전자를 포함한다. 일 실시형태에서, 핵산 작제물은 전이유전자를 포함한다.
재조합 부위에 측접되는 선택적 마커 및 재조합효소 유전자는 분화된 체세포의 유전자 변형된 게놈을 다능성 줄기 세포, 또는 ES 세포-특이적 전사 인자가 활성인 경우 다능성이 되도록 재프로그래밍된 임의의 체세포 내로 전달함으로써, 다능성 줄기 세포의 게놈으로부터 제거될 수 있다.
일 양태에서, 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 유전자조작된 비-인간 동물의 분화된 체세포가 제공되되, 자가-절단가능한 재조합효소 발현 카세트는 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하고, 재조합효소 발현 카세트는, 선택적 마커 유전자 및 재조합효소 유전자가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다.
일 실시형태에서, 분화된 체세포는 피부 세포, 혈액 세포, 신경 세포, 근육 세포, 뼈 세포, 간 세포 및 지방 세포로 이루어진 군으로부터 선택된다.
일 실시형태에서, 분화된 체세포는 섬유아세포이다. 일 실시형태에서, 섬유아세포는 마우스, 래트, 토끼, 조류, 젖소, 돼지, 양, 염소, 말 및 당나귀로 이루어진 군으로부터 선택된 비-인간 동물로부터 유래된다. 일 실시형태에서, 섬유아세포는 돼지로부터 유래된다. 더 구체적인 실시형태에서, 돼지는 미니피그이다. 일 실시형태에서, 섬유아세포는 젖소로부터 유래된다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된다.
일 실시형태에서, ES 세포-특이적 프로모터는 배반포-단계 배아의 ES 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시킨다.
일 실시형태에서, 핵산 작제물은 제1 재조합 부위와 제2 재조합 부위 사이에 제2 발현 카세트를 포함하되, 제2 발현 카세트는 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 다른 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 하류에 위치된다.
일 실시형태에서, 선택적 마커 유전자에 작동가능하게 연결된 프로모터는 항시성 프로모터(constitutive promoter)이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 선택적 마커 유전자를 포함하지 않으며, 선택적 마커 유전자는 분화된 체세포의 게놈에서 다른 다른 좌위에(예를 들어, 트랜스로) 위치되되, 선택적 마커 유전자는, 선택적 마커가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향되는 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 분화된 체세포는 게놈에서 조건적 넉아웃 대립유전자를 포함하되, 조건적 넉아웃 대립유전자는, 조건적 대립유전자가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 조건적 넉아웃 대립유전자는 제1 재조합 부위와 제2 재조합 부위 사이의 선택적 마커 유전자를 추가로 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된다. 더 구체적인 실시형태에서, 엑손은 내인성 유전자의 제1 엑손이다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된다.
일 실시형태에서, 핵산 작제물은, 전체 내인성 유전자가 상동성 재조합을 통해 핵산 작제물로 대체될 수 있도록, 내인성 유전자의 개시 코돈의 상류의 5'-미번역 영역(UTR) 및 내인성 유전자의 정지 코돈의 하류의 3'-미번역 영역(UTR)을 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역의 외부에 위치된다. 일 실시형태에서, 변형된 서열은 내인성 유전자의 적어도 하나의 엑손의 녹-인 대립유전자이다. 일 실시형태에서, 변형된 서열은 전체 내인성 유전자의 녹-인 대립유전자이다(즉, "유전자-스왑(gene-swap) 녹-인"). 녹-인 대립유전자는 대립유전자를 함유하는 동물에 대해 바람직한 특징, 예컨대 개선된 질환 내성 또는 더 큰 크기(예를 들어, 더 큰 근육 크기)를 부여하는 대립유전자일 수 있다. 일 실시형태에서, 핵산 작제물은 전이유전자 서열을 추가로 포함하되, 전이유전자 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역 외부에 위치된다. 일 실시형태에서, 전이유전자 서열은 인간 단백질(예를 들어, 인슐린, 알파-락트알부민, 트랜스페린, 인간 혈청 알부민, 인간 성장 호르몬, 혈액 응고 인자 등)을 암호화한다. 일 실시형태에서, 전이유전자 서열은 치료제(예를 들어, 치료적 항체)를 암호화한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 내인성 유전자의 넉아웃 대립유전자이다. 일 실시형태에서, 넉아웃 대립유전자는 리포터 유전자를 포함하되, 리포터 유전자의 5'은, 리포터 유전자의 전사가 내인성 유전자의 발현을 촉진시키는 내인성 프로모터에 의해 개시될 수 있고, 내인성 유전자의 전사가 없어질 수 있도록 내인성 유전자의 개시코돈(ATG)의 상류 가까이에 뉴클레오타이드 서열(즉, 5' 미번역 영역(5'-UTR))을 포함한다.
일 실시형태에서, 리포터 유전자는 제1 재조합 부위의 상류에 위치된다.
일 실시형태에서, 리포터 유전자는 알칼린 포스파타제, 루시페라제, 베타-갈락토시다제, 베타-글루쿠로니다제, 녹색 형광 단백질(green fluorescent protein: GFP), 증강된 녹색 형광 단백질(enhanced green fluorescent protein: EGFP), 시안 형광 단백질(cyan fluorescent protein: CFP), 황색 형광 단백질(yellow fluorescent protein: YFP), DsRed 및 ZsGreen으로 이루어진 군으로부터 선택된 리포터 단백질을 암호화한다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 분화된 체세포의 게놈에서 전사적으로 활성인 좌위에 위치된다. 일 실시형태에서, 전사적으로 활성인 좌위는 ROSA26 좌위이다. 일 실시형태에서, 전사적으로-활성인 좌위는 CH25h 좌위이다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre 재조합효소이다.
일 실시형태에서, Cre 재조합효소는 인트론 서열을 포함한다. 일 실시형태에서, Cre 재조합효소는 핵 위치 신호(nuclear localization signal: NLS)를 포함한다. 일 실시형태에서, Cre 재조합효소는 인트론 서열과 핵 위치 신호(NLS)를 둘 다 포함한다.
일 실시형태에서, 제1 재조합 부위 및 제2 재조합 부위는 loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT 및 Dre 부위로 이루어진 군으로부터 선택된다.
일 양태에서, 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생산하기 위한 방법이 제공되되, 상기 방법은,
(a) 비-인간 동물의 분화된 체세포 내로 핵산 작제물을 도입하여 유전자 변형된 게놈을 생성하는 단계;
(b) (a)의 유전자 변형된 게놈을 제핵 숙주 난모세포 내로 전달하는 단계;
(c) (b)의 난모세포를 융합 및 활성화시켜 인공 접합자를 형성하는 단계;
(d) 접합자가 배반포 배아기에 도달될 때까지 (c)의 인공 접합자를 배양시키는 단계; 및
(e) (d)의 배반포를 대리모의 자궁 내로 이식하여 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 형성하는 단계를 포함하되,
핵산 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하며, 재조합효소 발현 작제물은, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다. 일단 분화된 체세포의 변형된 게놈이 제핵 숙주 난모세포 내로 전달되고, 인공적으로 생성된 접합자는 클로닝된 배아로 발생되게 한다면, ES 세포-특이적 전사 인자가 다능성 줄기 세포에서 활성인 경우, 선택적 마커 및 재조합효소 유전자는 클로닝된 배아의 게놈으로부터 제거된다.
일 실시형태에서, 핵산 작제물은 표적화 작제물이다. 일 실시형태에서, 표적화 작제물은 넉아웃 대립유전자를 포함한다. 일 실시형태에서, 표적화 작제물은 녹-인 대립유전자를 포함한다. 일 실시형태에서, 핵산 작제물은 전이유전자를 포함한다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된다.
다양한 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이에 위치된 제2 발현 카세트를 포함하되, 제2 발현 카세트는 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 다른 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 하류에 위치된다.
일 실시형태에서, 선택적 마커 유전자에 작동가능하게 연결된 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 선택적 마커 유전자를 포함하지 않고, 선택적 마커 유전자는 분화된 체세포의 게놈에서 다른 다른 좌위에(예를 들어, 트랜스로) 위치되되, 선택적 마커 유전자는, 선택적 마커가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향된 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 분화된 체세포는 게놈 내에 조건적 넉아웃 대립유전자를 포함하되, 조건적 넉아웃 대립유전자는, 조건적 대립유전자가 부위-특이적 재조합효소의 존재에서 게놈으로부터 제거될 수 있도록 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 조건적 넉아웃 대립유전자는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된다. 일 실시형태에서, 엑손은 내인성 유전자의 제1 엑손이다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위와 제2 재조합 부위의 상류 및 하류에 측접된다.
일 실시형태에서, 핵산 작제물은 표적화 작제물이며, 표적화 작제물의 표적화 암(arm)은, 전체 내인성 유전자가 상동성 재조합을 통해 표적화 작제물로 대체될 수 있도록, 내인성 유전자의 개시 코돈 상류의 5'-미번역 영역(UTR) 및 내인성 유전자의 정지 코돈 하류의 3'-미번역 영역(UTR)을 포함한다. 일 실시형태에서, 표적화 암은 내인성 유전자의 개시 코돈의 상류 가까이에 5'-UTR 영역을 포함한다. 일 실시형태에서, 표적화 암은 내인성 유전자의 정지 코돈의 하류 가까이에 3' 미번역 영역을 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된 영역의 외부에 위치된다. 일 실시형태에서, 변형된 서열은 적어도 하나의 엑손의 녹-인 대립유전자이다. 일 실시형태에서, 변형된 서열은 전체 유전자의 녹-인 대립유전자이다(즉, "유전자-스왑 녹-인"). 녹-인 대립유전자는 대립유전자를 함유하는 동물에 대해 바람직한 특징, 예컨대 개선된 질환 내성 또는 더 큰 크기(예를 들어, 더 큰 근육 크기)를 부여하는 대립유전자일 수 있다. 일 실시형태에서, 핵산 작제물은 전이유전자 서열을 추가로 포함하되, 전이유전자 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역 외부에 위치된다. 일 실시형태에서, 전이유전자 서열은 인간 단백질(예를 들어, 인슐린, 알파-락트알부민, 트랜스페린, 인간 혈청 알부민, 인간 성장 호르몬, 혈액 응고 인자 등)을 암호화한다. 일 실시형태에서, 전이유전자 서열은 치료제(예를 들어, 치료적 항체)를 암호화한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 내인성 유전자의 넉아웃 대립유전자이다. 일 실시형태에서, 넉아웃 대립유전자는 리포터 유전자를 포함하되, 리포터 유전자의 5'은, 리포터 유전자의 전사가 내인성 유전자를 촉진시키는 내인성 프로모터에 의해 개시되고, 내인성 유전자의 전사가 없어지도록, 내인성 유전자의 개시 코돈(ATG)의 상류 가까이에 뉴클레오타이드 서열(즉, 5'-미번역 영역(5'-UTR))을 포함한다.
일 실시형태에서, 리포터 유전자는 제1 재조합 부위의 상류에 위치된다. 일 실시형태에서, 리포터 유전자는 녹색 형광 단백질(GFP), 증강된 녹색 형광 단백질(EGFP), 시안 형광 단백질(CFP), 황색 형광 단백질(YFP), DsRed, ZsGreen 및 lacZ로 이루어진 군으로부터 선택된 리포터 단백질을 암호화한다.
일 실시형태에서, 분화된 체세포의 유전자 변형된 게놈은 체세포 핵 전달 기법(somatic cell nuclear transfer technique: SCNT)을 통해 제핵 숙주 난모세포 내로 전달된다.
일 실시형태에서, 분화된 체세포의 유전적으로-변형된 게놈은 제핵 숙주 난모세포의 위란강(즉, 투명대와 세포막 사이의 공간) 내로 미세주사된다.
일 실시형태에서, 발현 작제물은 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시적으로 활성인 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소의 하류에 위치된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된 약물 내성 유전자이다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre, Flp, 및 Dre 재조합효소로 이루어진 군으로부터 선택된다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre 재조합효소이다.
일 실시형태에서, Cre 재조합효소는 인트론 서열을 포함한다. 일 실시형태에서, Cre 재조합효소는 핵 위치 신호(NLS)를 포함한다. 일 실시형태에서, Cre 재조합효소는 인트론 서열과 핵 위치 신호(NLS)를 둘 다 포함한다.
일 실시형태에서, 제1 재조합 부위와 제2 재조합 부위는 loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT 및 Dre 부위로 이루어진 군으로부터 선택된다.
일 양태에서, 돼지 또는 젖소의 체세포를 유전자 변형시켜 다능성 세포에서 활성인 프로모터에 의해 촉진되는 재조합효소 유전자, 및 재조합효소 부위에 측접되는 선택 유전자를 포함하는 자가-절단성 카세트를 포함하도록 체세포를 유전자 변형시켜 유전자 변형된 돼지 또는 젖소 게놈을 형성하는 단계; 및 유전자 변형된 게놈을 적합한 난모세포 내로 도입하는 단계, 난모세포를 배반포 단계로 배양시키는 단계, 적합한 대리모에서 배반포를 임신시키는 단계, 및 배반포를 유전자 변형된 자손으로 발생시키는 단계를 포함하는, 유전자 변형된 젖소 또는 돼지의 제조 방법이 제공된다.
일 양태에서, 분화된 체세포로부터 유전자 변형된 게놈을 포함하는 비-인간 동물의 클로닝된 난모세포가 제공되되, 유전자 변형된 게놈은 부위-특이적 재조합효소 유전자가 ES 세포-특이적 프로모터에 작동가능하게 연결된 자가-절단가능한 재조합효소 발현 카세트를 함유하는 핵산 작제물을 포함하며, 재조합효소 발현 카세트는, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 재조합 부위에 측접된다.
일 실시형태에서, 비-인간 동물은 마우스, 래트, 토끼, 조류, 소, 돼지, 양, 염소, 말 및 당나귀로 이루어진 군으로부터 선택된다.
일 실시형태에서, 분화된 체세포는 피부 세포, 혈액 세포, 신경 세포, 근육 세포, 뼈 세포, 간 세포, 및 지방 세포로 이루어진 군으로부터 선택된다.
일 실시형태에서, 분화된 체세포는 섬유아세포이다. 일 실시형태에서, 섬유아세포는 마우스, 래트, 토끼, 조류, 젖소, 돼지, 양, 염소, 말 및 당나귀로 이루어진 군으로부터 선택된 비-인간 동물로부터 유래된다. 일 실시형태에서, 섬유아세포는 돼지로부터 유래된다. 더 구체적인 실시형태에서, 돼지는 미니 돼지이다. 일 실시형태에서, 섬유아세포는 젖소로부터 유래된다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된다.
일 실시형태에서, 핵산 작제물은 제1 재조합 부위와 제2 재조합 부위 사이에 제2 발현 카세트를 포함하되, 제2 발현 카세트는 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 다른 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 하류에 위치된다.
일 실시형태에서, 선택적 마커 유전자에 작동가능하게 연결된 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 선택적 마커 유전자를 포함하지 않으며, 선택적 마커 유전자는 분화된 체세포의 게놈에서 다른 다른 좌위에(예를 들어, 트랜스로) 위치되되, 선택적 마커 유전자는, 선택적 마커 유전자가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향된 제3 재조합 부위 및 제4 재조합 부위의 하류에 측접된다. 일 실시형태에서, 분화된 체세포는 게놈 내에 조건적 넉아웃 대립유전자를 포함하되, 조건적 넉아웃 대립유전자는, 조건적 대립유전자가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록, 제1 재조합 부위와 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 조건적 넉아웃 대립유전자는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 추가로 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다. 더 구체적인 실시형태에서, 엑손은 내인성 유전자의 제1 엑손이다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다.
일 실시형태에서, 핵산 작제물은, 전체 내인성 유전자가 상동성 재조합을 통해 핵산 작제물로 대체될 수 있도록, 내인성 유전자의 개시 코돈 상류의 5'-미번역 영역(UTR) 및 내인성 유전자의 정지 코돈의 3'-미번역 영역(UTR)을 포함한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된 영역 외부에 위치된다. 일 실시형태에서, 변형된 서열은 내인성 유전자의 적어도 하나의 엑손의 녹-인 대립유전자이다. 일 실시형태에서, 변형된 서열은 전체 내인성 유전자의 녹-인 대립유전자이다(즉, "유전자-스왑 녹-인"). 녹-인 대립유전자는 대립유전자를 함유하는 동물에 대해 바람직한 특징, 예컨대 개선된 질환 내성 또는 더 큰 크기(예를 들어, 더 큰 근육 크기)를 부여하는 대립유전자일 수 있다. 일 실시형태에서, 핵산 작제물은 전이유전자 서열을 추가로 포함하되, 전이유전자 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역 외부에 위치된다. 일 실시형태에서, 전이유전자 서열은 인간 단백질(예를 들어, 인슐린, 알파-락트알부민, 트랜스페린, 인간 혈청 알부민, 인간 성장 호르몬, 혈액 응고 인자 등)을 암호화한다. 일 실시형태에서, 전이유전자 서열은 치료제(예를 들어, 치료적 항체)를 암호화한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 내인성 유전자의 넉아웃 대립유전자이다. 일 실시형태에서, 넉아웃 대립유전자는 리포터 유전자를 포함하되, 리포터 유전자의 5'은, 리포터 유전자의 전사가 내인성 유전자의 발현을 촉진시키는 내인성 프로모터에 의해 개시될 수 있고, 내인성 유전자의 전사가 없어질 수 있도록, 내인성 유전자의 개시 코돈(ATG)의 상류 가까이에 뉴클레오타이드 서열(즉, 5' 미번역 영역(5'-UTR))을 포함한다.
일 실시형태에서, 리포터 유전자는 제1 재조합 부위의 상류에 위치된다.
일 실시형태에서, 리포터 유전자는 알칼린 포스파타제, 루시페라제, 베타-갈락토시다제, 베타-글루쿠로니다제, 녹색 형광 단백질(GFP), 증강된 녹색 형광 단백질(EGFP), 시안 형광 단백질(CFP), 황색 형광 단백질(YFP), DsRed 및 ZsGreen로 이루어진 군으로부터 선택된 수용체 단백질을 암호화한다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 분화된 체세포의 게놈에서 전사적으로 활성인 좌위에 위치된다. 일 실시형태에서, 전사적으로 활성인 좌위는 ROSA26 좌위이다. 일 실시형태에서, 전사적으로-활성인 좌위는 CH25h 좌위이다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre 재조합효소이다.
일 실시형태에서, Cre 재조합효소는 인트론 서열을 포함한다. 일 실시형태에서, Cre 재조합효소는 핵 위치 신호(NLS)를 포함한다. 일 실시형태에서, Cre 재조합효소는 인트론 서열과 핵 위치 신호(NLS)를 둘 다 포함한다.
일 실시형태에서, 제1 재조합 부위와 제2 재조합 부위는 loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT, 및 Dre 부위로 이루어진 군으로부터 선택된다.
일 실시형태에서, ES 세포-특이적 프로모터는 클로닝된 난모세포에서 활성이 아니다. 일 실시형태에서, ES 세포-특이적 프로모터의 활성이 리간드 없이 끊어지지만, 프로모터 활성은 적합한 리간드, 예를 들어 테트라사이클린의 투여 후에, ES-세포 특이적 전사 인자의 존재에서 켜지는 방법으로, ES 세포-특이적 프로모터는 리간드-유도성 프로모터, 예를 들어, 테트라사이클린(tet) 온/오프 시스템에 결합된다.
일 양태에서, 다능성 세포에서 활성인 프로모터에 의해 촉진되는 부위-특이적 재조합효소 유전자 및 재조합효소 부위에 측접되는 선택 유전자를 포함하는 자가-절단성 카세트를 포함하도록 돼지 또는 젖소의 체세포를 유전자 변형시켜 유전자 변형된 돼지 또는 젖소 게놈을 형성하는 단계; 및 유전자 변형된 게놈을 적합한 난모세포 내로 도입하는 단계, 난모세포를 배반포 단계로 배양시키는 단계, 적합한 대리모에서 배반포를 임신시키는 단계, 및 배반포를 유전자 변형된 자손으로 발생시키는 단계를 포함하는, 선택 유전자가 없는 F0 발생에서 유전자 변형된 젖소 또는 돼지의 제조 방법이 제공된다.
일 양태에서, (a) (i) ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 함유하는 자가-절단가능한 재조합효소 발현 카세트를 포함하는 제1 핵산 작제물; 및 (ii) ES 세포-특이적 전사 인자를 암호화하는 유전자를 포함하는 제2 핵산 작제물을 포함하는 조성물을 젖소 또는 돼지의 분화된 체세포 내로 도입하는 단계를 포함하는, 젖소 또는 돼지의 분화된 체세포의 게놈을 변형시키는 방법이 제공되되,
재조합효소 발현 카세트는, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록, 서로에 대해 동일한 방향으로 배향된 재조합 부위에 측접되고,
ES 세포-특이적 전사 인자는 ES 세포-특이적 프로모터를 활성화시킬 수 있다.
일 실시형태에서, ES 세포-특이적 전사 인자는 Oct-3/4, Sox2, c-Myc, Kif4, Nanog 및 Lin28로 이루어진 군으로부터 선택된 적어도 하나이다. 일 실시형태에서, 적어도 하나의 ES 세포-특이적 전사 인자는 분화된 체세포를 다능성 줄기 세포로 재프로그래밍할 수 있다.
일 실시형태에서, 핵산 작제물은 표적화 작제물이다. 일 실시형태에서, 표적화 작제물은 넉아웃 대립유전자를 포함한다. 일 실시형태에서, 표적화 작제물은 녹-인 대립유전자를 포함한다. 일 실시형태에서, 핵산 작제물은 전이유전자를 포함한다.
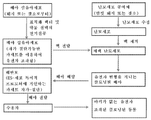
도 1은 유전자 조작되고 클로닝된 비-인간 동물을 생성하기 위한 단계를 도시한 도면;
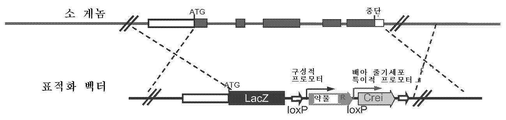
도 2는 마커가 없는 유전자 변형된 비-인간 동물을 발생시키기 위한 자가-절단가능한 카세트를 도시한 도면;
도 3은 선택적 마커가 없는 유전자 조작되고 클로닝된 비-인간 동물을 생성하기 위한 단계를 도시한 도면;
도 4는 유전자 변형 및 클로닝된 비-인간 동물을 생성하기 위한 플랫폼을 도시한 도면.
도 2는 마커가 없는 유전자 변형된 비-인간 동물을 발생시키기 위한 자가-절단가능한 카세트를 도시한 도면;
도 3은 선택적 마커가 없는 유전자 조작되고 클로닝된 비-인간 동물을 생성하기 위한 단계를 도시한 도면;
도 4는 유전자 변형 및 클로닝된 비-인간 동물을 생성하기 위한 플랫폼을 도시한 도면.
용어
본 명세서에서 사용되는 용어 "클로닝"은 본래의 유기체의 동일한 복제물을 생성하는 방법을 포함한다.
본 명세서에서 사용되는 용어 "배아 줄기 세포" 또는 "ES 세포"는 배아 내로 도입 시, 발생 배아의 임의의 조직에 기여할 수 있는 미분화된 내부 덩어리 세포로부터 유래된 줄기 세포를 포함한다.
본 명세서에서 사용되는 어구 "작동가능하게 연결된"은 프로모터가 단백질을 암호화하는 뉴클레오타이드 서열의 발현을 제어하는 그러한 방법으로 단백질을 암호화하는 다른 뉴클레오타이드 서열에 프로모터를 암호화하는 뉴클레오타이드 서열을 연결하는 것을 포함한다.
본 명세서에서 사용되는 용어 "프로모터" 및 "프로모터 조절 구성요소" 등은 해당 유전자의 발현을 제어하는 핵산 단편 또는 유전자 내에서 뉴클레오타이드 서열 구성요소를 포함한다. 이들은 또한 발현 제어 서열을 포함할 수 있다. 다양한 공급원으로부터의 프로모터 조절 구성요소 등은 프로모터 유전자 발현에 효율적으로 사용될 수 있다. 프로모터 조절 구성요소는 항시적, 조직-특이적, 발생-특이적, 유도성, 서브 게놈 프로모터 등을 포함하는 것을 의미한다. 프로모터 조절 구성요소는 또한 전사 효율을 개선 또는 조절하는 특정 인핸서 구성요소 또는 침묵 구성요소를 포함할 수 있다.
본 명세서에 사용되는 바와 같은 용어 "항시성 프로모터" 및 "항시적으로 활성인 프로모터"는 대부분의 시간에 대부분의 세포 또는 조직에서 유전자의 전사를 지시하는 조절 서열을 포함한다.
본 명세서에 사용되는 바와 같은 용어 "다능성 줄기 세포" 또는 "다분화능 줄기 세포"는 하나 이상의 분화된 세포 유형으로 발생하는 능력을 소유하는 미분화된 세포를 포함한다.
본 명세서에 사용되는 바와 같은 용어 "재조합 부위"는 부위-특이적 재조합효소에 의해 인식되고 재조합 사건에 대한 기질로서 작용할 수 있는 뉴클레오타이드 서열을 포함한다.
본 명세서에 사용되는 바와 같은 용어 "부위-특이적 재조합효소"는, 2개의 재조합 부위가 단일 핵산 분자 내에서 또는 별개의 핵산 분자 상에서 물리적으로 분리된 경우, "재조합 부위" 간의 재조합을 용이하게 할 수 있는 효소의 그룹을 포함한다. "부위-특이적 재조합효소"의 예는 Cre, Flp 및 Dre 재조합효소를 포함하지만, 이들로 제한되지 않는다.
본 명세서에 사용된 바와 같은 용어 "체세포"는 단일 세트의 염색체(n)를 갖는 생식세포를 제외하고, 2개 세트의 염색체(2n)를 갖는 유기체의 신체를 구성하는 임의의 세포를 포함한다.
본 명세서에서 사용된 바와 같은 용어 "체세포 핵 전달" 또는 "SCNT"는 공여체 동물, 예컨대 양, 소, 돼지, 염소, 토끼, 래트 또는 마우스로부터의 체(신체) 세포의 핵이 제핵 난자(그 자체의 핵이 제거된 난자)의 세포질에 전달되는 기법을 포함한다. 핵에 본 방법에 의한 유전자 변형이 실시될 수 있다. 일단 난자의 내부라면, 체세포 핵은 난자 세포질 인자에 의해 재프로그래밍되어 접합자(수정란) 핵이 된다. 이어서, 수정란은 시험관내에서, 예를 들어, 배반포 단계로 발생된 다음에, 수정란으로부터 클론 유래된 세포를 함유하고 전달된 핵에 도입된 임의의 유전자 변형을 갖는 새끼를 낳는 공여체와 전형적으로 동일한 종의 수용 동물에 전달될 수 있다. 유방 상피세포, 난구 세포, 피부 및 장기로부터의 섬유아세포 세포, 다양한 장기 세포, 세르톨리 세포, 대식 세포 및 혈액 백혈구를 포함하는 다수의 체세포 유형이 사용될 수 있다(예를 들어, 문헌[Tian et al., Reproductive Biology and Endocrinology1, 1-7 (2003)] 참조.
자가-절단가능한 재조합효소 발현 카세트를 포함하는 체세포
유전자 변형 후에 숙주 세포 또는 숙주 동물로부터 선택적 마커 및 재조합효소 유전자를 제거하기 위한 다수의 노력이 있었다. 예를 들어, 재조합 부위, 예를 들어, loxP 또는 FRT에 측접된 선택적 마커 유전자를 제거하기 위해, 부위-특이적 재조합효소 유전자는, 예를 들어, 미세주사, 형질감염을 통해 ES 세포 또는 수정란 내로 도입되거나 또는 바이러스 입자를 통해 형질도입된다. 대안적으로, 선택 카세트를 운반하는 동물은 동일한 효과를 수행하기 위해 부위-특이적 재조합효소를 발현시키는 제거자 균주로 번식된다. 그러나, 이들 기법은 ES 세포 내의 저수준의 형질감염 효율; 연장된 시험관내 배양에 기인하는 ES 세포 다능성의 감소; 및 추가 번식 단계에 필요한 추가적인 인간 및 재원을 포함하는, 다수의 문제점이 있다.
본 발명은 ES 세포-특이적 프로모터에 의해 촉진된 자가-절단가능한 부위-특이적 재조합효소 유전자를 분화된 체세포 내로 도입한 다음, 분화된 체세포의 유전자 변형된 게놈을, 예를 들어 체세포 핵 전달(SCNT) 기법을 통해 제핵 숙주 난모세포 내로 전달함으로써 유전자 변형 후에 비-인간 동물로부터 선택적 마커 및 재조합효소 유전자를 제거하는 신규한 접근을 제공한다. 융합 및 활성화 시, 체세포의 유전자 변형된 게놈을 포함하는 인공적으로 생성된 접합자는, 그것이 배반포 단계에 도달될 때까지 시험관내에서 배양되고 전체 발생 동안 대리모 내로 이식된다(예를 들어, 문헌[Gong et al., Generation of cloned calves from different types of somatic cells, Sci China C Life Sci, 2004, 47:470-476] 참조; 본 명세서에 그의 전문이 참조로서 포함됨). 인공적으로 생성된 접합자의 발생 동안, ES 세포-특이적 전사 인자가 활성인 경우, 부위-특이적 재조합효소는 다능성 줄기 세포에서 발현되고 활성으로 되며, 선택적 마커 및 재조합효소 유전자는 클로닝된 배아의 게놈으로부터 결실되게 된다. 이런 방법으로, 상기 방법은 ES 세포의 조작 또는 선택적 마커 및 재조합효소 유전자를 제거하는데 필요한 임의의 추가 번식 단계에 대한 필요를 제거한다.
ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 유전자 조작된 비-인간 동물의 비분화 체세포가 제공되되, 부위-특이적 재조합효소 유전자는 미분화 다능성 줄기 세포 내, 예를 들어 배반포-단계 배아의 내부 세포 덩어리 내 ES 세포에서 발현되지만, 분화된 체세포에서는 발현되지 않는다.
일 양태에서, 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 유전자 조작된 비-인간 동물의 분화된 체세포가 제공되되, 자가-절단가능한 재조합효소 발현 카세트는 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소를 포함하고, 부위-특이적 재조합효소 유전자는, 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 하류에 측접되며, ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 체세포에서는 그렇지 않다.
일단 분화된 체세포의 변형된 게놈이 제핵 숙주 난모세포 내로 전달된다면, 그리고 일단 인공적으로 생성된 접합자가 배아 내로 발생된다면, 선택적 마커 및 재조합효소 유전자는 발생 중인 클로닝된 배아의 게놈으로부터 제거될 수 있다.
일 실시형태에서, 분화된 체세포는, 피부 세포, 혈액 세포, 신경 세포, 근육 세포, 뼈 세포, 신장 세포, 간 세포 및 지방 세포를 포함하지만, 이들로 제한되지 않는다.
일 실시형태에서, 분화된 체세포는 섬유아세포이다. 섬유아세포는 마우스, 래트, 토끼, 조류, 젖소, 돼지, 양, 염소, 말 및 당나귀를 포함하지만, 이들로 제한되지 않는 임의의 비-인간 동물로부터 유래될 수 있다. 일 실시형태에서, 섬유아세포는 돼지로부터 유래된다. 더 구체적인 실시형태에서, 돼지는 미니 피그이다. 일 실시형태에서, 섬유아세포는 젖소로부터 유래된다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된다.
일 실시형태에서, ES 세포-특이적 프로모터는 배반포-단계 배아의 ES 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시킨다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이의 제2 발현 카세트를 포함하되, 제2 발현 카세트는 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 다른 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 하류에 위치된다.
일 실시형태에서, 선택적 마커 유전자에 작동가능하게 연결된 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 선택적 마커 유전자를 포함하지 않으며, 선택적 마커 유전자는 체세포의 게놈에서 다른 좌위에(예를 들어, 트랜스로) 위치되되, 선택적 마커 유전자는, 선택적 마커가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향되는 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접된다.
일 실시형태에서, 분화된 체세포는 게놈 내에 조건적 넉아웃 대립유전자를 포함하되, 조건적 대립유전자가 부위-특이적 재조합효소의 존재에서 제거될 수 있는 방법으로 조건적 넉아웃 대립유전자는 제1 재조합 부위와 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 조건적 넉아웃 대립유전자는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 포함한다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다. 더 구체적인 실시형태에서, 엑손은 내인성 유전자의 제1 엑손이다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은, 전체 내인성 유전자가 상동성 재조합을 통해 표적화 작제물로 대체될 수 있도록 내인성 유전자의 개시 코돈의 상류의 5'-미번역 영역(UTR) 및 내인성 유전자의 정지 코돈의 하류의 3'-미번역 영역(UTR)을 포함한다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 제1 재조합 부위와 제2 재조합 부위에 측접된 영역 외부에 위치된다. 일 실시형태에서, 변형된 서열은 내인성 유전자의 적어도 하나의 엑손의 녹-인 대립유전자이다. 일 실시형태에서, 변형된 서열은 전체 내인성 유전자의 녹-인 대립유전자이다(즉, "유전자-스왑 녹-인"). 녹-인 대립유전자는 대립유전자를 함유하는 동물에 대해 바람직한 특징, 예컨대 개선된 질환 내성 또는 더 큰 크기(예를 들어, 더 큰 근육 크기)를 부여하는 대립유전자일 수 있다. 일 실시형태에서, 핵산 작제물은 전이유전자 서열을 추가로 포함하되, 전이유전자 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역 외부에 위치된다. 일 실시형태에서, 전이유전자 서열은 인간 단백질(예를 들어, 인슐린, 알파-락트알부민, 트랜스페린, 인간 혈청 알부민, 인간 성장 호르몬, 혈액 응고 인자 등)을 암호화한다. 일 실시형태에서, 전이유전자 서열은 치료제(예를 들어, 치료적 항체)를 암호화한다.
일 실시형태에서, 핵산 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 내인성 유전자의 넉아웃 대립유전자이다. 일 실시형태에서, 넉아웃 대립유전자는 리포터 유전자를 포함하되, 리포터 유전자의 5'은, 리포터 유전자의 전사가 내인성 유전자의 발현을 촉진시키는 내인성 프로모터에 의해 개시될 수 있고, 내인성 유전자의 전사가 없어질 수 있도록 내인성 유전자의 개시코돈(ATG)의 상류 가까이에 뉴클레오타이드 서열(즉, 5' 미번역 영역(5'-UTR))을 포함한다.
일 실시형태에서, 리포터 유전자는 제1 재조합 부위의 상류에 위치된다.
일 실시형태에서, 리포터 유전자는 알칼린 포스파타제, 루시페라제, 베타-갈락토시다제, 베타-글루쿠로니다제, 녹색 형광 단백질(GFP), 증강된 녹색 형광 단백질(EGFP), 시안 형광 단백질(CFP), 황색 형광 단백질(YFP), DsRed 및 ZsGreen으로 이루어진 군으로부터 선택된 리포터 단백질을 암호화한다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 분화된 체세포의 게놈 내에 전사적으로 활성인 좌위에 위치된다. 일 실시형태에서, 전사적으로 활성인 좌위는 ROSA26 좌위이다. 일 실시형태에서, 전사적으로-활성인 좌위는 CH25h 좌위이다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre 재조합효소이다.
일 실시형태에서, Cre 재조합효소는 인트론 서열을 포함한다. 일 실시형태에서, Cre 재조합효소는 핵 위치 신호(NLS)를 포함한다. 일 실시형태에서, Cre 재조합효소는 인트론 서열과 핵 위치 신호(NLS)를 둘 다 포함한다.
일 실시형태에서, 제1 재조합 부위 및 제2 재조합 부위는 loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT 및 Dre 부위로 이루어진 군으로부터 선택된다.
유전자 변형 및
클로닝된
동물의 생산
본 발명은 특이적 좌위에서 ES 세포-특이적 프로모터에 의해 촉진된 자가-절단가능한 재조합효소 발현 카세트를 보유하도록 비-인간 동물의 분화된 체세포, 예를 들어 섬유아세포를 유전자 변형시키기 위한 전략을 사용한다. 선택 카세트 제거를 위해 시험관내에서 ES 세포를 조작하는 대신에, 유전자 변형된 체세포의 핵은 제핵 숙주 난모세포 내로 전달되어 클로닝된 배아의 발생 동안 다능성 줄기 세포 내 선택 카세트의 결실 및 게놈의 재프로그래밍을 유발한다. 이런 방법으로, 유전자 변형된 체세포로부터 클로닝된 선택적 마커가 없는 비-인간 동물은 부위-특이적 재조합효소를 발현시키는 제거자 균주에 대해 ES 세포를 조작하거나 또는 선택 카세트-함유 동물을 번식시킬 필요 없이 생산될 수 있다.
본 발명의 방법은 임의의 유전자 변형 및 클로닝된 비-인간 동물을 생산함에 있어 사용될 수 있다. 비-인간 동물의 비제한적 예는 설치류(예를 들어, 마우스, 래트), 토끼, 조류(예를 들어, 닭, 칠면조, 오리, 거위 등), 젖소, 돼지, 양, 염소, 말 및 당나귀를 포함한다. 바람직한 실시형태에서, 비-인간 동물은 돼지 또는 젖소 중 하나이다.
일 양태에서, 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생산하는 방법이 제공되되, 상기 방법은,
(a) 비-인간 동물의 분화된 체세포 내로 표적화 작제물을 도입하여 유전자 변형된 게놈을 생성하는 단계;
(b) (a)의 유전자 변형된 게놈을 제핵 숙주 난모세포 내로 전달하는 단계;
(c) (b)의 난모세포를 융합 및 활성화시켜 인공 접합자를 형성하는 단계;
(d) 접합자가 배반포 배아기에 도달될 때까지 시험관내에서 (c)의 인공 접합자를 배양시키는 단계; 및
(e) (d)의 배반포를 대리모의 자궁 내로 이식하여 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 형성하는 단계를 포함하되,
표적화 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하며, 재조합효소 발현 작제물은, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있는 방식으로 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접하며, ES 세포-특이적 프로모터는 발생 중인 클로닝된 배아에서 미분화 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다.
일 실시형태에서, 미분화 다능성 줄기 세포는 배반포-단계 배아의 내부 세포 덩어리(inner cell mass: ICM) 내 ES 세포이다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터 및 Lin28 프로모터로 이루어진 군으로부터 선택된다.
화학적으로 기반한 형질감염(예를 들어, 인산칼슘, 양이온성 지질, 예컨대 리포펙틴 또는 리포펙타민, 및 양이온성 중합체, 예컨대 DEAE-덱스트란 또는 덴드리머), 물리적 형질감염 기법(예를 들어, 미세주사, 바이오리스틱(biolistic) 입자 전달, 예컨대 유전자총, 지질-기반 형질감염, 전기천공법, 초음파천공법, 자기 나노입자, 및 레이저-조사), 및 자가-절단가능한 재조합효소 발현 카세트를 운반하는 바이러스 입자와 같은 생물학적 작용제를 통한 형질도입을 포함하지만, 이들로 제한되지 않는, 다양한 유전자 전달 기법이 자가-절단가능한 재조합 발현카세트를 분화된 체세포 내로 도입하기 위해 사용될 수 있다. 특히 표적화 작제물은 크기가 클 때에, 유전자 전달을 달성하기 위해 전기천공법이 널리 사용된다. 예를 들어, 참조로서 포함되는 문헌[Kim & Eberwine (2010), Anal. Bioanal. Chem. 397:3173-78]을 포함하는, 유전자 전달 기법이 기재된다. 일부 실시형태에서, 바이러스 입자는 아데노바이러스, 아데노-관련 바이러스, SV-40, 엡스타인-바르 바이러스, 레트로바이러스, 렌티바이러스, 바큘로바이러스, 코로나바이러스, 단순포진 바이러스, 폴리오바이러스, 셈리키 삼림열 바이러스, 신드비스 바이러스 및 백시니아 바이러스로 이루어진 군으로부터 선택된 바이러스로부터 유래된다.
분화된 체세포의 유전자 변형된 게놈을 함유하는 핵은 당업계에 공지된 임의의 방법을 사용하여 제핵 숙주 난모세포 내로 전달될 수 있다(예를 들어, 본 명세서에 그의 전문이 참조로서 포함되는 문헌[Gong et al., Generation of cloned calves from different types of somatic cells, Sci China C Life Sci, 2004, 47:470-476] 참조). 일 실시형태에서, 체세포의 유전자 변형된 게놈은 체세포 핵 전달 기법(SCNT)을 통해 제핵 숙주 난모세포 내로 전달된다.
다양한 실시형태에서, 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이에 위치된 제2 발현 카세트를 포함하되, 제2 발현 카세트는 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 다른 실시형태에서, 선택적 마커는 부위-특이적 재조합효소 유전자의 하류에 위치된다.
일 실시형태에서, 선택적 마커 유전자에 작동가능하게 연결된 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된다.
일 실시형태에서, 자가-절단가능한 재조합효소 발현 작제물은 선택적 마커 유전자를 포함하지 않으며, 선택적 마커 유전자는 분화된 체세포의 게놈 내의 다른 다른 좌위에(예를 들어, 트랜스로) 위치되되, 선택적 마커 유전자는, 선택적 마커가 부위-특이적 재조합효소의 존재에서 제거될 수 있도록, 서로에 대해 동일한 방향으로 배향된 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 분화된 체세포는 게놈 내에서 조건적 넉아웃 또는 녹-인 대립유전자를 포함하되, 조건적 넉아웃 또는 녹-인 대립유전자가 부위-특이적 재조합효소의 존재에서 게놈으로부터 제거될 수 있도록 조건적 넉아웃 또는 녹-인 대립유전자는 제1 재조합 부위와 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 조건적 넉아웃 또는 녹-인 대립유전자는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 포함한다.
일 실시형태에서, 표적화 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위와 제2 재조합 부위의 상류 및 하류에 측접된다. 일 실시형태에서, 엑손은 내인성 유전자의 제1 엑손이다.
일 실시형태에서, 표적화 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된다.
일 실시형태에서, 표적화 작제물의 표적화 암은, 전체 내인성 유전자가 상동성 재조합을 통해 표적화 작제물로 대체될 수 있도록 내인성 유전자의 개시 코돈의 상류의 5'-미번역 영역(UTR) 및 내인성 유전자의 정지 코돈의 하류의 3'-미번역 영역(UTR)을 포함한다. 일 실시형태에서, 표적화 암은 개시 코돈의 상류 가까이에 5'-UTR을 포함한다. 일 실시형태에서, 표적화 암은 내인성 유전자의 중단 코돈의 하류 가까이에 3'-UTR을 포함한다.
일 실시형태에서, 표적화 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접된 영역 외부에 위치된다. 일 실시형태에서, 변형된 서열은 내인성 유전자의 적어도 하나의 엑손의 녹-인 대립유전자이다. 일 실시형태에서, 변형된 서열은 전체 유전자의 녹-인 대립유전자이다(즉, "유전자-스왑 녹-인"). 녹-인 대립유전자는 대립유전자를 함유하는 동물에 대해 바람직한 특징, 예컨대 개선된 질환 내성 또는 더 큰 크기(예를 들어, 더 큰 근육 크기)를 부여하는 대립유전자일 수 있다.
일 실시형태에서, 표적화 작제물은 전이유전자 서열을 추가로 포함하되, 전이유전자 서열은 제1 재조합 부위 및 제2 재조합 부위에 측접되는 영역 외부에 위치된다. 일 실시형태에서, 전이유전자 서열은 인간 단백질(예를 들어, 인슐린, 알파-락트알부민, 트랜스페린, 인간 혈청 알부민, 인간 성장 호르몬, 혈액 응고 인자 등)을 암호화한다. 일 실시형태에서, 전이유전자 서열은 치료제(예를 들어, 치료적 항체)를 암호화한다.
일 실시형태에서, 표적화 작제물은 표적화되고 있는 내인성 유전자의 변형된 서열을 추가로 포함하되, 변형된 서열은 내인성 유전자의 넉아웃 대립유전자이다. 일 실시형태에서, 넉아웃 대립유전자는 리포터 유전자를 포함하되, 리포터 유전자의 5'은, 리포터 유전자의 전사가 내인성 유전자를 촉진시키는 내인성 프로모터에 의해 개시될 수 있고, 내인성 유전자의 전사가 없어질 수 있도록 내인성 유전자의 개시코돈(ATG)의 상류 가까이에 뉴클레오타이드 서열(즉, 5' 미번역 영역(5'-UTR))을 포함한다.
일 실시형태에서, 리포터 유전자는 제1 재조합 부위의 상류에 위치된다. 일 실시형태에서, 리포터 유전자는 녹색 형광 단백질(GFP), 증강된 녹색 형광 단백질(EGFP), 시안 형광 단백질(CFP), 황색 형광 단백질(YFP), DsRed, ZsGreen 및 lacZ로 이루어진 군으로부터 선택된 리포터 단백질을 암호화한다.
일 실시형태에서, 분화된 체세포의 유전적으로-변형된 게놈은 숙주 제핵 난모세포의 위란강(즉, 투명대와 세포막 사이의 공간) 내로 미세주사된다.
일 실시형태에서, 발현 작제물은 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함한다. 일 실시형태에서, 프로모터는 항시성 프로모터이다. 일 실시형태에서, 항시성 프로모터는 Ubc 프로모터, hCMV 프로모터, mCMV 프로모터, EF-1 프로모터, Pgk1 프로모터, 베타-액틴 프로모터 및 ROSA26 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소 유전자의 상류에 위치된다. 일 실시형태에서, 선택적 마커 유전자는 부위-특이적 재조합효소의 하류에 위치된다.
일 실시형태에서, 선택적 마커는 네오마이신 포스포트랜스퍼라제(neor), 하이그로마이신 B 포스포트랜스퍼라제(hygr), 퓨로마이신-N아세틸트랜스퍼라제(puror), 블라스티시딘 S 데아미나제(bsrr), 잔틴/구아닌 포스포리보실 트랜스퍼라제(gpt) 및 단순포진 바이러스 티미딘 키나제(HSV-k)로 이루어진 군으로부터 선택된 약물 내성 유전자이다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된다.
일 실시형태에서, 부위-특이적 재조합효소는 Cre 재조합효소이다. 일 실시형태에서, Cre 재조합효소는 인트론 서열을 포함한다. 일 실시형태에서, Cre 재조합효소는 핵 위치 신호(NLS)를 포함한다. 일 실시형태에서, Cre 재조합효소는 인트론 서열과 핵 위치 신호(NLS)를 둘 다 포함한다.
일 실시형태에서, 제1 재조합 부위 및 제2 재조합 부위는 loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT 및 Dre 부위로 이루어진 군으로부터 선택된다.
일 양태에서, 선택적 마커 유전자 및 재조합효소 유전자가 없는 비-인간 동물의 유전자 변형 및 클로닝된 다능성 줄기 세포를 생성하기 위한 방법이 제공되며:
(a) 표적화 작제물을 비-인간 동물의 분화된 체세포 내로 도입하여 유전자 변형된 게놈을 생성하는 단계; 및
(b) (a)의 유전자 변형된 게놈을 다능성 줄기 세포 내로 전달하여 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 다능성 줄기 세포를 생성하는 단계를 포함하되,
표적화 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하며, 재조합효소 발현 작제물은, 부위-특이적 재조합효소가 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 동일 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되고, ES 세포-특이적 프로모터는 클로닝된 다능성 줄기 세포 내 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 분화된 체세포에서는 촉진시키지 않는다.
따라서, ES 세포-특이적 전사 인자가 활성인 경우, 선택적 마커 및 재조합효소 유전자는 분화된 체세포의 유전자 변형된 게놈의 다능성 줄기 세포 또는 다능성이 될 임의의 체세포 내로의 전달 후에 클로닝된 다능성 줄기 세포의 게놈으로부터 제거될 수 있다.
일 실시형태에서, ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터 및 Lin28 프로모터로 이루어진 군으로부터 선택된다.
일 실시형태에서, 다능성 줄기 세포는 비-인간 동물의 ES 세포이다.
일 실시형태에서, 다능성 줄기 세포는 유도된 다능성 줄기 세포(iPS 세포)이다.
일 실시형태에서, 전달 단계 (b)는 체세포 핵 전달(SCNT) 기법을 통해 수행된다.
달리 정의되지 않는 한, 본 명세서에서 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 기술분야의 당업자에 의해 통상적으로 이해되는 것과 동일한 의미를 가진다. 본 명세서에 기재된 것과 유사 또는 동일한 임의의 방법 및 재료가 기재된 본 발명의 실행 또는 시험에서 사용될 수 있지만, 바람직한 방법 및 재료가 이제 기재된다. 본 명세서에 언급된 모든 간행물은 간행물이 인용한 것과 관련한 방법 및/또는 재료를 개시하고 기재하기 위해 참조로서 본 명세서에 포함된다.
본 명세서 및 첨부하는 특허청구범위에서 사용되는 바와 같이, 단수 형태는 문맥에서 달리 명확하게 지시되지 않는 한, 복수의 대상을 포함하는 것을 주의하여야 한다. 본 명세서에서 사용되는 모든 기술적 및 과학적 용어는 동일한 의미를 가진다.
본 명세서에서 논의된 간행물은 본 출원의 출원일 전의 그들의 개시내용에 대해서만 제공된다. 본 명세서의 어떤 것도 기재된 발명이 선행 발명이라는 이유로 이러한 간행물에 선행하는 것으로 자격을 부여하지 않는다는 용인으로서 해석되어서는 안 된다. 추가로, 제공된 간행물의 날짜는 실제 공개일과 상이할 수 있으며, 이는 독립적으로 확인될 필요가 있을 수 있다.
기재된 발명은 이의 정신 또는 필수적 속성으로부터 벗어나는 일 없이 다른 특이적 형태로 포함될 수 있고, 따라서, 앞서 언급한 명세서보다는, 본 발명의 범주를 나타내는, 첨부된 특허청구범위가 참조되어야 한다.
실시예
다음의 실시예는 당업자가 본 발명의 방법 및 조성물을 제조하고 사용하는 방법을 기재하기 위해 제공하며, 발명자들이 그들의 발명으로서 간주하는 것의 범위를 제한하는 것으로 의도되지 않는다. 사용한 수(예를 들어, 양, 온도 등)에 대한 정확성을 보장하기 위한 노력을 하였지만, 일부 실험적 오차 및 편차를 설명하여야 한다. 달리 표시되지 않는 한, 부분은 중량부이며, 분자량은 평균 분자량이고, 온도는 ℃이며, 압력은 대기압 또는 대기압 근처이다.
실시예 1: 선택적 마커가 없는 이형 접합적 유전자 변형 동물의 생산
유전자 변형을 돼지, 바람직하게는 미니 피그로부터 단리한 태아 섬유아세포에서 수행한다. 돼지 태아 섬유아세포로부터 단리한 게놈 DNA를 사용하여, 박테리아 인공 염색체(bacterial artificial chromosome: BAC) 라이브러리를 작성하고, 관심 대상의 유전자 또는 이의 부분을 함유하는 표적화 벡터("표적화된 대립유전자")를 설계하고 구성한다.
본 실시예에서, 내인성 표적 유전자의 암호 영역의 모두 또는 일부를 리포터 유전자로 대체하도록 표적화 벡터를 설계한다. 자가-절단가능한 재조합효소 발현 카세트를 함유하도록 표적화 벡터를 설계하며, 이때 (i) 항시성 프로모터(예를 들어, 유비퀴틴 프로모터)에 작동가능하게 연결된 네오마이신 내성 유전자와 (ii) ES 세포-특이적 프로모터(예를 들어, Nanog 프로모터)에 작동가능하게 연결된 Cre 재조합효소 유전자(Crei)는 둘 다 loxP 재조합 부위의 5' 및 3'에 측접된다. 추가로, 플록스된(floxed) 재조합효소 발현 카세트의 5' 상류에서, 성공적인 유전자 표적화 후에, 리포터 유전자(lacZ)의 전사를 내인성 유전자의 발현을 촉진시키는 내인성 프로모터에 의해 개시할 수 있고, 내인성 유전자의 전사가 없어질 수 있도록, 표적화 벡터는 표적화되고 있는 내인성 유전자의 개시 코돈(ATG)의 상류 가까이의 뉴클레오타이드 서열(즉, 5' 미번역 영역(5'-UTR))에 작동가능하게 연결된 lacZ 유전자를 함유한다(예를 들어, 도 3 참조). 표적화 벡터의 3' 말단은 표적 유전자의 3' 미번역 영역(3'-UTR)(또는 표적 유전자의 3'-UTR에 측접하는 돼지 게놈 DNA)을 포함한다. 항시성 및 ES 세포-특이적 프로모터의 다른 조합을 표적화 벡터에서 사용할 수 있다.
이어서, 표적화 벡터를 전기천공법 또는 뉴클레오펙션을 통해 태아 섬유아세포 내로 도입하며, 표적화된 대립유전자의 존재를 특이적 프로브 및 프라이머를 사용하여 분석적 PCR(예를 들어, 실시간 PCR)에 의해 확인한다.
일단 태아 섬유아세포의 성공적인 유전자 변형을 확인한다면, 표적화된 대립유전자(즉, 표적화된 대립유전자에 대해 이형 접합적)의 하나의 복제물을 함유하는 섬유아세포를 체세포 핵 전달(SCNT)을 통해 제핵 숙주 난모세포 내로 전달한다(예를 들어, 문헌[Gong et al., Generation of cloned calves from different types of somatic cells, Sci China C Life Sci, 2004, 47:470-476] 참조; 본 명세서에 그의 전문이 참조로서 포함됨). 융합 및 활성화 시, 클로닝한 접합자를, 그것이 배반포 배아기에 도달될 때까지, 시험관내에서 배양하고, 후속적으로 배반포-단계 배아를 표적화된 대립유전자에 대해 이형 접합적인 유전자-표적화된 동물로 완전한 발생을 위해 대리모 내로 이식한다.
클로닝된 배아의 발생 동안, 네오마이신 내성 유전자 및 Cre 재조합효소 유전자를 ES 세포-특이적 전사 인자를 발현시키는 다능성 줄기 세포로부터 제거한다. 네오마이신 내성 유전자 및 Cre 재조합효소 유전자의 부재를, 특이적 프로브 및 프라이머를 사용하는 분석적 PCR(예를 들어, 실시간 PCR)을 통해 또는 웨스턴 블롯 또는 ELISA 분석을 통해 확인할 수 있다.
얻어진 유전자-표적화된 이형 접합적 돼지의 성별은 전기천공한 돼지 태아 섬유아세포를 단리한 돼지의 성별에 의존하며, 암퇘지로부터 단리한 돼지 태아 섬유아세포는 암컷 유전자-표적화된 돼지로부터 생기게 하고, 수컷 돼지로부터 단리한 돼지 태아 섬유아세포는 수컷 유전자-표적화된 돼지로부터 생기게 한다.
이 절차는 젖소, 다른 유형의 소, 염소, 양, 토끼, 래트 또는 마우스와 같은 가축 포유류를 포함하는 다른 동물에게 적합하고, 적용할 수 있다.
실시예
2: 선택적
마커가
없는 동형
접합적인
유전자 변형된 동물의 생산
표적화된 대립유전자에 동형 접합적인 동물을 생산하기 위해, 태아 섬유아세포를 표적화된 대립유전자에 이형 접합적인 동물로부터 단리한다. 이형 접합적 동물을 생성하기 위해 사용한 표적화 벡터를 전기천공법 또는 뉴클레오펙션을 통해 이형 접합적 태아 섬유아세포 내로 도입한다. 표적화된 대립유전자의 접합자 구조를, 특이적 프로브 및 프라이머를 사용하는 분석적 PCR(예를 들어, 실시간 PCR)을 통해 분석하고 확인한다.
이어서, 표적화된 대립유전자에 동형 접합적인 게놈을 함유하는 태아 섬유아세포를 제핵 숙주 난모세포 내로 전달한다. 융합 및 활성화 시, 클로닝한 접합자(표적 대립유전자에 동형접합적임)를, 그들이 배반포 배아기에 도달될 때까지 시험관내에서 배양한다. 이어서, 배반포 단계 배아를 표적화된 대립유전자에 동형 접합적인 유전자-표적화된 동물로 완전한 발생을 위해 대리모 내로 이식한다.
클로닝된 배아의 발생 동안, ES 세포-특이적 전사 인자를 발현시키는 다능성 줄기 세포로부터 네오마이신 내성 유전자 및 Cre 재조합효소 유전자를 제거한다. 네오마이신 내성 유전자 및 Cre 재조합효소 유전자의 부재를, 특이적 프로브 및 프라이머를 사용하는 분석적 PCR(예를 들어, 실시간 PCR)을 통해 또는 웨스턴 블롯 또는 ELISA 분석을 통해 확인할 수 있다.
물론, 이 절차는 젖소, 다른 유형의 소, 염소, 양, 토끼, 래트 또는 마우스와 같은 가축 포유류를 포함하는 다른 동물에게 적합하고, 적용할 수 있다.
실시예 3: BAC 표적화 벡터를 사용하는 유전자 변형된 클로닝된 동물의 생산
상대적으로 짧은(예를 들어, 4kb 내지 8kb) 5' 및 3' 상동성 암(즉, 표적 삽입 부위의 상류 및 하류의 영역과 각각 상동성인 자가-절단가능한 재조합효소 발현 카세트에 측접하는 서열)을 갖는 표적화 벡터를 사용하여 실시예 1 및 2에서 유전자 표적화 단계를 수행할 수 있다. 이러한 예에서, 표적화 벡터는 전형적으로 크기가 20kb 또는 25kb 미만이다. 대안적으로, 상기 방법은 길이가 수백 kb까지일 수 있고 소수의 무작위 통합 사건 및 비정상적 표적화 사건(예를 들어, 유전자 재배열 및/또는 결실에 의해 수행하는 표적화 사건)을 생성하는 경향이 있는 박테리아 인공 염색체(BAC)-기반 표적화 벡터에 의해 수행할 수 있다.
유전자 표적화를 위한 BAC-기반 표적화 벡터의 사용은 본 명세서에 참조로서 포함된 문헌[Valenzuela et al. (2003), Nature Biotechnology 21(6): 652-59]에 기재되어 있다. 간략하게, 일단 표적 유전자를 아우르는 BAC를 동정하면, 자가-절단가능한 재조합효소 발현 카세트를 박테리아 상동성 재조합에 의해 표적 유전자 내로 삽입한다. 필수적이지는 않지만, 유전자 표적의 일부를 종종 자가-절단가능한 재조합효소 발현 카세트의 삽입 동안 BAC로부터 결실시킨다.
일단 표적화 벡터를 작성하기 위하여 BAC를 변형시키면, 표적화 벡터가 실시예 1에 기재한 바와 같이 체세포(예를 들어, 태아 섬유아세포) 내로 도입된다. 그들의 큰 크기 때문에, BAC 표적화 벡터는 가장 통상적으로는 전기천공법 또는 뉴클레오펙션에 의해 도입된다. 선택 및 단리 후에, BAC 형질전환체를 선별하여 표적화 사건이 성공적이었는지 여부를 결정한다. 이러한 선별을, 예를 들어 증폭-기반 "고유 대립유전자의 상실" 분석을 사용하여 수행할 수 있되, 단, BAC 표적화 벡터의 5' 및 3' 상동성 암은 문헌[Valenzuela et al. (상기 참조)]에 기재되어 있는 바와 같이 대응하는 표적 유전자 서열을 지니는 비동질유전자이다.
적절하게 표적화한 체세포를 발생시킨 후에, 실시예 1에 기재한 바와 같이 표적화된 대립유전자에 이형 접합적인 클로닝된 배아를 발생시키기 위해 체세포 핵 전달을 사용할 수 있다. 더 나아가, 실시예 2에 기재한 바와 같이 표적화된 대립유전자에 동형 접합적인 클로닝된 배아를 발생시키기 위해 클로닝된 배아(예를 들어, 태아 섬유아세포)로부터의 세포를 재표적화할 수 있다.
실시예 4: 경제적으로 바람직한 특성을 갖는 유전자 변형된 클로닝 가축의 생산
상이한 동물 번식의 유리한 특성을 조합한 동물을 생산하기 위한 번식을 사용하는 축산업을 추구하였다. 그러나, 동물 육종은, 특히 (1) 특성이 밀접하게 연관될 때, (2) 육종 중 하나에서 바람직한 특성이 복잡하고, 다원 발생의(polygenic) 특성일 때, 다수의 사항에서 부적절한 것으로 증명되었다. 추가로, 동물 육종은 단지 동일 종의 동물에서 존재하는 특성을 조합하기 위해 사용할 수 있다. 따라서 임의의 이들 문제점으로 고통받지 않는 유전자 조작을 시작하여 전통적이니 동물 육종 기법의 보완을 시작하였다. 그러나, 유전자 조작된 동물에서 비-고유 유전자의 존재(예를 들어, 선택적 마커 유전자 및/또는 재조합효소 유전자)는, 특히 동물이 식품 및 약제와 같은 인간을 위한 제품을 생산하는데 사용되고 있을 때, 문제의 공급원에 남아 있는다. 따라서, 본 방법에 의해 생산된 유전자 변형된, 클로닝된 동물은 이러한 문제를 완화시킨다.
인간 소비를 위해 유지한 가축에서 바람직한 것으로 고려되는 특성은, 예를 들어 질병 내성, 전반적 크기 또는 근육량을 포함할 수 있다. 관심 대상의 다수의 특성에 대해, 동물 사육자는 목적으로 하는 특징을 초래하거나 또는 기여하는 유전자를 동정하였다. 예로서, 마이오스타틴(myostatin)은 동물에서 근육 성장을 억제하는 유전자이다. 소에서(뿐만 아니라 개 및 마우스에서), 마이오스타틴 기능을 제거하는 돌연변이의 존재는 근육량을 증가시키는 것으로 나타났다. 예를 들어, 문헌[McPherron et al. (1997), Nature 387(6628): 83-90; Kambadur et al. (1997), Genome Res. 7(9): 910-6; Grobet et al. (1997), Nat. Genet. 17(1): 71-4; Mosher et al. (2007), PLoS Genet. 3(5):e79] 참조. 기능상실(loss-of-function) 마이오스타틴 돌연변이에 동형 접합적인 소로부터의 살코기는 현재 특수 제품으로서 판매된다. 그러나, 소의 증가된 건장한 체격은 특별한 처리 및 식습관을 필요로 하는데, 이는 광역 시장에 대해 그들의 살코기를 너무 비싸게 만든다. 기능상실 마이오스타틴 돌연변이에 있어서 이형 접합적인 동물은 또한, 동형 접합적 돌연변이체보다 더 적은 정도이긴 하지만, 증강된 근육량을 가진다. 이형 접합적 동물의 한 가지 이점은 그들이 동형 접합적 동물에 의해 필요로 되는 특별한 조작 및 식습관을 필요로 하지 않는다는 것이다.
따라서 본 발명은 근육량이 증가된 가축의 생산에 적용할 수 있다. 완전 또는 부분적 기능상실 마이오스타틴 대립유전자 및 자가-절단가능한 재조합효소 발현 카세트를 갖는 표적화 작제물을 생성하기 위해 돼지, 염소, 양, 토끼, 및 다양한 유형의 소와 같은 동물 내 마이오스타틴 유전자를 동정하고 사용할 수 있다. 예를 들어 돌연변이 마이오스타틴 대립유전자(예를 들어, 기능상실 대립유전자)에 이형 접합적인 실시예 1의 방법에 따라 클로닝된 동물을 생산하기 위해 표적화 작제물을 사용할 수 있다. 대안적으로, 예를 들어 돌연변이 마이오스타틴 대립유전자(예를 들어, 부분적 기능상실 대립유전자)에 이형접합적인 실시예 2의 방법에 따라 클로닝된 동물을 생산하기 위해 표적화 작제물을 사용할 수 있다. 동물은 달리 유전자 조작과 관련된 선택적 마커 및 재조합효소 유전자가 없기 때문에, 근육량이 증가된 가축은 기존의 유전자 조작 기법에 의해 생산된 식품 제품에 의해 상승된 우려를 회피하는 우수한 육류 공급원을 제공할 수 있다.
실시예
5: 유전자 조작된 우유를 생산하는 유전자 변형된
클로닝된
포유류의 생산
우유, 특히 젖소 및 염소로부터의 우유로부터 생산한 우유 및 낙농 제품은 서방의 식습관의 대부분을 구성한다. 영양학적 가치가 우수한 우유를 생산하기 위해 이러한 동물을 유전자 조작하는 상당한 작업을 행하였다. 예를 들어, 문헌[Magnus and Lali (2008), Veterinary World 1(10):319-20] 참조. 본 발명을, 선택적 마커 및 재조합효소 유전자가 없는 유전자 조작된 동물로부터 이러한 우유의 생산을 용이하게 하기 위해 유사하게 적용할 수 있다.
예를 들어, 실시예 1의 방법을 사용하여, 젖소(또는 염소 또는 양)를 유전자 조작하여 그들의 우유에서 인간 락토페린 또는 인간 알파-락트알부민을 발현시킬 수 있다. 인간 알파-락트알부민을 함유하는 우유는, 예를 들어 천연 소 우유보다 더 영양적으로 균형잡혀 있고, 아기 및 노인에 의한 소비에 더 적합하다. 문헌[Magnus and Lali, 상기참조]을 참조한다. 인간 락토페린은, 그것이 면역계를 자극하고 감염에 대한 제1 방어선으로서 작용하는 역할을 하기 때문에 유리하다. 단백질 중 하나를 암호화하는 인간 유전자를 자가-절단가능한 재조합효소 발현 카세트를 갖는 본 발명의 표적화 작제물 내로 도입할 수 있다. 인간 유전자를 우유-특이적 프로모터(예를 들어, 대응하는 젖소 유전자에 대한 프로모터 또는, 대안적으로 유청 산성 단백질 프로모터)의 제어 하에 놓을 수 있고, 인간 유전자 및 재조합효소 발현 카세트는 젖소의 게놈 내 적절한 영역(예를 들어, 적절한 전이유전자를 발현시키는 대응하는 젖소 유전자 또는 비-필수 영역)과 상동성인 5' 및 3' 상동성 암에 측접할 수 있다. 이어서, 실시예 1 또는 2의 방법에 따라 유전자 변형된 체세포 및 이형 접합적 또는 동형 접합적인 유전자 변형된 클로닝한 젖소(또는 염소 또는 양)을 생산하기 위해 표적화 작제물을 사용할 수 있었다.
이유들 중에서도, 유선 내 고비율의 단백질 생산 때문에, 우유 내 약제학적 단백질의 생산은 다른 영역의 상당한 진행중인 연구이다. 항체, 인슐린, 인간 성장 호르몬, 혈액 응고 인자, 및 인간 혈청 알부민과 같은 중요한 약제학적 작용제를 모두 생산하였고, 소의 우유 내로 분비하였다. 문헌[Houdebine (2009), Comp. Immun. Microbiol. Infect. Dis. 32:107-121] 참조. 각각의 이들 단백질을 본 발명의 방법에 따라 생산한 유전자 변형된 동물(예를 들어, 젖소, 염소, 돼지)에서 유리하게 생산할 수 있고, 이에 의해 약제학적 제품에 대한 선택적 마커 및 재조합효소 유전자의 영향에 관한 규제 및 소비자 우려를 회피한다. 상기 논의한 바와 같이, 인간 유전자는 우유-특이적 프로모터(예를 들어, 유청 산성 단백질 프로모터)의 제어 하에 놓일 수 있고, 인간 유전자 및 재조합효소 발현 카세트는 표적 동물 게놈 내 적절한 영역(예를 들어, 적절한 전이유전자 발현을 허용하는 비-필수 영역)에 상동성인 5' 및 3' 상동성 암에 측접할 수 있다. 이어서, 실시예 1 또는 2의 방법에 따라 유전자 변형된 체세포 및 이형 접합적 또는 동형 접합적인 유전자 변형, 클로닝된 동물을 생산하기 위해 표적화 작제물을 사용할 수 있다.
Claims (44)
- 배아 줄기(embryonic stem: ES) 세포-특이적 프로모터에 작동가능하게(operably) 연결된 부위-특이적 재조합효소 유전자를 갖는 자가-절단가능한 재조합효소 발현 카세트를 포함하는 비-인간 동물의 유전자 변형된 체세포로서,
상기 부위-특이적 재조합효소 카세트는, 상기 카세트가 상기 부위-특이적 재조합효소의 존재에서 절단될 수 있는 방식으로 서로에 대해 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접(flanking)되고,
상기 ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포에서 상기 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 상기 유전자 변형된 체세포에서는 촉진시키지 않는, 유전자 변형된 체세포. - 제1항에 있어서, 상기 체세포는 피부 세포, 혈액 세포, 신경 세포, 근육 세포, 뼈 세포, 신장 세포, 간 세포 및 지방 세포로 이루어진 군으로부터 선택된, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 체세포는 섬유아세포인, 유전자 변형된 체세포.
- 제3항에 있어서, 상기 섬유아세포는 돼지로부터 유래된, 유전자 변형된 체세포.
- 제4항에 있어서, 상기 돼지는 미니 피그인, 유전자 변형된 체세포.
- 제3항에 있어서, 상기 섬유아세포는 젖소로부터 유래된, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 ES 세포-특이적 프로모터는 배반포-단계 배아의 ES 세포 내 상기 부위-특이적 재조합효소 유전자의 전사를 촉진시키는, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 더 포함하되, 상기 선택적 마커 유전자는 프로모터에 작동가능하게 연결된, 유전자 변형된 체세포.
- 제9항에 있어서, 상기 선택적 마커 유전자에 작동가능하게 연결된 상기 프로모터는 항시성 프로모터(constitutive promoter)인, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 선택적 마커 유전자를 포함하지 않고, 상기 선택적 마커 유전자는 상기 체세포의 상기 게놈 내 다른 좌위에 위치되되, 상기 선택적 마커 유전자는, 상기 선택적 마커가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향된 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접되는, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 체세포의 상기 유전자 변형된 게놈은 조건적 넉아웃 대립유전자를 포함하고, 상기 조건적 넉아웃 대립유전자는, 상기 조건적 대립유전자가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 재조합효소 발현 카세트는 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 재조합효소 발현 카세트는 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 상기 체세포의 상기 게놈 내 전사적으로-활성인 좌위에 위치된, 유전자 변형된 체세포.
- 제1항에 있어서, 상기 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된, 유전자 변형된 체세포.
- 선택적 마커 유전자 및 재조합효소 유전자가 없는 유전자 변형 및 클로닝된 비-인간 동물을 생산하는 방법으로서, 상기 방법은,
(a) 핵산 작제물을 비-인간 동물의 분화된 체세포 내로 도입하여 유전자 변형된 게놈을 생산하는 단계;
(b) 상기 (a)의 유전자 변형된 게놈을 제핵 숙주 난모세포(enucleated host oocyte) 내로 전달하는 단계;
(c) 상기 (b)의 난모세포를 융합 및 활성화하여 인공 접합자를 형성하는 단계;
(d) 상기 접합자가 배반포 배아기에 도달될 때까지 상기 (c)의 인공 접합자를 배양시키는 단계; 및
(e) 상기 (d)의 배반포를 대리모의 자궁 내로 이식하여 상기 선택적 마커 유전자 및 상기 재조합효소 유전자가 없는 상기 유전자 변형 및 클로닝된 비-인간 동물을 형성하는 단계를 포함하되,
상기 핵산 작제물은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 포함하는 자가-절단가능한 재조합효소 발현 카세트를 포함하고,
상기 재조합효소 발현 카세트는, 상기 카세트가 상기 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되며,
상기 ES 세포-특이적 프로모터는 미분화 다능성 줄기 세포 내 상기 부위-특이적 재조합효소 유전자의 전사를 촉진시키지만, 상기 분화된 체세포에서는 촉진시키지 않는, 비-인간 동물의 생산방법. - 제17항에 있어서, 상기 ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택된, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이에 위치된 선택적 마커 유전자를 포함하되, 상기 선택적 마커 유전자는 프로모터에 작동가능하게 연결된, 비-인간 동물의 생산방법.
- 제19항에 있어서, 상기 선택적 마커 유전자에 작동가능하게 연결된 상기 프로모터는 항시성 프로모터인, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 선택적 마커 유전자를 포함하지 않고, 상기 선택적 마커 유전자는 상기 체세포의 상기 게놈 내 다른 좌위에 위치되되, 상기 선택적 마커 유전자는, 상기 선택적 마커가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록 서로에 대해 동일한 방향으로 배향된 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접된, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 체세포는 게놈 내 조건적 넉아웃 대립유전자를 포함하되, 상기 조건적 넉아웃 대립유전자는, 상기 조건적 대립유전자가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록, 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 핵산 작제물은 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 핵산 작제물은 프로모터에 작동가능하게 연결된 선택적 마커 유전자를 포함하는, 비-인간 동물의 생산방법.
- 제23항에 있어서, 상기 프로모터는 항시성 프로모터인, 비-인간 동물의 생산방법.
- 제17항에 있어서, 상기 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된, 비-인간 동물의 생산방법.
- 분화된 체세포로부터 유전자 변형된 게놈을 포함하는 비-인간 동물의 클로닝된 난모세포로서, 상기 유전자 변형된 게놈은 ES 세포-특이적 프로모터에 작동가능하게 연결된 부위-특이적 재조합효소 유전자를 갖는 자가-절단가능한 재조합효소 발현 카세트를 포함하되, 상기 자가-절단가능한 재조합효소 발현 카세트는, 상기 카세트가 상기 부위-특이적 재조합효소의 존재에서 절단될 수 있도록 서로에 대해 동일한 방향으로 배향된 제1 재조합 부위 및 제2 재조합 부위에 측접되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 비-인간 동물은 마우스, 래트, 토끼, 조류, 젖소, 돼지, 양, 염소, 말 및 당나귀로 이루어진 군으로부터 선택된, 클로닝된 난모세포.
- 제28항에 있어서, 상기 분화된 체세포는 피부 세포, 혈액 세포, 신경 세포, 근육 세포, 뼈 세포, 간 세포 및 지방 세포로 이루어진 군으로부터 선택된, 클로닝된 난모세포.
- 제28항에 있어서, 상기 분화된 체세포는 섬유아세포인, 클로닝된 난모세포.
- 제31항에 있어서, 상기 섬유아세포는 돼지로부터 유래된, 클로닝된 난모세포.
- 제32항에 있어서, 상기 돼지는 미니 피그인, 클로닝된 난모세포.
- 제31항에 있어서, 상기 섬유아세포가 젖소로부터 유래된, 클로닝된 난모세포.
- 제28항에 있어서, 상기 ES 세포-특이적 프로모터는 Oct-3/4 프로모터, Sox2 프로모터, Kif4 프로모터, c-Myc 프로모터, Nanog 프로모터, Lin28 프로모터, 및 이들의 조합으로 이루어진 군으로부터 선택되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 ES 세포-특이적 프로모터는 배반포-단계 배아의 ES 세포 내 상기 부위-특이적 재조합효소 유전자의 전사를 촉진시키는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 제1 재조합 부위와 제2 재조합 부위 사이에 선택적 마커 유전자를 포함하되, 상기 선택적 마커 유전자는 프로모터에 작동가능하게 연결된, 클로닝된 난모세포.
- 제37항에 있어서, 상기 선택적 마커 유전자에 작동가능하게 연결된 상기 프로모터는 항시성 프로모터인, 클로닝된 난모세포.
- 제28항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 선택적 마커 유전자를 포함하지 않으며, 상기 선택적 마커 유전자는 상기 체세포 게놈 내 다른 좌위에 위치되되, 상기 선택적 마커 유전자는, 상기 선택적 마커가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록, 서로에 대해 동일한 방향으로 배향되는 제3 재조합 부위 및 제4 재조합 부위의 상류 및 하류에 측접되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 체세포는 게놈 내 조건적 넉아웃 대립유전자를 포함하되, 상기 조건적 넉아웃 대립유전자는, 상기 조건적 대립유전자가 상기 부위-특이적 재조합효소의 존재에서 제거될 수 있도록, 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접된, 클로닝된 난모세포.
- 제28항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 표적화되고 있는 내인성 유전자의 적어도 하나의 엑손에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 표적화되고 있는 내인성 유전자의 적어도 하나의 인트론에 상동성인 뉴클레오타이드 서열을 포함하되, 상기 뉴클레오타이드 서열은 제1 재조합 부위 및 제2 재조합 부위의 상류 및 하류에 측접되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 자가-절단가능한 재조합효소 발현 카세트는 상기 체세포 게놈 내 전사적으로-활성인 좌위에 위치되는, 클로닝된 난모세포.
- 제28항에 있어서, 상기 부위-특이적 재조합효소는 Cre, Flp 및 Dre 재조합효소로 이루어진 군으로부터 선택된, 클로닝된 난모세포.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261730771P | 2012-11-28 | 2012-11-28 | |
| US61/730,771 | 2012-11-28 | ||
| PCT/US2013/072088 WO2014085501A1 (en) | 2012-11-28 | 2013-11-26 | Cloned non-human animals free of selective markers |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150089004A true KR20150089004A (ko) | 2015-08-04 |
Family
ID=49725406
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157012263A KR20150089004A (ko) | 2012-11-28 | 2013-11-26 | 선택적 마커가 없는 클로닝된 비-인간 동물 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US20140221734A1 (ko) |
| EP (1) | EP2925122A1 (ko) |
| JP (2) | JP6154479B2 (ko) |
| KR (1) | KR20150089004A (ko) |
| CN (1) | CN104918484A (ko) |
| AU (1) | AU2013352235A1 (ko) |
| BR (1) | BR112015012408A2 (ko) |
| CA (1) | CA2891163A1 (ko) |
| HK (1) | HK1211177A1 (ko) |
| IL (1) | IL238771A0 (ko) |
| MX (1) | MX353279B (ko) |
| MY (1) | MY193790A (ko) |
| RU (1) | RU2015122802A (ko) |
| SG (1) | SG11201503752SA (ko) |
| WO (1) | WO2014085501A1 (ko) |
| ZA (1) | ZA201503305B (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE202014010413U1 (de) | 2013-09-18 | 2015-12-08 | Kymab Limited | Zellen und Organismen |
| WO2016140353A1 (ja) * | 2015-03-04 | 2016-09-09 | 株式会社 医療実験用大動物供給事業準備会社 | 安定した表現型を示す疾患モデルブタおよびその作製方法 |
| CN105200086A (zh) * | 2015-10-22 | 2015-12-30 | 中国农业科学院北京畜牧兽医研究所 | 一种无选择标记的多基因复合性状基因工程猪的制备方法 |
| WO2019241350A1 (en) * | 2018-06-13 | 2019-12-19 | Regeneron Pharmaceuticals, Inc. | A rodent model of fibrodysplasia ossificans progressiva |
| CN109504708A (zh) * | 2018-12-03 | 2019-03-22 | 江苏集萃药康生物科技有限公司 | 一种筛选标记自我删除的基因打靶载体及方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1375654A3 (en) * | 1998-11-02 | 2008-01-16 | GTC Biotherapeutics, Inc. | Transgenic and cloned mammals |
| US7049480B1 (en) * | 2000-09-01 | 2006-05-23 | Avigenics, Inc. | Methods of enucleating an avian oocyte or zygote using two-photon laser scanning microscopy |
| EP1811023A4 (en) * | 2004-09-29 | 2009-04-29 | Dainippon Sumitomo Pharma Co | SPECIFICALLY EXPRESSED IN ES CELLS AND USE THEREOF |
| WO2009121999A1 (es) * | 2008-04-04 | 2009-10-08 | Consejo Superior De Investigaciones Científicas | Promotor especifico de celulas troncales |
| WO2011020014A1 (en) * | 2009-08-14 | 2011-02-17 | Regeneron Pharmaceuticals, Inc. | Promoter-regulated differentiation-dependent self-deleting cassette |
| CN102628061A (zh) * | 2012-04-09 | 2012-08-08 | 西北农林科技大学 | 一种hbd3 乳腺特异性表达载体及构建的重组细胞 |
-
2013
- 2013-11-26 MX MX2015006810A patent/MX353279B/es active IP Right Grant
- 2013-11-26 EP EP13802213.2A patent/EP2925122A1/en not_active Withdrawn
- 2013-11-26 SG SG11201503752SA patent/SG11201503752SA/en unknown
- 2013-11-26 BR BR112015012408A patent/BR112015012408A2/pt not_active IP Right Cessation
- 2013-11-26 WO PCT/US2013/072088 patent/WO2014085501A1/en active Application Filing
- 2013-11-26 US US14/091,207 patent/US20140221734A1/en not_active Abandoned
- 2013-11-26 RU RU2015122802A patent/RU2015122802A/ru not_active Application Discontinuation
- 2013-11-26 MY MYPI2015001216A patent/MY193790A/en unknown
- 2013-11-26 CA CA2891163A patent/CA2891163A1/en not_active Abandoned
- 2013-11-26 CN CN201380060720.0A patent/CN104918484A/zh active Pending
- 2013-11-26 AU AU2013352235A patent/AU2013352235A1/en not_active Abandoned
- 2013-11-26 JP JP2015544195A patent/JP6154479B2/ja not_active Expired - Fee Related
- 2013-11-26 KR KR1020157012263A patent/KR20150089004A/ko not_active Application Discontinuation
-
2015
- 2015-05-12 IL IL238771A patent/IL238771A0/en unknown
- 2015-05-12 ZA ZA2015/03305A patent/ZA201503305B/en unknown
- 2015-12-10 HK HK15112184.4A patent/HK1211177A1/xx unknown
-
2016
- 2016-11-22 JP JP2016226816A patent/JP6227747B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| HK1211177A1 (en) | 2016-05-20 |
| US20140221734A1 (en) | 2014-08-07 |
| MX2015006810A (es) | 2015-09-07 |
| JP2017060502A (ja) | 2017-03-30 |
| SG11201503752SA (en) | 2015-06-29 |
| CA2891163A1 (en) | 2014-06-05 |
| JP2016502407A (ja) | 2016-01-28 |
| EP2925122A1 (en) | 2015-10-07 |
| JP6154479B2 (ja) | 2017-06-28 |
| CN104918484A (zh) | 2015-09-16 |
| WO2014085501A1 (en) | 2014-06-05 |
| AU2013352235A1 (en) | 2015-05-28 |
| JP6227747B2 (ja) | 2017-11-08 |
| MY193790A (en) | 2022-10-27 |
| BR112015012408A2 (pt) | 2017-07-11 |
| MX353279B (es) | 2018-01-05 |
| IL238771A0 (en) | 2015-06-30 |
| RU2015122802A (ru) | 2017-01-10 |
| ZA201503305B (en) | 2016-05-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2014205134B2 (en) | Hornless livestock | |
| Valet et al. | Understanding adipose tissue development from transgenic animal models | |
| JP6227747B2 (ja) | 選択マーカーを含まないクローン化された非ヒト動物 | |
| KR20170003585A (ko) | 돼지에서 멀티플렉스 유전자 편집 | |
| CN105518132B (zh) | 缺乏lincRNA的非人类动物 | |
| CA2877297A1 (en) | Genetically modified animals and methods for making the same | |
| Laible | Production of transgenic livestock: overview of transgenic technologies | |
| US20210185990A1 (en) | Non-meiotic allele introgression | |
| CN107690279B (zh) | 非人动物表现出上运动神经元功能和下运动神经元功能以及感知减弱 | |
| Houdebine | Methods to generate transgenic animals | |
| US20210037797A1 (en) | Inducible disease models methods of making them and use in tissue complementation | |
| Wolf et al. | Nuclear transfer technology in mammalian cloning | |
| JP2023176591A (ja) | 遺伝子改変ブタの製造方法、樹立された体細胞、及び、遺伝子改変ブタ製造用原料 | |
| JPWO2005123918A1 (ja) | 外来遺伝子の誘導発現の制御が可能な発現ベクター | |
| Tizard | Conference XII | |
| Pandey et al. | Genetically Modified Food Animals: An Overview | |
| Laible | Conference VIII | |
| Houdebine | Animal Cloning and Transgenesis | |
| LAIBLE et al. | Transgenic Cattle Applications: The | |
| JP2004242557A (ja) | 筋ジストロフィー症の病態モデル哺乳動物、及びその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |