KR20150079964A - 효소적 컨쥬게이션에 의한 e.콜라이에서 재조합 백신의 생성 - Google Patents
효소적 컨쥬게이션에 의한 e.콜라이에서 재조합 백신의 생성 Download PDFInfo
- Publication number
- KR20150079964A KR20150079964A KR1020157014830A KR20157014830A KR20150079964A KR 20150079964 A KR20150079964 A KR 20150079964A KR 1020157014830 A KR1020157014830 A KR 1020157014830A KR 20157014830 A KR20157014830 A KR 20157014830A KR 20150079964 A KR20150079964 A KR 20150079964A
- Authority
- KR
- South Korea
- Prior art keywords
- gram
- coli
- negative bacterium
- gene
- negative
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
- A61K39/092—Streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1048—Glycosyltransferases (2.4)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1048—Glycosyltransferases (2.4)
- C12N9/1051—Hexosyltransferases (2.4.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/005—Glycopeptides, glycoproteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/52—Bacterial cells; Fungal cells; Protozoal cells
- A61K2039/523—Bacterial cells; Fungal cells; Protozoal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6037—Bacterial toxins, e.g. diphteria toxoid [DT], tetanus toxoid [TT]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Communicable Diseases (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Enzymes And Modification Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
생체내 글리코컨쥬게이트를 생성하기에 능숙한 원핵생물 세포, 뿐만 아니라 이러한 세포를 생성하는 방법 및 글리코컨쥬게이트를 생성하는데 이러한 세포를 이용하는 방법이 본원에서 제공된다. 언급된 글리코컨쥬게이트의 조성물 및 이들의 상이한 용도도 포함된다.
Description
1-
서론
생체내 글리코컨쥬게이트를 생성하기에 능숙한 원핵생물 세포, 뿐만 아니라 이러한 세포를 생성하는 방법 및 글리코컨쥬게이트를 생성하는데 이러한 세포를 이용하는 방법이 본원에서 제공된다. 언급된 글리코컨쥬게이트의 조성물 및 이들의 상이한 용도도 포함된다.
2-
배경
당화는 탄수화물 분자 또는 당 (단당류, 이당류, 올리고당류, 또는 다당류)이 단백질 또는 폴리펩티드의 상이한 아미노산 잔기의 측쇄에 부착하여 당단백질을 생성하는 과정이다.
당단백질은 세포 상호작용 및 세포 신호전달과 같은 여러 과정에 수반되며; 이들은 분비 및 막 단백질의 단백질 폴딩, 올리고머화, 안정성, 품질 제어, 분류 및 수송에 관여한다. 단백질 당화는 단백질의 항원성, 안정성 및 반감기에 대해 깊은 유리한 영향을 갖는다.
탄수화물 분자와 단백질 담체의 아미노산 잔기 간의 연결 유형에 따라 상이한 종류의 당단백질이 존재한다.
N-연결된 단백질 당화 -표적 단백질의 폴리펩티드 사슬에서 아르파라긴 잔기에 탄수화물 분자의 첨가- 는 진핵생물 유기체의 세포질 세망에서 발생하는 번역후 변형의 가장 흔한 유형이다. 상기 과정은 세포질 세망에서 보존된 서열 Asn-X-Ser/Thr (여기서 X는 프롤린 이외의 임의의 아미노산이다) 내에서 지질 담체 (돌리콜 포스페이트)로부터 신생 단백질의 아스파라긴 잔기로의 미리 어셈블링된 올리고당류의 전달을 담당하는 효소적 올리고사카릴트랜스퍼라제 복합체(OST)에 의해 달성된다. 그 후 당 사슬은 골지체에서 다른 변형을 겪는다. N-연결된 당화 과정은 원핵생물에서 발생하며 고세균에서 광범위하게 발생하지만, 박테리아에서는 매우 드물다 (하기 참조).
O-연결된 당화는 진핵생물, 고세균 및 박테리아에서 발생하는 당화의 형태이다. 이는 단백질 표적에서 아미노산 잔기의 산소 원자에 대한 당 분자의 부착으로 구성된다.
박테리아, 식중독 병원체 캄필로박터 제주니(Campylobacter jejuni)가 또한, 이것이 그 고유의 당화 기작을 지닌다는 사실로 인해, 이의 단백질을 N-당화시킬 수 있는 것으로 밝혀졌다 (Wacker et al., Science. 2002; 298(5599):1790-3). 이러한 반응을 담당하는 기작은 pgl (단백질 당화의 경우)이라 불리는 클러스터에 의해 엔코딩된다.
C. 제주니(C. jejuni) 당화 기작은 E. 콜라이(E. coli) 세포에 의해 발현되는 재조합 단백질의 당화를 허용하도록 E. 콜라이에 전달될 수 있다. 종래 연구는 N-당화를 수행할 수 있는 E. 콜라이 균주를 생성하는 법을 입증하였다 (예컨대, 문헌[Wacker et al., Science. 2002; 298 (5599):1790-3; Nita-Lazar et al., Glycobiology. 2005; 15(4):361-7; Feldman et al., Proc Natl Acad Sci U S A. 2005; 102(8):3016-21; Kowarik et al., EMBO J. 2006; 25(9):1957-66; Wacker et al., Proc Natl Acad Sci U S A. 2006; 103(18):7088-93; International Patent Application Publication Nos. WO2003/074687, WO2006/119987, WO 2009/104074, and WO/2011/06261, and WO2011/138361]을 참조하라).
박테리아는 이들이 캡슐 다당류에 의해 종종 둘러싸이는 단일 또는 이중 초세포 막을 갖는지에 따라 그램-양성 및 그램-음성의 두 그룹으로 분류될 수 있다. 그러한 박테리아에 대한 예는 스트렙토코쿠스 종(Streptococcus ssp.), 슈도모나스 종(Pseudomonas ssp.), 네이세리아 종(Neisseria ssp.), 살모넬라 종(Salmonella ssp.), 에스체리치아 종(Escherichia ssp.), 스타필로코쿠스 종(Staphylococcus ssp.), 캄필로박터 종(Campylobacter ssp.) 등을 포함한다. 의학적 및 상업적으로 가장 관련된 감염체 중 하나는 그램-양성 병원체인 스트렙토코쿠스 뉴모니애(Streptococcus pneumoniae)이다.
S. 뉴모니애(S. pneumoniae)는 전세계적으로 가벼운 감염 및 심한 감염 둘 모두의 주요 원인이다. 폐렴구균 감염과 관련된 주요 임상 증후군은 폐렴(pneumonia), 수막염(meningitis), 혈류 감염(bloodstream infections)과 급성 중이염(acute otitis media)이고, 이환율과 사망률의 관점에서 이들 중 폐렴이 가장 중요하다. S. 뉴모니애에 의해 야기된 감염은 특히 아주 어린이와 노인에서 상당한 질병 부담의 원인이다 (Isaacman DJ, M. E., Reinert RR. 2010. Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines. Int J Infect Dis. 14:197-209).
폐렴구균은 이들의 화학적으로 그리고 혈청학적으로 뚜렷한 캡슐 다당류를 기초로 하여 여러 혈청형(~ 93)으로 분류된다. 특정한 혈청형은 다른 것보다 더 풍부하여 임상적으로 명백한 감염과 관련되어, 심각한 침습성 감염을 야기하고 하나 이상의 부류의 항균제에 대한 내성을 획득한다 (Rueda, A. M. M., MSc; Serpa, Jose A. MD; Matloobi, Mahsa MD; Mushtaq, Mahwish MD; Musher, Daniel M. MD. 2010. The spectrum of invasive pneumococcal disease at an adult tertiary care hospital in the early 21st century. Medicine (Baltimore) 89:331-336). S. 뉴모니애의 별개의 혈청형은 다당류 캡슐에서 구조적 차이에 기반하여 확인되었다. 종래 분석에 따르면 대략 10 또는 11개의 혈청형은 세계의 모든 지역에서 침습성 소아 감염의 70%를 넘게 차지한다 (Hausdorff WP, Bryant J, Paradiso PR, Siber GR: Which pneumococcal serogroups cause the most invasive disease: implications for conjugate vaccine formulation and use, part I. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 2000, 30(1):100-121). 질병을 야기하는 혈청형의 분포는 연령, 질병 증후군, 질병 중증도, 지역, 및 시간 경과에 따라 달라진다. 페니실린, 에리트로마이신, 코-트리목사졸 또는 다수의 약물에 내성인 폐렴구균은 많은 지역에서 흔하다 (스트렙토코쿠스 뉴모니애 내성에서의 진화 경향: 지역사회-획득 세균성 폐렴의 치료를 위한 영향. Jones RN, Jacobs MR, Sader HS. Int J Antimicrob Agents. 2010 Sep;36(3):197-204).
폐렴구균 캡슐은 주요 박테리아 발병 인자 중 하나이고 다양한 백신에서 항원으로서 성공적으로 이용되었다. 캡슐 다당류에 대한 항체는 폐렴구균 감염에 보호성인 것으로 나타났다 (Musher DM PH, Watson DA, Baughn RE: Antibody to capsular polysaccharide of Streptococcus pneumoniae at the time of hospital admission for pneumococcal pneumonia. J Infect Dis 2000, 182(1):158-167, Isaacman DJ ME, Reinert RR: Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines. Int J Infect Dis 2010, 14(3):197-209)
폐렴구균 캡슐 다당류 (CPS) 합성의 경로는 혈청형 (~ 93)에 따라 다르다. 합성효소 경로에 의해 합성되는 유형 3 및 37을 예외로 하고 (Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, Donohoe K, Harris D, Murphy L, Quail MA et al: Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal serotypes. PLoS genetics 2006, 2(3):e31) 폐렴구균 CPS는 O-항원-플립파제 (Wzx)/폴리머라제 (Wzy)-의존성 경로에 의해 일반적으로 합성된다 (도 1).
CPS는 단계적 접근에 의해 담체 지질 상에서 일반적인 전구체 (예컨대, 뉴클레오티드 활성화 단당류)로부터 어셈블링된다. 먼저, 반복 단위가 상이한 글리코실트랜스퍼라제에 의해 담체 상에서 막의 세포질 측에서 어셈블링된다. 그 후 지질-연결된 올리고당류는 막의 외측으로 플리핑되며, 이 때 반복 단위는 중합된다. 완전한 CPS는 담체 지질로부터 방출되어 표면으로 보내진다.
박테리아 다당류는 이들이 T-세포 에피토프를 함유하는 단백질 담체에 커플링되는 경우 인간에서 오래-지속되는 면역 반응을 유도할 수 있다. 이러한 개념은 거의 100년 전에 상술되었고 (Avery, O. T., and W. F. Goebel, 1929. Chemo-immunological studies on conjugated carbohydrate-proteins. Immunological specificity of synthetic sugar-proteins. J. Exp . Med. 50:521-533), 단백질 담체 디프테리아 독소에 커플링된 헤모필루스 인플루엔자(Haemophilus influenza) 타입 B (HIB)의 다당류에 대해 이후에 입증되었다 (Anderson, P. 1983. Antibody responses to Haemophilus influenzae type b and diphtheria toxin induced by conjugates of oligosaccharides of the type b capsule with the nontoxic protein CRM197. Infect Immun 39:233-8; Schneerson, R., O. Barrera, A. Sutton, and J. B. Robbins. 1980. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. J Exp Med 152:361-76). 이러한 글리코컨쥬게이트는 또한 미국에서 1987년에 허가된 최초의 컨쥬게이션된 백신이며 그 직후에 US 유아 면역화 스케쥴에 도입되었다. HIB 외에, 컨쥬게이션된 백신은 캡슐화 인간 병원체 네이세리아 메닌지티디스(Neisseria meningitidis) 및 S. 뉴모니애에 대해 성공적으로 개발되었다. 이러한 백신의 일상적인 사용은 감소된 비인두 집락화 뿐만 아니라 감염을 발생시켰다. 현재 전세계 백신 시장의 대략 25%는 컨쥬게이션된 백신을 포함한다.
컨쥬게이트 백신은 박테리아 감염에 대한 보호를 위해 성공적으로 이용되어 왔다. 단백질 담체로의 항원성 다당류의 컨쥬게이션은, 다당류가 T-세포 독립적 항원이므로, 보호성 기억 반응에 요구된다. 다당류는 다당류 뿐만 아니라 단백질 담체의 활성화 반응기를 이용하는 상이한 화학 반응에 의해 단백질 담체에 컨쥬게이션되었다 (Pawlowski, A., G. Kallenius, and S. B. Svenson. 2000. Preparation of pneumococcal capsular polysaccharide-protein conjugates vaccines utilizing new fragmentation and conjugation technologies. Vaccine 18:1873-1885; Robbins, J. B., J. Kubler-Kielb, E. Vinogradov, C. Mocca, V. Pozsgay, J. Shiloach, and R. Schneerson. 2009. Synthesis, characterization, and immunogenicity in mice of Shigella sonnei O-specific oligosaccharide-core-protein conjugates. Proc Natl Acad Sci U S A 106:7974-7978).
컨쥬게이트 백신은 박테리아 감염에 대해 어린이를 보호하기 위해 이들에게 투여될 수 있고 성인에게 오래 지속되는 면역 반응을 제공할 수 있다. 본 발명의 작제물은 성인에서 IgG 반응을 생성하는 것이 발견되었다. 다당류 (즉, 당 잔기)는 당-특이적인 단기 면역 반응을 촉발하는 것으로 여겨진다. 실제로, 인간 면역 시스템은 O-항원 및 캡슐 다당류와 같은 박테리아의 특이적 다당류 표면 구조에 대해 강력한 반응을 생성한다. 그러나, 다당류에 대한 면역 반응은 IgM 의존적이므로, 면역 시스템은 기억을 발생시키지 않는다. 그러나, 다당류를 운반하는 단백질 담체는 면역 시스템이 기억을 발생시키기 때문에 오래 지속되는 보호를 제공하고 T-세포 의존적인 IgG 반응을 촉발시킨다. 이러한 이유로, 백신을 단백질 담체 - 다당류 컨쥬게이트로서 개발하는 것이 유리하다.
어린 아동에서 중요한 혈청형에 대한 보호성 면역 반응을 유도하는 순수한 폐렴구균 다당류 백신의 무능력은 유아 면역화에서의 이들의 고려를 배제시킨다.
현재까지, 폐렴구균 질병에 대한 백신은 널리 확립된 화학적 컨쥬게이션 기법에 의해 시험관내 합성된다. 항원성 캡슐 다당류는 병원성 유기체에서 추출되고, 정제되고, 화학적으로 활성화되고, 적합한 단백질 담체에 컨쥬게이션된다. 현재, 글리코컨쥬게이트를 생성하기 위해 이용되는, CRM197 (디프테리아 톡소이드), 파상풍 톡소이드, 및 헤모필루스 인플루엔자 단백질 D와 같은 여러 단백질 담체가 존재한다.
7-가 폐렴구균 컨쥬게이트 백신 (PCV7)은 몇 년 전에 허가되었고 WHO의 전략 자문 전문가 그룹 (SAGE)에 의해 높은 질병 부담을 지닌 개발도상국에서 사용할 것이 권고되었다 (Vaccine 2012 Jul 6;30(32):4717-8. Epub 2012 May 20. Pneumococcal vaccines WHO position paper - 2012 - recommendations. WHO Publication). 10-가 (PCV10) 및 13-가 (PCV13) 컨쥬게이트 백신도 다양한 국가에서 허가되었다. 추가적인 컨쥬게이트 백신은 여러 단계의 개발 중에 있다 (Jiang SM, Wang L and Reeves PR: Molecular characterization of Streptococcus pneumoniae type 4, 6B, 8, and 18C capsular polysaccharide gene clusters. Infect Immun 2001, 69(3):1244-1255).
화학적 컨쥬게이트 백신을 제조하는 상황에서 여러 문제점이 확인되었다. 컨쥬게이션을 위한 다당류의 화학적 처리는 항원의 품질에 영향을 주는 다당류의 자연 형태를 손상시켜, 결과적으로 최종 제품의 항원성 및 면역원성에 영향을 미치는 것으로 나타났다 (Impact of the conjugation method on the immunogenicity of Streptococcus pneumoniae serotype 19F polysaccharide in conjugate vaccines (Poolman J, Frasch C, Nurkka A, Kayhty H, Biemans R, Schuerman L.Clin Vaccine Immunol. 2011 Feb;18(2):327-36. Epub 2010 Dec 1).
3-
발명의 개요
본 발명은 폐렴구균 세포로부터의 다당류를 함유하는 글리코컨쥬게이트 백신을 생성하는 신규한 방법을 기재한다. 이러한 획기적인 폐렴구균 백신은 그램-양성 박테리아의 올리고- 또는 다당류 생합성에 관여하는 조절 유전자가 그램-음성 숙주 균주에서 올리고- 및 다당류를 효율적으로 합성하는데 이용될 수 있고, 이러한 방식으로 생성된 올리고- 또는 다당류가 그램-음성 숙주 세포에서 글리코컨쥬게이트 백신을 만드는데 이용될 수 있다는 발견에 기반한다. 본 발명의 추가의 신규하고 예기치 못한 특징은 비제한적으로 하기 개시된 구체예를 포함한다.
본 발명은 폐렴구균 다당류 기반 컨쥬게이트 백신의 생성을 위한 원래 절차를 기재한다. 상기 절차는 다양한 단계에 기반한다:
i) 다당류의 생성 효율을 향상시키는 조절 유전자를 이용하여 E. 콜라이에서 운데카프레닐-피로포스페이트 (Und-PP) 연결된 O 항원 유사 다당류로서 폐렴구균 다당류의 재조합 생성.
ii) 다당류 생성을 더욱 효율적으로 만들기 위해 초기 균주의 특수한 기능을 결실시킴에 의한 적합한 생성 균주의 발생.
iii) E. 콜라이에서 폐렴구균 다당류의 효율적인 재조합 합성을 허용하는 적합한 DNA 작제물의 설계.
iv) 올리고사카릴트랜스퍼라제에 의한 수용체 단백질로의 다당류의 효율적인 생체내 컨쥬게이션을 위한 방법.
4-
도면의 간단한 설명
도 1은 S. 뉴모니애의 캡슐 다당류 생합성 경로의 유전자 조직을 도시한다. 생체내 컨쥬게이션에 이용된 스트렙토코쿠스 뉴모니애 균주의 캡슐 다당류 생합성 경로의 일반적인 유전자 조직의 계통도.
도 2는 CPS 1 생합성과 관련된 유전자 조직을 도시한다. CPS1 유전자 조직, wzg 내지 rmlD는 캡슐 다당류의 생합성에 관여하는 유전자이다.
도 3은 CPS 1 서브유닛을 예시한다. CPS1 서브유닛의 계통도.
도 4는 S. 손네이(S. sonnei) 및 P. 시겔로이드(P. shigelloides)로부터의 O 항원 서브유닛을 도시한다. S. 손네이 및 P. 시겔로이드 반복 단위의 계통도.
도 5는 P. 시겔로이드 O17 항원 클러스터를 도시한다. 플레시오모나스 시겔로이드(Plesiomonas shigelloides) O17 O 항원 클러스터.
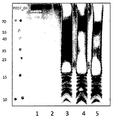
도 6은 E. 콜라이에서 S. 뉴모니애 CPS 1 다당류의 생성을 나타낸다. E. 콜라이에서 S. 뉴모니애 CPS1 다당류의 생성. 완전한 CPS1 생합성 유전자, wzg-ugd를 함유하는, 플라스미드 pGVX767로 형질전환된 상이한 E. 콜라이 균주로부터의 프로테이나제 K 처리된 전체 세포 추출물의 웨스턴-블롯 분석. 레인 1, 단백질 마커; 레인 2, E. 콜라이 GVX2174 (W3110 ΔwaaL ΔwecAwzzECA ΔrfbO16::rfbP. 시겔로이드O17-clmR); 레인 3, pGVX767 (프로모터, RBS, 및 CPS 타입 1의 wzg-ugd를 엔코딩하는 pLAFR)로 형질전환된 E. 콜라이 GVX2174; 레인 4 & 5, pGVX767로 형질전환된, E. 콜라이 GVX3329 (=GVX2174 wbgW::clmR= W3110 ΔwaaL ΔwecAwzzECA ΔrfbO16::( rfbP.시겔로이드O17 ΔwbgW::clmR)). 샘플을 MES와 함께 12% Bis-Tris 겔 (invitrogen) 상에서 35분 동안 200V에서 진행시킨 다음 iBlot에서 블롯팅하고 일차 항체로서 항-CP1 항체 (1:250)에 의해 현상하였다. clmR은 클로람페니콜 (clm) 내성을 제공하는 DNA 세그먼트, 즉 clm 내성 카세트를 표시한다.
도 7은 E. 콜라이에서 생성된 CPS1 다당류에 대한 산 처리에 대한 민감성을 도시한다. 플라스미드 pGVX767 (완전한 CPS1 생합성 유전자, wzg-ugd 함유)로 형질전환된 E. 콜라이 GVX3329의 웨스턴-블롯 분석. 레인 1, 3, 두 상이한 콜로니의 프로테이나제 K 처리된 전체-세포 추출물; 레인 2 & 4, TFA 처리된 상응하는 추출물; 레인 5, 단백질 마커. 샘플을 MES 완충제와 함께 12% Bis-Tris PAGE 겔 (invitrogen) 상에서 35분 동안 200V에서 진행시킨 다음 전기블롯팅하고 일차 항체로서 항-CP1 항체 (1:250)에 의해 현상하였다.
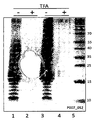
도 8은 S. 뉴모니애 CPS1에서 수송체 유전자의 결실의 효과를 도시한다. E. 콜라이에서 S. 뉴모니애 CPS1 다당류의 생합성에 대한 캡슐 다당류 수송체 유전자, wzg, wzh, wzd, 및 wze의 결실의 효과. 플라스미드 pGVX808 (=pGVX767 Δwzg-wze::clmR)로 형질전환된 E. 콜라이 GVX3329의 상이한 4개의 콜로니의 전체 세포 추출물 (프로테이나제 K 분해됨)의 웨스턴-블롯 분석, 레인 2-5 및 pGVX767 (완전한 CPS1 클러스터), 레인 6. 샘플을 MES와 함께 12% Bis-Tris 겔 (invitrogen) 상에서 35분 동안 200V에서 진행시킨 다음 iBlot에서 블롯팅하고 일차 항체로서 항-CP1 항체 (1:250)에 의해 현상하였다.
도 9 공학처리된 E. 콜라이로부터의 S. 뉴모니애 CPS 타입 1로 N-당화된 EPA의 His-Trap 정제 단계. 공학처리된 E. 콜라이로부터의 S. 뉴모니애 캡슐 다당류 그룹 1로 N-당화된 EPA의 HisTrap 정제 단계. 패널 A 및 B는 각각 항-His 및 항-CP1에 의해 현상된 EPA-CP1 컨쥬게이트의 정제 단계로부터의 단백질 샘플의 웨스턴-블롯을 도시한다. 단백질 샘플을 용해하는데 사용된 4-12% Bis-Tris PAGE-겔. pGVX767, pGVX114, 및 pGVX150로 형질전환된, E. 콜라이 균주 GVX3329 (=GVX2174 wbgW::clmR= W3110 ΔwaaL ΔwecAwzzECA ΔrfbO16::(rfbP.시겔로이드O17 wbgW::clmR))을 이용하였다.
도 10 CPS4 서브유닛의 계통도.
도 11 CPS4 유전자 조직. CPS4 유전자 조직, wzg 내지 fnlC는 캡슐 다당류의 생합성에 관여하는 유전자이다.
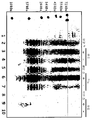
도 12는 E. 콜라이에서 S. 뉴모니애 CPS4 다당류의 생성을 도시한다. 상이한 E. 콜라이 균주로부터의 프로테이나제 K 처리된 전체 세포 추출물의 웨스턴-블롯 분석. 레인 1, 단백질 마커; 레인 2-4, pGVX803 (전체 CPS4 클러스터를 발현하는) 및 pGVX238 (Z3206, 에피머라제)로 형질전환된 E. 콜라이 W3110 ΔwaaL; 레인 5-7, pGVX803 and pGVX207 (galE, 에피머라제)로 형질전환된 E. 콜라이 W3110 ΔwaaL; 레인 8-10, pGVX753 (부분 CPS4 클러스터, wcij-fnlc, 조절 유전자 및 wciI 없음) 및 pGVX238로 형질전환된 E. 콜라이 W3110 ΔwaaL E. 콜라이. 유도에 이용되는 0.1% 아라비노스. 0.1 OD의 배양된 바이오매스에 대한 동등물을 MES와 함께 12% Bis-Tris 겔 (invitrogen) 상에서 35분 동안 200V에서 진행시킨 다음 iBlot에서 블롯팅하고 일차 항체로서 항-CPS4 항체 (1:100)에 의해 현상하였다.
도 13은 E. 콜라이 SCM6에서 생성된 S. 뉴모니애 CPS4의 분석으로부터의 결과를 도시한다. E. 콜라이에서 생성되는 S. 뉴모니애 CPS4의 분석. LLO를 E. 콜라이 SCM6으로부터 추출하고 (Schwarz F, Huang W, Li C, Schulz BL, Lizak C, Palumbo A, Numao S, Neri D, Aebi M, Wang LX: A combined method for producing homogeneous glycoproteins with eukaryotic N-glycosylation. Nat Chem Biol 2010) 전술한 대로 2AB로 표지하였다 (US 2011/0274720 A1). 패널 A; 빈 벡터 pLAFR 및 pMLBAD로 형질전환된 배경 E. 콜라이 균주, 실선과 비교하는, pGVX803 (pLAFR로부터 전체 CPS4 클러스터를 발현하는) 및 galE 에피머라제 (pGVX207, pMLBAD 백본)로 형질전환된 E. 콜라이 SCM6으로부터 추출된 2AB 표지된 LLO, 점선의 크로마토그램. 패널 B, 53.9분에 용리된 CPS4 피크의 단일한 반복 단위의 MS/MS 분석 (패널 A).
도 14는 E. 콜라이 SCM3에서 생성되는 S. 뉴모니애 CPS4의 분석의 결과를 도시한다 (Faridmoayer A, Fentabil MA, Mills DC, Klassen JS, Feldman MF: Functional characterization of bacterial oligosaccharyltransferases involved in O-linked protein glycosylation. JOURNAL OF BACTERIOLOGY 2007, 189(22):8088-8098). E. 콜라이에서 생성되는 S. 뉴모니애 CPS4의 분석. LLO는 E. 콜라이 SCM3에서 추출되고 (Sφ874, ΔwaaL) 기재된 대로 2AB로 표지되었다 (US 2011/0274720 A1). 빈 벡터 pGVX725 (프로모터와 RBS만을 지닌 pLAFR)로 형질전환된 배경 E. 콜라이 SCM3 균주, 점선과 비교하는, pGVX771 (조절 유전자 없이, 프로모터, RBS, Z3206 유전자, 및 CPS14 클러스터의 wciJ-fnlc를 함유하는 pLAFR)로 형질전환된 E. 콜라이 SCM3으로부터 추출된 2AB 표지된 LLO, 실선의 HPLC 크로마토그램. 50.8, 53.6 및 56.2분에 용리된 피크의 MS 분석은 피루베이트 (Pyr)가 있거나 없는 단일한 CPS4 반복 단위 (RU)와 일치하였다.
도 15는 CPS4-LLO를 이용한 시험관내 N-당화의 분석으로부터의 결과를 도시한다. CPS4 지질-연결된 올리고당류를 이용한 시험관내 N-당화. LLO는 pGVX771 (이전 도면에 기재됨) 및 pGVX725 (빈 벡터)로 형질전환된 E. 콜라이 SCM3 (Sφ874 ΔwaaL)으로부터 추출되었다. 시험관내 반응은 정제된 C. 제주니 PglB, 형광-표지된 펩티드 수용체 (Tamra-DANYTK) 및 LLO 추출물을 반응 완충제에서 혼합시킴에 의해 밤새 완료되었다. 펩티드를 유기상 분리에 의해 반응 혼합물로부터 분리시키고 UPLC 이후에 MS 분석으로 처리하였다. 패널 A 및 B, SCM3 함유 pGVX725, (음성 대조군), 및 SCM3 함유 pGVX771로부터 추출된 LLO를 이용한 당화 후에 펩티드의 UPLC 크로마토그램. 패널 C 및 D, 펩티드 상에 어셈블링된 CPS4의 하나 및 2개의 완전한 서브유닛(subununit)에 상응하는 15.43 및 17.62분에 용리되는 글리코펩티드의 MS/MS 분석.
도 16 S. 뉴모니애 CPS4를 지닌 N-당화된 EPA의 HisTrap 정제 단계 공학처리된 E. 콜라이로부터의 S. 뉴모니애 CPS4를 지닌 N-당화된 EPA의 HisTrap 정제 단계. E. 콜라이 W3110ΔwaaL는 pGVX539, pGVX114, pGVX207 및 pGVX803으로 형질전환되고 TB 배지에서 성장한다. 패널 A, B 및 C는 쿠마시 염색된 것과 각각 항-His 및 항-CP4로 현상된 EPA-CPS4 컨쥬게이트의 정제 단계로부터의 단백질 샘플의 웨스턴-블롯을 도시한다. 4-12% Bis-Tris SDS-겔이 단백질 샘플을 용해하는데 이용되었다. pGVX539는 EPA가 탈독화된 EPA 담체 단백질 발현을 위한 발현 플라스미드이고 2개의 N 당화 컨센서스 서열을 함유한다.
도 17은 CPS4-EPA 글리코컨쥬게이트의 HPLC RP 분석에 의한 PMP 유도체화 분석을 도시한다. E. 콜라이에서 생성되는 CPS4-EPA 글리코컨쥬게이트의 HPLC RP 분석에 의한 PMP 유도체화 분석. 실선: 글리코컨쥬게이트의 가수분해 및 분석으로부터 수득된 기록, 실선: CP4 캡슐 다당류로부터 동일하게 준비된 기록.
도 18은 CPS4-EPA 컨쥬게이트로 면역화된 토끼로부터의 혈청의 도트-블롯 분석을 도시한다. CPS4-EPA 컨쥬게이트로 면역화된 토끼로부터의 혈청의 도트-블롯 분석. S. 뉴모니애 그룹 4에서 분리된 50 ng의 CPS4 캡슐 다당류를 각 스폿에서 블롯팅하였다. 두 번째 주입 후에 수득된 혈청을 1 대 100 희석율로 분석에 이용하였다. 레인 1, 본 연구에 이용된 토끼의 면역전 혈청의 풀; 레인 2-7, EPA-CPS4가 주입된 상이한 토끼로부터의 혈청; 레인 8-9, 각각 알루미늄 하이드록사이드 및 프로인트 완전 애쥬번트를 함유하는 완충제가 주입된 대조군 토끼의 혈청; 레인 10-11, Prevenar-13이 주입된 양성 대조군 토끼의 혈청; 레인 12-13, 일차 항체로서 Statens 혈청 기관으로부터의 1:100 및 1:200 희석율을 각각 지닌 폐렴구균 항혈청 타입 4를 이용하였다.
도 19는 CPS의 생합성에 관여하는 유전자의 CPS14 유전자 조직을 기재한다. CPS14 유전자 조직, wzg 내지 wciY는 캡슐 다당류의 생합성에 관여하는 유전자이다.
도 20 CPS14 서브유닛의 계통도.
도 21 E. 콜라이에서 CPS14 LLO의 발현, CPS14 클러스터로부터의 wchA 내지 wciY 유전자를 O16 O 항원 클러스터 (rfbO16) 프로모터를 함유하는 유전자 교체 벡터 pDOC-C (pGVX615)로 클로닝하고 E. 콜라이 GVX1128 (W3110ΔwaaL)로 형질전환시켰다. 패널 A, 배경 균주로부터 추출된 LLO, 점선과 비교하는, pGVX615wzymut (단일한 서브유닛을 생성하는 CPS14 폴리머라제 돌연변이체)로 혈질전환된 E. 콜라이 GVX1128로부터 추출된 2AB 표지된 LLO, 실선의 크로마토그램; 삽화는 일차 항체로서 항-CPS14 항체에 의해 프로빙된 pGVX615로 형질전환된 프로테이나제 K 분해된 E. 콜라이 GVX1128의 웨스턴-블롯이다. 패널 B, 57분에 용리되는 CPS14의 단일한 서브유닛의 MS/MS 분석 (패널 A에서 화살표로 표시됨).
도 22. 콜라닌산 (CA)이 CPS14 클러스터로 교체된 E. 콜라이 균주에서 CPS14 다당류의 발현. 항-CPS14에 의해 프로빙된 통합된 여러 E. 콜라이 균주로부터의 프로테이나제 K 분해된 세포의 웨스턴-블롯이 도시된다. 모든 통합된 균주; GVX6126 (GVX1052 CA::CPS14; 레인 1 & 2), GVX6129 (GVX1128 CA::CPS14; 레인 3 & 4), 및 GVX6300 (GVX1716; 레인 5 & 6)는 RcsA를 발현하는 pGVX688로 형질전환될 때 CPS14 polymere의 생성에 대응하는 사다리와 같은 패턴을 보였다.
도 23은 E. 콜라이 균주 GVX6126 (E. 콜라이 W3110 CA::CPS14)에서 S. 뉴모니애 CPS14 다당류의 생성에 대한 CPS14 수송체 유전자의 효과를 도시한다. 상이한 E. 콜라이 세포로부터의 프로테이나제 K 처리된 전체 세포 추출물의 웨스턴-브롯 분석이 도시된다. 레인 1, 단백질 마커; 레인 2, pGVX688 (rcsA) 및 pGVX72 (빈 벡터)로 형질전환된 E. 콜라이 GVX6126; 레인 3, pGVX688 (rcsA) 및 pGVX1497 (pGVX72로 클로닝된 CPS14 wzg-wze)로 형질전환된 E. 콜라이 GVX6126. 0.4 OD의 배양된 바이오매스에 대한 동등물을 MES와 함께 12% Bis-Tris 겔 (invitrogen) 상에서 35분 동안 200V에서 진행시킨 다음 iBlot에서 블롯팅하고 일차 항체로서 항-CPS4 항체 (1:100)에 의해 현상하였다.
도 24는 pGVXN688 (RcsA 발현)로 형질전환된 E. 콜라이 GVX6129 (W3110ΔwaaL CA::CPS14)로부터 추출된 2AB 표지된 LLO의 크로마토그램을 도시하고 당지질을 섹션 0079 및 0080에 기재된 대로 2-AB 표지화 및 MS/MS 분석에 의해 분석하였다. MS/MS 분석은 CPS14의 2 및 3 서브유닛이 95.9분 및 115.3분에 각각 용리됨을 확인하였다 (화살표로 표시됨).
5-
발명의 상세한 설명
폐렴구균 캡슐 다당류는 S. 뉴모니애 세포의 CPS 클러스터에서 전형적으로 엔코딩되는 효소의 세트의 협력에 의해 담체 지질 상에서 합성된다 (Whitfield C, Roberts IS: Structure, assembly and regulation of expression of capsules in Escherichia coli . Mol Microbiol 1999, 31(5):1307-1319). wzy 의존성 CPS의 합성은 막의 세포질 측에서 운데카프레닐포스페이트 (Und-P)로의 단당류-포스페이트의 첨가에 의해 시작한다. 짧은 올리고당류는 상이한 글리코실트랜스퍼라제에 의해 활성화 당 뉴클레오티드로부터 단당류의 순차적 첨가에 의해 신장되고 지질-연결된 다당류는 플립파제에 의해 막을 통해 플립핑된다. 항원-반복 단위 (RU)는 단백질 wzy에 의해 수행되는 효소적 반응에 의해 중합된다. 그 후 다당류는 최종 수용체 구조로 보내진다. 중합화 및 세포 표면으로의 수송은 CPS 클러스터의 5' 말단에 위치한 3 내지 4개 효소의 세트에 의해 제어되는 것으로 여겨진다.
글리코실트랜스퍼라제, 폴리머라제 wzy, 플립파제 wzx, 및 단당류-포스페이트 트랜스퍼라제는 대부분의 경우에 dexB 내지 aliA 클러스터 내에서 엔코딩되는 반면, 뉴클레오티드 활성화 단당류 생합성 경로는 일반적인 살림 활성의 경우에 유전체 내의 다른 곳에서, 그리고 구체적으로 단당류가 CPS에 특이적일 때 CPS 클러스터 내에서 엔코딩된다 (Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, Donohoe K, Harris D, Murphy L, Quail MA et al: Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal serotypes. PLoS genetics 2006, 2(3):e31).
CPS 생합성에서 길이 제어는 조절을 위해 인산화 사건의 원을 수반하는 것으로 여겨진다 (Morona JK, Miller DC, Morona R, Paton JC. The effect that mutations in the conserved 캡슐 polysaccharide biosynthesis genes have on virulence of Streptococcus pneumoniae . J Infect Dis. 2004 May 15;189(10):1905-13.Epub 2004 Apr 27. PubMed PMID: 15122528). CPS를 생성하는 대부분의 생합성 경로는 기질로서 뉴클레오티드 디포스페이트 (NDP) 활성화 단당류를 이용하는데, 다시 말해, 이것은 UDP-Glc 및 UDP-GlcNAc이다. 이러한 NDP 당은 살림 유전자에 의해 그램-음성 및 그램-양성 숙주에서 제공되므로, 특수한 당의 합성을 위한 출발 물질로서 이용가능하다. 특수한 NDP-당의 합성 또는 다른 변형을 위한 생합성 유전자는 거의 항상 CPS 클러스터에서 엔코딩된다.
O 항원 합성과 CPS 합성은 생합성의 마지막 단계에서 상이하다. O 항원은 라이가제 WaaL에 의해 지질 A 코어에 첨가되고 추가로 외막으로 수송되는 반면, CPS는 세포 상에 캡슐 구조로서 존재한다. 평균적으로, 최종 O 항원 당 길이는 CPS보다 훨씬 짧다.
S. 뉴모니애 CPS는 이의 합성을 유도하는 특수한 생화하적 경로로 인해 그룹 I CPS로서 분류된다. 그램-음성 박테리아는 또한, 외막 수송을 담당하는 추가적인 막 수송체 단백질 유전자의 존재에 의해 폐렴구균 그룹 I 클러스터와 상이한, 그룹 I CPS 경로를 함유한다. 예를 들어, 이들은 콜라닌산 (CA) 생합성 기작 유전자 클러스터 wca (Stevenson G, Andrianopoulos K, Hobbs M, Reeves PR: Organization of the Escherichia coli K-12 gene cluster responsible for production of the extracellular polysaccharide colanic acid. J Bacteriol 1996, 178(16):4885-4893) 및 K30 CPS 클러스터 (Whitfield C: Biosynthesis and assembly of capsular polysaccharides in Escherichia coli . Annu Rev Biochem 2006, 75:39-68)이다.
그러나, 일부 그램-음성 및 양성 캡슐 다당류 클러스터가 기능적 요소에 있어서 유사하다는 사실에도 불구하고, E. 콜라이에서 기능적으로 발현되는 전체 폐렴구균 CPS 클러스터는 결코 존재하지 않았다. 상이한 세포 외피 구조가 다당류 생성을 위한 특수한 기작을 요구한다는 것은 일반적으로 수용되며, 이는 외막이 교차되어야 할 때 상이하다. 따라서, i) 그램-음성 유기체에서 LPS 및 캡슐 다당류 경로의 양태 및 ii) 그램-음성 숙주 세포 내에서 조합된 그램-양성 캡슐 생합성 조절 및 수송 경로의 양태를 이용하는 폐렴구균 캡슐 다당류의 개선된 생성 방법이 본원에 기재된다. 그러한 다당류는 그램-음성 숙주에서 LPS 경로 메커니즘에 의해 생성되고, 그러한 다당류의 구조는 LPS 다당류와 동일하다. 본 발명의 그램-음성 시스템에서 생성된 그러한 다당류는, 이에 따라, 본 출원의 목적을 위해 "변형된 캡슐 다당류" 또는 "LPS 캡슐"로서의 특징을 지닐 수 있다. 더욱이, LPS와 캡슐 생합성 경로를 조합시킨, 새롭게 합성된 이러한 발현 시스템 및 생합성 경로는 본 출원의 목적을 위해 "변형된 LPS 생합성 경로"로서의 특징을 나타낼 수 있다.
따라서, 추가적인 구체예는 변형된 캡슐 다당류 또는 LPS-캡슐의 생성을 포함하는, 변형된 LPS 경로를 이용한 당화 시스템에 의해 제조되는 S. 뉴모니애 백신을 포함한다.
본 발명의 또 다른 특수한 구체예는 폐렴구균 CPS의 최적화 발현을 위한 그램 음성 E. 콜라이 숙주 세포 유전체의 최적화를 포함한다. E. 콜라이 W3110은 gtr이라 불리는 프로파지(prophage) 유전자 클러스터를 엔코딩한다. Gtr 효소 GtrA, B, 및 S는 주변세포질 공간에서 성장하는 O 항원 사슬에 분지성 글루코스 잔기를 첨가시킴에 의해 O 항원을 변형시키는 기작을 엔코딩한다 (Lehane AM, Korres H, Verma NK: Bacteriophage-encoded glucosyltransferase GtrII of Shigella flexneri: membrane topology and identification of critical residues. The Biochemical journal 2005, 389(Pt 1):137-143). 상기 경로는 세포막의 세포질 면에서 운데카프레닐포스페이트 (Und-P, Und-PP 아님) 연결된 글루코스의 생성, 주변세포질로의 플립핑 및 성장하는 O 항원 다당류로의 Und-P-연결된 글루코스의 연속 전달을 포함한다.
특정한 구체예에서, gtrABS 유전자는 그램-음성 숙주 세포로부터 부분적으로 또는 완전히 기능적으로 불활성화되거나 결실되며, 예컨대, gtrABS는 E. 콜라이 숙주 세포에서 결실된다. 이론에 구애됨이 없이, 그러한 결실은 당화에 접근하기 쉬운 Und-PP 경로의 모든 CPS 생합성 활성을 채널링하므로, 당단백질 생성을 향상시킨다. 수많은 폐렴구균 다당류는 개시 단당류로서 글루코스를 지닌 반복 단위 (RU) 폴리머로서 합성된다. 따라서, 그러한 반복 단위는 Und-P 상에서 어셈블링되므로 단백질의 당화를 방해할 수 있다.
또 다른 특수한 구체예는 세포에서 Und-PP-Glc 양을 증가시키고, 이에 따라 CPS 반복 단위 (RU) 및 다당류의 향상된 생성 효율을 발생시키는 UDP-글루코스:운데카프레닐 포스페이트 글루코스-포스페이트 트랜스퍼라제 활성의 발현 및 활성을 증가시킴에 의한 Und-PP-연결된 CPS 생성의 향상이다. 그러한 UDP-글루코스:운데카프레닐 포스페이트 글루코스-포스페이트 트랜스퍼라제에 대한 예는 S. 뉴모니애의 WchA (즉, 개시자 기능을 제공하는 자연 효소) 또는 E. 콜라이 W3110 콜라닌산 wca 오페론에서 엔코딩되는 WcaJ이다. 본 발명의 특수한 구체예는 당지질 생성 성능을 최적화하기 위해 자연 S. 뉴모니애 wchA 유전자 기능을 wcaJ 유전자에서 엔코딩되는 E. 콜라이 기능으로 대체하는 것이다.
본 발명의 또 다른 구체예는 안정하고 높은 수율의 당지질 생성, 및 향상된 당화 활성을 위해 E. 콜라이 W3110 wca 오페론 대신 재조합 CPS 클러스터의 유전체 통합이다.
조절 유전자
그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 다양한 조절 유전자를 본 발명의 방법 및 숙주 세포에 이용할 수 있다. 특수한 구체예에서, 조절 유전자는 S. 뉴모니애의 캡슐 다당류 유전자 클러스터의 wzg, wzh, wzd, 또는 wze, 또는 S. 아우레우스(S. aureus)의 캡슐 다당류 유전자 클러스터의 capA, capB, 또는 capC 또는 스트렙토코쿠스 아갈락티애(Streptococcus agalactiae)(그룹 B 스트렙토코쿠스, 또는 GBS)의 캡슐 다당류 유전자 클러스터의 CpsA, CpsB, CpsC, 또는 CpsD이다. 특정한 구체예에서, 조절 유전자는 하기 섹션 "캡슐 다당류"에 열거된 캡슐 다당류 유전자 클러스터의 조절 유전자이다.
캡슐 다당류
특정한 구체예에서, 본 발명의 방법 및 숙주 세포를 이용하여 S. 뉴모니애의 캡슐 다당류를 생성한다. 이러한 캡슐 다당류는 S. 뉴모니애 CPS1, CPS2, CPS3, CP4, CPS5, CPS6 (A 및 B), CPS7 (A,B,C), CPS8, CPS9 (A,L,N,V), CPS10 (A,B,C,F), CPS11 (A,B,C,D,F), CPS12 (A,B,F), CPS13, CPS14, CPS15 (A,B,C,F), CPS16 (A,F), CPS17 (A,F), CPS18 (A,B,C,F), CPS19 (A,B,C,F), CPS20, CPS21, CPS22 (A,F), CPS23 (A,B,F), CPS24 (A,B,F), CPS25 (A,F), CPS26, CPS27, CPS28 (A,F), CPS29, CPS31, CPS32 (A,F), CPS33 (A,B,C,D,F), CPS34, CPS35 (A,B,C,D,F), CPS36, CPS37, CPS38, CPS39, CPS40, CPS41 (A,F), CPS42, CPS43, CPS44, CPS45, CPS46, CPS47 (A,F), CPS48 및 문헌(Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, Donohoe K, Harris D, Murphy L, Quail MA et al: Genetic analysis of the capsular biosynthetic locus from all 90 pneumococcal serotypes. PLoS genetics 2006, 2(3):e31)에서 언급된 모든 추가적인 캡슐을 포함한다. 구체적으로, 이러한 캡슐 다당류는 S. 뉴모니애 CPS1, CPS4, 및 CPS14를 포함한다.
다른 구체예에서, 그 밖의 그램-양성 박테리아의 캡슐 다당류는 본 발명의 방법 및 숙주 세포를 이용하여 생성될 수 있다. 그 밖의 그램-양성 박테리아는 스타필로코쿠스(Staphylococcus aureus) 및 스트렙토코쿠스 아갈락티애 (GBS)를 포함한다. 그러한 캡슐 다당류의 예는 S. 아우레우스 CPS5, CPS8, S. 아갈락티애(S. agalactiae)(그룹 B, GBS) CPSIa, CPSIb, CPSII, CPSIII, CPSIV, CPSV, CPSVI, CPSVII, CPSVIII, 엔테로코쿠스 패칼리스(Enterococcus faecalis) CPSA, CPSB, CPSC, CPSD를 포함한다.
특정한 구체예에서, 글리코실트랜스퍼라제는 요망되는 캡슐 다당류가 숙주 세포에서 합성되도록 본원에 제공된 숙주 세포에 도입된다. 예컨대, 그 전문이 본원에 참조로서 포함되는 국제 특허 출원 WO 2011/138361을 참조하라.
바이오컨쥬게이트
본 발명의 특정한 구체예에서, 숙주 세포는 바이오컨쥬게이트, 즉, 숙주 세포에서 생성되는 캡슐 단백질로 당화된 담체 단백질을 생성하도록 추가로 변형된다. 담체 단백질 상으로의 캡슐 다당류의 전달은 올리고사카릴트랜스퍼라제에 의해 촉매화된다. 특정한 구체예에서, 올리고사카릴트랜스퍼라제는 숙주 세포에서 재조합에 의해 발현된다. 특정한 구체예에서, 올리고사카릴트랜스퍼라제는 원핵생물 숙주로 도입된다. 올리고사카릴트랜스퍼라제는 임의의 공급원으로부터 비롯될 수 있고, 이종성 올리고사카릴트랜스퍼라제, 즉, 원핵생물 숙주 세포와 상이한 유기체로부터 유래된 올리고사카릴트랜스퍼라제를 포함할 수 있다 (예컨대, 상이한 박테리아 종으로부터 유래된 올리고사카릴트랜스퍼라제). 특수한 구체예에서, 올리고사카릴트랜스퍼라제는 캄필로박터 종, 예컨대 C. 제주니에서 유래된다.
담체 단백질은 재조합 단백질일 수 있다. 특정한 구체예에서, 담체 단백질은 자연적으로 하나 이상의 N-당화 컨센서스 서열을 포함하는 단백질이다. 다른 구체예에서, 하나 이상의 N-당화 컨센서스 서열은 재조합에 의해 담체 단백질에 도입되었다. 컨쥬게이트 백신의 생성에 사용하기 적합한 임의의 담체 단백질이 본원에서 사용될 수 있다. 예시적인 담체 단백질은, 비제한적으로, P. 아에루기노사(P. aeruginosa)의 외독소 A(EPA), CRM197, 디프테리아 톡소이드, 파상풍 톡소이드, S. 아우레우스의 무독화된 용혈소 A, S. 아우레우스의 응괴 인자 A, S. 아우레우스의 응괴 인자 B, E. 콜라이 FimH, E. 콜라이 FimHC, E. 콜라이 열 민감 장독소, E. 콜라이 열 민감 장독소의 무독화 변이체, 콜레라 독소 B 서브유닛 (CTB), 콜레라 독소, 콜레라 독소의 무독화된 변이체, E. 콜라이 Sat 단백질, E. 콜라이 Sat 단백질의 패신저 도메인, C. 제주니 AcrA, 및 C. 제주니 자연 당단백질, S. 뉴모니애 뉴몰리신 및 추가적인 S. 뉴모니애 단백질 항원, 예컨대 S. 뉴모니애 NOX, S. 뉴모니애 PspA, S. 뉴모니애 PcpA, S. 뉴모니애 PhtD, S. 뉴모니애 PhtE, S. 뉴모니애 Ply, 및 S. 뉴모니애 LytB를 포함한다.
특정한 구체예에서, 본원에 기재된 컨쥬게이트의 생성에서 사용되는 담체 단백질은 변형되고, 예를 들어, 단백질이 덜 독성이고/이거나, 당화 등에 더욱 민감하도록 하는 방식으로 변형된다. 특정한 구체예에서, 본원에 기재된 컨쥬게이트 백신의 생성에서 사용되는 담체 단백질은 단백질의 낮은 농도가, 예를 들어, 면역원성 조성물 내에 이의 바이오컨쥬게이트 형태로 투여되는 것을 가능케 하는 방식으로 담체 단백질 내의 당화 부위의 수가 최대화되도록 변형된다. 따라서, 특정한 구체예에서, 본원에 기재된 담체 단백질은 담체 단백질과 일반적으로 관련된 것보다(예를 들어, 자연/천연, 예를 들어, "야생형" 상태의 담체 단백질과 관련된 당화 부위의 수에 비해) 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 또는 그 초과의 당화 부위를 더 포함하도록 변형된다. 특정한 구체예에서, 당화 부위의 도입은 단백질의 일차 구조 어디에라도 당화 컨센서스 서열의 삽입에 의해 달성된다. 상기 당화 부위의 도입은, 예를 들어, 단백질의 일차 구조에 새로운 아미노산을 첨가(즉, 당화 부위가 전체적 또는 부분적으로 첨가됨)하거나, 당화 부위를 생성시키기 위해 단백질 내의 존재하는 아미노산을 돌연변이(즉, 아미노산이 단백질에 첨가되지 않고, 단백질의 선택된 아미노산이 당화 부위를 형성하도록 돌연변이됨)시킴으로써 달성될 수 있다. 당업자는 단백질의 아미노산 서열은 당 분야에 공지된 접근법, 예를 들어, 단백질을 엔코딩하는 핵산 서열의 변형을 포함하는 재조합 접근법을 이용하여 용이하게 변형될 수 있음을 인지할 것이다. 특정한 구체예에서, 당화 컨센서스 서열은 담체 단백질의 특정 영역, 예를 들어, 단백질의 표면 구조, 단백질의 N 또는 C 말단, 및/또는 단백질의 염기에서 디설파이드 브릿지에 의해 안정화되는 루프 내로 도입된다. 특정한 구체예에서, 고전적인 5개의 아미노산 당화 컨센서스 서열은 더욱 효과적인 당화를 위해 리신 잔기에 의해 연장될 수 있고, 이에 따라 삽입된 컨센서스 서열은 삽입되어야 하거나, 수용체 단백질 아미노산을 대체하는 5, 6, 또는 7개의 아미노산을 엔코딩할 수 있다.
특정한 구체예에서, 본원에 기재된 컨쥬게이트 백신의 생성에 사용되는 담체 단백질은 "태그", 즉, 담체 단백질의 분리 및/또는 확인을 가능케 하는 아미노산의 서열을 포함한다. 예를 들어, 본원에 기재된 담체 단백질에 태그를 첨가하는 것은 단백질의 정제, 및 그러므로 태깅된 담체 단백질을 포함하는 컨쥬게이트 백신의 정제에 유용할 수 있다. 본원에서 사용될 수 잇는 예시적 태그는 히스티딘(HIS) 태그(예를 들어, 헥사 히스티딘-태그, 또는 6XHis-Tag), FLAG-TAG, 및 HA 태그를 포함하나, 이에 제한되지는 않는다. 특정한 구체예에서, 본원에서 사용되는 태그는 이들이 더 이상 필요하지 않을 때, 예를 들어, 단백질이 정제된 후 제거가능하고, 예를 들어, 화학적 작용제 또는 효소적 수단에 의해 제거된다.
특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포 및 본원에 기재된 그러한 박테리아 숙주 세포에 의해 생성되는 컨쥬게이트는 유리한 특성을 지닌다. 예를 들어, 특정한 구체예에서, 본원에 기재된, 그램-양성 박테리아로부터 유래된 조절 유전자를 포함하고, 상기 조절 유전자가 올리고- 또는 다당류 생합성에 관여하는 박테리아 숙주 세포는 상기 조절 유전자의 존재의 결과로서 증가된 길이의 당 항원, 예컨대 올리고- 및/또는 다당류를 생성할 수 있다. 또한, 본원에 기재된 박테리아 숙주 세포는 그램-양성 박테리아에서 유래된 조절 유전자가 결여된 그램-음성 박테리아 숙주 세포에 비해, 증가된 양의 올리고- 및/또는 다당류와 같은 당 항원을 생성할 수 있다. 이러한 각각의 특징들은 박테리아 세포에 의해 생성된 컨쥬게이트가 보다 높은 당 항원 대 단백질 비를 지닌다는 점에서 그리고 박테리아 세포가 더 많은 수의 컨쥬게이트를 생성하기 때문에 유리하다.
특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 비해 약 5%, 10%, 15%, 20%, 약 25%, 약 30%, 약 40%, 약 50% 더 많거나, 50% 넘게 더 많은 컨쥬게이트를 생성한다. 특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 비해 5% 내지 10%, 10% 내지 20%, 20% 내지 30%, 30% 내지 40%, 또는 40% 내지 50% 더 많은 컨쥬게이트를 생성한다.
특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 비해 약 5%, 10%, 15%, 20%, 약 25%, 약 30%, 약 40%, 약 50% 더 많거나, 50% 넘게 더 많은 당 항원, 예컨대 올리고- 및/또는 다당류를 생성한다. 특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 비해 5% 내지 10%, 10% 내지 20%, 20% 내지 30%, 30% 내지 40%, 또는 40% 내지 50% 더 많은 당 항원, 예컨대 올리고- 및/또는 다당류를 생성한다.
특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 의해 생성된 당 항원, 예컨대 올리고- 및/또는 다당류보다 약 5%, 10%, 15%, 20%, 약 25%, 약 30%, 약 40%, 약 50% 더 길거나, 50% 넘게 더 긴 당 항원, 예컨대 올리고- 및/또는 다당류를 생성한다. 특정한 구체예에서, 본원에 기재된 박테리아 숙주 세포는 동일한 특성을 지니지만 올리고- 또는 다당류 생합성에 관여하는 그램 양성 박테리아로부터의 조절 유전자가 결여된 박테리아 숙주 세포에 의해 생성된 당 항원, 예컨대 올리고- 및/또는 다당류보다 5% 내지 10%, 10% 내지 20%, 20% 내지 30%, 30% 내지 40%, 또는 40% 내지 50% 더 긴 당 항원, 예컨대 올리고- 및/또는 다당류를 생성한다.
본원에 기재된 컨쥬게이트를 특성화하고, 예컨대 담체 단백질, 부착된 당 항원(들) (예컨대, 올리고- 및/또는 다당류), 또는 둘 모두를 특성화하기 위해, 예컨대 고성능 크기 배제 크로마토그래피, 등전점 전기영동, SDS-PAGE 및 웨스턴 블롯, MS에 의한 분자량 결정, N 말단 서열화, 아미노산 분석, 역상 액체 크로마토그래피, 전기분무 질량 분광학, 이중 질량 분광분석법 (MS/MS), 및 트립신 소화 후 질량 분광학에 의한 펩티드 맵핑을 포함하는 다양한 검정을 이용할 수 있다.
구체예
한 구체예에서, 다당류를 생성하기 위한 공학처리된 그램-음성 박테리아가 본원에서 제공되며, 여기서 그램-음성 박테리아는 그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 조절 유전자를 포함한다. 특정한 구체예에서, 그램-음성 박테리아는 캡슐 다당류 유전자 클러스터의 개방해독틀의 적어도 25%, 50%, 75%, 85%, 90%, 또는 적어도 95%를 포함한다. 특정한 구체예에서, 그램-음성 박테리아는 완전한 캡슐 다당류 유전자 클러스터를 포함한다. 특정한 구체예에서, 다당류는 캡슐 다당류의 에피토프를 포함한다.
특정한 구체예에서, 전술한 단락의 그램-음성 박테리아는 에스체리치아 종, E. 콜라이, 시겔라 종, 클렙시엘라 종, 살모넬라 종, 예르시니아 종, 네이세리아 종, 비브리오 종 및 슈도모나스 종으로 구성된 군으로부터 선택된다. 특수한 구체예에서, 그램-음성 박테리아는 E. 콜라이이다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아로 공학처리된 그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 조절 유전자는 스트렙토코쿠스 뉴모니애 조절 유전자이다. 특수한 구체예에서, S. 뉴모니애 조절 유전자는 S. 뉴모니애 타입 1에서 비롯된다. 특수한 구체예에서, S. 뉴모니애 조절 유전자는 S. 뉴모니애 타입 4에서 비롯된다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아로 공학처리된 그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 조절 유전자는 스타필로코쿠스 아우레우스 조절 유전자이다. 특수한 구체예에서, 조절 유전자는 스타필로코쿠스 아갈락티애 조절 유전자이다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아로 공학처리된 그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 조절 유전자는 엔테로코쿠스 패칼리스 조절 유전자이다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아는 올라고사카릴 트랜스퍼라제를 포함한다. 특수한 구체예에서, 올리고사카릴 트랜스퍼라제는 그램-음성 박테리아에 이종성이다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아는 적어도 하나의 이종성 글리코실트랜스퍼라제를 포함한다. 특수한 구체예에서, 이종성 글리코실트랜스퍼라제는 원핵생물 글리코실트랜스퍼라제이다. 특수한 구체예에서, 글리코실트랜스퍼라제는 조절 유전자와 동일한 그램-양성 박테리아로부터 수득된다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아는 그램-음성 박테리아 고유의 하나 이상의 유전자의 결실 또는 불활성화를 포함한다. 특수한 구체예에서, 하나 이상의 결실된 유전자는 waaL 유전자를 포함한다. 특수한 구체예에서, 하나 이상의 결실된 유전자는 그램-음성 박테리아에서 O 항원 생합성과 관련된 모든 유전자를 포함한다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아로 공학처리되는 조절 유전자는 wzg, wzh, wzd, wze, capA, capB, 또는 capC이다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아는 당화를 위한 컨센서스 서열을 포함하는 담체 단백질을 엔코딩하는 핵산을 포함한다. 특수한 구체예에서, 담체 단백질을 엔코딩하는 핵산은 그램-음성 박테리아에 이종성이다. 특수한 구체예에서, 담체 단백질은 P. 아에루기노사의 무독화된 외독소 A, CRM197, 디프테리아 톡소이드, 파상풍 톡소이드, S. 아우레우스의 무독화된 용혈소 A, 응괴 인자 A, 응괴 인자 B, E. 콜라이 FimH, E. 콜라이 FimHC, E. 콜라이 열 민감 장독소, E. 콜라이 열 민감 장독소의 무독화 변이체, 콜레라 독소 B 서브유닛 (CTB), 콜레라 독소, 콜레라 독소의 무독화된 변이체, E. 콜라이 sat 단백질, E. 콜라이 sat 단백질의 패신저 도메인, C. 제주니 AcrA, C. 제주니 자연 당단백질, 및 S. 뉴모니애 뉴몰리신이다. 특수한 구체예에서, 담체 단백질은 S. 뉴모니애 단백질, 예컨대, S. 뉴모니애 뉴몰리신, S. 뉴모니애 NOX, S. 뉴모니애 PspA, S. 뉴모니애 PcpA, S. 뉴모니애 PhtD, S. 뉴모니애 PhtE, S. 뉴모니애 Ply, 또는 S. 뉴모니애 LytB이다. 특수한 구체예에서, 담체 단백질은 올리고사카릴 트랜스퍼라제에 의해 다당류에 컨쥬게이션된다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아로 공학처리된 조절 유전자는 하기 캡슐 다당류 유전자 클러스터: S. 뉴모니애 CPS1, CPS2, CPS3, CP4, CPS5, CPS6 (A 및 B), CPS7 (A,B,C), CPS8, CPS9 (A,L,N,V), CPS10 (A,B,C,F), CPS11 (A,B,C,D,F), CPS12 (A,B,F), CPS13, CPS14, CPS15 (A,B,C,F), CPS16 (A,F), CPS17 (A,F), CPS18 (A,B,C,F), CPS19 (A,B,C,F), CPS20, CPS21, CPS22 (A,F), CPS23 (A,B,F), CPS24 (A,B,F), CPS25 (A,F), CPS26, CPS27, CPS28 (A,F), CPS29, CPS31, CPS32 (A,F), CPS33 (A,B,C,D,F), CPS34, CPS35 (A,B,C,D,F), CPS36, CPS37, CPS38, CPS39, CPS40, CPS41 (A,F), CPS42, CPS43, CPS44, CPS45, CPS46, CPS47 (A,F), 또는 CPS48; 또는 스타필로코쿠스 아우레우스 CPS5, 또는 CPS8; 스트렙토코쿠스 아갈락티애 (그룹 B, GBS) CPSIa, CPSIb, CPSII, CPSIII, CPSIV, CPSV, CPSVI, CPSVII, 또는 CPSVIII; 또는 엔테로코쿠스 패칼리스 CPSA, CPSB, CPSC, 또는 CPSD 중 하나에 상응하는 조절 유전자이다.
한 구체예에서, 그램-음성 박테리아에서 복제할 수 있는 벡터가 본원에서 제공되며, 여기서 상기 벡터는 그램-양성 박테리아에서 캡슐 다당류 생합성과 관련된 조절 유전자를 포함한다.
특정한 구체예에서, UDP-글루코스:운데카프레닐 포스페이트 글루코스-포스페이트 트랜스퍼라제 활성의 발현 및 활성은 전술한 단락들 중 어느 하나의 그램-음성 박테리아에서 증가한다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아는 장내 공통 박테리아 (예컨대, E. 콜라이 W3110)의 콜라닌산 wca 오페론에 의해 엔코딩되는 WcaJ를 발현시킨다.
특정한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아를 포함하는, 다당류의 생성을 위한 공학처리된 그램-음성 박테리아가 본원에서 제공되며, 여기서 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자는 기능적으로 불활성화된다. 특수한 구체예에서, Gtr 효소를 엔코딩하는 유전자의 기능적 불활성화는 Und-P 연결된 글루코스의 제거를 발생시킨다. 특수한 구체예에서, 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자는 결실된다. 특수한 구체예에서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자는 기능적으로 불활성화된다. 특수한 구체예에서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자는 결실된다. 특수한 구체예에서, 그램-음성 박테리아는 에스체리치아 종, E. 콜라이, 시겔라 종, 클렙시엘라 종, 살모넬라 종, 예르시니아 종, 및 슈도모나스 종으로 구성된 군으로부터 선택된다.
특수한 구체예에서, 전술한 단락의 그램-음성 박테리아는 올리고사카릴 트랜스퍼라제를 포함한다. 특수한 구체예에서, 올리고사카릴 트랜스퍼라제는 그램-음성 박테리아에 이종성이다.
특수한 구체예에서, 전술한 단락의 그램-음성 박테리아는 그램-음성 박테리아에 이종성인 적어도 하나의 글리코실트랜스퍼라제를 포함한다. 특수한 구체예에서, 글리코실트랜스퍼라제는 원핵생물 글리코실트랜스퍼라제이다.
특수한 구체예에서, 전술한 단락의 그램-음성 박테리아는 당화를 위한 컨센서스 서열을 포함하는 담체 단백질을 엔코딩하는 핵산을 포함한다. 특수한 구체예에서, 담체 단백질을 엔코딩하는 핵산은 그램-음성 박테리아에 이종성이다. 특수한 구체예에서, 담체 단백질은 P. 아에루기노사의 무독화된 외독소 A, CRM197, 디프테리아 톡소이드, 파상풍 톡소이드, S. 아우레우스의 무독화된 용혈소 A, 응괴 인자 A, 응괴 인자 B, E. 콜라이 FimH, E. 콜라이 FimHC, E. 콜라이 열 민감 장독소, E. 콜라이 열 민감 장독소의 무독화 변이체, 콜레라 독소 B 서브유닛 (CTB), 콜레라 독소, 콜레라 독소의 무독화된 변이체, E. 콜라이 sat 단백질, E. 콜라이 sat 단백질의 패신저 도메인, C. 제주니 AcrA, 및 C. 제주니 자연 당단백질이다. 특수한 구체예에서, 담체 단백질은 올리고사카릴 트랜스퍼라제에 의해 다당류에 컨쥬게이션된다.
특수한 구체예에서, 전술한 단락의 그램-음성 박테리아의 다당류는 스트렙토코쿠스 뉴모니애의 캡슐 다당류이다.
특수한 구체예에서, 전술한 단락의 그램-음성 박테리아의 다당류는 E. 콜라이의 O 항원 (O1, O2, O3, O4, O5, O6, O7, O8, O9, O10, O11, O12, O13, O14, O15, O16, O17, O18, O19, O20, O21, O22, O23, O24, O25, O26, O27, O28, O29, O30, O32, O33, O34, O35, O36, O37, O38, O39, O40, O41, O42, O43, O44, O45, O46, O48, O49, O50, O51, O52, O53, O54, O55, O56, O57, O58, O59, O60, O61, O62, O63, O64, O65, O66, O68, O69, O70, O71, O73, O74, O75, O76, O77, O78, O79, O80, O81, O82, O83, O84, O85, O86, O87, O88, O89, O90, O91, O92, O93, O95, O96, O97, O98, O99, O100, O101, O102, O103, O104, O105, O106, O107, O108, O109, O110, O111, O112, O113, O114, O115, O116, O117, O118, O119, O120, O121, O123, O124, O125, O126, O127, O128, O129, O130, O131, O132, O133, O134, O135, O136, O137, O138, O139, O140, O141, O142, O143, O144, O145, O146, O147, O148, O149, O150, O151, O152, O153, O154, O155, O156, O157, O158, O159, O160, O161, O162, O163, O164, O165, O166, O167, O168, O169, O170, O171, O172, O173, O174, O175, O176, O177, O178, O179, O180, O181, O182, O183, O184, O185, O186, O187), 살모넬라 종 (S. 엔테리카 아종 엔테리카(S. enterica subsp. Enterica), S. 엔테리카 아종 살라메(S. enterica subsp. Salamae), S. 엔테리카 아종 아리조네(S. enterica subsp. arizonae), S. 엔테리카 아종 디아리조네(S. enterica subsp. Diarizonae), S. 엔테리카 아종 휴테네(S. enterica subsp. Houtenae), S. 봉고리(S. bongori), 및 S. 엔테리카 아종 인디카(S. enterica subsp. Indica), 및 O 타입 1-67, 슈노모나스 종 (P. 아에루기노사 O 혈청형 1-20), 클렙시엘라 종 (특히 K. 뉴모니애 혈청형 O1, O2 (및 하위혈청형), O3, O4, O5, O6, O7, O8, O9, O10, O11, O12), 아시네토박터(Acinetobacter) O 항원 (특히, A. 바우만니이(A. baumannii) O 항원), 클라미디아 트라코마티스(Chlamydia trachomatis) O 항원 (혈청형 A, B, C, D, E, F, G, H, I J, K, L1, L2, L3), 비브리오 콜레라(Vibrio cholera) O 항원 O1 내지 155, 리스테리아 종(Listeria sp.), 특히 L. 모노사이토게네스(L. monocytogenes) 타입 1, 2, 3, 4 및 이들의 하위혈청형, 레지오넬라 뉴모필라(Legionella pneumophila) 혈청형 1 내지 15 O 항원, 보르데텔라 파라퍼투시스(Bordetella parapertussis) O 항원, 부르크홀데리아 말레이(Burkholderia mallei) 및 슈도말레이(pseudomallei) O 항원, 프란시셀라 툴라렌시스(Francisella tularensis), 캄필로박터 종(Campylobacter sp.)(C. 제주니); 클로스트리듐 디피실레(Clostridium difficile)(혈청형 A, G, H, K, S1, S4, D, Cd-5, 및 C. 퍼프린겐스(C. perfringens) 혈청형 A, B, C, D und E)의 캡슐 다당류, 스타필로코쿠스 아우레우스 타입 5 및 8, 스트렙토코쿠스 피로게네스(Streptococcus pyrogenes)(그룹 B 스트렙토코쿠스 캡슐 혈청형 다당류), E. 콜라이, 스트렙토코쿠스 아갈락티카에(Streptococcus agalacticae)(그룹 A 스트렙토코쿠스 캡슐 다당류), 네이세리아 메닌지티디스 (혈청형 A, B, C, W, Y, X), 칸디다 알비칸스(Candida albicans), 헤모필루스 인플루엔자, 엔테로코쿠스 패칼리스 캡슐 다당류 타입 I-V; 및 다른 표면 다당류 구조, 예컨대 보렐리아 부르그도르페리(Borrelia burgdorferi) 당지질), 네이세리아 메닌지티디스 필린 O 글리칸 및 리포올리고당류 (LOS), 헤모필루스 인플루엔자 LOS, 리슈매니아 메이저(Leishmania major) 리포포스포글리칸, 종양 관련 탄수화물 항원, 말라리아 글리코실 포스파티딜이노시톨, 또는 미코박테리움 튜베르쿨로시스 아라비노만난이다.
특수한 구체예에서, 전술한 단락들 중 어느 하나의 그램-음성 박테리아에 의해 생성된 재조합 당단백질이 본원에서 제공된다.
특수한 구체예에서, 단백질의 생성에 적합한 조건 하에 전술한 단락들 중 어느 하나의 그램-음성 박테리아를 배양하는 것을 포함하는, 재조합 당단백질을 생성하는 방법이 본원에서 제공된다. 특수한 구체예에서, 상기 방법은 재조합 당단백질을 정제하는 것을 추가로 포함한다.
특수한 구체예에서, 플레시오모나스 시겔로이드 O 항원 유전자 클러스터를 포함하는 공학처리된 E. 콜라이 세포가 본원에서 제공되며, 여기서 O 항원 유전자 클러스터의 wbgW 유전자는 불활성화되고 E. 콜라이 세포는 Und-PP-D-FucNAc4N을 생성한다.
특수한 구체예에서, 시겔라 손네이(Shigella sonnei) 또는 플레시오모나스 시겔로이드 O17 O 항원 유전자 클러스터를 포함하는 공학처리된 E. 콜라이 세포가 본원에서 제공되며, 여기서 O 항원 유전자 클러스터의 wbgW 유전자는 불활성화되고 E. 콜라이 세포는 Und-PP-D-FucNAc4N을 생성한다.
6-
실시예
실시예
1: E.
콜라이에서
CPS1
컨쥬게이트의
합성:
본 발명의 구체예의 목적은 E. 콜라이에서 CPS 타입 1 항원성 다당류를 생성하는 것이다. 상기 논의된 대로, 본 발명자들은 S. 뉴모니애 CPS 클러스터의 생합성 기작을 발현시키는 E. 콜라이의 능력을 새로운 방식으로 이용하였다.
CPS 클러스터 DNA (dexB 및 aliA 사이의 DNA 서열로 정의됨)는 도 2에 도시되며 S. 뉴모니애 타입 1의 반복 단위 구조는 도 3에 도시된다. 반복 단위는 D-FucNAc4N으로 시작하고, 알파 1-3 글리코시드 결합으로 연결되는 2개의 D-GalA 잔기가 이어진다 (-4-a-D-GalA-1,3-a-D-GalA-1,3-a-D-FucNAc4N-). 또한, RU는 비-화학량론적으로 O-아세틸화된다 (Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, Donohoe K, Harris D, Murphy L, Quail MA et al: Genetic analysis of the 캡슐 biosynthetic locus from all 90 pneumococcal serotypes. PLoS genetics 2006, 2(3):e31). DNA 서열은 하기에 대한 단백질을 엔코딩하는 추정 유전자를 함유한다:
i) 수송/조절 (Wzg, Wzh, Wzd, Wze),
ii) 상동성 검색의 결과로서, 2개의 GalA 잔기 (WchBD)의 전달을 아마도 가장 책임지는 2개의 글리코실트랜스퍼라제
iii) 추정 아세틸트랜스퍼라제 WchC,
iv) 세포질 막의 외엽 상의 반복 단위의 중합을 위한 폴리머라제 wzy
v) 세포질 막의 내엽에서 외엽으로 단일한 반복 단위를 플립핑하기 위한 플립파제 wzx
vi) 뉴클레오티드 활성화 D-GalA의 합성을 책임지는 2개의 단배질, 즉 Gla 및 Ugd. 살림 UDP-Glc로부터의 Gla 및 Ugd에 의한 UDP-D-GalA 합성이 도시된다 (Munoz R, Lopez R, de Frutos M, Garcia E: First molecular characterization of a uridine diphosphate galacturonate 4-epimerase: an enzyme required for capsular biosynthesis in Streptococcus pneumoniae tyep 1. Mol Microbiol 1999, 31(2):703-713)
vii) TDP-L-람노스를 제조하는 것으로 공지된 4개의 단백질 RmlACBD. 이러한 유전자는 수수께끼 같으며 아마도 CPS 생성에 중요하지 않다.
종합적으로, 이는 타입 1 CPS를 만들기 위한 모든 필요한 유전자는 하기를 제외하고 클러스터에서 엔코딩됨을 의미한다:
a) 개시자 당 UDP-D-FucNAc4N의 합성을 위한 단백질을 엔코딩하는 생합성 유전자;
b) 포스포-D-FucNAc4N을 지질 담체 Und-P에 첨가하기 위한 포스포당 트랜스퍼라제를 엔코딩하는 유전자. 변형된 LPS 생합성 경로에 의해 CPS 타입 1을 합성하기 위해 CPS 타입 1 클러스터의 첨가에 의해 폐렴구균 LPS 캡슐이 합성될 수 있는 방식으로 E. 콜라이 숙주 균주에서 a) 및 b)를 제공할 필요가 있다. E. 콜라이 균주는 일반적으로 그러한 효소를 엔코딩하지 않는다. 주목할 만하게는, FucNAc4N을 합성하고 이를 다당류에 혼입시키는 것이 공지된 소수의 미생물만이 존재한다: S. 뉴모니애 CP1 균주, 시겔라 손네이, 플레시오모나스 시겔로이드 O17, 및 박테로이드 프라길리스(Bacterioides fragilis).
따라서 본 발명자들은 상기 기능성을 제공하는 유전자 클러스터를 탐색할 필요가 있다고 추론한다. 이는 시겔라 손네이 또는 슈도모나스 시겔로이드 O17 O 항원의 합성을 위한 생합성 기작의 유전 인자를 이용함에 의해 달성되었다. 이러한 유기체 둘 모두는 동일한 구조를 갖는 O 항원을 합성한다. 이러한 O 항원 이당류 반복 단위 -4-a-L-AltNAcA-1,3-a-D-FucNAc4N-1-로 구성된 선형 폴리머로 구성된 진성 그램 음성 O 항원이다 (도 4) (Batta G, Liptak A, Schneerson R, Pozsgay V: Conformational stabilization of the altruronic acid residue in the O-specific polysaccharide of Shigella sonnei/Plesiomonas shigelloides . Carbohydr Res 1997, 305(1):93-99). 개시 당은 D-FucNAc4N인 것으로 밝혀졌다 (Kubler-Kielb J, Vinogradov E, Ben-Menachem G, Pozsgay V, Robbins JB, Schneerson R: Saccharide/protein conjugate vaccines for Bordetella species: preparation of saccharide, development of new conjugation procedures, and physico-chemical and immunological characterization of the conjugates. Vaccine 2008, 26(29-30):3587-3593). 생합성에 요구되는 유전자 클러스터 (도 5)는 P. 시겔로이드의 유전체 및 S. 손네이의 독성 플라스미드 상에서 엔코딩된다 (Kopecko DJ, Washington O, Formal SB: Genetic and physical evidence for plasmid control of Shigella sonnei form I cell surface antigen. Infection and immunity 1980, 29(1):207-214). 유전자 기능은 상동성 분석에 의해 추정상 알려져 있다 (Xu DQ, Cisar JO, Ambulos Jr N, Jr., Burr DH, Kopecko DJ: Molecular cloning and characterization of genes for Shigella sonnei form I O polysaccharide: proposed biosynthetic pathway and stable expression in a live salmonella vaccine vector. Infect Immun 2002, 70(8):4414-4423).
따라서, E. 콜라이에서 CPS 타입 1 생성을 위한 생합성 기작을 어셈블링하는 전략은 다음과 같았다:
먼저, 본 발명자들은 Und-PP-D-FucNAc4N 생성 경로를 재구성하는 것을 목표로 하였다. 이를 달성하기 위해, 본 발명자들은 E. 콜라이에서 P. 시겔로이드 O 항원 클러스터를 재조합에 의해 발현시켰다.
두 번째로, 본 발명자들은 P. 시겔로이드 O17 클러스터로부터 L-AltNAcA 글리코실트랜스퍼라제를 결실시켜, Und-PP-D-FucNAc4N 트렁케이션된 지질 전구체를 생성하였다.
세 번째로, 본 발명자들은 CPS 타입 1 클러스터를 플라스미드 상에 첨가하였다. 이러한 플라스미드에서 엔코딩된 효소는 P. 시겔로이드 시스템에 의해 제조된 Und-PP-D-FucNAc4N 전구체를 확장시켜 CPS 타입 1 RU를 완성하고 RU들을 중합시킴으로써 변형된 LPS를 만드는 것으로 여겨졌다.
기술적으로, 이는 하기와 같이 수행되었다:
제 1 단계에서, 본 발명자들은 P. 시겔로이드 O 항원 유전자 클러스터 (rfbP.shigelloidesO17)를 공여체 플라스미드 pDOC-C (, Lee DJ, Bingle LE, Heurlier K, Pallen MJ, Penn CW, Busby SJ, Hobman JL: Gene doctoring: a method for recombineering in laboratory and pathogenic Escherichia coli strains. BMC Microbiol 2009, 9:252)로 클로닝하였다. 재조합효소 및 엔도누클레아제를 엔코딩하는 이러한 공여체 플라스미드 및 헬퍼 플라스미드를 이용하여 (Kuhlman TE, Cox EC: Site-specific chromosomal integration of large synthetic constructs. Nucleic acids research 2010, 38(6):e92), 본 발명자들은 W3110 ΔwecAwzzECA ΔwaaL E. 콜라이 균주의 rfb 클러스터를 상동성 재조합에 의해 플라스미드로부터의 P. 시겔로이드 클러스터 (wzz 내지 wbgZ, FIG. 5)와 교환하였다. 예컨대, 그 전문이 본원에 참조로서 포함되는 국제출원 PCT/EP2013/071328을 참조하라. 그 결과 염색체로 통합된 균주는 웨스턴 블롯팅에서 항 S. 손네이 형별 혈청에 반응하는 재조합 O 항원을 만든다.
이러한 통합된 P. 시겔로이드 클러스터 내에서 엔코딩되는 wbgW 유전자는 Datsenko 및 Wanner의 방법에 따른 상동성 재조합에 의해 염색체로부터 결실되었다 (Datsenko KA, Wanner BL: One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A 2000, 97(12):6640-6645). 그 결과 균주는, 가장 가능성 있게는 완전한 이당류 반복 단위를 만드는 균주의 무능력으로 인해, 어떠한 항 S. 손네이 특이적 지질 연결된 다당류를 더 이상 생성하지 못했다.
다음으로, wzg 내지 ugd의 CPS 1 클러스터 (도 2)는 인공 프로모터 (J23103, http://partsregistry.org/Part:BBa_J23103) 및 E. 콜라이에서 활성인 최적 리보솜 결합 부위 뒤에 클로닝되었다.
지질 연결된 올리고당류 생합성의 분석을 위한 진탕 플라스크 배양에서 기재된 유전 시스템의 발현은 항 CPS 타입 1 특이적 항혈청을 이용한 웨스턴 블롯팅에서 사다리 같은 밴드 패턴을 생성하였다 (도 6). 이는 변형된 LPS 생합성 경로가 S. 뉴모니애의 타입 1의 CPS의 재조합 발현에 있어서 협력하였음을 나타낸다.
생성된 반응성 프로테아제 내성 물질이 실제로 운데카프레닐 피로포스페이트에 연결된 CPS 타입 1이었다는 증거를 추가로 제공하기 위해; 도 6으로부터의 샘플에 산 민감성 검사를 적용시켰다. TFA에 의한 약산 처리는 다당류와 운데카페닐을 연결시키는 피로포스페이트 결합의 존재를 나타내는 항 CPS 타입 1 신호를 폐지하였다 (도 7). 본 발명자들은 수송체 유전자 wzg-wzd의 존재 하에 변형된 O 항원을 제조할 수 있음을 발견하였다. 이러한 유전자가 직접 효과를 갖는 지를 조사하기 위해, 본 발명자들은 상동성 재조합에 의해 CPS 타입 1 플라스미드로부터의 4개의 수송체 유전자를 결실시켰다 (Bloor AE, Cranenburgh RM: An efficient method of selectable marker gene excision by Xer recombination for gene replacement in bacterial chromosomes. Applied and environmental microbiology 2006, 72(4):2520-2525). 변형된 플라스미드의 공동발현은 놀랍게도 항 CPS 타입 1 신호의 손실을 발생시켰다 (도 8). 이는 수송체 유전자가 변형된 O 항원의 효율적인 생성에 필요함을 나타낸다.
재조합 CPS 타입 1이 단백질의 당화 및 이에 따라 단백질-탄수화물 컨쥬게이트의 형성에 이용될 수 있음을 나타내기 위해 본 발명자들은 적합한 재조합 E. 콜라이 균주에서 컨쥬게이트 생성의 능력에 대해 박테리아 단백질 당화 기작을 시험하였다 (Wacker M, Linton D, Hitchen PG, Nita-Lazar M, Haslam SM, North SJ, Panico M, Morris HR, Dell A, Wren BW et al: N-linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli. Science 2002, 298(5599):1790-1793).
문헌(Feldman MF, Wacker M, Hernandez M, Hitchen PG, Marolda CL, Kowarik M, Morris HR, Dell A, Valvano MA, Aebi M: Engineering N-linked protein glycosylation with diverse O antigen lipopolysaccharide structures in Escherichia coli. Proc Natl Acad Sci U S A 2005, 102(8):3016-3021; Kowarik M, Young NM, Numao S, Schulz BL, Hug I, Callewaert N, Mills DC, Watson DC, Hernandez M, Kelly JF et al: Definition of the bacterial N-glycosylation site consensus sequence. The EMBO journal 2006, 25(9):1957-1966; Wacker M, Linton D, Hitchen PG, Nita-Lazar M, Haslam SM, North SJ, Panico M, Morris HR, Dell A, Wren BW et al: N-linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli. Science 2002, 298(5599):1790-1793; Ihssen J, Kowarik M, Dilettoso S, Tanner C, Wacker M, Thony-Meyer L: Production of glycoprotein vaccines in Escherichia coli. Microbial cell factories 2010, 9:61.)에 문서화된 N-당화 시스템을 이용하여 실험을 수행하였다. CPS 타입 1 지질 연결된 올라고당류를 발현하는 재조합 E. 콜라이를 2개의 유도성 플라스미드로 형질전환시켰다. 한 플라스미드는 수용체 단백질을 일반적으로 N 당화시키는 것이 반복적으로 밝혀진 PglB 효소를 엔코딩하였다 (-D/E-x-N-x-S/T- 타입의 컨센서스 아미노산 서열을 엔코딩함, 여기서 x는 프롤린일 수 없다). 두 번째 플라스미드 상에서, 2개의 삽입된 N 당화 컨센서스 서열 및 Ni-친화성 크로마토그래피 정제를 위한 His-tag를 함유하는 담체 단백질 EPA가 엔코딩되었다. 당화 실험 후에, EPA 단백질을 정제하고 항 his tag 항혈청 (도 9, 패널 A) 및 항 CPS 타입 1 항혈청 (도 9, 패널 B)으로 프로빙하였고 이는 용리 분획에서 명확하게 검출되었다. 이는 항-폐렴구균 백신 후보로서 이용될 수 있는 단백질 컨쥬게이트의 효율적인 생성을 가능케 하는 재조합 CPS 타입 1 발현 시스템과 함께 PglB 시스템을 입증한다.
실시예
2: E.
콜라이에서
CPS4
컨쥬게이트의
합성:
단백질 당화가 활성 컨쥬게이트 백신을 생성하는데 이용될 수 있음을 추가로 나타내기 위해, 본 발명자들은 CPS1에 관해 수송체 유전자의 존재 하에 CPS 타입 4 컨쥬게이트를 생성하는 것을 목표로 하였다.
CPS4는 환원성 말단에 GalNAc를 함유하는 반복 단위 구조를 갖는다 (도 10). 완전한 구조는 다음과 같다:
-1,4-(2,3 S pyr)-a-D-Gal-1,3-a-D-ManNAc-1,3-a-L-FucNAc-1,3-a-D-GalNAc
CPS1의 유전자 클러스터와 달리, S. 뉴모니애로부터의 CPS 타입 4를 엔코딩하는 클러스터는 CPS4 (도 11)를 합성하기 위한 모든 필요한 효소를 엔코딩한다. UDP-D-FucNAc 및 UDP-D-ManNAc는 단백질 MnaA, FnlA, B, 및 C로 만들어진다. 상이한 글리코실트랜스퍼라제의 기능은 공지된 특이성을 지닌 다른 글리코실트랜스퍼라제에 대한 이들의 상동성에 기반하여 예측된다. WciI는 예측된 글리코실-포스페이트 트랜스퍼라제이므로 Und-PP-D-GalNAc 합성을 담당한다. WciJ, K, 및 L은 D-ManNAc, L-FucNAc, 및 D-Gal 트랜스퍼라제이고, WciM은 피루베이트 트랜스퍼라제의 동족체이다 (Jiang SM, Wang L, Reeves PR: Molecular characterization of Streptococcus pneumoniae type 4, 6B, 8, and 18C capsular polysaccharide gene clusters. Infect Immun 2001, 69(3):1244-1255).
E. 콜라이에서 CPS4 변형된 경로를 재구성하기 위해, 본 발명자들은 먼저 CPS4 유전자 클러스터 (aliA와 dexB 사이의 유전자)를 E. 콜라이에서의 발현을 위한 플라스미드로 클로닝시켜 pGVXN803을 생성하였다. 두 번째 설정에서, 본 발명자들은 수송체 유전자 (pGVXN753 생성), 즉 wciJ-fnlC의 다운스트림 유전자만을 포함시켜, wzg, wzh, wzd, 및 wze의 효과 뿐만 아니라, wciI 결실의 효과도 명백하게 분석하였다. WciI은 바이오인포매틱스 분석에 따른 인-당 트랜스퍼라제 동족체이다. 유사한 활성은 E. 콜라이, 구체적으로 장내박테리아 공통 항원 (ECA) 클러스터에서 엔코딩되는 wecA 유전자에 존재한다. pGVXN753에서, 본 발명자들은 삽입된 유전자의 전사를 보장하기 위해 다수의 클로닝 부위의 업스트림에 인공 프로모터 서열을 포함시켰다.
E. 콜라이에서의 발현에 대한 상기 언급된 플라스미드의 효과를 분석하기 위해, 본 발명자들은 W3110 ΔwaaL 세포를 pGVXN753 및 pGVXN803으로 형질전환시켰다. W3110 ΔwaaL은 Und-PP-D-GlcNAc의 합성을 담당하는 WecA 단백질을 엔코딩하지만, Und-PP-D-GalNAc을 만들 수 없다. 후자의 지질 연결된 단당류는 CPS4 RU를 완성하는 CPS4 클러스터의 효소에 대한 예상되는 기질이다. 따라서, 본 발명자들은 CPS4 클러스터 플라스미드 외에 2개의 상이한 D-GlcNAc 내지 D-GalNAc 에피머라제, Z3206 (Rush JS, Alaimo C, Robbiani R, Wacker M, Waechter CJ: A novel epimerase that converts GlcNAc-P-P-undecaprenyl to GalNAc-P-P-undecaprenyl in Escherichia coli O157. J Biol Chem 2010, 285(3):1671-1680) 및 GalE (Linton D, Dorrell N, Hitchen PG, Amber S, Karlyshev AV, Morris HR, Dell A, Valvano MA, Aebi M, Wren BW: Functional analysis of the Campylobacter jejuni N-linked protein glycosylation pathway. Mol Microbiol 2005, 55(6):1695-1703)을 제공하였다. 두 유전자 모두는 생체내 D-GalNAc 합성을 가능케 하는 단백질을 엔코딩하며, 전자는 지질 연결된 D-GlcNAc (Und-PP-D-GlcNAc<-> Und-PP-D-GalNAc)의 에피머화에 의해, 그리고 후자는 기질로서 뉴클레오티드 활성화 당을 이용함에 의해서이다 (UDP-D-GlcNAc<->UDP-D-GalNAc).
도 12는 분석 결과를 도시한다. 세포를 성장시키고 에피머라제 발현을 유도하고, 프로테아제 내성 바이오매스를 SDS-PAGE에 의해 분리하고, 니트로셀룰로스 막으로의 당지질의 전달 후 면역검출에 의해 분석하였다. 상기 결과는 pGVXN803이 세포에 존재할 때마다, 항 CPS4 항혈청에 의해 사다리 유사 신호가 검출되었음을 나타낸다. 비록 수송체 유전자 및 wciI를 함유한 작제물보다 훨씬 약하긴 하지만, pGVXN753이 또한 신호를 유도하였다. 에피머라제의 유도 및 특성은 신호 강도에 근소한 영향을 주었다. 가장 강력한 반응성은 뉴클레오티드 활성화 당에 특이적인 에피머라제 및 pGVXN803으로 얻어졌는데, 이는 WciI가 D-GalNAc-포스페이트 트랜스퍼라제임을 제안한다. 따라서 CPS1에 관해 놀랍게도, 수송체 유전자는 E. 콜라이에서 CPS4 변형된 LPS의 효율적인 생성에 중요하다. wciI에 대한 수송체 유전자의 영향을 조사하기 위해, pGVX753의 존재 하에 wciI의 공동 발현을 이용할 수 있다. 대부분의 경우, wciI 단독으로는 수송체 유전자 (즉, pGVX803을 함유하는 W3110 ΔwaaL에서)의 존재 하에 관찰되는 수준까지 CPS4 발현을 향상시킬 수 없다.
E. 콜라이에서 생성된 CPS4를 추가로 특성화하기 위해, 본 발명자들은 E. 콜라이 SCM6에서 pGVXN803을 발현시키고 (Schwarz F, Huang W, Li C, Schulz BL, Lizak C, Palumbo A, Numao S, Neri D, Aebi M, Wang LX: A combined method for producing homogeneous glycoproteins with eukaryotic N-glycoslation. Nat Chem Biol 2010; SCM6 is deleted in wecA, ECA, waaL) 2-AB 표지화 및 MS/MS 분석에 의해 당지질을 분석하였다. 2-AB 표지화는 다당류 및 올리고당류를 분리, 가수분해, 변형시키고, 이들을 HPLC 및 MS/MS에 의해 분석하도록 개발된 방법이다. 세포를 밤새 성장시키고, 확립된 절차에 따라 제조 및 가공하였다 (US2011/0274720).
간단히 말해, 당지질을 유기 용매에 의해 바이오매스로부터 추출하고 (클로로포름:메탄올:물 10:10:3) C18 카트리지 상에서 정제시키고; 용리액을 물/이소프로판올에서 TFA로 처리하여, 피로포스페이트 결합을 가수분해하고 Und-PP-글리칸으로부터 글리칸 부분을 방출시켰다. 생성된 용액을 또 다른 C18 카트리지 상에서 통과시켜 지질을 제거하였다. 통과 유량(flow through)을 건조시키고 글리칸을 환원성 말단에서 2 아미노벤자미드로 표지화하였다. 생성된 표지된 글리칸을 gylcosepN 순상 컬럼을 이용하여 HPLC에 의해 분리하고 형광성에 의해 검출하였다 (US2011/0274720 A1).
생성된 크로마토그램을 도 13 (패널 A)에 도시한다. pGVXN803을 함유하거나 pGVXN803이 결여된 SCM6 세포로부터 수득된 크로마토그램의 비교는 전자에는 존재하지만 후자에는 결여된 여러 피크를 나타낸다. 이들 중 일부를 글리칸 동일성 및 서열의 확인을 위해 MS/MS에 의해 분석하였다. 여러 피크에 대해 예상되는 CPS4 RU 및 폴리머 구조와 일치하는 MS/MS 패턴을 확인할 수 있었다 (화살표로 표시됨). 도 13의 패널 B는 53.8분에 용리되는 피크로부터의 MALDI-MS/MS 스펙트럼을 도시한다. 단편화 이온 시리즈는 비-환원성 헥소스에서 피루베이트로 변형된 CPS4 RU와 일치한다.
본 발명자들은 피루베이트의 비-화학량론적 존재로 인한 이종성을 관찰하였는데, 이는 샘플 제조 동안 피루베이트를 지닌 CPS4 반복 단위의 비정량적 변형 또는 가수분해를 나타낸다. 본 발명자들은 데이터로부터 Und-PP에 대해 CPS4를 생성하는 변형된 LPS 생합성 경로를 생성할 수 있었다는 결론을 내렸다.
CSP4 당지질을 추가로 분석하기 위해, 본 발명자들은 CSP4를 발현하는 E. 콜라이 SCM3 균주로부터 당지질을 추출하고 (Faridmoayer A, Fentabil MA, Mills DC, Klassen JS, Feldman MF: Functional characterization of bacterial oligosaccharyltransferases involved in O-linked protein glycosylation. JOURNAL OF BACTERIOLOGY 2007, 189(22):8088-8098), 상기 기재된 대로 이들을 분석하거나 (도 14) 시험관내 당화에 당지질을 직접 이용하였다. 이러한 실험에서, 당지질, N 당화 컨센서스 서열을 함유하는 수용체 펩티드, 및 올리고사카릴트랜스퍼라제 PglB의 정제된 제조물을 혼합하였다 (Jervis AJ, Butler JA, Lawson AJ, Langdon R, Wren BW, Linton D: Characterization of the structurally diverse N-linked glycans of Campylobacter species. JOURNAL OF BACTERIOLOGY 2012, 194(9):2355-2362). 형성된 글리코펩티드는 글리칸의 서열화에 대해 HILIC 크로마토그래피 (도 15, 패널 A 및 B)에 이어서 ESI-MS/MS로 분석될 수 있다. 그러한 실험으로부터의 생성물을 분석했을 때, 펩티드에 부착된 독점적으로 피루빌화된(pyruvylation) 글리칸이 확인되었다 (도 15, 패널 C 및 D). 따라서, 도 13 및 14에서 관찰되는 비-화학량론적 피루빌화는 CPS4 RU의 비-정량적 장식이라기보다 샘플 제조 동안 글리칸에서 피루베이트의 가수분해로부터 유래되었을 가능성이 가장 높다. 따라서, 본 발명자들은 변형된 LPS 생합성 경로에 의해, 화학적 컨쥬게이션에 비해 활성이고 가능하게는 더 양호한 컨쥬게이트의 합성을 가능케 하는 자연 조건 하에 CPS를 생성할 수 있음을 주장한다.
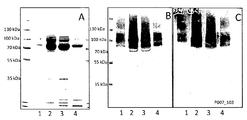
이러한 가설을 시험하기 위해, 본 발명자들은 임상전 분석에서 글리코컨쥬게이트를 시험하는 것을 목표로 하였다. 첫 번째 단계에서, 본 발명자들은 슈도모나스 아에루기노사의 유전적으로 무독화된 외독소 A인 제네릭 담체 단백질에 컨쥬게이션된 CPS4를 생성하기 위한 미생물 발효를 이용하였다 (EPA, US2011/0274720 A1). E. 콜라이 W3110 ΔwaaL는 pGVXN539 (2 N 당화 컨센서스 서열을 엔코딩하는 EPA 담체 단백질 발현 (US2011/0274720 A1 및 dyx), clmR 카세트가 카나마이신 내성 카세트 (kanR)로 교체된 pACT3 (GenBank: U51556.1)에서 클로닝됨; pGVXN114 (PglB의 유도성 발현, US2011/0274720 A1), pGVXN207 (GalE의 유도성 발현, (Rush JS, Alaimo C, Robbiani R, Wacker M, Waechter CJ: A novel epimerase that converts GlcNAc-P-P-undecaprenyl to GalNAc-P-P-undecaprenyl in Escherichia coli O157. J Biol Chem 2010, 285(3):1671-1680) 및 pGVXN803 (CPS4 클러스터 엔코딩)로 형질전환되었다. 세포들을 TB 배지에서 성장시키고 적합한 OD에서 유도하고 밤새 생성시켰다. His 태깅된 EPA를 라이소자임에 이어 IMAC를 이용하여 주변세포질 추출에 의해 제조된 주변세포질 추출물로부터 정제하였다. 용리 분획의 분석적 검정은 도 16에 도시된다. SDS-PAGE 및 쿠마시 염색은 70 및 70 초과 kDa에서 비- 및 당화된 EPA를 나타내며, 후자는 RU로 구성된 (변형된) O 항원 글리칸을 나타내는 사다리 같은 패턴으로 존재한다 (도 16, 패널 A). 동일한 분획의 니트로셀룰로스 막으로의 전기전달 후에 항 His (도 16, 패널 B) 및 항 CPS4 (도 16, 패널 C)에 의한 면역검출은 물질 중 CPS4 및 EPA의 존재를 확인시켜 주었다.
글리코컨쥬게이트를 비- 및 당화된 EPA의 분리를 위해 음이온 교환 크로마토그래피에 의해 추가로 정제하였다; 그 후 크기 배제 크로마토그래피에 의해 당단백질을 추가로 정제하였다. 생성된 당단백질 제조물을 1-페닐-3-메틸-5-피라졸론에 의한 유도체화를 이용하여 단당류 조성에 대해 분석하였는데 (PMP, Lv L, Yang X, Zhao Y, Ruan Y, Yang Y, Wang Z: Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection. Food Chemistry 2009, 112:742-746), 이는 재조합 글리코컨쥬게이트의 글리칸 조성이 S. 뉴모니애로부터 분리된 CPS4와 동일함을 입증하였다 (도 17).
글리코컨쥬게이트의 백신 활성을 시험하기 위해, 면역화 연구 및 옵소닌식작용(opsonophagocytosis) 검정 (OPA)을 수행하였다. OPA는 S. 뉴모니애 세포를 제거하기 위한 항체의 기능성을 다루는 일반적으로 인지된 검정이고 보호에 대한 대용물이다. 본 발명자들은 상이한 용량의 EPA-CPS4 컨쥬게이트로 토끼를 면역시켰다. 대조군으로서, 본 발명자들은 소아 폐렴구균 질환의 예방을 위해 광범위하게 이용되는 허가 및 판매되는 제품인 Prevenar 13을 이용하였다. 생성된 항혈청을 면역원성에 대해서는 도트 블롯에 의한 분석 (도 18)에 제공하고 기능성에 대해서는 표준화 프로토콜에 따라 OPA에 제공하였다 (Romero-Steiner S, Frasch CE, Carlone G, Fleck RA, Goldblatt D, Nahm MH: Use of opsonophagocytosis for serological evaluation of pneumococcal vaccines. Clin Vaccine Immunol 2006, 13(2):165-169).
표 1은 수득된 관련 옵소닌 역가를 도시한다. 상기 결과는 E. 콜라이에서 재조합에 의해 제조된 글리코컨쥬게이트가 충분히 동일하고 일부 경우에 옵소닌식작용 검정에서 활성인 항혈청을 생성하는 능력에 있어서 심지어 허가된 백신 비교기보다 양호함을 나타낸다.
실시예
3: E.
콜라이에서
CPS14
컨쥬게이트의
합성:
E. 콜라이가 CPS 컨쥬게이트의 생성에 이용될 수 있음을 추가로 나타내기 위해, 본 발명자들은 CPS14 컨쥬게이트를 생성하는 것을 목표로 하였다. CPS14 다당류는 CPS1 및 CPS4와 유사한 구조로 CPS14 클러스터에 의해 엔코딩된다 (도 19). CPS14는 하기 구조를 갖는 중합된 RU로 구성된다 (도 20): -1,6-(b-D-Gal-1,4)-b-D-GlcNAc-1,3-b-D-Gal-1,4-b-D-Glc-.
CPS14의 생합성은 WchA의 활성에 의한 포스포-D-Glc의 운데카프레닐 포스페이트 (Und-P)로의 첨가에 의해 개시된다. WchA는 콜라닌산 클러스터의 유전자에 의해 엔코딩된 E. 콜라이 WcaJ 단백질과 동일한 활성을 갖는, 포스포-글리코스 트랜스퍼라제인 것이 생화학적으로 밝혀졌다. D-Glc의 추가의 신장은 클러스터에 존재하는 다른 글리코실트랜스퍼라제의 효소 작용에 의해 달성된다 (Kolkman MA, van der Zeijst BA, Nuijten PJ: Functional analysis of glycosyltransferases encoded by the capsular polysaccharide biosynthesis locus of Streptococcus pneumoniae serotype 14. J Biol Chem 1997, 272(31):19502-19508). CPS14 클러스터에서 상이한 ORF의 상세한 기능은 wzg, wzh, wzd, wze (조절기, 및 3개의 수송 관련 유전자), WchJK (D-Gal 트랜스퍼라제), WchL (D-GlcNAc 트랜스퍼라제), WchM (D-Gal 트랜스퍼라제), Wzy (폴리머라제), Wzx (플립파제)에 대해 예측된다. WciY는 CPS14 형성에 없어도 좋은 반면, wchN 결실은 CPS14 수율에 부정적인 영향을 미친다 (Kolkman MA, Wakarchuk W, Nuijten PJ, van der Zeijst BA: capsular polysaccharide synthesis in Streptococcus pneumoniae serotype 14: molecular analysis of the complete cps locus and identification of genes encoding glycosyltransferases required for the biosynthesis of the tetrasaccharide subunit. Mol Microbiol 1997, 26(1):197-208). CPS14 클러스터는 CPS14 생합성에 최소로 필요한 것보다 더 많은 기능이 엔코딩된다는 점에서 특수하다. 아마도 대부분, 할당되지 않은 기능을 갖는 단백질의 일부는 캡슐의 생합성을 뒷받침하는 보조 효소이다.
E. 콜라이에서 CPS14 다당류의 생성을 시험하기 위해, wchA에서 wciY의 스트레치로 구성된 CPS14 유전자 클러스터를 O16 항원 클러스터로의 CPS14의 통합을 위해 지정된 pDOC 공여체 플라스미드 (Lee DJ, Bingle LE, Heurlier K, Pallen MJ, Penn CW, Busby SJ, Hobman JL: Gene doctoring: a method for recombineering in laboratory and pathogenic Escherichia coli strains. BMC Microbiol 2009, 9:252) (pGVXN615)로 클로닝하고 E. 콜라이 균주 GVXN1128 (W3110 ΔwaaL)로 형질전환시켰다. pGVXN615를 지니는 프로테이나제 K 분해된 E. 콜라이 세포의 면역블롯 분석은 사다리-같은 패턴을 나타냈는데, 이는 임상 CPS14 단리물의 캡슐 혈청형결정에 이용된 CPS14 항혈청으로 검출되었다 (도 21의 삽화, 패널 A). 더욱이, 단일한 반복 단위를 축적하기 위해, CPS14 클러스터의 폴리머라제, wzy를 트랜스포손 돌연변이유발에 의해 pGVXN615에서 결실시켜 pGVXN643을 생성하였다. 당지질을 pGVXN643으로 형질전환된 E. 콜라이 세포로부터 추출하고 상기 기재된 대로 가수분해 및 형광 표지화 후에 NP-HPLC에 의해 분석하였다. 특수한 피크가 glycosepN 컬럼으로부터 57.4분에 용리되었다 (도 21, 패널 A). 이러한 피크의 MS 및 MS/MS 분석은 CPS14의 단일한 반복 단위의 예상되는 질량 및 단편화 패턴과 일치하였다 (도 21, 패널 B). 이는 O 항원 프로모터의 제어 하에 부분적인 CPS14 유전자 클러스터의 발현이 일반적인 E. 콜라이 숙주 세포에서 재조합 LPS 생합성 CPS14 올리고사카라이드 생성을 발생시킬 수 있음을 확인시켜 준다.
E. 콜라이에서 CPS14 다당류의 생합성을 개선시키고 안정화시키기 위해, wchA부터 wciY의 스트레치를 함유하는 CPS14 클러스터의 부분을 E. 콜라이 콜라닌산 클러스터로의 CPS14의 통합을 위해 지정된 pDOC-C 교체 플라스미드 (Lee DJ, Bingle LE, Heurlier K, Pallen MJ, Penn CW, Busby SJ, Hobman JL: Gene doctoring: a method for recombineering in laboratory and pathogenic Escherichia coli strains. BMC Microbiol 2009, 9:252) (pGVXN710)로 클로닝시켰다. CPS14의 통합은 상기 기재된 대로 GVXN1052 (W3110), GVXN1128 (W3110 ΔwaaL) 및 GVXN1716 (W3110 ΔwaaLΔwecA-wzzE)을 포함하는 여러 E. 콜라이 균주에서 완료되었다. 콜라닌산 유전자는 정상 조건 하에 E. 콜라이에서 발현되지 않고, 이들의 발현은 조절기의 복잡한 네트워크에 의해 제어되는 것으로 밝혀졌다. 콜라닌산의 전사는 양성 조절기인 RcsA를 필요로 함이 확인되었다 (Ebel W, Trempy JE. J Bacteriol. 1999;181(2):577-84). 콜라닌산 클러스터가 RcsA의 발현을 위해 플라스미드 (pGVX688)를 함유하는 CPS14 클러스터로 교체된 프로테이나제 K 분해된 E. 콜라이 균주의 면역블롯 분석은 임상 CPS14 단리물의 혈청형결정에 이용되는 CPS14 항혈청에 의해 검출되는 사다리-같은 패턴을 나타내었고; 이러한 패턴은 RcsA의 부재하에 검출될 수 없었다 (도 22를 참조하라). 이러한 결과는 콜라닌산이 다당류 생합성 경로를 통합하기 위한 적합한 표적 위치이고 이종성 다당류의 발현이 E. 콜라이 RcsA 단백질에 의해 빈틈없이 제어됨을 입증한다.
E. 콜라이에서 생성되는 CPS14를 추가로 특성화하기 위해, GVX6129 (W3110ΔwaaL CA::CPS14)를 pGVXN688 (rcsA)을 이용하여 E. 콜라이로 형질전환시켰다. 당지질을 상기 기재된 대로 2-AB 표지화 및 MS/MS 분석에 의해 분석하였다. MS/MS 분석은 각각 95.9분 및 115.3분에 용리되는 CPS14의 2 및 3 서브유닛을 확인하였다 (도 24를 참조하라).
E. 콜라이에서 CPS14 다당류의 생성에 대한 수송체 유전자의 발현의 효과를 시험하기 위해, 수송체 유전자를 함유하는 S. 뉴모니애 CPS14 클러스터의 wzg 내지 wze를 IPTG 유도성 프로모터 (pGVX 72)를 지닌 낮은 복사체 수 플라스미드로 클로닝시켜 pGVX1497을 형성하였다. 플라스미드를 E. 콜라이 균주 GVX6126 (E. 콜라이 W3110 CA::CPS14)로 형질전환시키고, 이로부터 CPS14 클러스터의 wchA 내지 wciY 부분을 콜라닌산 E. 콜라이에 통합시켰다. GVX6126을 pGVX72 또는 pGVX1497로 형질전환시키고, 배양하여, 0.01 mM IPTG를 이용한 수송체 유전자 발현을 유도하였다. E. 콜라이 세포를 밤새 인큐베이션 후에 회수하고 프로테이나제 K로 분해시키고, 프로테아제 내성 바이오매스를 SDS-PAGE에 의해 분리하고, 당지질을 니트로셀룰로스 막으로 전달한 후 면역검출에 의해 분석하였다. 상기 결과는 pGVXN1497 (wzg-wzh-wzd-wze 발현)의 존재 하에, 높은 분자량의 사다리 같은 신호가 항 CPS14 항혈청에 의해 검출되었고 (도 23 참조. 레인 3), pGVXN1497이 빈 벡터 (pGVX72)로 교체되었을 때, 사다리 크기가 현저하게 감소되었음을 나타낸다 (도 23 참조. 레인 2). 이는 CPS의 생성을 위한 수송체 유전자의 지지 요건을 입증한다.
gtrABS 오페론은 CPS14(wchA에 의해 합성됨), Und-PP에 대한 자연 개시자 단계와 매우 유사한 세포 화합물인 Und-P에 대한 글루코스의 합성에 관여한다. gtrABS 오페론은 당지질을 주변세포질로 플립핑하는 세포질의 Und-P에 대한 글루코스의 어셈블리에 관여하는 효소, 및 E. 콜라이 W3110에서 O16 서브유닛의 환원성 말단 GlcNAc로 글루코스 잔기를 전달하는 공여체로서 Und-P-글루코스를 이용하는 글루코실트랜스퍼라제를 엔코딩하는 유전자를 함유한다.
D-Glc를 지닌 2개의 지질 전구체의 생성을 피하고 Und-P-CPS14가 아닌 Und-PP-CPS14만을 생성하기 위해, 개시자 글루코스로서 Und-PP-글루코스만을 만드는 효소를 이용할 수 있다. 또한, Und-P-글루코스 생성 경로는 결실될 수 있다. 이러한 방식으로, 모든 CPS는 피로포스페이트 결합에 의해 Und에 연결되므로 당화에 이용가능하다.
E. 콜라이에서 CPS14의 생합성 경로를 추가로 설명하고 최적화하기 위해, CPS14 경로의 개시자 글루코실트랜스퍼라제 활성을 향상시킬 수 있다. 이는 wchA 및 wcaJ의 결실에 의해 조사되었고, 이들을 동일한 유전자를 이용한 플라스미드 매개 과발현 전략에 의해 보충하고 당지질 생성에 대한 효과를 분석하였다.
wcaJ 유전자를 함유하는 플라스미드는 CPS14를 함유하지만 WchA 및 WcaJ가 결여된 E. 콜라이 균주로 잘 형질전환될 수 있다 (예컨대, W3110 ΔwaaL ΔrfbO16::CPS14-clmR ΔwchA ΔgtrABS). 확립된 방법을 이용하여, 당 생성을 이러한 균주에서 분석할 수 있다. 이러한 결과에 기반하여, Und-PP에 연결된 최대량의 CPS14의 생성을 위한 유전자의 최적 조합을 결정하고, E. 콜라이를 형질전환하는데 이용하여, 최적 생성 균주를 생성할 수 있었다. 확실히, 양호하게 당을 생성하는 이러한 신규한 E. 콜라이 균주는 N 및 O 당화 둘 모두의 당화된 단백질의 생성을 풍부하게 하는데 이상적일 수 있었다. 게다가, 만약 추가한다면, 신규하게 공학처리된 이러한 균주를 이용하여 상이한 글리코컨쥬게이트를 생성할 수 있었고; 다양한 단백질 담체가 환원성 말단에 Glc를 함유하는 임의의 글리코컨쥬게이트의 생성 균주에 포함된다.
표 1: '뉴질랜드 화이트' 토끼를 0일, 21일 및 42일에 지시된 글리코컨쥬게이트 백신 (주석, μg으로 언급된 양은 주입 당 다당류의 양을 의미한다)으로 피하 경로를 통해 면역시켰다. 글리코컨쥬게이트 백신은 3회 모두의 면역화 동안 0.12% Al3+으로 애쥬번트화되거나 프라임 면역화(d0)의 경우 프로인트 완전 애쥬번트 (FCA) 그리고 2회의 추가 면역화(d21 및 d42)의 경우 프로인트 불완전 애쥬번트 (FIA)로 애쥬번트화되었다. Prevnar-13을 제조자 지시에 따라 이용하였고 1회 인간 용량 (2.2 μg CPS4 다당류에 상응함)이 면역화 당 주입되었다. 56일에 동물을 희생시키고, 수득된 혈청을 옵소닌식작용 사멸 검정 (OPK)에서 중화 활성에 대해 분석하였다. '옵소닌 지수'는 박테리아의 50%를 사멸시키는 혈청의 희석율로서 정의된다 (폐렴구균 혈청형 4).
동등물:
본원에 개시된 방법, 숙주 세포, 및 조성물은 본원에 기재된 특정 구체예에 의한 범위 내로 제한되지 않는다. 또한, 기재된 것에 더한 방법, 숙주 세포, 및 조성물의 다양한 변형이 상기 설명 및 수반하는 도면으로부터 당업자에게 명백해질 것이다. 상기 변형은 첨부된 청구항의 범위 내에 속하는 것으로 의도된다.
다양한 공개문헌, 특허 및 특허 출원이 본원에 인용되며, 이의 전체 개시내용은 참조로서 포함된다.
Claims (55)
- 다당류를 생성하기 위한 공학처리된 그램-음성 박테리아로서, 그램-음성 박테리아가 그램-양성 박테리아의 캡슐 다당류 유전자 클러스터의 조절 유전자를 포함하는, 공학처리된 그램-음성 박테리아.
- 제 1항에 있어서, 그램-음성 박테리아가 캡슐 다당류 유전자 클러스터의 개방해독틀의 적어도 25%, 50%, 75%, 85%, 90%, 또는 적어도 95%를 포함하는 그램-음성 박테리아.
- 제 1항에 있어서, 그램-음성 박테리아가 완전한 캡슐 다당류 유전자 클러스터를 포함하는 그램-음성 박테리아.
- 제 1항에 있어서, 다당류가 캡슐 다당류의 에피토프를 포함하는 그램-음성 박테리아.
- 제 1항에 있어서, 상기 그램-음성 박테리아가 에스체리치아 종, E. 콜라이, 시겔라 종, 클렙시엘라 종, 살모넬라 종, 예르시니아 종, 네이세리아 종, 비브리오 종 및 슈도모나스 종으로 구성된 군으로부터 선택되는 그램-음성 박테리아.
- 제 5항에 있어서, 상기 그램-음성 박테리아가 E. 콜라이인 그램-음성 박테리아.
- 제 1항 내지 제 6항 중 어느 한 항에 있어서, 상기 조절 유전자가 스트렙토코쿠스 뉴모니애 조절 유전자인 그램-음성 박테리아.
- 제 7항에 있어서, 상기 S. 뉴모니애 조절 유전자가 S. 뉴모니애 타입 1에서 비롯되는 그램-음성 박테리아.
- 제 7항에 있어서, 상기 S. 뉴모니애 조절 유전자가 S. 뉴모니애 타입 4에서 비롯되는 그램-음성 박테리아.
- 제 1항 내지 제 9항 중 어느 한 항에 있어서, 상기 조절 유전자가 스타필로코쿠스 아우레우스 조절 유전자인 그램-음성 박테리아.
- 제 1항 내지 제 10항 중 어느 한 항에 있어서, 상기 조절 유전자가 스타필로코쿠스 아갈락티애 조절 유전자인 그램-음성 박테리아.
- 제 1항 내지 제 11항 중 어느 한 항에 있어서, 상기 조절 유전자가 엔테로코쿠스 패칼리스 조절 유전자인 그램-음성 박테리아.
- 제 1항 내지 제 12항 중 어느 한 항에 있어서, 올리고사카릴 트랜스퍼라제를 추가로 포함하는 그램-음성 박테리아.
- 제 13항에 있어서, 상기 올리고사카릴 트랜스퍼라제가 그램-음성 박테리아에 이종성인 그램-음성 박테리아.
- 제 1항 내지 제 14항 중 어느 한 항에 있어서, 적어도 하나의 이종성 글리코실트랜스퍼라제를 추가로 포함하는 그램-음성 박테리아.
- 제 15항에 있어서, 상기 이종성 글리코실트랜스퍼라제가 원핵생물 글리코실트랜스퍼라제인 그램-음성 박테리아.
- 제 16항에 있어서, 글리코실트랜스퍼라제가 조절 유전자와 동일한 그램-양성 박테리아로부터 수득되는 그램-음성 박테리아.
- 제 1항 내지 제 17항 중 어느 한 항에 있어서, 그램-음성 박테리아 고유의 하나 이상의 유전자가 결실되거나 불활성화된 그램-음성 박테리아.
- 제 18항에 있어서, 상기 하나 이상의 결실된 유전자가 waaL 유전자를 포함하는 그램-음성 박테리아.
- 제 18항에 있어서, 상기 하나 이상의 결실된 유전자가 그램-음성 박테리아에서 O 항원 생합성과 관련된 모든 유전자를 포함하는 그램-음성 박테리아.
- 제 1항 내지 제 20항 중 어느 한 항에 있어서, 상기 조절 유전자가 wzg, wzh, wzd, wze, capA, capB, 또는 capC인 그램-음성 박테리아.
- 제 1항 내지 제 21항 중 어느 한 항에 있어서, 당화를 위한 컨센서스 서열을 포함하는 담체 단백질을 엔코딩하는 핵산을 추가로 포함하는 그램-음성 박테리아.
- 제 22항에 있어서, 담체 단백질을 엔코딩하는 핵산이 그램-음성 박테리아에 이종성인 그램-음성 박테리아.
- 제 22항에 있어서, 상기 담체 단백질이 P. 아에루기노사의 무독화된 외독소 A, CRM197, 디프테리아 톡소이드, 파상풍 톡소이드, S. 아우레우스의 무독화된 용혈소 A, 응괴 인자 A, 응괴 인자 B, E. 콜라이 FimH, E. 콜라이 FimHC, E. 콜라이 열 민감 장독소, E. 콜라이 열 민감 장독소의 무독화 변이체, 콜레라 독소 B 서브유닛 (CTB), 콜레라 독소, 콜레라 독소의 무독화된 변이체, E. 콜라이 sat 단백질, E. 콜라이 sat 단백질의 패신저 도메인, C. 제주니 AcrA, C. 제주니 자연 당단백질, S. 뉴모니애 뉴몰리신, S. 뉴모니애 NOX, S. 뉴모니애 PspA, S. 뉴모니애 PcpA, S. 뉴모니애 PhtD, S. 뉴모니애 PhtE, S. 뉴모니애 Ply, 또는 S. 뉴모니애 LytB인 그램-음성 박테리아.
- 제 22항에 있어서, 상기 담체 단백질이 S. 뉴모니애 단백질인 그램-음성 박테리아.
- 제 22항 또는 제 24항에 있어서, 상기 담체 단백질이 올리고사카릴 트랜스퍼라제에 의해 다당류에 컨쥬게이션된 그램-음성 박테리아.
- 제 1항 내지 제 26항 중 어느 한 항에 있어서, 캡슐 다당류가 S. 뉴모니애 CPS1, CPS2, CPS3, CP4, CPS5, CPS6 (A 및 B), CPS7 (A,B,C), CPS8, CPS9 (A,L,N,V), CPS10 (A,B,C,F), CPS11 (A,B,C,D,F), CPS12 (A,B,F), CPS13, CPS14, CPS15 (A,B,C,F), CPS16 (A,F), CPS17 (A,F), CPS18 (A,B,C,F), CPS19 (A,B,C,F), CPS20, CPS21, CPS22 (A,F), CPS23 (A,B,F), CPS24 (A,B,F), CPS25 (A,F), CPS26, CPS27, CPS28 (A,F), CPS29, CPS31, CPS32 (A,F), CPS33 (A,B,C,D,F), CPS34, CPS35 (A,B,C,D,F), CPS36, CPS37, CPS38, CPS39, CPS40, CPS41 (A,F), CPS42, CPS43, CPS44, CPS45, CPS46, CPS47 (A,F), 또는 CPS48; 또는 스타필로코쿠스 아우레우스 CPS5, 또는 CPS8; 스트렙토코쿠스 아갈락티애 (그룹 B, GBS) CPSIa, CPSIb, CPSII, CPSIII, CPSIV, CPSV, CPSVI, CPSVII, 또는 CPSVIII; 또는 엔테로코쿠스 패칼리스 CPSA, CPSB, CPSC, 또는 CPSD인 그램-음성 박테리아.
- 그램-음성 박테리아에서 복제할 수 있는 벡터로서, 상기 벡터가 그램-양성 박테리아에서 캡슐 다당류 생합성과 관련된 조절 유전자를 포함하는, 벡터.
- 제 1항 내지 제 27항 중 어느 한 항에 있어서, UDP-글루코스:운데카프레닐 포스페이트 글루코스-포스페이트 트랜스퍼라제 활성의 발현 및 활성이 증가한 그램-음성 박테리아.
- 제 1항 내지 제 27항 중 어느 한 항에 있어서, 그램-음성 박테리아가 장내 공통 박테리아 (예컨대, E. 콜라이 W3110)의 콜라닌산 wca 오페론에 의해 엔코딩되는 WcaJ를 발현시키는 그램-음성 박테리아.
- 다당류의 생성을 위한 공학처리된 그램-음성 박테리아로서, 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자가 기능적으로 불활성화된, 공학처리된 그램-음성 박테리아.
- 제 31항에 있어서, Gtr 효소를 엔코딩하는 유전자의 기능적 불활성화가 Und-P 연결된 글루코스의 제거를 발생시키는 그램-음성 박테리아.
- 제 31항에 있어서, 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자가 결실된 그램-음성 박테리아.
- 제 31항 또는 제 33항에 있어서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자가 기능적으로 불활성화된 그램-음성 박테리아.
- 제 34항에 있어서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자가 결실된 그램-음성 박테리아.
- 제 1항 내지 제 27항 중 어느 한 항에 있어서, 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자가 기능적으로 불활성화된 그램-음성 박테리아.
- 제 36항에 있어서, 그램-음성 박테리아의 Gtr 효소를 엔코딩하는 유전자가 결실된 그램-음성 박테리아.
- 제 36항 또는 제 37항에 있어서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자가 기능적으로 불활성화된 그램-음성 박테리아.
- 제 38항에 있어서, GtrA, GtrB, 및/또는 GtrS를 엔코딩하는 유전자가 결실된 그램-음성 박테리아.
- 제 31항에 있어서, 상기 그램-음성 박테리아가 에스체리치아 종, E. 콜라이, 시겔라 종, 클렙시엘라 종, 살모넬라 종, 예르시니아 종, 및 슈도모나스 종으로 구성된 군으로부터 선택되는 그램-음성 박테리아.
- 제 31항 내지 제 40항 중 어느 한 항에 있어서, 올리고사카릴 트랜스퍼라제를 추가로 포함하는 그램-음성 박테리아.
- 제 41항에 있어서, 상기 올리고사카릴 트랜스퍼라제가 그램-음성 박테리아에 이종성인 그램-음성 박테리아.
- 제 31항 내지 제 40항 중 어느 한 항에 있어서, 그램-음성 박테리아에 이종성인 적어도 하나의 글리코실트랜스퍼라제를 추가로 포함하는 그램-음성 박테리아.
- 제 43항에 있어서, 상기 글리코실트랜스퍼라제가 원핵생물 글리코실트랜스퍼라제인 그램-음성 박테리아.
- 제 31항 내지 제 40항 중 어느 한 항에 있어서, 당화를 위한 컨센서스 서열을 포함하는 담체 단백질을 엔코딩하는 핵산을 추가로 포함하는 그램-음성 박테리아.
- 제 45항에 있어서, 담체 단백질을 엔코딩하는 핵산이 그램-음성 박테리아에 이종성인 그램-음성 박테리아.
- 제 45항에 있어서, 상기 담체 단백질이 P. 아에루기노사의 무독화된 외독소 A, CRM197, 디프테리아 톡소이드, 파상풍 톡소이드, S. 아우레우스의 무독화된 용혈소 A, 응괴 인자 A, 응괴 인자 B, E. 콜라이 FimH, E. 콜라이 FimHC, E. 콜라이 열 민감 장독소, E. 콜라이 열 민감 장독소의 무독화 변이체, 콜레라 독소 B 서브유닛 (CTB), 콜레라 독소, 콜레라 독소의 무독화된 변이체, E. 콜라이 sat 단백질, E. 콜라이 sat 단백질의 패신저 도메인, C. 제주니 AcrA, 및 C. 제주니 자연 당단백질인 그램-음성 박테리아.
- 제 45항에 있어서, 상기 담체 단백질이 올리고사카릴 트랜스퍼라제에 의해 다당류에 컨쥬게이션된 그램-음성 박테리아.
- 제 31항에 있어서, 다당류가 스트렙토코쿠스 뉴모니애의 캡슐 다당류인 그램-음성 박테리아.
- 제 31항 내지 제 48항 중 어느 한 항에 있어서, 다당류가 E. 콜라이의 O 항원 (O1, O2, O3, O4, O5, O6, O7, O8, O9, O10, O11, O12, O13, O14, O15, O16, O17, O18, O19, O20, O21, O22, O23, O24, O25, O26, O27, O28, O29, O30, O32, O33, O34, O35, O36, O37, O38, O39, O40, O41, O42, O43, O44, O45, O46, O48, O49, O50, O51, O52, O53, O54, O55, O56, O57, O58, O59, O60, O61, O62, O63, O64, O65, O66, O68, O69, O70, O71, O73, O74, O75, O76, O77, O78, O79, O80, O81, O82, O83, O84, O85, O86, O87, O88, O89, O90, O91, O92, O93, O95, O96, O97, O98, O99, O100, O101, O102, O103, O104, O105, O106, O107, O108, O109, O110, O111, O112, O113, O114, O115, O116, O117, O118, O119, O120, O121, O123, O124, O125, O126, O127, O128, O129, O130, O131, O132, O133, O134, O135, O136, O137, O138, O139, O140, O141, O142, O143, O144, O145, O146, O147, O148, O149, O150, O151, O152, O153, O154, O155, O156, O157, O158, O159, O160, O161, O162, O163, O164, O165, O166, O167, O168, O169, O170, O171, O172, O173, O174, O175, O176, O177, O178, O179, O180, O181, O182, O183, O184, O185, O186, O187), 살모넬라 종 (S. 엔테리카 아종 엔테리카(S. enterica subsp. Enterica), S. 엔테리카 아종 살라메(S. enterica subsp. Salamae), S. 엔테리카 아종 아리조네(S. enterica subsp. arizonae), S. 엔테리카 아종 디아리조네(S. enterica subsp. Diarizonae), S. 엔테리카 아종 휴테네(S. enterica subsp. Houtenae), S. 봉고리(S. bongori), 및 S. 엔테리카 아종 인디카(S. enterica subsp. Indica), 및 O 타입 1-67, 슈노모나스 종 (P. 아에루기노사 O 혈청형 1-20), 클렙시엘라 종 (특히 K. 뉴모니애 혈청형 O1, O2 (및 하위혈청형), O3, O4, O5, O6, O7, O8, O9, O10, O11, O12), 아시네토박터(Acinetobacter) O 항원 (특히, A. 바우만니이(A. baumannii) O 항원), 클라미디아 트라코마티스(Chlamydia trachomatis) O 항원 (혈청형 A, B, C, D, E, F, G, H, I J, K, L1, L2, L3), 비브리오 콜레라(Vibrio cholera) O 항원 O1 내지 155, 리스테리아 종(Listeria sp.), 특히 L. 모노사이토게네스(L. monocytogenes) 타입 1, 2, 3, 4 및 이들의 하위혈청형, 레지오넬라 뉴모필라(Legionella pneumophila) 혈청형 1 내지 15 O 항원, 보르데텔라 파라퍼투시스(Bordetella parapertussis) O 항원, 부르크홀데리아 말레이(Burkholderia mallei) 및 슈도말레이(pseudomallei) O 항원, 프란시셀라 툴라렌시스(Francisella tularensis), 캄필로박터 종(Campylobacter sp.)(C. 제주니); 클로스트리듐 디피실레(Clostridium difficile)(혈청형 A, G, H, K, S1, S4, D, Cd-5, 및 C. 퍼프린겐스(C. perfringens) 혈청형 A, B, C, D und E)의 캡슐 다당류, 스타필로코쿠스 아우레우스 타입 5 및 8, 스트렙토코쿠스 피로게네스(Streptococcus pyrogenes)(그룹 B 스트렙토코쿠스 캡슐 혈청형 다당류), E. 콜라이, 스트렙토코쿠스 아갈락티카에(Streptococcus agalacticae)(그룹 A 스트렙토코쿠스 캡슐 다당류), 네이세리아 메닌지티디스 (혈청형 A, B, C, W, Y, X), 칸디다 알비칸스(Candida albicans), 헤모필루스 인플루엔자, 엔테로코쿠스 패칼리스 캡슐 다당류 타입 I-V; 및 다른 표면 다당류 구조, 예컨대 보렐리아 부르그도르페리(Borrelia burgdorferi) 당지질), 네이세리아 메닌지티디스 필린 O 글리칸 및 리포올리고당류 (LOS), 헤모필루스 인플루엔자 LOS, 리슈매니아 메이저(Leishmania major) 리포포스포글리칸, 종양 관련 탄수화물 항원, 말라리아 글리코실 포스파티딜이노시톨, 또는 미코박테리움 튜베르쿨로시스 아라비노만난인 그램-음성 박테리아.
- 제 1항 내지 제 27항 및 제 29항 내지 제 50항 중 어느 한 항의 그램-음성 박테리아에 의해 생성된 재조합 당단백질.
- 제 1항 내지 제 27항 및 제 29항 내지 제 50항 중 어느 한 항의 그램-음성 박테리아를 단백질의 생성에 적합한 조건 하에 배양하는 것을 포함하는, 재조합 당단백질을 생성하는 방법.
- 제 52항에 있어서, 재조합 당단백질을 정제하는 것을 추가로 포함하는 방법.
- 플레시오모나스 시겔로이드 O 항원 유전자 클러스터를 포함하는 공학처리된 E. 콜라이 세포로서, O 항원 유전자 클러스터의 wbgW 유전자가 불활성화되고 E. 콜라이 세포가 Und-PP-D-FucNAc4N을 생성하는, 공학처리된 E. 콜라이 세포.
- 시겔라 손네이 또는 플레시오모나스 시겔로이드 O17 O 항원 유전자 클러스터를 포함하는 공학처리된 E. 콜라이 세포로서, O 항원 유전자 클러스터의 wbgW 유전자가 불활성화되고 E. 콜라이 세포가 Und-PP-D-FucNAc4N을 생성하는, 공학처리된 E. 콜라이 세포.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261723408P | 2012-11-07 | 2012-11-07 | |
| US61/723,408 | 2012-11-07 | ||
| PCT/EP2013/073266 WO2014072405A1 (en) | 2012-11-07 | 2013-11-07 | Production of recombinant vaccine in e. coli by enzymatic conjugation |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150079964A true KR20150079964A (ko) | 2015-07-08 |
Family
ID=49552366
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157014830A KR20150079964A (ko) | 2012-11-07 | 2013-11-07 | 효소적 컨쥬게이션에 의한 e.콜라이에서 재조합 백신의 생성 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US20150273043A1 (ko) |
| EP (3) | EP2917351B1 (ko) |
| JP (2) | JP6412875B2 (ko) |
| KR (1) | KR20150079964A (ko) |
| CN (1) | CN105008539B (ko) |
| AU (2) | AU2013343520B2 (ko) |
| BR (1) | BR112015010283A8 (ko) |
| CA (2) | CA3125293A1 (ko) |
| EA (1) | EA201590705A1 (ko) |
| ES (3) | ES2713166T3 (ko) |
| IL (1) | IL238586A0 (ko) |
| MX (1) | MX366912B (ko) |
| SG (1) | SG11201503308XA (ko) |
| TR (1) | TR201903066T4 (ko) |
| WO (1) | WO2014072405A1 (ko) |
| ZA (1) | ZA201503097B (ko) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HUE038456T2 (hu) * | 2009-11-19 | 2018-10-29 | Glaxosmithkline Biologicals Sa | Bioszintetikus rendszer, amely immunogén poliszaccharidokat termel prokarióta sejtekben |
| MX371513B (es) | 2013-10-11 | 2020-01-31 | Glaxosmithkline Biologicals Sa | Metodos de modificacion de celulas huespedes. |
| CN106794237B (zh) * | 2014-04-17 | 2022-04-12 | 葛兰素史密丝克莱恩生物有限公司 | 经修饰的宿主细胞及其用途 |
| US10307474B2 (en) * | 2014-08-08 | 2019-06-04 | Glaxosmithkline Biologicals S.A. | Modified host cells and hybrid oligosaccharides for use in bioconjugate production |
| AU2016224006B8 (en) * | 2015-02-26 | 2020-03-19 | Vaxnewmo Llc | Acinetobacter O-oligosaccharyltransferases and uses thereof |
| GB201518668D0 (en) * | 2015-10-21 | 2015-12-02 | Glaxosmithkline Biolog Sa | Immunogenic Comosition |
| GB201610599D0 (en) | 2016-06-17 | 2016-08-03 | Glaxosmithkline Biologicals Sa | Immunogenic Composition |
| CN105963691B (zh) * | 2016-07-03 | 2020-05-01 | 查文娟 | 一种肺炎链球菌疫苗 |
| CN106929573B (zh) * | 2017-02-21 | 2020-06-09 | 南开大学 | 对嗜肺军团菌O12型的wzm和wecA基因特异的核苷酸序列及其应用 |
| GB201712678D0 (en) * | 2017-08-07 | 2017-09-20 | Glaxosmithkline Biologicals Sa | Process for the manipulation of nucleic acids |
| WO2019043245A1 (en) * | 2017-09-04 | 2019-03-07 | London School Of Hygiene And Tropical Medicine | MICROBIAL CELLS EXPRESSING STREPTOCOCCAL SERROTYPES |
| EP3703745B1 (en) * | 2017-11-04 | 2024-04-10 | Nevada Research & Innovation Corporation | Immunogenic conjugates and methods of use thereof |
| GB201721576D0 (en) | 2017-12-21 | 2018-02-07 | Glaxosmithkline Biologicals Sa | Hla antigens and glycoconjugates thereof |
| GB201721582D0 (en) | 2017-12-21 | 2018-02-07 | Glaxosmithkline Biologicals Sa | S aureus antigens and immunogenic compositions |
| CA3103474A1 (en) * | 2018-06-16 | 2019-12-19 | Vaxnewmo Llc | Glycosylated comp pilin variants, methods of making and uses thereof |
| US11260119B2 (en) | 2018-08-24 | 2022-03-01 | Pfizer Inc. | Escherichia coli compositions and methods thereof |
| EP3650044A1 (en) * | 2018-11-06 | 2020-05-13 | ETH Zürich | Anti-glycan vaccines |
| JP2022514704A (ja) * | 2018-12-21 | 2022-02-14 | ヴァックスニューモ エルエルシー | O結合型グリコシル化認識モチーフ |
| AU2020240075A1 (en) * | 2019-03-18 | 2021-10-14 | Janssen Pharmaceuticals, Inc. | Methods of producing bioconjugates of e. coli o-antigen polysaccharides, compositions thereof, and methods of use thereof |
| EP3770269A1 (en) | 2019-07-23 | 2021-01-27 | GlaxoSmithKline Biologicals S.A. | Quantification of bioconjugate glycosylation |
| CN111518738B (zh) * | 2020-05-08 | 2022-02-08 | 徐州海润生物科技有限公司 | 重组卡介苗及其制备方法和应用 |
| WO2021259742A1 (en) | 2020-06-25 | 2021-12-30 | Glaxosmithkline Biologicals Sa | Modified exotoxin a proteins |
| WO2023118033A1 (en) | 2021-12-22 | 2023-06-29 | Glaxosmithkline Biologicals Sa | Vaccine |
| GB202302579D0 (en) | 2023-02-23 | 2023-04-12 | Glaxosmithkline Biologicals Sa | Immunogenic composition |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995031548A1 (en) * | 1994-05-16 | 1995-11-23 | The Uab Research Foundation | Streptococcus pneumoniae capsular polysaccharide genes and flanking regions |
| US7018637B2 (en) | 1998-02-23 | 2006-03-28 | Aventis Pasteur, Inc | Multi-oligosaccharide glycoconjugate bacterial meningitis vaccines |
| US7541043B2 (en) | 2002-01-16 | 2009-06-02 | The United States Of America As Represented By The Department Of Health And Human Services | Vaccine for protection against Shigella sonnei disease |
| KR20090110951A (ko) | 2002-03-07 | 2009-10-23 | 아이드게노쉬쉐 테흐니쉐 호흐슐레 쥬리히 | 원핵 숙주에서의 재조합 글리코실화 단백질 생산 방법 및 생산계 |
| CA2607595C (en) | 2005-05-11 | 2018-11-27 | Eth Zuerich | Recombinant n-glycosylated proteins from procaryotic cells |
| SG10201400320TA (en) | 2008-02-20 | 2014-05-29 | Glycovaxyn Ag | Bioconjugates made from recombinant n-glycosylated proteins from procaryotic cells |
| CA2756170C (en) * | 2009-03-23 | 2019-04-02 | The Brigham And Women's Hospital, Inc. | Glycoconjugate vaccines |
| CA2768263C (en) | 2009-07-17 | 2015-05-12 | Ocean Harvest Technology (Canada) Inc. | Natural and sustainable seaweed formula that replaces synthetic additives in fish feed |
| HUE037956T2 (hu) | 2010-05-06 | 2018-09-28 | Glaxosmithkline Biologicals Sa | Kapszuláris Gram-pozitív bakteriális biokonjugátum vakcinák |
| ES2905107T3 (es) * | 2012-10-12 | 2022-04-07 | Glaxosmithkline Biologicals Sa | Procedimientos de modificación de células hospedadoras |
-
2013
- 2013-11-07 CA CA3125293A patent/CA3125293A1/en active Pending
- 2013-11-07 EP EP13788753.5A patent/EP2917351B1/en active Active
- 2013-11-07 EP EP18198665.4A patent/EP3444352B1/en active Active
- 2013-11-07 ES ES13788753T patent/ES2713166T3/es active Active
- 2013-11-07 KR KR1020157014830A patent/KR20150079964A/ko not_active Application Discontinuation
- 2013-11-07 ES ES18198665T patent/ES2848774T3/es active Active
- 2013-11-07 WO PCT/EP2013/073266 patent/WO2014072405A1/en active Application Filing
- 2013-11-07 MX MX2015005797A patent/MX366912B/es active IP Right Grant
- 2013-11-07 TR TR2019/03066T patent/TR201903066T4/tr unknown
- 2013-11-07 CA CA2889767A patent/CA2889767C/en active Active
- 2013-11-07 SG SG11201503308XA patent/SG11201503308XA/en unknown
- 2013-11-07 EA EA201590705A patent/EA201590705A1/ru unknown
- 2013-11-07 US US14/440,311 patent/US20150273043A1/en not_active Abandoned
- 2013-11-07 BR BR112015010283A patent/BR112015010283A8/pt not_active Application Discontinuation
- 2013-11-07 JP JP2015541130A patent/JP6412875B2/ja active Active
- 2013-11-07 EP EP18211761.4A patent/EP3508579B1/en active Active
- 2013-11-07 AU AU2013343520A patent/AU2013343520B2/en active Active
- 2013-11-07 CN CN201380069524.XA patent/CN105008539B/zh active Active
- 2013-11-07 ES ES18211761T patent/ES2882282T3/es active Active
-
2015
- 2015-05-03 IL IL238586A patent/IL238586A0/en unknown
- 2015-05-06 ZA ZA2015/03097A patent/ZA201503097B/en unknown
-
2017
- 2017-12-20 AU AU2017279688A patent/AU2017279688B2/en active Active
-
2018
- 2018-07-13 US US16/034,906 patent/US10973901B2/en active Active
- 2018-10-01 JP JP2018186302A patent/JP6833785B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10973901B2 (en) | Production of recombinant vaccine in E. coli by enzymatic conjugation | |
| JP6435583B2 (ja) | 莢膜グラム陽性菌のバイオコンジュゲートワクチン | |
| ES2793023T3 (es) | Células huésped modificadas y oligosacáridos híbridos para su uso en producción de bioconjugados | |
| EP3240895B1 (en) | Compositions and methods for protein glycosylation | |
| TWI751513B (zh) | E. coli O-抗原多醣生物結合物、其製備方法及其使用方法 | |
| JP6682451B2 (ja) | 改変型宿主細胞およびその使用 | |
| CN113950524A (zh) | 生产大肠杆菌o-抗原多糖的生物缀合物的方法、其组合物及其使用方法 | |
| JP2022514704A (ja) | O結合型グリコシル化認識モチーフ | |
| Yates et al. | Bacterial glycoengineering as a biosynthetic route to customized glycomolecules | |
| Gallagher et al. | Glycosylation of the Arg-gingipains of Porphyromonas gingivalis and comparison with glycoconjugate structure and synthesis in other bacteria |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |