KR20140135766A - 종양괴사인자 수용체 융합 단백질 및 이를 이용하는 방법 - Google Patents
종양괴사인자 수용체 융합 단백질 및 이를 이용하는 방법 Download PDFInfo
- Publication number
- KR20140135766A KR20140135766A KR1020147026150A KR20147026150A KR20140135766A KR 20140135766 A KR20140135766 A KR 20140135766A KR 1020147026150 A KR1020147026150 A KR 1020147026150A KR 20147026150 A KR20147026150 A KR 20147026150A KR 20140135766 A KR20140135766 A KR 20140135766A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- pro
- ser
- thr
- leu
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7151—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for tumor necrosis factor [TNF], for lymphotoxin [LT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Cell Biology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Toxicology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Pulmonology (AREA)
- Cardiology (AREA)
- Endocrinology (AREA)
- Dermatology (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Hospice & Palliative Care (AREA)
- Heart & Thoracic Surgery (AREA)
- Microbiology (AREA)
- Mycology (AREA)
Abstract
개 IgG 면역글로불린 중쇄의 Fc 부위에 결합하는 개 TNF 수용체 p60 또는 p80 폴리펩타이드의 세포외 도메인을 포함하는 키메릭 융합 폴리펩타이드가 제공된다. 상기 키메릭 융합 폴리펩타이드는 TNF 발현에 의해 매개되는 개의 상태들의 치료 또는 예방에 이용될 수 있다.
Description
본 발명은 다이머 융합 단백질을 형성하기 위해 결합되는 개 종양괴사인자 수용체 폴리펩타이드들 및 개 면역글로불린 Fc 도메인 폴리펩타이드들의 세포외 리간드 결합 부분을 포함하는 키메릭 융합 폴리펩타이드들에 관한 것이다. 본 발명은 추가적으로 상기 폴리펩타이드들을 인코딩하는 폴리뉴클레오타이드들, 상기 키메릭 융합 폴리펩타이드들의 생산 방법을 포함하고, 및 추가적으로 염증 질병들, 특히 TNF-연관된 질환들의 치료 및 예방에 사용하는 것을 포함한다.
종양괴사인자 알파(TNF-α) 및 종양괴사인자 베타(TNF-β)는 기능 상에 유의한 중첩성(overlap)을 나타낸다. 이러한 상동성은 전체적으로 종양괴사인자(TNF)로서 언급되는 이들 사이토카인들을 초래하였다. TNF는 친염증 면역반응을 매개함에 있어 강력한 다면 발현성(pleiotropic) 역할을 나타내고 또한 세포 증식, 분화 및 아팝토시스의 조절에 포함되는 것으로 알려졌다. TNF는 TNF 반응 세포들에서 발현되는 세포 표면 수용체들인 제I형 및 제II형 TNF 수용체들(TNFR)과 결합하여 상술한 효과들을 매개한다.
항-TNF 항체, 용해성 TNF 수용체 단백질 및 TNF 수용체-Fc 융합 단백질 같은 TNF 길항제들의 사용이 TNF에 의해 매개되는 친염증 효과들, 예컨대 친염증성 사이토카인 발현(IL-1, IL-8)의 발현 유도 및 조직 파괴를 역전시킬 수 있다는 것이 밝혀졌다. 더 나아가, ENBREL(Etanercept, Immunex) 같은 재조합 TNFR-Fc 융합 단백질들의 용도가 TNF 길항작용이 TNF-연관된 상태들, 특히 류마티스 관절염을 치료하는 데 이용될 수 있다는 것이 보여졌다.
따라서, 종양괴사인자 수용체(TNFR)-면역글로불린 Fc 도메인 융합 단백질들 또는 항-TNF 중화 단일클론 항체들을 이용한 TNF 억제가 류마티스 관절염 및 건선성 관절염을 포함하는 다양한 인간 염증 질병들의 치료를 위한 성공적인 치료적 접근방법이라는 것이 증명되었다.
개 같은 반려동물들은 인간에서 발생하는 질병들, 예컨대 류마티스 관절염(RA), 골관절염, 면역-매개된 다발성 관절염, 혈장-림프구성 활막염(plasmatic-lymphocytic synovitis), 전신성 홍반성 루푸스(SLE), 혈관염 및 많은 자가면역 피부 질병들과 유사한 염증 질병들을 가진다. 미국에서 다섯 마리의 성체 개들 중 한 마리는 관절염을 가지고 인간 관절 질병, 예를 들어 골관절염, 전방 십자인대 파열(anterior cruciate ligament disruption) 및 반월 손상(meniscal damage)의 모델들로 이용되었다고 추정된다.
개에서 염증 발생에서의 TNF 역할은 광범위하게 보고되었다. 예를 들어, 뒷무릎 관절 관절염 TNF를 보이는 개들의 활막액의 세포 여과물들에서 TNF 알파의 증가된 배출이 있다는 것이 관찰되었으며, 제II형 TNF 수용체가 넓은 염증 반응의 일부로서 녹내장을 가지는 개들의 중심 망막 및 말초 망막에서 현저하게 증가되었다는 것이 알려졌다. 인간 TNFR-Fc 융합 단백질인 에타네셉트((huTNFR-Fc) Immunex, TNF 길항제)를 이용한 개들의 처리는 인간 심장 질병의 폐쇄된 가슴 모델에서 ICAM-1 및 NF-κB 같은 연관된 염증 마커들에서의 동반적 감소와 함께 풍선 폐색에 의해 유도되는 허혈-재관류에서 약 25-40%까지 심근 손상을 감소시켰다. 유사하게도, 2 mg/kg TNFR-Fc를 이용하여 허혈 재관류의 흉곽 개방 개 모델에서 뇌경색 크기의 60% 감소도 입증되었다. 하지만, 개의 질병 치료를 위한 치료제로서 huTNFR-Fc의 사용은 개에 주입되는 경우 인간 단백질들의 면역원성으로 인해 이러한 모델링의 인간 질병을 넘어 지시되지 않는다. 더 나아가, 에타네셉트의 상기 IgG Fc 도메인은 보체 모집성(complement recruiting)이며, 이로 인해 매개되는 면역반응으로 인해 염증 질병의 맥락에서 바람직하지 않다.
항-개 TNF 단일클론 항체들은 리포폴리사카라이드(LPS)로 처리된 개 PBMCs의 상층액에서의 캡쳐 ELISA에 의해 낮은 레벨의 TNF를 검출하는 데 이용되어 왔고, TNF 알파 발현이 개 혈관주위세포종(hemangiopericytoma), 모모세포종, 지방종 및 비만세포종의 피부 시료들에서도 보고되었다. TNF-알파 및 TNF 수용체들은 골관절염의 유도된 모델의 개 관절 연골에 존재하는 반면에, TNF에 대한 인간화된 단일클론 항체인 아달리무맙(Adalimumab)이 박리성 피부 홍반성 루푸스(exfoliative cutaneous lupus erythematosus, ECLE)를 가진 두 마리의 개에서 테스팅(8주 동안 2주 마다 0.5 mg/kg)되었었지만 질병 진행이 변함없는 혈청 TNF-알파 레벨과 함께 변화되지 않는 것으로 보여졌었다. 아달리무맙에 대한 면역원성은 잠재적으로 반복 투여 연구들에서 효능의 부재를 야기하였다. 특히, 아달리무맙에 대해 발생할 수 있는 중화 항체들은 반복 투여 효능을 억제하고 이로 인해 좀더 장기적인 용어인 그러한 치료적 접근방법의 효능성(effectiveness)을 제한할 것이다.
따라서, 개에서 넓은 범위의 염증 매개된 상태들에 TNF의 포함으로 인해, 개에서 TNF-연관된 질환들 및 염증 상태들을 치료하기 위해 TNF의 장-기간 억제에 이용될 수 있는 개 TNF의 억제제들에 대한 요구가 있다.
본 발명의 첫 번째 양태에 따르면 개 IgG 면역글로불린 중쇄의 Fc 부위, 또는 이의 단편을 포함하거나, 구성되거나 또는 본질적으로 구성되는 폴리펩타이드에 결합되는 개 TNF 수용체 폴리펩타이드의 세포외 도메인, 또는 상기 세포외 도메인의 TNF 결합 단편을 포함하거나, 구성되거나 또는 본질적으로 구성되는 키메릭 융합 폴리펩타이드가 제공되며, 상기 Fc 부위의 단편은 최소 CH2 및 CH3 불변 도메인들을 포함한다.
전형적으로 상기 키메릭 융합 폴리펩타이드는 개 TNF에 특이적으로 결합한다. 전형적으로 상기 키메릭 융합 폴리펩타이드는 개 TNF의 생물학적 활성을 중화시킨다. 어떤 구현예들에서 TNF는 TNF-α 및/또는 TNF-β를 의미한다. 상기 키메릭 융합 단백질은 개선된 안정성 및 인 비보 반감기를 나타낸다. 더 나아가, 상기 키메릭 융합 폴리펩타이드는 지금까지 알려진 항-TNF 화합물들을 개에 투여하는 것과 연관되어 있는 문제들을 극복시키는데, 가장 특이적으로는 개에 투여되는 경우에 중화 항체들, 특히 이식 항체들(xenoantibodies)의 생산을 반대로 제한시킴으로써 상기 문제들을 극복한다.
전형적으로 상기 개 TNF 수용체 폴리펩타이드의 세포외 도메인은 막통과 도메인 및 세포질 도메인 모두가 부재한 개 종양괴사인자 수용체의 절단된 형태를 포함하거나, 구성되거나 또는 본질적으로 구성된다. 전형적으로 상기 세포외 도메인 또는 이의 단편은 상기 개 TNF 수용체 폴리펩타이드의 리간드 결합 부분을 포함하고 TNF에 결합한다. 어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 상기 개 TNF 수용체 폴리펩타이드의 세포외 도메인과 연결된 시그널 서열을 포함한다. 전형적으로 상기 세포외 도메인 또는 이의 단편은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p60(caTNFR p60)이다. 따라서 어떤 구현예들에서 상기 세포외 도메인은 상기 개 TNF 수용체의 p60 가용성 형태의 세포외 도메인을 포함하거나, 구성되거나 또는 본질적으로 구성된다. 어떤 구현예들에서 상기 세포외 도메인은 상기 세포외 도메인에 결합된 시그널 서열을 포함한다. 어떤 구현예들에서 caTNFRp60 펩타이드의 단편, 특히 상기 세포외 도메인의 TNF 결합 부분이 이용될 수 있다. 어떤 구현예들에서 상기 TNF 수용체 폴리펩타이드는 서열번호 1(서열번호 23에 의해 인코딩됨), 또는 상기 서열에 대해 최소 80%, 85%, 90%,93%, 95%, 96%, 97%, 98% 또는 99% 서열 동일성을 가지는 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되며, 상기 서열은 개 TNF와 결합한다. 전형적으로 상기 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 추가적인 구현예들에서 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p80(caTNFR p80)이다. 따라서 어떤 구현예들에서 상기 세포외 도메인은 caTNFR p80의 세포외 도메인을 포함하거나, 구성되거나 또는 본질적으로 구성된다. 어떤 구현예들에서 상기 세포외 도메인은 상기 세포외 도메인에 결합된 시그널 서열을 포함한다. 어떤 구현예들에서 caTNFRp80 펩타이드의 단편, 특히 상기 세포외 도메인의 TNF 결합 부분이 이용될 수 있다. 어떤 구현예들에서 상기 TNF 수용체 폴리펩타이드는 서열번호 14, 또는 상기 서열에 대해 최소 80%, 85%, 90%,93%, 95%, 96%, 97%, 98% 또는 99% 서열 동일성을 가지는 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되며, 상기 서열은 개 TNF와 결합한다. 전형적으로 상기 서열은 개 TNF의 생물학적 활성을 억제한다.
전형적으로 상기 개 TNF 수용체 폴리펩타이드의 세포외 도메인의 단편은 개 TNF에 특이적으로 결합한다. 전형적으로 상기 단편은 개 TNF의 생물학적 활성을 억제한다.
전형적으로 개 IgG 면역글로불린 중쇄의 Fc 부위 또는 이의 단편을 포함하거나, 구성되거나 또는 본질적으로 구성되는 상기 폴리펩타이드는 적어도 상기 개 IgG 면역글로불린 중쇄의 CH2 및 CH3 불변 도메인들을 포함하거나, 구성되거나 또는 본질적으로 구성된다. 어떤 구현예들에서 경첩 부위(hinge region), 또는 이의 단편도 제공된다. 어떤 구현예들에서 개 IgG 면역글로불린 중쇄로부터 유래된 상기 Fc 부위는 IgG 서브타입 A(예컨대, caHCA, 서열번호 2), IgG 서브타입 B(예컨대, caHCB, 서열번호 3), IgG 서브타입 C(예컨대, caHCC, 서열번호 4) 또는 IgG 서브타입 D(예컨대, caHCD, 서열번호 5), 또는 이의 단편이다. 어떤 구현예들에서 상기 Fc 부위는 서열번호 2(서열번호 24에 의해 인코딩됨), 서열번호 3(서열번호 25에 의해 인코딩됨), 서열번호 4(서열번호 26에 의해 인코딩됨), 서열번호 5(서열번호 27에 의해 인코딩됨) 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택된 아미노산 서열, 또는 이의 단편을 포함하거나, 구성되거나 또는 본질적으로 구성된다. 전형적으로 상기 Fc 부위 또는 이의 단편 또는 상기 서열에 대해 상동성을 가지는 서열은 개선된 안정성 및 개선된 인 비보 반감기를 가지는 상기 개 TNF 수용체 폴리펩타이드를 제공한다.
상기 개 TNF 수용체 폴리펩타이드의 세포외 도메인, 또는 이의 단편은, 공유 결합(covalent linkage)을 통해 개 IgG 면역글로불린 중쇄의 Fc 부위, 또는 이의 단편을 포함하는 폴리펩타이드에 결합될 수 있다. 어떤 구현예들에서 폴리펩타이드 링커 같은 링커가 상기 개 TNFR 세포외 도메인 폴리펩타이드 및 상기 개 Fc 도메인 폴리펩타이드, 또는 이의 단편들과 공유결합적으로 연결되어 융합 단백질 또는 면역컨쥬게이트(immunoconjugate)로도 알려질 수 있는 키메릭 융합 폴리펩타이드를 형성하는 데 이용될 수 있다. 링커 부위가 상기 개 유래된 면역글로불린 구성요소의 Fc 도메인의 경첩 도메인에 의해 부여되는 구조적 유연성(flexibility)으로 인해 전형적으로 요구되지 않을 지라도, 링커가 사용되는 경우 이러한 링커는 최소 하나의 절단 위치를 포함할 수 있다. 따라서, 어떤 구현예에서 상기 키메릭 융합 폴리펩타이드는 상기 개 TNF 수용체 폴리펩타이드와 상기 개 IgG Fc 도메인 폴리펩타이드 사이에 기능적으로 삽입되는 링커 펩타이드를 추가적으로 포함한다.
어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 6(서열번호 28에 의해 인코딩됨), 서열번호 7(서열번호 29에 의해 인코딩됨), 서열번호 8(서열번호 30에 의해 인코딩됨), 서열번호 9(서열번호 31에 의해 인코딩됨) 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되고, 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되며, 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되며, 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되며, 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 추가적인 구현예들에서 본 발명의 키메릭 융합 폴리펩타이드는 1×10-8 또는 미만의 평형-해리 상수(equilibrium-dissociation constant, KD)를 가지는 결합 친화도로 개 TNF-알파(종양괴사인자 알파)에 특이적으로 결합한다. 더 나아가, 개 대상체에 투여함에 따라 본 발명의 키메릭 융합 폴리펩타이드에 대한 이식 항체들(중화 항체들로도 언급됨)이 발생되지 않는 것이 바람직하다. 더 나아가, 상기 키메릭 융합 폴리펩타이드들의 Fc 도메인 부분이 보체 모집(complement recruitment), 고정 및 활성화, ADCC 및 Fc 수용체 결합 및 활성화를 포함하지만 이에 제한되지 않는 어떠한 다운스트림 이펙터 기능들을 매개하지 않는 것이 바람직하다. Fc 수용체 매개된 다운스트림 이펙터 기능들이 발생하지 않도록 하기 위해, 돌연변이들, 치환들 및 부가들(additions)이 상기 개 IgG Fc 도메인 폴리펩타이드의 아미노산 서열에 대해 실시될 수 있다. 더 나아가, 개 IgG 중쇄들의 특이적 서브타입들로부터 유래되는 개 IgG Fc 도메인 폴리펩타이드들은 다운스트림 이펙터 기능들을 매개하지 않는 바람직한 특성들에 기반하여 선택될 수 있다.
어떤 구현예들에서 본 발명의 키메릭 융합 폴리펩타이드의 Fc 도메인들의 아미노산 잔기들의 아미노산 서열에 대한 변형들(modifications)이 실시될 수 있다. 상기 변형들은 하나 이상의 아미노산 잔기들의 부가, 치환 또는 결실을 포함할 수 있다. 상기 아미노산 변화들은 전형적으로 상기 항체의 기능적 특징들을 변형시키기 위해 실시된다. 예를 들어, 아미노산 변형들은 상기 키메릭 융합 폴리펩타이드의 Fc 도메인 구성요소에 의해 매개되는 다운스트림 이펙터 기능들을 예방하기 위해 실시될 수 있는데, 예를 들어 Fc 수용체들에 결합하거나, 보체를 활성화시키거나 또는 ADCC를 유도시키는 Fc 도메인 구성요소의 능력을 억제시켜 실시될 수 있다. 더 나아가, 상기 키메릭 융합 폴리펩타이드의 순환성 반감기(circulatory half life)를 변형시키기 위해 변형들이 상기 Fc 도메인 잔기들의 아미노산 잔기들에 대해 실시될 수 있다.
본 발명은 추가적으로 서열번호 1 또는 서열번호 14 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열을 포함하거나, 구성되거나 또는 본질적으로 구성되는 분리된 폴리펩타이드를 포함하고, 하기에 기재된 대로 본 발명의 방법들에서 동일한 용도를 포함한다. 전형적으로 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다. 본 발명은 개 TNF 수용체 폴리펩타이드 p80의 세포외 도메인으로서 서열번호 14의 용도를 추가적으로 포함한다.
다양한 추가적인 양태들에서 본 발명은 본 발명의 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함한다. 다양한 추가적인 양태들에서 본 발명은 개에서 본 발명의 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드의 발현을 포함한다.
따라서, 본 발명의 추가적인 양태는 개 IgG 면역글로불린 중쇄의 Fc 부위, 또는 이의 단편을 포함하는 폴리펩타이드에 결합하는 개 TNF 수용체 폴리펩타이드의 세포외 도메인, 또는 이의 단편을 포함하는 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 제공한다. 어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 28, 서열번호 29, 서열번호 30, 서열번호 31 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 서열을 포함하며, 상기 상동성 서열은 개 TNF에 결합하는 폴리펩타이드를 인코딩한다. 전형적으로 상기 폴리펩타이드는 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 서열을 포함하고, 상기 상동성 서열은 개 TNF에 결합하는 폴리펩타이드를 인코딩한다. 전형적으로 상기 폴리펩타이드는 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 서열을 포함하며, 상기 상동성 서열은 개 TNF에 결합하는 폴리펩타이드를 인코딩한다. 전형적으로 상기 폴리펩타이드는 개 TNF의 생물학적 활성을 억제한다.
본 발명의 추가적인 양태는 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 재조합 벡터를 제공하며, 상기 상동성 서열은 개 TNF에 결합한다. 전형적으로 상기 폴리펩타이드는 개 TNF의 생물학적 활성을 억제한다. 어떤 구현예들에서 상기 벡터는 발현 프로모터에 인접하고 이의 조절 하에 배치되거나, 또는 발현 프로모터에 작동적으로 결합되어 있다.
또한, 개 TNF 수용체 폴리펩타이드의 세포외 도메인을 인코딩하는 분리된 폴리뉴클레오타이드가 제공된다. 어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 1 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열의 아미노산 서열을 포함하는 개 TNF 수용체(caTNFR) 폴리펩타이드를 인코딩하며, 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다. 어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 14 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열의 아미노산 서열을 포함하는 개 TNF 수용체(caTNFR) 폴리펩타이드를 인코딩하고, 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다. 어떤 구현예들에서 상기 폴리뉴클레오타이드는 서열번호 23 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열을 포함하며, 상기 상동성 서열은 TNF에 결합하는 폴리펩타이드를 인코딩한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다. 서열번호 23은 서열번호 1의 아미노산 서열을 인코딩하는 뉴클레오타이드 서열이다. 본 발명은 추가적으로 본 명세서에 기재된 폴리뉴클레오타이드들 중 하나를 포함하는 재조합 벡터를 포함한다.
다양한 추가적인 양태들에서 본 발명은 TNF 발현에 의해 매개되는 개 상태들의 치료 및/또는 예방을 위한 방법들에서 상기 키메릭 융합 폴리펩타이드의 용도, 또는 상기 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드의 용도를 포함한다. 본 발명의 방법들에서 이용되는 키메릭 융합 폴리펩타이드, 벡터 또는 폴리뉴클레오타이드는 상기 기재된 키메릭 융합 폴리펩타이드들, 벡터들 또는 폴리뉴클레오타이드들 중 어느 하나일 수 있다.
따라서, 본 발명의 보다 추가적인 양태는 개에서 소망하지 않는 염증 반응을 예방, 감소 또는 개선시키기 위한 방법을 제공하고, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 제공하는 단계, 및
- 상기 염증 반응을 예방, 감소 또는 개선시키기에 충분한 치료학적으로 효과적인 양으로 상기 키메릭 융합 폴리펩타이드 또는 벡터를 상기 개에 투여하는 단계
를 포함한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 방법은 상기 키메릭 융합 폴리펩타이드와 함께 최소 하나의 추가적인 TNF 길항제 또는 항-염증 화합물을 투여하는 단계를 추가적으로 포함한다.
본 발명의 보다 추가적인 양태는 개에서 종양괴사인자 레벨을 감소시키는 방법을 제공하며, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 또는 상기 선행하는 서열들 중 어느 하나에 대해 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 제공하는 단계, 및
- 종양괴사인자 레벨을 감소시키기에 충분한 치료학적으로 효과적인 양으로 상기 키메릭 융합 폴리펩타이드 또는 벡터를 상기 개에 투여하는 단계
를 포함한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 방법은 최소 하나의 추가적인 TNF 길항제 또는 항-염증 화합물을 투여하는 단계를 추가적으로 포함한다.
본 발명의 보다 추가적인 양태는 개에서 종양괴사인자(TNF) 관계된 상태를 치료 또는 개선시키는 방법을 제공하며, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 또는 상기 선행하는 서열들 중 어느 하나에 대해 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 제공하는 단계, 및
- 상기 상태를 치료 또는 개선시키기에 충분한 치료학적으로 효과적인 양으로 상기 키메릭 융합 폴리펩타이드 또는 벡터를 상기 개에 투여하는 단계
를 포함한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 방법은 최소 하나의 추가적인 TNF 길항제 또는 항-염증 화합물을 투여하는 단계를 추가적으로 포함한다.
어떤 구현예들에서 상기 소망하지 않는 염증 반응 또는 TNF 관계된 상태는 만성 염증 질병이다. 상기 만성 염증 질병은 류마티스 관절염(RA), 골관절염, 다른 다발성 관절염들, 강직성 척추염(AS), 크론병 및 궤양성 대장염, 건선 및 건선성 관절염(PsA), 전신성 혈관염, 아토피성 피부염, 울혈성 심부전(CHF), 난치성 포도막염, 기관지성 천식 및 알러지성 상태들로 구성된 군으로부터 선택될 수 있지만, 이에 한정되는 것은 아니다. 염증 매개된 상태들은 폐혈증 및 쇼크, 당뇨병 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들을 포함할 수도 있다.
어떤 추가적인 구현예들에서 상기 소망하지 않는 염증 반응 또는 TNF-알파 관계된 질환, 또는 TNF-알파가 핵심적인 염증 매개인자인 질환으로도 언급될 수 있는 TNF 관계된 상태는 베체트병(Behcet's disease), 수포성 피부염, 호중구 피부염, 독물적표피괴저성분리증(toxic epidermal necrolysis), 전신성 혈관염, 괴저성 농피증, 농포성 피부염, 대뇌 말라리아, 용혈성 요독 증후군, 전자간증, 동종이식 거부, 중이염, 사교상, 결절성 홍반, 골수이형성증후군, 이식편대숙주질환(graft versus host disease), 피부근염 및 다발성근염을 포함할 수 있지만, 이에 한정되는 것은 아니다.
본 발명의 보다 추가적인 양태에 따르면 개에서 관절염 또는 관절염 상태의 치료를 위한 방법이 제공되며, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 제공하는 단계, 및
- 상기 개에 치료학적으로 효과적인 양을 투여하는 단계
를 포함한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 관절염 또는 관절염 상태는 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 건선성 관절염, 소아기 특발성 관절염, 강직성 척추염 및 관련된 상태들로 구성된 군으로부터 선택되는 상태들을 포함한다.
전형적으로, 상기 관절염 또는 관절염 상태의 치료는 상기 관절염 상태의 원인이 되거나, 이와 연관되어 있거나, 또는 이에 의해 기인하는 면역반응을 개선, 억제, 감소 또는 저해하는 것을 포함한다.
본 발명의 추가적인 양태는 개 대상체에서 개 TNF의 증가된 발현 또는 TNF에 대해 증가된 민감성(sensitivity)에 의해 야기되거나, 이와 연관되어 있거나 또는 이를 초래하는 상태의 치료를 위한 방법을 제공하고, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 제공하는 단계, 및
- 상기 치료를 요하는 개에 치료학적으로 효과적인 양을 투여하는 단계
를 포함한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 본 발명의 선행하는 방법들은 추가적으로 본 발명의 키메릭 융합 폴리펩타이드의 효능성을 증대 및/또는 보충할 수 있는 최소 하나 이상의 추가적인 제제를 공동-투여시키는 추가적인 단계를 포함한다. 예를 들어, 상기 키메릭 융합 폴리펩타이드는 하나 이상의 추가적인 약제학적 조성물들과 함께 공동-투여될 수 있다. 상기 추가적인 조성물들은 만성 염증 상태, 특히 TNF-알파 관계된 질환을 치료하는 데 유용한 약물을 포함할 수 있다. 어떠한 구현예들에서 상기 추가적인 약제학적 조성물은 메토트렉세이트 같은 TNF 길항제, 개 TNF에 대한 키메릭 또는 개화된(caninised) 항체, 항-개 TNF 항체 단편, 최소 하나의 진통제, 사이토카인 저해 항-염증 약물인 화합물, NSAID, 오피오이드(opioid), 코르티코스테로이드, 스테로이드 또는 신경성장인자의 길항제일 수 있다.
적합한 진통제의 예들은 부토르파놀, 부프레노르핀, 펜타닐, 플루닉신 메글루민, 메르피딘, 모르핀, 날부핀 및 이의 유도체들을 포함하지만, 이에 한정되는 것은 아니다. 적합한 NSAIDS는 아세트아미노펜, 아세틸살리실산, 카르프로펜, 에토돌락, 케토프로펜, 멜록시캄, 피로콕시브, 로베나콕시브, 데라콕시브 및 이와 유사한 것을 포함하지만, 이에 한정되는 것은 아니다.
어떠한 추가적인 구현예들에서 상기 최소 하나의 추가적인 제제 또는 약제학적 조성물은 항생제, 항진균제, 항원충제, 항바이러스제 및 유사한 치료제로부터 선택된 하나 이상의 군일 수 있는 치료학적 활성제일 수 있다. 더 나아가 상기 최소 하나의 추가적인 제제는 PGE-수용체 길항제 같은 염증의 매개인자(들)의 억제제, 사이클로스포린 같은 면역억제제, 또는 항-염증 글루코코르티코이드일 수 있다. 어떤 추가적인 구현예들에서 상기 최소 하나의 추가적인 제제는 늙은 개들에게 급격하게 증가할 수 있는 기억 손실 또는 관계된 상태들 같은 인지 기능장애 또는 손상의 치료에 이용되는 제제일 수 있다. 보다 추가적으로, 상기 최소 하나의 추가적인 제제는 심혈관 기능이상, 예를 들어 고혈압, 심근 허혈, 울혈성 심부전 및 이와 유사한 것을 치료하기 위해 이용되는 항-고혈압 화합물 또는 다른 화합물일 수 있다. 보다 추가적으로, 상기 최소 하나의 추가적인 제제는 이뇨제, 혈관확장제(vasodilator), 베타-아드레날린 수용체 길항제, 안지오텐신-II 전환 효소 억제제, 칼슘 채널 차단제 또는 HMG-CoA 환원효소 억제제일 수 있다.
어떤 구현예들에서 상기 키메릭 융합 단백질 또는 항원 결합 단편은 약 0.01 mg/몸무게(kg)부터 약 10 mg/몸무게(kg)까지의 투여량 범위, 특히 0.03 mg/몸무게(kg)부터 약 3 mg/몸무게(kg)까지의 투여량 범위로 상기 선행하는 방법들의 일부로서 상기 개에 투여된다.
본 발명의 추가적인 양태는 의약품, 특히 상술한 상태들 중 어느 하나의 치료 또는 예방에 사용하기 위한 상기 기재한 대로 키메릭 융합 폴리펩타이드 또는 폴리뉴클레오타이드를 제공한다. 본 발명은 상술한 상태들 중 어느 하나의 치료 또는 예방을 위한 의약품의 제조에서 상기 기재된 대로 키메릭 융합 폴리펩타이드 또는 폴리뉴클레오타이드의 용도를 포함한다.
다양한 추가적인 양태들에서 본 발명은 본 발명의 선행하는 어떠한 양태에 따라 개 TNF에 결합하는 키메릭 융합 폴리펩타이드를 포함하는 조성물을 포함한다. 본 발명의 조성물들에 이용되는 상기 키메릭 융합 폴리펩타이드는 상기 기재된 키메릭 융합 폴리펩타이드들 중 어느 하나일 수 있다. 어떤 구현예들에서, 상기 조성물은 최소 하나의 약제학적으로 허용가능한 담체를 추가적으로 포함한다.
보다 추가적인 양태에서, 본 발명은 최소 하나의 담체 희석제 또는 부형제와 함께 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드를 포함하는 약제학적 조성물을 제공한다.
어떤 구현예들에서 상기 상동성 서열은 TNF에 결합한다. 전형적으로 상기 상동성 서열은 개 TNF의 생물학적 활성을 억제한다.
어떤 구현예들에서 상기 약제학적 조성물은 최소 하나의 추가적인 TNF 길항제 화합물 및/또는 항-염증 화합물을 추가적으로 포함한다. 어떤 구현예들에서 상기 TNF 길항제 화합물은 메토트렉세이트이다.
어떤 구현예들에서 상기 약제학적 조성물은 최소 하나의 진통제, NSAID 오피오이드, 코르티코스테로이드, 스테로이드 또는 신경성장인자의 길항제를 추가적으로 포함한다.
본 발명의 보다 추가적인 양태는 개 IgG 면역글로불린의 Fc 도메인에 기능적으로 결합되는 TNF 수용체 폴리펩타이드의 세포외 도메인을 포함하는 키메릭 융합 폴리펩타이드를 생산하는 방법을 제공하며, 상기 방법은:
(i) 본 발명에 따른 키메릭 융합 폴리펩타이드를 인코딩하는 폴리펩타이드를 발현할 수 있는 벡터를 포함하는 재조합 숙주세포를 제공하는 단계;
(ii) 상기 폴리펩타이드의 발현에 적합한 조건 하에서 상기 숙주세포를 배양하는 단계, 및
(iii) 상기 키메릭 융합 폴리펩타이드를 회수하는 단계
를 포함한다.
어떤 구현예들에서 상기 숙주세포는 진핵세포이다. 추가적인 구현예들에서 상기 숙주세포는 원핵세포이다. 어떤 구현예들에서 상기 벡터는 상기 기재된 본 발명의 벡터이다. 어떤 구현예들에서 상기 폴리뉴클레오타이드는 상기 기재된 본 발명의 폴리뉴클레오타이드이다.
본 발명의 보다 추가적인 양태에 따르면 개에서 염증 매개된 상태의 치료 또는 예방에 사용하기 위해 본 발명의 선행하는 양태들 중 어느 하나에 따른 키메릭 융합 폴리펩타이드, 또는 본 발명의 선행하는 양태들에 따른 약제학적 조성물, 또는 핵산, 또는 본 발명의 선행하는 양태들 중 어느 하나에 따른 핵산을 포함하는 벡터가 제공된다.
본 발명의 보다 추가적인 양태는 개에서 관절염의 치료, 특히 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 건선성 관절염 또는 강직성 척추염의 치료에 사용하기 위한 본 발명의 선행하는 양태들 중 어느 하나에 따른 키메릭 융합 폴리펩타이드, 또는 본 발명의 선행하는 양태들에 따른 약제학적 조성물, 또는 핵산, 또는 본 발명의 선행하는 양태들 중 어느 하나에 따른 핵산을 포함하는 벡터를 제공한다.
본 발명의 보다 추가적인 양태는 개에서 만성 염증 질병의 치료 또는 예방을 위한 의약품의 제조에서 본 발명의 선행하는 양태들 중 어느 하나에 따른 키메릭 융합 폴리펩타이드, 또는 본 발명의 선행하는 양태들에 따른 약제학적 조성물, 또는 핵산, 또는 본 발명의 선행하는 양태들 중 어느 하나에 따른 핵산을 포함하는 벡터를 제공한다.
본 발명의 보다 추가적인 양태는 개에서 류마티스 관절염 또는 골관절염의 치료, 억제 개선 또는 예방을 위한 의약품의 제조에서 본 발명의 선행하는 양태들 중 어느 하나에 따른 키메릭 융합 폴리펩타이드, 또는 본 발명의 선행하는 양태들에 따른 약제학적 조성물, 또는 핵산, 또는 본 발명의 선행하는 양태들 중 어느 하나에 따른 핵산을 포함하는 벡터를 제공한다.
보다 추가적인 양태에서 본 발명에 따른 키메릭 융합 폴리펩타이드를 생산하는 세포주, 또는 이의 유도세포 또는 자손세포가 제공된다.
본 발명의 보다 추가적인 양태는 개에서 만성 염증 상태의 치료 또는 고통과 연관된 상태의 치료, 또는 골관절염 또는 류마티스 관절염과 연관된 고통의 치료, 개선 또는 억제를 위한 키트를 제공하며, 상기 키트는 본 발명의 선행하는 양태들 중 어느 하나에 따른 키메릭 융합 폴리펩타이드 및 이의 사용을 위한 설명서를 포함한다.
다양한 추가적인 양태들에서 본 발명은 본 발명의 일부 키메릭 융합 폴리펩타이드들의 정제를 위한 방법으로 확장된다. 특히, 본 발명자들은 놀랍게도 개 유래된 타입 B 또는 C의 면역글로불린 중쇄 도메인들을 포함하는 키메릭 융합 폴리펩타이드들이 타입 A 또는 D의 도메인들보다 보다 효율적으로 정제된다는 것을 확인하였다. 따라서, 본 발명의 키메릭 융합 폴리펩타이드들의 정제는 상기 면역글로불린 중쇄 도메인이 타입 B 또는 C인 경우 더 높은 수율을 제공한다. 이것은 단백질 A 매트리스에 기반된 단백질 정제가 치료 용도용 단백질의 상업적으로 관련된 수율(relevant yield)을 얻기 위해 이용되고 있다는 점에서 의미가 있다. 따라서, 본 발명의 키메릭 융합 폴리펩타이드들의 정제를 위해 단백질 A 정제의 사용은 상기 면역글로불린 중쇄 도메인이 타입 B 또는 C인 경우 더 높은 수율을 제공하고, 특히 상기 면역글로불린 중쇄 도메인이 타입 B인 경우 더 높은 수율을 제공한다. 상기 결과적으로 정제된 단백질들이 개에 투여되는 경우 보체를 모집하지 않거나 또는 다운스트림 이펙터 기능들을 매개하지 않는다는 전반적으로 놀라운 관찰들과 커플링되어 있는 이러한 특징은 치료 목적을 위해 개에 유리하게 투여될 수 있는 본 발명에 따른 조성물들을 제공하며, 특히 인간 기원의 폴리펩타이드들로 구성된 키메릭 융합 폴리펩타이드들보다 놀랍도록 유익한 단백질 치료제들을 제공한다.
따라서 본 발명의 추가적인 양태는 본 발명의 키메릭 융합 폴리펩타이드들, 특히 타입 B 면역글로불린 중쇄들을 가지는 키메릭 융합 폴리펩타이드들을 정제하는 방법을 제공하고, 상기 방법은 단백질 A를 이용하여 상기 키메릭 융합 폴리펩타이드를 정제하는 단계들을 포함한다. 어떤 구현예들에서 상기 용출 완충액은 pH 5를 가진다.
본 발명의 추가적인 양태는 본 발명의 키메릭 융합 폴리펩타이드, 특히 타입 C 면역글로불린 중쇄들을 가지는 키메릭 융합 폴리펩타이드들을 정제하는 방법을 제공하고, 상기 방법은 단백질 A를 이용하여 상기 키메릭 융합 폴리펩타이드를 정제하는 단계들을 포함한다.
본 발명의 보다 추가적인 양태는 최적 pH에서 단백질 A 칼럼으로부터 용출시킴으로써 CHO 세포 발현에 의해 형성된 고분자량 멀티머들로부터 본 발명의 키메릭 융합 폴리펩타이드들, 특히 타입 B 면역글로불린 중쇄들을 가지는 키메릭 융합 폴리펩타이드들의 바람직한 다이머 형태의 선택적 정제를 제공한다.
따라서, 본 발명의 추가적인 양태는 본 발명의 키메릭 융합 폴리펩타이드들, 특히 타입 B 면역글로불린 중쇄들을 가지는 키메릭 융합 폴리펩타이드들을 정제하는 방법을 제공하고, 상기 방법은 4.7보다 더 높은 pH에서 상기 키메릭 융합 폴리펩타이드들을 용출시키는 단계를 포함한다. 전형적으로, 상기 pH는 4.7 내지 5.3이며, 보다 전형적으로는 4.8 내지 5.2이고, 보다 전형적으로는 4.9 내지 5.1이며 가장 전형적으로는 상기 pH는 5.0이다. 전형적으로 상기 키메릭 융합 폴리펩타이드들은 CHO 세포 발현에 의해 형성된다. 전형적으로, 상기 키메릭 융합 폴리펩타이드들은 단백질 A, 예를 들어 단백질 A 컬럼으로부터 용출되고 상기 용출 완충액은 pH 5를 가진다.
어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 7, 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열을 포함한다. 어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 11, 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열을 포함한다. 어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 16, 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열을 포함한다. 어떤 구현예들에서 상기 키메릭 융합 폴리펩타이드는 서열번호 20, 또는 상기 서열에 대해 최소 90, 95, 96, 97, 98 또는 99% 서열 상동성을 가지는 폴리펩타이드 서열을 포함한다.
상기 방법은 TNFR-Fc 융합 단백질 다이머의 응집된 형태들로부터 소망하는 TNFR-Fc 융합 단백질 다이머를 정제하기 위해 단백질 A 크로마토그래피에 의한 정제의 표준 방법의 변형으로서 적용될 수 있다. 이것은 더 높은 특이적 활성 및 순도의 산물을 편리하게 수득하고, 나아가, 응집물들의 제거는 면역원성에 대한 가능성(potential)을 감소시킨다. 면역글로불린들의 단백질 A 정제를 위한 표준 과정은 중성 pH에서 결합시키고 pH 3에서 용출시키는 것이다.
어떤 구현예들에서 상기 방법은 4.5-4.7의 pH에서 고분자량 멀티머들을 용출시키는 단계를 포함한다.
본 발명의 다른 양태는 본 발명의 상기 기재된 방법을 이용하여 정제되는 키메릭 융합 폴리펩타이드들 및 의약품으로서 상기 펩타이드들의 용도, 예를 들어 상기 기재된 본 발명의 치료 방법들에서 의약품으로서 상기 펩타이드들의 용도를 제공한다.
본 발명자들은 개에서 TNF 매개된 상태들의 치료 및 예방에 사용하기 위한 조성물들 및 방법들을 제공하였다. 특히, 본 발명의 조성물들 및 방법들은 전신적으로 또는 특정 해부학적 위치(location)에서 TNF 레벨들을 감소시킨다.
특히, 상기 개 TNF 수용체 세포외 도메인에 대해 다양한 개 면역글로불린 중쇄 불변 도메인들을 모집하는 보체의 융합에도 불구하고, 본 발명의 결과적인 키메릭 융합 폴리펩타이드들은 높은 특이성으로 개 TNF에 결합하고 보체 C1q를 모집하지 않는다는 것이 본 명세서에서 확인된다. 더 나아가, 결합은 세포막 발현된 TNF 수용체들에 대한 개 TNF의 결합을 억제시킴으로써 개 TNF의 생물학적 활성을 격리시킨다. 이것은, 차례로, 상기 보체 경로(complement cascade)의 유도를 통해 수반하는 손상 없이 개과에서 관절염 같은 염증 매개된 질병의 TNF 매개된 유도, 발병 또는 진행의 발생을 예방 또는 감소시킬 것이다.
본 발명의 수용체 융합 단백질들은 재조합 DNA 방법들을 통해 생산되고 또한 개 숙주에 투여되는 경우 상기 단백질들의 면역원성을 감소시키는 개 불변 도메인 서열들을 가지면서 개 TNF에 대한 결합 특이성을 나타낸다. 그 결과, 이식-항체 유도의 위험이 최소화된다.
본 발명은 개 IgG 면역글로불린 이소형의 Fc 도메인과 결합된 개 TNF 수용체 p60(caTNFRp60)의 세포외 도메인을 포함하는 재조합 융합 단백질들을 제공한다. 본 발명은 추가적으로 개 IgG 면역글로불린 이소형의 Fc 도메인과 결합된 개 TNF 수용체 p80(caTNFRp80)의 세포외 도메인을 포함하는 재조합 융합 단백질들로 확장된다. 상기 결과적인 다이머성 폴리펩타이드들은 키메릭 Fc 융합 단백질들이다. 본 발명자들은 caTNFRp60:Fc 융합 단백질이 개 TNF에 결합 특이성을 가지고 TNF 길항제로서 기능한다는 것을 보였다. TNF 길항제들의 사용에 따라 염증 질병의 다른 TNF 매개된 진행 및 다른 TNF-매개된 상태들의 효과들을 역전시킨다는 것이 보여졌다.
본 발명의 융합 단백질 조성물들은 전형적으로 외인적으로 투여되는데, 예를 들어 정맥내 또는 피하내 투여에 의한다. 하지만, 어떤 구현예들에서 벡터는 본 발명의 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 운반하기 위해 이용될 수 있다. 따라서 본 발명은 TNF-매개된 염증 질병들 및 다른 TNF-연관된 상태들 및 질환들의 효과적이고 지속적인 치료를 위한 조성물들 및 방법들을 제공한다.
광범위한 실험과정(experimentation)을 통해, 본 발명자들은 개 TNF에 대한 결합 특이성을 가지지 않는 것으로 이전에 알려진 수용체인 인간 TNF 수용체 세포외 도메인(접근번호 AAD01516, Campbell, et al. 2001, Vet Immuno Immunopath 78, 207-214)과 유사성을 가지는 개 단백질 서열을 얻었고, 놀랍게도 개 TNF-알파에 특이적으로 결합하고 보체 C1q를 모집하지 않는 길항적 수용체-면역글로불린 융합 단백질들(융합 폴리펩타이드들)을 생산하기 위한 기초로서 이것을 이용하였다.
결과적인 비-면역원성 수용체 융합 단백질들이 개 TNF에 결합하는 높은 친화도를 나타낸다는 것이 보여진다. 상기 수용체 융합 단백질들은 개 TNF 생물학적 기능, 가장 특이적으로는 세포막 연관된 수용체 TNFR1에 대한 TNF의 결합을 억제시킴으로써 상기 개 TNF 생물학적 기능을 중화시킨다. 더 나아가, 상기 융합 단백질들은 또한 개에 투여되는 경우 이식 항체들이 거기에서 생산될 것 같지 않도록 상기 불변 부위들이 개 IgG 분자들에 존재하는 잔기들에만 삽입되도록 고안되었다. 따라서, 본 발명의 개화된 수용체 융합 단백질들은 개과에서 만성 염증 질병들의 치료를 위한 장-기간 투여에 적합하다.
놀랍게도, 본 발명자들은 예측된 카르복시 말단 잔기들 NCBI 게놈 레퍼런스 클론 XP_544562.2(본 발명자들이 개 p80의 부정확하게 예측된 시그널 서열 및 아미노 말단 잔기들을 포함하는 것으로 동정하였던)와 부분적인 개 cDNA 클론 DN368636로부터 얻어진 올바른 시그널 서열 및 아미노 말단 잔기들을 조합하여 전체로서 완전한 개 p80 TNF 수용체 세포외 도메인을 최초로 동정하였다. 이러한 신규 개 p80 세포외 도메인 서열(도 30)은 본 명세서에서 서열번호 14로서 보여진다. 그 결과, 올바른 전체 개 p80 세포외 도메인이 적절한 아미노 말단 잔기들로 온전하게 합성될 수 있으며, 결과적으로 개 대상체에 투여되는 경우에 면역원성을 나타내지 않을 것이다. 그에 비해, 클론 XP_544562.2로부터 유래된 서열은 개에 투여되는 경우 중화 항체들이 발생되는 외래 및 면역원성 아미노 말단을 발생시킬 것이다. 유사하게도, 개 TNF 수용체 p80-면역글로불린 Fc 도메인 융합 단백질들이 본 명세서에서 올바르게 결정된 p80 아미노 말단 아미노산 서열(본 명세서 내 서열번호 15 내지 22)을 이용하여 제공될 수 있다.
본 발명자들에 의해 실시되었던 본 발명의 수용체 융합 단백질들을 제조하는 과정은 본 발명자들의 분석에 따라 수용체의 형태(conformation)를 유지하여 결합 특이성 및 탐욕성(avidity)를 유지할 것인 상기 수용체 세포외 도메인의 제시를 초래하고, 신장에서 제거되었던 수용체 크기 이상으로 증가하는 반면에, 변화되지 않은 형태에서 개에 투여된다면 상기 수용체에 대한 중화 항체들(특히 이식 항체들)의 발생을 초래할 수 있는 면역원성 에피토프들의 존재를 감소시킬 것이다.
나아가, 상기 융합 단백질들의 Fc 도메인 구성요소들은 본 발명의 융합 단백질들이 투여될 타겟 종인 개 유래된 항체들로부터 얻어진 IgG 면역글로불린 중쇄 불변 부위들을 포함한다. 상기 면역글로불린 중쇄 불변 도메인들은 선택 또는 변형되어 다운스트림 이펙터 기능들을 매개하지 않는다. 더 나아가, 상기 면역글로불린 중쇄 불변 도메인과 상기 수용체 세포외 도메인의 융합이 상기 수용체 도메인의 3차원적 형태에 영향을 미치지 않는 그러한 방식으로 실시되기 때문에, 소망된 타겟에 대한 결합 특이성에 어떠한 변화도 없을 것이다.
인간 및 마우스에 4개의 주요 IgG 이소형들이 있으며 명명법이 유사할 지라도 그들은 단백질 A 및 단백질 G 같은 박테리아 산물들에 대한 친화도를 포함하여 행동 및 기능에서 상이하고, 보체 의존적 세포 붕괴(complement dependent cytolysis, CDC)를 활성화시키고 항체 의존적 세포내 세포독성(antibody dependent cellular cytotoxicity, ADCC)을 통해 타겟 세포들의 사멸(killing)을 유도하는 능력에서 다르다. CDC 및 ADCC 활성 또는 "무장된(armed)" 불변 도메인들과 함께 IgG 이소형들의 선택은 예를 들어 종양학 또는 감염 조절에서 항체들이 그들의 동족 항원을 가지는 타겟 세포들을 제거하도록 고안되는 경우에 임상적으로 유리한 것으로 고려된다(예를 들어, 인간 의학적 용도에서, 인간 IgG1 이소형들은 상술한 목적들을 위해 선호된다). 이와 대조적으로, 면역 시스템의 활성화는 염증, 고통 또는 자가면역의 감소 같은 다른 세팅들에서 바람직하지 않은 것으로 고려되어 최소 CDC 및 ADCC 활성을 가지는 인간 IgG 이소형들이 선호된다(예컨대, 그러한 인간 의학적 용도에서, 인간 IgG4 이소형들이 종종 선호된다). 네 개의 독특한 면역글로불린 감마(IgG) 중쇄 불변 도메인 이소형들은 단일 파카 및 람다 불변 도메인 서열들과 함께 개 면역 시스템에서 개시되었다(미국 특허번호 제5,852,183호, Tang L. et al. 2001. Veterinary Immunology and Immunopathology, 80. 259-270). 상기 4개의 개 중쇄 불변 도메인들 A, B, C 및 D는 매개하는 면역 시스템의 기능적 활성의 측면에서 특징화되지 않았다. 상기 IgG 패밀리에 대한 전체적인 상동성에도 불구하고, 개 IgG를 인코딩하는 단백질들은 다른 종들로부터 유래된 패밀리 멤버들보다 서로에 대해 더 관계되어 있으며, 설사 있다손 치더라도 상기 4개의 개 이소형들의 각각에 대해 기재될 수 있는 상기 기능들을 제한하는 것은 상동성 만으로는 불가능하였다. 하지만, 본 발명자들은 놀랍게도 개 IgG 서브타입 B 및 C가 다운스트림 이펙터 기능들, 특히 보체 고정(complement fixation)을 매개하지 않는다는 것을 발견하였고, 이에 따라, 개 IgG 서브타입 B 및 C로부터 유래된 폴리펩타이드 단편들이 본 발명의 키메릭 융합 폴리펩타이드들에서 선호된다.
어떤 구현예들에서, 상기 수용체 융합 단백질들은 변화된 당화 패턴들을 가지는 Fc 도메인 구성요소들을 포함하도록 제조된다. 어떤 구현예들에서, 본 발명의 TNF 수용체-Fc 융합 단백질은 Fc 부분이 당화되는 정도를 증가 또는 감소시키도록 변형될 수 있다. 폴리펩타이드들의 당화는 전형적으로 N-결합된 또는 O-결합된다. N-결합된 당화는 아스파라긴 잔기의 측쇄에 카보하이드레이트 모이어티의 부착을 의미한다. 트리펩타이드 서열들 아스파라긴-X-세린 및 아스파라긴-X-트레오닌은 아스파라긴 측쇄에 카보하이드레이트 모이어티의 효소적 부착을 위한 인지 서열들로, 상기 X는 프롤린을 제외한 어떠한 아미노산이다. 따라서, 폴리펩타이드에서 상술한 트리펩타이드 서열들 중 어느 하나의 존재는 잠재적인 당화 위치를 창출한다. O-결합된 당화는 하이드록시아미노산, 5-하이드록시프롤린 또는 5-하이드록시리신도 이용될 수 있지만 가장 일반적으로는 세린 또는 트레오닌에 당인 N-아세틸갈락토사민, 갈락토오스 또는 자일로오스 중 하나의 부착을 의미한다.
어떤 추가적인 구현예들에서 본 발명의 항-개 TNF 수용체 융합 단백질들은 상기 수용체 융합 단백질을 폴리에틸렌 글리콜(PEG) 유도체들과 반응시켜 PEG화될 수 있다. 어떤 구현예들에서 상기 수용체 융합 단백질은 탈푸코오스화되어(defucosylated) 푸코오스 잔기들이 없다.
어떤 구현예들에서 단백질의 생물학적 특성들에 대한 변형들은 (a) 치환의 영역에서 상기 폴리펩타이드 백본의 구조, 예를 들어 시트 또는 헬릭스 형태, (b) 타겟 위치에 상기 분자의 전하 또는 소수성, 또는 (c) 측쇄의 벌크에 영향을 미치는 치환들을 선택하여 완수될 수 있다. 아미노산들은 그들의 측쇄의 특성에서의 유사성에 따라 그룹핑될 수 있다(A. L. Lehninger, in Biochemistry, 2nd Ed., 73-75, Worth Publishers, New York (1975)): (1) 비-극성: Ala (A), VaI (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M); (2) 전하를 띄지 않는 극성: GIy (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q); (3) 산성: Asp (D), GIu (E); 및 (4) 염기성: Lys (K), Arg (R), His(H). 택일적으로, 천연 잔기들은 공통적인 측쇄(side-chain) 특성들에 기반하여 그룹들로 분류될 수 있다: (1) 소수성: 노르루이신(Norleucine), Met, Ala, VaI, Leu, Ile; (2) 중성 친수성: Cys, Ser, Thr, Asn, GIn; (3) 산성: Asp, GIu; (4) 염기성: His, Lys, Arg; (5) 체인 방향에 영향받는 잔기들: GIy, Pro; 및 (6) 방향성: Trp, Tyr, Phe. 비-보존적 치환들은 상술한 클래스들 중 하나의 멤버를 다른 클래스로 교환하는 것을 필요로 할 것이다. 그러한 치환된 잔기들도 보존적 치환 위치들 또는 나머지(예컨대, 비-보존적) 위치들로 도입될 수 있다.
본 발명의 수용체 융합 단백질들 및 결합 멤버들은 화학적 합성에 의해 전체적으로 또는 부분적으로 제조될 수 있다. 예를 들어, 본 발명의 수용체 융합 단백질들 및 결합 멤버들은 표준 액체 펩타이드 합성 또는 고체-상(solid-phase) 펩타이드 합성 방법 같은 당업자에게 잘 알려진 기술들에 의해 제조될 수 있다. 택일적으로, 상기 융합 단백질들은 액체 상 펩타이드 합성 기술들을 이용하는 용액 상에서 제조될 수 있거나, 또는 고체-상, 액체 상 및 용액 화학의 조합에 의해 추가적으로 제조될 수 있다.
본 발명은 추가적으로 적합한 발현 시스템에서 상기 키메릭 융합 폴리펩타이드 또는 이의 구성요소들을 인코딩하는 폴리펩타이드(들)의 발현에 의해 본 발명의 수용체 융합 단백질들 또는 결합 멤버들의 생산을 포함한다.
본 발명의 수용체 융합 단백질들을 인코딩하는 핵산 서열들은 당업자에게 잘 알려진 기술들, 예컨대, Sambrook 등 “Molecular Cloning”, A laboratory manual, cold Spring Harbor Laboratory Press, Volumes 1-3, 2001 (ISBN-0879695773), 및 Ausubel 등 Short Protocols in Molecular Biology. John Wiley and Sons, 4th Edition, 1999 (ISBN - 0471250929)에 기재된 기술들에 의해 용이하게 제조될 수 있다.
본 발명의 수용체 융합 단백질들을 인코딩하는 핵산 서열들은 최소 하나의 핵산을 포함하는 플라스미드, 벡터, 전사 또는 발현 카세트의 형태를 가지는 컨스트럭트들로서 제공될 수 있다. 상기 컨스트럭트는 하나 이상의 컨스트럭트들을 포함하는 재조합 숙주세포 내로 포함될 수 있다. 발현은 적절한 조건 하에서 적합한 핵산 서열을 포함하는 재조합 숙주세포들을 배양시킴으로써 간편하게 달성될 수 있다. 발현 후, 상기 수용체 융합 단백질 또는 수용체 융합 단백질 단편들은 적합한 어떤 기술을 이용하여 분리 및/또는 정제되고 이후에 적절하게 이용될 수 있다.
다양한 다른 숙주세포들에서 폴리펩타이드의 클로닝 및 발현을 위한 시스템들이 잘 알려져 있다. 적합한 숙주세포들은 박테리아, 포유동물세포, 효모, 곤충 및 배큘로바이러스 시스템들을 포함한다. 이종 폴리펩타이드의 발현을 위한 당업계의 포유동물 세포주들은 CHO(Chinese hamster ovary) 세포, HeLa 세포, 새끼 햄스터 신장세포 및 NSO 마우스 골수종 세포를 포함한다. 일반적으로 선호되는 박테리아 숙주는 대장균(E. coli)이다. 대장균 같은 원핵세포에서 수용체 융합 단백질들 및 수용체 융합 단백질 단편들의 발현은 당업계에 잘 확립되어 있다. 또한, 배양을 통한 진핵세포에서의 발현도 폴리펩타이드의 생산을 위한 선택사항으로서 당업자에게 이용가능하다.
본 발명의 수용체 융합 단백질은 재조합 방법에 의해 직접적으로 생산될 수 있을 뿐 아니라 바람직하게는 성숙 단백질 또는 폴리펩타이드의 N-말단에 특이적 절단 위치를 가지는 시그널 서열 또는 다른 폴리펩타이드인 이종 폴리펩타이드를 가지는 융합 폴리펩타이드로서 생산될 수 있다. 바람직하게 선택되는 상기 이종 시그널 서열은 숙주세포에 의해 인지되고 프로세싱되는 서열(즉, 시그널 펩티다제에 의해 절단되는 서열)이다. 본래의 수용체 시그널 서열을 인지하고 프로세싱하지 못하는 원핵 숙주세포들에 있어서, 상기 시그널 서열은, 예를 들어 알칼린 포스파타제, 페니실리나제, lpp, 및 열-안정 엔테로톡신 II 리더들(leaders)로 구성된 군으로부터 선택되는 원핵 시그널 서열로 대체된다.
본 발명의 수용체 융합 단백질들, 또는 상기 단백질들로부터 유래되는 결합 멤버들, 또는 상기 단백질들 또는 결합 멤버들을 인코딩하는 폴리뉴클레오타이드들에 대한 언급에서 사용되는 경우, 용어 "분리된(isolated)"은 상기 수용체 융합 단백질들 또는 폴리뉴클레오타이드들이 분리된 및/또는 정제된 형태, 즉 그들이 천연 환경으로부터 구분, 분리 또는 정제되었으며, 실질적으로 순수 또는 동종 형태로 제공되거나, 핵산의 경우에는 요구된 기능을 가지는 폴리펩타이드를 인코딩하는 서열을 제외하고는 원래의 핵산 또는 유전자들로부터 자유롭거나 또는 실질적으로 자유롭게 제공되는 상태를 의미한다. 따라서, 그러한 분리된 수용체 융합 단백질들 및 분리된 핵산들은 천연적으로 연관되어 있는 물질, 예컨대 천연 환경에서 발견되는 다른 폴리펩타이드들 또는 핵산들로부터 자유롭거나 또는 실질적으로 자유로울 것이거나, 또는 그러한 제조가 인 비트로 또는 인 비보에서 실시되는 재조합 DNA 기술에 의한 경우 상기 단백질들 및 핵산들이 제조되는 환경(예컨대, 세포 배양)으로부터 자유롭거나 또는 실질적으로 자유로울 것이다.
수용체 융합 단백질들 및 핵산들은 희석제 또는 보조제(adjuvants)와 함께 제형화될 수 있고, 실질적인 목적을 위해 분리된 형태로 제공되는 것도 고려될 수 있다. 예를 들어 면역어세이에 사용하기 위해 마이크로타이터 플레이트를 코팅하는 데 이용되는 경우 상기 수용체 융합 단백질들은 젤라틴 또는 다른 담체들과 혼합될 수 있거나 또는 진단 또는 치료에 이용되는 경우 약제학적으로 허용가능한 담체들 또는 희석제들과 혼합될 것이다. 수용체 융합 단백질들은 자연적으로 또는 이종 진핵세포(예컨대, CHO 또는 NSO 세포)의 시스템 중 어느 하나에서 당화될 수 있거나, 또는 당화되지 않을 수 있다(예를 들어 원핵세포에서의 발현에 의해 생산되는 경우).
항-개 TNF 수용체 융합 단백질 분자들을 포함하는 이종 제조물들도 본 발명의 일부를 형성한다. 예를 들어, 그러한 제조물들은 다양한 정도의 당화를 가지는 C-말단 리신이 부재한 수용체 융합 단백질들 및/또는 파이로글루탐산 잔기를 형성하는 N-말단 글루탐산의 고리화 같은 유도체화된 아미노산들을 가지는 수용체 융합 단백질들과 수용체 융합 단백질들의 혼합물일 수 있다.
전형적으로 본 발명의 약제학적 조성물들은 액체 제형, 동결건조된 제형, 액체로 재구축되는 동결건조된 제형, 또는 에어로졸 제형으로 제형화된다. 어떤 구현예들에서 상기 제형에서 수용체 융합 단백질은 약 0.5 mg/ml 내지 약 250 mg/ml, 약 0.5 mg/ml 내지 약 45 mg/ml, 약 0.5 mg/ml 내지 약 100 mg/ml, 약 100 mg/ml 내지 약 200 mg/ml 또는 약 50 mg/ml 내지 약 250 mg/ml의 농도로 존재한다.
어떤 구현예들에서 상기 제형은 완충액을 추가적으로 포함한다. 전형적으로 상기 제형의 pH는 약 pH 5.5부터 약 pH 6.5까지이다. 어떤 구현예들에서 상기 완충액은 약 4 mM부터 약 60 mM까지의 히스티딘 완충액, 약 5 mM부터 약 25 mM까지의 숙시네이트 완충액, 또는 약 5 mM부터 25 mM까지의 아세테이트 완충액을 포함할 수 있다. 어떤 구현예들에서 상기 완충액은 약 10 mM부터 300 mM까지의 농도, 전형적으로는 125 mM 근처의 농도인 나트륨 클로라이드 및 약 5 mM부터 50 mM까지의 농도, 전형적으로는 25 mM의 농도인 나트륨 시트레이트를 포함할 수 있다. 어떤 구현예들에서 상기 제형은 0% 초과 약 0.2%까지의 농도인 계면활성제를 추가적으로 포함할 수 있다. 어떤 구현예들에서 상기 계면활성제는 폴리소르베이트-20, 폴리소르베이트-40, 폴리소르베이트-60, 폴리소르베이트-65, 폴리소르베이트-80, 폴리소르베이트-85, 및 이의 조합들로 구성된 군으로부터 선택되지만, 이에 한정되는 것은 아니다. 바람직한 구현예에서 상기 계면활성제는 폴리소르베이트-20이며 약 125 mM 농도의 나트륨 클로라이드 및 약 25 mM 농도의 나트륨 시트레이트를 추가적으로 포함할 수 있다.
본 발명의 수용체 융합 단백질들은 단독으로 투여될 수 있지만, 일반적으로 의도된 투여 경로에 따라 선택되는 적합한 약제학적으로 허용가능한 부형제, 희석제 또는 담체를 포함하는 약제학적 조성물로서 바람직하게 투여될 것이다. 적합한 약제학적 담체들의 예는 물, 글리세롤, 에탄올 및 이와 유사한 것들을 포함한다.
본 발명의 수용체 융합 단백질 또는 결합 멤버는 외인적으로 또는 어떠한 다른 적합한 경로를 통해 치료를 요하는 개에 투여될 수 있다. 전형적으로는, 상기 조성물은 주사 또는 주입에 의한 비경구적으로 투여될 수 있다. 비경구 투여를 위한 바람직한 경로들의 예는 정맥내, 복강내, 근육내, 피하내 또는 경점막내 투여를 포함하지만, 이에 한정되는 것은 아니다. 투여 경로들은 국소 및 장내 투여, 예를 들어 점막(폐 포함), 구강, 비강 및 직장내 투여를 추가적으로 포함할 수 있다.
조성물이 주사가능한 조성물, 예를 들어 정맥내, 피부내 또는 피하내 적용 조성물로서 운반되는 구현예들에서, 유효성분은 피로젠-부재하고 적합한 pH, 등장성(isotonicity) 및 안정성을 가지는 비경구적으로 허용가능한 수용성 용액의 형태일 수 있다. 당업자는, 예를 들어 나트륨 클로라이드 주사, 링거 주사 또는 락테이트 링거 주사 같은 등장성 운반체(vehicles)를 이용하는 적합한 용액을 쉽게 제조할 수 있다. 보존제들, 안정화제들, 완충액들, 항산화제들 및/또는 다른 부가제들이 필요에 따라 포함될 수 있다. 조성물은 마이크로스피어, 리포좀, 다른 미세미립자(microparticulate) 운반 시스템들 또는 혈액을 포함하는 특정 조직들에 위치되는 지연된 방출 제형들을 통해 투여될 수도 있다.
상기 언급된 기술들 및 프로토콜들 및 본 발명에 부합되게 이용될 수 있는 다른 기술들 및 프로토콜들의 예는 Remington’s Pharmaceutical Sciences, 18th edition, Gennaro, A.R., Lippincott Williams & Wilkins; 20th edition ISBN 0-912734-04-3 and Pharmaceutical Dosage Forms and Drug Delivery Systems; Ansel, H.C. 등 7th Edition ISBN 0-683305-72-7에서 확인될 수 있다.
본 발명의 수용체 융합 단백질들 및 조성물들은 전형적으로 "치료학적으로 효과적인 양(therapeutically effective amount)"으로 대상자에게 투여되는데, 이것은 조성물이 투여되는 대상자에게 이득을 보이기에 충분한 양을 의미한다. 투여되는 실제 투여량, 및 투여의 속도 및 시간-경로(time-course)는, 치료될 상태의 특성 및 심각성(severity) 뿐 아니라 치료될 대상자의 나이, 성 및 몸무게, 뿐 아니라 투여 경로에 대한 적절한 참고에 의존적일 수 있고 이에 따라 결정될 수 있다. 추가적인 적절한 고려가 조성물의 특성들, 예를 들어 이의 결합 활성 및 인-비보 혈장 수명, 제형 내 수용체 융합 단백질 또는 결합 멤버의 농도, 뿐 아니라 운반의 경로, 위치 및 속도에 따라 주어질 수 있다.
투여량 요법들(regimens)은 본 발명의 수용체 융합 단백질 또는 조성물의 단일 투여, 또는 상기 수용체 융합 단백질 또는 조성물의 복수 투여(multiple administrative doses)를 포함할 수 있다. 상기 수용체 융합 단백질 또는 수용체 융합 단백질 포함 조성물들은 추가적으로 다른 항-염증 또는 TNF 길항제 조성물들과 연속적, 동시적 또는 개별적으로 투여될 수 있다.
대상자에게 투여될 수 있는 투여량 요법들의 예는 1 μg/kg/day를 지나 20 mg/kg/day까지, 1 μg/kg/day를 지나 10 mg/kg/day까지 및 10 μg/kg/day를 지나 1 mg/kg/day까지로 구성된 군으로부터 선택될 수 있지만, 이에 한정되는 것은 아니다. 어떤 구현예들에서 상기 투여량은 1 μg/ml부터 100 μg/ml까지의 혈장 농도의 항체가 얻어지도록 결정될 것이다. 하지만, 투여되는 조성물의 실제적인 투여량, 및 투여의 속도 및 시간-경과는 치료될 상태의 특성 및 심각성에 의존적일 것이다. 예를 들어 투여량의 결정 등 같은 치료의 처방전은, 궁극적으로 담당 수의사 및 다른 수의사들의 책임 안에 있고 재량에 따르며, 전형적으로 치료될 질환, 개체 환자의 상태, 운반 위치, 투여 방법 및 의사들에게 알려진 다른 인자들에 대해 고려한다.
정의들
특별히 다르게 정의되지 않는 한, 본 명세서에서 이용되는 모든 기술적 및 과학적 용어들은 본 발명의 분야에 있는 당업자에 의해 일반적으로 이해되는 의미를 가진다. 하지만, 어떠한 모호함의 이벤트에서 용어들의 의미 및 범위는 어떠한 사전적 또는 외부의 정의를 넘어 본 명세서에서 제공되는 정의들이 우선적으로 취해짐에 따라 명확하게 될 것이다.
명세서 전반에 걸쳐서, 맥락이 다르게 요구하지 않는 한, 용어 "포함하다(comprise)", 또는 "포함하다(include)", 또는 "포함하다(comprises)" 또는 "포함하는(comprising)", "포함하다(includes)" 또는 "포함하는(including)" 같은 변이형들은 정해진 정수 또는 정수들의 군의 포함을 함유하는 것으로 이해될 것이지만, 어떠한 다른 정수 또는 정수들의 군의 배제를 함유하는 것으로 이해되지 않을 것이다.
본 명세서에서 사용되는 대로, "a", "an" 및 "the" 같은 용어들은 맥락이 명확히 다르게 요구하지 않는 한 단수형 및 복수형 예들을 포함한다. 따라서, 예를 들어, "활성제(an active agent)" 또는 약제학적으로 활성을 가지는 제제(a pharmacologically active agent)"에 대한 언급은 단일 활성제 뿐 아니라 조합 상의 2개 이상의 다른 활성제들을 포함하는 반면에, "담체(a carrier)"에 대한 언급은 단일 담체 뿐 아니라 2개 이상의 담체들의 혼합물, 및 이와 유사한 것을 포함한다. 나아가, 맥락에 의해 다르게 요구되지 않는 한, 단수형 용어들은 복수형을 포함하고 복수형 용어들은 단수형을 포함한다.
전형적으로, 본 발명의 키메릭 융합 폴리펩타이드는 중화성 수용체 융합 단백질이다. 본 명세서에서 정의된 대로, 상기 용어 "중화성 수용체 융합 단백질(neutralising receptor fusion protein)"은 TNF의 생물학적 활성 및 시그널링을 중화시킬 수 있는 수용체 융합 단백질을 의미한다. 또한, TNF 길항제 융합 단백질, 길항성 수용체 융합 단백질, 또는 차단성 수용체 융합 단백질로도 언급될 수 있는 상기 중화성 수용체 융합 단백질은 TNF에 특이적으로 및 바람직하게는 선택적으로 결합하여 TNF의 하나 이상의 생물학적 활성들을 억제한다. 예를 들어, 상기 중화성 수용체 융합 단백질은 세포막 결합 TNF 수용체 1(TNFR1) 수용체(CD120a) 같은 TNF의 타겟 수용체에 TNF의 결합을 억제할 수 있다.
본 명세서에서 사용되는 대로, 용어 "생물학적 활성(biological activity)"은 분자의 어떠한 하나 이상의 내재성 생물학적 특성들(인 비보에서 발견되는 대로 천연적으로 존재하거나, 또는 재조합 방법에 의해 제공되거나 또는 가능할 수 있는 지에 따라)을 의미한다. 생물학적 특성들은 수용체 결합 및/또는 활성화, 세포 시그널링 또는 세포 증식의 유도, 세포 성장을 억제하는 것, 사이토카인 생산의 유도, 아팝토시스의 유도 및 효소적 활성을 포함하지만, 이에 한정되는 것은 아니다.
본 명세서에서 사용되는 대로, 용어 "불변 부위(constant region, CR)"는 이펙터 기능들을 부여하는 항체 분자의 일부를 의미한다. 본 발명에서, 불변 부위들은 전형적으로 개 불변 부위들을 의미하는데, 다시 말하면 상기 불변 부위들이 개 면역글로불린들로부터 유래한다는 것을 의미한다.
본 명세서에서 사용되는 대로, 용어 "면역원성(immunogenecity)"은 수령체(recipient)에 투여되는 경우 면역반응(체액성 또는 세포성)을 촉발시키는 단백질 또는 치료적 모이어티의 능력의 척도(measure)를 의미한다. 바람직하게는 본 발명의 키메릭 융합 폴리펩타이드들은 어떠한 면역원성도 가지지 않는데, 다시 말하면 상기 펩타이드들이 개에 투여되는 경우 어떠한 이식 항체들이 발생되지 않을 것이라는 것을 의미한다.
본 명세서에서 사용되는 대로 용어 "동일성(identity)" 또는 "서열 동일성(sequence identity)" 또는 "상동성(homology)"은 정렬된 서열 내 어떠한 특정 아미노산 잔기에서, 상기 아미노산 잔기가 정렬된 서열 간에 동일하다는 것을 의미한다. 본 명세서에서 사용되는 대로 용어 "유사성(similarity)" 또는 "서열 유사성(sequence similarity)"은 정렬된 서열 내 어떠한 특정 아미노산 잔기에서, 상기 아미노산 잔기가 정렬된 서열 간에 유사하다는 것을 나타낸다. 예를 들어, 루이신은 이소루이신 또는 발린 잔기로 치환될 수 있다. 이것은 보존적 치환으로서 언급될 것이다. 바람직하게는 본 발명의 아미노산 서열들이 이에 포함된 아미노산 잔기들 중 어느 하나의 보존적 치환에 의해 변형되는 경우, 이러한 변화들은 변형되지 않은 수용체 융합 단백질과 비교시 결과적인 수용체 융합 단백질의 결합 특이성 또는 기능적 활성 상에 어떠한 효과를 나타내지 않는다.
본 발명의 (천연) 폴리펩타이드 및 이의 기능적 유도체에 대한 서열 동일성은 서열들을 정렬시키고 필요하다면 최소 퍼센트 상동성을 얻기 위해 갭을 삽입시키며 서열 동일성의 일부로서 어떠한 보존적 치환들을 고려하지 않은 후 상응하는 천연 폴리펩타이드의 잔기들과 동일한 후보 서열에서의 아미노산 잔기들의 퍼센트에 관한 것이다. N- 또는 C-말단 연장들, 또는 삽입들 중 어느 것도 서열 동일성 또는 상동성을 감소시키는 것으로 이해되지 않을 것이다. 두 개 이상의 아미노산 서열들의 정렬을 실시하고 이들의 서열 동일성 또는 상동성을 결정하기 위한 방법들 및 컴퓨터 프로그램들은 당업자에게 잘 알려져 있다. 예를 들어, 두 개의 아미노산 서열들의 동일성 또는 유사성의 퍼센트는 알고리즘들, 예컨대, BLAST(Altschul et al. 1990), FASTA(Pearson & Lipman 1988), 또는 Smith-Waterman 알고리즘(Smith & Waterman 1981)을 이용하여 손쉽게 계산될 수 있다. 본 발명은 본 명세서에서 동정된 서열들과 최소 80%, 85%, 90%,93%, 95%, 96%, 97%, 98% 또는 99% 서열 동일성 또는 서열 상동성을 가지는 서열들, 및 본 명세서에 기재된 본 발명의 방법들에서 상기 서열들의 용도로 확장된다.
본 명세서에서 사용되는 대로 용어 "본질적으로 구성된다(consists essentially of)" 또는 "본질적으로 구성되는(consisting essentially of)"은, 추가적인 특징들 또는 엘리먼트들이 개 TNF에 대한 결합 특이성을 가지는 수용체 융합 단백질 또는 수용체 융합 단백질 단편의 능력에 구체적으로 영향을 미치지 않는다면, 폴리펩타이드가 기재된 폴리펩타이드 이외에 그러한 추가적인 특징들 또는 엘리먼트들을 가진다는 것을 의미한다. 즉, 상기 폴리펩타이드들을 포함하는 수용체 융합 단백질 또는 수용체 융합 단백질 단편들은 개 TNF에 결합하고 개 TNF 기능적 활성을 억제하는 수용체 융합 단백질 또는 수용체 융합 단백질 단편들의 능력을 방해하지 않는 추가적인 특징들 또는 엘리먼트들을 가질 수 있다. 그러한 변형들은 상기 수용체 융합 단백질의 면역원성을 감소시키기 위해 아미노산 서열 내로 도입될 수 있다. 예를 들어, 특화된 서열로 본질적으로 구성되는 폴리펩타이드는, 추가, 결실 또는 치환된 아미노산들이 개 TNF에 결합하고 이의 생물학적 기능을 격리시키는 수용체 융합 단백질 또는 단편의 역할을 방해, 억제, 차단 또는 중단시키지 않는다면, 하나, 둘, 셋, 넷, 다섯 또는 이상의 추가적인, 결실된 또는 치환된 아미노산들을 포함할 수 있다. 유사하게도, 본 발명의 개 TNF 길항적 수용체 융합 단백질들에 기여하는 폴리펩타이드 분자는, 기능기들이 개 TNF에 결합하고 이의 기능을 억제하는 수용체 융합 단백질 또는 수용체 융합 단백질 단편의 능력을 방해하지 않는다면, 하나 이상의 그러한 기능기들로 화학적으로 변형될 수 있다.
본 명세서에서 사용되는 대로, 용어 "효과적인 양(effective amount)" 또는 "치료학적으로 효과적인 양(therapeutically effective amount)"은 TNFR1 수용체에 대한 개 TNF 결합을 억제하는 데 요구되는 본 발명의 융합 단백질의 양 및/또는 유익하거나 또는 소망되는 임상적 결과들에 영향을 미치기에 충분한 본 발명의 키메릭 융합 폴리펩타이드의 양을 의미한다. 효과적인 양이 하나 이상의 투여량으로 투여될 수 있다. 본 발명의 목적을 위해, "효과적인 양"은 다음 중 최소 하나를 달성하는 양이다: TNF 레벨에서의 감소, 염증 반응의 감소 또는 TNF-매개된 질병 또는 상태의 감소, 예방 또는 개선.
본 명세서에서 사용되는 대로, 용어 "키메릭 폴리펩타이드(chimeric polypeptide)", "융합 폴리펩타이드", "융합 단백질" 또는 "다이머 폴리펩타이드(dimeric polypeptide)"는 다른 단백질들로부터 유래되는 최소 2개의 도메인들을 포함하는 폴리펩타이드이다. 상술한 도메인들은 키메릭, 다이머 또는 융합 단백질 내로 함께 도입되어 전형적으로 개 IgG 면역글로불린 중쇄 불변 부위로부터 유래된 Fc 도메인의 전체 또는 일부와 결합되는 p60 개 TNF 수용체(p60TNFR) 또는 p80 개 TNF 수용체(p80TNFR)의 세포외 도메인, 또는 이의 단편으로 인해 신규한 단백질을 형성한다.
용어 "폴리펩타이드", "펩타이드" 또는 "단백질"은 인접한 잔기들의 알파-아미노기와 카르복시기들 간의 펩타이드 결합을 통해 서로 연결되어 있는 선형 시리지의 아미노산 잔기들을 지시하도록 본 명세서에서 상호교환가능하게 사용된다. 아미노산 잔기들은 항상 천연 "L" 이성체 형태이다. 하지만, "D" 이성체 형태의 잔기들은 소망하는 기능적 특성이 상기 폴리펩타이드에 의해 유지되는 한 어떠한 L-아미노산 잔기로 대체될 수 있다.
용어 "폴리뉴클레오타이드" 및 "핵산"은 어떠한 길이의 뉴클레오타이드들의 폴리머 형태를 의미하도록 본 명세서에서 상호교환가능하게 사용된다. 또한, 상기 용어 폴리뉴클레오타이드는 이중 및 단일 가닥된 분자들을 상호교환가능하게 의미한다.
본 명세서에 정의되는 대로, "개(canine)"는 개로서 언급될 수도 있다. 개과(canines)는 3어명법 카니스 루푸스 파밀리아리스(Canis lupus familiaris)(카니스 파밀리아리스 도메스티쿠스, Canis familiaris domesticus) 또는 가니스 루푸스 딘고(Canis lupus dingo)와 함께 아종들에 속하는 것으로 분류될 수 있다. 개과는 어떠한 종의 개를 포함하고 야생 및 애완 변이종들 모두를 포함하며, 후자의 경우 반려동물로도 언급된다.
상기 구 "에 특이적으로 결합한다(specifically binds to)"는 이종 개체군의 단백질들에 존재하는 특이적 단백질 또는 타겟에 대한 항체 또는 단백질의 결합을 의미한다. 따라서, 특이적 면역어세이 조건들에서, 단백질들이 특이적 단백질, 본 발명의 경우에서는 개 TNF에 결합하고, 시료 내에 존재하는 충분한 양의 다른 단백질들에는 결합하지 않는다.
본 명세서에서 정의되는 대로, 용어 "이식 항체(xenoantibody)"는 숙주에 대해 외래인 에피토프에 대한 숙주에 의해 발생되는 항체를 의미한다.
도 1은 개 TNF 수용체(TNFR) p60 세포외 도메인(ECD) 단편의 아미노산 서열(서열번호 1)을 보여준다.
도 2는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 A(caHCA)의 Fc 도메인의 아미노산 서열(서열번호 2)을 보여준다.
도 3은 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 B(caHCB)의 Fc 도메인의 아미노산 서열(서열번호 3)을 보여준다.
도 4는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 C(caHCC)의 Fc 도메인의 아미노산 서열(서열번호 4)을 보여준다.
도 5는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 D(caHCD)의 Fc 도메인의 아미노산 서열(서열번호 5)을 보여준다.
도 6은 서열번호 1의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 6의 아미노산 서열을 보여준다.
도 7은 서열번호 1의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 7의 아미노산 서열을 보여준다.
도 8은 서열번호 1의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 8의 아미노산 서열을 보여준다.
도 9는 서열번호 1의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 9의 아미노산 서열을 보여준다.
도 10은 서열번호 1의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인의 아글리코실 형태(aglycosyl version)를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 10의 아미노산 서열을 보여준다.
도 11은 서열번호 1의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 11의 아미노산 서열을 보여준다.
도 12는 서열번호 1의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 12의 아미노산 서열을 보여준다.
도 13은 서열번호 1의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 13의 아미노산 서열을 보여준다.
도 14는 개 TNF 수용체(TNFR) p80 세포외 도메인(ECD) 단편의 아미노산 서열(서열번호 14)을 보여준다.
도 15는 서열번호 14의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 15의 아미노산 서열을 보여준다.
도 16은 서열번호 14의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 16의 아미노산 서열을 보여준다.
도 17은 서열번호 14의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 17의 아미노산 서열을 보여준다.
도 18은 서열번호 14의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 18의 아미노산 서열을 보여준다.
도 19는 서열번호 14의 개 TNFR 서열 및 서열번호 2의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 19의 아미노산 서열을 보여준다.
도 20은 서열번호 14의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 20의 아미노산 서열을 보여준다.
도 21은 서열번호 14의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 21의 아미노산 서열을 보여준다.
도 22는 서열번호 14의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 22의 아미노산 서열을 보여준다.
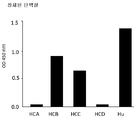
도 23은 2차 항-개 IgG 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되는 발현된 개 TNFR-Fc 융합 단백질들의 상층액을 개 TNF와 결합시키는 ELISA의 결과들을 보여주는 그래프이다. 서열번호 6(HCA), 서열번호 7(HCB), 서열번호 8(HCC) 및 서열번호 9(HCD)을 인코딩하는 발현 플라스미드들을 이용한 CHO 세포들의 트랜스펙션은 서열번호 7에 대해 유사한 융합으로 개 HCB 경첩-CH2-CH3에 N-말단으로 융합된 동등한 인간 TNFR-Fc 세포외 도메인과 비교하여 테스팅되는 다양한 상층액들을 생산하였다.
도 24는 탠덤(tandem) 단백질 A 및 단백질 G 세파로오스 컬럼들 상에 친화도 캡쳐 후 정제된 개 TNFR-Fc 융합 단백질의 결합에 대한 ELISA를 보여주는 그래프이다. 이 도면에서 볼 수 있듯이, 상기 개 TNF 수용체 융합 단백질들의 HCB 및 HCC 형태들이 단백질 A 또는 단백질 G에 의해 효율적으로 캡쳐되었던 반면에, 상기 융합 단백질들의 HCA 및 HCD 형태들은 거의 캡쳐되지 않았다. 추가적인 분석(보여지지 않음)은 상기 개 TNFR-HCB가 단백질 A에 의해 효과적으로 캡쳐되며 HCC 형태는 단백질 G에 의해 캡쳐되었다는 것을 확증하였다.
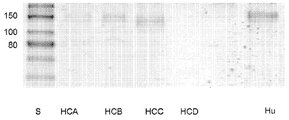
도 25는 탠덤 단백질 A 및 단백질 G 친화도 크로마토그래피의 산물들의 비 환원성 SDS-PAGE 젤의 결과들을 보여주는데, 이는 개 TNFR 융합 단백질들의 HCA(서열번호 6) 및 HCD(서열번호 9) 이소형들의 좋지 못한 회수를 확인시켜 준다.
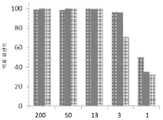
도 26 및 도 27은 NF-κB-EGFP 수용체 컨스트럭트인 pTRH1(Vince et al, Cell 131, 682, 2007)로 트랜스펙션된 293-HEK 세포들을 이용하여 개 TNF 알파 생물활성(bioactivity)(R&D systems, 1 ng/ml)의 억제를 보여준다. 상술한 세포들은 형광을 통해 개 TNF에 반응한다. 개 TNFR 융합 단백질들의 개 TNFR-HCB(서열번호 7)(도 26) 및 개 TNFR-HCC(서열번호 8)(도 27) 이소형들 모두가 인간 TNFR-개 HCB 대조군 융합 단백질(도 27에 정량됨)을 억제하였을 뿐 아니라 동일하게 TNF-유도된 형광을 억제시켰다. 상기 어세이의 IC50은 약 1 ng/ml이었다.
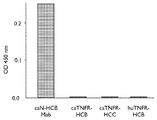
도 28은 보체 C1q 결합 ELISA의 결과들을 보여준다. 상기 개 TNFR-HCB, 개 TNFR-HCC 및 인간 TNFR-개 HCB 융합 단백질들이 개 TNF (4 μg/ml)로 전-코팅된 플레이트에서 반응되었다. 비교를 위해, 신경성장인자(NGF)에 특이성을 가지는 개화된 단일클론 항체(MAb, 개 이소형 HCB)가 NGF로 코팅된 플레이트에서 반응되었다. 상기 플레이트들은 세척되고 보체의 소스로서 정상 인간 혈청 또는 열-사멸된(heat-killed) 인간 혈청과 반응되었다. 보체 C1q의 결합이 C1q 반응성 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되었다. 결과들로부터 볼 수 있듯이, 개 HCB MAb가 보체를 모집할 수 있었던 반면에, 놀랍게도, 어떠한 개 또는 인간 TNFR-HCB 융합 단백질들, 또는 개 TNFR-HCC 융합 단백질도 보체를 모집할 수 없었다(다른 실험들에서 항-NGF 단일클론 항체들의 HCC 이소형은 C1q와 결합한다; 데이터를 보이지 않음).
도 29는 pH5에서 선택적 용출에 의해 동일한 고분자량 응집물들로부터 개 TNFR-HCB(서열번호 7) 폴리펩타이드 융합 단백질 다이머들의 최적화된 정제의 결과들을 보여준다.
도 30은 신규한 개 TNFR p80 세포외 도메인 아미노산 서열(서열번호 14)의 유도를 보여준다.
도 2는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 A(caHCA)의 Fc 도메인의 아미노산 서열(서열번호 2)을 보여준다.
도 3은 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 B(caHCB)의 Fc 도메인의 아미노산 서열(서열번호 3)을 보여준다.
도 4는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 C(caHCC)의 Fc 도메인의 아미노산 서열(서열번호 4)을 보여준다.
도 5는 경첩 부위부터 C 말단까지의 개 IgG1 면역글로불린 타입 D(caHCD)의 Fc 도메인의 아미노산 서열(서열번호 5)을 보여준다.
도 6은 서열번호 1의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 6의 아미노산 서열을 보여준다.
도 7은 서열번호 1의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 7의 아미노산 서열을 보여준다.
도 8은 서열번호 1의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 8의 아미노산 서열을 보여준다.
도 9는 서열번호 1의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 9의 아미노산 서열을 보여준다.
도 10은 서열번호 1의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인의 아글리코실 형태(aglycosyl version)를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 10의 아미노산 서열을 보여준다.
도 11은 서열번호 1의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 11의 아미노산 서열을 보여준다.
도 12는 서열번호 1의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 12의 아미노산 서열을 보여준다.
도 13은 서열번호 1의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 13의 아미노산 서열을 보여준다.
도 14는 개 TNF 수용체(TNFR) p80 세포외 도메인(ECD) 단편의 아미노산 서열(서열번호 14)을 보여준다.
도 15는 서열번호 14의 개 TNFR 서열 및 서열번호 2의 개 IgG HCA Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 15의 아미노산 서열을 보여준다.
도 16은 서열번호 14의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 16의 아미노산 서열을 보여준다.
도 17은 서열번호 14의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 17의 아미노산 서열을 보여준다.
도 18은 서열번호 14의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인을 포함하는 키메릭 융합 폴리펩타이드인 서열번호 18의 아미노산 서열을 보여준다.
도 19는 서열번호 14의 개 TNFR 서열 및 서열번호 2의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 19의 아미노산 서열을 보여준다.
도 20은 서열번호 14의 개 TNFR 서열 및 서열번호 3의 개 IgG HCB Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 20의 아미노산 서열을 보여준다.
도 21은 서열번호 14의 개 TNFR 서열 및 서열번호 4의 개 IgG HCC Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 21의 아미노산 서열을 보여준다.
도 22는 서열번호 14의 개 TNFR 서열 및 서열번호 5의 개 IgG HCD Fc 도메인의 아글리코실 형태를 포함하는 키메릭 융합 폴리펩타이드인 서열번호 22의 아미노산 서열을 보여준다.
도 23은 2차 항-개 IgG 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되는 발현된 개 TNFR-Fc 융합 단백질들의 상층액을 개 TNF와 결합시키는 ELISA의 결과들을 보여주는 그래프이다. 서열번호 6(HCA), 서열번호 7(HCB), 서열번호 8(HCC) 및 서열번호 9(HCD)을 인코딩하는 발현 플라스미드들을 이용한 CHO 세포들의 트랜스펙션은 서열번호 7에 대해 유사한 융합으로 개 HCB 경첩-CH2-CH3에 N-말단으로 융합된 동등한 인간 TNFR-Fc 세포외 도메인과 비교하여 테스팅되는 다양한 상층액들을 생산하였다.
도 24는 탠덤(tandem) 단백질 A 및 단백질 G 세파로오스 컬럼들 상에 친화도 캡쳐 후 정제된 개 TNFR-Fc 융합 단백질의 결합에 대한 ELISA를 보여주는 그래프이다. 이 도면에서 볼 수 있듯이, 상기 개 TNF 수용체 융합 단백질들의 HCB 및 HCC 형태들이 단백질 A 또는 단백질 G에 의해 효율적으로 캡쳐되었던 반면에, 상기 융합 단백질들의 HCA 및 HCD 형태들은 거의 캡쳐되지 않았다. 추가적인 분석(보여지지 않음)은 상기 개 TNFR-HCB가 단백질 A에 의해 효과적으로 캡쳐되며 HCC 형태는 단백질 G에 의해 캡쳐되었다는 것을 확증하였다.
도 25는 탠덤 단백질 A 및 단백질 G 친화도 크로마토그래피의 산물들의 비 환원성 SDS-PAGE 젤의 결과들을 보여주는데, 이는 개 TNFR 융합 단백질들의 HCA(서열번호 6) 및 HCD(서열번호 9) 이소형들의 좋지 못한 회수를 확인시켜 준다.
도 26 및 도 27은 NF-κB-EGFP 수용체 컨스트럭트인 pTRH1(Vince et al, Cell 131, 682, 2007)로 트랜스펙션된 293-HEK 세포들을 이용하여 개 TNF 알파 생물활성(bioactivity)(R&D systems, 1 ng/ml)의 억제를 보여준다. 상술한 세포들은 형광을 통해 개 TNF에 반응한다. 개 TNFR 융합 단백질들의 개 TNFR-HCB(서열번호 7)(도 26) 및 개 TNFR-HCC(서열번호 8)(도 27) 이소형들 모두가 인간 TNFR-개 HCB 대조군 융합 단백질(도 27에 정량됨)을 억제하였을 뿐 아니라 동일하게 TNF-유도된 형광을 억제시켰다. 상기 어세이의 IC50은 약 1 ng/ml이었다.
도 28은 보체 C1q 결합 ELISA의 결과들을 보여준다. 상기 개 TNFR-HCB, 개 TNFR-HCC 및 인간 TNFR-개 HCB 융합 단백질들이 개 TNF (4 μg/ml)로 전-코팅된 플레이트에서 반응되었다. 비교를 위해, 신경성장인자(NGF)에 특이성을 가지는 개화된 단일클론 항체(MAb, 개 이소형 HCB)가 NGF로 코팅된 플레이트에서 반응되었다. 상기 플레이트들은 세척되고 보체의 소스로서 정상 인간 혈청 또는 열-사멸된(heat-killed) 인간 혈청과 반응되었다. 보체 C1q의 결합이 C1q 반응성 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되었다. 결과들로부터 볼 수 있듯이, 개 HCB MAb가 보체를 모집할 수 있었던 반면에, 놀랍게도, 어떠한 개 또는 인간 TNFR-HCB 융합 단백질들, 또는 개 TNFR-HCC 융합 단백질도 보체를 모집할 수 없었다(다른 실험들에서 항-NGF 단일클론 항체들의 HCC 이소형은 C1q와 결합한다; 데이터를 보이지 않음).
도 29는 pH5에서 선택적 용출에 의해 동일한 고분자량 응집물들로부터 개 TNFR-HCB(서열번호 7) 폴리펩타이드 융합 단백질 다이머들의 최적화된 정제의 결과들을 보여준다.
도 30은 신규한 개 TNFR p80 세포외 도메인 아미노산 서열(서열번호 14)의 유도를 보여준다.
본 발명은 예시의 목적으로 제공되는 다음의 실시예들을 참고하여 기재될 것이지만 본 발명을 제한하고자 하는 것으로 이해되지 않는다. 본 발명의 방법들 및 기술들은 일반적으로 당업계에 잘 알려져 있고 특별하게 지시되지 않는 한 본 명세서 전반에 걸쳐서 인용되고 논의되는 다양한 일반 및 보다 특이적인 참고문헌들에 기재되는 종래의 방법들에 따라 실시된다.
실시예들
실시예
1 - 항-개
TNF
수용체 융합 단백질들을 인코딩하는
DNA
의 발현
ELISA는 2차 항-개 IgG 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되는 발현된 개 TNFR-Fc 융합 단백질의 상층액의 개 TNF에 대한 결합을 결정하기 위해 실시되었다. 결과들은 도 23에 보여진다.
서열번호 6(HCA (caTNFRp50:ca IgGHCA Fc)), 서열번호 7(HCB (caTNFRp50:ca IgGHCB Fc)), 서열번호 8(HCC (caTNFRp50:ca IgGHCC Fc)) 및 서열번호 9(HCD (caTNFRp50:ca IgGHCD Fc))을 인코딩하는 발현 플라스미드들의 CHO 세포 트랜스펙션은 테스트되었던 다양한 상층액들을 초래하였으며 이들 상층액들이 서열번호 7에 대한 유사 융합으로 개 HCB 경첩-CH2-CH3에 N-말단 융합된 인간 TNFR 세포외 도메인을 포함하는 동등한 인간 TNFR-Fc와 비교되었다.
도 24는 탠덤 단백질 A 및 단백질 G 세파로오스 컬럼들로 친화도 캡쳐 후 정제된 개 TNFR-Fc 융합 단백질들의 결합에 대한 ELISA 결과들을 보여준다. 이 도에서 볼 수 있듯이, 개 TNF 수용체 융합 단백질들의 HCB 및 HCC 형태들은 단백질 A 또는 단백질 G에 의해 효율적으로 캡쳐되었지만, 상기 융합 단백질들의 HCA 및 HCD 형태들은 거의 캡쳐되지 않았다. 추가적인 분석(보여지지 않음)은 상기 개 TNFR-HCB가 단백질 A에 의해 효과적으로 캡쳐되며 개 HCC 형태는 단백질 G에 의해 캡쳐될 수 있었다는 것을 증명하였다.
도 25는 탠덤 단백질 A 및 단백질 G 친화도 크로마토그래피의 산물들의 비 환원성 SDS-PAGE 젤의 결과들을 보여주는데, 이는 개 TNFR 융합 단백질들의 HCA(서열번호 6) 및 HCD(서열번호 9) 이소형들의 좋지 못한 회수를 확인시켜 준다.
실시예
2 - 개
TNF
활성의 억제
본 실험이 본 발명의 융합 폴리펩타이드들이 TNF 생물학적 활성의 길항제로서 기능하는 지를 평가하였다.
도 26 및 도 27은 NF-κB-EGFP 수용체 컨스트럭트인 pTRH1(Vince et al, Cell 131, 682, 2007)로 트랜스펙션된 293-HEK 세포들을 이용하여 개 TNF 알파 생물활성(R&D systems, 1 ng/ml)의 억제를 보여준다. 상술한 세포들은 형광을 통해 개 TNF에 반응한다. 개 TNFR 융합 단백질들의 개 TNFR-HCB(서열번호 7)(도 26) 및 개 TNFR-HCC(서열번호 8)(도 27) 이소형들 모두가 인간 TNFR-개 HCB 대조군 융합 단백질(도 27에 정량됨)을 억제하였을 뿐 아니라 동일하게 TNF-유도된 형광을 억제시켰다. 상기 어세이의 IC50은 약 1 ng/ml이었다.
실시예
3 -
TNF
수용체 융합 단백질들은
보체
활성이 없다
도 28은 보체 C1q 결합 ELISA의 결과들을 보여준다. 상기 개 TNFR-HCB, 개 TNFR-HCC 및 인간 TNFR-개 HCB 융합 단백질들이 개 TNF(4 μg/ml)로 전-코팅된 플레이트에서 반응되었다. 비교를 위해, 신경성장인자(NGF)에 특이성을 가지는 개화된 단일클론 항체(MAb, 개 이소형 HCB)가 NGF로 코팅된 플레이트에서 반응되었다. 상기 플레이트들은 세척되고 보체의 소스로서 정상 인간 혈청 또는 열-제거된(heat-killed) 인간 혈청과 반응되었다. 보체 C1q의 결합이 C1q 반응성 다중클론 항체-HRP 컨쥬게이트를 이용하여 검출되었다. 결과들로부터 볼 수 있듯이, 개 HCB 단일클론 항체가 보체를 모집할 수 있었던 반면에, 놀랍게도, 어떠한 전체 개 또는 키메릭 인간 TNFR-HCB 융합 단백질들, 또는 개 TNFR-HCC 융합 단백질도 보체를 모집할 수 없었다(다른 실험들에서 항-NGF 단일클론 항체들의 HCC 이소형은 C1q와 결합한다; 데이터를 보이지 않음).
종합하여 상술한 결과들은 본 발명의 개 TNF 수용체 융합 단백질들 및 인간 TNFR-개 Fc 키메라 컨스트럭트가 개 TNF와 결합하고 ELISA 및 억제 어세이 모두를 통해 동등한 효능을 가진다는 것을 보여주는 데, 이것은 상기 융합 과정이 완전한 활성의 개 버전의 TNF 수용체 융합 단백질들을 생산하였음을 입증하는 것이다.
더 나아가, 상술한 결과들은 단백질 A 및 단백질 G에 의한 정제가 개 IgG 중쇄 불변 도메인들 중 하나와 개 TNFR 세포외 도메인의 단순 융합에 의해 달성될 수 없음을 보여주는데, 왜냐하면 예상 밖으로 개 IgG HCA 또는 HCD 불변 도메인들 중 어느 것도 상기 유용한 정제 물질들에 결합하는 능력을 부여하지 않았기 때문이다. 결과적으로, HCB 및 HCC IgG 불변 도메인들이 개에서의 질병들을 치료하는 수의적 임상 용도를 위한 스케일에서 이용가능하게 정제될 수 있는 TNFR-Fc 융합 단백질들(또는 어떠한 다른 개 수용체 Fc 융합 단백질들)을 제조하기 위한 바람직한 융합 파트너들이다.
도 28은, 뜻밖에도 개 TNF 수용체 융합 단백질들의 HCB 및 HCC 이소형들의 디자인이 보체 모집에 대한 능력의 부재를 초래한다는 것을 보여준다. 따라서, 개 TNF 수용체 융합 단백질들은 TNF 염증 활성의 위치들의 손상에 대한 보체 모집의 바람직한 부재를 가지는 인간 TNF 수용체의 결합과 동등한 개 TNF에 대한 강한 결합의 예상치 못한 조합을 보여준다. 따라서, 본 발명의 개 TNF 수용체 융합 단백질들은 놀랍게도 개 TNF에 의해 매개되는 개 질병들의 치료에 유용하다.
도 29는 pH5에서 선택적 용출에 의해 동일한 고분자량 응집물들로부터 개 TNFR-HCB(서열번호 7) 폴리펩타이드 융합 단백질 다이머들의 최적화된 정제의 결과들을 보여준다. 면역글로불린들의 단백질 A 정제에 대한 표준 과정은 중성 pH에서 결합시키고 pH3에서 용출시키는 것이다. 개 TNFR-HCB 융합 단백질(서열번호 7)은 이러한 방식으로 캡쳐되어 용출될 수 있지만, 유의한 비율의 CHO 세포 산물은 고분자량 응집물들의 형태로 존재한다(도 29b, 레인 1; 또한, 도 25, 레인 HCB, 도 위쪽의 젤에 진입하는 곳). 그러한 응집물들은 면역원성을 나타낼 수 있으며, 이들의 제거가 바람직하다. 놀랍게도, 상기 고분자량 응집물들은 용출 완충액의 pH를 더 높은 pH로 변형시켜 개 TNFR-HCB 융합 단백질의 선호되는 다이머 형태로부터 정제될 수 있다. 도 29a에서, 서열번호 7의 발현에 의해 CHO 세포에서 생산된 개 TNFR-HCB 단백질은 pH7에서 단백질 A 컬럼에 결합된 후, 개 TNFR-HCB 융합 단백질 다이머를 특이적으로 용출시키는 pH5의 완충액으로 용출되었다. 이후, 개 TNFR-HCB의 고분자량 응집물들은 pH4.5-4.7에서 용출되었다. 분획들은 SDS-PAGE에 의해 CHO 세포-발현된 TNFR-HCB 단백질과 비교되었다(도 29b). 표준 pH3 용출에 의해 정제된 다이머 및 고분자량 응집물을 포함하는 본래의 TNFR-HCB 제조물은 레인 1 및 레인 4에 보여진다. 본 발명에 따라 제조된 정제된 다이머를 포함하는 pH5 용출물(도 29a에서 25-45 mL 런 용량으로부터 수집됨)은 레인 2 및 레인 5에 보여지는 반면에, 더 낮은 pH에서 용출된 응집된 형태들(도 29a에서 50-60 mL 런 용량(run volume)으로부터 수집됨)은 레인 3 및 레인 6에서 보여진다. 상기 고분자량 응집물들은 환원성 조건 하에서 관찰되는 동일한 밴딩 패턴에 의해 개 TNFR-HCB 융합 단백질으로 확인되었다(레인 4, 5, 및 6). 개 TNFR-HCB 융합 단백질 다이머의 순도에서의 개선은 레인 1 및 레인 2의 비교를 통해 명백하다. 따라서, 본 발명의 신규한 pH5 단백질 A 용출 조건은 치료제로서 사용하기에 적합한 더 높은 순도의 개 TNFR-HCB 융합 단백질을 제조하는 데 유용성을 가진다.
실시예
4 -
신규한
개
TNFR
p80
세포외
도메인 단백질 서열
도 30은 신규한 개 TNFR p80 세포외 도메인 아미노산 서열의 유도를 보여준다. 인간 p80 세포외 도메인 서열(P20333, 시그널 서열은 밑줄로 표시됨)과 비교하면, 개 TNFR p80의 두 개의 주석된 변이체들, 클론 XP_544562.2 및 DN368636으로부터 유래된 서열들이 불완전한 형태의 TNFR p80으로서 동정되었었는 데, 이들 중 어떤 것도 포유동물세포에서 발현될 수 있는 완전한 개 TNFR p80 세포외 도메인 서열을 코드하지 않는다 - 시그널 서열의 부재 및 N-말단 서열 VPG 부재에 따른 클론 544562.2(도 30에서 막통과 도메인까지만 번역되는 것으로 보여짐), 및 막 중심부 쪽의 세포외 도메인 서열 및 부정확한 C-말단 서열(TRRH)에 따른 클론 DN368636. 상술한 두 개의 서열들의 조합은 개 TNFR p80 ECD에 대한 신규한 서열을 초래하고, 이는 서열번호 14에서 보여진다.
본 출원서에서 언급되는 모든 문서들은 본 명세서에 참조로서 삽입된다. 본 발명의 기재된 구현예들에 대한 다양한 변형들 및 변이들이 본 발명의 범위를 벗어남이 없이 당업자에게 자명할 것이다. 본 발명이 특이적으로 선호된 구현예들과 조합되어 기재되었을 지라도, 청구된 대로 본 발명이 그러한 특이적 구현예들에만 제한되는 것이 아니라는 것이 이해될 것이다. 실제로, 당업자에게 자명한 본 발명을 실시하는 기재된 모드들의 다양한 변형들이 본 발명에 의해 포괄되는 것으로 의도된다.
SEQUENCE LISTING
<110> NVIP Pty Ltd
<120> Tumour Necrosis Factor Receptor Fusion Proteins and Methods of
using the same
<130> P122189.WO.01
<150> US 61/601,712
<151> 2012-02-22
<160> 31
<170> PatentIn version 3.5
<210> 1
<211> 212
<212> PRT
<213> Canis familiaris
<400> 1
Ala Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu
1 5 10 15
Leu Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val
20 25 30
Pro His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly
35 40 45
Lys Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His
50 55 60
Lys Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr
65 70 75 80
Asp Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His
85 90 95
Leu Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln
100 105 110
Val Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys
115 120 125
Arg Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys
130 135 140
Asn Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln
145 150 155 160
Glu Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg
165 170 175
Glu His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys
180 185 190
Gly Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp
195 200 205
Pro Gly Ser Thr
210
<210> 2
<211> 233
<212> PRT
<213> Canis familiaris
<400> 2
Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys Pro Val Pro Glu
1 5 10 15
Pro Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro Lys Pro Lys Asp
20 25 30
Ile Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys Val Val Leu Asp
35 40 45
Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly
50 55 60
Lys Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu Gln Gln Phe Asn
65 70 75 80
Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp
85 90 95
Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Asp Leu Pro
100 105 110
Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Arg Ala His Lys
115 120 125
Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser
130 135 140
Asp Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe Tyr Pro Pro Asp
145 150 155 160
Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu Arg Lys
165 170 175
His Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu
180 185 190
Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Pro
195 200 205
Phe Thr Cys Ala Val Met His Glu Thr Leu Gln Asn His Tyr Thr Asp
210 215 220
Leu Ser Leu Ser His Ser Pro Gly Lys
225 230
<210> 3
<211> 237
<212> PRT
<213> Canis familiaris
<400> 3
Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro Asp Cys Pro Lys
1 5 10 15
Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val Phe Ile Phe Pro
20 25 30
Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala Arg Thr Pro Glu Val Thr
35 40 45
Cys Val Val Val Asp Leu Asp Pro Glu Asp Pro Glu Val Gln Ile Ser
50 55 60
Trp Phe Val Asp Gly Lys Gln Met Gln Thr Ala Lys Thr Gln Pro Arg
65 70 75 80
Glu Glu Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile
85 90 95
Gly His Gln Asp Trp Leu Lys Gly Lys Gln Phe Thr Cys Lys Val Asn
100 105 110
Asn Lys Ala Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg
115 120 125
Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Arg Glu
130 135 140
Glu Leu Ser Lys Asn Thr Val Ser Leu Thr Cys Leu Ile Lys Asp Phe
145 150 155 160
Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu
165 170 175
Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro Gln Leu Asp Glu Asp Gly
180 185 190
Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln
195 200 205
Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu His Asn
210 215 220
His Tyr Thr Gln Glu Ser Leu Ser His Ser Pro Gly Lys
225 230 235
<210> 4
<211> 235
<212> PRT
<213> Canis familiaris
<400> 4
Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn Cys Pro Cys Pro
1 5 10 15
Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
20 25 30
Pro Lys Asp Ile Leu Val Thr Ala Arg Thr Pro Thr Val Thr Cys Val
35 40 45
Val Val Asp Leu Asp Pro Glu Asn Pro Glu Val Gln Ile Ser Trp Phe
50 55 60
Val Asp Ser Lys Gln Val Gln Thr Ala Asn Thr Gln Pro Arg Glu Glu
65 70 75 80
Gln Ser Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Gly His
85 90 95
Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys Cys Lys Val Asn Asn Lys
100 105 110
Ala Leu Pro Ser Pro Ile Glu Glu Ile Ile Ser Lys Thr Pro Gly Gln
115 120 125
Ala His Gln Pro Asn Val Tyr Val Leu Pro Pro Ser Arg Asp Glu Met
130 135 140
Ser Lys Asn Thr Val Thr Leu Thr Cys Leu Val Lys Asp Phe Phe Pro
145 150 155 160
Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro Glu
165 170 175
Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser Tyr
180 185 190
Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Arg Gly
195 200 205
Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu His Asn His Tyr
210 215 220
Thr Gln Ile Ser Leu Ser His Ser Pro Gly Lys
225 230 235
<210> 5
<211> 233
<212> PRT
<213> Canis familiaris
<400> 5
Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser Pro Cys Pro Val Pro Glu
1 5 10 15
Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp
20 25 30
Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val Val Leu Asp
35 40 45
Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe Val Asp Gly
50 55 60
Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His Gln Asp Trp
85 90 95
Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile Gly Leu Pro
100 105 110
Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln Ala His Gln
115 120 125
Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu Ser Ser Ser
130 135 140
Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Tyr Pro Pro Glu
145 150 155 160
Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro Glu Ser Lys
165 170 175
Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser Tyr Phe Leu
180 185 190
Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln Gly Asp Thr
195 200 205
Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His Tyr Thr Asp
210 215 220
Leu Ser Leu Ser His Ser Pro Gly Lys
225 230
<210> 6
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCA Fc Fusion Polypeptide
<400> 6
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys Pro
210 215 220
Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe
260 265 270
Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu Gln
275 280 285
Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His
290 295 300
Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile
305 310 315 320
Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Arg
325 330 335
Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu
340 345 350
Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe Tyr
355 360 365
Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro
370 375 380
Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser
385 390 395 400
Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr Leu Gln Asn His
420 425 430
Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 7
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCB Fc Fusion Polypeptide
<400> 7
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro Asp
210 215 220
Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asp Pro Glu Val
260 265 270
Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met Gln Thr Ala Lys Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly Lys Gln Phe Thr Cys
305 310 315 320
Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro
340 345 350
Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser Leu Thr Cys Leu Ile
355 360 365
Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly
370 375 380
Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro Gln Leu Asp
385 390 395 400
Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser
405 410 415
Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 8
<211> 446
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCC Fc Fusion Polypeptide
<400> 8
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn Cys
210 215 220
Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala Arg Thr Pro Thr Val
245 250 255
Thr Cys Val Val Val Asp Leu Asp Pro Glu Asn Pro Glu Val Gln Ile
260 265 270
Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr Ala Asn Thr Gln Pro
275 280 285
Arg Glu Glu Gln Ser Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro
290 295 300
Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys Cys Lys Val
305 310 315 320
Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Glu Ile Ile Ser Lys Thr
325 330 335
Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val Leu Pro Pro Ser Arg
340 345 350
Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr Cys Leu Val Lys Asp
355 360 365
Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln
370 375 380
Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu Asp Glu Asp
385 390 395 400
Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp
405 410 415
Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 9
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCD Fc Fusion Polypeptide
<400> 9
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser Pro Cys Pro
210 215 220
Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val
245 250 255
Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe
260 265 270
Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln
275 280 285
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His
290 295 300
Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile
305 310 315 320
Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln
325 330 335
Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu
340 345 350
Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Tyr
355 360 365
Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro
370 375 380
Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser
385 390 395 400
Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His
420 425 430
Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 10
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCA Aglycosyl Fc Fusion Polypeptide
<400> 10
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys Pro
210 215 220
Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe
260 265 270
Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu Gln
275 280 285
Gln Phe Ala Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His
290 295 300
Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile
305 310 315 320
Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Arg
325 330 335
Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu
340 345 350
Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe Tyr
355 360 365
Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu Pro
370 375 380
Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly Ser
385 390 395 400
Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr Leu Gln Asn His
420 425 430
Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 11
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCB Aglycosyl Fc Fusion Polypeptide
<400> 11
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro Asp
210 215 220
Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asp Pro Glu Val
260 265 270
Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met Gln Thr Ala Lys Thr
275 280 285
Gln Pro Arg Glu Glu Gln Phe Ala Gly Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly Lys Gln Phe Thr Cys
305 310 315 320
Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser
325 330 335
Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro
340 345 350
Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser Leu Thr Cys Leu Ile
355 360 365
Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly
370 375 380
Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro Gln Leu Asp
385 390 395 400
Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser
405 410 415
Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 12
<211> 446
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCC Aglycosyl Fc Fusion Polypeptide
<400> 12
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn Cys
210 215 220
Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala Arg Thr Pro Thr Val
245 250 255
Thr Cys Val Val Val Asp Leu Asp Pro Glu Asn Pro Glu Val Gln Ile
260 265 270
Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr Ala Asn Thr Gln Pro
275 280 285
Arg Glu Glu Gln Ser Ala Gly Thr Tyr Arg Val Val Ser Val Leu Pro
290 295 300
Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys Cys Lys Val
305 310 315 320
Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Glu Ile Ile Ser Lys Thr
325 330 335
Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val Leu Pro Pro Ser Arg
340 345 350
Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr Cys Leu Val Lys Asp
355 360 365
Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln
370 375 380
Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu Asp Glu Asp
385 390 395 400
Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp
405 410 415
Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser Pro Gly Lys
435 440 445
<210> 13
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFRp60:HCD Aglycosyl Fc Fusion Polypeptide
<400> 13
Met Gly Leu Pro Thr Val Pro Gly Leu Leu Leu Pro Leu Val Leu Leu
1 5 10 15
Ala Leu Leu Leu Glu Ile Tyr Pro Ile Ser Val Thr Ala Leu Val Pro
20 25 30
His Pro Arg Asn Arg Val Lys Arg Ala Ile Leu Cys Pro Gln Gly Lys
35 40 45
Tyr Ile His Pro Gln Asp Asp Ser Ile Cys Cys Thr Lys Cys His Lys
50 55 60
Gly Thr Tyr Leu Tyr Asn Asp Cys Pro Gly Pro Gly Leu Asp Thr Asp
65 70 75 80
Cys Arg Glu Cys Glu Asn Gly Thr Phe Thr Ala Ser Glu Asn His Leu
85 90 95
Arg Gln Cys Leu Ser Cys Ser Lys Cys Arg Lys Glu Met Asn Gln Val
100 105 110
Glu Ile Ser Pro Cys Thr Val Tyr Arg Asp Thr Val Cys Gly Cys Arg
115 120 125
Lys Asn Gln Tyr Arg Phe Tyr Trp Ser Glu Thr Leu Phe Gln Cys Asn
130 135 140
Asn Cys Ser Leu Cys Leu Asn Gly Thr Val Gln Ile Ser Cys Gln Glu
145 150 155 160
Lys Gln Asn Thr Ile Cys Thr Cys His Ala Gly Phe Phe Leu Arg Glu
165 170 175
His Glu Cys Val Ser Cys Val Asn Cys Lys Lys Asn Thr Glu Cys Gly
180 185 190
Lys Leu Cys Leu Pro Pro Val Glu Thr Val Lys Val Pro Gln Asp Pro
195 200 205
Gly Ser Thr Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser Pro Cys Pro
210 215 220
Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys Val
245 250 255
Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp Phe
260 265 270
Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu Gln
275 280 285
Gln Phe Ala Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu His
290 295 300
Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His Ile
305 310 315 320
Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly Gln
325 330 335
Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu Leu
340 345 350
Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe Tyr
355 360 365
Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu Pro
370 375 380
Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly Ser
385 390 395 400
Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn His
420 425 430
Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 14
<211> 260
<212> PRT
<213> Canis familiaris
<400> 14
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp
260
<210> 15
<211> 493
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-HCA Fusion Polypeptide
<400> 15
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys
260 265 270
Pro Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro
275 280 285
Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys
290 295 300
Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp
305 310 315 320
Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu
325 330 335
Gln Gln Phe Asn Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu
340 345 350
His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His
355 360 365
Ile Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly
370 375 380
Arg Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu
385 390 395 400
Leu Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe
405 410 415
Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu
420 425 430
Pro Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly
435 440 445
Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln
450 455 460
Gln Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr Leu Gln Asn
465 470 475 480
His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
485 490
<210> 16
<211> 497
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-HCB Fusion Polypeptide
<400> 16
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro
260 265 270
Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val
275 280 285
Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asp Pro Glu
305 310 315 320
Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met Gln Thr Ala Lys
325 330 335
Thr Gln Pro Arg Glu Glu Gln Phe Asn Gly Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly Lys Gln Phe Thr
355 360 365
Cys Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Arg Thr Ile
370 375 380
Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro
385 390 395 400
Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser Leu Thr Cys Leu
405 410 415
Ile Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn
420 425 430
Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro Gln Leu
435 440 445
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
450 455 460
Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser His Ser Pro Gly
485 490 495
Lys
<210> 17
<211> 495
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-HCC Fusion Polypeptide
<400> 17
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn
260 265 270
Cys Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile
275 280 285
Phe Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala Arg Thr Pro Thr
290 295 300
Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asn Pro Glu Val Gln
305 310 315 320
Ile Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr Ala Asn Thr Gln
325 330 335
Pro Arg Glu Glu Gln Ser Asn Gly Thr Tyr Arg Val Val Ser Val Leu
340 345 350
Pro Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys Cys Lys
355 360 365
Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Glu Ile Ile Ser Lys
370 375 380
Thr Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val Leu Pro Pro Ser
385 390 395 400
Arg Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr Cys Leu Val Lys
405 410 415
Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln
420 425 430
Gln Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu Asp Glu
435 440 445
Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg
450 455 460
Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser Pro Gly Lys
485 490 495
<210> 18
<211> 493
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-HCD Fusion Polypeptide
<400> 18
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser Pro Cys
260 265 270
Pro Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro
275 280 285
Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys
290 295 300
Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp
305 310 315 320
Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu
325 330 335
Gln Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu
340 345 350
His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His
355 360 365
Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly
370 375 380
Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu
385 390 395 400
Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe
405 410 415
Tyr Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu
420 425 430
Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly
435 440 445
Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln
450 455 460
Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn
465 470 475 480
His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
485 490
<210> 19
<211> 493
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-aglycosyl HCA Fc Fusion Polypeptide
<400> 19
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Phe Asn Glu Cys Arg Cys Thr Asp Thr Pro Pro Cys
260 265 270
Pro Val Pro Glu Pro Leu Gly Gly Pro Ser Val Leu Ile Phe Pro Pro
275 280 285
Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Val Thr Cys
290 295 300
Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp
305 310 315 320
Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Ser Arg Glu
325 330 335
Gln Gln Phe Ala Gly Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu
340 345 350
His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His
355 360 365
Ile Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly
370 375 380
Arg Ala His Lys Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu
385 390 395 400
Leu Ser Ser Ser Asp Thr Val Ser Ile Thr Cys Leu Ile Lys Asp Phe
405 410 415
Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Gln Glu
420 425 430
Pro Glu Arg Lys His Arg Met Thr Pro Pro Gln Leu Asp Glu Asp Gly
435 440 445
Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln
450 455 460
Gln Gly Asp Pro Phe Thr Cys Ala Val Met His Glu Thr Leu Gln Asn
465 470 475 480
His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
485 490
<210> 20
<211> 497
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-aglycosyl HCB Fc Fusion Polypeptide
<400> 20
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Pro Lys Arg Glu Asn Gly Arg Val Pro Arg Pro Pro
260 265 270
Asp Cys Pro Lys Cys Pro Ala Pro Glu Met Leu Gly Gly Pro Ser Val
275 280 285
Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Leu Ile Ala Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asp Pro Glu
305 310 315 320
Val Gln Ile Ser Trp Phe Val Asp Gly Lys Gln Met Gln Thr Ala Lys
325 330 335
Thr Gln Pro Arg Glu Glu Gln Phe Ala Gly Thr Tyr Arg Val Val Ser
340 345 350
Val Leu Pro Ile Gly His Gln Asp Trp Leu Lys Gly Lys Gln Phe Thr
355 360 365
Cys Lys Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Arg Thr Ile
370 375 380
Ser Lys Ala Arg Gly Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro
385 390 395 400
Pro Ser Arg Glu Glu Leu Ser Lys Asn Thr Val Ser Leu Thr Cys Leu
405 410 415
Ile Lys Asp Phe Tyr Pro Pro Asp Ile Asp Val Glu Trp Gln Ser Asn
420 425 430
Gly Gln Gln Glu Pro Glu Ser Lys Tyr Arg Thr Thr Pro Pro Gln Leu
435 440 445
Asp Glu Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys
450 455 460
Ser Arg Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Glu Ser Leu Ser His Ser Pro Gly
485 490 495
Lys
<210> 21
<211> 495
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-aglycosyl HCC Fc Fusion Polypeptide
<400> 21
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Ala Lys Glu Cys Glu Cys Lys Cys Asn Cys Asn Asn
260 265 270
Cys Pro Cys Pro Gly Cys Gly Leu Leu Gly Gly Pro Ser Val Phe Ile
275 280 285
Phe Pro Pro Lys Pro Lys Asp Ile Leu Val Thr Ala Arg Thr Pro Thr
290 295 300
Val Thr Cys Val Val Val Asp Leu Asp Pro Glu Asn Pro Glu Val Gln
305 310 315 320
Ile Ser Trp Phe Val Asp Ser Lys Gln Val Gln Thr Ala Asn Thr Gln
325 330 335
Pro Arg Glu Glu Gln Ser Ala Gly Thr Tyr Arg Val Val Ser Val Leu
340 345 350
Pro Ile Gly His Gln Asp Trp Leu Ser Gly Lys Gln Phe Lys Cys Lys
355 360 365
Val Asn Asn Lys Ala Leu Pro Ser Pro Ile Glu Glu Ile Ile Ser Lys
370 375 380
Thr Pro Gly Gln Ala His Gln Pro Asn Val Tyr Val Leu Pro Pro Ser
385 390 395 400
Arg Asp Glu Met Ser Lys Asn Thr Val Thr Leu Thr Cys Leu Val Lys
405 410 415
Asp Phe Phe Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln
420 425 430
Gln Glu Pro Glu Ser Lys Tyr Arg Met Thr Pro Pro Gln Leu Asp Glu
435 440 445
Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg
450 455 460
Trp Gln Arg Gly Asp Thr Phe Ile Cys Ala Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Ile Ser Leu Ser His Ser Pro Gly Lys
485 490 495
<210> 22
<211> 493
<212> PRT
<213> Artificial Sequence
<220>
<223> caTNFrecp80-aglycosyl HCD Fc Fusion Polypeptide
<400> 22
Met Ala Pro Ala Ala Leu Trp Ala Leu Leu Ala Ala Gly Leu Gln Leu
1 5 10 15
Trp Gly Ala Gly Arg Ala Val Pro Gly Gln Ala Thr Gln Leu Pro Tyr
20 25 30
Val Pro Asp Pro Glu Leu Gly Ser Ser Cys Gln Gln Ser Glu Tyr Phe
35 40 45
Asp Gln Arg Thr Gln Met Cys Cys Ser Met Cys Pro Pro Gly Ser His
50 55 60
Ala Arg Leu Phe Cys Thr Lys Thr Ser Asn Thr Val Cys Ala Arg Cys
65 70 75 80
Glu Asn Ser Thr Tyr Thr Gln Leu Trp Asn Trp Val Pro Glu Cys Leu
85 90 95
Ser Cys Gly Ser Arg Cys Gly Ala Asp Gln Val Glu Thr Gln Ala Cys
100 105 110
Thr Arg Glu Gln Asn Arg Ile Cys Ser Cys Lys Ser Gly Trp Tyr Cys
115 120 125
Thr Leu Arg Arg Gln Gly Gly Cys Arg Leu Cys Ala Pro Leu Arg Arg
130 135 140
Cys Arg Pro Gly Phe Gly Val Ala Lys Pro Gly Thr Ala Thr Ser Asp
145 150 155 160
Val Val Cys Ala Pro Cys Ala Pro Gly Thr Phe Ser Asn Thr Thr Ser
165 170 175
Ser Thr Asp Thr Cys Arg Pro His Arg Ile Cys Ser Ser Val Ala Val
180 185 190
Pro Gly Asn Ala Ser Val Asp Ala Val Cys Ser Pro Ala Pro Pro Thr
195 200 205
Val Arg Thr Ala Pro Arg Pro Ala Ser Thr Arg Gln Pro Gly Ser Thr
210 215 220
Gln Pro Arg Pro Ala Glu Pro Thr Pro Gly Pro Ser Thr Pro Pro Arg
225 230 235 240
Thr Ser Val Leu Phe Pro Ala Val Pro Ser Pro Pro Ala Glu Gly Leu
245 250 255
Ser Thr Gly Asp Pro Lys Glu Ser Thr Cys Lys Cys Ile Ser Pro Cys
260 265 270
Pro Val Pro Glu Ser Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro
275 280 285
Lys Pro Lys Asp Ile Leu Arg Ile Thr Arg Thr Pro Glu Ile Thr Cys
290 295 300
Val Val Leu Asp Leu Gly Arg Glu Asp Pro Glu Val Gln Ile Ser Trp
305 310 315 320
Phe Val Asp Gly Lys Glu Val His Thr Ala Lys Thr Gln Pro Arg Glu
325 330 335
Gln Gln Phe Ala Ser Thr Tyr Arg Val Val Ser Val Leu Pro Ile Glu
340 345 350
His Gln Asp Trp Leu Thr Gly Lys Glu Phe Lys Cys Arg Val Asn His
355 360 365
Ile Gly Leu Pro Ser Pro Ile Glu Arg Thr Ile Ser Lys Ala Arg Gly
370 375 380
Gln Ala His Gln Pro Ser Val Tyr Val Leu Pro Pro Ser Pro Lys Glu
385 390 395 400
Leu Ser Ser Ser Asp Thr Val Thr Leu Thr Cys Leu Ile Lys Asp Phe
405 410 415
Tyr Pro Pro Glu Ile Asp Val Glu Trp Gln Ser Asn Gly Gln Pro Glu
420 425 430
Pro Glu Ser Lys Tyr His Thr Thr Ala Pro Gln Leu Asp Glu Asp Gly
435 440 445
Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Lys Ser Arg Trp Gln
450 455 460
Gln Gly Asp Thr Phe Thr Cys Ala Val Met His Glu Ala Leu Gln Asn
465 470 475 480
His Tyr Thr Asp Leu Ser Leu Ser His Ser Pro Gly Lys
485 490
<210> 23
<211> 633
<212> DNA
<213> Canis familiaris
<400> 23
atgggcctgc ccaccgtgcc tggactgctg ctgcctctgg tgctgctggc cctgctgctg 60
gaaatctacc ccatcagcgt gaccgccctg gtgccccacc cccggaacag agtgaagcgg 120
gccatcctgt gtccacaggg caagtacatc caccctcagg acgacagcat ctgctgcacc 180
aagtgccaca agggcaccta cctgtacaac gactgccccg gacccggcct ggacaccgat 240
tgcagagagt gcgagaacgg caccttcacc gccagcgaga accacctgag acagtgcctg 300
tcctgcagca agtgcagaaa agagatgaac caggtcgaga tcagcccctg caccgtgtac 360
cgggacaccg tgtgcggctg ccggaagaac cagtacagat tctattggag cgagacactg 420
ttccagtgca acaactgcag cctgtgcctg aatggcaccg tgcagatcag ctgccaggaa 480
aagcagaaca ccatctgcac ctgtcacgcc ggattctttc tgcgcgagca cgagtgcgtg 540
tcctgtgtga actgcaagaa aaacaccgag tgtggcaagc tgtgcctgcc ccctgtggaa 600
accgtgaaag tgcctcagga ccctggcagc aca 633
<210> 24
<211> 702
<212> DNA
<213> Canis familiaris
<400> 24
ttcaacgagt gccggtgtac cgacaccccc ccttgtcctg tgcctgagcc tctgggcgga 60
ccctccgtgc tgatcttccc acccaagccc aaggacatcc tgcggatcac ccggaccccc 120
gaagtgacct gcgtggtgct ggatctgggc cgcgaggacc ctgaggtgca gatcagttgg 180
ttcgtggacg gcaaagaggt gcacaccgct aagacccaga gcagagagca gcagttcaac 240
ggcacctaca gagtggtgtc cgtgctgccc atcgagcacc aggactggct gaccggcaaa 300
gagttcaagt gcagagtcaa ccacatcgac ctgcctagcc ctatcgagcg gaccatcagc 360
aaggccagag gcagagccca caagcccagc gtgtacgtgc tcccacccag ccccaaagag 420
ctgagcagca gcgacaccgt gtccatcacc tgtctgatca aggacttcta cccccccgac 480
atcgacgtgg aatggcagag caacggacag caggaacccg agcggaagca cagaatgacc 540
cccccacagc tggacgagga cggcagctac ttcctgtaca gcaagctgag cgtggacaag 600
agccggtggc agcagggcga ccccttcaca tgtgccgtga tgcacgagac actgcagaac 660
cactacaccg acctgtctct gagccacagc cccggcaagt ga 702
<210> 25
<211> 714
<212> DNA
<213> Canis familiaris
<400> 25
cccaagcgcg agaacggcag agtgcccaga ccccccgact gccctaagtg tcccgcccct 60
gagatgctgg gcggaccctc cgtgttcatc ttcccaccca agcccaagga caccctgctg 120
atcgcccgga cccccgaagt gacctgcgtg gtggtggacc tggaccccga ggaccctgag 180
gtgcagatca gttggttcgt ggacggcaag cagatgcaga ccgccaagac ccagcccaga 240
gaggaacagt tcaacggcac ctaccgggtg gtgtccgtcc tgcctatcgg ccaccaggac 300
tggctgaagg gcaagcagtt tacctgcaaa gtgaacaaca aggccctgcc tagccccatc 360
gagcggacca tcagcaaggc cagaggccag gcccaccagc ccagcgtgta cgtgctgccc 420
cccagccggg aagaactgag caagaatacc gtgtccctga cctgcctgat caaggacttc 480
tacccccccg acatcgacgt ggaatggcag agcaacggcc agcaggaacc cgagagcaag 540
taccggacca cccccccaca gctggacgag gacggcagct acttcctgta cagcaagctg 600
agcgtggaca agagccggtg gcagcggggc gacaccttca tctgcgccgt gatgcacgag 660
gccctgcaca accactacac ccaggaaagc ctgtctcaca gccccggcaa gtga 714
<210> 26
<211> 708
<212> DNA
<213> Canis familiaris
<400> 26
gctaaagaat gcgagtgcaa gtgcaactgc aacaactgcc cctgtcctgg ctgcggactg 60
ctgggaggac ctagcgtgtt catcttccca cccaagccca aggacatcct ggtcaccgcc 120
cggaccccca ccgtgacatg cgtggtggtg gacctggacc ccgagaaccc cgaggtgcag 180
atcagttggt tcgtggacag caaacaggtg cagaccgcca acacccagcc cagagaggaa 240
cagagcaacg gcacctacag agtggtgtct gtgctgccta tcggccacca ggactggctg 300
agcggcaagc agttcaagtg caaagtgaac aacaaggccc tgcctagccc catcgaggaa 360
atcatcagca agacccctgg acaggcccac cagcctaacg tgtacgtcct gcctcccagc 420
cgggacgaga tgtccaagaa caccgtgacc ctgacttgcc tggtcaagga cttcttcccc 480
cccgaaatcg acgtggaatg gcagtccaac ggccagcagg aacccgagag caagtaccgg 540
atgacccccc cacagctgga cgaggacggc agctacttcc tgtacagcaa gctgagcgtg 600
gacaagagcc ggtggcagcg gggcgacacc ttcatctgcg ccgtgatgca cgaggccctg 660
cacaaccact acacccagat cagcctgagc cacagccccg gcaagtga 708
<210> 27
<211> 702
<212> DNA
<213> Canis familiaris
<400> 27
cccaaagaaa gcacatgcaa gtgcatcagc ccctgtcccg tgcctgagtc tctgggaggc 60
ccttccgtgt tcatcttccc acccaagccc aaggacatcc tgcggatcac ccggaccccc 120
gagatcacct gtgtggtgct ggacctgggc cgcgaggacc ctgaggtgca gatcagttgg 180
ttcgtggacg gcaaagaggt gcacaccgct aagacccagc ccagagagca gcagttcaac 240
agcacctacc gggtggtgtc cgtcctgccc atcgagcacc aggactggct gaccggcaaa 300
gagttcaagt gcagagtcaa ccacatcggc ctgcccagcc ctatcgagcg gaccatcagc 360
aaggccagag gccaggccca ccagcccagc gtgtacgtgc tgccacctag ccccaaagag 420
ctgagcagca gcgacaccgt gaccctgacc tgcctgatca aggacttcta cccccccgaa 480
atcgacgtgg aatggcagag caacggacag cctgagcccg agagcaagta ccacaccaca 540
gccccccagc tggacgagga cggcagctac ttcctgtaca gcaagctgag cgtggacaag 600
agccggtggc agcagggcga caccttcaca tgtgccgtga tgcacgaggc cctgcagaac 660
cactacaccg acctgagcct gagccacagc cccggcaagt ga 702
<210> 28
<211> 1335
<212> DNA
<213> Artificial Sequence
<220>
<223> caTNFRp60-HCA - nucleotide sequence encoding SEQ ID NO:6
<400> 28
atgggcctgc ccaccgtgcc tggactgctg ctgcctctgg tgctgctggc cctgctgctg 60
gaaatctacc ccatcagcgt gaccgccctg gtgccccacc cccggaacag agtgaagcgg 120
gccatcctgt gtccacaggg caagtacatc caccctcagg acgacagcat ctgctgcacc 180
aagtgccaca agggcaccta cctgtacaac gactgccccg gacccggcct ggacaccgat 240
tgcagagagt gcgagaacgg caccttcacc gccagcgaga accacctgag acagtgcctg 300
tcctgcagca agtgcagaaa agagatgaac caggtcgaga tcagcccctg caccgtgtac 360
cgggacaccg tgtgcggctg ccggaagaac cagtacagat tctattggag cgagacactg 420
ttccagtgca acaactgcag cctgtgcctg aatggcaccg tgcagatcag ctgccaggaa 480
aagcagaaca ccatctgcac ctgtcacgcc ggattctttc tgcgcgagca cgagtgcgtg 540
tcctgtgtga actgcaagaa aaacaccgag tgtggcaagc tgtgcctgcc ccctgtggaa 600
accgtgaaag tgcctcagga ccctggcagc acattcaacg agtgccggtg taccgacacc 660
cccccttgtc ctgtgcctga gcctctgggc ggaccctccg tgctgatctt cccacccaag 720
cccaaggaca tcctgcggat cacccggacc cccgaagtga cctgcgtggt gctggatctg 780
ggccgcgagg accctgaggt gcagatcagt tggttcgtgg acggcaaaga ggtgcacacc 840
gctaagaccc agagcagaga gcagcagttc aacggcacct acagagtggt gtccgtgctg 900
cccatcgagc accaggactg gctgaccggc aaagagttca agtgcagagt caaccacatc 960
gacctgccta gccctatcga gcggaccatc agcaaggcca gaggcagagc ccacaagccc 1020
agcgtgtacg tgctcccacc cagccccaaa gagctgagca gcagcgacac cgtgtccatc 1080
acctgtctga tcaaggactt ctaccccccc gacatcgacg tggaatggca gagcaacgga 1140
cagcaggaac ccgagcggaa gcacagaatg acccccccac agctggacga ggacggcagc 1200
tacttcctgt acagcaagct gagcgtggac aagagccggt ggcagcaggg cgaccccttc 1260
acatgtgccg tgatgcacga gacactgcag aaccactaca ccgacctgtc tctgagccac 1320
agccccggca agtga 1335
<210> 29
<211> 1347
<212> DNA
<213> Artificial Sequence
<220>
<223> caTNFRp60-HCB - nucleotide sequence encoding SEQ ID NO:7
<400> 29
atgggcctgc ccaccgtgcc tggactgctg ctgcctctgg tgctgctggc cctgctgctg 60
gaaatctacc ccatcagcgt gaccgccctg gtgccccacc cccggaacag agtgaagcgg 120
gccatcctgt gtccacaggg caagtacatc caccctcagg acgacagcat ctgctgcacc 180
aagtgccaca agggcaccta cctgtacaac gactgccccg gacccggcct ggacaccgat 240
tgcagagagt gcgagaacgg caccttcacc gccagcgaga accacctgag acagtgcctg 300
tcctgcagca agtgcagaaa agagatgaac caggtcgaga tctctccctg caccgtgtac 360
cgggacaccg tgtgcggctg ccggaagaac cagtacagat tctattggag cgagacactg 420
ttccagtgca acaactgcag cctgtgcctg aatggcaccg tgcagatcag ctgccaggaa 480
aagcagaaca ccatctgcac ctgtcacgcc ggattctttc tgcgcgagca cgagtgcgtg 540
tcctgtgtga actgcaagaa aaacaccgag tgtggcaagc tgtgcctgcc ccctgtggaa 600
accgtgaaag tgcctcagga ccccggcagc acacccaagc gcgagaacgg cagagtgccc 660
agaccccccg actgccctaa gtgtcccgcc cctgagatgc tgggcggacc ctccgtgttc 720
atcttcccac ccaagcccaa ggacaccctg ctgatcgccc ggacccccga agtgacctgc 780
gtggtggtgg acctggaccc cgaggaccct gaggtgcaga tcagttggtt cgtggacggc 840
aagcagatgc agaccgccaa gacccagccc agagaggaac agttcaacgg cacctaccgg 900
gtggtgtccg tcctgcctat cggccaccag gactggctga agggcaagca gtttacctgc 960
aaagtgaaca acaaggccct gcctagcccc atcgagcgga ccatcagcaa ggccagaggc 1020
caggcccacc agcccagcgt gtacgtgctg ccccccagcc gggaagaact gagcaagaat 1080
accgtgtccc tgacctgcct gatcaaggac ttctaccccc ccgacatcga cgtggaatgg 1140
cagagcaacg gccagcagga acccgagagc aagtaccgga ccaccccccc acagctggac 1200
gaggacggca gctacttcct gtacagcaag ctgagcgtgg acaagagccg gtggcagcgg 1260
ggcgacacct tcatctgcgc cgtgatgcac gaggccctgc acaaccacta cacccaggaa 1320
agcctgtctc acagccccgg caagtga 1347
<210> 30
<211> 1341
<212> DNA
<213> Artificial Sequence
<220>
<223> caTNFRp60-HCC - nucleotide sequence encoding SEQ ID NO:8
<400> 30
atgggcctgc ccaccgtgcc tggactgctg ctgcctctgg tgctgctggc cctgctgctg 60
gaaatctacc ccatcagcgt gaccgccctg gtgccccacc cccggaacag agtgaagcgg 120
gccatcctgt gtccacaggg caagtacatc caccctcagg acgacagcat ctgctgcacc 180
aagtgccaca agggcaccta cctgtacaac gactgccccg gacccggcct ggacaccgat 240
tgcagagagt gcgagaacgg caccttcacc gccagcgaga accacctgag acagtgcctg 300
tcctgcagca agtgcagaaa agagatgaac caggtcgaga tcagcccctg caccgtgtac 360
cgggacaccg tgtgcggctg ccggaagaac cagtacagat tctattggag cgagacactg 420
ttccagtgca acaactgcag cctgtgcctg aatggcaccg tgcagatcag ctgccaggaa 480
aagcagaaca ccatctgcac ctgtcacgcc ggattctttc tgcgcgagca cgagtgcgtg 540
tcctgtgtga actgcaagaa aaacaccgag tgtggcaagc tgtgcctgcc ccctgtggaa 600
accgtgaaag tgcctcagga ccccggcagc acagctaaag aatgcgagtg caagtgcaac 660
tgcaacaact gcccctgtcc tggctgcgga ctgctgggag gacctagcgt gttcatcttc 720
ccacccaagc ccaaggacat cctggtcacc gcccggaccc ccaccgtgac atgcgtggtg 780
gtggacctgg accccgagaa ccccgaggtg cagatcagtt ggttcgtgga cagcaaacag 840
gtgcagaccg ccaacaccca gcccagagag gaacagagca acggcaccta cagagtggtg 900
tctgtgctgc ctatcggcca ccaggactgg ctgagcggca agcagttcaa gtgcaaagtg 960
aacaacaagg ccctgcctag ccccatcgag gaaatcatca gcaagacccc tggacaggcc 1020
caccagccta acgtgtacgt cctgcctccc agccgggacg agatgtccaa gaacaccgtg 1080
accctgactt gcctggtcaa ggacttcttc ccccccgaaa tcgacgtgga atggcagtcc 1140
aacggccagc aggaacccga gagcaagtac cggatgaccc ccccacagct ggacgaggac 1200
ggcagctact tcctgtacag caagctgagc gtggacaaga gccggtggca gcggggcgac 1260
accttcatct gcgccgtgat gcacgaggcc ctgcacaacc actacaccca gatcagcctg 1320
agccacagcc ccggcaagtg a 1341
<210> 31
<211> 1335
<212> DNA
<213> Artificial Sequence
<220>
<223> caTNFRp60-HCD - nucleotide sequence encoding SEQ ID NO:9
<400> 31
atgggcctgc ccaccgtgcc tggactgctg ctgcctctgg tgctgctggc cctgctgctg 60
gaaatctacc ccatcagcgt gaccgccctg gtgccccacc cccggaacag agtgaagcgg 120
gccatcctgt gtccacaggg caagtacatc caccctcagg acgacagcat ctgctgcacc 180
aagtgccaca agggcaccta cctgtacaac gactgccccg gacccggcct ggacaccgat 240
tgcagagagt gcgagaacgg caccttcacc gccagcgaga accacctgag acagtgcctg 300
tcctgcagca agtgcagaaa agagatgaac caggtcgaga tcagcccttg caccgtgtac 360
cgggacaccg tgtgcggctg ccggaagaac cagtacagat tctattggag cgagacactg 420
ttccagtgca acaactgcag cctgtgcctg aatggcaccg tgcagatcag ctgccaggaa 480
aagcagaaca ccatctgcac ctgtcacgcc ggattctttc tgcgcgagca cgagtgcgtg 540
tcctgtgtga actgcaagaa aaacaccgag tgtggcaagc tgtgcctgcc ccctgtggaa 600
accgtgaaag tgccccagga ccccggcagc acacccaaag aaagcacatg caagtgcatc 660
agcccctgtc ccgtgcctga gtctctggga ggcccttccg tgttcatctt cccacccaag 720
cccaaggaca tcctgcggat cacccggacc cccgagatca cctgtgtggt gctggacctg 780
ggccgcgagg accctgaggt gcagatcagt tggttcgtgg acggcaaaga ggtgcacacc 840
gctaagaccc agcccagaga gcagcagttc aacagcacct accgggtggt gtccgtcctg 900
cccatcgagc accaggactg gctgaccggc aaagagttca agtgcagagt caaccacatc 960
ggcctgccca gccctatcga gcggaccatc agcaaggcca gaggccaggc ccaccagccc 1020
agcgtgtacg tgctgccacc tagccccaaa gagctgagca gcagcgacac cgtgaccctg 1080
acctgcctga tcaaggactt ctaccccccc gaaatcgacg tggaatggca gagcaacgga 1140
cagcctgagc ccgagagcaa gtaccacacc acagcccccc agctggacga ggacggcagc 1200
tacttcctgt acagcaagct gagcgtggac aagagccggt ggcagcaggg cgacaccttc 1260
acatgtgccg tgatgcacga ggccctgcag aaccactaca ccgacctgag cctgagccac 1320
agccccggca agtga 1335
Claims (56)
- 개 IgG 면역글로불린 중쇄의 Fc 부위, 또는 이의 단편을 포함하는 폴리펩타이드에 결합되는 개 TNF 수용체 폴리펩타이드의 세포외 도메인, 또는 상기 세포외 도메인의 TNF 결합 단편을 포함하는 키메릭 융합 폴리펩타이드로, 상기 Fc 부위의 단편은 최소 CH2 및 CH3 불변 도메인들을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제1항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p80 또는 이의 TNF 결합 단편을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제2항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 서열번호 14 또는 상기 서열에 대해 최소 95% 서열 동일성을 가지는 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제1항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p60 또는 이의 TNF 결합 단편을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제4항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 서열번호 1 또는 상기 서열에 대해 최소 95% 서열 동일성을 가지는 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제1항 내지 제5항 중 어느 하나의 항에 있어서, 상기 Fc 부위는 경첩 부위(hinge region), CH2 불변 도메인 및 CH3 불변 도메인을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제1항 내지 제6항 중 어느 하나의 항에 있어서, 상기 Fc 부위는 서브타입 A, 서브타입 B, 서브타입 C 및 서브타입 D로 구성된 군으로부터 선택되는 IgG 서브타입을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제7항에 있어서, 상기 Fc 부위는 서열번호 2, 서열번호 3, 서열번호 4 및 서열번호 5로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 선행하는 항 중 어느 하나의 항에 있어서, 상기 키메릭 융합 폴리펩타이드는 상기 개 TNF 수용체 폴리펩타이드와 상기 Fc 부위를 포함하는 상기 폴리펩타이드 사이에 기능적으로 삽입되는 링커 펩타이드를 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제5항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제5항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제3항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제3항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 선행하는 항 중 어느 하나의 항에 있어서, 상기 키메릭 융합 폴리펩타이드는 1×10-8 또는 미만의 평형-해리 상수(equilibrium-dissociation constant, KD)를 가지는 결합 친화도로 개 TNF-알파와 결합하는 것인 키메릭 융합 폴리펩타이드.
- 서열번호 14 또는 상기 서열에 대해 최소 95% 서열 상동성을 가지는 서열을 포함하는 분리된 폴리펩타이드.
- 제15항의 폴리펩타이드를 인코딩하는 분리된 폴리뉴클레오타이드.
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 키메릭 융합 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드.
- 제17항의 폴리뉴클레오타이드를 포함하는 재조합 벡터.
- 제18항에 있어서, 상기 벡터는 발현 프로모터에 인접하고 이의 조절 하에 배치되거나, 또는 발현 프로모터에 작동적으로 결합되어 있는 것인 재조합 벡터.
- 제1항 내지 제14항 중 어느 하나의 항의 키메릭 융합 폴리펩타이드 또는 제17항에 따른 폴리뉴클레오타이드 및 약제학적으로 허용가능한 담체 또는 부형제를 포함하는 약제학적 조성물.
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 및 약제학적으로 허용가능한 담체 또는 부형제를 포함하는 약제학적 조성물.
- 제20항 또는 제21항에 있어서, 상기 약제학적 조성물은 최소 하나의 추가적인 TNF 길항제 화합물 및/또는 항-염증 화합물을 포함하는 것인 약제학적 조성물.
- 제22항에 있어서, 상기 TNF 길항제 화합물은 메토트렉세이트(methotrexate)인 것인 약제학적 조성물.
- 의약품(medicament)으로서 사용하기 위한 제1항 내지 제14항 중 어느 하나의 항에 따른 키메릭 융합 폴리펩타이드, 제17항에 따른 폴리뉴클레오타이드, 제18항 또는 제19항에 따른 벡터 또는 제20항 내지 제23항 중 어느 하나의 항에 따른 약제학적 조성물.
- TNF 발현에 의해 매개되는 개의 상태(condition)의 치료 또는 예방에 사용하기 위한 제1항 내지 제14항 중 어느 하나의 항에 따른 키메릭 융합 폴리펩타이드, 제17항에 따른 폴리뉴클레오타이드, 제18항 또는 제19항에 따른 벡터 또는 제20항 내지 제23항 중 어느 하나의 항에 따른 약제학적 조성물.
- 제25항의 용도를 위한 제25항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염(polyarthritidies), 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크(shock), 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 키메릭 융합 폴리펩타이드.
- TNF 발현에 의해 매개되는 개의 상태의 치료 또는 예방을 위한 의약품의 제조에서 제1항 내지 제14항 중 어느 하나의 항에 따른 키메릭 융합 폴리펩타이드, 제17항에 따른 폴리뉴클레오타이드, 제18항 또는 제19항에 따른 벡터 또는 제20항 내지 제23항 중 어느 하나의 항에 따른 약제학적 조성물의 용도.
- 제27항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염, 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크, 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 용도.
- 제1항 내지 제14항 중 어느 하나의 항에 따른 키메릭 융합 폴리펩타이드, 제17항에 따른 폴리뉴클레오타이드, 제18항 또는 제19항에 따른 벡터 또는 제20항 내지 제23항 중 어느 하나의 항에 따른 약제학적 조성물을 개에게 투여하는 단계를 포함하는 TNF 발현에 의해 매개되는 상태를 상기 개에서 치료 또는 예방하는 방법.
- 제29항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염, 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크, 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 방법.
- 제29항 또는 제30항에 있어서, 상기 방법은 최소 하나의 추가적인 약제학적 조성물을 투여하는 단계를 추가적으로 포함하는 것인 방법.
- 제31항에 있어서, 상기 추가적인 약제학적 조성물은 TNF 길항제, 항-염증 화합물, 메토트렉세이트, 개 TNF에 대한 키메릭 또는 개화된(caninised) 항체, 항-개 TNF 항체 단편, 최소 하나의 진통제, 사이토카인 저해 항-염증 약물인 화합물, NSAID, 오피오이드(opioid), 코르티코스테로이드, 스테로이드 및 신경성장인자의 길항제로 구성된 군으로부터 선택되는 약물을 포함하는 것인 방법.
- 의약품으로 사용하기 위한 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 아미노산 서열을 인코딩하는 폴리뉴클레오타이드.
- TNF 발현에 의해 매개되는 개 상태의 치료 또는 예방에 사용하기 위한 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 아미노산 서열을 인코딩하는 폴리뉴클레오타이드.
- 제34항의 용도를 위한 제34항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염, 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크, 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 키메릭 융합 폴리펩타이드.
- TNF 발현에 의해 매개되는 개 상태의 치료 및/또는 예방을 위한 의약품의 제조에서 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 아미노산 서열을 인코딩하는 폴리뉴클레오타이드의 용도.
- 제36항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염, 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크, 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 키메릭 융합 폴리펩타이드의 용도.
- TNF 발현에 의해 매개되는 상태를 개에서 치료 또는 예방하는 방법으로, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 아미노산 서열을 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 치료학적으로 효과적인 양으로 상기 개에 투여하는 단계
를 포함하는 것인 방법. - 제38항에 있어서, TNF 발현에 의해 매개되는 상기 상태는 염증 매개된 상태, 만성 염증 질병, 면역 매개된 다발성 관절염, 류마티스 관절염, 골관절염, 다발성 관절염, 소아기 특발성 관절염 및 건선성 관절염 같은 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선, 전신성 혈관염, 아토피성 피부염, 울혈성 심부전, 난치성 포도막염, 기관지성 천식, 알러지성 상태들, 폐혈증, 쇼크, 당뇨병, 및 알쯔하이머병, 파킨슨병, 뇌졸중 및 근위축성 측색경화증 같은 신경-퇴행성 상태들로 구성된 군으로부터 선택되는 것인 방법.
- 제38항 또는 제39항에 있어서, 상기 방법은 최소 하나의 추가적인 약제학적 조성물을 투여하는 단계를 추가적으로 포함하는 것인 방법.
- 제40항에 있어서, 상기 추가적인 약제학적 조성물은 TNF 길항제, 항-염증 화합물, 메토트렉세이트, 개 TNF에 대한 키메릭 또는 개화된 항체, 항-개 TNF 항체 단편, 최소 하나의 진통제, 사이토카인 저해 항-염증 약물인 화합물, NSAID, 오피오이드, 코르티코스테로이드, 스테로이드 및 신경성장인자의 길항제로 구성된 군으로부터 선택되는 약물을 포함하는 것인 방법.
- 개에서 종양괴사인자 레벨을 감소시키는 방법으로, 상기 방법은:
- 서열번호 6, 서열번호 7, 서열번호 8, 서열번호 9, 서열번호 10, 서열번호 11, 서열번호 12, 서열번호 13, 서열번호 15, 서열번호 16, 서열번호 17, 서열번호 18, 서열번호 19, 서열번호 20, 서열번호 21, 서열번호 22 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 서열로 구성된 군으로부터 선택되는 아미노산 서열을 가지는 키메릭 융합 폴리펩타이드, 또는 상기 아미노산 서열을 인코딩하는 폴리뉴클레오타이드를 포함하는 벡터를 치료학적으로 유효한 양으로 상기 개에 투여하는 단계
를 포함하는 것인 방법. - 제42항에 있어서, 상기 방법은 최소 하나의 추가적인 약제학적 조성물을 투여하는 단계를 추가적으로 포함하는 것인 방법.
- 제43항에 있어서, 상기 추가적인 약제학적 조성물은 TNF 길항제, 항-염증 화합물, 메토트렉세이트, 개 TNF에 대한 키메릭 또는 개화된 항체, 항-개 TNF 항체 단편, 최소 하나의 진통제, 사이토카인 저해 항-염증 약물인 화합물, NSAID, 오피오이드, 코르티코스테로이드, 스테로이드 및 신경성장인자의 길항제로 구성된 군으로부터 선택되는 약물을 포함하는 것인 방법.
- 제1항 내지 제14항 중 어느 하나의 항에 따른 키메릭 융합 폴리펩타이드를 생산하는 방법으로, 상기 방법은:
(i) 제1항 내지 제14항 중 어느 하나의 항의 키메릭 융합 폴리펩타이드를 인코딩하는 폴리펩타이드를 발현할 수 있는 벡터를 포함하는 재조합 숙주세포를 제공하는 단계;
(ii) 상기 키메릭 융합 폴리펩타이드의 발현에 적합한 조건 하에서 상기 재조합 숙주세포를 배양하는 단계, 및
(iii) 상기 키메릭 융합 폴리펩타이드를 회수하는 단계
를 포함하는 것인 방법. - 개 IgG 면역글로불린 타입 B 중쇄의 Fc 부위, 또는 최소 CH2 및 CH3 불변 도메인들을 포함하는 이의 단편을 포함하는 폴리펩타이드에 결합되는 개 TNF 수용체 폴리펩타이드의 세포외 도메인, 또는 상기 세포외 도메인의 TNF 결합 단편을 포함하는 키메릭 융합 폴리펩타이드의 다이머 형태를 정제하는 방법으로, 상기 방법은 상기 키메릭 융합 폴리펩타이드의 다이머 형태를 pH 4.7 내지 5.3에서 단백질 A로부터 용출시키는 단계를 포함하는 것인 방법.
- 제46항에 있어서, 상기 키메릭 융합 폴리펩타이드의 다이머 형태는 pH 4.8 내지 5.2에서 단백질 A로부터 용출되는 것인 방법.
- 제47항에 있어서, 상기 키메릭 융합 폴리펩타이드의 다이머 형태는 pH 4.9 내지 5.1에서 단백질 A로부터 용출되는 것인 방법.
- 제48항에 있어서, 상기 키메릭 융합 폴리펩타이드의 다이머 형태는 pH 5.0에서 단백질 A로부터 용출되는 것인 방법.
- 제46항 내지 제49항 중 어느 하나의 항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p80 또는 이의 TNF 결합 단편을 포함하는 것인 방법.
- 제50항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 서열번호 14 또는 상기 서열에 대해 최소 95% 서열 동일성을 가지는 서열을 포함하는 것인 방법.
- 제46항 내지 제49항 중 어느 하나의 항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 개 TNF 수용체 폴리펩타이드 p60 또는 이의 TNF 결합 단편을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제52항에 있어서, 상기 개 TNF 수용체 폴리펩타이드는 서열번호 1 또는 상기 서열에 대해 최소 95% 서열 동일성을 가지는 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제46항 내지 제53항 중 어느 하나의 항에 있어서, 상기 Fc 부위는 서열번호 3을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제46항 내지 제54항 중 어느 하나의 항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 7, 서열번호 11, 서열번호 16, 서열번호 20 및 상기 선행하는 서열들 중 어느 하나에 대해 최소 90% 서열 상동성을 가지는 폴리펩타이드 서열로 구성된 군으로부터 선택되는 아미노산 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
- 제55항에 있어서, 상기 키메릭 융합 폴리펩타이드는 서열번호 7, 또는 상기 서열에 대해 최소 90% 서열 상동성을 가지는 폴리펩타이드 서열을 포함하는 것인 키메릭 융합 폴리펩타이드.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261601712P | 2012-02-22 | 2012-02-22 | |
| US61/601,712 | 2012-02-22 | ||
| PCT/GB2013/050433 WO2013124666A1 (en) | 2012-02-22 | 2013-02-22 | Tumour necrosis factor receptor fusion proteins and methods of using the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140135766A true KR20140135766A (ko) | 2014-11-26 |
Family
ID=47754861
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147026150A KR20140135766A (ko) | 2012-02-22 | 2013-02-22 | 종양괴사인자 수용체 융합 단백질 및 이를 이용하는 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US9731007B2 (ko) |
| EP (1) | EP2817326A1 (ko) |
| JP (1) | JP2015509714A (ko) |
| KR (1) | KR20140135766A (ko) |
| CN (1) | CN104159916A (ko) |
| AU (1) | AU2013223801B2 (ko) |
| CA (1) | CA2865288A1 (ko) |
| HK (1) | HK1201541A1 (ko) |
| NZ (1) | NZ629309A (ko) |
| SG (1) | SG11201405013RA (ko) |
| WO (1) | WO2013124666A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10023636B2 (en) * | 2013-12-20 | 2018-07-17 | Intervet Inc. | Caninized murine antibodies to human PD-1 |
| EP3250589A4 (en) * | 2015-01-29 | 2018-06-20 | Nexvet Australia Pty Ltd | Therapeutic and diagnostic agents |
| KR20170138426A (ko) * | 2015-03-13 | 2017-12-15 | 삼성바이오에피스 주식회사 | 항-tnf-알파 폴리펩티드 조성물 및 그 용도 |
| CN104840945B (zh) * | 2015-03-25 | 2018-09-07 | 上海市松江区中心医院 | 诱骗受体3在治疗脓毒症药物中的应用 |
| US11091556B2 (en) | 2015-12-18 | 2021-08-17 | Intervet Inc. | Caninized human antibodies to human IL-4R alpha |
| WO2017123642A1 (en) * | 2016-01-12 | 2017-07-20 | The Trustees Of The University Of Pennsylvania | Methods and uses of osteoclast associated receptor (oscar) for prevention and treatment of osteoarthritis |
| JP2020531002A (ja) * | 2017-08-15 | 2020-11-05 | キンドレッド バイオサイエンシズ インコーポレイテッド | 獣医学用igg fc変異体 |
| JP2020080784A (ja) * | 2018-11-29 | 2020-06-04 | シスメックス株式会社 | 融合ポリペプチド、融合ポリペプチドの製造方法、及び融合ポリペプチドをコードするdna |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU640397B2 (en) | 1989-08-25 | 1993-08-26 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | Dog-mouse heterohybridoma and gene fragment coding for constant region of canine immunoglobulin |
| TWI364458B (en) * | 2004-08-27 | 2012-05-21 | Wyeth Res Ireland Ltd | Production of tnfr-lg |
| AU2006230419A1 (en) | 2005-03-31 | 2006-10-05 | Targeted Genetics Corporation | Methods for lowering the level of tumor necrosis factor (TNF) in TNF-associated disorders |
| WO2010027488A2 (en) | 2008-09-04 | 2010-03-11 | Vet Therapeutics, Inc. | Monoclonal antibodies |
| CN101747440B (zh) * | 2008-12-18 | 2014-05-07 | 嘉和生物药业有限公司 | 一种TNFR-Fc融合蛋白及其用途 |
| CN101760506A (zh) * | 2008-12-25 | 2010-06-30 | 欣润(上海)生物药业有限公司 | 一种rhTNFR-Fc融合蛋白生物学活性的检测方法 |
| US8181211B2 (en) | 2009-03-30 | 2012-05-15 | John Mezzalingua Associates, Inc. | Total bandwidth conditioning device |
| WO2010117448A2 (en) * | 2009-04-05 | 2010-10-14 | Provenance Biopharmaceuticals Corp. | Chimeric immunocytokines and methods of use thereof |
| EP2435477A1 (en) * | 2009-05-28 | 2012-04-04 | Glaxo Group Limited | Antigen-binding proteins |
-
2013
- 2013-02-22 EP EP13706693.2A patent/EP2817326A1/en not_active Withdrawn
- 2013-02-22 US US14/380,277 patent/US9731007B2/en active Active
- 2013-02-22 CN CN201380010734.1A patent/CN104159916A/zh active Pending
- 2013-02-22 NZ NZ629309A patent/NZ629309A/en unknown
- 2013-02-22 KR KR1020147026150A patent/KR20140135766A/ko not_active Application Discontinuation
- 2013-02-22 AU AU2013223801A patent/AU2013223801B2/en active Active
- 2013-02-22 SG SG11201405013RA patent/SG11201405013RA/en unknown
- 2013-02-22 WO PCT/GB2013/050433 patent/WO2013124666A1/en active Application Filing
- 2013-02-22 CA CA2865288A patent/CA2865288A1/en not_active Abandoned
- 2013-02-22 JP JP2014558206A patent/JP2015509714A/ja active Pending
-
2015
- 2015-03-03 HK HK15102126.6A patent/HK1201541A1/xx unknown
-
2017
- 2017-07-14 US US15/650,209 patent/US20180153987A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| HK1201541A1 (en) | 2015-09-04 |
| US9731007B2 (en) | 2017-08-15 |
| SG11201405013RA (en) | 2014-09-26 |
| CN104159916A (zh) | 2014-11-19 |
| US20150037333A1 (en) | 2015-02-05 |
| JP2015509714A (ja) | 2015-04-02 |
| US20180153987A1 (en) | 2018-06-07 |
| WO2013124666A1 (en) | 2013-08-29 |
| AU2013223801B2 (en) | 2016-02-25 |
| NZ629309A (en) | 2016-03-31 |
| EP2817326A1 (en) | 2014-12-31 |
| AU2013223801A1 (en) | 2014-08-28 |
| CA2865288A1 (en) | 2013-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240247039A1 (en) | Il-2 muteins and uses thereof | |
| US20180153987A1 (en) | Tumour necrosis factor receptor fusion proteins and methods of using the same | |
| AU2018378078B2 (en) | IL-2 muteins and uses thereof | |
| EP2697257B1 (en) | Fc fusion proteins comprising novel linkers or arrangements | |
| US11779632B2 (en) | IL-2 muteins and uses thereof | |
| EP2512511B1 (en) | Humanized antibodies against human il-22ra | |
| KR20240095463A (ko) | 변형된 IgG1 Fc 도메인 및 그와의 항-CD40 도메인 항체 융합체 | |
| US20140294815A1 (en) | Caninised tumour necrosis factor antibodies and methods of using the same | |
| TW201321406A (zh) | 腫瘤壞死因子抗體及使用其之方法 | |
| NZ621619B2 (en) | Caninised tumour necrosis factor antibodies and methods of using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |