KR20140103122A - 신경교종을 치료하기 위한 조성물 및 방법 - Google Patents
신경교종을 치료하기 위한 조성물 및 방법 Download PDFInfo
- Publication number
- KR20140103122A KR20140103122A KR1020147016562A KR20147016562A KR20140103122A KR 20140103122 A KR20140103122 A KR 20140103122A KR 1020147016562 A KR1020147016562 A KR 1020147016562A KR 20147016562 A KR20147016562 A KR 20147016562A KR 20140103122 A KR20140103122 A KR 20140103122A
- Authority
- KR
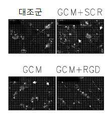
- South Korea
- Prior art keywords
- peptide
- glioma
- csf
- seq
- tumor
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/193—Colony stimulating factors [CSF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/53—Colony-stimulating factor [CSF]
- C07K14/535—Granulocyte CSF; Granulocyte-macrophage CSF
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/64—Cyclic peptides containing only normal peptide links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Toxicology (AREA)
- Cell Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명은 교아세포종과 같은 대식세포에 의해 침투된 종양을 치료하기 위한 분리된 펩티드, 이를 포함하는 조성물 및 이를 사용하는 방법에 관한 것이다.
Description
본 발명은 교아세포종(glioblastomas)과 같은 대식세포에 의하여 침투된 종양을 치료하기 위한 분리된 펩티드, 이를 포함하는 조성물 및 이의 사용 방법에 관한 것이다.
신경교종은 치료하기 가장 어려운 인간의 악성 종양(malignancy) 중의 하나로 간주되고 있다.
임상 및 실험 연구는 뇌잔류 대식세포(소교세포(microglia)), 주변의 단핵백혈구(monocyte)/대식세포(macrophages) 및 골수성-유도 억압 세포(myeloid-derived suppressive cells)에 의한 악성의 신경교종 섬유의 침투를 보여주었다. 이들 세포들의 종양내 밀도는 신경교종 진행 동안에 증가하며 기관형 뇌 단편 배양(organotypic brain slice cultures)에서 악성 종양 및 소교세포의 차단(ablation)과 상호 연관되어 있고, 동물 신경교종 모델은 신경교종 침투를 지지하는 이의 중요한 역할을 보여주었다(Gabrusiewicz K. 등, PLoS One; 6(8):e23902, 2011).
대식세포가 종양-방출 분자에 의하여 불러일으켜지며 항-종양 반응을 개시하는 대신에, 이들 세포들이 여러 형태의 종양에서 침투, 신생 혈관생성(angiogenesis), 세포외 매트릭스 리모델링 및 면역억제를 지지하는 것으로 알려져 있다(Gabrusiewicz K. 등, ibid).
오스테오폰틴(osteopontin (OPN))은 백혈구에 의하여 발현되는 α4β1, α9β1, 및 α9β4를 포함하는 다수의 인테그린(integrin) 수용체와 결합하는 것을 보여주는 인테그린 결합 리간드이다. OPN은 대식세포, 호중구(neutrophils), 수지상 세포(dendritic cells), 및 T와 B 세포를 포함하는 면역 세포의 범위내에서 발현된다. OPN은 면역 조절제(immune modulator)로서 작용한다고 보고되고 있다. 이는 염증 부위에 세포 보충(recruitment)을 촉진하는 화학주화성 성질을 갖고 있다. 또한 이는 세포 부착 및 상처 치료에 연관되는 부착 단백질로서 작용한다. 추가로, OPN은 세포자살(apoptosis)을 조절하여 세포 생존을 촉진하는 것뿐만 아니라 세포 활성 및 사이토카인 생성을 매개한다.
또한 대식세포의 활성에서 OPN의 역할은 암 연구에서 연루되어있음을 보여주며, 여기서 연구자들은 OPN-생성 종양은 OPN-결핍 종양과 비교하여 대식세포 활성을 유도할 수 있음을 발견하였다 (Crawford HC 등 1998 Cancer Res. 58 (22): 5206-15).
또한 유지방 구상체-세포성장 인자 8(milk fat globule-epidermal growth factor 8: EGF-8)로도 알려져 있는, 락타드헤린(lactadherin)은 대식세포에 의하여 분비되는 당단백질이다. 락타드헤린은 세포사멸 세포, 활성 혈소판, 및 포스파티딜세린-발현 적혈구 세포와 결합되어 이들을 이의 RGD 서열을 통하여 대식세포 인테그린으로 단단히 고정시킨다.
과립구-대식세포 콜로니-자극 인자(GM-CSF)는 대식세포, T 세포, 비만 세포, NK 세포, 내피 세포 및 섬유아세포에 의하여 분비되는 단백질이다. GM-CSF는 백혈구 성장 인자로서 작용하는 사이토카인이다. 따라서, 이는 면역/염증 증폭작용(cascade)의 일부이며, 이에 의하여 소수의 대식세포의 활성은 이들 개수에서 급격한 증가, 감염과 싸우기 위한 중요한 과정을 유도할 수 있다.
신경교종과 같은 종양에서 대식세포의 전-종양(pro-tumor) 활성을 억제할 수 있는 억제제를 식별하기 위한 필요성이 충족되지 않고 있다.
본 발명의 요약
본 발명에서는, 전-종양 활성을 가지며, 그리고 종양의 성장 또는 유지에 공헌하는 대식세포에 의하여 침투된 종양("infiltrating macrophages": 침투 대식세포)을 갖는 환자를 치료하기 위한 분리된 펩티드, 이를 함유하는 조성물 및 이의 사용 방법을 제공한다.
따라서, 본 발명은 전-종양 활성을 갖는 대식세포를 갖는 종양, 예를 들어, 신경교종을 치료하기 위한 첫번째 수단을 제공한다.
본 발명의 한 양태에 따르면, GM-CSF 활성을 억제하기 위한 분리된 펩티드를 제공하는데, 상기 펩티드는 다음으로 구성된 군으로부터 선택된 아미노산 서열을 포함한다:
서열 번호: 1 (CGKASATKGKGEATGGC)로 제시된 아미노산 서열, 서열 번호: 2 (CGTAEGKGGKGTASAKGGC)로 제시된 아미노산 서열, 서열 번호: 3 (QPWEHVNAIQERRLLNLSR)으로 제시된 아미노산 서열, 서열 번호: 4 (KDFLLVIPFDCWEPVQE)로 제시된 아미노산 서열, 서열 번호: 5 (FQYQLDVHRKN)로 제시된 아미노산 서열; 및 서열 번호: 6 (ADVRILN)로 제시된 아미노산 서열. 각각의 가능성은 별개의 양태이다.
본 발명의 다른 양태에 따르면, 본 발명은 RGD (Arg-Gly-Asp) 모티프를 포함하는 분리된 펩티드를 제공하는데, 여기서 상기 분리된 펩티드는 서열 번호: 7 (DGRGDSV)로 제시된 아미노산 서열을 포함한다.
한 양태에 따르면, 상기 펩티드는 7-25개의 아미노산으로 구성된다. 다른 양태에 따르면, 상기 펩티드는 7-20개의 아미노산으로 구성된다.
다른 양태에 따르면, 상기 분리된 펩티드는 서열 번호: 1로 제시된 서열, 또는 이의 유사체(analog) 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 2로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 3으로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 4로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 5로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 6으로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 7로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다.
또 다른 양태에 따르면, 상기 펩티드는 시클릭 펩티드이다.
또 다른 양태에 따르면, 본 발명은 본 발명의 이전 양태에서 개시된 바와 같이 필수적으로, 다음으로 구성된 군으로부터 선택된 분리된 펩티드 및 약제학적 허용 담체를 포함하는 약제학적 조성물을 제공한다:
서열 번호: 1로 제시된 아미노산 서열, 서열 번호: 2로 제시된 아미노산 서열, 서열 번호: 3으로 제시된 아미노산 서열, 서열 번호: 4로 제시된 아미노산 서열, 서열 번호: 5로 제시된 아미노산 서열, 서열 번호: 6으로 제시된 아미노산 서열 및 서열 번호: 7로 제시된 아미노산 서열.
한 양태에 따르면, 상기 약제학적 허용 담체는 수용액, 식물성 오일, 알콜, 폴리에틸렌 글리콜, 프로필렌 글리콜 및 글리세린으로 구성된 군으로부터 선택된다. 각각의 가능성은 별개의 양태이다.
다른 양태에 따르면, 상기 약제학적 조성물은 신경교종을 치료하기 위한 것이다. 또 다른 양태에 따르면, 상기 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 및 혼합 신경교종으로 구성된 군으로부터 선택된다. 각각의 가능성은 별개의 양태이다.
또 다른 양태에 따르면, 본 발명은 GM-CSF 활성을 억제할 수 있는 펩티드를 함유하는 약제학적 조성물의 치료학적 유효량을 신경교종의 치료가 필요한 환자에게 투여하는 과정을 포함하는 신경교종을 치료하기 위한 방법으로서, 상기 펩티드는 본 발명의 이전 양태에서 개시된 바와 같이 필수적으로, 다음으로 구성된 군으로부터 선택된 서열을 포함하는 방법을 제공한다:
서열 번호: 1로 제시된 아미노산 서열, 서열 번호: 2로 제시된 아미노산 서열, 서열 번호: 3으로 제시된 아미노산 서열, 서열 번호: 4로 제시된 아미노산 서열, 서열 번호: 5로 제시된 아미노산 서열, 서열 번호: 6으로 제시된 아미노산 서열.
본 발명의 또 다른 양태에 따르면, 본 발명은 RGD (Arg-Gly-Asp) 모티프를 포함하는 펩티드를 함유하는 약제학적 조성물의 치료학적 유효량을 신경교종의 치료가 필요한 환자에게 투여하는 과정을 포함하는 신경교종을 치료하기 위한 방법으로서, 상기 펩티드는 서열 번호: 7로 제시된 아미노산을 포함하는 방법을 제공한다.
한 양태에 따르면, 상기 펩티드는 7-25개의 아미노산으로 구성된다. 다른 양태에 따르면, 상기 펩티드는 7-20개의 아미노산으로 구성된다.
또 다른 양태에 따르면, 상기 펩티드는 서열 번호: 1로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 2로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 3으로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 4로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 5로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 6으로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다. 대안으로서, 상기 분리된 펩티드는 서열 번호: 7로 제시된 서열, 또는 이의 유사체 또는 유도체로 구성된다.
또 다른 양태에 따르면, 상기 펩티드는 시클릭 펩티드이다.
또 다른 양태에 따르면, 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 및 혼합 신경교종으로 구성된 군으로부터 선택된다. 각각의 가능성은 별개의 양태이다. 또 다른 양태에 따르면, 신경교종의 치료는 식세포작용을 감소시키는 것, 운동성을 감소시키는 것, 전-종양 활성을 갖는 종양 침투 대식세포의 증식을 감소시키는 것 및 상기 대식세포에 의한 염증전(pro-inflammatory) 사이토카인 또는 케모카인의 분비를 감소시키는 것으로 구성된 군으로부터 선택된다. 각각의 가능성은 별개의 양태이다.
본 발명의 다른 양태에 따르면, 본 발명은 본 발명의 이전 양태에서 개시된 바와 같이 필수적으로, 다음으로 구성된 군으로부터 선택된 분리된 펩티드를 함유하는 약제학적 조성물을 포함하는 신경교종의 치료를 위한 키트 및 상기 키트의 사용을 위한 설명을 제공한다:
서열 번호: 1로 제시된 아미노산 서열, 서열 번호: 2로 제시된 아미노산 서열, 서열 번호: 3으로 제시된 아미노산 서열, 서열 번호: 4로 제시된 아미노산 서열, 서열 번호: 5로 제시된 아미노산 서열, 서열 번호: 6으로 제시된 아미노산 서열 및 서열 번호: 7로 제시된 아미노산 서열.
본 발명의 다른 목적, 특징 및 이점들은 다음의 설명으로부터 분명해 질 것이다.
도 1은 신경교종 상태 매질(glioma Condition Media: GCM)에 의하여 치료된 소교세포(microglia)의 아메바상 형질전환 및 운동성을 보여준다: 1a는 빛 대조 현미경(상부 패널) 또는 F-액틴 염색 세포의 면역-형광 현미경(하부 패널)에 의하여 GCM 상태 매질에 노출된 쥐 초기 소교세포 배양의 세포 골격 변화의 현미경 분석이다; 1b는 LPS 및 GCM 처리 후 면역 블롯 사이클린 D1 및 pRb이다; 1c는 GCM-치료 소교세포의 스크래취 분석이다; 1d는 형광으로 표시된 비드에 의하여 접종된 GCM-처리 소교세포의 식세포작용 분석이다.
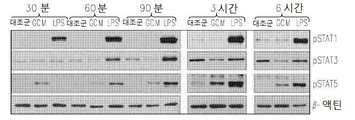
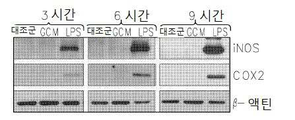
도 2는 GCM 소교세포 세포에서 염증 신호의 겹핍을 보여준다: 2a는 GCM 및 LPS 처리 소교세포 세포에서 포스포릴화된 (p) 또는 전체의 MAPK 키나제에 대한 항체에 의한 웨스턴 블롯(Western blots)이다; 2b는 GCM 및 LPS 처리 소교세포 세포에서 NFκB 억제제 (IκB) 또는 이의 포스포릴화된 형태(pIκB)의 면역블로팅이다; 2c는 GCM 및 LPS 처리 소교세포 세포에서 포스포릴화된 STAT 전사 인자(Signal Tranducers and Activators of Transcription)의 면역블로팅이다; 2d는 GCM 및 LPS, 자극 소교세포 세포에서 염증 매개인자 iNOS 및 COX2의 면역블로팅이다.
도 3은 GCM 및 LPS 자극의 결과로서 소교세포 세포에서 유도된 전사적 변화의 비교를 보여준다.
도 4는 GCM 또는 LPS에 의하여 자극된 소교세포 배양에서 선택된 유전자의 실시간 PCR을 보여준다.
도 5는 소교세포-활성 분획의 신경교종 유도 단백질, 오스테오폰틴 및 락타드헤린; 및 오스테오폰틴 및 락타드헤린을 과발현한 쥐 C6 신경교종 세포를 보여준다: 5a는 GCM 배양 매질의 분획 및 소교세포를 아메바상 세포로 전환시키는 능력의 점수표이다; 5b는 활성 분획의 MS/MS 분석이다; 5c는 활성 분획의 식세포작용 분석이다; 5d는 전환되지 않은 대뇌 피질 성상세포(cortical astrocytes)와 비교한 C6 신경교종 세포에서 오스테오폰틴 아이소포름(sppla 및 spplc) 및 락타드헤린의 실시간 PCR; 및 C6 신경교종 세포에 의한 오스테오폰틴 분비의 ELISA 분석이다.
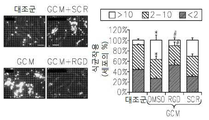
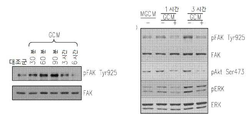
도 6은 RGB-함유 펩티드에 의하여 처리하고 신경교종-유도 액틴 세포골격 변화의 블록킹에 의하여 결합하는 인테그린에 의한 간섭, 식세포작용 및 세포 운동성을 보여준다: 6a는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포내의 F-액틴의 면역형광 현미경이다; 6b는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포의 식세포작용 분석이다; 6c는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포의 스크래치 분석이다; 6d는 αν, β3 (또는 둘 다) 인테그린 서브유닛에 대한 siRNA에 의하여 처리된 세포의 식세포작용 분석이다; 6e는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포내의 포스포릴화 FAK의 면역블로팅이다; 6f는 인테그린 리간드, 세포내 경로 및 급속하게 이동하는 아메바상 대식세포로의 세포 변형 간에 제안된 링크의 모델이다.
도 7은 GCM 유발 유전자 발현 및 소교세포-의존 신경교종 침습성에서 사일런싱하는 락타드헤린 및 오스테오폰틴의 뚜렷한 효과를 보여준다: 7a는 대조군 (shNeg), 또는 락타드헤린 shRNA을 안정적으로 발현하는 C6 신경교종에서 락타드헤린 (mfge8)의 정량적 PCR이다; 7b는 락타드헤린 고갈 GCM-처리 신경교종 세포에서 선택된 유전자의 정량적 PCR이다; 7c는 대조군 (shNeg), 또는 오스테오폰틴 shRNA을 안정적으로 발현하는 C6 신경교종 세포에서 오스테오폰틴 (sppl)의 정량적 PCR이다; 7d는 오스테오폰틴 고갈 GCM-처리 신경교종 세포에서 선택된 유전자의 정량적 PCR이다; 7e는 오스테오폰틴 및 락타드헤린 고갈 소교세포 세포의 존재 또는 부재하에서 신경교종 세포의 매트리겔 매트릭스 침습 분석이다.
도 8은 재조합 오스테오폰틴 및 락타드헤린을 발현하는 쥐(murine) 섬유아세포로부터 배양 매질에 노출된 소교세포 세포의 유도된 식세포작용 및 아메바상 변형을 보여준다: 8a는 오스테오폰틴 및/또는 락타드헤린을 인코딩하는 플라스미드에 의하여 일시적으로 감염된 NIH3T3 섬유아세포내에서 락타드헤린 (mfge8) 및 오스테오폰틴 (sppl)의 정량적 PCR이다; 8b는 쥐 락타드헤린 (mfge8) 및/또는 오스테오폰틴 (sppl)을 발현하는 섬유아세포로부터 조건화된 매질에 노출된 소교세포 배양의 식세포작용 분석이다; 8c는 락타드헤린 (mfge8), 및/또는 오스테오폰틴 (sppl)을 발현하는 섬유아세포로부터 조건화된 매질에 노출된 소교세포 세포내의 F-액틴 면역형광 현미경이다.
도 9는 재조합 오스테오폰틴을 발현하는 쥐 섬유아세포로부터 배양 매질에 노출된 소교세포 세포내의 M2 표현형 마커 유전자의 유도된 발현을 보여준다: 9a는 재조합 오스테오폰틴 및/또는 락타드헤린을 발현하는 쥐 섬유아세포로부터 배양 매질에 노출된 소교세포 세포에서 포스포릴화 (p) 또는 전체의 IκB 및 STAT1, 3 및 5에 대한 항체를 사용한 웨스턴 블롯이다; 9b는 오스테오폰틴 및/또는 락타드헤린을 발현하는 섬유아세포로부터 조절된 매질에 노출된 소교세포 배양에서 선택된 유전자의 실시간 PCR이다.
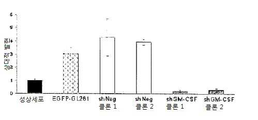
도 10은 GL261 신경교종 세포 및 세포 생존 또는 증식에서 GM-CSF 사일런싱을 보여준다: 10a는 전환되지 않은 성상세포와 비교로서 GM-CSF 특이 shRNA을 안정적으로 발현하는 신경교종 세포에서 GM-CSF의 실시간 PCR이다; 10b는 전환되지 않은 성상세포와 비교로서 GM-CSF 특이 shRNA을 안정적으로 발현하는 신경교종 세포에서 GM-CS 단백질 수준의 정량 분석이다; 10c는 shGM-CSF를 안정적으로 발현하는 신경교종 세포의 BrdU 혼입 분석이다; 10d는 shGM-CSF를 안정적으로 발현하는 신경교종 세포의 MTT 생존 분석이다.
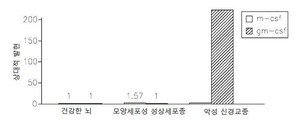
도 11은 GM-CSF 결핍 신경교종에서 뇌 대식세포 및 감소된 종양 크기의 손상된 세포 보충(recruitment)을 보여준다: 11a는 shNeg 또는 shGM-CSF를 안정적으로 발현하는 신경교종 세포에 의하여 이식된 쥐 뇌로부터 추출된 소교세포 세포에서 염색한 항-Iba-1의 현미경 분석이다; 11b는 11a의 정량 분석이다; 11c는 대조군과 비교하여 GM-CSF 결핍 신경교종 세포에 의하여 이식된 항-vWF 항체 쥐의 혈관의 염색이다. GM-CSF 결핍 EGFP-GL261 신경교종 세포내에서 종양 크기 분석이다; 11d는 GM-CSF 결핍 신경교종 세포에 의하여 이식된 쥐내의 종양 부피의 정량치이다; 11e는 대조군(shNeg) 또는 GM-CSF 결핍 EGFP-GL261 신경교종 세포에 의하여 이식된 쥐내에서 신경교종의 대표적인 이미지이다.
도 12는 소교세포 세포의 존재하에서 GM-CSF 결핍 신경교종 세포의 감소된 침습성을 보여준다: 12a는 소교세포 세포의 존재/부재하에서 대조 또는 GM-CSF 결핍 EGFP-GL261 신경교종 세포에 의하여 주입된 쥐 뇌 단편 배양에서 EGFP- 신경교종 세포에 의하여 덮어진 형광 면적에 의하여 종양 크기를 측정한 침해 분석이다; l2b는 12a의 정량치이다.
도 13은 op/op 쥐에서 M-CSF 결핍, 소교세포/대식세포의 축적의 결핍, 신생 혈관생성(angiogenesis) 및 종양 성장의 결핍을 보여준다: 13a는 TaqMan Allelic Discrimination 방법에 의한 B6C3Fe a/a-Csflop/J 쥐의 유전형(Genotyping)이다; 13b는 골화석증(osteopetrotic) op/op 및 야생형 (WT)의 뇌에서 소교세포 세포, 대식세포 및 림프구의 퍼센트를 정량하는 유동 세포계수(cytometry) 분석이다. 13c는 op/op 및 야생형 (WT) 쥐의 혈액에서 단핵백혈구(monocytes), 림프구 및 과립성백혈구(granulocytes)의 퍼센트를 정량하는 유동 세포계수 분석이다. 13d는 GFP-발현 GL261 신경교종 세포에 의하여 뇌내적으로 접종된 op/op 및 WT 쥐의 뇌에서 소교세포 세포, 대식세포 및 림프구의 퍼센트를 정량하는 유동 세포계수 분석이다. 13e는 GFP-발현 GL261 신경교종 세포에 의하여 뇌내적으로 접종된 op/op 및 WT 쥐의 뇌에서 단핵백혈구, 림프구 및 과립성백혈구의 퍼센트를 정량하는 유동 세포계수 분석이다. 13f는 EGFP-GL261 신경교종 세포에 의하여 접종되고; 항-Iba-1 항체에 의하여 염색되어 DAB에 의하여 가시적으로 보이도록 한 골화석증 및 WT 쥐의 소교세포 세포의 현미경 분석이다. 13g는 13f의 정량치이다; 13h는 EGFP-GL261 신경교종 세포에 의하여 접종된 골화석증 및 WT 쥐의 종양 부피이다.
도 14는 골화석증 op/op 쥐의 척수(spinal cord) 병소 탈수초성 장애(focal demyelinating lesion)에서 축적된 소교세포/대식세포의 감소를 보여준다: 14a는 척수 장애를 갖는 WT 및 op/op 쥐에서 항-Iba-1 항체에 의하여 염색되어 DAB에 의하여 가시적으로 보이도록 한 소교세포/대식세포의 현미경 분석이다; 14b는 14a의 정량치이다.
도 15는 CSF-2 발현, 높은 종양 등급 및 낮은 환자 생존사이에 상관관계를 보여준다. 15a는 인간 신경교종 생체 검사(biopsies)에서 CSF-1 및 CSF-2 발현의 정량적 분석이다; 15b는 각각 CSF-2 업 및 하향-조절(up- and down-regulation)을 갖는 환자들의 카플란-마이어(Kaplan-Meier) 생존 플롯이다.
도 16은 대조 또는 GM-CSF 특이 shRNA을 발현하는 두개내의(intracranial) 신경교종을 갖는 쥐에 대한 생존 곡선을 보여준다.
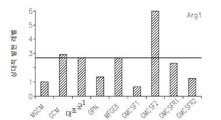
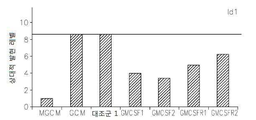
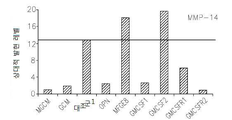
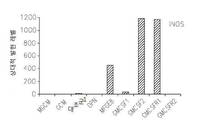
도 17은 OPN, GM-CSF 및 GM-CSFR의 펩티드 억제제로 처리된 쥐 소교세포 세포로 접종된 인간 신경교종 세포에서 택일적인 소교세포 활성 마커의 약화된 발현을 보여준다: 17a는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 Argl의 실시간 PCR이다; 17b 및 17c는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 Idl의 실시간 PCR이다; 17d는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 c-Myc의 실시간 PCR이다; 17e는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 MMP-14의 실시간 PCR이다; 17f는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 iNOS의 실시간 PCR이다.
도 18은 GM-CSF/GM-CSFR 펩티드 억제제에 의하여 치리된 소교세포 세포의 존재 또는 부재하에서 신경교종 세포의 매트리겔 매트릭스 침습 분석을 보여준다.
도 19는 오스테오폰틴의 RNAi 매개 영구적인 사일런싱을 갖는 생체내 쥐 신경교종 모델내에서 약화된 종양 성장을 보여준다: 19a는 오스테오폰틴의 RNAi 매개 영구적인 사일런싱을 갖는 쥐 C6 신경교종 클론 내에서 오스테오폰틴 (sppl)의 정량적 PCR이다; 19b는 대조군 shRNA (shNeg) 또는 오스테오폰틴 shRNA (shSPPl)을 발현하는 위스타 쥐 내로 C6 신경교종의 이식 후 15일에서 종양의 대표적인 이미지이다: 19c는 대조군 shRNA (shNeg) 또는 오스테오폰틴 shRNA (shSPPl)을 발현하는 C6 신경교종의 이식 후 15일에서 종양 부피다.
도 20은 OPN 과발현 및 낮은 환자 생존 사이의 상관관계를 보여준다. 차등적인 오스테오폰틴 (SPP1) 발현을 갖는 환자들에 대한 카플란-마이어 생존 플롯.
도 2는 GCM 소교세포 세포에서 염증 신호의 겹핍을 보여준다: 2a는 GCM 및 LPS 처리 소교세포 세포에서 포스포릴화된 (p) 또는 전체의 MAPK 키나제에 대한 항체에 의한 웨스턴 블롯(Western blots)이다; 2b는 GCM 및 LPS 처리 소교세포 세포에서 NFκB 억제제 (IκB) 또는 이의 포스포릴화된 형태(pIκB)의 면역블로팅이다; 2c는 GCM 및 LPS 처리 소교세포 세포에서 포스포릴화된 STAT 전사 인자(Signal Tranducers and Activators of Transcription)의 면역블로팅이다; 2d는 GCM 및 LPS, 자극 소교세포 세포에서 염증 매개인자 iNOS 및 COX2의 면역블로팅이다.
도 3은 GCM 및 LPS 자극의 결과로서 소교세포 세포에서 유도된 전사적 변화의 비교를 보여준다.
도 4는 GCM 또는 LPS에 의하여 자극된 소교세포 배양에서 선택된 유전자의 실시간 PCR을 보여준다.
도 5는 소교세포-활성 분획의 신경교종 유도 단백질, 오스테오폰틴 및 락타드헤린; 및 오스테오폰틴 및 락타드헤린을 과발현한 쥐 C6 신경교종 세포를 보여준다: 5a는 GCM 배양 매질의 분획 및 소교세포를 아메바상 세포로 전환시키는 능력의 점수표이다; 5b는 활성 분획의 MS/MS 분석이다; 5c는 활성 분획의 식세포작용 분석이다; 5d는 전환되지 않은 대뇌 피질 성상세포(cortical astrocytes)와 비교한 C6 신경교종 세포에서 오스테오폰틴 아이소포름(sppla 및 spplc) 및 락타드헤린의 실시간 PCR; 및 C6 신경교종 세포에 의한 오스테오폰틴 분비의 ELISA 분석이다.
도 6은 RGB-함유 펩티드에 의하여 처리하고 신경교종-유도 액틴 세포골격 변화의 블록킹에 의하여 결합하는 인테그린에 의한 간섭, 식세포작용 및 세포 운동성을 보여준다: 6a는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포내의 F-액틴의 면역형광 현미경이다; 6b는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포의 식세포작용 분석이다; 6c는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포의 스크래치 분석이다; 6d는 αν, β3 (또는 둘 다) 인테그린 서브유닛에 대한 siRNA에 의하여 처리된 세포의 식세포작용 분석이다; 6e는 RGD 억제제에 의하여 보충된 GCM 배양 매질에 의하여 예비-배양된 소교세포 세포내의 포스포릴화 FAK의 면역블로팅이다; 6f는 인테그린 리간드, 세포내 경로 및 급속하게 이동하는 아메바상 대식세포로의 세포 변형 간에 제안된 링크의 모델이다.
도 7은 GCM 유발 유전자 발현 및 소교세포-의존 신경교종 침습성에서 사일런싱하는 락타드헤린 및 오스테오폰틴의 뚜렷한 효과를 보여준다: 7a는 대조군 (shNeg), 또는 락타드헤린 shRNA을 안정적으로 발현하는 C6 신경교종에서 락타드헤린 (mfge8)의 정량적 PCR이다; 7b는 락타드헤린 고갈 GCM-처리 신경교종 세포에서 선택된 유전자의 정량적 PCR이다; 7c는 대조군 (shNeg), 또는 오스테오폰틴 shRNA을 안정적으로 발현하는 C6 신경교종 세포에서 오스테오폰틴 (sppl)의 정량적 PCR이다; 7d는 오스테오폰틴 고갈 GCM-처리 신경교종 세포에서 선택된 유전자의 정량적 PCR이다; 7e는 오스테오폰틴 및 락타드헤린 고갈 소교세포 세포의 존재 또는 부재하에서 신경교종 세포의 매트리겔 매트릭스 침습 분석이다.
도 8은 재조합 오스테오폰틴 및 락타드헤린을 발현하는 쥐(murine) 섬유아세포로부터 배양 매질에 노출된 소교세포 세포의 유도된 식세포작용 및 아메바상 변형을 보여준다: 8a는 오스테오폰틴 및/또는 락타드헤린을 인코딩하는 플라스미드에 의하여 일시적으로 감염된 NIH3T3 섬유아세포내에서 락타드헤린 (mfge8) 및 오스테오폰틴 (sppl)의 정량적 PCR이다; 8b는 쥐 락타드헤린 (mfge8) 및/또는 오스테오폰틴 (sppl)을 발현하는 섬유아세포로부터 조건화된 매질에 노출된 소교세포 배양의 식세포작용 분석이다; 8c는 락타드헤린 (mfge8), 및/또는 오스테오폰틴 (sppl)을 발현하는 섬유아세포로부터 조건화된 매질에 노출된 소교세포 세포내의 F-액틴 면역형광 현미경이다.
도 9는 재조합 오스테오폰틴을 발현하는 쥐 섬유아세포로부터 배양 매질에 노출된 소교세포 세포내의 M2 표현형 마커 유전자의 유도된 발현을 보여준다: 9a는 재조합 오스테오폰틴 및/또는 락타드헤린을 발현하는 쥐 섬유아세포로부터 배양 매질에 노출된 소교세포 세포에서 포스포릴화 (p) 또는 전체의 IκB 및 STAT1, 3 및 5에 대한 항체를 사용한 웨스턴 블롯이다; 9b는 오스테오폰틴 및/또는 락타드헤린을 발현하는 섬유아세포로부터 조절된 매질에 노출된 소교세포 배양에서 선택된 유전자의 실시간 PCR이다.
도 10은 GL261 신경교종 세포 및 세포 생존 또는 증식에서 GM-CSF 사일런싱을 보여준다: 10a는 전환되지 않은 성상세포와 비교로서 GM-CSF 특이 shRNA을 안정적으로 발현하는 신경교종 세포에서 GM-CSF의 실시간 PCR이다; 10b는 전환되지 않은 성상세포와 비교로서 GM-CSF 특이 shRNA을 안정적으로 발현하는 신경교종 세포에서 GM-CS 단백질 수준의 정량 분석이다; 10c는 shGM-CSF를 안정적으로 발현하는 신경교종 세포의 BrdU 혼입 분석이다; 10d는 shGM-CSF를 안정적으로 발현하는 신경교종 세포의 MTT 생존 분석이다.
도 11은 GM-CSF 결핍 신경교종에서 뇌 대식세포 및 감소된 종양 크기의 손상된 세포 보충(recruitment)을 보여준다: 11a는 shNeg 또는 shGM-CSF를 안정적으로 발현하는 신경교종 세포에 의하여 이식된 쥐 뇌로부터 추출된 소교세포 세포에서 염색한 항-Iba-1의 현미경 분석이다; 11b는 11a의 정량 분석이다; 11c는 대조군과 비교하여 GM-CSF 결핍 신경교종 세포에 의하여 이식된 항-vWF 항체 쥐의 혈관의 염색이다. GM-CSF 결핍 EGFP-GL261 신경교종 세포내에서 종양 크기 분석이다; 11d는 GM-CSF 결핍 신경교종 세포에 의하여 이식된 쥐내의 종양 부피의 정량치이다; 11e는 대조군(shNeg) 또는 GM-CSF 결핍 EGFP-GL261 신경교종 세포에 의하여 이식된 쥐내에서 신경교종의 대표적인 이미지이다.
도 12는 소교세포 세포의 존재하에서 GM-CSF 결핍 신경교종 세포의 감소된 침습성을 보여준다: 12a는 소교세포 세포의 존재/부재하에서 대조 또는 GM-CSF 결핍 EGFP-GL261 신경교종 세포에 의하여 주입된 쥐 뇌 단편 배양에서 EGFP- 신경교종 세포에 의하여 덮어진 형광 면적에 의하여 종양 크기를 측정한 침해 분석이다; l2b는 12a의 정량치이다.
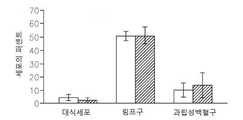
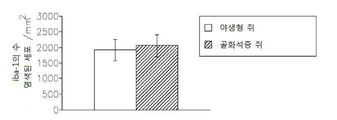
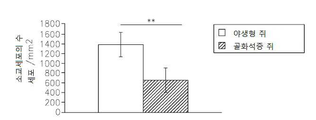
도 13은 op/op 쥐에서 M-CSF 결핍, 소교세포/대식세포의 축적의 결핍, 신생 혈관생성(angiogenesis) 및 종양 성장의 결핍을 보여준다: 13a는 TaqMan Allelic Discrimination 방법에 의한 B6C3Fe a/a-Csflop/J 쥐의 유전형(Genotyping)이다; 13b는 골화석증(osteopetrotic) op/op 및 야생형 (WT)의 뇌에서 소교세포 세포, 대식세포 및 림프구의 퍼센트를 정량하는 유동 세포계수(cytometry) 분석이다. 13c는 op/op 및 야생형 (WT) 쥐의 혈액에서 단핵백혈구(monocytes), 림프구 및 과립성백혈구(granulocytes)의 퍼센트를 정량하는 유동 세포계수 분석이다. 13d는 GFP-발현 GL261 신경교종 세포에 의하여 뇌내적으로 접종된 op/op 및 WT 쥐의 뇌에서 소교세포 세포, 대식세포 및 림프구의 퍼센트를 정량하는 유동 세포계수 분석이다. 13e는 GFP-발현 GL261 신경교종 세포에 의하여 뇌내적으로 접종된 op/op 및 WT 쥐의 뇌에서 단핵백혈구, 림프구 및 과립성백혈구의 퍼센트를 정량하는 유동 세포계수 분석이다. 13f는 EGFP-GL261 신경교종 세포에 의하여 접종되고; 항-Iba-1 항체에 의하여 염색되어 DAB에 의하여 가시적으로 보이도록 한 골화석증 및 WT 쥐의 소교세포 세포의 현미경 분석이다. 13g는 13f의 정량치이다; 13h는 EGFP-GL261 신경교종 세포에 의하여 접종된 골화석증 및 WT 쥐의 종양 부피이다.
도 14는 골화석증 op/op 쥐의 척수(spinal cord) 병소 탈수초성 장애(focal demyelinating lesion)에서 축적된 소교세포/대식세포의 감소를 보여준다: 14a는 척수 장애를 갖는 WT 및 op/op 쥐에서 항-Iba-1 항체에 의하여 염색되어 DAB에 의하여 가시적으로 보이도록 한 소교세포/대식세포의 현미경 분석이다; 14b는 14a의 정량치이다.
도 15는 CSF-2 발현, 높은 종양 등급 및 낮은 환자 생존사이에 상관관계를 보여준다. 15a는 인간 신경교종 생체 검사(biopsies)에서 CSF-1 및 CSF-2 발현의 정량적 분석이다; 15b는 각각 CSF-2 업 및 하향-조절(up- and down-regulation)을 갖는 환자들의 카플란-마이어(Kaplan-Meier) 생존 플롯이다.
도 16은 대조 또는 GM-CSF 특이 shRNA을 발현하는 두개내의(intracranial) 신경교종을 갖는 쥐에 대한 생존 곡선을 보여준다.
도 17은 OPN, GM-CSF 및 GM-CSFR의 펩티드 억제제로 처리된 쥐 소교세포 세포로 접종된 인간 신경교종 세포에서 택일적인 소교세포 활성 마커의 약화된 발현을 보여준다: 17a는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 Argl의 실시간 PCR이다; 17b 및 17c는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 Idl의 실시간 PCR이다; 17d는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 c-Myc의 실시간 PCR이다; 17e는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 MMP-14의 실시간 PCR이다; 17f는 지시된 펩티드에 의하여 보충된 GCM 내에서 배양된 U87-MG 인간 신경교종 세포내의 iNOS의 실시간 PCR이다.
도 18은 GM-CSF/GM-CSFR 펩티드 억제제에 의하여 치리된 소교세포 세포의 존재 또는 부재하에서 신경교종 세포의 매트리겔 매트릭스 침습 분석을 보여준다.
도 19는 오스테오폰틴의 RNAi 매개 영구적인 사일런싱을 갖는 생체내 쥐 신경교종 모델내에서 약화된 종양 성장을 보여준다: 19a는 오스테오폰틴의 RNAi 매개 영구적인 사일런싱을 갖는 쥐 C6 신경교종 클론 내에서 오스테오폰틴 (sppl)의 정량적 PCR이다; 19b는 대조군 shRNA (shNeg) 또는 오스테오폰틴 shRNA (shSPPl)을 발현하는 위스타 쥐 내로 C6 신경교종의 이식 후 15일에서 종양의 대표적인 이미지이다: 19c는 대조군 shRNA (shNeg) 또는 오스테오폰틴 shRNA (shSPPl)을 발현하는 C6 신경교종의 이식 후 15일에서 종양 부피다.
도 20은 OPN 과발현 및 낮은 환자 생존 사이의 상관관계를 보여준다. 차등적인 오스테오폰틴 (SPP1) 발현을 갖는 환자들에 대한 카플란-마이어 생존 플롯.
발명의 상세한 설명
대식세포에 의해 침투된("침투 대식세포"), 가령, 전-종양 활성을 보유하는 소교세포가 침투된 종양을 보유하는 대상을 치료하는데 적합한 방법들 및 조성물들이 본 명세서에서 제시된다. 전-종양 활성을 보유하는 침투 대식세포는 매트릭스 재구성, 침투, 혈관신생과 적응성(adaptive) 면역의 억제에 참여할 수 있으며, 그리고 증식하고, 식세포(phagocytic)일 수 있고, 그리고 이동할 수도 있다. 종양의 정상 또는 유지에 기여할 수 있는, 전-종양 활성을 가진 침투 대식세포는 종양들, 이를 테면 악성 종양들, 가령, 뇌 종양, 이를 테면 신경교종에 존재한다.
본 발명의 방법은 전-종양 활성을 보유하는 침투 대식세포가 있는 종양을 가진 대상에게 인테그린 리간드, 가령, 오스테오폰틴 ("OPN") 또는 락타드헤린(lactadherin)의 저해제의 치료학적 유효량을 투여하고, 이로 인하여 전-종양 활성을 보유하는 침투 대식세포의 전-종양 활성을 감소시키는 것을 포함한다. 대안으로, 본 발명의 방법은 전-종양 활성을 보유하는 침투 대식세포가 있는 종양을 가진 대상에게 치료학적 유효량의 GM-CSF의 저해제를 투여하고, 이로 인하여 전-종양 활성을 보유하는 침투 대식세포의 전-종양 활성을 감소시키는 것을 포함한다. 본 발명에 따른 저해제는 OPN, 락타드헤린 및/또는 GM-CSF의 생산 또는 합성을 저해할 수 있다. 대안으로, 이 저해제는 OPN, 락타드헤린 및/또는 GM-CSF의 활성을 중화시킬 수 있다. 대안으로, 이 저해제는 OPN, 락타드헤린 및/또는 GM-CSF가 이들의 각 수용체에 결합하는 것을 방해 또는 저해시킬 수 있다. 대안으로, 이 저해제는 OPN, 락타드헤린 및/또는 GM-CSF가 대식세포 또는 소교세포 세포들에 있는 이들의 수용체에 결합됨으로써 활성화되는 신호 유도 경로를 저해시킬 수 있다.
본 발명의 방법들은 종양, 가령, 악성 종양의 존재에 의해 특징되는 질환을 치료하는 것에 관계된다. 비-제한적 예로써, 이 종양은 신경교종이다.
본 발명은 OPN 합성의 저해 또는 소교세포 상에서 인테그린과 OPN의 상호작용의 저해로 소교세포의 신경교종 유도된 활성화, 식세포활동(phagocytosis) 그리고 인테그린 매개된 신호 변환 (가령, FAK와 Akt 키나제들의 포스포릴화)이 감소된다는 놀라운 발견에 일부 기초된다. 또한, 본 명세서에서 구체화된 것과 같이, 재조합 OPN은 대부분의 신경교종-유도된 기능적 반응들을 흉내내었고, 그리고 소교세포 배양물에서 추정 대체 표현형 표지들의 발현을 상향-조절하였다.
더욱이, 본 발명은 GM-CSF 합성의 억제로 대식세포/소교세포에 의한 신경교종의 침투이 감소되고, 종양 크기, 종양 진행과 혈관신생이 감소된다는 예상치 못한 발견에 기초된다. 또한, 본 명세서에서 구체화된 것과 같이, GM-CSF 수준은 다형성 교아종(glioblastoma multiforme) 환자들에서 매우 상향-조절되며, 그리고 높은 수준의 GM-CSF는 나쁜 예후와 관련된다.
OPN은 "분비된 인단백질 1," SPP1, BNSP; BSPI; 그리고 ETA-1으로도 또한 지칭되며, 그리고 유전자 ID: 6696을 보유한다. 인간 OPN은 OPNa, OPNb, OPNc, OPNd, 및 OPNe로 지칭되는 5가지 상이한 변이체들 또는 이소폼(isoform)으로 존재하는데, 이들의 전구체 단백질들은 차례로 GenBank Accession No NP 001035147.1, NP_000573.1, NP_001035149.1, NP_001238758.1, 및 NP_001238759.1에서 제공되는 아미노산 서열로 구성되며, 이 서열들은 각각 차례로 GenBank Accession No. NM_001040058.1, NM_000582.2, NM_001040060.1, NM_001251829.1 및 NM_001251830.1에서 제공되는 뉴클레오티드 서열에 의해 인코드된다. OPNa-OPNe의 아미노산 서열들은 각각 차례로 서열 번호: 9-13에서 제시된다. OPNa-e는 인테그린들, 이를 테면 인테그린 αVβ3과 ανβ5와 같은 인테그린과 상호작용한다.
락타드헤린(Lactadherin)은 "MFGE8 유지방 소구립-EGF 인자 8 단백질" 뿐만 아니라 MFGE8, BA46; HMFG; MFGM; SED1; hP47; EDIL1; MFG-E8; SPAG10; OAcGD3S; 그리고 HsT19888로 또한 지칭되며, 그리고 유전자 ID: 4240을 보유한다. 락타드헤린은 이소폼 a 및 b로 존재한다. 인간 락타드헤린 이소폼 프레프로(prepro)단백질의 뉴클레오티드 서열 및 아미노산 서열은 차례로 GenBank Accession No. NM_ 005928.2 및 NP_005919.2로 제공되며, 인간 락타드헤린 이소폼 b 프레프로단백질의 뉴클레오티드 서열 및 아미노산 서열은 차례로 GenBank Accession No. NM_ 001114614.1 및 NP_001108086.1로 제공된다. 락타드헤린 이소폼 a와 b는 인테그린들, 이를 테면 인테그린 αVβ3과 ανβ5와 상호작용한다. 락타드헤린 이소폼 a와 b의 아미노산 서열들은 각각 차례로 서열 번호: 14와 서열 번호: 15로 제시된다.
과립구 대식세포 콜로니 자극 인자는 "GM-CSF" 뿐만 아니라 CSF2, 몰그라모스틴(molgramostin)과 사르그라모스틴(sargramostin)으로도 지칭되며, 그리고 유전자 ID: 1437과 MIM: 138960을 보유한다. 이 단백질의 활성 형은 동종이합체로 세포밖에서 발견된다. 인간 GM-CSF 전구물질 단백질의 아미노산 서열은 GenBank Accession No. NP_000749.2 (서열 번호: 16)에서 제공되며, 그리고 GenBank Accession No. NM_000758.2에서 제공되는 뉴클레오티드 서열에 의해 인코드된다.
GM-CSF는 CSF2RA, CD116, CDw116, CSF2R, CSF2RAX, CSF2RAY, CSF2RX, CSF2RY, GM-CSF-R-알파, GMCSFR, GMRa 그리고 SMDP4로도 불리는 이의 수용체 "GMR α"에 결합되며, 유전자 ID: 1430을 보유한다. 인간 이소폼의 전구물질의 아미노산 서열들은 GenBank Accession No: NP_001155001.1, NP_001155002.1, NP_ 001155003.1, NP_001155004.1, NP_006131.2, NP_758448.1, NP_758449.1, NP_758450.1, 그리고 NP_758452.1에서 제공된다.
본 명세서에서 이용된 것과 같이, 용어 "인테그린 리간드 저해제"는 인테그린 리간드의 최소한 한 가지 생물학적 활성을 저해하는 물질을 지칭한다. 예를 들면, "OPN 저해제"는 OPN (이소폼 a, b, c, d 및/또는 e)의 최소한 한 가지 생물학적 활성을 저해하는 물질을 지칭하며, 그리고 "락타드헤린 저해제"는 락타드헤린 (이소폼 a 및/또는 b)의 최소한 한 가지 생물학적 활성을 저해하는 물질을 지칭한다. 일부 구체예들에 따르면, OPN 또는 락타드헤린 저해제는 각각 차례로 OPN 또는 락타드헤린의 대식세포의 전-종양 활성을 유도하는 능력을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 저해하거나 또는 대식세포의 전-종양 활성을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 감소시키는 물질이다. 인테그린 리간드 저해제는 가령, 증가된 식세포활동, 전-종양 대식세포의 운동성 또는 증식을 저지 또는 감소시킬 수 있거나 또는 전-종양 대식세포에 의한 전-염증성 사이토킨 또는 케모킨의 분비를 감소시킬 수 있다. 예시적인 인테그린 리간드 저해제, 가령, OPN 저해제는 인테그린 리간드, 가령, OPN와 대식세포, 가령 소교세포의 표면에 있는 단백질, 이를 테면 인테그린 사이의 상호작용을 저해 또는 감소시키는 물질이다. 인테그린 리간드 저해제는 단백질 또는 펩티드 계통일 수 있다. 인테그린 리간드 저해제는 인테그린 리간드 단백질의 발현을 저해시킬 수 있는 물질일 수도 있는데, 가령, 저해성 핵산, 가령, siRNA, shRNA, 안티센스 분자, 리보자임 또는 압타머(aptamer)일 수 있다. "물질"은 임의 유형의 분자 또는 분자의 복합체, 이를 테면 거대분자 또는 작은 분자들을 지칭한다.
일부 구체예들에 따르면, OPN 저해제는 5개의 모든 OPN 이소폼의 활성을 저해한다. 일부 구체예들에 따르면, OPN 저해제는 1, 2, 3 또는 4개의 OPN 이소폼의 활성을 저해한다. 일부 구체예들에 따르면, OPN 저해제는 OPN들의 활성을 저해한다.
일부 구체예들에 따르면, 락타드헤린 저해제는 두 가지 락타드헤린 이소폼 모두의 활성을 저해한다. 일부 구체예들에 따르면, 락타드헤린 저해제는 한 쪽 이소폼 또는 다른 쪽 이소폼만의 활성을 저해한다.
인테그린 리간드 저해제는 인테그린 리간드의 생물학적 활성을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 저해시킬 수 있다. 예를 들면 인테그린 리간드 저해제는 인테그린 리간드와 인테그린의 상호작용을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 감소시킬 수 있다. 인테그린 리간드 저해제는 또한 인테그린 리간드 단백질의 발현을 차단시키는 물질일 수 있으며, 그리고 가령, 이의 발현을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 감소시킬 수 있다.
본 명세서에서 이용된 것과 같이, 용어 "GM-CSF 저해제"는 GM-CSF의 최소한 한 가지 생물학적 활성을 저해하는 물질을 지칭한다. 일부 구체예들에 따르면, GM-CSF 저해제는 종양, 가령, 신경교종의 진행을 저해시키는, 이를 테면 GM-CSF 저해제가 없을 경우 종양 진행과 비교하였을 때, 종양 진행을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 지연시키는 물질이다. GM-CSF 저해제는 종양 (가령, 신경교종) 크기를 안정화시키거나 또는 크기를 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99%, 100% (2 배), 3 배, 5 배 또는 그 이상 감소시키는 저해제일 수도 있다. GM-CSF 저해제는 가령, 대식세포 또는 소교세포에 의한 종양 침투을 감소시킬 수 있고; 종양 침투 대식세포의 자극 및/또는 종양 침투 대식세포가 전-종양 활성을 보유하는 세포들로의 형질변환을 감소시키거나; 및/또는 종양에서 혈관신생을 감소시킬 수 있다. GM-CSF 저해제는 다음 특징들중 하나를 보유할 수 있다: (i) 가령, 종양 세포들에 의한 GM-CSF 생산 또는 합성을 차단; (ii) GM-CSF의 활성을 중화; (iii) GM-CSF가 이의 수용체에 결합하는 것을 방지(또는 저해); (iv) GM-CSF가 대식세포 또는 소교세포 상에 있는 이의 수용체에 결합됨으로써 활성화되는 신호 변환 경로를 저해 또는 (v) 가령, 대식세포 또는 소교세포에서 GM-CSF 수용체 생산 또는 합성을 저해. GM-CSF 저해제는 단백질 또는 펩티드 계통일 수 있다. GM-CSF 저해제는 GM-CSF의 발현을 저해하는 물질, 가령, 저해성 핵산, 가령, siRNA, shRNA, 안티센스 분자, 리보자임 또는 압타머일 수도 있다. 본 명세서에서 이용된 것과 같이, "물질"은 임의 유형의 분자 또는 분자의 복합체, 이를 테면 거대분자 또는 작은 분자들을 지칭한다
GM-CSF 저해제는 GM-CSF의 생물학적 활성을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 저해시킬 수 있다. 예를 들면 GM-CSF 저해제는 GM-CSF와 이의 수용체 간에 상호작용을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 감소시킬 수 있다. GM-CSF 저해제는 GM-CSF 단백질 또는 GM-CSF 수용체 (가령, α쇄)의 발현을 차단시키는 물질일 수도 있으며, 그리고 가령, 이의 발현을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 100% 감소시킬 수 있다.
저해성
펩티드들과 단백질들
A) 인테그린 리간드 저해성 펩티드들
일부 구체예들에 따르면, 인테그린 리간드, 가령, OPN의 저해제는 저해성 펩티드다. 인테그린 리간드 저해성 펩티드는 인테그린 리간드와 인테그린, 가령, 인테그린 αVβ3 또는 ανβ5 사이의 상호작용을 저해하는 펩티드일 수 있다. 예시적인 구체예에서, 인테그린 리간드 저해제는 RGD (Arg-Gly-Asp) 모티프 (서열 번호: 17)를 포함한다. 인테그린 리간드 저해제는 인테그린을 통하여 신호 변환을 유도하는 펩티드 또는 단백질 없이, RGD (Arg-Gly-Asp) 모티프를 포함하는 펩티드 또는 단백질이다.
저해성 펩티드는 서열 번호: 9-16중 하나에서 많아야 100개, 75개, 50개, 40개, 30개, 20개, 15개, 10개, 9개, 8개, 7개, 6개, 5개, 4개 또는 3개의 아미노산을 포함할 수 있다. 저해성 펩티드는 가령, 서열 번호: 9-16중 하나에서 3 내지 20개의 아미노산; 3 내지 15개의 아미노산; 5 내지 15개의 아미노산; 5 내지 10개의 아미노산; 6 내지 8개의 아미노산을 포함할 수 있다. 일부 구체예들에 따르면, 저해성 펩티드는 가령, 서열 번호: 9-16중 하나에서 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 아미노산을 포함하거나, 또는 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 아미노산으로 구성된다. 일부 구체예들에 따르면, 저해성 펩티드는 가령, 서열 번호: 9-16중 하나에서 7-20개의 아미노산을 포함하거나, 또는 7-20개의 아미노산으로 구성된다. 일부 구체예들에 따르면, 저해성 펩티드는 가령, 서열 번호: 9-16중 하나에서 7-15개의 아미노산을 포함하거나, 또는 7-15개의 아미노산으로 구성된다.
일부 구체예들에 따르면, 저해성 펩티드는 바람직하게는 RGD 모티프를 포함할 수 있다. RGD 모티프는 이 저해성 펩티드에서 중앙에 위치할 수 있고, 또는 대안으로 펩티드의 한 단부보다는 다른 쪽 단부에 더 가까지 위치할 수도 있다.
예시적인 랫(rat) 락타드헤린 저해성 펩티드는 아미노산 서열 TQRGDIF (서열 번호: 18)로 구성된다. 이용될 수 있는 예시적인 인간 OPN RGD 저해성 펩티드는 서열 번호: 7 - DGRGDSV로 제시된 아미노산 서열을 포함하거나 또는 이 서열로 구성된다. 임의의 다른 인간 OPN RGD 저해성 펩티드가 RGD 모티프를 포함한다면, 이 펩티드가 이용될 수 있다. 예를 들면 인간 OPN RGD 저해성 펩티드는 RGD 모티프를 포괄하는 서열 번호: 9-13에서 제시된 인간 OPN의 아미노산의 5 내지 20개의 아미노산을 포함할 수 있다.
본 발명의 방법에서 이용될 수 있는 예시적인 인간 락타드헤린 RGD 펩티드는 서열 번호: 8 - EVRGDVF에서 제시된 아미노산 서열을 포함하거나, 이 서열로 구성되거나 또는 이 서열로 필수적으로 구성된다. RGD 모티프를 포함한다면, 임의의 다른 인간 락타드헤린 RGD 저해성 펩티드가 이용될 수 있다. 예를 들면, 인간 락타드헤린 RGD 저해성 펩티드는 RGD 모티프를 포괄하는 서열 번호: 9-13에서 제시된 인간 락타드헤린의 아미노산의 5 내지 20개의 아미노산을 포함할 수 있다.
B) GM-CSF 저해성 펩티드들
일부 구체예들에 따르면, GM-CSF의 저해제는 저해성 펩티드다. GM-CSF 저해성 펩티드는 GM-CSF와 이의 수용체 간의 상호작용을 저해하는 펩티드일 것이다. 일부 구체예들에 따르면, GM-CSF 저해제는 GM-CSF 수용체와 상호작용하지만, GM-CSF 수용체를 통하여 신호 변환을 유도하지 않는, GM-CSF 일부분과 동일한 또는 유사한 아미노산 서열을 포함한다. 하기에서 추가 설명되는 것과 같이, GM-CSF의 잔기 54-61 (B 헬릭스)과 77-83 (C 헬릭스)은 이의 수용체와의 상호작용에 관련된다는 것이 밝혀졌고; 따라서 아미노산 54-61 또는 77-83과 동일한 또는 유사한 아미노산 서열을 포함하는 펩티드들이 GM-CSF 저해제로 이용될 수 있다.
일부 구체예들에 따르면, "GM-CSF 저해성 물질"은 (i) GM-CSF 수용체의 쇄 일부분과 동일한 또는 이와 유사하고; 그리고 (ii) GM-CSF와 상호작용하고, 이로 인하여 GM-CSF가 이의 수용체에 결합하는 것을 방지하는 아미노산 서열을 포함하는 펩티드 또는 단백질일 수도 있다.
가령, 제 1 아미노산이 제 2 아미노산 서열과 최소한 70%, 80%, 90%, 95%, 97%, 98% 또는 99% 동일한 경우, 제 1 아미노산 서열은 제 2 아미노산에 유사한 것으로 이해된다. 예를 들면, 제 1 아미노산 서열은 가령, 아미노산 치환, 결실 또는 추가로 단지 1개, 2개, 3개, 4개, 5개, 10개 또는 그 이상의 아미노산에서 제 2 아미노산과 상이할 수 있다.
일부 구체예들에 따르면, 저해성 펩티드는 가령, 서열 번호: 16의 단지 100개, 75개, 50개, 40개, 30개, 20개, 15개, 10개, 9개, 8개, 7개, 6개, 5개, 4개 또는 3개의 아미노산만을 포함할 수 있다. 저해성 펩티드는 가령, 서열 번호: 16에서 3 내지 20개의 아미노산; 3 내지 15개의 아미노산; 5 내지 15개의 아미노산; 5 내지 10개의 아미노산; 6 내지 8개의 아미노산을 또한 포함할 수 있다. 일부 구체예들에 따르면, 저해성 펩티드는 가령, 서열 번호: 16에서 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 아미노산을 포함하거나, 서열 번호: 16에서 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 아미노산으로 구성된다. 일부 구체예들에 따르면, 저해성 펩티드는 서열 번호: 16중 하나에서의 7-20개의 아미노산을 포함하거나, 또는 7-20개의 아미노산으로 구성된다. 일부 구체예들에 따르면, 저해성 펩티드는 는 서열 번호: 16중 하나에서 7-15개의 아미노산을 포함하거나, 또는 7-15개의 아미노산으로 구성된다. 저해성 펩티드는 바람직하게는 이의 수용체와 상호작용하는 인간 GM-CSF의 아미노산 서열 (또는 이와 유사한 서열)을 포함하고, 또는 GM-CSF와 상호작용하는 수용체의 α 또는 βc 쇄의 아미노산 서열(또는 이와 유사한 서열)을 포함한다. 이러한 특이적 서열은 이 저해성 펩티드에서 중앙에 위치할 수 있고, 또는 대안으로 펩티드의 한 단부보다는 다른 쪽 단부에 더 가까지 위치할 수도 있다.
일부 구체예들에 따르면, 예시적인 인간 GM-CSF 저해성 펩티드들은 펩티드 고리형성을 위하여 도입된 글리신, 알라닌, 그리고 시스테인과 함께, 서열 번호: 1 - CGKASATKGKGEATGGC에서 제시된 아미노산 서열 또는 서열 번호: 2 - CGTAEGKGGKGTASAKGGC에서 제시된 아미노산 서열을 포함한다. GM-CSF의 선형 펩티드 유사체들인 추가적인 저해성 펩티드들은 VonFeldt 그리고 다른 사람들에서 제시된 펩티드들을 포함하나 이에 한정되지 않는다 (Peptide Res. 8:20, 1995, 이의 전문이 명세서의 참고자료에 편입된다). 이들 펩티드는 고 친화성 수용체 결합을 저해하는 GM-CSF의 아미노산 17-31 (A 헬릭스)과 저 친화성 수용체 결합을 저해하는 아미노산 54-78 (B 및 C 헬릭스)의 펩티드로 구성된다(VonFeldt 등, 동일한 책).
본 발명의 범위에는 GM-CSF 또는 이의 수용체 또는 수용체 복합체를 표적으로 하는 GM-CSF의 저해제인 짧은 펩티드들이 더 포함된다. 예를 들면, 저해제는 인간 GM-CSF의 다음 아미노산 서열을 포함하고, 다음 아미노산 서열로 기본적으로 구성되거나 또는 다음 아미노산 서열로 구성될 수 있다:
QPWEHVNAIQEARRLLNLSR (서열 번호: 3); 및
KDFLLVIPFDCWEPVQE (서열 번호: 4).
GM-CSF의 저해제 활성은 인간 GM-CSF 수용체 알파의 다음 아미노산 서열을 포함하고, 다음 아미노산 서열로 기본적으로 구성되거나 또는 다음 아미노산 서열로 구성될 수 있다:
FQYQLDVHRKN (서열 번호: 5); 및
ADVRILN (서열 번호: 6).
폴리펩티드들 또는 단백질들인 GM-CSF 저해제들이 또한 제시된다. 예를 들면 유인(decoy) 수용체는 GM-CSF가 GM-CSF 수용체에 결합하는 것을 저해하는데 이용될 수 있다. 다른 구체예들에 있어서, 유인 GM-CSF가 이용될 수 있다. 유인 GM-CSF는 수용체에 결합하지만, 수용체를 활성화시키지 않고, 그리고 자연 발생 GM-CSF가 수용체들에 결합하는 것을 저지하는 GM-CSF 분자들이다. 유인 GM-CSF 분자들은 돌연변이된 GM-CSF 분자들일 수 있다.
GM-CSF의 제 1 (A) 헬릭스 상의 잔기 (성숙한 인간 GM-CSF의 아미노산 11-23)는 고 친화성 수용체 (GM-CSFRα.βc복합체)에 결합에 관련되지만, 저 친화성 수용체 (GM-CSFRα 단독)에는 관련되지 않는 것으로 나타났다(가령, VonFeldt 등, 상기와 동일한 문헌에서 나타낸 것과 같이). 단일 E21R 돌연변이를 가진 GM-CSF가 고 친화성 수용체의 길항제임을 보여줌으로써 이러한 사실이 확인되었다. 따라서, GM-CSF 저해제들은 A 헬릭스에서 돌연변이된 GM-1 서열들을 포함할 수 있는 것으로 예상된다.
본 발명은 가령, 인간의 세포 또는 조직에서 인테그린 리간드를 저해하는 방법 및/또는 GM-CSF를 저해하는 방법을 더 제시하는데, 이 방법은 이 세포 또는 조직에 치료학적 유효량의 저해성 펩티드를 노출시키고, 이로 인하여 인테그린 리간드의 활성 및/또는 GM-CSF의 활성을 저해 또는 감소시키는 것을 포함한다.
일부 구체예들에 따르면, 저해성 펩티드는 RGD 모티프를 포괄하는 인테그린 리간드의 서열에 대하여 최소한 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 동일성을 보유하는 서열이 포함된 펩티드일 수 있다. 저해성 펩티드는 인간 GM-CSF의 서열 또는 인간 GM-CSF 수용체의 쇄의 서열에 대하여 최소한 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 동일성을 보유하는 서열이 포함된 펩티드일 수 있다. 일반적으로, 펩티드의 생물학적 활성의 실질적인 변경없이, 이 폴리펩티드의 구조 내에 일부 변형 및 변화를 만듦으로써, 기능적으로 대등한 폴리펩티드를 획득할 수 있다. 따라서, 본 발명은 인테그린 리간드, 가령, OPN 또는 락타드헤린, 그리고 이들의 생물학적으로 활성 단편들의 아미노산 서열의 일부분이 보존적 아미노산 치환에 의해 상이한, 생물학적으로 대등한 폴리펩티드들까지 확장된다. 유사하게, 본 발명은 인간 GM-CSF 또는 인간 GM-CSF 수용체 쇄, 그리고 이들의 생물학적으로 활성 단편들의 아미노산 서열의 일부분이 보존적 아미노산 치환에 의해 상이한, 생물학적으로 대등한 폴리펩티드들까지 확장된다.
본 명세서에서 이용된 것과 같이, 용어 "보존적 아미노산 치환"은 펩티드에서 주어진 위치의 한 아미노산이 또다른 아미노산으로 치환되는 것을 지칭하는데, 이때 관련 기능의 실질적인 상실없이 치환이 만들어 질 수 있다. 이러한 변화를 만들 때, 유사한 아미노산 잔기의 치환은 측-쇄 치환체들의 관련 유사성, 예를 들면 이들의 크기, 전하, 소수성, 친수성 및 이와 유사한 것들에 근거하여 만들어질 수 있고, 그리고 통상적인 테스트를 통하여 펩티드 기능에 미치는 이러한 치환의 영향이 분석될 수 있다. 대체 구체예들에 있어서, 아미노산 잔기가 동일한 분류내 또다른 아미노산으로 대체되어 보존적 아미노산 치환이 만들어질 수 있으며, 이때 아미노산은 다음과 같이 비-극성, 산성, 염기성 그리고 중성 분류로 나뉜다: 비-극성: Ala, Val, Leu, He, Phe, Trp, Pro, Met; 산성: Asp, Glu; 염기성: Lys, Arg, His; 중성: Gly, Ser, Thr, Cys, Asn, Gin, Tyr. 보존적 아미노산 변화는 L-아미노산을 대응하는 D-아미노산으로의 치환, 보존적 D-아미노산에 의해, 또는 아미노산의 비-유전적 인코드된 형태에 의해, 뿐만 아니라 L-아미노산의 보존적 치환을 포함한다. 자연-발생적 비-유전적 인코드된 아미노산은 베타-알라닌, 3-아미노-프로피온산, 2,3-디아미노 프로피온산, 알파-아미노이소부틸산, 4-아미노-부틸산, N-메틸글리신 (사르코신), 히드록시프롤린, 오르니틴, 시트룰린, t-부틸알라닌, t-부틸글리신, N-메틸이소류신, 페닐글리신, 시클로헥실알라닌, 노르류신, 노르발린, 2-나프틸알라닌, 피리딜알라닌, 3-벤조티에닐 알라닌, 4-클로로페닐알라닌, 2-플루오르페닐알라닌, 3-플루오르페닐알라닌, 4-플루오르페닐알라닌, 페니실아민, l,2,3,4-테트라히드로-이소퀴놀린-3-카르복실산, 베타-2-티에닐알라닌, 메티오닌 술폭시드, 호모아르기닌, N-아세틸 리신, 2-아미노 부틸산, 2-아미노 부틸산, 2,4,-디아미노 부틸산, p-아미노페닐알라닌, N-메틸발린, 호모시스테인, 호모세린, 시스테인산, 엡실론-아미노 헥사노산, 델타-아미노 발레르산, 그리고 2,3-디아미노부틸산을 포함한다.
저해성 펩티드는 단백질의 안정성을 증가시키고, 그리고 표적 세포로 운반을 지원하기 위하여, 더 큰 융합 단백질에 혼입될 수 있다. 표적 세포에서 발현되는 프로테아제에 의해 인지되는 특이적 프로테아제 절단 부위가 융합 단백질에 통합되도록 기획되어, 표적 세포 안으로 진입될 때 융합 단백질로부터 펩티드 조절제가 방출된다. 저해성 펩티드는 혈액 뇌 장벽 (BBB)을 통하여 운반하는 펩티드에 또한 연결될 수 있다. 예를 들면, RGD 펩티드는 ArmaGen Technologies의 분자 Trojan horse (MTH)에 융합될 수 있다. 융합 단백질의 MTH 부분은 내생적 수용체-매개된 수송 시스템을 통하여 BBB를 통과하는 수송을 촉발시킨다.
저해성 펩티드는 C-말단에서 N-말단 방향으로 펩티드를 합성하기 위하여, 자동화된 펩티드 합성기의 이용을 포함하는 당분야에 공지된 표준 단백질 합성 기술, 예를 들면, 고형상 펩티드 합성이 포함된 화학적 펩티드 결찰 방법들을 이용하여 합성될 수 있다. 대안으로, 당분야에 공지된 표준 분자 생물학 기술을 이용하여 이 펩티드 조절제를 인코드하게 될 발현 카세트를 기획하는데 분자 생물학 기술이 이용될 수 있다. 예를 들면, 이 카세트가 박테리아성 플라스미드에 포함되어, 박테리아 세포에서 발현될 수 있고, 이 세포로부터 펩티드 조절제를 단리 및 정제할 수 있다. 이 발현 카세트에는 임의선택적으로 온전한 펩티드 또는 키메라 또는 융합 펩티드 또는 단백질의 일부분으로 저해성 펩티드를 인코드하는 오픈 리딩 프레임(open reading frame)이 포함될 것이며, 예를 들면, 프로테아제 절단에 의해 카세트로부터 이 펩티드가 방출될 수 있다. 이 발현 카세트에는 오픈 리딩 프레임에 작용가능하도록 연결된 적합한 조절 영역들, 예를 들면 프로모터 영역이 또한 포함될 것이며, 이 프로모터는 유도성 프로모터 영역일 수 있다.
대안으로, 이 저해성 펩티드는 예를 들면, 리포좀 조제물(preparation) 안에 저해성 펩티드를 포집시킴으로써, 세포에 의한 이 저해성 펩티드의 취입을 증가 또는 유도하는 생물물질이 포함될 수 있다. 리포좀을 이용한 세포로 펩티드 및 단백질들의 운반은 공지된 것이며, 예를 들면, 미국 특허 제6,372,720호와 US 20030108597에서 설명되며, 이들의 전문이 명세서의 참고자료에 편입된다 .
C) 인테그린 리간드 저해성 항체들
일부 구체예들에 따르면, 인테그린 리간드, 이를 테면 OPN 또는 락타드헤린의 활성은 인테그린 리간드에 특이적으로 결합하고, 이로 인하여 인테그린과의 상호작용을 저해하고, 그리고 인테그린 리간드와 인테그린의 상호작용으로 인하여 시작되는 신호 변환 경로를 저해하는 항체들, 이를 테면 단클론 항체들, 또는 이의 항원 결합 단편들 또는 이의 유도체들을 이용함으로써, 인테그린 리간드의 활성이 저해된다.
D) GM-CSF 또는 GM-CSF 수용체를 저해하는 항체들
일부 구체예들에 따르면, GM-CSF에 특이적으로 결합하고, 이로 인하여 GM-CSF 수용체와의 상호작용을 저해하고, 그리고 GM-CSF와 이의 수용체의 상호작용으로 인하여 시작되는 신호 변환 경로를 저해하는 항체들, 이를 테면 단클론 항체들, 또는 항원 결합 단편들 또는 이의 유도체들을 이용함으로써, GM-CSF의 활성이 저해된다. 항체는 또한 GM-CSF 또는 GM-CSF 수용체에 형태학적 변화를 유도할 수 있고, 이로 인하여 각각 차례로 GM-CSF 수용체 또는 GM-CSF와의 상호작용이 저지된다. 일부 구체예들에 따르면, GM-CSF 수용체에 특이적으로 결합하고, 이로 인하여 수용체를 통한 신호 변환을 저해하는 항체들 또는 이의 항원 결합 단편 또는 이의 유도체들을 이용함으로써, GM-CSF의 활성이 저해된다.
본 명세서에서 이용된 것과 같이, 용어 "항체"는 최소한 한 개의, 그리고 바람직하게는 두 개의 중쇄(H) 가변 영역들 (이하 VH로 약칭됨), 그리고 최소한 한 개의, 그리고 바람직하게는 두 개의 경쇄(L) 가변 영역들 (이하 VL로 약칭됨)이 포함된 단백질을 지칭한다. VH와 VL영역들은 "상보성 결정 영역들" ("CDR")이라고 명명되는 초가변성(hypervariability) 영역으로 더 세분되며, "골격(framework) 영역들"(FR)이라고 명명되는 더 보존된 영역들이 사이에 끼어있다. VH와 VL 각각은 3개의 CDR과 4개의 FR이 포함되는데, 이들은 아미노 말단에서 카르복시 말단으로 다음과 같은 순서로 배열된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
항체는 중쇄와 경쇄 불변 영역을 더 포함할 수 있고, 이로 인하여 중쇄와 경쇄 면역글로블린을 각각 형성할 수 있다. 한 구체예에서, 이 항체는 2개의 중쇄 면역글로블린과 2개의 경쇄 면역글로블린으로 된 사량체이며, 이때 중쇄와 경쇄 면역글로블린 쇄들은 가령, 이황화결합에 의해 서로 연결된다. 중쇄 불변 영역은 3개의 도메인 CH1, CH2 그리고 CH3을 포함한다. 경쇄 불변 영역은 한 개 도메인, CL을 포함한다. 중쇄와 경쇄의 가변 영역은 항원과 상호작용하는 결합 도메인을 포함한다. 항체의 불변 영역들은 이 항체가 면역계의 다양한 세포들(가령, 작동체(effector) 세포)과 고전적 보체계의 제 1 성분(C1q)을 포함하는, 숙주 조직 또는 인자들에게 결합되는 것을 일반적으로 중재한다.
본 명세서에서 이용된 것과 같이, 용어 항체의 "항원-결합 단편"(또는 단순하게 "항체 일부분," 또는 "단편")은 항원, 가령, OPN, 락타드헤린 또는 GM-CSF에 특이적으로 결합하는 능력을 보유하는 전장-항체의 하나 또는 그 이상의 단편들을 지칭한다. 용어 항체의 "항원-결합 단편"에 포괄되는 결합 단편들의 예로는 (i) VL, VH, CL 그리고 CH1 도메인들로 구성된 단가(monovalent) 단편인, Fab 단편; (ii) 힌지 영역에서 이황화결합 다리에 의해 연계된 2개의 Fab 단편을 포함하는 이가(bivalent) 단편인, F(ab')2 단편; (iii) VH와 CH1 도메인들로 구성된 Fd 단편; (iv) 항체의 단일 암(arm)의 VL과 VH 도메인으로 구성된 Fv 단편, (v) VH 도메인으로 구성된 dAb 단편; (vi) 단리된 상보성 결정 영역 (CDR), 그리고 (vii) 나노바디(nanobodies)를 포함한다. 더욱이, Fv 단편의 2개 도메인, VL과 VH는 별도의 핵산에 의해 코드되지만, 재조합 방법들을 이용하여 이들을 단일 단백질 쇄로 만들 수 있는 합성 링커에 의해 VL과 VH는 연합될 수 있으며, 이때 VL와 VH 영역들은 쌍을 이루어 단가 분자들 (단일 쇄 Fv (scFv)로 알려짐)이 형성된다. 이러한 단일 쇄 항체들은 용어 항체의 "항원-결합 단편"에 또한 포괄된다. 이들 항체 단편은 당분야에 기술을 보유한 자들에게 공지된 통상적인 기술을 이용하여 획득되며, 그리고 고유 항체와 동일한 방식의 용도로 이용되는데 적합한 단편들이 선별된다. 본 명세서에서 이용된 것과 같이, 용어 "단클론 항체" 또는 "단클론 항체 조성물"은 특정 에피토프와 면역작용을 할 수 있는 오직 한 종류의 항체 결합 부위를 가지는 항체 분자 집단을 지칭한다. 따라서, 단클론 항체 조성물은 이 조성물과 면역상호작용하는 특정 단백질에 대하여 단일 결합 친화성을 나타낸다.
락타드헤린의 활성을 저해하는데 이용될 수 있는 예시적인 항체는 Access Pharmaceuticals INC에 의해 제조된, 락타드헤린에 결합하는 인간화된 (HuMc3) 단클론 항체 Angiolix (HuMc3)다. Angliolix는 내피 세포에 있는 αVβ3 인테그린에 결합하고, 이로 인하여 VEGF-독립적 인테그린 신호생성을 저해하는 것으로 보고되고 있다.
이용될 수 있는 예시적인 항체는 MorphoSys에서 생산되는 온전한 인간 항-인간 GM-CSF 단클론 항체 MOR103이다. 인간 GM-CSF에 결합함으로써 인간 GM-CSF의 활성을 저해하는데 이용될 수 있는 또다른 예시적인 항체는 BVD2-21C11 단클론, 중화 항체 (BD Pharmingen) 또는 단클론 중화 마우스 MAB215, IgG1 클론 # 3209 (R&D 시스템)이다. 중화 분량(dose) (ND50)은 0.5 ng/mL 재조합 인간 GM-CSF 존재하에서 일반적으로 0.3-0.5㎍/mL이다. 인간 GM-CSF 수용체에 결합함으로써, 인간 GM-CSF의 활성을 저해하는데 이용될 수 있는 예시적인 항체는 단클론 중화 항-MGM-CSF 수용체, 클론 K12B7.17A (Millipore) 또는 인간 GM-CSF 수용체의 알파 쇄에 결합하여, 고유한 GM-CSFR과 재조합 GM-CSFR을 중화시키는 MAB1037 (Chemicon)이다.
본 명세서에서 설명된 방법들에서 이용될 수 있는 또다른 항체는 이전에는 CAM-3001로도 알려진 마브릴리무마브(Mavrilimumab)이며, 이는 GM-CSF 수용체-α를 표적으로 하는 인간 단클론 항체다.
저해성
핵산들
일부 구체예들에 따르면, 인테그린 리간드, 이를 테면 OPN의 발현을 감소시키는 저해성 핵산들이 이용된다. 일부 구체예들에 따르면, GM-CSF 또는 GM-CSF 수용체의 발현을 감소시키는 저해성 핵산들이 이용된다. 예를 들면, 작은 간섭 RNA들 (siRNAs), 안티센스, 몰포리노 올리고들(morpholino oligos), 그리고 리보자임들이 모두 이용될 수 있다. 저해성 핵산에 노출되지 않은 세포 또는 조직과 비교하였을 때, 인테그린 리간드의 발현을 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 99% 감소시키는 것들이 유용한 저해성 핵산에 포함된다.
따라서, 인테그린 리간드 또는 GM-CSF/GM-CSF 수용체를 표적으로 삼는 하나 또는 그 이상의 저해성 핵산 분자들, 가령, siRNA, 안티센스, 리보자임들, 펩티드 핵산들, 그리고 압타머를 이를 필요로 하는 대상에 투여하고, 이로 인하여 이 대상에서 인테그린 리간드 단백질 또는 GM-CSF 단백질의 수준이 감소되는 것을 포함하는 방법들이 본 명세서에서 제시된다.
A) RNAi에 적합한 인테그린 리간드, GM-CSF 및 GM-CSF 저해성 핵산 분자들
RNAi는 이중-가닥으로 된 RNA (dsRNA, 또한 본 명세서에서 siRNA들 또는 이중-가닥으로 된 작은 간섭 RNA들을 나타내는 ds RNA로 지칭되기도 함)가 동물와 식물 세포들 안에서 상동성 mRNA의 서열-특이적 분해를 유도하는 공정이다. 포유류 세포들에서, RNAi는 작은 간섭 RNA (siRNA)의 21개 뉴클레오티드(nt) 듀플렉스, 또는 micro-RNA들 (miRNA), 기능적 작은-헤어핀 RNA (shRNA), 또는 RNA 중합효소 III 프로모터와 함께 DNA 주형을 이용하여 생체내에서 발현되는 기타 dsRNA들에 의해 촉발될 수 있다.
핵산 분자들 또는 구조체들은 각 가닥에 16-30개, 가령, 16개, 17개, 18개, 19개, 20개, 21개, 22개, 23개, 24개, 25개, 26개, 27개, 28개, 29개, 또는 30개의 뉴클레오티드를 포함하는 dsRNA 분자들을 포함할 수 있는데, 이때 이 가닥중 하나는 mRNA에서 표적 영역에 대해 실질적으로 동일한, 가령, 최소한 80% (또는 그 이상, 가령, 85%, 90%, 95%, 99% 또는 100%) 동일한, 가령, 3개, 2개, 1개, 또는 0개의 부정합된(mismatched) 뉴클레오티드(들)을 가지며, 다른 한 가닥은 제 1가닥에 상보적이다. dsRNA 분자들은 화학적으로 합성되거나, 시험관내에서 DNA 주형로부터 또는 생체내에서 shRNA로부터 전사될 수 있다. dsRNA 분자들은 당분야에 공지된 임의의 방법에 의해 기획될 수 있고; 많은 알고리즘이 공지되어 있고, 그리고 상업적으로 이용가능하다. siRNA의 저해성 활성을 최적화시키기 위하여 유전자 워크(walk) 방법들이 이용될 수 있다.
일부 구체예들에 따르면, OPN RNAi 핵산은 5가지의 모든 OPN 이소폼의 발현을 저해한다. 일부 구체예들에 따르면, OPN RNAi 핵산은 1개, 2개, 3개 또는 4개의 OPN 이소폼을 선택적으로 저해한다. 일부 구체예들에 따르면, OPN RNAi 핵산은 선택적으로 OPNc를 저해한다.
렛(rat) OPN mRNA의 예시적인 표적 서열은 다음과 같다: 5'-CAAGCTAGTCCTAGACCCTAA-3' (서열 번호: 19). 렛(rat) 락타드헤린 mRNA의 예시적인 표적 서열은 다음과 같다: 5'- CAGGATGAAAGCGGAACCGGA-3 ' (서열 번호: 20). 인간 유전자에서 대응하는 서열이 인간 단백질들의 발현을 저해하기 위한 표적 서열로 이용될 수 있다.
일부 구체예들에 따르면, 수용체가 IL-3과 IL-5로의 발현에 영향을 주지 않도록 하기 위하여 GM-CSF 수용체를 표적으로 하는 저해성 핵산은 α쇄의 발현을 저해한다. 일부 구체예들에 따르면, GM-CSF 수용체를 표적으로 하는 저해성 핵산은 이를 테면 IL-3과 IL-5 수용체들의 발현을 또한 차단시키기 위하여, βc 쇄의 발현을 저해한다.
GM-CSF의 발현을 저해시키는데 적합한 shRNA를 형성하는 예시적인 올리고뉴클레오티드는 실시예들에서 제시된다.
특정 인간 유전자를 위한 RNAi 핵산, 가령, siRNA들을 작제하는데 적합한 표적 서열을 선택하는 몇 가지 도구들은 월드 와이드 웹(www)에서 이용가능하다. 웹 사이트에는 또한 다른 RNA 기반 저해제 분자들을 기획하는데 적합한 도구들도 제시되고 있다. 이러한 도구들은 G/C 비율, siRNA 크기, siRNA들의 열역학적 성질, 출발 뉴클레오티드, 그리고 게놈 또는 RNA 서열들과의 임의의 상동성을 고려할 수 있다.
상기 OPN과 락타드헤린 siRNA 표적 서열들 각각에 적합한 예시적인 헤어핀 삽입부들은 다음과 같다:
RAT OPN siRNA:
센스: 5'-r(AGC UAG UCC UAG ACC CUA A)dTdT-3' (서열 번호: 35)
안티센스: 5'-r(UUA GGG UCU AGG ACU AGC U)dTdG-3'(서열 번호: 36)
RAT 락타드헤린 siRNA:
센스 5'-r(GGA UGA AAG CGG AAC CGG A)dTdT (서열 번호: 37)
안티센스 5'-r(UCC GGU UCC GCU UUC AUC QdTdG (서열 번호: 38)
예시적인 방법들은 가령, 인간의 세포 또는 조직에서 인테그린 리간드, 가령, OPN의 발현을 저해하는 것을 포함하는데, 이 방법은 이 세포 또는 조직에 인테그린 리간드을 인코드하는 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열이 포함된 저해성 핵산, 이를 테면 siRNA의 유효량을 노출 또는 접촉(또는 투여)하는 것을 포함한다.
인간 GM-CSF를 저해하는데 적합한 예시적인 헤어핀 삽입부들은 다음과 같다:
센스:
5'GATCCAAAGAGAACCTGAAGGACTTTTCAAGAGAAAGTCCTTCAGGTTCTCTTT GTTTTTTGGAAA'3 (서열 번호: 39).
안티센스:
5'AGCTTTTCCAAAAAACAAAGAGAACCTGAAGGACTTTCTCTTGAAAAGTCCTTC AGGTTCTCTTTG ' 3 (서열 번호: 40)
인간 GM-CSF 수용체를 저해하는데 적합한 예시적인 헤어핀 삽입부들은 다음과 같다:
센스:
5'GATCCCCGGACAGCCCTGTGGCTATATTCAAGAGATATAGCCACAGGGCTGTC CTTTTTTGGAAG'3 (서열 번호: 41)
안티센스:
5'TCGACTTCCAAAAAAGGACAGCCCTGTGGCTATATCTCTTGAATATAGCCACAG GGCTGTCCGGG'3 (서열 번호: 42)
Scherr M 등, Oligonucleotides; 13(5):353-63; 2003)에 공개됨.
예시적인 방법들은 가령, 인간의 세포 또는 조직(가령, GM-CSF의 경우 종양, 그리고 GM-CSF 수용체의 경우 대식세포 또는 소교세포)에서 인테그린 리간드, 가령, GM-CSF 또는 GM-CSF 수용체의 발현을 저해하는 것을 포함하는데, 이 방법은 이 세포 또는 조직에 GM-CSF 또는 GM-CSF 수용체를 인코드하는 뉴클레오티드 서열에 상보적인 뉴클레오티드 서열이 포함된 저해성 핵산, 이를 테면 siRNA의 유효량을 노출 또는 접촉(또는 투여)하는 것을 포함한다.
핵산 조성물들은 siRNA 및 변형된 siRNA 유도물질들, 가령, 성질, 이를 테면 조성물의 약리동력학, 예를 들면, 신체내에서 반감기를 증가시키고, 뉴클레아제 저항성을 증가시키는 등의 성질을 변경시키기 위하여 변형된 siRNA들, 뿐만 아니라 제작된 RNAi 전구물질들을 포함할 수 있다. 다양한 siRNA 변경은 U.S. 20050176667에서 설명된다(이의 전문이 명세서의 참고자료에 편입된다).
RNAi 핵산들, 가령, siRNA들은 당분야에 공지된 방법들, 가령, 양이온 리포좀 형질감염과 전기천공에 의해 세포로 전달될 수 있다. siRNA 듀플렉스는 기능적 이중-가닥으로 된 siRNA들을 발현시킬 수 있는 포유류 Pol III 프로모터 시스템 (가령, HI 또는 U6/snRNA 프로모터 시스템을 이용하여 제작된 RNAi 전구물질들, 가령, 재조합 DNA 구조체들로부터 세포 내에서 발현될 수 있다. siRNA는 5'-3'과 3'-5' 방향에서 표적 유전자의 서열에 상보적이며, siRNA의 두 가닥들은 동일한 구조체 또는 별개의 구조체들에서 발현될 수 있다. T7 프로모터 조절하에 siRNA 서열을 포함하는 구조체들은 T7 RNA 중합효소를 발현시키는 벡터와 함께 세포내 공동-형질감염될 때 기능적 siRNA들을 또한 만든다.
B) 인테그린 리간드, GM-CSF와 GM-CSF 수용체 안티센스 분자들
일부 구체예들에 따르면, 인테그린 리간드, 가령, OPN은 하나 또는 그 이상의 인테그린 리간드 안티센스 분자들에 의해 저해된다.
일부 구체예들에 따르면, GM-CSF 또는 GM-CSF 수용체는 각각 차례로 하나 또는 그 이상의 GM-CSF 또는 GM-CSF 수용체 안티센스 분자들에 의해 저해된다.
"안티센스" 핵산은 단백질을 인코드하는 "센스" 핵산에 상보적인, 가령, 이중-가닥으로 된 cDNA 분자의 코딩 가닥에 상보적이거나 또는 인테그린 리간드 mRNA 서열에 상보적인 뉴클레오티드 서열을 포함할 수 있다. 안티센스 핵산은 표적 서열, 가령, mRNA, 또는 이의 단지 일부분의 전체 코딩 가닥에 상보적일 수 있다. 일부 구체예들에 따르면, 안티센스 핵산 분자는 뉴클레오티드 서열의 코딩 가닥의 "넌코딩" 영역 (가령, 5' 및 3' 해독안된 영역들)에 대하여 안티센스다. 예를 들면 안티센스 올리고뉴클레오티드는 표적 mRNA의 해독 개시 부위 주변 영역, 가령, 관심대상의 표적 유전자 뉴클레오티드 서열의 -10에서 +10 사이의 영역들에 대하여 상보적일 수 있다. 안티센스 올리고뉴클레오티드의 길이는 예를 들면 약 7개, 10개, 15개, 20개, 25개, 30개, 35개, 40개, 45개, 50개, 55개, 60개, 65개, 70개, 75개, 80개, 또는 그 이상의 뉴클레오티드일 수 있다.
안티센스 핵산은 당분야에 공지된 과정에 따라 화학적 합성과 효소적 결찰 반응들을 이용하여 작제될 수 있다. 예를 들면 안티센스 핵산 (가령, 안티센스 올리고뉴클레오티드)은 자연 발생 뉴클레오티드들 또는 분자들의 생물학적 안정성을 증가시키거나 또는 안티센스와 센스 핵산들 사이에 형성된 듀플렉스의 물리적 안정성을 증가시키기 위하여 기획된 다양하게 변형된 뉴클레오티드를 이용하여 화학적으로 합성될 수 있는데, 가령, 포스포로티오에이트 유도물질들과 아크리딘 치환된 뉴클레오티드들이 이용될 수 있다. 안티센스 핵산은 핵산이 안티센스 방향으로 서브클론된 발현 벡터를 이용하여 생물학적으로 또한 만들어질 수 있다.
본 명세서에서 공개된 서열들에 근거하여, 당업자는 본 발명에 따라 사용하기에 적합한 임의의 수의 적절한 안티센스 분자들을 선택하고 합성할 수 있다. 예를 들면 표적 핵산 길이에 걸친 15-30개 뉴클레오티드의 일련의 올리고뉴클레오티드를 포함하는 "유전자 워크(walk)"가 준비될 수 있어, 이어서 표적 유전자 발현의 저해에 대하여 테스트될 수 있다. 합성되고 테스트된 올리고뉴클레오티드 수를 감소시키기 위하여 임의선택적으로 5-10개의 뉴클레오티드의 갭(gap)을 올리고뉴클레오티드 사이에 남겨둘 수 있다.
RNAi 핵산들과 유사하게, 당업계 숙련자는 OPN 이소폼의 모든 또는 유일한 하위집단을 표적으로 하는 안티센스 분자들을 기획할 수 있다.
일부 구체예들에 따르면, 안티센스 핵산 분자는 α-아노머 핵산 분자다. α-아노머 핵산 분자는 상보적 RNA와 함께 특이적 이중-가닥으로 된 하이브리드를 형성하는데, 통상적인 β-단위들과 대조적으로, 이 가닥들은 서로 평행하게 이어진다. 안티센스 핵산 분자는 2'-o-메틸리보뉴클레오티드 또는 키메라 RNA-DNA 유사체를 또한 포함할 수 있다.
일부 구체예들에 따르면, 안티센스 핵산은 몰포리노 올리고뉴클레오티드다.
표적 유전자 발현은 표적 세포들에서 Spt5 유전자의 전사를 방해하는 삼중 헬릭스 수조를 형성하기 위하여 조절 영역(가령, 프로모터 및/또는 인헨서)에 상보적인 뉴클레오티드 서열을 표적화함으로써 또한 저해될 수 있다. 삼중 헬릭스 형성에 대하여 표적화될 수 있는 잠재적 서열은 소위 "스위치백(switchback)" 핵산 분자를 만듦으로써 증가될 수 있다. 스위치백 분자들은 듀플렉스의 제 1 가닥과 염기쌍을 이루고, 그 다음 다른 가닥과 염기상을 이루는 5'-3',3'-5'의 교번 방식으로 합성되어, 듀플렉스의 한 가작에 존재하는 퓨린 또는 피리미딘의 상당크기의 스트레취(stretch)의 필요성을 없앤다.
C) 인테그린 리간드, GM-CSF와 GM-CSF 수용체 리보자임들
일부 구체예들에 따르면, 인테그린 리간드, 가령, OPN은 하나 또는 그 이상의 인테그린 리간드 리보자임에 의해 저해된다.
일부 구체예들에 따르면, GM-CSF 또는 GM-CSF 수용체는 각각 차례로 하나 또는 그 이상의 GM-CSF 또는 GM-CSF 수용체 리보자임에 의해 저해된다.
리보자임들은 특이적, 서열-의존적 방식으로 다른 RNA 표적을 효소적으로 절단하고, 그리고 비활성화시키기 위하여 제작된 RNA 유형이다. 표적 RNA를 절단함으로써, 리보자임들은 해독을 저해하고, 따라서 표적 유전자의 발현이 저지된다. 리보자임들은 실험실에서 화학적으로 합성되고, 당분야에 공지된 방법을 이용하여 이들의 안정성 및 촉매 활성을 증가시키기 위하여 구조적으로 변경될 수 있다. 대안으로, 리보자임 유전자들은 당분야에 공지된 유전자-전달 기전을 통하여 세포 안으로 도입될 수 있다. 인테그린 리간드 핵산에 특이성을 보유하는 리보자임은 인테그린 리간드 핵산, 이를 테면 인테그린 리간드 유전자의 뉴클레오티드 서열에 상보적인 하나 또는 그 이상의 서열과 mRNA 절단을 담당하는 공지의 촉매 서열을 가진 서열을 포함할 수 있다. GM-CSF 핵산에 대한 특이성을 보유하는 리보자임은 GM-CSF 핵산, 이를 테면 GM-CSF 유전자의 뉴클레오티드 서열에 상보적인 하나 또는 그 이상의 서열과 mRNA 절단을 담당하는 공지의 촉매 서열을 가진 서열을 포함할 수 있다.
RNAi와 안티센스 핵산들에 유사하게, 당업계 숙련자는 OPN 이소폼의 모든 또는 유일한 하위집단을 표적으로 하는 안티센스 분자들을 기획할 수 있다.
D) 인테그린 리간드, GM-CSF와 GM-CSF 수용체 압타머들
압타머들은 특이적 단백질들에 특이적으로 결합할 수 있는 짧은 올리고뉴클레오티드 서열이다. 상이한 압타머 서열들은 상이한 단백질들에 특이적으로 결합할 수 있다는 것이 드러났다. 이러한 RNA 압타머들의 선별 및 조제 방법은 당분야에 공지되어 있다.
E) 인테그린 리간드들, GM-CSF 또는 GM-CSF 수용체를 표적으로 하는 DNA 효소
일부 구체예들에 따르면, 인테그린 리간드를 인코드하는 핵산의 발현은 인테그린 리간드 유전자의 전사체를 표적으로 하는 DNA 효소에 의해 저해되거나 또는 감소된다.
일부 구체예들에 따르면, GM-CSF 또는 GM-CSF 수용체를 인코드하는 핵산의 발현은 GM-CSF 또는 GM-CSF 수용체 유전자의 각 전사체를 표적으로 하는 DNA 효소에 의해 저해되거나 또는 감소된다.
DNA 효소는 Watson-Crick 염기-쌍형성에 의해 RNA 기질에 선택적으로 결합하고, 그리고 임의의 퓨린-피리미딘 접합부에서 RNA 기질의 기본골격의 포스포디에스테르 결합을 절단할 수 있는 DNA로 구성된 마그네슘-의존적 촉매 핵산이다. DNA 효소는 2개의 별도 기능적 도메인들로 구성되는데: 포스포디에스테르 결합 절단을 실행하는 15개-뉴클레오티드 촉매 코어, 그리고 촉매 코어의 측면에 있는 2개의 혼성화 암(arms); 암(arm)들의 서열 확인은 표적 RNA 기질과 상보적 염기-쌍형성을 획득하도록 주문될 수 있다.
따라서, DNA 효소는 퓨린-피리미딘 접합부의 측면에 있는 인테그린 유전자, GM-CSF 또는 GM-CSF 수용체 유전자의 전사체 상의 영역들과 어닐링되어, DNA 효소의 촉매 코어가 접합부에서 전사체를 절단하여, 이 전사체들이 해독되어 기능적 인테그린 리간드 단백질/ GM-CSF 또는 GM-CSF 단백질을 생산할 수 없도록 하는 상보적 영역들을 보유할 것이다.
DNA 효소는 당분야에 공지된 표준 기술로 합성될 수 있는데, 예를 들면 자동화된 핵산 합성기를 포함하는 표준 포스포라미다이트 화학적 결찰 방법들이 이용되어 고형 지지판 상에서 DNA 분자가 3'에서 5'방향으로 DNA 분자가 합성될 수 있다. 대안으로, DNA 효소는 DNA 효소를 인코드하는 핵산 분자가 전사됨으로써 합성될 수 있다. 핵산 분자는 세포 발현 시스템 안으로 운반에 적합한 DNA 또는 RNA 벡터, 예를 들면 바이러스 벡터 안에 포함될 수 있다. 적합한 바이러스 벡터들은 백시니아바이러스 벡터들과 아데노바이러스 벡터들을 포함한다.
따라서, 인테그린 리간드 또는 GM-CSF/GM-CSF 수용체는 세포 또는 조직에 DNA 효소를 노출시켜, DNA 효소가 세포에 의해 취입되고, 세포 안에서 인테그린 리간드 또는 GM-CSF/GM-CSF 수용체 전사체를 표적으로 하여 이들을 절단하고, 이로 인하여 세포 또는 조직 안에서 기능적 인테그린 리간드 단백질의 발현이 감소되거나 발현이 없도록 하는 것을 포함하는 방법에 의해, 세포 또는 조직에서 인테그린 리간드 또는 GM-CSF/GM-CSF 수용체가 저해될 수 있다. 노출은 세포에 네이키드(naked) DNA 효소를 노출시켜, 세포가 생체내에서 네이키드 DNA를 취입할 수 있도록 하는 것을 포함한다. 대안으로, DNA 효소가 핵산 벡터, 이를 테면 바이러스 벡터내에 포함되어 있는 경우, 이 바이러스 벡터로 세포를 감염시킬 수 있다.
작은 분자
인테그린
리간드
,
GM
-
CSF
와
GM
-
CSF
수용체 저해제들
일부 구체예들에 따르면, 전-종양 활성을 보유한 침투 대식세포를 가진 종양들을 치료하는 치료제들은 작은 분자들 또는 "저해성 작은 분자 화학적 화합물"이다. 작은 분자 치료제는 인테그린 리간드 또는 GM-CSF의 발현 또는 활성을 저해 또는 감소시킬 수 있다. 작은 분자 치료제는 인테그린 리간드와 인테그린 사이의 상호작용을 저해 또는 감소시킬 수 있고, 또는 GM-CSF와 GM-CSF 수용체 사이의 상호작용을 감소시킬 수 있다. 작은 분자 치료제는 인테그린 리간드가 대식세포 또는 소교세포 상의 인테그린에 결합됨으로써 활성화되는 신호 변환 경로를 또한 저해 또는 감소시킬 수 있거나, 또는 GM-CSF가 대식세포 또는 소교세포 상의 GM-CSF 수용체에 결합됨으로써 활성화되는 신호 변환 경로를 또한 감소시킬 수 있다. 예를 들면 FAK, JAK2 및 Akt에 대한 공지의 저해제들을 이용하여 전-종양 활성을 보유한 침투 대식세포가 있는 종양을 치료할 수 있다.
작은 분자 치료제들은 본 명세서에서 더 설명되는 것과 같이, 스크리닝 분석을 이용하여 또한 확인될 수 있다. 작은 분자 치료제들은 임의의 유형의 분자, 가령, 스크리닝 분석 부분에서 설명되는 것들이 될 수 있다.
치료제 투여 및 약학적 조성물들
전-종양 활성을 보유한 뇌 거주 (소교세포) 및 말초 대식세포에 의해 침투된 종양들을 가지고 있는 대상을 치료하는 방법들이 본 명세서에서 제시된다. 용어 "대식세포"는 뇌 거주 (소교세포) 및 말초 대식세포를 포괄하는 것으로 본 명세서에서 이용된다. 이 방법은 이를 필요로 하는 대상에게 치료학적 유효량의 인테그린 리간드 저해제를 투여하고, 이로 인하여 대상의 종양에서 대식 세포의 전-종양 활성이 감소되는 것을 포함한다. 일부 구체예들에 따르면, 인테그린 리간드 저해제는 가령, 종양에 국소적으로, 또는 전신적으로 투여된다. 이 방법들은 이 종양 크기를 유지 또는 안정화시키거나, 또는 이 종양 크기를 최소한 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 이상으로 감소시킬 수 있다.
용어 "치료(treating)"는 임상 결과를 포함하는 유익한 또는 바람직한 결과를 획득하기 위한 접근방법을 지칭한다. 유익한 또는 바람직한 임상 결과들은 하나 또는 그 이상의 증상 또는 상태의 경감 또는 개선, 질병의 범위 감소, 질환 상태의 안정화, 질환 또는 상태의 확산 또는 발달의 저지, 질병 진행의 지연 또는 서행, 질병 상태와 재발(부분적 또는 전체적으로)의 개선 및 변경을 포함하나 이에 한정되지 않는다. "치료"는 치료하지 않을 때 예상되는 것 이상으로 환자의 생존 연장을 또한 의미할 수 있다. "치료"는 질병의 진행을 저해, 일시적으로 질병의 진행을 느리게 하는 것을 또한 의미할 수 있지만, 더욱 바람직하게는 질병의 진행을 영구적으로 중단시키는 것이다.
치료 또는 예방이 필요한 대상은 인간일 수 있다. 이 대상은 종양을 가진 대상, 이를 테면, 암환자일 수 있다. 본 명세서에서 설명된 방법에 따라 치료될 수 있는 종양은 전-종양 활성을 가진 대식세포에 의해 침투된 종양들을 포함한다. 대식세포의 "전-종양" 활성은 항-종양 반응들을 개시하기보다는 가령, 매트릭스 재구성에 참여, 침투, 혈관신생과 적응성 면역의 억제함으로써 종양의 발달에 기여하는 특정 대식세포의 능력을 지칭한다. 전-종양 활성을 보유한 대식세포들은 "M2-유사 표현형"을 보유한다고 때때로 언급된다. 전-종양 활성을 보유한 침투 대식세포를 보유한 예시적인 종양은 뇌 종양, 이를 테면 악성 신경교종이다. 신경교종은 뇌실막세포종, 성상세포종 (가령, 교아종 다양한 형태), 희소돌기아교세포종 또는 핍지교성상세포종일 수 있다. 신경교종은 낮은-등급 신경교종 또는 높은 등급 신경교종일 수 있다. 신경교종은 천막상부(supratentorial) 신경교종, 천막하부(infratentorial) 신경교종 또는 뇌교(pontine) 신경교종일 수도 있다.
일부 구체예들에 따르면, 본 명세서에서 설명된 방법들은 대상이 종양, 이를 테면 악성 종양을 보유하는 지를 판단하는 것을 포함한다. 일부 구체예들에 따르면, 본 명세서에서 설명된 방법들은 대상이 전-종양 활성을 보유한 대식세포에 의해 침투된 종양을 보유하는 지를 판단하는 것을 포함한다. 일부 구체예들에 따르면, 이 방법은 우선 대상이 신경교종을 보유하는 지를 판단하는 것을 포함한다. 일단 이러한 판단이 이루어진 후, 본 방법들은 대상을 효과적으로 치료할 수 있는 양의 인테그린 리간드 저해제, 이를 테면 OPN 또는 락타드헤린 저해제를 이 대상에게 투여함으로써, 종양을 안정화시키거나 또는 종양 크기를 감소시키는 것을 포함할 수 있다.
일부 구체예들에 따르면, 본 명세서에서 설명된 방법들은 대상이 비정상적으로 높은 수준의 GM-CSF를 분비하는 종양을 보유하는 지를 판단하는 것을 포함한다. 이 방법은 종양 또는 종양의 주변 환경이 건강한 대상의 동일한 또는 유사한 조직에서 발견되는 것보다 더 많은 GM-CSF를 보유하는지를 판단하는 것을 포함한다. 이 방법은 최소한 40 pg/ml, 최소한 50 pg/ml, 최소한 70pg/ml, 최소한 100 pg/ml, 최소한 200 pg/ml, 최소한 300 pg/ml, 최소한 400pg/ml 또는 최소한 500pg/ml의 혈청 GM-1 수준을 보유하는 지를 판단하는 것을 포함할 수 있다. 일부 구체예들에 따르면, 이 방법은 우선 대상이 신경교종을 보유하는 지를 판단하는 것을 포함한다. 이 방법은 대상이 높은 수준의 GM-CSF를 분비하는 신경교종을 보유하는 지를 판단하는 것을 또한 포함한다. 하나 또는 그 이상의 상기 판단이 이루어진 후, 본 방법들은 대상을 효과적으로 치료할 수 있는 양의 GM-CSF 저해제를 이 대상에게 투여함으로써, 종양을 안정화시키거나 또는 종양 크기를 감소시키는 것을 포함할 수 있다.
본 명세서에서 설명된 저해성 핵산 분자들은 대상에게 투여될 수 있거나(가령, 조직 부위에 직접 주사에 의해), 또는 그 위치에서 생성되어, 표적 단백질, 가령, OPN, 락타드헤린 또는 GM-CSF/GM-CSF 수용체를 인코드하는 세포 mRNA 및/또는 게놈 DNA와 혼성화되는 또는 이에 결합되고, 이로써 가령, 전사 및/또는 해독을 저해함으로써 표적 단백질의 발현이 저해된다. 대안으로, 저해성 핵산 분자들은 선택된 세포를 표적으로 삼도록 변형되고, 전신으로 투여될 수 있다. 전신 투여의 경우, 저해성 핵산 분자들은 선택된 세포 표면상에서 발현되는 수용체들 또는 항원들에 특이적으로 결합되도록 변형될 수 있는데, 가령, 이 저해성 핵산 핵산 분자들, 또는 이들을 포함하는 운반 비이클, 이를 테면 리포좀을 세포 표면 수용체 또는 항원에 결합하는 펩티드 또는 항체에 연결시켜 변형될 수 있다. 이 저해성 핵산 분자들은 벡터를 이용하여 세포로 운반될 수도 있다. 세포 내에서 저해성 핵산 분자들의 충분한 농도를 획득하기 위하여, 저해성 핵산 핵산 분자가 강력한 프로모터 조절하에 위치되어 있는 벡터 구조체들이 이용될 수 있다. 운반체 이를 테면 리포좀 및 내화를 유도하는 다른 것들도 또한 이용될 수 있다.
치료제, 가령, 인테그린 리간드 저해제 또는 GM-CSF 저해제는 당분야에 공지된 표준 기술을 이용하여 환자에게 투여될 수 있다. 치료제는 전신으로 투여되거나, 표적 세포가 위치된 부위, 가령, 뇌에 직접적으로 투여될 수 있다. 이런 부위로 운반은 예를 들면 백색 지방 조직에 국소 투여, 부위에 주사, 또는 외과적 이식을 포함한다.
투여되는 치료제의 농도 및 양은 치료될 장애, 투여되는 치료제 유형, 투여 방식 그리고 환자의 연령 및 건강에 따라 달라질 것이다. 그러나, 당업자는 적절한 양을 결정할 수 있다.
투여를 돕기 위하여, 이 치료제는 약학 조성물 안의 성분으로 제형화될 수 있다. 따라서, 추가 구체예에서, 치료제와 약학적으로 수용가능한 희석제를 포함하는 약학 조성물이 제시된다. 따라서, 질환, 이를 테면 암을 치료하는데 이용되는 약학 조성물이 또한 제시된다. 이 조성물들은 약학적으로 수용가능한 농도의 염, 완충 물질, 보존제 및 다양한 양립가능한 운반체를 통상적으로 함유할 수 있다. 모든 형태의 운반을 위하여, 치료제는 생리학적 염 용액으로 제형화될 수 있다. 치료제들은 표적 세포로 치료제가 운반될 때까지 치료제를 보호 및/또는 보존하는데 유용한 리포좀 또는 기타 생물물질 안에 포집될 수 있다. 리포좀은 원하는 위치, 가령, 종양으로 치료제가 표적화되는 것을 또한 도울 수 있다.
상기 약학제학적 조성물들은 추가적으로 다른 암 치료제들과 같이, 질병을 치료하기에 유용한 다른 치료제들을 포함할 수 있다. 몇몇 실시예들에 따르면, 전-종양 활성(pro-tumoral activity)을 갖는 침윤 대식세포의 전-종양 활성을 억제 또는 경감시키는 1 이상의 다른 치료제들이 투여된다. 상기 치료제들은 간세포 생장인자(hepatocyte growth factor, HGF) 억제제; 단핵세포 화학주성 단백질-1(monocyte chemotactic protein-1, MCP-1) 억제제; MCP-3 억제제 및 CXCRL1-CXCR1 억제제를 포함한다.
몇몇 실시예들에 따르면, 본 발명은 인테그린 리간드 억제제의 약제학적으로 허용가능한 제제의 투여에 관한 것이다. 몇몇 실시예들에 따르면, 본 발명은 GM-CSF or GM-CSF 수용체 억제제의 약제학적으로 허용가능한 제제의 투여에 관한 것이다. "약제학적으로 허용가능한 제제"는 목적하는 결과를 나타내는 방식으로 적합한 인테그린 리간드 억제제 투여에 적절하고, 환자들에게 잠재적인 이득보다 잠재적인 해가 더 큰 부정적인 부작용을 생성하지 않아, 의사들을 설득시키기 충분한 것이다.
몇몇 실시예들에 따르면, 상기 언급한 방법은 인테그린 리간드 억제제를 GM-CSF 억제제와 함께 투여하는 것을 포함한다. 몇몇 실시예들에 따르면, 방법은 신경교종(glioma)을 가지는 피험자 또는 신경교종의 발병이 가능한 피험자에게, 치료학적으로 유효량의 인테그린 리간드 억제제, 예컨대, 오스테오폰틴(osteopontin) 억제제 또는 락타드헤린(lactadherin) 억제제 및 GM-CSF 억제제를 투여하는 것을 포함한다. 몇몇 실시예들에 따르면, 방법은 신경교종을 가지는 피험자 또는 신경교종 발병이 가능한 피험자에게 GM-CSF 억제제와 함께 오스테오폰틴(osteopontin) 억제제 및 락타드헤린(lactadherin) 억제제의 치료학적 유효량을 투여하는 것을 포함한다. 상기 방법은 우선 신경교종을 가지는 피험자의 샘플 내의 GM-CSF, 오스테오폰틴 및/또는 락타드헤린의 농도를 결정하는 것을 포함할 수 있고, GM-CSF, 오스테오폰틴 및/또는 락타드헤린의 농도가 신경교종의 악성형(aggressive form)과 같은 신경교종에 관련된 농도를 초과한다면, GM-CSF 억제제를 오스테오폰틴 억제제 및/또는 락타드헤린 억제제와 같은 인테그린 리간드 억제제와 조합하여 투여한다.
본 발명의 상기 약제학적 조성물은 치료학적 유효량, 및 임의의 추가적인 활성 물질 또는 활성 물질들을 약제학적으로 허용가능한 담체와 혼합물의 형태로 조합하여, 환자에게 투여하기에 적절한 약제학적으로 허용가능한 조성물의 알려져 있는 제조방법으로 제조될 수 있다. 이를 토대로, 상기 약제학적 조성물은, 유일하지는 않더라도, 적절한 pH 및 생리적 체액과 등삼투성(iso-osmotic)을 갖는 완충액에 함유되고, 1 이상의 약제학적으로 허용가능한 담체 또는 희석제와 관련된 치료적 용액을 포함한다.
치료제와 함께 사용되는 약제학적으로 허용가능한 희석제의 비율 및 정체(identity)는 투여 경로, 생 세포와의 양립성(compatibility) 및 표준 약제학적 실무(standard pharmaceutical practice)의 선택에 따라 결정된다. 일반적으로, 약제학적 조성물은 치료제의 생물학적 물성을 죽이지 않거나, 상당히 손상시키지 않는 성분과 함께 만들어질 수 있다.
본 발명의 상기 약제학적 조성물은 당해 기술분야의 기술자가 이해하는 바와 같이, 선택된 투여 경로에 따라 다양한 방식으로 환자에게 투여될 수 있다. 예를 들어, 조성물은 국부적, 외과적으로 또는 목적하는 부위에 주사하여 투여될 수 있다. 몇몇 실시예들에 따르면, 치료제는 국부적 또는, 주사(피하, 정맥, 근육)에 의해 환자 내에 표적세포, 예를 들어 백색 지방 세포(white adipose cell),가 위치한 목적하는 부위에 직접 투여할 수 있다.
진단 및
바이오마커
적용례
또한, 이하에서는 진단, 예후 및 바이오마커에 기초한 방법들 및 조성물이 제공된다. 방법들은 인테그린 리간드, 예를 들어, OPN 또는 락타드헤린의 농도 결정 및/또는 GM-CSF의 농도 결정에 기초할 수 있다. 샘플 내의 인테그린 리간드 및/또는 GM-CSF의 농도는, 예를 들어 항체가 특정 인테그린 리간드에 특이적으로 결합하는 항체를 이용한 ELISA 또는 웨스턴 블랏을 사용하는 것과 같은 다양한 방법, 방법에 의해 결정될 수 있다. 상기 방법은 또한 전-종양 활성을 갖는 종양 침윤 대식세포 또는 소교세포(microglia)의 농도, 또는 수의 결정에 의존할 수 있다. 대식세포 또는 소교세포는 전-종양 활성을 갖는 대식세포 또는 소교세포에 존재하는 상기 세포 표면 마커에 근거하여, 분리 또는 동정될 수 있으나, 전-종양 활성을 가지지 않는 것은 그렇지 아니하다. 마커들의 예를 이하에서 구체적으로 서술한다.
분석들은, 각 단백질들의 농도(level)를 결정하는 대신, 또는 이에 더하여, 예를 들어 종양세포 내, 인테그린 리간드들 및/또는 GM-CSF의 mRNA의 농도 결정에 기초할 수 있다.
방법들은 피험자로부터 조직 샘플을 얻는 것을 포함할 수 있다. 조직 샘플은 종양 샘플, 뇌 또는 중추 신경계(central nervous system, CNS) 샘플, 예를 들어, 신경교종 종양(glioma tumor)으로부터 획득된 샘플일 수 있다. 상기 샘플은 혈액 또는 혈청 또는 다른 체액일 수 있다
본 발명은 신경교종을 가지는 피험자의 신경교종 종양 샘플을 제공하는 것 및 피험자의 신경교종 종양 내 OPN 또는 락타드헤린의 농도 또는 활성을 결정(determining, 측정)하는 것을 포함하여, 신경교종 종양을 가진 피험자의 신경교종 치료제에 대한 반응성 여부를 결정하는 방법을 제공하는 것으로, 여기서,
(i) 치료제 처리 초기 또는 치료제 처리 시작 전의 OPN 또는 락타드헤린의 농도 또는 활성과 비교하여, 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성이 더 낮은 경우, 긍정적인 결과를 갖는 치료를 나타낸다.; 및
(ii) 치료제 처리 초기 또는 치료제 처리 시작 전의 OPN 또는 락타드헤린의 농도 또는 활성과 비교하여, 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성이 더 높은 경우, 긍정적이지 않은 결과를 갖는 치료를 나타낸다.
추가적으로, 본 발명은 신경교종을 가지는 피험자의 신경교종 종양 샘플을 제공하는 것 및 대식세포 또는 소교세포 표면의 수용체에 OPN 또는 락타드헤린이 결합함으로써, 대식세포 또는 소교세포에서 활성화되는 신호 전달 경로 내 분자의 농도 또는 활성을 결정하는 것을 포함하는, 신경교종 종양을 가진 피험자의 신경교종 치료제에 대한 반응성 여부를 결정하는 방법을 제공하는 것으로, 여기서,
(i) 치료제 처리 초기 또는 치료제 처리 시작 전의 분자의 농도 또는 활성과 비교하여, 샘플 내의 분자의 농도 또는 활성이 더 낮은 경우, 긍정적인 결과를 갖는 치료를 나타낸다.; 및
(ii) 치료제 처리 초기 또는 치료제 처리 시작 전의 분자의 농도 또는 활성과 비교하여, 샘플 내의 분자의 농도 또는 활성이 더 높은 경우, 긍정적이지 않은 결과를 갖는 치료를 나타낸다.
추가적으로, 본 발명은 신경교종을 가지는 피험자의 신경교종 종양 샘플을 제공하는 것 및 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도를 결정하는 것을 포함하는, 신경교종을 가지는 피험자의 신경교종 치료제에 대한 반응성 여부를 결정하는 방법을 제공하는 것으로, 여기서,
(i) 치료제 처리 초기 또는 치료제 처리 시작 전의 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도와 비교하여, 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포 농도가 더 낮은 경우, 긍정적인 결과를 갖는 치료를 나타낸다.; 및
(ii) 치료제 처리 초기 또는 치료제 처리 시작 전의 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도와 비교하여, 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포 농도가 더 높은 경우, 부정적인 결과를 갖는 치료를 나타낸다.
치료제는 OPN 또는 락타드헤린 억제제와 같은 인테그린 리간드 억제제일 수 있고, 이하에서 구체적으로 서술한다.
추가적으로, 본 발명은 피험자의 신경교종 종양 샘플을 제공하는 것 및 피험자의 신경교종 종양 내 OPN 또는 락타드헤린의 농도 또는 활성을 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정하는 방법을 제공하는 것으로, 여기서,
(i) 초기 신경교종 내 OPN 또는 락타드헤린의 농도 또는 활성과 비교하여 샘플 내의, OPN 또는 락타드헤린의 농도 또는 활성이 더 낮은 경우, 좋은 예후를 나타낸다.; 및
(ii) 초기 신경 교종 내 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성과 비교하여, 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성이 더 높은 경우, 좋지 않은 예후를 나타낸다.
본 발명은 추가적으로 피험자의 신경교종 종양 샘플을 제공하는 것, 및 대식세포 또는 소교세포 표면의 수용체에 OPN 또는 락타드헤린이 결합함으로써, 대식세포 또는 미세교세포에서 활성화되는 신호 전달 경로 내 분자의 농도 또는 활성을 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정하는 방법을 제공하는 것으로서, 여기서,
(i) 초기 신경교종 내 분자의 농도 또는 활성과 비교하여, 샘플 내의 분자의 농도 또는 활성이 더 낮은 경우, 좋은 예후를 나타낸다.
(ii) 초기 신경교종 내의 분자의 농도 또는 활성과 비교하여, 샘플 내의 분자의 농도 또는 활성이 더 높은 경우, 좋지 않은 예후를 나타낸다.
추가적으로, 본 발명은 피험자의 신경교종 종양의 샘플을 제공하는 것 및 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도를 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정하는 방법을 제공하는 것으로, 여기서,
(i) 초기 신경교종 내 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도와 비교하여, 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포 농도가 더 낮은 경우, 긍정적인 결과를 갖는 치료를 나타낸다.; 및
(ii) 초기 신경교종 내 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도와 비교하여, 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도가 더 높은 경우, 좋은 예후를 나타내지 않는다.
본 발명은 피험자의 신경교종 종양 샘플을 제공하는 것, 및 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성을 결정하는 것을 포함하는 신경교종 종양을 가지는 피험자의 예후 결정 방법을 제공하는 것으로, 여기서, 대조값보다 낮은(예: < 20 ng/mL) 상기 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성은 피험자의 예후가 좋은 것을 나타내고, 반면, 대조값보다 높은(예: > 20 ng/mL) 샘플 내의 OPN 또는 락타드헤린의 농도 또는 활성은 좋지 않은 예후를 나타낸다.
추가적으로, 본 발명은 피험자의 신경교종 종양 샘플을 제공하는 것 및 샘플 내의 대식세포 또는 소교세포 상의 인테그린에 OPN 또는 락타드헤린의 결합에 의하여 대식세포 또는 미세교세포에서 활성화되는 신호 전달 경로 내의 분자의 농도 또는 활성을 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정 방법을 제공하는 것으로, 여기서, 대조값보다 낮은 상기 샘플 내의 분자의 농도 또는 활성은 피험자의 예후가 좋은 것을 나타내고, 반면, 대조값보다 높은 샘플 내의 분자의 농도 또는 활성은 좋지 않은 예후를 나타낸다.
본 발명은 추가적으로 피험자의 신경교종 종양 샘플을 제공하는 것 및 샘플 내의 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도를 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정 방법을 제공하는 것으로, 여기서, 대조값보다 낮은 상기 샘플 내 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도는 피험자의 예후가 좋은 것을 나타내고, 반면, 대조값보다 높은 샘플 내 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도는 좋지 않은 예후를 나타낸다.
대조값은 좋은 예후를 나타내는(예를 들면, 안정화, 퇴행화되거나, 또는 다른 신경교종에 비해 매우 느리게 진행되는 신경교종), 피험자 내 전-종양 활성을 가지는 대식세포 또는 소교세포의 농도의 평균(예; 통계적으로 유의적인)일 수 있다. 상기 대조값은 20 ng/mL일 수 있다.
또한, 예를 들어 전-종양 활성을 나타내는, 침윤 대식세포와 관련된 종양을 확인하는 방법이 제공된다. 상기 방법은 종양 샘플, 예를 들어, 신경교종 샘플과 같은 종양 샘플을 제공하는 것 및 인테그린 리간드(예를 들어, OPN 또는 락타드헤린)과 수용체(예를 들어 인테그린)과의 결합에 의해 조절되는 1 이상 신호 전달 분자의 농도 또는 활성(예: 인산화 정도)을 결정하는 것을 포함할 수 있다. 상기 마커들의 상승 농도는 전-종양 활성을 가지는 종양 침윤 대식세포 또는 소교세포의 존재를 나타낸다.
나아가, 전-종양 활성을 나타내는 침윤 대식세포를 가지는 종양의 존재를 결정하는 진단 방법들이 제공된다. 상기 방법은 피험자의 조직 샘플을 제공하는 것 및 인테그린 리간드, 예를 들어 OPN 또는 락타드헤린의 농도를 결정하는 것을 포함할 수 있다. 인테그린 리간드의 존재는 종양의 존재 및 좋지 않은 예후를 나타내고, 또한, 전-종양 활성을 가지는 침윤 대식세포 또는 소교세포의 존재를 나타낸다. 몇몇 실시예들에 따르면, 샘플 내의 OPN 또는 락타드헤린의 존재는 조직, 예를 들어 종양,이 항-염증 활성보다는 전-종양(또는 전구-침습성(pro-invasive))을 갖는 대식세포 또는 소교세포를 포함하는 것을 나타낸다.
피험자의 조직 샘플, 예를 들어, 뇌 샘플 내의 OPN 또는 락타드헤린의 존재는 뇌 종양, 예를 들어 신경교종을 가지는 피험자의 존재를 나타낸다. 일 실시예에서, 방법은 피험자의 뇌 조직 샘플을 제공하는 것 및 뇌 조직 샘플 내의 OPN 또는 락타드헤린의 농도를 결정하는 것을 포함하고, 여기서, 신경교종을 가지지 않는 대조군에 비하여, 상기 피험자의 뇌 조직 샘플 내의 OPN 또는 락타드헤린의 농도가 통계적으로 유의적으로 더 높은 것은, 상기 피험자가 신경교종을 가지거나 신경교종의 발병 위험이 높음을 나타낸다.
본 발명은 추가적으로, 종양을 가지는 피험자의 샘플을 제공하는 것 및 샘플 내의 GM-CSF의 농도를 결정하는 것을 포함하는, 종양, 예를 들어, 신경교종을 가지는 피험자의 예후를 결정 방법을 제공하는 것으로서, 여기서,
(i) 종양을 가지고 있지 않은 피험자 내 농도와 비교하여 종양을 가지는 피험자의 샘플 내의 GM-CSF 농도가 더 높은 것은, 피험자가 좋지 않은 예후를 가지는 것을 나타낸다.
(ii) 종양을 가지고 있지 않은 피험자 내 농도와 비교하여 종양을 가지는 피험자 샘플 내의 GM-CSF 농도가 유사 또는 더 낮은 것은, 피험자가 좋은 예후를 가지는 것을 나타낸다.
상기 샘플은 뇌 샘플, 종양 샘플, 조직 샘플 또는 종양 부근의 조직 또는 유체(예; 두개(頭蓋) 내의 체액) 샘플, 혈액 또는 혈청 샘플일 수 있다. 상기 종양은 신경교종, 예를 들어 다형성 교종(glioma multiforme)일 수 있다. 상기 방법은 GM-CSF 단백질의 농도 또는 GM-CSF 핵산, 예를 들어 mRNA와 같은 RNA의 농도를 결정하는 것을 포함할 수 있다. 상기 GM-CSF 단백질의 농도는 건강한 피험자 내에서는 측정 불가능하고; 40 pg/ml 와 동등 또는 초과의 GM-CSF 농도는 비정상적 조건, 예를 들어 종양의 존재, 천식, 기생충 감염 또는 신경복구(neurorepair)임을 나타낸다. 따라서, 종양을 가지지 않은 피험자 내 GM-CSF의 농도는 < 40 pg/ml이고, GBMs 내 GM-CSF는(1.23 ± 0.37 pg/ml; p < 0.0001) 건강한 대조군과 비교된다(0.09 ± 0.1l pg/ml (Afat 등. J Neurosurg, 2010, 112(l):43-9)).
여기서 언급하는 바와 같이, GM-CSF 의 농도는 낮은 정도의 신경교종에서 3 내지 5 배까지, 높은 정도의 신경교종에서 200 배 초과까지 상향조절된다. 따라서, 또한, 종양을 가지는 피험자의 샘플을 제공하는 것 및 상기 샘플 내의 GM-CSF 농도를 결정하는 것을 포함하는, 종양, 예를 들면 신경교종을 가지는 피험자의 예후(또는 질병의 심각성) 결정 방법이 제공되는 것으로, 여기서,
(i) 종양을 가지고 있지 않은 피험자 내 농도와 비교하여, 종양을 가지는 피험자의 샘플 내의 GM-CSF 의 농도가 최소 100 배, 150 배 또는 200 배 높은 것은, 좋지 않은 예후를 나타낸다; 및
(ii) 종양을 가지고 있지 않은 피험자 내 농도와 비교하여, 종양을 가지는 피험자의 샘플 내의 GM-CSF 농도가 유사 또는 더 낮은 것은. 좋은 예후를 나타낸다.
본 발명은 추가적으로 종양을 가지는 피험자의 혈청 샘플을 제공하는 것 및 샘플 내의 GM-CSF의 농도를 결정하는 것을 포함하는, 종양, 예를 들어 신경교종을 가지는 피험자의 예후 결정 방법을 제공하는 것으로서, 여기서,
(i) 종양을 가지는 피험자의 혈청 샘플 중 GM-CSF의 농도가 lOO pg/ml, 150 pg/ml, 200 pg/ml, 300 pg/ml, 400 pg/ml, 또는 500 pg/ml 이상인 것은, 좋지 않은 예후를 나타낸다.; 및
(ii) 종양을 가지는 피험자의 혈청 샘플 중 GM-CSF의 농도가 1OO pg/ml, 70 pg/ml, 50 pg/ml, 또는 40 pg/ml보다 낮은 것은, 좋은 예후를 나타낸다.
또한, 이하에서는 종양을 가지는 피험자의 혈청 샘플을 제공하는 것 및 상기 샘플 내의 GM-CSF 농도를 결정하는 것을 포함하는, 피험자 내의 종양의 심각성 (또는 악성도)를 결정하는 방법이 제공되는 것으로, 여기서,
(i) 종양을 가지는 피험자의 혈청 샘플 중 GM-CSF의 농도가 lOO pg/ml, 150 pg/ml, 200 pg/ml, 300 pg/ml, 400 pg/ml, 또는 500 pg/ml 이상인 것은, 피험자가 공격적인 암, 예를 들면, 높은 정도의 신경교종을 가지는 것을 나타낸다.; 및
(ii) 종양을 가지는 피험자의 혈청 샘플 중 GM-CSF의 농도가 1OO pg/ml, 70 pg/ml, 50 pg/ml, 또는 40 pg/ml보다 낮은 것은, 공격적인 암을 가지지 않고, 매우 낮은 정도의 신경교종을 가질 수 있음을 나타낸다.
또한, 본 발명의 상기 방법들은 GM-CSF 농도 측정 방식으로 GM-CSF를 통해 신호 전달의 농도를 결정하는 것을 포함할 수 있다. 상기 방법은 또한, GM-CSF의 농도 결정을 위한 측정으로, GM-CSF 와 이의 수용체가 결합함으로써 활성화되는 신호 전달 분자의 농도를 결정하는 것을 포함할 수 있다. 분자는 활성화된 JAK2와 같은 JAK2 일 수 있다. 상기 방법의 일 예는 다음과 같다 :
본 발명은 추가적으로 종양을 가지는 피험자의 샘플을 제공하는 것 및 샘플 내의 활성화된 GM-CSF 신호 전달 분자(예; 활성화 또는 인산화 JAK2) 의 농도를 결정하는 것을 포함하는, 신경교종과 같은 종양을 가지는 피험자의 예후 (또는 질병의 심각도)결정 방법이 제공되며, 여기서,
(i) 종양을 가지지 않는 피험자 내 농도와 비교하여 종양을 가지는 피험자의 샘플 내의 활성화된 GM-CSF 신호 전달 분자의 농도가 더 높은 것은, 피험자가 좋지 않은 예후를 나타낸다.; 및
(ii) 종양을 가지지 않는 피험자 내 농도와 비교하여 종양을 가지는 피험자의 샘플 내의 활성화된 GM-CSF 신호 전달 분자의 농도가 더 낮은 것은, 좋은 예후를 나타낸다.
본 발명은 추가적으로, 피험자의 신경교종 종양 샘플을 제공하는 것 및 상기 샘플 내의 GM-CSF의 농도를 결정하는 것을 포함하는, 신경교종 종양을 가지는 피험자의 예후를 결정하는 방법을 제공하는 것으로서, 여기서, 대조값보다 낮은 상기 GM-CSF의 농도는 좋은 예후를 나타내고, 반면, 대조값보다 높은 GM-CSF의 농도는 좋지 않은 예후를 나타낸다. 상기 대조값은 좋은 예후를 나타내는(예를 들면, 안정화, 퇴행화되거나, 다른 신경교종에 비해 매우 느리게 진행되는 신경교종), 피험자 내 농도의 평균(예; 통계적으로 유의적인)일 수 있다. 상기 피험자의 샘플 내의 GM-CSF의 대조값은 50 pg/ml, 40 pg/ml, 또는 15 pg/mL일 수 있다.
본 발명은 추가적으로 피험자의 샘플을 제공하는 것 및 피험자의 샘플 내의 GM-CSF 농도 또는 활성을 결정하는 것을 포함하는, 종양, 예를 들어 신경교종을 가지는 피험자의 종양 치료제에 대한 반응성 여부의 결정 방법을 제공하는 것으로서, 여기서,
(iii) 치료제 처리 초기 또는 치료제 처리 시작 전에 샘플 내의 GM-CSF 농도 또는 활성과 비교하여 더 낮은 샘플 내의 GM-CSF의 농도 또는 활성은, 긍정적인 결과를 갖는 치료를 나타낸다.
(iv) 치료제 처리 초기 또는 치료제 처리 시작 전에 샘플 내의 GM-CSF 농도 또는 활성과 비교하여 보다 높은 샘플 내의 GM-CSF 농도 또는 활성은, 긍정적인 결과 나타내지 않는 치료를 나타낸다.
본 발명은 추가적으로 피험자의 샘플을 제공하는 것 및 대식세포 또는 소교세포 상의 GM-CSF 수용체와 GM-CSF 결합으로 인한 대식세포 또는 소교세포 내 활성화된 신호 전달 경로 내 분자의 농도 또는 활성을 결정하는 것을 포함하는 종양, 예를 들어 신경교종을 가지는 피험자의 종양 치료제에 대한 반응성 여부를 결정하는 방법을 제공하는 것으로, 여기서,
(iii) 치료제 처리 초기 또는 치료제 처리 시작 전의 종양 내 또는 종양 부근의 분자의 농도 또는 활성과 비교하여, 샘플 내의 분자의 농도 또는 활성이 보다 낮은 것은, 긍정적인 결과를 갖는 치료를 나타낸다.
(iv) 치료제 처리 초기 또는 치료제 처리 시작 전의 종양 내 또는 종양 부근의 분자의 농도 또는 활성과 비교하여, 샘플 내 분자의 농도 또는 활성이 보다 높은 것은, 긍정적인 결과를 갖는 치료를 나타내지 않는다.
상기 분자는 JAK2일 수 있으며, 예컨대, 활성화된 또는 인산화된 JAK2일 수 있다.
또한, 상기에서 언급한, 예를 들어 GM-CSF 억제제 투여에 의하여, 여기서 기재된 바와 같이 처치된 피험자를 규명하는 방법을 제공한다. 피험자들을 규명하는 방법들은 피험자로부터, 예를 들어 뇌 샘플로부터 샘플, 예를 들어 뇌 종양 샘플 또는 두개내 유체(intracranial fluid) 샘플, 또는 혈액 또는 혈청 샘플을 얻는 것 및 샘플 내의 GM-CSF 단백질의 농도 또는 활성(예:활성은 결정될 수 있다)을 포함할 수 있고, 여기서, 대조값에 비하여 샘플 내의 높은 GM-CSF 농도 또는 활성의 존재는 피험자가 GM-CSF 억제제를 투여에 의해 치료될 수 있음을 나타내는 반면, 대조값에 비해 더 낮은 샘플 내의 GM-CSF 농도 또는 활성은 피험자가 GM-CSF 억제제에 의한 치료에 대하여 반응성이지 않은 것을 나타낸다. 대조값은 뇌 종양을 가지지 않은 피험자(예를 들어, 신경교종을 가지지 않은 피험자) 내 GM-CSF 농도 또는 활성의 중간 또는 평균(통계적으로 유의적인) 일 수 있다. 예를 들어, 대조값은, 예컨대, 혈청 샘플 내에서, 40 pg/ml 또는 lOO pg/ml일 수 있다. 따라서, 예를 들어, 40 pg/ml, lOO pg/ml, 250 pg/ml, 300 pg/ml, 400 pg/ml 또는 500 pg/ml 초과의 GM-CSF의 혈액 또는 혈청 농도를 가지는 피험자는 GM-CSF 억제제를 투여함으로써 치료될 수 있는 반면, GM-CSF의 혈액 또는 혈청 농도가 lOO pg/ml 미만 또는 40pg/ml 미만인 피험자의 경우, GM-CSF 억제제 치료에 대하여 반응성이 아닐 수 있다.
몇몇 실시예들에 따르면, 방법은 피험자가 신경교종을 가지는지 결정할 수 있고, 피험자 및 피험자가 신경교종을 가진다면, 피험자의 샘플, 예를들어 종양 샘플, 뇌 샘플 또는 혈청 샘플 내의 GM-CSF 의 농도 또는 활성을 결정하는 것을 포함하고, 여기서 피험자 내 GM-CSF 의 농도 또는 활성이 신경교종을 가지지 않는 피험자에 비해 더 높거나, 대조값(예; 40pg/ml, lOOpg/ml, 250pg/ml, 300pg/ml, 400pg/ml 또는 500pg/ml serum GM-CSF)에 비해 높은 경우, GM-CSF 억제제 치료에 반응성인 것을 나타내는 반면, 피험자 내 GM-CSF 농도 또는 활성이 신경교종을 가지지 않은 피험자에 비해 유사 또는 낮거나, 대조값(예; lOO pg/ml 또는 40 pg/ml serum GM-CSF)보다 낮은 경우, 피험자는 GM-CSF 억제제 치료에 반응성이지 않은 것을 나타낸다.
상기 GM-CSF 억제제 치료에 대하여 피험자가 반응성인지 아닌지 여부를 결정하는 방법은, 피험자에게 GM-CSF 억제제를 투여하는 것(예; 단회투여(single dose of)); 피험체로부터 샘플을 획득하는 것 및 GM-CSF 의 농도를 결정하는 것을 더 포함할 수 있고, 상기에서 GM-CSF 억제제 투여 이전의 농도와 비교하여, 피험자 샘플 내의 GM-CSF 농도가 낮은 것은, 피험자가 GM-CSF 억제제 치료에 대하여 반응성임을 나타내는 반면, GM-CSF 억제제 투여 이전의 농도에 대한 피험자 샘플 내의 GM-CSF 농도가 유사 또는 더 높은 것은, 피험자가 GM-CSF 치료에 대하여 반응성이지 않은 것을 나타낸다. 상기 방법은 GM-CSF 억제제 투여 이전에 종양 샘플을 얻는 것을 포함할 수 있다.
상기 GM-CSF 억제제 치료에 대하여 피험자가 반응성인지 아닌지 여부를 결정하는방법은 피험자에게 GM-CSF 억제제를 투여하는 것(예; 단회투여(single dose of)); 피험체로부터 종양 샘플을 획득하는 것 및 종양 내 침입한 대식세포/소교세포의 농도를 결정하는 것을 더 포함할 수 있고, 상기에서 GM-CSF 억제제 투여 이전의 종양 내 침입한 대식세포/소교세포의 농도와 비교하여 피험자 종양 샘플 내의 침입한 대식세포/소교세포의 농도가 낮은 것은 피험자가 GM-CSF 억제제 치료에 대하여 반응성임을 나타내는 반면, GM-CSF 억제제 투여 이전의 종양 내 침입한 대식세포/소교세포의 농도와 비교하여, 피험자 종양 샘플 내의 침습한 대식세포/소교세포의 농도가 유사 또는 높은 것은, 피험자가 GM-CSF 치료에 대하여 반응성 이지 않은 것을 나타낸다. 상기 방법은 GM-CSF 억제제 투여 이전에 종양 샘플을 얻는 것을 포함할 수 있다.
나아가, GM-CSF을 생산하는 종양, 예를 들어 공격적인 신경교종의 존재를 결정하는 진단 방법이 제공된다. 상기 방법은 피험자 샘플, 뇌 샘플 또는 종양 샘플 또는 혈청 샘플을 제공하는 것 및 GM-CSF 농도 또는 활성을 결정하는 것을 포함할 수 있다. 신경교종을 가지지 않는 피험자 내 GM-CSF의 존재 또는 활성의 최소 100 배, 150 배, 200 배, 250 배, 300 배, 400 배 또는 500 배 초과는 종양의 존재 및 좋지 않은 예후를 나타낸다.
또한, 피험자의 체내 GM-CSF 농도의 측정은, 예를 들어, GM-CSF을 감지하는 이미징 기술(imaging technologies)을 사용하여 가능하다. 이 경우, 피험자로부터 샘플을 얻을 필요가 없다.
본 발명은 추가적으로 대식세포의 전-종양 활성을 억제할 수 있는 억제제를 규명하기 위한 스크리닝 분석(screening assays)을 제공한다. 스크리닝 분석은 GCM 유도 액틴 세포골격 변화(actin cytoskeleton changes) 및 형광 비드 식세포작용(fluorescent beads phagocytosis)의 분석에 기초한 분석; 소교세포의 존재 또는 부존재 중 신경교종 세포의 침습성(invasiveness) 테스팅에 근거한 분석, 예를 들어, DAPI 염색 및 iCys™ 리서치 이미징 세포분석기(Research Imaging Cytometer)가 뒤따르는, 정량 마트리겔 매트릭스 침습 분석(Matrigel matrix invasion assay) ; 특정 M2 타입 유전자 발현: Argl, mtl-mmp, CXCL4, c-Myc, SMAD7 을 포함한다. 상기 유전자들은 GCM 및 인테그린 리간드에 의해 선택적으로 유도된 유전자들이다.
스크리닝 분석의 일 예는, 시험 화합물의 존재 또는 부존재 조건에서, 전-종양 활성을 가지는 대식세포 또는 소교세포를 인테그린 리간드, 예를 들어 OPN(예; 인간 OPN) 또는 락타드헤린(예; 인간 락타드헤린) 또는 생물학적 활성 단편 또는 이들의 변이체(예; RGD 모티프(motif)를 포함하는)와 접촉시키는 것 및 시험 시약의 존재가 대식세포 또는 소교세포의 전-종양 활성의 적어도 일부를 최소한 반전하는지 것인지 여부를 결정하는 것을 포함할 수 있다. 이는 예를 들어, 전-종양 활성을 나타내는 대식세포 또는 소교세포에 특이성이고, 대식세포 또는 소교세포에는 존재하지 않는(또는 다른 농도로 존재) 마커를 측정함으로써 결정될 수 있다. 전-종양 활성을 나타내지 않는 본 분석에서 사용되는 대식 세포 또는 소교세포는 정제된 세포 집단(cell population) 일 수 있고(예를 들어, 분리된 세포 또는 세포 집단), 또는 다른 세포(예를 들어, 종양 세포)와 함께 조성물로 존재할 수 있다. 예를 들어, 세포 집단은 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 내외의, 전-종양 활성을 가지는 대식세포 또는 소교세포를 함유할 수 있다. 상기 대식세포 또는 소교세포는 세포주일 수 있다.
치료학적 조성물은 항-종양 활성을 가지는 대식세포 또는 소교세포를 각각 전-종양 활성을 가지는 대식세포 또는 소교세포로 변화에 매개 또는 기여하는 인테그린 리간드(예를 들어, OPN 또는 락타드헤린)를 억제하는 능력에 의해 규명(identify, 확인)될 수 있다. 방법의 예로, 항-종양 활성을 가지는 대식세포 또는 소교세포의 집단과 인테그린 리간드(예를 들어, OPN 또는 락타드헤린)를 시험 화합물 존재 또는 부존재 하에서, 접촉시키는 것 및 시험 화합물 억제제 존재가 항-종양 활성을 가지는 대식세포 또는 소교세포가 자신의 항-종양 활성을 잃고, 전-종양 활성을 얻는 것을 저해 또는 방지하는지를 결정하는 것을 포함할 수 있다.
본 분석에 사용되는 상기 대식세포 또는 소교세포는 정제된 세포 집단일 수 있고(예를 들어, 분리된 세포 또는 세포 집단), 또는 다른 세포(예를 들어, 종양 세포)와 함께 조성물로 존재할 수 있다. 예를 들어, 세포 집단은 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 내외의, 항-종양 활성을 가지는 대식세포 또는 소교세포를 함유할 수 있다. 상기 대식세포 또는 소교세포는 세포주일 수 있다.
또한, 상기 스크리닝 방법은 시험 화합물의 존재 또는 부존재 조건에서, 인테그린(예를 들어, αVβ3)을 OPN, 또는 락타드헤린 또는 그 생물학적 활성 단편 또는 변이체(예; RGD 모티프를 포함하는)와 접촉시키는 것, 및 시험 화합물이 OPN 또는 락타드헤린 또는 그 단편 또는 변이체와 인테그린 사이의 상호작용을 억제 또는 감소하는지 여부를 결정하는 것을 포함하고, 여기서 상기 시험 화합물은 최소 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 로 상기 작용을 감소시키는 시험 화합물은 여기서 언급한 방법에서 언급한 인테그린 리간드 억제제를 사용할 수 있다.
또한, 여기에는 GM-CSF, 신생 혈관 생성(angiogenesis) 또는 종양 부위로의 대식세포 또는 소교세포의 유입에 의해 유도된 종양 진행을 억제할 수 있는 제제를 확인하는 데 유용한 스크리닝 분석이 제공된다.
상기 방법은 GM-CSF를 생성하는 종양 세포(예를 들어 신경교종 세포)와, 최소 하나의 GM-CSF 생물학적 활성을 억제하는 시험 화합물을 접촉시키는 것 및 대식세포 또는 소교세포가 종양 세포의 위치로 유입되는지 여부를 결정하는 것 또는 종양의 진행을 늦출 수 있는지 여부에 대한 결정을 포함할 수 있다. 일 실시예에서, 분석은 기관형 뇌 단편 배양(organotypical brain slice culture)을 사용하고, 상기 분석은 시험 화합물, 예를 들어 최소 1 이상의 GM-CSF 활성을 억제하는 시험 화합물을 배양시 첨가하는 것을 포함한다. 시험 화합물을 첨가하지 않은 배양액과 비교하여 종양 세포로의 대식세포/소교세포의 이동의 감소량은, 시험 화합물이 GM-CSF 억제제이고, 이는 GM-CSF를 분비하는 종양치료에 사용될 수 있음을 나타낸다.
여기서 언급된 방법에서 사용되는 GM-CSF 억제제를 규명하는 방법은 GM-CSF 을 생성하는 종양 세포(예를 들어, 신경교종 세포)와 시험 화합물을 접촉시키는 것 및 종양 세포에 의한 GM-CSF 생성이 느려지는지를 결정하는 것을 포함한다. 종양 세포에 의한 GM-CSF 생성을 느리게 하는 시험 화합물은 여기서 언급한 방법들에서 GM-CSF을 분비하는 종양 및 선택적으로 종양 침윤 대식세포 또는 소교세포를 가지는 피험자를 치료하기 위해 사용되는 화합물일 수 있다. 분석에서 사용되는 종양 세포(예를 들어 신경교종 세포)는 정제된 세포 집단일 수 있고(예를 들어, 분리된 세포 또는 세포 집단), 또는 다른 세포(예를 들어, 침윤 대식세포 또는 미세아교세포)와 함께 조성물로 존재할 수 있다. 예를 들어, 종양 세포 집단은 10%, 20%, 30% 또는 40% 내외의 대식세포 또는 소교세포를 함유할 수 있다. 상기 종양 세포는 세포주의 세포, 예를 들어 실시예에서 언급되는 세포일 수 있다.
또한, 상기 스크리닝 방법은 시험 화합물의 존재 또는 부존재 조건에서, GM-CSF(예; 인간 GM-CSF) 또는 그 생물학적 활성 단편 또는 변이체를 GM-CSF 수용체(용해가능한 또는 세포막)에 접촉시키고, 시험 화합물이 GM-CSF, 또는 이들의 단편 또는 변이체와 GM-CSF 수용체 간의 상호작용을 최소 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 95% 로 억제 또는 감소할 수 있는지 여부를 결정하는 것을 포함할 수 있으며, 여기에서 상기 상호작용을 저해 또는 감소시키는 시험 화합물은 언급한 방법들에 사용될 수 있는 GM-CSF 억제제이다.
상기 방법은 추가적으로 세포 기반 분석 또는 생체 내(in vivo) 분석, 예를 들어 시험 화합물이 대식세포의 전-종양 활성을 반전시키는지 또는 항-종양 활성을 갖는 대식세포가 전-종양 활성을 나타내는 대식세포로 전환되는 것을 방지하는지 여부를 결정하는 분석으로, 규명된 시험 화합물을 테스팅하는 것을 포함할 수 있다.
몇몇 실시예들에 따르면, 상기 시험 화합물들은 처음에 라이브러리(library)의 성분(예를 들어 무기 또는 유기 화학 라이브러리, 펩타이드 라이브러리, 올리고뉴클레오타이드 라이브러리 또는 혼합-분자 라이브러리)일 수 있다. 몇몇 실시예들에 따르면, 상기 방법들은 소 분자(small molecule)(예를 들어, 자연물 또는 조합 화학 라이브러리의 성분)를 스크리닝하는 것을 포함한다.
주어진 라이브러리는 구조적으로 연관 또는 연관되지 않은 시험 화합물의 세트를 포함할 수 있다. 바람직하게, 한 세트의 다양한 분자는 전하(charge), 방향족성(aromaticity), 수소결합, 유연성(flexibility), 크기, 측쇄(side chain)의 길이, 소수성(hydrophobicity), 경직성(rigidity)과 같은 다양한 기능성을 포함하도록 사용되어야 한다. 라이브러리 생성에 적절한 조합 기술은 당해 기술분야에 알려져 있다. 나아가, 소분자 라이브러리를 포함하는 많은 라이브러리들은 상용화된 것을 사용할 수 있다.
몇몇 실시예들에 따르면, 시험 화합물들은 펩타이드 또는 펩티도미메틱(peptidomimetic) 분자일 수 있다. 예를 들면, 비-자연적 발생 아미노산을 함유하는 펩타이드를 포함하거나 또는 비-펩타이드 연결을 가지는 펩타이드 유사체(analogs); 펩티도미메틱(예; 펩토이드 올리고머(peptoid oligomer), 펩토이드 아미드(peptoid amide) 또는 에스테르 유사체, 베타-펩타이드, D-펩타이드, L-펩타이드, 올리고우레아(oligourea) 또는 올리고카바메이트(oligocarbamate)); 소 펩타이드(예; 펜타펩타이드(pentapeptides), 헥사펩타이드(hexapeptides), 헵타펩타이드(heptapeptides), 옥타펩타이드(octapeptides), 노나펩타이드(nonapeptides), 데카펩타이드(decapeptides), 또는 보다 큰 예를 들어, 20-mers 이상의 펩타이드); 사이클릭 펩타이드(cyclic peptides); 다른 비-자연성(non-natural) 또는 부자연성(unnatural) 펩타이드 유사 구조; 및 무기 분자(예;헤테로사이클릭 고리 분자(heterocyclic ring molecules)). 몇몇 실시예들에 따르면, 상기 시험 화합물들은 핵산, 예를 들어, DNA, RNA 또는 올리코뉴클레오타이드이다.
몇몇 실시예들에 따르면, 시험 화합물들 및 이들의 라이브러리들은 첫번째 시험 화합물의 체계적 구조 변화에 의해 획득될 수 있다. 예를 들어, 일 실시예에서, 첫번째 시험 소분자를 선택하기 위하여, 일반적인 소분자 라이브러리가 예를 들어, 여기서 기재한 방법들을 사용하여 스크리닝 된다. 당해 기술 분야에서 알려진 방법들을 사용하여, 상기 소분자의 구조는 필요하다면 규명되고, 종국의 생물학적 활성도, 예를 들어 구조-활성 상관관계 분석에 의하여 연관된다. 당해 기술 분야의 기술자는 구조-활성 상관관계를 정립할 다양한 표준 방법이 있음을 이해한다. 그러므로, 몇몇 예에서, 상기 스크리닝은 주로 경험적 및 다른 것들일 수 있으며, 내생(endogenous) 폴리펩타이드의 3 차원 구조 또는 이들의 일부는 소분자 화합물 또는 화합물들의 이론적 설계를 위한 출발점으로 이용될 수 있다.
몇몇 실시예들에 따르면, 첫 스크리닝에서 "히트(hits)"(예; 항-종양 대식세포의 전-종양 대식세포로의 전환을 방지하는 또는 대식세포의 전-종양 활성을 항-종양 활성으로 되돌리는 시험 화합물)된 것으로 규명된 시험 화합물들은 선택되고, 또한m 예를 들어, 합리적 설계(rational design), 결합 친화도, 결합능(avidity), 특이성, 또는 다른 파라미터들을 최적화하도록 최적화되었다. 잠재적으로 최적화 구조는 여기서 기재된 방법들의 사용으로 스크리닝 될 수 있다. 그러므로, 일 실시예에서, 발명은 여기에서 언급한 방법을 사용하여, 시험 화합물들의 첫번째 라이브러리(first library)를 스크리닝 하는 것, 그 라이브러리 중 1 이상의 히트를 규명하는 것, 히트와 구조적으로 관련된 1 이상의 2 세대 화합물들(second generation compounds)을 생성하기 위해 상기 히트들을 체계적 구조 변화시키는 것, 및 상기 2 세대 화합물들을 스크리닝 하는 것을 포함한다. 추가적인 최적화 라운드는 목적하는 치료적 프로파일(profile)을 나타내는 시험 화합물을 규명하기 위해 사용될 수 있다.
히트로 규명된 시험 화합물들은 상술한 장애를 치료 및 예방하는 방법에서 유용한 치료적 화합물의 후보로 고려될 수 있다. 그러므로, 또한 발명은 상술한 방법에 의하여 히트로 확인된 화합물을 포함하고, 상술한 질병의 치료, 예방 또는 질병의 발달 지연. 또는 진행 지연을 위한 투여 및 사용 방법을 포함한다.
또한, 치료하기 위한 하기의 키트를 제공한다; 진단, 예후 또는 바이오마커 사용을 위한 키트, 및 스크리닝 분석을 위한 키트. 상기 키트들은 치료, 진단, 예후, 바이오마커 분석 또는 스크리닝 분석 방법들에서 사용되는 최소 1 이상의 요소를 포함할 수 있다.
하기 예들은 본 발명의 어떤 실시예들을 보다 충분히 상술하기 위한 것이다. 그러나, 어떤 방식으로 발명의 넓은 범위를 제한하여 해석하지 아니한다. 당해 기술분야의 기술자는 본 발명의 범위를 벗어나지 않고, 개시된 원리의 다양한 변형 및 수정을 용이하게 할 수 있다.
실시예
실시예
1:
물질들과 방법들
세포 배양과 처리. 랫트의 소교세포의 초대 배양은 이전에 기술한 것처럼 태어난 지 하루 된 새끼 위스터 쥐로부터 제조하였다(Zawadzka 와 Kaminska 2003). 요약하면, 트립신을 통해 대뇌피질들로부터 세포들을 떼어, 기계적으로 분리하고, 폴리-L-라이신으로 코팅된 75cm2 의 배양 플라스크들 위에 열비활성화된 10% 소태아혈청 (Gibco), 100U/mL의 페니실린, 및 0.1mg/mL의 스트렙토마이신으로 보충된 둘베코 개질된 이글 배지(Glutamax와 고농도 글루코스 4.5g/L와 함께, Gibco)에서 3×105 cells/cm2 의 밀도로 플레이트하였다. 쥐의 pEGFP-GL261 신경교종 세포들은 DMEM에서 10% FBS와 항생제들(50U/ml의 페니실린, 50μg/ml의 스트렙토마이신)과 함께 배양하였다. 성상세포들의 초대 배양물들은 태어난 지 이틀 된 C57BL/6 신생 마우스들의 대뇌피질로부터 제조하였다. 성상세포들은 10% FBS, 100U/ml의 페니실린 및 100μg/ml의 스트렙토마이신으로 보충된 높은 당의 DMEM에서 배양하였다. 배양 배지는 3일 후 교체하였고, 이후 일주일에 두 번씩 교체하였다. 세포 배양물들을 인큐베이터(Heraeus, Hanau, Germany)에서 가습된 5% CO2/95% 공기 내에서 37℃로 유지하였다. 2주 후 약하게 부착된 소교세포들을 가볍게 흔드는 것과 원심분리(5분동안 300g)를 통해 접합된 글리알(glial) 배양들로부터 회수하였다. 몇몇 실험들에서 소교세포들을 RGD motif나 대조군을 함유한 7-아미노산 합성 펩타이드, 스크램블된 펩타이드로 처리하였다.
면역세포화학. 세포들을 인산완충식염수(PBS)로 세척하고 지정된 시한에 2% 파라포름알데히드로 고정하였다. 고정된 세포들을 실온에서 30분간 팔로이딘 테트라메틸로다민 B 이소티오시아네이트와 함께 배양하였다. 이후, 세포들을 PBS로 세척하였고 세포핵들을 10분간 DAPI 염색 (4, 6-디아미디노-2-페닐인돌, Sigma-Aldrich, Saint Louis, MO, USA, 10μg/mL)으로 가시화하고, 이후 PBS로 세 번 세척하였다. 형태학적 변화들을 여기 파장 450-490nm에서 형광 현미경을 통해 관찰하였고, 20X 배율로 기록하였다.
증식 분석. BrdU 혼입 테스트를 사용해 소교세포 증식 속도를 측정하였다. 요약하면, 5×104 개의 소교세포들을 96-웰 플레이트 위에 시딩시켰고, 48시간동안 배양하였으며, 그 후 LPS나 GCM으로 자극하였다. BrdU(10μΜ)을 24시간 후 상기 배양 배지에 첨가하였고 세포들을 이후 6시간동안 방치하였다. 그 후 세포들을 고정하였고, BrdU 혼입을 제조자의 프로토콜(Roche, Mannheim, Germany)에 따라 측정하였다.
세포 운동성과 침윤 분석. 소교세포들을 1.5×106 세포 밀도에서 35mm의 페트리 접시에 플레이트 하였고, 48시간 이후 상기 배양물들을 피펫 끝으로 부드럽게 긁었고, 소교세포들을 다양한 실험 조건들에서 배양하였다(대조군,lOOng/mL LPS 또는 G-CM). 소교세포들의 운동성을 처리 3시간 후에 측정하였다. 이주 세포들을 위상차 현미경을 통해 확인하였다.
침윤 분석을 문헌에 설명된 바 대로 수행하였다(Wesolowska 등. 2008, Kwiatkowska 등. 2011). 요약하면, 24-웰 조직 배양 삽입들(12μm 포어 크기 Transwell, Corning, NY, USA)을 Growth Factor Reduced Matrigel™ Matrix (BD Biosciences, San Diego. CA, USA)로 코팅하였다. 증류수에 용해된 Matrigel™ Matrix(1 mg/ml) 100μl을 5-6시간 동안 살균 조건(37℃)에서 건조하였고, 200μl 배양 배지에서 30분간 재구성하였다. C6 신경교종 세포들(1.5×l04/insert)을 저혈청 배지(2% FBS)에서 매트리겔 코팅된 막 위에 시드시켰고, 소교세포에 노출시키거나 처리하지 않았다. 48시간 후 세포들을 고정시켰고 세포핵들을 DAPI로 착색시켰다. Transwell®inserts 의 막들을 잘라내었고, Matrigel을 통해 이주한 세포들의 총 개수를 레이저 주사 혈구 계산(LSC,CompuCyte)에 의해 측정하였다. 모든 실험들을 3번씩 수행하였다. 세 번의 독립적인 실험들의 데이터들을 모았고 세포들의 평균 개수±S.D 로 표현되었다.
인테그린 사일런싱 . 소교세포들(1×105)을 24-웰 플레이트들에 시드시켰고, 24시간 이후 세포들을 0.5ml 배양 배지에서 0.25μl의 DharmaFECT 3 형질 주입 시약을 사용하여 25nM 대조군 비-표적화 siRNA, αv 또는 β3에 대한 siRNA, 또는 두 siRNA(ON-TARGET siRNA, Dharmacon)로 형질 전환하였다. 48시간 후, 형질 전환 배지를 G-CM으로 교체하고, 소교세포의 식세포 특성을 설명한 것처럼 측정하였다. 사일런싱 효율을 평가하기 위해 세포들을 트립신화를 통해 배양 플레이트에서 제거하고, MACS 완충액(PBS, 2mM EDTA, 0,5% BSA) 중에 최종 농도 1×105 cells/100μl로 현탁시켰다. 인테그린들의 세포 표면 발현을 αv 또는 β3에 대한 1차 항체(BD Biosciences)와 항 마우스-Alexa Fluor 647 이차항체(Invitrogen)를 사용하여 분석하였다. 표식된 세포들의 형광강도를 FACSCalibur(BecktonDickinson)로 분석하였다. 평균 형광강도를 대조군 siRNA와 비교하였고 각각의 실험 siRNA의 대조군 조건에 대한 상대적 변화로 표현하였다.
식세포 활동. 소교세포의 식세포 특성을 90분동안 2μm 형광 라텍스 비드들(Sigma-Aldrich, Saint Louis, MO, USA)과 함께 세포들을 인큐베이션하여 측정하였다. 소교세포를 1×106 세포 밀도에서 35mm 페트리 접시에 플레이트 하였고, 48시간동안 사일런싱 시킨 후, 24시간동안 상이한 실험 조건들(대조군, G-CM, 500μΜ RGD-펩타이드의 G-CM, 또는 스크램블 펩타이드)에 노출시켰다. 세포들을 PBS에서 두번 세척하였고, 2% 파라포름알데히드로 고정시켰고, FITC-콘쥬게이트 이소렉틴 B4로 착색시켰다. 식세포 활동의 없음/낮음(<2 세포 당 비드), 중간(≥2 <10) 또는 높음(≥10 세포 당 비드) 정도의 세포 백분율을 측정하였다. 또는, 세포들을 1.5×105 세포 밀도에서 24-웰 플레이트들에 시드시키고, 비드와 함께 인큐베이션 시킨 후 강도 높은 세척과 고정한 뒤, 마이크로플레이트 리더(Tecan)를 사용하여 총 형광도를 측정하였다.
단백질 분리, 전기 영동법 , 검출. 전체 세포용해물을, 포스파타아제와 프로테아제 억제제(20mM Tris HC1, pH6.8, 137 mM 염화 나트륨, 25mM β-glycerophosphate, 2 mM 피로인산나트륨, 2 mM EDTA, 1 mM sodium orthovanadate, 1% Triton X-100, 10% 글리세롤, 5μg/ml 류펩틴, 5μg/ml 아프로티닌, 2mM 벤자미딘, 0.5mM DTT, 1mM PMSF)를 함유한 완충액에 세포들을 긁어내는 것으로 준비하였다. 단백질 농도를 Bradford 분석(Sigma-Aldrich, Saint Louis, MO, USA)으로 측정하였다. 단백질 추출물들을 설명한 것처럼 니트로셀룰로오스(Amersham Biosciences, Germany)에 전기 영동 전이시키기 전에 SDS-PAGE상에 분리시켰다(Ellert-Miklaszewska 등. 2005; Sliwa 등. 2007). TBS-T(Tris-완충 염수 pH 7.6/0.15% Tween 20) 중 5% 무지방 우유로 블로킹한 뒤, 막들을 블록킹 완충액 중에 희석된 1차 항체와 함께 밤새 인큐베이트 시킨 후, 한시간 동안 관련 이차항체와 함께 인큐베이트 시켰다. Cox-2 뿐 아니라 p38, ER 1/2, INK, STAT1, STAT3, STAT5, AKT, FAK 과 ΙκΒ (모두 1 : 1000으로 희석된)의 항체 인식 인산화된 및 총 형태들, 및 horseradish peroxidase-conjugated anti-rabbit IgG (1 :2000으로 희석된)은 Cell Signaling Technology (Beverly, MA, USA)에서 구매하였고, iNOS(1 :2000으로 희석된)는 BD Biosciences (Bedford, MA, USA)에서 구매하였다. 면역복합체들을 ECL (Amersham)으로 가시화시켰다. 단백질 로딩의 동일 양을 확인하기 위해, 막들을 벗기고 horseradish peroxidase-conjugated anti-P-Actin 항체(1 : 10000으로 희석된, Sigma-Aldrich, Saint Louis, MO, USA)로 재프로빙하였다. 단백질들의 분자량을 미리 염색된 단백질 마커(Sigma-Aldrich, Saint Louis, MO, USA)로 측정하였다.
마이크로어레이 유전자 발현 프로파일링. 4개 내지 6개의 독립적으로 유도된 초대 글리아 배양들로부터 분리된 소교세포들을 48시간 동안 사일런스 세포들로 인큐베이트 시켰다. 배양들을 아무 처리하지 않거나(대조군 세포), 여섯시간 동안 lOOng/ml 리포다당류(LPS) 또는 G-CM으로 자극시켰다. 총 RNA을 제조자 추천에 따라 RNeasy Total RNA kit (Qiagen, Germany)을 사용해서 샘플들로부터 추출하였고, DNase 처리하였다. RNA의 양과 질을 Agilent Technologies의 Bioanalyser 2100 과 RNA 6000 LabChip kit로 모세관 전기이동법으로 측정하였다.
마이크로어레이 실험들은 템플릿으로 5μg의 총 RNA를 사용하여 Maria Sklodowska-Curie Memorial Cancer Center-Gliwice Branch (Gliwice, Poland)의 Affymetrix reference facility에서 수행하였다. 비오틴 라벨링된 cRNA들을 Affymetrix IVT labeling kit로 합성하였다. 분획된 cRNA를 일단 대조군 마이크로어레이로 하이브리드화시켰고, 샘플 질을 평가한 이후, 랫트의 게놈 230-2.0 유전자 칩들로 하이브리드화시켰다(28,000개의 랫트 유전자들을 포함한 31,042 probe sets).
마이크로어레이 데이터들을 "affy" R Bioconductor package (Irizarry 등. 2002)에서 시행한 것처럼 MAS 5.0 알고리즘으로 미리 진행시켰다. 적어도 세개의 하이브리드화에서 검출된 프로브셋들(Present로 부른다)만을 사용하였다. 이 프로브셋들을 Ensembl 56 gene identifiers에 맵핑하였고, log2-전환한 뒤, 각각의 유전자에 대한 평균치를 내었다. 상당히 변화된 발현을 보이는 유전자를 확인하기 위해 Welch의 근사법과 함께 Student's t-test를 사용하였다. 통계적 분석과 데이터 가시화에 Mathematica (Wolfram Research)를 사용하였다. false-discovery rate (FDR) 분석을 위해, p-values 리스트들을 R statistical environment (http://www.R-project.org)에 이입하였고, q-values (Storey and Tibshirani, 2003)를 R "q-value" 패키지를 사용하여 계산하였다.
관찰된 발현 변화율과 관련된 기능적 유전자 온톨로지 카테고리들을 확인하기 위해, 상당히 변화된 발현(t-test p-value<0.001)을 보인 유전자들의 리스트들을 log2 표현값에서의 차이에 따라 서열화하였고, 그 서열 리스트들을 디폴트 옵션(Wilcoxon Signed Rank test, Benjamini False Discovery Rate correction for multiple testing)과 함께 Rank GOstat (Beissbarth and Speed, 2004)를 사용하여 분석하였다. Rank Gostat 결과를 분석하고, 사람의 손으로 편집하고, custom script를 사용해 가시화하였다.
HPLC 분류, 활성화 분획들의 검출, 질량 분석 및 단백질 동정. 글리오마 조건의 배지를 TRIS-HC1 완충액에 대해 밤새 투석하였다. 염분과 저분자량 DMEM 요소들을 제거하고 난 뒤, 배지를 동결 건조하였다. 얻어진 준비 물질은 음이온 교환체 Q (Shodex IEC QA-825 PHM gel)를 사용해서 HPLC 하였다. HPLC 분획화 후, 90개의 분획을 부분을 모았다. 각 분획물(배양 배지에서 1 : 10 로 희석된)에 대해, 처리 후 24시간 동안 소교세포의 형태학적 변형을 유도할 수 있는 능력에 대한 테스트를 하였다. 두 명의 서로 다른 연구원들이 형태 변화들을 평가하고 1에서 6의 범위 내에서 점수매겼다.
HPLC 부분의 펩타이드를 나노스프레이 액체 크로마토그래피 이중 질량 분석기 (MS/MS) 기술을 통해 분석하였다. MS/MS 스펙트럼을 포함한 처리되지 않은 데이터 파일들을 MAscot daemon을 사용한 데이터베이스 검색을 위해 Mascot 검색 엔진(MatrixScience Ltd., London, United Kingdom)에 제출하였다. 각각의 펩타이드 염기서열를 -matrix blosum80 -E 1 -B 1 -topcomboN 1 -W 2 -Q 12 -R 12 -mformat 2 옵션에서 실행한 WU-Blast 2.0 software package(licensed from the Washington University)를 사용하여 비교 쥐와 소의 단백질 염기서열(IPI, International Protein Index)와 비교하였다.
데이터베이스상 hit가 있는 모든 펩타이드에 대해, 소의 e-value 부터 랫트의 e-value에 대한 log 비를 계산하였다. 랫트의 origin까지 확실히 쫓을 수 있는 단백질의 동정을 위해, 다음의 특성을 가진 단백질들을 선택하였다. 1) 통계적 유의도 상의 한계(P<0.05) 이상의 개연성 점수를 보이는 2이상의 독특한 펩타이드에의 강한 hit(blast hits)에 의한 확인; 2) 소의 (배양 배지) origin 보다 랫트(C6 세포들)의 origin을 나타내는 모든 서열에 대한 양의 log 비.
shRNA
발현 벡터들의
제너레이션
및 안정하게 형질 감염된
C6
글리오마
클론들.
BamH1, HindⅢ 돌출들과 함께 spp1 shRNA와 mfge8 shRNA를 인코딩하는 두 개의 상보성 올리고핵산염들을 쥐의 spp1 shRNA와 mfge8 mRNA의 발현을 방해하기 위해 설계하였다. 사용된 두 개의 올리고핵산염들은 다음과 같다.
spp1 : 전방향 5'- GATCCAGCTAGTCCTAGACCCTAATTCAAGAGATTAGGGTCTAGGACTAG CTTGTTTTTTGGAAA-3' (SEQ ID NO: 21)
및 역방향 5'- AGCTTTTCCAAAAAACAAGCTAGTCCTAGACCCTAATCTCTTGAATTAGGGTCTAGGACTAGCTG-3'(SEQIDNO:22).
Mfge8: 전방향 5'- GATCCGGATGAAAGCGGAACCGGATTCAAGAGATCCGGTTCCGCTTTCATCCTGTTTTTTGGAAA-3' (SEQ ID NO: 25)
및 역방향 5'- AGCTTTTCCAAAAAACAGGATGAAAGCGGAACCGGATCTCTTGAATCCGGTTCCGCTTTCATCCG-3 ' (SEQ ID NO: 26).
BamHl 및 HindⅢ 돌출들과 함께 GM-CSF shRNA을 인코딩하는 overhangs두 상보성 올리고핵산염들을 마우스의 GM-CSF mRNA의 발현을 방해하기 위해 설계하였다. 사용된 두 개의 올리고핵산염들은 다음과 같다.
센스: 5'- GATCCCGGAAACGGACTGTGAAACATTCAAGAGATGTTTCACAGTCCGTTTCCGGTTTTTTGGAAA-3'(SEQIDNO:23) 및
안티센스:
5'-AGCTTTTCCAAAAAACCGGAAACGGACTGTGAAACATCTCTTGAATGTTTCACAGTCCGTTTCCGG-3'.(SEQIDNO:24).
전방향 및 역방향 올리고뉴클레오티드를 94℃에서 3분간 0.1M NaCl에서 인큐베이트 하였고, 37℃에서 1시간동안 천천히 식혔다. 어닐링된 DNA를 BamHl 및 HindⅢ 지점들에서 pSilencer 2.0-U6 (Ambion, Germany)와 함께 묶었다. E.coli내로 변형한 후, 플라스미드들을 확장하여 분리시켰고, 시퀀싱을 통해 서열을 분석하였다. pSilencer-spp1, pSilencer-mfg8 pSilencer-GM-CSF 및 pSilencer 2.0-U6 Negative Control (Ambion) vectors를 Qiagen Plasmid Maxi Kit로 정제하였고, 각각의 DNA 1.6 μg을 2μl 의 Lipofectamine2000 (Invitrogen, UK)을 사용하여 세포로 형질 감염시켰다. 형질 감염 하루 후, hygromycin B (200 μg/ml)를 추가하였다. 내성 클론을 2주 후 뽑아내었고, qRT-PCR를 통해 적절한 mRNA 발현을 분석하였다.
RNA 분리와 유전자 발현의 정량화. RNeasy Mini Kit (Qiagen)으로 RNA를 분리하였다. First-strand cDNA를 전체 RNA(DNase-treated)의 2μg로부터 역전사 반응 혼합물 20μl에서 합성하였다. 18s rRNA를 내부 참고 유전자로 사용하였다. 오스테오폰틴과 C6 랫트의 글리오마 세포들과 초대 성상세포들의 락타드헤린의 발현을 qPCR를 통해 평가하였다. GL261 글리오마 세포들 및 초대 성상세포들 내의 GM-CSF의 발현을 qPCR를 통해 평가하였다. 예를 들어, GM-CSF의 발현을 평가하기 위해 다음과 같은 프라이머들이 사용되었다.
전방향: 5'TGCCTGTCACGTTGAATGAAGAGGT'3 (SEQ ID NO: 27), 역방향:
5'GCCCCGTAGACCCTGCTCGA'3 (SEQ ID NO: 28);
18s RNA에 대해서 다음과 같은 프라이머들을 사용하였다:
전방향: 5'CGGACATCTAAGGGCATCAACA'3 (SEQ ID NO: 29);
역방향: 5'AACGAACGAGACTCTGGCATG'3 (SEQ ID NO: 30).
반응 부피(20μl)는 50ng RNA, l×SYBR Green PCR master mix (Applied Biosystems) 및 각각의 primer들 0.9μΜ과 같은 양의 cDNA로 구성되었다. 열 사이클 조건은 다음과 같다: 50℃에서 2분간, 95℃에서 10분간, 그 후 변성을 위해 95℃, 15초의 40 사이클, 및 어닐링과 익스텐션을 위해 60℃에서 1분간. 유전자 발현의 상대적인 정량화는 comparative CT method를 사용하여 측정하였다.
플라스미드 설계, 형질 감염 및 재조합 단백질 제조. spp1a 및 spp1c의 코딩 염기서열을 TaqDNApolymerase(AppliedBiosystems)을 사용하여 다음의 primer들과 함께 랫트의 글리오마 C6 세포들의 cDNA 템플릿 위에서 확장하였다: 5'-ATCAAAGCTTCATATGAGACTGGCAGTGGTTTGC-3'(SEQIDNO:31)
및 5'-ATCGCGGCCGCTTAATTGACCTCAGAAGATGAACTC-3'(SEQIDNO:32). mfge8의 코딩 서열을 다음의 primer들과 함께 랫트의 글리오마 C6의 cDNA 위에 확장하였다.
5'-ATCAAAGCTTCATATGCAGTTCTCCCGTGTGCTGGC-3'(SEQIDNO:33)
및
5'-ATCGCGGCCGCTAACAGCCCAGCAGCTCCAGGC-3'(SEQIDNO:34).
spp1a, spp1c 및 mfge8 의 증폭된 서열을 HindⅢ, pEGFP-Nl 플라스미드의 NotⅠ site에 서브클론 하였다. 생성된 플라스미드들(pSpp1a, pSpp1c 및 pMFG8라 고 부른다)을 서열에 따라 확인하였다.
재조합된 오스테오폰틴과 락타드헤린 단백질들을 pSpp1a, pSpp1c 및 pMFG8 플라스미드들의 과발현을 통해 murine 섬유아세포에서 생산하였다. 섬유아세포 NIH 3T3(ATTC로부터 얻어진)을 24-웰 플레이트들에 1.7×105의 밀도에서 플레이트하였고, 24시간 후 세포들을 Amaxa program U-30을 사용해서, NIH 3T3 세포들에 대해서는 Kit R을 사용해서(Amaxa,Germany) pSpp1a, pSpp1c 및 pMFG8 플라스미드들로 1.6μg의 DNA를 사용하여 세포 감염시켰다. 그 후, 세포들을 회복을 위해 24시간 인큐베이트 시켰다. 단백질 생산물을 ELISA(R&D, Germany)로 측정하였다.
실시간 PCR . 처리하지 않거나 LPS 또는 G-CM으로 6시간동안 처리한 소교세포 배지에서 분리된 총 RNA(2μg)을 cDNA를 만들기 위한 템플릿으로 사용하였다. 대인성 대조군으로 18S (Hs99999901_sl) rRNA를 적용시켰다. 유전자 발현 정량화을 Applied Biosystem TaqMan®을 사용하여 수행하였다. 실시간 증폭이 2xSYBR PCR MasterMix와 PRIMER EXPRESS software를 사용하여 설계한 primer 세트를 포함하는 반응 부피 20μl에서 두번 다음과 같은 유전자들에 대해 수행되었다: iNOS, COX-2, Ⅰl1beta, TNF alpha, MMP-2, MMP-9, MMP-14, Argl, Ⅰd1 및 c-Myc. 타켓 mRNA의 양은 처음에 18S RNA 발현 단계에서 정상화시켰고, 이후 대조군에서 정상화시켰다. 데이터를 7500 System SDS software (Applied Biosystems)를 사용하여 Relative Quantification(ΔΔCt) 방법으로 분석하였다. 각각의 생산물의 발현을 18S rRNA로 정상화되었고, 2-ΔΔ Ct으로 계산된 타켓 유전자과 18S 유전자 발현의 비율로 표현하였다.
두개내 글리오마 이식과 종양 크기의 정량화. 이 연구는 동물 실험에 대한 지역 윤리 위원회의 승인을 받은 857/2008 프로토콜에 따라 수행하였다.
다 자란 C57BL/6 마우스들(12-16주령)을 케타민(75 mg/kg) 및 메데토미딘(1 mg/kg)의 복강 내 주사를 통해 마취시켰다. 고정 장치 내에서 좌표들(+1.5mm AP,-1.5ML)에 따라, EGFP-GL261 글리오마 세포들, shGM-CSF 글리오마 세포들 또는 shNeg 글리오마 세포들(1μl 의 DMEM 내 8×l04 세포들)을 26-게이지이 달린 1-μl 주사기를 사용하여 오른쪽 선조체에 접종하였다.
마우스들을 아티파메졸의 복강 내 투여를 사용하여 소생시켰고, 톨페딘 4% (4mg/kg s.c.)로 마취하였다. 15일째 되는 날, 글리오마 이식 후, 동물들을 마취시켰고, 죽였으며, PBS, 또는 PBS 및 PBS 중 4% 파라포름알데이드를 살포하였다. 뇌들을 떼어냈고, 갈거나 24시간동안 상기와 동일한 고정화 용액에 후-고정했으며, 4℃에서 PBS 내에서 30% 자당에 두었다. 그 다음, 뇌들을 건조 CO2로 얼렸고, 일련의 20-μm-두께의 관상 절편을 저온 유지 장치를 사용하여 수집하였다. 그 이미지들은 Leica DM4000B 현미경을 사용하여 얻었다.
관상 절편들 내의 종양 면적을 Image Pro-Plus software을 사용하여 모든 두번째 뇌 슬라이스에서 측정하였고, 종양 부피는 카발리에리 원리에 따라 측정하였다.
골화성 마우스와 Csf1 op 돌연변이의 검출을 위한 제노타이핑 . 쌍으로 번식한 B6C3Fe a/a-/ Csf1op/J 마우스들을 Jackson Laboratory(BarHarbor,ME)에서 얻었고, 빛(12L:12D)과 온도가 조절된 조건 하에 장벽 시설에서 유지시키고 길렀다. 동형접합체 돌연변이들을 야생형에서 분별해냈고, 10-11일된 이형접합체 마우스들을 앞니가 없는 것과 실시간 PCR-기초의 genotyping기법을 통해 분별해냈다. op/op 돌연변이 쥐들은 출생 후 (P)-21일에 이유를 시작했고, 분말형 설치류용 음식을 먹였다. Csf1op 돌연변이는 TaqMan Allelic Discrimination Method 및 ABI PRISM 7700(Applied Biosystem)을 사용하여 게놈 DNA의 PCR 분석을 통해 검출하였다. DNA 샘플들은 태어난지 4에서 10일된 쥐의 꼬리 끝에서 준비하였다.
척수 내 초점 탈수의 유도와 소교세포 밀도의 정량화. 2개월된 골화성 쥐와 야생쥐를 사용하였다. 동물들을 지속적인 아이소플루레인과 산소 흡입을 통해 마취하였다. T4의 위치를 확인하였고, 축상부 근육조직(epaxial musculature)를 제거하였다. T4와 5사이의 공간을 현미경을 사용하여 노출시키고, 제거하였다. 중심정맥을 확인하였고, 경막에 치과용 바늘로 구멍을 뚫었다. 탈수 손상은 3-방향 매니퓰레이터(three-way manipulator)에 부착된 파인 글라스 끝을 가진 해밀턴 바늘을 이용하여 2분의 시간 넘게 등쪽섬유단(dorsal funiculus)에 1%의 Lα-리소포스파티딜콜린 (Sigma) 1μl의 stereotaxic 주사를 통해 유도하였다. 독소의 주입은 축색돌기의 탈수를 야기했으며, 이후 손상 부위의 소교세포의 점증이 발생하였다. 손상 유도된지 열흘 후, 쥐들은 아이소플루레인으로 마취하였고, 인산완충식염수 내 4% 파라포름알데히드로 대동맥 관류시켰다. 손상부위를 포함하는 척수의 부분을 해부하였고, 4℃에서 4% PFA로 고정하였으며, 4℃에서 48시간 30% 자당 내에서 한랭보호(cryoprotect) 시켰고, OCT 함유 화합물(OCT embedding compound)에 놓은 뒤, 드라이아이스로 얼리고, 저온 유지 장치에서 12μm로 잘라내었다. 단면들을 폴리-L-라이신 코팅된 유리 슬라이드(Thermo Scientific)에 올렸다. Ibal staining 과 DAB와의 가시화를 수행하였다. 척수의 손상의 이미지들은 디지털 카메라와 함께 Leica DM 4000B 현미경을 이용하여 얻었다. 각각의 동물들의 손상 부분의 두 대표 그림들을 얻었고, 손상 부분의 Iba-1 라벨된 소교세포 세포들의 총 개수는 Image J software (NIH)를 사용하여 계산하였다.
면역 조직 화학. 항-Iba1 및 항-vWF 항체들을 통한 착색을 소교세포/대식세포 그리고 혈관을 각각 검출하기위해 사용하였다. 각 부분들은 RT에서 30분간 PBS내 0.5% H2O2 상태에서 인큐베이트 하였고, 투과성이 있도록 하였고, PBS내 0.3% 트립톤 X-100을 추가한 10% 당나귀 혈청으로 막았다. 그 후, 4℃에서 24시간 초대 항체들: 항-Iba-1 (토끼, 다클론항체, WAKO, 1 : 1000) or 항-vWF (토끼, 다클론항체, Abeam, 1 : 1000) 과 인큐베이트 시켰고, RT에서 2시간동안 이차 염소 항-토끼 비오틴화 IgG 와 함께 인큐베이트 시켰다. 초대와 이차 항체들을 0.1% 트립톤 X-100과 3% 당나귀 항체를 포함하는 PBS에서 용해시켰다. 그 부분들을 RT에서 1시간동안 extravidin-peroxidase complex (1 :200)에 노출시켰고, 페록시다제의 활동성은 0.2% 3.3'-다이아미노벤지딘(DAB)와 Tris 완충액(pH7.6)내의 0.01% H202 로 가시화시켰다. 부분들은 건조시켜서 Histofluid(Sigma,Germany)에 놓았다.
CD11b 양성 세포들의 분리와 유세포분석 . 반구종양들을 분리시켰고, 뇌조직을 작은 조각으로 잘라냈으며, 단일 세포 현탁액를 얻기 위해 갈았다. 세포들은 소교세포와 대식 세포의 백분율을 측정하기 위해 CD11b-PE와 C45-PerCP 항체로 착색하였다(BD Pharmingen). 착색된 세포들은 유세포분석기(FACSCalibur)를 통해 평가하였다. 데이터들을 얻었으며 CellQuest software를 통해 분석하였다.
기관형적 ( Organotype ) 뇌 단편 배지에서의 종양 침습. 기관형적 뇌 단편 배지는 16일 된 수컷C57/BL6 쥐로부터 얻을 수 있었다(동물 사육 시설, Schonwalde, 독일). 250μm의 부분으로 잘린 뇌 단편은 6-웰 플레이트의 Transwell insert로 옮겨졌고(Becton Dickinson, 링컨 파크, NJ, 미국), 10% FCS(Atlanta Biological, 미국), 0.2mM 글루타민 및 항생제로 채워진 DMEM(Gibco사, gaithersburg, MD, 미국) 1ml에서 배양되었다. 밤새 평형화 한 후에, 배지를 25%의 FCS, 50mM의 소듐 바이카보네이트, 2%의 글루타민, 25%의 행크스 균형 염 용액, 1μg/ml 인슐린(모두 Gibco사, gaithersburg, MD, 미국), 2.46mg/ml 글루코스(Braun Melsungen사, AG, 독일), 0.8μg/ml의 비타민 C(Sigma-Aldrich사, 독일), 5μM의 트리스 및 항생제를 포함하는 배양 배지로 교환하였다. 조각에 10,000 GFP-GL261의 교아세포종(0.5μl)를 미세 조작기에 장착된 주사기를 사용하여 주입하였다. 소교세포가 결핍된 조각을 준비하기 위하여, 기관형적 뇌 단편을 24시간 동안 클로드로네이트로 채워진 리포좀으로 처리하였다.
인간 신경교종 생체 조직과 기준 정상 뇌에서의 CSF -1(M- CSF ) 및 CSF -2( GM - CSF )의 정량 분석. 신경교종 생체 조직은 뇌종양 조직 은행((London Health Sciences Centre, 런던, 온타리오, CA)과 어린이 기념 건강 연구소(The Children's Memorial Health Institute, 바르샤바, 폴란드)에서 얻을 수 있었다. 본 연구는 24 GBM 및 20 모양세포성상세포종을 포함하고 있다(WHO 1등급). 기준 뇌의 RNA는 정상적인 뇌 5개의 RNA의 혼합물이다(Ambion). 전체 RNA는 순간 냉동 조직으로부터 트라이 시약(Tri-Reagent, Sigma-Aldrich사, 뮌헨, 독일)에 의해 추출하여 설명한 바와 같이 제조하였다. RNA는 RNeasy 미니 키트(Qiagen사, 힐덴, 독일)를 사용하여 세척하였다. 전체 RNA의 정량 및 정성을 Agilent 바이오분석기(Agilent Technologies사, 산타클라라, CA)를 사용하여 확인하였다. 실시간 PCR의 증폭은 프라이머 세트와 함께 25ng의 RNA에 상당하는 cDNA에 세번 반복하여 실시하였다: CSF-1에 대해 - Hs 00174164_ml; CSF-2에 대해 - Hs 00929373_1; GAPDH - Hs 02753991_gl (Applied Biosystem). GAPDH는 내부 표준 기준으로 사용되었다. 유전자 발현의 상대적인 정량은 비교 CT법을 이용하여 ABI PRISM 7700 서열 검출 시스템으로 측정하였다. 값은 기준 정상 뇌에서의 관련 유전자의 발현과 비교되었다.
캐플런 - 마이어 생존 곡선. 모든 인간의 데이터는 렘브란트(Rembrandt)의 웹사이트에서 공개적으로 이용할 수 있었다(https :// caintegrator . nci . nih . gov / rembrandt /). 마이크로어레이 유전자 발현 데이터와 임상 데이터 모두, 분자 뇌 신생물 데이터에 관한 NCI 저장소(NCI Repository for Molecular Brain Neoplasia Data, REMBRANDT)의 2011년 10월 1일에 사용할 수 있는 데이터베이스로부터 얻을 수 있었다. 접속 당시, 343명의 신경교종 환자의 유전자 발현 데이터 및 대응하는 생존 시간에 관한 샘플을 렘브란트 데이터베이스로부터 얻을 수 있었다. 그래프는 Affymetrix사의 U133 플러스 2.0 유전자 칩(U133 Plus 2.0 Gene Chip)으로부터의 프로브에 대한 렘브란트 마이크로 어레이 데이터 및 관련 생존 데이터를 사용하여 만들어졌다. CSF1 및 CSF2 상향- 또는 하향-조절은 주어진 데이터 세트의 평균 발현 수준으로부터의 2배(또는 그 이상)의 차이를 의미한다.
통계 분석. 결과는 평균 ± 표준 편차(s.d.)로 표현되었다. 통계적 유의값은 U-맨-휘트니 검사와, STATISTICA 소프트웨어(버전 7.1, StatSoft사, OK, 미국)를 사용한 학생들의 T-테스트에 의해 측정되었다.
실험예
2 :
소교세포의 행동 및 신경교종에서 파생된 요인에 의해 유도된 세포 내 신호의 특성
출생 후의 쥐의 뇌로부터 분리된 1차 소교세포 배지가 모든 실험에 사용되었다. FITC-렉틴 B4 염색에 의해 측정되는 소교세포 배양의 순도는 항상 >95%였다. 배지는 소교세포를 정지시키기 위한 각 실험 전에 48시간 동안 방치되었다. 소교세포는, 다른 외인적인 자극없이 또는 고전적으로 염증 활성을 반영하는 100ng/mL의 리포 다당류(LPS)에 의해 자극되어, 신경교종 또는 성상세포 가동 배지에 노출되었다. 성상세포 배지가 아닌, 신경교종 세포(GCM) 배지만이 소교세포의 아메바 세포로의 형태학적 변화를 유도할 수 있었으며, 이는 빛 대조 현미경(상단 패널) 및 FITC-팔로이딘으로 염색된 F-액틴(하단 패널)에 의해 입증되었다. 배양 사진은 자극을 준 지 24시간 후에 촬영되었다. 고전적인 염증 유도 물질-리포 다당류(LPS, 100ng/mL)로 처리한 후에 유사 형태 변환이 관찰되었다. LPS가 성장 정지를 유도하고 사이클린 Dl와 포스포-Rb(phospho-Rb)의 레벨을 감소시킨 반면, GCM 자극된 소교세포는 정상적으로 증식되었고 사이클린 Dl와 포스포-Rb(phospho-Rb)의 레벨에 영향을 주지 않았다(도 1b).
그러나, 스크래치 분석에서, GCM의 존재는 소교세포의 세포가 없는 영역으로의 운동성을 강하게 증가시켰다(도 1c). 식균작용은 제어하기 위해 6시간동안 붉은 형광 비드를 대조군 또는 GCM-처리된 배양 조직에 첨가하고, 형광 현미경에 의해 두 개 이상의 식균작용된 비드의 백분율을 정량화함으로써 평가되었다. 여러 비드를 식균작용한 소교세포의 수는, 대조군에 비교했을 때, GCM에 노출된 후 60 ± 9%(평균 ± 표준편차) 까지 증가하였다(도 1d). 데이터는 소교세포로부터 독립적으로 파생된 3개의 독립적인 실험의 평균 ± 표준편차로 나타내었으며, ***p<0.005이다.
염증성 자극(예:LPS)은 염증의 개시에 대한 일반적인 신호 전달 경로를 활성화하고, MAP 키나아제 및 NFκB, STAT1, 3 및 5와 같은 소교세포에서의 전사 인자를 포함한다. 인산화 MAPK, ρ-ΙκΒ 와 인산-STATs의 수준은 LPS처리 30분 후 증가하였고, 6시간 동안 증가된 상태로 유지되었다(도 2a). 특히, GCM 처리된 소교세포 사이에 약간의 차이가 있었다: JNK가 활성화되지 않았고, p38 MAPK의 활성화는 약해졌으며 LPS처리 이후에 비해 더 일시적이었다(도 2a). ΙκΒ의 인산화 및 그것의 저하는 GCM처리된 소교세포에서 검출되지 않고(도 2b 왼쪽 패널), 이는 NFκB 활성화 부족의 결과를 야기하였다. 이것은 NFNFκB 활성화 부족의 결과로, B DNA 결합 활성을 ELISA를 통해 측정함으로써 더욱 확실해졌다(도 2b 오른쪽 패널). 증가된 STAT1 및 STAT3의 인산화는 LPS처리된 소교세포에서만 발생하였고, 인산화된 STAT5의 상승은 두 조건 모두에서 발생하였다(도 2c). 염증에 중요한 신호 전달 경로 활성화의 결함은 유도성 일산화질소 합성 물질(iNOS) 및 산소 첨가 효소 2와 같은 염증 매개 물질 발현의 부족을 야기하였다(도 2d). 모든 데이터는 일치하여 GCM에 의한 소교세포의 비염증성, M2와 같은 활성화의 유발을 나타낸다.
실시예
3:
GCM
에 의해 유도된 전사 변화들의 분석
도 3에서 보여지는 것과 같이, GCM은 소교세포들의 발현 측면에 있어서 분명한 변화들을 유도한다. GCM으로 자극된 소신경교세포 배양들에서 유전적인 반응의 총체적인 파악을 위해, 전체적 유전자 발현 측면과 유전자 온톨로지(Ontology ) 분석을 별도로 소교세포들을 자극하여 수행하였다. 전체적 유전자 발현을 GCM 또는 LPS 중 선택된 어느 하나로 처리한 뒤, 6시간 후 Affymetrix 올리고뉴클레오티드 마이크로어레이로 조사하였다. 별개의 통계적 분석(t-test)을 GCM(n=4)과 대조군(MGCM, n=6)사이에서, 그리고 LPS (n=4)와 동일한 대조군 사이에서 수행하였다. t-test p<0.001의 동일한 알파 단계를 두 가지 처리방법에 의한 유전자 영향을 확인하기 위해 선택하였다. 이 선택은 LPS에 의해 유도되는 더욱 강한 변화를 위해 FDR<0.002이고, GCM에 의해 유도되는 상대적으로 작은 변화를 위해 FDR<0.04 이다. GCM (G) 및/또는 LPS (L)에 의해 유전자 발현에서의 변화들이 조절되었고, Log2 스케일에서 각가 MGCM (M)을 조절하는 경우와 비교하여 그래프화되었다. 각각의 유전자는 점으로 표현되고, X, Y 좌표는 각각 LPS와 GCM에 의해 야기된 발현들에서의 변화를 나타낸다. 큰 회색점은 LPS에 의해 상당히 조절된 유전자를 나타낸다(L 대 M t-test p<0.001). 작은 푸른점은 GCM에 의해 상당히 조절된 유전자를 나타낸다(G 대 M t-test p<0.001). 두 처리 방법들에 의해 상당히 조절된 유전자들을 나타내는 점들은 반대 방향(그리고 추가적으로 SMAD3 과 7)에서 유전자 기호들로 표시되고, 개개의 소교세포 배양들(번호매겨진)에 있어서 그들의 발현 형태를 보여준다.
알파 단계에서, 174개 유전자들은 GCM 처리 방법에 따라, 1794개 유전자들은 LPS 처리 방법에 따라(회색점), 그리고 63개 유전자들은 두 처리 방법에 모두에 따라, 발현을 변화시켰다. 마지막 그룹으로 9개 유전자들(알려진 유전자 8)은 두 처리 방법과 반대로 조절되었다.
LPS에 의해 상당히 조절된 1794개 유전자들의 기능적 구성의 분석은 Rank GOStat 프로그램을 통해 GO 용어들로 나타났다: 면역/ 방어/ 흥분 반응의 LPS 처리 방법에 따른 유전자 상향 조절과 상당히 관련되 카테고리. 특히, 이 카테고리들은 GCM 처리 방법에 의해 상당한 영향을 받지 않는다. 이러한 면역 반응과 염증 세포의 부족은 열지도 가시화에 의해 확인되었다. 더욱이, LPS에 의해 가장 강력하게 상향 조절되는 인터페론과 관련한 유전자들(Best5, CxcllO, Ifit3, Mx2)을 GCM 처리 방법에 의해 적절히 하향 조절하였다.
GCM에 의해 상당히 조절된 174개 유전자들의 기능적 구성의 분석은 Rank GOStat 프로그램을 통해 GO 카테고리인 "초대 대사 과정"으로 확인되었고, 이는 GCM에 의해 상향 조절되는 유전자와 관련한 가장 높은 순위의 카테고리이다. 흥미롭게도 이 유전자들은 LPS 처리 후 하향 조절되었다.
c-Myc, SMAD7, klhl6, hla-dmb 및 CX3CR1 같은 몇몇 유전자들은 GCM 처리된 소교세포에서 강하게 유도되었지만, LPS 처리된 세포들에서는 하향 조절되었다. c-Myc는 전사, 리보솜 생물발생, 세포-사이클 진행, 분화, 세포 자살, 세포 운동력을 위해 요구되는 유전자 발현을 지시하는 세포-다기능 전사 요소를 암호화한다.
흥미롭게도, GCM 상향 조절된 유전자들은 Garl, Gtpbp4, Nol8, Ddx5, Polrle, Polrlb, Eif4ebpl, Eif3s9, Nobl, Tsen2, Ndell, Hnrnpr, Nip7, Nup93, 및 몇몇 aminoacid-tRNA synthetase를 포함하는 전사와 해석의 통제와 연관되었다. GCM에 의해 유도되는 다른 유전자들은 CD69, C-type lectin R family의 구성, 수지상세포 성장과 연관된 동시 자극성 분자, RANTES (ccl5), MCP-1 (ccl2), 및 CXCL (cxcll, 2, 7)같은 조직의 대식세포 보충과 연관된 케모카인(chemokines)을 포함한다.
14개 유전자의 발현을 4개의 독립적인 소교세포 배양에서 양적 PCR을 통해 확인하였다. Q-PCR 데이터는 GCM에 의해 자극된 소교세포의 유전자들(COX-2, ILi p, iNOS, MMP-9, Irf7, ST ATI, TRAIL, IFNβ)과 관련된 염증과 인터페론 발현의 약한 신호 또는 신호의 부재, 그리고 c-Myc, SMAD7, Arg-1, MMP-14의 발현의 상향 조절을 확인하였다(도 4). 우리는 GCM에 의해 유도된 변화들이 LPS에 의해 '전형적인' 소교세포/대식세포의 활성화을 동반하는 변화들과 기능적으로 차이가 있고 부분적으로 반대(인터페론과 관련된 유전자들에 대한)라는 것으로 결론 내린다.
실험예
4 :
오스테오폰틴
및
락타드헤린의
종양 가동 배지에서의 소교세포 활성 작용의 확인
소교세포를 활성화시키는 신경교종 세포 배지의 요소들을 확인하기 위해 프로테오믹스 접근법이 사용되었다. GCM은 음이온 교환기 Q(Shodex IEC QA-825 PHM 젤)를 사용하여 HPLC로 분획되었고, GCM으로부터 유래된 단백질을 포함하는 90 분획이 수집되었다. 각 분획(1 : 10으로 배양 배지에서 희석된)의 소교세포 배양 활성화 능력을 평가하였다. 소교세포의 아메바 세포로의 변환은 24시간 처리 후 2명의 연구원에 의해 1 내지 6의 범위로 기록되었다. 16개의 분획의 자극 활성(4 내지 6을 기록) vs. 대조군(3을 기록), 소교세포를 억제하는 몇몇 분획(1 내지 2를 기록) 얻어졌다(도 5a). 소교세포를 자극하는 단백질 제제를 ESI_FTICR을 이용하여 MS/MS 분석을 실시하였다. 각 분획에 대하여 소교세포의 식균작용을 촉진하는 능력을 평가하였다(도 5c). MS/MS 스펙트럼을 포함하는 제시되지 않은 데이터 파일은 Mascot 검색 엔진에 데이터베이스 검색을 위하여 제출되었다. 단백질 서열은 둘 이상의 고유 펩티드의 질량 분광법 분석에 의해 확인되었고, 각각은 적어도 p<0.05의 낮은 오검출률을 보장하였다. 이 과정을 통해 오스테오폰틴 및 락타드헤린을 확인하였다(도 5b). 신경교종 세포와 성상세포에 의한 오스테오폰틴의 생산이 ELISA에 의해 확인되었고(도 5d-오른쪽 패널), 쥐의 C6 신경교종 세포에서의 오스테오폰틴(spp1)과 락타드헤린 mRNA의 레벨은 정량 PCR에 의해 확인되었으며, 배수 변화 vs. 쥐의 대뇌 피질의 성상세포로 나타냈다. 신경교종 세포는 비 변형 성상세포에 비해 오스테오폰틴의 두 형태: spp1 a mRNA는 35배, spp1 c mRNA는 600배 과발현한다는 것이 발견되었다(도 5d-왼쪽 패널). 데이터는 적어도 세 번의 독립적인 실험의 평균±표준편차이다.
실험예
5 :
인테그린에
결합된
오스테오폰틴과
락타드헤린에
의한 간섭이 신경교종에서 파생된 요인에 의해 유도된 형태 변환, 이동과
식균작용을
폐지한다.
쥐의 락타드헤린 아미노산 서열을 사용하여, 7-aa RGD 함유 펩티드(RGD)를 경쟁적 억제제로 설계하였다(서열번호 : 18로 제시). 스크램블된 서열의 펩티드는 대조군으로 사용되었다. SCR 펩티드에 의한 것이 아닌, 화학적으로 합성된 500μΜ RGD 펩티드에 의한 사전 배양은 GCM 유발 후 소교세포의 아메바 세포로의 변형을 방지한다(화살표로 표시된 아메바 세포)(도 6a). RGD 펩티드는 스크래치 분석에서 GCM에 의한 식세포 작용(도 6b) 및 소교세포의 이동(도 6c)을 완벽히 차단했다. GCM에 의한 식세포 작용의 증가는 인테그린 서브유닛 αv 또는 β3 또는 특정 siRNA들 모두의 사일런싱 후에 소교세포에서 상당히 감소하였다(도 6d).
인테그린을 통한 행동으로 추정해 볼 때, GCM 처리는 지속적으로 인테그린 신호의 공통 매개체인 국소 접착 인산화 효소(FAK)의 인산화를 증가시켰다(도 6e). GCM은 인산화된 FAK와 소교세포의 다른 인산화 효소인 Akt와 ERK의 레벨을 증가시켰고, RGD 펩티드 전처리는 조사된 모든 인산화 효소의 활성을 폐지시켰다(도 6e). 인테그린 리간드, 세포 내 경로와 세포의 빠른 변형, 아메바 식세포 사이의 제안된 링크의 연결되지 않은 모델이 도 6f에 제시되어있다.
실험예
6 :
소교세포에서의
오스테오폰틴의
사일런싱이
다른 표현형의 획득에 영향을 미치고 친-침습 활동을 손상시킨다.
GCM에 의해 유발된 소교세포의 활성에서 식별된 단백질의 역할을 조사하기 위해, 오스테오폰틴에 특정된 shR(shSPP1)을 발현하는 안정한 C6 신경교종 세포주, 또는 대조군 음성 shRNA(shNeg)가 생성되었다. 사일런싱 효율은 약 98.5%로 나타났다(도 7a 및 c). 락타드헤린의 사일런싱은 소교세포에서 GCM에 의한 c-Myc와 smad7의 발현을 억제하였다(도 7b). 오스테오폰틴의 정지는 소교세포에서 GCM에 의한 arg-1과 smad7의 발현을 억제하였다(도 7d). 또한, 마트리겔로 채워진 삽입물을 통하여 이주한 신경교종 세포의 수는, 레이저 주사 혈구 계산으로 추정해 볼 때, 신경교종 세포에서의 오스테오폰틴의 사일런싱은 소교세포 의존적 침습을 강하게 감소시킨다는 것을 보여주었다.
실험예
7 :
오스테오폰틴과
락타드헤린은
소교세포의
GCM
에 의한 활성에서 특이적이고 협력적인 역할을 수행한다.
재조합 단백질이 소교세포에서 신경교종 세포 배지의 작용을 모방할 수 있는지 확인하기 위하여, 오스테오폰틴 및 락타드헤린의 두 형태를 코딩하는 DNA가 쥐의 NIH3T3 섬유 아세포에서 복제 및 발현되었다. Amaxa로 형질 전환된 섬유 아세포에서의 락타드헤린 및/또는 오스테오폰틴의 발현이 qPCR에 의해 확인되었다(도 8a). 식세포 작용(도 8b) 또는 소교세포의 형태학적 변화(도 8c)를 유도하는 재조합된 쥐의 단백질을 생산하는, 섬유 아세포로부터 컨디셔닝된 배지(CM)의 효능을 측정하였다. 오스테오폰틴을 발현는, 섬유 아세포로부터의 CM은 소교세포의 식세포 작용을 촉진시켰지만, 대조군은 그렇지 않았다(GFP). 오스테오폰틴을 발현하는 섬유 아세포로부터의 CM은 또한 소교세포의 아메바 변형 유도에도 효과적이었다.
재조합 단백질이 소교세포에서의 M2 도는 Ml 표현형에 특징적인 선택 유전자의 신호 전달과 발현에 있어서의 GCM의 작용을 모방할 수 있는지 여부를 평가하기 위해, 소교세포에서 재조합된 쥐의 단백질을 생산하는 섬유 아세포로부터 컨디셔닝된 배지의 효과를 시험하였다; LPS와 GCM이 대조군으로 사용되었다(도 9). GCM과는 대조적으로, 오스테오폰틴의 이소 형태들을 모두 발현하는 섬유 아세포로부터의 CM은 ΙκΒ, STAT1, 3 및 5의 인산화를 LPS와 유사한 정도로 증가시켰다(도 9a). 락타드헤린은 smad7과 c-myc의 발현을 유발하는 반면, 오스테오폰틴을 생산하는 섬유 아세포로부터의 CM은 arg-1과 smad7 뿐만 아니라 inos 및 irf7의 발현을 증가시켰다.
실험예
8 :
신경교종 파생
GM
-
CSF
는 신경교종 및 종양의 진행에 소교세포/대식세포의 보충을 담당한다.
신경교종 파생 GM-CSF는 신경교종 및 종양의 진행에 소교세포/대식세포의 보충을 담당하는지 확인하기 위하여, GM-CSF를 안정적으로 고갈시키는 EGFP-GL261 신경교종 세포가 특정한 shRA를 인코딩하는 플라스미드의 과발현에 의해 생성되었다. 두 독립적으로 파생된 클론에서의 mRNA 레벨(도 10a)과 단백질 레벨(도 10 b)에서의 GM-CSF 발현의 사일런싱이 qPCR 및 ELISA에 의해 확인되었다. 두 클론은 동시에 파생되었고 shRNA 음성 발현하는 것이 대조군으로 사용되었다. BrdU의 혼입과 MTT 대사 테스트에 의해 각각 설명되는 것과 같이, 신경교종 세포에서의 GM-CSF 발현의 사일런싱은 그들의 증식과 생존에 영향을 미치지 않았다(도 10c및 d).
shNeg 또는 shGM-CSF를 발현하는 EGFP-GL261 신경교종 세포의 두 개의 클론을 C57BL/ 6 쥐의 선조체에 이식 하였다. 대조군 신경교종 세포(shNeg)와 비교했을 때, 항- Iba-1로 염색한 항체는 GM-CSF 고갈된 신경교종 세포를 이식한 쥐에서 소교세포/대식세포의 줄어든 수를 나타냈다(도 11a 및 b). GM-CSF를 고갈된 신경교종을 이식한 쥐에서, 항-vWF로 혈관을 염색한 항체는 대조군과 비교했을 때 종양 혈관 형성의 감소를 나타냈다(도 11c). 더 나아가, shNeg 신경교종 세포를 이식한 쥐에 비해, 종양의 크기의 상당한 감소(65 %)가 GM-CSF 고갈된 신경교종 세포로 이식 된 쥐의 뇌에서 관찰되었다(도 11d-e). 각 점은 개별 동물을, 굵은 선은 특정 그룹의 6 쥐의 중간값을 나타낸다; *p<0.05, **p<0.01.
이러한 결과는 GM-CSF가 신경교종에서의 소교세포/대식세포 축적뿐만 아니라 신경교종 침습 및 혈관 신생 증가를 담당하는 중요한 요소임을 보여준다.
실험예
9 :
GM
-
CSF
가 고갈된 신경교종 세포가 뇌
기관형적
슬라이스 배지에서의 소교세포 의존적 신경교종 침습을 저하시켰다.
GM-CSF 발현이 소교세포 의존적 침습에 영향을 미치는지, 또는 직접적으로 신경교종의 침습에 영향을 미치는지를 조사하기 위하여, 뇌의 기관형적 슬라이스 배지가 모델로 사용되었다. 대조군 또는 GM-CSF가 고갈된 EGFP-GL261 교종세포가 쥐의 뇌 단편에 주입되었고 생성된 종양의 크기는 주입 후에 조각 내 EGFP-교종 세포로 덮인 투영되는 형광 영역을 측정함으로써 5d 정량하였다. GM-CSF가 고갈된 EGFP-신경교종 세포를 주입한 뇌 단편 배지에서의 평균 종양의 크기는 58%(***p<0.001)로 대조군에 비해 작았다(도 12a 및 b). 또한, 클로드로네이트로 채워진 리포솜으로 사전 배양된 소교세포의 고갈은 신경교종 세포를 발현하는 shNeg의 줄어든 침습을 야기했으나, GM-CSF가 고갈된 신경교종 세포는 그렇지 않았다(도 12a 및 b). 특히, 소교세포 의존적인, 신경교종 세포의 뇌 실질 조직으로의 장거리의 침습은 신경교종 유래의 GM-CSF의 부재 하에 강하게 감소하였다. 이는 GM-CSF가 소교세포 의존적 신경교종의 침습을 담당함을 확인한다.
실험예
10 :
대식세포의 모집 및 신경교종의 성장은
골화석증
쥐에 영향받지 않는다.
골화석증(op/op) 쥐는 m-scf/scfl 유전자에 열성 삭제 돌연변이를 가지고 있어 M-CSF 생산이 결핍되고 및 단핵 백혈구/대식세포 또한 결핍된다. 동형 접합의 op/op 돌연변이, 이형 접합체 및 야생형(WT) 쥐는 TaqMan 대립 유전자 판별 방법으로 유전자형에 의해 확인되었다(도 13a). 다음 두 집단을 구별하기 위해 종양 조직으로부터의 CDl lb+ 세포의 면역 자석 분리에 이어 유동 세포 계측법이 사용되었다: 소교세포 (CD1 lb+/CD45low) 및 혈액 유래의 대식세포(CD1 lb /CD45hlgh): op/op 쥐의 혈액 단핵 백혈구 세포의 수가 변하지 않은 것에 비해(도 13c), WT 쥐(흰색 막대)와 반대로 op/op 쥐의 뇌의 CDl lb+ 소교세포 및 대식세포의 수가 감소(회색 막대)된 것이 확인되었다(도 13b).
소교세포/대식세포의 보충 및 신경교종의 진행에서의 M-CSF의 역할을 확인하기 위하여, 골화석증 쥐에 동생성 EGFP-GL261 신경교종 세포를 이식하였다. 유동 세포 계측법 분석은 야생형 및 op/op 쥐(회색 막대)의 뇌에서의 CDllb+CD45l0W 소교세포와 CD1lb+CD45high 대식세포에 침투하는 신경교종의 비율 차이를 보이지 않았다(도 13d). 신경교종을 가진 op/op 및 야생형 쥐에서의 혈액 단핵 백혈구 세포의 비율은 유사했고, 과립성 백혈구의 비율은 두 쥐에서 유사하게 증가하였다(도 13e). 종양을 가진 뇌의 소교세포/대식세포를 감지하기 위하여 사용되 항-Ibal로 염색한 항체에 의해, 야생형 및 op/op 쥐에서의 신경교종에 침투하는 Ibal 양성 세포의 유사한 축적과 형태를 입증하였다. 대부분의 Ibal 양성 세포는 신경교종을 가진 op/op쥐의 활성화된 대식세포의 아메바 형태를 가지고 있었다(도 13f 및 g).
뇌 부분의 항-vWF(폰 빌레브란트 인자) 항체로 신경교종을 함유한 혈관을 염색하는 것은, WT 대조군에 비해 CSF-1 이 없는 쥐의 종양 혈관 네트워크 형성과 유사한 형태를 보였다(데이터는 도시하지 않음). 종양 부피의 정량은 종양의 크기에 있어서 op/op 쥐와 야생형 쥐 사이에 차이를 보이지 않았다(도 13h). 이러한 결과는, 순수한 op/op 쥐에서의 소교세포/대식세포의 줄어든 수에도 불구하고, CSF-1은 신경교종에 있는 소교세포/대식세포의 축적을 담당하는 사이토카인이 아니라는 것을 암시하며, 종양 이식이 소교세포/대식세포의 침습, 혈관 밀도와 종양의 진행을 유사하게 유발한다는 것을 증명한다.
실험예
11 :
M-
CSF
결핍된 쥐의
탈수초성
장애 척수에서의 소교세포/대식세포의 축적 감소
M-CSF 결핍이 일반적으로 소교세포/대식세포의 침투에 영향을 미치는지 여부를 확인하기 위하여, 야생형과 op/op 쥐의 척수 손상에 대한 반응을 조사하였다. 척수 백색질에서의 병소 탈수초성 장애를 유도하고, 10일 이후 op/op쥐와 야생형 대조군에서의 소교세포/대식세포의 수와 형태를 조사하였다. 야생형 대조군에 비해 op/op쥐의 병소 내 Iba-1 양성 세포의 수가 크게 감소된 것이 관찰되었다(op/op쥐는 676 ± 94 세포/mm², WT는 1389 ± 129 세포/mm²; p<0.001)(도 14a 및 B).
실험예
12 :
CSF
-2는
GBM
에서 높게 발현되어 있으나 저급 신경교종이 아니고 정상 피질에서는 그렇지 않으며, 환자의 생존과 상관 관계를 보인다.
실제 인간 환자의 종양 표본에 생체 외 연구 결과를 연관시키기 위해, GBM, 건강한 뇌, 저급 신경교종에서의 CSF-1 및 CSF-2의 발현이 정량적 PCR에 의해 평가되었다. 도 15a는 저급 모양세포 신경교종(WHO 등급 I)과 대비하였을 때 다형성교아종(GBM, WHO 등급 Ⅳ) 생체 검사에서 CSF-1은 높은 상향-조절 발현을 보여주나, CSF-1은 그렇지 않다. 분자 뇌 종양 형성 데이터(REMBRANDT)에 관한 NCI 저장소에서 데이터를 공개적으로 이용할 수 있는 343명의 신경교종 환자의, 차등을 둔 CSF-1 및 CSF-2 발현에 기초한 캐플런-메이어 생존 곡선이 생성되었다. 상향- 및 하향- 조절은 데이터 집합 내에서의 평균 발현 수준에 비해, CSF-1/CSF-2 발현의 2배 증가 또는 감소로 정의되었다. 이러한 기준에 따라, CSF-2는 모든 신경교종 환자 중 16명에서 상향- 조절되었고, 22명에서 하향 조절되었다. CSF-2가 상향 조절된 환자에게서 좋지 않은 예후가 관찰된 반면, CSF-2 발현이 감소된 환자는 생존 기간이 향상되었다. 이러한 상관 관계는 CSF-1의 발현에서는 관찰되지 않았다. 이러한 두 극단적인 환자 집단에서의 생존을 비교했을 때, 통계적 유의값에 도달하였다(P=0.0217).
실험예
13 :
GM
-
CSF
의 억제는 신경교종 동물의 수명을
연장시킨다
.
shNeg 또는 shRNA 신경교종 세포의 두개 내 주입을 받을 쥐를 무작위로 배정하였고, 죽어갈 때까지 관찰하였다. EGFP-GL261 신경교종 세포, shGM-CSF 신경교종 세포 또는 shNeg 신경교종 세포가 좌표에 따라 정위 장치의 26게이지 바늘의 주사기를 이용하여 오른쪽 선조체에 접종되었다(+ 1.5mm AP, -1.5ML). 쥐들은 복강 내 아티파메졸 주사를 사용하여 소생되었고, 토르페딘 4%(4mg/kg s.c.) 진통제로 치료받았다. shGM-CSF 및 shNeg 교종 세포를 주입한 쥐들(그룹당 n=10 쥐)을 상대로 캐플런-메이어 분석을 수행하였다.
두개 내 신경교종 발현의 대조군, 또는 GM-CSF 특정 shRNA를 가진 쥐의 생존 곡선은 GM-CSF 결핍된 신경교종을 이식받은 쥐들의 중요한 생존 이익을 보여주었다(도 16). shGM-CSF-신경교종을 가진 두 쥐는 이식 후 63일을 살아있었다.
실험예
14 :
OPN
,
GM
-
CSF
및
GM
-
CSFR
펩티드의 억제는 대안적 소교세포 활성화 마커(
M2 표현형
)의 발현을 약화시킨다
.
U87-MG 인간 신경교종 세포를 총 부피 8mL 배양 배지 안에 100mm 배양 접시에 24시간 플레이팅시켰다. 그 후에, 배지가 또다른 24시간 동안 신경교종 세포에 의해 컨디셔닝되었다(GCM, 신경교종-가동 배지). 컨디셔닝 후, 배지를 수집하고 상온에서 5분동안 1000xg로 원심분리하였다. 500μL 배지는 선택된 펩티드로 500μM의 최종 농도로 보충되었고, 소교세포는 펩티드로 보충된 GCM으로 6시간 동안 처리되었다. 세포를 용해하고, 전체 RNA는 분리되었으며 cDNA는 역전사효소 및 무작위의 6합체 프라이머를 이용하여 합성되었다. 다음의 저해 펩티드가 사용되었다.
GMCSF1 QPWEHVNAIQEARRLLNLSR (서열번호 : 3)
GMCSF2 KDFLLVIPFDCWEPVQE (서열번호 : 4)
GMCSFR1 FQYQLDVHRKN (서열번호 : 5)
GMCSFR2 ADVRILN (서열번호: 6)
OPN DGRGDSV (서열번호: 7)
MFGE8 EVRGDVF (서열번호: 8)
MFGE8rat TQRGDIF (서열번호: 18)
Argl, Idl, c-Myc 및 MMP-14와 같은 M2 소교세포/대식세포 표현형의 마커에 의해 이전에 확인된 유전자의 발현 레벨은(도 4 참조) 실시간 PCR을 사용하여 측정되었다. 마찬가지로, iNOS의 발현 수준은 면역 반응의 유도를 평가하기 위하여 측정되었다. 측정한 모든 유전자의 발현 수준은 그들의 대조군, 소교세포 가동 배지(MGCM)로 처리된 세포에서의 발현 수준으로 표준화했다.
도표의 선은 제어된 펩티드 DQIGFRT(서열번호 : 43)로 처리된 대조군 세포(CTRLl)에서의 유전자 발현 수준에 대한 임계값을 나타낸다.
도 17a-b에서와 같이, OPN 저해 펩티드(서열번호 : 7)는 소교세포에서의 가장 중요한 M2 표현형 마커 - Argl 및 Idl 을 하향-조절했다. 마찬가지로 GM-CSF 및 GM-CSFR 저해제 또한 소교세포에서 Argl, Idl, c-Myc 및 MMP14와 같은 M2 표현형 마커를 하향-조절했다(도 17a, c-e).
놀랍게도, GM-CSF와 GM-CSFR을 저해하는 펩티드는 친-염증성 유전자 iNOS의 발현 또한 유도 할 수 있었다(도 17f).
실험예
15 :
OPN
,
GM
-
CSF
및
GM
-
CSFR
저해 펩티드는
U87
-
MG
인간
교종세포의
침습을 약화시킨다.
BV2 불멸화 쥐의 소교세포가 24-웰 배양 접시에 총 부피 0.7mL 배양 배지 안에 24시간 동안 플레이팅되었다. 이어서, 배양 배지는 최종 농도 500μΜ으로 펩티드로 보충된 0.7mL의 신선한 배지(2% FBS, Glutamax 포함 DMEM, PenStrep)로 한 시간 동안 대체되었다. U87-MG 인간 신경교종 세포가 마트리겔로 코팅된 인서트에 접종되었다. 18시간 이후 마트리겔은 인서트로부터 제거되었고, 세포는 10% 메탄올로 고정되었으며 DAPI로 염색되었다. 마트리겔을 통해 이주된 세포(침습 세포)의 수는 형광 현미경을 통해 계산되었다. BV2 세포와 함께 배양된 U87-MG(NULL+BV2)는 침습의 양성 대조군으로 사용되었고, U87-MG 단독으로는(NULL) 침습의 음성 대조군으로 사용되었다.
통계 분석은 분산 분석을 사용하여 수행되었다(ANOVA : 단일 요소). “P-값”은 관찰된 결과가 무작위 사건인 확률을 정의한다.
도표의 선은 BV2/소교세포(NULL + BV2)와 함께 배양된, 처리되지 않은 세포의 침습에 대한 임계값을 나타낸다.
도 18에 도시된 바와 같이, GMCSF 및 GMCSFR 펩티드는 소교세포의 존재 하에서 신경교종 세포의 침습화시킬 수 있었다.
실험예
16 :
오스테오폰틴의
영구적 정지로
매개된
RNAi
는 생체 내의 쥐의 신경교종 모델에서 종양 성장을 약화시킨다.
RNA는 오스테오폰틴 세포에 대해 shRNA를 안정적으로 발현하는 쥐의 C6 신경교종 클론으로부터 분리되었고, cDNA는 역전사효소 및 무작위의 6합체 프라이머를 이용하여 합성되었다. 오스테오폰틴의 정지 효율은 Real-Time PCR에 의해 확인되었다(도 19a). 제어된 shRNA(shNeg)를 발현하는 C6 신경교종 세포 또는 오스테오폰틴이 고갈된 신경교종 세포(shSPP1)(5xl04 세포/2.5μl의 DMEM)가 8-10주 된 위스타 쥐의 오른쪽 선조체에 주입되었다. 신경교종이 주입된 15일 이후, 동물들은 희생되었고 4%의 파라포름알데히드로 관류되었다. 뇌는 제거되어져 건조 CO₂로 냉동되었고 일련된 20- 또는 12-μm 두께의 관상 부분이 저온 유지 장치를 사용하여 수집되었다. 종양의 크기를 정량화하기 위해, 20μm 두께의 부분이 톨루이딘 블루로 염색되었고, Leica DM4000B 현미경을 사용하여 영상을 얻었다. 종양 영역은 ImageJ 소프트웨어를 사용하여 4번째 뇌 단편마다 측정되었고, 종양의 부피는 카발리에리 원리(Gabrusiewicz et al, 2011)에 따라 계산되었다. 쥐 뇌의 톨루이딘 블루로 염색된 부분의 대표 현미경 사진은, C6-shSPP1 세포 이식 동물이 C6-shNeg 세포 이식 동물에 비해 훨씬 종양이 작게 발전된 것을 보여준다(도 19b). 또한, C6-Neg이 이식된 신경교종은 WT C6 세포의 크기와 유사하였다(n=5, 28.33±14.53 mm³). 종양 부피의 정량은 오스테오폰틴이 결핍된 신경교종의 종양 부피에 비해 88% 감소를 보였다(평균값 C6-Neg=34.02mm³, C6-shSPP1=6.03mm³)(도 19c). 결과는 2개의 독립적 실험으로부터의 평균±표준편차로 표현되었다(U-만-휘트니 검증).
이 데이터는 신경교종으로부터 파생된 오스테오폰틴이 생체 내에서 신경교종의 성장에 기여한다는 것을 보여준다.
실험예
17 :
OPN
발현은
II
-
IV
급 신경교종 환자의 낮은 생존율과 연관된다.
분자 뇌 종양 형성 데이터(REMBRANDT)에 관한 NCI 저장소에서 데이터를 공개적으로 이용할 수 있는 343명의 신경교종 환자의, 차등을 둔 Spp1 발현에 기초한 캐플런-메이어 생존 곡선이 생성되었다. 곡선은 n=162일 때 2배 이상 상향-조절된 오스테오폰틴 발현(Spp1) 환자와(좋지 않은 예후), n=13일 때 2배 이상 하향-조절된 오스테오폰틴 발현(Spp1)환자(더 나은 예후)의 예측된 생존 기간의 음의 상관 관계를 보여줌으로써 오스테오폰틴 발현과 환자의 예측된 생존 시간 사이의 음의 상관관계를 보여준다(도 20).
전술한 특정 실시예의 설명은 발명의 일반적인 성격을 드러내기 위한 것으로, 다른 사람들이 이러한 특정 실시예를 통해, 통상적인 지식에 의해 과도한 실험을 거치거나 일반적인 개념을 벗어나지 않고도 용이하게 개조 및/또는 다양하게 응용하여 적용할 수 있다. 그러므로, 이러한 개조 및 적용은 기재된 실시예의 의미와 균등물의 범위 내에 포함되도록 의도되어야 한다. 또한 본원에 사용된 표현이나 용어는 설명하기 위한 것이지 제한하기 위한 것이 아니다. 수단, 재료 및 여러 기재된 기능들을 수행하기 위한 단계는 본 발명으로부터 벗어나지 않은 다른 다양한 형태를 취할 수 있다.
Claims (41)
- GM-CSF 활성을 억제하기 위한 분리된 펩티드로서, 상기 펩티드는 다음으로 구성된 군으로부터 선택된 아미노산 서열을 포함하고:
서열 번호: 1로 제시된 아미노산 서열, 서열 번호: 2로 제시된 아미노산 서열, 서열 번호: 3으로 제시된 아미노산 서열, 서열 번호: 4로 제시된 아미노산 서열, 서열 번호: 5로 제시된 아미노산 서열; 및 서열 번호: 6으로 제시된 아미노산 서열;
여기서, 상기 펩티드는 7 내지 25개의 아미노산으로 구성되는
분리된 펩티드. - 제1항에 있어서, 상기 펩티드는 7 내지 20개의 아미노산으로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 1로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 2로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 3으로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 4로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 5로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 서열 번호: 6으로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 분리된 펩티드.
- 제1항에 있어서, 상기 펩티드는 시클릭 펩티드인 분리된 펩티드.
- 제1항 내지 제9항 중 어느 한 항의 분리된 펩티드 및 약제학적 허용 담체를 포함하는 약제학적 조성물.
- 제10항에 있어서, 상기 약제학적 허용 담체는 수용액, 식물성 오일, 알콜, 폴리에틸렌 글리콜, 프로필렌 글리콜 또는 글리세린으로 구성된 군으로부터 선택되는 약제학적 조성물.
- 제10항에 있어서, 신경교종을 치료하기 위한 약제학적 조성물.
- 제12항에 있어서, 상기 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 또는 혼합 신경교종으로 구성된 군으로부터 선택되는 약제학적 조성물.
- GM-CSF 활성을 억제할 수 있는 펩티드를 함유하는 약제학적 조성물의 치료학적 유효량을 신경교종의 치료가 필요한 환자에게 투여하는 과정을 포함하는 신경교종을 치료하기 위한 방법으로서, 상기 펩티드는 다음으로 구성된 군으로부터 선택된 서열을 포함하는 방법:
서열 번호: 1로 제시된 아미노산 서열, 서열 번호: 2로 제시된 아미노산 서열, 서열 번호: 3으로 제시된 아미노산 서열, 서열 번호: 4로 제시된 아미노산 서열, 서열 번호: 5로 제시된 아미노산 서열; 및 서열 번호: 6으로 제시된 아미노산 서열. - 제14항에 있어서, 상기 펩티드는 7 내지 20개의 아미노산으로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 1로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 2로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 3으로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 4로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 5로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 서열 번호: 6으로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제14항에 있어서, 상기 펩티드는 시클릭 펩티드인 방법.
- 제14항에 있어서, 상기 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 또는 혼합 신경교종으로 구성된 군으로부터 선택되는 방법.
- 제14항에 있어서, 상기 신경교종의 치료는 식세포작용을 감소시키는 것, 운동성을 감소시키는 것, 전-종양 활성을 갖는 종양 침투 대식세포의 증식을 감소시키는 것, 및 대식세포에 의한 염증전(pro-inflammatory) 사이토카인 또는 케모카인의 분비를 감소시키는 것으로 구성된 군으로부터 선택되는 방법.
- 제10항 내지 제13항 중 어느 한 항의 약제학적 조성물을 함유하는 신경교종의 치료를 위한 키트 및 상기 키트의 사용 설명.
- RGD (Arg-Gly-Asp) 모티프를 포함하는 분리된 펩티드로서, 상기 분리된 펩티드는 서열 번호: 7을 함유하는 분리된 펩티드.
- 제26항에 있어서, 7 내지 20개의 아미노산으로 구성된 분리된 펩티드.
- 제26항에 있어서, 7 내지 15개의 아미노산으로 구성된 분리된 펩티드.
- 제26항에 있어서, 상기 펩티드는 서열 번호: 7로 제시된 아미노산 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제26항 내지 제29항 중 어느 한 항의 분리된 펩티드 및 약제학적 허용 담체를 포함하는 약제학적 조성물.
- 제30항에 있어서, 상기 약제학적 허용 담체는 수용액, 식물성 오일, 알콜, 폴리에틸렌 글리콜, 프로필렌 글리콜 또는 글리세린으로 구성된 군으로부터 선택되는 약제학적 조성물.
- 제30항에 있어서, 신경교종을 치료하기 위한 약제학적 조성물.
- 제30항에 있어서, 상기 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 또는 혼합 신경교종으로 구성된 군으로부터 선택되는 약제학적 조성물.
- RGD (Arg-Gly-Asp) 모티프를 포함하는 펩티드를 함유하는 약제학적 조성물의 치료학적 유효량을 신경교종의 치료가 필요한 환자에게 투여하는 과정을 포함하는 신경교종을 치료하기 위한 방법으로서, 상기 펩티드는 서열 번호: 7로 제시된 아미노산을 포함하는 방법.
- 제34항에 있어서, 상기 펩티드는 7 내지 20개의 아미노산으로 구성된 방법.
- 제34항에 있어서, 상기 펩티드는 7 내지 15개의 아미노산으로 구성된 방법.
- 제34항에 있어서, 상기 펩티드는 서열 번호: 7로 제시된 상기 서열, 또는 이의 유사체 또는 유도체로 구성되는 방법.
- 제34항에 있어서, 상기 펩티드는 시클릭 펩티드인 방법.
- 제34항에 있어서, 상기 신경교종은 상의세포종(ependymoma), 성상세포종(astrocytoma), 핍지교종(oligodendroglioma), 교아세포종(glioblastoma) 또는 혼합 신경교종으로 구성된 군으로부터 선택되는 방법.
- 제34항에 있어서, 상기 신경교종의 치료는 식세포작용을 감소시키는 것, 운동성을 감소시키는 것, 전-종양 활성을 갖는 종양 침투 대식세포의 증식을 감소시키는 것, 및 상기 대식세포에 의한 염증전(pro-inflammatory) 사이토카인 또는 케모카인의 분비를 감소시키는 것으로 구성된 군으로부터 선택되는 방법.
- 제30항 내지 제33항 중 어느 한 항의 약제학적 조성물을 함유하는 신경교종의 치료를 위한 키트 및 상기 키트의 사용 설명.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161561080P | 2011-11-17 | 2011-11-17 | |
| US61/561,080 | 2011-11-17 | ||
| US201261583745P | 2012-01-06 | 2012-01-06 | |
| US61/583,745 | 2012-01-06 | ||
| PCT/IB2012/056533 WO2013072901A2 (en) | 2011-11-17 | 2012-11-18 | Compositions and methods for treating glioma |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140103122A true KR20140103122A (ko) | 2014-08-25 |
Family
ID=47358252
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147016562A KR20140103122A (ko) | 2011-11-17 | 2012-11-18 | 신경교종을 치료하기 위한 조성물 및 방법 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US9453050B2 (ko) |
| EP (1) | EP2780363B1 (ko) |
| JP (1) | JP6426001B2 (ko) |
| KR (1) | KR20140103122A (ko) |
| CA (1) | CA2856329A1 (ko) |
| IL (1) | IL232648B (ko) |
| WO (1) | WO2013072901A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220025115A (ko) * | 2014-09-26 | 2022-03-03 | 내셔널 유니버시티 오브 싱가포르 | Th-gm 세포 기능 조절 방법 및 조성물 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201220573D0 (en) | 2012-11-15 | 2013-01-02 | Univ Central Lancashire | Methods of diagnosing proliferative disorders |
| DE102014207498A1 (de) * | 2014-04-17 | 2015-10-22 | Universitätsklinikum Hamburg-Eppendorf | Viraler Vektor für den zielgerichteten Gentransfer in Gehirn und Rückenmark |
| US11078264B2 (en) | 2018-10-17 | 2021-08-03 | University Of Connecticut | Inhibiting granulocyte macrophage-colony stimulating factor (GM-CSF) prevents preterm birth |
| EP3886888A4 (en) * | 2018-11-28 | 2022-09-28 | Glia Sp. z o.o. | COMPOSITIONS AND METHODS FOR TREATING GLIOMA |
| CN112007142A (zh) * | 2019-05-31 | 2020-12-01 | 生物蚕茧研究所股份有限公司 | 向抗炎m2表型小胶质细胞的极性转化促进剂 |
| PL441229A1 (pl) * | 2022-05-19 | 2023-11-20 | Instytut Biologii Doświadczalnej im. Marcelego Nenckiego Polska Akademia Nauk | Zaprojektowane, syntetyczne peptydy, zawierające je kompozycje i sposoby ich zastosowania w leczeniu glejaków złośliwych |
| CN116650650A (zh) * | 2023-06-12 | 2023-08-29 | 郑州大学 | 一种抑制食管鳞癌中肿瘤相关巨噬细胞浸润的方法 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6410516B1 (en) | 1986-01-09 | 2002-06-25 | President & Fellows Of Harvard College | Nuclear factors associated with transcriptional regulation |
| NZ234479A (en) * | 1989-07-14 | 1992-03-26 | Schering Corp | Antagonists of gm-csf derived from the carboxyl terminus, antibodies, hybridomas and pharmaceutical compositions containing anti-idiotypic antibodies |
| ATE161883T1 (de) * | 1989-08-11 | 1998-01-15 | Amrad Corp Ltd | Rezeptor für granulozyten-macrophagen- koloniestimulierungsfaktor und seine derivate |
| AUPN780096A0 (en) * | 1996-01-30 | 1996-02-22 | Medvet Science Pty. Ltd. | Cytokine antagonists and agonists |
| US5837231A (en) * | 1996-06-27 | 1998-11-17 | Regents Of The University Of Minnesota | GM-CSF administration for the treatment and prevention of recurrence of brain tumors |
| US6372720B1 (en) | 1998-02-05 | 2002-04-16 | Kenneth J. Longmuir | Liposome fusion and delivery vehicle |
| CA2288680A1 (en) | 1998-11-12 | 2000-05-12 | Jcr Pharmaceuticals Co., Ltd. | Modulation of cell proliferative disorders by cyclic rgd |
| US6551990B2 (en) * | 1998-12-07 | 2003-04-22 | University Of Washington | Methods of inhibiting ectopic calcification |
| EP1140182A2 (en) | 1998-12-23 | 2001-10-10 | G.D. Searle & Co. | Use of a matrix metalloproteinase inhibitor together with an antineoplastic agent, optionally also together with radiation, in the treatment of neoplasia |
| US6521593B1 (en) | 1999-02-01 | 2003-02-18 | Childrens Hospital Los Angeles | Methods for inhibiting brain tumor growth |
| EP1272633B1 (en) * | 2000-03-30 | 2011-04-27 | Dendreon Corporation | Compositions and methods for dendritic cell-based immunotherapy |
| US7767802B2 (en) | 2001-01-09 | 2010-08-03 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of anti-apoptotic genes |
| US7611711B2 (en) * | 2001-01-17 | 2009-11-03 | Vegenics Limited | VEGFR-3 inhibitor materials and methods |
| US7063860B2 (en) | 2001-08-13 | 2006-06-20 | University Of Pittsburgh | Application of lipid vehicles and use for drug delivery |
| WO2004018498A2 (en) * | 2002-05-10 | 2004-03-04 | Children's Medical Center Corporation | Minicell display and products therefrom |
| WO2006087579A1 (en) * | 2005-02-18 | 2006-08-24 | Proximagen Ltd. | Treatment for neurodegeneration |
| EP2377884A1 (en) * | 2005-05-10 | 2011-10-19 | Neoloch Aps | Neuritogenic peptides |
| JP2009508650A (ja) * | 2005-09-21 | 2009-03-05 | ダスク テクノロジーズ, エルエルシー | 臓器および組織機能のための方法および組成 |
| ES2521679T3 (es) | 2006-01-18 | 2014-11-13 | Merck Patent Gmbh | Terapia específica usando ligandos de integrinas para el tratamiento del cáncer |
| CN103641915B (zh) * | 2006-03-27 | 2017-04-12 | 医学免疫有限公司 | Gm‑csf受体结合元件 |
| HUE033487T2 (en) | 2007-03-09 | 2017-12-28 | Pathologica Llc | MGBG for osteopontin control and multiple sclerosis treatment |
| WO2009052286A1 (en) | 2007-10-16 | 2009-04-23 | Ventana Medical Systems, Inc. | Grading, staging, and prognosing cancer using osteopontin-c |
| KR20200075044A (ko) * | 2008-01-22 | 2020-06-25 | 아라임 파마슈티칼즈, 인크. | 조직 손상 관련 질환 및 장애를 예방 및 치료하기 위한 조직 보호 펩티드 및 펩티드 유사체 |
| JP2012509287A (ja) | 2008-11-20 | 2012-04-19 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 癌を治療するためのインテグリンリガンドを用いる新規療法および医薬 |
| EA201101651A1 (ru) | 2009-05-25 | 2012-08-30 | Мерк Патент Гмбх | Непрерывное введение интегриновых лигандов для лечения рака |
| BR112012027745A2 (pt) * | 2010-04-27 | 2017-01-10 | Univ Johns Hopkins | método e composição imunogênica para tratamento de neoplásia |
-
2012
- 2012-11-18 KR KR1020147016562A patent/KR20140103122A/ko not_active Application Discontinuation
- 2012-11-18 WO PCT/IB2012/056533 patent/WO2013072901A2/en active Application Filing
- 2012-11-18 JP JP2014541807A patent/JP6426001B2/ja not_active Expired - Fee Related
- 2012-11-18 EP EP12801640.9A patent/EP2780363B1/en not_active Not-in-force
- 2012-11-18 CA CA2856329A patent/CA2856329A1/en not_active Abandoned
-
2014
- 2014-05-15 IL IL232648A patent/IL232648B/en unknown
- 2014-05-16 US US14/280,095 patent/US9453050B2/en active Active
-
2016
- 2016-08-09 US US15/232,165 patent/US20170035851A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220025115A (ko) * | 2014-09-26 | 2022-03-03 | 내셔널 유니버시티 오브 싱가포르 | Th-gm 세포 기능 조절 방법 및 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2014533681A (ja) | 2014-12-15 |
| US20140256628A1 (en) | 2014-09-11 |
| WO2013072901A3 (en) | 2013-07-25 |
| US20170035851A1 (en) | 2017-02-09 |
| CA2856329A1 (en) | 2013-05-23 |
| IL232648B (en) | 2021-12-01 |
| IL232648A0 (en) | 2014-06-30 |
| US9453050B2 (en) | 2016-09-27 |
| WO2013072901A2 (en) | 2013-05-23 |
| JP6426001B2 (ja) | 2018-11-21 |
| EP2780363B1 (en) | 2019-07-03 |
| EP2780363A2 (en) | 2014-09-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140103122A (ko) | 신경교종을 치료하기 위한 조성물 및 방법 | |
| EP2513146B1 (en) | Antibodies against ror1 capable of inducing cell death of cll | |
| EP3431498A1 (en) | Treatment of fibrosis of the gastrointestinal tract with antibodies which prevent il-11:il-11ralpha interaction | |
| US20130273057A1 (en) | Methods and compositions for the treatment and diagnosis of vascular inflammatory disorders or endothelial cell disorders | |
| KR20200100866A (ko) | 항-전이성 요법에서 axl 신호전달의 저해 | |
| WO2011066284A1 (en) | Methods and compositions for the treatment of immune disorders | |
| KR20150122786A (ko) | 암 전이의 진단, 예후 및 치료를 위한 방법 | |
| US20210277102A1 (en) | Compositions and methods for treating a tumor suppressor deficient cancer | |
| KR20130107203A (ko) | 섬유증의 검출 및 치료 | |
| JP6053255B2 (ja) | 新規癌抗原eEF2 | |
| EP2723350B1 (en) | New uses of nanog inhibitors and related methods | |
| JP2009523409A (ja) | がん治療用およびがん診断用の組成物および方法 | |
| AU2017285726B2 (en) | Methods for diagnosing and treating metastatic cancer | |
| JP6078633B2 (ja) | 治療用のチオレドキシン相互作用タンパク質(txnip)のインヒビター | |
| US11911468B2 (en) | Compositions and methods of treating sarcoma lung metastasis | |
| EP2575883B1 (en) | Treatment of inflammatory disorders | |
| CN110719790A (zh) | 治疗癌症的反义疗法 | |
| US11155820B2 (en) | Target of VGSC β3 protein for prevention, treatment and diagnostic detection of cancers | |
| KR102270926B1 (ko) | Banf1, plod3 또는 sf3b4의 억제제를 유효성분으로 포함하는 간암의 예방 및 치료용 조성물 | |
| EP4299119A1 (en) | Therapeutic applications based on the inhibition of g protein-coupled receptor 182 (gpr182) | |
| US9150929B2 (en) | Anaplastic thyroid cancers harbor novel oncogenic mutations of the ALK gene | |
| DK2257299T3 (en) | Modulation of SRPX2-mediated angiogenesis | |
| JP2024511569A (ja) | 免疫増強剤 | |
| WO2023183822A1 (en) | Hematopoietic loss of y chromosome leads to cardiac fibrosis and dysfunction and is associated with death due to heart failure | |
| WO2012052995A2 (en) | Treatment and prevention of hepatocellular carcinoma with chemokine receptor modulators |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |