KR20140099475A - 개질 촉매의 제조 방법 및 메탄의 개질 - Google Patents
개질 촉매의 제조 방법 및 메탄의 개질 Download PDFInfo
- Publication number
- KR20140099475A KR20140099475A KR1020147015234A KR20147015234A KR20140099475A KR 20140099475 A KR20140099475 A KR 20140099475A KR 1020147015234 A KR1020147015234 A KR 1020147015234A KR 20147015234 A KR20147015234 A KR 20147015234A KR 20140099475 A KR20140099475 A KR 20140099475A
- Authority
- KR
- South Korea
- Prior art keywords
- range
- catalyst
- less
- hydrotalcite
- temperature
- Prior art date
Links
- 239000003054 catalyst Substances 0.000 title claims abstract description 147
- 238000000034 method Methods 0.000 title claims abstract description 145
- 230000008569 process Effects 0.000 title claims abstract description 103
- 238000002407 reforming Methods 0.000 title claims abstract description 23
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 title description 58
- 229910052751 metal Inorganic materials 0.000 claims abstract description 85
- 239000002184 metal Substances 0.000 claims abstract description 85
- GDVKFRBCXAPAQJ-UHFFFAOYSA-A dialuminum;hexamagnesium;carbonate;hexadecahydroxide Chemical compound [OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[OH-].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Mg+2].[Al+3].[Al+3].[O-]C([O-])=O GDVKFRBCXAPAQJ-UHFFFAOYSA-A 0.000 claims abstract description 77
- 229910001701 hydrotalcite Inorganic materials 0.000 claims abstract description 77
- 229960001545 hydrotalcite Drugs 0.000 claims abstract description 77
- 150000003839 salts Chemical class 0.000 claims abstract description 66
- 239000007858 starting material Substances 0.000 claims abstract description 50
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 41
- 150000001875 compounds Chemical class 0.000 claims abstract description 32
- 238000010438 heat treatment Methods 0.000 claims abstract description 29
- 238000002156 mixing Methods 0.000 claims abstract description 24
- 229930195733 hydrocarbon Natural products 0.000 claims abstract description 19
- 150000002430 hydrocarbons Chemical class 0.000 claims abstract description 19
- 238000000465 moulding Methods 0.000 claims abstract description 14
- 239000004215 Carbon black (E152) Substances 0.000 claims abstract description 12
- 230000004048 modification Effects 0.000 claims abstract description 10
- 238000012986 modification Methods 0.000 claims abstract description 10
- 238000002360 preparation method Methods 0.000 claims abstract description 10
- AOPCKOPZYFFEDA-UHFFFAOYSA-N nickel(2+);dinitrate;hexahydrate Chemical compound O.O.O.O.O.O.[Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O AOPCKOPZYFFEDA-UHFFFAOYSA-N 0.000 claims abstract description 6
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims description 89
- 239000000203 mixture Substances 0.000 claims description 52
- 239000011777 magnesium Substances 0.000 claims description 50
- 238000001354 calcination Methods 0.000 claims description 40
- 229910052759 nickel Inorganic materials 0.000 claims description 33
- 229910052749 magnesium Inorganic materials 0.000 claims description 30
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims description 27
- 230000015572 biosynthetic process Effects 0.000 claims description 26
- 229910052782 aluminium Inorganic materials 0.000 claims description 24
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 23
- 229910052596 spinel Inorganic materials 0.000 claims description 22
- 239000011029 spinel Substances 0.000 claims description 22
- 238000003786 synthesis reaction Methods 0.000 claims description 20
- 239000011148 porous material Substances 0.000 claims description 17
- 238000004519 manufacturing process Methods 0.000 claims description 14
- 239000012530 fluid Substances 0.000 claims description 8
- ATTFYOXEMHAYAX-UHFFFAOYSA-N magnesium nickel Chemical compound [Mg].[Ni] ATTFYOXEMHAYAX-UHFFFAOYSA-N 0.000 claims description 4
- KBJMLQFLOWQJNF-UHFFFAOYSA-N nickel(ii) nitrate Chemical compound [Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O KBJMLQFLOWQJNF-UHFFFAOYSA-N 0.000 claims description 4
- VXAUWWUXCIMFIM-UHFFFAOYSA-M aluminum;oxygen(2-);hydroxide Chemical compound [OH-].[O-2].[Al+3] VXAUWWUXCIMFIM-UHFFFAOYSA-M 0.000 claims description 3
- 150000004687 hexahydrates Chemical class 0.000 claims description 3
- 230000002902 bimodal effect Effects 0.000 claims description 2
- 150000002815 nickel Chemical class 0.000 claims description 2
- 150000001868 cobalt Chemical class 0.000 claims 2
- NSVFPFUROXFZJS-UHFFFAOYSA-N nickel;hexahydrate Chemical group O.O.O.O.O.O.[Ni] NSVFPFUROXFZJS-UHFFFAOYSA-N 0.000 claims 1
- 229910052739 hydrogen Inorganic materials 0.000 abstract description 12
- 239000001257 hydrogen Substances 0.000 abstract description 8
- 238000003837 high-temperature calcination Methods 0.000 abstract description 4
- 125000004435 hydrogen atom Chemical class [H]* 0.000 abstract 1
- 239000000126 substance Substances 0.000 abstract 1
- 239000007789 gas Substances 0.000 description 44
- 239000000463 material Substances 0.000 description 41
- 238000006243 chemical reaction Methods 0.000 description 30
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 25
- 230000003197 catalytic effect Effects 0.000 description 19
- 239000000523 sample Substances 0.000 description 17
- 238000006555 catalytic reaction Methods 0.000 description 13
- CPLXHLVBOLITMK-UHFFFAOYSA-N Magnesium oxide Chemical compound [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 12
- 230000000052 comparative effect Effects 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 10
- 239000002243 precursor Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 9
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 9
- 229910052799 carbon Inorganic materials 0.000 description 9
- HYBBIBNJHNGZAN-UHFFFAOYSA-N furfural Chemical compound O=CC1=CC=CO1 HYBBIBNJHNGZAN-UHFFFAOYSA-N 0.000 description 9
- 239000011521 glass Substances 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 238000000629 steam reforming Methods 0.000 description 9
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- 239000000654 additive Substances 0.000 description 8
- -1 lanthanum or cerium Chemical compound 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 238000007873 sieving Methods 0.000 description 7
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 6
- 229910002651 NO3 Inorganic materials 0.000 description 6
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 6
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 6
- 229910052786 argon Inorganic materials 0.000 description 6
- 239000001569 carbon dioxide Substances 0.000 description 6
- 229910002092 carbon dioxide Inorganic materials 0.000 description 6
- 229910052742 iron Inorganic materials 0.000 description 6
- 229910052746 lanthanum Inorganic materials 0.000 description 6
- 239000000395 magnesium oxide Substances 0.000 description 6
- 239000000155 melt Substances 0.000 description 6
- 230000003647 oxidation Effects 0.000 description 6
- 238000007254 oxidation reaction Methods 0.000 description 6
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 6
- 239000012266 salt solution Substances 0.000 description 6
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 5
- 229910052684 Cerium Inorganic materials 0.000 description 5
- 230000008021 deposition Effects 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- 150000002823 nitrates Chemical class 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 229910020068 MgAl Inorganic materials 0.000 description 4
- 238000002441 X-ray diffraction Methods 0.000 description 4
- 150000004703 alkoxides Chemical class 0.000 description 4
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 4
- 239000003575 carbonaceous material Substances 0.000 description 4
- 238000003763 carbonization Methods 0.000 description 4
- ZMIGMASIKSOYAM-UHFFFAOYSA-N cerium Chemical compound [Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce][Ce] ZMIGMASIKSOYAM-UHFFFAOYSA-N 0.000 description 4
- 230000003750 conditioning effect Effects 0.000 description 4
- 238000001125 extrusion Methods 0.000 description 4
- 150000004679 hydroxides Chemical class 0.000 description 4
- 229910052747 lanthanoid Inorganic materials 0.000 description 4
- 150000002602 lanthanoids Chemical class 0.000 description 4
- FZLIPJUXYLNCLC-UHFFFAOYSA-N lanthanum atom Chemical compound [La] FZLIPJUXYLNCLC-UHFFFAOYSA-N 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 238000002844 melting Methods 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- 150000002739 metals Chemical class 0.000 description 4
- 150000002826 nitrites Chemical class 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 238000006057 reforming reaction Methods 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000007711 solidification Methods 0.000 description 4
- 230000008023 solidification Effects 0.000 description 4
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- ZZBAGJPKGRJIJH-UHFFFAOYSA-N 7h-purine-2-carbaldehyde Chemical compound O=CC1=NC=C2NC=NC2=N1 ZZBAGJPKGRJIJH-UHFFFAOYSA-N 0.000 description 3
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 238000001994 activation Methods 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 229910001593 boehmite Inorganic materials 0.000 description 3
- 239000000470 constituent Substances 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 238000000354 decomposition reaction Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 239000005350 fused silica glass Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 3
- FAHBNUUHRFUEAI-UHFFFAOYSA-M hydroxidooxidoaluminium Chemical compound O[Al]=O FAHBNUUHRFUEAI-UHFFFAOYSA-M 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 229910000000 metal hydroxide Inorganic materials 0.000 description 3
- 150000004692 metal hydroxides Chemical class 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 238000001694 spray drying Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 150000001449 anionic compounds Chemical class 0.000 description 2
- 125000000129 anionic group Chemical group 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 2
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 2
- 239000012018 catalyst precursor Substances 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000010941 cobalt Substances 0.000 description 2
- 229910017052 cobalt Inorganic materials 0.000 description 2
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 238000000280 densification Methods 0.000 description 2
- WMWXXXSCZVGQAR-UHFFFAOYSA-N dialuminum;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3] WMWXXXSCZVGQAR-UHFFFAOYSA-N 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 238000007654 immersion Methods 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000012778 molding material Substances 0.000 description 2
- 239000002086 nanomaterial Substances 0.000 description 2
- 229910000480 nickel oxide Inorganic materials 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 150000002891 organic anions Chemical class 0.000 description 2
- GNRSAWUEBMWBQH-UHFFFAOYSA-N oxonickel Chemical compound [Ni]=O GNRSAWUEBMWBQH-UHFFFAOYSA-N 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 239000011833 salt mixture Substances 0.000 description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 229910052726 zirconium Inorganic materials 0.000 description 2
- 238000004438 BET method Methods 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- XTEGARKTQYYJKE-UHFFFAOYSA-M Chlorate Chemical class [O-]Cl(=O)=O XTEGARKTQYYJKE-UHFFFAOYSA-M 0.000 description 1
- 101001131990 Homo sapiens Peroxidasin homolog Proteins 0.000 description 1
- 229910003023 Mg-Al Inorganic materials 0.000 description 1
- 102100034601 Peroxidasin homolog Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- GANNOFFDYMSBSZ-UHFFFAOYSA-N [AlH3].[Mg] Chemical compound [AlH3].[Mg] GANNOFFDYMSBSZ-UHFFFAOYSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- QANIADJLTJYOFI-UHFFFAOYSA-K aluminum;magnesium;carbonate;hydroxide;hydrate Chemical compound O.[OH-].[Mg+2].[Al+3].[O-]C([O-])=O QANIADJLTJYOFI-UHFFFAOYSA-K 0.000 description 1
- 150000003868 ammonium compounds Chemical class 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000002453 autothermal reforming Methods 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-M bromate Chemical class [O-]Br(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-M 0.000 description 1
- CDQSJQSWAWPGKG-UHFFFAOYSA-N butane-1,1-diol Chemical compound CCCC(O)O CDQSJQSWAWPGKG-UHFFFAOYSA-N 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000003889 chemical engineering Methods 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011362 coarse particle Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- CZTAKVJWYINREU-UHFFFAOYSA-N cobalt nickel hydrate Chemical compound O.[Co].[Ni] CZTAKVJWYINREU-UHFFFAOYSA-N 0.000 description 1
- 238000004939 coking Methods 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000010924 continuous production Methods 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 230000009699 differential effect Effects 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 239000008246 gaseous mixture Substances 0.000 description 1
- 229910001679 gibbsite Inorganic materials 0.000 description 1
- 239000010439 graphite Substances 0.000 description 1
- 229910002804 graphite Inorganic materials 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229910001412 inorganic anion Inorganic materials 0.000 description 1
- ICIWUVCWSCSTAQ-UHFFFAOYSA-N iodic acid Chemical class OI(=O)=O ICIWUVCWSCSTAQ-UHFFFAOYSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 150000002601 lanthanoid compounds Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- VUZPPFZMUPKLLV-UHFFFAOYSA-N methane;hydrate Chemical compound C.O VUZPPFZMUPKLLV-UHFFFAOYSA-N 0.000 description 1
- 238000003801 milling Methods 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000002159 nanocrystal Substances 0.000 description 1
- DWAHIRJDCNGEDV-UHFFFAOYSA-N nickel(2+);dinitrate;hydrate Chemical compound O.[Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O DWAHIRJDCNGEDV-UHFFFAOYSA-N 0.000 description 1
- 229910052758 niobium Inorganic materials 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000003209 petroleum derivative Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229910052573 porcelain Inorganic materials 0.000 description 1
- 238000002459 porosimetry Methods 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000012255 powdered metal Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 238000010298 pulverizing process Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- 238000004227 thermal cracking Methods 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B3/00—Hydrogen; Gaseous mixtures containing hydrogen; Separation of hydrogen from mixtures containing it; Purification of hydrogen
- C01B3/02—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen
- C01B3/32—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air
- C01B3/34—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents
- C01B3/38—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents using catalysts
- C01B3/40—Production of hydrogen or of gaseous mixtures containing a substantial proportion of hydrogen by reaction of gaseous or liquid organic compounds with gasifying agents, e.g. water, carbon dioxide, air by reaction of hydrocarbons with gasifying agents using catalysts characterised by the catalyst
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/005—Spinels
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/02—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the alkali- or alkaline earth metals or beryllium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/76—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper combined with metals, oxides or hydroxides provided for in groups B01J23/02 - B01J23/36
- B01J23/78—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper combined with metals, oxides or hydroxides provided for in groups B01J23/02 - B01J23/36 with alkali- or alkaline earth metals
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J27/00—Catalysts comprising the elements or compounds of halogens, sulfur, selenium, tellurium, phosphorus or nitrogen; Catalysts comprising carbon compounds
- B01J27/20—Carbon compounds
- B01J27/232—Carbonates
- B01J27/236—Hydroxy carbonates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/30—Catalysts, in general, characterised by their form or physical properties characterised by their physical properties
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/30—Catalysts, in general, characterised by their form or physical properties characterised by their physical properties
- B01J35/31—Density
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/30—Catalysts, in general, characterised by their form or physical properties characterised by their physical properties
- B01J35/391—Physical properties of the active metal ingredient
- B01J35/393—Metal or metal oxide crystallite size
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/61—Surface area
- B01J35/613—10-100 m2/g
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/61—Surface area
- B01J35/615—100-500 m2/g
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/64—Pore diameter
- B01J35/647—2-50 nm
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/64—Pore diameter
- B01J35/651—50-500 nm
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/64—Pore diameter
- B01J35/653—500-1000 nm
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/66—Pore distribution
- B01J35/69—Pore distribution bimodal
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/60—Catalysts, in general, characterised by their form or physical properties characterised by their surface properties or porosity
- B01J35/66—Pore distribution
- B01J35/695—Pore distribution polymodal
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/0009—Use of binding agents; Moulding; Pressing; Powdering; Granulating; Addition of materials ameliorating the mechanical properties of the product catalyst
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/0081—Preparation by melting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/02—Impregnation, coating or precipitation
- B01J37/0201—Impregnation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/08—Heat treatment
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/02—Impregnation, coating or precipitation
- B01J37/03—Precipitation; Co-precipitation
- B01J37/031—Precipitation
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/02—Processes for making hydrogen or synthesis gas
- C01B2203/0205—Processes for making hydrogen or synthesis gas containing a reforming step
- C01B2203/0227—Processes for making hydrogen or synthesis gas containing a reforming step containing a catalytic reforming step
- C01B2203/0233—Processes for making hydrogen or synthesis gas containing a reforming step containing a catalytic reforming step the reforming step being a steam reforming step
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/02—Processes for making hydrogen or synthesis gas
- C01B2203/0205—Processes for making hydrogen or synthesis gas containing a reforming step
- C01B2203/0227—Processes for making hydrogen or synthesis gas containing a reforming step containing a catalytic reforming step
- C01B2203/0238—Processes for making hydrogen or synthesis gas containing a reforming step containing a catalytic reforming step the reforming step being a carbon dioxide reforming step
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/10—Catalysts for performing the hydrogen forming reactions
- C01B2203/1041—Composition of the catalyst
- C01B2203/1047—Group VIII metal catalysts
- C01B2203/1052—Nickel or cobalt catalysts
- C01B2203/1058—Nickel catalysts
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/10—Catalysts for performing the hydrogen forming reactions
- C01B2203/1041—Composition of the catalyst
- C01B2203/1082—Composition of support materials
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/10—Catalysts for performing the hydrogen forming reactions
- C01B2203/1041—Composition of the catalyst
- C01B2203/1094—Promotors or activators
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B2203/00—Integrated processes for the production of hydrogen or synthesis gas
- C01B2203/12—Feeding the process for making hydrogen or synthesis gas
- C01B2203/1205—Composition of the feed
- C01B2203/1211—Organic compounds or organic mixtures used in the process for making hydrogen or synthesis gas
- C01B2203/1235—Hydrocarbons
- C01B2203/1241—Natural gas or methane
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/141—Feedstock
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Thermal Sciences (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Combustion & Propulsion (AREA)
- Inorganic Chemistry (AREA)
- Catalysts (AREA)
Abstract
본 발명은, CO2, 물 및/또는 수소의 존재하에 탄화수소-포함 화합물을 개질하기 위한 촉매, 이의 제조 방법 및 이를 사용하여 탄화수소-포함 화합물을 개질하는 방법에 관한 것이다. 상기 촉매의 제조는, 하이드로탈사이트-포함 출발 물질과 가융성 금속 염(더욱 바람직하게는 질산 니켈 6수화물을 포함함)을 친밀 혼합 및 열처리하여 금속염 용융물을 생성함을 기본으로 한다. 몰딩 및 성형 후, 상기 화합물은 고온 하소 단계로 처리된다. 또한, 탄화수소-포함 화합물 개질용 촉매를 사용하는 공정은 500 내지 1100℃의 온도 범위에서 2 내지 70 바 범위의 압력하에 수행된다. 상기 촉매는 물리화학적 특성이 선행 기술과 구별된다.
Description
본 발명은 촉매의 제조 방법 및 상기 촉매의, 고 비율 CO2의 존재하의, 탄화 수소의 개질, 바람직하게는 고 메탄 함량을 가진 공급물 가스의 개질을 위한 용도에 관한 것이다. 상기 촉매를 제조하기 위해, 하이드로탈사이트(hydrotalcite)-포함 출발 물질이 가융성(fusible) 금속 염, 바람직하게는 질산 니켈을 포함하는 염과 접촉되고, 친밀 혼합되고, a) 열 처리 단계 및 b) 하소 단계를 거치게 된다.
GB 1 058 757는, 합성 가스 제조용 탄화수소의 개질을 위한 촉매적 방법 및 이 목적에 적합한 촉매를 개시한다. 이 발명의 촉매 제조 방법은, 우선, 후속 단계에 활성 금속으로 담지되는 스피넬 화합물 또는 스피넬-포함 화합물을 제조하는 것을 포함한다. 바람직한 실시양태에서, 활성 금속의 적용은 용융 침지에 의해 수행된다. 사용된 스피넬은 다공성 마그네슘-알루미늄 스피넬 MgAl2O4 을 포함할 수 있고 상기 용융 침지용 염 용융물은 질산 니켈 6수화물을 포함한다고 개시되어 있다.
GB 1 442 172에서, BASF는 스팀 존재 하에 C2-C30 탄화수소로부터 메탄-포함 가스를 제조하기 위한 크래킹 촉매를 개시한다. 촉매의 제조시, 니켈-포함 하이드로탈사이트로 구성된 전구체 화합물이 형성된다. 상기 전구체 화합물의 형성은, 원한다면 니켈, 마그네슘 및 알루미늄을 포함하는 염 용액으로부터 수산화물을 동시에 또는 연속적으로 침전시키는 것에 의해 수행된다. 수산화물-포함 침전물을 수세함으로써 알칼리-포함 종을 제거한다. 침전된 혼합된 금속 수산화물을 건조 및 하소 처리한다. 80 내지 180 ℃ 범위의 온도가 건조를 위해, 350 내지 550 ℃ 범위의 온도가 하소를 위해 사용되는 것으로 개시되어 있다. 하소에 이어, 촉매를 300 내지 500 ℃로 가열하고 환원성 분위기 하에 노출시켜 산화 니켈의 주요 부분을 니켈 금속으로 전환시킨다. 여기에서는 환원제로서 수소를 사용한다.
문헌 [Catalysis Today, Volume 113, Issues 3-4, 15 April 2006, pages 194-200]에서, 디아이디아(Djaidja) 등은, 니켈, 마그네슘 및 알루미늄을 함유하는 촉매가 건조 개질에 성공적으로 사용될 수 있다고 개시한다.
제이콥스(Jacobs) 등은 문헌[Catalysis Today, Volume 159, Issue 1, 10 January 2011, pages 12-24; Applied Catalysis B: Environmental Volume 105, Issues 3-4, 22 June 2011, pages 263-275)]에서, 일련의 다른 원소들에 의해 촉진될 수 있는 고-처리량 공정에 의해 니켈-포함 촉매를 개발한 것을 보고한다. 건조 개질용 촉매는 당업자에게 공지된 침전 방법에 의해 제조되었다. 제이콥스 등은, 란타늄 또는 세륨과 같은 희토류 및 지르코늄이 특히 촉매 활성을 유지하는데 우수한 촉진제라고 보고한다.
라오시리포자나(Laosiripojana) 등은 마찬가지로, 니켈, 마그네슘 및 알루미늄을 함유하는 촉매에 세륨을 첨가하는 것의 성능-증대 효과를 보고한다(문헌[Chemical Engineering Journal Volume 112, Issues 1-3, 1 September 2005, pages 13-22] 참조).
바티오트-듀페이라트(Batiot-Dupeyrat) 등은, 란탄족 화합물과 니켈의 착체 산화물이 건조 개질에 성공적으로 사용될 수 있음을 보고한다(문헌[Catalysis Today Volumes 107-108, 30 October 2005, pages 474-480] 참조). 상기 연구의 발견은, 반응 조건하에서 란탄과의 착체 화합물로부터 니켈이 스며나와 금속 니켈의 나노결정자를 형성함을 자명하게 한다.
제네퀸(Gennequin) 등[Catalysis Today Article in Press, Corrected Proof - Note to usersdoi:10.1016/j.cattod. 2011.01.029]은, 코발트, 마그네슘 및 알루미늄의 하이드로탈사이트-유사 전구체가 건조 개질 반응용 촉매로서 사용될 수 있는 물질을 생성함을 확립할 수 있었다.
다자(Daza) 등[Fuel Volume 89, Issue 3, March 2010, pages 592-603]은, 마찬가지로, 하이드로탈사이트-유사 전구체의 이용이, 니켈, 마그네슘, 알루미늄 및 세륨을 포함하고 건조 개질 반응용 촉매로서 사용될 수 있는 물질을 생성함을 보여줄 수 있었다.
US 3 436 358는 개질 반응용 니켈, 마그네슘 및 알루미늄 포함 촉매의 제조 방법을 개시한다. 이 방법에서는, 마그네슘-포함 스피넬을 먼저 고온 처리에 의해 생성하고, 이어서 이를 용융 질산 니켈로 처리하여 니켈, 마그네슘 및 알루미늄을 포함하는 촉매를 수득한다.
US 3 451 949는, 니켈, 마그네슘 및 알루미늄 포함 촉매가 칼륨과 같은 알칼리 금속 첨가에 의해 촉진될 수 있음을 개시한다.
EP 2 308 594 A2는 1.0/1.0 내지 2.0/0.3 내지 0.6 범위의 비율의 메탄, 물 및 이산화 탄소로부터 합성 가스를 생산하는 니켈-포함 촉매를 개시한다. 촉매의 개선된 안정성은 Ce 및/또는 Zr의 첨가에 의해 달성된다. 실험예에서, 마그네슘-알루미늄 하이드로탈사이트를 출발 물질로서 사용하는 합성이 또한 개시된다. 지지체로서의 하이드로탈사이트가 수성 질산 니켈 용액으로 함침되고, 후속적으로 물이 진공 증발기에서 70℃에서 제거되는 함침 공정이 개시되어 있다. 합성 가스를 생산하기 위해 EP 2 308 594 A2에 개시된 공정에서, 사용된 공급 스트림은 메탄 1 몰당 물 1 몰의 최소 함량을 갖고, 공정은 0.5 내지 20 atm 범위의 압력에서 실시된다. EP 2 308 594 A2는 합성 가스를 생산하기 위한 촉매 시험을 10 atm에서 실시하는 실시예를 개시한다.
모크(Mok) 등[Studies in Surface Science and Catalysis Volume 16, 1983, pages 291-299]은, 란타늄과 같은 란탄족 물질이 니켈 및 알루미늄 포함 개질 촉매에 촉진제로 성공적으로 사용될 수 있음을 보고한다. 개질 반응에서의 란탄족 촉진제의 유리한 효과와 별도로, 이 방식으로 촉진된 촉매는 또한 메탄화에 유리한 효과를 가질 수 있다. 유사하게, 겔스쓰로프(Gelsthorpe) 등[Journal of Molecular Catalysis Volume 25, Issues 1-3, July 1984, pages 253-262]은, 란타늄 및 세륨이 니켈-포함 메탄화 촉매에 성공적으로 사용될 수 있음을 보고한다.
추가의 저자들은 란탄족의 촉진 효과와 관련한 유사한 발견을 보고한다: 이들 저자는 란싱크 로트거링크 등(Lansink Rotgerink et al.)[Applied Catalysis Volume 45, Issue 2, 1988, pages 257-280], 리펜스 등(Lippens et al.)[Solid State Ionics Volume 16, June 1985, pages 275-282], 보로윅키 등(Borowiecki et al.)[Studies in Surface Science and Catalysis Volume 119, 1998, pages 711-716]을 포함한다. 루오준 등(Ruojun et al.)은, 이 효과는 란탄족과 같은 촉진제 존재하의 더 작은 니켈 결정자 크기에 기인된 것일 수 있다고 개시한다[Studies in Surface Science and Catalysis Volume 68, 1991, pages 243-247].
따라서, 본 발명의 목적들 중 하나는, CO2의 존재하에 탄화수소를 개질하기 위한 개선된 방법 및 개선된 촉매를 제공하는 것이다. 여기에서는, 촉매 물질의 합성이 먼저 개선되어야 한다. 또한, 개질 방법은, 동시에, 선행 기술에 비해 개선된 촉매를 사용할 때 최적화되어야 한다. 추가의 목적은 특히, 촉매 제조를 위한 매우 친환경적인 방법을 제공하고, 단지 소량의 불순물을 가진 촉매가 수득될 수 있는 제조 방법을 개발하는 것이다.
본원에서 언급한 목적 및 본원에서 언급하지 않은 목적은, 출발 물질의 가융성 금속 염에 의한 침지에 의해 합성 가스를 제공하기 위해 물 및 CO2의 존재하에 탄화수소를 개질하기 위한 촉매의 제조 방법에 의해 달성되며, 상기 방법은 하기 단계들을 포함한다:
(i) 가융성 금속 염 및 미분된 하이드로탈사이트-포함 출발 물질을 접촉시키는 단계,
(ii) 가융성 금속 염 및 하이드로탈사이트-포함 출발 물질을 친밀 혼합하는 단계,
(iii) 가융성 금속 염 및 하이드로탈사이트-포함 출발 물질을 열 처리하고, 금속 염이 금속 염 용융물의 형태로 존재하는 조건하에, 바람직하게는 30 내지 250℃ 범위의 온도, 더 바람직하게는 50 내지 140℃ 범위의 온도에서 혼합물을 가열하는 단계,
(iv) 500℃ 미만의 온도, 바람직하게는 250 내지 500℃ 범위의 온도에서 혼합물을 저온 하소하는 단계로서, 이때 저온 하소 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계,
(v) 몰딩(molding) 또는 성형하는 단계,
(vi) 500℃ 이상의 온도, 바람직하게는 500 내지 1000℃ 범위의 온도에서 혼합물을 고온 하소하는 단계로서, 이때 고온 하소의 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계.
한 바람직한 실시양태에서, 공정 단계 (iv) 및 (vi)에서의 하소는 규정된 가열 속도 및/또는 냉각 속도를 사용하여 실시되고, 가열 속도 및/또는 냉각 속도는 바람직하게는 1 분당 0.01 내지 10℃의 범위이고, 더 바람직하게는 1 분당 0.1 내지 5℃의 범위이다.
공정의 하나의 바람직한 실시양태에서, 성형 단계 (v) 이후 체질(sieving) 단계가 수반된다.
니켈 염, 바람직하게는 질산 니켈 6수화물을 포함하는 금속 염 분획이 추가로 바람직하다.
하이드로탈사이트-포함 출발 물질은 바람직하게는 마그네슘 및 알루미늄의 규정된 비율, 바람직하게는 10 몰% 이상의 마그네슘 및 10 몰% 이상의 알루미늄을 갖는다.
본 발명은 또한 탄화수소-포함 화합물 및 CO2를 개질하여 합성 가스를 수득하기 위한 촉매를 제공하고, 여기서 이러한 촉매는 하기 단계에 의해 수득될 수 있다:
(i) 가융성 금속 염 및 미분된 하이드로탈사이트-포함 출발 물질을 접촉시키는 단계,
(ii) 금속 염 및 하이드로탈사이트-포함 출발 물질을 친밀 혼합하는 단계,
(iii) 가융성 금속 염 및 하이드로탈사이트-포함 출발 물질을 열 처리하고, 금속 염이 용융물의 형태로 존재하는 조건하에, 바람직하게는 30 내지 250℃ 범위의 온도에서, 더 바람직하게는 50 내지 140℃ 범위의 온도에서 혼합물을 가열하는 단계,
(iv) 500℃ 미만의 온도, 바람직하게는 250 내지 500℃ 범위의 온도에서 혼합물을 저온 하소하는 단계로서, 이때 저온 하소 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계,
(v) 몰딩 또는 성형하는 단계,
(vi) 500℃ 이상의 온도, 바람직하게는 500 내지 1000℃ 범위의 온도에서 이전 단계에서 수득된 혼합물을 고온 하소하는 단계로서, 이때 고온 하소의 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계.
본 발명의 촉매에서, 니켈은 지지체 산화물 상에 매우 고도의 분산 형태로 존재하고, 이러한 지지체 산화물은 MgAl2O4의 매우 작은 입자로 구성되거나 이를 포함한다. 이는 고온에서 개선된 하소 안정성 및 개선된 탄화 거동 둘다로 반영되는 개선된 특성 프로파일(profile)을 갖는 촉매를 생성한다.
본 발명의 제조 방법은 침전 방법에 기초한 제조 방법에 비해 이점을 갖는다. 본 발명의 방법은 공정 수를 별로 형성하지 않거나, 본 발명의 방법은 또한 공정 수를 절대적으로 형성하지 않는 방식으로 실시될 수도 있다. 공정 수의 형성을 방지함과 동시에, 침전 시약이 또한 절약될 수 있다. 침전 시약과 연관된 문제점, 즉 오염 물질의 도입이 방지될 수 있다.
본 발명의 촉매의 합성에 관하여, 극히 에너지-효율적이고 환경적으로 친화적인 방법이 크게는 물-부재 제조 공정으로 인해 제공된다는 것이 또한 강조되어야 한다.
사용되는 하이드로탈사이트-포함 지지체, 바람직하게는 하이드로탈사이트의 총 기공 부피에 기초하여, 사용되는 물의 양은 바람직하게는 지지체의 총 기공 부피의 100% 이하, 더욱 바람직하게는 90% 이하, 더욱 더 바람직하게는 70% 이하, 더욱 바람직하게는 50% 이하, 더욱 더 바람직하게는 40% 이하, 특히 바람직하게는 30% 이하 및 더욱 바람직하게는 20% 이하이다. 본 발명의 추가의 바람직한 실시양태에서, 촉매는 물의 첨가 없이 제조될 수 있는데, 이는 합성에 필요한 물이 이러한 경우 단지 염의 수화수에 의해서 공급되기 때문이다.
또한, 지지체 산화물 상의 금속-포함 상의 높은 금속 담지 또는 침적, 또는 지지체 산화물의 전구체인 물질 상의 침전이 본 발명의 방법에 의해 달성될 수 있다.
본 발명의 방법은 탄화-안정성 활성 조성물을 제조할 수 있게 한다. 활성 조성물은 10 내지 3 범위의 물 대 탄소의 비(스팀 대 탄소 비)에서 메탄 또는 고 메탄 함량을 가진 가스를 스팀 개질하는데 적합하다. 본 발명의 활성 조성물은, 특히 3 미만, 바람직하게는 2 미만, 특히 바람직하게는 1 미만의 물 대 탄소 비에서 실시될 수 있다.
본 발명의 방법은, 메탄 또는 고메탄 함량을 가진 가스의 스팀 개질과 같은 고전적인 용도 이외에도 CO2 도입을 또한 허용하는 탄화-안정성 활성 조성물을 제조할 수 있게 한다. 상기 촉매는 특히, 3 이하, 바람직하게는 2 이하, 매우 특히 바람직하게는 1 이하의 메탄-대-이산화탄소 비에서 안정적으로 작동될 수 있다. 상기 촉매는 3 미만, 바람직하게는 2 미만, 매우 특히 바람직하게는 1 미만의 스팀-대-탄소 비에서 안정적으로 작동될 수 있다. CO2 도입의 경우, 탄소는 메탄과 이산화탄소의 합으로서 산출된다.
통상의 촉매의 경우 유사하게 급속한 탄화를 초래하는 탄소-포함 공급물의 스팀 개질에서의 상기 촉매의 작동이 본 발명의 방법에 유사하게 포함된다. 그러한 공급물은 예를 들면 에탄올, 특히 바이오에탄올, 석유 유도체, 예를 들면 나프타 또는 디젤, 바이오젠 또는 화석 탄소-포함 공급원의 열분해와 같은 사용으로부터 생성되는 오일, 또는 코크화 작업으로부터의 오프 가스 또는 오일일 수 있다.
본 발명의 방법은, 고 CO 함량을 가진 합성 가스를 제조할 수 있게 하며, 상기 방법에 의해 수득된 합성 가스는 2.5 미만의 H2/CO 비, 특히 1.5 미만의 H2/CO 비를 갖는다. 본 발명의 방법에 사용된 공급물 가스는 탄화 수소, CO2 및 물을 포함한다. 고 비율의 탄화수소로서의 CH4 및 CO2를 포함하는 탄화수소-포함 공급물 가스를 사용하는 것이 바람직하며, 메탄과 이산화탄소의 비율의 합이 총 가스 스트림을 기준으로 80% 초과인 공급물 가스가 특히 바람직하다. CO2 및 수소와 별개로, 상기 공급물 가스는 유사하게 CO 및 H2와 같은 성분을 포함할 수 있다.
본 발명의 방법에 따른 하이드로탈사이트-포함 출발 물질의 금속 염 용융물과의 혼합 및 이에 따른 배합 방식은 활성 성분을 망상조직(framework structure)으로 적용 및 도입함에 있어서 극히 효과적이다.
이론적인 고려에 의해 본 발명을 제한하려는 것은 아니지만, 본 발명의 촉매의 형성에 대한 하기 설명은 형성 기작에 대한 구조적 연구에 기초하여 타당해 보인다: 500℃ 이하의 온도에서 니켈-포함 질산염 용융물에 의한 하이드로탈사이트-포함 출발 물질의 본 발명에 따른 처리는 물질의 나노구조화를 유도한다. 마그네슘은 예비형성된 층-유사 탄소-포함 전구체 물질로부터 침출된다. 니켈과 함께, 페리클레이스(periclase)-분세나이트(bunsenite) 구조를 갖는 나노결정질 혼합된 결정 상 NixMg(1-x)O가 하이드로탈사이트로부터 형성된다. 또한, Mg 스피넬 상 및 산화 알루미늄 상(이는 부분적으로 비결정질이고, 입자가 단지 비교적 높은 하소 온도에서만 나노결정질인 결정질 스피넬로 변형됨)이 형성된다.
1000℃까지의 온도에서 100 nm 미만, 바람직하게는 70 nm 이하, 특히 바람직하게는 40 nm 이하인 니켈 결정자를 갖고, 하소 및 탄화 공정에 대해 높은 저항성을 갖는 촉매가 수득된다. 상기 물질의 이러한 나노구조는 이의 촉매 특성에 있어서 특히 유리하다. 특히, 본 발명에 따른 물질은 선행 기술에 비해 유리하여, 고탄소 함량을 가진 가스 스트림의 개질에 특히 적합한 촉매인 것으로 밝혀졌다.
본 발명의 한 바람직한 실시양태에서, 촉매 지지체는 니켈 및 마그네슘의 혼합된 산화물 상과 친밀 접촉되는 마그네슘 스피넬을 포함한다. 본 발명에 따른 이러한 촉매 또는 촉매 전구체에서, 니켈-포함 상 및 스피넬-포함 상 둘다는 매우 작은 결정자 크기를 갖는다. 스피넬-포함 상의 경우, 평균 결정자 크기는 100 nm 미만, 바람직하게는 70 nm 이하, 더욱 바람직하게는 40 nm 이하이다.
본 발명의 추가의 바람직한 실시양태에서, 본 발명의 촉매의 상 조성은 44.83°±0.20°2θ(d = 2.02±0.01 Å)에서의 회절 반사의 강도 이하인, 43.15°±0.15°2θ(2 쎄타)(d = 2.09±0.01Å)에서의 회절 반사의 강도에 의해 구별되고, 43.15°±0.15°2θ(2 쎄타)(d = 2.09±0.01Å)에서의 회절 반사의 강도는 더욱 바람직하게는 44.83°±0.20°2θ(d = 2.02±0.01Å)에서의 회절 반사의 강도 미만이고, 2개의 회절 반사의 강도 비 I(43.15°)/I(44.83°)는 더욱 더 바람직하게는 0.3 내지 1.0, 바람직하게는 0.5 내지 0.99, 더욱 바람직하게는 0.6 내지 0.97, 특히 바람직하게는 0.7 내지 0.92의 범위이다. 본 발명에 따른 촉매의 회절 패턴(5-80°2θ)에 대한 예는 도 2에 도시되어 있다.
본 발명의 촉매 물질 또는 촉매 전구체 물질중 Ni 스피넬 상 및 가능하게는 또한 NiO의 소량의 존재는 배제되지 않는다. 그러나, Ni 스피넬 상이 본 발명의 전구체 물질에 존재한다면, 이는 촉매의 본 발명에 따른 사용의 고압 및 고온에서 변형될 것으로 추정될 수 있다.
본 발명의 방법은 금속 염으로서 존재하는 모든 활성 금속이 30℃ 내지 250℃의 온도 범위에서 용융되도록 하여, 하이드로탈사이트 또는 하이드로탈사이트-포함 출발 물질에 적용되는 개질 촉매로서의 촉매 활성을 나타내는 촉매를 생성한다. 한 바람직한 실시양태에서, 촉진제는 금속 염 용융물 및/또는 추가의 지지체 산화물에 첨가되고, 기공-형성제 또는 결합제는 하이드로탈사이트-포함 출발 물질에 더하여 합성 시스템내로 도입될 수 있다.
본 발명의 촉매를 생산하기 위해, 용융 동안 또는 분해가 역학적으로 크게 저해되지 않는 경우에 분해되지 않는 금속 염을 사용하는 것이 바람직하다. 이러한 금속 염의 예는, 무엇보다도, 질산염, 아질산염, 할로겐화물, 염소산염, 브롬산염, 요오드산염, 황산염, 아황산염이다. 질산염, 아질산염 및 질산염과 아질산염을 포함하는 염 용융물이 특히 바람직하다. 특정 첨가제의 용융물로의 첨가, 예를 들면 우레아, 에틸렌 글리콜의 첨가가 포함된다.
가융성 금속 염은, 예를 들면, Na, K, Ca, Mg, Sr, Ba, Al, La, Y, Mo, W, Nb, Zr, Ti, Fe, Co, Ni, Cu, 백금 및/또는 Ce를 양이온성 종으로서 포함할 수 있다. 가능한 음이온성 종은 특히, 질소-포함 음이온, 예컨대 질산염 및 아질산염이다. 그러나, 당분야의 숙련가에게 공지된 다른 음이온, 예컨대 할로겐, 황산염 및 아황산염 및 다른 무기 및 유기 음이온이 원칙적으로 사용될 수 있다. 금속 염은 바람직하게는 1종 이상의 니켈-포함 또는 코발트-포함 성분, 바람직하게는 질산 니켈 수화물 또는 코발트 니켈 수화물, 예를 들면 6수화물을 포함한다.
본원에 사용될 경우 용어 "하이드로탈사이트-포함 출발 물질"은 사용되는 물질이 1종 이상의 하이드로탈사이트-유사 화합물을 중요한 구성성분으로서 포함하고 임의적으로 산화 첨가제 및/또는 2차 구성성분을 포함할 수 있음을 의미한다. 하이드로탈사이트-유사 화합물 및 산화 첨가제의 총 비율은 50 중량% 초과, 바람직하게는 70 중량% 초과, 및 특히 바람직하게는 90 중량% 초과이다. 하이드로탈사이트-유사 화합물 및 산화 첨가제에 더하여, 하이드로탈사이트-포함 출발 물질은 또한, 예를 들면, 금속 염을 포함하고, 예를 들면, 2가 금속 염으로 3가 금속 염의 금속 농도를 조정하는 2차 구성성분을 또한 포함할 수 있다. 이러한 2차 금속 염은 10 중량% 이하, 바람직하게는 5 중량% 이하의 양으로 존재한다.
하이드로탈사이트-유사 화합물은 2가 및 3가 금속의 혼합된 수산화물이고, 이는 다중양이온으로 이루어지고 층 구조물을 갖는다. 하이드로탈사이트-유사 화합물은 또한 문헌에 음이온성 클레이, 층상 이중 수산화물(LDH: layered double hydroxide), 파이트네크트(Feitknecht) 화합물 또는 2중 층 구조물로도 지칭된다. 사용될 수 있는 2가 금속은, 예를 들면, Mg, Zn, Cu, Ni, Co, Mn, Ca 및 Fe로 구성된 군에서 선택된 금속이고, 사용될 수 있는 3가 금속은, 예를 들면, Al, Fe, Co, Mn, La, Ce 및 Cr로 구성된 군에서 선택된 금속이다.
한 바람직한 실시양태에서, 하이드로탈사이트-유사 화합물은 하이드로탈사이트이다. 본 발명의 방법에 사용되는 하이드로탈사이트는 바람직하게는 마그네슘을 2가 금속으로, 알루미늄을 3가 금속으로 포함한다. 사용되는 하이드로탈사이트의 금속은 바람직하게는 주로 마그네슘 및 알루미늄을 포함한다.
산화 첨가제는 또한 혼합물, 바람직하게는 알루미늄-포함 화합물의 혼합물일 수 있다. 이러한 알루미늄-포함 산화 첨가제의 예는, 무엇보다도, 깁사이트, 뵈마이트 및 슈도뵈마이트이다. 이러한 산화 알루미늄, 수산화물 또는 산화물 수화물의 전형적인 함량은 산화 알루미늄(즉, Al2O3)을 기준으로 계산될 경우 30 내지 95 중량%의 범위일 수 있다. 이는 총 금속에 기초하여 26 내지 84 몰%의 알루미늄의 몰 비율에 상응한다. 산화 알루미늄에 기초하여 계산될 경우 50 내지 80 중량% 범위가 특히 바람직하다. 이는 총 금속을 기준으로 44 내지 70 몰%의 알루미늄의 몰 비율에 상응한다. 산화 알루미늄에 기초하여 계산될 경우 60 내지 75 중량% 범위가 특히 바람직하다. 이는 총 금속을 기준으로 53 내지 66 몰%의 알루미늄의 몰 비율에 상응한다.
하이드로탈사이트-유사 화합물 및 산화 첨가제는 또한 매우 친밀 혼합을 나타낸다.
이러한 혼합은, 예를 들면, 하이드로탈사이트-유사 및 알루미늄 수산화물-포함 분말의 물리적 혼합에 의해 수행될 수 있다. 예를 들면, 분말 혼합은 적합한 산업용 장치, 예컨대 혼합기에서 실시될 수 있다. 이러한 혼합 공정은 당분야의 숙련가에게 공지되어 있다. 추가의 가능성은 하이드로탈사이트-유사 분말 및 수산화 알루미늄-포함 분말을 적합한 분산 매질에서 혼합하는 것이다. 분산 매질로서, 예를 들면, 물, 알코올, 예컨대 메탄올, 에탄올, 프로판올, 부탄올, 에틸렌 글리콜 및/또는 부탄디올 및 케톤, 예컨대 아세톤 또는 메틸 에틸 케톤을 사용하는 것이 가능하다. 분산 매질이 혼합물로서 존재하고 표면-활성제, 예컨대 계면활성제를 포함하는 것이 또한 가능하다. 이러한 계면활성제의 예는, 무엇보다도, 폴리에틸렌 글리콜, 메르솔레이트(Mersolate), 카복실레이트, 장쇄 암모늄 화합물, 예컨대 CTAB이다.
친밀 혼합을 달성하는 또 다른 가능한 방식은 침전 반응에 의한 하이드로탈사이트-유사 및 수산화 알루미늄-포함 물질의 혼합물의 직접적인 합성이다. 이러한 방법은, 무엇보다도, DE 195 03 522 A1에 기재된 바와 같이, 수민감성 전구체의 가수분해에 의해 수행될 수 있고, 이는 많은 가능한 조성물을 허용한다. 하이드로탈사이트-포함 및 수산화 알루미늄-포함 물질의 혼합물을 제조하는 또 다른 대안의 방법은 수성 매질로부터의 침전 반응에 기초하여 실시될 수 있다. 예를 들면, 탄산염-포함 침전물을 사용하는 것이 가능하거나, 이산화 탄소-포함 가스 혼합물은 금속 염 또는 금속 수산화물의 적합한 전구체 용액 상에서 압력하에 작용하는 것이 허용될 수 있다.
본 발명의 목적을 위해 사용되는 하이드로탈사이트-포함 출발 물질의 예는 상품명 퓨랄(Pural) MG 하에 시판되는 사솔(Sasol)로부터의 제품이다[퓨랄 MG5 내지 퓨랄 MG70이 상업적으로 입수가능하고, 여기서 퓨랄 MG70은 수산화 알루미늄이 첨가되지 않은 Mg-Al 하이드로탈사이트임]. 마그네슘- 및 알루미늄-포함 하이드로탈사이트와 다른 탄산염, 수산화물 또는 수산화 탄산염의 친밀 혼합은 또한 본 발명에 내포된다.
본 발명의 방법에는 특히 고순도를 갖는 하이드로탈사이트 또는 하이드로탈사이트-유사 화합물을 사용하는 것이 바람직하다. 본 발명의 방법에 특히 바람직하게 사용되는 이들 하이드로탈사이트-유사 화합물을 제조하는 방법은 반 베르게(J.P. van Berge) 등에 의해 DE 195 03 522 A1에 개시되어 있다.
DE 195 03 522 A1에 따르면, 하이드로탈사이트 또는 하이드로탈사이트-유사 화합물은 물에 의한 금속 알콕시화물의 가수분해, 및 침전물로서 수득된 가수분해 생성물의 후속적인 건조에 의해 형성된다. 금속 알콕시화물은 1가, 2가 및/또는 3가 알코올과 하나 이상의 2가 금속 및/또는 하나 이상의 3가 금속의 반응에 의해 형성된다. 가수분해를 위해 사용된 물은 바람직하게는 수산화물 음이온, 유기 음이온, 특히 알콕시화물, 알킬 에테르 설페이트, 아릴 에테르 설페이트 및 글리콜 에테르 설페이트, 및 무기 음이온, 특히 탄산염, 탄산수소, 염화물, 질산염, 황산염 및/또는 폴리옥시메탈레이트 음이온으로 구성된 군에서 선택된 수용성 음이온을 포함한다.
촉매를 생산하기 위한 출발 물질로서 특히 적합하고 금속 알콕시화물의 가수분해에 의해 제조된 하이드로탈사이트-포함 물질로서, 상품명 퓨랄 MG5, 퓨랄 MG20, 퓨랄 MG30, 퓨랄 MG50 및 퓨랄 MG70하에 사솔로부터 구입될 수 있는 물질이 언급될 수 있다. 제조업체에 의해 제공된 정보에 따라서, 제품명에서의 수치는 제품에 존재하는 MgO의 중량 백분율이다. 100%의 총 중량을 수득하기 위해, Al2O3의 중량 비율은 MgO 중량 비율에 더해져야 한다. 여기서 수치는 산화물에 기초하지만, 샘플은 또한 수산화 기 및 물을 포함함을 주지해야 한다. 또한, 다른 MgO 대 Al2O3 비율을 갖는 물질을 구입하는 것이 가능하다. 특히, 낮은 마그네슘 함량을 갖는 이들 제품 또는 물질에서, 이들은 마그네슘-알루미늄-포함 하이드로탈사이트 뿐만 아니라 일정 비율의 미분된 수산화 알루미늄 또는 산화물 수화물을 포함하는 것이 가능하다.
특히 바람직한 하이드로탈사이트-포함 출발 물질, 예컨대 퓨랄 MG30은, 예를 들면, 하이드로탈사이트(즉, 조성 Mg6Al2(OH)18*4H2O 또는 Mg6Al2(OH)16CO3*4H2O를 갖는 성분)및 뵈마이트의 혼합물을 포함하고, 혼합물은 70 내지 30 중량%에 가까운 전체 Al2O3/MgO 비를 갖는다. 본원에 사용된 제품의 상품명에서의 이러한 번호는 칼사이트 물질에 관련되고, 이러한 특히 바람직한 예에서, 출발 물질은 약 55 중량%의 뵈마이트 함량을 가짐을 의미한다.
본 발명의 제조 방법에서 출발 물질의 구성성분으로서 특히 바람직한 하이드로탈사이트 대신에, 다른 금속 수산화물 또는 수산화 탄산염을 출발 물질로서 사용하는 것도 가능하다. 하이드로탈사이트 및 하이드로탈사이트-유사 화합물과 동일한 합성 방법에 의해 제조될 수 있는 것들이 특히 바람직하다.
본 발명의 목적을 위해 하이드로탈사이트-포함 출발 물질이 바람직한 Al/Mg 비를 갖는 것이 중요하다. 하이드로탈사이트-포함 출발 물질의 조성을 이에 포함된 산화물(발화 형태)에 관하여 설명함에 있어서, 바람직한 알루미나/마그네시아 비(즉 Al2O3/MgO 비)는 중량 기준으로 0.5 내지 20의 범위이고, 중량 기준으로 1 내지 10의 알루미나/마그네시아 비가 더욱 바람직하다.
바람직한 Al/Mg 비는 몰 기준으로 1.5 내지 2.5의 범위이고, 몰 기준으로 1.7 내지 2.3의 Al/Mg 비가 더욱 바람직하다. 바람직한 하이드로탈사이트-포함 출발 물질은 바람직하게는, 500℃ 이상의 온도에서 고온 하소에 의해 상당한 비율로 또는 실질적으로 완전히 스피넬 또는 스피넬-관련된 구조물을 갖는 물질로 또는 이러한 구조물의 상 혼합물로 전환될 수 있어야 한다.
본 발명의 또 다른 중요한 양태는 하이드로탈사이트-포함 출발 물질을 가융성 금속 염과 매우 친밀 혼합하는 것으로, 이는 니켈 종과 지지 전구체 성분 사이에 밀착된 접촉을 제공하고 니켈 종의 예상치못한 양호한 안정화를 유도한다. 하소 이후, 이는 상기 언급된 바와 같이 조성 NixMg(1-x)O를 갖는 혼합된 산화물 상으로 유도되고, 여기서 x = 0.3 내지 0.7, 바람직하게는 0.4 내지 0.6이다(x = 0.3 내지 0.7의 몰 범위는 약 44 내지 81 중량%의 NiO 함량에 상응하고, x = 0.4 내지 0.6의 경우 NiO 함량은 약 55 내지 73.5 중량%임). 추가로, Ni 스피넬의 특정 비율은 하소 후 XRD 분석에 의해 검출될 수 있다.
XRD 결과는, 혼합된 산화물 상 NixMg(1-x)O에서 Mg 종의 고갈이 초래됨을 나타낸다. Mg 종은 Ni 스피넬에서 Ni 종을 대체한다. 본 발명을 제한하지 않는 하나의 가능한 설명은, 알루미늄의 비율이 고온에서 조차도 산화 알루미늄 수화물로서 지속적으로 존재한다는 것일 수 있다. 고온에서 환원 조건하에, 혼합된 산화물 상 NixMg(1-x)O로부터의 금속성 니켈이 제거될 수 있고, 이어서 마그네슘이 방출되어 산화 알루미늄 수화물과 반응하여 마그네슘-알루미늄 스피넬을 형성한다.
하이드로탈사이트-포함 출발 물질 MHT에서의 금속 종 및 염 용융물 MS에서의 금속 종의 몰 비에 관하여, MHT/MS의 몰 비는 항상 1을 초과한다고 할 수 있다. 몰 비 MHT/MS는 바람직하게는 15 내지 1.5의 범위, 더욱 바람직하게는 10 내지 3의 범위이다. 바람직한 비의 사용은, 성분들의 양호한 혼합 및 하이드로탈사이트의 균질한 코팅을 위한 조건을 확보하고, 이에 따라 본 발명에 따른 물질의 나노구조화, 특히 니켈의 높은 분산 및 미분된 특성, 및 Mg 스피넬의 미분된 특성을 확보하기 위해 중요하다.
한 바람직한 실시양태에서, 분말상의 하이드로탈사이트-포함 물질은 가융성 금속 염과 접촉되기 전에 가열되고 금속 염과 접촉될 때 30 내지 250℃의 범위, 바람직하게는 50℃ 내지 140℃의 범위의 온도를 갖는다.
금속 염을 용융시키기 위해 필요한 온도는 각 경우에 사용된 금속 염 또는 금속 염 혼합물의 특성에 좌우된다. 본 발명의 방법에 특히 적합한 금속 염은 30 내지 250℃ 범위의 용융점을 갖는다.
본 발명의 방법의 바람직한 실시양태중 하나에서, 하이드로탈사이트-포함 출발 물질은 금속 염 용융물과 접촉된다. 하이드로탈사이트와 접촉되고 혼합되는 동안 금속 염 용융물의 고체화를 억제하기 위해, 각 경우에 사용되는 염 또는 염 혼합물의 용융점의 온도에 비해 10℃ 이상, 바람직하게는 20℃ 더 높은 온도로 예열하는 것이 유리하다.
분말과 용융물을 접촉시키기 위한 공정 매개변수를 선택하는데 있어서, 하이드로탈사이트 및 금속 염 용융물의 결정화수가 증발되는 것이 고려되어야 한다. 이러한 증발은 온도, 가스 교환, 가스 분위기 및 공정 기간에 좌우된다. 결정화수의 완전한 증발은 바람직하지 않을 수 있는데, 이는 염 또는 하이드로탈사이트의 분해가 혼합물의 균질화 이전에 초래될 수 있기 때문이다. 하이드로탈사이트-포함 물질과 친밀 혼합된 용융물에서 임의의 영역의 고체화는 고체 하이드로탈사이트-포함 출발 물질 상의 금속 종의 분포의 균일성에 해로운 영향을 준다.
접촉 기간은 매우 짧아야 하고, 즉 바람직하게는 30 분 이하이다. 가스 분위기는 바람직하게는 금속 염 또는 하이드로탈사이트-포함 출발 물질의 분해를 혼합 동안 억제하기 위해 특정 비율의 물을 포함해야 한다. 수증기의 함량은, 예를 들면, 0 내지 10 부피%의 범위일 수 있다.
염 용융물의 제어되지 않은 고체화를 방지하기 위해 하이드로탈사이트-포함 출발 물질이 염 용융물과 접촉되기 전에 염 용융물의 온도에 대략 상응하는 온도로 하이드로프탈사이트-포함 출발 물질을 가열하는 것이 유리하다.
I.
하이드로탈사이트와
금속 염의
접촉 및 혼합
우선, 하이드로탈사이트-포함 출발 물질을 금속 염과 접촉시키는 공정 단계는 제한되지 않음을 알아야 한다. 그러나, 유리한 접촉에 대한 다수의 실시양태이 이후 기재된다.
예를 들면, 하이드로탈사이트-포함 출발 물질은 분말상의 금속 염이 용융되기 이전에 염의 용융점 미만의 온도에서 이와 우선적으로 배합되고 혼합된다. 이 물질은 우선적으로 차갑게 배합된다. 배합 및 혼합은 복수 개의 단계 또는 단일 단계로 실시될 수 있다.
본 발명의 방법의 또 다른 바람직한 실시양태는, 분말상의 하이드로탈사이트-포함 출발 물질이 용기에 위치되고, 금속 염 용융물이 이에 첨가되는 동안 고체는 진탕된다. 용융물은 일정 시간에 복수 개의 단계 또는 단일 단계로 하이드로탈사이트에 약간씩 첨가될 수 있다.
유사하게 바람직한 또 다른 실시양태에서, 하이드로탈사이트-포함 출발 물질은 금속 염이 용융되기 전에 이로 먼저 코팅된다. 여기서, 예를 들면, 우선적으로 하이드로탈사이트-포함 출발 물질을 물에 현탁시키고 이를 금속 염 용액과 배합하는 것이 가능하다. 하이드로탈사이트-포함 출발 물질 및 금속 염 용액의 혼합물은 현탁액을 형성하고, 이는 예를 들면, 분무 건조에 의해 건조될 수 있다.
가융성 금속 염 및 하이드로탈사이트-포함 출발 물질의 친밀 혼합을 확보하기 위해, 서로 접촉되어지는 성분들은 기계적 혼합 요소에 의해 혼합되고 균질화된다. 혼합기로서, 예를 들면, 파워 혼합기(power miser), 텀블러(tumbler), 반죽기 등을 사용하는 것이 가능하다. 혼합에 적합한 산업용 수단은 당분야의 숙련가에게 공지되어 있어야 한다. 혼합 단계의 기간은 바람직하게는 2 분 이상, 더욱 바람직하게는 10 분 이상, 더욱 더 바람직하게는 30 분 이상이다.
단계 (ii)에 따른 혼합 및 단계 (iii)에 따른 열 처리는 바람직하게는 동시에 실시된다. 혼합되는 물질은 염 용융물의 고체화 또는 결정화를 방지하기 위해 바람직하게는 혼합 공정 동안 가열된다.
II
. 촉매를 제조하기 위한 추가의 공정 단계
(a) 금속 염 및 하이드로탈사이트의 균질화된 혼합물은 저온 하소처리된다. 저온 하소는 100℃ 내지 500℃의 온도 범위에서 0.1 시간 내지 24 시간 범위의 시간 동안 균질화된 혼합물을 열 처리함으로써 실시된다. 이 물질은 바람직하게는 제어된 가열 속도를 사용하여 가열된다. 가열 속도는 바람직하게는 20℃/분 미만, 바람직하게는 10℃/분 미만, 더욱 바람직하게는 5℃/분 미만이다.
저온 하소 후 수득된 물질은 미분된 분말 또는 굵은 미립자의 느슨한 물질로서 존재할 수 있다. 느슨한 미립자 촉매로서의 물질을 사용할 수 있기 위해, 성형 공정이 필요할 수 있다. 성형 단계로서, 예를 들면, 분쇄 또는 밀링을 실시하는 것이 가능하다. 매우 굵은 미립자의 느슨한 물질의 추가의 가공은 후속 고온 하소 시에 물질에 역 영향을 줄 수도 있다.
(b) 저온에서 하소된 물질은 몰딩 물질을 수득하기 위해 바람직하게는 성형 공정을 거친다. 이러한 성형 공정은 하나 이상의 하기 단계를 포함할 수 있다:
b.i) 압착, b.ii) 분쇄, b.iii) 체질 및/또는 b.iv) 타정.
추가의 공정 변형에서, 성형 공정은 압출 공정이다. 용융물-함침된 촉매 조성물은, 예를 들면, 원하는 성형체를 제공하기 위해 추가의 첨가제와 함께 압출기에 의해 가공된다. 압출에 의한 성형 공정이 사용될 경우, 저온 하소의 공정 단계 (iv)가 실시될 필요가 없을 수 있다. 이 공정은 고온 하소 단계의 형태로 압출한 후에만 일어나는 하소에 의해 실시될 수 있다. 일반적으로, 저온 하소는 압출 전에 실시된다.
(c) 몰딩 물질은 항상 고온 하소 공정을 거쳐야 한다. 고온 하소에서의 목표 온도는 500℃ 이하의 영역이고, 바람직하게는 500 내지 1000℃, 더욱 바람직하게는 바람직하게는 700 내지 1000의 범위이다. 고온 하소, 즉 목표 온도에서 샘플의 가열 기간은 0.1 내지 24 시간의 범위이다.
(d) 고온 하소는 산소-포함 분위기, 바람직하게는 공기의 존재하에 실시될 수 있다. 목표 온도로의 샘플의 가열은 바람직하게는 제어된 가열 속도, 바람직하게는 20℃/분 미만 및 더욱 바람직하게는 10℃/분 미만의 가열 속도를 사용하여 실시된다.
본 발명의 촉매의 제조시, 제조 방법의 적어도 개별적 하위단계는 연속적으로 실시되는 것이 바람직할 수 있다. 예를 들면, 연속적으로 작동되는 회전 관상로(rotary tube furnace)에서 저온 하소를 실시하는 것이 특히 바람직하다.
추가의 공정 단계에서, 하소된 촉매는 금속 종, 바람직하게는 니켈의 적어도 일부를 감소시키기 위해 가열되면서 환원성 가스 분위기에 노출될 수 있다. 환원성 가스 분위기하의 이러한 열 처리는 바람직하게는 촉매 공정이 실시되는 동일한 반응기에서 실시된다.
특히 바람직한 하나의 실시양태에서, 본 발명은 비균질 반응, 바람직하게는 메탄, 이산화 탄소 및 물의 반응에 대한 촉매 작용을 위한 촉매 및 방법을 제공하여 합성 가스를 수득하는데, 상기 촉매는 적어도 3상 니켈-마그네슘 혼합된 산화물, 마그네슘 스피넬 및 산화 알루미늄 수산화물을 포함하고, 여기서 니켈-마그네슘 혼합된 산화물은 100 nm 이하, 바람직하게는 70 nm 이하, 더욱 바람직하게는 40 nm 이하의 평균 결정자 크기를 갖고, 마그네슘 스피넬 상은 100 nm 이하, 바람직하게는 70 nm 이하, 더욱 바람직하게는 40 nm 이하의 평균 결정자 크기를 가지며, 니켈의 비율은 7 내지 28 몰%의 범위이고, 마그네슘의 비율은 8 내지 26 몰%의 범위이며, 알루미늄의 비율은 50 내지 70 몰%의 범위이고, BET 표면적은 10 내지 200 m2/g의 범위이다.
또한 6 내지 30 몰% 범위의 니켈 비율 및 8 내지 38 몰% 범위, 바람직하게는 23 내지 35 몰% 범위의 마그네슘 비율을 갖는 본 발명의 촉매의 실시양태가 특히 바람직하다. 알루미늄의 비율은 바람직하게는 50 내지 70 몰%이다.
특히 고성능 촉매 및 이에 따라 본 발명의 특히 바람직한 실시양태는 촉매의 물리화학적 특성이 특정한 값을 가질 경우 수득됨이 강조되어야 한다.
한 바람직한 실시양태에서, 본 발명의 촉매의 XRD에 따른 상 조성, BET 표면적, 평균 기공 직경 및/또는 탬핑된 밀도(tamped density)로 구성된 군에서 선택된 물리화학적 특성은 바람직한 값을 갖는다.
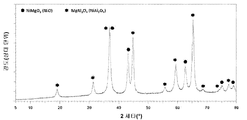
특히 바람직한 촉매의 상 조성은 44.83°±0.20°2θ(d = 2.02±0.01 Å)에서의 회절 반사의 강도 이하인, 43.15°±0.15°2θ(2 쎄타)(d = 2.09±0.01Å)에서의 회절 반사의 강도에 의해 구별되고, 43.15°±0.15°2θ(2 쎄타)(d = 2.09±0.01Å)에서의 회절 반사의 강도는 더욱 바람직하게는 44.83°±0.20°2θ(d = 2.02±0.01Å)에서의 회절 반사의 강도 미만이고, 2개의 회절 반사의 강도 비 I(43.15°)/I(44.83°)는 더욱 더 바람직하게는 0.3 내지 1.0, 바람직하게는 0.5 내지 0.99, 더욱 바람직하게는 0.6 내지 0.97, 특히 바람직하게는 0.7 내지 0.92이다. 14/29/57의 Ni/Mg/Al의 몰 비를 갖는 본 발명에 따른 촉매의 회절 패턴(5-80°2θ)은 예로서 도 2에 도시되어 있다.
촉매의 특히 바람직한 실시양태는 10 내지 200 m2/g, 바람직하게는 15 내지 150 m2/g, 더욱 바람직하게는 20 내지 100 m2/g, 더 바람직하게는 30 내지 80 m2/g, 매우 특히 바람직하게는 30 내지 78 m2/g, 특히 바람직하게는 30 내지 76 m2/g 범위의 BET 표면적을 갖는다. BET 방법에 의한 비표면적의 결정은 DIN 66131에 따라 실시되었다.
또한, 적어도 이중 모드(bimodal) 기공 구조, 바람직하게는 삼중 모드 기공 구조를 가진 본 발명의 촉매가 바람직하다. 촉매의 기공 구조(파쇄된 물질 분획 0.5 내지 1.0 m)의 특성 분석은 DIN 66133에 따라 수행되는 수은 기공측정법에 의해 실시된다. 본원에서, 적어도 이중모드 기공 구조는 중간 기공(4 내지 40 nm 범위의 기공 직경을 가짐) 및 거대 기공(30 내지 120 nm 범위의 기공 직경을 가짐)을 포함한다. 또한, 상기 촉매는 추가의 바람직한 실시양태에서, 또한, 기공 직경이 예를 들면 100 내지 2000 nm 범위인 거대 기공을 갖는다. 상기 촉매의 바람직한 실시양태에서, 평균 기공 직경(평균 기공 크기)은 15 nm 초과, 더욱 바람직하게는 18 nm 초과, 특히 20 nm 초과이다.
또한, 상기 촉매의 바람직한 실시양태는 또한 바람직하게는 < 1500 g/ℓ, 더욱 바람직하게는 < 1350 g/ℓ 및 더욱 더 바람직하게는 ≤ 1100 g/ℓ인 특성적인 탬핑된(tamped) 밀도를 갖는다. 상기 특성적인 탬핑된 밀도의 결정은 JEL로부터 입수된 탬핑된 용적계 STAV 2003에 의해 수행되었다. 촉매의 0.5 내지 1.0 mm 파쇄된 물질 분획이 측정을 위해 사용되었다.
추가의 가공 단계에서, 하소된 촉매는, 금속 종, 바람직하게는 니켈의 적어도 일부를 환원시키기 위해, 가열되면서 환원성 가스 분위기에 노출된다. 이 환원성 가스 분위기 하의 열처리는 바람직하게는, 촉매 공정이 수행되는 것과 동일한 반응기에서 수행된다.
또한, 특히, 본 발명의 촉매는 합성 가스 제조용 본 발명의 공정을 위한 환원성 예비처리 없이 사용될 수 있음을 확인하였다. 이 결과는, 공정의 개시시에 수소를 사용하는 처리 단계가 절약될 수 있고, 그 결과 공정 경제가 개선될 수 있으므로 가치가 있다. 니켈 또는 활성 금속의 주요 부분은 산화물 형태로 존재하는 것으로 추정될 수 있다.
III
.
CO
2
존재 하의 메탄의 개질 공정
일반적으로, 메탄 개질은 촉매가 관형 반응기로 도입되는 연속 공정으로 수행된다. 여기서, 환원 단계는, 촉매가 개질을 수행하기 위해 사용되는 것과 동일한 관형 반응기에서 수행되는 것이 유리하다.
상기 개질은 500 내지 1100 ℃ 범위의 온도 및 2 내지 70 바(bar)의 압력에서 수행된다. 상기 공정 수행시 압력은 바람직하게는 5 내지 70 바, 더욱 바람직하게는 10 내지 40 바, 및 더더욱 바람직하게는 20 내지 40 바이다. 상기 개질 공정의 유리한 실시양태에서, 상기 촉매는 콘디셔닝 처리된다. 상기 콘디셔닝은, 촉매가 예비활성화되는 규정된 시동 과정이다. 촉매 물질은, 활성 금속의 하소 및 탄소성 물질의 촉매상의 증착이 억제되거나 배제되는 나노 구조를 형성한다.
본 발명의 중요한 양상은 또한, 매우 높은 CO2 함량 및 동시에 소량의 수증기를 갖는 공급물 가스의 반응을 위한 고압 공정(20바 이상의 압력)에 관한 것이다. 여기서는, 그러한 작동 모드가 가능하고 촉매상의 탄소성 침착물을 야기하지 않는다는 것이 놀랍고 기대치 못한 것임이 강조되어야 한다. 소량의 수증기는 상기 공정 경제를 매우 실질적으로 개선되게 하며, 이는 니켈-포함 촉매의 경우 특히 기대치못한 것이다. 또한, 그 결과는, 자가열 개질 및 부분 산화에 의해서만 달성될 수 있는 수소 대 CO의 몰비 면에서 유리한 화학양론적 조성(2.0 이하의 H2/CO)을 갖는 생성물 스트림이다.
상기 콘디셔닝 중에, 본 발명의 촉매는 먼저, 고비율의 수증기 및/또는 수소를 가진 메탄-포함 가스 스트림에 노출된다. 여기서, 상기 촉매는 700℃의 온도로 가열된다.
후속 단계에서는, 상기 공급물 가스 스트림에 CO2가 부가되고 이어서 수소가 첨가되며, 동시에 수증기의 도입은 먼저 감소된 다음 중단된다.
공급물 유체 스트림은 원하는 공정에 필요한 화합물, 즉 CH4, CO2 및 H2 및 또한 H2O을 포함한다.
상기 촉매의 온도는 콘디셔닝 온도에서 공정 온도로 증가될 수 있다. 공정 온도는 바람직하게는 700 내지 1100℃ 범위이다. 상기 공정 온도의 상한선은 상기 공정에 사용된 스틸 반응기의 내열성에 의해 부과된다. 상기 공정 온도에 대한 상한선은 바람직하게는 950 내지 980 ℃ 범위이다.
상기 예비활성화용 공급물 유체의 유리한 조성물은 30% 내지 45%의 각각의 메탄 및 CO2 및 또한 5 내지 40%의 H2 및 5 내지 15%의 H2O를 포함한다. 또한, 상기 공급물 유체는 또한 추가의 성분들, 예를 들면 내부 표준물로서 기능하는 아르곤 가스를 포함할 수도 있다.
본 발명의 공정의 특히 유리한 실시양태에서, 상기 촉매의 예비활성화용 공급물 유체의 조성물은 25% 내지 50%의 각각의 메탄 및/또는 CO2 및 5 내지 50%의 H2O 및/또는 5-40%의 H2를 포함한다. 또한, 상기 공급물 유체는 또한 추가의 성분들, 예를 들면 내부 표준물로서 기능하는 아르곤 가스를 포함할 수도 있다.
본 발명의 촉매는 CH4 및 CO2의 반응에 대해 높은 효율을 갖는다. 수소 대 CO의 몰비 면에서 유리한 화학양론적 조성을 가진 생성물 스트림이 수득된다. 2 미만, 특히 바람직하게는 1.5 미만, 특히 1.2 미만의 H2/CO 비가 유리한 것으로 고려된다.
바람직한 실시모드의 본 발명의 개질 공정에서, 상기 CO2/CH4 몰비는 0 내지 1.5 범위, 바람직하게는 0.3 내지 1.4 범위, 더욱 바람직하게는 0.5 내지 1.3 범위, 및 더더욱 바람직하게는 0.7 내지 1.2 범위이다.
또한, 한 실시모드의 본 발명의 개질 공정에서, H2O/CH4 몰비는 2 이하, 더욱 바람직하게는 1.5 이하, 더더욱 바람직하게는 1.0 이하, 특히 0.9 이하이다. 원칙적으로, 수증기의 양이 추가로 감소되거나 수증기의 첨가가 완전히 생략될 수 있는 실시모드로 본 발명의 공정을 실시하는 것이 완전히 배제되지 않는다.
본 발명의 공정과 관련하여 언급할 수 있는 이점은, 본 발명의 공정에 의해 생성될 수 있는 촉매가 선행 기술에서 공지된 촉매보다 긴 작동 수명을 갖는다는 점이다. 더 긴 작동 수명은 개질 공정의 촉매 대체 사이클을 감소시키고 경제성을 개선할 수 있게 해준다.
본 발명의 공정과 관련하여 언급할 수 있는 또하나의 이점은, 본 발명의 공정에 의해 생성될 수 있는 촉매가 선행 기술에서 공지된 개질 촉매보다 실질적으로 더 높은 반응기 압력에서 작동될 수 있다는 점이다.
본 발명의 공정은, 자체가 고압인 합성 가스를 생성할 수 있게 해준다. 따라서, 상기 공정은, 고압을 가지며 하류 고압 공정에 사용되는 합성 가스의 제조에 적합하다. 선행 기술의 방법과 비교할 때, 압축 단계의 사용은 본 발명에서 생략될 수 있다.
합성 가스 제조를 위한 본 발명의 공정은 500 내지 50 000 h-1 범위, 바람직하게는 1000 내지 15 000 h-1 범위 및 특히 1000 내지 5000 h-1 범위의 GHSV에서 실시된다.
본 발명의 추가의 양태에서, 본 발명의 방법에 의해 본 발명의 촉매를 사용하여 열역학적 평형에 가까운 메탄 전환율로 고압의 촉매적 공정을 실시할 수 있는 작동 상태의 달성이 가능하며, 이때 메탄 전환율은 바람직하게는 열역학적 평형에서의 메탄 전환율의 50% 이상, 더욱 바람직하게는 열역학적 평형에서의 메탄 전환율의 85% 이상, 특히 열역학적 평형에서의 메탄 전환율의 90% 이다.
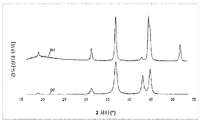
도 1은, Ni/Mg/Al 비가 0.14/0.29/0.57인 본 발명에 따른 물질의 두 가지의 X-선 회절 패턴을 보여준다. 회절 패턴 (a)는 하소된 물질에 대해 기록된 것이고, 회절 패턴 (b)는 본 발명에 따라 스팀 개질 공정에 사용된 후 상기 물질에 대해 기록된 것이다.
도 2는, Ni/Mg/Al 비가 0.14/0.29/0.57인 본 발명에 따른 물질의 X-선 회절 패턴을 보여준다. 이 회절 패턴은 5 내지 80 범위의 각에 걸쳐 기록된 것이다.
도 2는, Ni/Mg/Al 비가 0.14/0.29/0.57인 본 발명에 따른 물질의 X-선 회절 패턴을 보여준다. 이 회절 패턴은 5 내지 80 범위의 각에 걸쳐 기록된 것이다.
실시예
제조 공정
촉매를 제조하기 위한 본 발명의 방법을 하기에서 실시예 E1으로써 설명한다. 261.7 g의 분말 질산 니켈 6수화물(Ni(NO3)2*6H2O, 메르크로부터 입수)을 유리 비이커에 넣고 핫플레이트 상에서 가열함으로써 약 100℃의 온도에서 용융시켰다. 이어서, 400g의 예비가열된 하이드로탈사이트 분말을, 상기 질산염 용융물이 존재하는 상기 비이커에 도입하였다. 상기 하이드로탈사이트의 도입 중에 상기 질산염 용융물은 핫플레이트 상에서 자석교반봉에 의해 혼합되었다. 상기 교반봉의 구동 수단은 유리 비이커의 개구부 위에 배치하였다. 사솔(Sasol)로부터의 퓨랄 MG30(Pural MG30)을 하이드로탈사이트로서 사용하였다. 하이드로탈사이트의 도입 전에, 이는 대류 오븐에서 130℃에서 30분 동안 가열되었다. 상기 용융물에 하이드로탈사이트를 도입하는 것은 복수의 여러 단계로 나누어 총 10분의 기간에 걸쳐 수행하였다. 하이드로탈사이트와 상기 염 용융물의 혼합물을 가진 유리 비이커를 오븐에서 130℃에서 30분 동안 가열한 후 교반봉에 의해 5분 동안, 그리고 울트라-튜락스(Ultra-Turrax) 교반봉에 의해 추가로 2분 동안 혼합하였다.
수득된 질산염과 하이드로탈사이트의 혼합물을 냉각하고 약 330 g의 두 분획으로 나눈 다음, 이들을 회전식 벌브 로(bulb furnace)에서 저온 하소 처리하였다. 이 목적을 위해, 샘플을, 상기 회전식 벌브 로에 고정된 용융 실리카 플라스크내로 도입하고 12 rpm의 속도로 회전시키면서 1 l/분의 공기 스트림을 거기에 통과시켰다. 샘플 혼합물이 존재하는 상기 용융된 실리카 플라스크를 단계적으로 120℃, 180℃, 및 280℃의 세 가지의 다른 온도 단계로 425℃의 목표 온도까지 가열하였다. 상기 샘플의 상기 가열 과정의 개별 온도 단계 및 상기 목표 온도에서의 체류 시간은 각각 2시간이었다. 가열 속도로서 2℃/분이 사용되었다.
상기 저온 하소로부터 수득된 생성물을 윤활제(5중량%)와 혼합하고, 30 내지 35 kN 범위의 압착력을 사용하는 기계적 펀치 프레스에 의해 압축하여 펠렛을 형성하였다.
윤활제로서는, 예를 들면 그라파이트, 스테아르산 또는 스테아르산 마그네슘을 사용하는 것이 가능하다. 본원에서 수득된 펠렛은 13 mm의 직경 및 약 4 내지 5 mm의 두께를 가졌다.
상기 펠렛을 회전식 스크린 밀(mill) 수단에 의해 70 rpm의 회전 속도로 예비분쇄하고 체를 통해 압착하였다. 예비분쇄된 물질을 이어서, 500 내지 1000 ㎛의 입자 크기를 가진 목표 분획을 분리하기 위해 체질하였다. 체질하는 것은 레취(Retch)(모델 AS 200)으로부터 입수한 체 장비에 의해 60 Hz의 진탕 진동수를 사용하여 수행하였다.
체질 후에 수득된 물질을 950℃에서 고온 하소 처리하였다. 이 목적을 위해, 샘플 물질을 머플 로에서 950 ℃로 5℃/분의 가열 속도로 가열하면서 상기 로에 공기 스트림(6 l/분)을 통과시키고, 950℃에서 4시간 동안 열처리 한 다음 실온으로 냉각시켰다.
실시예 E2 및 E3에서는, 실시예 E1에서와 동일한 방식으로 촉매를 제조하였으며, 실시예 E2의 경우에는 하이드로탈사이트-포함 출발 물질로서 퓨랄 MG5(Pural MG5)가 사용되고, 실시예 E3의 경우에는 퓨랄 MG20이 사용되었다. 상기 촉매의 화학양론적 조성은, 실시예 E1의 경우 Ni14Mg29Al57, 실시예 E2의 경우 Ni24 .0Mg9 .4Al66 .7 및 실시예 E3의 경우 Ni8 .1Mg25 .2Al66 .7이었다. 상기 촉매의 BET 표면적은 실시예 E2의 경우 47 m2/g, 실시예 E3의 경우 77 m2/g이었다.
비교예
1
비교예 1로서, 침전된 촉매를 제조하였다. 이 목적을 위해 0.9 l의 탈이온수를 먼저, 교반 장치 및 pH 전극이 구비된 유리 반응기 내로 도입하고, 70℃로 가열하였다. 상기 유리 반응기 내로, 이어서, 2.94 l의 금속 염 용액을 33 ml/분의 일정한 계량 속도로 도입하고 2M의 탄산 나트륨 용액을 공급하였다. (상기 금속 염 용액은 미리, 질산 니켈, 질산 마그네슘 및 질산 알루미늄의 용액을 합침으로써 제조하였다. 각각의 출발 용액은 1몰/l의 농도를 가졌으며, 0.394 l의 니켈 용액, 0.861 l의 마그네슘 용액, 및 1.684 l의 알루미늄 용액을 사용하였다. 이는 13.4:29.3:57.3의 Ni:Mg:Al 몰비에 상응한다.)
상기 유리 반응기 내로의 상기 금속 염 용액 및 상기 탄산염 용액의 도입과 동시에, 상기 유리 반응기에 포함된 혼합물을 교반기에 의해 혼합하였다. 첨가되는 탄산염 용액의 양은 pH 수단에 의해 모니터링하였으며, pH가 8.5 영역으로 유지되는 공급 속도를 선택하였다. 침전이 완료되고 금속 염 용액이 완전히 유리 반응기로 전달된 후, 상기 혼합물을 추가의 60분 동안 교반하여 침전 생성물을 에이징시켰다. 에이징 동안, 상기 유리 반응기에 존재하는 혼합물을 70℃로 가열하고 동시에 상기 반응기 내로 공기를 송풍하였다.
에이징이 완료된 후, 상기 침전물을 포클레인(porcelain) 흡인 필터 상의 블랙 밴드 필터 상에서 여과하고 탈이온수로 세척하였다. 상기 세척 공정을 수행하는 동안, 상기 세척수의 질산염 함량을 모니터링하였으며, 질산염 함량이 10 ppm 미만에 도달할 때 상기 세척을 중단하였다. 세척된 필터 케익을 5 l의 물에 슬러리화하고, 울트라-튜락스 수단에 의해 분산시킨 후 분무 건조하였다. 분무 건조는, 나이로(Niro)로부터 입수한 모바일 마이너(Mobile Minor) 분무건조기를 사용하여 2-유체 노즐 수단에 의해 수행하였으며, 건조기의 상부에서 사용된 온도는 350℃였고, 배출 가스 온도는 115℃였다. 분무 건조에 공급된 현탁액은 약 5 중량%의 고체 함량을 가졌다.
분무 건조된 분말을 융용된 실리카 플라스크로 도입하고 이어서 회전식 벌브 로에서 예비하소하였다. 상기 예비하소 중에 상기 용융 실리카 플라스크는 12 rpm의 속도로 회전되었다. 상기 용융 실리카 플라스크 내부에 공기 스트림을 1 l/분의 유속으로 통과시켰다.
실온에서 출발하여, 내부에 샘플을 가진 상기 용융 실리카 플라스크를 2℃/분의 가열 속도로 425℃로 가열하고 이 온도에서 2시간 동안 가열하였으며, 이때 상기 가열 공정은 120℃, 180℃, 및 280℃에서 각각 2시간 동안 중단되었다.
성형을 위해, 상기 예비하소된 샘플 분말을 윤활제 부재하에 타입 RC100x30의 롤러 콤팩터 수단에 의해 처리하였다. 조밀화는, 250 바의 압착 압력을 사용하여 5 사이클로 수행되었으며, 상기 콤팩터에는 플루티드 롤러(fluted roller)가 구비되어 있었다. 5번의 조밀화 사이클의 마지막에서, 1.6 mm의 메쉬 개구부를 가진 스크린 인써트를 예비분급을 위해 상기 회전형 스크린 밀 하부에서 사용하였다. 예비분급에서 수득된 샘플을, 1 mm의 메쉬 개구부를 가진 체를 통해 가압한 다음 체 장비를 사용하여 0.5 내지 1 mm 입자 분획을 목표 분획물로서 분리하였다. 상기 분리는, 70 Hz의 진동수를 사용하여 20분 동안 체질함으로써 수행되었다.
촉매 시험
개별 촉매의 개질에서의 효율을 결정하기 위해, 이들(즉, 실시예 1 내지 실시예 3 및 비교예 1로부터의 촉매)을, 산업적 공정에서 중요한 개질 반응을 위한 공정 조건 하에 실험실 용 촉매작용 장치에서 사용하였다. 시험에 사용된 관형 반응기는 약 30 ml의 용량을 가졌다. 개별적 시험에 사용된 촉매의 양은 20 g(또는 등온 영역에서는 20 ml)이었다.
상기 촉매작용 실험에서 달성된 결과는 실시예 1 내지 실시예 3에 대해서는 하기 표 2 내지 5에, 비교예 1에 대해서는 하기 표 6에 나타내었다.
실시예 1 내지 실시예 3 및 비교예 1에서 반응기 내로 도입된 촉매는 우선 활성화 처리되었다. 활성화를 수행하기 위해, 촉매를 수소-포함 분위기((N2중의 5부피%의 H2)에서 450℃에서 10 시간 동안 가열하여, 산화 니켈을 적어도 부분적으로 금속 니켈로 전환하였다. 촉매의 가열은, 250℃ 및 350℃에서 중간 단계가 들어가는 온도 프로그램 수단에 의해 수행되었다. 제1 중간 단계에 도달하기 위해서 10℃/분의 가열 속도가 선택되었다. 제2 중간 단계 및 목표 온도는 1℃/분의 가열 속도로 도달되었다. 상기 중간 단계에서의 체류 시간은 25분이었다. 추가의 공정 조건은 GHSV 3810 h-1, 공급물 가스 도입 속도 1.27 표준l/분 및 공정 압력 20 바였다.
스팀 개질 반응은 850℃ 이상의 온도에서 수행되었다.
각각의 경우 47.5%의 H2O 및 47.5%의 CH4 를 포함하는 특정 시험 공정이 확립되었다. 내부 표준물로서의 5%의 Ar이 상기 공급물 가스 내로 혼합되었다. 촉매의 탄소성 물질의 형성 및 침착을 피하기 위해, 상기 실험의 초기에, 상기 촉매는 단지 수증기, 질소 및 아르곤을 포함하고 메탄은 포함하지 않는 분위기에 노출되었다. 공급물 가스의 메탄 함량은, 질소 함량을 감소시키면서, 0 부피%에서 47.5 부피%로 증가되었다. 상기 실험의 초기 단계는 상이한 공급물 가스 조성물을 가진 5개의 공정 단계로 나누어질 수 있다(표 1 참조).
초기 단계(즉, 표 1의 단계 1)가 끝난 후, (47.5 부피%의) CH4 농도는 (47.5 부피%의)의 H2O 농도와 동일하다. 다음 공정 단계에서는, CH4의 일부 및 H2O의 일부가 CO2 로 대체된다 (상응하는 비율은 표 2에 기재되어 있다).
이어서, H2O가 완전히 H2로 완전히 대체된다 (표 2에서 단계 3).
H2 농도의 단계적 저하 및 반응 온도의 850℃에서 950℃로의 증가는 점차적으로 공정 조건의 심각도를 증가시킨다.
마지막 공정 단계 설정시, H2가 완전히 H2O로 완전히 대체된다 (표 2에서 단계 8에서 단계 9로의 전이).
촉매의 품질을 추정하는 중요한 변수는 촉매에 의해 달성된 CO2 및 CH4의 전환율 및 생성물 가스에서의 H2/CO의 몰비[mol%/mol%]이다.
단계 6 중에 달성된 약 1의 H2/CO의 비는 산업적으로 및 경제적으로 매우 중요하다. 공급물 가스 내의 CH4 및 CO2의 농도는 각각의 경우 37.5 부피%이고, 공급물 가스 내의 H2의 농도는 20 부피%였다. 실시예 2의 촉매는 이들 공정 조건 하에서 메탄을 활성화하는데 비정상적인 능력을 나타내었으며, 이는 표 2에서의 높은 CH4 전환율로부터 알 수 있다. 또한, 상기 촉매는 CO2 면에서도 높은 수소화 성능을 갖는다.
실시예 1, 실시예 2 및 실시예 3의 촉매는 매우 심각하거나 매우 거친 공정 ("높은 심각도") 조건하에서 100 초과의 시간 동안 실시될 수 있었다(단계 7, 8 및 9).
산업적으로 관련된 개질 조건하에서 추가로 본 발명의 촉매의 성능을 조사하기 위해, 실시예 1의 촉매를 추가로 850℃의 온도 및 20바의 공정 압력에서 추가로 시험하였으며, 시험 프로그램은 수증기 함량의 구배적 감소를 제공하였다. 상기 실험에서 얻은 결과는 표 5에 나타내었다.
촉매 E1은 전술된 촉매작용 실험에서 기술한 방식으로 수행되는 활성화로 처리되었다. 추가의 공정 조건은 GHSV 3810 h-1, 공급물 가스 도입 속도 1.27 표준l/분 및 공정 압력 20 바였다.
공급물 가스가 47.5%의 H2O 및 47.5%의 CH4를 포함하고 내부 표준물로서 5%의 Ar이 사용되어 공급물 가스내로 혼합되는 특정 시험 프로그램이 확립되었다. 촉매 상의 탄소성 물질의 형성 및 침착을 피하기 위해, 상기 실험의 초기에, 상기 촉매는 단지 수증기, 질소 및 아르곤을 포함하고 메탄은 포함하지 않는 분위기에 노출되었다. 선행 촉매작용 실험에서와 유사한 방식으로, 공급물 가스의 메탄 함량은, 질소 함량을 감소시키면서, 0 부피%에서 47.5 부피%로 증가되었다. 상기 실험의 초기 단계는 상이한 공급물 가스 조성물을 가진 5개의 공정 단계로 나누어질 수 있다(표 1 참조).
초기 단계(즉, 표 5의 단계 1)가 끝난 후, (47.5 부피%의) CH4 농도는 (47.5 부피%의)의 H2O 농도와 동일하다. 다음 공정 단계에서는, CH4의 일부 및 H2O의 일부가 CO2 로 대체된다 (표 5의 단계 2)
공급물 가스 내의 H2O는 이어서 단계적으로 감소되며 등몰량의 CH4 및 CO2로 대체된다 (표 5에서 단계 3 내지 4). H2O 농도의 저하는 공정 조건의 심각도를 증가시킨다.
촉매의 품질을 추정하는 중요한 변수는 촉매에 의해 달성된 CO2 및 CH4의 전환율 및 생성물 가스에서의 H2/CO의 몰비[mol%/mol%] 및 탄소성 침착물을 초개하는 반응을 효과적으로 억제하고 따라서 고-심각도 공정 조건 하에서 장기간에 거쳐 안정한 작동을 보장하는 촉매의 능력이다.
이들 공정 조건하에서, 실시예 1의 촉매는, 고-심각도 조건 하에서 800 시간 초과의 누적 시간에 걸친 안정한 탄소성 침착물-비함유 작동을 보장하는 탁월한 능력을 보여주었다(표 5 참조).
비교예
1로부터의 촉매의 시험
비교예 1의 촉매의 촉매 시험 데이터는 표 6에 나와 있다. 비교예 1의 촉매를 본 발명에 따른 촉매와 동일한 조건하에 처리하였다. 본 발명에 따르지 않은 촉매를 사용할 때 물 부재 하에 850℃의 온도에서 달성된 메탄 전환율은 본 발명에 따른 촉매를 사용하여 달성된 메탄 전환율보다 훨씬 낮음을 알 수 있다. 또한, 본 발명에 따르지 않은 촉매를 사용할 때는 단지 적은 CO2 전환율이 달성되었다. 표 6에 상응 데이터가 나와 있다; 특히, 공정 단계 3 및 4 수행 동안, 단지 매우 낮은 전환율이 달성되었다. 비교예 1의 촉매의 경우, 상기 시험은, 촉매가 탄소성 물질의 침착에 의해 탈활성화되어 반응이 더이상 수행될 수 없어서, 공정 단계 7 후에 중단되어야 했다. 탄화에 의한 촉매 탈활성화에 이르기까지, 비교예 1의 촉매는 공정 조건 하에서 60시간 동안 작동될 수 있었다.
물리적 특성 분석
XRD 분석은, CuK-알파 공급원(40 kV 및 40 mA에서 0.154 nm의 파장을 가짐)및 θ-θ 지오메트리(geometry)(브래그-브렌타노(Bragg-Brentano) 지오메트리)을 반사 모드로 사용하여 브루커(Bruker)/AXS로부터 D8 어드밴스(Advance) 시리즈 2 수단에 의해 수행되었다. 상기 측정은, 4.8 초/단계에서 0.02°단계로 5 내지 80°(2-θ)의 측정 범위에 걸쳐 수행되었다. 구조 분석 소프트웨어 TOPAS (브루커 AXS)를 사용하여 개별 단계의 평균 결정 크기를 결정하였다.
도 1에 도시된 회절 패턴은, (a)의 경우 31.24°2θ, 36.84°2θ, 및 44.82°2θ, (b)의 경우 44.44 및 44.64°2θ에서의 스피넬 상의 반사 특성을 나타낸다.
도 2는, 본 발명의 예인 촉매의 회절 패턴을 보여준다. 상기 회절 패턴은 5 내지 80 °2θ 범위의 각에서 기록되었다.
회절 패턴 (a)에는, Ni와 Mg의 혼합된 산화물 상에 할당될 수 있는 43.8°2θ가 있다. 촉매적 공정 도중에 상기 물질의 환원 처리 결과로서, 혼합된 산화물의 양이 감소되고 금속 니켈이 형성되며, 이는, 이제 51.74°2θ에서 반사값이 있는 회절 패턴 (b)에서 알 수 있다. 그러나, 43.12°2θ에서의 반사는 상기 회절 패턴에서는 사실상 사라졌다.
표 1은, 실험 초기, 즉 활성화 공정 후의 초기 단계에 각각의 개별 촉매 샘플이 노출되는 다섯 가지의 다른 공급물 조성물(또는 다른 공급물 유체 조성물)을 보여준다.
| 공정 단계 | CH4 [부피%] | H2O [부피%] | N2 [부피%] |
| 0 | 0 | 47.5 | 47.5 |
| 1 | 10 | 47.5 | 37.5 |
| 2 | 20 | 47.5 | 27.5 |
| 3 | 30 | 47.5 | 17.5 |
| 4 | 40 | 47.5 | 7.5 |
| 5 | 47.5 | 47.5 | 0 |
표 2는 스팀 개질 실험 중에 실시예 E1으로부터 얻은 샘플에 대해 측정한 촉매적 데이터의 요약을 보여준다.
| 단계 | 온도 [℃] |
CH4 [부피%] |
CO2 [부피%] |
H2O [부피%] |
H2 [부피%] |
CH4 전환율 [%] |
CO2 전환율 [%] |
H2/CO 비 |
| 1 | 850 | 47.5 | 0 | 47.5 | 0 | 45 | 0 | 4.0 |
| 2 | 850 | 27.5 | 27.5 | 40 | 0 | 65 | 33 | 1.6 |
| 3 | 850 | 27.5 | 27.5 | 0 | 40 | 46 | 78 | 1.5 |
| 4 | 850 | 32.5 | 32.5 | 0 | 30 | 49 | 76 | 1.2 |
| 5 | 950 | 32.5 | 32.5 | 0 | 30 | 66 | 78 | 1.1 |
| 6 | 950 | 37.5 | 37.5 | 0 | 20 | 64 | 73 | 1.0 |
| 7 | 950 | 42.5 | 42.5 | 0 | 10 | 57 | 67 | 0.8 |
| 8 | 950 | 42.5 | 42.5 | 5 | 5 | 67 | 67 | 0.8 |
| 9 | 950 | 42.5 | 42.5 | 10 | 0 | 82 | 74 | 0.9 |
표 3은 스팀 개질 실험 중에 실시예 2로부터 얻은 샘플에 대해 측정한 촉매적 데이터의 요약을 보여준다.
| 단계 | 온도 [℃] |
CH4 [부피%] |
CO2 [부피%] |
H2O [부피%] |
H2 [부피%] |
CH4 전환율 [%] |
CO2 전환율 [%] |
H2/CO 비 |
| 1 | 850 | 47.5 | 0 | 47.5 | 0 | 40 | 0 | 4.3 |
| 2 | 850 | 27.5 | 27.5 | 40 | 0 | 45 | 22 | 1.7 |
| 3 | 850 | 27.5 | 27.5 | 0 | 40 | 11 | 54 | 2.0 |
| 4 | 850 | 27.5 | 27.5 | 0 | 30 | 6 | 35 | 2.2 |
| 5 | 950 | 32.5 | 32.5 | 0 | 30 | 50 | 73 | 1.2 |
| 6 | 950 | 37.5 | 37.5 | 0 | 20 | 53 | 77 | 1.0 |
| 7 | 950 | 42.5 | 42.5 | 0 | 10 | 41 | 67 | 0.8 |
| 8 | 950 | 42.5 | 42.5 | 5 | 5 | 45 | 64 | 0.8 |
| 9 | 950 | 42.5 | 42.5 | 10 | 0 | 46 | 56 | 0.8 |
표 4는 스팀 개질 실험 중에 실시예 3으로부터 얻은 샘플에 대해 측정한 촉매적 데이터의 요약을 보여준다.
| 단계 | 온도 [℃] |
CH4 [부피%] |
CO2 [부피%] |
H2O [부피%] |
H2 [부피%] |
CH4 전환율 [%] |
CO2 전환율 [%] |
H2/CO 비 |
| 1 | 850 | 47.5 | 0 | 47.5 | 0 | 26 | 0 | 4.2 |
| 2 | 850 | 27.5 | 27.5 | 40 | 0 | 35 | 17 | 1.8 |
| 3 | 850 | 27.5 | 27.5 | 0 | 40 | 16 | 52 | 2.3 |
| 4 | 850 | 27.5 | 27.5 | 0 | 30 | 11 | 34 | 2.7 |
| 5 | 950 | 32.5 | 32.5 | 0 | 30 | 46 | 77 | 1.2 |
| 6 | 950 | 37.5 | 37.5 | 0 | 20 | 47 | 72 | 0.9 |
| 7 | 950 | 42.5 | 42.5 | 0 | 10 | 32 | 56 | 0.7 |
| 8 | 950 | 42.5 | 42.5 | 5 | 5 | 36 | 50 | 0.7 |
| 9 | 950 | 42.5 | 42.5 | 10 | 0 | 25 | 30 | 0.8 |
표 5는 제2 스팀 개질 실험 중에 실시예 E1으로부터 얻은 샘플에 대해 측정한 촉매적 데이터의 요약을 보여준다.
| 단계 | 온도 [℃] |
CH4 [부피%] |
CO2 [부피%] |
H2O [부피%] |
H2 [부피%] |
CH4 전환율 [%] |
CO2 전환율 [%] |
H2/CO 비 |
| 1 | 850 | 47.5 | 0 | 47.5 | 0 | 41 | 0 | 4.2 |
| 2 | 850 | 27.5 | 27.5 | 40 | 0 | 70 | 31 | 1.6 |
| 3 | 850 | 27.5 | 27.5 | 0 | 40 | 4 | 43 | 2.3 |
| 4 | 850 | 32.5 | 32.5 | 0 | 30 | 4 | 22 | 2.5 |
| 5 | 950 | 32.5 | 32.5 | 0 | 30 | 29 | 65 | 1.2 |
| 6 | 950 | 37.5 | 37.5 | 0 | 20 | 31 | 60 | 0.9 |
| 7 | 950 | 42.5 | 42.5 | 0 | 10 | 33 | 52 | 0.6 |
표 6은 비교예 1로부터 얻은 촉매를 사용하여 촉매적 시험에서 수득된 측정데이터의 요약을 보여준다. 시험 초기에, 비교예 1로부터 얻은 촉매를 본 발명에 따른 촉매와 동일한 예비처리 공정으로 처리하였다 (표 1에 기재된 시동 공정 및 관련 설명 참조)
| 단계 | 온도 [℃] |
CH4 [부피%] |
CO2 [부피%] |
H2O [부피%] |
H2 [부피%] |
CH4 전환율 [%] |
CO2 전환율 [%] |
H2/CO 비 |
| 1 | 850 | 47.5 | 0 | 47.5 | 0 | 41 | 0 | 4.2 |
| 2 | 850 | 27.5 | 27.5 | 40 | 0 | 70 | 31 | 1.6 |
| 3 | 850 | 27.5 | 27.5 | 0 | 40 | 4 | 43 | 2.3 |
| 4 | 850 | 32.5 | 32.5 | 0 | 30 | 4 | 22 | 2.5 |
| 5 | 950 | 32.5 | 32.5 | 0 | 30 | 29 | 65 | 1.2 |
| 6 | 950 | 37.5 | 37.5 | 0 | 20 | 31 | 60 | 0.9 |
| 7 | 950 | 42.5 | 42.5 | 0 | 10 | 33 | 52 | 0.6 |
표 7은 실시예 1로부터의 하소된 샘플에 대해 측정한 물리적 특성 분석 데이터의 요약을 보여준다. 상기 샘플을 본 발명의 공정에 따라 처리하였으며 950℃에서 4시간 동안 하소시켰다. 상기 샘플의 밀도는 0.82 g/cm3 이다.
| 물리적 변수 | 단위 | 측정치 |
| MgAl2O4의 격자 변수 | [Å] | 8.083 |
| MgAl2O4의 평균 결정 크기 | [nm] | 15.0 |
| Mg0 .5Ni0 .5O의 격자 변수 | [Å] | 4.19 |
| Mg0 .5Ni0 .5O의 평균 결정 크기 | [nm] | 18.0 |
| BET 표면적(N2를 사용하여 측정됨) | [m2/g] | 42 |
| Hg 기공분석 | [ml/g] | 0.80 |
Claims (17)
- 탄화수소-포함 화합물 및 CO2를 개질하여 합성 가스를 수득하기 위한 촉매로서,
적어도 니켈-마그네슘 혼합된 산화물 및 마그네슘 스피넬 및 임의적으로 알루미늄 산화물 수산화물을 포함하며, 이때,
상기 니켈-마그네슘 혼합된 산화물은 100 nm 이하, 바람직하게는 70 nm 이하, 더욱 바람직하게는 40 nm 이하의 평균 결정자(crystallite) 크기를 가지며,
상기 마그네슘 스피넬 상은 100 nm 이하, 바람직하게는 70 nm 이하, 더욱 바람직하게는 40 nm 이하의 평균 결정자 크기를 가지며,
촉매 내 니켈의 비율은 30 몰% 범위이고,
마그네슘 비율은 8 내지 38 몰% 범위, 바람직하게는 23 내지 35 몰% 범위이고,
알루미늄의 비율은 50 내지 70 몰% 범위이고,
43.09°2θ에서의 촉매의 회절 반사의 강도가 44.82°2θ에서의 회절 반사의 강도 이하이고, 더욱 바람직하게는 43.08°2θ에서의 회절 반사의 강도가 44.72°2θ에서의 회절 반사의 강도 미만인, 촉매. - 제 1 항에 있어서,
BET 표면적이 10 내지 200 m2/g 범위, 바람직하게는 15 내지 150 m2/g 범위, 더욱 바람직하게는 20 내지 100 m2/g 범위, 더욱 더 바람직하게는 30 내지 80 m2/g 범위, 매우 특히 바람직하게는 30 내지 78 m2/g , 특히 30 내지 76 m2/g 범위인, 촉매. - 제 1 항 또는 제 2 항에 있어서,
촉매가 중간 기공 및 거대 기공을 가진 이중 모드(bimodal) 기공 구조를 가지며, 이때 중간 기공의 평균 직경은 바람직하게는 4 내지 40 nm 범위이고, 거대 기공의 평균 직경은 바람직하게는 30 내지 120 nm 범위이고, 바람직하게는 촉매는 추가로 평균 직경 100 내지 2000 nm 범위의 거대 기공을 가진 삼중 모드 기공 구조를 갖는, 촉매. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,
평균 기공 직경(평균 기공 크기)가 15 nm 초과, 더욱 바람직하게는 18 nm 초과, 특히 20 nm 초과인, 촉매. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
촉매의 특징적인 탬핑된(tamped) 밀도가 1500 g/l 미만, 더욱 바람직하게는 1350 g/l 미만, 및 더욱 바람직하게는 1100 g/l 이하이고/이거나, 촉매 제조를 위한 출발 물질이 니켈-포함 염 및 하이드로탈사이트-포함 화합물, 바람직하게는 질산 니켈 및 하이드로탈사이트, 더욱 바람직하게는 질산 니켈 6수화물 및 하이드로탈사이트를 포함하는, 촉매. - 탄화수소-포함 화합물 및 CO2를 개질하여 합성 가스를 수득하기 위한 촉매로서,
(i) 바람직하게는 6수화물, 더욱 바람직하게는 니켈 6수화물 형태의, 니켈 염 및/또는 코발트 염을 포함하는 가융성 금속 염, 및 미분된 하이드로탈사이트-포함 출발 물질을 접촉시키는 단계,
(ii) 상기 금속 염 및 상기 하이드로탈사이트-포함 출발 물질을 친밀 혼합하는 단계,
(iii) 상기 가융성 금속 염 및 상기 하이드로탈사이트-포함 출발 물질을 열 처리하고, 금속 염이 금속 염 용융물의 형태로 존재하는 조건하에, 바람직하게는 30 내지 250℃ 범위의 온도, 더 바람직하게는 50 내지 140℃ 범위의 온도에서, 혼합물을 가열하는 단계,
(iv) 500℃ 미만의 온도, 바람직하게는 250 내지 500℃ 범위의 온도에서 혼합물을 저온 하소하는 단계로서, 이때 저온 하소 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계,
(v) 몰딩(molding) 또는 성형하는 단계,
(vi) 500℃ 이상의 온도, 바람직하게는 500 내지 1000℃ 범위의 온도에서 이전 단계에서 수득된 혼합물을 고온 하소하는 단계로서, 이때 고온 하소의 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계
에 의해 수득될 수 있고,
43.08°2θ에서의 촉매의 회절 반사의 강도가 44.82°2θ에서의 회절 반사의 강도 이하이고, 더욱 바람직하게는 43.08°2θ에서의 회절 반사의 강도가 44.82°2θ에서의 회절 반사의 강도 미만이며,
촉매의 BET 표면적이 10 내지 200 m2/g 범위인, 촉매. - 출발 물질을 가융성 금속 염으로 침지시킴으로써, 물 및 CO2의 존재하에 탄화수소를 개질하여 합성 가스를 수득하기 위한 촉매를 제조하는 방법으로서, 하기 단계들을 포함하는 방법:
(i) 가융성 금속 염 및 미분된 하이드로탈사이트-포함 출발 물질을 접촉시키는 단계,
(ii) 가융성 금속 염 및 하이드로탈사이트-포함 출발 물질을 친밀 혼합하는 단계,
(iii) 가융성 금속 염 및 하이드로탈사이트-포함 출발 물질을 열 처리하고, 금속 염이 금속 염 용융물의 형태로 존재하는 조건하에, 바람직하게는 30 내지 250℃ 범위의 온도, 더 바람직하게는 50 내지 140℃ 범위의 온도에서 혼합물을 가열하는 단계,
(iv) 500℃ 미만의 온도, 바람직하게는 250 내지 500℃ 범위의 온도에서 혼합물을 저온 하소하는 단계로서, 이때 저온 하소 기간은 바람직하게는 0.1 내지 24 시간의 범위인, 단계,
(v) 몰딩 또는 성형하는 단계,
(vi) 500℃ 이상의 온도, 바람직하게는 500 내지 1000℃ 범위의 온도에서 혼합물을 고온 하소하는 단계로서, 이때 고온 하소의 기간은 바람직하게는 0.1 내지 24 시간인, 단계. - 제 7 항에 있어서,
가융성 금속 염이, 바람직하게는 6수화물 형태의, 니켈 염 및/또는 코발트 염이고, 가융성 금속 염이, 더욱 바람직하게는 질산 니켈 6수화물인, 방법. - 제 7 항 또는 제 8 항에 있어서,
공정 단계 (ii)가 단계 (iii)과 동시에 수행되는, 방법. - 제 7 항 내지 제 9 항 중 어느 한 항에 있어서,
공정 단계 (ii)가 단계 (iii)과 동시에 수행되는, 방법. - 제 7 항 내지 제 10 항 중 어느 한 항에 있어서,
상기 단계 (iii)의 열처리 및 단계 (iv)의 혼합물의 저온 하소 단계가 하나의 통합된 공정 단계로 수행되는, 방법. - 제 7 항 내지 제 11 항 중 어느 한 항에 있어서,
상기 가융성 금속 염이 단계 (i) 수행시 금속 용융물 형태로 존재하는, 방법. - 제 1 항 내지 제 5 항 중 어느 한 항에 따른 촉매 또는 제 7 항 내지 제 12 항 중 어느 한 항에 따른 방법에 의해 제조된 촉매를 사용하고, 500 내지 1000℃ 범위, 바람직하게는 650 내지 1000℃ 범위, 더욱 바람직하게는 700 내지 980℃ 범위의 온도에서 수행되는, 합성 가스를 수득하기 위한 탄화수소-포함 화합물 및 CO2의 개질 방법.
- 제 13 항에 있어서,
상기 방법이 2 내지 70 바, 바람직하게는 10 내지 40 바, 및 더욱 바람직하게는 20 내지 40 바 범위의 압력에서 수행되는, 합성 가스를 수득하기 위한 탄화수소-포함 화합물 및 CO2의 개질 방법. - 제 13 항 또는 제 14 항에 있어서,
각각 20 내지 45 부피% 범위의 CH4 함량 및 CO2 함량, 0 내지 40 부피% 범위의 수증기, 및 임의적으로 0 내지 40 부피% 범위의 H2 함량을 가진 공급물 유체가 사용되는, 탄화수소-포함 화합물 및 CO2의 개질 방법. - 제 13 항 또는 제 14 항에 있어서,
CO2/CH4 비가 0 내지 1.5 범위, 바람직하게는 0.3 내지 1.4 범위, 더욱 바람직하게는 0.5 내지 1.3 범위, 특히 0.7 내지 1.2 범위이고/이거나, H2O/CH4 비가 2.0 미만, 더욱 바람직하게는 1.5 미만, 더욱 바람직하게는 1.0 미만, 특히 0.9 미만인, 탄화수소-포함 화합물 및 CO2의 개질 방법. - 제 13 항 내지 제 16 항 중 어느 한 항에 있어서,
2 미만의 H2/CO 비, 바람직하게는 1.5 미만의 H2/CO 비, 더욱 바람직하게는 1.2 미만의 H2/CO 비를 가진 합성 가스가 생성되는, 탄화수소-포함 화합물 및 CO2의 개질 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11188237.9 | 2011-11-08 | ||
| EP11188237 | 2011-11-08 | ||
| PCT/IB2012/056158 WO2013068905A1 (en) | 2011-11-08 | 2012-11-05 | Process for producing reforming catalyst and reforming of methane |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140099475A true KR20140099475A (ko) | 2014-08-12 |
Family
ID=48288609
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147015234A KR20140099475A (ko) | 2011-11-08 | 2012-11-05 | 개질 촉매의 제조 방법 및 메탄의 개질 |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP2776157B1 (ko) |
| JP (1) | JP6296990B2 (ko) |
| KR (1) | KR20140099475A (ko) |
| CN (1) | CN104039445B (ko) |
| CA (1) | CA2854863A1 (ko) |
| DK (1) | DK2776157T3 (ko) |
| RU (1) | RU2632197C2 (ko) |
| WO (1) | WO2013068905A1 (ko) |
| ZA (1) | ZA201404090B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230005097A (ko) * | 2020-10-20 | 2023-01-09 | 한국화학연구원 | 메탄의 수증기 개질용 니켈계 촉매 및 이를 이용한 메탄의 수증기 개질 반응 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103917291A (zh) * | 2011-11-09 | 2014-07-09 | 巴斯夫欧洲公司 | 用于在燃料电池中蒸汽转化甲烷的催化剂组合物 |
| CN103611541B (zh) * | 2013-12-06 | 2016-03-30 | 新奥科技发展有限公司 | 一种低温甲烷水蒸汽重整催化剂及其制备方法 |
| EP2886514A1 (de) | 2013-12-20 | 2015-06-24 | Basf Se | Verfahren zur Reformierung von Gemischen aus Kohlenwasserstoffen und Kohlendioxid |
| KR20160133490A (ko) * | 2014-03-14 | 2016-11-22 | 바스프 에스이 | 고온 이산화탄소 수소화, 조합된 고온 이산화탄소 수소화 및 개질, 및/또는 개질을 위한 이트륨 함유 촉매, 및 고온 이산화탄소 수소화, 조합된 고온 이산화탄소 수소화 및 개질, 및/또는 개질을 위한 방법 |
| FR3020356A1 (fr) | 2014-04-29 | 2015-10-30 | Univ Lille Sciences Tech | Procede de reformage sec d'au moins un alcane. |
| CN103962145B (zh) * | 2014-04-30 | 2016-08-24 | 上海倍能化工技术有限公司 | 一种高温型甲烷合成用催化剂、制备方法及甲烷合成方法 |
| CN106660020A (zh) | 2014-07-17 | 2017-05-10 | 沙特基础全球技术有限公司 | 橄榄石催化剂用于甲烷的二氧化碳重整的用途 |
| DE102014011213A1 (de) | 2014-07-29 | 2016-02-04 | Linde Aktiengesellschaft | Verfahren zur Synthesegasherstellung |
| DK201400705A1 (en) * | 2014-12-03 | 2016-04-18 | Haldor Topsoe As | A catalyst for prereforming and/or steam reforming |
| EP3456411A4 (en) * | 2016-05-12 | 2019-12-18 | Fujian Institute Of Research On The Structure Of Matter, Chinese Academy Of Sciences | CATALYST, ITS PREPARATION METHOD AND ITS APPLICATION IN THE PREPARATION OF SYNTHESIS GAS |
| CN106622321B (zh) * | 2016-09-06 | 2019-07-12 | 中国海洋石油集团有限公司 | 一种甲烷化催化剂及其制备方法与应用 |
| EP3574994A1 (en) | 2018-05-30 | 2019-12-04 | Basf Se | Method for producing catalyst monoliths for the reforming of hydrocarbons |
| FR3104462B1 (fr) * | 2019-12-17 | 2022-06-10 | Ifp Energies Now | Catalyseur pour l’hydrogenation de composes aromatiques obtenu a partir de sels fondus et d’un additif organique |
| CN115003412A (zh) | 2020-01-31 | 2022-09-02 | 巴斯夫欧洲公司 | 一种制备模制品的方法、模制品及其作为甲烷重整催化剂的用途 |
| WO2022184892A1 (en) | 2021-03-04 | 2022-09-09 | Basf Se | Process for the preparation of a mixed metal oxide |
| WO2023111017A1 (en) | 2021-12-15 | 2023-06-22 | Basf Se | High pressure nh3-reforming and combined reforming of nh3 as co-feed for hydrocarbon/co2-reforming |
| WO2023227605A1 (en) | 2022-05-24 | 2023-11-30 | Basf Se | Method for the preparation of a supported mixed metal oxide |
| CN115282975B (zh) * | 2022-07-29 | 2024-02-20 | 东南大学 | 适用于甲烷湿重整的催化剂、制备、还原及应用方法 |
| WO2024056607A1 (en) | 2022-09-12 | 2024-03-21 | Basf Se | Ni-based catalyst for nh3 reforming applications |
| WO2024056606A1 (en) | 2022-09-12 | 2024-03-21 | Basf Se | Process for nh3 reforming |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL302476A (ko) * | 1962-12-29 | |||
| GB1182829A (en) * | 1967-06-12 | 1970-03-04 | Haldor Frederik Axel Topsoe | Improvements in or relating to Nickel Catalysts. |
| US3926583A (en) * | 1967-06-12 | 1975-12-16 | Haldor Topsoe As | Process for the catalytic steam reforming of hydrocarbons |
| US6242380B1 (en) * | 1993-08-25 | 2001-06-05 | Korea Research Institute Of Chemical Technology | Process for preparing supported nickel catalyst for reforming hydrocarbons |
| WO2001025142A1 (en) * | 1999-10-01 | 2001-04-12 | Bp Amoco Corporation | Preparing synthesis gas using hydrotalcite-derived nickel catalysts |
| KR100398058B1 (ko) * | 2001-05-18 | 2003-09-19 | 주식회사 경동도시가스 | 수식된 θ-알루미나에 담지되어 이루어진 니켈계 개질촉매및 이를 이용한 천연가스로부터 합성가스의 제조방법 |
| JP4013689B2 (ja) * | 2002-07-30 | 2007-11-28 | 宇部興産株式会社 | 炭化水素改質用触媒、炭化水素分解装置、及び燃料電池用改質器 |
| FR2879478B1 (fr) * | 2004-12-17 | 2007-10-26 | Inst Francais Du Petrole | Catalyseur a base de cobalt pour la synthese fisher-tropsch |
| KR101300501B1 (ko) * | 2005-10-20 | 2013-08-26 | 에스케이이노베이션 주식회사 | 유사 하이드로탈사이트 전구체를 이용한 니켈계 촉매와이를 이용한 액화석유가스의 수증기 개질반응 |
| US20080260628A1 (en) * | 2007-04-17 | 2008-10-23 | Korea Institute Of Science And Technology | Ni-based catalyst for tri-reforming of methane and its catalysis application for the production of syngas |
| KR100892033B1 (ko) * | 2007-10-08 | 2009-04-07 | 한국에너지기술연구원 | 고표면적 스핀넬 구조의 나노크기 결정을 가지는yMgO(1-y)Al₂O₃에 나노크기로 담지된 니켈계개질촉매 및 이를 이용한 수증기-이산화탄소 복합개질에의한 천연가스로부터 합성가스의 제조방법 |
| KR100991263B1 (ko) * | 2008-08-01 | 2010-11-01 | 현대중공업 주식회사 | 천연가스를 수증기와 이산화탄소로 동시에 개질하는 혼합개질 반응용 니켈계 촉매 |
| CN101391218B (zh) * | 2008-10-31 | 2010-08-11 | 西南化工研究设计院 | 一种焦炉气甲烷化催化剂的制备方法 |
| ES2342814B1 (es) * | 2009-01-13 | 2011-05-23 | Hynergreen Technologies, S.A | Catalizador para un proceso para la obtencion de hidrogeno mediante reformado de hidrocarburos con vapor de agua, proceso de preparacion del catalizador y uso del mismo en el proceso. |
| JP5477561B2 (ja) * | 2009-09-09 | 2014-04-23 | 戸田工業株式会社 | 炭化水素を分解する多孔質触媒体及びその製造方法、炭化水素から水素を含む混合改質ガスを製造する方法、並びに燃料電池システム |
| CA2817490C (en) * | 2010-11-16 | 2019-02-12 | Stichting Energieonderzoek Centrum Nederland | Catalyst for hydrogen production |
| CA2854914A1 (en) * | 2011-11-08 | 2013-05-16 | Basf Se | Process for producing a methanation catalyst and a process for the methanation of synthesis gas |
-
2012
- 2012-11-05 RU RU2014123056A patent/RU2632197C2/ru active
- 2012-11-05 DK DK12847506.8T patent/DK2776157T3/da active
- 2012-11-05 WO PCT/IB2012/056158 patent/WO2013068905A1/en active Application Filing
- 2012-11-05 KR KR1020147015234A patent/KR20140099475A/ko not_active Application Discontinuation
- 2012-11-05 CN CN201280066204.4A patent/CN104039445B/zh active Active
- 2012-11-05 JP JP2014540596A patent/JP6296990B2/ja active Active
- 2012-11-05 CA CA2854863A patent/CA2854863A1/en not_active Abandoned
- 2012-11-05 EP EP12847506.8A patent/EP2776157B1/en active Active
-
2014
- 2014-06-05 ZA ZA2014/04090A patent/ZA201404090B/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230005097A (ko) * | 2020-10-20 | 2023-01-09 | 한국화학연구원 | 메탄의 수증기 개질용 니켈계 촉매 및 이를 이용한 메탄의 수증기 개질 반응 |
Also Published As
| Publication number | Publication date |
|---|---|
| ZA201404090B (en) | 2017-05-31 |
| EP2776157B1 (en) | 2021-01-06 |
| CN104039445A (zh) | 2014-09-10 |
| WO2013068905A1 (en) | 2013-05-16 |
| RU2014123056A (ru) | 2015-12-20 |
| CN104039445B (zh) | 2017-05-31 |
| CA2854863A1 (en) | 2013-05-16 |
| JP6296990B2 (ja) | 2018-03-20 |
| DK2776157T3 (da) | 2021-03-29 |
| RU2632197C2 (ru) | 2017-10-03 |
| JP2014532559A (ja) | 2014-12-08 |
| EP2776157A1 (en) | 2014-09-17 |
| EP2776157A4 (en) | 2015-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140099475A (ko) | 개질 촉매의 제조 방법 및 메탄의 개질 | |
| US9259712B2 (en) | Process for producing a reforming catalyst and the reforming of methane | |
| US8916491B2 (en) | Process for producing a methanation catalyst and a process for the methanation of synthesis gas | |
| RU2631497C2 (ru) | Содержащий гексаалюминат катализатор риформинга углеводородов и способ риформинга | |
| JP6125518B2 (ja) | メタン化触媒を製造するための方法および合成ガスのメタン化のための方法 | |
| US9295978B2 (en) | Catalyst and method for the direct synthesis of dimethyl ether from synthesis gas | |
| KR20160133490A (ko) | 고온 이산화탄소 수소화, 조합된 고온 이산화탄소 수소화 및 개질, 및/또는 개질을 위한 이트륨 함유 촉매, 및 고온 이산화탄소 수소화, 조합된 고온 이산화탄소 수소화 및 개질, 및/또는 개질을 위한 방법 | |
| EP3685916A1 (en) | Perovskite metal oxide catalyst, in which metal ion is substituted, for reducing carbon deposition, preparation method therefor, and methane reforming reaction method using same | |
| US10987660B2 (en) | Hexaaluminate-comprising catalyst for the reforming of hydrocarbons and a reforming process | |
| EP2545000A2 (en) | Palladium-modified hydrotalcites and their use as catalyst precursors | |
| US11712679B2 (en) | Method for producing catalyst monoliths for the reforming of hydrocarbons | |
| CA2846994A1 (en) | Catalysts for producing hydrogen and synthesis gas | |
| Laassiri et al. | Waste-free scale up synthesis of nanocrystalline hexaaluminate: properties in oxygen transfer and oxidation reactions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |