KR20140063513A - 거미막밑 출혈을 갖는 인간의 예후를 개선시키기 위한 조성물 및 방법 - Google Patents
거미막밑 출혈을 갖는 인간의 예후를 개선시키기 위한 조성물 및 방법 Download PDFInfo
- Publication number
- KR20140063513A KR20140063513A KR1020137023962A KR20137023962A KR20140063513A KR 20140063513 A KR20140063513 A KR 20140063513A KR 1020137023962 A KR1020137023962 A KR 1020137023962A KR 20137023962 A KR20137023962 A KR 20137023962A KR 20140063513 A KR20140063513 A KR 20140063513A
- Authority
- KR
- South Korea
- Prior art keywords
- less
- calcium channel
- voltage
- channel blocker
- another embodiment
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A61K9/1647—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/01—Introducing, guiding, advancing, emplacing or holding catheters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/14—Infusion devices, e.g. infusing by gravity; Blood infusion; Accessories therefor
- A61M5/158—Needles for infusions; Accessories therefor, e.g. for inserting infusion needles, or for holding them on the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
- A61P3/14—Drugs for disorders of the metabolism for electrolyte homeostasis for calcium homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Heart & Thoracic Surgery (AREA)
- Diabetes (AREA)
- Dermatology (AREA)
- Psychology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Obesity (AREA)
- Anesthesiology (AREA)
- Rheumatology (AREA)
- Endocrinology (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Biophysics (AREA)
- Pulmonology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
기재된 본 발명은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는, 전압-작동 칼슘 채널 차단제 및 약학적으로 허용되는 담체를 함유하는 치료적 유효량의 약학적 조성물을 뇌 내의 소정의 위치로 이식함으로써 포유동물의 뇌 손상과 관련된 지연 합병증을 치료하고, 포유동물에서 상기 뇌 손상과 관련된 지연 합병증의 예후를 개선시키기 위한 약학적 조성물, 전달 시스템 및 방법을 제공한다.
Description
관련 출원의 전후 참조
본 출원은 2011년 2월 11일에 출원된 미국 가출원 번호 61/441,695호를 우선권으로 주장하며, 이는 2007년 10월 29일에 출원된 미국 가출원 번호 60/976,902호 및 2007년 6월 11일에 출원된 미국 가출원 번호 60/943,124호를 우선권으로 주장하는 2008년 6월 11일에 출원된 미국 출원 번호 12/137,320호의 일부계속 출원이다. 상기 출원들 각각은 이들의 전체내용이 본원에 참조로서 포함된다.
발명의 분야
기재된 본 발명은 거미막밑 출혈의 유해한 예후를 치료하기 위한 조성물, 시스템 및 방법에 관한 것이다.
발명의 배경
인간의 뇌는 전체 체중의 단지 약 2%만 구성하나, 이는 심장박출량의 약 15%를 수용하며, 이의 산소 소비는 신체 전체의 산소 소비의 약 20%이다. 상기 값은 단위 뇌 중량 당 상응하게 높은 혈류 속도에 의해 상쇄되는 뇌의 높은 대사율 및 산소 요구를 나타낸다. 뇌순환은 내경동맥 및 척추동맥에 의해 공급된다. 뇌로의 전체 혈류는 약 750-1000 ml/분이며, 이러한 양 중 약 350 ml는 각각의 내경동맥을 통해 유동하고, 약 100-200 ml는 척추 기저 시스템을 통해 유동한다. 정맥 배출은 내경정맥 및 척추정맥에 의해 배출된다.
본원에서 사용되는 용어 "뇌졸중" 또는 "뇌혈관 사고"는 혈관과 관련된 질병으로부터 발생하는 보통 국소적이고 급성인 신경학적 증상 및 징후를 나타낸다. 뇌졸중은 폐쇄성(혈관의 폐쇄로 인함) 또는 출혈성(혈관으로부터의 출혈로 인함)이다. 본원에서 사용되는 용어 "허혈"은 혈관의 비정상적 협소화(협착증)에 대해 원위에서의 감소된 관류 압력이 저항 혈관의 자가조절성 확장에 의해 상쇄되지 않는 경우에 발생하는 혈액 공급 및 산소의 결핍을 나타낸다. 허혈이 충분히 중증이고 연장되는 경우, 뉴런 및 다른 세포 구성요소가 사멸하며, 이러한 상태는 "경색증"으로 언급된다.
출혈은 뇌 표면(실질외(extraparenchymal)), 예를 들어, 윌리스환(circle of Willis)에서 선천성 동맥류의 파열로부터 발생하여, 거미막밑 출혈(SAH)을 야기시킬 수 있다. 출혈은 또한 실질내, 예를 들어, 오래 지속된 고혈압에 의해 손상된 혈관의 파열로부터 발생할 수 있으며, 이는 대뇌반구 내, 뇌간 내, 또는 소뇌 내에서 혈병(뇌내 혈종)을 야기시킬 수 있다. 출혈은 혀혈 또는 경색증을 수반할 수 있다. 뇌내 혈종의 종괴 효과는 인접한 뇌 조직의 혈액 공급을 손상시킬 수 있거나, 거미막밑 출혈은 대뇌 표면 혈관의 반응성 혈관연축(vasospasm)을 야기시켜, 추가의 허혈 뇌 손상을 발생시킬 수 있다. 경색 조직은 또한 이차로 출혈성이 될 수 있다. 동맥류는 종종 뇌로 파열되어 뇌내 혈종을 야기시킬 수 있고, 뇌실로 파열되어 뇌실내 출혈을 야기시킬 수 있다.
대부분의 폐쇄성 뇌졸중은 죽상경화증 및 혈전증으로 인한 것이고, 대부분의 출혈성 뇌졸중은 고혈압 또는 동맥류와 관련되어 있으나, 상기 두 유형 중 어느 유형의 뇌졸중도 심장병, 외상, 감염, 신생물, 혈액 질환, 혈관 기형, 면역학적 장애, 및 외인성 독소를 포함하는 많은 원인으로부터 임의의 연령에서 발생할 수 있다.
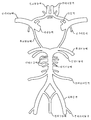
대뇌동맥
도 1 및 5는 뇌 혈관의 개략적 예시를 나타낸다. 각각의 대뇌반구는 턱의 모퉁이 아래의 일반적인 경동맥으로부터 발생하고, 경동맥 구멍(carotid foramen)을 통해 두개골로 진입하고, 해면정맥동(cavernosus sinus)(안동맥을 가지냄)을 통과하고, 경질막을 관통하고, 전대뇌동맥 및 중대뇌동맥으로 나뉘어지는 내경동맥에 의해 공급된다. 전대뇌동맥의 큰 표면 가지들은 피질 및 하전두엽(inferior frontal lobe)의 백색질, 전두엽 및 두정엽의 내측면 및 전방 뇌량(anterior corpus callosum)에 공급한다. 더 작은 관통 가지들은 변연계 구조, 미상의 머리(head of the caudate), 및 속섬유막앞다리(anterior limb of the internal capsule)를 포함하는 더 심부의 대뇌 및 간뇌에 공급한다. 중대뇌동맥의 더 큰 표면 가지들은 전두엽, 두정엽, 측두엽 및 후두엽, 및 뇌섬엽을 포함하는 피질 대부분 및 반구 궁륭부(hemisphere's convexity)의 백색질에 공급한다. 더 작은 관통 가지들은 심부 백색질 및 간뇌 구조, 예를 들어, 속섬유막뒤다리(posterior limb of the internal capsule), 피각(putamen), 외부 창백핵(outer globus pallidus), 및 미상몸통(body of the caudate)에 공급한다. 내경동맥이 해면정맥동으로부터 나타난 후, 이는 또한 전방 해마 및 미측(caudal) 수준에서 속섬유막뒤다리에 공급하는 전맥락동맥을 낸다. 각각의 척추동맥은 쇄골하동맥으로부터 나타나, 큰구멍(foramen magnum)을 통해 두개골로 진입하고, 전척수동맥 및 후하소뇌동맥을 낸다. 척추동맥은 교뇌(pons) 및 연수의 접합부에서 연결되어, 교뇌의 수준에서 전하소뇌동맥 및 내이동맥, 및 중뇌에서 위소뇌동맥을 내는 뇌기저동맥을 형성한다. 이후, 뇌기저동맥은 2개의 후대뇌동맥으로 나뉘어진다. 후대뇌동맥의 더 큰 표면 가지들은 아래가쪽 및 중간 후두엽 및 후뇌량에 공급하고, 상기 동맥의 더 작은 관통 가지들은 시상 및 시상밑핵을 포함하는 간뇌 구조 뿐만 아니라 중뇌의 일부에 공급한다(Principles of Neural Sciences, 2d Ed., Eric R. Kandel and James H. Schwartz, Elsevier Science Publishing Co., Inc., New York, pp. 854-56 (1985) 참조).
혈관 사이의 상호연결(문합)은 뇌의 혈관 공급의 일부가 손상되는 경우에 뇌를 보호한다. 문합은 뇌의 혈관 공급의 일부가 손상되는 경우에 뇌를 보호하는 혈관 사이의 상호연결이다. 윌리스환에서, 2개의 전대뇌동맥은 전교통동맥에 의해 연결되고, 후대뇌동맥은 후교통동맥에 의해 내경동맥에 연결된다. 다른 중요한 문합은 안와를 통한 안동맥과 외경동맥의 가지들 사이의 연결, 및 중간대뇌동맥, 전대뇌동맥, 및 후대뇌동맥의 가지들 사이의 뇌 표면에서의 연결을 포함한다(Principles of Neural Sciences, 2d Ed., Eric R. Kandel and James H. Schwartz, Elsevier Science Publishing Co., Inc., New York, pp. 854-56 (1985)).
통상적으로 한 말단에 머리 및 입을 갖고, 반대 말단에 항문 및 꼬리를 종종 갖는 동물에 대해 언급하는 경우, 머리 말단은 두개 말단으로 언급되는 한편, 꼬리 말단은 미측 말단으로 언급된다. 머리 자체 내에서, 입쪽은 코의 말단을 향한 방향을 나타내고, 미측은 꼬리 방향을 나타내는데 사용된다. 중력의 당김으로부터 멀어지는 보통 위를 향해 배향되는 동물의 신체의 표면 또는 측면은 등쪽 면이고, 통상적으로 모든 다리로 보행하거나, 수영하거나, 비행하는 경우에 땅에 가장 가까운 측면인 반대 측면은 복측 면이다. 수족 또는 다른 부속기관에서, 주요 몸통에 가장 가까운 지점은 "근위"이고, 더 먼 지점은 "원위"이다. 3개의 기본적인 기준면이 동물학적 해부학에서 사용된다. "시상면"은 신체를 좌측 및 우측 부분으로 나눈다. "정중시상면"은 중간선이며, 즉, 이는 중간선 구조, 예를 들어, 척추를 통해 통과하며, 모든 다른 시상면은 이에 대해 평행하다. "관상면"은 신체를 등쪽 및 복측 부분으로 나눈다. "횡단면"은 신체를 두개 및 미측 부분으로 나눈다. 인간에 대해 언급하는 경우, 신체 및 이의 일부는 항상 신체가 직립하여 있다는 가정을 이용하여 기재된다. 머리 말단에 더 근접한 신체의 부분은 "위쪽"(동물에서 두개에 해당함)인 한편, 더 먼 신체 부분은 "아래쪽"(동물에서 미측에 해당함)이다. 신체의 앞 근처의 대상은 "전방"(동물에서 복측에 해당함)으로 언급되는 한편, 신체의 뒤 근처의 대상은 "후방"(동물에서 등쪽에 해당함)으로 언급된다. 횡단면, 축면, 또는 수평면은 아래쪽/발로부터 위쪽/머리를 분리시키는 지면과 평행한 X-Y 면이다. 관상면 또는 이마면은 후방으로부터 전방을 분리시키는 지면과 직각을 이루는 Y-Z 면이다. 시상면은 우측으로부터 좌측을 분리시키는 지면 및 관상면과 직각을 이루는 X-Z 면이다. 정중시상면은 정확하게 신체의 중간에 존재하는 특정 시상면이다.
중간선 근처의 구조는 내측으로 언급되고, 동물의 측면 근처의 구조는 측면으로 언급된다. 따라서, 내측 구조는 정중시상면에 더 가깝고, 측면 구조는 정중시상면으로부터 더 멀다. 신체의 중간선 내의 구조는 정중 구조이다. 예를 들어, 인간 피검체의 코의 말단은 정중선에 존재한다.
동측은 동일 면 상을 의미하고, 반대측은 다른 측면 상을 의미하고, 양측은 양면 상을 의미한다. 신체의 중심에 가까운 구조는 근위 또는 중심인 한편, 더 먼 구조는 원위 또는 주변이다. 예를 들어, 손은 팔의 원위 말단에 존재하는 한편, 어깨는 근위 말단에 존재한다.
뇌척수액을 함유하는 뇌 내의 실인 뇌실은 2개의 가쪽뇌실, 1개의 셋째뇌실, 및 1개의 넷째뇌실을 포함한다. 가쪽뇌실은 대뇌반구에 존재한다. 이들은 몬로공(foramen of Monroe)을 통해 뇌의 2개의 간뇌 구조 사이에 위치된 셋째뇌실로 배출한다. 셋째뇌실은 중간뇌수도관(aqueduct of Sylvius)에 의해 넷째뇌실로 유도된다. 넷째뇌실은 뇌간과 소뇌 사이의 후두와에 존재한다. 뇌척수액은 루시카공(foramenae of Luschka) 및 마장디공(foramenae of Magendie)을 통해 넷째뇌실에서 기저수조로 배출된다. 이후, 뇌척수액은 거미막밑 수조를 통해 스며나오고, 거미막 융모를 통해 정맥 시스템으로 배출된다.
혈관수축 및 혈관확장
본원에서 사용되는 용어 "혈관수축"은 혈관의 근육벽의 수축으로부터 발생하는 혈관의 협소화를 나타낸다. 혈관이 수축하는 경우, 혈액의 유동은 제한되거나 느려진다. 본원에서 사용되는 혈관수축의 반대인 용어 "혈관확장"은 혈관의 확장을 나타낸다. 본원에서 사용되는 용어 "혈관수축제", "혈압상승제" 또는 "승압제"는 혈관수축을 야기시키는 인자를 나타낸다. 혈관수축은 보통 혈압의 증가를 발생시키고, 가볍거나 중증의 혈관수축일 수 있다. 혈관수축은 질병, 약물, 또는 심리학적 조건으로부터 발생할 수 있다. 혈관수축을 야기시키는 약물은 카테콜아민, 항히스타민, 충혈제거제, 메틸페니데이트, 기침 및 감기 배합제, 슈도에페드린, 및 카페인을 포함하나, 이에 제한되지는 않는다.
혈관확장제는 혈관 내의 평활근을 이완시켜 혈관을 확장시키는 약물 또는 화학물질이다. 동맥 혈관(주로 소동맥)의 확장은 혈압의 감소를 초래한다. 평활근의 이완은 세포내 칼슘 이온 농도 및 미오신 경쇄(MLC)의 인산화에 주로 좌우되는 수축에 대한 자극의 제거에 의존한다. 따라서, 혈관확장은 주로 미오신 경쇄 포스파타제의 자극 및 칼슘 공동수송체(symporter) 및 역수송체(antiporter)(세포내 구획 외부로 칼슘 이온을 펌핑함)의 유도를 포함하는, 1) 세포내 칼슘 농도의 저하, 또는 2) MLC의 탈인산화에 의해 작용한다. 교환체(exchanger)를 통한 평활근의 근세포질그물(sarcoplasmic reticulum)로의 이온의 재흡수 및 형질막을 가로지르는 이온의 배출이 또한 혈관확장을 달성하는데 도움이 된다. 상기 효과를 달성하기 위한 특정 메커니즘은 혈관확장제마다 다양하며, 내인성 및 외인성으로 그룹화될 수 있다. 본원에서 사용되는 용어 "내인성"은 내부로부터의 진행 또는 내부로부터 유래된 진행, 또는 외부적으로 야기되는 것이 아닌 유기체 내부의 환경으로부터 발생하는 진행을 나타낸다. 본원에서 사용되는 용어 "외인성"은 외부로부터 발생하거나, 외부적으로 유래되거나, 유기체 내의 환경으로부터 발생하는 것이 아니라 외부적으로 야기되는 것을 나타낸다.
혈관확장은 평균 동맥압 및 심장박출량과 전체 말초 저항(TPR) 사이의 관계에 직접적으로 영향을 미친다. 심장박출량은 심장박동수(박동/분)과 일회 박출량(심장수축기 동안 배출된 혈액의 부피)을 곱함으로써 계산될 수 있다. TPR은 혈관의 길이, 혈액의 점도(적혈구용적률에 의해 결정됨), 및 혈관의 직경을 포함하나, 이에 제한되지는 않는 여러 요인에 좌우된다. 혈관 직경은 저항을 결정하는데 있어서 가장 중요한 변수이다. 심장박출량 또는 TPR에서의 증가는 평균 동맥압의 상승을 야기시킨다. 혈관확장제는 큰동맥 및 보다 작은 세동맥의 혈관 중간막 층 내의 평활근 세포의 이완을 통해 TPR 및 혈압을 감소시키는 작용을 한다.
혈관확장은 온혈동물의 주위 환경이 고온인 경우 온혈 동물의 표면 혈관에서 발생하며, 이러한 과정은 가열된 혈액의 유동을 동물의 피부로 전환시키며, 열은 대기로 보다 용이하게 방출될 수 있다. 혈관수축은 반대의 생리학적 과정이다. 혈관확장 및 혈관수축은 내피세포에 의해 생성되는 국소 주변분비 작용제(예를 들어, 브라디키닌, 아데노신), 뿐만 아니라 유기체의 자율 신경계 및 부신에 의해 자연적으로 조절되며, 상기 자율 신경계 및 부신 둘 모두는 카테콜아민, 예를 들어, 노르에피네프린 및 에피네프린을 각각 분비한다.
혈관확장제는 고혈압과 같은 질환을 치료하는데 사용되며, 여기서 환자는 비정상적으로 높은 혈압 뿐만 아니라 협심증 및 울혈성 심부전을 가지며, 낮은 혈압을 유지시키는 것은 환자의 다른 심장 문제를 발생시킬 위험을 감소시킨다.
뇌실
도 6은 뇌의 뇌실 시스템의 도면이다. 상기 시스템은 뇌 내의 일련의 공동(뇌실)이며, 이는 척수의 거미막밑 공간과 중심관 둘 모두와 연속하여 존재한다. 우측 및 좌측 가쪽뇌실, 및 중간선의 셋째뇌실 및 넷째뇌실의 4개의 뇌실이 존재한다. 2개의 가쪽내실은 대뇌 내에 위치되고, 각각 심실간 몬로공을 통해 셋째뇌실에 연결된다. 셋째뇌실은 간뇌에 위치되고, 대뇌 중간뇌수도관에 의해 넷째뇌실에 연결된다. 넷째뇌실은 후뇌에 위치되고, 이는 적어도 발생학적으로 척수의 중심관과 연속하여 존재한다. 정중구멍 또는 마장디공, 및 루시카의 좌측 및 우측 가쪽구멍(공)의 3개의 공이 거미막밑 공간에 넷째뇌실을 연결시킨다.
뇌에서의
CSF
유동
도 7은 뇌실로부터 거미막밑 공간으로의 CSF 유동의 예시적 개념을 제시한다. 뇌척수액(CSF)은 뇌의 뇌실 시스템, 거미막밑 공간, 및 척수의 중심관을 점유하는 투명한 체액이다. CSF는 뇌실 시스템 전체에 걸쳐 발견되는 맥락얼기의 변형된 뇌실막세포에 의해 생성된다. 또한, 이는 추측상 뇌의 세포외 공간으로부터 뇌실벽 및 혈관 주위에서 또한 형성된다. CSF는 뇌실간공을 통해 가쪽뇌실로부터 셋째뇌실로 유동한다. 이후, CSF는 대뇌수도관을 통해 넷째뇌실로 유동한다. CSF는 정중 구멍 및 좌측 및 우측 가쪽구멍을 통해 거미막밑 공간에서 외부로 유동한다. 최종적으로, CSF는 거미막과립 및 거미막 융모를 통해 경막정맥동으로 재흡수된다. 거미막과립은 융모의 집합물로 구성된다. 융모는 경질막을 통해 상시상정맥동의 루멘 및 다른 정맥 구조로 향하는 거미막의 가시적 탈출이다. 과립(granulation)은 거미막밑 공간으로부터 정맥혈로의 CSF의 단방향 유동을 가능케 하는 밸브로 작용하는 것으로 보인다. 소분자, 단백질, 미생물, 및 적혈구 세포를 포함하는 CSF의 모든 성분은 유체와 함께 떠난다.
CSF는 약 0.3-0.37 ml/분 또는 20 ml/시간 또는 500 ml/일의 속도로 생성된다. CSF 공간의 부피는 약 150 ml이며, CSF는 하루에 3.7회 턴 오버(turn over)된다.
맥락얼기는 CSF의 화학적 안정성을 유지시키기 위해 모세관 여과 및 상피 분비 메커니즘을 이용한다. 맥락얼기를 가로지르는 모세관은 혈장 용질에 대해 자유롭게 투과성인 한편, 맥락얼기를 구성하는 상피 세포의 수준에서 장벽이 존재하며 이는 담체-매개 능동 수송을 담당한다. CSF 및 뇌의 세포외 유체는 항정 상태로 존재하며, 혈장 및 CSF는 정상 생리학적 조건하에서 삼투 평형 상태로 존재한다.
혈액뇌장벽
혈액뇌장벽은 뇌로의 혈액-매개 물질의 진입을 방지하고, 뉴런이 효과적으로 작동하기 위한 안정적 환경을 유지시킨다. 이는 뇌 미세혈관 내피 세포, 혈액뇌장벽의 주요 해부학적 부위, 이들의 세포간연접, 및 소포이동의 상대적 결핍의 특화된 특성으로부터 발생하며, 이는 상기 세포가 일반적 모세혈관의 세포와 상이하게 만든다. 혈액뇌장벽 혈관의 내피 세포는 또한 천공되어 있지 않으며, 대신 이들은 혈관벽을 가로지르는 확산을 차단하는 빈틈없는 접합부의 복잡한 배열에 의해 서로 연결되어 있다.
거미막밑
출혈
뇌는 연질막, 거미막, 및 경질막의 막 또는 수막의 3개의 층에 의해 싸여져 있다. 거미막밑 공간은 뇌 주위의 거미막과 연질막 사이의 영역이다. 용어 "거미막밑 출혈"("SAH"로도 언급됨)은 거미막밑 공간으로의 출혈을 나타낸다. SAH는 보통 뇌동맥류로부터 자연적으로 발생할 수 있거나, 외상으로부터 발생할 수 있다. 증상은 신속한 발생을 갖는 강한 두통(종종, "벼락 두통(thunderclap headache)"으로 언급됨), 구토, 및 변경된 의식 수준을 포함한다. 진단은 일반적으로 컴퓨터단층촬영술(CT 스캐닝), 또는 종종 요추 천자에 의해 이루어진다. 치료는 면밀한 관찰, 의약 및 초기 신경외과적 연구 및 재발 및 합병증을 예방하기 위한 치료에 의해 이루어진다.
SAH는 의학적 응급상황이며, 사망 또는 초기 단계에 인지되고 치료되는 경우에도 중증 장애를 발생시킬 수 있다. 모든 SAH 환자의 절반은 치명적이며, 환자의 10-15%는 병원에 도착하기 전에 사망한다. SAH는 뇌졸중의 형태로 간주되며, 모든 뇌졸중의 1% 내지 7%를 야기시킨다. 두개내 동맥류의 파열에 의해 야기되는 경우, 출혈은 거미막밑 공간, 덜 흔하게는 뇌실내 및 뇌내 공간에서 관찰된다. SAH로 인한 출혈은 뇌 손상, 뇌 이동, 감소된 뇌관류 및 수두증을 발생시킬 수 있다. 미국에서 파열된 두개내 동맥류로부터의 SAH의 발생률은 10,000명 당 1명이며, 이는 매년 약 27,000-30,000명의 새로운 환자를 발생시키는 것으로 판단된다. 상기 파열된 동맥류는 45%의 30일 사망률을 갖는다. 또한, 생존자의 30%는 중간 내지 중증 장애를 가질 것으로 예측된다.
일부 연구는 SAH의 발생률이 매년 100,000명 당 평균 9.1명인 것을 나타낸다. 일본 및 핀란드로부터의 연구는 이들 국가에서 더 높은 비율(각각 100,000명 당 22.7명 및 100,000명 당 19.7명)을 나타내며, 그 이유에 대해서는 완전히 이해되어 있지 않다. 대조적으로, 남아메리카 및 중앙 아메리카는 평균적으로 100,000명 당 4.2명의 비율을 갖는다. SAH에 대한 위험이 있는 사람의 그룹은 보통 뇌졸중에 걸리는 집단보다는 어리나, 위험은 연령에 따라 더 증가한다. 어린 사람은 중년의 사람(위험비 0.1, 또는 10%)보다 SAH를 경험할 가능성이 훨씬 적다. 위험은 연령에 따라 지속적으로 증가하고, 45세 내지 55세의 사람보다 매우 노년(85세 이상)에서 60% 더 높다. SAH의 위험은 55세를 초과하는 여성에서 약 25% 더 높으며, 이는 폐경으로부터 발생하는 호르몬 변화를 잠재적으로 반영한다.
SAH에서 생존한 환자는 또한 이차 합병증의 위험이 있다. 이러한 합병증 중에서 가장 특별히는 동맥류 재출혈, 혈관조영술 뇌혈관연축 및 지연 대뇌 허혈(DCI)이 있다.
DCI는 국소적 신경계 장애(예를 들어, 반신불완전마비, 언어상실증, 행위상실증, 반맹, 또는 무시)의 발생, 또는 글래스고 혼수 척도(Glasgow coma scale)에서의 감소(전체 스코어 또는 이의 개별적 구성요소[안구, 어느 한 측면에서의 운동, 언어] 중 하나에서의 감소)이다. 이는 적어도 1시간 동안 지속되거나 지속되지 않을 수 있고, 동맥류 폐색 직후에 명백하지 않으며, 뇌의 임상적 평가, CT 또는 자기 공명 영상(MRI) 스캐닝, 및 적절한 실험실 연구에 의해 다른 원인에 기인될 수 없다. 뇌경색증은 DCI의 결과일 수 있으며, SAH 후 6주 이내에 뇌의 CT 또는 MRI 스캔 또는 6주 이내의 사망 전에 이루어지는 마지막 CT 또는 MRI에서의 뇌경색증의 존재로 정의되거나, 부검시에 증명되거나, 초기 동맥류 폐색 후 24 내지 48시간 후에 CT 또는 MRI 스캔 상에 존재하지 않고, 외과적 클리핑(surgical clipping) 또는 혈관내 치료와 같은 다른 원인에 기인될 수 없다. 뇌실 카테터 또는 실질내 혈종으로부터 발생하는 CT 영상에서의 저밀도는 일반적으로 DCI로부터의 뇌경색증으로 간주되지 않는다. 혈관조영술 뇌혈관연축은 방사선 시험(CT 혈관조영술[CTA], MR 혈관조영술[MRA] MRA 또는 카테터 혈관조영술[CA])의 서술이며, DCI의 원인일 수 있다. 용어 "혈관조영술 뇌혈관연축"은 거미막밑 공간으로의 출혈에 따른 뇌의 기저에서의 큰 용량의 동맥(즉, 대뇌동맥)의 협소화를 나타내며, 이는 원위 뇌 영역의 감소된 관류를 발생시킨다. 혈관조영술 혈관연축은 SAH의 결과이나, 이는 또한 거미막밑 공간 내에 혈액을 침착시키는 임의의 질환 후에 발생할 수 있다.
증상
SAH의 통상적 증상은 번개 두통(수초 내지 수분에 걸쳐 발생하는 "이제까지 최악" 또는 "머리 속에서 걷어차는" 것으로 기재되는 두통)이나, 이는 모든 SAH 환자의 약 1/3 만에서만 증상이 존재한다. 상기 증상을 갖는, 의료 방법을 찾는 환자의 약 10%는 내재성 SAH를 갖는다. 환자는 또한 구토가 존재할 수 있으며, 14명 중 1명은 발작을 갖는다. 경부 경직 및 착란, 감소된 의식 수준, 또는 혼수일 수 있는 수막증의 다른 징후가 존재할 수 있다. 뇌 주위의 상승된 압력에 반응하여 안구내 출혈이 발생할 수 있다. 유리체밑(유리체막이 안구의 유리체를 둘러쌈) 및 유리체 출혈이 안저검사(fundoscopy)에서 관찰될 수 있다. 이는 터슨 증후군(Terson syndrome)(환자의 3-13%에서 발생함)으로 공지되어 있고, 더욱 중증의 SAH에서 더욱 통상적이다. 번개 두통을 갖는 환자에서, 상기 언급된 징후 중 어느 것도 출혈을 확인하거나 배제시키는데 도움이 되지 않지만, 출혈이 다른 원인에 비하여 파열된 동맥류의 결과인 경우에 발작이 더욱 흔하다. 눈돌림 신경 비정상(아래쪽 및 바깥쪽으로의 병에 걸린 안구 운동, 동일면 상에서의 눈꺼풀을 들어올릴 수 없으나, 정상적인 동공 반사)은 후교통동맥 근처에서 발생하는 동맥류로부터의 출혈을 나타낼 수 있다. 동공의 독립된 확장은 또한 두개내압 상승의 결과로서 뇌 헤르니아를 반영할 수 있다.
신체는 출혈의 결과로서 많은 양의 아드레날린 및 유사한 호르몬을 방출하며, 이는 혈압에서의 급격한 증가를 발생시킨다. 심장은 많이 긴장하게 되고, 신경성 폐부종, 기절 심근, 심장부정맥, 심전도 변화(종종 큰 역 "대뇌" T 파(wave)를 가짐) 및 심장 정지(3%)가 출혈의 발생 후에 신속히 발생할 수 있다.
SAH는 또한 두부 손상을 입은 사람에서 발생할 수 있다. 증상은 두통, 감소된 의식 수준 또는 반신불완전마비를 포함할 수 있다. SAH는 특히 더 낮은 글래스고 혼수 척도 수준과 관련되는 경우에 두부 손상의 중증 합병증으로 간주된다.
진단
SAH가 의심되는 사람을 평가하기 위한 최초 단계는 의학적 개인력을 획득하고 신체 검사를 수행하는 단계이다. 번개 두통을 갖는 병원에 입원된 환자의 단지 10-25%가 SAH를 가지므로, 수막염, 편두통, 및 대뇌 정맥동 혈전증과 같은 다른 가능한 원인이 보통 동시에 고려된다. SAH보다 2배 더 흔한 뇌내출혈이 종종 SAH로 오진된다.
SAH의 진단은 임상적 근거 단독으로 이루어질 수 없다. 일반적으로, 출혈을 확인하거나 배제시키기 위해 뇌의 의학적 영상화[보통 높은 민감도(특히 출혈의 발생 후 첫번째 날에서 95%를 초과하는 정확한 확인)를 갖는 컴퓨터단층촬영술(CT 스캔)]가 요구된다. CT 스캔과 비교하는 경우 수일 후에 자기공명영상(MRI 스캔)이 더 민감할 수 있다. 일반적인 CT 또는 MRI 스캔을 받은 사람에서, 뇌척수액(CSF)이 바늘을 이용하여 요추 낭(lumbar sac)으로부터 분리되는 요추 천자는 CT에서 정상인 것으로 밝혀진 그룹의 3%에서 출혈의 증거를 나타내며, 따라서, 요추 천자는 영상화가 음성인 경우에 필수적인 것으로 간주된다. CSF 샘플은 원심분리된 유체의 황색 외형인 황색변색증에 대해 시험되거나, 분광광도법을 이용하여 CSF 내의 헤모글로빈의 분해 생성물인 빌리루빈에 대해 시험된다.
SAH가 확인된 후, 이의 원인이 결정될 필요가 있다. 동맥류를 확인하기 위한 CT 혈관조영술(CT 스캔에서 방사선조영제(radiocontrast)를 이용하여 혈관을 시각화시킴)이 일반적으로 첫번째 단계이나, 더욱 침습성의 카테터 혈관조영술(뇌 동맥으로 진행되는 카테터를 통해 방사선조영제를 주입함)이 최적 표준시험이나, 이는 합병증의 위험이 더 높다. 더욱 침습성의 카테터 혈관조영술은 동시에 동맥류와 같은 출혈의 근원을 제거하기 위한 계획이 있는 경우에 유용하다.
원인
가장 흔한 자연적 SAH는 대뇌 동맥류의 파열(85%)로 인한 것이다. 대뇌 동맥류는 확장되는 뇌의 동맥벽에서의 약함이다. 이들은 윌리스환 및 이의 가지들에 위치되는 경향이 있다. SAH의 가장 많은 환자는 작은 동맥류로부터의 출혈로 인한 것인 한편, 더 큰 동맥류(더 희귀함)는 파열될 가능성이 더 높다. 자연적 SAH의 환자의 15-20%에서 첫번째 혈관조영상으로부터 동맥류가 검출되지 않는다. 혈액이 중뇌의 영역으로 제한되는 비-동맥류성 중간뇌주위 출혈이 SAH 환자의 또 다른 10%를 야기시킨다. 이들 중에서, 동맥류는 일반적으로 발견되지 않는다. 환자의 나머지 5%는 동맥에 대한 혈관염 손상, 혈관에 영향을 미치는 다른 장애, 척수 혈관의 장애, 및 다양한 종양으로의 출혈로 인한 것이다. 가장 외상성인 SAH가 두개 골절 또는 뇌내 좌상 근처에서 발생한다.
분류
여러 등급화 척도가 SAH에 대해 이용가능하다. 이들 척도는 이들의 결과를 갖는 환자의 특징을 회고적으로 매치시킴으로써 유도된다. 도처에서 사용되는 글래스고 혼수 척도(GCS)에 더하여, 3개의 다른 특화된 스코어가 사용된다. 모든 스코어에서, 더 높은 수는 더 나쁜 결과와 관련된다. 중증도의 첫번째 척도는 문헌[Hunt and Hess in 1968]("헌트 및 헤스 척도(Hunt and Hess scale"))에 의해 기재되었으며, 이는 환자의 임상 상태를 분류한다. 피셔 등급(Fisher Grade)은 CT 스캔에서의 SAH의 외관을 분류한다. 피셔 척도는 클라센(Claassen) 및 그의 동료에 의해 변형("클라센 척도")되었으며, 이는 SAH 크기 및 수반하는 뇌실내 출혈로부터 추가 위험을 반영한다. 세계신경외과학회(World Federation of Neurological Surgeons) 분류는 증상의 중증도를 측정하기 위해 GSC 및 국소 신경계 결손을 이용한다. 포괄적인 분류 계획이 결과를 예측하고 요법을 평가하기 위해 오길비(Ogilvy) 및 카터(Carter)에 의해 제안되었다. 오길비 시스템은 5 등급을 가지며, 이는 50을 초과하는 연령; 헌트(Hunt) 및 헤스(Hess) 등급 4 또는 5; 피셔 척도 3 또는 4; 10 mm를 초과하는 동맥류 크기; 및 25 mm 이상의 후순환계 동맥류(posterior circulation aneurysms)의 5개의 요인 각각의 존재 또는 부재에 대해 1 포인트를 할당한다.
치료
SAH의 처리는 환자를 안정화시키는 일반적 수단, 출혈 근원을 제거함으로써 재출혈을 방지하는 특정 수단, 혈관연축의 예방, 및 합병증의 예방 및 치료로 구성된다.
일반적 수단
첫번째 우선사항은 환자를 안정화시키는 것이다. 억제된 의식 수준을 갖는 환자는 삽관되고 기계적으로 환기될 필요가 있을 수 있다. 혈압, 맥박, 호흡수 및 글래스고 혼수 척도가 빈번히 모니터된다. 진단이 확인된 후, 특히 상기 환자의 15%가 입원 후 1시간 이내에 추가 에피소드(재출혈)를 갖는 경우에 집중치료실에 대한 입원이 바람직할 수 있다. 영양공급이 초기의 우선사항이며, 경구 또는 코위영양관 영양공급이 비경구 경로에 비해 바람직하다. 진통(동통 조절)은 일반적으로 코데인과 같이 비-진정성 작용제로 제한되는데, 이는 진정이 정신 상태에 영향을 미쳐, 이에 따라 의식 수준을 모니터하는 능력을 방해할 수 있기 때문이다. 심정맥 혈전증은 압박 스타킹, 종아리의 간헐적 공기 압박, 또는 둘 모두로 예방된다.
재출혈의 예방
억제된 의식 수준 또는 국소적 신경학적 증상과 관련된 큰 혈종을 갖는 환자가 혈액의 긴급한 외과적 제거 및 출혈 동맥류의 폐색을 위한 후보일 수 있다. 카테터 또는 튜브가 수두증을 치료하기 위해 뇌실에 삽입될 수 있다. 나머지는 더 광범위하게 안정화되고, 경대퇴동맥 카테터 혈관조영상 또는 CT 혈관조영상을 이후에 겪는다. 처음 24시간 후, 재출혈 위험이 이후 4주에 걸쳐 약 40%가 남아있으며, 이는 상기 위험을 감소시키는데 있어서 중재적시술이 계획되어야 함을 암시한다.
재출혈은 예측하기가 어렵고, 임의의 기간에 발생할 수 있으며, 불량한 예후를 갖는다. 따라서, 재출혈을 방지하기 위한 중재적시술, 주로 파열된 동맥류의 클리핑(clipping) 또는 코일링(coiling)이 가능한 초기에 수행된다. 혈관조영술에서 뇌동맥류가 확인되는 경우, 동일한 동맥류로부터 추가의 출혈 위험을 감소시키기 위해 신경외과적 클리핑 및 혈관내 코일링의 2개의 수단이 이용가능하다. 클리핑은 동맥류의 위치를 정한 후, 동맥류의 목 부분 전체에 걸친 클립 또는 클립들의 배치를 위해 개두술(두개골의 개방)을 필요로 한다. 코일링은 큰 혈관을 통해 수행되며, 카테터가 서혜부 내의 대퇴동맥으로 삽입되고, 대동맥을 통해 뇌에 공급하는 동맥(둘 모두의 경동맥 및 둘 모두의 척추동맥)으로 전진된다. 동맥류의 위치가 정해지는 경우, 동맥류 내의 혈병의 형성 및 제거를 발생시키는 금속 코일이 전개된다. 치료가 수행되는 것에 관한 결정은 통상적으로 신경외과 의사 및 신경방사선학자를 포함하는 각 전문 분야 협력팀에 의해 이루어진다.
중대뇌동맥 및 이의 관련 혈관의 동맥류는 혈관조영술로 도달하기는 어렵고, 클리핑에 적용되기 쉬운 경향이 있는 한편, 뇌기저동맥 및 후대뇌동맥의 동맥류는 외과적으로 도달하기는 어렵고, 혈관내 치료기술에 대해 더욱 접근가능한 경향이 있다. 코일링의 주요 결점은 동맥류가 재발할 수 있는 가능성이며, 이러한 위험은 외과적 방법에서는 극도로 적다. 코일링을 겪은 환자는 통상적으로 동맥류의 재발이 초기에 확인되는 것을 보장하기 위해 혈관조영술 또는 다른 수단으로 수년 동안 추적조사된다.
예후
초기 이환율 및 사망률
SAH에 대한 사망률은 40% 내지 50%이다. 최초 입원, 치료 및 합병증에서 생존한 환자 중, 적어도 25%는 이들의 생활양식에서 유의한 제한을 가지며, 20% 미만은 어떤 경우에도 잔여 증상을 갖지 않는다. 혼수를 갖지 않는 작은 SAH의 진단에서의 지연(또는 편두통에 대한 갑작스러운 두통의 오해)이 불량한 결과에 기여한다. 불량한 결과에 대한 위험 요인은 보다 높은 연령, 불량한 신경학적 등급, 최초 CT 스캔에서의 보다 많은 출혈 및 보다 큰 동맥류, 후순환에서의 동맥류의 위치, 수축기 고혈압, 및 심부전, 고혈압, 간 질병 또는 이전의 SAH의 이전의 진단을 포함한다. 병원 체류 동안, 혈관연축으로부터 발생하는 지연성 허혈의 발생, 뇌내 혈종 또는 뇌실내 출혈(뇌의 뇌실로의 출혈)의 발달, 및 입원 8일째의 열의 존재가 또한 예후를 악화시킨다.
완전한 카테터 혈관조영술에 의해 동맥류를 나타내지 않는 SAH는 "혈관조영상-음성 SAH"로 언급될 수 있다. 이는 동맥류로부터의 SAH보다 나은 예후를 갖지만, 이는 여전히 허혈, 재출혈 및 수두증의 위험과 관련이 있다. 그러나, 중간뇌주변 SAH(뇌의 중뇌 부분 주위의 출혈)는 매우 낮은 비율의 재출혈 또는 지연성 허혈을 가지며, 이러한 서브타입의 예후는 우수하다.
장기간 결과
신경인지 증상, 예를 들어, 피로, 기분 장애, 및 다른 관련 증상이 SAH를 갖는 사람에서 흔하다. 양호한 신경학적 회복이 이루어진 환자에서도, 불안, 우울증, 외상후 스트레스 장애 및 인지 장애가 흔하다. 60% 초과가 빈번한 두통을 보고하였다. 동맥류 SAH는 호르몬 조절 및 생성에서 중추적인 역할을 하는 뇌의 두 영역인 시상하부 및 뇌하수체의 손상을 야기시킬 수 있다. 연구는 이전에 SAH를 가진 사람의 적어도 25%가 시상하부-뇌하수체 호르몬, 예를 들어, 성장 호르몬, 프로락틴 또는 갑상선-자극 호르몬 중 하나 이상의 결핍이 발달할 수 있는 것을 나타낸다.
혈관연축
혈관조영술 뇌혈관연축은 SAH 후의 국소 허혈의 가장 흔한 원인이다. 이는 SAH를 갖는 환자에서 결과에 불리한 영향을 미치는데, 이는 SAH-관련 장애 및 사망의 23% 이하를 담당하기 때문이다. 허혈성 뇌졸중의 모든 유형 중, 혈관연축은 다소 예측가능하고, 예방가능하고, 치료가능한 점에서 독특하다(Macdonald, R.L. and Weir, B. In Cerebral Vasospasm. Academic Press, Burlington, MA, USA (2001) 참조).
혈관연축은 감소된 대뇌 혈류 및 증가된 대뇌 혈관 저항을 발생시킨다. 이론으로 제한하는 것은 아니지만, 일반적으로 혈관연축은 죽상경화증, 및 외상성 두부 손상, 동맥류성 거미막밑 출혈 및 거미막밑 출혈의 다른 원인을 포함하는 다른 구조적 손상으로부터 발생하는 것과 같은 혈관에 대한 국소적 손상에 의해 야기되는 것으로 생각된다. 뇌혈관연축은 동맥류 파열 후 또는 외상성 두부 손상 후의 흔한 발생인 CSF 내의 혈액의 존재에 의해 또한 촉발될 수 있는 자연 발생 혈관수축이다. 뇌혈관연축은 궁극적으로 중단된 혈액 공급으로 인해 대뇌 허혈 및 경색의 형태의 뇌세포 손상을 발생시킬 수 있다.
혈관조영술 혈관연축은 DCI에 기여하는 하나의 과정이다. DCI에 기여할 수 있는 다른 과정은 피질 확산 허혈(cortical spreading ischemia) 및 미세혈전색전증(microthromboemboli)이다(도 4). DCI는 적어도 상기 과정 뿐만 아니라 초기 뇌 손상으로 인한 다인성 과정이다. 피질 확산 허혈은 DCI를 야기시킬 수 있는 신규한 메커니즘으로서 SAH의 동물 모델에서 기재되었다. 이는 SAH 및 혈관조영술 혈관연축을 갖는 인간에서 검출되었다. DCI에 기여할 수 있는 또 다른 과정은 미세혈전색전증의 형성이다.
매년, 10,000명의 사람 중 약 1명이 동맥류 파열을 갖는다. 사망률 및 이환률은 출혈의 부피에 따라 증가하고, 이는 환자의 연령 및 건강 상태를 반영하며, 연령에 따라 동맥류가 발달할 가능성이 꾸준히 증가한다. 재출혈은 SAH의 부피에서의 증가 뿐만 아니라 뇌 및 뇌실로의 확대의 증가된 가능성으로 인해 특별히 불리하다. 동맥류 파열로부터 발생하는 대부분의 사망은 최초 출혈 또는 초기 재출혈의 영향으로 인해 병원 외부 또는 입원 직후에 발생한다. 혈관연축으로부터의 증상의 잠재적 표시는 처음 수일이 지난 후에 생존한 환자에서만 발생한다.
혈관연축의 발생률은 SAH의 발생률보다 적다(이는 SAH를 갖는 일부 환자만이 혈관연축이 발달하기 때문이다). 혈관연축의 발생률은 제공되는 병원에 수용되는 환자의 유형, 및 혈관연축이 진단되는 방법에 좌우될 것이다.
제한되지 않는 용어 "혈관연축"은 보통 상기 정의된 바와 같은 혈관조영술로 결정된 동맥 협소화에 대한 언급과 함께 사용된다. 임상적 혈관연축은 가장 흔하게는 지연 대뇌 허혈(DCI)과 유의어로 사용된다. 또 다른 방식으로 사용되는 경우, 예를 들어, 증가된 중대뇌동맥 경두개 도플러 속도를 기초로 한 혈관연축의 경우, 이는 상술되어야 한다.
SAH 후 4 내지 12일 후에 혈관조영술을 받는 환자의 적어도 2/3에서 다소의 혈관조영술 협소화가 발생할 것이다. 상기 DCI로부터 신경계 황폐가 발달하는 환자의 수는 환자가 모니터되는 근면성 및 예방의 효능에 따라 다양하나, 이는 약 1/3로 예측된다. 입원한 SAH 환자 중, 5 내지 10%가 혈관연축으로 인해 사망한다. 중간 등급의 SAH 후 환자와 비교하는 경우, 매우 양호한 상태의 SAH 후 환자는 혈관연축이 발달할 가능성이 덜한데, 이는 이들이 작은 부피의 SAH를 갖기 때문인 한편, 매우 불량한 조건의 SAH 후 환자는 최초 에피소드 전에 사망할 가능성이 더 높다. 출혈 에피소드에 근접하여 수행되는 컴퓨터단층촬영술(CT) 스캔에서 시각화될 수 있는 두껍고 만연된 거미막밑 혈병의 존재가 중요한 예후 인자이다. 최초 CT 스캔에서의 혈액의 부재는 재출혈의 부재하에서 혈관연축이 발생할 가능성이 매우 없는 것을 나타낸다. 혈관연축 및 결과로서 발생하는 DCI의 가능성은 혈병에 대한 노출의 기간을 감소시키는 요인에 의해 감소된다. 역으로, 혈관연축 및 DCI의 발생률은 혈병에 대한 동맥의 노출을 연장시키고, 가능하게는 다른 메커니즘에 의해 허혈을 야기시키는 항섬유소용해 약물의 사용에 의해 증가된다. 불량한 입원 임상 등급이 DCI와 관련되어 있으며, 이는 추정상 이들이 모두 SAH의 더 큰 부피를 나타내기 때문이다. 연령, 고혈압, 또는 성별과 DCI 사이의 명확한 상관관계는 확립되지 않았다. 흡연자는 더욱 혈관연축 및 DCI에 걸리기 쉬울 가능성이 있다. 혈관연축의 발달과 관련되지 않은 요인은 계절, 지형, 조영제, 및 당뇨병을 포함한다.
혈관연축이 발달하는 환자는 그렇지 않은 환자보다 악화된다. 수술 또는 동맥류 코일링이 초기(첫날 이내 정도)에 수행되는 경우, 결과는 치료가 지연되는 경우보다 더 나은 경향이 있다. 수술이 혈관연축에 대해 피크 기간 동안 우선적으로 수행되는 경우, 결과는 일반적으로 보다 나빴다. 혈관연축은 초기 수술 또는 코일링으로부터 발생하지 않으며, 초기 수술 또는 코일링은 혈관연축이 발달하는 경우 보다 강한 치료를 허용한다. 두꺼운 혈병이 존재하는 경우, 조심스러운 제거의 시도가 이루어져야 한다. 수술 후의 잔여 혈병의 양은 DCI에 대한 예후 요인이다. 개방 수술은 환자를 견인기 압력, 정맥 희생, 일시적 클리핑 허혈, 뇌 이동, 및 동맥 손상에 노출시킨다. 연구는 수술 후에 대뇌 혈류, 산소의 국부적 대뇌 대사율, 및 산소 추출율에서의 감소를 나타내었다.
독립적 변수, 예를 들어, 입원 신경학적 등급, 연령 증가, 및 대량의 두개내 또는 뇌실내 출혈이 혈관연축이 아닌 결과와 보다 밀접하게 관련되어 있다. 혈관연축은 등급화된 과정이므로, 극단적인 환자만이 전신 저혈압, 심장 기능장애, 무산소증, 및 두개내 고혈압의 부재하에서 경색을 발생시킬 것으로 예상된다. 미리 존재하는 고혈압 및 노령이 또한 허혈에 대한 뇌의 취약성에 강하게 영향을 미친다. 혈관연축과 치명적 환자에서의 경색 사이의 병인학적 상관관계는 논란이 되지 않는다.
혈관연축이 외과적 또는 약리학적인 혈병 제거에 의해 감소될 수 있다는 증거가 있다. DCI가 고혈압 및 혈량과다증 뿐만 아니라 칼슘 길항제에 의해 감소될 수 있음을 암시하는 데이터가 또한 존재한다. 혈관연축은 또한 기계적으로 또는 약리학적 혈관성형술에 의해 일시적으로 파기될 수 있다.
혈관연축의
발생률
혈관조영술 혈관연축의 발생률은 SAH 후의 시간 간격에 좌우된다. 피크 발생률은 SAH 6-8일 후(범위, 3-12일)에 발생한다. SAH 후의 시간에 더하여, 혈관연축의 유병율에 영향을 미치는 다른 주요 요인은 거미막밑 출혈의 부피 및 분포이다.
혈관연축에
대한 예후 인자
혈관연축에 대한 예후 인자는 CT 스캔에서의 출혈; 고혈압; 해부학적 및 전신 인자; 임상 등급; 환자가 항섬유소용해제를 투여 받는지의 여부; 연령 및 성별; 흡연; 생리학적 파라미터; 및 수두증을 포함한다.
진단
혈관연축의 진단은 주로 임상 진단이다. 혈관연축은 무증상일 수 있으나, 대뇌 혈류가 허혈 역치 아래인 경우, 증상이 명백해진다. 증상은 통상적으로 아급성적으로 발달하며, 변동될 수 있다. 증상은 과도한 졸리움, 기면, 혼미, 반신불완전마비 또는 편마비, 의지상실증, 언어 장애, 시야 부족, 주시 장애, 및 뇌신경마비를 포함할 수 있다. 일부 증상은 국소화되나, 이들은 임의의 특정 병리 과정에서 진단되지 않고, 따라서, 대안적 진단, 예를 들어, 재출혈, 수두증, 및 발작이 방사선, 임상 및 실험실 평가를 이용하여 신속히 배제되어야 한다. 대뇌 혈관조영술은 대뇌동맥을 시각화시키고 연구하기 위한 최적 표준이며, 경두개 도플러 초음파촬영술이 또한 이용된다.
혈관연축의 병태생리학은 혈관 내피 및 평활근 세포 내에 구조적 변화 및 생화학적 변화를 수반할 수 있다. 거미막밑 공간 내의 혈액의 존재는 상기 변화를 개시시킬 수 있다. 또한, 혈량저하증 및 손상된 대뇌 자가조절 기능은 동시에 뇌관류를 방해할 수 있다. 상기 과정의 누적 효과는 뇌 혈류에서의 감소를 매우 심각하게 감소시켜, 경색을 초래하는 뇌 허혈을 야기시킬 수 있다. 또한, 일정 기간의 중증 수축은 대뇌동맥벽에서의 형태 변화를 초래할 수 있고, 이는 대뇌동맥벽을 혈관작용제의 지속된 존재 없이도 협소화된 채로 유지되게 만들 수 있다. 이후, 영향을 받은 동맥에 의해 공급되는 뇌의 영역은 허혈(혈액 공급에서의 제한을 의미함)을 경험할 것이다.
다른 합병증
수두증(뇌실의 확장 및 상승된 두개내압을 발생시키는 CSF의 과도한 누적을 특징으로 하는 질환)은 단기간 및 장기간 모두에서 SAH를 악화시킬 수 있고, CT 스캐닝에서 검출될 수 있다. 의식 수준이 감소되는 경우, 과도한 유체의 외과적 배수(예를 들어, 뇌실 배수 또는 션트(shunt)를 이용함)가 종종 필요하다.
혈압에서의 변동 및 전해질 장애, 뿐만 아니라 폐렴 및 심대상부전이 SAH를 갖는 입원 환자의 약 50%에서 발생하며, 예후를 악화시킬 수 있다. 이들은 징후적으로 관리된다.
발작은 모든 환자의 약 1/3에서 발생한다.
치료
경구 칼슘 채널 차단제인 니모디핀(nimodipine)은 임상 시험에서 불량한 결과의 가능성을 감소시키는 것으로 밝혀졌으나, 이는 혈관조영술에서 검출되는 혈관연축의 양을 유의하게 감소시키지 않을 수 있다. 다른 칼슘 채널 차단제 및 마그네슘 설페이트가 연구되었으나, 현재 권장되지 않는다. 니모디핀이 정맥내로 제공되는 경우에 이점을 나타내는 증거는 없다. 외상성 SAH에서, 경구 니모디핀의 효능은 의문인 채로 남아있다.
이전에 "삼중 H" 요법으로 언급된 혈류역학 처치가 종종 혈관연축을 치료하기 위한 수단으로 사용된다. 이는 고혈압(높은 혈압), 혈량과다증(순환에서의 과다한 유체) 및 혈액희석(혈액의 가벼운 희석)의 상태를 달성하기 위해 정맥내 유체의 사용을 수반한다. 유도된 고혈압은 상기 치료의 가장 중요한 구성요소인 것으로 여겨지나, 상기 방법의 이용에 대한 증거는 결론이 나지 않았으며, 이의 이점을 입증하기 위해 충분히 큰 무작위 대조 시험이 수행된 적이 없다.
대증 혈관연축이 의학적 치료에 반하는 경우, 혈관연축의 부위를 확인하고, 혈관확장제 약물(혈관벽을 이완시키는 약물)을 동맥에 직접 투여(약리학적 혈관성형술)하기 위해 혈관조영술이 시도될 수 있고, 기계적 혈관성형술(풍선을 이용하여 수축된 영역을 개방시킴)이 수행될 수 있다.
전압-작동 이온 채널
전압-작동 이온 채널은 막 전압에서의 변화에 반응하여 개방시키거나 폐쇄시킴으로써 세포막을 가로지르는 선택된 무기 이온의 통과를 가능케 하는 통합 막 단백질의 한 부류이다(Sands, Z. et al., "Voltage-gated ion channels," Current Biology, 15(2): R44-R47 (2005)). 이들 유형의 이온 채널은 특히 뉴런에서 중요하나, 많은 유형의 세포에서 흔한 것이다. 이들은 전압 변화를 촉발시키는 것에 반응하여 신속하고 조화된 탈분극을 가능케 하므로 흥분성 신경 및 근육 조직에서 중요한 역할을 한다. 축삭을 따라 시냅스에 위치되는 경우, 전압-작동 이온 채널은 전기 신호를 지향적으로 전파한다.
구조
전압-작동 포타슘, 소듐 및 칼슘 이온 채널은 유사한 전체 구조를 갖는 것으로 생각된다(Sands, Z. et al., "Voltage-gated ion channels," Current Biology, 15(2): R44-R47 (2005)). 전압-작동 이온 채널은 일반적으로 이온이 이의 전기화학 구배에서 아래로 이동할 수 있는 중심 포어가 존재하도록 배열된 여러 서브유닛으로 구성된다. 상기 채널은 매우 이온-특이적인 경향이 있으나, 유사한 크기 및 하전 이온이 또한 이들을 통해 다소 이동할 수 있다.
메커니즘
포타슘 채널의 결정 구조 연구(상기 구조는 해당 형질막에서 온전하게 유지되는 것으로 추정됨)는 전위차가 막 상에 도입되는 경우, 관련된 전자기장이 포타슘 채널에서 입체형태적 변화를 유도하는 것을 암시한다. 상기 입체형태적 변화는 채널, 또는 공동, 구멍이 충분히 이온 유입 또는 유출이 막을 가로질러 발생하는 것을 허용하고, 막의 전기화학 구배를 낮추게 하도록 채널 단백질의 형태를 왜곡시킨다. 이는 이후에 세포막을 탈분극화시키기에 충분한 전류를 발생시킨다.
전압-작동 소듐 채널 및 칼슘 채널은 4개의 상동성 도메인을 갖는 하나의 폴리펩티드로 구성된다. 각각의 도메인은 6개의 막 스패닝 알파 헬릭스를 함유한다. 전압 감지 헬릭스인 S4는 세포 외부의 높은 양성 전하가 헬릭스를 반발시키도록 만드는 다수의 양성 전하를 가지며, 이온이 채널을 통해 유동할 수 있도록 하는 입체형태적 변화를 유도한다. 포타슘 채널은, 이들이 하나의 도메인을 각각 포함하는 4개의 독립된 폴리펩티드 사슬로 구성되는 것을 제외하고는 유사한 방식으로 작용한다. 상기 채널들의 전압-민감성 단백질 도메인("전압 센서")은 일반적으로 이의 외형으로 인해 "패들(paddle)"로 공지된, 보존된 서열인 것으로 보이는 S3b 및 S4 헬릭스로 구성되는 영역을 함유한다.
전압-의존성 칼슘 채널
전압-의존성 칼슘 채널(VDCC)은 막 전위 변화에 반응하여 세포로의 칼슘 진입을 조절하는 전압-작동 이온 채널의 한 그룹이다(Van Petegem F. et al., Biochemical Society Transactions, 34(5): 887-893 (2006)). 전압-의존성 칼슘 채널은 흥분성 세포(예를 들어, 근육, 신경아교세포, 뉴런 등)에서 발견된다. 생리학적 또는 휴지 막 전위에서, VDCC는 보통 닫혀있다. 이들은 탈분극화된 막 전위에서 활성화(즉, 개방)된다. 특정 VDCC의 활성화는 세포 유형에 따라 세포로의 Ca2+ 진입; 근육 수축, 뉴런의 흥분, 유전자 발현의 상향조절, 또는 호르몬의 방출 또는 신경전달물질 결과를 가능케 한다(Catterall W. A. et al., "International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels," Pharmacol. Rev., 57(4): 411-25 (2005); Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)).
전압-의존성 칼슘 채널은 α1, α2δ, β1-4, 및 γ의 여러 다양한 서브유닛의 복합체로 형성된다. 알파 서브유닛은 이온 전도 포어를 형성하는 반면, 결합된 서브유닛은 게이팅(gating)의 조절을 포함하는 여러 기능을 갖는다(Dolphin A. C. "A short history of voltage-gated calcium channels," Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006)).
α
1
서브유닛
α1 서브유닛 포어(약 190 kDa 분자 질량)는 VDCC에서 작용하는 채널에 필요한 주요 서브유닛이며, 6개의 막횡단 α-헬릭스를 각각 함유하는 특징적인 4개의 상동성 I-IV 도메인으로 구성된다. 알파 서브유닛은 Ca2 + 선택적 포어를 형성하며, 이는 전압-감지 기구 및 약물/독소-결합 부위를 함유한다. 10개의 알파 서브유닛이 인간에서 확인되었다(Dolphin A. C. "A short history of voltage-gated calcium channels," Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006)).
α
2
δ 서브유닛
α2δ 유전자는 α2 및 δ의 2개의 서브유닛을 엔코딩한다. 이들은 이황화결합을 통해 서로 연결되며, 170 kDa의 결합 분자량을 갖는다. α2는 a1 서브유닛과 가장 많이 상호작용하는 세포외 당화 서브유닛이다. δ 서브유닛은 형질막에서 단백질을 고정시키는 작용을 하는 짧은 세포내 부분을 갖는 단일한 막횡단 영역을 갖는다. CACNA2D1(CACNA2D1), (CACNA2D2), (CACNA2D3), 및 (CACNA2D4)의 4개의 α2δ 유전자가 존재한다. α2δ의 공동발현은 α1 서브유닛의 발현 수준을 향상시키고, 전류 진폭의 증가, 보다 신속한 활성화 및 비활성화 동역학 및 비활성화의 전압 의존성에서의 과다분극 전환을 야기시킨다. 상기 효과 중 일부는 베타 서브유닛의 부재하에서 관찰되는 반면, 다른 경우에, 베타의 공동 발현이 요구된다. α2δ-1 및 α2δ-2 서브유닛은 적어도 2개의 항경련 약물 가바펜틴(gabapentin) 및 프레가발린(pregabalin)에 대한 결합 부위이며, 상기 약물은 또한 만성 신경병변성 동통을 치료하는데 사용된다(Dolphin A. C. "A short history of voltage-gated calcium channels," Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006)).
β 서브유닛
세포내 β 서브유닛(55 kDa)은 구아닐레이트 키나제(GK) 도메인 및 SH3(src 상동성 3) 도메인을 함유하는 세포내 막-결합 구아닐레이트 키나제(MAGUK)-유사 단백질이다. β 서브유닛의 구아닐레이트 키나제 도메인은 알파 서브유닛 I-II 세포질 루프에 결합하고, HVGCC 활성을 조절한다. CACNB1, CACNB2, CACNB3, 및 CACNB4의 β 서브유닛의 4개의 공지된 아이소형(isoform)이 존재한다(Dolphin A. C. "A short history of voltage-gated calcium channels," Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006)).
이론으로 제한하는 것은 아니지만, 세포질 β 서브유닛은 최종 알파 서브유닛 입체형태를 안정화시키고, 알파 서브유닛 내의 소포체 보유 신호를 차폐하는 능력에 의해 세포 막으로 최종 알파 서브유닛을 전달하는데 있어서 중요한 역할을 하는 것으로 가정된다. 내형질 보유 브레이크(brake)는 β 서브유닛이 결합하는 경우에 차폐되는 알파 서브유닛의 I-II 루프 내에 함유된다. 따라서, β 서브유닛은 먼저 세포막에서 발현되는 알파 서브유닛의 양을 조절함으로써 전류 밀도를 조절하는 작용을 한다.
상기 전위 트래피킹(potential trafficking) 역할에 더하여, β 서브유닛은 활성화 및 비활성화 동역학을 조절하고, 알파 서브유닛 포어의 활성화를 위한 전압-의존성을 과다분극화시키는 추가적인 중요한 기능을 가져, 보다 작은 탈분극화에 대해 더 많은 전류가 통과한다. β 서브유닛은 채널 전기생리학적 특성의 중요한 조정자로 작용한다. 도메인 I과 II(알파 상호작용 도메인, AIDBP) 사이의 α1 서브유닛 세포내 링커 상의 고도로 보존된 18-아미노산 영역과 β 서브유닛의 GK 도메인(알파 상호작용 도메인 결합 포켓) 상의 영역 사이의 상호작용은 β 서브유닛에 의해 발휘되는 조절 효과를 담당한다. 또한, β 서브유닛의 SH3 도메인은 또한 채널 기능에 추가된 조절 효과를 제공하며, 이는 β 서브유닛이 α1 서브유닛 포어와의 다수의 조절 상호작용을 가질 수 있는 것을 나타낸다. 알파 상호작용 도메인 서열은 소포체 보유 신호를 함유하는 것으로 보이지 않으며, 이는 I-II α1 서브유닛 링커의 다른 영역에 위치될 수 있다.
γ 서브유닛
γ1 서브유닛은 골격근 VGCC 복합체와 결합되는 것으로 공지되어 있으나, 이러한 증거는 다른 서브타입의 칼슘 채널과 관련하여 결론이 내려져 있지 않다. γ1 서브유닛 당단백질(33 kDa)은 4개의 막횡단 스패닝 헬릭스로 구성된다. γ1 서브유닛은 트래피킹에 영향을 미치지 않으며, 대부분의 부분에 대해 채널 복합체를 조절하는데 요구되지 않는다. 그러나, γ2, γ3, γ4 및 γ8은 또한 CNS에서 신속한 시냅스 전달을 매개하는 글루타메이트에 대한 비-NMDA-타입 이온성 막횡단 수용체인 α-아미노-3-하이드록시-S-메틸-4-이속사졸프로피온산(AMPA) 글루타메이트 수용체와 결합된다. NMDA-타입 수용체는 NMDA (N-메틸-D-아스파테이트)가 특이적으로 결합하는 수용체이다. γ1 (CACNG1), γ2 (CACNG2), γ3 (CACNG3), γ4 (CACNG4), (CACNG5), (CACNG6), (CACNG7), 및 (CACNG8)의 감마 서브유닛에 대한 8개의 유전자가 존재한다(Chu P. J. et al., "Calcium channel gamma subunits provide insights into the evolution of this gene family," Gene, 280 (1-2): 37-48 (2002)).
전압 의존성 칼슘 채널은 구조 및 형태에 있어서 매우 다양하다. 칼슘 채널은 이들의 약리학적 및 전기생리학적 특성에 따라 L-, N-, P/Q, T- 및 R-타입으로 분류된다. 이들 채널 서브타입은 별개의 생리학적 기능을 갖는다. 분자 클로닝은 해명된 각각의 채널의 α1 서브유닛 서열을 갖는다. α1 서브유닛은 개별적 채널에서 활성을 유발시키는데 있어서 특정 역할을 갖는다. 그럼에도 불구하고, 상기 채널 서브타입에 대한 선택적 차단제가 각각의 활성과 관련된 특정 채널을 규명하는데 요구된다. 중성 N-타입 채널은 ω-코노톡신 GVIA에 의해 차단되고, R-타입 채널은 다른 차단제 및 독소에 대해 내성이고, SNX-482에 의해 차단되고, 이는 뇌에서의 과정들과 관련될 수 있으며, 밀접하게 관련된 P/Q-타입 채널은 코-아자톡신(co-agatoxin)에 의해 차단된다. 디하이드로피리딘-민감성 L-타입 채널은 골격근, 평활근, 및 심근의 흥분-수축 커플링 및 내분비 세포에서의 호르몬 분비를 담당하며, 이는 또한 페닐알킬아민 및 벤조티아제핀에 의해 길항된다.
전압-작동 칼슘 채널의 타입
L-타입 칼슘 채널
L-타입 전압-작동 칼슘 채널은 평활근 세포가 탈분극화되는 경우에 개방된다. 이러한 탈분극화는 세포의 스트레칭(stretching), G 단백질-결합 수용체(GPCR)에 결합하는 효능제, 또는 자율신경계 자극에 의해 발생될 수 있다. L-타입 칼슘 채널의 개방은 세포외 Ca2 +의 유입을 야기시키고, 이후 이는 칼모듈린에 결합한다. 활성화된 칼모듈린 분자는 미오신 경쇄 키나제(MLCK)를 활성화시키고, 이는 굵은 필라멘트 내의 미오신을 인산화시킨다. 인산화된 미오신은 액틴의 얇은 필라멘트와 교차결합을 형성할 수 있고, 평활근 섬유(즉, 세포)는 활주 필라멘트 메커니즘을 통해 수축한다(Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)).
L-타입 칼슘 채널은 또한 가로무늬 근육 세포, 예를 들어, 골격 및 심장 근육섬유의 t-세관에서 풍부화(enrich)된다. 평활근에서와 같이, L-타입 칼슘 채널은 이들 세포가 탈분극화되는 경우에 개방된다. 골격근에서, L-타입 칼슘 채널 및 칼슘-방출 채널(라이아노딘(ryanodine) 수용체, 또는 RYR)은 기계적으로 서로 게이팅되고, 칼슘-방출 채널은 근소포체(SR)에 위치되므로, L-타입 칼슘 채널의 개방은 RYR의 개방을 야기시킨다. 심장 근육에서, L-타입 칼슘 채널의 개방은 세포로의 칼슘의 유입을 허용한다. 칼슘은 SR 내의 칼슘 방출 채널(RYR)에 결합하여, 이들을 개방시킨다("칼슘-유도 칼슘 방출" 또는 "CICR"로 언급됨). Ca2 +는 SR로부터 방출되고, 기계적-게이팅 또는 CICR을 통해 RYR이 개방되는 방법에 상관 없이 액틴 필라멘트 상의 트로포닌 C에 결합할 수 있다. 이후, 근육은 활주 필라멘트 메커니즘을 통해 수축하여, 근섬유분절의 단축 및 근육 수축을 야기시킨다.
R-타입 전압 의존성 칼슘 채널
R-타입 전압 의존성 칼슘 채널(VDCC)은 칼슘 유동 조절과 관련된다. R-타입 VDCC는 SAH 후에 관찰되는 감소된 대뇌 혈류에서 중요한 역할을 한다. 이론으로 제한하는 것은 아니지만, 작은 직경의 대뇌동맥 내에 위치될 수 있는 R-타입 전압-의존성 Ca2 + 채널은 전체적 및 국소적 대뇌 혈류를 조절할 수 있는데, 이는 세포내 유리 칼슘 이온의 농도가 혈관 평활근의 수축 상태를 결정하기 때문이다. 문헌[Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)]을 참조하라.
R-타입 전압 의존성 칼슘 채널 억제제는 주요 약리학적 효과가 R-타입 전압-작동 칼슘 채널을 통한 세포로의 칼슘의 진입을 방지하거나 늦추는 것인 칼슘 진입 차단제 약물이다. 유전자 Cav2.3은 뉴런에서 발현되는 R-타입 전압-의존성 칼슘 채널의 주요 포어-형성 유닛을 엔코딩한다.
N-타입 칼슘 채널
N-타입("중성-타입"에 대해 'N') 칼슘 채널은 시냅스이전 종말에서 주로 발견되고, 신경전달물질 방출과 관련된다. 활동 전위에 의한 강한 탈분극화는 상기 채널을 개방시키고, Ca2 +의 유입을 허용하여, 소포 융합 및 저장된 신경전달물질의 방출을 개시시킨다. N-타입 채널은 ω-코노톡신에 의해 차단된다. 문헌[Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)]을 참조하라.
P/Q-타입 칼슘 채널
P-타입(소뇌 푸르킨예 세포에 대한 'P') 칼슘 채널은 시냅스이전 종말에서의 신경전달물질 방출, 및 많은 뉴런 타입에서의 뉴런 통합에서 N-타입 칼슘 채널과 유사한 역할을 한다. 이들은 또한 심장의 전기 전도 시스템의 푸르킨예 섬유에서 발견된다(Winds, R., et al., J. Physiol. (Lond.) 305: 171-95 (1980); Llinds, R. et al., Proc. Natl. Acad. Sci. U.S.A. 86 (5): 1689-93 (1989)). Q-타입 칼슘 채널 차단제는 소뇌 과립 세포에 존재하는 것으로 보인다. 이들은 높은 활성화 역치 및 비교적 낮은 동역학을 갖는다. 문헌[Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)]을 참조하라.
T-타입 칼슘 채널
T-타입(일시적에 대한 'T') 칼슘 채널 차단제는 저 전압 활성화된다. 이들은 가장 흔하게는 뉴런 및 박동조율기(pacemaker) 활성을 갖는 세포 및 골세포에서 발견된다. 미베프라딜(Mibefradil)은 VDCC의 다른 타입에 비해 T-타입에 대해 약간의 선택성을 나타낸다. 문헌[Yamakage M. et al, "Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review," Can. J. Anaesth., 49(2): 151-64 (2002)]을 참조하라.
칼슘 채널의 차단제 및 억제제
칼슘 채널 차단제는 신체의 많은 흥분성 세포, 예를 들어, 심장의 근육, 혈관의 평활근 또는 뉴런 세포에 대한 효과를 갖는 약물 및 자연 물질의 한 부류이다. 칼슘 채널 차단제의 주요 작용은 혈압을 감소시키는 것이다.
대부분의 칼슘 채널 차단제는 심근의 수축력을 감소시킨다. 이는 칼슘 채널 차단제의 "음성 수축력 효과"로 공지되어 있다. 대부분의 칼슘 채널 차단제는 이들의 음성 수축력 효과로 인해 심근병증을 갖는 개체에서 바람직한 치료 선택이 아니다.
많은 칼슘 채널 차단제는 심장의 활동 전위의 편평기(plateau phase) 동안에 칼슘 채널을 차단함으로써 심장 내에서의 전기 활성의 전도를 늦춘다. 이러한 "음성 전도영향성(negative dromotropic) 효과"는 심장박동수를 낮추고, 심장 차단(칼슘 채널 차단제의 "음성 심장박동수변동 효과"로 공지됨)을 야기시킬 수 있다. 칼슘 채널 차단제의 음성 심장박동수변동 효과는 이들을 심방 세동 또는 조동을 갖는 개체에서 심장박동수의 조절을 위한 통상적으로 사용되는 부류의 작용제로 만든다.
칼슘 채널 차단제는 심장 및 혈관의 근육 세포 내의 전압-작동 칼슘 채널(VGCC)에서 작용한다. 칼슘 채널을 차단함으로써, 이들은 자극되는 경우 세포에서의 칼슘 수준의 큰 증가를 방지하고, 이는 이후에 보다 덜한 근육 수축을 발생시킨다. 심장에서, 각각의 박동에 대해 이용가능한 칼슘의 감소는 심장 수축성의 감소를 발생시킨다. 혈관에서, 칼슘의 감소는 혈관 평활근의 보다 덜한 수축을 발생시키고, 이에 따라 혈관 직경을 증가시킨다. 발생된 혈관확장은 전체 말초 저항을 감소시키는 한편, 심장 수축성의 감소는 심장박출량을 감소시킨다. 혈압은 부분적으로 심장박출량 및 말초 저항에 의해 결정되므로, 혈압이 떨어진다.
칼슘 채널 차단제는 교감신경계로부터의 자극에 대한 심장의 반응성을 감소시키지 않는다. 혈압 조절은 교감신경계에 의해 수행(압수용체 반사를 통함)되므로, 칼슘 채널 차단제는 β-차단제보다 혈압이 더욱 효과적으로 유지되도록 한다. 그러나, 칼슘 채널 차단제는 혈압을 감소시키므로, 압수용체 반사는 종종 교감신경 활성에서의 반사성 증가를 개시시켜, 증가된 심장박동수 및 수축성을 초래한다. 혈압의 감소는 또한 혈관 평활근에서의 VDCC의 길항작용의 직접적인 효과를 반영하여 혈관확장을 초래할 가능성이 있다. β-차단제는 상기 효과들을 최소화시키기 위해 칼슘 채널 차단제와 조합될 수 있다.
L, N, 및 P/Q-타입의 칼슘 채널에 대한 차단제가 채널 서브타입을 구별하는데 이용된다. R-타입 칼슘 채널 서브타입에 대해, ω-아가톡신 IIIA는 이의 선택성이 다소 낮음에도 불구하고 차단 활성을 나타낸다. 이러한 펩티드는 L, N, 및 P/Q 서브타입을 포함하는 모든 높은 전압-활성화 채널에 결합한다(J. Biol. Chem., 275, 21309 (2000)). 타란튤라 히스테로크라테스 기가스(Hysterocrates gigas)로부터의 독소인 추정 R-타입(또는 클래스 α1E) 선택성 차단제 SNX-482는 3개의 이황화결합(1-4, 2-5 및 3-6 배열)을 갖는 41개의 아미노산 잔기 펩티드이다(Biochemistry, 37, 15353 (1998), Peptides 1998, 748 (1999)). 이러한 펩티드는 클래스 E 칼슘 채널(IC50=15 nM 내지 30 nM) 및 40 nM 농도에서 신경뇌하수체 신경 종말에서의 R-타입 칼슘 전류를 차단한다. R-타입(클래스 E) 칼슘 채널 차단 활성은 매우 선택적이며, K+ 및 Na+ 전류, 및 L, P/Q 및 T-타입 칼슘 전류에 대한 효과는 관찰되지 않는다. N-타입 칼슘 전류는 300 nM 내지 500 nM에서 단지 약하게 30-50% 차단된다. SNX-482에 대한 R-타입 전류의 지역적으로 상이한 민감도가 관찰되며, 신경 세포 본체, 망막 신경절 세포 및 해마 피라미드 세포의 제조물에서 R-타입 전류에 대한 유의한 효과가 발생하지 않는다. SNX-482를 이용하여, 별개의 약리학적 특성을 갖는 3개의 알파 E-칼슘 서브유닛이 소뇌 R-타입 칼슘 채널에서 인지된다(J. Neurosci., 20, 171 (2000)). 유사하게, 옥시토신의 분비가 신경뇌하수체 종말에서 R-타입 칼슘 전류에 의해 조절되는 것으로 밝혀졌으나, 바소프레신은 그렇지 않았다(J. Neurosci., 19, 9235 (1999)).
디하이드로피리딘 칼슘 채널 차단제는 종종 전신 혈관 저항 및 동맥압을 감소시키는데 사용되나, 협심증을 치료하는데는 사용되지 않는데(만성의 안정적 협심증 뿐만 아니라 혈관연축 협심증을 치료하기 위한 표시를 갖는 암로디핀은 제외), 이는 혈관확장 및 저혈압이 반사성 빈맥을 발생시킬 수 있기 때문이다. 이러한 칼슘 채널 차단제 부류는 접미사 "-디핀"에 의해 용이하게 확인된다.
페닐알킬아민 칼슘 채널 차단제는 심근에 대해 비교적 선택성이다. 이들은 심근 산소 요구량을 감소시키고, 관상 혈관연축을 역전시킨다. 이들은 디하이드로피리딘에 비해 최소의 혈관확장 효과를 갖는다. 이들의 작용은 세포내 작용이다.
벤조티아제핀 칼슘 채널 차단제는 혈관 칼슘 채널에 대한 이들의 선택성에 있어서 페닐알킬아민과 디하이드로피리딘 사이의 중간 부류이다. 벤조티아제핀은 이들의 심장 억제제 및 혈관확장제 작용으로 인해 디하이드로피리딘에 의해 야기되는 동일한 정도의 반사 심장 자극을 생성시키지 않고 동맥압을 감소시킬 수 있다.
L-타입 VDCC 억제제는 주요 약리학적 효과가 L-타입 전압-작동 칼슘 채널을 통한 세포로의 칼슘의 진입을 방지하거나 늦추는 것인 칼슘 진입 차단 약물이다. L-타입 칼슘 채널 억제제의 예는 디하이드로피리딘 L-타입 차단제, 예를 들어, 니솔디핀(nisoldipine), 니카르디핀(nicardipine) 및 니페디핀(nifedipine), AHF(예를 들어, 4aR,9aS)-(+)-4a-아미노-1,2,3,4,4a,9a-헥사하이드로-4a14-플루오렌, HCl), 이스라디핀(isradipine)(예를 들어, 4-(4-벤조푸라자닐)-1,-4-디하이드로-2,6-디메틸-3,5-피리딘디카르복실산 메틸 1-메틸에틸 에스테르), 칼시셉틴(calciseptine)(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스(Dendroaspis polylepis ploylepis)로부터의 분리물), H-Arg-Ile-Cys-Tyr-Ile-His-Lys-Ala-Ser-Leu-Pro-Arg-Ala-Thr-Lys-Thr-Cys-Val-Glu-Asn-Thr-Cys-Tyr-Lys-Met-Phe-Ile-Arg-Thr-Gln-Arg-Glu-Tyr-Ile-Ser-Glu-Arg-Gly-Cys-Gly-Cys-Pro-Thr-Ala-Met-Trp-Pro-Tyr-Gln-Thr-Glu-Cys-Cys-Lys-Gly-Asp-Arg-Cys-Asn-Lys-OH, 칼시클루딘(Calcicludine)(예를 들어, 덴드로아스피스 앙구스티셉스(Dendroaspis angusticeps)(이스턴 그린 맘바(eastern green mamba))로부터의 분리물), (H-Trp-Gln-Pro-Pro-Trp-Tyr-Cys-Lys-Glu-Pro-Val-Arg-Ile-Gly-Ser-Cys-Lys-Lys-Gln-Phe-Ser-Ser-Phe-Tyr-Phe-Lys-Trp-Thr-Ala-Lys-Lys-Cys-Leu-Pro-Phe-Leu-Phe-Ser-Gly-Cys-Gly-Gly-Asn-Ala-Asn-Arg-Phe-Gln-Thr-Ile-Gly-Glu-Cys-Arg-Lys-Lys-Cys-Leu-Gly-Lys-OH, 실니디핀(Cilnidipine)(예를 들어, 또한 FRP-8653, 디하이드로피리딘-타입 억제제), 딜란티젬(Dilantizem)(예를 들어, (2S,3S)-(+)-시스-3-아세톡시-5-(2-디메틸아미노에틸)-2,3-디하이드로-2-(4-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 하이드로클로라이드), 딜티아젬(diltiazem)(예를 들어, 벤조티아제핀-4(5H)-온, 3-(아세틸옥시)-5-[2-(디메틸아미노)에틸]-2,3-디하이드로-2-(4-메톡시페닐)--, (+)-시스-, 모노하이드로클로라이드), 펠로디핀(Felodipine)(예를 들어, 4-(2,3-디클로로페닐)-1,4-디하이드로-2,6-디메틸-3,5-피리딘카르복실산 에틸 메틸 에스테르), FS-2(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스 베놈(Dendroaspis polylepis polylepis venom)으로부터의 분리물), FTX-3.3(예를 들어, 아겔레놉시스 아페르타(Agelenopsis aperta)로부터의 분리물), 네오마이신 설페이트(예를 들어, C23H46N6O13·3H2SO4), 니카르디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닙메틸-2-[메틸(페닐메팁아미노]-3,5-피리딘디카르복실산 에틸 에스테르 하이드로클로라이드, 또한 YC-93, 니페디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(2-니트로페닐)-3,5-피리딘디카르복실산 디메틸 에스테르), 니모디핀(Nimodipine)(예를 들어, 4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 2-메톡시에틸 1-메틸에틸 에스테르) 또는 (이소프로필 2-메톡시에틸 1,4-디하이드로-2,6-디메틸-4-(m-니트로페닐)-3,5-피리딘디카르복실레이트), 니트렌디핀(Nitrendipine)(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 에틸 메틸 에스테르), S-페타신(S-Petasin)(예를 들어, (3S,4aR,5R,6R)-[2,3,4,4a,5,6,7,8-옥타하이드로-3-(2-프로페닐)-4a,5-디메틸-2-옥소-6-나프틸]Z-3'-메틸티오-1'-프로페노에이트), 플로레틴(Phloretin)(예를 들어, 2',4',6'-트리하이드록시-3-(4-하이드록시페닐)프로피오페논, 또한 3-(4-하이드록시페닐)-1-(2,4,6-트리하이드록시페닐)-1-프로파논, 또한 b-(4-하이드록시페닐)-2,4,6-트리하이드록시프로피오페논), 프로토핀(Protopine)(예를 들어, C20HI9NO5Cl), SKF-96365(예를 들어, 1-[b-[3-(4-메톡시페닐)프로폭시]-4-메톡시펜에틸]-1H-이미다졸, HCl), 테트란딘(Tetrandine)(예를 들어, 6,6',7,12-테트라메톡시-2,2'-디메틸베르바만), (.+-.)-메톡시베라파밀 또는 (+)-베라파밀(예를 들어, 54N-(3,4-디메톡시페닐에틸)메틸아미노]-2-(3,4-디메톡시페닐)-2-이소-프로필발레로니트릴 하이드로클로라이드), 및 (R)-(+)-Bay K8644(예를 들어, R-(+)-1,4-디하이드로-2,6-디메틸-5-니트로-442-(트리플루오로메틸)페닐]-3-피리딘카르복실산 메틸 에스테르)를 포함하나, 이에 제한되지는 않는다. 전술한 예는 L-타입 전압-작동 칼슘 채널에 특이적일 수 있거나, 더 광범위한 전압-작동 칼슘 채널, 예를 들어, N, P/Q, R, 및 T-타입을 억제할 수 있다.
엔도텔린
엔도텔린은 혈압 및 혈관 긴장도를 증가시키는 내피에서 주로 생성되는 혈관수축 펩티드이다. 이러한 펩티드의 패밀리는 엔도텔린-1(ET-1), 엔도텔린-2(ET-2) 및 엔도텔린-3(ET-3)를 포함한다. 이들 작은 펩티드(21개의 아미노산)는 혈관 항상성에서 중요한 역할을 갖는다. ET-1은 대부분 혈관 내피 세포에 의해 분비된다. 우세한 ET-1 아이소형은 혈관구조에서 발현되고, 가장 효능있는 혈관수축제이다. ET-1은 또한 수축력, 화학주성 및 분열촉진 특성을 갖는다. 이는 교감신경계를 자극하고, 레닌-안지오텐신-알도스테론 시스템(RAAS), 바소프레신 및 동맥 나트륨배설 펩티드에 대한 이의 효과를 통해 염 및 물 항상성에 영향을 미친다. 엔도텔린은 공지된 가장 강한 혈관수축제이며, 이는 심장, 전신 순환 및 뇌를 포함하는 여러 기관계의 혈관 질병과 관련되어 있다.
2개의 중요한 엔도텔린 수용체 타입 ETA 및 ETB가 존재한다. ETA 및 ETB는 별개의 약리학적 특징을 갖는다. ETA-수용체 친화성은 ET-3보다 ET-1에 대해 훨씬 높다. ETA-수용체는 혈관 평활근 세포에 위치되나, 내피 세포에는 위치되지 않는다. ETA에 대한 엔도텔린의 결합은 혈관수축 및 소듐의 보유를 증가시켜, 혈압을 증가시킨다. ETB 수용체는 주로 혈관의 내부에 라이닝된 내피 세포에 위치된다. ETB 수용체에 결합하는 엔도텔린은 나트륨 배설 증가 및 이뇨를 증가시키고, 산화질소를 방출함으로써 혈압을 낮춘다. ET-1 및 ET-3은 ETB-수용체를 동등하게 활성화시키고, 차례로 NO 및 프로스타글란딘의 생성을 통해 혈관확장을 발생시킨다. 엔도텔린-1(ET-1)은 또한 ETA-수용체 자극을 통해 혈관 평활근 수축을 야기시키고, ETB-수용체를 통해 내피 세포에서 NO 생성을 유도하는 것으로 입증되었다. 일부 ETB-수용체는 혈관 평활근에 위치됨으로써 이들은 혈관수축을 매개할 수 있다. 다수의 엔도텔린 수용체가 다양한 인자에 의해 조절된다. 안지오텐신 II 및 포르볼 에스테르는 엔도텔린 수용체를 하향조절하는 반면, 허혈 및 사이클로스포린은 엔도텔린 수용체의 수를 증가시킨다.
다수의 펩티드 및 비펩티드 ET 길항제가 연구되었다. ETA-수용체 길항제는 A-127722(비-펩티드), ABT-627(비-펩티드), BMS 182874(비-펩티드), BQ-123(펩티드), BQ-153(펩티드), BQ-162(펩티드), BQ-485(펩티드), BQ-518(펩티드), BQ-610(펩티드), EMD-122946(비-펩티드), FR 139317(펩티드), IPI-725(펩티드), L-744453(비-펩티드), LU 127043(비-펩티드), LU 135252(비-펩티드), PABSA(비-펩티드), PD 147953(펩티드), PD 151242(펩티드), PD 155080(비-펩티드), PD 156707(비-펩티드), RO 611790(비-펩티드), SB-247083(비-펩티드), 클라조센탄(clazosentan)(비-펩티드), 아트라센탄(atrasentan)(비-펩티드), 시탁센탄 소듐(sitaxsentan sodium)(비-펩티드), TA-0201(비-펩티드), TBC 11251(비-펩티드), TTA-386(펩티드), WS-7338B(펩티드), ZD-1611(비-펩티드), 및 아스피린(aspirin)(비-펩티드)를 포함할 수 있으나, 이에 제한되지는 않는다. ETA/B-수용체 길항제는 A-182086(비-펩티드), CGS 27830(비-펩티드), CP 170687(비-펩티드), J-104132(비-펩티드), L-751281(비-펩티드), L-754142(비-펩티드), LU 224332(비-펩티드), LU 302872(비-펩티드), PD 142893(펩티드), PD 145065(펩티드), PD 160672(비-펩티드), RO-470203(보센탄(bosentan), 비-펩티드), RO 462005(비-펩티드), RO 470203(비-펩티드), SB 209670(비-펩티드), SB 217242(비-펩티드), 및 TAK-044(펩티드)를 포함할 수 있으나, 이에 제한되지는 않는다. ETB-수용체 길항제는 A-192621(비-펩티드), A-308165(비-펩티드), BQ-788(펩티드), BQ-017(펩티드), IRL 1038(펩티드), IRL 2500(펩티드), PD-161721(비-펩티드), RES 701-1(펩티드), 및 RO 468443(펩티드)를 포함할 수 있으나, 이에 제한되지는 않는다.
ET-1은 처음에 212개의 아미노산 펩티드(프리-프로엔도텔린-1)로 번역된다. 이는 추가로 분비 서열의 제거 후에 프로엔도텔린-1으로 전환된다. 이후, 프로엔도텔린-1은 퓨린에 의해 분해되어 생물학적으로 비활성의 전구체인 big 엔도텔린-1이 발생된다. 성숙 ET-1이 여러 엔도텔린-전환 효소(ECE) 중 하나에 의한 big 엔도텔린-1의 분해 후에 형성된다. ECE-1의 2개의 스플라이스 변이체가 존재하며, 이들은 ECE-1a 및 ECE-1b이다. 이들 각각은 기능적으로 별개의 역할 및 조직 분포를 갖는다. ECE-1a는 엔도텔린-생성 세포의 골지 네트워크에서 발현되고, big 엔도텔린-1을 분해하여 ET-1을 형성시킨다. ECE-1b는 형질막에 국소화되고, 세포외 big 엔도텔린-1을 분해한다. ECE-1a 및 ECE-1b 둘 모두는 금속단백분해효소 억제제 포스포라미돈(phosphoramidon)에 의해 억제된다. ECE는 또한 평활근 세포 내의 α-액틴 필라멘트에 위치된다. 포스포라미돈에 의한 ECE 억제는 big 엔도텔린-1에 대한 혈관수축을 완전히 차단한다. ECE 억제제는 B-90063(비-펩티드), CGS 26393(비-펩티드), CGS 26303(비-펩티드), CGS 35066(비-펩티드), 포스포라미돈(펩티드), PP-36(펩티드), SM-19712(비-펩티드), 및 TMC-66(비-펩티드)을 포함할 수 있으나, 이에 제한되지는 않는다.
건강한 개체에서, 혈관수축과 혈관확장 사이의 정교한 균형이 한편으로 엔도텔린 및 다른 혈관수축제, 및 다른 한편으로 산화질소, 프로스타사이클린 및 다른 혈관확장제에 의해 유지된다. 엔도텔린 길항제는 국소적 또는 전신 혈관수축 및 세포 증식과 관련된 심장, 혈관 및 신장 질병, 예를 들어, 본태 고혈압, 폐 고혈압, 만성 심부전 및 만성 신부전의 치료에서 일정한 역할을 가질 수 있다.
일시적 수용체 전위 채널
일시적 수용체 전위(TRP) 채널 패밀리는 칼슘 채널 그룹의 한 일원이다. 이들 채널은 일시적 수용체 전위 단백질 및 이의 동족체, 바닐로이드 수용체 서브타입 I, 스트레치-억제성 비-선택적 양이온 채널, 후각, 기계감각적 채널, 인슐린-유사 성장 인자 I-조절 칼슘 채널, 및 비타민 D-반응성 아피칼(vitamin D-responsive apical), 상피 칼슘 채널(ECaC)을 포함한다. 상기 분자 각각은 적어도 700개의 아미노산 길이이고, 특정한 보존된 구조적 특징부를 공유한다. 상기 구조적 특징부 중에서 우세한 것은 다섯번째 막횡단 도메인과 여섯번째 막횡단 도메인 사이에 존재하는 추가 소수성 루프를 갖는 6개의 막횡단 도메인이다. 상기 루프는 막 삽입시에 형성되는 채널의 포어의 활성에 필수적인 것으로 생각된다. TRP 채널 단백질은 또한 하나 이상의 앙키린 도메인을 포함하며, 종종 N-말단에 프롤린-풍부 영역을 나타낸다.
일시적 수용체 전위(TRP) 양이온 채널은 혈관 평활근에 존재하며, 이는 막 스트레치와 같은 자극에 대한 평활근 탈분극화 반응과 관련된다. 유리딘 트리포스페이트(UTP)는 내향 정류를 나타내고, 신속하게 탈민감화되지 않고, Gd3+에 의해 차단되는 양이온 전류를 활성화시킴으로써 혈관 평활근의 수축 및 막 탈분극화를 발생시킨다. 정준 일시적 수용체 전위(TRPC) 단백질은 다양한 포유동물 조직에서 Ca2 + 투과성의 비-선택적 양이온 채널을 형성한다. 이러한 채널의 패밀리의 한 일원인 TRPC6의 억제는 배양된 토끼 간문맥 근육세포에서의 알파-아드레날린수용체-활성화 양이온 전류를 방지하는 것으로 보고되었다. 그러나, 대뇌 혈관 평활근에서의 TRPC6 채널의 억제는 UTP-유도성 막 탈분극화 및 혈관수축을 약화시키지 않는다. 대조적으로, TRPC6과는 달리 TRPC3는 P2Y 수용체의 UTP 활성화 후에 래트 대뇌동맥에서 관찰되는 바와 같이 효능제 유도성 탈분극화를 매개하는 것으로 밝혀졌다. 따라서, 혈관 평활근에서의 TRPC3 채널은 저항-크기조절된 대뇌동맥에서의 혈관수축에 기여하는 효능제-유도성 탈분극화를 매개한다.
TRP1 채널 패밀리는 신호 및 감각 전달 경로의 어레이를 매개하는 큰 그룹의 채널을 포함한다. 포유동물 TRPC 서브패밀리의 단백질은 포스포리파제 C(PLC)-결합 수용체에 대해 반응하여 활성화되는 것으로 보이는 양이온 채널을 코딩하는 적어도 7개의 유전자의 생성물이다. 추정 이온 채널 서브유닛 TRPC3, TRPC6, 및 TRPC7은 포유동물 TRPC 채널의 패밀리의 구조적으로 관련된 서브그룹을 포함한다. 상기 단백질에 의해 형성된 이온 채널은 포스포리파제 C(PLC)의 활성화된 다운스트림인 것으로 보인다. TRPC6 및 TRPC7의 PLC-의존성 활성화는 디아실글리세롤을 수반하는 것으로 밝혀졌으며, 이는 G 단백질 또는 이노시톨 1,4,5-트리포스페이트(IP3)와는 독립적이다.
TRPC 채널은 세포 유형들에서 널리 발현되고, 수용체-매개 Ca2 + 신호전달에서 중요한 역할을 할 수 있다. TRPC3 채널은 PLC-결합 수용체에 반응하여 활성화되는 Ca2 +-전도 채널인 것으로 공지되어 있다. TRPC3 채널은 세포내 이노시톨 1,4,5-트리스포스페이트 수용체(InsP3Rs)와 직접적으로 상호작용하는 것으로 밝혀졌고, 즉, 채널 활성화는 InsP3Rs로의 결합을 통해 매개된다.
동맥 혈류를 증가시키거나, 혈관수축을 억제하거나, 혈관확장을 유도하는데 유용한 작용제는 TRP 채널을 억제하는 작용제이다. 이들 억제제는 TRP 채널 길항제인 화합물을 포함한다. 이러한 억제제는 활성 억제제 또는 TRP 채널 활성 억제제로 언급된다. 본원에서 사용되는 용어 "활성 억제제"는 TRP 채널의 활성을 방해하거나 예방하는 작용제를 나타낸다. 활성 억제제는 UTP와 같은 효능제에 결합하는 TRP 채널의 능력을 방해할 수 있다. 활성 억제제는 TRP 채널 상의 활성화 결합 부위와의 상호작용을 위한 TRP 채널의 자연 발생 활성제와 경쟁하는 작용제일 수 있다. 대안적으로, 활성 억제제는 활성화 결합 부위와 다른 부위에서 TRP 채널에 결합할 수 있으며, 그렇게 함으로서, 이는, 예를 들어, 활성화 결합 부위로 전달됨으로써 자연 활성제의 결합을 배제시키는 TRP 채널에서의 입체형태적 변화를 야기시킬 수 있다. 대안적으로, 활성 억제제는 TRP 채널의 구성요소 업스트림 또는 다운스트림을 방해할 수 있으며, 이는 TRP 채널의 활성을 방해한다. 이러한 후자 유형의 활성 억제제는 기능적 길항제로 언급된다. 활성 억제제인 TRP 채널 억제제의 비제한적 예는 가돌리늄 클로라이드, 란탄 클로라이드, SKF 96365 및 LOE-908이다.
뇌혈관연축을 예방하거나 감소시키기 위한 현재의 치료는 이차 뇌 손상을 예방하거나 최소화시키기 위한 수단, 칼슘 채널 차단제 이용, 혈류역학 처리 및 혈관내 요법으로 이루어진다. 요법은 종종 환자에서 예방적으로 개시되며, 이는 (단계 1에서) 정상혈액량 유지, 혈압 관리, 및 경구 투여되는 L-타입 전압-작동 칼슘 채널 길항제를 포함하는 혈류역학 안정화; 및 (단계 2에서) 추가의 혈류역학 조작 또는 혈관연축 동맥으로의 혈관확장제 약물의 주입 또는 풍선을 이용한 혈관연축 동맥의 확장을 포함할 수 있다. 그러나, 상기 언급된 치료는 고비용이고, 시간 소모적이고, 부분적으로만 효과가 있다.
35년 이상 동안, 의사들은 혈관연축을 포함하는 SAH의 유해한 결과의 발생을 예방하거나 감소시키려고 노력하였으나, 현재 작용제의 부작용 또는 효능의 결핍으로 인해 제한된 효과를 갖는다. 혈관연축의 예방 또는 지연 대뇌 허혈(DCI)로도 공지된 지연 허혈 신경학적 결손의 감소를 위한 FDA 승인된 작용제는 현재 없다. 혈관연축을 예방하기 위한 현재의 방법은 효능의 결핍 또는 안전성 문제, 주로 저혈압 또는 뇌부종으로 인해 실패하였다. 현재, 유일한 FDA-승인된 이용가능한 작용제는 혈관연축을 감소시키지 않지만 SAH 환자에서의 결과를 개선시키는 니모디핀이다.
전압-작동 칼슘 채널 길항제는 혈관연축을 예방하고 특정한 정도로 역전시키는데 효과적일 수 있으나, 종래 치료 투여 용량은 최대 약리학적 효과를 발휘하기에는 너무 적다. 엔도텔린-수용체 길항제는 또한 혈관연축을 예방하고 특정한 정도로 역전시키는데 효과적일 수 있으나, 이러한 혈관연축의 역전 또는 예방은 혈관연축에서의 감소로 예상되는 바와 같은 결과에서의 개선을 특징짓는 것으로 해석되지는 않는다. 이론으로 제한하는 것은 아니지만, 전압-작동 칼슘 채널 차단제의 전신 전달은 혈관연축에 대한 유리한 효과를 경감시키는 부작용, 예를 들어, 보다 많은 전신 용량의 투여를 회피시키는 전신 저혈압 및 폐부종을 갖는 폐 혈관확장을 야기시킬 수 있는 것으로 가정된다. 폐에서의 혈관의 확장은 또한 폐부종 및 폐 손상을 야기시킬 수 있다.
통상적인 요법은 거미막밑 출혈 후의 뇌혈관연축을 치료하는데 집중되어온 한편, 누적되는 증거는 거미막밑 출혈 치료 후의 예후를 개선시키기 위해 치료 중재적시술에 표적화되는 것이 필요한 거미막밑 출혈로부터 유래되는 추가 합병증이 존재하는 것을 암시한다. 기재된 본 발명은 이러한 방법을 제공한다.
개요
한 양태에 따르면, 기재된 본 발명의 방법은 (a)(i) 전압-작동 칼슘 채널 차단제의 미립자(microparticulate) 제형; 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물을 제공하는 단계, 및 (b) 투여 부위에서 치료량의 약학적 조성물의 투여를 위한 수단에 의해 치료량의 약학적 조성물을 투여하는 단계를 포함하는, 적어도 하나의 대뇌동맥의 중단(interruption)을 포함하는 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 상기 뇌 손상과 관련된 지연 합병증을 치료하는 방법을 제공하며, 상기 치료량은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적이고, 상기 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI), 복수의 미세혈전색전증, 피질 확산 허혈(cortical spreading ischemia, CSI), 및 혈관조영술 혈관연축 중 적어도 하나이다.
상기 방법의 한 구체예에 따르면, 단계 (b)에서, 투여 수단은 외과적 주사 장치이고, 투여 부위는 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥에 근접하여 위치한다. 또 다른 구체예에 따르면, 단계 (b)에서, 투여 수단은 외과적 주사 장치이고, 투여 부위는 뇌실이다. 또 다른 구체예에 따르면, 외과적 주사 장치는 바늘, 캐뉼라, 카테터, 또는 이들의 조합물이다. 또 다른 구체예에 따르면, 또 다른 구체예에 따르면, 미립자 제형은 뇌척수액에 의해 운반되어 뇌 손상에 의해 영향을 받은 대뇌동맥과 접촉된다. 또 다른 구체예에 따르면, 치료량은 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적이다. 또 다른 구체예에 따르면, 뇌 손상은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합의 결과이다. 또 다른 구체예에 따르면, 뇌 손상은 거미막밑 출혈의 결과이다. 또 다른 구체예에 따르면, 뇌 손상과 관련된 적어도 하나의 지연 합병증은 뇌내 혈종, 뇌실내 출혈, 열, 행동 결손, 신경계 결손, 뇌경색증, 및 신경 세포 사멸 중 적어도 하나를 추가로 포함한다. 또 다른 구체예에 따르면, 행동 결손이 개선되며, 개선된 행동 결손은 식욕에서의 증가를 포함한다. 또 다른 구체예에 따르면, 신경계 결손이 개선되며, 개선된 신경계 결손은 실조 또는 불완전마비의 개선을 포함한다. 또 다른 구체예에 따르면, 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 주로 국소화된 약리학적 효과를 발휘한다. 또 다른 구체예에 따르면, 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 뇌 전체에 걸쳐 광범위한 약리학적 효과를 발휘한다. 또 다른 구체예에 따르면, 미립자 제형은 복수의 미세입자(microparticle)를 포함하며, 미세입자는 균일한 크기 분포를 갖고, 각각의 미세입자는 매트릭스를 포함한다. 또 다른 구체예에 따르면, 미립자 제형은 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 추가로 포함한다. 또 다른 구체예에 따르면, 미세입자 제형은 미세입자의 액체 현탁액을 포함한다. 또 다른 구체예에 따르면, 뇌실은 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합이다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 서방형 화합물을 포함한다. 또 다른 구체예에 따르면, 서방형 화합물은 중합체이다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 서방형 중합체 상 또는 서방형 중합체 내에 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리 (D, L-락티드-코-글리콜리드)를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리(오르토에스테르)를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리언하이드라이드를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 칼슘 채널 차단제이다. 또 다른 구체예에 따르면, 디하이드로피리딘 칼슘 채널 차단제는 니모디핀이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔 화합물을 포함한다. 또 다른 구체예에 따르면, 겔 화합물은 생물분해성 하이드로겔이다. 또 다른 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 담체를 포함하지 않는다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함하지 않는다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0% 내지 5% 범위의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 5% 미만의 히알루론산을 포함한다.
또 다른 양태에 따르면, 기재된 본 발명은, (a)(i) 전압-작동 칼슘 채널 차단제의 미립자 제형, 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물, 및 (b) 투여를 위한 부위에 치료량의 약학적 조성물을 투여하기 위한 수단을 포함하는, 적어도 하나의 대뇌동맥의 중단을 포함하는 상기 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 뇌 손상과 관련된 지연 합병증을 치료하기 위한 반고체 다중입자 전달 시스템을 제공하며, 상기 치료량은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적이다.
한 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI), 복수의 미세혈전색전증, 피질 확산 허혈(CSI), 및 혈관조영술 혈관연축 중 적어도 하나이다. 제 31항에 따른 시스템으로서, 투여 수단이 외과적 주사 장치이고, 투여 부위가 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥에 근접하여 위치하는 시스템. 또 다른 구체예에 따르면, 투여 수단은 외과적 주사 장치이고, 투여 부위는 뇌실이다. 또 다른 구체예에 따르면, 외과적 주사 장치는 바늘, 캐뉼라, 카테터, 또는 이들의 조합물이다. 또 다른 구체예에 따르면, 미립자 제형은 뇌척수액에 의해 운반되어 뇌 손상에 의해 영향을 받은 대뇌동맥과 접촉될 수 있다. 또 다른 구체예에 따르면, 치료량은 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적이다. 또 다른 구체예에 따르면, 뇌 손상은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합의 결과이다. 또 다른 구체예에 따르면, 뇌 손상은 거미막밑 출혈의 결과이다. 또 다른 구체예에 따르면, 뇌 손상과 관련된 적어도 하나의 지연 합병증은 뇌내 혈종, 뇌실내 출혈, 열, 행동 결손, 신경계 결손, 뇌경색증, 및 신경 세포 사멸 중 적어도 하나를 추가로 포함한다. 또 다른 구체예에 따르면, 행동 결손이 개선되며, 개선된 행동 결손은 식욕에서의 증가를 포함한다. 또 다른 구체예에 따르면, 신경계 결손이 개선되며, 개선된 신경계 결손은 실조 또는 불완전마비의 개선을 포함한다. 또 다른 구체예에 따르면, 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 주로 국소화된 약리학적 효과를 발휘한다. 또 다른 구체예에 따르면, 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 뇌 전체에 걸쳐 광범위한 약리학적 효과를 발휘한다. 또 다른 구체예에 따르면, 미립자 제형은 복수의 미세입자를 포함하며, 미세입자는 균일한 크기 분포를 갖고, 각각의 미세입자는 매트릭스를 포함한다. 또 다른 구체예에 따르면, 미립자 제형은 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 추가로 포함한다. 또 다른 구체예에 따르면, 미세입자 제형은 미세입자의 액체 현탁액을 포함한다. 또 다른 구체예에 따르면, 뇌실은 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합이다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 서방형 화합물을 포함한다. 또 다른 구체예에 따르면, 서방형 화합물은 중합체이다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 서방형 중합체 상 또는 서방형 중합체 내에 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리 (D, L-락티드-코-글리콜리드)를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리(오르토에스테르)를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 미립자 제형은 폴리언하이드라이드를 포함한다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 칼슘 채널 차단제이다. 또 다른 구체예에 따르면, 디하이드로피리딘 칼슘 채널 차단제는 니모디핀이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔 화합물을 포함한다. 또 다른 구체예에 따르면, 겔 화합물은 생물분해성 하이드로겔이다. 또 다른 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 담체를 포함하지 않는다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함하지 않는다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0% 내지 5% 범위의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 5% 미만의 히알루론산을 포함한다.
도면의 간단한 설명
도 1은 대뇌동맥의 예시적 도면을 제시한다.
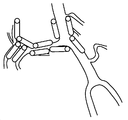
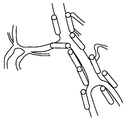
도 2A는 본 발명의 한 구체예에 따른 전교통동맥으로의 칼슘 채널 차단제, 엔도텔린 수용체 길항제, 또는 추정 일시적 수용체 전위 단백질 차단제 겔, 서방형 고체 또는 반고체 화합물의 적용의 예시적 도면을 제시한다.
도 2B는 중대뇌동맥으로의 칼슘 채널 차단제, 엔도텔린 수용체 길항제, 또는 추정 일시적 수용체 전위 단백질 차단제 겔, 서방형 고체 또는 반고체 화합물의 적용의 한 구체예의 도면을 제시한다.
도 2C는 내경동맥으로의 칼슘 채널 차단제, 엔도텔린 길항제, 또는 추정 일시적 수용체 전위 단백질 차단제 겔, 서방형 고체 또는 반고체 화합물의 적용의 한 구체예의 도면을 제시한다.
도 3은 20년 이상의 사망률에서의 50%의 감소를 나타내는 거미막밑 출혈(SAH)의 7개의 집단 기반 연구에서의 거미막밑 출혈의 결과에서의 시간적 추세를 제시한다.
도 4A는 거미막밑 출혈 후의 예후에 대한 간단한 흐름도표를 제시한다.
도 4B는 거미막밑 출혈 후의 지연 합병증과 관련되는 것으로 제안된 경로의 흐름도표를 제시한다.
도 5는 대뇌동맥의 예시적 도면을 제시한다(Netter FH. The CIBA Collection of Medical Illustrations: Volumes 1, Nervous System. Vol. 1. Part I. CIBA: USA. 1986. pp. 256로부터의 도면).
도 6은 뇌실의 예시적 도면을 제시한다(page 192, Ross LM, Lamperti ED, Taub E (eds), Schuenke M, Schulte E, Schumacher U. Thieme Atlas of Anatomy. Georg Thieme Verlag: Stuttgart. 2006. pp. 541).
도 7은 뇌실로부터 거미막밑 공간으로의 CSF 흐름의 예시적 도면을 제시한다(page 194, Ross LM, Lamperti ED, Taub E (eds), Schuenke M, Schulte E, Schumacher U. Thieme Atlas of Anatomy. Georg Thieme Verlag: Stuttgart. 2006. pp. 541).
도 8은 뇌실내 카테터를 통한 뇌실로의 칼슘 채널 차단제, 엔도텔린 수용체 길항제, 또는 추정 TRP 단백질 차단제 미세입자 현탁액의 적용의 예시적 도면을 제시한다(Mccomb JG: Techniques of CSF diversion. In: Scott RM (ed). Hydrocephalus. Vol. 3. Williams & Wilkins: Baltimore. 1990. page 48, pp. 128로부터의 도면).
도 9는 거미막밑 공간의 동맥 각각으로의 CSF 유동에 의해 운반되는 미세입자 내 또는 미세입자 상의 칼슘 채널 차단제, 엔도텔린 수용체 길항제, 또는 추정 TRP 단백질 차단제 중 적어도 하나를 포함하는 조성물의 적용을 도시하는 개략도를 제시한다(Pollay M: Cerebrospinal fluid. In: Tindall GT, Cooper PR, Barrow DL (eds). The Practice of Neurosurgery. Vol. 1. Williams & Wilkins: Baltimore. 1996. page 36, pp. 1381).
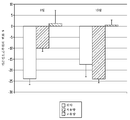
도 10은 연구 1에서 적은 용량(10 mg)의 미립자 니모디핀 제형 + 염수 비히클("저용량"), 많은 용량(30 mg)의 미립자 니모디핀 제형 + 염수 비히클("고용량"), 및 미립자 위약 제형 + 염수 비히클("위약")의 수조내 투여에 의한 국소 치료 후의 기준선으로부터의 평균 뇌기저동맥 직경에서의 변화 퍼센트(%)를 나타내는 막대 그래프이다.
도 11은 연구 1에서 미립자 위약 제형 + 염수 비히클("위약"), 적은 용량(10 mg)의 미립자 니모디핀 제형 + 염수 비히클("저용량"), 또는 많은 용량(30 mg)의 미립자 니모디핀 제형 + 염수 비히클("고용량")로 치료되는 거미막밑 출혈에 적용된 개에서 수득된 시간(일) 경과에 따른 행동 스코어의 플롯을 제시한다.
도 12는 연구 1에서 미립자 위약 제형 + 염수 비히클 ("위약"), 적은 용량(10 mg)의 미립자 니모디핀 제형 + 염수 비히클("저용량") 또는 많은 용량(30 mg)의 미립자 니모디핀 제형 + 염수 비히클("고용량")로 치료되는 거미막밑 출혈에 적용된 개에서의 시간(일) 경과에 따른 혈청 약물 농도(ng/mL)의 플롯을 제시한다. 값은 평균 +/- 표준편차(그룹 당 n=2)이다.
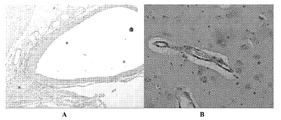
도 13은 미립자 위약 제형 + 염수 비히클 (A) 또는 적은 용량(10 mg)의 미립자 니모디핀 제형 + 염수 비히클 (B)로 치료되는 거미막밑 출혈에 적용된 개의 조직병리학을 제시한다. 위약 미세입자로 처리된 개의 거미막밑 공간은 가벼운 육아종 염증을 나타내었다 (A). 미세혈전색전증이 위약, 적거나 많은 용량의 니모디핀 미세입자로 처리된 거미막밑 출혈을 갖는 개의 작은 혈관에서 관찰되었다. 위약 처리된 개의 뇌에서 정성적으로 더 많은 미세혈전색전증이 존재하였다. 도 (B)는 적은 용량의 니모디핀 미세입자로 처리된 거미막밑 출혈을 갖는 개의 작은 혈관에서의 미세혈전색전증의 예를 제시한다.
도 14는 개과 모델 실험에서 사용된 절단면(sectional plane)을 제시한다.
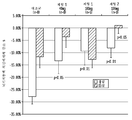
도 15는 연구 2에서 수조내 투여에 의한 용량 1(40 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 수조내 투여에 의한 용량 2(100 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 뇌실내 투여에 의한 용량 2(100 mg)의 히알루론산(HA)이 없는 미립자 니모디핀 제형("제형 2"); 및 대조군(수조내 투여에 의한 미립자 위약 제형 + 히알루론산(HA) 비히클 후, 경구 니모디핀)을 이용한 처리 후의 기준선으로부터의 평균 뇌기저동맥 직경에서의 변화 퍼센트(%)를 나타내는 막대 그래프이다.
도 16은 연구 2에서 수조내 투여에 의한 용량 1(40 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 수조내 투여에 의한 용량 2(100 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 뇌실내 투여에 의한 용량 2(100 mg)의 히알루론산(HA)이 없는 미립자 니모디핀 제형("제형 2"); 및 대조군(수조내 투여에 의한 미립자 위약 제형 + 히알루론산(HA) 비히클 후, 경구 니모디핀)을 이용하여 처리되는 거미막밑 출혈에 적용된 개에서의 시간(일) 경과에 따른 혈청 약물 농도(ng/mL)의 플롯을 제시한다.
도 17은 연구 2에서 수조내 투여에 의한 용량 1(40 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 수조내 투여에 의한 용량 2(100 mg)의 미립자 니모디핀 제형 + 히알루론산(HA) 비히클("제형 1"); 뇌실내 투여에 의한 용량 2(100 mg)의 히알루론산(HA)이 없는 미립자 니모디핀 제형("제형 2"); 및 대조군(수조내 투여에 의한 미립자 위약 제형 + 히알루론산(HA) 비히클 후, 경구 니모디핀)으로 처리되는 거미막밑 출혈에 적용된 개에서의 시간(일) 경과에 따른 뇌척수액(CSF) 니모디핀 농도(ng/mL)의 플롯을 제시한다.
발명의 상세한 설명
어휘
본원에서 사용되는 용어 "활성"은 의도된 치료 효과를 담당하는 본 발명의 조성물의 성분, 구성요소 또는 구성물을 나타낸다.
본원에서 사용되는 용어 "길항제"는 또 다른 물질의 효과를 방해하는 물질을 나타낸다.
본원에서 사용되는 용어 "투여하는"은 생체내 투여 뿐만 아니라 생체외에서 조직으로의 직접적인 투여를 포함한다. 일반적으로, 조성물은 요망되는 바와 같은 통상적인 비독성의 약학적으로 허용되는 담체, 애쥬번트, 및 비히클을 함유하는 투여 단위 제형으로 경구, 협측, 비경구, 국소, 흡입 또는 통기(즉, 입 또는 코를 통함), 또는 직장내로 전신적으로 투여될 수 있거나, 비제한적인 예로, 주사, 삽입, 이식, 국소 적용, 또는 비경구와 같은 수단에 의해 국소적으로 투여될 수 있다.
본원에서 사용되는 용어 "효능제"는 완전하거나 부분적인 약리학적 반응을 유도하기 위해 수용체를 활성화시킬 수 있는 화학물질을 나타낸다. 수용체는 내인성 또는 외인성 효능제 및 길항제에 의해 활성화되거나 비활성화되어, 생물학적 반응을 자극하거나 억제할 수 있다. 생리학적 효능제는 동일한 신체 반응을 발생시키지만, 동일 수용체에 결합하지는 않는 물질이다. 특정 수용체에 대한 내인성 효능제는 수용체에 결합하고 이를 활성화시키는 신체에 의해 자연적으로 생성되는 화합물이다. 초효능제(superagonist)는 표적 수용체에 대해 내인성 효능제보다 더 큰 최대 반응, 및 이에 따라 100%를 초과하는 효율을 발생시킬 수 있는 화합물이다. 이는 내인성 효능제보다 더 효능이 있다는 것을 반드시 의미하는 것은 아니고, 오히려 이는 수용체 결합 후에 세포 내부에서 발생될 수 있는 최대의 가능한 반응의 비교이다. 완전한 효능제는 수용체에 결합하고 이를 활성화시키며, 상기 수용체에서 완전한 효능을 나타낸다. 부분적 효능제가 또한 제공된 수용체에 결합하고 이를 활성화시키나, 완전한 효능제에 비해 수용체에서 단지 부분적 효능을 갖는다. 역효능제(inverse agonist)는 수용체에 대해 효능제와 동일한 수용체 결합 부위에 결합하고, 수용체의 항시적 활성을 역전시키는 작용제이다. 역효능제는 수용체 효능제의 반대의 약리학적 효과를 발휘한다. 비가역적 효능제는 수용체가 영구적으로 활성화되는 방식으로 수용체에 영구적으로 결합하는 효능제의 한 유형이다. 이는 수용체로의 효능제의 결합이 가역적인 반면, 수용체로의 비가역적 효능제의 결합은 비가역적인 것으로 생각된다는 점에서 단순한 효능제와는 다르다. 이는 화합물이 효능제 활성의 간단한 파열 후, 수용체의 탈민감화 및 내재화를 발생시키도록 하며, 장기간의 처리는 길항제와 더욱 유사한 효과를 발생시킨다. 선택적 효능제는 한 특정 유형의 수용체에 특이적이다.
용어 "문합" 및 "문합들"은 혈관 사이의 상호연결을 나타내기 위해 상호교환적으로 사용된다. 이들 상호연결은 뇌의 혈관 공급의 일부가 손상되는 경우에 뇌를 보호한다. 윌리스환에서, 2개의 전대뇌동맥은 전교통동맥에 의해 연결되고, 후대뇌동맥은 후교통동맥에 의해 내경동맥에 연결된다. 다른 중요한 문합들은 안와를 통한 안동맥과 외경동맥의 가지들 사이의 연결, 및 중간 대뇌동맥, 전대뇌동맥, 및 후대뇌동맥의 가지들 사이의 뇌 표면에서의 연결을 포함한다(Principles of Neural Sciences, 2d Ed., Eric R. Kandel and James H. Schwartz, Elsevier Science Publishing Co., Inc., New York, pp. 854-56 (1985)).
본원에서 사용되는 용어 "혈관조영술 혈관연축"은 거미막밑 출혈 후의 환자의 약 50%에서 발생하는, 혈관조영 검사에서 검출될 수 있는 혈관 크기의 감소를 나타낸다. 다른 한편으로, 본원에서 사용되는 용어 "임상 혈관연축"은 환자의 약 30%에서 발생하는 뇌 실질로의 감소된 혈류와 관련된 착란의 증후군 및 감소된 의식 수준을 나타낸다.
본원에서 사용되는 용어 "길항제"는 또 다른 물질의 효과를 방해하는 물질을 나타낸다.
본원에서 사용되는 용어 "실조"는 수의 운동 동안 근육 활동을 조정하는 것에 대한 무능력을 나타낸다.
본원에서 사용되는 용어 "생체적합성"은 살아있는 조직에 대한 임상적으로 관련된 조직 자극, 손상, 독성 반응, 또는 면역학적 반응을 야기시키지 않는 것을 나타낸다.
본원에서 사용되는 용어 "생물분해성"은 간단한 화학적 과정, 신체 효소의 작용, 또는 다른 유사한 생물학적 활성 메커니즘에 의해 시간 경과에 따라 능동적 또는 수동적으로 분해되는 물질을 나타낸다.
본원에서 사용되는 용어 "차단제"는 또 다른 물질의 생리학적 작용을 억제하는 물질을 나타낸다.
본원에서 사용되는 용어 "담체"는 유기체에게 유의한 자극을 야기시키지 않고, 기재된 본 발명의 조성물의 활성 화합물의 생물학적 활성 및 특성을 파기하지 않는 물질을 기재한다. 담체는 이들이 치료되는 포유동물로의 투여에 적합하게 만들기 위해 충분히 높은 순도 및 충분히 낮은 독성이어야 한다. 담체는 비활성일 수 있거나, 이는 약학적 이점, 미용적 이점 또는 둘 모두를 가질 수 있다. 용어 "부형제", "담체" 또는 "비히클"은 본원에 기재된 약학적으로 허용되는 조성물의 제형화 및 투여에 적합한 담체 물질을 나타내기 위해 상호교환적으로 사용된다. 본원에서 유용한 담체 및 비히클은 비독성이고, 다른 성분과 상호작용하지 않는 당 분야에 공지된 임의의 상기 물질을 포함한다.
도 1에 제시된 바와 같이, 용어 "대뇌동맥"은 특히 전교통동맥, 중대뇌동맥, 내경동맥, 전대뇌동맥, 안동맥, 전맥락동맥, 후교통동맥, 및 뇌기저동맥, 및 척추동맥 중 적어도 하나를 나타낸다.
본원에서 사용되는 용어 "뇌혈관연축"은 종종 영향을 받은 혈관의 원위의 영역에서의 감소된 관류와 관련된, 거미막밑 출혈 후의 뇌의 기저에서의 큰 용량 동맥의 협소화의 지연 발생을 나타낸다. 뇌혈관연축은 동맥류의 파열 후에 임의의 시점에서 발생할 수 있으나, 가장 흔하게는 출혈 7일 후에 피크이고, 종종 혈액이 신체에 의해 흡수되는 경우 14일 이내에 해소된다.
본원에서 사용되는 구 "근접하여"는 뇌 손상 부위 또는 뇌 손상 부위에 근접한 혈관에 대해 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만 이내의 거미막밑 공간 내를 의미한다.
본원에서 사용되는 용어 "합병증"은 미리 존재하는 장애의 치료 동안 발달하는 병리학적 과정 또는 사건을 나타낸다. 거미막밑 출혈과 관련된 합병증은 혈관조영술 혈관연축, 미세혈전색전증, 및 피질 확산 서열을 포함하나, 이에 제한되지는 않는다.
본원에서 사용되는 용어 "질환"는 다양한 건강 상태를 나타내며, 건강한 조직 및 기관의 임의의 기초적 메커니즘 또는 장애에 의해 야기되는 장애 또는 질병, 손상, 및 촉진을 포함하는 것을 의미한다.
본원에서 사용되는 용어 "접촉하다" 및 이의 모든 문법 형태는 접촉하거나, 가깝거나, 공간적으로 근접한 상태 또는 조건을 나타낸다.
용어 "조절된 방출"은 제형으로부터의 약물 방출의 방식 및 프로파일이 조절되는 임의의 약물-함유 제형을 나타내는 것을 의도한다. 이는 즉시 뿐만 아니라 비-즉시 방출 제형을 나타내며, 비-즉시 방출 제형은 지속 방출 및 지연 방출 제형을 포함하나, 이에 제한되지는 않는다.
본원에서 사용되는 용어 "피질 확산 탈분극화" 또는 "CSD"는 세포막을 가로지르는 수동 양이온 유입이 ATP-의존성 소듐 및 칼슘 펌프 활성을 초과하는 경우에 점화되는 뇌에서의 신경 종창 및 거의-완전한 신경 탈분극화의 파(wave)를 나타낸다. 양이온 유입 후에 물 유입 및 약 70%까지의 세포외 공간의 수축이 후속된다. 정상 이온 항상성이 소듐 및 칼슘 펌프 활성의 추가 보충을 통해 회복되지 않는 경우, 연장된 세포내 칼슘 파동 및 미토콘드리아 탈분극화를 통해 잠재적으로 세포 사멸을 발생시킴으로 인해 "세포독성 부종"으로 명명된 과정인 세포 종창이 유지된다. CSD는 건강한 조직에서 저항 혈관의 확장을 유도하며, 그러므로 국소 대뇌 혈류가 신경 탈분극화 단계 동안 증가한다(Dreier, J.P. et al., Brain 132: 1866-81 (2009).
용어 "피질 확산 허혈" 또는 "CSI", 또는 "역 혈류역학 반응"은 신경 탈분극화 단계와 커플링된 중증의 미세혈관 연축을 나타낸다. 발생된 확산 관류 결손은 신경 탈분극화[세포외 직류(DC) 전위의 연장된 음성 변화에 의해 반영됨] 및 세포내 소듐 및 칼슘 파동을 연장시킨다. 관류저하는 신경 에너지 요구 및 공급 사이의 미스매치를 발생시키기에 유의하게 충분하다 (Id.).
본원에서 사용되는 용어 "지연 대뇌 허혈" 또는 "DCI"는 국소 신경학적 장애(예를 들어, 반신불완전마비, 언어상실증, 행위상실증, 반맹, 또는 무시)의 발생, 또는 글래스고 혼수 척도에서의 감소(전체 스코어 또는 이의 개별적 구성요소[안구, 어느 한 측면에서의 운동, 언어] 중 하나에서의 감소)를 나타낸다. 이는 적어도 1시간 동안 지속되거나 지속되지 않을 수 있고, 동맥류 폐색 직후에 명백하지 않으며, 뇌의 임상적 평가, CT 또는 자기 공명 영상(MRI) 스캐닝, 및 적절한 실험실 연구에 의해 다른 원인에 기인될 수 없다. 혈관조영술 뇌혈관연축은 방사선 시험(CT 혈관조영술[CTA], MR 혈관조영술[MRA] MRA 또는 카테터 혈관조영술[CA])의 서술이며, DCI의 원인일 수 있다.
통상적인 의미에서의 본원에서 사용되는 용어 "지연 방출"은 제형의 투여와 이로부터의 약물의 방출 사이에 시간 지연이 존재하는 약물 제형을 나타낸다. "지연 방출"은 연장된 기간에 걸친 약물의 단계적 방출을 수반하거나 수반하지 않을 수 있고, 따라서 "지속 방출"이거나 "지속 방출"이 아닐 수 있다.
본원에서 사용되는 용어 "광범위한 약리학적 효과"는 공간 또는 표면 전체에 걸쳐 광범위하게 확산되거나, 전파되거나, 산재되는 약리학적 효과를 나타낸다.
본원에서 사용되는 용어 "질병" 또는 "장애"는 건강의 장애 또는 비정상적 기능의 상태를 나타낸다.
본원에서 사용되는 용어 "배치된"은 특정 방식으로 위치되거나, 배열되거나, 분배되는 것을 나타낸다.
본원에서 사용되는 용어 "약물"은 질병의 예방, 진단, 경감, 치료, 또는 치유에서 사용되는 음식이 아닌 치료제 또는 임의의 물질을 나타낸다.
용어 "유효량"은 요망되는 생물학적 효과를 실현시키는데 필요하거나 충분한 양을 나타낸다.
본원에서 사용되는 용어 "에멀젼"은 2개의 비혼화성 액체 담체를 조합시킴으로써 제조되는 2상 시스템을 나타내며, 상기 2상 시스템 중 하나는 나머지 상 시스템의 전체에 걸쳐 균일하게 분배되고, 가장 큰 콜로이드 입자와 동등하거나 이보다 큰 직경을 갖는 소구체로 이루어진다. 소구체 크기는 중요하며, 시스템이 최대 안정성을 달성하도록 하는 크기여야 한다. 보통, 2개의 상의 분리는 제 3의 물질인 유화제가 혼입되지 않는 한 발생할 것이다. 따라서, 기본적인 에멀젼은 적어도 3개의 구성성분, 즉, 2개의 비혼화성 액체 담체 및 유화제, 뿐만 아니라 활성 성분을 함유한다. 대부분의 에멀젼은 비-수성 상으로 수성상을 혼입시킨다(또는 수성상으로 비-수성상을 혼입시킨다). 그러나, 기본적으로 비-수성인 에멀젼, 예를 들어, 비-수성의 비혼화성 시스템 글리세린 및 올리브유의 음이온 및 양이온 계면활성제를 제조하는 것이 가능하다.
본원에서 사용되는 용어 "유동가능한"은 스트림으로 또는 상대 위치의 연속적 변화에 의해 스트림인 것처럼 이동가능한 것을 나타낸다.
본원에서 사용되는 용어 "육아종 염증"은 다핵 거대 세포 및 결합 조직을 갖거나 갖지 않는 상피모양 대식세포에 대한 규칙성의 우세를 특징으로 하는 염증 반응을 나타낸다.
본원에서 사용되는 용어 "하이드로겔"은 젤라틴 모양 또는 젤리-유사 덩어리를 생성시키는데 필요한 수성 성분을 함유하는 고체, 반고체, 슈도플라스틱(pseudoplastic), 또는 플라스틱 구조를 발생시키는 물질을 나타낸다.
본원에서 사용되는 용어 "고혈압"은 높은 전신 혈압; 심장혈관 손상 또는 다른 유해한 결과를 유도할 수 있는 수준까지의 전신 혈압의 일시적 또는 지속된 상승을 나타낸다.
본원에서 사용되는 용어 "저혈압"은 정상이하 전신 동맥 혈압; 임의의 종류의 감소된 압력 또는 긴장을 나타낸다.
본원에서 사용되는 용어 "이식하는"은 물질, 조성물, 또는 장치의 조직 내의 소정의 위치로의 이식, 엠베딩 또는 삽입을 나타낸다.
다양한 문법 형태의 본원에서 사용되는 용어 "주입하다"는 간극을 물질로 채우기 위해 전체에 걸쳐 주입되거나 스며들게 하는 것을 나타낸다.
본원에서 사용되는 용어 "경색"은 색전, 혈전, 기계적 요인, 또는 괴사의 육안적 영역을 발생시키는 압력으로 인한 동맥 또는 정맥 혈액 공급의 갑작스러운 부족을 나타낸다. 본원에서 사용되는 용어 "뇌경색증"은 뇌의 대뇌 영역으로의 순환 및/또는 산소 전달의 일시적 또는 영구적 손실 후의 뇌 조직의 손실을 나타낸다.
본원에서 사용되는 용어 "염증"은 혈관 조직이 손상에 반응하는 생리학적 과정을 나타낸다. 예를 들어, 참조로서 본원에 포함되는 문헌[FUNDAMENTAL IMMUNOLOGY, 4th Ed., William E. Paul, ed. Lippincott-Raven Publishers, Philadelphia (1999) at 1051-1053]을 참조하라. 염증 과정 동안, 해독 및 복구와 관련된 세포가 염증 매개체에 의해 손상 부위로 이동된다. 염증은 종종 염증 부위에서의 백혈구, 특히 호중구(다형핵 세포)의 강한 침윤을 특징으로 한다. 이들 세포는 혈관벽 또는 손상되지 않은 조직에서 독성 물질을 방출함으로써 조직 손상을 촉진시킨다. 통상적으로, 염증은 급성 또는 만성 반응으로 나뉘어져 왔다.
본원에서 사용되는 용어 "손상"은 물리적이거나 화학적일 수 있는 외부 작용제 또는 힘에 의해 야기되는 신체의 구조 또는 기능에 대한 손상 또는 손해를 나타낸다.
본원에서 사용되는 용어 "허혈"은 혈관의 비정상적 협소화(협착증)에 대해 원위에서의 감소된 관류압이 저항 혈관의 자가조절 확장에 의해 상쇄되지 않는 경우에 발생하는 혈액 공급 및 산소의 결핍을 나타낸다.
본원에서 사용되는 용어 "분리된 분자"는 실질적으로 순수하고, 이의 의도된 용도에 대해 실시가능하고 적절한 정도까지 자연적으로 또는 생체내 시스템에서 보통 발견되는 다른 물질을 함유하지 않는 분자를 나타낸다.
본원에서 사용되는 용어 "체내", "공간 용적", "절제 포켓(resection pocket)", "함몰", "주사 부위", "침착 부위" 또는 "이식 부위" 또는 "전달 부위"는 제한 없이 신체의 모든 조직을 포함하는 것을 의미하며, 이는 주사, 외과적 절개, 종양 또는 조직 제거, 조직 손상, 농양 형성으로부터 형성된 공간, 또는 이에 따라 이의 비제한적인 예로서 질병 또는 병리에 대한 임상 평가, 치료 또는 생리학적 반응의 작용에 의해 형성된 임의의 다른 유사한 공동, 공간, 또는 포켓을 나타낼 수 있다.
본원에서 사용되는 구 "국소화된 투여"는 국소화된 약리학적 효과(즉, 특정 위치로 제한되는 약리학적 효과) 또는 광범위한 약리학적 효과(즉, 공간 또는 표면에 걸쳐 광범위하게 확산되거나, 분산되거나, 산재되는 약리학적 효과)를 발생시킬 수 있는 체내의 특정 위치 내로의 치료제의 투여를 나타낸다.
본원에서 사용되는 구 "국소화된 약리학적 효과"는 특정 위치, 장소, 영역 또는 부위에 근접하는 것과 같이 특정 위치로 제한되는 약리학적 효과를 나타낸다.
본원에서 사용되는 용어 "장기간" 방출은 적어도 7일, 잠재적으로는 약 30일 이하 내지 약 60일 동안 활성 성분의 치료 수준을 전달하도록 이식물이 작제되고 배열되는 것을 의미한다.
본원에서 사용되는 용어 "미세혈전색전증"(또는 이의 복수형태 "미세혈전색전증들")은 혈관의 폐색 또는 폐쇄를 야기시키는 혈병의 작은 단편을 나타낸다.
본원에서 사용되는 용어 "조절하다"는 특정 척도 또는 비율로 조절하거나, 변경시키거나, 적합화시키거나, 조정하는 것을 의미한다.
본원에서 사용되는 용어 "임의로"는 기재된 본 발명의 약학적 조성물이 약학적으로 허용되는 담체를 함유할 수 있거나 함유하지 않을 수 있고, 전압-작동 칼슘 채널 차단제의 미립자 제형 및 약학적으로 허용되는 담체 둘 모두를 함유하는 약학적 조성물을 포함하는 것을 의미한다.
본원에서 사용되는 용어 "비경구"는, 예를 들어, 피하(즉, 피부 아래로의 주사), 근내(즉, 근육으로의 주사); 정맥내(즉, 정맥으로의 주사), 수막강내(즉, 척수 주위 또는 뇌의 거미막 아래의 공간으로의 주사), 복장내(intrasternal) 주사, 또는 주입 기술을 포함하는 위장관 외부의 주사(즉, 주사에 의한 투여)에 의한 신체로의 도입을 나타낸다. 비경구적으로 투여되는 조성물은 바늘, 예를 들어, 외과용 바늘을 이용하여 전달된다. 본원에서 사용되는 용어 "외과용 바늘"은 선택된 해부학적 구조로의 유체(즉, 유동가능한) 조성물의 전달에 적합화된 임의의 바늘을 나타낸다. 주사가능한 제조물, 예를 들어, 멸균된 주사가능한 수성 또는 유성 현탁액은 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당 분야에 공지된 바에 따라 제형화될 수 있다.
본원에서 사용되는 용어 "불완전마비"는 부분적 또는 불완전한 마비를 나타낸다.
본원에서 사용되는 용어 "입자" 또는 "미세입자"는 전체적으로 또는 부분적으로 본원에 기재된 바와 같은 적어도 하나의 치료제를 함유할 수 있는 극도로 작은 성분, 예를 들어, 나노입자 또는 미세입자를 나타낸다. 입자는 코팅에 의해 둘러싸인 코어 내에 치료제(들)를 함유할 수 있다. 치료제(들)는 또한 입자 전체에 걸쳐 분산될 수 있다. 치료제(들)는 또한 입자에 흡착될 수 있다. 입자는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 입자는 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다. 입자는 용액 또는 반고체 상태의 전압-작동 칼슘 채널 차단제를 함유하는 미세캡슐일 수 있다. 입자는 사실상 임의의 형태일 수 있다.
본원에서 사용되는 용어 "약학적으로 허용되는 담체"는 인간 또는 다른 척추동물로의 투여에 적합한 하나 이상의 상용성 고체 또는 액체 충전제, 희석제 또는 피막형성 물질을 나타낸다. 본원에서 사용되는 용어 "담체"는 적용을 촉진시키기 위해 활성 성분이 조합되는 자연 또는 합성의 유기 또는 무기 성분을 나타낸다. 약학적 조성물의 성분은 또한 요망되는 약학적 효율을 실질적으로 손상시키는 상호작용이 존재하지 않도록 하는 방식으로 혼합될 수 있다.
본원에서 사용되는 용어 "약학적 조성물"은 표적 질환 또는 질병을 예방하거나, 이들의 강도를 감소시키거나, 치유시키거나, 달리 치료하기 위해 사용되는 조성물을 나타낸다.
본원에서 사용되는 용어 "약리학적 효과"는 활성제에 대한 노출의 결과 또는 영향을 나타낸다.
본원에서 사용되는 구 "주로 국소화된 약리학적 효과"는 전신 투여에 비해 국소화된 투여로 적어도 수십배 내지 수천배까지 달성되는 특정 위치로 제한되는 약물의 약리학적 효과를 나타낸다.
본원에서 사용되는 용어 "예후"는 의학적 지식을 기초로 한 질병 또는 장애의 예상되는 미래의 원인 및 결과를 나타낸다.
본원에서 사용되는 용어 "감소시키다" 또는 "감소시키는"은 장애가 발달할 위험이 있는 개체에서의 장애의 정도, 강도, 범위, 크기, 양, 밀도, 수 또는 발생의 축소, 감소, 약화, 제한 또는 증상감소를 나타낸다.
본원에서 사용되는 용어 "아급성 염증"은 호중구, 림프구, 및 때때로 대식세포 및/또는 형질 세포의 혼합물을 특징으로 하는 초기 염증 과정 이후에 통상적으로 관찰되는 조직 반응을 나타낸다.
용어 "거미막밑 출혈" 또는 "SAH"는 거미막 아래에 혈액이 모이는 질환을 나타내기 위해 본원에서 사용된다. 거미막밑 공간으로 언급되는 이러한 영역은 보통 뇌척수액을 함유한다. 거미막밑 공간 내의 혈액의 누적은 뇌졸중, 발작, 및 다른 합병증을 발생시킬 수 있다. 또한, SAH는 영구적 뇌 손상 및 뇌에서의 다수의 해로운 생화학적 사건을 야기시킬 수 있다. SAH의 원인은 뇌동맥류로부터의 출혈, 혈관 기형, 외상 및 일차 뇌내출혈로부터 거미막밑 공간으로의 확장을 포함한다. SAH의 증상은, 예를 들어, 갑작스럽고 중증인 두통, 구역 및/또는 구토, 수막 자극의 증상(예를 들어, 경부 경직, 요통, 양다리 동통), 눈부심 및 시력 변화, 및/또는 의식 상실을 포함한다. SAH는 종종 두부 손상 또는 동맥류로 공지된 혈관 결함에 대해 속발성이다. 일부 예에서, SAH는 차례로 허혈성 뇌졸중을 발생시킬 수 있는 뇌혈관연축을 유도할 수 있다. SAH의 흔한 표시는 CSF 내의 혈액의 존재이다. SAH를 갖는 피검체는 다수의 증상에 의해 확인될 수 있다. 예를 들어, 거미막밑 출혈을 갖는 피검체는 거미막밑에 보통 대량으로 혈액이 존재할 것이다. 거미막밑 출혈을 갖는 피검체는 또한 평균 동맥압에 가까운 두개내 압력, 대뇌 관류압의 하락, 또는 갑작스러운 일시적 의식 상실(종종, 고통스러운 두통이 선행함)에 의해 확인될 수 있다. 환자의 약 절반에서, 피검체에는 신체적 작업과 관련될 수 있는 중증의 두통이 존재한다. 거미막밑 출혈과 관련된 다른 증상은 구역, 구토, 기억상실, 반신불완전마비 및 언어상실증을 포함한다. SAH를 갖는 피검체는 또한 이들의 CSF 내에서의 크레아틴 키나제-BB 동종효소 활성의 존재에 의해 확인될 수 있다. 이러한 효소는 뇌에서는 풍부화되나, 일반적으로 CSF에는 존재하지 않는다. 따라서, CSF에서의 상기 효소의 존재는 뇌로부터 거미막밑 공간으로의 "누출"을 나타낸다. CSF에서의 크레아틴-키나제 BB 동종효소 활성의 검정은 문헌[Coplin et al. (Coplin et al 1999 Arch Neurol 56, 1348-1352)]에 기재되어 있다. 또한, 거미막밑 출혈의 확실한 표시인 CSF 내에 혈액이 존재하는지의 여부를 입증하기 위해 척추 천자 또는 요추 천자가 이용될 수 있다. 거미막밑 영역 내의 혈액을 확인하기 위해 두개 CT 스캔 또는 MRI가 또한 이용될 수 있다. 출혈이 발생한 지의 여부 뿐만 아니라, 출혈의 위치를 결정하기 위해 혈관조영술이 또한 이용될 수 있다. 거미막밑 출혈은 일반적으로 두개내 소낭성 동맥류의 파열 또는 뇌 내 및 뇌로 유도되는 동정맥 시스템의 기형으로부터 발생한다. 따라서, 거미막밑 출혈의 위험이 있는 피검체는 소낭성 동맥류를 갖는 피검체 뿐만 아니라 동정맥 시스템의 기형을 갖는 피검체를 포함한다. 소낭성 동맥류의 흔한 부위는 뇌기저동맥의 상부 및 뇌기저동맥과 위소뇌동맥 또는 전하소뇌동맥의 접합부이다. 거미막밑 출혈을 갖는 피검체는 육안 검사에 의해 확인될 수 있고, 여기서 둔화된 안구 운동이 뇌 손상을 나타낼 수 있다. 소낭성 동맥류를 갖는 피검체는 CT 및 MRI와 같은 통상적인 의학적 영상화 기술을 통해 확인될 수 있다. 소낭성 또는 뇌동맥류는 버섯-유사 또는 장과(berry)-유사 형태를 형성한다(종종, "목을 갖는 둥근 지붕" 형태로 언급된다).
용어 "피검체" 또는 "개체" 또는 "환자"는 인간을 포함하는 포유동물 기원의 다수의 동물 종을 나타내기 위해 상호교환적으로 사용된다.
본원에서 사용되는 구 "혈관연축을 갖는 피검체"는 혈관연축과 관련된 진단 마커 및 증상이 존재하는 피검체를 나타낸다. 진단 마커는 CSF 내의 혈액의 존재 및/또는 거미막밑 출혈의 최근의 병력을 포함하나, 이에 제한되지는 않는다. 혈관연축 관련 증상은 신체의 한 측면 상의 마비, 단어를 발음하거나, 말하거나 쓰여진 단어를 이해하는 능력이 없음, 및 공간적 분석을 필요로 하는 업무를 수행하는 능력이 없음을 포함하나, 이에 제한되지는 않는다. 상기 증상은 수일에 걸쳐 발달할 수 있거나, 이들은 이들의 양상에 있어서 변동될 수 있거나, 이들은 갑작스럽게 존재할 수 있다.
본원에서 사용되는 구 "혈관조영술 혈관연축을 갖는 피검체"는 혈관연축과 관련된 진단 마커가 존재하는 피검체를 나타낸다. 진단 마커는 CSF 내의 혈액의 존재, SAH의 최근의 병력 및/또는 카테터에서 관찰된 대뇌동맥의 루멘 직경의 감소, SAH 또는 TBI 후 1 내지 14일 후의 컴퓨터 단층촬영술 또는 자기 공명 혈관조영상을 포함하나, 이에 제한되지는 않는다. 혈관연축 관련 증상은 신체의 한 측면 상의 마비, 단어를 발음하거나, 말하거나 쓰여진 단어를 이해하는 능력이 없음, 및 공간적 분석을 필요로 하는 업무를 수행하는 능력이 없음을 포함하나, 이에 제한되지는 않는다. 상기 증상은 수일에 걸쳐 발달할 수 있거나, 이들은 이들의 양상에 있어서 변동될 수 있거나, 이들은 갑작스럽게 존재할 수 있다. 경두개 도플러 초음파가 또한, 예를 들어, 혈관조영술 혈관연축의 진행을 진단하고 모니터하는데 이용될 수 있다. CSF 내의 혈액의 존재는 CT 스캔을 이용하여 검출될 수 있다. 그러나, 혈액의 양이 CT에 의해 검출되지 않을 만큼 적은 일부 예에서, 요추 천자가 권장된다.
본원에서 사용되는 구 "뇌혈관연축을 갖는 피검체"는 뇌혈관연축의 증상을 갖거나, 뇌혈관연축을 갖는 것으로 진단된 피검체를 나타낸다. 뇌혈관연축의 위험이 있는 피검체는 뇌혈관연축의 발달에 대한 하나 이상의 선행 요인을 갖는 피검체이다. 선행 요인은 거미막밑 출혈의 존재를 포함하나, 이에 제한되지는 않는다. 최근에 SAH를 겪은 피검체는 최근에 SAH를 겪지 않은 피검체보다 뇌혈관연축이 발달할 위험이 현저히 높다. MR 혈관조영술, CT 혈관조영술 및 카테터 혈관조영술이 뇌혈관연축을 진단하는데 이용될 수 있다. 혈관조영술은 혈류 및/또는 동맥을 관찰하기 위해 조영제가 혈류로 도입되는 기술이다. 혈류 및/또는 동맥은 종종 통상적인 MR 스캔, CT 스캔 또는 카테터 혈관조영술을 위한 방사선 필름에서 단지 약하게 보이므로 조영제가 필요하다. 적절한 조영제는 사용되는 영상화 기술에 따라 다양할 것이다. 예를 들어, 가돌리늄은 MR 스캔에서 사용되는 조영제로서 통상적으로 사용된다. 다른 MR에 적절한 조영제는 당 분야에 공지되어 있다.
본원에서 사용되는 구 "지연 대뇌 허혈" 또는 "DCI"를 갖는 피검체는 DCI와 관련된 진단 마커가 존재하는 피검체를 나타낸다. 진단 마커는 CSF 내의 혈액의 존재 및/또는 SAH의 최근의 병력 및/또는 신경계 황폐가 발작, 수두증, 증가된 두개내 압력, 감염, 두개내 출혈 또는 다른 전신 요인을 포함하나, 이에 제한되지는 않는, 진단될 수 있는 또 다른 원인으로 인한 것이 아닌 경우의 SAH 후 1 내지 14일 후의 신경계 황폐의 발달을 포함하나, 이에 제한되지는 않는다. DCI-관련 증상은 신체의 한 측면 상의 마비, 단어를 발음하거나, 말하거나 쓰여진 단어를 이해하는 능력이 없음, 및 공간적 분석을 필요로 하는 업무를 수행하는 능력이 없음을 포함하나, 이에 제한되지는 않는다. 상기 증상은 수일에 걸쳐 발달할 수 있거나, 이들은 이들의 양상에 있어서 변동될 수 있거나, 이들은 갑작스럽게 존재할 수 있다.
본원에서 사용되는 구 "미세혈전색전증을 갖는 피검체"는 미세혈전색전증과 관련된 진단 마커가 존재하는 피검체를 나타낸다. 진단 마커는 CSF 내의 혈액의 존재 및/또는 SAH의 최근의 병력 및/또는 신경계 황폐가 발작, 수두증, 증가된 두개내 압력, 감염, 두개내 출혈 또는 다른 전신 요인을 포함하나, 이에 제한되지는 않는, 진단될 수 있는 또 다른 원인으로 인한 것이 아닌 경우의 SAH 후 1 내지 14일 후의 신경계 황폐의 발달을 포함하나, 이에 제한되지는 않는다. 또 다른 진단 마커는 큰 전도성 대뇌동맥의 경두개 도플러 초음파에서 검출되는 색전 신호일 수 있다. 미세혈전색전증-관련 증상은 신체의 한 측면 상의 마비, 단어를 발음하거나, 말하거나 쓰여진 단어를 이해하는 능력이 없음, 및 공간적 분석을 필요로 하는 업무를 수행하는 능력이 없음을 포함하나, 이에 제한되지는 않는다. 상기 증상은 수일에 걸쳐 발달할 수 있거나, 이들은 이들의 양상에 있어서 변동될 수 있거나, 이들은 갑작스럽게 존재할 수 있다.
본원에서 사용되는 구 "피질 확산 허혈을 갖는 피검체"는 피질 확산 허혈과 관련된 진단 마커가 존재하는 피검체를 나타낸다. 진단 마커는 CSF 내의 혈액의 존재 및/또는 SAH의 최근의 병력 및/또는 신경계 황폐가 발작, 수두증, 증가된 두개내 압력, 감염, 두개내 출혈 또는 다른 전신 요인을 포함하나, 이에 제한되지는 않는, 진단될 수 있는 또 다른 원인으로 인한 것이 아닌 경우의 SAH 후 1 내지 14일 후의 신경계 황폐의 발달을 포함하나, 이에 제한되지는 않는다. 또 다른 진단 마커는 피질뇌파검사에 의해 검출되는 혈관수축을 갖는 탈분극화의 전파되는 파의 검출일 수 있다. 피질 확산 허혈-관련 증상은 신체의 한 측면 상의 마비, 단어를 발음하거나, 말하거나 쓰여진 단어를 이해하는 능력이 없음, 및 공간적 분석을 필요로 하는 업무를 수행하는 능력이 없음을 포함하나, 이에 제한되지는 않는다. 상기 증상은 수일에 걸쳐 발달할 수 있거나, 이들은 이들의 양상에 있어서 변동될 수 있거나, 이들은 갑작스럽게 존재할 수 있다.
DCI, 미세혈전색전증, 피질 확산 허혈, 또는 혈관조영술 혈관연축의 위험이 있는 피검체는 상기 질환의 발달에 대한 하나 이상의 선행 요인을 갖는 피검체이다. 선행 요인은 SAH의 존재를 포함하나, 이에 제한되지 않는다. 최근에 SAH를 겪은 피검체는 최근에 SAH를 겪지 않은 피검체보다 혈관조영술 혈관연축 및 DCI가 발달할 위험이 현저히 높다. MR 혈관조영술, CT 혈관조영술 및 카테터 혈관조영술이 DCI, 미세혈전색전증, 피질 확산 허혈 또는 혈관조영술 혈관연축 중 적어도 하나를 진단하는데 사용될 수 있다. 혈관조영술은 혈류 및/또는 동맥을 관찰하기 위해 조영제가 혈류로 도입되는 기술이다. 혈류 및/또는 동맥은 종종 통상적인 MR 스캔, CT 스캔 또는 카테터 혈관조영술을 위한 방사선 필름에서 단지 약하게 보이므로 조영제가 필요하다. 적절한 조영제는 사용되는 영상화 기술에 따라 다양할 것이다. 예를 들어, 가돌리늄은 MR 스캔에서 사용되는 조영제로서 통상적으로 사용된다. 다른 MR에 적절한 조영제는 당 분야에 공지되어 있다.
본원에서 사용되는 구 "실질적으로 순수한"은 살아있는 시스템 또는 합성 동안 관련될 수 있는 물질로부터 실질적으로 분리된 치료제의 상태를 나타낸다. 일부 구체예에 따르면, 실질적으로 순수한 치료제는 적어도 70% 순수하거나, 적어도 75% 순수하거나, 적어도 80% 순수하거나, 적어도 85% 순수하거나, 적어도 90% 순수하거나, 적어도 95% 순수하거나, 적어도 96% 순수하거나, 적어도 97% 순수하거나, 적어도 98% 순수하거나, 적어도 99% 순수하다.
용어 "지속 방출"("연장 방출"로도 언급됨)은 연장된 기간에 걸친 약물의 단계적 방출을 제공하고, 바람직하게는 필수적인 것은 아니지만 연장된 기간에 걸친 약물의 실질적으로 일정한 혈액 수준을 발생시키는 약물 제형을 나타내는 이의 통상적인 의미로 본원에서 사용된다. 대안적으로, 비경구적으로 투여되는 약물 형태의 지연 흡수는 약물을 오일 비히클에 용해시키거나 현탁시킴으로써 달성된다. 지속 방출 생물분해성 중합체의 비제한적 예는 폴리에스테르, 폴리에스테르 폴리에틸렌 글리콜 공중합체, 폴리아미노-유래 생체중합체, 폴리언하이드라이드, 폴리오르토에스테르, 폴리포스파젠, SAIB, 광중합가능한 생체중합체, 단백질 중합체, 콜라겐, 다당류, 키토산, 및 알기네이트를 포함한다.
본원에서 사용되는 용어 "증후군"은 일부 질병 또는 질환을 나타내는 증상의 패턴을 나타낸다.
본원에서 사용되는 구 "전신 투여"는 전체 신체에 대한 약리학적 효과를 갖는 치료제의 투여를 나타낸다. 전신 투여는 위장관을 통한 소화관내 투여(예를 들어, 경구) 및 위장관 외부의 비경구 투여(예를 들어, 정맥내, 근내 등)를 포함한다.
활성제 중 하나 이상의 용어 "치료량" 또는 "유효량"은 의도된 치료 이익을 제공하기에 충분한 양이다. 다양한 활성 화합물 중에서 선택하고, 효능, 상대적 생체이용율, 환자 체중, 유해한 부작용의 중증도 및 바람직한 투여 방식과 같은 요인을 고려함으로써 본원에 제공된 교시내용과 조합하여, 실질적인 독성을 야기시키지 않고, 특정 피검체를 치료하는데 여전히 유효한 효과적인 예방적 또는 치료적 치료 요법이 계획될 수 있다. 사용될 수 있는 활성제의 치료적 유효량은 일반적으로 0.1 mg/kg 체중 내지 약 50 mg/kg 체중의 범위이다. 임의의 특정 적용을 위한 치료적 유효량은 치료되는 질병 또는 질환, 투여되는 특정 전압-작동 칼슘 채널 차단제, 피검체의 크기, 또는 질병 또는 질환의 중증도와 같은 요인에 따라 다양할 수 있다. 당업자는 과도한 실험을 필요로 하지 않고 특정 억제제 및/또는 다른 치료제의 유효량을 경험적으로 결정할 수 있다. 일반적으로, 최대 용량, 즉, 일부 의학적 판단에 따라 가장 많은 안전한 용량이 사용되는 것이 바람직하다. 그러나, 투여량 수준은 손상의 유형, 환자의 연령, 체중, 성별, 의학적 상태, 질환의 중증도, 투여 경로, 및 사용되는 특정 활성제를 포함하는 다양한 요인을 기초로 한다. 따라서, 투여 요법은 매우 다양할 수 있으나, 표준 방법을 이용하여 외과의사에 의해 통상적으로 결정될 수 있다. "용량" 및 "투여량"은 본원에서 상호교환적으로 사용된다.
본원에서 사용되는 용어 "치료제"는 치료 효과를 제공하는 약물, 분자, 핵산, 단백질, 조성물 또는 다른 물질을 나타낸다. 용어 "치료제" 및 "활성제"는 상호교환적으로 사용된다. 활성제는 칼슘 채널 억제제, 칼슘 채널 길항제, 칼슘 채널 차단제, 일시적 수용체 전위 단백질 차단제, 또는 엔도텔린 길항제일 수 있다.
칼슘 채널 억제제, 칼슘 채널 길항제, 칼슘 채널 차단제, 일시적 수용체 전위 단백질 차단제, 및/또는 엔도텔린 길항제를 포함하는 치료제(들)이 입자 내에 제공될 수 있다.
본원에서 사용되는 용어 "치료 성분"은 집단의 백분율에서 특정 질병 소견의 진행을 제거하거나, 감소시키거나, 예방하는 치료적 유효 투여량(즉, 투여 용량 및 빈도)을 나타낸다. 통상적으로 사용되는 치료 성분의 예는 집단의 50%에서 특정 질병 소견에 대해 치료적으로 효과적인 특정 투여량 내의 용량을 기재하는 ED50이다.
본원에서 사용되는 용어 "치료 효과"는 요망되고 이로운 것으로 판단되는 결과인 치료 결과를 나타낸다. 치료 효과는 질병 소견의 직접적 또는 간접적인 억제, 감소, 또는 제거를 포함할 수 있다. 치료 효과는 또한 질병 소견의 진행의 직접적 또는 간접적인 억제, 감소, 또는 제거를 포함할 수 있다.
용어 "국소적"은 적용 지점 또는 적용 지점 바로 아래의 조성물의 투여를 나타낸다. 구 "국소적으로 적용하는"은 상피 표면을 포함하는 하나 이상의 표면(들)로의 적용을 기재한다. 경피 투여와 대조적으로 국소 투여는 일반적으로 전신 효과가 아닌 국소 효과를 제공한다.
본원에서 사용되는 용어 "일시적 수용체 전위 단백질 차단제"는 다른 칼슘 채널 차단제와 구조적으로 다르고, 수용체-매개 칼슘 유입으로 인한 세포에서의 세포내 칼슘 증가를 차단하는 단백질을 나타낸다.
본원에서 사용되는 용어 "일시적 수용체 전위 단백질 길항제"는 다른 칼슘 채널 길항제와 구조적으로 다르고, 수용체-매개 칼슘 유입으로 인한 세포에서의 세포내 칼슘 증가를 길항시키는 단백질을 나타낸다. 일시적 수용체 전위 단백질 차단제 및 길항제는 SK&F 96365 (1-(베타-[3-(4-메톡시-페닐)프로폭시]-4-메톡시펜에틸)-1H-이미다졸 하이드로클로라이드) 및 LOE 908 (RS)-(3,4-디하이드로-6,7-디메톡시이소퀴놀린-1-감마 1)-2-페닐-N,N-디트2-(2,3,4-트리메톡시페닙에틸]아세트아미드)를 포함하나, 이에 제한되지는 않는다.
용어 "치료하다" 또는 "치료하는"은 질병, 질환 또는 장애의 진행을 파기시키거나, 실질적으로 억제하거나, 둔화시키거나, 역전시키고, 질환의 임상적 또는 심미적 증상을 실질적으로 개선시키고, 질병, 질환, 또는 장애의 임상적 또는 심미적 증상의 출현을 실질적으로 예방하고, 유해하거나 성가신 증상으로부터 보호하는 것을 포함한다. "치료하는"은 추가로 (a) 장애의 중증도를 감소시키고; (b) 치료되는 장애(들)에 특징적인 증상의 발달을 제한하고; (c) 치료되는 장애(들)에 특징적인 증상의 악화를 제한하고; (d) 장애(들)을 이전에 가졌던 환자에서 장애(들)의 재발을 제한하고; (e) 장애(들)에 대해 이전에 무증상이었던 환자에서 증상의 재발을 제한하는 것 중 하나 이상을 달성하는 것을 나타낸다.
본원에서 사용되는 용어 "혈관수축"은 혈관의 근육벽의 수축으로부터 발생하는 혈관의 협소화를 나타낸다. 혈관이 수축하는 경우, 혈류는 제한되거나 느려진다.
본원에서 사용되는 혈관수축의 반대인 용어 "혈관확장"은 혈관의 확장을 나타낸다. 본원에서 사용되는 용어 "혈관수축제", "혈압상승제" 또는 "승압제"는 혈관수축을 야기시키는 인자를 나타낸다.
본원에서 사용되는 용어 "혈관연축"은 혈류의 감소를 야기시키나, 일반적으로 전신 혈관 저항의 증가를 갖지 않는 동맥벽 내의 평활근의 수축으로부터 발생하는 대뇌동맥의 내부 직경의 감소를 나타낸다. 혈관연축은 대뇌 혈류를 감소시키고, 대뇌 혈관 저항을 증가시킨다. 이론으로 제한하는 것은 아니지만, 일반적으로 혈관연축은 죽상경화증으로부터 발생하는 것과 같은 혈관에 대한 국소 손상 및 외상성 두부 손상, 동맥류성 거미막밑 출혈 및 거미막밑 출혈의 다른 원인을 포함하는 다른 구조적 손상에 의해 야기되는 것으로 생각된다. 뇌혈관연축은 동맥류의 파열 후 또는 외상성 두부 손상 후의 흔한 발생인 CSF 내의 혈액의 존재에 의해 또한 촉발될 수 있는 자연 발생 혈관수축이다. 뇌혈관연축은 궁극적으로 중단된 혈액 공급으로 인한 대뇌 허혈 및 경색의 형태의 뇌 세포 손상을 발생시킬 수 있다. 본원에서 사용되는 용어 "뇌혈관연축"은 추가로 영향을 받은 혈관에서 원위의 영역 내의 감소된 관류와 종종 관련되는 거미막밑 출혈 후의 뇌의 기저에서의 큰 용량의 동맥의 협소화의 지연 발생을 나타낸다. 뇌혈관연축은 동맥류의 파열 후에 임의의 시점에서 발생할 수 있으나, 가장 흔하게는 출혈 7일 후에 피크이고, 종종 혈액이 신체에 의해 흡수되는 경우 14일 이내에 해소된다. 혈관조영술 혈관연축은 SAH의 결과이나, 이는 또한 거미막밑 공간 내에 혈액을 침착시키는 임의의 질환 후에 발생할 수 있다. 더욱 특히, 용어 "혈관조영술 뇌혈관연축"은 거미막밑 공간으로의 출혈 후에 뇌의 기저에서의 큰 용량의 동맥(즉, 대뇌동맥)의 협소화를 나타내고, 이는 원위의 뇌 영역의 감소된 관류를 발생시킨다.
I. 조성물
한 양태에서, 기재된 본 발명은 (i) 전압-작동 칼슘 채널 차단제의 미립자 제형; 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물을 제공한다.
일부 구체예에 따르면, 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 필요가 있는 포유동물에서 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 수 있으며, 상기 뇌 손상은 적어도 하나의 대뇌동맥의 중단을 포함한다. 일부 상기 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI), 뇌내 혈종, 뇌실내 출혈, 열, 혈관조영술 혈관연축, 미세혈전색전증, 피질 확산 허혈(CSI), 행동 결손, 신경계 결손, 뇌경색증, 신경 세포 사멸, 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌내 혈종이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌실내 출혈이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 열이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 혈관조영술 혈관연축이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 피질 확산 허혈(CSI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 미세혈전색전증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 행동 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경계 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌경색증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경 세포 사멸이다.
일부 구체예에 따르면, 뇌 손상은 내재성 질환의 결과이다. 예시적인 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합을 포함하나, 이에 제한되지는 않는다. 한 구체예에 따르면, 내재성 질환은 동맥류이다. 또 다른 구체예에 따르면, 내재성 질환은 갑작스러운 외상성 두부 손상이다. 또 다른 구체예에 따르면, 내재성 질환은 거미막밑 출혈(SAH)이다. 또 다른 구체예에 따르면, 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 및 거미막밑 출혈(SAH)의 조합이다.
일부 구체예에 따르면, 포유동물의 전달 부위에 치료량으로 투여되는 경우 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 필요가 있는 포유동물에서 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시키는데 효과적이며, 상기 뇌 손상은 적어도 하나의 대뇌동맥의 중단을 포함한다. 한 구체예에 따르면, 전달 부위는 뇌실이다. 일부 구체예에 따르면, 뇌실은 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 전달 부위는 거미막밑 공간이다. 한 구체예에 따르면, 전달 부위는 뇌 손상과 근접하여 존재한다. 또 다른 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받는 혈관에 근접하여 존재한다. 한 구체예에 따르면, 혈관은 적어도 하나의 대뇌동맥이다. 또 다른 구체예에 따르면, 혈관은 뇌 손상에 의해 영향을 받는 적어도 하나의 대뇌동맥이다.
일부 구체예에 따르면, 전달 부위는 뇌 손상의 10 mm 이내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만이다.
일부 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥의 10 mm 이내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만이다.
일부 구체예에 따르면, 약학적 조성물은 전달 부위에 1일 내지 30일 범위의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 한 구체예에 따르면, 약학적 조성물은 전달 부위에 1일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 2일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 3일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 4일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 5일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 6일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 7일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 8일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 9일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 10일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 15일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 30일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 주로 국소화된 약리학적 효과를 발생시킬 수 있다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 주로 국소화된 약리학적 효과를 발생시킨다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킨다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 중추신경계(CNS)를 통해 광범위한 약리학적 효과를 발생시킬 수 있다.
한 구체예에 따르면, 전달 부위에서의 국소화된 약리학적 효과는 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥의 내부 직경이 대조군에 비해 증가되도록 하는 혈관연축의 감소이다. 한 구체예에 따르면, 약학적 조성물은 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적이다.
한 구체예에 따르면, 광범위한 약리학적 효과는 전달 부위로부터 적어도 10 mm, 적어도 9.9 mm, 적어도 9.8 mm, 적어도 9.7 mm, 적어도 9.6 mm, 적어도 9.5 mm, 적어도 9.4 mm, 적어도 9.3 mm, 적어도 9.2 mm, 적어도 9.1 mm, 적어도 9.0 mm, 적어도 8.9 mm, 적어도 8.8 mm, 적어도 8.7 mm, 적어도 8.6 mm, 적어도 8.5 mm, 적어도 8.4 mm, 적어도 8.3 mm, 적어도 8.2 mm, 적어도 8.1 mm, 적어도 8.0 mm, 적어도 7.9 mm, 적어도 7.8 mm, 적어도 7.7 mm, 적어도 7.6 mm, 적어도 7.5 mm, 적어도 7.4 mm, 적어도 7.3 mm, 적어도 7.2 mm, 적어도 7.1 mm, 적어도 7.0 mm, 적어도 6.9 mm, 적어도 6.8 mm, 적어도 6.7 mm, 적어도 6.6 mm, 적어도 6.5 mm, 적어도 6.4 mm, 적어도 6.3 mm, 적어도 6.2 mm, 적어도 6.1 mm, 적어도 6.0 mm, 적어도 5.9 mm, 적어도 5.8 mm, 적어도 5.7 mm, 적어도 5.6 mm, 적어도 5.5 mm, 적어도 5.4 mm, 적어도 5.3 mm, 적어도 5.2 mm, 적어도 5.1 mm, 적어도 5.0 mm인 혈관의 내부 직경이 대조군에 비해 증가되는 혈관연축의 감소이다.
전압-작동 칼슘 채널 차단제
일부 구체예에 따르면, 전압-작동 채널 차단제는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택된다.
조성물로 제형화될 수 있는 전압-작동 칼슘 채널 차단제의 비제한적인 예는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는다.
예를 들어, L-타입 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 L-타입 차단제, 예를 들어, 니솔디핀, 니카르디핀 및 니페디핀, AHF(예를 들어, 4aR,9aS)-(+)-4a-아미노-1,2,3,4,4a,9a-헥사하이드로-4aH-플루오렌, HCl), 이스라디핀(예를 들어, 4-(4-벤조푸라자닐)-1,-4-디하이드로-2,6-디메틸-3,5-피리딘디카르복실산 메틸 1-메틸에틸 에스테르), 칼시셉틴(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스로부터의 분리물), H-Arg-Ile-Cys-Tyr-Ile-His-Lys-Ala-Ser-Leu-Pro-Arg-Ala-Thr-Lys-Thr-Cys-Val-Glu-Asn-Thr-Cys-Tyr-Lys-Met-Phe-Ile-Arg-Thr-Gln-Arg-Glu-Tyr-Ile-Ser-Glu-Arg-Gly-Cys-Gly-Cys-Pro-Thr-Ala-Met-Trp-Pro-Tyr-Gln-Thr-Glu-Cys-Cys-Lys-Gly-Asp-Arg-Cys-Asn-Lys-OH, 칼시클루딘(예를 들어, 덴드로아스피스 앙구스티셉스(이스턴 그린 맘바)로부터의 분리물), (H-Trp-Gln-Pro-Pro-Trp-Tyr-Cys-Lys-Glu-Pro-Val-Arg-Ile-Gly-Ser-Cys-Lys-Lys-Gln-Phe-Ser-Ser-Phe-Tyr-Phe-Lys-Trp-Thr-Ala-Lys-Lys-Cys-Leu-Pro-Phe-Leu-Phe-Ser-Gly-Cys-Gly-Gly-Asn-Ala-Asn-Arg-Phe-Gln-Thr-Ile-Gly-Glu-Cys-Arg-Lys-Lys-Cys-Leu-Gly-Lys-OH, 실니디핀(예를 들어, 또한 FRP-8653, 디하이드로피리딘-타입 억제제), 딜란티젬(예를 들어, (2S,3S)-(+)-시스-3-아세톡시-5-(2-디메틸아미노에틸)-2,3-디하이드로-2-(4-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 하이드로클로라이드), 딜티아젬(예를 들어, 벤조티아제핀-4(5H)-온, 3-(아세틸옥시)-5-[2-(디메틸아미노)에틸]-2,3-디하이드로-2-(4-메톡시페닐)-- ,(+)-시스-, 모노하이드로클로라이드), 펠로디핀(예를 들어, 4-(2,3-디클로로페닐)-1,4-디하이드로-2,6-디메틸-3,5-피리딘카르복실산 에틸 메틸 에스테르), FS-2(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스 베놈으로부터의 분리물), FTX-3.3(예를 들어, 아겔레놉시스 아페르타로부터의 분리물), 네오마이신 설페이트(예를 들어, C23H46N6O13·3H2SO4), 니카르디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닙메틸-2-[메틸(페닐메팁아미노]-3,5-피리딘디카르복실산 에틸 에스테르 하이드로클로라이드, 또한 YC-93, 니페디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(2-니트로페닐)-3,5-피리딘디카르복실산 디메틸 에스테르), 니모디핀(예를 들어, 4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 2-메톡시에틸 1-메틸에틸 에스테르) 또는 (이소프로필 2-메톡시에틸 1,4-디하이드로-2,6-디메틸-4-(m-니트로페닐)-3,5-피리딘디카르복실레이트), 니트렌디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 에틸 메틸 에스테르), S-페타신(예를 들어, (3S,4aR,5R,6R)-[2,3,4,4a,5,6,7,8-옥타하이드로-3-(2-프로페닐)-4a,5-디메틸-2-옥소-6-나프틸]Z-3'-메틸티오-1'-프로페노에이트), 플로레틴(예를 들어, 2',4',6'-트리하이드록시-3-(4-하이드록시페닐)프로피오페논, 또한 3-(4-하이드록시페닐)-1-(2,4,6-트리하이드록시페닐)-1-프로파논, 또한 b-(4-하이드록시페닐)-2,4,6-트리하이드록시프로피오페논), 프로토핀(예를 들어, C20H19NO5Cl), SKF-96365(예를 들어, 1-[b-[3-(4-메톡시페닐)프로폭시]-4-메톡시펜에틸]-1H-이미다졸, HCl), 테트란딘(예를 들어, 6,6',7,12-테트라메톡시-2,2'-디메틸베르바만), (.+-.)-메톡시베라파밀 또는 (+)-페라파밀(예를 들어, 54N-(3,4-디메톡시페닐에틸)메틸아미노]-2-(3,4-디메톡시페닐)-2-이소-프로필발레로니트릴 하이드로클로라이드), 및 (R)-(+)-Bay K8644(예를 들어, R-(+)-1,4-디하이드로-2,6-디메틸-5-니트로-442-(트리플루오로메틸)페닐]-3-피리딘카르복실산 메틸 에스테르)를 포함하나, 이에 제한되지는 않는다. 전술한 예는 L-타입 전압-작동 칼슘 채널에 특이적일 수 있거나, 더 광범위한 전압-작동 칼슘 채널, 예를 들어, N, P/Q, R, 및 T-타입을 억제할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 칼슘 채널 차단제이다. 한 구체예에 따르면, 디하이드로피리딘 칼슘 채널 차단제는 니모디핀이다. 한 구체예에 따르면, 니모디핀은 본원에 기재된 바와 같이 제형화되는 경우 7-10일의 반감기, 및 적절한 지질 용해도를 갖는다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 분리된 분자이다. 본원에서 사용되는 용어 "분리된 분자"는 실질적으로 순수하고, 이의 의도된 용도에 대해 실시가능하고 적절한 정도까지 자연적으로 또는 생체내 시스템에서 보통 발견되는 다른 물질을 함유하지 않는 분자를 나타낸다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 약학적 제조물 내에서 약학적으로 허용되는 담체와 혼합된다. 일부 상기 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 제조물의 단지 작은 중량 백분율을 포함한다. 일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 실질적으로 순수하다.
약학적으로 허용되는
담체
일부 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 담체를 포함하지 않는다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함하지 않는다.
한 구체예에 따르면, 약학적으로 허용되는 담체는 고체 담체 또는 부형제이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔-상 담체 또는 부형제이다. 담체 또는 부형제의 예는 칼슘 카르보네이트, 칼슘 포스페이트, 다양한 단량체 및 중합체 당(히알루론산을 포함하나, 이로 제한되지는 않음), 전분, 셀룰로스 유도체, 젤라틴, 및 중합체를 포함하나, 이에 제한되지는 않는다. 예시적 담체는 또한 염수 비히클, 예를 들어, 인산염 완충 염수(PBS) 중 하이드록실 프로필 메틸 셀룰로스(HPMC)를 포함할 수 있다.
일부 구체예에 따르면, 약학적으로 허용되는 담체는 조성물에 점착성을 제공한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함한다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 0% 내지 5%의 히알루론산을 포함한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 0.05% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 5.0% 미만의 히알루론산을 포함한다.
일부 구체예에서, 약학적으로 허용되는 담체는, 임의로 지속 방출 겔로서 겔, 서방형 고체 또는 반고체 화합물을 포함하나, 이에 제한되지는 않는다. 일부 상기 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체에 엠베딩(embedding)된다. 일부 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체 상에 코팅된다. 코팅은 임의의 요망되는 물질, 바람직하게는 중합체 또는 다양한 중합체의 혼합물일 수 있다. 임의로, 중합체는 활성 성분의 요망되는 방출 패턴을 수득하기 위해 활성 성분과 함께 매트릭스를 형성시키기 위해 과립화 단계 동안 이용될 수 있다. 겔, 서방형 고체 또는 반고체 화합물은 요망되는 기간에 걸쳐 활성제를 방출할 수 있다. 겔, 서방형 고체 또는 반고체 화합물은, 예를 들어, 대뇌동맥과 같은 혈관에 근접하여 있으나 이에 제한되지는 않는 인간 뇌 내의 조직에 이식될 수 있다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 서방형 고체 화합물을 포함한다. 한 상기 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 서방형 고체 화합물에 엠베딩되거나, 서방형 고체 화합물 상에 코팅된다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 전압-작동 칼슘 채널 차단제를 함유하는 서방형 미세입자를 포함한다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔 화합물, 예를 들어, 생물분해성 하이드로겔이다.
미세입자 제형
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 형태로 제공된다. 본원에서 사용되는 용어 "입자"는 전체적으로 또는 부분적으로 칼슘 채널 차단제를 함유할 수 있는 나노 또는 미세입자(또는 일부 예에서, 더 큰 입자)를 나타낸다. 일부 구체예에 따르면, 미립자 제형은 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 포함한다. 한 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 코팅에 의해 둘러싸인 입자의 코어 내에 함유된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 표면 전체에 걸쳐 분산된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자 상 또는 미세입자 내에 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자의 표면 전체에 걸쳐 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자에 흡착된다.
일부 상기 구체예에 따르면, 미세입자는 균일한 크기 분포의 미세입자이다. 일부 구체예에 따르면, 미세입자 크기의 균일한 분포는 미세입자를 포함하는 균일한 에멀젼을 형성시키기 위한 균질화 과정에 의해 달성된다. 일부 상기 구체예에 따르면, 각각의 미세입자는 매트릭스를 포함한다. 일부 구체예에 따르면, 매트릭스는 전압 작동 칼슘 채널 차단제를 포함한다.
일부 구체예에 따르면, 약학적 조성물은 유동가능하다. 일부 구체예에 따르면, 약학적 조성물의 미립자 제형 성분은 유동가능하다.
일부 구체예에 따르면, 입자는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출, 및 이들의 조합으로 구성되는 군으로부터 선택된다. 입자는 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 입자는 용액 또는 반고체 상태의 전압-작동 칼슘 채널 차단제를 함유하는 미세캡슐이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 미세입자이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 나노입자이다. 일부 구체예에 따르면, 입자는 실질적으로 임의의 형태일 수 있다.
일부 구체예에 따르면, 입자 크기는 약 25 ㎛ 내지 약 100 ㎛이다. 일부 구체예에 따르면, 입자 크기는 약 30 ㎛ 내지 약 80 ㎛이다. 한 구체예에 따르면, 입자 크기는 적어도 약 25 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 30 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 35 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 40 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 45 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 50 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 55 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 60 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 65 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 70 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 75 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 80 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 85 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 90 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 95 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 100 ㎛이다.
또 다른 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 스트링(string) 내에 제공될 수 있다. 스트링은 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제는 스트링 전체에 걸쳐 분산될 수 있거나, 치료제(들)은 스트링에 흡수될 수 있다. 스트링은 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 스트링은 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 적어도 하나의 시트 내에 제공될 수 있다. 시트는 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제는 시트 전체에 걸쳐 분산될 수 있거나, 전압-작동 칼슘 채널 차단제는 시트에 흡수될 수 있다. 시트는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 시트는 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 보존제를 추가로 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 단위 투여 형태로 제공된다. 예시적 단위 투여 형태는 앰풀 또는 다용량 용기를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 미립자 제형은 미세입자의 현탁액을 포함한다. 일부 구체예에 따르면, 약학적 조성물은 추가로 현탁제, 안정화제 및 분산제 중 적어도 하나를 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 현탁액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 용액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 에멀젼으로 제공된다.
일부 구체예에 따르면, 약학적 조성물의 제형은 수용성 형태의 전압-작동 칼슘 채널 차단제의 수용액을 포함한다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 오일 현탁액을 포함한다. 전압-작동 칼슘 채널 차단제의 오일 현탁액은 적합한 친지질성 용매를 이용하여 제조될 수 있다. 예시적 친지질성 용매 또는 비히클은 지방 오일, 예를 들어, 참기름, 또는 합성 지방산 에스테르, 예를 들어, 에틸 올레에이트 또는 트리글리세라이드를 포함하나, 이에 제한되지는 않는다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 수성 현탁액을 포함한다. 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질, 예를 들어, 소듐 카르복시메틸 셀룰로스, 소르비톨, 또는 덱스트란을 함유할 수 있다. 임의로, 현탁액은 또한 적합한 안정화제 또는 매우 농축된 용액의 제조를 가능케 하는 화합물의 용해도를 증가시키는 작용제를 함유할 수 있다. 대안적으로, 전압-작동 칼슘 채널 차단제는 사용전에 적합한 비히클, 예를 들어, 멸균 발열원 비함유 물을 이용한 구성을 위한 분말 형태일 수 있다.
적합한 액체 또는 고체 약학적 제조물은, 예를 들어, 적절한 경우, 하나 이상의 부형제를 갖거나, 인코클리에이트화(encochleation)되거나, 현미경적 금 입자 상에 코팅되거나, 리포솜에 함유되거나, 조직으로의 이식을 위해 펠렛화되거나, 조직으로 러빙(rubbing)되는 목표 상으로 건조되는 미세피막화된 투여 형태를 포함한다. 본원에서 사용되는 용어 "미세피막화"는 논파레일(nonpareil), 펠렛, 결정, 응집물, 미세구, 또는 나노입자를 포함하나, 이에 제한되지는 않는 고체 구조를 생성시키기 위해 매우 작은 비말 또는 입자가 생체적합하거나, 생물분해성이거나, 중합성 또는 비-중합성인 물질의 연속적 필름으로 둘러싸이거나 코팅되는 과정을 나타낸다. 이러한 약학적 조성물은 또한 활성 화합물의 연장된 방출을 갖는 과립, 비드, 분말, 정제, 코팅된 정제, (미세)캡슐, 좌약, 시럽, 에멀젼, 현탁액, 크림, 점적 또는 제조물의 형태로 존재할 수 있고, 이의 제조에서 부형제 및 첨가제 및/또는 보조제, 예를 들어, 붕해제, 결합제, 코팅 작용제, 팽창 작용제(swelling agent), 윤활제, 또는 용해화제가 상기 기재된 바와 같이 통상적으로 사용된다. 약학적 조성물은 다양한 약물 전달 시스템에서의 사용에 적합하다. 약물 전달을 위한 방법의 간단한 개관을 위해, 참조로서 본원에 포함되는 문헌[Langer (1990) Science 249, 1527-1533]을 참조하라.
미세피막화 방법
미세피막화 방법 및 생성물; 에멀젼-기반 미세입자의 생성을 위한 방법; 에멀젼-기반 미세입자 및 이의 생성을 위한 방법; 조정가능한 추출 속도를 갖는 용매 추출 미세피막화; 용매 및 염을 이용한 미세피막화 방법; 미세입자를 제조하기 위한 연속적 이중 에멀젼 방법; 미세입자 특성인 중합체 블렌드로부터의 조절된 방출 시스템을 조정하기 위한 건조 방법; 다양한 비-반복 단위를 갖는 중합체를 포함하는 중합체 혼합물 및 이를 제조하거나 이용하는 방법; 및 미세입자 및 이와 함께 사용하기 위한 워크헤드 어셈블리(workhead assembly)를 제조하기 위한 에멀젼 기반 방법의 예는 미국 특허 번호 5,407,609호(제목: Microencapsulation Process and Products Thereof), 미국 출원 번호 10/553,003호(제목: Method for the production of emulsion-based microparticles), 미국 출원 번호 11/799,700호(제목: Emulsion-based microparticles and methods for the production thereof), 미국 출원 번호 12/557,946호(제목: Solvent Extraction Microencapsulation With Tunable Extraction Rates), 미국 출원 번호 12/779,138호(제목: Hyaluronic Acid (HA) Injection Vehicle), 미국 출원 번호 12/562,455호(제목: Microencapsulation Process With Solvent And Salt), 미국 출원 번호 12/338,488호(제목: Process For Preparing Microparticles Having A Low Residual Solvent Volume); 미국 출원 번호 12/692,027호(제목: Controlled Release Systems From Polymer Blends); 미국 출원 번호 12/692,020호(제목: Polymer Mixtures Comprising Polymers Having Different Non-Repeating Units And Methods For Making And Using Same); 미국 출원 번호 10/565,401호(제목: "Controlled release compositions"); 미국 출원 번호 12/692,029호(제목: "Drying Methods for Tuning Microparticle Properties); 미국 출원 번호 12/968,708호(제목: "Emulsion Based Process for Preparing Microparticles and Workhead for Use with Same); 및 미국 출원 번호 13/074,542호(제목: Composition and Methods for Improved Retention of a Pharmaceutical Composition at a Local Administration Site")에 개시되고 기재되어 있다. 상기 참고문헌 각각의 내용은 전체내용이 참조로서 본원에 포함된다.
일부 구체예에 따르면, 미세입자 기술을 이용한 전압-작동 칼슘 채널 차단제의 전달은 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 피막화시키는 생분해성 중합 입자를 포함한다.
한 구체예에 따르면, 미세입자 제형은 중합체 매트릭스를 포함하며, 전압-작동 칼슘 채널 차단제가 상기 중합체 매트릭스에 주입된다. 한 구체예에 따르면, 중합체는 서방형 중합체이다. 한 구체예에 따르면, 중합체는 폴리 (D, L-락티드-코-글리콜리드)이다. 또 다른 구체예에 따르면, 중합체는 폴리(오르토에스테르)이다. 또 다른 구체예에 따르면, 중합체는 폴리(언하이드라이드)이다. 또 다른 구체예에 따르면, 중합체는 폴리락티드-폴리글리콜리드이다.
비-생물분해성 및 생물분해성 중합 물질 둘 모두는 전압-작동 칼슘 채널 차단제를 전달하기 위한 입자의 제조에서 사용될 수 있다. 이러한 중합체는 자연 또는 합성 중합체일 수 있다. 중합체는 방출이 요망되는 기간을 기초로 하여 선택된다. 특히 관심있는 생체결합성 중합체는 교시내용이 본원에 포함되는 문헌[Sawhney et al in Macromolecules (1993) 26, 581-587]에 기재된 바와 같은 생분해성 하이드로겔을 포함하나, 이에 제한되지는 않는다. 예시적 생분해성 하이드로겔은 폴리히알루론산, 카세인, 젤라틴, 글루틴, 폴리언하이드라이드, 폴리아크릴산, 알기네이트, 키토산, 폴리(메틸 메타크릴레이트), 폴리(에틸 메타크릴레이트), 폴리(부틸메타크릴레이트), 폴리(이소부틸 메타크릴레이트), 폴리(헥실메타크릴레이트), 폴리(이소데실 메타크릴레이트), 폴리(라우릴 메타크릴레이트), 폴리(페닐 메타크릴레이트), 폴리(메틸 아크릴레이트), 폴리(이소프로필 아크릴레이트), 폴리(이소부틸 아크릴레이트), 및 폴리(옥타데실 아크릴레이트)를 포함하나, 이에 제한되지는 않는다. 한 구체예에 따르면, 생체결합성 중합체는 히알루론산이다. 일부 상기 구체예에서, 생체결합성 중합체는 약 2.3% 미만의 히알루론산을 포함한다.
일부 구체예에 따르면, 약학적 조성물은 비경구 주사, 외과적 이식, 또는 이들의 조합을 위해 제형화된다. 일부 상기 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 멸균 수용액 또는 비수성 용액, 분산액, 현탁액 또는 에멀젼 또는 멸균의 주사가능한 용액 또는 분산액으로의 재구성을 위한 멸균 분말의 형태이다. 적합한 수성 및 비수성 담체, 희석제, 용매 또는 비히클의 예는 물, 에탄올, 디클로로메탄, 아세토니트릴, 에틸 아세테이트, 폴리올 (프로필렌 글리콜, 폴리에틸렌 글리콜, 글리세롤 등), 이들의 적합한 혼합물, 식물성 오일(예를 들어, 올리브유) 및 주사가능한 유기 에스테르, 예를 들어, 에틸 올레에이트를 포함하나, 이에 제한되지는 않는다. 적절한 유동성은, 예를 들어, 레시틴과 같은 코팅의 사용, 분산액의 경우에서 필요한 입자 크기의 유지, 및 계면활성제의 사용에 의해 유지될 수 있다. 현탁액은 추가로 현탁제, 예를 들어, 에톡실화된 이소스테아릴 알콜, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미정질 셀룰로스, 알루미늄 메타하이드록사이드, 벤토나이트, 아가-아가, 트래거캔쓰(tragacanth), 및 이들의 혼합물을 함유할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 주사가능한 데포(depot) 형태로 제형화된다. 주사가능한 데포 형태는 생물분해성 중합체 중에서 전압 작동 칼슘 채널 차단제의 미세피막화된 매트릭스를 형성시킴으로써 제조된다. 약물 대 중합체의 비 및 사용되는 특정 중합체의 특성에 따라, 약물 방출의 속도가 조절될 수 있다. 이러한 장기 작용 제형은 적합한 중합성 또는 소수성 물질(예를 들어, 허용가능한 오일 중의 에멀젼) 또는 이온 교환 수지와 함께 제형화될 수 있거나, 가용성이 부족한 유도체, 예를 들어, 가용성이 부족한 염으로 제형화될 수 있다. 생물분해성 중합체의 예는 폴리락티드-폴리글리콜리드, 폴리(오르토에스테르) 및 폴리(언하이드라이드)를 포함하나, 이에 제한되지는 않는다. 데포 주사용 제형은 또한 신체 조직과 상용성인 리포솜 또는 마이크로에멀젼 중에 약물을 엔트랩핑(entrapping)시킴으로서 제조된다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리글리콜리드(PGA) 매트릭스 중 또는 상에 주입된다. PGA는 봉합에서 사용하기 위해 개발된 선형 지방족 폴리에스테르이다. 연구들은 트리메틸렌 카르보네이트, 폴리락트산(PLA), 및 폴리카프롤락톤과 함께 형성된 PGA 공중합체를 보고하였다. 이들 공중합체 중 일부는 지속 약물 방출을 위한 미세입자로서 제형화될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리에스테르-폴리에틸렌 글리콜 매트릭스 내 또는 상에 주입된다. 폴리에스테르-폴리에틸렌 글리콜 화합물이 합성될 수 있고, 이들은 연성이고, 약물 전달에 사용될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리 (아미노)-유래 생체중합체 매트릭스 내 또는 상에 주입된다. 폴리 (아미노)-유래 생체중합체는 지방족 디아민으로서 락트산 및 리신을 함유하는 것(예를 들어, 미국 특허 5,399,665호 참조), 및 티로신-유래 폴리카르보네이트 및 폴리아크릴레이트를 포함할 수 있으나, 이에 제한되지는 않는다. 폴리카르보네이트의 변형은 에스테르의 알킬 사슬(에틸 내지 옥틸)의 길이를 변경시킬 수 있는 한편, 폴리아릴레이트의 변형은 중합체의 큰 과변이 및 중합체 특성에서의 큰 유연성을 가능케 하는 이산(예를 들어, 숙신산 내지 세바식산)의 알킬 사슬의 길이를 변경시키는 것을 추가로 포함할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리언하이드라이드 매트릭스 내 또는 상에 주입된다. 폴리언하이드라이드는 용융 중합에 의한 2개의 이산 분자의 탈수에 의해 제조된다(예를 들어, 미국 특허 4,757,128호 참조). 이들 중합체는 표면 침식(벌크 침식에 의해 분해되는 폴리에스테르에 비함)에 의해 분해된다. 약물의 방출은 선택된 단량체의 친수성에 의해 조절될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 광중합성 생체중합체 매트릭스 내 또는 상에 주입된다. 광중합성 생체중합체는 락트산/폴리에틸렌 글리콜/아크릴레이트 공중합체를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 하이드로겔 매트릭스 내 또는 상에 주입된다. 용어 "하이드로겔"은 젤라틴성 또는 젤리-유사 덩어리를 생성시키기 위해 필요한 수성 성분을 함유하는 고체, 반고체, 슈도플라스틱 또는 플라스틱 구조를 발생시키는 물질을 나타낸다. 하이드로겔은 일반적으로 친수성 중합체, 아크릴산, 아크릴아미드 및 2-하이드록시에틸메타크릴레이트(HEMA)를 포함하는 다양한 중합체를 포함한다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 생체중합체 매트릭스 내 또는 상에 주입된다. 자연-발생 생체중합체는 단백질 중합체, 콜라겐, 다당류, 및 광중합성 화합물을 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 단백질 중합체 매트릭스 내 또는 상에 주입된다. 단백질 중합체는 자가-어셈블링 단백질 중합체, 예를 들어, 비단 피브로인, 엘라스틴, 콜라겐, 및 이들의 조합물로부터 합성되었다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 다당류 매트릭스 내 또는 상에 주입된다. 자연-발생 다당류는 키틴 및 이의 유도체, 히알루론산, 덱스트란 및 셀룰로식(cellulosic)(일반적으로, 변형 없이 생체분해성이지 않음), 및 수크로스 아세테이트 이소부티레이트(SAIB)를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 키틴 매트릭스 내 또는 상에 주입된다. 키틴은 주로 2-아세트아미도-2-데옥시-D-글루코스 기로 구성되며, 이는 효모, 진균 및 해양 무척추동물(새우, 갑각류)에서 발견되며, 여기서 이는 외골격의 주요 성분이다. 키틴은 수용성이 아니며, 탈아세틸화된 키틴, 키토산 만이 산성 용액(예를 들어, 아세트산)에서 가용성이다. 연구들은 수용성이고, 매우 높은 분자량(2백만 달톤 초과)이고, 점탄성이고, 비독성이고, 생체적합성이고, 과산화물, 글루테르알데하이드, 글리옥살 및 다른 알데하이드 및 카르보디아미드와 가교되어 겔을 형성할 수 있는 키틴 유도체를 보고하였다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 히알루론산(HA) 매트릭스 내 또는 상에 주입된다. 교대하는 글루쿠로니드 결합(glucuronidic bond) 및 글루코사미니드 결합(glucosaminidic bond)으로 구성되고, 분리되고 정제되는 포유동물 유리체액, 뇌의 세포외 기질, 윤활액, 제대 및 수탉 볏에서 발견되는 히알루론산(HA)이 또한 발효 과정에 의해 생성될 수 있다.
일부 구체예에 따르면, 약학적 조성물은 애쥬번트를 추가로 포함한다. 예시적 애쥬번트는 보존제, 습윤제, 에멀젼화제, 및 분산제를 포함하나, 이에 제한되지는 않는다. 미생물의 작용의 예방은 다양한 항균제 및 항진균제, 예를 들어, 파라벤, 클로로부탄올, 페놀, 소르브산 등에 의해 보장될 수 있다. 등장화제, 예를 들어, 당, 소듐 클로라이드 등이 또한 포함될 수 있다. 주사용 약학적 형태의 연장 흡수는 흡수를 지연시키는 작용제, 예를 들어, 알루미늄 모노스테아레이트 및 젤라틴의 사용에 의해 발생될 수 있다.
제형은, 예를 들어, 말단 감마 방사선조사, 박테리아-보전 필터를 통한 여과에 의하거나, 사용 직전에 멸균수 또는 다른 멸균된 주사용 매질에 용해되거나 분산될 수 있는 멸균 고체 조성물 형태의 멸균 작용제를 혼입시킴으로써 멸균될 수 있다. 주사용 제조물, 예를 들어, 멸균 주사용 수성 또는 유성 현탁액이 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당 분야에 공지된 바에 따라 제형화될 수 있다. 멸균 주사용 제조물은 또한 비독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사용 용액, 현탁액 또는 에멀젼, 예를 들어, 1,3-부탄디올, 디클로로메탄, 에틸 아세테이트, 아세토니트릴 등 중 용액일 수 있다. 사용될 수 있는 허용되는 비히클 및 용매는 물, 링거액, U.S.P. 및 등장성 소듐 클로라이드 용액이다. 또한, 멸균 고정유가 통상적으로 사용되거나 용매 또는 현탁 매질로 사용된다. 이러한 목적을 위해, 합성 모노- 또는 디글리세라이드를 포함하는 임의의 순한 고정유가 사용될 수 있다. 또한, 지방산, 예를 들어, 올레산이 주사 가능 물질의 제조에서 사용된다.
비경구(피하, 피내, 근내, 정맥내, 동맥내, 수막강내, 뇌실내 및 관절내를 포함하나, 이에 제한되지는 않음) 투여를 위한 제형은 항산화제, 완충제, 정균제 및 제형이 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비수성 멸균 주사 용액; 및 현탁제 및 증점제를 포함할 수 있는 수성 및 비수성 멸균 현탁액을 포함한다.
또 다른 구체예에 따르면, 약학적 조성물은 전압-작동 칼슘 채널 차단제를 수 용해도를 향상시키는 중합체에 컨쥬게이션시킴으로써 제형화된다. 적합한 중합체의 예는 폴리에틸렌 글리콜, 폴리-(d-글루탐산), 폴리-(1-글루탐산), 폴리-(1-글루탐산), 폴리-(d-아스파르트산), 폴리-(1-아스파르트산), 폴리-(1-아스파르트산) 및 이들의 공중합체를 포함하나, 이에 제한되지는 않는다. 약 5,000 내지 약 100,000의 분자량, 및 약 20,000 내지 약 80,000의 분자량을 갖는 폴리글루탐산이 사용될 수 있고, 약 30,000 내지 약 60,000의 분자량을 갖는 폴리글루탐산이 또한 사용될 수 있다. 중합체는 참조로서 본원에 포함되는 미국 특허 번호 5,977,163호에 본질적으로 기재된 바와 같은 프로토콜을 이용하여 본 발명의 에포틸론의 하나 이상의 하이드록실로 에스테르 결합을 통해 컨쥬게이션된다. 특정 컨쥬게이션 부위는 본 발명의 21-하이드록시-유도체의 경우에 하이드록실 오프 탄소-21(hydroxyl off carbon-21)을 포함한다. 다른 컨쥬게이션 부위는 하이드록실 오프 탄소 3 및/또는 하이드록실 오프 탄소 7을 포함하나, 이에 제한되지는 않는다.
적합한 완충제는 아세트산 및 염(1-2% w/v); 시트르산 및 염(1-3% w/v); 붕산 및 염(0.5-2.5% w/v); 및 인산 및 염(0.8-2% w/v)을 포함한다. 적합한 보존제는 벤즈알코늄 클로라이드(0.003-0.03% w/v); 클로로부탄올(0.3-0.9% w/v); 파라벤(0.01-0.25% w/v) 및 티메로살(0.004-0.02% w/v)을 포함한다.
II
. 전달 시스템
또 다른 양태에서, 본 발명은 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 뇌 손상과 관련된 지연 합병증을 치료하기 위한 반고체(다소 단단한 경도를 갖는 것을 의미함) 미립자 전달 시스템을 제공하며, 상기 뇌 손상은 적어도 하나의 대뇌동맥의 중단을 포함하고, 상기 시스템은 (a)(i) 전압-작동 칼슘 채널 차단제의 미립자 제형; 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물; 및 (b) 치료량의 약학적 조성물을 투여하기 위한 수단을 포함하며, 상기 치료량은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적이다.
일부 구체예에 따르면, 반고체 미립자 전달 시스템은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 필요가 있는 포유동물에서 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 수 있으며, 상기 뇌 손상은 적어도 하나의 대뇌동맥의 중단을 포함한다. 일부 상기 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI), 뇌내 혈종, 뇌실내 출혈, 열, 혈관조영술 혈관연축, 미세혈전색전증, 피질 확산 허혈(CSI), 행동 결손, 신경계 결손, 뇌경색증, 신경 세포 사멸, 또는 이들의 조합으로 구성된 군으로부터 선택된다. 한 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌내 혈종이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌실내 출혈이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 열이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 혈관조영술 혈관연축이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 피질 확산 허혈(CSI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 복수의 미세혈전색전증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 행동 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경계 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌경색증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경 세포 사멸이다.
일부 구체예에 따르면, 뇌 손상은 내재성 질환의 결과이다. 예시적인 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH) 등을 포함하나, 이에 제한되지는 않는다. 일부 상기 구체예에 따르면, 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 내재성 질환은 동맥류이다. 또 다른 구체예에 따르면, 내재성 질환은 갑작스러운 외상성 두부 손상이다. 또 다른 구체예에 따르면, 내재성 질환은 거미막밑 출혈(SAH)이다.
일부 구체예에 따르면, 약학적 조성물은 비경구 주사 또는 외과적 이식에 의해 투여된다.
일부 구체예에 따르면, 반고체 다중입자 전달 시스템은 약학적 조성물이 전달되는 캐뉼라 또는 카테터를 포함하며, 상기 카테터는 포유동물에서 전달 부위로 삽입된다. 한 구체예에 따르면, 전달 부위는 뇌실 내 존재한다. 일부 구체예에 따르면, 뇌실은 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 전달 부위는 거미막밑 공간에 존재한다. 한 구체예에 따르면, 전달 부위는 뇌 손상에 근접하여 존재한다. 또 다른 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받는 혈관에 근접하여 존재한다. 한 구체예에 따르면, 혈관은 적어도 하나의 대뇌동맥이다. 또 다른 구체예에 따르면, 적어도 하나의 대뇌동맥은 뇌 손상에 의해 영향을 받는다.
뇌실은 당 분야에 널리 공지되어 있고, 다양한 신경외과 교과서에 기재된 바와 같이 삽관되거나 도관삽입될 수 있다. 이는 뇌실 카테터 또는 드레인의 삽입 또는 뇌실창냄술(ventriculostomy)로 언급된다. 다양한 크기의 구멍이 두개골 내에서 구멍이 뚫릴 수 있고, 뇌를 덮는 외부 경질막이 절개될 수 있다. 연질막이 절개되고, 카테터(일부 다른 생체적합성, 비흡수 화합물의 실리콘 탄성체로 일반적으로 이루어진 공동 튜브)가 뇌를 통해 선택 뇌실로 삽입된다. 이는 보통 가쪽뇌실이나, 임의의 뇌실이 도관삽입될 수 있다. 카테터는 두부 내의 압력을 모니터하거나, CSF를 배출시키거나, CSF로 물질을 투여하기 위해 이용될 수 있다. 도 8은 뇌실내 카테터를 통한 뇌실로의 전압-작동 칼슘 채널 차단제 미세입자 현탁액을 포함하는 약학적 조성물의 전달의 예시적 도면을 제시한다. 도 9는 거미막밑 공간의 동맥 각각으로의 CSF 유동에 의해 수행되는 미세입자 내 또는 상의 전압-작동 칼슘 채널 차단제를 포함하는 약학적 조성물의 적용을 도시하는 개략도를 제시한다.
일부 구체예에 따르면, 전달 부위는 뇌 손상의 10 mm 내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만에 존재한다.
일부 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받는 적어도 하나의 대뇌동맥의 10 mm 내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만에 존재한다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제를 포함하는 약학적 조성물은 치료적 유효량의 전압-작동 칼슘 채널 차단제의 국소화된 방출을 수행함으로써, 내재성 질병, 장애, 질환 또는 갑작스러운 뇌 손상에 의해 야기되는 적어도 하나의 지연 합병증의 발생률 또는 중증도를 치료하거나 감소시키고, 예후를 개선시키기 위해, 뇌실로 전달된 후, 거미막밑 공간의 적어도 하나의 대뇌동맥으로의 뇌척수액(CSF)의 유동에 의해 운반될 수 있다. 한 구체예에 따르면, 전달 부위는 적어도 하나의 뇌실이다. 전압-작동 칼슘 채널 차단제가 뇌 손상의 부위로 국소적으로 전달되므로, 적어도 하나의 지연 합병증을 치료하거나 이의 중증도를 감소시키는데 필요한 투여량은 더 적어, 저혈압과 같은 보다 많은 용량의 전신 전달과 관련된 원치않는 부작용을 회피한다.
한 구체예에 따르면, 전압-작동 칼슘 채널 차단제를 포함하는 약학적 조성물은 뇌실로 카테터를 삽입하고, 카테터를 통해 약학적 조성물을 주입하여, 약학적 조성물이 카테터의 말단으로부터 뇌실로 국소적으로 방출됨으로써 전달될 수 있다.
또 다른 구체예에 따르면, 약학적 조성물은 단일한 볼루스 주사로 제공된다. 또 다른 구체예에 따르면, 주사는 소정의 기간 후에 반복된다. 일부 상기 구체예에 따르면, 소정의 기간은 1분 이상 내지 10일 이상의 범위일 수 있다. 예를 들어, 반복 주사는 환자의 모니터링이 환자가 혈관조영술 혈관연축 및/또는 DCI의 증거를 여전히 갖는 것을 나타내는 경우에 제공될 수 있다. CSF 순환은 뇌실의 외부에서 거미막밑 공간으로 약학적 조성물을 운반할 수 있다. CSF의 순환은 종종 SAH 후에 느려지며, 거미막밑 공간이 혈병을 함유한다. 따라서, 약학적 조성물은 혈병 내에 트랩핑될 수 있고, 이에 의해, 조성물로부터 약리학적 작용제(들)의 국소화된 방출이 존재할 것이며, 여기서 이들은 인접한 동맥 및 뇌에서 약리학적 효과를 발휘할 것이다.
더욱 일반적으로, 본 발명의 반고체 다중입자 전달 시스템은 경구 또는 주입에 의해 전신 투여에 비해 다수의 장점을 제공한다. 예로서, 니모디핀은 이제 연속적 정맥내 주입으로 또는 2 내지 4시간 마다 제공되는 환약으로 경구적으로 투여되어야 한다. 전압-작동 칼슘 채널 차단제가 국소적으로 이들의 효과를 발휘하는 CSF 내에서 전압-작동 칼슘 채널 차단제의 농도는 높고, 혈장 농도는 전압-작동 칼슘 채널 차단제가 경구적으로 또는 정맥내로 투여되는 경우보다 낮다. 이는 신체 내에서의 덜한 효과와 함께 뇌 동맥 및/또는 뇌에서의 국소화된 약리학적 효과를 발생시킨다. 저혈압과 같은 신체내에서의 부작용이 발생할 가능성이 덜하다. 일부 약리학적 작용제는 전신 투여 후에도 혈액뇌장벽을 가로지르지 않는다. 뇌실로의 직접적인 투여는 상기 문제를 극복한다. 투여되는 전압-작동 칼슘 채널 차단제의 전체 용량은 전신적으로 투여되는 것보다 훨씬 적어, 기타 및 공지되지 않은 부작용의 위험이 낮다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제를 포함하는 약학적 조성물은 조절 방출 시스템에 함유된다. 약물의 효과를 연장시키기 위해, 약물의 흡수를 늦추는 것이 종종 바람직하다. 이는 불량한 수 용해도를 갖는 결정형 또는 무정형 물질의 액체 현탁액의 사용에 의해 달성될 수 있다. 이후, 약물의 흡수 속도는 차례로 결정 크기 및 결정 형태에 좌우될 수 있는 용해 속도에 좌우된다. 예를 들어, 일부 구체예에 따르면, 고점도 베이스(base) 성분, 예를 들어, 수크로스 아세테이트 이소부티레이트(SAIB)를 포함하는 SABER™ 전달 시스템이 전압-작동 칼슘 채널 차단제의 조절 방출을 제공하기 위해 이용된다(참조로서 본원에 포함되는 미국 특허 번호 5,747,058호 및 미국 특허 번호 5,968,542호 참조). 고점성 SAIB가 약물, 생체적합성 부형제 및 다른 첨가제와 함께 제형화되는 경우, 생성된 제형은 표준 주사기 및 바늘을 이용하여 용이하게 주사하기에 충분한 액체이다. SABER™ 제형의 주사 후, 부형제는 확산되어, 점성 데포를 남긴다.
일부 구체예에 따르면, 조절 방출 시스템은 전달 부위에 1일 내지 30일 범위의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 한 구체예에 따르면, 조절 방출 시스템은 전달 부위에 1일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 2일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 3일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 4일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 5일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 6일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 7일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 8일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 9일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 10일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 15일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 조절 방출 시스템은 전달 부위에 30일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다.
일부 구체예에 따르면, 조절 방출 시스템은 만성 질환의 치료에 특히 적합할 수 있는 장기간의 지속 방출 이식물을 포함한다. 본원에서 사용되는 용어 "장기간" 방출은 이식물이 적어도 7일, 바람직하게는 약 30 내지 약 60일 동안 치료적 수준의 활성 성분을 전달하도록 작제되고 배열되는 것을 의미한다. 장기간의 지속 방출 이식물은 당업자에게 널리 공지되어 있고, 이는 상기 기재된 방출 시스템 중 일부를 포함한다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 주로 국소화된 약리학적 효과를 발생시킬 수 있다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 주로 국소화된 약리학적 효과를 발생시킨다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킨다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다.
한 구체예에 따르면, 전달 부위에서의 국소화된 약리학적 효과는 뇌 손상에 의해 영향을 받는 적어도 하나의 대뇌동맥의 내부 직경이 대조군에 비해 증가되도록 하는 혈관연축의 감소이다. 한 구체예에 따르면, 약학적 조성물은 대조군에 비해 뇌 손상에 의해 영향을 받는 대뇌동맥의 내부 직경을 증가시키는데 효과적이다.
한 구체예에 따르면, 광범위한 약리학적 효과는 전달 부위의 적어도 10 mm, 적어도 9.9 mm, 적어도 9.8 mm, 적어도 9.7 mm, 적어도 9.6 mm, 적어도 9.5 mm, 적어도 9.4 mm, 적어도 9.3 mm, 적어도 9.2 mm, 적어도 9.1 mm, 적어도 9.0 mm, 적어도 8.9 mm, 적어도 8.8 mm, 적어도 8.7 mm, 적어도 8.6 mm, 적어도 8.5 mm, 적어도 8.4 mm, 적어도 8.3 mm, 적어도 8.2 mm, 적어도 8.1 mm, 적어도 8.0 mm, 적어도 7.9 mm, 적어도 7.8 mm, 적어도 7.7 mm, 적어도 7.6 mm, 적어도 7.5 mm, 적어도 7.4 mm, 적어도 7.3 mm, 적어도 7.2 mm, 적어도 7.1 mm, 적어도 7.0 mm, 적어도 6.9 mm, 적어도 6.8 mm, 적어도 6.7 mm, 적어도 6.6 mm, 적어도 6.5 mm, 적어도 6.4 mm, 적어도 6.3 mm, 적어도 6.2 mm, 적어도 6.1 mm, 적어도 6.0 mm, 적어도 5.9 mm, 적어도 5.8 mm, 적어도 5.7 mm, 적어도 5.6 mm, 적어도 5.5 mm, 적어도 5.4 mm, 적어도 5.3 mm, 적어도 5.2 mm, 적어도 5.1 mm, 적어도 5.0 mm 이내의 혈관의 내부 직경이 대조군에 비해 증가되도록 하는 혈관연축의 감소이다.
투여 수단
한 구체예에 따르면, 투여 수단은 제형이 뇌 손상에 의해 영향을 받는 대뇌동맥에 근접한 위치에 배치되어, 치료량의 약학적 조성물이 거미막밑 공간에 전달되도록 하는 외과적 주사를 통하는 것이다(1).
또 다른 구체예에 따르면, 투여 수단은 제형이 뇌 손상에 의해 영향을 받는 대뇌동맥과 접촉되도록 CSF 순환에 의해 운반되어, 치료량의 약학적 조성물이 거미막밑 공간에 전달되도록 하는, 뇌실로 국소적으로 카테터를 통하는 것이다(2).
약학적 조성물
전압-작동 칼슘 채널 차단제
일부 구체예에 따르면, 전압-작동 채널 차단제는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택된다.
조성물로 제형화될 수 있는 전압-작동 칼슘 채널 차단제의 비제한적 예는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는다.
예를 들어, L-타입 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 L-타입 차단제, 예를 들어, 니솔디핀, 니카르디핀 및 니페디핀, AHF(예를 들어, 4aR,9aS)-(+)-4a-아미노-1,2,3,4,4a,9a-헥사하이드로-4aH-플루오렌, HCl), 이스라디핀(예를 들어, 4-(4-벤조푸라자닐)-1,-4-디하이드로-2,6-디메틸-3,5-피리딘디카르복실산 메틸 1-메틸에틸 에스테르), 칼시셉틴(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스로부터의 분리물), H-Arg-Ile-Cys-Tyr-Ile-His-Lys-Ala-Ser-Leu-Pro-Arg-Ala-Thr-Lys-Thr-Cys-Val-Glu-Asn-Thr-Cys-Tyr-Lys-Met-Phe-Ile-Arg-Thr-Gln-Arg-Glu-Tyr-Ile-Ser-Glu-Arg-Gly-Cys-Gly-Cys-Pro-Thr-Ala-Met-Trp-Pro-Tyr-Gln-Thr-Glu-Cys-Cys-Lys-Gly-Asp-Arg-Cys-Asn-Lys-OH, 칼시클루딘(예를 들어, 덴드로아스피스 앙구스티셉스(이스턴 그린 맘바)로부터의 분리물), (H-Trp-Gln-Pro-Pro-Trp-Tyr-Cys-Lys-Glu-Pro-Val-Arg-Ile-Gly-Ser-Cys-Lys-Lys-Gln-Phe-Ser-Ser-Phe-Tyr-Phe-Lys-Trp-Thr-Ala-Lys-Lys-Cys-Leu-Pro-Phe-Leu-Phe-Ser-Gly-Cys-Gly-Gly-Asn-Ala-Asn-Arg-Phe-Gln-Thr-Ile-Gly-Glu-Cys-Arg-Lys-Lys-Cys-Leu-Gly-Lys-OH, 실니디핀(예를 들어, 또한 FRP-8653, 디하이드로피리딘-타입 억제제), 딜란티젬(예를 들어, (2S,3S)-(+)-시스-3-아세톡시-5-(2-디메틸아미노에틸)-2,3-디하이드로-2-(4-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 하이드로클로라이드), 딜티아젬(예를 들어, 벤조티아제핀-4(5H)-온, 3-(아세틸옥시)-5-[2-(디메틸아미노)에틸]-2,3-디하이드로-2-(4-메톡시페닐)-- ,(+)-시스-, 모노하이드로클로라이드), 펠로디핀(예를 들어, 4-(2,3-디클로로페닐)-1,4-디하이드로-2,6-디메틸-3,5-피리딘카르복실산 에틸 메틸 에스테르), FS-2(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스 베놈으로부터의 분리물), FTX-3.3(예를 들어, 아겔레놉시스 아페르타로부터의 분리물), 네오마이신 설페이트(예를 들어, C23H46N6O13·3H2SO4), 니카르디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닙메틸-2-[메틸(페닐메팁아미노]-3,5-피리딘디카르복실산 에틸 에스테르 하이드로클로라이드, 또한 YC-93, 니페디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(2-니트로페닐)-3,5-피리딘디카르복실산 디메틸 에스테르), 니모디핀(예를 들어, 4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 2-메톡시에틸 1-메틸에틸 에스테르) 또는 (이소프로필 2-메톡시에틸 1,4-디하이드로-2,6-디메틸-4-(m-니트로페닐)-3,5-피리딘디카르복실레이트), 니트렌디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 에틸 메틸 에스테르), S-페타신(예를 들어, (3S,4aR,5R,6R)-[2,3,4,4a,5,6,7,8-옥타하이드로-3-(2-프로페닐)-4a,5-디메틸-2-옥소-6-나프틸]Z-3'-메틸티오-1'-프로페노에이트), 플로레틴(예를 들어, 2',4',6'-트리하이드록시-3-(4-하이드록시페닐)프로피오페논, 또한 3-(4-하이드록시페닐)-1-(2,4,6-트리하이드록시페닐)-1-프로파논, 또한 b-(4-하이드록시페닐)-2,4,6-트리하이드록시프로피오페논), 프로토핀(예를 들어, C20H19NO5Cl), SKF-96365(예를 들어, 1-[b-[3-(4-메톡시페닐)프로폭시]-4-메톡시펜에틸]-1H-이미다졸, HCl), 테트란딘(예를 들어, 6,6',7,12-테트라메톡시-2,2'-디메틸베르바만), (.+-.)-메톡시베라파밀 또는 (+)-베라파밀(예를 들어, 54N-(3,4-디메톡시페닐에틸)메틸아미노]-2-(3,4-디메톡시페닐)-2-이소-프로필발레로니트릴 하이드로클로라이드), 및 (R)-(+)-Bay K8644(예를 들어, R-(+)-1,4-디하이드로-2,6-디메틸-5-니트로-442-(트리플루오로메틸)페닐]-3-피리딘카르복실산 메틸 에스테르)를 포함하나, 이에 제한되지는 않는다. 전술한 예는 L-타입 전압-작동 칼슘 채널에 특이적일 수 있거나, 더 광범위한 전압-작동 칼슘 채널, 예를 들어, N, P/Q, R, 및 T-타입을 억제할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 칼슘 채널 차단제이다. 한 구체예에 따르면, 디하이드로피리딘 칼슘 채널 차단제는 니모디핀이다. 한 구체예에 따르면, 니모디핀은 본원에 기재된 바와 같이 제형화되는 경우 7-10일의 반감기, 및 적절한 지질 용해도를 갖는다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 분리된 분자이다. 본원에서 사용되는 용어 "분리된 분자"는 실질적으로 순수하고, 이의 의도된 용도에 대해 실시가능하고 적절한 정도까지 자연적으로 또는 생체내 시스템에서 보통 발견되는 다른 물질을 함유하지 않는 분자를 나타낸다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 약학적 제조물 내에서 약학적으로 허용되는 담체와 혼합된다. 일부 상기 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 제조물의 단지 작은 중량 백분율을 포함한다. 일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 실질적으로 순수하다.
약학적으로 허용되는 담체
일부 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 담체를 포함하지 않는다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함하지 않는다.
한 구체예에 따르면, 약학적으로 허용되는 담체는 고체 담체 또는 부형제이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔-상 담체 또는 부형제이다. 담체 또는 부형제의 예는 칼슘 카르보네이트, 칼슘 포스페이트, 다양한 단량체 및 중합체 당(히알루론산을 포함하나, 이로 제한되지는 않음), 전분, 셀룰로스 유도체, 젤라틴, 및 중합체를 포함하나, 이에 제한되지는 않는다. 예시적 담체는 또한 염수 비히클, 예를 들어, 인산염 완충 염수(PBS) 중 하이드록실 프로필 메틸 셀룰로스(HPMC)를 포함할 수 있다.
일부 구체예에 따르면, 약학적으로 허용되는 담체는 점착성을 제공한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함한다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 0% 내지 5%의 히알루론산을 포함한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 0.05% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 5.0% 미만의 히알루론산을 포함한다.
일부 구체예에서, 약학적으로 허용되는 담체는, 임의로 지속 방출 겔로서 겔, 서방형 고체 또는 반고체 화합물을 포함하나, 이에 제한되지는 않는다. 일부 상기 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체에 엠베딩된다. 일부 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체 상에 코팅된다. 코팅은 임의의 요망되는 물질, 바람직하게는 중합체 또는 다양한 중합체의 혼합물일 수 있다. 임의로, 중합체는 활성 성분의 요망되는 방출 패턴을 수득하기 위해 활성 성분과 함께 매트릭스를 형성시키기 위해 과립화 단계 동안 이용될 수 있다. 겔, 서방형 고체 또는 반고체 화합물은 요망되는 기간에 걸쳐 활성제를 방출할 수 있다. 겔, 서방형 고체 또는 반고체 화합물은, 예를 들어, 대뇌동맥과 같은 혈관에 근접하여 있으나 이에 제한되지는 않는 인간 뇌 내의 조직에 이식될 수 있다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 서방형 고체 화합물을 포함한다. 한 상기 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 서방형 고체 화합물 내에 엠베딩되거나, 서방형 고체 화합물 상에 코팅된다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 전압-작동 칼슘 채널 차단제를 함유하는 서방형 미세입자를 포함한다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔 화합물, 예를 들어, 생물분해성 하이드로겔이다.
미세입자 제형
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 형태로 제공된다. 본원에서 사용되는 용어 "입자"는 전체적으로 또는 부분적으로 칼슘 채널 차단제를 함유할 수 있는 나노 또는 미세입자(또는 일부 예에서 더 큰 입자)를 나타낸다. 일부 구체예에 따르면, 미립자 제형은 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 포함한다. 한 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 코팅에 의해 둘러싸인 입자의 코어 내에 함유된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 표면 전체에 걸쳐 분산된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자 상 또는 미세입자 내에 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자의 표면 전체에 걸쳐 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자에 흡착된다.
일부 상기 구체예에 따르면, 미세입자는 균일한 크기 분포를 갖는다. 일부 구체예에 따르면, 미세입자 크기의 균일한 분포는 미세입자를 포함하는 균일한 에멀젼을 형성시키기 위한 균질화 과정에 의해 달성된다. 일부 상기 구체예에 따르면, 각각의 미세입자는 매트릭스를 포함한다. 일부 구체예에 따르면, 매트릭스는 전압 작동 칼슘 채널 차단제를 포함한다.
일부 구체예에 따르면, 약학적 조성물은 유동가능하다. 일부 구체예에 따르면, 약학적 조성물의 미립자 제형 성분은 유동가능하다.
일부 구체예에 따르면, 입자는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 조합으로 구성되는 군으로부터 선택된다. 입자는 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 입자는 용액 또는 반고체 상태의 전압-작동 칼슘 채널 차단제를 함유하는 미세캡슐이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 미세입자이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 나노입자이다. 일부 구체예에 따르면, 입자는 실질적으로 임의의 형태일 수 있다.
일부 구체예에 따르면, 입자 크기는 약 25 ㎛ 내지 약 100 ㎛이다. 일부 구체예에 따르면, 입자 크기는 약 30 ㎛ 내지 약 80 ㎛이다. 한 구체예에 따르면, 입자 크기는 적어도 약 25 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 30 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 35 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 40 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 45 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 50 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 55 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 60 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 65 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 70 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 75 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 80 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 85 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 90 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 95 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 100 ㎛이다.
또 다른 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 스트링 내에 제공될 수 있다. 스트링은 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제는 스트링 전체에 걸쳐 분산될 수 있거나, 치료제(들)은 스트링에 흡수될 수 있다. 스트링은 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 스트링은 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 적어도 하나의 시트 내에 제공될 수 있다. 시트는 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제는 시트 전체에 걸쳐 분산될 수 있거나, 전압-작동 칼슘 채널 차단제는 시트에 흡수될 수 있다. 시트는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 시트는 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 보존제를 추가로 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 단위 투여 형태로 제공된다. 예시적 단위 투여 형태는 앰풀 또는 다용량 용기를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 미립자 제형은 미세입자의 현탁액을 포함한다. 일부 구체예에 따르면, 약학적 조성물은 현탁제, 안정화제 및 분산제 중 적어도 하나를 추가로 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 현탁액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 용액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 에멀젼으로 제공된다.
일부 구체예에 따르면, 약학적 조성물의 제형은 수용성 형태의 전압-작동 칼슘 채널 차단제의 수용액을 포함한다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 오일 현탁액을 포함한다. 전압-작동 칼슘 채널 차단제의 오일 현탁액은 적합한 친지질성 용매를 이용하여 제조될 수 있다. 예시적 친지질성 용매 또는 비히클은 지방 오일, 예를 들어, 참기름, 또는 합성 지방산 에스테르, 예를 들어, 에틸 올레에이트 또는 트리글리세라이드를 포함하나, 이에 제한되지는 않는다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 수성 현탁액을 포함한다. 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질, 예를 들어, 소듐 카르복시메틸 셀룰로스, 소르비톨, 또는 덱스트란을 함유할 수 있다. 임의로, 현탁액은 또한 적합한 안정화제 또는 매우 농축된 용액의 제조를 가능케 하는 화합물의 용해도를 증가시키는 작용제를 함유할 수 있다. 대안적으로, 전압-작동 칼슘 채널 차단제는 사용전에 적합한 비히클, 예를 들어, 멸균 발열원 비함유 물을 이용한 구성을 위한 분말 형태일 수 있다.
적합한 액체 또는 고체 약학적 제조물은, 예를 들어, 적절한 경우, 하나 이상의 부형제를 갖거나, 인코클리에이트화(encochleation)되거나, 현미경적 금 입자 상에 코팅되거나, 리포솜에 함유되거나, 조직으로의 이식을 위해 펠렛화되거나, 조직으로 러빙(rubbing)되는 목표 상으로 건조되는 미세피막화된 투여 형태를 포함한다. 본원에서 사용되는 용어 "미세피막화"는 논파레일(nonpareil), 펠렛, 결정, 응집물, 미세구, 또는 나노입자를 포함하나, 이에 제한되지는 않는 고체 구조를 생성시키기 위해 매우 작은 비말 또는 입자가 생체적합하거나, 생물분해성이거나, 중합성 또는 비-중합성인 물질의 연속적 필름으로 둘러싸이거나 코팅되는 과정을 나타낸다. 이러한 약학적 조성물은 또한 활성 화합물의 연장된 방출을 갖는 과립, 비드, 분말, 정제, 코팅된 정제, (미세)캡슐, 좌약, 시럽, 에멀젼, 현탁액, 크림, 점적 또는 제조물의 형태로 존재할 수 있고, 이의 제조에서 부형제 및 첨가제 및/또는 보조제, 예를 들어, 붕해제, 결합제, 코팅 작용제, 팽창 작용제(swelling agent), 윤활제, 또는 용해화제가 상기 기재된 바와 같이 통상적으로 사용된다. 약학적 조성물은 다양한 약물 전달 시스템에서의 사용에 적합하다. 약물 전달을 위한 방법의 간단한 개관을 위해, 참조로서 본원에 포함되는 문헌[Langer (1990) Science 249, 1527-1533]을 참조하라.
미세피막화
방법
미세피막화 방법 및 생성물; 에멀젼-기반 미세입자의 생성을 위한 방법; 에멀젼-기반 미세입자 및 이의 생성을 위한 방법; 조정가능한 추출 속도를 갖는 용매 추출 미세피막화; 용매 및 염을 이용한 미세피막화 방법; 미세입자를 제조하기 위한 연속적 이중 에멀젼 방법; 미세입자 특성인 중합체 블렌드로부터의 조절된 방출 시스템을 조정하기 위한 건조 방법; 다양한 비-반복 단위를 갖는 중합체를 포함하는 중합체 혼합물 및 이를 제조하거나 이용하는 방법; 및 미세입자 및 이와 함께 사용하기 위한 워크헤드 어셈블리(workhead assembly)를 제조하기 위한 에멀젼 기반 방법의 예는 미국 특허 번호 5,407,609호(제목: Microencapsulation Process and Products Thereof), 미국 출원 번호 10/553,003호(제목: Method for the production of emulsion-based microparticles), 미국 출원 번호 11/799,700호(제목: Emulsion-based microparticles and methods for the production thereof), 미국 출원 번호 12/557,946호(제목: Solvent Extraction Microencapsulation With Tunable Extraction Rates), 미국 출원 번호 12/779,138호(제목: Hyaluronic Acid (HA) Injection Vehicle), 미국 출원 번호 12/562,455호(제목: Microencapsulation Process With Solvent And Salt), 미국 출원 번호 12/338,488호(제목: Process For Preparing Microparticles Having A Low Residual Solvent Volume); 미국 출원 번호 12/692,027호(제목: Controlled Release Systems From Polymer Blends); 미국 출원 번호 12/692,020호(제목: Polymer Mixtures Comprising Polymers Having Different Non-Repeating Units And Methods For Making And Using Same); 미국 출원 번호 10/565,401호(제목: "Controlled release compositions"); 미국 출원 번호 12/692,029호(제목: "Drying Methods for Tuning Microparticle Properties); 미국 출원 번호 12/968,708호(제목: "Emulsion Based Process for Preparing Microparticles and Workhead for Use with Same); 및 미국 출원 번호 13/074,542호(제목: Composition and Methods for Improved Retention of a Pharmaceutical Composition at a Local Administration Site")에 개시되고 기재되어 있다. 상기 참고문헌 각각의 내용은 전체내용이 참조로서 본원에 포함된다.
일부 구체예에 따르면, 미세입자 기술을 이용한 전압-작동 칼슘 채널 차단제의 전달은 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 피막화시키는 생분해성 중합 입자를 포함한다.
한 구체예에 따르면, 미세입자 제형은 중합체 매트릭스를 포함하며, 전압-작동 칼슘 채널 차단제가 상기 중합체 매트릭스에 주입된다. 한 구체예에 따르면, 중합체는 서방형 중합체이다. 한 구체예에 따르면, 중합체는 폴리 (D, L-락티드-코-글리콜리드)이다. 또 다른 구체예에 따르면, 중합체는 폴리(오르토에스테르)이다. 또 다른 구체예에 따르면, 중합체는 폴리(언하이드라이드)이다. 또 다른 구체예에 따르면, 중합체는 폴리락티드-폴리글리콜리드이다.
비-생물분해성 및 생물분해성 중합 물질 둘 모두는 전압-작동 칼슘 채널 차단제를 전달하기 위한 입자의 제조에서 사용될 수 있다. 이러한 중합체는 자연 또는 합성 중합체일 수 있다. 중합체는 방출이 요망되는 기간을 기초로 하여 선택된다. 특히 관심있는 생체결합성 중합체는 교시내용이 본원에 포함되는 문헌[Sawhney et al in Macromolecules (1993) 26, 581-587]에 기재된 바와 같은 생분해성 하이드로겔을 포함하나, 이에 제한되지는 않는다. 예시적 생분해성 하이드로겔은 폴리히알루론산, 카세인, 젤라틴, 글루틴, 폴리언하이드라이드, 폴리아크릴산, 알기네이트, 키토산, 폴리(메틸 메타크릴레이트), 폴리(에틸 메타크릴레이트), 폴리(부틸메타크릴레이트), 폴리(이소부틸 메타크릴레이트), 폴리(헥실메타크릴레이트), 폴리(이소데실 메타크릴레이트), 폴리(라우릴 메타크릴레이트), 폴리(페닐 메타크릴레이트), 폴리(메틸 아크릴레이트), 폴리(이소프로필 아크릴레이트), 폴리(이소부틸 아크릴레이트), 및 폴리(옥타데실 아크릴레이트)를 포함하나, 이에 제한되지는 않는다. 한 구체예에 따르면, 생체결합성 중합체는 히알루론산이다. 일부 상기 구체예에서, 생체결합성 중합체는 약 2.3% 미만의 히알루론산을 포함한다.
일부 구체예에 따르면, 약학적 조성물은 비경구 주사, 외과적 이식, 또는 이들의 조합을 위해 제형화된다. 일부 상기 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 멸균 수용액 또는 비수성 용액, 분산액, 현탁액 또는 에멀젼 또는 멸균의 주사가능한 용액 또는 분산액으로의 재구성을 위한 멸균 분말의 형태이다. 적합한 수성 및 비수성 담체, 희석제, 용매 또는 비히클의 예는 물, 에탄올, 디클로로메탄, 아세토니트릴, 에틸 아세테이트, 폴리올 (프로필렌 글리콜, 폴리에틸렌 글리콜, 글리세롤 등), 이들의 적합한 혼합물, 식물성 오일(예를 들어, 올리브유) 및 주사가능한 유기 에스테르, 예를 들어, 에틸 올레에이트를 포함하나, 이에 제한되지는 않는다. 적절한 유동성은, 예를 들어, 레시틴과 같은 코팅의 사용, 분산액의 경우에서 필요한 입자 크기의 유지, 및 계면활성제의 사용에 의해 유지될 수 있다. 현탁액은 추가로 현탁제, 예를 들어, 에톡실화된 이소스테아릴 알콜, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미정질 셀룰로스, 알루미늄 메타하이드록사이드, 벤토나이트, 아가-아가, 트래거캔쓰, 및 이들의 혼합물을 함유할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 주사가능한 데포 형태로 제형화된다. 주사가능한 데포 형태는 생물분해성 중합체 중에서 전압 작동 칼슘 채널 차단제의 미세피막화된 매트릭스를 형성시킴으로써 제조된다. 약물 대 중합체의 비 및 사용되는 특정 중합체의 특성에 따라, 약물 방출의 속도가 조절될 수 있다. 이러한 장기 작용 제형은 적합한 중합성 또는 소수성 물질(예를 들어, 허용가능한 오일 중의 에멀젼) 또는 이온 교환 수지와 함께 제형화될 수 있거나, 가용성이 부족한 유도체, 예를 들어, 가용성이 부족한 염으로 제형화될 수 있다. 생물분해성 중합체의 예는 폴리락티드-폴리글리콜리드, 폴리(오르토에스테르) 및 폴리(언하이드라이드)를 포함하나, 이에 제한되지는 않는다. 데포 주사용 제형은 또한 신체 조직과 상용성인 리포솜 또는 마이크로에멀젼 중에 약물을 엔트랩핑(entrapping)시킴으로서 제조된다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리글리콜리드(PGA) 매트릭스 중 또는 상에 주입된다. PGA는 봉합에서 사용하기 위해 개발된 선형 지방족 폴리에스테르이다. 연구들은 트리메틸렌 카르보네이트, 폴리락트산(PLA), 및 폴리카프롤락톤과 함께 형성된 PGA 공중합체를 보고하였다. 이들 공중합체 중 일부는 지속 약물 방출을 위한 미세입자로서 제형화될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리에스테르-폴리에틸렌 글리콜 매트릭스 내 또는 상에 주입된다. 폴리에스테르-폴리에틸렌 글리콜 화합물이 합성될 수 있고, 이들은 연성이고, 약물 전달에 사용될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리 (아미노)-유래 생체중합체 매트릭스 내 또는 상에 주입된다. 폴리 (아미노)-유래 생체중합체는 지방족 디아민으로서 락트산 및 리신을 함유하는 것(예를 들어, 미국 특허 5,399,665호 참조), 및 티로신-유래 폴리카르보네이트 및 폴리아크릴레이트를 포함할 수 있으나, 이에 제한되지는 않는다. 폴리카르보네이트의 변형은 에스테르의 알킬 사슬(에틸 내지 옥틸)의 길이를 변경시킬 수 있는 한편, 폴리아릴레이트의 변형은 중합체의 큰 과변이 및 중합체 특성에서의 큰 유연성을 가능케 하는 이산(예를 들어, 숙신산 내지 세바식산)의 알킬 사슬의 길이를 변경시키는 것을 추가로 포함할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리언하이드라이드 매트릭스 내 또는 상에 주입된다. 폴리언하이드라이드는 용융 중합에 의한 2개의 이산 분자의 탈수에 의해 제조된다(예를 들어, 미국 특허 4,757,128호 참조). 이들 중합체는 표면 침식(벌크 침식에 의해 분해되는 폴리에스테르에 비함)에 의해 분해된다. 약물의 방출은 선택된 단량체의 친수성에 의해 조절될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 광중합성 생체중합체 매트릭스 내 또는 상에 주입된다. 광중합성 생체중합체는 락트산/폴리에틸렌 글리콜/아크릴레이트 공중합체를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 하이드로겔 매트릭스 내 또는 상에 주입된다. 용어 "하이드로겔"은 젤라틴성 또는 젤리-유사 덩어리를 생성시키기 위해 필요한 수성 성분을 함유하는 고체, 반고체, 슈도플라스틱 또는 플라스틱 구조를 발생시키는 물질을 나타낸다. 하이드로겔은 일반적으로 친수성 중합체, 아크릴산, 아크릴아미드 및 2-하이드록시에틸메타크릴레이트(HEMA)를 포함하는 다양한 중합체를 포함한다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 생체중합체 매트릭스 내 또는 상에 주입된다. 자연-발생 생체중합체는 단백질 중합체, 콜라겐, 다당류, 및 광중합성 화합물을 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 단백질 중합체 매트릭스 내 또는 상에 주입된다. 단백질 중합체는 자가-어셈블링 단백질 중합체, 예를 들어, 비단 피브로인, 엘라스틴, 콜라겐, 및 이들의 조합물로부터 합성되었다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 다당류 매트릭스 내 또는 상에 주입된다. 자연-발생 다당류는 키틴 및 이의 유도체, 히알루론산, 덱스트란 및 셀룰로식(일반적으로, 변형 없이 생체분해성이지 않음), 및 수크로스 아세테이트 이소부티레이트(SAIB)를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 키틴 매트릭스 내 또는 상에 주입된다. 키틴은 주로 2-아세트아미도-2-데옥시-D-글루코스 기로 구성되며, 이는 효모, 진균 및 해양 무척추동물(새우, 갑각류)에서 발견되며, 여기서 이는 외골격의 주요 성분이다. 키틴은 수용성이 아니며, 탈아세틸화된 키틴, 키토산 만이 산성 용액(예를 들어, 아세트산)에서 가용성이다. 연구들은 수용성이고, 매우 높은 분자량(2백만 달톤 초과)이고, 점탄성이고, 비독성이고, 생체적합성이고, 과산화물, 글루테르알데하이드, 글리옥살 및 다른 알데하이드 및 카르보디아미드와 가교되어 겔을 형성할 수 있는 키틴 유도체를 보고하였다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 히알루론산(HA) 매트릭스 내 또는 상에 주입된다. 교대하는 글루쿠로니드 결합(glucuronidic bond) 및 글루코사미니드 결합(glucosaminidic bond)으로 구성되고, 분리되고 정제되는 포유동물 유리체액, 뇌의 세포외 기질, 윤활액, 제대 및 수탉 볏에서 발견되는 히알루론산(HA)이 또한 발효 과정에 의해 생성될 수 있다.
일부 구체예에 따르면, 약학적 조성물은 애쥬번트를 추가로 포함한다. 예시적 애쥬번트는 보존제, 습윤제, 에멀젼화제, 및 분산제를 포함하나, 이에 제한되지는 않는다. 미생물의 작용의 예방은 다양한 항균제 및 항진균제, 예를 들어, 파라벤, 클로로부탄올, 페놀, 소르브산 등에 의해 보장될 수 있다. 등장화제, 예를 들어, 당, 소듐 클로라이드 등이 또한 포함될 수 있다. 주사용 약학적 형태의 연장 흡수는 흡수를 지연시키는 작용제, 예를 들어, 알루미늄 모노스테아레이트 및 젤라틴의 사용에 의해 발생될 수 있다.
제형은, 예를 들어, 말단 감마 방사선조사, 박테리아-보전 필터를 통한 여과에 의하거나, 사용 직전에 멸균수 또는 다른 멸균된 주사용 매질에 용해되거나 분산될 수 있는 멸균 고체 조성물 형태의 멸균 작용제를 혼입시킴으로써 멸균될 수 있다. 주사용 제조물, 예를 들어, 멸균 주사용 수성 또는 유성 현탁액이 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당 분야에 공지된 바에 따라 제형화될 수 있다. 멸균 주사용 제조물은 또한 비독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사용 용액, 현탁액 또는 에멀젼, 예를 들어, 1,3-부탄디올, 디클로로메탄, 에틸 아세테이트, 아세토니트릴 등 중 용액일 수 있다. 사용될 수 있는 허용되는 비히클 및 용매는 물, 링거액, U.S.P. 및 등장성 소듐 클로라이드 용액이다. 또한, 멸균 고정유가 통상적으로 사용되거나 용매 또는 현탁 매질로 사용된다. 이러한 목적을 위해, 합성 모노- 또는 디글리세라이드를 포함하는 임의의 순한 고정유가 사용될 수 있다. 또한, 지방산, 예를 들어, 올레산이 주사 가능 물질의 제조에서 사용된다.
비경구(피하, 피내, 근내, 정맥내, 동맥내, 수막강내, 뇌실내 및 관절내를 포함하나, 이에 제한되지는 않음) 투여를 위한 제형은 항산화제, 완충제, 정균제 및 제형이 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비수성 멸균 주사 용액; 및 현탁제 및 증점제를 포함할 수 있는 수성 및 비수성 멸균 현탁액을 포함한다.
또 다른 구체예에 따르면, 약학적 조성물은 전압-작동 칼슘 채널 차단제를 수 용해도를 향상시키는 중합체에 컨쥬게이션시킴으로써 제형화된다. 적합한 중합체의 예는 폴리에틸렌 글리콜, 폴리-(d-글루탐산), 폴리-(1-글루탐산), 폴리-(1-글루탐산), 폴리-(d-아스파르트산), 폴리-(1-아스파르트산), 폴리-(1-아스파르트산) 및 이들의 공중합체를 포함하나, 이에 제한되지는 않는다. 약 5,000 내지 약 100,000의 분자량, 및 약 20,000 내지 약 80,000의 분자량을 갖는 폴리글루탐산이 사용될 수 있고, 약 30,000 내지 약 60,000의 분자량을 갖는 폴리글루탐산이 또한 사용될 수 있다. 중합체는 참조로서 본원에 포함되는 미국 특허 번호 5,977,163호에 본질적으로 기재된 바와 같은 프로토콜을 이용하여 본 발명의 에포틸론의 하나 이상의 하이드록실로 에스테르 결합을 통해 컨쥬게이션된다. 특정 컨쥬게이션 부위는 본 발명의 21-하이드록시-유도체의 경우에 하이드록실 오프 탄소-21(hydroxyl off carbon-21)을 포함한다. 다른 컨쥬게이션 부위는 하이드록실 오프 탄소 3 및/또는 하이드록실 오프 탄소 7을 포함하나, 이에 제한되지는 않는다.
적합한 완충제는 아세트산 및 염(1-2% w/v); 시트르산 및 염(1-3% w/v); 붕산 및 염(0.5-2.5% w/v); 및 인산 및 염(0.8-2% w/v)을 포함한다. 적합한 보존제는 벤즈알코늄 클로라이드(0.003-0.03% w/v); 클로로부탄올(0.3-0.9% w/v); 파라벤(0.01-0.25% w/v) 및 티메로살(0.004-0.02% w/v)을 포함한다.
또 다른 구체예에 따르면, 반고체 다중입자 전달 시스템은 부분적으로 또는 전체적으로 생체적합성, 생물분해성, 점성 반고체를 포함하며, 여기서 반고체는 하이드로겔을 포함하고, 하이드로겔은 전압-작동 칼슘 채널 차단제를 포함한다. 본원에서 사용되는 용어 "하이드로겔"은 젤라틴성 또는 젤리-유사 덩어리를 생성시키기 위해 필요한 수성 성분을 함유하는 고체, 반고체, 슈도플라스틱 또는 플라스틱 구조를 발생시키는 물질을 나타낸다. 하이드로겔은 수성 환경의 존재하에서 평형 함량에 궁극적으로 도달하는 유의한 양의 H2O를 포함하고 보유한다. 한 구체예에서, 이하 GMO로 언급되는 글리세릴 모노올레에이트가 의도된 반고체 전달 시스템 또는 하이드로겔이다. 그러나, 점도/견고성과 관련하여 유사한 물리적/화학적 특성을 갖는 많은 하이드로겔, 중합체, 탄화수소 조성물 및 지방산 유도체가 반고체 전달 시스템으로 작용할 수 있다.
한 구체예에서, 겔 시스템은 GMO를 이의 융점(40-50℃) 이상으로 가열하고, 가온된 수성-기반 완충액 또는 전해질 용액, 예를 들어, 포스페이트 완충액 또는 일반 염수를 첨가하여 이에 따라 3차원 구조를 생성시킴으로써 생성된다. 수성-기반 완충액은 다른 수용액 또는 반-극성 용매를 함유하는 조합물로 이루어질 수 있다.
GMO는 친지질성 물질을 혼입시키는 능력을 갖는 주로 지질-기반 하이드로겔을 제공한다. 본원에서 사용되는 용어 "친지질성"은 극성 또는 수성 환경에 비해 비-극성 환경에 대한 친화성을 우선화시키거나 가공시키는 것을 나타낸다. GMO는 친수성 화합물을 혼입시키고 전달하는 내부 수성 채널을 추가로 제공한다. 본원에서 사용되는 용어 "친수성"은 극성 물질, 예를 들어, 물에 대한 친화성을 갖는 재료 또는 물질을 나타낸다. 실온(-25℃)에서, 겔 시스템이 광범위한 점도 척도를 포함하는 다양한 상을 나타낼 수 있는 것이 인지된다.
한 구체예에서, 실온 및 생리학적 온도(약 37℃) 및 pH(약 7.4)에서의 특성으로 인해 2개의 겔 시스템 상이 이용된다. 2개의 겔 시스템 상 내에서, 첫번째 상은 약 5% 내지 약 15%의 H2O 함량 및 약 95% 내지 약 85%의 GMO 함량의 층판 상이다. 층판 상은 적절한 점성의 유체이며, 이는 용이하게 조작되고, 따라지고, 주사될 수 있다. 두번째 상은 약 15% 내지 약 40%의 H2O 함량 및 약 85%-60%의 GMO 함량으로 이루어지는 입방 상이다. 이는 약 35 중량% 내지 약 40 중량%의 평형 물 함량을 갖는다. 본원에서 사용되는 용어 "평형 물 함량"은 과량의 물의 존재하에서의 최대 물 함량을 나타낸다. 따라서, 입방 상은 약 35 중량% 내지 약 40 중량%의 물을 포함한다. 입방 상은 고도로 점성이다. 점도는 브룩필드(Brookfield) 점도계에 의해 측정시 120만 센티푸아즈(centipoise, cp)를 초과하며, 120만 cp는 브룩필드 점도계의 cup 및 bob 구성을 통해 수득가능한 점도의 최대 측정치이다. 일부 상기 구체예에서, 치료제는 지속된 연속 전달을 위한 시스템을 제공하기 위해 반고체로 혼입될 수 있다. 일부 상기 구체예에서, 치료제는 칼슘 채널 차단제이다. 일부 상기 구체예에서, 치료제는 디하이드로피리딘 칼슘 채널 차단제이다. 일부 상기 구체예에서, 치료제는 니모디핀이다. 일부 상기 구체예에서, 다른 치료제, 생물학적 활성제, 약물, 의약 및 비활성제가 다양한 방출 속도로 신체에서 국소적인 생물학적, 생리학적 또는 치료적 효과를 제공하기 위해 반고체로 혼입될 수 있다.
일부 구체예에서, 반고체의 친지질성 특성이 변경되거나, 대안적으로, 반고체 내에 함유된 수성 채널이 변경되도록 하는 대안적 반고체, 변형된 제형 및 생성 방법이 이용된다. 따라서, 다양한 농도의 다양한 치료제가 다양한 속도로 반고체로부터 확산될 수 있거나, 반고체의 수성 채널을 통해 시간 경과에 따라 반고체로부터 방출될 수 있다. 수성 성분의 점도, 유동성, 표면 장력 또는 극성의 변경에 의해 반고체 일관성 또는 치료제 방출을 변경시키기 위해 친수성 물질이 이용될 수 있다. 예를 들어, 단일결합이 아닌 지방산 모이어티의 탄소 9 및 탄소 10에서의 이중결합을 제외하고는 GMO와 구조적으로 동일한 글리세릴 모노스테아레이트(GMS)는 가열 및 수성 성분의 첨가 후에 겔이 아닌 반면, GMO는 겔이다. 그러나, GMS는 계면활성제이므로, GMS는 약 20 중량%/중량까지 H2O에서 혼화성이다. 본원에서 사용되는 용어 "계면활성제"는 제한된 농도에서 H2O 중에서 혼화성일 뿐만 아니라 극성 물질인 표면 활성 작용제를 나타낸다. 가열 및 교반시, 80% H2O/20% GMS 조합은 핸드 로션과 유사한 일관성을 갖는 바를 수 있는 페이스트를 생성시킨다. 이후, 페이스트는 상기 언급된 높은 점도를 갖는 입방 상 겔을 형성시키기 위해 융해된 GMO와 조합된다.
또 다른 구체예에 따르면, 가수분해된 젤라틴, 예를 들어, 시판되는 Gelfoam™이 수성 성분을 변경시키는데 이용된다. 약 6.25 중량% 내지 12.50 중량% 농도의 Gelfoam™이 약 93.75 중량% 내지 87.50 중량%의 H2O 또는 또 다른 수성 기반 완충액에 각각 배치될 수 있다. 가열 및 교반시, H2O(또는 다른 수성 완충액)/GelfoamTM 조합은 진한 젤라틴성 물질을 생성시킨다. 생성된 물질은 GMO와 조합되고, 이렇게 형성된 생성물은 팽창하고, 순수한 GMO 겔 단독에 비해 덜 순응성(malleable)인 매우 점성의 반투명 겔을 형성한다.
또 다른 구체예에 따르면, 약물 용해화를 돕기 위해 수성 성분을 변경시키는데 폴리에틸렌 글리콜(PEG)이 이용될 수 있다. 약 0.5 중량% 내지 40 중량% 농도의 PEG(PEG 분자량에 따름)가 약 99.5 중량% 내지 60 중량%의 H2O 또는 다른 수성 기반 완충액에 배치될 수 있다. 가열 및 교반 시, H2O(또는 다른 수성 완충액)/PEG 조합이 반고체 물질에 대한 점성 액체를 발생시킨다. 생성된 물질은 GMO와 조합되고, 이에 의해 형성된 생성물은 팽창하고, 매우 점성의 겔을 형성한다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 생각되는 바로는 2상 방식으로 확산을 통해 반고체로부터 방출된다. 첫번째 상은, 예를 들어, 친지질성 막 내에 함유되어, 이로부터 수성 채널로 확산되는 친지질성 약물을 포함한다. 두번째 상은 수성 채널로부터 외부 환경으로의 약물의 확산을 포함한다. 친지질성인 경우, 약물은 이의 제안된 지질 이중층 구조 내에서 GMO 겔 내부에서 자체로 배향될 수 있다. 따라서, 약 7.5 중량%를 초과하는 약물을 GMO로 혼입시키는 것은 3차원 구조의 온전성의 손실을 야기시킴으로써, 겔 시스템은 더 이상 반고체 입방 상을 유지하지 않고, 점성의 층판 상 액체로 복귀된다. 일부 상기 구체예에서, 치료제는 니모디핀이다. 일부 상기 구체예에서, 치료제는 칼슘 채널 차단제이다. 일부 상기 구체예에서, 치료제는 일시적 수용체 전위 단백질 차단제이다. 또 다른 구체예에 따르면, 약 1 중량% 내지 약 45 중량%의 치료제가 일반적인 3차원 구조의 붕괴 없이 생리학적 온도에서 GMO 겔에 혼입된다. 결과로서, 이러한 시스템은 약물 투여량과의 유의하게 증가된 유연성의 능력을 가능케 한다. 전달 시스템은 순응성이 있으므로, 이는 신체 내의 벽, 공간, 또는 다른 틈의 윤곽에 부착하고 적합시킬 뿐만 아니라 존재하는 모든 틈을 완전히 채우기 위해, 이식 부위, 예를 들어, 대뇌동맥 또는 거미막밑 공간에 인접한 이식 부위에 전달되고 여기서 조작될 수 있다. 전달 시스템은 이식 부위 전체에 걸친 약물 분포 및 균일한 약물 전달을 보장한다. 공간, 비제한적인 예로, 거미막밑 공간 내의 전달 시스템의 전달 및 조작의 용이성은 반고체 전달 장치를 통해 촉진된다. 반고체 전달 장치는 전달 시스템의 표적화되고 조절된 전달을 촉진한다.
대안적으로, 본 발명은 융점 이상으로 가열된 후, 물 함량을 기초로 하여 가변성의 점도의 젤라틴성 조성물을 생성시키기 위해 가온된 수성 성분을 포함시킨, 친지질성, 친수성 또는 양친매성(amphophilic)의 고체 또는 반고체 물질을 포함하는, 치료제의 국소 전달을 위한 비히클로서 작용하는 반고체 전달 시스템을 제공한다. 치료제(들)은 반고체 시스템의 혼합 및 형성 전에 융해된 친지질성 성분 또는 수성 완충액 성분으로 혼입되고 분산된다. 젤라틴성 조성물은 이후의 배치, 또는 침착을 위해 반고체 전달 장치 내에 배치된다. 순응성인 경우, 겔 시스템은 이식 부위에서 반고체 전달 장치를 통해 용이하게 전달되고 조작되며, 여기서 이는 신체 내의 이식 부위, 공간, 또는 다른 틈의 윤곽에 부착하고 적합시킬 뿐만 아니라 존재하는 모든 틈을 완전히 채운다. 대안적으로, 생체적합성 중합성 또는 비-중합성 시스템으로 구성되는 다중입자 성분이 미세구 내에 엔트랩핑된 치료제를 갖는 미세구를 생성시키는데 이용된다. 최종 가공 방법 후, 미세구는 반고체 시스템으로 통합된 후, 반고체 전달 장치 내에 배치되어, 반고체 전달 장치로부터 이식 부위 또는 동등한 공간으로 용이하게 절달됨으로써, 치료제는 이후 약물 방출 메커니즘(들)에 의해 이로부터 방출된다.
III
. 방법
또 다른 양태에서, 기재된 본 발명은 (a)(i) 전압-작동 칼슘 채널 차단제의 미립자 제형; 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물을 제공하는 단계, 및 (b) 투여 부위로 치료량의 약학적 조성물을 투여하기 위한 수단에 의해 치료량의 약학적 조성물을 투여하는 단계를 포함하는, 적어도 하나의 대뇌동맥의 중단(interruption)을 포함하는 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 상기 뇌 손상과 관련된 지연 합병증을 치료하는 방법을 제공하며, 상기 치료량은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적이다.
한 구체예에 따르면, 단계 (b)의 치료량의 약학적 조성물을 투여하는 수단은 외과적 주사 장치이고, 투여 부위는 뇌 손상에 의해 영향을 받는 대뇌동맥에 근접한 부위이다.
또 다른 구체예에 따르면, 단계 (b)의 치료량의 약학적 조성물을 투여하는 수단은 카테터이고, 투여 부위는 뇌실로의 국소적인 부위여서, 조성물의 미세입자 제형 성분은 CSF 순환에 의해 운반되어 뇌 손상에 의해 영향을 받은 대뇌동맥과 접촉된다.
일부 상기 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI), 뇌내 혈종, 뇌실내 출혈, 열, 혈관조영술 혈관연축, 미세혈전색전증, 피질 확산 허혈(CSI), 행동 결손, 신경계 결손, 뇌경색증, 신경 세포 사멸, 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 적어도 하나의 지연 합병증은 지연 대뇌 허혈(DCI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌내 혈종이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌실내 출혈이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 열이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 혈관조영술 혈관연축이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 피질 확산 허혈(CSI)이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 미세혈전색전증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 행동 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경계 결손이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 뇌경색증이다. 또 다른 구체예에 따르면, 적어도 하나의 지연 합병증은 신경 세포 사멸이다.
일부 구체예에 따르면, 뇌 손상은 내재성 질환의 결과이다. 예시적 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH) 등을 포함하나, 이에 제한되지는 않는다. 일부 상기 구체예에 따르면, 내재성 질환은 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 내재성 질환은 동맥류이다. 또 다른 구체예에 따르면, 내재성 질환은 갑작스러운 외상성 두부 손상이다. 또 다른 구체예에 따르면, 내재성 질환은 거미막밑 출혈(SAH)이다.
일부 구체예에 따르면, 포유동물 내의 전달 부위에 치료량으로 투여되는 경우 약학적 조성물은 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시킬 필요가 있는 포유동물에서 뇌 손상과 관련된 적어도 하나의 지연 합병증의 발생률 또는 중증도를 예방하거나 감소시키는데 효과적이며, 상기 뇌 손상은 적어도 하나의 대뇌동맥의 중단을 포함한다. 한 구체예에 따르면, 전달 부위는 뇌실이다. 일부 구체예에 따르면, 뇌실은 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합으로 구성되는 군으로부터 선택된다. 한 구체예에 따르면, 전달 부위는 거미막밑 공간이다. 한 구체예에 따르면, 전달 부위는 뇌 손상과 근접하여 존재한다. 또 다른 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받는 혈관에 근접하여 존재한다. 한 구체예에 따르면, 혈관은 적어도 하나의 대뇌동맥이다. 또 다른 구체예에 따르면, 혈관은 뇌 손상에 의해 영향을 받는 적어도 하나의 대뇌동맥이다.
일부 구체예에 따르면, 약학적 조성물은 비경구 주사 또는 외과적 이식에 의해 투여된다.
뇌실은 당 분야에 널리 공지되어 있고, 다양한 신경외과 교과서에 기재된 바와 같이 삽관되거나 도관삽입될 수 있다. 이는 뇌실 카테터 또는 드레인의 삽입 또는 뇌실창냄술로 언급된다. 다양한 크기의 구멍이 두개골 내에서 구멍이 뚫릴 수 있고, 뇌를 덮는 외부 경질막이 절개될 수 있다. 연질막이 절개되고, 카테터(일부 다른 생체적합성, 비흡수 화합물의 실리콘 탄성체로 일반적으로 이루어진 공동 튜브)가 뇌를 통해 선택 뇌실로 삽입된다. 이는 보통 가쪽뇌실이나, 임의의 뇌실이 도관삽입될 수 있다. 카테터는 두부 내의 압력을 모니터하거나, CSF를 배출시키거나, CSF로 물질을 투여하기 위해 이용될 수 있다.
일부 구체예에 따르면, 전달 부위는 뇌 손상의 10 mm 내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만이다.
일부 구체예에 따르면, 전달 부위는 뇌 손상에 의해 영향을 받은 대뇌동맥의 10 mm 내, 10 mm 미만, 9.9 mm 미만, 9.8 mm 미만, 9.7 mm 미만, 9.6 mm 미만, 9.5 mm 미만, 9.4 mm 미만, 9.3 mm 미만, 9.2 mm 미만, 9.1 mm 미만, 9.0 mm 미만, 8.9 mm 미만, 8.8 mm 미만, 8.7 mm 미만, 8.6 mm 미만, 8.5 mm 미만, 8.4 mm 미만, 8.3 mm 미만, 8.2 mm 미만, 8.1 mm 미만, 8.0 mm 미만, 7.9 mm 미만, 7.8 mm 미만, 7.7 mm 미만, 7.6 mm 미만, 7.5 mm 미만, 7.4 mm 미만, 7.3 mm 미만, 7.2 mm 미만, 7.1 mm 미만, 7.0 mm 미만, 6.9 mm 미만, 6.8 mm 미만, 6.7 mm 미만, 6.6 mm 미만, 6.5 mm 미만, 6.4 mm 미만, 6.3 mm 미만, 6.2 mm 미만, 6.1 mm 미만, 6.0 mm 미만, 5.9 mm 미만, 5.8 mm 미만, 5.7 mm 미만, 5.6 mm 미만, 5.5 mm 미만, 5.4 mm 미만, 5.3 mm 미만, 5.2 mm 미만, 5.1 mm 미만, 5.0 mm 미만, 4.9 mm 미만, 4.8 mm 미만, 4.7 mm 미만, 4.6 mm 미만, 4.5 mm 미만, 4.4 mm 미만, 4.3 mm 미만, 4.2 mm 미만, 4.1 mm 미만, 4.0 mm 미만, 3.9 mm 미만, 3.8 mm 미만, 3.7 mm 미만, 3.6 mm 미만, 3.5 mm 미만, 3.4 mm 미만, 3.3 mm 미만, 3.2 mm 미만, 3.1 mm 미만, 3.0 mm 미만, 2.9 mm 미만, 2.8 mm 미만, 2.7 mm 미만, 2.6 mm 미만, 2.5 mm 미만, 2.4 mm 미만, 2.3 mm 미만, 2.2 mm 미만, 2.1 mm 미만, 2.0 mm 미만, 1.9 mm 미만, 1.8 mm 미만, 1.7 mm 미만, 1.6 mm 미만, 1.5 mm 미만, 1.4 mm 미만, 1.3 mm 미만, 1.2 mm 미만, 1.1 mm 미만, 1.0 mm 미만, 0.9 mm 미만, 0.8 mm 미만, 0.7 mm 미만, 0.6 mm 미만, 0.5 mm 미만, 0.4 mm 미만, 0.3 mm 미만, 0.2 mm 미만, 0.1 mm 미만, 0.09 mm 미만, 0.08 mm 미만, 0.07 mm 미만, 0.06 mm 미만, 0.05 mm 미만, 0.04 mm 미만, 0.03 mm 미만, 0.02 mm 미만, 0.01 mm 미만, 0.009 mm 미만, 0.008 mm 미만, 0.007 mm 미만, 0.006 mm 미만, 0.005 mm 미만, 0.004 mm 미만, 0.003 mm 미만, 0.002 mm 미만, 0.001 mm 미만이다.
일부 구체예에 따르면, 약학적 조성물은 전달 부위에 1일 내지 30일 범위의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 한 구체예에 따르면, 약학적 조성물은 전달 부위에 1일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 2일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 3일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 4일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 5일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 6일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 7일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 8일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 9일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 10일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 15일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다. 또 다른 구체예에 따르면, 약학적 조성물은 전달 부위에 30일의 반감기 내로 전압 작동 칼슘 채널 차단제를 방출할 수 있다.
치료 효과
또 다른 구체예에 따르면, 손상된 뇌로의 약학적 조성물의 이식은 식욕을 개선시킬 수 있다.
또 다른 구체예에 따르면, 손상된 뇌로의 약학적 조성물의 이식은 실조 또는 불완전마비를 개선시킬 수 있다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 주로 국소화된 약리학적 효과를 발생시킬 수 있다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 주로 국소화된 약리학적 효과를 발생시킨다. 한 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 주로 국소화된 약리학적 효과를 발생시킨다.
또 다른 구체예에 따르면, 전달 부위에서의 전압-작동 칼슘 채널 차단제의 방출은 요망되는 기간에 걸쳐 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킨다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 1일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 2일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 3일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 4일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 5일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 6일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 7일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 8일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 15일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제의 방출은 30일 동안 중추신경계(CNS) 전체에 걸쳐 광범위한 약리학적 효과를 발생시킬 수 있다.
한 구체예에 따르면, 전달 부위에서의 국소화된 약리학적 효과는 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥의 내부 직경이 대조군에 비해 증가되도록 하는 혈관연축의 감소이다. 한 구체예에 따르면, 약학적 조성물은 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적이다.
한 구체예에 따르면, 광범위한 약리학적 효과는 전달 부위로부터 적어도 10 mm, 적어도 9.9 mm, 적어도 9.8 mm, 적어도 9.7 mm, 적어도 9.6 mm, 적어도 9.5 mm, 적어도 9.4 mm, 적어도 9.3 mm, 적어도 9.2 mm, 적어도 9.1 mm, 적어도 9.0 mm, 적어도 8.9 mm, 적어도 8.8 mm, 적어도 8.7 mm, 적어도 8.6 mm, 적어도 8.5 mm, 적어도 8.4 mm, 적어도 8.3 mm, 적어도 8.2 mm, 적어도 8.1 mm, 적어도 8.0 mm, 적어도 7.9 mm, 적어도 7.8 mm, 적어도 7.7 mm, 적어도 7.6 mm, 적어도 7.5 mm, 적어도 7.4 mm, 적어도 7.3 mm, 적어도 7.2 mm, 적어도 7.1 mm, 적어도 7.0 mm, 적어도 6.9 mm, 적어도 6.8 mm, 적어도 6.7 mm, 적어도 6.6 mm, 적어도 6.5 mm, 적어도 6.4 mm, 적어도 6.3 mm, 적어도 6.2 mm, 적어도 6.1 mm, 적어도 6.0 mm, 적어도 5.9 mm, 적어도 5.8 mm, 적어도 5.7 mm, 적어도 5.6 mm, 적어도 5.5 mm, 적어도 5.4 mm, 적어도 5.3 mm, 적어도 5.2 mm, 적어도 5.1 mm, 적어도 5.0 mm 내인 혈관의 내부 직경이 대조군에 비해 증가되는 혈관연축의 감소이다.
일부 구체예에 따르면, 약학적 조성물은 뇌의 가쪽뇌실, 셋째뇌실, 또는 넷째뇌실, 또는 거미막밑 수조 중 하나로 삽입되는 카테터 또는 튜브를 통해 뇌실로 주입된다.
전압-작동 칼슘 채널 차단제
일부 구체예에 따르면, 전압-작동 채널 차단제는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택된다.
조성물로 제형화될 수 있는 전압-작동 칼슘 채널 차단제의 비제한적인 예는 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는다.
예를 들어, L-타입 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 L-타입 차단제, 예를 들어, 니솔디핀, 니카르디핀 및 니페디핀, AHF(예를 들어, 4aR,9aS)-(+)-4a-아미노-1,2,3,4,4a,9a-헥사하이드로-4aH-플루오렌, HCl), 이스라디핀(예를 들어, 4-(4-벤조푸라자닐)-1,-4-디하이드로-2,6-디메틸-3,5-피리딘디카르복실산 메틸 1-메틸에틸 에스테르), 칼시셉틴(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스로부터의 분리물), H-Arg-Ile-Cys-Tyr-Ile-His-Lys-Ala-Ser-Leu-Pro-Arg-Ala-Thr-Lys-Thr-Cys-Val-Glu-Asn-Thr-Cys-Tyr-Lys-Met-Phe-Ile-Arg-Thr-Gln-Arg-Glu-Tyr-Ile-Ser-Glu-Arg-Gly-Cys-Gly-Cys-Pro-Thr-Ala-Met-Trp-Pro-Tyr-Gln-Thr-Glu-Cys-Cys-Lys-Gly-Asp-Arg-Cys-Asn-Lys-OH, 칼시클루딘(예를 들어, 덴드로아스피스 앙구스티셉스(이스턴 그린 맘바)로부터의 분리물), (H-Trp-Gln-Pro-Pro-Trp-Tyr-Cys-Lys-Glu-Pro-Val-Arg-Ile-Gly-Ser-Cys-Lys-Lys-Gln-Phe-Ser-Ser-Phe-Tyr-Phe-Lys-Trp-Thr-Ala-Lys-Lys-Cys-Leu-Pro-Phe-Leu-Phe-Ser-Gly-Cys-Gly-Gly-Asn-Ala-Asn-Arg-Phe-Gln-Thr-Ile-Gly-Glu-Cys-Arg-Lys-Lys-Cys-Leu-Gly-Lys-OH, 실니디핀(예를 들어, 또한 FRP-8653, 디하이드로피리딘-타입 억제제), 딜란티젬(예를 들어, (2S,3S)-(+)-시스-3-아세톡시-5-(2-디메틸아미노에틸)-2,3-디하이드로-2-(4-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 하이드로클로라이드), 딜티아젬(예를 들어, 벤조티아제핀-4(5H)-온, 3-(아세틸옥시)-5-[2-(디메틸아미노)에틸]-2,3-디하이드로-2-(4-메톡시페닐)-- ,(+)-시스-, 모노하이드로클로라이드), 펠로디핀(예를 들어, 4-(2,3-디클로로페닐)-1,4-디하이드로-2,6-디메틸-3,5-피리딘카르복실산 에틸 메틸 에스테르), FS-2(예를 들어, 덴드로아스피스 폴리레피스 폴리레피스 베놈으로부터의 분리물), FTX-3.3(예를 들어, 아겔레놉시스 아페르타로부터의 분리물), 네오마이신 설페이트(예를 들어, C23H46N6O13·3H2SO4), 니카르디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닙메틸-2-[메틸(페닐메팁아미노]-3,5-피리딘디카르복실산 에틸 에스테르 하이드로클로라이드, 또한 YC-93, 니페디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(2-니트로페닐)-3,5-피리딘디카르복실산 디메틸 에스테르), 니모디핀(예를 들어, 4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 2-메톡시에틸 1-메틸에틸 에스테르) 또는 (이소프로필 2-메톡시에틸 1,4-디하이드로-2,6-디메틸-4-(m-니트로페닐)-3,5-피리딘디카르복실레이트), 니트렌디핀(예를 들어, 1,4-디하이드로-2,6-디메틸-4-(3-니트로페닐)-3,5-피리딘디카르복실산 에틸 메틸 에스테르), S-페타신(예를 들어, (3S,4aR,5R,6R)-[2,3,4,4a,5,6,7,8-옥타하이드로-3-(2-프로페닐)-4a,5-디메틸-2-옥소-6-나프틸]Z-3'-메틸티오-1'-프로페노에이트), 플로레틴(예를 들어, 2',4',6'-트리하이드록시-3-(4-하이드록시페닐)프로피오페논, 또한 3-(4-하이드록시페닐)-1-(2,4,6-트리하이드록시페닐)-1-프로파논, 또한 b-(4-하이드록시페닐)-2,4,6-트리하이드록시프로피오페논), 프로토핀(예를 들어, C20H19NO5Cl), SKF-96365(예를 들어, 1-[b-[3-(4-메톡시페닐)프로폭시]-4-메톡시펜에닐]-1H-이미다졸, HCl), 테트란딘(예를 들어, 6,6',7,12-테트라메톡시-2,2'-디메틸베르바만), (.+-.)-메톡시베라파밀 또는 (+)-베라파밀(예를 들어, 54N-(3,4-디메톡시페닐에틸)메틸아미노]-2-(3,4-디메톡시페닐)-2-이소-프로필발레로니트릴 하이드로클로라이드), 및 (R)-(+)-Bay K8644(예를 들어, R-(+)-1,4-디하이드로-2,6-디메틸-5-니트로-442-(트리플루오로메틸)페닐]-3-피리딘카르복실산 메틸 에스테르)를 포함하나, 이에 제한되지는 않는다. 전술한 예는 L-타입 전압-작동 칼슘 채널에 특이적일 수 있거나, 더 광범위한 전압-작동 칼슘 채널, 예를 들어, N, P/Q, R, 및 T-타입을 억제할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 디하이드로피리딘 칼슘 채널 차단제이다. 한 구체예에 따르면, 디하이드로피리딘 칼슘 채널 차단제는 니모디핀이다. 한 구체예에 따르면, 니모디핀은 본원에 기재된 바와 같이 제형화되는 경우 7-10일의 반감기, 및 적절한 지질 용해도를 갖는다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 분리된 분자이다. 본원에서 사용되는 용어 "분리된 분자"는 실질적으로 순수하고, 이의 의도된 용도에 대해 실시가능하고 적절한 정도까지 자연적으로 또는 생체내 시스템에서 보통 발견되는 다른 물질을 함유하지 않는 분자를 나타낸다.
일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 약학적 제조물 내에서 약학적으로 허용되는 담체와 혼합된다. 일부 상기 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 제조물의 단지 작은 중량 백분율을 포함한다. 일부 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 실질적으로 순수하다.
약학적으로 허용되는
담체
일부 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 담체를 포함하지 않는다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함하지 않는다.
한 구체예에 따르면, 약학적으로 허용되는 담체는 고체 담체 또는 부형제이다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔-상 담체 또는 부형제이다. 담체 또는 부형제의 예는 칼슘 카르보네이트, 칼슘 포스페이트, 다양한 단량체 및 중합체 당(히알루론산을 포함하나, 이로 제한되지는 않음), 전분, 셀룰로스 유도체, 젤라틴, 및 중합체를 포함하나, 이에 제한되지는 않는다. 예시적 담체는 또한 염수 비히클, 예를 들어, 인산염 완충 염수(PBS) 중 하이드록실 프로필 메틸 셀룰로스(HPMC)를 포함할 수 있다.
일부 구체예에 따르면, 약학적으로 허용되는 담체는 점착성을 제공한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 히알루론산을 포함한다. 일부 구체예에 따르면, 약학적으로 허용되는 담체는 0% 내지 5%의 히알루론산을 포함한다. 한 구체예에 따르면, 약학적으로 허용되는 담체는 0.05% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 0.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 1.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.1% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.2% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.3% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.4% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.6% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.7% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.8% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 2.9% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 3.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.0% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 4.5% 미만의 히알루론산을 포함한다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 5.0% 미만의 히알루론산을 포함한다.
일부 구체예에서, 약학적으로 허용되는 담체는, 임의로 지속 방출 겔로서 겔, 서방형 고체 또는 반고체 화합물을 포함하나, 이에 제한되지는 않는다. 일부 상기 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체에 엠베딩된다. 일부 구체예에서, 전압-작동 칼슘 채널 차단제는 약학적으로 허용되는 담체 상에 코팅된다. 코팅은 임의의 요망되는 물질, 바람직하게는 중합체 또는 다양한 중합체의 혼합물일 수 있다. 임의로, 중합체는 활성 성분의 요망되는 방출 패턴을 수득하기 위해 활성 성분과 함께 매트릭스를 형성시키기 위해 과립화 단계 동안 이용될 수 있다. 겔, 서방형 고체 또는 반고체 화합물은 요망되는 기간에 걸쳐 활성제를 방출할 수 있다. 겔, 서방형 고체 또는 반고체 화합물은, 예를 들어, 대뇌동맥과 같은 혈관에 근접하여 있으나 이에 제한되지는 않는 인간 뇌 내의 조직에 이식될 수 있다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 서방형 고체 화합물을 포함한다. 한 상기 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 서방형 고체 화합물에 엠베딩되거나, 서방형 고체 화합물 상에 코팅된다. 또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 전압-작동 칼슘 채널 차단제를 함유하는 서방형 미세입자를 포함한다.
또 다른 구체예에 따르면, 약학적으로 허용되는 담체는 겔 화합물, 예를 들어, 생물분해성 하이드로겔이다.
미세입자 제형
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 형태로 제공된다. 본원에서 사용되는 용어 "입자"는 전체적으로 또는 부분적으로 칼슘 채널 차단제를 함유할 수 있는 나노 또는 미세입자(또는 일부 예에서, 더 큰 입자)를 나타낸다. 일부 구체예에 따르면, 미립자 제형은 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 포함한다. 한 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 코팅에 의해 둘러싸인 입자의 코어 내에 함유된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자의 표면 전체에 걸쳐 분산된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자 상 또는 미세입자 내에 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 미세입자의 표면 전체에 걸쳐 배치된다. 또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 입자에 흡착된다.
일부 상기 구체예에 따르면, 미세입자는 균일한 크기 분포를 갖는다. 일부 구체예에 따르면, 미세입자 크기의 균일한 분포는 미세입자를 포함하는 균일한 에멀젼을 형성시키기 위한 균질화 과정에 의해 달성된다. 일부 상기 구체예에 따르면, 각각의 미세입자는 매트릭스를 포함한다. 일부 구체예에 따르면, 매트릭스는 전압 작동 칼슘 채널 차단제를 포함한다.
일부 구체예에 따르면, 약학적 조성물은 유동가능하다. 일부 구체예에 따르면, 약학적 조성물의 미립자 제형 성분은 유동가능하다.
일부 구체예에 따르면, 입자는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출, 및 이들의 조합으로 구성되는 군으로부터 선택된다. 입자는 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 입자는 용액 또는 반고체 상태의 전압-작동 칼슘 채널 차단제를 함유하는 미세캡슐이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 미세입자이다. 일부 구체예에 따르면, 입자는 전체적으로 또는 부분적으로 전압-작동 칼슘 채널 차단제를 함유하는 나노입자이다. 일부 구체예에 따르면, 입자는 실질적으로 임의의 형태일 수 있다.
일부 구체예에 따르면, 입자 크기는 약 25 ㎛ 내지 약 100 ㎛이다. 일부 구체예에 따르면, 입자 크기는 약 30 ㎛ 내지 약 80 ㎛이다. 한 구체예에 따르면, 입자 크기는 적어도 약 25 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 30 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 35 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 40 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 45 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 50 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 55 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 60 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 65 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 70 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 75 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 80 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 85 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 90 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 95 ㎛이다. 또 다른 구체예에 따르면, 입자 크기는 적어도 약 100 ㎛이다.
또 다른 구체예에 따르면, 전압 작동 칼슘 채널 차단제는 스트링 내에 제공될 수 있다. 스트링은 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제는 스트링 전체에 걸쳐 분산될 수 있거나, 치료제(들)은 스트링에 흡수될 수 있다. 스트링은 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 스트링은 치료제(들)에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
또 다른 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 적어도 하나의 시트 내에 제공될 수 있다. 시트는 코팅에 의해 둘러싸인 코어 내에 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 함유할 수 있거나, 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제는 시트 전체에 걸쳐 분산될 수 있거나, 전압-작동 칼슘 채널 차단제는 시트에 흡수될 수 있다. 시트는 영차 속도 방출, 일차 속도 방출, 이차 속도 방출, 지연 방출, 지속 방출, 즉시 방출 등, 및 이들의 임의의 조합을 포함하는 임의의 속도의 방출 동역학을 가질 수 있다. 시트는 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제에 더하여 침식가능한 물질, 침식가능하지 않은 물질, 생물분해성 물질, 또는 비-생물분해성 물질 또는 이들의 조합물을 포함하나, 이에 제한되지는 않는 약학 및 의약 분야에서 통상적으로 사용되는 물질 중 임의의 물질을 포함할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 보존제를 추가로 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 단위 투여 형태로 제공된다. 예시적 단위 투여 형태는 앰풀 또는 다용량 용기를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 미립자 제형은 미세입자의 현탁액을 포함한다. 일부 구체예에 따르면, 약학적 조성물은 추가로 현탁제, 안정화제 및 분산제 중 적어도 하나를 포함한다. 일부 상기 구체예에 따르면, 약학적 조성물은 현탁액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 용액으로 제공된다. 일부 상기 구체예에 따르면, 약학적 조성물은 에멀젼으로 제공된다.
일부 구체예에 따르면, 약학적 조성물의 제형은 수용성 형태의 전압-작동 칼슘 채널 차단제의 수용액을 포함한다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 오일 현탁액을 포함한다. 전압-작동 칼슘 채널 차단제의 오일 현탁액은 적합한 친지질성 용매를 이용하여 제조될 수 있다. 예시적 친지질성 용매 또는 비히클은 지방 오일, 예를 들어, 참기름, 또는 합성 지방산 에스테르, 예를 들어, 에틸 올레에이트 또는 트리글리세라이드를 포함하나, 이에 제한되지는 않는다. 일부 구체예에 따르면, 약학적 조성물의 제형은 전압-작동 칼슘 채널 차단제의 수성 현탁액을 포함한다. 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질, 예를 들어, 소듐 카르복시메틸 셀룰로스, 소르비톨, 또는 덱스트란을 함유할 수 있다. 임의로, 현탁액은 또한 적합한 안정화제 또는 매우 농축된 용액의 제조를 가능케 하는 화합물의 용해도를 증가시키는 작용제를 함유할 수 있다. 대안적으로, 전압-작동 칼슘 채널 차단제는 사용전에 적합한 비히클, 예를 들어, 멸균 발열원 비함유 물을 이용한 구성을 위한 분말 형태일 수 있다.
적합한 액체 또는 고체 약학적 제조물은, 예를 들어, 적절한 경우, 하나 이상의 부형제를 갖거나, 인코클리에이트화(encochleation)되거나, 현미경적 금 입자 상에 코팅되거나, 리포솜에 함유되거나, 조직으로의 이식을 위해 펠렛화되거나, 조직으로 러빙(rubbing)되는 목표 상으로 건조되는 미세피막화된 투여 형태를 포함한다. 본원에서 사용되는 용어 "미세피막화"는 논파레일(nonpareil), 펠렛, 결정, 응집물, 미세구, 또는 나노입자를 포함하나, 이에 제한되지는 않는 고체 구조를 생성시키기 위해 매우 작은 비말 또는 입자가 생체적합하거나, 생물분해성이거나, 중합성 또는 비-중합성인 물질의 연속적 필름으로 둘러싸이거나 코팅되는 과정을 나타낸다. 이러한 약학적 조성물은 또한 활성 화합물의 연장된 방출을 갖는 과립, 비드, 분말, 정제, 코팅된 정제, (미세)캡슐, 좌약, 시럽, 에멀젼, 현탁액, 크림, 점적 또는 제조물의 형태로 존재할 수 있고, 이의 제조에서 부형제 및 첨가제 및/또는 보조제, 예를 들어, 붕해제, 결합제, 코팅 작용제, 팽창 작용제(swelling agent), 윤활제, 또는 용해화제가 상기 기재된 바와 같이 통상적으로 사용된다. 약학적 조성물은 다양한 약물 전달 시스템에서의 사용에 적합하다. 약물 전달을 위한 방법의 간단한 개관을 위해, 참조로서 본원에 포함되는 문헌[Langer (1990) Science 249, 1527-1533]을 참조하라.
미세피막화
방법
미세피막화 방법 및 생성물; 에멀젼-기반 미세입자의 생성을 위한 방법; 에멀젼-기반 미세입자 및 이의 생성을 위한 방법; 조정가능한 추출 속도를 갖는 용매 추출 미세피막화; 용매 및 염을 이용한 미세피막화 방법; 미세입자를 제조하기 위한 연속적 이중 에멀젼 방법; 미세입자 특성인 중합체 블렌드로부터의 조절된 방출 시스템을 조정하기 위한 건조 방법; 다양한 비-반복 단위를 갖는 중합체를 포함하는 중합체 혼합물 및 이를 제조하거나 이용하는 방법; 및 미세입자 및 이와 함께 사용하기 위한 워크헤드 어셈블리(workhead assembly)를 제조하기 위한 에멀젼 기반 방법의 예는 미국 특허 번호 5,407,609호(제목: Microencapsulation Process and Products Thereof), 미국 출원 번호 10/553,003호(제목: Method for the production of emulsion-based microparticles), 미국 출원 번호 11/799,700호(제목: Emulsion-based microparticles and methods for the production thereof), 미국 출원 번호 12/557,946호(제목: Solvent Extraction Microencapsulation With Tunable Extraction Rates), 미국 출원 번호 12/779,138호(제목: Hyaluronic Acid (HA) Injection Vehicle), 미국 출원 번호 12/562,455호(제목: Microencapsulation Process With Solvent And Salt), 미국 출원 번호 12/338,488호(제목: Process For Preparing Microparticles Having A Low Residual Solvent Volume); 미국 출원 번호 12/692,027호(제목: Controlled Release Systems From Polymer Blends); 미국 출원 번호 12/692,020호(제목: Polymer Mixtures Comprising Polymers Having Different Non-Repeating Units And Methods For Making And Using Same); 미국 출원 번호 10/565,401호(제목: "Controlled release compositions"); 미국 출원 번호 12/692,029호(제목: "Drying Methods for Tuning Microparticle Properties); 미국 출원 번호 12/968,708호(제목: "Emulsion Based Process for Preparing Microparticles and Workhead for Use with Same); 및 미국 출원 번호 13/074,542호(제목: Composition and Methods for Improved Retention of a Pharmaceutical Composition at a Local Administration Site")에 개시되고 기재되어 있다. 상기 참고문헌 각각의 내용은 전체내용이 참조로서 본원에 포함된다.
일부 구체예에 따르면, 미세입자 기술을 이용한 전압-작동 칼슘 채널 차단제의 전달은 전압-작동 칼슘 채널 차단제 및 적어도 하나의 추가 치료제를 피막화시키는 생분해성 중합 입자를 포함한다.
한 구체예에 따르면, 미세입자 제형은 중합체 매트릭스를 포함하며, 전압-작동 칼슘 채널 차단제가 상기 중합체 매트릭스에 주입된다. 한 구체예에 따르면, 중합체는 서방형 중합체이다. 한 구체예에 따르면, 중합체는 폴리 (D, L-락티드-코-글리콜리드)이다. 또 다른 구체예에 따르면, 중합체는 폴리(오르토에스테르)이다. 또 다른 구체예에 따르면, 중합체는 폴리(언하이드라이드)이다. 또 다른 구체예에 따르면, 중합체는 폴리락티드-폴리글리콜리드이다.
비-생물분해성 및 생물분해성 중합 물질 둘 모두는 전압-작동 칼슘 채널 차단제를 전달하기 위한 입자의 제조에서 사용될 수 있다. 이러한 중합체는 자연 또는 합성 중합체일 수 있다. 중합체는 방출이 요망되는 기간을 기초로 하여 선택된다. 특히 관심있는 생체결합성 중합체는 교시내용이 본원에 포함되는 문헌[Sawhney et al in Macromolecules (1993) 26, 581-587]에 기재된 바와 같은 생분해성 하이드로겔을 포함하나, 이에 제한되지는 않는다. 예시적 생분해성 하이드로겔은 폴리히알루론산, 카세인, 젤라틴, 글루틴, 폴리언하이드라이드, 폴리아크릴산, 알기네이트, 키토산, 폴리(메틸 메타크릴레이트), 폴리(에틸 메타크릴레이트), 폴리(부틸메타크릴레이트), 폴리(이소부틸 메타크릴레이트), 폴리(헥실메타크릴레이트), 폴리(이소데실 메타크릴레이트), 폴리(라우릴 메타크릴레이트), 폴리(페닐 메타크릴레이트), 폴리(메틸 아크릴레이트), 폴리(이소프로필 아크릴레이트), 폴리(이소부틸 아크릴레이트), 및 폴리(옥타데실 아크릴레이트)를 포함하나, 이에 제한되지는 않는다. 한 구체예에 따르면, 생체결합성 중합체는 히알루론산이다. 일부 상기 구체예에서, 생체결합성 중합체는 약 2.3% 미만의 히알루론산을 포함한다.
일부 구체예에 따르면, 약학적 조성물은 비경구 주사, 외과적 이식, 또는 이들의 조합을 위해 제형화된다. 일부 상기 구체예에 따르면, 약학적 조성물은 약학적으로 허용되는 멸균 수용액 또는 비수성 용액, 분산액, 현탁액 또는 에멀젼 또는 멸균의 주사가능한 용액 또는 분산액으로의 재구성을 위한 멸균 분말의 형태이다. 적합한 수성 및 비수성 담체, 희석제, 용매 또는 비히클의 예는 물, 에탄올, 디클로로메탄, 아세토니트릴, 에틸 아세테이트, 폴리올 (프로필렌 글리콜, 폴리에틸렌 글리콜, 글리세롤 등), 이들의 적합한 혼합물, 식물성 오일(예를 들어, 올리브유) 및 주사가능한 유기 에스테르, 예를 들어, 에틸 올레에이트를 포함하나, 이에 제한되지는 않는다. 적절한 유동성은, 예를 들어, 레시틴과 같은 코팅의 사용, 분산액의 경우에서 필요한 입자 크기의 유지, 및 계면활성제의 사용에 의해 유지될 수 있다. 현탁액은 추가로 현탁제, 예를 들어, 에톡실화된 이소스테아릴 알콜, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미정질 셀룰로스, 알루미늄 메타하이드록사이드, 벤토나이트, 아가-아가, 트래거캔쓰, 및 이들의 혼합물을 함유할 수 있다.
일부 구체예에 따르면, 약학적 조성물은 주사가능한 데포(depot) 형태로 제형화된다. 주사가능한 데포 형태는 생물분해성 중합체 중에서 전압 작동 칼슘 채널 차단제의 미세피막화된 매트릭스를 형성시킴으로써 제조된다. 약물 대 중합체의 비 및 사용되는 특정 중합체의 특성에 따라, 약물 방출의 속도가 조절될 수 있다. 이러한 장기 작용 제형은 적합한 중합성 또는 소수성 물질(예를 들어, 허용가능한 오일 중의 에멀젼) 또는 이온 교환 수지와 함께 제형화될 수 있거나, 가용성이 부족한 유도체, 예를 들어, 가용성이 부족한 염으로 제형화될 수 있다. 생물분해성 중합체의 예는 폴리락티드-폴리글리콜리드, 폴리(오르토에스테르) 및 폴리(언하이드라이드)를 포함하나, 이에 제한되지는 않는다. 데포 주사용 제형은 또한 신체 조직과 상용성인 리포솜 또는 마이크로에멀젼 중에 약물을 엔트랩핑(entrapping)시킴으로서 제조된다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리글리콜리드(PGA) 매트릭스 중 또는 상에 주입된다. PGA는 봉합에서 사용하기 위해 개발된 선형 지방족 폴리에스테르이다. 연구들은 트리메틸렌 카르보네이트, 폴리락트산(PLA), 및 폴리카프롤락톤과 함께 형성된 PGA 공중합체를 보고하였다. 이들 공중합체 중 일부는 지속 약물 방출을 위한 미세입자로서 제형화될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리에스테르-폴리에틸렌 글리콜 매트릭스 내 또는 상에 주입된다. 폴리에스테르-폴리에틸렌 글리콜 화합물이 합성될 수 있고, 이들은 연성이고, 약물 전달에 사용될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리 (아미노)-유래 생체중합체 매트릭스 내 또는 상에 주입된다. 폴리 (아미노)-유래 생체중합체는 지방족 디아민으로서 락트산 및 리신을 함유하는 것(예를 들어, 미국 특허 5,399,665호 참조), 및 티로신-유래 폴리카르보네이트 및 폴리아크릴레이트를 포함할 수 있으나, 이에 제한되지는 않는다. 폴리카르보네이트의 변형은 에스테르의 알킬 사슬(에틸 내지 옥틸)의 길이를 변경시킬 수 있는 한편, 폴리아릴레이트의 변형은 중합체의 큰 과변이 및 중합체 특성에서의 큰 유연성을 가능케 하는 이산(예를 들어, 숙신산 내지 세바식산)의 알킬 사슬의 길이를 변경시키는 것을 추가로 포함할 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 폴리언하이드라이드 매트릭스 내 또는 상에 주입된다. 폴리언하이드라이드는 용융 중합에 의한 2개의 이산 분자의 탈수에 의해 제조된다(예를 들어, 미국 특허 4,757,128호 참조). 이들 중합체는 표면 침식(벌크 침식에 의해 분해되는 폴리에스테르에 비함)에 의해 분해된다. 약물의 방출은 선택된 단량체의 친수성에 의해 조절될 수 있다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 광중합성 생체중합체 매트릭스 내 또는 상에 주입된다. 광중합성 생체중합체는 락트산/폴리에틸렌 글리콜/아크릴레이트 공중합체를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 하이드로겔 매트릭스 내 또는 상에 주입된다. 용어 "하이드로겔"은 젤라틴성 또는 젤리-유사 덩어리를 생성시키기 위해 필요한 수성 성분을 함유하는 고체, 반고체, 슈도플라스틱 또는 플라스틱 구조를 발생시키는 물질을 나타낸다. 하이드로겔은 일반적으로 친수성 중합체, 아크릴산, 아크릴아미드 및 2-하이드록시에틸메타크릴레이트(HEMA)를 포함하는 다양한 중합체를 포함한다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 생체중합체 매트릭스 내 또는 상에 주입된다. 자연-발생 생체중합체는 단백질 중합체, 콜라겐, 다당류, 및 광중합성 화합물을 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 단백질 중합체 매트릭스 내 또는 상에 주입된다. 단백질 중합체는 자가-어셈블링 단백질 중합체, 예를 들어, 비단 피브로인, 엘라스틴, 콜라겐, 및 이들의 조합물로부터 합성되었다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 자연-발생 다당류 매트릭스 내 또는 상에 주입된다. 자연-발생 다당류는 키틴 및 이의 유도체, 히알루론산, 덱스트란 및 셀룰로식(일반적으로, 변형 없이 생체분해성이지 않음), 및 수크로스 아세테이트 이소부티레이트(SAIB)를 포함하나, 이에 제한되지는 않는다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 키틴 매트릭스 내 또는 상에 주입된다. 키틴은 주로 2-아세트아미도-2-데옥시-D-글루코스 기로 구성되며, 이는 효모, 진균 및 해양 무척추동물(새우, 갑각류)에서 발견되며, 여기서 이는 외골격의 주요 성분이다. 키틴은 수용성이 아니며, 탈아세틸화된 키틴, 키토산 만이 산성 용액(예를 들어, 아세트산)에서 가용성이다. 연구들은 수용성이고, 매우 높은 분자량(2백만 달톤 초과)이고, 점탄성이고, 비독성이고, 생체적합성이고, 과산화물, 글루테르알데하이드, 글리옥살 및 다른 알데하이드 및 카르보디아미드와 가교되어 겔을 형성할 수 있는 키틴 유도체를 보고하였다.
일부 구체예에 따르면, 전압-작동 칼슘 채널 차단제는 히알루론산(HA) 매트릭스 내 또는 상에 주입된다. 교대하는 글루쿠로니드 결합(glucuronidic bond) 및 글루코사미니드 결합(glucosaminidic bond)으로 구성되고, 분리되고 정제되는 포유동물 유리체액, 뇌의 세포외 기질, 윤활액, 제대 및 수탉 볏에서 발견되는 히알루론산(HA)이 또한 발효 과정에 의해 생성될 수 있다.
일부 구체예에 따르면, 약학적 조성물은 애쥬번트를 추가로 포함한다. 예시적 애쥬번트는 보존제, 습윤제, 에멀젼화제, 및 분산제를 포함하나, 이에 제한되지는 않는다. 미생물의 작용의 예방은 다양한 항균제 및 항진균제, 예를 들어, 파라벤, 클로로부탄올, 페놀, 소르브산 등에 의해 보장될 수 있다. 등장화제, 예를 들어, 당, 소듐 클로라이드 등이 또한 포함될 수 있다. 주사용 약학적 형태의 연장 흡수는 흡수를 지연시키는 작용제, 예를 들어, 알루미늄 모노스테아레이트 및 젤라틴의 사용에 의해 발생될 수 있다.
제형은, 예를 들어, 말단 감마 방사선조사, 박테리아-보전 필터를 통한 여과에 의하거나, 사용 직전에 멸균수 또는 다른 멸균된 주사용 매질에 용해되거나 분산될 수 있는 멸균 고체 조성물 형태의 멸균 작용제를 혼입시킴으로써 멸균될 수 있다. 주사용 제조물, 예를 들어, 멸균 주사용 수성 또는 유성 현탁액이 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당 분야에 공지된 바에 따라 제형화될 수 있다. 멸균 주사용 제조물은 또한 비독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사용 용액, 현탁액 또는 에멀젼, 예를 들어, 1,3-부탄디올, 디클로로메탄, 에틸 아세테이트, 아세토니트릴 등 중 용액일 수 있다. 사용될 수 있는 허용되는 비히클 및 용매는 물, 링거액, U.S.P. 및 등장성 소듐 클로라이드 용액이다. 또한, 멸균 고정유가 통상적으로 사용되거나 용매 또는 현탁 매질로 사용된다. 이러한 목적을 위해, 합성 모노- 또는 디글리세라이드를 포함하는 임의의 순한 고정유가 사용될 수 있다. 또한, 지방산, 예를 들어, 올레산이 주사 가능 물질의 제조에서 사용된다.
비경구(피하, 피내, 근내, 정맥내, 동맥내, 수막강내, 뇌실내 및 관절내를 포함하나, 이에 제한되지는 않음) 투여를 위한 제형은 항산화제, 완충제, 정균제 및 제형이 의도된 수용자의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비수성 멸균 주사 용액; 및 현탁제 및 증점제를 포함할 수 있는 수성 및 비수성 멸균 현탁액을 포함한다.
또 다른 구체예에 따르면, 약학적 조성물은 전압-작동 칼슘 채널 차단제를 수 용해도를 향상시키는 중합체에 컨쥬게이션시킴으로써 제형화된다. 적합한 중합체의 예는 폴리에틸렌 글리콜, 폴리-(d-글루탐산), 폴리-(1-글루탐산), 폴리-(1-글루탐산), 폴리-(d-아스파르트산), 폴리-(1-아스파르트산), 폴리-(1-아스파르트산) 및 이들의 공중합체를 포함하나, 이에 제한되지는 않는다. 약 5,000 내지 약 100,000의 분자량, 및 약 20,000 내지 약 80,000의 분자량을 갖는 폴리글루탐산이 사용될 수 있고, 약 30,000 내지 약 60,000의 분자량을 갖는 폴리글루탐산이 또한 사용될 수 있다. 중합체는 참조로서 본원에 포함되는 미국 특허 번호 5,977,163호에 본질적으로 기재된 바와 같은 프로토콜을 이용하여 본 발명의 에포틸론의 하나 이상의 하이드록실로 에스테르 결합을 통해 컨쥬게이션된다. 특정 컨쥬게이션 부위는 본 발명의 21-하이드록시-유도체의 경우에 하이드록실 오프 탄소-21(hydroxyl off carbon-21)을 포함한다. 다른 컨쥬게이션 부위는 하이드록실 오프 탄소 3 및/또는 하이드록실 오프 탄소 7을 포함하나, 이에 제한되지는 않는다.
적합한 완충제는 아세트산 및 염(1-2% w/v); 시트르산 및 염(1-3% w/v); 붕산 및 염(0.5-2.5% w/v); 및 인산 및 염(0.8-2% w/v)을 포함한다. 적합한 보존제는 벤즈알코늄 클로라이드(0.003-0.03% w/v); 클로로부탄올(0.3-0.9% w/v); 파라벤(0.01-0.25% w/v) 및 티메로살(0.004-0.02% w/v)을 포함한다.
본원에서 사용되는 바와 같은 단수 형태는 문맥이 달리 명백히 지정하지 않는 한 복수의 지시대상물을 포함한다. 예를 들어, "폴리펩티드"에 대한 언급은 하나 이상의 폴리펩티드를 의미한다.
일정 범위의 값이 제공되는 경우, 상기 범위의 상한과 하한 사이의 문맥이 명백히 달리 지정하지 않는 한 하한의 단위의 1/10까지의 각각의 사이에 존재하는 값 및 상기 언급된 범위 내의 임의의 다른 언급되거나 사이에 존재하는 값이 본 발명에 포함됨이 이해된다. 언급된 범위에서 임의의 특별히 배제된 한계에 종속되는, 보다 작은 범위 내에 독립적으로 포함될 수 있는 상기 보다 작은 범위의 상한 및 하한이 또한 본 발명에 포함된다. 언급된 범위가 한계 중 하나 또는 둘 모두를 포함하는 경우, 상기 포함된 둘 모두의 한계 중 어느 하나를 배제하는 범위가 또한 본 발명에 포함된다.
달리 정의되지 않는 한, 본원에서 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 분야의 당업자에 의해 통상적으로 이해되는 것과 동일한 의미를 갖는다. 본원에 기재된 것과 유사하거나 동등한 임의의 방법 및 물질이 또한 본 발명의 실시 또는 시험에서 사용될 수 있으나, 바람직한 방법 및 물질이 이제 기재된다. 본원에 언급된 모든 간행물은 이러한 간행물이 인용되는 것과 관련하여 방법 및/또는 물질을 개시하고 기재하기 위한 참조로서 본원에 포함된다.
본원에 논의된 간행물은 본 출원의 출원일 전에 이들의 개시내용에 대해 단독으로 제공된다. 본원에서는 본 발명이 종래 발명에 의해 상기 간행물보다 앞설 자격이 없음을 시인하는 것으로 해석되지 않아야 한다. 추가로, 제공되는 간행물의 날짜는 실제 간행물 날짜와 상이할 수 있으며, 이는 독립적으로 확인될 필요가 있을 수 있다.
실시예
하기 실시예는 당업자에게 본 발명을 제조하고 이용하는 방법의 완전한 개시 및 기재를 제공하기 위해 제시되며, 발명자들이 이들의 발명으로 간주하는 것의 범위를 제한하거나, 하기 실험이 수행된 전부이거나 유일한 실험인 것을 나타내는 것을 의도하지 않는다. 사용된 수(예를 들어, 양, 온도 등)와 관련하여 정확성을 보장하기 위해 노력하였으나, 일부 실험 오차 및 편차가 감수되어야 한다. 달리 지정하지 않는 한, 부(part)는 중량부이고, 분자량은 중량 평균 분자량이고, 온도는 섭씨 온도이고, 압력은 대기압 또는 대기압 근처이다.
실시예
1. 파일럿 연구 1 -
거미막밑
출혈(
SAH
) 개 모델에서의
뇌혈관연축에
대한
니모디핀
제형의 효과
물질 및 방법
제형
균일한 미세입자 크기 분포를 포함하는 미립자 니모디핀 제형의 시험 제형을 니모디핀의 존재하에서 중합체 용액(예를 들어, 50-50 글리콜리드-락티드 블렌드)과 용매를 조합시킴으로써 제조하였다. 혼합물을 계면활성제 함유 수용액에 첨가하여 에멀젼을 형성시켰고, 용매를 추출하여 유동가능한 미립자 니모디핀 제형을 생성시켰다. 최초 약물 로드(load)는 65%, 즉, 65% 니모디핀 및 35% 중합체였다. 평균 입자 크기는 약 52μ였다.
미립자 니모디핀 제형을 약학적 담체와 조합시켜 기재된 본 발명의 약학적 조성물을 형성시켰다. 전달 수단이 외과적 주사 장치이고, 전달 부위가 거미막밑 공간 내의 대뇌동맥에 근접하여 존재하는 경우, 비히클(예를 들어, 염수(인산염 완충 염수(PBS) 중 하이드록실 프로필 메틸 셀룰로스(HPMC))을 미립자 니모디핀 제형과 혼합한다. 위약 제형은 니모디핀 없이 비히클을 더하여 생성된 미립자를 함유하였다.
처리 군
전체 6마리의 수컷 개를 하기 표 1에 제시된 바와 같이 연구에 할당하였다.
표 1. 처리 군 할당
투여
대조군(미립자 위약 제형) 및 시험 항목(저용량의 미립자 니모디핀 제형 또는 고용량의 미립자 니모디핀 제형)을 대수조(cisterna magna)(소뇌의 꼬리면과 연수의 등면 사이의 비대화된 거미막밑 공간)로의 주사를 통해 1일에서의 외과수술 동안 1회 투여하였다. 처리되는 군에 대한 용량 수준은 0.25 mL(미립자 위약 제형), 0.17 mL 또는 0.18 mL(저용량의 미립자 니모디핀 제형), 또는 0.46 mL(고용량의 미립자 니모디핀 제형)의 고정된 용량 부피에서의 10 mg 또는 30 mg이었다. 제공되는 주사기에 저용량의 미립자 니모디핀 제형 및 고용량의 미립자 니모디핀 제형의 16 및 40 mg 각각을 로딩하였고, 이는 전달 시스템에서의 사장 용적(dead volume)을 채우는데 필요한 과충전을 고려한 것이었다. 물질이 재구성/주사 절차에 따라 투여됨에 따라, 전달된 용량은 약 10 mg 및 30 mg이었다. 대조군에는 처리군과 동일한 방식으로 대조군 항목(미립자 위약 제형)을 투여하였다.
재구성/주사를 위해, 희석제를 포함하는 주사기를 연결기를 통해 미립자 니모디핀 제형을 포함하는 주사기에 부착시켰다. 플런저(plunger)를 순환시켜 미립자 제형으로 비히클을 끌어당긴다. 이후, 생성된 약학적 조성물이 좌측 주사기로 밀어 넣어지고, 연결기로부터 분리된다. 전달을 위해, 조성물은 외과용 바늘을 통해 주사가능하거나, 임의의 적절한 크기의 캐뉼라 또는 카테터와 조립되거나 이들을 통해 주사될 수 있다.
외과적 절차
1일에서, 개의 체중을 재고, 기준선 혈액을 수거하고, 혈압, 체온, 심박 산소, 및 혈액 가스를 외과적 절차를 통해 모니터하였다. 대뇌 혈관조영술을 하나의 척추동맥을 통해 수행하였다. 이미지를 모든 혈관조영상에 대해 동일한 노출 인자 및 배율을 이용하여 포착하였다. 내부 배율 표준을 모든 혈관조영상에 포함시켰다.
혈관조영술 후, 동물을 엎드린 자세로 돌리고, 18 게이지 척추 바늘을 이용하여 대수조를 경피 천공하였다. 0.3 mL/kg CSF의 표적화 부피를 자연적으로 배출시키고, 이후 0.5 mL/kg의 헤파린화되지 않은 신선한 자가 동맥 혈액을 대퇴 카테터로부터 회수하고, 약 5 mL/분의 속도로 대수조에 주사하였다. 혈액 부피의 약 1/2을 주사한 후, 위약 또는 니모디핀 제형을 약 5 mL/분의 속도로 투여하였다. 미립자 위약 또는 미립자 니모디핀 제형(저용량 및 고용량)의 투여 완료시, 나머지 혈액을 주사하였다. 바늘을 주사 직후에 회수하였다. 동물을 수조 혈액 주사 동안 머리를 30° 아래로 기울였고, 주사 완료 후 15분 동안 상기 위치를 유지시켰다. 이후, 동물을 뒤로 눕히고, 대퇴부 카테터를 제거하고, 대퇴 동맥을 결찰시켰다. 절개를 표준 방식으로 닫았다.
3일에서, 개를 전신 마취 하에 두고, 수조 혈액 주사를 반복하였다. 8일 및 15일에서, 동물을 마취시키고, 혈관조영술 및 대수조로부터의 CSF의 제거를 반복하였다. 15일에서의 혈관조영술 후, 동물은 마취로부터 회복되지 않았다. 이들을 마취하에서 안락사시키고, 인산염-완충 염수 및 이후 중성 완충 포르말린으로 관류시키고, 뇌를 상기 기재된 바와 같은 조직학 분석에 적용시켰다.
1, 8, 및 15일에서 뇌기저동맥의 직경을 비교함으로써 혈관연축을 평가하였다. 혈관조영술 데이터를 동물군에 대해 맹검된 4명의 평가자에 의해 독립적으로 분석하였다. 각각의 동물에 대해 5개의 평균을 낸 루멘 직경을 이후에 평균을 내어 각 시점에서 각 동물에 대한 평균 루멘 직경을 획득하였다. 개별적 혈관연축 퍼센트를 하기 식 (1)을 이용하여 8일 및 15일에 대한 각각의 동물에 대해 결정하였다:
8일 및 15일에 대한 평균 혈관연축 퍼센트를 또한 각 군에 대해 결정하였다. 도 10은 저용량(10 mg) 니모디핀 제형, 고용량(30 mg) 제형, 및 위약을 이용한 거미막밑 공간의 대수조에서의 처리 후의 기준선으로부터의 평균 뇌기저동맥 직경에서의 변화 퍼센트(%)를 제시한다. 하기 표 2에는 혈관연축 퍼센트에 대한 평균, 표준오차, 중간 및 표준편차가 요약되어 있다.
표 2:
혈관조영상의
개관으로부터의
혈관연축
퍼센트 데이터의 요약
8일에서, 평균 뇌기저동맥 직경은 기준선과 비교시 대조군 동물에서 24% 감소하였다. 저용량 니모디핀 미세입자로 처리된 동물은 기준선과 비교시 뇌기저동맥 직경에서 -9.9%의 평균 감소를 가졌다. 고용량의 니모디핀 미세입자로 처리된 동물은 기준선과 비교시 1.2%의 평균 뇌기저동맥 직경 증가를 가졌다.
15일에서, 대조군 동물(위약-처리)에 대한 평균 뇌기저동맥 직경 감소는 기준선과 비교시 -17.3%였다. 저용량의 니모디핀 미세입자로 처리된 동물은 기준선과 비교시 뇌기저동맥 직경에서 -24%의 평균 감소를 가졌다. 고용량의 니모디핀 미세입자로 처리된 동물은 기준선과 비교시 0.7%의 평균 뇌기저동맥 직경 증가를 가졌다. 연구된 동물의 적은 수로 인해 통계 분석은 수행하지 않았다.
본 실시예는, (1) 8일에서, 뇌기저동맥의 협소화가 대조군에서 가장 높았고, 그 다음으로 저용량 군이었고, 고용량 군에서 가장 낮았으며; (2) 15일에서, 뇌기저동맥의 협소화가 대조군에서 가장 높았고, 그 다음으로 저용량 군이었고, 고용량 군에서 가장 낮은 것을 나타낸다. 연구에서의 동물의 적은 수로 인해, 15일에서의 저용량 군에서의 뇌기저동맥의 변화는 예상된 통계적 변이성 내였다.
연구 절차와 관련된 것으로 간주된 임상적 발견은 감소된 활동 및 식욕부진의 관찰로 제한되었다. 감소된 활동은 연구 첫번째 주 동안 6마리의 동물 모두에서 인지되었고, 두번째 주 동안 위약 처리된 동물 1마리 및 저용량 니모디핀 미립자 처리된 동물 1마리에서 인지되었다. 식욕부진은 첫번째 주 동안 6마리 동물 중 5마리, 및 두번째 주 동안 6마리 동물 중 4마리에서 인지되었다. 상기 발견은 모든 용량 군으로부터의 동물에서 존재하였고, 따라서 연구 절차와 관련된 것으로 간주되었다.
행동 관찰
이환률, 사망률, 손상, 및 음식 및 물의 이용도에 대한 관찰을 모든 동물에 대해 매일 2회 수행하였다. 무작위화 전 및 연구 동안 매주 체중을 측정하고 기록하였다. 직원 수의사 예비 검사에 의해 모든 동물에 대해 전체 신체검사를 수행하였다.
연구에 등록된 각각의 동물에 대해 매일을 기초로 하여 직원 수의사가 행동 관찰을 수행하였다. 각각의 동물의 행동을 직원 수의사가 매일 검사하였다. 식욕, 활동 및 신경 결함의 행동 부류에 속하는 행동이 하기 표 3-5에 따라 행동 스코어로 제공되었다.
표 3은 식욕에 대해 제공된 행동 스코어를 제공한다.
표 3. 식욕에 대한 행동 스코어
표 4는 활동에 대한 행동 스코어를 제공한다.
표 4. 활동에 대한 행동 스코어
표 5는 신경 결함에 대한 행동 스코어를 제공한다. 스코어링된 신경 결함은 실조 또는 불완전마비로 인한 보행하는 능력이었다.
표 5. 신경 결함에 대한 행동 스코어
도 11은 위약, 저용량(10 mg)의 미립자 니모디핀 제형, 또는 고용량(30 mg)의 미립자 니모디핀 제형으로 처리되는, 거미막밑 출혈에 적용된 개의 평균 행동 스코어의 플롯을 제시한다.
식욕 또는 활동에서 일관적이거나 현저한 변화가 없었고, 신경 기능에서 변화가 없었다.
연구 절차나 위약 또는 니모디핀 미세입자를 이용한 처리는 체중에서의 어떠한 실질적 변화와 관련되지 않았다. 니모디핀 미세입자 용량과 위약 사이의 혈액학 파라미터에서 명백한 차이가 없었다.
혈청 분석
니모디핀에 대한 혈청 샘플의 분석은 3일에서 가장 높은 농도를 나타내었고, 15일에서 검출가능한 수준의 니모디핀이 여전히 존재하였다(도 7, 표 6). 하기 표 6에는 위약, 저용량(10 mg) 미립자 니모디핀 제형 또는 고용량(30 mg) 미립자 니모디핀 제형으로 처리되는 경우, 거미막밑 출혈에 적용된 개에서의 혈청 약물 농도(ng/mL)가 나열되어 있다. 도 12는 위약, 저용량(10 mg) 미립자 니모디핀 제형 또는 고용량(30 mg) 미립자 니모디핀 제형으로 처리되는 경우, 거미막밑 출혈에 적용된 개에서의 시간 경과에 따른 혈청 약물 농도(ng/mL)의 플롯을 제시한다.
니모디핀의 혈청 농도는 고용량 니모디핀 미세입자로 처리된 동물에서 더 높았다. 니모디핀은 위약 동물에서 어느 시점에서도 검출되지 않았다.
표 6. 혈청 약물 농도(
ng
/
mL
)
뇌척수액(
CSF
) 분석
CSF 샘플의 분석은 저용량의 니모디핀 미립자의 투여 후 3 및 8일에서 지속된 높은 농도의 니모디핀을 발견하였고, 15일에서 낮은 농도가 존재하였다. 하기 표 7에는 위약, 저용량(10 mg) 미립자 니모디핀 제형 또는 고용량(30 mg) 미립자 니모디핀 제형으로 처리되는 경우, 거미막밑 출혈에 적용된 개로부터의 CSF 내의 약물 농도(ng/mL)가 나열되어 있다.
CSF 니모디핀 농도는 저용량 및 고용량의 니모디핀 미세입자의 투여를 이용하여 혈청 농도보다 유의하게 더 높았고, 검출가능한 농도가 15일에 여전히 존재하였다. 고용량 3일 샘플 중 하나는 정량 한계 초과(>500 ng/mL)하였고, 추가 샘플의 부족으로 인해 재시험이 불가능하였다. 적은 샘플 수로 인해 통계적 유의성이 결정될 수 없었다. 니모디핀은 위약 동물에서 어떠한 시점에서도 검출되지 않았다.
표 7. 각각의 처리 군에 대한
CSF
니모디핀
농도(
ng
/
mL
)
현미경 분석
도 13은 (A) 위약으로 처리되는 경우 및 (B) 저용량 미립자 니모디핀 제형으로 처리되는 경우의, 거미막밑 출혈(SAH)에 적용된 개의 조직병리학을 제시한다. 도 14는 개과 모델 실험에서 사용되는 절단면을 제시한다. 유일한 현미경 발견은 저용량 미립자 니모디핀 제형 군으로부터의 둘 모두의 동물 및 고용량 미립자 니모디핀 제형 군으로부터의 2마리의 동물 중 한 마리의 동물에서 교뇌 및/또는 연수의 거미막밑 공간 내의 최소 내지 가벼운 육아종 염증으로 이루어졌다. 염증은 외래 물질을 포식한 거대세포의 응집을 특징으로 하였다. 최소 아급성 염증 또는 림프구성 혈관주위 침윤물이 또한 군 전체에 걸쳐 소수의 동물에서 인지되었다. 림프구성 혈관주위 침윤물은 육아성 염증과 밀접하게 관련이 있었다.
위약 군으로부터의 2마리의 동물 중 한 마리 및 저용량 니모디핀 미세입자 군으로부터의 둘 모두의 동물에서 최소 내지 가벼운 변성이 인지되었다. 변성은 교뇌 및/또는 연수의 배쪽 부분에 존재하였고, 출혈로 부분적으로 채워진 속이 빈 공간, 증식하는 작은 혈관, 및 증가된 수의 신경아교세포/별아교세포를 특징으로 하였다. 포말 공포성 세포가 종종 존재하였다. 축삭 팽창/변성이 인접한 뇌 조직에 존재하였다. 이러한 발견은 주사 절차와 관련된 것으로 간주되었고, 주사된 조성물의 효과는 아니었다.
수막 출혈 및/또는 섬유증식이 시험된 대부분의 동물에서 인지되었고, 이는 부검 및/또는 주사 절차와 관련되었을 가능성이 크다.
현미경 연구는 거미막밑 공간 내에서 최소 내지 가벼운 육아종 염증, 모든 처리군, 즉, 위약, 저용량(10 mg) 미립자 니모디핀 제형 및 고용량(30 mg) 미립자 니모디핀 제형에서 최소 내지 가벼운 변성 및 수막 출혈 및/또는 섬유증식을 나타내었다.
실시예
2. 연구 2 -
거미막밑
출혈(
SAH
) 개 모델에서의
뇌혈관연축에
대한
니모디핀
제형의 효과
물질 및 방법
제형
균일한 미세입자 크기 분포를 포함하는 미립자 니모디핀 제형의 시험 제형을 니모디핀의 존재하에서 중합체 용액(예를 들어, 50-50 글리콜리드-락티드 블렌드)과 용매를 조합시킴으로써 제조하였다. 혼합물을 계면활성제 함유 수용액에 첨가하여 에멀젼을 형성시켰고, 용매를 추출하여 유동가능한 미립자 니모디핀 제형을 생성시켰다. 최초 약물 로드는 65%, 즉, 65% 니모디핀 및 35% 중합체였다. 평균 입자 크기는 약 52μ였다.
미립자 니모디핀 제형을 약학적 담체와 조합시켜 기재된 본 발명의 약학적 조성물을 형성시켰다. 전달 수단이 외과적 주사 장치이고, 전달 부위가 거미막밑 공간 내의 대뇌동맥에 근접하여 존재하는 경우, 점착성을 제공하는 비히클(예를 들어, 히알루론산)을 미립자 니모디핀 제형과 혼합하였다("니모디핀 제형 1"). 미립자 니모디핀 제형 2("니모디핀 제형 2")에 대해, 약학적으로 허용되는 담체, 점착성을 제공하는 비히클을 약학적으로 허용되는 담체로 사용하지 않았다. 위약 제형은 미립자 + 비히클을 함유하였으나, 니모디핀은 함유하지 않았다.
처리 군
전체 30 마리의 개를 하기 표 8에 제공된 바와 같이 연구에 할당하였다.
표 8. 처리 군 할당
투여
미립자 니모디핀 제형(제형 1)을 거미막밑 공간의 대수조 내에 외과적 주사에 의해 비히클(예를 들어, 히알루론산)과 함께 처리군 2 및 3에 투여하였다. 미립자 니모디핀 제형(제형 2)을 뇌실로의 카테터를 통한 주사기(14 게이지 내지 18 게이지)에 의해 비히클 없이 처리군 4에 투여하였다. 미립자 위약 제형을 거미막밑 공간의 대수조 내에 외과적 주사에 의해 비히클(예를 들어, 히알루론산)과 함께 처리군 1(경구 대조군)에 투여하였다. 1일에서의 미립자 위약 제형의 투여 후, 처리군 1(경구 대조군)에 21일까지 하루 당 6회 경구 니모디핀 캡슐(0.86mg/kg)을 투여하였다. 위약 대조군에 거미막밑 공간의 대수조 내에 외과적 주사에 의해 비히클(예를 들어, 히알루론산)과 함께 미립자 위약 제형을 또한 투여하였다(데이터는 제시하지 않음). 처리군 2, 3 및 4에 대해 전달된 용량 수준은 상기 표 8에 제시된 바와 같다. 주사기에 전달 시스템에서의 사장 용적을 채우는데 필요한 과충전을 고려하여 약학적 조성물을 로딩하였다. 전달된 용량은 약 40 mg(용량 1) 및 100 mg(용량 2)이었다. 경구 대조군 및 위약군에 처리군과 동일한 방식으로 대조 항목을 투여하였다.
재구성/주사를 위해, 희석제를 포함하는 주사기를 연결기를 통해 미립자 니모디핀 제형을 포함하는 주사기에 부착시켰다. 처리군 1, 2, 및 3의 경우, 플런저를 순환시켜 미립자 제형으로 비히클을 끌어당겼다. 이후, 생성된 약학적 조성물이 좌측 주사기로 밀어 넣어지고, 연결기로부터 분리된다. 전달을 위해, 조성물은 외과용 바늘을 통해 주사가능하거나, 임의의 적절한 크기의 캐뉼라 또는 카테터와 조립되거나 이들을 통해 주사될 수 있다.
외과적 절차
1일에서, 개의 체중을 재고, 기준선 혈액을 수거하고, 혈압, 체온, 심박 산소, 및 혈액 가스를 외과적 절차를 통해 모니터하였다. 대뇌 혈관조영술을 하나의 척추동맥을 통해 수행하였다. 이미지를 모든 혈관조영상에 대해 동일한 노출 인자 및 배율을 이용하여 포착하였다. 내부 배율 표준을 모든 혈관조영상에 포함시켰다.
치료군 1, 2, 및 3의 경우, 혈관조영술 후, 동물을 엎드린 자세로 돌리고, 14 게이지 척추 바늘을 이용하여 대수조를 경피 천공하였다. 0.3 mL/kg CSF의 표적화 부피를 자연적으로 배출시키고, 이후 0.5 mL/kg의 헤파린화되지 않은 신선한 자가 동맥 혈액을 대퇴 카테터로부터 회수하고, 약 5 mL/분의 속도로 대수조에 주사하였다. 혈액 부피의 약 1/2을 주사한 후, 미립자 위약 제형 또는 미립자 니모디핀 제형을 약 5 mL/분의 속도로 투여하였다. 위약 또는 니모디핀 제형(용량 1 및 용량 2)의 투여 완료시, 나머지 혈액을 주사하였다. 바늘을 주사 직후에 회수하였다. 동물을 수조 혈액 주사 동안 머리를 30° 아래로 기울였고, 주사 완료 후 15분 동안 상기 위치를 유지시켰다. 이후, 동물을 뒤로 눕히고, 대퇴부 카테터를 제거하고, 대퇴 동맥을 결찰시켰다. 절개를 표준 방식으로 닫았다.
처리군 4의 경우, 미립자 니모디핀 제형을 5 mL/분의 속도로 카테터(14 게이지)를 통해 단일 주사로서 가쪽뇌실로 투여하였다.
3일에서, 개를 전신 마취 하에 두고, 수조 혈액 주사(처리군 1, 2, 및 3의 경우) 또는 뇌실내 투여(처리군 4의 경우)를 반복하였다. 8일 및 15일에서, 동물을 마취시키고, 혈관조영술 및 대수조로부터의 CSF의 제거를 반복하였다. 15일에서의 혈관조영술 후, 동물은 마취로부터 회복되지 않았다. 이들을 마취하에서 안락사시키고, 인산염-완충 염수 및 이후 중성 완충 포르말린으로 관류시키고, 뇌를 상기 기재된 바와 같은 조직학 분석에 적용시켰다.
1, 8, 및 15일에서 뇌기저동맥의 직경을 비교함으로써 혈관연축을 평가하였다. 혈관조영술 데이터를 동물군에 대해 맹검된 2명의 평가자에 의해 독립적으로 분석하였다. 각각의 동물에 대해 5개의 평균을 낸 루멘 직경을 이후에 평균을 내어 각 시점에서 각 동물에 대한 평균 루멘 직경을 획득하였다. 개별적 혈관연축 퍼센트를 하기 식 (1)을 이용하여 8일 및 15일에 대한 각각의 동물에 대해 결정하였다:
8일 및 15일에 대한 평균 혈관연축 퍼센트를 또한 각 군에 대해 결정하였다. 도 15는 니모디핀 제형 1, 용량 1(40 mg), 니모디핀 제형 1, 용량 2(100 mg), 및 경구 대조군을 이용한 거미막밑 공간의 대수조에서의 처리 후, 뿐만 아니라 뇌실로의 니모디핀 제형 2 용량 2(100 mg)의 투여 후의 기준선으로부터의 평균 뇌기저동맥 직경에서의 변화 퍼센트(%)를 제시한다. 하기 표 9에는 혈관연축 퍼센트에 대한 평균, 표준오차, 중간 및 표준편차가 요약되어 있다.
표 9.
혈관조영상의
개관으로부터의
혈관연축
퍼센트 데이터의 요약
본 실시예는 8일에서 경구 니모디핀으로 처리된 대조군 동물이 기준선에 비해 뇌기저동맥 직경에서 가장 높은 감소를 가졌고, 이어서 뇌실내 전달을 통한 40 mg 용량의 제형 1로 처리된 동물, 이어서 100 mg 용량의 제형 1로 처리된 동물, 및 이어서 100mg 용량의 제형 2로 처리된 동물의 순서인 것을 나타낸다. 뇌실내 전달을 통해 100mg 용량의 제형 2로 처리된 동물은 뇌기저동맥 직경에서 가장 낮은 감소를 나타내었다. 3개 모두의 제형은 대조군과 비교하는 경우 8일에서 통계적으로 유의하였다. 15일에서, 대조군 및 제형 1 100 mg 용량은 뇌기저동맥 직경에서 유사한 감소를 가졌고, 40 mg 용량의 제형 1은 감소가 낮았고, 100 mg 용량의 제형 2는 기준선에 비해 뇌기저동맥 직경의 감소가 없거나 약간의 확장을 가졌다. 15일에서, 100 mg 용량의 제형 2만이 대조군에 비해 통계적으로 유의하였다. 본 실시예는 3개 모두의 제형이 7일에서 경구 니모디핀 대조군에 비해 혈관연축을 감소시킬 수 있었고, 제형 2 100 mg 용량이 15일에서 경구 니모디핀 대조군에 비해 혈관연축을 감소시킬 수 있었던 것을 나타내었다.
행동 관찰(연구 2)
이환률, 사망률, 손상, 및 음식 및 물의 이용도에 대한 관찰을 모든 동물에 대해 매일 2회 수행하였다. 무작위화 전 및 연구 동안 매주 체중을 측정하고 기록하였다. 직원 수의사 예비 검사에 의해 모든 동물에 대해 전체 신체검사를 수행하였다.
연구에 등록된 각각의 동물에 대해 매일을 기초로 하여 직원 수의사가 행동 관찰을 수행하였다. 각각의 동물의 행동을 직원 수의사가 매일 검사하였다. 식욕, 활동 및 신경 결함의 행동 부류에 속하는 행동이 상기 표 3-5에 따라 행동 스코어로 제공되었다.
식욕 또는 활동에서 일관적이거나 현저한 변화가 없었고, 신경 기능에서 변화가 없었다.
혈청 분석(연구 2)
하기 표 10a-10g에는 니모디핀 제형 1, 용량 1(40 mg), 니모디핀 제형 1, 용량 2(100 mg), 및 경구 대조군으로 처리되는 경우 뿐만 아니라 뇌실로의 니모디핀 제형 2 용량 2(100 mg)의 투여 후의, 거미막밑 출혈에 적용된 개에서의 혈청 약물 농도(ng/mL)가 나열되어 있다. 도 16은 니모디핀 제형 1, 용량 1(40 mg), 니모디핀 제형 1, 용량 2(100 mg), 및 경구 대조군으로 처리되는 경우 뿐만 아니라, 뇌실로의 니모디핀 제형 2 용량 2(100 mg)의 투여 후의, 거미막밑 출혈에 적용된 개에서의 시간 경과에 따른 혈청 약물 농도(ng/mL)의 플롯을 제시한다.
도 16 및 표 10a-10g는 40 mg 용량 및 100 mg 용량의 제형 1 둘 모두가 3일에서 피크 혈장 농도를 나타냈고, 100 mg 용량의 제형 2가 4일에서 피크 혈장 농도를 나타냈고, 대조군 경구 니모디핀이 7일에서 피크 혈장 농도를 갖는 것을 나타낸다. 40 mg의 제형 1은 가장 낮은 피크 농도(8.3 ng/mL)를 가진 한편, 100mg의 제형 1, 100 mg의 제형 2, 및 경구 니모디핀을 이용한 대조군은 모두 대략 동등한 피크 농도(각각, 13.6 ng/mL, 14.6 ng/mL, 및 14.6 ng/mL)를 가졌다. 본 실시예는 모든 제형이 경구 니모디핀을 갖는 대조군에서 관찰된 최대 혈장 농도의 혈장 농도 또는 이 미만의 혈장 농도를 갖는 것을 나타내었다.
표 10. 혈청 약물 농도(
ng
/
mL
)(연구 2)
뇌척수액(
CSF
) 분석(연구 2)
하기 표 11a-11b에는 니모디핀 제형 1, 용량 1(40 mg), 니모디핀 제형 1, 용량 2(100 mg), 및 경구 대조군으로 처리되는 경우, 뿐만 아니라 뇌실로의 니모디핀 제형 2 용량 2(100 mg)의 투여 후의, 거미막밑 출혈에 적용된 개에서의 CSF 약물 농도(ng/mL)가 나열되어 있다. 도 17은 니모디핀 제형 1, 용량 1(40 mg), 니모디핀 제형 1, 용량 2(100 mg), 및 경구 대조군으로 처리되는 경우, 뿐만 아니라 뇌실로의 니모디핀 제형 2 용량 2(100 mg)의 투여 후의, 거미막밑 출혈에 적용된 개에서의 시간 경과에 따른 CSF 약물 농도(ng/mL)의 플롯을 제시한다.
도 17 및 표 11a-11b는 경구 니모디핀을 갖는 대조군, 제형 0 mg 용량, 제형 1 100 mg 용량, 및 제형 2 100 mg 용량 모두가 3일에서 피크 CSF 니모디핀 농도를 가진 것을 제시한다. 경구 니모디핀을 갖는 대조군은 1.6 ng/mL의 피크 CSF 니모디핀 농도를 가졌고, 제형 1 40 mg 용량은 1763.5 ng/mL의 피크 CSF 니모디핀 농도를 가졌고, 제형 1 100 mg 용량은 3028.5 ng/mL의 피크 CSF 니모디핀 농도를 가졌고, 제형 2 100 mg 용량은 1896.5 ng/mL의 피크 CSF 니모디핀 농도를 가졌다. 경구 니모디핀을 갖는 대조군은 8일까지 검출가능한 CSF 농도를 가졌고, 제형 1 40 mg 및 100 mg 용량은 35일까지 검출가능한 CSF 농도를 가졌고, 제형 2 100 mg 용량은 42일까지 검출가능한 CSF 농도를 가졌다. 본 실시예는 제형 1 및 2 둘 모두가 경구 니모디핀을 갖는 대조군보다 유의하게 높은 CSF 니모디핀 농도를 가질 수 있었고, 보다 긴 기간 동안 상기 농도를 유지할 수 있었음을 나타내었다. 본 실시예는 제형 1 및 제형 2 둘 모두가 대조군 경구 니모디핀으로 관찰되는 최대 수준의 혈장 니모디핀 농도 또는 이 미만의 혈장 니모디핀 농도를 유지하면서 높은 CSF 니모디핀 농도를 발생시킬 수 있었던 것을 나타낸다. 본 실시예는 국소적(수조내 또는 뇌실내 투여에 의함)으로 투여되는 경우 미립자 니모디핀 제형으로 달성된 CSF 니모디핀 농도의 높은 수준이 거미막밑 출혈을 갖는 개에서 혈관연축을 감소시킬 수 있는 것을 나타낸다.
표 11. 각각의
처리군에
대한
CSF
니모디핀
농도(
ng
/
mL
)(연구 2)
동등부
본 발명은 이의 특정 구체예를 참조로 하여 기재되었으나, 다양한 변화가 이루어질 수 있고, 동등부가 본 발명의 진정한 사상 및 범위를 벗어남이 없이 치환될 수 있음이 당업자에 의해 이해되어야 한다. 또한, 특정 상황, 물질, 물질의 조성, 방법, 방법 단계 또는 단계들을 채택하기 위해 본 발명의 객관적 사상 및 범위에 대한 많은 변형이 이루어질 수 있다. 모든 이러한 변형은 하기 첨부되는 청구항의 범위 내이다.
Claims (68)
- (a)(i) 전압-작동 칼슘 채널 차단제(voltage-gated calcium channel blocker)의 미립자 제형; 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물을 제공하는 단계, 및 (b) 투여 부위에 치료량의 약학적 조성물을 투여하기 위한 수단에 의해 치료량의 약학적 조성물을 투여하는 단계를 포함하는, 적어도 하나의 대뇌동맥의 중단(interruption)을 포함하는 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 상기 뇌 손상과 관련된 지연 합병증을 치료하는 방법으로서,
상기 치료량이 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적이고,
상기 적어도 하나의 지연 합병증이 지연 대뇌 허혈(delayed cerebral ischemia, DCI), 복수의 미세혈전색전증(microthromboemboli), 피질 확산 허혈(cortical spreading ischemia, CSI), 및 혈관조영술 혈관연축(angiographic vasospasm) 중 적어도 하나인, 방법. - 제 1항에 있어서, 단계 (b)에서, 투여 수단이 외과적 주사 장치이고, 투여 부위가 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥에 근접하여 위치하는 방법.
- 제 1항에 있어서, 단계 (b)에서, 투여 수단이 외과적 주사 장치이고, 투여 부위가 뇌실인 방법.
- 제 2항에 있어서, 외과적 주사 장치가 바늘, 캐뉼라, 카테터, 또는 이들의 조합물인 방법.
- 제 3항에 있어서, 미립자 제형이 뇌척수액에 의해 운반되어 뇌 손상에 의해 영향을 받은 대뇌동맥과 접촉하는 방법.
- 제 1항에 있어서, 치료량이 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적인 방법.
- 제 1항에 있어서, 뇌 손상이 동맥류(aneurysm), 갑작스러운 외상성 두부 손상, 거미막밑 출혈(subarachnoid hemorrhage, SAH), 또는 이들의 조합의 결과인 방법.
- 제 7항에 있어서, 뇌 손상이 거미막밑 출혈의 결과인 방법.
- 제 1항에 있어서, 뇌 손상과 관련된 적어도 하나의 지연 합병증이 뇌내 혈종, 뇌실내 출혈, 열, 행동 결손, 신경계 결손, 뇌경색증, 및 신경 세포 사멸 중 적어도 하나를 추가로 포함하는 방법.
- 제 9항에 있어서, 행동 결손이 개선되며, 개선된 행동 결손이 식욕에서의 증가를 포함하는 방법.
- 제 9항에 있어서, 신경계 결손이 개선되며, 개선된 신경계 결손이 실조(ataxia) 또는 불완전마비(paresis)의 개선을 포함하는 방법.
- 제 1항에 있어서, 약학적 조성물이 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 주로 국소화된 약리학적 효과를 발휘하는 방법.
- 제 1항에 있어서, 약학적 조성물이 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 뇌 전체에 걸쳐 광범위한 약리학적 효과를 발휘하는 방법.
- 제 1항에 있어서, 미립자 제형이 복수의 미세입자를 포함하며, 미세입자가 균일한 크기 분포를 갖고, 각각의 미세입자가 매트릭스를 포함하는 방법.
- 제 1항에 있어서, 미립자 제형이 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 추가로 포함하는 방법.
- 제 1항에 있어서, 미세입자 제형이 미세입자의 액체 현탁액을 포함하는 방법.
- 제 1항에 있어서, 뇌실이 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합인 방법.
- 제 1항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 서방형 화합물을 포함하는 방법.
- 제 18항에 있어서, 서방형 화합물이 중합체인 방법.
- 제 19항에 있어서, 전압-작동 칼슘 채널 차단제가 서방형 중합체 상 또는 서방형 중합체 내에 배치되는 방법.
- 제 20항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리 (D, L-락티드-코-글리콜리드)를 포함하는 방법.
- 제 20항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리(오르토에스테르)를 포함하는 방법.
- 제 20항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리언하이드라이드를 포함하는 방법.
- 제 1항에 있어서, 전압-작동 칼슘 채널 차단제가 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택되는 방법.
- 제 1항에 있어서, 전압-작동 칼슘 채널 차단제가 디하이드로피리딘 칼슘 채널 차단제인 방법.
- 제 25항에 있어서, 디하이드로피리딘 칼슘 채널 차단제가 니모디핀(nimodipine)인 방법.
- 제 1항에 있어서, 약학적으로 허용되는 담체가 겔 화합물을 포함하는 방법.
- 제 27항에 있어서, 겔 화합물이 생물분해성 하이드로겔인 방법.
- 제 1항에 있어서, 약학적 조성물이 약학적으로 허용되는 담체를 포함하지 않는 방법.
- 제 1항에 있어서, 약학적으로 허용되는 담체가 히알루론산을 포함하지 않는 방법.
- 제 1항에 있어서, 약학적으로 허용되는 담체가 히알루론산을 포함하는 방법.
- 제 31항에 있어서, 약학적으로 허용되는 담체가 0% 내지 5%의 히알루론산의 범위인 방법.
- 제 33항에 있어서, 약학적으로 허용되는 담체가 2.3% 미만의 히알루론산을 포함하는 방법.
- 제 33항에 있어서, 약학적으로 허용되는 담체가 5% 미만의 히알루론산을 포함하는 방법.
- (a)(i) 전압-작동 칼슘 채널 차단제의 미립자 제형, 및 임의로, (ii) 약학적으로 허용되는 담체를 포함하는 약학적 조성물, 및
(b) 투여를 위한 부위에 치료량의 약학적 조성물을 투여하기 위한 수단을 포함하는,
적어도 하나의 대뇌동맥의 중단을 포함하는 뇌 손상과 관련된 지연 합병증을 치료할 필요가 있는 포유동물에서 상기 뇌 손상과 관련된 지연 합병증을 치료하기 위한 반고체 다중입자 전달 시스템으로서,
상기 치료량이 뇌 손상과 관련된 적어도 하나의 지연 합병증의 징후 또는 증상을 감소시키는데 효과적인, 반고체 다중입자 전달 시스템. - 제 31항 또는 제 35항에 있어서, 적어도 하나의 지연 합병증이 지연 대뇌 허혈(DCI), 복수의 미세혈전색전증, 피질 확산 허혈(CSI), 및 혈관조영술 혈관연축 중 적어도 하나이고, 투여 수단이 외과적 주사 장치이고, 투여 부위가 뇌 손상에 의해 영향을 받은 적어도 하나의 대뇌동맥에 근접하여 위치하는 시스템.
- 제 35항에 있어서, 투여 수단이 외과적 주사 장치이고, 투여 부위가 뇌실인 시스템.
- 제 37항에 있어서, 외과적 주사 장치가 바늘, 캐뉼라, 카테터, 또는 이들의 조합물인 시스템.
- 제 35항에 있어서, 미립자 제형이 뇌척수액에 의해 운반되어 뇌 손상에 의해 영향을 받은 대뇌동맥과 접촉될 수 있는 시스템.
- 제 35항에 있어서, 치료량이 뇌 손상에 의해 영향을 받은 대뇌동맥의 내부 직경을 대조군에 비해 증가시키는데 효과적인 시스템.
- 제 35항에 있어서, 뇌 손상이 동맥류, 갑작스러운 외상성 두부 손상, 거미막밑 출혈(SAH), 또는 이들의 조합의 결과인 시스템.
- 제 41항에 있어서, 뇌 손상이 거미막밑 출혈의 결과인 시스템.
- 제 35항에 있어서, 뇌 손상과 관련된 적어도 하나의 지연 합병증이 뇌내 혈종, 뇌실내 출혈, 열, 행동 결손, 신경계 결손, 뇌경색증, 및 신경 세포 사멸 중 적어도 하나를 추가로 포함하는 시스템.
- 제 43항에 있어서, 행동 결손이 개선되며, 개선된 행동 결손이 식욕에서의 증가를 포함하는 시스템.
- 제 43항에 있어서, 신경계 결손이 개선되며, 개선된 신경계 결손이 실조 또는 불완전마비의 개선을 포함하는 시스템.
- 제 35항에 있어서, 약학적 조성물이 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 주로 국소화된 약리학적 효과를 발휘하는 시스템.
- 제 35항에 있어서, 약학적 조성물이 뇌 손상과 관련된 적어도 하나의 지연 합병증을 치료하는데 있어서 뇌 전체에 걸쳐 광범위한 약리학적 효과를 발휘하는 시스템.
- 제 35항에 있어서, 미립자 제형이 복수의 미세입자를 포함하며, 미세입자가 균일한 크기 분포를 갖고, 각각의 미세입자가 매트릭스를 포함하는 시스템.
- 제 35항에 있어서, 미립자 제형이 전압-작동 칼슘 채널 차단제가 주입된 복수의 미세입자를 추가로 포함하는 시스템.
- 제 35항에 있어서, 미세입자 제형이 미세입자의 액체 현탁액을 포함하는 시스템.
- 제 35항에 있어서, 뇌실이 가쪽뇌실, 셋째뇌실, 넷째뇌실, 또는 이들의 조합인 시스템.
- 제 35항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 서방형 화합물을 포함하는 시스템.
- 제 52항에 있어서, 서방형 화합물이 중합체인 시스템.
- 제 53항에 있어서, 전압-작동 칼슘 채널 차단제가 서방형 중합체 상 또는 서방형 중합체 내에 배치되는 시스템.
- 제 52항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리 (D, L-락티드-코-글리콜리드)를 포함하는 시스템.
- 제 55항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리(오르토에스테르)를 포함하는 시스템.
- 제 55항에 있어서, 전압-작동 칼슘 채널 차단제의 미립자 제형이 폴리언하이드라이드를 포함하는 시스템.
- 제 35항에 있어서, 전압-작동 칼슘 채널 차단제가 L-타입 전압-작동 칼슘 채널 차단제, N-타입 전압-작동 칼슘 채널 차단제, P/Q-타입 전압-작동 칼슘 채널 차단제, 또는 이들의 조합물로 구성되는 군으로부터 선택되는 시스템.
- 제 35항에 있어서, 전압-작동 칼슘 채널 차단제가 디하이드로피리딘 칼슘 채널 차단제인 시스템.
- 제 59항에 있어서, 디하이드로피리딘 칼슘 채널 차단제가 니모디핀인 시스템.
- 제 35항에 있어서, 약학적으로 허용되는 담체가 겔 화합물을 포함하는 시스템.
- 제 61항에 있어서, 겔 화합물이 생물분해성 하이드로겔인 시스템.
- 제 35항에 있어서, 약학적 조성물이 약학적으로 허용되는 담체를 포함하지 않는 시스템.
- 제 35항에 있어서, 약학적으로 허용되는 담체가 히알루론산을 포함하지 않는 시스템.
- 제 35항에 있어서, 약학적으로 허용되는 담체가 히알루론산인 시스템.
- 제 64항에 있어서, 약학적으로 허용되는 담체가 0% 내지 5%의 히알루론산의 범위인 시스템.
- 제 66항에 있어서, 약학적으로 허용되는 담체가 2.3% 미만의 히알루론산을 포함하는 시스템.
- 제 66항에 있어서, 약학적으로 허용되는 담체가 5% 미만의 히알루론산을 포함하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161441695P | 2011-02-11 | 2011-02-11 | |
| US61/441,695 | 2011-02-11 | ||
| PCT/US2012/024893 WO2012109664A1 (en) | 2011-02-11 | 2012-02-13 | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140063513A true KR20140063513A (ko) | 2014-05-27 |
Family
ID=46638990
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137023962A KR20140063513A (ko) | 2011-02-11 | 2012-02-13 | 거미막밑 출혈을 갖는 인간의 예후를 개선시키기 위한 조성물 및 방법 |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US20120164226A1 (ko) |
| EP (2) | EP2672983B1 (ko) |
| JP (1) | JP6146814B2 (ko) |
| KR (1) | KR20140063513A (ko) |
| CN (3) | CN105997890A (ko) |
| AU (1) | AU2012214137B2 (ko) |
| BR (1) | BR112013020512A2 (ko) |
| DK (1) | DK2672983T3 (ko) |
| ES (1) | ES2646720T3 (ko) |
| GB (1) | GB2501664B (ko) |
| HU (1) | HUE035226T2 (ko) |
| IL (1) | IL227861B (ko) |
| PL (1) | PL2672983T3 (ko) |
| PT (1) | PT2672983T (ko) |
| RU (1) | RU2597791C2 (ko) |
| SG (1) | SG192662A1 (ko) |
| WO (1) | WO2012109664A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10092524B2 (en) | 2008-06-11 | 2018-10-09 | Edge Therapeutics, Inc. | Compositions and their use to treat complications of aneurysmal subarachnoid hemorrhage |
| US9399019B2 (en) | 2012-05-09 | 2016-07-26 | Evonik Corporation | Polymorph compositions, methods of making, and uses thereof |
| JP2020531057A (ja) | 2017-06-29 | 2020-11-05 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 薬品容器にいっぱいに充填するためのデバイス及び方法 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4757128A (en) | 1986-08-01 | 1988-07-12 | Massachusetts Institute Of Technology | High molecular weight polyanhydride and preparation thereof |
| ES2084698T5 (es) | 1989-05-04 | 2005-03-01 | Southern Research Institute | Procedimiento de encapsulacion. |
| IT1243390B (it) * | 1990-11-22 | 1994-06-10 | Vectorpharma Int | Composizioni farmaceutiche in forma di particelle atte al rilascio controllato di sostanze farmacologicamente attive e procedimento per la loro preparazione. |
| US5399665A (en) | 1992-11-05 | 1995-03-21 | Massachusetts Institute Of Technology | Biodegradable polymers for cell transplantation |
| US5968542A (en) | 1995-06-07 | 1999-10-19 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system as a device |
| US5747058A (en) | 1995-06-07 | 1998-05-05 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system |
| JP2909418B2 (ja) * | 1995-09-18 | 1999-06-23 | 株式会社資生堂 | 薬物の遅延放出型マイクロスフイア |
| CN1304058C (zh) | 1996-03-12 | 2007-03-14 | Pg-Txl有限公司 | 水溶性紫杉醇产品 |
| US6123956A (en) * | 1997-07-10 | 2000-09-26 | Keith Baker | Methods for universally distributing therapeutic agents to the brain |
| US20050214227A1 (en) * | 1999-03-08 | 2005-09-29 | Powderject Research Limited | Microparticle formulations for sustained-release of bioactive compounds |
| US20040235801A1 (en) * | 2001-10-25 | 2004-11-25 | Jean-Pierre Julien | Therapy for stroke |
| SI1553927T1 (sl) * | 2002-09-11 | 2010-12-31 | Elan Pharma Int Ltd | Z gelom stabilizirani nanodeläśni sestavki uäśinkovine |
| AU2003298749A1 (en) * | 2002-11-26 | 2004-06-18 | Seacoast Neuroscience, Inc. | Buoyant polymer particles delivering therapeutic agents |
| WO2005020933A2 (en) * | 2003-09-02 | 2005-03-10 | University Of South Florida | Nanoparticles for drug-delivery |
| WO2006002365A2 (en) * | 2004-06-24 | 2006-01-05 | Angiotech International Ag | Microparticles with high loadings of a bioactive agent |
| WO2007062186A2 (en) * | 2005-11-21 | 2007-05-31 | The Board Of Trustees Of The University Of Alabama For And On Behalf Of The University Of Alabama | Methods of using small molecule compounds for neuroprotection |
| EP2164497B1 (en) | 2007-06-11 | 2018-08-15 | Edge Therapeutics Inc. | A drug delivery system for the prevention of cerebral vasospasm |
| US20100008968A1 (en) * | 2008-06-26 | 2010-01-14 | Lampe John W | Method for treating cardiovascular diseases using rho kinase inhibitor compounds |
-
2012
- 2012-02-13 CN CN201610320098.8A patent/CN105997890A/zh active Pending
- 2012-02-13 CN CN201710373877.9A patent/CN107115270A/zh active Pending
- 2012-02-13 KR KR1020137023962A patent/KR20140063513A/ko not_active Application Discontinuation
- 2012-02-13 US US13/372,264 patent/US20120164226A1/en not_active Abandoned
- 2012-02-13 ES ES12744708.4T patent/ES2646720T3/es active Active
- 2012-02-13 SG SG2013060058A patent/SG192662A1/en unknown
- 2012-02-13 EP EP12744708.4A patent/EP2672983B1/en not_active Not-in-force
- 2012-02-13 WO PCT/US2012/024893 patent/WO2012109664A1/en active Application Filing
- 2012-02-13 BR BR112013020512A patent/BR112013020512A2/pt not_active IP Right Cessation
- 2012-02-13 PT PT127447084T patent/PT2672983T/pt unknown
- 2012-02-13 RU RU2013141558/15A patent/RU2597791C2/ru not_active IP Right Cessation
- 2012-02-13 CN CN201280013759.2A patent/CN103582489A/zh active Pending
- 2012-02-13 EP EP17166614.2A patent/EP3222284A1/en not_active Withdrawn
- 2012-02-13 HU HUE12744708A patent/HUE035226T2/hu unknown
- 2012-02-13 DK DK12744708.4T patent/DK2672983T3/en active
- 2012-02-13 GB GB1315577.5A patent/GB2501664B/en not_active Expired - Fee Related
- 2012-02-13 JP JP2013553640A patent/JP6146814B2/ja not_active Expired - Fee Related
- 2012-02-13 PL PL12744708T patent/PL2672983T3/pl unknown
- 2012-02-13 AU AU2012214137A patent/AU2012214137B2/en not_active Ceased
-
2013
- 2013-08-08 IL IL227861A patent/IL227861B/en not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| SG192662A1 (en) | 2013-09-30 |
| CN103582489A (zh) | 2014-02-12 |
| EP3222284A1 (en) | 2017-09-27 |
| JP2014509318A (ja) | 2014-04-17 |
| AU2012214137B2 (en) | 2016-10-06 |
| EP2672983A1 (en) | 2013-12-18 |
| EP2672983A4 (en) | 2015-06-24 |
| DK2672983T3 (en) | 2017-08-07 |
| BR112013020512A2 (pt) | 2016-09-06 |
| RU2013141558A (ru) | 2015-03-20 |
| JP6146814B2 (ja) | 2017-06-14 |
| US20120164226A1 (en) | 2012-06-28 |
| CN107115270A (zh) | 2017-09-01 |
| CN105997890A (zh) | 2016-10-12 |
| EP2672983B1 (en) | 2017-04-19 |
| RU2597791C2 (ru) | 2016-09-20 |
| GB2501664A (en) | 2013-10-30 |
| IL227861A0 (en) | 2013-09-30 |
| ES2646720T3 (es) | 2017-12-15 |
| GB2501664B (en) | 2017-09-27 |
| PT2672983T (pt) | 2017-07-25 |
| WO2012109664A1 (en) | 2012-08-16 |
| PL2672983T3 (pl) | 2017-10-31 |
| GB201315577D0 (en) | 2013-10-16 |
| HUE035226T2 (hu) | 2018-05-02 |
| NZ613970A (en) | 2015-08-28 |
| IL227861B (en) | 2018-10-31 |
| AU2012214137A1 (en) | 2013-09-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6336899B2 (ja) | 脳血流に影響する脳損傷後の結果を改善するための脳室内ドラッグデリバリーシステム | |
| EP2164497B1 (en) | A drug delivery system for the prevention of cerebral vasospasm | |
| KR101902319B1 (ko) | 동맥류 지주막하 출혈의 합병증 치료를 위한 조성물 및 그의 용도 | |
| KR20140063513A (ko) | 거미막밑 출혈을 갖는 인간의 예후를 개선시키기 위한 조성물 및 방법 | |
| CA2826890A1 (en) | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage | |
| NZ613970B2 (en) | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage | |
| NZ727856B2 (en) | Intraventricular drug delivery system for improving outcome after a brain injury affecting cerebral blood flow | |
| NZ616458B2 (en) | Intraventricular drug delivery system for improving outcome after a brain injury affecting cerebral blood flow |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |