JP6146814B2 - クモ膜下出血のヒトの予後を改善する組成物及び方法 - Google Patents
クモ膜下出血のヒトの予後を改善する組成物及び方法 Download PDFInfo
- Publication number
- JP6146814B2 JP6146814B2 JP2013553640A JP2013553640A JP6146814B2 JP 6146814 B2 JP6146814 B2 JP 6146814B2 JP 2013553640 A JP2013553640 A JP 2013553640A JP 2013553640 A JP2013553640 A JP 2013553640A JP 6146814 B2 JP6146814 B2 JP 6146814B2
- Authority
- JP
- Japan
- Prior art keywords
- less
- voltage
- calcium channel
- another embodiment
- brain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A61K9/1647—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/01—Introducing, guiding, advancing, emplacing or holding catheters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/14—Infusion devices, e.g. infusing by gravity; Blood infusion; Accessories therefor
- A61M5/158—Needles for infusions; Accessories therefor, e.g. for inserting infusion needles, or for holding them on the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
- A61P3/14—Drugs for disorders of the metabolism for electrolyte homeostasis for calcium homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Description
本出願は、2011年2月11日に出願の米国仮特許出願第61/441,695号に対する優先権を主張するものであり、また、2007年10月29日に出願の米国仮特許出願第60/976,902号及び2007年6月11日に出願の米国仮特許出願第60/943,124号に対する優先権を主張する2008年6月11日に出願の米国特許出願第12/137,320号の一部継続出願である。これらの出願の各々は、本願明細書に全体として援用されている。
発明の分野
本発明は、クモ膜下出血の不利な結果を治療する組成物、系及び方法に関する。
本明細書に用いられる用語「脳卒中」又は「脳血管発作」は、血管に関わる疾患から生じる通常は局所及び急性の神経学的症状及び徴候を意味する。脳卒中は、閉塞性(血管の閉鎖による)か又は出血性(血管からの出血による)のいずれかである。本明細書に用いられる用語「虚血」は、血管の異常な狭窄化(狭窄症)に遠位な灌流圧の低下が抵抗血管の自動調節拡張によって補償されないときに生じる血液供給及び酸素の欠如を意味する。虚血が充分に激しく且つ長いときに、ニューロン及び他の細胞要素は死滅し; この状態が「梗塞」と呼ばれる。
出血は、脳表面(実質外)で、例えばウイリス動脈輪の先天性動脈瘤の破裂から生じ、クモ膜下出血(SAH)を引き起こし得る。出血は、また、例えば長期の高血圧によって損傷を受けた血管の破裂から、実質内である場合もあり、脳幹において、又は小脳において大脳半球内に血液凝固(脳内血腫)を生じ得る。出血は、虚血又は梗塞を随伴し得る。脳内血腫の腫瘤効果は、隣接する脳組織の血液供給を危うくし得る; 或いはクモ膜下出血は大脳表面血管の反応性血管攣縮を引き起こし、更に虚血性脳損傷につながり得る。梗塞性組織は、また、二次出血し得る。動脈瘤は、時々、脳内で破裂して、脳内血腫を引き起こし、また、脳室内で破裂して、脳室内出血を引き起こし得る。
ほとんどの閉塞性脳卒中がアテローム性動脈硬化症や血栓症によるものであり、ほとんどの出血性脳卒中が高血圧又は動脈瘤と関係があるが、いずれのタイプの脳卒中も、心臓病、外傷、感染、腫瘍、血液疾患、血管奇形、免疫学的障害及び外因性毒素を含む、多くの原因からいかなる年齢においても起こり得る。
図1及び図5は、脳の血管を示す概略図である。各大脳半球は内頸動脈によって供給され、内頸動脈は下顎角の下の総頸動脈から生じ、頚動脈孔を通って頭蓋に入り、海綿洞を横断し(眼動脈を出す)、硬膜を貫通し、前大脳動脈と中大脳動脈に分かれる。前大脳動脈の大表面分岐が、下前頭葉の皮質と白質、前頭葉と頭頂葉の内側面及び脳梁前部を供給する。より小さい貫通する分岐が、辺縁系構造、尾状核頭、及び内包前脚を含む、より深い大脳と間脳を供給する。中大脳動脈の大表面分岐が、前頭葉、頭頂葉、側頭葉後頭葉、及び島を含む、半球の凸面の大部分の皮質と白質を供給する。より小さい貫通する分岐が、深部白質と間脳の構造、例えば内包後脚、被殻、外側淡蒼球、尾状核体を供給する。内頸動脈が海綿静脈洞から現れた後、前脈絡叢動脈も出し、これが海馬前部及び尾側レベルで、内包の後肢を供給する。各椎骨動脈は、鎖骨下動脈から生じ、大後頭孔を通って頭蓋に入り、前脊髄動脈及び後下小脳動脈を出す。椎骨動脈は脳橋と髄質の接合部で連結して、脳底動脈を形成し、脳橋のレベルで前下小脳動脈及び内耳動脈を出し、中脳で上小脳動脈を出す。次に、脳底動脈が2つの後大脳動脈に分かれる。後大脳動脈の大表面分岐が、下側頭葉と内側後頭葉及び後方脳梁を供給する; これらの動脈のより小さい貫通する分岐が、視床及び視床下核を含む間脳構造だけでなく、中脳の一部を供給する(Principles of Neural Sciences, 2d Ed., Eric R. Kandel and James H. Schwartz, Elsevier Science Publishing Co., Inc., New York, pp. 854-56 (1985)を参照のこと)。
典型的には一方の端部が頭部と口腔を有し、反対の端部がしばしば肛門と尾部を有する動物を参照すると、頭端部は頭蓋端と呼ばれ、尾端部は尾方端と呼ばれる。頭部自体の範囲内で、吻側は鼻の端部の方の方向を示し、尾側は尾部方向を示すために用いられる。重力の引きから離れて、通常は上向きの方向である動物の体の表面又は側面は、背側であり; 反対の側面、典型的にはすべての足で歩くか、泳ぐか又は飛ぶときに地面に最も近いものは、腹側である。四肢又は他の付属器官については、本体により近い点が「近位」であり; より離れている点が「遠位」である。動物学的解剖においては3つの基本的な基準面が用いられる。「矢状」面は、体を左右の部分に分ける。「正中矢状」面は正中線にある。すなわち、正中矢状面は脊椎のような正中線構造を通過し、全ての他の矢状面は正中矢状面と平行である。「冠状」面は、体を背側部分と腹側部分に分ける。「横断」面は、体を頭蓋部分と尾側部分に分ける。ヒトを参照すると、体とその部分は体が直立していると仮定して常に記載されている。頭端部により近い体の部分は「上方」であり(動物において頭側に対応する)、より離れている部分は「下方」である(動物において尾側に対応する)。体の正面に近い対象は、「前方」と呼ばれ(動物の腹側に対応する); 体の後ろに近い対象は、「後方」と呼ばれる(動物の背側に対応する)。横面、軸面、又は水平面は、地面と平行したX-Y面であり、これは下方/足部から上方/頭部を分ける。冠状面又は前面は地面と垂直なY-Z面であり、これは後方から前方を分ける。矢状面は地面に、また、前頭面に垂直なX-Z面であり、これは右方から左方を分ける。正中矢状面は、正確には体の中央にある特定の矢状面である。
同側は同じ側面上を意味し、対側はその他の側面上を意味し、両側は双方の側面上を意味する。体の中心の近い構造は近位又は中枢であり、より離れている構造は遠位又は末梢である。例えば、手は腕の遠位端にあり、肩は近位端にある。
脳脊髄液を含有する脳における室である脳室には、2つの側脳室、1つの第三脳室及び1つの第四脳室が含まれる。側脳室は、大脳半球にある。側脳室はモンロー孔を経て第三脳室に流出させ、これは脳の2つの間脳構造の間に位置する。第三脳室はシルビウス水道を経由して第四脳室に至る。第四脳室は、脳幹と小脳の間の後頭蓋窩にある。脳脊髄液は、第四脳室からルシュカ孔とマジャンディ孔を通って大脳基底槽に流出させる。脳脊髄液は、次に、クモ膜下槽に浸透し、クモ膜絨毛を介して静脈系に流出する。
本明細書に用いられる用語「血管収縮」は、血管の筋肉壁を収縮することから生じる血管の狭小化を意味する。血管が収縮するときに、血流は制限されるか又は遅くなる。本明細書に用いられる血管収縮の逆である用語「血管拡張」は、血管の拡幅化を意味する。本明細書に用いられる用語「血管収縮薬」、「昇圧薬」又は「昇圧薬」は、血管収縮を引き起こす因子を意味する。血管収縮は、通常は血圧の上昇をもたらし、わずかであっても激しくてもよい。血管収縮は、疾患、薬剤、又は心理状態から生じ得る。血管収縮を引き起こす薬剤としては、カテコールアミン、抗ヒスタミン薬、鬱血除去薬、メチルフェニデート、感冒薬、プソイドエフェドリン、及びカフェインが挙げられるがこれらに限定されない。
血管拡張薬は、血管の平滑筋を弛緩させて血管を拡張させる薬剤又は化学薬品である。動脈血管(主に細動脈)の拡張は、血圧の低下につながる。平滑筋の弛緩は、収縮のための刺激を取り除くことに依存し、これは主に細胞内カルシウムイオン濃度及びミオシン軽鎖(MLC)のリン酸化に左右される。従って、血管拡張は、主に1)細胞内カルシウム濃度を下げるか、又は2)ミオシンL鎖ホスファターゼの刺激並びにカルシウムシンポーター及びアンチポーター(細胞内コンパートメントからカルシウムイオンをポンピングする)の誘導を含むMLCの脱リン酸化のいずれかによって働く。交換体を経た平滑筋の筋小胞体へのイオンの再取込み及び原形質膜全体のイオンの放出も血管拡張を達成するのを援助する。これらの作用を達成する特定の機序は、血管拡張薬ごとに異なり、内因性及び外因性として分類され得る。本明細書に用いられる用語「内因性」は、内部から進行するか又は内部的に由来するか; 又は外部的に生じるのではなく生物体内の状態から生じることを意味する。本明細書に用いられる用語「外因性」は、外部に由来するか; 外部的に由来するか; 又は生物体内の状態から生じるのではなく外部的に引き起こされることを意味する。
血管拡張は、温血動物の周囲環境が熱いときに温血動物の表在性血管に起こり; このプロセスは加熱した血液の流れを動物の皮膚にそらし、熱が大気中により容易に放出され得る。血管収縮は、逆の生理的プロセスである。血管拡張と血管収縮は、内皮細胞によって産生される局部的パラクリン因子(例えば、ブラジキニン、アデノシン)によってだけでなく、生物体の自律神経系及び副腎(いずれもそれぞれカテコールアミン、例えばノルエピネフリンやエピネフリンを分泌する)によって自然にモジュレートされる。
血管拡張薬を用いて、患者が異常に高い血圧を有する高血圧だけでなく、狭心症及びうっ血心不全のような症状を治療し、より低い血圧を維持することにより他の心臓障害を発症する患者のリスクが低減される。
図6は、脳の脳室系の図である。系は、脳内の一連の空洞(室)であり、脊髄のクモ膜下腔と中心管と連続している。4つの脳室: 左右の側脳室、及び正中の第三脳室と第四脳室がある。2つの側脳室は大脳内に位置し、各々モンロー孔によって第三脳室に接続している。第三脳室は、間脳に位置し、シルビウス中脳水道によって第四脳室に接続している。第四脳室は、後脳に位置し、少なくとも発生学的には、脊髄の中心管と連続している。3つの孔が第四脳室をクモ膜下腔に接続している: 正中口又はマジャンディ孔、及び左右のルシャカ外側口(孔)。
図7は、脳室からクモ膜下腔までCSFの流を示す図である。脳脊髄液(CSF)は、脳室系、脳のクモ膜下腔及び脊髄の中心管を占める透明な体液である。CSFは、脳室系全体に見られる脈絡叢の変形した脳室上衣細胞によって産生される。更に、CSFは、血管及び脳室壁周辺で、おそらく脳の細胞外空間からも形成される。CSFは、側脳室から心室間孔を経て第三脳室に流れる。次に、CSFは中脳水道を通って第四脳室に流れ込む。CSFは、正中口及び左右の側方口を経てクモ膜下腔内に流れ出る。最後に、CSFは、クモ膜顆粒及びクモ膜絨毛を通って硬膜静脈洞に再吸収される。クモ膜顆粒は、絨毛の集合からなる。絨毛は、硬膜を通って上矢状静脈洞及び他の静脈構造の内腔にくも膜の可視できるヘルニアを形成する。顆粒は、クモ膜下腔から静脈血にCSFの一方向の流れを可能にする弁として機能するように見える。小分子、タンパク質、微生物、及び赤血球が含まれるCSFのすべての成分が液と共に出る。
CSFは、約0.3-0.37ml/分又は20ml/時間又は500ml/日の速度で産生される。CSF空間の容積は約150mlであり、CSFは1日につき3.7回入れ替わる。
脈絡叢は毛管ろ過及び上皮分泌の機序を用いて、CSFの化学安定性を維持する。脈絡叢を横断する毛細管が血漿溶質に自由に浸透するが、脈絡叢を形成する上皮細胞のレベルに関門が存在し、これがキャリア仲介能動輸送に関与している。脳のCSF及び細胞外液は定常状態にあり、血漿及びCSFは通常の生理的条件下に浸透圧平衡状態にある。
血液脳関門は、脳への血液由来物質の侵入を防止するとともにニューロンの安定な環境を維持して、効果的に機能にする。血液脳関門は、脳微小血管内皮細胞の特殊な特性、血液脳関門の主要な解剖部位、その細胞間結合、及び小胞輸送の相対的不足から生じ、そのような細胞が一般の毛細血管と異なるようになる。血液脳関門血管の内皮細胞は、また、有窓でなく; 代わりに、血液脳関門血管の内皮細胞は密着結合の複合体アレイによって相互接続され、血管壁全体の拡散が阻止される。
脳は、3層の膜又は髄膜: 軟膜、くも膜、及び硬膜で包まれている。クモ膜下腔は、くも膜と脳を囲んでいる軟膜の間の領域である。用語「クモ膜下出血」(「SAH」とも呼ばれる)は、クモ膜下腔内への出血を意味する。SAHは、通常は脳動脈瘤から、自発的に起こる場合があり、外傷に起因する場合もある。症状には、急速に発生する頭痛(時には「雷鳴頭痛」と呼ばれる)、嘔吐、及び意識レベルの変化が含まれる。診断は、一般的にはコンピュータ断層撮影(CTスキャン)で行われ、時には腰椎穿刺による。治療は、再発及び合併症を予防するための綿密な観察、投薬法及び早期神経外科的治験及び処置による。
SAHは医学的な緊急事態であり、初期に認識且つ治療された場合であっても死亡又は重度障害につながり得る。すべてのSAH症例の半分が致命的であり、病院に到着する前に患者の10-15%が死亡する。SAHは、脳卒中の形態とみなされ、すべての脳卒中の1%と7%の間で起こる。頭蓋内動脈瘤の破裂によって起こった場合、出血はクモ膜下腔内で見られ、一般に脳室内及び大脳内空間にはあまり見られない。SAHによる出血により、脳損傷、脳偏位、脳灌流低下及び水頭症になり得る。米国では頭蓋内動脈瘤破裂からのSAHの発生率が10,000人に1症例であると推定され、毎年約SAHの27,000 - 30,000の新たな症例が生じている。これらの大動脈瘤破裂は、45%が30日の死亡率である。更に、生存者の推定30%が中度から重度の障害にかかるであろう。
SAHの発生率が毎年100,000人当たり平均して9.1人であることをいくつかの研究が示している。日本とフィンランドの研究は、全く理解されない理由で、その国々においてより高い割合を示している(それぞれ、100,000人当たり22.7人及び100,000人当たり19.7人)。南アメリカと中央アメリカは、対照的に、平均して100,000人当たり4.2人の割合を有する。SAHのリスクがある人々のグループは通常脳卒中によって影響を受けた集団よりも若いが、リスクは年齢と共になお増加する。若年者は、SAHにかかる中年の人々(危険率0.1、又は10%)よりそれほど起こらない。リスクは、年齢と共に上がり続け、45歳と55歳の間よりまさに初老(85歳を超える)においては60%以上である。SAHのリスクは55歳を超える女性において約25%以上であり、潜在的には閉経から生じるホルモン変化を反映している。
DCIは、局所神経障害(例えば片側不全麻痺、失語症、失行、半盲又はネグレクト)の発生、又はグラスゴーコーマスケール(全スコアか又はその個々の構成要素[開眼、両側の運動、発語]の1つ)の減少である。これは少なくとも1時間持続してもしなくてもよく、動脈瘤閉塞の直後に明らかでなく、脳の臨床評価、CT又は磁気共鳴映像法(MRI)スキャン、及び適切な検査室実験によって他の原因に起因する可能性がない。脳梗塞はDCIの結果である場合があり、SAH後6週間以内に脳のCT又はMRIで、又は6週間以内に死亡する前に作成された最新のCT又はMRIスキャンで脳梗塞の存在と定義されるか、又は剖検で初期動脈瘤閉塞の24と48時間の間のCT又はMRIスキャンで存在せず、また外科クリッピング又は血管内処置のような他の原因によるものでないと証明される。一般的に脳室カテーテル又は実質内血から生じるCT画像診断による白質は、DCIからの脳梗塞とみなされない。血管造影脳血管攣縮は、放射線試験(CT血管造影[CTA]、MRアンジオグラフィー[MRA] MRA又はカテーテル血管造影[CA])の説明であり、DCIの原因であり得る。用語「血管造影脳血管攣縮」は、クモ膜下腔への出血後の脳の底部(すなわち、大脳動脈)の大キャパシタンス動脈の狭小化を意味し、遠位脳領域の灌流減少につながる。血管造影血管攣縮は、SAHの結果であるが、血液をクモ膜下腔に沈着させるいかなる状態の後にも起こり得る。
SAHの古典的な症状は雷鳴頭痛(数秒から数分にわたって生じる「史上最悪」又は「頭部が蹴り破れる」と言われるが、すべてのSAH患者の約1/3のみの症状である。この症状を有する医療を求める患者の約10%が基礎をなすSAHを有する。患者が嘔吐を伴う場合もあり、14人中1人には発作がある。錯乱状態、意識レベルの低下、又は昏睡が存在し得るように、頸部硬直及び他の髄膜症の徴候が存在し得る。脳周辺の圧力の上昇に応答して眼内出血が起こる場合がある。硝子体下(硝子体膜が眼の硝子体を覆っている)及び硝子体の出血が眼底検査により見える場合がある。これは、テルソン症候群として知られ(症例の3-13%で起こる)、より重度のSAHにおいてより一般的である。雷鳴頭痛患者において、上述した徴候のいずれもが出血を確認又は除外するのに有効であるが、出血が他の原因とは反対に大動脈瘤破裂の結果である場合には発作がより一般的である。動眼神経異常(影響を受けたた下向き及び外向きの眼球運動、同じ側に眼瞼を持ち上げることができないが、瞳孔反射は正常である)は、後交通動脈近傍で生じる動脈瘤からの出血を示し得る。瞳孔の孤立した散大もまた、上昇する頭蓋内圧の結果として、脳ヘルニアを反映し得る。
出血の結果として体は大量のアドレナリン及び同様のホルモンを放出し、これが血圧の急な上昇につながる。心臓は実質的な緊張を受け、神経原性肺水腫、気絶心筋、心臓不整脈、心電図変化(時々巨大陰性「大脳」T波による)及び心停止(3%)が出血の発生後急速に起こり得る。
SAHは、また、頭部外傷を受けた人々に起こり得る。症状には、頭痛、意識レベルの低下又は片側不全麻痺が含まれ得る。SAHは、特により低いグラスゴーコーマスケールレベルと関係している場合には頭部外傷の重度の合併症とみなされる。
SAHの疑いがある人を評価するための初期段階は、病歴を得る段階及び身体検査を行う段階である。雷鳴頭痛により病院に入院する患者の10-25%のみがSAHを罹患しているので、通常、他の可能性のある原因、例えば髄膜炎、片頭痛、脳静脈静脈洞血栓症が同時に考慮される。SAHの2倍一般的である脳内出血が時々SAHと誤診される。
SAHの診断は、治療的背景単独でなされることはない。一般に、出血を確認するか又は除外するには脳の医用画像が必要である[通常は、高感度(特に出血の発生後1日目に>95%の正確な識別)のコンピュータ断層撮影(CTスキャン)]。CTスキャンと比較すると、磁気共鳴画像法(MRIスキャン)は数日後でも高感度であり得る。CT又はMRIスキャンが正常な人々において、脳脊髄液(CSF)が腰椎嚢から針で取り出される腰椎穿刺は、CTが正常であるとわかったグループの3%に出血の徴候を示し; それ故、画像診断が陰性である場合には腰椎穿刺は必須とみなされる。CSF試料についてキサントクロミー、遠心分離液の黄色の外観を、又は分光光度法を用いてビリルビン、CSFにおけるヘモグロビンの分解産物を調べる。
SAHが確認された後、その由来を決定する必要がある。一般的に、動脈瘤を確認するCT血管造影(CTスキャンにより造影で血管を可視化する)が第一段階であるが、より侵略的カテーテル血管造影(脳動脈に前進するカテーテルを通して造影剤を注入する)は判断基準試験であるが、合併症のリスクがより大きい。カテーテル血管造影は、同時に、出血源、例えば動脈瘤を除去する計画がある場合には有用である。
自発的SAHは、しばしば脳動脈瘤の破裂による(85%)。脳動脈瘤は、肥大化してくる脳の動脈の壁の弱さである。脳動脈瘤は、ウイリス動脈輪及びその分岐部内に位置する傾向がある。SAHのほとんどの症例が小さい動脈瘤から出血によるものであり、より大きな動脈瘤(まれである)は破裂しやすい。自発的SAHの症例の15-20%における最初の血管造影図から動脈瘤は検出されない。血液が中脳の領域に限定される非動脈瘤性中脳周辺出血によって、SAH症例の他の10%が生じる。これにおいて、一般的に動脈瘤は見られない。症例の残りの5%は、動脈に対する血管炎損傷、血管に作用する他の障害、脊髄血管の障害、及び種々の腫瘍への出血によるものである。ほとんどの外傷性SAHは、頭蓋骨骨折又は脳内挫傷の近傍で起こる。
いくつかの評価尺度がSAHに利用できる。患者の特性と結果を過去にさかのぼって適合させることによってこれらの評価尺度が誘導された。偏在して用いられるグラスゴーコーマスケール(GCS)に加えて、3つの他の特殊なスコアが用いられている。すべてのスコアにおいて、より大きい数字がより悪い結果と関係している。重症度の最初の尺度は、1968年にHunt & Hessによって記載されており(「ハント・ヘス分類」)、患者の臨床状態を分類する。フィッシャー評価は、CTスキャンによるSAHの出現を分類する。フィッシャー尺度は、Claassen及び共同研究者によって修正され(「Claassen尺度」)、SAHサイズから付加的リスクが反映され且つ脳室内出血が随伴する。世界脳神経外科分類はGCS及び局所神経障害を用いて症状の重症度を測定する。結果を予測し且つ治療法を測定するために総合的な分類体系がOgilvy & Carterによって提唱された。Ogilvyシステムは5つの評価を有し、5つの因子の各々の有無に1点が割り当てられる: 50歳を超える年齢; Hunt & Hess評価4又は5; フィッシャー尺度3又は4; 10mmより大きい動脈瘤サイズ; 及び後方循環動脈瘤25mm以上。
SAHの管理は、患者を安定させる一般処置、出血源を除去することによって再出血を防止する特定処置、血管攣縮の予防及び合併症の予防と治療からなる。
最優先事項は、患者を安定させることである。意識レベルが低下した患者は、挿管及び人工呼吸をすることを必要とし得る。血圧、脈拍、呼吸数及びグラスゴーコーマスケールがしばしばモニタされる。診断が確認されると、特にそのような患者の15%が入院後最初の数時間で更なる発症(再出血)があると考えれば、集中治療室への入院が好ましいことになる。栄養が初期の優先事項であり、経口又は経鼻胃管栄養が非経口経路がより好ましい。鎮静が精神状態に影響し、従って意識レベルをモニタする能力を妨げる場合があるので、鎮痛(疼痛管理)は、一般的に、コデインのような非鎮静薬に限定される。深部静脈血栓症は、加圧ストッキング、ふくらはぎの間欠的空気圧迫、又はこれらの双方によって予防する。
意識レベルの低下又は局所神経症状と関係がある大きな血腫患者は、血液の緊急外科的除去及び出血動脈瘤の閉塞の候補であり得る。カテーテル又はチューブを脳室に挿入して、水頭症を治療し得る。残りの患者は、より広範囲に安定させ、後に経大腿動脈カテーテル血管造影又はCT血管造影を受ける。最初の24時間後に、再出血リスクが引き続き4週間にわたって約40%残り、処置がこのリスクを低下させることを目的としなければならないことが示唆される。
再出血は予測するのが難しいが、いつでも起こる可能性があり、暗い予後をもたらす。それ故、再出血を防止する処置、主に大動脈瘤破裂のクリッピング又はコイリングができるだけ早期に行われる。脳動脈瘤が血管造影により確認された場合には、2つの処置が同じ動脈瘤から更なる出血のリスクを低下させるのに利用できる: 神経外科クリッピング及び血管内コイリング。クリッピングは動脈瘤の位置を決める開頭(頭蓋を開く)が必要であり、続いて動脈瘤の頸部全体に1つ又は複数のクリップが配置される。コイリングは、大血管を通して行われる: カテーテルを鼠径部内の大腿動脈に挿入し、大動脈を通って脳に供給する動脈(両頸動脈と両椎骨動脈)に進める。動脈瘤が位置したときに、動脈瘤における凝血の形成及び閉塞につながる金属コイルは配置される。治療が行われるかについての決定は、典型的には、神経外科医及び神経放射線科医を含む多学科的チームによってなされる。
中大脳動脈及びその関連した血管の動脈瘤は血管造影によって到達しにくく、クリッピングに従う傾向があり、脳底動脈及び後大脳動脈の動脈瘤は外科的に到達しにくく、血管内管理がより利用できる傾向がある。コイリングの主な欠点は、動脈瘤が再発し得る可能性であり; このリスクは、外科的方法においては極めて少ない。コイリングを受けた患者は、典型的には、血管造影又は他の処置によって長年にわたって追跡されて、動脈瘤の再発が早期に確認されることを確実にする。
早期罹患率及び死亡率
SAHの死亡率は、40%と50%の間にある。最初の入院、治療及び合併症を乗り切る患者の中で、少なくとも25%はこの生活様式に重大な制限があり、20%未満は全く後遺症状がない。昏睡のない軽度のSAHの診断の遅れ(又は突然の頭痛を片頭痛と間違えること)は、悪い結果の一因となる。悪い結果のリスク因子には、高齢、より不充分な神経学的評価、初期CTスキャンによるより多くの血液及びより大きな動脈瘤、後方循環における動脈瘤の位置、収縮期高血圧、及び心臓発作、高血圧、肝疾患の以前の診断又は以前のSAHが含まれる。入院中、血管攣縮に起因する遅発性虚血の発生、脳内血腫又は脳室内出血の発生(脳室への出血)、及び入院の8日目に熱があることも予後を悪化させる。
完全なカテーテル血管造影によって動脈瘤を示さないSAHは、「血管造影図陰性SAH」と呼ばれ得る。これは、動脈瘤由来のSAHより良好な予後をもたらす; しかしながら、なお虚血、再出血及び水頭症のリスクと関係がある。しかしながら、中脳周辺SAH(脳の中脳部周囲の出血)は、再出血又は遅発性虚血が非常に低速度であり、このサブタイプの予後は優れている。
神経認知症状、例えば疲労、気分障害、他の関連した症状は、SAHに罹った人々に共通する。良好な神経学的回復をした人々でさえ、不安、うつ病、外傷後ストレス障害及び認知障害は一般的である。60%を超える人が頻繁な頭痛を報告している。動脈瘤性SAHは、結果として視床下部及び脳下垂体の損傷につながる場合があり、脳のこの2つの領域はホルモン調節と産生において中心的役割を果たす。研究は、以前にSAHに罹った人々の少なくとも25%が視床下部下垂体ホルモン、例えば成長ホルモン、プロラクチン又は甲状腺刺激ホルモンの1つ以上の欠乏症を生じ得ることを示している。
血管造影脳血管攣縮は、SAH後の局所虚血の最も一般的な原因である。SAH関連の障害及び死亡の23%までを占めるように、血管攣縮はSAH患者の予後に悪影響を与える。全てのタイプの虚血性脳卒中の中で、血管攣縮はある程度予測可能、予防可能、且つ治療可能であるという点で独特である(Macdonald, R.L. and Weir, B. In Cerebral Vasospasm. Academic Press, Burlington, MA, USA (2001)を参照のこと)。
血管攣縮によって、脳血流の減少及び脳血管抵抗の増大が生じる。理論によって制限されることなく、一般的には、血管攣縮がアテローム硬化及び血管への局所的外傷、例えば外傷性頭部外傷、動脈瘤クモ膜下出血及びクモ膜下出血の他の原因を含む他の構造損傷から生じるものによると考えられる。脳血管攣縮は自然に生じる血管収縮であり、CSFにおける血液の存在、動脈瘤の破裂後又は外傷性頭部外傷後に共通して生じることによっても引き金となり得る。脳血管攣縮は、最終的には、血液供給が中断したことにより、脳虚血及び梗塞形成の形で脳細胞損傷につながり得る。
血管造影血管攣縮は、DCIに関与する1つのプロセスである。DCIに関与し得る他のプロセスは、皮質拡延性虚血及び微小血栓塞栓(図4)である。DCIは、少なくともこれらのプロセスだけでなく、早期の脳損傷による多因子プロセスである。皮質拡延性虚血は、SAHの動物モデルにおいてDCIを起こし得る新規な機序として記載された。DCIは、SAH及び血管造影血管攣縮をもったヒトにおいて検出されている。DCIに関与し得る他のプロセスは、微小血栓塞栓の形成である。
毎年、10,000人のうちの約1人に動脈瘤破裂がある。死亡率及び罹患率は、出血量と共に増加し且つ患者の年齢と健康状態を反映し、動脈瘤を生じる可能性が年齢と共に着実に増加する。再出血は、SAH量の増加だけでなく脳と脳室への拡張の可能性の増加により例外的に有害である。動脈瘤破裂が起因するほとんどの死は、最初の出血又は早期の再出血の影響により病院外で又は入院直後に起こる。血管攣縮の症状の潜在的徴候は、最初の数日を過ぎて生き延びた患者にのみ生じる。
無条件の用語「血管攣縮」は、通常は上で定義された血管造影的に決定された動脈の狭小化に関して用いられる。臨床上の血管攣縮は、遅発性脳虚血(DCI)と同意語としてよく用いられる。他の方法、例えば、中大脳動脈経頭蓋ドップラー速度増加に基づく血管攣縮に用いられる場合、これは明記されなければならない。
SAH後4と12日の間に血管造影した患者の少なくとも2/3にある程度の血管造影的狭小化が生じる。このDCIから神経機能の低下を発生する患者の数は、患者をモニタする努力と予防の効力によって変動するが、約1/3と推定されている。入院したSAH患者のうち、5〜10%の患者が血管攣縮で死亡する。中程度のSAH後患者と比較した場合、非常に良好な状態のSAH後患者はSAHの量が少ないので血管攣縮を発生しないようであり、非常に悪い状態のSAH後患者は最初の発症から早い段階に死亡するようである。出血の発症にごく近接して行われるコンピュータ断層撮影(CT)スキャンにより可視化され得る濃厚で広範囲にわたるクモ膜下凝血の存在は、鍵となる予後因子である。最初のCTスキャンに血液が存在しないことは、再出血がない場合血管攣縮がほとんどありそうにないことを示している。血管攣縮とその結果としてのDCIの可能性は、凝血にさらされる時間を減らす因子によって減少する。逆に言えば、血管攣縮とDCIの発生率は、動脈を凝血にさらす時間を延長し且つおそらく他の機序によって虚血を引き起こす抗線溶薬の使用によって増加する。おそらく抗線溶薬の使用とDCIがいずれも多量のSAHを示していることから、悪い入院時臨床評価はDCIと関係がある。年齢、高血圧、又は性別とDCIの間の明確な関係は、確立されていない。喫煙者は血管攣縮及びDCIをより起こしやすいようである。血管攣縮の発生と無関係な因子には、季節、地理、造影剤、及び糖尿病が含まれる。
独立変数、例えば入院時の神経学的評価、加齢、及び大量の頭蓋内又は脳室内出血が血管攣縮よりも密接に結果と関係がある。血管攣縮が段階的プロセスであるので、極端な症例のみが全身性血圧低下、心臓機能不全、アノキシア、及び頭蓋内圧亢進がない場合に梗塞をもたらすと予想される。既存の高血圧及び高齢もまた、虚血に対する脳の脆弱性に強く影響する。死亡例における血管攣縮と梗塞の病因関係は、議論されていない。
外科的に又は薬理的に凝血を除去するによって血管攣縮が減少し得る証拠がある。DCIが高血圧及び循環血液量過多だけでなくカルシウム拮抗薬によって少なくなり得ることを提唱しているデータもある。血管攣縮は、また、機械的又は一時的に薬理学的血管形成術によって消滅させ得る。
血管造影血管攣縮の発生率は、SAH後の時間間隔による。ピーク発生率は、SAH6-8日後に生じる(範囲、3-12日間)。SAH後の時間に加えて、血管攣縮の有病率に影響する他の主要因は、クモ膜下血液の容積と分布である。
血管攣縮の予後因子には、以下のものが含まれる: CTスキャンによる血液; 高血圧; 解剖学的及び全身的因子; 臨床グレード; 患者が抗線溶薬を受けているか; 年齢及び性別; 喫煙; 生理学的パラメーター; 及び水頭症。
血管攣縮の診断は、主に臨床的である。血管攣縮は、無症状であり得る; しかしながら、脳血流量が虚血閾値より少ないときに、症状は明らかになる。症状は、典型的には亜急性に発生し、変動し得る。症状には、過剰な眠気、嗜眠、昏迷、片側不全麻痺又は半身不随、意志欠乏、言語障害、視野欠損、凝視障害、及び脳神経麻痺が含まれ得る。一部の症状が局在化されるが、特定の病理過程の診断ではない; それ故、別の診断、例えば再出血、水頭症、発作は、エックス線撮影、臨床的及び検査上の評価を用いて、直ちに除外されなければならない。脳血管造影は、大脳動脈を可視化し且つ研究する最も基準となる; 経頭蓋ドップラー超音波検査も利用される。
血管攣縮の病態生理学は、血管内皮及び平滑筋細胞内で構造変化及び生化学的変化を伴い得る。クモ膜下腔内の血液の存在は、これらの変化を開始し得る。更に、血液量不足及び脳自動調整機能低下は、同時に脳灌流を妨げ得る。これらのプロセスの蓄積作用は、脳虚血を引き起こして梗塞につながるほど重度の脳血流の減少につながり得る。更に、重度の収縮期が大脳動脈の壁の形態学的変化につながり、血管作動物質が継続して存在せずに狭くしたままにさせ得る。次に影響を受けた動脈によって供給される脳の領域は、虚血(血液供給の制限を意味する)を経験する。
水頭症(脳室拡大及び頭蓋内圧上昇を生じるCSFの過剰蓄積が目立った状態)は、短期及び長期の双方においてSAHを併発する場合があり、CTスキャンにより検出され得る。意識レベルが低下する場合には、過剰な液体の外科的ドレナージ(例えば脳室ドレイン又はシャントによって)が時々必要である。
血圧の変動及び電解質障害だけでなく、肺炎及び心代償不全が、SAHの入院患者の約50%に起こり、予後を悪化させ得る。これらは、対症的に管理される。
全症例の約1/3に発作が起こる。
ニモジピン、経口カルシウムチャネルブ遮断薬は、臨床試験において悪い結果の可能性を減少させることを示したが、ニモジピンは、血管造影により検出された血管攣縮量をほとんど減少させ得ない。他のカルシウムチャネル遮断薬及び硫酸マグネシウムも調査されたが、現在は推奨されていない。ニモジピンが静注で投与れる場合には、利点を示す証拠がない。外傷性SAHにおいて、経口ニモジピンの効力は、依然として問題となっている。
以前は「トリプルH」療法と呼ばれた血行動態的操作が、血管攣縮を治療する処置としてしばしば用いられる。これは、高血圧(高い血圧)、循環血液量過多(循環における過剰な流体)及び血液希釈(血液の穏やかな希釈)の状態を達成するための静脈内輸液の使用を伴う。高血圧の誘発がこの治療の最も重要な構成要素であると考えられているが、この方法の使用の証拠は確定的でなく、これまでその利益を実証するために充分多くの無作為化比較試験が行われていない。
症候性脳血管攣縮が医療に抵抗する場合には、血管造影を試みて、血管攣縮の部位を確認するとともに血管拡張薬(血管壁を弛緩させる薬剤)を動脈へ直接投与してもよく(薬理学的血管形成)、機械的血管形成(収縮領域をバルーンで開く)が行われてもよい。
電位開口型イオンチャネルは、膜内外電圧の変化に応答して開閉によって細胞膜全体に選択された無機イオンの通過を可能にする膜内在性タンパク質の一種である。(Sands, Z. et al., 「Voltage-gated ion channels」, Current Biology, 15(2): R44-R47 (2005)). このタイプのイオンチャネルは、ニューロンにおいて特に重要であるが、多くのタイプの細胞において共通している。イオンチャネルが電圧変化の引き金となることに応答して急速な調整脱分極を可能にするように、興奮性ニューロン及び筋肉組織において重要な役割がある。軸索に沿ってシナプスに配置されれば、電位開口型イオンチャネルが方向的に電気シグナルを伝達する。
電位開口型カリウム、ナトリウム及びカルシウムイオンチャネルは、同様の全体構造を有すると考えられる。(Sands, Z. et al., 「Voltage-gated ion channels」, Current Biology, 15(2): R44-R47 (2005))。電位開口型イオンチャネルは、一般的に、イオンがその電気化学的勾配の下に進み得る中心ポアがあるように配置されたいくつかのサブユニットから構成される。チャネルは非常にイオン特異的である傾向があるが、同様のサイズと荷電のイオンはある程度そのチャネルも通過し得る。
カリウムチャネルの結晶学構造研究は、この構造が対応する原形質膜において完全なままであると仮定した場合、電位差が膜を通じて導入されるときに、付随する電磁場がカリウムチャネル内に立体配置的変化を引き起こすことを示唆している。立体配置的変化は充分にチャネルタンパク質の形状を歪め、チャネル、又はキャビティが開いて、イオンの流入又は流出がその電気化学的勾配の下で、膜全体に生じるようにする。これが引き続き細胞膜を脱分極するのに充分な電流を生成する。
電位開口型ナトリウムチャネル及びカルシウムチャネルは、4つの相同ドメインを有する単一のポリペプチドで構成される。各ドメインは、6つの膜貫通アルファヘリックスを含有する。電位感知ヘリックス、S4は、複数の正電荷を有し、細胞外部の高い正電荷がヘリックスに反発し且つ立体配置的変化を引き起こし、イオンがチャネルに流れ込み得る。カリウムチャネルは、各々が1つのドメインを含む4つの別々のポリペプチド鎖から構成される以外は、同様の方法で機能する。これらのチャネルの電位感知タンパク質ドメイン(「電位センサ」)は、一般的に、その形状のため「パドル」として知られ、保存配列であると思われるS3b及びS4ヘリックスから構成される領域を含有する。
電位依存性カルシウムチャネル(VDCC)は、膜電位変化に応答して細胞へのカルシウム流入を制御する一群の電位開口型イオンチャネルである。(Van Petegem F. et al., Biochemical Society Transactions, 34(5): 887-893 (2006)). 電位依存性カルシウムチャネルは、興奮性細胞(例えば、筋肉、グリア細胞、ニューロン等)に見られる。生理的又は静止膜電位において、VDCCは通常は閉じている。VDCCは、脱分極した膜電位で活性化される(すなわち、開く)。特定のVDCCの活性化により、Ca2+が細胞に流入することができ; 細胞タイプによっては、筋収縮、ニューロンの興奮、遺伝子発現のアップレギュレーション、又はホルモン又は神経伝達物質の放出が起こる。(Catterall W. A. et al.,「International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels」, Pharmacol. Rev., 57(4): 411-25 (2005); Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002)).
電位依存性カルシウムチャネルは、いくつかの異なるサブユニット: α1、α2δ、β1-4及びγの複合体として形成される。アルファサブユニットはイオン伝導性ポアを形成し、関連サブユニットはゲーティングの変調を含むいくつかの機能を有する。(Dolphin A. C. 「A short history of voltage-gated calcium channels」, Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006))
α1サブユニットポア(分子量が約190kDa)は、VDCCにおいて機能するチャネルに必要な主サブユニットであり、各々6つの膜貫通α-ヘリックスを含有する特徴的な4つの相同I〜IVドメインからなる。アルファサブユニットはCa2+選択的ポアを形成し、これは電圧感知機構と薬剤/毒素-結合部位を含有する。ヒトにおいて10のアルファサブユニットが確認されている。(Dolphin A. C. 「A short history of voltage-gated calcium channels」, Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006))
α2δ遺伝子は、2つのサブユニット、α2及びδをコードする。これらがジスルフィド結合を経て相互に連結され、170kDaの合わせた分子量を有する。α2は、最もα1サブユニットと相互作用する細胞外グリコシル化サブユニットである。δサブユニットは短い細胞内部分を有する単一の膜貫通領域を有し、これが原形質膜内にタンパク質を固定するのに役に立つ。4つのα2δ遺伝子: CACNA2D1(CACNA2D1)、(CACNA2D2)、(CACNA2D3)、及び(CACNA2D4)がある。α2δの同時発現が、α1サブユニットの発現レベルを高め且つ電流振幅の増加、より速い活性化及び不活性化速度論及び不活性化の電圧依存における過分極化シフトを引き起こす。これらの作用の一部はベータサブユニットがないときに観察されるが、他の場合には、ベータの同時発現が必要である。α2δ-1及びα2δ-2のサブユニットは、慢性神経因性疼痛を治療するのに用いられる少なくとも2つの抗けいれん薬、ガバペンチン及びプレガバリンの結合部位である。(Dolphin A. C. 「A short history of voltage-gated calcium channels」, Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006))
細胞内のβサブユニット(55kDa)は、グアニル酸キナーゼ(GK)ドメイン及びSH3(src相同3)ドメインを含有する細胞内膜結合型グアニル酸キナーゼ(MAGUK)様タンパク質である。βサブユニットのグアニル酸キナーゼドメインは、アルファサブユニットI〜II細胞質内ループに結合するとともにHVGCC活性を調節する。βサブユニットの4つの既知のイソ型がある: CACNB1、CACNB2、CACNB3及びCACNB4。(Dolphin A. C. 「A short history of voltage-gated calcium channels」, Br. J. Pharmacol., 147 (Suppl 1): S56-62 (2006))
理論によって制限されないが、細胞質βサブユニットが最終のアルファサブユニット構造を安定させ且つそれをアルファサブユニットにおける小胞体保留シグナルをマスクするその能力によって細胞膜に送達するのに主要な役割を有すると仮定される。βサブユニットが結合するときにマスクされるアルファサブユニットのI〜IIループに小胞体保留ブレーキが含有されている。それ故、βサブユニットは、最初に、細胞膜で発現されるアルファサブユニットの量を制御することによって電流密度を調節するように機能する。
この電位輸送役割に加えて、βサブユニットは活性化及び不活性化速度論を調節し、且つアルファサブユニットポアの活性化の電位依存を過分極化する重要な追加機能を有するので、より多くの電流がより少ない脱分極のために通過する。βサブユニットは、チャネル電気生理学的性質の重要なモジュレーターとして作用する。ドメインIとIIの間のαlサブユニット細胞内リンカー上の高度に保存された18-アミノ酸領域(Alpha相互作用ドメイン、AIDBP)とβサブユニットのGKドメイン上の領域(アルファ相互作用ドメイン結合ポケット)の間の相互作用がβサブユニットによって示される調節作用に関与する。更に、βサブユニットのSH3ドメインもまたチャネル機能に対する追加の調節作用を与え、βサブユニットがαlサブユニットポアと複数の調節相互作用を有し得ることが示される。アルファ相互作用ドメイン配列は、小胞体保留シグナルを含有しないと考えられ; これは、I〜IIα1サブユニットリンカーの他の領域に位置し得る。
γ1サブユニットが骨格筋VGCC複合体と関係していることは知られているが、証拠はカルシウムチャネルの他のサブタイプに関して断定的でない。γlサブユニット糖タンパク質(33kDa)は、4つの膜貫通ヘリックスから構成される。γlサブユニットは、輸送に影響せず、大部分は、チャネル複合体を調節することを必要としない。しかしながら、γ2、γ3、γ4及びγ8もまた、α-アミノ-3-ヒドロキシ-S-メチル-4-イソキサゾールプロピオン酸(AMPA)グルタミン酸受容体、CNSにおいて速いシナプス伝達を仲介するグルタミン酸塩の非-NMDA-タイプ向イオン性膜貫通受容体と関係している。NMDA-タイプ受容体は、NMDA(N-メチル-D-アスパラギン酸)が特異的に結合する受容体である。γサブユニットには8つの遺伝子がある: γ1(CACNG1)、γ2(CACNG2)、γ3(CACNG3)、γ4(CACNG4)、(CACNG5)(CACNG6)、(CACNG7)、及び(CACNG8)。(Chu P. J. et al., 「Calcium channel gamma subunits provide insights into the evolution of this gene family」, Gene, 280 (1-2): 37-48 (2002))。
電位依存性カルシウムチャネルは、構造及び形が非常に変化する。カルシウムチャネルは、その薬理学的及び電気生理学的性質に従ってL-、N-、P/Q、T-及びR-型と分類される。これらのチャネルサブタイプは、異なった生理機能を有する。分子クローニングは、各チャネルのαlサブユニット配列を明らかにした。αlサブユニットは、個々のチャネルにおける活性を誘発する特定の役割がある。それにもかかわらず、このチャネルサブタイプの選択的遮断薬が、各活性に関与する特定のチャネルを明らかにするのに必要とされる。神経N型チャネルは、ω-コノトキシンGVIAによって遮断され; R型チャネルは、他の遮断薬及び毒素に対して耐性であり、SNX-482によって遮断され、且つ脳内のプロセスに関与する場合があり; 密接に関連したP/Q型チャネルは、ω-アガトキシンによって遮断される。ジヒドロピリジン感受性があるL型チャネルは、骨格筋、平滑筋及び心筋の興奮収縮連関に、また、内分泌細胞におけるホルモン分泌に関与し、更にフェニルアルキルアミン及びベンゾチアゼピンによって拮抗される。
L型カルシウムチャネル
L型電位開口型カルシウムチャネルは、平滑筋細胞が脱極されるときに開く。この脱分極は細胞の伸長によって、そのGタンパク質共役受容体(GPCR)をアゴニスト結合することによって、又は自律神経系刺激によってもたらされ得る。L型カルシウムチャネルを開口は細胞外Ca2+の流入を引き起こし、次にカルモジュリンを結合する。活性化されたカルモジュリン分子はミオシン軽鎖キナーゼ(MLCK)を活性化し、太いフィラメントのミオシンがリン酸化される。リン酸化されたミオシンは架橋を細いアクチンフィラメントと架橋を形成することができ、平滑筋繊維(すなわち、細胞)は滑りフィラメントメカニズムによって収縮する。(Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002))
L型カルシウムチャネルは、また、横紋筋細胞、例えば、骨格筋繊維や心筋繊維のt管において多く含まれる。平滑筋のように、これらの細胞が脱分極されるときにL型カルシウムチャネルが開く。骨格筋において、L型カルシウムチャネル及びカルシウム遊離チャネル(リアノジン受容体、又はRYR)が相互に機械的にゲート開閉し、後者が筋小胞体(SR)に位置するので、を有する各々にゲートを付けた時から、L型カルシウムチャネルの開口部によってRYRの開口部が生じる。心筋において、L型カルシウムチャネルの開口が、カルシウムの細胞への流入を可能にする。カルシウムはSRにおけるカルシウム遊離チャネル(RYR)に結合し、これらを開口する(「カルシウム誘発カルシウム遊離」又は「CICR」と呼ばれる)。Ca2+がSRから遊離され、RYRがどのように開くかに関係なく、機械的ゲート開閉か又はCICRによって、アクチンフィラメント上のトロポニンCに結合することができる。次に、筋肉は滑りフィラメントメカニズムによって収縮し、筋節の短縮と筋収縮が生じる。
R型電位依存性カルシウムチャネル(VDCC)は、カルシウム流量の調節に関与する。R型VDCCは、SAH後に観察される脳血流量低下に重要な役割を果たす。理論によって制限されないが、細胞内遊離カルシウムイオンの濃度が血管平滑筋の収縮状態を決定するので、小径大脳動脈内に位置し得るR型電位依存性Ca2+チャンネルが全体的及び局部的な脳血流量を調節し得る。Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002).
R型電位依存性カルシウムチャネル阻害剤は、カルシウム流入遮断剤であり、その主要な薬理作用はR型電位開口型カルシウムチャネルによるカルシウムの細胞への流入を防止するか又は遅くすることである。遺伝子Cav2.3は、ニューロンにおいて発現されるR型電位依存性カルシウムチャネルの主要なポア形成単位をコードしている。
N型(「神経(Neural)型」の『N』)カルシウムチャネルは、主にシナプス前終末に見られ、神経伝達物質放出に関与する。活動電位による強い脱分極はこれらのチャネルを開かせるとともにCa2+の流入を可能にし、小胞融合及び貯蔵神経伝達物質の放出が開始される。N型チャネルは、ω-コノトキシンによって遮断される。Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002).
P型(小脳プルキンエ(Purkinje)細胞の『P』)カルシウムチャネルは、シナプス前終末での神経伝達物質放出、及び多くのニューロン型のニューロン統合におけるN型カルシウムチャネルに同様の役割を果たす。P型カルシウムチャネルは、また、心臓の電気伝導系におけるプルキニエ繊維に見られる(Winds, R., et al., J. Physiol. (Lond.) 305: 171-95 (1980); Llinds, R. et al., Proc. Natl. Acad. Sci. U.S.A. 86 (5): 1689-93 (1989))。Q型カルシウムチャネル遮断薬は、小脳顆粒細胞に存在するように思われる。これらは、活性化の高い閾値及び比較的遅い速度論を有する。Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002).
T型(一過性(transient)の『T』)カルシウムチャネル遮断薬は、低電位活性化型である。これらは、ペースメーカー活性を有するニューロン及び細胞及び骨細胞によく見られる。ミベフラジルは、他の型のVDCCよりT型に若干の選択性を示す。Yamakage M. et al, 「Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review」, Can. J. Anaesth., 49(2): 151-64 (2002).
カルシウムチャネル遮断薬は、体の多くの興奮性細胞、例えば心臓の筋肉、血管の平滑筋又はニューロン細胞に作用を有する薬剤及び天然物質の一種である。カルシウムチャネル遮断薬の主作用は、血圧を低下させることである。
ほとんどのカルシウムチャネル遮断薬は、心筋の収縮力を減少させる。これは、カルシウムチャネル遮断薬の「負の変力作用」として知られる。ほとんどのカルシウムチャネル遮断薬は、この負の変力作用による心筋症をもつ個体における治療の好ましい選択ではない。
多くのカルシウムチャネル遮断薬は、心臓の活動電位のプラトー基の間にカルシウムチャネルを遮断することによって心臓内の電気的活性の伝導を遅らせる。この「負の変伝導作用」は、心拍数の低減を引き起こし、心ブロックを引き起こし得る(カルシウムチャネル遮断薬の「負の変時作用」として知られる)。カルシウムチャネル遮断薬の負の変時作用は、これらを心房細動又は粗動をもつ個体の心拍数の制御のための薬剤の一般的に用いられる種類にする。
カルシウムチャネル遮断薬は、心臓及び血管の筋細胞の電位開口型カルシウムチャネル(VGCC)に作用する。カルシウムチャネルを遮断することによって、刺激されたときに細胞内のカルシウムレベルの大きな上昇を防止し、引き続き筋収縮を少なくするのにつながる。心臓において、拍動毎が利用できるカルシウムの減少により、心収縮性の減少が生じる。血管において、カルシウムの減少により、血管平滑筋の収縮が少なくなるので、血管径が増大する。得られた血管拡張は全末梢抵抗を減少させ、心収縮性の減少は心拍出量を減少させる。血圧が心拍出量及び末梢抵抗によって部分的に決定されるので、血圧が低下する。
L、N及びP/Q型のカルシウムチャネルのための遮断薬は、チャネルサブタイプを区別するのに用いられる。R型カルシウムチャネルサブタイプについては、その選択性がむしろ低くても、ω-アガトキシンIIIAが遮断活性を示す。このペプチドは、L、N及びP/Qサブタイプを含む高電位活性チャネルの全てに結合する(J. Biol. Chem., 275, 21309 (2000))。推定上のR型(又はクラスαlE)選択遮断薬、SNX-482、タランチュラヒステロクラテス・ギガス(Hysterocrates gigas)由来の毒素は、3つのジスルフィド結合(1-4、2-5及び3-6の配置)を有する41のアミノ酸残基ペプチドである(Biochemistry, 37, 15353 (1998), Peptides 1998, 748 (1999))。このペプチドは、40nM濃度で神経下垂体神経終末におけるクラスEカルシウムチャネル(IC50=15 nM〜30nM)及びR型カルシウム電流を遮断する。R型(クラスE)カルシウムチャネル遮断活性は、高度に選択的であり; K+及びNa+電流、及びL、P/Q及びT型カルシウム電流には作用が観察されない。N型カルシウム電流は、300nM〜500nMで弱く30-50%のみ遮断される。局所的に、SNX-482に対するR型電流の異なる感受性が観察され; ニューロン細胞体、網膜神経節細胞及び海馬錐体細胞の標品にはR型電流に対してほとんど作用が生じない。SNX-482を用いて、異なった薬理学的性質を有する3つのアルファE-カルシウムサブユニットが、小脳R型カルシウムチャネルに認められる(J. Neurosci., 20, 171 (2000))。同様に、オキシトシンの分泌が神経下垂体端末のR型カルシウム電流によって調節されるが、バソプレシンの分泌は調節されないことが示された(J. Neurosci., 19, 9235 (1999))。
フェニルアルキルアミンカルシウムチャネル遮断薬は、心筋に比較的選択的である。これは、心筋酸素要求量を減少させ、冠血管攣縮を逆転させる。これは、ジヒドロピリジンと比較して最小限の血管拡張効果を有する。この作用は細胞内である。
ベンゾチアゼピンカルシウムチャネル遮断薬は、血管カルシウムチャネルのこの選択性においてフェニルアルキルアミンとジヒドロピリジンの間の中間のクラスである。ベンゾチアゼピンは、この心抑制作用及び血管拡張作用のためにジヒドロピリジンによって生じる同程度の反射心臓刺激を生じることなく動脈圧を低下させることができる。
エンドセリンは、主に血圧及び血管緊張を増加させる内皮において産生される血管収縮性ペプチドである。このペプチドファミリーには、エンドセリン-1(ET-1)、エンドセリン-2(ET-2)及びエンドセリン-3(ET-3)が含まれる。これらの小ペプチド(21個のアミノ酸)は、血管ホメオスタシスにおいて重要な役割がある。ET-1は、大部分は血管内皮細胞によって分泌される。主なET-1イソ型は、血管系において発現され、最も強力な血管収縮剤である。ET-1は、また、変力性、走化性及び分裂促進的性質を有する。ET-1は、交感神経系を刺激して、レニン-アンギオテンシン-アルドステロン系(RAAS)、バソプレシン及び心房性ナトリウム利尿ペプチドに対するその作用によって塩類及び水分ホメオスタシスに影響する。エンドセリンは既知の最も強い血管収縮剤一種であり、心臓、全身循環及び脳が含まれるいくつかの器官系の血管疾患に関係があるとされている。
2つの鍵となるエンドセリン受容体型、ETA及びETBがある。ETA及びETBは、異なった薬理学的特性を有する。ETA-受容体親和性は、ET-3に対するよりET-1に対して非常に高い。ETA-受容体は血管平滑筋細胞に位置するが、内皮細胞にない。エンドセリンのETAへの結合は血管収縮及びナトリウム保留を増加させ、血圧上昇につながる。ETB受容体は、主に血管の内部に沿って並ぶ内皮細胞上に位置する。ETB受容体に結合するエンドセリンは、ナトリウム利尿及び多尿を増加させ、且つ酸化窒素を放出することによって、血圧を低下させる。ET-1及びET-3は等しくETB-受容体を活性化させ、またNO及びプロスタグランジンの産生によって血管拡張につながる。エンドセリン-1(ET-1)は、また、ETA-受容体刺激によって血管平滑筋収縮を引き起こし且つETB-受容体によって内皮細胞におけるNO産生を誘発することが証明されている。若干のETB-受容体は血管平滑筋に位置し、ここで血管収縮を仲介し得る。多くのエンドセリン受容体は、種々の因子によって調節される。アンジオテンシンII及びホルボールエステルはエンドセリン受容体をダウンレギュレーションするが、虚血及びシクロスポリンはエンドセリン受容体の数を増加させる。
健常な個体において、血管収縮と血管拡張の間の微妙な釣合いは、一方ではエンドセリン及び他の血管収縮剤、もう一方では酸化窒素、プロスタサイクリン及び他の血管拡張剤によって維持される。エンドセリンアンタゴニストは、局所又は全身の血管収縮及び細胞増殖と関係がある心臓、血管及び腎臓の疾患、例えば本態性高血圧症、肺高血圧症、慢性心不全、慢性腎不全の治療に役割があり得る。
一過性受容器電位(TRP)チャネルファミリーは、カルシウムチャネル群の一部である。これらのチャネルには、一過性受容器電位タンパク質及びその同族体、バニロイド受容体サブタイプI、伸長を抑制できる非選択的カチオンチャネル、嗅覚の機械感覚性チャネル、インスリン様成長因子I調節カルシウムチャネル及びビタミンD応答性アピカル、上皮カルシウムチャネル(ECaC)が含まれる。これらの分子の各々は、長さが少なくとも700個のアミノ酸であり、一定の保存構造特徴を共有する。6つの膜貫通ドメインがこれらの構造特徴の中で主なものであり、5及び6番目の膜貫通ドメインの間に追加の疎水性ループが存在する。このループが膜挿入時に形成されるチャネルのポアの活性に不可欠であると考えられる。TRPチャネルタンパク質は、また、1つ以上のアンキリンドメインを含み、N末端にプロリン多く含む領域をしばしば示している。
一過性受容器電位(TRP)カチオンチャネルは血管平滑筋に存在し、膜伸張のような刺激に対する平滑筋の脱分極性応答に関与する。ウリジン三リン酸(UTP)は、内向きの整流作用を示し、急速には脱感作されず、且つGd3+によって遮断されるカチオン電流を活性化することによって膜脱分極及び血管平滑筋収縮を引き起こす。標準的な一過性受容器電位(TRPC)タンパク質は、種々の哺乳類組織においてCa2+透過性の非選択性カチオンチャネルを形成する。このファミリーのチャネルの一部、TRPC6の抑制により、培養ウサギ門脈筋細胞においてアルファ-アドレナリン受容体活性化カチオン電流が阻止されることが報告されている。しかしながら、脳血管平滑筋におけるTRPC6チャネルの抑制は、UTP-誘発膜脱分極及び血管収縮を減弱しない。対照的に、TRPC3は、TRPC6と異なり、P2Y受容体のUTP活性化後にラット大脳動脈において観察されるように、アゴニスト誘発脱分極を仲介することが見られた。従って、血管平滑筋におけるTRPC3チャネルは、抵抗サイズの大脳動脈において血管収縮に寄与するアゴニスト誘発脱分極を仲介する。
TRPCチャネルは広範に細胞型の間で発現され、受容体仲介Ca2+シグナル伝達に重要な役割を果たし得る。TRPC3チャネルは、PLC共役受容体に応答して活性化されるCa2+伝導チャネルであることが知られている。TRPC3チャネルは、細胞内イノシトール1,4,5-三リン酸受容体(InsP3R)と直接相互作用することが示されている。すなわち、チャネル活性化はInsP3Rへの結合によって仲介される。
動脈血流量を増加させるか、血管収縮を阻害するか又は血管拡張を誘発するのに有効な薬剤は、TRPチャネルを阻害する薬剤である。これらの阻害剤は、TRPチャネルアンタゴニストである化合物を包含する。そのような阻害剤は、活性阻害剤又はTRPチャネル活性阻害剤と呼ばれる。本明細書に用いられる用語「活性阻害剤」は、TRPチャネルの活性を妨害又は防止する薬剤を意味する。活性阻害剤はTRPチャネルがUTPのようなアゴニストを結合する能力を妨害し得る。活性阻害剤は、TRPチャネル上の活性化結合部位と相互作用のためにTRPチャネルの天然に存在するアクチベーターと競合する薬剤であり得る。或いは、活性阻害剤は、活性化結合部位と異なる部位でTRPチャネルに結合し得るが、そうすることで、活性阻害剤は、例えば、TRPチャネルの立体構造変化を引き起こす場合があり、これが活性化結合部位に伝達され、それによって天然アクチベーターの結合が妨げられる。或いは、活性阻害剤は、TRPチャネルの上流又は下流の成分を妨害する場合があるが、TRPチャネルの活性を妨害する。この後者のタイプの活性阻害剤は機能性アンタゴニストと呼ばれる。活性阻害剤であるTRPチャネル阻害剤の限定されない例は、塩化ガドリニウム、塩化ランタン、SKF 96365及びLOE-908である。
35年以上の間、医師は、血管攣縮含む、SAHの有害な結果の発生を予防又は軽減しようと努力しており、現在の薬剤の副作用又は効力不足のために効果が制限されている。現在、血管攣縮の予防又は遅発性脳虚血(DCI)としても知られる遅発性虚血神経障害の軽減用にFDAで認可された薬剤はない。現在の血管攣縮の予防法は、効力不足又は安全性の問題、主に高血圧及び脳水腫のために失敗している。現在、FDAで認可された唯一の利用可能な薬剤はニモジピンであり、これはSAH患者の予後を改善したが、血管攣縮を軽減しない。
電位開口型カルシウムチャネルアンタゴニストは血管攣縮を予防し且つある程度回復させるのに有効であり得るが、従来技術の治療は、最大の薬理作用を及ぼすには少なすぎる用量を投与する。エンドセリン受容体アンタゴニストも血管攣縮を予防し、ある程度回復させるのに有効であり得るが、血管攣縮のこの回復又は予防は、血管攣縮の軽減によって予測されるほど顕著には予後の改善とはならない。理論によって制限されないが、電位開口型カルシウムチャネル遮断薬の全身送達が、血管攣縮に対する有益な効果を軽減する副作用、例えば、全身低血圧、肺水腫による肺血管拡張を引き起こす場合があり、より多い全身的用量の投与を妨げる。肺における血管の拡張もまた肺水腫及び肺損傷を引き起こし得る。
従来の治療法がクモ膜下出血後の脳血管攣縮を治療することに集中してきたが、証拠を蓄積することにより、クモ膜下出血に由来する追加の合併症があることが示され、クモ膜下出血治療後の予後を改善するために治療処置を標的にすることが求められている。本発明は、そのような方法を提供する。
本明細書に用いられる用語「活性(活性な)」は、意図した治療効果に関与する本発明の組成物の成分、構成成分又は構成要素を意味する。
本明細書に用いられる用語「アンタゴニスト」は、他の物質の作用に対抗する物質を意味する。
本明細書に用いられる用語「投与する」には、インビボ投与だけでなく、組織への直接的なエクスビボ投与が含まれる。一般的に、組成物は、経口的に、口腔的に、非経口的に、局所的に、吸入又は通気によって(すなわち、口又は鼻を通して)、又は直腸的のいずれかで、慣用の非毒性の医薬的に許容され得る担体、アジュバント、及び所望される賦形剤を含有する単位用量製剤において全身投与され得るか、又は注入、埋め込み、移植、局所適用、又は非経口的に限定されない手段で局所投与され得る。
本明細書に用いられる用語「アゴニスト」は、全体的又は部分的薬理学的応答を誘発するために受容体を活性化することのできる化学物質を意味する。受容体は内因性か又は外因性のいずれかのアゴニスト及びアンタゴニストによって活性化又は不活性化することができ、結果として生物学的応答が刺激又は阻害される。生理学的アゴニストは、同一の身体的応答を引き起こすが、同一の受容体に結合しない物質である。特定の受容体の内因性アゴニストは、その受容体に結合し且つそれを活性化する体が自然に産生する化合物である。スーパーアゴニストは、標的受容体の内因性アゴニストよりも大きい最大応答を生じることのできる化合物であるので、効率が100%を超える。このことは、それが内因性アゴニストよりも強力であることを必ずしも意味しないが、むしろ受容体結合後に細胞の内部で生じ得る可能な最大応答の比較である。完全アゴニストは、受容体を結合し且つ活性化し、その受容体で完全な効力が示される。部分アゴニストも、所定の受容体に結合し且つ活性化するが、完全アゴニストと比較して受容体で部分効力のみ有する。逆アゴニストは、その受容体のアゴニストと同一の受容体結合部位に結合し且つ受容体の構成的活性を逆転させる物質である。逆アゴニストは、受容体アゴニストと反対の薬理学的作用を示す。不可逆的アゴニストは、受容体が永久に活性化されるような方法で受容体に永久に結合するアゴニストの一種である。これは、アゴニストの受容体に対する関連が可逆的であるが、不可逆的アゴニストの受容体に対する結合が不可逆的であると考えられるという点で単なるアゴニストとは異なる。これによって、化合物がアゴニスト活性の短時間のバーストを生じさせ、その後、受容体の脱感作及びインターナリゼーションが続き、長期にわたる治療とともに、よりアンタゴニストに類似した作用が生じる。選択的アゴニストは、1つの特定の種類の受容体に特異的である。
本明細書に用いられる用語「血管造影血管攣縮」は、血管造影試験で検出され得る血管サイズの減少を意味し、クモ膜下出血後の患者の約50%に生じる。その一方、本明細書に用いられる用語「臨床血管攣縮」は、脳実質への血流量の減少に伴う錯乱徴候及び意識水準の低下を意味し、患者の30%に生じる。
本明細書に用いられる用語「アンタゴニスト」は、他の物質の作用に対抗する物質を意味する。
本明細書に用いられる用語「運動失調」は、随意運動の間に筋肉活動を調整することができないことを意味する。
本明細書に用いられる用語「生体適合性」は、生体組織に対して臨床的に関連した組織刺激、損傷、中毒反応又は免疫反応を引き起こさないことを意味する。
本明細書に用いられる用語「生分解性」は、簡単な化学プロセスによって、体の酵素の作用によって又は他の同様の生物活性機序によって経時能動的に又は受動的に分解する物質を意味する。
本明細書に用いられる用語「担体」は、生物体にほとんど刺激を引き起こさず且つ本発明の組成物の活性化合物の生物活性及び特性を抑止しない物質を記載している。担体は、治療される哺乳動物への投与に適切にするのに充分に高い純度及び充分に低い毒性を有しなければならない。担体は、不活性であり得るか又は医薬的利点を有し得る。用語「補形薬」、「担体」、又は「賦形剤」は同じ意味で用いられ、本明細書に記載される医薬的に許容され得る組成物の配合及び投与に適した担体物質を意味する。本明細書に有用な担体及び賦形剤には、非毒性であり且つ他の成分と相互作用しない当該技術において既知のそのような任意の物質が含まれる。
図1に示されるように、用語「大脳動脈」は、特に前通信動脈、中大脳動脈、内頸動脈、前大脳動脈、眼動脈、前脈絡叢動脈、後交通動脈、及び脳底動脈の少なくとも1つ、及び椎骨動脈を意味する。
本明細書に用いられる用語「脳血管攣縮」は、影響を受けた血管に遠位の領域の灌流減弱にしばしば伴うクモ膜下出血後の脳底における大容量動脈の狭小化の遅延発生を意味する。脳血管攣縮は、動脈瘤の破裂後いつでも発生し得るが、血液が体によって吸収される場合、ほとんどは出血後7日目にピークに達し、しばしば14日以内におさまる。
本明細書に用いられる用語「症状」は、種々の健康状態を意味し、健康な組織及び器官のいかなる基礎にある機序又は障害、損傷、及び増進によっても引き起こされる障害又は疾患を含むことを意味する。
本明細書に用いられる用語「接触」及びその全ての文法上の形は、接近の状態又は症状又は直接又は局部近接の状態又は症状を意味する。
用語「放出制御」は、製剤からの薬剤放出の方法及びプロファイルが調節されているいかなる薬剤含有製剤も意味する。これは、即時放出製剤だけでなく非即時放出製剤も意味し、非即時製剤としては徐放製剤及び遅延放出製剤が挙げられるがこれらに限定されない。
本明細書に用いられる用語「皮質拡延性脱分極」又は「CSD」は、細胞膜全体の受動的カチオン流入がATP依存性ナトリウム及びカルシウムポンプ活性を超えるときに起動する脳における完全に近いニューロンの脱分極及びニューロンの腫脹の波動を意味する。カチオン流入後、水流入が続き、細胞外空間が約70%だけ収縮する。正常なイオンホメオスタシスがナトリウム及びカルシウムポンプ活性の追加の補充によって回復しない場合には、細胞腫脹が潜在的に遅延細胞内カルシウムサージ及びミトコンドリア脱分極によって細胞死につながるので、細胞腫脹が保持され、プロセスはその場合「細胞毒性浮腫」と呼ばれる。CSDは、健康な組織の抵抗血管の拡張を誘導し; 従って、部分脳血流がニューロン脱分極相の間に増加する。(Dreier, J.P. et al., Brain 132: 1866-81 (2009).
本明細書に用いられる用語「遅発性脳虚血」又は「DCI」は、局所神経障害(例えば片側不全麻痺、失語症、失行、半盲、又はネグレクト)の発生、又はグラスゴー昏睡尺度の低下(全スコアによるか又はその個々の成分[眼、両側の運動、言語]の1つによる)を意味する。これは、少なくとも1時間持続してもしなくてもよく、動脈瘤閉塞直後に明らかでなく、脳の臨床評価、CT又は磁気共鳴画像(MRI)スキャン、及び適切な基礎研究によって他の原因に起因し得ないものである。血管造影脳血管攣縮は、放射線学的検査(CT血管撮影[CTA]、MRアンジオグラフィー[MRA] MRA又はカテーテル血管撮影[CA])の種類であり、DCIの原因であり得る。
用語「遅延放出」は、本明細書においてその一般的な意味で用いられ、製剤の投与とそこからの薬剤の放出の間に時間の遅れがある薬剤配合物を意味する。「遅延放出」は、長時間にわたって薬剤の漸進的放出を含んでも含まなくてもよく、従って「徐放」であってもなくてもよい。
本明細書に用いられる用語「拡散薬理学的作用」は、空間又は表面を広範に広がるか、分散するか又は散乱する薬理学的作用を意味する。
本明細書に用いられる用語「疾患」又は「障害」は、健康の障害又は異常な機能の症状を意味する。
本明細書に用いられる用語「薬剤」は、疾患の予防、診断、改善、治療、又は治癒に用いられる食品以外の治療薬又は任意の物質を意味する。
用語「有効量」は、所望の生物効果を理解するのに必要な又は充分な量を意味する。
本明細書に用いられる用語「エマルジョン」は、2つの不混和性液体担体を組み合わせることによって調製される二相系を意味し、一方が他方の全体に均一に分散し且つ最も大きいコロイド粒子の直径に等しいか又はそれよりも大きい直径を有する小球からなる。小球寸法は重要であり、系が最大安定性を達成するような寸法でなければならない。通常、第3の物質である乳化剤が組み込まれない場合、2相の分離が生じる。従って、基本的なエマルジョンは、少なくとも3つの成分、2つの不混和性液体担体と乳化剤だけでなく活性成分を含有する。大部分のエマルジョンは、水相を非水相に(逆もまた同様に)組み込んでいる。しかしながら、基本的に非水性、例えば、非水不混和性系グリセリン及びオリーブ油のアニオン性及びカチオン性界面活性剤であるエマルジョンを調製することが可能である。
本明細書に用いられる用語「流動性」は、相対位置の連続変化によって流れて又は流れているかのように運動のできるものを意味する。
本明細書に用いられる用語「肉芽腫性炎症」は、多核巨細胞及び結合組織を含む又は含まない類上皮マクロファージに対して規則的優勢に特徴を有する炎症反応を意味する。
本明細書に用いられる用語「高血圧」は、高い体血圧; 心臓血管の損傷又は他の悪い結果を誘導しそうなレベルに対する体血圧の一時的又は持続した上昇を意味する。
本明細書に用いられる用語「低血圧」は、正常未満の全身動脈圧; いかなる種類の低圧又は圧力低下も意味する。
本明細書に用いられる用語「移植する」は、組織内に物質、組成物、又はデバイスを所定の位置にグラフトするか、埋め込むか又は挿入することを意味する。
その種々の文法上の形で本明細書に用いられる用語「含浸」は、全体に注入させるか又は浸透させる; 隙間を物質で充填させることを意味する。
本明細書に用いられる用語「梗塞」は、塞栓、血栓、機械的要因、又は肉眼で見える壊死領域を生じる圧力による動脈又は静脈血供給の突然の不足を意味する。本明細書に用いられる用語「脳梗塞」は、脳の大脳領域への血行及び/又は酸素送達の一時的又は永続的減少に続く脳組織の損失を意味する。
本明細書に用いられる用語「炎症」は、血管化組織が損傷に反応する生理的プロセスを意味する。例えば、FUNDAMENTAL IMMUNOLOGY, 4th Ed., William E. Paul, ed. Lippincott-Raven Publishers, Philadelphia (1999) at 1051-1053を参照のこと、この内容は本願明細書に援用されている。炎症プロセスの間、解毒及び修復に関係する細胞は、炎症伝達物質によって損なわれた部位に動員される。炎症は、しばしば炎症の部位に白血球、特に好中球(多形核細胞)の強い浸潤に特徴を有する。これらの細胞は、血管壁又は無傷組織において毒性物質を放出することによって組織損傷を増進させる。伝統的に、炎症は、急性反応と慢性反応に分けられている。
本明細書に用いられる用語「虚血」は、血管の異常な狭小化(狭窄症)に遠位の灌流圧低下が抵抗血管の自動調節拡張によって補償されないときに生じる血液供給及び酸素の不足を意味する。
本明細書に用いられる用語「孤立分子」は、実質的に純粋であり且つ意図した使用に実際的で適切な程度まで天然に又は生体内系に通常見られる他の物質を含まない分子を意味する。
本明細書に用いられる用語「体において」、「空隙容積」、「切除ポケット」、「陥凹」、「注入部位」、「沈着部位」又は「植え込み部位」又は「送達部位」は、制限なく体のすべての組織を含むことを意味し、その限定されない例として臨床評価、治療又は疾患又は病状に対する生理的反応の作用によって注入、外科的切開、腫瘍又は組織除去、組織損傷、膿瘍形成からその中に形成された空間、又はこのようにして形成された他のいかなる同様の腔、空間、又はポケットを意味し得る。
本明細書に用いられる語句「局所的な投与」は、局所的な薬理学的作用(すなわち、ある位置に限定された薬理学的作用)又は拡散薬理学的作用(すなわち、空間又は表面にわたって広く拡散するか、分散するか又は散乱する薬理学的作用)を生じ得る体内の特定の位置に治療薬を投与することを意味する。
本明細書に用いられる語句「局所的な薬理学的作用」は、ある位置に限定された、すなわちある位置、場所、領域又は部位にごく近接した薬理学的作用を意味する。
本明細書に用いられる用語「長期」放出は、移植片が構成され且つ配置されて、少なくとも7日間及び潜在的に約30〜約60日間まで活性成分の治療レベルを送達することを意味する。
本明細書に用いられる用語「モジュレートする」は、ある基準又は割合に調節するか、変化させるか、適合させるか、又は調整することを意味する。
本明細書に用いられる用語「任意に」は、本発明の医薬組成物が医薬的に許容され得る担体を含有しても含有しなくてもよく、電位開口型カルシウムチャネル遮断薬及び医薬的に許容され得る担体の微小粒状配合物双方を含有する医薬組成物を含むことを意味する。
本明細書に用いられる用語「非経口」は、例えば、皮下(すなわち、皮膚の下への注入)、筋肉内(すなわち、筋肉への注入); 静脈内(すなわち、静脈への注入)、髄腔内(すなわち、脊髄周囲又は脳のくも膜下の空間への注入)、胸骨内注入、又は注入技術を含む、胃腸管の外側に注入によって体に導入すること(すなわち、注入による投与)を意味する。非経口投与組成物は、針、例えば、外科用針を用いて送達される。本明細書に用いられる用語「外科用針」は、選択された解剖学的構造への流体(すなわち、流れることのできる)組成物の送達に適合した任意の針を意味する。注射用製剤、例えば無菌の注入用水性又は油性懸濁液は、適切な分散剤又は湿潤剤及び沈殿防止剤を用いて、既知の技術に従って配合させ得る。
本明細書に用いられる用語「不全麻痺」は、部分的又は不完全な麻痺を意味する。
本明細書に用いられる用語「医薬的に許容され得る担体」は、ヒト又は他の脊椎動物に投与するのに適している1つ以上の適合する固体又は液体充填剤、希釈剤又は封入物質を意味する。本明細書に用いられる用語「担体」は、活性成分を組み合わせて適用を容易にする、天然又は合成の、有機又は無機成分を意味する。医薬組成物の成分は、また、所望の医薬効率を実質的に損なう相互作用がないような方法で混ぜ合わせることができる。
本明細書に用いられる用語「医薬組成物」は、標的症状又は疾患を予防、強度の軽減、治癒或いは治療するために使われる組成物を意味する。
本明細書に用いられる用語「薬理学的作用」は、活性剤にさらされた結果又は成行きを意味する。
本明細書に用いられる語句「主に局所的な薬理学的作用」は、全身投与と比較して、局所的な投与で達成された少なくとも1〜3桁の大きさだけある位置に限定された薬剤の薬理学的作用を意味する。
本明細書に用いられる用語「予後」は、医学知識に基づく疾患又は障害の予想される将来の原因及び結果を意味する。
本明細書に用いられる用語「低下」又は「低下する」は、障害を生じるリスクで個体における障害の程度、強度、範囲、サイズ、量、密度、数又は発生の縮小、減少、減弱、制限又は寛解を意味する。
本明細書に用いられる用語「亜急性炎」は、好中球、リンパ球、及び時々マクロファージ及び/又は血漿細胞の混合物に特徴を有する初期の炎症プロセスに続いて典型的に見られる組織反応を意味する。
本明細書に用いられる語句「血管攣縮がある被検者」は、血管攣縮と関連する診断マーカー及び症状を示す被検者を意味する。診断マーカーとしては、CSF内の血液の存在及び/又はくも膜下出血の最近の病歴が挙げられるが、これらに限定されない。血管攣縮関連症状としては、体の片側の麻痺、言葉を声に出せないこと又は話した言葉又は書かれた言葉を理解できないこと、及び空間分析を要する課題を行えないことが挙げられるが、これらに限定されない。そのような症状は、数日にわたって生じる場合があり、又はその出現が変動する場合があり、又は症状が不意に現れる場合がある。
本明細書に用いられる語句「血管造影血管攣縮がある被検者」は、血管攣縮と関連する診断マーカーを示す被検者を意味する。診断マーカーとしては、CSF中の血液の存在、SAHの最近の病歴又はカテーテルに認められる大脳動脈の内腔径の減少、SAH又はTBIの1〜14日後にコンピュータ断層撮影図又は磁気共鳴血管撮影図が挙げられるが、これらに限定されない。血管攣縮関連症状としては、体の片側の麻痺、言葉を声に出せないこと又は話した言葉又は書かれた言葉を理解できないこと、及び空間分析を要する課題を行えないことが挙げられるが、これらに限定されない。そのような症状は、数日にわたって生じる場合があり、又はその出現が変動する場合があり、又は症状が不意に現れる場合がある。経頭蓋ドップラー超音波もまた、例えば、血管造影血管攣縮の進行を診断及びモニタし得る。CSFにおける血液の存在は、CTスキャンを用いて検出され得る。しかしながら、血液の量がCTによって検出されないほど少ない場合には、腰椎穿刺が保証される。
本明細書に用いられる語句「遅発性脳虚血がある被検者」又は「DCI」は、DCIと関連する診断マーカーを示す被検者を意味する。診断マーカーとしては、CSF中の血液の存在、SAHの最近の病歴及び/又はSAHの1〜14日後の神経学的悪化の発生で、その神経学的悪化が診断され得る他の原因、発作、水頭症、頭蓋内圧の上昇、感染、頭蓋内出血又は他の全身的因子が挙げられるが、これらに限定されないものによるものでないときのものが挙げられるが、これらに限定されない。DCI関連症状としては、体の片側の麻痺、言葉を声に出せないこと又は話した言葉又は書かれた言葉を理解できないこと、及び空間分析を要する課題を行えないことが挙げられるが、これらに限定されない。そのような症状は、数日にわたって生じる場合があり、又はその出現が変動する場合があり、又は症状が不意に現れる場合がある。
本明細書に用いられる語句「皮質内拡延性虚血がある被検者」は、皮質内拡延性虚血と関連する診断用マーカーを示す被検者を意味する。診断マーカーとしては、CSF中の血液の存在、SAHの最近の病歴及び/又はSAHの1〜14日後の神経学的悪化の発生で、その神経学的悪化が診断され得る他の原因、発作、水頭症、頭蓋内圧の上昇、感染、頭蓋内出血又は他の全身的因子が挙げられるが、これらに限定されないものによるものでないときのものが挙げられるが、これらに限定されない。他の診断用マーカーは、皮質脳波検査によって検出される血管収縮による伝播脱分極波の検出であり得る。皮質内拡延性虚血関連症状としては、体の片側の麻痺、言葉を声に出せないこと又は話した言葉又は書かれた言葉を理解できないこと、及び空間分析を要する課題を行えないことが挙げられるが、これらに限定されない。そのような症状は、数日にわたって生じる場合があり、又はその出現が変動する場合があり、又は症状が不意に現れる場合がある。
本明細書に用いられる語句「実質的に純粋な」は、治療薬の条件を意味し、生体系において又は合成の間にそれと関連し得る物質から実質的に分離されている。一部の実施態様によれば、実質的に純粋な治療薬は、少なくとも70%純粋、少なくとも75%純粋、少なくとも80%純粋、少なくとも85%純粋、少なくとも90%純粋、少なくとも95%純粋、少なくとも96%純粋、少なくとも97%純粋、少なくとも98%純粋、又は少なくとも99%純粋である。
用語「徐放性」(「長期放出」とも呼ばれる)は、本明細書においてその従来の意味で用いられ、長期にわたって薬剤の漸進的な放出を備え、且つ好ましくは、必ずしも必要ではないが、長期にわたって薬剤の実質的に一定の血中レベルをもたらす薬剤配合物を意味する。或いは、非経口的に投与された剤形の遅延吸収は、薬剤を油性賦形剤に溶解するか又は懸濁することによって達成される。徐放性生分解性高分子の限定されない例としては、ポリエステル、ポリエステルポリエチレングリコールコポリマー、ポリアミノ由来バイオポリマー、ポリ無水物、ポリオルトエステル、ポリホスファゼン、SAIB、光重合性バイオポリマー、タンパク質ポリマー、コラーゲン、多糖類、キトサン、及びアルギン酸塩が挙げられる。
本明細書に用いられる語句「全身投与」は、全身に対する薬理学的作用を有する治療薬の投与を意味する。全身投与には、胃腸管を通しての経腸投与(例えば経口)及び胃腸管の外側の非経口投与(例えば静脈内、筋肉内等)が含まれる。
活性薬剤の1つ以上の用語「治療的な量」又は「有効な量」は、意図した治療利益を与えるのに充分な量である。本明細書に示される教示と組み合わせれば、種々の活性化合物及び計量因子、例えば効力、相対的生物学的利用能、患者の体重、副作用の重症度及び好ましい投与方法を選択することによって、実質的な毒性を生じないが具体的な被検者を治療するのに効果的である有効な予防的又は治療的な治療法が計画されることになる。使われ得る活性剤の治療的に有効な量は、一般的には0.1mg/kg体重〜約50mg/kg体重の範囲にある。いずれかの具体的な適用についての治療的に有効な量は、治療される疾患又は症状のような因子、投与される具体的な電位開口型カルシウムチャネル遮断薬、被検者のサイズ、又は疾患又は症状の重症度によって異なり得る。当業者は、過度の実験を必要とせずに具体的な阻害剤及び/又は他の治療薬の有効量を経験的に決定し得る。一般的には、ある医学的な判断に従って最大用量、すなわち、最も安全な用量が用いられることが好ましい。しかしながら、用量レベルは種々の要因に基づき、損傷のタイプ、年齢、体重、性別、患者の医学的状態、症状の重症度、投与経路、及び使われる具体的な活性剤が含まれる。従って、投与計画は、広く変動し得るが、標準の方法を用いて外科医が日常的に決定し得る。「用量」及び「投薬量」は、本明細書において同じ意味で用いられる。
カルシウムチャネル阻害剤、カルシウムチャネルアンタゴニスト、カルシウムチャネル遮断薬、一過性受容器電位タンパク質遮断薬及び/又はエンドセリンアンタゴニストを含む治療薬(1つ以上)は、粒子で供給され得る。
本明細書に用いられる用語「治療成分」は、具体的な疾患症状の進行を集団のパーセントで除くか、弱めるか又は妨げる治療的に有効な用量(すなわち、投与量及び投与回数)を意味する。一般に用いられる治療成分の例は、用量を集団の50%が具体的な疾患症状に治療的に有効である個々の投薬量で記載するED50である。
本明細書に用いられる用語「治療効果」は、治療の結果で、望ましく且つ有益であると判断される結果を意味する。治療効果には、直接または間接に、疾患症状の停止、減少、又は除去が含まれ得る。治療効果には、また、直接または間接に、疾患症状の進行の停止、低下又は排除が含まれ得る。
用語「局所的」は、適用点に、又はそのすぐ下に組成物を投与することを意味する。語句「局所的に投与する」は、上皮表面を含む1つ以上の表面上に適用することを記載する。局所投与は、経皮投与と対照的に、一般的に全身的効果よりも局所的効果を与える。
本明細書に用いられる用語「一過性受容器電位タンパク質アンタゴニスト」は、他のカルシウムチャネルアンタゴニストとは構造的に異なり且つ受容体仲介カルシウム流入よる細胞における細胞内カルシウム上昇に拮抗するタンパク質を意味する。一過性受容器電位タンパク質遮断薬及びアンタゴニストとしては、SK&F 96365(1-(ベータ-[3-(4-メトキシフェニル)プロポキシ]-4-メトキシフェネチル)-1H-イミダゾール塩酸塩)及びLOE 908 (RS)-(3,4-ジヒドロ-6,7-ジメトキシイソキノリン-l-ガンマ1)-2-フェニル-N,N-ジ[2-(2,3,4-トリメトキシフェニル)エチル]アセトアミドが挙げられるが、これらに限定されない。
用語「治療」又は「治療する」には、疾患、症状又は障害の進行を停止させるか、実質的に阻止するか、遅らせるか又は逆転させること、症状の臨床的又は審美的徴候を実質的に改善すること、疾患、症状、又は障害の臨床的又は審美的徴候の出現を実質的に予防すること、及び有害な又は不快な徴候から保護することが含まれる。治療することは、更に以下の1つ以上を達成することを意味する: (a)障害の重症度を軽減すること; (b)治療されている障害(1つ以上)に特有の症状の発症を制限すること; (c)治療されている障害(1つ以上)に特有の症状の悪化することを制限すること; (d)以前に障害(1つ以上)があった患者において障害(1つ以上)の再発を制限すること; 及び(e)以前には障害(1つ以上)が無症候性であった患者において症状の再発を制限すること。
本明細書に用いられる血管収縮の逆である用語「血管拡張」は、血管を広げることを意味する。本明細書に用いられる用語「血管収縮薬」、「血圧上昇薬」又は「昇圧薬」は、血管収縮を引き起こす因子を意味する。
本明細書に用いられる用語「血管攣縮」は、血流量の減少を引き起こす動脈の壁内の平滑筋の収縮から生じる大脳動脈の内径の減少を意味するが、一般的に全身血管抵抗は増大しない。血管攣縮によって、脳血流量の減少及び脳血管抵抗の増大が生じる。理論によって制限されないが、一般的には、血管攣縮は血管に対する局所的損傷、例えばアテローム硬化や外傷性頭部外傷、動脈瘤クモ膜下出血及びクモ膜下出血の他の原因を含む他の構造損傷から生じるものによると考えられる。脳血管攣縮は、自然に生じる血管収縮であり、CSFにおける血液の存在、動脈瘤の破裂後又は外傷性頭部損傷後に共通して生じることによっても引き金となり得る。脳血管攣縮は、最終的には、血液供給が妨害されたことにより、脳虚血及び梗塞形成の形で脳細胞損傷につながり得る。本明細書に用いられる用語「脳血管攣縮」は、更に、影響を受けた血管に遠位の領域の灌流減弱にしばしば伴うクモ膜下出血後の脳底における大容量動脈の狭小化の遅延発生を意味する。脳血管攣縮は、動脈瘤の破裂後いつでも発生し得るが、血液が体によって吸収される場合、ほとんどは出血後7日目にピークに達し、しばしば14日以内におさまる。血管造影血管攣縮は、SAHの結果であるが、血液をクモ膜下腔に沈着させるいかなる状態の後にも起こり得る。より詳しくは、用語「血管造影脳血管攣縮」は、クモ膜下腔に出血の後の脳底における大容量動脈(すなわち、大脳動脈)の狭小化を意味し、遠位脳領域の灌流低下につながる。
一態様において、本発明は、(i)電位開口型カルシウムチャネル遮断薬の微小粒子配合物; 及び任意に(ii)医薬的に許容され得る担体を含む医薬組成物を提供する。
一部の実施態様によれば、医薬組成物は、その治療を必要としている哺乳類において脳損傷に伴う少なくとも1つの遅発性合併症の発生又は重症度を予防又は軽減させることができ、脳損傷が少なくとも1つの大脳動脈の妨害を含んでいる。そのような一部の実施態様によれば、少なくとも1つの遅発性合併症は、遅発性脳虚血(DCI)、脳内血腫、脳室内出血、熱、血管造影血管攣縮、微小血栓塞栓、皮質拡延性虚血(CSI)、行動に関する欠陥、神経障害、脳梗塞、ニューロン細胞死、又はこれらの組み合わせからなる群より選ばれる。一実施態様によれば、少なくとも1つの遅発性合併症は、遅発性脳虚血(DCI)である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳内血腫である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳室内出血である。他の実施態様によれば、少なくとも1つの遅発性合併症は、熱である。他の実施態様によれば、少なくとも1つの遅発性合併症は、血管造影血管攣縮である。他の実施態様によれば、少なくとも1つの遅発性合併症は、皮質拡延性虚血(CSI)である。他の実施態様によれば、少なくとも1つの遅発性合併症は、微小血栓塞栓症である。他の実施態様によれば、少なくとも1つの遅発性合併症は、行動に関する欠陥である。他の実施態様によれば、少なくとも1つの遅発性合併症は、神経障害である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳梗塞である。他の実施態様によれば、少なくとも1つの遅発性合併症は、ニューロン細胞死である。
一部の実施態様によれば、哺乳類における配達の部位に治療的な量で投与される場合、医薬組成物はそれを必要としている哺乳類において脳損傷に伴う少なくとも1つの遅発性合併症の発生又は重症度を予防するか又は減少させるのに効果的であり、その脳損傷には少なくとも1つの大脳動脈の妨害が含まれている。一実施態様によれば、配達部位は脳室である。一部の実施態様によれば、脳室は側脳室、第三脳室、第四脳室、又はこれらの組み合わせからなる群より選ばれる。一実施態様によれば、送達部位はクモ膜下腔にある。一実施態様によれば、送達部位は脳損傷にごく近接している。他の実施態様によれば、送達部位は脳損傷によって影響を受けている血管にごく近接している。一実施態様によれば、血管は少なくとも1つの大脳動脈である。他の実施態様によれば、血管は、脳損傷によって影響を受けた少なくとも1つの大脳動脈である。
一実施態様によれば、拡散薬理学的作用は、血管攣縮の減少であり、送達部位から少なくとも10mm、少なくとも9.9mm、少なくとも9.8mm、少なくとも9.7mm、少なくとも9.6mm、少なくとも9.5mm、少なくとも9.4mm、少なくとも9.3mm、少なくとも9.2mm、少なくとも9.1mm、少なくとも9.0mm、少なくとも8.9mm、少なくとも8.8mm、少なくとも8.7mm、少なくとも8.6mm、少なくとも8.5mm、少なくとも8.4mm、少なくとも8.3mm、少なくとも8.2mm、少なくとも8.1mm、少なくとも8.0mm、少なくとも7.9mm、少なくとも7.8mm、少なくとも7.7mm、少なくとも7.6mm、少なくとも7.5mm、少なくとも7.4mm、少なくとも7.3mm、少なくとも7.2mm、少なくとも7.1mm、少なくとも7.0mm、少なくとも6.9mm、少なくとも6.8mm、少なくとも6.7mm、少なくとも6.6mm、少なくとも6.5mm、少なくとも6.4mm、少なくとも6.3mm、少なくとも6.2mm、少なくとも6.1mm、少なくとも6.0mm、少なくとも5.9mm、少なくとも5.8mm、少なくとも5.7mm、少なくとも5.6mm、少なくとも5.5mm、少なくとも5.4mm、少なくとも5.3mm、少なくとも5.2mm、少なくとも5.1mm、少なくとも5.0mm以内である血管の内径が対照と比較して増大する。
一部の実施態様によれば、電位開口型チャネル遮断薬は、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる。
組成物に配合され得る電位開口型カルシウムチャネル遮断薬の限定されない例としては、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、孤立分子である。本明細書に用いられる用語「孤立分子」は、実質的に純粋であり且つ意図した使用に実際的で適切な程度まで天然に又はインビボ系に通常見られる他の物質を含まない分子を意味する。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、医薬製剤において医薬的に許容され得る担体と混合されている。そのような一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、製剤の少量のみの質量パーセントを含んでいる。一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、実質的に純粋である。
一部の実施態様によれば、医薬組成物は、医薬的に許容され得る担体を含まない。一部の実施態様によれば、医薬的に許容され得る担体は、ヒアルロン酸を含まない。
一実施態様によれば、医薬的に許容され得る担体は、固体担体又は賦形剤である。他の実施態様によれば、医薬的に許容され得る担体は、ゲル相担体又は賦形剤である。担体又は賦形剤の例としては、炭酸カルシウム、リン酸カルシウム、種々のモノマー及びポリマーの糖(ヒアルロン酸が挙げられるが限定されない)、デンプン、セルロース誘導体、ゼラチン、及びポリマーが挙げられるが、これらに限定されない。例示的な担体には、食塩水賦形剤、例えばリン酸緩衝食塩水(PBS)中のヒドロキシルプロピルメチルセルロース(HPMC)も含まれ得る。
他の実施態様によれば、医薬的に許容され得る担体は、徐放性固体化合物を含んでいる。そのような一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、徐放性固体化合物に埋め込まれるか又は徐放性固体化合物に被覆される。更に他の実施態様によれば、医薬的に許容され得る担体は、電位開口型カルシウムチャネル遮断薬を含有する徐放性微粒子を含んでいる。
他の実施態様によれば、医薬的に許容され得る担体は、ゲル化合物、例えば生分解性ヒドロゲルである。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の形で供給される。本明細書に用いられる用語「粒子」は、カルシウムチャネル遮断薬を全体的に又は部分的に含有し得るナノ又は微粒子(又はある場合により大きい)を意味する。一部の実施態様によれば、微小粒子配合物は、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含んでいる。一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、コーティングによって囲まれた粒子のコア内に含有される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の表面全体に分散される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の上に又は微粒子の中に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の表面全体に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子に吸着される。
そのような一部の実施態様によれば、微粒子は、一様なサイズ分布を有する。一部の実施態様によれば、微粒子サイズの一様分布は、微粒子を含む一様なエマルジョンを形成する均質化プロセスによって達成される。そのような一部の実施態様によれば、各微粒子はマトリックスを含んでいる。一部の実施態様によれば、マトリックスは電位開口型カルシウムチャネル遮断薬を含んでいる。
一部の実施態様によれば、医薬組成物は流動性である。一部の実施態様によれば、医薬組成物の微小粒子配合成分は流動性である。
一部の実施態様によれば、粒子は、溶液で又は半固体状態で電位開口型カルシウムチャネル遮断薬を含有するマイクロカプセルである。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有する微粒子である。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有するナノ粒子である。一部の実施態様によれば、粒子は、実質的に任意の形状を有し得る。
一部の実施態様によれば、粒径は、約25μm〜約100μmにある。一部の実施態様によれば、粒径は、約30μm〜約80μmにある。一実施態様によれば、粒径は、少なくとも約25μmである。他の実施態様によれば、粒径は、少なくとも約30μmである。他の実施態様によれば、粒径は、少なくとも約35μmである。他の実施態様によれば、粒径は、少なくとも約40μmである。他の実施態様によれば、粒径は、少なくとも約45μmである。他の実施態様によれば、粒径は、少なくとも約50μmである。他の実施態様によれば、粒径は、少なくとも約55μmである。他の実施態様によれば、粒径は、少なくとも約60μmである。他の実施態様によれば、粒径は、少なくとも約65μmである。他の実施態様によれば、粒径は、少なくとも約70μmである。他の実施態様によれば、粒径は、少なくとも約75μmである。他の実施態様によれば、粒径は、少なくとも約80μmである。他の実施態様によれば、粒径は、少なくとも約85μmである。他の実施態様によれば、粒径は、少なくとも約90μmである。他の実施態様によれば、粒径は、少なくとも約95μmである。他の実施態様によれば、粒径は、少なくとも約100μmである。
他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、少なくとも1つのシートにおいて供給され得る。シートがコーティングによって囲まれたコア内に電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬を含有し得るか、又は電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬がシート全体に分散され得るか、又は電位開口型カルシウムチャネルがシートに吸収され得る。シートは、ゼロ次放出、一次放出、二次放出、遅延放出、持続放出、即時放出、及びこれらの組み合わせを含む、次数放出速度論を有し得る。シートには、電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬に加えて、浸食性、非浸食性、生分解性、又は非生分解性の物質又はこれらの組み合わせが挙げられるがこれらに限定されない、調剤及び医薬品の技術において日常的に用いられる物質のいずれもが含まれ得る。
一部の実施態様によれば、微小粒子配合物は、微粒子の懸濁液を含んでいる。一部の実施態様によれば、医薬組成物は、更に、沈殿防止剤、安定剤及び分散剤の少なくとも1つを含んでいる。そのような一部の実施態様によれば、医薬組成物は、懸濁液として存在する。そのような一部の実施態様によれば、医薬組成物は、溶液として存在する。そのような一部の実施態様によれば、医薬組成物は、エマルジョンとして存在する。
一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水溶液を水溶性形態で含んでいる。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の油性懸濁液を含んでいる。電位開口型カルシウムチャネル遮断薬の油性懸濁液は、適切な親油性溶媒を用いて調製され得る。例示的な親油性溶媒又は賦形剤としては、脂肪油、例えばゴマ油、又は合成脂肪酸エステル、例えばエチルオレエート又はトリグリセリドが挙げられるが、限定されない。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水性懸濁液を含んでいる。水性注入懸濁液は、懸濁液の粘度を増加させる物質、例えばカルボキシルメチルセルロースナトリウム、ソルビトール、又はデキストランを含有し得る。任意に、懸濁液は、また、適切な安定剤又は化合物の溶解性を増加させて高度に濃縮された溶液の調製を可能にする物質を含有し得る。或いは、電位開口型カルシウムチャネル遮断薬は、使用前に、適切な賦形剤、例えば、発熱物質を含まない滅菌水と構成するために粉末の形であり得る。
マイクロカプセル封入プロセス及び製品の例; エマルジョンベースの微粒子の製造方法; エマルジョンベースの微粒子及びその製造方法; 調整可能な抽出速度を有する溶媒抽出マイクロカプセル封入; 溶媒及び塩によるマイクロカプセル封入プロセス; 微粒子を作成する連続二重エマルジョンプロセス; ポリマーブレンドから微粒子特性、放出制御系を調整する乾燥方法; 非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法; 及び微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドアセンブリが、米国特許第5,407,609号明細書(マイクロカプセル封入プロセス及びその製品と称する)、米国特許出願公開第10/553,003号明細書(エマルジョンベースの微粒子の製造方法と称する)、米国特許出願公開第11/799,700号明細書(エマルジョンベースの微粒子及びその製造方法と称する)、米国特許出願公開第12/557,946号明細書(抽出速度可変による溶媒抽出マイクロカプセル封入と称する)、米国特許出願公開第12/779,138号明細書(ヒアルロン酸(HA)注入賦形剤と称する)、米国特許出願公開第12/562,455号明細書(溶媒及び塩によるマイクロカプセル封入プロセスと称する)、米国特許出願公開第12/338,488号明細書(低残留溶媒容積を有する微粒子の調製方法と称する); 米国特許出願公開第12/692,027号明細書(ポリマーブレンドからの放出制御系と称する); 米国特許出願公開第12/692,020号明細書(非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法と称する); 米国特許出願公開第10/565,401号明細書(「放出制御組成物」と称する); 米国特許出願公開第12/692,029号明細書(「微粒子特性を調整する乾燥方法と称する); 米国特許出願公開第12/968,708号明細書(「微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドと称する); 及び米国特許公開第13/074542号明細書(「局所投与部位において医薬組成物の保持が改善される組成物及び方法」と称する)に開示され記載されている。これらの各々の内容は、全体として本願明細書に援用されている。
一実施態様によれば、微粒子配合物は、ポリマーマトリックスを含み、電位開口型カルシウムチャネル遮断薬がそのポリマーマトリックスに含浸されている。一実施態様によれば、ポリマーは、徐放性ポリマーである。一実施態様によれば、ポリマーは、ポリ(D,L-ラクチド-コ-グリコリド)である。他の実施態様によれば、ポリマーは、ポリ(オルトエステル)である。他の実施態様によれば、ポリマーは、ポリ(無水物)である。他の実施態様によれば、ポリマーは、ポリラクチド-ポリグリコリドである。
電位開口型カルシウムチャネル遮断薬を送達する粒子の製造において非生分解性と生分解性双方のポリマー材料が使用し得る。そのようなポリマーは、天然又は合成ポリマーであり得る。ポリマーは、放出が望まれる期間に基づいて選ばれる。特に興味がある生体接着性ポリマーとしては、Sawhney et al in Macromolecules (1993) 26, 581-587によって記載されている生物侵食性ヒドロゲルが挙げられるが、これに限定されない。この文献の教示は本願明細書に援用されている。例示的な生物侵食性ヒドロゲルとしては、ポリヒアルロン酸酸、カゼイン、ゼラチン、グルチン、ポリ無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、及びポリ(オクタデシルアクリレート)が挙げられるが、これらに限定されない。一実施態様によれば、生体接着性ポリマーは、ヒアルロン酸である。そのような一部の実施態様において、生体接着性ポリマーには、約2.3%未満のヒアルロン酸が含まれる。
一部の実施態様によれば、医薬組成物は、注射用デポ形態で配合される。注射用デポ形態は、生分解性ポリマー中に電位開口型カルシウムチャネル遮断薬のマイクロカプセル封入マトリックスを形成することによって製造される。薬剤とポリマーの比及び使われる具体的なポリマーの種類によって、薬剤放出速度が制御され得る。そのような長時間作用する配合物は、適切なポリマー材料又は疎水性材料(例えば許容され得る油中のエマルジョンとして)又はイオン交換樹脂と共に、又はやや難溶の誘導体として、例えば、やや難溶の塩として配合され得る。生分解性ポリマーの例としては、ポリラクチド-ポリグリコリド、ポリ(オルトエステル)及びポリ(無水物)が挙げられるが、これらに限定されない。注射用デポ製剤は、また、体組織と適合するリポソームまたはマイクロエマルジョン中に薬剤を封入することによって調製され得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリエステル-ポリエチレングリコールマトリックス中に又はポリエステル-ポリエチレングリコールマトリックス上に含浸させる。ポリエステル-ポリエチレングリコール化合物は合成され得る; これらは、軟質であり、薬剤送達に用い得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリ(アミノ)由来バイオポリマーマトリックス中に又はポリ(アミノ)由来バイオポリマーマトリックス上に含浸させる。ポリ(アミノ)由来バイオポリマーとしては、脂肪族ジアミンとして乳酸及びリシンを含有するもの(例えば、米国特許第5,399,665号明細書を参照のこと)、及びチロシン由来ポリカーボネート及びポリアクリレートが挙げられるが、これらに限定されない。ポリカーボネートの変性はエステルのアルキル鎖の長さを変化させることができ(エチルをオクチルに)、ポリアリーレートの変性は二酸のアルキル鎖の長さを変化させることを更に含むことができ(例えば、コハク酸をセバシン酸に)、これによりポリマーの大きな置換及びポリマー特性の大きな可撓性が可能になる。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を光重合性バイオポリマーマトリックス中に又は光重合性バイオポリマーマトリックス上に含浸させる。光重合性バイオポリマーとしては、乳酸/ポリエチレングリコール/アクリレートコポリマーが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒドロゲルマトリックス中に又はヒドロゲルマトリックス上に含浸させる。用語「ヒドロゲル」は、ゼラチン状又はゼリー状の塊を生成するのに必要な水性成分を含有する固体、半固体、擬塑性又は塑性構造をもたらす物質を意味する。ヒドロゲルは、一般的に、親水性ポリマー、アクリル酸、アクリルアミド及び2-ヒドロキシエチルメタクリレート(HEMA)が含まれる種々のポリマーを含む。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在するバイオポリマーマトリックス中に又は天然に存在するバイオポリマーマトリックス上に含浸させる。天然に存在するバイオポリマーとしては、タンパク質ポリマー、コラーゲン、多糖類及び光重合性化合物が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在する多糖マトリックス中に又は天然に存在する多糖マトリックス上に含浸させる。天然に存在する多糖類は、キチン及びその誘導体、ヒアルロン酸、デキストラン及び セルロース系(一般的には変性せずに生分解性でない)、及びスクロースアセテートイソブチレート(SAIB)が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をキチンマトリックス中に又はキチンマトリックス上に含浸させる。キチンは、主に2-アセトアミド-2-デオキシ-D-グルコース基から構成され、外骨格の主成分である酵母、菌類及び海の無脊椎動物(エビ、甲殻類)に見られる。キチンは水溶性でなく、脱アセチル化キチン、キトサンのみが酸性溶液(例えば、酢酸)に可溶性である。研究によって、水溶性で、非常に高分子量で(2,000,000ダルトンよりも大きい)、粘弾性で、非毒性で、生体適合性で、過酸化物、グルタルアルデヒド、グリオキサール及び他のアルデヒド及びカルボジアミドと架橋してゲルを形成することのできるキチン誘導体が報告されている。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒアルロン酸(HA)マトリックス中に又はヒアルロン酸(HA)マトリックス上に含浸させる。交互のグルクロニドとグルコサミニド結合から構成され且つ分離され精製されている哺乳類の硝子体液、脳の細胞外マトリックス、滑液、臍帯及び鶏冠に見られるヒアルロン酸(HA)もまた発酵プロセスによって生産され得る。
配合物は、例えば、最後のガンマ照射、細菌保持フィルタを通すろ過によって又は使用直前に滅菌水又は他の注射用滅菌媒質に溶解又は分散され得る滅菌固体組成物の形で滅菌剤を組み込むことによって滅菌され得る。注射用製剤、例えば、注射用滅菌水性又は油性懸濁液は、適切な分散剤又は湿潤剤及び沈殿防止剤を用いて既知の技術に従って配合され得る。注射用滅菌製剤は、また、非毒性の非経口的に許容され得る希釈剤又は溶媒中の注射用滅菌溶液、懸濁液又はエマルジョン、例えば、1,3-ブタンジオール、ジクロロメタン、酢酸エチル、アセトニトリル等に溶解したものであり得る。許容され得る賦形剤及び溶媒の中で水、リンゲル液、U.S.P.及び等張食塩液が使われ得る。更に、滅菌固定油が通例溶媒又は懸濁媒質として使われる。このためには、合成モノグリセリド又はジグリセリドが含まれる無刺激固定油が使われ得る。更に、オレイン酸のような脂肪酸が、注射剤の調製に用いられる。
非経口(皮下、内皮、筋肉内、静脈内、動脈内、鞘内、脳室内及び関節内が含まれるがこれらに限定されない)投与用の配合物には、配合物を意図した受容個体の血液と等張にする、抗酸化剤、緩衝剤、静菌薬及び溶質を含有し得る水性及び非水性滅菌注射溶液; 及び沈殿防止剤及び増粘剤を含み得る水性及び非水性滅菌懸濁液が含まれる。
好適な緩衝剤としては、酢酸と塩(1-2% w/v); クエン酸と塩(1-3% w/v); ホウ酸と塩(0.5-2.5% w/v); 及びリン酸と塩(0.8-2% w/v)が挙げられる。好適な防腐剤としては、塩化ベンザルコニウム(0.003-0.03% w/v); クロロブタノール(0.3-0.9% w/v); パラベン(0.01-0.25% w/v)及びチメロサール(0.004-0.02% w/v)が挙げられる。
一態様において、本発明は、その治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療する半固体(幾分硬い粘稠度を有することを意味する)微小粒子送達系であって、脳損傷が少なくとも1つの大脳動脈の妨害を含む前記送達系であって、(a)(i)電位開口型カルシウムチャネル遮断薬の微小粒子配合物; 及び任意に(ii)医薬的に許容され得る担体を含む医薬組成物; 及び(b)治療的な量の医薬組成物を投与する手段であって、治療的な量が脳損傷に伴う少なくとも1つの遅発性合併症の徴候又は症状を軽減させるのに効果的である前記手段を含む、前記系を提供する。
一部の実施態様によれば、半固体多粒子送達系は、その治療を必要としている哺乳類において脳損傷に伴う少なくとも1つの遅発性合併症の発生又は重症度を予防するか又は軽減させることができ、脳損傷が、少なくとも1つの大脳動脈の妨害を含んでいる。そのような一部の実施態様によれば、少なくとも1つの遅発性合併症は、遅発性脳虚血(DCI)、脳内血腫、脳室内出血、熱、血管造影血管攣縮、微小血栓塞栓、皮質拡延性虚血(CSI)、行動に関する欠陥、神経障害、脳梗塞、ニューロン細胞死、又はこれらの組み合わせからなる群より選ばれる。一実施態様によれば、少なくとも1つの遅発性合併症は、遅発性脳虚血(DCI)である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳内血腫である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳室内出血である。他の実施態様によれば、少なくとも1つの遅発性合併症は、熱である。他の実施態様によれば、少なくとも1つの遅発性合併症は、血管造影血管攣縮である。他の実施態様によれば、少なくとも1つの遅発性合併症は、皮質拡延性虚血(CSI)である。他の実施態様によれば、少なくとも1つの遅発性合併症は、微小血栓塞栓症である。他の実施態様によれば、少なくとも1つの遅発性合併症は、行動に関する欠陥である。他の実施態様によれば、少なくとも1つの遅発性合併症は、神経障害である。他の実施態様によれば、少なくとも1つの遅発性合併症は、脳梗塞である。他の実施態様によれば、少なくとも1つの遅発性合併症は、ニューロン細胞死である。
一部の実施態様によれば、医薬組成物は、非経口注入又は外科移植によって投与される。
一部の実施態様によれば、半固体多粒子送達系は、医薬組成物が送達されるカニューレ又はカテーテルを含み、そのカテーテルは、哺乳類において送達部位に挿入される。一実施態様によれば、送達部位は、脳室にある。一部の実施態様によれば、脳室は、側脳室、第三脳室、第四脳室、又はこれらの組み合わせからなる群より選ばれる。一実施態様によれば、送達部位は、クモ膜下腔にある。一実施態様によれば、送達部位は、脳損傷にごく近接している。他の実施態様によれば、送達部位は、脳損傷によって影響を受けている血管にごく近接している。一実施態様によれば、血管は、少なくとも1つの大脳動脈である。他の実施態様によれば、少なくとも1つの大脳動脈は、脳損傷に影響を受けている。
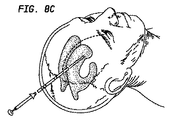
脳室は、当該技術においてよく知られるように、また、種々の脳神経外科の教科書に記載されているように、カニューレが挿入され得るか又はカテーテルが挿入され得る。このことは、脳室カテーテル又はドレインの挿入又は脳室フィステル形成術と呼ばれている。様々なサイズの穴がドリルで頭蓋骨にあけられ且つ脳を覆っている外側の硬膜が切開され得る。軟膜が切開され、カテーテル(一般的には他の一部の生体適合性の非吸収性化合物のシリコーンエラストマーでできている中空管)が選択の脳室に大脳を通って挿入される。これは通常側脳室であるが、任意の脳室がカテーテル挿入され得る。カテーテルを用いて、頭部内の圧力をモニタするか、CSFを排出するか又はCSFに物質を投与し得る。図8は、電位開口型カルシウムチャネル遮断薬微粒子懸濁液を含む医薬組成物を脳室内のカテーテルを通って脳室に送達することを示す例示的な図である。図9は、CSF流量によってクモ膜下腔の動脈の各々に運ばれる微粒子の中に又はそれの上に電位開口型カルシウムチャネル遮断薬を含む医薬組成物を適用することを示す概略図である。
一実施態様によれば、電位開口型カルシウムチャネル遮断薬を含む医薬組成物は、カテーテルを脳室に挿入し且つカテーテルを通して医薬組成物を注入し、医薬組成物が局所的に脳室にカテーテルの端部から出ることによって送達され得る。
他の実施態様によれば、医薬組成物は、1回のボーラス注射として投与される。他の実施態様によれば、所定の時間後に注射が反復される。そのような一部の実施態様によれば、所定の時間は、1分以上から10日以上までの範囲にあり得る。例えば、患者をモニタすることにより患者がまだ血管造影血管攣縮又はDCIの証拠があることが示される場合には反復注射が投与され得る。CSF循環によって、脳室からクモ膜下腔へ医薬組成物が運ばれ得る。SAH後にCSF循環がしばしば遅くなり、クモ膜下腔が凝血塊を含有する。従って、医薬組成物が凝血塊の中に閉じ込められ、このことにより、組成物からの薬理学的薬剤(1つ以上)の放出が局在化され、そこで隣接する動脈及び脳において薬理効果を示すことになる。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を含む医薬組成物は、放出制御系で含有されている。薬剤の作用を延長するために、薬剤の吸収を遅らせることがしばしば望ましい。これは、水溶性が不充分な結晶材料か又はアモルファス材料の液体懸濁液の使用によって達成され得る。その場合、薬剤の吸収速度は薬剤の溶解速度に依存し、溶解速度は結晶サイズ及び結晶形に依存する。例えば、一部の実施態様によれば、高粘度のベース成分、例えばスクロースアセテートイソブチレート(SAIB)を含むSABERTMデリバリーシステムを用いて、電位開口型カルシウムチャネル遮断薬の放出制御が得られる。(米国特許第5,747,058号明細書及び同第5,968,542号明細書を参照のこと、これらの内容は本明細書に援用されている)。高粘度SAIBが薬剤、生体適合性賦形剤及び他の添加剤と配合される場合、得られた配合物は標準のシリンジと針で容易に注射するのに充分な液体である。SABERTM配合物を注射した後、賦形剤が離れて拡散し、粘性のデポ剤が残る。
他の実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が所望の時間量にわたって生じ得る。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が1日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が2日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が3日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が4日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が5日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が6日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が7日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が8日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が15日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が30日間生じる。
一実施態様によれば、拡散薬理学的作用は、血管攣縮の減少であり、送達部位の少なくとも10mm、少なくとも9.9mm、少なくとも9.8mm、少なくとも9.7mm、少なくとも9.6mm、少なくとも9.5mm、少なくとも9.4mm、少なくとも9.3mm、少なくとも9.2mm、少なくとも9.1mm、少なくとも9.0mm、少なくとも8.9mm、少なくとも8.8mm、少なくとも8.7mm、少なくとも8.6mm、少なくとも8.5mm、少なくとも8.4mm、少なくとも8.3mm、少なくとも8.2mm、少なくとも8.1mm、少なくとも8.0mm、少なくとも7.9mm、少なくとも7.8mm、少なくとも7.7mm、少なくとも7.6mm、少なくとも7.5mm、少なくとも7.4mm、少なくとも7.3mm、少なくとも7.2mm、少なくとも7.1mm、少なくとも7.0mm、少なくとも6.9mm、少なくとも6.8mm、少なくとも6.7mm、少なくとも6.6mm、少なくとも6.5mm、少なくとも6.4mm、少なくとも6.3mm、少なくとも6.2mm、少なくとも6.1mm、少なくとも6.0mm、少なくとも5.9mm、少なくとも5.8mm、少なくとも5.7mm、少なくとも5.6mm、少なくとも5.5mm、少なくとも5.4mm、少なくとも5.3mm、少なくとも5.2mm、少なくとも5.1mm、少なくとも5.0mm以内である血管の内径が対照と比較して増大する。
一実施態様によれば、投与手段は、(1)外科的注入よるものであるので、配合物が脳損傷に影響を受けた大脳動脈にごく近接して配置されて、治療的な量の医薬組成物がクモ膜下腔に送達される。
他の実施態様によれば、投与手段は、(2)局所的に脳室へのカテーテルによるものであるので、配合物が脳損傷によって影響を受けた大脳動脈を接触させるCSF循環によって運ばれて、治療的な量の医薬組成物がクモ膜下腔に送達される。
電位開口型カルシウムチャネル遮断薬
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる。
組成物に配合され得る電位開口型カルシウムチャネル遮断薬の限定されない例としては、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、孤立分子である。本明細書に用いられる用語「孤立分子」は、実質的に純粋であり且つ意図した使用に実際的で適切な程度まで天然に又は生体内系に通常見られる他の物質を含まない分子を意味する。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、医薬製剤において医薬的に許容され得る担体と混合されている。そのような一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、製剤の少量質量パーセントのみを含んでいる。一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、実質的に純粋である。
一部の実施態様によれば、医薬組成物は、医薬的に許容され得る担体を含まない。一部の実施態様によれば、医薬的に許容され得る担体は、ヒアルロン酸を含まない。
一実施態様によれば、医薬的に許容され得る担体は、固体担体又は賦形剤である。他の実施態様によれば、医薬的に許容され得る担体は、ゲル相担体又は賦形剤である。担体又は賦形剤の例としては、炭酸カルシウム、リン酸カルシウム、種々のモノマー及びポリマーの糖(ヒアルロン酸が挙げられるが限定されない)、デンプン、セルロース誘導体、ゼラチン、及びポリマーが挙げられるが、これらに限定されない。例示的な担体には、食塩水賦形剤、例えばリン酸緩衝食塩水(PBS)中のヒドロキシルプロピルメチルセルロース(HPMC)も含まれ得る。
他の実施態様によれば、医薬的に許容され得る担体は、徐放性固体化合物を含んでいる。そのような一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、徐放性固体化合物に埋め込まれるか又は徐放性固体化合物に被覆される。更に他の実施態様によれば、医薬的に許容され得る担体は、電位開口型カルシウムチャネル遮断薬を含有する徐放性微粒子を含んでいる。
他の実施態様によれば、医薬的に許容され得る担体は、ゲル化合物、例えば生分解性ヒドロゲルである。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の形で供給される。本明細書に用いられる用語「粒子」は、カルシウムチャネル遮断薬を全体的に又は部分的に含有し得るナノ又は微粒子(又はある場合にはより大きい)を意味する。一部の実施態様によれば、微小粒子配合物は、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含んでいる。一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、コーティングによって囲まれた粒子のコア内に含有される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の表面全体に分散される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の上に又は微粒子の中に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の表面全体に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子に吸着される。
そのような一部の実施態様によれば、微粒子は、一様なサイズ分布を有する。一部の実施態様によれば、微粒子サイズの一様分布は、微粒子を含む一様なエマルジョンを形成する均質化プロセスによって達成される。そのような一部の実施態様によれば、各微粒子はマトリックスを含んでいる。一部の実施態様によれば、マトリックスは電位開口型カルシウムチャネル遮断薬を含んでいる。
一部の実施態様によれば、医薬組成物は流動性である。一部の実施態様によれば、医薬組成物の微小粒子配合成分は流動性である。
一部の実施態様によれば、粒子は、溶液で又は半固体状態で電位開口型カルシウムチャネル遮断薬を含有するマイクロカプセルである。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有する微粒子である。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有するナノ粒子である。一部の実施態様によれば、粒子は、実質的に任意の形状を有し得る。
一部の実施態様によれば、粒径は、約25μm〜約100μmである。一部の実施態様によれば、粒径は、約30μm〜約80μmである。一実施態様によれば、粒径は、少なくとも約25μmである。他の実施態様によれば、粒径は、少なくとも約30μmである。他の実施態様によれば、粒径は、少なくとも約35μmである。他の実施態様によれば、粒径は、少なくとも約40μmである。他の実施態様によれば、粒径は、少なくとも約45μmである。他の実施態様によれば、粒径は、少なくとも約50μmである。他の実施態様によれば、粒径は、少なくとも約55μmである。他の実施態様によれば、粒径は、少なくとも約60μmである。他の実施態様によれば、粒径は、少なくとも約65μmである。他の実施態様によれば、粒径は、少なくとも約70μmである。他の実施態様によれば、粒径は、少なくとも約75μmである。他の実施態様によれば、粒径は、少なくとも約80μmである。他の実施態様によれば、粒径は、少なくとも約85μmである。他の実施態様によれば、粒径は、少なくとも約90μmである。他の実施態様によれば、粒径は、少なくとも約95μmである。他の実施態様によれば、粒径は、少なくとも約100μmである。
他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、少なくとも1つのシートにおいて供給され得る。シートがコーティングによって囲まれたコア内に電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬を含有し得るか、又は電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬がシート全体に分散され得るか、又は電位開口型カルシウムチャネルがシートに吸収され得る。シートは、ゼロ次放出、一次放出、二次放出、遅延放出、持続放出、即時放出、及びこれらの組み合わせを含む、次数放出速度論を有し得る。シートには、電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬に加えて、浸食性、非浸食性、生分解性、又は非生分解性の物質又はこれらの組み合わせが挙げられるがこれらに限定されない、調剤及び医薬品の技術において日常的に用いられる物質のいずれもが含まれ得る。
一部の実施態様によれば、微小粒子配合物は、微粒子の懸濁液を含んでいる。一部の実施態様によれば、医薬組成物は、更に、沈殿防止剤、安定剤及び分散剤の少なくとも1つを含んでいる。そのような一部の実施態様によれば、医薬組成物は、懸濁液として存在する。そのような一部の実施態様によれば、医薬組成物は、溶液として存在する。そのような一部の実施態様によれば、医薬組成物は、エマルジョンとして存在する。
一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水溶液を水溶性形態で含んでいる。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の油性懸濁液を含んでいる。電位開口型カルシウムチャネル遮断薬の油性懸濁液は、適切な親油性溶媒を用いて調製され得る。例示的な親油性溶媒又は賦形剤としては、脂肪油、例えばゴマ油、又は合成脂肪酸エステル、例えばエチルオレエート又はトリグリセリドが挙げられるが、限定されない。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水性懸濁液を含んでいる。水性注入懸濁液は、懸濁液の粘度を増加させる物質、例えばカルボキシルメチルセルロースナトリウム、ソルビトール、又はデキストランを含有し得る。任意に、懸濁液は、また、適切な安定剤又は化合物の溶解性を増加させて高度に濃縮された溶液の調製を可能にする物質を含有し得る。或いは、電位開口型カルシウムチャネル遮断薬は、使用前に、適切な賦形剤、例えば、発熱物質を含まない滅菌水と構成するために粉末の形であり得る。
マイクロカプセル封入プロセス及び製品の例; エマルジョンベースの微粒子の製造方法; エマルジョンベースの微粒子及びその製造方法; 調整可能な抽出速度を有する溶媒抽出マイクロカプセル封入; 溶媒及び塩によるマイクロカプセル封入プロセス; 微粒子を作成する連続二重エマルジョンプロセス; ポリマーブレンドから微粒子特性、放出制御系を調整する乾燥方法; 非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法; 及び微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドアセンブリが、米国特許第5,407,609号明細書(マイクロカプセル封入プロセス及びその製品と称する)、米国特許出願公開第10/553,003号明細書(エマルジョンベースの微粒子の製造方法と称する)、米国特許出願公開第11/799,700号明細書(エマルジョンベースの微粒子及びその製造方法と称する)、米国特許出願公開第12/557,946号明細書(抽出速度可変による溶媒抽出マイクロカプセル封入と称する)、米国特許出願公開第12/779,138号明細書(ヒアルロン酸(HA)注入賦形剤と称する)、米国特許出願公開第12/562,455号明細書(溶媒及び塩によるマイクロカプセル封入プロセスと称する)、米国特許出願公開第12/338,488号明細書(低残留溶媒容積を有する微粒子の調製方法と称する); 米国特許出願公開第12/692,027号明細書(ポリマーブレンドからの放出制御系と称する); 米国特許出願公開第12/692,020号明細書(非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法と称する); 米国特許出願公開第10/565,401号明細書(「放出制御組成物」と称する); 米国特許出願公開第12/692,029号明細書(「微粒子特性を調整する乾燥方法と称する); 米国特許出願公開第12/968,708号明細書(「微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドと称する); 及び米国特許公開第13/074542号明細書(「局所投与部位において医薬組成物の保持が改善された組成物及び方法」と称する)に開示され記載されている。これらの各々の内容は、全体として本願明細書に援用されている。
一実施態様によれば、微粒子配合物は、ポリマーマトリックスを含み、電位開口型カルシウムチャネル遮断薬がそのポリマーマトリックスに含浸されている。一実施態様によれば、ポリマーは、徐放性ポリマーである。一実施態様によれば、ポリマーは、ポリ(D,L-ラクチド-コ-グリコリド)である。他の実施態様によれば、ポリマーは、ポリ(オルトエステル)である。他の実施態様によれば、ポリマーは、ポリ(無水物)である。他の実施態様によれば、ポリマーは、ポリラクチド-ポリグリコリドである。
電位開口型カルシウムチャネル遮断薬を送達する粒子の製造において非生分解性と生分解性双方のポリマー材料が使用し得る。そのようなポリマーは、天然又は合成ポリマーであり得る。ポリマーは、放出が望まれる期間に基づいて選ばれる。特に興味がある生体接着性ポリマーとしては、Sawhney et al in Macromolecules (1993) 26, 581-587によって記載されている生物侵食性ヒドロゲルが挙げられるが、これに限定されない。この文献の教示は本願明細書に援用されている。例示的な生物侵食性ヒドロゲルとしては、ポリヒアルロン酸酸、カゼイン、ゼラチン、グルチン、ポリ無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、及びポリ(オクタデシルアクリレート)が挙げられるが、これらに限定されない。一実施態様によれば、生体接着性ポリマーは、ヒアルロン酸である。そのような一部の実施態様において、生体接着性ポリマーには、約2.3%未満のヒアルロン酸が含まれる。
一部の実施態様によれば、医薬組成物は、注射用デポ形態で配合される。注射用デポ形態は、生分解性ポリマー中に電位開口型カルシウムチャネル遮断薬のマイクロカプセル封入マトリックスを形成することによって製造される。薬剤とポリマーの比及び使われる具体的なポリマーの種類によって、薬剤放出速度が制御され得る。そのような長時間作用する配合物は、適切なポリマー材料又は疎水性材料(例えば許容され得る油中のエマルジョンとして)又はイオン交換樹脂と共に、又はやや難溶の誘導体として、例えば、やや難溶の塩として配合され得る。生分解性ポリマーの例としては、ポリラクチド-ポリグリコリド、ポリ(オルトエステル)及びポリ(無水物)が挙げられるが、これらに限定されない。注射用デポ製剤は、また、体組織と適合するリポソーム又はマイクロエマルジョン中に薬剤を封入することによって調製され得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリエステル-ポリエチレングリコールマトリックス中に又はポリエステル-ポリエチレングリコールマトリックス上に含浸させる。ポリエステル-ポリエチレングリコール化合物は合成され得る; これらは、軟質であり、薬剤送達に用い得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリ(アミノ)由来バイオポリマーマトリックス中に又はポリ(アミノ)由来バイオポリマーマトリックス上に含浸させる。ポリ(アミノ)由来バイオポリマーとしては、脂肪族ジアミンとして乳酸及びリシンを含有するもの(例えば、米国特許第5,399,665号明細書を参照のこと)、及びチロシン由来ポリカーボネート及びポリアクリレートが挙げられるが、これらに限定されない。ポリカーボネートの変性はエステルのアルキル鎖の長さを変化させることができ(エチルをオクチルに)、ポリアリーレートの変性は二酸のアルキル鎖の長さを変化させることを更に含むことができ(例えば、コハク酸をセバシン酸に)、これによりポリマーの大きな置換及びポリマー特性の大きな可撓性が可能になる。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を光重合性バイオポリマーマトリックス中に又は光重合性バイオポリマーマトリックス上に含浸させる。光重合性バイオポリマーとしては、乳酸/ポリエチレングリコール/アクリレートコポリマーが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒドロゲルマトリックス中に又はヒドロゲルマトリックス上に含浸させる。用語「ヒドロゲル」は、ゼラチン状又はゼリー状の塊を生成するのに必要な水性成分を含有する固体、半固体、擬塑性又は塑性構造をもたらす物質を意味する。ヒドロゲルは、一般的に、親水性ポリマー、アクリル酸、アクリルアミド及び2-ヒドロキシエチルメタクリレート(HEMA)が含まれる種々のポリマーを含む。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在するバイオポリマーマトリックス中に又はバイオポリマーマトリックス上に含浸させる。天然に存在するバイオポリマーとしては、タンパク質ポリマー、コラーゲン、多糖類及び光重合性化合物が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在する多糖マトリックス中に又は天然に存在する多糖マトリックス上に含浸させる。天然に存在する多糖類は、キチン及びその誘導体、ヒアルロン酸、デキストラン及びセルロース系(一般的には変性せずに生分解性でない)、及びスクロースアセテートイソブチレート(SAIB)が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をキチンマトリックス中に又はキチンマトリックス上に含浸させる。キチンは、主に2-アセトアミド-2-デオキシ-D-グルコース基から構成され、外骨格の主成分である酵母、菌類及び海の無脊椎動物(エビ、甲殻類)に見られる。キチンは水溶性でなく、脱アセチル化キチン、キトサンのみが酸性溶液(例えば、酢酸)に可溶性である。研究によって、水溶性で、非常に高分子量で(2,000,000ダルトンよりも大きい)、粘弾性で、非毒性で、生体適合性で、過酸化物、グルタルアルデヒド、グリオキサール及び他のアルデヒド及びカルボジアミドと架橋してゲルを形成することのできるキチン誘導体が報告されている。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒアルロン酸(HA)マトリックス中に又はヒアルロン酸(HA)マトリックス上に含浸させる。交互のグルクロニドとグルコサミニド結合から構成され且つ分離され精製されている哺乳類の硝子体液、脳の細胞外マトリックス、滑液、臍帯及び鶏冠に見られるヒアルロン酸(HA)もまた発酵プロセスによって生産され得る。
配合物は、例えば、最後のガンマ照射、細菌保持フィルタを通すろ過によって又は使用直前に滅菌水又は他の注射用滅菌媒質に溶解又は分散され得る滅菌固体組成物の形で滅菌剤を組み込むことによって滅菌され得る。注射用製剤、例えば、注射用滅菌水性又は油性懸濁液は、適切な分散剤又は湿潤剤及び沈殿防止剤を用いて既知の技術に従って配合され得る。注射用滅菌製剤は、また、非毒性の非経口的に許容され得る希釈剤又は溶媒中の注射用滅菌溶液、懸濁液又はエマルジョン、例えば、1,3-ブタンジオール、ジクロロメタン、酢酸エチル、アセトニトリル等に溶解したものであり得る。許容され得る賦形剤及び溶媒の中で水、リンゲル液、U.S.P.及び等張食塩液が使われ得る。更に、滅菌固定油が通例溶媒又は懸濁媒質として使われる。このためには、合成モノグリセリド又はジグリセリドが含まれる無刺激固定油が使われ得る。更に、オレイン酸のような脂肪酸が、注射剤の調製に用いられる。
非経口(皮下、内皮、筋肉内、静脈内、動脈内、鞘内、脳室内及び関節内が含まれるがこれらに限定されない)投与用の配合物には、配合物を意図した受容個体の血液と等張にする、抗酸化剤、緩衝剤、静菌薬及び溶質を含有し得る水性及び非水性滅菌注射溶液; 及び沈殿防止剤及び増粘剤を含み得る水性及び非水性滅菌懸濁液が含まれる。
好適な緩衝剤としては、酢酸と塩(1-2% w/v); クエン酸と塩(1-3% w/v); ホウ酸と塩(0.5-2.5% w/v); 及びリン酸と塩(0.8-2% w/v)が挙げられる。適切な防腐剤としては、塩化ベンザルコニウム(0.003-0.03% w/v); クロロブタノール(0.3-0.9% w/v); パラベン(0.01-0.25% w/v)及びチメロサール(0.004-0.02% w/v)が挙げられる。
他の実施態様によれば、半固体多粒子送達系は、一部に又は全体に生体適合性、生分解性、粘着性半固体を含んでおり、その半固体はヒドロゲルを含んでおり、そのヒドロゲルは電位開口型カルシウムチャネル遮断薬を含んでいる。本明細書に用いられる用語「ヒドロゲル」は、ゼラチン状又はゼリー状の塊を生成するのに必要な水性成分を含有する固体、半固体、擬塑性、又は塑性構造をもたらす物質を意味する。ヒドロゲルは相当量のH2Oを取り込み且つ保持しており、最終的には水性環境の存在下に平衡含量に達する。一実施態様において、グリセリルモノオレート(以下GMOと記載する)は、意図した半固体送達系又はヒドロゲルである。しかしながら、粘性/剛性について同様の物理的/化学的性質を有する多くのヒドロゲル、ポリマー、炭化水素組成物及び脂肪酸誘導体は、半固体送達系として機能し得る。
GMOは主に脂質系ヒドロゲルを与え、親油性材料を組み込む能力を有する。本明細書に用いられる用語「親油性」は、極性又は水性環境と比較して無極性環境に対する親和性を好むか又は所有することを意味する。GMOは、更に、親水性化合物を取り込み且つ送達する内部水性チャネルを与える。本明細書に用いられる用語「親水性」は、極性物質に対する親和性を有する材料又は物質、例えば水を意味する。室温(-25℃)において、ゲル系は広範囲の粘度測定値を含む異相を示し得ることが認識されている。
一実施態様において、2つのゲル系相が、それらの特性により室温及び生理的温度(約37℃)及びpH(約7.4)で用いられる。2つのゲル系相内で、第1の相は、約5%〜約15%のH2O含量及び約95%〜約85%のGMO含量のラメラ相である。ラメラ相は、容易に操作され、注がれ且つ注入され得る適度に粘性な流体である。第2の相は、約15%〜約40%のH2O含量及び約85%-60%のGMO含量からなる立方相である。これは、約35%〜約40質量%の平衡含水比を有する。本明細書に用いられる用語「平衡含水比」は、過剰な水の存在下に最大含水量を意味する。従って、立方相は、約35%〜約40質量%で水を取り込む。立方相は、高度に粘性である。粘度は、ブルックフィールド粘度計によって測定した場合、1,200,000センチポアズ(cp)を超え; ここで、1,200,000cpは、ブルックフィールド粘度計のカップ及びボブの構成によって得られる粘度の最大測定値である。そのような一部の実施態様において、治療薬は、系が持続的な連続送達を備えるように半固体に取り込まれ得る。そのような一部の実施態様において、治療薬はニモジピンである。そのような一部の実施態様において、種々の放出速度で体内に局所的な生物学的、生理学的、又は治療効果を与える半固体に他の治療薬、生理学的活性剤、薬剤、医薬及び不活性剤が取り込まれ得る。
他の実施態様によれば、水性成分を変更するために加水分解されたゼラチン、例えば市販のGelfoamTMが用いられる。約6.25質量%〜12.50質量%の濃度のGelfoamTMが、それぞれ約93.75質量%〜87.50質量%の濃度のH2O又は他の水性緩衝剤中に配置され得る。加熱及び撹拌時に、H2O(又は他の水性緩衝剤)/GelfoamTMの組み合わせが濃厚なゼラチン状物質を生成する。得られた物質をGMOと合わせ; そのように形成された生成物は膨張し且つニートGMOゲル単独と比較して展性の低い高度に粘性の半透明ゲルを形成する。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、おそらく二相方式で、拡散によって半固体から遊離する。第1の相は、例えば、親油性膜内に含有される親油性薬剤がそこから水性チャネルに拡散することを必要とする。第2の相は、水性チャネルから外部環境へ薬剤を拡散することを必要とする。親油性であるため、薬剤は、それ自体その提案された脂質二層構造内のGMOゲルの内側に配向させ得る。従って、約7.5質量%よりも多い薬剤をGMOに組み込むことにより、三次元構造の完全性の喪失を引き起こし、それによってゲル系はもはや半固体立方相を維持せず且つラメラ相粘性液体に戻る。そのような一部の実施態様によれば、治療薬はニモジピンである。そのような一部の実施態様によれば、治療薬は一過性受容体電位タンパク質遮断薬である。他の実施態様によれば、約1質量%〜約45質量%の治療薬は、正常な三次元構造が破損せず生理的温度でGMOゲルに取り込まれる。結果として、この系は、薬剤用量と共に著しく増加する可撓性の能力を可能にする。送達系が展性であることから、体内の壁、空間、又は他の空隙の輪郭に付着及び適合するだけでなく存在する全ての空隙を完全に充填するように、送達系が移植部位に、例えば、大脳動脈に隣接して、又はクモ膜下腔に送達及び操作され得る。送達系は、移植部位全体に薬剤分布及び一様な薬剤送達を確実にする。例えば、空間内に、クモ膜下腔に限定されないが、送達系を送達及び操作する容易さは、半固体送達装置によって促進される。半固体送達装置は、送達系の標的及び制御送達を促進させる。
一態様において、本発明は、その治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療する方法であって、脳損傷が少なくとも1つの大脳動脈の妨害を含む前記方法であって、
(a)医薬組成物を準備する段階であって、
(i)電位開口型カルシウムチャネル遮断薬の微小粒子配合物; 及び任意に
(ii)医薬的に許容され得る担体
を含む前記段階; 及び
(b)治療的な量の医薬組成物を投与部位に投与する手段によって治療的な量の医薬組成物を投与する段階であって、治療的な量が脳損傷に伴う少なくとも1つの遅発性合併症の徴候又は症状を軽減させるのに効果的である前記段階
を含む、前記方法を提供する。
一実施態様によれば、段階(b)において治療的な量の医薬組成物を投与する手段は外科的注入装置であり、投与用部位は、脳損傷によって影響を受けた大脳動脈にごく近接した部位である。
他の実施態様によれば、段階(b)において治療的な量の医薬組成物を投与する手段はカテーテルであり、投与用部位は局所的に脳室であり、組成物の微粒子配合成分が脳損傷によって影響を受けた大脳動脈を接触させるCSF循環によって運ばれる。
一部の実施態様によれば、脳損傷は、基礎にある症状の結果である。例示的な基礎にある症状としては、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)等が挙げられるが、これらに限定されない。そのような一部の実施態様によれば、基礎にある症状は、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせからなる群より選ばれる。一実施態様によれば、基礎にある症状は、動脈瘤である。他の実施態様によれば、基礎にある症状は、突然の外傷性頭部損傷である。他の実施態様によれば、基礎にある症状は、クモ膜下出血(SAH)である。
一部の実施態様によれば、医薬組成物は、非経口注入又は外科移植によって投与される。
脳室は、当該技術においてよく知られるように、また、種々の脳神経外科の教科書に記載されているように、カニューレが挿入され得るか又はカテーテルが挿入され得る。このことは、脳室カテーテル又はドレインの挿入又は脳室フィステル形成術と呼ばれている。様々なサイズの穴がドリルで頭蓋骨にあけられ且つ脳を覆っている外側の硬膜が切開され得る。軟膜が切開され、カテーテル(一般的には他の一部の生体適合性の非吸収性化合物のシリコーンエラストマーでできている中空管)が選択の脳室に大脳を通って挿入される。これは通常側脳室であるが、任意の脳室がカテーテル挿入され得る。カテーテルを用いて、頭部内の圧力をモニタするか、CSFを排出するか又はCSFに物質を投与し得る。
他の実施態様によれば、損傷した脳へ医薬組成物を埋め込むと、食欲が改善され得る。
他の実施態様によれば、損傷した脳へ医薬組成物を埋め込むと、運動失調又は不全麻痺が改善され得る。
他の実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が所望の時間量にわたって生じ得る。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が1日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が2日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が3日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が4日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が5日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が6日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が7日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が8日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が15日間生じる。一実施態様によれば、送達部位で電位開口型カルシウムチャネル遮断薬が放出されると、主に局所的な薬理学的作用が30日間生じる。
一実施態様によれば、送達部位での局所的な薬理学的作用は血管攣縮の減少であり、脳損傷によって影響を受けた少なくとも1つの大脳動脈の内径が対照と比較して増大する。一実施態様によれば、医薬組成物は、対照と比較して脳損傷によって影響を受けた大脳動脈の内径を増大させるのに効果的である。
一部の実施態様によれば、医薬組成物は、側脳室、第三脳室、第四脳室の1つに挿入されたカテーテル又はチューブによって脳室に注入されるか、又は脳のクモ膜下槽に注入される。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる。
組成物に配合され得る電位開口型カルシウムチャネル遮断薬の限定されない例としては、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、孤立分子である。本明細書に用いられる用語「孤立分子」は、実質的に純粋であり且つ意図した使用に実際的で適切な程度まで天然に又は生体内系に通常見られる他の物質を含まない分子を意味する。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、医薬製剤において医薬的に許容され得る担体と混合されている。そのような一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、製剤の少量質量パーセントのみを含んでいる。一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、実質的に純粋である。
一部の実施態様によれば、医薬組成物は、医薬的に許容され得る担体を含まない。一部の実施態様によれば、医薬的に許容され得る担体は、ヒアルロン酸を含まない。
一実施態様によれば、医薬的に許容され得る担体は、固体担体又は賦形剤である。他の実施態様によれば、医薬的に許容され得る担体は、ゲル相担体又は賦形剤である。担体又は賦形剤の例としては、炭酸カルシウム、リン酸カルシウム、種々の単糖類及び多糖類(ヒアルロン酸が挙げられるが限定されない)、デンプン、セルロース誘導体、ゼラチン、及びポリマーが挙げられるが、これらに限定されない。例示的な担体には、食塩水賦形剤、例えばリン酸緩衝食塩水(PBS)中のヒドロキシルプロピルメチルセルロース(HPMC)も含まれ得る。
他の実施態様によれば、医薬的に許容され得る担体は、徐放性固体化合物を含んでいる。そのような一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、徐放性固体化合物に埋め込まれるか又は徐放性固体化合物に被覆される。更に他の実施態様によれば、医薬的に許容され得る担体は、電位開口型カルシウムチャネル遮断薬を含有する徐放性微粒子を含んでいる。
他の実施態様によれば、医薬的に許容され得る担体は、ゲル化合物、例えば生分解性ヒドロゲルである。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の形で供給される。本明細書に用いられる用語「粒子」は、カルシウムチャネル遮断薬を全体的に又は部分的に含有し得るナノ又は微粒子(又はある場合にはより大きい)を意味する。一部の実施態様によれば、微小粒子配合物は、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含んでいる。一実施態様によれば、電位開口型カルシウムチャネル遮断薬は、コーティングによって囲まれた粒子のコア内に含有される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子の表面全体に分散される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の上に又は微粒子の中に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、微粒子の表面全体に配置される。他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、粒子に吸着される。
そのような一部の実施態様によれば、微粒子は、一様なサイズ分布を有する。一部の実施態様によれば、微粒子サイズの一様分布は、微粒子を含む一様なエマルジョンを形成する均質化プロセスによって達成される。そのような一部の実施態様によれば、各微粒子はマトリックスを含んでいる。一部の実施態様によれば、マトリックスは電位開口型カルシウムチャネル遮断薬を含んでいる。
一部の実施態様によれば、医薬組成物は流動性である。一部の実施態様によれば、医薬組成物の微小粒子配合成分は流動性である。
一部の実施態様によれば、粒子は、溶液で又は半固体状態で電位開口型カルシウムチャネル遮断薬を含有するマイクロカプセルである。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有する微粒子である。一部の実施態様によれば、粒子は、全体的に又は部分的に電位開口型カルシウムチャネル遮断薬を含有するナノ粒子である。一部の実施態様によれば、粒子は、実質的に任意の形状を有し得る。
一部の実施態様によれば、粒径は、約25μm〜約100μmにある。一部の実施態様によれば、粒径は、約30μm〜約80μmにある。一実施態様によれば、粒径は、少なくとも約25μmである。他の実施態様によれば、粒径は、少なくとも約30μmである。他の実施態様によれば、粒径は、少なくとも約35μmである。他の実施態様によれば、粒径は、少なくとも約40μmである。他の実施態様によれば、粒径は、少なくとも約45μmである。他の実施態様によれば、粒径は、少なくとも約50μmである。他の実施態様によれば、粒径は、少なくとも約55μmである。他の実施態様によれば、粒径は、少なくとも約60μmである。他の実施態様によれば、粒径は、少なくとも約65μmである。他の実施態様によれば、粒径は、少なくとも約70μmである。他の実施態様によれば、粒径は、少なくとも約75μmである。他の実施態様によれば、粒径は、少なくとも約80μmである。他の実施態様によれば、粒径は、少なくとも約85μmである。他の実施態様によれば、粒径は、少なくとも約90μmである。他の実施態様によれば、粒径は、少なくとも約95μmである。他の実施態様によれば、粒径は、少なくとも約100μmである。
他の実施態様によれば、電位開口型カルシウムチャネル遮断薬は、少なくとも1つのシートにおいて供給され得る。シートがコーティングによって囲まれたコア内に電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬を含有し得るか、又は電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬がシート全体に分散され得るか、又は電位開口型カルシウムチャネルがシートに吸収され得る。シートは、ゼロ次放出、一次放出、二次放出、遅延放出、持続放出、即時放出、及びこれらの組み合わせを含む、次数放出速度論を有し得る。シートには、電位開口型カルシウムチャネル遮断薬及び少なくとも1つの追加の治療薬に加えて、浸食性、非浸食性、生分解性、又は非生分解性の物質又はこれらの組み合わせが挙げられるがこれらに限定されない、調剤及び医薬品の技術において日常的に用いられる物質のいずれもが含まれ得る。
一部の実施態様によれば、微小粒子配合物は、微粒子の懸濁液を含んでいる。一部の実施態様によれば、医薬組成物は、更に、沈殿防止剤、安定剤及び分散剤の少なくとも1つを含んでいる。そのような一部の実施態様によれば、医薬組成物は、懸濁液として存在する。そのような一部の実施態様によれば、医薬組成物は、溶液として存在する。そのような一部の実施態様によれば、医薬組成物は、エマルジョンとして存在する。
一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水溶液を水溶性形態で含んでいる。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の油性懸濁液を含んでいる。電位開口型カルシウムチャネル遮断薬の油性懸濁液は、適切な親油性溶媒を用いて調製され得る。例示的な親油性溶媒又は賦形剤としては、脂肪油、例えばゴマ油、又は合成脂肪酸エステル、例えばエチルオレエート又はトリグリセリドが挙げられるが、これらに限定されない。一部の実施態様によれば、医薬組成物の配合物は、電位開口型カルシウムチャネル遮断薬の水性懸濁液を含んでいる。水性注入懸濁液は、懸濁液の粘度を増加させる物質、例えばカルボキシルメチルセルロースナトリウム、ソルビトール、又はデキストランを含有し得る。任意に、懸濁液は、また、適切な安定剤又は化合物の溶解性を増加させて高度に濃縮された溶液の調製を可能にする物質を含有し得る。或いは、電位開口型カルシウムチャネル遮断薬は、使用前に、適切な賦形剤、例えば、発熱物質を含まない滅菌水と構成するために粉末の形であり得る。
マイクロカプセル封入プロセス及び製品の例; エマルジョンベースの微粒子の製造方法; エマルジョンベースの微粒子及びその製造方法; 調整可能な抽出速度を有する溶媒抽出マイクロカプセル封入; 溶媒及び塩によるマイクロカプセル封入プロセス; 微粒子を作成する連続二重エマルジョンプロセス; ポリマーブレンドから微粒子特性、放出制御系を調整する乾燥方法; 非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法; 及び微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドアセンブリが、米国特許第5,407,609号明細書(マイクロカプセル封入プロセス及びその製品と称する)、米国特許出願公開第10/553,003号明細書(エマルジョンベースの微粒子の製造方法と称する)、米国特許出願公開第11/799,700号明細書(エマルジョンベースの微粒子及びその製造方法と称する)、米国特許出願公開第12/557,946号明細書(抽出速度可変による溶媒抽出マイクロカプセル封入と称する)、米国特許出願公開第12/779,138号明細書(ヒアルロン酸(HA)注入賦形剤と称する)、米国特許出願公開第12/562,455号明細書(溶媒及び塩によるマイクロカプセル封入プロセスと称する)、米国特許出願公開第12/338,488号明細書(低残留溶媒容積を有する微粒子の調製方法と称する); 米国特許出願公開第12/692,027号明細書(ポリマーブレンドからの放出制御系と称する); 米国特許出願公開第12/692,020号明細書(非反復単位が異なるポリマーを含むポリマー混合物及びその製造及び使用方法と称する); 米国特許出願公開第10/565,401号明細書(「放出制御組成物」と称する); 米国特許出願公開第12/692,029号明細書(「微粒子特性を調整する乾燥方法と称する); 米国特許出願公開第12/968,708号明細書(「微粒子を調製するエマルジョンベースのプロセス及びそれと用いられるワークヘッドと称する); 及び米国特許公開第13/074542号明細書(「局所投与部位において医薬組成物の保持が改善される組成物及び方法」と称する)に開示され記載されている。これらの各々の内容は、全体として本願明細書に援用されている。
一実施態様によれば、微粒子配合物は、ポリマーマトリックスを含み、電位開口型カルシウムチャネル遮断薬がそのポリマーマトリックスに含浸されている。一実施態様によれば、ポリマーは、徐放性ポリマーである。一実施態様によれば、ポリマーは、ポリ(D,L-ラクチド-コ-グリコリド)である。他の実施態様によれば、ポリマーは、ポリ(オルトエステル)である。他の実施態様によれば、ポリマーは、ポリ(無水物)である。他の実施態様によれば、ポリマーは、ポリラクチド-ポリグリコリドである。
電位開口型カルシウムチャネル遮断薬を送達する粒子の製造において非生分解性と生分解性ポリマー双方の材料が使用し得る。そのようなポリマーは、天然又は合成ポリマーであり得る。ポリマーは、放出が望まれる期間に基づいて選ばれる。特に興味がある生体接着性ポリマーとしては、Sawhney et al in Macromolecules (1993) 26, 581-587によって記載されている生物侵食性ヒドロゲルが挙げられるが、これに限定されない。この文献の教示は本願明細書に援用されている。例示的な生物侵食性ヒドロゲルとしては、ポリヒアルロン酸酸、カゼイン、ゼラチン、グルチン、ポリ無水物、ポリアクリル酸、アルギン酸塩、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、及びポリ(オクタデシルアクリレート)が挙げられるが、これらに限定されない。一実施態様によれば、生体接着性ポリマーは、ヒアルロン酸である。そのような一部の実施態様において、生体接着性ポリマーには、約2.3%未満のヒアルロン酸が含まれる。
一部の実施態様によれば、医薬組成物は、注射用デポ形態で配合される。注射用デポ形態は、生分解性ポリマー中に電位開口型カルシウムチャネル遮断薬のマイクロカプセル封入マトリックスを形成することによって製造される。薬剤とポリマーの比及び使われる具体的なポリマーの種類によって、薬剤放出速度が制御され得る。そのような長時間作用する配合物は、適切なポリマー材料又は疎水性材料(例えば許容され得る油中のエマルジョンとして)又はイオン交換樹脂と共に、又はやや難溶の誘導体として、例えば、やや難溶の塩として配合され得る。生分解性ポリマーの例としては、ポリラクチド-ポリグリコリド、ポリ(オルトエステル)及びポリ(無水物)が挙げられるが、これらに限定されない。注射用デポ製剤は、また、体組織と適合するリポソームまたはマイクロエマルジョン中に薬剤を封入することによって調製され得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリエステル-ポリエチレングリコールマトリックス中に又はポリエステル-ポリエチレングリコールマトリックス上に含浸させる。ポリエステル-ポリエチレングリコール化合物は合成され得る; これらは、軟質であり、薬剤送達に用い得る。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をポリ(アミノ)由来バイオポリマーマトリックス中に又はポリ(アミノ)由来バイオポリマーマトリックス上に含浸させる。ポリ(アミノ)由来バイオポリマーとしては、脂肪族ジアミンとして乳酸及びリシンを含有するもの(例えば、米国特許第5,399,665号明細書を参照のこと)、及びチロシン由来ポリカーボネート及びポリアクリレートが挙げられるが、これらに限定されない。ポリカーボネートの変性はエステルのアルキル鎖の長さを変化させることができ(エチルをオクチルに)、ポリアリーレートの変性は二酸のアルキル鎖の長さを変化させることを更に含むことができ(例えば、コハク酸をセバシン酸に)、これによりポリマーの大きな置換及びポリマー特性の大きな可撓性が可能になる。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を光重合性バイオポリマーマトリックス中に又は光重合性バイオポリマーマトリックス上に含浸させる。光重合性バイオポリマーとしては、乳酸/ポリエチレングリコール/アクリレートコポリマーが挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒドロゲルマトリックス中に又はヒドロゲルマトリックス上に含浸させる。用語「ヒドロゲル」は、ゼラチン状又はゼリー状の塊を生成するのに必要な水性成分を含有する固体、半固体、擬塑性又は塑性構造をもたらす物質を意味する。ヒドロゲルは、一般的に、親水性ポリマー、アクリル酸、アクリルアミド及び2-ヒドロキシエチルメタクリレート(HEMA)が含まれる種々のポリマーを含む。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在するバイオポリマーマトリックス中に又は天然に存在するバイオポリマーマトリックス上に含浸させる。天然に存在するバイオポリマーとしては、タンパク質ポリマー、コラーゲン、多糖類及び光重合性化合物が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬を天然に存在する多糖マトリックス中に又は天然に存在する多糖マトリックス上に含浸させる。天然に存在する多糖類は、キチン及びその誘導体、ヒアルロン酸、デキストラン及びセルロース系(一般的には変性せずに生分解性でない)、及びスクロースアセテートイソブチレート(SAIB)が挙げられるが、これらに限定されない。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をキチンマトリックス中に又はキチンマトリックス上に含浸させる。キチンは、主に2-アセトアミド-2-デオキシ-D-グルコース基から構成され、外骨格の主成分である酵母、菌類及び海の無脊椎動物(エビ、甲殻類)に見られる。キチンは水溶性でなく、脱アセチル化キチン、キトサンのみが酸性溶液(例えば、酢酸)に可溶性である。研究によって、水溶性で、非常に高分子量で(2,000,000ダルトンよりも大きい)、粘弾性で、非毒性で、生体適合性で、過酸化物、グルタルアルデヒド、グリオキサール及び他のアルデヒド及びカルボジアミドと架橋してゲルを形成することのできるキチン誘導体が報告されている。
一部の実施態様によれば、電位開口型カルシウムチャネル遮断薬をヒアルロン酸(HA)マトリックス中に又はヒアルロン酸(HA)マトリックス上に含浸させる。交互のグルクロニドとグルコサミニド結合から構成され且つ分離され精製されている哺乳類の硝子体液、脳の細胞外マトリックス、滑液、臍帯及び鶏冠に見られるヒアルロン酸(HA)もまた発酵プロセスによって生産され得る。
配合物は、例えば、最後のガンマ照射、細菌保持フィルタを通すろ過によって又は使用直前に滅菌水又は他の注射用滅菌媒質に溶解又は分散され得る滅菌固体組成物の形で滅菌剤を組み込むことによって滅菌され得る。注射用製剤、例えば、注射用滅菌水性又は油性懸濁液は、適切な分散剤又は湿潤剤及び沈殿防止剤を用いて既知の技術に従って配合され得る。注射用滅菌製剤は、また、非毒性の非経口的に許容され得る希釈剤又は溶媒中の注射用滅菌溶液、懸濁液又はエマルジョン、例えば、1,3-ブタンジオール、ジクロロメタン、酢酸エチル、アセトニトリル等に溶解したものであり得る。許容され得る賦形剤及び溶媒の中で水、リンゲル液、U.S.P.及び等張食塩液が使われ得る。更に、滅菌固定油が通例溶媒又は懸濁媒質として使われる。このためには、合成モノグリセリド又はジグリセリドが含まれる無刺激固定油が使われ得る。更に、オレイン酸のような脂肪酸が、注射剤の調製に用いられる。
非経口(皮下、内皮、筋肉内、静脈内、動脈内、鞘内、脳室内及び関節内が含まれるがこれらに限定されない)投与用の配合物には、配合物を意図した受容個体の血液と等張にする、抗酸化剤、緩衝剤、静菌薬及び溶質を含有し得る水性及び非水性滅菌注射溶液; 及び沈殿防止剤及び増粘剤を含み得る水性及び非水性滅菌懸濁液が含まれる。
好適な緩衝剤としては、酢酸と塩(1-2% w/v); クエン酸と塩(1-3% w/v); ホウ酸と塩(0.5-2.5% w/v); 及びリン酸と塩(0.8-2% w/v)が挙げられる。好適な防腐剤としては、塩化ベンザルコニウム(0.003-0.03% w/v); クロロブタノール(0.3-0.9% w/v); パラベン(0.01-0.25% w/v)及びチメロサール(0.004-0.02% w/v)が挙げられる。
ある範囲の値が示される場合、その範囲の上限と下限との間のそれぞれの介在値、及びその規定範囲内の任意の他の規定値又は介在値は、文脈が特に明確に指示しない限り、下限の単位の10分の1まで本発明に包含されることが理解される。より小さい範囲に独立して含まれ得るこれらのより小さい範囲の上限及び下限も、規定範囲内の具体的に除外された限界に従って本発明に包含される。規定範囲がその限界の1つ又は双方を含む場合、それらの包含される限度のいずれかを排除する範囲も本発明に含まれる。
特に定義されない限り、本明細書に用いられる全ての技術用語及び科学用語は、本発明が属する当業者によって一般に理解される用語と同一の意味を有する。本明細書に記載の方法及び物質と類似又は同等の任意の方法及び材料を本発明の実施又は試験に使用し得るが、好ましい方法及び材料がここで記載される。本明細書に言及される全ての文献は、文献が関連して引用される方法及び/又は材料を開示且つ記載するために本明細書に援用されている。
本明細書で述べられる刊行物は、単に本出願の出願日前のそれらの開示のために示されているだけである。本明細書において、本発明が、先行発明によりそのような刊行物に先行する権利がないと承認するものと解釈されるべきではない。更に、示された刊行物の日付は、実際の刊行日と異なる場合もあり、独立して確認される必要があり得る。
材料及び方法
配合物
ニモジピンの存在下にポリマー溶液(例えば、50-50のグリコリド-ラクチドブレンド)と溶媒とを合わせることによって一様な微粒子サイズ分布を含有する微小粒子ニモジピン配合物の試験配合物を調製した。その混合物を界面活性剤含有水溶液に添加して、エマルジョンを形成し、溶媒抽出して、流動性微小粒子ニモジピン配合物を製造した。最初の薬剤負荷は、65%、すなわち、65%ニモジピン及び35%ポリマーであった。平均粒子径は、約52μであった。
微小粒子ニモジピン配合物を医薬担体と合わせて、本発明の医薬組成物を形成した。送達する手段が外科的注入装置であり、送達部位がクモ膜下腔内の大脳動脈のごく近接した範囲内であるときに、賦形剤(例えば食塩水(リン酸緩衝食塩水(PBS)中の(ヒドロキシルプロピルメチルセルロース(HPMC)))と微小粒子ニモジピン配合物とを混合する。プラセボ配合物は、ニモジピンなしプラス賦形剤で作成した微小粒子を含有した。
合計6匹の雄のイヌを表1に示されるように実験に割り当てた。
対照(微小粒子プラセボ配合物)及び試験製品(低用量の微小粒子ニモジピン配合物又は高用量の微小粒子ニモジピン配合物)を、大槽へ注入によって1日目の手術の間に1回投与した(小脳の尾側表面と延髄の背面の間のクモ膜下腔の拡大)。治療したグループの用量レベルは、0.25mL(微小粒子プラセボ配合物)、0.17mL又は0.18mL(低用量の微小粒子ニモジピン配合物)、又は0.46mL(高用量の微小粒子ニモジピン配合物)の一定投与容量で10mg又は30mgであった。準備したシリンジに16mg及び40mgの低用量の微小粒子ニモジピン配合物及び高用量の微小粒子ニモジピン配合物をそれぞれ装填し; これは、送達系のデッドボリュームを充填するのに必要なオーバフィルを考慮した。材料を再構成/注入手順によって投与したので、送達された用量は約10mg及び30mgであった。対照グループには、治療グループと同様に対照製品(微小粒子プラセボ配合物)を投与した。
再構成/注入に対して、希釈剤を含むシリンジを、微小粒子ニモジピン配合物を含むシリンジにコネクタを介して取り付けた。プランジャーを繰り返して、賦形剤を微小粒子配合物に引き込む。次に得られた医薬組成物を左のシリンジに押し込め、コネクタから分離する。送達に対して、組成物はいずれも外科用針を通しての注射用であるか又は適切な任意のサイズのカニューレ又はカテーテルによって取付けられ得るか又は注入され得る。
1日目に、イヌの重さを計り、ベースラインの血液を集め、血圧、温度、心拍数酸素、及び血液ガスを外科的手順全体にモニタした。脳血管造影を1つの椎骨動脈によって行った。血管造影図毎に同一の露出因子と倍率を用いて画像を獲得した。倍率内部標準を血管造影図毎に含めた。
血管造影後、動物をうつ伏せにし、大槽を18ゲージのクモ膜下穿刺針で経皮的に穿刺した。0.3mL/kgCSFの標的容積を自発的に流出させ、その後、0.5mL/kgの新しい自己由来の非ヘパリン化動脈血を大腿カテーテルから取り出し、大槽に約5mL/分の速度で注入した。血液量の約1/2を注入し、プラセボ又はニモジピン配合物を約5mL/分の速度で投与した。微小粒子プラセボ又は微小粒子ニモジピン配合物(低用量及び高用量)の投与終了後、残りの血液を注入した。針を注入直後に引き抜いた。大槽血液注入の間、動物の頭部を下に30°傾け、注入完了後15分間のその位置のままにした。次に動物を仰向きにし、大腿カテーテルを取り外し、大腿動脈を結紮した。標準法で切開を閉じた。
3日目に、イヌを全身麻酔下に置き、大槽の血液注入を繰り返した。8日目と15日目に、動物に麻酔し、血管造影と大槽からCSFの除去を繰り返した。15日目の血管造影後、動物は麻酔から戻らなかった。動物を麻酔によって安楽死させ、リン酸緩衝食塩水、次に中性緩衝ホルマリンで灌流し、脳を上記のように組織学的分析に供した。
1、8及び15日目に脳底動脈の直径を比較することによって血管攣縮を評価した。動物グループに対して盲検の4人のレビュアによって血管造影データを独立して分析した。次に、各動物の5つの平均内腔径を、各時点で各動物の平均内腔径を得るために平均した。式(1)を用いて8日目と15日目の各動物の個々の血管攣縮パーセントを定量した:
15日目に、対照動物(プラセボ治療)の平均脳底動脈径減少はベースラインと比較したときに-17.3%であった。低用量のニモジピン微粒子で治療した動物はベースラインと比較したときに平均脳底動脈径が-24%減少した。高用量のニモジピン微粒子で治療した動物はベースラインと比較したときに平均脳底動脈径が0.7%増大した。試験した動物が少数のため統計解析は行わなかった。
この実施例は、(1)8日目に、脳底動脈の狭小化は、対照グループが最も高く、続いて低用量グループ、高用量グループが最も低かった; また、(2)15日目に、脳底動脈の狭小化は、対照が最も高く、続いて低用量グループ、高用量グループが最も低かったことをを示している。試験における動物が少数のため、15日目の低用量グループにおける脳底動脈の変化は、予想される統計変動の範囲内であった。
試験手順と関連があると考えられる臨床所見は、活動低下及び食欲不振の観察に限定した。活動低下は、試験の第1週の間に全6匹の動物に、また、第2週の間に1匹のプラセボ治療及び1匹の低用量ニモジピン微粒子治療動物にみられた。食欲不振は、第1週の間に6匹の動物のうちの5匹及び第2週の間に6匹の動物のうちの4匹にみられた。これらの所見は、すべての用量グループからの動物に存在するので、試験手順が関係すると考えられた。
罹患率、死亡率、損傷、及び食物と水のアベイラビリティに対する観察を、すべての動物に対して1日2回行った。ランダム化前に及び試験の間に毎週体重を測定し記録した。完全な身体検査をスタッフの獣医師予備検査によってすべての動物に行った。
試験について記載された各動物に対して毎日スタッフの獣医師が行動観察を行った。毎日スタッフの獣医師が各動物の行動を調べた。食欲、活動及び神経学的欠陥の行動分類に関連する行動を、表3-5の行動スコアを示した。
表3は、食欲について示された行動スコアを示すものである。
食欲又は活動の一貫した又は著しい変化がなく、神経機能の変化もなかった。
試験手順もプラセボ又はニモジピン微小粒子による治療も、実質的な体重の変化と関係していなかった。ニモジピン微小粒子用量とプラセボの間には血液学パラメーターの差が明らかでなかった。
ニモジピンに対する血清試料の分析により、ニモジピンの検出可能なレベルを有する3日目のより高い濃度が15日目になお示していることがわかった(図7、表6)。表6は、プラセボ、低用量(10mg)の微小粒子ニモジピン配合物又は高用量(30mg)の微小粒子ニモジピン配合物で治療したときのクモ膜下出血に供したイヌにおける血清薬剤濃度(ng/mL)を示すものである。図12は、プラセボ、低用量(10mg)微小粒子ニモジピン配合物又は高用量(30mg)微小粒子ニモジピン配合物で治療したときのクモ膜下出血に供したイヌにおける経時血清中の薬剤濃度(ng/mL)のプロットを示す図である。
ニモジピンの血清濃度は、高用量ニモジピン微小粒子で治療した動物においてより高かった。プラセボ動物においていかなる時点でもニモジピンは検出されなかった。
CSF試料の分析により、低用量のニモジピン微粒子の投与後3日目と8日目に持続した高濃度が見られ、15日目により低濃度のニモジピン微粒子が示された。表7は、プラセボ、低用量(10mg)微小粒子ニモジピン配合物又は高用量(30mg)微小粒子ニモジピン配合物で治療したときのクモ膜化出血に供したイヌからのCSF中の薬剤濃度(ng/mL)を示すものである。
CSFニモジピン濃度は低用量及び高用量のニモジピン微粒子を投与した血清濃度より著しく高く、検出可能な濃度が15日目になお示された。高用量の3日目の試料の1つは、定量限度よりも多く(>500ng/mL)、追加の試料がないために再試験できなかった。統計的有意性は、少ない試料数のために決定され得ない。プラセボ動物のいかなる時点でもニモジピンは検出されなかった。
図13は、プラセボ(A)で治療したとき及び低用量微小粒子ニモジピン配合物(B)で治療したときのクモ膜下出血(SAH)に供したイヌの組織病理学を示す写真である。図14は、イヌモデル実験において用いられる断面を示す図である。唯一の顕微鏡的所見は、低用量微小粒子ニモジピン配合物グループからの動物及び高用量微小粒子ニモジピン配合物グループから2匹の動物のうちの1匹の双方において脳橋及び/又は髄質のくも膜下腔内に最小のものから軽度までの肉芽腫性炎からなるものであった。炎症は、異物を包み込んだ巨細胞の集合に特徴を有した。ごく小さい亜急性炎又はリンパ性血管周囲浸潤もまた、グループ全体で2、3の動物にみられた。後者の所見は、肉芽腫性炎と密接に関係していた。
最小のものから軽度までの変性が、プラセボグループからの2匹の動物のうちの1匹及び低用量ニモジピン微粒子グループからの双方の動物にみられた。変性は、脳橋又は髄質の腹側部に存在し、出血で部分的に満たされた空間を空洞化すること、小血管を増殖させること、及び神経膠/アストロサイト細胞の数の増加に特徴を有した。泡沫空胞化細胞が時々存在した。隣接する脳組織には 軸索膨張/変性が存在した。この所見は、注入手順に関連があるとみなされ、注入された組成物の効果ではなかった。
髄膜出血及び/又は線維増殖が試験したほとんどの動物にみられ、検死及び/又は注入手順におそらく関係しているようであった。
顕微鏡的実験から、すべての治療グループ、すなわち、プラセボ、低用量(10mg)微小粒子ニモジピン配合物及び高用量(30mg)微小粒子ニモジピン配合物においてくも膜下腔内のごく小さいものから軽度の肉芽腫性炎、ごく小さいものから軽度の退化及び髄膜出血及び/又は線維増殖が示された。
材料及び方法
配合物
ニモジピンの存在下にポリマー溶液(例えば、50-50のグリコリド-ラクチドブレンド)と溶媒とを合わせることによって一様な微粒子サイズ分布を含有する微小粒子ニモジピン配合物の試験配合物を調製した。その混合物を界面活性剤含有水溶液に添加して、エマルジョンを形成し、溶媒抽出して、流動性微小粒子ニモジピン配合物を製造した。最初の薬剤負荷は、65%、すなわち、65%ニモジピン及び35%ポリマーであった。平均粒子径は、約52μであった。
微小粒子ニモジピン配合物を医薬担体と合わせて、本発明の医薬組成物を形成した。送達する手段が外科的注入装置であり、送達部位がクモ膜下腔内の大脳動脈のごく近接した範囲内にあるときに、粘着性(例えばヒアルロン酸)を与える賦形剤と微小粒子ニモジピン配合物(「ニモジピン配合物1」)とを混合する。微小粒子ニモジピン配合物2(「ニモジピン配合物2」)に対しては、医薬的に許容され得る担体、粘着性を与える賦形剤を医薬的に許容され得る担体として用いなかった。プラセボ配合物は、微粒子プラス賦形剤を含有したが、ニモジピンを含有しなかった。
表8に示されるように合計30匹のイヌを実験に割り当てた。
ニモジピン配合物(配合物1)を賦形剤(例えばヒアルロン酸)と共にクモ膜下腔の大槽内に外科的注入によって治療グループ2及び3に微小粒子投与した。微小粒子ニモジピン配合物(配合物2)を、賦形剤を含めずに脳室にカテーテル(14ゲージ〜18ゲージ)を通してシリンジによって治療グループ4に投与した。微小粒子プラセボ配合物を賦形剤(例えばヒアルロン酸)と共にクモ膜下腔の大槽内に外科的注入によって治療グループ1(経口対照)に投与した。1日目に微小粒子プラセボ配合物を投与した後、次に治療グループ1(経口対照)に経口ニモジピンカプセル(0.86mg/kg)を21日目まで1日につき6回投与した。プラセボ対照グループにも、賦形剤(例えばヒアルロン酸)を含む微小粒子プラセボ配合物をクモ膜下腔の大槽内に外科的注入によって投与した。(データは示されていない)。治療されたグループ2、3及び4に送達された用量レベルは上記の表8に示した通りである。シリンジに送達系におけるデッドボリュームを充填するのに必要なオーバフィルを考慮する医薬組成物を装填した。送達用量は、約40mg(用量1)及び100mg(用量2)であった。経口対照及びプラセボグループに治療されたグループと同様に対照製品を投与した。
再構成/注入に対しては、希釈剤を含むシリンジを、微小粒子ニモジピン配合物を含むシリンジにコネクタを介して取り付けた。治療グループ1、2、及び3の場合には、プランジャーを繰り返して、賦形剤を微小粒子配合物に引き込む。次に得られた医薬組成物を左のシリンジに押し込め、コネクタから分離する。送達に対して、組成物はいずれも外科用針を通しての注射用であるか又は適切な任意のサイズのカニューレ又はカテーテルによって取付けられ且つ注入され得る。
1日目に、イヌの重さを計り、ベースラインの血液を集め、血圧、温度、心拍数酸素、及び血液ガスを外科的手順全体にモニタした。脳血管造影を1つの椎骨動脈によって行った。血管造影図毎に同一の露出因子と倍率を用いて画像を獲得した。倍率内部標準を血管造影図毎に含めた。
治療グループ1、2及び3の場合には、血管造影後、動物をうつ伏せにし、大槽を14ゲージのクモ膜下穿刺針で経皮的に穿刺した。0.3mL/kgCSFの標的容積を自発的に流出させ、その後、0.5mL/kgの新しい自己由来の非ヘパリン化動脈血を大腿カテーテルから取り出し、約5mL/分の速度で大槽に注入した。血液量の約1/2を注入し、微小粒子プラセボ配合物又は微小粒子ニモジピン配合物を約5mL/分の速度で投与した。プラセボ又はニモジピン配合物(用量1及び用量2)投与終了後、残りの血液を注入した。針は、注入直後に引き抜いた。大槽血液注入の間、動物の頭部を下に30°傾け、注入完了後15分間のその位置のままにした。次に動物を仰向きにし、大腿カテーテルを取り外し、大腿動脈を結紮した。標準法で切開を閉じた。
治療グループ4の場合には、微小粒子ニモジピン配合物を5mL/分の速度で側脳室へカテーテル(14ゲージ)を通して1回の注入として投与した。
3日目に、イヌを全身麻酔下に置き、大槽の血液注入(治療グループ1、2、及び3の場合)又は脳室内投与(治療グループ4の場合)を繰り返した。8日目と15日目に、動物に麻酔し、血管造影と大槽からCSFの除去を繰り返した。15日目の血管造影後、動物は麻酔から戻らなかった。動物を麻酔によって安楽死させ、リン酸緩衝食塩水、次に中性緩衝ホルマリンで灌流し、脳を上記のように組織学的分析に供した。
1、8及び15日目に脳底動脈の直径を比較することによって血管攣縮を評価した。動物グループに対して盲検の4人のレビュアによって血管造影データを独立して分析した。次に、各動物の5つの平均内腔径を、各時点で各動物の平均内腔径を得るために平均した。
式(1)を用いて8日目と15日目の各動物の個々の血管攣縮パーセントを定量した:
罹患率、死亡率、損傷、及び食物と水のアベイラビリティに対する観察を、すべての動物に対して1日2回行った。ランダム化前に及び試験の間に毎週体重を測定し記録した。完全な身体検査をスタッフの獣医師予備検査によってすべての動物に行った。
試験について記載された各動物に対して毎日スタッフの獣医師が行動観察を行った。毎日スタッフの獣医師が各動物の行動を調べた。食欲、活動及び神経学的欠陥の行動分類に関連する行動を、上記表3-5の行動スコアに示した。
食欲又は活動の一貫した又は著しい変化がなく、神経機能の変化もなかった。
表10a-10gは、ニモジピン配合物1、用量1(40mg)、ニモジピン配合物1、用量2(100mg)、及び経口対照で治療したときだけでなく、ニモジピン配合物2、用量2(100mg)を投与した後の、くも膜下出血に供したイヌにおける血清中薬剤濃度(ng/mL)を示すものである。図16は、ニモジピン配合物1、用量1(40mg)、ニモジピン配合物1、用量2(100mg)、及び経口対照で治療したときだけでなく、ニモジピン配合物2、用量2(100mg)の脳室への投与後の、くも膜下出血に供したイヌにおける経時血清中薬剤濃度(ng/mL)のプロットを示すグラフである。
図16及び表10a-10gは、40mgの用量及び100mgの用量の配合物1がいずれも3日目に血漿濃度のピークを示し、100mgの用量の配合物2が4日目に血漿濃度のピークを示し、対照経口ニモジピンが7日目に血漿濃度のピークを有したことを示している。40mgの配合物1は、ピーク濃度が最も低く(8.3ng/mL)、100mgの配合物1、100mgの配合物2、及び経口ニモジピンによる対照はすべて、ほぼ等しいピーク濃度(それぞれ13.6ng/mL、14.6ng/mL及び14.6ng/mL)を有した。この実施例は、すべての配合物が経口ニモジピンによる対照に見られた最大血漿濃度か又はそれよりも低い血漿濃度を有することを示した。
表11a-11bは、ニモジピン配合物1、用量1(40mg)、ニモジピン配合物1、用量2(100mg)、及び経口対照で治療したときだけでなく、ニモジピン配合物2、用量2(100mg)を脳室に投与した後の、くも膜下出血に供したイヌにおけるCSF薬剤濃度(ng/mL)を示すものである。図17は、ニモジピン配合物1、用量1(40mg)、ニモジピン配合物1、用量2(100mg)、及び経口対照で治療したときだけでなく、ニモジピン配合物2、用量2(100mg)を脳室に投与した後の、くも膜下出血に供したイヌにおける経時CSF薬剤濃度(ng/mL)を示すグラフである。
図17及び表11a-11bは、経口ニモジピンによる対照、配合物の0mg用量、配合物1の100mg用量、及び配合物2の100mg用量すべてが、3日目にCSFニモジピン濃度のピークであったことを示している。経口ニモジピンによる対照は、1.6ng/mLのピークCSFニモジピン濃度を有し、配合物1、40mg用量は、1763.5ng/mLのピークCSFニモジピン濃度を有し、配合物1、100mg用量は、3028.5ng/mLのピークCSFニモジピン濃度を有し、配合物2、100mg用量は、1896.5ng/mLのピークCSFニモジピン濃度を有した。経口ニモジピンによる対照は、8日目まで検出可能なCSF濃度を有し、配合物1、40mg及び100mgの用量は、35日目まで検出可能なCSF濃度を有し、配合物2、100mg用量は、42日目まで検出可能なCSF濃度を有した。この実施例は、配合物1及び2いずれも、経口ニモジピンによる対照よりも著しく高いCSFニモジピン濃度を有することが可能であり且つより長い時間これらの濃度を維持することが可能であることを示した。この実施例は、配合物1及び配合物2いずれも、血漿ニモジピン濃度を対照経口ニモジピンで見られる最大レベルに又はそれよりも低く保ちつつ高CSFニモジピン濃度を生じることが可能であったことを示している。この実施例は、局所的に投与される(嚢内投与か又は脳室内投与による)ときに微小粒子ニモジピン配合物で達成された高レベルのCSFニモジピン濃度がクモ膜下出血をもつイヌの血管攣縮を減少させることが可能であることを示している。
本発明をその個々の実施態様に関して記載してきたが、その種々の変更がなされ得ること及び等価物が本発明の真の精神と範囲から逸脱することなく置換され得ることは当業者によって理解されるべきである。更に、多くの修正がなされて、本発明の客観的精神及び範囲に対して、具体的な状況、材料、合成物、プロセス、プロセス工程(1つ以上)が用いられてもよい。そのようなすべての修正は、本明細書に添付された特許請求項の範囲内とする。
本発明の態様として、例えば以下のものがある。
〔1〕脳損傷に伴う遅発性合併症の治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療する方法であって、脳損傷が少なくとも1つの大脳動脈の妨害を含む前記方法であって、
(a)(i)電位開口型カルシウムチャネル遮断薬の微小粒子配合物; 及び任意に
(ii)医薬的に許容され得る担体
を含む医薬組成物を準備する工程; 並びに
(b)治療的な量の前記医薬組成物を投与部位に投与する手段によって治療的な量の前記医薬組成物を投与する工程
を含み、
前記治療的な量が脳損傷に伴う少なくとも1つの遅発性合併症の徴候又は症状を軽減させるのに効果的であり、
前記少なくとも1つの遅発性合併症が、遅発性脳虚血(DCI)、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、及び血管造影血管攣縮のうちの少なくとも1つである、前記方法。
〔2〕工程(b)において、前記投与する手段が外科的注入装置であり、前記投与部位が脳損傷によって影響を受けた少なくとも1つの大脳動脈にごく近接している、前記〔1〕に記載の方法。
〔3〕工程(b)において、前記投与する手段が外科的注入装置であり、前記投与部位が脳室である、前記〔1〕に記載の方法。
〔4〕前記外科的注入装置が、針、カニューレ、カテーテル、又はこれらの組み合わせである、前記〔2〕に記載の方法。
〔5〕前記微小粒子配合物が脳脊髄液によって運ばれ、脳損傷によって影響を受けた大脳動脈に接触する、前記〔3〕に記載の方法。
〔6〕前記治療的な量が、対照と比較して、脳損傷によって影響を受けた大脳動脈の内径を増大させるのに効果的である、前記〔1〕に記載の方法。
〔7〕脳損傷が、動脈瘤、突然の外傷性頭部外傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔1〕に記載の方法。
〔8〕脳損傷が、クモ膜下出血の結果である、前記〔7〕に記載の方法。
〔9〕脳損傷に伴う前記少なくとも1つの遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔1〕に記載の方法。
〔10〕前記行動に関する欠陥が改善され、前記行動に関する欠陥の改善が食欲増進を含む、前記〔9〕に記載の方法。
〔11〕前記神経障害が改善され、前記神経障害の改善が運動失調又は不全麻痺の改善を含む、前記〔9〕に記載の方法。
〔12〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに主に局所的な薬理学的作用を示す、前記〔1〕に記載の方法。
〔13〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに脳全体に拡散薬理学的作用を示す、前記〔1〕に記載の方法。
〔14〕前記微小粒子配合物が複数の微粒子を含み、前記微小粒子が一様なサイズ分布を有し、各微小粒子がマトリックスを含む、前記〔1〕に記載の方法。
〔15〕前記微小粒子配合物が、更に、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含む、前記〔1〕に記載の方法。
〔16〕前記微粒子配合物が、微小粒子の液体懸濁液を含む、前記〔1〕に記載の方法。
〔17〕脳室が、側脳室、第三脳室、第四脳室、又はこれらの組み合わせである、前記〔1〕に記載の方法。
〔18〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、徐放性化合物を含む、前記〔1〕に記載の方法。
〔19〕前記徐放性化合物が、ポリマーである、前記〔18〕に記載の方法。
〔20〕電位開口型カルシウムチャネル遮断薬が、徐放性ポリマー上に又は徐放性ポリマー中に配置されている、前記〔19〕に記載の方法。
〔21〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ(D,L-ラクチド-コ-グリコリド)を含む、前記〔20〕に記載の方法。
〔22〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ(オルトエステル)を含む、前記〔20〕に記載の方法。
〔23〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ無水物を含む、前記〔20〕に記載の方法。
〔24〕電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔1〕に記載の方法。
〔25〕電位開口型カルシウムチャネル遮断薬が、ジヒドロピリジンカルシウムチャネル遮断薬である、前記〔1〕に記載の方法。
〔26〕前記ジヒドロピリジンカルシウムチャネル遮断薬が、ニモジピンである、前記〔25〕に記載の方法。
〔27〕前記医薬的に許容され得る担体が、ゲル化合物を含む、前記〔1〕に記載の方法。
〔28〕前記ゲル化合物が、生分解性ヒドロゲルである、前記〔27〕に記載の方法。
〔29〕前記医薬組成物が、医薬的に許容され得る担体を含まない、前記〔1〕に記載の方法。
〔30〕前記医薬的に許容され得る担体が、ヒアルロン酸を含まない、前記〔1〕に記載の方法。
〔31〕前記医薬的に許容され得る担体が、ヒアルロン酸を含む、前記〔1〕に記載の方法。
〔32〕前記医薬的に許容され得る担体が、0%〜5%ヒアルロン酸の範囲にある、前記〔31〕に記載の方法。
〔33〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含んでいる、前記〔33〕に記載の方法。
〔34〕医薬的に許容され得る担体が、5%未満のヒアルロン酸を含んでいる、前記〔33〕に記載の方法。
〔35〕脳損傷に伴う遅発性合併症の治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療するための半固体多粒子送達系であって、脳損傷が少なくとも1つの大脳動脈の妨害を含む前記系であって、
(a)(i)電位開口型カルシウムチャネル遮断薬の微小粒子配合物; 及び任意に
(ii)医薬的に許容され得る担体
を含む医薬組成物; 並びに
(b)治療的な量の前記医薬組成物を投与部位に投与する手段
を含み、
前記治療的な量が脳損傷に伴う少なくとも1つの遅発性合併症の徴候又は症状を軽減させるのに効果的である、前記系。
〔36〕前記少なくとも1つの遅発性合併症が、遅発性脳虚血(DCI)、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、及び血管造影血管攣縮のうちの少なくとも1つである、前記〔35〕に記載の系。前記投与する手段が外科的注入装置であり、前記投与部位が脳損傷によって影響を受けた少なくとも1つの大脳動脈にごく近接している、前記〔31〕に記載の系。
〔37〕前記投与する手段が外科的注入装置であり、前記投与部位が脳室である、前記〔35〕に記載の系。
〔38〕前記外科的注入装置が、針、カニューレ、カテーテル、又はこれらの組み合わせである、前記〔37〕に記載の系。
〔39〕前記微小粒子配合物が脳脊髄液によって運ばれて脳損傷によって影響を受けた大脳動脈に接触することができる、前記〔35〕に記載の系。
〔40〕前記治療的な量が、対照と比較して、脳損傷によって影響を受けた大脳動脈の内径を増大させるのに効果的である、前記〔35〕に記載の系。
〔41〕脳損傷が、動脈瘤、突然の外傷性頭部外傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔35〕に記載の系。
〔42〕脳損傷が、クモ膜下出血の結果である、前記〔41〕に記載の系。
〔43〕脳損傷に伴う前記少なくとも1つの遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔35〕に記載の系。
〔44〕前記行動に関する欠陥が改善され、前記行動に関する欠陥の改善が食欲増進を含む、前記〔43〕に記載の系。
〔45〕前記神経障害が改善され、前記神経障害の改善が運動失調又は不全麻痺の改善を含む、前記〔43〕に記載の系。
〔46〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに主に局所的な薬理学的作用を示す、前記〔35〕に記載の系。
〔47〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに脳全体に拡散薬理学的作用を示す、前記〔35〕に記載の系。
〔48〕前記微小粒子配合物が複数の微粒子を含み、前記微粒子が一様なサイズ分布を有し、各微粒子がマトリックスを含む、前記〔1〕に記載の方法。
〔49〕前記微小粒子配合物が、更に、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含む、前記〔35〕に記載の系。
〔50〕前記微粒子配合物が、微粒子の液体懸濁液を含む、前記〔35〕に記載の系。
〔51〕脳室が、側脳室、第三脳室、第四脳室、又はこれらの組み合わせである、前記〔35〕に記載の系。
〔52〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、徐放性化合物を含む、前記〔35〕に記載の系。
〔53〕前記徐放性化合物が、ポリマーである、前記〔52〕に記載の系。
〔54〕電位開口型カルシウムチャネル遮断薬が、徐放性ポリマー上に又は徐放性ポリマー中に配置されている、前記〔53〕に記載の系。
〔55〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ(D,L-ラクチド-コ-グリコリド)を含む、前記〔52〕に記載の系。
〔56〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ(オルトエステル)を含む、前記〔55〕に記載の系。
〔57〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、ポリ無水物を含む、前記〔55〕に記載の系。
〔58〕電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔35〕に記載の系。
〔59〕電位開口型カルシウムチャネル遮断薬が、ジヒドロピリジンカルシウムチャネル遮断薬である、前記〔35〕に記載の系。
〔60〕前記ジヒドロピリジンカルシウムチャネル遮断薬が、ニモジピンである、前記〔59〕に記載の系。
〔61〕前記医薬的に許容され得る担体が、ゲル化合物である、前記〔35〕に記載の系。
〔62〕前記ゲル化合物が、生分解性ヒドロゲルである、前記〔61〕に記載の系。
〔63〕前記医薬組成物が、医薬的に許容され得る担体を含まない、前記〔35〕に記載の系。
〔64〕前記医薬的に許容され得る担体が、ヒアルロン酸を含まない、前記〔35〕に記載の系。
〔65〕前記医薬的に許容され得る担体が、ヒアルロン酸である、前記〔35〕に記載の系。
〔66〕前記医薬的に許容され得る担体が、0%〜5%ヒアルロン酸の範囲にある、前記〔64〕に記載の系。
〔67〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、前記〔66〕に記載の方法。
〔68〕前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、前記〔66〕に記載の方法。
本発明のまた別の態様は、以下のとおりであってもよい。
〔1'〕脳損傷に伴う遅発性合併症の治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療するための半固体多粒子送達システムであって、脳損傷がクモ膜下腔の少なくとも1つの大脳動脈の妨害を含み、前記システムが、
(a)(i)電位開口型カルシウムチャネル遮断薬を含む治療薬の流動性微小粒子配合物; 及び (ii)医薬的に許容され得る担体
を含む医薬組成物; 並びに
(b)治療的な量の前記医薬組成物を投与部位に局所投与する手段
を含み、
(i)微小粒子が前記治療薬で含浸されているか、或いは、前記治療的な量の医薬組成物が粒子の表面全体に分散されているか、コーティングによって囲まれた粒子のコア内に含有されているか、又は微小粒子の上に若しくは微小粒子の中に配置されており、
(ii)前記微小粒子配合物が徐放性配合物であり、
(iii)前記治療的な量の医薬組成物が、体内における少ない影響で脳動脈及び/又は脳における局所的な薬理効果をもたらし、かつ
(iv)投与される量の全投与量は、全身投与の投与量よりも非常に少量であり副作用のリスクが低い
前記システム。
〔2'〕前記少なくとも1つの遅発性合併症が、遅発性脳虚血(DCI)、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、及び血管造影血管攣縮のうちの少なくとも1つである、前記〔1'〕に記載のシステム。
〔3'〕前記投与する手段が、前記組成物の注入用シリンジであり、前記投与部位が、脳室であるか若しくは脳のクモ膜下槽であるか、又は脳損傷によって影響を受けた少なくとも1つの大脳動脈にごく近接している、前記〔1'〕に記載のシステム。
〔4'〕注入が、針、カニューレ、カテーテル、又はこれらの組み合わせを通してのものである、前記〔3'〕に記載のシステム。
〔5'〕前記治療的な量が、対照と比較して、脳損傷によって影響を受けた大脳動脈の内径を増大させるのに効果的である、前記〔1'〕に記載のシステム。
〔6'〕脳損傷が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔1'〕に記載のシステム。
〔7'〕脳損傷に伴う前記少なくとも1つの遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔1'〕に記載のシステム。
〔8'〕前記行動に関する欠陥が改善され、前記行動に関する欠陥の改善が食欲増進を含む、前記〔7'〕に記載のシステム。
〔9'〕前記神経障害が改善され、前記神経障害の改善が運動失調又は不全麻痺の改善を含む、前記〔7'〕に記載のシステム。
〔10'〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに局所的な薬理学的作用又は脳全体に拡散薬理学的作用を示す、前記〔1'〕に記載のシステム。
〔11'〕前記微小粒子配合物が、更に、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含む、前記〔1'〕に記載のシステム。
〔12'〕前記微粒子配合物が、微粒子の液体懸濁液を含む、前記〔1'〕に記載のシステム。
〔13'〕脳室が、側脳室、第三脳室、第四脳室、又はこれらの組み合わせである、前記〔3'〕に記載のシステム。
〔14'〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、徐放性化合物を含み、前記徐放性化合物がポリマーである、前記〔1'〕に記載のシステム。
〔15'〕電位開口型カルシウムチャネル遮断薬が、徐放性ポリマー上に又は徐放性ポリマー中に配置されている、前記〔14'〕に記載のシステム。
〔16'〕徐放性化合物が、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、前記〔14'〕に記載のシステム。
〔17'〕電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔1'〕に記載のシステム。
〔18'〕電位開口型カルシウムチャネル遮断薬が、ニモジピンである、前記〔17'〕に記載のシステム。
〔19'〕前記医薬的に許容され得る担体が、ゲル化合物を含む、前記〔1'〕に記載のシステム。
〔20'〕前記医薬的に許容され得る担体が、ヒアルロン酸を含む、前記〔1'〕に記載のシステム。
〔21'〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、前記〔1'〕に記載のシステム。
〔22'〕前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、前記〔1'〕に記載のシステム。
〔23'〕脳損傷に伴う遅発性合併症の治療を必要としている哺乳類において脳損傷に伴う遅発性合併症を治療するための医薬の製造のための、電位開口型カルシウムチャネル遮断薬と医薬的に許容され得る担体とを含む、徐放性の流動性微小粒子医薬組成物の使用であって、脳損傷がクモ膜下腔の少なくとも1つの大脳動脈の妨害を含み、前記少なくとも1つの遅発性合併症が、遅発性脳虚血(DCI)、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、及び血管造影血管攣縮のうちの少なくとも1つである、前記使用。
〔24'〕前記脳損傷が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔23'〕に記載の使用。
〔25'〕脳損傷に伴う前記少なくとも1つの遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔23'〕に記載の使用。
〔26'〕前記医薬組成物が、脳損傷に伴う前記少なくとも1つの遅発性合併症を治療するのに局所的な薬理学的作用又は脳全体に拡散薬理学的作用を示す、前記〔23'〕に記載の使用。
〔27'〕微小粒子配合物が、更に、電位開口型カルシウムチャネル遮断薬を含浸した複数の微粒子を含む、前記〔23'〕に記載の使用。
〔28'〕微小粒子配合物が、微粒子の液体懸濁液を含む、前記〔23'〕に記載の使用。
〔29'〕電位開口型カルシウムチャネル遮断薬の微小粒子配合物が、徐放性化合物を含み、前記徐放性化合物がポリマーである、前記〔23'〕に記載の使用。
〔30'〕電位開口型カルシウムチャネル遮断薬が、徐放性ポリマー上に又は徐放性ポリマー中に配置されている、前記〔29'〕に記載の使用。
〔31'〕徐放性化合物が、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、前記〔23'〕に記載の使用。
〔32'〕電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔23'〕に記載の使用。
〔33'〕電位開口型カルシウムチャネル遮断薬が、ニモジピンである、前記〔32'〕に記載の使用。
〔34'〕前記医薬的に許容され得る担体が、ゲル化合物を含む、前記〔23'〕に記載の使用。
〔35'〕前記医薬的に許容され得る担体が、ヒアルロン酸を含む、前記〔23'〕に記載の使用。
〔36'〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、前記〔35'〕に記載の使用。
〔37'〕前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、前記〔35'〕に記載の使用。
〔38'〕電位開口型カルシウムチャネル遮断薬が、コーティングによって囲まれた微小粒子のコア内にあるか、粒子の全体にわたって分散されているか、粒子に吸着されているか、又はこれらの組合せである、前記〔23'〕に記載の使用。
〔39'〕微小粒子配合物が、脳室から流れる脳脊髄液によって運ばれて、クモ膜下腔における脳損傷によって影響を受けた大脳動脈に接触する、前記〔23'〕に記載の使用。
本発明のまた別の態様は、以下のとおりであってもよい。
〔1''〕血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するための、遅延放出速度論の半固体多粒子送達システムであって、前記遅発性合併症が、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、血管造影血管攣縮又はこれらの組合せに起因する遅発性脳虚血(DCI)を含み、前記システムが、
(a)以下を含む流動性医薬組成物:
(i)治療的な量の電位開口型カルシウムチャネル遮断薬と、ポリマーとを含む微粒子の懸濁液; 及び
(ii)前記組成物に粘着性を与える医薬的に許容され得る担体
であって、
(1)25μm〜100μmの一様分布の微粒子サイズ;及び
(2)長時間にわたっての該組成物からの前記電位開口型カルシウムチャネル遮断薬の漸進的放出であり、送達後生体内において1日〜30日で該組成物から前記電位開口型カルシウムチャネル遮断薬の半分が放出されること
により特徴付けられる前記医薬組成物、並びに
(b)前記流動性医薬組成物を前記クモ膜下腔に局所送達するための外科的注入装置
を含み、
前記流動性医薬組成物の局所送達が、前記血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するのに効果的である、
前記システム。
〔2''〕投与部位が、脳室又は脳のクモ膜下槽である、前記〔1''〕に記載のシステム。
〔3''〕前記外科的注入装置が、針、カニューレ、カテーテル、又はこれらの組み合わせである、前記〔1''〕に記載のシステム。
〔4''〕前記組成物が、対照と比較して、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈の内径を増大させるのに効果的である、前記〔1''〕に記載のシステム。
〔5''〕前記血液を脳のクモ膜下腔に沈積させる状態が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔1''〕に記載のシステム。
〔6''〕前記遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔1''〕に記載のシステム。
〔7''〕前記組成物が、前記行動に関する欠陥を改善するのに効果的であり、前記行動に関する欠陥の改善が食欲増進を含む、前記〔6''〕に記載のシステム。
〔8''〕前記組成物が、前記神経障害を改善するのに効果的であり、前記神経障害の改善が運動失調又は不全麻痺の改善を含む、前記〔6''〕に記載のシステム。
〔9''〕前記微粒子の懸濁液が、微粒子の液体懸濁液を含む、前記〔1''〕に記載のシステム。
〔10''〕前記脳室が、側脳室、第三脳室、第四脳室、又はこれらの組み合わせである、前記〔2''〕に記載のシステム。
〔11''〕前記ポリマーが徐放性ポリマーである、前記〔1''〕に記載のシステム。
〔12''〕前記電位開口型カルシウムチャネル遮断薬が、前記徐放性ポリマー中に配置されている、前記〔11''〕に記載のシステム。
〔13''〕前記徐放性ポリマーが、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、前記〔11''〕に記載のシステム。
〔14''〕前記電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔1''〕に記載のシステム。
〔15''〕前記L型電位開口型カルシウムチャネル遮断薬が、ジヒドロピリジンL型遮断薬である、前記〔14''〕に記載のシステム。
〔16''〕前記医薬的に許容され得る担体が、ゲル化合物を含む、前記〔1''〕に記載のシステム。
〔17''〕前記医薬的に許容され得る担体が、ヒアルロン酸を含む、前記〔1''〕に記載のシステム。
〔18''〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、前記〔1''〕に記載のシステム。
〔19''〕前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、前記〔1''〕に記載のシステム。
〔20''〕血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するための医薬の製造における流動性医薬組成物の使用であって、前記遅発性合併症が、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、血管造影血管攣縮又はこれらの組合せに起因する遅発性脳虚血(DCI)を含み、前記医薬が、
(a)以下を含む前記流動性医薬組成物:
(i)治療的な量の電位開口型カルシウムチャネル遮断薬と、ポリマーとを含む微粒子の懸濁液; 及び
(ii)前記組成物に粘着性を与える医薬的に許容され得る担体
であって、
(1)25μm〜100μmの一様分布の微粒子サイズ;及び
(2)長時間にわたっての該組成物からの前記電位開口型カルシウムチャネル遮断薬の漸進的放出であり、送達後生体内において1日〜30日で該組成物から前記電位開口型カルシウムチャネル遮断薬の半分が放出されること
により特徴付けられる前記医薬組成物、並びに
(b)前記流動性医薬組成物を前記クモ膜下腔に局所送達するための外科的注入装置
を含み、
前記流動性医薬組成物の局所送達が、前記血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するのに効果的である、前記使用。
〔21''〕前記血液を脳のクモ膜下腔に沈積させる状態が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、前記〔20''〕に記載の使用。
〔22''〕前記遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、前記〔20''〕に記載の使用。
〔23''〕前記微粒子の懸濁液が、微粒子の液体懸濁液を含む、前記〔20''〕に記載の使用。
〔24''〕前記ポリマーが、徐放性ポリマーである、前記〔20''〕に記載の使用。
〔25''〕前記電位開口型カルシウムチャネル遮断薬が、前記徐放性ポリマー中に配置されている、前記〔24''〕に記載の使用。
〔26''〕前記徐放性ポリマーが、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、前記〔24''〕に記載の使用。
〔27''〕前記電位開口型カルシウムチャネル遮断薬が、L型電位開口型カルシウムチャネル遮断薬、N型電位開口型カルシウムチャネル遮断薬、P/Q型電位開口型カルシウムチャネル遮断薬、又はこれらの組み合わせからなる群より選ばれる、前記〔20''〕に記載の使用。
〔28''〕前記L型電位開口型カルシウムチャネル遮断薬が、ジヒドロピリジンL型遮断薬である、前記〔27''〕に記載の使用。
〔29''〕前記医薬的に許容され得る担体が、ゲル化合物を含む、前記〔20''〕に記載の使用。
〔30''〕前記医薬的に許容され得る担体が、ヒアルロン酸を含む、前記〔20''〕に記載の使用。
〔31''〕前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、前記〔30''〕に記載の使用。
〔32''〕前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、前記〔30''〕に記載の使用。
〔33''〕前記微粒子懸濁液が、脳室から流れる脳脊髄液によって運ばれて、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈に接触する、前記〔20''〕に記載の使用。
〔34''〕前記L型電位開口型カルシウムチャネル遮断薬が、ニモジピンである、前記〔15''〕に記載のシステム。
〔35''〕前記ゲル化合物が、生分解性ヒドロゲルである、前記〔16''〕に記載のシステム。
〔36''〕投与部位が、脳室又は脳のクモ膜下槽である、前記〔20''〕に記載の使用。
〔37''〕前記外科的注入装置が、針、カニューレ、カテーテル、又はこれらの組み合わせである、前記〔20''〕に記載の使用。
〔38''〕前記組成物が、対照と比較して、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈の内径を増大させるのに効果的である、前記〔20''〕に記載の使用。
〔39''〕前記L型電位開口型カルシウムチャネル遮断薬が、ニモジピンである、前記〔28''〕に記載の使用。
〔40''〕前記ゲル化合物が、生分解性ヒドロゲルである、前記〔29''〕に記載の使用。
〔41''〕最初の薬剤負荷が、65%ニモジピン及び35%ポリマーである、前記〔34''〕に記載のシステム。
〔42''〕最初の薬剤負荷が、65%ニモジピン及び35%ポリマーである、前記〔39''〕に記載の使用。
Claims (26)
- 血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するための、遅延放出速度論の半固体多粒子送達システムであって、前記遅発性合併症が、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、血管造影血管攣縮又はこれらの組合せに起因する遅発性脳虚血(DCI)を含み、前記システムが、
(a)以下を含む流動性医薬組成物:
(i)治療的な量のニモジピンと、ポリマーとを含む微粒子の懸濁液であって、最初の薬剤負荷が65%ニモジピン及び35%ポリマーである、前記懸濁液; 及び
(ii)ヒアルロン酸を含む、医薬的に許容され得る担体
であって、
(1)25μm〜100μmの一様分布の微粒子サイズであって、平均粒子径が52μm;及び
(2)長時間にわたっての該組成物からの前記ニモジピンの漸進的放出であり、送達後生体内において1日〜30日で該組成物から前記ニモジピンの半分が放出されること
により特徴付けられる前記医薬組成物、並びに
(b)前記流動性医薬組成物を前記クモ膜下腔に局所送達するための手段
を含み、
前記流動性医薬組成物の局所送達が、前記血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療し、かつ予後を改善するのに効果的である、
前記システム。 - 投与部位が、脳室又は脳のクモ膜下槽である、請求項1に記載のシステム。
- 前記組成物が、対照と比較して、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈の内径を増大させるのに効果的である、請求項1又は2に記載のシステム。
- 前記血液を脳のクモ膜下腔に沈積させる状態が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、請求項1〜3のいずれか1項に記載のシステム。
- 前記遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、請求項1〜4のいずれか1項に記載のシステム。
- 前記組成物が、前記行動に関する欠陥を改善するのに効果的であり、前記行動に関する欠陥の改善が食欲増進を含む、請求項5に記載のシステム。
- 前記組成物が、前記神経障害を改善するのに効果的であり、前記神経障害の改善が運動失調又は不全麻痺の改善を含む、請求項5に記載のシステム。
- 前記微粒子の懸濁液が、微粒子の液体懸濁液を含む、請求項1〜7のいずれか1項に記載のシステム。
- 前記脳室が、側脳室、第三脳室、第四脳室、又はこれらの組み合わせである、請求項2に記載のシステム。
- 前記ポリマーが徐放性ポリマーである、請求項1〜9のいずれか1項に記載のシステム。
- 前記ニモジピンが、前記徐放性ポリマー中に配置されている、請求項10に記載のシステム。
- 前記徐放性ポリマーが、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、請求項10又は11に記載のシステム。
- 前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、請求項1〜12のいずれか1項に記載のシステム。
- 前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、請求項1〜12のいずれか1項に記載のシステム。
- 血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療するための医薬の製造における流動性医薬組成物の使用であって、前記遅発性合併症が、複数の微小血栓塞栓、皮質拡延性虚血(CSI)、血管造影血管攣縮又はこれらの組合せに起因する遅発性脳虚血(DCI)を含み、前記医薬が、
(a)以下を含む前記流動性医薬組成物:
(i)治療的な量のニモジピンと、ポリマーとを含む微粒子の懸濁液であって、最初の薬剤負荷が65%ニモジピン及び35%ポリマーである、前記懸濁液; 及び
(ii)ヒアルロン酸を含む、医薬的に許容され得る担体
であって、
(1)25μm〜100μmの一様分布の微粒子サイズであって、平均粒子径が52μm;及び
(2)長時間にわたっての該組成物からの前記ニモジピンの漸進的放出であり、送達後生体内において1日〜30日で該組成物から前記ニモジピンの半分が放出されること
により特徴付けられる前記医薬組成物、並びに
(b)前記流動性医薬組成物を前記クモ膜下腔に局所送達すること
を含み、
前記流動性医薬組成物の局所送達が、前記血液を脳のクモ膜下腔に沈積させる状態の遅発性合併症を治療し、かつ予後を改善するのに効果的である、前記使用。 - 前記血液を脳のクモ膜下腔に沈積させる状態が、動脈瘤、突然の外傷性頭部損傷、クモ膜下出血(SAH)、又はこれらの組み合わせの結果である、請求項15に記載の使用。
- 前記遅発性合併症が、更に、脳内血腫、脳室内出血、熱、行動に関する欠陥、神経障害、脳梗塞、及びニューロン細胞死のうちの少なくとも1つを含む、請求項15又は16に記載の使用。
- 前記微粒子の懸濁液が、微粒子の液体懸濁液を含む、請求項15〜17のいずれか1項に記載の使用。
- 前記ポリマーが、徐放性ポリマーである、請求項15〜18のいずれか1項に記載の使用。
- 前記ニモジピンが、前記徐放性ポリマー中に配置されている、請求項19に記載の使用。
- 前記徐放性ポリマーが、ポリ(D,L-ラクチド-コ-グリコリド)、ポリ(オルトエステル)又はポリ無水物を含む、請求項19又は20に記載の使用。
- 前記医薬的に許容され得る担体が、2.3%未満のヒアルロン酸を含む、請求項15〜21のいずれか1項に記載の使用。
- 前記医薬的に許容され得る担体が、5%未満のヒアルロン酸を含む、請求項15〜21のいずれか1項に記載の使用。
- 前記微粒子懸濁液が、脳室から流れる脳脊髄液によって運ばれて、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈に接触する、請求項15〜23のいずれか1項に記載の使用。
- 投与部位が、脳室又は脳のクモ膜下槽である、請求項15〜24のいずれか1項に記載の使用。
- 前記組成物が、対照と比較して、前記血液を脳のクモ膜下腔に沈積させる状態によって影響を受けた大脳動脈の内径を増大させるのに効果的である、請求項15〜25のいずれか1項に記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161441695P | 2011-02-11 | 2011-02-11 | |
| US61/441,695 | 2011-02-11 | ||
| PCT/US2012/024893 WO2012109664A1 (en) | 2011-02-11 | 2012-02-13 | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014509318A JP2014509318A (ja) | 2014-04-17 |
| JP2014509318A5 JP2014509318A5 (ja) | 2015-01-22 |
| JP6146814B2 true JP6146814B2 (ja) | 2017-06-14 |
Family
ID=46638990
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013553640A Expired - Fee Related JP6146814B2 (ja) | 2011-02-11 | 2012-02-13 | クモ膜下出血のヒトの予後を改善する組成物及び方法 |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US20120164226A1 (ja) |
| EP (2) | EP2672983B1 (ja) |
| JP (1) | JP6146814B2 (ja) |
| KR (1) | KR20140063513A (ja) |
| CN (3) | CN105997890A (ja) |
| AU (1) | AU2012214137B2 (ja) |
| BR (1) | BR112013020512A2 (ja) |
| DK (1) | DK2672983T3 (ja) |
| ES (1) | ES2646720T3 (ja) |
| GB (1) | GB2501664B (ja) |
| HU (1) | HUE035226T2 (ja) |
| IL (1) | IL227861B (ja) |
| PL (1) | PL2672983T3 (ja) |
| PT (1) | PT2672983T (ja) |
| RU (1) | RU2597791C2 (ja) |
| SG (1) | SG192662A1 (ja) |
| WO (1) | WO2012109664A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10092524B2 (en) * | 2008-06-11 | 2018-10-09 | Edge Therapeutics, Inc. | Compositions and their use to treat complications of aneurysmal subarachnoid hemorrhage |
| US9399019B2 (en) | 2012-05-09 | 2016-07-26 | Evonik Corporation | Polymorph compositions, methods of making, and uses thereof |
| CA2973151C (en) | 2017-06-29 | 2023-12-19 | Daniel B. Dix | Devices and methods for overfilling drug containers |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4757128A (en) | 1986-08-01 | 1988-07-12 | Massachusetts Institute Of Technology | High molecular weight polyanhydride and preparation thereof |
| AU5741590A (en) | 1989-05-04 | 1990-11-29 | Southern Research Institute | Improved encapsulation process and products therefrom |
| IT1243390B (it) * | 1990-11-22 | 1994-06-10 | Vectorpharma Int | Composizioni farmaceutiche in forma di particelle atte al rilascio controllato di sostanze farmacologicamente attive e procedimento per la loro preparazione. |
| US5399665A (en) | 1992-11-05 | 1995-03-21 | Massachusetts Institute Of Technology | Biodegradable polymers for cell transplantation |
| US5747058A (en) | 1995-06-07 | 1998-05-05 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system |
| US5968542A (en) | 1995-06-07 | 1999-10-19 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system as a device |
| JP2909418B2 (ja) * | 1995-09-18 | 1999-06-23 | 株式会社資生堂 | 薬物の遅延放出型マイクロスフイア |
| JP3737518B2 (ja) | 1996-03-12 | 2006-01-18 | ピージー−ティーエックスエル カンパニー, エル.ピー. | 水溶性パクリタキセルプロドラッグ |
| US6123956A (en) * | 1997-07-10 | 2000-09-26 | Keith Baker | Methods for universally distributing therapeutic agents to the brain |
| US20050214227A1 (en) * | 1999-03-08 | 2005-09-29 | Powderject Research Limited | Microparticle formulations for sustained-release of bioactive compounds |
| US20040235801A1 (en) * | 2001-10-25 | 2004-11-25 | Jean-Pierre Julien | Therapy for stroke |
| DE60334924D1 (de) * | 2002-09-11 | 2010-12-23 | Elan Pharma Int Ltd | Anoteilchengrösse |
| US7923032B2 (en) * | 2002-11-26 | 2011-04-12 | Seacoast Neuroscience, Inc. | Buoyant polymer particles for delivery of therapeutic agents to the central nervous system |
| WO2005020933A2 (en) * | 2003-09-02 | 2005-03-10 | University Of South Florida | Nanoparticles for drug-delivery |
| US20080124400A1 (en) * | 2004-06-24 | 2008-05-29 | Angiotech International Ag | Microparticles With High Loadings Of A Bioactive Agent |
| US20070203079A1 (en) * | 2005-11-21 | 2007-08-30 | Caldwell Guy A | Methods of using small molecule compounds for neuroprotection |
| NZ599430A (en) * | 2007-06-11 | 2014-03-28 | Loch Macdonald R | A drug delivery system for the prevention of cerebral vasospasm |
| US20100008968A1 (en) * | 2008-06-26 | 2010-01-14 | Lampe John W | Method for treating cardiovascular diseases using rho kinase inhibitor compounds |
-
2012
- 2012-02-13 AU AU2012214137A patent/AU2012214137B2/en not_active Ceased
- 2012-02-13 DK DK12744708.4T patent/DK2672983T3/en active
- 2012-02-13 US US13/372,264 patent/US20120164226A1/en not_active Abandoned
- 2012-02-13 GB GB1315577.5A patent/GB2501664B/en not_active Expired - Fee Related
- 2012-02-13 CN CN201610320098.8A patent/CN105997890A/zh active Pending
- 2012-02-13 KR KR1020137023962A patent/KR20140063513A/ko not_active Application Discontinuation
- 2012-02-13 HU HUE12744708A patent/HUE035226T2/hu unknown
- 2012-02-13 PL PL12744708T patent/PL2672983T3/pl unknown
- 2012-02-13 EP EP12744708.4A patent/EP2672983B1/en not_active Not-in-force
- 2012-02-13 WO PCT/US2012/024893 patent/WO2012109664A1/en active Application Filing
- 2012-02-13 JP JP2013553640A patent/JP6146814B2/ja not_active Expired - Fee Related
- 2012-02-13 RU RU2013141558/15A patent/RU2597791C2/ru not_active IP Right Cessation
- 2012-02-13 CN CN201280013759.2A patent/CN103582489A/zh active Pending
- 2012-02-13 EP EP17166614.2A patent/EP3222284A1/en not_active Withdrawn
- 2012-02-13 BR BR112013020512A patent/BR112013020512A2/pt not_active IP Right Cessation
- 2012-02-13 CN CN201710373877.9A patent/CN107115270A/zh active Pending
- 2012-02-13 SG SG2013060058A patent/SG192662A1/en unknown
- 2012-02-13 PT PT127447084T patent/PT2672983T/pt unknown
- 2012-02-13 ES ES12744708.4T patent/ES2646720T3/es active Active
-
2013
- 2013-08-08 IL IL227861A patent/IL227861B/en not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| AU2012214137B2 (en) | 2016-10-06 |
| JP2014509318A (ja) | 2014-04-17 |
| RU2597791C2 (ru) | 2016-09-20 |
| EP2672983B1 (en) | 2017-04-19 |
| KR20140063513A (ko) | 2014-05-27 |
| WO2012109664A1 (en) | 2012-08-16 |
| HUE035226T2 (hu) | 2018-05-02 |
| EP2672983A4 (en) | 2015-06-24 |
| DK2672983T3 (en) | 2017-08-07 |
| BR112013020512A2 (pt) | 2016-09-06 |
| IL227861A0 (en) | 2013-09-30 |
| NZ613970A (en) | 2015-08-28 |
| GB2501664B (en) | 2017-09-27 |
| CN107115270A (zh) | 2017-09-01 |
| EP3222284A1 (en) | 2017-09-27 |
| RU2013141558A (ru) | 2015-03-20 |
| CN103582489A (zh) | 2014-02-12 |
| GB201315577D0 (en) | 2013-10-16 |
| PL2672983T3 (pl) | 2017-10-31 |
| US20120164226A1 (en) | 2012-06-28 |
| ES2646720T3 (es) | 2017-12-15 |
| AU2012214137A1 (en) | 2013-09-26 |
| CN105997890A (zh) | 2016-10-12 |
| SG192662A1 (en) | 2013-09-30 |
| IL227861B (en) | 2018-10-31 |
| EP2672983A1 (en) | 2013-12-18 |
| PT2672983T (pt) | 2017-07-25 |
| GB2501664A (en) | 2013-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6336899B2 (ja) | 脳血流に影響する脳損傷後の結果を改善するための脳室内ドラッグデリバリーシステム | |
| JP5576790B2 (ja) | 脳血管れん縮の予防用薬物送達システム | |
| JP6146814B2 (ja) | クモ膜下出血のヒトの予後を改善する組成物及び方法 | |
| AU2016201681B2 (en) | A drug delivery system for the prevention of cerebral vasospasm | |
| CA2826890A1 (en) | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage | |
| AU2013203192B2 (en) | A drug delivery system for the prevention of cerebral vasospasm | |
| NZ613970B2 (en) | Compositions and methods for improving prognosis of a human with subarachnoid hemorrhage |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20141125 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20141125 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150930 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20151228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160331 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160810 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161108 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170110 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170419 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170511 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6146814 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |