KR20140060263A - 비드-기반 면역분석 내에서 사용하기 위한 미소유체 디스크 - Google Patents
비드-기반 면역분석 내에서 사용하기 위한 미소유체 디스크 Download PDFInfo
- Publication number
- KR20140060263A KR20140060263A KR1020137033623A KR20137033623A KR20140060263A KR 20140060263 A KR20140060263 A KR 20140060263A KR 1020137033623 A KR1020137033623 A KR 1020137033623A KR 20137033623 A KR20137033623 A KR 20137033623A KR 20140060263 A KR20140060263 A KR 20140060263A
- Authority
- KR
- South Korea
- Prior art keywords
- channel
- flow
- beads
- particle
- reservoir
- Prior art date
Links
- AVFZOVWCLRSYKC-UHFFFAOYSA-N CN1CCCC1 Chemical compound CN1CCCC1 AVFZOVWCLRSYKC-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5302—Apparatus specially adapted for immunological test procedures
- G01N33/5304—Reaction vessels, e.g. agglutination plates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502753—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by bulk separation arrangements on lab-on-a-chip devices, e.g. for filtration or centrifugation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0636—Focussing flows, e.g. to laminate flows
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
- B01L2200/0652—Sorting or classification of particles or molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0684—Venting, avoiding backpressure, avoid gas bubbles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0803—Disc shape
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0409—Moving fluids with specific forces or mechanical means specific forces centrifugal forces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/043—Moving fluids with specific forces or mechanical means specific forces magnetic forces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0677—Valves, specific forms thereof phase change valves; Meltable, freezing, dissolvable plugs; Destructible barriers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0688—Valves, specific forms thereof surface tension valves, capillary stop, capillary break
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/08—Regulating or influencing the flow resistance
- B01L2400/084—Passive control of flow resistance
- B01L2400/086—Passive control of flow resistance using baffles or other fixed flow obstructions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/08—Regulating or influencing the flow resistance
- B01L2400/084—Passive control of flow resistance
- B01L2400/088—Passive control of flow resistance by specific surface properties
Abstract
본 발명은 회전모터; 상기 모터를 제어하기 위한 수단; 상기 회전모터에 결합되고 그리고 적어도 하나의 입자-세척 구조 및 상기 입자 세척 구조 내에서 세척된 입자들을 수령하도록 적용된 입자 수령 구조를 제공하도록 적용된 플랫폼; 및 상기 플랫폼이 회전하는 동안 상기 입자 수령 구조 내의 세척된 입자들의 검출을 위한 검출영역;을 포함하는 생물학적 샘플들을 처리하기 위한 미소유체 시스템에 관한 것이다. 본 발명은 자동화되고 그리고 수작업 처리에 비해 오류들이 적은 경향이 있는 샘플 처리 시스템을 제공한다. 이는 고-품질의 비드-기반 면역형광 분석을 수행하기 위하여 조생물학적 샘플(예를 들면, 혈액, 객담, 오줌)들을 처리할 수 있는 원심 미소유체 플랫폼을 사용하여 수행된다. 본 발명은 앞서 개요된 샘플 제조를 수행하기 위하여 단순 회전모터 및 주문-설계된 플라스틱 디스크를 사용한다.
Description
본 발명은 면역분석 진단 또는 휴대용 진단 분석기(portable diagnostic analyser)에서 사용하기 위한 미소유체 디스크, 장치, 시스템 및 방법에 관한 것이다.
유동 세포 분석(Flow cytometry)은 여러 형태들의 샘플들, 특히 살아 있는 세포들을 포함하는 샘플들의 세포/생물학적 내용물을 결정하기 위한 강력한 분석법이다. 임상 응용들에 있어서, 유동 세포 분석기(flow cytometers)들은 백혈병(leukaemias) 및 림프종(lymphomas)의 면역학적 특정(immunological characterization), 백혈구(leukocyte) 계수 및 분류 그리고 비드-기반 면역분석 진단을 위한 림프구(lymphocyte) 계수(counting) 및 분류(classification)를 포함하여 수많은 응용들에 유용하다.
대부분의 유동 세포 분석 기술들에 있어서, 유체 용액(fluid solution) 내의 세포들은 대개는 레이저광원(laser light source) 또는 단색광으로 필터링된 발광다이오드원(monochromatically filtered LED source)에 의하여 생성된 광 빔(light beam)을 통하여 개별적으로 유동하게 된다. 광이 각 세포를 타격함에 따라, 상기 광은 산란되고 그리고 그 결과의 산란된 광이 분석되어 세포의 형태를 결정한다. 상기 세포는 또한 선택적으로 형광분자(fluorescent molecule)에 결합된 표지자(marker)로 표지될 수 있으며, 광이 형광분자를 타격하는 경우 형광을 발하고 그리고 그에 의하여 상기 세포 상의 상기 표지자의 존재를 나타낸다. 이러한 방식으로, 상기 세포의 표면 성분(surface components)들에 대한 정보가 수득될 수 있다.
형광비드(Fluorescent beads)들은 멀티플렉스화된 면역분석(multiplexed immunoassays)들을 수행하기 위한 편리하고도 강력한 방법을 제공한다. 예를 들면, 다른 별개의 색상으로 균일하게 염색되는 분석물질(analytes)들에 결합되는 서로 다른 색상(산란되거나 또는 형광 발광 둘 중의 하나)들의 비드들을 사용하는 것에 의하여 멀티플렉스화(multiplexing)가 달성될 수 있다. 이러한 방식으로, 분석 동정(assay identity)이 상기 비드 색상/형광으로부터 판독될 수 있는 한편으로 그 분석결과(analytic result)는 상기 비드에 결합된 형광염료(fluorescent dye)의 양으로부터 판독될 수 있다. 비드들은 또한 면역분석의 고체상(solid phases)들이 대량으로 생산될 수 있도록 하여 분석의 항내성(robustness)을 증가시키는 포맷(format)을 제공한다. 전형적으로 유동 세포 분석기들은 입자들로부터의 형광을 검출하고 그리고 정량하는 능력 덕분으로 멀티플렉스화된, 비드-기반의 면역분석에 사용된다.
현재 시행되는 면역형광 비드 분석(immunofluorescent bead assays)에 대한 하나의 분명한 문제는 이들이 과도한 수작업 또는 자동 샘플 처리(manual or robotic sample processing)를 요구한다는 것이다. 샌드위치-형 면역분석(sandwich-type immunoassay)에 대하여, 이러한 샘플 처리는 하기의 단계들 중의 일부 또는 전부로 이루어질 수 있다:
ㆍ 전혈(whole blood)로부터의 혈장(plasma)의 분리
ㆍ 출발 샘플의 공지의 용적을 제공하기 위한 혈장의 계량(metering)
ㆍ 혈장의 희석
ㆍ 분석물질의 결합을 촉진하기 위한 희석 샘플과 면역형광 비드의 혼합
ㆍ 결합에 적절한 온도에서의 충분한 시간 동안의 배양
ㆍ 비드의 세척
ㆍ 결합을 촉진하기 위한 세척된 비드들과 표지된 2차 항체(secondary antibody)의 혼합
ㆍ 결합에 적절한 온도에서의 충분한 시간 동안의 배양
ㆍ 미결합된 2차 항체의 세척
ㆍ 유동 세포 분석 유동채널(flow channel) 내로의 비드들의 주입
많은 응용들에서 수작업 처리는 비용-과도적(cost-prohibitive)이고 그리고 또한 오류를 유발하는 경향이 있다. 많은 응용들에서 자동화는 또한 비용-과도적이고 그리고, 예를 들면, 현장진단(point-of-care) 또는 의원 분석(doctor's office analysis) 등과 같은 응용들을 위하여 액체 취급 로봇(liquid handling robots)을 사용하는 것은 현재 관행으로서는 부적절하다. 결과적으로, 현재의 자동화 또는 수동 처리 보다 저렴하고 오류가 적은 경향이 있는 멀티플렉스화된, 비드-기반 면역분석을 위한 샘플 처리를 제공할 충족되지 않은 요구가 존재하고 있다.
현장진단 진단분석 시스템들의 단점은 이들이 전형적으로 다양한 분석 형태들의 멀티플렉스화가 불가능하다는 것이다. 비록 이들 시스템들이 - 측방 유동 분석(lateral flow assays)들 또는 전기화학적 분석(electrochemical assays) 등과 같은 - 다양한 유사한 분석 형태들을 수행하는 데에는 상당히 양호한 반면, 면역분석 대 비색적 혈액 분석(immunoassay vs. colorimetric blood chemistry) 등과 같은 다른 종류들의 분석들이 요구되는 분석 조건들은 이들을 이들 서로 다른 분석 형태들을 멀티플렉스화하기에 부적절하게 만든다. 또한, 집중화된 실험실들(centralized laboratories)은 샘플들을 분할(splitting)하고 그리고 서로 다른 장치들에서 분석을 수행하는 것에 의하여 이러한 통합(integraion)을 달성할 수 있다. 광학 검출(optical detection)을 구비하는 원심분리 미소유체 플랫폼(centrifugal microfluidic platform)은 단일의 기구(instrument)를 사용하고 폐기할 수 있는 다양한 분석 기술들을 병렬로 수행하는 것을 허용한다.
현재 실행되는 면역형광 비드 분석들의 다른 명백한 문제는 이들이 혈액학적 유동 세포분석(hematologic flow cytometry)을 위하여 개발된 장비들 상에서 수행된다는 것이다. 이들 장비들이 이들 분석들을 수행할 수 있기는 하나, 이들은 고가이고 그리고 복잡하며 상당한 유지보수(maintenance) 및 교정(calibration)을 필요로 한다는 것이다. 결과적으로, 이러한 분석들을 수행하기 위한 저가이고 그리고 낮은 유지보수 장비에 대한 요구가 존재하고 있다.
더욱이, 면역형광 비드 분석들은 전형적으로 쉬스 유동(sheath flow)을 사용하여 구현되며, 여기에서 비드들이 비드 유체 스트림(bead liquid stream) 주위의 완충제(buffer)의 유동(flow)을 집중시키는 것에 의하여 희석되고 그리고 정렬된다. 이는 입자들이 상기 기기의 검출영역(detection volume) 내에 동시적으로 존재하지 않도록 하고 그리고 입자들을 대략적으로 광학시스템(optical system) 내의 동일한 위치 내에 위치되도록 하는 이중 효과(dual effect)를 갖는다. 이는 혈액학적 분석들에서 매우 유용한 반면에, 형광 비드 등과 같은 다수의 필수적으로 동일한 대상들의 검출에 대하여는 어떠한 잇점도 부여하지 않으며, 상기 시스템의 기능을 크게 복잡하게 한다. 상기 비드 샘플이 예를 들여 이들의 형광표지들의 발광 스펙트럼(emission spectrum)으로 구분된 2 또는 그 이상의 잘-정의된 개체군들(well-defined populations)로 이루어지는 경우 유사한 서술들이 유지된다.
쉬스 유동이 요구되는 경우들 - 극히 고도로 멀티플렉스화된 면역분석들, 또는 면역분석 시스템과 동일한 시스템 상에서 구동되는 혈액학적 분석들 - 에서 원심분리 포맷(centrifugal format)이 통상의 펌프-기반 시스템(pump-based systems)에 비해 명백한 잇점을 제공한다. 후자의 경우, 전형적으로 샘플 및 쉬스 유체 흐름(sheath fluid flow)에 대하여 다중 펌프(multiple pumps)들이 사용되며, 상기 펌프들의 맥동(pulsatility)을 최소화하여 정의된 완만한 흐름(smooth flow) 및 샘플과 쉬스 유동 사이의 비율을 유지하도록 하기 위해서는 매우 큰 주의가 요구된다. 원심력으로 인한 펌핑(pumping)은 무맥동(pulseless)이기 때문에, 이러한 변동들은 시스템 내에 고유적으로 존재하지 않는다.
비드-기반 면역분석(Bead-Based Immunoassays)들을 수행하기 위한 다수의 방법들 및 장치들이 존재하고 있다.
앤더슨과 그의 동료들(Anderson et al)의 미합중국 공개특허공보 제US2004/096867호는 "통과 세척되는(washed through)" 포획된 비드(trapped beads)들을 구비하는 시스템을 기술하고 있으며, 이러한 미합중국 공개특허에 대한 하나의 약점은 이것이 하나의 지점에서 다른 하나로 비드들을 이동시키는 수단을 제공하지 못하여 단일 비드 검출을 불가능하게 만든다는 것이다. 다른 약점은 고체상을 형성하는 포획된 비드들을 구비하는 시스템들이 부담이 큰 제조 기술들을 요구한다는 것이다. 예를 들면, 분석물질 분자들과 형광 표지들의 고도로 재현가능한 결합을 제공하기 위해서는, 비드들의 충진된(packed) '베드(bed)'가 재현가능하게 구조화되어야 하고; 상기 비드들의 낮은 충진(poor packing)은 상기 비드 베드(bead bed) 내에 결합을 위한 충분한 시간 없이 빠르게 분석물질이 통과하여 낮은 결합 효율(binding efficiency)의 결과를 야기하는 채널들을 형성시킬 수 있다.
자이로스 페이턴트 에이비(Gyros Patent AB)의 국제공개특허공보 제WO2006/110098호는 마이크로채널 구조(microchannel structure)를 포함하는 원심력 기반 미소유체 장치를 기술하고 있으며, 여기에서는 상류 방향(upstream direction)에서는 검출미세공동(detection microcavity)으로의 유체의 전달(미세도관 전달)을 위하여 인입 미세도관(inlet microconduit)에 부착되고 그리고 상기 검출미세공동 내에서 또는 상기 검출미세공동의 상류에 위치하는 반응미세공동(reaction microcavity) 내에서 일어나는 반응의 결과를 검출하는 데 사용되는 검출미세공동이 존재한다. 이러한 응용은 일차적으로는 유체 "플러그" 유동("plug" flow)을 형성하고 그리고 거품이나 폐색 없이 유체들을 결합하기 위한 수단을 제공하는 방향으로 지향되며, 밸브들의 소수성 표면 처리를 필요로 한다. 이러한 구조들을 위한 피쳐 크기(feature sizes)들은 컴팩트 디스크 압축/사출 주조 기술(compact disc compression/injection moulding technology)에 대한 확장을 사용하여 실현되었으나, 이는 임상적으로 적절한(예를 들면 수십 내지 수백 마이크로리터(㎕)) 보다 큰 용적들을 수용할 수 있는 구조들을 생성하는 것은 불가능하다. 자이로스에 의해 생산된 디스크들은 0.5㎜ 이하(≤0.5㎜)의 심도(deep)의 피쳐들을 가지며 작거나 미소한 용적들에 대하여 작동하지 않는다.
가메라 바이오사이언스 코포레이션(Gamera Bioscience Corp)의 국제특허 제W09853311A2호에서는 미소유체 디스크 상에서의 경쟁적 면역분석의 수행을 위한 장치들이 기술되어 있다. 이들은 고정 고체상(stationary solid phase) - 예를 들면 디스크 상의 격실(chamber) 내에 건조된 항체들을 사용하여 수행된다. 더욱이, 결합에 특이적인 기질(substrate)에 의한 색상-형성(color-formation)을 통하여 검출된다.
디스크 재료들에의 항체의 직접적인 결합은 제조상의 난점들을 제공하며, 이들은 상기 항체를 대신에 비드 등과 같은 "이동" 고정상("mobile" solid phase)에 결합시키는 것에 의하여 회피될 수 있다. 디스크 구조들을 코팅하고 그리고 이들을 상당한 반응시간 동안 습윤상태(wet state)로 유지시킬 필요가 없다. 비드들은 또한 이들의 캡쳐 항체(capture antibodies)들과의 결합 동안의 반응속도(reaction kinetics)를 향상시키기 위한 격렬한 교반을 포함하여 최적의 조건들 하에서 다수의(hundreds of thousands) 일회용(disposables)을 생산하기에 충분하게 대량으로 처리될 수 있다.
비색 기질(colorimetric substrate)을 통한 검출이 매력적이며 여기에서 이는 색상의 축적을 야기하는 효소반응을 통한 신호의 증폭을 허용하나 그러나 단순 형광-결합 분석에 비하여 온도 변화들에 훨씬 더 민감하다. 이러한 온도-감응성(temperature-sensitivity)은 또한 효소-기반 시약(enzyme-based reagents)들의 장기간의 보관(유통기한)을 어렵게 만든다.
미합중국 특허 제US20040089616호에서 켈로그와 그의 동료들(Kellogg et al.)은 당화 헤모글로빈(glycated haemoglobin), 총 헤모글로빈 및 전혈 중의 당(glucose)의 평가를 위한 미소유체 디스크를 기술하고 있다. 상기 미소유체 디스크의 일부는 용해된(lysed), 희석 혈액의 흐름 경로(flow path) 내의 프릿(frits)들 사이에 보류되는 아가로스 비드(aragrose beads)들을 포함하는 친화성 매트릭스(affinity matrix)를 사용한다: 혈액이 흐름에 따라 당회 분획(glycated fraction)이 상기 비드들에 결합되고, 그리고 비-당화 분획(non-glycated fraction)이 큐벳(cuvette) 내에서 광도측정식으로(photometrically) 측정된다. 다른 큐벳 내의 총 헤모글로빈의 측정과 함께, 이는 당화 헤모글로빈 분획을 제공한다. 이러한 친화성법(affinity method)의 포맷팅(formatting)에는 여러 문제점들이 존재한다. 먼저, 상기 비드들의 보류(retention)는 a) 프릿 등과 같은 삽입된 성분들 또는 b) 상기 고체상 비드들을 보류시키는 1차원(비드의 채널에 대하여 과도하게 얕은 "둑(weirs)") 또는 2차원의 채널 협착(channel constrictions)들 중의 어느 하나를 요구한다. 각 경우에 있어서, 제조 요구조건들은 수 미크론(microns) 내지 수십 미크론 정도로 낮은 피쳐들의 생산을 위한 특화된 방법들을 요구한다는 것이 명백하다.
사출 성형 도구(injection moulding tools)의 가공(machining) 후의 사출 성형 등과 같은 보다 통상적인 방법을 사용하여 장치들을 제조하는 것이 바람직하다.
따라서, 본 발명의 목적은 앞서 언급된 문제들 중의 적어도 하나를 극복하는 면역분석 진단 장치, 시스템 및/또는 방법을 제공하는 것이다.
본 발명에 따르면, 첨부된 특허청구범위들에서 규정된 바와 같이,
회전모터;
상기 모터를 제어하기 위한 수단;
상기 회전모터에 결합되고 그리고 적어도 하나의 입자-세척 구조(particle-washing structure) 및 상기 입자 세척 구조 내에서 세척된 입자들을 수령하도록 적용된 입자 수령 구조(particle receiving structure)를 제공하도록 적용된 플랫폼(platform); 및
상기 플랫폼이 회전하는 동안 상기 입자 수령 구조 내의 세척된 입자들의 검출을 위한 검출영역;
을 포함하는 생물학적 샘플들을 처리하기 위한 미소유체 시스템이 제공된다.
본 발명은 쉬스 유동의 복잡성을 제거하는 면역분석에 적절한 무-쉬스 유동법(sheathless flow method)을 제공한다.
본 발명은 자동화되고 그리고 수작업 처리에 비해 오류들이 적은 경향이 있는 샘플 처리 시스템을 제공한다. 이는 또한 로봇 시스템(robotic systems)들에 비해 비용-효과적(cost-effective)이다. 이는 고-품질의 비드-기반 면역형광 분석을 수행하기 위하여 조생물학적 샘플(raw biological samples)(예를 들면, 혈액, 객담(sputum), 오줌(urine))들을 처리할 수 있는 원심 미소유체 플랫폼을 사용하여 수행된다. 본 발명은 단일 플랫폼 상의 신규한 입자 세척 구조 및 입자 수령 구조 조합을 사용하는 공정을 수행하기 위하여 단순 회전모터 및 주문-설계된(custom-designed) 플라스틱 디스크를 사용한다.
본 발명은 또한 회전을 수행하는 동안 상기 미소유체 디스크 상의 유동-채널(flow-channel) 내의 비드들의 검출을 위한 수단을 제공한다. 하나의 구체예에 있어서, 상기 비드들(또는 입자들)이 쉬스(sheaths), 자기(magnetism), 관성력(inertial forces) 또는 다른 집중 수단(focusing means)들에 의한 별도의 흐름 집중(additional flow focusing)의 사용 없이 상기 유동 채널 내로 주입된다. 이는 분석을 수행하는 데 요구되는 장치 구조(device architecture)를 극히 단순화시킨다.
하나의 구체예에 있어서 상기 입자들은 상기 생물학적 샘플의 특성들을 대표하는 면역-변성 비드(immuno-modified beads)들 및/또는 형광적으로 표지된 면역-변성 비드들이다.
하나의 구체예에 있어서, 상기 검출영역은 상기 플랫폼이 회전하는 동안 광학시스템에 협력하도록 적용된다.
하나의 구체예에 있어서 상기 입자 수령 구조는 펠릿화 챔버(pelleting chamber)를 포함한다. 하나의 구체예에 있어서 상기 펠릿화 챔버는 일측단부에서 상기 검출영역이 그의 최외점(outermost point)에서 한정되도록 하는 지점까지 테이퍼되어 있다.
하나의 구체예에 있어서 상기 테이퍼 진 단부(tapered end)는 일측단부에서 폐쇄되어 원심력 하에서 상기 채널 내에서 비드들이 침강되는 것을 허용하도록 하는 연장된 얇은 채널부(elongated thin channel portion)를 더 포함한다.
하나의 구체예에 있어서 상기 검출영역은 원심분리에 의한 펠릿화에 의하여 상기 입자들이 작은 영역 내로 압축되도록 형성된다.
하나의 구체예에 있어서 상기 입자들은 원심력의 영향 하에서 회전의 중심으로부터 원위의 벽에 대하여 비드들이 침강하도록 적용된 저장조(reservoir) 내에서 세척된다.
하나의 구체예에 있어서 상기 입자 수령 구조는 유동 채널을 포함한다.
다른 구체예들에 있어서, 쉬스 유동이 채용된다. 이들 경우들에 있어서, 원심력과 용이-창작 미소유체 디스크 토폴로지(easily-created microfluidic disc topologies)들을 사용하여 다중 계수(multiple counting)의 가능성을 크게 감소시키는 단순 1-차원 쉬스들이 생성될 수 있다.
다른 구체예들에 있어서, 멀티플렉스화된 분석 유형(multiplexed assay types)들이 수행된다. 예를 들면, 비드들의 유동 세포 분석 검출(flow cytometric detection)을 사용하는 면역분석들이 반사율(reflectance) 또는 벌크 광학밀도(OD) 측정을 사용하여 수행되는 효소 분석의 비색 검출과 결합될 수 있다.
다른 구체예에 있어서
회전모터;
상기 모터를 제어하기 위한 수단;
상기 회전모터에 결합되고 그리고 입자들을 수령하도록 적용된 플랫폼; 및
상기 플랫폼이 회전하는 동안 유동-채널 내의 샘플의 입자들을 검출하기 위한 수단;
을 포함하는 생물학적 샘플들을 처리하기 위한 미소유체 시스템이 제공된다.
하나의 구체예에 있어서 상기 입자들은 면역-변성 비드들이다.
하나의 구체예에 있어서 상기 입자들은 원심력의 영향 하에서 회전의 중심으로부터 원위의 벽에 대하여 비드들이 침강하도록 적용된 저장조 내에서 세척된다.
하나의 구체예에 있어서 세척 저장조(washing reservoir)는 폐기 저장조(waste reservoir)와 유동 채널 둘 다에로 인도하는 분기된 출구 채널(bifurcated outlet channel)을 갖는다.
하나의 구체예에 있어서 상기 출구 채널의 분기점(bifurcations) 내의 모세관 크기와 확장의 기하학적 협착(geometric constrictions)들은 상기 세척 저장조가 유체를 포함하는 경우, 상기 플랫폼의 제1 회전속도에서는 유동에 저항하나 그러나 제2의 보다 높은 회전속도에서는 유체의 유동을 허용하도록 작용한다.
하나의 구체예에 있어서 상기 유동 채널로 인도하는 상기 분기점에 대한 협착의 반경 위치의 지수(quotient of radial position)는 상기 폐기 저장조로 인도하는 상기 분기점에 대한 협착의 반경 위치의 지수 및 상기 협착의 직경 보다 작다.
하나의 구체예에 있어서 상기 출구 채널은 원심력에 대응하여 상기 폐기 저장조 내로 비워지는 경우에 상기 세척 저장조 내에 한정된 용적이 보류되도록 하는 방법으로 상기 세척 저장조의 방사상으로 원위의 벽의 최대 반경 위치 보다 작은 반경에서 상기 세척 저장조로부터 돌출된다.
하나의 구체예에 있어서 상기 보류된 유체는 입자들을 포함한다.
하나의 구체예에 있어서 상기 폐기 저장조는 소정의 샘플 용적에서 상기 보류된 용적을 차감한 것과 같은 한정된 용적을 갖는다.
하나의 구체예에 있어서 상기 폐기 저장조로부터 배출된 공기를 이송하기 위한 채널이 제공된다.
하나의 구체예에 있어서 상기 채널은 반경 위치 내부에서 하나의 포트(port) 또는 다른 채널에서 종결되는 상기 폐기 저장조로부터 상기 플랫폼이 회전 하에 있고 그리고 세척실(washing chamber)이 최대 용적의 작동 유체로 채워져 있는 동안에 상기 세척 저장조 내에서 달성되어야 할 최내 액체 수준(innermost liquid level)으로 방사상으로 내측으로 지향된다.
하나의 구체예에 있어서 상기 저장조의 내용적은 회전 가속(rotational accelerations) 및 감속 하에 있는 동안 상기 유체의 혼합에서 상기 저장조 내의 공기의 사용을 가능하게 하도록 작동 유체의 최대설계용적 보다 더 크다.
하나의 구체예에 있어서 상기 유동 채널은 다른 채널 분기점들/접점들(bifurcations/junctions) 없이 상기 세척 저장조로부터 폐기 저장조로 직접적으로 인도된다.
하나의 구체예에 있어서 상기 유동 채널은 분기점 또는 접점들 없이 제2 폐기 저장조로 인도된다.
하나의 구체예에 있어서 하나의 포트 또는 다른 채널에 의하여 종결되는 하나의 포트 또는 채널이 상기 유동 채널을 통하여 유동하는 유체에 의하여 상기 폐기 저장조로부터 배출된 공기를 배출하는 데 사용된다.
하나의 구체예에 있어서 상기 유동 채널은 실질적으로 상기 플랫폼에 대하여 방위각 방향(azimuthal orientation)으로 구성된다.
하나의 구체예에 있어서 상기 유동 채널 길이 및 직경은 상기 플랫폼의 회전주기로 곱하고 그리고 상기 채널의 길이로 나눈 상기 채널의 중심에서의 유체 유선(fluid streamline)의 속도가 매 회전 당 적어도 1회 각 입자가 검출되는 것을 보장하는 것을 확실하게 하도록 선택된다.
하나의 구체예에 있어서 하기의 단계들:
적어도 하나의 입자-세척 저장조 및 세척된 입자들을 수령하기 위한 하나의 유동 채널을 제공하도록 적용되는 청구항 제1항에 기술된 바와 같은 플랫폼을 구성하는 단계;
상기 세척 저장조 내에 한정된 용적으로 입자들과 용액의 혼합물을 제공하는 단계;
완충제 저장조(buffer reservoir) 내에 제1 용액(first solution) 보다 더 큰 용적의 제2 용액(second solution)을 제공하는 단계;
상기 입자들이 상기 세척 저장조의 원위의 벽에 대하여 침강되기에 충분한 시간 동안 상기 플랫폼을 제1 회전속도(first rotational velocity)로 회전시키는 단계;
압력이 폐기 채널(waste channel)을 통하여 유체가 제1 폐기 저장조(first waste reservoir)에로 전달되도록 하는 데 요구되는 모세관 압력(capillary pressure)을 초과하도록 상기 회전속도를 증가시키고, 그에 의하여 상기 침강된 입자들을 포함하는 한정된 양을 제외한 모든 유체를 상기 폐기 저장조 내로 배수시키는 단계;
상기 제2 용액에 의해 가해지는 압력이 상기 저장조로부터 혼합실에로 상기 용액을 전달하는 데 요구되는 모세관 압력을 초과하도록 상기 회전속도를 일시적으로 증가시키는 단계;
상기 침강된 입자들을 상기 제2 유체 내로 재현탁시키는 동안 상기 회전속도가 한정된 값을 초과하지 않도록 하고, 그에 의하여 입자들의 현탁액 내에 원래의 유체가 실질적으로 제거되도록 상기 플랫폼을 주기적으로 가속 및 감속시키는 단계;
중의 하나 또는 그 이상을 포함하는 입자들을 세척하기 위한 방법이 제공된다.
하나의 구체예에 있어서 하기의 단계들:
채널의 길이로 나눈 회전의 주기로 곱한 중심 유선의 속도가 1 이하가 되도록 하는 속도로 플랫폼을 회전시키는 것에 의하여 입자들을 포함하는 유체가 실질적으로 방위각으로 배향된 유동 채널을 통하여 흐르도록 하는 단계;
상기 유동 채널의 반경 위치에서 조명을 제공하는 단계;
조명점(illuminating spot)의 크기가 방위각 방향 내에서 100㎛ 이하가 되도록 그리고 대각방향 내에서 상기 유동 채널의 폭보다 크거나 같아지도록 한정하는 단계; 및
상기 조명점을 통과하는 상기 유동 채널 내의 입자들에 의하여 산란되거나 또는 방출된 형광 방사(fluorescent radiation)를 검출하는 단계;
중의 하나 또는 그 이상을 포함하는 회전하는 플랫폼 상의 입자들을 검출하기 위한 방법이 제공된다.
하나의 구체예에 있어서 하기의 단계들:
적어도 하나의 입자-세척 저장조 및 세척된 입자들을 수령하기 위한 하나의 유동 채널을 제공하도록 적용되는 플랫폼을 구성하는 단계;
상기 세척 저장조 내에 한정된 용적으로 입자들과 용액의 혼합물을 제공하는 단계;
상기 입자들이 상기 세척 저장조의 원위의 벽에 대하여 침강되기에 충분한 시간 동안 상기 플랫폼을 제1 회전속도로 회전시키는 단계;
압력이 폐기 채널을 통하여 유체가 제1 폐기 저장조에로 전달되도록 하는 데 요구되는 모세관 압력을 초과하도록 상기 회전속도를 증가시키고, 그에 의하여 상기 침강된 입자들을 포함하는 한정된 양을 제외한 모든 유체를 상기 폐기 저장조 내로 배수시키는 단계;
용액 내의 상기 입자들의 초기 용적(initial volume) 보다 더 큰 제2 용적의 유체를 첨가하는 단계;
상기 침강된 입자들을 상기 제2 유체 내로 재현탁시키는 동안 상기 회전속도가 한정된 값을 초과하지 않도록 하고, 그에 의하여 입자들의 현탁액 내에 원래의 유체가 실질적으로 제거되도록 상기 플랫폼을 주기적으로 가속 및 감속시키는 단계;
압력이 폐기 채널을 통하여 유체가 제2 폐기 저장조에로 전달되도록 하는 데 요구되는 모세관 압력을 초과하도록 제1의 한정된 값 보다 큰 속도로 상기 플랫폼을 회전시키는 단계;
상기 채널의 길이로 나눈 회전의 주기로 곱한 상기 중앙 유선의 속도와 같이 상기 회전속도를 조절하는 단계;
상기 유동 채널의 상기 반경 위치에 조명을 제공하는 단계;
조명점의 크기가 방위각 방향 내에서 100㎛ 이하가 되도록 그리고 대각방향 내에서 상기 유동 채널의 폭보다 크거나 같아지도록 한정하는 단계; 및
상기 조명점을 통과하는 상기 유동 채널 내의 입자들에 의하여 산란되거나 또는 방출된 형광 방사를 검출하는 단계;
중의 하나 또는 그 이상을 포함하는 입자들을 세척하고 계속해서 검출하는 방법이 제공된다.
하나의 구체예에 있어서
적어도 하나의 입자-세척 구조 및 상기 입자 세척 구조 내에서 세척된 입자들을 수용하도록 적용되는 입자 수용 구조; 및 상기 플랫폼이 회전하는 동안 상기 입자 수용 구조 내의 세척된 입자들의 검출을 위한 검출영역을 포함하는 회전모터에 결합될 수 있도록 적용되는 플랫폼이 제공된다.
다른 구체예에 있어서
플랫폼을 회전모터에 결합시키는 단계;
상기 플랫폼을 적어도 하나의 입자-세척 구조 및 입자 수령 구조로 구성하는 단계;
상기 입자 세척 구조 내에서 세척된 입자 수령 구조 내로 수령하는 단계; 및
상기 플랫폼이 회전하는 동안 상기 입자 수령 구조 내의 세척된 입자들을 검출하는 단계를 포함하며, 여기에서 상기 입자들이 생물학적 샘플의 특징들을 대표하는 면역-변성 비드들 및/또는 형광적으로 표지된 면역-변성 비드들인 생물학적 샘플들을 처리하기 위한 방법이 제공된다.
본 발명은 첨부된 도면들을 참조하여 단순히 실시예로서 주어진 하기의 구체예의 설명으로부터 보다 명백하게 이해될 수 있을 것이며, 여기에서:
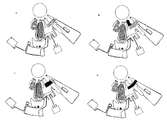
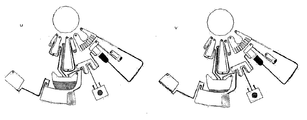
도 1은 원심 미소유체 디스크 상에서의 면역분석 및 임상 화학 분석을 수행하는 장치의 예시적인 공정 흐름을 설명하는 도면이고;
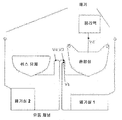
도 2는 희석 또는 세척 공정들 후에 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내는 도면이고;
도 3a 내지 도 3b들은 도 2의 세척의 유체 공정들을 나타내는 도면들이고;
도 4는 대안의 희석 또는 세척 공정들 후에 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내는 도면이고;
도 5a 내지 도 5c들은 도 4의 세척의 유체 공정들을 나타내는 도면들이고;
도 6은 입자들의 세척을 위하여 필터를 사용하는 디스크-기반 구조를 나타내는 도면이고;
도 7a 내지 도 7b들은 이러한 세척의 유체 공정들 및 도 6의 상기 유동 채널 내로의 주입을 나타내는 도면들이고;
도 8은 둑 또는 댐(dam)을 제공하기 위한 정확한 형상으로 형성된 본 발명의 층들을 나타내는 도면이고;
도 9는 1차원의 쉬스 유동에 적절한 채널 구성을 나타내는 도면이고;
도 10은 대안의 1차원의 쉬스 유동에 적절한 채널 구성을 나타내는 도면이고;
도 11은 액체 회전을 이용하는 집중법(focusing method)을 설명하는 도면이고;
도 12는 관성 집중(inertial focusing)을 설명하는 도면이고;
도 13a, 도 13b 및 도 13c들은 본 발명의 바람직한 구체예에 따라 비드들이 볼륨(volume) 내로 침강되고 그리고 검출되는 대안의 검출 기법(detection scheme)을 설명하는 도면들이고;
도 14는 비색("임상적") 화학 분석을 위한 건조된 화학적 다공성 패드의 구성 및 용도를 설명하는 도면이고;
도 15는 하나의 구체예에 따른 미소유체 디스크들의 가능한 구성을 설명하는 도면이고;
도 16은 하나의 구체예에 따른 본 발명의 디스크를 설명하는 도면이고;
도 17은 하나의 구체예에 따른 하나의 샘플-처리 분석 구조의 상세한 구성을 설명하는 도면이고;
도 18은 상기 미소유체 분석 구조의 기능을 설명하는 도면이고;
도 19는 도 5와 함께 쉬스 유동의 생성을 위하여 적절한 미소유체 디스크를 설명하는 도면이고;
도 20은 샘플 및 쉬스 유체의 유동 채널 내로 그리고 계속해서 폐기 저장조로의 유동을 설명하는 도면이고;
도 21은 10:1의 쉬스 유동을 제공하기 위한 디스크의 배치를 나타내는 도면이고;
도 22는 유체가 또한 도 9에 설명된 상기 채널의 "플로어(floor)"를 통하여 두 번째 층으로부터 첫 번째 층 내로 유입되는 본 발명의 특정의 구체예를 설명하는 도면이다.
도 1은 원심 미소유체 디스크 상에서의 면역분석 및 임상 화학 분석을 수행하는 장치의 예시적인 공정 흐름을 설명하는 도면이고;
도 2는 희석 또는 세척 공정들 후에 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내는 도면이고;
도 3a 내지 도 3b들은 도 2의 세척의 유체 공정들을 나타내는 도면들이고;
도 4는 대안의 희석 또는 세척 공정들 후에 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내는 도면이고;
도 5a 내지 도 5c들은 도 4의 세척의 유체 공정들을 나타내는 도면들이고;
도 6은 입자들의 세척을 위하여 필터를 사용하는 디스크-기반 구조를 나타내는 도면이고;
도 7a 내지 도 7b들은 이러한 세척의 유체 공정들 및 도 6의 상기 유동 채널 내로의 주입을 나타내는 도면들이고;
도 8은 둑 또는 댐(dam)을 제공하기 위한 정확한 형상으로 형성된 본 발명의 층들을 나타내는 도면이고;
도 9는 1차원의 쉬스 유동에 적절한 채널 구성을 나타내는 도면이고;
도 10은 대안의 1차원의 쉬스 유동에 적절한 채널 구성을 나타내는 도면이고;
도 11은 액체 회전을 이용하는 집중법(focusing method)을 설명하는 도면이고;
도 12는 관성 집중(inertial focusing)을 설명하는 도면이고;
도 13a, 도 13b 및 도 13c들은 본 발명의 바람직한 구체예에 따라 비드들이 볼륨(volume) 내로 침강되고 그리고 검출되는 대안의 검출 기법(detection scheme)을 설명하는 도면들이고;
도 14는 비색("임상적") 화학 분석을 위한 건조된 화학적 다공성 패드의 구성 및 용도를 설명하는 도면이고;
도 15는 하나의 구체예에 따른 미소유체 디스크들의 가능한 구성을 설명하는 도면이고;
도 16은 하나의 구체예에 따른 본 발명의 디스크를 설명하는 도면이고;
도 17은 하나의 구체예에 따른 하나의 샘플-처리 분석 구조의 상세한 구성을 설명하는 도면이고;
도 18은 상기 미소유체 분석 구조의 기능을 설명하는 도면이고;
도 19는 도 5와 함께 쉬스 유동의 생성을 위하여 적절한 미소유체 디스크를 설명하는 도면이고;
도 20은 샘플 및 쉬스 유체의 유동 채널 내로 그리고 계속해서 폐기 저장조로의 유동을 설명하는 도면이고;
도 21은 10:1의 쉬스 유동을 제공하기 위한 디스크의 배치를 나타내는 도면이고;
도 22는 유체가 또한 도 9에 설명된 상기 채널의 "플로어(floor)"를 통하여 두 번째 층으로부터 첫 번째 층 내로 유입되는 본 발명의 특정의 구체예를 설명하는 도면이다.
원심 미소유체 디스크 상에서의 면역분석 및 임상 화학 분석을 수행하는 장치에 대한 예시적인 공정 흐름을 도 1에 나타내었다. 이들 공정들은 사용자에 의하여 수행되는 것들과 일회용의 시약 및 기구 시스템에 의해 수행되는 것들로 구분되었다. 사용자 공정들로는 하기의 것들이 있다:
ㆍ 전혈을 상기 장치에 적용하기. 이는 헤파린 처리된 샘플링 장치(heparanized sampling device)로부터 또는 손가락-천공(finger-prick)으로부터 직접적으로 항응혈제(anticoagulant)를 포함하는 포트 내로 수행될 수 있다.
ㆍ 상기 미소유체 장치를 상기 기구 내로 삽입하기. 사용자는 또한 에어로졸(aerosols) 등의 발생을 방지하기 위하여 진입 포트(entry port)를 밀봉할 수 있다.
ㆍ 시험 공정의 개시.
계속해서 시스템에 의해 수행되는 공정들이 완전히 자동화된 하기의 것들로 이루어진다:
ㆍ 전혈의 계량.
ㆍ 혈장 분리.
ㆍ 면역분석 처리 채널 및 임상 화학 처리 채널을 위한 혈장 분획들의 분리 및 계량.
단일의 면역분석 및 단일의 임상 화학 처리 채널들이 설명됨에도 불구하고, 단지 상기 샘플의 크기 및 상기 미소유체 디스크의 크기에 의하여 제한되는 많은 보다 많은 분석들이 존재할 수 있다는 것이 인식된다.
상기 임상 화학 채널에서의 공정들은
ㆍ 필요에 따라 상기 임상 화학을 위한 혈장 용적을 더 한정하기 위한 별도의 계량
ㆍ 상기 혈장의 상기 미소유체 디스크 내에 매립된 건조된 시약 패드 장치(dried reagent pad device)에로의 전달
ㆍ 형광 생성물(fluorescent product)의 발색(color generation)을 허용하도록 상기 패드 상에서의 혈장의 배양
ㆍ 검출
들로 이루어진다.
상기 면역분석 채널 내에서의 공정들은
ㆍ 필요에 따라 상기 임상 화학을 위한 상기 혈장 용적을 더 한정하기 위한 별도의 계량
ㆍ 혈장의 혼합실로의 전달. 이러한 혼합실은 면역-변성 비드들 및 분석물질 및 비드 기질과의 경쟁 분석 또는 샌드위치 분석에 참여하는 형광적으로-표지된 항체들 등과 같은 건조된 시약들을 포함할 수 있다. 상기 시약들은 또한 액체 상태로 저장되고 그리고 상기 혼합실로 전달될 수 있다는 것이 인식된다.
ㆍ 샘플과 시약들의 혼합. 이는 a) 교반(agitation), b) 왕복(reciprocation), c) 공동-주입(co-injection)을 포함하여 이하에서 상술되는 여러가지 방법들로 일어날 수 있다.
ㆍ 완전한 면역화학 반응을 보장하기에 충분한 온도에서 충분한 시간 동안의 혼합물의 배양
ㆍ 미결합 형광 표지자들을 제거하기 위한 비드들의 세척, 일부 경우들에서는 세척은 비드들의 침강, 상청액(supernatant)의 제거 및 상기 비드(및 잔여의 미결합된 표지자)들의 완충제에 의한 재현탁 및 희석으로 대체될 수 있다.
ㆍ 검출을 위한 비드들의 상기 유동 채널 내로의 주입
들로 이루어진다.
원심 플랫폼들 상에서의 유체 공정들
3가지 기본적인 기능들이 최적의 디스크-기반 공정들을 가능하게 한다:
ㆍ 사전-정의된 회전속도로의 특정의 설계의 디스크의 회전에 의한 채널들을 통한 유체들의 펌핑
ㆍ 피동 제어(passive means)를 이용한 밸브작용(valving)
ㆍ 밀도차 및 원심력에 기초하는 분리, 예를 들면 혈장 분리, 비드들의 침강
이들 공정들의 상세한 설명이 이하에서 제공된다. 앞서 상술된 전체 샘플 처리 단계들의 실행을 가능하게 하는 특정의 설계 고려사항들 - 상기 미소유체 디스크의 기하학적 설계(geometric design) 및 회전 프로파일(rotation profile) 둘 다 - 이 기술된다.
펌핑
쉬스 유체들의 사용과 함께 또는 사용 없이 유동의 생성이 원심 포맷(centrifugal format)에서 쉽게 수행될 수 있다. 실질적으로 직선인 채널에 대하여는, 기하구조, 유체 및 층류 영역(laminar regime)에서의 작동 매개변수들(레이놀드수(Reynolds number) ≤2200)에 대한 유량(Q)에 관한 기본식은 수학식 1인
이다.
이 식에서, Q는 유량이다. 기하학적 매개변수들은 A = 상기 채널의 단면적 = h * w이고, 여기에서 h 및 w는 직사각형의 채널의 깊이 및 폭들이고; dH는 상기 채널의 둘레(perimeter)로 나눈 단면적의 4배로 정의되는 수력학적 직경(hydraulic diameter)이고; ΔR은 상기 유체의 R0에서의 내측 메니스커스(inner meniscus)와 R1에서의 외측 메니스커스 사이의 반경 상의 위치에서의 차이로 정의되는 상기 유체의 "수두높이(head height)"이고, ΔR = R1 - R0이고; 는 상기 액체의 평균 위치이고, = 0.5(R1 + R0)이고; 그리고 L은 상기 채널의 길이이다. 유체 매개변수(fluid parameters)들은 ρ = 상기 유체의 밀도이고 그리고 η = 상기 유체의 동점도(kinematic viscosity)이다. 마지막으로, 작동 매개변수(operational parameter)는 각속도 이고, 여기에서 fR은 초당 회전수(number of revolutions)이고, 이 자체는 요구되는 회전 프로파일에 대한 시간의 변수가 될 수 있다. 이 식은 레이놀드수 <2200(층류)에 대한 유량에 대하여 정확하다.
이다.
최대 속도 - 상기 채널의 중심에서 유체에 의해 경험되는 - 는 2이다. 일부 응용들에서 이 속도는 관련 매개변수, 즉 유동 채널 내의 각 입자가 매 회전 당 적어도 1회 검출되는 것을 보장하는 관련 매개변수이다.
밸브작용
사이펀작용(siphoning); 표면장력 효과(surface tension effects)들에 기초하는 피동 일회용 밸브(passive single-use valves)들(모세관 밸브(capillary valves), 소수성 밸브(hydrophobic valves)); 히터(heater) 또는 광원의 접촉에 의하여 적용되는 열로 인한 "플러그"의 고체-대-액체 상 전이(solid-to-liquid phase transition) 또는 용융에 기초하는 일회용 밸브들; 및 동일한 원리들에 기초하는 다회용 밸브(multiple-use valves)들의 사용을 포함하나 이들에 제한되지 않는 원심분리 유체 플랫폼 내에서 액체들의 통문작용(gating) 또는 밸브작용을 위한 다양한 수단들이 존재한다.
이들 밸브작용 메카니즘들의 일부는 당해 기술분야에서는 잘 알려져 있으며 사이펀 등과 같은 공공 영역(public domain)에 들어간다.
피동 '모세관' 밸브작용이 특히 유용하며 시험된 거의 모든 유체들에 대하여 가치가 있는 것으로 밝혀졌다. 모세관 밸브작용에 있어서, 표면장력 또는 모세관력(capillary forces)이 채널의 단면적의 변화들에서 유체들을 보류시키도록 작용한다. 액체/고체 접촉각이 0°(0 degrees) 보다 큰 경우, 좁은 채널로부터 보다 큰 채널로, 특히 불연속을 갖는 접점을 가로지르는 출현(emergence)은 상기 액체 측 상에의 보다 높은 압력으로, 액체-증기 계면을 가로지르는 차동압력(pressure differential)의 적용을 통한 이 계면의 만곡(curvature)의 양의 반경(positive radius)의 생성을 필요로 한다. 이 압력은 상기 미소-유체 디스크의 회전을 통하여 생성될 수 있다. 대체로, 친수성 표면들에 대한 상기 계면을 가로지르는 유동을 생성하는 데 요구되는 압력은 상기 유체의 표면장력 및 상기 접촉각의 코사인(cosine)에 직접적으로 비례하고 그리고 상기 모세관의 직경에 반비례한다. 유용하고 그리고 쉽게 제작되는 모세관 밸브들의 규격들은 전형적으로 보다 깊은 채널 또는 포켓(pocket)을 교차(intersecting)하는 50 내지 500㎛ 폭 * 50 내지 500㎛ 깊이의 채널 세그먼트(channel segments)들이다.
회전으로 인한 정수압(hydrostatic pressure)이 이러한 모세관 압력 이하인 경우, 유체는 모세관 접점(capillary junction)에서 보류된다. 플랫폼의 회전에서, 이 정수압은 상기 유체의 평균 위치(메니스커스들의 선도(leading) 및 꼬리끌기(trailing) 또는 상기 액체 용적의 방사상으로 외측 및 내측 메니스커스들 사이에서 측정된); 상기 메니스커스들의 위치들에서의 차이; 및 회전주파수의 제곱(rotational frequency squared)에 직접적으로 비례한다.
액체 특성들(표면장력, 밀도), 재료 특성들(접촉각); 및 상기 모세관 규격들 등과 같은 기하학적 매개변수들 및 상기 디스크 상의 상기 유체들의 구성;의 조작이 잘-정의된 회전속도의 결과를 가져오며, 이 회전속도에서 모세관 압력이 '극복(defeated)'되고 그리고 액체가 피동 밸브들을 통하여 '분출(bursts)'된다는 것은 당해 기술분야에서 인식되고 있다. 이러한 관계들을 이용하여, 광범위한 관련 생물학적 유체들 및 시약들이 수백 RPM(분당 회전수) 내지 5000RPM 이상까지의 회전속도들에서 통문작용될 수 있다. 이들 관계들은 하기의 수학식으로 요약될 수 있다:
여기에서 RPMc는 그 이하에서는 유체가 상기 모세관 밸브를 통하여 유동하지 못하고 그리고 그 이상에서는 유동하는 임계 RPM이고; γ는 상기 액체 표면장력이고; θc는 상기 디스크의 재질 상에서의 상기 액체의 접촉각이고; , ΔR, dH 및 ρ는 상기한 바와 같이 정의된다.
밀도차 및 원심력에 기초한 분리
원심력의 적용 하에서 성분들 간의 밀도차에 기초하여 유체를 분리하는 능력이 원심분리 플랫폼 내에 내재한다. 구형 입자들에 대하여는, 입자들이 "침강(sediment)"하는 속도에 대한 유용한 식은
이다.
여기에서, Vs는 ㎝/초의 단위의 상기 입자의 속도이고; ρp는 상기 입자의 밀도이고; ρL은 상기 액체의 밀도이고; ηW는 물의 동점도이고; ηL은 상기 액체의 동점도이고; d는 미크론 단위의 상기 입자의 직경이고; 그리고 acc는 중력가속도(982㎝/초2 = 9.82m/초2 = 1중력가속도(gravity))이다.
혼합
원심분리 디스크 상에서의 유체들의 혼합에 대하여는 다양한 방법들이 가능하다. 먼저, 교반이 사용될 수 있으며, 여기에서 혼합될 상기 액체들 또는 액체와 용해될 고체들이 공기가 포함된 격실 내에 위치된다. 가속 및 감속의 교호(alternating)가 혼합 작용을 제공한다. 이 방법은 하기의 구체예들 및 실시예에서 채용된다.
다른 혼합 수단은 포획된 공기에 대한 유체의 왕복 운동이다. 이 방법에 있어서 유체혼합실(fluid mixing chamber)은 좁은 채널에 의하여 배기포트(venting port)가 없는 포획된 공기 용적 "밸러스트"(trapped air volume "ballast")에 연결된다. 그 결과, 낮은 회전속도에서 상기 유체는 상기 포획된 공기에 의하여 정지된다. 회전속도가 증가함에 따라, 상기 유체는 상기 포획된 공기 용적 내로 침투하여 상기 유체로 인하여 원심력으로-생성된 압력에 대응하여 상기 공기를 압축한다. 회선속도를 감소시키는 것이 밸러스트실(ballast chamber)로부터의 상기 유체의 회수를 일으킨다. 이러한 방법으로, 높은 회전속도/낮은 회전속도 사이클을 교호시켜 "피펫(pipette)" 혼합과 유사한 왕복운동이 제공된다.
마지막으로, 혼합은 혼합될 2가지 유체들을 저장조들로부터 하나의 채널 내로 주입하는 것에 의하여, 예를 들면, 상기 유체들을 상기 채널의 대향되는 측들 상의 모세관 밸브들에로 옮겨가는 것에 의하여 수행될 수 있다. 계속해서 상기 유체는 수령 저장조(receiving reservoir) 내에 퇴적된다. 2가지 공-유동 용액들(two co-flowing solutions)들이 상기 채널 내에 머무르는 시간이 충분한 경우, 상기 유체들의 확산 혼합(diffusional mixing)이 일어난다. 그렇지 않은 경우, 상기 수령 저장조 내로의 난류 운동(turbulent motion)의 도입이 상기 유체들을 효과적으로 혼합시킨다.
검출요건들 - 면역분석 검출: 회전하는 유동 채널
전통적인 유동 세포분석기들에 있어서는, 쉬스 유동이 사용되어 상기 입자들을 희석시키고 그리고 이들을 채널의 중심 내에 "한 줄(single file)"로 위치시키며, 여기에서 이들은 상기 기구의 상기 광원에 의하여 탐색(interrogated)된다. 이는 상기 유동 방향 내의 전형적으로는 10㎛의 좁은, 그러나 대각 방향 내의 상기 쉬스 유동의 "핵(core)" 유동 보다는 훨씬 더 넓은 광학 검출 용적(optical detection volume)으로 수행된다. 쉬스 유동은 상기 입자들을 상기 광원으로부터의 실질적으로 균질한 방사 영역 내에 상기 입자들을 위치시키고, 그에 의하여 상기 광원으로 하여 검출된 방사에서의 편차를 최소화하고; 마찬가지로 상기 입자들을 희석시켜 한 번에 단지 하나의 입자가 상기 광원에 의하여 조명되도록 하는 이중 기능들을 갖는다.
면역분석 응용들에 대하여는, 상기 비드 농도는 더 이상의 희석이 요구되지 않을 정도로 설정될 수 있다. 예를 들면, 전형적인 면역분석 농도인 10㎕ 내의 200개의 입자들의 농도는 800㎛의 평균 입자-입자 간격(mean particle-particle spacing)의 결과를 가져온다. 결과적으로, 한 번에 하나 이상의 입자를 계수(counting)할 가능성은 사라질 정도로 작아진다. 전체 유동 채널을 가로지르고 그리고 실질적으로 균일한 빔(beam)을 사용하는 것에 의하여, 동시적인 검출 없이 그리고 상기 광원에 의하여 유발되는 명백한 편차들 없이 모든 입자들이 계수될 수 있다. 이는 쉬스 유동에 대한 요구를 제거한다.
고정 검출기를 사용하는 동안 회전하는 디스크 상의 움직이는 입자들의 검출에 있어서, 상기 검출 시스템의 표본추출비율(sampling rate)가 입자들을 검출하기에 적절하다는 것이 중요하다. 속도가 상기 유동 채널의 반경인 반경 RF에서의 디스크의 속도에 의하여 지배되기 때문에, 샘플들의 총수는 단순히 상기 디스크의 방위(회전) 방향 내의 검출 용적의 폭(여기서는 w l ), 속도 = ωR 및 ㎐ 단위의 표본추출비율 f S에 연관된다:
f S = 106, w l = 80㎛ 및 500RPM의 회전속도와 50㎜의 반경 위치 RF를 사용하여 양호한 통계학적 샘플링에 적절한 수인 NS가 약 31임을 발견하였다.
구체예들
검출 단계로서 유동하는 비드들을 갖는 원심분리 포맷에 대한 많은 형태의 면역분석이 본 발명에 포함되어 실행될 수 있다. 예를 들면, 하나의 구체예에 있어서:
1. 50㎕의 관능화된 비드들(functionalized beads)(약 6000개의 비드들)을 50㎕의 샘플 및 50㎕의 표지화 시약(파이코에리트린(phycoerythrin), PE)(VS = 150㎕)와 혼합한다.
2. 3시간 동안 배양한다.
3. 1000㎕의 세정 완충제(wash buffer) VW를 첨가한다.
4. 원심분리시켜 비드들을 펠릿화한다.
5. 상청액을 폐기한다.
6. 300㎕의 완충제에 재현탁시킨다(VE)
7. 유동 세포계수를 수행한다.
근본적으로, 비드 세척은 염료가 비드 형광의 검출에 대하여 간섭하지 않는(즉, 상기 비드 형광에 비하여 배경이 낮은) 수준까지 과량의 미결합된 염료(PE)를 제거한다.
세척의
구체예들
세척의 바람직한 구체예들에는:
ㆍ 펠릿(pellet) + 따라내기(decant) + 희석(dilute): 원심분리시켜 비드를 펠릿화시킴; 잔량의 용액을 뒤에 남기고 상청액 제거(따라내기); 및 완충제 중에서의 비드들의 재현탁에 의하여 잔류 물질들의 농도를 충분히 감소시킴
ㆍ 펠릿화에 의한 세척: 두 번째의 비드들의 펠릿화 및 상청액의 제거에 후속하여 완충제 중에 상기 비드들을 재현탁시키는 것을 수반하는 것을 제외하고는 앞서와 같음. 이는 반복될 수 있다.
ㆍ 필터로의 여과: 상기 비드들을 포함하는 용액을 여과요소(filtering element)에 대하여 구동시키고 그리고 상기 비드들이 세척된다.
ㆍ 트랩(traps)들로의 여과: 상기 비드들을 포함하는 용액을 상기 비드들 또는 둑들의 치수들 보다 작은 치수들의 채널(1차원 내에 한정되나 그러나 대각방향의 치수에서 더 큰 채널들) 등과 같은 상기 디스크의 기질 내에 형성된 트랩들에 대하여 구동시킨다. 이는 상기 비드들을 포획하고 그리고 세척되도록 한다.
들이 포함된다.
모든 경우들에서, 폐기는 비드들의 재현탁 및 이하에서 보다 상술되는 바와 같은 유동 채널 또는 펠릿화 챔버 등과 같은 검출 구조 내로의 주입 이전에 하나 또는 그 이상의 저장조들에로 전달되어야 한다.
펠릿 + 따라내기 + 희석. 이 공정은 필수적으로 상기한 벡톤 디킨슨(Becton Dickinson: BD)에 따른 프로토콜(protocol)에서 기술된 실험실-규모의 공정을 최소화한다. 상기 BD 공정에 있어서, 샘플은 초기에 세척에 의하여 희석되고 그리고 계속해서 과도한 세척이 삭제된다. 완충제 중에서의 재현탁은 비드들의 수는 보존되는 동안 상기 제1 용액의 가용성의 구성성분들의 전체 농도를 낮추는 결과를 가져온다.
대안으로서, 본 발명은 먼저 상기 비드들을 침강시키고, 그리고 상기 상청액을 따라내고, 후속하여 일정한 용적의 완충제 중에 재현탁시킨다.
상기 디스크-기반 공정은:
1. 샘플 용적 VS로 개시함
2. 원심분리를 통하여 상기 비드들을 침강시킴
3. 상청액의 용적 VS-VRR을 폐기함
4. 용리/세척 완충제(elution/wash buffer)의 용적 VE>VS를 첨가하고 그리고 부드러운 교반을 통하여 상기 비드들을 재현탁시킴
5. 유동 세포계수를 수행함
에 의하여 실행될 수 있다.
계속해서 원래의 시약들의 희석 인자 DFC에서의 이러한 결과들은
이 된다.
VRR, VE의 적절한 선택은 이러한 희석 인자가 잔류하는 오염물들의 배경에 대한 상기 비드들의 검출에 요구되는 것과 같거나 또는 더 작게 되는 것을 보장한다.
도 2는 이러한 희석 또는 세척 공정들 후에 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내고 있다. 도시되지 않은 다른 디스크 구조들이 상기 샘플의 제조(예를 들면, 혈장 분리) 및 액체 시약들 및 도시한 샘플의 상기 혼합실로의 전달에 사용되는 것은 이해되어야 한다. 혼합실 내에서 상기 비드, 샘플 및 시약들이 배양되고 그리고 상기 세척 공정의 초기에 용액 내에 존재한다. 2개의 폐기실(waste chambers)들이 여기에 연결된다. 폐기실 1은 상기 혼합실에 공급되어야 할 용액의 용적과 대략 같은 용적을 가지며, 모세관 밸브(V1)을 경유하여 상기 혼합실에 연결된다. 폐기실 2는 상기 유동 채널 내에서 검출된 상기 비드-함유 "주입물(injection)"을 수령하고 그리고 모세관 밸브(V3)에 의하여 연결된다. 별도로 용리액실(eluent chamber)이 모세관 밸브(V2)에 의하여 상기 혼합실에 연결된다.
도 3a 내지 도 3b들은 이러한 세척의 유체 공정들을 나타낸다:
a. 샘플 용적 VS가 혼합실에 첨가된다. 상기 용액은 비드들을 포함할 수 있거나 또는 비드들을 재수화시키는 샘플 및 상기 혼합실 내에 존재하는 시약들일 수 있다. 필요한 경우, 계속해서 상기 시스템은 가속 및 감속에 의하여 교반되어 상기 비드들과 액체를 혼합시킨다.
b. 주파수 W1에서의 고속 회전을 사용하여 비드들을 침강시킨다.
c. 회전속도를 W2>W1 까지 증가시킨다. 이는 상기 혼합실의 출력(output) 내의 모세관 밸브(V1)을 극복하고 그리고 상기 채널과 상기 혼합실이 만나는 지점의 방사상으로-내측의 용액을 상기 제1 폐기 저장조 내로 따라낸다. 이 구체예에 있어서, 상기 설계된 용적 VS에 대한 내측 메니스커스의 상기 방사상 위치는 밸브 V3의 상기 위치의 방사상 외측이고; 그 결과, 밸브(V3)는 어떠한 임의의 회전속도에서도 상기 초기 샘플에 의하여 극복되지 않을 수 있다. 상기 속도는 밸브(V1)이 극복된 이후 W2 이하의 값까지 감소될 수 있다. 상기 보류된 유체 VRR은 상기 채널로부터 방사상으로-외측으로 한정된다. 이러한 유체 유동이 감소하고 그리고 명백하게 외벽 근처의 유체를 방해하지 않음에 따라, 앞서의 단계에서 침강된 상기 비드들은 상기 혼합실의 최외측 표면에 잔류한다. 상기 제1 폐기실(first waste chamber)은 상기 혼합실로부터 제거되는 액체의 용적 VS-VRR과 대략적으로 동일한 크기를 갖도록 한정된다. 더욱이, 상기 제1 폐기실로부터의 상기 공기 배출 채널은 하나의 포트 내에서 종결되거나 또는 균일한 회전속도 하에서 임의의 고려되는 유체 메니스커스의 방사상으로-내측의 채널에 연결된다.
d. 회전이 W3>W2로 촉진되어 모세관 밸브(V2)를 극복하는 것에 의하여 용리액 완충제의 일정 용적을 상기 혼합실에로 전달한다. 전체 용적이 전달되기 이전에 회전을 늦춤으로써 모세관 밸브(V3)를 극복하기에 충분한 정수압이 발휘되지 않도록 하는 것을 보장한다.
e. 상기 용리액 유체가 낮은 RPM에서의 완만한 교반을 통하여 상기 비드들을 재현탁시킨다.
f. 회전이 W4로 촉진되어 상기 유동 채널로 연결되는 모세관 밸브(V3)를 극복하도록 하고 빠르게 늦추어져서 상기 비드들의 침강을 방지한다. 제1 폐기실이 유체로 채워지기 때문에, 이는 상기 유동 채널을 통하여 비드-함유 용액을 제2 폐기실로 이송시키고; 부가적으로, 상기 제1 폐기실로부터의 상기 배출 채널이 폐기 유체로 채워지고 그리고 이것이 상기 유동 채널 내로 유동함에 따라 상기 용리액 완충제에 의하여 형성된 압력에 대한 반대압력(countering pressure)을 제공하여 상기 비드-함유 주입물이 제1 폐기실로 유입되지 않도록 하는 것을 보장한다. 필요에 따라, 상기 혼합실 내의 비드들의 농도가 균질하게 유지되도록 하는 것을 보장하도록 상기 샘플이 유동하는 것과 같은 별도의 교반 단계들이 있을 수 있다.
펠릿화에 의한 세척: 하기의 단계들을 사용하는 실제의 다-단계 세척(true multi-step wash)을 수행하는 것이 바람직한 방법이다:
1. 샘플 용적 VS로 개시함
2. 원심분리를 통하여 상기 비드들을 침강시킴
3. 뒤에 VRR1을 남기고 상청액의 용적 VS-VRR1을 폐기함, 여기에서 VRR1은 상당히 크다(예를 들면, 0.2VS)
4. 세척 완충제의 용적 VW를 첨가하여 총 용적 VW+VRR1을 만들고, 그리고 완만한 교반을 통하여 상기 비드들을 재현탁시킴
5. 원심분리를 통하여 상기 비드들을 침강시킴
6. 뒤에 VRR2를 남기고 상기 희석 용액의 용적 VW+VRR-VRR2를 폐기함
7. 용리/세척 완충제의 용적 VE를 첨가하여 총 용적 VE+VRR2를 만들고, 그리고 완만한 교반을 통하여 상기 비드들을 재현탁시킴
8. 유동 세포계수를 수행하거나 또는 비드들을 검출함
이 경우에서 희석인자(dilution factor)는
도 4는 이러한 희석 및 세척 공정들 후의 비드들의 유동 채널 내로의 주입을 제공하는 디스크 구조를 모식적으로 나타내고 있다. 이는 배양되고 그리고 세척되어야 할 비드들이 용액으로 위치되는 혼합실로 이루어진다. 2개의 직렬의 폐기실들이 이것에 연결된다. 폐기실 1a는 상기 혼합실에 공급될 용액의 용적과 대략적으로 동일한 용적을 가지고 그리고 모세관 밸브(V1)을 경유하여 상기 혼합실에 연결된다. 제2의 직렬로 연결된 폐기실(1b)는 모세관 밸브(V3)를 경유하여 상기 제1 폐기실의 출구에 연결되고 그리고 상기 초기 샘플 용적 - 폐기실(1a) + 세척 완충제 용적 보다 어느 정도 작은 용적을 가지며, 상기 세척 완충제는 초기에 상기 세척실 내에 고정된다. 이 세척실은 밸브(V2)에 의하여 상기 혼합실에 연결되고: 제3 세척실, 폐기실(2)는 상기 유동 채널에서 검출된 상기 비드-함유 "주입물"을 수령하고 그리고 모세관 밸브(V5)에 의하여 상기 폐기실에 연결된다. 별도로 용리액실이 모세관 밸브(V4)에 의하여 상기 혼합실에 연결된다.
도 5a 내지 도 5d들은 이 세척의 유체공정을 나타낸다:
a. 샘플 용적 VS가 혼합실에 첨가된다. 이 용액은 비드들을 포함할 수 있거나 또는 비드들을 재수화시키는 샘플 및 상기 혼합실 내에 존재하는 시약들일 수 있다. 필요한 경우, 계속해서 상기 시스템은 가속 및 감속에 의하여 교반되어 상기 비드들과 액체를 혼합시킨다.
b. 주파수 W1에서의 고속 회전을 사용하여 비드들을 침강시킨다.
c. 회전속도를 W2>W1 까지 증가시킨다. 이는 상기 혼합실의 출력 내의 모세관 밸브(V1)을 극복하고 그리고 용액을 폐기 저장조 폐기실(1a) 내로 따라낸다. 상기 용액은 상기 폐기실(1)의 상기 출력 내의 밸브(V3)에 의하여 멈출 때까지 흘러서 뒤에 용적 VRR1을 남긴다. 샘플의 메니스커스의 방사상 위치는 V4의 메니스커스의 외측이며, 이 공정 동안에 밸브(V4)가 상기 샘플 용적 VS에 의하여 극복되지 않도록 하는 것을 보장한다.
d. 회전이 W3>W2로 촉진되어 모세관 밸브(V2)를 극복하는 것에 의하여 세척 완충제의 일정 용적을 상기 혼합실에로 전달한다.
e. 상기 세척 완충제 유체가 낮은 RPM에서의 완만한 교반을 통하여 상기 비드들을 재현탁시킨다.
f. 도시된 바와 같이, 상기 비드들이 재현탁된다.
g. 회전이 W1으로 증가되어 이 혼합된 용액 내에서 상기 입자들을 한번 더 침강시킨다.
h. 회전이 W4로 촉진되어 폐기실(1a)과 폐기실(1b)를 연결하는 모세관 밸브(V3)를 극복하도록 한다. 상기 혼합된 세척 및 잔류하는 초기 샘플 용액들이 따라내어지고, 폐기실(1a)를 통하여 먼저 그리고 계속해서 폐기실(2a) 내로 통과한다. 용적 VRR2 = VRR1 + VWASH - VWASTE(1b)가 상기 혼합실 내에 보류된다.
i. 회전이 W5로 촉진되어 용리 완충제를 상기 혼합실에 연결하는 모세관 밸브(V4)를 극복하도록 하고 용리 완충제가 전달된다.
j. 완만한 교반으로 상기 입자들을 재현탁시킨다.
k-1. 회전이 W6로 촉진되어 상기 혼합실과 상기 유동 채널을 연결하는 모세관 밸브(V6)를 극복하도록 하고 그리고 빠르게 늦추어서 상기 비드들의 침강을 방지하도록 한다. 폐기실이 유체로 채워져 있기 때문에 이는 상기 유동 채널을 통하여 비드-함유 용액을 폐기실(2)로 이송한다. 필요에 따라 상기 혼합실 내의 비드들의 농도가 균질하게 유지되도록 하는 것을 보장하도록 상기 샘플이 유동하는 것과 같은 별도의 교반 단계들이 있을 수 있다.
이들 두 가지 예들은 모세관 밸브들, 사이펀(siphons)들 및 세척의 효과를 가져오는 펠릿화의 사용을 결합하는 개념들을 결코 제한하는 것이 아니다.
내장형 필터(embedded filters)들이 용이하게 미소유체 장치들 내로 통합될 수 있으며, 전형적으로 동일한 재료들이 보다 통상적인 생성물들에서 사용되는 바와 동일한 방법으로 사용된다. 일부 응용들은 입자들을 제거하기 위한 생성물들의 여과; 다른 사용을 위한 입자들의 포착을 위한 필터; 소수성 배기 필터; 또는 고상추출(SPE: solid phase extraction)을 위한 고체상 결합 지지체들이 있다. 많은 필터 재료들이 획득가능하고 그리고 재료 선택은 응용에 따른다. 삽입을 위한 결합 방법들에는 억지끼워맞춤(press-fit), 오-링(O-rings), 접착제 및 열접착(thermal bonding: 핫멜트접착(hot melt bonding))이 포함된다. 방법들은 필터 선택에 의존적이며: 실리카 멤브레인(silica membranes)은 깨지기 쉽고 그리고 종종 억지끼워맞춤 부재들에 의한 압축을 사용하여 장치들 내로 고정되고; 폴리프로필렌 필터는 접착을 위하여 138℃까지 가열되어야 하는 열-접착된 고리 올레핀(thermally-bonded cyclic olefin: 고리 올레핀 중합체(cyclic olefin polymer [COP]) 또는 고리 올레핀 공중합체(cyclic olefin copolymer [COP])) 부재들에서는 적절하지 않을 수 있다. "거시" 세계("macro" world)에서의 예들에는 밀리포어 앤 폴(Millipore and Pall)의 필터-기반 제품(filter-based products)들이 포함된다. 프릿들이 사용되어 대상의 여과재(filter media)에 대한 기계적인 지지를 제공할 수 있다.
필터들은 부가의 제조상 난점(manufacturing complications)들을 제공하나, 그러나 이들은 극복할 수 없는 것은 아니다. 필터들은 성형되고(예를 들면, 다이-컷(die-cut)) 그리고 위치되고(예를 들면, 자동화된 기계에 의하여) 그리고 잠재적으로 최종 접합 이전에 제 자리에 고정되어야 한다. 시제품화(prototyping)에서는 이는 상대적으로 간단하나; 대규모 제조에 있어서는, 필터들은 전형적으로 절단되고 그리고 계속해서 픽 앤드 플레이스 자동화(pick-and-place automation)를 사용하여 위치될 수 있다. 밀리포어사는 필터 유닛(filter units)들의 대규모 "열판" 용접("hot plate" welding)을 수행한다.
실험실 여과를 위하여 통상적으로 사용되는 0.4㎛ PES(폴리에테르설폰) 필터 등과 같이 적절한 기공 크기(pore size)의 작은 필터가 상기 혼합실과 상기 폐기실로 향하는 상기 채널 사이에 접합된다. 그 결과, 유체는 디스크의 하나의 구성성분으로부터 다른 구조화된 구성성분까지(누설-방지 접합(leak-proof bonding)에 요구되는 중간층(interlayer)를 수반하는 "덮개(lid)"에서 "바닥(bottom)"까지) 전달되어야만 한다. 이러한 접근법의 장점은 이것이 상기 세척 단계 동안 상기 샘플의 농축을 쉽게 허용한다는 것이다: 적용되는 샘플의 용적은 용리액 완충제의 용적 이상일 수 있다. 상기 입자들을 침강시키는 것이 요구되지 않기 때문에, 이는 또한 회전속도 및 기하학적 구조의 관점에서의 요구조건들을 완화한다.
도 6은 입자들의 세척을 위한 필터를 사용하는 디스크-기반의 구조를 설명한다. 상기 디스크는 2 또는 3개의 층들로 구성된다. 상기 구조들의 대부분은 흑색으로 나타낸 메인층(main layer) 상에 존재한다. 상기 필터는 이 층과 단일 채널로 이루어지는 제2 층 사이에 접합된다. 게다가 상부층(upper layer)과 하부층(lower layer)이 연결되는 관통홀(through-holes)들로 이루어지는 중간층(intermediate layer)을 사용하는 것이 때로 유용하며; 상기 필터 영역 내의 상기 관통홀은 상기 필터 주위에 누설-방지 "고리(ring)"가 형성되도록 하는 것을 보장한다. 이러한 디스크 상의 피쳐들에는 제1 층(first layer) 내에 배양되고 그리고 세척되어야 할 비드들이 용액 중에서 위치되는 혼합실이 포함된다. 폐기실(1)이 폐기실(1)에서 종결되고 그리고 상기 내장된 필터 아래에 위치되는 상기 제2 층 내의 채널에 의하여 상기 혼합실에 연결된다. 저속에서 이 채널 및 폐기실(1) 내로의 유동에 저항하는 데 모세관 밸브(V1)이 사용된다. 폐기실(1)은 상기 적용된 샘플과 대략적으로 동일한 용적을 갖도록 하는 크기이다. 밸브(V2)에 의하여 상기 혼합실에 연결되는 용리액/완충제 저장조가 또한 존재한다. 제2 폐기실은 상기 유동 채널 내에서 검출되는 상기 비드-함유 "주입물"을 수령하고 그리고 모세관 밸브 V3에 의하여 상기 폐기실에로 연결된다.
도 7a 내지 도 7b들은 이러한 세척의 유체 공정들 및 상기 유동 채널 내로의 주입을 나타낸다.
a. 샘플 용적 VS가 혼합실에 첨가된다. 이 용액은 비드들을 포함할 수 있거나 또는 비드들을 재수화시키는 샘플 및 상기 혼합실 내에 존재하는 시약들일 수 있다. 필요한 경우, 계속해서 상기 시스템은 가속 및 감속에 의하여 교반되어 상기 비드들과 액체를 혼합시킨다.
b. 주파수 W1에서의 고속 회전이 밸브(V1)을 극복하고, 그리고 상기 샘플 액체가 상기 내장된 필터를 통하여 폐기실(1) 내로 구동된다.
c. 모든 상청액은 폐기실(1)로 전달된다. 모든 입자들은 상기 혼합실에 노출된 상기 필터의 표면 상에 포착된다.
d. 회전속도를 순간적으로 W2>W1으로 증가시킨다. 이는 모세관 밸브(V2)를 극복하여 용리액 완충제가 상기 혼합실로 들어가는 것을 허용한다.
e. 낮은 RPM에서의 완만한 교반을 사용하여 상기 입자들이 용액 내에 재현탁시킨다.
f. 재현탁된 입자들은 이제 상기 유동 채널 내에서 검출을 위하여 준비가 된 상태이다.
g. 회전을 W3>W2로 촉진시켜 밸브(V3)를 극복하여 입자-함유 용액을 상기 유동 채널로 전달한다. 회전을 신속하게 감소시켜 상기 비드들의 침강을 방지한다. 이는 상기 유동 채널을 통하여 비드-함유 용액을 폐기실(2)로 이송한다. 필요에 따라 상기 혼합실 내의 비드들의 농도가 균질하게 유지되도록 하는 것을 보장하도록 상기 샘플이 유동하는 것과 같은 별도의 교반 단계들이 있을 수 있다.
채널 협착; 둑과 댐들. 협착된 채널들, 즉 채널 규격들이 입자 직경 보다 작은 것에 의하여 입자들이 포착될 수 있다.
입자들이 협착에 대하여 충진되는 경우, 이들 입자들은 입자들 사이의 공간들에 의하여 형성된 매우 작은 평균 "채널 직경(channel diameter)"을 갖는 충진된 입자상(packed particle bed)을 형성한다. 협착된 채널에 근접하는 "원추상(cone)" 내에 충진된 입자들은 상기 충진된 상을 통하여 상기 채널로 인도하는 길고 구불구불한 유체 경로에 의하여 형성된 유동에 대하여 매우 큰 임피던스(impedance)를 야기할 수 있다.
둑 또는 댐을 사용하는 것이 하나의 바람직한 접근법이며, 이는 1차원 내에서의 협착이다. 전형적으로 이는 예를 들면 챔버의 단부에서 상기 미소유체 디스크평면에 대하여 수직으로 형성된다. 상기 디스크의 2가지 구성성분들 사이에 형성되는 5㎛ 간극(gap)이 이러한 둑을 생성하고, 그리고 5㎛ 보다 큰 직경의 입자들을 포착하는 데 사용된다. 이는 상대적으로 넓게 되어 상기 충진된 상의 길이 - 및 그에 따라 상기 유동을 감소시키도록 작용하는 상기 구불구불한 채널들의 길이 및 그 결과의 압력 강하 - 가 최소화되도록 하는 것이 바람직하다.
이러한 시스템들을 생성하기 위하여 미세가공법(microfabrication methods)이 사용될 수 있다. 전형적으로 이들은 2가지 구성성분들 - 예를 들면 하나의 층 내의 하나의 챔버 및 다른 층 내의 "팬 형상(fan shaped)" 채널 입구 및 채널을 결합하는 것에 의하여 생성된다. 정확한 기하학적 구조로 형성된 층들 간의 접합이 상기 둑을 제공한다. 이를 도 8에 나타내었다.
입자 수령 구조의 구체예들
입자 수령 구조의 바람직한 구체예들에는 앞서 기술한 바와 같이 설계된 무-쉬스 유동 채널들이 포함되며, 여기에서 입자들의 농도는 대각 방향(상기 유동 채널을 가로지르는) 내에서 실질적으로 균일한 여기 빔(excitation beam)으로의 명백하게 동시적인 검출을 방지하는 수준으로 유지된다. 상기 채널의 길이 및 직경은 상대적으로 낮은 회전속도가 사용되는 동안 상기 유동 채널 내에 있는 동안 적절한 샘플링 시간으로 각 입자가 적어도 한 번 검출되도록 하는 것을 보장하도록 선택된다.
유동 집중 시스템(flow focusing systems)
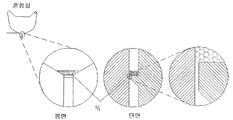
혈액학 응용 등과 같은 일부 응용들에 있어서, 앞서의 설명은 유동 집중이 바람직할 수 있음을 나타내고 있다. 이러한 유동 집중이 제공될 수 있는 2가지 방법들은 통상적인 방법들의 연장으로서의 쓰루 쉬스 유동(through sheath flow) 및 관성 집중들이다.
쉬스 유동
다양한 쉬스 유동 실행들이 사용될 수 있다. 바람직한 방법들에는
ㆍ 비-동축 쉬스 유동(non-coaxial sheath flow)
ㆍ 1차원적 쉬스(one-dimensional sheath)
ㆍ 채널 벽들 내의 피쳐들로 인한 액체 회전
들이 포함된다.
각각을 이하에서 보다 상세하게 다룬다.
비-동축 쉬스 유동. 비-동축 쉬스 유동에 있어서, 샘플 흐름(sample stream)이 상기 채널 바닥(channel floor)로부터 상기 쉬스 유동 내로 주입된다. 그 결과, 상기 샘플 흐름이 상기 채널 바닥에 "달라붙고(clings)" 그리고 상기 채널 내에서 중심에 위치하지 않게 된다. 그러나 명백한 집중이 발생한다. 유량(flow rates)들의 비율이 집중의 정도를 결정한다. 이는 도 12에 나타낸 바와 같이 설명된다. 디스크 구성은 바람직하게는 3 부분들: 유체소자(fluidics) 및 쉬스 채널(sheath channel)을 수반하는 베이스부(base part); 작은 구멍 또는 관통홀을 갖는 밀봉 중간층(sealing interlayer); 및 상기 관통홀을 통하여 주입될 샘플을 수반하는 하부층;일 수 있다. 상기 구멍의 크기들이 작은 경우, 이는 모세관 밸브로서 작용할 것이다.
작동에 있어서, 샘플 유체는 상기 구멍에 대하여 구동되나, 그러나 초기 회전속도 W1에서 모세관력들에 의하여 보류되기 때문에 이를 통하여 메인 유동 채널(main flow channel) 내로 유동하지는 않는다. 회전속도에서 잠재적으로 감소를 수반하는 W2로의 별도의 가속이 상향류 저장조(upstream reservoir)로부터 쉬스 유동을 방출한다. 상기 쉬스 유동이 상기 유동 채널을 통하여 통과하는 공기를 대체함에 따라, 그의 메니스커스는 마침내 상기 관통홀에서 상기 보류된 유체의 메니스커스와 결합하게 된다. 이 점에서, 쉬스 유체와 샘플 유체 둘 다 유동하게 된다. 하향-류 프로파일(down-stream profile)에서 나타난 바와 같이, 상기 쉬스 유체 내의 상기 샘플 기둥(sample plume)의 크기는 상기 홀 및 유동 채널 폭의 크기들 및 유량들의 비율에 따라 상당히 작아질 수 있다.
쉬스 유량과 샘플 유량들의 비율은 3가지 인자들: 상기 유동 채널에서의 쉬스와 샘플의 결합에 앞서 그들 저장조들 내에서의 쉬스와 샘플 메니스커스들의 방사상 위치들로 인한 구동 "압력"들; 상기 쉬스와 샘플 저장조들의 단면적; 및 이들 저장조들로부터 상기 쉬스와 샘플 유체들이 결합되는 접점으로 향하는 상기 채널들의 임피던스들;에 의하여 결정될 수 있다. 상기 임피던스들은 상기 채널들의 길이 및 직경을 변화시키는 것에 의하여 상기 샘플 채널에 대한 상기 쉬스 채널의 임피던스의 비율이 소정의 쉬스 유동에 대한 샘플 유동의 비율과 같아지도록 선택될 수 있다. 이는 주어진 회전속도에서 상기 쉬스 저장조 및 샘플 저장조에 의하여 생성된 압력 수두(pressure head)가 같아질 수 있다는 것을 의미한다. 계속해서 소정의 유량비(flow ratio)는:
을 보장하도록 하는 것에 의하여 달성된다.
각 dr에 대하여 상기 샘플의 메니스커스가 하강하는 소정의 유량비가 주어지면(방사상 위치에서 외측으로 이동), 용적 ASample * dr이 유동하고; 유사하게, 용적 ASheath * dr이 유동한다. 그 결과, 상기 두 유체들이 함께 상기 채널 내로 주입될 모든 r에 대하여 ASheath/ASample은 소정의 쉬스/샘플 유량과 같아야 한다.
도면에 나타낸 바와 같이, 상기 샘플 유동은 하나의 채널을 통하여 상기 반경을 따라 내측으로 연속하는 흐름으로 상기 관통홀로 유도될 수 있다. 이는 상기 공급 채널(feeding channel)로부터 포착된 공기를 수세(flushing)하는 소정의 목표를 달성하도록 한다.
상기 도면에 나타낸 바와 같이 하향류 단면적을 감소시키는 것에 의하여 측방(lateral) 및 수직방향들 둘 다에서의 그 이상의 집중이 달성될 수 있음에 주목하여야 한다.
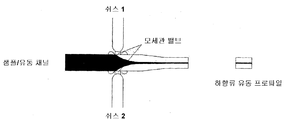
1차원 쉬스. 샘플 흐름을 2개의 대칭 쉬스 흐름들과 접촉시키고 그리고 상기 샘플 흐름에 대한 상기 쉬스들의 유량들을 조작하는 것에 의하여 1차원 쉬스 유동이 생성될 수 있다. 그 결과의 상기 유동채널 내에서의 샘플 흐름은 상기 유동 채널의 바닥으로부터 천정까지 연장되나 그러나 상기 유량에 의하여 측방으로 한정된다. 예를 들면, 쉬스 유체의 총 유량이 상기 2개의 쉬스들 사이에서 균일하게 Qsheath이고, 그리고 상기 샘플 흐름이 Qsample인 경우, 상기 쉬스로 된 샘플 흐름(sheathed sample flow)은
이고, 여기에서 w는 채널 폭이다. 250㎛ 폭의 유동 채널의 사용으로 25㎛ 폭의 1차원 쉬스를 수득할 수 있다.
도 10에 나타낸 바와 같이 원심 포맷의 구현은 간단하다. 쉬스(1 및 2)들이 상기 쉬스 채널들을 상기 유동 채널에 연결하는 2개의 모세관 밸브들에서 중단되는 단일 쉬스 유체 저장조로부터 공급될 수 있다. 계속해서 샘플이 상향류 위치로부터 상기 유동 채널을 억제하고, 그리고 상기 메니스커스가 상기 쉬스들의 노출된 메니스커스들을 통과하는 경우에, 3개의 유체들 모두가 흐르게 된다. 상대적 임피던스들은 쉽게 조작될 수 있다. 예를 들면, 상기 샘플 채널의 상향류 부분은 크기에 있어서 상기 접점의 근처에서 보다 훨씬 더 작아서 상기 쉬스 채널들 보다 더 높은 임피던스를 생성할 수 있거나; 또는 구불구불하게 되어 더 큰 길이의 덕분으로 훨씬 더 큰 임피던스를 가질 수 있다.
채널 벽들에서의 피쳐들(스트라이프들(stripes))로 인한 액체 회전 이 방법에서는, 샘플 흐름들과 쉬스 흐름들이 상기 샘플 흐름이 상기 쉬스의 흐름 보다 명백하게 더 낮은 유량으로 표준 "티(T)" 접점에서 결합된다. 이와 같은 경우에서, 상기 샘플은 초기에 우선적으로 얇은 리본(thin ribbon) 내의 하나의 벽에 달라붙는다. 상기 채널의 상기 바닥 및 천정 내에 위치되는, 상기 흐름에 대하여 45°의 각도로의 "스트라이프들"의 설치는 순환 운동(circulatory motion)을 야기하도록 작용한다. 이는 상기 샘플 흐름을 상기 벽으로부터 그리고 상기 채널의 중심 쪽으로 끌어낸다. 대략적으로 타원형인 코어 유동(core flow)은 그의 위치 및 면적이 상기 상대적인 유량들 및 스트라이프들의 수의 함수로 형성된다. 상기 스트라이프들의 폭, 깊이 및 간격은 상기 채널의 깊이와 동일한 정도의 크기이다. 전형적으로, 상기 채널은 또한 넓이에 비해 보다 더 얕다.
도 11에 나타낸 바와 같이 원심 포맷의 구현은 간단하다. 상기 쉬스 유체와 샘플 유체들이 모세관 밸브들에서 존재하고; 충분한 RPM으로의 가속에 의하여, 두 밸브들이 극복되고 그리고 액체들이 합쳐지게 된다. 쉬스와 샘플 유동을 결합하는 다른 경우들에서와 마찬가지로, 상향류 임피던스 및 압력들이 쉽게 조작되어 소정의 유량을 생성할 수 있다.
완전 2차원 쉬스 유동. 완전 2차원 쉬스 유동을 도입하는 것이 또한 가능하다. 이 방법에 있어서, 1차원 쉬스 유동이 먼저 생성된다. 계속해서 상하로부터의 쉬스 흐름들의 도입이 수직 방향의 상기 샘플 흐름을 압축하도록 작용하여 완전 2차원 쉬스를 생성한다.
관성 집중(
inertial
focusing
)
"관성"으로 정의되는 여러 방법들이 있다. 이들은 앞서와 같이 단순히 상기 액체의 흐름 내에서 형성되는 유동 경로들에 대하여서가 아닌 상기 입자들 자체의 다양한 불연속의 정도에 의존하여 집중을 생성한다. 일부 관성 방법들은 또한 마찬가지로 집중된 흐름들의 생성으로 인한 집중 구성성분(focusing component)을 갖는다. 이들 방법들 거의 모두는 신속한 분석들에 대하여 요구되는 범위까지 명백하게 확장될 수 없는 매우 적은 유량들, 예를 들면, 1분 이내에서 수백 ㎕의 액체의 흐름에서 작동한다. 이들 유동 방법들의 거의 대부분의 2차적인 문제는 구조들의 크기들이 집중되어야 할 상기 입자들의 크기들의 수준에 있기 때문에, 제조 요건(fabrication demands)들이 단기(near-term) 또는 중기(mid-term) 내에 대량생산(high-volume manufacture)을 기대할 수 있는 합리적인 수준 너머에 있다는 것이다.
미소유체 디스크에서 실행되는 관성 집중 방법을 도 15에 나타내었다. 이 방법은 유동 흐름(flow stream) 내의 확장(expansions) 및 수축(contractions)을 사용하여 샘플 흐름을 집중하는 효과를 갖는 와류(vortices)를 유발시킨다. 5.5㎖/시간 이하(≤5.5㎖/시간)의 총 유량 및 1:10의 샘플:쉬스 비율에 대하여, 50㎛ 폭 * 53㎛ 깊이 및 300㎛ 길이의 채널들로 연결된 350㎛2 및 53㎛ 깊이의 다중의 수축/확장들을 갖는 구조는 상기 샘플을 대략적으로 원통형의 코어(직경 약 8 내지 20㎛) 코어로 집중시키는 효과를 갖는다.
이는 제조 및 실행의 관점에서 상당히 매력적이다: 모든 피쳐들이 하나의 덮개로 밀봉될 수 있는 한 부분 내에 존재한다. 상기 쉬스 및 샘플 유체들은 모세관 밸브들을 사용하여 전형적인 "티(T)" 접점 내에 함께 가져올 수 있다.
검출 구체예들
비드-기반 면역분석들 등과 같은 일부 응용들에서, 유동 세포분석 검출에 의해 제공되는 각 입자에 대한 상세한 정보는 필요치 않다. 싱글-플렉스 면역분석(single-plex immunoassay)을 위하여는, 단지 단일의 매개변수인 형광 세기(fluorescence intensity)만이 중요하며: 이는 상기 비드 표면에의 형광 라벨(fluorescent labels)들의 결합에 직접적으로 의존하며 상기 분석물질 농도를 정량적으로 반영한다. 이들 경우들에 있어서 - 비록 이들 사이에 물론 통계학적 변동들이 존재하기는 하나 - 모든 비드들은 근본적으로 동일하며, 개별적으로 측정되어야 할 필요는 없다. 비드들이 집합(aggregate)으로 측정될 수 있는 경우, 전체 시스템 설계에서 매개변수들의 수가 완화된다: 상기 장치는 검출 동안 더 이상 회전할 필요가 없고; 농도 및 비드/검출 용적 크기들이 다중 계수를 최소화하도록 맞추어야 할 필요가 없고; 검출기의 표본추출비율이 더 이상 높아야 할 필요가 없다. 이들 제한들을 제거하는 것에 더해, 대량 검출(bulk detection)은 신호-대-잡음의 증가를 허용한다: 디스크의 작은 영역 내에서의 많은 비드들을 동시적으로 검출하는 것에 의하여, 전체 형광 신호가 증가하고 그리고 배경에 대한 형광 신호의 비율이 흐름 내의 단일-입자 검출에 비하여 훨씬 크다.
비드들의 대량의 측정에 있어서, 비드들은 상기 디스크의 내부 표면에 대하여 부동화(immobilized)될 수 있다. 이는 여러 방법들로 수행될 수 있다:
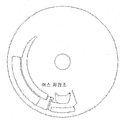
1. 원심분리를 통한 펠릿화
2. 채널들의 협착에서의 포착
3. 필터 상에서의 포착
4. 자성화(magentism)
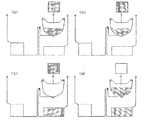
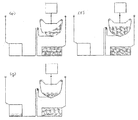
도 13a는 비드들의 대량의 검출에 앞서 원심분리를 통한 펠릿화의 실행을 나타내고 있다.
상기한 면역분석 프로토콜의 매개변수들을 사용하여, 상기 분석은 7.5㎛의 크기의 1000개의 비드들을 제공할 수 있다. 구형 입자들의 충진된 베드가 차지하는 최소 용적은:
이다.
d = 7.5㎛의 크기의 NP = 1000 입자들에 대하여는, 이 용적은 약 3E5㎛3이다. 이들 입자들이 60㎛ 깊이의 작은 용적으로 펠릿화된 경우, 상기 비드(대략 7 내지 8개의 비드들의 깊이)들이 차지하는 면적은 측면 상에서 약 5e3㎛2 또는 71㎛이다. 이는 저가의 광학장치들을 사용하여 쉽게 탐색될 수 있다.
도 13a에서, 도 5의 세척 시스템을 사용하여 분석이 수행된다. 상기 세척된 비드들을 유동 채널 내로 주입하기 보다는 오히려, 상기 비드들은 제2 펠릿화 챔버 또는 입자 수령 구조에 전달된다. 상기 펠릿화 챔버는 그의 최외측 지점에 작고, 얕은 검출 영역이 존재하도록 형상화된다. 이러한 방법으로 형광 비드들이 그의 전체가 상기 광학 시스템에 의하여 탐색될 수 있도록 원심분리에 의하여 펠릿화되는 것에 의하여 작은 면적으로 압축되어 단일 비드의 형광 신호에 비해 1000배의 형광 신호의 증폭의 결과를 가져온다. 본 발명이 훨씬 큰 크기의 비드들에 대한 응용들에서 사용될 수 있음이 예상된다. 심지어 0의 증폭(10개의 비드들)이 명백해져서 보다 큰 비드들/보다 많은 비드들에 대한 신호/잡음(signal/noise) 개선되도록 한다.
그의 최대 50% 등과 같은 상기 용적의 분획을 탐색하는 것에 의하여 비드들의 손실에 대한 제어가 수행될 수 있다.
잘-분리된 방출 피크들로의 차등 염색(differential staining)을 통하여 멀티플렉스화된 분석들이 수용될 수 있다. 예를 들면, 파이코에리쓰린(phycoerythrin: PE) 및 FITC(Fluorescein isothiocyanate: 플루오레세인 이소티오시아네이트) 둘 다는 488㎚에서의 흡광에 의하여 자극될 수 있다. 상기 PE 발광 피크는 575㎚에서 이고, 그리고 상기 FITC 발광 피크는 520㎚에서 이다. 이들은 당해 기술분야에서 숙련된 자들에게 공지된 광학 필터링 방법(optical filtering methods)들을 사용하여 스펙트럼-분광(spectrally-resolved)될 수 있다.
필터의 사용은 앞서와 유사하게 간단하며, 여기에서 상기 비드들이 필터 상에서 농축되고 그리고 계속해서 광학 시스템을 사용하여 대량으로 탐색된다. 자성들이 사용되어 비드들을 단일 검출 지점으로 끌어들일 수 있음은 또한 이해될 수 있을 것이다.
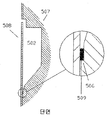
도 13b 및 도 13c들은 도 13의 대량 펠릿화 및 검출실의 평면도 및 단면도를 보다 상세하게 나타낸다. 상기 구조는 상기 저장조(502)의 본체(main body)로 인입되는 채널(501)을 경유하여 충진되고; 배출되는 공기는 채널 및 배기구(503)를 통하여 배기된다. 상기 저장조의 상기 본체로부터 아래(방사상으로 외측)는 높은 회전속도들에서 상기 디스크 상에서 외측으로 침강되는 비드들을 이동시키도록(funnel) 설계된 원추형의 구조이다. 이는 변화하는 크기들의 다수의 "깔대기(cones)"들로 구성될 수 있다. 예를 들면, "급격한(steep)" 깔대기는 큰 덩어리의 두께로부터 수백 미크론(504)의 두께까지 상기 용적을 줄이고, 후속하여 훨씬 더 점진적인 경사(505)로 되도록 할 수 있다. 이러한 급격한 그리고 얕은 조합은 변화하는 비드 갯수들이 상기 디스크의 위에서 볼 때('평면' 보기('plan' view)) 대략적으로 동일한 면적을 차지하도록 하는 것을 보증한다. 형광 신호는 비드들의 가시화된 면적(viewed area)에 비례하고; 입사 방사(incident radiation)가 비드들의 처음 몇 개의 층들 아래를 투과함에 따라 상기 비드들에 의하여 강하게 산란되기 때문에, 표면 아래의 상기 비드 베드의 덩어리는 측정가능한 형광 신호를 제공하지 못한다.
이러한 특징 - 상기 충진된 비드들로 인한 강한 광 산란 - 으로 인하여, 나타낸 상기 검출 구조는 또한 추가로 매우 얇은 최종 침강 "핑거(finger)"(506)를 갖는다. 이는 전형적으로 60㎛가 아닌 50㎛ 깊이 및 약 100㎛ 폭 * 약 300㎛ 길이이다. 그 정화한 규격들은 중요하나, 그러나 완만한 모서리들이 영역(506) 내에 공기 - 초기에 상기 챔버 내에 존재하는 - 가 기포(bubble)로서 포착되는 것을 방지하는 데 유용하다.
임상화학 응용(
Clinical
Chemistry
Applications
)
상기 장치에 공급되는 바 대로의 전혈 또는 상기 전혈 샘플로부터 분리된 혈장 둘 다에 대하여 표준 임상화학 분석들이 수행될 수 있다.
대상의 분석물질의 존재 또는 부재 중에서 기질로부터 착색되거나 또는 형광의 생성물들을 생성하기 위하여 효소 시스템들을 활용하는 발색원(chromogenic) 또는 형광원(fluorogenic) 화학을 포함하여 다양한 분석화학들이 사용될 수 있다. 이들 분석 시스템들에는 대량 형광 측정(bulk fluorescent measurement); 미소유체 디스크 상 또는 반사 매질(reflective media)의 존재 중에서의 광학 큐벳(optical cuvette)을 통한 투과에서의 광학 밀도(optical density) 또는 흡광 측정; 또는 시약들로 함침되고 그리고 검출에 적절한 생성물들을 방출하는 매트릭스들로부터의 반사도 측정(reflectance measurements)을 통하는 것을 포함하여 다양한 방법들이 사용될 수 있다.
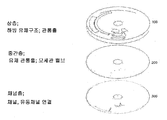
본 발명에 따른 매트릭스를 제조함에 있어서, 검출, 보다 바람직하게는 생물학적 유체 샘플의 구성성분의 양을 정량하는 데 유리하게 사용되는 시약들이 상기 매트릭스 내로 함침된다. 비-제한적인 예들로서, 본 발명에 따라 일련의 결합된 반응들을 사용하여 크레아티닌(creatinine)이 검출되며, 여기에서 크레아티닌은 먼저 크레아티닌 이미노하이드로라이즈(creatinine iminohydrolyse)에 의하여 N-메틸히단토인(N-methylhydantoin) 및 암모니아로 전환되고; 연쇄반응(cascade)의 최종 단계는 하이드로겐퍼옥시다아제(hydrogen peroxidase) 및 예를 들면 기질로서 테트라메틸블루(tetramethyl blue)를 사용하는 생성된 과산화수소의 검출가능한 생성물로의 전환이다. 반사 매트릭스(reflectance matrix)의 제조에는 상기 미소유체 디스크 내로의 삽입에 앞서 다중의 함침 및 건조가 포함된다.
상기 매트릭스들을 제조하는 데 사용되는 재료들에는 유도체화된 나일론(derivatized nylons), 니트로셀룰로오스(nitrocellulose), 유리섬유(fiberglass) 및 폴리에스테르(polyesters), 가장 바람직하게는 0.2 내지 2.0㎛의 기공크기(pore size)를 갖는 것, 전형적으로는 약 0.8㎛의 기공크기를 갖는 양으로-하전된 나일론 매트릭스(positively-charged nylon matrix)들이 포함되나, 이들로 제한되는 것은 아니다. 매트릭스의 기공크기의 상한은 혈액세포가 상기 매트릭스 내로 유입되는 것을 억제하거나 또는 방지하도록 선택된다. 상기 매트릭스는 샘플계량실(sample metering chamber)로부터 인도되는 채널과 유체 접촉하게 되는 분석실(assay chamber) 내에 위치된다. 상기 매트릭스에는 혈액 샘플 내의 분석물질의 양에 비례하여 검출가능한 생성물을 생성하는 부동화된 시약들이 더 함침된다. 가장 바람직하게는, 상기 검출가능한 생성물은 착색된 생성물, 즉, 검출가능한, 가장 바람직하게는 가시광 파장에서 빛을 흡수하는 생성물이다.
시약 패드(reagent pad)가 도 14에서와 같이 설치될 수 있다. 상기 디스크의 유체 표면(fluidic surface) 내에 형성된 요홈이 샘플에 의하여 배출되는 공기의 제거를 위한 하나 이상의 공기-배출 채널과 마찬가지로 샘플을 이송하기 위한 채널로 형성된다. 상기 요홈 내로 가압되는 경우에 액체-기밀 억지-끼워맞춤(liquid-tight press-fit)이 수득되도록 하여 실질적으로 이 요홈과 동일한 측방 규격을 갖는 패드 캐리어(pad carrier)가 형성된다. 상기 디스크의 상기 채널들 및 공기 배출 채널들은 상기 패드 캐리어의 하부표면 상의 대응하는 채널 및 공기0배출 채널로 밀봉된다. 상기 패드 캐리어의 하부표면은 또한 그의 상부표면과 연결되는 큰 관통홀을 갖는 샘플을 위한 "보울(bowl)"을 포함한다. 이 상부표면에는 상기 시약-함침 반사 패드가 부착된다.
실시예들
본 발명에 따른 미소유체 디스크들의 가능한 구성을 도 15에 나타내었다. 이 미소유체 디스크는 3개의 주요 구성요소들: 즉, 저장조들, 채널들, 피동 밸브들 및 액체 시약 또는 건조된 시약들의 형태의 시약들 등과 같은 유체 구조들의 대부분을 포함하는 유체층(fluidic layer)(100); 주로 관통홀을 포함하는 얇은 중간층(200); 및 하부 또는 채널층(300);들로 이루어진다. 200 내의 상기 관통홀들을 경유하여 100과 300 사이에 연결이 이루어진다. 이러한 구성은 액체 '크로스오버(crossovers)'를 요구하는 3차원-구조를 만드는 경우에 유용하며, 여기에서 채널들은 서로 연결되어야 한다.
어떻게든 이러한 구성으로 한정되는 것이 아님은 인식되어야 한다. 미소유체 디스크들은 별도의 채널들 또는 관통홀들 없이 필수적으로 무-피쳐의 층(featureless layer) 또는 얇은 필름으로 유체층을 밀봉하는 것에 의하여 형성될 수 있다. 하나의 구성에서 하나의 무-피쳐의 밀봉 필름 및 하나의 디스크가 제공된다.
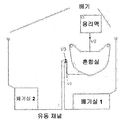
면역분석 및 임상화학 장치
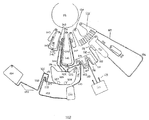
본 발명의 디스크를 도 16에 나타내었으며, 여기에서는 단지 상기 유체층(100)을 나타내었다. 이 디스크 구성은 구조화된 기질 및 무-피쳐의 밀봉 필름으로 이루어진다. 이 디스크는 2가지 형태의 분석들: 즉, 하나의 면역분석, 이는 다중-착색된 비드들 또는 다중-착색된 라벨들의 사용을 통하여 멀티플렉스화될 수 있음; 및 반사도 검출을 위하여 개발된 임상화학 분석을 수행하도록 설계된다. 상기 디스크는 구멍(hole) 또는 상기 디스크를 회전모터의 허브(hub)에 포지티브 락(positively lock)이 걸리도록 설계되는 다른 피쳐일 수 있는 중심의 마운팅 피쳐(central mounting feature)(101)를 갖는다. 이 디스크는 3가지 독립적인 샘플들에 대하여 분석을 수행하도록 설계되고; 하나의 샘플은 분석구조(102)의 세트로 측정된다.
중심의 피쳐(101)는 상기 디스크가 상기 회전모터에 결합될 수 있는 단지 하나의 방법이며; 다른 반경에서의 결합 피쳐들, 예를 들면, 회전자(rotor) 상에 대칭적으로 위치되는 핀들이 상기 미소유체 디스크 상의 구멍들에 맞춰질 수 있음을 주목하여야 한다.
비록 이 디스크가 전혈 샘플들과 마찬가지로 수작업으로 피펫된(manually pipetted) 완충제들 및 액체 시약들에 대한 사용을 위하여 설계되기는 하였으나, 블리스터 파우치(blister pouches)들 또는 주머니(bags)들 또는 다른 액체 시약 수단들이 사용될 수 있고, 그리고 혈액-인출(blood-draw) 및 응용 장치들을 사용하거나 또는 손가락을 천공(lancing)하고 그리고 그 결과의 혈액 방울을 상기 디스크의 포트에 적용하는 것에 의한 전혈의 응용이 수행될 수 있음은 인식되어야 한다.
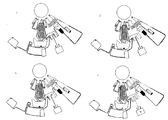
도 17은 하나의 샘플-처리 분석 구조(sample-processing assay structure)의 상세한 구성을 나타내고 있다. 상기 지정된피쳐들이 이들의 기능과 관련하여 기술될 것이다. 도 8은 상기 미소유체 분석 구조의 기능을 나타내고 있다.
상기 디스크는 저장조(138) 내에 존재하는 재현탁 완충제 및 저장조(145) 내의 용리액 완충제를 포함한다. 시제품들에 있어서는, 이들 완충제들인 상기 디스크 상으로 피펫될 수 있다. 생산에 있어서, 이들 완충제들은 블리스터 파우치들 내에 존재할 수 있다. 블리스터 파우치들은 하기의 다양한 방법들로 개방될 수 있다:
ㆍ 회전에 의하여 개방되는 취약성 시일(frangible seals). 시약 용기 내에서 발생되는 압력이 상기 파우치들 내의 약한 시일(weak seals)들이 개방되도록 작용한다.
ㆍ 기구(instrument)에 의한 파열(rupture). 상기 디스크는 상기 기구의 회전허브(rotary hub) 상의 구조들이 상기 블리스터들을 천공하는 것을 허용하는 메카니즘을 갖도록 설계될 수 있다.
ㆍ 내장된 핀들/날카로운 표면들에 의한 파열. 제조 동안에 추가되거나 또는 플라스틱 내로 직접적으로 주조된 내장된 핀들이 상기 저장조들의 외측 모서리 내에 존재할 수 있으며; 충분한 속도로 회전시키는 것에 의하여, 이들 핀들에 대한 상기 파우치들의 힘이 상기 파우치들을 파열시킨다.
사용자에 의하여 혈액이 혈액 인입 구조(blood entry structure)(103)의 포트(104)에 공급되며, 이는 회전에 앞서 부주의로 다른 채널들 및 구조들 내로 혈액이 흘러들어가는 것을 방지하도록 설계된 텍스쳐드 표면(textured surface)을 가질 수 있다. 이들 구조들은 소정의 유동 경로에 대하여 수직인 좁은 "트렌치(trenches)"들을 포함할 수 있으며, 이들은 회전에 앞서 상기 표면의 의도치 않은 습윤(wetting)을 방지하도록 작용한다. 상기 인입 구조 내에 공기 배출 포트(air exhaust port)가 존재하거나 또는 달리 배출된 공기가 다른 유체 채널들을 통하여 배기된다.
상기 디스크는 상기 회전모터 상에 설치되고 그리고 회전 프로파일(spin profile)이 개시된다.
초기 회전속도 W1(전형적으로는 200 내지 400RPM)에서, 원심력에 의하여 상기 혈액이 구동되어 상기 인입 구조를 채우고 그리고 계속해서 채널(105)로 진입하게 된다. 선택적으로, 채널(105)은 그 내부에 위치되어 103 내에 잔류하는 내측 메니스커스가 상기 반경에 대하여 수직인 형상으로 안정화될 때까지 혈액의 더 이상의 유동을 정지시키도록 하는 모세관 밸브(106)를 가질 수 있다. W2>W1으로의 회전속도를 증가시켜 밸브(106)을 극복하도록 한다; 상기 회전속도는 다시 낮추어질 수 있다.
이제 상기 gfdor은 원심력으로 분리컬럼(separation column)(107) 내로 펌핑되고, 이는 채널(108)을 경유하여 오버플로우챔버(overflow chamber)(109)에로 연결된다. 챔버(109)는 배출되는 공기를 배기하기 위한 수단을 가지며, 상기 디스크의 중심에 가까운 분리구조(separation structure)(107)의 영역들이 또한 배기수단을 가질 수 있다. (패널 e 내지 f). 동시에, 138 내에 존재하는 재현탁 완충제가 모세관 밸브(139)를 통하여 채널(140 및 141)들 내로 방출된다. 채널(141) 내의 모세관 밸브(142)는 그 채널을 통한 그 이상의 유동을 부여하고; 140을 통한 유동은 오버플로우 저장조(overflow reservoir)(143) 내로 지속되며, 저장조(138) 내의 완충제의 잔여의 용적을 정밀하게 결정하는 데 유용하다. 이를 패널 e 내지 f들에 나타내었다.
회전속도가 W3>(W1, W2), 전형적으로는 1000 내지 3000RPM의 범위 이내로 증가하여 상기 혈액의 혈장과 충진된 세포 분획으로의 분리를 수행하도록 한다. 상기 분리 구조에서 임의의 과량의 혈액은 구동되어 상기 오버플로우챔버(109)에로 완전히 들어간다. 패널 g는 상기 분리 과정의 개시(onset)를 나타내며, 혈액 세포들은 107의 외측 표면 쪽으로 충진된다.
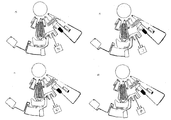
상기 혈장의 분리 과정 동안, 모세관 밸브(142)가 재현탁 완충제를 방출하고, 이는 채널(144)를 통하여 상기 혼합실(126)으로 전달된다. 혼합실 내에는 건조된 시약들, 예를 들면, 건조된 면역-변성된 비드(immuno-modified beads)들(127) 및 건조된 형광염료(fluorescent dye)(128)가 존재할 수 있다.
혈장 분리가 지속된다. 이러한 분리 동안, 혈액 및 혈장은 상기 분리용적(107)에 연결된 측방 채널(side-arm channel)(110) 내에 존재하나, 그러나 모세관 밸브(111)에 의하여 보류된다.
또한 분리 동안, 상기 용리액 완충제에 대한 상기 모세관 밸브(146)가 상기 재현탁 완충제와 유사하게 원심력으로-개시된 압력(centrifugally-initiated pressure)에 의하여 극복되어 과량의 완충제의 채널(147)을 통한 저장조(148) 내로의 오버플로우를 유도한다.
패널 j에서, 회전속도가 순간적으로 W4>W3로 증가되고 그리고 전형적으로 보다 완만한 수준으로 늦추어진다. 이는 모세관 밸브(111)을 극복하고 그리고 107의 내부로부터 상기 채널(110)이 상기 격실(이 지점에서 공기가 110으로 인출되어 상기 보류된 충진된 혈액 세포들로부터 상기 혈장이 분리됨)에 연결되는 수준까지 혈장이 따라내어지는 것을 허용한다. 상기 혈장은 먼저 계량저장조(metering reservoir)(114) 내로 유동하고 통로(passageway)(115)를 통하여 제2 계량저장조(121)로 오버플로우되고 그리고 용적(122)으로 오버플로우된다. 저장조(114)는 반사도-기반 분석의 수행을 위하여 혈장 분획을 계량하고, 한편 저장조(121)는 면역분석에 적절한 용적을 계량한다. 각 계량된 용적은 모세관 밸브(각각 117 및 124)에 의하여 보류된다.
패널 l에서, 회전속도가 W5로 촉진되고, 계속해서 늦추어져서 모세관 밸브(117 및 124)들을 극복하도록 한다.
밸브(117)을 통하여 통과하는 상기 혈장은 채널(118)을 경유하여 반사 구조(reflectance structure)(119)에로 이동하고, 여기에는 상기 혈장 내의 분석물질에 기초하여 형광 또는 착색된 생성물을 생성하기에 적절한 시약들이 내장되어 있다. 배출된 공기는 배기구(120)을 통하여 배기된다.
밸브(124)를 통하여 통과하는 상기 혈장은 채널(125)을 경유하여 상기 혼합실(126)에로 유입된다.
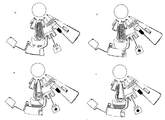
회전이 늦추어진다. 패널 n에 나타낸 바와 같이 상기 디스크를 늦추고 그리고 가속하는 것에 의하여 전형적으로는 1000 내지 10,000RPM/초로 그러나 100 내지 500RPM의 전체적으로 저속으로 완만한 교반이 수행된다. 이러한 교반은 "단향성(unidirectional)"이 될 수 있으며, 즉, 상기 디스크는 그의 500RPM으로부터 감속디어 휴지되고 계속해서 천천히 다시 500RPM으로 가속되고; 그리고 계속해서 다시 정지되고, 그리고 이들이 순환되도록 한다. 또는 상기 교반은 매 반-사이클(half-cycle) 마다 디스크 회전방향을 바꿔서 이-방향성(bi-directional)이 될 수 있다. 단방향성 교반은 상기 채널들(129 및 131)이 상기 격실로부터 빠져나오는 방향에 대하여 대향하는 접선방향(tangential direction) 내에서의 높은 가속 또는 감속을 적용하는 것에 의하여 채널들(129 및 131)에 의하여 상기 혼합실의 출구(바닥)에 부착되는 상기 모세관 밸브들에 대한 압력과도현상(pressure transients)을 최소화하도록 하는 데 특히 유용하다.
패널 o에서는, 상기 시약들이 완전히 재용해되고 그리고 샘플 및 재현탁 완충제와 혼합되고 그리고 상기 비드들이 이제 용액 내에 균질하게 분산된다. 상기 반사 구조에 있어서, 검출가능한 생성물을 유도하는 화학반응이 지속된다. 상기 혼합실 내에서 상기 면역분석이 배양될 때 상기 디스크는 연속적으로 교반될 수 있다.
패널 p에 나타낸 바와 같이, 상기 혼합실 내의 상기 비드들을 펠릿화시키기 위하여 회전속도가 W5, 전형적으로는 500 내지 2500RPM으로 증가된다.
패널 q에서, 상기 반사 패드 내에서 검출가능한 반응 생성물을 생성하는 상기 화학반응이 완료된다. 상기 디스크가 낮은 속도로 회전하는 동안 1 내지 수개의 파장들에서 반사도의 측정에 의한 검출이 일어날 수 있다.
후속하는 회전속도의 감소를 수반하여 회전속도의 W6로의 촉진이 모세관 밸브(130)을 극복하도록 하고 그리고 상기 혼합실 내에서 상기 침강된 비드들의 상청액이 채널(133)을 통하여 폐기저장조(134)로 이동하도록 하는 것을 허용하고, 이는 좁은 채널(135) 및 포트(136)에 의하여 배출된다. 패널 r에 나타낸 바와 같이, 상기 저장조(134)는 소 용적의 상청액이 상기 혼합실 내에 보류되도록 하는 것과 같은 크기가 될 수 있다: 134가 채워짐에 따라, 마침내 액체가 채널(135) 내로 상승되고, 그리고 이 액체의 메니스커스가 126 내에 보류된 유체의 메니스커스와 방사상으로 동일한 위치에 있을 때, 유체 이동이 정지된다.
패널 r에서, 회전속도가 속도 W7로 촉진되고 그리고 용리액 완충제가 모세관 밸브(150)을 통하여 채널(151) 내로 그리고 거기에서 상기 혼합실 내로 방출된다. 상기 폐기실이 채워져 있고 그리고 상기 공기 배출 채널(135)이 좁은 직경이고 그리고 상기 혼합실의 방사상 내측으로 연장되기 때문에, 유체들은 채널(133)을 통하여 이동하여 폐기되지 못하고, 그리고 초기 샘플 + 재현탁 용적의 용적 보다 더 큰 용리액 용적이 수용될 수 있다. 이를 패널 t에 나타내었다.
완만한 교반이 상기 비드들을 재현탁시켜 패널 u에서 상기 혼합실 내의 상기 용리액 완충제 내에 비드들이 균질하게 분포된 최종 상태가 되도록 한다.
마지막으로, 회전속도가 속도 W7로 촉진되고 그리고 계속해서 감소되어, 모세관 밸브(132)를 극복하도록 하고 그리고 상기 비드-수반 유체가 채널(152) 내로 흐르도록 하는 것을 허용한다. 152의 하나의 영역이 상기 검출 시스템에 의한 검사를 위한 고정된 반경에서 접선방향으로 배치되는 유동 채널 영역(153)이다. 이 유체는 배기 포트를 갖는 폐기저장조(154) 내로 더 구동된다. 유체가 153을 통하여 유동됨에 따라 검출이 일어난다. 필요에 따라, 추가의 교반 단계들이 사용되어 상기 혼합실 내에 잔류하는 용액 내의 상기 비드들의 과도한 침강을 방지하도록 할 수 있다. 이 단계에서 낮은 속도에서 출발하고 그리고 실질적으로 일정한 유량이 유지되도록 증가하도록 회전속도가 변할 수 있다.
그의 폐기실을 갖는 상기 유동 채널을 통일된 대량 펠릿화 챔버 - 이는 그 자체가 폐기실로 작용함 - 로 대체하는 것이 용이하며, 여기에서 검출 단계가 고속 원심분리(예를 들면, 30초간 7200RPM)에 후속하는 검출을 포함하는 것은 이해될 수 있을 것이다.
쉬스
유동
도 19는 쉬스 유동의 생성에 적절한 미소유체 디스크를 나타내고 있다. 여기에서는 도 5의 세척 방법과 함께 설명된다. 이미 기술된 혼합실, 용리액실, 폐기실 및 모세관 밸브들 및 채널들에 더해, 쉬스 유체를 포함하는 저장조가 모세관 밸브(V4)에 의하여 상기 유동 채널 및 혼합실로부터 분리되어 존재한다.
일체화된 디스크 작동에서의 초기 단계에서 이러한 쉬스 유동 저장조로 구동되기 이전에 상기 쉬스 유체가 큰 시약 파우치 또는 블리스터 내에 존재할 수 있다는 것이 이해되어야 한다.
앞서의 실시예에서와 같이 세척 단계들이 진행된다. 회전속도가 촉진되어 상기 혼합실로부터 상기 비드-함유 용액이 밸브(V3)를 통하여 상기 유동 채널 내로 방출되고; 동시에 쉬스 유체가 구동되어 밸브(V4)를 지나서 상기 유동 채널 내에서 상기 샘플 용액과 결합된다. 이를 도 20에 나타내었다. 쉬스 유동에 대한 유체 결합들의 구성에 대한 상세한 설명은 하기와 같다.
앞서 설명한 바와 같이, 쉬스 유동에 대한 소정의 유량비는
에 의해 결정된다.
도 20은 10:1의 쉬스 유동을 제공하기 위한 디스크 배치를 나타내고 있다. 상기 쉬스 저장조는 상기 혼합실의 깊이의 2배이다. 반경 위치가 증가함에 따라 쉬스 저장조가 좁아지고 - 그리고 단면적이 감소하고 - 같은 방법으로 상기 혼합실이 좁아지고 따라서 상기 유량비가 유지된다.
상기 미소유체 디스크에 대한 쉬스 유동의 실행은 앞서 제공된 방법들을 사용할 수 있으며, 여기에서 쉬스와 샘플 용액들 간의 접점의 상세들이 쉬스 발생(sheathing)의 형태를 결정한다. 예를 들면, 도 15에서와 같은 3개-부분 디스크를 생성하는 것에 의하여 도 2에 나타낸 전체 구조와 도 12의 비-동축 쉬스의 조합이 수행될 수 있다. 이를 도 21에 나타내었다. 분석되어야 할 용액은 하부 채널 층 내에서 상기 혼합 채널로부터 이것이 주 흐름 채널과 만나는 지점까지 중간층의 관통홀을 통하여 이동하게 된다. 이 관통홀은 도 22에서 밸브(V3)로서 작용할 수 있다. 밸브(V4)를 통하여 쉬스 유체를 방출하는 속도 촉진이 사용되어 상기 샘플의 유동을 촉발시키고, 그리고 집중된 쉬스 유동이 일어난다.
이들 기본 아이디어들에 대한 많은 변형들이 존재함은 인식되어야 한다. 예를 들면, 사이펀의 사용이 모세관 밸브들을 보충할 수 있다. 사이펀은 또한 모세관 밸브들과 함께 사용될 수 있다: 모세관 밸브들은 원치 않는, 낮은 회전 속도들에서의 사이펀의 '마중하기(priming)'을 방지할 수 있으며; 밸브 분출(bursting)은상기 디스크 상에서의 다른 단계의 일부가 될 수 있고; 후속하는 상기 디스크의 늦춤(slowing)은 상기 사이펀의 마중하기를 유도하고 후속하여 유동을 유도한다.
도면들을 참조하여 기술된 본 발명의 구체예들은 컴퓨터 장치 및/또는 컴퓨터 장치에서 수행되는 공정들을 포함한다. 그러나, 본 발명은 또한 컴퓨터 프로그램, 특히 본 발명을 실행하도록 적용되는 캐리어(carrier) 상에 또는 그 안에 저장된 컴퓨터 프로그램들까지 연장된다. 상기 프로그램은 원시 코드(source code), 목적 코드(object code) 또는 부분적으로 컴파일링된 형태 또는 본 발명에 따른 상기 방법의 실행에서 사용하기에 적절한 임의의 다른 형태 등과 같은 원시 코드와 목적 코드 중간의 코드(code intermediate source and object code) 형태가 될 수 있다. 상기 캐리어는 ROM, 예를 들면, CD ROM, 또는 자기기록매체(magnetic recording medium), 예를 들면, 플로피 디스크(floppy disk) 또는 하드 디스크(hard disk) 등과 같은 저장매체를 포함할 수 있다. 상기 캐리어는 전기 케이블 또는 광 케이블을 통하여 또는 무선이나 다른 수단들에 의하여 전달될 수 있는 전기신호 또는 광신호일 수 있다.
본 상세한 설명에서 용어 "포함하는(comprise, comprises, comprised 및 comprising)"들 또는 이들의 임의의 변형 및 용어 "포함하는(include, includes, included 및 including)"들 또는 이들의 임의의 변형들은 전체로 상호호환가능한 것으로 고려되어야 하며, 이들은 모두 가능한 가장 광범위한 해석 및 그 반대를 제공할 수 있다.
본 발명은 앞서 기술된 구체예들로 제한되는 것은 아니나, 그러나 구성 및 상세 둘 다에서 변화될 수 있다.
Claims (20)
- 회전모터;
상기 모터를 제어하기 위한 수단;
상기 회전모터에 결합되고 그리고 적어도 하나의 입자-세척 구조 및 상기 입자 세척 구조 내에서 세척된 입자들을 수령하도록 적용된 입자 수령 구조를 제공하도록 적용된 플랫폼; 및
상기 플랫폼이 회전하는 동안 상기 입자 수령 구조 내의 세척된 입자들의 검출을 위한 검출영역;
을 포함하는 생물학적 샘플들을 처리하기 위한 미소유체 시스템. - 제 1 항에 있어서,
상기 입자들이 상기 생물학적 샘플의 특성들을 대표하는 면역-변성 비드들 및/또는 형광적으로 표지된 면역-변성 비드들인 미소유체 시스템. - 제 1 항 또는 제 2 항에 있어서,
상기 검출영역이 상기 플랫폼이 회전하는 동안 광학시스템에 협력하도록 적용되는 상기 미소유체 시스템. - 상기 전 청구항들 중 어느 한 항에 있어서,
상기 입자 수령 구조가 펠릿화 챔버를 포함하는 상기 미소유체 시스템. - 제 4 항에 있어서,
상기 펠릿화 챔버가 일측단부에서 상기 검출영역이 그의 최외점에서 한정되도록 하는 지점까지 테이퍼된 상기 미소유체 시스템. - 제 5 항에 있어서,
상기 테이퍼 진 단부가 일측단부에서 폐쇄되어 원심력 하에서 상기 채널 내에서 비드들이 침강되는 것을 허용하도록 하는 연장된 얇은 채널부를 더 포함하는 미소유체 시스템. - 상기 전 청구항들 중 어느 한 항에 있어서,
상기 검출영역이 원심분리에 의한 펠릿화에 의하여 상기 입자들이 작은 영역 내로 압축되도록 형성되는 미소유체 시스템. - 상기 전 청구항들 중 어느 한 항에 있어서,
상기 입자들이 원심력의 영향 하에서 회전의 중심으로부터 원위의 벽에 대하여 비드들이 침강하도록 적용된 저장조 내에서 세척되는 미소유체 시스템. - 제 1 항에 있어서,
상기 입자 수령 구조가 유동 채널을 포함하는 미소유체 시스템. - 제 9 항에 있어서,
상기 유동 채널이 다른 채널 분기점들/접점들 없이 상기 세척 저장조로부터 폐기 저장조로 직접적으로 인도되는 미소유체 시스템. - 상기 전 청구항들 중 어느 한 항에 있어서,
상기 세척 구조가 폐기 저장조와 상기 입자 수령 구조 둘 다에로 인도하는 분기된 출구 채널을 포함하는 미소유체 시스템. - 제 11 항에 있어서,
하나의 포트 또는 다른 채널에 의하여 종결되는 하나의 포트 또는 채널이 상기 입자 수령 구조를 통하여 유동하는 유체에 의하여 상기 폐기 저장조로부터 배출된 공기를 배기하도록 적용되는 미소유체 시스템. - 제 11 항 또는 제 12 항에 있어서,
상기 출구 채널의 분기점 내의 모세관 크기와 확장의 기하학적 협착들이 상기 세척 저장조가 유체를 포함하는 경우, 상기 플랫폼의 제1 회전속도에서는 유동에 저항하나 그러나 제2의 보다 높은 회전속도에서는 유체의 유동을 허용하도록 작용하는 미소유체 시스템. - 제 11 항 내지 제 14 항들에 있어서,
상기 출구 채널이 원심력에 대응하여 상기 폐기 저장조 내로 비워지는 경우에 상기 세척 저장조 내에 한정된 용적이 보류되도록 하는 방법으로 상기 세척 저장조의 방사상으로 원위의 벽의 최대 반경 위치 보다 작은 반경에서 상기 세척 저장조로부터 돌출되는 미소유체 시스템. - 제 14 항에 있어서,
상기 보류된 유체가 입자들을 포함하는 미소유체 시스템. - 제 14 항 또는 제 15 항에 있어서,
상기 폐기 저장조가 소정의 샘플 용적과 대략 동일한 한정된 폐기 용적을 포함하는 미소유체 시스템. - 제 16 항에 있어서,
상기 폐기 저장조로부터 배출된 공기를 이송하기 위한 채널이 제공되는 미소유체 시스템. - 제 17 항에 있어서,
상기 채널이 반경 위치 내부에서 하나의 포트 또는 다른 채널에서 종결되는 상기 폐기 저장조로부터 상기 플랫폼이 회전 하에 있고 그리고 세척실이 최대 용적의 작동 유체로 채워져 있는 동안에 상기 세척 저장조 내에서 달성되어야 할 최내 액체 수준으로 방사상으로 내측으로 지향되는 미소유체 시스템. - 제 17 항 또는 제 18 항에 있어서,
상기 저장조의 내용적이 회전 가속 및 감속 하에 있는 동안 상기 유체의 혼합에서 상기 저장조 내의 공기의 사용을 가능하게 하도록 작동 유체의 최대설계용적 보다 더 큰 미소유체 시스템. - 플랫폼을 회전모터에 결합시키는 단계;
상기 플랫폼을 적어도 하나의 입자-세척 구조 및 입자 수령 구조로 구성하는 단계;
상기 입자 세척 구조 내에서 세척된 입자 수령 구조 내로 수령하는 단계; 및
상기 플랫폼이 회전하는 동안 상기 입자 수령 구조 내의 세척된 입자들을 검출하는 단계;
를 포함하는 생물학적 샘플들을 처리하기 위한 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161493234P | 2011-06-03 | 2011-06-03 | |
| EP11168702 | 2011-06-03 | ||
| US61/493,234 | 2011-06-03 | ||
| EP11168702.6 | 2011-06-03 | ||
| PCT/IE2012/000026 WO2012164552A1 (en) | 2011-06-03 | 2012-06-05 | Microfluidic disc for use in with bead-based immunoassays |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140060263A true KR20140060263A (ko) | 2014-05-19 |
Family
ID=47258481
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137033623A KR20140060263A (ko) | 2011-06-03 | 2012-06-05 | 비드-기반 면역분석 내에서 사용하기 위한 미소유체 디스크 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9897596B2 (ko) |
| EP (1) | EP2715357B1 (ko) |
| JP (1) | JP6200419B2 (ko) |
| KR (1) | KR20140060263A (ko) |
| WO (1) | WO2012164552A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019098532A1 (ko) * | 2017-11-17 | 2019-05-23 | 주식회사 엘지화학 | 고상 추출용 마이크로 디바이스 |
| US11260319B2 (en) | 2018-08-21 | 2022-03-01 | Lg Chem, Ltd. | Solid phase extraction method using micro device |
Families Citing this family (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110579435B (zh) | 2012-10-15 | 2023-09-26 | 纳诺赛莱克特生物医药股份有限公司 | 颗粒分选的系统、设备和方法 |
| JP6590697B2 (ja) | 2012-11-07 | 2019-10-16 | サンドストーン ダイアグノスティックス インコーポレイテッドSandstone Diagnostics,Inc. | サンプル処理及び細胞計数のための方法及びデバイス |
| US10197480B2 (en) | 2012-11-07 | 2019-02-05 | Sandstone Diagnostics, Inc. | Methods and devices for processing samples and counting cells |
| US10888862B2 (en) | 2012-12-05 | 2021-01-12 | Radisens Diagnostics Limited | Acceleration-primed valving system for centrifugal microfluidics |
| US10130947B2 (en) * | 2012-12-05 | 2018-11-20 | Radisens Diagnostics Limited | Valving system for use in centrifugal microfluidic platforms |
| CA2897117C (en) | 2013-02-07 | 2021-06-22 | Sandstone Diagnostics, Inc. | Automated sample processing, fluid distribution, and sedimentation assay |
| CA2949151C (en) | 2014-05-16 | 2023-09-05 | Qvella Corporation | Apparatus, system and method for performing automated centrifugal separation |
| JP6588908B2 (ja) | 2014-06-30 | 2019-10-09 | Phcホールディングス株式会社 | 試料分析用基板、試料分析装置、試料分析システムおよび試料分析システム用プログラム |
| US10539582B2 (en) | 2014-06-30 | 2020-01-21 | Phc Holdings Corporation | Substrate for sample analysis, sample analysis device, sample analysis system, and method for removing liquid from liquid that contains magnetic particles |
| JP6588910B2 (ja) * | 2014-06-30 | 2019-10-09 | Phcホールディングス株式会社 | 試料分析用基板、試料分析装置、試料分析システムおよび試料分析システム用プログラム |
| US10539560B2 (en) | 2014-06-30 | 2020-01-21 | Phc Holdings Corporation | Substrate for sample analysis, and sample analysis apparatus |
| GB2528954B (en) * | 2014-08-07 | 2017-05-24 | Clyde Process Ltd | Adjustable multi-hole orifice plate in a pneumatic conveying apparatus |
| US10073091B2 (en) | 2014-08-08 | 2018-09-11 | Ortho-Clinical Diagnostics, Inc. | Lateral flow assay device |
| JP6146388B2 (ja) * | 2014-09-30 | 2017-06-14 | ブラザー工業株式会社 | 検査装置及び検査プログラム |
| EP3232203B1 (en) | 2014-12-12 | 2022-02-02 | PHC Holdings Corporation | Substrate for sample analysis, sample analysis device, sample analysis system, and program for sample analysis system |
| EP3396385B1 (en) * | 2015-12-24 | 2020-07-01 | PHC Holdings Corporation | Sample analysis substrate, sample analysis device, sample analysis system, and program for sample analysis |
| CN108431610B (zh) * | 2015-12-28 | 2022-04-05 | 普和希控股公司 | 试样分析用基板、试样分析装置、试样分析系统和记录介质 |
| US10065187B2 (en) * | 2016-02-12 | 2018-09-04 | Schlumberger Technology Corporation | Centrifugal platform and device for rapid analysis of oilfield fluids |
| US20200330982A1 (en) * | 2016-03-17 | 2020-10-22 | Amin KAZEMZADEH | Long-term storage and proportional dispensing device |
| JP6479730B2 (ja) * | 2016-06-30 | 2019-03-06 | シスメックス株式会社 | 化学発光測定装置 |
| JP6470238B2 (ja) * | 2016-06-30 | 2019-02-13 | シスメックス株式会社 | 測定装置および測定方法 |
| CN107561299B (zh) | 2016-06-30 | 2021-08-31 | 希森美康株式会社 | 检测装置以及检测方法 |
| US11480525B2 (en) | 2016-06-30 | 2022-10-25 | Sysmex Corporation | Chemiluminescence measurement apparatus |
| CN107561298B (zh) | 2016-06-30 | 2020-05-05 | 希森美康株式会社 | 测定装置以及测定方法 |
| JP6457451B2 (ja) * | 2016-06-30 | 2019-01-23 | シスメックス株式会社 | 検出装置および検出方法 |
| JP6635897B2 (ja) * | 2016-08-30 | 2020-01-29 | シスメックス株式会社 | 試料分析用カートリッジ及びその製造方法、並びにその利用 |
| TWI655417B (zh) * | 2017-05-05 | 2019-04-01 | Feng Chia University | 微流體檢驗裝置及其微流體控制方法 |
| JP6435387B1 (ja) * | 2017-09-29 | 2018-12-05 | シスメックス株式会社 | カートリッジ、検出方法、および検出装置 |
| CN109030813A (zh) * | 2018-07-19 | 2018-12-18 | 东莞东阳光科研发有限公司 | 一种化学发光免疫检测微流控芯片、检测仪及检测方法 |
| CN110118859A (zh) * | 2019-05-27 | 2019-08-13 | 东莞东阳光医疗智能器件研发有限公司 | 一种离心式试剂盘 |
| GB201915499D0 (en) * | 2019-10-25 | 2019-12-11 | Radisens Diagnostics Ltd | A point-of-care test cartridge |
| AU2021237737A1 (en) * | 2020-03-20 | 2022-11-24 | Orbis Diagnostics Limited | Multi-chambered assay devices and associated methods, systems and apparatuses thereof for detection of analytes |
| CN111205966B (zh) * | 2020-04-18 | 2020-07-21 | 博奥生物集团有限公司 | 样本提取芯片和生物反应装置 |
| CN115667931A (zh) * | 2020-04-22 | 2023-01-31 | 创新有限公司 | 高通量血清学检测 |
| BE1029227B1 (fr) * | 2021-03-22 | 2022-10-17 | Unisensor | Dispositif microfluidique rotatif |
| BR112023018966A2 (pt) | 2021-03-22 | 2023-10-17 | Unisensor | Dispositivo de controle |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6632399B1 (en) | 1998-05-22 | 2003-10-14 | Tecan Trading Ag | Devices and methods for using centripetal acceleration to drive fluid movement in a microfluidics system for performing biological fluid assays |
| AU7591998A (en) | 1997-05-23 | 1998-12-11 | Gamera Bioscience Corporation | Devices and methods for using centripetal acceleration to drive fluid movement in a microfluidics system |
| WO2002075312A1 (en) * | 2001-03-19 | 2002-09-26 | Gyros Ab | Characterization of reaction variables |
| EP1874677B1 (en) | 2005-04-14 | 2013-03-20 | Gyros Patent Ab | Microfluidic device with meander |
| JP2007024851A (ja) * | 2005-07-16 | 2007-02-01 | Adobic:Kk | 検体分析チップおよび検体分析チップの使用方法 |
| WO2007106013A1 (en) * | 2006-03-13 | 2007-09-20 | Gyros Patent Ab | Enhanced magnetic particle steering |
| JP2007330857A (ja) * | 2006-06-13 | 2007-12-27 | Matsushita Electric Ind Co Ltd | 送液装置及び送液方法 |
| KR101343034B1 (ko) * | 2006-09-05 | 2013-12-18 | 삼성전자 주식회사 | 원심력 기반의 단백질 검출용 미세유동 장치 및 이를포함하는 미세유동 시스템 |
| JP4869205B2 (ja) * | 2007-10-23 | 2012-02-08 | シャープ株式会社 | マイクロ流体デバイス及びマイクロ流体デバイス装置 |
| EP2309266A1 (en) * | 2009-09-21 | 2011-04-13 | F. Hoffmann-La Roche AG | Method for carrying out reactions in an analytical device |
-
2012
- 2012-06-05 JP JP2014513307A patent/JP6200419B2/ja not_active Expired - Fee Related
- 2012-06-05 EP EP12729743.0A patent/EP2715357B1/en not_active Not-in-force
- 2012-06-05 WO PCT/IE2012/000026 patent/WO2012164552A1/en active Application Filing
- 2012-06-05 US US14/123,625 patent/US9897596B2/en active Active
- 2012-06-05 KR KR1020137033623A patent/KR20140060263A/ko not_active Application Discontinuation
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019098532A1 (ko) * | 2017-11-17 | 2019-05-23 | 주식회사 엘지화학 | 고상 추출용 마이크로 디바이스 |
| KR20190056500A (ko) * | 2017-11-17 | 2019-05-27 | 주식회사 엘지화학 | 고상 추출용 마이크로 디바이스 |
| US11065557B2 (en) | 2017-11-17 | 2021-07-20 | Lg Chem, Ltd. | Micro device for solid phase extraction |
| US11260319B2 (en) | 2018-08-21 | 2022-03-01 | Lg Chem, Ltd. | Solid phase extraction method using micro device |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2715357B1 (en) | 2015-11-04 |
| JP6200419B2 (ja) | 2017-09-20 |
| US20140242721A1 (en) | 2014-08-28 |
| WO2012164552A1 (en) | 2012-12-06 |
| US9897596B2 (en) | 2018-02-20 |
| JP2014518374A (ja) | 2014-07-28 |
| EP2715357A1 (en) | 2014-04-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2715357B1 (en) | Microfluidic disc for use in with bead-based immunoassays | |
| RU2555049C2 (ru) | Картридж для обработки образца и способ обработки и/или анализа образца под действием центробежной силы | |
| JP4707035B2 (ja) | マイクロ流体装置における混合 | |
| KR101722548B1 (ko) | 원심력기반의 미세유동장치 및 이를 이용한 유체시료 내 분석대상물질 검출방법 | |
| JP4869602B2 (ja) | 被検物をマイクロ流体デバイスの多チャネルに分割する方法及び装置 | |
| EP2309266A1 (en) | Method for carrying out reactions in an analytical device | |
| Sasso et al. | Automated microfluidic processing platform for multiplexed magnetic bead immunoassays | |
| US9186668B1 (en) | Microfluidic devices, systems, and methods for quantifying particles using centrifugal force | |
| JP2007502979A5 (ko) | ||
| EP2285491A1 (en) | Flow control in microfluidic systems | |
| JP2007520693A (ja) | 被検体物のマイクロ流体デバイスへの取り込みならびに収納の方法および装置 | |
| WO2006076567A2 (en) | Microfluidic rare cell detection device | |
| JP2003510554A (ja) | 複数の分析物の拡散に基づく化学センサ | |
| US20060204403A1 (en) | Micro-fluidic fluid separation device and method | |
| Madadi et al. | Separation of human granulocytes and mononuclear cells from whole blood using percoll on a centrifugal microfluidic disc | |
| Weigl et al. | Standard and high-throughput microfluidic disposables based on laminar fluid diffusion interfaces | |
| CN116144458A (zh) | 一种生物微流控芯片及其应用 | |
| CN116855360A (zh) | 一种全自动离心微流控芯片及其制备方法 | |
| Bessler et al. | Journal of the Association for Laboratory |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |