KR20140041670A - 행동 장애 및 정신 장애의 치료를 위한 실로―이노시톨 - Google Patents
행동 장애 및 정신 장애의 치료를 위한 실로―이노시톨 Download PDFInfo
- Publication number
- KR20140041670A KR20140041670A KR1020147000006A KR20147000006A KR20140041670A KR 20140041670 A KR20140041670 A KR 20140041670A KR 1020147000006 A KR1020147000006 A KR 1020147000006A KR 20147000006 A KR20147000006 A KR 20147000006A KR 20140041670 A KR20140041670 A KR 20140041670A
- Authority
- KR
- South Korea
- Prior art keywords
- inositol
- scyllo
- dementia
- patient
- myo
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/047—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates having two or more hydroxy groups, e.g. sorbitol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7004—Monosaccharides having only carbon, hydrogen and oxygen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Psychiatry (AREA)
- Molecular Biology (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Anesthesiology (AREA)
- Pain & Pain Management (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
본 발명은 대상체에게 유효량의 실로-이노시톨을 투여함으로써 뇌에서의 미오-이노시톨 수준 상승과 관련된 장애, 특히 행동 장애 및 신경정신 장애, 예컨대 치매, 경도 알츠하이머병, 경도 인지 장애 또는 양극성 장애를 치료하는 것에 관한 것이다.
Description
본 발명은 뇌에서의 미오-이노시톨 수준 상승과 관련된 장애, 및 특히 행동 장애 및 신경정신 장애를 치료하는 방법에 관한 것이다.
"치매의 행동 심리 증상" (BPSD: Behavioral and Psychological Symptoms in Dementia)이라는 신조어는 임상적으로는 치매로 알려져 있는 결과를 초래하는 장기간의 진행성 신경퇴행 과정의 중요한 소견인 행동 장애 또는 신경정신 증상 (NPS)의 범위를 기술하기 위해 만들어졌다. BPSD 상위 용어는 무감동 또는 무관심, 정동 및 정신병적 증상, 탈억제 및 과잉행동, 과민성, 초조증/공격성, 식욕 변화, 및 야간 혼돈 또는 수면 장애를 포함하는 광범위한 범위의 NPS를 포함한다. BPSD 증상의 다양한 조합 (서브-증후군)은 대부분의 치매에서 발생한다. 이러한 치매로는 알츠하이머병 치매 (AD), 전측두엽 치매 (FTD), 혈관성 치매, 루이소체병 (LBD), 및 다운증후군 치매를 포함한다. 비록 BPSD가 질환 특이적인 것은 아니지만, 특이 질환의 특징이 되는 특정의 신경정신 장애 프로파일이 존재한다.
예를 들어, AD에서 무감동 및 정동 증상 (정동이란 느낌 또는 감정의 경험을 의미하는 것으로 이는 대개 무감동 및 우울증에서는 무딘 또는 둔한 것으로 언급된다)은 보통 상기 질환 중 조기에 나타나는 반면, 정신병적 증상, 이상 운동 행동, 및 탈억제는 치매 과정에서 후반에 발생한다. FTD에서, 무감동/무관심, 사회 탈억제, 및 성격 변화는 매우 초기에 발생하며, 이는 심지어는 (예를 들어, 행동 변이형 FTD (bv-FTD)에서) 주 소견일 수도 있다. LBD는 인지 변동, 추체외로 운동 증상, 주간 리듬 장애, 시각적 환각, 야간 초조증 및 우울증을 특징으로 한다. 혈관성 치매는 현저한 무감동, 주도력 부족, 과민성 및 우울증을 특징으로 한다.
AD에서 점진적으로 감소하는 기억, 추리, 및 언어력과 달리, 일부 NPS (예컨대, 우울증 및 불안감)는 진행 과정이 변동적일 수 있는데, 일부 증상은 완화되고, 다른 것은 질환의 다른 단계에서 출현할 수 있다. 그러나, 질환이 진행되어 감에 따라, 무감동, 초조증, 및 과잉행동 증상은 더 지속되고 진행될 수 있으며, 결국에는 정신병이라는 무거운 부담을 안게 된다. NPS 중 일부, 예컨대 초조증/공격성, 환각 또는 망상, 이상 운동 행동, 및 탈억제는 관리가 특히 어려우며, 의료인의 고충의 주된 원인을 나타낸다. 정신병적 증상 및 초조증/공격성이 중등도 내지 중증 AD에서 요양원 입소의 빈번한 원인이 된다. 알츠하이머병과 관련된 BPSD는 이들 신경정신 증후군들 중 가장 잘 연구되어 있는 것이다.
BPSD 증상군 또는 서브 증후군
BPSD에 대한 신경생물학적 연구와 치료학적 시험을 촉진시키기 위하여 NPS를 증상군으로 분류하였다. 이러한 증상군은 치매 집단에서 잠재 부류 또는 인자 분석에 기초한 것이었다. 집단 기반 또는 임상 기반 샘플의 샘플 크기 및 용도를 비롯한 방법상의 차이에도 불구하고, 상기 연구를 통해 일관되게 3 또는 4가지 증상군 또는 서브 증후군이 확인되었다. 가장 일관된 증상군은 i) 정동, ii) 정신병적, 및 iii) 과잉행동 서브 증후군이다. 정동 서브 증후군에 대해 핵심이 되는 증상은 우울증 및 불안감이지만, 일부 연구는 상기 증상군에 과민성 및 초조증을 포함한다. 정신병적 증상군은 일관되게 망상 및 환각을 포함하는 반면; 과잉행동 증상군은 일반적으로 이상 운동 행동, 들뜸 및 탈억제를 포함하고, 전두엽 또는 "실행기능장애 증후군"으로 간주된다. 무감동이 정동 증상군의 일부인지 또는 분리 증후군인지 여부가 여전히 논란의 주제가 되고 있다. 식욕 및 수면 변화 (또는 야간 행동)는 빈번하게 정동 증상과 관련이 되고, 이 뿐만 아니라, 환자의 동시 이환 의학적 상태와 관련될 수 있다. 증상군 접근법의 유용성은 공통된 신경 화학적 기반을 공유할 수 있고, 잠재적으로는 유사 분류의 약물에 대하여 반응할 수 있는 임상 증후군을 정의하는 것을 돕는다는 점이다. BPSD에 대한 이러한 증후군 접근법은 또한 치매에서 나타나는 상기 서브 증후군의 인식과 정확한 진단을 촉진시키며, 그의 적절한 관리에 대해 의료 전문인에게 알려줄 수 있다.
BPSD의 역학
알츠하이머병 (AD) 집단에서 BPSD의 유병률은 연구 방법에 따라 60-90%가 될 것으로 추정되며, 평생 동안의 위험률은 100%에 육박한다. AD에서 NPS의 유병률 및 이환수는 질환 중증도 및 지속 기간에 따라 증가하는 것으로 알려져 있다. NPS의 유병률 증가는 경도 인지 장애 (MCI)에서 AD로의 진행과 관련이 있다.
AD 진행에서 가장 먼저 출현하는 2가지 NPS는 일반적으로 무감동 또는 우울증이며, 이 중 하나가 경도 인지 장애 (MCI) 단계에서, 또는 조기 AD 단계에서 나타날 수 있다. 무감동은 질환이 진행되는 전 기간 동안에 걸쳐 계속해서 고도로 우세하게 나타나며, 전형적으로는 진행성 과정이 뒤를 잇는다. 대조적으로, 우울증 또는 불쾌 기분의 중증도는 특별히 상기 질환 조기에 변동하는 경향이 있다. 우울증은 경도 내지 중등도 AD에서는 유병률이 높지만, 중증 AD에서는 유발률이 더 낮아진다. 불안감의 유병률은 우울증보다 다소 더 낮지만, 불안감 이후에는 AD에서의 우울증과 유사한 과정이 이어지는 경향이 있으며, 불안감은 빈번하게는 AD에서의 우울증과 관련이 있다. 경도 또는 중등도의 질환에서 중간 또는 고도한 유병률로 발생하는 다른 증상에는 과민성, 초조증/공격성, 및 식욕 변화가 있다 (문헌 [Aalten et al., 2007, Neuropsychiatric syndromes in dementia. Results from the European Alzheimer Disease Consortium: Part I. Dement Geriatr Cogn Disord 2007;24:457-63] 및 [Steinberg et al., 2008, Point and 5-year period prevalence of neuropsychiatric symptoms in dementia: The Cache County Study. International Journal of Geriatric Psychiatry, 23(2): 170-177]). 들뜸 또는 행복감은 NPS 중 가장 흔치 않은 것이지만, 탈억제 및 이상 운동 행동과 관련하여 전두엽 또는 실행기능장애 증후군의 일부인 것으로 간주될 수 있다. 과잉행동 증상 (이상 운동 행동, 야간 행동, 및 탈억제)은 중등도 내지 중증 AD에서 상대적으로 흔히 볼 수 있다. 조기 내지 경도 단계에서는 흔하지 않은 망상 및 환각 또한 중증 단계의 AD에서는 더욱 우세해진다. AD가 진행성일 경우, 행동 기능장애의 누적 부담은 상당히 커지게 되고, 결국은 AD에서 상당한 관리 도전 과제를 제기하게 된다.
BPSD 증후군의 신경생물학적 기반
치매에서 다양한 NPS는 각 치매에 특이적인 국소 퇴행성 변화의 발현인 것으로 간주될 수 있다. 뇌 부위는 각종의 미스폴딩된 단백질 병적 측면에 대하여 선택적으로 취약한 것으로 입증되어 있는 바, 치매 장애에서 가장 먼저 출현하는 NPS는 선택적 취약 부위에 따라 달라질 것이다. 무감동, 우울증, 초조증 및 정신병적 증상의 신경화학적 기반은 더욱더 정교화된 방법을 사용함으로써 설명되었다. 이는 수용체 결합, 기능/부피 측정 영상화, 게놈 연관, 및 부검 연구를 포함하였다.
AD에서, 아밀로이드 병적 측면은 일반적으로 내비 및 두정 피질에서 시작되지만, 전두엽 병적 측면은 무감동 또는 주도력 감소로서 관찰되고, 이로써 제시될 수 있으며, 이는 기저 전뇌 콜린성 활성의 감소를 반영한다. 무감동은 또한 부검 연구 결과, 신경섬유 매듭 (NFT로서도 지칭되는, 과인산화된 타우 단백질의 응집체)의 양과 상관관계가 있는 것으로 밝혀졌다. 정동 증상이 조기에 나타나는 것은 청반 및 등쪽 솔기핵 중에서 각각 노르아드레날린 및 세로토닌 수준의 유의적인 감소, 및 흑색질 도파민 수준 감소와 함께, 각종의 모노아민계 신경전달물질 네트워크의 기능장애를 반영하는 것으로 간주된다. 기능 영상화 연구를 통해 전대상에서 양측으로, 및 상측 측두엽에서 및 상측 전두엽에서 대사저하증이 제안되었다.
진행성 AD에서 두드러지는 초조증 및 이상 운동 행동은 안와 전두 피질에서 NFT 부하량과 관련이 있는 것으로 밝혀졌다. 정신병적 증상이 나타나는 것은 인지 및 기능 결과의 악화와 관련이 있었다. 망상 및 환각은 각각 안와 전두 및 중간 측두 피질에서 M1이 아닌 M2 서브타입 무스카린 수용체 밀도와 상관관계가 있는 것으로 밝혀졌다. 초조증과 함께, 정신병적 증상 또한 특이 도파민 수용체 유전자 변이와 관련이 있었다. 추가로, 세로토닌 수송체의 다형태 및 5-HT2A 수용체 다형태는 각각 초조증/공격성 및 정신병과 관련이 있었다.
피질하 허혈 혈관성 질환에 의해 유발된 혈관성 치매에서는, 기저 전뇌에서 구심로 차단 (구심 신경 자극 제거 또는 방해) 및 콜린 손실을 유발하는 전두 백색질이 조기에 관여한다. 안쪽의 전두앞 네트워크 및 그의 피질하 연결부의 조기 파괴는 무감동 및 충동 손실을 일으키는 결과를 초래하는 반면, 등외측쪽 전두앞 네트워크 파괴는 실행 기능장애로 나타나며; 이 두 증상 모두 혈관성 치매의 조기 소견이다. 배쪽 안와 전두 네트워크가 후반에 관여함으로써 사회적으로 부적절한 및/또는 탈억제된 행동을 보이게 된다.
행동 변이형 FTD (bv-FTD)는 조기의 전두 및 전측두 위축증을 특징으로 한다. bv-FTD의 BPSD 증상은 감정의 무뎌짐, 감정이입 부족 및 억제저해를 보임과 동시에, 전두엽에서 콜린 손실, 및 "돌각(salient) 네트워크"에서 기능 결핍을 반영한다. LBD는 피질에 널리 영향을 미치는 널리 퍼진 도파민 및 콜린 손실을 나타내는 것으로 기술된다. LBD에서 BPSD는 항-콜린성 효과 및 특히 신경이완제 투약에 대한 상기 환자의 현저한 감수성으로 인해 독특한 치료 시험 과제를 제기한다.
현 치료 옵션 및 충족되지 않은 의학적 요구
현재 BPSD를 장기간 관리할 수 있는 것으로 승인받은 약물은 없다. 비정형 항정신병제인 리스페리돈 (리스페리달(Risperidal)®)이 중증 초조증을 단기간 관리하기 위한 것으로 승인받은 유일의 약물이다. 이러한 승인은 일부 유럽 국가로 제한되어 있으며, 단기간에 수행된 2개의 양성 대조군 시험을 기초로 하지만, 모든 시험이 일관되게 양성으로 나타난 것은 아니었다. BPSD에서 연구되는 주요 약물 부류는 리스페리돈, 쿠에티아핀 (세로켈(Seroquel)®) 및 지프라시돈 (지오돈(Geodon)®)을 비롯한 비정형 항정신병제; AD에서 인지력 감퇴 증상을 치료하는 약물 (콜린에스테라제 억제제 및 메만틴); 및 항우울제 (예컨대, 선택적 세로토닌 재흡수 억제제 (SSRI) 또는 세로토닌 노르에피네프린 재흡수 억제제 (SNRI))가 있다. 비정형 항정신병제에 관한 연구는 정신병적 또는 초조증/공격성 증상을 보이는 AD 환자에 초점을 두었다. 이 연구 결과는 일관되게 양성으로 나타난 것은 아니었으며, 3가지 약물 대 위약에 대한 비교 시험을 통해 내성이 낮은 것 또한 한계인 것으로 나타났다. 추가로, AD 환자에서 이들 약물을 사용하는 것은 사망 위험 증가와 관련이 있다. 이로써, 미국 FDA는 노인 치매 환자에게 비정형 항정신병제에 대한 안전성 주의 경고를 내렸고, 사망 위험 증가와, 이들 약물은 치매를 앓는 노인에서 행동 문제를 치료하기 위한 것으로 미국 식품의약국 (FDA)의 승인을 받은 것은 아니라고 언급하는 "돌출주의문(boxed warning)"을 약물 라벨에 표시하게 되었다. 행동 증상을 1차 결과로서 측정하고, 아세틸 콜린에스테라제 억제제 (ChEI)의 메타-분석시 NPS에 대해 일관된 효과를 보인 ChEI를 이용하여 수행된 연구는 거의 없었다. 일부 연구에서는 무감동에 대하여 효과가 있는 것으로 나타난 반면, 다른 경우에는 효과가 없는 것으로 나타났고, 일부에서는 정동 증상에 일부 유익한 효과를 보였다. ChEI 효과는 보통 정도이며, 임상적 적절성에는 한계가 있는 것으로 간주된다. 항우울제 및 기분 안정제에 대한 연구에서 비-우울증-관련 NPS에 대한 시험 간에 일관된 유익한 효과는 나타나지 않았으며; 시탈로프람 (세렉사(Celexa)®)을 이용한 한 연구에서는 오직 초조증 및 정서적 불안정에 대해서만 가능한 유익한 효과가 있는 것으로 나타났다. AD에서의 우울증을 표적화한 메타-분석 연구는 차세대 항우울제 (SSRI/ SNRI)를 이용함으로써 보통 정도의 유익한 효과를 얻을 수 있다고 제안하였고, 상기 연구는 또한 상기 노인 환자 집단에서는 유해 사례로 인해 중단율이 더 높은 것과 관련이 있다는 것도 밝혀냈다. 그러므로, BPSD를 치료하기 위한 약리학적 치료 선택은 매우 제한되어 있으며, 행동 및 정신 증상에 대하여 임상적으로 유익한 효과를 발휘하는 안전하고, 내성이 우수한 약물에 대한 요구가 여전히 충족되지 않은 상태 그대로 남아있다.
기분 안정화제인 (탄산리튬으로서 투여되는 것으로, 본원에서 Li 또는 LI로 약칭되는) 리튬은 뇌 미오-이노시톨 수준을 감소시키는 것으로 알려져 있다. 리튬 치료법이 양극성 장애 환자에서 (수일 이내에) 미오-이노시톨 수준을 조기에 ~30%만큼 감소시키는 것을 유도하였고, 2주 경과 후 정동 증상을 개선시키는 것으로 나타났다는 것에 주목할 만하다. 미오-이노시톨 감소와 정동 개선 사이에 지연이 관찰되는 것은 조기의 Li에 의해 유도된, 포스포-이노시티드 신호전달 변경 (포스포-이노시티드는 알콜 관능기를 통해 하나 이상의 포스페이트기에 결합된 미오-이노시톨 분자를 포함하고, 이는 또한 다른 세포 과정을 조절하는 2차 메신저로서도 명명된다)이 기분에 대한 그의 임상적 효과를 매개하는 유전자 발현 및 단백질 합성에 대하여 하류에 효과를 발휘할 가능성이 있다는 것을 제안한다.
지난 10여 년간에 걸쳐, 의학계 및 보건 기관은 BPSD의 중요성과, 그의 영향을 최소화시키기 위한 관리 전략법 및 효과적인 치료법이 개발되어야 할 필요성의 중요성을 더욱 깨닫게 되었다. 미국 FDA는 이러한 주제를 논의하고, 이 분야에서의 연구 및 약물 개발 노력의 필요성에 주의를 집중시키기 위하여 2000년 3월 미국 노인 정신 의학회(American Association of Geriatric Psychiatry)와 협력하여 자문 회의를 구성하였다 (문헌 [T. Laughren, 2001, Am J Geriatr Psychiatry, 9(4):340-5]). FDA는 치매의 다양한 행동 소견을 포함하는 "BPSD"를 광범위한 개념으로서 인정하였다. 상기 기관은 공통된 신경화학적 기반을 공유할 가능성이 있는, 더욱 특이적인 서브 증후군 (또는 증상군)을 확인해야 할 필요성에 대하여 강조하였다. 이어서, 적절한 작용 기전을 가지는 약물에 의해 상기 서브 증후군을 특별히 표적화시킬 수 있다. 이때, 합의 회의 직전에 공개된 기준에 기초한 "AD 정신병(Psychosis of AD)"의 진단학적 타당성을 인정하였다 (문헌 [Jeste and Finkel, 2000 Am J Geriatr Psychiatry, 8(1):29-34]). 이후, "AD에서의 우울증(Depression in AD)"에 대한 (문헌 [Olin et al., 2002, Geriatric Psychiatry, 10, 125-128]), 및 독립 증후군(stand-alone syndrome)으로서 무감동 (문헌 [Robert et al., 2009, Eur Psychiatry, 24(2):98-104])에 대한 임시 진단학적 기준이 공개되었다. 그러나, 이러한 구체적인 적응증에 대해서 어떤 약물도 승인받지는 못했다.
BPSD를 평가하는 데 있어서 여러 가지 척도가 사용되어 왔다. 이는 치매 환자에서 특별히 NPS를 연구하기 위해 디자인된 것인 척도, 예컨대 "AD 평가 척도에서 행동 병리(Behavioral Pathology in AD Rating Scale)" (BEHAVE-AD, 문헌 [Reisberg et al., BEHAVE-AD: A clinical rating scale for the assessment of pharmacologically remediable behavioral symptomatology in Alzheimer's disease. In: Altman HJ, editor. Alzheimer's Disease: Problems, prospects, and perspectives. Plenum; New York: 1987. pp. 1-161996]), 치매에 대한 CERAD 행동 평가 척도 (문헌 [BRSD, Tariot 1996, International Psychogeriatrics, 8(Suppl. 3):317-320]), 및 신경정신 행동 검사(Neuropsychiatric Inventory) (문헌 [NPI, Cummings et al., 1994, Neurology. 1994;44:2308-14])를 포함한다. 치매 환자에서 발생할 수 있는 광범위한 행동 증상을 평가하기 위해 디자인된 NPI는 검증된 기구이며, BPSD 연구 및 AD 치료 시험에서 널리 사용되고 있다. 원래 버전은 망상, 환각, 초조증/공격성, 우울증/불쾌 기분, 불안감, 무감동, 과민성, 행복감/들뜸, 탈억제, 및 이상 운동 행동을 비롯한 10가지 증상 또는 항목을 평가하였고; 이어서, 식욕 변화 및 야간 행동 (수면 장애)을 포함하는 것으로 업데이트되었다. NPI는 유자격 개체에 의해 환자의 의료인과의 조직적인 인터뷰로서 시행된다. 각 항목은 스크립트된 스크리닝 설문에 의해 평가하고, 각 항목의 빈도 및 중증도를 0-4 (0: 없음, 1: 가끔 또는 주 1회 미만인 경우에서부터, 4: 매일 1회 이상), 및 1-3 (1: 경도 또는 환자에서 거의 고통을 일으키지 않음; 2: 중등도 또는 환자를 더 불안하게 할 수 있지만, 의료인에 의해 전가될 수 있는 정도; 및 3: 중증 또는 환자를 매우 불안하게 할 수 있고 전가시키기 어려운 정도)로 점수화한다. 이어서, 빈도에 중증도 점수를 곱하여 항목에 대한 총 점수를 도출해 내고; NPI 총 점수 (NPI-T)는 항목 점수 모두를 합산하여 도출해 내는데, 여기서 점수 범위는 0 (NPS가 전혀 없는 경우)에서부터 144 (12개의 NPS 모두 매일 중증도 최대치로 존재하는 경우)까지이다. 경도/중등도 AD에서의 대부분의 약물 시험에서 NPI 평균 총 점수는 기준선에서는 ~10-12이다. 하기 실시예에 기술된 2상 연구에서는 NPI-12가지 항목 평가를 사용하였는데, NPI 평균 총 점수는 기준선에서 8-10 사이였다. 이러한 기준선 중증도는 문헌에 보고된 다수의 경도 내지 중등도 AD로 보고된 범위보다 약간 더 낮다.
상기 일반 설명 및 하기의 상세한 설명, 둘 모두 단지 예시적인 것이며, 주장하는 본 개시내용을 제한하는 것이 아님을 이해하여야 한다.
본 발명의 개요
실로-이노시톨을 환자에게 투여하는 것이 상기 환자의 뇌에서 미오-이노시톨의 수준을 하향조절 (즉, 감소)시키고, 신경정신 증상 (NPS)의 출현을 지연시키고, 그 정도를 완화시킨다는 예상 밖의 발견을 하게 되었다. 따라서, 본 발명의 한 측면에서, 유효량의 실로-이노시톨을 대상체에게 투여하는 단계를 포함하는, 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키는 방법을 제공한다. 측면들에서, 본 발명은 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키거나 미오-이노시톨을 하향조절시키는 데, 또는 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키거나 미오-이노시톨을 하향조절시키기 위한 약제를 제조하는 데 사용하기 위한, 실로-이노시톨, 또는 실로-이노시톨을 포함하는 제약 조성물을 제공한다.
본 발명의 방법은 치매, 경도 AD, MCI, 또는 양극성 장애를 앓는 환자에서 미오-이노시톨의 수준을 감소시키거나 미오-이노시톨을 하향조절시키는 데 사용될 수 있다. 그러므로, 본 발명의 한 측면에서, 치료학상 유효한 치료 기간 동안 유효량의, 실로-이노시톨 또는 실로-이노시톨을 포함하는 조성물을 투여하는 단계를 포함하고, 여기서 실로-이노시톨 또는 조성물 투여가 환자의 뇌에서 그 수준을 투여 이전에 측정된 기준선 측정치로부터 감소시키는 것인, 치매, 경도 AD, MCI 또는 양극성 환자의 뇌에서 미오-이노시톨을 하향조절시키는 방법을 제공한다.
본 발명의 실시양태에서, 미오-이노시톨의 수준은 약 60% 미만만큼 감소된다. 본 발명의 실시양태에서, 미오-이노시톨의 수준은 약 20 내지 약 55% 만큼 감소된다. 본 발명의 실시양태에서, 미오-이노시톨의 수준은 약 20 내지 약 50% 만큼 감소된다. 본 발명의 다른 실시양태에서, 미오-이노시톨의 수준은 약 25% 내지 약 45% 만큼 감소된다. 추가의 실시양태에서, 미오-이노시톨의 수준은 약 25% 내지 약 35% 만큼 감소된다.
본 발명의 또 다른 측면에서, 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 대상체에서 신경정신 증상을 치료하는 방법을 제공한다. 다른 측면에서, 본 발명은 대상체에서 신경정신 증상을 치료하는 데, 또는 대상체에서 신경정신 증상을 치료하기 위한 약제의 제조에 사용하기 위한, 실로-이노시톨 또는 실로-이노시톨을 포함하는 조성물에 관한 것이다.
본 발명의 한 측면은 환자에게 유효량의 실로-이노시톨 또는 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하는, 환자에서 신경정신 증상 또는 신경정신 증상군의 출현을 지연시키고/거나, 그의 중증도를 감소시키는 방법을 제공한다. 본 발명의 실시양태에서, 신경정신 증상은 정동, 행동, 전두 또는 무감동 증상이다. 본 발명의 실시양태에서, 신경정신 증상은 2가지 이상의 정동, 행동, 전두 또는 무감동 증상을 포함한다. 특정 실시양태에서, 신경정신 증상은 우울증, 불안감, 식욕 변화, 초조증, 야간 행동, 망상, 환각, 무감동, 과민성, 이상 운동 행동, 탈억제, 수면 장애 및 들뜸으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 특정 실시양태에서, 신경정신 증상은 우울증, 불안감, 식욕 변화, 초조증, 야간 행동, 망상, 환각, 무감동, 탈억제, 수면 장애 및 들뜸으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 특정 실시양태에서, 신경정신 증상은 우울증, 불안감, 식욕 변화, 초조증 및 무감동으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 특정 실시양태에서, 신경정신 증상은 탈억제, 수면 장애, 무감동 및 들뜸으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 본 발명의 실시양태에서, 신경정신 증상군은 정동 증상군, 정신병적 증상군, 무감동, 전두엽 들뜸 및 탈억제 증상군, 행동 증상군, 및 이들의 임의의 조합으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다.
한 측면에서, 본 발명은 치료학상 유효한 치료 기간에 걸쳐 환자에게 유효량의 실로-이노시톨 또는 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 2가지 이상의 새로운 신경정신 증상의 출현을 투여 이전의 기준선 측정치와 비교하여 지연시키는 것인, 환자에서 2가지 이상의 새로운 신경정신 증상의 출현을 지연시키는 방법을 제공한다. 환자는 치매, 특히 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매를 앓을 수 있다. 본 발명의 실시양태에서, 환자는 알츠하이머병 치매를 앓고 있고, 경도 또는 중등도의 알츠하이머병을 앓고 있는 환자이다.
한 측면에서, 본 발명은 치료학상 유효한 치료 기간에 걸쳐 치매 환자에게 유효량의 실로-이노시톨 또는 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨 또는 조성물 투여가 1가지 이상의 신경정신 증상군의 출현을 투여 이전의 기준선 측정치와 비교하여 지연시키는 것인, 치매 환자에서 1가지 이상의 신경정신 증상군의 출현을 지연시키는 방법을 제공한다. 한 실시양태에서, 신경정신 증상군은 정동 증상군, 정신병적 증상군, 무감동, 전두엽 들뜸 및 탈억제 증상군, 행동 증상군, 및 이들의 임의의 조합으로부터 선택된다. 한 실시양태에서, 치매는 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로 이루어진 군으로부터 선택된다. 특정 실시양태에서, 치매는 중등도의 알츠하이머병이고, 1가지 이상의 증상군은 행동 증상군이다.
한 측면에서, 본 발명은 치료학상 유효한 치료 기간에 걸쳐 치매 환자에게 유효량의 실로-이노시톨 또는 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 1가지 이상의 신경정신 증상의 중증도를 투여 이전의 기준선 측정치로부터 감소시키는 것인, 치매 환자에서 1가지 이상의 신경정신 증상의 중증도를 감소시키는 방법을 제공한다. 한 실시양태에서, 1가지 이상의 신경정신 증상은 우울증, 불안감, 식욕 변화, 초조증, 무감동, 탈억제, 수면 장애, 무감동 및 들뜸으로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 한 실시양태에서, 치매는 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로 이루어진 군으로부터 선택된다.
본 발명의 측면에서, 치료 기간은 약 12주 이상, 약 24주 이상, 약 48주 이상, 또는 약 78주 이상이다. 본 발명의 실시양태에서 치료 기간은 약 48주 이상이다. 본 발명의 또 다른 실시양태에서, 치료 기간은 약 78주 이상이다.
한 측면에서, 본 발명은 78주 이상의 치료 기간에 걸쳐 치매 환자에게 유효량의 실로-이노시톨 또는 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 1가지 이상의 현존하는 신경정신 증상의 진행을 투여 이전의 기준선 측정치로부터 지연시키는 것인, 치매 환자에서 1가지 이상의 현존하는 신경정신 증상의 진행을 지연시키는 방법을 제공한다. 한 실시양태에서, 치매는 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로 이루어진 군으로부터 선택되거나, 이들로부터 선택된다. 특정 실시양태에서, 치매는 중등도 또는 중증 알츠하이머병이다.
본 발명의 특정 실시양태에서, 실로-이노시톨의 유효량은 약 250 mg이다. 본 발명의 특정 실시양태에서, 실로-이노시톨 또는 실로-이노시톨을 포함하는 제약 조성물은 1일 2회 투여된다.
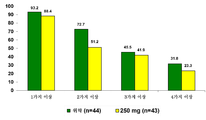
도 1은 경도 m-ITT 집단 (MMSE: 22-26)에 대해 제시된, 78주 동안에 걸쳐 진행된 연구에서 새로운 NPS가 발생한 환자 비율에 관한 차트이다.
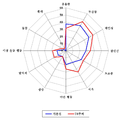
도 2a 및 2b는 기준선 및 78주째에서의 각종 NPI 증상의 유병률에 대한 플롯이다: 위약 (도 2a) 및 250 mg 군 (도 2b).
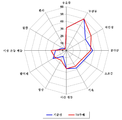
도 3은 위약군 (경도 MMSE: 22-26)에서의 유병률 감소 순서대로 제시된, 연구 기간 동안 임의의 시점에서 새로 출현한 NPI 증상의 유병률에 대한 플롯이다.
도 4는 중등도의 m-ITT 집단 (MMSE: 16-21)에 대해 제시된, 78주 동안에 걸쳐 진행된 연구에서 새로운 NPS가 발생한 환자 비율에 관한 차트이다.
도 5는 위약군 (중등도의 MMSE: 16-21)에서의 유병률 감소 순서대로 제시된, 연구 기간 동안 임의의 시점에서 새로 출현한 NPI 증상의 유병률에 대한 플롯이다.
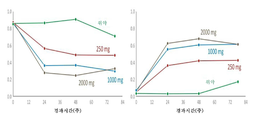
도 6은 MR 분광법에 의해 측정된, 실로-이노시톨이 미오-이노시톨 및 실로-이노시톨 뇌 수준에 미치는 효과에 관한 차트이다.
도 7은 혈장, 뇌, 및 CSF 중의 최대 약물 농도 (C최대)와 CSF A베타42/40 비 사이의 상관관계에 대한 플롯이다. 비가 더 낮을수록 (즉, A베타42, 원섬유발생성이 더 큰 형태가 덜 우세한 경우) 임상적으로 유익하다고 가정할 수 있다.
도 8a 및 8b는 실로-이노시톨 혈장 노출 (혈장 AUC의 사분위수) 및 정동 증상 출현 확률 사이의 관계에 대한 플롯이다.
도 9는 기준선 (표지된 스크리닝) 및 24주째의 250 mg bid 및 1,000 mg bid 용량에 대한 실로-이노시톨 및 미오-이노시톨의 수준을 보여주는 MRS 뇌 스캔에 대한 4개의 플롯이다.
도 2a 및 2b는 기준선 및 78주째에서의 각종 NPI 증상의 유병률에 대한 플롯이다: 위약 (도 2a) 및 250 mg 군 (도 2b).
도 3은 위약군 (경도 MMSE: 22-26)에서의 유병률 감소 순서대로 제시된, 연구 기간 동안 임의의 시점에서 새로 출현한 NPI 증상의 유병률에 대한 플롯이다.
도 4는 중등도의 m-ITT 집단 (MMSE: 16-21)에 대해 제시된, 78주 동안에 걸쳐 진행된 연구에서 새로운 NPS가 발생한 환자 비율에 관한 차트이다.
도 5는 위약군 (중등도의 MMSE: 16-21)에서의 유병률 감소 순서대로 제시된, 연구 기간 동안 임의의 시점에서 새로 출현한 NPI 증상의 유병률에 대한 플롯이다.
도 6은 MR 분광법에 의해 측정된, 실로-이노시톨이 미오-이노시톨 및 실로-이노시톨 뇌 수준에 미치는 효과에 관한 차트이다.
도 7은 혈장, 뇌, 및 CSF 중의 최대 약물 농도 (C최대)와 CSF A베타42/40 비 사이의 상관관계에 대한 플롯이다. 비가 더 낮을수록 (즉, A베타42, 원섬유발생성이 더 큰 형태가 덜 우세한 경우) 임상적으로 유익하다고 가정할 수 있다.
도 8a 및 8b는 실로-이노시톨 혈장 노출 (혈장 AUC의 사분위수) 및 정동 증상 출현 확률 사이의 관계에 대한 플롯이다.
도 9는 기준선 (표지된 스크리닝) 및 24주째의 250 mg bid 및 1,000 mg bid 용량에 대한 실로-이노시톨 및 미오-이노시톨의 수준을 보여주는 MRS 뇌 스캔에 대한 4개의 플롯이다.
본 개시내용의 특정 측면은 하기에서 더욱 상세하게 기술된다. 본 출원에서 사용되고, 본원에서 명확하게 언급되거나 지정된 것과 같은 용어, 정의 및 약어는 본 개시내용 내의 의미를 나타내는 것으로 한다. 본원에서 언급된 특허 및 과학 문헌은 본원에서 참고로 포함된다. 본원에서 제공된 용어 및 정의가 참고로 포함된 용어 및/또는 정의와 모순되는 경우, 본원에서의 것이 그를 조정한다.
단수 형태 "하나("a," "an")" 및 "그"라는 것은 달리 명시되지 않는 한, 복수 개의 지시 대상을 포함한다.
"대락적으로" 및 "약"이라는 용어는 언급된 수치 또는 값과 거의 동일하다는 것을 의미한다. 본원에서 사용되는 바, "대락적으로" 및 "약"이라는 용어는 일반적으로는 명시된 양, 빈도, 또는 값의 ±10%를 의미하는 것으로 이해되어야 한다. 특정 값과 관련하여, 대상체 집단 (예컨대, 기술된 임상 시험의 대상체)에 대하여 본원에 기술된 특정 값은 달리 명시되지 않는 한, 평균값을 나타낸다는 것을 이해하여야 한다. 따라서, 대상체에서 특정 값을 필요로 하는 본 개시내용의 측면은 본원에서 실질적으로 관련 값이 대상체 집단의 의미있는 경계가 되는 것으로 평가되는 집단 데이터에 의해 입증된다.
임상 연구 또는 임상 연구 디자인과 관련하여 사용되는 "아암(arm)" 또는 "연구 아암"이란 임상 연구에서 평가하고자 하는 특정의 치료 요법을 의미하고, 이는 보통 용량 범위 검색 임상 연구에서 사전 결정된 환자 세트가 취하는 상이한 투여량 및/또는 투약 빈도를 특징으로 한다.
"A베타 또는 AB 또는 Aβ"는 AD 환자의 뇌에서 플라크를 형성하는 베타 아밀로이드 펩티드를 의미하며; A베타, AB 또는 Aβ 다음에 기재된 숫자 40 또는 42는 AB 펩티드를 포함하는 아미노산의 개수를 의미한다. AB42는 가장 우세하게는 플라크 형성과 관련이 있으며, 이에 뇌 병적 측면이 추론된다.
"BID" 또는 "bid"란, 양 앞에 기재될 경우, 이는 1일 2회 투여를 의미하고, 양은 1일 동안 다른 시점에 2회에 걸쳐 투여된다는 것을 의미한다.
"기준선"은 연구 약물 투여 개시 이전에 측정된 환자의 신체 및/또는 정신적 상태, 및 그와 관련된 측정치를 의미한다.
"CSF"는 뇌척수액을 의미힌다.
"LTP"는 장기 강화 작용을 의미하고, 이는 기억 형성의 실험 모델로서 사용된다 (문헌 [Bliss TV, et al., (1993). "A synaptic model of memory: long-term potentiation in the hippocampus". Nature 361 (6407): 31-39]).
"m-ITT"는 전체 분석 세트(FAS: Full Analysis Set)로도 지칭되는 변형된 치료 의향 집단을 정의되며, 이는 궁극적으로 시행되는 치료법이 아니라, 처음의 치료 의향 (연구 디자인)에 기초하여 포함된 환자이다.
"PPS"란 프로토콜을 잘 지킨 세트(Per Protocol Set)로서 정의되고, 이는 II상 연구를 마치고, 그의 투여량 수준 (50, 1,000, 또는 2,000 mg BID)으로 지정된 약물 용량 중 80% 이상을 받은 대상체의 수이다.
"MMSE"는 인지 장애에 대해 스크리닝하는 데 사용되는 간단한 30점짜리 설문 검사인 간이 정신 상태 검사(Mini Mental State Exam)이다. 이는 의료계에서는 치매를 스크리닝하는 데 일반적으로 사용된다. 이는 또한 주어진 시점에서의 인지 장애 중증도를 평가하고, 시간 경과에 따라 개체의 인지 변화 과정을 추적하는 데 사용되며, 이로써 이는 치료법에 대한 개체의 인지 반응을 기록하는 데 효과적인 방법이 될 수 있다 (예를 들어, 문헌 [Folstein MF et al., 1975, Journal of Psychiatric Research 12 (3): 189-98] 참조).
"MRS"는 뇌 영상을 스캐닝하고, 뇌에서 화합물을 측정하는 데 사용되는 자기 공명 분광법이다.
"위약"은 활성 제약 성분이 부족하고, 이중 맹검 임상 시험에서 대조군 아암 환자, 즉, 연구되는 치료법을 받지 않는 환자에게 투여되는 환자 또는 다른 투여 형태를 의미한다.
실로-이노시톨은 이노시톨의 여러 내인성 입체이성질체 중 하나이다. 주요 내인성 이노시톨인 미오-이노시톨 (MI)은 삼투 조절, 및 포스파티딜-이노시톨 (PI) 2차 메신저 신호전달에서 중요한 역할을 하고, 미오-이노시톨은 성인 뇌에서 ~4-5 mM의 세포내 농도로 발견되는 반면, 실로-이노시톨은 보통 <1 mM이다. 미오-이노시톨과 달리, 실로-이노시톨은 인산화되거나, 또는 PI 신호전달에 직접적으로 관여하지는 않는 것으로 간주된다.
AD에서 임상전 연구는 동물 모델에서 측정할 수 있는 정도로까지 실로-이노시톨이 기억 및 추리에 대해 미치는 유익한 효과에 대해, 및 더욱 직접적으로 측정가능한 결과, 예컨대 장기 강화 작용의 유지 또는 개선, 및 플라크 부하 동물 및 세포의 감소에 중점을 두었다. AD를 앓는 트랜스제닉 마우스 모델에게 경구적으로 투여되었을 때, 실로-이노시톨은 뇌에서 아밀로이드 β-펩티드의 응집을 억제시키고, 여러 AD-유사 표현형을 호전시킨다. 트랜스제닉 동물에서, 실로-이노시톨은 뇌 Aβ 농도 및 플라크 부하를 감소시켰고, 시냅스 밀도를 보존시켰고, 학습 결핍을 개선시켰다. 실로-이노시톨은 또한 올리고머 유동성 시냅스 손실 및 수상돌기 밀도, LTP 억제, 및 기억/학습 결핍 호전을 비롯한, Aβ 올리고머의 독성 효과를 중화시키는 것으로 보인다.
실로-이노시톨은 알츠하이머병의 인지 증상 치료에 대한 II상 임상 연구를 완료하였다. 상기 연구는 NPI-12 항목 척도를 사용하는 신경심리 평가 뿐만 아니라, 자기 공명 분광법 (MRS)을 사용하여 실시되는 실로-이노시톨 (SI) 및 미오-이노시톨 (MI) 뇌 수준 평가를 포함하였다. MRS 데이터에서는 실로-이노시톨이 용량에 의존하는 방식으로 증가하는 것으로 나타났고, 예상 밖으로 미오-이노시톨의 수준은 그에 상응하여 용량에 의존하는 방식으로 감소하는 것으로 나타났으며 (도 6 및 9); 이러한 변화는 24주째에 유의적이지만, 준최대치였고, 약 48 내지 약 78주째에 최대 수준에 도달하였다. 연구된 3가지 용량에서 측정된 미오-이노시톨의 최대 감소율은 250 mg, 1,000 mg, 및 2,000 mg bid 용량에서 각각 44%, 66% 및 60%였다. 이론으로 제한하고자 하는 것은 아니지만, 실로-이노시톨은 그의 수송체에 의해 활성 미오-이노시톨 흡수를 경쟁적으로 억제시키는 것으로 간주된다 (문헌 [Sodium-Sensitive myo-inositol transporter, Wiesinger, 1991, J Neurochem, 56(5): 1698-704]). 실로-이노시톨이 신경정신 지수 결과에 미치는 유익한 효과는 적어도 부분적으로는 미오-이노시톨 뇌 수준의 하향조절에 기초하는 것으로 보인다. 최적의 미오-이노시톨 감소 범위는 기준선으로부터 약 20 내지 약 55%, 또는 약 25% 내지 약 45%, 또는 약 25% 내지 약 35%인 것으로 보이지만, 60% 이상의 미오-이노시톨 감소는 임상의 유익성 손실, 및 가능하게는 CNS 유해 사례와 관련이 있는 것으로 보인다.
뇌 기능장애에서 뇌 미오-이노시톨 증가가 미치는 잠재적인 역할은 정상적인 노인, MCI 및 AD에서 MRS 측정에 의해 추가로 입증된다. 인지력 감퇴에 의해 측정된 바와 같이, 미오-이노시톨의 수준 상승은 질환 단계와 가장 강력한 상관관계를 보였다 (미오-이노시톨의 수준은 MCI보다는 AD에서, 및 정상적인 노인 대상체에서보다는 MCI에서 유의적으로 더 높았다). 따라서, 본원에 개시된 바와 같이, 실로-이노시톨을 사용함으로써 뇌에서 미오-이노시톨의 수준을 저하시키는 방법은 환자, 예컨대 치매 환자 또는 다운증후군 환자 (미오-이노시톨이 상승되어 있는 것인 환자), 및 양극성 장애 환자 (여기서, 미오-이노시톨을 감소시키는 것이 기분 안정화 치료 효과가 있는 것으로 입증된 바 있다)에서 미오-이노시톨을 더욱 정상적인 (즉, 비-치매, 비-MCI 또는 비-경도 알츠하이머 대조군에서 임상적으로 관찰되는 범위) 뇌 수준으로 하향조절하고 유지시키는 데 유용하다.
실로-이노시톨을 환자에게 투여하면, 상기 환자의 뇌에서 미오-이노시톨의 수준은 하향조절되고 (즉, 감소되고), 신경정신 증상 (NPS)의 출현은 지연되고, 그의 중증도는 완화된다는 예상 밖의 발견에 기초하여, 한 측면에서, 본 발명은 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키는 방법을 제공한다. 특정 실시양태에서, 대상체는 인간 환자이다. 특정 실시양태에서, 환자는 치매를 앓는 환자이다. 특정 실시양태에서, 환자는 알츠하이머병을 앓는 환자이다. 특정 실시양태에서, 환자는 MMSE이 22 내지 26인 경도 알츠하이머병을 앓는 환자이다. 특정 실시양태에서, 환자는 MMSE이 16 내지 21인 중등도의 알츠하이머병을 앓는 환자이다. 특정 실시양태에서, 환자는 경도 인지 장애를 앓는 환자이다. 특정 실시양태에서, 환자는 치매를 앓지 않는 환자이다. 특정 실시양태에서, 환자는 알츠하이머병을 앓지 않는 환자이다. 특정 실시양태에서, 환자는 경도 인지 장애를 앓지 않는 환자이다.
본 발명의 또 다른 측면에서, 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 환자에서 고도한 미오-이노시톨의 수준에 의해 매개되는 질환 또는 병증을 치료하는 방법을 제공한다. 한 실시양태에서, 대상체는 인간 환자이다. 또 다른 실시양태에서, 질환 또는 병증은 양극성 장애이다. 또 다른 특정 실시양태에서, 질환 또는 병증은 양극성 장애의 서브타입이다. 특정 실시양태에서, 질환 또는 병증은 I형 양극성 장애이다. 특정 실시양태에서, 질환 또는 병증은 II형 양극성 장애이다. 특정 실시양태에서, 질환 또는 병증은 혼합형 양극성 장애, 급속-순환성 양극성 장애, 경조증, 순환성 기분장애, 급성 조증, 약물 유도성 조증, 또는 약물 유도성 경조증이다. 또 다른 실시양태에서, 질환 또는 병증은 편두통이다. 또 다른 실시양태에서, 질환 또는 병증은 정신분열병이다. 또 다른 실시양태에서, 질환 또는 병증은 알츠하이머병과 관련 초조증이다. 또 다른 실시양태에서, 질환 또는 병증은 알츠하이머병과 관련이 없는 초조증이다. 또 다른 실시양태에서, 질환 또는 병증은 다운증후군이다. 또 다른 실시양태에서, 질환 또는 병증은, 환자가 A-베타 관련 신경퇴행을 앓지 않는 것인, 다운증후군이다. 또 다른 실시양태에서, 질환 또는 병증은 편두통이다. 특정 실시양태에서, 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 환자에서 편두통을 예방하는 방법을 제공한다.
본 발명의 한 측면에서, 양극성 병증 또는 장애 치료를 필요로 하는 대상체에게 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키는 데 효과적인 양으로 실로-이노시톨을 투여하는 단계를 포함하는, 양극성 병증 또는 장애를 치료하는 방법을 제공한다. 본 발명의 실시양태에서, 미오-이노시톨의 양은 투여 이전에 측정된 기준선 측정치로부터 약 20%, 30%, 40%, 50% 또는 60% 이상만큼, 특히 약 20% 내지 약 50% 만큼 감소된다.
본 발명의 또 다른 측면에서, 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 대상체에서 신경정신 증상 (NPS)을 치료하는 방법을 제공한다. 특정 실시양태에서, NPS는 양극성 장애이다. 특정 실시양태에서, 질환 또는 병증은 발기 부전이다. 또 다른 실시양태에서, 질환 또는 병증은 중증 기분 조절곤란이다. 또 다른 실시양태에서, 질환 또는 병증은 만성 통증 증후군이다. 또 다른 실시양태에서, 질환 또는 병증은 무감동이다. 또 다른 실시양태에서, 질환 또는 병증은 이상 운동 행동이다. 또 다른 실시양태에서, 질환 또는 병증은 식욕 감퇴이다. 또 다른 실시양태에서, 질환 또는 병증은 환각이다. 또 다른 실시양태에서, 질환 또는 병증은 들뜸이다.
실로-이노시톨의 "유효량" 또는 "치료 유효량"이란 환자에서 원하는 치료 또는 예방 효과를 제공하는, 예를 들어 본원에서 질환 및 장애의 중증도, 또는 발생 빈도를 감소시키는, 실로-이노시톨의 양 또는 용량을 의미한다. 한 실시양태에서, 실로-이노시톨의 유효량은 환자의 뇌에서 미오-이노시톨의 수준을 감소시키는 데 필요한 양이다. 특정 실시양태에서, 실로-이노시톨의 유효량은 환자의 뇌에서 미오-이노시톨의 수준을 투여 이전에 측정된 기준선 측정치로부터 투여 이전의 기준선 측정치로부터 60% 미만으로 감소시키는 데 필요한 양이다. 특정 실시양태에서, 실로-이노시톨의 유효량은 환자의 뇌에서 미오-이노시톨의 수준을 투여 이전의 기준선 측정치로부터 약 20% 내지 약 55%, 약 20% 내지 약 50%, 약 25% 내지 약 45%, 또는 약 25% 내지 약 35% 만큼 감소시키는 데 필요한 양이다. 바람직한 실시양태에서, 실로-이노시톨의 유효량은 환자의 뇌에서 미오-이노시톨의 수준을 투여 이전의 기준선 측정치로부터 약 20% 내지 약 50% 만큼 감소시키는 데 필요한 양이다. 실로-이노시톨의 유효량은 인자, 예컨대 특정 질환 또는 장애, 환자의 연령, 성별, 및 체중에 따라 달라질 수 있다. 투여 요법은 최적의 치료 반응을 제공할 수 있도록 조정될 수 있다. 예를 들어, 수개로 분할된 용량을 매일 투여될 수 있거나, 또는 치료학적 상황으로 위급할 경우, 그가 지시하는 대로 상기 용량은 비례하여 감량될 수 있다. 특정 실시양태에서, 실로-이노시톨의 투여량은 약 1 mg 내지 약 5,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 약 10 mg 내지 약 2,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 100 mg 내지 약 1,500 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 150 mg 내지 약 1,300 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 200 mg 내지 약 1,200 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 250 mg 내지 약 1,100 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 300 mg 내지 약 1,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 500 mg 내지 약 1,500 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 600 mg 내지 약 1,300 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 700 mg 내지 약 1,200 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 800 mg 내지 약 1,100 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 900 mg 내지 약 1,100 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 1,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 1,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 1,000 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 약 500 mg이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 1일당 500 mg이다. 특정 실시양태에서, 상기 양의 실로-이노시톨은 1일 1회 투여된다. 특정 실시양태에서, 상기 양의 실로-이노시톨은 1일 2회 투여된다. 특정 실시양태에서, 실로-이노시톨의 투여량은 약 250 mg씩 1일 2회이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 250 mg씩 1일 2회이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 약 500 mg씩 1일 2회이다. 특정 실시양태에서, 실로-이노시톨의 투여량은 500 mg씩 1일 2회이다. 또 다른 특정 실시양태에서, 상기 양의 실로-이노시톨은 1일 3회 투여된다.
본 발명의 방법은 또한 실로-이노시톨의 투여 이전, 그 이후, 및 그와 동시에 다른 제약상 활성인 화합물을 공동 투여하는 단계를 포함한다. 특정 실시양태에서, 실로-이노시톨은 신경정신 장애를 치료하기 위한 치료제와 함께 공동 투여된다. 특정 실시양태에서, 실로-이노시톨은 제한 없이, 베타-세크레타제 억제제, 감마-세크레타제 억제제, 엡실론-세크레타제 억제제, 베타-쉬트 응집/원섬유발생/ADDL 형성을 억제하는 다른 억제제 (예컨대, 알츠히메드(Alzhemed)), NMDA 길항제 (예컨대, 메만틴), 비스테로이드성 항염증성 화합물 (예컨대, 이부프로펜(Ibuprofen), 쎄레브렉스(Celebrex)), 항산화제 (예컨대, 비타민 E), 호르몬 (예컨대, 에스트로겐), 영양제 및 식품 보충제 (예컨대, 징코 빌로바(Gingko biloba)), 스타틴 및 다른 콜레스테롤 강하 약물 (예컨대, 로바스타틴(Lovastatin) 및 심바스타틴(Simvastatin)), 아세틸콜린에스테라제 억제제 (예컨대, 도네제필), 무스카린 효능제 (예컨대, AFl 02B (세비멜린(Cevimeline), 이보작(EVOXAC)), AFl 50(S), 및 AF267B), 항정신병제 (예컨대, 할로페리돌, 클로자핀, 올란자핀), 항우울제, 예컨대 트리시클릭제 및 세로토닌 재흡수 억제제 (예컨대, SSRI 및 SNRS, 예컨대 세르트랄린(Sertraline) 및 시탈로프람 HBr), 스타틴 및 다른 콜레스테롤 강하 약물 (예컨대, 로바스타틴 및 심바스타틴), 면역치료제 및 A-베타에 대한 항체 (예컨대, 바피뉴주맙), 백신, 타우 단백질을 인산화시키는 키나제 (CDK5, GSK3-알파, GSK3-베타) 억제제 (예컨대, 염화리튬), A-베타 생산을 조절하는 키나제 (GSK3-알파, GSK3-베타, Rho/ROCK 키나제) 억제제 (예컨대, 염화리튬 및 이부프로펜), 네프릴리신 (A-베타를 분해하는 효소)을 상향조절하는 약물; 인슐린 분해 효소 (A-베타를 분해하는 효소)를 상향조절하는 약물, 질환으로부터 유발되거나, 그와 관련된 합병증 치료를 위해 사용되는 작용제, 또는 부작용을 치료 또는 예방하는 일반 약물을 비롯한, 하나 이상의 추가의 치료제와 함께 공동 투여될 수 있다. 특정 실시양태에서, 실로-이노시톨은 기분 안정제와 함께 공동 투여된다. 특정 실시양태에서, 실로-이노시톨은 리튬, 예컨대 염화리튬과 함께 공동 투여된다. 특정 실시양태에서, 실로-이노시톨은 제한 없이, 리스페리돈 (예컨대, 리스페리달®), 쿠에티아핀 (예컨대, 세로켈®) 및 지프라시돈 (예컨대, 지오돈®)을 비롯한, 항정신병제와 함께 공동 투여된다. 한 실시양태에서, 실로-이노시톨은 페노티아진, 티오크산텐, 및 특히, 쿠에티아핀, 아리피프라졸, 할로페리돌, 클로자핀, 올란자핀, 지프라시돈, 클로르프로마진, 티오리다진, 메조리다진, 플루페나진, 페르페나진, 프로클로르페라진, 트리플루오페라진, 티오틱신, 몰린돈, 록사핀, 리스페리돈, 아리피라졸, 및 아미술프리드로부터 선택되는 항정신병제와 함께 공동 투여된다. 한 실시양태에서, 실로-이노시톨은 아브리피프라졸, 아리술프리드, 클로자핀, 쿠에티아핀 푸마레이트, 할로페리돌, 록사핀 숙시네이트 (록사팩(Loxapac), 록시탄(Loxitane)), 클로티아핀, 메티아핀, 조테핀, 몰린돈 히드로클로라이드, 올란자핀, 팔리페리돈, 미모지드, 프로클로르페라진 (콤파진(Compazine), 부카스템(Buccastem), 스테메틸(Stemetil) 또는 페노틸(Phenotil)) 리스페리돈, 트리플루오로페라진, 주클로펜티솔 (클로픽솔(Clopixol)), 및 그의 조합으로부터 선택되는 항정신병제와 함께 공동 투여된다. 한 실시양태에서, 실로-이노시톨은 리튬, 나트륨 발프로에이트/발프론산/디발프록엑스, 카르바마제핀, 라모트리진, 가바페닌, 토피라메이트, 및 티아가빈으로부터 선택되는 기분 안정제 약물과 함께 공동 투여된다.
한 실시양태에서, 실로-이노시톨은 상기 치료제를 포함하는 조성물로서 투여된다. 한 실시양태에서, 본 발명은 실로-이노시톨 및 하나 이상의 제2 치료제를 포함하는 제약 조성물을 제공한다. 일부 실시양태에서, 조성물은 치료량 이하의 용량(subtherapeutic dose) (예컨대, 전체 용량보다 약 25%, 20%, 15%, 10%, 5%, 2%, 1% 이하로 더 적은 양)으로 하나 또는 상기 두 활성제 모두를 포함한다. 조성물은 대상체가 섭취할 수 있는 형태, 예컨대 환제, 정제, 캐플릿, 연질 및 경질 젤라틴 캡슐제, 로젠지, 사셰, 까셰, 베기캅, 액체 드롭제, 엘리시르, 현탁제, 에멀젼, 액제, 시럽제, 에어로졸 (고체로서 또는 액체 매질 중), 좌제, 멸균 주사액, 및/또는 멸균 패키지형 분제일 수 있다.
실로-이노시톨을 포함하는 제약 조성물은 또한 제약상 허용되는 담체, 부형제, 또는 비히클을 포함할 수 있다. 제약상 허용되는 담체, 부형제, 또는 비히클은 일반적으로 활성 성분의 효능 또는 활성을 방해하지 않으며, 그를 투여받는 호스트에게 독성을 띠지 않는 매질을 의미한다. 담체, 부형제, 또는 비히클은 희석제, 결합제, 부착제, 윤활제, 붕해제, 벌크화제, 습윤제 또는 유화제, pH 완충화제, 및 기타 물질, 예컨대 특정 조성물을 제조하기 위해서 필요할 수 있는 흡수제를 포함한다. 담체 등의 예로는 염수, 완충처리된 염수, 덱스트로스, 글리세롤, 에탄올, 및 그의 조합을 포함하나, 이에 한정되지 않는다. 활성 물질을 위해 상기 매질 및 작용제를 사용하는 것은 당업계에 주지되어 있다. 본 발명에서 사용하기 위한 조성물 및 제제는 예를 들어, 문헌 [Remington : The Science and Practice of Pharmacy, 21st Ed., 2005]; [Martindale : The Complete Drug Reference , Sweetman, 2005, London: Pharmaceutical Press]; [Niazi, Handbook of Pharmaceutical Manufacturing Formulations , 2004, CRC Press]; 및 [Gibson , Pharmaceutical Preformulation and Formulation : A Practical Guide from Candidate Drug Selection to Commercial Dosage Form , 2001, Interpharm Press] (상기 문헌은 본원에 참고로 포함된다)에서 살펴볼 수 있다.
실로-이노시톨은 다양한 종래 합성 또는 반합성 기법에 따라 제조될 수 있거나, 코코넛 팜으로부터의 천연 생성물로서 단리될 수 있다. 특정 실시양태에서, 실로-이노시톨은 WO2005035774 및 WO2011100670 (상기 출원의 전문이 본원에 참고로 포함된다)에 기술된 방법에 따라 제조된다.
실시예
경도 내지 중등도 AD (MMSE 16-26)를 앓는 환자에서의 2상, 평행 아암, 용량-범위, 위약-대조군, 이중-맹검, 다기관 시험에서, 실로-이노시톨을 각 연구 아암에 대해 설정된 투여량 수준으로 1일 2회에 걸쳐 즉시 방출형 정제로 연구 대상체에게 투여하거나, 동일하게 보이는 위약 정제를 대조군 아암에 투여하였다. 연구 결과, 경도 내지 중등도의 전체 집단에서는 신경심리 테스트 배터리 및 알츠하이머병 협력 연구-일상 활동 척도 (각각 NTB: Neuropsychological Test Battery 및 ADCS-ADL: Alzheimer's Disease Cooperative Study - Activities of Daily Living Scale)에서 공동-1차 인지 및 기능 종점에 대하여 통계학상 유의적인 이점은 나타나지 않았지만; 사전 지정된 경도 AD 환자군에서는 고무적인 경향이 있었다. 상기 연구는 NPI-12 항목 척도를 사용하는 신경심리 평가 뿐만 아니라, 자기 공명 분광법 (MRS)을 사용하여 실시되는 실로-이노시톨 (SI) 및 미오-이노시톨 (MI) 뇌 수준 평가를 포함하였다.
연구 약물을 위약으로서, 또는 3가지 용량: 250 mg, 1,000 mg 및 2,000 mg 중 한 용량의 실로-이노시톨 (SI)로서 투여하였으며, 각 용량을 250 mg 또는 1,000 mg의 캡슐제로서 1일 2회 (bid) 제공하였다.
MRS 데이터에서는 실로-이노시톨이 용량에 의존하는 방식으로 증가하는 것으로 나타났고, 예상 밖으로 미오-이노시톨의 수준은 그에 상응하여 용량에 의존하는 방식으로 감소하는 것으로 나타났으며 (도 6 및 9), 이러한 변화는 24주째에 유의적이지만, 준최대치였고, 약 48 내지 약 78주째에 최대 수준에 도달하였다. 연구된 3가지 용량에서 측정된 미오-이노시톨의 최대 감소율은 250 mg, 1,000 mg, and 2,000 mg bid 용량에서 각각 44%, 66% 및 60%였다.
본 연구에서, 위약 및 보다 고용량의 2가지와 비교하였을 때, 250 mg bid 용량의 실로-이노시톨이 수개의 임상 종점에 대하여 가장 큰 (양성) 치료 효과를 보였다 (데이터는 하기 섹션에서 논의된다). 250 mg 용량이 뇌척수액 (CSF) A베타42 감소에 미치는 효과 (기준선과 비교하여 ~27%)는 통계학상 유의적이었지만, 보다 고용량은 A베타42를 추가로 감소시키는 것으로 보였다. 실로-이노시톨의 CSF A베타42에 대하여 미치는 용량-의존식 효과에도 불구하고, 2가지 고용량은 일관되게 임상 종점에 대하여 250 mg 용량보다 더 작은 효과를 나타내었다. CSF A베타42에 대하여 미치는 용량-의존식 효과와 임상적으로 측정된 NPI 결과 사이는 관련이 없음을 분명히 나타내는 상기 관찰 결과는, 실로-이노시톨 임상 효과는 2개의 상이한 기전에 의해 매개된다는 개념을 입증한다. 이러한 기전으로는 1. 앞서 NPS가 아닌 기억 및 추리/문제 해결에 영향을 주는 것으로 개시된 뇌 아밀로이드 부하 및 생성된 시냅스 독성 감소, 및 2. 뉴런 기능에 대한 2차적인 유익한 효과와 함께, 뇌 미오-이노시톨의 수준 하향조절(문헌 [Machado-Vieira et al., 2009])을 포함하였다. 실로-이노시톨의 투여 이후의 미오-이노시톨 및 실로-이노시톨의 생체내 뇌 수준을 측정하는 유일의 다른 MRS 연구는 트랜스제닉 마우스에서 이루어졌다 (문헌 Choi, et al., 2010, Neuropharmacology, 59(4-5): 353-357]). 상기 최(Choi)의 연구에서 실로-이노시톨은 처리된 마우스의 전두 피질 및 해마에서 통계학상 유의적으로 차별적인 수준으로 나타났으며, 해마에서 더 높은 수준으로 발견되었고, 비록 마우스에 투여된 실로-이노시톨 용량을 본원에서 보고된 인간 용량과 의미 있게 비교하는 것이 불가능하기는 하지만, 전두 피질 및 해마, 둘 모두에서 미오-이노시톨 감소는 상당한 보통 정도의 비유의적인 것이었다. 2상 데이터에 대한 상세한 설명은 하기 기술한다.
2상 임상 데이터 요약
본 연구는 (MMSE 점수가 16-26 (16 및 26 포함)인 것으로 정의되는) 경도 내지 중등도 AD 환자에서의 용량 범위 연구였고, bid로 제공되는 3가지 용량의 실로-이노시톨 (250 mg, 1,000 mg, 및 2,000 mg), 및 위약을 포함하였다. 연구는 78주 동안 진행되었고, 총 353명의 환자가 등록하였으며, 351명이 연구 약물을 받았다 (안전 집단). 2개의 최고 용량군에서의 안전성 관찰 결과에 기인하여, 상기 2개의 군은 중단시켰고, 연구의 최종 효능 분석은 오직 250 mg 및 위약군에만 기초하여 수행되었다. 1차 효능 분석은 전체 집단 (경도 내지 중등도인 집단)에 기초하여 수행되었지만, 통계 분석 계획 (SAP)은 질환 중증도에 의한 서브군 분석을 포함하였으며, MMSE가 23-26 (23 및 26 포함)인 환자를 경도 환자로 정의하였고, 16-22 (16 및 22 포함)인 환자는 중등도의 환자로 정의하였다. 전체 연구 집단에서, 전체 353명을 모두 4개의 투여군으로 무작위화하였고, 전체 351명이 연구 약물을 투여받았다 (안전 집단, 임의 용량에서). 위약 및 250 mg 군의 경우, 전체 m-ITT (변형된 치료 의향 집단)=166, 전체 PPS(프로토콜을 잘 지킨 세트)=96이었다. 각각의 사전 지정된 서브군에 포함되어 있는 환자수는 하기 표 1에 제시되어 있다.
전체 m-ITT 집단에서 두 공동-1차 종점은 연구 종료시 (78주째) 통계적 유의성을 달성하지 못했다. 그러나, 연구를 마치고, 연구 약물을 80% 이상 따른 환자 (프로토콜을 잘 지킨 대상체)에서; NTB (신경심리 테스트 배터리-인지 종점)는 수치상, 250 mg 군에게 유리한 이점을 나타내었다 (도 2). 250 mg이 NTB에 미치는 효과 크기는, 비록 통계학상 유의적이지는 않았지만, 임상적으로 의미가 있었다 (위약과 비교하여 0.15 또는 40% 유익). 중등도의 서브군에서는 인지 또는 기능 임상 종점에 대한 일관된 음성적 또는 양성적 경향은 없었다.
사전 정의된 경도 서브군 (MMSE: 23-26)은 또한 임상적으로 관련된 약물에 유리한 NTB 차이를 보였고, 프로토콜을 잘 지킨 분석에서는 통계적 유의성에 도달하였다 (표 1 참조). 두 기능 결과 척도인 알츠하이머병 협력 연-일상 활동 척도 (ADCS-ADL) (공동-1차 종점) 및 임상 치매 평가 척도-총점 (CDR-SB: Clinical Dementia Rating Scale-sum of box) (2차 종점) 또한 임상적으로 의미있는 약물에 유리한 수치상의 차이를 보였다 (하기 표 2). 모든 임상 결과 척도에 대한 값을 계산하였고, 기준선으로부터의 양(+)의 변화는 개선되었음을 나타내고, 위약으로부터의 양(+)의 차이는 약물의 유익성을 나타낸다.
샘플 크기가 더 큰, 보다 확대된 정의를 가지는 경도 서브군 (MMSE: 22-26 (22 및 26 포함))을 이용하여 사후 감도 분석을 수행하였다. 본 감도 분석에서, NTB 점수에 대해 미치는 250 mg이 미치는 양(+)의 효과는 m-ITT 분석에서는 거의 유의적인 경향 (p<0.1)에 근접하였고 (하기 표 3), PP 분석에서는 유의적이었다 (p<0.05) (파일상의 데이터). 상기 250 mg 군은 ADCS-ADL에 대해 수치상 더 큰 이점을 나타내었고; CDR-SB 효과 또한 더 컸고, 거의 유의적인 경향에 근접하였다 (p=0.1, 표 3). 이에 기초하여, 여기서 제시된 모든 추가 분석에서는 경도 내지 중등도의 서브군은 MMSE 점수가 22-26 (22 및 26 포함) (경도) 내지 16-21 (16 및 21 포함) (중등도)인 환자로서 정의하였다.
특히, 상기 연구에서 환자 대다수 (투여군 모두에 걸쳐 ~90%)는 이미 증후성 AD 약물로 처리된 상태였고; 상기 약물로는 콜린에스테라제 억제제, 메만틴, 또는 그 둘 모두를 포함하였다. 추가로, 모든 환자 중 ~50%는 또한 가정컨대, BPSD용의 정신작용 약물로 처리하였고, 위약과 250 mg 군 사이의 처리된 대상체의 비율은 유사하였다 (파일상 데이터). AD 약물 및 정신작용 약물, 이 둘 모두 NPS에 대하여 일부 효과를 미칠 수 있는 바, 배경 처리에도 불구하고, 실로-이노시톨의 효과는 뚜렷하였다. NPS의 프로파일은 질환 중증도에 따라 다르기 때문에, 실로-이노시톨이 NPS에 미치는 효과를 경도 내지 중등도의 서브군에 대해 따로따로 기술하였다.
경도
AD
(
MMSE
: 22-26)에서 실로-이노시톨이
신경정신
프로파일에 대해 미치는 효과
기준선에서의 경도 서브군에 대한 신경정신 행동 검사 (NPI) 평균 총점은 위약군 및 250 mg 군에 대하여 각각 7.1 및 10.7 (중앙값: 3.0 및 4.0)이었다. 위약군에서, 원시 NPI 점수는 78주 동안에 걸쳐 4.5점만큼 증가하였다 (악화되었다). m-ITT 분석에서, 250 mg 군은 위약군으로부터 단지 수치상의 차이를 보였지만 (위약과 비교하여 ~2점 또는 44% 유익), PP 분석에서 치료 효과의 방향은 반대 방향이었다 (어느 것도 통계학상 유의적인 것은 아니었다). 기준선에서의 NPI 점수가 낮을 경우에는 NPI 척도에 대한 "바닥 효과"에 기인하여 경도 환자에서의 잠재적인 치료학상의 유익성을 입증하기는 어려웠다. 경도 AD 환자에서는 시간이 경과함에 따라 새로운 NPS가 계속해서 발생하는 것으로 알려져 있는 바, 보다 적절한 분석은 새로운 NPS 출현에 대한 치료 효과를 평가하는 것이 될 것이다.
잠재적으로 질환을 변경시키는 약물은 국소 뉴런 기능장애를 변경시킴으로써 NPI 결과로서 정량화되는 바와 같이, 비정상적인 행동의 출현을 막거나 지연시킬 수 있다. NPI 증상은 그의 기준선 점수가 0이고, 이후 임의의 후속 방문시의 점수가 > 0일 때, 새로 출현한 것으로 간주된다. 250 mg 용량이 (78주 동안에 걸쳐 1, 2, 3, 또는 4가지 이상의 새로운 증상에 대한) 새로운 NPS 출현에 대해 미치는 효과는 도 1에 제시되어 있다. 78주 동안에 걸쳐 2가지 이상의 새로운 증상이 발생한 환자의 비율은 위약과 비교하여 250 mg 군에서 21.5% 만큼 더 낮았다 (p<0.05).
치료 이전, 및 치료 종결 시점에 경도 환자에서 나타나는 가장 일반적인 NPS의 성질을 이해하기 위해, 기준선 및 연구 종결 시점에서의 각 NPI 항목의 유병률을 나타내었다 (도 2a). 위약군에서 연구 종결 시점에서의 무감동, 과민성, 불안감, 초조증, 식욕 및 수면 변화 (야간 행동)의 유병률은 증가된 상태였다. 250 mg 군에서, 상기 증상에 대한 유병률은 안정하게 그대로 유지되었으며 (도 2b), 단, 예외적으로, 과민성만이 10% 증가한 것으로 나타났다. 경도 군에서는 실로-이노시톨 대상체 및 위약 대상체 중 유사한 대상체수가 유해 사례로서 과민성을 보고하였고; 이 중 과민성에 기인하여 연구를 중단한 대상체는 없었다 (파일상의 데이터). 이는 250 mg 군에서 과민성의 유병률이 소폭 증가한 것은 임상적으로 유의적인 관찰 결과를 제기하지 않았다는 것을 제안한다.
일부 NPS는 특히 경도 단계의 AD에서는 진행 과정이 변동적인 것으로 알려져 있으며, 따라서, 78주간의 연구 기간 동안 출현할 수 있고, 소멸할 수 있다. 따라서, 상기 연구 기간 동안의 임의 시점에서 새로운 NPS의 출현에 대한 평가 또한 인자가 된다 (도 3).
도 3에 제시된 바와 같이, 우울증 및 불안감 뿐만 아니라, 식욕 변화 및 초조증이 가장 일반적으로 출현하는 증상 중 하나이고; 250 mg의 실로-이노시톨은 상기 증상, 및 무감도의 출현을 감소시켰다. 환자에서는 근원이 동일한 피질 기능장애의 표현인 다양한 증상 (증상군)이 빈번하게 발생하는 바, 이들 증상군이 특이적인 행동 증후군을 구성한다.
증상군에 미치는 효과: NPI 증상군이 출현하는 데 소요되는 시간에 대하여 실로-이노시톨이 미치는 효과는 카플란-마이어(Kaplan-Meier) 생존 분석을 사용하여 수행하였다. 추가로, 증상 중증도 감소 (기준선으로부터의 증상군 점수 변화)에 대하여 실로-이노시톨이 미치는 효과에 대해서도 또한 수행하였다. 두 분석 모두에 대한 결과는 하기 표 4에 제시되어 있다.
각 증상군 점수는, 기준선 차이에 대해 조정하기 위하여 반복 측정 혼합 효과 모델에 의해 분석된 그의 개별 항목 점수의 요약이었다. 상기 분석을 위해, 증상군 및 그의 핵심 증상은 하기와 같이 정의되었다: 정동 증상군 (우울증 및 불안감), 정신병적 증상군 (망상 및 환각), 실행기능장애 또는 전두 증상군 (탈억제 및 들뜸), 과잉행동 증상군 (핵심 증상: 이상 운동 및 이상 야간 행동), 및 별개의 군으로서 무감동.
표 4에 제시된 바와 같이, 상기 경도 집단에서 가장 일반적으로 출현하는 증상군은 정동 증후군이었다. 정동 증상군에 대한 상기의 기본 정의를 사용하였을 때, 실로-이노시톨 250 mg 용량은 상기 증후군의 출현을 지연시키는 경향을 보였다 (p<0.1). 처리시에는 상기 증상군에 대한 점수 또한 위약군과 비교하여 개선되었다 (0.65 개선).
AD에서의 증상군을 조사한 공개된 연구는 위탁원 (지역 사외 대 진료소 대상체), 질환 중증도, 및 (AD 및 정신작용 약물, 둘 모두의) 용량 사용 정도에 따라 달라지는 샘플 집단, 및 가변 방법을 사용하였다. 상기 데이터가 임상 시험 집단에 대하여 더 큰 관련성을 가지고 있을 수 있기 때문에, 본 연구 집단에 기반한 인자 분석을 수행하였다. 본 연구의 인자 분석은 기준선 NPI 데이터를 가진 환자 모두를 포함하였다 (n=351). 인자 분석에서, 베리맥스(Varimax) 방법이 가장 일반적으로 사용되는 방법이며; 샘플 크기가 ~300-500일 때, 신뢰도가 우수한 것으로 간주된다 (문헌 [Comrey and Lee, 1992, A first course in factor analysis, Hillsdale, New Jersey: Erlbaum]). 베리맥스 회전 방법을 통해 하기 인자의 로딩값은 0.4 이상인 것으로 밝혀졌고, 이는 증상군에서 중요한 인자인 것으로 간주될 수 있다 (파일상의 데이터).
정동: 우울증, 불안감, 초조증, 야간 행동, 식욕 변화 및 무감동.
정신병적: 망상 및 환각.
전두엽 또는 실행기능장애: 들뜸/행복감 및 탈억제.
본 연구의 인자 분석을 통해 (이전 섹션에서 논의된) 공개된 연구와 유사한 결과를 얻었는데, 단, "정동 증후군"은 예외적이었다. 본 결과와 이전 연구 사이의 주된 차이는 식욕 및 수면 변화는 정동 증후군 내에서 군집화된 반면, 과민성은 그렇지 못하였다는 점이다. 이는 부분적으로는 여러 연구가 식욕 및 수면 변화를 포함하지 않는 10가지 항목의 NPI를 사용하였다는 사실을 반영할 수 있다 (요약에 대해서는 문헌 [Aalten et al., 2007, The Journal of Neuropsychiatry and Clinical Neurosciences, 19:50-56], [Garre-Olmo et al., 2010, Quality of Life Research 19(3):445-53]). "과민성"을 정동 증상과 함께 군집화하지 못하는 것은 2가지 인자와 관련이 있을 수 있다: 1. 연구 AD201 집단에서의 고도한 정신작용 약물 사용 (이는 과민성과 우울증/불안감 사이의 관계를 변화시킬 수 있다); 및 2. 본 연구에서 "경도" AD에 대한 정의 (이를 통해 (보통은 MMSE가 20-26인 것을 경도 것으로 정의하는) 이전의 많은 연구에서보다 더 경도 환자군으로 확인되었다). 상기 중 후자의 가능성은, 경도 것에 대하여 더 낮은 MMSE를 21로 설정하여 수행하였고, 본 관찰 결과와 유사하게, 과민성이 정동 증상과 함께 군집화되지 않은 것으로 나타난, 브누아(Benoit) 등의 REAL-FR 연구의 결과에 의해 입증되었다 (문헌 [Benoit et al., 2003, Revue de Medecine Interne 24: 319s-324s]). 요인 분석에서, 무감동은 정동 증상군 (0.4)과 함께 경계 로딩 인자를 가졌다. 가장 최근의 연구에서, 무감동은 독립 엔티티인 것으로 간주되었지만, 이전의 한 연구 (문헌 [Aalten et al., 2003, Dement Geriatr Cogn Disord 15: 99-105])에서 무감동은 기분/정동 증상과 함께 군집화되는 것으로 나타났다.
"정동 증후군" 점수, 및 상기 증후군이 출현하는 데 소요되는 시간에 대하여 실로-이노시톨 250 mg이 미치는 효과는 하기 표 5에 제시되어 있다. 정동 증후군 점수는 혼합 효과 반복 측정 분석 (MMRM)에 의해, 및 요약 통계량에 의해 제시하였다. 약물과 위약간의 (기준선으로부터의 변화의) 양(+)의 차이는 약물이 유익하다는 것을 나타낸다.
실로-이노시톨이 MMRM 및 요약 통계량에 의한 점수 변화에 미치는 효과는 위약군과 비교하여 각각 35% 및 91% 개선인 것으로 나타났다. MMRM에 의한 점수 변화 분석은 이것이 두 군 사이의 기준선 불균형을 조정하는 바, 보다 보수적인 추정치가 된다. 샘플 크기가 작음에도 불구하고 (위약군 n= 31, 250 mg 군 n= 32), 상기의 보다 폭넓은 정동 증후군이 출현하는 데 소요되는 시간은 거의 유의적인 경향에 근접하였다.
종합해보면, 다양한 분석을 통해 실로-이노시톨 (250 mg bid)이 경도 AD 환자에서의 정신병 부담을 감소시키는 데 있어 효능이 있다는 것이 입증되었다. 이러한 효과는 7가지의 일반적인 출현 증상 중 6가지의 출현 및 그의 중증도를 감소시키는 것을 포함하였다.
현재까지는 어느 AD 증후성 약물도 항우울제/항정신병제 약물도 상기의 광범위한 정동 증상의 출현 및 중증도, 이 둘 모두에 대하여 양(+)의 효과를 보인 것은 없었다. 경도 AD 환자에서의 양(+)의 인지 효과 및 우수한 안전성/내성과 함께, 행동상 유익에 관한 상기의 프로파일을 통해 실로-이노시톨을 상기 환자 집단 치료를 위한 것으로 만들었다.
중등도
AD
(
MMSE
: 16-21)에서 실로-이노시톨이
신경정신
프로파일에 대해 미치는 효과
기준선에서의 중등도의 서브군에 대한 NPI 평균 총점은 250 mg 군 및 위약군에 대하여 각각 10.0 및 9.2 (중앙값: 두 군 모두 7)이었다. 위약군에서 NPI 점수는 78주 동안에 걸쳐 점진적으로 ~8점만큼 악화되었다. 기준선에서 중등도 AD 환자의 정신병 부담은 경도 환자보다 약간 더 높았지만, 중등도인 위약군은 경도 위약군보다 더 크게 악화되었다 (경도 환자 비율의 2배보다 약간 더 작은 값이었다). 중등도의 환자에서, 250 mg 군은 m-ITT 분석에서 위약으로부터 유의적인 차이를 보이지 않았다. 그러나, 연구를 마친 순응한 대상체 에서 (PP 분석), 250 mg 군은 (~50% 개선을 나타내는) ~4점만큼 위약보다 우수한 성능을 보였다. 이러한 정도의 유익은 비록 통계학상 유의적이지는 않았지만, 임상적으로 관련이 있었다.
250 mg bid의 실로-이노시톨은 중등도 AD 환자에서 NPS의 전체 빈도 및 중증도를 개선시키는 것으로 나타났다. 어느 NPS가 상기 약물 효과에 대해 가장 기여하는지를 이해하기 위하여, 수개의 분석을 수행하였다. 이러한 분석을 통해 실로-이노시톨이 개별 항목 점수, 증상군 점수, 및 새로운 NPS의 출현에 대해 미치는 효과를 조사하였다.
중등도의 군에서 기준선에서의 가장 우세한 NPS는 경도 서브군과 유사하였으며, 단, 예외적으로, 과민성은 가장 우세한 상위 6가지의 NPS 중 야간 행동으로 대체되었다. 중등도 AD 군에서, 과민성은 약간 덜 일반적이었고, 이상 운동 행동 및 망상은 경도 군에서보다 더 일반적이었다 (하기 표 6).
중등도의 군에서의 새로운 NPS의 출현 (1, 2, 3 또는 4가지 이상의 새로운 증상)은 도 4에 제시되어 있다.
도 4로부터, 78주 동안에 걸쳐 2가지 이상, 또는 4가지 이상의 새로운 증상이 발생한 환자의 비율은 250 mg 군 대 위약군에서 각각 12.4% 및 12.1% 만큼 더 낮았지만, 가능하게는 샘플 크기가 작은 것에 기인하여 어느 것도 통계적 유의성을 달성하지 못하였다 (p=0.33 및 0.34).
각 NPI 항목 출현에 대한 평가 또한 수행하였고, 이는 도 5에 제시되어 있다.
도 5에는 중등도 AD 환자에서는 대부분의 NPS의 출현이 감소되었다는 것이 도시되어 있다. 이러한 효과는 특히, 상기 단계의 질환에서 더욱 우세하게 나타나는 탈억제 및 수면 장애에 대해 강력하였다. 질환이 진행됨에 따라 악화되는 것으로 알려져 있는 무감동의 출현 또한 실로-이노시톨에 의해 감소되는 것으로 보였다. 탈억제와 함께 전두 기능장애의 핵심 증상인 들뜸은 그의 낮은 유병률에도 불구하고, 그 출현 또한 감소되었다. 그러나, 과민성은 처리에 따라 더욱 우세해진 것으로 보였다. 과민성이 유해 사례인 것으로 보고된 모든 사례에 대한 평가를 통해, 이는 빈번하게는 기분 장애 및/또는 불면증의 이전 병력과 관련이 있는 것으로 밝혀졌다. 과민성 사례 중 어느 경우에도 연구를 중단하지는 않았으며, 이는 상기 내용이 임상적으로 관련되는 것은 아니라는 것을 제안한다.
증상군에 미치는 효과: NPI 증상군이 출현하는 데 소요되는 시간에 대하여 실로-이노시톨이 미치는 효과는 카플란-마이어 생존 분석을 사용하여 수행하였다. PP 분석에서 처리에 따라 출현이 지연되는 경향을 보인 증상군은 행동 증상군이었다 (이상 운도 및 야간 행동, p=0.051). 전두 증상 (탈억제 및 들뜸) 출현까지의 소요 시간은 가능하게는 들뜸의 낮은 유병률에 기인하여 가능한 약한 경향 (p=0.182)을 보였다. MMRM 및 요약 통계량, 둘 모두를 사용하여, 증상 중증도 감소 (기준선으로부터의 증상군 점수 변화)에 대하여 실로-이노시톨이 미치는 효과에 대해서도 또한 분석하였다 (하기 표 7).
표 7은 중등도 AD 군에서 실로-이노시톨의 효과가 대부분의 NPS 증상의 개선에 의해 구동된다는 것을 보여주고 있다. 상기 효과는 이상 행동 증상군에 대해, 정동 증상군에 대해, 및 무감동에 대해 가장 일관된 것으로 나타났다.
중등도 AD 군 및 경도 AD 군에서의 실로-이노시톨의 효과는 약간의 차이를 보이는데, 이는 경도 환자에서는 대부분 새로운 NPS가 누적되는 반면, 중등도의 환자에서는 현존 NPS가 추가로 완화되는 것인, 각 질환 단계에서의 상이한 NPS 진행 프로파일을 반영하는 것일 수 있다. 경도 환자에서 실로-이노시톨이 미치는 가장 현저한 효과는, 심지어 정동 증후군이 광범위하게 정의된 경우에도, 새로운 정동 증상의 출현 지연에 대한 것이었다. 중등도의 환자에서 실로-이노시톨의 효과는 정동, 행동, 전두, 및 무감동 증상을 비롯한, 다양한 증상의 악화를 감소시킴으로써 분명해졌다.
비록 본 연구가 보다 중증 치매 (MMSE가 16 미만) 환자를 포함하지는 않았지만, 효과는 중등도 내지 중증 단계에서 더욱 특징적인 NPS, 예컨대 망상, 및 환각인 정신병적 증상, 내지 초조증 및 공격성인 정신병적 증상에 대하여 더욱 현저할 수 있어도, 실로-이노시톨이 상기 환자에서 NPS의 중증도를 감소시키는 데 있어서 유익할 것이라고 기대하는 것도 타당하다. 이는 중등도가 MMSE 등급=16-19으로 정의되며, 따라서, 상기 분석된 16-21 군보다는 중등도의 중증 단계에 더욱 가까운 중등도의 서브군에 대한 감도 분석에 의해 입증된다. 중등도 AD 환자 중 "강화된" 군 (MMSE 16-19)에서, 정신병적 증상군, 무감동, 및 이상 행동에 대해 실로-이노시톨이 미치는 효과는 더욱 현저해졌다.
도 6으로부터, 1,000 mg bid 및 2,000 mg bid의 실로-이노시톨의 효과는 뇌 실로-이노시톨 수준을 최대로 포화시켰고, 미오-이노시톨의 수준을 ~60-66%로 최대로 감소시키는 것으로 나타난 반면, 250 mg bid 용량은 미오-이노시톨의 수준을 준최대치로 44% 감소시켰는데, 이는 양극성 질환 환자에서 사용되었을 때, 치료량의 리튬과 관련하여 ~30% 감소한 것과 유사한 값이다. 비록 본 연구가 다운증후군 환자는 포함하지 않았지만, 실로-이노시톨이 미오-이노시톨 변화의 결과로서 NPS의 중증도를 감소시키는 데 있어서 유익할 것이라고 기대하는 것도 타당하다. 다운증후군에서는 미오-이노시톨이 높은 수준으로 존재하는 것으로 알려져 있다 (문헌 [Shetty et al., 1996, Biochem J., 1;313 (Pt 1):31-3]; [Shonk et al., 1995, Magnetic Resonance in Medicine, 33(6): 858-861]; [Beacher et al., 2005, Arch Gen Psychiatry. 62(12):1360-1365]).
도 7에 제시된 바와 같이, ≥1,000 mg bid 용량에 상응하는 실로-이노시톨 노출에 의한 CSF A베타42의 보다 큰 감소에도 불구하고, 이러한 노출은 증상군에서 NPS에 대하여 일관된 유익성을 보이지 않았다. 이는 미오-이노시톨 뇌 수준 조절이 실로-이노시톨의 치료학상의 유익성을 매개하는 데 중요한 역할을 한다는 개념을 입증한다.
도 8a 및 8b에 비추어 보면, 250 mg bid 용량에 상응하는 혈장 AUC (제2분위)는 우울증 및/또는 불안감 출현의 유의적인 감소와 관련이 있는 반면, 최고 용량의 노출은 유의적인 유익성은 없는 것으로 나타났다. 시험된 용량 중 250 mg bid 용량을 통해 A베타42 CSF 수준은 27% 감소하였고, 미오-이노시톨 뇌 수준은 44% 감소하였다. 이는 NPI에 대한 임상적 유익성을 매개하는 최적 범위의 효과인 것으로 보인다.
요약하면, ≥1,000 mg bid의 실로-이노시톨 노출은 250 mg bid 용량보다 더 적은 인지 및 기능상의 유익성을 제공하였다. 이러한 고용량의 노출은 신경정신 유해 사례 증가와 관련될 수 있다. 250 mg bid 용량은 또한 노인 연구 집단에서 허용되는 안전성 및 우수한 CNS 내성을 보였다. NPI의 지연, 방해, 또는 완화에 의해 입증되는 바, 250 mg bid 노출은 양(+)의 임상적 유익성/위험성 프로파일을 제공하였으며, 250 mg bid 용량 (1일 총 500 mg)은 CSF Aβ42 베타 감소를 감소시킬 뿐만 아니라, 미오-이노시톨 뇌 수준을 치료학상 유용한 수준으로 지속적으로 하향조절시킨다는 관찰 결과를 얻었다.
종합해보면, 상기 데이터는 알츠하이머병 및 다른 치매 치료에서 실로-이노시톨을 이용한 최적의 치료 요법을 정의하는 데 도움이 된다. 상기 데이터는 또한 뇌 미오-이노시톨 감소를 측정하는 것이 다양한 치매 집단에서 최적의 치료학적 실로-이노시톨 투약을 예측 또는 결정하는 방법을 제공할 수 있다는 것을 제안한다. 본 발명의 다른 실시양태는 본원에 개시된 본 발명의 명세서 및 실시에 대한 고려로부터 당업자에게 자명할 것이다. 본 명세서 및 실시예는 단지 예시적인 것으로 간주하고자 하며, 본 발명의 진정한 범주 및 정신은 하기 특허청구범위에 의해 제시되는 것으로 한다.
Claims (30)
- 대상체에게 유효량의 실로-이노시톨을 투여하는 단계를 포함하는, 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키는 방법.
- 치료학상 유효한 치료 기간 동안 치매, 경도 AD, MCI 또는 양극성 장애 환자에게 치료 유효량의 실로-이노시톨을 투여하는 단계를 포함하고, 여기서 실로-이노시톨의 투여가 환자의 뇌에서 미오-이노시톨 수준을 투여 이전에 측정된 기준선 측정치로부터 감소시키는 것인, 치매, 경도 AD, MCI 또는 양극성 장애 환자의 뇌에서 미오-이노시톨 수준을 하향조절시키는 방법.
- 제1항에 있어서, 실로-이노시톨의 유효량이 1일당 약 125 mg 내지 약 900 mg인 방법.
- 제3항에 있어서, 실로-이노시톨을 1일 2회 투여하는 것인 방법.
- 제1항에 있어서, 투여가 환자의 뇌 미오-이노시톨 수준을 투여 이전의 기준선 측정치로부터 약 20% 내지 약 50% 만큼 감소시키는 것인 방법.
- 치료학상 유효한 치료 기간에 걸쳐 환자에게 치료 유효량의 실로-이노시톨을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 2가지 이상의 새로운 신경정신 증상의 출현을 투여 이전의 기준선 측정치와 비교하여 지연시키는 것인, 환자에서 2가지 이상의 새로운 신경정신 증상의 출현을 지연시키는 방법.
- 제6항에 있어서, 환자가 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 또는 다운증후군 치매를 앓는 것인 방법.
- 제7항에 있어서, 알츠하이머병 치매가 경도 또는 중등도의 알츠하이머인 방법.
- 제6항에 있어서, 실로-이노시톨의 치료 유효량이 약 250 mg인 방법.
- 제9항에 있어서, 실로-이노시톨을 1일 2회 투여하는 것인 방법.
- 치료학상 유효한 치료 기간에 걸쳐 치매 환자에게 치료 유효량의 실로-이노시톨을 포함하는 제약 조성물을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 1가지 이상의 신경정신 증상군의 출현을 투여 이전의 기준선 측정치와 비교하여 지연시키는 것인, 치매 환자에서 1가지 이상의 신경정신 증상군의 출현을 지연시키는 방법.
- 제11항에 있어서, 신경정신 증상군이 정동 증상군, 정신병적 증상군, 무감동, 전두엽 들뜸 및 탈억제 증상군, 행동 증상군, 및 이들의 임의의 조합으로부터 선택되는 것인 방법.
- 제11항에 있어서, 실로-이노시톨의 치료 유효량이 약 250 mg인 방법.
- 제13항에 있어서, 실로-이노시톨을 1일 2회 투여하는 것인 방법.
- 제11항에 있어서, 치매가 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로부터 선택되는 것인 방법.
- 제11항에 있어서, 치매가 중등도의 알츠하이머병이고, 1가지 이상의 증상군이 행동 증상군인 방법.
- 치료학상 유효한 치료 기간에 걸쳐 치매 환자에게 치료 유효량의 실로-이노시톨을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 1가지 이상의 신경정신 증상의 중증도를 투여 이전의 기준선 측정치로부터 감소시키는 것인, 치매 환자에서 1가지 이상의 신경정신 증상의 중증도를 감소시키는 방법.
- 제17항에 있어서, 1가지 이상의 신경정신 증상이 우울증, 불안감, 식욕 변화, 초조증, 야간 행동, 망상, 환각, 무감동, 탈억제, 수면 장애 및 들뜸으로부터 선택되는 것인 방법.
- 제17항에 있어서, 치매가 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로부터 선택되는 것인 방법.
- 제17항에 있어서, 실로-이노시톨의 치료 유효량이 약 250 mg인 방법.
- 제20항에 있어서, 실로-이노시톨을 1일 2회 투여하는 것인 방법.
- 78주 이상의 치료 기간에 걸쳐 치매 환자에게 치료 유효량의 실로-이노시톨을 투여하는 단계를 포함하고, 여기서 상기 치료 기간에 걸쳐 실로-이노시톨의 투여가 1가지 이상의 현존하는 신경정신 증상의 진행을 투여 이전의 기준선 측정치로부터 지연시키는 것인, 치매 환자에서 1가지 이상의 현존하는 신경정신 증상의 진행을 지연시키는 방법.
- 제22항에 있어서, 치매가 알츠하이머병 치매, 전측두엽 치매, 혈관성 치매, 루이소체 치매, 및 다운증후군 치매로부터 선택되는 것인 방법.
- 제23항에 있어서, 치매가 중등도 또는 중증 알츠하이머인 방법.
- 제22항에 있어서, 실로-이노시톨의 유효량이 약 250 mg인 방법.
- 제25항에 있어서, 실로-이노시톨을 1일 2회 투여하는 것인 방법.
- 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키거나 미오-이노시톨을 하향조절시키는 데, 또는 대상체의 뇌에서 미오-이노시톨의 수준을 감소시키거나 미오-이노시톨을 하향조절시키기 위한 약제의 제조에 사용하기 위한 실로-이노시톨.
- 대상체에서 신경정신 증상을 치료하는 데, 또는 대상체에서 신경정신 증상을 치료하기 위한 약제의 제조에 사용하기 위한 실로-이노시톨.
- 치매, 경도 AD, MCI 또는 양극성 장애를 앓는 대상체에서 신경정신 증상의 출현을 지연시키는 데, 또는 신경정신 증상의 중증도를 감소시키는 데 사용하기 위한 실로-이노시톨.
- 제29항에 있어서, 신경정신 증상이 우울증, 불안감, 식욕 변화, 초조증, 야간 행동, 망상, 환각, 무감동, 탈억제, 수면 장애 및 들뜸으로부터 선택되는 것인 실로-이노시톨.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161520031P | 2011-06-03 | 2011-06-03 | |
| US61/520,031 | 2011-06-03 | ||
| US201161541333P | 2011-09-30 | 2011-09-30 | |
| US61/541,333 | 2011-09-30 | ||
| US201261618680P | 2012-03-31 | 2012-03-31 | |
| US61/618,680 | 2012-03-31 | ||
| PCT/US2012/040789 WO2012173808A1 (en) | 2011-06-03 | 2012-06-04 | Scyllo-inositol for the treatment of behavioral and psychiatric disorders |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140041670A true KR20140041670A (ko) | 2014-04-04 |
Family
ID=46298680
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147000006A KR20140041670A (ko) | 2011-06-03 | 2012-06-04 | 행동 장애 및 정신 장애의 치료를 위한 실로―이노시톨 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20140243422A1 (ko) |
| EP (1) | EP2714050A1 (ko) |
| JP (1) | JP2014515408A (ko) |
| KR (1) | KR20140041670A (ko) |
| CN (1) | CN103906520A (ko) |
| AU (1) | AU2012271068A1 (ko) |
| BR (1) | BR112013031117A8 (ko) |
| CA (1) | CA2837926A1 (ko) |
| IL (1) | IL229658A0 (ko) |
| RU (1) | RU2013154699A (ko) |
| WO (1) | WO2012173808A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7521481B2 (en) | 2003-02-27 | 2009-04-21 | Mclaurin Joanne | Methods of preventing, treating and diagnosing disorders of protein aggregation |
| WO2014110234A1 (en) * | 2013-01-09 | 2014-07-17 | Elan Pharmaceuticals, Llc | Methods of treating developmental and personality disorders |
| US11191735B2 (en) | 2015-03-13 | 2021-12-07 | Nutrition 21, Llc | Arginine silicate for periodontal disease |
| EP3721876A1 (en) * | 2015-06-30 | 2020-10-14 | Nutrition 21, LLC | Arginine silicate inositol for improving cognitive function |
| WO2017029353A1 (en) * | 2015-08-20 | 2017-02-23 | Transition Therapeutics Ireland Limited | Treatment of behaviors in dementia patients |
| US20170135969A1 (en) | 2015-11-12 | 2017-05-18 | Jds Therapeutics, Llc | Topical arginine-silicate-inositol for wound healing |
| MX2019002468A (es) | 2016-09-01 | 2019-09-18 | Jds Therapeutics Llc | Composiciones de biotinato de magnesio y metodos de uso. |
| AU2019371825B2 (en) | 2018-11-02 | 2023-07-27 | Nutrition 21, Llc | Compositions containing inositol-stabilized arginine silicate complexes and inositol for improving cognitive function in video gamers |
| JP2023506724A (ja) * | 2019-12-02 | 2023-02-20 | スヴェン・ライフ・サイエンシーズ・リミテッド | 認知症患者の行動心理学的症状の治療 |
| EP4076413A1 (en) | 2019-12-16 | 2022-10-26 | Nutrition 21, LLC | Methods of production of arginine-silicate complexes |
| WO2024054415A1 (en) * | 2022-09-07 | 2024-03-14 | Eirgen Pharma, Ltd. | A combination of scyllo-inositol and flavones |
| CN115998724B (zh) * | 2023-03-28 | 2023-06-16 | 中国人民解放军军事科学院军事医学研究院 | 布洛芬在抗幻觉作用药物中的新用途 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7521481B2 (en) * | 2003-02-27 | 2009-04-21 | Mclaurin Joanne | Methods of preventing, treating and diagnosing disorders of protein aggregation |
| IL156203A0 (en) * | 2003-05-29 | 2003-12-23 | Yissum Res Dev Co | Use of 2,2,3,3, tetramethylcyclopropane carboxylic acid derivatives for treating psychiatric disorders |
| CA2774930C (en) | 2003-10-14 | 2014-08-05 | Hokko Chemical Industry Co., Ltd. | Method for producing purified scyllo-inositol utilizing boric acid |
| ZA200807993B (en) * | 2006-03-09 | 2010-02-24 | Waratah Pharmaceuticals Inc | A cyclohexane polyalcohol formulation for treatment of disorders of protein aggregation |
| MX2008011553A (es) * | 2006-03-09 | 2008-12-09 | Waratah Pharmaceuticals Inc | Formulacion de polialcohol de ciclohexano para el tratamiento de transtornos de agregacion de proteinas. |
| WO2011100670A1 (en) | 2010-02-15 | 2011-08-18 | Abbott Laboratories | Process for the preparation of scyllo-inositol |
| US20150306043A1 (en) * | 2012-09-28 | 2015-10-29 | Transition Therapeutics Ireland Limited | Combination treatments for bipolar disorders |
-
2012
- 2012-06-04 BR BR112013031117A patent/BR112013031117A8/pt not_active IP Right Cessation
- 2012-06-04 JP JP2014513795A patent/JP2014515408A/ja active Pending
- 2012-06-04 WO PCT/US2012/040789 patent/WO2012173808A1/en active Application Filing
- 2012-06-04 CN CN201280037339.8A patent/CN103906520A/zh active Pending
- 2012-06-04 KR KR1020147000006A patent/KR20140041670A/ko not_active Application Discontinuation
- 2012-06-04 CA CA2837926A patent/CA2837926A1/en not_active Abandoned
- 2012-06-04 US US14/123,581 patent/US20140243422A1/en not_active Abandoned
- 2012-06-04 AU AU2012271068A patent/AU2012271068A1/en not_active Abandoned
- 2012-06-04 EP EP12727719.2A patent/EP2714050A1/en not_active Withdrawn
- 2012-06-04 RU RU2013154699/15A patent/RU2013154699A/ru not_active Application Discontinuation
-
2013
- 2013-11-27 IL IL229658A patent/IL229658A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2012271068A1 (en) | 2013-12-19 |
| CA2837926A1 (en) | 2012-12-20 |
| JP2014515408A (ja) | 2014-06-30 |
| BR112013031117A8 (pt) | 2018-08-14 |
| CN103906520A (zh) | 2014-07-02 |
| US20140243422A1 (en) | 2014-08-28 |
| WO2012173808A1 (en) | 2012-12-20 |
| IL229658A0 (en) | 2014-01-30 |
| EP2714050A1 (en) | 2014-04-09 |
| RU2013154699A (ru) | 2015-07-20 |
| BR112013031117A2 (pt) | 2018-06-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140041670A (ko) | 행동 장애 및 정신 장애의 치료를 위한 실로―이노시톨 | |
| Robinson et al. | Memantine: a review of its use in Alzheimer’s disease | |
| WO2019094724A1 (en) | Ganaxolone for use in treating genetic epileptic disoders | |
| Mayer et al. | Insomnia in central neurologic diseases–occurrence and management | |
| US11033543B2 (en) | Methods of providing weight loss therapy in patients with major depression | |
| US20220362197A1 (en) | Lipids with odd number of carbon atoms and their use as pharmaceutical composition or nutritional supplement | |
| JP2007526335A (ja) | 焦燥およびその他の行動障害、特にアルツハイマー病に関連する行動障害の治療用1−アミノシクロヘキサン誘導体 | |
| EP4076419A1 (en) | Treatment of amyotrophic lateral sclerosis and related disorders | |
| Dalvi | Alzheimer's disease | |
| AU2016268153B2 (en) | Therapeutic uses of L-4-chlorokynurenine | |
| JP2018534336A (ja) | アルツハイマー病および関連障害を処置するための方法 | |
| WO2023081482A1 (en) | Combination of turso and sodium phenyl butyrate for the treatment of neurodegenerative diseases | |
| US10328051B2 (en) | Proline or proline derivatives for the treatment of dementia | |
| Bashir et al. | Amyloid-Induced Neurodegeneration: A Comprehensive Review through Aggregomics Perception of Proteins in Health and Pathology | |
| Lazowski | An Investigation of Sleep Architecture and Consequent Cognitive Changes in Olanzapine Treated Patients with Depression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |