KR20140022773A - 약학 조성물 - Google Patents
약학 조성물 Download PDFInfo
- Publication number
- KR20140022773A KR20140022773A KR1020137013955A KR20137013955A KR20140022773A KR 20140022773 A KR20140022773 A KR 20140022773A KR 1020137013955 A KR1020137013955 A KR 1020137013955A KR 20137013955 A KR20137013955 A KR 20137013955A KR 20140022773 A KR20140022773 A KR 20140022773A
- Authority
- KR
- South Korea
- Prior art keywords
- group
- pharmaceutical composition
- present
- pharmaceutical
- patient
- Prior art date
Links
- 0 CC(NC[C@@](CN1c2ccc(-c3ccc(CNCC*4=*N=N4)cc3)c(F)c2)OC1=O)=O Chemical compound CC(NC[C@@](CN1c2ccc(-c3ccc(CNCC*4=*N=N4)cc3)c(F)c2)OC1=O)=O 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4192—1,2,3-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/421—1,3-Oxazoles, e.g. pemoline, trimethadione
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/08—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D263/16—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D263/18—Oxygen atoms
- C07D263/20—Oxygen atoms attached in position 2
- C07D263/22—Oxygen atoms attached in position 2 with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to other ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Abstract
본 발명은 약학 조성물에 유용한 캐리어 시스템에 관한 것이다. 이러한 캐리어는 유화제를 포함하며, 추가의 구체예에서, 상기 캐리어는 또한 중합체 용출 조제를 포함한다. 이와 같은 캐리어는 약학 활성 성분, 예를 들어 항 미생물 제제를 전달하는데 유용하다.
Description
관련 출원에 대한 상호 참고 문헌
본 출원은 2010. 11. 1자 제출된 미국 가출원 제61/408,830호에 대한 우선권 및 그의 혜택을 주장하며, 미국 가출원의 내용은 본원에서 원용된다.
본 발명의 분야
본 발명은 약학 조성물에 유용한 캐리어(carrier) 시스템에 관한 것이다. 이와 같은 캐리어는 유화제를 포함한다. 추가의 구체예에서, 상기 캐리어는 또한 중합체 용출 조제(polymeric dissolution aid)도 포함한다. 상기 캐리어는 약학 활성 성분(pharmaceutical active), 예를 들어 항 미생물 제제를 전달하는데 유용하다. 본 발명은 또한 항 미생물 제제를 포함하는 약학 조성물, 이 약학 조성물을 제조하는 방법, 그리고 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄여주는 방법에 관한 것이기도 하다.
적당한 약학 캐리어 시스템은 일반적으로 약학 활성 성분을 안전하고 효율적으로 전달하는데 필요하다. 전체 약학 조성물, 즉 약학 캐리어 중에 제제화된 약학 약물 활성 성분은 생체 이용도뿐만 아니라 활성 성분의 약물 동태학 및 약력학적 특성에도 영향을 미칠 수 있다. 그러므로 약학 조성물을 신중하게 개발하여 안전하고 효율적인 방식으로 원하던 약학 활성 성분을 전달하도록 제조하는 것이 중요하다.
미생물 감염을 치료하기 위하여 항 미생물 제제를 전달하는 것은 특히 어려운 과제일 수 있다. 치료 효능을 제공하기 위하여, 일반적으로는 항 미생물 제제가 환자에게 투여되었을 때 이 제제의 혈류 또는 표적 장기 중 전신 농도(systemic concentration)는, 특정 미생물 유기체 또는 유기체들이 표적화되는데 충분한 시간 동안 최소 억제 농도(즉 MIC) 이상이 되어야 할 것이 요망된다. 결과적으로, 상기 항 미생물 제제가 생체 내 투여용으로서 적당히 제제화되지 않는다면, 시험관 내 유효 항 미생물 프로필을 나타내지 않는 항 미생물 제제는 비효율적일 수 있거나, 심지어는 유해할 수도 있다.
그러므로, 약학 약물 활성 성분, 특히 항 미생물 제제의 안전하고 효율적인 전달을 위해 적합한 약학 캐리어 시스템 및 약학 조성물의 개발과 제조는 중요하며 계속 진행중인 요구이다. 본 발명은 이들 요구와 기타 요구를 충족할 것으로 보인다.
본 발명은 약학 조성물에 유용한 캐리어 시스템에 관한 것이다. 본 발명은 유화제를 포함하는 약학 캐리어에 관한 것이고, 추가의 구체예는 중합체 용출 조제를 포함하는 약학 캐리어에 관한 것이다. 본 발명은 또한 약학 활성 성분을 추가로 포함하는 약학 조성물에 관한 것이기도 하다. 본 발명은 또한 약학 활성 성분이 항 미생물 제제인 약학 조성물에 관한 것이기도 하다. 본 발명은 또한 약학 캐리어 및 약학 조성물을 제조하는 방법에 관한 것이기도 하다.
본 발명은, 본 발명에 따른 약학적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 치료하는 방법을 제공한다. 본 발명은, 본 발명에 따른 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 예방하는 방법을 제공한다. 본 발명은, 본 발명에 따른 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염 위험을 줄여주는 방법을 제공한다.
본 발명은 환자의 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄여주는데 유용한 조성물을 제공한다.
본 발명은 환자의 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄여주는데 유용한 약학 조성물 또는 약품을 제조함에 있어서 항 미생물 제제의 용도를 제공한다.
본 발명은 방법, 조성물 또는 용도를 제공하는데, 여기서, 상기 조성물은 대조 조성물에 비하여 2단계 용출 테스트 시스템에서의 용출률이 5% 이상 개선된다.
본 발명은 방법, 조성물 또는 용도를 제공하는데, 여기서, 상기 조성물은 대조 조성물에 비하여 2단계 용출 테스트 시스템에서의 용출률이 5% 이상 개선되며, 상기 2단계 용출 시스템은, 제1 단계에서, pH 약 4의 모의 위 환경에서 30분 이하의 기간 동안 용출을 측정한 후, 제2 단계에서, pH 약 5.4~약 6.5의 모의 위 환경에서 약 60분 이하의 기간 동안 용출을 측정하는 단계를 포함한다.
본 발명의 전술한 양태들과 기타 양태, 그리고 구체예는 하기 상세한 설명 및 특허 청구 범위를 참고로 하였을 때 더욱 잘 이해될 수 있을 것이다.
도 1: 도 1은 실시예("모의 위장관계 내 용출 테스트")의 섹션 C에 기술된 바와 같은, 모의 위장관계 내에서 행해지는 약물의 2단계 용출 테스트를 개략적으로 도시한 것이다.
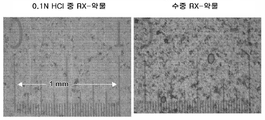
도 2: 도 2는 개를 대상으로 한 생체 내 연구와 관련하여 염소 이온의 존재 하에 약물 응집체의 현미경 이미지를 도시한 것이다.
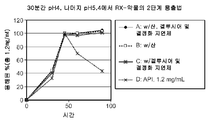
도 3: 도 3은 방법 1에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 5.4의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 4: 도 4는 방법 2에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 5: 도 5는 방법 3에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다. 상기 완충액 둘 다의 NaCl 농도는 0.9%였다. 0.9% NaCl을 사용하는 2단계 용출법은 공통 이온 효과를 모의하는데 사용되었다.
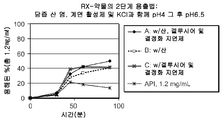
도 6: 도 6은 방법 4에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 NaCl 함유 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 담즙산 염, 계면활성제 및 KCl을 함유하는 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 7: 도 7은 비글 개(n=3)의 RX-약물 제제의 PK 프로필을 도시한 것이다.
도 2: 도 2는 개를 대상으로 한 생체 내 연구와 관련하여 염소 이온의 존재 하에 약물 응집체의 현미경 이미지를 도시한 것이다.
도 3: 도 3은 방법 1에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 5.4의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 4: 도 4는 방법 2에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 5: 도 5는 방법 3에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다. 상기 완충액 둘 다의 NaCl 농도는 0.9%였다. 0.9% NaCl을 사용하는 2단계 용출법은 공통 이온 효과를 모의하는데 사용되었다.
도 6: 도 6은 방법 4에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다. RX-약물 용출은, RX-약물 용출 실험을 pH 4.0의 NaCl 함유 완충액 중에서 0~30분 동안 수행하다가 다시 상기 RX-약물을 담즙산 염, 계면활성제 및 KCl을 함유하는 pH 6.5의 완충액으로 옮겨 이 완충액 중에서 30~90분 동안 수행함으로써 테스트되었다.
도 7: 도 7은 비글 개(n=3)의 RX-약물 제제의 PK 프로필을 도시한 것이다.
본 발명은 약학 조성물에 유용한 캐리어 시스템에 관한 것이다. 본 발명은 유화제를 포함하는 약학 조성물용 캐리어 시스템에 관한 것이고, 또한 추가의 구체예에서는 중합체 용출 조제도 포함하는 약학 조성물용 캐리어 시스템에 관한 것이기도 하다.
1. 정의
"캐리어" 또는 "캐리어 시스템"이란 용어는, 환자나 피험체에 투여하기 위하여 약학 활성 성분을 전달, 함유 또는 "운반"하는데 적당한 혼화성 물질 하나 이상을 의미한다.
본원에 사용된 "환자" 또는 "피험체"란 용어는, 본 발명의 약학 조성물의 필요성이 있거나, 또는 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄여주는 방법을 필요로 한다고 생각되는 인간 또는 동물(동물일 경우, 더욱 통상적으로는 포유 동물, 예를 들어 가축인 포유 동물이거나, 또는 동물, 예를 들어 가금류, 그리고 어류 및 기타 해산물, 또는 민물에서 사는 식용 생물)을 의미한다.
본원에 사용된 "유효량"이란 용어는, 단독으로 또는 조합하여 투여될 때, 병상 또는 병태(예를 들어 미생물 감염)를 치료 또는 예방하거나, 이 병상 또는 병태의 위험을 줄여주는, 약학 활성 화합물, 예를 들어 항 미생물 제제 또는 제제들, 또는 이 화합물들의 조합의 양을 말한다. 이 용어는 또한 활성 화합물 또는 이 화합물의 조합을 포함하는 약학 조성물의 양을 말하기도 한다. 예를 들어 유효량은, 수용자 환자 또는 피험체에 제공된 제제 중에 존재하는 화합물의 양으로서, 생물 활성, 예를 들어 항 감염 활성, 예를 들어 항 미생물 활성 또는 항 박테리아 활성을 끌어내기에 충분한 양을 말한다.
본원에 사용된 "약학적으로 허용 가능한"이란 어구는, 건전한 의학적 판단 범위 내에서, 합리적인 혜택/위험 비율(benefit/risk ratio)에 상응하는, 과도한 독성, 자극, 알레르기 반응 또는 기타 문제점 또는 합병증 없이 인간 및 동물의 조직과 접촉하여 사용하는데 적합한 활성 화합물, 물질, 조성물, 캐리어 및/또는 제형을 말한다.
본원에 사용된 "약학적 유효량"이란 용어는, 약학 활성 화합물, 예를 들어 항 미생물 제제 또는 제제들, 또는 이 화합물들의 조합이 단독으로 또는 조합하여 투여될 때 병상 또는 병태, 예를 들어 미생물 감염을 치료 또는 예방하거나, 이 병상 또는 병태의 위험을 줄여주는, 약학 활성 화합물 또는 화합물들의 조합의 양을 말한다. 상기 용어는 또한 활성 화합물이나 화합물의 조합을 포함하는 약학 조성물의 양을 말하기도 한다. 예를 들어 약학적 유효량이란, 본 발명의 약학 조성물 또는 약학 제제 중에 존재하거나, 또는 본 발명의 조성물 또는 제제를 포함하는 의료 장치상에 존재하는 약학 활성 성분의 양으로서, 수용체 환자 또는 피험체에 투여되었을 때 생물 활성, 예를 들어 미생물 감염에 저항하는 활성을 끌어내기에 충분한 양을 말하기도 한다.
"예방적 유효량"이란 용어는, 약학 활성 화합물, 예를 들어 항 미생물 제제 또는 제제들, 또는 이 화합물들의 조합이 단독으로 또는 조합하여 투여될 때 병상 또는 병태, 예를 들어 미생물 감염을 치료 또는 예방하거나, 이 병상 또는 병태의 위험을 줄여주는, 약학 활성 화합물 또는 화합물들의 혼합물의 유효량(다시 말해서, 보호 효과 또는 예방 효과를 나타내는 양)을 말한다. 상기 용어는 또한, 활성 화합물이나 이 화합물들의 조합을 포함하는 약학 조성물의 양을 말하기도 한다.
본원에 사용된 "치료하는"이란 용어는, 환자 또는 피험체에서 이미 발병한 병상 또는 병태, 예를 들어 미생물 감염을 치유하는 것을 의미한다. 치료는 또한 억제, 즉 병상 또는 병태, 예를 들어 미생물 감염의 발생 정지, 경감 또는 완화(즉 병상 또는 병태, 예를 들어 미생물 감염의 퇴행을 유도하는 것)를 포함할 수도 있다.
본원에 사용된 "예방하는"이란 용어는, 환자 또는 피험체, 특히 병상 또는 병태, 예를 들어 미생물 감염이 발병할 소인이 있거나 위험이 있는 환자 또는 피험체에서 병상 또는 병태, 예를 들어 미생물 감염이 진행되는 것을 완전히 중단시키거나 거의 완전히 중단시키는 것을 말한다. 예방은 또한, 예를 들어 병상 또는 병태, 예를 들어 미생물 감염이 이미 발병할 가능성이 있을 때, 이 병상 또는 병태, 예를 들어 미생물 감염의 억제, 즉 발생 정지, 경감 또는 완화(즉 병상 또는 병태, 예를 들어 미생물 감염의 퇴행을 유도하는 것)를 포함할 수도 있다.
본원에 사용된 "~의 위험을 줄여주는"이란 용어는, 환자 또는 피험체, 특히 병상 또는 병태, 예를 들어 미생물 감염이 발병할 소인이 있거나 위험이 있는 환자 또는 피험체에서 병상 또는 병태, 예를 들어 미생물 감염이 진행될 가능성이나 확률을 낮추는 것을 의미한다.
당업자는, "치료하는", "예방하는" 및 "~의 위험을 줄여주는"의 정의가 어느 정도 중첩된다는 것을 이해할 것이다.
본원에 사용된 "정제"란 용어는, 코팅되었거나 코팅되지 않은 압축 약학 제형 제제로서, 모든 형태와 크기를 가지는 것을 포함한다.
본원에 사용된 "캡슐"이란 용어는, 쉘(shell), 예를 들어 젤라틴 쉘, 예를 들어 연질 젤라틴 또는 경질 젤라틴 캡슐 내에 내포된 약학 제형을 포함한다.
본원에 개시된 화학 화합물은 비대칭 중심을 가질 수 있다. 비대칭 치환된 원자를 포함하는 본 발명의 화합물은 광학적 활성 형태 또는 라세미체 형태로서 분리될 수 있다. 광학 활성인 형태를 제조하는 방법, 예를 들어 라세미체 형태를 분할하거나 광학 활성인 출발 물질을 사용하여 합성함으로써 제조하는 방법은 당 업계에 널리 공지되어 있다. 올레핀 및 C=N 이중 결합 등의 기하학적 이성체 다수는 또한 본원에 개시된 화합물 중에 존재할 수 있으며, 이와 같은 안정한 이성체는 모두 본 발명에서 고려된다. 본 발명의 화합물의 cis 및 trans 기하학적 이성체가 개시되어 있으며, 이는 이성체의 혼합물 또는 개별 이성체 형태로서 분리될 수 있다. 특이적인 입체 화학적 형태 또는 이성체 형태가 특별히 지정되지 않는 한, 화합물 구조의 키랄 이성체, 부분 입체 이성체, 라세미체 및 기하학적 이성체 형태 모두가 포함될 것이다. 본 발명의 화합물 및 이의 합성 중에 생성되는 중간체를 제조하는데 사용되는 모든 방법은, 적당한 경우, 본 발명의 일부를 이루는 것으로 간주된다. 본원에 보이거나 개시한 화합물의 호변 이성체 전부는, 적당한 경우, 본 발명의 일부를 이루는 것으로 간주된다.
치환기에 대한 결합이 고리 내 2개의 원자들을 연결하는 결합을 크로스하는 것으로 보이는 경우, 이와 같은 치환기는 고리 내 임의의 원자에 결합될 수 있다. 치환기가 원자를 통해 이러한 치환기가 제시 화학식의 화합물의 나머지에 결합되는 원자를 나타내지 않고 리스트되어 있는 경우, 이러한 치환기는 이러한 치환기의 임의 원자를 통해 결합될 수 있다. 치환기 및/또는 변인의 조합이 허용될 수 있지만, 이와 같은 조합이 안정한 화합물을 생성하는 경우에만 가능하다.
본원에 사용된 "약학적으로 허용 가능한 염"이란, 약학 활성 화합물의 유도체를 말하는 것으로서, 여기서 모 화합물은 이 화합물의 산 염 또는 염기 염을 생성함으로써 변형된다. 약학적으로 허용 가능한 염의 예로서는 염기성 잔기, 예를 들어 아민의 무기산 또는 유기산 염과, 산성 잔기, 예를 들어 카복실산의 알칼리 또는 유기 염 등을 포함하나, 이에 한정되는 것은 아니다. 약학적으로 허용 가능한 염은, 예를 들어 무독성 무기산 또는 유기산으로부터 생성된 모 화합물의 통상적인 무독성 염 또는 4차 암모늄 염을 포함한다. 예를 들어 이와 같은 통상적인 무독성 염으로서는, 2-아세톡시벤조산, 2-하이드록시에탄 설폰산, 아세트산, 아스코르브산, 벤젠 설폰산, 벤조산, 중탄산, 탄산, 시트르산, 에데트산, 에탄 디설폰산, 에탄 설폰산, 푸마르산, 글루코헵톤산, 글루콘산, 글루탐산, 글리콜산, 글리콜리아르사닐산, 헥실레소르신산, 하이드라밤산, 브롬화수소산, 염화수소산, 요드화수소산, 하이드록시말레산, 하이드록시나프톤산, 이세티온산, 젖산, 락토비온산, 라우릴 설폰산, 말레산, 말산, 만델산, 메탄 설폰산, 납실산, 질산, 옥살산, 파모인산, 판토텐산, 페닐아세트산, 인산, 폴리갈락투론산, 프로피온산, 살리실산, 스테아르산, 서브아세트산(subacetic), 숙신산, 설팜산, 설파닐산, 황산, 탄닌산, 타르타르산, 톨루엔 설폰산 및 통상적으로 생성되는 아민산, 예를 들어 글리신, 알라닌, 페닐알라닌 및 아르기닌 등으로부터 선택되는 유기산 및 무기산으로부터 유래하는 것들을 포함하나, 이에 한정되는 것은 아니다.
본 발명의 약학적으로 허용 가능한 염은 통상의 화학 방법에 따라서 염기성 또는 산성 부분을 포함하는 모 화합물로부터 합성될 수 있다. 일반적으로 이와 같은 염은, 물이나 유기 용매, 또는 이들의 혼합물(일반적으로 비수성 매질, 예를 들어 에테르, 아세트산 에틸, 에탄올, 이소프로판올 또는 아세토니트릴이 바람직함) 중에서 상기 화합물의 유리산 또는 유리 염기 형태와 화학 양론적 양의 적당한 염기 또는 산을 반응시킴으로써 제조될 수 있다. 적당한 염 목록은 그 자체로서 본원에 참고용으로 인용되어 있는 문헌[Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing Company, 1990) and Remington : The Science and Practice of Pharmacy , 20th Edition, Baltimore, MD: Lippincott Williams & Wilkins, 2000]에서 살펴볼 수 있다. 염으로서는, 예를 들어 본 발명의 지방족 아민 함유, 하이드록실 아민 함유 및 이민 함유 화합물의 하이드로클로라이드 염 및 아세테이트를 포함할 수 있으나, 이에 한정되는 것은 아니다.
부가적으로, 본 발명의 화합물, 예를 들어 본 발명의 화합물의 염은 수화 형태 또는 비 수화(무수) 형태로 존재할 수 있거나, 또는 기타 용매 분자와의 용매화물로서 존재할 수 있다. 수화물의 비 제한적인 예로서는 일수화물 및 이수화물 등을 포함한다. 용매화물의 비 제한적인 예로서는 에탄올 용매화물 및 아세톤 용매화물 등을 포함한다.
본 발명의 화합물은 또한 에스테르, 예를 들어 약학적으로 허용 가능한 에스테르로서 제조될 수도 있다. 예를 들어 화합물 내 카복실산 작용기는 이와 상응하는 에스테르, 예를 들어 메틸, 에틸 또는 기타 에스테르로 전환될 수 있다. 뿐만 아니라, 화합물 내 알코올 기는 이와 상응하는 에스테르, 예를 들어 아세테이트, 프로피오네이트 또는 기타 에스테르로 전환될 수 있다.
본 발명의 화합물은 또한 전구 약물, 예를 들어 약학적으로 허용 가능한 전구 약물로서 제조될 수도 있다. 전구 약물은 약학적으로 요망되는 다수의 성질(예를 들어 용해도, 생체 이용도 및 제조 특성 등)을 강화하는 것으로 알려져 있으므로, 본 발명의 화합물은 전구 약물의 형태로 전달될 수 있다. 그러므로, 본 발명은 본원에 제공되는 화합물의 전구 약물, 전구 약물 및 이 전구 약물을 포함하는 조성물을 전달하는 방법을 포함한다. "전구 약물"은, 이 전구 약물이 포유 동물 피험체에 투여될 때 생체 내에서 본 발명의 활성 모 약물을 방출하는, 공유 결합하고 있는 임의의 캐리어를 포함한다. 본 발명의 전구 약물은, 화합물 내에 존재하는 작용기들을 변형함으로써(이때, 상기 변형은 모 화합물의 통상의 조작 방법이나 생체 내 방법을 수행함으로 이루어짐) 절단된다. 전구 약물은 본 발명의 화합물을 포함하며, 여기서, 하이드록시, 아미노 또는 설프히드릴 기는, 본 발명의 전구 약물이 포유 동물 피험체에 투여될 때 절단되어 유리 하이드록실, 유리 아미노 또는 유리 설프히드릴 기를 각각 생성하도록 만드는 임의의 기와 결합하고 있다. 전구 약물의 예로서는 본 발명의 화합물 내에 존재하는 알코올 및 아민 작용기의 아세테이트, 포르메이트 및 벤조에이트 유도체를 포함하나, 이에 한정되는 것은 아니다.
"안정한 화합물" 및 "안정한 구조"는, 반응 혼합물로부터 분리시, 적당하게는 정제시, 그리고 유효한 치료제로 제제화로부터 존재하기에 충분히 강한 화합물을 나타내는 의미이다.
본 발명의 명세서에서 단수 형태는, 문맥 중 명확하게 달리 지정하지 않는 한, 복수 형태도 포함한다. 달리 정의되지 않는 한, 본원에 사용된 모든 기술 용어와 과학 용어는 본 발명이 속하는 기술의 당업자에 의해 통상적으로 이해되는 바와 동일한 의미를 가진다. 분쟁이 있는 경우, 본 명세서가 이 분쟁을 막아줄 것이다.
본원에 사용된 백분율과 비율은 모두, 달리 지정하지 않는 한, 중량을 기준으로 한 것이다.
상세한 설명 전반을 살펴 보았을 때, 조성물이 특정 성분들을 가지거나 포함하거나(including) 포함하는(comprising) 것으로 기술되어 있는 경우, 이와 같은 조성물은 본질적으로 언급된 성분들로 이루어지거나, 이 성분들로 이루어진 것으로 간주된다. 이와 유사하게, 방법 또는 공정이 구체적인 공정 단계를 가지거나, 포함하거나(including), 포함하는(comprising) 것으로 기술되어 있는 경우, 이와 같은 공정은 또한 본질적으로 언급된 공정 단계들로 이루어지거나, 이 단계들로 이루어진 것으로 간주된다. 뿐만 아니라, 단계의 순서 또는 임의의 작업을 수행하는 순서는, 본 발명이 작업 가능한 것으로 남아있는 한, 중요하지 않음이 이해될 것이다. 더욱이, 2개 이상의 단계 또는 작업은 동시에 수행될 수도 있다.
2. 본 발명의 조성물
본 발명의 조성물의 캐리어는 다음과 같은 필수 성분 및 임의의 성분을 포함한다. 본 발명의 조성물은 또한 하기에 더욱 상세히 기술된 약학 활성 성분을 포함한다.
적당한 캐리어 성분들에 대해서는, 예를 들어 본원에 그 자체로서 참고용으로 인용되어 있는 문헌[Eds. R. C. Rowe, 외 다수, Handbook of Pharmaceutical Excipients, Fifth Edition, Pharmaceutical Press (2006); Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing Company, 1990); and Remington: The Science and Practice of Pharmacy , 20th Edition, Baltimore, MD: Lippincott Williams & Wilkins, 2000]에 기술되어 있다. 비록 작용 카테고리가 상기와 같은 캐리어 성분들 다수에 대해 제공될 수 있긴 하지만, 당업자는 이와 같은 성분이 하나 이상의 작용 카테고리에 속할 수 있으며, 특정 성분의 수준과 기타 성분의 존재는 상기 성분의 작용 특성에 영향을 미칠 수 있음을 인지할 것이므로, 이와 같은 작용 카테고리는 상기 성분의 작용 또는 범위를 제한하고자 하는 것은 아니다.
a. 유화제
추가의 구체예에서 본 발명의 조성물은 유화제를 추가로 포함한다. 유용한 유화제로서는 폴리글리콜화된 글리세라이드(폴리글리콜화 글리세라이드라고도 알려짐)를 포함한다. 이와 같은 물질은 일반적으로 계면활성제로서, 자체의 정확한 조성에 따라서 특정한 융점 범위와 친수성/친지성 밸런스 범위(HLB)를 가진다. 이러한 물질은 종종 다가 알코올, 예를 들어 글리세롤과 추가로 혼합되기도 한다. 상기 폴리글리콜화된 글리세라이드는 지방산의 글리세라이드의 혼합물, 그리고 폴리옥시에틸렌의 에스테르와 지방산의 혼합물이다. 이와 같은 혼합물에 있어서, 지방산은 일반적으로 포화 또는 불포화 C8∼C22, 예를 들어 C8∼C12 또는 C16∼C20이다. 글리세라이드는 일반적으로 모노글리세라이드, 디글리세라이드 또는 트리글리세라이드이거나, 이들의 임의의 비율의 혼합물이다. 폴리글리콜화된 글리세라이드는, 예를 들어 갓포스(Gattefosse)에 의해 상품명 라브라필(Labrafil), 라브로솔(Labrosol) 및 겔루시어(Gelucire)로 시판되고 있다. 상기 겔루시어 폴리글리콜화 글리세라이드는 종종 융점과 HLB가 정해져 있다. 예를 들어 겔루시어 53/10은 융점이 53℃이고 HLB가 10인 물질을 말한다. 본 발명에 유용한 겔루시어 물질로서는 겔루시어 44/14 및 겔루시어 50/13을 포함한다. 기타 본 발명에 유용한 유화제는 비타민 E TPGS, 플록사머 및 레시틴을 포함한다. 비타민 E TPGS는 또한 d-α-토코페릴 폴리에틸렌 글리콜 1000 숙시네이트로서도 알려져 있다.
플록사머는 플루로닉스(Pluronics)라는 상품명으로서 알려져 있는 것으로서, 폴리옥시에틸렌(폴리(에틸렌 옥사이드))의 친수성 사슬 2개가 측접하고 있는 폴리옥시프로필렌(폴리(프로필렌 옥사이드))의 중심 소수성 사슬로 이루어진, 비 이온성 3블록 공중합체이다.
유화제는 본 발명의 조성물의 약 0.1%~약 99.9%를 포함할 수 있다. 다른 구체예에서, 유화제는 본 발명의 조성물의 약 1%~약 20%, 약 1%~약 15% 및 약 1%~약 10%를 포함할 수 있다.
b. 중합체 용출 조제
본 발명의 조성물은 중합체 용출 조제를 포함한다. 이와 같은 중합체 용출 조제는 1-에테닐-2-피롤리디논의 중합체; 폴리아민 N-옥사이드 중합체; N-비닐피롤리돈 및 N-비닐이미다졸의 공중합체; 폴리비닐옥사졸리돈 및 폴리비닐이미다졸 또는 이들의 혼합물을 포함한다. 1-에테닐-2-피롤리디논의 중합체, 특히 동종 중합체가 특히 유용하다. 일반적으로 이와 같은 동종 중합체의 분자량 범위는 약 2500~3,000,000이다. 이와 같은 동종 중합체는 폴리비닐피롤리돈, PVP 또는 포비돈으로 알려져 있으며, 다른 경우에 있어서는 용출 조제, 붕해제, 현탁제 또는 결합제로서 작용을 할 수도 있다.
상기 중합체 용출 조제는 본 발명의 조성물의 약 0.1~약 99.9%를 포함할 수 있다. 다른 구체예에서, 중합체 용출 조제는 본 발명의 조성물의 약 1%~약 10%, 약 1%~약 5% 및 약 1%~약 2.5%를 포함할 수 있다.
c. 결합제
본 발명의 조성물은 결합제나 결합 제제를 추가로 포함할 수 있다. 결합제의 예로서는 셀룰로스; 미세 결정질 셀룰로스; 저 점도 수용성 셀룰로스 유도체, 예를 들어 미세 결정질 셀룰로스, 하이드록시프로필 셀룰로스, 하이드록시프로필메틸 셀룰로스(HPMC), 하이드록시에틸 셀룰로스, 에틸 셀룰로스, 메틸 셀룰로스 그리고 소듐 카복시-메틸 셀룰로스; 알긴산 유도체; 폴리비닐피롤리돈; 마그네슘 알루미늄 실리케이트; 전분, 예를 들어 옥수수 전분 및 감자 전분; 젤라틴; 및 트래거칸트가 있다. 바람직한 결합제로서는 HPMC가 있다. 바람직하게는, 결합 제제는 약 1%~약 10%를 포함한다. 바람직하게는, 결합제는 조성물의 약 1 중량~약 4 중량%를 포함한다.
d.
pH
조정제
본 발명의 조성물은 pH 조정제를 추가로 포함할 수 있다. pH 조정제의 예로서는 일반적으로, 제제나 이 제제가 존재하는 환경의 pH를 조정하거나 맞추는데 사용될 수 있는 산성 또는 염기성 물질이 있다. 본 발명에 유용한 pH 조정제에 관한 비 제한적 예로서는 아스파르트산, 시트르산, 에탄설폰산, 푸마르산, 젖산, 메탄설폰산, 타르타르산 및 이들의 혼합물을 포함한다.
c. 충전제
본 발명의 조성물은 충전제를 추가로 포함할 수 있다. 충전제의 예로서는 미세 결정질 셀룰로스; 글루코스; 락토스; 덱스트로스; 만니톨; 솔비톨; 수크로스; 전분; 흄드 실리카; 염, 예를 들어 탄산 나트륨 및 탄산 칼슘; 그리고 폴리올, 예를 들어 프로필렌 글리콜이 있다. 바람직하게는, 충전제는 단독으로 또는 조합하여 본 발명의 조성물의 0 중량%~약 50 중량%의 양으로 존재한다. 더욱 바람직하게, 충전제는 본 발명의 조성물 중량의 약 5%~약 20%로 존재한다.
f.
분산제
또는 습윤제
본 발명의 조성물은 분산제 또는 습윤제를 추가로 포함할 수 있다. 분산제 또는 습윤제의 예로서는 중합체, 예를 들어 폴리에틸렌-폴리프로필렌, 그리고 계면활성제, 예를 들어 소듐 라우릴 설페이트가 있다. 바람직하게는 분산제 또는 습윤제는 단독으로 또는 조합하여 0 중량%~약 50 중량%의 양으로 존재한다. 더욱 바람직하게는 분산제 또는 습윤제는 본 발명의 조성물 중량의 약 5%~약 20%로 존재한다.
g.
붕해제
본 발명의 조성물은 붕해제를 추가로 포함할 수 있다. 붕해제의 예로서는 변형 전분 또는 변형 셀룰로스 중합체, 예를 들어 소듐 전분 글리콜레이트가 있다. 기타 붕해제로서는 아가; 알긴산 및 이의 소듐 염; 포화제(예를 들어 수성 환경에 노출될 때 서로 반응하여, 조성물이 파괴 또는 붕해되는 것을 돕는 이산화탄소 기포를 형성하는, 산, 예를 들어 타르타르산 또는 시트르산과 염기성 염, 예를 들어 중탄산 나트륨 또는 중탄산 칼륨의 조합); 크로스카멜로스; 크로스포비돈; 소듐 카복시메틸 전분; 소듐 전분 글리콜레이트; 점토; 및 이온 교환 수지를 포함한다. 바람직하게 붕해제는 단독으로 또는 조합하여 본 발명의 조성물의 0 중량%~약 50 중량%의 양으로 존재한다. 더욱 바람직하게 붕해제는 본 발명의 조성물의 약 5 중량%~약 20 중량%로 존재한다.
h. 윤활제
본 발명의 조성물은 윤활제를 추가로 포함할 수 있다. 일반적으로 윤활제는 장쇄 지방산 또는 장쇄 지방산의 염으로부터 선택된다. 적당한 윤활제의 예로서는 고체 윤활제, 예를 들어 실리카; 활석; 스테아르산 및 이의 마그네슘 염과 칼슘 염; 황산 칼슘; 그리고 액체 윤활제, 예를 들어 폴리에틸렌 글리콜; 및 식물성 오일, 예를 들어 피넛 오일, 면실 오일, 참깨 오일, 올리브 오일, 옥수수 오일 및 테오브로마 오일이 있다. 바람직하게 윤활제는 단독으로 또는 조합하여 본 발명의 조성물의 0 중량%~약 50 중량%의 양으로 존재한다. 더욱 바람직하게 윤활제는 본 발명의 조성물 중량의 약 5%~약 20%로 존재한다.
i. 부가 성분들
본 발명의 조성물은 약학 제제 기술에 공지된 다양한 부형제들로부터 선택되는 부가 성분들 하나 이상을 추가로 포함할 수 있다. 정제 또는 캡슐의 원하는 특성들에 따라서, 임의의 수의 성분들은 본 발명의 조성물을 제조하는데 있어 상기 성분들의 공지된 용도를 기준으로 단독 또는 조합하여 선택될 수 있다. 이와 같은 성분으로서는 물; 비수성 용매(예를 들어 에탄올); 코팅; 캡슐 쉘; 착색제; 왁스, 젤라틴; 풍미제; 보존제(예를 들어 메틸 파라벤, 벤조산 나트륨 및 벤조산 칼륨); 항산화제[예를 들어 부틸화 하이드록시아니솔("BHA"), 부틸화 하이드록시톨루엔("BHT"), 그리고 비타민 E 및 비타민 E 에스테르, 예를 들어 토코페롤 아세테이트]; 조미료; 감미제(예를 들어 아스파탐 및 사카린); 압축 조제; 계면활성제 등을 포함하나, 이에 한정되는 것은 아니다.
3. 본 발명의 약학 활성 성분 및 항 미생물 제제
본 발명의 약학 조성물은 약학 캐리어 및 하나 이상의 약학 활성 성분을 포함한다. 광범위한 약학 활성 성분은 원하는 치료 군, 그리고 치료, 예방 및 위험성이 감소되기를 원하는 질병 또는 병태에 따라서 사용될 수 있다. 이와 같은 약학 활성 성분의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 범위 내에 포함되는 것으로 간주된다.
본 발명의 하나의 구체예에서, 약학 활성 성분은 항 미생물 제제 또는 화합물이다. 광범위한 항 미생물 제제는 본 발명의 방법, 조성물 및 용도에 사용될 수 있다. 이러한 항 미생물 제제는 다양한 생화학적 기전 또는 생물 물리학적 기전에 의해 자체의 치료 효과를 제공할 수 있다. 이와 같이 본 발명에 유용한 제제는 리보좀 RNA, 예를 들어 박테리아 리보좀 RNA에 결합하거나 이 리보좀 RNA를 조정하는 것들을 포함할 수 있다. 또한, 본 발명에 유용한 제제로서는 리보좀 대 서브유닛, 예를 들어 박테리아 유기체의 리보좀 대 서브유닛에 결합하거나 이 서브유닛을 조정하는 것들을 포함할 수 있다. 이와 같이 본 발명에 유용한 제제는 또한 DNA 토포이소머라제, 예를 들어 박테리아 DNA 토포이소머라제에 결합하거나 이 DNA 토포이소머라제를 조정하는 것들을 포함할 수 있다. 이와 같이 본 발명에 유용한 제제는 또한 박테리아 DNA 자이라제, 예를 들어 박테리아 DNA 자이라제, 즉 토포이소머라제의 일례인 자이라제에 결합하거나 상기 박테리아 DNA 자이라제를 조정하는 것들을 포함할 수 있다. 이와 같이 본 발명에 유용한 제제는 박테리아 토포이소머라제 IV에 결합하거나 이 토포이소머라제 IV를 조정하는 것들을 포함할 수 있다.
유용한 항 미생물 제제는 항 박테리아 제제, 항진균 제제, 항바이러스 제제 및 항 기생체 제제를 포함한다. 화합물의 유용한 화학 군으로서는 옥사졸리디논(예를 들어 리네졸리드, 에페레졸리드, N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2-옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 및 기타 옥사졸리디논), 매크롤리드, 케톨리드, 스트렙토그라민 A군, 스트렙토그라민 B군, 클로람페니콜 및 클로람페니콜 유도체, 플루오르페니콜 및 플루오르페니콜 유도체, 글리코펩티드, 플루로뮤틸린, 아미노글리코시드, 베타-락탐 및 카바페넴(7-아실화 이미다졸[5,1-b]티아졸-2-일 기가 C-2 위치의 카바페넴 부분에 직접 결합되어 있는 카바페넴 포함), 세팔로스포린, 린코사미드, 퀴놀론 및 플루오로퀴놀론(피리돈카복실산 유도체, 가레녹사신, 가티플록사신, 게미플록사신, 레보플록사신 및 목시플록사신 포함), 벤조헤테로시클릭 화합물, 아미노메틸시클린 화합물, 달바반신, 답토마이신, 오리타반신, 텔레반신 및 이들의 혼합물로부터 선택되는 것들을 포함한다. 몇몇 경우에 있어서 본 발명에 유용한 화합물은 한 가지 이상의 방식으로 분류될 수 있다는 것을 유의할 필요가 있다. 화합물 또는 화합물들의 설명 또는 분류는 이와 같은 화합물 또는 화합물들을 제한하고자 하는 것이 아니라, 오로지 편의를 위해서 행해진 것이다.
본 발명에 유용한 화합물은 약학적으로 허용 가능한 염, 에스테르 또는 이의 전구 약물을 포함할 수 있다. 본 발명은 또한 본 발명의 화합물들 중 임의의 하나를 합성하는 방법을 추가로 제공한다. 본 발명은 또한, 본 발명의 화합물들 중 하나 이상의 유효량과 약학적으로 허용 가능한 캐리어를 포함하는 약학 조성물도 제공한다. 본 발명은 또한 이와 같은 화합물, 캐리어 및 약학 조성물을 제조하는 방법도 제공한다.
옥사졸리디논
옥사졸리디논, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 상품명 또는 등록 상표명 자이복스(Zyvox)로서 시판되고 있는 리네졸리드, 즉 (N-[[(5S)-3-[3-플루오로-4-(4-모폴리닐)페닐]-2-옥소-5-옥사졸리디닐]메틸]아세타미드)는 상업상 시판되고 있는 옥사졸리디논이다. 문헌[미국 특허 제6,559,305호(B1)(Bergren; 2003년 5월 6일); 미국 특허 제5,688,792호(Barbachyn 외 다수; 1997년 11월 18일); 및 문헌(M.R. Barbychan 외 다수, "Development of Linezolid: Oxazolidinone Structure-Activity Relationships Leading to Linezolid", Angew. Chem. Int. Ed., 42, pp. 2010-2023 (2003))]을 참조하시오. 본 발명의 방법 및 조성물에 유용하고, 본 발명의 용도로서 유용한 기타 옥사졸리디논과 기타 화합물에 관하여는 미국 특허 제6,969,726호(B2)(Lou 외 다수; 2005년 11월 29일); PCT 특허 출원 공보 WO 2006/022794(Rib-X Pharmaceuticals, Inc.; 2006년 3월 2일); PCT 특허 출원 공보 WO 2005/070904(Rib-X Pharmaceuticals, Inc.; 2005년 8월 4일); PCT 특허 출원 공보 WO 2005/061468(Rib-X Pharmaceuticals, Inc.; 2005년 7월 7일); PCT 특허 출원 공보 WO 2005/019211(Rib-X Pharmaceuticals, Inc.; 2005년 3월 3일); PCT 특허 출원 공보 WO 2005/012271(Rib-X Pharmaceuticals, Inc.; 2005년 2월 10일); PCT 특허 출원 공보 WO 2005/012270(Rib-X Pharmaceuticals, Inc.; 2005년 2월 10일); 미국 특허 출원 US 2005/0043317(A1)(Zhou 외 다수; 2005년 2월 24일); 미국 특허 출원 US 2005/0153971(A1)(Chen 외 다수; 2005년 7월 14일); 미국 특허 제5,654,435호(Barbachyn 외 다수; 1997년 8월 5일) 및 PCT 특허 출원 공보 WO 2001/094342(Dong A Pharm. Co., Ltd.; 2001년 12월 13일), 그리고 PCT 특허 출원 공보 WO 01/081350(AstraZeneca AB 및 AstraZeneca UK Limited; 2001년 11월 1일)에 기술되어 있다.
옥사졸리디논의 비 제한적인 예로서는 하기 화합물들로 이루어진 군으로부터 선택되는 것들, 이들의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다.
염의 예로서는 상기 옥사졸리디논 A, B, C 및 D의 모노하이드로클로라이드 염이 있다.
상기 화합물 C에 있어서, 트리아졸 고리가 본 발명의 화합물의 나머지에 대해 "4번" 위치에 결합되어 있고, 트리아졸 고리의 "5번" 위치에 존재하는 나머지 탄소 원자가 치환되지 않은(즉 수소를 가지는) 경우, 다음과 같이 넘버링 규약이 이용될 수 있다:
화합물 C
트리아졸 고리는 5원 이종 방향족 고리이고, 대부분의 화학식에 그려진 2개의 이중 결합의 위치는 그려질 수 있는 다수의 구조들 중 하나를 임의로 표시한 것으로서, 편의를 위해 사용된 것이지 본 발명을 제한하고자 사용된 것은 아니라는 것을 인식해야 할 것이다. 실제로 5개의 상이한 구조들(때때로 호변 이성체 구조라고 불림)은 1,2,3-트리아졸을 도시하기 위해 그려질 수 있다. 이와 같은 호변 이성체 구조는 각각의 구조들 간 헤드가 2개인 화살표로 표시될 수 있는데, 이는 곧, 이와 같이 표시된 분자가 서로 균형을 이루고 있음을 나타내는 것이다. 예를 들어 화합물 C에 있어서 호변 이성체 구조는 다음과 같이 그려질 수 있다:
[화합물 C의 호변 이성체 구조들]
본 발명에 유용한 옥사졸리디논 및 화합물, 예를 들어 옥사졸리디논 C 및 D에 대한 추가의 개시 사항은 상기 언급한 미국 특허 제6,969,726호(B2)(Lou 외 다수; 2005년 11월 29일)에서 살펴볼 수 있다. 화합물 C는 또한 화학명 아세타미드, N-[[(5S)-3-(2-플루오로-4'-[[(1H-1,2,3-트리아졸-4-일메틸)-아미노]메틸][1,1'-비페닐]-4-일]-2-옥소-5-옥사졸리디닐]-메틸]-로서 알려져 있기도 하며, CAS 등록 번호는 869884-78-6이다. 화합물 C의 모노하이드로클로라이드 염은 또한 다음과 같은 화학명, 즉 아세타미드, N-[[(5S)-3-(2-플루오로-4'-[[(1H-1,2,3-트리아졸-4-일메틸)-아미노]메틸][1,1'-비페닐]-4-일]-2-옥소-5-옥사졸리디닐]-메틸]-, 모노하이드로클로라이드로서 알려져 있기도 하며, CAS 등록 번호는 869884-77-5이다.
이와 같은 옥사졸리디논과 기타 옥사졸리디논은 다음과 같은 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물과 관련되어 있다:
상기 식 중,
A는 페닐, 피리딜, 피라지닐, 피리미디닐 및 피리다지닐로 이루어진 군으로부터 선택되고;
B는 페닐, 피리딜, 피라지닐, 피리미디닐 및 피리다지닐로 이루어진 군으로부터 선택되며;
Het-CH2-R3는 다음과 같은 것들로 이루어진 군으로부터 선택되고:
M은 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) 포화, 불포화 또는 방향족 C3 ∼14 탄소환 및 b) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 포화, 불포화 또는 방향족 3~14원 복소환[여기서, 상기 a) 또는 b)는 하나 이상의 R5 기로 임의 치환됨];
M-L은 다음과 같은 것들로 이루어진 군으로부터 선택되고:
a) M-X, b) M-L1, c) M-L1-X, d) M-X-L2, e) M-L1-X-L2, f) M-X-L1-X-L2, g) M-L1-X-L2-X, h) M-X-X-, i) M-L1-X-X-, j) M-X-X-L2 및 k) M-L1-X-X-L2
[여기서, X는 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) -O-, b) -NR4-, c) -N(O)-, d) -N(OR4)-, e) -S(O)p-, f) -SO2NR4-,
g) -NR4SO2-, h) -NR4-N=, i) =N-NR4-, j) -O-N=, k) =N-O-, l) -N=,
m) =N-, n) -NR4-NR4-, o) -NR4C(O)O-, p) -OC(O)NR4-,
q) -NR4C(O)NR4- r) -NR4C(NR4)NR4- 및
L1은 다음과 같은 것들로 이루어진 군으로부터 선택되고:
a) C1 ∼6 알킬, b) C2 ∼6 알케닐 및 c) C2 ∼6 알키닐
[여기서, 상기 a)~c) 중 임의의 것은 하나 이상의 R5기로 임의 치환됨]
L2는 다음과 같은 것들로 이루어진 군으로부터 선택됨:
a) C1 ∼6 알킬, b) C2 ∼6 알케닐 및 c) C2 ∼6 알키닐
[여기서, 상기 a)~c) 중 임의의 것은 하나 이상의 R5기로 임의 치환됨]]
R1은 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) F, b) Cl, c) Br, d) I, e) -CF3, f) -OR4, g) -CN, h) -NO2, i) -NR4R4, j) -C(O)R4,
k) -C(O)OR4, l) -OC(O)R4, m) -C(O)NR4R4, n) -NR4C(O)R4, o) -OC(O)NR4R4,
p) -NR4C(O)OR4, q) -NR4C(O)NR4R4, r) -C(S)R4, s) -C(S)OR4, t) -OC(S)R4,
u) -C(S)NR4R4, v) -NR4C(S)R4, w) -OC(S)NR4R4, x) -NR4C(S)OR4,
y) -NR4C(S)NR4R4, z) -NR4C(NR4)NR4R4, aa) -S(O)pR4, bb) -SO2NR4R4 및 cc) R4;
R2는 각각의 경우 독립적으로 다음과 같은 것들로부터 선택되고:
a) F, b) Cl, c) Br, d) I, e) -CF3, f) -OR4, g) -CN, h) -NO2, i) -NR4R4, j) -C(O)R4,
k) -C(O)OR4, l) -OC(O)R4, m) -C(O)NR4R4, n) -NR4C(O)R4, o) -OC(O)NR4R4,
p) -NR4C(O)OR4, q) -NR4C(O)NR4R4, r) -C(S)R4, s) -C(S)OR4, t) -OC(S)R4,
u) -C(S)NR4R4, v) -NR4C(S)R4, w) -OC(S)NR4R4, x) -NR4C(S)OR4,
y) -NR4C(S)NR4R4, z) -NR4C(NR4)NR4R4, aa) -S(O)pR4, bb) -SO2NR4R4 및 cc) R4;
R3는 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) -OR4, b) -NR4R4, c) -C(O)R4, d) -C(O)OR4, e) -OC(O)R4, f) -C(O)NR4R4,
g) -NR4C(O)R4, h) -OC(O)NR4R4, i) -NR4C(O)OR4, j) -NR4C(O)NR4R4,
k) -C(S)R4, l) -C(S)OR4, m) -OC(S)R4, n) -C(S)NR4R4, o) -NR4C(S)R4,
p) -OC(S)NR4R4, q) -NR4C(S)OR4, r) -NR4C(S)NR4R4, s) -NR4C(NR4)NR4R4,
t) -S(O)pR4, u) -SO2NR4R4 및 v) R4;
R4는 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되고:
a) H, b) C1 ∼6 알킬, c) C2 ∼6 알케닐, d) C2 ∼6 알키닐, e) C3 ∼14 포화, 불포화 또는 방향족 탄소환, f) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 3∼14원 포화, 불포화 또는 방향족 복소환, g) -C(O)-C1 ∼6 알킬, h) -C(O)-C2 ~6 알케닐, i) -C(O)-C2 ~6 알키닐, j) -C(O)-C3 ~14 포화, 불포화 또는 방향족 탄소환, k) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 -C(O)-3~14원 포화, 불포화 또는 방향족 복소환, l) -C(O)O-C1 ~6 알킬, m) -C(O)O-C2 ~6 알케닐, n) -C(O)O-C2 ~6 알키닐, o) -C(O)O-C3 ~14 포화, 불포화 또는 방향족 탄소환, 및 p) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 -C(O)O-3~14원 포화, 불포화 또는 방향족 복소환
[여기서, 상기 b)~p) 중 임의의 것은 하나 이상의 R5기로 임의 치환됨];
R5는 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) F, b) Cl, c) Br, d) I, e) =O, f) =S, g) =NR6, h) =NOR6, i) =N-NR6R6, j) -CF3,
k) -OR6, l) -CN, m) -NO2, n) -NR6R6, o) -C(O)R6, p) -C(O)OR6, q) -OC(O)R6,
r) -C(O)NR6R6, s) -NR6C(O)R6, t) -OC(O)NR6R6, u) -NR6C(O)OR6,
v) -NR6C(O)NR6R6, w) -C(S)R6, x) -C(S)OR6, y) -OC(S)R6, z) -C(S)NR6R6,
aa) -NR6C(S)R6, bb) -OC(S)NR6R6, cc) -NR6C(S)OR6, dd) -NR6C(S)NR6R6,
ee) -NR6C(NR6)NR6R6, ff) -S(O)pR6, gg) -SO2NR6R6 및 hh) R6;
R6은 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되고:
a) H, b) C1 ∼6 알킬, c) C2 ∼6 알케닐, d) C2 ∼6 알키닐, e) C3 ∼14 포화, 불포화 또는 방향족 탄소환, f) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 3∼14원 포화, 불포화 또는 방향족 복소환, g) -C(O)-C1 ∼6 알킬, h) -C(O)-C2 ~6 알케닐, i) -C(O)-C2 ~6 알키닐, j) -C(O)-C3 ~14 포화, 불포화 또는 방향족 탄소환, k) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 -C(O)-3~14원 포화, 불포화 또는 방향족 복소환, l) -C(O)O-C1 ~6 알킬, m) -C(O)O-C2 ~6 알케닐, n) -C(O)O-C2 ~6 알키닐, o) -C(O)O-C3 ~14 포화, 불포화 또는 방향족 탄소환, 및 p) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 -C(O)O-3~14원 포화, 불포화 또는 방향족 복소환
[여기서, 상기 b)~p) 중 임의의 것은 하나 이상의 R7기로 임의 치환됨];
R7은 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되며:
a) F, b) Cl, c) Br, d) I, e) =0, f) =S, g) =NR8 , h) =NOR8, i) =N-NR8R8, j) -CF3,
k) -OR8, l) -CN, m) -NO2, n) -NR8R8, o) -C(0)R8, p) -C(0)OR8, q) -OC(O)R8,
r) -C(O)NR8R8, s) -NR8C(O)R8, t) -OC(O)NR8R8, u) -NR8C(0)OR8,
v) -NR8C(0)NR8R8, w) -C(S)R8, x) -C(S)OR8, y) -OC(S)R8, z) -C(S)NR8R8,
aa) -NR8C(S)R8, bb) -OC(S)NR8R8, cc) -NR8C(S)OR8, dd) -NR8C(S)NR8R8,
ee) -NR8C(NR8)NR8R8, ff) -S(O)pR8, gg) -SO2NR8R8, hh) C1 ~6 알킬,
ii) C2 ~6 알케닐, jj) C2 ~6 알키닐, kk) C3 ~14 포화, 불포화 또는 방향족 탄소환, 및
ll) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 3~14원 포화, 불포화 또는 방향족 복소환
[여기서, 상기 hh)~ll) 중 임의의 것은 R8, F, Cl, Br, I, -CF3, - OR8, -SR8, -CN, -NO2, -NR8R8, -C(O)R8, -C(O)OR8, -OC(O)R8, -C(O)NR8R8, -NR8C(O)R8, -OC(O)NR8R8, -NR8C(O)OR8, -NR8C(O)NR8R8, -C(S)R8, -C(S)OR8, -OC(S)R8, -C(S)NR8R8, -NR8C(S)R8, -OC(S)NR8R8, -NR8C(S)OR8, -NR8C(S)NR8R8, -NR8C(NR8)NR8R8, -SO2NR8R8 및 -S(O)pR8로 이루어진 군으로부터 선택되는 부 하나 이상으로 임의 치환됨];
R8은 각각의 경우 독립적으로 다음과 같은 것들로 이루어진 군으로부터 선택되고:
a) H, b) C1 ~6 알킬, c) C2 ~6 알케닐, d) C2 ~6 알키닐, e) C3 ~14 포화, 불포화 또는 방향족 탄소환, f) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 3~14원 포화, 불포화 또는 방향족 복소환, g) -C(O)-C1~6 알킬, h) -C(O)-C2 ~6 알케닐, i) -C(O)-C2 ~6 알키닐, j) -C(O)-C3 ~14 포화, 불포화 또는 방향족 탄소환, k) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 이종 원자 하나 이상을 포함하는 -C(O)-3~14원 포화, 불포화 또는 방향족 복소환, l) -C(O)O-C1 ∼6 알킬, m) -C(O)O-C2 ~6 알케닐, n) -C(O)O-C2 ~6 알키닐, o) -C(O)O-C3 ~14 포화, 불포화 또는 방향족 탄소환, 그리고 p) 질소, 산소 및 황으로 이루어진 군으로부터 선택되는 -C(O)O-3~14원 포화, 불포화 또는 방향족 복소환
[여기서, 상기 b)~p) 중 임의의 것은 F, Cl, Br, I, -CF3, -OH, -OCH3, -SH, -SCH3, -CN, -NO2, -NH2, -NHCH3, -N(CH3)2, -C(O)CH3, -C(O)OCH3, -C(O)NH2, -NHC(O)CH3, -SO2NH2, -SO2NHCH3, -SO2N(CH3)2 및 -S(O)pCH3로 이루어진 군으로부터 선택되는 부 하나 이상으로 임의 치환됨];
m은 각각의 경우 독립적으로 0, 1, 2, 3 또는 4이며;
n은 각각의 경우 독립적으로 0, 1, 2, 3 또는 4이고;
p는 각각의 경우 독립적으로 0, 1 또는 2이다.
본 발명의 특정 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, B, L, M, R1, R2, R3, m 및 n은 상기된 바와 같이 정의됨].
기타 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, B, L, M, R1, R2, R3, m 및 n은 상기된 바와 같이 정의됨].
특정 화합물은, A는 페닐 및 피리딜로 이루어진 군으로부터 선택되고; B는 페닐 및 피리딜로 이루어진 군으로부터 선택되며; m은 0, 1 또는 2이고; n은 0, 1 또는 2인 것들을 포함한다.
몇몇 구체예에서, A-B는
[상기 식 중, A, R2 및 n은 상기된 바와 같이 정의됨]이다.
특정 구체예에서, A-B는
[상기 식 중, A는 상기된 바와 같이 정의됨]이다.
다양한 구체예에서, A-B는
[상기 식 중, B는 상기된 바와 같이 정의됨]이다.
몇몇 구체예에서, R3는 -NHC(O)R4이다. 이와 같은 구체예들에 의한 특정 화합물로서는 R4가 -CH3인 것들을 포함한다. 다른 구체예에서, R3는
본 발명의 특정 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, B, L, M, R1, R2, m 및 n은 상기된 바와 같이 정의됨]
본 발명의 다른 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, L, M, R1, R3 및 m은 상기된 바와 같이 정의됨]
본 발명의 또 다른 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, L, M, R1 및 m은 상기된 바와 같이 정의됨]
본 발명의 몇몇 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, L, M 및 R3 은 상기된 바와 같이 정의됨]
이와 같은 구체예에 의한 특정 화합물로서는 R3가 -NHC(O)CH3인 것들을 포함한다.
본 발명의 기타 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, L, M, R1, R3 및 m은 상기된 바와 같이 정의됨]
본 발명의 또 다른 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, A, L, M, R1 및 m은 상기된 바와 같이 정의됨]
본 발명의 몇몇 구체예는 하기 화학식을 가지는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
[상기 식 중, L, M 및 R3 은 상기된 바와 같이 정의됨]
이와 같은 구체예에 의한 특정 화합물은 R3가 -NHC(O)CH3인 것들을 포함한다.
몇몇 구체예에서, M-L은 M-L1이고, L1은 C1 ∼6 알킬이다. 특정 구체예에서, M-L1은 M-CH2-이다.
다른 구체예에서, M-L은 M-L1-X-L2이고 X는 -NR4-이다. 이와 같은 구체예에 의한 특정 화합물에서, X는 -NH-, -N(O)- 또는 -N(OR4)-이며, 여기서, R4는 H 또는 C1 ~6 알킬이다. 기타 화합물은 X가
이와 같은 구체예에 의한 임의의 화합물에서, L1은 C1 ∼6 알킬이고, L2는 C1 ∼6 알킬이다. 몇몇 구체예에서, L1은 -CH2-이고, L2는 -CH2-이다. 이와 같은 구체예에 의한 화합물의 구체적인 예로서는 M-L이 M-CH2-NH-CH2- 또는
또 다른 구체예에서, M-L은 M-S-L1-NR4-L2인데, 여기서 L1은 C1 ∼6 알킬이고, L2는 C1 ∼6 알킬이다. 이와 같은 구체예에 의한 특정 화합물에서, M-L은 M-S-CH2CH2-NH-CH2-이다.
특정 구체예에서, M은 다음과 같은 것들로 이루어진 군으로부터 선택된다:
a) 페닐, b) 피리딜, c) 피라지닐, d) 피리미디닐, e) 피리다지닐, f) 옥시라닐, g) 아지리디닐, h) 푸라닐, i) 티오페닐, j) 피롤릴, k) 옥사졸릴, l) 이속사졸릴, m) 이미다졸릴, n) 피라졸릴, o) 이소티아졸릴, p) 티아졸릴, q) 트리아졸릴, r) 테트라졸릴, s) 인돌릴, t) 퓨리닐, u) 벤조푸라닐, v) 벤족사졸릴, w) 벤즈이속사졸릴, x) 퀴놀리닐, y) 이소퀴놀리닐, z) 퀴녹살리닐, aa) 퀴나졸리닐, bb) 신놀리닐, cc) 시클로프로필, dd) 시클로부틸, ee) 시클로펜틸, ff) 시클로헥실, gg) 시클로헵틸, hh) 옥세타닐, ii) 테트라하이드로푸라닐, jj) 테트라하이드로피라닐, kk) 아제티디닐, ll) 피롤리디닐, mm) 피페리디닐, nn) 티에타닐, oo) 테트라하이드로티오페닐, pp) 테트라하이드로티오피라닐, qq) 피페라지닐, rr) 퀴뉴클리디닐, ss) 1-아자비시클로[2.2.1 ]히엡타닐, tt) 모폴리닐, uu) 티오모폴리닐, vv) 티오옥소모폴리닐, ww) 티오디옥소모폴리닐 및 xx) 벤조티오페닐.
[상기 a)~xx) 중 임의의 것은 하나 이상의 R5기로 임의 치환됨].
특정 구체예에서, M은 4-이속사졸릴, [1,2,3]트리아졸-1-일, 3H-[1,2,3]트리아졸-4-일, 1H-테트라졸-5-일, 피페리딘-1-일 또는 피롤리딘-1-일이다.
바람직한 구체예에서, A는 페닐, 치환된 페닐, 피리딜 또는 치환된 피리딜이다. 임의의 환경 하에서, A가 2번 위치에서 M-L로 치환되는 피리딘-4-일일 때, M-L은 (이미다졸-1-일)메틸 또는 (모폴린-4-일)메틸이 아니다.
바람직한 구체예에서, B는 페닐 또는 치환된 페닐이다. 더욱 바람직하게, B는 치환된 페닐이다. 바람직한 치환기로서는 할로겐, 특히 플루오르를 포함한다. 임의의 환경 하에서, B가 치환되지 않은 페닐일 때, M-L은 M-X, M-L1-X, M-L1-X-L2, M-X-L1-X-L2, M-X-X-, M-L1-X-X-, M-X-X-L2 및 M-L1-X-X-L2로 이루어진 군으로부터 선택된다. 임의의 환경 하에서, B가 5번 위치에서 A로 치환되는 피리딘-2-일일 때, M-L은 M-X, M-L1-X, M-L1-X-L2, M-L1-X-L2-X, M-X-X-, M-X-X-L2 및 M-L1-X-X-L2로 이루어진 군으로부터 선택된다.
퀴놀론
및 플루오로퀴놀론
본 발명에 유용한 퀴놀론 유도체, 예를 들어 피리돈카복실산 유도체에 관한 사항(예를 들어 이의 합성, 제제화 및 용도)은 미국 특허 제6,156,903호(Yazaki외 다수; 2000년 12월 5일) 및 이의 정정된 특허(2001년 12월 11일); 미국 특허 제6,133,284호(Yazaki외 다수; 2000년 10월 17일); 미국 특허 제5,998,436호(Yazaki외 다수; 1999년 12월 7일) 및 이의 정정된 특허(2001년 1월 23일 및 2002년 12월 17일); PCT 특허 출원 공보 WO 2006/042034(Abbott Laboratories; 2006년 4월 20일); PCT 특허 출원 공보 WO 2006/015194(Abbott Laboratories; 2006년 2월 9일); PCT 특허 출원 공보 WO 01/34595(Wakunaga Pharmaceutical Co.,Ltd.; 2001년 5월 17일); 및 PCT 특허 출원 공보 WO 97/11068(Wakunaga Pharmaceutical Co.,Ltd.; 1997년 3월 27일)에 기술되어 있다.
본 발명의 방법, 조성물 및 용도와 관련된 피리돈카복실산 유도체는 하기 구조식에 해당하는 화합물(피리돈카복실산 유도체 1), 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
피리돈카복실산 유도체 1
상기 식 중, R1은 수소 원자 또는 카복실 보호기를 나타내고; R2는 하이드록실기, 저급 알콕시기, 또는 치환 또는 비치환 아미노기를 나타내며; R3는 수소 원자 또는 할로겐 원자를 나타내고; R4는 수소 원자 또는 할로겐 원자를 나타내며; R5는 할로겐 원자 또는 임의 치환되는 포화 시클릭 아미노기를 나타내고; R6는 수소 원자, 할로겐 원자, 니트로기 또는 임의로 보호된 아미노기를 나타내며; X, Y 및 Z는 동일하거나 상이할 수 있는 것으로서, 각각 질소 원자, CH 또는 CR7[여기서, R7은 저급 알킬기, 할로겐 원자 또는 시아노기를 나타냄]을 나타내되, 다만, X, Y 및 Z 중 하나 이상은 질소 원자를 나타내고, W는 질소 원자 또는 CR8[여기서, R8은 수소 원자, 할로겐 원자 또는 저급 알킬기를 나타냄]을 나타내되, 다만, R1이 수소 원자를 나타내며, R2가 아미노기를 나타내고, R3 및 R4가 플루오르 원자를 나타내며, R6가 수소 원자를 나타내고, X가 질소 원자를 나타내며, Y가 CR7[여기서, R7은 플루오르 원자를 나타냄]을 나타내고, Z가 CH를 나타내며, W가 CR8[여기서, R8은 염소 원자를 나타냄]일 때, R5는 3-하이드록시아제티딘-1-일기가 아니다.
상기 문단에 기술된 바와 같이, R1이 카복실 보호기일 때, 비교적 용이하게 절단되어 상응하는 유리 카복실기를 생성하는 것은 임의의 카복실레이트 에스테르 잔기일 수 있다. 예시적인 카복실 보호기로서는, 가수 분해, 촉매에 의한 환원 및 기타 온화한 조건 하에서의 처리법에 의해 제거될 수 있는 것들, 예를 들어 저급 알킬기, 예를 들어 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, t-부틸기, 펜틸기, 헥실기 및 헵틸기; 저급 알케닐기, 예를 들어 비닐기, 알릴기, 1-프로페닐기, 부테닐기, 펜테닐기, 헥세닐기 및 헵테닐기; 아랄킬기, 예를 들어 벤질기; 그리고 아릴기, 예를 들어 페닐기 및 나프틸기; 그리고 체 내에서 용이하게 제거될 수 있는 것들, 예를 들어 저급 알카노일옥시 저급 알킬기, 예를 들어, 아세톡시메틸기 및 피발로일옥시메틸기; 저급 알콕시카보닐옥시 저급 알킬기, 예를 들어 메톡시카보닐옥시메틸기 및 1-에톡시카보닐옥시에틸기; 저급 알콕시메틸기, 예를 들어 메톡시메틸기; 락토닐기, 예를 들어 프탈리딜; 디-저급 알킬아미노 저급 알킬기, 예를 들어 1-디메틸아미노에틸기; 및 (5-메틸-2-옥소-1,3-디옥솔-4-일)메틸기를 포함한다.
치환기 R1, R2, R3, R4, R5, R6, R7, R8, R9, A, J1, J2, J3, W, X, Y, Z, e, f 및 g는 피리돈카복실산 유도체, 예를 들어 피리돈카복실산 유도체 1의 화학 구조식과 관련하여 편의상 본원에 정의된 것으로서, 본 발명의 기타 화합물에 대한 기타 치환기들을 의미하는 것은 아니다.
다른 구체예에서, 본 발명은 W가 CR8[여기서, R8은 수소 원자, 할로겐 원자 또는 저급 알킬기를 나타냄]인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R5가 하기 화학식 (a) 또는 (b)에 의해 표시되는 기인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다:
상기 식 중, A는 산소 원자, 황 원자 또는 NR9[여기서, R9는 수소 원자 또는 저급 알킬기를 나타냄]를 나타내고, e는 3~5의 수를 나타내며, f는 1~3의 수를 나타내고, g는 0~2의 수를 나타내며, 서로 동일하거나 상이할 수 있는 J1, J2 및 J3는 수소 원자, 하이드록실기, 저급 알킬기, 아미노 저급 알킬기, 아미노기, 저급 알킬아미노기, 저급 알콕시기 또는 할로겐 원자를 나타낸다.
다른 구체예에서, 본 발명은 R5가 하기 화학식 (a)에 의해 표시되는 기인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다:
다른 구체예에서, 본 발명은 하기 화학식 (a) 중 e가 3 또는 4인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다:
다른 구체예에서, 본 발명은 R1이 수소 원자이고; R2가 아미노기, 저급 알킬아미노기 또는 디-저급 알킬아미노기이며; R3가 할로겐 원자이고; R4가 할로겐 원자이며; R6가 수소 원자이고; X가 질소 원자이며; Y 및 Z가 CH 또는 CR7[여기서, R7은 저급 알킬기 또는 할로겐 원자임]이며; W가 CR8[여기서, R8은 할로겐 원자 또는 저급 알킬기임]인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2가 아미노기이고; R3가 플루오르 원자이며; R4가 플루오르 원자이고; Y가 CF이며; Z가 CH이고; W가 CR8[여기서, R8은 염소 원자, 브롬 원자 또는 메틸기임]이며; 하기 화학식 (a) 중 e는 3인 구조식 피리돈카복실산 유도체 1의 피리돈카복실산 유도체와 관련된 방법, 조성물 또는 용도에 관한 것이다:
다른 구체예에서, 본 발명은 상기 피리돈카복실산의 구조가 하기 구조식과 상응하는 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물과 관련된 방법, 조성물 또는 용도에 관한 것이다:
상기 피리돈카복실산은 또한 공중에 개시된 코드명 ABT-492 및 WQ3034로서도 알려져 있으며, 또한 화학명 1-(6-아미노-3,5-디플루오로-2-피리디닐)-8-클로로-6-플루오로-1,4-디하이드로-7-(3-하이드록시-1-아제티디닐)-4-옥소-3-퀴놀린카복실산 또는 1-(6-아미노-3,5-디플루오로-2-피리디닐)-8-클로로-6-플루오로-1,4-디하이드로-7-(3-하이드록시아제티딘-1-일)-4-옥소-3-퀴놀린카복실산으로서도 알려져 있다. 상기 화합물의 이와 같은 카복실산 형태의 CAS 등록 번호는 189279-58-1이다. 뿐만 아니라, 상기 언급된 WO 2006/042034에는, 상기 화합물의 D-글루시톨 염, 즉 [D-글루시톨 1-(6-아미노-3,5-디플루오로-2-피리디닐)-8-클로로-6-플루오로-1,4-디하이드로-7-(3-하이드록시-1-아제티디닐)-4-옥소-3-퀴놀린카복실레이트(염)]와 상기 화합물의 D-글루시톨 염의 삼수화물, 즉 [D-글루시톨 1-(6-아미노-3,5-디플루오로-2-피리디닐)-8-클로로-6-플루오로-1,4-디하이드로-7-(3-하이드록시-1-아제티디닐)-4-옥소-3-퀴놀린카복실레이트 삼수화물(염)]이 개시되어 있다. 상기 D-글루시톨 염과 D-글루시톨 염 삼수화물의 CAS 등록 번호는 각각 352458-37-8 및 883105-02-0이다. D-글루시톨의 CAS 등록 번호는 6284-40-8이다. WO 2006/042034에는 또한, 약 25℃에서 Cu-Ka 방사선을 조사하여 분말 회절 패턴[WO 2006/042034의 도 1에 도시됨]에 의해 분석되어 특성 규명된 D-글루시톨 염의 결정형과, 약 25℃에서 Cu-Ka 방사선을 조사하여 분말 회절 패턴[WO 2006/042034의 도 2에 도시됨]에 의해 분석되어 특성 규명된 D-글루시톨 염 삼수화물의 결정형이 개시되어 있다. 이와 같은 D-글루시톨 염은 본 발명에 유용하다. 또한, 문헌[A.R. Haight외 다수, "Synthesis of the Quinolone ABT-492: Crystallizations for Optimal Processing", Organic Process Research & Development (2006), 10(4), 751 -756]을 참조하시오.
본 발명에 유용한 기타 퀴놀론 화합물로서는 플루오로퀴놀론, 예를 들어 가레녹사신, 가티플록사신, 게미플록사신, 레보플록사신 및 목시플록사신을 포함한다.
가레녹사신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법과 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 가레녹사신은 또한, 1-시클로프로필-8-(디플루오로메톡시)-7-(1R)-(1-메틸-2,3-디하이드로-1H-5-이소이노딜)-4-옥소-1,4-디하이드로-3-퀴놀린카복실산 메탄설포네이트 일수화물로서도 알려져 있으며, 공중에게는 코드명 T-3811 및 BM 284756으로 알려져 있다. 문헌[M. Takahata외 다수, "In Vitro and In Vivo Antimicrobial Activities of T-381 1 ME, a Novel Des-F(6)-Quinolone", Antimicrobial Agents and Chemotherapy, vol. 43, no. 5, pp. 1077-1084 (1999); 미국 특허 제 6,025,370호(Todo et al; 2000년 2월 15일); 및 미국 특허 제5,935,952호(Todo외 다수; 1999년 8월 10일) 및 이의 정정된 특허(2000년 12월 5일)]을 참조하시오.
가티플록사신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물이 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 가티플록사신은 상품명 또는 등록 상표명 테쿠인(Tequin)으로서 시판되고 있다. 미국 특허 제6,589,955호(B2)(Raghavan외 다수; 2003년 7월 8일); 미국 특허 제5,880,283호(Matsumoto외 다수; 1999년 3월 9일); 및 미국 특허 제4,980,470호(Masuzawa외 다수; 1990년 12월 25일) 및 이의 정정된 특허(1992년 8월 11일)를 참조하시오.
게미플록사신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 게미플록사신은 상품명 또는 등록 상표명 팩티브(Factive)로서 시판되고 있다. 미국 특허 제6,803,376호(B1)(Appelbaum외 다수; 2004년 10월 12일); 미국 특허 제6,723,734호(B2)(Kim외 다수; 2004년 4월 20일); 미국 특허 제6,455,540호(B1)(Citron외 다수; 2002년 9월 24일); 미국 특허 제6,340,689호(B1)(Dubois외 다수; 2002년 1월 22일) 및 이의 정정된 특허(2002년 6월 18일); 미국 특허 제6,331,550호(B1)(Citron외 다수; 2001년 12월 18일); 미국 특허 제6,262,071호(B1)(Crabb외 다수; 2001년 7월 17일); 미국 특허 제5,962,468호(Hong외 다수; 1999년 10월 5일) 및 이의 정정된 특허(2000년 5월 9일); 미국 특허 제5,776,944호(Hong외 다수; 1998년 7월 17일); 및 미국 특허 제5,633,262호(Hong외 다수; 1997년 5월 27일)를 참조하시오.
레보플록사신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 레보플록사신은 상품명 또는 등록 상표명 레바퀸(Levaquin)으로서 시판되고 있다. 미국 특허 제5,053,407호(Hayakawa외 다수; 1991년 10월 1일) 및 이의 정정된 특허(1994년 9월 27일)를 참조하시오.
목시플록사신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 목시플록사신은 상품명 또는 등록 상표명 아벨록스(Avelox)로서 시판되고 있다. 미국 특허 제5,849,752호(Grunenberg외 다수; 1998년 12월 15일); 미국 특허 제5,607,942호(Petersen외 다수; 1997년 3월 4일); 및 미국 특허 제4,990,517호(Petersen외 다수; 1991년 2월 5일) 및 이의 정정된 특허(1995년 4월 25일)를 참조하시오.
벤조헤테로시클릭
화합물
본 발명에 유용한 벤조헤테로시클릭 화합물에 관한 사항(예를 들어 이의 합성, 제제화 및 용도)은, 미국 특허 제6,753,333호(B2)(De Souza외 다수; 2004년 6월 22일); 미국 특허 제6,750,224호(B1)(Patel외 다수; 2004년 6월 15일) 및 이의 정정된 특허(2004년 11월 2일); 미국 특허 제6,664,267호(B1)(De Souza외 다수; 2003년 12월 1일); 미국 특허 제6,608,078호(B2)(De Souza외 다수; 2003년 8월 19일); 미국 특허 제6,514,986호(B2)(De Souza외 다수; 2003년 2월 4일); 미국 특허 제4,552,879호(Ishikawa외 다수; 1985년 11월 12일); 및 미국 특허 제4,399,134호(Ishikawa외 다수; 1983년 8월 16일)에 기술되어 있다.
본 발명의 방법, 조성물 및 용도와 관련된 벤조헤테로시클릭 화합물은 하기 구조식에 상응하는 화합물(벤조헤테로시클릭 화합물 I), 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다.
벤조헤테로시클릭 화합물 I
상기 식 중, R1은 수소 원자 또는 저급 알킬기를 나타내고; R2는 수소 원자 또는 할로겐 원자를 나타내며; R3는 하이드록시메틸기, 1,2,5,6-테트라하이드로-1-피리딜기, 또는 화학식 인 기[여기서, R4는 수소 원자, 저급 알킬기, 저급 알콕시기, 하이드록시기, 페닐-저급 알킬기, 저급 알카노일옥시기, 아미노기(이는 저급 알킬기 또는 저급 알카노일기로 치환될 수 있음), 옥소기 또는 카바모일기를 나타냄]로 치환될 수 있는 1-피롤리디닐기를 나타내고; Z는 산소 원자, 황 원자 또는 메틸렌기를 나타내며; m은 1 또는 2이고; n은 1 또는 2와 같은 정수이다.
치환기 R1, R2, R3, R4, Z, m 및 n은 벤조헤테로시클릭 화합물, 예를 들어 벤조헤테로시클릭 화합물 (I)의 화학 구조식과 관련하여 편의상 본원에 정의된 것으로서, 본 발명의 기타 화합물에 대한 기타 치환기들을 의미하는 것은 아니다.
다른 구체예에서, 본 발명은 n이 2인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 n이 1인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R3가 하기 화학식의 기를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다:
상기 식 중, R4는 수소 원자, 저급 알킬기, 저급 알콕시기, 하이드록시기, 페닐-저급 알킬기, 저급 알카노일옥시기, 아미노기(이는 저급 알킬기 또는 저급 알카노일기로 치환될 수 있음), 옥소기 또는 카바모일기를 나타내고; Z는 산소 원자, 황 원자 또는 메틸렌기를 나타내며; m은 1 또는 2이고; n은 1이다.
다른 구체예에서, 본 발명은 R3가 하이드록시메틸기 또는 1,2,5,6-테트라하이드로-1-피리딜기로 치환될 수 있는 1-피롤리디닐기를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R4가 수소 원자, 하이드록시기 또는 저급 알카노일옥시기를 나타내고, 하기 화학식의 기가 결합되는 위치는 8-번 위치인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다:
상기 식 중, R4는 수소 원자, 저급 알킬기, 저급 알콕시기, 하이드록시기, 페닐-저급 알킬기, 저급 알카노일옥시기, 아미노기(이는 저급 알킬기 또는 저급 알카노일기로 치환될 수 있음), 옥소기 또는 카바모일기를 나타내고; Z는 산소 원자, 황 원자 또는 메틸렌기를 나타내며; m은 1 또는 2이고; n은 1이다.
다른 구체예에서, 본 발명은 R4가 저급 알킬기, 저급 알콕시기, 페닐-저급 알킬기, 저급 알킬기 또는 저급 알카노일기로 치환될 수 있는 아미노기, 옥소기, 카바모일기를 나타내고, 하기 화학식의 기가 결합되는 위치는 8-번 위치인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다:
상기 식 중, R4는 수소 원자, 저급 알킬기, 저급 알콕시기, 하이드록시기, 페닐-저급 알킬기, 저급 알카노일옥시기, 아미노기(이는 저급 알킬기 또는 저급 알카노일기로 치환될 수 있음), 옥소기 또는 카바모일기를 나타내고; Z는 산소 원자, 황 원자 또는 메틸렌기를 나타내며; m은 1 또는 2이고; n은 1이다.
다른 구체예에서, 본 발명은 R2가 할로겐 원자를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2가 수소 원자를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2가 플루오르 원자를 나타내고, 플루오르 원자가 결합하는 위치는 9-번 위치인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2가 염소 원자를 나타내고, 플루오르 원자가 결합하는 위치는 9-번 위치인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 저급 알킬기를 나타내는 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸기를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2가 9-번 위치에 결합되어 있는 플루오르 원자를 나타내고, R1은 메틸기를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸기를 나타내고, R2는 9-번 위치에 결합되어 있는 플루오르 원자를 나타내며, R3로 표시되는 기가 결합되는 위치는 8-번 위치인 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R3가 결합되는 위치가 9-번 위치인 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸기를 나타내고, R2는 8-번 위치에 결합되어 있는 플루오르 원자를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸기를 나타내고, R2는 8-번 위치에 결합되어 있는 염소 원자를 나타내는 구조식 벤조헤테로시클릭 화합물 I의 벤조헤테로시클릭 화합물과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 9-플루오로-8-(4-하이드록시-1-피페리딜)-5-메틸-6,7-디하이드로-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물인 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물인 방법, 조성물 또는 용도에 관한 것이다. 상기 화합물은 또한 화학명 나디플록사신으로 알려져 있기도 하다.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산 아르기닌 염인 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산 아르기닌 염의 특이적 다형체 또는 결정형인 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 다음과 같은 X-선 회절 데이터를 가지는, S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산 아르기닌 염인 방법, 조성물 또는 용도에 관한 것이다: (2θ): 10.16, 11 .78, 12,52, 16.00, 18.94, 19.66, 20.36, 21.28, 21.92, 22.52, 24.74, 25.28, 30.74.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 다음과 같은 X-선 회절 데이터를 가지는, S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산 아르기닌 염인 방법, 조성물 또는 용도에 관한 것이다: (2θ): 18.28, 18.8, 19.8, 20.12, 20.62, 21.10, 21.44, 21.88, 22.6, 23.02.
다른 구체예에서, 본 발명은 상기 벤조헤테로시클릭 화합물이 다음과 같은 X-선 회절 데이터를 가지는, S-(-)-9-플루오로-6,7-디하이드로-8-(4-하이드록시피페리딘-1-일)-5-메틸-1-옥소-1H,5H-벤조[i,j]퀴놀리진-2-카복실산 아르기닌 염인 방법, 조성물 또는 용도에 관한 것이다: (2θ): 14.02±0.2, 14.82±0.2, 19.28±0.2, 22.12±0.2, 22.96±0.2, 23.46±0.2, 28.36±0.2.
벤조헤테로시클릭 화합물의 특이적인 다형체 또는 결정형과 관련하여, 예를 들어 아르기닌 염의 공중에 알려진 코드명은, 이와 같은 화합물일 경우 WCK771이다.
베타-락탐
본원에서 유용한 베타 락탐, 예를 들어 카바페넴은 이들의 합성, 제제화 및 용도를 비롯하여, 문헌[M. Kurazano et al, "In Vitro Activities of ME1036 (CP5609), a Novel Parenteral Carbapenem, Against Methicillin-Resistant Staphylococci", Antimicrobial Agents and Chemotherapy, vol. 48, no. 8, pp. 2831-2837 (August 2004); 미국 특허 출원 US 2004/0038967(A1)(Kano외 다수; 2004년 2월 26일); PCT 특허 출원 공보 WO 2004/055027(Meiji Seika Kaisha, Ltd.; 2004년 7월 1일); 및 PCT 특허 출원 공보 WO 02/042312(Meiji Seika Kaisha, Ltd.; 2002년 5월 30일)]에 기술되어 있으며, 이들의 일예는 7-아실화 이미다조[5-1,b]티아졸-2-일 기가 C-2 위치의 카바페넴 부분에 직접적으로 결합하고 있는 카바페넴이다.
본 발명의 방법, 조성물 및 용도와 관련된 베타-락탐 화합물은 하기 구조식에 상응하는 화합물(베타-락탐 I), 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물을 포함한다:
베타-락탐 I
상기 식 중, R1은 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자; 할로겐 원자; 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노, 저급 알킬티오, 저급 알콕시, 저급 시클로알킬, N,N-디-저급 알킬아미노 또는 N-카바모일 저급 알킬-N,N-디-저급 알킬암모니노에 의해 임의 치환되는 저급 알킬; 저급 시클로알킬; 저급 알킬카보닐[여기서, 상기 저급 알킬카보닐의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노, 저급 알킬티오, 저급 알콕시, 저급 시클로알킬, N,N-디-저급 알킬아미노 또는 N-카바모일 저급 알킬-N,N-디-저급 알킬암모니노에 의해 임의 치환됨]; 카바모일; 저급 알킬기 1개 또는 2개에 의해 임의 치환되는 아미노에 의해 임의 치환되는 아릴; 저급 알킬티오[여기서, 상기 저급 알킬티오의 알킬 부분은 아미노, 하이드록실, 아지드, 할로겐 원자, 시아노, 카바모일, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]; 모폴리닐; 저급 알킬설포닐; 또는 포르밀을 나타내며; n은 0~4의 정수이고, Hy는 4~7원 모노시클릭이거나, 9원 또는 10원 이중 시클릭인 포화 또는 불포화 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자를 1~4개 가짐)를 나타내며, Hy로 표시되는 포화 또는 불포화 복소환기는 할로겐 원자; 시아노; 저급 알킬[여기서, 상기 저급 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자; 하이드록실; 카바모일; 카복실메틸-치환 카바모일; 아미노; N,N-디-저급 알킬아미노; 아미노에 의해 임의 치환되는 아릴; 아미노설포닐 또는 카복실에 의해 임의 치환되는, 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함); 카복실; 이미노; 저급 알콕시카보닐; 저급 알킬카보닐; 아미노설포닐아미노; 아미노 저급 알킬티오; 저급 알킬설포닐; (N,N-디-저급 알킬아미노)설포닐아미노; N'-(N,N-디-저급 알킬아미노)설포닐-N'-저급 알킬아미노; 할로겐화된 저급 알킬카보닐; N-아미노설포닐피페리디닐; 및 시아노로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬티오[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬설포닐[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노, 1-이미노에틸아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 하이드록실; 저급 알콕시; 하이드록시아미노페닐-치환된 저급 알콕시; 할로겐화된 저급 알콕시; 아미노페닐-치환된 저급 알콕시; 포르밀; 저급 알킬카보닐; 아릴카보닐; 카복실; 저급 알콕시카보닐; 카바모일; N-저급 알킬카바모일; N,N-디-저급 알킬아미노카보닐; 아미노; N-저급 알킬아미노; N,N-디-저급 알킬아미노; 포르밀아미노; 저급 알킬카보닐아미노; 아미노설포닐아미노; (N-저급 알킬아미노)설포닐아미노-; (N,N-디-저급 알킬아미노)설포닐아미노; 아릴; 또는 아미노설포닐 또는 카복실에 의해 임의 치환되는, 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함함)에 의해 임의 치환된다.
치환기 R1, R2, R3, Hy 및 n은 베타 락탐 또는 카바페넴, 예를 들어 베타-락탐 I 및 베타-락탐 II의 화학 구조와 관련하여 편의상 본원에 정의되어 있으나, 본 발명의 기타 화합물에 관한 기타 치환기를 말하는 것은 아니다.
다른 구체예에서, 본 발명은 R1이 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자; 할로겐 원자; 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환되는 저급 알킬; 저급 알킬카보닐[여기서, 상기 저급 알킬카보닐의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]; 카바모일; 아릴; 또는 저급 알킬티오[여기서, 상기 저급 알킬티오의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]를 나타내며, n은 0~4의 정수이고, Hy는 4~7원 모노시클릭이거나, 9원 또는 10원 이중 시클릭인 포화 또는 불포화 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자를 1~4개 포함함)를 나타내고, Hy로 표시되는 포화 또는 불포화 복소환기는 할로겐 원자; 시아노; 저급 알킬[여기서, 상기 저급 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노, 아릴, 그리고 질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함하는 모노시클릭 또는 이중 시클릭 복소환기로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬티오[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬설포닐[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 하이드록실; 저급 알콕시; 포르밀; 저급 알킬카보닐; 아릴카보닐; 카복실; 저급 알콕시카보닐; 카바모일; N-저급 알킬카바모일; N,N-디-저급 알킬아미노카보닐; 아미노; N-저급 알킬아미노; N,N-디-저급 알킬아미노; 포르밀아미노; 저급 알킬카보닐아미노; 아미노설포닐아미노; (N-저급 알킬아미노)설포닐아미노; (N,N-디-저급 알킬아미노)설포닐아미노; 아릴; 또는 질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함하는 모노시클릭이거나 이중 시클릭인 복소환기에 의해 임의 치환되는 구조식 베타-락탐 I의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자, 할로겐 원자, 임의 치환되는 저급 알킬, 저급 시클로알킬, 저급 알킬카보닐, 카바모일, 임의 치환되는 아릴, 임의 치환되는 저급 알킬티오, 모폴리닐, 저급 알킬설포닐 또는 포르밀을 나타내며, n은 0~2의 정수이고, Hy는 임의 치환되는 피리디닐, 임의 치환되는 피리디늄-일, 임의 치환되는 테트라하이드로피리디닐, 임의 치환되는 티아졸릴, 임의 치환되는 피리미디닐, 임의 치환되는 티에닐, 임의 치환되는 퀴놀리닐, 임의 치환되는 퀴놀리늄-일, 임의 치환되는 이소퀴놀리닐, 임의 치환되는 디하이드로이소퀴놀리닐, 임의 치환되는 피페라지닐, 임의 치환되는 피페리디닐, 임의 치환되는 인돌릴, 임의 치환되는 티오모폴리닐, 임의 치환되는 이미다졸릴 및 임의 치환되는 피롤리디닐로부터 선택되는 기를 나타내는 구조식 베타-락탐 I의 베타-락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1은 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자, 할로겐 원자, 임의 치환되는 저급 알킬, 임의 치환되는 저급 알킬카보닐, 카바모일, 아릴 또는 임의 치환되는 저급 알키티오를 나타내며, n은 0~4인 정수이고, Hy는 임의 치환되는 피리디닐, 임의 치환되는 피리디늄-일, 임의 치환되는 테트라하이드로피리디닐, 임의 치환되는 티아졸릴, 임의 치환되는 피리미디닐, 임의 치환되는 티에닐, 임의 치환되는 퀴놀리닐, 임의 치환되는 퀴놀리늄-일 및 임의 치환되는 피롤리디닐로부터 선택되는 기를 나타내는 구조식 베타-락탐 I의 베타-락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 하기 구조식(베타-락탐 II)에 상응하는 화합물을 사용하는 본 발명의 방법 및 조성물, 그리고 본 발명에 의한 상기 화합물의 용도에 관한 베타-락탐 화합물, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물에 관한 것이다.
베타-락탐 II
상기 식 중, R1은 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자; 할로겐 원자; 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노, 저급 알킬티오, 저급 알콕시, 저급 시클로알킬, N,N-디-저급 알킬아미노 또는 N-카바모일 저급 알킬-N,N-디-저급 알킬암모니노에 의해 임의 치환되는 저급 알킬; 저급 시클로알킬; 저급 알킬카보닐[여기서, 상기 저급 알킬카보닐의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알칼카보닐아미노, 아미노설포닐아미노, 저급 알킬티오, 저급 알콕시, 저급 시클로알킬, N,N-디-저급 알킬아미노 또는 N-카바모일 저급 알킬-N,N-디-저급 알킬암모니노에 의해 임의 치환됨]; 카바모일; 1개 또는 2개의 저급 알킬기에 의해 임의 치환되는 아미노에 의해 임의 치환되는 아릴; 저급 알킬티오[여기서, 상기 저급 알킬티오의 알킬 부분은 아미노, 하이드록실, 아지드, 할로겐 원자, 시아노, 카바모일, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]; 모폴리닐; 저급 알킬설포닐; 또는 포르밀을 나타내며; n은 0~4의 정수이고, Hy는 4~7원 모노시클릭이거나, 9원 또는 10원 이중 시클릭인 포화 또는 불포화 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자를 1~4개 가짐)를 나타내고, Hy에 의해 표시되는 포화 또는 불포화 복소환기는 할로겐 원자; 시아노; 저급 알킬[여기서, 상기 저급 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자; 하이드록실; 카바모일; 카복실메틸-치환된 카바모일; 아미노; N,N-디-저급 알킬아미노; 아미노에 의해 임의 치환되는 아릴; 아미노설포닐 또는 카복실에 의해 임의 치환되는 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함함); 카복실; 이미노; 저급 알콕시카보닐; 저급 알킬카보닐; 아미노설포닐아미노; 아미노 저급 알킬티오; 저급 알킬설포닐; (N,N-디-저급 알킬아미노)설포닐아미노; N'-(N,N-디-저급 알킬아미노)설포닐-N'-저급 알킬아미노; 할로겐화된 저급 알킬카보닐; N-아미노설포닐피페리디닐; 및 시아노로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬티오[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬설포닐[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노, 1-이미노에틸아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 하이드록실; 저급 알콕시; 하이드록시아미노페닐-치환된 저급 알콕시; 할로겐화된 저급 알콕시; 아미노페닐-치환된 저급 알콕시; 포르밀; 저급 알킬카보닐; 아릴카보닐; 카복실; 저급 알콕시카보닐; 카바모일; N-저급 알킬카바모일; N,N-디-저급 알킬아미노카보닐; 아미노; N-저급 알킬아미노; N,N-디-저급 알킬아미노; 포르밀아미노; 저급 알킬카보닐아미노; 아미노설포닐아미노; (N-저급 알킬아미노)설포닐아미노-; (N,N-디-저급 알킬아미노)설포닐아미노; 아릴; 또는 아미노설포닐 또는 카복실에 의해 임의 치환되는, 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함함)에 의해 임의 치환된다.
다른 구체예에서, 본 발명은 R1이 수소 원자 또는 메틸을 나타내고, 동일하거나 상이할 수 있는 R2 및 R3는 각각 수소 원자, 할로겐 원자, 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환되는 저급 알킬; 저급 알킬카보닐[여기서, 상기 저급 알킬카보닐의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]; 카바모일; 아릴; 또는 저급 알킬티오[여기서, 상기 저급 알킬티오의 알킬 부분은 할로겐 원자, 시아노, 하이드록실, 카바모일, 아미노, 포르밀아미노, 저급 알킬카보닐아미노, 아미노설포닐아미노 또는 저급 알킬티오에 의해 임의 치환됨]를 나타내고, n은 0~4의 정수이며, Hy는 4~7원 모노시클릭이거나, 9원 또는 10원 이중 시클릭인 포화 또는 불포화 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자를 1~4개 포함함)를 나타내고, Hy에 의해 표시되는 포화 또는 불포화 복소환기는 할로겐 원자; 시아노; 저급 알킬[여기서, 상기 저급 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노, 아릴, 그리고 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함함)로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬티오[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 저급 알킬설포닐[여기서, 상기 알킬기 상에 존재하는 수소 원자 하나 이상은 할로겐 원자, 하이드록실, 카바모일, 아미노 및 아릴로부터 선택되는 기에 의해 임의 치환됨]; 하이드록실; 저급 알콕시; 포르밀; 저급 알킬카보닐; 아릴카보닐; 카복실; 저급 알콕시카보닐; 카바모일; N-저급 알킬카바모일; N,N-디-저급 알킬아미노카보닐; 아미노; N-저급 알킬아미노; N,N-디-저급 알킬아미노; 포르밀아미노; 저급 알킬카보닐아미노; 아미노설포닐아미노; (N-저급 알킬아미노)설포닐아미노; (N,N-디-저급 알킬아미노)설포닐아미노; 아릴; 또는 모노시클릭이거나 이중 시클릭인 복소환기(질소, 산소 및 황 원자로부터 선택되는 이종 원자 하나 이상을 포함함)에 의해 임의 치환되는 구조식 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R2 및 R3에 의해 임의로 표시되는, 저급 알킬기 및 저급 알킬카보닐기 상에 존재하는 치환기가 하이드록실, 저급 알콕시, N,N-디-저급 알킬아미노 또는 N-카바모일 저급 알킬-N,N-디-저급 알킬암모니노이고, 상기 R2 및 R3에 의해 임의로 표시되는 아릴기 상에 존재하는 치환기는 N,N-디-저급 알킬아미노이며, 상기 R2 및 R3에 의해 임의로 표시되는 저급 알킬티오기 상에 존재하는 치환기는 아미노, 하이드록실 또는 아지드이고, 상기 Hy에 의해 표시되는 포화 또는 불포화 복소환 고리 상에 존재하는 치환기는, 카복실메틸-치환된 카바모일, 카바모일, 페닐, 아미노페닐, N,N-디-저급 알킬아미노, 아미노, 하이드록실, 모폴리닐, 피롤리디닐, 카복실, 이미노, 아미노 저급 알킬티오, 저급 알콕시카보닐, 저급 알킬카보닐, 아미노설포닐아미노, 피페리디닐, 저급 알킬설포닐, (N,N-디-저급 알킬아미노)설포닐아미노, N'-(N,N-디-저급 알킬아미노)설포닐-N'-저급 알킬아미노, 할로겐화된 저급 알킬카보닐, N-아미노설포닐피페리디닐 또는 시아노에 의해 임의 치환되는 저급 알킬; 카바모일; 피리디닐; N-아미노설포닐피롤리디닐; 2-카복시피롤리디닐; 페닐; 하이드록실; 저급 알콕시; 하이드록시아미노페닐-치환된 저급 알콕시; 할로겐화된 저급 알콕시; 아미노페닐-치환된 저급 알콕시; 아미노; 카복실; 아미노에 의해 임의 치환되는 저급 알킬티오; 아미노 저급 알킬티오; 아미노 저급 알킬설포닐; 또는 1-이미노에틸아미노 저급 알킬설포닐인 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 수소 원자 또는 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 자체의 1-번 위치에 카바모일메틸을 가지는 피리디늄-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 n이 0(제로)인 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 임의로는 자체의 1번 위치에 카바모일 저급 알킬, 카복실 저급 알킬 또는 아미노설포닐아미노 저급 알킬을 가지고, 1번 위치 이외의 다른 위치에는 아미노 저급 알킬티오를 가지는 피리디늄-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 피리딘-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 1-카바모일메틸피리디늄-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1, R2 및 R3가 수소 원자를 나타내고, n은 0(제로)이며, Hy는 1-카바모일메틸피리디늄-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 1-카바모일메틸-5-페닐피리디늄-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 (2S)-피롤리딘-2-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 1-카복시메틸피리디늄-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 R1이 메틸을 나타내고, R2 및 R3는 수소 원자를 나타내며, n은 0(제로)이고, Hy는 1-(2-아미노설포닐아미노에틸)피리디늄-3-일을 나타내는 구조식 베타-락탐 I 또는 베타-락탐 II의 베타 락탐과 관련된 방법, 조성물 또는 용도에 관한 것이다.
다른 구체예에서, 본 발명은 상기 베타-락탐 또는 카바페넴, 이의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물이 하기 구조식에 해당하는 방법, 조성물 또는 용도에 관한 것이다:
상기 베타-락탐 또는 카바페넴은 또한 공중에 공개된 코드명 ME1036 및 CP5609로서도 알려져 있다.
아미노메틸시클린
화합물
아미노메틸시클린 화합물, 예를 들어 7-메틸아미노-9-(2,2-디메틸-프로필)아미노메틸시클린, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 화합물 7-메틸아미노-9-(2,2-디메틸-프로필)아미노메틸시클린은 또한 공중에 공개된 코드명 PTK0796 및 BAY 73-6944로서도 알려져 있다. 미국 특허 제6,846,939호(B2)(Nelson외 다수; 2005년 1월 25일); 미국 특허 출원 US 2005/0070510(A1)(Draper외 다수; 2005년 3월 31일); 미국 특허 출원 US 2005/0026876(A1)(Nelson외 다수; 2005년 2월 3일); 미국 특허 출원 US 2005/0026875(A1)(Nelson외 다수; 2005년 2월 3일); 미국 특허 출원 US 2004/0242548(A1)(Draper외 다수; 2004년 12월 2일); 미국 특허 출원 US 2004/0214801(A1)(Nelson외 다수; 2004년 10월 28일); 미국 특허 출원 US 2004/0214800(A1)(Levy외 다수; 2004년 10월 28일); 미국 특허 출원 US 2004/0092490(A1)(Draper외 다수; 2004년 5월 13일); 미국 특허 출원 US 2004/0063674(A1)(Levy외 다수; 2004년 4월 1일); 미국 특허 출원 US 2003/0166585(A1)(Draper외 다수; 2003년 9월 4일); 미국 특허 출원 US 2003/0125348(A1)(Nelson외 다수; 2003년 7월 3일); PCT 특허 출원 공보 WO 2005/009944(Paratek Pharmaceuticals, Inc.; 2005년 2월 3일); PCT 특허 출원 공보 WO 2004/091513(Paratek Pharmaceuticals, Inc.; 2004년 10월 28일); PCT 특허 출원 공보 WO 2004/064728(Paratek Pharmaceuticals, Inc.; 2004년 8월 5일); PCT 특허 출원 공보 WO 2004/038001(Paratek Pharmaceuticals, Inc.; 2004년 5월 6일); PCT 특허 출원 공보 WO 2004/038000(Paratek Pharmaceuticals, Inc.; 2004년 5월 6일); PCT 특허 출원 공보 WO 03/075857(Paratek Pharmaceuticals, Inc.; 2003년 9월 18일); PCT 특허 출원 공보 WO 03/005971(Paratek Pharmaceuticals, Inc.; 2003년 1월 23일); PCT 특허 출원 공보 WO 02/072031(Paratek Pharmaceuticals, Inc.; 2002년 9월 19일); 및 PCT 특허 출원 공보 WO 02/04406(Trustees of Tufts College 및 Paratek Pharmaceuticals, Inc.; 2002년 1월 17일)을 참조하시오.
달바반신
달바반신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 반합성 글리코펩티드인 달바반신은 또한 공중에 공개된 코드명 VER-001 및 BI397로서도 알려져 있다. 문헌[G. Candiani외 다수, "In-Vitro and In-Vivo Antibacterial Activity of BI 397, a New Semi-Synthetic Glycopeptide Antibiotic", J. Antimicrob. Chemotherapy, 44, pp. 179-192 (1999); 미국 특허 출원 US 2005/0090433(A1)(Colombo외 다수; 2005년 4월 28일); 미국 특허 출원 US 2005/0004050(A1)(Stogniew; 2005년 1월 6일); 미국 특허 출원 US 2004/0224908(A1)(Cavaleri외 다수; 2004년 11월 11일); 미국 특허 출원 US 2004/0220122(A1)(Cavaleri외 다수; 2004년 11월 4일); 미국 특허 출원 US 2004/0198715(A1)(Cavaleri외 다수; 2004년 10월 7일)]을 참조하시오.
답토마이신
답토마이신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법과 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 답토마이신은 상품명 또는 등록 상표명 쿠비신(Cubicin)으로 시판되고 있다. 미국 특허 제6,852,689호(B2)(Oleson, Jr.외 다수; 2005년 2월 8일); 미국 특허 제6,468,967호(B1)(Oleson, Jr.외 다수; 2002년 10월 22일); 미국 특허 제5,912,226호(Baker외 다수; 1999년 6월 15일); 및 PCT 특허 출원 공보 WO 00/18419(Cubist Pharmaceuticals, Inc.; 2000년 4월 6일)를 참조하시오.
오리타반신
오리타반신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법과 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 글리코펩티드인 오리타반신은 또한 공중에 공개된 코드명 LY333328로서도 알려져 있다. 문헌[R.C. Mercier외 다수, "Pharmacodynamic Evaluation of a New Glycopeptide, LY333328, and In Vitro Activity against Staphylococcus aureus and Enterococcus faecium", Antimicrobial Agents and Chemotherapy, vol. 41, no. 6, pp. 1307-1312 (June 1997); 미국 특허 제5,998,581호(Berglund외 다수; 1999년 12월 7일) 및 이의 정정된 특허(2000년 11월 14일); 미국 특허 제5,994,297호(Nicas외 다수; 1999년 11월 30일); 미국 특허 제5,977,062호(Cooper외 다수; 1999년 11월 2일); 미국 특허 제5,952,466호(Berglund외 다수; 1999년 9월 14일); 미국 특허 제5,939,382호(Berglund외 다수; 1999년 8월 17일); 미국 특허 제5,843,889호(Cooper외 다수; 1998년 12월 1일) 및 이의 정정된 특허(2000년 3월 28일); 미국 특허 제5,840,684호(Cooper외 다수; 1998년 11월 24일); PCT 특허 출원 공보 WO 00/66144(Eli Lilly and Company; 2000년 11월 9일); PCT 특허 출원 공보 WO 99/10006호(Eli Lilly and Company; 1999년 3월 4일); PCT 특허 출원 공보 WO 98/22121호(Eli Lilly and Company; 1998년 5월 28일); PCT 특허 출원 공보 WO 98/21952호(Eli Lilly and Company; 1998년 5월 28일); 및 PCT 특허 출원 공보 WO 96/30401(Eli Lilly and Company; 1996년 10월 3일]를 참조하시오.
텔레반신
텔레반신, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. 펩티도글리칸인 텔레반신은 반코마이신의 연속 환원 아민화 및 아미노메틸포스폰산과의 반응에 의해 제조될 수 있다. 텔레반신은 또한, N-데실-N-플루오로에닐-메틸옥시카보닐-2-아미노아세탈데히드를 사용하는, 소듐 시아노-보로하이드라이드 및 트리플루오로 아세테이트를 통한 반코마이신의 환원적 알킬화와, 마니히 아미노메틸화를 통한 레소르시놀 위치의 변형에 의해 제조될 수도 있다. 텔레반신은 또한 포름알데히드의 존재 하에, 보호된 아미노-알데히드 → 아민 → 아미노알킬포스폰산과의 연속 반응에 의해 반코마이신 또는 이의 유사체로부터 제조될 수도 있다. 미국 특허 제6,887,976호(B2)(Leadbetter외 다수; 2005년 5월 3일); 미국 특허 제6,878,686호(B2)(Marquess외 다수; 2005년 4월 12일); 미국 특허 제6,872,804호(B2)(Mu; 2005년 3월 29일); 미국 특허 제6,872,701호(B2)(Leadbetter외 다수; 2005년 3월 29일); 미국 특허 제6,858,584호(B2)(Judice외 다수; 2005년 2월 22일); 미국 특허 제6,831,150호(B2)(Linsell; 2004년 12월 14일); 미국 특허 제6,828,299호(B2)(Yang외 다수; 2004년 12월 7일); 미국 특허 제6,770,621호(B2)(Linsell외 다수; 2004년 8월 3일); 미국 특허 제6,635,618호(B2)(Leadbetter외 다수; 2003년 10월 21일); 미국 특허 제6,620,781호(B2)(Linsell외 다수; 2003년 9월 16일); 미국 특허 제6,518,242호(B1)(Chen외 다수; 2003년 2월 11일); 및 미국 특허 제6,455,669호(B1)(Judice외 다수; 2002년 9월 24일); 및 PCT 특허 출원 공보 WO 03/029270(Theravance, Inc.; 2003년 4월 10일)을 참조하시오.
DK
-507k
화합물 DK-507k, 이의 약학적으로 허용 가능한 염, 에스테르 및 전구 약물은 본 발명의 방법 및 조성물에 사용될 수 있으며, 본 발명의 용도로서 사용될 수 있다. DK-507k는 플루오로퀴놀론으로서 기술될 수 있다. DK-507k는 또한 화학명 (-)-7-[(7S)-7-아미노-5-아자스피로[2.4]헵탄-5-일]-6-플루오로-1-[(1R,2S)-2-플루오로-1-시클로프로필]-1,4-디하이드로-8-메톡시-4-옥소-3-퀴놀린카복실산 모노하이드로클로라이드 일수화물로서도 알려져 있다. 문헌[Otani외 다수, In Vitro and In Vivo antibacterial Activities ofDK-507k, a Novel Fluoroquinolone, Antimicrobial Agents and Chemotherapy, Vol. 47, no. 12, pages 3750-3759 (2003); 일본 특허 JP 2004244380(A2)(Daiichi Seiyaku Co., Ltd., Japan; 2004년 9월 2일); PCT 특허 출원 공보 WO 2004/058261(Daiichi Pharmaceutical Co., Ltd., Japan; 2004년 7월 15일); PCT 특허 출원 공보 WO 2003/076248(Daiichi PHarmaceuitcal Co., Ltd., Japan; 2003년 9월 18일); 일본 특허 JP 2003096075(A2)(Daiichi Seiyaku Co., Ltd., Japan; 2003년 4월 3일); 일본 특허 JP 2002255962(A2)(Daiichi Seiyaku Co., Ltd., Japan; 2002년 9월 11일); 일본 특허 JP 2002201191(A2)(Daiichi Seiyaku Co., Ltd., Japan; 2002년 7월 16일); PCT 특허 출원 공보 WO 2001/072738(Daiichi Pharmaceutical Co., Ltd., Japan; 2001년 10월 4일); 미국 특허 제6,900,225호(B2)(Takemura외 다수; 2005년 5월 31일); 미국 특허 출원 2004/142957(A1)(Takemura외 다수; 2004년 7월 22일); 미국 특허 출원 2003/187008(A1)(Takemura외 다수; 2003년 10월 2일); PCT 특허 출원 공보 WO 2001/058876(Daiichi Pharmaceutical Co., Ltd., Japan; 2001년 8월 16일); 및 미국 특허 출원 2003/119848(A1)(Takemura외 다수; 2003년 6월 26일)]을 참조하시오.
DK-507k는 하기 화학식에 의해 표시될 수 있다:
상기 화합물은 또한, 분말 X선 회절 분석법 수행시 회절 각(2θ) 6.9, 10.5, 14.4, 23.1, 26.9 및 27.8°근방에서 특징적인 피크를 나타내는 결정으로서 생성될 수 있다.
상기 화합물의 무수 유리산, 상기 화합물의 기타 염, 에스테르 및 전구 약물, 그리고 수화물이 본 발명에서 제조 및 사용될 수 있다. 또한 상기 화합물의 기타 결정형도 본 발명에서 제조 및 사용될 수 있다.
약학 조성물을 이루는 약학 활성 성분의 투여량 및 이 조성물의 투여 방식은 대상 환자 또는 피험체, 그리고 표적 미생물, 예를 들어 표적 박테리아 유기체에 따라서 달라질 것이다.
이하에 추가로 기술된 바와 같이, 본 발명의 약학 활성 성분을 작고 균일한 입도(일반적으로는 마이크론 범위)를 가지도록 분쇄하는 것(즉 미분화)이 유리하기도 하다. 분쇄는 당업자에게 널리 공지된 표준 기술을 이용하여 수행될 수 있다. 약학 활성 성분에 유용한 입도 범위는 일반적으로 약 0.25~약 100 마이크론, 바람직하게는 약 0.5~약 50 마이크론, 그리고 더욱 바람직하게는 약 1~약 10 마이크론이다.
4. 약학
캐리어
및 약학 조성물을 제조하는 방법
경구 투여에 유용한 캐리어 및 조성물은 약학 기술에 널리 공지된 방법들 중 임의의 방법에 의해 제조될 수 있다[예를 들어 본원에 그 자체로서 참고용으로 인용되어 있는 문헌(Eds. R. C. Rowe,외 다수, Handbook of Pharmaceutical Excipients, Fifth Edition, Pharmaceutical Press (2006), Remington 's Pharmaceutical Sciences, 18th ed. (Mack Publishing Company, 1990), Remington: The Science and Practice of Pharmacy, 20th Edition, Baltimore, MD: Lippincott Williams & Wilkins, 2000, and L. Lachman, H.A. Lieberman, J.L. Kanig (1986). The Theory and Practice of Industrial Pharmacy (3rd Ed.). Lea & Febiger, Philadelphia) 참조].
경구 투여에 적당한 본 발명의 제제는 다음과 같은 형태일 수 있다: 개별 단위, 예를 들어 정제, 캡슐, 캡슐(예를 들어 연질 몇 경질 및 젤라틴 캡슐 및 경질 전분 캡슐), 사세트, 트로키, 로진즈 또는 단위 각각이 소정 양의 약물을 포함하는 기타 단위.
경구 투여용 조성물은 투여의 용이함과 투여량의 균일함을 도모하기 위해 단위 제형으로 제제화될 수 있다. 단위 제형이란, 치료될 피험체에 대한 단위 투여량으로서 적당한, 물리적으로 분리되어 있는 단위를 말하는데; 각각의 단위에는 필요로 하는 약학 캐리어와 함께 원하는 치료 효과를 발휘하도록 산정된, 약학 활성 화합물의 소정 양이 담겨 있다. 본 발명의 단위 제형에 대한 명세 사항은 활성 화합물의 독특한 특징, 이루고자 하는 치료 효과, 그리고 개체 치료용 활성 화합물을 배합 기술에 본래부터 존재하던 한계에 의해 결정되고 또한 이들에 직접적으로 좌우된다.
정제
본 발명의 정제는 표준 혼합 및 제조 기술들 중 임의의 것을 이용하여 제조된다. 정제는 습식 과립화 또는 직접적 건조 압축 중 어느 하나에 의해 제조될 수 있다. 일반적으로 정제는 약학 활성 성분을 포함하는 과립 내 성분(intragranular component)을 가지는데, 이때, 이와 같은 과립은 부가의 부형제, 즉 정제를 최종적으로 완성시켜 제조하기 위한 입자 외 성분과 추가로 혼합된다. 정제는 추가로 코팅될 수도 있다.
연질 젤라틴 캡슐
본 발명의 약학 조성물은 또한 연질 젤라틴 쉘 내에 캡슐화될 수도 있다. 임의로, 연질 젤라틴 쉘은 본질적으로 투명해서 캡슐의 미적인 품질을 향상시킨다. 연질 젤라틴 쉘은 다음과 같은 필수 성분들과 임의 성분들을 포함한다.
젤라틴은 본 발명의 연질 젤라틴 쉘을 이루는 필수 성분이다. 연질 캡슐을 제조하는데 사용되는 출발 젤라틴 재료는 콜라겐 재료, 예를 들어 동물의 피부, 백색 결합 조직 또는 뼈를 부분 가수 분해하여 제조된다. 젤라틴 재료는 A형 젤라틴[돼지 피부를 산 처리하여 생산되는 것으로서, pH 7~9에서 등전점에 도달함]; 그리고 B형 젤라틴[뼈 및 동물(소) 피부를 알칼리 처리하여 생산되는 것으로서, pH 4.7~5.2에서 등전점에 도달함]으로 분류될 수 있다. A형 젤라틴과 B형 젤라틴의 배합물은 캡슐 제조시 요구되는 점도와 블룸 강도(bloom strength) 특징을 가지는 젤라틴을 제조하는데 사용될 수 있다. 캡슐 제조에 적당한 젤라틴은 미국 미주리주 세인트 루이스 소재, 시그마 케미컬 컴퍼니(Sigma Chemical Company)로부터 시판되고 있다. 젤라틴 및 젤라틴계 캡슐에 관한 일반적인 설명은 본원에 그 자체로서 참고용으로 인용되어 있는 문헌들[Remingtons's Pharmaceutical Sciences, 16th ed., Mack Publishing Company, Easton, Pa. (1980), page 1245 and pages 1576-1582; 및 미국 특허 제4,935,243호(Borkan외 다수; 1990년 6월 19일]을 참조하시오.
처음으로 제조되는 본 발명의 캡슐의 연질 젤라틴 쉘은 젤라틴을 약 20~약 60%, 더욱 바람직하게는 약 25~약 50%, 그리고 가장 바람직하게는 약 40~약 50% 포함한다. 젤라틴은 A형, B형 또는 이와 같은 A형 및 B형의 혼합물로서 블룸수(bloom number)가 약 60~약 300인 것일 수 있다.
가소제는 본 발명의 연질 젤라틴 쉘을 이루는 또 다른 필수 성분이다. 하나 이상의 가소제는 연질 젤라틴 쉘을 생산하기 위해 혼입되는 물질이다. 이와 같이 제조된 연질 젤라틴은 캡슐화 제제로서 사용되는데 있어서 요구되는, 가요 특징을 갖는다. 본 발명의 유용한 가소제로서는 글리세린, 솔비탄, 솔비톨 또는 유사한 저 분자량 폴리올, 그리고 이들의 혼합물을 포함한다.
처음으로 제조되는 본 발명의 쉘은 가소제를 약 10~약 35%, 바람직하게는 약 10~약 25%, 그리고 가장 바람직하게는 약 10~약 20% 포함한다. 본 발명에 유용한 가소제는 글리세린이 바람직하다.
본 발명의 연질 젤라틴 쉘은 또한 필수 성분으로서 물을 포함하기도 한다. 이론에 국한되지 않을 때, 물은, 연질 젤라틴 쉘이 체내에서 맞닥뜨리게 되는 위장관 유체와 접촉할 때 상기 연질 젤라틴 쉘이 신속하게 용출되거나 분해되는 것을 돕는 것으로 생각된다.
처음으로 제조되는 본 발명의 쉘은 물을 약 15~약 50%, 더욱 바람직하게는 약 25~약 40%, 그리고 가장 바람직하게는 약 30~약 40% 포함한다.
연질 젤라틴 쉘에 혼입될 수 있는 기타 임의의 성분으로서는 발색제, 풍미제, 보존제, 항산화제, 에센스 및 기타 외관을 미적으로 향상시키는 성분을 포함한다.
본 발명의 용해된 약학 조성물은 적당한 기간 동안 실질적으로 조성물을 담을 수 있는 임의의 통상적인 연질 젤라틴 쉘 내에 캡슐화될 수 있다. 본 발명의 연질 젤라틴 쉘은, 균질한 용액이 생산될 때까지 약 65℃로 가열하면서, 적당량의 젤라틴, 물, 가소제 및 임의의 성분들을 적당한 용기 내에서 혼합하고, 흔들고/흔들거나 교반함으로써 제조될 수 있다. 이후, 이와 같은 연질 젤라틴 쉘 제제는 표준 캡슐화 방법을 사용하여 원하는 양의 용해된 충전 조성물을 캡슐화함으써, 하나의 조각으로 되어 있으며 밀폐 밀봉된 연질 젤라틴 캡슐을 생산하는데 사용될 수 있다. 젤라틴 캡슐은 원하는 모양과 크기를 가져서 용이하게 삼킬 수 있도록 제조된다. 본 발명의 연질 젤라틴 캡슐은 삼키기 용이한 크기를 가지며, 통상적으로는 약학 활성 조성물을 약 100∼약 2000㎎ 담는다. 연질 젤라틴 캡슐과 캡슐화 방법에 관하여는 본원에 그 자체로서 참고용으로 인용된 문헌[P.K.Wilkinson et al, "Softgels: Manufacturing Considerations", Drugs and the Pharmaceutical Sciences, 41 (Specialized Drug Delivery Systems), P. Tyle, Ed. (Marcel Dekker, Inc., New York, 1990) pp. 409-449; F. S. Horn et al, "Capsules, Soft" Encyclopedia of Pharmaceutical Technology, vol. 2, J. Swarbrick and J. C. Boylan, eds. (Marcel Dekker, Inc., New York, 1 990) pp. 269-284; M. S. Patel외 다수,"Advances in Softgel Formulation Technology", Manufacturing Chemist, vol. 60, no. 7, pp. 26-28 (July 1989); M. S. Patel외 다수, "Softgel Technology", Manufacturing Chemist, vol, 60, no. 8, pp. 47-49 (August 1989); R. F. Jimerson, "Softgel (Soft Gelatin Capsule) Update", Drug Development and Industrial Pharmacy (Interphex '86 Conference), vol. 12, no. 8 & 9, pp. 1133-1144 (1986); and W. R. Ebert, "Soft Elastic Gelatin Capsules: A Unique Dosage Form", Pharmaceutical Technology, vol. 1 , no. 5, pp. 44-50 (1977)]에 기술되어 있다. 생성된 연질 젤라틴 캡슐은 물과 위장관 유체 내에서 가용성이다. 캡슐을 삼킬 때, 젤라틴 쉘은 위장관 내에서 신속하게 용해 또는 분해되며, 이로서 약학 활성 성분은 생리학적 시스템에 도입된다.
경질 캡슐
또 다른 구체예에서, 본 발명의 단위 제형은 경질 캡슐(즉 전분 또는 젤라틴 경질 캡슐), 예를 들어 전분 캡슐, 예를 들어 캡슐겔(Capsulgel)사(사우스캐롤라이나 그린우드 소재)제 캐필(Capill)이다. 캡슐은 본 발명의 약학 조성물로 충전될 수 있다.
5. 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄여주는 방법
본 발명은 또한 환자 또는 피험체 내에서 미생물 감염을 치료 또는 예방하거나 미생물 감염의 위험을 줄여주는 방법을 제공한다. 이와 같은 방법들은, 본 발명의 캐리어를 적당한 투여량으로 포함하는 약학 조성물 또는 제제로서 본 발명에 따른 약학적 또는 예방적 유효량의 약학 활성 성분을 환자나 피험체에 투여하는 단계를 포함한다.
당업자는 약학 활성 성분의 적당한 투여량을 선택할 수 있다. 본 발명의 방법을 수행함에 있어서, 환자 또는 피험체 내 화합물의 혈중 또는 조직 중 수준은 충분한 시간 간격을 두고 적당한 수준으로 만들어질 것이 요망된다. 상기 언급된 바와 같이, 치료 효능을 제공하기 위해서는 일반적으로 환자에게 투여되는 항 미생물 제제의 혈류 또는 표적 장기 중 전신 농도를 특정 미생물 유기체 또는 유기체들이 표적화되는데 충분한 시간 동안 최소 억제 농도(즉 MIC) 이상으로 만드는 것이 요망된다.
본 발명의 약학 조성물은 환자 또는 피험체, 예를 들어 인간, 또는 인간 이외의 포유 동물 또는 기타 동물의 질환, 예를 들어 미생물 감염을 치료 또는 예방하거나 미생물 감염의 위험을 줄여주는데 유용하다. 본 발명의 방법은 본 발명에 따른 약학적 유효량 또는 예방적 유효량의 조성물을 투여하는 단계 또는 단계들을 포함한다. 미생물 감염 또는 치료 대상으로서는, 무엇보다도, 피부 감염, 폐렴(병원 내 감염 및 지역 사회 획득 폐렴), 바이러스 감염 후 폐렴, 복부 전염, 요로 감염, 균혈증, 패혈증, 심내막염, 방실 문합 감염, 혈관 통로 감염, 뇌수막염, 수술 예방(surgical prophylaxis), 복막 감염, 골 감염, 관절 감염, 메티실린 내성 스타필로코커스 아우레우스(Staphylococcus aureus) 감염, 반코마이신 내성 장내 구균 감염, 리네졸리드 내성 유기체 감염 및 결핵으로 이루어진 군으로부터 선택되는 것들을 포함한다.
본 발명의 방법과 함께 약리게놈학(즉 개체의 유전자형과 이 개체의 외래 화합물 또는 약물에 대한 반응 사이의 관계를 연구하는 분야)이 고려될 수 있다. 치료제의 대사상 차이로 인하여 약학적으로 활성인 약물의 투여량과 혈중 농도 간 관계가 바뀌게 되고, 이로서 심각한 독성을 유발할 수 있거나 또는 치료를 실패로 만들 수 있다. 그러므로 전문의 또는 임상의는 약물을 투여할지, 아니면 이 약물을 사용하는 치료법의 치료 계획 및/또는 약물의 투여량을 조절할지 여부를 결정함에 있어서 관련 약리게놈학 연구를 통해 얻어진 지식을 적용하는 것을 고려할 수 있다.
일반적으로 약학 활성 성분의 유효 투여량은 체중 1㎏당 1일에 약 0.1~약 100㎎, 더욱 바람직하게는 약 1.0∼약 50㎎일 것이다. 투여량은 또한 이와 같은 변인들, 예를 들어 치료, 예방 또는 그 위험성을 줄이고자 하는 질병 또는 병태, 환자의 전체적인 건강 상태, 황산 수소 염으로부터 전달되는 모 화합물의 상대적 생물 효능, 제형, 제형 중 부형제의 존재 여부 및 종류, 그리고 투여 경로에 따라서 달라질 수 있을 것이다. 뿐만 아니라, 초기 투여량은 신속하게 원하는 혈중 수준 또는 조직 내 수준에 도달하도록 만들기 위해 상한치 수준 이상으로 증가될 수 있다거나, 아니면 초기 투여량은 최적 투여량보다 적을 수 있다는 것이 이해될 것이다.
6.
실시예
정제
표준적 혼합 기술을 이용하여 정제 조성물을 제조하였다. 습식 및 건식 과립화 방법을 사용할 수 있었다. 본 발명에 유용한 정제는 과립 내 성분뿐만 아니라 과립 외 성분 둘 다를 포함할 수 있었으며, 이와 같은 성분들 중 일부는 하기 표에 제시된 과립 내 부분 및 과립 외 부분 둘 다에 사용될 수 있었다. 정제는 왁스, 젤라틴, 셸락 및 기타 적당한 재료로 추가 코팅될 수도 있었으며, 이 정제는 그것의 표면에 글씨가 인쇄되거나 연마될 수도 있었다. 하기 표에 제시된 모든 성분들의 함량은 달리 표시하지 않는 한 중량(㎎)을 기준으로 한 것이다.
| 실시예 1~5의 정제 | |||||
| 정제 1 | 정제 2 | 정제 3 | 정제 4 | 정제 5 | |
| 활성 약물1 | 541.6 | 541.6 | 541.6 | 541.6 | 541.6 |
| 유화제 | 70.002 | 70.003 | 115.002 | 75.003 | 85.002 |
| 하이드록시프로필 메틸셀룰로스 |
45.00 | 45.00 | -- | 45.00 | -- |
| 소듐 전분 글리콜레이트 | 45.00 | 45.00 | 45.00 | 45.00 | 45.00 |
| 만니톨 | 54.40 | 54.40 | 54.40 | 54.40 | 54.40 |
| 미세 결정질 셀룰로스 | 32.00 | 32.00 | 32.00 | 32.00 | 32.00 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.00 | 4.00 | 4.00 | 4.00 | 4.00 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 50/13 3: 겔루시어 44/14 |
|||||
상기 정제는 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 6~10의 정제 | |||||
| 정제 6 | 정제 7 | 정제 8 | 정제 9 | 정제 10 | |
| 활성 약물1 | 541.6 | 541.6 | 541.6 | 541.6 | 541.6 |
| 유화제 | 70.002 | 70.003 | 80.002 | 65.003 | 110.002 |
| 하이드록시프로필 메틸셀룰로스 |
35.00 | 35.00 | -- | 45.00 | -- |
| 소듐 전분 글리콜레이트 | 35.00 | 35.00 | 35.00 | 45.00 | 50.00 |
| 만니톨 | 54.40 | 54.40 | 54.40 | 54.40 | 54.40 |
| 미세 결정질 셀룰로스 | 32.00 | 32.00 | 32.00 | 32.00 | 32.00 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.00 | 4.00 | 4.00 | 4.00 | 4.00 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 50/13 3: 겔루시어 44/14 |
|||||
상기 정제는 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 11~15의 정제 | |||||
| 정제 11 | 정제 12 | 정제 13 | 정제 14 | 정제 15 | |
| 활성 약물1 | 541.6 | 541.6 | 541.1 | 541.6 | 541.1 |
| 유화제 | 80.002 | 80.003 | 120.002 | 85.003 | 90.002 |
| 하이드록시프로필 메틸셀룰로스 |
40.00 | 40.00 | -- | 40.00 | -- |
| 소듐 전분 글리콜레이트 | 40.00 | 40.00 | 40.00 | 40.00 | 40.00 |
| 만니톨 | 54.40 | 54.40 | 54.40 | 54.40 | 54.40 |
| 미세 결정질 셀룰로스 | 32.00 | 32.00 | 32.00 | 32.00 | 32.00 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.00 | 4.00 | 4.00 | 4.00 | 4.00 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 50/13 3: 겔루시어 44/14 |
|||||
상기 정제는 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 16~20의 정제 | |||||
| 정제 16 | 정제 17 | 정제 18 | 정제 19 | 정제 20 | |
| 활성 약물1 | 541.6 | 541.6 | 541.1 | 541.6 | 541.1 |
| 유화제 | 60.002 | 60.003 | 75.002 | 75.003 | 120.002 |
| 하이드록시프로필 메틸셀룰로스 |
40.00 | 40.00 | -- | 40.00 | -- |
| 소듐 전분 글리콜레이트 | 40.00 | 40.00 | 40.00 | 40.00 | 40.00 |
| 만니톨 | 54.40 | 54.40 | 54.40 | 54.40 | 54.40 |
| 미세 결정질 셀룰로스 | 32.00 | 32.00 | 32.00 | 32.00 | 32.00 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.00 | 4.00 | 4.00 | 4.00 | 4.00 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 50/13 3: 겔루시어 44/14 |
|||||
상기 정제는 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
캡슐
표준 혼합 기술을 이용하여 캡슐 조성물을 제조하였다. 젤라틴 캡슐, 예를 들어 연질 젤라틴 캡슐 또는 경질 2조각 젤라틴 캡슐 또는 전분 캡슐 내에 로딩될 과립화 성분을 만드는데 습식 및 건식 과립화 방법을 사용할 수 있었다. 모든 성분들의 함량은 캡슐 1개당 중량(㎎)을 기준으로 한 것이다.
| 실시예 1~5의 캡슐 | |||||
| 캡슐 1 | 캡슐 2 | 캡슐 3 | 캡슐 4 | 캡슐 5 | |
| 활성 약물1 | 324.93 | 324.93 | 324.93 | 324.93 | 324.93 |
| 유화제 | 65.002 | 125.002 | 65.002 | 65.002 | 65.002 |
| 포비돈 | -- | -- | 25.00 | 20.00 | 55.00 |
| 하이드록시프로필메틸 셀룰로스 |
31.00 | -- | -- | 15.00 | -- |
| 소듐 전분 글리콜레이트 | 30.00 | 25.00 | 30.00 | 30.00 | 30.00 |
| 만니톨 | 78.00 | 66.00 | 78.00 | 78.00 | 63.00 |
| 미세 결정질 셀룰로스 | 58.57 | 46.57 | 64.57 | 64.57 | 49.57 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.50 | 4.50 | 4.50 | 4.50 | 4.50 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 44/14 |
|||||
상기 캡슐은 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 6~10의 캡슐 | |||||
| 캡슐 6 | 캡슐 7 | 캡슐 8 | 캡슐 9 | 캡슐 10 | |
| 활성 약물1 | 324.93 | 324.93 | 324.93 | 324.93 | 324.93 |
| 유화제 | 55.002 | 55.003 | 115.003 | 55.003 | 55.003 |
| 포비돈 | 30.00 | -- | -- | 35.00 | 15.00 |
| 하이드록시프로필메틸 셀룰로스 |
-- | 36.00 | -- | -- | 20.00 |
| 소듐 전분 글리콜레이트 | 35.00 | 35.00 | 35.00 | 30.00 | 30.00 |
| 만니톨 | 78.00 | 78.00 | 66.00 | 78.00 | 78.00 |
| 미세 결정질 셀룰로스 | 64.57 | 58.57 | 46.57 | 64.57 | 64.57 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.50 | 4.50 | 4.50 | 4.50 | 4.50 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 44/14 3: 겔루시어 50/13 |
|||||
상기 캡슐은 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 11~15의 캡슐 | |||||
| 캡슐 11 | 캡슐 12 | 캡슐 13 | 캡슐 14 | 캡슐 15 | |
| 활성 약물1 | 324.93 | 324.93 | 324.93 | 324.93 | 324.93 |
| 유화제 | 60.002 | 120.002 | 60.002 | 60.002 | 60.002 |
| 포비돈 | -- | -- | 30.00 | 15.00 | 60.00 |
| 하이드록시프로필메틸 셀룰로스 |
36.00 | -- | -- | 15.00 | -- |
| 소듐 전분 글리콜레이트 | 30.00 | 30.00 | 30.00 | 30.00 | 30.00 |
| 만니톨 | 78.00 | 66.00 | 78.00 | 78.00 | 63.00 |
| 미세 결정질 셀룰로스 | 58.57 | 46.57 | 64.57 | 64.57 | 49.57 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.50 | 4.50 | 4.50 | 4.50 | 4.50 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 44/14 |
|||||
상기 캡슐은 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
| 실시예 16~20의 캡슐 | |||||
| 캡슐 16 | 캡슐 17 | 캡슐 18 | 캡슐 19 | 캡슐 20 | |
| 활성 약물1 | 324.93 | 324.93 | 324.93 | 324.93 | 324.93 |
| 유화제 | 60.002 | 60.003 | 120.003 | 60.003 | 60.003 |
| 포비돈 | 30.00 | -- | -- | 30.00 | 15.00 |
| 하이드록시프로필메틸 셀룰로스 |
-- | 36.00 | -- | -- | 15.00 |
| 소듐 전분 글리콜레이트 | 30.00 | 30.00 | 30.00 | 30.00 | 30.00 |
| 만니톨 | 78.00 | 78.00 | 66.00 | 78.00 | 78.00 |
| 미세 결정질 셀룰로스 | 64.57 | 58.57 | 46.57 | 64.57 | 64.57 |
| 흄드 실리카 | 8.00 | 8.00 | 8.00 | 8.00 | 8.00 |
| 스테아르산 마그네슘 | 4.50 | 4.50 | 4.50 | 4.50 | 4.50 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염 2: 겔루시어 44/14 3: 겔루시어 50/13 |
|||||
상기 캡슐은 미생물 감염을 치료 또는 예방하거나, 미생물 감염의 위험을 줄이기 위해 환자 또는 피험체에 투여하는데 유용하였다.
연질 젤라틴 캡슐
연질 젤라틴 혼합물을 처음에 다음과 같은 성분들로 제조하였다.
성분
중량%
젤라틴 47.00
글리세린 15.00
물 QS 100
상기 성분들을 적당한 용기 내에 모두 담은 후 이를 혼합하면서 약 65℃에서 가열하여 균일한 용액을 제조하였다. 표준 캡슐화 방법을 이용하여 제조된 용액을 사용함으로써, 상기 캡슐 1~20의 조성물을 약 600㎎ 담고 있는 연질 젤라틴 캡슐을 제조하였다. 제조된 연질 젤라틴 캡슐은 경구 투여용으로 적당하였다.
경질 젤라틴 캡슐
경질 젤라틴 캡슐을 임의의 상업적 공급처로부터 구입하였다. 캡슐에 상기 캡슐 1~20의 조성물 약 600㎎을 수동식으로 충전하거나, 아니면 캡슐 충전 기계로 충전하였다. 제조된 경질 젤라틴 캡슐은 경구 투여용으로 적당하였다.
| 실시예 1의 경구 투여용 고체 제제 조성물 | |
| 경구 투여용 고체 제제 | |
| 활성 약물1 | 162.51 |
| 푸마르산 | 75.00 |
| 타르타르산 | 75.00 |
| 소듐 전분 글리콜레이트 | 0~25.00 |
| 폴리덱스트로스 | 25.00 |
| 글루시어 44/14 | 25~50.00 |
| 시클로덱스트린(카비트론 하이드록시프로필-β-시클로덱스트린) | 0~125.00 |
| 만니톨 | 50~100 |
| 정제수2 | |
| 콜로이드성 이산화실리콘 | 4.00 |
| 스테아르산 마그네슘 | 3.50 |
| 장용 필름 코팅 | 0~100 |
| 1: N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4- 일메틸)-아미노]-메틸}-비페닐-4-일)-2- 옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 모노하이드로클로라이드 염. 162㎎은 유리 염기 150㎎에 해당함. 2: 정제수는 과립화 제제로 사용되었으며, 건조 공정에서 제거되었다. |
|
상기 성분들을 표준 습식 과립화 방법을 이용하여 합함으로써 정제를 제조하였으며, 이후, 상기 정제를 임의로 장용 코팅하였다. 제조된 조성물은 경구 투여용으로 적당하였다.
실시예
- 모의 위장관계 내 용출 테스트
A. 위장관계를 모의하는, 수행이 용이한 2단계 용출법 개발
용출 및 현미경적 방법을 이용하여 공통 이온 효과를 연구하였다. 현미경적 방법은 염화나트륨 존재 및 부재하에 물, pH 1.2, pH 4 및 pH 6.5인 완충액에 현탁된 약물로 수행하였다. 다음과 같은 완충액들을 사용하는 3가지의 상이한 2단계 용출법을 이용하여 약물의 용출 및 이의 과립화를 연구하였다: 방법 #1: pH 4에서 0~30분 및 pH 6.5에서 30~90분의 단순 2단계 완충액. 방법 #2: 2단계 모두 염소 이온 존재하 단순 2단계 완충액. 방법 #3: pH 4에서 염소 이온 존재하에 0~30분 단순 완충액, 및 pH 6.5에서 30~90분의, 담즙산 염 및 계면활성제가 있는 완충액. 2 단계는 각각 급식 위 및 내장 조건을 나타낸다.
현미경 관찰을 통하여, 약물은 염소 이온이 존재할 때 응집체를 형성한다는 것이 확인되었다. 예상 외로, 대안적 비 염화물 염(순수 약물)은 크기가 더욱 큰 응집체로 회합되었다. 그러므로, 공통 이온 효과와 위장관 조건 둘 다를 설명하는 용출법을 연구하였다. 그 결과를 통하여, 염소 이온이 존재할 때의 단순 완충액은 가장 분석력이 뛰어난 용출 매질이었음이 확인되었다. 동일한 제형에 있어서, 용출률은 다음과 같은 순서로 측정되었다: 염화나트륨 부재의 2단계 단순 완충액 > 담즙산 염 및 계면활성제가 있는 2단계 > 염화나트륨이 있는 단순 완충액. 염화나트륨을 포함하는 단순 완충액 시스템을 사용할 경우 스크린 제제는, 공통 이온 효과가 감소함과 동시에 가장 많은 과포화를 유도할 수 있었다. 한편, 염소 이온을 포함하지 않는 단순 완충액 시스템은 염화물 Ksp가 낮은 약물의 제제들을 구별하기 충분한 능력을 제공하지 않았다.
염화나트륨이 존재한 단순 완충액을 사용하는 2단계 용출법은, 담즙산 염과 계면활성제를 포함하는 통상의 2단계 용출 시스템에 대한, 수행이 용이한 대안이었다. 이와 같은 매질 중 용출은, 수중 용해도가 마이크로그램 미만인 고 함량 하이드로클로라이드 염 약물의 제제에 대한 과포화 및 공통 이온 효과를 연구할 수 있도록 하였다.
B. 과포화를 이루기 위한 제제화 접근법
낮은 수중 용해도와 공통 이온 효과를 극복하고, 용해도가 마이크로그램 미만인 약물에 대하여 과포화를 이루기 위한 제제화 접근법을 분석하였다.
약물 화합물을 다양한 부형제 혼합물을 사용하여 과립화하였다. 2단계 용출법(염화 나트륨의 존재 하 및 부재 하에서 pH 4, 0~30분 및 pH 6.5, 30~90분)을 이용하여 약물 물질과 과립화를 연구하였다.
위장관 모의 시스템 내에서 수행된 용출 실험의 데이터를 통하여, 상대적 용해도가 낮은 pH 개질제는, 용해도가 높은 pH 개질제보다 용출을 훨씬 많이 향상시켰음을 알 수 있었다. 또한, 이 데이터를 통하여, 제제화 용으로서 선택된 중합체 및 임의의 계면활성제는 과포화를 더욱 심화시켰고 염화물로 인한 공통 이온 효과는 감소시켰음도 알 수 있었다. 제제화에 통상의 수용성 부형제를 사용함으로써 가공성 이외에도 용출을 향상시켰다. 대안적인 비 염화물 염은 산성 매질 중 용해도를 유의적으로 증가시켰음에도 불구, 순수한 비 염화물 염의 용출은 염화물 염의 용출과 유사하였다. 현미경 관찰을 통하여, 염소 이온이 존재할 때 비 염화물 염은 응집체로 생성되었음을 알 수 있었다. 그러나, 선택된 부형제를 이용하여 제제화되었을 때, 비 염화물 염의 이점은 용출시 드러났다.
용해도가 낮은 염기성 약물의 용출 및 생체 이용도는, 선택된 pH 개질제, 계면활성제 및 중합체를 사용함으로써 향상될 수 있었다. 대안적인 염이 최적화된 부형제와 함께 제제화될 때, 이 염도 용출을 증가시킬 수 있었다. 위장관계와 공통 이온 효과 둘 다를 다루는 용출법을 선택하는 것은 최대로 노출시킬 제제를 선택하는데 있어서 중요하였다.
C. 모의 위장관계 내 약물의 2단계 용출 테스트에 관한 연구
과포화시키기 위한 제제를 스크리닝하는 단순 2단계 용출법을 개발하기 위함.
수 불용성 약물의 하이드로클로라이드 염의 용출에 대한 염화나트륨의 영향력을 관찰하기 위함.
급식 GI pH 조건들 하에서의 제제들을 구별하기 위함.
생체 내 및 시험관 내 용출 시스템 연관성에 관하여 연구하기 위함.
통상의 2단계 용출 시스템은 사용시 시간이 많이 소요되고 때로는 제제 스크리닝에 충분할 정도로 우수한 성능을 갖지 않는 담즙산 염과 계면활성제를 사용한다.
본 실험의 목적은, 담즙산 염과 계면활성제를 사용하지 않고 위장관 내 pH 수치와 공통 이온 효과를 모의하는, 수행이 용이한 2단계 용출법을 개발하기 위한 것이다.
수 불용성 화합물의 하이드로클로라이드 염은 공통 이온 효과를 나타낸다는 사실은 잘 알려져 있다. 그러므로, 공통 이온 효과를 모의하기 위해서 염화나트륨을 용출 완충액에 첨가하였다.
수 불용성 약물의 하이드로클로라이드 염을 다음과 같은 생물 약제학적 특성을 가지는 표준 화합물로서 선택하였다.
- pKa = 6.8 및 9.4;
- logP = 0.7;
- 고유 용해도 = 0.01㎎/㎖ (pH 6.8);
- 수중 염의 용해도:
2.6, 0.2 및 0.06㎎/㎖ (pH 각각 4, 5.4 및 6.5);
- 카코(Caco)-2 투과도 = 0.5 × 10-6㎝/s;
- 원숭이 경구 생체 이용도 = 투여량 20㎎/㎏의 경우 15%
- 긍정적인 식효(4×).
| 위장관계의 pH 와 용출 매질의 pH | ||
| 위내 pH | 장내 pH | |
| 공복시 | pH 1.7 BC: 7~18 mM/pH |
pH 6.2 BC: 5.6mM/pH |
| 급식시 | pH 4(평균): 6.4(주입시)~2.7(3.5시간 경과시) BC: 14~28 mM/pH |
pH 5.4(4시간 동안) BC: 18~30 mM/pH |
| 출처: Dressman:Pharmaceutical Research, p165-176, vol23, No.1, Jan.2006 BC = 완충능 |
||
제제의 제조
벌크한 약물 분말을 부형제 존재 하 및 부재 하에서 습식 과립화하였다. 과립을 건조한 후 #18 메쉬 스크린을 사용하여 크기별로 분류하였다.
편광 현미경 관찰
염화 나트륨의 존재 하 및 부재 하에서 물과 완충액(pH 1.2, 4 및 6.5인 완충액)에 현탁된 약물을 사용하여 현미경 테스트를 수행하였다.
용출 테스트
4개의 용출 매질을 테스트하였다. 이 테스트 결과들을 도 3~7에 꺾은 선 그래프의 형태로 나타내었다. 벌크한 약물 분말을 부형제 존재 하 및 부재 하에서 습식 과립화하였다. 과립을 건조한 후 #18 메쉬 스크린을 사용하여 크기별로 분류하였다. 4개의 상이한 2단계 용출법을 수행하여 약물의 용출과 약물 과립화에 대해 연구하였다. 방법 1: 2단계 용출 테스트(제1 용출 단계에서는 pH 4.0인 완충액을 0~30분 동안 사용하였으며, 제2 용출 단계에서는 pH 5.4인 완충액을 30~90분 동안 사용하였다(하부 우측 패널)). 방법 2: 2단계 용출 테스트(제1 용출 단계에서는 pH 4.0인 완충액을 0~30분 동안 사용하였으며, 제2 용출 단계에서는 pH 6.5인 완충액을 30~90분 동안 사용하였다(상부 우측 패널)). 방법 3: 방법 2의 2단계 용출 테스트와 동일하되, 다만 2개의 단계 모두에서 사용한 완충액은 염소 이온을 포함하였음. 방법 4: 방법 2의 2단계 용출 테스트와 동일하되, 다만 제1 용출 단계에서는 pH 4.0인 완충액(염소 이온 포함)을 0~30분 동안 사용하였으며, 제2 용출 단계에서는 pH 6.5인 완충액(염소 이온, 담즙산 염 및 계면활성제 포함)을 30~90분 동안 사용하였다. 상기 2개의 단계들은 각각 공급시 위 및 소장 환경을 나타내는 것이다. 장내 pH(문헌 참조)에 관하여는 문헌[Dressman, Pharmaceutical Research, 23(1): 165-176 (2006)(표 10에 제시된 바와 같음)]에 개시되어 있다. 상기 4개의 방법을 하기 표 11에 나열하였다.
| 테스트된 4가지 2단계 용출법(결과는 도 3~7에 도시됨) | ||
| # | 0~30분 | 30~90분 |
| 1 | pH 4 아세테이트 완충액(100mM) | pH 5.4 (pH 6.4 포스페이트 완충액 50mM 첨가) |
| 2 | pH 4 아세테이트 완충액(100mM) | pH 6.5 (pH 7.0 포스페이트 완충액 50mM 첨가) |
| 3 | pH 4 아세테이트 완충액(100mM) + 0.9% NaCl |
pH 6.5 + 0.9% NaCl (pH 7.0 포스페이트 완충액 50mM 첨가) |
| 4 | pH 4 아세테이트 완충액(100mM) + 0.9% NaCl |
pH 6.5 + KCl + 타우로콜레이트 및 레시틴 (염화칼륨, 타우로콜레이트 및 레시틴을 포함하는 포스페이트 완충액 50mM 첨가) |
본 연구의 결과를 도 3~7에 나타내었다. 도 3은 표 11에 제시된 방법 1에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다(상기 참조). RX-약물의 용출을 pH 4.0인 완충액 중에서 0~30분 동안 테스트한 후, 다시 상기 약물을 pH 5.4인 완충액으로 옮겨 30~90분 동안 테스트하였다. 상기 2개의 조건은 약물 물질(도시하지 않음) 이외의 제제들(A~C) 간에 다르지 않았다.
도 4는 표 11에 제시된 방법 2에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다(상기 참조). RX-약물의 용출을 pH4.0인 완충액 중에서 0~30분 동안 테스트한 후, 다시 상기 약물을 pH 6.5인 완충액으로 옮겨 30~90분 동안 테스트하였다. 산도 조절제를 포함하는 제제 A 및 B로부터 약물이 용해되어 나오는 비율(%)은 대조군의 그것보다 6~8배 높았다. 그러나, 용출은 공통 이온 효과를 해결해줄 수 없었을 뿐만 아니라, 산성화된 제제(중합체 분산제를 포함하는 것과 포함하지 않는 것)를 구별할 수도 없었다.
도 5는 표 11에 제시된 방법 3에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다(상기 참조). RX-약물의 용출을 pH 4.0인 완충액 중에서 0~30분 동안 테스트한 후, 다시 상기 약물을 pH 6.5인 완충액으로 옮겨 30~90분 동안 테스트하였다. 상기 완충액은 둘 다 0.9% NaCl을 포함하였다. 0.9% NaCl을 사용하는 2단계 용출 실험은 공통 이온 효과를 모의하는데 사용되었다. 방법 3은 결과가 더욱 우수하였으며, 제제 A의 방출을 50%까지 감소시켰다(공통 이온 효과에 의함). 한편, 겔루시어 및 결정화 지연제를 포함하는 제제 C의 용출은 유의적으로 증가하였으나, 다만 겔루시어 및 결합제 이외에 산도 조절제를 함유하는 제제 A의 용출에는 미치지 못하였다.
도 6은 표 11에 제시된 방법 4에 따라서 수행된 2단계 용출 테스트 결과를 도시한 것이다(상기 참조). RX-약물의 용출을 pH 4.0인 완충액(NaCl 함유) 중에서 0~30분 동안 테스트한 후, 다시 상기 약물을 pH 6.5인 완충액(담즙산 염, 계면활성제 및 KCl 함유)으로 옮겨 30~90분 동안 테스트하였다. 방법 4는, 방법 3을 수행하였을 때 관찰되었던 결과와 유사한 결과(순위 순서(rank order))를 보였다[도 5: 담즙산 염과 계면활성제를 포함하지 않는 경우].
도 7은 비글 개(n = 3)를 대상으로 수행된, RX-약물 제제의 PK 프로필을 도시한 것이다. 개를 제제 C보다 제제 A에 더 많이 노출시켰는데, 이는 용출법 C의 조건(본 발명의 명세서 중에 기술됨)과 일치하는 조건이었다. 표에는 Cmax, Tmax, T1 /2 및 AUC 수치가 나열되어 있다.
염화나트륨을 포함하는 단순 완충액을 사용하는 2단계 용출법은 담즙산 염과 계면활성제를 포함하는 통상의 2단계 용출 시스템에 대한, 수행이 용이한 대안을 제공하였다. 이와 같은 매질 중 용출은, 수중 용해도가 마이크로그램 수준 미만인 고 함량 하이드로클로라이드 염 약물의 제제에 대한 과포화 및 공통 이온 효과를 연구할 수 있도록 해 주었다. 표준 화합물을 개에 노출시키는 것은 용출 결과를 분석하고자 하는 것이었다. 한편, 염소 이온을 포함하지 않는 단순 완충액 시스템은 염화물 Ksp가 낮은 약물 제제들을 구별하지 못하였다. 담즙산 염과 계면활성제를 사용하는 용출 실험은 제제의 순위 순서를 구별하기에 충분하지 않았다.
또한, 본 연구의 결과를 통하여는, 제제에 중합체와 계면활성제를 혼입하면 2개의 pH 매질 중에서 표준 화합물, 염기성 염의 용출 및 과포화 정도가 효율적으로 향상되었다는 것을 알 수 있었다. 중합체 및 계면활성제 이외에 pH 개질제를 혼입하면 화합물의 용출/과포화 및 생체 내 노출을 더욱 향상시켰다.
개의 생체 내 연구
비글 개(wt = 12㎏, n = 3)를 사용하여 개의 생체 내 연구를 수행하였다. 개를 굶긴 상태에서 개에 약물 150㎎을 경구 투여하였다. 혈장 샘플을 연속으로 수집하여, 추출한 다음, LC/MS/MS로 분석하였다. Cmax 및 AUC를 산정하여 상이한 제제들에 전신이 노출되었을 때의 결과를 평가하였다. 물과 0.1N HCl 중에서 RX-약물 (N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2-옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드)의 편광 현미경 분석을 수행하였다. 물, pH 1.2인 완충액, pH 4.0인 완충액 및 pH 6.5인 완충액(염화나트륨 포함 또는 불포함) 중 현탁된 약물을 사용하여 현미경 방법을 수행하였다. 제조후 약 30분 경과시에 사진을 촬영하였다. 현미경 분석 결과, 염소 이온이 존재할 때 약물은 응집체로 생성되었음을 알 수 있었다(좌측 패널). 도 2는 염소 이온이 존재할 때 약물 응집체의 현미경 이미지를 도시한 것이다.
인용 문헌의 원용
본원에서 참조된 정정된 특허증, 특허 출원 서류, 과학 논문, 정부 보고서, 웹사이트 및 기타 참고 문헌들을 비롯한, 특허 서류 각각의 전체 개시 사항은 전반적으로 모든 목적을 위하여 원용된다.
균등물
본 발명은, 본 발명의 사상과 본질적인 특징들로부터 벗어나지 않고 기타 구체적인 형태로서 구현될 수 있다. 그러므로 전술한 구체예들은 본원에 기술된 본 발명을 제한하기보다는 본 발명을 모든 측면에서 예시하는 것으로 간주될 것이다. 그러므로 본 발명의 범위는 전술한 발명의 상세한 설명에 의해서 보다는 첨부된 특허 청구 범위의 청구항들에 의해 특정되며, 상세한 설명 중 의미를 정의하는 부분과 특허 청구 범위의 균등 범위 내에 속하는 모든 변화는 본 발명의 범위에 포함될 것이다.
Claims (30)
- 유화제를 포함하는 약학 캐리어.
- 제1항에 있어서, 중합체 용출 조제를 추가로 포함하는 것인 약학 캐리어.
- 제1항 또는 제2항의 약학 캐리어를 포함하는 약학 조성물.
- 제1항 내지 제3항 중 어느 하나의 항에 있어서, 상기 유화제는 폴리글리콜화된 글리세라이드인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제4항 중 어느 하나의 항에 있어서, 상기 유화제는 라브라필(Labrafil), 라브로솔(Labrosol) 및 겔루시어(Gelucire)로 이루어진 군으로부터 선택되는 것인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제5항 중 어느 하나의 항에 있어서, 상기 유화제는 겔루시어 50/13, 겔루시어 44/14 및 이들의 혼합물로 이루어진 군으로부터 선택되는 것인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제6항 중 어느 하나의 항에 있어서, 상기 중합체 용출 조제는 1-에테닐-2-피롤리디논의 중합체; 폴리아민 N-옥사이드 중합체; N-비닐피롤리돈 및 N-비닐이미다졸의 공중합체; 폴리비닐옥사졸리돈 및 폴리비닐이미다졸 또는 이들의 혼합물로 이루어진 군으로부터 선택되는 것인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제7항 중 어느 하나의 항에 있어서, 상기 중합체 용출 조제는 1-에테닐-2-피롤리디논의 중합체인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제8항 중 어느 하나의 항에 있어서, 상기 중합체 용출 조제는 폴리비닐피롤리돈인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제9항 중 어느 하나의 항에 있어서, 결합제, 충전제, 분산제, 습윤제, 붕해제 또는 윤활제를 추가로 포함하는 것인 약학 캐리어 또는 약학 조성물.
- 제1항 내지 제10항 중 어느 하나의 항에 있어서, 물, 비수성 용매, 코팅, 캡슐 쉘, 착색제, 풍미제, 보존제, 항산화제, 조미료, 압축 조제 및 계면활성제로 이루어진 군으로부터 선택되는 하나 이상의 성분을 추가로 포함하는 것인 약학 캐리어 또는 약학 조성물.
- 제3항 내지 제11항 중 어느 하나의 항에 있어서, 정제의 형태인 약학 조성물.
- 제3항 내지 제11항 중 어느 하나의 항에 있어서, 캡슐의 형태인 약학 조성물.
- 제3항 내지 제13항 중 어느 하나의 항에 있어서, 상기 약학 활성 성분(pharmaceutical active)은 항 미생물 제제인 약학 조성물.
- 제3항 내지 제14항 중 어느 하나의 항에 있어서, 상기 항 미생물 제제는 옥사졸리디논(예를 들어 리네졸리드, 에페레졸리드, N-[3-(2-플루오로-4'-{[(3H-[1,2,3]트리아졸-4-일메틸)-아미노]-메틸}-비페닐-4-일)-2-옥소-옥사졸리딘-5-(S)-일메틸]-아세타미드 및 기타 옥사졸리디논), 매크롤리드, 케톨리드, 스트렙토그라민 A군, 스트렙토그라민 B군, 클로람페니콜 및 클로람페니콜 유도체, 플루오르페니콜 및 플루오르페니콜 유도체, 글리코펩티드, 플루로뮤틸린, 아미노글리코시드, 베타-락탐 및 카바페넴(7-아실화 이미다졸[5,1-b]티아졸-2-일 기가 C-2 위치의 카바페넴 부분에 직접 결합되어 있는 카바페넴 포함), 세팔로스포린, 린코사미드, 퀴놀론 및 플루오로퀴놀론(피리돈카복실산 유도체, 가레녹사신, 가티플록사신, 게미플록사신, 레보플록사신 및 목시플록사신 포함), 벤조헤테로시클릭 화합물, 아미노메틸시클린 화합물, 달바반신, 답토마이신, 오리타반신, 및 텔레반신, 또는 이들의 약학적으로 허용 가능한 염, 에스테르 또는 전구 약물, 또는 이들의 혼합물로 이루어진 군으로부터 선택되는 것인 약학 조성물.
- 제3항 내지 제15항 중 어느 하나의 항에 있어서, 상기 항 미생물 제제는 옥사졸리디논인 약학 조성물.
- 제3항 내지 제17항 중 어느 하나의 항의 약학적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 치료하는 방법.
- 제3항 내지 제17항 중 어느 하나의 항의 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 예방하는 방법.
- 제3항 내지 제17항 중 어느 하나의 항의 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염 위험을 줄이는 방법.
- 제3항 내지 제17항 중 어느 하나의 항에 있어서, 환자의 미생물 감염을 치료하기 위한 것인 약학 조성물.
- 제3항 내지 제17항 중 어느 하나의 항에 있어서, 환자의 미생물 감염을 예방하기 위한 것인 약학 조성물.
- 제3항 내지 제17항 중 어느 하나의 항에 있어서, 환자의 미생물 감염의 위험을 줄이기 위한 것인 약학 조성물.
- 환자에 약학적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 치료하기 위한, 제3항 내지 제17항 중 어느 하나의 항의 약학 조성물의 제조에서 항생 화합물의 용도.
- 환자에 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염을 예방하기 위한, 제3항 내지 제17항 중 어느 하나의 항의 약학 조성물의 제조에서 항생 화합물의 용도.
- 환자에 예방적 유효량의 약학 조성물을 투여하는 것을 포함하는, 환자의 미생물 감염의 위험을 줄이기 위한, 제3항 내지 제17항 중 어느 하나의 항의 약학 조성물의 제조에서 항생 화합물의 용도.
- 제18항 내지 제26항 중 어느 하나의 항에 있어서, 상기 환자는 포유 동물 또는 가축인 방법, 조성물 또는 용도.
- 제18항 내지 제27항 중 어느 하나의 항에 있어서, 상기 환자는 인간인 방법, 조성물 또는 용도.
- 제1항 내지 제28항 중 어느 하나의 항에 있어서, 상기 조성물은 대조 조성물에 비하여 2단계 용출 테스트 시스템에서 5% 이상의 용출 향상을 제공하는 것인 방법, 조성물 또는 용도.
- 제29항에 있어서, 상기 2단계 용출 시스템은, 제1 단계에서, pH 약 4의 모의 위 환경에서 30분 이하의 기간 동안 용출을 측정한 후, 제2 단계에서, pH 약 5.4~약 6.5의 모의 위 환경에서 약 60분 이하의 기간 동안 용출을 측정하는 단계를 포함하는 것인 방법, 조성물 또는 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US40883010P | 2010-11-01 | 2010-11-01 | |
| US61/408,830 | 2010-11-01 | ||
| PCT/US2011/058743 WO2012061360A2 (en) | 2010-11-01 | 2011-11-01 | Pharmaceutical compositions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140022773A true KR20140022773A (ko) | 2014-02-25 |
Family
ID=46025057
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137013955A KR20140022773A (ko) | 2010-11-01 | 2011-11-01 | 약학 조성물 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US9409896B2 (ko) |
| EP (1) | EP2635307B1 (ko) |
| JP (1) | JP5902188B2 (ko) |
| KR (1) | KR20140022773A (ko) |
| CN (1) | CN103379917B (ko) |
| AU (1) | AU2011323594C1 (ko) |
| BR (1) | BR112013010714A2 (ko) |
| CA (1) | CA2816077C (ko) |
| EA (1) | EA028054B1 (ko) |
| ES (1) | ES2824898T3 (ko) |
| HU (1) | HUE051133T2 (ko) |
| IL (1) | IL225952A0 (ko) |
| MX (1) | MX359366B (ko) |
| NZ (1) | NZ609964A (ko) |
| PT (1) | PT2635307T (ko) |
| SG (2) | SG190117A1 (ko) |
| UA (1) | UA114469C2 (ko) |
| WO (1) | WO2012061360A2 (ko) |
| ZA (1) | ZA201303177B (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108785654A (zh) | 2009-11-23 | 2018-11-13 | 丘比斯特制药有限责任公司 | 脂肽组合物和相关方法 |
| EA027791B1 (ru) | 2010-11-24 | 2017-09-29 | Мелинта Терапьютикс, Инк. | Фармацевтические композиции |
| CN104364240B (zh) * | 2012-06-08 | 2017-02-22 | 四川贝力克生物技术有限责任公司 | 一种用于预防或治疗分支杆菌疾病的药物 |
| RU2019118984A (ru) | 2014-01-10 | 2019-08-06 | Анаптисбайо, Инк. | Антитела, направленные против интерлейкина-33 (il-33) |
| EP4058020A4 (en) * | 2019-12-26 | 2023-04-12 | Santa Farma Ilaç Sanayi A.S. | SOLID ORAL PHARMACEUTICAL GEMIFLOXACIN MESYLATE COMPOSITION WITH IMPROVED RELEASE PATTERN AND DISEASE MECHANISM |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TR199802424T2 (xx) | 1996-05-24 | 1999-03-22 | Schering Corporation | Biyo-temin-edilebilirli�i artt�r�lm�� mantara-kar�� bile�im. |
| CN1207895A (zh) * | 1997-08-12 | 1999-02-17 | 陕西省西安制药厂 | 一种克拉霉素胶囊 |
| DE69811233T2 (de) | 1997-10-27 | 2003-11-20 | Merck Patent Gmbh | Feste lösungen und dispersionen von eines schlecht wasserlöslichen wirkstoffes |
| GB2331458B (en) * | 1997-11-21 | 2002-07-31 | Gursharan Singh Moonga | Solubilising systems for difficult pharmaceutical actives for preparing concentrated stable solutions for encapsulation into soft gelatine |
| KR19990080453A (ko) * | 1998-04-17 | 1999-11-05 | 성재갑 | 비가역성 hiv 프로테아제 억제제를 함유하는 약제학적 조성물 |
| US7374779B2 (en) * | 1999-02-26 | 2008-05-20 | Lipocine, Inc. | Pharmaceutical formulations and systems for improved absorption and multistage release of active agents |
| US20030180352A1 (en) * | 1999-11-23 | 2003-09-25 | Patel Mahesh V. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US7527807B2 (en) * | 2000-06-21 | 2009-05-05 | Cubist Pharmaceuticals, Inc. | Compositions and methods for increasing the oral absorption of antimicrobials |
| US6696426B2 (en) * | 2000-08-22 | 2004-02-24 | Pharmacia Corporation | Preservative free ophthalmic oxazolidinone antibiotic drug delivery systems |
| US20020119196A1 (en) | 2000-12-21 | 2002-08-29 | Narendra Parikh | Texture masked particles containing an active ingredient |
| JP4570357B2 (ja) * | 2001-07-06 | 2010-10-27 | ライフサイクル ファーマ エー/エス | 制御された凝集 |
| US7842791B2 (en) * | 2002-12-19 | 2010-11-30 | Nancy Jean Britten | Dispersible pharmaceutical compositions |
| CN100457742C (zh) * | 2003-06-03 | 2009-02-04 | 瑞伯-X医药品有限公司 | 联芳基杂环化合物的制备和用途 |
| EP2492264A3 (en) | 2003-06-03 | 2012-12-19 | Rib-X Pharmaceuticals, Inc. | Biaryl Heterocyclic Compounds And Methods Of Making And Using The Same |
| CA2540984C (en) * | 2003-10-10 | 2011-02-08 | Lifecycle Pharma A/S | A solid dosage form comprising a fibrate |
| KR100854211B1 (ko) | 2003-12-18 | 2008-08-26 | 동아제약주식회사 | 신규한 옥사졸리디논 유도체, 그의 제조방법 및 이를유효성분으로 하는 항생제용 약학 조성물 |
| KR20050104152A (ko) * | 2004-04-28 | 2005-11-02 | 최승호 | 경구용 약물의 흡수를 증진하는 약제학적 조성물 |
| CA2606386C (en) * | 2005-04-29 | 2014-06-10 | Cubist Pharmaceuticals, Inc. | Therapeutic compositions |
| WO2006133397A2 (en) | 2005-06-08 | 2006-12-14 | Rib-X Pharmaceuticals, Inc. | Process for the synthesis of triazoles |
| WO2007103687A2 (en) * | 2006-03-01 | 2007-09-13 | Tristrata, Inc. | Composition and method for topical treatment of tar-responsive dermatological disorders |
| AR059742A1 (es) | 2006-03-06 | 2008-04-23 | Wyeth Corp | Formulaciones farmaceuticas de una forma cristalina anhidra de 2-(3- fluor-4- dihidroxifenil) 7- vinil-1,3- benzoxazol -5-ol |
| MX2008012486A (es) * | 2006-03-27 | 2008-10-10 | Panacea Biotec Ltd | Composicion farmaceutica de liberacion sostenida basada en un sistema de liberacion que comprende un polimero soluble en acido y un polimero independiente del ph. |
| WO2008085913A1 (en) | 2007-01-04 | 2008-07-17 | Rib-X Pharmaceuticals, Inc. | Methods for treating, preventing, or reducing the risk of opthalmic, otic, and nasal infections |
| US20090061009A1 (en) | 2007-08-29 | 2009-03-05 | Joseph Schwarz | Composition and Method of Treatment of Bacterial Infections |
| WO2010046933A2 (en) * | 2008-10-22 | 2010-04-29 | Rubicon Research Private Limited | Pharmaceutical compositions of taste-masked linezolid |
-
2011
- 2011-11-01 MX MX2013004711A patent/MX359366B/es active IP Right Grant
- 2011-11-01 KR KR1020137013955A patent/KR20140022773A/ko active IP Right Grant
- 2011-11-01 PT PT118386648T patent/PT2635307T/pt unknown
- 2011-11-01 JP JP2013536921A patent/JP5902188B2/ja not_active Expired - Fee Related
- 2011-11-01 CA CA2816077A patent/CA2816077C/en active Active
- 2011-11-01 US US13/882,698 patent/US9409896B2/en active Active
- 2011-11-01 NZ NZ609964A patent/NZ609964A/en not_active IP Right Cessation
- 2011-11-01 AU AU2011323594A patent/AU2011323594C1/en not_active Ceased
- 2011-11-01 EP EP11838664.8A patent/EP2635307B1/en active Active
- 2011-11-01 WO PCT/US2011/058743 patent/WO2012061360A2/en active Application Filing
- 2011-11-01 SG SG2013033865A patent/SG190117A1/en unknown
- 2011-11-01 SG SG10201508982TA patent/SG10201508982TA/en unknown
- 2011-11-01 UA UAA201306779A patent/UA114469C2/uk unknown
- 2011-11-01 CN CN201180063510.8A patent/CN103379917B/zh not_active Expired - Fee Related
- 2011-11-01 EA EA201390646A patent/EA028054B1/ru not_active IP Right Cessation
- 2011-11-01 ES ES11838664T patent/ES2824898T3/es active Active
- 2011-11-01 HU HUE11838664A patent/HUE051133T2/hu unknown
- 2011-11-01 BR BR112013010714A patent/BR112013010714A2/pt unknown
-
2013
- 2013-04-25 IL IL225952A patent/IL225952A0/en unknown
- 2013-04-30 ZA ZA2013/03177A patent/ZA201303177B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| UA114469C2 (uk) | 2017-06-26 |
| AU2011323594C1 (en) | 2017-06-01 |
| SG10201508982TA (en) | 2015-12-30 |
| WO2012061360A2 (en) | 2012-05-10 |
| MX2013004711A (es) | 2013-08-29 |
| ZA201303177B (en) | 2018-12-19 |
| ES2824898T3 (es) | 2021-05-13 |
| PT2635307T (pt) | 2020-11-03 |
| AU2011323594B2 (en) | 2016-12-22 |
| CA2816077C (en) | 2021-08-10 |
| US20140094463A1 (en) | 2014-04-03 |
| EP2635307A4 (en) | 2014-11-05 |
| CN103379917B (zh) | 2016-10-12 |
| AU2011323594A1 (en) | 2013-05-23 |
| MX359366B (es) | 2018-09-26 |
| NZ609964A (en) | 2015-08-28 |
| EP2635307A2 (en) | 2013-09-11 |
| CA2816077A1 (en) | 2012-05-10 |
| JP5902188B2 (ja) | 2016-04-13 |
| JP2013542226A (ja) | 2013-11-21 |
| WO2012061360A3 (en) | 2012-07-12 |
| SG190117A1 (en) | 2013-06-28 |
| HUE051133T2 (hu) | 2021-03-01 |
| US9409896B2 (en) | 2016-08-09 |
| BR112013010714A2 (pt) | 2024-01-16 |
| IL225952A0 (en) | 2013-07-31 |
| EA028054B1 (ru) | 2017-10-31 |
| CN103379917A (zh) | 2013-10-30 |
| EP2635307B1 (en) | 2020-07-29 |
| EA201390646A1 (ru) | 2014-01-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2635307B1 (en) | Pharmaceutical compositions | |
| US20220257584A1 (en) | Methods of treating infections in overweight and obese patients using antibiotics | |
| JP2013542226A5 (ko) | ||
| AU2016234893A1 (en) | Pharmaceutical Compositions | |
| WO2011080570A2 (en) | Extended release pharmaceutical composition comprising linezolid and process for preparing the same | |
| US10300046B2 (en) | Pharmaceutical compositions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |