KR20120093397A - 선택적 사이토페레시스 장치 및 그와 관련된 방법 - Google Patents
선택적 사이토페레시스 장치 및 그와 관련된 방법 Download PDFInfo
- Publication number
- KR20120093397A KR20120093397A KR1020127016409A KR20127016409A KR20120093397A KR 20120093397 A KR20120093397 A KR 20120093397A KR 1020127016409 A KR1020127016409 A KR 1020127016409A KR 20127016409 A KR20127016409 A KR 20127016409A KR 20120093397 A KR20120093397 A KR 20120093397A
- Authority
- KR
- South Korea
- Prior art keywords
- blood
- leukocytes
- scid
- inflammatory
- platelets
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3687—Chemical treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/49—Urokinase; Tissue plasminogen activator
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/34—Filtering material out of the blood by passing it through a membrane, i.e. hemofiltration or diafiltration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/34—Filtering material out of the blood by passing it through a membrane, i.e. hemofiltration or diafiltration
- A61M1/3403—Regulation parameters
- A61M1/341—Regulation parameters by measuring the filtrate rate or volume
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A61M1/3666—Cardiac or cardiopulmonary bypass, e.g. heart-lung machines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A61M1/3666—Cardiac or cardiopulmonary bypass, e.g. heart-lung machines
- A61M1/3667—Cardiac or cardiopulmonary bypass, e.g. heart-lung machines with assisted venous return
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3672—Means preventing coagulation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56972—White blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A61M1/3627—Degassing devices; Buffer reservoirs; Drip chambers; Blood filters
- A61M1/3633—Blood component filters, e.g. leukocyte filters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3679—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits by absorption
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/04—Liquids
- A61M2202/0413—Blood
- A61M2202/0427—Platelets; Thrombocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/04—Liquids
- A61M2202/0413—Blood
- A61M2202/0439—White blood cells; Leucocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/33—Controlling, regulating or measuring
- A61M2205/3331—Pressure; Flow
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Heart & Thoracic Surgery (AREA)
- Chemical & Material Sciences (AREA)
- Vascular Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Cardiology (AREA)
- Immunology (AREA)
- Anesthesiology (AREA)
- Pulmonology (AREA)
- Cell Biology (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Rheumatology (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Zoology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Tropical Medicine & Parasitology (AREA)
- General Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Food Science & Technology (AREA)
- Transplantation (AREA)
Abstract
본 발명은 대상체 내에서 염증성 상태를 치료 및/또는 예방하기 위한 시스템 및 장치, 및 관련된 방법에 관한 것이다. 더욱 특히, 본 발명은 백혈구 및/또는 혈소판을 격리시킨 다음에, 그들의 염증성 작용을 억제하는 시스템, 장치, 및 관련된 방법에 관한 것이다.
Description
본 발명은 대상체에서 염증성 상태를 치료 및/또는 예방하기 위한 시스템, 장치 및 방법에 관한 것이다. 더욱 특히, 본 발명은 백혈구 및 혈소판과 같은 염증과 연관된 세포를 격리시킴으로써 이들의 염증활성을 감소시키는 시스템, 장치 및 관련된 방법에 관한 것이다.
다양한 의학적 상태는 원치 않는 염증에 의해서 야기되고, 악화되고/되거나 특정화된다. 박테리아, 바이러스, 및 진균 감염과 같은 염증; 추락, 자동차 사고, 총 및 칼에 의한 것과 같은 외상; 동맥류 및 종종 수술과 연관된 허혈성 현상과 같은 심혈관 현상; 및 췌장염 및 신장염과 같은 내인성 염증반응은 종종 심혈관 및 면역계 기능을 조절하는데 수반되는 항상성 기전의 심각한 기능부전을 유도한다. 허혈 및 감염과 같은 이들 상태 중의 몇 가지는 면역계의 비정상적이거나 과도한 활성화를 통해서 몇 시간 내지 며칠에 걸쳐 발현할 수 있으며, 특정의 환경 하에서 생명을 위협하거나 치명적일 수조차 있는 심혈관 기능부전을 야기할 수 있다.
특정의 세포 타입은 심혈관 및 면역계의 기능부전에 중요하다. 예를 들어, 백혈구, 특히 호중구는 전신적 염증반응 증후군 (SIRS), 패혈증, 허혈/재관류 손상 및 ARDS를 포함한 다양한 염증성 상태의 병인론 및 진행의 원인이 된다 [참조: 예를 들어, Kaneider et al. (2006) FEBS J 273:4416-4424; Maroszynska et al. (2000) Ann. Transplant. 5(4):5-11]. 또한, 활성화된 혈소판은 백혈구 부착을 증진시키고, 백혈구 활성화를 촉진한다. 염증 및 전신적 염증반응은 어떤 환경에서는 이로울 수 있지만, 이들은 또한 치명적일 수도 있다.
기관의 염증성 손상은 백혈구 활성화 및 응집뿐만 아니라 혈소판 활성화 및 응집에 의해서 유도된 미세혈관 손상을 야기할 수 있다. 이들 활성화된 세포는 환자의 조직 내로 독성 화합물을 방출함으로써 미세혈관 울혈 및 재관류 손상의 원인이 될 수 있다. 급성 염증에서, 활성화된 백혈구와 혈소판은 혈관 내에서 겔-양 구조물로 상호작용한다. 이것은 통상적으로 모세혈관에 의해 산소 및 영양소를 공급하는 조직의 관류가 나쁘게 되도록 한다. 활성화된 백혈구는 추가로, 내피를 통해서 조직 내로 삼출하고, 여기에서 이들이 통상적으로는 침입성 미생물을 파괴하거나, 괴사성 파편을 청소할 목적인 독성 성분을 방출함으로써 손상을 야기한다. 활성화된 혈소판은 추가로, 백혈구의 활성화 및 내피 이행을 증진시킴으로써 손상을 야기한다. 이들 과정이 제어되지 않으면, 이들은 조직 손상 및 사망을 유도할 수 있다.
SIRS는 미국에서 사망의 13번째 주된 원인이다. SIRS를 갖는 심각한 패혈증은 집중치료실 및 광범위 항생제의 사용에 의해서도 30-40%의 사망률을 가지고, 미국에서 매년 200,000 명의 환자에게서 나타난다. SIRS는 대부분, 체온의 상승 (발열) 또는 저하 (저체온증), 증가된 심박수 (빈맥), 증가된 호흡율 (빈호흡), 증가하거나 감소된 백혈구 수 및 부적절한 조직 및 기관의 관류와 같은 관찰된 생리학적 변화를 근거로 진단된다. 혈압의 저하는 증후군의 과정에서 후기에 나타나는 SIRS와 연관된 합병증이다. 구체적으로, 혈압의 저하는 쇼크의 발생을 반영할 수 있고, 이들 환자에게서 사망의 주요 원인인 다발성 기관 기능부전의 원인이 될 수 있다. 패혈성 쇼크는 체액 소생 및 적절한 심장 혈액 박출량에도 불구하고 감염 및 혈압 강하의 존재의 임상적 소견을 포함하는 상태이다. 유사한 상태인 패혈증 증후군은 어떤 타입의 감염의 증거도 없이 유사한 생리학적 시그날을 포함한다. 패혈증-유사 상태를 유도하는 그 밖의 다른 상해에는 췌장염, 화상, 허혈증, 다발성 외상 및 조직 손상 (종종 수술 및 이식에 기인함), 출혈성 쇼크 및 면역-매개된 기간 기능부전이 포함된다.
SIRS 및 패혈성 쇼크에 대한 표준 치료법은 항생제를 투여하여 감염이 제어되도록 하고, 체액/콜로이드 치료법으로 순환하는 혈액 용적을 유지시키는 것을 포함한다. 빈번하게, 도파민 및 바소프레신과 같이 혈압을 유지시키는 것을 돕는 약물이 또한 투여된다.
심폐우회술 (CPB)은 보체 및 응고 시스템을 활성화시키고 사이토킨 생산을 자극하여 SIRS를 강력하게 유도한다. CPB 중의 백혈구의 활성화 및 축적을 제한하기 위한 다수의 치료학적 방법이 연구되고 있다. 실제로, 동물 및 초기 임상 데이터는 백혈구 고갈 필터의 사용에 의한 CPB 수술 중의 폐 및 신장 손상의 개선을 시사하였다 [참조: 예를 들어, Gu et al. (1996) J. Thorac. Cardiovasc. Surg. 112:494-500; Bolling et al. (1997) J. Thorac. Cardiovasc. Surg. 113:1081-1090; Tang et al. (2002) Ann. Thorac. Surg. 74:372-377; Alaoja et al. (2006) J. Thorac. Cardiovasc. Surg. 132:1339-1347]. 그러나, 투석은 일시적인 호중구감소증을 발생시킬 수 있는 것으로 보인다 [참조: Kaplow et al. (1968) JAMA 203:1135].
패혈증의 치료를 위해서 더욱 표적화된 치료법을 개발하기 위한 최근의 전략은 실망적이었다. 또한, 새로운 세대의 항패혈증제의 대부분의 부자는 매우 고가이고, 비-균혈성 쇼크와 같은 일부의 경우에 이들이 금기가 되도록 하는 해로운 면역학적 및 심혈관 반응을 발생시킬 수 있다.
심혈관 쇼크, 패혈증, 전신적 염증반응 증후군 및 아나필락시스와 같은 염증성 상태의 효과적인 치료법에 대한 필요성이 여전히 있다.
발명의 요약
대상체에서의 염증성 상태는 부분적으로, 백혈구 및 혈소판과 같은 염증과 연관된 세포의 활성화로부터 발생한다. 본 발명은 백혈구 또는 혈소판을 격리시키고, 이들의 염증성 작용을 억제하거나 불활성화시킴으로써 이러한 상태를 치료 및/또는 예방하는 시스템, 장치 및 방법에 관한 것이다. 본 발명의 시스템, 장치 및 방법은 백혈구 및 혈소판 중의 하나 또는 둘 다를 체외로 격리시키고, 이들의 염증성 작용을 억제한다. 예를 들어, 이들 세포는 불활성화될 수 있고/있거나, 이들이 전-염증성 물질의 방출이 억제될 수 있다. 본 발명을 실시하는 데는 다수의 방법이 있지만, 한가지 방법은 백혈구 및 혈소판 중의 하나 또는 둘 다를, 이들 세포가 회합할 수 있는 표면을 제공하고, 세포를 불활성화시킬 수 있고/있거나 전-염증성 물질의 방출을 억제할 수 있는 약제를 제공하는 장치의 내부에 격리시키는 것이다. 한가지 비-제한적인 구체예에서, 장치는 중공 섬유를 함유하며, 세포는 이들 섬유의 외부와 회합한다. 시트레이트를 제공하여 세포를 불활성화시키고/시키거나 전염증성 물질의 방출을 방지한다. 본 발명의 이 구체예 및 다른 구체예를 사용하여 수행된 실험은 대상체 생존을 최대화시키는데 전례가 없는 놀라운 성공을 제공한다. 이들 결과는 광범한 염증성 질환 및 상태에 걸친 본 발명의 시스템, 장치 및 방법의 강력한 유용성을 예시한다.
따라서, 한가지 관점에서, 본 발명은 생물학적 샘플이 통과하도록 하는 통로 (passageway)를 한정하며, 샘플로부터 유래하는 하나 또는 그 이상의 백혈구를 격리시키도록 배열된 구역을 포함하는 장치를 포함하는 백혈구 처리용 시스템을 제공한다. 이 시스템은 또한, 백혈구로부터 전-염증성 물질의 방출을 억제하거나 백혈구를 불활성화시킬 수 있는 약제를 포함한다.
본 발명의 이러한 관점은 하나 또는 그 이상의 다음의 특징을 가질 수 있다. 백혈구는 활성화될 수 있고/있거나 초회 자극될 수 있다. 이 시스템은 통로를 한정하는 장치와 직렬로 제2 장치를 추가로 포함할 수 있다. 약제는 통로의 표면과 회합될 수 있다. 특정의 환경에서, 약제는 통로 내에 주입될 수 있다. 약제는 면역억제제, 세린 백혈구 억제제, 산화질소, 다형핵 백혈구 억제제 인자, 분비성 백혈구 억제제, 및 칼슘 킬레이트화제를 포함할 수 있으며, 여기에서 칼슘 킬레이트화제는 시트레이트, 나트륨 헥사메타포스페이트, 에틸렌 디아민 테트라아세트산 (EDTA), 트리에틸렌 테트라민, 디에틸렌 트리아민, o-페난트롤린 또는 옥살산일 수 있다. 그러나, 약제는 바람직하게는 시트레이트와 같은 칼슘 킬항제이다.
백혈구를 격리시키도록 배열된 구역은 막을 포함할 수 있다. 막은 다공성, 반-다공성, 또는 비-다공성일 수 있고/있거나, 막은 약 0.2 ㎡ 보다 큰 표면적을 가질 수 있다. 백혈구를 격리시키도록 배열된 구역은 이 구역 내에서의 전단력이 백혈구가 혈액 또는 체액의 또 다른 성분보다 더 오래 이 부분 내에 잔류하도록 하기에 충분히 낮도록 배열될 수 있다. 예를 들어, 백혈구를 격리시키도록 배열된 구역 내의 전단력은 약 1000 dyne/㎠ 미만일 수 있다. 대신으로 및/또는 이와 함께, 백혈구를 격리시키도록 배열된 구역은 백혈구가 혈액 또는 체액의 또 다른 성분보다 더 오래 이 부분 내에 잔류하도록 하는 세포-부착 분자를 포함할 수 있다.
또 다른 관점에서, 본 발명은 체액 내에 함유된 백혈구를 처리하는 방법을 제공한다. 이 방법은 (a) 초회 자극되거나 활성화된 백혈구를 체외로 격리시키고, (b) 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키도록 백혈구를 처리하는 것을 포함한다. 본 발명의 이 관점은 하나 또는 그 이상의 다음의 특징을 가질 수 있다. 백혈구는 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키기에 충분한 시간 동안, 및/또는 연장된 기간 동안, 및/또는 적어도 1 시간 동안 격리시킬 수 있다. 이 방법은 또한, 단계 (b)에서 생산된 백혈구를 대상체에게 다시 복귀시키는 단계를 추가로 포함할 수 있다. 단계 (b)에서는, 칼슘 킬레이트화제를 사용하여 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킬 수 있다. 단계 (b)는 백혈구를 격리시키도록 배열된 구역을 포함하는 통로를 한정하는 장치를 사용하여 수행될 수 있다.
또 다른 관점에서, 본 발명은 염증성 상태를 발생시키거나 가질 위험이 있는 대상체를 치료하는 방법을 제공한다. 이 방법은 (a) 대상체로부터 초회 자극되거나 활성화된 백혈구를 체외로 격리시키고, (b) 백혈구를 처리하여 염증성 상태와 연관된 염증을 발생시킬 위험을 감소시키거나, 염증성 상태와 연관된 염증을 완화시키는 것을 포함한다. 이 방법이 치료할 수 있는 염증성 상태에는 전신적 염증반응 증후군 (SIRS), 심폐우회술 증후군, 급성 호흡부전 증후군 (ARDS), 패혈증, 류마티스성 관절염, 전신성 홍반성 루푸스, 염증성 장질환, 다발성 경화증, 건선, 동종이식 거부반응, 천식, 만성 신부전, 심신성 증후군, 간신성 증후군, 심근, 중추신경계, 간, 신장 또는 췌장에 대한 허혈성 재관류 손상으로 인한 급성 기관 부전, 및 독성 손상, 예를 들어, 화학요법으로 인한 급성 기관 부전이 포함되나, 이들로 제한되지는 않는다. 단계 (a)는 백혈구를 격리시키도록 배열된 구역을 포함하는 통로를 한정하는 장치를 사용하여 수행될 수 있다.
본 발명의 시스템, 장치 및 방법은 백혈구 억제제의 특정한 타입 또는 종류로 제한되지 않는다. 일부의 구체예에서, 백혈구 억제제는 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킬 수 있는 어떤 약제라도 된다. 백혈구 억제제의 예로는 면역억제제, 세린 백혈구 억제제, 산화질소, 다형핵 백혈구 억제제 인자, 및 분비성 백혈구 억제제가 포함되나, 이들로 제한되지는 않는다. 일부의 구체예에서, 백혈구 억제제는 칼슘 킬레이트화제 (예를 들어, 시트레이트)이다. 본 발명은 시트레이트, 나트륨 헥사메타포스페이트, 에틸렌 디아민 테트라아세트산 (EDTA), 트리에틸렌 테트라민, 디에틸렌 트리아민, o-페난트롤린, 옥살산 등을 포함하는 (단, 이들로 제한되지는 않음) 특정한 타입 또는 종류의 칼슘 킬레이트화제로 제한되지는 않는다.
본 발명의 상기 확인된 관점 또는 구체예는 모두 혈소판 (예를 들어, 활성화된 혈소판), 백혈구와 혈소판의 조합, 또는 염증과 연관된 세포의 격리 및 불활성화 또는 억제에 동등하게 적용될 수 있는 것으로 이해된다. 따라서, 또 다른 관점에서, 본 발명은 염증성 상태를 발생시키거나 가질 위험이 있는 대상체를 치료하는 방법을 제공한다. 이 방법은 (a) 대상체로부터 염증과 연관된 초회 자극되거나 활성화된 세포를 체외로 선택적으로 격리시키고; (b) 세포를 처리하여 염증성 상태와 연관된 염증을 발생시킬 위험을 감소시키거나 염증성 상태와 연관된 염증을 완화시키는 것을 포함한다. 일부의 구체예에서, 염증과 연관된 활성화된 세포는 혈소판 및 백혈구로 이루어진 군으로부터 선택될 수 있다. 일부의 구체예에서, 염증과 연관된 초회 자극된 세포는 백혈구이다.
본 발명의 전술한 관점 및 구체예는 이하의 상세한 설명 및 특허청구범위를 참고로 하여 더 충분히 이해될 수 있다.
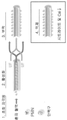
도 1은 본 발명의 시스템 내의 장치의 예시적 구체예의 절편의 개략도이다. 이 도면에서, (1) 대상체의 혈액으로부터 초회 자극된 백혈구는 (2) 시스템 내의 상류 장치, 예를 들어, 혈액여과 장치에 의해서 활성화된다. 상류 장치에서, 혈액은 중공 챔버의 내부 공간을 통해서 흐르고, 한외여과액 (UF)은 챔버의 벽을 통해서 여과된다. 제1 장치에서 배출되면, 혈액은 이어서 중공 섬유의 외부를 따라서 제2 장치, 예를 들어, 선택적 사이토포레시스 (cytophoresis) 억제성 장치 (SCID)의 내부로 흐르는 한편, UF는 중공 섬유의 내부 공간을 통해서 흐른다. 중공 섬유의 외부를 따라서 흐르는 혈액은 (3) 혈액 내의 백혈구가 예를 들어, 중공 섬유의 외부 표면에 부착함으로써 격리되도록 하는 조건에 노출되며, 이에 의해서 (4) 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구 억제제, 예를 들어, 탈이온화된 칼슘 (Cai)을 감소시키는 시트레이트에 의한 백혈구의 불활성화를 촉진시킨다.
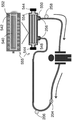
도 2A는 시스템 내의 유일한 장치이며, 캡 (cap)이 있는 양 말단을 갖는 모세관내 공간 (ICS)를 포함하는 SCID 555를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다. 도 2B는 한외여과액 (UF)이 캡이 있는 ICS의 단지 하나의 말단을 갖는 SCID 655로부터 수집되는 것을 제외하고는 도 2A와 유사한 구체예의 개략적 표현이다. 도 2C는 제1 장치, 예를 들어, 혈액여과 장치 210, 및 캡이 있는 양 말단을 갖는 ICS를 포함하는 SCID 555를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다. 도 2D는 한외여과액 (UF)이 캡이 있는 ICS의 단지 하나의 말단을 갖는 SCID 655로부터 수집되는 것을 제외하고는 도 2C와 유사한 구체예의 개략적 표현이다.
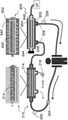
도 3은 그의 ICS 상에 캡이 없는 SCID 755를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다.
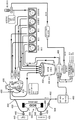
도 4A-4F는 CPB 회로에서 이용되는 것으로서 본 발명의 시스템 배열의 구체예의 개략적 표현이다. 도 4A-4C에서는, 양 말단에 캡이 있는 ICS를 갖는 SCID 555에 의해서 (도 4A 및 4B), 또는 캡이 있는 하나의 말단을 갖는 SCID 655에 의해서 처리된 혈액을 정맥혈 저혈조 450 및 산소화기 460 이전의 회로의 일부분 내로 재순환시킨다. 도 4D-4F에서는, 양 말단에 캡이 있는 ICS를 갖는 SCID 555에 의해서 처리된 혈액을 산소화기 460 이후의 회로의 일부분 내의 혈액과 재조합시킨다. HF/HC는 혈액여과기/혈액농축기를 나타내고, P는 펌프 504를 나타내며, UF는 한외여과액을 수집하기 위한 저혈조를 나타낸다.
도 5는 양 말단에 캡이 있는 ICS를 갖는 본 발명의 SCID 555의 구체예의 개략적 표현을 나타낸다.
도 6은 하나의 말단에 캡이 있는 ICS를 갖는 본 발명의 SCID 655의 구체예의 개략적 표현을 나타낸다.
도 7은 ICS 유입구 745 및 ICS 배출구 746 (이들 중의 어느 것도 캡이 없음)을 갖는 본 발명의 SCID 755의 구체예의 개략적 표현을 나타낸다.
도 8은 본 발명의 SCID 855의 추가의 구체예를 나타낸다.
도 9는 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에 대한 평균 동맥압을 나타낸다.
도 10은 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에서의 심박출량을 나타낸다.
도 11은 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에서의 헤마토크리트 레벨을 나타낸다.
도 12는 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹의 생존곡선을 나타낸다.
도 13은 실시예 1에 기술된 바와 같이, 각각의 동물 그룹 (n = 각각의 그룹당 2 내지 3)에서 박테리아 공격 후에 SCID 노출 시간에 따른 평균 총 백혈구 수를 나타낸다.
도 14A-14D는 3 가지 상이한 동물로부터 유래하는 H&E에 의해서 염색된 중공 섬유 막을 함유하는 SCID의 광학 현미경사진을 나타낸다. 도 14A는 각각의 중공 섬유 주위의 부착성 세포를 나타내는 저배율 (low power) 현미경사진이다 (160×). 도 14B 및 14C는 중공 섬유의 외부 표면을 따라 백혈구 군집형성 (clustering)을 나타내는 더 고배율의 현미경사진이다 (400×). 도 14D는 부착성 세포 군집 내의 단핵 세포를 따라 주로 다형핵 세포를 표시하는 고배율 현미경사진이다 (1600×).
도 15는 SCID 및 시트레이트 또는 헤파린 처리에 의해서 처리된 대상체에서의 생존율 차이를 나타내는 그래프이다.
도 16A 및 16B는 본 발명의 1 펌프 및 2 펌프 시스템 배열에서의 백혈구 (WBC) 및 호중구의 수를 각각 비교하는 그래프이다.
도 17은 본 발명의 시스템 배열의 두 가지 예시적 구체예에서의 혈소판의 양을 나타내는 그래프이다.
도 18은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서의 평균 미엘로퍼옥시다제 (MPO) 레벨을 나타내는 그래프이다.
도 19는 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서, 내피에 대한 호중구 결합을 책임지고 있는 호중구 막 단백질인 CD11b의 발현을 나타내는 그래프이다.
도 20은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서, 본 발명에 따르는 시스템의 동맥 및 정맥 라인 내의 호중구의 수를 나타내는 그래프이다.
도 21은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서 시간의 함수로서 패혈성 동물의 생존 백분율을 나타내는 그래프이다.
도 22A-22F는 심폐우회술 수술을 받고, SCID 및 시트레이트를 포함하는 본 발명의 시스템으로 처리한 동물에게서 전신적 총 백혈구 (WBC), 전신적 호중구, 전신적 림프구, 전신적 단핵구, 전신적 호산구, 및 전신적 혈소판의 농도를 나타내는 그래프이다.
도 23A 및 23B는 심폐우회술 수술을 받고, SCID 및 시트레이트를 포함하는 본 발명의 시스템으로 처리한 동물에게서 각각, 전신적 및 회로 Cai를 나타내는 그래프이다.
도 1은 본 발명의 시스템 내의 장치의 예시적 구체예의 절편의 개략도이다. 이 도면에서, (1) 대상체의 혈액으로부터 초회 자극된 백혈구는 (2) 시스템 내의 상류 장치, 예를 들어, 혈액여과 장치에 의해서 활성화된다. 상류 장치에서, 혈액은 중공 챔버의 내부 공간을 통해서 흐르고, 한외여과액 (UF)은 챔버의 벽을 통해서 여과된다. 제1 장치에서 배출되면, 혈액은 이어서 중공 섬유의 외부를 따라서 제2 장치, 예를 들어, 선택적 사이토포레시스 (cytophoresis) 억제성 장치 (SCID)의 내부로 흐르는 한편, UF는 중공 섬유의 내부 공간을 통해서 흐른다. 중공 섬유의 외부를 따라서 흐르는 혈액은 (3) 혈액 내의 백혈구가 예를 들어, 중공 섬유의 외부 표면에 부착함으로써 격리되도록 하는 조건에 노출되며, 이에 의해서 (4) 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구 억제제, 예를 들어, 탈이온화된 칼슘 (Cai)을 감소시키는 시트레이트에 의한 백혈구의 불활성화를 촉진시킨다.
도 2A는 시스템 내의 유일한 장치이며, 캡 (cap)이 있는 양 말단을 갖는 모세관내 공간 (ICS)를 포함하는 SCID 555를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다. 도 2B는 한외여과액 (UF)이 캡이 있는 ICS의 단지 하나의 말단을 갖는 SCID 655로부터 수집되는 것을 제외하고는 도 2A와 유사한 구체예의 개략적 표현이다. 도 2C는 제1 장치, 예를 들어, 혈액여과 장치 210, 및 캡이 있는 양 말단을 갖는 ICS를 포함하는 SCID 555를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다. 도 2D는 한외여과액 (UF)이 캡이 있는 ICS의 단지 하나의 말단을 갖는 SCID 655로부터 수집되는 것을 제외하고는 도 2C와 유사한 구체예의 개략적 표현이다.
도 3은 그의 ICS 상에 캡이 없는 SCID 755를 포함하는 본 발명의 시스템의 구체예의 개략적 표현이다.
도 4A-4F는 CPB 회로에서 이용되는 것으로서 본 발명의 시스템 배열의 구체예의 개략적 표현이다. 도 4A-4C에서는, 양 말단에 캡이 있는 ICS를 갖는 SCID 555에 의해서 (도 4A 및 4B), 또는 캡이 있는 하나의 말단을 갖는 SCID 655에 의해서 처리된 혈액을 정맥혈 저혈조 450 및 산소화기 460 이전의 회로의 일부분 내로 재순환시킨다. 도 4D-4F에서는, 양 말단에 캡이 있는 ICS를 갖는 SCID 555에 의해서 처리된 혈액을 산소화기 460 이후의 회로의 일부분 내의 혈액과 재조합시킨다. HF/HC는 혈액여과기/혈액농축기를 나타내고, P는 펌프 504를 나타내며, UF는 한외여과액을 수집하기 위한 저혈조를 나타낸다.
도 5는 양 말단에 캡이 있는 ICS를 갖는 본 발명의 SCID 555의 구체예의 개략적 표현을 나타낸다.
도 6은 하나의 말단에 캡이 있는 ICS를 갖는 본 발명의 SCID 655의 구체예의 개략적 표현을 나타낸다.
도 7은 ICS 유입구 745 및 ICS 배출구 746 (이들 중의 어느 것도 캡이 없음)을 갖는 본 발명의 SCID 755의 구체예의 개략적 표현을 나타낸다.
도 8은 본 발명의 SCID 855의 추가의 구체예를 나타낸다.
도 9는 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에 대한 평균 동맥압을 나타낸다.
도 10은 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에서의 심박출량을 나타낸다.
도 11은 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹에서의 헤마토크리트 레벨을 나타낸다.
도 12는 실시예 1에 기술된 바와 같이 본 발명의 시스템에 의해서 처리된 돼지 모델 그룹의 생존곡선을 나타낸다.
도 13은 실시예 1에 기술된 바와 같이, 각각의 동물 그룹 (n = 각각의 그룹당 2 내지 3)에서 박테리아 공격 후에 SCID 노출 시간에 따른 평균 총 백혈구 수를 나타낸다.
도 14A-14D는 3 가지 상이한 동물로부터 유래하는 H&E에 의해서 염색된 중공 섬유 막을 함유하는 SCID의 광학 현미경사진을 나타낸다. 도 14A는 각각의 중공 섬유 주위의 부착성 세포를 나타내는 저배율 (low power) 현미경사진이다 (160×). 도 14B 및 14C는 중공 섬유의 외부 표면을 따라 백혈구 군집형성 (clustering)을 나타내는 더 고배율의 현미경사진이다 (400×). 도 14D는 부착성 세포 군집 내의 단핵 세포를 따라 주로 다형핵 세포를 표시하는 고배율 현미경사진이다 (1600×).
도 15는 SCID 및 시트레이트 또는 헤파린 처리에 의해서 처리된 대상체에서의 생존율 차이를 나타내는 그래프이다.
도 16A 및 16B는 본 발명의 1 펌프 및 2 펌프 시스템 배열에서의 백혈구 (WBC) 및 호중구의 수를 각각 비교하는 그래프이다.
도 17은 본 발명의 시스템 배열의 두 가지 예시적 구체예에서의 혈소판의 양을 나타내는 그래프이다.
도 18은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서의 평균 미엘로퍼옥시다제 (MPO) 레벨을 나타내는 그래프이다.
도 19는 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서, 내피에 대한 호중구 결합을 책임지고 있는 호중구 막 단백질인 CD11b의 발현을 나타내는 그래프이다.
도 20은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서, 본 발명에 따르는 시스템의 동맥 및 정맥 라인 내의 호중구의 수를 나타내는 그래프이다.
도 21은 SCID 및 시트레이트 또는 SCID 및 헤파린으로 처리한 동물에서 시간의 함수로서 패혈성 동물의 생존 백분율을 나타내는 그래프이다.
도 22A-22F는 심폐우회술 수술을 받고, SCID 및 시트레이트를 포함하는 본 발명의 시스템으로 처리한 동물에게서 전신적 총 백혈구 (WBC), 전신적 호중구, 전신적 림프구, 전신적 단핵구, 전신적 호산구, 및 전신적 혈소판의 농도를 나타내는 그래프이다.
도 23A 및 23B는 심폐우회술 수술을 받고, SCID 및 시트레이트를 포함하는 본 발명의 시스템으로 처리한 동물에게서 각각, 전신적 및 회로 Cai를 나타내는 그래프이다.
발명의 상세한 설명
백혈구 (또는 백색 혈구) 및 혈소판과 같은 염증과 연관된 세포는 통상적으로 감염 및 손상으로부터 신체를 방어한다. 그러나, 다수의 질병 상태 및 의학적 절차는 이들 세포를 활성화시키고/시키거나 초회 자극할 수 있고, 이것은 다시 치명적일 수 있는 바람직하지 않은 면역 및 염증성 반응을 생성시킬 수 있다. 본 발명은 대상체에서 염증성 상태를 치료 및/또는 예방하도록 배열된 시스템 및 장치, 및 관련된 방법에 관한 것이다. 본 발명의 시스템, 장치 및 방법은 백혈구 및 혈소판 중의 하나 또는 둘 다를 체외로 격리시키며, 이들의 염증성 작용을 억제한다. 구체적으로, 본 발명은 활성화되고/되거나 초회 자극된 백혈구와 같은 백혈구를 격리시키고, 이들을 대상체에 반송하기 전에 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키기 위한 시스템, 장치 및 방법을 포함한다. 본 발명은 또한, 혈소판 (예를 들어, 활성화된 혈소판)과 같은 염증과 연관된 세포의 다른 타입을 격리시키고, 이들을 대상체에 반송하기 전에 이들 세포로부터 전-염증성 물질의 방출을 억제하기 위한 시스템, 장치 및 방법을 포함한다.
본 발명을 실행하는 다수의 방법이 있지만, 한가지 방법은 백혈구 및 혈소판과 회합할 수 있는 표면을 제공하는 장치의 내부에서 이들 세포 중의 하나 또는 둘 다를 격리시키고, 세포를 불활성화시키고/시키거나 전-염증성 물질의 방출을 억제할 수 있는 약제를 제공하는 것이다. 한가지 비제한적 구체예에서, 이 장치는 중공 섬유를 함유하며, 세포는 이들 섬유의 외부와 회합한다. 세포를 불활성화시키고/시키거나 전-염증성 물질의 방출을 방지하기 위해서 시트레이트가 제공된다. 본 발명은 여기에서 혈액과 관련하여 기술되어 있지만, 본 발명은 이들 세포를 함유하는 대상체의 신체로부터의 어떤 체액과 같은 체외 회로를 통해서 흐를 수 있는 어떤 생물학적 샘플에 대해서도 적용할 수 있다. 체외 회로의 예는 예를 들어, 미국 특허 제6,561,997호에 기술되어 있다.
1. 개요
본 발명의 시스템, 장치 및 방법은 특정한 장치 및 시스템이 활성화되고/되거나 초회 자극된 백혈구를 격리시킬 수 있을 뿐만 아니라, 이들의 염증성 활성을 억제할 수도 있어서 패혈증 및 SIRS와 같은 염증성 질병 및 상태의 다기관 효과를 감소시킬 수 있다는 예상하지 못한 관찰결과로부터 유래하였다. 이들 급성 효과는 또한, 말기 신장병 (ESRD)과 연관된 만성 전-염증성 상태와 같은 만성 전-염증성 상태에도 영향을 미칠 수 있다. 이들 시스템, 장치 및 방법은 또한, 혈소판의 효과적인 격리를 나타내었다. 본 발명의 구체예를 사용하여 수행된 실험은 대상체의 생존을 최대화시키는데 있어서 전례가 없는 놀라운 성공을 제공하며 (참조: 예를 들어, 실시예 3), 치료학적, 진단적 및 탐색 용도를 위해 광범한 질병 및 상태에 걸친 이들 시스템, 장치 및 방법의 강력한 유용성을 예시한다.
한가지 예시적 구체예의 개략적 표현은 도 1에 나타낸다. 나타낸 바와 같이, 혈액은 제1 장치에 노출된다. 그 후에, 백혈구는 활성화된다 (및/또는 초회 자극된다). 그 후, 활성화된 (및/또는 초회 자극된) 백혈구는 일반적으로 선택적 사이토페레시스 억제장치 (SCID)라 불리는 장치에 들어가며, 여기에서 활성화된 백혈구가 격리된다. 백혈구는 제1 장치에 의해서 활성화되기보다는 일차 환자 상태의 결과로, 또는 의학적 개입의 다른 형태에 대해서 이차적으로 활성화 (및/또는 초회 자극)될 수 있는 것으로 이해된다.
즉, SCID에서 혈액으로부터 활성화 (및/또는 초회 자극)된 백혈구는 예를 들어, SCID 내부의 하나 또는 그 이상의 표면에 일시적으로 부착함으로써 격리된다. 백혈구의 격리는 다양한 접근방법에 의해서, 예를 들어, 백혈구, 예를 들어, 활성화되고/되거나 초회 자극된 백혈구를 결합시키는 SCID 내의 통로 또는 통로 부분에서 분자와 회합시킴으로써, 또는 혈류를 장치 내에 배치하여 백혈구 상에 낮은 전단 응력을 제공하여 이들이 SCID 내의 하나 또는 그 이상의 표면과 회합하도록 함으로써 달성될 수 있다. 그 후, 이들 격리된 백혈구를 약제, 예를 들어, 시트레이트에 노출시켜 백혈구를 불활성화시키거나, 이들의 전-염증성 물질 방출을 억제한다. 이들 시스템 및 장치는 또한, 혈소판과 같은 다른 세포 타입에 적용할 수 있다.
이론적으로 속박됨이 없이, 칼슘 킬레이트화제, 예를 들어, 시트레이트는 장치 내에서 낮은 Cai 환경을 유도하여 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키는 것으로 믿어진다. 전-염증성 물질은 백혈구로부터의 파괴 효소 및/또는 사이토킨을 포함할 수 있다. 이러한 억제 및/또는 불활성화는 백혈구의 염증성 상태의 개선을 유도한다. 이러한 방식으로, 도 1에 나타낸 예시적 구체예 (및 본 발명의 다른 구체예)에서, SCID는 예를 들어, 시트레이트 및/또는 저-Cai 환경에 의해서 백혈구, 예를 들어, 호중구 및 단핵구를 격리시키고, 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킨다. 혈소판의 격리 및 억제 및/또는 불활성화는 유사한 방식으로 달성될 수 있다.
백혈구를 격리시키는 중공 섬유를 함유하는 하우징 (housing)을 포함하는 본 발명의 장치에 칼슘 킬레이트화제, 예를 들어, 시트레이트를 첨가하는 것은 대상체의 선천적인 면역학적 시스템을 개선시키는 예상치 못한 결과를 갖는 것으로 이해되었다. 따라서, 본 발명의 시스템, 장치 및 방법은 백혈구 (예를 들어, 활성화되고/되거나 초회 자극된 백혈구) 또는 혈소판 (예를 들어, 활성화된 혈소판)을 포함하는 대상체의 혈액을 직접 처리함으로써 다양한 염증성 상태 (일차 질병 상태로서 또는 의학적 개입의 결과로서)를 치료 또는 예방할 수 있다. 처리 후에, 혈액은 대상체에게 반송된다.
또한, 백혈구 또는 혈소판 (예를 들어, 활성화된 백혈구, 초회 자극된 백혈구, 또는 활성화된 혈소판)을 격리하고, 이러한 세포를 불활성화시키거나 이러한 세포가 전-염증성 물질을 방출하는 것을 방지하는 어떤 방법, 장치 또는 시스템이라도 사용될 수 있다. 따라서, 이하의 항목에는 (1) 염증성 상태를 치료하기 위해서 사용될 수 있는 시스템의 배열, (2) 어떻게 염증과 연관된 세포가 격리될 수 있는지의 예, (3) 어떻게 이러한 세포가 불활성화될 수 있고/있거나 전-염증성 물질을 방출하는 것을 억제할 수 있는지의 예, 및 (4) 본 명세서에 기술된 방법, 장치 및 시스템을 사용하여 치료될 수 있는 염증성 상태를 기술한다. 이하의 항목에서의 검토는 일반적으로 특정한 세포 타입 (예를 들어, 백혈구)의 격리 및 억제 및/또는 불활성화를 기술하고 있지만, 동일한 원리는 염증과 연관된 다른 세포 타입 (예를 들어, 활성화된 혈소판과 같은 혈소판)의 격리 및 억제 및/또는 불활성화를 위해서 적용하는 것으로 이해된다.
2. 시스템 배열
본 명세서에서 사용된 것으로서, 용어 "사이토페레시스" 또는 "선택적 사이토페레시스"는 혈액으로부터 특정의 입자를 격리시키는 것을 나타낸다. 선택적 사이토페레시스를 사용하여 이러한 세포로부터 전-염증성 물질의 방출의 억제 및/또는 이러한 세포의 불활성화를 촉진시킬 목적으로 혈액으로부터 백혈구 (예를 들어, 활성화되고/되거나 초회 자극된 백혈구) 또는 혈소판 (예를 들어, 활성화된 혈소판)과 같은 특정의 세포를 격리시킨다. 이러한 억제 및/또는 불활성화는 격리시키기 전, 중 및/또는 후에 일어날 수 있는 것으로 이해되어야 한다.
"선택적 사이토페레시스 장치", "선택적 사이토페레시스 억제장치", "SCD" 및 "SCID"는 백혈구 (예를 들어, 활성화되고/되거나 초회 자극된 백혈구) 또는 혈소판 (예를 들어, 활성화된 혈소판)과 같은 특정의 세포를 격리시키는 본 발명의 구체예를 나타낸다. 이들 구체예는 격리시키기 전, 중 및/또는 후에 이러한 세포를 불활성화시키고/시키거나 이들로부터 전-염증성 물질의 방출을 억제할 수도 있다.
본 발명의 시스템은 선택적 사이토페레시스를 달성하도록 배열된다. 기본적 형태에서, 시스템은 SCID, 혈액 공급원 (예를 들어, 환자와 같은 대상체)으로부터 SCID로 혈액이 흐르도록 하는 유체 연결부 (fluid connection), 및 처리된 혈액이 SCID로부터 수용기로 흐르도록 하는 (예를 들어, 대상체에게 반송하는) 유체 연결부를 포함한다. SCID는 활성화되고/되거나 초회 자극된 백혈구와 같은 백혈구를 격리시키고, 백혈구로부터 전-염증성 물질의 방출의 억제를 촉진시키고/시키거나 백혈구를 불활성화시키는 작용을 한다. 백혈구의 격리는 이하의 항목 3에 기술된 어떤 기술에 의해서나 달성될 수 있다. 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화는 이하의 항목 4에 기술된 어떤 기술에 의해서나 달성될 수 있다.
일부의 구체예에서, 시스템은 추가의 처리 장치가 없이, 임의로 다른 혈액 처리를 수행할 수도 있는 SCID를 포함할 수 있다. 예를 들어, 도 2A-2B 및 도 8을 참고로 한다. 시스템의 다른 구체예는 임의로 다른 혈액 처리를 수행할 수 있는 SCID뿐만 아니라 혈액을 처리하는 추가의 장치를 포함할 수 있다. 예를 들어, 도 2C-2D 및 도 4A-4F를 참고로 한다. 예를 들어, 추가의 장치는 혈액이 SCID에 들어가기 전 또는 후에 혈액을 여과하거나, 산소화시키거나 다른 식으로 처리할 수 있다. 또한, 시스템 내의 SCID 및/또는 추가의 장치는 다른 방법 또는 보충적 방법으로 혈액을 처리하기 위한 하나 이상의 성분, 예를 들어, 다공성 섬유, 산소 펌프, 및/또는 제노그래픽 (xenographic) 또는 알로그래픽 (allographic) 세포 (예를 들어, 신장 세뇨관 세포와 같은 제노그래픽 또는 알로그래픽 신장 세포)를 포함할 수 있다. 일부의 구체예에서, 선택적 사이토페레시스를 촉진시키는 시스템 내의 장치 또는 장치들은 이러한 추가의 성분이 없다. 예를 들어, 본 발명의 SCID는 제노그래픽 또는 알로그래픽 새포 (예를 들어, 제노그래픽 또는 알로그래픽 신장 세포)와 같은 세포를 갖지 않을 수 있다. 이들 기본적 원리는 이하에 더 상세히 기술된다.
2.A. 단일 장치 시스템
언급된 바와 같이, 시스템은 시스템 내에서 추가의 처리 장치 없이 선택적 사이토페레시스, 및 임의로, 다른 혈액 처리를 수행하기 위한 SCID를 함유할 수 있다 (참조: 도 2A-2B). 이러한 SCID의 한가지 구체예는 도 5에 개략적으로 나타낸다. 도 5에서, SCID 555는 중공 섬유 552 (명료하게 하기 위해서 단지 하나가 표시됨)인 다수의 다공성 막을 함유한다. 이들 섬유 내의 루미날 (luminal) 공간은 모세관내 공간 ("ICS") 540이라 부른다. 이 구체예에서, ICS 유입구 및 ICS 배출구는 캡 544가 있다. 중공 섬유 552를 둘러싸고, SCID 555의 하우징 554 내에 있는 공간 542는 모세관외 공간 ("ECS")이라 부른다. 백혈구를 함유하는 혈액은 ECS 유입구 548로 들어가서, 섬유 552를 둘러싼 ECS 542 내로 이동한다 (즉, 통로 내로 이동한다). 백혈구는 장치 내에서, 예를 들어, 중공 섬유 552의 외부 표면에서 격리되고, 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킬 수 있는 약제, 예를 들어, 시트레이트에 노출된다. 이 약제는 ECS 유입구 548 상류의 라인 (line) 내로 주입될 수 있거나, 포트 (port)를 통해서 SCID 그 자체 내로 주입될 수 있다. 대신으로, 또는 추가로, SCID는 SCID를 사용하기 전에 약제로 준비될 수 있다. ECS 542 내에서의 유속은 섬유 552의 표면에서의 낮은 전단력 (본 명세서에 기술된 범위 내)으로 백혈구가 그와 회합하도록 하는, 본 명세서에 기술된 범위 내에서 선택된다. 이러한 방법으로, 백혈구의 억제 및/또는 불활성화가 달성되거나 개시된다. 그 후, ECS 내의 혈액은 ECS 배출구 550을 통해서 SCID로부터 나오며, 이것은 유출 라인 (outflow line) 내로 들어간다.
도 2A는 본 발명에 따르는 회로 내의 도 5의 예시적 SCID 555를 나타낸다. 대상체로부터의 혈액은 혈액 라인으로 들어가서, 펌프 204에 의해 그 라인을 통해서 이동한다. 동일한 혈액 라인 상에서, 백혈구 억제제 (예를 들어, 시트레이트)는 임의로 펌프에 의해서 포트 206에서 주입할 수 있다. 그 후, 혈액 라인 내의 혈액은 ECS 유입구 548로 들어가고, ECS 배출구 550에서 SCID 555로부터 배출된다. ECS 유입구 548 및 배출구 550에서의 혈액 라인은 각각, 잠금 기전 (locking mechanism) 256을 갖는 혈액 라인 접속자 (connector)를 사용하여 부착된다. 백혈구는 ECS 542 내의 중공 섬유 552의 외부 표면에서 격리되는 것으로 보인다. ECS 배출구 550으로부터의 혈액 유출 라인은 혈액을 대상체에게 반송한다. 칼슘 (예를 들어, 염화칼슘 또는 칼슘 글루코네이트)과 같은 또 다른 약제는 이 혈액 유출 라인 상의 포트 258에서 주입되어 대상체에게 재-도입시키기 위한 혈액을 제조할 수 있다. 특정의 구체예에서, ICS는 각각의 섬유의 ICS 540의 라이닝 상에서 단일층으로 배양된 제노그래픽 또는 알로그래픽 세포, 예를 들어, 신장 세뇨관 세포를 함유하여 혈액의 처리를 더 도와줄 수 있다. 그러나, 다른 구체예에서 ICS은 세포를 갖지 않는다. 도 2A에서, SCID 555의 루멘 540은 식염수로 충진된다.
도 2B의 회로는 도 2B가 도 6에 나타낸 SCID 655를 이용하고, 한외여과액이 이 SCID 655에 의해서 생산되는 것을 제외하고는, 도 2A와 동일한 성분을 포함하며, 동일한 방식으로 작동한다. SCID 655는 중공 섬유 652인 다수의 다공성 막을 함유한다. 섬유 내의 루미날 공간은 ICS 640이며, 섬유 652 외부 및 SCID 하우징 654 내부의 주변 공간은 ECS 642이다. 백혈구를 함유하는 혈액은 ECS 유입구 648로 들어가서 섬유 652를 둘러싼 ECS 642 내로 이동하고, ECS 배출구 650에서 배출된다. 백혈구 격리 및 억제 및/또는 불활성화는 상술한 바와 같이 달성될 수 있다. 그러나, SCID 655에서는 단지 ICS 유입구만이 캡 644이 있다. ICS 배출구 646는 캡이 없다. 따라서, 다공성 중공 섬유 652의 특징 (예를 들어, 투과성 및 공극 크기)에 따라, ECS 642 내의 혈액의 일부분은 중공 섬유 652를 가로질러서 한외여과액 (UF)로서 ICS 640 내로 들어간다. 폐기물로서 버려질 수 있는 한외여과액 (UF)을 수집하기 위하여 튜브를 ICS 배출구 646에 연결시킬 수 있다.
단일 처리 장치를 갖는 시스템의 또 다른 구체예에서, SCID는 도 8에 나타낸 바와 같은 장치일 수 있다. 혈액은 SCID 855의 하나의 말단 810으로 들어가고, 중공 섬유 802를 통해서 이동하며, 이 중공 섬유를 통해서 한외여과액은 중공 공간 804 내로 들어간다. 중공 섬유 802로부터 여과된 혈액은 ECS 806 내로 들어가고, 중공 공간 804를 통과한 한외여과액을 함유하는 중공 섬유 808을 둘러싼다. ECS 내의 혈액은 한외여과액으로 충진된 중공 섬유 808을 거쳐서 흐르고, 백혈구는 그 위에 격리된다. 유속은 한외여과액 중공 섬유 808의 표면에서 백혈구가 섬유와 회합하도록 하는 전단력 (본 명세서에 기술된 범위 내임)이 발생하도록 본 명세서에 기술된 범위 내에서 선택된다. 혈액은 궁극적으로 측면 포트 812에서 장치로부터 배출되며, 한외여과액은 말단 포트 813을 통해서 폐기물로 배출된다. 한외여과액 중공 섬유 808의 내부는 임의로 신장 세뇨관 세포를 함유한다. SCID의 이 구체예는 도 2A-2B의 SCID에 대해서 기술한 바와 같이 회로 내에 배치될 수 있다.
도 5, 6, 또는 8의 SCID를 갖는 도 2A-2B의 회로에 나타낸 구체예에 대한 유속 및 막 특징은 이하에 기술한 바와 같을 수 있다. 예를 들어, ECS 유속은 약 100 ㎖/분 내지 약 500 ㎖/분일 수 있다. 한외여과액 폐기물의 유속 (예를 들어, 도 6 및 8에 나타낸 SCIDs의 경우)은 예를 들어, 약 5 ㎖/분 내지 약 50 ㎖/분의 유속을 포함할 수 있다.
2.B. 혈액투석 또는 혈액여과 시스템의 일부분으로서 선택적
사이토페레시스
억제 장치
언급된 바와 같이, 일부의 구체예에서 SCID는 혈액을 처리하기 위한 다른 장치를 갖는 시스템의 일부분이다. 예를 들어, SCID는 시스템 내에 SCID와는 별도로 하나 또는 그 이상의 여과 카트리지를 포함하는 혈액여과 시스템, 혈액투석 시스템 및/또는 혈액투석여과 시스템의 일부분일 수 있다. SCID가 아닌 시스템의 부분을 기술하는 경우에, 용어 "혈액여과"는 혈액투석, 혈액투석여과, 혈액여과 및/또는 혈액농축을 나타낼 수 있고, "혈액여과기 (hemofilter)"는 혈액투석, 혈액투석여과, 혈액여과 및/또는 혈액농축 중의 하나 또는 그 이상을 수행하기 위한 장치 (예를 들어, 카트리지)를 포함할 수 있다. 혈액여과 카트리지(들)는 체외 혈액 회로 내에서 SCID와 병렬로, 또는 직렬로 배열될 수 있으며, 회합된 혈액 펌프 및 튜빙 (tubing)을 사용하여 체외 회로를 통해서 혈액을 이동시킬 수 있다. 예를 들어, 도 2C 및 2D에 나타낸 바와 같이, 혈액은 대상체로부터 혈액 라인을 통해서 흐른다. 혈액은 펌프 204에 의해 혈액 라인을 통해서 이동한다. 백혈구 억제제 (예를 들어, 시트레이트)는 임의로 펌프에 의해, 포트 206에서 동일한 혈액 라인 내로 주입될 수 있다. 그 후, 혈액은 통상적인 혈액여과기 210 내에서 중공 섬유 214를 통해서 흐른다. 투석액을 중공 섬유 214를 둘러싸며 혈액여과기 210 하우징 내에 있는 ESC 내로 주입하며, 투석은 용질이 혈액으로부터 혈액여과 여과막 214 (중공 섬유)을 가로질러서 투석액 내로 "페기물"로 제거됨에 따라서 일어난다. 투석액은 혈액에 대해서 역류 방식으로 흐르며, 투석액은 투석액 펌프 218에 의해서 이동한다. 추가로, 혈액으로부터의 분자 및 체액은 막 전체에 걸친 공극 크기에 따라 한외여과액으로서 혈액여과 여과막 214 (중공 섬유)를 가로질러서 통과한다.
도 2C의 예시적 시스템은 도 5의 SCID 555를 갖는 회로를 나타낸다. 혈액은 혈액여과기 210으로부터 배출되고, ECS 유입구 548에서 SCID 555로 들어간다. 그 후, 혈액은 SCID를 통해서 처리되며, SCID는 상기 도 2A-2B에 대해서 기술된 방식으로 중공 섬유 552 상에서 백혈구를 격리시키고, 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킨다. SCID 555로 들어가고 나가는 혈액 라인은 잠금 기전 256을 갖는 연결부를 사용하여 부착된다. 그 후, 혈액은 혈액 유출 라인에 의해서 ESC 배출구 550으로부터 대상체에게 반송된다. 칼슘과 같은 또 다른 약제는 이 혈액 유출 라인 상의 포트 258에서 주입되어 대상체에게 재-도입시키기 위한 혈액을 제조한다. 특정의 구체예에서, SCID의 모세관내 공간 (ICS)은 각각의 섬유의 루멘의 라이닝 상에서 단일층으로 배양된 제노그래픽 또는 알로그래픽 세포, 예를 들어, 신장 세뇨관 세포를 함유하여 혈액의 처리를 더 도와줄 수 있다. 그러나, 다른 구체예에서 ICS은 세포를 갖지 않는다. 도 2C의 회로에서, SCID 555의 ICS 540은 식염수로 충진되며, ICS의 말단 포트는 캡 544를 갖는다.
도 2D의 회로는 도 2D가 도 6의 SCID 655를 이용하고, 한외여과액이 이 SCID 655에 의해서 생산되는 것을 제외하고는, 도 2C와 동일한 성분을 포함하며, 동일한 방식으로 작동한다. SCID 655를 통한 혈액의 흐름은 도 2B와 관련하여 상술한 바와 같다. 추가로, SCID 655는 도 2B와 관련하여 상술한 바와 같이 작동한다. 상기 언급한 바와 같이, SCID 655는 단지 캡 644가 있는 ICS 유입구만을 갖는다. ICS 배출구 646은 캡을 갖지 않는다. 따라서, 다공성 중공 섬유 652의 특징에 따라 ECS 642 내의 혈액의 일부분은 중공 섬유 652를 가로질러서 한외여과액 (UF)으로 ICS 내로 들어간다. 폐기물로 버릴 수 있는 한외여과액 (UF)를 수집하기 위하여 튜브가 ICS 배출구 646에 연결될 수 있다.
이론적으로 속박됨이 없이, SCID 시스템 (및 도 1, 2A-2B, 3, 및 4A-4F에 도시된 것)의 이들 구체예에서 유동 기하학은 백혈구가 SCID의 ECS 내의 낮은 전단력 환경으로 배출되고, 따라서 SCID 내의 하나 또는 그 이상의 내부 표면, 예를 들어, 중공 섬유와 회합하도록 하는 것으로 생각된다. 반대로, 혈액여과 카트리지 (예를 들어, 도 2C 및 2D의 회로 내의 제1 장치 210)의 전형적인 사용에서, 중공 섬유의 작은 직경의 루멘을 통한 혈액 흐름은 중공 섬유와 백혈구의 회합 및 장치에 의한 백혈구의 격리를 저해하는 (SCID 내의 전단력보다) 더 높은 전단력을 제공한다. 따라서, 반전된 그의 작동 (즉, 중공 섬유 내부가 아닌 중공 섬유 외부에서의 혈액 흐름)을 지지하는 통상적인 유동 회로를 갖는 혈액여과 장치는 잠재적으로 손상성이며 순환성인 활성화된 백혈구를 격리시키는 SCID로 작용할 수 있다. 이들 격리된 백혈구는 백혈구 억제제 (예를 들어, 시트레이트)로 처리될 수 있다.
추가로, 격리된 백혈구의 염증성 반응은 격리 전, 중 및/또는 후에 낮은 Cai (예를 들어, 시트레이트에 의해서 야기됨)의 존재 하에서 억제 및/또는 불활성화되는 것으로 생각된다.
특정의 구체예에서는, 혈액여과기 (예를 들어, 도 2C 및 2D의 혈액여과기 210)에 의해서 생산되는 투석액 및 한외여과액 둘 다가 아니라 단지 한외여과액만이 생산된다. 한외여과 중에, 혈액은 막과 같은 매질을 통해서 여과된 한외여과액과 매질을 통해서 통과하지 않은 농축물 (retentate)로 분리된다. 이러한 타입의 시스템의 한가지 예는 도 3의 시스템 내의 도 7의 SCID 755이다. 간략하면, 이 시스템에서 혈액은 SCID 755의 ECS 유입구 748을 통해서 흘러서 SCID 하우징 754 및 중공 섬유 752에 의해서 한정된 ECS 742 내로 들어가고, SCID 755 내의 ECS 배출구 750을 통해서 유출된다. 추가로, 혈액여과기 210으로부터의 한외여과액 라인 320은 ICS 유입구 745를 거쳐서 SCID 755의 ICS 740과 교통 관계에 있으며, ICS 740에 한외여과액을 제공한다. 여과된 혈액 (ECS 742 내의) 및 한외여과액 (ICS 740 내의)은 분리되지만, 중공 섬유 752의 막을 가로질러서 서로 상호작용할 수 있다. SCID 755의 ICS 740 내의 한외여과액 및 ECS 742 내의 여과된 혈액은 병류 또는 역류 방식으로 흐를 수 있다. 처리된 한외여과액은 SCID 755의 ICS 배출구 746에서 ICS 740으로부터 배출되며, 폐기 생성물로 버릴 수 있다. 따라서, 이 구체예에서 ICS 유입구 745 및 ICS 배출구 746은 캡이 없지만, SCID 755는 다른 식으로는 도 5 및 도 6에 나타낸 것과 실질적으로 동일하다.
더욱 특히, 도 7에 따르는 SCID 755를 사용한 도 3의 시스템에서 혈액은 대상체 (예를 들어, 환자 또는 모든 동물)로부터 혈액 라인 내로 이동한다. 혈액은 펌프 204에 의해서 혈액 라인 전체에 걸쳐서 펌핑된다. 시트레이트와 같은 백혈구 억제제는 임의로 펌프에 의해서 포트 206에서 주입될 수 있다. 그 후, 혈액은 혈액여과기 210의 중공 섬유 내로 들어가고, 상기 도 2C-2D에 대해서 기술된 방식으로 혈액여과기 210의 ECS 내에 침착된다. 한외여과액은 혈액여과기 210의 중공 섬유를 가로질러서 생산되며, 혈액여과기 210의 ECS 내로 침착된다. 그 후, 한외여과액은 혈액여과기 210으로부터 한외여과액 라인 320을 통해서 통과하여 ICS 유입구 745에서 SCID 755 내로 들어간다. 한외여과액은 중공 섬유 752의 ICS 740을 통해서 이동하여 ICS 배출구 746에서 배출된다. 중공 섬유는 다공성, 반-다공성 또는 비-다공성 막일 수 있다.
*혈액여과기 210의 중공 섬유의 ICS (즉, 혈액여과기 210 내의 중공 섬유의 루멘) 내에 잔류하는 여과된 혈액은 혈액여과기 210로부터 배출되어 펌프 300에 의해서 SCID 755의 ECS 유입구 748내로 펌핑된다. 임의로, 이 펌프는 SCID와 대상체 사이의 혈액 라인 상에 배치될 수 있거나, 제3 펌프 (도시되지 않음)가 SCID와 대상체 사이의 혈액 라인 상에 배치될 수 있다. 혈액은 중공 섬유 752를 둘러싸는 ECS 742 내로 흘러 들어간다 (즉, 통로 내에서 이동한다). 활성화되고/되거나 초회 자극된 백혈구와 같은 백혈구는 장치 내에서, 예 중공 섬유 752의 외부 표면에서 격리된다. 그 후, 혈액은 ECS 배출구 750에서 SCID 755로부터 배출되고, 대상체에게 반송된다. 잠금 기전을 갖는 혈액 라인 접속자 256은 혈액 라인을 ECS 유입구 748 및 ECS 배출구 750에 부착시킨다. 칼슘과 같은 또 다른 약제는 대상체에게 반송하는 혈액 유출 라인 상의 포트 258에서 주입되어 대상체에게 재도입시키기 위한 혈액을 제조할 수 있다. 또한, 한외여과액 펌프 304는 한외여과액을 ICS 740으로부터 폐기물로 이동시킨다. 그러나, 시스템 내의 펌프 유속에 따라 한외여과액의 전부 또는 일부가 중공 섬유 752를 가로지를 수 있으며, ECS 742 내의 여과된 혈액에 반송될 수 있거나, 한외여과액은 전혀 이렇게 되지 않을 수도 있다.
도 3에 나타낸 회로에서 도 7의 SCID의 사용은 전-임상시험 중인 100 마리 이상의 대형 동물에서, 및 SCID 및 관류 회로와 관련된 예상하지 못한 부작용이 없이 I, IIa 및 IIb 임상시험 중인 거의 100 명의 환자에게서 평가되었다. ICS는 세포를 갖지 않을 수 있지만, 이 시스템은 임의로, ICS 740 내에 세포, 예를 들어, 신장 세뇨관 세포를 포함할 수 있는 것으로 이해된다. 혈류의 속도는, 예를 들어, 약 100 ㎖/분 내지 약 500 ㎖/분의 혈액 유속으로 섬유와 회합함으로써 백혈구가 격리되도록 다공성 중공 섬유의 표면에서 충분히 낮은 전단력 (본 명세서에 기술된 범위 내임)을 갖도록 선택된다. 대신으로, 체외 회로를 통한, 혈액여과기 210 내의 중공 섬유의 루멘을 통한, 및 SCID 755의 ECS 742를 통한 혈액 유속은 약 120 ㎖/분일 수 있다. 한외여과액은 본 명세서에 기술된 범위 내의 속도로, 예를 들어, 약 50 ㎖/분 미만, 약 5 ㎖/분 내지 약 50 ㎖/분, 및 약 10 ㎖/분 내지 약 20 ㎖/분의 유속으로 이동할 수 있다. 대신으로, 한외여과액 유속은 15 ㎖/분에서 유지될 수 있다. 임의로, 균형잡힌 전해질 대체용액 (예를 들어, 비카보네이트 염기를 함유하는 용액)은 생산된 한외여과액에 대해 1:1 용적 대체로 혈액 라인 내에 주입될 수 있다. 유체 (예를 들어, 한외여과액) 및 혈액 (또는 백혈구-함유 유체)은 동일한 방향으로, 또는 반대 방향으로 흐를 수 있다.
이 구체예 및 다른 구체예에서, SCID를 통한 혈액 유동 배열은 전형적인 혈액여과 카트리지를 통한 혈액 유동 배열과 반대이다. 즉, 혈액은 SCID의 중공 섬유의 외부 주위에 대비하여, 그의 목적하는 용도에서 혈액여과 카트리지의 중공 섬유의 내부를 통해서 흐른다. SCID를 통한 이러한 통상적이지 않은 혈액 유동 배열은 혈액여과기의 중공 섬유의 루멘 내에서의 더 높은 전단력에 비해서 중공 섬유의 외부 표면에서 ECS 내의 더 낮은 전단력을 제공함으로써 SCID의 ECS 내에서 백혈구의 격리를 용이하게 한다. 반대로, 혈액여과기의 중공 섬유의 내부를 통한 혈액 유동은 중공 섬유의 작은 직경 루멘을 통한 혈액 유동에 의해서 야기된 높은 전단력으로 인하여 백혈구 격리를 저해한다. 예를 들어, 시험은 혈액여과기의 중공 섬유의 내부 안에서의 혈액은 1.5×107 dyne/㎠의 전단력을 발생시키는 반면에 SCID의 특정 구체예의 ECS를 통한 혈액 유동은 5.77 dyne/㎠의 전단력, 또는 106 보다 적은 전단력을 발생시키는 것을 나타내었다. 비교를 위해서, 대표적인 동맥벽에서의 전단력은 6 내지 40 dyne/㎠이고, 대표적인 정맥벽에서의 전단력은 1-5 다인/㎠이다. 따라서, 모세관벽은 5 다인/㎠ 미만의 전단응력을 갖는다.
따라서, 일부의 구체예에서 본 발명은 백혈구를 격리하도록 배열된 통로의 부분 내의 표면에서 백혈구가 그 표면과 회합하고, 활성화되고/되거나 초회 자극된 백혈구와 같은 백혈구가 이 부분에서 격리될 수 있도록 충분히 낮은 전단력을 사용한다. 예를 들어, 일부의 구체예에서 1000 dyne/㎠ 미만, 또는 500 dyne/㎠ 미만, 또는 100 dyne/㎠ 미만, 또는 10 dyne/㎠ 미만, 또는 5 dyne/㎠ 미만의 전단력이 백혈구를 격리시키도록 배열된 통로 부분 내의 표면에서 유용하다. 이들 전단력은 본 명세서에 기술된 SCID 구체예 중의 어떤 것에서나 유용할 수 있는 것으로 이해되어야 한다. 혈액여과기 및 SCID와 같은 두 개의 장치를 갖는 특정의 구체예에서, 혈액여과기에서의 혈액 유동과 SCID 내에서의 혈액 유동 사이의 전단력의 차이는 적어도 1000 dyne/㎠일 수 있다.
이들 구체예 및 다른 구체예에서, 통상적이지 않은 유동 배열이 필요한 전단력을 수득하도록 수행되는 한은 (즉, 혈액이 중공 섬유 내부가 아니라 중공 섬유의 외부에서 유동한다면), SCID는 급성 및 만성 혈액투석에서 사용하도록 FDA에 의해서 승인된 통상적인 0.7 ㎡ 폴리설폰 혈액여과기 (예를 들어, 모델 F40, Fresenius Medical Care North America, Waltham, MA, U.S.A.)로 이루어질 수 있다. 유사하게, 이 구체예 또는 어떤 다른 구체예의 체외 관류 회로는 표준 투석 동정맥 혈액 튜빙을 사용할 수 있다. 카트리지 및 혈액 튜빙은 만성 투석에 현재 사용되는 어떤 투석액 송달 펌프 시스템 (예를 들어, Fresenius 2008H)에나 배치될 수 있다.
한가지 예시적 시스템에서, 시스템은 주입기에 의해서 튜빙 내로 주입된 시트레이트 용액의 백 (bag)과 함께 대상체 (혈액 라인)와 연결된 튜빙을 포함한다. 제1 F40 혈액여과기 카트리지는 시트레이트가 혈액 라인에 들어간 후의 지점에서 혈액 라인과 연결된다. 그 후, 혈액 라인 내의 혈액은 말단 포트 유입구로부터 말단 포트 배출구까지 카트리지 내부의 중공 섬유의 내부 (ICS)를 통해서 흐르며, 투석액은 이들 중공 섬유의 외부 및 카트리지 (ECS) 내에서 하나의 측면 포트로부터 제2 측면 포트까지 혈류 유동에 대해서 역류 방식으로 흐른다. 제2 측면 포트로부터 배출되는 투석액/한외여과액 혼합물을 수집한다. 실질적으로 어떤 혈액 세포, 혈소판 또는 혈장도 ICS로부터 ECS로 건너가지 않으며, 실질적으로 어떤 백혈구도 중공 섬유의 내부에 부착하지 않는다. 중공 섬유는 서로에 대해서 병렬식으로 다발로 배열되며, 각각의 섬유는 약 240 마이크로미터의 직경을 갖는다. 또한, 중공 섬유의 공극은 섬유를 통한 약 30 옹스트롬의 분자인 알부민의 통과를 방지하기에 충분히 작으며, 공극은 일반적으로 전체 섬유를 가로지르는 크기이다. 그 후, 여과된 혈액은 튜빙을 통해서 말단 포트 배출구로부터 제2 F40 카트리지 (즉, SCID)의 측면 포트 유입구까지 계속된다. 혈액은 제2 F40 카트리지의 ECS를 통해서 흘러서 측면 포트 배출구에서 카트리지로부터 배출된다. 제2 F40 카트리지 내에서 생산된 모든 한외여과액은 ICS에 들어가고, 말단 포트를 통해서 배출된다. 카트리지의 다른 말단 포트는 캡을 갖는다. 실질적으로 어떤 혈액 세포, 혈소판 또는 혈장도 ECS로부터 ICS로 건너가지 않으며, 백혈구는 약간의 시간 동안 중공 섬유의 외부에 부착한다. 제2 F40 카트리지에서 배출된 혈액은 튜빙 내로 들어가고, 여기에서 칼슘 용액이 주입기를 사용하여 혈액 내에 주입된다. 마지막으로, 튜빙은 처리된 혈액을 대상체에게 반송한다. 특정의 구체예에서, 시스템 내의 혈액 유속은 500 ㎖/분을 초과하지 않으며, 혈액은 어떤 지점에서도 시스템 내의 공기를 교체시키지 않는다. 추가로, 펌핑 및 주입 속도는 전해질 및 백혈구 수의 베드사이드 판독치 (bedside readings)에 비추어서 수동으로 변화될 수 있다. i-STAT® 핸드헬드 (handheld) 모니터링 장치는 대상체로부터 뽑은 소량의 혈액으로부터 이들 판독치를 제공한다.
이러한 시스템을 사용하는 위험은 혈액투석 처리와 연관된 위험과 유사하며, 예를 들어, 관류 회로의 응고, 회로 내로의 공기 도입, 카테터 또는 혈액 튜빙 비틀림 또는 단절, 및 온도 조절곤란을 포함한다. 그러나, 투석 기계 및 회합된 투석 혈액 관류 세트는 처리 중에 경보 시스템에 의해서 이들 문제를 확인하고, 혈병 필터 및 기포 트랩 (trap)에 의해서 대상체에 대한 모든 혈병 또는 공기 색전을 경감시키도록 디자인되었다. 이들 펌프 시스템 및 혈액 튜빙 세트는 이러한 치료 적용을 위해서 FDA 승인된다.
상기 언급한 바와 같이, 백혈구 억제제, 예를 들어, 시트레이트의 주입은 SCID에 대해 국소적이거나, 지역적이거나, 시스템 전체에 걸쳐서 이루어질 수 있다. 이 구체예 또는 어떤 구체예에서라도, 시트레이트는 또한 항응고제로 사용될 수도 있으며, 이 경우에는 시스템 전체를 통한 관류가 유용할 수 있다. 임상적 경험은, 응고가 혈액여과 시스템 내에서 일어난다면, 이것은 제1 투석 카트리지 내에서 개시된다는 것을 시사한다. 전신적 헤파린 또는 지역적 시트레이트와 같은 항응고 프로토콜이 임상적 혈액투석에서 현재 정립되고, 일상적으로 사용된다.
2.C.
심폐우회기
시스템의 일부분으로서 선택적
사이토페레시스
억제장치
도 4A-4F에 나타내고, 본 명세서의 실시예 8 및 9에 기술된 바와 같이, SCID는 수술 (예를 들어, 우회 수술)에 대해 이차적인 염증성 상태를 치료하고/하거나 예방하기 위해서 심폐우회 (CPB) 회로 내에서 사용될 수 있다. 도 4A, 4B, 4D, 4E, 및 4F는 예시적 CPB 시스템 내의 도 5의 SCID를 나타낸다. 도 4C는 예시적 CPB 시스템 내의 도 6의 SCID를 나타낸다. CPB를 사용하여 심장 및 폐의 좌측 및 우측 둘 다로부터 혈액을 우회시킨다. 이것은 심장의 우측으로부터 혈액을 배액하고, 동맥 순환을 관류시킴으로써 달성된다. 그러나, 체폐 측부혈행 (systemic-to-pulmonary collaterals), 체체(systemic-to-systemic) 측부혈행 및 수술 부위 출혈은 심장의 좌측에 반송되며, CPB 중에는 심장의 좌측의 특별한 배액 기전이 필요하다. 임의로, 심장마비가 특별한 펌프 및 튜빙 기전을 통해서 송달될 수 있다. 표준 CPB 시스템은 광범하게 3 가지 서브시스템으로 분류될 수 있는 몇 가지의 특징을 갖는다. 제1 서브시스템은 산소를 공급하고, 혈액으로부터 이산화탄소를 제거하는 산소화-환기 서브시스템이다. 제2 서브시스템은 온도 조절 시스템이다. 제3 서브시스템은 인-라인 모니터 및 안전성 장치를 포함한다.
도 4A에 나타낸 바와 같이, 혈액은 정맥 카눌라 400를 통해서 대상체로부터 혈액 라인 410 내로 이동한다. 혈액은 SCID 유출 라인 430에 연결되는 재순환 접합부 420을 통과하는 혈액 라인 410을 통해서 흐른다. SCID 유출 라인 430은 SCID 장치 555에 의해서 처리된 혈액을 함유한다. 혈액 라인 410 내의 혈액은 SCID-처리된 혈액과 혼합하여, 정맥혈 저혈조 450 쪽으로, 및 혈액이 산소화되는 산소화기 460 쪽으로 계속 진행한다. 산화된 혈액은 이어서 산소화기 460으로부터 SCID 유입 라인 480과의 접합부 470 쪽으로 흐른다. 여기에서는, 혈액 라인 400 내의 혈액의 일부분이 SCID 555에 의한 처리를 위해서 SCID 유입 라인 480을 통해 SCID 555 쪽으로 우회한다. SCID 유입 라인480을 통한 혈액의 유동은 펌프 504에 의해서 조절된다. SCID 555는 염증과 연관된 선택 세포, 예를 들어, 백혈구 또는 혈소판을 격리시키도록 디자인된다. 이 구체예에서는, 백혈구 억제제가 SCID 555에 들어가는 혈액에 첨가되지 않는다. 백혈구를 함유하는 혈액은 ECS 유입구 548에 들어가서 중공 섬유 552를 둘러싸는 ECS 542 내로 이동한다. 백혈구는 이 장치 내에서, 예를 들어, 중공 섬유 552의 외부 표면에서 격리된다. 펌프 504에서의 유속은, 중공 섬유 552의 표면에서 백혈구가 그와 회합하도록 하는 낮은 전단력 (본 명세서에 기술된 범위 내)이 있도록, 본 명세서에 기술된 범위에서 선택될 수 있다. ECS 542 내의 혈액은 ECS 배출구 550을 통해서 SCID로부터 배출되고, SCID 유출 라인 430으로 들어간다. 접합부 470에서, 혈액 라인 410 내의 혈액의 일부분은 또한, 동맥 카눌라 495에서 대상체에게 반송되기 전에 동맥혈 여과기/버블 트랩 490 쪽으로 계속 진행한다.
도 4B의 회로는 SCID 유입 라인 480에서 혈액에 시트레이트를 첨가하기 위한 시트레이트 공급부 (feed) 435 및 시트레이트 펌프 436 및 SCID 유출 라인 430에서 혈액에 칼슘을 첨가하기 위한 칼슘 공급부 445 및 칼슘 펌프 446의 추가의 특징을 가지면서 도 4A의 회로와 유사한 방식으로 흐른다. 시트레이트 (또는 본 명세서에 기술된 또 다른 백혈구 억제제)는 백혈구와 같은 염증과 연관된 세포를 억제하고/하거나 불활성화시키기 위해서 시트레이트 공급부 435로부터 SCID 555 내로 흐르는 혈액에 첨가된다. 칼슘은 대상체에게 재도입시키기 위한 혈액을 제조하기 위해서 혈액에 역으로 첨가될 수 있다.
도 4C의 회로는 혈액여과기/혈액농축기 (HF/HC) 476과 연관된 추가의 특징을 가지면서 도 4B의 회로와 유사한 방식으로 작동한다. 구체적으로, 접합부 470에서 SCID 유입 라인 480을 통해서 SCID 655 쪽으로 우회한 산소화된 혈액의 일부분은 접합부 472에서 SCID 655 쪽으로 흐르는 부분 및 HF/HC 유입 라인 474를 통해서 HF/HC 476 쪽으로 흐르는 별도의 부분으로 더 분할된다. HF/HC는 혈액을 여과하거나 농축시킬 수 있으며, 여기에서 한외여과액은 폐기물 튜브 477을 통해서 장치로부터 지나간다. 여과되거나 농축된 혈액은, 접합부 444에서 SCID 유출 라인 430으로 여과되거나 농축된 혈액을 반송시키는 HF/HC 유출 라인 479를 통해서 HF/HC 476으로부터 배출된다. 도 4C에 나타낸 SCID는 상술한 바와 같은 도 6의 SCID이다. 혈액은 SCID 유출 라인 480으로부터 ECS 유입구 648 내로 흐르고, ECS를 통해서 ECS 배출구 650을 나와서 SCID 유출 라인 430 내로 흐른다. 한외여과액은 SCID 내의 중공 섬유를 가로질러서 (ECS로부터 ICS 쪽으로) 생산될 수 있으며, 한외여과액은 ICS 배출구 646에서 SCID로부터 폐기물 튜브 478 내로 들어간다.
SCID 655 쪽으로의 혈액 유동은 펌프 504에 의해서 조절될 수 있다. 펌프 504는 SCID 처리 후에 백혈구를 억제하거나 불활성화시키는 시트레이트와 같은 약제, 및/또는 칼슘과 같은 또 다른 약제를 주입하는 구체예에서 일정한 유동을 유지시키는데 바람직하다. 대신으로, SCID 쪽으로의 혈액 유동은 단지 약 200 ㎖/5 ℓ (유동 용적의 약 4%)만이 접합부 472에서 SCID 쪽으로 우회하도록, HF/HC 유입 라인 474의 직경에 비해 접합부 472와 SCID 655 사이에서 SCID 유입 라인 480의 더 작은 직경을 선택함으로써 조절될 수 있다. 이것은 격리를 용이하게 할 수 있는 SCID 내의 낮은 전단력을 제공한다.
도 4D-4F에 나타낸 회로는 이들이 혈액을 회로 내에서, 예를 들어, 재순환 접합부 420에서 재순환시키지 않는다는 점에서 도 4A-4C의 회로와는 상이하다. 오히려, 도 4D에 나타낸 바와 같이, 혈액은 정맥 카눌라 400을 통해서 대상체로부터 혈액 라인 410 내로 이동하며, 여기에서 혈액은 직접 정맥혈 저혈조 450로, 및 혈액이 산소화되는 산소화기 460 쪽으로 흐른다. 산소화된 혈액은 이어서 SCID 유입 라인 480에 의해서 산소화기 460으로부터 접합부 470으로 흐른다. 여기에서, 혈액 라인 410 내의 혈액의 일부분은 도 4A에 대해서 상술한 바와 같이, SCID 555에 의한 백혈구의 격리를 위해서 SCID 유입 라인 480을 통해서 SCID 555로 우회한다. SCID 555에서 나온 혈액은 SCID 유출 라인 430으로 들어가고, 접합부 422에서 산소화된 혈액과 혼합된다. SCID로부터의 혈액이 혈액 라인 410 내의 혈액과 혼합된 후에, 이것은 동맥 카눌라 495에서 대상체에게 반송되기 전에 혈액 라인 410 내에서 동맥혈 여과기/버블 트랩 490 쪽으로 계속 진행한다.
도 4E의 회로는 SCID 유입 라인 480에서 혈액에 시트레이트를 첨가하기 위한 시트레이트 공급부 435 및 시트레이트 펌프 436 및 SCID 유출 라인 430에서 혈액에 칼슘을 첨가하기 위한 칼슘 공급부 445 및 칼슘 펌프 446의 추가의 특징을 가지면서 도 4D의 회로와 유사한 방식으로 흐른다. 도 4B에 대해 기술된 바와 같이, 시트레이트 또는 어떤 다른 백혈구 억제제를 시트레이트 공급부 435로부터 혈액에 첨가하여 백혈구와 같은 염증과 연관된 세포를 억제하고/하거나 불활성화시킨다. 칼슘은 대상체에게 재도입시키기 위한 혈액을 제조하기 위해서 혈액에 역으로 첨가될 수 있다.
도 4F의 회로는 혈액 라인 410으로부터의 혈액의 일부분을 SCID 유입 라인 480 쪽으로 우회시키는 접합부 및 SCID-처리된 혈액을 SCID 유출 라인 430을 통해서 혈류 라인 410으로 반송하는 접합부가 회로 내의 동맥혈 여과기/버블 트랩 490 이후에 배치되는 것을 제외하고는 도 4E의 회로와 동일한 방식으로 흐른다. 이들 접합부는 각각 492 및 494로 표지된다. 도 4F는 또한, 상기 언급된 구체예 중의 어떤 것에서라도 사용될 수 있는 열교환기, 추가의 펌프, 가스 미터 및 교환기, 및 모니터와 같은 다른 서브시스템 및 특징을 도시한다. 또한, 도 4A-4F에 기술된 구체예 중의 어떤 것에서라도 SCID는 본 명세서에 기술된 어떤 구체예에 따르는 특징 (예를 들어, SCID와 같은 장치의 배열, 막 특징, 유속)으로 배열될 수 있다.
2.D. 선택적
사이토페레시스
억제장치의 추가의 특징
일부의 구체예에서, 본 발명의 장치는 특정의 장애를 치료 및/또는 예방하기 위해서 배열된다. 그러나, 다수의 상이한 배열이 특정의 장애를 치료 및/또는 예방하기 위해서 사용될 수 있는 것으로 이해된다.
또한, 모든 구체예의 SCID는 수평으로 또는 수직으로 배향될 수 있으며, 온도 조절된 환경에 배치될 수 있다. 세포를 함유하는 SCID의 온도는 바람직하게는 SCID 내에서 세포의 최적 기능을 보장하도록 SCID의 조작 전체적으로 약 37℃ 내지 약 38℃에서 유지된다. 예를 들어, 제안되는 것은 아니지만 가온 블랭킷 (warming blanket)을 사용하여 적절한 온도에서 SCID를 유지시킬 수 있다. 다른 장치가 시스템 내에서 사용된다면, 최적 수행을 위해서 상이한 온도가 필요할 수 있다.
일부의 구체예에서, 본 발명의 장치 및 시스템은 프로세서 (processor) (예를 들어, 컴퓨터 소프트웨어)에 의해서 조절된다. 이러한 구체예에서, 장치는 대상체에서 활성화된 백혈구 레벨의 변화를 검출하고, 프로세서에 이러한 정보 (예를 들어, 백혈구 레벨 및/또는 염증 장애를 발생시키는데 대한 증가된 위험에 관한 정보)를 제공하도록 배열될 수 있다. 일부의 구체예에서, 특정의 활성화된 백혈구 레벨에 도달하거나, 대상체가 염증 장애 (예를 들어, SIRS)를 발생시킬 특정의 위험이 있는 것으로 생각되는 경우에, 대상체의 혈액은 염증 장애가 발생할 가능성을 감소시킬 목적으로 SCID를 통해서 처리된다. 일부의 구체예에서, 장치 또는 시스템은 이들 측정치에 대한 응답으로 자동으로 SCID를 통해서 대상체의 혈액을 처리한다. 다른 구체예에서는, 의료 전문가가 대상체에서 증가된 백혈구 레벨 또는 증가된 위험에 대해 경보를 발하고, 전문가는 치료를 시작한다.
본 발명의 장치는 다양한 키트 또는 시스템 내에 포함될 수 있는 것으로 생각된다. 예를 들어, 키트 또는 시스템은 본 발명의 장치 또는 장치의 다양한 부분, 예를 들어, 중공 섬유 혈액여과기 카트리지, 백혈구 억제제 (예를 들어, 시트레이트와 같은 칼슘 킬레이트화제), 알로그래픽 새포 (예를 들어, 신장 세뇨관 세포), 또는 다른 부분을 포함할 수 있다. 추가로, 키트 또는 시스템은 대상체에게 여과장치를 이식하는데 필요한 다양한 수술기구와 조합될 수 있다.
3. 염증과 연관된 세포의 격리
본 발명의 시스템 및 장치는 대상체로부터 백혈구를 격리시키고, 이들의 염증성 활성 (예를 들어, 염증 반응)을 개선시키도록 배열되어야 하지만, 본 발명의 시스템, 장치 및 방법은 백혈구를 격리시키고, 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화를 용이하게 하는 특정한 디자인 또는 기술로 제한되지 않는다. 백혈구 (예를 들어, 활성화되고/되거나 초회 자극된 백혈구)의 격리는 어떤 시스템, 장치 또는 그의 성분에 의해서나 달성될 수 있다. 용어 "샘플" 및 "검체"는 그들의 가장 광범한 개념으로 사용된다. 한편으로, 이들은 검체 또는 배양물을 포함하는 것을 의미한다. 다른 하편으로, 이들은 생물학적 및 환경적 샘플 둘 다를 포함하는 것을 의미한다. 이들 용어는 소변, 혈액, 혈청, 혈장, 배설물질 (fecal matter), 뇌척수액 (CSF), 정액 및 타액뿐만 아니라 고체 조직을 포함하는 (단, 이들로 제한되지는 않음), 인간 및 다른 동물로부터 수득한 모든 타입의 샘플을 포함한다. 그러나, 이들 예는 본 발명에 적용할 수 있는 샘플 타입을 제한하는 것으로 해석되지는 않는다. 본 명세서의 문맥에서 용어 샘플은 빈번하게 대상체로부터의 혈액을 나타낸다. 용어 "혈액"은 모든 관점에서의 혈액, 예를 들어, 전체 혈액, 처리된 혈액, 여과된 혈액, 또는 혈액으로부터 유도된 모든 액체를 나타낸다.
본 발명의 시스템 또는 장치에서, 생물학적 샘플 또는 그의 하나 또는 그 이상의 부분이 흐르기 위한 하나 또는 그 이상의 통로는 백혈구를 격리시키는 다양한 방식 중의 어떤 것에 의해서나 배열될 수 있다. 하나보다 많은 통로가 사용되는 경우에, 이들은 직렬로 및/또는 병렬로 배치될 수 있다. 일부의 구체예에서, 하나 또는 그 이상의 통로는 카트리지, 예를 들어, 일회용 카트리지 내에 함유될 수 있다. 통로 또는 통로 부분은 어떤 수의 표면, 예를 들어, 1, 2, 3, 4, 5, 10, 20, 50, 100 개, 또는 그 이상의 표면에 의해서 한정될 수 있다. 표면의 예로는 원통형 장치 벽 및 평평한 장치 벽과 같은 장치의 벽, 및/또는 본 명세서에 기술된 중공 섬유의 외부 표면이 포함되나, 이들로 제한되지는 않는다.
통로 또는 통로 부분을 한정하는 표면은 백혈구를 격리시키는 다양한 형태로부터 선택될 수 있다. 예를 들어, 평평한 표면 (예를 들어, 시트), 만곡된 표면 (예를 들어, 중공 튜브 또는 섬유), 패턴화된 (patterned) 표면 (예를 들어, z-접힘 시트 또는 오목한 표면), 불규칙적-형상의 표면, 또는 다른 배열이 백혈구를 격리시키기 위하여 배열된 통로 (또는 그의 부분) 내에서 사용될 수 있다. 이들 표면 중의 어떤 것이라도 공극을 포함할 수 있으며, 다공성, 선택적-다공성 또는 반-다공성일 수 있다. 예를 들어, 표면은 막일 수 있다. 용어 "막"은 표면의 양면 상에서 유체, 또는 표면의 한 면에서는 유체 및 다른 면에서는 가스를 수용할 수 있는 표면을 나타낸다. 막은 일반적으로, 이것을 그를 통해서 유체 또는 가스를 유동시킬 수 있도록 다공성 (예를 들어, 선택적-다공성 또는 반-다공성)이다. 본 명세서에서 표면 또는 막을 기술하기 위해서 사용된 것으로서, 용어 "다공성"은 일반적으로 다공성, 선택적-다공성 및/또는 반-다공성 표면 또는 막을 포함한다. 또한, 입자 (예를 들어, 비드) 표면, 통로 내로의 하나 또는 그 이상의 사출부의 표면, 또는 유동하는 생물학적 샘플에 노출된 하나 또는 그 이상의 막의 표면과 같은 통로 또는 통로 부분 내의 추가의 표면 (통로를 한정하거나 하지 않을 수 있음)이 백혈구 격리를 용이하게 할 수 있다. 이들 추가의 표면은 또한, 평평한 표면, 만곡된 표면, 패턴화된 표면, 불규칙적-형상의 표면, 및 상술한 다른 배열, 및 이하에 기술되는 재료 중에서 선택될 수도 있으며, 이하에 기술된 강화가 이루어질 수 있다.
백혈구를 격리하도록 배열된 통로 또는 통로 부분의 일부분이고/이거나 이를 한정하는 통로 표면 또는 통로 부분 표면 (예를 들어, 중공 섬유의 외부 표면)은 특정한 타입, 종류 또는 크기로 제한되지 않으며, 어떤 적절한 물질로도 제조될 수 있다. 예를 들어, 표면은 나일론, 폴리에틸렌, 폴리우레탄, 폴리에틸렌 테레프탈레이트 (PET), 폴리테트라플루오로에틸렌 (PTFE), 폴리아릴에테르설폰, 큐프로판 (CUPROPHAN; 큐르파모늄 방법을 이용하여 제생된 셀룰로즈, 엔카 (Enka)로부터 이용할 수 있음), 헤모판 (HEMOPHAN; 개선된 생체적합성을 갖는 변형된 큐프로판, 엔카로부터 이용할 수 있음), 큐프라모늄 레이온 (CUPRAMMONIUM RAYON; 다양한 규프로판, 아사히 (Asahi)로부터 이용할 수 있음), 바이오멤브레인 (BIOMEMBRANE; 아사히로부터 이용할 수 있는 큐르파모늄 레이온), 비누화된 셀룰로즈 아세테이트 (예를 들어, 테이진 (Teijin) 또는 CD 메디칼 (CD Medical)로부터 이용할 수 있는 섬유), 셀룰로즈 아세테이트 (예를 들어, 토요보 니프로 (Toyobo Nipro)로부터 이용할 수 있는 섬유), 셀룰로즈 (예를 들어, 각각 테루모 (Terumo) 또는 텍스티콤비나트 (Textikombinat, Pirna, GDR)로부터 입수할 수 있는 변형된 큐르라모늄 방법에 의해서, 또는 비스코스 방법을 이용하여 재생된 것), 폴리아크릴로니트릴 (PAN), 폴리설폰, 아크릴릭 코폴리머 (예를 들어, 호스팔 (Hospal)로부터 이용할 수 있는 아크릴로니트릴-NA-메탈릴-설포네이트 코폴리머), 폴리카보네이트 코폴리머 (예를 들어, 갬브로 (Gambro)로부터 이용할 수 있는 섬유인 갬브론 (GAMBRONE)), 폴리메틸메타크릴레이트 코폴리머 (예를 들어, 토레이 (Toray)로부터 이용할 수 있는 섬유), 및 에틸렌 비닐 코폴리머 (예를 들어, 큐라레이 (Kuraray)로부터 이용할 수 있는 에틸렌-비닐 알콜 코폴리머인 에발 (EVAL)) 중의 하나 또는 그 이상을 포함하는 어떤 생체적합성 폴리머라도 될 수 있다. 대신으로, 표면은 나일론 메시 (mesh), 면 메시, 또는 직조된 섬유일 수 있다. 표면은 일정한 두께 또는 불규칙적인 두께를 가질 수 있다. 일부의 구체예에서, 표면은 실리콘, 예를 들어, 실리콘 나노가공된 막 (참조: 예를 들어, 미국 특허공보 제20040124147호)을 포함할 수 있다. 일부의 구체예에서, 표면은 폴리설폰 섬유를 포함할 수 있다. 다른 적합한 생체적합성 섬유는 본 기술분야에서, 예를 들어, 문헌 [Salem and Mujais (1993) Dialysis Therapy 2d Ed., Ch. 5: Dialyzers, Eds. Nissensen and Fine, Hanley & Belfus, Inc., Philadelphia, PA]에 공지되어 있다. 중공 섬유를 포함하는 카트리지는 특정한 크기 (예를 들어, 길이, 폭, 중량 또는 다른 크기)로 제한되지 않는다.
통로는 표면의 어떤 조합이라도 포함할 수 있다. 예를 들어, 통로 또는 통로 부분의 표면(들)은 평평, 만곡, 패턴화 및/또는 불규칙적 형상의 외관의 어떤 조합이라도 포함할 수 있다. 또한, 통로 또는 통로 부분은 하나 이상의 재료의 표면에 의해서 한정될 수 있거나, 이러한 표면을 포함할 수 있다. 또한, 통로는 두 개 또는 그 이상의 부분을 포함할 수 있다. 이들 상이한 부분은 동일하거나 상이한 표면을 가질 수 있다.
상기 검토한 바와 같이, 성공적으로 사용된 SCID의 한 구체예는 중공 섬유를 함유하는 하우징을 포함한다. 혈액을 위한 통로는 하우징의 내부 및 중공 섬유의 외부에 의해서 한정된다. 혈액으로부터의 백혈구는 통로 내의 특정한 부분과, 특히 중공 섬유의 외부 표면과 회합한다. 따라서, 특정한 구체예에서, 백혈구를 격리시키도록 배열된 통로 부분은 더 작은 분자가 그 전체에 걸쳐서 통과하지만, 더 큰 분자 및/또는 세포는 막을 따라서 흐르도록 만드는 다공성 막을 포함할 수 있다. 또한, 특정의 구체예에서, 백혈구를 격리시키도록 배열된 통로 부분은 하우징의 표면에 의해서 한정되며, 생물학적 샘플 (예를 들어, 대상체의 혈액 또는 여과된 혈액)이 이들 표면에 걸쳐서 (즉, 중공 섬유에 걸쳐서) 흐르도록 배열된 중공 섬유의 외부 표면 또는 표면들에 의해서 한정되며, 이들을 포함할 수 있다 [참조: 예를 들어, 도 1]. 중공 섬유는 다공성, 반-다공성 또는 비-다공성일 수 있으며, 상이한 유체 (예를 들어, 한외여과액)는 임의로 중공 섬유 내에서 흐르거나, 그 안에 존재할 수 있다. 섬유는 본 명세서에 기술된 어떤 적합한 물질로부터나 형성될 수 있다.
일부의 구체예에서, 본 발명의 시스템, 장치 및 방법은 바람직한 시간 동안, 예를 들어, 1 내지 59 초, 1 내지 59 분, 1 내지 24 시간, 1 내지 7일, 1 주일 또는 그 이상, 1 개월 또는 그 이상, 또는 1 년 또는 그 이상 동안 백혈구를 격리시키도록 배열된다. 일부의 구체예에서, 장치는 후속으로 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화를 허용하기에 충분한 시간 동안 백혈구를 격리시키도록 배열된다.
예를 들어, 생물학적, 화학적, 기계적 및/또는 물리적 기술을 포함한, 백혈구의 격리를 용이하게 하는 어떤 기술 또는 기술의 조합이라도 사용될 수 있다. 일부의 구체예에서는, 격리시키기 위한 생물학적 또는 화학적 기술이 사용될 수 있다. 이러한 기술에는 백혈구를 격리시키기 위해서 조직, 세포, 생체분자 (예를 들어, 단백질 또는 핵산), 또는 소분자를 사용하는 것을 포함한다. 백혈구가 활성화되면, 백혈구에 의해서 셀렉틴이 생산된다. 이렇게 변화된 셀렉틴 생산은 백혈구와 다른 백혈구 사이의 결합을 용이하게 할 수 있다. 다시, 백혈구 사이의 결합은 추가로 결합된 백혈구 내에서의 셀렉틴 생산을 증가시켜 백혈구의 기하급수적인 결합을 수득할 수 있다. 따라서, 셀렉틴은 격리를 증진시키는데 유용할 수 있다. 백혈구를 결합시키는 것으로 알려진 단백질, 단백질 컴플렉스, 및/또는 단백질 성분에는 CD11a, CD11b, CD11c, CD18, CD29, CD34, CD44, CD49d, CD54, 포도칼릭신, 엔도뮤신, 글리코사미도글리칸 세포 부착 분자-1 (GlyCAM-1), 점막 어드레신 세포 부착 분자-1 (MAdCAM-1), E-셀렉틴, L-셀렉틴, P-셀렉틴, 피부 림프구 항원 (CLA), P-셀렉틴 당단백질 리간드 1 (PSGL-1), 백혈구 기능적 항원-1 (LFA-1), Mac-1, 백혈구 표면 항원 p150,95, 백혈구 인테그린 CR4, 매우 후기의 항원-4 (VLA-4), 림프구 파이어 패치 (Peyers patch) 부착 분자-1 (LPAM-1), 세포내 부착 분자-1 (ICAM-1), 세포내 부착 분자-2 (ICAM-2), 세포내 부착 분자-3 (ICAM-3), 불활성화된 C3b (C3bi), 피브리노겐, 피브로넥틴, 말초 림프절 어드레신 (PNAd), 내피 혈관 부착 단백질 1 (VAP-1), 프랙탈카인 (fractalkine), CCL19, CCL21, CCL25, 및 CCL27이 포함된다. 백혈구를 결합시키는 것으로 알려진 다른 대분자에는 히알우론산, 글리코사미노글리칸 (GAGs), 및 푸코실화 올리고사카라이드 및 이들의 전구체가 포함된다. 특정의 구체예에서, 백혈구를 격리시키기 위해서 사용된 소분자 또는 부착제 (adherents)에는 아미노산 서열 아르기닌-글리신-아스파르트산 (RGD)을 포함하는 펩타이드와 같은 펩타이드, 및 시알산을 포함하는 분자가 포함되나, 이들로 제한되지는 않는다. 따라서, 이들 물질 중의 어떤 것도 격리를 증진시키기 위해서 사용될 수 있다.
사용 시에, 이들 생물학적 또는 화학적 물질은 어느 것이라도 본 발명의 시스템 또는 장치의 표면에 (예를 들어, SCID의 통로 내에서) 결합되어 격리를 용이하게 하거나 증진시킬 수 있다. 대신으로, 또는 조합하여, 이들 물질 중의 어떤 것은 본 발명의 시스템 또는 장치 중에서 용액 상태일 수 있다. 이 경우에, 물질은 추가의 기술과 협력하여 백혈구를 격리시킬 수 있다. 예를 들어, 이들 물질은 용액 중의 백혈구를 응집시켜 단일 백혈구의 크기에 비해서 전체적인 크기를 증가시킴으로써 결합시킬 수 있다. 그 후, 응집된 백혈구는 특정한 공극 크기를 갖는 막에 의해서 포착될 수 있다.
일부의 구체예에서, 본 발명의 시스템 또는 장치는 기계적 힘의 조절을 통해서 백혈구의 체류를 달성한다. 예를 들어, 백혈구는 백혈구와 표면(들) 사이의 전단력을 최소화하여 백혈구가 표면(들)과 회합하도록 하는 유속 및 장치 배열을 이용함으로써, 통로 또는 통로 부분의 (또는 그 안의) 하나 또는 그 이상의 표면 (예를 들어, 다공성 중공 섬유의 외부) 상에 격리될 수 있다. 유동 백혈구와 격리 표면(들) 사이의 유용한 전단력은 1000 dyne/㎠ 미만, 또는 500 dyne/㎠ 미만, 또는 100 dyne/㎠ 미만, 또는 10 dyne/㎠ 미만, 또는 5 dyne/㎠ 미만의 전단력을 포함한다. 이들 전단력을 달성하는데 유용한, 본 발명에 따르는 시스템 및 장치를 통한 혈액의 예시적인 유속은 예를 들어, 약 500 ㎖/분 미만, 약 100 ㎖/분 내지 약 500 ㎖/분, 및 약 200 ㎖/분 내지 약 500 ㎖/분을 포함한다.
일부의 구체예에서, 장치는 격리되는 백혈구의 양 및/또는 백혈구가 장치 내에서 격리되는 시간을 증가시키기 위해서, 막 또는 필터와 같은 표면을 사용하거나, 백혈구를 증가된 통로 표면적, 예를 들어, 약 0.2 ㎡ 초과, 또는 약 0.2 ㎡ 내지 약 2.0 ㎡, 또는 약 0.5 ㎡ 내지 약 1.0 ㎡, 또는 약 0.7 ㎡의 표면적에 노출시킴으로써 백혈구를 예를 들어, 하나 또는 그 이상의 통로 표면 또는 그의 일부분에 물리적으로 잔류시킬 수 있다.
일부의 구체예에서, 시스템은 백혈구를 격리시키도록 배열된 구역의 길이 및 그 안에서 백혈구의 체류시간을 증가시키기 위해서, 백혈구를 일련의 장치, 예를 들어, 각각 하나 또는 그 이상의 격리 통로 또는 통로 부분을 포함하는 2, 4, 10, 20 개 또는 그 이상의 카트리지 (예를 들어, 중공 섬유 카트리지)에 적용함으로써 격리를 달성할 수 있다. 전술한 구체예 중의 어떤 것에서도, 장치는 격리 전, 중 또는 후에 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화를 허용하는 방식으로 백혈구의 격리를 달성하도록 배열된다. 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화는 격리 중, 및 본 발명의 통로, 통로 부분 또는 전체 시스템을 통한 수송 중 모두에서 성취될 수 있다.
본 명세서에 기술된 격리기술은 또한, 혈소판에도 적용할 수 있는 것으로 이해되어야 한다. 혈소판의 경우에는, 상술한 것과 유사한 생물학적, 화학적, 기계적 및/또는 물리적 기술을 사용하여 혈소판을 격리시킬 수 있다. 특정의 구체예에서, 혈소판을 격리시키기 위해서 사용된 약제는 당단백질 Ibα (GPIbα), 당단백질 IIb (GPIIb), 당단백질 IIIa (GPIIIa), CD41, CD61, 폰 빌레브란트 (von Willebrand) 인자, β2-인테그린 대식세포 항원-1, P-셀렉틴과 같은 셀렉틴, 및 세포-부착 분자 중의 하나 또는 그 이상을 포함한다.
4. 염증과 연관된 세포의 억제 및/또는 불활성화
대상체 내에서 염증성 반응이 방지되고/되거나 감소되도록 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 초회 자극되거나 활성화된 백혈구와 같은 백혈구를 불활성화시키기 위해서 본 발명의 시스템 및 장치는 배열되고, 본 발명의 방법이 디자인된다. 다양한 기술이 사용될 수 있다. 예를 들어, 일부의 구체예에서, 장치 및 시스템은 백혈구 (예를 들어, 격리된 활성화 및/또는 초회 자극된 백혈구)를 백혈구 억제제에 노출시킴으로써 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시킬 수 있다. 백혈구 억제제는 통로의 표면, 예를 들어, 중공 섬유에 공유적으로 또는 비공유적으로 결합될 수 있다. 추가로 또는 대신으로, 백혈구 억제제는 백혈구의 격리 전, 중 또는 후에, 예를 들어, 막 표면에서 또는 그에 근접하여 장치 또는 시스템 내로 주입될 수 있다. 언급한 바와 같이, 개념 증명 (proof-of-concept) SCID는 시트레이트에 의해서 백혈구를 처리하여 증가된 대상체 생존을 유도하였다.
본 발명은 백혈구 억제제의 특정한 타입 또는 종류로 제한되지 않는다. 백혈구 억제제에는 예를 들어, 항염증성 생물학적 약제, 항염증성 소분자, 항염증성 약물, 항염증성 세포, 및 항염증성 막이 포함된다. 일부의 구체예에서, 백혈구 억제제는 비-스테로이드성 항염증성 약물 (NSAIDs), 항-사이토킨, 이마티니브 메실레이트, 소라페니브, 수니티니브 말레이트, 항-케모킨, 면역억제제, 세린 백혈구 억제제, 산화질소, 다형핵 백혈구 억제제 인자, 분비성 백혈구 억제제, 및 칼슘 킬레이트화제를 포함하는 것으로 (단, 이들로 제한되지는 않음) 활성화된 백혈구 활성을 억제할 수 있는 어떤 물질 또는 화합물이라도 된다. 칼슘 킬레이트화제의 예로는 시트레이트, 나트륨 헥사메타포스페이트, 에틸렌 디아민 테트라아세트산 (EDTA), 트리에틸렌 테트라민, 디에틸렌 트리아민, o-페난트롤린, 옥살산 등이 포함되나, 이들로 제한되지는 않는다. 백혈구 억제제는 안지오게닌, MARCKS, MANS, 보체 인자 D, 디설파이드 C39-C92 함유 트립신 안지오게닌 단편 LHGGSPWPPC92QYRGLTSPC39K (SEQ ID NO: 1) 및 그의 합성 동족체를 포함하는 (단, 이들로 제한되지는 않음) 것으로서 백혈구 또는 면역세포를 억제하는 것으로 공지된 어떤 단백질 또는 펩타이드라도 될 수 있으며; 억제제는 또한, 백혈구로부터 전-염증성 물질의 방출의 억제를 용이하게 하고/하거나 백혈구를 불활성화시킬 수 있는 것으로 문헌 [Tschesche et al . (1994) J. Biol. Chem. 269(48): 30274-80, Horl et al . (1990) PNAS USA 87: 6353-57, Takashi et al . (2006) Am. J. Respirat. Cell and Molec. Biol. 34: 647-652, 및 Balke et al. (1995) FEBS Letters 371: 300-302]에 보고된 이들 단백질, 펩타이드 및 동족체일 수도 있다. 또한, 백혈구 억제제는 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키는 것으로 공지된 어떤 핵산이라도 될 수 있다. 백혈구 억제제는 용액 상태이거나 동결건조될 수 있다.
백혈구 억제제의 어떤 양 또는 농도라도 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키기 위해서 사용될 수 있다. 백혈구 억제제는 본 기술분야에서 공지된 어떤 방법에 의해서라도 시스템의 통로, 통로 부분, 장치, 장치 부분, 또는 시스템 부분에 도입될 수 있다. 예를 들어, 백혈구 억제제는 포트에서 주입될 수 있다. 통로에 주입된 백혈구 억제제의 양은 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 동일한 통로 내에서 또는 인접한 통로 내에서 격리된 백혈구를 불활성화시키는데 충분할 수 있다. 일부의 구체예에서, 백혈구 억제제, 예를 들어, 시트레이트는 다른 기능을 수행하며 백혈구를 격리시키지 않는 장치를 포함한 시스템, 시스템의 부분, 또는 시스템 내의 하나 또는 그 이상의 장치 내로 주입될 수 있다. 더욱 특히, 백혈구 억제제 (예를 들어, 시트레이트)는 백혈구를 격리시키는 통로 내에, 또는 그로부터 상류 또는 하류에서 주입될 수 있다. 대신으로, 백혈구 억제제는 시스템 내의 하나 또는 그 이상의 통로, 통로 부분, 장치, 또는 시스템 부분 내에 함유될 수도 있다. 예를 들어, 백혈구 억제제는 백혈구를 격리시키도록 배열된 통로 내, 또는 또 다른 통로 내의 표면에 백혈구로부터 전-염증성 물질의 방출을 억제하고/하거나 백혈구를 불활성화시키는데 충분한 양으로 결합될 수 있다.
백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화는 백혈구의 격리 전, 중 및/또는 후에 일시적으로 일어날 수 있다. 또한, 백혈구는 격리 후에 일정한 시간 동안 억제되거나 불활성화된 채로 유지될 수 있다. 특정의 구체예에서, 백혈구는 백혈구가 표적 농도의 백혈구 억제제에 노출되거나, 시트레이트와 같은 백혈구 억제제로부터 제공되는 표적으로 Cai의 농도 (일반적으로, 약 0.20 mmol/ℓ 내지 약 0.40 mmol/ℓ)에 노출되는 기간 동안 억제되거나 불활성화될 수 있다. 백혈구가 표적 농도의 백혈구 억제제 또는 표적 농도의 Cai에 노출되는 기간은 백혈구가 격리되는 기간에 앞서거나, 그 기간을 포함하고/하거나 그 기간 이후일 수 있다. 특정의 구체예에서, 백혈구는 백혈구 억제제에 노출시킨 후의 일정 기간 동안 계속 억제 또는 불활성화되거나, 억제 또는 불활성화된 채로 유지될 수 있다.
백혈구 억제제에 대한 노출 시간은 사용된 약제, 백혈구 활성화의 정도, 전-염증성 물질의 생산 정도, 및/또는 염증성 상태가 환자의 건강을 손상시키는 정도에 따라 달라질 수 있다. 노출은 예를 들어, 1 내지 59 초, 1 내지 59 분, 1 내지 24 시간, 1 내지 7일, 1 주일 또는 그 이상, 1 개월 또는 그 이상, 또는 1 년 또는 그 이상일 수 있다. 백혈구 억제제는 시스템의 운전 전 또는 중에 시스템에 적용될 수 있다. 특정의 구체예에서, 백혈구 억제제는 시스템의 운전 중에 적용되며, 시스템에 적용된 백혈구 억제제의 양은 모니터링된다.
일부의 구체예에서, 백혈구 억제제는 시스템 내로 적정될 수 있다 (예를 들어, 도 2A-2D 및 3에 나타낸 바와 같은 포트 206에서, 또는 도 4B, 4C, 4E, 및 4F에 나타낸 바와 같은 공급부 435 및 펌프 436으로부터). 적정은 모니터링된 혈액 특징에 대비하여 조정될 수 있다. 예를 들어, 시트레이트는 혈액 내의 Cai를 특정의 레벨에서, 예를 들어, 약 0.2 내지 약 0.4 mmol/ℓ의 Cai 농도에서 유지시키기 위해서 시스템 내로 적정될 수 있다. 생물학적으로 적합한 모든 타입의 시트레이트, 예를 들어, 0.67% 트리나트륨 시트레이트 또는 0.5% 트리나트륨 시트레이트가 사용될 수 있다 [참조: 예를 들어, Tolwani et al . (2006) Clin. J. Am. Soc. Nephrol. 1: 79-87]. 일부의 구체예에서, 대상체에게 재도입시키기 위한 혈액을 재조정하기 위해서 제2 용액을 백혈구로부터 전-염증성 물질의 방출의 억제 및/또는 백혈구의 불활성화 후에 시스템에 첨가할 수 있다 (예를 들어, 도 2A-2D 및 3에 나타낸 포트 258에서, 또는 도 4B, 4C, 4E, 및 4F에 나타낸 공급부 445 및 펌프 446으로부터). 예를 들어, 칼슘 킬레이트화제가 백혈구 억제제로 사용되는 구체예에서, 칼슘은 대상체에게 재도입시키기 전에 역으로 혈액 내에 첨가될 수 있다.
한가지 구체예에서, 시트레이트 용액, 예를 들어, ACD-A (Baxter Fenwal, Chicago IL; 100 ㎖당 함량: 25℃에서 덱스트로즈 2.45 g, 나트륨 시트레이트 2.2 g, 시트르산 730 ㎎, pH 4.5-5.5)를 함유하는 1000 ㎖ 백은 주입 펌프에 부착된 다음에, 시스템의 동맥 라인 (대상체로부터 장치로의 유출물)에 부착될 수 있다 (예를 들어, 포트 206에서; CPB 상황에서 대상체로부터의 유출물은 정맥 라인으로 불리며, 주입은 예를 들어, 공급부 435 및 펌프 436으로부터 일어난다). 음압 밸브 (negative pressure valve)를 사용하여 시트레이트 펌프 기능 (혈액 펌프에 인접한 음압 영역 내로의 주입)을 용이하게 할 수 있다. 시트레이트 주입의 초기 속도는 일정할 수 있으며, 예를 들어, ㎖/시간으로 ㎖/분의 혈액 유속의 약 1.5 배일 수 있다 (예를 들어, 혈액 유속이 약 200 ㎖/분이면, 시트레이트 주입의 초기 일정 속도는 약 300 ㎖/시간일 수 있다). 또한, 약 20 ㎎/㎖ 농도의 염화칼슘 주입이 시스템의 정맥 포트 근처에서 첨가될 수 있다 (예를 들어, 포트 258에서; CPB 상황에서 유사한 위치는 도 4B, 4C, 4E, 및 4F에서 공급부 445 및 펌프 446으로 나타낸다). 초기 칼슘 주입은 시트레이트 주입 속도 (예를 들어, 30 ㎖/시간)의 10%로 설정될 수 있다. Cai는 연속적으로 또는 다양한 시간에, 예를 들어, 처음 8 시간 동안은 매 2 시간마다, 그 후에는 다음 16 시간 동안 매 4 시간마다, 다음으로 그 후에는 매 6 내지 8 시간마다 모니터링될 수 있다. 모니터링은 필요에 따라 증가될 수 있으며, 시스템 내의 하나 이상의 위치에서, 예를 들어, 시트레이트 주입 이후 및 칼슘 주입 이후에 모니터링될 수 있다.
예시적인 시트레이트 및 염화칼슘 적정 프로토콜은 각각 표 1 및 표 2에 나타내었다. 이 구체예에서, SCID 내의 표적 Cai 범위는 시트레이트 (예를 들어, ACD-A 시트레이트 용액)의 주입에 의해서 달성된 Cai 표적 농도에 의해서 약 0.20 mmol/ℓ 내지 약 0.40 mmol/ℓ이다. 이것은 동적 방법 (dynamic process)이기 때문에, 시트레이트 주입의 속도는 SCID 내에서 표적 Cai 범위를 달성하도록 변화시키는 것이 필요할 수 있다. 이렇게 하기 위한 프로토콜은 이하에 나타내었으며, 주입은 상술한 주입점에서 일어난다.
|
회로 이온화된
Ca
2
+
( SCID 와 환자 사이에서) |
ACD
-A
시트레이트
용액에 의한 주입 조정
(상술한 바와 같음) |
| 회로 이온화된 Ca2 +가 0.20 mmol/ℓ 미만인 경우 | 시트레이트 주입의 속도는 5 ㎖/시간만큼 감소한다. |
| 회로 이온화된 Ca2 +가 0.20-0.40 mmol/ℓ (최적 범위)인 경우 | 시트레이트 주입의 속도에 대한 변화는 없다. |
| 회로 이온화된 Ca2 +가 0.41-0.50 mmol/ℓ인 경우 | 시트레이트 주입의 속도는 5 ㎖/시간만큼 증가한다. |
| 회로 이온화된 Ca2 +가 0.50 mmol/ℓ 이상인 경우 | 시트레이트 주입의 속도는 10 ㎖/시간만큼 증가한다. |
|
환자 이온화된
Ca
2
+
(환자로부터 전신적으로 채취함) |
Ca 2 + 주입 (20 ㎎/㎖ CaCl 3 ) 조정 |
| 환자 이온화된 Ca2 +가 1.45 mmol/ℓ 이상인 경우 | CaCl2 주입의 속도는 10 ㎖/시간만큼 감소한다. |
| 환자 이온화된 Ca2 +가 1.45 mmol/ℓ (최대 허용량)인 경우 | CaCl2 주입의 속도는 5 ㎖/시간만큼 감소한다. |
| 환자 이온화된 Ca2 +가 0.90 mmol/ℓ (최소 허용량)인 경우 | CaCl2 주입의 속도는 5 ㎖/시간만큼 증가한다. |
| 환자 이온화된 Ca2 +가 0.90 mmol/ℓ 미만인 경우 | 10 ㎎/㎏ CaCl2 볼루스를 투여하고, CaCl2 주입의 속도는 10 ㎖/시간만큼 증가한다. |
| 디폴트 범위 (바람직한 표적 레벨) | 1.0-1.2 mmol /ℓ |
본 명세서에 기술된 불활성화 기술은 또한, 혈소판에 적용할 수 있는 것으로 이해되어야 한다. 특정의 구체예에서, 혈소판을 불활성화시키고/시키거나 혈소판으로부터 전-염증성 물질의 방출을 억제하기 위해서 사용된 약제에는 트롬빈, 안티트롬빈 III, 메글라트란, 헤루딘, 단백질 C 및 조직인자 경로 억제제를 억제하는 약제가 포함되나, 이들로 제한되지는 않는다. 또한, 일부의 백혈구 억제제는 혈소판 억제제로 작용할 수 있다. 예를 들어, 시트레이트, 나트륨 헥사메타포스페이트, 에틸렌 디아민 테트라아세트산 (EDTA), 트리에틸렌 테트라민, 디에틸렌 트리아민, o-페난트롤린 및 옥살산과 같은 칼슘 킬레이트화제는 혈소판을 불활성화시키고/시키거나 혈소판으로부터 전-염증성 물질의 방출을 억제할 수 있다.
5. 적응증
본 발명의 방법, 장치 및 시스템은 염증과 연관된 다수의 상태를 치료 및/또는 예방하기 위해서 사용될 수 있다. 본 명세서에서 사용된 것으로서, 용어 "염증성 상태"에는 모든 염증성 질병, 모든 염증성 장애, 및/또는 유기체의 면역세포가 활성화된 백혈구 활성화된 장애가 포함된다. 이러한 상태는 (i) 병리학적 후유증을 갖는 지속적인 염증성 반응 및/또는 (ii) 조직 파괴를 유도하는 백혈구, 예를 들어, 단핵세포 및 호중구의 침윤을 특징으로 할 수 있다. 염증성 상태에는 대상체 내에서 일어나는 원발성 염증성 질병 및/또는 의학적 과정에 대한 반응으로 일어나는 이차적 염증성 장애가 포함된다. 본 발명의 시스템, 장치 및 방법은 어떤 대상체에 대한 모든 염증성 상태를 치료할 수 있다. 본 명세서에서 사용된 것으로서, 용어 "대상체"는 특정한 진단적 시험 또는 치료의 수용주인 인간 (예를 들어, 포유동물), 비-인간 영장류, 설치류 등을 포함하는 (단, 이들로 제한되지는 않음) 모든 동물 (예를 들어, 포유동물)을 의미한다.
백혈구, 예를 들어, 호중구는 전신적 염증반응 증후군 (SIRS), 패혈증, 허혈/재관류 손상 및 급성 호흡부전 증후군 (ARDS)을 포함하는 다수의 임상적인 염증성 상태의 병인론 및 진행에 대한 주된 기여물질이다. 몇 가지의 상이하며 다양한 타입의 백혈구가 존재하지만; 이들은 모두 조혈성 줄기세포로 알려진 골수에서 만능세포로부터 생산 및 유도된다.
백색 혈액 세포로 또한 알려져 있는 백혈구는 혈액 및 림프계를 포함한 신체 전체에 걸쳐서 발견된다. 여기에는 과립구 및 무과립구를 포함하는 몇 가지 상이한 타입의 백혈구가 있다. 과립구는 광학 현미경 하에서 관찰하는 경우에, 그들의 세포질에서 상이하게 염색된 과립이 존재하는 것을 특징으로 하는 백혈구이다. 이들 과립은 주로, 세포내이입된 입자의 분해에 작용하는 막-결합된 효소를 함유한다. 과립구에는 이들의 염색 특성에 따라 명명된 호중구, 호염기구 및 호산구의 3 가지 타입이 있다. 무과립구는 그들의 세포질 내에 과립이 부재하는 것을 특징으로 하는 백혈구이며, 림프구, 단핵구 및 대식세포를 포함한다.
혈소판 또는 혈전구는 또한, 염증성 상태뿐만 아니라 항상성에 기여한다. 활성화되면, 혈소판은 응집하여 혈소판 플러그를 형성하며, 이들은 사이토킨 및 케모킨을 분비하여 백혈구를 유인하고 활성화시킨다. 혈소판은 신체의 순환 전체에 걸쳐서 발견되며, 거핵세포로부터 유도된다.
내피에 대한 백혈구 및 혈소판 부착의 개시에 주로 책임이 있는 분자는 각각 P-셀렉틴 및 폰 빌레브란트 인자이다. 이들 분자는 내피세포 내의 바이벨-펠라드 소체 (Weibel-Palade bodies)로 공지된 동일한 과립에서 발견된다. 내피세포의 활성화에 의해서, 바이벨-펠라드 소체는 세포막으로 이동하여 내피세포 표면에서 P-셀렉틴 및 가용성 폰 빌레브란트 인자를 노출시킨다. 이것은 다시 백혈구 및 혈소판 활성 및 응집의 캐스케이드를 유도한다.
따라서, 본 발명의 시스템, 장치 및 방법은 대상체 내에서 일어나는 원발성 염증성 질병 및/또는 의학적 과정 (예를 들어, 투석 또는 심폐우회술)에 대한 반응으로 일어나는 이차적 염증성 장애를 포함하는 모든 염증성 상태를 치료 및/또는 예방할 수 있다. 염증성 질병 및/또는 장애를 포함하는 적용가능한 염증성 상태의 예로는 전신적 염증반응 증후군 (SIRS), 심폐우회술 증후군, 급성 호흡부전 증후군 (ARDS), 패혈증, 전신성 홍반성 루푸스, 염증성 장질환, 췌장염, 신장염, 다발성 경화증, 건선, 동종이식 거부반응, 천식, 만성 신부전, 심신성 증후군, 간신성 증후군, 및 심근, 중추신경계, 간, 폐, 신장 또는 췌장에 대한 허혈성 재관류 손상으로 인한 모든 급성 기관 부전이 포함되나, 이들로 제한되지는 않는다.
염증성 상태의 추가의 예로는 이식 (예를 들어, 기관 이식, 급성 이식, 이종이식) 또는 이종이식편 또는 동종이식편 (예를 들어, 화상 치료에 사용되는 것) 거부반응; 수집 또는 기관 이식, 심근경색 또는 졸중 중에 초래된 허혈성 또는 재관류 손상과 같은 허혈성 또는 재관류 손상; 이식 내성 유도; 관절염 (예를 들어, 류마티스성 관절염, 건선성 관절염 또는 골관절염); 만성 폐쇄성 폐질환 (COPD), 폐기종 및 기관지염을 포함한 (단, 이들로 제한되지는 않음) 호흡기 및 폐 질병; 궤양성 대장염 및 크론병 (Crohn's disease); 이식편 대 숙주 질환; 접촉성 과민반응, 지연된 타입의 과민반응 및 글루텐-민감성 장질환 (셀리악병 (Celiac disease))을 포함한 T-세포 매개된 과민성 질환; 접촉 피부염 (독성 아이비 (ivy)에 기인하는 것을 포함); 하시모토 (Hashimoto) 갑상선염; 쇼그렌 (Sjogren) 증후군; 그레이브스병 (Graves' Disease)과 같은 자가면역 갑상선기능항진증; 애디슨 (Addison) 병 (부신의 자가면역질병); 자가면역 다선성 질병 (또한, 자가면역 다선성 증후군으로 공지됨); 자가면역 탈모증; 악성 빈혈; 백반; 자가면역 뇌하수체기능저하증; 길랑-바레 (Guillain-Barre) 증후군; 그 밖의 다른 자가면역질환; 사구체신염; 혈청병 (serum sickness); 두드러기; 호흡기 앨러지 (고초열, 앨러지성 비염) 또는 피부 앨러지와 같은 앨러지성 질병; 경피증; 균상 식육종; 급성 염증성 및 호흡기 반응 (예를 들어, 급성 호흡부전 증후군 및 허혈/재관류 손상); 피부근염; 원형 탈모증; 만성 화학방사선 피부염; 습진; 베세트병 (Behcet's disease); 수장족척농포증; 괴저성 농피증; 세자리 (Sezary) 증후군; 아토피성 피부염; 전신성 경화증; 반상경피증; 총, 칼, 자동차 사고, 추락 또는 전투로 인한 외상과 같은 외상; 및 자가유래, 동종성 또는 외인성 세포 대체와 같은 세포 치료법이 포함되나, 이들로 제한되지는 않는다. 추가의 염증성 상태는 본 명세서의 다른 곳에 기술되어 있거나, 또는 본 기술분야에서 다른 식으로 공지되어 있다.
본 발명의 시스템, 장치 및 방법은 또한, 생체외에서 조직 및 기관의 발생 및 사용을 지지하기 위해서 사용될 수도 있다. 예를 들어, 본 발명은 이식을 위한 기관 수집과정, 조직 엔지니어링 용도, 기관의 생체외 생성, 및 생물-마이크로전기기계적 시스템 (bio-microelectromechanical systems; MEMs)의 사용을 지지하기 위해서 사용될 수 있다.
전술한 설명에 비추어, 이하에 제시된 특정의 비-제한적 실시예는 설명을 목적으로 하는 것이며, 본 발명의 범위를 어떤 식으로든 제한하고자 하는 것이 아니다.
실시예
실시예
1. 동물 모델에서 급성 패혈증 및 급성 신부전과 연관된 염증의 치료
본 실시예는 급성 패혈증 및 급성 신부전의 상태와 연관된 염증을 치료하기 위한 본 발명의 구체예를 평가하기 위해서 사용된 일련의 실험을 기술한 것이다.
(I) 배경 및 이론적 설명
백혈구, 특히 호중구는 SIRS, 패혈증, 허혈증/재관류 손상 및 급성 호흡부전 증후군 (ARDS)을 포함한 다수의 임상적 염증성 장애의 병인론 및 진행에 대한 주된 기여물질이다. 조직 파괴 및 질병 진행을 최소화하기 위하여 염증의 부위에서 백혈구의 활성화 및 조직 축적을 제한하는 다수의 치료학적 접근방법이 조사 중에 있다. SIRS가 있는 중증의 패혈증은 집중치료실 및 광범위 항생제를 사용하더라도 30-40%의 사망률로 미국에서 연간 200,000 명의 환자에게서 나타난다.
이 연구의 기원은 급성 신부전 (ARF)을 치료하기 위한 체외 장치에서 신장 세뇨관 선조세포를 사용하여 진행중인 고무적인 전임상 및 임상시험으로부터 유래한다. ARF는 다기관 기능부전 및 사망으로 귀결되는 현상의 캐스케이드에서 신독성 및/또는 허혈성 신장 세뇨관 세포 손상에 대해 이차적인 급성 세뇨관 괴사 (ATN)로부터 발생한다. 신장 대체요법이 필요한 ATN으로부터의 사망률은 50 내지 70%의 범위이다. 이러한 높은 사망률은 장애의 병태생리학에 대한 더 큰 이해와 혈액투석 및 혈액여과 치료법의 진보에도 불구하고, 지난 몇십 년에 걸쳐서 지속되어 왔다.
이들 상태를 위한 치료법으로서 신장 세뇨관 선조세포의 이용은 신장 세뇨관 세포가 패혈성 쇼크에서 중요한 면역학적 조절성 역할을 한다는 주제를 기초로 하였다. 구체적으로, 중증의 패혈성 쇼크는 패혈성 쇼크의 돼지 모델에서 균혈증의 몇 시간 이내에 급성 세뇨관 괴사 (ATN) 및 ARF를 야기하는 것으로 나타났다. 따라서, ARF는 패혈성 쇼크의 시간 과정 중의 초기에 발생하며, 그 시간 틀은 임상적으로 판단되지 않는데, 이는 급성 공격 후에 혈중 우레아 질소 및 혈청 크레아티닌의 상승을 관찰하는데 며칠이 걸리기 때문이다. ARF 및 ATN에서 신장의 면역조절 기능의 상실은 SIRS, 패혈증, 다기관 기능부전, 및 큰 사망 위험을 발생시키는 경향을 야기한다. 최근의 보고는 개심수술 이후에 회복실 과정 중에 ARF를 발생시킨 환자에게서 패혈증 현상이 3.3%에서 거의 60%로 상승한 것을 나타내었다.
ARF 또는 ATN의 장애는 특히 연속적 혈액여과기술과 협력한 치료를 받을 수 있는데, 이는 급성 혈액투석 또는 혈액여과 단독으로는 합성물질 및 체외 회로에서의 진보에도 불구하고 아직 ATN의 사망률을 50% 이하로 감소시키지 못하였기 때문이다. ATN은 주로, 신장 근위 세뇨관 세포의 손상 및 괴사에 기인하여 발생한다. 패혈성 쇼크와 동시에 발생하는 ATN의 에피소드 중에 이들 세포의 기능의 초기 대체는 혈액여과와 협력하여 거의 완전한 신장 대체요법을 제공할 수 있다. 암모니아생성 (ammoniagenesis) 및 글루타치온 재생과 같은 대사적 활성, 비타민 D3 활성화와 같은 내분비 활성, 및 사이토킨 항상성의 부가는 이러한 질병 진행의 현재의 발달사를 변화시키는 추가의 생리학적 대체 활성을 제공할 수 있다.
이러한 상태에 대한 신장 세뇨관 선조세포의 영향을 시험하기 위해서 사용된 한가지 시스템은 일반적으로 미국 특허 제6,561,997호에 기술된 바와 같이, 여과장치 (통상적인 고속 (high-flux) 혈액여과기) 다음에 직렬로 이어진 신장 보조장치 (renal assist device; RAD)로 구성되었다. 이들 더 초기의 실험에서, RAD는 섬유의 내부 표면을 따라 성장하는 인간 신장 상피세포를 함유하는 표준 혈액여과 카트리지를 이용한 체외 시스템을 나타낸다. 이 배열은 여액이 조절된 수송 및 대사기능을 위해서 신장 세뇨관 세포에 의해서 라이닝된 중공 섬유 네트워크의 내부 구획에 들어가도록 허용한다. 대상체로부터 펌핑되어 나온 혈액은 제1 혈액여과기의 섬유 내로 들어가며, 여기에서 한외여과액 (UF)이 형성되고, 혈액여과기의 하류 RAD 내의 중공 섬유의 루멘 내에 송달되었다. RAD에서 배출되는 처리된 UF는 "소변"으로 수집되어 버려졌다. 초기 혈액여과기에서 배출되는 여과된 혈액은 모세관외 공간 (ECS) 포트를 통해서 RAD에 들어가며, 장치의 섬유들 사이에 분산되었다. RAD에서 배출되면, 처리된 혈액은 제3 펌프를 통해서 대상체의 신체에 반송되었다. 체외 혈액 회로는 신부전이 있는 환자의 연속적 또는 간헐적 혈액투석 요법을 위해서 사용된 것과 동일한 혈액 펌프 시스템 및 혈액 튜빙을 기초로 하였다.
RAD에서 신장 세뇨관 선조세포의 시험관내 시험은, 세포가 차별화된 활성 수송 특성, 차별화된 대사적 활성 및 중요한 내분비 과정을 유지하였음을 나타내었다. 추가의 시험은 RAD가 체외 혈액 관류 회로 내에서 혈액여과 카트리지와 직렬로 일체화되는 경우에, 급성적으로 요독성인 개에게서 신장의 여과, 수송, 대사 및 내분비 기능을 대체하였음을 나타내었다. 또한, RAD는 급성적으로 요독성인 동물에게서 내독소 쇼크를 개선시켰다.
신장 세뇨관 세포 치료법의 면역조절 역할을 더 잘 이해하기 위해서, RAD 치료법이 있거나 없는 패혈증의 조직-특이적 결과는 기관지폐포 세척 (BAL)에 의해서 평가되었다. BAL 검체를 사용하여 SIRS에 대한 응답으로 폐 미세혈관 손상 및 염증을 평가하였다. 이하에 상세하게 나타낸 예비 데이터는, 신장 세포 치료법이 손상된 혈관으로부터의 적은 단백질 누출 및 더 적은 염증과 연관되었음을 나타내었다.
이러한 실험적 모델 시스템에 의해서, 전신적 및 조직-특이적 염증과정에 대한 신장 세포 치료법의 역할은 평가의 제2 시리즈에서 더 신중하게 평가될 수 있었다. 동시에, RAD를 평가하는 임상실험에서 등록에 대한 장애물은 체외 혈액 라인 및 투석 카트리지의 혈액 관류를 유지시키기 위해서 헤파린에 의한 전신적 항응고 처리에 대한 필요성이었다. 최근 10년간에 걸쳐, 연속적 신장 대체요법 (CRRT) 회로에서 전신적 헤파린 처리 및 혈액 관류의 더 우수한 유지에 대한 필요성을 경감시키기 위해서 칼슘 결합제로서 시트레이트에 의한 지역적 항응고 처리가 표준 치료학적 양식이 되었다.
따라서, 모조 (sham) 무-세포 카트리지 및 세포-함유 카트리지를 사용한 전-임상적 동물 모델에서의 비교를 수행하여 혈액 회로 내의 시트레이트 및 낮은 Cai 레벨이 전신적 헤파린 처리에 의해서 관찰된 신장 세뇨관 세포 치료법의 효능을 감소시키지 않았음을 확인하였다. 이하에 상세히 기술한 바와 같이, 2-카트리지 시스템에서 시트레이트 항응고 처리는 깊이 있고 예기치 않은 결과를 나타내었다.
(Ⅱ) 실험 A - 동물 모델의 초기 실험
본 발명의 구체예를 일차적으로 평가하기 위해서, 패혈증의 돼지 모델에서 SIRS의 정립된 재현성 모델이 사용되었다 [참조: 예를 들어, Humes et al. (2003) Crit. Care Med. 31:2421-2428].
방법 및 재료
표준 돼지 (30-35 ㎏)는 심혈관 파라메터를 평가하기 위한 적절한 카테터의 도입 및 연속적 정정맥 혈액여과 (CVVH)에 의한 처리에 의해서 준비하였다. 그 후, 돼지에게 체중 ㎏당, 30×1010 박테리아의 이. 콜라이를 복강내로 제공하였다. 박테리아 주입 후 15 분 이내에, 동물을 2 개의 카트리지 (첫 번째는 혈액여과기이고, 두 번째는 다공성 중공 섬유를 포함하는 신장 보조장치 (RAD)임)를 갖는 CVVH 회로 내에 배치하였다. 이 실험을 위해서, RAD는 도 3에 나타낸 회로 내의 도 7에 개략적으로 나타낸 장치를 의미한다. 도 7에서, RAD는 중공 섬유 752 (명료성을 위해서 단지 하나만을 표시함)인 다수의 막을 함유한다. 섬유 내의 루미날 공간은 모세관내 공간 ("ICS") 740이라 부른다. 주변의 공간은 RAD의 하우징 754 내의 모세관외 공간 ("ECS") 742라 부른다. 활성화된 백혈구를 함유하는 혈액은 ECS 유입구 748로 들어가고, 섬유 752를 둘러싼 ECS 742 내에서 이동하고, ECS 배출구 750을 통해서 RAD를 나와서 유출 라인 내로 들어간다. 이 실험을 위해서, RAD의 중공 섬유 752는 다공성이며, 각각의 섬유의 루멘 740의 라이닝 상에서 단일층으로 배양된 알로그래픽 신장 세뇨관 세포를 함유한다. 대조군은 신장 세뇨관 세포를 함유하지 않지만 다른 식으로는 RAD와 동일한 모조-RAD였다.
도 3에 나타낸 바와 같이, 동물에서 배출되는 혈액을 제1 혈액여과기의 섬유 내로 펌핑하였으며, 여기에서 한외여과액 (UF)을 형성시키고, 혈액여과기 하류의 RAD 중공 섬유 752 내의 ICS 740 내로 송달하였다. RAD에서 배출되는 처리된 UF를 수집하여 UF 펌프 304를 사용하여 폐기물로 버렸다. 초기 혈액여과기에서 배출되는 여과된 혈액은 모세관외 공간 (ECS) 유입구 748을 통해서 RAD에 들어가고, 장치의 섬유 752 사이에서 분산되었다. ECS 배출구 750을 통해서 RAD에서 배출되면, 처리된 혈액은 대상체의 신체에 반송되었다. 혈액은 혈액여과 장치 전 및 후에 배치된 혈액 펌프 204 및 300, 및 RAD와 동물 사이에 배치된 제3의 혈액 펌프 (도 3에 나타내지 않음)에 의해 시스템 전체에 걸쳐서 이동하였다. 시트레이트 또는 헤파린은 206에서 시스템에 첨가되었으며, 필요에 따라, 제2 약제 (재도입을 위한 혈액을 제조하기 위함)는 대상체에게 혈액을 재도입시키기 전에 258에서 첨가되었다.
박테리아 주입 후의 처음 1 시간 중에, 동물은 80 ㎖/㎏의 크리스탈로이드 및 80 ㎖/㎏의 콜로이드 (Hepspan)로 구성된 용적에 의해서 소생되었다. 박테리아 주입 후 15 분에, 동물에게 100 ㎎/㎏의 항생제 세프트리악손을 투여하여 임상적 상황을 반복하였다. 동물에게 혈관수축제 또는 근변력제 (inotropic agents)는 투여하지 않았다.
결과 및 고찰
혈압, 심박출량, 심박수, 폐모세혈관 쐐기압, 전신적 혈관 저항성 및 신장 혈류는 시험 전체에 걸쳐서 측정하였다. 이 모델을 사용하여, RAD 처리가 심박출량 및 신장 혈류에 의해서 측정되는 바와 같이 대조군에 비해 더 우수한 심혈관 성능을 유지하였음을 나타내었다. 개선된 신장 혈류는 대조군에 비해 RAD 동물에서의 더 낮은 신장 혈관 저항성에 기인하였다.
개선된 심혈관 파라메터는 더 큰 생존시간을 제공하였다. 대조 동물 (신장 세뇨관 세포를 갖지 않는 모조-RAD에 의해서 처리됨)은 모두 7 시간 이내에 사망하였으며, 반면에 모든 RAD-처리된 동물은 7 시간 이상 생존하였다. RAD 그룹은 대조군에서의 5±1 시간에 비해 10±2 시간 동안 생존하였다 (p < 0.02). 패혈성 쇼크에서 예후적 염증 표지물인 인터로이킨 (IL-6)뿐만 아니라 사이토킨 염증반응의 개시인자인 인터페론-감마 (IFN-γ)의 혈장 레벨은 대조군에 비해서 RAD 그룹에서 더 낮았다.
초기 데이터는, 돼지 모델이 급성 패혈성 쇼크의 신뢰할 수 있는 모델이었으며, RAD 처리는 사이토킨 프로필의 변화와 연관된 심혈관 성능을 개선시켰으며, 상당한 생존적 이점을 제공하였음을 입증하였다. 초기 데이터는 또한, RAD 치료법이 패혈성 쇼크에서 발생하는 다기관 기능부전을 개선시킬 수 있음을 입증하였다.
이 모델의 재현성을 개선시키기 위해서, 용적 소생 프로토콜은 박테리아 투여 시에 크리스탈로이드/콜로이드 볼루스 주입 직후에 100 ㎖/시간에서 150 ㎖/시간으로 상승하였다. 이러한 개선된 소생 프로토콜 이외에도, RAD 치료법이 있거나 없는 패혈증의 조직-특이적 결과는 신장 세뇨관 세포 치료법의 면역조절 역할을 더 잘 이해하기 위해서 기관지폐포 세척 (BAL)에 의해서 평가되었다. BAL 검체를 사용하여 SIRS에 대한 응답으로 폐 미세혈관 손상 및 염증을 평가하였다. 신장 세포 치료법은 BAL 유체 샘플 내에서 손상된 혈관으로부터의 더 적은 단백질 누출 및 더 적은 염증뿐만 아니라 SIRS의 다른 심혈관 효과의 개선과 연관되었음이 나타났다.
용적 소생을 이용한 상술한 순화된 동물 모델이, 시트레이트 지역적 항응고 처리 하에서의 RAD 치료법의 효능이 전신적 헤파린 항응고 처리 하에서의 효능과 유사하였는지 여부를 평가하는 일련의 시험에서 사용되었다. 따라서, 모조 RAD (무-세포) 카트리지 및 RAD (세포-함유) 카트리지의 전-임상 동물 모델에서의 비교는 혈액 회로 내의 시트레이트 및 낮은 Cai 레벨이 전신적 헤파린 처리에 의해서 관찰된 신장 세뇨관 세포 치료법의 효능에 부정적으로 영향을 미쳤는지 여부를 평가하기 위해서 시작하였다.
예기치 않게, 결과는 신장 세포가 없는 RAD를 사용한 시트레이트 항응고 처리 (즉, 시트레이트에 의해서 처리된 SCID)는 SIRS로 인한 폐 손상을 개선시키는데 효과적이었으며, 이하에 상세히 기술하는 바와 같이, 거의 이 큰 동물 모델에서 패혈성 쇼크로 인한 심혈관 기능부전 및 사망까지의 시간을 감소시키는데 효과적이었던 것으로 나타났다.
(Ⅲ) 실험 B - 신장 상피세포를 이용하거나 이것을 결여한 시스템의 큰 동물 모델 비교
상술한 패혈성 쇼크의 개선된 돼지 모델을 사용하여 신장 보조장치 (RAD)에 의한 개입의 다기관 효과를 선택적 사이토페레시스 억제장치 (SCID)에 대비하여 평가하였다. 이 실험에서, RAD 및 SCID는 둘 다 상술한 바와 같이, 도 3의 회로 내의 도 7의 장치를 나타낸다. 그러나, RAD 시스템은 RAD 755의 ICS 740 내에 돼지 신장 상피세Ⅲ포를 함유하며, 헤파린 항응고 처리를 받는다. SCID 시스템은 SCID 755의 ICS 740 내에 세포를 함유하지 않으며, 시트레이트 처리를 받는다 (헤파린 없음). 이하의 데이터는 총 14 마리의 동물로부터 유도되었다. 7 마리의 동물은 도 9-13에서 "모조/헤파린"으로 표시된 것으로, ICS 내에 돼지 신장 상피세포가 없는 RAD인 모조 대조군으로 처리되었으며, 헤파린 항응고 처리를 받았다. 4 마리의 동물은 도 9-13에서 "세포 RAD"로 표시된 것으로, 돼지 신장 상피세포 및 전신적 헤파린 치료법을 포함한 RAD에 의해서 처리되었다. 3 마리의 동물은 도 9-13에서 "모조/시트레이트"로 표시된 것으로, ICS 내에 세포를 포함하지 않는 SCID에 의해서 처리되었고, 시트레이트 지역적 항응고 처리를 받았다.
심혈관
파라메터의
관찰
도 9에서 입증되는 바와 같이, 상술한 벡티리아의 복강내 투여는 모든 그룹에서 빠르고, 깊으며 결국에는 치명적인 평균 동맥압 (MAP)의 저하를 유도하였다. 초기 데이터는, 시트레이트를 갖는 SCID가 모조/헤파린 대조군에 비해 MAP에 대한 효과를 약화시켰음을 시사하였다. 심박출량 (CO)은 도 10에서 각각의 그룹에 대해 상세히 기술하였다. CO는 다른 그룹에 비해 RAD 그룹에서 실질적으로 더 컸다. 시트레이트 효과는 모조/헤파린 대조군에 비해 RAD 효과보다 덜 탁월하였지만, 이것은 더 많은 동물에 의해서 유의성에 도달하였다. 그룹들 간의 유사한 경향은 일회박출량에서도 역시 관찰되었다.
이러한 패혈성 과정에 의해서 유도된 전신적 모세혈관 누출의 대략적 척도로서 헤마토크리트의 변화는 도 11에 나타내었다. 도 11에서, 모조/헤파린 대조군은 RAD 및 SCID 그룹 둘 다에 비해 모조 대조그룹에서 혈관내 구획으로부터의 더 큰 용적 상실율을 반영하는 것으로, 시간에 따른 더 큰 증가율을 가졌다. 이들 변화는 모조/헤파린 그룹과 비교한 이러한 예비적 평가단계에서, RAD 및 SCID 그룹에서의 실질적인 생존적 이점과 연관되었다 (참조: 도 12). 평균 생존시간은 모조/헤파린 그룹에 대해서는 7.25±0.26 시간, SCID (모조/시트레이트) 그룹에 대해서는 9.17±0.51 시간, 및 RAD (ICS 공간 내에 세포를 가짐) 그룹에 대해서는 9.56±0.84 시간이었다. 이들 데이터는 RAD (ICS 공간 내에 세포를 가짐), 및 예기치 않게, SCID가 둘 다 모조/헤파린 대조군에 비해서 심박출량, 신장 혈류 및 생존시간을 개선한다는 것을 나타내었다.
염증성
파라메터의
관찰
돼지 SIRS 모델을 사용하여 다양한 치료학적 개입의 효과를 조사하기 위해서, 기관지폐포 세척 (BAL) 유체를 사망 시점에 수득하고, 미세혈관 손상의 파라메터로서 단백질 함량, 다양한 염증성 사이토킨 및 다형핵 세포 (PMNs)의 절대수에 대해서 평가하였다. 표 3에 요약한 바와 같이, 예비 데이터는 RAD 및 SCID 처리 둘 다가 SIRS에서 폐 침습의 초기 상에서 더 적은 혈관 손상 및 단백질 누출 및 더 적은 염증성 사이토킨 방출을 야기하였음을 나타내었다. IL-6, IL-8 및 종양 괴사인자 (TNF)-α의 레벨은 모조 대조군에 비해서 처리 개입시에 더 낮았다. IL-1 및 IL-10의 레벨은 상이하지 않았다. 모조 대조군에서 절대 호중구 수는 1000 세포/㎖이상이었으며, 각각의 그룹에서 n = 1 또는 2이었지만, RAD 및 SCID 그룹은 더 낮은 경향이 있었다.
| 단백질 (㎍/㎖) |
TNF-α (pg/㎖) |
IL-1 (pg/㎖) |
IL-6 (pg/㎖) |
IL-8 (pg/㎖) |
|
| 모조 대조군 (n=6) | 143±11 | 21±1 | 18±2 | 63±14 | 126±42 |
| RAD (n=3) | 78±10 | 18±5 | 18±5 | 32±6 | 33±10 |
| SCD (n=2) | 110±12 | 13±2 | 14±8 | 33±2 | 84±62 |
| 주: 평균±SE. BAL은 사망 시점에 수행하였다. | |||||
백혈구 격리의 관찰
혈액투석 문헌은, 단일 카트리지의 중공 섬유를 통한 혈액 순환이 일시적인 1-시간 호중구 반응을 야기함을 시사한다 [참조: 예를 들어, Kaplow et al. (1968) JAMA 203:1135]. 제2 카트리지의 모세관외 공간을 통한 혈액 유동이 순환 백혈구의 더 높은 비율의 부착을 야기하는지 여부를 시험하기 위해서, 패혈증 동물에서의 총 백혈구 (WBC) 수 및 차이를 측정하였다. 결과는 도 13에 나타내었다.
도 13에 나타낸 바와 같이, 각각의 그룹은 2 시간째에 최저 발생 및 7 시간째에 회복을 가지고 체외 회로에 대한 백혈구감소증 반응을 나타내었다. 이들 동물 (각각의 그룹에서 n = 1-2, 총수 = 5) 물에서 기준선으로부터 3 시간까지의 평균 차등 수는 표 4에 상세히 나타내었다. 백혈구의 모든 서브세트는 감소하였으며, 가장 현저한 것은 호중구였다.
| 총 WBCs | 호중구 | 림프구 | 단핵구 | |
| 기준선 (0 시간) | 15,696 | 6,422 | 6,792 | 306 |
| 최저점 (3 시간) | 2,740 | 684 | 1,856 | 94 |
| 주: 값은 5 마리의 동물로부터의 평균이다: 1 모조 대조군, 2 RAD-처리, 3 SCD-처리된 동물. | ||||
SCID에서 백혈구의 격리를 입증하기 위해서, 도 14A-D는 중공 섬유의 외부 표면에 대한 백혈구 부착의 밀도를 도시한다. 이들 영상은 SCID 내에서 백혈구의 격리를 나타낸다. 이 처리 프로토콜을 받는 표준 동물은 8-시간 처리과정 중에 그들의 WBC를 9,000 이하로 하락시키지 않으며, 이것은 초회 자극되거나 활성화된 백혈구를 제2 막 시스템에 부착시키는 것이 필요할 수 있음을 시사한다.
이들 데이터는 RAD가 모조/헤파린 대조군에 비해서 심박출량, 신장 혈류 (데이터는 나타내지 않음) 및 생존시간을 개선시킴을 뒷받침한다. 또한, 예기치 않게, 제2의 저전단력 중공 섬유 카트리지 (즉, SCID)와 함께 시트레이트를 사용하는 것은, 비록 이것이 ICS 내에 세포를 함유하지 않지만, 큰 소염효과를 가지는 것으로 확인되었다.
실시예
2. 백혈구 격리 및 억제 및/또는 불활성화의
시험관내
시험
본 실시예에 기술된 실험은, 투석막에 부착된 백혈구가 시트레이트의 존재 하에서 억제되고/되거나 불활성화되는 것을 보여준다. 또한, 다른 데이터는 시트레이트 항응고 처리가 말기 신장병 (ESRD)을 갖는 대상체의 혈액투석 중에 호중구의 탈과립화 (칼슘-의존적 현상)를 무효화시키는 것을 입증한다. 이 방법을 더 상세히 평가하고, 이것을 다른 백혈구 집단 및 사이토킨 방출에 확대시키기 위해서, 이하의 시험관내 실험이 수행되었다.
방법 및 재료
백혈구는 정립된 방법을 사용하여 건강한 표준 개체로부터 분리되었다. 백혈구 (106 세포/웰)를 14×14 ㎜ 제곱의 폴리설폰 막 (Fresenius, Walnut Creek, CA)을 함유하는 12-웰 조직 배양 플레이트에 배치하고, RPMI 배지 내에서 37℃로 60 분 동안 부착하도록 하였다. 배지를 제거하고, 세포를 PBS로 세척하고, 분리된 상등액을 세포 방출에 대해서 분석하였다. 시트레이트가 있거나 (Cai = 0.25 mmol/ℓ), 시트레이트가 없는 (Cai = 0.89 mmol/ℓ) RPMI 배지를 사용하여 이하의 표 5에 기술된 Cai 레벨을 달성하였다. 각각의 칼슘 조건은 또한, 백혈구를 활성화시키기 위한 리포폴리사카라이드 (LPS, 1 ㎍/㎖)가 있거나 없는 배지를 가졌다.
세포를 이들 조건에 60 초 동안 노출시키고, 배지로부터 분리하여 락토페린 (LF) 및 미엘로퍼옥시다제 (MPO)의 방출, 호중구로부터의 세포외유출 소포체 내의 단백질, 및 백혈구로부터 방출된 사이토킨, IL-6 및 IL-8을 평가하였다. 이들 화합물은 상업적으로 이용할 수 있는 ELISA 키트 (R & D Systems, Cell Sciences, 및 EMD BioSciences)를 사용하여 시험하였다.
결과 및 고찰
결과는 표 5에 기술하였다.
|
|
락토페린 (ng/㎖/106 세포) |
미엘로퍼옥시다제 (ng/㎖/106 세포) |
IL-6 (pg/㎖/106 세포) |
IL-8 (ng/㎖/106 세포) |
||||
| 기준선 | 자극됨 | 기준선 | 자극됨 | 기준선 | 자극됨 | 기준선 | 자극됨 | |
| 표준 Cai (0.89 mmol/ℓ) |
205 | 416 | 437 | 886 | 3.9 | 4.4 | 29.9 | 35.0 |
| 시트레이트 Cai (0.89 mmol/ℓ) |
221 | 187 | 268 | 270 | 3.3 | 2.9 | 25.8 | 19.4 |
| 주: 두가지 상이한 표준 대조군으로부터의 WBC 분리; 각각의 조건은 이중으로 분석하였다. 기준선은 LPS가 부재하였으며; 자극된 조건은 LPS (1 ㎍/㎖)가 존재하였다. |
||||||||
낮은 Cai를 갖는 시트레이트-함유 배지는 이들 염증성 단백질의 실질적인 증가를 갖는 표준 Cai 배지와는 대조적으로 LF, MPO, IL-6, 또는 IL-8의 증가가 없었다. 이들 결과는, 투석막에 부착된 백혈구 집단의 자극이 배양 배지 내의 Cai 레벨을 저하시키는 시트레이트의 존재 하에서 억제되고/되거나 불활성화되는 것을 입증한다. 이러한 낮은 Cai 레벨은 사이토졸성 칼슘 레벨의 변화를 야기하여 백혈구 내에서 다수의 염증성 반응 (예를 들어, 전-염증성 물질의 방출)을 억제하고/하거나 백혈구를 불활성화시킨다.
실시예
3. 인간에게서 급선 신부전 (
ARF
)과 연관된 염증의 치료
본 실시예에 기술된 실험은 헤파린으로 처리된 시스템 내의 유사한 장치로 치료한 환자에 대비하여 본 발명의 구체예, 즉 시트레이트에 의해서 처리된 시스템 내의 중공 섬유 튜브를 포함하는 SCID에 의해서 치료된 인간 대상체에서 예기치 않은 생존율을 나타낸다. 구체적으로, 본 실험에서 SCID는 도 3의 회로 내의 도 7의 장치를 나타낸다. SCID의 ICS 내에 신장 세포는 포함되지 않았다.
배경기술
연속적인 정정맥 혈액여과 (CVVH)를 받는 ARF 및 다기관 기능부전을 갖는 10 명의 위독한 환자에 대한 신장 세포 치료법의 안전성 및 유효성은 이전에 I/II 상 실험에서 조사되었다 [참조: 예를 들어, Humes et al. (2004) Kidney Int. 66(4):1578-1588]. 이들 환자에 대해 예상되는 병원 사망률은 평균 85% 이상이었다. 이전에 보고된 실험에서 사용된 장치는 사체 이식을 위해 공여된 신장으로부터 분리된 인간 신장 근위 세뇨관 세포로 접종되었지만, 해부학적 또는 섬유성 결함으로 인하여 이식에 부적합한 것으로 밝혀졌다. 이 임상실험의 결과는, 실험적 처리가 CVVH와 함께 사용되는 경우에 24 시간 이하 동안 시험 프로토콜 지침 하에서 안전하게 송달될 수 있었음을 입증하였다. 임상적 데이터는, 이 시스템이 임상적 세팅에서 생존력, 내구성 및 기능성을 나타내고, 유지하였음을 나타내었다. 환자의 심혈관 안정성은 유지되었으며, 증가된 요량에 의해서 결정되는 바와 같은 증가된 천연 신장 기능은 치료와 일시적인 상관관계를 나타내었다.
이전의 임상적 연구에서의 시스템도 또한, 차별화된 대사적 및 내분비적 활성을 입증하였다. 3-일 이상 추적을 한 치료된 환자 중의 한 명을 제외한 전부는 급성 생리학적 스코어에 의해서 평가되는 바와 같이 개선을 나타내었다. 비록 APACHE 3 스코어링 시스템을 사용하여 이들 10 명의 환자에 대해서 예상된 사망률은 평균적으로 85%였지만, 10 명의 치료된 환자 중의 6 명은 신장 기능 회복과 함께 지난 28일 동안 생존하였다. 혈장 사이토킨 레벨은, 이 세포 치료법이 환자에게서 이들의 독특한 병태생리학적 조건에 따라 동적이며 개별화된 반응을 제공하였음을 시사하였다.
유망한 I/II 상 실험 결과는, 이러한 세포 치료법이 환자의 사망률을 변화시키는지 여부를 결정하기 위한 12-15 임상 사이트에서의 후속 FDA-승인된, 무작위 대조 II 상 연구를 유도하였다. 하나의 II 상 시험에는 58 명의 환자가 포함되었으며, 이들 중에서 40 명은 RAD 치료법에 대해서 무작위화되었으며, 18 명은 순차적 기관 부전 평가 (sequential organ failure assessment; SOFA) 스코어에 의해서 필적하는 인구학 및 질병의 중증도를 갖는 대조군을 구성하였다. 초기 결과는 I/II 상 결과와 같이 강력하였다. 신장 세포 치료법은 28-일 사망률을 통상적인 혈액여과-치료된 대조그룹에서의 61%에서 세포-치료된 그룹에서의 34%로 개선시켰다 [참조: 예를 들어, Tumlin et al. (2005) J. Am. Soc. Nephrol. 16:46A]. 이러한 생존 효과는 90- 및 180-일 추적기간을 통해서 계속되었으며 (p < 0.04), 콕스 (Cox) 비례 위험비는 사망의 위험이 통상적인 CRRT 그룹에서 관찰된 것의 50%였음을 나타내었다. 신장 세포 치료법에 의한 이러한 생존적 이점은 기관 부전 수 (1 내지 5+) 또는 패혈증의 존재와는 무관하게 ARF의 다양한 병인론에 대해서 관찰되었다.
방법
상업적 세포 제조방법 및 시트레이트 지역적 항응고 처리의 부가를 평가하기 위해서 추가의 시험이 수행되었다. 이들 환자 치료 그룹의 결과는 분석하여 전신적 헤파린 항응고 처리 또는 시트레이트 지역적 항응고 처리를 갖는 SCID (ICS 내에 세포가 없음)에 의해서 치료된 환자에서의 사망률을 비교하였다. 이들 실험에서 사용된 장치는 상술한 바와 같은 도 3에 도시된 회로 내의 도 7에 개략적으로 나타내었다. 그러나, 본 실험을 위해서는 제2 혈액 라인 펌프가 SCID와 대상체 사이에 존재한다 (도 3에 나타낸 바와 같은 장치들 사이가 아님).
결과
표 6은 SCID/시트레이트 시스템이 28일에서, 및 90 내지 180일 사이에서 생존율의 현저한 증가를 제공하였음을 보여준다.
|
|
생존 | |||||||
| (N) | 28 d | (N) | 90-180 d | SOFA | OF | MOF | 패혈증 | |
| SCID/시트레이트 | 9/12 | 75% | 8/12 | 67% | 11.9 | 3.8 | 2.6 | 58% |
| SCID/헤파린 | 6/12 | 50% | 3/12 | 25% | 12.3 | 4.1 | 2.65 | 58% |
| 주: SOFA = 순차적 기관 부전 평가; OF = 기관 부전 수; MOF = 다발성 기관 부전 수 | ||||||||
도 15는 헤파린 ("SCID/헤파린") 대신에 시트레이트 ("SCID/시트레이트")를 이용하는 장치에서 치료된 환자에게서 0일과 180일 사이의 생존율의 현저한 증가를 그래프로 나타낸다. 환자 그룹이 SOFA 스코어 및 기관 부전 수에 의해서 측정되는 바와 같이 질병의 유사한 활성을 갖더라도, 이들 생존율 차이는 나타났다. 어떤 그룹도 시스템의 제2 카트리지의 ICS 내에 세포를 갖지 않았다.
고찰
이러한 임상적 영향은 예기치 못한 것이었다. 이들 결과는 환자의 생존을 극대화시키는데 있어서 전례가 없는 놀라운 성공을 제공하였다. 비록 이들 임상적 데이터가 ARF를 갖는 환자로부터 유도되었지만, 관찰결과는 더욱 일반적으로는, 예를 들어, SIRS, ESRD 및 다른 염증성 조건에 대해서 적용할 수 있는 것으로 생각된다. 잠재적 기전에 대한 추가의 평가는 시트레이트- 및 헤파린-처리된 그룹에서 무-세포 카트리지의 조직학적 평가에 의해서 성취되었다. 상술한 동물 모델로부터의 데이터와 유사하게, 시트레이트/SCID 시스템은 이 카트리지의 혈액 쪽에서 백혈구로 덮인 제2 카트리지의 중공 섬유의 외부 표면을 가졌다. 유사한 결합은 헤파린/SCID 시스템에서 확인되었다.
실시예
4. 단일-장치 시스템에 의한 염증의 치료
일부의 경우에, 단일 처리 장치 (즉, 다른 처리 장치가 없는 SCID)를 사용하는 처리 시스템을 사용하는 것이 유익할 수 있다. 이전에 언급한 바와 같이, 본 발명의 특정의 구체예는 그의 일차적인 처리 기능을 수행하는 이외에도 백혈구를 (원치 않는 방식으로) 활성화시킬 수 있는 체외 회로에서 제1 처리 장치 (예를 들어, 혈액여과기)를 이용한다. 시리즈에서의 제2 처리 장치인 SCID는 ECS의 저-저항성 구획에서 부착 및 체계적 격리를 달성한다 (예를 들어, 도 2C 및 2D에 나타낸 바와 같음). 따라서, 만일 제1 처리 장치가 그의 일차적 기능을 수행하는데 필요하지 않다면, 이것을 제거하고, 백혈구의 원치 않는 활성화를 감소시키는 것이 유익할 수 있다. 패혈증과 같은 다른 구체예에서, 순환 백혈구는 이미 활성화될 수 있으며, ECS의 저-저항성 구획을 통한 혈액 유동을 갖는 단일-장치 SCID 시스템 (예를 들어, 도 2A 및 2B에 나타낸 바와 같음)이 백혈구의 부착 및 격리에 적합할 수 있다. 이 회로에 의해서는 혈액 라인 상에서 단지 단일 펌프만이 필요하여 치료학적 개입을 단순화시킨다.
본 실험은 선택적 사이토페레시스의 유효성뿐만 아니라 대상체 (예를 들어, 염증성 반응을 갖거나 염증성 반응을 발생시킬 위험이 있는 동물 또는 인간 환자)에게서 생존율, 및 염증성 반응을 감소시키고/시키거나 예방하는 효과를 평가한다. 구체적으로, 본 실험에서는 시스템 내에 단지 SCID를 갖는 단일-장치 시스템을 시스템 내에 SCID뿐만 아니라 혈액을 처리하는 다른 시스템 성분, 예를 들어, 하나 또는 그 이상의 혈액여과 카트리지를 갖는 2-장치 시스템과 비교하다. 단일-장치 시스템은 SIRS와 같은 상태를 갖거나, 그런 상태를 가질 위험이 있는 대상체에게 특히 유용할 수 있는데, 여기에서는 백혈구 격리 및 임의로, 백혈구 불활성화 및/또는 백혈구로부터 전-염증성 물질의 방출의 억제가 체외 회로에 대한 일차적 처리 목표이다. 2-장치 (또는 다수-장치) 시스템은 체외 회로를 사용한 하나 이상의 치료가 필요한 대상체에게, 예를 들어, 신장 투석 치료 및 백혈구 격리 및 임의로, 백혈구 불활성화 및/또는 백혈구로부터 전-염증성 물질의 방출의 억제 모두가 필요한 급성 신부전이 있는 대상체에게 유용할 수 있다.
제1 시험 시스템은 도 2A 또는 2B의 회로 내의 각각 도 5 또는 도 6 중의 하나에 나타낸 바와 같은 단일 SCID를 포함할 수 있다. 제2 시험 시스템은 도 2C 또는 도 2D의 다수-장치 회로 내의 각각 도 5 또는 6 중의 하나에 나타낸 바와 같은 SCID를 포함할 수 있다. 시험 시스템 둘 다의 경우에, SCID 중공 섬유 카트리지 또는 전체 시스템은 시트레이트를 함유할 것이다. 두 가지 시스템 모두의 경우에, 한외여과액 및 세포는 SCID의 ICS 내에 포함되지 않을 것이다.
두 그룹의 대상체 (예를 들어, 돼지)에게 박테리아를 투여하여 상기 실시예 1에 기술된 바와 같이 패혈증 및 SIRS를 유도할 수 있다. 그 후, 각각의 그룹을 시험 시스템 중의 하나에 의해서 치료할 수 있으며, 실시예 1에 기술된 것과 같은 측정을 수행할 수 있다. 두 가지 그룹의 측정을 비교할 수 있다. 기술된 단일-장치 및 2-장치 시스템 배열 이외에도, 이들 장치를 함유하는 장치 및 시스템의 다른 배열을 또한 시험할 수 있다.
일시적인 백혈구감소증 및 호중구감소증의 크기는 단일-장치 및 2-장치 시스템 사이에서 비교할 수 있을 것으로 예상된다. 단일-장치 및 2-장치 배열이 둘 다 효과적일 것으로 예상되지만, WBC 수와 심혈관 및 폐 기능 파라메터, 전신적 및 폐 염증성 지표물질, 및 단일- 대 2-장치 시스템에 걸친 백혈구 활성화 마커의 변화에 대한 영향의 관계는 더 간단한 단일-장치 시스템 또는 2-장치 시스템이 제2 처리 장치를 필요로 하지 않는 상황에서 유익한지 여부를 뒷받침할 수 있을 것이다.
실시예
5. 백혈구 격리
표면적의
비교
본 실험은 염증성 반응을 예방하고, 시험 대상체에서 생존율을 증가시키기 위한, 선택적 사이토페레시스를 수행하는데 있어서 상이한 백혈구 격리 표면적을 갖는 하나 또는 그 이상의 SCID 중공 섬유 카트리지의 유효성을 평가한다. 몇 가지의 막 크기가 시험될 것이다. 초기 시험에는 각각 약 0.7 ㎡ 및 약 2.0 ㎡의 표면적을 갖는 SCID 막의 비교가 포함될 것이다. 추가의 시험 그룹은 약 0.7 ㎡ 및 약 2.0 ㎡의 막 표면적 및/또는 약 2.0 ㎡ 이상의 막 표면적의 비교를 포함할 수 있다.
하나의 시험에서는, 상술한 바와 같은 다양한 백혈구 격리 표면적을 갖는 중공 섬유 카트리지를 갖는 SCIDs가 제조될 수 있다. 도 5의 일반적 디자인의 SCIDs를 도 2A 또는 2C의 회로 내에 배치할 수 있거나, 또는 도 6의 일반적 디자인의 SCIDs를 도 2B 또는 2D의 회로 내에 배치할 수 있다. 대상체 (예를 들어, 돼지)에게 박테리아를 투여하여 상기 실시예 1에 기술된 바와 같이 패혈증 및 SIRS를 유도할 수 있다. 그 후, 대상체의 그룹을 본 명세서에 기술된 시스템 중의 하나 또는 그 이상으로 처리할 수 있다. 시험한 각각의 시스템의 경우에, 적어도 2 개의 상이한 크기의 SCID 막 표면적 (예를 들어, 0.7 ㎡ 및 2.0 ㎡)을 시험할 수 있다. 실시예 1에 기술된 것과 같은 측정을 수행할 수 있으며, 각각의 그룹으로부터의 측정치를 비교할 수 있다.
또 다른 시험에서는, CPB를 받고 있는 대상체 (예를 들어, 돼지 또는 송아지)를 시험할 수 있다. CPB에 의한 처리는 급성 신장 손상 (AKI) 및 급성 폐 손상 (ALI)을 포함한 기관 기능부전을 야기할 수 있다. 다양한 백혈구 격리 표면적을 갖는 중공 섬유 카트리지를 갖는 SCIDs를 CPB 회로 내에서 시험할 수 있다.
CPB는 도 4A-4F 중의 어떤 것에 나타낸 바와 같은 회로 내에 배열된 SCIDs를 사용하여 본 명세서의 실시예 8 및 9에 기술된 바와 같은 대상체에 대해서 수행할 수 있다. 각각의 시스템에 대해서, 적어도 두 개의 상이한 크기의 SCID 막 표면적 (예를 들어, 0.7 ㎡ 및 2.0 ㎡)을 시험할 수 있다. 종말점 측정에는 본 명세서에, 예를 들어, 실시예 1 또는 8에 기술된 것이 포함될 수 있다. 또한, CPB-유도된 AKI 및 CPB-유도된 ALI의 중증도는 SCID 막 격리 표면적의 함수로서 평가될 수 있다.
증가된 막 표면적은 백혈구 결합을 증가시킬 수 있고, SCID에 의해서 유도된 백혈구감소증의 더 긴 시간 간격을 야기할 수 있는 것으로 예상된다. 따라서, (더 작은 격리 표면적에 비해서) 더 큰 격리 표면적을 갖는 SCIDs는 선택적 사이토페레시스의 유효성을 개선시킬 수 있고 (예를 들어, 개선된 생존율 및/또는 염증성 반응을 감소 및/또는 예방하는 개선된 효과에 의해서 측정되는 바와 같음), CPB와 연관된 기관 손상 (예를 들어, AKI 및 ALI)과 같은 CPB와 연관된 합병증을 완화시키는데 더 큰 유익한 효과를 가질 수 있는 것으로 예상된다.
실시예 6. 급성 신장 손상을 갖는 패혈성 쇼크 모델에서 선택적 사이토페레시스 장치
본 실시예에 기술된 실험은 AKI를 갖는 패혈성 쇼크의 돼지 모델에서 SCID를 갖는 1-펌프 및 2-펌프 시스템 및 시트레이트 또는 헤파린 투여의 전임상 시험을 기술한 것이다. 실험은 일반적으로 두 가지 평가에 대해서 지시되었다. 첫째로, 실험은 1-펌프 회로 내의 SCID (예를 들어, 도 2D의 회로 내의 도 6의 SCID)를 이용하는 것의 효능을 2-펌프 회로 내의 SCID (예를 들어, 도 3의 회로 내의 도 7의 SCID)에 대비하여 평가하였다. "1-펌프" 또는 "2-펌프"는 예를 들어, 도 2D에서의 펌프 204 (1-펌프 시스템)에 의해서, 또는 도 3의 펌프 204 및 300 (2-펌프 시스템)에 의해서 나타낸 바와 같은 회로의 혈액 라인 상의 펌프의 수를 나타낸다. 1-펌프 회로를 사용하는 것의 이점은 기존의 투석 장치를 침대 맡에서 간호를 제공하기 위한 추가의 훈련이나 펌프 시스템이 없이 이용할 수 있다는 점이다. 또한, 실험은 활성화된 백혈구를 격리시키고, 헤파린에 대비하여 시트레이트를 사용하여 그들의 활성화 상태를 억제하는 SCID의 작용 기전을 평가하였다.
재료 및 방법
1-펌프 회로에서의 SCID의 효능을 2-펌프 회로에 대비하여 평가하기 위해서, 다음의 두 개의 시험 시스템이 제조되었다. 첫째로, 1-펌프 시험 시스템은 도 2D의 회로 내의 도 6의 SCID를 포함하였다. 둘째로, 2-펌프 시험 시스템은 도 3의 회로 내의 도 7의 SCID를 포함하였다. 두 가지 시험 시스템은 모두 시트레이트 또는 헤파린을 또한 포함하였으며, SCID의 ICS 내에 세포를 포함하지 않았다.
본 실시예에서의 실험은 실시예 1에 기술된 바와 같이 연관된 AKI 및 다기관 기능부전을 갖는 패혈성 쇼크의 정립된 돼지 모델을 이용하였다 [참조: 예를 들어, Humes et al. (2003) Crit. Care Med. 31:2421-2428]. 간략하면, 두 그룹의 대상체 (돼지)에게 박테리아를 투여하여 상기 실시예 1에 기술된 바와 같이 패혈증 및 SIRS를 유도하였다. 그 후, 각각의 그룹을 1-펌프 또는 2-펌프 시험 시스템 중의 하나로 처리하였다. 각각의 1-펌프 및 2-펌프 시스템은 시트레이트 주입 또는 헤파린 주입에 의한 처리인 두 가지 처리 서브그룹을 가졌다. 따라서, 패혈증 및 SIRS를 갖는 대상체의 한 그룹은 1-펌프 시스템으로, 및 시트레이트 또는 헤파린으로 처리하였으며; 패혈증 및 SIRS를 갖는 대상체의 다른 그룹은 2-펌프 시스템으로, 및 시트레이트 또는 헤파린으로 처리하였다.
백혈구, 호중구 및 혈소판을 측정하여 1-펌프 및 2-펌프 시스템의 상대적 효능을 평가하였다. 또한, 헤파린에 대비하여 시트레이트와 함께 SCID에 의한, 활성화된 백혈구의 격리 및 억제에 대한 작용기전을 평가하기 위해서, 몇 가지의 파라메터를 시트레이트 또는 헤파린을 사용한 시스템에서 측정하였다. 평가된 파라메터에는 호중구 활성화의 지표물질인 미엘로퍼옥시다제 (MPO) 및 CD11b가 포함되었다. CD11b의 측정을 위해서는, 동물로부터 혈액 샘플을 채취하고, 백혈구의 세포 표면상에서 발현된 CD11b 단백질에 결합하는 형광 항체를 첨가하였다. 백혈구를 세포 분류에 의해서 다양한 서브세트로 분리시키고, 그 후 호중구 게이트 (gate) 내의 호중구를 형광 항체를 결합시킨 표면상의 CD11b 분자의 수에 비례하는 형광 강도에 의해서 분석하였다. 그 후, 전체 호중구 집단을 분석하고, CD11b 발현에 의한 활성화의 레벨을 평균 형광 강도 (MFI)로서 정량적으로 평가하였다. 평가된 파라메터는 또한, 동물 생존도를 포함하였다.
결과
도 16A, 16B, 및 17은 백혈구 수, 호중구 수 및 혈소판 수에 대한 1-펌프 및 2-펌프 시스템의 효과의 결과를 나타낸다. 백혈구 격리 (도 16A), 호중구 격리 (도 16B) 및 혈소판 격리 (도 17)는 일반적으로 시트레이트-처리 및 헤파린-처리된 1-펌프 시스템에 대해서, 및 시트레이트-처리 및 헤파린-처리된 2-펌프 시스템에 대해서 동일하였기 때문에, 이들 도면은 두 개의 1-펌프 서브그룹의 평균을 두 개의 2-펌프 서브그룹의 평균에 대비하여 나타낸다. 도 18-21은 시트레이트-처리되거나 헤파린-처리된 시스템의 결과를 나타낸다. 도 18-21에 대해서 측정된 특징은 일반적으로 시트레이트로 처리된 1-펌프 및 2-펌프 시스템에 대해서, 및 헤파린으로 처리된 1-펌프 및 2-펌프 시스템에 대해서 동일하였기 때문에, 이들 도면은 두 개의 두 개의 시트레이트 서브그룹의 평균을 두 개의 헤파린 서브그룹의 평균에 대비하여 나타낸다.
2-펌프 대비 1-펌프 시험 시스템 비교. 1-펌프 및 2-펌프 회로 사이의 압력 및/또는 유동 차이가 두 가지 시험 시스템의 SCIDs에서 격리에 대해 가질 수 있는 가능한 효과를 평가하기 위해서, 전신적 혈류 내의 백혈구 (WBC) 및 호중구 수를 검사하였다. WBC 및 호중구 수에 관한 1-펌프 및 2-펌프 시스템에 대한 결과는 각각 도 16A 및 도 16B에 나타내었다. 도면에 상세히 나타낸 바와 같이, 1-펌프 시스템 (n=5) 및 2-펌프 시스템 (n=5) 사이에서 이들 파라메터의 차이는 관찰되지 않았다.
혈소판 격리. 혈소판 수는 또한, 1-펌프 또는 2-펌프 시스템에 의해서 처리된 동물에 대해서 평가하였다. 도 17에 나타낸 바와 같이, SCID를 갖는 1-펌프 및 2-펌프 시스템은 둘 다 SCID에 의한 처리 후에 적어도 9 시간 동안 감소된 혈소판 수를 나타내었다. 이들 데이터는, SCID를 갖는 시스템이 혈소판을 격리시킨다는 것을 나타낸다.
호중구 활성화. 활성화된 호중구는 침입한 미생물 또는 조직 손상에 대한 반응으로 다양한 효소를 방출하여 조직 수복을 개시한다. 호중구 과립으로부터 방출된 주된 효소는 미엘로퍼옥시다제 (MPO)이다. 따라서, MPO의 전신적 레벨을 측정하여 대상체에서 호중구 활성화의 레벨을 나타내었다. 도 18은 SCID 및 시트레이트로 처리된 동물 (SCID 평균; n=5)에서 평균 MPO 레벨은 SCID 및 헤파린으로 처리된 동물 (헤파린 평균; n=3)에서보다 더 낮았음을 보여준다. 호중구 활성화의 레벨은 또한, 염증의 부위에 순환을 배출시키는 제1 단계로서 내피 상에 결합하는데 책임이 있는 막 단백질인 CD11b의 발현을 측정함으로써 정량화되었다. 도 19에 상세히 나타낸 바와 같이, 패혈증 유도의 6 시간째에 전신 순환 내의 호중구의 MFI는 SCID 및 시트레이트 처리된 동물 (시트레이트 (전신적); n=4)에 비해 SCID 및 헤파린으로 처리된 동물 (헤파린 (전신적); n=4)에서 극적으로 증가하였다.
분석은 또한, 회로의 동맥 및 정맥 라인 내의 호중구 MFI를 평가하여 전체 회로를 가로지르는 평균을 구함으로써 더 개선되었다. 샘플은 혈액이 대상체로부터 혈액 라인으로 배출되는 회로의 동맥 라인으로부터, 및 혈액이 혈액 라인으로부터 배출되고 대상체에 재도입되는 회로의 정맥 라인으로부터 동시에 채취하였다. 헤파린 그룹 (n=4)과 시트레이트 그룹 (n=4)에서의 MFI (동맥-정맥) 차이는 도 20에 나타낸 바와 같이 3 및 6 시간째에 극적으로 상이하였다. 이 데이터는 시트레이트 주입이 회로를 따라서 호중구 활성화의 레벨을 억제하는 것을 시사하며, 이것은 동일한 시간 동안 전신적으로 활성화된 순환 호중구가 더 적은 것을 나타낼 수 있다.
동물 생존. 헤파린을 갖는 SCID와 비교하여 시트레이트를 갖는 SCID의 효능의 궁극적인 평가는 생존 효과이다. 도 21에 나타낸 바와 같이, 일관된 생존시간 이점은 헤파린 그룹에 대비해서 시트레이트 그룹에서 관찰되었다. 시트레이트와 함께 SCID로 처리된 동물에 대한 평균 생존시간은 8.38±0.64 시간 (n=8)인 반면에, 헤파린과 함께 SCID로 처리한 동물에 대한 평균 생존시간은 6.48±0.38 시간 (n=11)이었다.
추가의 평가가 고려된다. 예를 들어, 지역적 시트레이트 항응고 처리에 대비하여 전신적 헤파린 처리를 갖는 SCID의 효과, 또는 1-펌프 또는 2-펌프 시스템의 효과를 평가하기 위한 데이터 세트에는 다음이 포함될 수 있다: 1. 심혈관 파라메터 (심박수; 수축기, 확장기 및 MAP; 심박출량; 전신적 혈관 저항성, 일회 박출량; 신장 동맥 혈류; 중심 정맥압; 폐모세혈관 쐐기압); 2. 폐 파라메터 (폐동맥 수축기 및 확장기 압력, 폐 혈관 저항성, 동맥-대-폐포 O2 구배); 3. 동맥혈 가스 (pO2, pCO2, pH, 총 CO2); 4. 전혈구 수 (헤마토크리트 (모세관 누출의 간접적 측정); WBC 및 차이); 5. 염증성 지수 (사이토킨 (IL-6, IL-8, IL-1, INF-γ, TNF-α)의 전신적 혈청 레벨); 및 6. BAL 유체 파라메터에 의한 폐 염증 (단백질 함량 (혈관 누출); 차이가 있는 총 세포수; TNF-α, IL-6, IL-8, IL-1, INF-γ, 호중구 미엘로퍼옥시다제 및 엘라스타제; BAL 유체로부터의 폐포 대식세포 및 LPS 공격 후에 평가된 사이토킨의 기준선 및 자극된 레벨). 또한, SCID 염증성 파라메터 (다양한 사이토킨 (IL-6, IL-8, TNF-α, IL-1, INF-γ)의 혈액여과기-전, 제2 카트리지-전 및 제2 카트리지-후의 혈청 레벨) 및 호중구 세포외유출 화합물 (미엘로퍼옥시다제, 엘라스타제 및 락토페린)을 측정하여 백혈구 활성을 평가할 수 있으며, 이들 요소의 동시 측정은 또한, 처리의 진행 중에 혈액 및 UF 구획과 연관시키기 위해서 제2 카트리지-전 및 -후의 UF에서 이루어질 수 있다. 또한, 혈청 및 BAL 유체 중의 산화적 마커는 가스 크로마토그래피 및 질량분석법을 사용하여 측정하여 다양한 그룹 내에서 염증-유도된 산화적 스트레스를 평가할 수 있다.
고찰
실험으로부터의 데이터는, SCID 및 시트레이트 처리를 포함하는 체외 회로가 효과적으로 백혈구를 격리시키고, 그로부터 전-염증성 물질의 방출을 억제하거나 백혈구를 불활성화시킬 수 있음을 확인한다. 구체적으로, 이들 데이터는, 백혈구 격리 효과가 1-펌프 및 2-펌프 회로 사이에서 유사한 것을 나타낸다. 또한, SCID 및 시트레이트 처리 시스템은 패혈성 쇼크 동물 모델에서 SCID 및 헤파린 처리 시스템에 비해 호중구 활성화의 레벨을 감소시켰다. SCID 및 시트레이트 처리 시스템의 효능은 패혈증의 치명적인 동물 모델에서 증가된 생존시간을 제공하였다. 또한, 1-펌프 시스템 및 2-펌프 시스템은 둘 다 적어도 9 시간 동안 혈소판을 효과적으로 격리시켰다. 이 데이터를 기초로 하여, 혈소판의 격리 및 혈소판의 불활성화 및/또는 혈소판으로부터 전-염증성 물질의 방출 억제는 상세한 설명 및 실시예 전체에 걸쳐서 기술된 바와 같이 백혈구를 격리시키고, 백혈구를 불활성화시키고/시키거나 백혈구로부터 전-염증성 물질의 방출을 억제함으로써 달성된 것과 유사한 유익한 효과를 가질 수 있다.
실시예
7. 인간에게서 말기 신장병의 치료
본 실시예에 기술된 실험은 본 발명의 구체예, 즉 헤파린으로 처리된 유사한 시스템에 대비하여 시트레이트로 처리된 시스템 내에 중공 섬유 튜브를 포함하는 카트리지에 의해서 치료된 인간 대상체에서 생존율을 평가하도록 디자인된다. 본 실험에서 시스템 배열은 SCID의 ICS 내에 세포가 없이, 각각 도 2C 또는 2D 중의 하나의 회로 내의 도 5 또는 6 중의 하나의 SCID일 수 있다. 방법 및 관찰소견은 SCID 카트리지 내에 추가의 신장 세포가 없이 시트레이트 장치 대 헤파린 장치의 비교를 포함할 수 있다.
배경기술
만성 전-염증성 상태와 연관된 질병의 한가지 예는 말기 신장병 (ESRD)이다 [참조: 예를 들어, Kimmel et al. (1998) Kidney Int. 54:236-244; Bologa et al. (1998) Am. J. Kidney Dis. 32:107-114; Zimmermann et al. (1999) Kidney Int. 55:648-658]. 주된 치료법인 투석은 소분자 폐기물 제거 및 체액 평형에 중점을 둔다. 그러나, 이것은 ESRD와 연관된 만성 염증을 대처하지는 못한다. ESRD 환자에게서, 이것은 중증의 질병률 및 21%까지의 허용할 수 없게 높은 사망률과 연관된다 [참조: 예를 들어, USRD System, USRDS 2001 Annual data report: Atlas of end-stage renal disease in the United States, 2001, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases: Bethesda. p. 561].
ESRD를 갖는 환자에 대한 예상 여명은 평균 4 내지 5 년이다. 혈관 변성, 심혈관 질환, 불량한 혈압 조절, 빈번한 감염증, 만성 피로, 및 골변성은 생활의 질에 상당한 영향을 미치며, 높은 질병률, 빈번한 입원, 높은 비용을 발생시킨다. ESRD 환자에게서 사망률의 주된 원인은 ESRD의 전반적인 사망률의 거의 50%를 차지하는 심혈관 질환이고 [참조: 예를 들어, USRD System, USRDS 2001 Annual data report: Atlas of end-stage renal disease in the United States, 2001, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases: Bethesda. p. 561], 그 다음은 감염성 현상이다.
ESRD 환자는 이들에게 심혈관 질환뿐만 아니라 감염성 합병증 둘 다의 소인을 주는 만성 염증성 상태를 발생시킨다. ESRD 환자는 적절한 혈액투석에도 불구하고, 감염에 더 민감하다. 만성 혈액투석은 막 활성화, 염증 및 청소율과는 무관하게, 만성 전-염증성 상태와 동등한 사이토킨의 패턴 변화를 유도한다 [참조: 예를 들어, Himmelfarb et al. (2002) Kidney Int. 61(2):705-716; Himmelfarb et al. (2000) Kidney Int. 58(6):2571-2578]. 이들 작은 단백질은 혈액여과될 수 있지만, 혈장 레벨은 증가된 생성율로 인하여 변화되지 않는다 [참조: 예를 들어, Kimmel et al. (1998) supra; Bologa et al. (1998) supra; Zimmermann et al. (1999) supra; Himmelfarb et al. (2002) supra; Himmelfarb et al. (2000) supra]. 혈액투석을 받고 있는 ESRD 환자에게서 산화적 스트레스에 대한 증가된 노출은 또한, 면역계를 손상시키고, 감염에 대한 민감성을 증가시킨다 [참조: 예를 들어, Himmelfarb et al. (2002) supra; Himmelfarb et al. (2000) supra].
임상적으로, ESRD 환자에게서 만성 염증성 상태는 IL-1, IL-6 및 TNF-α를 포함한 전-염증성 사이토킨의 증가된 레벨과 함께 새로운 임상적 마커인 CRP의 증가된 레벨에 의해서 명백하다 [참조: 예를 들어, Kimmel et al. (1998) supra; Bologa et al. (1998) supra; Zimmermann et al. (1999) supra]. 이들 모든 파라메터는 ESRD 환자에게서 증가된 사망률과 연관된다. 구체적으로, IL-6은 혈액투석 환자에게서 사망률과 밀접하게 상관관계가 있는 단일 예측인자로 확인되었다. IL-6의 밀리리터당 매 피코그램씩의 증가는 심혈관 질환의 상대적 사망률 위험을 4.4%만큼 증가시킨다 [참조: 예를 들어, Bologa et al. (1998) supra]. 실제로, 증가하고 있는 증거는 전-염증성 상태가 ESRD가 있는 환자에게서 호중구의 초회 자극 및 활성화에 기인하는 것임을 시사한다 [참조: 예를 들어, Sela et al. (2005) J. Am. Soc. Nephrol. 16:2431-2438].
방법
말기 신부전이 있는 환자는 혈액여과 장치, a SCID, 및 시트레이트 또는, 대조군으로서 혈액여과 장치, SCID, 및 헤파린을 포함하는 체외 회로 (즉, 시트레이트 또는 헤파린 처리와 함께, 각각 도 2C 또는 2D 중의 하나의 회로 내의 도 5 또는 6 중의 하나의 SCID)에 의해서 그들의 혈액을 처리할 수 있다. 시험은 또한, 각각의 SCID 내에 신장 세뇨관 세포를 포함할 수도 있다 (이렇게 하여, SCID는 또한, 신장 보조장치 또는 RAD로 작용함). 혈액은 환자로부터 혈액여과 장치로, SCID로, 및 다시 환자에게로 흐른다. 적절한 펌프 및 안전성 필터가 또한 포함되어 환자에게 반송되는 혈액의 흐름을 용이하게 할 수도 있다.
시트레이트 또는 헤파린과 함께 SCID의 효과를 평가하기 위한 데이터 세트는 SCID 내의 다양한 성분 카트리지를 거쳐서 백혈구 활성을 평가하기 위해 측정되는, SCID 염증성 파라메터 (다양한 사이토킨 (IL-6, IL-8, TNF-α, IL-1, INF-γ)의 혈액여과기-전, 제2 카트리지-전 및 제2 카트리지-후의 혈청 레벨) 및 호중구 세포외유출 화합물 (미엘로퍼옥시다제, 엘라스타제 및 락토페린)을 포함할 수 있다. SCID 및 UF를 갖는 회로가 사용되는 경우에 (예를 들어, 도 3의 회로 내의 도 7의 SCID), 이들 요소의 동시 측정은 또한, 처리의 진행 중에 혈액 및 UF 구획과 연관시키기 위해서 제2 카트리지-전 및 -후의 UF에서 이루어질 수 있다.
결과 및 고찰
그의 혈액이 SCID 및 시트레이트를 포함하는 체외 회로에 의해서 치료되는 ESRD 환자는 SCID 및 헤파린을 포함하는 체외 회로에 의해서 치료된 ESRD 환자에 비해서 상당히 더 우수한 결과를 나타내는 것으로 예상된다. 구체적으로, 전-염증성 마커는 헤파린 처리와 함께 SCID를 받은 환자에 비해서 시트레이트 처리와 함께 SCID를 받은 환자에게서 저하되는 것으로 예상된다.
실시예
8.
심폐우회
회로의 일부로서 선택적
사이토페레시스
본 실시예에 기술된 실험은 더 큰 용적의 유동 회로에 대한 병렬 회로 내에 혈액 유동 (200 ㎖/분)을 갖는 체외 회로에 연결된 SCID (예를 들어, 도 5 또는 6에 나타낸 SCID)로서 단일 혈액여과기 카트리지를 사용하였다. 시트레이트 지역적 항응고 처리를 사용하여 이러한 병렬 회로의 항응고 처리뿐만 아니라, SCID 내의 막의 외부 표면을 따라 격리된 백혈구를 불활성화시키기 위한 수단 둘 다를 개선시켰다.
프로토콜은 송아지 모델에서 SCID를 갖는 체외 CPB 회로를 포함하였다. 각각의 회로에서 SCID의 사용은 순환하는 백혈구, 주로 호중구의 실질적인 하강과 일시적인 상관관계를 가졌다. 이러한 감소는 격리효과의 급등이 없이 과정 전체에 걸쳐서 유지되었다. 안전성 문제가 없이 기존의 CPB 회로 내에 SCID를 쉽게 통합시키기 위한 회로 디자인은 도 4B 및 4C에 나타낸다.
배경기술
심장수술 진보는 절대적으로 CPB에 대한 기술에 따라 좌우되었다. 불행하게도, 전신적 염증성 반응은 CPB와 연관되어 일어나며, 수술 후에 다발성 기관 기능부전을 야기하는 것으로 인식되었다. CPB 중의 다발성 공격은 혈액 성분의 인공 막 활성화 (막 산소화기), 수술 외상, 기관의 허혈-재관류 손상, 체온의 변화, 심장절개 흡인에 의한 혈액 활성화 및 내독소의 방출을 포함한 이러한 염증성 반응을 개시시키고, 확대시키는 것으로 나타났다. 이들 공격은 백혈구 활성화, 사이토킨의 방출, 보체 활성화, 및 유리-래디칼 생성을 포함하는 복잡한 염증성 반응을 촉진시킨다. 이러한 복잡한 염증성 과정은 종종 ALI, AKI, 출혈 장애, 변화된 간 기능, 신경적 기능부전 및 궁극적으로는 다발성 기관 부전 (MOF)의 발생의 원인이 된다.
폐 기능부전은 CPB를 필요로 하는 수술 후에 매우 통상적이다. 이러한 급성 폐 손상은 수술후 호흡곤란에서 격발성 ARDS까지 온화할 수 있다. 환자의 거의 20%는 CPB를 필요로 하는 심장 수술 후 48 시간 이상 동안 기계적 환기를 필요로 한다. ARDS는 50%를 초과하는 사망률로 CPB 환자의 약 1.5-2.0%에서 발생한다. AKI를 갖는 신장 기능부전도 또한, CPB 이후에 성인 환자에게서 통상적인 발생이다. 이들 환자 중의 40%까지는 혈청 크레아티닌 및 BUN의 상승을 나타내며, 투석에 의한 유지를 필요로 하는 1-5%에서 수술후 사망률은 80%에 가깝다.
CPB 이후에 다발성 기관 기능부전에 책임이 있는 기전은 다수이며, 상호 연관되고, 복잡하지만, 증가하고 있는 증거는 CPB-유도된 펌프-후 증후군에서 ARDS의 발생에 있어서 순환하는 혈액 백혈구, 특히 호중구의 활성화에 중요한 역할을 시사한다. 증가하는 증거는, ARDS 및 펌프-후 증후군 둘 다에서 급성 폐 손상이 폐에서의 PMN 격리 이후에 주로 호중구 매개되는 것을 뒷받침한다. 격리 및 활성화된 PMNs는 조직 내로 이동하여 조직 손상 및 기관 기능부전을 야기한다. CPB 중에 백혈구 고갈 쪽으로 향해지는, 본 기술분야에서 기술된 치료학적 개입은 전-임상 동물 모델 및 초기 임상시험 둘 다에서 평가되었다. 선행기술의 백혈구-고갈 필터에 의한 결과는 CPB 중에 순환하는 백혈구 수에 있어서의 감소는 없지만 산소 필요성은 온화하게 개선되어 일관성이 없었다. 유의적인 임상적 개선은 선행기술의 백혈구-고갈 필터를 사용하여 선택적 관상동맥 우회로 이식술 (CABG)을 받는 환자에게서는 나타나지 않았다. 대조적으로, 본 발명의 시스템, 장치 및 방법은 이하에 기술하는 바와 같은 유익한 효과를 가질 것이다.. 혈액 분리기에 의한 백혈구의 고갈은 수술후 폐 가스 교환 기능을 개선시킬 수 있다.
방법 및 결과
수술은 SCID 102, SCID 103, 및 SCID 107로 지정된 3 마리의 송아지 각각에 대해 시행되었다. 각각의 송아지 (약 100 ㎏)를 전신 마취 하에 두고, 심실 보조장치 (VAD)를 배치시키기 위해서 CPB 회로에 연결시켰다. CPB는 심장마비 및 대동맥 교차-클램핑에 의해서 60-90 분 사이에 수행되었다. SCID는 각각의 동물에 대해서 이하에 나타낸 바와 같이, 도 4B 또는 도 4C에 도시된 위치에 배치하였다. 3 마리의 동물 (SCID 102, SCID 103, 및 SCID 107)의 결과는 도 22A-22F 및 23A-23B에 요약하였다.
수술 세부사항 및 결과. SCID 102의 경우에, 회로는 회로 내의 SCID로서 F40 카트리지 (Fresenius Medical Care, Germany)를 사용하여 도 4B에서와 같이 조립되었다. 도 22A-22F에 나타낸 바와 같이, 백혈구 및 혈소판 수에 있어서의 하락이 관찰되었다. 도 22E에 나타낸 바와 같이, 여기에서는 급성 폐 손상에 중요할 수 있는 호산구 수의 하락이 있었다.
SCID 103의 경우에, 회로는 회로 내의 SCID로서 HPH 1000 혈액농축기 (Minntech Therapeutic Technologies, Minneapolis, MN)를 사용하여 도 4B에서와 같이 조립되었다. SCID 처리는 75 분 동안 지속하였으며, 추가의 샘플은 SCID 처리를 종료한 지 15 분 후에 채취하였다. 도 22A-22E에 나타낸 바와 같이, 백혈구의 시간-의존적 하락이 관찰되었다. SCID는 15 분 이내에 호중구의 극적인 리바운드로 75 분째에 중단하였다. 응고는 관찰되지 않았다.
SCID 107의 경우에, 회로는 회로 내의 SCID 및 혈액여과기/혈액농축기 각각으로서 HPH 1000 혈액농축기 (Minntech Therapeutic Technologies, Minneapolis, MN)를 사용하여 도 4C에서와 같이 조립되었다. CPB는 SCID가 통합되기 전 15 분에 개시되었으며, SCID 처리는 45 분 동안 지속하였다. 추가의 샘플은 SCID 처리를 종료한 지 15 분 후에 채취하였다. 도 22A-22F에 나타낸 바와 같이, 백혈구 및 혈소판 수는 SCID를 회로 내로 통합시키기 전에 하락하였으며, 단핵구를 제외하고는 SCID의 통합에 의해서 더 하락하였다. 이 수술에서, 압력 프로필을 수득하였으며, 50 ㎖/분의 UF 유속이 입증되었다.
도 23A 및 23B에 나타낸 바와 같이, 전신적 Cai는 유지되었으며, SCID 회로 Cai는 표적 범위 내에 있었다. 이들 수술로부터 일반적으로 주목할 것으로, 한외여과액 (UF)은 더 낮은 SCID 압력에서 관찰되지 않았다.
고찰
본 실시예에 기술된 실험은, CPB 회로와 같은 체외 회로 내로의 SCID 장치를 통합이 백혈구 및 혈소판을 격리시키고, 수술 중에 성공적인 임상적 결과의 가능성을 증진시킬 수 있음을 시사한다.
실시예
9. 동물 모델에서
심폐우회술
-유도된 급성 폐 손상 (
ALI
) 및 급성 신장 손상 (
AKI
)과 연관된 염증의 치료
실시예 8에 기술된 실험의 연장으로서, 본 실시예에 기술된 실험은 CPB-유도된 ALI 및 AKI의 치료 시에 백혈구를 격리시키고, 이들의 염증성 작용을 억제하는 본 발명의 장치의 효능을 나타내도록 디자인된다.
구체적으로, 본 실시예의 목적은 CPB-유도된 ALI 또는 AKI를 효과적으로 치료하는 SCID 프로토콜을 최적화하는 것을 수반한다. 이 목표를 달성하기 위해서, 동물은 각각 SCID 및 시트레이트 공급물을 포함하는, 도 4B, 4C, 4E, 또는 4F에 기술된 CPB 회로 중의 어느 하나에 의해서 치료될 수 있다. 대신으로, 각각 시트레이트 주입이 없이 SCID를 포함하는 도 4A 또는 4D에 기술된 CPB 회로를 시험할 수 있다. 또한, CPB 중에 사용된 SCID는 치료가 일어나면서 새로운 SCID로 대체될 수 있으며/있거나, 하나 또는 그 이상의 SCIDs가 도 4A-4F 중의 어느 것의 "SCID" 위치에 직렬로 또는 병렬로 배치될 수 있다.
CPB-유도된 ALI의 기전 및 치료학적 개입을 평가하기 위한 다수의 돼지 모델이 문헌에 보고되었다. 예를 들어, 입증가능한 ALI는 다음을 포함하는 추가의 공격에 의해서 증가하여 유도될 수 있다는 것이 선행기술의 돼지 모델에서 입증되었다: (1) 60 내지 120 분의 CPB에 대한 시간의 길이; (2) 허혈/재관류 손상을 발생시키는 대동맥 교차 클램핑 및 심장 냉각 심장마비; (3) 혈액 요소 (백혈구, 혈소판 및 보체)의 활성화를 촉진시키는 개방 저혈조에 의한 심장절개 흡인; 및 (4) CPB 후 내독소의 검출가능한 레벨에 기인하여, 아마도 심장 수술 후의 위장 장벽 기능부전 및 온화한 허혈/재관류 손상에 기인하여 환자에게서 관찰되는 것과 유사한 SIRS 반응을 촉진시키는 CPB 후 내독소 주입.
CPB 이후 3.5 시간 및 후속 리포폴리사카라이드 (LPS; 60 분에 걸쳐서 1 ㎍/㎏) 이후 2 시간 이내에 폐기능 및 기관지폐포 (BAL) 유체 내의 분자 마커에 있어서의 상당한 변화를 갖는 CPB-유도된 ALI의 정립된 돼지 프로토콜이 보고되었다. 이 보고된 프로토콜은 대퇴-대퇴 저체온 우회방법에 이어서, CPB의 연결을 절단시킨 후 30 분에 시작하는 60-분 LPS 주입을 사용하였다. 폐 파라메터는 이들 순차적 공격 이후에 2 시간까지 측정되었으며, 상당한 파라메터 손상이 관찰되었다. CPB에 의한 임상적 실무를 더 잘 반영하면서 4 시간 이내에 측정가능한 ALI를 발생시키도록 하는 다른 프로토콜이 개발될 수 있었다.
본 실시예는 증가하는 공격을 촉진시키기 위하여 개방 정맥혈 저혈조 내로의 CPB 중의 심장절개 및 심장 흡인과 함께, 기준선 프로토콜로서 60 분의 CPB, 대동맥 교차 크램핑 및 심장 저체온 심장마비를 이용하는 ALI 및 AKI의 임상적으로 적절한 모델을 사용할 수 있다. 만일 이것이 측정가능한 ALI 및 AKI를 야기하기에 충분하지 않다면, CPB 완료 후 30 분에 시작하는 이. 콜라이 LPS (0.5-1.0 ㎍/㎏)의 30-60 분 주입이 첨가될 수 있다. 이러한 CPB 돼지 모델에 대한 일반적인 접근방법은 이하에 상세히 기술한다.
CPB
프로토콜
한가지 예시적 프로토콜에서는, 요크셔 (Yorkshire) 돼지 (30-35 ㎏)를 IM 아트로핀 (0.04 ㎎/㎏), 아자페론 (4 ㎎/㎏), 및 케타민 (25 ㎎/㎏)으로 전투약한 다음에, 5 ㎍/㎏의 펜타닐 및 5 ㎎/㎏의 티오펜탈로 마취시켰다. 8-㎜ 기관내 튜브 (Mallinckrodt Company, Mexico City, Mexico)를 삽관한 후에, 돼지를 앙와위로 놓는다. 마취는 5 ㎎/㎏/시간의 티오펜탈 및 20 ㎍/㎏/시간의 펜타닐을 연속 주입함으로써 유지시킨다. 0.2 ㎎/㎏의 판큐로늄에 이어서 0.1 ㎎/㎏의 간헐적 재주입으로 근육 이완을 유도하여 최적 수술 및 환기 상태를 달성한다.
환기는 10 ㎖/㎏ 총 용적으로 용량 설정 환기장치 (volume cycle ventilator), 및 호기말 양압법이 없이 1의 흡입 산소 분율을 사용하여 정립시킨다. 폴리에틸렌 모니터링 라인을 외경정맥 및 대퇴 동맥 및 정맥 내에 배치한다. 식도 및 직장 온도 프로브를 삽입한다. 정중 흉골절개술을 수행한다. 16 또는 20 ㎜ 천음속 혈관주위 유동 프로브 (Transonic perivascular flow probe)를 주폐동맥 상에 배치하고, 밀라 마이크로팁 압력 변환기 (Millar microtip pressure transducer)를 폐동맥 및 좌심방에 배치한다. CPB를 개시하기 전에, 기준선 폐동맥 압력 및 유속 및 좌심방 압력 판독치를 심박출량의 결정을 위해서 채택한다. 전신적 헤파린 처리 (300 U/㎏) 후에, 18F 메드트로닉 (Medtronic) DLP 동맥 카눌라를 상행 대동맥 내에 배치하고, 24F 메드트로닉 DLP 단일-상 정맥 카눌라를 우심방 내에 배치한다.
CPB 회로를 1,000 ㎖의 락테이트화 링커 용액 및 25 mEq의 NaHCO3로 초회 자극한다. 회로는 메드트로닉 바이오메디쿠스 (Medtronic Biomedicus) 원심분리 혈액 펌프, 일체형 열교환기를 갖는 메드트로닉 친호성 중공 섬유 산소화기, 및 심장절개 저혈조로 구성된다. 메드트로닉 친화성 38-㎛ 필터를 동맥 림 (limb) 내에 배치하여 미립상 파편을 포착시킨다. 좌심실은 산스 롤러 펌프 (Sarns roller pump) 및 심장절개 저혈조에 연결된 환기 라인 (vent line)을 갖는 12-Ga 메드트로닉 표준 대동맥근 (aorta root) 카눌라를 사용하여 환기된다. 배출된 혈액은 역시 산스 롤러 펌프 및 심장절개 저혈조에 연결된 심장절개 흡인 카테터에 의해서 구조된다. 심폐우회술을 개시하고, 환기는 중단시키고, 전신적 관류는 2.4 ℓ/분/㎡ (체표면적)에서 유지시킨다. 적절한 관류 저체온 (32℃ 직장 온도)가 사용되며, 평균 대동맥 압력은 유동의 변형 및 정맥내 페닐에프린 주입 (0-2 ㎍/㎏/분)에 의해서 60-80 ㎜Hg에서 유지시킨다. 상행 대동맥을 교차 클램핑하고, 4:1 비로 혈액에 의해 희석된 미시간 대학 (the University of Michigan) 표준 심장마비 용액으로 구성된 심장마비액을 7 도에서 대동맥근 내로 송달한다. 용액은 시트레이트 포스페이트 및 덱스트로즈 (CPD), 트로메타민 및 염화칼륨으로 구성된다. 총 용량 1 ℓ의 심장마비액이 송달되며, 500 ㎖를 매 20 분 마다 반복한다. 전신적 재가온은 40 분 후에 시작하며, 체외 순환은 60 분 후에 중단한다 (클램핑 시간 45 분). CPB로부터 떼어내기 전에, 폐는 3 호흡에 대해서 10 초 동안 30-㎝ H2O 기도 압력까지 팽창시키며, 기계적 환기는 동일한 환기장치 세팅을 사용하여 재개한다. CPB로부터 떼어내는 중에, 에피네프린 (0-1 ㎍/㎏/분)의 주입을 적정하여 대동맥 혈압을 표준 범위 내에서 유지시킨다. 체외 회로의 중단 30 분 이내에, 산소화기 내의 혈액은 다시 순환 내로 전이되며, 헤파린은 프로타민 (헤파린 100 U에 대해서 1 ㎎)에 의해서 반전되고, 정상체온의 직장 온도가 얻어진다. 생리학적 측정치는 CPB 전 및 중에, 및 CPB 후 4 시간 동안에 기록된다.
체외 회로
ALI 및 AKI를 반영하는 실질적인 변화를 갖는 CPB의 돼지 모델을 사용하여, 기관 손상을 개선시키는데 있어서의 SCID의 영향을 직접 시험할 수 있다. 단일-카트리지 SCID를 막 산소화기 이후의 병렬 회로 내에 배치할 수 있다 (예를 들어, 도 4F에 나타낸 바와 같음). 막 산소화기는 이후에 SCID 내에서 격리되는 순환하는 백혈구를 활성화시키는 것으로 생각된다. 시트레이트를 지역적 SCID 병렬 혈액 회로에 첨가하여 혈액 이온화된 Cai를 표적 레벨까지, 예를 들어, 약 0.2 내지 약 0.4 mM로 저하시키고, Ca2 +는 병렬 회로의 말단에서 재주입한다. 두 개의 그룹의 동물을 평가하고 비교할 수 있다. 제1 그룹은 SCID 및 헤파린 항응고 처리를 받으며, 제2 그룹은 SCID 및 시트레이트 항응고 처리를 받을 수 있다. 각각의 그룹은 6 마리의 동물을 포함할 것이며, 각각의 그룹으로부터 3 마리의 동물을 처리한 후에 두 그룹의 초기 분석을 한다. 지역적 시트레이트 항응고 처리는 표준 실행 용액 및 임상적 프로토콜을 이용하여 달성될 수 있다. 시트레이트는 칼슘과 결합함으로써 항응고제로서 작용한다. 그 후에, 결합된 칼슘은 응고인자를 유발하도록 이용할 수 없다. 적절한 응고 및 심장 기능을 허용하는 전신적 Cai 레벨을 회복시키기 위해서, 혈액을 동물에게 반송하기 직전에 칼슘을 혈류에 첨가한다.
시트레이트 항응고 처리에 대해서는 연속적 신장 대체요법을 위해서 사용된 현행 표준 프로토콜이 사용될 것이다. ACD-A 시트레이트 IV 용액 (Baxter Healthcare)을 시트레이트 주입 펌프 및 SCID 이전의 SCID 혈액 주입 포트에 대한 라인에 연결시킬 수 있다. 칼슘은 전신적 칼슘을 회복시키기 위해서 주입 포트를 통해서 SCID 이후의 반송된 혈액에 투여될 수 있다. 시트레이트 주입 유체 속도 (㎖/시간)는 혈액 유속 (㎖/분)의 1.5 배여서 0.2 내지 0.4 mmol/ℓ의 카트리지-전 Cai 레벨을 달성할 수 있다,
SCID 혈액 유속은 200 ㎖/분이 되는 것을 표적으로 하며, 200 ㎖/분의 유속으로 설정된 SCID-전의 혈액 회로 내에 배치된 펌프에 의해서 조절될 수 있다. 염화칼슘 (20 ㎎/㎖, 0.9% N.S.)은 SCID-후의 혈액 라인 내에 주입되어 0.9 내지 1.2 mmol/ℓ의 시스템 내 Cai 레벨 (동물 혈류 값)을 달성할 수 있다. 초기 Ca2 + 주입속도는 시트레이트 주입 속도의 10%이다. Cai 레벨은 전신적 Cai 레벨을 반영하도록 펌프 시스템 이전의 CPB 회로의 동맥 말단에서, 및 SCID 병렬 회로의 정맥 말단에서 평가될 수 있다. 모든 Cai는 i-STAT® 진단장치 (Abbott Labs)에 의해서 측정될 수 있다.
급성 폐 손상 (
ALI
)의 측정
폐기능. CPB 이후의 ALI는 폐포-동맥 산소화 구배, 폐내 단락율 (shunt fraction), 폐 순응성 및 폐혈관 저항성의 증가를 야기한다. 이들 파라메터는 4 시간의 CPB-후 기간 중에 매 30 분 마다 측정될 수 있다.
폐조직 분석. 펌프-후 증후군에서 ALI는 폐 내의 호중구 축적 및 간질액의 증가와 연관된다. 호중구 응집은 BAL을 위해서 사용되지 않은 절편으로부터 폐조직을 수득함으로써 탐색 프로토콜의 말기에 평가될 수 있다. 조직의 샘플은 조직 호중구 침윤을 반영하는 미엘로퍼옥시다제 조직 활성, 반정량적 호중구 수에 대한 조직학적 처리, 및 건조시키기 전 및 후의 수분 중량의 차이에 의해서 습윤 중량의 퍼센트 [(습윤 중량-건조 중량)/습윤 중량]로 표현되는 폐조직 내의 수분 중량에 관해서 사용될 수 있다.
BAL 유체 분석. BAL 유체는 20 ㎖의 생리식염수의 3 회 연속 주입 및 온화한 흡인과 함께 폐의 우중엽의 카눌라 삽입에 의해서 수득된다. 유체는 단백질 함량 (미세혈관 손상을 반영함) 및 사이토킨 농도 (IL-1, IL-6, IL-8, IL-10, IFN-γ 및 TNF-α)에 대해서 평가한다. BAL 유체 내의 세포수는 세포학적 염색에 의한 사이토스핀 (cytospin) 후에 결정하여 상피, 호중구 및 대식세포/단핵구를 포함한 다양한 세포 성분의 전체 및 백분율을 제공한다. 폐포 대식세포를 분리하여 밤새 배양하고, LPS에 대한 그들의 사이토킨 반응을 다음날에 평가한다. 매트릭스-메탈로프로테이나제-2 및 -9, 엘라스타제, 및 미엘로퍼옥시다제의 유체 레벨은 조직 손상을 발생시키는데 중요한 활성화된 호중구-분비된 생성물을 반영하는 것으로서 잘-정립된 시험방법에 의해서 측정된다.
급성 신장 손상 (
AKI
)의 측정
최근의 임상 데이터는 호중구 젤라티나제-연관된 리포칼린 (NGAL)이 CPB 이후의 AKI에 대한 초기 바이오마커 (early biomarker)인 것을 입증하였다. CPB 이후의 2 시간째에 소변 및 혈청 내의 NGAL의 양은 혈청 크레아티닌 및 BUN의 후속 증가를 갖는 AKI의 매우 특이적이고 민감한 예측 마커이다. 혈청 및 소변은 모든 동물에서 기준선, CPB 중단의 시점 및 CPB 후의 q 1 시간에 수집할 수 있다. NGAL 레벨은 돼지에 대한 민감성 ELISA 시험방법에 의해서 결정될 수 있다. NGAL 레벨의 차이는 이러한 동물 모델에서 AKI의 정도를 반영하여야 한다.
혈청 화학은 자동화된 화학 분석기를 사용하여 측정될 수 있다. 사이토킨 레벨은 돼지 사이토킨 IL-1, IL-6, IL-8, IL-10, IFN-γ 및 TNF-α에 대해서 반응성인 상업적 ELISA 시험 키트 (R & D Systems)를 사용하여 측정될 수 있다. BAL 유체는 세포 수 및 세포-타입 분포, 혈관 누출의 척도로서 단백질, 및 IL-1, IL-6, IL-8, IL-10, IFN-γ 및 TNF-α를 포함한 사이토킨 레벨에 관해서 수득될 수 있다.
심혈관 및 생화학적 데이터는 반복측정 공변량분석 (ANOVA)에 의해서 분석될 수 있다. 다양한 부위의 혈장 레벨, 및 생존시간은 경우에 따라 짝이 있거나 (paired) 짝이 없는, 스투던트 t-시험 (Student's T-test)을 이용하여 비교할 수 있다.
SCID를 포함하는 CPB 시스템 내에서 시트레이트 지역적 항응고 처리를 받은 동물은 보다 더 적은 폐 기능부전, 폐 염증, 및 NGAL에 의해 측정된 것으로서 AKI를 가지는 것으로 생각된다. 또한, 호중구 감소증 및 백혈구 감소증과 함께 전신적 WBC 수의 정도는 3 시간째에 최저일 수 있지만, 양 그룹에서 동일한 크기일 수 있다. 또한, 백혈구 염증성 인덱스의 방출은 헤파린 그룹에 대비하여 시트레이트 그룹에서 억제될 수 있는 것으로 생각된다.
참고에 의한 결합
본 명세서에 언급된 문헌 및 특허자료 각각의 전체 기술내용은 각각의 개별적인 문헌 또는 특허자료를 개별적으로 나타낸 것처럼 동일한 정도로 모든 목적에 따라 온전히 참고로 포함된다.
등가물
본 발명은 그의 정신 또는 본질적 특징을 벗어남이 없이 다른 특정한 형태로 구체화될 수 있다. 따라서, 전술한 구체예는 모든 관점에서 본 명세서에 기술된 본 발명에 대해서 제한적이 아니라 설명하는 것으로 간주되어야 한다. 따라서. 본 발명의 범위는 전술한 설명에 의해서가 아니라 첨부된 특허청구범위에 의해서 나타나며, 특허청구범위의 동등성의 의미 및 범주 안에 있는 모든 변화는 여기에 포함된다.
<110> The Regents of the University of Michigan
Innovative Biotherapies, Inc.
<120> Selective Cytopheresis Devices and Related Methods Thereof
<130> IPA100097-DIV1
<150> US 60/969,394
<151> 2007-08-31
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 149
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 1
Leu His Gly Gly Ser Pro Trp Pro Pro Cys Cys Cys Cys Cys Cys Cys
1 5 10 15
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
20 25 30
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
35 40 45
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
50 55 60
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
65 70 75 80
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
85 90 95
Cys Cys Cys Cys Cys Gln Tyr Arg Gly Leu Thr Ser Pro Cys Cys Cys
100 105 110
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
115 120 125
Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys Cys
130 135 140
Cys Cys Cys Cys Lys
145
Claims (42)
- 샘플로부터 유래하는 백혈구를 격리시키도록 배열된 구역을 포함하는 생물학적 샘플 유동용 통로를 한정하는 장치; 및
백혈구로부터 전-염증성 물질의 방출을 억제하거나 백혈구를 불활성화시킬 수 있는 약제를 포함하는, 백혈구 처리용 시스템.
- 제1항에 있어서, 상기 통로를 한정하는 장치와 직렬로 제2 장치를 추가로 포함하는 시스템.
- 제1항에 있어서, 상기 약제가 통로의 표면과 회합된 시스템.
- 제1항에 있어서, 상기 약제가 통로 내로 주입되는 시스템.
- 제1항에 있어서, 상기 약제가 칼슘 킬레이트화제를 포함하는 시스템.
- 제5항에 있어서, 상기 칼슘 킬레이트화제가 시트레이트를 포함하는 시스템.
- 제1항에 있어서, 상기 약제가 면역억제제, 세린 백혈구 억제제, 산화질소, 다형핵 백혈구 억제제 인자, 분비성 백혈구 억제제, 및 칼슘 킬레이트화제를 포함하며, 여기에서 칼슘 킬레이트화제는 시트레이트, 나트륨 헥사메타포스페이트, 에틸렌 디아민 테트라아세트산 (EDTA), 트리에틸렌 테트라민, 디에틸렌 트리아민, o-페난트롤린 및 옥살산으로 구성된 그룹 중의 하나 또는 그 이상인 시스템.
- 제1항에 있어서, 백혈구를 격리시키도록 배열된 상기 구역이 막을 포함하는 시스템.
- 제8항에 있어서, 상기 막이 다공성인 시스템.
- 제8항에 있어서, 상기 막이 약 0.2 ㎡ 초과의 표면적을 갖는 시스템.
- 제1항에 있어서, 백혈구를 격리시키도록 배열된 구역이 그 구역 내에서의 전단력이 약 1000 dyne/㎠ 미만이 되도록 배열된 시스템.
- 제1항에 있어서, 백혈구를 격리시키도록 배열된 상기 구역이 세포-부착 분자를 포함하는 시스템.
- (a) 초회 자극되거나 활성화된 백혈구를 체외로 격리시키고;
(b) 백혈구를 처리하여 전-염증성 물질의 방출을 억제하거나, 백혈구를 불활성화시키는 것을 포함하여, 체액 내에 함유된 백혈구를 처리하는 방법.
- 제13항에 있어서, 상기 백혈구가 전-염증성 물질의 방출을 억제하거나 백혈구를 불활성화시키기에 충분한 시간 동안 격리되는 방법.
- 제13항에 있어서, 상기 백혈구가 장시간 동안 격리되는 방법.
- 제15항에 있어서, 상기 백혈구가 적어도 1 시간 동안 격리되는 방법.
- 제13항에 있어서, 단계 (b)에서 생산된 백혈구를 대상체에게 다시 역으로 반송하는 단계를 추가로 포함하는 방법.
- 제13항에 있어서, 단계 (b)에서 칼슘 킬레이트화제가 전-염증성 물질의 방출을 억제하거나 백혈구를 불활성화시키는 방법.
- (a) 대상체로부터의 초회 자극되거나 활성화된 백혈구를 체외로 격리시키고;
(b) 백혈구를 처리하여 염증성 상태와 연관된 염증이 발생할 위험을 감소시키거나, 염증성 상태와 연관된 염증을 완화시키는 것을 포함하여, 염증성 상태를 발생할 위험이 있거나 염증성 상태를 갖는 대상체를 치료하는 방법.
- 제19항에 있어서, 상기 염증성 상태가 전신적 염증반응 증후군 (SIRS), 심폐우회술 증후군, 급성 호흡부전 증후군 (ARDS), 패혈증, 류마티스성 관절염, 전신성 홍반성 루푸스, 염증성 장질환, 다발성 경화증, 건선, 동종이식 거부반응, 천식, 만성 신부전, 심신성 증후군, 간신성 증후군, 및 심근, 중추신경계, 간, 신장 또는 췌장에 대한 허혈성 재관류 손상으로 인한 급성 기관 부전으로 이루어진 군으로부터 선택되는 방법.
- 제13항 또는 제19항에 있어서, 상기 단계 (a)가 백혈구를 격리시키도록 배열된 구역을 포함하는 통로를 한정하는 장치를 사용하여 수행되는 방법.
- 샘플로부터 유래하는 혈소판을 격리시키도록 배열된 구역을 포함하는 생물학적 샘플 유동용 통로를 한정하는 장치; 및
혈소판으로부터 전-염증성 물질의 방출을 억제하거나 혈소판을 불활성화시킬 수 있는 약제를 포함하는, 혈소판 처리용 시스템.
- 제22항에 있어서, 통로를 한정하는 장치와 직렬로 제2 장치를 추가로 포함하는 시스템.
- 제22항에 있어서, 상기 약제가 통로 내에 주입되는 시스템.
- 제22항에 있어서, 상기 약제가 칼슘 킬레이트화제를 포함하는 시스템.
- 제25항에 있어서, 상기 칼슘 킬레이트화제가 시트레이트를 포함하는 시스템.
- 제22항에 있어서, 혈소판을 격리시키도록 배열된 상기 구역이 막을 포함하는 시스템.
- 제27항에 있어서, 상기 막이 다공성인 시스템.
- 제27항에 있어서, 상기 막이 약 0.2 ㎡ 초과의 표면적을 갖는 시스템.
- 제22항에 있어서, 혈소판을 격리시키도록 배열된 상기 구역이 그 구역 내에서의 전단력이 약 1000 dyne/㎠ 미만이 되도록 배열되는 시스템.
- (a) 활성화된 혈소판을 체외로 격리시키고;
(b) 혈소판을 처리하여 전-염증성 물질의 방출을 억제하거나, 혈소판을 불활성화시키는 것을 포함하여, 체액 내에 함유된 혈소판을 처리하는 방법.
- 제31항에 있어서, 상기 혈소판이 전-염증성 물질의 방출을 억제하거나 혈소판을 불활성화시키기에 충분한 시간 동안 격리되는 방법.
- 제31항에 있어서, 상기 혈소판이 장시간 동안 격리되는 방법.
- 제33항에 있어서, 상기 혈소판이 적어도 1 시간 동안 격리되는 방법.
- 제31항에 있어서, 단계 (b)에서 생산된 혈소판을 대상체에게 다시 역으로 반송하는 단계를 추가로 포함하는 방법.
- 제31항에 있어서, 단계 (b)에서 칼슘 킬레이트화제가 전-염증성 물질의 방출을 억제하거나 혈소판을 불활성화시키는 방법.
- (a) 대상체로부터의 활성화된 혈소판을 체외로 격리시키고;
(b) 혈소판을 처리하여 염증성 상태와 연관된 염증이 발생할 위험을 감소시키거나, 염증성 상태와 연관된 염증을 완화시키는 것을 포함하여, 염증성 상태를 발생할 위험이 있거나 염증성 상태를 갖는 대상체를 치료하는 방법.
- 제37항에 있어서, 상기 염증성 상태가 전신적 염증반응 증후군 (SIRS), 심폐우회술 증후군, 급성 호흡부전 증후군 (ARDS), 패혈증, 류마티스성 관절염, 전신성 홍반성 루푸스, 염증성 장질환, 다발성 경화증, 건선, 동종이식 거부반응, 천식, 만성 신부전, 심신성 증후군, 간신성 증후군, 및 심근, 중추신경계, 간, 신장 또는 췌장에 대한 허혈성 재관류 손상으로 인한 급성 기관 부전으로 이루어진 군으로부터 선택되는 방법.
- 제31항 또는 제37항에 있어서, 단계 (a)가 혈소판을 격리시키도록 배열된 구역을 포함하는 통로를 한정하는 장치를 사용하여 수행되는 방법.
- (a) 대상체로부터 염증과 연관된 초회 자극되거나 활성화된 세포를 체외로 선택적으로 격리시키고;
(b) 세포를 처리하여 염증성 상태와 연관된 염증이 발생할 위험을 감소시키거나, 염증성 상태와 연관된 염증을 완화시키는 것을 포함하여, 염증성 상태를 발생할 위험이 있거나 염증성 상태를 갖는 대상체를 치료하는 방법.
- 제40항에 있어서, 염증과 연관된 활성화된 세포가 혈소판 및 백혈구로 이루어진 군으로부터 선택되는 방법.
- 제40항에 있어서, 염증과 연관된 초회 자극된 세포가 백혈구인 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96939407P | 2007-08-31 | 2007-08-31 | |
| US60/969,394 | 2007-08-31 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20107006729A Division KR20100061704A (ko) | 2007-08-31 | 2008-08-29 | 선택적 사이토페레시스 장치 및 그와 관련된 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120093397A true KR20120093397A (ko) | 2012-08-22 |
Family
ID=40388135
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127016409A KR20120093397A (ko) | 2007-08-31 | 2008-08-29 | 선택적 사이토페레시스 장치 및 그와 관련된 방법 |
| KR20107006729A KR20100061704A (ko) | 2007-08-31 | 2008-08-29 | 선택적 사이토페레시스 장치 및 그와 관련된 방법 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20107006729A KR20100061704A (ko) | 2007-08-31 | 2008-08-29 | 선택적 사이토페레시스 장치 및 그와 관련된 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (13) | US8251941B2 (ko) |
| EP (2) | EP2187957A4 (ko) |
| JP (3) | JP5769418B2 (ko) |
| KR (2) | KR20120093397A (ko) |
| CN (2) | CN102908690A (ko) |
| AU (1) | AU2008293431B2 (ko) |
| BR (1) | BRPI0816165A2 (ko) |
| CA (2) | CA2789592C (ko) |
| MX (1) | MX2010002351A (ko) |
| NZ (1) | NZ583591A (ko) |
| WO (1) | WO2009029801A2 (ko) |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090081296A1 (en) * | 2006-02-02 | 2009-03-26 | Humes H David | Extracorporeal cell-based therapeutic device and delivery system |
| WO2007092735A2 (en) | 2006-02-02 | 2007-08-16 | Innovative Bio Therapies | An extracorporeal cell-based therapeutic device and delivery system |
| EP2101843B1 (de) * | 2007-01-13 | 2016-04-13 | 3M Innovative Properties Company of 3M Center | Vorrichtung zur entfernung von leukozyten aus blut |
| CA2789592C (en) | 2007-08-31 | 2015-05-12 | The Regents Of The University Of Michigan | Selective cytopheresis devices and related methods thereof |
| US8266791B2 (en) | 2007-09-19 | 2012-09-18 | The Charles Stark Draper Laboratory, Inc. | Method of fabricating microfluidic structures for biomedical applications |
| EP2288397B1 (en) * | 2008-04-01 | 2019-03-13 | Gambro Lundia AB | An apparatus and a method for monitoring a vascular access |
| WO2010071692A2 (en) | 2008-06-18 | 2010-06-24 | Innovative Biotherapies, Inc. | Methods for enhanced propagation of cells |
| DE102008045127A1 (de) * | 2008-09-01 | 2010-03-04 | Heinrich, Hans-Werner, Prof. Dr. | Filtersystem zur extrakorporalen Abreicherung von aktivierten Polymorphkernigen Granuloyzten (Polymorphonuclear leukocytes-PMNs) |
| ATE545440T1 (de) * | 2008-09-25 | 2012-03-15 | Gambro Lundia Ab | Hybride biologische künstliche niere |
| US20110082563A1 (en) * | 2009-10-05 | 2011-04-07 | The Charles Stark Draper Laboratory, Inc. | Microscale multiple-fluid-stream bioreactor for cell culture |
| US20120201799A1 (en) * | 2009-10-07 | 2012-08-09 | Federspiel William J | Devices, systems and methods for cell modification |
| CN102712503A (zh) * | 2009-10-08 | 2012-10-03 | 大冢制药株式会社 | 用于治疗恶性肿瘤的免疫活性血液灌注过滤器 |
| US8425662B2 (en) | 2010-04-02 | 2013-04-23 | Battelle Memorial Institute | Methods for associating or dissociating guest materials with a metal organic framework, systems for associating or dissociating guest materials within a series of metal organic frameworks, and gas separation assemblies |
| US20110250578A1 (en) * | 2010-04-13 | 2011-10-13 | Northern Alberta Institute Of Technology | Ventilator test lung and trigger assembly |
| JP2014500735A (ja) | 2010-10-15 | 2014-01-16 | サイトフェリックス インコーポレイテッド | サイトフェレーシスカートリッジおよびその使用 |
| US9199026B2 (en) * | 2011-01-07 | 2015-12-01 | Somerset Group Enterprises, Inc. | Modular extracorporeal systems and methods for treating blood-borne diseases |
| US10307167B2 (en) | 2012-12-14 | 2019-06-04 | Corquest Medical, Inc. | Assembly and method for left atrial appendage occlusion |
| US10813630B2 (en) | 2011-08-09 | 2020-10-27 | Corquest Medical, Inc. | Closure system for atrial wall |
| US10314594B2 (en) | 2012-12-14 | 2019-06-11 | Corquest Medical, Inc. | Assembly and method for left atrial appendage occlusion |
| JP2015504318A (ja) * | 2011-10-14 | 2015-02-12 | サイトフェリックス インコーポレイテッド | 心筋機能を向上させるためのカートリッジおよび方法 |
| US20150246169A1 (en) * | 2011-10-14 | 2015-09-03 | Cytopherx, Inc. | Cartridge and method for increasing myocardial function |
| US9375525B2 (en) * | 2012-01-09 | 2016-06-28 | Somerset Group Enterprises, Inc. | Modular extracorporeal systems and methods for treating blood-borne diseases |
| WO2013128013A1 (en) * | 2012-03-01 | 2013-09-06 | Medical Device Works Nv | Perfusion-occlusion device |
| JP2014061285A (ja) * | 2012-08-31 | 2014-04-10 | Asahi Kasei Medical Co Ltd | 臓器炎症抑制用基材及びデバイス |
| US20140142689A1 (en) | 2012-11-21 | 2014-05-22 | Didier De Canniere | Device and method of treating heart valve malfunction |
| US20160058839A1 (en) * | 2013-05-02 | 2016-03-03 | University Of Vermont And State Agricultural College | Leptin for treating systemic inflammatory response syndrome |
| US9566443B2 (en) | 2013-11-26 | 2017-02-14 | Corquest Medical, Inc. | System for treating heart valve malfunction including mitral regurgitation |
| CN205163774U (zh) * | 2013-12-08 | 2016-04-20 | 杨海龙 | 悬吊式回输血器 |
| EP3102224B1 (en) * | 2013-12-20 | 2019-02-20 | NephroGenesis, LLC. | Apparatuses for kidney dialysis and lipocalin protein for use in the prevention or treatment of uremia by dialysis |
| CN103725599B (zh) * | 2014-01-14 | 2015-05-27 | 刘韬 | 一种流体膜过滤细胞分离装置 |
| EP4335539A3 (en) | 2014-03-29 | 2024-05-01 | Princeton Trade and Technology Inc. | Blood processing cartridges and systems, and methods for extracorporeal blood therapies |
| US20170165334A1 (en) * | 2015-12-11 | 2017-06-15 | Tianxin Wang | Methods to Treat Diseases with Protein, Peptide, Antigen Modification and Hemopurification |
| US20170266362A1 (en) * | 2014-08-26 | 2017-09-21 | 3M Innovative Properties Company | System for removal of pro-inflammatory mediators as well as granulocytes and monocytes from blood |
| GB201420829D0 (en) * | 2014-11-24 | 2015-01-07 | Imp Innovations Ltd | Lymph node replacement construct |
| US10842626B2 (en) | 2014-12-09 | 2020-11-24 | Didier De Canniere | Intracardiac device to correct mitral regurgitation |
| CA2974619C (en) | 2015-01-26 | 2020-12-22 | Ube Industries, Ltd. | Method for isolating, removing and analyzing cells |
| US10426884B2 (en) | 2015-06-26 | 2019-10-01 | Novaflux Inc. | Cartridges and systems for outside-in flow in membrane-based therapies |
| EP3352888B8 (en) | 2015-09-24 | 2022-01-12 | Princeton Trade and Technology Inc. | Cartridges for hollow fibre membrane-based therapies |
| WO2017223377A1 (en) * | 2016-06-23 | 2017-12-28 | New Health Sciences, Inc. | Methods for managing adverse events in patient populations requiring transfusion |
| EP3479119B1 (en) | 2016-06-30 | 2020-08-12 | Koninklijke Philips N.V. | Method for detecting an analyte in a body fluid sample containing a plurality of cells |
| WO2018145035A1 (en) * | 2017-02-03 | 2018-08-09 | Nxstage Medical, Inc. | Multiple mode treatment devices methods and systems |
| IT201700038389A1 (it) * | 2017-04-07 | 2018-10-07 | In10Sivecare S R L | Apparecchiatura per il trattamento extracorporeo del sangue |
| EP3388140A1 (en) * | 2017-04-10 | 2018-10-17 | Gambro Lundia AB | Extracorporeal blood circuit |
| EP3400976A1 (en) * | 2017-05-12 | 2018-11-14 | Universitat Rovira i Virgili | Device and method for the preparation of platelet rich plasma |
| CN107224624B (zh) * | 2017-06-12 | 2023-12-15 | 谢华南 | 血液透析器、血液透析装置及血液透析方法 |
| EP3427772B1 (en) | 2017-07-10 | 2023-05-03 | B. Braun Avitum AG | Oxygenator unit with a pressure relief valve |
| EP3473327A1 (en) | 2017-10-19 | 2019-04-24 | 3M Innovative Properties Company | Integrated fluid treatment device, and process using such device |
| MA51419A (fr) | 2017-12-28 | 2021-04-07 | I Sep | Système et procédé de traitement de liquide hémorragique pour de l'autotransfusion |
| CN112088023B (zh) | 2018-01-05 | 2024-05-14 | 帕斯艾克斯公司 | 用于捕获和去除流体中的疾病物质的装置 |
| EP3873343A4 (en) * | 2019-03-26 | 2022-01-05 | Nuwellis, Inc. | NEONATAL AND PEDIATRIC BLOOD FILTRATION SYSTEM |
| US20220273855A1 (en) * | 2019-08-01 | 2022-09-01 | Seastar Medical, Inc. | Device and method for preparing a donor organ for transplantation |
| EP3846875A4 (en) * | 2019-11-19 | 2021-07-14 | Immunicom, Inc. | SYSTEM AND METHOD FOR THE REMOVAL OF IMMUNINHIBITORS FROM BIOLOGICAL LIQUIDS |
| DE102020104117A1 (de) * | 2020-02-18 | 2021-08-19 | Universität des Saarlandes | Vorrichtung zum Entfernen eines Gases aus einer wässrigen Flüssigkeit |
| CN111939599B (zh) * | 2020-07-14 | 2024-01-12 | 山东中保康医疗器具有限公司 | 富血小板血浆的制备方法及装置 |
| CN113686605B (zh) * | 2021-08-16 | 2023-07-07 | 北京林业大学 | 一种花粉管超薄切片及其制备方法 |
| CN116212121A (zh) * | 2023-04-25 | 2023-06-06 | 四川大学华西医院 | 一种铜氨络合物-多巴胺-肝素抗菌抗凝透析导管及其制备方法 |
Family Cites Families (95)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3489145A (en) | 1966-08-08 | 1970-01-13 | Surgeon General Of The Public | Method and apparatus for continuous separation of blood in vivo |
| GB2018151B (en) | 1978-03-06 | 1982-12-08 | Asahi Chemical Ind | Seperation of leukocytes from leukocyte-containing suspension by filtration |
| US4334993A (en) | 1979-12-05 | 1982-06-15 | Baxter Travenol Laboratories, Inc. | Potted-typed seal with stress relief and method of making same |
| US4500309A (en) | 1982-05-07 | 1985-02-19 | The Kansas University Endowment Association | Method for regional anticoagulation during extracorporeal dialysis |
| US4980068A (en) | 1983-08-15 | 1990-12-25 | Lavender Ardis R | System, apparatus and method for continuously fractionating blood in situ |
| SE441236B (sv) | 1984-06-18 | 1985-09-23 | Gambro Dialysatoren | Forfarande for framstellning av en anordning innefattande en halfiberbunt |
| SE8601891D0 (sv) | 1986-04-24 | 1986-04-24 | Svante Jonsson | Maskin for plasmabytesbehandling och trombocytgivning |
| SE454847B (sv) | 1987-08-31 | 1988-06-06 | Gambro Dialysatoren | Anordning for diffusion och/eller filtrering samt forfarande for tillverkning av denna anordning |
| WO1989001967A1 (en) | 1987-09-03 | 1989-03-09 | Brown University Research Foundation | Blood purification with cultured renal cells |
| CA1325770C (en) | 1988-04-04 | 1994-01-04 | Toru Kuroda | Adsorber module for whole blood treatment and an adsorber apparatus containing the adsorber module |
| US5104373A (en) * | 1988-09-22 | 1992-04-14 | American Immuno Tech, Inc. | Method and apparatus for extracorporeal blood treatment |
| US5229012A (en) | 1989-05-09 | 1993-07-20 | Pall Corporation | Method for depletion of the leucocyte content of blood and blood components |
| US5344561A (en) | 1989-05-09 | 1994-09-06 | Pall Corporation | Device for depletion of the leucocyte content of blood and blood components |
| US5100564A (en) | 1990-11-06 | 1992-03-31 | Pall Corporation | Blood collection and processing system |
| US5032615A (en) | 1989-10-31 | 1991-07-16 | The Regents Of The University Of California | Continuous hemodialysis using citrate |
| US5266219A (en) | 1989-12-28 | 1993-11-30 | Pall Corporation | Device and method for separating plasma from blood |
| ATE170982T1 (de) | 1990-02-14 | 1998-09-15 | Pentapharm Ag | Inhibitoren zur antikoagulierenden vorbehandung von blutproben |
| US5383847A (en) * | 1990-03-29 | 1995-01-24 | Therakos, Inc. | Non-specific immune system enhancement |
| US5362406A (en) * | 1990-07-27 | 1994-11-08 | Pall Corporation | Leucocyte depleting filter device and method of use |
| US5217627A (en) | 1990-11-06 | 1993-06-08 | Pall Corporation | System and method for processing biological fluid |
| US5486286A (en) | 1991-04-19 | 1996-01-23 | Althin Medical, Inc. | Apparatus for performing a self-test of kidney dialysis membrane |
| SE502103C2 (sv) | 1991-08-01 | 1995-08-14 | Gambro Dialysatoren | Filterenhet för överföring av massa och/eller värme innehållande hålrumsfibrer |
| US5443743A (en) | 1991-09-11 | 1995-08-22 | Pall Corporation | Gas plasma treated porous medium and method of separation using same |
| CA2074671A1 (en) | 1991-11-04 | 1993-05-05 | Thomas Bormann | Device and method for separating plasma from a biological fluid |
| EP0612526A4 (en) * | 1991-11-15 | 1995-08-02 | Ss Pharmaceutical Co | ANTI-INFLAMMATORY AND ANALGESIC PLATTER. |
| US5804079A (en) | 1991-12-23 | 1998-09-08 | Baxter International Inc. | Systems and methods for reducing the number of leukocytes in cellular products like platelets harvested for therapeutic purposes |
| JPH0614996A (ja) * | 1992-05-01 | 1994-01-25 | Kawasumi Lab Inc | 吸着モジュ−ル |
| US5403272A (en) | 1992-05-29 | 1995-04-04 | Baxter International Inc. | Apparatus and methods for generating leukocyte free platelet concentrate |
| IL104670A (en) | 1993-02-09 | 1998-04-05 | Travenol Lab Israel Ltd | Leukocyte removal method and filter unit for same |
| EP0697880B1 (en) | 1993-05-03 | 2001-08-22 | Genentech, Inc. | Inhibition of leukocyte adhesion |
| US5567443A (en) | 1993-08-04 | 1996-10-22 | Japan Immunoresearch Laboratories Co., Ltd. | Method of treating inflammatory diseases |
| US5571418A (en) | 1993-08-20 | 1996-11-05 | Lee; Patrice A. | Hemofiltration of toxic mediator-related disease |
| US5545339A (en) | 1994-02-25 | 1996-08-13 | Pall Corporation | Method for processing biological fluid and treating separated component |
| EP0692268B2 (de) | 1994-07-13 | 2005-02-09 | Fresenius Medical Care Deutschland GmbH | Substituataufbereitung bei der Hämofiltration oder Hämodiafiltration |
| US5582907A (en) | 1994-07-28 | 1996-12-10 | Pall Corporation | Melt-blown fibrous web |
| EP0772484B1 (en) | 1994-07-28 | 2008-02-27 | Pall Corporation | Fibrous web and process of preparing same |
| US5836934A (en) | 1995-06-07 | 1998-11-17 | Baxter International Inc. | Closed system and methods for mixing additive solutions while removing undesired matter from blood cells |
| WO1997002851A1 (fr) | 1995-07-10 | 1997-01-30 | Asahi Medical Co., Ltd. | Systeme de traitement du sang circulant dans un circuit extracorporel pour soigner des maladies inflammatoires |
| DE19528907C1 (de) | 1995-08-05 | 1996-11-07 | Fresenius Ag | Vorrichtung zur Ermittlung hämodynamischer Parameter während einer extrakorporalen Blutbehandlung |
| DE19541783C1 (de) | 1995-11-09 | 1997-03-27 | Fresenius Ag | Verfahren zum Betreiben einer Blutbehandlungsvorrichtung zur Ermittlung hämodynamischer Parameter während einer extrakorporalen Blutbehandlung und Vorrichtung zur Ermittlung hämodynamischer Parameter während einer extrakorporalen Blutbehandlung |
| JPH1017493A (ja) * | 1996-07-02 | 1998-01-20 | Masashi Fujii | カルシウムの金属イオン封鎖剤を含む抗炎症性または抗アレルギー性皮膚外用剤 |
| WO1998001208A1 (en) | 1996-07-08 | 1998-01-15 | Memtec America Corporation | Cationically charge-modified membranes |
| EP0910451B1 (en) | 1996-07-09 | 2004-05-06 | Pall Corporation | Biological fluid filter device comprising a leukocyte depletion medium |
| US6045899A (en) | 1996-12-12 | 2000-04-04 | Usf Filtration & Separations Group, Inc. | Highly assymetric, hydrophilic, microfiltration membranes having large pore diameters |
| US6595943B1 (en) | 1997-02-14 | 2003-07-22 | Nxstage Medical, Inc. | Systems and methods for controlling blood flow and waste fluid removal during hemofiltration |
| US6830553B1 (en) | 1997-02-14 | 2004-12-14 | Nxstage Medical, Inc. | Blood treatment systems and methods that maintain sterile extracorporeal processing conditions |
| DE19712298C2 (de) | 1997-03-24 | 1999-05-20 | Fresenius Ag | Vorrichtung und Verfahren zum Trennen von Blut in Blutkomponenten |
| US6889082B2 (en) | 1997-10-09 | 2005-05-03 | Orqis Medical Corporation | Implantable heart assist system and method of applying same |
| JP4197545B2 (ja) * | 1997-12-01 | 2008-12-17 | 旭化成クラレメディカル株式会社 | 特異的細胞除去材料 |
| US6123859A (en) | 1998-04-22 | 2000-09-26 | Hemasure Inc. | Method for in-line filtering biological liquid |
| US6287516B1 (en) | 1998-07-10 | 2001-09-11 | Immunocept, L.L.C. | Hemofiltration systems, methods, and devices used to treat inflammatory mediator related disease |
| JP3640824B2 (ja) * | 1999-01-07 | 2005-04-20 | テルモ株式会社 | 白血球除去フィルターおよびその製造方法 |
| PT1126859E (pt) | 1999-03-17 | 2006-09-29 | Jimro Co Ltd | Aferese dos leucocitos sanguineos para o tratamento do vih ep1126859 |
| US6561997B1 (en) | 1999-04-23 | 2003-05-13 | The Regents Of The University Of Michigan | Extracorporeal fluid circuit and related methods |
| US6736972B1 (en) | 2000-03-24 | 2004-05-18 | Immunocept, L.L.C. | Method and system for providing therapeutic agents with hemofiltration for reducing inflammatory mediator related diseases |
| JP2001276217A (ja) * | 2000-04-04 | 2001-10-09 | Dountsuendorufaa Udo | 単一又は複数の疾患のある患者での組織、血漿又は血液透析用のバイオコートされた吸着剤 |
| WO2001089513A1 (en) | 2000-05-24 | 2001-11-29 | Uab Research Foundation | Use of citrate-containing dialysate for renal dialysis treatment |
| US20020107469A1 (en) | 2000-11-03 | 2002-08-08 | Charles Bolan | Apheresis methods and devices |
| DE10114283C2 (de) | 2000-12-22 | 2003-04-24 | Fresenius Medical Care De Gmbh | Verfahren zur Ermittlung der Ionenkonzentration des Blutes eines Patienten bei der citrat-antikoagulierten Hämodialyse und/oder Hämofiltration; Dialysegerät |
| US6706274B2 (en) * | 2001-01-18 | 2004-03-16 | Scimed Life Systems, Inc. | Differential delivery of nitric oxide |
| US6582386B2 (en) | 2001-03-06 | 2003-06-24 | Baxter International Inc. | Multi-purpose, automated blood and fluid processing systems and methods |
| US6706008B2 (en) | 2001-03-06 | 2004-03-16 | Baxter International Inc. | Automated system and method for withdrawing compounds from blood |
| US6653131B2 (en) | 2001-08-30 | 2003-11-25 | The Regents Of The University Of Michigan | Method of treating systemic inflammatory response syndrome |
| US8986944B2 (en) * | 2001-10-11 | 2015-03-24 | Aviva Biosciences Corporation | Methods and compositions for separating rare cells from fluid samples |
| US7442546B2 (en) | 2002-03-15 | 2008-10-28 | The Regents Of The University Of Michigan | Method of modulating inflammatory response |
| US7531133B2 (en) * | 2002-09-10 | 2009-05-12 | Pulmonox Technologies Corporation | Use of nitric oxide gas in an extracorporeal circuitry to treat blood plasma |
| AU2003272310A1 (en) | 2002-09-11 | 2004-04-30 | The Cleveland Clinic Foundation | Ultrafiltration membrane, device, bioartificial organ and methods |
| AU2003284304B8 (en) | 2002-10-21 | 2009-08-06 | Nagler, Richard | Surface coating comprising bioactive compound |
| AU2003284534A1 (en) * | 2002-12-02 | 2004-06-23 | Asahi Medical Co., Ltd. | Method of removing leukocytes, leukocyte-removing filter and utilization thereof |
| US7351218B2 (en) | 2002-12-20 | 2008-04-01 | Gambro Lundia Ab | Device and process for extracorporeal treatment by citrate anticoagulant |
| JP2004243048A (ja) | 2003-02-10 | 2004-09-02 | Besutekku:Kk | 電位治療装置制御方法、電位治療装置及び白血球分画の顆粒球とリンパ球との比率を調整する方法 |
| US7201730B2 (en) | 2003-03-17 | 2007-04-10 | Hemavation, Llc | Device and method for reducing inflammatory mediators in blood |
| US7297270B2 (en) | 2003-04-04 | 2007-11-20 | Chf Solutions, Inc. | Hollow fiber filter for extracorporeal blood circuit |
| US20070148772A1 (en) | 2003-06-21 | 2007-06-28 | Lifeforce Group Plc | Leukocyte cell banks |
| EP1518573B1 (en) | 2003-09-23 | 2006-08-23 | Fresenius Hemocare Italia S.r.l. | Filter, purification device and method for the removal of substances from blood products |
| US7029456B2 (en) | 2003-10-15 | 2006-04-18 | Baxter International Inc. | Medical fluid therapy flow balancing and synchronization system |
| CA2555552A1 (en) * | 2004-02-09 | 2005-09-09 | Noxilizer, Inc. | Nitric oxide-releasing molecules |
| US20050281809A1 (en) | 2004-02-23 | 2005-12-22 | Roberts Craig P | Plasma detoxification and volume control system and methods of use |
| US20050215937A1 (en) | 2004-03-05 | 2005-09-29 | Spinale Francis G | System and method for filtering leukocytes in cardiac surgery |
| DK1949915T3 (da) | 2004-04-30 | 2012-11-26 | Biopheresis Technologies Inc | Fremgangsmåde og system til fjernelse af opløselig TNFR1, TNRF2 og IL2R i patienter |
| EP1754496B1 (en) | 2004-06-09 | 2016-01-20 | Asahi Kasei Medical Co., Ltd. | Method for removing leukocyte and filter for use therein |
| WO2006008906A1 (ja) | 2004-07-22 | 2006-01-26 | Asahi Kasei Medical Co., Ltd. | 手術部位感染の抑制方法およびそれに使用するカラム |
| WO2006083322A2 (en) * | 2004-07-29 | 2006-08-10 | Ligocyte Pharmaceuticals, Inc. | Methods for the treatment and prevention of infection using anti-selectin agents |
| KR100876819B1 (ko) * | 2005-01-06 | 2009-01-07 | 아사히 가세이 메디컬 가부시키가이샤 | 백혈구 제거 방법 |
| US8584869B2 (en) | 2005-03-31 | 2013-11-19 | Toray Industries, Inc. | Absorbent and column for extracorporeal circulation |
| DE602006017713D1 (de) | 2005-08-31 | 2010-12-02 | Gambro Lundia Ab | Verfahren und gerät zur entfernung von immunzellen |
| EP1931404B1 (de) | 2005-09-09 | 2011-08-03 | Membrana GmbH | Verfahren zur entfernung von leukozyten aus blut |
| US7874998B2 (en) | 2005-11-04 | 2011-01-25 | The Regents Of The University Of Michigan | Filtration devices and related methods thereof |
| US7527737B2 (en) | 2006-05-09 | 2009-05-05 | Wang Xiangyu | Hemodialysis apparatus and methods |
| CN101583722A (zh) | 2006-07-14 | 2009-11-18 | 阿维瓦生物科学股份有限公司 | 从生物学样品检测稀有细胞的方法和组合物 |
| US7410583B2 (en) * | 2006-08-10 | 2008-08-12 | East Bay Municipal Utility District | Process of treating organic waste for anaerobic digestion |
| EP2101843B1 (de) | 2007-01-13 | 2016-04-13 | 3M Innovative Properties Company of 3M Center | Vorrichtung zur entfernung von leukozyten aus blut |
| CA2789592C (en) | 2007-08-31 | 2015-05-12 | The Regents Of The University Of Michigan | Selective cytopheresis devices and related methods thereof |
| DE102008045127A1 (de) | 2008-09-01 | 2010-03-04 | Heinrich, Hans-Werner, Prof. Dr. | Filtersystem zur extrakorporalen Abreicherung von aktivierten Polymorphkernigen Granuloyzten (Polymorphonuclear leukocytes-PMNs) |
| EA201101568A1 (ru) | 2009-04-28 | 2012-05-30 | Бёрингер Ингельхайм Интернациональ Гмбх | Лечение ex vivo иммунологических нарушений с помощью ингибиторов pkc-teta |
-
2008
- 2008-08-29 CA CA2789592A patent/CA2789592C/en active Active
- 2008-08-29 US US12/201,576 patent/US8251941B2/en active Active
- 2008-08-29 CN CN2012104459898A patent/CN102908690A/zh active Pending
- 2008-08-29 NZ NZ583591A patent/NZ583591A/xx unknown
- 2008-08-29 JP JP2010523158A patent/JP5769418B2/ja active Active
- 2008-08-29 KR KR1020127016409A patent/KR20120093397A/ko not_active Application Discontinuation
- 2008-08-29 KR KR20107006729A patent/KR20100061704A/ko active IP Right Grant
- 2008-08-29 MX MX2010002351A patent/MX2010002351A/es not_active Application Discontinuation
- 2008-08-29 BR BRPI0816165-8A2A patent/BRPI0816165A2/pt not_active IP Right Cessation
- 2008-08-29 WO PCT/US2008/074804 patent/WO2009029801A2/en active Application Filing
- 2008-08-29 CA CA2697681A patent/CA2697681C/en active Active
- 2008-08-29 EP EP08828222A patent/EP2187957A4/en not_active Ceased
- 2008-08-29 CN CN200880113549A patent/CN101842111A/zh active Pending
- 2008-08-29 AU AU2008293431A patent/AU2008293431B2/en not_active Withdrawn - After Issue
- 2008-08-29 EP EP20194312.3A patent/EP3789056A1/en active Pending
-
2010
- 2010-06-30 US US12/827,609 patent/US8425446B2/en active Active
- 2010-06-30 US US12/827,606 patent/US8409126B2/en active Active
- 2010-06-30 US US12/827,601 patent/US8430832B2/en active Active
- 2010-06-30 US US12/827,594 patent/US8425445B2/en active Active
-
2011
- 2011-04-15 US US13/087,995 patent/US9341626B2/en active Active
-
2012
- 2012-06-25 US US13/531,870 patent/US9128093B2/en active Active
- 2012-06-25 US US13/531,872 patent/US9498566B2/en active Active
- 2012-08-23 US US13/593,127 patent/US20120323224A1/en not_active Abandoned
- 2012-08-23 US US13/593,169 patent/US8425447B2/en active Active
-
2014
- 2014-01-30 JP JP2014015748A patent/JP6027556B2/ja active Active
-
2016
- 2016-10-14 JP JP2016202237A patent/JP2017080400A/ja active Pending
- 2016-10-14 US US15/294,229 patent/US20170246208A1/en not_active Abandoned
-
2019
- 2019-03-20 US US16/359,300 patent/US20200038578A1/en not_active Abandoned
-
2022
- 2022-10-03 US US17/937,632 patent/US20230277746A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230277746A1 (en) | Selective cytopheresis devices and related methods thereof | |
| JP7224329B2 (ja) | サイトフェレーシスカートリッジおよびその使用 | |
| CA2852220A1 (en) | Cartridge and method for increasing myocardial function | |
| AU2012261515A1 (en) | Selective cytopheresis devices and related methods thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |