KR20120051734A - 항-cMET 항체 및 암의 검출과 진단을 위한 그의 용도 - Google Patents
항-cMET 항체 및 암의 검출과 진단을 위한 그의 용도 Download PDFInfo
- Publication number
- KR20120051734A KR20120051734A KR1020127005757A KR20127005757A KR20120051734A KR 20120051734 A KR20120051734 A KR 20120051734A KR 1020127005757 A KR1020127005757 A KR 1020127005757A KR 20127005757 A KR20127005757 A KR 20127005757A KR 20120051734 A KR20120051734 A KR 20120051734A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- sequence
- cdr
- met
- antibody
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57496—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving intracellular compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Plant Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 환자에서 증식성 질환의 예후 (prognosis) 및/또는 진단의 분야에 관한 것이다. 보다 상세하게는, 본 발명은 인간 cMet 수용체에 특이적으로 결합할 수 있는 항체 뿐만 아니라 본 항체를 코딩하는 아미노산 및 핵산 서열들에 관한 것이다. 본 발명은 마찬가지로 상기 항체의 용도, 및 cMet의 발현과 연관된 병리학적 과다증식 (hyperproliferative) 종양원 유전자성 질병들 (oncogenic disorders)을 검출하고 진단하는, 이에 해당하는 방법들을 포함한다. 소정의 구현예들에서, 질병들은 cMet의 과다발현과 연관된 정상 또는 기타 다른 병리학과 대비하여 cMet 폴리펩타이드의 증가된 발현과 연관된 종양원 유전자성 질병들이다. 마지막으로, 본 발명은 소정의 암들의 예후 또는 진단하는 이러한 항체를 적어도 포함하는 산물들 및/또는 조성물들 또는 키트들을 포함한다.
Description
본 발명은 환자에서 증식성 질환의 예후 (prognosis) 및/또는 진단의 분야에 관한 것이다. 보다 상세하게는, 본 발명은 인간 cMet 수용체에 특이적으로 결합할 수 있는 새로운 항체 뿐만 아니라 본 항체를 코딩하는 아미노산 및 핵산 서열들에 관한 것이다. 본 발명은 마찬가지로 상기 항체의 용도, 및 cMet의 발현과 연관된 병리학적 과다증식 (hyperproliferative) 종양원 유전자성 질병들 (oncogenic disorders)을 검출하고 진단하는, 이에 해당하는 방법들을 포함한다. 소정의 구현예들에서, 질병들은 cMet의 과다발현과 연관된 정상 또는 기타 다른 병리학과 대비하여 cMet 폴리펩타이드의 증가된 발현과 연관된 종양원 유전자성 질병들이다. 마지막으로, 본 발명은 소정의 암들의 예후 또는 진단하는 이러한 항체를 적어도 포함하는 산물들 및/또는 조성물들 또는 키트들을 포함한다.
트라스투주 Mab (trastuzumab), 세투시 Mab (cetuximab), 베박시주 Mab (bevacizumab), 이마티닙 (imatinib) 및 제피티닙 (gefitinib) 저해제들와 같은 수용체 타이로신 키나제 (receptor tyrosine kinase, RTK)를 표적하는 제제 (agents)는 선택된 암을 치료하는 본 단백질 부류 (class)를 표적하는 장점을 기술하여 왔다.
c-Met은 RON 및 SEA도 포함하는 RTKs 서브-패밀리의 프로토타입 구성원이다. c-Met RTK 패밀리는 구조적으로 다른 RTK 패밀리들과 다르고. 또한 스케이터 인자 (scater factor, SF)라고도 불리는 간세포 성장인자 (hepatocyte growth factor, HGF)에 대해 고친화도를 가진 기지의 유일한 수용체이다 [D.P. Bottaro et al., Science 1991, 251: 802-804; L. Naldini et al., Eur. Mol. Biol. Org. J. 1991, 10:2867-2878]. c-Met 및 HGF는 다양한 조직에서 널리 발현되지만, 정상적으로 이들의 발현이 표피 (epithelial) 및 중간엽 (mesenchymal) 기원의 세포들에 각각 제한된다 [M.F. Di Renzo et al., Oncogene 1991, 6:1997-2003; E. Sonnenberg et al., J. Cell. Biol. 1993, 123:223-235]. 그들 모두는 정상적인 포유동물 발생에 필요하고, 성장 및 혈관형성 (angiogenesis) 뿐만 아니라 세포 이동 (cell migration), 형태적 분화 (morphogenic differentiation), 및 삼차원적 튜브 구조 (tubular structure)의 구성에 특히 중요한 것으로 관찰되어 왔다 [F. Baldt et al., Nature 1995, 376:768-771; C. Schmidt et al., Nature, 1995, 373:699-702; Tsarfaty et al., Science, 1994, 263:98-101]. c-Met 및 HGF의 통제된 조절이 포유동물 발생, 조직 유지 (tissue maintenance) 및 복원 (repair)에서 중요한 것으로 보여지는 한편 [Nagayama T, Nagayama M, Kohara S, Kamiguchi H, Shibuya M, Katoh Y, Itoh J, Shinohara Y., Brain Res. 2004, 5;999(2):155-66; Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H., J. Pharmacol. Exp. Ther. 2003, 307(1):146-51], 그들의 이상 조절 (dysregulation)은 암들의 진행과 관련이 있다.
c-Met의 부적절한 활성화에 의해 유발되는 비정상적 신호 전달 (aberrant signalling)은 인간 암들에서 관찰되는 가장 흔한 이상 중 하나이고, 종양 생성 (tumorigenesis) 및 전이 (metastasis)에 결정적인 역할을 한다 [Birchmeier et al., Nat. Mol. Cell Biol. 2003, 4:915-925; L. Trusolino and Comoglio P.M., Nat. Rev. Cancer, 2002, 2(4):289-300].
부적절한 c-Met 활성화가 c-Met의 과다 발현 (overexpression) 및/또는 타가 (paracrine) 또는 자가 (autocrine) 활성화를 포함하는 리간드-의존성 및 비의존성 기작들에 의해 또는 기능 돌연변이 (function mutation)의 획득을 통해 유발될 수 있다 [J.G. Christensen, Burrows J. and Salgia R., Cancer Letters, 2005, 226:1-26]. 그러나. c-Met 수용체의 올리고머화 (oligomerization)는, 리간드 존재 시 또는 부재 시 ATP 및 타이로신-포함하는 펩타이드 기질들에 대한 키나제의 결합 친화도 (binding affinity) 및 결합 역학 (binding kinetics)을 조절하는 데 필요하다 [Hays JL, Watowich SJ, Biochemistry, 2004 Aug 17, 43: 10570-8]. 활성화된 c-Met은 세포질 도메인 (cytoplasm domain)에 위치하는 다중도킹 부위 (multidocking site)에 신호전달 효과기 (signalling effector)들을 채용하여, Ras-MAPK, PI3K, Src 및 Stat3를 포함하는 수 개의 중요한 신호전달 경로들의 활성화를 유발한다 [Gao CF, Vande Woude GF, Cell Res. 2005, 15(1):49-51; Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000,19(49):5582-9]. 이들 경로들은 종양 세포 증식, 침습 (invasion) 및 혈관형성 그리고 회피성 세포사멸 (evading apoptosis)에 필수적이다 [Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000, 19(49): 5582-9; Gu H, Neel BG, Trends Cell Biol. 2003 Mar 13(3):122-30; Fan S, Ma YX, Wang JA, Yuan RQ, Meng Q, Cao Y, Laterra JJ, Goldberg ID, Rosen EM, Oncogene, 2000 Apr 27, 19(18):2212-23]. 또한, 다른 RTK와 달리 c-Met 신호전달의 독특한 면은 α6β4 인테그린 (integrin)들 [Trusolino L, Bertotti A, Comoglio PM, Cell, 2001, 107:643-54], CD44v6 [Van der Voort R, Taher TE, Weilenga VJ, Spaargaren M, Prevo R, Smit L, David G, Hartmann G, Gherardi E, Pals ST, J. Biol. Chem.1999, 274(10):6499-506], 플렉신 B1 (plexin B1) 또는 세마포린 (semaphorin)들 [Giordano S, Corso S, Conrotto P, Artigiani S, Gilestro G, Barberis D, Tamagnone L, Comoglio PM, Nat Cell Biol. 2002, 4(9):720-4; Conrotto P, Valdembri D, Corso S, Serini G, Tamagnone L, Comoglio PM, Bussilino F, Giordano S, Blood, 2005, 105(11):4321-9; Conrotto P, Corso S, Gamberini S, Comoglio PM, Giordano S, Oncogene, 2004, 23:5131-7]과 같은 병소 부착 복합체 (focal adhesion complex)들 및 비-키나제 결합 파트너들과의 알려져 있는 상호작용이다. 이것은 더 나아가 이 수용체에 의한 세포 기능의 조절에서 복잡미묘한 점을 추가로 부여할 수 있다. 마지막으로, 최근 결과는 EGFR 및 c-Met 양쪽에 표적하는 화합물의 조합은 상당한 장점이 될 수 있다고 제시하면서, c-Met 이 제피티닙 (gefitinib) 또는 에르로티닙 (erlotinib)에 대한 종양 저항성에 관여하는 것을 기술한다 [Engelman JA et al., Science, 2007, 316:1039-43].
지난 몇 년 동안, 많은 서로 다른 전략들이 암 세포주들에서 c-Met 신호전달 (c-Met signalling)을 지연시키기 위해 개발되어 왔다. 이들 전략에는 i) c-Met 또는 HGF/SF [Cao B, Su Y, Oskarsson M, Zhao P, Kort EJ, Fisher RJ, Wang LM, Vande Woude GF, Proc. Natl. Acad. Sci. USA 2001, 98(13):7443-8; Martens T, Schmidt NO, Eckerich C, Fillbrandt R, Merchant M, Schwall R, Westphal M, Lamszus K, Clin. Cancer Res. 2006, 12(20):6144-52]에 대한 중화 항체들의 사용 또는 c-Met에 결합하는 리간드 [Kuba K, Matsumoto K, Data K, Shimura H, Tanaka M, Nakamura T, Cancer Res., 2000, 60:6737-43]를 방해하는 HGF/SF 길항제 (antagonist) NK4의 사용, ii) 키나제 활성을 방해하는 c-Met에 대한 작은 ATP 결합 부위 저해제들 [Christensen JG, Schreck R, Burrows J, Kuruganti P, Chan E, Le P, Chen J, Wang X, Ruslim L, Blake R, Lipson KE, Ramphal J, Do S, Cui JJ, Cherrington JM, Mendel DB, Cancer Res. 2003, 63:7345-55], iii) 수용체 또는 리간드 발현을 감소시키는 다중도킹 부위 및 RNAi 또는 리보자임에 대한 접근을 방해하는 조작된 SH2 도메인 폴리펩타이드가 포함된다. 이들 접근법의 대부분은 종양 억제를 유도하는 c-Met의 선택적인 억제를 나타내고, c-Met이 암의 치료에 개입되어 있는 것이 흥미로울 수 있는 점을 보여준다.
본 발명은 진단적 또는 예후적 바이오마커 (biomarker)로서 종양원 유전자성 질병들, 특히 c-Met 발현에 의한 특징을 가지는 것들 또는 c-Met 발현 이상에 의해 매개된 것들을 검출하고 및/또는 감시하는 데 사용될 수 있는 적어도 하나의 반응시약 (reagent)을 제공하는 것을 목적으로 한다.
진단적 (diagnostic) 또는 예후적 (prognostic) 도구로서 사용될 수 있는 가치 있는 항체를 개발하려는 이전의 시도들은 전혀 보고된 바 없었다. 본 명세서에서는 본 판정기준 (criteria)을 만족시키는 새로운 항체들이 기술되어 있다.
본 발명의 다른 특징들 및 장점들은 다음의 상세한 설명 및 실시예들로부터 자명해질 것이다.
첫 번째 관점에서, 본 발명의 주제는 높은 친화도로 cMet 수용체 (cMet), 바람직하게는 인간 cMet에 결합하고 따라서 cMet 발현에 의해 매개된 병리학적 과다증식 (proliferative) 종양원 유전자성 (oncogenic) 질병들을 진단하는 방법들에서 유용할 수 있는, 분리된 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나이다.
용어 표현 "기능적 단편(들) 및/또는 유도체(들)"은 본 명세서에서 이후에 자세하게 정의될 것이다.
본 발명은 천연 그대로 형태의 항체들에 관한 것이 아니고, 다시 말해 그들은 그들의 자연 환경에서는 존재하지 않지만 자연적 출처들로부터 분리되거나 정제에 의해 획득되거나, 또는 그 외에도 유전적 재조합에 의해, 또는 화학적 합성에 의해 획득될 수 있었으며, 다음으로 그들은 계속 좀 더 기술될 바와 같이 비천연 (unnatural) 아미노산들을 포함할 수 있는 것으로 이해되어야 한다.
보다 상세하게 본 발명이 또 다른 관점에 따르면, cMet에 특이적으로 결합할 수 있는 분리된 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나가 청구되고, 상기 항체는 서열번호 1 내지 12 또는 서열번호 29 내지 39의 아미노산 서열을 포함하는 CDRs로부터 선택되는 적어도 하나의 상보적 결정 부위 (complementary determining region, CDR) 또는 최적의 정렬 이후에 서열번호 1 내지 12 또는 서열번호 29 내지 39의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 적어도 하나의 CDR를 포함하는 것을 특징으로 한다.
상세하게, 항체의 "기능적 단편 (functional fragment)"은 단편들 Fv, scFv [sc = 단일 사슬 (simple chain)], Fab, F(ab')2, Fab', scFv-Fc 단편 또는 다이아바디들 (diabodies), 또는 반감기가 연장되었던 단편이라면 모두와 같은 항체 단편을 의미한다. 이러한 기능적 단편들은 본 명세서에서 이후에 자세하게 기술될 것이다.
상세하게, 항체의 "유래된 화합물 (derived compound)" 또는 "유도체 (derivative)"는 그의 인식되는 능력을 보존하기 위해 단백질 스캐폴드 (scaffold) 및 고유의 (original) 항체의 CDRs 적어도 하나로 구성되는 결합 단백질 (binding protein)을 의미한다. 당업자라면 잘 숙지하고 있는 이러한 유래된 화합물들은 본 명세서에서 이후에 보다 자세하게 기술될 것이다.
보다 상세하게, 본 발명은 유전적 재조합 또는 화학적 합성에 의해 획득되는, 본 발명에 따른 항체들, 그들의 유래된 화합물들 또는 그들의 기능적 단편들을 포함한다.
바람직한 구현예에 따르면, 본 발명에 따른 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들은 모노클론 항체로 구성되는 것을 특징으로 한다.
"모노클론 항체 (monoclonal antibody)"는 거의 균질한 항체 집단으로부터 나온 항체를 의미하는 것으로 이해된다. 보다 상세하게, 집단의 개별 항체들은 최소의 비율들로 발견될 수 있는 자능한 소수의 자연적으로-발생하는 돌연변이들을 제외하고는 일치한다. 다시 말하면, 모노클론 항체는 단일한 세포 클론 (예를 들어, 하이브리도마 (hybridoma), 균질한 항체를 코딩하는 DNA 분자로 형질전환된 숙주세포, 균질한 항체를 코딩하는 DNA 분자로 형질전환된 원핵성 숙주세포 등)의 성장으로부터 나온 균질한 항체로 구성되고, 일반적으로 하나 및 단 하나의 클래스 및 서브클래스의 중쇄들 또한 단 하나 유형의 경쇄들에 의한 특징을 가진다. 모노클론 항체들은 매우 특이적이고 단일한 항원에게로 유도된다 (directed against). 또한 전형적으로 다양한 결정기들 (determinants), 또는 에피토프들에게 유도되는 다양한 항체들을 포함하는 폴리클론 항체들의 제조물들과는 대조적으로, 각 모노클론 항체는 항원의 단일한 에피토프에게로 유도된다.
본 발명은 천연 그대로 형태의 항체들에 관한 것이 아니고, 예로 그들은 그들의 자연 환경으로부터 가져온 것이 아니지만 자연적 출처들로부터 분리되거나 정제에 의해 획득되거나, 또는 유전적 재조합 또는 화학적 합성에 의해 획득되는 것이고 따라서 그들은 하기에 기술될 바와 같이 비천연 아미노산들을 보유할 수 있는 것으로 이해되어야 한다.
독특한 IMGT 번호매김 (IMGT unique numbering)은 어떤 항원 수용체, 사슬 유형 또는 종이라도 가변 도메인을 비교할 수 있도록 정의되어 왔다 [Lefranc M.-P., Immunology Today 18, 509 (1997); Lefranc M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M. P., Pommie C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. 독특한 IMGT 번호매김에서, 보존되는 아미노산은 항상 23번 시스테인 (1st-CYS), 41번 트립토판 (보존되는 TRP), 89번 소수성 아미노산, 104번 시스테인 (2nd-CYS), 118번 페닐알라닌 또는 트립토판 (J-PHE 또는 TRP)과 같이 동일한 위치를 보유한다. 독특한 IMGT 번호매김은 구조틀 부위 (FR1-IMGT: 1 내지 26번 위치, FR2-IMGT: 39 내지 55번 위치, FR3-IMGT: 66 내지 104번 위치 및 FR4-IMGT: 118 내지 128번 위치) 또한 상보성 결정 부위 (CDR1-IMGT: 27 내지 38번 위치, CDR2-IMGT: 56 내지 65번 위치 및 CDR3-IMGT: 105 내지 117번 위치)의 표준화된 구획 (standardized delimitation)을 제공한다. 공간 (gaps)은 채워지지 않은 위치를 나타내기 때문에, CDR-IMGT 길이 (괄호들 사이에 나타나고 점으로 분리됨)는 결정적인 정보가 된다. 독특한 IMGT 번호매김은 IMGT 진주목걸이 (IMGT pearl necklace)라고도 명명되는 [Ruiz, M. and Lefranc, M. P., Immunogenetics, 53, 857-883 (2002); Kaas, Q. and Lefranc, M. P., Current Bioinformatics, 2, 21-30 (2007)] 2차원 그래픽 전시 또한 IMGT/3D 구조-DB 라고 언급되는 3차원 구조 [Kaas, Q., Ruiz, M. and Lefranc, M. P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)]에서 사용된다.
세 가지의 중쇄 CDRs 및 세 가지의 경쇄 CDRs가 존재한다. 본 명세서에서, 용어 표현 CDR 및 CDRs는 경우에 따라 항체가 인식하는 항원 또는 에피토프에 대한 항체의 친화도에 의한 결합을 부여할 수 있는 대다수의 아미노산 잔기들을 포함하는 이들 부위의 하나 또는 여럿, 또는 심지어 이들 부위 전체를 가르키도록 사용된다.
보다 상세하게는, 첫 번째 관점에 따르면, 본 발명은 i) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 다음의 CDR-H1, CDR-H2 및 CDR-H3의 적어도 하나를 포함하고, CDR-H1은 서열번호 55의 서열을 포함하고, CDR-H2은 서열번호 56의 서열을 포함하고, CDR-H3은 서열번호 56의 서열을 포함하는 중쇄; 및/또는 ii) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 적어도 다음의 3가지 CDRs, CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 58의 서열을 포함하고, CDR-L2은 서열번호 59의 서열을 포함하고, CDR-L3은 서열번호 60의 서열을 포함하는 경쇄를 포함하는, c-Met 단백질에 특이적으로 결합할 수 있는 분리된 항체, 또는 그의 기능적 단편 또는 유도체에 관한 것이다.
바람직한 구현예에서, 본 발명은 i) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 다음의 CDR-H1, CDR-H2 및 CDR-H3의 적어도 하나를 포함하고, CDR-H1은 서열번호 55의 서열을 포함하고, CDR-H2은 서열번호 56의 서열을 포함하고, CDR-H3은 서열번호 56의 서열을 포함하는 중쇄; 및/또는 ii) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 적어도 다음의 3가지 CDRs, CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 58의 서열을 포함하고, CDR-L2은 서열번호 59의 서열을 포함하고, CDR-L3은 서열번호 60의 서열을 포함하는 경쇄를 포함하는, c-Met 단백질에 특이적으로 결합할 수 있는 분리된 항체, 또는 그의 기능적 단편 또는 유도체를 지향한다.
명확하게 하기 위하여, 본 발명의 서열번호 55 내지 서열번호 60의 공통적 서열들은 다음의 표 1에 정리되어 있다.
Xi: S 또는 T X2: 1 또는 F X3: A 또는 - X4: F 또는 W
X5: Y 또는 P X6: D or S X7: - 또는 N X8: T 또는 R
X9: N 또는 T X10: T 또는 A X11: D 또는 R X12: R 또는 V
X13: T 또는 G X14: F 또는 Y X15: A 또는 L X16: - 또는 M
X17: - 또는 D X18: Q 또는 - X19: R 또는 S X20: 1 또는 S
X21: Y 또는 V X22: N 또는 S X23: Y 또는 D X24: A 또는 T
X25: S 또는 W X26: W 또는 N X27: L 또는 P로,
"소실 (missing)"의 경우 "-" (본 위치에서 아미노산 잔기의 결실)로 나타낸다.
상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-H1, CDR-H2 및 CDR-H3를 포함하고, CDR-H1은 서열번호 7의 서열을 가지고, CDR-H2는 서열번호 2의 서열을 가지고, CDR-H3은 서열번호 8의 서열을 가지는 중쇄를 포함하는 것을 특징으로 한다.
상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 4의 서열을 가지고, CDR-L2는 서열번호 5의 서열을 가지고, CDR-L3은 서열번호 6의 서열을 가지는 경쇄를 포함하는 것을 특징으로 한다.
상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-H1, CDR-H2 및 CDR-H3를 포함하고, CDR-H1은 서열번호 29의 서열을 가지고, CDR-H2는 서열번호 30의 서열을 가지고, CDR-H3은 서열번호 31의 서열을 가지는 중쇄를 포함하는 것을 특징으로 한다.
상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김 시스템에 따라 정의된 바와 같은 다음의 3가지 CDRs, 각각 CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 32의 서열을 가지고, CDR-L2는 서열번호 33의 서열을 가지고, CDR-L3은 서열번호 34의 서열을 가지는 경쇄를 포함하는 것을 특징으로 한다.
다시 말하면, 본 발명은 또한
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 7의 서열을 가지는 CDR-H1, 서열번호 2의 서열을 가지는 CDR-H2 및 서열번호 8의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 29의 서열을 가지는 CDR-H1, 서열번호 30의 서열을 가지는 CDR-H2 및 서열번호 31의 서열을 가지는 CDR-H3를 포함하는 중쇄:
로 이루어진 그룹으로부터 선택되는 중쇄를 포함하는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체로서 기술될 수 있다.
본 발명은 또한
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 4의 서열을 가지는 CDR-L1, 서열번호 5의 서열을 가지는 CDR-L2 및 서열번호 6의 서열을 가지는 CDR-L3를 포함하는 경쇄; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 32의 서열을 가지는 CDR-L1, 서열번호 33의 서열을 가지는 CDR-L2, 서열번호 34의 서열을 가지는 CDR-L3를 포함하는 경쇄:
로 이루어진 그룹으로부터 선택되는 경쇄를 포함하는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체로서 기술될 수 있다.
또 다른 구현예에서, 상보성-결정 부위 또는 CDR은 카밧 등 (Kabat et al., 면역학적 관심있는 단백질의 서열들, 제 5판, 미국 보건복지부, NIH, 1991 및 이후 개정판들)에 의해 정의된 바와 같이 면역글로불린 (immunoglobulins)의 중쇄들 및 경쇄들의 과다가변 (hypervariable) 부위들을 의미한다. 세 가지의 중쇄 CDRs 및 세 가지의 경쇄 CDRs가 존재한다. 본 명세서에서, 용어 표현 "CDR" 및 "CDRs"는 경우에 따라 항체가 인식하는 항원 또는 에피토프에 대한 항체의 결합 친화도를 부여할 수 있는 대다수의 아미노산 잔기들을 포함하는 이들 부위의 하나 또는 여럿, 또는 심지어 이들 부위 전체를 가르키도록 사용된다.
또 다른 상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-H1, CDR-H2 및 CDR-H3를 포함하고, CDR-H1은 서열번호 9의 서열을 가지고, CDR-H2는 서열번호 10의 서열을 가지고, CDR-H3은 서열번호 3의 서열을 가지는 중쇄를 포함하는 것을 특징으로 한다.
또 다른 상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 11의 서열을 가지고, CDR-L2는 서열번호 12의 서열을 가지고, CDR-L3은 서열번호 6의 서열을 가지는 경쇄를 포함하는 것을 특징으로 한다.
또 다른 상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-H1, CDR-H2 및 CDR-H3를 포함하고, CDR-H1은 서열번호 35의 서열을 가지고, CDR-H2는 서열번호 36의 서열을 가지고, CDR-H3은 서열번호 37의 서열을 가지는 중쇄를 포함하는 것을 특징으로 한다.
또 다른 상세한 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 38의 서열을 가지고, CDR-L2는 서열번호 39의 서열을 가지고, CDR-L3은 서열번호 34의 서열을 가지는 경쇄를 포함하는 것을 특징으로 한다.
본 발명에 따른 항체들의 CDRs를 정의하는 또 다른 방식은 IMGT 및 카밧에 따른 각 CDR에 대한 공통적인 잔기들을 결정하는 것으로 이루어질 수 있다.
또 다른 구현예에 따르면, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 서열번호 1, 서열번호 2 또는 서열번호 3의 서열들의 세 가지 CDRs의 적어도 하나 또는 최적의 정렬 이후에 서열번호 1, 서열번호 2 또는 서열번호 3의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 적어도 하나의 서열을 포함하는 중쇄를 포함하는 것을 특징으로 한다.
보다 상세하게, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 서열번호 4 서열번호 5 또는 서열번호 6 서열들의 세 가지 CDRs의 적어도 하나 또는 최적의 정렬 이후에 서열번호 4 서열번호 5 또는 서열번호 6의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 적어도 하나의 서열을 포함하는 경쇄를 포함하는 것을 특징으로 한다.
바람직한 방식으로, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 다음의 세 가지 CDRs, 각각 CDR-H1, CDR-H2 및 CDR-H3를 포함하는 중쇄를 포함하고,
- CDR-H1는 서열번호 1, 7, 9, 29 또는 35의 서열들 또는 최적으로 정렬 이후에 서열번호 1, 7, 9, 29 또는 35의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하고;
- CDR-H2는 서열번호 2, 10, 30 또는 36의 서열들 또는 최적으로 정렬 이후에 서열번호 2, 10, 30 또는 36의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하고; 또한
- CDR-H3는 서열번호 3, 8, 31 또는 37의 서열들 또는 최적으로 정렬 이후에 서열번호 3, 8, 31 또는 37의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는:
것을 특징으로 한다.
보다 더 바람직하게, 본 발명의 항체, 또는 그의 기능적 단편들 또는 유도체들의 하나는 다음의 세 가지 CDRs, 각각 CDR-L1, CDR-L2 및 CDR-L3를 포함하는 경쇄를 포함하고,
- CDR-L1는 서열번호 4, 11, 32 또는 38의 서열들 또는 최적으로 정렬 이후에 서열번호 4, 11, 32 또는 38의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하고;
- CDR-L2는 서열번호 5, 12, 33 또는 39의 서열들 또는 최적으로 정렬 이후에 서열번호 5, 12, 33 또는 39의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하고; 또한
- CDR-L3는 서열번호 6 또는 34의 서열들 또는 최적으로 정렬 이후에 서열번호 6 또는 34의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는:
것을 특징으로 한다.
보다 또 다른 구현예에서, 본 발명은 또한
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 7의 서열을 가지는 CDR-H1, 서열번호 2의 서열을 가지는 CDR-H2 및 서열번호 8의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 4의 서열을 가지는 CDR-L1, 서열번호 5의 서열을 가지는 CDR-L2 및 서열번호 6의 서열을 가지는 CDR-L3를 포함하는 경쇄:
를 포함하는 항체, 또는 그의 기능적 단편 또는 유도체; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 29의 서열을 가지는 CDR-H1, 서열번호 30의 서열을 가지는 CDR-H2 및 서열번호 31의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 32의 서열을 가지는 CDR-L1, 서열번호 33의 서열을 가지는 CDR-L2, 서열번호 34의 서열을 가지는 CDR-L3를 포함하는 경쇄:
를 포함하는 항체, 또는 그의 기능적 단편 또는 유도체:
로 이루어진 그룹으로부터 선택되는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체로서 기술될 수 있다.
본 기술내용에서, 용어 표현 "폴리펩타이드 (polypeptides)", "폴리펩타이드 서열 (polypeptide sequences)", "펩타이드 (peptides)" 및 "항체 화합물들에 또는 그들의 서열들에 부착된 단백질들"은 상호교환이 가능하다.
본 발명은 천연 그대로 형태의 항체들에 관한 것이 아니고, 예로 그들은 그들의 자연 환경으로부터 가져온 것이 아니지만 자연적 출처들로부터 분리되거나 정제에 의해 획득되거나, 또는 유전적 재조합 또는 화학적 합성에 의해 획득되는 것이고 따라서 그들은 하기에 기술될 바와 같이 비천연 아미노산들을 보유할 수 있는 것으로 이해되어야 한다.
보다 명확하게 하기 위하여, 다음의 기술내용에서 또한 보다 상세하게 표 3a 및 표 4a에서 224D10이라고 불리는 항체의 CDRs는 IMGT 번호매김, 카밧 번호매김 및 공통적 번호매김에 의해 정의될 수 있다.
공통적 번호매김 (common numbering)은 IMGT 및 카밧 번호매김 시스템에 의해 정의된 바와 같이 CDRs에 공통적인 각 CDR의 잔기들 부분을 재그룹화하고 있다.
IMGT 번호매김 시스템은 정의된 바와 같이 IMGT 시스템에 따라 CDRs를 정의하는 한편, 카밧 번호매김 시스템은 상기 정의된 바와 같이 카밧 시스템에 따라 CDRs를 정의한다.
보다 상세하게, CDR-H1은 공통적 번호매김 시스템에서 서열번호 1 (TSAYF), IMGT 번호매김 시스템에서 서열번호 7 (GYSITSAYF) 및 카밧 번호매김 시스템에서 서열번호 9 (TSAYFWS)로 구성된다.
CDR-H2는 공통적 및 IMGT 번호매김 시스템들에서 서열번호 2 (INYDGTN) 및 IMGT 번호매김 시스템에서 서열번호 10 (FINYDGTNNYNPSLKN)로 구성된다.
CDR-H3는 공통적 및 카밧 번호매김 시스템들에서 서열번호 3 (DRTFAY)로 구성되는 한편 이것은 IMGT 번호매김 시스템에서 서열번호 8 (TRDRTFAY)로 구성된다.
경쇄의 경우, CDR-Ll은 공통적 및 IMGT 번호매김 시스템들에서 서열번호 4 (QRIYNY) 및 카밧 번호매김 시스템에서 서열번호 11 (RASQRIYNYLH)로 구성된다.
CDR-L2에 관하여, 이것은 공통적 및 IMGT 번호매김 시스템들에서 서열번호 5 (YAS) 및 카밧 번호매김 시스템에서 서열번호 12 (YASQSIS)로 구성된다.
마지막으로, CDR-L3은 세 가지의 번호매김 시스템들의 각각에서 서열번호 6 (QQSNSWPLT)으로 구성된다.
항체 221C9의 경우에도, 당업자에 의해 동일한 것이 쉽게 시행될 수 있다.
동일 선상에서 보다 명확하게 하기 위하여, 다음의 기술내용에서 보다 상세하게 표 3b 및 표 4b에서 221C9이라고 불리는 항체의 CDRs는 IMGT 번호매김 및 카밧 번호매김에 의해 정의될 수 있다.
본 발명의 의미에서, 두 개의 핵산 또는 아미노산 서열들 간 "일치도 백분율 (percentage identity)"은 최고의 정렬 (최적의 정렬) 이후에 획득되어 비교될 두 개의 서열들 간에 일치하는 뉴클레오타이드 또는 아미노산의 백분율을 의미하고, 이 백분율은 순수하게 통계적이고 이 두 서열들 간의 차이는 그들의 서열 길이를 통하여 무작위적으로 분포한다. 두 개의 핵산 또는 아미노산 서열들 간의 서열 비교는 통상적으로 그들을 최적으로 정렬시킨 이후 서열들을 비교하여 수행되고, 상기 비교는 분절마다 또는 "정렬창 (alignment window)"에 의해 수행될 수 있다. 비교를 위한 서열들의 최적의 정렬은 수동적인 비교에 추가하여 스미스 및 워터맨의 로칼 상동성 알고리즘 (local homology algorithm) (Smith and Waterman, 1981, Ad. App. Math. 2:482]에 의해, 네들만 및 운쉬의 로칼 상동성 알고리즘 (Neddleman and Wunsch, 1970, J. Mol. Biol. 48:443]에 의해, 피어슨 및 립만 의 유사도 조사 방법 (similarity search method)[Pearson and Lipman, 1988, Proc. Natl. Acad. Sci. USA 85:2444]에 의해, 또는 이들 알고리즘을 사용하는 컴퓨터 소프트웨어 (위스콘신 유전학 소프트웨어 패키지, 유전학 컴퓨터 그룹, 575 Science Dr., Madison, WI에서의 GAP, BESTFIT, FASTA 및 TFASTA, 또는 비교 소프트웨어 BLAST NR 또는 BLAST P에 의해)에 의해 수행될 수 있다.
두 개의 핵산 또는 아미노산 서열들 간 일치도 백분율은 비교되는 핵산 또는 아미노산 서열이 이들 두 서열들 간 최적의 정렬을 위한 기준 서열 (reference sequence)에 대비하여 부가 (addition) 또는 결실 (deletion)을 포함할 수 있는 두 개의 최적으로 정렬된 서열을 비교하여 결정된다. 일치도 백분율은 뉴클레오타이드 또는 아미노산 잔기가 두 개 서열들 간에 일치하는 동일한 위치의 숫자를 결정하고, 동일한 위치의 숫자를 비교 창에서의 전체 위치 숫자로 나눈 다음 획득된 결과를 두 개 서열들 간 일치도 백분율을 얻기 위하여 100으로 곱하여 계산된다.
예를 들어, 웹 사이트 http://www.ncbi.nlm.nih.gov/gorf/bl2.html 상에서 입수가능한 BLAST 프로그램 "BLAST 2 서열" (Tatusova et al ., "Blast 2 서열- 단백질 및 뉴클레오타이드 서열을 비교하기 위한 새로운 도구", FEMS Microbiol., 1999, Lett. 174: 247-250)이 디폴트 매개변수 (명확하게, 매개변수 "오픈 갭 페널티 (open gap penalty)"의 경우: 5, 및 "연장 갭 페널티 (extension gap penalty)": 2; 선택된 매트릭스는 예를 들어 프로그램에 의해 제시되는 "BLOSUM 62" 매트릭스임)와 함께 사용될 수 있고, 비교되는 두 개 서열들 간 일치도 백분율은 프로그램에 의해 직접 계산된다.
기준 아미노산 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98%의 일치도를 가지는 아미노산 서열에 의하여, 이들은 기준 서열에 대하여, 소정의 변형 (modifications), 상세하게는 적어도 하나의 아미노산의 결실 (deletion), 부가 (addition) 또는 치환 (substituiton), 절단 (truncation) 또는 연장 (extension)을 가지는 것이 바람직하다. 하나 이상의 연속적 (consecutive) 또는 비-연속적 (non-consecutive) 아미노산(들)의 치환의 경우에서, 치환된 아미노산이 "동등한 (equivalent)" 아미노산에 의해 대체되는 치환이 바람직하다. 본 명세서에서 용어 표현 "동등한 아미노산 (equivalent amino acids)"은 해당하는 항체 및 하기 정의된 바와 같이 특히 실시예에서의 항체의 생물학적 활성을 근본적으로 변형시키지 않지만, 구조적 아미노산의 하나가 치환될 수 있는 아미노산이라면 모두를 가르키려고 한다.
이들 동등한 아미노산들은 그들이 치환되어진 아미노산과의 구조적 상동성 (structural homology)을 기초로 하거나 생산될 수 있는 다양한 항체들 간의 생물학적 활성의 비교 테스트 결과를 기초로 하여 결정될 수 있다.
비-제한적인 예로서, 하기 표 2는 해당하는 변형된 항체의 생물학적 활성의 유의한 변형을 유발시키지 않고도 수행될 수 있는 가능한 치환을 정리하고 있다. 역 치환 (inverse substituiton)도 당연히 동일한 조건들 하에서 가능하다.
당업자에게 현재의 기술 상태에서, 6가지 CDRs 간의 가장 큰 다양성 (길이 및 조성)이 3가지 중쇄 CDRs, 보다 상세하게는 본 중쇄의 CDR-H3에서 발견되는 것은 잘 알려져 있다.
특정한 구현예에서, 본 발명은 마우스 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들에 관한 것이다.
본 발명의 또 다른 구현예는 CDRs의 "공통적 (common)" 정의에 기초하여 다음의 세 가지 CDRs를 포함하는 중쇄:
- 서열번호 1의 서열 또는 최적의 정렬 이후에 서열번호 1의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H1;
- 서열번호 2의 서열 또는 최적의 정렬 이후에 서열번호 2의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H2; 및
- 서열번호 3의 서열 또는 최적의 정렬 이후에 서열번호 3의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H3; 또한
다음의 세 가지 CDRs를 포함하는 경쇄를 포함하는, 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나를 기재하고 있다:
- 서열번호 4의 서열 또는 최적의 정렬 이후에 서열번호 4의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L1;
- 서열번호 5의 서열 또는 최적의 정렬 이후에 서열번호 5의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L2; 및
- 서열번호 6의 서열 또는 최적의 정렬 이후에 서열번호 6의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L3.
본 발명의 보다 또 다른 구현예는 IMGT 번호매김 시스템에 기초하여 다음의 세 가지 CDRs를 포함하는 중쇄:
- 서열번호 7의 서열 또는 최적의 정렬 이후에 서열번호 7의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H1;
- 서열번호 2의 서열 또는 최적의 정렬 이후에 서열번호 2의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H2; 및
- 서열번호 8의 서열 또는 최적의 정렬 이후에 서열번호 8의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H3; 또한
다음의 세 가지 CDRs를 포함하는 경쇄를 포함하는, 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나를 기재하고 있다:
- 서열번호 4의 서열 또는 최적의 정렬 이후에 서열번호 4의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L1;
- 서열번호 5의 서열 또는 최적의 정렬 이후에 서열번호 5의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L2; 및
- 서열번호 6의 서열 또는 최적의 정렬 이후에 서열번호 6의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L3.
본 발명의 보다 또 다른 구현예는 카밧 번호매김 시스템에 기초하여 다음의 세 가지 CDRs를 포함하는 중쇄:
- 서열번호 9의 서열 또는 최적의 정렬 이후에 서열번호 9의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H1;
- 서열번호 10의 서열 또는 최적의 정렬 이후에 서열번호 10의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H2; 및
- 서열번호 3의 서열 또는 최적의 정렬 이후에 서열번호 3의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H3; 또한
다음의 세 가지 CDRs를 포함하는 경쇄를 포함하는, 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나를 기재하고 있다:
- 서열번호 11의 서열 또는 최적의 정렬 이후에 서열번호 11의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L1;
- 서열번호 12의 서열 또는 최적의 정렬 이후에 서열번호 12의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L2; 및
- 서열번호 6의 서열 또는 최적의 정렬 이후에 서열번호 6의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L3.
본 발명에 따른 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나는 "공통적" 번호매김 시스템에 따라
- 서열번호 1 서열의 CDR-H1, 서열번호 2 서열의 CDR-H2 및 서열번호 3 서열의 CDR-H3를 포함하는 중쇄; 또한
- 서열번호 4 서열의 CDR-L1, 서열번호 5 서열의 CDR-L2, 및 서열번호 6 서열의 CDR-L3:
를 포함하는 것을 특징으로 한다.
또 다른 구현예에서, 본 발명에 따른 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김 시스템에 따라
- 서열번호 7 서열의 CDR-H1, 서열번호 2 서열의 CDR-H2 및 서열번호 8 서열의 CDR-H3를 포함하는 중쇄; 또한
- 서열번호 4 서열의 CDR-L1, 서열번호 5 서열의 CDR-L2, 및 서열번호 6 서열의 CDR-L3:
를 포함하는 것을 특징으로 한다.
또 다른 구현예에서, 본 발명에 따른 항체 224D10, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라
- 서열번호 9 서열의 CDR-H1, 서열번호 10 서열의 CDR-H2 및 서열번호 3 서열의 CDR-H3를 포함하는 중쇄; 또한
- 서열번호 11 서열의 CDR-L1, 서열번호 12 서열의 CDR-L2, 및 서열번호 6 서열의 CDR-L3:
를 포함하는 것을 특징으로 한다.
보다 또 다른 구현예에 따르면, 본 발명의 항체 224D10, 또는 그의 유래된 화합물들 또는 기능적 단편들은 서열번호 13의 아미노산 서열 또는 최적의 정렬 이후에 서열번호 13의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 중쇄 가변 도메인 서열을 포함하고; 및/또는 서열번호 14의 아미노산 서열 또는 최적의 정렬 이후에 서열번호 14의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 경쇄 가변 도메인 서열을 포함하는 것을 특징으로 한다.
보다 상세하게, 본 발명의 항체, 그의 유래된 화합물들 또는 기능적 단편들은:
a) 최적의 정렬 이후에 서열번호 13의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 아미노산 서열을 포함하는 중쇄 가변 도메인 서열 및/또는 최적의 정렬 이후에 서열번호 14의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 경쇄 가변 도메인 서열을 포함하고; 또한
b) 상기 항체, 또는 그의 기능적 단편 또는 유도체가
- c-Met 단백질에 특이적으로 결합할 수 있고, 바람직하게는
- c-Met 단백질에 HGF 리간드의 결합을 차단하지 않는 것을 특징으로 한다.
본 발명의 또 다른 구현예에서, 본 발명은 다음의 세 가지 CDRs를 포함하는 중쇄:
- 서열번호 29의 서열 또는 최적의 정렬 이후에 서열번호 29의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H1;
- 서열번호 30의 서열 또는 최적의 정렬 이후에 서열번호 30의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H2; 및
- 서열번호 31의 서열 또는 최적의 정렬 이후에 서열번호 31의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H3; 또한
다음의 세 가지 CDRs를 포함하는 경쇄를 포함하는, 항체 221C9, 또는 그의 기능적 단편들 또는 유도체들의 하나를 기재하고 있다:
- 서열번호 32의 서열 또는 최적의 정렬 이후에 서열번호 32의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L1;
- 서열번호 33의 서열 또는 최적의 정렬 이후에 서열번호 33의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L2; 및
- 서열번호 34의 서열 또는 최적의 정렬 이후에 서열번호 34의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L3.
본 발명의 보다 또 다른 구현예는 다음의 세 가지 CDRs를 포함하는 중쇄:
- 서열번호 35의 서열 또는 최적의 정렬 이후에 서열번호 35의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H1;
- 서열번호 36의 서열 또는 최적의 정렬 이후에 서열번호 36의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H2; 및
- 서열번호 37의 서열 또는 최적의 정렬 이후에 서열번호 37의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-H3; 또한
다음의 세 가지 CDRs를 포함하는 경쇄를 포함하는, 항체 221C9, 또는 그의 기능적 단편들 또는 유도체들의 하나를 기재하고 있다:
- 서열번호 38의 서열 또는 최적의 정렬 이후에 서열번호 38의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L1;
- 서열번호 39의 서열 또는 최적의 정렬 이후에 서열번호 39의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L2; 및
- 서열번호 34의 서열 또는 최적의 정렬 이후에 서열번호 34의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열의 CDR-L3.
다시 말하면, 본 발명에 따른 분리된 항체 221C9, 또는 그의 기능적 단편들 또는 유도체들의 하나는 IMGT 번호매김 시스템에 따라
- 서열번호 29 서열의 CDR-H1, 서열번호 30 서열의 CDR-H2 및 서열번호 31 서열의 CDR-H3를 포함하는 중쇄; 또한
- 서열번호 32 서열의 CDR-L1, 서열번호 33 서열의 CDR-L2, 및 서열번호 34 서열의 CDR-L3:
를 포함하는 것을 특징으로 한다.
또 다른 구현예에서, 분리된 항체 221C9, 또는 그의 기능적 단편들 또는 유도체들의 하나는 카밧 번호매김 시스템에 따라
- 서열번호 35 서열의 CDR-H1, 서열번호 36 서열의 CDR-H2 및 서열번호 37 서열의 CDR-H3를 포함하는 중쇄; 또한
- 서열번호 38 서열의 CDR-L1, 서열번호 39 서열의 CDR-L2, 및 서열번호 34 서열의 CDR-L3:
를 포함하는 것을 특징으로 한다.
보다 또 다른 구현예에 따르면, 본 발명의 항체 221C9, 또는 그의 유래된 화합물들 또는 기능적 단편들은 서열번호 40의 아미노산 서열 또는 최적의 정렬 이후에 서열번호 40의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 중쇄 가변 도메인 서열을 포함하고; 및/또는 서열번호 41의 아미노산 서열 또는 최적의 정렬 이후에 서열번호 41의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 경쇄 가변 도메인 서열을 포함하는 것을 특징으로 한다.
보다 상세하게, 본 발명의 항체, 그의 유래된 화합물들 또는 기능적 단편들은:
a) 최적의 정렬 이후에 서열번호 40의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 아미노산 서열을 포함하는 중쇄 가변 도메인 서열 및/또는 최적의 정렬 이후에 서열번호 41의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 경쇄 가변 도메인 서열을 포함하고; 또한
b) 상기 항체, 또는 그의 기능적 단편 또는 유도체가
- c-Met 단백질에 특이적으로 결합할 수 있고, 바람직하게는
- c-Met 단백질에 HGF 리간드의 결합을 차단하지 않는 것을 특징으로 한다.
다시 말하면, 본 발명은 또한
a) 서열번호 13의 아미노산 서열을 포함하는 서열의 중쇄 가변 도메인 및 서열번호 14의 아미노산 서열을 포함하는 서열의 경쇄 가변 도메인을 포함하는 항체, 그의 기능적 단편 또는 유도체; 또한
b) 서열번호 40의 아미노산 서열을 포함하는 서열의 중쇄 가변 도메인 및 서열번호 41의 아미노산 서열을 포함하는 서열의 경쇄 가변 도메인을 포함하는 항체, 그의 기능적 단편 또는 유도체:
로 이루어진 그룹으로부터 선택되는 것을 특징으로 하는 항체, 또는 그의 기능적 단편 또는 유도체로서 기술될 수 있다.
상기에서 살펴본 바와 같이, 본 발명은 본 발명에서 기술된 항체로부터 유래된 화합물이라면 모두에 관한 것이다.
보다 상세하게는, 본 발명의 항체 또는 그의 유래된 화합물들 또는 기능적 단편들은 상기 유래된 화합물이 초기 항체의 파라토프 인식 (paratopic recognition) 특성의 전부 또는 일부를 보존하도록 하는 방식으로 적어도 하나의 CDR가 그 위에 이식된 스캐폴드를 포함하는 결합 단백질로 이루어진 것을 특징으로 한다.
본 발명에서 기술된 6개 CDR 서열들 중에서 하나 이상의 서열들이 또한 다양한 면역글로불린의 단백질 스캐폴드 상에 표현될 수 있다. 이 경우에, 단백질 서열은 이식된 CDRs의 적절한 접힘 (folding)을 선호하는 펩타이드 골격을 재창조하도록 만들고, 그들이 파라토프 항원-인식 특성들을 보존하도록 허용한다.
일반적으로, 당업자라면 고유의 항체로부터 나온 적어도 하나의 CDRs가 이식되는 단백질 스캐폴드의 유형을 결정하는 방법을 잘 알고 있다. 보다 상세하게, 이러한 스캐폴드들은 선택되기 위해 다음과 같이 가장 많은 판정기준들을 만족시켜야 하는 것으로 알려져 있다 (Skerra A., J. Mol. Recogn., 13, 2000, 167-187):
- 계통유전학적으로 (phylogenetically) 좋은 보존;
- (예를 들어, 결정학 (crystallography), NMR 분광측정법 또는 기타 다른 당업자에게 알려진 기법과 같음) 잘 알려진 삼차원 구조;
- 작은 크기;
- 없거나 매우 낮은 전사후 (post-transcriptional) 변형들
- 생산, 발현 및 정제의 용이성.
이러한 단백질 스캐폴드들의 기원은 이에 제한되는 것은 아니지만, 피브로넥틴 (fibronectin), 선호하기로는 피브로넥틴 제 Ⅲ형 도메인 10, 리포칼린 (lipocalin), 안티칼린 (anticalin) (Skerra A., J. Biotechnol., 2001, 74(4):257-75), 스태필로코커스 아우레우스 (Staphylococcus aureus)의 단백질 A의 도메인 B로부터 나온 단백질 Z, 티오레독신 A (thioredoxin A) 또는 "안킬린 반복서열 (ankyrin repeat)" (Kohl et al., PNAS, 2003, Vol. 100, No. 4, 1700-1705), "아마딜로 반복서열 (amadillo repeat)", "루이신-풍부 반복서열 (leucin-rich repeat)" 또는 "테트라트리코펩타이드 반복서열 (tetratricopeptide repeat)"과 같은 반복되는 모티브를 가지는 단백질들: 중에서 선택되는 구조들일 수 있다.
또한, 예를 들어 전갈, 곤충, 식물 또는 연체류 등으로부터 나온 독소들와 같은 독소들 및 신경성 NO 합성효소 (PIN)의 단백질 저해제들로부터 나온 스캐폴드들도 언급될 수 있다.
이러한 하이브리드 작제물 (constructions)의 제한되지 않는 예로는, 항-CD4 항체, 즉 13B8.2 항체의 CDR-H1 (중쇄)를 PIN의 노출된 루프들의 하나에의 삽입을 들 수 있고, 따라서 획득된 결합 단백질의 결합 특성은 고유의 항체와 동일하게 유지된다 (Bes et al., BBRC 343, 2006, 334-344). 순수하게 설명에 근거하여, 항-리소자임 (lyzozyme) VHH 항체의 CDR-H3 (중쇄)를 네오카지노스타틴 (neocarzinostatine) 루프들 하나 상에 이식하는 것도 역시 언급될 수 있다 (Nicaise et al., 2004).
마지막으로 상기에 언급된 바와 같이, 이러한 단백질 스캐폴드들은 고유의 항체로부터 나온 1개로부터 6개까지의 CDRs를 포함할 수 있다. 바람직하게 요구사항이 되는 것은 아니지만, 당업자라면 중쇄, 주로 항체의 특이성을 부여할 수 있는것으로 알려져 있는 중쇄로부터 적어도 하나의 CDR을 선택할 수 있을 것이다. 하나 이상의 적절한 CDRs의 선별은 다음으로 적합한 기지의 기법들을 선택할 당업자에게 자명할 것이다 (BES et al., FEBS Letters 508, 2001, 67-74).
따라서 본 발명은 펩타이드 스캐폴드가 a) 계통유전학적으로 잘 보존되고, b) 건강한 구조물 (architecture)이고, c) 잘-알려진 3차원 분자 조직구성 (organization)을 가지고, d) 작은 크기이고 및/또는 e) 안정성 특성들을 변형시키지 않고도 결실 및/또는 삽입에 의해 변형될 수 있는 부위들을 포함하는 단백질들 중에서 선택되는 것을 특징으로 하는, 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들에 관한 것이다.
바람직한 구현예에 따르면, 본 발명의 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들은 상기 단백질 스캐폴드가 i) 피브로넥틴, 선호하기로는 피브로넥틴 제 Ⅲ형 도메인 10, 리포칼린, 안티칼린, 스태필로코커스 아우레우스의 단백질 A의 도메인 B로부터 나온 단백질 Z, 티오레독신 A 또는 "안킬린 반복서열" (Kohl et al., PNAS, 2003, Vol. 100, No. 4, 1700-1705), "아마딜로 반복서열", "루이신-풍부 반복서열" 또는 "테트라트리코펩타이드 반복서열"과 같은 반복되는 모티브를 가지는 단백질들 또는 ii) 신경성 NO 합성효소 (PIN)의 단백질 저해제들 중에서 선택되는 것을 특징으로 한다.
본 발명의 또 다른 관점은 상기 기술된 항체의 기능적 단편들에 관한 것이다.
보다 상세하게, 본 발명은 상기 기능적 단편이 단편들 Fv, Fab, F(ab')2, Fab', scFv, scFv-Fc 및 다이아바디들, 또는 PEG화된 (PEGylated) 단편들과 같은 반감기가 연장되었던 단편이라면 모두 중에서 선택되는 것을 특징으로 하는 항체, 그의 유래된 화합물들 또는 기능적 단편들을 표적한다.
본 발명에 따른 항체의 이러한 기능적 단편들은, 예를 들어 단편들 Fv, scFv [sc = 단일 사슬], Fab, F(ab')2, Fab', scFv-Fc 또는 다이아바디들, 또는 폴리에틸렌글리콜 ("PEG화 (PEGylation)")(Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG, Fab'-PEG 라고 명명되는 PEG화된 단편들)과 같은 폴리에틸렌 글리콜의 첨가와 같은 화학적 변형, 또는 리포좀, 미세구 (microspheres) 또는 PLGA에 통합에 의해 반감기가 연장되었던 단편이라면 모두로 구성되고, 상기 단편들은 일반적인 방식으로 이것이 나온 항체의 활성을 심지어 부분적이라도 명확하게 나타낼 수 있는 본 발명의 특징적인 CDRs의 적어도 하나를 소유한다.
바람직하게, 상기 기능적 단편들은 그들이 유래한 항체의 중쇄 또는 경쇄 가변 사슬의 부분적 서열로 이루어지거나 이를 포함할 것이고, 상기 부분적 서열은 그것이 나온 항체와 동일한 결합 특이성을 유지하기에 충분하며, 충분한 친화도는 바람직하게 항체 단편이 나온 항체의 결합 특이성의 적어도 1/100 정도, 더욱 바람직하게는 적어도 1/10 정도이다.
이러한 기능적 단편은 그것이 나온 항체 서열의 최소 5개 아미노산들, 바람직하게는 6개, 7개, 8개, 9개, 10개, 12개, 15개, 25개, 50개 및 100개의 연속적 아미노산들을 포함할 것이다.
바람직하게, 이들 기능적 단편들은 유형들 Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc 또는 다이아바디들이 될 것이고, 이는 일반적으로 항체가 나온 항체와 동일한 결합 특이성을 가진다. 본 발명에 따르면, 본 발명의 항체 단편들은 상기에 언급된 바와 같은 항체들로부터 펩신 (pepsin) 또는 파파인 (papain)을 포함하는 효소 소화, 및/또는 화학적 환원에 의한 디설파이드 연결 (disulfide bridge)의 절단과 같은 방법들에 의해 획득될 수 있다. 또한 항체 단편들은 당업자도 역시 알고있는 재조합 유전학의 기법들에 의해, 또는 예를 들어 어플라이드 바이오시스템사 (Applied Biosystems) 등이 시판하는 것들과 같은 자동 펩타이드 합성기 (automatic peptide synthesizers) 수단으로 펩타이드 합성에 의해 획득될 수 있다.
보다 명확하게 하기 위해, 하기 표 3a는 본 발명의 항체 224D10에 해당하는 다양한 아미노산 서열들을 정리하고 있다. 표 3a에서 Mu.는 마우스를 말한다.
[표 3a]
보다 명확하게 하기 위해, 하기 표 3b는 본 발명의 항체 221C9에 해당하는 다양한 아미노산 서열들을 정리하고 있다. 표 3b에서 Mu.는 마우스를 말한다.
[표 3b]
또 다른 관점에 따르면, 본 발명은 본 발명에 따른 모노클론 항체를 분비할 수 있는 마우스 하이브리도마, 명확하게는 프랑스 파리, 파스퇴르 연구소 CNCM에 2008년 03월 12일자로 기탁번호 제 I-3949호 하에 기탁된 마우스 기원의 하이브리도마에 관한 것이다. 상기 하이브리도마는 마우스 비장세포들로 면역화된 Balb/c 및 골수종 Sp 2/O-Ag 14 세포주의 융합에 의해 획득되었다.
본 명세서에서 224D10이라고 명명되는 모노클론 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들은 프랑스 파리, 파스퇴르 연구소 CNCM에 2008년 03월 12일자로 기탁번호 제 I-3949호 하에 기탁된 하이브리도마에 의해 분비되는 것을 특징으로 하고, 자명하게는 본 발명의 일부가 되고 있다
또 다른 관점에 따르면, 본 발명은 본 발명에 따른 모노클론 항체를 분비할 수 있는 마우스 하이브리도마, 명확하게는 프랑스 파리, 파스퇴르 연구소 CNCM에 2010년 01월 14일자로 기탁번호 제 I-4273호 하에 기탁된 마우스 기원의 하이브리도마에 관한 것이다. 상기 하이브리도마는 마우스 비장세포들로 면역화된 Balb/c 및 골수종 Sp 2/O-Ag 14 세포주의 융합에 의해 획득되었다.
본 명세서에서 221C9이라고 명명되는 모노클론 항체, 또는 그의 유래된 화합물들 또는 기능적 단편들은 프랑스 파리, 파스퇴르 연구소 CNCM에 2010년 01월 14일자로 기탁번호 제 I-4273호 하에 기탁된 하이브리도마에 의해 분비되는 것을 특징으로 하고, 자명하게 본 발명의 일부가 되고 있다.
본 발명의 새로운 관점은 다음의 핵산
a) 본 발명에 따른 항체 또는 그의 유래된 화합물 또는 기능적 단편을 코딩하는 핵산, DNA 또는 RNA;
b) 서열번호 15 내지 26 또는 서열번호 42 내지 52의 서열들로 이루어진 그룹으로부터 선택되는 서열, 또는 최적의 정렬 이후에 서열번호 15 내지 26 또는 서열번호 42 내지 52의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 DNA 서열을 포함하는 핵산;
c) 서열번호 27, 28, 53 및/또는 서열번호 54의 서열, 또는 최적의 정렬 이후에 서열번호 27, 28, 53 및/또는 서열번호 54의 서열들과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열을 포함하는 DNA 서열을 포함하는 핵산;
d) a), b) 또는 c)에 정의된 바와 같은 핵산들의 해당되는 RNA 핵산들;
e) a), b) 또는 c)에 정의된 바와 같은 핵산들의 상보적인 핵산들; 또한
f) 서열번호 15 내지 28 또는 서열번호 42 내지 54의 서열 또는 최적의 정렬 이후에 서열번호 15 내지 28 또는 서열번호 42 내지 54의 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98% 일치도를 가지는 서열, 또는 그의 상보적인 서열의 적어도 하나의 CDRs와 높은 엄격도 조건들 하에서 혼성화할 수 있는 적어도 18개 뉴클레오타이드들의 핵산:
으로부터 선택되는 것을 특징으로 하는, 분리된 핵산에 관한 것이다.
하기 표 4a는 본 발명의 항체 224D10에 관한 다양한 뉴클레오타이드 서열들을 정리하고 있다.
[표 4a]
하기 표 4b는 본 발명의 항체 221C9에 관한 다양한 뉴클레오타이드 서열들을 정리하고 있다.
[표 4b]
본 발명에서 상호교환적으로 사용되는 용어 표현들, "핵산 (nucleic acid)", "핵 서열 (nucleic sequence)", 핵산 서열 (nucleic acid sequence)", "폴리뉴클레오타이드 (polynucleotide)", "올리고뉴클레오타이드 (oligonucleotide)", "폴리뉴클레오타이드 서열 (polynucleotide sequence)", 및 "뉴클레오타이드 서열 (nucleotide sequence)"은 변형이 있거나 없이 핵산의 단편 또는 부위를 정의하고 비자연적 뉴클레오타이드들을 포함하기도 하며 또한 이중가닥 DNA, 단일가닥 DNA 또는 상기 DNAs의 전사 산물들인 뉴클레오타이드들의 명확한 서열을 의미한다.
본 명세서에서는 또한 본 발명이 그들의 자연적 염색체 환경 하에서의, 다시 말하면 자연 상태의, 뉴클레오타이드 서열들에 관한 것이 아니라고 이해되어야 한다. 본 발명의 서열들은 분리되었고 및/또는 정제되었으며, 예로 그들은 직접적으로 또는 간접적으로 예를 들어 사본으로 시료 채집되었고, 그들의 환경은 적어도 부분적으로는 변형되었던 것이다. 본 명세서에서, 예를 들어 숙주세포를 사용한 재조합 유전학에 의해 획득되거나 화학적 합성에 의해 획득된 분리된 핵산들도 역시 언급되어야 한다.
"최적의 정렬 이후에 바람직한 서열과 적어도 80%, 바람직하게는 85%, 90%, 95% 및 98%의 일치도 백분율을 나타내는 핵산 서열들"은 기준 핵산 서열의 측면에서, 상세하게는 결실 (deletion), 절단 (truncation), 연장 (extension), 키메라 융합 (chimeric fusion) 및/또는 치환 (substitution) 명확하게는 점 치환과 같은 소정의 변형들 (modifications)을 나타내는 핵산 서열들을 의미한다. 바람직하게, 이들은 기준 서열과 동일한 아미노산 서열들을 코드하는 서열들이고, 이것은 유전적 암호의 반복성 (degeneration), 또는 기준 서열들과 특이적으로, 바람직하게 높은 엄격도 조건들, 명확하게는 하기 정의된 것들 하에서 혼성화할 것 같은 상보성 (complementarity) 서열들과 관련되어 있다.
높은 엄격도 조건들 하에서의 혼성화는 온도 및 이온 강도와 관련된 조건들이 상보적인 DNA의 두 개 단편들 간 혼성화를 유지하도록 허용하는 방식으로 선택되는 것을 의미한다. 순수하게 설명에 근거하여, 상기 기술된 폴리뉴클레오타이드 단편들을 정의할 목적으로의 혼성화 단계의 높은 엄격도 조건들은 유리하게 다음과 같다.
DNA-DNA 또는 DNA-RNA 혼성화는 두 단계로 수행된다: (1) 5x SSC (1x SSC는 0.15 M NaCl + 0.015 M 소듐 사이트레이트 용액에 해당한다), 50%의 포름아마이드, 7%의 소듐 도데실 설페이트 (SDS), 10 x 덴하르트 용액 (Denhardt's), 5%의 덱스트란 설페이트 및 1%의 연어 정자 DNA를 포함하는 인산 완충용액 (phosphate buffer, 20 mM, pH 7.5)을 사용하여 42℃에서 3시간 동안 전혼성화 (prehybridization); (2) 프로브의 길이에 따른 온도에서 일차적인 혼성화 (예로, 프로브 크기 > 100개 뉴클레오타이드들인 경우 42℃), 이어서 2 x SSC + 2%의 SDS를 사용하여 20℃에서 20분 동안 두 번 세척, 0.1 x SSC + 0.1%의 SDS를 사용하여 20℃에서 20분 동안 한 번 세척. 마지막 세척 과정은 0.1x SSC + 0.1%의 SDS를 사용하여 프로브 크기 > 100개 뉴클레오타이드들의 경우 60℃에서 30분 동안 수행된다. 정해진 크기의 폴리뉴클레오타이드에 대한 상기 기술된 높은 엄격도의 혼성화 조건들은 샘브룩 등의 문헌에 기재된 절차들에 따라 (Sambrook et al., 1989, Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor), 당업자라면 더 크거나 더 작은 올리고뉴클레오타이드들에 적응시킬 수 있다.
본 발명은 또한 본 발명에 기술된 바와 같은 핵산을 포함하는 벡터에 관한 것이다.
명확하게, 본 발명은 이러한 뉴클레오타이드 서열을 포함하는 클로닝 및/또는 발현 벡터들을 지향한다.
바람직하게 본 발명의 벡터들은 주어진 숙주세포에서 뉴클레오타이드 서열들의 발현 및/또는 분비를 허용하는 요소들을 포함한다. 따라서, 본 벡터는 프로모터, 해독의 개시 및 종결 신호들, 뿐만 아니라 적합한 전사 조절 부위들을 포함해야 한다. 이것은 안정한 방식으로 숙주세포에서 유지될 수 있어야 하고 임의적으로 (optionally) 해독된 단백질의 분비를 특정하는 특정한 신호를 가질 수 있다. 이들 다양한 요소들은 당업자라면 사용되는 숙주세포에 따라 선택하고 최적화할 수 있다. 본 목적으로, 뉴클레오타이드 서열들은 선택된 숙주 내에 있는 자가 복제 벡터들 (autonomous replication vectors)에 삽입되거나 선택된 숙주의 통합 벡터들 (integrative vectors)이 될 수 있다.
이러한 벡터들은 당업자가 전형적으로 사용하는 방법들에 의해 제조되고, 이로부터 얻은 클론들은 리포펙션 (lipofection), 전기천공 (electroporation), 열 쇼크 (thermal shock), 또는 화학적 방법들과 같은 표준 방법들에 의해 적합한 숙주 내로 도입될 수 있다.
본 벡터들은 예를 들어 플라스미드 또는 바이러스성 기원의 벡터들이다. 그들은 본 발명의 뉴클레오타이드 서열들을 클론하거나 발현시키기 위해 숙주세포들을 형질전환하는 데 사용된다.
본 발명은 또한 본 발명에서 기술된 바와 같은 벡터에 의해 형질전환되거나 이를 포함하는 숙주세포들을 포함한다.
본 숙주세포는 원핵성 또는 진핵성 시스템들, 예를 들어 박테리아성 세포들 뿐만 아니라 효모세포들 또는 동물세포들, 상세하게는 포유동물 세포들로부터 선택될 수 있다. 곤충 또는 식물 세포들도 역시 사용될 수 있다.
본 발명은 또한 본 발명에 따른 적어도 하나의 형질전환된 세포를 가지는, 사람을 제외한 동물들에 관한 것이다.
본 발명의 또 다른 관점은 다음의 단계들
a) 본 발명에 따른 숙주세포의 배지 및 이에 적합한 배양 조건들에서의 배양; 또한
b) 배양 배지 또는 상기 배양된 세포들로부터 생산된 상기 항체, 또는 그의 기능적 단편들 하나의 회수:
로 이루어지는 것을 특징으로 하는, 본 발명에 따른 항체, 또는 그의 기능적 단편들의 하나를 생산하는 방법에 관한 것이다.
본 발명에 따라 형질전환된 세포들은 본 발명에 따른 재조합 폴리펩타이드들의 제조 방법들에 유용하다. 본 발명에 따른 폴리펩타이드의 재조합 형태로 제조방법들은 본 발명에 따른 벡터 및/또는 벡터에 의해 형질전환된 세포를 사용하는 것을 특징으로 하고, 이들도 역시 본 발명에 포함된다. 바람직하게, 본 발명에 따른 벡터에 의해 형질전환된 세포는 상기 폴리펩타이드의 발현 및 상기 재조합 펩타이드의 회수를 허용하는 조건들 하에서 배양된다.
상기에서 이미 언급한 바와 같이, 숙주세포는 원핵성 또는 진핵성 시스템들로부터 선택될 수 있다. 상세하게는, 이러한 원핵성 또는 진핵성 시스템에서 분비를 용이하게 하는 본 발명의 뉴클레오타이드 서열들을 확인하는 것이 가능하다. 따라서 이러한 서열을 보유하는 본 발명의 벡터는 분비되어야 할 재조합 단백질들의 생산에 유리하게 사용될 수 있다. 그러므로, 이들 흥미있는 재조합 단백질의 정제는 그들이 숙주세포들의 내부가 아닌 세포 배양 상청액에 존재하는 사실로 인하여 용이해질 수 있다.
또한 본 발명의 폴리펩타이드들은 화학적 합성에 의해 제조될 수 있다. 이러한 제조방법도 역시 본 발명의 목적이다. 당업자라면 단편들의 응축 (condensation)에 의해 또는 용액에서의 통상적인 합성에 의한 고체상 기법들 [명확하게는 Steward et al., 1984, 고체성 펩타이드 합성 (Solid phase peptide synthesis), 피어스 화학사 (Pierce Chem. Company), Rockford, 111, 제 2판] 또는 부분적 고체상 기법들과 같은 화학적 합성의 방법들을 숙지하고 있다. 화학적 합성에 의해 획득되고 해당하는 비자연적인 아미노산들을 포함할 수 있는 폴리펩타이드들도 또한 본 발명에 포함된다. 본 발명의 제조방법에 의해 획득될 수 있는 항체들, 또는 그들의 유래한 화합물들 또는 기능적 단편들도 역시 본 발명에 포함된다.
본 발명의 항체의 바이오마커로서의 용도도 또한 기재되고 있다, 본 방법들은 이에 제한되는 것은 아니지만 전립선 암 (prostate cancer), 골육종 (osteosarcomas), 폐암 (lung cancer), 유방암 (breast cancer), 자궁내막암 (endometrial cancer), 교아세포종 (glioblastoma), 결장암 (colon, cancer), 위암 (gastric cancer), 신장암 (renal cancer) 또는 기타 다른 c-Met의 발현과 연관된 암으로 대표되는 c-Met의 발현과 관련된 다양한 과다증식 종양원 유전자성 질병들을 검출하거나 진단하는 데 사용될 수 있다. 당업자가 인식하고 있는 바와 같이, 특정한 질병과 연관된 항체 발현의 수준은 기존 병폐의 성질 및/또는 중증도에 따라 달라질 것이다.
본 발명의 항체들의 당업자가 알고 있는 통상적인 방식이라면 모두 (예로, 국소적, 비경구적, 근육내 등)에 의한 투여는 시료에서 이상형성 (dysplastic) 세포들을 검출할 뿐만 아니라 의사가 c-Met의 발현과 연관되거나 이에 의해 매개된 과다증식성 질병의 치료를 받고 있는 환자의 치료적 섭생을 감시하도록 하는, 매우 유용한 방법을 제공할 것이다.
또 다른 구현예에서, 본 발명은 표지되고 생체내에서 cMet과 결합하는 상기 모노클론 항체 또는 그의 단편; 및 약제학적으로 허용가능한 담체를 포함하는 cMet의 발현과 연관된 종양원 유전자성 질병을 생체내 영상화하는 약제학적 조성물에 관한 것이다.
본 발명의 항체, 또는 그의 기능적 단편 또는 유도체는 cMet의 발현과 연관된 다양한 병리학들의 검출, 진단, 및 단계 결정 (staging)을 포함하는 다양한 의학적 또는 연구적 목적으로 용도를 찾게 될 것이다.
단계 결정 (stage determination)은 잠재적인 예후적 가치를 가지고 최적의 치료법을 설계하는 판정기준을 제공한다. 심슨 등 (Simpson et al., J. Clin. Oncology, 18: 2059 (2000)). 예를 들어 일반적으로, 유방암의 병리학적 단계 결정은 전자가 더 정확한 예후를 주기 때문에 임상적 단계 결정에 바람직하다. 그러나, 임상적 단계 결정은 이것이 병리학적 평가를 위해 조직을 획득하는 침습적 절차에 의존하지 않기 때문에 병리학적 단계 만큼 정확한 경우라면 더욱 바람직할 것이다.
상세하게, 본 발명의 항체는 적합한 표지들 또는 기타 적절한 검출가능한 바이오분자 (biomolecule) 또는 화합물들과 함께 사용될 때, 시험관내 및 생체내 진단적 및 예후적 적용에 유용하다.
면역검정법들 (immunoassays)에 사용되는 표지들은 일반적으로 당업자에게 알려져 있고 효소들, 방사성 동위원소들, 또한 형광성, 발광성 및 콜로이드 골드 또는 라텍스 비드들과 같은 색상 입자들을 포함하는 발색성 (chromogenic) 물질들을 포함한다. 적합한 면역검정법으로는 효소-결합 면역흡착 검정법 (enzyme-linked immunosorbent assays, ELISA)를 포함한다. 본 발명의 항체들에 표지들을 결합시키는 다양한 유형의 표지들 및 방법들은 하기에 설명되는 것들과 같이 당업자에게 잘 알려져 있다.
본 발명에서 사용되는 바, 용어 "c-Met의 발현과 연관된 종양원 유전자성 질병 (an oncogenic disorder associated with expression of cMet)"은 질병으로 고생하는 개체에서 c-Met (이상성)의 높은 수준들 또는 비정상적으로 낮은 수준들의 존재가 관찰되었거나 이것이 질병의 병리생리학 또는 질병 악화의 원인이 되는 요인을 부여하는 것으로 의심되는 질환들 및 기타 다른 질병들을 포함하는 것으로 의도된다. 대안으로, 이러한 질병들은 예를 들어 세포 표면 상에서 cMet 수준의 증가에 의해 또는 질병으로 고생하는 개체의 세포들 또는 조직들에서 증가된 타이로신 자가인산화 (tyrosine autophosphorylation) cMet으로 입증될 수 있다. cMet 수준들에서의 증가는 예를 들어 본 발명의 항체 224D10을 사용하여 검출될 수 있다. 보다 상세하게는, 이것은 비교적 자발성 성장을 나타내는 세포들을 말하고 따라서 그들은 세포 증식의 조절의 유의한 상실을 특징으로 하는 이상성장 표현형을 나타낸다. 대안으로, 세포들은 정상적 수준의 cMet을 발현할 수 있지만 비정상적 증식에 의해 구별된다.
소정의 구현예들에서, "증가된 발현 (increased expression)"은 cMet에 관한 것일 때 대조군에 대비하여 통계적으로 유의한 발현에서의 증가를 (RNA 발현 또는 단백질 발현에 의해 측정됨) 보여주는 단백질 또는 유전자 발현 수준들을 말한다.
보다 상세하게, c-Met의 발현과 연관된 종양원 유전자성 질병을 시험관내에서 진단하거나 c-Met의 발현과 연관된 종양원 유전자성 질병 예를 들어 c-Met의 발현과 연관된 암을 생성하는 예후를 시험관내에서 결정하는, 기술된 바와 같은 본 발명에 따른 항체, 또는 그의 기능적 단편 또는 유도체의 용도가 고려된다.
본 발명에 따른 또 다른 광범위한 관점은 시료에서 cMet를 보유하는 세포들의 존재 또는 부재를 결정하고, 또한 상기 cMet 보유하는 세포들의 존재 또는 부재를 근거로 하여 병리학적 병폐 또는 병리학적 병폐에 대한 취약성 (susceptibility)을 진단하는 것을 포함하는, 개체에서 병리학적 과다증식 종양원 유전자성 질병 또는 cMet 발현과 연관된 병리학적 병폐에 대한 취약성을 진단하는 방법에 관한 것이다. 본 발명의 항체의 진단적 용도들은 일차 종양들, 암 전이들 (metastases)을 포함한다. 본 항체는 검출가능한 및/또는 정량가능한 신호를 획득하도록 표지된 항체 (labeled antibody) 또는 면역결합체 (immunoconjugate)의 형태로 존재할 수 있다.
보다 상세하게, 본 발명에 따른 바람직한 주제는 (a) 개체로부터 나온 시료를 본 발명에 따른 항체, 또는 그의 기능적 단편 또는 유도체와 접촉시키고, 또한 (b) 상기 시료와 상기 항체의 결합을 검출하는 단계들을 포함하는, 개체에서 c-Met 발현하는 종양의 존재 및/또는 위치를 시험관내에서 검출하는 방법이다. 본 주제의 또 다른 관점은 c-Met 표적된 치료법에 대한 반응으로서, 임상 시험기간 동안, 보다 상세하게는 c-Met 수용체의 저하조절 (downregulation) 또는 분해 (degradation)가 테스트된 화합물의 작용 기작의 하나의 구성성분일 때 c-Met 발현의 추적 (follow-up)이다.
당업자에게는 자명하게 될 바, 본 발명의 항체의 결합 검출은 다양한 검정법들에 의해 밝혀질 수 있다. 검정법들을 수행하기 위한 수단이라면 모두가 본 발명과 양립가능하긴 하지만, 예로서, FACS, ELISA 또는 IHC가 언급될 수 있다.
본 명세서에서 사용되는 바, 용어 "시료 (sample)"는 결장, 위, 직장, 유방, 난소, 전립선, 신장, 폐, 혈액, 뇌 또 신생물 (neoplastic) 세포를 포함하거나 포함할 것으로 의심되는 기타 다른 기관 또는 조직으로부터 나온 세포와 같은 신생물 세포를 포함하거나 잠재적으로 포함하는 생물학적 체액, 세포, 조직, 기관 또는 그의 일부라면 모두를 의미하도록 의도된다. 본 용어는 개인에서 존재하는 시료들 뿐만 아니라 개인으로부터 획득되거나 유래된 시료들도 포함한다. 예를 들어, 시료는 생검에 의해 획득된 표본의 조직 절편 또는 조직 배양에 놓여지거나 이에 적응된 세포들일 수 있다. 시료는 좀 더 나아가 세포이하 (subcellular) 분획 또는 추출물, 또는 조 (crude) 또는 실질적으로 순수한 핵산 분자 또는 단백질 제조물일 수 있다.
임상적 시료는 개체로부터 획득되고, 예를 들어 cMet 발현 수준들을 결정하거나 검출하는 진단적 또는 감시하는 테스트와 같은 본 발명의 절차에 유용한 다양한 시료 유형들을 포괄하도록 의도된다. 정의는 수술적 제저, 병리학 표본, 보관된 시료, 또는 생검 표본, 조직 배양들 또는 이로부터 유래된 세포들 및 그의 자손, 및 이들 출처라면 모두로부터 제조된 절편들 또는 도말들에 의해 획득된 고형 조직 시료들을 포괄한다. 제한되지 않는 예로는 유방 조직, 림프절, 결장, 췌장, 전립선 등으로부터 획득된 시료들이다. 또한 정의는 생물적 기원의 액체 시료들을 포괄하고, 본 명세서에서의 세포들 또는 세포 단편들, 또는 액체 배지 및 그의 용질물들 (solutes)을 말한다.
본 발명에 따른 또 다른 관점은 (a') 개체로부터 나온 시료를 본 발명에 따른 항체, 또는 그의 기능적 단편 또는 유도체와 접촉시키고, 또한 (b') 상기 시료에서 c-Met에 결합하는 항체의 수준을 정량하는 단계들을 포함하는, 개체로부터 나온 c-Met 발현하는 종양에서 c-Met의 발현 수준을 시험관내에서 결정하는 방법에 관한 것이다.
당업자에게는 자명하게 될 바, cMet에 결합하는 항체의 수준은 다양한 검정법들과 같은 많은 방식들로 정량될 수 있다. 검정법들을 수행하기 위한 수단이라면 모두가 본 발명과 양립가능하긴 하지만, 바람직한 방법은 엘라이자 (ELISA) 기법에 따라, 면역형광 (immunofluorescence)에 의해, 면역조직화학 (immunohistochemistry) 또는 방사성-면역검정법 (radio-immunoassay, RIA) 또는 동등한 것에 의한 면역효소적 공정들을 작동시키게 된다
바람직하게, 생물학적 시료는 인간 기원의 혈청, 전혈, 세포들, 조직 시료 또는 생검들로 형성된다. 시료는 예를 들어 생검된 조직을 포함할 수 있고, 이는 cMet의 발현과 연관된 병리학적 과다증식 종양원 유전자성 질병의 존재가 편리하게 검정될 수 있다.
일단 테스트 시료에 존재하는 cMet의 양이 결정되면, 결과들이 테스트 시료들과 유사한 방식으로 획득되지만 cMet의 발현과 연관된 과다증식 종양원 유전자성 질병을 가지지 않거나 이것이 존재하지 않는 개인으로부터 나온 대조군 시료의 결과들과 비교될 수 있다. cMet의 수준이 테스트 시료에서 유의하게 올라가는 경우, 유래된 개체로부터 상기 질병을 가지거나 발생시킬 가능성의 증가가 존재하는 것으로 판단될 수 있다.
보다 상세하게, 본 발명은 (i) 상기 기술된 바와 같이 c-Met의 발현 수준을 결정하고, 또한 (ii) 단계 (i)의 발현 수준을 정상 조직 또는 발현하지 않는 cMet 조직으로부터 나온 기준 (reference) c-Met의 발현 수준과 비교하는 단계들을 포함하는, 개체에서 c-Met을 발현하는 종양을 시험관내에서 진단하거나 c-Met 발현하는 종양을 발생시키는 예후를 시험관내에서 결정하는 방법에 관한 것이다.
본 출원에서 사용되는 바, 질환을 "진단하는 것 (diagnosing)"은 예를 들어 cMet의 발현과 연관되거나 이에 의해 매개되는 병리학적 과다증식 종양원 유전자성 질병의 존재를 진단하거나 검출하는 것, 질환의 진행을 감시하는 것 또한 cMet의 발현과 연관된 질병의 표시 (indicative)가 되는 세포들 또는 시료들을 확인하거나 검출하는 것을 포함하는 것으로 의도된다.
본 출원에서 사용되는 바, "예후 (prognosis)"는 질환으로부터의 회복 가능성 (likelihood) 또는 질환의 가능한 발생 또는 결과의 예측을 의미한다. 예를 들어 개체로부터 나온 시료가 본 발명의 항체로 염색에 대해 양성인 경우라면, 다음으로 해당 개체의 "예후"는 시료가 cMet 염색에 대해 음성이었던 경우보다 더 호전된 것이다. 시료들은 이하 본 명세서에서 보다 자세하게 설명될 바와 같이 적절한 척도 (scale) 상에서 cMet 발현 수준들에 대해 점수가 매겨질 수 있다.
그러나 본 발명의 또 다른 관점은 또한 cMet의 분해를 유도하는 치료적 화합물들의 경우 그들의 작용 기작의 하나로서 c-Met 발현을 감시하는 것에 관한 것이다. 이 경우에, 이어지는 세포막 상에서의 c-Met 발현이 임상 시험들 및 "개인적인 (personalized)" 치료법들 기간 동안 치료의 효능을 평가하도록 결정적인 도구가 될 수 있다.
유익하게, cMet의 발현 수준은 "기준 수준 (reference level)" 또는 "기준 발현 수준 (reference expression level)"이라고도 명명되는 대조군 세포 또는 시료에서의 수준들에 대비하여 비교되거나 측정된다. "기준 수준". "기준 발현 수준", "대조군 수준 (control level)" 및 "대조군 (control)"은 본 명세서에서 상호교환적으로 사용된다. 광범위하게 말하자면, "대조군 수준"은, 일반적으로 질환 또는 암이 없는 비교가능한 대조군 세포에서 측정된 별도의 기본선 (baseline) 수준을 의미한다. 이것은 동일한 개인으로부터 또는 정상이거나 질환을 가지거나 테스트 시료가 획득된 것과 동일한 질환을 가지지 않는 또 다른 개인으로부터 나올 수 있다. 본 발명의 문맥 내에서, 용어 표현 "기준 수준"은 환자의 암세포-포함 시료에서 cMet 발현의 테스트 수준을 평가하는 데 사용되는 cMet 발현의 "대조군 수준"을 말한다. 예를 들어, 환자의 생물학적 시료에서 cMet 수준이 cMet의 기준 수준보다 더 높을 때, 세포들은 cMet의 발현의 높은 수준, 또는 이의 과다발현을 가지는 것으로 고려될 것이다. 기준 수준은 다수의 방법들에 의해 결정될 수 있다. 따라서 발현 수준들은 cMet을 보유하는 세포들 또는 대안으로 cMet을 발현하는 세포들의 수와는 독립적으로 cMet의 발현 수준을 정의할 수 있다. 따라서 각 환자를 위한 기준 수준은 cMet의 기준 비율에 의해 처방될 수 있고, 여기에서 기준 비율은 본 명세서에서 기술된 기준 수준들을 결정하는 방법들이라면 모두에 의해 결정될 수 있다.
예를 들어, 대조군은 다양한 형태들을 취할 수 있는 선결정된 수치 (predetermined value)일 수 있다. 이것은 중앙값 또는 평균값과 같은 단일한 컷-오프 수치 (cut-off value)일 수 있다. "기준 수준"은 모든 환자에게 개인적으로 동등하게 적용가능한 단일한 수이거나, 기준 수준은 환자들의 특정한 소집단들에 따라 달라질 수 있다. 따라서, 예를 들어 동일한 암의 경우 나이든 남자들은 젊은 남자들과는 다른 기준 수준을 가질 수 있고, 동일한 암의 경우 여자들은 남자들과는 다른 기준 수준을 가질 수 있다. 대안으로, "기준 수준"은 테스트될 신생물 세포들의 조직과 동일한 조직으로부터 나온 비-종양원 유전자성 암 세포들에서 cMet의 발현 수준을 측정하여 결정될 수 있다. 마찬가지로, "기준 수준"은 환자의 신생물 세포들에서의 cMet의 동일한 환자 안에서 비-종양 세포들에서의 cMet 수준들에 대비한 소정의 비율일 수 있다. 또한 "기준 수준"은 시험관내에서 배양된 세포들의 cMet 수준일 수 있고, 이것은 종양 세포들을 자극하도록 조작될 수 있거나 기준 수준을 정확하게 결정하는 발현 수준들을 수득하는 기타 다른 방식이라면 모두에서 조작될 수 있다. 한편으로, "기준 수준"은 올라간 cMet 수준들을 가지지 않는 실험군들 및 올라간 cMet 수준들을 가진 실험군들에서와 같은 비교군들에 기초하여 확립될 수 있다. 비교군들의 또 다른 예로는 특정한 질환, 병폐 또는 증상들을 가지는 실험군들 및 질환이 없는 실험군들일 수 있다. 선결정된 수치는, 예를 들어 테스트된 집단이 저-위험군, 중-위험군 및 고-위험군과 같은 실험군들로 또는 4가지 (quadrants) 또는 5가지 (quintiles) 실험군들로, 가장 낮은 4가지 또는 5가지 실험군은 가장 낮은 위험도 또는 가장 많은 양의 cMet를 가진 개인이고 가장 높은 4가지 또는 5가지 실험군은 가장 높은 위험도 또는 가장 적은 양의 cMet를 가진 개인이 되도록 균등하게 (또는 비균등하게) 나뉘어지 곳에 배정될 수 있다.
또한 기준 수준은 동일한 암을 가진 환자들의 집단들에서 cMet 수준의 비교에 의해 결정될 수 있다. 이것은 예를 들어 환자들의 전체 군집 (cohort)이 그래프로 표현되는 히스토그램 분석에 의해 성취될 수 있고, 여기에서 첫 번째 축은 cMet의 수준을 나타내고, 두 번째 축은 종양성 세포들이 주어진 수준으로 cMet을 발현하는 군집에서 환자들의 수를 나타낸다. 둘 이상의 분리된 환자들의 실험군들이 동일하거나 유사한 수준의 cMet을 가지는 군집의 소집단 (subsets populations)을 확인하여 결정될 수 있다. 다음으로 기준 수준의 결정이 이들 분리된 실험군들을 가장 잘 구별하는 수준에 근거하여 이루어질 수 있다. 또한 기준 수준은 하나가 cMet이 되는 둘 이상의 마커들의 수준들을 나타낼 수 있다. 둘 이상의 마커들은 예를 들어 각 마커의 수준들에 대한 수치의 비율에 의해 나타내질 수 있다.
마찬가지로, 외관상으로 건강한 집단은 cMet의 발현과 연관된 병폐를 가지는 것으로 알려진 집단이 가지는 것보다 '정상'인 서로 다른 범위를 가질 것이다. 따라서, 선택된 선결정된 수치는 개인이 배정되는 카테고리를 고려할 수 있다. 적절한 범위들 및 카테고리들은 당업자에 의한 단지 일상적인 실험으로 선택될 수 있다. "올라간 (elevated)" "증가된 (increased)"에 의하여, 이것은 선택된 대조군에 대비하여 높은 것을 의미한다. 전형적으로 대조군은 적절한 연령 분포 내에서 외관상으로 건강한 정상의 개인들에 기초하게 될 것이다.
또한 본 발명에 따른 대조군들은 선결된 수치들에 추가하여, 실험적 물질들로 동등하게 테스트된 물질들의 시료들일 수 있는 것으로도 이해될 것이다. 예로는 동일한 개체로부터 동시에 획득된 조직 또는 세포들, 예를 들어 단일한 생검의 부분들, 또는 개체로부터 나온 단일한 세포 시료의 부분들을 포함한다.
cMet 매개성 질환들을 가지는 환자들의 임상적 진단 또는 감시하는 것에서, cMet을 발현하는 세포들 또는 cMet 수준들에서 증가의 검출은 정상 개체 또는 비-암성 조직을부터 나온 해당 생물학적 시료에서 수준과 비교하여, 일반적으로 cMet 매개성 질병을 가지거나 이를 표현하는 것으로 의심되는 환자의 표시이다.
상기에 따르면, 본 발명은 조직 시료에서 암에 대한 취약성 (susceptibility)을 표시하는 존재로서 cMet의 발현 수준을 검출하는 것을 포함하는 암에 대한 취약성을 예측하는 방법을 제공하고, 여기에서 cMet 발현의 정도는 취약성의 정도와 상호관련되어 있다. 따라서 특정한 구현예들에서, 예를 들어 전립선 조직, 골육종 조직, 폐 조직, 취장 조직, 결장 조직, 유방 조직, 교아종 조직, 난소 조직, 또는 cMet을 발현하는 세포들이 의심되는 기타 조직이라면 모두에서 cMet의 발현이 암 취약성 또는 조직 특이적 종양의 출현 또는 존재의 표시 (indication)를 제공하는 시료에서 cMet의 존재로 조사된다.
또한 종양의 공격성 (aggressiveness)을 평가하는 방법도 제공된다. 한 가지 구현예에서, 개인에서 시간 경과 시 악성도 (malignancy)의 진행을 관찰하는 방법은 종양의 시료에서 세포들에 의해 발현되는 cMet의 수준을 결정하고, 상기 수준을 동일한 개인으로부터 동시에 가져온 동등한 조직 시료에서 발현되는 cMet의 결정된 수준과 비교하는 것을 포함하고, 여기에서 종양 시료에서 시간 경과 시 cMet 발현의 정도는 암의 진행에 관한 정보를 제공한다.
보다 또 다른 구현예에서, 응용 (application)은 개체를 위한 적절한 치료적 프로토콜을 결정하는 방법들을 제공한다. 상세하게는, 본 발명의 항체들은 개인에서, 특히 개체가 cMet에 결합을 위해 본 발명의 항체들과 경쟁하지 않는 cMet 항체로 치료되는 이들 상황들에서 악성도의 개선 (amelioration) 과정을 감시하는 데 매우 유용할 것이다. 본 발명에 따른 cMet 수준에서 존재 또는 부재 또는 변화는 개체가 cMet과 연관된 재발성 또는 진행성 또는 영구적 암을 가질 가능성을 표시할 수 있다. 따라서, cMet을 발현하는 세포들의 수에서의 증가 또는 다양한 조직들 또는 세포들에 존재하는 cMet의 농도에서의 변화를 측정하여, cMet과 연관된 악성도를 개선할 목적을 가진 특정한 치료적 섭생이 효과적인지 여부를 결정하는 것이 가능하다.
본 발명의 또 다른 주제는 cMet의 발현과 연관된 종양원 유전자성 질병을 영상화하는 생체내 방법이다. 예를 들어, 이러한 방법은 종양원 유전자성 질병의 증상들을 표현하는 환자 상에서 사용될 수 있다. 환자가 예를 들어 cMet의 증가된 발현 수준들을 가지는 경우라면, 다음으로 환자는 암성 질병으로 고생할 가능성이 있다. 마찬가지로, 본 방법은 이전에 cMet 매개성 암으로 진단되었던 환자들에서 진행 및/또는 치료에 대한 반응을 감시하는 데 유용할 수 있다. 상기 목적에 따르면, 본 발명은 본 발명에 따른 항체, 또는 그의 기능적 단편 또는 유도체를 포함하는, 바람직하게는 표지된, 특히 방사선 표지된 생체내 영상화 반응시약 및 의학적 영상화에서 그의 용도를 제공한다. 따라서, 본 발명에 따른 일반적인 방법은 환자에게 상기 기술된 표지된 항체와 같은 영상화 반응시약 및 약제학적으로 유효한 담체의 영상화-유효량 (imaging-effective amount)을 투여한 다음 시료에 존재하는 cMet에 결합시킨 이후 제제를 검출하여 달성된다. 소정의 구현예들에서, 본 방법은 표적하는 소부분 (targeting moiety) 및 활성을 가진 소부분 (active moiety)을 포함하는 영상화-유효량의 영상화 제제를 투여하여 달성된다. 영상화 제제는 인간과 같은 포유동물에서 진단적 용도에 효과적인 양으로 투여된 다음 영상화 제제의 정착 (localization) 및 축적 (accumulation)이 검출된다. 영상화 제제의 정착 및 축적은 방사성 핵종 영상화 (radionuclide imaging), 방사성 섬광분석법 (radioscintigraphy), 핵자기 공명 영상화 (nuclear magnetic resonance imaging), 전산화 단층촬영법 (computed tomography), 양전자 방출 단층촬영법 (positron emission tomography), 전산화 축상 단층촬영법 (computerized axial tomography), X-선 또는 자기공명 영상화 방법 (magnetic resonance imaging method), 형광 검출 (fluorescence detection), 및 화학발광 검출 (chemiluminescent detection)에 의해 검출될 수 있다.
표적화된 항종양 치료법의 개발의 관점에서, 면역조직학적 기법들을 사용한 진단은 자리에서 (in situ) 수용체 발현 수준에 관한 정보를 제공하고 이러한 치료에 필요한 수용체들의 발현 수준에 이어지는 치료될 취약한 환자들을 선별하는 것을 가능하게 한다.
모노클론 항체들을 사용하는 면역치료법의 경우, 치료에 대한 반응은 인간화된 항-Her2 모노클론 항체 트라스투주 Mab (trastuzumab)의 출시 (advent)와 함께 유방 암종에서 Her2 과다발현의 결정이 주요한 임상적 중요성을 가지는 트라스투주 Mab로의 치료와 같이 수용체 표적된 발현 수준에 의존한다. Her2 과다발현의 전시는 이것이 Her2를 과다발현하는 암종 세포들을 특이적으로 표적하여 작용하기 때문에 트라스투주 Mab로의 치료를 위해 선결조건이 된다. Her2에 대한 정확한 테스트는 비용이 많이 들고 잠재적으로 독성을 가지는 트라스투주 Mab 치료가 비-과다발현하는 종양들을 가지는 환자들에 주어지지 않고 트라스트주 Mab로부터 유익이 되는 모든 환자가 적절한 치료를 받는 것을 입증하는 것을 목적으로 한다.
트라스투주 Mab에서의 가르침은, 과다발현된 Her2가 모노클론 항체로의 치료법을 사용할 때 수용체의 발현 수준을 결정하고 동시에 치료적 모노클론 항체보다는 환자 선별에 사용될 수 있는 모노클론 항체를 개발하는 데 유익이 되는 것을 보여주었던, 환자 선별과 관련되어 있다.
결론적으로, 본 발명은 (1) 상기 기술된 바와 같이 c-Met의 발현 수준을 결정하고, (2) c-Met 발현 수준에 대해 상기 종양을 점수 매기고, 또한 (3) 상기 점수 매긴 것을 대조군 시료로부터 획득된 것과 비교하는 단계들을 포함하는, 개체의 종양의 c-Met 상태를 시험관내에서 결정하는 방법에 관한 것이다.
본 발명의 의미에서, "cMet 상태 (cMet status)"는 면역조직화학 (IHC), 형광 자리 혼성화 (fluorescence in situ hybridization, FISH), 비색성 자리 혼성화 (colorimetric in situ hybridization, CISH), 유전자 칩 (gene chip) 또는 당업자가 숙지하고 있는 다른 방법들과 같은 방법들이라면 모두에 의해 측정되는 바와 같이, cMet 유전자의 발현 수준의 결정에 기초하여 cMet 양성 [cMet(+)] 또는 cMet 음성 [cMet(-)] 부류 (class)로 종양의 분류 (classification)에 관한 것이다.
바람직한 구현예에서, 진단적 용도를 위한 항체는 조직 시료들이 포르말린으로 고정되고 파라핀에 함몰될 때 표적된 수용체에 결합될 수 있어야 한다.
보다 상세하게, cMet 발현 수준은 면역조직화학 (immunohistochemistry, IHC)에 의해 측정된다.
예로서, 시료들은 cMet 발현 수준을 위해 항체 염색의 수준으로 0으로부터 3+까지의 척도 상에 점수가 매겨질 수 있고, 여기에서는 증가하는 강도의 반정량적인 4 단계들에서 0은 음성이고 1+ - 3+은 양성을 나타낸다. 점수 1+ - 3+은 각 양성 점수가 재발 및 치명적 질환에 대한 유의하게 감소된 위험도와 연관될 수 있기 때문에 점수 0와 대비될 때 양성으로서 기록될 수 있지만, 양성 점수들 중에서 증가하는 강도는 추가적인 위험도 감소를 제공할 수 있다. 통상적인 위험 분석 방법은 cMet의 예후적 수치를 추정하는 데 사용될 수 있다. 대표적인 분석 방법들로는 검열된 사례들의 존재 시 생존 또는 시간-대-사건 결과를 모델링하는 반매개변수적 (semiparametric) 방법인 콕스 회귀 분석 (Cox regression analysis)을 포함한다 (Hosmer and Lemeshow, 1999; Cox, 1972). 다른 생존 분석법들, 예로 라이프 표들 또는 카프란-메이어 (Kaplan-Meyer)와는 대조적으로, 콕스는 모델들에서 예측인자 변수들 (공동분산 (covariates)의 포함을 허용한다. 통상적인 분석 방법, 예로 콕스를 사용하여, 일차 종양의 cMet 발현 상태에 대비한 질환 재발 (무-질환 생존 기간, 또는 전이적 질환까지의 시간)의 시간-대-발생, 또는 질환으로 사망까지의 시간 (전체 생존 기간)의 상호관련성에 관한 가설들을 테스트할 수 있을 것이다. 콕스 회귀 분석은 콕스 비율적 위험 분석법 (Cox proportional hazard analysis)으로도 역시 알려져 있다. 본 방법은 환자 생존기간에 관한 종양 마커의 예후적 수치를 테스트하는 표준이 된다. 다중분산 방식으로 사용될 때, 여러 개의 공동분산의 효과는 동일 선상에서 테스트되고, 독립적인 예후적 수치를 가지는 개별 공동분산은 예로 가장 유용한 마커들을 확인할 수 있다. 용어 표현, 종양의 양성 또는 음성 "cMet 상태" [cMet(+) 또는 cMet(-)라고도 명명됨]는 각각 점수들 0 또는 점수들 1+ - 3+를 말한다.
시료는 예를 들어 유방암과 같은 암의 진단 또는 감시하는 동안 "점수 매기기 (scored)"될 수 있다. 가장 단순한 형태로, 점수 매기기는 면역조직화학에 의해 시료들의 시각적 조사로 판단되는 바와 같이 분류적 음성 또는 양성이 될 수 있다. 더욱 정량적인 점수 매기기는 염색의 강도 및 시료 수집된 염색된 세포들 ("양성")의 비율, 두 가지 매개변수들을 판단하는 것이 관여한다. 이들 두 가지 매개변수들에 기초하여, 양성 염색의 증가하는 수준들을 반영하는 수치들이 배당될 수 있다. 올레드 등 (Allred et al., Allred, Harvey et al. 1998)은 이것을 성취하는 한 가지 방식을 기술하였고, 여기에는 0 (음성)으로부터 3+까지의 척도 상에 매개변수들 둘 다를 점수 매기고, 또한 개별 매개변수들의 점수들을 전체 점수에 합산하는 것이 관여된다. 이것은 0, 2, 3, 4, 5, 6, 7 또는 8의 가능한 점수들을 가진 척도를 가져온다 (점수 1은 올레드 척도에서는 가능하지 않은 점을 주목하라). 약간 더 단순한 점수 매기기 방법은 핵 염색의 강도 및 염색된 핵을 나타내는 세포들의 비율을 0으로부터 3+까지의 조합된 척도 내로 통합시킨다. 점수 매기기 방법이라면 모두가 세포 핵에서 활성화된 Stat5 염색의 강도 및 비율을 점수 매기는 데 적용될 수 있다. 용어, 본 기술내용에 사용되는 종양들의 양성 또는 음성 "cMet 상태"는 단순화된 척도 상에 각각 점수들 0 또는 1+ - 3+에 해당하는 cMet의 발현 수준들을 말한다.
일반적으로, 본 발명에 따른 테스트 또는 검정법의 결과들은 다양한 형식들 (formats)이라면 모두로 표현될 수 있다. 결과들은 정성적인 방식 (qualitative fashion)으로 표현될 수 있다. 예를 들어, 테스트 보고서는 특정 폴리펩타이드가 검출되었는지 여부만을 아마도 검출의 한계도 역시 표시하여 가르킬 수 있다. 결과들은 반-정량적인 (semi-quantitative) 방식으로 표현될 수 있다. 예를 들어, 다양한 범위들이 정의될 수 있고, 범위들은 소정의 양의 정량적 정보를 제공하는 점수 (예로, 1+ 내지 3+)를 배당할 수 있다. 이러한 점수는 다양한 요인들, 예로 cMet이 검출되는 세포들의 수, 신호의 강도 (cMet의 발현 수준 또는 cMet을 보유하는 세포들을 가르킬 수 있음) 등을 반영할 수 있다. 결과들은 정량적인 방식 (quantitative fashion) 방식으로, 예로 폴리펩타이드 (cMet)이 검출되는 세포들의 백분율, 단백질 농도 등으로서 표현될 수 있다. 당업자라면 이해할 바와 같이, 테스트에 의해 제공되는 결과 (output)의 유형은 테스트의 기술적인 한계들 및 폴리펩타이드의 검출과 연관된 생물학적 유의성에 의존하여 달라질 것이다. 예를 들어, 소정의 폴리펩타이드들의 경우에는 순수하게 정성적인 결과가 (예로, 폴리펩타이드가 소정의 검출 수준으로 검출되는 지 여부) 유의한 정보를 제공한다. 다른 경우에는, 더욱 정량적인 결과가 (예로, 테스트되는 시료에서 폴리펩타이드의 발현 수준의 정상 수준에 대비한 비율) 필요하다.
더욱 바람직한 구현예에서, cMet 발현 수준의 점수 매기기는 반응 산물의 강도 및 양성 세포들의 백분율의 평가에 기초하여 0으로부터 3+까지의 등급이 매겨진다. 더욱 명확하게 하기 위해, 본 명세서에서 하기 표 5는 이들 매개변수들을 정리하고 있다. 침습성 종양의 완벽한 주변 막 반응성만이 고려되어야 하고 종종 "육각형 철장 (chicken wire)" 모양을 닮아있다. 현재의 지침들 하에서, cMet IHC에 대한 경계선 (2+ 이상의 점수)으로 점수가 매겨진 시료들은 cMet(+)로서 고려되어야 하고 심화된 평가를 거질 것이 요구된다. 비-제한적인 예로서, 대조군은 예상한 바와 같지 않고, 대부분의 시료에 오염물질 (artifacts)을 포함하며 시료가 정상 유방 관들의 강한 막 양성도를 가지고 과다한 항원 복구를 제시하는 경우라면 IHC 분석법은 거부되고, 분석이 반복되거나 FISH 또는 기타 다른 방법에 의해 검증되어야 한다.
| c-Met 상태 | IHC 기술 |
| 0 | 반응 없음 또는 10% 이하의 종양 세포들에서 막 반응성 |
| 1+ | 희미한/약간 감지가능한 반응성이 10% 이상의 종양 세포들에서 검출된다. 세포는 막의 일부분에서만 면역반응성이다. |
| 2+ | 약한 내지 적당한 완전 반응성이 10% 이상의 종양세포들에서 관찰된다. |
| 3+ | 강한 완전 반응성이 10% 이상의 종양 세포들에서 관찰된다. |
본 발명에 따른 방법의 더욱 바람직한 구현예에서, 상기 점수 매기기는 염색의 강도 및 양성 세포들의 백분율이 되는 두 가지 매개변수들에 기초하여 적절한 척도를 사용하는 것을 포함한다.
바람직한 구현예에서, 본 발명에 따른 방법은 0 내지 3+의 척도가 되는 적절한 척도를 말하고, 여기에서 종양 세포들의 막 반응성 없음은 0으로 점수 매겨지고 10% 이상의 종양 세포들에서의 강한 완전 반응성은 3+로 점수 매겨진다.
더욱 자세하게는, 상기에 기술된 바와 같이 상기 적절한 척도는 종양 세포들의 막 반응성 없음은 0으로 점수를 매기고; 10% 이상의 종양 세포들에서 희미하게 감지가능한 막 반응성은 1+로 점수를 매기고; 10% 이상의 종양 세포들에서 약한 내지 적당한 완전 막 반응성은 2+로 점수를 매기고; 또한 10% 이상의 종양 세포들에서 강한 완전 막 반응성은 3+로 점수를 매기는, 0 내지 3의 척도이다.
본 발명의 상세한 관점에서, 종양은 2+의 점수를 가진 cMet(+)이다.
본 발명의 상세한 관점에서, 종양은 3+의 점수를 가진 cMet(+)이다.
본 발명의 또 다른 상세한 관점에서, 종양은 2+ 또는 3+의 점수를 가진 cMet(+)이다.
본 발명에 따르면, 본 방법은 (a) 상기 기술된 바와 같이 개체의 종양의 c-Met 상태를 시험관내에서 결정하고, 또한 (b) 상기 상태가 c-Met(+)인 경우라면, 종양원 유전자성 질병이 항-c-Met 항체, 또는 그의 단편 또는 유도체로의 치료에 민감한 (susceptible) 것을 결정하는 단계들을 포함하는, 종양원 유전자성 질병이 항-c-Met 항체, 또는 그의 단편 또는 유도체로의 치료에 민감한지 여부를 결정하는 방법도 또한 기술된다.
본 발명의 또 다른 관점에서, 본 발명의 항체를 포함하는 이러한 진단 또는 예후 진단하는 방법에 유용한 키트가 고려된다.
편의성을 위해, 진단적 검정법을 수행하기 위한 설명서들와 함께 선결정된 양들의 반응시약들의 포장된 조합물 (packaged combination), 예로 키트들도 역시 본 발명의 범위에 속한다. 본 키트는 cMet의 시험관내에서, 예로 엘라이자 또는 웨스턴 블럿으로 검출 및 정량을 위한 항체들을 포함하고 있다. 본 발명의 항체는 cMet의 시험관내에서, 예로 엘라이자 또는 웨스턴 블럿으로 검출 및 정량을 위한 키트로 제공될 수 있다. 항체가 효소로 표지되는 곳에서는, 키트가 효소에 의해 요구되는 기질들 및 보조인자들을 포함할 것이다 (예로, 검출가능한 발색단 (chromophore) 또는 형광단 (fluorophore)을 제공하는 기질 전구체). 또한, 다른 첨가물이 안정화제들 (stabilizers), 완충용액들 (예로, 차단 완충용액 또는 용해 완충용액) 등과 같이 포함될 수 있다. 이러한 키트는 바이알들, 튜브들 등과 같은 하나 이상의 용기들 (containers)을 수용하도록 구분되어진 저장용기 (receptacle)를 포함할 수 있고, 이러한 용기들은 본 발명의 별도의 요소들을 보관한다. 예를 들어, 하나의 용기는 불용성 또는 부분적으로 수용성 담체에 결합된 첫 번째 항체를 포함할 수 있다. 두 번째 용기는 냉동건조된 형태로 또는 용액에 넣어 수용성, 검출가능하게-표지된 두 번째 항체를 포함할 수 있다. 또한 저장용기는 냉동건조된 형태로 또는 용액에 넣어 수용성, 검출가능하게 표지된 세 번째 항체를 보관하는 세 번째 용기도 포함할 수 있다. 이러한 성질의 키트는 본 발명의 샌드위치 검정법에 사용될 수 있다. 라벨 또는 포장 삽입물은 조성물의 기술내용 뿐만 아니라 의도된 시험관내 또는 진단적 용도를 위한 설명서들을 제공할 수 있다.
다양한 반응시약들의 상대적 양들은 검정법의 민감도를 실질적으로 최적화하는 반응시약들의 용액 농도를 제공하도록 광범위하게 달라질 수 있다. 상세하게, 반응시약들은, 용해 시 적절한 농도를 가지는 반응시약 용액을 제공할 부형제들을 포함하는 건조 파우더, 보통 냉동건조된 형태로 제공될 수 있다.
본 발명의 좀 더 나아간 관점에서, 본 명세서에서 가세하게 기술된 바와 같은 모노클론 항체들 또는 그들의 결합 단편들이 검출가능한 소부분으로 표지되어 제공되어, 예를 들어 상기 언급된 항원을 가지는 세포들을 진단하거나 확인하도록 키트들로 포장되고 사용된다. 이러한 표지들의 비-제한적인 예로는 플루오레신 이소티오시아네이트와 같은 형광단들, 발색단들, 방사성 핵종들, 또는 효소들을 포함한다. 이러한 표지된 항체들 또는 결합 단편들은, 예를 들어 항원의 조직학적 정착, 엘라이자, 세포 선별 (cell sorting), 뿐만 아니라 cMet, 및 본 항원 본 항원을 보유하는 세포들을 검출하거나 정량하는 다른 면역학적 기법들에 사용될 수 있다.
또한 세포사멸 검정법 (apoptosis assay)들의 양성 대조군으로서 유용한 키트들이 세포들로부터 나온 cMet의 정제 또는 면역침전을 위해 제공된다. cMet의 분리 및 정제를 위해, 키트들은 비드들을 (예로, 세파로스 비드들) 결합시킨 본 명세서에서 기술된 항체들 또는 그들의 항원 결합 단편들을 포함할 수 있다. cMet의 시험관내에서, 예로 엘라이자 또는 웨스턴 블럿으로 검출 및 정량을 위한 항체들을 포함하는 키트들이 제공될 수 있다. 제조의 문헌을 참조하여, 키트들은 용기 및 라벨 또는 용기와 연관된 포장 삽입물을 포함한다. 용기는 적어도 하나의 본 발명의 항-cMet 항체 또는 그의 결합 단편을 포함하는 조성물을 보관한다. 예로, 희석제들, 완충용액들 및 대조군 항체들을 포함하는 추가적인 용기들이 포함될 수 있다. 라벨 또는 포장 삽입물은 조성물의 기술내용 뿐만 아니라 의도된 시험관내 또는 진단적 용도를 위한 설명서들을 제공할 수 있다.
보다 상세하게, 본 발명은 당업자가 숙지하고 있는 방법이라면 모두에 의해 종양의 cMet 상태의 결정을 위한 키트에 관한 것이다. 바람직한 구현예에서, 실시예에서 기술될 바와 같이, 본 발명은 IHC 방법들에 의해 종양의 cMet 상태의 결정을 위한 키트에 관한 것이다.
상세한 구현예에서, 본 발명은 상기 기술된 바와 같이 적어도 하나의 항-c-Met 항체, 또는 그의 기능적 단편 또는 유도체를 포함하는 키트로 구성되고, 바람직하게 상기 항체는 표지된다.
표지 방법이라면 모두가, 예를 들어 상기 언급된 표지들의 사용과 같이 당업자에 의해 사용될 수 있는 것으로 이해되어야 한다.
바람직한 구현예에서, 본 발명에 따른 키트는 좀 더 나아가 상기 항-c-Met 항체 및 c-Met 간의 결합 정도를 검출하는 데 유용한 반응시약을 포함하는, 개체에서 c-Met을 발현하는 종양의 존재 및/또는 위치를 시험관내에서 검출하는 데 유용한 것이다.
또 다른 바람직한 구현예에서, 본 발명의 키트는 좀 더 나아가 상기 항-c-Met 항체 및 c-Met 간의 결합 수준을 정량하는 데 유용한 반응시약을 포함하는, c-Met을 발현하는 종양에서 c-Met의 발현 수준을 시험관내에서 결정하는 데 유용한 것이다.
보다 또 다른 구현예에서, 본 발명의 키트는 좀 더 나아가
i) 상기 항-c-Met 항체 및 c-Met 간의 결합 정도를 검출하는 데 유용한 반응시약; 또한
ii) c-Met 발현 수준을 점수 매기는 데 유용한 양성 및 음성 대조군 시료들:
을 포함하는, 종양의 c-Met 상태를 시험관내에서 결정하는 데 유용한 것이다.
상기 종양의 c-Met 상태를 시험관내에서 결정하는 키트는 좀 더 나아가 마우스 항체들에 특이적인 폴리클론 항체를 포함하고, 바람직하게 상기 마우스 항체들에 특이적인 폴리클론 항체는 표지된다.
본 발명의 다른 특징들 및 장점들은 실시예들의 기술내용 및 하기 도면의 설명들이 나타나 있는 도면들과 연속하여 기술된다.
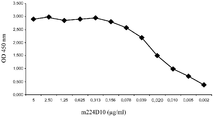
도 1A 및 1B는 m224D10 Mab 항체에 의한 c-Met의 인식을 엘라이자 (ELISA) (도 1A) 및 FACS (도 1B)로 나타낸 것이다.
도 2는 [125I]-HGF 결합 저해 실험들을 나타낸 것이다. 전체 특이적 [125I]-HGF 결합 (%)은 반로그 (semilog) 그래프 상에 리간드 농도의 함수로서 좌표 표시되었다. 특이적 결합 수치들은 세 번 수행된 시험들의 평균값들이다.
도 3A 및 3B는 이소형 대조군 (도 3A) 및 m224D10 Mab (도 3B)로 염색된 U87-MG 이종이식된 종양들로부터 나온 파라핀에 함몰된 절편들의 IHC 분석을 나타낸 것이다.
도 4는 m221C9 Mab 항체에 의한 c-Met의 인식을 FACS로 나타낸 것이다.
도 5A 및 5B는 고정된 이중체 (A) 및 단일체 (B) c-Met 단백질 상의 221C9 Mab 항체의 역가 측정 곡선을 나타낸 것이다.
도 6은 다양한 수준들의 cMet을 발현하는 유방 (A) 및 위장 (B) 종양 조직들로부터 나온 파라핀에 함몰된 절편들의 m224D10 항체를 사용한 IHC 염색을 나타낸 것이다.
도 7은 다양한 수준들의 cMet을 발현하는 유방 (A) 및 위장 (B) 종양 조직들로부터 나온 파라핀에 함몰된 절편들의 m221C9 항체를 사용한 IHC 염색을 나타낸 것이다.
도 8은 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 (flowcell) 상에서 201.7 RU의 포획된 c-Met-Fc 상의 Mabs 11E1 및 224D10의 연속적 주입의 센서그램 (sensorgram)을 나타낸 것이다.
도 9는 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 상에서 203.4 RU의 포획된 c-Met-Fc 상의 Mabs 224G11 및 224D10의 연속적 주입의 센서그램을 나타낸 것이다.
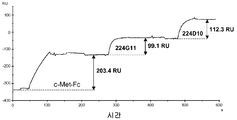
도 10은 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 상에서 203.6 RU의 포획된 c-Met-Fc 상의 Mabs 5D5 및 224D10의 연속적 주입의 센서그램을 나타낸 것이다.
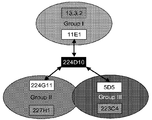
도 11은 7개의 항-cMet 항체들의 에피토프 맵핑 계획을 나타낸 것이다. 화살표는 본 연구를 위해 수행된 세 가지 실험들을 표시한다. 회색 네모는 224D10으로 테스트되지 않았던 항체들을 표시한다.
도 12는 m221C9 Mab를 사용한 HGF 경쟁 검정법을 나타낸 것이다.
도 1A 및 1B는 m224D10 Mab 항체에 의한 c-Met의 인식을 엘라이자 (ELISA) (도 1A) 및 FACS (도 1B)로 나타낸 것이다.
도 2는 [125I]-HGF 결합 저해 실험들을 나타낸 것이다. 전체 특이적 [125I]-HGF 결합 (%)은 반로그 (semilog) 그래프 상에 리간드 농도의 함수로서 좌표 표시되었다. 특이적 결합 수치들은 세 번 수행된 시험들의 평균값들이다.
도 3A 및 3B는 이소형 대조군 (도 3A) 및 m224D10 Mab (도 3B)로 염색된 U87-MG 이종이식된 종양들로부터 나온 파라핀에 함몰된 절편들의 IHC 분석을 나타낸 것이다.
도 4는 m221C9 Mab 항체에 의한 c-Met의 인식을 FACS로 나타낸 것이다.
도 5A 및 5B는 고정된 이중체 (A) 및 단일체 (B) c-Met 단백질 상의 221C9 Mab 항체의 역가 측정 곡선을 나타낸 것이다.
도 6은 다양한 수준들의 cMet을 발현하는 유방 (A) 및 위장 (B) 종양 조직들로부터 나온 파라핀에 함몰된 절편들의 m224D10 항체를 사용한 IHC 염색을 나타낸 것이다.
도 7은 다양한 수준들의 cMet을 발현하는 유방 (A) 및 위장 (B) 종양 조직들로부터 나온 파라핀에 함몰된 절편들의 m221C9 항체를 사용한 IHC 염색을 나타낸 것이다.
도 8은 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 (flowcell) 상에서 201.7 RU의 포획된 c-Met-Fc 상의 Mabs 11E1 및 224D10의 연속적 주입의 센서그램 (sensorgram)을 나타낸 것이다.
도 9는 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 상에서 203.4 RU의 포획된 c-Met-Fc 상의 Mabs 224G11 및 224D10의 연속적 주입의 센서그램을 나타낸 것이다.
도 10은 항-태그-His 항체에 의해 활성화된 CM5 센서칩의 플로우셀 2 상에서 203.6 RU의 포획된 c-Met-Fc 상의 Mabs 5D5 및 224D10의 연속적 주입의 센서그램을 나타낸 것이다.
도 11은 7개의 항-cMet 항체들의 에피토프 맵핑 계획을 나타낸 것이다. 화살표는 본 연구를 위해 수행된 세 가지 실험들을 표시한다. 회색 네모는 224D10으로 테스트되지 않았던 항체들을 표시한다.
도 12는 m221C9 Mab를 사용한 HGF 경쟁 검정법을 나타낸 것이다.
실시예 1: 진단적 목적에 사용될 수 있는 cMet에 대한 항체들의 생산 및 선별
- 면역접종 단계
항-c-Met 항체를 생산하기 위하여, 8주령 된 BALB/c 마우스가 c-Met을 세포질 막 (plasma membrane) 상에 발현하는 형질전환된 CHO 세포주를 사용하여 (20 x 106 세포/용량/마우스) 3 내지 5회 면역접종되고, c-Met 세포외 도메인 융합 단백질 (10 - 15 μg/용량/마우스) (R & D 시스템사, 카탈로그 #358MT) 또는 이 재조합 단백질의 단편이 첫 번째 면역화를 위한 완전 프런드 아주반트 (complete Freund adjuvant) 또한 이후 면역화를 위한 비완전 프런드 아쥬반트와 혼합되어 2 내지 3회 피하로 면역화되었다. 마우스가 CHO-c-Met 세포 및 재조합 단백질 둘 다를 받는 혼합된 프로토콜들도 역시 수행되었다. 세포 융합 3일 이전에 마우스는 재조합 단백질 또는 단편을 사용하여 복강내 (i.p.)로 또는 정맥내 (i.v.)로 추가자극 (boost)되었다. 그 다음 마우스의 비장이 채취되었고 SP2/0-Ag14 마이엘로마 세포 (ATCC)에 융합되었으며 HAT 선별이 착수되었다. 4번의 융합이 실시되었다. 일반적으로, 모노클론 항체 또는 그들의 기능적 단편, 특히 마우스 기원의 것을 제조하기 위해, "항체들 (Antibodies)" 매뉴얼에 상세하게 기술되어 있는 기법 (Harlow and Lane, 항체들: 실험실 매뉴얼 (Antibodies: A Laboratory Manual), 콜드 스프링 하버 연구소 (Cold Spring Harbor Laboratory), Cold Spring Harbor NY, pp.726, 1988) 또는 코흘러 및 밀스타인에 의해 기술된 하이브리도마 제조의 기법 (Kohler and Milstein, Nature, 256:495-497, 1975)을 참조하는 것이 가능하다.
- 224D10에 대한 검색 단계
획득된 하이브리도마는 처음에 cMet 재조합 단백질 상에서 엘라이자에 의해 검색되었다. 간략하게, 재조합 인간 c-Met-Fc 단백질 (R & D 시스템사)은 이뮬론사 Ⅱ (Immunon Ⅱ) 96-웰 플레이트들에 4℃에서 하룻밤 동안 코팅되었고, 0.5% 젤라틴 용액으로 블록킹 단계 1시간 이후에, m224G10의 용량 범위가 추가 1시간 동안 37℃에서 첨가되었다. 다음으로 플레이트들은 세척되었고 염소 항-마우스 특이적 HgG HRP (잭슨사)가 37℃에서 1시간 동안 첨가되었다. 반응 현상은 TMB 기질 용액을 사용하여 수행되었다. 다음으로 생산된 항체들이 종양 세포들 상에서 고유의 수용체도 역시 인식할 수 있을 것이라는 사실을 입증하도록 두 번째 검색이 c-Met을 적당한 내지 높은 수준으로 발현하는 A549 및 NCI-H441 세포주들 상에서 FACS 분석에 의해 수행되었다. 본 목적으로, 2 x 106개의 세포들이 미결합된 224D10 Mab 또는 9G4 (IgG1 이소형 대조군 Mab) 둘 중 하나의 농도 범위에서 4℃로 20분 동안 배양되었다. 1% BSA 및 0.01% NaN3가 보충된 인산-완충된 식염수 (PBS)로 3번 세척한 이후에, 세포들은 두 번째 항체 염소 항- 마우스 알렉사 488 (1/500 희석)으로 4℃에서 20분 동안 배양되었다. 1% BSA 및 0.1% NaN3가 보충된 PBS로 3번 세척한 이후에, 세포들은 FACS (팩스칼리버, 벡튼-디킨슨사)에 의해 분석되었다. 적어도 5,000개의 세포들이 형광 강도의 평균 수치를 계산하도록 평가되었다.
이들 2번 테스트들 상에서 양성 반응인자들은 증폭되었고, 클론되었으며 하이브리도마 한 벌이 회수되었고 정제되었으며 방사성 표지된 HGF와의 경쟁의 결여로 검색되었다. 따라서 진단적 항체는 보통 환자의 선별 및 치료적 항체로 치료된 환자들에서 표적된 수용체의 행동을 추적하는 바이오마커로서 둘 다 필요하다. 이러한 후자의 관점에서, 고려해야 할 주요한 판정기준은 진단적 항체가 치료적 항체에 의해 인식되는 것과는 다른 에피토프에 결합해야 하는 점이다. 성장인자 수용체에게로 유도되는 치료적 항체를 중화하기 위한 한 가지 목표는 리간드 결합을 저해하는 것이다. 본 측면에서, 진단적 항체의 선택 동안, 리간드 결합을 간섭하지 않는 것들이 선택될 수 있다. 본 특성을 테스트하기 위하여, 방사성 표지된 HGF를 사용하는 항체들의 경쟁 검정법이 설정되었다. 간략하게, 프로테인 A 플래쉬플레이트 (FlashPlate) 96-웰 마이크로플레이트들 (퍼킨 엘머사)이 재조합 c-Met-Fc 단백질 (R & D 시스템사)로 4℃에서 하룻밤 동안 코팅되기 이전에, PBS에 넣은 0.5% 젤라틴으로 (상온에서 2시간) 블록킹되었다. 남아있는 자유 프로테인 A는 좀 더 나아가 부적절한 hIgG를 사용하여 상온에서 2시간 동안 포화시켰다. 플레이트들은 각 단계 이후에 PBS로 세척되었다. 경쟁 검정법을 위해, 고정된 c-Met에 200 pM에서 [125I]-HGF (특이적 활성 ~ 2,000 Ci/mmol)의 결합이 테스트될 항-c-Met 모노클론 항체 또는 HGF (R & D 시스템사) 둘 중 하나를 PBS pH 7.4에 넣어 0.1 pM로부터 1μM까지의 범위에 이르는 다양한 농도들의 존재 시 측정되었다. HGF를 치환하는 그들의 능력이 알려져 있는 항체들 (224G11, 11E1 및 5D5)은 실험들의 양성 대조군들로서 도입되었다. 5D5 Mab는 제넨테크사 (Genentech)에 의해 생산된 항체이고 ATCC에서 하이브리도마로서 입수가능하다. 9G4로서 기술되는 마우스 IgG1은 이소형 대조군으로서 사용되었다. 다음으로 플레이트들은 상온에서 6시간 동안 배양되었고 패커드 탑 카운트 마이크로플레이트 섬광 계수기 (Packard Top Count Microplate Scintillation Counter) 상에서 계수되었다. 비특이적 결합은 1 μM의 HGF의 존재 시 결정되었다.
마지막으로, 상기 기술된 3가지 판정기준들을 만족시켰던 Mabs는 [i) 엘라이자 테스트에서 c-Met 인식, ii) 고유의 c-Met 상의 인식 또한 iii) 방사성 표지된 리간드와 경쟁 없음] c-Met을 발현하는 종양 이종이식으로부터 파라핀에 함몰된 절편들 상의 최종 c-Met 인식 테스트를 위해 선별되었다. 본 평가를 위해, U87-MG 이종이식들로부터 나온 종양 절편들은 파라핀이 제거되었고, 재수화되었으며, 표적 복구 완충용액 1x (다코사 S1699)을 넣어 끓이는 수조에 98℃로 놓아두었고 열-유도성 에피토프 복구를 위해 98℃에서 30분 다음으로 표적 복구 완충용액에서 추가 30분 동안 두었다. 트리스 완충용액 식염수 - 0.05% 트윈 20 (TBS-T) (다코사 S3006)로 3번 세척한 이후에, 내인성 퍼옥시다제 활성이 퍼옥시다제 블록킹 반응시약 (다코사 K4007)을 사용하여 5분 동안 블록킹되었다. 절편들은 TBS-T로 세척되었고, 테스트될 c-Met 마우스 모노클론 항체 (5 μg/mL)의 첨가 이전에 블록킹 반응시약 (울트라V 블록-TA-125UB 랩 비전사)으로 5분 동안 배양되었다. 마우스 IgG1/카파 (5 μg/mL, 다코사 X0931)가 음성 대조군으로서 사용되었다. 다음으로 절편들은 4℃에서 하룻밤 동암 배양되었고 TBS-T로 세척되었으며 바이오틴화된 링크 유니버설 (link universal) (LSAB+, 다코사 K0679)로 15분 동안 상온에서 배양되었다. TBS-T로 세척한 이후에, 절편들은 스트렙트아비딘-퍼옥시다제 복합체 유니버설 (LSAB+, 다코사 K0679)로 추가 15분 동안 배양되었다. 디아미노벤지딘이 갈색 반응 산물의 현상에 사용되었다.
한 벌의 융합들을 이어서, 마우스 224D10 (m224D10) 항체가 c-Met 양성 종양들의 진단을 위한 후보로서 확인되었다. 도 1에 예시된 바와 같이 m224D10은 엘라이자 검정법 (도 1A) 또한 c-Met을 발현하는 것으로 알려져 있는 A549 및 NCI-H441 세포주들의 표면 (도 1B) 둘 다에서 c-Met을 인식할 수 있다.
다음으로 m224D10은 방사성 표지된 HGF-치환 테스트에서 테스트되었다. 도 2에서, 전체 특이적 [125I]-HGF 결합의 백분율은 반로그 그래프 상에 리간드 농도의 함수로서 좌표 표시되었고, 방사성 리간드 결합을 50% 저해하는 데 필요한 다양한 저해제들의 농도 (IC50)가 획득된 S자 (sigmoid) 경쟁 곡선으로부터 그래프적으로 결정되었다. 예상된 바와 같이, 비-방사성 표지된 HGF는 고정된 c-Met에 [125I]-HGF 결합을 완전하게 치환시킬 수 있었던 반면, 대조군 9G4는 HGF 차단 활성을 보여주지 않았다. 양성 대조군으로서 사용된 항-c-Met Mabs 224G11, 11E1 및 5D5는 고정된 c-Met에 [125I]-HGF 결합을 각각 3.6 nM, 42 nM 및 4.4 mM의 IC50 수치들로 저해할 수 있었다. Mab m224D10은 [125I]-HGF를 치환시킬 수 없었으며 면역조직화학 (IHC) 연구들을 위해 선택되었다.
도 3B에 보여준 결과들은 m224D10 Mab가 c-Met 표적된 치료법에 특정하게 민감한 것으로 알려져 있는 U87-MG 이종이식된 종양들 상에 c-Met을 인식할 수 있는 것을 전시하였다. 예상된 바와 같이, IgG1 이소형 대조군으로는 염색이 전혀 관찰되지 않았다 (도 3A). 이들 결과들을 근거로 하여, 실험들이 224D10 Mab가 종양들 상에서 c-Met을 점수 매기는 데 사용될 수 있는지 여부를 결정하도록 설정되었다.
- 224C9에 대한 검색 단계
획득된 하이브리도마는 처음에 이중체 또는 단일체 cMet 재조합 단백질 상에서 엘라이자에 의해 검색되었다. 간략하게, 재조합 인간 c-Met (이중체 또는 단일체) 단백질들 (R & D 시스템사)은 이뮬론사 Ⅱ (Immunon Ⅱ) 96-웰 플레이트들에 4℃에서 하룻밤 동안 코팅되었고, 0.5% 젤라틴 용액으로 블록킹 단계 1시간 이후에, 순수한 하이브리도마 상청액이 추가 1시간 동안 37℃에서 첨가되었다. 다음으로 플레이트들은 세척되었고 염소 항-마우스 특이적 HgG HRP (잭슨사)가 37℃에서 1시간 동안 첨가되었다. 반응 현상은 TMB 기질 용액을 사용하여 수행되었다. 다음으로 생산된 항체들이 종양 세포들 상에서 고유의 수용체도 역시 인식할 수 있을 것이라는 사실을 입증하도록 두 번째 검색이 c-Met을 적당한 내지 높은 수준으로 발현하는 A549 및 NCI-H441 세포주들 상에서 FACS 분석에 의해 수행되었다. 본 목적으로, 2 x 106개의 세포들이 10 μg/mL의 221C9 Mab 또는 m10D9 (IgG1 이소형 대조군 Mab)로 4℃로 20분 동안 배양되었다. 1% BSA 및 0.01% NaN3가 보충된 인산-완충된 식염수 (PBS)로 3번 세척한 이후에, 세포들은 두 번째 항체 염소 항- 마우스 알렉사 488 (1/500 희석)으로 4℃에서 20분 동안 배양되었다. 1% BSA 및 0.1% NaN3가 보충된 PBS로 3번 세척한 이후에, 세포들은 FACS (팩스칼리버, 벡튼-디킨슨사)에 의해 분석되었다. 적어도 5,000개의 세포들이 형광 강도의 평균 수치를 계산하도록 평가되었다.
이들 2번 테스트들 상에서 양성 하이브리도마들은 증폭되었고, 클론되었으며 이소형이 결정되어 증식되었다. 다음으로 새로운 하이브리도마 상청액들이 수집되었다. 그들의 IgG 함량이 결정되었다. 상보성 세포측정법 분석 (complementary cytometry analysis)이 5가지 인간 종양 세포주들 (A549, BXPC3, MCF7, U87MG, 및 HepG2)의 패널 상에서 수행되었다. 이들 세포주 모두는 ATCC에 의해 공급되었다. 획득된 결과는 도 4에 나타나 있고 MFI 수치들은 하기 본 명세서에서 표 6으로 나타나있다.
| 5가지 인간 종양 세포주들 (ATCC) 상에서 221C9 Mab으로 수행된 세포측정 분석법 (MFI)로부터 나온 결과들 |
|||||
| A549 | BXPC-3 | MCF7 | U87MG | HepG2 | |
| 세포 만 | 13.98 | 11.87 | 9.87 | 9.10 | 10.52 |
| 이차 항체 | 11.98 | 13.23 | 11.10 | 11.20 | 15.85 |
| 이소형 대조군 | 11.83 | 14.77 | 12.06 | 11.56 | 18.12 |
| 221C9 | 243.59 | 375.57 | 31.95 | 71 | 233.58 |
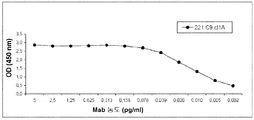
상보성 실험들은 정제된 221C9 항체를 사용하여 시행되었다. 먼저 단일체 c-Met 단백질 및 이중체 c-Met 단백질 둘 다 상에서 항체 역가 측정이 수행되었다.
역가 측정 곡선들은 도 5에 나타나있다. c-Met 수용체 형태들의 유사한 친화도가 관찰되었다. 이들 엘라이자를 수행하기 위하여, 인간 이중체 c-Met 단백질 (R & D 시스템사, 카탈로그 번호 358MT)이 PBS에서 0.25 μg/mL의 농도로 4℃에서하룻밤 동안 코팅된다. 0.5% 젤라틴 용액을 사용하여 37℃에서 2시간 동안 플레이트들 (코스타사, #3690)을 포화시킨 이후에, 하이브리도마 상청액들이 37℃에서 1 시간 동안 배양되었다. 일단 PBS로 헹구고, 항-마우스 HRP 항체 (잭슨 이뮤노리서치사, 카탈로그 번호 115-035-164)가 각 웰에 엘라이자 완충용액 (PBS에 넣은 0.1% 젤라틴/0.05% 트윈 20)에 1/5000 희석으로 첨가되고 플리이트는 37℃에서 1시간 동안 배양된다. PBS로 3번 세척한 이후에, 퍼옥시다제의 활성이 50 μl의 TMB 기질 (웁티마사)의 첨가에 의해 드러난다. 반응이 일어나도록 상온에서 5분 동안 방치된다. 반응은 50 μL/웰의 1 M H2SO4 용액의 첨가에 의해 정지되고 450 nm에서 플레이트 리더 상에서 결과를 읽는다. 동일한 종류의 프로토콜이 단일체 c-Met 상에서도 수행되었지만 본 경우에는 단백질이 5 μg/mL로 코팅되었다.
마지막으로, 221C9 Mab는 상기 기술된 2가지 판정기준들 (i) 엘라이자 테스트에서 c-Met 인식, (ii) 인간 종양 세포주들의 표면 상에서 발현된 고유의 c-Met 상의 결합을 만족시켰다.
실시예 2: m224D10 및 m221C9 Mabs를 사용한 c-Met 발현에 대한 조직들의 점수 매기기
상기 기술된 프로토콜을 사용하여, 다양한 수준들의 c-Met을 발현하는 한 벌의 파라핀-함몰된 인간 종양 조직들이 m224D10 및 m221C9 Mabs로 각각 염색되었다.
m224D10의 경우 도 6에 또한 m221C9 Mab의 경우 도 7에 보여준 결과들은 두 가지 종양 유형들에서 m224D10 및 m221C9 둘 다가 c-Met의 다양한 수준들로 인간 종양들을 구별할 수 있는 것을 확인하였다. 이들 항체들을 사용하여, 종양들은 다음과 같이 점수가 매겨질 수 있다:
- 0 또는 음성: 막 염색이 전혀 없거나 10% 이하의 막 양성 세포가 관찰되었던 음성 종양들,
- 1+: 10% 이상의 종양 세포들에서 희미하게 감지가능한 염색,
- 2+: 10% 이상의 종양 세포들에서 관찰된 적당한 완전 막 염색,
- 3+: 10% 이상의 종양 세포들에서 강한 완전 막 염색.
실시예 3: 224D10 경쟁 실험들
상기에 이미 기술된 바와 같이, 진단적 Mab도 또한 표적된 수용체의 저하 조절을 유도하는 치료적 항체들을 위한 "반응 마커 (response marker)"로서 사용될 수 있었다. 본 관점에서, 혈액 또는 생검 제거가 치료된 환자들에서 수행되었고 c-Met 상태에 대해 분석될 수 있었다. 본 목적으로, 사용될 진단적 항체가 치료적 항체에 의해 표적된 것과는 서로 다른 에피토프를 인식해야 한다. 치료적 항체는 보통 HGF를 치환시킬 수 있기 때문에, 리간드 치환을 위해 경쟁하지 않는 진단적 항체의 선택이 모든 치료적 Mabs의 경우에서 반응 마커로서 도움이 될 수 있었다.
본 실시예에서, 224D10 및 많은 치료적 Mabs 간의 경쟁 실험들이 224D10이 반응 마커로서 사용될 수 있었던 점을 보여주도록 수행되었다.
치료적 항-c-Met Mabs 11E1, 227H1, 224G11 및 하나의 팔을 가지고 ATCC에서 하이브리도마로서 시판되는 5D5의 마우스 형태인 5D5 Mab가 비아코아 (biacore) 실험으로 연구되었다. 간략하게, CM5 센서칩이 항-폴리히스티딘 Mab를 공급자의 설명서에 따라 아민 커플링 키트를 사용하여 공유적으로 결합시켜 플로우셀 1 및 2 상에서 활성화되었다. 작동 완충용액 (running buffer)은 HBS-EP 완충용액이다. 실험들은 30 μL/분의 유속으로 25℃에서 수행된다. HGF-R/Fc 키메라 단백질이 작동 완충용액에서 10 μg/mL의 농도로 사용되고 플로우셀 2 위에 1분 동안 주입되었다. 전형적으로, 대략 190 RU의 c-Met-Fc가 포획되었다. 플로우셀 1은 Mabs의 비-특이적 결합의 추정을 위한 기준으로서 작용한다. 첫 번째 Mab (20 μg/mL)가 플로우셀 둘 다 상에 2분 동안 주입된다. 다음으로 두 번째 Mab (20 μg/mL)가 플로우셀 둘 다 상에 2분 동안 주입된다. 차별적인 Fc2-Fc1 공명 신호가 기록된다. 각 순환의 마지막에, 센서칩은 둘 다의 플로우셀 상에 1/2 분 동안 글리신 pH 1.5 재생 완충용액의 주입으로 c-Met 및 Mabs 단백질들을 제거하여 재생되었다.
첫 번째 실험은 첫 번째 항체로서 11E1 또한 두 번째 항체로서 224D10를 사용하여 수행된다 (도 8을 참조하라). 본 실험은 11E1 및 224D10이 c-Met-Fc 분자의 표면에서 두 가지의 분리된 에피토프 부위와 결합하는 것을 보여준다. 두 번째 실험은 첫 번째 항체로서 224G11 또한 두 번째 항체로서 224D10를 사용하여 수행된다 (도 9를 참조하라). 본 실험은 224G11 및 224D10이 역시 두 가지의 분리된 (distant) 부위와 결합하는 것을 보여준다. 세 번째 실험은 첫 번째 항체로서 5D5 또한 두 번째 항체로서 224D10를 사용하여 수행된다 (도 10을 참조하라). 다시 한 번 본 실험은 5D5 및 224D10이 두 가지의 분리된 부위와 결합하는 것을 보여준다. 결론적으로, 224D10은 11E1, 224G11 및 5D5의 결합 부위들의 c-Met 분자 상에 분리된 부위에 결합하고 있다. 동일한 종류의 비아코아 프로토콜로 획득된 예비적인 결과가 파이저사 (Pfizer)로부터 나온 13.3.2 항-c-Met 항체가 11E1과 동일한 에피토프 맵핑 그룹에 속하는 것을 보여주었기 때문에 (도 11), 우리는 224D10 및 13.3.3이 본 조합이 테스트되지 않더라도 동일한 c-Met 분자 상에 동시에 결합할 수 있는 것을 의심할 수 있다. 유사하게 224G11과 동일한 에피토프 그룹에 속하는 227H1의 경우도 (도 11), 227H1 및 224D10 항체들 둘 다가 c-Met에 동시에 결합할 수 있었을 것이다. 마지막으로, D5D와 동일한 에피토프 맵핑 그룹에 속하는 223C4 (도 11)는 224D10과 동시에 c-Met에 결합할 수 있을 것 같다.
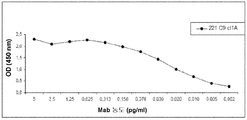
실시예 4: 221C9 항체의 존재 시 수행된 HGF 경쟁 실험들
진단적 Mabs를 좀 더 특성분석하기 위하여, HGF 결쟁 검정법들이 수행되었다. 먼저 테스트될 Mab가 존재 시 또는 부재 시 c-Met 단백질을 포함하는 반응 혼합물이 별도의 포화된 (PBS 1x에 넣은 0.5% 젤라틴) 플레이트 상에 제조된다. 마우스 항체들 (기준들 및 연구될 Mabs)의 일련의 1 : 2 희석들 (12개 컬럼 상에 40 μg/mL로부터 시작됨)이 수행된다. 다음으로, 엘라이자 희석액 (PBS 1x에 넣은 0.5% 젤라틴, 0.05% 트윈 20)만을 포함하는 음성 대조군 주를 제외하고, rh c-Met-Fc 단백질의 0.8 μg/mL이 첨가된다 (R & D 시스템사, 참조번호 358-MT/CF). 균질화 이후에, 경쟁 시료들이 PBS에 0.3 μg/mL rhHGF 용액을 가진 HGF-코팅된 플레이트들 상에 로딩된다 (R & D 시스템사, 참조번호 294-HGN/CF). 배양 및 여러 번의 세척 이후에, 결합된 c-Met 단백질들이 염소 항-인간 IgG-HRP (잭슨사, 참조번호 109-035-098)을 사용하여 검출된다. 일단 결합되면, TMB 기질에 플레이트들에 첨가된다. 반응은 H2SO4 산 용액의 첨가에 의해 정지되고 획득된 광학 밀도들을 마이크로플레이트 리더 (microplate reader) 기기를 사용하여 450 nm에서 읽는다.
실험은 c-Met-Fc 재조합 단백질의 존재 시 또는 부재 시 221C9를 사용하여 수행된다 (도 12를 참조하라). 본 실험은 221C9가 그의 고정된 리간드 수용체 상에서의 c-Met 결합과 경쟁할 수 있는 것을 보여준다. 그러나 20 μg/mL의 221C9의 존재 시 c-Met의 단지 부분적 결합만이 관찰된다.
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> ANTI-cMET ANTIBODY AND ITS USE FOR THE DETECTION AND THE
DIAGNOSTIC OF CANCER.
<130> D27752
<140> PCT/EP2010/062271
<141> 2010/08/23
<150> EP 09305777.6
<151> 2009-08-21
<150> US 61/235,864
<151> 2009-08-21
<150> US 61/348,005
<151> 2010-05-25
<160> 60
<170> PatentIn version 3.3
<210> 1
<211> 5
<212> PRT
<213> mus musculus
<400> 1
Thr Ser Ala Tyr Phe
1 5
<210> 2
<211> 7
<212> PRT
<213> mus musculus
<400> 2
Ile Asn Tyr Asp Gly Thr Asn
1 5
<210> 3
<211> 6
<212> PRT
<213> mus musculus
<400> 3
Asp Arg Thr Phe Ala Tyr
1 5
<210> 4
<211> 6
<212> PRT
<213> mus musculus
<400> 4
Gln Arg Ile Tyr Asn Tyr
1 5
<210> 5
<211> 3
<212> PRT
<213> mus musculus
<400> 5
Tyr Ala Ser
1
<210> 6
<211> 9
<212> PRT
<213> mus musculus
<400> 6
Gln Gln Ser Asn Ser Trp Pro Leu Thr
1 5
<210> 7
<211> 9
<212> PRT
<213> mus musculus
<400> 7
Gly Tyr Ser Ile Thr Ser Ala Tyr Phe
1 5
<210> 8
<211> 8
<212> PRT
<213> mus musculus
<400> 8
Thr Arg Asp Arg Thr Phe Ala Tyr
1 5
<210> 9
<211> 7
<212> PRT
<213> mus musculus
<400> 9
Thr Ser Ala Tyr Phe Trp Ser
1 5
<210> 10
<211> 16
<212> PRT
<213> mus musculus
<400> 10
Phe Ile Asn Tyr Asp Gly Thr Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 11
<211> 11
<212> PRT
<213> mus musculus
<400> 11
Arg Ala Ser Gln Arg Ile Tyr Asn Tyr Leu His
1 5 10
<210> 12
<211> 7
<212> PRT
<213> mus musculus
<400> 12
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 13
<211> 115
<212> PRT
<213> mus musculus
<400> 13
Asp Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr Ser Ala
20 25 30
Tyr Phe Trp Ser Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Phe Ile Asn Tyr Asp Gly Thr Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Arg Leu Asn Ser Val Thr Thr Asp Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Arg Asp Arg Thr Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 14
<211> 107
<212> PRT
<213> mus musculus
<400> 14
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Arg Ile Tyr Asn Tyr
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Ile Leu Thr Ile Asn Ser Val Glu Thr
65 70 75 80
Glu Asp Phe Gly Met Tyr Phe Cys Gln Gln Ser Asn Ser Trp Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
100 105
<210> 15
<211> 15
<212> DNA
<213> mus musculus
<400> 15
accagtgctt atttc 15
<210> 16
<211> 21
<212> DNA
<213> mus musculus
<400> 16
ataaactacg acggtaccaa t 21
<210> 17
<211> 18
<212> DNA
<213> mus musculus
<400> 17
gatcggacct ttgcttat 18
<210> 18
<211> 18
<212> DNA
<213> mus musculus
<400> 18
caaagaattt acaactac 18
<210> 19
<211> 9
<212> DNA
<213> mus musculus
<400> 19
tatgcttcc 9
<210> 20
<211> 27
<212> DNA
<213> mus musculus
<400> 20
caacagagta acagctggcc tctcacg 27
<210> 21
<211> 27
<212> DNA
<213> mus musculus
<400> 21
ggctactcca tcaccagtgc ttatttc 27
<210> 22
<211> 24
<212> DNA
<213> mus musculus
<400> 22
acaagagatc ggacctttgc ttat 24
<210> 23
<211> 21
<212> DNA
<213> mus musculus
<400> 23
accagtgctt atttctggag c 21
<210> 24
<211> 48
<212> DNA
<213> mus musculus
<400> 24
ttcataaact acgacggtac caataactac aacccatctc tcaaaaat 48
<210> 25
<211> 33
<212> DNA
<213> mus musculus
<400> 25
agggccagtc aaagaattta caactaccta cac 33
<210> 26
<211> 21
<212> DNA
<213> mus musculus
<400> 26
tatgcttccc agtccatctc t 21
<210> 27
<211> 345
<212> DNA
<213> mus musculus
<400> 27
gatctacagc ttcaggagtc aggacctggc ctcgtgaaac cttctcagtc tctgtctctc 60
acctgctctg tcactggcta ctccatcacc agtgcttatt tctggagctg gatccggcag 120
tttccaggaa acaaactgga atggatgggc ttcataaact acgacggtac caataactac 180
aacccatctc tcaaaaatcg aatctccatc actcgtgata catctaagaa ccagtttttc 240
ctgaggttga attctgtgac tactgacgac acagctacgt attactgtac aagagatcgg 300
acctttgctt attggggcca agggactctg gtcactgtct ctgca 345
<210> 28
<211> 321
<212> DNA
<213> mus musculus
<400> 28
gatattgtgt taactcagtc tccagccacc ctgtctgtga ctccaggaga tagagtcagt 60
ctttcctgca gggccagtca aagaatttac aactacctac actggtatca acaaaaatca 120
catgagtctc caaggcttct catcaagtat gcttcccagt ccatctctgg gatcccctcc 180
aggttcagtg gcagtggctc agggacagat ttcattctca ctatcaacag tgtggagact 240
gaagattttg gaatgtattt ctgtcaacag agtaacagct ggcctctcac gttcggtgct 300
gggaccaagc tggagctgag a 321
<210> 29
<211> 8
<212> PRT
<213> Mus musculus
<400> 29
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 30
<211> 8
<212> PRT
<213> Mus musculus
<400> 30
Ile Asn Pro Ser Asn Gly Arg Thr
1 5
<210> 31
<211> 10
<212> PRT
<213> Mus musculus
<400> 31
Ala Arg Arg Val Gly Tyr Leu Met Asp Tyr
1 5 10
<210> 32
<211> 5
<212> PRT
<213> Mus musculus
<400> 32
Ser Ser Val Ser Tyr
1 5
<210> 33
<211> 3
<212> PRT
<213> Mus musculus
<400> 33
Asp Thr Ser
1
<210> 34
<211> 9
<212> PRT
<213> Mus musculus
<400> 34
Gln Gln Trp Asn Ser Asn Pro Pro Thr
1 5
<210> 35
<211> 5
<212> PRT
<213> Mus musculus
<400> 35
Ser Tyr Trp Met His
1 5
<210> 36
<211> 17
<212> PRT
<213> Mus musculus
<400> 36
Glu Ile Asn Pro Ser Asn Gly Arg Thr His Tyr Asn Glu Lys Phe Arg
1 5 10 15
Thr
<210> 37
<211> 8
<212> PRT
<213> Mus musculus
<400> 37
Arg Val Gly Tyr Leu Met Asp Tyr
1 5
<210> 38
<211> 10
<212> PRT
<213> Mus musculus
<400> 38
Ser Ala Ser Ser Ser Val Ser Tyr Met His
1 5 10
<210> 39
<211> 7
<212> PRT
<213> Mus musculus
<400> 39
Asp Thr Ser Lys Leu Ala Ser
1 5
<210> 40
<211> 117
<212> PRT
<213> Mus musculus
<400> 40
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Arg Thr His Tyr Asn Glu Lys Phe
50 55 60
Arg Thr Lys Ala Thr Leu Thr Val Ala Lys Ser Ser Ile Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Thr Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Val Gly Tyr Leu Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Ala Pro Gln
115
<210> 41
<211> 106
<212> PRT
<213> Mus musculus
<400> 41
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Asn Ser Asn Pro Pro Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 42
<211> 24
<212> DNA
<213> Mus musculus
<400> 42
ggctacacct tcaccagcta ctgg 24
<210> 43
<211> 24
<212> DNA
<213> Mus musculus
<400> 43
attaatccta gcaacggtcg tact 24
<210> 44
<211> 30
<212> DNA
<213> Mus musculus
<400> 44
gcaagaaggg ttggttacct catggactac 30
<210> 45
<211> 15
<212> DNA
<213> Mus musculus
<400> 45
tcaagtgtaa gttac 15
<210> 46
<211> 9
<212> DNA
<213> Mus musculus
<400> 46
gacacatcc 9
<210> 47
<211> 27
<212> DNA
<213> Mus musculus
<400> 47
cagcagtgga atagtaaccc acccacg 27
<210> 48
<211> 15
<212> DNA
<213> Mus musculus
<400> 48
agctactgga tgcac 15
<210> 49
<211> 51
<212> DNA
<213> Mus musculus
<400> 49
gagattaatc ctagcaacgg tcgtactcac tacaatgaga agttcaggac c 51
<210> 50
<211> 24
<212> DNA
<213> Mus musculus
<400> 50
agggttggtt acctcatgga ctac 24
<210> 51
<211> 30
<212> DNA
<213> Mus musculus
<400> 51
agtgccagct caagtgtaag ttacatgcac 30
<210> 52
<211> 21
<212> DNA
<213> Mus musculus
<400> 52
gacacatcca aactggcttc t 21
<210> 53
<211> 351
<212> DNA
<213> Mus musculus
<400> 53
caggtccaac tgcagcagcc tggggctgaa ctggtgaagc ctggggcttc agtgaagctg 60
tcctgcaagg cttctggcta caccttcacc agctactgga tgcactgggt gaagcagagg 120
cctggacaag gccttgagtg gattggagag attaatccta gcaacggtcg tactcactac 180
aatgagaagt tcaggaccaa ggccacactg actgttgcca aatcctccat cacagcctac 240
atgcaactca gcaccctgac atctgaggac tctgcggtct attactgtgc aagaagggtt 300
ggttacctca tggactactg gggtcaagga acctcagtca ccgctcctca g 351
<210> 54
<211> 318
<212> DNA
<213> Mus musculus
<400> 54
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgcact ggtaccagca gaagtcaggc 120
acctccccca aaagattgat ttatgacaca tccaaactgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg aatagtaacc cacccacgtt cggtgctggg 300
accaagctgg agctgaaa 318
<210> 55
<211> 9
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-H1
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is S or T
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is I or F
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa is A or missing
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa is F or W
<400> 55
Gly Tyr Xaa Xaa Thr Ser Xaa Tyr Xaa
1 5
<210> 56
<211> 8
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-H2
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is Y or P
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is D or S
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is N or missing
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa is T or R
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is N or T
<400> 56
Ile Asn Xaa Xaa Xaa Gly Xaa Xaa
1 5
<210> 57
<211> 10
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-H3
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa is T or A
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is D or R
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is R or V
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is T or G
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is F or Y
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa is A or L
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is M or missing
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa is D or missing
<400> 57
Xaa Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr
1 5 10
<210> 58
<211> 6
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-L1
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa is Q or missing
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa is R or S
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is I or S
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is Y or V
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is N or S
<400> 58
Xaa Xaa Xaa Xaa Xaa Tyr
1 5
<210> 59
<211> 3
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-L2
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa is Y or D
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa is A or T
<400> 59
Xaa Xaa Ser
1
<210> 60
<211> 9
<212> PRT
<213> artificial
<220>
<223> Sequence from CDR-L3
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is S or W
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is W or N
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa is L or P
<400> 60
Gln Gln Xaa Asn Ser Xaa Pro Xaa Thr
1 5
Claims (25)
- i) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 적어도 다음의 3가지 CDRs, CDR-H1, CDR-H2 및 CDR-H3를 포함하고, CDR-H1은 서열번호 55의 서열을 포함하고, CDR-H2은 서열번호 56의 서열을 포함하고, CDR-H3은 서열번호 57의 서열을 포함하는 중쇄; 및/또는 ii) IMGT 번호매김 시스템에 따라 정의된 바와 같이, 적어도 다음의 3가지 CDRs, CDR-L1, CDR-L2 및 CDR-L3를 포함하고, CDR-L1은 서열번호 58의 서열을 포함하고, CDR-L2은 서열번호 59의 서열을 포함하고, CDR-L3은 서열번호 60의 서열을 포함하는 경쇄를 포함하는 것을 특징으로 하는, c-Met 단백질에 특이적으로 결합할 수 있는 분리된 항체, 또는 그의 기능적 단편 또는 유도체.
- 제 1항에 있어서,
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 7의 서열을 가지는 CDR-H1, 서열번호 2의 서열을 가지는 CDR-H2 및 서열번호 8의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 29의 서열을 가지는 CDR-H1, 서열번호 30의 서열을 가지는 CDR-H2 및 서열번호 31의 서열을 가지는 CDR-H3를 포함하는 중쇄:
로 이루어진 그룹으로부터 선택되는 중쇄를 포함하는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 제 1항에 있어서,
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 4의 서열을 가지는 CDR-L1, 서열번호 5의 서열을 가지는 CDR-L2 및 서열번호 6의 서열을 가지는 CDR-L3를 포함하는 경쇄; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 32의 서열을 가지는 CDR-L1, 서열번호 33의 서열을 가지는 CDR-L2, 서열번호 34의 서열을 가지는 CDR-L3를 포함하는 경쇄:
로 이루어진 그룹으로부터 선택되는 경쇄를 포함하는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 제 1항 내지 제 3항의 어느 한 항에 있어서,
a) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 7의 서열을 가지는 CDR-H1, 서열번호 2의 서열을 가지는 CDR-H2 및 서열번호 8의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 4의 서열을 가지는 CDR-L1, 서열번호 5의 서열을 가지는 CDR-L2 및 서열번호 6의 서열을 가지는 CDR-L3를 포함하는 경쇄:
를 포함하는 항체, 또는 그의 기능적 단편 또는 유도체; 또한
b) IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 29의 서열을 가지는 CDR-H1, 서열번호 30의 서열을 가지는 CDR-H2 및 서열번호 31의 서열을 가지는 CDR-H3를 포함하는 중쇄; 또한
IMGT 번호매김 시스템에 따라 정의된 바와 같이 다음의 3가지 CDRs, 각각 서열번호 32의 서열을 가지는 CDR-L1, 서열번호 33의 서열을 가지는 CDR-L2, 서열번호 34의 서열을 가지는 CDR-L3를 포함하는 경쇄:
를 포함하는 항체, 또는 그의 기능적 단편 또는 유도체:
로 이루어진 그룹으로부터 선택되는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 제 1항 내지 제 4항의 어느 한 항에 있어서,
a) 서열번호 13의 아미노산 서열을 포함하는 서열의 중쇄 가변 도메인 및 서열번호 14의 아미노산 서열을 포함하는 서열의 경쇄 가변 도메인을 포함하는, 항체, 또는 그의 기능적 단편 또는 유도체; 또한
b) 서열번호 40의 아미노산 서열을 포함하는 서열의 중쇄 가변 도메인 및 서열번호 41의 아미노산 서열을 포함하는 서열의 경쇄 가변 도메인을 포함하는, 항체, 또는 그의 기능적 단편 또는 유도체:
로 이루어진 그룹으로부터 선택되는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 제 1항 내지 제 5항의 어느 한 항에 있어서,
상기 항체는 마우스 항체인 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 제 1항 내지 제 6항의 어느 한 항에 있어서,
상기 항체는 c-Met 단백질에 HGF 리간드의 결합을 차단하지 않는 것을 특징으로 하는, 항체, 또는 그의 기능적 단편 또는 유도체. - 프랑스 파리, 파스퇴르 연구소 CNCM에 2008년 03월 12일자로 기탁번호 제 I-3949호 하로 기탁된 하이브리도마, 및 프랑스 파리, 파스퇴르 연구소 CNCM에 2010년 01월 14일자로 기탁번호 제 I-4273호 하로 기탁된 하이브리도마로부터 선택되는, 제 1항 내지 제 7항의 어느 한 항에 따른 항체를 분비할 수 있는 마우스 하이브리도마.
- 다음의 핵산
a) 제 1항 내지 제 7항의 어느 한 항에서 청구된 바와 같이 항체를 코딩하는 핵산, DNA 또는 RNA;
b) 서열번호 15 내지 26 또는 서열번호 42 내지 52의 서열들로 이루어진 그룹으로부터 선택되는 서열을 포함하는 DNA 서열을 포함하는 핵산;
c) 서열번호 27, 서열번호 28, 서열번호 53 또는 서열번호 54의 서열들을 포함하는 DNA 서열을 포함하는 핵산;
d) a), b) 또는 c)에 정의된 바와 같은 핵산들의 해당되는 RNA 핵산들;
e) a), b) 또는 c)에 정의된 바와 같은 핵산들의 상보적인 핵산들; 또한
f) 서열번호 15 내지 28 또는 서열번호 42 내지 54의 서열 또는 그의 상보적인 서열의 적어도 하나의 CDRs와 높은 엄격도 조건들 하에서 혼성화할 수 있는 적어도 18개 뉴클레오타이드들의 핵산:
으로부터 선택되는 것을 특징으로 하는, 분리된 핵산. - c-Met의 발현과 연관된 종양원 유전자성 질병을 시험관내에서 진단하거나, c-Met의 발현과 연관된 종양원 유전자성 질병을 발생시킬 예후를 시험관내에서 결정하기 위한, 제 1항 내지 제 7항의 어느 한 항에 따른 항체, 또는 그의 기능적 단편 또는 유도체의 용도.
- (a) 개체로부터 나온 시료를 제 1항 내지 제 7항의 어느 한 항에 따른 항체, 또는 그의 기능적 단편 또는 유도체와 접촉시키고, 또한 (b) 시료와 상기 항체의 결합을 검출하는 단계들을 포함하는, 개체에서 c-Met을 발현하는 종양의 존재 및/또는 위치를 시험관내에서 검출하는 방법.
- (a') 개체로부터 나온 시료를 제 1항 내지 제 7항의 어느 한 항에 따른 항체, 또는 그의 기능적 단편 또는 유도체와 접촉시키고, 또한 (b') 상기 시료에서 c-Met에 결합하는 항체의 수준을 정량하는 단계들을 포함하는, 개체로부터 나온 c-Met을 발현하는 종양에서 c-Met의 발현 수준을 시험관내에서 결정하는 방법.
- 제 12항에 있어서,
상기 c-Met 발현 수준은 면역조직화학 (IHC)에 의해 측정되는, 방법. - (i) 제 13항에 따라 c-Met의 발현 수준을 결정하고, 또한 (ii) 단계 (i)의 발현 수준을 정상 조직으로부터 나온 기준 c-Met의 발현 수준과 비교하는 단계들을 포함하는, 개체에서 c-Met을 발현하는 종양을 시험관내에서 진단하거나 c-Met을 발현하는 종양을 발생시킬 예후를 시험관내에서 결정하는 방법.
- (1) 제 12항에 따라 c-Met의 발현 수준을 결정하고, (2) c-Met 발현 수준에 대해 종양에 점수를 매기고, 또한 (3) 상기 점수를 매긴 것을 대조군 시료로부터 획득된 것과 비교하는 단계들을 포함하는, 개체의 종양의 c-Met 상태를 시험관내에서 결정하는 방법.
- 제 15항에 있어서,
상기 점수를 매기는 것은 염색의 강도 및 양성 세포들의 백분율이 되는 두 가지의 매개변수들에 기초하는 적절한 척도 (scale)를 사용하는 것을 포함하는, 방법. - 제 16항에 있어서,
상기 적절한 척도는 0 내지 3+ 범위의 척도이고, 종양세포들의 막 반응성 없음은 0으로 점수를 매기고, 10% 이상의 종양세포들에서 강한 완전 반응성은 3+로 점수를 매기는, 방법. - 제 17항에 있어서,
상기 적절한 척도는 0 내지 3의 척도이고, 종양세포들의 막 반응성 없음은 0으로 점수를 매기고; 10% 이상의 종양세포들에서 약한 감지가능한 막 반응성은 1+로 점수를 매기고; 10% 이상의 종양세포들에서 약한 내지 적당한 완전 막 반응성은 2+로 점수를 매기고; 또한 10% 이상의 종양세포들에서 강한 완전 반응성은 3+로 점수를 매기는, 방법. - 제 17항 또는 제 18항에 있어서,
종양은 2+ 또는 3+의 점수를 가진 c-Met(+)인, 방법 - (a) 제 19항에 따라 개체의 종양의 c-Met 상태를 시험관내에서 결정하고, 또한 (b) 상기 상태가 c-Met(+)인 경우라면, 종양원 유전자성 질병이 항-c-Met 항체, 또는 그의 단편 또는 유도체로의 치료에 민감한 것을 결정하는 단계들을 포함하는, 종양원 유전자성 질병이 항-c-Met 항체, 또는 그의 단편 또는 유도체로의 치료에 민감한지 여부를 결정하는 방법.
- 제 1항 내지 제 7항의 어느 한 항에 따른 항-c-Met 항체, 또는 그의 단편 또는 유도체를 적어도 하나 포함하고, 바람직하게 상기 항체는 표지되는, 키트.
- 제 21항에 있어서,
상기 키트는 상기에 더하여 상기 항-c-Met 항체 및 c-Met 간의 결합 정도를 검출하는 데 유용한 반응시약을 포함하고, 개체에서 c-Met을 발현하는 종양의 존재 및/또는 위치를 시험관내에서 검출하는, 키트. - 제 21항에 있어서,
상기 키트는 상기에 더하여 상기 항-c-Met 항체 및 c-Met 간의 결합 수준을 정량하는 데 유용한 반응시약을 포함하고, c-Met을 발현하는 종양에서 c-Met의 발현 수준을 시험관내에서 결정하는, 키트. - 제 21항 또는 제 22항에 있어서,
상기 키트는 상기에 더하여
i) 상기 항-c-Met 항체 및 c-Met 간의 결합 정도를 검출하는 데 유용한 반응시약; 또한
ii) c-Met 발현 수준을 점수로 매기는 데 유용한 양성 및 음성 대조군 시료들:
을 포함하고, 종양의 c-Met 상태를 시험관내에서 결정하는, 키트. - 제 24항에 있어서,
상기 키트는 상기에 더하여 마우스 항체들에 특이적인 폴리클론 항체를 포함하고, 바람직하게 상기 마우스 항체들에 특이적인 폴리클론 항체는 표지되는, 종양의 c-Met 상태를 시험관내에서 결정하는 키트.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US23586409P | 2009-08-21 | 2009-08-21 | |
| EP09305777.6 | 2009-08-21 | ||
| US61/235,864 | 2009-08-21 | ||
| EP09305777A EP2287197A1 (en) | 2009-08-21 | 2009-08-21 | Anti-cMET antibody and its use for the detection and the diagnosis of cancer |
| US34800510P | 2010-05-25 | 2010-05-25 | |
| US61/348,005 | 2010-05-25 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120051734A true KR20120051734A (ko) | 2012-05-22 |
Family
ID=41571045
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127005757A KR20120051734A (ko) | 2009-08-21 | 2010-08-23 | 항-cMET 항체 및 암의 검출과 진단을 위한 그의 용도 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US8673302B2 (ko) |
| EP (2) | EP2287197A1 (ko) |
| JP (1) | JP5951486B2 (ko) |
| KR (1) | KR20120051734A (ko) |
| CN (1) | CN102639564B (ko) |
| AR (1) | AR077901A1 (ko) |
| AU (1) | AU2010284944B2 (ko) |
| BR (1) | BR112012003759A2 (ko) |
| CA (1) | CA2769427C (ko) |
| ES (1) | ES2692522T3 (ko) |
| IL (1) | IL218202A (ko) |
| IN (1) | IN2012DN01322A (ko) |
| MX (1) | MX2012002139A (ko) |
| NZ (2) | NZ598194A (ko) |
| RU (1) | RU2582265C2 (ko) |
| SG (1) | SG178339A1 (ko) |
| TW (1) | TW201111781A (ko) |
| WO (1) | WO2011020925A1 (ko) |
| ZA (1) | ZA201202076B (ko) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2287197A1 (en) * | 2009-08-21 | 2011-02-23 | Pierre Fabre Medicament | Anti-cMET antibody and its use for the detection and the diagnosis of cancer |
| SG187886A1 (en) | 2010-08-31 | 2013-04-30 | Genentech Inc | Biomarkers and methods of treatment |
| KR101444837B1 (ko) | 2011-06-03 | 2014-09-30 | 한국생명공학연구원 | HGF 활성을 가지는 c-Met에 대한 인간항체 및 이의 용도 |
| AU2012312515A1 (en) | 2011-09-19 | 2014-03-13 | Genentech, Inc. | Combination treatments comprising c-met antagonists and B-raf antagonists |
| KR20130036993A (ko) * | 2011-10-05 | 2013-04-15 | 삼성전자주식회사 | c-Met의 SEMA 도메인 내의 에피토프에 특이적으로 결합하는 항체 |
| CN104395752B (zh) * | 2011-11-21 | 2017-09-15 | 泰纬生命科技股份有限公司 | 对hec1活性调节剂具有反应的癌症的生物标记 |
| TW201326193A (zh) | 2011-11-21 | 2013-07-01 | Genentech Inc | 抗-c-met抗體之純化 |
| GB201121914D0 (en) | 2011-12-20 | 2012-02-01 | Ge Healthcare Ltd | Method for patient selection |
| US9260531B2 (en) | 2012-05-09 | 2016-02-16 | Eli Lilly And Company | Anti-c-met antibodies |
| EP2863946A4 (en) * | 2012-06-21 | 2016-04-13 | Sorrento Therapeutics Inc | ANTIGEN-BINDING PROTEINS THAT BIND TO C-MET |
| CA2900097A1 (en) | 2013-02-22 | 2014-08-28 | F. Hoffmann-La Roche Ag | Methods of treating cancer and preventing drug resistance |
| US10214593B2 (en) | 2013-04-02 | 2019-02-26 | Samsung Electronics Co., Ltd. | Anti-idiotype antibody against anti-c-MET antibody |
| GB201314936D0 (en) | 2013-08-21 | 2013-10-02 | Ge Healthcare Ltd | Radiolabelling method |
| WO2015031614A1 (en) * | 2013-08-28 | 2015-03-05 | Abbvie Inc. | Soluble cmet assay |
| WO2015031626A1 (en) * | 2013-08-28 | 2015-03-05 | Abbvie Inc. | Soluble cmet assay |
| WO2015032695A1 (en) * | 2013-09-09 | 2015-03-12 | Ventana Medical Systems, Inc. | Scoring method for mesothelin protein expression |
| GB201322456D0 (en) | 2013-12-18 | 2014-02-05 | Ge Healthcare Ltd | Radiotracer compositions and methods |
| JP2017516458A (ja) | 2014-03-24 | 2017-06-22 | ジェネンテック, インコーポレイテッド | c−met拮抗剤による癌治療及びc−met拮抗剤のHGF発現との相関 |
| WO2015179835A2 (en) | 2014-05-23 | 2015-11-26 | Genentech, Inc. | Mit biomarkers and methods using the same |
| JP6864953B2 (ja) | 2014-12-09 | 2021-04-28 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | Axlに対するヒトモノクローナル抗体 |
| EP3253791A1 (en) * | 2015-02-03 | 2017-12-13 | INSERM - Institut National de la Santé et de la Recherche Médicale | Anti-rho gtpase conformational single domain antibodies and uses thereof |
| WO2016135041A1 (en) | 2015-02-26 | 2016-09-01 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Fusion proteins and antibodies comprising thereof for promoting apoptosis |
| ES2795818T3 (es) * | 2015-03-18 | 2020-11-24 | Seattle Genetics Inc | Anticuerpos CD48 y conjugados de los mismos |
| EP3411067B1 (en) | 2016-02-05 | 2021-10-20 | Helixmith Co., Ltd | Anti-c-met antibodies and uses thereof |
| EP4233909A3 (en) | 2016-05-17 | 2023-09-20 | AbbVie Biotherapeutics Inc. | Anti-cmet antibody drug conjugates and methods for their use |
| TWI782930B (zh) | 2016-11-16 | 2022-11-11 | 美商再生元醫藥公司 | 抗met抗體,結合met之雙特異性抗原結合分子及其使用方法 |
| RU2735918C2 (ru) * | 2018-06-07 | 2020-11-10 | Общество с ограниченной ответственностью "ДЖЕЙВИС ДИАГНОСТИКС" | Набор реагентов для выявления маркера эпителиальных карцином |
| CN112351998B (zh) * | 2018-06-29 | 2022-07-22 | 苏州智核生物医药科技有限公司 | Pd-l1结合多肽及其用途 |
| KR102396194B1 (ko) * | 2018-12-07 | 2022-05-10 | 서울대학교 산학협력단 | 항 c-Met 아고니스트 항체 및 이의 용도 |
| WO2020244654A1 (en) * | 2019-06-06 | 2020-12-10 | Apollomics Inc. (Hangzhou) | Method for treating cancer patients using c-met inhibitor |
| MX2022002886A (es) | 2019-09-16 | 2022-04-06 | Regeneron Pharma | Proteinas de union met radiomarcadas para la obtencion de imagenes por inmuno-pet. |
| US20240165253A1 (en) | 2020-09-01 | 2024-05-23 | Remegen Co., Ltd. | Anti-c-met antibody-drug conjugate and applications thereof |
| IL300952A (en) * | 2020-09-08 | 2023-04-01 | Ideaya Biosciences Inc | Drug combination and tumor treatment |
| WO2023240272A2 (en) * | 2022-06-09 | 2023-12-14 | Santa Ana Bio, Inc. | Antibodies targeting c-kit and/or siglec and uses thereof |
| WO2024030341A1 (en) | 2022-07-30 | 2024-02-08 | Pinetree Therapeutics, Inc. | Compositions for targeted lysosomal degradaton and methods of use thereof |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6214344B1 (en) * | 1995-06-02 | 2001-04-10 | Genetech, Inc. | Hepatocyte growth factor receptor antagonists and uses thereof |
| AU2002357388A1 (en) * | 2001-12-27 | 2003-07-24 | The United States Of America, As Represented By The Department Of Veterans Affairs | Monoclonal antibody imaging and therapy of tumors that express met and bind hepatocyte growth factor |
| US20040208876A1 (en) * | 2003-04-18 | 2004-10-21 | Kim Kyung Jin | Monoclonal antibodies to hepatocyte growth factor |
| US7964365B2 (en) * | 2005-11-08 | 2011-06-21 | The United States of Americam as represented by the Secretary, Department of Health and Human Services | Methods for diagnosing and monitoring the progression of cancer |
| SG169382A1 (en) * | 2006-02-06 | 2011-03-30 | Metheresis Translational Res S A Ch | Anti-met monoclonal antibody, fragments and vectors thereof, for the treatment of tumors and corresponding products |
| EP2014681A1 (en) * | 2007-07-12 | 2009-01-14 | Pierre Fabre Medicament | Novel antibodies inhibiting c-met dimerization, and uses thereof |
| US7892770B2 (en) * | 2007-08-24 | 2011-02-22 | Van Andel Research Institute | Monoclonal antibody which binds cMet (HGFR) in formalin-fixed and paraffin-embedded tissues and related methods |
| AR074439A1 (es) * | 2008-12-02 | 2011-01-19 | Pf Medicament | Anticuerpo anti-cmet (receptor c-met) |
| US8545839B2 (en) * | 2008-12-02 | 2013-10-01 | Pierre Fabre Medicament | Anti-c-Met antibody |
| EP2287197A1 (en) * | 2009-08-21 | 2011-02-23 | Pierre Fabre Medicament | Anti-cMET antibody and its use for the detection and the diagnosis of cancer |
-
2009
- 2009-08-21 EP EP09305777A patent/EP2287197A1/en not_active Withdrawn
-
2010
- 2010-08-23 ES ES10744608.0T patent/ES2692522T3/es active Active
- 2010-08-23 AU AU2010284944A patent/AU2010284944B2/en active Active
- 2010-08-23 TW TW099128075A patent/TW201111781A/zh unknown
- 2010-08-23 KR KR1020127005757A patent/KR20120051734A/ko not_active Application Discontinuation
- 2010-08-23 EP EP10744608.0A patent/EP2467402B1/en active Active
- 2010-08-23 CN CN201080036635.7A patent/CN102639564B/zh active Active
- 2010-08-23 AR ARP100103069A patent/AR077901A1/es not_active Application Discontinuation
- 2010-08-23 RU RU2012109004/10A patent/RU2582265C2/ru active
- 2010-08-23 NZ NZ598194A patent/NZ598194A/en unknown
- 2010-08-23 US US13/391,435 patent/US8673302B2/en active Active
- 2010-08-23 CA CA2769427A patent/CA2769427C/en active Active
- 2010-08-23 JP JP2012525183A patent/JP5951486B2/ja active Active
- 2010-08-23 NZ NZ700437A patent/NZ700437A/en unknown
- 2010-08-23 BR BR112012003759A patent/BR112012003759A2/pt not_active Application Discontinuation
- 2010-08-23 IN IN1322DEN2012 patent/IN2012DN01322A/en unknown
- 2010-08-23 MX MX2012002139A patent/MX2012002139A/es not_active Application Discontinuation
- 2010-08-23 WO PCT/EP2010/062271 patent/WO2011020925A1/en active Application Filing
- 2010-08-23 SG SG2012009106A patent/SG178339A1/en unknown
-
2012
- 2012-02-19 IL IL218202A patent/IL218202A/en active IP Right Grant
- 2012-03-20 ZA ZA2012/02076A patent/ZA201202076B/en unknown
-
2014
- 2014-01-24 US US14/163,501 patent/US20140295452A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| IL218202A0 (en) | 2012-04-30 |
| CA2769427A1 (en) | 2011-02-24 |
| EP2467402A1 (en) | 2012-06-27 |
| IN2012DN01322A (ko) | 2015-06-05 |
| CA2769427C (en) | 2020-03-10 |
| ES2692522T3 (es) | 2018-12-04 |
| BR112012003759A2 (pt) | 2017-07-11 |
| EP2467402B1 (en) | 2018-08-01 |
| US20140295452A1 (en) | 2014-10-02 |
| SG178339A1 (en) | 2012-03-29 |
| MX2012002139A (es) | 2012-03-07 |
| NZ598194A (en) | 2015-05-29 |
| AU2010284944B2 (en) | 2016-01-28 |
| AU2010284944A1 (en) | 2012-03-08 |
| RU2582265C2 (ru) | 2016-04-20 |
| JP5951486B2 (ja) | 2016-07-13 |
| CN102639564A (zh) | 2012-08-15 |
| ZA201202076B (en) | 2012-11-28 |
| JP2013502213A (ja) | 2013-01-24 |
| IL218202A (en) | 2017-07-31 |
| TW201111781A (en) | 2011-04-01 |
| EP2287197A1 (en) | 2011-02-23 |
| CN102639564B (zh) | 2015-01-07 |
| WO2011020925A1 (en) | 2011-02-24 |
| AR077901A1 (es) | 2011-09-28 |
| US8673302B2 (en) | 2014-03-18 |
| NZ700437A (en) | 2016-04-29 |
| US20120149031A1 (en) | 2012-06-14 |
| RU2012109004A (ru) | 2013-09-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2467402B1 (en) | Anti-cmet antibody and its use for the detection and the diagnosis of cancer | |
| EP2588497B1 (en) | Novel antibody for the diagnosis and/or prognosis of cancer | |
| RU2706967C2 (ru) | Антитело к igf-1r и его применение для диагностики рака | |
| KR102350259B1 (ko) | Igf-1r 항체 및 암의 진단을 위한 그의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |