KR20100093037A - 폐질환의 건강 관련 삶의 질 부족을 치료하기 위한 흡입용 아즈트레오남 라이신 - Google Patents
폐질환의 건강 관련 삶의 질 부족을 치료하기 위한 흡입용 아즈트레오남 라이신 Download PDFInfo
- Publication number
- KR20100093037A KR20100093037A KR1020107009839A KR20107009839A KR20100093037A KR 20100093037 A KR20100093037 A KR 20100093037A KR 1020107009839 A KR1020107009839 A KR 1020107009839A KR 20107009839 A KR20107009839 A KR 20107009839A KR 20100093037 A KR20100093037 A KR 20100093037A
- Authority
- KR
- South Korea
- Prior art keywords
- azli
- aerosol
- day
- dose
- treatment
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
Landscapes
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pulmonology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
폐질환의 건강 관련 삶의 질 (health-related quality-of- life; HRQOL) 증상들을 치료하기 위한 의약 제조시의 아즈트레오남 라이신 (azlreonam lysine)의 흡입용 에어로졸의 용도를 제공한다. 상기 용도는 HRQOL 증상들의 지속가능한 장기적인 치료에 적합하다.
Description
본 발명은 2007년 10월 1일에 출원된 임시 출원 60/997,072와 2007년 10월 1일에 출원된 임시 출원 60/997,071에 대하여 35 U.S.C. 119(e) 하에서의 특권을 주장하며 35 U.S.C. 361하에서 출원한 국제 출원이다. 상기 각 출원은 본 명세서에 그 전체가 참조로 포함된다.
본 발명의 기술 분야
본 발명은 흡입용 아즈트레오남 라이신의 투여를 포함하는 폐질환의 건강 관련 삶의 질 (heatl-related quality-of-life; HRQOL) 증상들의 치료, 예방 및 개선에 관한 것이다.
낭포성 섬유증 (Cystic fibrosis; CF)은 백인에게 있어서 가장 일반적인 수명을 단축시키는 유전 질환으로서, 전 세계적으로 대략 70,000 명이 이 질병의 진단을 받았다. CF는 기도, 소화계 및 비뇨생식기계에도 영향을 미치는 다발적 전신 질환이다. 24세까지 거의 80%의 CF 환자는 만성 녹농균 (Pseudomonas aeruginosa; PA)기도 감염을 갖는데, 이는 폐 기능 감소의 가속화와 관련되며 사망률의 중요한 예측 변수가 되므로, 주요한 치료 목적은 기도관이다 (2005 Annual Data Report to the Center Directors, Bethesda, Maryland, Cystic Fibrosis Foundation, Bethesda, MD 2006; Pamukcu, A, Pediatr. Pulmonol. 1995; 19:10-5; Henry, RL, Pediatr. Pulmonol. 1992; 12:158-61).
CF의 임상 관리는 지난 15년 동안 개선되어 왔다. 증가된 관리의 표준화와 영양을 포함한 유지 치료의 초점은, 1993년의 도나아제 알파의 도입, 1998년의 토브라마이신 흡입 용액 (TIS)(TOBI®), 그리고 지난 5년 동안의 만성 아지쓰로마이신 (azithromycin)의 광범위한 이용과 더불어 대략 8년이라는 평균 예상 생존 나이의 평균값 증가 (36.5세; 1990-2005)와 모든 연령군에 있어서 1초간 노력성 호기량 (FEV1) 평균값의 대략 10%의 증가 (1990-2005)와 관련이 있다 (Clement, A, Thorax 2006; 61:895-902; Gibson, RL, Am. J. Respir. Crit. Care Med. 2003; 168:918-51).
FEV1와 세균성 가래 밀도 등과 같은 CF에 대한 종래의 임상적 개선 조치로는, 치료가 호흡 효과에 대해서만 직접적이고, 환자의 물리적, 사회적, 그리고 정서적 기능에 있어서의 넓은 효과에 영향을 미치지는 못했으며, 상기 질병으로 영향을 받을 수 있는 기타 시스템(계)에 대한 치료 효과도 놓칠 수 있다. 이러한 다양한 폐질환의 추가적 측면들은, CF, 천식 및 기타 폐질환을 위하여 개발된 건강 관련 삶의 질 (HRQOL) 도구로 측정된다 (Chang, JA, Chest 1999, 116, 1175-1182; Juniper, E, Am . Rev . Respir. Dis., 1993, 147, 832-838; Henry, B, Qual . Life Res ., 2003, 12, 63-76). 이러한 측정은 그 또는 그녀의 일상 기능과 행복에 대한 개인의 주관적 평가를 반영하는 것으로, 의사 중심의 평가라기보다는 환자 중심의 평가이다. 만성 질환에 있어서, 몇몇 치료는 종래의 의학적 측정에는 반영되지 않았던 일상 생활 활동에서의 유익을 초래할 수 있다. 예를 들면, 어린 아이의 몸무게와 키를 변화시키기 위한 칼로리 섭취의 증가를 위한 의학적 개입은 몇몇 개인들에게 있어서, 에너지 수준과 스포츠에 참여할 능력을 증가시킬 수 있다. 그러한 결과는 단순히 몸무게나 키를 얻는 것보다 가족들에게 있어서 종종 더욱 신나는 일이다. 또한, 일상 기능 중에서의 환자의 인식 개선은 복잡하고 시간이 걸리는 치료 요법에 대한 환자들의 치료 순응을 증가시킬 수 있다. 게다가, HRQOL 도구는 시간이 걸리는 치료의 유효성 평가의 기초를 제공하고, 중요한 건강 관리 자료로 이용된다. 이러한 후자의 효과는, 치료와 치료 비용 회수 정책에 영향을 줄 수 있는 서로 다른 치료의 비용 효율을 비교하는데 있어서 중요하다. 따라서, 동일하거나 서로 다른 약제에 의한 치료에 의하여 별도로 발생될 수 있는 종래의 임상 측정과는 관계없이, 폐질환을 가진 환자의 HRQOL의 점수를 증가시키기 위한 약을 개발할 필요가 있다.
CF의 삶의 질 증상의 효과는 CF 설문지 개정안 (CF Questionnaire-Revised; CFQ-R) (Quittner, Chest 2005, 128, 2347-2354) 등과 같은 HRQOL 도구로 측정할 수 있다. 질병과 관련된 CF의 삶의 질 증상에는 식사와 소화 장애, 정서적 장애와 신체적 장애, 건강 인식의 감소, 호흡기 장애, 역할/학교 생활 장애, 활력의 감소, 사회적 기능의 감소, 체중의 감소, 그리고 치료 부담의 증가 등과 같은 삶의 질에 대한 측정이 포함된다. 이러한 질환 관련 증상은, 정상적인 활동에 영향을 줄 수 있는 복잡하고 시간이 걸리는 의학적 식이요법을 지켜야만 하는 CF 환자와 특히 관련이 있다. 그들의 치료 유익에 대한 인식은 치료 식이 요법을 더욱 충실히 지키도록 하고, 종래의 임상적 측정에 의하여 측정되는 오랜 기간의 건강 결과에 영향을 줄뿐 아니라, 그들의 치료 선택의 비용적 효과도 증가시킬 것이다 (Modi, AC, Pediatr. Pulmonol. 2005; S28:371). 따라서, CF 환자의 HRQOL의 점수를 일반적으로 증가시키는 치료법이 요구된다.
흡입용 아즈트레오남 라이신 (AZLI)은 모노박탐계 항생제, 아즈트레오남 및 라이신의 건조 분말 또는 에어로졸화 제형이다 (몽고메리, 미국 특허 6,660,249, 7,138,419, 7208,141, 7,214,364, 미국 특허 출원 11/732,234 및 11/729,698; 각 특허는 그 전체가 참조로서 본 명세서에 통합된다). 병원에서, AZLI는 FEV1를 포함하는 CF의 임상적 증상, 가래 녹농균 (Pseudomonas aeruginosa) 농도, 흡입 또는 정맥내 항생제를 필요로 하는 시간을 개선하였다 (Gilead press releases, December 19, 2006 and April 19, 2007; McCoy, K.; et al., 30th European Cystic Fibrosis Conference June 13-16, 2007, Poster 40, Antalya, Turkey).
본 발명은 폐질환의 건강 관련 삶의 질 (health-related quality-of- life; HRQOL) 증상들을 치료하는 것을 목적으로 한다.
발명의 요약
현재, CF 환자에 대한 AZLI의 투여는 환자의 HRQOL 점수를 증가시킬 것이라는 사실이 예상외로 발견되었다. 본 명세서에서 기술한 임상 시험에서는, 종전에 폐의 녹농균 감염에 대하여 토브라마이신 흡입 용액 (tobramycin inhalation soulution; TIS)을 처방받아 치료받은 적이 있는 낭포성 섬유증 환자에게 TIS를 28일 코스로 투여하였다. 상기 연구는, 이들 환자들이 CFQ-R의 증상 영역에 대하여 어떻게 응답하는지를 평가하였다. 28일 연구의 종료 시점에서, 환자들의 CFQ-R-호흡 영역의 평균 점수는 -1.47 포인트가 감소하여 CRQ-R 증상 영역의 악화를 나타낸 반면, 임상 효능의 종래 측정값, FEV1와 녹농균 (Pseudomonas aeruginosa) 가래 농도는 증가하였다. 그 후, 28일 코스에 걸친 이들 모두의 동일한 임상 효과에 대한 AZLI의 효과를 평가하기 위하여, 이 환자들을 이중 맹검, 위약 대조군으로 등록시켰다. TIS 연구와는 대조적으로, CFQ-R-호흡기 영역 점수에서의 급격한 증가가 AZLI로 치료받은 환자들 중에서 나타났다. AZLI로 치료받은 환자의 FEV1와 녹농균 (Pseudomonas aeruginosa) 가래 농도의 증가는 등록 시료인 토브라마이신을 흡입한 보고된 환자들의 경우와 비슷하였다 ( Ramsey, BW, New Engl. J. Med. 1999, 340, 23-30). 따라서, AZLI와 TIS는 FEV1와 PA 가래 농도 등과 같은 종래의 임상적 측정에 대하여는 비슷한 효과를 나타내지만, AZLI는 CFQ-R 점수의 증가를 야기하고 TIS 등과 같은 항균성 약에 의해 생성되지 않았다.
또한, 이러한 임상 시험은 CFQ-R 호흡기 점수에서의 증가와 AZLI로 치료받은 환자들의 FEV1 간의 단지 보통 내지 약한 연관성이 AZLI는 예상외로 환자의 질병에 대한 인식을 치료한다는 것을 증명하였다. 이는 CF와 폐질환의 치료에 대한 AZLI의 새롭고 기대하지 않은 용도이며, 종래의 임상적 종말점 (FEV1)과 증가된 CFQ-R 점수 간의 낮은 연관성은 AZLI가 종래의 임상적 종말점에 의하여 측정된 것과는 별개로 폐질환의 다른 요소를 치료한다는 것을 나타낸다.
또한, 본 명세서에 기술한 2 번째의 무작위 배정, 이중 맹검, 위약 대조 임상 시험에서는, 다른 흡입 항생제로는 집중적으로 치료받은 적이 없는 낭포성 섬유증 환자에게 AZLI를 28일간 투여하였다. 상기에서 논의한 실험에서 종래에 사용된 임상적 매개 변수와 CFQ-R 증상 영역을 이 연구에서 평가하였다. AZLI로 치료된 환자에게서는 기준치에 대하여 CFQ-R 증상 영역의 11 내지 12의 점수 증가가 나타났는데, 상기 점수는 모든 12개의 영역 모두에 대한 위약군 환자의 점수보다 더욱 높았다. 이는, AZLI가 기타의 흡입용 항생제로 집중적으로 치료받은 적이 없는 낭포성 섬유증 환자의 CFQ-R 점수를 증가시킨다는 것을 증명한다.
또한, 두 번째 임상 시험은 AZLI가 종래의 임상적 종말점으로 측정된 것과는 별개의 폐질환의 또 다른 특성을 치료한다는 것을 증명하였다. 첫 번째 임상 시험에서와 같이, 증가된 CFQ-R 호흡기 점수와 AZLI로 치료된 환자들의 FEV1 간의 보통 내지는 약한 상관관계만 있었다는 것은, AZLI가 환자의 질병에 대한 인식을 치료한다는 것을 나타낸다. 게다가, 이 두 번째 임상 시험에서의 CFQ-R 호흡기 영역에서의 영향은 AZLI 투여 중단 후 최소 2주간 지속된 반면, 유효성, PA 가래 농도에 대한 종래의 임상적 측정은 치료 전 농도로 회복되었다. 이는 한번 더, 낭포성 섬유증과 폐질환에 있어서의 새롭고도 예상치 못한 AZLI의 용도를 증명하며, PA 밀도가 치료 전 농도로 회복될 때, 종래의 임상적 종말점 (FEV1)과 CFQ-R 효과 간의 낮은 상관관계와 CFQ-R 효과의 지속은, AZLI는 종래의 임상적 종말점에 의하여 측정된 것과는 별개인 또 다른 폐질환의 특성을 치료한다는 것을 나타낸다.
세 번째로, 본 명세서에서 기술한 공개 실험 (open-label), 임상 시험에서는, 상기 논의한 2개의 임상 시험 환자들에게 다양한 28일 코스로 AZLI로 치료하고, 교차로 28일의 휴약기를 갖다록 치료하였다. 이 실험에서는, 앞서 논의한 실험에서 사용된 종래의 임상적 매개변수와 CFQ-R 호흡기 영역을 평가하였다. AZLI는 일관되게 각 치료 기간 동안의 CFQ-R 호흡기 영역에서의 증가를 생산하는데, 이는 AZLI가 다양한 치료 코스에 걸쳐 낭포성 섬유증 환자들에 있어서 HRQOL에 대하여 지속 가능한 효과를 생산한다는 것을 증명하는 것이다. 또한, 예상치 않게도 28일의 휴약기 동안, CFQ-R 호흡기 영역 점수는 환자가 연구에 참여할 때 보여준 기준치 농도까지는 감소되지 않았는데, 이는 약 치료를 중단한 후에도 오랜 기간 동안 AZLI의 효과가 지속됨을 보여준다. 치료의 복합 사이클 (multiple cycles) 동안의 CFQ-R 점수의 지속적인 증가는 임상적 효율, 폐 기능 (FEV1), 및 PA 가래 밀도의 종래 측정된 효과와 대비되며, 복합 사이클 후 반응은 약화된다. 복합 사이클 동안의 약화된 FEV1와 PA 가래 밀도 반응은, TSI 등록 실험에서 폐 기능과 박테리아 밀도 변화가 세 번째 치료 사이클에 의하여 약화되었기 때문에 항생제 효과를 갖는 것으로 예상된다. 이는, AZLI의 CFQ-R 효과는 그것의 항생제 효과와는 구별되며, AZLI가 예상치 않게도 폐 기능과 가래 내의 박테리아 밀도로 측정된 것과는 별개의 낭포성 섬유증과 폐질환의 또 다른 특성을 치료한다는 것을 보여준다.
AZLI로 1일 2회 치료, 1일 3회 치료 간의 차이도 예상 밖이었다. 3번째 치료 사이클에 의한 CFQ-R 호흡기 영역 점수에서의 증가는 1일 3회 군 내에서는 유지되었지만, 1일 2회 군 내에서는 크게 약화되었다. 이는 뜻 밖이었으며, CF 흡입 항생제 실험에서 나타난 최초 식이 요법 반응이다.
따라서, AZLI는 낭포성 섬유증 환자에게서 기타의 흡입용 항생제로 인하여 나타나지 않은 예상치 않은 HRQOL 임상적 효과를 초래한다. 이러한 HRQOL 효과는 심지어 AZLI 치료의 중단 후에도 지속된다. 임상적 효율의 종래 측정이 치료 전 농도로 회복되고, 종래의 임상적 측정에 대한 반응들이 약화될 때, 복합 치료 코스 동안에 HRQOL 효과가 지속되는 것은, 그것의 항생제 효과와는 별개인 낭포성 섬유증과 폐질환의 특성을 AZLI가 치료한다는 것을 증명하는 것이다.
본 발명의 목적은, 이를 필요로 하는 환자에게 폐질환의 건강 관련 삶의 질 증상 중 최소 1개 이상을 예방, 개선, 치료학적으로 치료하기 위하여 흡입용 아즈트레오남 라이신을 투여하는 것을 포함하는 방법을 제공하는 것이다. 폐질환의 비제한적인 예로는, 천식, 만성 폐쇄성 폐질환 (Chronic Obstructive Pulmonary Disease; COPD), 낭포성 섬유증, 기관지 확장증, 기계환기 폐렴, 천식, 폐기종, 만성 기관지염, 그리고 특발성 폐섬유증이 있다.
도 1은 임상 시험 Ⅰ을 위한 연구 고안 및 환자 기질. 환자들 모두는 공개 TIS 실험 (run-in)을 시행하기 전에, 무작위로 AZLI/위약군 치료에 배정하였다; TIS 실험의 중단 이유는 무작위 군에 의하여 나타냈다. 기준치 (0일)에서 연구에 남겨진 211 환자들은 최소 1회 AZLI/위약을 투여받았으며, 처리 의향 분석 (intent to treat; ITT) 군을 포함한다.
도 2는 폐의 악화를 나타내는 증상을 치료하기 위한 추가의 흡입 또는 Ⅳ 항슈도모나스 항생제를 필요로 하는 시간. 미리 정의한 증상들 (운동 내성 감소, 기침 증가, 가래/가슴 답답함 증가, 또는 식욕의 감소)을 치료하기 위하여 추가적인 항생제를 필요로 하는 것 이외의 이유로 인하여 연구를 중단한 환자들의 데이타는 삭제하였다. 항생제를 요구하는 평균 시간을 양 치료군 (AZLI vs. 위약군, P=0.007)에 대하여 나타냈다.
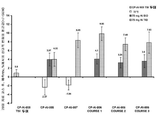
도 3은 CFQ-R-호흡기 점수, FEV1, 및 PA 가래 밀도의 평균값에서의 변화. 어린이, 청소년, 그리고 성인 CFQ-R-호흡기 점수를 합산하였다. CFQ-R은 42일에는 투여되지 않았다. CFQ-R-호흡기에 있어서, 28일 시점에서, AZLI-BID 대 위약군에서는 P=0.021이고, AZLI-TID 대 위약군에서는 P=0.092이었다. 28일 시점에서, FEV1는 AZLI-BID 대 위약군에서는 P=0.006이고, AZLI-TID 대 위약군에서는 P=0.005이었다. 28일 시점에서, PA 밀도 (log10 PA CFU/그램 가래)는 AZLI-BID 대 위약군에서는 P=0.011이고, AZLI-TID 대 위약군에서는 P=0.031이었다.
도 4는 FEV1에서 관찰된 백분율 변화. 28일째, 환자들은 무작위로 치료군으로 배정되었고, 공개 실험, TIS 시행 기간 동안 모든 3개의 치료군은 TIS를 투여받았다. AZLI/위약군 치료는 0일째 시작하였다.
도 5는 28일째 기준치 FEV1로부터의 백분율 변화 대 AZLI-BID, AZLI-TID 및위약군 치료군 내에서의 각 환자에 대한 28일째 기준치 CFQ-R-호흡기 점수로부터의 변화.
도 6은 임상 시험 Ⅱ을 위한 연구 고안 및 환자 기질.
도 7은 CFQ-R-호흡기 점수, FEV1 및 가래 PA 밀도의 보정 평균: 기준치부터 연구 종료시까지의 변화 (0~42일). CFQ-R-호흡기 점수에 대한 어린이, 청소년 및 성인 반응은 합산하였다.
도 8은 CFQ-R-호흡기 점수와 FEV1에 대한 치료의 기준치에서 종료시까지의 변화: 연령의 효과와 CF 페 질환 심각도 기준치. 환자 수는 분석 연구에 포함된다: 모든 환자: AZLI, 80; 위약군, 83/84; 질환 심각성-보통: AZLI, 50; 위약군, 53/54; 질환 심각성-중증: AZLI, 30; 위약군, 30; 연령<18 세: AZLI, 21; 위약군, 16; 연령≥18세: AZLI, 59; 위약군, 67/68.
도 9는 28일의 AZLI 치료과정 동안 CFQ-R 호흡기 증상 영역 점수의 변화.
도 10은 28일에 걸친 AZLI 치료 코스에 걸쳐 예측된 FEV1%에서의 상대적 변화의 평균값.
도 2는 폐의 악화를 나타내는 증상을 치료하기 위한 추가의 흡입 또는 Ⅳ 항슈도모나스 항생제를 필요로 하는 시간. 미리 정의한 증상들 (운동 내성 감소, 기침 증가, 가래/가슴 답답함 증가, 또는 식욕의 감소)을 치료하기 위하여 추가적인 항생제를 필요로 하는 것 이외의 이유로 인하여 연구를 중단한 환자들의 데이타는 삭제하였다. 항생제를 요구하는 평균 시간을 양 치료군 (AZLI vs. 위약군, P=0.007)에 대하여 나타냈다.
도 3은 CFQ-R-호흡기 점수, FEV1, 및 PA 가래 밀도의 평균값에서의 변화. 어린이, 청소년, 그리고 성인 CFQ-R-호흡기 점수를 합산하였다. CFQ-R은 42일에는 투여되지 않았다. CFQ-R-호흡기에 있어서, 28일 시점에서, AZLI-BID 대 위약군에서는 P=0.021이고, AZLI-TID 대 위약군에서는 P=0.092이었다. 28일 시점에서, FEV1는 AZLI-BID 대 위약군에서는 P=0.006이고, AZLI-TID 대 위약군에서는 P=0.005이었다. 28일 시점에서, PA 밀도 (log10 PA CFU/그램 가래)는 AZLI-BID 대 위약군에서는 P=0.011이고, AZLI-TID 대 위약군에서는 P=0.031이었다.
도 4는 FEV1에서 관찰된 백분율 변화. 28일째, 환자들은 무작위로 치료군으로 배정되었고, 공개 실험, TIS 시행 기간 동안 모든 3개의 치료군은 TIS를 투여받았다. AZLI/위약군 치료는 0일째 시작하였다.
도 5는 28일째 기준치 FEV1로부터의 백분율 변화 대 AZLI-BID, AZLI-TID 및위약군 치료군 내에서의 각 환자에 대한 28일째 기준치 CFQ-R-호흡기 점수로부터의 변화.
도 6은 임상 시험 Ⅱ을 위한 연구 고안 및 환자 기질.
도 7은 CFQ-R-호흡기 점수, FEV1 및 가래 PA 밀도의 보정 평균: 기준치부터 연구 종료시까지의 변화 (0~42일). CFQ-R-호흡기 점수에 대한 어린이, 청소년 및 성인 반응은 합산하였다.
도 8은 CFQ-R-호흡기 점수와 FEV1에 대한 치료의 기준치에서 종료시까지의 변화: 연령의 효과와 CF 페 질환 심각도 기준치. 환자 수는 분석 연구에 포함된다: 모든 환자: AZLI, 80; 위약군, 83/84; 질환 심각성-보통: AZLI, 50; 위약군, 53/54; 질환 심각성-중증: AZLI, 30; 위약군, 30; 연령<18 세: AZLI, 21; 위약군, 16; 연령≥18세: AZLI, 59; 위약군, 67/68.
도 9는 28일의 AZLI 치료과정 동안 CFQ-R 호흡기 증상 영역 점수의 변화.
도 10은 28일에 걸친 AZLI 치료 코스에 걸쳐 예측된 FEV1%에서의 상대적 변화의 평균값.
CFQ-R 기술
상기 CFQ-R은 환자 보고 결과에 대한 최근의 FDA 초안 지침을 만족하는 건강 관련 삶의 질 평가를 입증한다 (Henry, B., Qual . Life Res . 2003, 12:63-76; Quittner, A.L., Chest, 2005, 128:2347-54; Modi A.C., J. Ped . Psychol . 2003, 28:535-46; Quittner, A.L., Cystic Fibrosis Foundation. CFQ-R cystic fibrosis questionnaire: a health-related quality of life measure, 2000). 상기 영역들은 신체적, 활력, 정서적, 식욕, 치료 부담, 건강 인식, 사회적, 신체 이미지, 역할/학교 생활, 체중, 호흡 및 소화를 포함한다. 영역의 수는 사용되어지는 CFQ-R 포맷에 따라 다양할 수 있다. CRF에 대한 자료를 수집하기 위하여 4가지의 설문지 포맷을 사용하였다:
자기 기입:
● 6세 내지 13세의 어린이 (부모 또는 돌봐주는 사람에 의하여 작성됨, 자기 보고 포맷)
● 12세 내지 13세의 어린이 (어린이에 의하여 작성됨)
● 청소년과 14세 이상의 성인 (부모에 의하여 작성됨)
면담자 주관 기입:
● 6세 내지 11세 (연구 간호사 또는 연구 코디네이터에 의하여 작성됨, 면담자 포맷)
어린이의 경우, 면담자 주관 포맷 (6세 내지 11세)과 어린이에 의하여 작성된 설문지 (12세와 13세)는 동일하다. 보고를 목적으로, 이러한 2개의 포맷의 결과를 합산하고 "어린이" 버전이라고 언급하였다.
각 CFQ-R 버전에서의 각 영역에 관한 설문을 표 1에 나타냈다.
| 영역 ( Domain ) | 버젼 ( Version ) | ||
| 부모/돌봐주는 사람 | 어린이 | 청소년/성인 | |
| 신체적 | 1-5, 13-16 | 1-6 | 1-5, 13, 19-20 |
| 활력 | 8-12 | - | 6, 9-11 |
| 정서적 | 6-7, 23, 25-26 | 7-14 | 7-8, 12, 31, 33 |
| 식욕 | 17, 44 | 15, 17, 19 | 14, 21, 50 |
| 치료 부담 | 18, 30-31 | 16, 18, 30 | 15-17 |
| 건강 인식 | 22, 24, 32 | - | 18, 32, 34 |
| 사회적 | - | 20-26 | 22-23, 27-30 |
| 신체 이미지 | 19-21 | 27-29 | 24-26 |
| 역할/학교 생활 | 27-29 | - | 35-38 |
| 체중 | 33 | - | 39 |
| 호흡 | 34-36, 38-40 | 31-34 | 40-42, 44-46 |
| 소화 | 41-43 | 35 | 47-49 |
각 CFQ-R 영역에 대한 등급 점수는 아래와 같이 계산하였다:
각 설문에 대한 응답 (점수)은 CFQ-R에 나타내기 위하여 1 내지 4로 할당될 것이다. 각 특정 응답에 표기된 배정된 수를 갖는 설문에 있어서, 상기 수가 응답 점수가 될 것이다. 부모/돌봐주는 사람 버젼, 설문 37 (SAS Program Codes for Scoring the CFQ-R Parent/caregiver Verision, CFQ-R handbook [Section 13.3.2]) and Teen/Adult version, Question 43 (SAS Program Codes for Scoring the CFQ-R Teen/Adult Version, CFQ-R handbook [Section 13.3.2])와 청소년/성인 버젼, 설문 43 ( SAS Program Codes for Scoring the CFQ-R Teen/Adult Version, CFQ-R handbook [Section 13.3.2])은 관련 영역 점수의 일부가 되지는 않을 것이다. 표 2의 설문에 대한 응답은 점수가 뒤집힐 것이다.
| 버젼 ( Version ) | 점수가 뒤집힌 설문 |
| 부모/돌봐주는 사람 | 6, 10, 12, 15, 22, 24, 28, 31, 32 |
| 어린이 | 1, 2, 3, 4, 5, 14, 18, 19, 20, 22, 24, 26 |
| 청소년/성인 | 6, 10, 13, 15, 17, 18, 23, 28, 30, 32, 34, 35 |
즉, 상기 설문 응답에 대하여, 점수 1은 4에서 시작할 것이고, 점수 2는 3에서 시작할 것이고, 점수 3은 2에서 시작할 것이고, 점수 4는 1에서 시작할 것이다.
만약, 참여자가 설문을 생략한다면, 상기 응답은 누락으로 시작될 것이다. 누락값은 관련 영역 내의 모든 완료된 응답의 평균값으로 입력될 것이다. 만약, 동점이 발생한 경우 그 평균이 정수(整數)가 아니라면, 상기 값은 정수보다 낮도록 입력, 예를 들면, 평균값이 2.5라면 2로 기입되어야 한다. 만약, 특정 영역에서의 응답이 반 이상 누락된 경우라면, 값은 입력하지 않고, 영역 점수도 계산하지 않는다.
등급 영역 점수는 다음과 같이 계산될 것이다 (만약, 영역 응답의 최소한 반이 누락되지 않았을 시):
발명의 양태
한 가지 양태에 있어서, 본 발명은 폐질환의 건강 관련 삶의 질 증상들 중 한 가지 이상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에 있어서, 본 발명은 폐질환의 건강 관련 삶의 질 증상들 중 한 가지 이상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다.
이 양태의 또 다른 실시 상태에 있어서, 상기 환자는 그람 음성 박테리아에 의한 만성 폐질환 세균 감염증을 갖는다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250 mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 네뷸라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 대개 약 1 내지 5 ㎛의 공기 역학적 중량 평균 직경 (mass median aerodynamic diameters; MMAD)을 포함하는 에어로졸 입도를 전달하기에 적당한 전자식 네뷸라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회의 복용량으로 투여되는데, 각 복용량은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함하고, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 연속하여 최소 14일간 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
이 양태의 또 다른 실시 상태에 있어서, 본 발명은 낭포성 섬유증의 건강 관련 삶의 질 증상들 중 한 가지 이상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 약 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증의 건강 관련 삶의 질 증상들 중 한 가지 이상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 아즈트레오남 라이신의 총 복용량은 1일 약 750 mg 보다는 높지 않다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회 내지 10회로 투여되고, 각 복용량은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함하고, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 14일 연속하여 투여되고, 상기 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에 있어서, 본 발명은 CF 개정 설문지의 모든 증상 영역의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 전부를 치료하기 위하여, 이를 필요로 하는 낭포성 섬유증 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 상기 흡입 가능한 건조 분말 또는 에어로졸은 1일 3 내지 10회, 연속하여 14일 내지 28일간 투여되고, 상기 총 1일 투여량은 하루에 750 mg을 초과하지는 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250 mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 네뷸라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 대개 약 1 내지 5 ㎛의 MMAD을 포함하는 에어로졸 입도를 전달하기에 적당한 전자식 네뷸라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회의 복용량으로 투여되는데, 각 복용량은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함하고, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 14일 연속하여 투여되는데, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되는데, 상기 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 호흡기 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 호흡기 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 복용량은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함하고, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 상기 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 호흡기 증상 영역 점수는 투여 초기시의 점수에 비하여 최소 5 포인트 증가하였다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 신체 이미지 증상을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 신체 이미지 증상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 소화 증상영역을 치료하기 위 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 소화 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 1일 복용량으로 약 1 내지 약 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸을 유효 치료랑으로 폐 기관지 공간의 기도로 투여하는 것을 포함하는, CF 개정 설문지의 식사 증상 영역을 치료하기 위한 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 식사 증상을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 정서적 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 정서적 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 건강 인식 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 건강 인식 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 신체적 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 신체적 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 역할/학교 생활 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 역할/학교 생활 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 사회적 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 사회적 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 치료 부담 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 치료 부담 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 활력 증상영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 활력 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 체중 증상 영역을 치료하기 위하여, 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하는 것을 포함하는 방법을 제공한다.
또 다른 양태에서, 본 발명은 낭포성 섬유증 환자의 CF 개정 설문지의 체중 증상 영역을 치료하기 위하여, 이를 필요로 하는 환자에게 1회 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 폐 기관지 공간의 기도에 투여하되, 여기서 흡입 가능한 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여되고, 총 1일 투여량은 1일 750 mg을 넘지 않도록 투여되는 것을 포함하는 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸 복용량은 약 75 mg의 아즈트레오남을 포함한다. 이 양태의 또 다른 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3 내지 10회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 특히 양호한 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회, 최소 28일 연속하여 투여되고, 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
또 다른 양태에서, 본 발명은 흡입 가능한 아즈트레오남 에어로졸의 유효 치료량을 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여하되, 상기 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달되는 것을 포함하는, 이를 필요로 하는 낭포성 섬유증 환자에게 CF 개정 설문지의 증상 영역의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 전부를 치료하기 위한 방법을 제공한다. 이 양태의 하나의 실시 상태에 있어서, 흡입 가능한 아즈트레오남 라이신의 복용량은 1일 3 내지 10회, 연속하여 최소 28일간 투여된다. 이 양태의 또 다른 실시 상태에서, 상기 CFQ-R의 증상 영역은 호흡기 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 투여 초기에 비하여 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 정서적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 식사 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 치료 부담 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 건강 인식 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 사회적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체 이미지 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 역할/학교 생활 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 체중 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 소화 영역이다.
또 다른 양태에서, 본 발명은 CF 개정 설문지의 증상 영역의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 전부를 치료하기 위하여, 이를 필요로 하는 낭포성 섬유증 환자에게 흡입 가능한 아즈트레오남 에어로졸의 유효 치료량을 1일 3회 내지 10회, 연속하여 최소 14일 내지 28일간 투여하는 것을 포함하는 방법을 제공하되, 상기 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달되며, 상기 환자는 폐의 녹농균 (Pseudomonas aeruginosa)을 갖는다. 이 양태의 하나의 실시 상태에 있어서, 흡입 가능한 아즈트레오남 라이신의 복용량은 1일 3 내지 10회, 연속하여 28일간 투여된다. 이 양태의 또 다른 실시 상태에서, 상기 CFQ-R의 증상 영역은 호흡기 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 투여 초기에 비하여 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 정서적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 식사 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 치료 부담 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 건강 인식 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 사회적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체 이미지 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 역할/학교 생활 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 체중 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 소화 영역이다.
휴약기 조건
본 발명의 하나의 양태에 있어서, AZLI 치료는 기타 약, 특히 항생제 치료 코스 중에 배치하거나, 휴약기, 즉 기타 약제가 투여되지 않을 때 배치하였다. 제한되지 않는 실시예에 따르면, 환자에게 흡입용 토브라마이신 용액이 28일간 보통의 처방 과정으로 투여되고, 뒤이어 14일 내지 28일의 AZLI의 치료 코스로 투여된다. 별법으로, 상기 환자에게 AZLI가 14일 내지 28일의 치료 코스로 투여되고, 뒤이어 흡입용 토브라마이신 용액이 보통의 처방된 과정으로 투여된다 (28일). 별법으로, 환자는 14일 내지 28일의 AZLI 치료 코스로 투여되고, 뒤이어 14일 내지 28일간은 어떠한 약제도 투여하지 않는 휴약기를 갖는다. 이러한 교대되는 치료 코스들 모두는 반복될 수 있다. 즉, 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10회 적용될 수 있다.
또 다른 양태에 있어서, 본 발명은 개정 CF 설문지의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 모든 증상 영역을 치료하기 위하여, 폐의 녹농균 감염을 갖는 환자에게 흡입 가능한 에어로졸 아즈트레오남 라이신의 유효 치료량을 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여하는 것을 포함하는 방법을 제공하되, 상기 각 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 하나의 실시 상태에서, 흡입 가능한 아즈트레오남 라이신 에어로졸의 복용량은 1일 3 내지 10회, 연속하여 최소 28일간 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 아즈트레오남 라이신 에어로졸의 복용량은 1일 3회, 연속으로 최소 28일간 투여된다. 이 양태의 또 다른 실시 상태에서, 상기 CFQ-R의 증상 영역은 호흡기 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 흡입 가능한 에어로졸의 투여 초기에 비하여 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 환자의 녹농균 가래 밀도가 흡입 가능한 에어로졸의 투여를 중단 후, 치료 전 농도로 증가한 후, 증가된 채로 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 활력 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 정서적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 식사 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 치료 부담 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 건강 인식 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 사회적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체 이미지 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 역할/학교 생활 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 체중 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 소화 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 낭포성 섬유증 환자는 28일 연속 기간 동안 흡입용 토브라마이신 용액으로 전술한 과정으로 종래에 치료를 받았다. 이 양태의 또 다른 실시 상태에 있어서, 상기 낭포성 섬유증 환자는 AZLI로 14일 내지 28일간 연속하여 치료받고, 뒤이어 28일 연속 기간 동안 흡입용 토브라마이신 용액으로 전술한 표준 과정으로 치료받았다.
또 다른 양태에서, 본 발명은 개정 CF 설문지의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 모든 증상 영역을 치료하기 위하여, 이를 필요로 하는 폐의 녹농균 감염을 갖는 환자에게 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간, 흡입 가능한 에어로졸 아즈트레오남 라이신의 유효 치료량을 투여한 다음, 연속하여 14일 내지 28일간 휴약 기간을 두는 것을 포함하는 방법을 제공하되, 상기 흡입 가능한 에어로졸의 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에서, 상기 CFQ-R의 증상 영역은 호흡기 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 흡입 가능한 에어로졸의 투여 초기에 비하여 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 호흡기 영역이며, 상기 영역 점수는 환자의 녹농균 가래 밀도가 흡입 가능한 에어로졸의 투여를 중단 후, 치료 전 농도로 증가한 다음 증가된 채로 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 활력 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 정서적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 식사 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 치료 부담 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 건강 인식 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 사회적 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 신체 이미지 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 역할/학교 생활 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 체중 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 상기 CFQ-R의 증상 영역은 소화 영역이다. 이 양태의 또 다른 실시 상태에 있어서, 치료 요법은 1, 2, 3, 4, 5, 6, 7, 8 또는 9번 반복된다.
또 다른 양태에 있어서, 본 발명은 CF 개정 설문지의 호흡기 증상 영역을 치료하기 위하여, 이를 필요로 하는 낭포성 섬유증 환자에게 아즈트레오남 라이신의 흡입 가능한 에어로졸의 유효 치료량을 1일 3 내지 10회, 연속하여 14일 내지 28일간 투여하는 것을 포함하는 방법을 제공하되, 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3회 내지 10회, 연속하여 최소 28일간 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 호흡기 영역 점수는 흡입 가능한 에어로졸 투여 초기에 비하여 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 호흡기 영역 점수는 상기 영역 점수는 환자의 녹농균 가래 밀도가 흡입 가능한 에어로졸의 투여를 중단 후, 치료 전 농도로 증가한 다음 증가된 채로 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 낭포성 섬유증 환자는 종래에 상기 낭포성 섬유증 환자는 28일 연속 기간 동안 흡입용 토브라마이신 용액으로 전술한 과정으로 종래에 치료를 받았고, 호흡기 영역 점수는 아즈트레오남 라이신의 흡입 가능한 에어로졸의 투여 개시시에 비하여 최소 5 포인트 증가하였다.
또 다른 양태에 있어서, CF 개정 설문지의 호흡기 증상 영역을 치료하기 위하여, 이를 필요로 하는 낭포성 섬유증 환자로 폐의 녹농균 감염을 가진 환자에게 아즈트레오남 라이신의 흡입 가능한 에어로졸의 유효 치료량을 1일 3 내지 10회, 연속하여 14일 내지 28일간 투여한 다음, 연속하여 14일 내지 28일간 휴약 기간을 두는 것을 포함하는 방법을 제공하되, 흡입 가능한 에어로졸 복용량은 약 0.17%, w.v의 염화나트륨을 포함하는 1mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하며, 약 1 내지 5 ㎛의 MMAD를 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸은 1일 3 내지 10회 투여된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 호흡기 영역 점수는 흡입 가능한 에어로졸 투여 후 최소 5 포인트 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 호흡기 영역 점수는 흡입 가능한 에어로졸 투여 중단 후, 환자의 녹농균 가래 밀도가 최소한 치료 전 농도로 증가한 후, 증가된 채로 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 투여 요법은 1, 2, 3, 4, 5, 6, 7, 8 또는 9번 반복된다. 이 양태의 또 다른 실시 상태에 있어서, 상기 투여 요법은 1, 2, 3, 4, 5, 6, 7, 8 또는 9번 반복되고, 최소 1개의 투여 요법 동안의 호흡기 영역 점수는 투여 요법을 최소 1번 시작할 때의 점수에 비하여 최소 5 포인트까지 증가하였다. 이 양태의 또 다른 실시 상태에 있어서, 상기 투여 요법은 1, 2, 3, 4, 5, 6, 7, 8 또는 9회 반복되고, 최소 1회의 투여 요법 도중에 호흡기 영역 점수는, 휴약기 도중의 환자의 녹농균 가래 밀도가 최소한 상기 투여 요법의 개시시의 밀도로 증가하여 증가된 채로 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 흡입 가능한 에어로졸 투여 후의 호흡기 영역 점수는 전체 휴약기 동안 흡입 가능한 에어로졸 투여 전의 상기 호흡기 영역 점수보다 높게 유지된다. 이 양태의 또 다른 실시 상태에 있어서, 아즈트레오남 라이신의 흡입 가능한 에어로졸은 1일 3회, 연속하여 최소 28일간 투여된다.
추가의 양호한 실시 상태
1. 폐질환의 건강 관련 삶의 질 증상의 한 가지 이상을 치료하기 위하여, 이를 필요로 하는 환자에게 1일 복용량당 약 1 내지 250 mg의 아즈트레오남 라이신을 포함하는 흡입 가능한 건조 분말 또는 에어로졸의 유효 치료량을 투여하는 것을 포함하는 방법.
2. 실시 상태 2의 방법에 있어서, 흡입 가능한 건조 분말 또는 에어로졸은 1일 3 내지 10회, 연속하여 최소 14일 내지 28일간 투여된다.
3. 실시 상태 1 또는 2의 방법에 있어서, 환자는 그람 음성 박테리아에 의한 폐 감염을 갖는다.
4. 실시 상태 1 내지 3 중 어느 하나의 방법에 있어서, 폐질환은 낭포성 섬유증이다.
5. 실시 상태 4의 방법에 있어서, 건강 관련 삶의 질 증상은 개정된 섬유성 낭포증 설문지의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 모든 영역이다.
6. 실시 상태 5의 방법에 있어서, 상기 영역은 호흡기 영역, 신체 이미지 영역, 소화 영역, 식사 영역, 정서적 영역, 건강 인식 영역, 신체적 영역, 역할/학교 생활 영역, 사회적 영역, 치료 부담 영역, 활력 영역 및 체중 영역으로 구성된 군으로부터 선택된다.
7. 실시 상태 6의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸의 투여 바로 이전의 점수에 비하여 최소 5 포인트까지 증가된다.
8. 실시 상태 1 내지 7 중 어느 하나의 방법에 있어서, 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 1회 복용량당 약 1 내지 약 250mg의 아즈트레오남 라이신을 포함한다.
9. 실시 상태 1 내지 8 중 어느 하나의 방법에 있어서, 흡입 가능한 에어로졸은 약 1 내지 5 ㎛의 공기 역학적 중량 평균 직경을 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 뉴블라이저에 의하여 전달된다.
10. 실시 상태 1 내지 9 중 어느 하나의 방법에 있어서, 흡입 가능한 에어로졸의 복용량은 1일 3회 투여된다.
11. 실시 상태 6 내지 10 중 어느 하나의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸의 투여 바로 전의 점수에 비하여 최소 5 포인트까지 증가하였다.
12. 실시 상태 1 내지 11 중 어느 하나의 방법에 있어서, 흡입 가능한 에어로졸의 각 복용량은 약 0.17%, w/v의 염화나트륨을 포함하는 약 1 mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함한다.
13. 실시 상태 6 내지 12 중 어느 하나의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸의 투여 바로 전의 점수에 비하여 최소 5 포인트까지 증가하였다.
14. 실시 상태 1 내지 13 중 어느 하나의 방법에 있어서, 환자는 폐의 녹농균 감염을 가진다.
15. 실시 상태 1 내지 14 중 어느 하나의 방법에 있어서, 흡입 가능한 에어로졸의 투여는 표준 처방된 28일의 토브라마이신 흡입 용액의 투여에 비하여 선행된다.
16. 실시 상태 6 내지 15 중 어느 하나의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸의 투여 바로 전의 점수에 비하여 최소 5 포인트까지 증가하였다.
17. 실시 상태 6 내지 16 중 어느 하나의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸의 투여 바로 전의 점수에 비하여 최소 5 포인트까지 증가하였다.
18. 실시 상태 6 내지 17 중 어느 하나의 방법에 있어서, 호흡기 영역 점수는 흡입 가능한 에어로졸 투여의 중단 후 환자의 녹농균 가래 밀도가 최소한 치료 전 농도로 증가한 후, 증가된 채로 유지되었다.
19. 실시 상태 2 내지 18 중 어느 하나의 방법에 있어서, 최소 1회의 연속하여 14일 내지 28일간의 흡입 가능한 에어로졸을 투여한 다음, 14일 내지 28일간의 휴약기가 이어진다.
20. 실시 상태 2 내지 19 중 어느 하나의 방법에 있어서, 최소 1회의 연속하여 14일 내지 28일간의 흡입 가능한 에어로졸을 투여한 다음, 연속하여 14일 내지 28일간의 휴약기는 투여 요법으로 정의되고 1 내지 9회 반복된다.
21. 실시 상태 2 내지 20 중 어느 하나의 방법에 있어서, 최소 1회의 요법 도중에, 연속하여 14일 내지 28일간의 흡입 가능한 에어로졸 투여한 다음, 호흡기 영역 점수는 연속하여 14일 내지 28일간 흡입 가능한 에어로졸을 투여하기 바로 전의 점수에 비하여 최소 5 포인트까지 증가하였다.
22. 실시 상태 2 내지 21 중 어느 하나의 방법에 있어서, 최소 1회의 투여 요법 도중에, 14일 내지 28일의 흡입 가능한 에어로졸 투여에 따른 호흡기 영역 점수는, 휴약기 동안 환자의 녹농균 가래 밀도가 최소한 상기 투여 요법의 개시시의 농도로 증가한 후, 연속적인 14일 내지 28일간의 흡입 가능한 에어로졸 투여 바로 전 점수에 비하여 증가된 채로 유지된다.
23. 실시 상태 2 내지 22 중 어느 하나의방법에 있어서, 상기 투여 요법은 최소 3회 반복되고, 호흡기 영역 점수는 첫 번째 요법 바로 전의 점수에 비하여 증가되었다.
흡입용
아즈트레오남
라이신 (
AZLI
)
달리 나타내지 않는 한, 본 명세서에서 사용된 아즈트레오남 라이신과 아즈트레오남 라이신네이트는 동의어다. 흡입용 아즈트레오남 라이신은 알파-아즈트레오남과 L-라이신을 결합하여 형성한 흰색 내지 황백색의 분말이다 (몽트고메리, ㅁ미미국 특허 6660249, 7,138,419, 7208,141, 7,214,364, 미국 특허 출원 11/732,234 및 11/729,698; 각각은 전체로서 본 명세서에 참조로 포함된다). 생성물의 아즈트레오남 대 L-라이신 모노하이드레이트의 몰비는 1.9:1이다. 따라서, 제한되지 않는 실시예의 방법에 의하여, 양호한 단일 복용 형태에 있어서, 흡입용 아즈트레오남 라이신은 75 mg의 아즈트레오남과 52.5 mg의 L-라이신 모노하이드레이트 (46.7 mg의 L-라이신)을 포함한다.
AZLI는 에어로졸 또는 건조 분말로서 폐 기관지 공간의 기도로 효과적으로 전달하는데 적합하다. 가장 좋기로는, AZLI는 에어로졸화를 위하여 미립화, 제트 (jet), 초음파, 가압, 진동 다공판 또는 등가 뉴블라이저에 의하여, 또는 대부분 아즈트레오남 라이신 에어로졸을 생산하는 건조 분말 흡입기에 의하여, 또는 약 1 내지 약 5 ㎛의 MMAD를 포함하는 건조 분말 입자에 의하여 농축된 아즈트레오남 라이신으로서의 제형이 적합하다.
AZLI는 미세하게 분쇄된 AZLI 분말을 기관지 내부 공간으로 효과적으로 전달하기 위하여 제형화된 건조 분말을, 건조 분말 또는 정량식 흡입기를 사용하여 기관지 내부로 투여될할 수 있다. 건조 분말의 이송을 위하여, 제형 내의 AZLI는 분쇄, 침강, 분무 건조 또는 기타의 방법으로 주로 약 1 내지 약 5 ㎛의 MMAD을 포함하는 입도로 공정화되었다.
에어로졸을 위한 AZLI 조성물은 폐 기관지 공간의 기도로 에어로졸화된 아즈트레오남 라이신의 효과적인 전달을 위하여 제형화된다. 에어로졸 제형은 1개의 흡입 복용량에 대하여 총 부피가 약 1 내지 5 mL인 수성의 생리적으로 허용 가능한 용액 내에서 전달된다. 본 발명의 방법에 따라 제형화되고 이송될 때, 이는 섬유성 낭포증의 건강 관련 삶의 질 증상들을 치료하기 위하여, 이를 필요로 하는 환자들에게 폐 기관지 공간의 기도에 대하여 유효 치료량의 아즈트레오남 라이신을 전달한다.
에어로졸화 가능한 제형들은 아즈트레오남 라이신의 최소이지만 효과적인 양으로 약 1 내지 약 250 mg, 더좋기로는 약 25 내지 약 150 mg/mL, 가장 좋기로는 약 122 mg/mL을 함유하고, 약간의 염분과 특정 pH 범위를 갖는 생리학적으로 허용 가능한 희석제의 최소한의 가능한 부피 내에서 제형화하였다. 환자에 의하여 충분히 용인되고 기관지 경련과 기침 등과 같은 바람직하지 않은 부작용의 발생을 최소화하는 아즈트레오남 라이신 에어로졸의 생산이 가능하도록, 아즈트레오남 라이신의 농도, 염분 및 pH 범위는 조정하였다.
비제한적으로, 양호한 단일 복용량 제형에 있어서, AZLI를 에어로졸화에 의한 투여 직전에 약 0.17% 염화나트륨, w/v의 약 1 mL에 용해하였다.
미립화, 제트 (jet), 초음하, 가압, 진동 다공판 또는 등가 뉴블라이저에 의한 수성 제형의 조합은 뉴블라이저에 따라, 최소 약 20 내지 90%, 가장 전형적으로는 70%, 폐의 기도로 아즈트레오남 라이신의 투여된 복용량의 전달이 가능하게 한다.
AZLI
의 전달 기구
뉴블라이저
상기 기술한 본 발명에 의한 조성물은 아즈트레오남 라이신의 유효 치료량의 전달을 가능하게 하는 용액 내에 제형화된 AZLI를 ㎛제공가, 효율적인 약의 전달을 위하여 요구되는 분무화 기준에 의하여 생성되어 제공된다. 따라서, AZLI의 제형을 에어로졸화하는 뉴블라이저는 본 발명의 중요한 특징이다. 비록 많은 뉴블라이저 종류가 구매 가능하지만, 모두가 본 발명의 실시에 적합한 것은 아니다.
뉴블라이저는 주로 수성 AZLI 제형을 대부분이 약 1 내지 약 5 ㎛의 MMAD를 포함하는 입자로 에어로졸화하는 능력에 근거하여 선택하였다. 제트 (jet), 초음파, 원자화 뉴블라이저는 필요한 MMAD가 지배적인 에어로졸 입자를 생산하도록 개발되었다.
또한, 뉴블라이저는 효과적인 복용량을 투여하는데 필요한 약값과 시간을 한정하기 위하여, 농축된 제형의 소량으로부터 필요한 입도의 에어로졸을 생산하는데 효율적이어야 한다. 수성 AZLI 제형과 분무 장치의 조합은 아즈트레오남 라이신 투여의 효율과 속도를 확연히 향상시킨다. 예를 들면, 토브라마이신 등과 같은 기타의 에어로졸화 약제의 평균 투여 시간은 복용량 당 15 내지 20분이다. 이 치료를 위하여 요구되는 시간은 환자에게는 중대한 부담으로 나타나며, 전술한 1일 2회 요법의 감소된 준수에 기여한다.
더욱이, 토브라마이신 투여에 사용된 뉴블라이저 시스템은 새로운 원자화 장치보다 덜 효율적이다. 폐에 침착되는 토브라마이신의 총 복용량은 12 내지 15% 범위; 대략 30%의 분산된 약제가 치료 종료 시점에서 뉴블라이저 내에 잔여한다; 그리고, 에어로졸화된 약제의 일부, 약 30%는 더 낮은 기도에 도달하기 위하여 너무 크거나 작은 입자로 방출되었다.
본 발명의 실시에 적합한 분무 장치로는, 특정의 pH, 삼투압 농도 및 염도를 갖는 특정 제형 내의 고도로 농축된 소량의 약제를 다루기 위한 원자화 뉴블라이저, 변경한 제트 뉴블라이저, 초음파 뉴블라이저 및 전자식 뉴블라이저가 포함된다. 특히 양호한 뉴블라이저는 미국 특허 5,152,456, 5,261,601, 5,518,179, 6,983,747, 6,962,151와 국제 출원 WO 01/034232에 개시된 Pari eFlowR 전자식 ㄴ뉴뉴블라이저이다; 각각은 전체로서 본 명세서에 참조로 통합된다. 산출량이 8 내지 10 mL/초, 또는 0.48 내지 0.60 mL/분인 원자화 뉴블라이저는, PARI LC plus NebulizerR등과 같은 종래의 뉴블라이저보다 2 내지 4배 빠르게 약 물질을 전달할 수 있다.
건조 분말 흡입제
건조 분말 흡입제로서 적합한 2개의 주요 고안이 있다. 하나의 고안은 약의 저장소가 내부에 있는 계량기가 장치 내에 위치하고, 환자는 1회분의 약을 흡입 챔버 내로 첨가한다. 두 번째는 각각의 독립적인 복용량이 분리된 용기 내에서 제조된 공장-계량된 장치이다. 양 시스템은 약 1 내지 약 5 ㎛의 MMAD를 갖는 소입자로의 약 제형에 의존하며, 보통 직경이 100 ㎛인 락토오스 입자 등의 더 큰 부형제 입자를 갖는 복합 제형을 포함한다. 건조 분말은 흡입 챔버 (기구 계량 또는 공장 계량된 복용량 중 어느 하나) 내에 두고, 환자의 흡기 유속은 장치로부터 분말이 나와서 구강으로 들어가는 것을 가속화한다. 상기 분말 경로의 비층류 특성은 분해를 위한 부형제의 뭉침을 야기하고, 상기 큰 부형제 입자의 덩어리는 목구멍 뒤쪽이 꽉 들어차는 것을 야기하는 반면, 더 작은 약 입자는 폐 내의 깊은 곳에 침착된다.
건조 분말 흡입기에 대한 현재의 기술은, 탑재허용중량이 약 분말의 100 mg이다. 따라서, 건조 분말 흡입기의 복합 활동과 그 후의 환자 흡입이, 이러한 장치를 갖는 아즈트레오남 라이신의 효과적인 복용량을 제공하기 위하여 요구될 수 있다.
정의
달리 언급하지 않으면, 본 명세서에서 사용된 하기의 용어들과 구(句)는 아래의 의미를 갖는 것으로 의도된다.
본 명세서에서 상표명이 사용될 때, 출원인들은 상표명 생산물과 활성 성분(들) 또는 상표명 생산물의 장치를 독립적으로 포함하는 것을 의도한다.
본 명세서에서 사용되는 "에어로졸"이라는 용어는, 달리 언급하지 않으면, 고운 액체 또는 고체 입자 또는 기체 내의 이들의 배합물의 현탁제를 의미한다. 본 명세서에서 사용된 바와 같이, 상기 용어는 에어로졸을 생산하는데 사용되는 제형도 포함할 것이다.
본 명세서에서 사용되는 "흡입 가능한 에어로졸"이라는 용어는, 달리 언급하지 않으면, 상기 정의한 바와 같이 생리학적으로 허용 가능하도록 조정한 에어로졸을 의미한다. 생리학적으로 허용 가능한 흡입 가능한 에어로졸을 제조하는데 있어서, 중요한 비제한적인 측면에는 pH, 삼투압 농도, 그리고 침투 가능한 음이온 농도가 포함된다. 본 명세서에서 사용된 바와 같이, 상기 용어는 또한, 흡입 가능한 에어로졸을 생산하는데 사용된 제형을 포함한다.
본 명세서에서 사용되는 "치료하는"이라는 용어는, 달리 언급하지 않으면, 그러한 용어가 적용되는 질병 또는 질환, 또는 그러한 질병 또는 질환의 증상의 1개 이상을 역전, 경감, 진척 방지 또는 예방하는 것을 의미한다.
"치료하는"의 비제한적인 실시예는 HRQOL 기구의 1개 이상의 영역의 점수를 증가시키는 것이다. 본 명세서에서 사용되는 "치료하는"이라는 용어는, 바로 상기에서 정의한 "치료하는"과 같이, 치료하는 활동을 의미한다.
본 명세서에서 사용되는 "유효 치료량"이라는 용어는, 달리 언급하지 않으면, 예상되는 생리학적 반응, 목적하는 생물학적 효과, 또는 그러한 조성물이 흡입에 의하여 투여될 때 ARQOL의 영역에서의 개선을 제공하기 위하여 치료받는 환자의 기도와 폐의 분비물과 조직 내로, 또는 별법으로, 혈류 내로 목적 수준의 약을 제공하는데 필요한, 흡입 가능한 에어로졸 등의 본 명세서에서 기술한 조성물 내에 존재하는 아즈트레오남 라이신의 양이다. 정확한 양은 예컨대, 특정 제형, 조성물의 특정 활성, 사용되는 운반 장치, 조성물의 물리적 특성 등의 다양한 요인들, 그것의 사용 목적뿐 아니라 질병 상태의 심각성, 환자의 협력 등과 같은 환자의 고려사항에 의하여 좌우될 수 있고, 본 명세서에서 제공된 정보에 기초하여 당해 기술의 숙련자에 의하여 손쉽게 결정될 수 있다.
"MMAD"라는 용어는 공기 역학적 중량 평균 직경을 의미한다.
입도에 관하여 언급할 때, "대부분" 또는 "우세한"이라는 용어는 1 ㎛ 내지 5 ㎛의 입도를 최소 70%, 좋기로는 90% 포함하는 것을 의미한다.
"w/v"라는 용어는 부피당 무게를 의미한다.
양에 관하여 사용된 한정어인 "약"은 명시한 값을 포함하며, 사정에 따라 좌우될 수 있다는 의미를 갖는다 (예컨대, 특정량의 측정에 관한 오류 정도를 포함한다).
"기술한 방침(들)"이라는 용어는, 등록된 양이 삽입된 라벨 또는 용기에 표시된 치료 방침을 의미한다.
"CFQ-R" 또는 "CF-개정 설문지"는 개정된 낭포성 섬유증 HRQRL 기구"를 의미한다.
"TIS"라는 용어는 토프라마이신 흡입용 용액, USP 또는 TOBIR을 의미한다.
"휴약"이라는 용어는 환자가 일정 기간 동안 약의 복용을 중단하는 것을 의미한다.
"녹농균 가래 밀도" 또는 "PA 가래 밀도"라는 용어는 녹농균에 대한 표준화한 미생물 배양 내의 집락 형성 단위 (colony forming units; CFU)의 수로 측정되는 환자 가래 내의 녹농균 (Pseudomonas aeruginosa)의 농도를 의미한다.
실시예
도입: 임상 시험 Ⅰ
본 명세서에서 기술된 연구는 집중 치료 환자 개체군 내의 AZLI의 유효성을 평가하는데 있어서, PA 기도 감염으로 인하여 항생제를 자주 이용하는 CF를 갖는 환자들을 포함하였다. 폐의 악화에 대한 초기 치료는 더 짧은 입원 기간을 야기하였다; 따라서, 입원 시간은 연구 종료점으로서 임상적 관련성이 떨어진다. 따라서, 임상적 악화는 새로운 기준으로 평가하였다: 폐 악화로 나타나는 증상들을 치료하기 위하여 추가적인 항슈도모나스 항생제를 필요로 하는 시간 (Rosenfeld, M, J. Pediatr 2001; 139:359-65). 임상적 증상에서 환자 보고 개선은 개정된 낭포성 섬유증 설문지, 승인된 건강 관련 삶의 질 측정으로 측정하였다. 본 연구에서 또한, 확립된 효율성 측정, FEV1에서의 변화가 포함될 수 있다. 이러한 종료시점의 조합은 AZLI 치료에 대한 폭넓은 환자의 반응을 제공하였다. 임상 시험 Ⅱ 에서 뒤이어 기술될 임상 연구는 항슈도모나스 항생체 치료를 자주 이용하는 CF 환자 내의 PA 기도 감염을 치료하기 위한 AZLI의 안정성 및 효율성을 평가하였다.
방법
연구 설계
무작위, 이중 맹검, 위약 조절된 연구를 56 US CF 센터에서 수행하였다 (2월, 2005-9월, 2006). 검사 후(42일, 도 1), 적격의 환자들을 등록하고 (28일), 75 mg AZLI (1일 2회 [BID] 또는 1일 3회 [TID]) 또는 위약 (1:1:1)을 무작위로 부여하고, 공개 실험 TIS (28일)로 치료를 시작하였다. 기준치 (0일)에서, 환자들은 TIS 코스를 완료하였고, 무작위로 AZLI/위약 치료를 시작하였다. 환자들을 치료 중간 (14일), 치료 종료 시점 (28일), 그리고 확인 절차 시점 (42, 56, 70, 84일)에서 관찰하였다.
검사시, 완전한 신체적 조사를 수행하였다. 폐활량 측정 (미국인 흉부 집단 표준들)을 연구 방문시마다 수행하였다 (치료 전과 임의의 치료 30분 후) (Am J Respir Crit Care Med 1995;152:1107-36). 예측 FEV1 % 값은 Knudson equation을 사용하여 계산하였다 (Knudson, RJ, Am Rev Respir Dis 1983;127:725-34).
TIS (300 mg, BID)를 PARI LC®PLUS 제트 뉴블라이저로 투여하였고, 1 mL의 0.17% NaCl (BID or TID)로 희석한 AZLI (75 mg의 아즈트레오남, 52.5 mg의 라이신 모노하이드레이트) 또는 위약 (5 mg 락토오스)은 eFlow® 전자식 뉴블라이저 (PARI Innovative Manufacturers, Midlothian, VA)로 희석시켰다. 환자들은 기관지 확장제를 연구 치료 전, 집에서, 그리고 단시간 작용하는 β2-효능제를 연구 방문에서의 첫 번째 폐할량 측정 15분 전에 자가 투여하였다. 연구 방문 6시간 전을 제외하고는, 환자들은 임의의 전술한 기관지 확장제를 계속 사용하였다.
TIS는 28일째, AZLI/위약은 0일째 제공하였다; 그 뒤, 치료 준수를 측정하기 위하여 사용된 물약병과 사용하지 않은 물약병을 수집하였다.
이 연구는 헬싱키 선언(Declaration of Helsinki)에 따라 수행되었다.
임상 시험 심사위원회(Institutional Review Board; IRB)는 각 장소와 모든 환자들 또는 그들의 후견인에 대한 연구가 임의의 연구 절차 이전의 사전 서면 동의를 받았음을 증명하였다. 임상 시험.정부 등록번호는 NCT00104520이다.
연구 개체군
적격의 환자들 (6세 이상, CF 진단이 기록됨)은 현재 PA 기도 감염을 가지며, 전년도에 3 이상의 TIS 치료, 재현성 폐 기능 시험을 수행할 능력이 있고, 검사시에 25% 이상 75% 이하의 FEV1 예측값, 실내에서의 동맥혈 산소 포화도가 90% 이상이다. 식이요법이 지난 3 개월 동안 변동이 없는 경우와 아지쓰로마이신 개시 이후 추가적인 항슈도모나스 치료를 이용한 경우에는 만성적인 아지쓰로마이신 (azithromycin)의 사용이 가능하다.
배제 기준으로는, 현재 경구용 코르티코르스테로이드의 사용 (1일 10 mg 초과의 프레드니손과 동량); 이전 2년 내에 버크홀데리아 세파시아(Burkholderia cepacia) 집합체를 산출하는 기도 환경; 산소 보충 (oxygen supplementation): 매일 반복적으로, 또는 밤에 2 L/분 이상; 모노박탐계(monobactam) 항생제 과민증; 흡입용 단시간 작용하는 β2-효능제(agonist) 내성; 또는 조사관의 견해, 연구 참가를 방해하는 정신병이 포함된다.
효능 측정
최초 효능 종료점은 폐 악화를 나타내는 증상들을 치료하기 위한 추가적인 흡입 또는 항슈도모나스 항생제 Ⅳ를 필요로 하는 시간이었다. 미리 정의한 증상들 목록에는, 운동 내성의 감소, 기침 증가, 가래 생산/흉부 답답함의 증가, 또는 식욕의 감소이 포함된다. 주요한 2번째 효능 종료점들로는 임상적 증상들 (CFQ-R-호흡기 증상 규모), 폐 증상, PA 밀도 (집락 형성 단위 (CFU)/g 가래, log10 변형), 입원 시간, 입원 기간 및 체중이 포함된다. CFQ-R 등급들에 대한 점수 범위는 0 내지 100이다; 증가된 점수는 개선을 나타낸다. CFQ-R은 환자 반응들에 대한 생리학적 자료 또는 연구 직원의 임의의 영향을 최소화하기 위하여, 연구 방문의 초기에 투여하였다. 설문지 변화의 국제 등급 (Global Rationg of Change Questionnaire; GROCQ) 호흡기 영역에 대한 TIS 단계의 응답들을 사용하여, CFQ-R-호흡기 등급에 대한 5 지수의 임상학적 최소 중요 차이 (minimal clinically important difference; MCID)를 결정하였다; 따라서, 5 포인트 변화는 호흡기 증상의 개선/악화를 나타낸다 (Guyqtt, GH, Med Care 2000:Ⅱ:175-9; Jaeschke, R, Control Clin Trials 1989;10:407-15).
미생물학적 종료점에는, PA에 대한 아즈트레오남의 최소 억제 농도 (minimum inhibitory concentration; MIC), 그리고 기타 병원균의 유행이 포함된다.
안정성 측정
안정성은 임상 검사 수치값, 생명 증상 및 기도 반응성 내에서의 이상 반응과 변화들을 관찰하여 평가하였다. CF 증상들의 악화는 이상 반응처럼 치료하였고, 폐 악화의 미리 정의된 증상들 중 어느 하나가 환자들에게서 나타나는 경우, 연구를 철회하였다 (Rosenfeld, M, J Pediatr 2001;139:359-65). 미리 정의된 증상들과 추가적인 항생제에 대한 필요가 결합되어 철회한 환자들은 최초 효능 종료점을 만족시켰다; 그들의 연구 참여는 완료.
통계적 분석
효능과 안정성 분석은 AZLI/위약을 1회 이상의 투여받은 무작위로 배정된 환자들에게 포함시켰다. 상기 연구 프로토콜 내에서 개시한 바와 같이, 위약-BID와 위약-TID군의 반응을 모았다. 항생제를 요구하는 시간의 차이를 측정하는데 있어서 AZLI/위약 치료에 대한 210 환자들의 샘플 크기는, α=0.05로 90%를 초과하는 영향력을 제공하는 것으로 측정되었다.
CFQ-R 및 FEV1 효능 분석은 종래에 수행된 최근 관찰을 사용하였다. 연속적인 변동의 분석에, 고정된 효과로서 처리시 공분산 분석 (Analysis of Covariance; ANCOVA) 모델을 사용하였고, 공변량으로는 기준치 (0일)을 사용하였다. 기준치에서의 가장 높은 아즈트레오남 MIC를 log10 PA CFUs의 분석에 있어서 공변하였다. FEV1 내에서의 변화와 예측 FEV1 %에서의 변화는 상대값을 사용하여 분석하였다; 기준치 FEV1 또는 예측값 FEV1 %의 백분율로 계산한 증가 또는 감소. 항생제를 필요로 하고 입원하는 시간을 카플란-마이어 (Kaplan-Meier) 측정을 사용하여 분석하였고, 치료군을 로그-순위 검정법 (Log-Rank test)을 사용하여 비교하였다. 입원기간을 윌콕슨의 순위합 검정법(Wilcoxon Rank Sum Test) (일)과 피셔의 정확 검정법(Fisher's exact test) (환자 비율)을 사용하여 분석하였다. 혈장과 가래 내의 아즈트레오남 농도 (Alta Analytical Laboratory, El Dorado Hills, CA)를 비경구 중단점과 기타 병원성 박테리아 보다 상위의 아즈트레오남 또는 토브라마이신 MIC 값을 갖는 환자의 비율, PA 분리의 50% (MIC50) 또는 90% (MIC90)를 제어하는 아즈트레오남 또는 토브라마이신 MIC 값으로 요약하였다 (Covance Central Laboratory Services, Indianapolis, IN) (Gibson, RL, Am J Respir Crit Care Med 2003;168:918-51; Gibson, RL, Pediatr Pulmonol 2006;41:656-65; Burns JL, Clin Infect Dis 1998;27:158-63). 통계적 분석 소프트웨어 버젼 8.2와 9.1을 사용하였다 (SAS®, SAS Institute Inc, Cary, NC).
결과
363명의 환자를 검사하여, 211명은 28일 TIS 실행을 완료하였고, 28일간 AZLI/위약 치료를 시작하였다; 173명 (82%)이 치료를 완료하였다 (도 1).
TIS 실행을 99.5%가 준수하였고 (50% 이상 복용) AZLI/위약 치료는 95.3%가 준수하였다 (66% 이상 복용). AZLI/위약 치료의 대부분의 중단은 악화 기도 증상으로 야기되었다. 또한, Ⅳ 또는 흡입용 항슈도모나스 항생제를 요하는 중단한 환자의 다수 (0 내지 84일)는 최초 연구 종료점을 충족하였다 (AZLI-BID: 32명 중단 중 17명; AZLI-TID: 39명 중 21명; 위약: 50명 중 38명; 도 1, 2).
환자 특성
환자 특성들은 치료군들 사이에서 잘 균형을 이루고 있음이 나타났다 (표 3). 18 세 이상의 환자 165명 (78%)의 평균 연령은 26.2세였다. 평균 예측 FEV1 %는 55.1%; 76명 (36%) 환자에 대해서는 FEV1 가 50% 이하였다. 검사시 사용된 수반되는 약물들 (50% 초과 환자들)로는, 췌장 효소 (92%), 살부타몰 (89%), 도나아제 알파 (85%), 비타민 (84 %), 아지트로마이신 (70%) 및 살메테롤을 함유한 프로피온산 플루티카손 (56%)이 사용되었다. 평균 TIS 사용은 연구 전년도에는 5.3 과정이었고; 최대 허용되는 수는 6.5 과정/년이다 (처방 정보, TOBI® 흡입용 토브라마이신 용액, USP).
효능
연구 종료시까지 AZLI로 치료받은 환자들 중 반 이하의 수가 추가적인 흡입용 또는 Ⅳ 항슈도모나스 항생제를 요구하였다 (84일); 따라서, 항생제 필요에 대한 중앙 시간은 84일보다 많았다 (도 2). 연구 종료/조기 철회 후 2주 동안 일어날 수 있는 미리 정의한 기도 증상을 치료하기 위하여 자료에서는 항슈도모나스 항생제의 사용이 가능하였다. 이러한 자료 (16명 환자, 공개 연구 전에 첨가)를 포함함으로써, 항생제 요구에 대한 중앙 시간은 위약군 보다 AZLI-집단군에서 21일로 더 긴 것으로 측정하였다 (92 대 71일, 기준치으로 측정; P=0.07; 도 2). 또한, 항생제를 필요로 한 중앙 시간은 위약군 (71일) 보다 AZLI-BID (>92일, P=0.02)와 AZLI-TID (87일, P=0.182)군에서 더 길었다.
조정된 평균 CFQ-R-호흡기 점수는 위약군에 비하여 AZLI-집단 군에서 5.01 포인트 증가하였다 (28일, 95% 신뢰 구간 [CI]: 0.81; 9.21; P=0.020). AZLI-BID와 AZLI-TID군 모두에서 위약군에 비하여 상당한 개선이 관찰되었다 (도 3). 후속 확인 기간 동안, 점수는 감소되었다 (84일; AZLI-집단: 0.71 포인트; 위약군: -0.78 포인트; 0일부터의 변화). AZLI/위약 치료 동안 (0~28일), CFQ-R-호흡기 증상은 위약으로 치료된 환자보다 AZLI로 치료된 환자의 경우 더 증가하였고 (5 포인트 이상 증가; AZLI: 52%; 위약군: 37%), AZLI로 치료된 환자에게서 악화가 더 적었다 (5 포인트 이상 감소; AZLI: 28%; 위약군: 38%; 전체적인 분류 비교, P=0.029).
조정된 평균 FEV1는 위약군에 비하여 AZLI-집단군에서 6.3% 증가하였다 (28일, 95% CI: 2.5, 10.1; P=0.001). AZLI-BID와 AZLI-TID군 모두에서 위약군에 비하여 상당한 개선이 관찰되었다 (도 3). 모든 군에 대하여 후속 확인 기간 동안 FEV1가 감소되었다. TIS 연속 및 AZLI 치료 동안, 관찰된 FEV1의 증가가 AZLI-BID군보다 AZLI-TID에서 더 컸다; 이러한 큰 개선은 followup 기간 동안 AZLI-TID 군에 대한 더 큰 감소에 뒤따랐다 (도 4).
또한, 예상 FEV1 %의 조정된 평균은 위약군에 비하여 AZLI 집단군에서 개선되었다 (28일, 치료 효과 6.6%; 95% CI: 2.8, 10.4; P<0.001).
치료 마지막 시점 (28일)에서의 CFQ-R-호흡기 점수의 변화는 FEV1 내에서의 변화 (피어슨 상관계수=0.33, 0.24, 0.33; AZLI-BID, AZLI-TID, 위약군; 도 5)와 GRCQ-호흡기 영역 반응 (피어슨 상관계수=0.46, 모든 그룹 합산, P<0.001)과 약간의 연관성이 있었다.
조정된 평균 PA 가래 밀도는, 위약군에 비하여 AZLI 집단군 내에서 0.66 log10 PA CFU/g 가래만큼 감소하였다 (28일, 95% CI: -1.13, -0.19; P =0.006). AZLI-BID 및 AZLI-TID 둘 다에서 위약군에 비하여 상당한 감소가 관찰되었다 (도 3). followup 기간 동안에는 모든 군의 PA 밀도가 감소하였다.
28일 TIS 연속 동안, 평균 CFQ-R-호흡기 점수는 -1.47 감소하였고, 평균 FEV1 는 0.9% 증가하였고, 평균 PA 밀도는 0.28 log10 PA CFU/g 가래 감소하였다.
첫 번째 입원 시간과 입원한 평균 일/환자 수는 치료군 사이에서 상당한 차이는 없었다 (0 내지 84일). AZLI-집단군의 경우 위약군에 비하여 체중이 0.77% 증가하였다 (28일, 95% CI: 0.00, 1.55; P=0.051).
안정성
치료로 인한 이상 반응의 발생 정도는 일반적으로 3 군의 경우 비슷하였다 (표 4); 어떠한 차이도 통계학적으로 상당하지 않았다. 9명의 환자들이 AZLI/위약 치료 기간 동안 발생한 심각한 이상 반응으로 인하여 입원하였다; 7명은 폐 악화 (AZLI-BID: 2; AZLI-TID: 4; placebo: 1), 1명은 소장폐색 (AZLI-BID), 1명은 저나트륨혈증 (AZLI-TID). 이 연구 동안 사망은 없었으며, 과민증도 보고되지 않았다. 치료후의 기도 반응성 (치료 후 30분 이내에 ≥ 15 %의 급성 FEV1 감소; 0일, 14일)이 6명의 환자에게서 발생되었다 (AZLI 집단: 4 [3.0%]; 위약군: 2 [2.6%]); 이들 환자들 중에서 이러한 이유로 철회한 사람은 없었다.
28일 또는 0일부터 가변적인 생명 증상, 혈액학 및 혈청 화학에서의 평균 변화는, 연구 동안의 모든 치료군이 비슷하였다.
평균 총 백혈구 수, 호중구 수, % 호중구, 혈청 글루코오스 농도는 연구 동안 내내 모든 치료군에 있어서 정상적인 상한선에 가깝거나 그를 넘어섰다.
임상 약리학과 미생물학
14일째, 복용 1시간 후의 혈장 내의 아즈트레오남 농도는 (평균 [범위]): AZLI-BID: 581 (45-1540) ng/mL 및 AZLI-TID: 622 (31-1710) ng/mL, 복용 10분 후의 가래 내에서는: AZLI-BID: 429 (0.273-3430) mg/그램 및 AZLI-TID: 406 (68-3240) mg/그램이다.
PA 분리균에 대한 아즈트레오남의 MIC50와 MIC90값은, AZLI-TID군에서 14일째에서 일시적으로 4배 증가한 것을 제외하고는 0 내지 56일 동안 변하지 않고 유지되었다. PA를 갖는 환자들 중, AZLI 치료 동안에 아즈트레오남 MIC 값이 8 mg/mL 초과 (비경구 중단점)로 갖는 일부를 분리한다; 상기 증가는 AZLI-TID군 내에서 일시적이었다 (0일, 28일, 42일, AZLI-BID: 27%, 44%, 39%; AZLI-TID: 33%, 43%, 28%; 위위약군: 38%, 37%, 30%) (Gibson, RL, Am J. Respir Crit Care Med 2003; 168:918-51). PA 분리균 대한 토브라마이신의 MIC50와 MIC90값은, 4배 이하로 변화되었다 (-28일 내지 56일). 토브라마이신의 MIC값이 8 ㎍/mL 이상 (비경구 중단점)인 PA 를 갖는 환자들 중 일부는 증가하지 않았다 (-28일 내지 42일). 지속적인 증가가 황색포도상구균 (Staphylococcus aureus), 스테노트로포모나스 말토필리아 (Stenotrophomonas maltophilia), 또는 아크로모박터 자일로스옥시단스(Achromobacter xylosoxidans)의 유행에 대하여 발견되지 않았다 (0 내지 28일).;버크홀데리아 세파시아 (B. cepacia) 복합체는 분리되지 않았다.
고찰
75 mg 복용량으로 아즈트레오남 라이신 (AZLI)의 흡입, 28일간 BID 또는 TID는, CF를 갖는 환자들 중 폐 악화를 나타내는 호흡기 증상을 치료하기 위하여 추가적인 흡입용 또는 Ⅳ 항슈도모나스 항생제를 필요로 하는 시간이 상당히 지연되었다. 위약군에 비하여 AZLI 치료는 또한, 호흡기 증상과 폐 기능을 상당히 개선시키고, log10 PA CFUs는 상당히 감소하였다. AZLI를 잘 견뎌냈다; 일반적으로, 이상 증상들은 CF 폐질환의 증상과 일치하였다.
비록 연구 전체 기준은 비슷하였고, 연구 내 환자들은 TIS 연구 내의 환자들의 10년 전보다 예측 평균 FEV1 %가 더 높은 (55% 대 50-51%) 나이가 많았다 (26 대 21세) (Ramsey, BW, N. Engl. J. Med. 1999; 341:23-30). 이 환자 집단은, 더 나이가 많음에도 불구하고, 폐질환의 진행이 덜하였다; CF의 개선된 임상 관리를 반영할 것 같은.
TIS 연속 기간 동안 환자들의 반응은 종전의 TIS 연구들에서 발견된 반응에 비하여 현저히 약화되었다 (Ramsey, BW, N. Engl. J. Med. 1999; 341:23-30; JMoss, RB, Chest 2001; 120(Suppl):107-13S; Moss, RB, Chest 2002; 121:55-63; Ramsey, BS, N. Engl. J. Med. 1993; 328:1740-46; Smith AL, Pediatr. Pulmonol. 1989; 7:265-71; Hodson, ME, Eur Respir J. 2002; 20:658-64). 만성적 TIS 사용으로 인한 임상적 효능의 이러한 분명한 감소의 근본적인 메카니즘(들)을 설명하기 위하여서는 추가적인 연구가 필요할 것이다. AZLI 치료 28일 후, FEV1에서의 증가가 관찰되었는 바, AZLI가 TIS에 대한 환자 반응에 영향을 미치는 메카니즘(들)은 회피하는 것 같다. 그러나, 이 연구는 단지 하나의 치료 기간, AZLI의 유효성, 그리고 더 오랜 시간 기간에 걸쳐 실험하기 위하여 필요한 미생물 저항의 개발, 그리고 다수의 치료 코스를 포함한다.
증가된 CFQ-R-호흡기 점수들은, 환자들이 그들의 호흡기 증상을 AZLI 치료에 따른 개선으로 여긴다는 것을 나타냈다.
CFQ-R-호흡기 점수는 FEV1와 동일한 민감성, 확립된 효능 종료점을 갖는 CF 개체군 내에서의 변화를 감지하는 것인 것 같다. 그러나, 이러한 종료점들은 호흡기 증상에서의 환자가 보고한 변화들 (CFQ-R-호흡기)과 폐 기능 (FEV1)에서 측정된 변화들 사이의 보통의 상관관계에 의하여 나타나는 바와 같이, 임상 효능의 서로 다른 측면들의 측정이다 (Goss, CH, Proc. Amer. Thorac. Soc. 2007; 4:378-86).
이 연구에서의 환자들은 대부분이 성인이고 (78%, 18세 이상), 광범위하게 치료된다. TIS 연속뿐 아니라, 전년도의 TIS 사용은 평균 5.3 코스로 1년간 허용되는 최고 6.5 코스에 육박한다. 따라서, AZLI 치료 후의 FEV1(6.3%)와 예측 FEV1 (6.6%)에서의 개선 등급은 예상 밖이었고, CF를 가진 성인들의 폐질환이 종전에 여겨지던 것보다 추가적인 치료에 더욱 즉각 반응할 수 있음을 시사하였다.
TIS 연속과 AZLI/위약 치료 기간 동안, AZLI-BID 또는 위약군보다 AZLI-TID군에 무작위로 등록된 환자들에게 있어서 더 많은 FEV1 개선이 관찰되었다; 후속 기간 동안 발생한 더 많은 감소와 일치. AZLI-TID군의 환자들은 이러한 감소를 호흡기 증상의 악화로 여길 수 있고, 이는 AZLI-TID군에서 관찰된 더 짧은 항생제 요구 시간으로 여겨질 수 있다.
AZLI 치료 후의 PA 가래 밀도의 감소는 적었지만 통계학적으로는 상당하였고, 상기 감소는 TIS 코스 후 즉시, 임상적으로 안정한 환자들에게서 관찰되었다.
상기 감소는 종전 TIS 연구에서 집중적으로 치료된 등록된 환자들에게서 관찰된 것과 비슷하였지만, 종전 AZLI 연구에서 덜 집중적으로 치료받은 등록된 환자들에게서 관찰되는 것보다는 작았다 (Clinical Trial II; Hodson, ME, Eur. Respir. J. 2002; 20:658-64; Lamb, HM, Dis. Manage. Health Outcomes 1999; 6:93-108을 참조). 따라서, PA 밀도는, 상기 변화의 규모는 최근의 항생제 치료에 좌우되는 것인 것 같다.
이 연구로 인하여, AZLI가 TIS로 집중적으로 치료받은 CF와 만성 PA 기도 감염을 가진 환자에 대하여 "추가물" 치료로서 효율적일 수 있다; 2005년, 이 군은 CF와 만성 PA 기도 감염을 가진 미국 환자들 (5세 초과)의 58%를 포함하였다. FEV1와 PA 가래 밀도에서의 개선은 치료를 중단한 후 2주 동안 감소하였다. 따라서, 폐 기능을 유지하기 위하여, 관리하는 환자들에 대한 미래 전략은 상이한 흡입용 항생제의 교대 사용 또는 복합 치료의 사용을 포함할 수 있다.
| 임의의 치료군 내에서 5% 이상의 TEAEs*, n (%) | 위약 n=76 |
AZLI-BID n=69 |
AZLI-TID n=66 |
AZLI-집단 n=135 |
||||
| 기침 | 26 | (34.2) | 19 | (27.5) | 24 | (36.4) | 43 | (31.9) |
| 마른 기침 | 13 | (17.1) | 9 | (13.0) | 9 | (13.6) | 18 | (13.3) |
| 천명 | 6 | (7.9) | 5 | (7.2) | 9 | (13.6) | 14 | (10.4) |
| 객혈 | 7 | (9.2) | 7 | (10.1) | 6 | (9.1) | 13 | (9.6) |
| 비충혈 | 6 | (7.9) | 5 | (7.2) | 5 | (7.6) | 10 | (7.4) |
| 비루 | 2 | (2.6) | 5 | (7.2) | 5 | (7.6) | 10 | (7.4) |
| 두통 | 5 | (6.6) | 2 | (2.9) | 6 | (9.1) | 8 | (5.9) |
| 인후 통증 | 7 | (9.2) | 3 | (4.3) | 5 | (7.6) | 8 | (5.9) |
| 호흡 곤란 | 3 | (3.9) | 2 | (2.9) | 5 | (7.6) | 7 | (5.2) |
| 발열 | 2 | (2.6) | 4 | (5.8) | 3 | (4.5) | 7 | (5.2) |
| 기도 막힘 | 5 | (6.6) | 5 | (7.2) | 2 | (3.0) | 7 | (5.2) |
| 복통, 상부 | 3 | (3.9) | 4 | (5.8) | 1 | (1.5) | 5 | (3.7) |
| 식욕 감퇴 | 5 | (6.6) | 4 | (5.8) | 1 | (1.5) | 5 | (3.7) |
| 피로 | 7 | (9.2) | 3 | (4.3) | 2 | (3.0) | 5 | (3.7) |
| 언어 장애 | 4 | (5.3) | 1 | (1.4) | 1 | (1.5) | 2 | (1.5) |
| 운동 내성 감소 | 4 | (5.3) | 1 | (1.4) | 1 | (1.5) | 2 | (1.5) |
| 누관 출혈 | 5 | (5.6) | 0 | (0.0) | 2 | (3.0) | 2 | (1.5) |
*MedDRA (Medical Dictionary for Regulatory Activities)을 사용하여 TEAE s 우선어를 기재하였다; 임의의 군 내에서 10% 이상의 TEAEs 발생, 치료군 내에서의 각 TEAE에 대한 % 환자에는 상당한 차이가 없었다 (피셔의 정확 검정법).
임상 시험
II
본 명세서에서 기술된 연구에서는 중등도 내지는 중증의 CF 폐질환과 PA 기도 감염을 갖는 환자들에게, 매일 3회, 28일간 75 mg의 AZLI를 투여하여 그 효능과 안정성을 측정하였다. CF 개정된 설문지 호흡기 영역에서 측정된 (CFQ-R-호흡기), 임상 증상들 내에서 최초 효능 종료점이 변하였다. 이 연구는 전년도에 TIS로 집중적으로 치료받은 적이 없고, 연구 시작 시점에 아지쓰로마이신으로 치료받은 적이 없는, CF를 갖는 환자들에게 초점을 맞췄다.
방법
연구 설계
무작위, 이중 맹검, 위약 조절된 연구를, 미국, 캐나다, 호주 및 뉴질랜드 내에 있는 53 CF 센터에서 수행하였다 (6월, 2005-4월, 2007). 기준치 (0일)에서, 적격 환자들은 예상 FEV1 % (중등도: 예상 FEV1는 50% 초과 75% 이하; 중증: 예상 FEV1는 25% 이상 50% 이하; 검사시 측정됨 [14일과 7일 사이])를 사용하여 CF 질병 중증도 (severity)로 계층화하였고, 75 mg AZLI 또는 위약 (1:1; 매일 3회)으로의 28일 치료에 배정하였다. 환자들을 치료 중간 (14일), 치료 종료시 (28일), 그리고 치료 완료 후 14일 (42일; 도 6)에 관찰하였다.
검사시, 신체 검사를 수행하였다. 폐활량 측정 (American Thoracic Society standards, Am J. Respir. Crit. Care Med. 1995; 152:1107-36)을 연구 방문시마다 수행하였다 (치료 전 및 임의 치료 후 30분). 예상 FEV1 %값은 누센 방정식 (Knudson equation)을 사용하여 계산하였다.
1 mL의 0.17% NaCl로 희석한 AZLI (75 mg의 아즈트레오남, 52.5 mg의 라이신 모노하이드레이트) 또는 위약 (5 mg lactose)을 eFlow® 전자식 뉴블라이저 (PARI Innovative Manufacturers, Midlothian, VA)를 사용하여 투여하였다. 환자들은 단시간 작용하는 β2-효능제를 연구 방문에서의 첫 번째 폐할량 측정 15분 전에 자가 투여하였고, 집에서 연구 약 전에 β2-효능제를 자가 투여하였다 (2시간 내에 단시간 작용하도록 투여, 또는 장시간 작용하는 제제를 투여하기 전 30분 내지 8시간). 연구 방문 전 4시간의 가간을 제외하고는, 환자들은 임의의 전술한 기관지 확장제를 계속 사용하였다.
연구 약은 기준치에서 제공하였다; 치료 준수를 평가하기 위하여 사용된/사용되지 않은 물약병은 나중에 수집하였다.
이 연구는 헬싱키 선언(Declaration of Helsinki), 임상 시험 심사위원회(Institutional Review Board; IRB)에 대한 국제 임상시험관리기준 (International Conference on Harmonisation guideline)에 따라, 각 참여한 국가에 대하여 해당되는 규정으로 수행하였다. 임상 시험 심사위원회(Institutional Review Board; IRB)와 윤리 위원회 (캐나다, 호주, 뉴질랜드)는 각 장소와 모든 환자들 또는 그들의 후견인에 대한 연구가 임의의 연구 절차 이전의 사전 서면 동의를 받았음을 증명하였다. 임상 시험.정부 등록번호는 NCT00112359이다.
연구 개체군
적격의 환자들은, CF 진단이 기록되고 중등도에서 중증의 폐질환 (예상 FEV1가 25% 이상 75% 이하), 실내에서의 동맥혈 산소 포화도가 90% 이상 (검사시), 재현성 폐 기능 시험을 수행할 능력, PA 기도 감염 (검사시 기록되거나, 종전 3개월 내에 1회를 포함하여 전년도에 2회의 감염)을 갖는 6세 이상의 환자들이다.
배제 기준으로는, 최근 (-28일부터 검사시까지)의 항슈도모나스 항생제 또는 아지쓰로마이신의 흡입, 정맥주사 또는 경구에 의한 투여; 최근 에어로졸화된 고장성 식염수 (hypertonic saline): 현재 1일 10 mg 초과의 프레드니손과 동량인 경구용 코르티코르스테로이드의 사용; 이전 2년 내에 버크홀데리아 세파시아(Burkholderia cepacia) 집합체를 산출하는 기도 환경; 산소 보충 (oxygen supplementation): 매일 반복적으로, 또는 밤에 2 L/분 이상; 모노박탐계(monobactam) 항생제 과민증; 흡입용 단시간 작용하는 β2-효능제(agonist) 내성; 현재 (검사 7일 전부터) 항균제, 기관지 확장제, 소염제, 코르티코스테로이드 약, 또는 물리치료 기술/스케쥴의 변화; 폐 이식; 검사시 또는 이전 90일 이내의 흉부 방사선 사진에서의 새로운 발견; 정상의 상한선 보다 5배 초과의 AST 또는 ALT, 또는 2배 초과의 혈청 크레아티닌 (검사시); 임신; 수유; 또는 조사관의 견해, 연구 참가를 방해하는 정신병이 포함된다.
효능 측정
기준치에서, 그 후 매 연구 방문시에 CFQ-R를 투여하였다. 별도로 언급하지 않으면, 성인, 청소년 및 아이 버젼의 반응들을 발표를 위하여 합산하였다 (Quittner, AL, Chest 2005; 128:2347-54). 최초 효능 종료점은 임상적 증상들 내에서 측정된 CFQ-R 호흡기 점수와 함께 변화하였다. 등급들에 대한 점수 범위는 0 내지 100이다; 증가된 점수는 개선을 나타낸다. 조기 연구에서, CFQ-R-호흡기 영역에 대한 임상학적 최소 중요 차이는 5가지로 확인되었다 (Guyatt, GH, Med. Care 2000;II:175-9; Jaeschke, R, Control Clin. Trials 1989; 10:407-15). 따라서, CFQ-R-호흡기 점수에서의 5 포인트 차이는 증상의 개선/악화를 나타낸다
2번째 효능 종료점으로는 폐 기능, 입원 기간, 그리고 비호흡기 CFQ-R 영역에서의 변화를 포함하였다.
미생물학적 종료점에는, 가래 PA 밀도 (집락 형성 단위 (CFU)/g 가래, log10 변형), PA에 대한 아즈트레오남의 최소 억제 농도 (minimum inhibitory concentration; MIC), 병원균의 수, 그리고 PA에 대한 8 mg/ml 초과의 아즈트레오남 MIC를 갖는 환자 비율 (비경구 구분점), 그리고 기타 병원균의 유행이 포함된다.
안정성 측정
안정성은 임상 검사 수치값, 생명 증상 및 기도 반응성 내에서의 이상 반응과 변화들을 관찰하여 평가하였다. CF 증상들의 악화는 이상 반응으로 치료하였다. 비연구 항슈도모나스 항생제를 요하는 환자들은 연구에서 철회시켰다.
통계적 분석
효능과 안정성 분석은 AZLI/위약을 1회 이상의 투여받은 무작위로 배정된 환자들에게 포함시켰다. FEV1 및 CFQ-R 분석을 가장 최근의 종래 수행된 것을 사용하였다. CFQ-R-호흡기 점수에서의 8 포인트의 변화 차이 (가령 SD=20)를 검출하기 위한 77% 파워를 제공하기 위하여, 그리고 α=0.05로 FEV1 에서의 9%의 차이 (가령 SD=12)를 검출하기 위한 90%를 초과하는 파워를 제공하기 위하여 140개의 시료 크기를 측정하였다.
고정 효과로서 처리시 공분산 분석 (Analysis of Covariance; ANCOVA) 모델을 사용하여 연속 변수를 분석하였다; 질병 중증도 (중등도/중증)와 기준치 값 (가래 내의 log10 PA CFUs 분석은 제외)은 공변하였다. FEV1 내에서의 변화와 예측 FEV1 %에서의 변화는 상대값을 사용하여 분석하였다.
28일, 환자들을 개선 (기준치 CFQ-R-호흡기 증상에서 5 포인트 이상 증가), 악화 (기준치로부터 5 포인트 감소) 또는 안정/변화없음 (기준치로부터 5 포인트 미만의 변화)으로 분류하였다. 이들 분류는 질병 중증도는 코크란-만텔-헨첼 평균 점수 통계 (Cochran-Mantel-Haenszel mean score statistic)로, 층화변수 (stratification variable)를 기준 점수로 하여 분석하였다.
입원기간을 윌콕슨의 순위합 검정법(Wilcoxon Rank Sum Test) (일)과 피셔의 정확 검정법(Fisher's exact test) (환자 비율)을 사용하여 분석하였다.
PA 분리균의 50% (MIC50) 또는 90% (MIC90)의 성장을 제어하는 아즈트레오남 농도와 기타 병원균 박테리아의 존재 (Covance Central Laboratory Services, Indianapolis, IN)는 혈장과 가래 아즈트레오남 농도로 요약하였다 (Alta Analytical Laboratory, El Dorado Hills, CA) (Burns, JL, Clin. Infect. Dis. 1998; 27:158-63). 통계적 분석 소프트웨어 버젼 8.2와 9.1을 사용하였다 (SAS®, SAS Institute Inc, Cary, NC).
결과
253명의 환자를 검사하여, 164명은 AZLI 또는 위약으로 치료를 시작하였고, 138명은 28일 치료를 완료하였고, 그리고 124명은 연구를 완료하였다 (도 6). 투여는 92%가 준수 (80% 이상 투여)하였다. 28일의 치료 코스 중단되는 가장 흔한 이유는 이상 증상이었다 (ALZI: 6, 7.5%; 위약군: 13, 15.5%; 도 6); 이들 환자의 대부분 (16/19)은 비연구 항슈도모나스 항생제로의 치료를 요하였다.
환자 특성
전체 인구 특성들은 치료군들 사이에서 잘 균형을 이루고 있음이 나타났다 (표 5). 평균 연령은 29.6세였다. 대부분의 환자들 (127, 77.4%)은 18세 이상이었다. 반 정도 (93, 56.7%)가 남성이었다 (표 5).
검사시, 60명 (36.6%) 환자들이 기준치에서 예측값 FEV1가 50% 이하였고, 평균 예측값 FEV1%는 54.6%였다. 기준치에서 40% 이상의 환자들이 사용한 수반되는 약물들로는, 췌장 효소 (87%), 비타민 (87%), 살부타몰 (795), 도나아제 알파 (65%), 그리고 크시나포산살마테롤을 함유하는 프로피온산 플루티카손 (40%)가 있다.
효능
조정된 평균 CFQ-R-호흡기 점수는, AZLI 치료 환자들에 대하여는 기준치에서 증가하였고, 위약 치료 환자들에 대해서는 감소하였다 (28일, 치료 차이=9.7 포인트; 95% 신뢰 구간 [CI]=4.3, 15.1; P<0.001; 도 7), 표 6). 42일까지 (치료 종료 후 14일), 점수는 감소하였지만 AZLI 치료 환자들은 기준치보다 상위로 유지되었고, 위약 치료 환자들의 경우에는 계속 감소되었다 (42일, 치료 차이=6.3 포인트; 95% CI=1.2, 11.4; P=0.015, 도 7).
위약군과 비교하여, 평균 CFQ-R-호흡기 점수는 CF 폐질환 중증도와 연령의 차이에 따라 AZLI-치료 환자들에 대해서는 증가하였다 (도 8). 중등도 또는 중증 폐질환을 갖는 환자들에 대한 치료 반응은 비슷하였고, 나이든 환자들 보다 더 어린 환자들 (18세 미만)에 대하여 더 컸다.
치료 동안, CFQ-R-호흡기 점수는 위약으로 치료된 환자들 보다 AZLI로 치료받은 환자들에 대하여 더 개선되었다 (5 포인트 이상 증가; AZLI:45, 56%; 위약군:31, 37%). 또한, 점수들은 AZLI로 치료받은 더 적은 환자들이 악화되었다 (5 포인트 이상 감소; AZLI:20, 25%; 위약군: 37, 45%; 전체 범주 비교에 대하여 P=0.006).
조정된 평균 FEV1는 AZLI로 치료받은 환자들에 대하여는 기준치로부터 증가하였고, 위약으로 치료받은 환자들에 대하여는 감소하였다 (28일, 95% CI=6.3, 14.3; P<0.001; 도 7). 42일까지 (치료 종료 후 14일), 평균 FEV1는 감소하였지만 AZLI 치료 환자들은 기준치보다 상위로 유지되었고, 위약 치료 환자들의 경우에는 계속 감소되었다 (42일, 치료 차이=5.7%; 95% CI=2.1, 9.4; P=0.002). 위약군과 비교하여, AZLI 치료는 CF 폐질환 중증도와 연령의 차이에 따라 평균 FEV1값을 증가시켰다. 서로 다른 부분 집단에 대하여 치료 반응은 비슷하였다 (도 8).
치료 종료시, CFQ-R-호흡기 점수 및 FEV1에서의 변화는 약한 연관성이 있다 (28일, 피어슨 상관계수; AZLI: 0.32; 위약군: 0.32).
치료 동안, 조정된 평균 예상 FEV1%도 AZLI 치료 환자들에 대하여는 증가하였고, 위약 치료 환자들에 대해서는 감소하였고 (28일, 치료 차이=10.2%; 95% CI=6.2, 14.2; P<0.001), 치료 후에는 두개의 군 모두에서 감소하였다 (42일, 치료 차이=5.7%; 95% CI =2.0, 9.4; P=0.003).
조정된 평균 가래 PA 밀도는 AZLi로 치료받은 환자들에 대하여서는 감소하였고, 위약으로 치료받은 환자들에 대하여서는 기준치 근처로 유지되었다 (28일, 치료 차이= -1.453 log10 CFU/그램; 95% CI = -2.1, -0.8; P<0.001; 도 7). 두 개의 치료군 모두에 대한 42일 시점에서의 값 (치료 종료 후 14일)은 기준치 근처였다 (P=0.822).
위약군 (14%; 0에서 42일; P=0.064)보다 AZLI군 (5%)에서의 입원한 환자의 수와 입원한 기간 (AZLI: 0.5일; 위약: 1.5일; P=0.049)이 더 적은 경향이 있었다. 위약군에 비하여, AZLI로 치료받은 군에서 체중이 1.0% 증가하였다 (28일, 95% CI: 0.33, 1.69; P=0.004).
11개의 비호흡기 CFQ-R 영역 중 6개의 영역에서, AZLI로 치료받은 환자들의 반응이 위약으로 치료받은 환자들의 반응에 비하여 상당히 컸다; 이들은 식욕, 정서적 기능, 건강 인식, 신체적 기능, 역할/학교 생활, 그리고 활력이다 (표 6).
안정성
AZLI/위약 치료 기간 동안, 마른 기침의 경우는 위약으로 치료받은 환자들 (21, 25%; P=0.047; 표 7).에 비하여 AZLI로 치료받은 환자들 (10, 12.5%)의 경우에 상당히 감소됨이 보고된 것을 제외하고는, 두 군의 치료로 인한 이상 반응의 발생 정도는 비슷하였다 (표 4). AZLI/위약 치료 기간 동안 5명의 환자가 입원하였다; 호흡기 증상으로 2명 (AZLI: 1; 위약: 1), 장폐색으로 2명 (AZLI: 1, 위약: 1), 배꼽 탈장으로 1명 (위약). 연구 방문시 AZLI/위약 투여 후 30분 이내의 FEV1에서의 15% 이상의 감소로 규정한, 기도 과민반응은 8명의 환자에게서 발생하였다 (AZLI: 3; 위약군: 5); 이 환자들 중 이를 이유로 철회한 환자는 아무도 없었다. AZLI로 치료받은 환자들 내에서의 경향을 제외하고는, 생명 증상 또는 평균 임상 검사 수치 내에서의 의학적으로 상당한 변화는 관찰되지 않았다; AZLI/위약 치료 기간 동안,
백혈구, 혈소판, 호중구 수, 호중구 %, 전신 염증의 모든 표지에 대하여, 위약으로 치료받은 환자들 보다 정상 범위에서의 변화가 더 적었다. 이 연구 동안에 사망은 없었으며, 과민증도 보고되지 않았다.
임상 약리학과 미생물학
0일, 14일 및 28일째의 복용 후 10분에서의 가래 아즈트레오남 농도는 (평균 [범위]): 530 (8-6010), 677 (2-2780), 그리고 451 (0.6-2800) mg/g 가래였다.
0일, 14일 및 28일째의 복용 후 1시간 시점에서의 혈장 아즈트레오남 농도는 (평균 [범위]): 495 (0-1620), 595 (12-1660), 그리고 603 (0-1740) ng/mL였다.
연구 기간 동안 내도록, 위약으로 치료받은 환자들의 모든 PA 분리균에 대한 아즈트레오남의 MIC50와 MIC90값은, 변화하거나 감소하지 않고 유지되었다. AZLI로 치료받은 환자들의 PA 분리균은 MIC90에서 일시적으로 4배 증가하였다 (14일). AZLI 치료 동안에 MIC 값이 8 mg/mL 을 초과하는 PA 분리균의 수와 그러한 분리균을 갖는 환자들의 비율은 증가하지 않았다. 황색포도상구균 (Staphylococcus aureus), 스테노트로포모나스 말토필리아 (Stenotrophomonas maltophilia), 또는 아크로모박터 자일로스옥시단스(Achromobacter xylosoxidans)에서의 지속적인 증가에 대한 증거는 분리되지 않았다.
고찰
75 mg 복용량으로 흡입용 아즈트레오남 라이신 (AZLI)을 28일간 1일 3회, 중등도에서 중증의 CF 폐질환과 PA 기도 감염을 갖는 환자들에게 투여하였는데, 위약군에 비하여 호흡기 증상과 폐 기능이 상당히 개선되었고, 가래 PA 밀도는 상당히 감소하였다. AZLI는 잘 용인되었다; 일반적으로 이상 증상는 CF 폐질환의 증상과 일치하였다.
비록 최근 에어로졸화된 고장성 식염수는 두 번째 종료점으로 사용되었지만, 이는 최초 효능 종료점으로서의 환자 보고 결과 (CFQ-R-호흡기)에 대한 최초 에어로졸화된 항생제 임상 연구였다 (Elkins, MR, N. Eng. J. Med. 2006; 354:229-40; Donaldson, SH, N. Engl. J. Med. 2006; 354:241-50). CFQ-R-호흡기 점수는 환자의 관점에서의 AZLI의 이점으로 직접적으로 측정하였다 (Quittner, AL, Chest 2005; 128:2347-54, Goss, CH, Proc. Amer. Thorac. Soc. 2007; 4:378-86).
호흡기 증상에 대하여 보고된 개선은, FEV1 내에서의 상당한 개선과 이상 증상 측정으로 확정하였다: 위약군에 비하여, AZLI 치료는 "마른 기침" 이상 증후의 보고를 반으로 감소시켰다. 이러한 결과는, CF를 가진 환자들이 표준화된 단위를 사용하여 손쉽게 그들의 증상을 보고할 수 있고, 임상 연구들 내에서 환자에 의하여 보고된 결과의 이용에 대한 지원을 제공한다. 그러나, 호흡기 증상 (CFQ-R-호흡기) 내에서 환자에 의하여 보고된 변화와 폐 기능에서 측정된 변화 (FEV1) 간의 약한 상관 관계는 그들이 임상 효능의 상이한 측면을 측정한다는 것을 제시한다; 따라서, 환자에 한 보고와 생리적 측정의 결합이 적절할 수 있다.
호흡기 증상 이외에도, AZLI로 치료된 환자들은 식욕, 정서적 기능과 물리적 기능, 건강 인식, 역할/학교 생활 기능 및 활력을 포함하는 질병 관련 증상들의 개선을 보고하였다. 이들 결과는, 정상적인 활동에 영향을 끼치는 복잡하고 시간이 소요되는 의학 요법을 고수하던 만성 질환을 갖는 환자들에 대하여 특정 관련성을 가진다.
치료 유익에 대한 그들의 인식이, 치료 요법에 대한 고수를 증가시키고 장기 건강 결과에 영향을 미치는 것 같다 (Modi, AC, Pediatr Pulmonol. 2005;S28:371).
AZLI로 치료된 환자들의 CFQ-R-호흡기 점수와 FEV1 는, 치료 종료시 (28일)까지 추가적인 변화가 거의 없이, 기준치에서 치료 중간 (0 내지 14일)까지 증가하였다. 그러나, 치료 종료 후 14일인 42일 시점에서는 계속된 치료 효과가 관찰되었다. 조정된 평균 PA 밀도는 28일의 AZLI 치료 동안 내도록 감소하였고, 42일 시점에서는 기준치으로 복귀하였다.
임상 시험 I에서 개시한 AZLI 연구 내의 환자들과 비교하면, 이 연구에서는 더 적은 환자들이 도나아제 알파 (65% 대 85% 환자들), TIS (전년도의 평균 코스 1.8 대 5.3), 그리고 아지쓰로마이신 (0% 대 70% 환자들; 연구 전체 기준에 의하여 배제)을 사용하였다. 둘 다의 AZLI 연구 내에서의 환자들의 폐 기능은 비슷하였다 (예측값 FEV1는 25% 내지 75%). 이러한 덜 집중적인 치료 요법은 다수의 요인들을 반영할 수 있다: 가능한 치료 요법에 대한 환자의 불관용, 특정 요법에 대한 임상적 반응의 부족, 의사와 환자의 선호도, 또는 이 연구에 참여하는 몇몇 국가에서의 TIS 획득의 어려움.
덜 집중적으로 치료받은 환자들에게서 관찰된 치료 효과(CFQ-R-호흡기에 대하여 9.7 포인트 증가, 10.3%의 FEV1 증가, 10.2%의 예측값 FEV1% 증가, 가래 PA 밀도의 1.453 log10 감소)는 동반한 논문 내에 개시된 AZLI 연구에서 관찰된 치료 효과 (CFQ-R-호흡기에 대하여 5.0 포인트 증가, 6.3%의 FEV1 증가, 6.6%의 예측값 FEV1 % 증가, 가래 PA 밀도의 0.66 log10 감소)보다 컸고, 10년 전의 본래의 TIS 연구에서 관찰된 치료 효과 (예측 FEV1 %에 대하여 대략 12% 증가)에 근접하였다 (Ramsey, BW, N. Engl. J. Med. 1999; 341:23-30; Lamb, HM, Dis Manage Health Outcomes 1999; 6:93-108).
AZLI는 중등도 내지 중증의 폐질환을 갖는 CF 환자들에게 중요하고 새로운 치료법을 제공할 수 있다. 만성 PA 기도 감염의 치료에 AZLI의 사용을 포함시키기 위한 적절한 전략을 규정하기 위하여서는 추가적인 연구가 필요할 것이다.
| 위약 n =84 |
AZLI n =80 |
|
| 나라; n (%) | ||
| 미국 및 캐나다 | 63 (75.0) | 62 (77.5) |
| 호주 및 뉴질랜드 | 21 (25.0) | 18 (22.5) |
| 연령, 세*; 평균 (범위) | 31.7 (11-74) | 27.4 (7-54) |
| 연령군; n (%) | ||
| < 18 세 | 16 (19.0) | 21 (26.3) |
| ≥18세 | 68 (81.0) | 59 (73.8) |
| 남성; n (%) | 45 (53.6) | 48 (60.0) |
| 체중, kg; 평균 (SD) | 60.7 (15.2) | 59.9 (17.3) |
| 체질량지수, kg/m2; 평균 (SD) | 21.9 (3.9) | 21.4 (4.3) |
| CFTR 유전자형; n (%) | ||
| △DF508에 대한 동형접합성 | 30 (35.7) | 38 (47.5) |
| △DF508에 대한 이형접합성 | 22 (26.2) | 21 (26.3) |
| 미확인 또는 기타 | 32 (38.1) | 21 (26.3) |
| 전년도의 TIS 코스**; 평균 | 1.7 | 1.8 |
| 도나아제 알파 사용; % 환자 | 64% | 66% |
| 예측값 FEV1 %; 평균 (SD) | 54.8 (14.0) | 54.4 (13.4) |
| 예측값* FEV1≤50%을 갖는 환자들, n (%) | 30 (35.7) | 30 (37.5) |
| CFQ-R-호흡기 점수; 평균(SD) | 60.9 (18.9) | 60.5 (18.1) |
| 모든PA 병원균에 대한 아즈트레오남의 MIC, mg/mL | ||
| MIC50 | 2 | 4 |
| MIC90 | 64 | 128 |
| 최소 MIC | ≤1 | ≤1 |
| 최대 MIC | 256 | >2048 |
| 검사된 병원균의 수 | 140 | 128 |
*검사시 (-7일과 -14일 사이)
**TIS는 호주와 뉴질랜드에서는 시판되지 않는다. 이 나라들의 2 환자들은 전년도 동안의 TIS 사용을 보고하였다:
두 군간의 인구 통계학과 기준치 특성의 상당한 차이 (P<0.05)는 평균 연령, 더 어려지는 AZLI군 내의 환자들이었다. 그러나, 18세 미만 대 18세 이상으로 분류된 환자의 비율은 AZLI군과 위약군 사이에서 상당한 차이가 없었다.
| CFQ-R 등급 | 기준치로부터의 변화, 조정된 평균 점수 | 95% 신뢰 구간 | P 값 | |
| 위약 | AZLI | |||
| 신체 이미지 | 1.0 | 3.2 | -2.2, 6.5 | 0.327 |
| 소화 | 1.9 | 2.2 | -3.5, 4.0 | 0.889 |
| 식욕 | -4.7 | 3.6 | 4.1, 12.7 | <0.001 |
| 정서적 기능 | -1.3 | 3.9 | 1.6, 8.8 | 0.005 |
| 건강 인식 | -4.8 | 5.0 | 4.8, 14.9 | <0.001 |
| 신체적 기능 | -6.9 | 2.3 | 3.6, 14.8 | 0.001 |
| 호흡기 증상들 | -2.6 | 7.1 | 4.3, 15.1 | <0.001 |
| 역할/학교 생활 | -4.2 | 2.1 | 1.3, 11.4 | 0.014 |
| 사회적 기능 | -3.6 | -1.2 | -1.7, 6.5 | 0.248 |
| 치료 부담 | -3.1 | 0.2 | -1.5, 7.9 | 0.177 |
| 활력 | -4.4 | 3.6 | 2.5, 13.5 | 0.005 |
| 체중 | 1.4 | 4.7 | -4.0, 10.5 | 0.376 |
| TEAEs*, n (%) | 위약 n=84 |
AZLI n=80 |
||
| 기침 | 25 | (29.8) | 28 | (35.0) |
| 마른 기침** | 21 | (25.0) | 10 | (12.5) |
| 인후 통증 | 7 | (8.3) | 10 | (12.5) |
| 비충혈 | 8 | (9.5) | 8 | (10.0) |
| 발열 | 4 | (4.8) | 7 | (8.8) |
| 폐 수포음 | 6 | (7.1) | 6 | (7.5) |
| 두통 | 10 | (11.9) | 5 | (6.3) |
| 호흡 곤란 | 8 | (9.5) | 5 | (6.3) |
| 천명 | 7 | (8.3) | 5 | (6.3) |
| 흉부 불쾌감 | 4 | (4.8) | 5 | (6.3) |
| 목등 자극 | 2 | (2.4) | 5 | (6.3) |
| 피로 | 7 | (8.3) | 3 | (3.8) |
| 감소된 폐 기능 검사 | 6 | (7.1) | 3 | (3.8) |
| 복통 | 6 | (7.1) | 2 | (2.5) |
| 객혈 | 6 | (7.1) | 2 | (2.5) |
*MedDRA (Medical Dictionary for Regulatory Activities; 버젼 8.0)을 사용하여 우선어를 TEAEs 기재하였다.
**AZLI군에서는 상당히 적었음 (P =0.047), 피셔의 정확 검정법; TEAE 발생 정도가 각 치료군에서 10% 이상인 경우 시험함.
임상 시험
III
CP
-
AI
-006 연구
이는 전술한 임상 시험 I 또는 임상 시험 II 중 어느 하나에 참여한 CF 환자에서의 반복적인 AZLI 노출에 대한 안전성 및 효능을 평가하는 공개로 (open-label) 진행되는 다중 (multi-center) 연구이다. 환자들은 동일한 투여 계획 (regimen)으로, 임상 시험 I 또는 임상 시험 II 중 어느 하나로 할당되었던 BID 또는 TID인 AI로 된 최대 9회 28일 코스를 받았다. AZLI의 각 코스 다음에는 28일의 휴약기를 두었다. 환자들은 임상 시험 I 또는 임상 시험 II를 필수적으로 완성하여야 하고, 그렇지 않으면 의약물 내성을 연구하기 위하여 무관한 부작용 (AE) 때문에 또는 폐 항생제에 대한 필요성 때문에 도중에 시험 취소되었다. 연구 기간 중, 환자에게 IV 아제트레오남을 제외하고 폐 항생제 (경구로, IV로, 또는 흡입으로)를 필요에 따라 처리할 수 있다. 2007년 3월 1일 중간 자료 컷오프 (cut-off)에서, 207명의 환자가 등록되었고, 최소한 1회의 등록후 방문이 있었다. AI BID군에 82명의 환자가 있었고, AI TID군에 125명의 환자가 있었다. 처음 3회 코스에 걸쳐 관찰된 안전성 특징은 CF 폐질환에 걸린 환자의 예상되는 증상와 일치하였다. 호흡기 증상는 AE 보고의 주요 원인이었다. AE, 약물과 관련된 AE, 또는 심각한 부작용 (SAE)의 전체적인 비율에 있어서, 투약 계획 간의 차이는 발견되지 않았다. 시험 기간 중에 아제트레오남에 대한 PA의 민감성에는 거의 변화가 없었다. BID 및 TID 치료군 양자에 있어서, MIC50는 1회 방문시로부터 변화하지 않고 남아있었지만 (±2배 변화), MIC90의 일시적인 증가는 관찰되었다. AZLI의 각 처음 3회 코스 완료 후, CFQ-R 호흡기 증상 영역 점수에서 기준치로부터 절대적인 평균값 변화는 BID군에 비하여 TID 군에서 더욱 컸다. 마찬가지로, FEV1 (예상되는 [L] 및 %)는 AZLI의 각 28일 코스 이후에 기준치로부터 상대적으로 개선되었고, 그 중 28일의 후속 (follow-up) 기간 말미에는 (AZLI의 다음 코스 직전), 군의 평균이 기준치까지 회귀되었다. FEV1에서 1회 방문으로부터의 백분율 변화는 각 처음 3회의 AZLI 코스의 말미에서 BID군보다 TID군에서 더욱 높았다. 6회 방문에서, 1회 방문으로부터의 백분율 변화는 TID군에서 BID군에 비하여 더 높은 채로 유지되었지만, 통계학적으로 유의한 것은 아니었다. PA 객담 밀도는 치료 기간 중 모든 군에서 기준치로부터 상대적으로 감소되었으며, 그 감소량은 BID로 치료된 환자보다 TID로 치료된 환자에서 더욱 많이 일치하였다.
0일째로부터
CFQ
-R 호흡기 증상 영역 점수의 평균 변화
공개 팔로우 온 (follow on) 연구에서, 기준치 (1회 방문)에서 평균 CFQ-R 호흡기 증상 영역 점수는 BID군 및 TID군 각각에 대하여 약 66 및 62점이었다. 공개 치료의 처음 28일 경과 후 CFQ-R 호흡기 증상 영역 점수에서의 평균 (표준편차 (SD))의 변화는 BID군에 대하여 3.53 (12.53)이고, TID 군에 대하여 7.06 (16.35)이었다. 이 변화는 대조 시험에서 AZLI 치료 28일 후 관찰된 것과 일치하였다. 표 8은 공개 시험의 0일째로부터 처음 3회 공개 AZLI 코스의 종료시까지, 그리고 공개 시험의 최종 방문시까지, CFQ-R 호흡기 증상 영역 점수에서의 변화를 나타낸다.
| AI BID (N = 82) | AI TID (N = 125) | |
| 코스 1 종료 (28일) | ||
| n | 78 | 124 |
| 평균 (SD) | 3.53 (12.53) | 7.06 (16.35) |
| 중앙값 | 5.56 | 5.56 |
| 범위 | -38.9 - 27.8 | -38.9 - 72.2 |
| 코스 2 종료 (84일) | ||
| N | 75 | 106 |
| 평균 (SD) | 2.93 (13.98) | 6.39 (16.46) |
| 중앙값 | 0.00 | 5.56 |
| 범위 | -50.0 - 33.3 | -38.9 - 55.6 |
| 코스 3 종료 (140일) | ||
| n | 69 | 88 |
| 평균 (SD) | -0.16 (19.78) | 7.45 (19.01) |
| 중앙값 | 0.00 | 5.56 |
| 범위 | -61.1 - 33.3 | -44.4 - 50.0 |
| 마지막 방문 참석 | ||
| n | 79 | 124 |
| 평균 (SD) | 0.84 (16.29) | 4.03 (19.60) |
| 중앙값 | 0.00 | 2.78 |
| 범위 | -61.11 - 44.44 | -61.11 - 66.67 |
도 9는 공개 시험에서 각 처음 3회의 AZLI 치료 코스의 첫날부터 마지막날까지 관찰된 (즉, 각 28일 간격 내) 대조 시험에서 기준치로부터 28일째까지 관찰된 CFQ-R 호흡기 증상 영역 점수에서의 평균 변화를 비교한 것이다. 도 9에서 자료는 코스 중의 변화이므로, 표 8의 정보와는 일치하지 않음을 주의하여야 한다. 임상 시험 I의 기간 중 TSI 런 (run) 도중에 관찰된 평균 CFQ-R 호흡기 증상 영역 점수에서의 변화를 비교용으로 나타내었다.
이전 연구에 의한 공개
팔로우온
시험의 0일째로부터
CFQ
-R 호흡기 증상 영역 점수의 평균 변화
표 9는 이전의 연구에 의한 임상 시험 III의 0일째로부터의 CFQ-R 호흡기 증상 영역 점수의 평균 변화를 나타낸다. 각 처음 3회 공개 AZLI 치료 코스의 완료시, 평균 변화는 임상 시험 I으로부터의 환자보다 임상 시험 II로부터의 환자에 대하여 더욱 컸다.
| 임상 시험 I | 임상 시험 II | |||||
|
AI
BID
(N = 82) |
AI
TID
(N = 74) |
AI
집단
(N = 156) |
AI
TID
(N = 51) |
|||
| 코스 1 종료 (28일) | ||||||
| n | 78 | 73 | 151 | 51 | ||
| 평균 (SD) | 3.53 (12.54) | 7.61 (15.78) | 5.50 (14.93) | 6.26 (17.26) | ||
| 중앙값 | 5.56 | 5.56 | 5.56 | 5.56 | ||
| 범위 | -38.89 - 27.78 | -33.33 - 66.67 | -38.89 - 66.67 | -38.89 - 72.22 | ||
| 코스 2 종료 (84일) | ||||||
| n | 75 | 67 | 142 | 39 | ||
| 평균 (SD) | 2.93 (13.98) | 4.39 (16.00) | 3.62 (14.93) | 9.83 (16.88) | ||
| 중앙값 | 0.00 | 5.56 | 0.00 | 11.11 | ||
| 범위 | -50.00 - 33.33 | -38.89 - 55.56 | -50.00 - 55.56 | -33.33 - 55.56 | ||
| 코스 3 종료 (140일) | ||||||
| n | 70 | 59 | 129 | 29 | ||
| 평균 (SD) | 0.08 (19.74) | 6.36 (20.56) | 2.95 (20.28) | 9.67 (15.48) | ||
| 중앙값 | 0.00 | 0.00 | 0.00 | 5.56 | ||
| 범위 | -61.11 - 33.33 | -44.44 - 50.00 | -61.11 - 50.00 | -22.22 - 50.00 | ||
CFQ
-R 호흡기 증상 영역 점수의 카테고리 변화
표 10은 임상 시험 III에서의 처음 3회 AZLI 코스에 걸친 CFQ-R 호흡기 증상 영역 점수의 카테고리 변화를 나타내는데, 그 변화는 공개 시험의 0일째로부터 계산한다. 처음 3회 코스의 종료시에, 증상의 개선이 있는 환자의 비율은 증상가 악화된 환자의 비율보다 약 20% 더 높았다. BID군보다 TID군에서 더 높은 비율의 환자들의 증상가 개선되었다.
|
AZLI
BID
(N = 82) n (%) |
AZLI
TID
(N = 125) n (%) |
AZLI
Total
(N = 207) n (%) |
|
| 코스 1 종료 (28일) | |||
| n | 78 | 124 | 202 |
| 개선 | 40 (51.3) | 79 (63.7) | 119 (57.5) |
| 안정됨 또는 변화없음 | 22 (28.2) | 13 (10.5) | 35 (16.9) |
| 악화 | 16 (20.5) | 32 (25.8) | 48 (23.2) |
| 코스 2 종료 (84일) | |||
| n | 75 | 106 | 181 |
| 개선 | 33 (44.0) | 61 (57.5) | 94 (51.9) |
| 안정됨 또는 변화없음 | 22 (29.3) | 21 (19.8) | 43 (23.7) |
| 악화 | 20 (26.7) | 24 (22.6) | 44 (24.3) |
| 코스 3 종료 (140일) | |||
| n | 79 | 88 | 157 |
| 개선 | 32 (46.4) | 49 (55.7) | 81 (51.6) |
| 안정됨 또는 변화없음 | 13 (18.8) | 17 (19.3) | 30 (19.1) |
| 악화 | 24 (34.8) | 22 (25.0) | 46 (29.9) |
개선- ≥5의 점수 증가
안정 또는 변화 없음 - 5 미만의 변화 (감소이든 증가이든 )
악화 - ≥5의 점수 감소
공개
팔로우
온 시험
예상된
FEV
1
%의 상대적 평균 변화
표 11은 0일째로부터 공개 시험의 각 처음 3회의 AI 치료 간격의 종료시까지 예상된 FEV1 %의 상대적인 평균 변화를 나타낸다. 각 치료 코스 종료시 주목되는 양성 FEV1 반응이 있었는데, 더욱 큰 반응이 TID 아암 (arm)에서 관찰되었다는 것과 일치한다. 이들 결과는 대조 시험 도중에 관찰된 것을 뒷받침해 준다.
|
AZLI
BID
(N = 82) |
AZLI
TID
(N = 125) |
|
| 코스 1 종료 (28일) | ||
| n | 80 | 122 |
| 평균 (SD) | 4.10 (10.48) | 9.85 (17.27) |
| 중앙값 | 3.61 | 6.94 |
| 범위 | -17.71 - 36.34 | -25.26 - 108.86 |
| 코스 2 종료 (84일) | ||
| n | 75 | 107 |
| 평균 (SD) | 2.40 (8.89) | 8.65 (19.00) |
| 중앙값 | 3.18 | 6.02 |
| 범위 | -16.74 - 23.86 | -44.08 - 110.48 |
| 코스 3 종료 (140일) | ||
| n | 71 | 90 |
| 평균 (SD) | 2.63 (11.47) | 6.86 (18.27) |
| 중앙값 | 3.61 | 4.93 |
| 범위 | -32.24 - 28.76 | -37.91 - 93.83 |
도 10은 공개 시험에서 각 처음 3회의 AZLI 치료 코스 내에서의 FEV1 반응을 나타낸다. 제3기 대조군 시험의 치료 기간 중 관찰된 예상된 FEV1 %의 상대적 변화와, 임상 시험 I의 기간 중 TSI 런에 대한 것을 비교를 위해 제시한다.
FEV
1
에서의 평균 백분율 변화 (L)
표 12는 FEV1에서의 평균 백분율 변화 (L)에 대한 결과를 나타낸다. 이들 결과와 예상된 FEV1 %에 있어서의 상대적인 평균 변화에 대한 결과 간에는 의미 있는 차이가 없었다.
|
AZLI
BID
(N = 82) |
AZLI
TID
(N = 125) |
|
| 코스 1 종료 (28일) | ||
| n | 80 | 122 |
| 평균 (SD) | 4.05 (10.27) | 9.86 (17.27) |
| 중앙값 | 3.71 | 6.99 |
| 범위 | -17.50 - 33.33 | -25.13 - 108.74 |
| 코스 2 종료 (84일) | ||
| n | 75 | 107 |
| 평균 (SD) | 2.43 (8.85) | 8.66 (18.98) |
| 중앙값 | 3.50 | 5.48 |
| 범위 | -16.86 - 23.68 | -44.16 - 110.16 |
| 코스 3 종료 (140일) | ||
| n | 70 | 97 |
| 평균 (SD) | 2.72 (11.51) | 6.76 (18.22) |
| 중앙값 | 3.59 | 4.41 |
| 범위 | -31.74 - 28.37 | -37.57 - 93.20 |
이전의 연구에 의하여 예상된
FEV
1
%에서의 상대적인 평균 변화
표 13은 이전의 시험에 의하여 공개 연구의 처음 3회 코스 중 예상된 FEV1 %에서의 상대적인 평균 변화를 제시한다. 양쪽 연구로부터의 환자에서 각 코스 도중에 양성 FEV1 반응이 관찰되었는데, 임상 시험 I에서 TID 아암은 BID 아암보다 더 큰 반응을 일관적으로 보였다. 임상 시험 II로부터의 환자는 임상 시험 I의 BID 또는 RID 중 어느 하나로부터의 환자보다 각 치료 코스 중에 예상된 FEV1 % 의 더욱 큰 개선을 보였다.
| 임상 시험 I | 임상 시험 II | |||
|
AZLI
BID
(N = 82) |
AZLI
TID
(N = 74) |
AZLI
집단
(N = 156) |
AZLI
TID
(N = 51) |
|
| 코스 1 종료 (28일) | ||||
| n | 80 | 72 | 152 | 50 |
| 평균 (SD) | 4.10 (10.48) | 8.93 (16.18) | 6.39 (13.65) | 11.19 (18.81) |
| 중앙값 | 3.61 | 6.55 | 4.99 | 7.92 |
| 범위 | -17.71 - 33.34 | -25.26 - 66.56 | -25.26 - 66.56 | -13.85 - 108.86 |
| 코스 2 종료 (84일) | ||||
| n | 75 | 67 | 142 | 40 |
| 평균 (SD) | 2.40 (8.89) | 5.32 (13.65) | 3.78 (11.44) | 14.23 (24.78) |
| 중앙값 | 3.18 | 4.39 | 3.76 | 7.32 |
| 범위 | -16.74 - 23.86 | -44.08 - 47.00 | -44.08 - 47.00 | -22.11 - 110.48 |
| 코스 3 종료 (140일) | ||||
| n | 71 | 60 | 131 | 30 |
| 평균 (SD) | 2.63 (11.47) | 3.54 (15.00) | 3.04 (13.16) | 13.51 (22.32) |
| 중앙값 | 3.61 | 2.08 | 3.17 | 7.78 |
| 범위 | -32.24 - 28.76 | -37.91 - 42.22 | -37.91 - 42.22 | -11.17 - 93.83 |
이전 연구에 의한
FEV
1
의 평균 백분율 변화 (L)
표 14는 이전 연구에 의한 FEV1의 평균 백분율 변화 (L)에 대한 자료를 제시한다. 이들 결과와 예상된 FEV1 %의 상대적인 평균 변화에 대한 결과 간의 의미있는 차이는 없었다 (표 13 참조).
| 임상 시험 I | 임상 시험 II | |||
|
AZLI
BID
(N = 82) |
AZLI
TID
(N = 74) |
AZLI
집단
(N = 156) |
AZLI
TID
(N = 51) |
|
| 코스 1 종료 (28일) | ||||
| n | 80 | 72 | 152 | 50 |
| 평균 (SD) | 4.05 (10.27) | 8.93 (16.21) | 6.36 (13.59) | 11.20 (18.78) |
| 중앙값 | 3.71 | 6.60 | 4.93 | 7.95 |
| 범위 | -17.50 - 33.33 | -25.13 - 66.47 | -25.13 - 66.47 | -13.89 - 108.74 |
| 코스 2 종료 (84일) | ||||
| n | 75 | 67 | 142 | 40 |
| 평균 (SD) | 2.43 (8.85) | 5.35 (13.72) | 3.81 (11.46) | 14.22 (24.69) |
| 중앙값 | 3.50 | 4.26 | 3.60 | 7.17 |
| 범위 | -16.86 - 23.68 | -44.16 - 48.00 | -44.16 - 48.00 | -22.11 - 110.16 |
| 코스 3 종료 (140일) | ||||
| n | 71 | 60 | 131 | 30 |
| 평균 (SD) | 2.72 (11.43) | 3.56 (15.04) | 3.11 (13.16) | 13.14 (22.25) |
| 중앙값 | 3.33 | 2.26 | 3.00 | 6.21 |
| 범위 | -31.74 - 28.37 | -37.57 - 41.84 | -37.57 - 41.84 | -11.43 - 93.20 |
검토
임상 개발 프로그램에 있어서의 가장 중요한 효능 종점인 CFQ-R 호흡기 증상 영역 점수의 변화는 이들의 호흡기 증상의 변화의 환자 인지 (patient perception)를 측정하였다. 이 종점은 양자의 연구에서 AZLI 및 위약군 사이에 유의한 차이를 보였다. 14일째 및 28일째에, 임상 시험 II (7.98 및 9.71) 및 임상 시험 I (5.53 및 5.01)에 대한 처리 차이는 위약군과 비교하여 AZLI로 치료된 환자 중의 호흡기 증상의 임상학적으로 유의한 개선을 증명하게 해 주었는데, 이러한 개선은 임상 시험 II 연구에서의 42일째에도 유지되었다. 5개 지점의 변화는 각 환자에 의하여 검출될 수 있는 최소한의 변화를 나타낸다. 더욱이, 위약군에 비하여 AZLI를 투여 받은 환자의 유의하게 더 높은 백분율은 호흡기 증상의 개선을 나타내는 점수를 가졌고, 더 낮은 백분율은 14일째 및 28일째에 더욱 악화된 증상를 보였다. 공개로 진행되는 시험에서 유사한 결과가 관찰되었는데, 여기서는 임상 시험 II에 등록된 환자에 대한 더욱 많은 점수 변화가 있었고, 반응 중 일부 감퇴가 임상 시험 I으로부터의 환자 중의 제2 및 제3 AZLI 코스에서 관찰되었지만, 조합된 시험의 분석은 유지된 반응을 보였다. AZLI 치료된 환자 중에서, CFQ-R 호흡기 증상 영역 점수의 증가는 예상된 FEV1 >50 % 기준치을 갖고, 여성이며, US 출신 이외의 환자 중에서 더욱 컸다. 여성이 CFQ-R 점수에서 더욱 큰 개선을 가진다는 발견은 예측 밖이었다. 성별간 차이는 CF 환자 중에 잘 기록되어 있는데, TSI 등록 시험에서 증명된 바와 같이, 여성은 역사적으로 더욱 좋지 않은 경과를 보이지만, 치료에 대한 반응은 더욱 강력하였다.
관찰된 호흡기 증상의 개선 및 항생제 사용의 감소의 일관되게, CF에서의 항생제 치료의 효능을 평가하기 위하여 전통적으로 사용되어 온 두 가지 핵심 마커인 폐 기능 및 객담의 PA 밀도의 변화는 AZLI 치료된 환자에서 유의한 장점을 증명하는 것이다. 양자의 대조군 시험에서 AZLI 치료의 14일째까지, FEV1 (예상된 [L] 및 %)는 위약군에 비하여 유의하게 개선되었다. 28일째에, AZLI 및 위약군 간의 FEV1의 평균 백분율 변화 (L)에 대한 차이는 각각 6.3% (임상 시험 I), 10.3%였다 (임상 시험 II)고, 예상된 FEV1 %의 상대적인 변화에 대한 차이는 6.6% 및 10.2%였다. 이들 결과는 TSI 및 Pulmozyme에 대한 등록 시험 뿐 아니라, 흡입한 토브라마이신 및 콜스틴을 비교하는 유럽 시험 (표 15 참조)에서 관찰된 치료 효과와 문제 없이 비교된다. 더욱이, 이들 개선은 AZLI 치료 종료후 14일 후인 42일째까지 유지된 반면, TSI 시험의 FEV1 반응은 14일째에 정점이었고, 그 이후 감소되었다. 임상 시험 I에서의 치료 효과는 이들 환자가 AZLI 치료 직전에 28일 TSI 코스를 받았다는 점에서 현저하다. TSI 런 기간 도중에 관찰된 최소한의 개선 (0.9%)은 AZLI 치료 14일 도중에 폐 기능에서의 강력한 증가가 달성될 수 있다는 점을 예상하지 못하였다.
공개 시험의 처음 3가지 코스 중의 FEV1 반응은 기준치로부터 일관적으로 개선된 것을 보였다. 환자의 증상 인식의 변화에 관하여 관찰된 것으로서, 임상 시험 II로부터 등록된 환자는 공개 시험에서의 더욱 현저한 FEV1 반응을 가졌으며, 제3 코스 종료시까지 (공개 치료를 시작한 후 6개월), 예상된 FEV1 %의 개선 (13.5%)은 처음 코스의 종료 이후 (12.0%)보다 컸으며, 임상 시험 III으로부터의 환자에 대한 공개 시험 결과는 임상 시험 I (0.9%)의 시기에서 TSI 런 동안에 관찰된 예상된 FEV1 %에서의 무시할 만한 변화와 첨예하게 대립되었다. 이는 TSI 등록 시험의 제3 TSI 코스 (10%)의 종료시에 관찰된 개선보다 더 컸다.
FEV1 에서의 더욱 큰 개선이 덜 심각한 기준치 질병을 가진 환자에서 관찰되었으며, 더욱 민감한 PA 분리체 뿐만 아니라, US 외부의 환자로부터 관찰되었다. 모든 연령군의 AZLI 치료된 환자에 대한 필적할 만한 FEV1 반응의 발견은 TSI 등록 시험 결과와 다른데, TSI 등록 시험 결과에서는 13 내지 17세 환자 중의 반응은 이보다 더 어리거나 더 연령이 높은 환자 중에서보다 유의하게 높았다.
PA CFU 밀도의 감소는 28일 치료 코스 중의 폐 기능의 증가를 반영하며, 이는 치료 시작 후 14일 이내에 관찰된 양자의 연구에서의 AZLI 치료된 환자에 대한 상당한 감소와 일치한다. 14일 째에, 임상 시험 I 및 임상 시험 II에 대한 치료 차이는 0.49 및 0.88 log10이고, 28일째까지 군 사이의 치료 차이는 0.66 log10 및 1.45 log10으로 증가되었다. 이들 감소의 규모는 TSI 등록 시험을 비롯하여, 흡입된 토브라마이신 및 콜리스틴 연구에서 관찰된 것과 필적할만 하다 (표 15 참조). 치료를 중지한 다음에, CFU 밀도는 증가되었고, 42일째까지 호흡기 증상 및 폐 기능은 여전히 AZLI 치료된 환자에 대한 기준치보다 개선된 것을 보였지만, CFU 밀도는 기준치 근처에 있거나 또는 그를 초과하였다. 공개 팔로우 온 시험에 있어서, CFU 밀도는 각 처음 3회의 28일 코스 도중에 감소되었지만, 감소의 규모는 대조군 시험에서의 치료 28일째 만큼 크지는 않았다. 이들 결과는 TSI 등록 시험에서의 결과와 일치하였으며, 여기서 이후의 치료 코스에서 효과는 감소되었다. 임상 시험 I에서 0일 및 28일 간에 관찰된 작은 감소는, 이전의 항생제 치료가 CFU 반응을 감쇠시킬 수 있기 때문에, 런 도중에 TSI 치료에 기여할 수 있다. CFU 밀도 감소는 덜 심한 질병을 가진 AZLI 치료된 환자, 더 민감한 PA 분리체, 남성 및 18세 미만의 환자에 대하여 더 컸는데, 후자의 결과는 연령이 증가됨에 따라 감소된 CFU 반응을 보이는 TSI 시험과 일치한다.
| 연구 | 폐 기능 시작 조건 a | 예측 FEV 1 % 기준치 (평균±SD) a |
복용량
(mg)/기간 |
FEV 1 변화 |
PA
밀도 변화
( Log 10 ) |
| 토브라마이신21 (N=36) |
FVC > 40% | 55 ±3.7 to 60 ±3.2 |
600 TID | 10%a | -2.0 |
| TOBI (All) (N=258)1 |
FEV1 25~75% | 49.9 ±15.5 | 300 BID/28 일 | 12%b | -2.0 |
| 청소년 (N=63)1 | FEV1 25~75% | 알려지지 않음 | 300 BID/28 일 | ~16%b | 평가 불가 |
| 성인 (N=140)1 |
FEV1 25~75% | 알려지지 않음 | 300 BID/28 일 | ~6%b | 평가 불가 |
| TOBI (N=53) | FEV1 ≥25% | 55.4 ±22.9 | 300 BID/28 일 | 7%b | -0.9 |
| 콜리스틴20 (N=62) |
FEV1 ≥25% | 59.4 ±22.6 | 80 BID/28 일 | 0%b | -0.6 |
| 풀모자임19 | FVC > 40% | 61.1 ±26.9 | 2.5 mg BID/24 주 | 5.8±0.7c | 평가 불가 |
| 풀모자임19 | FVC > 40% | 60.0 ±2.69 | 2.5 mg TID/24 주 | 5.6±0.7c | 평가 불가 |
a. 28일 치료 후 대조군에 비하여 예상된 FEV1 %의 절대적인 변화
b. 28일 치료 후 대조군에 비하여 예상된 FEV1 %의 상대적인 변화
c. 24주 치료 후 대조군에 비하여 예상된 FEV1 %의 백분율 변화 (L)
d. 28일째 대조군에 비하여 상대적인 변화에서의 FEV1 % 변화
호흡기 증상 개선을 보이는 것 외에도, CFQ-R은 신체적 기능, 정서적 기능, 신체 이미지, 섭식 장애, 역할 제한/학교에서의 행동, 체중 장애, 활력 및 치료 부담 등의 비호흡기적인 영역에서의 개선을 증명하였다. 이들 결과는 정상 활성에 영향을 미치는 복잡하고 시간이 소요되는 의료적 투여 계획에 의존해야만 하는 만성 질병을 가진 환자에게 특히 알맞다. 이들의 치료적 장점의 인지는 치료 투여 계획에 대한 환자의 복종 (adherence)을 개선시킬 가능성이 높다.
AZLI로 치료한 치료군 환자 대 위약군 환자에서의 체중 및 체질량지수 증가는 이들 시험 중 AZLI 치료로부터 유래한 일반적인 건강상의 장점을 다시 한번 확인해 주었다.
치료적 장점은 연령, 기준치 질병 중증도 및 PA 민감성 및 성별에 의하여 규정된 모든 하위 그룹에서 증명되었으며, CF 폐 질병에 대한 현재의 표준 치료를 브라켓팅 (bracketing)하는 것으로서 관찰될 수 있는 3가지 시험으로부터의 결과와 유사한 결과가 얻어졌다 (즉, 임상 시험 II = 28+일간 항생제를 투여하지 않은 환자의 치료, 임상 시험 I = 28일 TSI 코스 직후에 집중 치료한 환자 및 임상 시험 III = 임상적으로 표시된 바와 같이 현재 치료되는 환자에서의 치료).
전술한 실시 상태는 본 발명의 특정한 측면을 나타내는 것이다. 다른 목적, 측면 및 실시 상태는 이 기술 분야의 숙련자가 명백히 알 수 있고, 본 발명의 범위에 포함되는 것으로 의도된다.
본 출원의 모든 참조 문헌은 그 전체가 본 명세서에 참조로서 포함된다.
Claims (17)
- 폐질환의 건강 관련 삶의 질 증상들 중 한 가지 이상을 치료하기 위한 의약의 제조시에 1회 복용량당 약 1 내지 약 250 mg의 아즈트레오남 라이신을 포함하는 흡입용 건조 분말 또는 에어로졸의 유효 치료량을 이를 필요로 하는 환자에게 투여하는 용도에 있어서,
상기 흡입용 건조 분말 또는 에어로졸은 연속하여 최소 14일 내지 28일간 투여된 다음 14일 내지 28일 휴약 기간을 두고, 상기 투여 요법을 최소한 1회 반복하는 것을 포함하는 투여 요법을 사용하여 폐의 기도에 투여되는 것인 용도. - 제1항에 있어서, 상기 흡입용 건조 분말 또는 에어로졸의 복용량은 1일 3 내지 10회 투여되는 것인 용도.
- 제1항 또는 제2항에 있어서, 상기 환자는 그람 음성 박테리아에 의한 폐의 세균에 감염된 것인 용도.
- 제3항에 있어서, 상기 폐의 세균 감염은 녹농균 (Pseudomonas aeruginosa)인 것인 용도.
- 제1항 내지 제4항 중 어느 하나의 항에 있어서, 상기 폐질환은 낭포성 섬유증인 것인 용도.
- 제5항에 있어서, 상기 건강 관련 삶의 질 증상은 개정된 낭포섬 성유증 설문지 영역의 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 또는 전부인 것인 용도.
- 제6항에 있어서, 상기 영역은 호흡기 영역, 신체 이미지 영역, 소화 영역, 식사 영역, 정서적 영역, 건강 인식 영역, 신체적 영역, 역할/학교 생활 영역, 사회적 영역, 치료 부담 영역, 활력 영역 및 체중 영역으로 이루어진 군으로부터 선택되는 것인 용도.
- 제1항 내지 제7항 중 어느 하나의 항에 있어서, 상기 흡입 가능한 에어로졸은 약 0.1 내지 약 0.45%, w/v의 염화나트륨을 포함하는 약 1 내지 약 5 mL의 생리 식염수에 용해된 1회 복용량당 약 1 내지 250mg의 아즈트레오남 라이신을 포함하는 것인 용도.
- 제1항 내지 제8항 중 어느 하나의 항에 있어서, 상기 흡입 가능한 에어로졸은 약 1 내지 약 5 ㎛의 공기 역학적 중량 평균 직경을 포함하는 대부분의 에어로졸 입도를 전달하기에 적당한 전자식 네블라이저에 의하여 전달되는 것인 용도.
- 제1항 내지 제9항 중 어느 하나의 항에 있어서, 상기 흡입 가능한 에어로졸 복용량은 1일 3회 투여되는 것인 용도.
- 제1항 내지 제10항 중 어느 하나의 항에 있어서, 상기 각 흡입 가능한 에어로졸 복용량은 약 0.17%, w/v의 염화나트륨을 포함하는 약 1 mL의 식염수에 용해된 약 75 mg의 아즈트레오남을 포함하는 것인 용도.
- 제1항 내지 제11항 중 어느 하나의 항에 있어서, 상기 흡입 가능한 에어로졸의 투여는 토브라마이신 흡입 용액의 표준 처방된 28일의 투여가 선행하는 것인 용도.
- 제1항 내지 제12항 중 어느 하나의 항에 있어서, 상기 투여 요법은 1회 내지 9회 반복되는 것인 용도.
- 제6항 내지 제13항 중 어느 하나의 항에 있어서, 최소 1회의 요법 도중에, 흡입 가능한 에어로졸 투여 후의 호흡기 영역 점수는 상기 투여 요법의 개시시의 점수에 비하여 최소 5 포인트 증가하는 것인 용도.
- 제6항 내지 제14항 중 어느 하나의 항에 있어서, 최소 1번의 요법 도중에, 흡입가능한 에어로졸 투여 후의 호흡기 영역 점수는 요법의 휴약기 도중의 환자의 녹농균 가래 밀도가 최소한 상기 투여 요법의 개시시의 밀도를 증가한 후의 상기 투여 요법의 개시시에 비하여 증가하는 것인 용도.
- 제6항 내지 제15항 중 어느 하나의 항에 있어서, 상기 투여 요법은 최소 3회 반복되고, 2회의 투여 요법 후에 임의의 1회의 투여 요법 후의 호흡기 영역 점수는 최초의 투여 요법 개시시의 점수로 감소되지 않는 것인 용도.
- 본 발명에서 청구된 용도 또는 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US99707107P | 2007-10-01 | 2007-10-01 | |
| US99707207P | 2007-10-01 | 2007-10-01 | |
| US60/997,072 | 2007-10-01 | ||
| US60/997,071 | 2007-10-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100093037A true KR20100093037A (ko) | 2010-08-24 |
Family
ID=40032482
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107009839A KR20100093037A (ko) | 2007-10-01 | 2008-09-15 | 폐질환의 건강 관련 삶의 질 부족을 치료하기 위한 흡입용 아즈트레오남 라이신 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US7973029B2 (ko) |
| EP (1) | EP2200608A1 (ko) |
| JP (1) | JP2010540539A (ko) |
| KR (1) | KR20100093037A (ko) |
| CN (1) | CN101951906A (ko) |
| AR (1) | AR068514A1 (ko) |
| AU (1) | AU2008307268A1 (ko) |
| BR (1) | BRPI0817636A2 (ko) |
| CA (1) | CA2701118A1 (ko) |
| EA (1) | EA201070336A1 (ko) |
| IL (1) | IL204593A0 (ko) |
| MX (1) | MX2010003618A (ko) |
| NZ (1) | NZ584269A (ko) |
| TW (1) | TW200927193A (ko) |
| WO (1) | WO2009045706A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2002231244B2 (en) | 2000-12-27 | 2006-06-29 | Gilead Sciences, Inc. | Inhalable aztreonam for treatment and prevention of pulmonary bacterial infections |
| US7214364B2 (en) * | 2000-12-27 | 2007-05-08 | Corus Pharma, Inc. | Inhalable aztreonam lysinate formulation for treatment and prevention of pulmonary bacterial infections |
| CN104784159A (zh) * | 2015-04-15 | 2015-07-22 | 苏州惠仁生物科技有限公司 | 氨曲南粉雾剂的制备方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5152456A (en) * | 1989-12-12 | 1992-10-06 | Bespak, Plc | Dispensing apparatus having a perforate outlet member and a vibrating device |
| US5518179A (en) * | 1991-12-04 | 1996-05-21 | The Technology Partnership Limited | Fluid droplets production apparatus and method |
| US6962151B1 (en) * | 1999-11-05 | 2005-11-08 | Pari GmbH Spezialisten für effektive Inhalation | Inhalation nebulizer |
| DE19953317C1 (de) | 1999-11-05 | 2001-02-01 | Pari Gmbh | Inhalationsvernebler |
| AU2002231244B2 (en) * | 2000-12-27 | 2006-06-29 | Gilead Sciences, Inc. | Inhalable aztreonam for treatment and prevention of pulmonary bacterial infections |
| US7214364B2 (en) * | 2000-12-27 | 2007-05-08 | Corus Pharma, Inc. | Inhalable aztreonam lysinate formulation for treatment and prevention of pulmonary bacterial infections |
| US7138419B2 (en) * | 2000-12-27 | 2006-11-21 | Corus Pharma, Inc. | Process for manufacturing bulk solutions and a lyophilized pure α-aztreonam lysinate |
| DE10102846B4 (de) * | 2001-01-23 | 2012-04-12 | Pari Pharma Gmbh | Aerosolgenerator |
-
2008
- 2008-09-15 CN CN2008801170106A patent/CN101951906A/zh active Pending
- 2008-09-15 BR BRPI0817636A patent/BRPI0817636A2/pt not_active IP Right Cessation
- 2008-09-15 NZ NZ584269A patent/NZ584269A/en not_active IP Right Cessation
- 2008-09-15 WO PCT/US2008/076431 patent/WO2009045706A1/en active Application Filing
- 2008-09-15 AR ARP080104006A patent/AR068514A1/es not_active Application Discontinuation
- 2008-09-15 TW TW097135359A patent/TW200927193A/zh unknown
- 2008-09-15 CA CA2701118A patent/CA2701118A1/en not_active Abandoned
- 2008-09-15 MX MX2010003618A patent/MX2010003618A/es not_active Application Discontinuation
- 2008-09-15 EP EP08836327A patent/EP2200608A1/en not_active Withdrawn
- 2008-09-15 KR KR1020107009839A patent/KR20100093037A/ko not_active Application Discontinuation
- 2008-09-15 US US12/210,965 patent/US7973029B2/en not_active Expired - Fee Related
- 2008-09-15 EA EA201070336A patent/EA201070336A1/ru unknown
- 2008-09-15 JP JP2010527021A patent/JP2010540539A/ja active Pending
- 2008-09-15 AU AU2008307268A patent/AU2008307268A1/en not_active Abandoned
-
2010
- 2010-03-18 IL IL204593A patent/IL204593A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010540539A (ja) | 2010-12-24 |
| NZ584269A (en) | 2012-06-29 |
| AR068514A1 (es) | 2009-11-18 |
| CN101951906A (zh) | 2011-01-19 |
| BRPI0817636A2 (pt) | 2019-09-24 |
| TW200927193A (en) | 2009-07-01 |
| WO2009045706A1 (en) | 2009-04-09 |
| CA2701118A1 (en) | 2009-04-09 |
| EP2200608A1 (en) | 2010-06-30 |
| US7973029B2 (en) | 2011-07-05 |
| US20090124594A1 (en) | 2009-05-14 |
| MX2010003618A (es) | 2010-04-21 |
| AU2008307268A1 (en) | 2009-04-09 |
| IL204593A0 (en) | 2010-11-30 |
| EA201070336A1 (ru) | 2011-06-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US5508269A (en) | Aminoglycoside formulation for aerosolization | |
| JP2008503500A (ja) | 気管支感染症の治療法 | |
| US20080260863A1 (en) | Compositions for mucociliary clearance and methods for administering same | |
| KR20100093037A (ko) | 폐질환의 건강 관련 삶의 질 부족을 치료하기 위한 흡입용 아즈트레오남 라이신 | |
| EP3393517B1 (en) | Acetylsalicylic acid for use in the treatment of moderate to severe influenza | |
| IL164078A (en) | Antithrombin iii for use in treating lung injury | |
| JP2010540539A5 (ko) | ||
| Stass et al. | Pharmacokinetics and tolerability of BAY41-6551 in subjects with chronic kidney disease | |
| WO2022093767A1 (en) | Alpha-2 adrenergic receptor agonists to reduce mortality and improve outcomes in viral respiratory syndromes | |
| TW201016215A (en) | Compositions and uses of antiviral active pharmaceutical agents | |
| US20230113110A1 (en) | Composition for the treatment of lesions of the respiratory system | |
| Witt et al. | Dornase alfa: a new option in the management of cystic fibrosis | |
| Art et al. | Pulmonary function and antimicrobial concentration after marbofloxacin inhalation in horses | |
| EP4129322A1 (en) | Treatment of non-cystic fibrosis bronchiectasis | |
| US20230052317A1 (en) | Treatment of non-cystic fibrosis bronchiectasis | |
| KR20240033039A (ko) | 호흡기 질환의 치료 | |
| US20230310467A1 (en) | PHARMACEUTICAL COMBINATION THERAPY AND PREVENTION WITH APROTININ + REMDESIVIR OF SARS-CoV-2 AND/OR DISEASE ASSOCIATED WITH THIS INFECTION, INCLUDI COVID-19 | |
| CN117442588A (zh) | 一种吸入用人干扰素α2b溶液及其制备方法 | |
| EP4142691A1 (en) | Clofazimine composition and method for the treatment or prophylaxis of viral infections | |
| CN114129705A (zh) | 一种多肽在预防和治疗肺炎的药物中的应用 | |
| JPWO2006078066A1 (ja) | 経気道呼吸器感染症治療剤 | |
| Dal Negro et al. | Use of aerosols in bronchiectasis patients | |
| Bronchiectasis | 12 Inhaled Therapy for Other Respiratory Diseases | |
| Alfano et al. | Le Infezioni in Medicina, n. 1, 11-21, 2022 | |
| Hoffman et al. | Inhaled Aztreonam Lysine for Cystic Fibrosis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |