KR100694450B1 - 에틸렌형 불포화 모노머의 중합 억제방법 - Google Patents
에틸렌형 불포화 모노머의 중합 억제방법 Download PDFInfo
- Publication number
- KR100694450B1 KR100694450B1 KR1020027001664A KR20027001664A KR100694450B1 KR 100694450 B1 KR100694450 B1 KR 100694450B1 KR 1020027001664 A KR1020027001664 A KR 1020027001664A KR 20027001664 A KR20027001664 A KR 20027001664A KR 100694450 B1 KR100694450 B1 KR 100694450B1
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- group
- hydrogen
- independently selected
- composition
- Prior art date
Links
- 0 CN(*)C(CC1(*)*)CC(*)(*)N1O Chemical compound CN(*)C(CC1(*)*)CC(*)(*)N1O 0.000 description 2
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K15/00—Anti-oxidant compositions; Compositions inhibiting chemical change
- C09K15/04—Anti-oxidant compositions; Compositions inhibiting chemical change containing organic compounds
- C09K15/20—Anti-oxidant compositions; Compositions inhibiting chemical change containing organic compounds containing nitrogen and oxygen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B63/00—Purification; Separation; Stabilisation; Use of additives
- C07B63/04—Use of additives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C7/00—Purification; Separation; Use of additives
- C07C7/20—Use of additives, e.g. for stabilisation
Abstract
본 발명은 하기 식의 구조를 갖는 억제제의 유효량을 모노머에 첨가하는 단계를 포함하는 에틸렌형 불포화 모노머의 미성숙 중합 억제방법이다.
여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기
부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이다.
중합, 억제, 에틸렌형, 불포화, 모노머
Description
본 발명은 C-치환-아미노 시클릭 니트록사이드, 특히 4-아미노-2,2,6,6-테트라메틸-1-피페리디닐옥시를 에틸렌형 불포화 모노머, 특히 비닐 방향족 모노머 및 아크릴 모노머의 중합을 억제하기 위해 사용하는 것에 관한 것이다.
많은 에틸렌형 불포화 모노머는 이들의 제조, 가공, 취급, 저장 및 사용의 여러가지 단계에서 바람직하지 않게 중합한다. 특히 문제가 되는 것은 이런 모노머의 제조공정의 정제 단계에서 중합에 의해 야기되는 설비의 오염이다. 열적 중합과 같은 중합은 이들의 정제동안 모노머의 손실을 초래하고, 정제동안 사용되는 설비내에 또는 설비에 폴리머의 피착(depositon)에 기인한 생성 효율의 손실을 초래하고, 이 피착은 때때로 제거되어야 한다.
광범위한 화합물은 에틸렌형 불포화 모노머의 비제어되고 바람직하지 않는 중합을 억제하기 위해 제안되고 사용되어진다. 그러나, 이들 화합물이 완전히 만족스럽지는 않다. 따라서, 이 분야에서는 정제 또는 불순물 분리를 위한 증류 공정동안, 뿐만 아니라 전달 및 저장 동안, 이와 같은 모노머의 중합을 억제하는 개선된 조성물이 실질적으로 필요하다. 추가로, 용해성 폴리머의 형성은 모노머의 손실, 예를 들면 낮은 수율을 초래하고, 생성될 수 있는 모든 타르의 점도를 증가시킨다. 이어서, 타르의 가공은 잔류 모노머를 제거하기 위해 높은 온도와 작업 (에너지 비용)을 요구한다.
힌더링된 니트록실 화합물은 불포화 모노머, 예를 들면 스티렌, 아크릴산, 메타크릴산 및 등등의 프리 라디칼 중합에 대한 매우 활성적인 억제제임이 알려져 있다.
미국 특허 제3,163,677호에는 하기 식의 N,N,O-삼치환된-히드록실아민 및 N,N-이치환된 니트록사이드가 기재되어 있다.
여기서, R1, R2 및 R3는 각각 1 내지 15개의 탄소 원자를 갖는 알킬 라디칼이다. (본 명세서에 N-O* 지정은 아스테릭이 홀전자인 안정한 프리 라디칼을 나타낸다.) N,N,O-삼치환된 히드록실아민은 N,N-이치환된 니트록사이드를 만들기 위해 사용될 수 있고, 이것은 안정한 프리 라디칼이며 중합 억제제로서 유용하다고 알려져 있다.
미국 특허 제3,334,103호에는 니트록사이드가 니트록사이드기의 질소 원자가 지방족기의 삼차 탄소 이외에 부착되는 대응하는 헤테로고리 아민으로부터 제조될 수 있다는 것이 기재되어 있다(예를 들면, 질소 원자는 헤테로고리 핵의 일부를 형성한다). 이들 니트록사이드는 미국 특허 제3,163,677호의 N,N-이치환된 니트록사이드에 대해 설명된 것과 유사한 유용한 물성을 갖는 것으로 알려져 있다.
미국 특허 제3,372,182호에는 용이하게 이용될 수 없는 매우 다양한 N,N-이치환된 안정한 프리 라디칼 니트록사이드가 O-C 결합이 쉽게 끊어질 수 있는 임의의 히드록시아민(예를 들면, 트리-t-부틸히드록시아민)을 불활성 반응 배지에서 실질적으로 열분해(pyrolyzing)하는 단계를 포함하는 간단하고 편리한 공정에 의해 제조될 수 있다고 기재되어 있다.
영국 특허 제1,127,127호에는 하기와 같은 필수적인 골격 구조를 갖는 니트록사이드를 첨가하는 것에 의해 아크릴산이 중합에 대해 안정해질 수 있다고 기재되어 있다.
여기서, R1, R2, R3 및 R4는 알킬기이고, 질소에 결합된 탄소 원자상의 남아있는 원자가에 결합된 수소는 없다. R1, 내지 R4 또는 질소에 의해 만족하지 않는 두개의 남아있는 원자가는 또한 고리의 일부를 형성할 수 있다(예를 들면, 2,2,6,6-테트라메틸-4-히드록시-피페리딘-1-옥실).
미국 특허 제3,422,144호에는 하기 식의 안정한 프리라디칼 니트록사이드가 기재되어 있다.
여기서, R은 알킬, 아릴, 알크아릴, 할로아릴, 카르복시아릴, 알콕시아릴, 알킬티오아릴, 피리딜 및 디알킬아미노아릴로 이루어진 군에서 선택되고, R'는 삼차 알킬이다. 이들 니트록사이드는 프리 라디칼 카운팅에서 및 산화와 프리 라디칼 중합을 억제하는 데 모두에서 반응성 프리 라디칼을 위한 트랩(trap)으로써 유용하다고 알려져 있다.
미국 특허 제3,494,930호에는 프리 라디칼 반응의 억제제, 프리 라디칼의 수집제(collector), 중합 억제제 또는 산화방지제로서 유용한 니트록사이드 유형의 프리 라디칼이 기재되어 있다. 이들은 브릿지의 하나가 니트록사이드 라디칼기를 단독으로 포함하는 질소를 함유하는 비시클릭 화합물, 특히 아자-9-비시클로(3,3,1)노나논-3-옥실-9, 및 아자-9-비시클로(3,3,1)노난 옥실-9에 의해 구성된다.
미국 특허 제3,873,564호에는 효소를 함유한 배지에, 효소촉매반응을 행하는 경우 프리 라디칼 관능성의 환경이 변하는 안정한 프리 라디칼 관능성을 갖는 안정한 프리 라디칼 화합물을 첨가하여 효소를 분석하기 위한 화합물 및 방법이 기재되어 있다. 환경의 변화에 의해 영향을 받는 바에 따라서, 전자 스핀 공명 스펙트럼의 변화로, 효소의 유형 및 효소의 활성이 결정될 수 있다.
발견된 유용한 화합물들은 일반적으로 안정한 니트록사이드 라디칼이다. 특히, 이미다졸린 고리에 질소를 갖는 니트로닐 니트록사이드가 사용되고, 이들은 이미다졸린 고리의 2 위치를 비대칭 탄소 원자와 합치는 메틸렌기를 갖는다. 비대칭 탄소 원자에 결합된 기들중 하나는 효소 불안정한 관능성을 갖는다. 기타 화합물들은 효소 불안정한 관능성을 갖는 사슬에 의해 합쳐진 고리를 함유한 두개의 시클릭 니트록사이드를 포함한다.
미국 특허 제3,966,711호에는 1 내지 4가 라디칼에 의해 4-위치에 치환된 2,2,7,7-테트라알킬- 및 2,7-디스피로알킬렌-5-옥소-1,4-디아자시클로헵탄이 유기 폴리머에 대한 강력한 광-안정화제임을 교시하고 있다. 이들은 이들의 4-비치환된 상동물보다 높은 상용성을 갖는다고 알려져 있고, 여기서 이들은 N-알킬화에 대해 알려진 반응에 의해 합성될 수 있다. 4-위치에서 바람직한 치환체는 알킬, 알킬렌, 알케닐, 알알킬 및 에스테르알킬기이다. 과산화수소 또는 과카르복실산으로의 산화에 의해 이미다졸리딘으로부터 유도된 1-니트록시는 또한 우수한 광 안정화제라고 알려져 있다.
미국 특허 제4,182,658호에는 비상 조건, 예를 들면, 전력 정전과 같은 상황에서 증류 장치내의 상승 온도에서 증류동안 용이하게 중합할 수 있는 비닐 방향족 화합물의 중합을 억제하는 방법이 기술되어 있다. 이 방법은 비닐 방향족 화합물에서 높은 용해성과 효능의 장기간 내구성을 갖는 보충적인 중합 억제제를 증류 용 기내의 중합을 방지할 수 있는 충분한 양으로 통상적인 증류 장치의 증류 용기의 각각에 강제 공급하는 단계를 포함한다.
유럽 특허 출원 제0 178 168 A2호에는 니트록사이드 프리 라디칼을 사용하는 증류에 의한 회수동안 α,β-에틸렌형 불포화 모노카르복실산의 중합을 억제하는 방법이 기재되어 있다.
미국 특허 제4,665,185호에는 고효율 및 고순도로 니트록실을 얻기 위해 소량의 금속이온 촉매의 존재하에서, 중간 온도에서 짧은 시간동안 히드로퍼옥사이드를 사용한 아민의 산화에 의해 입체 장애 아민의 니트록실을 효율적으로 제조하는 공정이 기재되어 있다.
미국 특허 제5,254,760호에는 증류 또는 정제 동안 비닐 방향족 화합물, 예를 들면, 스티렌의 중합이 하나 이상의 안정한 니트록실 화합물과 하나 이상의 방향족 니트로 화합물의 존재에 의해 효과적으로 억제된다는 것을 교시하고 있다.
미국 특허 제5,545,782호 및 제5,545,786호에는 일부의 산소와 조합한 니트록실 억제제가 비닐 방향족 모노머의 미성숙 중합을 이런 모노머에 대한 제조 공정동안 감소시킨다고 기재하고 있다. 니트록실 억제제와 조합해서 사용된 소량의 공기조차도 모노머에 대한 억제 시간을 길게 연장시킨다고 기재되어 있다.
유럽 특허 출원 제0 765 856 A1호에는 아크릴산의 중합이 아크릴산의 증류 또는 분리를 위한 증류 공정동안 뿐만 아니라 전송 및 저장 동안 억제되는 안정한 아크릴산 조성물이 기재되어 있다. 상기 조성물은 세개의 성분을 포함한다: (a) 아크릴산, (b) 안정한 니트록실 라디칼, 및 (c) 하나 이상의 전달성 수소를 갖는 디헤테로-치환된 벤젠 화합물(예를 들면, 히드로퀴논의 모노메틸 에테르(MEHQ)와 같은 퀴논 유도체). 증류 공정, 전달 및 저장 동안, 성분(b) 및 (c)는 중합-억제 양으로 존재한다. 증류공정 동안, 산소(d)는 성분(b)와 (c)와 함께 첨가되는 것이 바람직하다. 명세서에 따르면, 적합한 니트록사이드 프리 라디칼 화합물의 실예는 디-t-부틸니트록사이드; 디-t-아밀니트록사이드; 2,2,6,6-테트라메틸-피페리디닐옥시; 4-히드록시-2,2,6,6-테트라메틸-피페리디닐옥시; 4-옥소-2,2,6,6-테트라메틸-피페리디닐옥시; 4-디메틸아미노-2,2,6,6-테트라메틸-피페리디닐옥시; 4-아미노-2,2,6,6-테트라메틸-피페리디닐옥시; 4-에타노일옥시-2,2,6,6-테트라메틸-피페리디닐옥시; 2,2,5,5-테트라메틸피롤리디닐옥시; 3-아미노-2,2,5,5-테트라메틸피롤리디닐옥시; 2,2,5,5-테트라메틸-1-옥사-3-아자시클로펜틸-3-옥시; 2,2,5,5-테트라메틸-1-옥사-3피롤리닐-1-옥시-3-카르복실산; 및 2,2,3,3,5,5,6,6-옥타메틸-1,4-디아자시클로헥실-1,4-디옥시를 포함한다.
WO 98/14416호에는 스티렌과 같은 비닐 방향족 모노머의 중합이 안정한 힌더링된 니트록실 라디칼과 옥심 화합물의 조성물의 첨가에 의해 억제된다고 기재되어 있다.
CS-260755 B1은 올레핀 안정화제로서 4-치환된-2,2,6,6-테트라메틸피페리딘 니트록실의 제조에 관한 것이다.
SU-334845 A1은 주어진 식의 이미녹실(imminoxyl) 라디칼 억제제를 사용하여 올리고에스테르 아크릴산염의 라디칼 중합을 억제하는 것에 관한 것이다.
SU-478838은 퀴논을 포함하는 바이너리 중합 억제제를 사용하여 올리고에스 테르 아크릴산염의 라디칼 중합 억제 및 올리고머 과산화물의 방지에 관한 것이다.
상기 문헌들은 이들 전체를 참조로서 본 명세서에 포함한다.
본 명세서에 사용된 바와 같이, TEMPO 색어는 2,2,6,6-테트라메틸-1-피페리디닐옥시를 나타낸다. 따라서, 4-아미노-TEMPO는 4-아미노-2,2,6,6-테트라메틸-1-피페리디닐옥시이고; 4-히드록시-TEMPO는 4-히드록시-2,2,6,6-테트라메틸-1-피페리디닐옥시(이 분야에서 HTEPO로 알려짐)이고; 4-옥소-TEMPO는 4-옥소--2,2,6,6-테트라메틸-1-피페리디닐옥시이다.
상기에 언급된 바와 같이, 힌더링된 니트록실 화합물은 스티렌, 아크릴산, 메타크릴산 등과 같은 불포화 모노머의 프리 라디칼 중합의 매우 활성적인 억제제로서 알려져 있다. 본 발명은 4-아미노-TEMPO를 증류 트레인에 대한 제조 설비의 억제제 공급 손실을 시뮬레이션하는 시험에 사용하는 경우 특이한 특징을 갖는 다는 발견에 기초한다. 이들 조건하에서, 대부분의 니트록실 화합물은 폴리머가 유사한 비율로 형성되게 한다. 그러나, 4-아미노-TEMPO는 폴리머 퍼센트 대 시간 곡선에서 완만한 기울기로 나타나는 바와 같이 현저하게 낮은 비율로 폴리머를 형성한다. 이것은 받아들일 수 없는 양으로 폴리머가 증류 트레인에서 형성되기 전에 설비 전복 상황(plant upset situation)을 구제할 수 있는 추가 시간을 제공한다는 점에서 이롭다.
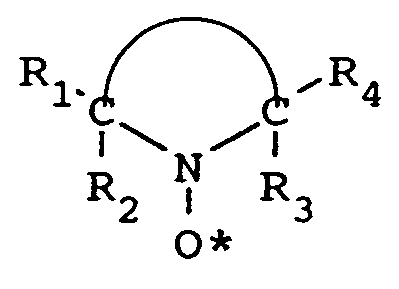
보다 바람직하게, 본 발명은 하기 식의 구조를 갖는 억제제의 유효량을 모노머에 첨가하는 단계를 포함하는 에틸렌형 불포화 모노머의 미성숙 중합을 억제하는 방법에 관한 것이다.
여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기
부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이다.
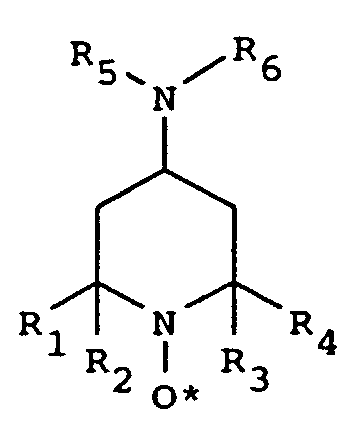
바람직한 구현예에서, 본 발명은 하기 구조식을 갖는 억제제의 유효량을 모노머에 첨가하는 단계를 포함하는 에틸렌형 불포화 모노머의 미성숙 중합을 억제하기 위한 방법에 관한 것이다.
여기서, R1 및 R4은 수소, 알킬, 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R5 및 R6는 수소, 알킬, 아릴 및 아실로 이루어진 군에서 독립적으로 선택된다.
가장 바람직한 억제제는 4-아미노-2,2,6,6-테트라메틸피페리디닐옥시(예를 들면, 4-아미노-TEMPO)이다.
니트록실 화합물의 유효량은 에틸렌형 불포화 모노머의 중량에 기초하여 전형적으로 약 1 내지 2,000ppm이고, 비록 이 범위 밖의 양일지도 사용 조건에 따라 적절할 수 있다. 니트록실 화합물의 양은 에틸렌형 불포화 모노머의 중량에 기초하여 약 5 내지 1,000ppm이 바람직하다.
또 다른 구현예에서, 본 발명은 하기의 것을 포함하는 조성물에 관한 것이다:
(a) 에틸렌형 불포화 모노머, 및
(b) 에틸렌형 불포화 모노머의 미성숙 중합을 억제하기 위한 효과적인 억제 량의 하기 구조식의 억제제:
여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기
부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이다.
또 다른 바람직한 구현예에서, 본 발명은 하기 것을 포함하는 조성물에 관한 것이다:
(a) 에틸렌형 불포화 모노머, 및
(b) 에틸렌형 불포화 모노머의 미성숙 중합을 억제하기 위한 효과적인 억제량의 하기 구조식의 억제제:
여기서, R1 및 R4은 수소, 알킬, 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R5 및 R6는 수소, 알킬, 아릴 및 아실로 이루어진 군에서 독립적으로 선택된다.
도 1은 정상 상태 동적 시험 시스템에서 리보일러 공급의 차단 후에 다른 종류의 조성물에 의해 제공된 속도와 비교해서 본 발명에 따른 조성물의 중합의 느린 속도를 보여주는 그래프이다. 도면에서, A는 4-아미노-TEMPO이고, B는 4-옥소-TEMPO이고, C는 4-히드록시-TEMPO이고, D는 TEMPO이다.
상기 설명된 바와 같이, 본 발명의 하나의 태양은 하기 구조식의 억제제의 유효량을 모노머에 첨가하는 단계를 포함하는 에틸렌형 불포화 모노머의 미성숙 중합을 억제하는 방법에 관한 것이다:
여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기
부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이다. 이런 고리-완성 원자는 탄소 원자가 바람직하지만, O, N 또는 S와 같은 헤테로원자가 또한 존재할 수 있다.
본 발명의 실시에 사용되는 억제제는 다음의 구조식을 갖는 것이 바람직하다:
여기서, R1 및 R4은 수소, 알킬, 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R5 및 R6는 수소, 알킬, 아릴 및 아실로 이루어진 군에서 독립적으로 선택된다.
R1, R2, R3, 또는 R4가 알킬인 경우, 이들은 1 내지 15개의 탄소 원자를 갖는 것(예를 들면, 메틸, 에틸, 프로필, 부틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실, 도데실, 트리데실, 테트라데실, 펜타데실 및 등등)과 그의 이성체(예를 들면, t-부틸, 2-에틸헥실 및 등등)가 바람직하다.
R5 및/또는 R6가 알킬인 경우, 이들은 저급 알킬(예를 들면, 1 내지 4개의 탄소 원자를 갖는 것, 구체적으로 메틸, 에틸, 프로필, 부틸 및 그의 이성체)인 것이 바람직하다.
R5 및/또는 R6가 아릴인 경우, 이들은 6 내지 10개의 탄소 원자를 갖는 아릴인 것, 예를 들면, 페닐 또는 나프틸이 바람직하고, 게다가 비-방해 치환체, 예를 들면, 저급 알킬기, 할로겐 및 등등으로 치환될 수 있다.
R5 및/또는 R6는 아실이고, 이들은 하기 구조의 아실인 것이 바람직하다:
여기서, R7은 알킬, 아릴, OR8 또는 NR8R9이고, R8 및 R9는 알킬, 아릴 또는 하기 구조이다:
여기서, R10은 알킬 또는 아릴이다. R7, R8, R9, 또는 R10
가 알킬인 경우, 이들은 1 내지 15개의 탄소 원자를 갖는 알킬이 바람직하고, 보다 바람직하게는 상기 설명된 바와 같이 1 내지 4개의 탄소 원자를 갖는 것이다. R7, R8, R9 및 R10이 아릴인 경우, 이들은 상기 설명된 바와 같이 6 내지 10개의 탄소 원자를 갖는 아릴이 바람직하다.
억제제는 4-아미노-TEMPO인 것이 바람직하다.
상기 구조식은 본 발명의 실시에 사용된 시클릭 니트록사이드가 포화 피페리딘 유도체임을 나타내지만, 이들은 또한 하기 식의 불포화 피페리딘 유도체일 수 있다.
여기서, Z1은 =C(NR5R6)-이다.
본 발명의 실시에 사용된 시클릭 니트록사이드는 또한 5개 고리, 예를 들면 피롤리딘으로부터 유도될 수 있다. 이들 화합물들은 다음 구조이다:
여기서, 단 Z2 및 Z3의 하나 이상이 >CNR5R6인 경우, Z2
및 Z3는 치환 또는 비치환 탄소 원자이다. Z2 및 Z3의 다른 것은 동일하거나 다를 수 있으며, 산소, 질소, 황, >CH2, >CHCH3, >C=O, >C(CH3)2, >CHBr, >CHCl, >CHI, >CHF, >CHOH, >CHCN, >C(OH)CN, >CHCOOH, >CHCOOCH3, >CHCOOC2H5, >C(OH)COOC
2H5, >C(OH)COOCH3, >C(OH)CHOHC2H5, >CNR5R6, >CCONR
5R6, >CH=NOH, >C=C-C6H5, CF2, CCl2, CBr2, CI2, 등등일 수 있고, 여기서, R5 및 R6는 상기 설명된 것과 같다.
본 발명의 실시에서 사용된 시클릭 니트록사이드는 피롤리딘으로부터 유도될 수 있고, 다음 구조식을 갖는다.
여기서, Z4는 =C(NR7R8)-이고, 여기서 R5 및 R7은 상기에서 설명된 것과 같다.
본 발명의 실시에 사용될 수 있는 시클릭 니트록사이드의 또 다른 부류는 다음 구조식이다:
여기서, Z2 및 Z3는 상기에서 설명된 것과 같다.
상기 설명된 바와 같이, R1 및 R4는 수소, 알킬, 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되며, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택된다. 상기 알킬(또는 헤테로원자-치환된 알킬)기 R1 내지 R4는 동일하거나 다를 수 있으며, 바람직하게 1 내지 15개의 탄소 원자를 포함한다. R1 내지 R4는 탄소 원자 1 내지 4개의 저급 알킬(또는 헤테로원자-치환된 저급 알킬)인 것이 보다 바람직하고, 예를 들면, 메틸, 에틸, 프로필, 부틸 및 그의 이성체이다. 헤테로원자 치환체가 존재하는 경우, 이들은 예를 들면, 할로겐, 산소, 황, 질소 및 등등을 포함할 수 있다. 가장 바람직한 것은 R1 내지 R4이 메틸인 것이다.
이런 안정한 니트록사이드 프리 라디칼 화합물은 공지된 방법에 의해 제조될 수 있다. (예를 들면, 미국 특허 제3,163,677호; 제3,334,103호; 제3,372,182호; 제3,422,144호; 제3,494,930호; 제3,502,692호; 제3,873,564호; 제3,966,711호; 및 제4,665,185호) 이들은 넓은 범위의 온도에 대해 사용하기에 적합하다. 그러나, 본 발명의 공정에 의해 안정화된 에틸렌형 불포화 모노머가 사용된 증류 온도는 전형적으로 약 60 내지 180℃이고, 바람직하게는 약 70 내지 165℃이고, 가장 바람직하게는 약 80 내지 150℃이다. 이런 증류는 일반적으로 약 10 내지 1,200mmHg의 절대 압력에서 수행된다.
본 발명에서 미성숙 중합의 대상이 되는 에틸렌형 불포화 모노머는 그의 제조, 저장 및/또는 분배 동안 미성숙 중합과 같은 고려되지 않은 중합이 문제가 되는 임의의 이런 모노머일 수 있다. 본 발명의 실시로부터 이득이 되어지는 모노모 중에는 다음과 같은 것들이 있다: 스티렌, α-메틸스티렌, 스티렌 술폰산, 비닐톨루엔, 디비닐벤젠, 폴리비닐벤젠, 알킬화 스티렌, 2-비닐피리딘 등등.
에틸렌형 불포화 모노머는 니트록사이드의 존재에 의해 무기한으로 안정화될 필요가 없고, 특히 모노머가 증류에서와 같이 가열되는 경우, 이들은 이들이 중합의 개시 전에 가열될 수 있기 위한 측정가능한 증가 시간 만큼 만 안정화되어진다고 여겨질 수 있다.
당업자들은 추가적인 프리 라디칼 스캐빈져(sacvengers)가, 필요한 경우, 본 발명에 속하는 안정화된 조성물 및 이들을 제조하는 방법에 포함될 것이라는 것을 이해할 것이다. 예를 들면, 미국 특허 제5,545,782호 및 제5,545,786호에 나타난 바와 같이, 공기, O2가 첨가될 수 있고, 마찬가지로 미국 특허 제5,254,760호에 공개된 방향족 니트로 화합물, 하나 이상의 전달용 수소를 갖는 이헤테로-치환된 벤젠 화합물, 예를 들면 유럽 특허 출원 제0 765 856 A1에 기재된 히드로퀴논의 모노-메틸-에테르와 같은 퀴논 유도체, 및 기타 억제제, 예를 들면, 이 분야에 잘 알려진 페놀류 및 특정 무기 염이 첨가될 수 있다.
중합 억제제는 임의의 통상적인 방법에 의해 보호될 수 있는 모노모로 도입될 수 있다. 이것은 임의의 적합한 수단에 의해 요구된 적용 시점으로부터 업스트림으로 적합한 용매중의 농축된 용액으로 첨가될 수 있다. 게다가, 억제제는 억제제의 효율적인 분배가 이루어지도록 들어오는 공급물과 함께 증류 트레인으로 분리해서 또는 분리 진입 포인트를 통해 주입될 수 있다. 억제제가 증류 작동 동안 점차적으로 고갈되기 때문에, 증류 과정 동안 추가적인 양을 첨가하는 것으로 증류 장치에서 억제제의 적절한 양을 유지하는 것이 일반적으로 필요하다. 억제제를 첨가하는 것은 최소의 요청 레벨 이상의 농도를 유지하기 위해 일반적으로 연속적으 로 또는 간헐적으로 수행될 수 있다.
본 발명의 이점과 중요 특징은 다음의 실시예를 통해 더욱 분명해 질 것이다.
실시예
공급 중단으로 동적 리보일러 시험을 위한 절차
공급 용액의 제조
T-부틸카테콜(TBC)은 진공하에서 증류에 의해 시판되는 스티렌으로부터 빼낸다. TBC의 분리는 가성 적정에 의해 확인하였다. 억제제의 요구된 양은 이 TBC-없는 스티렌에 직접적으로 또는 TBC-없는 스티렌중의 억제제 농축용액을 우선 만들고 이어서 이것을 TBC-없는 스티렌으로 희석하는 것으로 하여 첨가하였다.
동적 리보일러 시험을 위한 절차
요구되는 충전량(스티렌에 대한 전체 억제제 wt/wt로 표현)으로 억제제를 포함한 공급 용액(혼합물)의 정량을 둥근 바닥 플라스크(이하, "포트"라 함)에 첨가하고, 요구되는 온도(일반적으로 116℃)로 가열하고 압력/진공을 조절하여 환류하였다. 포트 내용물이 그 온도가 되면, 신선한 공급 용액을 체류 시간(전형적으로 한시간)이라고 불리는 시간 동안 포트에 대한 초기 포트 용액 부피를 첨가하는 비율로 연속적으로 유출시키기 시작했다. 신선한 공급 용액이 흐르기 시작함과 동시에 바닥 스트림이 또한 흐르기 시작했다. 바닥 스트림은 신선한 공급 용액이 첨가되는 것과 같은 비율로 제거되는 포트중의 용액이다. 공급 및 바닥 스트림의 동일 한 흐름은 억제제의 연속적인 보충을 허용하면서 포트중의 정량이 실험 시간 내내 일정하게 남아있도록 하였다. 이 절차는 억제제가 비닐 모노머 생성하는 설비의 증류 트레인에 사용되는 방법을 시뮬레이션한다. 특정 시간 동안, 전형적으로 7시간 동안 포트 안으로 밖으로 흐르게 하는 것으로 실험을 계속하였다. 샘플을 바닥 스트림으로부터 매시간 수집하였다. 이들 샘플을 메탄올 혼탁도 방법(methanol turbidity method)을 통해 폴리머의 함량에 대해 분석하였다. 샘플중의 폴리머의 양은 테스트되는 억제제의 효과를 나타내는 것이다.
공급 중단에 관한 절차
리보일러 테스트 가동의 말기(전형적으로 7시간)에, 샘플을 바닥 스트림으로부터 수집하였다. 이 샘플은 공급 중단 시간이 0분에 해당한다. 신선한 공급 용액과 바닥 스트림의 흐름이 멈추는 것이다. 진공 및 온도를 모니터하고 조절하여 실험의 요구되는 온도에서 끊는 것이 유지되도록 하였다. 샘플을 주기적으로 포트로부터 제거하였다(전형적으로 매 5분). 이들 샘플을 메탄올 혼탁도 방법을 통해 폴리머 함량에 대해 분석하였다. 이 시간 동안 얻어진 데이터는 가동에 대한 "공급 중단 커브"를 만드는데 사용된다.
공급 중단 커브에서 더 완만한 기울기(시간에 대한 폴리머 생성의 느린 속도)은 설비의 공급 손실인 경우 억제 시스템이 더 효과적이라는 것을 나타낸다. 현저한 폴리머 형성이 시작되기 전의 더 오랜 기간은 설비의 공급 손실의 경우에 억제 시스템이 더욱 효과적이라는 것을 또한 나타낸다. 바람직한 시스템은 폴리머 형성 개시 전에 오랫동안 지연되고 이어서 일단 개시되면 폴리머가 느린 속도로 생성되는 것이다.
상기 절차는 4-아미노-TEMPO, 4-옥소-TEMPO, 4-히드록실-TEMPO 및 TEMPO를 억제제로서 사용하였다. 결과는 도 1에 나타내었고, 4-아미노-TEMPO를 사용하는 경우가 다른 세개의 니트록사이드 억제제의 동량을 사용한 경우와 비교하여 개선되었음이 명백하게 나타난다. 도 1의 그래프에 대한 데이터는 표 1에 나타냈다.
| 5개의 다른 니트록사이드의 리보일러 가동 116℃/1시간 체류시간(%폴리머) | ||||
| 시간(시) | A(100ppm) | B(100ppm) | C(100ppm) | D(100pp) |
| 0 | 0 | 0 | 0 | 0 |
| 2 | 0.0003 | 0.0013 | 0.00038 | 0.00025 |
| 3 | 0.00037 | 0.0011 | 0.00068 | 0.00024 |
| 4 | 0.0004 | 0.0013 | 0.001 | 0.00024 |
| 5 | 0.00046 | 0.0017 | 0.0012 | 0.0003 |
| 6 | 0.00049 | 0.0017 | 0.0012 | 0.0004 |
| 7 | 0.00052 | 0.0017 | 0.0012 | 0.00037 |
| 시간(분. F/SO) | ||||
| 0 | 0 | 0 | 0 | 0 |
| 5 | 0.00064 | 0.0024 | 0.0012 | 0.00038 |
| 10 | 0.0004 | 0.0024 | 0.0012 | 0.00044 |
| 15 | 0.0135 | 0.043 | 0.002 | 0.00030 |
| 20 | 0.108 | 0.65 | 0.123 | 0.0013 |
| 25 | 0.25 | 1.03 | 0.45 | 0.117 |
| 30 | 0.35 | 1.38 | 1.12 | 0.545 |
| 35 | 0.44 | 2.12 | 1.68 | 1.27 |
| 40 | 0.69 | 3.1 | 2.32 | 1.96 |
| 45 | 1.17 | 3.85 | 3 | 2.3 |
| 50 | 1.28 | 4.25 | 3.2 | 3 |
A는 4-아미노-TEMPO
B는 4-옥소-TEMPO
C는 4-히드록시-TEMPO
D는 TEMPO
F/SO는 공급 중단
본 발명에 담겨져 있는 원리를 벗어남 없이 만들어질 수 있는 많은 변화와 변형이라는 점에서, 본 발명에 의해 제공되는 보호 범위의 이해를 위해 첨부된 청구범위가 참조되어야 한다.
Claims (26)
- 하기 식의 구조를 갖는 억제제를 비닐 방향족 모노머의 중량에 기초하여 1 내지 2000ppm으로 비닐 방향족 모노머에 첨가하는 단계를 포함하는 비닐 방향족 모노머의 미성숙 중합을 억제하는 방법:화학식 1여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 아미도기를 제외한 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이고, 여기서 상기 억제제는 방향족 니트로 화합물을 포함하지 않는다.
- 제 2항에 있어서, R5는 수소인 방법.
- 제 3항에 있어서, R6는 수소인 방법.
- 제 2항에 있어서, R1, R2, R3, 및 R4는 독립적으로 선택된 알킬기인 방법.
- 제 5항에 있어서, R5는 수소인 방법.
- 제 6항에 있어서, R6는 수소인 방법.
- 제 6항에 있어서, R1, R2, R3, 및 R4는 모두 메틸인 방법.
- 제 7항에 있어서, R1, R2, R3, 및 R4는 모두 메틸인 방법.
- 제 1항에 있어서, 비닐 방향족 모노머는 스티렌, α-메틸스티렌, 스틸렌술폰산, 비닐톨루엔, 디비닐벤젠, 폴리비닐벤젠, 알킬화 스티렌 및 2-비닐피리딘으로 이루어진 군에서 선택되는 것인 방법.
- 제 1항에 있어서, 비닐 방향족 모노머는 스티렌인 방법.
- 제 2항에 있어서, 비닐 방향족 모노머는 스티렌인 방법.
- 제 9항에 있어서, 비닐 방향족 모노머는 스티렌인 방법.
- (a) 비닐 방향족 모노머; 및(b) 하기 구조식을 갖는 억제제를 비닐 방향족 모노머의 중량에 기초하여 1 내지 2000ppm 포함하는 조성물:화학식 3여기서, R1 및 R4는 수소, 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, R2 및 R3는 알킬 및 헤테로원자-치환된 알킬로 이루어진 군에서 독립적으로 선택되고, 하기부분은 5-, 6- 또는 7-개 헤테로고리를 형성하기 위해 필요한 원자를 나타내고, 상기 원자의 하나 이상은 아미도기를 제외한 일차, 이차 또는 삼차 아미노기로 치환된 탄소 원자이고, 여기서 상기 억제제는 방향족 니트로 화합물을 포함하지 않는다.
- 제 15항에 있어서, R5는 수소인 조성물.
- 제 16항에 있어서, R6는 수소인 조성물.
- 제 15항에 있어서, R1, R2, R3, 및 R4는 독립적으로 선택된 알킬기인 조성물.
- 제 18항에 있어서, R5는 수소인 조성물.
- 제 19항에 있어서, R6는 수소인 조성물.
- 제 19항에 있어서, R1, R2, R3, 및 R4는 모두 메틸인 조성물.
- 제 20항에 있어서, R1, R2, R3, 및 R4는 모두 메틸인 조성물.
- 제 14항에 있어서, 비닐 방향족 모노머는 스티렌, α-메틸스티렌, 스틸렌술폰산, 비닐톨루엔, 디비닐벤젠, 폴리비닐벤젠, 알킬화 스티렌 및 2-비닐피리딘으로 이루어진 군에서 선택되는 것인 조성물.
- 제 14항에 있어서, 비닐 방향족 모노머는 스티렌인 조성물.
- 제 15항에 있어서, 비닐 방향족 모노머는 스티렌인 조성물.
- 제 22항에 있어서, 비닐 방향족 모노머는 스티렌인 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/375,033 | 1999-08-16 | ||
| US09/375,033 US6300533B1 (en) | 1999-08-16 | 1999-08-16 | Inhibition of polymerization of ethylenically unsaturated monomers |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20020027528A KR20020027528A (ko) | 2002-04-13 |
| KR100694450B1 true KR100694450B1 (ko) | 2007-03-12 |
Family
ID=23479224
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020027001664A KR100694450B1 (ko) | 1999-08-16 | 2000-08-02 | 에틸렌형 불포화 모노머의 중합 억제방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US6300533B1 (ko) |
| EP (1) | EP1206507B1 (ko) |
| JP (1) | JP4083429B2 (ko) |
| KR (1) | KR100694450B1 (ko) |
| AR (1) | AR025296A1 (ko) |
| AT (1) | ATE280209T1 (ko) |
| AU (1) | AU777484B2 (ko) |
| BR (1) | BR0013346B8 (ko) |
| CA (1) | CA2379934C (ko) |
| DE (1) | DE60015154D1 (ko) |
| MX (1) | MXPA02001651A (ko) |
| MY (1) | MY128862A (ko) |
| TW (1) | TWI252864B (ko) |
| WO (1) | WO2001012750A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR029410A1 (es) | 1999-12-02 | 2003-06-25 | Crompton Corp | Metodo para inhibir la polimerizacion prematura de monomeros etilenicamente insaturados y composiciones de los mismos |
| CN1230492C (zh) * | 1999-12-03 | 2005-12-07 | 尤尼罗亚尔化学公司 | 用于抑制聚合和聚合物增长的组合物和方法 |
| US20030225182A1 (en) * | 2001-01-04 | 2003-12-04 | Dentsply Detrey Gmbh | Dental composition with improved light stability |
| US20040225029A1 (en) * | 2000-02-17 | 2004-11-11 | Uwe Walz | Dental composition with improved light stability |
| US8026295B2 (en) * | 2000-02-17 | 2011-09-27 | Dentsply International, Inc. | Dental composition with improved light stability |
| US6723255B2 (en) * | 2000-03-07 | 2004-04-20 | Atofina Chemicals, Inc. | Compositions for shortstopping free radical emulsion polymerizations and stabilizing latices made therefrom |
| AU2003247502A1 (en) * | 2002-06-12 | 2003-12-31 | Stone And Webster, Inc. | Eb/sm splitter heat recovery |
| US20040209990A1 (en) * | 2003-04-15 | 2004-10-21 | Uwe Walz | Low shrinking polymerizable dental material |
| US8138268B2 (en) * | 2004-06-09 | 2012-03-20 | Hitachi Chemical Company, Ltd. | Adhesive composition, circuit connecting material, connecting structure for circuit member, and semiconductor device |
| FR2891841B1 (fr) * | 2005-10-11 | 2007-12-28 | Arkema Sa | Melange odorisant pour combustible gazeux inodore |
| KR101035810B1 (ko) * | 2005-10-18 | 2011-05-20 | 히다치 가세고교 가부시끼가이샤 | 접착제 조성물, 회로 접속 재료, 회로 접속 부재의 접속구조 및 반도체 장치 |
| FR2902798B1 (fr) * | 2006-06-26 | 2009-04-24 | Arkema France | Melange odorisant pour combustible gazeux inodore |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU334845A1 (ru) * | 1970-07-22 | 1984-01-30 | Филиал Института Химической Физики Ан Ссср | Способ ингибировани радикальной полимеризации олигоэфиракрилатов |
| US5928558A (en) * | 1997-06-13 | 1999-07-27 | Ciba Specialty Chemicals Corporation | Derivatives of 1-oxyl-4-amino-2,2,6,6-tetramethylpiperidine as polymerization inhibitors for (meth)acrylate monomers |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB968891A (en) | 1961-07-04 | 1964-09-02 | British Petroleum Co | Improvements relating to the conversion of hydrocarbons |
| US3163677A (en) | 1961-08-07 | 1964-12-29 | American Cyanamid Co | Process for preparing n, n, o-trisubstituted hydroxyl amines and n, n-disubstituted nitroxides and products |
| US3502692A (en) | 1962-06-13 | 1970-03-24 | American Cyanamid Co | Cyclic nitroxides and process for preparing same |
| GB983134A (en) | 1962-06-13 | 1965-02-10 | American Cyanamid Co | Cyclic nitroxides and process for preparing same |
| US3372182A (en) | 1965-04-27 | 1968-03-05 | American Cyanamid Co | Process for preparation of stable, free radical nitroxides |
| US3422144A (en) | 1965-04-27 | 1969-01-14 | American Cyanamid Co | Stable free radical nitroxides |
| GB1127127A (en) | 1966-04-26 | 1968-09-11 | Bp Chem Int Ltd | Stabilization of acrylic acid |
| FR1501769A (fr) | 1966-07-04 | 1967-11-18 | Commissariat Energie Atomique | Radicaux libres du type nitroxyde |
| DE1936410A1 (de) | 1969-07-17 | 1971-02-11 | Hoechst Ag | O-Acyl-lysergole und Verfahren zu ihrer Herstellung |
| US3873564A (en) | 1971-03-03 | 1975-03-25 | Synvar Ass | 2-Imidazolinyl-3-oxide-1-oxypropionic acid |
| CH579118A5 (ko) | 1973-06-22 | 1976-08-31 | Ciba Geigy Ag | |
| SU478838A1 (ru) | 1973-09-17 | 1975-07-30 | Отделение ордена Ленина института химической физики АН СССР | Способ ингибировани радикальной полимеризации олигоэфиракрилатов |
| US4182658A (en) | 1977-11-23 | 1980-01-08 | Cosden Technology, Inc. | Emergency polymerization inhibitor system for vinyl aromatic compounds |
| US4665185A (en) | 1984-03-22 | 1987-05-12 | Ciba-Geigy Corporation | Process for preparing nitroxyls of sterically hindered amines |
| EP0178168B1 (en) | 1984-10-10 | 1990-01-17 | Amoco Corporation | Process for purification of methacrylic acid |
| CS260755B1 (en) | 1985-06-26 | 1989-01-12 | Milan Karvas | Method of 4-substituted-2,2,6,6-tetramethyl piperidine-n-oxides preparation |
| US5254760A (en) | 1992-07-29 | 1993-10-19 | Ciba-Geigy Corporation | Inhibiting polymerization of vinyl aromatic monomers |
| US5728872A (en) | 1994-06-27 | 1998-03-17 | Lutz Riemenschneider | Stabilized acrylic acid compositions |
| ES2126185T3 (es) * | 1994-08-19 | 1999-03-16 | Huels Chemische Werke Ag | Inhibicion de la polimerizacion del estireno. |
| US5888356A (en) * | 1994-08-19 | 1999-03-30 | Huels Aktiengesellschaft | Inhibition of polymerization of vinylaromatic or vinylaliphatic |
| US5545786C1 (en) | 1994-11-28 | 2001-10-16 | Ciba Geigy Corp | Method for inhibiting premature polymerization of vinyl aromatic monomers |
| DE19510184A1 (de) * | 1995-03-21 | 1996-09-26 | Basf Ag | 4-Acylaminopiperidin-N-oxyle |
| JP3524640B2 (ja) * | 1995-07-31 | 2004-05-10 | 三洋電機株式会社 | 車いす |
| DE19622498A1 (de) * | 1996-06-05 | 1997-12-11 | Basf Ag | Mischungen, enthaltend Monomere und Stabilisatoren |
| ES2162299T5 (es) | 1996-06-05 | 2010-09-13 | Basf Se | Mezclas que contienen monomeros y estabilizantes. |
| WO1998002403A1 (en) | 1996-07-15 | 1998-01-22 | Betzdearborn Inc. | Method for inhibiting vinyl aromatic monomer polymerization in condenser and compression systems |
| WO1998014416A1 (en) | 1996-10-04 | 1998-04-09 | Betzdearborn Inc. | Compositions and methods for inhibiting vinyl aromatic monomer polymerization |
| DE19651307A1 (de) | 1996-12-10 | 1998-06-18 | Basf Ag | Stoffmischungen, enthaltend vinylgruppenhaltige Verbindungen und Stabilisatoren |
| ID20069A (id) | 1997-03-20 | 1998-09-24 | Ciba Sc Holding Ag | Proses inhibitor polimerisasi |
| US5877344A (en) | 1997-06-13 | 1999-03-02 | Ciba Specialty Chemicals Corporation | Polymerization inhibition of acrylates using blends of nitroxides |
| US6156858A (en) * | 1997-06-25 | 2000-12-05 | Xerox Corporation | Stable free radical polymerization processes |
| DE19735223A1 (de) * | 1997-08-15 | 1999-02-18 | Basf Ag | Verfahren zur Stabilisierung von (Meth)acrylsäureestern gegen unerwünschte radikalische Polymerisation |
| US5907071A (en) * | 1998-04-21 | 1999-05-25 | Betzdearborn Inc. | Compositions and methods for inhibiting vinyl aromatic monomer polymerization |
-
1999
- 1999-08-16 US US09/375,033 patent/US6300533B1/en not_active Expired - Lifetime
-
2000
- 2000-08-02 DE DE60015154T patent/DE60015154D1/de not_active Expired - Lifetime
- 2000-08-02 CA CA002379934A patent/CA2379934C/en not_active Expired - Fee Related
- 2000-08-02 EP EP00952395A patent/EP1206507B1/en not_active Expired - Lifetime
- 2000-08-02 AT AT00952395T patent/ATE280209T1/de not_active IP Right Cessation
- 2000-08-02 JP JP2001517637A patent/JP4083429B2/ja not_active Expired - Fee Related
- 2000-08-02 KR KR1020027001664A patent/KR100694450B1/ko not_active IP Right Cessation
- 2000-08-02 BR BRPI0013346-9A patent/BR0013346B8/pt not_active IP Right Cessation
- 2000-08-02 AU AU65103/00A patent/AU777484B2/en not_active Ceased
- 2000-08-02 WO PCT/US2000/021030 patent/WO2001012750A1/en active IP Right Grant
- 2000-08-02 MX MXPA02001651A patent/MXPA02001651A/es active IP Right Grant
- 2000-08-11 TW TW089116233A patent/TWI252864B/zh not_active IP Right Cessation
- 2000-08-14 MY MYPI20003714A patent/MY128862A/en unknown
- 2000-08-16 AR ARP000104238A patent/AR025296A1/es active IP Right Grant
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU334845A1 (ru) * | 1970-07-22 | 1984-01-30 | Филиал Института Химической Физики Ан Ссср | Способ ингибировани радикальной полимеризации олигоэфиракрилатов |
| US5928558A (en) * | 1997-06-13 | 1999-07-27 | Ciba Specialty Chemicals Corporation | Derivatives of 1-oxyl-4-amino-2,2,6,6-tetramethylpiperidine as polymerization inhibitors for (meth)acrylate monomers |
Also Published As
| Publication number | Publication date |
|---|---|
| DE60015154D1 (de) | 2004-11-25 |
| MY128862A (en) | 2007-02-28 |
| BR0013346B1 (pt) | 2011-12-27 |
| JP4083429B2 (ja) | 2008-04-30 |
| MXPA02001651A (es) | 2002-08-06 |
| US6300533B1 (en) | 2001-10-09 |
| EP1206507A1 (en) | 2002-05-22 |
| AU777484B2 (en) | 2004-10-21 |
| KR20020027528A (ko) | 2002-04-13 |
| ATE280209T1 (de) | 2004-11-15 |
| EP1206507B1 (en) | 2004-10-20 |
| AR025296A1 (es) | 2002-11-20 |
| BR0013346A (pt) | 2002-06-25 |
| WO2001012750A1 (en) | 2001-02-22 |
| JP2003507525A (ja) | 2003-02-25 |
| CA2379934A1 (en) | 2001-02-22 |
| AU6510300A (en) | 2001-03-13 |
| BR0013346B8 (pt) | 2012-08-21 |
| CA2379934C (en) | 2009-06-16 |
| TWI252864B (en) | 2006-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100715592B1 (ko) | 불포화 모노머의 중합 억제방법 | |
| KR100812038B1 (ko) | 중합 억제제로서 퀴논 알키드와 니트록실 화합물의 블렌드물 | |
| EP1235885B1 (en) | Composition and method for inhibiting polymerization and polymer growth | |
| KR100727222B1 (ko) | 불포화 모노머의 중합 억제방법 | |
| KR100694450B1 (ko) | 에틸렌형 불포화 모노머의 중합 억제방법 | |
| KR100694451B1 (ko) | 불포화 모노머의 중합 억제방법 | |
| EP1438277B1 (en) | Recycle of nitroxyl-containing streams at low temperature |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20120228 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20130227 Year of fee payment: 7 |
|
| LAPS | Lapse due to unpaid annual fee |