JP7634112B2 - Stingを活性化することができるヘテロ環式化合物 - Google Patents
Stingを活性化することができるヘテロ環式化合物 Download PDFInfo
- Publication number
- JP7634112B2 JP7634112B2 JP2023564644A JP2023564644A JP7634112B2 JP 7634112 B2 JP7634112 B2 JP 7634112B2 JP 2023564644 A JP2023564644 A JP 2023564644A JP 2023564644 A JP2023564644 A JP 2023564644A JP 7634112 B2 JP7634112 B2 JP 7634112B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- group
- following formula
- compound
- compound represented
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/10—Spiro-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
PRRPのうち、STING(TMEM173、MPYS、MITA、ERISとしても知られている)は、核酸センサーのファミリーに属し、サイトゾルDNAシグナル伝達のアダプターである。哺乳類細胞において、健全な状態では、DNAは、核において区画化される。DNAを含む病原体の侵襲など発病状況で、又は悪性細胞において、DNAは細胞質中に存在する。この場合、STINGは、上記のサイトゾルDNAを検出して、病原性事象に対して免疫反応を誘導するのに重要である。
STINGは基礎状態では二量体として存在し、そのN末端ドメインがERに固定され、C末端ドメインがサイトゾルに存在する。タンパク質のサイクリックGMP-AMP合成酵素(cGAS)によって生成された環式ジヌクレオチド(CDN)は、STINGの天然リガンドである(Ablasser et al, Nature 498, 380 - 384, 2013)。CDNとSTINGとの結合は、TANK結合キナーゼ(TBK1)及びインターフェロン制御因子3(IRF3)の結合及び活性化、次にERから核周辺エンドソームへの再局在化を可能にする立体構造変化を誘導する(Liu et al, Science 347, Issue 6227, 2630-1 - 2630-14, 2015)。TBK1による転写因子IRF3及びNF-kBのリン酸化によって、I型インターフェロン(IFN)を含めて複数のサイトカインが発現する。
I型インターフェロンは、適応免疫細胞と自然免疫細胞の両方の活性化を誘導することによって抗腫瘍免疫応答を顕著に増強することができる。
先行技術では、STINGの低分子調節物質が例えば国際公開第2020075790号に記載されている。
一態様において、本発明は、式(I)の化合物又はその塩に関する。
(式中、
Aは、N又はCであり、
Bは、
1個又は2個のN原子を含む5~7員の単環式ヘテロシクリル、
1個のN原子を含む6員の二環式ヘテロシクリル、
2個のN原子を含む7~11員の二環式ヘテロシクリル、
1個のN原子及び1個のO原子を含む7員の二環式ヘテロシクリル、
1個のN原子並びにO及びSからなる群から選択される1個のヘテロ原子を含む6員の単環式ヘテロシクリル、
3個のヘテロ原子を含み、そのうちの2個がNであり、もう1個がOである9員の二環式ヘテロシクリル、
1個のN原子及び1個のS原子を含む9員の二環式ヘテロシクリル、
3個のN原子を含み、そのうち2個がC1-6-アルキルで置換されている10員の二環式ヘテロシクリル、
フェニル、
3個のN原子を含む9員の二環式ヘテロアリール、
-C1-4-アルキレン-ピリミジン、及び
-C1-4-アルキレン-O-C1-3-アルキル
からなる群の中から選択される基であり;
Dは、
2個のN原子を含む9員の二環式ヘテロアリール、
1個のN原子を含む10員の二環式ヘテロアリール、及び
ベンゾジオキソール
からなる群の中から選択される基であり;
R1は、-H、-C1-6-アルキル、-CF3、-C2-6-アルキニル、-O-C1-6-アルキル及びハロゲンからなる群の中から選択され;
R2は、-H、-C1-6-アルキル、-C1-6-アルキレン-OH、-C(O)OH、-C(O)O-C1-6-アルキル及び-ピラゾリル-C1-6-アルキルからなる群の中から選択され;
R3は、-H又は-C1-6-アルキルであり;
R4は、-H、-C1-3-アルキル、-NH2、-NHC1-3-アルキル及びN(C1-3-アルキル)2からなる群の中から選択され;
R5は、非存在であり、或いは-H、-C1-6-アルキル、-S(O2)-C1-6-アルキル、-NH-S(O2)-C1-6-アルキル、=O、-C(O)-C1-6-アルキル、-C(O)H、-C(O)OH、-C(O)NH2、-C(O)O-C1-6-アルキル、-NR5.1R5.2、-C1-6-アルキレン-C(O)OH、-S(O2)-NH2、-ピロリジン(pyrolidin)-2-オン-1-イル、-テトラゾリル、並びにR5.3で置換されている、N及びOからなる群から選択される1個又は2個のヘテロ原子を有する5員のヘテロアリールからなる群の中から選択され;
R5.1は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル及び-C1-6-アルキレン-O-C1-6-アルキルからなる群の中から選択され;
R5.2は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル、-C1-6-アルキレン-O-C1-6-アルキル及び-C1-6-アルキレン-R5.3からなる群の中から選択され;
R5.3は、-H、-C1-6-アルキル、並びにN及びOからなる群から選択される1個又は2個のヘテロ原子を有する6員のヘテロアリールからなる群の中から選択され;
R6は、非存在であり、或いは-H、-C1-6-アルキル、=O及び-C(O)OHからなる群の中から選択される)
さらに、本発明による化合物は、ヒトSTINGバリアント「H232R」(野生型と名付けられることもある)に対しても10μM未満、好ましくは7μM未満、より好ましくは5μM未満、最も好ましくは3μM未満の細胞EC50を示す(Yi et al., 2013; PLOS ONE 8(10))。
さらに、本発明による化合物は、ヒトSTINGバリアント「R232H」に対しても10μM未満、好ましくは7μM未満、より好ましくは5μM未満、最も好ましくは3μM未満の細胞EC50を示す。
さらに、本発明による化合物は、ヒトSTINGバリアント「R293Q」に対しても10μM未満、好ましくは7μM未満、より好ましくは5μM未満、最も好ましくは3μM未満の細胞EC50を示す。
さらに、本発明による化合物は、ヒトSTINGバリアント「AQ」に対しても10μM未満、好ましくは7μM未満、より好ましくは5μM未満、最も好ましくは3μM未満の細胞EC50を示す。
さらに、本発明の化合物は、ヒトSTINGタンパク質への好適な結合を示す。ヒトSTINGへの好適な結合親和性は好適な細胞活性及び/又は好適な薬物動態特性と相まって、薬理学的有効性のためのより低い用量を実現することができる。用量の低減は、副作用の低減を引き起こす可能性がある患者への「薬物負荷」又は「薬物負担」(親薬物及びその代謝物)の低減、及び薬物製品の生産コストの低減という利点を有する。
化合物のタンパク質への結合は、表面プラズモン共鳴、シンチレーション近接アッセイ、等温滴定熱量測定又は示差走査蛍光定量などの公知方法によって決定することができる。後者の試験では、融解温度Tmとも呼ばれる、タンパク質がアンフォールドする温度は、タンパク質の疎水性部分に結合する色素の蛍光の変化によって測定される。低分子の結合後のTmシフトは、この低分子の結合親和性と相互関係がある。STINGアゴニストの高結合親和性は、>10K、好ましくは>13K、より好ましくは>15KのTmのシフトによって反映される。
本明細書に定義された一般式(I)による本発明の化合物又はその塩
(式中、
Aは、N又はCであり、
Bは、
1個又は2個のN原子を含む5~7員の単環式ヘテロシクリル、
1個のN原子を含む6員の二環式ヘテロシクリル、
2個のN原子を含む7~11員の二環式ヘテロシクリル、
1個のN原子及び1個のO原子を含む7員の二環式ヘテロシクリル、
1個のN原子並びにO及びSからなる群から選択される1個のヘテロ原子を含む6員の単環式ヘテロシクリル、
3個のヘテロ原子を含み、そのうちの2個がNであり、もう1個がOである9員の二環式ヘテロシクリル、
1個のN原子及び1個のS原子を含む9員の二環式ヘテロシクリル、
3個のN原子を含み、そのうち2個がC1-6-アルキルで置換されている10員の二環式ヘテロシクリル、
フェニル、
3個のN原子を含む9員の二環式ヘテロアリール、
-C1-4-アルキレン-ピリミジン、及び
-C1-4-アルキレン-O-C1-3-アルキル
からなる群の中から選択される基であり;
Dは、
2個のN原子を含む9員の二環式ヘテロアリール、
1個のN原子を含む10員の二環式ヘテロアリール、及び
ベンゾジオキソール
からなる群の中から選択される基であり;
R1は、-H、-C1-6-アルキル、-CF3、-C2-6-アルキニル、-O-C1-6-アルキル及びハロゲンからなる群の中から選択され;
R2は、-H、-C1-6-アルキル、-C1-6-アルキレン-OH、-C(O)OH、-C(O)O-C1-6-アルキル及び-ピラゾリル-C1-6-アルキルからなる群の中から選択され;
R3は、-H又は-C1-6-アルキルであり;
R4は、-H、-C1-3-アルキル、-NH2、-NHC1-3-アルキル及びN(C1-3-アルキル)2からなる群の中から選択され;
R5は、非存在であり、或いは-H、-C1-6-アルキル、-S(O2)-C1-6-アルキル、-NH-S(O2)-C1-6-アルキル、=O、-C(O)-C1-6-アルキル、-C(O)H、-C(O)OH、-C(O)NH2、-C(O)O-C1-6-アルキル、-NR5.1R5.2、-C1-6-アルキレン-C(O)OH、-S(O2)-NH2、-ピロリジン-2-オン-1-イル、-テトラゾリル、並びにR5.3で置換されている、N及びOからなる群から選択される1個又は2個のヘテロ原子を有する5員のヘテロアリールからなる群の中から選択され;
R5.1は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル及び-C1-6-アルキレン-O-C1-6-アルキルからなる群の中から選択され;
R5.2は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル、-C1-6-アルキレン-O-C1-6-アルキル及び-C1-6-アルキレン-R5.3からなる群の中から選択され;
R5.3は、-H、-C1-6-アルキル、並びにN及びOからなる群から選択される1個又は2個のヘテロ原子を有する6員のヘテロアリールからなる群の中から選択され;
R6は、非存在であり、或いは-H、-C1-6-アルキル、=O及び-C(O)OHからなる群の中から選択される)
は、STINGに関連した又はSTINGによって調節された病態生理学的プロセスの処置、特に炎症、アレルギー若しくは自己免疫疾患、感染症又はがんの処置、或いはワクチンアジュバントとしての使用に特に適している。上記に鑑み、別の態様において、本発明はさらに、医薬品として使用するための、本明細書に定義された式(I)の化合物又はその薬学的に許容される塩にも関する。本発明の他の態様は、上記及び下記の説明並びに実施例から直接に当業者に明らかになる。
本明細書で具体的に定義されていない用語は、本開示及び文脈を考慮に入れて当業者が与えるはずの意味が与えられるべきである。しかし、本明細書において使用されたように、別段の指定がない限り、以下の用語は指示された意味を有し、以下の慣例に準拠する。
例えば、用語「3-カルボキシプロピル基」は、以下の置換基を表す。
本明細書では用語「置換された」とは、指名された原子上の1個又は複数の水素が、置換基の定義された一群から選択される基で置き換えられていることを意味する。ただし、指名された原子の正常な原子価を超えていないこと、及び置換によって、安定な化合物になることを条件とする。同様に、用語「置換された」は、例えば「置換アルキル」、「置換アリール」など、単一の原子ではなく化学的部分と結びつけて使用することができる。
明確に示されていない限り、本明細書及び添付の特許請求の範囲の全体にわたって、所与の化学式又は化学名は、互変異性体、並びにすべての立体異性体、光学異性体、幾何異性体(例えば、エナンチオマー、ジアステレオマー、E/Z異性体など)及びそれらのラセミ体、並びに別個のエナンチオマーのさまざまな割合の混合物、ジアステレオマーの混合物、又はそのような異性体及びエナンチオマーが存在する上記の形のいずれかの混合物、並びにそれらの溶媒和物、例えば水和物などを包含するものとする。
明確に示されていない限り、以下にさらに詳細に定義された「薬学的に許容される塩」も、それらの溶媒和物、例えば水和物などを包含するものとする。
一般に、実質的に純粋な立体異性体は、当業者に公知の合成原理に従って、例えば対応する混合物の分離、立体化学的に純粋な出発物質の使用及び/又は立体選択的合成によって得ることができる。当技術分野において、ラセミ体の分割、又は合成、例えば光学活性出発物質から始める合成、及び/又はキラル試薬の使用などによって光学活性体を調製する方法が公知である。
さらに、対応するラセミ混合物のキラル固定相クロマトグラフィー分離;又は適切な分割剤を使用したラセミ混合物の分割、例えば光学活性酸若しくは塩基を用いたラセミ化合物のジアステレオマー塩の形成、その後の塩分割及び塩からの所望の化合物の遊離;又はキラル光学活性補助試薬を用いた対応するラセミ化合物の誘導体化、その後のジアステレオマー分離及びキラル補助基の除去;又はラセミ体の速度論的分割(例えば、酵素分割);適した条件下におけるエナンチオモルファス結晶のコングロメレートからのエナンチオ選択的結晶化;又はキラル光学活性補助剤の存在における適した溶媒からの(分別)結晶化などによって、エナンチオマーとして純粋な化合物を対応するラセミ混合物から調製する方法が当業者に公知である。
本明細書で「薬学的に許容される」という句は、妥当な医学的判断の範囲内で、過度の毒性、刺激、アレルギー応答、又は他の問題若しくは合併症なしにヒトの組織と接触させて使用するのに適し、且つ合理的なベネフィット・リスク比に相応した化合物、材料、組成物、及び/又は剤形を指すために使用される。
本明細書では「薬学的に許容される塩」は、親化合物の酸又は塩基塩を作製することによって親化合物が改変された、開示化合物の誘導体を指す。薬学的に許容される塩の例としては、アミンなどの塩基性残基の鉱物又は有機酸塩、カルボン酸などの酸性残基のアルカリ又は有機塩などが挙げられるが、これらに限定されない。
例えば、そのような塩には、ベンゼンスルホン酸、安息香酸、クエン酸、エタンスルホン酸、フマル酸、ゲンチシン酸、臭化水素酸、塩酸、マレイン酸、リンゴ酸、マロン酸、マンデル酸、メタンスルホン酸、4-メチル-ベンゼンスルホン酸、リン酸、サリチル酸、コハク酸、硫酸及び酒石酸に由来する塩が含まれる。
本発明の薬学的に許容される塩は、塩基性又は酸性部分を含む親化合物から通常の化学的方法で合成することができる。一般的に、そのような塩は、これらの化合物の遊離酸又は塩基の形と十分量の適切な塩基又は酸を水中或いはエーテル、酢酸エチル、エタノール、イソプロパノール、若しくはアセトニトリル、又はそれらの混合物などの有機希釈剤中で反応させることによって調製することができる。
例えば、本発明の化合物を精製又は単離するのに有用な上記以外の酸の塩(例えば、トリフルオロ酢酸塩)も、本発明の一部を構成する。
用語「ハロゲン」は、フッ素、塩素、臭素及びヨウ素を表す。
1.1.1.6 ヘテロ原子
ヘテロ原子は、考えられる酸化段階すべてで存在することができる。例えば、硫黄は、スルホキシド(R-S(O)-R’)及びスルホン(-R-S(O)2-R’)として存在することができる。
1.1.1.7 アルキル
用語「C1-n-アルキル」(ここで、nは、2、3、4、5又は6、好ましくは4、5又は6から選択される整数である)は単独で又は別のラジカルとの組合せで、1~n個のC原子を有する非環式、飽和、分枝状又は線状の炭化水素ラジカルを表す。例えば、用語C1-5-アルキルは、ラジカルH3C-、H3C-CH2-、H3C-CH2-CH2-、H3C-CH(CH3)-、H3C-CH2-CH2-CH2-、H3C-CH2-CH(CH3)-、H3C-CH(CH3)-CH2-、H3C-C(CH3)2-、H3C-CH2-CH2-CH2-CH2-、H3C-CH2-CH2-CH(CH3)-、H3C-CH2-CH(CH3)-CH2-、H3C-CH(CH3)-CH2-CH2-、H3C-CH2-C(CH3)2-、H3C-C(CH3)2-CH2-、H3C-CH(CH3)-CH(CH3)-及びH3C-CH2-CH(CH2CH3)-を包含する。
用語「C1-n-アルキレン」(ここで、nは、2、3、4、5又は6、好ましくは4、5又は6から選択される整数である)単独で又は別のラジカルとの組合せで、1~n個の炭素原子を含む非環式、飽和、分枝状又は直鎖の2価のアルキルラジカルを表す。例えば、用語C1-4-アルキレンには、-CH2-、-CH2-CH2-、-CH(CH3)-、-CH2-CH2-CH2-、-C(CH3)2-、-CH(CH2CH3)-、-CH(CH3)-CH2-、-CH2-CH(CH3)-、-CH2-CH2-CH2-CH2-、-CH2-CH2-CH(CH3)-、-CH(CH3)-CH2-CH2-、-CH2-CH(CH3)-CH2-、-CH2-C(CH3)2-、-C(CH3)2-CH2-、-CH(CH3)-CH(CH3)-、-CH2-CH(CH2CH3)-、-CH(CH2CH3)-CH2-、-CH(CH2CH2CH3)-、-CH(CH(CH3))2-及び-C(CH3)(CH2CH3)-が含まれる。
用語「C2-m-アルケニル」は、「C2-m-アルキル」基(ここで、mは、3、4、5又は6、好ましくは4、5又は6から選択される整数である)の少なくとも2個の炭素原子が互いに二重結合で結合している場合に使用される。
1.1.1.10 アルケニレン
用語「C2-m-アルケニレン」は、「C2-m-アルキレン」基(ここで、mは、3、4、5又は6、好ましくは4、5又は6から選択される整数である)の少なくとも2個の炭素原子が互いに二重結合で結合している場合に使用される。
1.1.1.11 アルキニル
用語「C2-m-アルキニル」は、「C2-m-アルキル」基(ここで、mは、3、4、5又は6、好ましくは4、5又は6から選択される整数である)の少なくとも2個の炭素原子が互いに三重結合で結合している場合に使用される。
1.1.1.12 アルキニレン
用語「C2-m-アルキニレン」は、「C2-m-アルキレン」基(ここで、mは、3、4、5又は6、好ましくは4、5又は6から選択される整数である)の炭素原子の少なくとも2個が互いに三重結合で結合している場合に使用される。
用語「C3-k-シクロアルキル」(ここで、kは、3、4、5、6、7又は8、好ましくは4、5又は6から選択される整数である)は単独又は別のラジカルとの組合せで、3~k個のC原子を有する環式、飽和、非分枝状炭化水素ラジカルを表す。例えば、用語C3-7-シクロアルキルには、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びシクロヘプチルが含まれる。
1.1.1.14 シクロアルケニル
用語「C3-k-シクロアルケニル」(ここで、kは、3、4、5、6、7又は8、好ましくは4、5又は6から選択される整数である)は単独又は別のラジカルとの組合せで、3~k個のC原子を有する環式、不飽和ではあるが非芳香族、非分枝状炭化水素ラジカルを表し、3~k個のC原子のうち少なくとも2個が互いに二重結合で結合している。例えば、用語C3-7-シクロアルケニルには、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロペンタジエニル、シクロヘキセニル、シクロヘキサジエニル、シクロヘプテニル、シクロヘプタジエニル及びシクロヘプタトリエニルが含まれる。
(飽和又は不飽和)「アルキル」、「アルキレン」又は「シクロアルキル」基に付いている用語「ハロ」は、1個又は複数の水素原子がフッ素、塩素又は臭素、好ましくはフッ素及び塩素の中から選択されるハロゲン原子、特に好ましくはフッ素で置き換えられている、アルキル、アルキレン又はシクロアルキル基を定義する。例としては、H2FC-、HF2C-、F3C-が挙げられる。
用語「カルボシクリル」は単独で又は別のラジカルとの組合せで、3~14個の炭素原子からなる単環、二環又は三環式の環構造を意味する。用語「カルボシクリル」は、完全飽和、部分飽和及び芳香族の環系を指す。用語「カルボシクリル」は、縮合、架橋及びスピロ環系を包含する。
本明細書では用語「アリール」は単独で又は別のラジカルとの組合せで、6個の炭素原子を含む炭素環式芳香族単環式基を表し、別の5員又は6員の飽和又は不飽和芳香族炭素環式基にさらに縮合していてもよい。アリールとしては、フェニル、インダニル、インデニル、ナフチル、アントラセニル、フェナントレニル、テトラヒドロナフチル及びジヒドロナフチルが挙げられるが、これらに限定されない。
用語「ヘテロシクリル」とは、芳香族環を含んでいてもよい、N、O、S、SO、SO2から選択される1個又は複数のヘテロ原子を含み、3~14個の環原子からなる飽和又は不飽和の単環式又は多環式環系を意味し、ヘテロ原子のいずれも、芳香族環の一部でない。用語「ヘテロシクリル」は、考えられる異性体すべてを含むように意図される。
したがって、用語「ヘテロシクリル」には、以下の例示的構造(それぞれの形は適切な原子価が維持される限り共有結合を通していずれの原子に付着されていてもよいので、ラジカルとして描かれていない)が含まれる。
用語「ヘテロアリール」とは、少なくとも1個の芳香族環を含み、N、O、S、SO又はSO2から選択される1個又は複数のヘテロ原子を含み、5~14個の環原子からなる単環式又は多環式環系を意味し、ヘテロ原子の少なくとも1個が芳香族環の一部であり、得られた環系が化学的に安定でなければならない。用語「ヘテロアリール」は、考えられる異性体すべてを含むように意図される。
用語「二環式環系」とは、スピロ環、縮合、及び架橋環系を含めて、連結した2つの環式部分構造からなる基を意味する。
好ましい実施形態
本発明の特定の一実施形態は、式(I)の化合物又はその塩
別の特定の実施形態は、式(I)の化合物又はその塩(式中、R1は、-C1-6-アルキル、-CF3、-Br及び-Clからなる群の中から選択される)に関する。
別の特定の実施形態は、式(I)の化合物又はその塩(式中、R1は、-C1-6-アルキル、-CF3、-O-C1-6-アルキル、ハロゲンからなる群の中から選択され、R4は、-H又は-C1-3-アルキルである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R3は-Hである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R2は-Hであり、R3は-Hである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R4は、-H又は-C1-3-アルキルである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R5は、-H、-C1-6-アルキル、-S(O2)-C1-6-アルキル、=O、-C(O)H、-C(O)NH2、-C(O)OH及び-C(O)O-C1-6-アルキルからなる群の中から選択される)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R5は、-C(O)OH又は-C(O)O-C1-3-アルキルである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R5は、原子価によって必要とされた場合、非存在である)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R6は、-H又は-C(O)OHである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、R5は-Hであり、R6は-Hである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、AはNである)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Bは、1個又は2個のN原子を含む5~7員の単環式ヘテロシクリル、1個のN原子を含む6員の二環式ヘテロシクリル、2~3個のN原子を含む7~11員の二環式ヘテロシクリル、1個のN原子及び1個のO原子を含む7員の二環式ヘテロシクリル、1個のN原子並びにO及びSからなる群から選択される1個のヘテロ原子を含む6員の単環式ヘテロシクリル、3個のヘテロ原子を含み、そのうちの2個がNであり、もう1個がOである9員の二環式ヘテロシクリル、1個のN原子及び1個のS原子を含む9員の二環式ヘテロシクリル、並びに3個のN原子を含み、そのうち2個がC1-6-アルキルで置換されている10員の二環式ヘテロシクリルからなる群の中から選択される基である)に関する。
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Bは、
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Dは、
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Dは、
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Dは、
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Dは、
本発明の別の特定の実施形態は、式(I)の化合物又はその塩(式中、Dは、
本発明の別の特定の実施形態は、
式中、式(I)の構造的代表において描かれているように、AはBの一部であり、すなわちBはAを含む。例えば、Aがヘテロ原子であるとき、このヘテロ原子は、BがヘテロシクリルであるときBの唯一のヘテロ原子でありうる。また、例えば、Bがメンバーのある特定の数(例えば、5~7員、6員など)によって定義されたヘテロシクリルである場合、Aは、そのようなメンバーの1員である。また、別の例として、Bが1個のN原子を含む6員の単環式ヘテロシクリルである場合、Aは、このN原子とすることができる。
A、B、D、R1、R2、R3、R4、R5、R5.1、R5.2、R5.3、R6の定義のいずれか及びそれぞれを互いに組み合わせてもよい。
一態様において、本発明は、塩を含まない形態の式(I)の化合物に関する。
一態様において、本発明は、医薬品として使用するための式(I)の化合物又はその薬学的に許容される塩に関する。一態様において、本発明は、炎症、アレルギー若しくは自己免疫疾患、感染症及びがんからなる群の中から選択される疾患の処置において使用するための、又はワクチンアジュバントとして使用するための、式(I)の化合物又はその薬学的に許容される塩に関する。一態様において、本発明は、式(I)の化合物又はその薬学的に許容される塩及び薬学的に許容される担体に関する。一態様において、本発明は、式(I)の化合物又はその薬学的に許容される塩、別の活性物質として細胞静止物質、細胞傷害性物質、細胞増殖阻害物質、抗血管新生物質、ステロイド、ウイルス、免疫原性細胞死誘導物質、がん標的剤、免疫調節剤、抗体及びナノボディからなる群から選択される物質に関する。
本発明の別の態様において、一般式(I)の化合物又はその塩は、STINGの調節が治療上有益である疾患及び/又は状態の予防及び/又は処置に有用でありうることが見出される。さらに、本発明の化合物は、それらの活性のためにワクチンアジュバントとして適している。
STINGに関連した又はSTINGによって調節された疾患及び状態は、炎症、アレルギー若しくは自己免疫疾患、例えばアレルギー性鼻炎若しくは喘息、感染症又はがんを包含するが、これらに限定されない。
本発明の化合物を使用して、身体のあらゆる組織及び器官の炎症を処置することができ、それらの炎症には、筋骨格炎症、血管炎症、神経炎症、消化器系炎症、眼炎症、生殖器系炎症、及び他の炎症が含まれるが、これらに限定されない。
新しい化合物は、上記の疾患の予防、姑息的、根治的又は半根治的、短期又は長期処置のために、手術、放射線治療又は他の「最新」化合物、例えば細胞静止物質若しくは細胞傷害性物質、細胞増殖阻害物質、抗血管新生物質、ステロイド、抗体、ナノボディ、がん標的剤、腫瘍溶解性ウイルスを含むがこれに限定されないウイルス、又は免疫原性細胞死誘導物質などと任意に組み合わせても使用することができる。
新しい化合物は、上記の疾患の予防、姑息的、根治的又は半根治的、短期又は長期処置のために、化合物にとって異なる投与経路、例えば静脈内、腫瘍内、皮下、吸入、経口投与経路などを組み合わせることによって、手術、放射線治療又は他の「最新」化合物、例えば細胞静止物質若しくは細胞傷害性物質、細胞増殖阻害物質、抗血管新生物質、ステロイド、抗体、ナノボディ、がん標的剤、腫瘍溶解性ウイルスを含むがこれらに限定されないウイルス、又は免疫原性細胞死誘導物質などと任意に組み合わせても使用することができる。手術の一例にすぎないものとして、部分又は完全腫瘍切除を本発明の化合物と組み合わせることができる。放射線治療の一例にすぎないものとして、外照射療法を本発明の化合物と組み合わせることができる。
したがって、本発明は、医薬品又はワクチンアジュバントとして使用するための一般式(I)の化合物に関する。
さらなる態様において、本発明は、炎症、アレルギー若しくは自己免疫疾患、例えばアレルギー性鼻炎若しくは喘息を処置するための、感染症若しくはがんを処置するため、又はワクチンアジュバントとして使用するための式(I)の新規化合物又はその塩を提供する。
したがって、本発明は、医薬品又はワクチンアジュバントとして使用するための一般式(I)の化合物に関する。
さらに、本発明は、上記の疾患及び病態を処置及び/又は予防するための一般式(I)の化合物の使用に関する。
さらなる態様において、本発明は、上記のがんの処置及び/又は予防において腫瘍切除及び/又は放射線治療の前又は後に使用するための一般式(I)の化合物に関する。
さらなる態様において、本発明は、上記の疾患及び病態の処置及び/又は予防のための医薬品を調製するための一般式(I)の化合物の使用に関する。
さらなる態様において、本発明は、上記の疾患及び病態を処置又は予防する方法であって、有効量の一般式(I)の化合物をヒトに投与するステップを含む方法に関する。
1日当たり適用可能な一般式(I)の化合物の投与量範囲は、患者の体重1kg当たり通常0.00001~100mg、例えば体重1kg当たり0.00001~10mgである。各投与単位は、好都合に0.001~1000mg、例えば0.001~100mgを含むことができる。
実際の治療有効量又は治療用量は、当然、患者の年齢及び体重、投与経路、並びに疾患の重症度など、当業者によって公知の因子に依存する。いずれの場合も、化合物又は組成物は、用量で、且つ患者の独自の状態に基づいて治療有効量を送達することが可能になる形で投与される。
関連した態様において、本発明は、個体における免疫応答を誘導し、刺激し、又はアジュバントする方法に関する。これらの方法は、本発明の化合物を個体に投与するステップを含む。
さらなる態様において、本発明は、疾患を処置又は予防する方法であって、疾患に苦しむ又はなりやすいヒト対象に、抗原又は抗原組成物及び一般式(I)の化合物を含む免疫原性組成物を投与するステップを含む方法を提供する。
さらなる態様において、本発明は、疾患の処置又は予防において使用するための抗原又は抗原組成物及び一般式(I)の化合物を含むワクチン組成物を提供する。
さらなる態様において、本発明は、疾患の処置又は予防のための抗原又は抗原組成物を含むワクチン組成物を製造するための一般式(I)の化合物の使用を提供する。
さらなる態様において、本発明は、疾患を処置又は予防する方法であって、疾患に苦しむ又はなりやすいヒト対象に、抗原又は抗原組成物及び一般式(I)の化合物を含むワクチン組成物を投与するステップを含む方法を提供する。
本発明の別の態様において、治療有効量の上記化合物の投与に適した前記化合物の医薬組成物を製剤化できることが見出される。式(I)の化合物を投与するのに適した調製物は当業者に明らかであり、例えば錠剤、丸剤、カプセル、坐剤、ロゼンジ、トローチ、内用液剤、シロップ、エリキシル、サシェ、注射液剤(皮下、静脈内、筋肉内、腹腔内、腫瘍内及び腫瘍周囲)、吸入剤、注入剤、エリキシル、乳剤、及び散剤が含まれる。さらに、本発明による化合物は、標的送達プラットフォームを介して投与することができ、例えばそのような標的送達プラットフォームは、抗体-薬物コンジュゲート、ナノボディ-薬物コンジュゲート、ペプチド-薬物コンジュゲート、ウイルス様粒子、又はナノ粒子製剤とすることができる。
本開示の目的としては、医薬組成物は、薬学的に許容される担体、アジュバント及びビヒクルを含む製剤として、経口、非経口、吸入噴霧、局所、経鼻、経口、又は直腸内投与を含めてさまざまな手段によって投与することができる。本開示の医薬組成物は、注射可能な無菌水性又は油性懸濁剤など注射可能な無菌調製物の形で投与することができる。
別の実施形態によれば、一般式(I)の1種又は複数の化合物を含むワクチンが提供される。さらなる態様において、本発明は、一般式(I)の化合物を含むワクチンアジュバントを提供する。さらなる態様において、本発明は、抗原又は抗原組成物及び一般式(I)の化合物を含む免疫原性組成物を提供する。
さらなる態様において、本発明は、疾患の処置又は予防において使用するための抗原又は抗原組成物及び一般式(I)の化合物を含む免疫原性組成物を提供する。
本発明の化合物は単独で使用することができ、又は適切な免疫応答を誘導し、改変し、若しくは刺激するのに十分な量の薬学的に許容される賦形剤と組み合わせることができる。免疫応答は、特異的免疫応答、非特異的免疫応答、特異的応答と非特異的応答の両方、生得的応答、一次免疫応答、適応免疫、二次免疫応答、記憶免疫応答、免疫細胞活性化、免疫細胞増殖、免疫細胞分化、及びサイトカイン発現を含むことができるが、これらに限定されない。
ある特定の実施形態において、本明細書に記載された化合物及びそれらの組成物は、1種又は複数の所定の抗原に対する免疫応答を刺激するように意図されたワクチン;アジュバント;CTLA-4及びPD-1経路アンタゴニスト、脂質、リポソーム、化学療法剤、免疫調節性細胞株、がん標的剤、免疫原性細胞死誘導物質、免疫調節剤などを含む1種又は複数の追加の組成物と併せて投与され、免疫調節剤が、一般に全般的活性化-調節型の作用剤並びにある特定の免疫細胞サブタイプの頻度を調節及び/又は増加させる作用剤であると理解されうる。
本発明による化合物、組成物は1種又は複数の追加の治療剤とのあらゆる組合せを含めて、粘膜(例えば、経口、舌下、腟内、経鼻、頸部など)、腫瘍内、腹腔内、腫瘍周囲、経皮、吸入、又は非経口(例えば、皮下、静脈内、筋肉内、動脈内、皮内、髄腔内及び硬膜外投与)経路によって投与することができる。
さらに、本発明による化合物、組成物は1種又は複数の追加の治療剤とのあらゆる組合せを含めて、標的送達プラットフォームを介して投与することができ、例えばそのような標的送達プラットフォームは、抗体-薬物コンジュゲート、ナノボディ-薬物コンジュゲート、ペプチド-薬物コンジュゲート、ウイルス様粒子、又はナノ粒子とすることができる。
本発明の化合物のアジュバント特性のため、それらの使用は、他のワクチン、アジュバント、抗原、抗体、及び免疫調節物質を含めて他の治療モダリティと組み合わせることもできる。
本明細書に記載された本発明の化合物及びそれらの組成物に加えて、本発明の組成物又は方法は、1種又は複数の追加の物質をさらに含んでもよく、追加の物質は、それらの性質のため、免疫系を刺激又はその他の方法で利用するように働いて、標的とされる腫瘍細胞に存在するがん抗原に応答することができる。
本発明の化合物は、がん免疫アゴニストとの組合せ、T-細胞受容体アゴニストとの組合せ、又はTNF受容体スーパーファミリーアゴニスト若しくはアンタゴニストとの組合せで使用することができる。
式(I)の化合物若しくはその薬学的に許容される塩(化合物(I)の個々の実施形態又は一般的サブセットをすべて含む)と一緒に/組合せで、又は本明細書に(以上及び以下で)開示された医学的使用、使用、処置及び/若しくは予防方法において使用することもできる追加の薬理活性物質には、ホルモン、ホルモン類似体及び抗ホルモン(例えば、タモキシフェン、トレミフェン、ラロキシフェン、フルベストラント、酢酸メゲストロール、フルタミド、ニルタミド、ビカルタミド、アミノグルテチミド、酢酸シプロテロン、フィナステリド、酢酸ブセレリン、フルドロコルチゾン、フルオキシメステロン、メドロキシプロゲステロン、オクトレオチド);アロマターゼ阻害物質(例えば、アナストロゾール、レトロゾール、リアロゾール、ボロゾール、エキセメスタン、アタメスタン);LHRHアゴニスト及びアンタゴニスト(例えば、酢酸ゴセレリン、リュープロリド(luprolide));増殖因子及び/又はそれらの対応する受容体の阻害物質(増殖因子は、例えば血小板由来増殖因子(PDGF)、繊維芽細胞増殖因子(FGF)、血管内皮増殖因子(VEGF)、上皮増殖因子(EGF)、インスリン様増殖因子(IGF)、ヒト上皮増殖因子(HER、例えばHER2、HER3、HER4))及び/又はそれらの対応する受容体であり、阻害物質は、例えば(抗)増殖因子抗体、(抗)増殖因子受容体抗体、及びチロシンキナーゼ阻害物質であり、例えばアファチニブ、ダコミチニブ、カネルチニブ、ネラチニブ、アビチニブ、ポジオチニブ、AV 412、PF-6274484、HKI 357、オルムチニブ、オシメルチニブ、アルモネルチニブ、ナザルチニブ、ラゼルチニブ、ペリチニブ、エルロチニブ、ゲフィチニブ、イコチニブ、サピチニブ、ラパチニブ、バルリチニブ、バンデタニブ、TAK-285、AEE788、BMS599626/AC-480、GW 583340、ネシツムマブ、パニツムマブ、セツキシマブ、アミバンタマブ(amivantanab)、ペルツズマブ、トラスツズマブ、トラスツズマブエムタンシンなど、又は変異EGFR、エクソン20変異を有するHER2、及び肝細胞増殖因子(HGF)/c-METの阻害物質、例えばエミベツズマブ、アミバンタマブ、サボリチニブ、カボザンチニブ、フォレチニブである);代謝拮抗物質(例えば、メトトレキセート、ラルチトレキセド、5-フルオロウラシル(5-FU)、カペシタビン、フロクスウリジン、ゲムシタビン、メルカプトプリン、チオグアニン、クラドリビン、ペントスタチン、シタラビン(ara C)、フルダラビン、トリフルリジン及びチピラシルの組合せ(=TAS102)); 抗腫瘍性抗生物質(例えば、ドキソルビシン、ドキシル(PEG化リポソームドキソルビシン塩酸塩)、マイオセット(非PEG化リポソームドキソルビシン)、ダウノルビシン、エピルビシン及びイダルビシンなどのアントラサイクリン、マイトマイシン-C、ブレオマイシン、ダクチノマイシン、プリカマイシン、ストレプトゾシン);白金誘導体(例えば、シスプラチン、オキサリプラチン、カルボプラチン);アルキル化剤(例えば、エストラムスチン、メクロレタミン(meclorethamine)、メルファラン、クロラムブシル、ブスルファン、ダカルバジン、シクロホスファミド、イホスファミド、テモゾロミド、ニトロソウレア、例えばカルムスチンやロムスチンなど、チオテパ);有糸分裂阻害剤(例えば、ビンカアルカロイド、例えばビンブラスチン、ビンデシン、ビノレルビン及びビンクリスチン;及びパクリタキセル、ドセタキセル、nab-パクリタキセル(アブラキサン)などのタキサン);血管新生阻害物質(例えば、タスキニモド、ベバシズマブ)、チューブリン阻害物質;DNA合成阻害物質、PARP阻害物質、トポイソメラーゼ阻害物質(例えば、エピポドフィロトキシン、例えばエトポシドやエトポホスなど、テニポシド、アムサクリン、トポテカン、イリノテカン、ミトキサントロン);セリン/トレオニンキナーゼ阻害物質(例えば、PDK 1阻害物質、Raf阻害物質、A-Raf阻害物質、B-Raf阻害物質、C-Raf阻害物質、mTOR阻害物質(例えば、ラパマイシン、テムシロリムス、エベロリムス、リダホロリムス、ゾタロリムス、サパニセルチブ、トリン1、ダクトリシブ(dactosilib)、GDC-0349、vs-5584;ビスツセルチブ;AZD8055)、mTORC1/2阻害物質、PI3K阻害物質、PI3Kα阻害物質(例えば、アルペリシブ、セラベリシブ、GDC-0077、HH-CYH33、AMG 511、ブパルリシブ、ダクトリシブ、ピクチリシブ、タセリシブ)、二重mTOR/PI3K阻害物質、STK 33阻害物質、AKT阻害物質、PLK 1阻害物質、CDK4/6の阻害物質(例えば、パルボシクリブ、リボシクリブ、アベマシクリブ、トリラシクリブ、PF-06873600)、オーロラキナーゼ阻害物質);チロシンキナーゼ阻害物質(例えば、PTK2/FAK阻害物質);タンパク質間相互作用阻害物質(例えば、IAP阻害物質/SMAC模倣物、MCL-1(例えば、AZD-5991、AMG-176、AMG-397、S64315、S63845、A-1210477)、MDM2、MDM2/MDMX);MEK阻害物質(例えば、トラメチニブ、コビメチニブ、ビニメチニブ、セルメチニブ、レファメチニブ);SOS1-阻害物質(すなわち、SOS1のGEF官能性を、例えばSOS1に結合し、SOS1と(変異)Rasタンパク質、例えばKRASとの間のタンパク質間相互作用を妨げることによって調節/阻害する化合物;例えばBAY-293)、GDP負荷又はGTP負荷RAS及び/又はそのあらゆる変異体の阻害物質(すなわち、(変異)RASタンパク質の官能性を、例えばGDP負荷又はGTP負荷(変異)RASタンパク質、例えばKRAS、NRAS及び/又はHRAS、好ましくはKRASに結合することによって調節/阻害する化合物);KRAS G12Cの不可逆的阻害物質(AMG-510、MRTX849、ARS-324、GDC-6036);GDP負荷(変異)KRASへの可逆的又は不可逆的結合剤;GTP負荷(変異)KRASへの可逆的又は不可逆的結合剤;ALK阻害物質(例えば、クリゾチニブ、アレクチニブ、エントレクチニブ、ブリガチニブ、セリチニブ);ERK阻害物質;FLT3阻害物質;BRD4阻害物質;IGF-1R阻害物質;TRAILR2アゴニスト;Bcl-xL阻害物質;Bcl-2阻害物質(例えば、ベネトクラクス、オバトクラックス、ナビトクラックス、オブリマーセン);Bcl-2/Bcl-xL阻害物質;ErbB受容体阻害物質;BCR-ABL阻害物質;ABL阻害物質;Src阻害物質(例えば、ダサチニブ、ポナチニブ、ボスチニブ、バンデタニブ、KX-01、サラカチニブ、KX2-391、SU 6656、WH-4-023);ラパマイシン類似体(例えば、エベロリムス、テムシロリムス、リダホロリムス、シロリムス);アンドロゲン合成阻害物質;アンドロゲン受容体阻害物質;DNMT阻害物質;HDAC阻害物質;ANG1/2阻害物質;ヒストンデアセチラーゼ阻害物質;IL6の阻害物質;JAK及び/又はそのあらゆる変異体の阻害物質;A-Raf及び/若しくはB-Raf及び/若しくはC-Raf並びに/又はそれらのあらゆる変異体の阻害物質(エンコラフェニブ、ダブラフェニブ、ベムラフェニブ、PLX-8394、RAF-709(=国際公開第2014/151616号の実施例131)、LXH254、ソラフェニブ、LY-3009120(=国際公開第2013/134243号の実施例1)、リフィラフェニブ、TAK-632、アゲラフェニブ、CCT196969、RO5126766、RAF265);受容体チロシンキナーゼ(RTK)及び/又はそのあらゆる変異体の阻害物質;SHP2及び/又はそのあらゆる変異体の阻害物質(例えば、SHP099、TNO155、RMC-4550、RMC-4630、IACS-13909);CYP17阻害物質;放射性医薬品;プロテアソーム阻害物質(例えば、カルフィルゾミブ);免疫チェックポイント阻害物質などの免疫療法剤(例えば、CTLA4、PD1、PD-L1、PD-L2、LAG3、SIRPα抗体、及びTIM3結合分子/免疫グロブリン(イピリムマブ、ニボルマブ、ペンブロリズマブ、チスレリズマブ、アテゾリズマブ、アベルマブ、デュルバルマブ、ピディリズマブ、PDR-001(=スパルタリズマブ)、AMG-404、エザベンリマブ、シンチリマブ、カムレリズマブ、トリパリマブ(toribalimab)、チスレリズマブ);ADCC(抗体依存性細胞傷害)エンハンサー(例えば、抗CD33抗体、抗CD37抗体、抗CD20抗体);T細胞エンゲージャー、例えばPSMA×CD3、B7H6/CD3(例えば、国際公開第2021/064137号に開示)、DLL3/CD3(例えば、国際公開第2019/234220に開示)、例えば二重特異性T細胞エンゲージャー(例えばCD3×BCMA、CD3×CD33、CD3×CD19のようなBiTE(登録商標))、がんワクチン、MDM2-阻害物質、腫瘍溶解性ウイルス、並びにアミフォスチン、アナグレリド、クロドロナト、フィルグラスチム(filgrastin)、インターフェロン、インターフェロンα、ロイコボリン、プロカルバジン、レバミソール、メスナ、ミトタン、パミドロネート及びポルフィマーなどのさまざまな化学療法剤が含まれるが、これらに限定されない。本発明の化合物は、OX40アゴニスト、ICOS-リガンド、CD27アゴニスト、GITRアゴニスト、Toll様受容体アゴニストとの組合せで使用することができる。
本明細書に記載された方法の追加の実施形態において、本発明の化合物は、本明細書の方法に記載された適応症を処置するための化学療法剤及び/若しくは追加の作用剤、並びに/又は放射線治療及び/若しくは腫瘍切除などの追加の療法との組合せで使用される。
さらに別の態様において、本発明は、患者におけるSTINGに関連した又はSTINGによって調節された疾患又は状態を処置する方法であって、そのような処置を必要とするヒト患者に、治療有効量の本発明の化合物を治療有効量の1種又は複数の以上に記載された追加の治療剤との組合せで投与するステップを含む方法に関する。
本発明による化合物及び1種又は複数の追加の治療剤は、両方が一緒に1個の製剤中に存在してもよく、又は別々に2個の同一若しくは異なる製剤中に、例えばいわゆるキットオブパーツとして存在してもよい。
したがって、さらなる態様において、本発明は、一般式(I)の化合物及び別の少なくとも1種の治療剤を含む組合せを提供する。
さらなる態様において、本発明は、治療において使用するための、式(I)の化合物又はその薬学的に許容される塩及び別の少なくとも1種の治療剤を含む組合せを提供する。
さらなる態様において、本発明は、STINGの調節が有益である疾患又は状態の処置において使用するための式(I)の化合物又はその薬学的に許容される塩及び別の少なくとも1種の治療剤を含む組合せを提供する。
さらなる態様において、本発明は、炎症、アレルギー及び自己免疫疾患、感染症並びにがんの処置において使用するための式(I)の化合物又はその薬学的に許容される塩及び別の少なくとも1種の治療剤を含む組合せを提供する。
さらなる態様において、本発明は、患者におけるSTINGの調節が有益である疾患又は状態を処置する方法であって、治療有効量の式(I)の化合物又はその薬学的に許容される塩及び別の少なくとも1種の治療剤を含む組合せを投与するステップを含む方法を提供する。
さらなる態様において、本発明は、患者における炎症、アレルギー若しくは自己免疫疾患、感染症又はがんを処置する方法であって、治療有効量の式(I)の化合物又はその薬学的に許容される塩及び別の少なくとも1種の治療剤を含む組合せを投与するステップを含む方法を提供する。
化学合成
別段の記載がない限り、反応はすべて、化学研究室でよく使用される方法を使用して市販の装置で実施される。空気及び/又は水分に敏感な出発物質は保護ガス下で貯蔵され、それらを用いた対応する反応及び操作が保護ガス(窒素又はアルゴン)下で実施される。
本発明による化合物は、IUPACガイドラインに従って命名される。化合物を構造式とその命名法の両方によって表すことになっている場合、矛盾するときには構造式が決め手となる。
薄層クロマトグラフィーは、Merck社によって作製された(蛍光指示薬F-254を用いた)ガラスにシリカゲル60を塗布した既製TLCプレートで実施される。
Biotage Isolera Four装置が、自動分取NPクロマトグラフィーのために、Millipore社によって作製されたシリカゲル(Granula Silica Si-60A 35~70μm)を充填したInterchim Puri Flashカラム(50μm、12~300g)又はガラスカラムと共に使用される。
分取RP HPLCは、Waters社によって作製されたカラム(Sunfire C18、10μm、30×100mm Part. No. 186003971又はX-Bridge C18、10μm、30×100mm Part. No. 186003930)を用いて実施される。化合物は、0.2% HCOOHを水に添加した、H2O/アセトニトリル又はH2O/MeOHのさまざまなグラジエント、又は水-HCOOH混合物の代わりに塩基性水性緩衝液(1Lの水は、5mLの炭酸水素アンモニウム溶液(H2O 1L当たり158g)及び2mLのアンモニア(MeOH中7mol/l溶液)を含む)を利用するさまざまなグラジエントを用いて溶離される。
中間体化合物の分析用HPLC(反応モニタリング)は、Waters社及びPhenomenex社によって作製されたカラムを用いて実施される。分析用機器は、各場合において質量検出器も備える。
本発明による実施例化合物を特徴付ける保持時間/MS-ESI+は、例えばAgilent社で作製されたHPLC-MS装置(質量検出器を用いた高速液体クロマトグラフィー)を使用して決定される。注入ピークに溶離する化合物を保持時間tR=0とする。
方法_1
HPLC: Agilent 1100/1200シリーズ
MS: Agilent LC/MSD SL
カラム: Waters X-Bridge BEH C18、2.5μm、2.1×30mm XP
溶離液: A: H2O中5mM NH4HCO3/19mM NH3; B: ACN(HPLCグレード)
検出: MS: 正と負のモード
質量範囲: 100~800m/z
流速: 1.4ml/分
カラム温度: 45℃
グラジエント: 0.00~0.01分: 5% B
0.01~1.00分: 5% → 100% B
1.00~1.37分: 100% B
1.37~1.40分: 100% → 5% B
HPLC: Agilent 1100/1200シリーズ
MS: Agilent LC/MSD(API-ES +/- 3000V、Quadrupol、G6140)
カラム: Waters、XBridge C18、2.5μm、2.1×20mmカラム
溶媒: A: H2O中20mM NH4HCO3/NH3 pH9;B: ACN(HPLCグレード)
検出: MS: 正と負のモード
質量範囲: 120~900m/z
流速: 1.00mL/分
カラム温度: 60℃
グラジエント: 0.00~1.50分: 10% → 95% B
1.50~2.00分: 95% B
2.00~2.10分: 95% → 10% B
HPLC: Agilent 1260システム
MS: 1200シリーズ LC/MSD(MM-ES+APCI +/- 3000 V、Quadrupol、G6130)
カラム: YMC;Part. No. TA12S03-0302WT;Triart C18、3μm、12nm;30×2.0mmカラム
溶離液: A: H2O + 0.11% HCOOH;B: MeCN + 0.1% HCOOH(HPLCグレード)
検出シグナル: UV 254nm(バンド幅10、リファレンスオフ)
質量範囲: 正 150~750m/z
流速: 1.4mL/分
カラム温度: 45℃
グラジエント: 0.0~1.0分: 15% → 100% B
1.0~1.23分: 100% B
UPLC/MS: Waters Acquity-UPLC-SQ Detector-2
カラム: AQUITY UPLC BEH C18 1.7μm、2.1×50mm
溶媒: A: ACN中0.05% HCOOH;B: H2O + 0.05% HCOOH
検出: MS: 正と負のモード
質量範囲: 100~1500m/z
流速: 0.6mL/分
カラム温度: 35℃
グラジエント: 0.00~0.30分: 97% B
0.30~2.20分: 97% → 2% B
2.20~3.30分: 2% B
3.30~4.50分: 2% B
4.50~4.51分: 2% B → 97% B
UPLC/MS: Waters Acquity-UPLC-SQ Detector-2
カラム: AQUITY UPLC BEH C18 1.7μm、2.1×50mm
溶媒: A: ACN中0.07% HCOOH;B: H2O + 0.07% HCOOH
検出: MS: 正と負のモード
質量範囲: 100~1500m/z
流速: 0.6mL/分
カラム温度: 35℃
グラジエント: 0.00~0.30分: 97% B
0.30~2.20分: 97% → 2% B
2.20~3.30分: 2% B
3.30~4.50分: 2% B
4.50~4.51分: 2% B → 97% B
UPLC/MS: Waters Acquity-UPLC-SQ Detector-2
カラム: AQUITY UPLC BEH C18 1.7μm、2.1×50mm
溶媒: A: H2O + 0.07% HCOOH; B: ACN中0.07% HCOOH
検出: MS: 正と負のモード
質量範囲: 100~1500m/z
流速: 0.6mL/分
カラム温度: 35℃
グラジエント: 0.00~0.30分: 97% A
0.30~2.70分: 97% → 2% A
2.70~3.50分: 2% A
3.50~3.51分: 2% → 97% A
HPLC: Agilent 1100/1200システム
MS: 1200シリーズ LC/MSD(MM-ES + APCI +/- 3000 V、Quadrupol、G6130B)
カラム: Waters、Part.No. 186003389、XBridge BEH C18、2.5μm、2.1×30mm)カラム
溶離液: A: 5mM NH4HCO3/18mM NH3(pH=9.2);B: ACN(HPLCグレード)
検出シグナル: UV 254nm、230nm、214nm(バンド幅8、リファレンスオフ)
質量範囲: 正 150~750m/z
流速: 1.4mL/分
カラム温度: 45℃
グラジエント: 0.0~1.0分 15% → 95% B
1.0~1.3分 95% B
HPLC: Agilent 1100/1200システム
MS: 1200シリーズ LC/MSD(MM-ES + APCI +/- 3000 V、Quadrupol、G6130B)
カラム: Waters、Part.No. 186003389、XBridge BEH C18、2.5μm、2.1×30mm)カラム
溶離液: A: 5mM NH4HCO3/18mM NH3(pH=9.2);B: ACN(HPLCグレード)
質量範囲: 正/負 150~750
検出シグナル: UV 254nm、230nm、214nm(バンド幅8、リファレンスオフ)
流速: 1.4mL/分
カラム温度: 45℃
グラジエント: 0.0~1.0分: 15% → 95% B
1.0~1.3分: 95% B
本発明による化合物及びそれらの中間体は、当業者に公知で、有機合成の文献に記載されている合成方法を使用して得ることができる。これらの方法は、本発明を例示するものであり、その主題事項及び特許請求された化合物の範囲をこれらの実施例に限定するものではない。好ましくは、化合物は、以下にさらに十分に説明された調製方法、特に実験の部に記載された調製方法に類似した形で得られる。場合によっては、反応ステップを実施する際の順序は、変えてもよい。当業者に公知であるが、ここでは詳細に記載されていない反応方法の変形を使用してもよい。
本発明による化合物を調製する一般方法は、以下のスキームを研究する当業者に明らかになる。出発物質は、文献若しくは本明細書に記載されている方法によって調製することができ、又は類似若しくは同様の方式で調製することができる。通常の保護基を使用して、出発物質又は中間体のあらゆる官能基を保護することができる。これらの保護基は、当業者によく知られている方法を使用して、反応順序内の好適な段階で再び切断することができる。
スキームI:
B2 7-メチル-1H-インダゾール-6-カルボン酸メチル
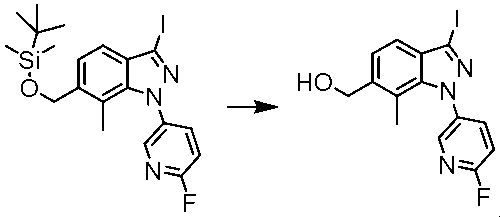
B3 (7-メチル-1H-インダゾール-6-イル)メタノール
中間体Cの調製
C1 (3-ヨード-7-メチル-1H-インダゾール-6-イル)メタノール
同じようにして、中間体Bから以下の中間体を調製する。
中間体Dの調製
D1 1-(6-フルオロピリジン-3-イル)-3-ヨード-7-メチル-1H-インダゾール
同じようにして、対応する3-ヨード-インダゾール(中間体C)から以下の中間体を調製する。
中間体Eの調製
E1 1-(6-フルオロピリジン-3-イル)-2’,7-ジメチル-1H,2’H-3,4’-ビインダゾール
同じようにして、中間体Dから、対応するボロン酸誘導体を利用して以下の中間体を調製する。
E10 1-(6-フルオロピリジン-3-イル)-2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-6-アミン
E11 1-(6-フルオロピリジン-3-イル)-6-ヨード-2’,7-ジメチル-1H,2’H-3,4’-ビインダゾール
E12 1-(6-フルオロピリジン-3-イル)-2’,7-ジメチル-6-(1-メチル-1H-ピラゾール-4-イル)-1H,2’H-3,4’-ビインダゾール
1-(6-フルオロピリジン-3-イル)-6-ヨード-2’,7-ジメチル-1H,2’H-3,4’-ビインダゾールE11(100mg、200μmol)、1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(52mg、240μmol)、({[1,1’-ビフェニル]-2-イル}アミノ)パラジウムイリウムジシクロヘキシル({2’,6’-ジメトキシ-[1,1’-ビフェニル]-2-イル})ホスファンメタンスルホネート(8mg、10μmol)、K3PO4(87mg、400μmol)、ジオキサン(1ml)及び水(0.5ml)の混合物を、アルゴン雰囲気下で80℃で16時間撹拌する。室温で、水(30ml)を添加し、混合物をDCMで抽出する。合わせた有機層をNa2SO4で脱水し、真空中で濃縮して、50mg(56%)の粗E12を得る。それをさらに精製することなく、次ステップで使用する。
スキーム1に示した合成ステップの代替順序に従うことによって、中間体Sを経由して追加の中間体Eを得ることができる。
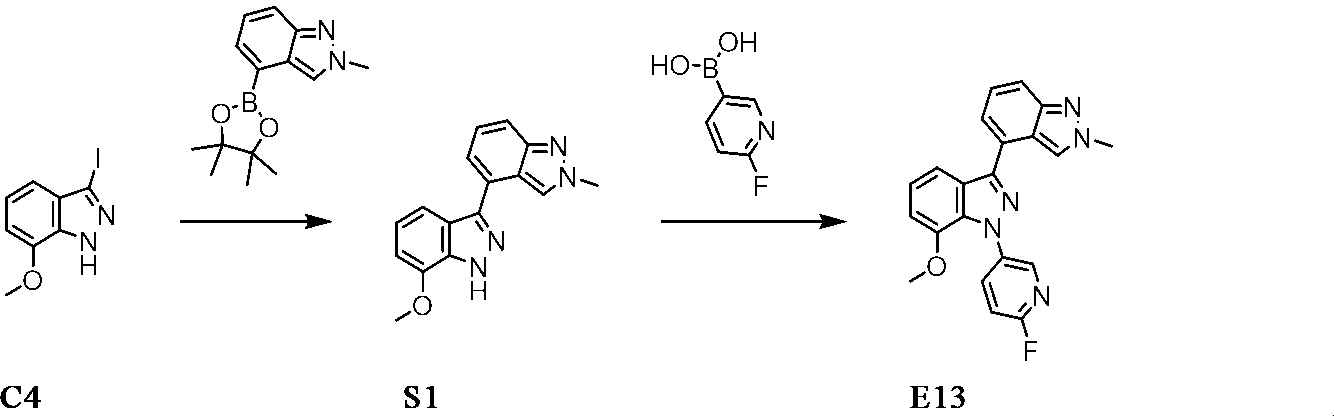
3-ヨード-7-メトキシ-1H-インダゾールC4(500mg、1.62mmol)、2-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-2H-インダゾール(512mg、1.94mmol)、({[1,1’-ビフェニル]-2-イル}アミノ)パラジウムイリウムジシクロヘキシル({2’,6’-ジメトキシ-[1,1’-ビフェニル]-2-イル})ホスファンメタンスルホネート(126mg、162μmol)、K3PO4(695mg、3.24mmol)、ジオキサン(5ml)及び水(1ml)の混合物を、アルゴン雰囲気下で80℃で16時間撹拌する。室温で、混合物をDCMで希釈し、水で抽出する。有機層をNa2SO4で脱水し、真空中で濃縮し、中間体7-メトキシ-2’-メチル-1H,2’H-3,4’-ビインダゾールをNPクロマトグラフィーによって精製する。収量:256mg(57%)。HPLC-MS:M+H=279;tR=0.55分(方法_7)
S1と同じようにして、以下の中間体S2を合成する。
7-メトキシ-2’-メチル-1H,2’H-3,4’-ビインダゾールS1(256mg、920μmol)に、DCM(5ml)及びDMF(2.25ml)中の(6-フルオロピリジン-3-イル)ボロン酸(259mg、1.84mmol)、酢酸銅(II)(167mg、920μmol)及びピリジン(218μl、2.8mmol)を添加する。混合物を、空気に曝露しながら室温で60時間撹拌する。固体を濾過して取り除き、濾液を真空中で濃縮し、生成物をNPクロマトグラフィーによって精製する。収量:185mg(54%)。HPLC-MS:M+H=374;tR=0.70分(方法_7)
さらに、中間体Dを中間体Tにボロニル化して、例えばヘテロアリールブロミドと鈴木カップリングして、別の中間体Eを得ることができる。
T1 3-(5,5-ジメチル-1,3,2-ジオキサボリナン-2-イル)-1-(6-フルオロピリジン-3-イル)-7-メチル-1H-インダゾール
E14 1-(6-フルオロピリジン-3-イル)-7-メチル-3-{ピラゾロ[1,5-a]ピリジン-4-イル}-1H-インダゾール
U2 4-ブロモ-2-メチルピラゾロ[1,5-a]ピリジン
U3) 5-ブロモ-N,N-ジメチルイソキノリン-3-アミン
#1) 3-(5-(2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-1-イル)ピリジン-2-イル)-3-アザビシクロ[3.1.0]ヘキサン-6-カルボン酸メチル
同じようにして、中間体Eから、対応するアミンを利用して以下の実施例を調製する。アミンの塩(例えば、塩酸塩)の場合には、それぞれ当量の追加の塩基を使用する。
同じようにして、それぞれF2~F6から、以下の実施例を調製する。
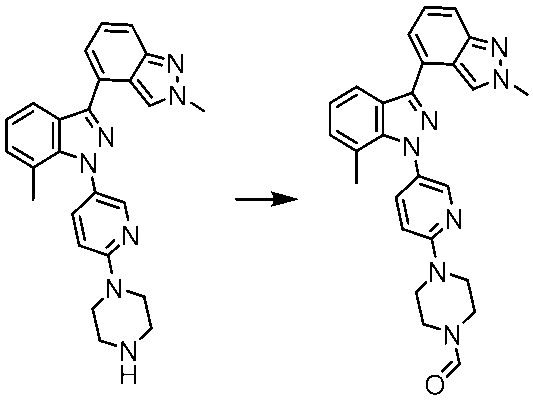
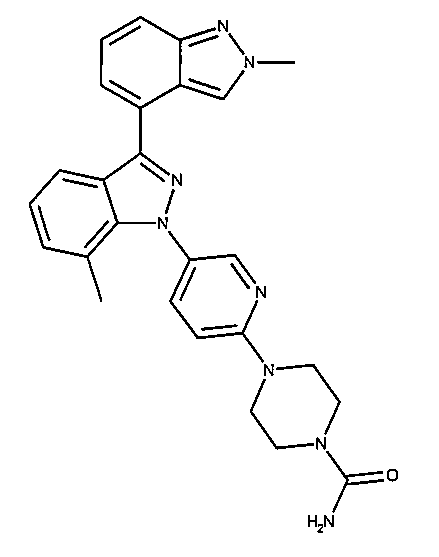
#51 4-(5-(2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-1-イル)ピリジン-2-イル)ピペラジン-1-カルボアルデヒド
同じようにして、それぞれ#45、#48及び#49から、以下の実施例を調製する。
#56 N-[1-(5-{2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-1-イル}ピリジン-2-イル)ピペリジン-4-イル]メタンスルホンアミド
#57 1-(5-(2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-1-イル)ピリジン-2-イル)ピペリジン-4-カルボン酸
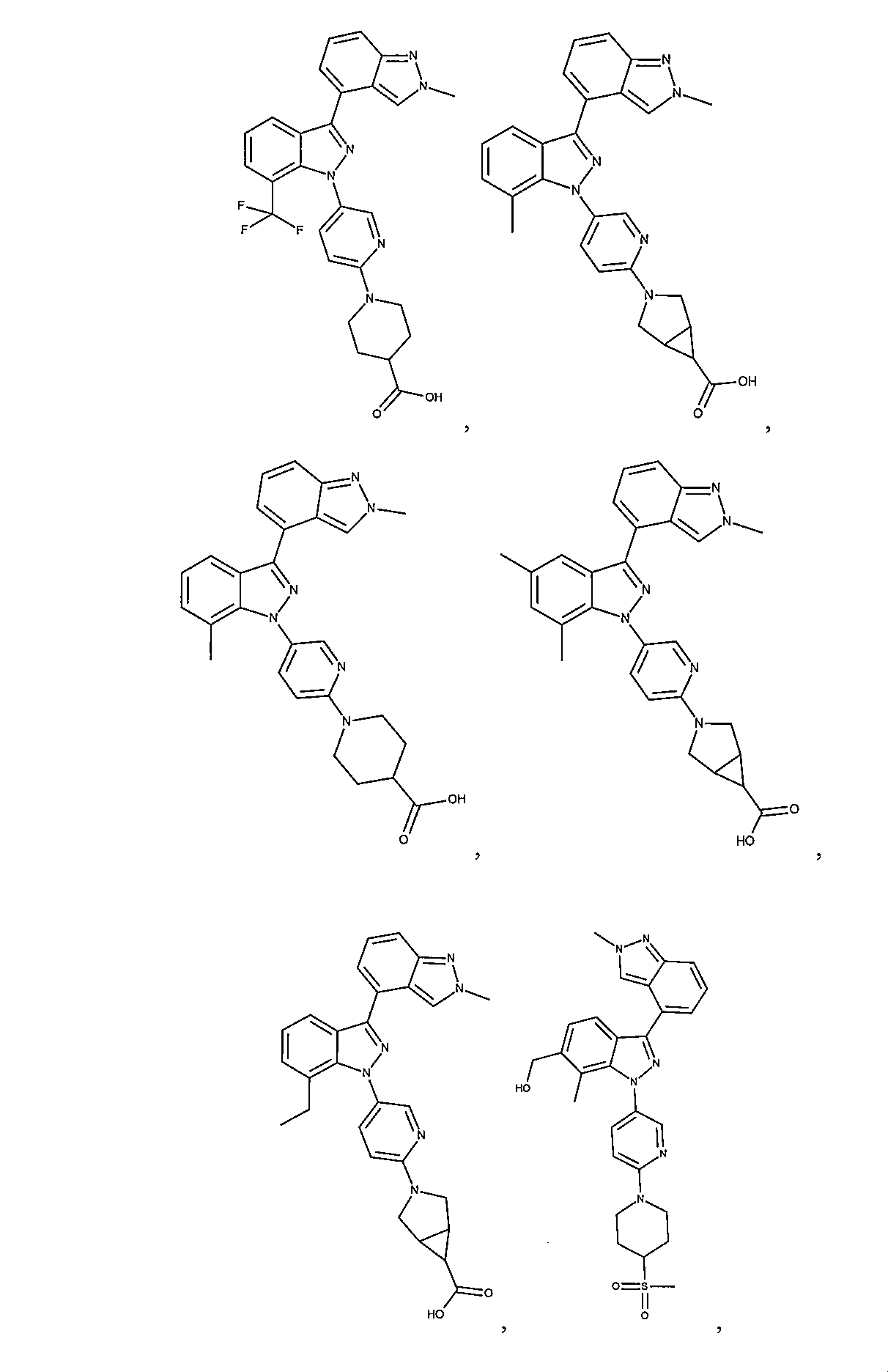
同じようにして、それぞれ#32、#1、#33~#44から、以下の実施例を調製する。
#72 3-(5-{2’,7-ジメチル-1H,2’H-[3,4’-ビインダゾール]-1-イル}ピリジン-2-イル)-3-アザビシクロ[3.1.0]ヘキサン-6-カルボキサミド
塩化アンモニウム(10mg、187μmol)を添加し、撹拌を16時間続ける。混合物を真空中で濃縮し、生成物をRPクロマトグラフィーによって精製する。収量:11mg(55%)。HPLC-MS:M+H=464;tR=1.28分(方法_2)
中間体S2から出発して、ビルディングブロックVを用いて実施例#73を合成する。
V1 5-ブロモ-2-(4-メタンスルホニルフェニル)ピリジン
V2 [6-(4-メタンスルホニルフェニル)ピリジン-3-イル]ボロン酸
#73 1-[6-(4-メタンスルホニルフェニル)ピリジン-3-イル]-2’,7-ジメチル-1H,2’H-3,4’-ビインダゾール
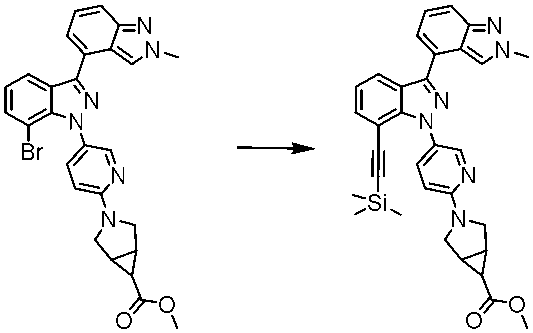
W1 3-(5-{2’-メチル-7-[2-(トリメチルシリル)エチニル]-1H,2’H-[3,4’-ビインダゾール]-1-イル}ピリジン-2-イル)-3-アザビシクロ[3.1.0]ヘキサン-6-カルボン酸メチル
示差走査蛍光定量(DSF)により決定されたhSTINGとの相互作用
DSFでは、融解温度Tmとも呼ばれる、タンパク質がアンフォールドする温度は、タンパク質の疎水性部分に結合する色素の蛍光の変化によって測定される。低分子の結合後のTmシフトは、この低分子の結合親和性と相互関係がある。標的タンパク質として、ヒトSTING(hSTING、残基155~341、MW: 21578.4Da;タンパク質ストック溶液:c=20mM Tris、100mM NaCl、2mM TCEP(pH8.8)中1302μMストック溶液)を使用し、アッセイ緩衝液として、20mM Tris、150mM NaCl(pH7.5)を必要な場合に適宜添加した。
アッセイにおける成分の最終濃度:100μM 試験化合物、5μM 標的タンパク質、「5倍」SYPR Orange(ストック溶液のDMSO中SYPRO橙色溶液から(invitrogen社カタログ番号S6650-500ul)、濃度「5000倍」)
アッセイ手順:
1)化合物ストック溶液(DMSO中10mM)の希釈液をアッセイ緩衝液(20mM Tris、150mM NaCl;pH7.5)中で調製した。
2)5μlの蛍光色素ストック溶液(DMSO中5000倍SYPROオレンジ)を、19μlの標的タンパク質(1302μM)及び976μlのアッセイ緩衝液と混合した。
3)このタンパク質-色素-混合物(25倍SYPROオレンジ及び25μMタンパク質)の2μlを、ステップ1で調製された希釈化合物溶液の8μlに添加した。最終体積は10μlであった。
4)20個の化合物ごとに、2個の陰性対照を測定した。
5)2連測定のためにプレートを準備し、1000gで2分間遠心分離した。
6)測定には、CFX384 Real-Time System(Bio-Rad社)を使用した。工程は、0.5℃/サイクルで140サイクルからなるものであった(温度傾斜15秒/サイクル、25℃から95℃)。
データ分析:融解曲線をBio-Rad CFX Managerで処理した。ピーク型を「負」に設定した。2回反復のTM(融解温度)測定を平均し、標準偏差を算出した。
本発明による化合物のサイトカイン誘導活性は、THP1レポーター細胞系を使用し、細胞EC50値を得ることによって示されてきた。細胞系において発現されたSTINGタンパク質の活性化によって、インターフェロン産生が増加する。インターフェロン制御因子(IRF)誘導性SEAP遺伝子(分泌型胚性アルカリホスファターゼ)レポーターコンストラクトの安定な組込みによって、機能的インターフェロンシグナル伝達経路をモニターすることができる。Invivogen社のTHP1-Blue(商標)ISG比色酵素アッセイ及び好適な光学濃度(OD)読み取り装置を使用して、SEAPの活性を検出及び定量することができる。この技法を使用すれば、STING経路の薬理学的改変を特徴付けることができる。
異なるヒトSTINGアイソフォーム及びIRF誘導性SEAPレポーターコンストラクトを安定に発現するTHP1-Blue(商標)ISG細胞において、SEAP活性の測定を行った。37℃、湿度95%及び5%CO2のインキュベーター中、10%ウシ胎仔血清、50μg/mlのペニシリン-ストレプトマイシン、100μg/mlのZeocin、及び100μg/mlのNormocinを含むRPMI1640培地で、細胞を培養した。
アッセイの当日に、1ウェル当たり75μlのQuanti-Blue(商標)試薬をプレートのウェルすべてに添加し、プレートを37℃でもう30分インキュベートした。620nmにおけるODをEnVision読み取り装置(PerkinElmer社)で測定した。
EC50値のデータは、表2a~2eで見ることができる。
STING HAQ-バリアントのEC50値のデータは、表2aで見ることができる。以下に示されたデータは、(HAQを内因的に発現する)親のTHP1-Blue(商標)ISG細胞株又は遺伝子操作されたTHP1-Blue(商標)ISG細胞株に由来するデータであり、最初のSTINGはノックアウトされ、HAQ特異的STINGアイソフォームは以上に記載されたように再導入された。
Caco-2細胞を、Leibniz Institute DSMZ-German Collection of Microorganisms and Cell Cultures(Braunschweig、Germany)から入手し、(最終濃度で)10% FCS(ウシ胎仔血清)、1% NEAA(非必須アミノ酸)、2mMのグルタミン、100U/mLのペニシリン及び100μg/mLのストレプトマイシンを含むDMEM(ダルベッコ変法イーグル培地)で培養した。Caco-2細胞を、双方向透過性アッセイのために24ウェルのTranswellインサート(Corning社、#3379)に160,000細胞/cm2の密度で播種し、培地を2日ごとに変えながら3週間培養した。
Papp,AB=QAB/(C0 ・ s ・ t)
Papp,BA=QBA/(C0 ・ s ・ t)
排出比=Papp,BA/Papp,AB
ここで、Qは、インキュベーション時間t後にレシーバコンパートメントにおいて回収された化合物の量であり、C0は、ドナーコンパートメントに与えられた初期の化合物濃度であり、sは、Transwellインサートの表面積である。品質管理として、1種の基準P-gp基質(アパファント)及び1種の低透過性化合物(BI内部基準、Papp約3・10-7cm/秒、排出なし)がアッセイプレートごとに含まれる。さらに、透過性アッセイの前に、各プレートについて経上皮電気抵抗(TEER)値を測定し、ドナー及びレシーバコンパートメントにおける全回収率を各化合物について決定した。結果を表3a及び3bで見ることができる。
DMSO中の化合物の10mMストック溶液を最終濃度250μMに水性McIlvaine緩衝液(pH6.8)又は参照としてアセトニトリル/水(1:1)で希釈して、水性溶解度を決定した。試料を、室温で96ウェルプレート(Whatman Uniplate(登録商標)96ウェル、750μL、ポリプロピレン、丸底)中で24時間振盪した。次いで、プレートを3,000rpmで2分間遠心分離した。250μLの各試料を、ポリカーボネートメンブラン(孔径0.45μm)付きのMillipore MultiScreenHTSフィルタープレートに移した。3,000rpmで2分間遠心分離することによって、濾液を収集した。溶解した濃度は、Waters ACQUITY UPLC(登録商標)BEH 2.1×50mm C18カラム、粒径1.7μmを装備したWaters ACQUITY UPLC(登録商標)SQDシステムで、水/0.1% ギ酸を溶媒Aとし、アセトニトリル/0.1% ギ酸を溶媒Bとして短期グラジエント(5→95% B、全サイクル時間1.7分)を使用して、UPLC/UV(超高速液体クロマトグラフィー/紫外線)によって決定した。光ダイオードアレイUV検出器を254nmで操作して、化合物シグナルを測定した。Waters Empowerソフトウェアを使用して、参照標準に対してピーク面積を比較することによって、溶解度を1点較正で決定した。結果を表4で見ることができる。
Claims (38)
- 式(I)の化合物又はその塩。
(式中、
Aは、N又はCであり、
Bは、
1個又は2個のN原子を含む5~7員の単環式ヘテロシクリル、
1個のN原子を含む6員の二環式ヘテロシクリル、
2個のN原子を含む7~11員の二環式ヘテロシクリル、
1個のN原子及び1個のO原子を含む7員の二環式ヘテロシクリル、
1個のN原子並びにO及びSからなる群から選択される1個のヘテロ原子を含む6員の単環式ヘテロシクリル、
3個のヘテロ原子を含み、そのうちの2個がNであり、もう1個がOである9員の二環式ヘテロシクリル、
1個のN原子及び1個のS原子を含む9員の二環式ヘテロシクリル、
3個のN原子を含み、そのうち2個がC1-6-アルキルで置換されている10員の二環式ヘテロシクリル、
フェニル、
3個のN原子を含む9員の二環式ヘテロアリール、
からなる群の中から選択される基であり;
Dは、
2個のN原子を含む9員の二環式ヘテロアリール、
1個のN原子を含む10員の二環式ヘテロアリール、及び
ベンゾジオキソール
からなる群の中から選択される基であり;
R1は、-H、-C1-6-アルキル、-CF3、-C2-6-アルキニル、-O-C1-6-アルキル及びハロゲンからなる群の中から選択され;
R2は、-H、-C1-6-アルキル、-C1-6-アルキレン-OH、-C(O)OH、-C(O)O-C1-6-アルキル及び-ピラゾリル-C1-6-アルキルからなる群の中から選択され;
R3は、-H又は-C1-6-アルキルであり;
R4は、-H、-C1-3-アルキル、-NH2、-NHC1-3-アルキル及びN(C1-3-アルキル)2からなる群の中から選択され;
R5は、非存在であり、或いは-H、-C1-6-アルキル、-S(O2)-C1-6-アルキル、-NH-S(O2)-C1-6-アルキル、=O、-C(O)-C1-6-アルキル、-C(O)H、-C(O)OH、-C(O)NH2、-C(O)O-C1-6-アルキル、-NR5.1R5.2、-C1-6-アルキレン-C(O)OH、-S(O2)-NH2、-ピロリジン-2-オン-1-イル、-テトラゾリル、並びにR5.3で置換されている、N及びOからなる群から選択される1個又は2個のヘテロ原子を有する5員のヘテロアリールからなる群の中から選択され;
R5.1は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル及び-C1-6-アルキレン-O-C1-6-アルキルからなる群の中から選択され;
R5.2は、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル、-C1-6-アルキレン-O-C1-6-アルキル及び-C1-6-アルキレン-R5.3からなる群の中から選択され;
R5.3は、-H、-C1-6-アルキル、並びにN及びOからなる群から選択される1個又は2個のヘテロ原子を有する6員のヘテロアリールからなる群の中から選択され;
R6は、非存在であり、或いは-H、-C1-6-アルキル、=O及び-C(O)OHからなる群の中から選択される。) - R1が、-C1-6-アルキル、-CF3、-O-C1-6-アルキル及びハロゲンからなる群の中から選択され;
R4が、-H又は-C1-3-アルキルである、
請求項1に記載の化合物又はその塩。 - R5が、-H、-C1-6-アルキル、-S(O2)-C1-6-アルキル、=O、-C(O)H、-C(O)NH2、-C(O)OH、-C(O)O-C1-6-アルキル、-NR5.1R5.2、並びにR5.3で置換されている、N及びOからなる群から選択される1個又は2個のヘテロ原子を有する5員のヘテロアリールからなる群の中から選択され;
R5.1が、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル及び-C1-6-アルキレン-O-C1-6-アルキルからなる群の中から選択され:
R5.2が、-H、-C1-6-アルキル、-C(O)-C1-6-アルキル、-C1-6-アルキレン-O-C1-6-アルキル及び-C1-6-アルキル-R5.3からなる群の中から選択され;
R5.3が、-H又は-C1-6-アルキルである、
請求項1に記載の化合物又はその塩。 - 塩の形態ではない、請求項1に記載の化合物。
- 請求項1に記載の化合物又はその薬学的に許容される塩を含有する医薬組成物。
- 炎症、アレルギー及び自己免疫疾患、感染症並びにがんからなる群の中から選択される疾患の処置において使用するための、又はワクチンアジュバントとして使用するための、請求項1に記載の化合物又はその薬学的に許容される塩を含有する医薬組成物。
- 放射線治療後に投与される、がんの処置において使用するための、請求項1に記載の化合物又はその薬学的に許容される塩を含有する医薬組成物。
- さらに、薬学的に許容される担体を含む請求項12~14のいずれか1項記載の医薬組成物。
- さらに、別の活性物質として細胞静止物質、細胞傷害性物質、細胞増殖阻害物質、抗血管新生物質、ステロイド、ウイルス、免疫原性細胞死誘導物質、がん標的剤、免疫調節剤、抗体及びナノボディからなる群から選択される物質を含む請求項12~14のいずれか1項記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP21171155.1 | 2021-04-29 | ||
| EP21171155 | 2021-04-29 | ||
| PCT/EP2022/061379 WO2022229341A1 (en) | 2021-04-29 | 2022-04-28 | Heterocyclic compounds capable of activating sting |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2024514361A JP2024514361A (ja) | 2024-04-01 |
| JP7634112B2 true JP7634112B2 (ja) | 2025-02-20 |
Family
ID=75825418
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023564644A Active JP7634112B2 (ja) | 2021-04-29 | 2022-04-28 | Stingを活性化することができるヘテロ環式化合物 |
Country Status (30)
| Country | Link |
|---|---|
| US (2) | US12065427B2 (ja) |
| EP (1) | EP4330250B1 (ja) |
| JP (1) | JP7634112B2 (ja) |
| KR (1) | KR20240004646A (ja) |
| CN (2) | CN118546123A (ja) |
| AR (1) | AR125477A1 (ja) |
| AU (1) | AU2022265323C1 (ja) |
| BR (1) | BR112023017873A2 (ja) |
| CA (1) | CA3214127A1 (ja) |
| CL (1) | CL2023002959A1 (ja) |
| CO (1) | CO2023014672A2 (ja) |
| CR (1) | CR20230509A (ja) |
| DK (1) | DK4330250T3 (ja) |
| DO (1) | DOP2023000234A (ja) |
| EC (1) | ECSP23069018A (ja) |
| ES (1) | ES3019235T3 (ja) |
| FI (1) | FI4330250T3 (ja) |
| HR (1) | HRP20250430T1 (ja) |
| HU (1) | HUE071621T2 (ja) |
| IL (1) | IL307977A (ja) |
| LT (1) | LT4330250T (ja) |
| MA (1) | MA64568B1 (ja) |
| MX (1) | MX2023012800A (ja) |
| PE (1) | PE20240069A1 (ja) |
| PL (1) | PL4330250T3 (ja) |
| PT (1) | PT4330250T (ja) |
| RS (1) | RS66626B1 (ja) |
| SI (1) | SI4330250T1 (ja) |
| TW (1) | TW202309031A (ja) |
| WO (1) | WO2022229341A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12065427B2 (en) * | 2021-04-29 | 2024-08-20 | Boehringer Ingelheim International Gmbh | Heterocyclic compounds capable of activating STING |
| CN119998286A (zh) * | 2022-10-28 | 2025-05-13 | 勃林格殷格翰国际有限公司 | 作为sting拮抗剂的杂环化合物 |
| WO2024209363A1 (en) | 2023-04-06 | 2024-10-10 | Pfizer Inc. | Substituted indazole propionic acid derivative compounds and uses thereof as ampk activators |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012095781A1 (en) | 2011-01-13 | 2012-07-19 | Pfizer Limited | Indazole derivatives as sodium channel inhibitors |
| JP2012521429A (ja) | 2009-03-23 | 2012-09-13 | メルク・シャープ・エンド・ドーム・コーポレイション | 疼痛治療用のp2x3受容体アンタゴニスト |
| WO2020075790A1 (ja) | 2018-10-11 | 2020-04-16 | 小野薬品工業株式会社 | Sting作動化合物 |
| US20200172534A1 (en) | 2018-07-03 | 2020-06-04 | Ifm Due, Inc. | Compounds and compositions for treating conditions associated with sting activity |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR090151A1 (es) | 2012-03-07 | 2014-10-22 | Lilly Co Eli | Compuestos inhibidores de raf |
| US9242969B2 (en) | 2013-03-14 | 2016-01-26 | Novartis Ag | Biaryl amide compounds as kinase inhibitors |
| TWI848953B (zh) | 2018-06-09 | 2024-07-21 | 德商百靈佳殷格翰國際股份有限公司 | 針對癌症治療之多特異性結合蛋白 |
| TW202028183A (zh) | 2018-10-10 | 2020-08-01 | 大陸商江蘇豪森藥業集團有限公司 | 含氮雜芳類衍生物調節劑、其製備方法和應用 |
| CN111499617B (zh) * | 2019-01-31 | 2021-08-06 | 成都先导药物开发股份有限公司 | 一种免疫调节剂 |
| CN112521394A (zh) * | 2019-09-19 | 2021-03-19 | 中国药科大学 | 杂环酰胺类化合物、其可药用的盐及其制备方法和用途 |
| MX2022003633A (es) * | 2019-09-25 | 2022-04-19 | Pfizer | Moduladores poliheterociclicos de sting (estimulador de genes de interferon). |
| TWI878355B (zh) | 2019-10-02 | 2025-04-01 | 德商百靈佳殷格翰國際股份有限公司 | 用於癌症治療之多重專一性結合蛋白 |
| CN112869927B (zh) | 2019-11-29 | 2024-11-19 | 百安健康复医疗(深圳)有限公司 | 用于治疗膝骨性关节炎的矫正器 |
| WO2021143823A1 (zh) | 2020-01-16 | 2021-07-22 | 浙江海正药业股份有限公司 | 吡啶或嘧啶类衍生物及其制备方法和用途 |
| EP4110459A1 (en) | 2020-02-28 | 2023-01-04 | Remix Therapeutics Inc. | Heterocyclic amides and their use for modulating splicing |
| US12065427B2 (en) * | 2021-04-29 | 2024-08-20 | Boehringer Ingelheim International Gmbh | Heterocyclic compounds capable of activating STING |
-
2022
- 2022-04-27 US US17/730,395 patent/US12065427B2/en active Active
- 2022-04-28 SI SI202230106T patent/SI4330250T1/sl unknown
- 2022-04-28 DK DK22727008.9T patent/DK4330250T3/da active
- 2022-04-28 PL PL22727008.9T patent/PL4330250T3/pl unknown
- 2022-04-28 CR CR20230509A patent/CR20230509A/es unknown
- 2022-04-28 KR KR1020237040758A patent/KR20240004646A/ko active Pending
- 2022-04-28 FI FIEP22727008.9T patent/FI4330250T3/fi active
- 2022-04-28 RS RS20250291A patent/RS66626B1/sr unknown
- 2022-04-28 JP JP2023564644A patent/JP7634112B2/ja active Active
- 2022-04-28 CA CA3214127A patent/CA3214127A1/en active Pending
- 2022-04-28 BR BR112023017873A patent/BR112023017873A2/pt active Search and Examination
- 2022-04-28 MA MA64568A patent/MA64568B1/fr unknown
- 2022-04-28 PE PE2023002941A patent/PE20240069A1/es unknown
- 2022-04-28 AR ARP220101113A patent/AR125477A1/es unknown
- 2022-04-28 EP EP22727008.9A patent/EP4330250B1/en active Active
- 2022-04-28 WO PCT/EP2022/061379 patent/WO2022229341A1/en not_active Ceased
- 2022-04-28 TW TW111116155A patent/TW202309031A/zh unknown
- 2022-04-28 IL IL307977A patent/IL307977A/en unknown
- 2022-04-28 AU AU2022265323A patent/AU2022265323C1/en active Active
- 2022-04-28 CN CN202410587835.5A patent/CN118546123A/zh active Pending
- 2022-04-28 CN CN202280030669.8A patent/CN117255784A/zh active Pending
- 2022-04-28 HU HUE22727008A patent/HUE071621T2/hu unknown
- 2022-04-28 MX MX2023012800A patent/MX2023012800A/es unknown
- 2022-04-28 ES ES22727008T patent/ES3019235T3/es active Active
- 2022-04-28 PT PT227270089T patent/PT4330250T/pt unknown
- 2022-04-28 LT LTEPPCT/EP2022/061379T patent/LT4330250T/lt unknown
- 2022-04-28 HR HRP20250430TT patent/HRP20250430T1/hr unknown
-
2023
- 2023-09-13 EC ECSENADI202369018A patent/ECSP23069018A/es unknown
- 2023-10-03 CL CL2023002959A patent/CL2023002959A1/es unknown
- 2023-10-20 DO DO2023000234A patent/DOP2023000234A/es unknown
- 2023-10-30 CO CONC2023/0014672A patent/CO2023014672A2/es unknown
-
2024
- 2024-03-06 US US18/596,986 patent/US20240270718A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012521429A (ja) | 2009-03-23 | 2012-09-13 | メルク・シャープ・エンド・ドーム・コーポレイション | 疼痛治療用のp2x3受容体アンタゴニスト |
| WO2012095781A1 (en) | 2011-01-13 | 2012-07-19 | Pfizer Limited | Indazole derivatives as sodium channel inhibitors |
| US20200172534A1 (en) | 2018-07-03 | 2020-06-04 | Ifm Due, Inc. | Compounds and compositions for treating conditions associated with sting activity |
| WO2020075790A1 (ja) | 2018-10-11 | 2020-04-16 | 小野薬品工業株式会社 | Sting作動化合物 |
Non-Patent Citations (1)
| Title |
|---|
| Chen, Nan-Nan et al.,Agonist of stimulator of interferon genes as antitumor agents: a patent review (2008-2020),Expert Opinion on Therapeutic Patents,2021年,31(6),pp. 563-584,https://doi.org/10.1080/13543776.2021.1877660 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7634112B2 (ja) | Stingを活性化することができるヘテロ環式化合物 | |
| ES2624439T3 (es) | Derivados de piridinil triazolona y piridinil triazolona condensados | |
| EP4608820A1 (en) | Heterocyclic compounds capable of activating sting | |
| JP2020535168A (ja) | Tam阻害剤として有用なピロロトリアジン誘導体の塩 | |
| WO2021000855A1 (en) | Malt1 inhibitors and uses thereof | |
| JP2025536352A (ja) | Stingを活性化することができるヘテロ環化合物 | |
| HK40108588B (en) | Heterocyclic compounds capable of activating sting | |
| HK40108588A (en) | Heterocyclic compounds capable of activating sting | |
| EA049138B1 (ru) | Гетероциклические соединения, способные активировать sting | |
| WO2024089008A1 (en) | Heterocyclic compounds capable of activating sting | |
| BR112019006512A2 (pt) | compostos dinucleotídeos cíclicos | |
| BR112019006512B1 (pt) | Compostos, estereoisômeros substancialmente puros, sal farmaceuticamente aceitável, sal de sódio, composições farmacêuticas, vacina e usos dos referidos compostos |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231020 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20231020 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20241003 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20241004 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241225 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250109 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250207 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7634112 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |