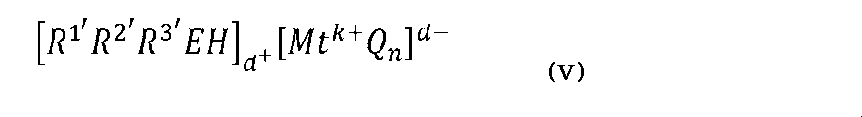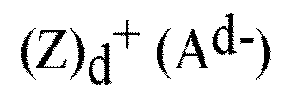JP7629985B2 - 遷移金属ビス(フェノラート)触媒錯体を使用して得られる環含有ポリマー組成物およびその製造方法 - Google Patents
遷移金属ビス(フェノラート)触媒錯体を使用して得られる環含有ポリマー組成物およびその製造方法 Download PDFInfo
- Publication number
- JP7629985B2 JP7629985B2 JP2023509861A JP2023509861A JP7629985B2 JP 7629985 B2 JP7629985 B2 JP 7629985B2 JP 2023509861 A JP2023509861 A JP 2023509861A JP 2023509861 A JP2023509861 A JP 2023509861A JP 7629985 B2 JP7629985 B2 JP 7629985B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- mol
- substituted
- hydrocarbyl
- alternatively
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F210/00—Copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond
- C08F210/04—Monomers containing three or four carbon atoms
- C08F210/06—Propene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F232/00—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system
- C08F232/02—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system having no condensed rings
- C08F232/04—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system having no condensed rings having one carbon-to-carbon double bond
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F232/00—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system
- C08F232/08—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system having condensed rings
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/62—Refractory metals or compounds thereof
- C08F4/64—Titanium, zirconium, hafnium or compounds thereof
- C08F4/659—Component covered by group C08F4/64 containing a transition metal-carbon bond
- C08F4/65908—Component covered by group C08F4/64 containing a transition metal-carbon bond in combination with an ionising compound other than alumoxane, e.g. (C6F5)4B-X+
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Crystallography & Structural Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Transition And Organic Metals Composition Catalysts For Addition Polymerization (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Description
本出願は、2020年8月13日に出願された米国仮出願第63/065344号の利益および優先権を主張し、その開示は参照により本明細書に組み込まれる。
1)USSN16/788,022、出願日2020年2月11日;
2)USSN16/788,088、出願日2020年2月11日;
3)USSN16/788,124、出願日2020年2月11日;
4)USSN16/787,909、出願日2020年2月11日;
5)USSN16/787,837、出願日2020年2月11日;
6)PCT出願番号PCT/US2020/045819、出願日2020年8月11日;
7)PCT出願番号PCT/US2020/045820、出願日2020年8月11日;および
8)PCT出願番号PCT/US2020/045822、出願日2020年8月11日
本発明は、第4族ビス(フェノラート)錯体を含む新規な触媒化合物を使用して調製された環状モノマーを含むポリマー組成物、それを含む組成物、およびかかるコポリマーの製造方法に関する。
[式中:
Mは、3~6族の遷移金属またはランタニドであり;
EおよびE’は、それぞれ独立して、O、SまたはNR9であり、ここに、R9は、独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビルまたはヘテロ原子含有基であり;
Qは、金属Mと配位結合を形成する、14、15、または16族の原子であり、
A1QA1’は、3原子架橋により、A2とA2’を連結する、4~40個の非水素原子を含むヘテロサイクリックルイス塩基の一部であり、ここに、Qは、3原子架橋の中心原子であり、A1およびA1’は、独立して、C、N、またはC(R22)であり、R22は、水素、C1~C20ヒドロカルビル、C1~C20置換ヒドロカルビルから選択され;
は、2原子架橋によりA1とE結合アリール基を連結する、2~40個の非水素原子を含む二価の基であり;
は、2原子架橋によりA1’とE’結合アリール基を連結する、2~40個の非水素原子を含む二価の基であり;
Lは、ルイス塩基であり;
Xは、アニオン配位子であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’のうちの1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよい。]
により表される触媒化合物を含む触媒系と接触させることを含む、重合方法。
本発明および特許請求の範囲の目的に関し、以下の定義を使用するものとする。
[式中、R18は、水素、C1~C40ヒドロカルビル(C1~C40アルキルなど)またはC1~C40置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であり、E17は、酸素、硫黄、またはNR17であり、R17、R19、R20、およびR21は、それぞれお独立して、水素、C1~C40ヒドロカルビル(C1~C40アルキルなど)またはC1~C40置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基から選択され、またはR18、R19、R20、およびR21の2つ以上は、結合して、C4~C62環式もしくは多環式環構造、またはそれらの組み合わせを形成し、波線は、置換フェノラート基が触媒化合物の残りの部分と結合する場所を示す。]
で表される。
[式中、RA、RBおよびRCは、互いに結合していてもよいヒドロカルビル基または置換ヒドロカルビル基であり、波線は、第三級ヒドロカルビル基が他の基との結合を形成する場所を示す。]
により示され得る。
[式中、RAは、ヒドロカルビル基または置換ヒドロカルビル基であり、RDは、それぞれ独立して、水素またはヒドロカルビル基または置換ヒドロカルビル基であり、wは1~約30の整数であり、RAおよび1つまたは複数のRD 、およびまたは2つ以上のRDは、任意に互いに結合して追加の環を形成してもよい。]
により示され得る。
本発明は、溶液プロセス、およびビス(フェノラート)配位子、好ましくは中央の中性ドナー基および2つのフェノラートドナーを特徴とするジアニオン性三座配位子の遷移金属錯体を含む新規触媒ファミリーを使用して調製された環状モノマーを含むポリマー組成物に関する。ここに、三座配位子は金属中心に配位し、2つの8員環を形成する。このタイプの錯体では、中心の中性ドナーがヘテロサイクリック基であることが有利である。ヘテロサイクリック基がヘテロ原子に対してアルファ位に水素を欠いていることが特に有利である。このタイプの錯体では、フェノラートが1つまたは複数の環状第三級アルキル置換基で置換されていることも有利である。環状第三級アルキル置換フェノラートの使用は、高分子量ポリマーを生成するこれらの触媒の能力を向上させることが実証される。
用語「触媒」、「化合物」、「触媒化合物」、および「錯体」は、適切な活性化剤と組み合わせた場合に、オレフィン重合触媒を形成する遷移金属またはランタニド金属錯体を表すために交換可能に使用することができる。
[式中:
Mは、3、4、5、または6族の遷移金属またはランタニド(例えば、Hf、Zr、またはTi)であり;
EおよびE’は、それぞれ独立して、O、SまたはNR9であり、ここに、R9は、独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビルまたはヘテロ原子含有基、好ましくはOであり、好ましくは両方のEおよびE’はOであり;
Qは、金属Mと配位結合を形成する、14、15、または16族の原子であり、好ましくは、QはC、O、SまたはNであり、より好ましくは、QはC、NまたはOであり、最も好ましくは、QはNであり;
A1QA1’は、3原子架橋により、A2とA2’を連結する、4~40個の非水素原子を含むヘテロサイクリックルイス塩基の一部であり、ここに、Qは、3原子架橋の中心原子であり、(A1QA1’は、A1とA1’を結ぶ曲線で結合して、ヘテロサイクリックルイス塩基を表す)、A1およびA1’は、独立して、C、N、またはC(R22)であり、R22は、水素、C1~C20ヒドロカルビル、C1~C20置換ヒドロカルビルから選択され、好ましくは、A1およびA1’はCであり;
は、2原子架橋によりA1とE結合アリール基を連結する、2~40個の非水素原子を含む二価の基、例えば、オルトフェニレン、置換オルトフェニレン、オルトアレーン、インドレン、置換インドレン、ベンゾチオフェン、置換ベンゾチオフェン、ピロレン、置換ピロレン、チオフェン、置換チオフェン、1,2-エチレン(-CH2CH2-)、置換1,2-エチレン、1,2-ビニレン(-HC=CH-)、または置換1,2-ビニレンであり、好ましくは
は、二価のヒドロカルビル基であり;
は、2原子架橋によりA1’とE’結合アリール基を連結する、2~40個の非水素原子を含む二価の基、例えば、オルトフェニレン、置換オルトフェニレン、オルトアレーン、インドレン、置換インドレン、ベンゾチオフェン、置換ベンゾチオフェン、ピロレン、置換ピロレン、チオフェン、置換チオフェン、1,2-エチレン(-CH2CH2-)、置換1,2-エチレン、1,2-ビニレン(-HC=CH-)、または置換1,2-ビニレンであり、好ましくは
は、二価のヒドロカルビル基であり;
Lは、それぞれ独立して、ルイス塩基であり;
Xは、それぞれ独立して、アニオン配位子であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり(好ましくは、R1’およびR1は、独立して環状第三級アルキル基などの環状基である);
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’のうちの1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよい。]
[式中:
Mは、3、4、5、または6族の遷移金属またはランタニド(例えば、Hf、Zr、またはTi)であり;
EおよびE’は、それぞれ独立して、O、SまたはNR9であり、ここに、R9は、独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビルまたはヘテロ原子含有基であり、好ましくはOであり、好ましくは両方のEおよびE’はOであり;
Lは、それぞれ独立して、ルイス塩基であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよく;
R5、R6、R7、R8、R5’、R6’、R7’、R8’、R10、R11、およびR12は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であり;
R5とR6、R6とR7、R7とR8、R5’とR6’、R6’とR7’、R7’とR8’、R10とR11、またはR11とR12の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよい。]
は、それぞれ、好ましくはオルトフェニレン基、好ましくは置換オルトフェニレン基の一部である。式(II)のR7およびR7’位が水素、またはメチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、トリデシル、テトラデシル、ペンタデシル、ヘキサデシル、ヘプタデシル、オクタデシル、ノナデシル、エイコシル、またはイソプロピルなどのその異性体などのC1~C20アルキルであることが好ましい。高い立体規則性を持つポリマーをターゲットとする用途では、式(II)のR7およびR7’位がC1~C20アルキルであることが好ましい。R7およびR7’の両方がC1~C3アルキルであることが最も好ましい。
は、2~20個の非水素原子を含む二価基であり、2原子架橋によりA1をE結合アリール基に結合する。
は、直鎖アルキル基であるか、または環状基(例えば、置換されていてもよいオルト-フェニレン基、またはオルト-アリーレン基)またはその置換変異体の一部を形成する。
は、直鎖アルキルであるか、環状基(例えば、置換されていてもよいオルト-フェニレン基、またはオルト-アリーレン基)、またはその置換変異体の一部を形成する。
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1-C20ヒドロカルビル、C1-C20置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であり、あるいは、R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’の1つまたは複数は、結合して、それぞれ、5、6、7、または8個の環原子を有し、環上の置換基が結合して追加の環を形成してもよい、1つまたは複数の置換ヒドロカルビル環、非置換ヒドロカルビル環、または置換ヘテロサイクリック環、非置換ヘテロサイクリック環を形成してもよく;R9は、水素、C1-C20ヒドロカルビル、C1-C20置換ヒドロカルビル、またはヘテロ原子含有基であり、例えば、水素、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、またはそれらの異性体であり;
Xは、それぞれ独立して、1~20個の炭素原子を有するヒドロカルビル基(例えば、アルキルまたはアリール)、水素化物、アミド、アルコキシド、スルフィド、リン化物、ハロゲン化物、ジエン、アミン、ホスフィン、エーテル、およびそれらの組み合わせであり(2つ以上のXが縮合環または環系の一部を形成してもよい);nは2であり;mは0であり;R5、R6、R7、R8、R5’、R6’、R7’、R8’ 、R10、R11およびR12は、それぞれ独立して、水素、C1~C20ヒドロカルビル、C1~C20置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であるか、または1つまたは複数の隣接するR基が結合して、それぞれが5、6、7、または8個の環原子を有し、環上の置換が結合して追加の環を形成してもよい、1つまたは複数の置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、例えば、R5、R6、R7、R8、R5’、R6’、R7’、R8’、R10、R11およびR12は、それぞれ独立して、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、トリデシル、テトラデシル、ペンタデシル、ヘキサデシル、ヘプタデシル、オクタデシル、ノナデシル、エイコシル、ヘネイコシル、ドコシルから独立して選択される、トリコシル、テトラコシル、ペンタコシル、ヘキサコシル、ヘプタコシル、オクタコシル、ノナコシル、トリアコンチル、フェニル、置換フェニル(例えば、メチルフェニル、ジメチルフェニル)、ベンジル、置換ベンジル(例えば、メチルベンジル)、ナフチル、シクロヘキシル、シクロヘキセニル、メチルシクロヘキシル、およびそれらの異性体から選択される。
配位子合成
ビス(フェノール)配位子は、スキーム1に示す一般的な方法を用いて調製することができる。化合物Aと化合物Bとのカップリングによるビス(フェノール)配位子の形成(方法1)は、既知のPd-およびNi-触媒カップリング、例えば根岸カップリング、鈴木カップリング、熊田カップリングなどの触媒カップリングによって達成することができる。化合物Cと化合物Dとのカップリングによるビス(フェノール)配位子の形成(方法2)は、既知のPd-およびNi-触媒カップリング、例えば根岸カップリング、鈴木カップリング、熊田カップリングによるカップリングによって達成することができる。化合物Dは、化合物Eから、化合物Eと有機リチウム試薬またはマグネシウム金属との反応、続いて、ハロゲン化主族金属(例えば、ZnCl2)またはホウ素ベースの試薬(例えば、B(OiPr)3、iPrOB(pin))との任意の反応により調製することができる。化合物Eは、アリールリチウムまたはアリールグリニャール試薬(化合物F)と1-ブロモ-2-クロロベンゼンなどのジハロゲン化アレーン(化合物G)との反応による非触媒反応で調製することができる。化合物Eはまた、アリール亜鉛またはアリールホウ素試薬(化合物F)とジハロゲン化アレーン(化合物G)との反応によるPdまたはNi触媒反応で調製することもできる。
スキーム1
[式中、M’は1、2、12、または13族の元素、またはLi、MgCl、MgBr、ZnCl、B(OH)2、B(ピナコラート)などの置換元素であり、Pはメトキシメチル(MOM)、テトラヒドロピラニル(THP)、t-ブチル、アリル、エトキシメチル、トリアルキルシリル、t-ブチルジメチルシリル、またはベンジルなどの保護基であり、Rは、C1~C40アルキル、置換アルキル、アリール、第三級アルキル、環状第三級アルキル、アダマンタニル、または置換アダマンタニルであり、X’およびXは、それぞれ、Cl、Br、F、またはIなどのハロゲンである。]
カルベンビス(フェノール)配位子を合成する一般的な合成方法をスキーム2に示す。置換フェノールは、オルト-ブロモ化されており、次いで、公知のフェノール保護基、例えば、メトキシメチルエーテル(MOM)、テトラヒドロピラニルエーテル(THP)、t-ブチルジメチルシリル(TBDMS)、ベンジル(Bn)などにより保護される。その後、臭化物は、ブロモアニリンとの鈴木カップリングで使用できるボロン酸エステル(化合物I)またはボロン酸に変換される。ビフェニルアニリン(化合物J)は、ジブロモエタンとの反応またはオキサルアルデヒドとの縮合によって架橋され、脱保護される(化合物K)。オルトギ酸トリエチルとの反応により、イミニウム塩が形成され、脱保護してカルベンとなる。
スキーム2
遷移金属またはランタニド金属ビス(フェノラート)錯体は、本発明におけるオレフィン重合のための触媒成分として使用される。用語「触媒」および「触媒錯体」は、交換可能に使用される。遷移金属またはランタニド金属ビス(フェノラート)錯体の調製は、ビス(フェノール)配位子と、アニオン塩基性脱離基を含む金属反応物との反応によって達成され得る。典型的なアニオン塩基性脱離基は、ジアルキルアミド、ベンジル、フェニル、ヒドリド、およびメチルを含む。この反応では、塩基性脱離基の役割は、ビス(フェノール)配位子を脱プロトン化することである。このタイプの反応に適した金属反応物には、限定するものではないが、HfBn4(Bn=CH2Ph)、ZrBn4、TiBn4、ZrBn2Cl2(OEt2)、HfBn2Cl2(OEt2)2、Zr(NMe2)2Cl2(ジメトキシエタン)、Zr(NEt2)2Cl2(ジメトキシエタン)、Hf(NEt2)2Cl2(ジメトキシエタン)、Hf(NMe2)2Cl2(ジメトキシエタン)、Hf(NMe2)4、Zr(NMe2)4、およびHf(NEt2)4が含まれる。適切な金属試薬には、ZrMe4、HfMe4、およびその場で形成され、単離せずに使用され得る他の4族アルキルも含まれる。遷移金属ビス(フェノラート)錯体の調製は、典型的には、エーテルまたは炭化水素溶媒または溶媒混合物中で、典型的には-80℃~120℃の範囲の温度で行われる。
用語「共触媒」および「活性化剤」は、本明細書では交換可能に使用される。
アルモキサン活性化剤は、本明細書に記載の触媒系における活性化剤として利用される。アルモキサンは、一般に、-Al(R99)-O-サブユニット(式中、R99はアルキル基)を含むオリゴマー化合物である。アルモキサンの例としては、メチルアルモキサン(MAO)、修飾メチルアルモキサン(MMAO)、エチルアルモキサンおよびイソブチルアルモキサンが挙げられる。アルキルアルモキサンおよび修飾アルキルアルモキサンは、特に引き抜き可能な配位子がアルキル、ハロゲン化物、アルコキシドまたはアミドである場合に、触媒活性化剤として適している。異なるアルモキサンおよび修飾アルモキサンの混合物も使用することができる。視覚的に透明なメチルアルモキサンを使用することが好ましい。濁ったまたはゲル化したアルモキサンをろ過して、透明な溶液を生成するか、透明なアルモキサンを濁った溶液からデカントしてもよい。有用なアルモキサンは、修飾メチルアルモキサン(MMAO)触媒タイプ3A(米国特許第5,041,584号でカバーされ、「Modified Methylalumoxane type 3A」の商品名でAkzo Chemicals,Inc.から市販されている)である。別の有用なアルモキサンは、固体ポリメチルアルミノキサンであり、これは、米国特許第9,340,630号、米国特許第8,404,880号;および米国特許第8,975,209号に記載されている。
用語「非配位アニオン」(NCA)は、カチオンに配位しないか、またはカチオンに弱く配位するだけであり、それによって中性ルイス塩基によって置換されるのに十分に不安定なままであるアニオンを意味する。さらに、アニオンは、中性遷移金属化合物およびアニオンからの中性副生成物を形成させるように、アニオン性置換基またはフラグメントを、カチオンに移動させない。本発明の有用な非配位アニオンは、適合性があり、イオン電荷を+1でバランスさせるという意味で遷移金属カチオンを安定化し、さらに重合中に置換を可能にする十分な不安定性を保持するものである。用語NCAは、酸性カチオン基と非配位アニオンを含むN,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレートなどの多成分NCA含有活性化剤も含むと定義される。用語NCAはまた、トリス(ペンタフルオロフェニル)ホウ素などの中性ルイス酸を含むと定義され、触媒と反応してアニオン基の引き抜きによって活性化種を形成することができる。適合性の弱配位錯体を形成できる任意の金属または半金属を、非配位アニオンに使用または含有させることができる。適切な金属には、限定するものではないが、アルミニウム、金、およびプラチナが含まれる。適切な半金属には、限定するものではないが、ホウ素、アルミニウム、リン、およびシリコンが含まれる。
[式中、Zは(L-H)または還元可能なルイス酸であり、Lは中性のルイス塩基であり;Hは水素であり;(L-H)+はブレンステッド酸であり;Ad-は、電荷d-を持つ非配位アニオンであり;dは1~3までの整数(例えば、1、2または3)であり、好ましくは、Zは(Ar3C+)であり、ここでArはアリールまたはヘテロ原子で置換されたアリール、C1~C40ヒドロカルビル、または置換C1~C40ヒドロカルビルである]。アニオン成分Ad-には、式[Mk+Qn]d-を有するものが含まれる。式中、nは1、2、3、4、5、または6(好ましくは1、2、3、または4)であり;n-k=d;Mは、元素の周期表の第13族から選択される元素、好ましくはホウ素またはアルミニウムであり、Qは、独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、およびハロ置換ヒドロカルビル基であり、Qは40個までの炭素原子を有する(任意に、ただし、1回以下の出現でQがハロゲン化物である)。好ましくは、各Qは、1~40個(例えば1~20個)の炭素原子を有するフッ素化ヒドロカルビル基であり、より好ましくは、各Qはパーフルオロアリール基などのフッ素化アリール基であり、最も好ましくは、各Qはペンタフルオロアリール基またはパーフルオロナフタレン-2-イル基である。適切なAd-の例には、米国特許第5,447,895号に開示されているジボロン化合物が含まれ、これは参照により本明細書に完全に組み込まれる。
[式中:
Eは、窒素またはリンであり;
dは、1、2、または3であり;kは、1、2、または3であり;nは、1、2、3、4、5、または6であり;n-k=dであり(好ましくは、dは、1、2、または3であり;kは3であり;nは、4、5、または6である。);
R1’、R2’、およびR3’は、独立して、1つまたは複数の、アルコキシ基、シリル基、ハロゲン原子、またはハロゲン含有基により置換されていてもよい、C1~C50ヒドロカルビル基であり;
ここに、R1’、R2’、およびR3’は、合わせて15個以上の炭素原子を含み;
Mtは、元素の周期表の第13族から選択された元素(例えば、BまたはAl)であり;
Qは、それぞれ独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、またはハロ置換ヒドロカルビル基である。]
[式中、Eは窒素またはリンであり;R1’はメチル基であり;R2’およびR3’は、独立して、1つまたは複数のアルコキシ基、シリル基、ハロゲン原子、またはハロゲン含有基により置換されていてもよいC4~C50ヒドロカルビル基であり、ここで、R2’およびR3’は、一緒になって、14個以上の炭素原子を含み;Bはホウ素であり;R4’、R5’、R6’およびR7’は、独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、またはハロ置換ヒドロカルビルラジカルである。]
および
[式中:
Nは窒素であり、
R2’およびR3’は、独立して、1つまたは複数のアルコキシ基、シリル基、ハロゲン原子、またはハロゲン含有基で置換されていてもよいC6~C40ヒドロカルビル基であり、R2’およびR3’(存在する場合)は、一緒になって14個以上の炭素原子を含み;
R8’、R9’およびはR10’は、独立して、C4~C30ヒドロカルビル基または置換C4~C30ヒドロカルビル基であり;
Bはホウ素であり;
R4’、R5’、R6’およびR7’は、独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、またはハロ置換ヒドロカルビル基である。]
本明細書に記載の活性化剤のアニオン成分は、式[Mtk+Qn]d-により表されるものを含む。式中、kは1、2、または3であり;nは1、2、3、4、5、または6であり(好ましくは1、2、3、または4)、(好ましくはkはであり;nは4、5、または6であり、好ましくはMがBである場合、nは4である);Mtは、元素の周期表の第13族から選択される元素であり、好ましくはホウ素またはアルミニウムであり、Qは、独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、およびハロ置換ヒドロカルビルラジカルであり、該Qは、20個までの炭素原子を有し、ただし、1回以下の出現でQはハロゲン化物である。好ましくは、Qは、それぞれ、1~20個の炭素原子を有していてもよいフッ素化ヒドロカルビル基であり、より好ましくは、Qは、それぞれ、フッ素化アリール基であり、最も好ましくは、Qは、それぞれパーフルオロアリール基である。好ましくは、少なくとも1つのQは、パーフルオロフェニルなどの置換フェニルではなく、好ましくはQのすべては、パーフルオロフェニルなどの置換フェニルではない。
[式中:
M*は、第13族原子、好ましくはBまたはAl、好ましくはBであり;
R11は、それぞれ独立して、ハロゲン化物、好ましくはフッ化物であり;
R12は、それぞれ独立して、ハロゲン化物、C6~C20置換芳香族ヒドロカルビル基、または式-O-Si-Raであらわされるシロキシ基であり、ここに、RaはC1~C20ヒドロカルビルまたはヒドロカルビルシリル基であり、好ましくはR12はフッ化物またはパーフルオロフェニル基であり;
R13は、それぞれ、ハロゲン化物、C6~C20置換芳香族ヒドロカルビル基、または式-O-Si-Raで表されるシロキシ基であり、ここに、RaはC1~C20ヒドロカルビルまたはヒドロカルビルシリル基であり、好ましくはR13は、フッ化物またはC6パーフルオロ芳香族ヒドロカルビル基であり;
ここで、R12およびR13は、1つまたは複数の飽和または不飽和の置換または非置換環を形成していてもよく、好ましくはR12およびR13はパーフルオロ化フェニル環を形成する。好ましくは、アニオンは、700g/モルより大きい分子量を有し、好ましくは、M*原子上の少なくとも3つの置換基は、それぞれ、180立方Åより大きい分子体積を有する。]
N,N-ジ(水素化牛脂)メチルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ノナデシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ヘキサデシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-テトラデシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ドデシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-デシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-オクチル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ヘキシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ブチル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-オクタデシル-N-デシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ノナデシル-N-ドデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ノナデシル-N-テトラデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-4-ノナデシル-N-ヘキサデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-エチル-4-ノナデシル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジオクタデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジヘキサデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジテトラデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジドデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N,N-ジオクチルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-エチル-N,N-ジオクタデシルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N,N-ジ(オクタデシル)トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N,N-ジ(ヘキサデシル)トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N,N-ジ(テトラデシル)トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N,N-ジ(ドデシル)トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-オクタデシル-N-ヘキサデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-オクタデシル-N-ヘキサデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-オクタデシル-N-テトラデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-オクタデシル-N-ドデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-オクタデシル-N-デシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-ヘキサデシル-N-テトラデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-ヘキサデシル-N-ドデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-ヘキサデシル-N-デシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-テトラデシル-N-ドデシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-テトラデシル-N-デシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-ドデシル-N-デシル-トリルアンモニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N-オクタデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N-ヘキサデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N-テトラデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N-ドデシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、
N-メチル-N-デシルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]、および
N-メチル-N-オクチルアニリニウム[テトラキス(パーフルオロフェニル)ボレート]
活性化剤化合物に加えて、スカベンジャーまたはコアクチベーターを使用することができる。スカベンジャーは、典型的には、不純物を除去して重合を促進するために添加される化合物である。いくつかのスカベンジャーは活性化剤としても機能し得、コアクチベーターとも称される。活性触媒を形成するために、スカベンジャーではないコアクチベーターを活性化剤と組み合わせて使用することもできる。いくつかの実施形態において、コアクチベーターを遷移金属化合物と予備混合して、アルキル化遷移金属化合物を形成することができる。
溶液重合プロセスを使用して、当業者に知られている任意の適切な方法で、本明細書に開示される重合反応を実施することができる。特定の実施形態において、重合プロセスは、連続重合プロセスで実施することができる。用語「バッチ」は、重合反応の終結時に完全な反応混合物が重合反応容器から取り出されるプロセスを意味する。対照的に、連続重合プロセスでは、1つまたは複数の反応物が反応容器に連続的に導入され、ポリマー生成物を含む溶液が同時にまたはほぼ同時に取り出される。溶液重合は、生成されたポリマーが、不活性溶媒もしくはモノマーまたはそれらのブレンドなどの液体重合媒体に可溶である重合プロセスを意味する。溶液重合は典型的に均一である。均一重合は、ポリマー生成物が重合媒体に溶解されるものである。かかる系は、J. Vladimir Oliveira, et al., Ind. Eng. Chem. Res., v.29, 2000, pg. 4627に記載されている。
本発明はまた、本明細書に記載の方法によって生成されるものの組成物にも関する。本明細書に記載の方法は、環状オレフィンのポリマーおよびコポリマーを製造するために使用することができる。調製できるポリマーは、環状モノマーのホモポリマー、および環状オレフィンとC2~C20オレフィンとのコポリマーを含む。本明細書で調製できるポリマーは、環状オレフィンおよびエチレンと、任意のC4~C20オレフィンとのコポリマー;環状オレフィンとプロピレンと、任意のC4~C20オレフィンとの共重合体;環状オレフィン、エチレン、およびプロピレンと、任意のC4~C20オレフィンとの共重合体を含む。
a.5,000g/モル超、あるいは10,000g/モル超、あるいは100,000g/モル超、あるいは150,000g/モル超のMn;
b.10,000g/モル超、あるいは20,000g/モル超、あるいは200,000g/モル超、あるいは300,000g/モル超のMw;
c.約1~10、あるいは約1.5~5.0、あるいは約1.8~3.0、あるいは約2.0~4.0のMw/Mn;
d.0.1モル%以上、上限50モル%以下、あるいは45モル%以下のシクロペンテン含有量;
e.ポリマーに組み込まれた全シクロペンテン単位の約90%以上でシクロペンテン1,2結合
を有する。
a.50,000g/モル超、あるいは100,000g/モル超、あるいは150,000g/モル超、あるいは200,000g/モル超のMn;
b.100,000g/モル超、あるいは200,000g/モル超、あるいは300,000g/モル超、あるいは400,000g/モル超のMw;
c.約1.2~5.0、あるいは約1.5~4.0、あるいは約2.0~3.0のMw/Mn;
d.20モル%以上、上限が80モル%以下のノルボルネン含有量;
e.10~80%の独立、10~80%の交互、1~50%のブロックであるノルボルネン単位、独立、交互、およびブロックの合計は100%;
を有する。
a.3,000g/モル超、あるいは5,000g/モル超、あるいは10,000g/モル超のMn;
b.6,000g/モル超、あるいは10,000g/モル超、あるいは20,000g/モル超のMw;
c.約1~10、あるいは約1.5~5.0、あるいは約1.8~3.0、あるいは約2.0~4.0のMw/Mn;
d.0.1モル%以上、上限50モル%以下、あるいは45モル%以下のシクロペンテン含有量;
e.ポリマーに組み込まれた全シクロペンテン単位の約90%以上がシクロペンテン1,2結合;
を有する。
a.3,000g/モル超、あるいは5,000g/モル超、あるいは10,000g/モル超のMn;
b.6,000g/モル超、あるいは10,000g/モル超、あるいは20,000g/モル超のMw;
c.約1.2~5.0、あるいは約1.5~4.0、あるいは約2.0~3.0のMw/Mn;
d.1モル%以上、上限50モル%以下のノルボルネン含有量
を有する。
別の実施形態において、本明細書で生成されるポリマー組成物は、フィルム、成形部品、または他の物品に形成される前に、1つまたは複数の追加のポリマーと組み合わされる。他の有用なポリマーは、ポリエチレン、ポリプロピレン、プロピレンとエチレンのランダムコポリマー、および/またはブテン、および/またはヘキセン、ポリブテン、エチレン酢酸ビニル、LDPE、LLDPE、HDPE、エチレン酢酸ビニル、エチレンメチルアクリレート、アクリル酸のコポリマー、ポリメチルメタクリレートまたは高圧フリーラジカルプロセスによって重合可能なその他のポリマー、ポリ塩化ビニル、ポリブテン-1、アイソタクチックポリブテン、ABS樹脂、エチレンプロピレンゴム(EPR)、加硫EPR、EPDM、ブロックコポリマー、スチレン系ブロックコポリマー、ポリアミド、ポリカーボネート、PET樹脂、架橋ポリエチレン、エチレンとビニルアルコールのコポリマー(EVOH)、ポリスチレンなどの芳香族モノマーのポリマー、ポリ-1エステル、ポリアセタール、ポリフッ化ビニリデン、ポリエチレングリコール、および/またはポリイソブチレンを含む。
具体的には、前述のポリマーまたはそのブレンドなどの前述のポリマーのいずれも、種々のエンドユーズ用途に使用することができる。そのような用途には、例えば、単層または多層のインフレーション、押出、および/または収縮フィルムが含まれる。これらのフィルムは、インフレーションバブルフィルム加工技術などの任意の数の周知の押出または共押出技術によって形成することができ、この場合、組成物を環状ダイを通して溶融状態で押出し、次いで膨張させて一軸または二軸配向溶融物は、冷却される前に管状のインフレーションフィルムを形成する。次に、軸方向にスリットを入れて展開し、平らなフィルムを形成する。フィルムは、続いて、未延伸、一軸延伸、または同程度または異なる程度の二軸延伸することができる。フィルムの1つまたは複数の層は、横方向および/または縦方向に、同じかまたは異なる程度に配向することができる。一軸配向は、典型的な冷間延伸法または熱間延伸法を使用して得ることができる。二軸配向は、テンターフレーム装置またはダブルバブルプロセスを使用して行うことができ、個々の層を一緒にする前または後に行うことができる。例えば、ポリエチレン層を配向ポリプロピレン層上に押出コーティングまたは積層することができ、またはポリエチレンとポリプロピレンを一緒にフィルムに共押出し、次いで配向することができる。同様に、延伸ポリプロピレンを延伸ポリエチレンに積層するか、または延伸ポリエチレンをポリプロピレン上にコーティングし、任意に組み合わせをさらに延伸することができる。典型的には、フィルムは機械方向(MD)に最大15、好ましくは5~7の比率で配向され、横方向(TD)に最大15、好ましくは7~9の比率で配向される。別の実施形態において、フィルムはMD方向とTD方向の両方に同程度に配向される。
本発明はまた、本明細書に記載のエチレン-環状モノマーコポリマーと潤滑油とのブレンドを含む潤滑剤組成物を提供する。潤滑油中のエチレン環状単量体共重合体の濃度は5重量%以下である。分岐エチレンコポリマーの潤滑油中の剪断安定指数(30サイクル)は、約10%~約60%であり、100℃での動粘度は約5cSt~約20cStである。せん断安定性指数(SSI)は、Kurt Orbahnディーゼル噴射装置を使用して30サイクルでASTMD6278に従って決定される。動粘度(KV)は、ASTMD445に従って測定される。
1. 環状オレフィンモノマーおよびC2~C20アルファオレフィンから選択される任意のコモノマーを、活性化剤および式(I):
[式中:
Mは、3、4、5、または6族の遷移金属またはランタニドであり;
EおよびE’は、それぞれ独立して、O、SまたはNR9であり、ここに、R9は、独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビルまたはヘテロ原子含有基であり;
Qは、金属Mと配位結合を形成する、14、15、または16族の原子であり、
A1QA1’は、3原子架橋により、A2とA2’を連結する、4~40個の非水素原子を含むヘテロサイクリックルイス塩基の一部であり、ここに、Qは、3原子架橋の中心原子であり、A1およびA1’は、独立して、C、N、またはC(R22)であり、R22は、水素、C1~C20ヒドロカルビル、C1~C20置換ヒドロカルビルから選択され;
は、2原子架橋によりA1とE結合アリール基を連結する、2~40個の非水素原子を含む二価の基であり;
は、2原子架橋によりA1’とE’結合アリール基を連結する、2~40個の非水素原子を含む二価の基であり;
Lは、ルイス塩基であり;
Xは、アニオン配位子であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’のうちの1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよい。]
により表される触媒化合物を含む触媒系と接触させることを含む、重合方法。
2. 前記触媒化合物は、式(II):
[式中:
Mは、3、4、5、または6族の遷移金属またはランタニドであり;
EおよびE’は、それぞれ独立して、O、SまたはNR9であり、ここに、R9は、独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビルまたはヘテロ原子含有基であり;
Lは、それぞれ独立して、ルイス塩基であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよく;
R5、R6、R7、R8、R5’、R6’、R7’、R8’、R10、R11、およびR12は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であり;
R5とR6、R6とR7、R7とR8、R5’とR6’、R6’とR7’、R7’とR8’、R10とR11、またはR11とR12の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよい。]
により表される、項1に記載の方法。
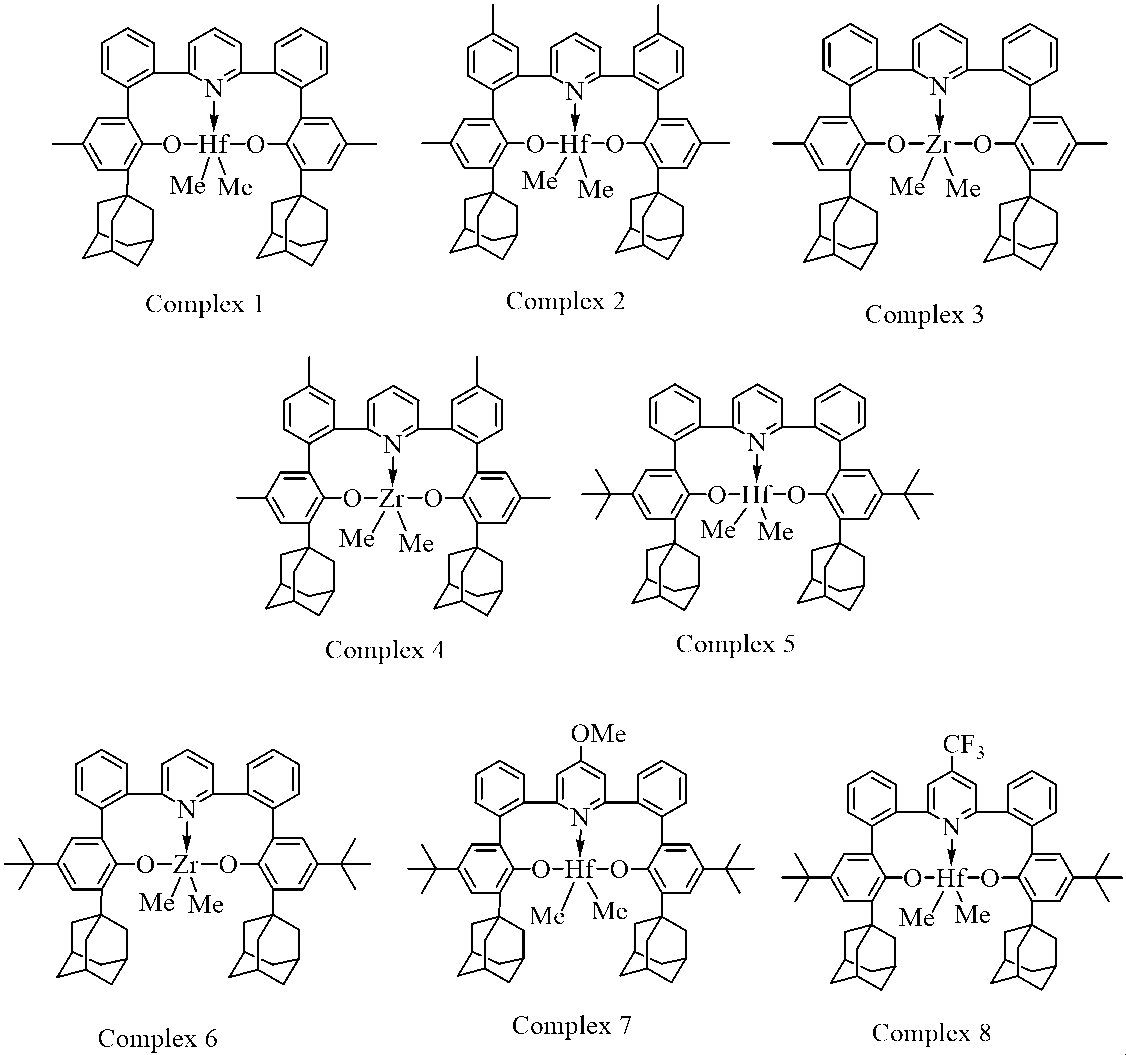
3. Mは、Hf、ZrまたはTiである、項1または2に記載の方法。
4.
EおよびE’は、それぞれOである、項1、2または3に記載の方法。
5. R1およびR1’は、それぞれ独立して、C4~C40第三級ヒドロカルビル基である、項1、2、3、または4に記載の方法。
6. R1およびR1’は、それぞれ独立して、C4~C40環式第三級ヒドロカルビル基である、項1、2、3、または4に記載の方法。
7. R1およびR1’は、それぞれ独立して、C4~C40多環式第三級ヒドロカルビル基である、項1、2、3、または4に記載の方法。
8. Xは、それぞれ独立して、1~20個の炭素原子を有する置換または非置換のヒドロカルビルラジカル、水素化物、アミド、アルコキシド、スルフィド、リン化物、ハロゲン化物、およびそれらの組み合わせ(2つのXは、縮合環または環系の一部を形成してもよい)である、項1~7のいずれか1項に記載の方法。
9. Lは、それぞれ独立して、エーテル、チオエーテル、アミン、ホスフィン、エチルエーテル、テトラヒドロフラン、ジメチルスルフィド、トリエチルアミン、ピリジン、アルケン、アルキン、アレン、およびカルベン、ならびにそれらの組み合わせ(所望により、2つ以上のLは、縮合環または環系の一部を形成してもよい)である、項1~8のいずれか1項に記載の方法。
10. MはZrまたはHfであり、Qは窒素であり、A1およびA1’の両方は炭素であり、EおよびE’の両方は酸素であり、R1およびR1’の両方はC4~C20環状第三級アルキルである、項1に記載の方法。
11. MはZrまたはHfであり、Qは窒素であり、A1およびA1’の両方は炭素であり、EおよびE’の両方は酸素であり、R1およびR1’の両方はアダマンタン-1-イルまたは置換アダマンタン-1-イルである、項1に記載の方法。
12. MはZrまたはHfであり、Qは窒素であり、A1およびA1’の両方は炭素であり、EおよびE’の両方は酸素であり、Xはメチルまたはクロロであり、nは2である、項1に記載の方法。
13. Qは窒素であり、A1およびA1’の両方は炭素であり、R1およびR1’の両方は水素であり、EおよびE’の両方はNR9であり、R9はC1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、またはヘテロ原子含有基から選択される、項1に記載の方法。
14. Qは炭素であり、A1およびA1’の両方は窒素であり、EおよびE’の両方は酸素である、項1に記載の方法。
15. Qは炭素であり、A1は窒素であり、A1’はC(R22)であり、EおよびE’の両方は酸素であり、R22は水素、C1~C20ヒドロカルビル、またはC1~C20置換ヒドロカルビルから選択される、項1に記載の方法。
16. ヘテロサイクリックルイス塩基は、下記式:
[式中、R23は、それぞれ独立して、水素、C1~C20アルキル、およびC1~C20置換アルキルから選択される。]
により表される基から選択される、項1に記載の方法。
17. MはZrまたはHfであり、EおよびE’の両方は酸素であり、R1およびR1’の両方はC4~C20環状第三級アルキルである、項2に記載の方法。
18. MはZrまたはHfであり、EおよびE’の両方は酸素であり、R1およびR1’の両方はアダマンタン-1-イルまたは置換アダマンタン-1-イルである、項2に記載の方法。
19. MはZrまたはHfであり、EおよびE’の両方は酸素であり、R1、R1’、R3およびR3’のそれぞれはアダマンタン-1-イルまたは置換アダマンタン-1-イルである、項2に記載の方法。
20. MはZrまたはHfであり、EおよびE’の両方は酸素であり、R1およびR1’の両方はC4~C20環状第三級アルキルであり、R7およびR7’の両方はC1~C20アルキルである、項2に記載の方法。
21. MはZrまたはHfであり、EおよびE’の両方はOであり、R1およびR1’の両方はC4~C20環状第三級アルキルであり、R7およびR7’の両方はC1~C20アルキルである、項2に記載の方法。
22. MはZrまたはHfであり、EおよびE’の両方はOであり、R1およびR1’の両方はC4~C20環状第三級アルキルであり、R7およびR7’の両方はC1~C3アルキルである、項2に記載の方法。
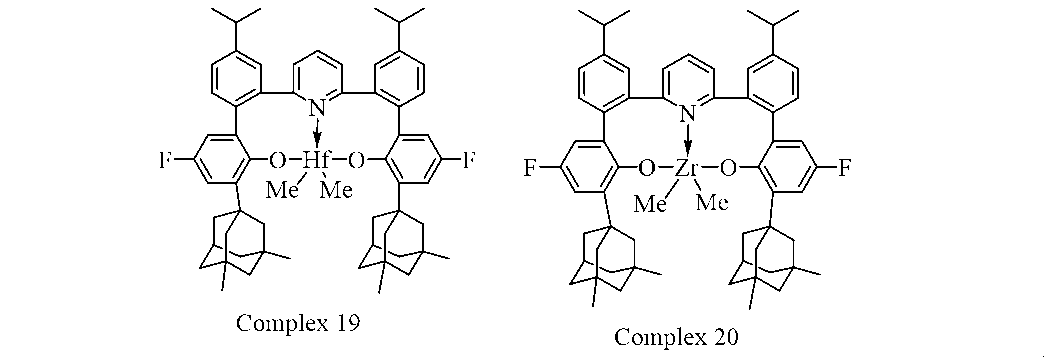
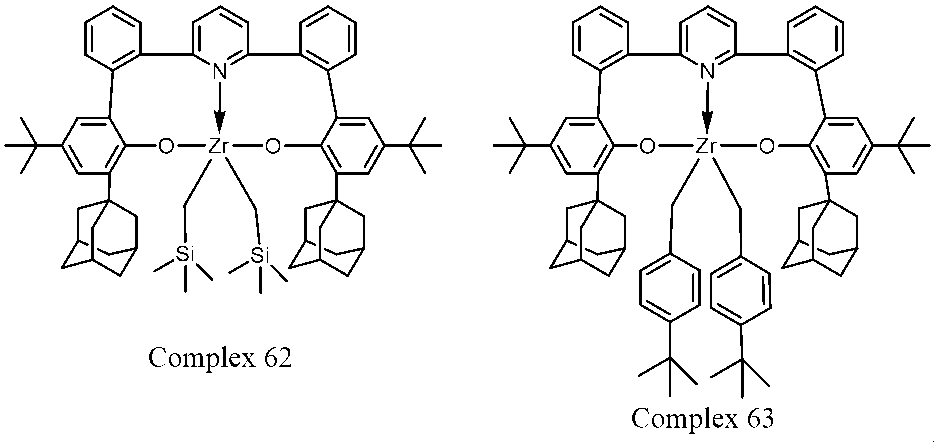
23. 触媒化合物は、下記式:
により表される基の1つまたは複数である、項1に記載の方法。
24. 触媒化合物は、下記式:
により表される基の1つまたは複数である、項1に記載の方法。
25. 活性化剤は、アルモキサンまたは非配位アニオンを含む、項1~24のいずれか1項に記載の方法。
26. 活性化剤は、非芳香族炭化水素溶媒に可溶である、項1~24のいずれか1項に記載の方法。
27. 触媒系は、芳香族溶媒を含まない、項1~24のいずれか1項に記載の方法。
28. 活性化剤は、式:
[式中、Zは(L-H)または還元可能なルイス酸であり、Lは中性ルイス塩基であり;Hは水素であり;(L-H)+はブレンステッド酸であり;Ad-は、電荷d-を有する非配位アニオンであり;dは1~3の整数である。]
により表される、項1~27のいずれか1項に記載の方法。
29. 活性化剤は、式:
[式中:
Eは、窒素またはリンであり;
dは、1、2、または3であり;kは、1、2、または3であり;nは、1、2、3、4、5、または6であり;n-k=dであり;
R1’、R2’、およびR3’は、独立して、1つまたは複数の、アルコキシ基、シリル基、ハロゲン原子、またはハロゲン含有基により置換されていてもよい、C1~C50ヒドロカルビル基であり;
ここに、R1’、R2’、およびR3’は、合わせて15個以上の炭素原子を含み;
Mtは、元素の周期表の第13族から選択された元素であり;
Qは、それぞれ独立して、水素化物、架橋または非架橋ジアルキルアミド、ハロゲン化物、アルコキシド、アリールオキシド、ヒドロカルビル、置換ヒドロカルビル、ハロカルビル、置換ハロカルビル、またはハロ置換ヒドロカルビル基である。]
により表される、項1~27のいずれか1項に記載の方法。
30. 活性化剤は、式:
[式中、Ad-は、電荷d-を有する非配位アニオンであり;dは1~3の整数であり、(Z)d +は、
の1つまたは複数により表される。]
により表される、項1~27のいずれか1項に記載の方法。
31. 活性化剤は:
N-メチル-4-ノナデシル-N-オクタデシルベンゼンアミニウムテトラキス(ペンタフルオロフェニル)ボレート、
N-メチル-4-ノナデシル-N-オクタデシルベンゼンアミニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
ジオクタデシルメチルアンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
ジオクタデシルメチルアンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリメチルアンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリエチルアンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリプロピルアンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリ(n-ブチル)アンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリ(t-ブチル)アンモニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
N,N-ジメチルアニリニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
N,N-ジエチルアニリニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラキス(パーフルオロナフタレン-2-イル)ボレート、
トロピリウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリフェニルカルベニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリフェニルホスホニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリエチルシリリウムテトラキス(パーフルオロナフタレン-2-イル)ボレート、
ベンゼン(ジアゾニウム)テトラキス(パーフルオロナフタレン-2-イル)ボレート、
トリメチルアンモニウムテトラキス(パーフルオロビフェニル)ボレート、
トリエチルアンモニウムテトラキス(パーフルオロビフェニル)ボレート、
トリプロピルアンモニウムテトラキス(パーフルオロビフェニル)ボレート、
トリ(n-ブチル)アンモニウムテトラキス(パーフルオロビフェニル)ボレート、
トリ(t-ブチル)アンモニウムテトラキス(パーフルオロビフェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(パーフルオロビフェニル)ボレート、
N,N-ジエチルアニリニウムテトラキス(パーフルオロビフェニル)ボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラキス(パーフルオロビフェニル)ボレート、
トロピリウムテトラキス(パーフルオロビフェニル)ボレート、
トリフェニルカルベニウムテトラキス(パーフルオロビフェニル)ボレート、
トリフェニルホスホニウムテトラキス(パーフルオロビフェニル)ボレート、
トリエチルシリリウムテトラキス(パーフルオロビフェニル)ボレート、
ベンゼン(ジアゾニウム)テトラキス(パーフルオロビフェニル)ボレート、
[4-t-ブチル-PhNMe2H][(C6F3(C6F5)2)4B]、
トリメチルアンモニウムテトラフェニルボレート、
トリエチルアンモニウムテトラフェニルボレート、
トリプロピルアンモニウムテトラフェニルボレート、
トリ(n-ブチル)アンモニウムテトラフェニルボレート、
トリ(t-ブチル)アンモニウムテトラフェニルボレート、
N,N-ジメチルアニリニウムテトラフェニルボレート、
N,N-ジエチルアニリニウムテトラフェニルボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラフェニルボレート、
トロピリウムテトラフェニルボレート、
トリフェニルカルベニウムテトラフェニルボレート、
トリフェニルホスホニウムテトラフェニルボレート、
トリエチルシリリウムテトラフェニルボレート、
ベンゼン(ジアゾニウム)テトラフェニルボレート、
トリメチルアンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリエチルアンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリプロピルアンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリ(n-ブチル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリ(sec-ブチル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート、
N,N-ジエチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラキス(ペンタフルオロフェニル)ボレート、
トロピリウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルホスホニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリエチルシリリウムテトラキス(ペンタフルオロフェニル)ボレート、
ベンゼン(ジアゾニウム)テトラキス(ペンタフルオロフェニル)ボレート、
トリメチルアンモニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリエチルアンモニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリプロピルアンモニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリ(n-ブチル)アンモニウムテトラキス-(2,3,4,6-テトラフルオロ-フェニル)ボレート、
ジメチル(t-ブチル)アンモニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
N,N-ジエチルアニリニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トロピリウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリフェニルホスホニウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリエチルシリリウムテトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
ベンゼン(ジアゾニウム)テトラキス-(2,3,4,6-テトラフルオロフェニル)ボレート、
トリメチルアンモニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリエチルアンモニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリプロピルアンモニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリ(n-ブチル)アンモニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリ(t-ブチル)アンモニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
N,N-ジメチルアニリニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
N,N-ジエチルアニリニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
N,N-ジメチル-(2,4,6-トリメチルアニリニウム)テトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トロピリウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリフェニルカルベニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリフェニルホスホニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
トリエチルシリリウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
ベンゼン(ジアゾニウム)テトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート、
ジ-(i-プロピル)アンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
ジシクロヘキシルアンモニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリ(o-トリル)ホスホニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリ(2,6-ジメチルフェニル)ホスホニウムテトラキス(ペンタフルオロフェニル)ボレート、
トリフェニルカルベニウムテトラキス(パーフルオロフェニル)ボレート、
1-(4-(トリス(ペンタフルオロフェニル)ボレート)-2,3,5,6-テトラフルオロフェニル)ピロリジニウム、
テトラキス(ペンタフルオロフェニル)ボレート、
4-(トリス(ペンタフルオロフェニル)ボレート)-2,3,5,6-テトラフルオロピリジン、および
トリフェニルカルベニウムテトラキス(3,5-ビス(トリフルオロメチル)フェニル)ボレート)
の1つまたは複数の1つまたは複数である、項1~27のいずれか1項に記載の方法。
32. 溶液法である、項1~31のいずれか1項に記載の方法。
33. 約80℃~約300℃の温度、約0.35MPa~約10MPaの範囲の圧力、および300分以下の滞留時間で行われる、項1~32のいずれか1項に記載の方法。
34. 連続プロセスである、項1~33のいずれか1項に記載の方法。
35. ポリマーは、少なくとも0.1モル%の環状オレフィンを含む、項1~34のいずれか1項に記載の方法。
36. ポリマーは、少なくとも1モル%の環状オレフィンを含む、項1~34のいずれか1項に記載の方法。
37. ポリマーは、少なくとも10モル%の環状オレフィンを含む、項1~34のいずれか1項に記載の方法。
38. ポリマーは、少なくとも1モル%の環状オレフィンおよび少なくとも20モル%のエチレンを含む、項1~37のいずれか1項に記載の方法。
39. ポリマーは、少なくとも1モル%の環状オレフィンおよび少なくとも20モル%のプロピレンを含む、項1~37のいずれか1項に記載の方法。
40. 置換または非置換シクロペンテンおよび置換または非置換2-ノルボルネンから選択される1つまたは複数の環状オレフィンモノマーを含む、項1~40のいずれか1項に記載の方法により製造されるポリマー。
41. 置換または非置換シクロペンテンから選択される1つまたは複数の環状モノマーを含む、項1~40のいずれか1項に記載の方法により製造されるポリマー。
42. 置換または非置換の2-ノルボルネンから選択される1つまたは複数の環状モノマーを含む、項1~39のいずれか1項に記載の方法により製造されるポリマー。
43. ポリマーは、置換または非置換シクロペンテンのホモポリマーである、項1~33のいずれか1項に記載の方法。
44. ポリマーはシクロペンテンのホモポリマーである、項43に記載の方法。
45. ポリマーは、
a.5,000g/モル超、あるいは10,000g/モル超、あるいは100,000g/モル超、あるいは150,000g/モル超のMn;
b.10,000g/モル超、あるいは20,000g/モル超、あるいは200,000g/モル超、あるいは300,000g/モル超のMw;
c.約1~10、あるいは約1.5~5.0、あるいは約1.8~3.0、あるいは約2.0~4.0のMw/Mn;
d.0.1モル%以上、上限は50モル%以下、あるいは45モル%以下のシクロペンテン含有量;
e.ポリマーに組み込まれた全シクロペンテン単位の約90%以上でシクロペンテン1,2結合
を有する、エチレンシクロペンテンコポリマーである、項1~40のいずれか1項に記載の方法。
46. ポリマーは、
a.50,000g/モル超、あるいは100,000g/モル超、あるいは150,000g/モル超、あるいは200,000g/モル超のMn;
b.100,000g/モル超、あるいは200,000g/モル超、あるいは300,000g/モル超、あるいは400,000g/モル超のMw;
c.約1.2~5.0、あるいは約1.5~4.0、あるいは約2.0~3.0のMw/Mn;
d.20モル%以上、上限が80モル%以下のノルボルネン含有量;
e.10~80%の独立、10~80%の交互、1~50%のブロックであるノルボルネン単位を有し、独立、交互、およびブロックの合計が100%に等しい
エチレンノルボルネンコポリマーである、項1~40のいずれか1項に記載の方法。
47. ポリマーは、
a.3,000g/モル超、あるいは5,000g/モル超、あるいは10,000g/モル超のMn;
b.6,000g/モル超、あるいは10,000g/モル超、あるいは20,000g/モル超のMw;
c.約1~10、あるいは約1.5~5.0、あるいは約1.8~3.0、あるいは約2.0~4.0のMw/Mn;
d.0.1モル%以上、上限は50モル%以下、あるいは45モル%以下のシクロペンテン含有量;
e.ポリマーに組み込まれた全シクロペンテン単位の約90%以上でシクロペンテン1,2結合
を有する、プロピレンシクロペンテンコポリマーである、項1~40のいずれか1項に記載の方法。
48. ポリマーは、
a.3,000g/モル超、あるいは5,000g/モル超、あるいは10,000g/モル超のMn;
b.6,000g/モル超、あるいは10,000g/モル超、あるいは20,000g/モル超のMw;
c.約1.2~5.0、あるいは約1.5~4.0、あるいは約2.0~3.0のMw/Mn;
d.1モル%以上、上限が50モル%以下のノルボルネン含有量
を有する、プロピレンノルボルネンコポリマーである、項1~40のいずれか1項に記載の方法。
分子量および組成分布(GPC-IR):
分子量(例えば、Mn、Mw、Mz)およびコモノマー分布(C2、C3、C6など)の分布およびモーメントは、複数チャネルバンドフィルターベースの赤外線検出器アンサンブルIR5を備えた高温ゲル透過クロマトグラフィー(PolymerChar GPC-IR)で測定する。ここに、広帯域チャネルを使用してポリマー濃度を測定し、2つの狭帯域チャネルを組成の特徴付けする。3つのAgilent PLgel 10μm Mixed-B LSカラムを使用して、ポリマーを分離する。Aldrich試薬グレードの1,2,4-トリクロロベンゼン(TCB)と300ppmの酸化防止剤ブチル化ヒドロキシトルエン(BHT)を移動相として使用する。TCB混合物は0.1マイクロメートルのテフロンフィルターでろ過し、GPC装置に投入する前にオンライン脱気装置で脱気する。公称流量は1.0mL/minで、公称注入量は200マイクロリットルである。トランスファーライン、カラム、検出器を含むシステム全体は、145℃に維持されたオーブン内に置かれる。所定量のポリマーサンプルを計量し、10マイクロリットルのフローマーカー(ヘプタン)を加えた標準バイアルに密封する。バイアルをオートサンプラーにロードした後、ポリマーは8mLのTCB溶媒を加えて装置内で自動的に溶解される。ほとんどのPEサンプルでは約1時間、PPサンプルでは2時間、連続的に振盪しながら160℃でポリマーを溶解する。濃度の計算に使用されるTCB密度は、室温で1.463g/ml、145℃で1.284g/mlである。サンプル溶液の濃度は0.2~2.0mg/mlで、高分子量のサンプルには低濃度が使用される。
c=αI
式中、αはPE標準NBS1475で決定される質量定数である。質量回収率は、溶出体積に対する濃縮クロマトグラフィーの積分面積と、所定の濃度に注入ループ体積を掛けたものに等しい注入質量との比から計算される。
式中、KとαはMark-Houwink方程式の係数である。下付き「X」が付いた変数はテストサンプルを表し、下付き「PS」が付いた変数はポリスチレンを表す。この方法では、αPS=0.67およびKPS=0.000175、及びαXおよびKXは、標準的な較正手順を使用して、線状エチレン/プロピレンコポリマーおよび線状エチレン-プロピレン-ジエンターポリマーの組成に基づいて決定される。コモノマー組成は、一連のPEおよびPPホモ/コポリマー標準で較正されたCH2およびCH3チャネルに対応するIR検出器強度の比率によって決定される。
式中、NAはアボガドロ数であり、(dn/dc)は系の屈折率の増分である。145℃およびλ=665nmでのTCBの屈折率n=1.500である。ポリエチレンホモポリマー、エチレン-ヘキセンコポリマー、エチレン-オクテンコポリマーの分析では、dn/dc=0.1048ml/mg、A2=0.0015であり;エチレン-ブテン共重合体の分析では、dn/dc=0.1048*(1-0.00126*w2)ml/mg、A2=0.0015(w2はブテンコモノマーの重量パーセント)である。
式中、αpsは0.67であり、KPSは0.000175である。
式中、合計は積分限界の間のクロマトグラフィースライスiを超える。
式中、MvはLS分析によって決定された分子量に基づく粘度平均分子量であり、Kおよびαは参照線状ポリマーの値であり、本開示の目的に関して、線状エチレンについてα=0.695およびK=0.000579であり、線状プロピレンポリマーについてα=0.705およびK=0.0002288、線状ブテンポリマーについてα=0.695およびK=0.000181、エチレン-ブテンコポリマーについてαは0.695、Kは0.000579*(1-0.0087*w2b+0.000018*(w2b)^2)、ここに、w2bはブテンコモノマーのバルク重量パーセントであり、エチレン-ヘキセンコポリマーについてαは0.695、Kは0.000579*(1-0.0075*w2b)であり、ここに、w2bはヘキセンコモノマーのバルク重量パーセントであり、エチレン-オクテンコポリマーについてαは0.695、Kは0.000579*(1-0.0077*w2b)であり、ここに、w2bはオクテンコモノマーのバルク重量パーセントである。特記しない限り、濃度はg/cm3で、分子量はg/moleで、固有粘度(Mark-Houwink式中のK)はdL/gで表される。w2b値の計算は、上記の通りである。
本明細書で報告される重合に使用される触媒は、US2020-0255553、USSN62/972953、USSN62/972936、US2020-0255555、US2020-0254431、およびUS2020-0255556で報告された手順に従って合成された。
2-イソプロポキシ-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン(Aldrich)
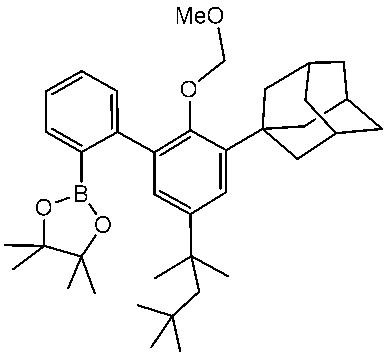
2,6-ジブロモピリジン(Aldrich)、2-ブロモヨードベンゼン(Acros)、ヘキサン中2.5M nBuLi(Chemetall GmbH))、Pd(PPh3)4(Aldrich)、塩化メトキシメチル(Aldrich)、NaH(鉱油中60重量%、Aldrich)、THF(Merck)、酢酸エチル(Merck)、メタノール(Merck)、トルエン(Merck))、ヘキサン(Merck)、ジクロロメタン(Merck)、HfCl4(<0.05%Zr、Strem)、ZrCl4(Strem)、Cs2CO3(Merck)、K2CO3(Merck)、Na2SO4(Akzo Nobel)、シリカゲル60(40-63μm;Merck)、CDCl3(Deutero GmbH)は受領した状態のまま使用した。ベンゼン-d6(Deutero GmbH)およびジクロロメタン-d2(Deutero GmbH)は、使用前にMS 4Aで乾燥した。有機金属合成用のTHFは、ベンゾフェノンケチルナトリウムから新たに蒸留した。有機金属合成用のトルエンとヘキサンは、MS 4Aで乾燥した。2-(アダマンタン-1-イル)-4-(tert-ブチル)フェノールは、Organic Letters, 2015, 17(9), 2242-2245に記載されているように、4-tert-ブチルフェノール(Merck)とアダマンタノール-1(Aldrich)から調製しました。
57.6g(203mmol)の2-(アダマンタン-1-イル)-4-(tert-ブチル)フェノールの400mLのクロロホルム溶液に、10.4mL(203mmol)の臭素の200mLのクロロホルム溶液を室温で30分間かけて滴下した。得られた混合物を水400mLで希釈した。得られた混合物をジクロロメタン(3×100mL)で抽出し、合わせた有機抽出物を5%NaHCO3で洗浄し、Na2SO4で乾燥させ、次いで蒸発乾固した。収量71.6g(97%)の白色固体。
1H NMR (CDCl3, 400 MHz): δ 7.32 (d, J = 2.3 Hz, 1 H), 7.19 (d, J = 2.3 Hz, 1 H), 5.65 (s, 1 H), 2.18 - 2.03 (m, 9 H), 1.78 (m, 6 H), 1.29 (s, 9 H). 13C NMR (CDCl3, 100 MHz): δ 148.07, 143.75, 137.00, 126.04, 123.62, 112.11, 40.24, 37.67, 37.01, 34.46, 31.47, 29.03.
71.6g(197mmol)の2-(アダマンタン-1-イル)-6-ブロモ-4-(tert-ブチル)フェノールの1000mLのTHF溶液8.28g(207mmol、ミネラル中の60重量%、油中)の水素化ナトリウムを室温で少しずつ加えた。得られた懸濁液に、塩化メトキシメチル16.5mL(217mmol)を室温で10分間かけて滴下した。得られた混合物を一晩攪拌した後、水1,000mLに注いだ。得られた混合物をジクロロメタン(3×300mL)で抽出し、合わせた有機抽出物を5%NaHCO3で洗浄し、Na2SO4で乾燥させ、次いで蒸発乾固させた。収量80.3g(~quant)の白色固体。
1H NMR (CDCl3, 400 MHz): δ 7.39 (d, J = 2.4 Hz, 1 H), 7.27 (d, J = 2.4 Hz, 1 H), 5.23 (s, 2 H), 3.71 (s, 3 H), 2.20 - 2.04 (m, 9 H), 1.82 - 1.74 (m, 6 H), 1.29 (s, 9 H). 13C NMR (CDCl3, 100 MHz): δ 150.88, 147.47, 144.42, 128.46, 123.72, 117.46, 99.53, 57.74, 41.31, 38.05, 36.85, 34.58, 31.30, 29.08.
22.5g(55.0ミリモル)の1-(3-ブロモ-5-(tert-ブチル)-2-(メトキシメトキシ)フェニル)アダマンタンの300mL乾燥THF溶液に23.2mL(57.9ミリモル、2.5M)のnBuLiのヘキサン溶液を-80℃で20分間滴下した。反応混合物をこの温度で1時間撹拌し、続いて14.5mL(71.7mmol)の2-イソプロポキシ-4,4,5,5-テトラメチル-1,3,2-ジオキサボロランを添加した。得られた懸濁液を室温で1時間攪拌した後、水300mLに注いだ。得られた混合物をジクロロメタン(3×300mL)で抽出し、合わせた有機抽出物をNa2SO4で乾燥させ、次いで蒸発乾固させた。収量25.0g(~quant)の無色の粘性油。
1H NMR (CDCl3, 400 MHz): δ 7.54 (d, J = 2.5 Hz, 1 H), 7.43 (d, J = 2.6 Hz, 1 H), 5.18 (s, 2 H), 3.60 (s, 3 H), 2.24 - 2.13 (m, 6 H), 2.09 (br. s., 3 H), 1.85 - 1.75 (m, 6 H), 1.37 (s, 12 H), 1.33 (s, 9 H). 13C NMR (CDCl3, 100 MHz): δ 159.64, 144.48, 140.55, 130.58, 127.47, 100.81, 83.48, 57.63, 41.24, 37.29, 37.05, 34.40, 31.50, 29.16, 24.79.
(2-(3-アダマンタン-1-イル)-5-(tert-ブチル)-2-(メトキシメトキシ)フェニル)-4,4,5,5-テトラメチル-25.0g(55.0mmol)の溶液に、200mLのジオキサン中の1,3,2-ジオキサボロラン15.6g(55.0ミリモル)の2-ブロモヨードベンゼン、19.0g(137ミリモル)の炭酸カリウム、および100mLの水を続いて添加した。得られた混合物をアルゴンで10分間パージし、続いて3.20g(2.75ミリモル)のPd(PPh3)4を添加した。得られた混合物を100℃で12時間攪拌した後、室温まで冷却し、水100mLで希釈した。得られた混合物をジクロロメタン(3×100mL)で抽出し、合わせた有機抽出物をNa2SO4で乾燥させ、次いで蒸発乾固させた。残留物をシリカゲル60(40~63μm、溶離剤:ヘキサン-ジクロロメタン=10:1、体積)でのフラッシュクロマトグラフィーにより精製した。収量23.5g(88%)の白色固体。
1H NMR (CDCl3, 400 MHz): δ 7.68 (dd, J = 1.0, 8.0 Hz, 1 H), 7.42 (dd, J = 1.7, 7.6 Hz, 1 H), 7.37 - 7.32 (m, 2 H), 7.20 (dt, J = 1.8, 7.7 Hz, 1 H), 7.08 (d, J = 2.5 Hz, 1 H), 4.53 (d, J = 4.6 Hz, 1 H), 4.40 (d, J = 4.6 Hz, 1 H), 3.20 (s, 3 H), 2.23 - 2.14 (m, 6 H), 2.10 (br. s., 3 H), 1.86 - 1.70 (m, 6 H), 1.33 (s, 9 H). 13C NMR (CDCl3, 100 MHz): δ 151.28, 145.09, 142.09, 141.47, 133.90, 132.93, 132.41, 128.55, 127.06, 126.81, 124.18, 123.87, 98.83, 57.07, 41.31, 37.55, 37.01, 34.60, 31.49, 29.17.
500mL中の1-(2’-ブロモ-5-(tert-ブチル)-2-(メトキシメトキシ)-[1,1’-ビフェニル]-3-イル)アダマンタン30.0g(62.1mmol)の溶液に、ヘキサン中のnBuLi25.6mL(63.9mmol、2.5M)の乾燥THFを、-80℃で20分間滴下した。反応混合物をこの温度で1時間撹拌し、続いて16.5mL(80.7ミリモル)の2-イソプロポキシ-4,4,5,5-テトラメチル-1,3,2-ジオキサボロランを添加した。得られた懸濁液を室温で1時間攪拌した後、水300mLに注いだ。得られた混合物をジクロロメタン(3×300mL)で抽出し、合わせた有機抽出物をNa2SO4で乾燥させ、次いで蒸発乾固させた。収量32.9g(~quant.)の無色のガラス状の固体。
1H NMR (CDCl3, 400 MHz): δ 7.75 (d, J = 7.3 Hz, 1 H), 7.44 - 7.36 (m, 1 H), 7.36 - 7.30 (m, 2 H), 7.30 - 7.26 (m, 1 H), 6.96 (d, J = 2.4 Hz, 1 H), 4.53 (d, J = 4.7 Hz, 1 H), 4.37 (d, J = 4.7 Hz, 1 H), 3.22 (s, 3 H), 2.26 - 2.14 (m, 6 H), 2.09 (br. s., 3 H), 1.85 - 1.71 (m, 6 H), 1.30 (s, 9 H), 1.15 (s, 6 H), 1.10 (s, 6 H). 13C NMR (CDCl3, 100 MHz): δ 151.35, 146.48, 144.32, 141.26, 136.15, 134.38, 130.44, 129.78, 126.75, 126.04, 123.13, 98.60, 83.32, 57.08, 41.50, 37.51, 37.09, 34.49, 31.57, 29.26, 24.92, 24.21.
2-(3'-(アダマンタン-1-イル)-5-(tert-ブチル)-2’-(メトキシメトキシ)-[1,1’-ビフェニル]-2-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン32.9g(62.0mmol)の溶液に(140mLのジオキサン中)、7.35g(31.0mmol)の2,6-ジブロモピリジン、50.5g(155mmol)の炭酸セシウム、および続いて水70mLを添加した。得られた混合物をアルゴンで10分間パージし、続いて3.50g(3.10ミリモル)のPd(PPh3)4を添加した。この混合物を100℃で12時間攪拌し、次いで室温まで冷却し、50mLの水で希釈した。得られた混合物をジクロロメタン(3×50mL)で抽出し、合わせた有機抽出物をNa2SO4で乾燥させ、次いで蒸発乾固させた。得られた油に、300mLのTHF、300mLのメタノール、および21mLの12NのHClを続けて添加した。反応混合物を60℃で一晩撹拌し、次いで500mLの水に注いだ。得られた混合物をジクロロメタン(3×350mL)で抽出し、合わせた有機抽出物を5%NaHCO3で洗浄し、Na2SO4で乾燥させ、次いで蒸発乾固した。残留物をシリカゲル60(40~63μm、溶離剤:ヘキサン-酢酸エチル=10:1、体積)でのフラッシュクロマトグラフィーにより精製した。得られたガラス状の固体を70mLのn-ペンタンで摩砕し、得られた沈殿物を濾別し、2×20mLのn-ペンタンで洗浄し、真空乾燥した。収量21.5g(87%)の2つの異性体の白色粉末としての混合物。
1H NMR (CDCl3, 400 MHz): δ 8.10 + 6.59 (2s, 2H), 7.53 - 7.38 (m, 10H), 7.09 + 7.08 (2d, J = 2.4 Hz, 2H), 7.04 + 6.97 (2d, J = 7.8 Hz, 2H), 6.95 + 6.54 (2d, J = 2.4 Hz), 2.03 - 1.79 (m, 18H), 1.74 - 1.59 (m, 12H), 1.16 + 1.01 (2s, 18H). 13C NMR (CDCl3, 100 MHz, * で標識された少量の異性体シフト): δ 157.86, 157.72*, 150.01, 149.23*, 141.82*, 141.77, 139.65*, 139.42, 137.92, 137.43, 137.32*, 136.80, 136.67*, 136.29*, 131.98*, 131.72, 130.81, 130.37*, 129.80, 129.09*, 128.91, 128.81*, 127.82*, 127.67, 126.40, 125.65*, 122.99*, 122.78, 122.47, 122.07*, 40.48, 40.37*, 37.04, 36.89*, 34.19*, 34.01, 31.47, 29.12, 29.07*.
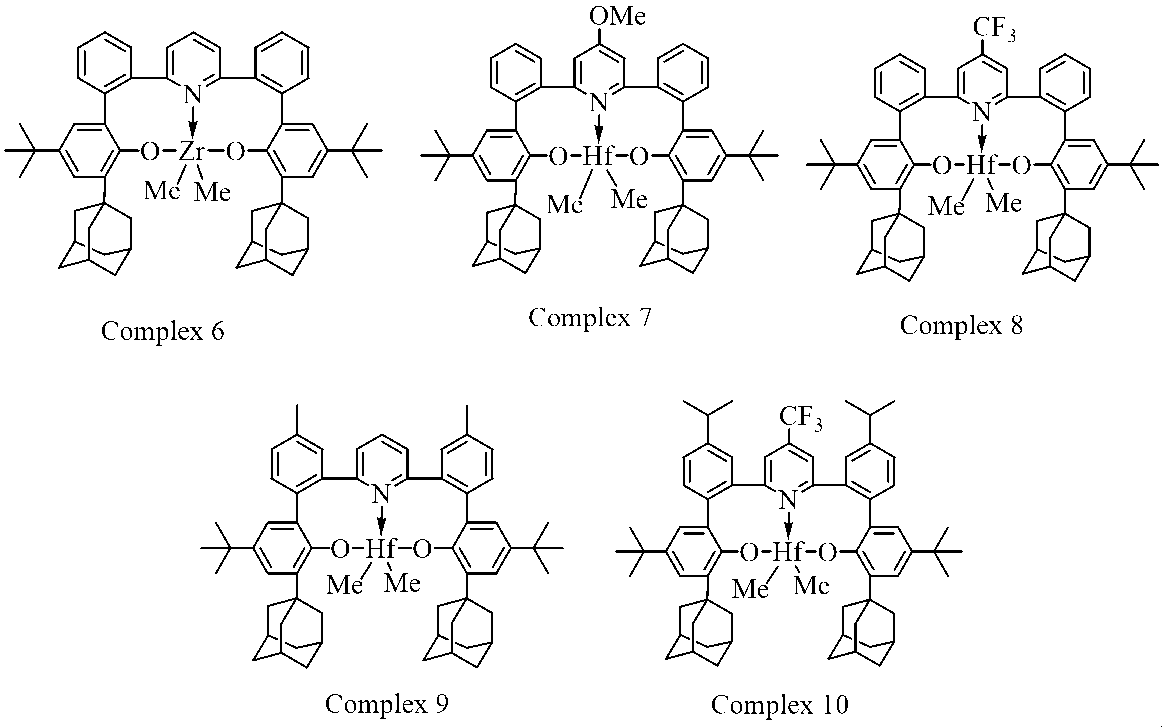
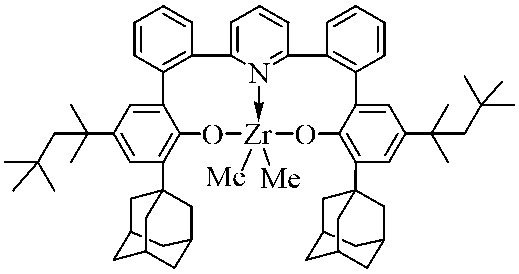
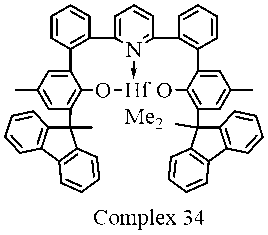
250mLの乾燥トルエン中の3.22g(10.05mmol)の四塩化ハフニウム(<0.05%Zr)の懸濁液に、ジエチルエーテル中の14.6mL(42.2mmol、2.9M)のMeMgBrを注射器で0℃で一度に加えた。得られた懸濁液を1分間攪拌し、8.00g(10.05mmol)の(2’,2’’’-(ピリジン-2,6-ジイル)ビス((3-アダマンタン-1-イル)-5-(tert-ブチル)-[1,1’-ビフェニル]-2-オール))を1分間かけて少しずつ加えた。反応混合物を室温で36時間攪拌し、次いで蒸発乾固した。得られた固体を熱トルエン2×100mLで抽出し、合わせた有機抽出物をセライト503の薄いパッドを通して濾過した。次に、濾液を蒸発乾固させた。残渣を50mLのn-ヘキサンで摩砕し、得られた沈殿物を濾別し(G3)、20mLのn-ヘキサン(2×20mL)で洗浄し、次いで真空乾燥した。収量6.66g(61%、n-ヘキサンとの~1:1溶媒和物)の明るいベージュ色の固体。
C59H69HfNO2×1.0(C6H14)として計算値: C, 71.70; H, 7.68; N, 1.29. 実測値: C 71.95; H, 7.83; N 1.18. 1H NMR (C6D6, 400 MHz): δ 7.58 (d, J = 2.6 Hz, 2 H), 7.22 - 7.17 (m, 2 H), 7.14 - 7.08 (m, 4 H), 7.07 (d, J = 2.5 Hz, 2 H), 7.00 - 6.96 (m, 2 H), 6.48 - 6.33 (m, 3 H), 2.62 - 2.51 (m, 6H), 2.47 - 2.35 (m, 6H), 2.19 (br.s, 6H), 2.06 - 1.95 (m, 6H), 1.92 - 1.78 (m, 6H), 1.34 (s, 18 H), -0.12 (s, 6 H). 13C NMR (C6D6, 100 MHz): δ 159.74, 157.86, 143.93, 140.49, 139.57, 138.58, 133.87, 133.00, 132.61, 131.60, 131.44, 127.98, 125.71, 124.99, 124.73, 51.09, 41.95, 38.49, 37.86, 34.79, 32.35, 30.03.
300mLの乾燥トルエン中の2.92g(12.56ミリモル)の四塩化ジルコニウムの懸濁液に、ジエチルエーテル中の18.2mL(52.7ミリモル、2.9M)のMeMgBrを注射器を介して0℃で一度に加えた。得られた懸濁液に、10.00g(12.56ミリモル)の(2’,2’’’-(ピリジン-2,6-ジイル)ビス((3-アダマンタン-1-イル)-5-(tert-ブチル)-[1,1’-ビフェニル]-2-オール))をすぐに一度に添加した。反応混合物を室温で2時間撹拌し、次いで蒸発させてほぼ乾燥させた。得られた固体を熱トルエン2×100mLで抽出し、合わせた有機抽出物をセライト503の薄いパッドを通して濾過した。次に、濾液を蒸発乾固させた。残渣を50mLのn-ヘキサンで摩砕し、得られた沈殿物を濾別し(G3)、n-ヘキサン(2×20mL)で洗浄し、次いで真空乾燥した。収量8.95g(74%、n-ヘキサンとの~1:0.5溶媒和物)のベージュ色の固体。
C59H69ZrNO2×0.5(C6H14)として計算値: C, 77.69; H, 7.99; N, 1.46. 実測値: C 77.90; H, 8.15; N 1.36. 1H NMR (C6D6, 400 MHz): δ 7.56 (d, J = 2.6 Hz, 2 H), 7.20 - 7.17 (m, 2 H), 7.14 - 7.07 (m, 4 H), 7.07 (d, J = 2.5 Hz, 2 H), 6.98 - 6.94 (m, 2 H), 6.52 - 6.34 (m, 3 H), 2.65 - 2.51 (m, 6H), 2.49 - 2.36 (m, 6H), 2.19 (br.s., 6H), 2.07 - 1.93 (m, 6H), 1.92 - 1.78 (m, 6H), 1.34 (s, 18 H), 0.09 (s, 6 H). 13C NMR (C6D6, 100 MHz): δ 159.20, 158.22, 143.79, 140.60, 139.55, 138.05, 133.77, 133.38, 133.04, 131.49, 131.32, 127.94, 125.78, 124.65, 124.52, 42.87, 41.99, 38.58, 37.86, 34.82, 32.34, 30.04.
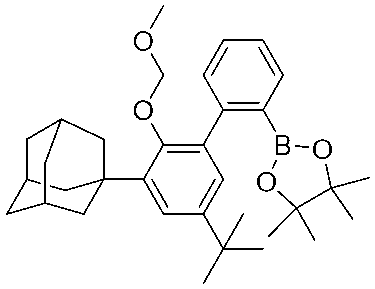
ヘキサン(100mL)を1-(2-(メトキシメトキシ)-5-(2,4,4-トリメチルペンタン-2-イル)フェニル)アダマンタン(12.15g、31.59ミリモル)に加えて、透明な淡黄色溶液を形成した。BuLi(12.69mL、31.59ミリモル)を滴下して、黄色の溶液を形成した。DME(3.284mL、31.59mmol)を素早く加えた。一晩攪拌した後、フリット上に白色固体を集め、ヘキサン(3×10mL)で洗浄した。固体を減圧下で乾燥させた。H NMR分析は、0.88当量のDMEの存在を示した。さらに精製することなく使用した。収量:8.36g、56.3%。
トルエン(120mL)を、(3-(アダマンタン-1-イル)-2-(メトキシメトキシ)-5-(2,4,4-トリメチルペンタン-2-イル)フェニル)リチウム(dme)0.88(8.36g、17.79mmol)に加え、懸濁液を形成した。1-ブロモ-2-クロロベンゼン(3.747g、19.57mmol)のトルエン溶液(25mL)を3.5時間かけて滴下した。一晩攪拌した後、濁った混合物を分液漏斗に移し、水(5×50mL)、次いでブライン(2×10mL)で抽出した。有機物をMgSO4で乾燥させ、濾過し、蒸発させて淡黄色の油を得た。H NMRは、粗生成物中のトルエンの0.5当量の存在を示した。さらに精製することなく使用した。収量:9.92g、95.2%。
ヘキサン(200mL)を1-(2’-ブロモ-2-(メトキシメトキシ)-5-(2,4,4-トリメチルペンタン-2-イル)-[1,1’-ビフェニル]-3-イル)に加えた)アダマンタン(9.92g,16.94mmol)を添加して、透明な溶液を形成した。混合物を-40℃に冷却し、BuLi(6.84mL、17.79ミリモル)を滴下した。20分間攪拌した後、混合物を冷浴から取り出し、25分かけて周囲温度近くまで温めた。次いで混合物を-40℃に冷却し、2-イソプロポキシ-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン(4.964g、26.68ミリモル)の冷ヘキサン溶液(2mL)を加えた。混合物を周囲温度までゆっくり温め、次いで周囲温度で撹拌した。1時間後、濁った混合物を分液漏斗に注ぎ、水層が中性になるまで水(6×100mL)で抽出した。有機物をブライン(2×20mL)で抽出した。有機物をMgSO4で乾燥させ、濾過し、減圧下で数日間乾燥させて、生成物を無定形固体として得た。さらに精製することなく使用した。収量:9.197g、92.6%。
500mLの丸底フラスコに、2-(3’-(アダマンタン-1-イル)-2’-(メトキシメトキシ)-5’-(2,4,4-トリメチルペンタン-2-イル)-[1,1’-ビフェニル]-2-イル)-4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン(9.197g、15.68mmol)、2,6-ジブロモピリジン(1.783g、7.525mol)、Na2CO3(4.154g、39.19mmol)、ジオキサン(180mL)および水(90mL)を充填した。混合物を窒素で50分間スパージし、次いで固体Pd(PPh3)4(0.906g、0.784mmol)を添加した。混合物をさらに40分間スパージし、次いで急速に攪拌し、100℃に維持した油浴中で加熱した。20時間後、揮発物を蒸発させて、黄色の泡状固体を得た。固体を砕き、水(200mL)と共に数分間撹拌した。次に固体をフリット上に集め、水(3×200mL)で洗浄した。次いで、黄色固体を減圧下で乾燥させた。メタノール(100mL)、thf(100mL)、および濃HCl(7mL)を加え、混合物を60℃に一晩加熱した。次に揮発物を蒸発させ、残留物をエーテル(200mL)で抽出し、分液漏斗に入れた。有機物を希NaHCO3(100mL)、水(4×150mL)、次いでブライン(20mL)で抽出した。有機物をMgSO4で乾燥させ、次いで蒸発させて、泡状の黄色固体(8.4g)を得た。粗生成物をSiO2で精製し、イソヘキサン中の1~5%EtOAcで溶出した。収量:4.92g、72.0%。
ベンゼン(4mL)をZrCl2(NMe2)2(dme)(0.0374g、0.110mmol)に添加して、わずかに濁った溶液を形成した。次に、2’,2’’’-(ピリジン-2,6-ジイル)ビス(3-((3r,5r,7r)-アダマンタン-1-イル)-5-(2,4,4-トリメチルペンタン-2-イル)-[1’’,1’’’-ビフェニル]-2-オール)(0.0998g、0.110mmol)および少量のトルエン(2mL)を加え、混合物を35℃で撹拌した。30分後、H NMR分析のためにアリコートを採取し、推定される二塩化物のかなりきれいな形成を示した。次に溶液を80℃に25分間加熱した。揮発物を蒸発させ、残留物を減圧下で乾燥させた。残留物を熱イソヘキサン(8mL)で抽出し、濾過した。揮発性物質を蒸発させて白色固体を得て、これを減圧下、80℃で約5分間乾燥させた。収量:0.0948g、80.7%。
トルエン(6mL)を錯体33-ジクロリド(0.0948g、0.0887ミリモル)に加えて、無色透明の溶液を形成した。混合物を-15℃に冷却し、MeMgBr(0.0995mL、0.326ミリモル)を添加した。混合物を約15分かけて周囲温度まで温めた。1時間後、溶液を蒸発させて残留物とし、少量のイソヘキサン(1mL)を添加した。混合物を撹拌し、蒸発させた。少量のイソヘキサン(1mL)を加えて残留物を溶解し、揮発性物質を再び蒸発させた。その後、残渣を減圧乾燥した。次に残留物をイソヘキサン(10mL)で抽出し、セライト503を通して濾過し、蒸発させて残留物とし、減圧下で乾燥させた。バイアルをこすり取り、錯体33を薄茶色の固体として得られた。収量:0.0819g、90.0%。
溶媒としての、重合グレードのトルエンおよび/またはイソヘキサンを、ExxonMobil Chemical Companyから得、一連のカラムを通して精製した:Labclear(Oakland,California)からの直列の2つの500cm3 Oxyclearシリンダー、続いて、乾燥した3Åモレキュラーシーブ(8メッシュ-12メッシュ;Aldrich Chemical Company)を充填した直列の2つの500cm3カラム、および乾燥した5Åモレキュラーシーブ(8-12メッシュ;Aldrich Chemical Company)を充填した直列の2つの500cm3カラム。
0cm3カラム、SelexsorbCD(BASF)を充填した500cm3カラム、最後にSelexsorbCOS(BASF)を充填した500cm3カラム。
重合を、不活性雰囲気(N2)ドライボックス内で、オートクレーブを用いて行った。オートクレーブは、温度制御用の外部ヒーター、ガラス製インサート(反応器の内部容積=C2を含む操作の場合は23.5mL、C3を含む操作の場合は22.5mL)、セプタム入口を備え、窒素、エチレン、プロピレンの供給を調整し、使い捨てのポリエーテルエーテルケトンメカニカルスターラー(800RPM)を備える。オートクレーブは、110℃または115℃で5時間、次いで25℃で5時間、乾燥窒素でパージすることによって準備した。
反応器を上記のように準備し、次いでエチレンでパージするか、またはエチレンを使用しない反応器の場合は窒素でパージした。イソヘキサン(特記しない限り溶媒)および環状コモノマーを、室温および大気圧で注射器により添加した。次いで、反応器をプロセス温度(典型的には100℃)にし、800RPMで攪拌しながらエチレン(使用する場合)を充填した。次にスカベンジャー溶液(例えば、イソヘキサンまたはトルエン中のTNOA)をシリンジによりプロセス条件で反応器に添加した。非配位活性化剤(例えば、N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレート)溶液(トルエン中)を注射器によりプロセス条件で反応器に添加し、続いてプレ触媒(すなわち、CatIDで識別される錯体または触媒)を添加した。溶液(トルエン中)を注射器でプロセス条件の反応器に注入した。使用する場合、重合中にエチレンをオートクレーブに入れて(コンピューター制御の電磁弁を使用して)反応器のゲージ圧(+/-2psi)を維持した。反応器の温度を監視し、典型的には±1℃以内に維持した。約50psiの圧縮乾燥空気混合物をオートクレーブに約30秒間添加することにより、重合を停止させた。所定の累積量のエチレンを添加した後(使用した場合)、または重合時間の最大分数の間に、重合をクエンチした。反応器を冷却し、排気した。真空中で溶媒を除去した後、ポリマーを単離した。報告する収率には、ポリマーと残留触媒の総重量が含まれる。触媒活性は、1時間の反応時間当たりの遷移金属化合物1ミリモル当たりのポリマーのグラム数(g/ミリモル/時間)として報告される。「C#」は比較例を示す。マイクロリットル(μlまたはμL)は、以下の表でuLまたはulとして報告され得る。
反応器を上記のように準備し、次いで40℃に加熱し、大気圧でプロピレンガスでパージした。イソヘキサン(特記しない限り溶媒)、環状コモノマー、および液体プロピレンを注射器で加えた。次いで、反応器を800RPMで撹拌しながらプロセス温度(典型的には100℃)まで加熱した。次いで、スカベンジャー溶液(例えば、イソヘキサンまたはトルエン中のTNOA)をシリンジによりプロセス条件で反応器に添加した。次いで、非配位活性化剤(例えば、N,N-ジメチルアニリニウムテトラキス(ペンタフルオロフェニル)ボレートまたはN,N-ジメチルアニリニウムテトラキス(パーフルオロナフタレン-2-イル)ボレート)溶液(トルエン中)を、プロセス条件で注射器により反応器に添加した。続いて、前触媒(すなわち、触媒IDで識別される錯体または触媒)溶液(トルエン中)を、プロセス条件でシリンジにより反応器に注入した。反応器の温度を監視し、典型的には±1℃以内に維持した。重合は、特記しない限り約50psiの圧縮乾燥空気(代わりに、言及する場合はCO2)ガス混合物をオートクレーブに約30秒間添加することによって停止させた。約8psiの所定の圧力損失に基づいて(特に言及しない限り)、または最大30分間の重合時間(特に言及しない限り)に基づいて、重合をクエンチした。反応器を冷却し、排気した。真空中で溶媒を除去した後、ポリマーを単離した。報告した収率には、ポリマーと残留触媒の総重量が含まれる。触媒活性は、通常、反応時間1時間あたりの遷移金属化合物1mmolあたりのポリマーのグラム数(g/mmol/hr)として報告され得る。
分析試験のために、ポリマーを、2,6-ジ-tert-ブチル-4-メチルフェノール(BHT、Aldrichから入手、99%)を含む1,2,4-トリクロロベンゼン(TCB、Aldrichから入手、99+%)中に、165℃のシェーカーオーブンで約3時間溶解することにより調製した。溶液中のポリマーの典型的な濃度は、TCBの1.25mgBHT/mLのBHT濃度で、0.1~0.9mg/mLであった。サンプルをテストのために135°Cに冷却した。
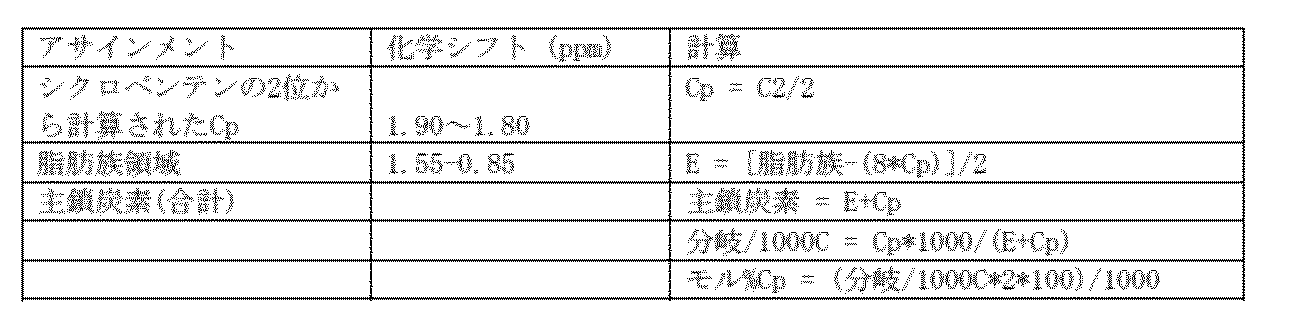
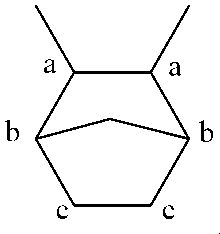
特記しない限り、1H NMR分光法用のエチレン-シクロペンテン(E-Cp)サンプルは、1,1,2,2-テトラクロロエタン-d2(tc-d2)に140℃で、30mg/mLの濃度で溶解した。サンプルを、120℃でBrukerNMR分光計を使用して測定した。NMR測定は、600MHz以上の1H NMR周波数、10mmクライオプローブを使用して30°パルス、少なくとも512回のスキャン、5秒ディレイで行った。E-Cpの化学シフトは、5.98ppmの溶媒tc-d2を参照した。
E=エチレン、Cp=シクロペンテン、1000C=1000主鎖炭素
この計算は、Cpの1,2付加に用いれる。
特に断りのない限り、1H NMR分光法用のポリシクロペンテン(ポリCp)サンプルは、1,1,2,2-テトラクロロエタン-d2(tc-d2)に、140℃で30mg/mLの濃度で溶解した。サンプルを、120℃でBrukerNMR分光計を使用して測定した。NMR測定は、500MHz以上の1H NMR周波数、30°パルス、少なくとも512回のスキャン、5秒ディレイで行った。ポリCpの化学シフトは、5.98ppmの溶媒tc-d2を参照した。
特記しない限り、1H NMR分光法用のエチレン-ノルボルネン共重合体(E-NB)サンプルは、1,1,2,2-テトラクロロエタン-d2に、140℃で30mg/mLの濃度で溶解した。サンプルを、BrukerNMR分光計を使用し、120℃で測定した。NMR測定は、600MHz以上の1H NMR周波数、3°パルス、512回のスキャン、15秒ディレイで行った。
特記しない限り、13C NMR分光法用のコポリマーサンプル(E-Cp、PP-Cp、E-NB、およびPP-NB)は、1,1,2,2-テトラクロロエタン-d2(tc-d2)、140℃で濃度33~67mg/mLなるように溶解した。サンプルを、120℃でBrukerNMR分光計を使用して測定した。NMR測定は、150MHz以上の13C周波数、90°パルスでのゲート付きデカップリングを用いる10mmクライオプローブを使用して、少なくとも512回のトランジェント、10秒ディレイで行った。エチレンベースのポリマーに関しては、化学シフトは、29.98ppmの主要なPEピークを参照し、プロピレンベースのポリマーに関しては、化学シフトは、21.83ppmの主要なアイソタクチックCH3ピークを参照した。
シクロペンテンの1,3シスおよび1,3トランス付加、およびエチレン-シクロペンテン共重合体のシクロペンテンの1,2付加に関するアサインメントとベース計算は、M. Napoli et.al. 「Copolymerization of Ethylene with Cyclopentene or 2-butene with Half Titanocenes-Based Catalysts」 Journal of Polymer Science A: Polymer Chemistry, v.46, pp. 4725-4733, (2008)から得た。
プロピレン-シクロペンテン(P-Cp)のアサインメントと命名は、N. Naga, Y. Imanishi, 「Structure of cyclopentene unit in the copolymer with propylene obtained by stereospecific zirconocene catalysts」 Polymer, v.43, pp. 2133-2139, (2002)に基づく。これらのアサインメントは、1,2付加のみを対象とする。
E-NB(エチレン-ノルボルネン)組成(モル%)の計算、および組成分布(孤立、交互、ブロック状)のアサインメントと定量は、Bergstrom et.al. 「Influence of Polymerization Conditions on Microstructure of Norbornene-Ethylene Copolymers Made Using Metallocene Catalysts and MAO」 Journal of Applied Polymer Science, v.63, pp. 1071-1076, (1997)に基づく。
P-NB(プロピレン-ノルボルネン)のアサインメントとナンバリングは、I. Tritto et.al. 「Propene-Norbornene Copolymers: Synthesis and Analysis of Polymer Structure by 13C NMR Spectroscopy and ab Initio Chemical Shift Computations」 Macromolecules, v.36, pp. 882-890 (2003)に基づく。組成(モル%)の計算は以下のように決定した。
Claims (12)
- 環状オレフィンモノマーおよびC2~C20アルファオレフィンから選択される任意のコモノマーを、活性化剤および式(I):
[式中:
Mは、HfまたはZrであり;
EおよびE’は、Oであり;
A1QA1’は、置換または非置換のピリジン環の一部であり、ここに、Qは、Nであり、A1およびA1’は、独立して、CまたはC(R22)であり、R22は、水素、C1~C20ヒドロカルビル、C1~C20置換ヒドロカルビルから選択され;
は、置換または非置換のベンゼン環の一部、あるいは、ベンゾチオフェンまたはインドールのヘテロ環の一部であり;
は、置換または非置換のベンゼン環の一部、あるいは、ベンゾチオフェンまたはインドールのヘテロ環の一部であり;
Lは、ルイス塩基であり;
Xは、アニオン配位子であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’のうちの1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよい。]
により表される触媒化合物を含む触媒系と接触させることを含む、重合方法。 - 前記触媒化合物は、式(II):
[式中:
Mは、HfまたはZrであり;
EおよびE’は、Oであり;
Lは、それぞれ独立して、ルイス塩基であり;
Xは、それぞれ独立して、アニオン配位子であり;
nは1、2または3であり;
mは0、1、または2であり;
n+mは4以下であり;
R1、R2、R3、R4、R1’、R2’、R3’、およびR4’は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子、またはヘテロ原子含有基であり;
R1とR2、R2とR3、R3とR4、R1’とR2’、R2’とR3’、R3’とR4’の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよく;
任意の2つのL基は、結合して、二座ルイス塩基を形成してもよく;
X基は、L基に結合して、モノアニオン性二座基を形成してもよく;
任意の2つのX基は、結合して、ジアニオン配位子を形成してもよく;
R5、R6、R7、R8、R5’、R6’、R7’、R8’、R10、R11、およびR12は、それぞれ独立して、水素、C1~C40ヒドロカルビル、C1~C40置換ヒドロカルビル、ヘテロ原子またはヘテロ原子含有基であり;
R5とR6、R6とR7、R7とR8、R5’とR6’、R6’とR7’、R7’とR8’、R10とR11、またはR11とR12の1つまたは複数は、結合して、それぞれが5、6、7、または8個の環原子を有する、1つまたは複数の、置換ヒドロカルビル環、非置換ヒドロカルビル環、置換ヘテロサイクリック環、または非置換ヘテロサイクリック環を形成してもよく、ここに、環上の置換は、結合して追加の環を形成してもよい。]
により表される、請求項1に記載の方法。 - R1およびR1’は、それぞれ独立して、C4~C40第三級ヒドロカルビル基、またはC4~C40環式第三級ヒドロカルビル基である、請求項1または2に記載の方法。
- Xは、それぞれ独立して、1~20個の炭素原子を有する置換または非置換のヒドロカルビルラジカル、水素化物、アミド、アルコキシド、スルフィド、リン化物、ハロゲン化物、およびそれらの組み合わせ(2つのXは、縮合環または環系の一部を形成してもよい)からなる群より選択される化合物または構造に由来する一価の基であり、
Lは、それぞれ独立して、エーテル、チオエーテル、アミン、ホスフィン、エチルエーテル、テトラヒドロフラン、ジメチルスルフィド、トリエチルアミン、ピリジン、アルケン、アルキン、アレン、およびカルベン、ならびにそれらの組み合わせ(所望により、2つ以上のLは、縮合環または環系の一部を形成してもよい)からなる群より選択される化合物または構造に由来する一価の基である、
請求項1~3のいずれか1項に記載の方法。 - R1およびR1’の両方はC4~C20環状第三級アルキル、アダマンタン-1-イルまたは置換アダマンタン-1-イルである、
請求項1に記載の方法。 - Xはメチルまたはクロロであり、nは2である、
請求項1に記載の方法。 - ポリマーの構成単位として少なくとも0.1モル%の環状オレフィンを含むポリマーを回収することをさらに含む、請求項1~3のいずれか1項に記載の方法。
- ポリマーの構成単位として少なくとも1モル%の環状オレフィンおよびポリマーの構成単位として少なくとも20モル%のエチレンまたは少なくとも20モル%のプロピレンを含むポリマーを回収することをさらに含む、請求項1~3のいずれか1項に記載の方法。
- 環状オレフィンモノマーが、置換または非置換シクロペンテンおよび置換または非置換2-ノルボルネンから選択される少なくとも1つを含む、請求項1~3のいずれか1項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063065344P | 2020-08-13 | 2020-08-13 | |
| US63/065,344 | 2020-08-13 | ||
| PCT/US2021/043331 WO2022035585A1 (en) | 2020-08-13 | 2021-07-27 | Cyclic containing polymer compositions obtained using transition metal bis(phenolate) catalyst complexes and process for production thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023538006A JP2023538006A (ja) | 2023-09-06 |
| JP7629985B2 true JP7629985B2 (ja) | 2025-02-14 |
Family
ID=77693566
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023509861A Active JP7629985B2 (ja) | 2020-08-13 | 2021-07-27 | 遷移金属ビス(フェノラート)触媒錯体を使用して得られる環含有ポリマー組成物およびその製造方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20240018279A1 (ja) |
| EP (1) | EP4196507B1 (ja) |
| JP (1) | JP7629985B2 (ja) |
| CN (1) | CN116490528B (ja) |
| WO (1) | WO2022035585A1 (ja) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002524567A (ja) | 1998-09-12 | 2002-08-06 | ビーピー ケミカルズ リミテッド | 重合触媒 |
| JP2018504512A (ja) | 2015-01-14 | 2018-02-15 | エクソンモービル ケミカル パテンツ インコーポレイテッド | ポリマー組成物の製造方法 |
| JP2019504838A (ja) | 2016-01-25 | 2019-02-21 | リライアンス インダストリーズ リミテッドReliance Industries Ltd. | 遷移金属−シッフ塩基(イミン)配位子錯体の製造方法 |
| US20200255555A1 (en) | 2019-02-12 | 2020-08-13 | Exxonmobil Chemical Patents Inc. | Lewis Base Catalysts and Methods Thereof |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5153157A (en) | 1987-01-30 | 1992-10-06 | Exxon Chemical Patents Inc. | Catalyst system of enhanced productivity |
| US5041584A (en) | 1988-12-02 | 1991-08-20 | Texas Alkyls, Inc. | Modified methylaluminoxane |
| EP0574561B1 (en) | 1992-01-06 | 1998-01-28 | The Dow Chemical Company | Improved catalyst composition |
| BE1005957A5 (fr) | 1992-06-05 | 1994-04-05 | Solvay | Procede de preparation d'un systeme catalytique, procede de (co)polymerisation d'olefines et (co)polymeres d'au moins une olefine. |
| DE69312306T2 (de) | 1992-10-02 | 1997-11-13 | Dow Chemical Co | Aufträger homogener komplexkatalysator für olefinpolymerisation |
| DE69421411T2 (de) | 1993-11-19 | 2000-06-08 | Exxon Chemical Patents, Inc. | Polymerisationskatalysatorsysteme, ihre herstellung und verwendung |
| US5447895A (en) | 1994-03-10 | 1995-09-05 | Northwestern University | Sterically shielded diboron-containing metallocene olefin polymerization catalysts |
| JP3806980B2 (ja) * | 1995-08-11 | 2006-08-09 | 住友化学株式会社 | オレフィン重合用触媒成分、オレフィン重合用触媒及びオレフィン重合体の製造方法 |
| US6294388B1 (en) | 1998-04-03 | 2001-09-25 | Symyx Technologies, Inc. | Indirect calibration of polymer characterization systems |
| US6406632B1 (en) | 1998-04-03 | 2002-06-18 | Symyx Technologies, Inc. | Rapid characterization of polymers |
| US6175409B1 (en) | 1999-04-02 | 2001-01-16 | Symyx Technologies, Inc. | Flow-injection analysis and variable-flow light-scattering methods and apparatus for characterizing polymers |
| US6260407B1 (en) | 1998-04-03 | 2001-07-17 | Symyx Technologies, Inc. | High-temperature characterization of polymers |
| US6147173A (en) | 1998-11-13 | 2000-11-14 | Univation Technologies, Llc | Nitrogen-containing group 13 anionic complexes for olefin polymerization |
| US6436292B1 (en) | 1999-04-02 | 2002-08-20 | Symyx Technologies, Inc. | Parallel high-performance liquid chromatography with post-separation treatment |
| US6296771B1 (en) | 1999-04-02 | 2001-10-02 | Symyx Technologies, Inc. | Parallel high-performance liquid chromatography with serial injection |
| US6825296B2 (en) | 2002-03-29 | 2004-11-30 | The University Of Hong Kong | Catalyst component for olefin polymerization |
| US6897276B2 (en) | 2002-04-24 | 2005-05-24 | Symyx Technologies, Inc. | Bridged bi-aromatic ligands, catalysts, processes for polymerizing and polymers therefrom |
| US7319125B2 (en) | 2002-09-20 | 2008-01-15 | Exxonmobil Chemical Patents Inc. | Supercritical polymerization process and polymers produced therefrom |
| WO2004046214A2 (en) | 2002-10-15 | 2004-06-03 | Exxonmobil Chemical Patents Inc. | Multiple catalyst system for olefin polymerization and polymers produced therefrom |
| US7528203B2 (en) * | 2006-09-14 | 2009-05-05 | Exxonmobil Chemical Patents Inc. | Cyclic olefin copolymers, and methods of making the same |
| US7847099B2 (en) | 2006-09-21 | 2010-12-07 | California Institute Of Technology | Non-metallocene organometallic complexes and related methods and systems |
| CN102239187B (zh) | 2008-11-11 | 2014-04-30 | 东曹精细化工株式会社 | 固体状聚甲基铝氧烷组合物及其制造方法 |
| JP5856561B2 (ja) | 2010-05-11 | 2016-02-10 | 東ソー・ファインケム株式会社 | 固体状担体−ポリメチルアルミノキサン複合体、その製造方法、オレフィン類の重合触媒及びポリオレフィン類の製造方法 |
| US8658556B2 (en) | 2011-06-08 | 2014-02-25 | Exxonmobil Chemical Patents Inc. | Catalyst systems comprising multiple non-coordinating anion activators and methods for polymerization therewith |
| US9340630B2 (en) | 2012-03-28 | 2016-05-17 | Tosoh Finechem Corporation | Method for manufacturing a small particle diameter product of solid polymethylaluminoxane composition |
| EP3286202B1 (en) | 2015-04-20 | 2019-03-13 | Univation Technologies, LLC | Bridged bi-aromatic ligands and transition metal compounds prepared therefrom |
| US20160060430A1 (en) | 2015-11-06 | 2016-03-03 | ExxonMobil Chemical Company - Law Technology | Polyolefin Compositions And Processes For Making The Same |
| KR102121437B1 (ko) | 2016-08-23 | 2020-06-10 | 주식회사 엘지화학 | 신규한 리간드 화합물 및 이를 포함하는 전이금속 화합물 |
| WO2018212852A1 (en) * | 2017-05-19 | 2018-11-22 | Exxonmobil Chemical Patents Inc. | Catalyst systems and polymerization processes for using the same |
| WO2019210029A1 (en) * | 2018-04-26 | 2019-10-31 | Exxonmobil Chemical Patents Inc | A process to make non-coordinating anion type activators in aliphatic and alicyclic hydrocarbon solvents |
| WO2020018254A1 (en) * | 2018-07-16 | 2020-01-23 | Exxonmobil Chemical Patents Inc. | Catalysts for olefin polymerization |
| US11248113B2 (en) * | 2018-11-30 | 2022-02-15 | Exxonmobil Chemical Patents Inc. | Cyclic olefin copolymers and films prepared therefrom |
| US11254763B2 (en) * | 2019-02-12 | 2022-02-22 | Exxonmobil Chemical Patents Inc. | Transition metal bis(phenolate) complexes and their use as catalysts for olefin polymerization |
| US11248070B2 (en) | 2019-02-12 | 2022-02-15 | Exxonmobil Chemical Patents Inc. | Lewis base catalysts and methods thereof |
-
2021
- 2021-07-27 EP EP21766728.6A patent/EP4196507B1/en active Active
- 2021-07-27 WO PCT/US2021/043331 patent/WO2022035585A1/en not_active Ceased
- 2021-07-27 US US18/040,677 patent/US20240018279A1/en active Pending
- 2021-07-27 CN CN202180069829.5A patent/CN116490528B/zh active Active
- 2021-07-27 JP JP2023509861A patent/JP7629985B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002524567A (ja) | 1998-09-12 | 2002-08-06 | ビーピー ケミカルズ リミテッド | 重合触媒 |
| JP2018504512A (ja) | 2015-01-14 | 2018-02-15 | エクソンモービル ケミカル パテンツ インコーポレイテッド | ポリマー組成物の製造方法 |
| JP2019504838A (ja) | 2016-01-25 | 2019-02-21 | リライアンス インダストリーズ リミテッドReliance Industries Ltd. | 遷移金属−シッフ塩基(イミン)配位子錯体の製造方法 |
| US20200255555A1 (en) | 2019-02-12 | 2020-08-13 | Exxonmobil Chemical Patents Inc. | Lewis Base Catalysts and Methods Thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| CN116490528A (zh) | 2023-07-25 |
| JP2023538006A (ja) | 2023-09-06 |
| EP4196507B1 (en) | 2025-05-21 |
| US20240018279A1 (en) | 2024-01-18 |
| WO2022035585A1 (en) | 2022-02-17 |
| EP4196507A1 (en) | 2023-06-21 |
| CN116490528B (zh) | 2025-07-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112351987B (zh) | 含有具有大烷基基团的阳离子的非配位阴离子型活化剂 | |
| JP7242879B2 (ja) | 遷移金属ビス(フェノレート)錯体およびオレフィン重合のための触媒としてのその使用 | |
| JP7757293B2 (ja) | 遷移金属ビス(フェノラート)触媒錯体を用いて得られるポリエチレン組成物及びその生成のための均一プロセス | |
| JP7684981B2 (ja) | 遷移金属ビス(フェノラート)触媒錯体を用いて得られるプロピレンコポリマー及びその生成のための均一プロセス | |
| CN112513110B (zh) | 作为粘度改性剂的乙烯-丙烯线性共聚物 | |
| CN115315452A (zh) | 使用过渡金属双(酚盐)催化剂络合物获得的丙烯聚合物及生产该丙烯聚合物的均相方法 | |
| JP7757294B2 (ja) | 遷移金属ビス(フェノラート)触媒錯体を用いて得られるエチレン-アルファオレフィン-ジエンモノマーのコポリマー及びその生成のための均一プロセス | |
| JP7629985B2 (ja) | 遷移金属ビス(フェノラート)触媒錯体を使用して得られる環含有ポリマー組成物およびその製造方法 | |
| CN114867758B (zh) | 茂金属和其方法 | |
| EP4222180B1 (en) | Bis(heterocyclic-olate) lewis base catalysts and methods thereof | |
| EP3956370A1 (en) | Metallocenes with two -si-si-bridges |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230413 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230413 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240325 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240402 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240607 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240910 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240925 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20241203 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241213 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250121 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250203 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7629985 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |