JP7586819B2 - 不適応性疼痛の処置のためのレシニフェラトキシンの神経周囲投与 - Google Patents
不適応性疼痛の処置のためのレシニフェラトキシンの神経周囲投与 Download PDFInfo
- Publication number
- JP7586819B2 JP7586819B2 JP2021535038A JP2021535038A JP7586819B2 JP 7586819 B2 JP7586819 B2 JP 7586819B2 JP 2021535038 A JP2021535038 A JP 2021535038A JP 2021535038 A JP2021535038 A JP 2021535038A JP 7586819 B2 JP7586819 B2 JP 7586819B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- use according
- rtx
- nerve
- pharma
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- DSDNAKHZNJAGHN-MXTYGGKSSA-N resiniferatoxin Chemical compound C1=C(O)C(OC)=CC(CC(=O)OCC=2C[C@]3(O)C(=O)C(C)=C[C@H]3[C@@]34[C@H](C)C[C@@]5(O[C@@](O4)(CC=4C=CC=CC=4)O[C@@H]5[C@@H]3C=2)C(C)=C)=C1 DSDNAKHZNJAGHN-MXTYGGKSSA-N 0.000 title claims description 153
- IKYCZSUNGFRBJS-UHFFFAOYSA-N Euphorbia factor RL9 = U(1) = Resiniferatoxin Natural products COC1=CC(O)=CC(CC(=O)OCC=2CC3(O)C(=O)C(C)=CC3C34C(C)CC5(OC(O4)(CC=4C=CC=CC=4)OC5C3C=2)C(C)=C)=C1 IKYCZSUNGFRBJS-UHFFFAOYSA-N 0.000 title claims description 146
- DSDNAKHZNJAGHN-UHFFFAOYSA-N resinferatoxin Natural products C1=C(O)C(OC)=CC(CC(=O)OCC=2CC3(O)C(=O)C(C)=CC3C34C(C)CC5(OC(O4)(CC=4C=CC=CC=4)OC5C3C=2)C(C)=C)=C1 DSDNAKHZNJAGHN-UHFFFAOYSA-N 0.000 title claims description 146
- 229940073454 resiniferatoxin Drugs 0.000 title claims description 146
- 208000002193 Pain Diseases 0.000 title claims description 97
- 230000036407 pain Effects 0.000 title claims description 94
- 238000011282 treatment Methods 0.000 title claims description 49
- 239000000203 mixture Substances 0.000 claims description 168
- 238000000034 method Methods 0.000 claims description 123
- 239000003937 drug carrier Substances 0.000 claims description 45
- 241000282326 Felis catus Species 0.000 claims description 44
- 210000005036 nerve Anatomy 0.000 claims description 40
- 238000002347 injection Methods 0.000 claims description 38
- 239000007924 injection Substances 0.000 claims description 38
- 239000008194 pharmaceutical composition Substances 0.000 claims description 34
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical group [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 21
- 210000003414 extremity Anatomy 0.000 claims description 19
- 210000004126 nerve fiber Anatomy 0.000 claims description 18
- 241000124008 Mammalia Species 0.000 claims description 15
- 238000002266 amputation Methods 0.000 claims description 12
- 230000001953 sensory effect Effects 0.000 claims description 12
- 208000004983 Phantom Limb Diseases 0.000 claims description 11
- 239000008363 phosphate buffer Substances 0.000 claims description 11
- 239000011780 sodium chloride Substances 0.000 claims description 11
- 206010056238 Phantom pain Diseases 0.000 claims description 10
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 9
- 208000013404 behavioral symptom Diseases 0.000 claims description 9
- 239000008121 dextrose Substances 0.000 claims description 9
- 230000000694 effects Effects 0.000 claims description 9
- 210000001640 nerve ending Anatomy 0.000 claims description 9
- 230000002159 abnormal effect Effects 0.000 claims description 8
- 241000282849 Ruminantia Species 0.000 claims description 7
- 150000003839 salts Chemical class 0.000 claims description 7
- 238000001356 surgical procedure Methods 0.000 claims description 7
- 210000003099 femoral nerve Anatomy 0.000 claims description 6
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 6
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 6
- 229920000053 polysorbate 80 Polymers 0.000 claims description 6
- 229940068968 polysorbate 80 Drugs 0.000 claims description 6
- 210000001364 upper extremity Anatomy 0.000 claims description 6
- 241000283690 Bos taurus Species 0.000 claims description 5
- 208000005890 Neuroma Diseases 0.000 claims description 5
- 241001494479 Pecora Species 0.000 claims description 5
- 210000005056 cell body Anatomy 0.000 claims description 5
- 229920001223 polyethylene glycol Polymers 0.000 claims description 5
- 210000003497 sciatic nerve Anatomy 0.000 claims description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 5
- 241000283707 Capra Species 0.000 claims description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 4
- 241000283073 Equus caballus Species 0.000 claims description 4
- 229930195725 Mannitol Natural products 0.000 claims description 4
- 239000002202 Polyethylene glycol Substances 0.000 claims description 4
- 239000000872 buffer Substances 0.000 claims description 4
- 239000000594 mannitol Substances 0.000 claims description 4
- 235000010355 mannitol Nutrition 0.000 claims description 4
- 150000005846 sugar alcohols Chemical class 0.000 claims description 4
- 241000282898 Sus scrofa Species 0.000 claims description 3
- 210000000578 peripheral nerve Anatomy 0.000 claims description 3
- 241000009328 Perro Species 0.000 claims description 2
- 210000004247 hand Anatomy 0.000 claims description 2
- 238000009472 formulation Methods 0.000 description 27
- 241001465754 Metazoa Species 0.000 description 23
- 238000011084 recovery Methods 0.000 description 14
- 210000003194 forelimb Anatomy 0.000 description 13
- 230000002093 peripheral effect Effects 0.000 description 13
- 238000012360 testing method Methods 0.000 description 13
- 210000000658 ulnar nerve Anatomy 0.000 description 13
- 108050004388 Transient receptor potential cation channel subfamily V member 1 Proteins 0.000 description 10
- 210000003169 central nervous system Anatomy 0.000 description 10
- 230000006872 improvement Effects 0.000 description 10
- 210000004027 cell Anatomy 0.000 description 9
- 230000006399 behavior Effects 0.000 description 8
- 210000002414 leg Anatomy 0.000 description 8
- 210000003594 spinal ganglia Anatomy 0.000 description 8
- 206010000362 Accessory carpal bone Diseases 0.000 description 7
- 210000002979 radial nerve Anatomy 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 241000282324 Felis Species 0.000 description 6
- 238000011887 Necropsy Methods 0.000 description 6
- 230000001684 chronic effect Effects 0.000 description 6
- 210000001617 median nerve Anatomy 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 241000700159 Rattus Species 0.000 description 5
- 230000002411 adverse Effects 0.000 description 5
- 230000009191 jumping Effects 0.000 description 5
- 210000002569 neuron Anatomy 0.000 description 5
- 230000003040 nociceptive effect Effects 0.000 description 5
- 210000000056 organ Anatomy 0.000 description 5
- 229920000136 polysorbate Polymers 0.000 description 5
- 229950008882 polysorbate Drugs 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 206010015548 Euthanasia Diseases 0.000 description 4
- 230000016571 aggressive behavior Effects 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 231100000517 death Toxicity 0.000 description 4
- 210000002683 foot Anatomy 0.000 description 4
- 210000000245 forearm Anatomy 0.000 description 4
- 208000014674 injury Diseases 0.000 description 4
- 238000007726 management method Methods 0.000 description 4
- 230000002085 persistent effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 206010003739 Attention-seeking behaviour Diseases 0.000 description 3
- 208000000094 Chronic Pain Diseases 0.000 description 3
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 3
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 3
- 206010028851 Necrosis Diseases 0.000 description 3
- 206010070834 Sensitisation Diseases 0.000 description 3
- 208000027418 Wounds and injury Diseases 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 230000000202 analgesic effect Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- YKPUWZUDDOIDPM-SOFGYWHQSA-N capsaicin Chemical class COC1=CC(CNC(=O)CCCC\C=C\C(C)C)=CC=C1O YKPUWZUDDOIDPM-SOFGYWHQSA-N 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 230000008030 elimination Effects 0.000 description 3
- 238000003379 elimination reaction Methods 0.000 description 3
- 229960002725 isoflurane Drugs 0.000 description 3
- 238000004898 kneading Methods 0.000 description 3
- 210000003141 lower extremity Anatomy 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 210000001107 musculocutaneous nerve Anatomy 0.000 description 3
- 230000017074 necrotic cell death Effects 0.000 description 3
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 3
- 239000004810 polytetrafluoroethylene Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000008313 sensitization Effects 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 108010088751 Albumins Proteins 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 208000035404 Autolysis Diseases 0.000 description 2
- 108090000312 Calcium Channels Proteins 0.000 description 2
- 102000003922 Calcium Channels Human genes 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 206010057248 Cell death Diseases 0.000 description 2
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 2
- 238000001134 F-test Methods 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 238000012313 Kruskal-Wallis test Methods 0.000 description 2
- 238000001295 Levene's test Methods 0.000 description 2
- 208000007256 Nevus Diseases 0.000 description 2
- 206010039424 Salivary hypersecretion Diseases 0.000 description 2
- 108010025083 TRPV1 receptor Proteins 0.000 description 2
- 102100029613 Transient receptor potential cation channel subfamily V member 1 Human genes 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 210000003050 axon Anatomy 0.000 description 2
- 231100000871 behavioral problem Toxicity 0.000 description 2
- 230000002146 bilateral effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 230000007850 degeneration Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 230000001627 detrimental effect Effects 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 229930004069 diterpene Natural products 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 210000004744 fore-foot Anatomy 0.000 description 2
- 230000009760 functional impairment Effects 0.000 description 2
- 230000035876 healing Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 210000003127 knee Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 210000001087 myotubule Anatomy 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 231100000062 no-observed-adverse-effect level Toxicity 0.000 description 2
- 210000000929 nociceptor Anatomy 0.000 description 2
- 230000028043 self proteolysis Effects 0.000 description 2
- 210000001044 sensory neuron Anatomy 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 210000000278 spinal cord Anatomy 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 210000003371 toe Anatomy 0.000 description 2
- 210000000689 upper leg Anatomy 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000002699 waste material Substances 0.000 description 2
- QGVLYPPODPLXMB-UBTYZVCOSA-N (1aR,1bS,4aR,7aS,7bS,8R,9R,9aS)-4a,7b,9,9a-tetrahydroxy-3-(hydroxymethyl)-1,1,6,8-tetramethyl-1,1a,1b,4,4a,7a,7b,8,9,9a-decahydro-5H-cyclopropa[3,4]benzo[1,2-e]azulen-5-one Chemical compound C1=C(CO)C[C@]2(O)C(=O)C(C)=C[C@H]2[C@@]2(O)[C@H](C)[C@@H](O)[C@@]3(O)C(C)(C)[C@H]3[C@@H]21 QGVLYPPODPLXMB-UBTYZVCOSA-N 0.000 description 1
- GZNWHPFWQMQXII-UHFFFAOYSA-N 1-(2-ethylphenyl)pyrrole-2,5-dione Chemical compound CCC1=CC=CC=C1N1C(=O)C=CC1=O GZNWHPFWQMQXII-UHFFFAOYSA-N 0.000 description 1
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 1
- 108010082126 Alanine transaminase Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 108010003415 Aspartate Aminotransferases Proteins 0.000 description 1
- 102000004625 Aspartate Aminotransferases Human genes 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 241000282817 Bovidae Species 0.000 description 1
- 235000002566 Capsicum Nutrition 0.000 description 1
- 235000002568 Capsicum frutescens Nutrition 0.000 description 1
- 240000008574 Capsicum frutescens Species 0.000 description 1
- 108091005462 Cation channels Proteins 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 238000001061 Dunnett's test Methods 0.000 description 1
- 241000221079 Euphorbia <genus> Species 0.000 description 1
- 206010015719 Exsanguination Diseases 0.000 description 1
- 241000282818 Giraffidae Species 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 1
- 238000000585 Mann–Whitney U test Methods 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 208000006187 Onycholysis Diseases 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000758706 Piperaceae Species 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 229920002556 Polyethylene Glycol 300 Polymers 0.000 description 1
- 208000008630 Sialorrhea Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 102000003566 TRPV1 Human genes 0.000 description 1
- 208000009979 Traumatic Amputation Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 210000003766 afferent neuron Anatomy 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- 229960002504 capsaicin Drugs 0.000 description 1
- 235000017663 capsaicin Nutrition 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 230000009194 climbing Effects 0.000 description 1
- 230000019771 cognition Effects 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000013872 defecation Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- HRLIOXLXPOHXTA-NSHDSACASA-N dexmedetomidine Chemical compound C1([C@@H](C)C=2C(=C(C)C=CC=2)C)=CN=C[N]1 HRLIOXLXPOHXTA-NSHDSACASA-N 0.000 description 1
- 229960004253 dexmedetomidine Drugs 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical compound C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 1
- 229960000520 diphenhydramine Drugs 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 150000004141 diterpene derivatives Chemical class 0.000 description 1
- 125000000567 diterpene group Chemical group 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 210000005117 flexor retinaculum Anatomy 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 210000000609 ganglia Anatomy 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 230000003370 grooming effect Effects 0.000 description 1
- 210000002758 humerus Anatomy 0.000 description 1
- 230000003116 impacting effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 229960003299 ketamine Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 210000001037 metacarpus Anatomy 0.000 description 1
- DLEDLHFNQDHEOJ-UDTOXTEMSA-N mezerein Chemical compound O([C@@H]1[C@H]([C@@]23[C@H]4[C@](C(C(C)=C4)=O)(O)[C@H](O)[C@@]4(CO)O[C@H]4[C@H]3[C@H]3O[C@@](O2)(O[C@]31C(C)=C)C=1C=CC=CC=1)C)C(=O)\C=C\C=C\C1=CC=CC=C1 DLEDLHFNQDHEOJ-UDTOXTEMSA-N 0.000 description 1
- DLEDLHFNQDHEOJ-KVZAMRGJSA-N mezerein Natural products CC1C(OC(=O)C=C/C=C/c2ccccc2)C3(OC4(OC3C5C6OC6(CO)C(O)C7(O)C(C=C(C)C7=O)C15O4)c8ccccc8)C(=C)C DLEDLHFNQDHEOJ-KVZAMRGJSA-N 0.000 description 1
- 238000007431 microscopic evaluation Methods 0.000 description 1
- 230000027939 micturition Effects 0.000 description 1
- 210000002161 motor neuron Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000000118 neural pathway Anatomy 0.000 description 1
- 230000010004 neural pathway Effects 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000008058 pain sensation Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 230000008447 perception Effects 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- QGVLYPPODPLXMB-QXYKVGAMSA-N phorbol Natural products C[C@@H]1[C@@H](O)[C@]2(O)[C@H]([C@H]3C=C(CO)C[C@@]4(O)[C@H](C=C(C)C4=O)[C@@]13O)C2(C)C QGVLYPPODPLXMB-QXYKVGAMSA-N 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- -1 polytetrafluoroethylene Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 229940071643 prefilled syringe Drugs 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 208000026451 salivation Diseases 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 238000000528 statistical test Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940126703 systemic medication Drugs 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 231100000607 toxicokinetics Toxicity 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 210000000623 ulna Anatomy 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/357—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having two or more oxygen atoms in the same ring, e.g. crown ethers, guanadrel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Inorganic Chemistry (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Dermatology (AREA)
- Pain & Pain Management (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Rheumatology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Microbiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Description
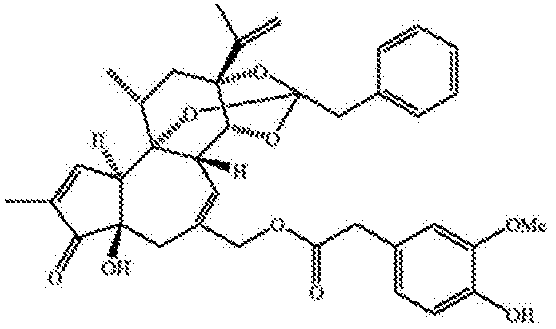
RTXは、赤トウガラシの辛味主成分であるカプサイシンの非常に強力なアナログとして作用する。RTXは、ユーフォルビア(Eurphorbia)のある特定種から単離された三環式ジテルペンである。ホモバニリル基は、カプサイシンの重要な構造的特色であり、レシニフェラトキシンを典型的なホルボール関連化合物と区別する、最も顕著な特色である。天然RTXは、以下の構造を有する。
不適応性疼痛は、治癒にもかかわらず生じ、存在している傷害または他の外部疼痛源には相関しない疼痛である。不適応性疼痛には、それに限定されるものではないが、切断手術を受けた者において生じる疼痛、例えば幻肢痛または断端痛が含まれ、ここでは、治癒プロセス中のニューロンの誤形成が、不適切なニューロンの接続および求心性侵害受容ニューロンの望ましくない活性をもたらし得る。幻肢症候群において経験される疼痛は、不適応性疼痛の一例である。より一般的には、不適応性疼痛は、例えば慢性または持続性求心性侵害受容ニューロン活性後に不適切な量の疼痛が生じ、中枢神経系における疼痛モジュレーション機序が関与する、任意の慢性状態において生じ得る。
不適応性疼痛の処置は、困難なことがある。鎮痛薬の全身投与は、副作用および/または依存性/嗜癖に関する問題に起因して、長期的には望ましくない。一方、侵害受容神経末端の部位における疼痛抑制物質の直接的な投与は、望ましくなく高い用量および/または頻繁な投薬を必要とするおそれがある。さらに、髄腔内および硬膜外投与は、脊髄に近接しているのでリスクがより高い。それにもかかわらず、既存の論文は、不適応性疼痛、例えば幻肢痛における後根神経節および中枢神経系の活性を暗示している。例えば、Subedi et al., Pain Res. Treatment (2011) 2011:864605, 8 pages(幻肢痛の機序における、皮質再構築を伴う中枢神経変化の関与を論じている)、Borkum, J. Rat-Emo. Cognitive-Behav. Ther. (2010) 28:4-24(慢性疼痛における不適応認知の役割を論じている)を参照されたい。現在では、不適応性疼痛の発生は末梢において惹起されるが、中枢神経系において感作をもたらし、その時点でその感作が、末梢治療の成功が期待されない根強い問題になっていると考えられている。したがって、現在の考えでは、後根神経節または中枢神経系を処置せずに後根神経節に対して末梢に位置する神経系の要素に焦点を合わせた処置は、後根神経節または中枢神経系を標的とする処置よりも有効性が低いまたは少ない場合があるという予測に至っている。したがって、当技術分野では、不適応性疼痛の処置において使用するための改善された方法および組成物を開発する必要がある。
ここで、本発明のある特定の実施形態に詳細に言及し、その例を添付の図に例示する。本発明は、例示される実施形態と共に記載されるが、例示される実施形態は、本発明をそれらの実施形態に限定することを企図しないことが理解されよう。それとは対照的に、本発明は、あらゆる代替形態、改変形態、および等価形態を網羅することが企図され、それらは添付の特許請求の範囲によって定義される通り、本発明に含まれ得る。
A.定義
B.使用のための例示的な方法および組成物
1.対象
2.投与部位
3.投薬量
4.製剤
A.ネコにおける神経周囲投与試験のための研究設計
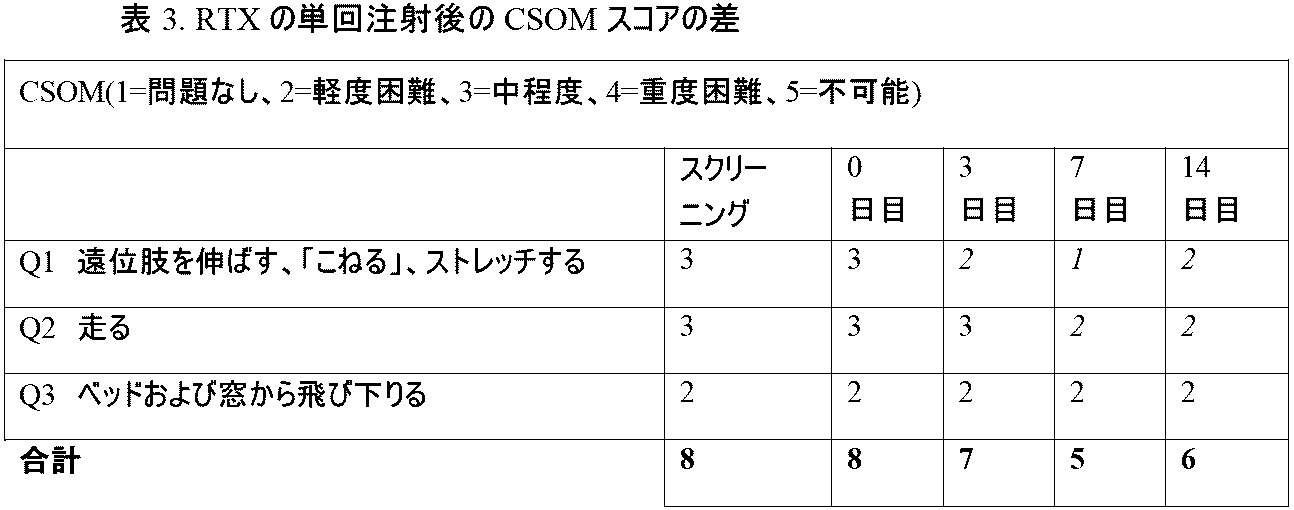
本明細書に記載の通り、RTXの局所領域的適用を、表2に示される通り耐容性、安全性、および鎮痛効果を評価するために、治療抵抗性の限局性不適応性疼痛を有するネコのコホートにおいて使用する。
B.不適応性疼痛に罹患している抜爪ネコへの神経周囲投与
C.抜爪ネコにおける重症慢性遠位肢疼痛についての神経周囲レシニフェラトキシンの研究
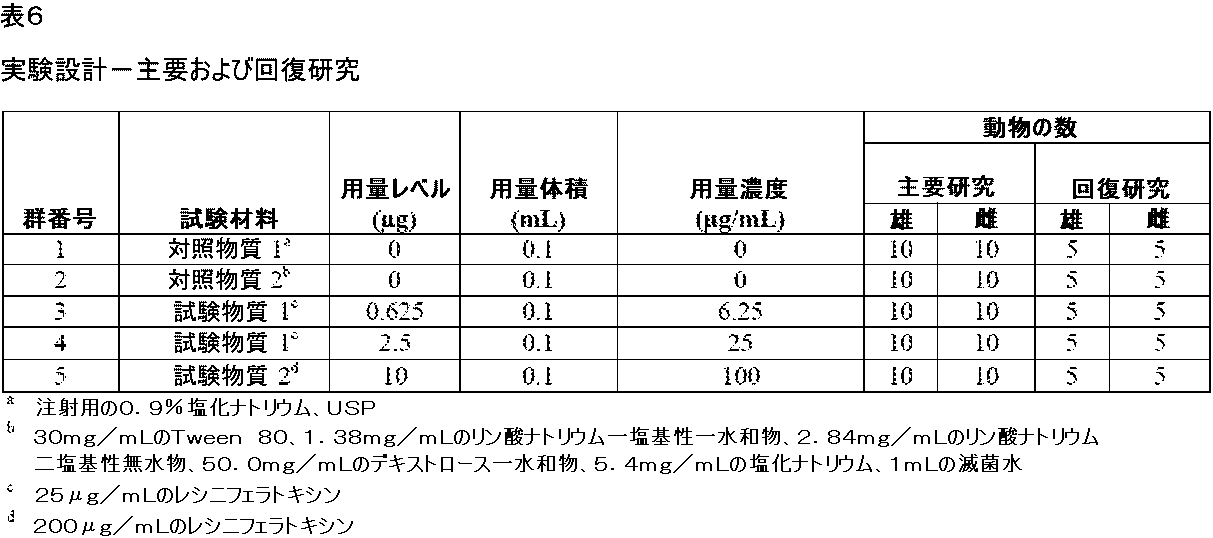
D.ラットにおける神経ブロック注射としてのレシニフェラトキシンの14日間の回復期間を含む単回用量研究
結果
特定の実施形態では、例えば以下の項目が提供される。
(項目1)
不適応性疼痛を処置する方法であって、不適応性疼痛の処置を必要とする対象にレシニフェラトキシン(RTX)を末梢神経周囲投与するステップを含む、方法。
(項目2)
不適応性疼痛を処置する方法における使用のための、レシニフェラトキシン(RTX)を含む組成物であって、前記方法が、不適応性疼痛の処置を必要とする対象にRTXを末梢神経周囲投与するステップを含む、組成物。
(項目3)
前記方法が、0.1μg~100μgの用量のRTXを投与するステップを含む、項目1または2に記載の使用のための方法または組成物。
(項目4)
前記RTXの用量が、0.1~1μg、1~2μg、2~5μg、5~10μg、10~20μg、20~30μg、30~40μg、40~50μg、50~60μg、60~70μg、70~80μg、80~90μg、または90~100μgの範囲である、項目3に記載の使用のための方法または組成物。
(項目5)
前記RTXが、単一部位、複数部位、坐骨神経、伏在神経、大腿神経、橈骨神経、尺骨神経、正中神経、筋皮神経、および/または掌側指神経に神経周囲投与される、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目6)
前記RTXが、1つまたは複数の指、足もしくは手、前肢、肢、および/または関節からの感覚入力に集合的に対応する複数部位に神経周囲投与される、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目7)
前記対象が、切断手術を受けた者である、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目8)
神経周囲投与が、切断部位の下流の1つまたは複数の神経線維を標的とする、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目9)
前記対象が、幻肢痛または断端痛に罹患している、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目10)
神経周囲投与が、切断部位の下流の少なくとも2つ、3つ、4つの、または5つの神経線維を標的とする、項目7から9のいずれか一項に記載の使用のための方法または組成物。
(項目11)
前記対象が、神経末端において異常神経成長を有する、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目12)
神経周囲投与が、その末梢端に異常成長を伴う神経の下流の1つまたは複数の神経線維を標的とする、項目11に記載の使用のための方法または組成物。
(項目13)
神経周囲投与が、神経腫の下流の1つまたは複数の神経線維を標的とする、先行する項目のいずれか一項に記載の使用のための方法または組成物。
(項目14)
前記方法が、前記RTXおよび薬学的に許容される担体を含む医薬製剤を投与するステップを含む、先行する項目のいずれか一項に記載の使用のための方法または組成物。
(項目15)
前記薬学的に許容される担体が、水を含む、項目14に記載の使用のための方法または組成物。
(項目16)
前記薬学的に許容される担体が、ポリソルベート(登録商標)80を含む、項目14または15に記載の使用のための方法または組成物。
(項目17)
前記薬学的に許容される担体が、ポリエチレングリコールを含む、項目14から16のいずれか一項に記載の使用のための方法または組成物。
(項目18)
前記薬学的に許容される担体が、糖または糖アルコールを含む、項目14から17のいずれか一項に記載の使用のための方法または組成物。
(項目19)
前記薬学的に許容される担体が、マンニトールを含む、項目18に記載の使用のための方法または組成物。
(項目20)
前記薬学的に許容される担体が、デキストロースを含む、項目18または19に記載の使用のための方法または組成物。
(項目21)
前記薬学的に許容される担体が、薬学的に許容される緩衝液を含む、項目14から20のいずれか一項に記載の使用のための方法または組成物。
(項目22)
前記薬学的に許容される担体が、リン酸緩衝液を含む、項目21に記載の使用のための方法または組成物。
(項目23)
前記医薬製剤が、6~7.6の範囲のpHを有する、項目14から22のいずれか一項に記載の使用のための方法または組成物。
(項目24)
前記医薬製剤が、6~6.4、6.3~6.7、6.4~6.8、6.8~7.2、7~7.4、または7.2~7.6の範囲のpHを有する、項目23に記載の使用のための方法または組成物。
(項目25)
前記医薬製剤が、6.5または7.2のpHを有する、項目23に記載の使用のための方法または組成物。
(項目26)
前記薬学的に許容される担体が、薬学的に許容される塩を含む、項目14から25のいずれか一項に記載の使用のための方法または組成物。
(項目27)
前記薬学的に許容される塩が、NaClである、項目26に記載の使用のための方法または組成物。
(項目28)
前記医薬製剤におけるRTXの濃度が、0.02~0.1μg/mlまたは0.1~300μg/mlの範囲である、項目14から27のいずれか一項に記載の使用のための方法または組成物。
(項目29)
前記医薬製剤におけるRTXの濃度が、0.02~0.1μg/ml、0.1~1μg/ml、1~5μg/ml、5~10μg/ml、10~20μg/ml、20~50μg/ml、50~100μg/ml、100~150μg/ml、150~200μg/ml、200~250μg/ml、または250~300μg/mlの範囲である、項目28に記載の使用のための方法または組成物。
(項目30)
前記医薬製剤におけるRTXの濃度が、150~250μg/mlの範囲であるか、または約200μg/mlである、項目28または29に記載の使用のための方法または組成物。
(項目31)
前記医薬製剤におけるRTXの濃度が、0.1~200μg/mlの範囲であり、必要に応じて前記医薬製剤におけるRTXの濃度が、0.1~50μg/mlの範囲である、項目28または29に記載の使用のための方法または組成物。
(項目32)
前記RTXが、0.05~10mlの注射体積で投与され、必要に応じて前記注射体積が、0.05~0.2ml、0.2~0.5ml、0.5~1ml、1~2ml、2~5ml、または5~10mlの範囲である、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目33)
前記対象が、哺乳動物である、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目34)
前記対象が、ネコ、イヌ、ウマ、ブタ、反芻動物、ウシ、ヒツジ、ヤギ、または家畜化哺乳動物である、項目33に記載の使用のための方法または組成物。
(項目35)
前記対象が、ヒトである、項目33に記載の使用のための方法または組成物。
(項目36)
前記処置が、前記不適応性疼痛の局所および中枢効果を低減する、前記項目のいずれか一項に記載の使用のための方法または組成物。
(項目37)
前記対象が、処置の前に不適応性疼痛の1つまたは複数の行動症状を有しており、前記処置が、前記1つまたは複数の行動症状を低減または排除する、前記項目のいずれか一項に記載の使用のための方法または組成物。
Claims (38)
- 不適応性疼痛を処置する方法における使用のための、レシニフェラトキシン(RTX)を含む組成物であって、前記方法が、不適応性疼痛の処置を必要とする対象の末梢神経末端と細胞体との間の神経線維に前記組成物を末梢神経周囲投与するステップを含む、組成物。
- 前記方法が、0.1μg~100μgの用量のRTXを投与するステップを含む、請求項1に記載の使用のための組成物。
- 前記RTXの用量が、0.1~1μg、1~2μg、2~5μg、5~10μg、10~20μg、20~30μg、30~40μg、40~50μg、50~60μg、60~70μg、70~80μg、80~90μg、または90~100μgの範囲である、請求項2に記載の使用のための組成物。
- 前記組成物が、単一部位、複数部位、坐骨神経、伏在神経、大腿神経、橈骨神経、尺骨神経、正中神経、筋皮神経、および/または掌側指神経に神経周囲投与される、請求項1から3のいずれか一項に記載の使用のための組成物。
- 前記組成物が、1つまたは複数の指、足もしくは手、前肢、肢、および/または関節からの感覚入力に集合的に対応する複数部位に神経周囲投与される、請求項1から4のいずれか一項に記載の使用のための組成物。
- 前記対象が、切断手術を受けた者である、請求項1から5のいずれか一項に記載の使用のための組成物。
- 神経周囲投与が、切断部位の下流の1つまたは複数の神経線維を標的とする、請求項1から6のいずれか一項に記載の使用のための組成物。
- 前記対象が、幻肢痛または断端痛に罹患している、請求項1から7のいずれか一項に記載の使用のための組成物。
- 神経周囲投与が、切断部位の下流の少なくとも2つ、3つ、4つの、または5つの神経線維を標的とする、請求項6から8のいずれか一項に記載の使用のための組成物。
- 前記対象が、神経末端において異常神経成長を有する、請求項1から9のいずれか一項に記載の使用のための組成物。
- 神経周囲投与が、その末梢端に異常成長を伴う神経の下流の1つまたは複数の神経線維を標的とする、請求項10に記載の使用のための組成物。
- 神経周囲投与が、神経腫の下流の1つまたは複数の神経線維を標的とする、請求項1から11のいずれか一項に記載の使用のための組成物。
- 前記方法が、前記RTXおよび薬学的に許容される担体を含む医薬製剤を投与するステップを含む、請求項1から12のいずれか一項に記載の使用のための組成物。
- 前記薬学的に許容される担体が、水を含む、請求項13に記載の使用のための組成物。
- 前記薬学的に許容される担体が、ポリソルベート(登録商標)80を含む、請求項13または14に記載の使用のための組成物。
- 前記薬学的に許容される担体が、ポリエチレングリコールを含む、請求項13から15のいずれか一項に記載の使用のための組成物。
- 前記薬学的に許容される担体が、糖または糖アルコールを含む、請求項13から16のいずれか一項に記載の使用のための組成物。
- 前記薬学的に許容される担体が、マンニトールを含む、請求項17に記載の使用のための組成物。
- 前記薬学的に許容される担体が、デキストロースを含む、請求項17または18に記載の使用のための組成物。
- 前記薬学的に許容される担体が、薬学的に許容される緩衝液を含む、請求項13から19のいずれか一項に記載の使用のための組成物。
- 前記薬学的に許容される担体が、リン酸緩衝液を含む、請求項20に記載の使用のための組成物。
- 前記医薬製剤が、6~7.6の範囲のpHを有する、請求項13から21のいずれか一項に記載の使用のための組成物。
- 前記医薬製剤が、6~6.4、6.3~6.7、6.4~6.8、6.8~7.2、7~7.4、または7.2~7.6の範囲のpHを有する、請求項22に記載の使用のための組成物。
- 前記医薬製剤が、6.5または7.2のpHを有する、請求項22に記載の使用のための組成物。
- 前記薬学的に許容される担体が、薬学的に許容される塩を含む、請求項13から24のいずれか一項に記載の使用のための組成物。
- 前記薬学的に許容される塩が、NaClである、請求項25に記載の使用のための組成物。
- 前記医薬製剤におけるRTXの濃度が、0.02~0.1μg/mlまたは0.1~300μg/mlの範囲である、請求項13から26のいずれか一項に記載の使用のための組成物。
- 前記医薬製剤におけるRTXの濃度が、0.02~0.1μg/ml、0.1~1μg/ml、1~5μg/ml、5~10μg/ml、10~20μg/ml、20~50μg/ml、50~100μg/ml、100~150μg/ml、150~200μg/ml、200~250μg/ml、または250~300μg/mlの範囲である、請求項27に記載の使用のための組成物。
- 前記医薬製剤におけるRTXの濃度が、150~250μg/mlの範囲であるか、または約200μg/mlである、請求項27または28に記載の使用のための組成物。
- 前記医薬製剤におけるRTXの濃度が、0.1~200μg/mlの範囲である、請求項27または28に記載の使用のための組成物。
- 前記医薬製剤におけるRTXの濃度が、0.1~50μg/mlの範囲である、請求項30に記載の使用のための組成物。
- 前記組成物が、0.05~10mlの注射体積で投与される、請求項1から31のいずれか一項に記載の使用のための組成物。
- 前記注射体積が、0.05~0.2ml、0.2~0.5ml、0.5~1ml、1~2ml、2~5ml、または5~10mlの範囲である、請求項32に記載の使用のための組成物。
- 前記対象が、哺乳動物である、請求項1から33のいずれか一項に記載の使用のための組成物。
- 前記対象が、ネコ、イヌ、ウマ、ブタ、反芻動物、ウシ、ヒツジ、ヤギ、または家畜化哺乳動物である、請求項34に記載の使用のための組成物。
- 前記対象が、ヒトである、請求項34に記載の使用のための組成物。
- 前記処置が、前記不適応性疼痛の局所および中枢効果を低減する、請求項1から36のいずれか一項に記載の使用のための組成物。
- 前記対象が、処置の前に不適応性疼痛の1つまたは複数の行動症状を有しており、前記処置が、前記1つまたは複数の行動症状を低減または排除する、請求項1から37のいずれか一項に記載の使用のための組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862784212P | 2018-12-21 | 2018-12-21 | |
| US62/784,212 | 2018-12-21 | ||
| PCT/US2019/068030 WO2020132553A1 (en) | 2018-12-21 | 2019-12-20 | Perineural administration of resiniferatoxin for treatment of maladaptive pain |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022514014A JP2022514014A (ja) | 2022-02-09 |
| JPWO2020132553A5 JPWO2020132553A5 (ja) | 2022-12-27 |
| JP7586819B2 true JP7586819B2 (ja) | 2024-11-19 |
Family
ID=71100359
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021535038A Active JP7586819B2 (ja) | 2018-12-21 | 2019-12-20 | 不適応性疼痛の処置のためのレシニフェラトキシンの神経周囲投与 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US12144886B2 (ja) |
| EP (1) | EP3898991A4 (ja) |
| JP (1) | JP7586819B2 (ja) |
| KR (1) | KR20210108979A (ja) |
| CN (1) | CN113490745A (ja) |
| AU (1) | AU2019403441A1 (ja) |
| CA (1) | CA3123222A1 (ja) |
| IL (1) | IL283947A (ja) |
| MX (1) | MX2021007453A (ja) |
| SG (1) | SG11202105938RA (ja) |
| WO (1) | WO2020132553A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019049112A1 (en) * | 2017-09-11 | 2019-03-14 | Sorrento Therapeutics, Inc. | RESINIFERATOXIN FORMULATION |
| AU2019403441A1 (en) | 2018-12-21 | 2021-06-10 | Vivasor, Inc. | Perineural administration of resiniferatoxin for treatment of maladaptive pain |
| US11254659B1 (en) | 2019-01-18 | 2022-02-22 | Centrexion Therapeutics Corporation | Capsaicinoid prodrug compounds and their use in treating medical conditions |
| US11447444B1 (en) | 2019-01-18 | 2022-09-20 | Centrexion Therapeutics Corporation | Capsaicinoid prodrug compounds and their use in treating medical conditions |
| WO2020154261A1 (en) | 2019-01-22 | 2020-07-30 | Sorrento Therapeutics, Inc. | Method for treating osteoarthritis pain by administering resiniferatoxin |
| US20240261258A1 (en) * | 2021-05-18 | 2024-08-08 | Sorrento Therapeutics, Inc. | Presurgical Perineural Administration of Resiniferatoxin For Reduction of Post-Operative Pain |
| US20250228765A1 (en) | 2024-01-15 | 2025-07-17 | Gruenenthal Gmbh | Treating knee joint pain by injecting resiniferatoxin at ultra low doses |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006522815A (ja) | 2003-04-08 | 2006-10-05 | アルゴルクス ファーマスーティカルズ,インク | 合成カプサイシンの製造および精製 |
| WO2008109026A1 (en) | 2007-03-05 | 2008-09-12 | Mt Cook Pharma | Pharmaceutical compositions for the localized treatment of neurogenic dysfunction |
| WO2017087803A1 (en) | 2015-11-20 | 2017-05-26 | Sorrento Therapeutics, Inc. | Methods for pain treatment using resiniferatoxin |
| JP2017513864A (ja) | 2014-04-14 | 2017-06-01 | フレックス ファーマ, インコーポレイテッド | イオンチャネル活性化剤及び使用方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6630515B2 (en) | 1997-08-28 | 2003-10-07 | Afferon Corporation | Urinary incontinence therapy |
| US20040146590A1 (en) | 2001-03-22 | 2004-07-29 | Iadarola Michael J | Molecular neurochirurgie for pain control administering locally capsaicin or resinferatoxin |
| JP2006515846A (ja) * | 2002-12-13 | 2006-06-08 | ニューロジェン・コーポレーション | カプサイシン受容体モジュレーターとしての2−置換キナゾリン−4−イルアミン類似体 |
| US20040186182A1 (en) | 2002-12-18 | 2004-09-23 | Algorx | Administration of capsaicinoids |
| US7329664B2 (en) * | 2003-07-16 | 2008-02-12 | Neurogen Corporation | Substituted (7-pyridyl-4-phenylamino-quinazolin-2-yl)-methanol analogues |
| DK1838301T3 (en) * | 2004-12-28 | 2015-04-27 | Mestex Ag | Use of resiniferate toxin (RTX) for the preparation of a pain management agent |
| WO2014019095A1 (de) | 2012-08-03 | 2014-02-06 | Mestex Ag | Resiniferatoxin-lösung |
| IL298314B2 (en) | 2016-04-13 | 2025-04-01 | Univ Nebraska | Methods of administration and methods of treating cardiovascular diseases with resiniparatoxin |
| AU2019403441A1 (en) | 2018-12-21 | 2021-06-10 | Vivasor, Inc. | Perineural administration of resiniferatoxin for treatment of maladaptive pain |
| CA3124499A1 (en) | 2018-12-24 | 2020-07-02 | Sorrento Therapeutics, Inc. | Method for treating parkinson's disease by administering resiniferatoxin |
| WO2020154261A1 (en) | 2019-01-22 | 2020-07-30 | Sorrento Therapeutics, Inc. | Method for treating osteoarthritis pain by administering resiniferatoxin |
| AU2021292420A1 (en) | 2020-06-19 | 2023-02-09 | Vivasor, Inc. | Administration of resiniferatoxin for treatment of bladder pain or bladder cancer |
| US20240261258A1 (en) | 2021-05-18 | 2024-08-08 | Sorrento Therapeutics, Inc. | Presurgical Perineural Administration of Resiniferatoxin For Reduction of Post-Operative Pain |
-
2019
- 2019-12-20 AU AU2019403441A patent/AU2019403441A1/en not_active Abandoned
- 2019-12-20 JP JP2021535038A patent/JP7586819B2/ja active Active
- 2019-12-20 CA CA3123222A patent/CA3123222A1/en active Pending
- 2019-12-20 EP EP19900434.2A patent/EP3898991A4/en not_active Withdrawn
- 2019-12-20 KR KR1020217022875A patent/KR20210108979A/ko not_active Ceased
- 2019-12-20 MX MX2021007453A patent/MX2021007453A/es unknown
- 2019-12-20 SG SG11202105938RA patent/SG11202105938RA/en unknown
- 2019-12-20 WO PCT/US2019/068030 patent/WO2020132553A1/en not_active Ceased
- 2019-12-20 CN CN201980092224.0A patent/CN113490745A/zh active Pending
-
2021
- 2021-06-11 US US17/345,545 patent/US12144886B2/en active Active
- 2021-06-13 IL IL283947A patent/IL283947A/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006522815A (ja) | 2003-04-08 | 2006-10-05 | アルゴルクス ファーマスーティカルズ,インク | 合成カプサイシンの製造および精製 |
| WO2008109026A1 (en) | 2007-03-05 | 2008-09-12 | Mt Cook Pharma | Pharmaceutical compositions for the localized treatment of neurogenic dysfunction |
| JP2017513864A (ja) | 2014-04-14 | 2017-06-01 | フレックス ファーマ, インコーポレイテッド | イオンチャネル活性化剤及び使用方法 |
| WO2017087803A1 (en) | 2015-11-20 | 2017-05-26 | Sorrento Therapeutics, Inc. | Methods for pain treatment using resiniferatoxin |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3898991A4 (en) | 2022-09-14 |
| US12144886B2 (en) | 2024-11-19 |
| JP2022514014A (ja) | 2022-02-09 |
| US20210393515A1 (en) | 2021-12-23 |
| WO2020132553A1 (en) | 2020-06-25 |
| EP3898991A1 (en) | 2021-10-27 |
| SG11202105938RA (en) | 2021-07-29 |
| CA3123222A1 (en) | 2020-06-25 |
| AU2019403441A1 (en) | 2021-06-10 |
| IL283947A (en) | 2021-07-29 |
| CN113490745A (zh) | 2021-10-08 |
| KR20210108979A (ko) | 2021-09-03 |
| MX2021007453A (es) | 2021-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7586819B2 (ja) | 不適応性疼痛の処置のためのレシニフェラトキシンの神経周囲投与 | |
| KR950007233B1 (ko) | 포유동물에게 히알우론산을 원격투여하는 방법 | |
| JP5662492B2 (ja) | 抗炎症製剤 | |
| JP7530365B2 (ja) | レシニフェラトキシンを投与することによって変形性関節症疼痛を処置するための方法 | |
| Koh et al. | Effects of maropitant, acepromazine, and electroacupuncture on vomiting associated with administration of morphine in dogs | |
| McClure et al. | A preliminary field trial evaluating the efficacy of 4% polyacrylamide hydrogel in horses with osteoarthritis | |
| Iacopetti et al. | Effect of MLS® laser therapy with different dose regimes for the treatment of experimentally induced tendinopathy in sheep: pilot study | |
| Cojean et al. | Clinical management of avian renal disease | |
| CN103588672A (zh) | 一种治疗癌性疼痛的药物 | |
| Ramzan | The racehorse: A veterinary manual | |
| US20240261258A1 (en) | Presurgical Perineural Administration of Resiniferatoxin For Reduction of Post-Operative Pain | |
| MX2014004362A (es) | Preparado de huevo con propiedades regeneradoras, analgesicas y/o anti-inflamatorias. | |
| Zhang et al. | Comparison of the effects of nefopam and tramadol on postoperative analgesia in dogs undergoing ovariohysterectomy. | |
| Koch et al. | Principles of Therapy for Lameness: SYSTEMIC/PARENTERAL | |
| EP1227826B1 (en) | Composition comprising an extract of perna canaliculus, methylsulfonylmethane and glucosamine and use thereof | |
| Easter | How to select cases and use autologous conditioned serum to treat proximal suspensory desmitis. | |
| CN118873649B (zh) | 抗cxcl16抗体在制备治疗脊髓损伤药物中的用途 | |
| Beebe | Chinese Herbal Medicine and Prolotherapy for Treatment of Forelimb Angular Deformity in a Juvenile Bactrian Camel. | |
| RU2722162C1 (ru) | Способ лечения травм сухожильно-связочного аппарата у лошадей | |
| CA2577352A1 (en) | Canine and equine collagen joint health supplement | |
| US20210022993A1 (en) | Method of remotely controlling pain | |
| KR20170116498A (ko) | 관절염의 예방 또는 치료용 약학적 조성물 | |
| TW202406540A (zh) | 類黃酮化合物在對抗蛇毒誘發的毒性上的用途 | |
| Bartels | Studies of local anaesthetics for velvet antler analgesia: a thesis presented in partial fulfilment of the requirements for the degree of Master of Science at Massey University | |
| Hailemariam Kefyalew et al. | Post-operative analgesic effect of epidural bupivacaine alone and bupivacaine with tramadol for ovariohysterectomy in bitches. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221219 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20221219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231201 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240603 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240913 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241008 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241107 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7586819 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |