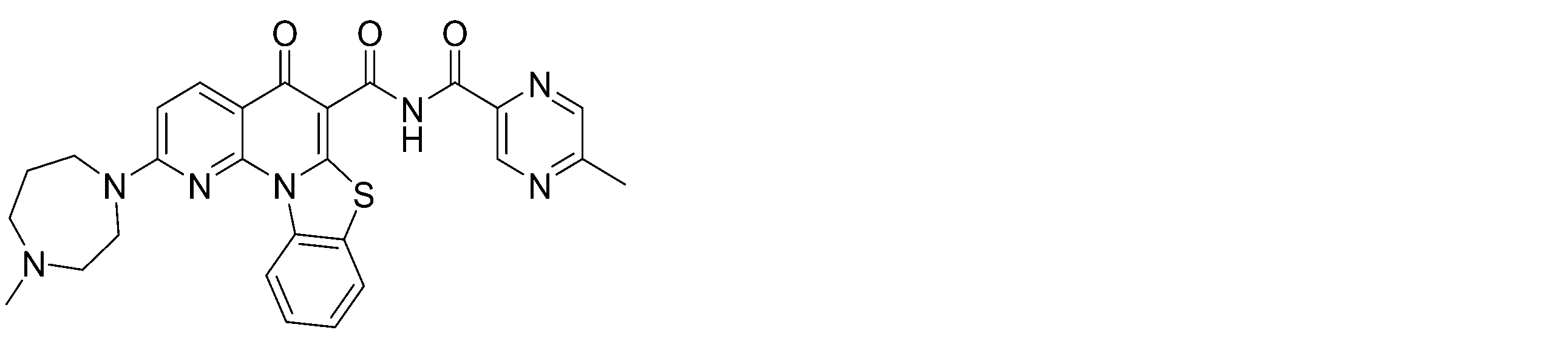本発明は、2-(4-メチル-[1,4]ジアゼパン-1-イル)-5-オキソ-5H-7-チア-1,11b-ジアザ-ベンゾ[c]フルオレン-6-カルボン酸(5-メチル-ピラジン-2-イルメチル)-アミド(化合物I)またはその薬学的に許容される塩もしくは溶媒和物に関する。化合物Iまたはその薬学的に許容される塩もしくは溶媒和物は、G四重鎖(G4)を安定化及び/またはPol Iを阻害し得、細胞の増殖を特徴とする障害の処置に有用であり得る。
定義
本明細書で使用される用語は、特定の実施形態を説明することを目的とするにすぎず、限定することは意図されないことを理解されたい。
別途規定されない限り、本明細書で使用される全ての技術用語及び科学用語は、本願が属する技術分野の当業者に一般的に理解される意味と同じ意味を有する。本明細書に記載される方法及び材料と類似または同等の任意の方法及び材料が、本願の実施または試験に使用され得るが、代表的な方法及び材料が本明細書に記載される。
長年にわたる特許法の慣例に従って、「a」、「an」、及び「the」という用語は、特許請求の範囲を含めて、本願で使用される場合、「1つまたは複数」を指す。故に、例えば、「担体」への言及は、1つまたは複数の担体、2つ以上の担体等の混合物を含む。
「本発明の化合物(複数可)」または「本化合物(複数可)」という用語は、2-(4-メチル-[1,4]ジアゼパン-1-イル)-5-オキソ-5H-7-チア-1,11b-ジアザ-ベンゾ[c]フルオレン-6-カルボン酸(5-メチル-ピラジン-2-イルメチル)-アミド(化合物I)またはその異性体、塩、N-オキシド、スルホキシド、スルホン、もしくは溶媒和物を指す。
「異性体」という用語は、同じ化学式を有するが、異なる立体化学式、構造式、または原子の特有の配置を有する可能性がある化合物を指す。異性体の例としては、立体異性体、ジアステレオマー、エナンチオマー、配座異性体、回転異性体、幾何異性体、及びアトロプ異性体が挙げられる。
「N-オキシド」、別名アミンオキシドまたはアミン-N-オキシドは、本発明の化合物のアミン基の酸化を介して本発明の化合物から誘導される化合物を意味する。N-オキシドは、典型的には、官能基R3N+-O-(R3N=OまたはR3N→Oと記述される場合もある)を含有する。
「エステル」という用語は、分子の-COOH官能基のうちのいずれかが-COOR官能基で置き換えられている本発明の化合物の任意のエステルを指し、ここで、エステルのR部分は、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルキルアルキル、アリール、アリールアルキル、ヘテロシクリル、ヘテロシクリルアルキル、及びそれらの置換誘導体を含むがこれらに限定されない、安定なエステル部分を形成する任意の炭素含有基である。「エステル」という用語は、その薬学的に許容されるエステルを含むが、これに限定されない。薬学的に許容されるエステルには、カルボン酸、リン酸、ホスフィン酸、スルホン酸、スルフィン酸、及びボロン酸を含むがこれらに限定されない、酸性基のアルキル、アルケニル、アルキニル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、シクロアルキル、及びヘテロシクリルエステルが含まれるが、これらに限定されない。
「スルホキシド」は、硫黄(S)原子の酸化を介して本発明の化合物から誘導された化合物を指す。スルホキシドは、一般的に-S(=O)-、-S(O)-、または-(S→O)-と記述される。「スルホン」は、硫黄原子のさらなる酸化を介して本発明の化合物から誘導された化合物を指す。スルホンは、一般的に-S(=O)2-、-S(O)2-、または-(S(→O)2)-と記述される。
本明細書で使用される「室温」という用語は、摂氏21度~摂氏27度を意味する。
「組成物」という用語は、固体、液体、気体、またはそれらの混合物等の物理的形態にある1つまたは複数の物質を表す。組成物の一例は、薬学的組成物、すなわち、医学的処置に関連する、そのために調製される、またはそれに使用される組成物である。「製剤」という用語もまた、固体、液体、気体、またはそれらの混合物等の物理的形態にある1つまたは複数の物質を示すように使用される。
「共投与(co-administration)」または「共投与(coadministration)」という用語は、化合物I、またはその薬学的に許容される塩もしくは溶媒和物を含む製剤または組成物と、(b)1つまたは複数の追加の治療剤及び/または放射線療法との組み合わせた、すなわち連携した様式で一緒にした、投与を指す。
「カルボン酸」という用語は、酢酸及びシュウ酸等の、1つまたは複数のカルボキシル基を特徴とする有機酸を指す。「スルホン酸」は、R-(S(O)2-OH)nの一般式を有する有機酸を指し、式中、Rは有機部分であり、nは1、2、及び3等のゼロを超える整数である。「ポリヒドロキシ酸」という用語は、2つ以上のヒドロキシル基を含有するカルボン酸を指す。ポリヒドロキシ酸の例としては、ラクトビオン酸、グルコン酸、及びガラクトースが挙げられるが、これらに限定されない。
本明細書で使用されるとき、「薬学的に許容される」とは、過度の毒性、刺激、アレルギー応答等を伴わずにヒト及び動物の組織と接触して使用するのに好適であり、合理的なベネフィット/リスク比に見合っており、賢明な医学的判断の範囲内でのそれらの意図される使用に有効であることを意味する。
「塩」は、活性薬剤がその酸または塩基付加塩を作製することによって修飾されている、活性薬剤の誘導体を含む。好ましくは、塩は、薬学的に許容される塩である。かかる塩には、薬学的に許容される酸付加塩、薬学的に許容される塩基付加塩、薬学的に許容される金属塩、アンモニウム及びアルキル化アンモニウム塩が含まれるが、これらに限定されない。酸付加塩には、有機酸ならびに無機酸の塩が含まれる。好適な無機酸の代表的な例としては、塩酸、臭化水素酸、ヨウ化水素酸、リン酸、硫酸、硝酸等が挙げられる。好適な有機酸の代表的な例としては、ギ酸、酢酸、トリクロロ酢酸、トリフルオロ酢酸、プロピオン酸、安息香酸、ケイ皮酸、クエン酸、フマル酸、グリコール酸、乳酸、マレイン酸、リンゴ酸、マロン酸、マンデル酸、シュウ酸、ピクリン酸、ピルビン酸、サリチル酸、コハク酸、メタンスルホン酸、エタンスルホン酸、酒石酸、アスコルビン酸、パモ酸、ビスメチレンサリチル酸、エタンジスルホン酸、グルコン酸、シトラコン酸、アスパラギン酸、ステアリン酸、パルミチン酸、EDTA、グリコール酸、p-アミノ安息香酸、グルタミン酸、ベンゼンスルホン酸、p-トルエンスルホン酸、サルフェート、ナイトレート、ホスフェート、パークロレート、ボレート、アセテート、ベンゾエート、ヒドロキシナフトエート、グリセロホスフェート、ケトグルタレート等が挙げられる。塩基付加塩には、エチレンジアミン、N-メチル-グルカミン、リジン、アルギニン、オルニチン、コリン、N,N’-ジベンジルエチレンジアミン、クロロプロカイン、ジエタノールアミン、プロカイン、N-ベンジルフェネチルアミン、ジエチルアミン、ピペラジン、トリス-(ヒドロキシメチル)-アミノメタン、水酸化テトラメチルアンモニウム、トリエチルアミン、ジベンジルアミン、エフェナミン、デヒドロアビエチルアミン、N-エチルピペリジン、ベンジルアミン、テトラメチルアンモニウム、テトラエチルアンモニウム、メチルアミン、ジメチルアミン、トリメチルアミン、エチルアミン、塩基性アミノ酸、例えば、リジン及びアルギニンジシクロヘキシルアミン等が含まれるが、これらに限定されない。金属塩の例としては、リチウム塩、ナトリウム塩、カリウム塩、マグネシウム塩等が挙げられる。アンモニウム塩及びアルキル化アンモニウム塩の例としては、アンモニウム塩、メチルアンモニウム塩、ジメチルアンモニウム塩、トリメチルアンモニウム塩、エチルアンモニウム塩、ヒドロキシエチルアンモニウム塩、ジエチルアンモニウム塩、ブチルアンモニウム塩、テトラメチルアンモニウム塩等が挙げられる。有機塩基の例としては、リジン、アルギニン、グアニジン、ジエタノールアミン、コリン等が挙げられる。薬学的に許容される塩及びそれらの製剤の調製のための標準的な方法は、当該技術分野で周知であり、例えば、“Remington:The Science and Practice of Pharmacy”,A.Gennaro,ed.,20th edition,Lippincott,Williams & Wilkins,Philadelphia,PA.を含めた、種々の参考文献に開示される。
本明細書で使用されるとき、「溶媒和物」とは、溶媒和によって形成される複合体(溶媒分子と本発明の化合物の分子またはイオンとの組合せ)、または溶質イオンもしくは分子(本発明の化合物)と1つもしくは複数の溶媒分子とからなる凝集体を意味する。本発明において、好ましい溶媒和物は水和物である。水和物の例としては、半水和物、一水和物、二水和物、三水和物、六水和物等が挙げられるが、これらに限定されない。本化合物の薬学的に許容される塩がまた溶媒和物形態で存在してもよいことが当業者には理解されるはずである。溶媒和物は、典型的には、本化合物の調製の一部であるか、または本発明の無水化合物による自然な吸湿によるかのいずれかである水和反応を介して形成される。水和物を含む溶媒和物は、化学量論比で、例えば、溶媒和物分子または水和物分子当たり2個、3個、4個の塩分子で構成され得る。別の可能性として、例えば、2個の塩分子が3個、5個、7個の溶媒分子または水和物分子と化学量論的に関連する。結晶化に使用される溶媒、例えば、アルコール、特にメタノール及びエタノール;アルデヒド;ケトン、特にアセトン;エステル、例えば、酢酸エチルが、結晶格子に埋め込まれてもよい。薬学的に許容される溶媒が好ましい。
薬物動態のバイオアベイラビリティに関して本明細書で使用される「実質的に類似した」という用語は、2つ以上の治療活性薬剤または薬物が、対象において同じ治療効果を提供することを意味する。
本明細書で使用される「~を実質的に含まない」という用語は、示唆される用量で投与される場合に治療上有効量の化合物を含まないが、非治療上有効量の微量の化合物を含み得ることを意味する。
「賦形剤」、「担体」、及び「ビヒクル」という用語は、本願全体を通して互換的に使用され、本発明の化合物と共に投与される物質を表す。
「治療上有効量」とは、疾患または他の望ましくない医学的状態を処置するために患者に投与される場合に、その疾患または状態に関して有益な効果を有するのに十分である、治療活性薬剤の量を意味する。治療上有効量は、治療活性薬剤、疾患または状態及びその重症度、ならびに処置される患者の年齢、体重等に応じて様々であろう。治療上有効量の治療活性薬剤の決定は、当業者の技能の範囲内であり、日常的な実験しか必要としない。
本明細書で使用されるとき、本明細書に記載の化合物に関する「追加の医薬品」または「追加の治療剤」または「追加の治療活性薬剤」という用語は、治療効果を引き出すために投与される、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物以外の活性薬剤を指す。医薬品(複数可)は、本開示の化合物により処置または改善することが意図される状態(例えば、がん)に関連する治療効果を目的とし得るか、あるいは医薬品は、基礎状態の症状(例えば、腫瘍増殖、出血、潰瘍形成、疼痛、リンパ節腫大、咳、黄疸、腫脹、体重減少、悪液質、発汗、貧血、腫瘍随伴現象、血栓症等)を処置もしくは改善すること、または本開示の化合物の副作用の出現もしくは重症度をさらに低減することが意図され得る。
本明細書で使用されるとき、「細胞増殖を特徴とする障害」または「細胞増殖を特徴とする状態」という語句は、がん、良性及び悪性腫瘍を含むが、これらに限定されない。がん及び腫瘍の例としては、大腸、乳房(炎症性乳癌を含む)、肺、肝臓、膵臓、リンパ節、結腸、直腸、前立腺、脳、頭頸部、皮膚、腎臓、骨肉腫、血液及び心臓(例えば、白血病、リンパ腫、及び癌腫)のがんまたは腫瘍増殖が挙げられるが、これらに限定されない。
「処置する」という用語は、対象における状態の少なくとも1つの症状を軽減、緩和、遅延、低減、改善、または管理することのうちの1つまたは複数を意味する。「処置する」という用語はまた、発症の阻止、遅延(すなわち、状態の臨床症状前の期間)、または状態を発症もしくは悪化させるリスクの低減のうちの1つまたは複数を意味する場合がある。
本明細書で使用される「患者」または「対象」という用語は、ヒト及び動物、好ましくは哺乳動物を含む。
本明細書で使用されるとき、細胞増殖を「阻害する」または「低減する」という用語は、本願の方法及び組成物に供されていない増殖細胞と比較した場合に、当業者に既知の方法を使用して測定されるような細胞増殖の量を、例えば、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%減速させる、減少させる、または例えば、停止させることを意味する。
本明細書で使用されるとき、「アポトーシス」という用語は、内因性の細胞自己破壊または自殺プログラムを指す。誘発刺激に応答して、細胞は、細胞収縮、細胞膜の小疱形成、ならびにクロマチン凝縮及び断片化を含む、一連の事象を経る。これらの事象は、やがて細胞を膜結合粒子のクラスター(アポトーシス小体)へと変換させることとなり、これらはその後、マクロファージによって貪食される。
別途指示されない限り、本明細書及び特許請求の範囲で使用される成分量、反応条件等を表す全ての数字は、全ての出現例において「約」という用語によって修飾されているものとして理解されるべきである。したがって、反対の指示がない限り、本明細書及び添付の特許請求の範囲に定められる数値パラメータは、本願によって得られることが求められる所望の特性に応じて様々であり得る近似値である。
化合物I
化合物Iは、合成的に誘導された低分子であり、これはDNA G四重鎖(G4)構造に選択的に結合してそれを安定化させ得る。化合物Iの主要な特質には、分解に向けたインタクトなBRCA1/2及び他の相同組換え媒介経路に依存するG4安定化によるDNA損傷の誘導が含まれる。BRCA1/2及び相同組換え(HR)欠損腫瘍細胞に影響を及ぼす累積変異は、合成致死性をもたらす。
化合物Iは、異なる遺伝的背景(結腸、乳房、及び卵巣)及び異なる種の起源(specifies origin)(マウス及びヒト)のいくつかの細胞株においてBRCA1/2欠損細胞に対して特異的な毒性を示した。化合物Iは、同質遺伝子野生型対照細胞と比較した場合に、異種移植モデルにおけるBRCA2ノックアウト腫瘍細胞において幅広い活性治療指数を表した。いかなる理論にも束縛されるものではないが、これまでのデータは、化合物Iの抗腫瘍活性が、G4 DNA構造に結合してそれを安定化させ、DNA複製複合体の進行を妨げて一本鎖DNAギャップまたは切断を誘導することに起因するとしている。BRCA経路は、化合物I誘導性DNA損傷の修復に必要とされ、BRCA遺伝子の不在下でのその損なわれたDNA損傷の修復は、致死性につながろう。BRCA欠損細胞は、rDNA転写の阻害には有効でない低薬物濃度で化合物Iによって死滅させることができ、このことは、いかなる理論にも束縛されるものではないが、BRCA欠損癌の処置に使用される用量が、RNAポリメラーゼIの阻害及び核子機能の破壊に必要とされる用量よりも低いことを示唆する。
さらに、化合物Iは、PALB2変異型癌に反応性であることが示されている。PALB2遺伝子は、BRCA2遺伝子のパートナー及びローカライザーと呼ばれる。それは、損傷したDNAを修復し、腫瘍増殖を停止させるようにBRCA2タンパク質と共に働くタンパク質を作製するための指示を提供する。2つの異常なPALB2遺伝子を受け継ぐことにより、ファンコニ貧血N型が引き起こされ、これは骨髄機能を抑制して、極めて低レベルの赤血球、白血球、及び血小板につながる。
一部の実施形態では、化合物Iは、遊離塩基である。他の実施形態では、化合物Iは、薬学的に許容される塩として提供される。一実施形態では、塩は、塩酸付加塩、硫酸付加塩、スルホン酸付加塩、カルボン酸付加塩、またはポリヒドロキシ酸付加塩である。
化合物Iは、様々ながん細胞株に対して抗増殖活性を表した。実施例2を参照されたい。
薬学的製剤
一実施形態では、本発明は、活性成分として、本明細書に開示されるような治療上有効量の化合物I、またはその薬学的に許容される塩、エステル、及び/または溶媒和物を、薬学的に許容される賦形剤または担体と組み合わせて含む、薬学的組成物を提供する。賦形剤は、様々な目的で製剤に添加される。
一実施形態では、本開示は、固体または液体製剤に関する。一実施形態では、液体製剤は、静脈内投与用であり得る。一実施形態では、固体製剤は、凍結乾燥させた治療活性成分を含み得る。
希釈剤が本発明の製剤に添加されてもよい。希釈剤は、固体の薬学的組成物の嵩を増加させ、組成物を含有する医薬品剤形を患者及び介護者にとって扱いやすいものにし得る。固体組成物用の希釈剤には、例えば、微結晶セルロース(例えば、AVICEL)、超微細セルロース、ラクトース、デンプン、アルファ化デンプン、炭酸カルシウム、硫酸カルシウム、糖、デキストレート、デキストリン、デキストロース、二塩基性リン酸カルシウム二水和物、三塩基性リン酸カルシウム、カオリン、炭酸マグネシウム、酸化マグネシウム、マルトデキストリン、マンニトール、ポリメタクリレート(例えば、EUDRAGIT(登録商標))、塩化カリウム、粉末セルロース、塩化ナトリウム、ソルビトール、及びタルクが含まれる。液体組成物用の希釈剤には、水、糖類及び/または糖アルコールの水溶液(例えば、グルコース溶液、デキストロース溶液、ラクトース溶液、マルトース溶液、フルクトース溶液)、食塩液、ならびに他の水性媒体が含まれるが、これらに限定されない。
錠剤等の剤形に圧縮固化される固体の薬学的組成物は、賦形剤を含んでもよく、その機能には、圧縮後に活性成分及び他の賦形剤を一緒に結合させるのを助けることが含まれる。固体の薬学的組成物用の結合剤には、アカシア、アルギン酸、カルボマー(例えば、カーボポール)、カルボキシメチルセルロースナトリウム、デキストリン、エチルセルロース、ゼラチン、グアーガム、トラガカントガム、硬化植物油、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース(例えば、KLUCEL)、ヒドロキシプロピルメチルセルロース(例えば、METHOCEL)、液体グルコース、ケイ酸アルミニウムマグネシウム、マルトデキストリン、メチルセルロース、ポリメタクリレート、ポビドン(例えば、KOLLIDON、PLASDONE)、アルファ化デンプン、アルギン酸ナトリウム、及びデンプンが含まれる。
患者の胃中における圧縮固化された固体の薬学的組成物の溶解速度は、組成物に崩壊剤を添加することによって増加させてもよい。崩壊剤には、アルギン酸、カルボキシメチルセルロースカルシウム、カルボキシメチルセルロースナトリウム(例えば、AC-DI-SOL及びPRIMELLOSE)、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、クロスポビドン(例えば、KOLLIDON及びPOLYPLASDONE)、グアーガム、ケイ酸アルミニウムマグネシウム、メチルセルロース、微晶質セルロース、ポラクリリンカリウム、粉末セルロース、アルファ化デンプン、アルギン酸ナトリウム、デンプングリコール酸ナトリウム(例えば、EXPLOBTAB)、ジャガイモデンプン、及びデンプンが含まれる。
圧縮固化されていない固体組成物の流動性を改善し、投薬の精度を改善するために、流動促進剤が添加され得る。流動促進剤として機能し得る賦形剤には、コロイド状二酸化ケイ素、三ケイ酸マグネシウム、粉末セルロース、デンプン、タルク、及び三塩基性リン酸カルシウムが含まれる。
粉末状組成物を圧縮固化することによって錠剤等の剤形を作製する場合には、組成物は、パンチ及びダイ(punch and dye)から圧力をかけられる。一部の賦形剤及び活性成分は、パンチ及びダイの表面に付着する傾向を有し、これにより製品に窪み及び他の表面の不規則性を引き起こし得る。付着を低減し、製品をダイから容易に外すために、滑沢剤が組成物に添加され得る。滑沢剤には、ステアリン酸マグネシウム、ステアリン酸カルシウム、モノステアリン酸グリセリル、パルミトステアリン酸グリセリル、硬化ヒマシ油、硬化植物油、鉱油、ポリエチレングリコール、安息香酸ナトリウム、ラウリル硫酸ナトリウム、フマル酸ステアリルナトリウム、ステアリン酸、タルク、及びステアリン酸亜鉛が含まれる。
一部の実施形態では、化合物Iの結晶形態は、パンチ及びダイからの圧力下に置くことを含む錠剤化プロセスにより維持される。
香味剤及び香味増強剤は、患者にとって剤形をより味の良いものにする。本発明の組成物に含まれ得る一般的な医薬製品用の香味剤及び香味増強剤には、マルトール、バニリン、エチルバニリン、メントール、クエン酸、フマル酸、エチルマルトール、及び酒石酸が含まれる。
固体及び液体組成物はまた、それらの外観を改善するため及び/または患者による製品及び単位投与量レベルの識別を容易にするために、任意の薬学的に許容される着色剤を使用して着色されてもよい。
液体中の薬学的組成物が、本発明の結晶形態及び任意の他の固体賦形剤を使用して調製されてもよく、この場合、構成成分は、水、植物油、アルコール、ポリエチレングリコール、プロピレングリコール、またはグリセリン等の液体担体中に溶解または懸濁される。
液体の薬学的組成物は、液体担体中に溶解しない活性成分または他の賦形剤を組成物全体に均一に分散させるために乳化剤を含有してもよい。本発明の液体の組成物において有用であり得る乳化剤には、例えば、ゼラチン、卵黄、カゼイン、コレステロール、アカシア、トラガカント、ツノマタ、ペクチン、メチルセルロース、カルボマー、セトステアリルアルコール、及びセチルアルコールが含まれる。
液体の薬学的組成物はまた、製品の口当たりを改善するため及び/または胃腸管の内壁をコーティングするために粘度増強剤を含有してもよい。かかる薬剤には、アカシア、アルギン酸ベントナイト、カルボマー、カルボキシメチルセルロースカルシウムまたはナトリウム、セトステアリルアルコール、メチルセルロース、エチルセルロース、ゼラチングアーガム、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、マルトデキストリン、ポリビニルアルコール、ポビドン、炭酸プロピレン、アルギン酸プロピレングリコール、アルギン酸ナトリウム、デンプングリコール酸ナトリウム、デンプントラガカント、及びキサンタンガムが含まれる。
アスパルテーム、ラクトース、ソルビトール、サッカリン、サッカリンナトリウム、スクロース、アスパルテーム、フルクトース、マンニトール、及び転化糖等の甘味剤が、味を改善するために添加されてもよい。
アルコール、安息香酸ナトリウム、ブチル化ヒドロキシルトルエン、ブチル化ヒドロキシアニソール、及びエチレンジアミン四酢酸等の防腐剤及びキレート剤が、保管安定性を改善するために、摂取に安全なレベルで添加されてもよい。
液体組成物はまた、グルコン酸、乳酸、クエン酸もしくは酢酸、グルコン酸ナトリウム、乳酸ナトリウム、クエン酸ナトリウム、または酢酸ナトリウム等の緩衝液を含有してもよい。賦形剤の選択及び使用される量は、経験ならびに当該分野における標準的手順及び参考文献の考慮に基づいて、製剤科学者によって容易に決定され得る。
液体組成物は、注射用であり得る。液体組成物は、限定されないが、水、グルコース溶液、デキストロース溶液、スクロース溶液、または食塩液等の滅菌希釈剤を含有してもよい。
本開示の液体組成物において、組成物のpHは、酸性化剤及び/またはアルカリ化剤を使用して調整することができる。一部の実施形態では、組成物のpHは、HCl水溶液及び/またはNaOH水溶液で調整することができる。一部の実施形態では、組成物のpHは、約4.0~約6.0(それらの間の全ての値及び部分範囲を含む)の範囲にある。
一部の実施形態では、液体組成物は、嫌気条件下で調製される。一部の実施形態では、液体組成物を調製するために使用される材料は、使用前に窒素でスパージされる。一部の実施形態では、液体組成物は、可溶性酸素レベルが1.0ppm未満に達するまで窒素でスパージされる。一部の実施形態では、液体組成物は、窒素下で調製され、密封または蓋をされる。
一実施形態では、液体製剤は、約10mg/mL超、約11mg/mL超、約12mg/mL超、約13mg/mL超、約14mg/mL超、約15mg/mL超、約16mg/mL超、約17mg/mL超、約18mg/mL超、約19mg/mL超、約20mg/mL超、約21mg/mL超、約22mg/mL超、約23mg/mL超、約24mg/mL超、もしくは約25mg/mL超、またはそれらのうちの任意の他の値もしくは値の範囲の濃度で、化合物I、またはその薬学的に許容される塩及び/または溶媒和物を含む。一部の実施形態では、製剤は、約15mg/mL超の濃度で、化合物I、またはその薬学的に許容される塩及び/または溶媒和物を含む。他の実施形態では、製剤は、約25mg/mL超の濃度で、化合物I、またはその薬学的に許容される塩及び/または溶媒和物を含む。
本発明の固体組成物には、粉末、顆粒、凝集体、及び圧縮固化された組成物が含まれる。投与量には、経口、頬側、直腸、非経口(皮下、筋肉内、及び静脈内を含む)、吸入剤、及び眼投与に好適な投与量が含まれる。いずれの所定の場合においても、最も好適な投与は、処置されている状態の性質及び重症度に左右されようが、本発明の最も好ましい経路は、経口である。投与量は、単位剤形で好都合に提示されてもよく、薬学分野で周知の方法のうちのいずれかによって調製されてもよい。
剤形には、錠剤、散剤、カプセル剤、坐剤、サシェ剤、トローチ剤及びロゼンジ剤のような固体剤形、ならびに液体シロップ剤、懸濁剤、エアロゾル剤、及びエリキシル剤が含まれる。
本発明の剤形は、本発明の組成物、好ましくは粉末状または顆粒の固体組成物をハードシェル内またはソフトシェル内のいずれかに含有する、カプセル剤であってもよい。シェルはゼラチンから作製されてもよく、任意選択でグリセリン及びソルビトール等の可塑剤、ならびに乳白剤または着色剤を含有してもよい。
錠剤化またはカプセル充填用の組成物は、湿式造粒法によって調製されてもよい。湿式造粒法では、粉末形態の活性成分及び賦形剤の一部または全てを混ぜ合わせ、次いで液体、典型的には水の存在下でさらに混合することにより、粉末を顆粒へと凝集させる。その顆粒を篩分する、及び/または粉砕し、乾燥させ、次いで篩分する、及び/または粉砕することにより、所望の粒径が得られる。その顆粒は錠剤化されてもよいし、または錠剤化の前に流動促進剤及び/または潤沢剤等の他の賦形剤が添加されてもよい。
錠剤化組成物は、乾式混合によって従来通りに調製されてもよい。例えば、活性物質及び賦形剤の混ぜ合わされた組成物が、スラグまたはシートに圧縮固化され、次いで圧縮固化された顆粒へと粉砕されてもよい。圧縮固化された顆粒はその後、錠剤へと圧縮されてもよい。
乾式造粒法の代替手段として、混ぜ合わされた組成物は、直接圧縮技法を使用して圧縮固化された剤形へと直接圧縮されてもよい。直接圧縮は、顆粒を伴わずにより均一な錠剤を生み出す。直接圧縮錠剤化に特に適している賦形剤には、微晶質セルロース、噴霧乾燥ラクトース、リン酸二カルシウム二水和物、及びコロイド状シリカが含まれる。直接圧縮錠剤化におけるこれらの及び他の賦形剤の適切な使用は、直接圧縮錠剤化の特定の製剤化課題において経験及び技能を有する当業者に既知である。
本発明のカプセル充填剤は、錠剤化に関して説明した前述のブレンド及び顆粒のうちのいずれも含み得るが、それらは、最終的な錠剤化ステップに供されていない。
一実施形態では、化合物I、またはその薬学的に許容される塩及び/または溶媒和物は、投与前に薬学的に許容される担体または溶媒中で再構成される。一実施形態では、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を含む再構成された溶液製剤は、IVによって投与される。
一実施形態では、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物は、凍結乾燥製剤で提供される。凍結乾燥製剤は、増量剤を含み得る。一部の実施形態では、増量剤には、スクロース、マンニトール、及びトレハロースが含まれ得るが、これらに限定されない。化合物Iの凍結乾燥製剤及び液体製剤に関してはPCT/US2019/018225を参照されたい。PCT/US2019/018225の開示は、参照によりそれらの全体が全目的で本明細書に援用される。他の実施形態では、固体または液体製剤は、凍結乾燥形態の化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を使用して調製される。
一実施形態では、凍結乾燥形態の化合物Iまたはその薬学的に許容される塩及び/または溶媒和物から調製された液体製剤が提供される。一実施形態では、液体製剤は、任意の形態の化合物Iまたはその薬学的に許容される塩及び/または溶媒和物から調製され得、提供される。一実施形態では、液体製剤は、任意の固体形態の化合物Iまたはその薬学的に許容される塩及び/または溶媒和物から調製され得、提供される。この液体製剤は、IV投与に使用することができる。
活性成分及び賦形剤は、当該技術分野で既知の方法に従って組成物及び剤形へと製剤化されてもよい。
一実施形態では、剤形は、化合物Iの結晶形態と薬学的に許容される賦形剤及び担体とを別個の構成成分として含む、キットとして提供されてもよい。一部の実施形態では、剤形キットは、医師及び患者が、化合物Iの結晶形態を薬学的に許容される賦形剤及び担体と溶解、懸濁、または混合することによって、使用前に経口溶液または注射液を製剤化することを可能にする。一実施形態では、化合物Iの結晶形態を提供する剤形キットは、事前に製剤化された化合物Iの液体製剤と比較して、化合物Iの安定性を改善させる。
本発明の剤形は、約5mg~約500mg、またはそれらの間の任意の値の量で、本明細書に開示されるような化合物Iまたはその薬学的に許容される塩もしくは溶媒和物の結晶形態のうちの少なくとも1つを含有してもよい。すなわち、本発明の剤形は、約5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、110mg、120mg、125mg、130mg、140mg、150mg、160mg、170mg、175mg、180mg、190mg、200mg、210mg、220mg、225mg、230mg、240mg、250mg、260mg、270mg、275mg、280mg、290mg、300mg、310mg、320mg、325mg、330mg、340mg、350mg、360mg、370mg、375mg、380mg、390mg、400mg、410mg、420mg、425mg、430mg、440mg、450mg、460mg、470mg、475mg、480mg、490mg、または500mgの量で、化合物Iまたはその薬学的に許容される塩もしくはエステルを含有してもよい。
本発明の剤形は、化合物I(遊離塩基、塩、多形等を含めた種々の形態にあり得る)の総量が総計で約5mg~約500mg、またはそれらの間の任意の値となるように、本明細書に開示されるような化合物Iまたはその薬学的に許容される塩もしくはエステルの結晶形態のうちの少なくとも1つを含有してもよい。すなわち、本発明の剤形は、化合物Iの総量が約5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、110mg、120mg、125mg、130mg、140mg、150mg、160mg、170mg、175mg、180mg、190mg、200mg、210mg、220mg、225mg、230mg、240mg、250mg、260mg、270mg、275mg、280mg、290mg、300mg、310mg、320mg、325mg、330mg、340mg、350mg、360mg、370mg、375mg、380mg、390mg、400mg、410mg、420mg、425mg、430mg、440mg、450mg、460mg、470mg、475mg、480mg、490mg、または500mgの量であるように、化合物Iまたはその薬学的に許容される塩もしくはエステルの結晶形態、及び任意選択で化合物Iの他の形態を含む。
一実施形態では、本発明の薬学的製剤または組成物は、製剤または組成物中に25~100重量%または50~100重量%の、本明細書に記載されるような化合物Iの結晶形態のうちの少なくとも1つを含有する。
本開示の一実施形態では、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を含む薬学的製剤のうちのいずれか1つは、約5%未満の不純物を含む。一部の実施形態では、不純物は、約4%未満、約3%未満、約2%未満である。一実施形態では、不純物は、約1%未満である。
本開示の一実施形態では、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を含む薬学的製剤のうちのいずれか1つは、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物の酸化からもたらされる5%未満の不純物を含む。一実施形態では、酸化不純物は、約4%未満、約3%未満、約2%未満、または約1%である。一実施形態では、不純物は、約0.5%未満または約0.1%未満である。
一実施形態では、化合物Iの酸化生成物は、下記から選択される:
一実施形態では、酸化生成物は、ケトン生成物である。一部の実施形態では、酸化生成物は、N-オキシド生成物である。一実施形態では、ケトン生成物は、化合物10である。一実施形態では、N-オキシド生成物は、化合物9である。
本開示の一実施形態では、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を含む薬学的製剤のうちのいずれか1つは、約0.5%未満または約0.1%未満の化合物9を含む。
一実施形態では、本明細書に開示されるような組成物、製剤、剤形のうちのいずれか1つの調製物は、嫌気条件下で調製され得る。
治療的使用
本発明はまた、細胞の増殖に関連する障害の処置も提供する。一態様では、細胞増殖に関連する障害に罹患した細胞を本化合物と接触させることを含む、p53タンパク質を選択的に活性化する方法が提供される。一実施形態では、本方法は、がん及び/または腫瘍細胞を、本明細書に開示されるような化合物I、またはその薬学的に許容される塩、エステル、及び/または溶媒和物の結晶形態と接触させることを含む。別の実施形態では、がん及び/または腫瘍細胞を、本明細書に開示されるような化合物I、またはその薬学的に許容される塩、エステル、及び/または溶媒和物の結晶形態と接触させる方法は、細胞アポトーシスを誘導、または障害の進行を緩和もしくは阻止し得る。
一実施形態では、本発明は、細胞増殖に関連する障害に罹患した細胞を本発明の少なくとも1つの化合物と接触させることを含む、G四重鎖(G4)を安定化する方法を提供する。一実施形態では、方法は、がん及び/または腫瘍細胞を本発明の少なくとも1つの化合物と接触させることを含む。別の実施形態では、がん及び/または腫瘍細胞を本発明の少なくとも1つの化合物と接触させる方法は、細胞アポトーシスを誘導、または障害の進行を緩和もしくは遅延させ得る。
一実施形態では、本発明の化合物は、がん及び/または腫瘍細胞においてG4を安定化するのに有効な量で投与され得、これにより細胞死またはアポトーシスがもたらされ得る。
本発明はまた、対象における細胞増殖を特徴とする障害または状態の進行を処置、予防、改善、及び/または緩和する方法も提供する。より具体的には、本発明の方法は、細胞増殖を特徴とする障害または状態を処置するために、対象において、有効量の本明細書に記載のキノロン化合物の結晶形態を投与することを伴う。結晶形態は、がん及び/または腫瘍細胞においてp53タンパク質を選択的に活性化するのに有効な量で投与され得、これにより細胞死またはアポトーシスがもたらされ得る。「対象」及び「患者」という用語は、本願全体を通して互換的に使用される。
一実施形態では、本発明は、がんの処置を必要とする対象に有効量の本発明の化合物を投与することを含む、がんの処置方法に関する。一実施形態では、本明細書に開示されるような方法によって処置または改善されるがんは、急性リンパ芽球性白血病、急性骨髄性白血病、副腎皮質癌、AIDS関連癌、カポジ肉腫、リンパ腫、肛門癌、虫垂癌、星細胞腫、小児異型奇形腫瘍/ラブドイド腫瘍、基底細胞癌、皮膚癌(非黒色種)、小児胆管癌、肝外膀胱癌、骨癌、ユーイング肉腫ファミリー腫瘍、骨肉腫及び悪性線維性組織球腫、脳幹神経膠腫、脳腫瘍、胎児性腫瘍、胚細胞腫瘍、頭蓋咽頭腫、上衣腫、気管支腫瘍、バーキットリンパ腫(非ホジキンリンパ腫)、カルチノイド腫瘍、胃腸の原発不明癌、心(心臓)腫瘍、原発性リンパ腫、子宮頸癌、小児癌、脊索腫、慢性リンパ性白血病、慢性骨髄性白血病、慢性骨髄増殖性腫瘍、結腸癌、大腸癌、皮膚T細胞リンパ腫、非浸潤性乳管癌、子宮内膜癌、上衣腫、食道癌、嗅神経芽細胞腫、ユーイング肉腫、頭蓋外胚細胞腫瘍、性腺外胚細胞腫瘍、肝外胆管癌、眼癌、眼内黒色腫、網膜芽細胞腫、骨の悪性線維性組織球腫、及び骨肉腫、胆嚢癌、胃(Gastric)(胃(Stomach))癌、消化管カルチノイド腫瘍、消化管間質腫瘍、性腺外癌、卵巣癌、精巣癌、妊娠性絨毛性疾患、神経膠腫、脳幹癌、有毛細胞白血病、頭頸部癌、心臓癌、肝細胞(肝臓)癌、組織球腫、ランゲルハンス細胞癌、ホジキンリンパ腫、下咽頭癌、眼内黒色腫、膵島細胞腫瘍、膵神経内分泌腫瘍、カポジ肉腫、腎臓癌、腎細胞癌、ウィルムス腫瘍及び他の小児腎臓腫瘍、ランゲルハンス細胞組織球症、喉頭癌、白血病、慢性リンパ球性癌、慢性骨髄性癌、有毛細胞癌、口唇及び口腔癌、肝臓癌(原発性)、非浸潤性小葉癌(LCIS)、肺癌、非小細胞癌、小細胞癌、リンパ腫、皮膚T細胞(菌状息肉腫及びセザリー症候群)、ホジキン癌、非ホジキン癌、ワルデンシュトレームマクログロブリン血症、男性乳癌、骨の悪性線維性組織球腫及び骨肉腫、黒色腫、眼内(眼)癌、メルケル細胞癌、悪性中皮腫、原発不明転移性扁平上皮頸部癌、NUT遺伝子が関与する正中管癌、口腔癌、多発性内分泌腫瘍症候群、多発性骨髄腫/形質細胞腫、菌状息肉腫、骨髄異形成症候群、骨髄異形成/骨髄増殖性腫瘍、慢性骨髄性白血病、急性骨髄性白血病、多発性骨髄腫、慢性骨髄増殖性腫瘍、鼻腔及び副鼻腔癌、上咽頭癌、神経芽細胞腫、非ホジキンリンパ腫、非小細胞肺癌、口部癌(Oral Cancer)、口腔癌(Oral Cavity Cancer)、口唇及び口腔咽頭癌、骨肉腫及び骨の悪性線維性組織球腫、上皮癌、低悪性度腫瘍、膵臓癌、膵神経内分泌腫瘍(膵島細胞腫瘍)、乳頭腫症、パラガングリオーマ、副甲状腺癌、陰茎癌、咽頭癌、褐色細胞腫、下垂体腫瘍、形質細胞腫/多発性骨髄腫、胸膜肺芽腫、中枢神経系原発リンパ腫、直腸癌、腎細胞(腎臓)癌、網膜芽細胞腫、横紋筋肉腫、唾液腺癌、肉腫ユーイング癌、カポジ癌、骨肉腫(骨癌)、軟組織癌、子宮癌、セザリー症候群、皮膚癌、小児黒色腫、メルケル細胞癌、非黒色種、小細胞肺癌、小腸癌、軟部組織肉腫、扁平上皮癌、皮膚癌(非黒色種)、原発不明小児扁平上皮頸部癌、転移癌、胃(Stomach)(胃(Gastric))癌、T細胞リンパ腫、皮膚癌、精巣癌、咽頭癌、胸腺腫及び胸腺癌、甲状腺癌、腎盂と尿管の移行上皮癌、原発不明小児癌、小児には稀な癌、尿道癌、子宮癌、子宮内膜癌、子宮肉腫、膣癌、外陰癌、ワルデンシュトレームマクログロブリン血症、ウィルムス腫瘍、ならびに女性のがんから選択されてもよい。
さらに、がん、がん細胞、腫瘍、または腫瘍細胞の処置方法が開示される。本開示の方法によって処置され得るがんの非限定的な例としては、大腸、乳房、肺、肝臓、膵臓、リンパ節、結腸、直腸、前立腺、脳、頭頸部、皮膚、卵巣、子宮頸部、甲状腺、膀胱、腎臓、ならびに血液及び心臓(例えば、白血病、リンパ腫、及び癌腫)のがんまたはがん細胞が挙げられる。本開示の方法によって処置され得る腫瘍の非限定的な例としては、大腸、乳房、肺、肝臓、膵臓、リンパ節、結腸、直腸、前立腺、脳、頭頸部、皮膚、腎臓、ならびに血液及び心臓(例えば、白血病、リンパ腫、及び癌腫)、子宮、胃腸、喉頭、ならびに口腔の腫瘍及び腫瘍細胞が挙げられる。
一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、ヘム癌(血液悪性腫瘍)、大腸癌、乳癌、肺癌、肝臓癌、卵巣癌、子宮頸癌、ユーイング肉腫、膵臓癌、リンパ節の癌、結腸癌、前立腺癌、脳癌、頭頸部の癌、皮膚癌、腎臓癌、心臓の癌、子宮癌、胃腸悪性腫瘍、ならびに喉頭及び口腔の癌からなる群から選択されてもよい。一部の実施形態では、本方法によって処置または改善されるがんは、子宮癌、胃腸悪性腫瘍、ならびに喉頭及び口腔の癌からなる群から選択される。一実施形態では、本方法によって処置または改善されるがんは、白血病、リンパ腫、骨髄腫、及び多発性骨髄腫からなる群から選択される血液悪性腫瘍である。一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、血液悪性腫瘍、大腸癌、乳癌、肺癌、肝臓癌、卵巣癌、子宮頸癌、ユーイング肉腫、膵臓癌、リンパ節の癌、結腸癌、前立腺癌、脳癌、頭頸部の癌、皮膚癌、腎臓癌、骨肉腫、及び心臓の癌からなる群から選択されてもよい。一実施形態では、本方法によって処置または改善されるがんは、白血病、リンパ腫、骨髄腫、及び多発性骨髄腫からなる群から選択されるヘム癌である。
一実施形態では、本発明の化合物は、乳癌の処置に有用である。一実施形態では、本発明の化合物は、卵巣癌の処置に有用である。一実施形態では、本発明の化合物は、固形腫瘍の処置に有用である。一実施形態では、本発明の化合物は、膵臓癌の処置に有用である。一実施形態では、本発明の化合物は、膵臓腫瘍の処置に有用である。一実施形態では、本発明の化合物は、非小細胞肺癌の処置に有用である。一実施形態では、本発明の化合物は、血液悪性腫瘍の処置に有用である。一実施形態では、本発明の化合物は、血液悪性腫瘍の処置に有用である。
一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、対象がDNA修復遺伝子において変異を有するものであり得る。具体的な実施形態では、DNA修復遺伝子は、相同組換え遺伝子である。別の実施形態では、DNA修復遺伝子は、相同組換え(HR)依存性のデオキシリボ核酸(DNA)二本鎖切断(DSB)修復経路における遺伝子である。具体的な実施形態では、DNA修復遺伝子は、相同組換え(HR)または非相同末端結合(NHEJ)遺伝子である。別の実施形態では、DNA修復遺伝子は、相同組換え(HR)または非相同末端結合(NHEJ)依存性のデオキシリボ核酸(DNA)二本鎖切断(DSB)修復経路における遺伝子である。別の方法では、DNA修復遺伝子は、BRCA1、BRCA2、ATM、ATR、CHK1、CHK2、Rad51、RPA、及びXRCC3からなる群から選択される1つまたは複数の遺伝子である。
本明細書に開示されるような方法のうちのいずれか1つの一実施形態では、対象は、HR経路、ファンコニ貧血経路、ミスマッチ修復経路、ATM経路、細胞周期経路、p53シグナル伝達経路、ポリメラーゼ経路、トポイソメラーゼ経路における1つまたは複数の遺伝子において変異を有する。一実施形態では、対象は、HR修復、ATM経路、細胞周期、トポイソメラーゼ、二本鎖切断修復、除去修復、C-Myb転写因子ネットワーク、p-53シグナル伝達、及び/またはアポトーシスもしくはゲノム安定性において機能を有する1つまたは複数の遺伝子において変異を有する。一実施形態では、対象は、BRCA1、BRCA2、PTEN、ATM、CHEK1、TOP2A、ABL1、PER1、RAD51、ERCC5、NBN、TRIM28、SETMAR、RAD54L、EYA1、及びTP53から選択される1つまたは複数の遺伝子において変異を有する。一実施形態では、対象は、ARID1A、ATM、ATR、BAP1、BARD1、BLM、BRCA1、BRCA2、CHEK1、CHEK2、ERCC3、FANCG、FANCI、FANCL、HELQ、MLH1、MRE11A、MSH2、MSH6、MUTYH、PMS1、POLE、POLR1B、PTEN、RAD17、RAD51D、RAD54L、TOP3A、及び/またはWRNから選択される1つまたは複数の遺伝子において変異を有する。
一実施形態では、対象は、BRCA1、BRCA2、TP53、及びPALB2から選択される1つまたは複数の遺伝子において変異を有する。別の実施形態では、対象は、BRCA1、及び/またはBRCA2遺伝子、及び/またはHR経路の他の遺伝子において変異を有する。一部の実施形態では、変異は、体細胞変異である。他の実施形態では、変異は、生殖細胞変異である。
一実施形態では、化合物Iまたはその薬学的に許容される塩の有効性は、HR経路またはファンコニ貧血経路における遺伝子の変異またはコピー数損失に関連し、該遺伝子は、ARID1A、ATM、ATR、BAP1、BARD1、BLM、BRCA1、BRCA2、FANCG、FANCI、FANCL、HELQ、MRE11A、NBN、PALB2、PTEN、RAD51、RAD51D、RAD54L、及び/またはWRNから選択される。一実施形態では、化合物Iまたはその薬学的に許容される塩の有効性は、HR経路遺伝子BRCA2及び/またはPALB2の変異またはコピー数損失に関連する。
別の実施形態では、本方法によって処置または改善されるがんは、BRCA1遺伝子(乳癌1型)、BRCA2(乳癌2型)、及び/または相同組換え経路の他のメンバーにおいて欠陥を持つがん細胞を含む。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2を欠損している。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2における変異についてホモ接合型である。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2における変異についてヘテロ接合型である。一部の実施形態では、がん細胞は、生殖細胞系列BRCA1及び/またはBRCA2を欠損している。別の実施形態では、がん細胞は、体細胞系列BRCA1及び/またはBRCA2を欠損している。
一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA2欠損型である。別の実施形態では、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物は、BRCA2機能正常(proficient)またはBRCA2野生型細胞と比べて、BRCA2欠損またはBRCA2ノックアウト細胞においてより多くのアポトーシス細胞死を誘導する。一実施形態では、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物は、BRCA2機能正常またはBRCA2野生型細胞よりも、BRCA2欠損またはBRCA2ノックアウト細胞に対して選択的に毒性がある。他の実施形態では、BRCA2欠損またはBRCA2ノックアウト細胞は、BRCA2機能正常またはBRCA2野生型細胞と比較したときに、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物に対してより高い感受性を表す。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA1またはBRCA2遺伝子における1つまたは複数の変異を特徴とする。BRCA1及びBRCA2は、腫瘍抑制遺伝子であり、DNA損傷修復に関与するタンパク質をコードする。BRCA1またはBRCA2タンパク質の発現または活性を変化させる変異は、遺伝的変更の蓄積につながる場合があり、対象におけるがんにつながり得る。かかる変異は、本明細書で「疾患関連変異」と称される。一部の実施形態では、がんは、BRCA1及びBRCA2遺伝子における1つまたは複数の変異を特徴とする。一部の実施形態では、がんは、BRCA1遺伝子における1つまたは複数の変異を特徴とするが、BRCA2遺伝子においては変異を有しない。一部の実施形態では、がんは、BRCA2遺伝子における1つまたは複数の変異を特徴とするが、BRCA1遺伝子においては変異を有しない。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA1またはBRCA2における1つまたは複数の疾患関連変異を特徴とする。一部の実施形態では、がんは、BRCA1及びBRCA2における1つまたは複数の疾患関連変異を特徴とする。一部の実施形態では、がんは、BRCA1における1つまたは複数の疾患関連変異を特徴とするが、BRCA2においては疾患関連変異を持たない。一部の実施形態では、がんは、BRCA2における1つまたは複数の疾患関連変異を特徴とするが、BRCA1においては疾患関連変異を持たない。
一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA変異体またはBRCA様変異体がんである。一部の実施形態では、BRCA変異体またはBRCA様変異体がんは、BRCA2変異型癌である。他の実施形態では、BRCA変異体またはBRCA様変異体がんは、乳癌、卵巣癌、膵臓癌、または前立腺癌である。一実施形態では、BRCA変異体またはBRCA様変異体がんは、乳癌または前立腺癌である。一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA変異体がんである。一部の実施形態では、BRCA変異体がんは、BRCA2変異型癌である。他の実施形態では、BRCA変異体がんは、乳癌、卵巣癌、膵臓癌、または前立腺癌である。他の実施形態では、BRCA変異体がんは、乳癌、卵巣癌、または膵臓癌である。一実施形態では、BRCA変異体がんは、乳癌または前立腺癌である。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、BRCA駆動型(driven)がんである。一部の実施形態では、がんは、BRCA1駆動型がんである。一部の実施形態では、がんは、BRCA2駆動型がんである。一部の実施形態では、がんは、BRCA1駆動型及びBRCA2駆動型がんである。一部の実施形態では、がんは、BRCA1駆動型がんでも、BRCA2駆動型がんでもない。
一実施形態では、本開示は、ヒト対象における細胞増殖障害の処置方法または改善方法に関し、該方法は、それを必要とする対象に、治療上有効量の、本明細書に開示されるような本発明の化合物または本発明の化合物から調製された製剤を投与することを含む。一部の実施形態では、ヒト対象は、BRCA変異を保有する。他の実施形態では、ヒト対象は、BRCA2変異を保有する。別の実施形態では、ヒト対象は、BRCA2における変異についてホモ接合型である。
一実施形態では、本開示は、ヒト対象における細胞増殖障害の処置方法または改善方法に関し、該方法は、それを必要とする対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することを含む。一部の実施形態では、ヒト対象は、BRCA変異を保有する。他の実施形態では、ヒト対象は、BRCA2変異を保有する。別の実施形態では、ヒト対象は、BRCA2における変異についてホモ接合型である。
一実施形態では、BRCA2変異は、BRCA2遺伝子の置換、有害な短縮、スプライシング、挿入、または欠失である。一部の実施形態では、BRCA2変異は、機能喪失型変異である。
一実施形態では、BRCA2変異は、4088insA、c.68-80insT、c.793+34T>G、999del5、6503delTT、4486delG、2594delC、5382insC、3829delT、Q563X、3438G>T、1675delA、999del5、8295T4A、9900insA、5579insA、7647delTG、7253delAA、9303ins31、3034del4bp、5910C3G、6676insTA、6085G>T、8765delAG、3398delAAAAG、1499insA、7525_7526insT、6174delT、c.289G>T、c.2950G>T、c.7963C>T、c.8878C>T、
6503-6504delTT、9132delC、9254del5、c.9254_9258delATCAT、c.3492_3493insT、9475A>G、c.9026_9030delATCAT、c.3264insT、c.8978_8991del14、c.156_157insAlu、6238ins2del21、10323delCins11、8876delC、8138_8142del5、c.8765_8766delAG、エクソン21-24 del、c.6589delA、4817A>G、8477delAGA、8984delG、G4X、3783del10、c.5101C>T、c.5433_5436delGGAA、c.7806-2A>G、c.5291C>G、c.3975_3978dupTGCT、IVS16-2A>G、c.3318C>A、c.4790C>A、9326insA及び6174delT、8984delG、1913T>A、1342C>A、3199A>G、1093A>C、c.3394C>T、c.7697T>C、5531delTT、C5507G、6174delT、c.5373_5376 del GTAT、c.373G>T、S2219X、C1290Y、6633del5、3034delACAA、818delA、エクソン8-9 del、c.3036_3039delACAA、c.6024_6025_delTA、c.2732_2733insA、c.3870_3873delG、4150G>T、6027del4、c.5114_5117delTAAA、c.2639_2640delTG、6880 insG、3034 del AAAC、695insT、1528del4、9318del4、S1099X、5802delAATT、8732C>A、c.2835C>A、c.7480C>T、1627A.T、3972delTGAG、7708C.T、7883delTTAA、c.2808_2811delACAA、c.3109C>T、c.7436_7805del370、c.9097_9098insA、2670delC、3073delT、6696-7delTC、エクソン4-11 dup、4859delA、4265delCT、1342C.A、490 delCT、3337C>T、5057delTG、g.-1235G>A、g.-26G>A、g.681+56C>T、c.865A>C、c.1114A>C、c.1365A>G、c.2229T>C、c.2971A>G、c.3396A>G、c.3516G>A、c.3807T>C、c.4415_4418delAGAA、c.5529A>C、c.6033_6034insGT、c.7242A>G、g.7435+53C>T、g.7806-14T>C、g.8755-66T>C、c.4415-4418delAGAA、c.6033insGT、c.5576_5579delTTAA、c.9485-1G>A、4265delCT、4859delA、6775G>T、p.Glu2183X、c.2699_2704delTAAATG、4706delAAAG、R2336P、IVS2+1G>A、8765delAG、999 del 5、1537 del4、5909 insA、c.211dupA、c.3381delT/3609delT、c.7110delA/7338delA、c.7235insG/7463insG、c.2826_2829del、c.6447_6448dup、c.5771_5774del、及び/または5999del4のうちの1つまたは複数におけるコーディング変化または変異として存在する。Karami,F.et al.BioMed Res.Int’l2013,2013,Article ID 928562を参照されたく、同文献は参照によりその全体が全目的で本明細書に援用される。
一実施形態では、BRCA2変異は、c.8537_8538del AG、エクソン20におけるc.8537_8538del AG変異、c.859G>C、エクソン7におけるc.859G>C、c.4614T>C、p.Ser1538Ser同義変異、c.5946delT、p.S1982fs、c.6819DelinsGT、c.6592G>T、c.3847_3848delGT、c.6821G>T、またはエクソン11におけるc.6821G>Tのうちの1つまたは複数におけるコーディング変化または変異として存在する。
一実施形態では、本開示の化合物は、親細胞株と比べてBRCA2ヌル細胞株に対して感受性を示す。一実施形態では、BRCA2ヌル細胞株の感受性は、BRCA2野生型細胞株よりも少なくとも200倍高い。他の実施形態では、感受性は、少なくとも20倍高い。一部の実施形態では、感受性は、少なくとも200倍高い。他の実施形態では、感受性は、少なくとも2、5、10、15、20、25、30、35、40、45、50、60、70、80、90、100、125、150、175、200、または400倍高い。
一実施形態では、本開示は、対象におけるがんの処置方法に関し、該方法は、治療上有効量の化合物I、またはその薬学的に許容される塩及び/または溶媒和物を対象に投与することを含み、該対象は、PALB2変異及び/またはBRCA2変異を有する。一実施形態では、対象は、PALB2変異を有する。一実施形態では、対象は、BRCA2変異を有する。一実施形態では、対象は、PALB2変異及びBRCA2変異を有する。一実施形態では、対象は、相同組換え経路における1つまたは複数の追加の遺伝子変異を有する。
別の実施形態では、本方法によって処置または改善されるがんは、PALB2遺伝子において欠陥を持つがん細胞を含む。別の実施形態では、がん細胞は、PALB2を欠損している。別の実施形態では、がん細胞は、PALB2における変異についてホモ接合型である。別の実施形態では、がん細胞は、PALB2における変異についてヘテロ接合型である。
一実施形態では、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物は、PALB2機能正常またはPALB2野生型細胞と比べて、PALB2欠損またはPALB2ノックアウト細胞においてより多くのアポトーシス細胞死を誘導する。一実施形態では、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物は、PALB2機能正常またはPALB2野生型細胞よりも、PALB2欠損またはPALB2ノックアウト細胞に対して選択的に毒性がある。他の実施形態では、PALB2欠損またはPALB2ノックアウト細胞は、PALB2機能正常またはPALB2野生型細胞と比較したときに、化合物Iまたはその薬学的に許容される塩もしくは溶媒和物、すなわち本発明の化合物に対してより高い感受性を表す。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、PALB2遺伝子における1つまたは複数の変異を特徴とする。PALB2タンパク質の発現または活性を変化させる変異は、遺伝的変更の蓄積につながる場合があり、対象におけるがんにつながり得る。かかる変異は、本明細書で「疾患関連変異」と称される。一部の実施形態では、がんは、PALB2遺伝子における1つまたは複数の変異を特徴とする。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、PALB2における1つまたは複数の疾患関連変異を特徴とする。
一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、PALB2変異体またはPALB2様変異体がんである。一部の実施形態では、PALB2変異体またはPALB2様変異体がんは、PALB2変異型癌である。他の実施形態では、PALB2変異体またはPALB2様変異体がんは、乳癌、卵巣癌、膵臓癌、または前立腺癌である。一実施形態では、PALB2変異体またはPALB2様変異体がんは、乳癌または前立腺癌である。一実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、PALB2変異体がん(PALB2変異型癌)である。他の実施形態では、PALB2変異体がんは、乳癌、卵巣癌、膵臓癌、または前立腺癌である。他の実施形態では、PALB2変異体がんは、乳癌、卵巣癌、または膵臓癌である。一実施形態では、PALB2変異体がんは、乳癌または前立腺癌である。
一実施形態では、PALB2変異は、PALB2遺伝子の機能喪失型変異である。一実施形態では、PALB2変異は、PALB2遺伝子がその機能を喪失する原因となる。一実施形態では、PALB2変異は、PALB2遺伝子の置換、有害な短縮、スプライシング、挿入、または欠失である。一部の実施形態では、PALB2変異は、片アレルにおける機能喪失型変異である。他の実施形態では、PALB2変異は、両アレルにおける機能喪失型変異である。
一実施形態では、本開示は、ヒト対象における細胞増殖障害の処置方法または改善方法に関し、該方法は、それを必要とする対象に、治療上有効量の、本明細書に開示されるような本発明の化合物または本発明の化合物から調製された製剤を投与することを含む。一部の実施形態では、ヒト対象は、PALB2変異を保有する。別の実施形態では、ヒト対象は、PALB2における変異についてホモ接合型である。
一部の実施形態では、本明細書に開示されるような方法のうちのいずれか1つによって処置または改善されるがんは、PALB2駆動型がんである。
一実施形態では、本開示は、ヒト対象における細胞増殖障害の処置方法または改善方法に関し、該方法は、それを必要とする対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することを含む。一部の実施形態では、ヒト対象は、PALB2変異を保有する。別の実施形態では、ヒト対象は、PALB2における変異についてホモ接合型である。
一実施形態では、PALB2変異は、c.48G>A、c.72del、c.156del、c.172_175del、c.196C>T、c.229del、c.451C>T、c.509_510del、c.757_758del、c.886del、c.956_962del、c.1027C>T、c.1037_1041del、c.1108C>T、c.1240C>T、c.1314del、c.1431del、c.1571C>G、c.1591_1600del、c.1592del、c.1653T>A、c.2074C>T、c.2167_2168del、c.2257C>T、c.2323C>T、c.2386G>T、c.2515-1G>T、c.2521del、c.2686dup、c.2718G>A、c.2787_2788del、c.2834+1G>T、c.2835-1G>C、c.2888del、c.2919_2920del、c.2982dup、c.3022del、c.3113G>A、c.3116del、c.3201+1G>C、c.3323del、c.3423_3426del、c.3426dup、c.3456dup、c.3497_3498del、c.3504_3505del、c.3549C>A、c.3549C>G、del5340bp、またはc.3362delのうちの1つまたは複数におけるコーディング変化として存在する。Antoniou,A.C.et al.N.Engl.J.Med.2014,371,497-506を参照されたく、同文献は参照によりその全体が全目的で本明細書に援用される。
一実施形態では、本開示は、対象におけるがんの処置方法に関し、該方法は、a)対象がBRCA1、BRCA2、またはPALB2変異を持つかどうかを決定することと、b)対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2変異を持つかどうかを決定することと、b)対象がBRCA1、BRCA2、またはPALB2変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2変異を持つかどうかを決定することと、b)対象がBRCA2またはPALB2変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2変異を持つかどうかを決定することと、b)対象がBRCA2変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2変異を持つかどうかを決定することと、b)対象がPALB2変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。
一実施形態では、本開示は、対象におけるがんの処置方法に関し、該方法は、a)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つかどうかを決定することと、b)対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つかどうかを決定することと、b)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つかどうかを決定することと、b)対象がBRCA2またはPALB2遺伝子における疾患関連変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つかどうかを決定することと、b)対象がBRCA2遺伝子における疾患関連変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。一実施形態では、対象におけるがんの処置方法は、a)対象がBRCA1、BRCA2、またはPALB2遺伝子における疾患関連変異を持つかどうかを決定することと、b)対象がPALB2遺伝子における疾患関連変異を持つ場合、その対象に、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することと、を含む。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2を欠損している。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2における変異についてホモ接合型である。別の実施形態では、がん細胞は、BRCA1及び/またはBRCA2における変異についてヘテロ接合型である。一部の実施形態では、がん細胞は、生殖細胞系列BRCA1及び/またはBRCA2を欠損している。別の実施形態では、がん細胞は、体細胞系列BRCA1及び/またはBRCA2を欠損している。
さらに、本開示は、がん、がん細胞、腫瘍、または腫瘍細胞の処置方法に関し、該方法は、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を投与することを含む。本開示はまた、がん、がん細胞、腫瘍、または腫瘍細胞の処置方法に関し、該方法は、治療上有効量の本発明の化合物または本発明の化合物から調製された製剤を、それを必要とする対象に投与することを含む。本開示の方法によって処置され得るがんの非限定的な例としては、大腸、乳房、卵巣、子宮頸部、肺、肝臓、膵臓、リンパ節、結腸、直腸、前立腺、脳、頭頸部、皮膚、腎臓、骨肉腫、骨(例えば、ユーイング肉腫)、血液及び心臓(例えば、白血病、リンパ腫、癌腫)、子宮、胃腸悪性腫瘍、ならびに喉頭及び口腔の癌のがんまたはがん細胞が挙げられる。本開示の方法によって処置され得る腫瘍の非限定的な例としては、大腸、乳房、卵巣、子宮頸部、肺、肝臓、膵臓、リンパ節、結腸、直腸、前立腺、脳、頭頸部、皮膚、腎臓、骨肉腫、骨(例えば、ユーイング肉腫)、血液及び心臓(例えば、白血病、リンパ腫、癌腫)、子宮、胃腸悪性腫瘍、ならびに喉頭及び口腔の癌の腫瘍及び腫瘍細胞が挙げられる。
本発明はまた、Pol I転写を減少させる方法も提供し、該方法は、本発明の化合物または本発明の化合物から調製された製剤を、必要性のある対象に投与することを含む。一部の実施形態では、Pol I転写の阻害は、末梢血単核細胞(PBMC)中で起こる。他の実施形態では、Pol I転写の阻害は、有効量の本発明の化合物または本発明の化合物から調製された製剤を含む用量のIV注入後1時間で、PBMC中で観察され得る。
一実施形態では、注入後1時間でのPBMC中のPol I転写の阻害は、平均で約15%以上の阻害レベルである。別の実施形態では、注入後1時間でのPBMC中のPol I転写は、平均で約5%以上の阻害、約10%以上の阻害、約15%以上の阻害、約20%以上の阻害、約25%以上の阻害、約30%以上の阻害、約35%以上の阻害、約40%以上の阻害、約45%以上の阻害、約50%以上の阻害、約55%以上の阻害、約65%以上の阻害、または約70%以上の阻害レベルである。
本明細書に開示される本方法の一実施形態では、Pol I転写の阻害は、MACS(磁気活性化細胞選別)で選別された腫瘍細胞中で観察され得る。
本明細書で使用されるとき、投与は、当業者に既知の種々の方法のうちのいずれかを使用して遂行または実施され得る。本発明の化合物または本発明の化合物から調製された製剤は、従来の非毒性の生理学的に許容される担体もしくはビヒクルを含有する投与製剤において、例えば、皮下に、静脈内に、非経口的に、腹腔内に、皮内に、筋肉内に、局所的に、経腸(例えば、経口的に)、経直腸的に、経鼻的に、頬側に、舌下に、経膣的に、吸入スプレーによって、薬物ポンプによって、または埋め込みリザーバを介して投与され得る。本発明の化合物を含む製剤または組成物は、従来の非毒性の生理学的に許容される担体もしくはビヒクルを含有する投与製剤において、例えば、皮下に、静脈内に、非経口的に、腹腔内に、皮内に、筋肉内に、局所的に、経腸(例えば、経口的に)、経直腸的に、経鼻的に、頬側に、舌下に、経膣的に、吸入スプレーによって、薬物ポンプによって、または埋め込みリザーバを介して投与され得る。一実施形態では、本開示の組成物は、静脈内投与される。
さらに、本発明の化合物または本発明の化合物から調製された製剤は、処置を必要とする局所的領域に投与され得る。例えば、本発明の化合物から調製された製剤は、処置を必要とする局所的領域に投与され得る。局所的領域への投与は、例えば、限定するものではないが、手術中の局所注入、局所適用、経皮パッチによって、注射によって、カテーテルによって、坐剤によって、またはサイラスティック膜もしくは繊維等の膜を含む、インプラント(インプラントは、任意選択で、多孔質、非多孔質、もしくはゼラチン状材料のものであり得る)によって達成され得る。
対象への投与用の本発明の化合物の製剤形態(例えば、シロップ剤、エリキシル剤、カプセル剤、錠剤、泡沫剤、乳剤、ゲル等)は、それが投与される経路に部分的に左右されよう。例えば、粘膜(例えば、口腔粘膜、直腸、腸粘膜、気管支粘膜)投与の場合、点鼻薬、エアロゾル剤、吸入剤、ネブライザー、点眼剤、または坐剤が使用され得る。本発明の化合物または本発明の化合物から調製された製剤はまた、体内埋め込み型材料をコーディングして、神経突起伸長、神経系細胞生存、またはインプラント表面との細胞の相互作用を向上させるために使用することもできる。本発明の化合物または本発明の化合物から調製された製剤は、細胞増殖を特徴とする障害または状態の1つまたは複数の症状または原因を制御し得る、抗がん剤、鎮痛剤、抗炎症剤、麻酔剤、及び他の薬剤等の他の生物活性薬剤と一緒に投与され得る。
一実施形態では、本明細書に開示されるような本発明の化合物または本発明の化合物から調製された製剤は、1つまたは複数の治療活性薬剤と組み合わせて投与され得る。一実施形態では、1つまたは複数の治療活性薬剤は、抗がん剤である。一部の実施形態では、1つまたは複数の治療的に活性な抗がん剤には、パクリタキセル、ビンブラスチン、ビンクリスチン、エトポシド、ドキソルビシン、ハーセプチン、ラパチニブ、ゲフィチニブ、エルロチニブ、タモキシフェン、フルベストラント、アナストラゾール、レトロゾール、エキセメスタン、ファドロゾール、シクロホスファミド、タキソテール、メルファラン、クロラムブシル、メクロレタミン、クロラムブシル、フェニルアラニン、マスタード、シクロホスファミド、イホスファミド、カルムスチン(BCNU)、ロムスチン(CCNU)、ストレプトゾトシン、ブスルファン、チオテパ、シスプラチン、カルボプラチン、ダクチノマイシン(アクチノマイシンD)、ドキソルビシン(アドリアマイシ)、ダウノルビシン、イダルビシン、ミトキサントロン、プリカマイシン、マイトマイシンC、ブレオマイシン、それらの組合せ等が含まれるが、これらに限定されない。別の実施形態では、1つまたは複数の治療的に活性な抗がん剤には、PARP(ポリ(DP-リボース)ポリメラーゼ)阻害剤が含まれるが、これらに限定されない。好適なPARP阻害剤には、4-(3-(1-(シクロプロパンカルボニル)ピペラジン-4-カルボニル)-4-フルオロベンジル)フタラジン-1(2H)-オン(オラパリブ、AZD2281、Ku-0059436)、2-[(2R)-2-メチルピロリジン-2-イル]-1H-ベンゾイミダゾール-4-カルボキサミド(ベリパリブ、ABT-888)、(8S,9R)-5-フルオロ-8-(4-フルオロフェニル)-9-(1-メチル-1H-1,2,4-トリアゾール-5-イル)-8,9-ジヒドロ-2H-ピリド[4,3,2-de]フタラジン-3(7H)-オン(タラゾパリブ、BMN673)、4-ヨード-3-ニトロベンズアミド(イニパリブ、BSI-201)、8-フルオロ-5-(4-((メチルアミノ)メチル)フェニル)-3,4-ジヒドロ-2H-アゼピノ[5,4,3-cd]インドール-1(6H)-オンリン酸(ルカパリブ、AG-014699、PF-01367338)、2-[4-[(ジメチルアミノ)メチル]フェニル]-5,6-ジヒドロイミダゾ[4,5,1-jk][1,4]ベンゾジアゼピン-7(4H)-オン(AG14361)、3-アミノベンズアミド(INO-1001)、2-(2-フルオロ-4-((S)-ピロリジン-2-イル)フェニル)-3H-ベンゾ[d]イミダゾール-4-カルボキサミド(A-966492)、N-(5,6-ジヒドロ-6-オキソ-2-フェナントリジニル)-2-アセトアミド塩酸塩(PJ34、PJ34 HCl)、MK-4827、3,4-ジヒドロ-4-オキソ-3,4-ジヒドロ-4-オキソ-N-[(1S)-1-フェニルエチル]-2-キナゾリンプロパンアミド(ME0328)、5-(2-オキソ-2-フェニルエトキシ)-1(2H)-イソキノリノン(UPF-1069)、4-[[4-フルオロ-3-[(4-メトキシ-1-ピペリジニル)カルボニル]フェニル]メチル]-1(2H)-フタラジノン(AZD2461)、5-((3-クロロフェニル)アミノ)ベンゾ[c][2,6]ナフチリジン-8-カルボン酸等が含まれるが、これらに限定されない。別の実施形態では、1つまたは複数の治療活性薬剤は、免疫療法剤である。一部の実施形態では、1つまたは複数の免疫療法剤には、モノクローナル抗体、免疫エフェクター細胞、養子細胞移入、免疫毒素、ワクチン、サイトカイン等が含まれるが、これらに限定されない。
一実施形態では、1つまたは複数の治療活性薬剤は、アルキル化剤、代謝拮抗薬、ビンカアルカロイド、タキサン、トポイソメラーゼ阻害剤、抗腫瘍抗生物質、チロシンキナーゼ阻害剤、免疫抑制性マクロライド、Akt阻害剤、HDAC阻害剤Hsp90阻害剤、mTOR阻害剤、PI3K/mTOR阻害剤、PI3K阻害剤、CDK(サイクリン依存性キナーゼ)阻害剤、CHK(チェックポイントキナーゼ)阻害剤、PARP(ポリ(DP-リボース)ポリメラーゼ)阻害剤、またはそれらの組合せから選択される。
一実施形態では、1つまたは複数の治療活性薬剤は、PI3K阻害剤である。別の実施形態では、PI3K阻害剤は、イデラリシブである。
一実施形態では、1つまたは複数の治療活性薬剤は、PARP阻害剤である。別の実施形態では、PARP阻害剤は、オラパリブである。
他の実施形態では、1つまたは複数の治療活性薬剤は、PD-1遮断及びCTLA-4遮断等の免疫チェックポイント遮断を誘導する薬剤である。
一部の実施形態では、1つまたは複数の治療活性薬剤は、プログラム死-1(PD-1)とプログラム死リガンド-1(PD-L1)との間の相互作用を妨害する抗体またはその抗原結合部分である。一実施形態では、1つまたは複数の治療活性薬剤は、抗PD-1抗体、PD-1アンタゴニスト、抗PD-L1抗体、PD-1の発現を標的とするsiRNA、PD-L1の発現を標的とするsiRNA、及びペプチド、断片、ドミナントネガティブ型、またはPD-1もしくはPD-L1の可溶型からなる群から選択される。
一実施形態では、1つまたは複数の治療活性薬剤は、モノクローナル抗体である。一実施形態では、モノクローナル抗体は、抗PD-1抗体、ニボルマブ、ペムブロリズマブアレムツズマブ、ベバシズマブ、ブレンツキシマブベドチン、セツキシマブ、ゲムツズマブオゾガマイシン、イブリツモマブチウキセタン、イピリムマブ、オファツムマブ、パニツムマブ、リツキシマブ、トシツモマブ、トラスツズマブ、抗B7-H4、抗B7-H1、抗LAG3、BTLA、抗Tim3、抗B7-DC、抗CD160、MRアンタゴニスト抗体、抗4-1BB、抗OX40、抗CD27、及び/またはCD40アゴニスト抗体からなる群から選択される。一部の実施形態では、1つまたは複数の治療活性薬剤は、抗PD-1抗体である。他の実施形態では、抗PD-1抗体は、ヒト化抗体である。一実施形態では、モノクローナル抗体は、ニボルマブ及びペムブロリズマブからなる群から選択される。具体的な実施形態では、モノクローナル抗体は、ニボルマブである。
一部の実施形態では、WO2017/087235に開示される1つまたは複数の治療活性薬剤が、参照によりその全体が全目的で本明細書に援用される。
別の実施形態では、本明細書に開示されるような化合物I、または化合物Iの薬学的に許容される塩、エステル、及び/または溶媒和物の結晶形態は、放射線療法と組み合わせて投与され得る。
さらに、投与は、好適な期間にわたって複数の投与量を対象に投与することを含み得る。かかる投与レジメンは、本開示を査読すれば、日常的な方法に従って決定することができる。
化合物Iまたは薬学的に許容される塩及び/または溶媒和物は、一般に、約0.01mg/kg/用量~約100mg/kg/用量の用量で投与される。代替として、用量は、約0.1mg/kg/用量~約10mg/kg/用量、または約1mg/kg/用量~10mg/kg/用量であり得る。徐放性調製物が用いられてもよいし、または用量は、好都合であるだけ多くの分割用量で投与されてもよい。他の方法が使用される場合(例えば、静脈内投与)、結晶形態は、約0.05~約10mg/kg/時間、代替として、約0.1~約1mg/kg/時間の速度で患部組織に投与される。かかる速度は、本明細書で考察されるようにこれらの結晶形態が静脈内投与される場合に、容易に維持される。一般に、局所的に投与される製剤は、約0.5mg/kg/用量~約10mg/kg/用量範囲の用量で投与される。代替として、局所製剤は、約1mg/kg/用量~約7.5mg/kg/用量、またはさらには約1mg/kg/用量~約5mg/kg/用量の用量で投与される。
約0.1~約100mg/kgの範囲が、単回用量に適切である。連続投与は、約0.05~約10mg/kgの範囲で適切である。
薬物用量はまた、体重ではなく、体表面積1平方メートル当たりのミリグラム単位で与えられることもあり得、これは、この方法によりある特定の代謝及び排泄機能との良好な相関が得られるためである。さらに、体表面積は、成人及び小児、ならびに異なる動物種における薬物投与量の公分母として使用され得る(Freireich et al.,(1966)Cancer Chemother Rep.50,219-244)。簡潔に述べると、任意の所与の種においてmg/kg用量を同等のmg/sq m用量として表すためには、投与量に適切なkm係数を乗じる。成人ヒトでは、100mg/kgは、100mg/kg×37kg/sq m=3700mg/m2に相当する。
本発明の剤形は、約5mg~約500mgの量で、本明細書に開示されるような化合物I、またはその薬学的に許容される塩、エステル、及び/または溶媒和物を含有してもよい。すなわち、本発明の剤形は、約5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、110mg、120mg、125mg、130mg、140mg、150mg、160mg、170mg、175mg、180mg、190mg、200mg、210mg、220mg、225mg、230mg、240mg、250mg、260mg、270mg、275mg、280mg、290mg、300mg、310mg、320mg、325mg、330mg、340mg、350mg、360mg、370mg、375mg、380mg、390mg、400mg、410mg、420mg、425mg、430mg、440mg、450mg、460mg、470mg、475mg、480mg、490mg、500mg、またはそれらの間の任意の値の量で、化合物Iを含有してもよい。一実施形態では、かかる投与量は、単回用量で、または1日に複数回、例えば、1日に2回、3回、もしくは4回で提供される分割部分量のいずれかで、1日用量として患者に投与される。
一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、一般に、対象の体表面積(mg/m2)当たり約1mgの化合物Iまたはその薬学的に許容される塩及び/または溶媒和物から、約2,000mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約25mg/m2~約2,000mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約25mg/m2、約30mg/m2、約35mg/m2、約40mg/m2、約45mg/m2、約50mg/m2、約55mg/m2、約60mg/m2、約65mg/m2、約70mg/m2、約75mg/m2、約80mg/m2、約85mg/m2、約90mg/m2、約95mg/m2、約100mg/m2、約110mg/m2、約120mg/m2、約125mg/m2、約130mg/m2、約140mg/m2、約150mg/m2、約160mg/m2、約170mg/m2、約175mg/m2、約180mg/m2、約190mg/m2、約200mg/m2、約210mg/m2、約220mg/m2、約225mg/m2、約230mg/m2、約240mg/m2、約250mg/m2、約260mg/m2、約270mg/m2、約275mg/m2、約280mg/m2、約290mg/m2、約300mg/m2、約310mg/m2、約320mg/m2、約325mg/m2、約330mg/m2、約340mg/m2、約350mg/m2、約360mg/m2、約370mg/m2、約375mg/m2、約380mg/m2、約390mg/m2、約400mg/m2、約410mg/m2、約420mg/m2、約425mg/m2、約430mg/m2、約440mg/m2、約450mg/m2、約460mg/m2、約470mg/m2、約475mg/m2、約480mg/m2、約490mg/m2、約500mg/m2、約510mg/m2、約520mg/m2、約525mg/m2、約530mg/m2、約540mg/m2、約550mg/m2、約560mg/m2、約570mg/m2、約575mg/m2、約580mg/m2、約590mg/m2、約600mg/m2、約610mg/m2、約620mg/m2、約625mg/m2、約630mg/m2、約640mg/m2、約650mg/m2、約660mg/m2、約670mg/m2、約675mg/m2、約680mg/m2、約690mg/m2、約700mg/m2、約710mg/m2、約720mg/m2、約725mg/m2、約730mg/m2、約740mg/m2、約750mg/m2、約760mg/m2、約770mg/m2、約775mg/m2、約780mg/m2、約790mg/m2、約800mg/m2、約810mg/m2、約820mg/m2、約825mg/m2、約830mg/m2、約840mg/m2、約850mg/m2、約860mg/m2、約870mg/m2、約875mg/m2、約880mg/m2、約890mg/m2、約900mg/m2、約910mg/m2、約920mg/m2、約925mg/m2、約930mg/m2、約940mg/m2、約950mg/m2、約960mg/m2、約970mg/m2、約975mg/m2、約980mg/m2、約990mg/m2、約1000mg/m2、またはそれらの間の任意の値の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与され得る。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約50mg、約100mg、約150mg、約170mg、約325mg、約475mg、または約650mgの化合物Iまたはその薬学的に許容される塩及び/または溶媒和物の用量で投与され得る。一部の実施形態では、用量は、患者の健康状態、あるいは化合物I、またはその薬学的に許容される塩及び/または溶媒和物に対する患者の感受性に応じて様々であり得る。
一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約50mg/m2~約800mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約50mg/m2~約650mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約100mg/m2~約700mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約150mg/m2~約700mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約150mg/m2~約650mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約250mg/m2~約700mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約300mg/m2~約700mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約400mg/m2~約700mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約425mg/m2~約675mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約450mg/m2~約650mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約475mg/m2の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。
一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約150mg/m2~約300mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約150mg/m2~約250mg/m2(またはそれらの間の任意の値もしくは部分範囲)の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約170mg/m2の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。
一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、一般に、約500mg/m2未満ほどの化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与され得る。別の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、一般に、約500mg/m2未満、約490mg/m2未満、約480mg/m2未満、約475mg/m2未満、約470mg/m2未満、約460mg/m2未満、約450mg/m2未満、約440mg/m2未満、約430mg/m2未満、約420mg/m2未満、約410mg/m2未満、約400mg/m2未満、約390mg/m2未満、約380mg/m2未満、約375mg/m2未満、約370mg/m2未満、約360mg/m2未満、約350mg/m2未満、約340mg/m2未満、約330mg/m2未満、約320mg/m2未満、約310mg/m2未満、約300mg/m2未満、約290mg/m2未満、約280mg/m2未満、約275mg/m2未満、約270mg/m2未満、約260mg/m2未満、約250mg/m2未満、約240mg/m2未満、約230mg/m2未満、約220mg/m2未満、約210mg/m2未満、約200mg/m2未満、約190mg/m2未満、約180mg/m2未満、もしくは約170mg/m2未満、またはそれらの間の任意の値の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で投与される。
一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約750mg/m2未満、約700mg/m2未満、約600mg/m2未満、約500mg/m2未満、約475mg/m2未満、約400mg/m2未満、約325mg/m2未満、約300mg/m2未満、約200mg/m2未満、約170mg/m2未満、またはそれらの間の任意の部分範囲の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量でがん患者に投与され得る。他の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約170mg/m2未満の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量で、3週間毎にがん患者に投与され得る。一実施形態では、がん患者は、ヘム癌患者である。
一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約50mg/m2~約1,550mg/m2、約150mg/m2~約1,250mg/m2、約250mg/m2~約1,050mg/m2、約350mg/m2~約950mg/m2、約375mg/m2~約850mg/m2、約425mg/m2~約850mg/m2、約450mg/m2~約800mg/m2、もしくは約500mg/m2~約750mg/m2、またはそれらの間の任意の部分範囲の化合物I、またはその薬学的に許容される塩及び/または溶媒和物としてがん患者に投与され得る。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、約750mg/m2未満の化合物I、またはその薬学的に許容される塩及び/または溶媒和物の用量でがん患者に投与され得る。他の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、本明細書に記載の投薬頻度、投薬サイクル、または投薬レジメンのうちのいずれかでがん患者に投与され得る。一実施形態では、処置は、固形腫瘍に対するものである。
一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、部分奏効、病勢安定(腫瘍増殖なし)、または腫瘍縮小を含めた臨床結果をもたらすために、約50mg/m2超の用量でがん患者に投与され得る。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、部分奏効、病勢安定、または腫瘍縮小を含めた臨床結果をもたらすために、約100mg/m2超の用量でがん患者に投与され得る。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、部分奏効、病勢安定、または腫瘍縮小を含めた臨床結果をもたらすために、約150mg/m2超の用量でがん患者に投与され得る。
本発明の剤形は、毎時、毎日、毎週、または毎月投与されてもよい。本発明の剤形は、1日2回または1日1回投与されてもよい。本発明の剤形は、食物と共にまたは食物なしで投与されてもよい。
一実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、週1回、2週間に1回、3週間に1回、4週間に1回、または1ヶ月に1回投与される。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、毎週1回の投与を含む4週間の処置サイクル(QW×4)で投与される。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、2週間にわたって毎週1回の投与、続いて2週間の休薬期間(処置なし)を含む4週間の処置サイクル(QW×2)で投与される。一部の実施形態では、投与は、3週間にわたって毎週1回の投与、続いて1週間の休薬期間(処置なし)を含む4週間の処置サイクルで行われる。一部の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、2週間にわたって毎週1回の投与、続いて1週間の休薬期間を含む3週間の処置サイクルで投与される。別の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、3週間に1回投与される。他の実施形態では、本発明の化合物または本発明の化合物により調製された製剤は、IV注入によって3週間に1回投与される。
一部の実施形態では、本明細書に開示されるような化合物I、またはその薬学的に許容される塩及び/または溶媒和物での処置レジメンは、1サイクル~20サイクル、またはそれよりも長い一定期間持続し得る。処置の適切な長さは、医師によって決定され得る。
一部の実施形態では、本発明の化合物での処置は、PCT/US2019/018225に開示されるようなPK範囲をもたらし、同文献の開示は参照によりそれらの全体が全目的で本明細書に援用される。
本明細書に開示される結晶形態が模倣体またはその断片の形態をとり得る限り、有効量の効力、したがって投与量は、様々であり得ることが理解されるべきである。しかしながら、当業者は、本願によって現在想定される種類の結晶形態の効力を容易に評価することができる。
細胞増殖を特徴とする、徐々に進行する障害または状態の設定では、本願の結晶形態は、一般に、継続的に投与される。ある特定の設定では、本明細書に開示される結晶形態の投与は、疾患を遅延または予防するための戦略の一環として、疾患症状の発症前に開始することができる。他の設定では、本明細書に開示される結晶形態は、疾患過程を減速もしくは逆行させるための戦略の一環として及び/または細胞機能を改善して症状を低減するための戦略の一環として、疾患症状の発現後に投与される。
投与量範囲は特定の結晶形態、及びその効力に左右されることが当業者には理解されよう。投与量範囲は、神経変性もしくは他の障害及びそれらに関連する症状が改善される及び/または細胞の生存が達成される所望の効果をもたらすのに十分大きいが、管理できない有害な副作用を引き起こすほどには大きくないと理解される。しかしながら、当業者には十分に理解されるように、任意の特定の患者に対する具体的な用量レベルは、用いられる具体的な結晶形態の活性;処置されている個体の年齢、体重、全般的な健康、性別、及び食生活;投与時間及び経路;排泄速度;以前に投与されたことのある他の薬物;ならびに療法を受けている特定の疾患の重症度を含めた、様々な要因に左右されることが理解されよう。投与量はまた、何らかの合併症が生じた場合、個々の医師によって調整され得る。本明細書に開示される結晶形態が本願に従って使用される場合、許容できない毒物学的作用は何ら予想されない。
本明細書に開示される有効量の結晶形態は、測定可能な生物学的応答をもたらすのに十分な量を含む。本願の治療用結晶形態における活性成分の実際の投与量レベルは、特定の対象及び/または適用に対して所望の治療応答を達成するのに有効である活性結晶形態の量を投与するように変動させることができる。好ましくは、最小用量が投与され、この用量は、用量制限毒性の不在下で最小有効量まで段階的に増加させられる。治療上有効用量の決定及び調整、ならびにかかる調整をいつどのように行うかについての評価は、当業者に既知である。
さらに本願の方法に関して、好ましい対象は脊椎動物対象である。好ましい脊椎動物は温血であり、好ましい温血脊椎動物は哺乳動物である。本開示の方法によって処置される対象は、望ましくはヒトであるが、本願の原理が、「対象」という用語に含まれる全ての脊椎動物種に関して有効性を示すことを理解されたい。この文脈において、脊椎動物は、神経変性障害の処置が望ましい任意の脊椎動物種であると理解される。
そのため、本願は、哺乳動物、例えば、ヒト、ならびにシベリアトラ等の絶滅の危機に瀕しているために重要な哺乳動物;ヒトによる消費のために農場で飼育される動物等の経済的に重要な哺乳動物;及び/またはペットとしてもしくは動物園もしくは農場で飼育されている動物等のヒトにとって社会的に重要な動物等の処置を可能にする。かかる動物の例としては、ネコ及びイヌ等の肉食動物;ブタ(pig)、雄ブタ、及びイノシシを含むブタ(swine);反芻動物及び/または有蹄動物、例えば、ウシ、雄ウシ、ヒツジ、キリン、シカ、ヤギ、バイソン、及びラクダ;ならびにウマが挙げられるが、これらに限定されない。トリの処置もまた提供され、例えば、絶滅の危機に瀕している及び/または動物園で飼育されている種類のトリ、ならびに家禽、より具体的には家畜化された家禽(fowl)、すなわち、家禽(poultry)、例えば、シチメンチョウ、ニワトリ、アヒル、ガチョウ、ホロホロチョウ等の処置も、それらがまたヒトにとって経済的に重要な動物であることから含まれる。故に、家畜の処置もまた提供され、これには家畜化されたブタ、反芻動物、有蹄動物、ウマ(競走馬を含む)、家禽等が含まれるが、これらに限定されない。
以下の実施例は、本発明をさらに例示しているが、その範囲をいかようにも限定するものとして解釈されるべきではない。
本明細書に開示されるような製剤のうちのどれでも1つは、がんの処置を含めた、本明細書に開示される方法のうちのどれでも1つに使用することができる。化合物Iまたはその薬学的に許容される塩及び/または溶媒和物について本明細書に開示されるような用量のうちのどれでも1つは、がんの処置を含めた、本明細書に開示される方法のうちのどれでも1つに使用することができる。本明細書に開示されるような投薬スケジュールのうちのどれでも1つは、がんの処置を含めた、本明細書に開示される方法のうちのどれでも1つに使用することができる。
薬物動態
一部の実施形態では、本明細書に開示されるような化合物I、またはその薬学的に許容される塩及び/または溶媒和物での処置レジメンは、1サイクル~20サイクル、またはそれよりも長い一定期間持続し得る。1サイクルは、4週間の処置(28日間)1回であり得る。4週間の処置は、3週間にわたって週1回の投与、次いで1週間の休薬であり得る(投薬スケジュールA)。投薬スケジュールAの例は、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を、28日サイクルの1日目、8日目、及び15日目に投与することである。4週間の処置は、2週間にわたって週1回の投与、次いで2週間の休薬であり得る(投薬スケジュールB)。処置の適切な長さは、医師によって決定され得る。投薬スケジュールBの例は、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物を、28日サイクルの1日目及び8日目に投与することである。
一実施形態では、約25mg/m2~約1,000mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての、化合物I、またはその薬学的に許容される塩及び/または溶媒和物のTmaxは、約0.25時間~約1.25時間、またはそれらの間の任意の値もしくは部分範囲である。別の実施形態では、Tmaxは、約0.5時間~約1.0時間、またはそれらの間の任意の値もしくは部分範囲である。
一実施形態では、ヒト対象についての化合物IのTmaxは、約0.3時間~約2.0時間、またはそれらの間の任意の値もしくは部分範囲である。一部の実施形態では、Tmaxは、約0.4時間~約1.5時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、ヒト対象には、約50mg/m2~約650mg/m2で、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物が与えられる。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての、化合物IのTmaxは、約0.4時間~約1.4時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.6時間~約0.8時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約1.0時間~約1.4時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約1.1時間~約1.3時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.5時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.7時間~約0.9時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の3回目の用量を与えたヒト対象についての化合物IのTmaxは、約0.2時間~約1.2時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.7時間~約0.9時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.2時間~約1.3時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.9時間~約1.2時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.9時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての化合物IのTmaxは、約0.4時間~1.6時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約0.6時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約0.8時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.5時間~約0.9時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.7時間~約0.9時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.9時間~約1.1時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約1.0時間~約1.2時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の2回目の用量を与えたヒト対象についての化合物IのTmaxは、約0.1時間~2.7時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.2時間~約2.0時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.3時間~約1.5時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.4時間~約1.3時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、Tmaxは、約0.5時間~約1.2時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、約25mg/m2~約1,000mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての、化合物I、またはその薬学的に許容される塩及び/または溶媒和物の平均消失半減期(T1/2)は、約20時間~約95時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、約50mg/m2~約1,000mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての、化合物I、またはその薬学的に許容される塩及び/または溶媒和物の平均消失半減期(T1/2)は、約20時間~約50時間、またはそれらの間の任意の値もしくは部分範囲である。
一実施形態では、ヒト対象についての化合物I、またはその薬学的に許容される塩及び/または溶媒和物の平均消失半減期(T1/2)は、約10時間~約195時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均T1/2は、約20時間~約125時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均T1/2は、約30時間~約130時間、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均T1/2は、約30時間~約100時間、またはそれらの間の任意の値もしくは部分範囲である。
一実施形態では、ヒト対象についての化合物Iの平均Cmaxは、約200ng/mL~約6,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一部の実施形態では、平均Cmaxは、約500ng/mL~約5,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、ヒト対象には、約50mg/m2~約650mg/m2で、化合物Iまたはその薬学的に許容される塩及び/または溶媒和物が与えられる。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての化合物Iの平均Cmaxは、約800ng/mL~約4,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,000ng/mL~約3,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約800ng/mL~約1,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約900ng/mL~約2,600ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,200ng/mL~約2,300ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,200ng/mL~約2,200ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約2,000ng/mL~約4,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約2,500ng/mL~約3,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の3回目の用量を与えたヒト対象についての化合物Iの平均Cmaxは、約500ng/mL~約6,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,500ng/mL~約5,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約500ng/mL~約5,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約2,000ng/mL~約3,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約2,500ng/mL~約6,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約3,500ng/mL~約4,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象についての化合物Iの平均Cmaxは、約400ng/mL~約2,800ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約400ng/mL~約2,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約500ng/mL~約2,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約400ng/mL~約1,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約600ng/mL~約1,600ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約400ng/mL~約2,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約550ng/mL~約1,300ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約800ng/mL~約1,300ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,400ng/mL~約2,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の2回目の用量を与えたヒト対象についての化合物Iの平均Cmaxは、約200ng/mL~約2,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約400ng/mL~約1,900ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約400ng/mL~約1,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約200ng/mL~約1,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約300ng/mL~約1,300ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約700ng/mL~約1,800ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約300ng/mL~約2,100ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約200ng/mL~約1,500ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約500ng/mL~約1,600ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、平均Cmaxは、約1,400ng/mL~約2,000ng/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、定常状態の曝露量が達成された後168時間毎の各投薬間隔についての濃度-時間曲線下面積における未結合の化合物I(AUCssτ)は、約50mg/m2~約1,550mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約2ng*時間/mL~約300ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約150mg/m2~約1,050mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約5ng*時間/mL~約200ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約250mg/m2~約950mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約10ng*時間/mL~約150ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約350mg/m2~約850mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約15ng*時間/mL~約140ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約450mg/m2~約750mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約15ng*時間/mL~約150ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約450mg/m2~約750mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約20ng*時間/mL~約120ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一部の実施形態では、対象は、投薬スケジュールAまたは投薬スケジュールBで、QW×4サイクルの投薬レジメンを受ける。
一実施形態では、AUCssτは、約50mg/m2~約1,550mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約2ng*時間/mL~約250ng*時間/mLである。一実施形態では、AUCssτは、約150mg/m2~約1,050mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約5ng*時間/mL~約150ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約250mg/m2~約950mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約10ng*時間/mL~約150ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約350mg/m2~約850mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約15ng*時間/mL~約130ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約450mg/m2~約750mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約15ng*時間/mL~約130ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUCssτは、約450mg/m2~約750mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約20ng*時間/mL~約120ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一部の実施形態では、対象は、QW×2の4週間サイクルの投薬レジメンを受ける。
一実施形態では、ヒト対象(血漿中で測定)におけるAUC∞(0時間から無限大時間までの濃度-時間曲線下面積における未結合の化合物I;総曝露量)は、約50mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物を与えた対象について、約2,000ng*時間/mL~約110,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約5,000ng*時間/mL~約70,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象におけるAUC∞は、約10,000ng*時間/mL~約80,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約24,000ng*時間/mL~約77,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約25,000ng*時間/mL~約75,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約15,000ng*時間/mL~約75,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約24,000ng*時間/mL~約34,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約28,000ng*時間/mL~約31,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約10,000ng*時間/mL~約52,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約11,000ng*時間/mL~約52,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約30,000ng*時間/mL~約40,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約38,000ng*時間/mL~約77,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約50,000ng*時間/mL~約65,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールAに基づき、約325mg/m2~約650mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の3回目の用量を与えたヒト対象におけるAUC∞は、約12,000ng*時間/mL~約101,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約15,000ng*時間/mL~約90,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約12,000ng*時間/mL~約55,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約20,000ng*時間/mL~約45,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約24,000ng*時間/mL~約101,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約45,000ng*時間/mL~約75,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールAでの用量は、約325mg/m2、475mg/m2、または650mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の1回目の用量を与えたヒト対象におけるAUC∞は、約5,00ng*時間/mL~約54,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約5,500ng*時間/mL~約45,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約5,500ng*時間/mL~約7,500ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約10,000ng*時間/mL~約30,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約15,000ng*時間/mL~約25,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約7,000ng*時間/mL~約25,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約18,000ng*時間/mL~約24,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約13,500ng*時間/mL~約33,500ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約19,000ng*時間/mL~約53,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約30,000ng*時間/mL~約40,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
一実施形態では、投薬スケジュールBに基づき、約50mg/m2~約475mg/m2で化合物I、またはその薬学的に許容される塩及び/または溶媒和物のIV注入投与の2回目の用量を与えたヒト対象におけるAUC∞は、約1,000ng*時間/mL~約53,500ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約2,500ng*時間/mL~約53,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約8,500ng*時間/mL~約53,500ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約8,500ng*時間/mL~約10,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約15,000ng*時間/mL~約30,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約15,000ng*時間/mL~約25,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約6,000ng*時間/mL~約27,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約10,000ng*時間/mL~約20,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約24,000ng*時間/mL~約32,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約19,000ng*時間/mL~約39,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約25,000ng*時間/mL~約35,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約19,000ng*時間/mL~約53,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、AUC∞は、約30,000ng*時間/mL~約40,000ng*時間/mL、またはそれらの間の任意の値もしくは部分範囲である。一実施形態では、投薬スケジュールBでの用量は、約50mg/m2、100mg/m2、150mg/m2、200mg/m2、250mg/m2、325mg/m2、または475mg/m2での化合物I、またはその薬学的に許容される塩及び/または溶媒和物である。
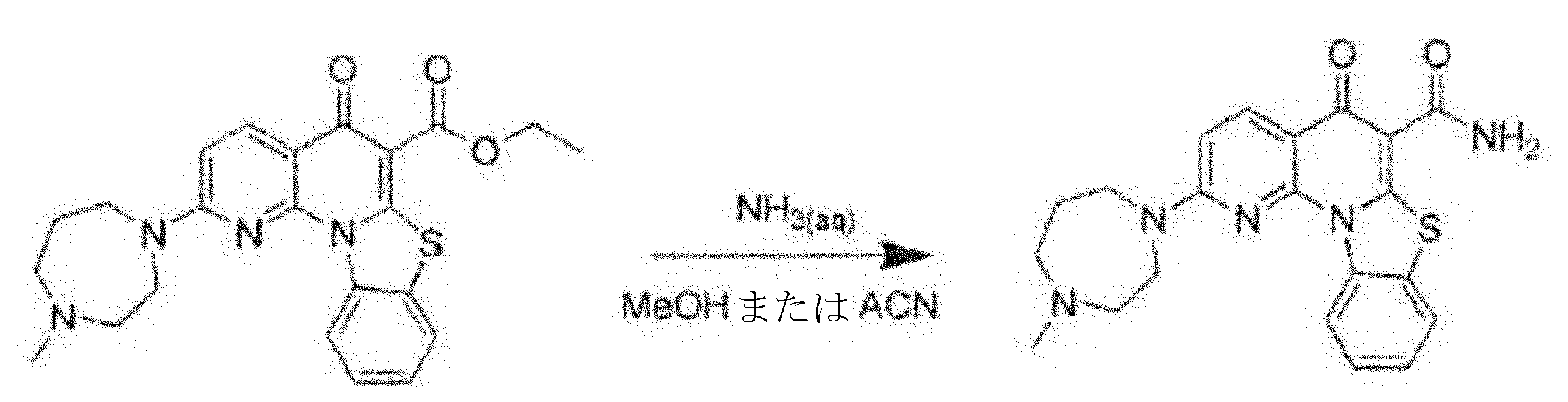
5L反応器に、2-(4-メチル-1,4-ジアゼパン-1-イル)-5-オキソ-5H-ベンゾ[4,5]チアゾロ[3,2-a][1,8]ナフチリジン-6-カルボン酸エチル(101g、合成についてはWO2009/046383を参照されたい)及びアセトニトリル(2L)を添加した。混合物に28~30%NH3(水溶液)(1950ml)を添加し、次いで-13℃の凝縮器温度で最大60℃まで加熱した(大量のNH3ガスが放出)。混合物を4日間撹拌し、さらなる28~30%NH3(水溶液)(400ml)を添加した。混合物を2日間撹拌し、さらなる28~30%NH3(水溶液)(200ml)を添加した。混合物を1日撹拌し、さらなる28~30%NH3(水溶液)(100ml)を添加した。10日間の撹拌後、大量の固体が沈殿した。混合物を室温まで冷却し、1日撹拌した。混合物を濾過して、92gの粗化合物1を94.66%の純度により53.8%の収率で得、乾燥減量(LOD)は42.1%であった。
2L反応器に、38gの粗化合物1及び800mlのアセトニトリルを添加した。得られた混合物を60℃に加熱し、次いで800mlの28~30%NH3(水溶液)を添加した。混合物を3時間撹拌し、50~60℃で濾過し、350mlのアセトニトリルで洗浄した。湿潤ケークを40℃で一晩乾燥させて、34.8gの化合物1、(2-(4-メチル-1,4-ジアゼパン-1-イル)-5-オキソ-5H-ベンゾ[4,5]チアゾロ[3,2-a][1,8]ナフチリジン-6-カルボキサミド)を98.0%の純度により92%の収率で得、LODは2.30%であった。MS: m/z 408.136 [M+H]+。
生物学的アッセイ及び実施例
実施例2.細胞生存能評価及び細胞増殖評価
細胞生存能に対する化合物Iの効果を、種々のがん細胞株における代謝活性のAlamar Blueアッセイによって評価した。表1は、化合物Iが複数のがん細胞株において広範囲の抗増殖活性を実証する一方で、正常細胞では有意に活性が低いことを示している。
実施例3.ヒトにおける薬物動態(PK)研究
疾患進行まで抗がん剤による事前処置(複数可)を受けた、転移性、再発性、局所、進行性、または切除不能な固形悪性腫瘍を有する成人患者(組織学的及び/または細胞学的に確認された固形悪性腫瘍を有する患者)において、10種の異なる用量レベルの化合物Iで薬物動態研究及び用量漸増研究を実施した。群1~7には、4週間サイクルの1日目及び8日目に、それぞれ50、100、150、200、250、325、及び475mg/m2(凍結乾燥製剤)で静脈内投与した。群8~10には、4週間サイクルの1日目、8日目、及び15日目に、それぞれ325、475、及び650mg/m2(凍結乾燥製剤)で静脈内投与した。各患者には、上述した日に各用量をIV注入によって1時間かけて与えた。
凍結乾燥製剤:
2LのWFIをSchottボトルに注ぎ、溶存酸素含量が≦1ppmになるまで(溶存酸素計及びプローブ;Mettler Toledo)N2で30分間脱気した。150g±1.0gのマンニトール及び1000mLの脱気WFIを、マグネチックスターラーを備え、アルミ箔で包んだ風袋計量済みの2L Schottボトルに添加することによって、10%マンニトール溶液を調製した。マンニトールを含有するSchottボトルに、15mLの2M HClを添加し、およそ10分間撹拌した。得られた溶液を、溶存酸素含量が≦1ppmになるまで(およそ30分間)撹拌しながらN2でスパージした。マンニトール及びHClを含有するSchottボトルのヘッドスペースをN2で3分間パージし、ボトルを密封した。
45.335gの化合物I(遊離塩基)を計量し、次いでBig Neat及びCTSキャビネット内部で継続的に磁気撹拌しながら、マンニトール及びHCl溶液を含有する2L Schottボトルに添加した。化合物Iを添加してから約55分の撹拌後、懸濁液が観察された。約30mLの2M HClを添加し、約25分間撹拌したが、懸濁液のままであった。約5mLの2M HClを添加し、約15分間撹拌し、次いで約100mLの脱気WFIを添加し、約5分間撹拌して、明澄な溶液を得た。明澄な溶液が得られると、溶液を、溶存酸素含量が≦1ppmになるまで(およそ40分間)撹拌しながらN2でスパージした。
化合物I溶液(Schottボトル中)のpHを測定し、次いで段階的な方式で2M HCl及び2M NaOH溶液を使用してpH4.5±0.1に調整した。HClまたはNaOH溶液の各添加の後では、pHを検証する前に溶液を数分間撹拌した。pH調整済みの化合物I溶液を1000mLのメスフラスコ及び500mLのメスフラスコに移し、フラスコを、マークに達するまで脱気WFIで充填した。希釈した溶液を元の2L Schottボトルに戻し、溶存酸素含量が≦1ppmになるまで(およそ30分間)撹拌しながらN2でスパージした。SchottボトルのヘッドスペースをN2で3分間パージし、ボトルを密封した。
最終溶液(pH調整及び希釈済み)をBig Neat及びCTSキャビネット中で濾過し(PVDFメンブレンフィルター1×0.45μm及び2×0.22μmを直列で含むチェーン、蠕動濾過ポンプ)、濾過した溶液を含有するボトルを密封した(蠕動ポンプ濾過ステップはN2下で実施しなかった)。濾過した溶液を、30mL Schott透明ガラスバイアルにポンプで注入した(Watson Marlow Flexicon PF6-Bポンプ、100RPM)(各々5.0mLの濾過した溶液)。ガラスバイアルを、ヒュームフード内部で滅菌器具を用いて、20mmの凍結乾燥栓Flurotec(West Pharma)で一度に1バイアルずつ部分的に栓をし、凍結乾燥機のトレイ上に置いた。凍結乾燥機のトレイを凍結乾燥チャンバーに移し、バイアルプローブを配置した。実施例2、表3に従った凍結乾燥サイクルを使用して、凍結乾燥を実施した。凍結乾燥サイクルが終了した後、バイアルをN2でバックフィルし、その場で栓を配置し、凍結乾燥機から取り出すとすぐにヒュームフード中においてイソプロパノールで拭き取り、一致させ(reconciled)、次いで圧着した。
凍結乾燥製剤を、IV注入のために滅菌水中の5%グルコース、または類似の生物学的に許容される流体で再構成した。
血漿収集:
群1~7の患者については、血液試料を典型的に、1日目の注入前(t=-1時間)、注入中の約30分時点(t=-0.5時間)、注入直後(t=0時間)、注入後30分、注入後1時間、注入後2時間、注入後4時間、及び注入後6時間、ならびに注入後約24時間、注入後48時間、及び注入後72時間で収集した。8日目には、血液試料を典型的に、注入前(t=-1時間)、注入中の約30分時点(t=-0.5時間)、注入直後(t=0時間)、注入後30分、注入後1時間、注入後2時間、注入後4時間、及び注入後6時間、ならびに注入後約24時間、及び注入後168時間(15日目)で収集した。
群8~10の患者については、血液試料を典型的に、1日目の注入前(t=-1時間)、注入中の約30分時点(t=-0.5時間)、注入直後(t=0時間)、注入後30分、注入後1時間、注入後2時間、注入後4時間、及び注入後6時間、ならびに注入後約24時間、注入後48時間、及び注入後72時間で収集した。8日目には、血液試料を典型的に、注入前(t=-1時間)で収集した。15日目には、血液試料を典型的に、注入前(t=-1時間)、注入中の約30分時点(t=-0.5時間)、注入直後(t=0時間)、注入後30分、注入後1時間、注入後2時間、注入後4時間、及び注入後6時間、ならびに注入後約24時間、及び注入後168時間(22日目)で収集した。
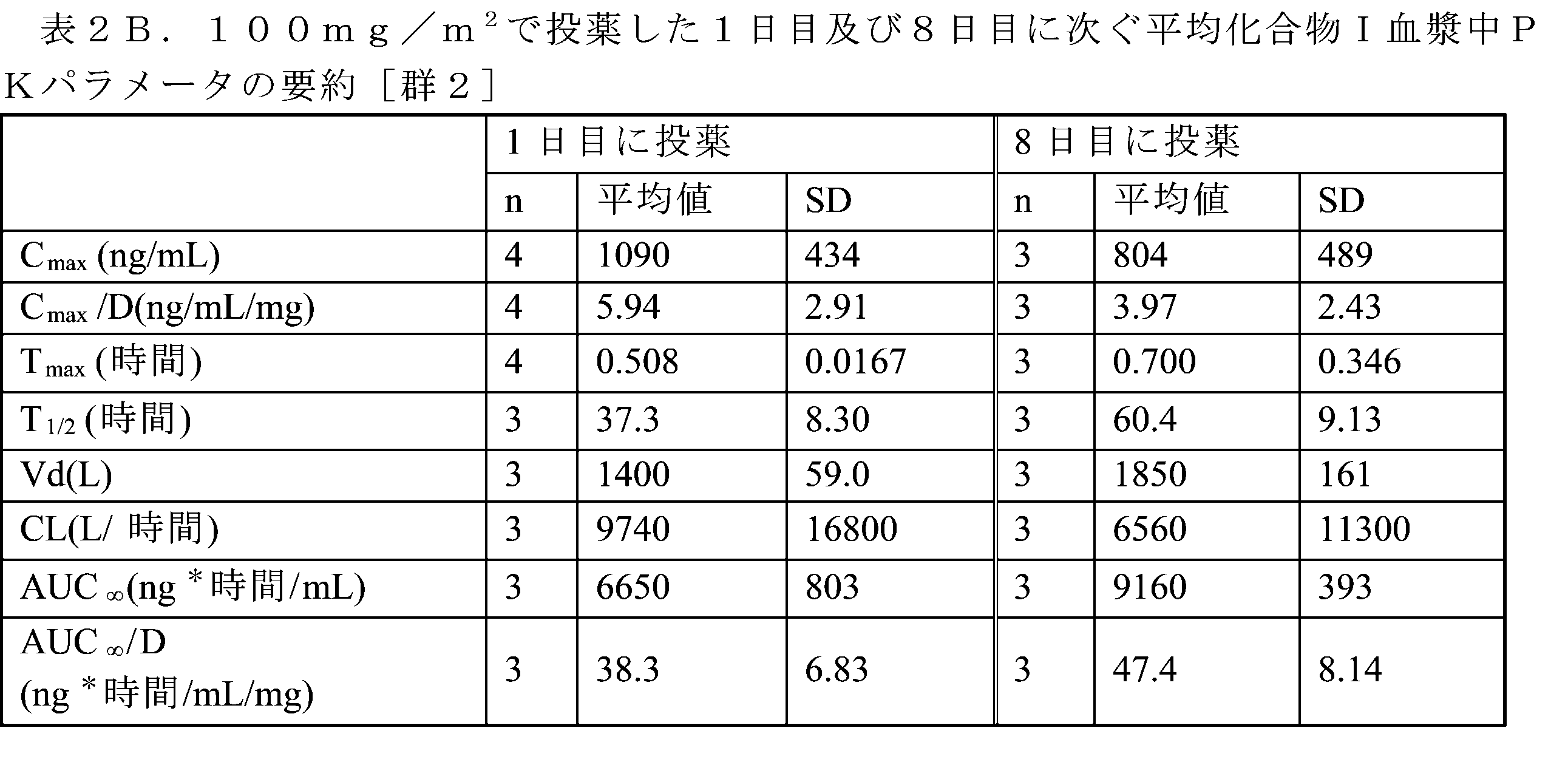
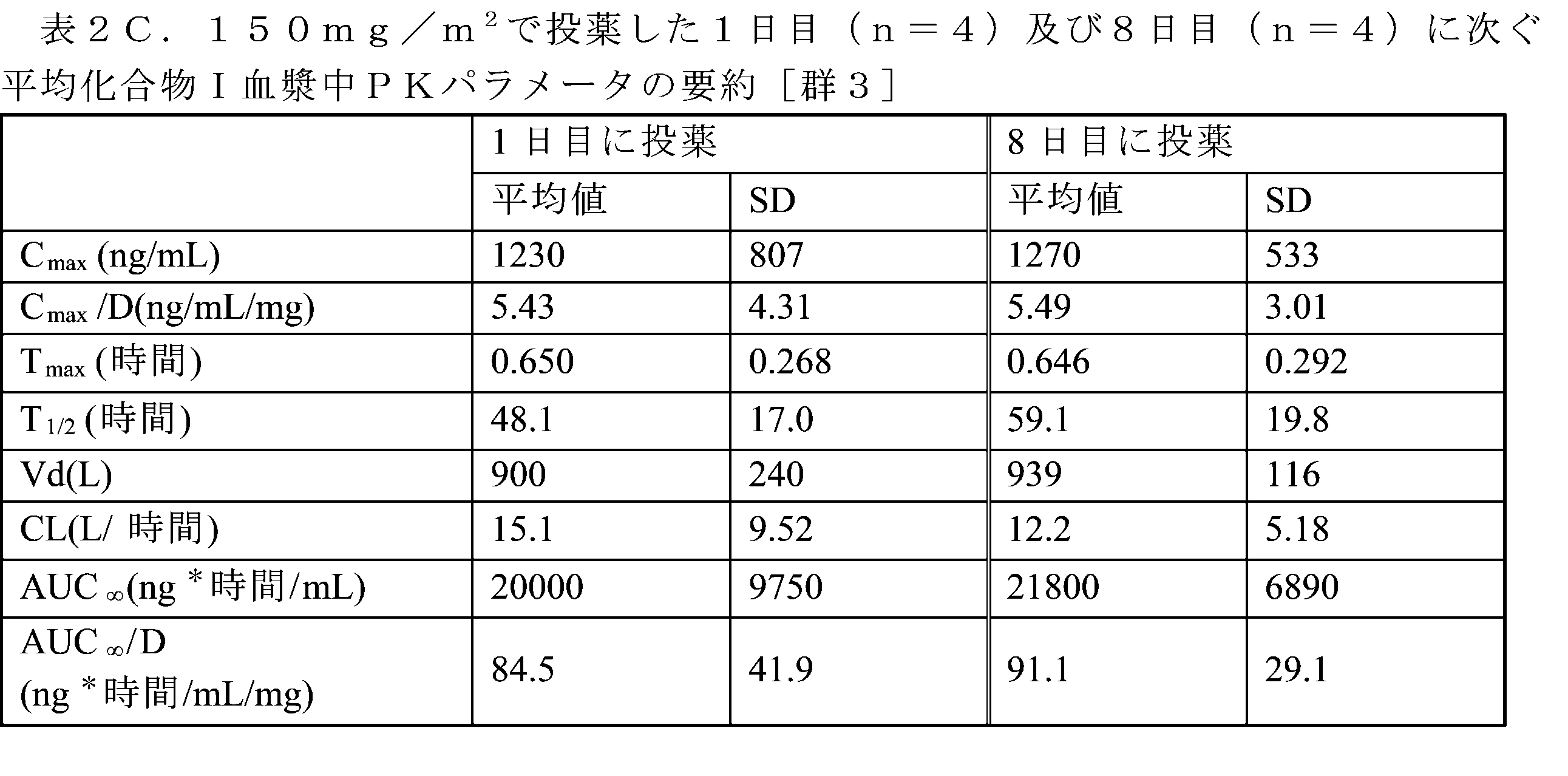
患者の血漿中の化合物Iのレベルを、液体クロマトグラフィータンデム質量分析(LC/MS/MS)アッセイによって分析した。検証された方法の実験手順を下記に要約する。群1~7については1回目の用量及び2回目の用量後、群8~10については1回目の用量及び3回目の用量後の薬物動態パラメータが、表2A~2Jに示される。表2A~2Jにおいて、SD=標準偏差、Cmax=最高観察濃度、D=用量、Tmax=最高観察濃度までの時間、T1/2=消失半減期;Vd=分布容積、CL=薬物クリアランス、及びAUC∞=0時間から無限大時間までの濃度-時間曲線下面積(総曝露量)。
表2A~2Gに示されるように、1日目/8日目Q4wレジメン(群1~7)による1日目及び8日目の用量に次いで、化合物Iは一般に、両日において、定常分布相、続いて長い緩徐な消失相を伴う片対数的な二相性の速度論的挙動を表した。これは全ての用量レベルにわたって類似していた。さらに、これはまた1日目/8日目/15日目Q4wレジメンによる1日目及び15日目の両方の用量でも観察された(群8~10、表2H~2J)。
1日目/8日目Q4wレジメン(群1~7)によると、1日目の投与に次いで、化合物Iは、試験した全ての用量レベル(公称50mg/m2~475mg/m2)にわたって、0.508±0.0167時間~1.19±0.337時間(Tmax)で最高血漿中濃度に達することが観察された。Cmax値は、728±291ng/mL~1,940±531ng/mLの範囲であった。200mg/m2の用量では外れ値が存在するようであり、平均Cmax値は8,950±15,100ng/mLであった。8日目には、Cmaxは、642±385ng/mL~1,710±221ng/mLと観察された。両日に次ぐ総曝露量(AUC∞)は、1日目及び8日目の投薬について、それぞれ6,650±803時間*ng/mL~36,200±16,600ng/mL、及び9,120±7,630時間*ng/mL~35,400±16,800時間*ng/mLと観察された。対象間PK変動にもかかわらず、試験した7つの用量レジメンにわたって用量と曝露量との間にいくらかの相関が存在するようであった(図1A~1D)。見かけ上の消失半減期は長く、1日目の用量に次いで37.3±8.3時間~81.8±41.2時間、及び8日目の用量に次いで42.6±22.2時間~96.9±15.3時間の範囲であった。これら2つの用量間で観察される見かけ上の差異は存在しないようであった。
1日目/8日目/15日目Q4wレジメン(群8~10)によると、1日目の投与に次いで、化合物Iは、0.767±0.289時間~1.18±0.169時間(Tmax)で最高血漿中濃度に達することが観察された。Cmax値は、1,140±295ng/mL~3,080±1,020ng/mLの範囲であった。15日目には、Cmax値は、2,870±2,310ng/mL~4,170±1,570ng/mLの範囲であった。325mg/m2の用量では外れ値が存在するようであり、平均Cmax値は21,100±38,000ng/mLであった。両日に次ぐ総曝露量(AUC∞)は、1日目及び15日目の投薬について、それぞれ29,100±4,440時間*ng/mL~57,500±18,700ng/mL、及び32,500±19,600時間*ng/mL~62,200±38,200時間*ng/mLと観察された。対象間PK変動にもかかわらず、試験した3つの用量レジメンにわたって用量と曝露量との間にいくらかの相関が存在するようであった(図2A~2D)。見かけ上の消失半減期は長く、1日目の用量に次いで61.5±15.5時間~122±71.9時間、及び15日目の用量に次いで59.0±11.2時間~93.6±78.8時間の範囲であった。1回目の用量と3回目の用量との間で観察される見かけ上の差異は存在しないようであった。
2つの用量スケジュール(群1~7対群8~10)間において、大きい対象間変動に起因して、曝露量と消失半減期との間に見かけ上の差異は存在しないようであった(図3A~3D)。
用量レベル毒性(dose level toxicity)(DLT)は、群1~10の間で何ら観察されなかった。5件の処置関連のグレード3の非DLT光線過敏症(群1、5、及び8~10において)が生じたが、これは可逆的であり、光防護措置の欠如に続発するものであった。3件の重篤な有害事象(SAE)は、化合物Iに関連すると考えられた(皮膚の光線過敏症(n=2)及び眼の光線過敏症(n=1))。処置関連AE≧10%は、皮膚の光線過敏症(59%)、眼の光線過敏症(21%)、粘膜炎(15%)、悪心(44%)、手足症候群(23%)、頭痛(10%)、及び湿疹(10%)であった。
このPK研究から、第II相試験に関して475mg/m2が1日目/8日目/15日目Q4wレジメンに適切な用量であると決定された。
処置された40人の患者のうち、34人は、病勢進行(n=29)、疾患症状の進行(n=4)、または同意撤回(n=1)のいずれかに起因して試験中止となった。最良奏効の点では、乳癌を有する3人を含めた4人の患者(2例の生殖細胞系列BRCA2、1例の生殖細胞系列BRCA2 VUS、生殖細胞系列PALB2)、及び乳癌を有する2人を含めたさらなる6人の患者(4例の生殖細胞系列BRCA2、2例の体細胞系列BRCA1/2)において部分奏効が確認され、このうち≧4サイクルについては病勢安定が最良奏効であった。実施例3における患者のうち、PARP阻害剤による事前療法を受けた8人の患者は全て、≦2サイクル後に早期進行を有したが、1人の卵巣癌患者及び1人の転移性乳癌患者のみがBRCA2変異を有していた。
ヒト血漿試料のアッセイ
上述したように対象から収集したヒト血漿試料中の化合物Iの濃度。血漿試料中の化合物Iの濃度を、5.00~5000ng/mLの9つのレベルの校正標準、ならびに15.0ng/mL(低)、2500ng/mL(中)、及び4000ng/mL(高)の3つのレベルのQCに基づいて測定した。
ヒト血漿中の化合物Iを測定するLC/MS/MSで検証した方法(ヘパリンナトリウム)
試料調製
化合物Iの2つの参照標準マスター原液を、化合物1参照標準を50:50:0.1のACN:diH2O:FA(v/v/v)と共に溶解させ、7分間超音波処理することによって調製した(diH2O=脱イオン水)。得られた溶液を、化合物I校正標準及びQC試料のスパイキングのために50:50:0.1のACN:diH2O:FA(v/v/v)で一連の希釈標準原液(WSS)へとさらに希釈した。マスター原液は、アッセイ当日に新たに調製したか、または後の使用のために公称2℃~8℃で保管した。マスター原液は、安定性時間枠内に使用した。
内部標準マスター原液である(2-(4-メチル-ピペラジン-1-イル)-5-オキソ-5H-7-チア-1,11b-ジアザ-ベンゾ[c]フルオレン-6-カルボン酸(5-メチル-ピラジン-2-イルメチル)-アミド)(化合物A)を、化合物A内部標準を50:50:0.1のACN:diH2O:FA(v/v/v)に溶解させることによって調製した。この原液を、使用するまで公称2℃~8℃で保管した。保管された内部標準原液は、各アッセイのバッチにおいて化合物Iの検出に対する干渉の欠如を示すことにより、使用に好適であることが検証された。アッセイ当日、原液を、試料のスパイキングのために50:50:0.1のACN:diH2O:FA(v/v/v)で希釈標準原液へとさらに希釈した。
各校正標準及びQC試料を調製するために、10μLの適切な希釈標準原液をPPE管に添加した。ブランクアッセイマトリックスを500×gで1分間遠心分離して沈殿物を除去し、遠心分離したアッセイマトリックスを適切にラベル付けされた新たな容器に注いだ。遠心分離したアッセイマトリックスの190μLのアリコートを全ての管に添加し、渦流混合した。体積10μLのスパイキングITS(内部標準)を、blk試料を除いて全ての二次PPE管に添加し、100μLの適切にスパイクした試料を二次PPE管に移し、渦流混合した。全てを600μLのACNの添加によりタンパク質沈殿させ、渦流混合し、13700×gで5分間遠心分離した。上清を13×100mm使い捨てガラス管に移し、空気または窒素流下において40℃±2℃で蒸発乾固させた。乾燥させた試料を、50:50:0.1のACN:diH2O:FA(v/v/v)を添加することによって再構成し、1分間渦流混合し、7分間超音波処理し、2440×gで5分間遠心分離した。試料を機器にロードするためにLCバイアルに移す。
ヒト血漿試験試料を室温で補助なしに解凍させた。室温まで解凍すると、試料を最高速度で渦流混合した。体積10μLのスパイキングITSをPPE管に添加し、100μLの試験試料を適切なPPE管に添加した。試験試料を、タンパク質沈殿、乾燥、及び再構成のために、校正試料及びQC試料と同じプロセスに供した。希釈を必要とする試験試料の場合、50μLの試験試料を二次PPE管に移し、450μLのブランクアッセイマトリックスを添加し、十分に渦流混合した。総体積100μLの希釈した試験試料を、アッセイのためにITSを含有するPPE管に添加する。再構成した試料は、校正標準及びQC試料と共にLC/MS/MS分析のためにLCバイアルに移すことになる。
LC/MS/MS計測機器パラメータ
Micromass MassLynx(登録商標)バージョン4.0によって制御されるWaters Micromass(商標)Quattro-LCまたはQuattro-Microタンデムトリプル四重極型質量分析計と結合したAgilent Model 1100 HPLCシステムをアッセイに使用した。
分析法パラメータを下記に要約する。
一定濃度
移動相:7:3(v/v)のACN:75mMギ酸アンモニウム(pH2.5)とギ酸を使用した溶出
カラム:Zorbax 300-SCX、3×50mm、5μm
流量:0.5mL/分
ランタイム:6分間
注入体積:5μL
MSモード:ESIポジティブMRMモード
データ収集及びクロマトグラフピーク積分は、Micromass MassLynx(登録商標)バージョン4.0を使用して実施した。回帰分析は、Thermo Watson(商標)Bioanalytical LIMSバージョン7.4.0.0により実施した。記述統計は、Thermo Watson(商標)Bioanalytical LIMSバージョン7.4.0.0またはMicrosoft Excel 2007を使用して実施した。
ノンコンパートメント薬物動態パラメータは、定着しているソフトウェアプログラムであるPhoenix WinNonlinバージョン8から導出した。
実施例4:化合物Iに対する応答の予測的バイオマーカーの評価
図7は、gBRCA1、gBRCA2、体細胞系列BRCA1、p53、PALB2における遺伝子変異、または他の体細胞系列相同組換え変異を有する患者における、各用量レベルでのベースラインからの腫瘍縮小%を示す。変異ステータス不明の患者は、図7で「u」とラベル付けされ、ラベル付けのない患者は、同定されたゲノム変異を有しなかった。評価可能な患者についての各用量レベルでの治療を受けている継続期間は、図8に図示される。
実施例3に記載される研究において、18人の患者が転移性乳癌であると診断された。これら18人の患者のうち、PARP阻害剤による事前処置を受けなかった、BRCA1/2生殖細胞及び関連性のある体細胞変異を有する転移性乳癌である10人の患者を、乳癌に関連するバイオマーカーの予測性を評価するための継続中の研究に組み入れた。この研究は、化合物Iに対する応答の予測的バイオマーカーを評価し、生殖細胞系列HRD異常と化合物Iの処置の成果との間の関係を探索するために実施された。
実施例3に記載される研究において、12人の患者がBRCA1またはBRCA2変異を持っていた。処置中のこれらの12人の患者の腫瘍体積の要約が図4に示される。BRCA1またはBRCA2変異を持つ12人の患者の同じ群から、8人の患者が乳癌を有していた(図5)。これら8人の患者のうち、6人の患者がBRCA2変異を持ち、乳癌を有していた(図6)。図4~6において、各バーは、実施例3における処置群に対応する群番号によって示されるような処置群の個体を表す。
この研究に組み入れた10人の患者のうちの1人は、群10(650mg/m2)からの患者であり、この患者はPALB2変異及びBRCA2変異を持ち、化合物Iでの処置に対して部分奏効(PR)を示した。
この研究は、BRCA2変異を有する患者が、150mg/m2以上の用量で化合物Iでの処置に応答し、腫瘍縮小が観察されたことを示した。
実施例5:注射30mg/mL(150mg/バイアル)用の化合物I及びスクロースを含む液体製剤の調製ならびにスクロースとの化合物Iの凍結乾燥形態の調製
配合:37.5kgのWFIを15~30℃の範囲の温度で配合容器に加えた。圧力容器の底に窒素スパージング管を配置することによって、WFIを窒素で30分以上激しくスパージする。溶存酸素含量が≦1ppmとなるまで、容器中でスパージングを継続する。第2の圧力容器に20.0kgの窒素でスパージしたWFI及びスクロースを添加し、窒素スパージングを継続しながら溶解するまで15分以上混合した。溶存酸素含量がスクロース溶液の≦1ppmとなるまで、必要に応じて窒素スパージングを継続した。スクロース溶液に、813.8gの2M HCl溶液をゆっくりと添加し、添加が完了してから10分以上混合した。化合物Iをスクロース溶液の容器に添加し、化合物Iを含有していた容器を、窒素でスパージしたWFIですすぐ。溶解するまで溶液を混合する(15分以上)。43.5mLの2M HClを添加し、5分以上混合する。溶液が外観上溶解していない場合、さらなる43.5mL分量の2M HClを添加し、5分以上混合する。必要であれば、窒素でスパージしたWFIを使用して調製した2M HClまたは1M NaOH溶液で、pHを4.4~4.6に調整する。2M HClまたは1M NaOHの各添加の後では、溶液を混合する。必要に応じて、窒素でスパージしたWFIで量を調整する。10mLの試料を取り出してpHを測定する。必要であれば、窒素でスパージしたWFIを使用して調製した2M HClまたは1M NaOH溶液を使用して、pHを4.4~4.6に再調整する。このステップに直接続けて濾過及び充填を行った。いかなる材料も一晩保管はしなかった。
0.22μMメンブレンフィルターによる滅菌:標準的な滅菌濾過作業は、ポリカーボネートハウジングに収容される2つの0.22μM親水性ポリフッ化ビニリデン(PVDF)膜に通した膜濾過によって、配合済みバルク溶液の滅菌を実施するように設計された。配合済みバルクは、滅菌濾過作業では典型的であるが、重複的な滅菌性能を提供するように直列の2つの滅菌膜に通過させた。
滅菌溶液の無菌充填:化合物Iの滅菌溶液を、目標充填量(5.05g/バイアル)の維持を保証するために定期的な重量チェックを行いながら、20ccの清浄な脱パイロジェン処理したガラスバイアル中に充填し、バイアルを滅菌エラストマークロージャーで半分栓をして、製剤Aの試料を得た。次いで、充填したバイアルを、凍結乾燥のために凍結乾燥機チャンバーの棚上に移して、凍結乾燥製剤Bの試料を得る。製剤Bは、IV投与用に、水、5%デキストロース水溶液、または5%グルコース水溶液等の溶液で再構成することができる。
引用を特定することによって本明細書で参照される全ての刊行物、特許、特許出願、及び公開特許出願の開示は、参照によりそれらの全体が本明細書に援用される。
引用される参考文献と本明細書との間に何らかの矛盾がある場合、本明細書が優先されるものとする。本願の実施形態の説明においては、明確さを目的として具体的な用語が用いられる。しかしながら、本発明は、そのように選択された具体的な用語に限定されることは意図されない。本明細書において、本発明の範囲を限定するものと見なされるべきものは何もない。提示される全ての実施例は、代表的かつ非限定的なものである。上記の教示に照らして当業者には理解されようが、上述の実施形態は、本発明から逸脱することなく修正または変更されてもよい。したがって、特許請求の範囲及びそれらの均等物の範囲内で、本発明が具体的に記載される様態とは異なる様態で実施されてもよいことを理解されたい。