JP7565564B2 - 化合物、有機半導体材料、および有機電子デバイス - Google Patents
化合物、有機半導体材料、および有機電子デバイス Download PDFInfo
- Publication number
- JP7565564B2 JP7565564B2 JP2023541123A JP2023541123A JP7565564B2 JP 7565564 B2 JP7565564 B2 JP 7565564B2 JP 2023541123 A JP2023541123 A JP 2023541123A JP 2023541123 A JP2023541123 A JP 2023541123A JP 7565564 B2 JP7565564 B2 JP 7565564B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- hydrocarbon group
- units
- compound
- acceptor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains three hetero rings
- C07D513/20—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10D—INORGANIC ELECTRIC SEMICONDUCTOR DEVICES
- H10D30/00—Field-effect transistors [FET]
- H10D30/60—Insulated-gate field-effect transistors [IGFET]
- H10D30/67—Thin-film transistors [TFT]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Electroluminescent Light Sources (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Description
[1] 下記式(Do-A)で表される単位を含むドナー性ユニットと、アクセプター性ユニットとを、それぞれ1つ以上有し、ドナー性ユニットとアクセプター性ユニットが互いに連結されている化合物。下記式(Do-A)中、Raは炭素数2~10のアルキレン基を表し、*は、結合手を表す。
[3] 前記ドナー性ユニットと、前記アクセプター性ユニットとを繰り返し単位として有する[1]または[2]に記載の高分子型化合物。
[4] 前記ドナー性ユニットと前記アクセプター性ユニットとが交互に配置されている[3]に記載の高分子型化合物。
[5] 重量平均分子量(Mw)が1500以上である[3]または[4]に記載の高分子型化合物。
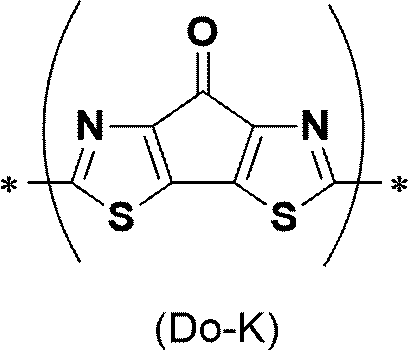
[6] 前記高分子型化合物に含まれる複数のドナー性ユニットが、更に下記式(Do-K)で表される単位を含む[3]~[5]のいずれかに記載の高分子型化合物。下記式(Do-K)中、*は、結合手を表す。
[8] 前記ドナー性ユニットに2つの前記アクセプター性ユニットが連結されている[1]に記載の三量体型化合物。
[9] [1]~[8]のいずれかに記載の化合物を含む有機半導体材料。
[10] [9]に記載の有機半導体材料を含む有機電子デバイス。
(1)縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子とヘテロ原子である、ヘテロ芳香族縮環型ユニット。
(2)縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子である、芳香族縮環型ユニット。
(3)芳香族環を有し、縮環構造を有さない、単環型ユニット。
ヘテロ芳香族縮環型ユニットとは、縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子とヘテロ原子である構造単位である。ヘテロ原子とは、炭素原子以外の原子のことである。ヘテロ芳香族縮環型ユニットを換言すると、芳香族環を含有する縮環型ユニットであって、この縮環型ユニットの縮環を構成する環の少なくとも1つが炭素原子とヘテロ原子から構成される複素環であるユニットである。即ち、縮環構造を有している縮環型ユニットは、少なくとも1つの複素環を有している。ヘテロ原子は各々、例えば窒素原子、硫黄原子、または酸素原子である。
R1は、水素原子であるか、炭化水素基であるか、-(CH2)p-OR3であり、R3は、炭化水素基である。アクセプター性ユニットが複数のR1を有するとき、当該複数のR1のうち、互いに同一のR1があってもよく、互いに異なるR1があってもよい。
R2は、炭化水素基である。アクセプター性ユニットが複数のR2を有するとき、当該複数のR2のうちに、互いに同一のR2があってもよく、互いに異なるR2があってもよい。
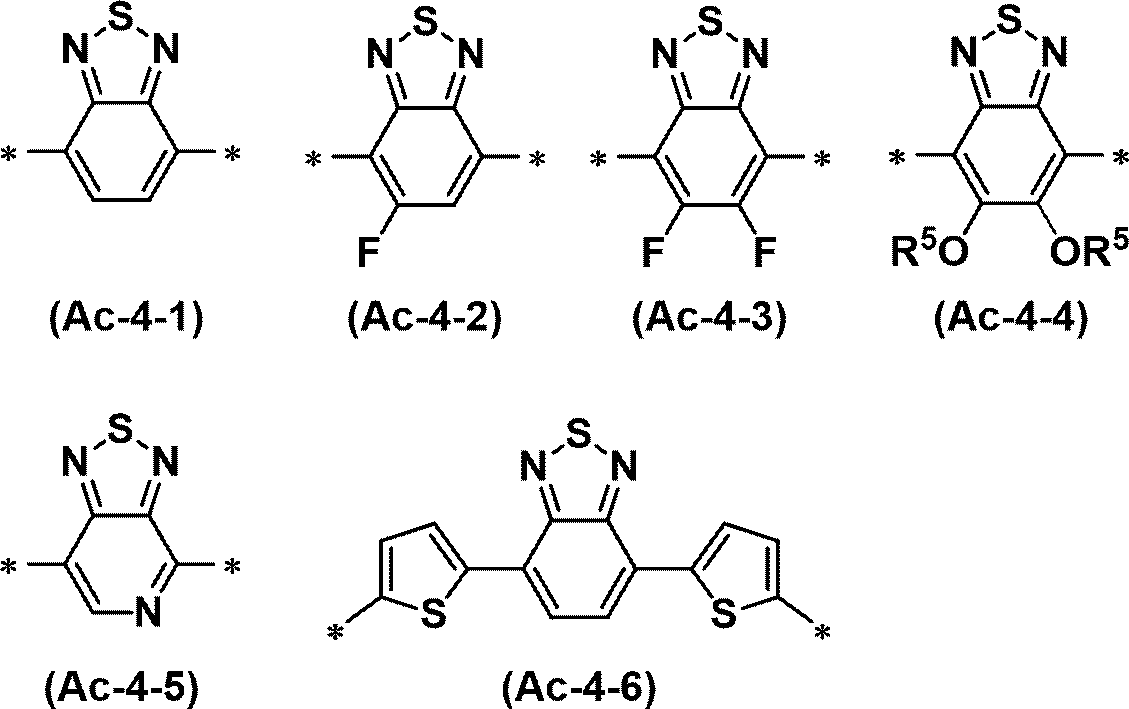
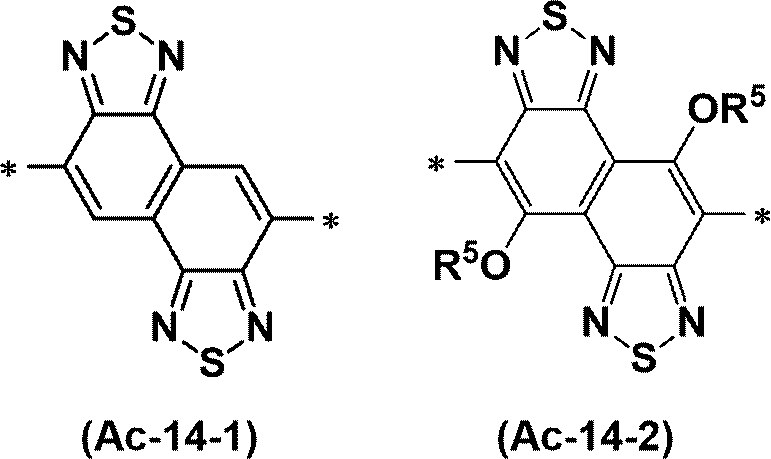
A1およびA2は、それぞれ独立に、-(CH2)q-OR4であるか、アルコキシ基、チオアルコキシ基、炭化水素基、またはオルガノシリル基で置換されていてもよいチオフェン環であるか、炭化水素基またはオルガノシリル基で置換されていてもよいチアゾール環であるか、アルコキシ基、チオアルコキシ基、炭化水素基、オルガノシリル基、ハロゲン原子、またはハロゲン化アルキル基で置換されていてもよいフェニル基であり、R4は、炭化水素基である。
D1は、CHまたは窒素原子である。アクセプター性ユニットが複数のD1を有するとき、当該複数のD1のうちに、互いに同一のD1があってもよく、互いに異なるD1があってもよい。
D2は、炭素原子、ケイ素原子、または窒素原子である。
nは、0または1である。
*は、結合手を表す。式(Ac-1)~式(Ac-17)で表されるユニットが化合物の末端の場合は、*は水素原子であってもよい。
化合物が複数のアクセプター性ユニットを有するとき、T1、T2、R1、R2、A1、A2、D1、およびD2は各々、ユニット間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
芳香族縮環型ユニットとは、縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子である構造単位である。
R2は、炭化水素基であり、R2は、互いに同一でも異なっていてもよい。
*は、結合手を表す。式(Ac-21)で表されるユニットが化合物の末端の場合は、*は水素原子であってもよい。
化合物が複数のアクセプター性ユニットを有するとき、T1、T2、およびR2は各々、ユニット間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
単環型ユニットとは、芳香族環を有し、縮環構造を有さない構造単位である。
*は、結合手を表す。式(Ac-31)~式(Ac-33)で表されるユニットが化合物の末端の場合は、*は水素原子であってもよい。
化合物が複数のアクセプター性ユニットを有するとき、T1およびT2は各々、ユニット間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
Yは、ハロゲン原子を表す。
式(ac-1)~式(ac-17)で表されるアクセプター原料の2種以上を組み合わせて用いるとき、T1、T2、R1、R2、A1、A2、D1、D2、およびYは各々、アクセプター原料間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
Yは、ハロゲン原子を表す。
式(ac-21)で表されるアクセプター原料の2種以上を組み合わせて用いるとき、T1、T2、R2、およびYは各々、アクセプター原料間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
Yは、ハロゲン原子を表す。
式(ac-31)~式(ac-33)で表されるアクセプター原料の2種以上を組み合わせて用いるとき、T1、T2、およびYは各々、アクセプター原料間で同一でもよく、互いに異なっていてもよい。
環には、上述した置換基が結合していてもよい。]
(NMRスペクトル測定)
NMRスペクトル測定装置として、Varian社製の「400-MR」、およびBruker社製の「AVANCE NEO 600」を用いて、NMRスペクトル測定を行った。
(高分子型化合物の紫外可視吸収スペクトル測定)
紫外可視吸収スペクトルの測定は、高分子型化合物を溶媒に溶解させた溶液の状態で測定した。具体的には、高分子型化合物を、濃度が0.03g/Lになる様にクロロホルムに溶解し、紫外・可視分光装置(島津製作所社製、「UV-3600i Plus」)、および光路長1cmのセルを用いて、溶液状態における紫外可視吸収スペクトルを測定した。
(低分子型化合物の紫外可視吸収スペクトル測定)
紫外可視吸収スペクトルの測定は、低分子型化合物を溶媒に溶解させた溶液の状態で測定した。具体的には、低分子型化合物を、濃度が0.03g/Lになる様にクロロホルムに溶解し、紫外・可視分光装置(島津製作所社製、「UV-3600i Plus」)、および光路長1cmのセルを用いて、溶液状態における紫外可視吸収スペクトルを測定した。測定結果は実線で示した。
(実施例1)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、217mg、0.265mmol)、3,6-Bis(5-bromo-2-thienyl)-2,5-bis(2-hexyldecyl)-2,5-dihydropyrrolo[3,4-c]pyrrole-1,4-dione(HD-DPP-DB、242mg、0.265mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(10mg、9.7μmol)、トリス(2-メトキシフェニル)ホスフィン(16mg、45μmol)およびクロロベンゼン(8mL)を加え130℃で24時間反応した。反応終了後、メタノール(45mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が110.3mg(収率42%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-HD-DPP(以下、高分子型化合物1ということがある)であった。この際に、得られた高分子型化合物1の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図1に実線で示す。横軸は測定波長、縦軸は吸光度を示す(以下、紫外可視吸収スペクトル測定の結果について同じ)。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、3,6-Bis(5-bromo-2-thienyl)-2,5-bis(3,7-dimethyloctyl)-2,5-dihydropyrrolo[3,4-c]pyrrole-1,4-dione(DMO-DPP-DB、90.1mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(6.7mg、19μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が36.7mg(収率37%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-DMO-DPP(以下、高分子型化合物2ということがある)であった。この際に、得られた高分子型化合物2の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図2に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、3,6-Bis(5-bromo-2-pyridinyl)-2,5-dihydro-2,5-bis(2-octyldodecyl)pyrrolo[3,4-c]pyrrole-1,4-dione(ODD-DPPDPy-DB、116mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(6.7mg、19μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が107.2mg(収率86%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-ODD-DPPDPy(以下、高分子型化合物3ということがある)であった。この際に、得られた高分子型化合物3の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図3に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、5,13-Dibromo-2,9-bis(2-octyldodecyl)anthra[2,1,9-def:6,5,10-d’e’f’]diisoquinoline-1,3,8,10(2H,9H)-tetrone(ODD-PDI-DB、135mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(6.7mg、19μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、褐色固体が48.4mg(収率39%)得られた。NMRスペクトル測定の結果、得られた褐色固体は、P-Ac―CBTZ-ODD-PDI(以下、高分子型化合物4ということがある)であった。この際に、得られた高分子型化合物4の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図4に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、1,3-Dibromo-5,7-bis(2-butyloctyl)-4H,8H-benzo[1,2-c:4,5-c’]dithiophene-4,8-dione(BO-BDT-DB、87.5mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、褐色固体が22.9mg(収率29%)得られた。NMRスペクトル測定の結果、得られた褐色固体は、P-Ac―CBTZ-BO-BDT(以下、高分子型化合物5ということがある)であった。この際に、得られた高分子型化合物5の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図5に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、4,9-Dibromo-2,7-bis(2-octyldodecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(ODD-NDI-DB、120mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が8.8mg(収率8%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-ODD-NDI(以下、高分子型化合物6ということがある)であった。この際に、得られた高分子型化合物6の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図6に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、6-Bromo-3-(5-bromo-2,3-dihydro-3-oxo-2-ethylhexyl-1H-isoindol-1-ylidene)-2,3-dihydro-2-ethylhexyl-1H-Isoindol-1-one(EH-IND-DB、78.6mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(6.7mg、19μmol)およびクロロベンゼン(4mL)を加え130℃で24時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が23.4mg(収率34%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-EH-IND(以下、高分子型化合物7ということがある)であった。この際に、得られた高分子型化合物7の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図7に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、4,9-Dibromo-2,7-bis(2-octyldodecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(ODD-NDI-DB、121.4mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え、溶解性を確認しながら50℃から100℃まで段階的に昇温し、100℃で15時間反応した。50℃から100℃までの昇温は、溶解性を確認しながら50℃で1時間保持、65℃に昇温して1時間保持、75℃に昇温して1時間保持、85℃に昇温して1時間保持した後、100℃に昇温した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が43.2mg(収率41%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-ODD-NDI(以下、高分子型化合物8ということがある)であった。この際に、得られた高分子型化合物8の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図8に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、4,9-Dibromo-2,7-bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(TD-NDI-DB、134mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え130℃で15時間反応した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が42.4mg(収率36%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-TD-NDI(以下、高分子型化合物9ということがある)であった。この際に、得られた高分子型化合物9の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図9に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、217mg、0.265mmol)、3,6-Bis(5-bromo-2-thienyl)-2,5-bis(2-hexyldecyl)-2,5-dihydropyrrolo[3,4-c]pyrrole-1,4-dione(HD-DPP-DB、242mg、0.265mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(10mg、9.7μmol)、トリス(2-メトキシフェニル)ホスフィン(16mg、45μmol)およびクロロベンゼン(8mL)を加え130℃で24時間反応した。反応終了後、メタノール(45mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が110.3mg(収率42%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-HD-DPPであった。
マイクロウェーブ反応装置としてBiotage製の「Initiator+ Microwave System 356700」を用い、5mLのマイクロウェーブ(MW)用反応容器に、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、1,3-Dibromo-5-(2-decyltetradecyl)-4H-thieno[3,4-c]pyrrole-4,6(5H)-dione(TD-IMTH-DB、79.0mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え180℃で10分間MW反応を実施した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が63.7mg(収率89%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-TD-IMTH(以下、高分子型化合物11ということがある)であった。この際に、得られた高分子型化合物11の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図11に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、100mg、0.122mmol)、4,9-Dibromo-2,7-bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(TD-NDI-DB、134mg、0.122mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(5mg、4.8μmol)、トリス(2-メトキシフェニル)ホスフィン(7.5mg、21μmol)およびクロロベンゼン(4mL)を加え、溶解性を確認しながら50℃から100℃まで段階的に昇温し、100℃で15時間反応した。50℃から100℃までの昇温は、溶解性を確認しながら50℃で1時間保持、70℃に昇温して1時間保持した後、100℃に昇温した。反応終了後、メタノール(30mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン)した。次いでソックスレー抽出(クロロホルム)した結果、紺色固体が125mg(収率91%)得られた。NMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-TD-NDI(以下、高分子型化合物12ということがある)であった。この際に、得られた高分子型化合物12の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図12に実線で示す。
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、300mg、0.367mmol)、4,9-Dibromo-2,7-bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(TD-NDI-DB、402mg、0.367mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(15mg、14.7μmol)、トリス(2-メトキシフェニル)ホスフィン(22.0mg、62μmol)およびクロロベンゼン(12mL)を加え、130℃で24時間反応した。反応終了後、メタノール(90mL)に反応液を加えて析出した固体をろ取して、得られた固体をソックスレー洗浄(メタノール、アセトン、ヘキサン、クロロホルム)した。次いでソックスレー円筒ろ紙内部の固体を取り出し、再度クロロホルム中、超音波および攪拌操作によって溶解した結果、紺色固体が285.3mg(収率70%)得られた。クロロホルム可溶部に関してNMRスペクトル測定の結果、得られた紺色固体は、P-Ac―CBTZ-TD-NDI(以下、高分子型化合物13ということがある)であった。この際に、得られた高分子型化合物13の紫外可視吸収スペクトル測定を溶液の状態で行い、その測定結果も考慮に入れた。紫外可視吸収スペクトルの測定結果を図13に実線で示す。
20mLフラスコに、4-bromo-2,7-bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(TD-NDI-DB、299.2mg、0.2727mmol)、2-(tributylstannyl)-Thiazole(Bu3Sn-Thz、299.1mg、0.799mmol)、テトラキストリフェニルホスフィンパラジウム(0)(34mg、30μmol)およびトルエン(6.4mL)を添加し、110℃で16時間反応した。反応終了後、ブライン洗浄、トルエン抽出を実施し、濃縮した。さらに、メタノール(10mL)を加え、析出した固体をろ取した結果、黄色固体が247.9mg(収率82.2%)で得られた。NMRスペクトル測定の結果、得られた黄色固体は、TD-NDI-2Thz(以下、化合物14ということがある)であった。
1H NMR(400MHz,CDCl3):8.915(s,1H),8.018(d,2H),7.645(d,2H),4.024(d,4H),1.895(bs,2H),1.199(bs,80H),0.847(t,12H)
20mLフラスコに、実施例14で得られた化合物14(TD-NDI-2Thz、18.1mg、0.02mmol)およびテトラヒドロフラン(0.25mL)を添加し、-78℃で冷却後、ノルマルブチルリチウム(1.6mol/L、0.05mL)を添加し1時間反応させた。その後、1,3-Dibromo-5,5-dimethylhydantoin(DBH、15.51mg、0.06mmol)を添加し、室温で1時間反応した。反応終了後、酢酸エチルで抽出し、亜硫酸ナトリウム、水洗を実施し、有機層を硫酸マグネシウムで乾燥後に濃縮した。カラムクロマトグラフィー(クロロホルム/酢酸エチル=10)、メタノール(10mL)を加え、析出した固体をろ取した結果、黄色固体が15mg(収率72.5%)で得られた。NMRスペクトル測定の結果、得られた黄色固体は、TD-NDI-2Thz―Br(以下、化合物15ということがある)であった。
1H NMR(400MHz,CDCl3):9.140(s,2H),7.931(s,2H),4.085(d,4H),1.227-1.186(bs,80H),0.855(t,12H)
20mLフラスコ中において、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB)と、実施例15で得られた化合物15と、触媒量のトリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体と、触媒に配位させる配位子としてのトリス(2-メトキシフェニル)ホスフィンをクロロベンゼン中で加熱して反応させる。Ac-CBTZ-SBと化合物15のモル比は、1:1とする。反応液から、P-Ac-CBTZ-TD-NDI―2Thz(以下、高分子化合物16ということがある)を単離する。
装置:高速液体クロマトグラフ L-2420/L-2130(株式会社日立ハイテク社製)
移動相:クロロホルム流速1mL/min
カラム:Shodex GPC K-803L(昭和電工株式会社製)
<評価基準>
○:溶媒に溶解した。
△:高分子型化合物の一部が溶解せずに残っていた。
×:溶媒に溶解しなかった。
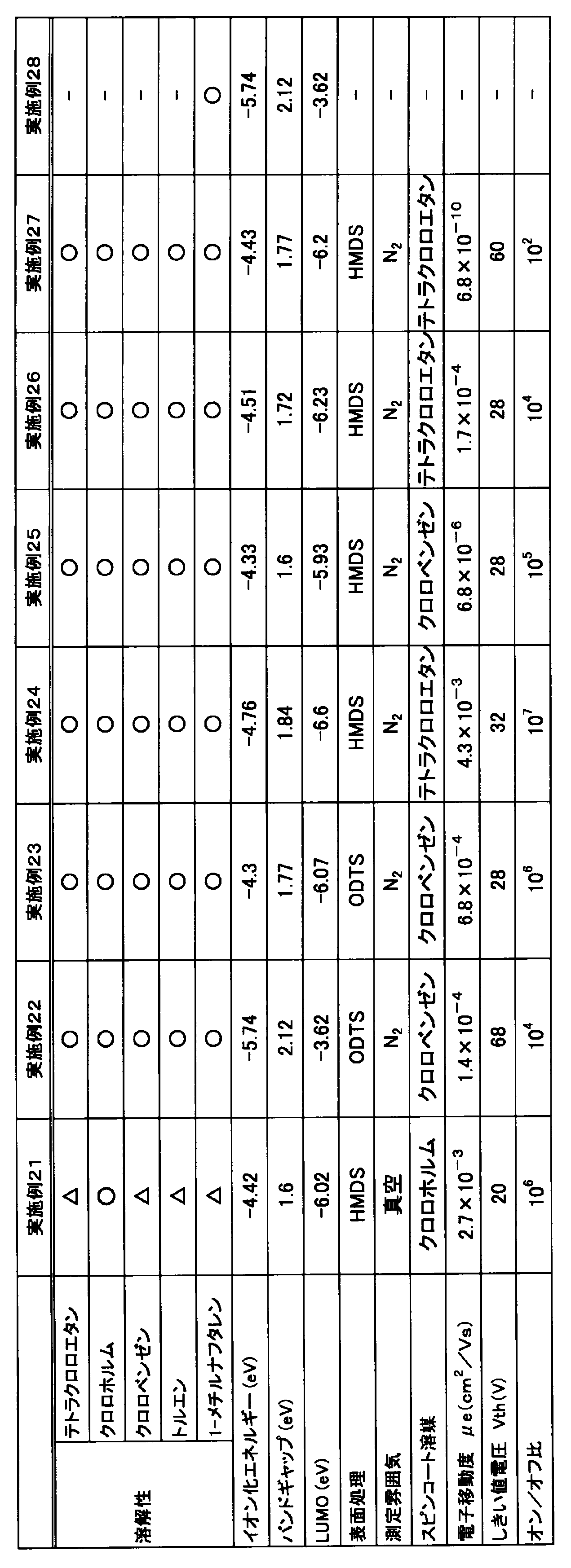
高分子型化合物の濃度が8mg/mLとなるようにクロロベンゼンに溶解し、得られた溶液をITO基板上にドロップキャストして成膜した。この膜について、常温、減圧下(0.1Pa以下)で、イオン化エネルギー測定装置(分光計器株式会社製、「BIP-KV202GD」)によりイオン化エネルギー(eV)を測定した。測定したイオン化エネルギーの値(eV)を下記表1に示す。
高分子型化合物のバンドギャップは、高分子型化合物を含む薄膜のUV(紫外可視吸収スペクトル)測定を行い、UVの立ち上がりに基づいて算出した。即ち、高分子型化合物の濃度が8mg/mLとなるようにクロロベンゼンに溶解し、得られた溶液をガラス基板(2.5cm×2.5cm四方、厚み0.8~1.0mm)上にスピンコートして薄膜を成膜した。この薄膜について、常温常圧下で、紫外・可視分光装置(島津製作所社製、「UV-3600i Plus」)によりUV測定を行った。薄膜の状態で測定したUV測定の結果を図1~図5、図7~図13に点線で示した。なお、実施例6については、薄膜の状態でのUV測定は行わなかった。また、UVの立ち上がりに基づいてバンドギャップ(eV)を算出した。算出したバンドギャップの値(eV)を下記表1に示す。
E=hc/λ
E=1239.8/841≒1.47(eV)
LUMO=-5.96+1.47=-4.49(eV)
オゾン処理したシリコン基板上を、ヘキサメチルジシラザン(HMDS)またはオクタデシルトリクロロシラン(ODTS)を用いて処理した。処理後の基板表面に、高分子型化合物の濃度が0.5質量%(7.4mg/mL)のクロロホルム溶液をスピンコートすることで、有機電界効果型トランジスタ(OFET)素子を作製した。なお、実施例13については、クロロホルムの代わりにクロロベンゼンを用い、高分子型化合物の濃度が0.5質量%のクロロベンゼン溶液をスピンコートした。作製したOFET素子につき、100℃で1時間のアニールを実施、放冷、150℃で1時間のアニールを実施、放冷後、Id-Vg特性を測定した。Id-Vg特性は、窒素雰囲気下または真空下で測定した。Id-Vg特性の測定には、ケースレーインスツルメンツ(KEITHLEY)製の「4200-SCS」を用い、有機半導体素子のチャネル長さは25μm、チャネル幅は294mmとした。Id-Vg特性の測定を行い、電子移動度μe(cm2/Vs)、しきい値電圧Vth(V)、オン/オフ比(Ion/Ioff)を求めた。150℃で1時間アニールを実施した後に測定したId-Vg特性の結果を下記表1に示す。なお、下記表1に示したイオン化エネルギー、バンドギャップ、LUMOの値の欄に記載した「-」は未実施を示している。
(実施例21)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-dibutyl-benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(BU-NDI-MB、67.3mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、クロロホルム(3mL)、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が52.7mg(収率72.3%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(Bu-NDI)(以下、低分子型化合物1ということがある)であった。得られた低分子型化合物1の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図15に実線で示す。
1H NMR(400MHz,CDCl3):9.075(s,2H),8.847(d,2H),8.826(d,2H),4.596(s,4H),4.216-4.134(m,8H),1.771-1.597(m,8H),1.407-1.201(m,16H),0.862(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-bis(2-ethylhexyl)-benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(EH-NDI-MB、84.3mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(10mL)を加え、析出した固体をろ取した結果、紺色固体が40.1mg(収率44.2%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(EH-NDI)(以下、低分子型化合物2ということがある)であった。
1H NMR(400MHz,CDCl3):9.367(s,2H),8.818(d,2H),8.788(d,2H),4.597(s,4H),4.218-4.139(m,8H),1.407-1.201(m,49H),0.951-0.864(m,32H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-dihexyl-benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(Hex-NDI-MB、75.3mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が59.9mg(収率73.3%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(Hex-NDI)(以下、低分子型化合物3ということがある)であった。得られた低分子型化合物3の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図16に実線で示す。
1H NMR(400MHz,CDCl3):9.334(s,2H),8.821(d,2H),8.786(d,2H),4.596(s,4H),4.218(quin,8H),1.836-1.588(m,4H),1.547-1.318(m,32H),0.894(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-dioctyl-benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(n-o-NDI-MB、83.5mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が71.7mg(収率80%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(n-o-NDI)(以下、低分子型化合物4ということがある)であった。得られた低分子型化合物4の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図17に実線で示す。
1H NMR(400MHz,CDCl3):9.341(s,2H),8.832(d,2H),8.787(d,2H),4.596(s,4H),4.218(quin,8H),1.535-1.153(m,48H),0.826(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7- bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(DMO-NDI-MB、91.2mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が85.9mg(収率95.5%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(DMO-NDI)(以下、低分子型化合物5ということがある)であった。得られた低分子型化合物5の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図18に実線で示す。
1H NMR(400MHz,CDCl3):9.355(s,2H),8.814(d,2H),8.778(d,2H),4.599(s,4H),4.214(quin,8H),1.505-1.123(m,48H),1.008(t,24H),0.849(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-didecylbenzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(DE-NDI-MB、92.5mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が57.5mg(収率71.0%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(DE-NDI)(以下、低分子型化合物6ということがある)であった。得られた低分子型化合物6の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図19に実線で示す。
1H NMR(400MHz,CDCl3):9.341(s,2H),8.820(d,2H),8.785(d,2H),4.596(s,4H),4.180(quin,4H),1.719(bs,4H),1.423-1.340(m,56H),0.859(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-bis(2-decyltetradecyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(TD-NDI-MB、183.4mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が58.3mg(収率38.3%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(TD-NDI)(以下、低分子型化合物7ということがある)であった。得られた低分子型化合物7の紫外可視吸収スペクトル測定を溶液の状態で行ない、測定結果を図20に実線で示す。
1H NMR(400MHz,CDCl3):9.393(s,2H),8.817(d,2H),8.780(d,2H),4.600(s,4H),4.131(t,4H),1.974(bs,4H),1.546-0.867(m,168H),0.818(t,12H)
20mLフラスコに、2,5-Bis(tributylstannyl)spiro[7H-cyclopenta[1,2-d:4,3-d’]bisthiazole-7,2’-[1,3]dioxolane](Ac-CBTZ-SB、60mg、0.0735mmol)、4-bromo-2,7-bis(2-phenylethyl)benzo[lmn][3,8]phenanthroline-1,3,6,8(2H,7H)-tetrone(PhEt-NDI-MB、81.8mg、0.147mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0)クロロホルム付加体(6mg、5.9μmol)、トリス(2-メトキシフェニル)ホスフィン(8.9mg、25.0μmol)およびクロロベンゼン(4mL)を添加し、130℃で16時間反応した。反応終了後、セライトろ過を実施し、濃縮した。さらに、メタノール(7mL)を加え、析出した固体をろ取した結果、紺色固体が68.3mg(収率84.2%)で得られた。NMRスペクトル測定の結果、得られた紺色固体は、Ac-CBTZ-2(PhEt-NDI)(以下、低分子型化合物8ということがある)であった。
1H NMR(400MHz,CDCl3):8.931(s,2H),8.806(d,2H),8.772(d,2H),7.732-7.205(m,10H),4.441-4.390(m,4H),3.055-3.006(m,8H)
<評価基準>
○:溶媒に溶解した。
△:低分子型化合物の一部が溶解せずに残っていた。
×:溶媒に溶解しなかった。
Claims (10)
- 下記式(Do-A)で表される単位を含むドナー性ユニットと、アクセプター性ユニットとを、合計で2つまたは3つ有する化合物であり、ドナー性ユニットとアクセプター性ユニットが互いに連結されており、
前記アクセプター性ユニットが、縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子とヘテロ原子である、下記式(Ac-1)~式(Ac-17)のいずれかで表されるヘテロ芳香族縮環型ユニットを含む低分子型化合物。
[式(Do-A)中、Raは炭素数2~6のアルキレン基を表し、*は、結合手を表す。]
[式(Ac-1)~式(Ac-17)中、T1およびT2は、それぞれ独立に、単結合であるか、-CH=CH-であるか、-C≡C-であるか、炭化水素基で置換されていてもよいチオフェン環であるか、炭化水素基で置換されていてもよいチアゾール環であるか、炭化水素基で置換されていてもよいピリジン環であるか、炭化水素基で置換されていてもよいピラジン環である。
R1は、水素原子であるか、炭化水素基であるか、-(CH2)p-OR3であり、R3は、炭化水素基であり、pは1~5の整数である。アクセプター性ユニットが複数のR1を有するとき、当該複数のR1のうち、互いに同一のR1があってもよく、互いに異なるR1があってもよい。
R2は、炭化水素基である。アクセプター性ユニットが複数のR2を有するとき、当該複数のR2のうちに、互いに同一のR2があってもよく、互いに異なるR2があってもよい。
A1およびA2は、それぞれ独立に、-(CH2)q-OR4であるか、アルコキシ基、チオアルコキシ基、炭化水素基、またはオルガノシリル基で置換されていてもよいチオフェン環であるか、炭化水素基またはオルガノシリル基で置換されていてもよいチアゾール環であるか、アルコキシ基、チオアルコキシ基、炭化水素基、オルガノシリル基、ハロゲン原子、またはハロゲン化アルキル基で置換されていてもよいフェニル基であり、R4は、炭化水素基であり、qは1~5の整数である。
D1は、CHまたは窒素原子である。アクセプター性ユニットが複数のD1を有するとき、当該複数のD1のうちに、互いに同一のD1があってもよく、互いに異なるD1があってもよい。
D2は、炭素原子、ケイ素原子、または窒素原子である。
nは、0または1である。
*は、結合手を表す。式(Ac-1)~式(Ac-17)で表されるユニットが化合物の末端の場合は、*は水素原子である。
化合物が複数のアクセプター性ユニットを有するとき、T1、T2、R1、R2、A1、A2、D1、およびD2は各々、ユニット間で同一でもよく、互いに異なっていてもよい。
環には、ハロゲン原子、炭化水素基、アルコキシ基、アシル基、エステル基、ハロゲン化アルキル基、シアノ基よりなる群から選ばれる少なくとも1種の置換基が結合していてもよい。] - 下記式(Do-A)で表される単位を含むドナー性ユニットと、アクセプター性ユニットとを、それぞれ2つ以上有し、ドナー性ユニットとアクセプター性ユニットが互いに連結されており、
前記アクセプター性ユニットが、縮環構造を有し、かつ環の少なくとも1つが芳香族環であり、環を構成する元素が炭素原子とヘテロ原子である、下記式(Ac-1)~式(Ac-17)のいずれかで表されるヘテロ芳香族縮環型ユニットを含む高分子型化合物。
[式(Do-A)中、Raは炭素数2~6のアルキレン基を表し、*は、結合手を表す。]
[式(Ac-1)~式(Ac-17)中、T1およびT2は、それぞれ独立に、単結合であるか、-CH=CH-であるか、-C≡C-であるか、炭化水素基で置換されていてもよいチオフェン環であるか、炭化水素基で置換されていてもよいチアゾール環であるか、炭化水素基で置換されていてもよいピリジン環であるか、炭化水素基で置換されていてもよいピラジン環である。
R1は、水素原子であるか、炭化水素基であるか、-(CH2)p-OR3であり、R3は、炭化水素基であり、pは1~5の整数である。アクセプター性ユニットが複数のR1を有するとき、当該複数のR1のうち、互いに同一のR1があってもよく、互いに異なるR1があってもよい。
R2は、炭化水素基である。アクセプター性ユニットが複数のR2を有するとき、当該複数のR2のうちに、互いに同一のR2があってもよく、互いに異なるR2があってもよい。
A1およびA2は、それぞれ独立に、-(CH2)q-OR4であるか、アルコキシ基、チオアルコキシ基、炭化水素基、またはオルガノシリル基で置換されていてもよいチオフェン環であるか、炭化水素基またはオルガノシリル基で置換されていてもよいチアゾール環であるか、アルコキシ基、チオアルコキシ基、炭化水素基、オルガノシリル基、ハロゲン原子、またはハロゲン化アルキル基で置換されていてもよいフェニル基であり、R4は、炭化水素基であり、qは1~5の整数である。
D1は、CHまたは窒素原子である。アクセプター性ユニットが複数のD1を有するとき、当該複数のD1のうちに、互いに同一のD1があってもよく、互いに異なるD1があってもよい。
D2は、炭素原子、ケイ素原子、または窒素原子である。
nは、0または1である。
*は、結合手を表す。式(Ac-1)~式(Ac-17)で表されるユニットが化合物の末端の場合は、*は水素原子であってもよい。
化合物が複数のアクセプター性ユニットを有するとき、T1、T2、R1、R2、A1、A2、D1、およびD2は各々、ユニット間で同一でもよく、互いに異なっていてもよい。
環には、ハロゲン原子、炭化水素基、アルコキシ基、アシル基、エステル基、ハロゲン化アルキル基、シアノ基よりなる群から選ばれる少なくとも1種の置換基が結合していてもよい。] - 前記ドナー性ユニットと、前記アクセプター性ユニットとを繰り返し単位として有する請求項2に記載の高分子型化合物。
- 前記ドナー性ユニットと前記アクセプター性ユニットとが交互に配置されている請求項3に記載の高分子型化合物。
- 重量平均分子量(Mw)が1500以上である請求項3に記載の高分子型化合物。
- 前記ドナー性ユニットに2つの前記アクセプター性ユニットが連結されている請求項1に記載の低分子型化合物。
- 請求項1に記載の低分子型化合物を含む有機半導体材料。
- 請求項2に記載の高分子型化合物を含む有機半導体材料。
- 請求項8または9に記載の有機半導体材料を含む有機電子デバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021200324 | 2021-12-09 | ||
| JP2021200324 | 2021-12-09 | ||
| PCT/JP2022/045473 WO2023106405A1 (ja) | 2021-12-09 | 2022-12-09 | 化合物、有機半導体材料、および有機電子デバイス |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JPWO2023106405A1 JPWO2023106405A1 (ja) | 2023-06-15 |
| JPWO2023106405A5 JPWO2023106405A5 (ja) | 2023-11-10 |
| JP7565564B2 true JP7565564B2 (ja) | 2024-10-11 |
Family
ID=86730537
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023541123A Active JP7565564B2 (ja) | 2021-12-09 | 2022-12-09 | 化合物、有機半導体材料、および有機電子デバイス |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP7565564B2 (ja) |
| TW (1) | TW202330554A (ja) |
| WO (1) | WO2023106405A1 (ja) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009098254A1 (en) | 2008-02-05 | 2009-08-13 | Basf Se | SEMICONDUCTOR MATERIALS PREPARED FROM RYLENE-(π-ACCEPTOR) COPOLYMERS |
| WO2012070582A1 (ja) | 2010-11-24 | 2012-05-31 | 住友化学株式会社 | 共役系化合物、並びにこれを用いた有機薄膜及び有機薄膜素子 |
-
2022
- 2022-12-09 TW TW111147509A patent/TW202330554A/zh unknown
- 2022-12-09 JP JP2023541123A patent/JP7565564B2/ja active Active
- 2022-12-09 WO PCT/JP2022/045473 patent/WO2023106405A1/ja not_active Ceased
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009098254A1 (en) | 2008-02-05 | 2009-08-13 | Basf Se | SEMICONDUCTOR MATERIALS PREPARED FROM RYLENE-(π-ACCEPTOR) COPOLYMERS |
| WO2012070582A1 (ja) | 2010-11-24 | 2012-05-31 | 住友化学株式会社 | 共役系化合物、並びにこれを用いた有機薄膜及び有機薄膜素子 |
Non-Patent Citations (1)
| Title |
|---|
| LI,S.B. et al.,Theoretical design and characterization of pyridalthiadiazole-based chromophores with fast charge tr,RSC Advances,2015年,Vol.5, No.37,pp.29401-29411,DOI:10.1039/C5RA00785B |
Also Published As
| Publication number | Publication date |
|---|---|
| TW202330554A (zh) | 2023-08-01 |
| WO2023106405A1 (ja) | 2023-06-15 |
| JPWO2023106405A1 (ja) | 2023-06-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102158583B1 (ko) | 전자 응용을 위한 관능화 벤조디티오펜 중합체 | |
| EP2834286B1 (en) | Diketopyrrolopyrrole polymers and small molecules | |
| US10211401B2 (en) | Organic semiconductor material | |
| TWI698457B (zh) | 高分子化合物 | |
| Mahesh et al. | Role of cyano substituents on thiophene vinylene benzothiadiazole conjugated polymers and application as hole transporting materials in perovskite solar cells | |
| JP6688453B2 (ja) | 有機半導体材料 | |
| JP7565564B2 (ja) | 化合物、有機半導体材料、および有機電子デバイス | |
| JP7468346B2 (ja) | 高分子化合物 | |
| JP6459971B2 (ja) | 有機半導体材料 | |
| JP7026391B2 (ja) | 半導体ポリマー | |
| JP7291360B1 (ja) | 高分子化合物、有機半導体材料、および有機電子デバイス | |
| Lim et al. | Well-defined alternative polymer semiconductor using large size regioregular building blocks as monomers: electrical and electrochemical properties | |
| JP6798651B1 (ja) | 高分子化合物 | |
| KR20240024264A (ko) | 유기 광검출기, 및 이것에 이용되는 유기 반도체 화합물 | |
| JP2024179191A (ja) | 化合物、有機半導体材料、および有機電子デバイス | |
| WO2023106404A1 (ja) | 高分子化合物、有機半導体材料、および有機電子デバイス | |
| WO2024237165A1 (ja) | 高分子化合物、および該高分子化合物を含む有機半導体材料 | |
| JP2024180252A (ja) | 低分子化合物、有機半導体材料、および有機電子デバイス | |
| TW202544012A (zh) | 組成物、光電轉換元件及光感測器 | |
| KR20180069823A (ko) | 디피롤로[1,2-b:1',2'-g][2,6]나프티리딘-5,11-디온 기재 중합체 및 화합물 | |
| TW202540118A (zh) | 化合物、組成物、墨水、光電轉換元件及光感測器 | |
| TW202545369A (zh) | 光電轉換元件和光學感測器 | |
| CN104592491B (zh) | 基于萘的共轭聚合物及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230705 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230705 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20230705 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230926 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231115 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240124 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240402 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240530 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240903 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240920 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7565564 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |