JP7428480B2 - 睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 - Google Patents
睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 Download PDFInfo
- Publication number
- JP7428480B2 JP7428480B2 JP2019106129A JP2019106129A JP7428480B2 JP 7428480 B2 JP7428480 B2 JP 7428480B2 JP 2019106129 A JP2019106129 A JP 2019106129A JP 2019106129 A JP2019106129 A JP 2019106129A JP 7428480 B2 JP7428480 B2 JP 7428480B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- sleep
- whey protein
- improving sleep
- improving
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000007958 sleep Effects 0.000 title claims description 72
- 239000000203 mixture Substances 0.000 title claims description 59
- 235000013305 food Nutrition 0.000 title claims description 18
- 239000003814 drug Substances 0.000 title description 7
- 229940079593 drug Drugs 0.000 title description 5
- 108010046377 Whey Proteins Proteins 0.000 claims description 59
- 102000007544 Whey Proteins Human genes 0.000 claims description 58
- 235000021119 whey protein Nutrition 0.000 claims description 57
- 239000003531 protein hydrolysate Substances 0.000 claims description 33
- 102000004157 Hydrolases Human genes 0.000 claims description 12
- 108090000604 Hydrolases Proteins 0.000 claims description 12
- 230000001965 increasing effect Effects 0.000 claims description 11
- 102000004190 Enzymes Human genes 0.000 claims description 10
- 108090000790 Enzymes Proteins 0.000 claims description 10
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 10
- 150000001413 amino acids Chemical class 0.000 claims description 8
- 238000010438 heat treatment Methods 0.000 claims description 7
- 230000008452 non REM sleep Effects 0.000 claims description 7
- 230000004622 sleep time Effects 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- 102000008192 Lactoglobulins Human genes 0.000 claims description 5
- 108010060630 Lactoglobulins Proteins 0.000 claims description 5
- 238000000354 decomposition reaction Methods 0.000 claims description 5
- 238000009826 distribution Methods 0.000 claims description 5
- 108091005804 Peptidases Proteins 0.000 claims description 3
- 102000035195 Peptidases Human genes 0.000 claims description 3
- 239000004480 active ingredient Substances 0.000 claims description 3
- 230000001737 promoting effect Effects 0.000 claims description 3
- 230000006698 induction Effects 0.000 claims description 2
- 230000000694 effects Effects 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 238000000034 method Methods 0.000 description 12
- 239000000243 solution Substances 0.000 description 10
- 229940088598 enzyme Drugs 0.000 description 8
- 239000006187 pill Substances 0.000 description 8
- 102000004407 Lactalbumin Human genes 0.000 description 7
- 108090000942 Lactalbumin Proteins 0.000 description 7
- 235000001014 amino acid Nutrition 0.000 description 7
- 229940024606 amino acid Drugs 0.000 description 7
- 235000021241 α-lactalbumin Nutrition 0.000 description 7
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 6
- 229940049706 benzodiazepine Drugs 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 208000019116 sleep disease Diseases 0.000 description 6
- 239000004365 Protease Substances 0.000 description 5
- 241000700159 Rattus Species 0.000 description 5
- 239000012141 concentrate Substances 0.000 description 5
- 235000013336 milk Nutrition 0.000 description 5
- 239000008267 milk Substances 0.000 description 5
- 210000004080 milk Anatomy 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 239000002775 capsule Substances 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 239000002994 raw material Substances 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 108090000526 Papain Proteins 0.000 description 3
- 206010062519 Poor quality sleep Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229940055729 papain Drugs 0.000 description 3
- 235000019834 papain Nutrition 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 230000002618 waking effect Effects 0.000 description 3
- NHJVRSWLHSJWIN-UHFFFAOYSA-N 2,4,6-trinitrobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O NHJVRSWLHSJWIN-UHFFFAOYSA-N 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 238000011993 High Performance Size Exclusion Chromatography Methods 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- DATAGRPVKZEWHA-YFKPBYRVSA-N N(5)-ethyl-L-glutamine Chemical compound CCNC(=O)CC[C@H]([NH3+])C([O-])=O DATAGRPVKZEWHA-YFKPBYRVSA-N 0.000 description 2
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 2
- 108090001109 Thermolysin Proteins 0.000 description 2
- 239000005862 Whey Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229940125717 barbiturate Drugs 0.000 description 2
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000005018 casein Substances 0.000 description 2
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 2
- 235000021240 caseins Nutrition 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 208000002173 dizziness Diseases 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 206010022437 insomnia Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000003183 myoelectrical effect Effects 0.000 description 2
- 238000001728 nano-filtration Methods 0.000 description 2
- ZWLUXSQADUDCSB-UHFFFAOYSA-N phthalaldehyde Chemical compound O=CC1=CC=CC=C1C=O ZWLUXSQADUDCSB-UHFFFAOYSA-N 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101000898643 Candida albicans Vacuolar aspartic protease Proteins 0.000 description 1
- 101000898783 Candida tropicalis Candidapepsin Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 101000957724 Catostomus commersonii Corticoliberin-1 Proteins 0.000 description 1
- 101000898784 Cryphonectria parasitica Endothiapepsin Proteins 0.000 description 1
- 108090000395 Cysteine Endopeptidases Proteins 0.000 description 1
- 102000003950 Cysteine Endopeptidases Human genes 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108090000131 Metalloendopeptidases Proteins 0.000 description 1
- 102000003843 Metalloendopeptidases Human genes 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 241000238413 Octopus Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 101000933133 Rhizopus niveus Rhizopuspepsin-1 Proteins 0.000 description 1
- 101000910082 Rhizopus niveus Rhizopuspepsin-2 Proteins 0.000 description 1
- 101000910079 Rhizopus niveus Rhizopuspepsin-3 Proteins 0.000 description 1
- 101000910086 Rhizopus niveus Rhizopuspepsin-4 Proteins 0.000 description 1
- 101000910088 Rhizopus niveus Rhizopuspepsin-5 Proteins 0.000 description 1
- 101000898773 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Saccharopepsin Proteins 0.000 description 1
- 108090000083 Serine Endopeptidases Proteins 0.000 description 1
- 102000003667 Serine Endopeptidases Human genes 0.000 description 1
- 208000032140 Sleepiness Diseases 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 102000005158 Subtilisins Human genes 0.000 description 1
- 108010056079 Subtilisins Proteins 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 230000007529 anxiety like behavior Effects 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 235000019658 bitter taste Nutrition 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 239000005417 food ingredient Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 208000013433 lightheadedness Diseases 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 235000020124 milk-based beverage Nutrition 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 108010043535 protease S Proteins 0.000 description 1
- 208000020016 psychiatric disease Diseases 0.000 description 1
- 230000036385 rapid eye movement (rem) sleep Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000033764 rhythmic process Effects 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 230000008667 sleep stage Effects 0.000 description 1
- 230000037321 sleepiness Effects 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 235000011121 sodium hydroxide Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229940026510 theanine Drugs 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 235000013618 yogurt Nutrition 0.000 description 1
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P60/00—Technologies relating to agriculture, livestock or agroalimentary industries
- Y02P60/80—Food processing, e.g. use of renewable energies or variable speed drives in handling, conveying or stacking
- Y02P60/87—Re-use of by-products of food processing for fodder production
Landscapes
- Fodder In General (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
すなわち本発明は、以下の様態を含むものである。
(1)ホエイタンパク質加水分解物を有効成分とする睡眠改善用組成物。
(2)前記睡眠改善用組成物が、ノンレム睡眠時間増加用組成物、睡眠時間増加用組成物、及び睡眠導入促進用組成物からなる群より選択される1つ以上であることを特徴とする、(1)に記載の睡眠改善用組成物。
(3)前記ホエイタンパク質加水分解物の分解率が25%以上であることを特徴とする(1)又は(2)のいずれかに記載の睡眠改善用組成物。
(4)前記ホエイタンパク質加水分解物が、以下の特徴を有するものである(1)から(3)のいずれかに記載の睡眠改善用組成物。
(A)分子量分布は10kDa以下、メインピーク200Da~3kDaである。
(B)APL(平均ペプチド鎖長)は2~8である。
(C)遊離アミノ酸含量が20%以下である。
(D)抗原性がβ-ラクトグロブリンの抗原性の1/10,000以下である。
(5)前記ホエイタンパク質加水分解物が、ホエイタンパク質をpH6~10、50~70℃において耐熱性のタンパク質加水分解酵素を用いて熱変性させながら酵素分解し、加熱して酵素を失活させて得られるものであることを特徴とする(1)から(4)のいずれかに記載の睡眠改善用組成物。
(6)前記ホエイタンパク質加水分解物が、ホエイタンパク質をpH6~10、20~55℃においてタンパク質加水分解酵素を用いて酵素分解し、これを50~70℃に昇温させ、pH6~10、50~70℃において耐熱性のタンパク質加水分解酵素を用いて未分解のホエイタンパク質を熱変性させながら酵素分解し、加熱して酵素を失活させて得られるものであることを特徴とする(1)から(4)のいずれかに記載の睡眠改善用組成物。
(7)(1)から(6)のいずれかに記載の睡眠改善用組成物を含むことを特徴とする睡眠改善用食品、睡眠改善用食品組成物、睡眠改善用医薬品、睡眠改善用医薬品組成物、又は睡眠改善用飼料。
本願の睡眠改善用組成物について説明する。
本願の睡眠改善用組成物は、ホエイタンパク質を加水分解したものである。
より具体的には、
ホエイタンパク質加水分解物の分解率が25%以上であり、
分子量分布は10kDa以下、メインピーク200Da~3kDaであり、
APL(平均ペプチド鎖長)は2~8であり、
遊離アミノ酸含量が20%以下であり、
抗原性がβ-ラクトグロブリンの抗原性の1/10,000以下、
という特徴を有するものである。
本願の睡眠改善用組成物に使用するホエイタンパク質加水分解物には、全長のαラクトアルブミンは実質的に含まれていない(HPLCによる当該ホエイタンパク質加水分解物の分析結果に基づく。データを示さず。)。より具体的には、当該ホエイタンパク質加水分解物に含まれる全長のαラクトアルブミンの量は、加水分解前のホエイタンパク質に含まれるαラクトアルブミンの量の10%以下、好ましくは、5%以下、2%以下、1%以下、0.5%以下、0.2%以下、又は0.1%以下である。
睡眠改善用組成物のホエイタンパク質加水分解物の分解率は、遊離のアミノ基を修飾して測定するオルトフタルアルデヒド(OPA)法等で測定することができる。ホエイタンパク質加水分解物の分子量分布は、High performance size exclusion chromatography (HPSEC)法等の方法で測定することができる。APL(平均ペプチド鎖長)は、TNBS(2,4,6-トリニトロベンゼンスルホン酸)法等の方法によって測定することができる。遊離アミノ酸含量は、75%エタノール等で遊離アミノ酸を抽出して、アミノ酸分析装置等で測定することができる。抗原性はInhibition ELISA法により評価することができる。
本発明の睡眠改善用組成物は、上記したように複数のペプチドを含むことから、2つ以上のペプチドの相加・相乗効果により0.01g/日以上の摂取で睡眠改善作用を発現しうる。一方、本発明の睡眠改善用組成物は、抗原性がβ-ラクトグロブリンの1/10,000以下で安全に摂取できるため、摂取量は投与対象者や食品の形態に応じて0.025g/日以上、0.1g/日以上、0.25g/日以上、1g/日以上、又は2.5g/日以上、及び、30g/日以下、20g/日以下、10g/日以下、5g/日以下、2.5g/日以下、又は1g/日以下とすることができる。
本発明の睡眠改善用組成物は、以下に記載のとおり、食品、食品組成物、医薬品、医薬品組成物、及び飼料に添加することができるが、その際の睡眠改善用組成物の添加量は上記した有効量が摂取できるよう適宜調整すればよい。
本発明の睡眠改善用組成物の睡眠改善作用は、実施例に記載したラットを対象とした動物試験により確認することができる。
本発明の睡眠改善用組成物の有効成分であるホエイタンパク質加水分解物は、例えば特開平4-112753号公報で報告されている方法によって得ることができる。この方法では、ホエイタンパク質をpH6~10、50~70℃とし、これに耐熱性のタンパク質加水分解酵素を加えて熱変性させながら酵素分解し、これを加熱して酵素を失活させることによって得られる。なお、上記酵素分解を行う前に、ホエイタンパク質をpH6~10、20~55℃においてタンパク質加水分解酵素を用いて酵素分解し、これを冷却することなく直ちに上記条件で酵素分解すると収率を一層高めることができる。
最後に、反応液を加熱して酵素を失活させる。酵素の失活は、反応液を100℃以上で10秒間以上加熱することにより行うことができる。
ホエイタンパク質10%水溶液1Lに、パパイン50U/g・ホエイタンパク質及びプロレザー(天野エンザイム社製)150U/g・ホエイタンパク質を加え、pH8に調整し、55℃において6時間ホエイタンパク質を変性させながら酵素分解を行った。反応液を100℃で15秒間以上加熱して酵素を失活させ、遠心分離して上清を回収し、これを乾燥してホエイタンパク質加水分解物(実施例品1)を得た。
得られたホエイタンパク質加水分解物の分子量分布は10kDa以下、メインピークは1.3kDa、APLは7.2、すべての構成成分に対する遊離アミノ酸含量は18.9%であった。
Inhibition ELISA法によってβ-ラクトグロブリンに対する抗原性の低下を測定したところ1/10,000以下で、分解率は28%、収率(酵素反応液を遠心分離し、仕込み量の乾燥重量に対する上清の乾燥重量の比率(%))は80.3%であった。
このようにして得られたホエイタンパク質加水分解物は、そのまま本発明の睡眠改善用組成物として使用可能である。
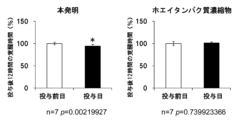
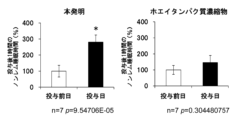
ホエイタンパク質加水分解物を使用して、睡眠改善効果について評価した。
8週齢のWistar系雄性ラット(日本SLC社)を購入し、12時間ごとの明暗周期の下で、市販固形飼料CRF-1(オリエンタル酵母社製)を与えて、飼料と水を自由に摂取させた。ラットに、脳波及び筋電位を測定するための電極を装着する手術を実施し、回復期として1週間以上の期間をおいて、試験を実施した。
ホエイタンパク質分解物を水に溶解し、ラット体重1kgあたり2.5g経口投与した(FDAのガイドラインをもちいてヒトに換算すると、1日当たり約30gに相当する)、また、比較対象として、ホエイタンパク質濃縮物(タンパク質含量80%)を水に溶解し、ラット体重1kgあたり2.5g経口投与した。投与は17時~18時(消灯1時間以内)に行い、投与前日の睡眠・覚醒時間と比較した。
脳波及び筋電位は睡眠解析ソフト「スリープサイン」(キッセイコムテック社製、Sleep sign ver2.0)を用いて、覚醒、ノンレム睡眠、レム睡眠の各睡眠ステージに分類した。
投与後12時間の覚醒時間、ノンレム睡眠時間を積算し、投与前日の覚醒時間、ノンレム睡眠時間と比較した。また、Student’s t-testの検定を行い、p<0.05で有意差ありと判定した。
一方で、比較対象として用いたホエイタンパク質濃縮物では、投与12時間のノンレム睡眠時間、覚醒時間、及び投与直後1時間のノンレム睡眠時間は、投与前日と比較して差はなかった。
ホエイタンパク質の加水分解に、パパイン及びプロレザーとは異なるプロテアーゼ(システインエンドペプチダーゼ、メタロエンドペプチダーゼ、セリンエンドペプチダーゼ、アスパラギン酸プロテアーゼ)を使用した場合に、図1~3と同様の結果が得られた(データを示さず)。
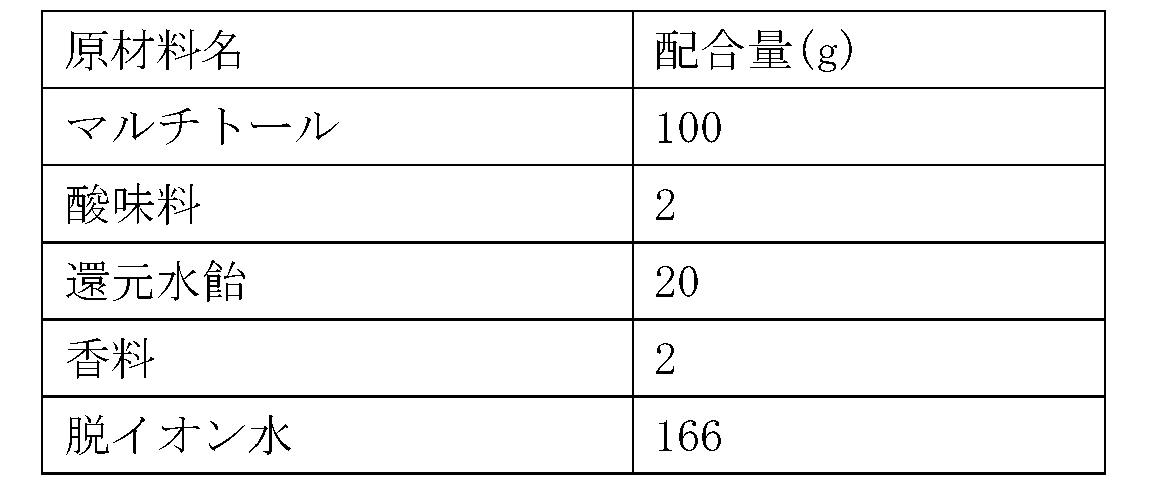
表1に示す配合で原材料を混合後、常法により造粒し、カプセルに充填して、睡眠改善用カプセル剤を製造した。
10gの実施例品1を700gの脱イオン水に添加し、50℃まで加熱後、9,500rpmで30分間撹拌混合した。
前記混合物に表2の原材料を添加した後、100mlのガラス瓶に充填し、95℃、15秒間殺菌後、密栓し、睡眠改善用飲料10本(100ml入り)を調製した。
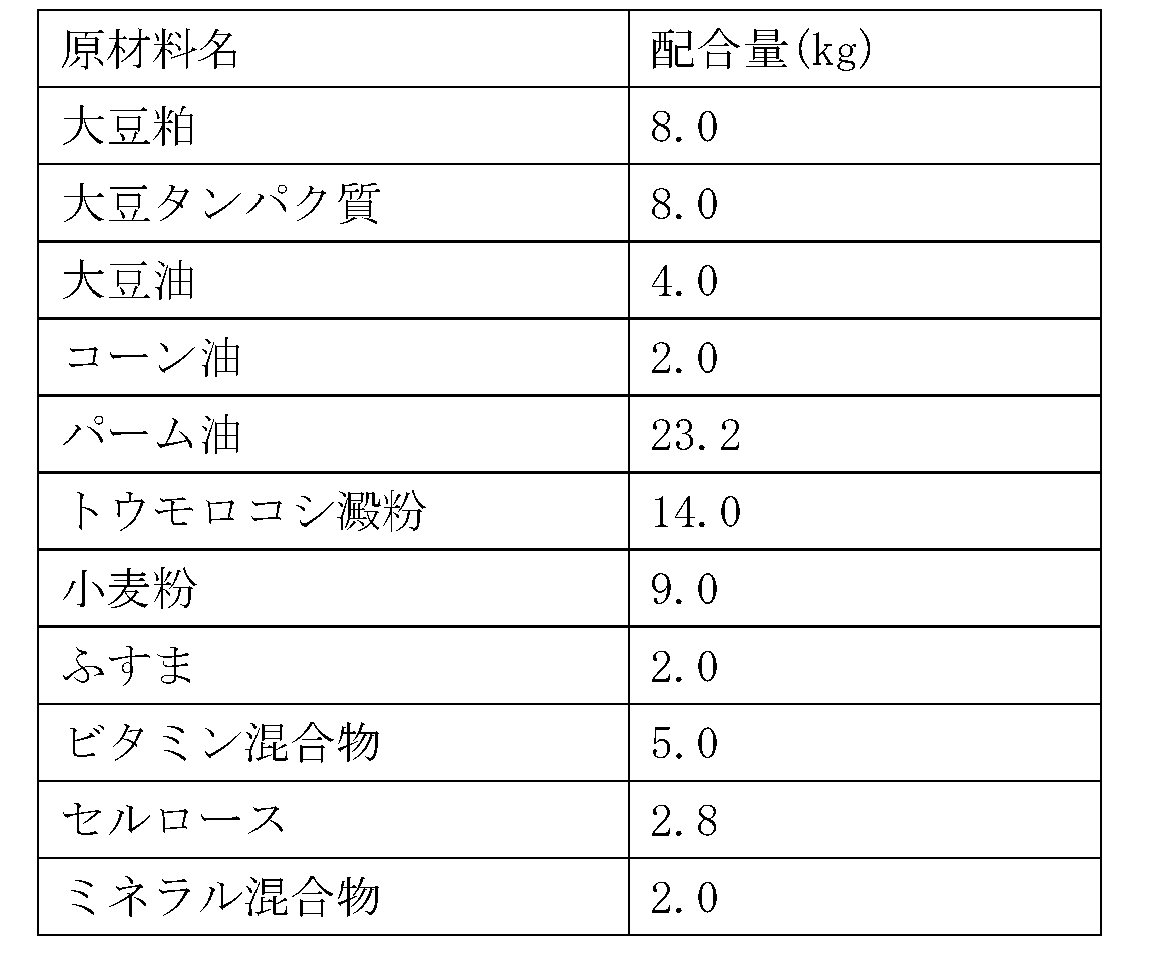
5kgの実施例品1を95kgの脱イオン水に添加し、50℃まで加熱後、3,600rpmで40分間撹拌混合して、実施例品1を5kg/100kg含有する溶液を得た。この溶液20kgに、表3の原材料の全量を混合し、120℃、4分間殺菌して、本発明のイヌ用睡眠改善用飼料100kgを製造した。
Claims (7)
- ホエイタンパク質加水分解物を有効成分とする睡眠改善用組成物。
- 前記睡眠改善用組成物が、ノンレム睡眠時間増加用組成物、睡眠時間増加用組成物、及び睡眠導入促進用組成物からなる群より選択される1つ以上であることを特徴とする、請求項1に記載の睡眠改善用組成物。
- 前記ホエイタンパク質加水分解物の分解率が25%以上であることを特徴とする請求項1又は請求項2のいずれか1項に記載の睡眠改善用組成物。
- 前記ホエイタンパク質加水分解物が、以下の特徴を有するものである請求項1から請求項3のいずれか1項に記載の睡眠改善用組成物。
(A)分子量分布は10kDa以下、メインピーク200Da~3kDaである。
(B)APL(平均ペプチド鎖長)は2~8である。
(C)遊離アミノ酸含量が20%以下である。
(D)抗原性がβ-ラクトグロブリンの抗原性の1/10,000以下である。 - 前記ホエイタンパク質加水分解物が、ホエイタンパク質をpH6~10、50~70℃において耐熱性のタンパク質加水分解酵素を用いて熱変性させながら酵素分解し、加熱して酵素を失活させて得られるものであることを特徴とする請求項1から請求項4のいずれか1項に記載の睡眠改善用組成物。
- 前記ホエイタンパク質加水分解物が、ホエイタンパク質をpH6~10、20~55℃においてタンパク質加水分解酵素を用いて酵素分解し、これを50~70℃に昇温させ、pH6~10、50~70℃において耐熱性のタンパク質加水分解酵素を用いて未分解のホエイタンパク質を熱変性させながら酵素分解し、加熱して酵素を失活させて得られるものであることを特徴とする請求項1から請求項4のいずれか1項に記載の睡眠改善用組成物。
- 請求項1から請求項6のいずれかに記載の睡眠改善用組成物を含むことを特徴とする睡眠改善用食品、睡眠改善用食品組成物、睡眠改善用医薬品、睡眠改善用医薬品組成物、又は睡眠改善用飼料。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019106129A JP7428480B2 (ja) | 2019-06-06 | 2019-06-06 | 睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019106129A JP7428480B2 (ja) | 2019-06-06 | 2019-06-06 | 睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020198791A JP2020198791A (ja) | 2020-12-17 |
| JP7428480B2 true JP7428480B2 (ja) | 2024-02-06 |
Family
ID=73741530
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019106129A Active JP7428480B2 (ja) | 2019-06-06 | 2019-06-06 | 睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7428480B2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2022202985A1 (ja) * | 2021-03-24 | 2022-09-29 | ||
| KR20240070539A (ko) * | 2021-09-30 | 2024-05-21 | 유키지루시 메그밀크 가부시키가이샤 | 펩티드의 제조 방법 |
| KR102750114B1 (ko) * | 2023-08-28 | 2025-01-03 | (주)네오크레마 | 유청 단백 가수분해물을 포함하는 수면장애의 예방, 개선 또는 치료용 조성물 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003039565A1 (en) | 2001-11-06 | 2003-05-15 | Mario Baraldi | Use of milk serum containing substances with benzodiazepine-like activity as adjuvants to therapy of anxiety and insomnia |
| CN1557475A (zh) | 2004-02-04 | 2004-12-29 | 高春平 | 美容、减肥营养组合物 |
| CN1557196A (zh) | 2004-02-04 | 2004-12-29 | 高春平 | 调节压力、改善睡眠的天然营养剂 |
| WO2005094849A1 (ja) | 2004-03-31 | 2005-10-13 | Calpis Co., Ltd. | 内因性メラトニン分泌リズム改善用機能性食品、及び概日リズム改善用機能性食品 |
| JP2011523547A (ja) | 2008-04-29 | 2011-08-18 | ディーエスエム アイピー アセッツ ビー.ブイ. | ペプチド結合トリプトファンとポリペプチド結合トリプトファンの混合物 |
| JP2012530779A (ja) | 2009-06-22 | 2012-12-06 | エスケー バイオファーマシューティカルズ カンパニー リミテッド | 疲労を治療又は予防するための方法 |
| JP2018008916A (ja) | 2016-07-15 | 2018-01-18 | 株式会社明治 | 血中アミノ酸濃度上昇促進剤 |
| CN108157963A (zh) | 2017-12-25 | 2018-06-15 | 广电计量检测(湖南)有限公司 | 具有改善睡眠功效的组合物、片剂及其制备方法 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2626700B2 (ja) * | 1990-08-31 | 1997-07-02 | 雪印乳業株式会社 | 低アレルゲン化したホエータンパク加水分解物及びその製造法 |
-
2019
- 2019-06-06 JP JP2019106129A patent/JP7428480B2/ja active Active
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003039565A1 (en) | 2001-11-06 | 2003-05-15 | Mario Baraldi | Use of milk serum containing substances with benzodiazepine-like activity as adjuvants to therapy of anxiety and insomnia |
| CN1557475A (zh) | 2004-02-04 | 2004-12-29 | 高春平 | 美容、减肥营养组合物 |
| CN1557196A (zh) | 2004-02-04 | 2004-12-29 | 高春平 | 调节压力、改善睡眠的天然营养剂 |
| WO2005094849A1 (ja) | 2004-03-31 | 2005-10-13 | Calpis Co., Ltd. | 内因性メラトニン分泌リズム改善用機能性食品、及び概日リズム改善用機能性食品 |
| JP2011523547A (ja) | 2008-04-29 | 2011-08-18 | ディーエスエム アイピー アセッツ ビー.ブイ. | ペプチド結合トリプトファンとポリペプチド結合トリプトファンの混合物 |
| JP2012530779A (ja) | 2009-06-22 | 2012-12-06 | エスケー バイオファーマシューティカルズ カンパニー リミテッド | 疲労を治療又は予防するための方法 |
| JP2018008916A (ja) | 2016-07-15 | 2018-01-18 | 株式会社明治 | 血中アミノ酸濃度上昇促進剤 |
| CN108157963A (zh) | 2017-12-25 | 2018-06-15 | 广电计量检测(湖南)有限公司 | 具有改善睡眠功效的组合物、片剂及其制备方法 |
Non-Patent Citations (1)
| Title |
|---|
| ROB, Markus C. et al.,Evening intake of α-lactalbumin increases plasma tryptophan availability and improves morning alertness and brain measures of attention,The American Journal of Clinical Nutrition,2005年,vol. 81, issue 5,p. 1026-1033 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020198791A (ja) | 2020-12-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5626807B2 (ja) | ペプチド結合トリプトファンとポリペプチド結合トリプトファンの混合物 | |
| AU2011221852B2 (en) | Agent for preventing muscular atrophy | |
| JP5749419B2 (ja) | 筋肉増強剤 | |
| US20110086803A1 (en) | Peptides containing tryptophan | |
| JP7428480B2 (ja) | 睡眠改善用組成物及び組成物を含む食品、医薬品、飼料 | |
| WO2018021471A1 (ja) | 脳機能改善するための食品組成物 | |
| WO2022168413A1 (ja) | デプレスタチン含有組成物の製造方法 | |
| WO2015166938A1 (ja) | 脳神経疾患の予防又は脳機能改善用食品を製造するための食品添加物 | |
| US20120178673A1 (en) | Fat accumulation suppressor | |
| JP2007051090A (ja) | 卵白ペプチドを有効成分として含有する血流改善剤 | |
| KR20130004284A (ko) | 단백질 합성 촉진제 | |
| JP2019054769A (ja) | 白髪抑制用食品 | |
| JP7392474B2 (ja) | 脳機能を改善するための食品組成物 | |
| JP5717433B2 (ja) | 胆汁酸吸着用組成物 | |
| JP6279851B2 (ja) | 筋萎縮防止及び/又は筋合成促進剤 | |
| JP2019041696A (ja) | 経口用組成物 | |
| JP2009296914A (ja) | 心肺機能向上用組成物 | |
| JP2006348051A (ja) | 血管拡張による血流促進性医薬及び健康食品組成物 | |
| HK1173653A (zh) | 肌肉萎缩防止剂 | |
| JP2006348050A (ja) | 血管拡張による血流促進性医薬及び健康食品組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220428 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230310 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230315 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230407 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231004 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240124 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240125 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7428480 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |