JP7295360B2 - 固形腫瘍細胞及びエスケープバリアントを治療するための足場 - Google Patents
固形腫瘍細胞及びエスケープバリアントを治療するための足場 Download PDFInfo
- Publication number
- JP7295360B2 JP7295360B2 JP2019534814A JP2019534814A JP7295360B2 JP 7295360 B2 JP7295360 B2 JP 7295360B2 JP 2019534814 A JP2019534814 A JP 2019534814A JP 2019534814 A JP2019534814 A JP 2019534814A JP 7295360 B2 JP7295360 B2 JP 7295360B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- lymphocyte
- scaffold
- tumor
- cancer cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 206010028980 Neoplasm Diseases 0.000 title claims description 248
- 210000004881 tumor cell Anatomy 0.000 title claims description 67
- 210000004698 lymphocyte Anatomy 0.000 claims description 377
- 210000004027 cell Anatomy 0.000 claims description 257
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 142
- 229940044665 STING agonist Drugs 0.000 claims description 76
- 230000004913 activation Effects 0.000 claims description 48
- 239000011159 matrix material Substances 0.000 claims description 46
- 201000011510 cancer Diseases 0.000 claims description 40
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 32
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 32
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 24
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 24
- 108010073385 Fibrin Proteins 0.000 claims description 23
- 102000009123 Fibrin Human genes 0.000 claims description 23
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 claims description 23
- 229950003499 fibrin Drugs 0.000 claims description 23
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 22
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 21
- 206010033128 Ovarian cancer Diseases 0.000 claims description 20
- 201000002528 pancreatic cancer Diseases 0.000 claims description 20
- 102000003812 Interleukin-15 Human genes 0.000 claims description 18
- 108090000172 Interleukin-15 Proteins 0.000 claims description 18
- 210000000822 natural killer cell Anatomy 0.000 claims description 18
- 239000012528 membrane Substances 0.000 claims description 10
- 230000003213 activating effect Effects 0.000 claims description 9
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 9
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 9
- 206010009944 Colon cancer Diseases 0.000 claims description 8
- 229910001000 nickel titanium Inorganic materials 0.000 claims description 8
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 claims description 8
- 206010006187 Breast cancer Diseases 0.000 claims description 6
- 208000026310 Breast neoplasm Diseases 0.000 claims description 6
- 239000010409 thin film Substances 0.000 claims description 6
- XGOYIMQSIKSOBS-UHFFFAOYSA-N vadimezan Chemical compound C1=CC=C2C(=O)C3=CC=C(C)C(C)=C3OC2=C1CC(O)=O XGOYIMQSIKSOBS-UHFFFAOYSA-N 0.000 claims description 6
- 229950008737 vadimezan Drugs 0.000 claims description 6
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 claims description 5
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 5
- 101000802471 Sylvirana guentheri Brevinin-2GHb Proteins 0.000 claims description 5
- 208000029742 colonic neoplasm Diseases 0.000 claims description 5
- 208000005017 glioblastoma Diseases 0.000 claims description 5
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 claims description 5
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 4
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 4
- 208000032612 Glial tumor Diseases 0.000 claims description 4
- 206010018338 Glioma Diseases 0.000 claims description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 206010029260 Neuroblastoma Diseases 0.000 claims description 4
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 4
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 4
- 206010038389 Renal cancer Diseases 0.000 claims description 4
- 201000010208 Seminoma Diseases 0.000 claims description 4
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 206010043276 Teratoma Diseases 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 4
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 4
- 201000005188 adrenal gland cancer Diseases 0.000 claims description 4
- 208000024447 adrenal gland neoplasm Diseases 0.000 claims description 4
- 201000010881 cervical cancer Diseases 0.000 claims description 4
- 201000004101 esophageal cancer Diseases 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 201000010536 head and neck cancer Diseases 0.000 claims description 4
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 4
- 201000002313 intestinal cancer Diseases 0.000 claims description 4
- 201000010982 kidney cancer Diseases 0.000 claims description 4
- 201000007270 liver cancer Diseases 0.000 claims description 4
- 208000014018 liver neoplasm Diseases 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 201000010453 lymph node cancer Diseases 0.000 claims description 4
- 206010038038 rectal cancer Diseases 0.000 claims description 4
- 201000001275 rectum cancer Diseases 0.000 claims description 4
- 201000000849 skin cancer Diseases 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- 206010046766 uterine cancer Diseases 0.000 claims description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 3
- 208000005016 Intestinal Neoplasms Diseases 0.000 claims description 3
- 230000006378 damage Effects 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims 4
- 229920000642 polymer Polymers 0.000 description 81
- 108090000765 processed proteins & peptides Proteins 0.000 description 78
- 238000000034 method Methods 0.000 description 52
- 108090000623 proteins and genes Proteins 0.000 description 48
- 241000699670 Mus sp. Species 0.000 description 45
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical group O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 44
- 239000000427 antigen Substances 0.000 description 44
- 102000036639 antigens Human genes 0.000 description 44
- 108091007433 antigens Proteins 0.000 description 44
- 239000002245 particle Substances 0.000 description 41
- 230000003308 immunostimulating effect Effects 0.000 description 34
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 32
- 229920000615 alginic acid Polymers 0.000 description 32
- 235000010443 alginic acid Nutrition 0.000 description 31
- 229940072056 alginate Drugs 0.000 description 30
- 239000003795 chemical substances by application Substances 0.000 description 29
- 230000014509 gene expression Effects 0.000 description 29
- 239000000203 mixture Substances 0.000 description 29
- 102000004196 processed proteins & peptides Human genes 0.000 description 29
- 239000000243 solution Substances 0.000 description 27
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 26
- 230000000975 bioactive effect Effects 0.000 description 26
- 238000002513 implantation Methods 0.000 description 25
- 229910052751 metal Inorganic materials 0.000 description 24
- 239000002184 metal Substances 0.000 description 24
- 239000003446 ligand Substances 0.000 description 20
- 239000010408 film Substances 0.000 description 19
- 150000002632 lipids Chemical class 0.000 description 19
- 238000002271 resection Methods 0.000 description 19
- 108010035532 Collagen Proteins 0.000 description 18
- 102000008186 Collagen Human genes 0.000 description 18
- 102100035533 Stimulator of interferon genes protein Human genes 0.000 description 18
- 229920001436 collagen Polymers 0.000 description 18
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 18
- 102000004127 Cytokines Human genes 0.000 description 17
- 108090000695 Cytokines Proteins 0.000 description 17
- -1 poly(lactide) Polymers 0.000 description 17
- 102000004169 proteins and genes Human genes 0.000 description 17
- 230000009885 systemic effect Effects 0.000 description 17
- 238000011282 treatment Methods 0.000 description 17
- 210000000612 antigen-presenting cell Anatomy 0.000 description 16
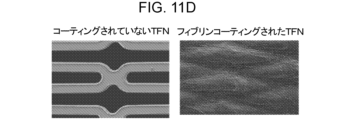
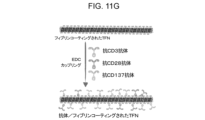
- 238000000576 coating method Methods 0.000 description 16
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 16
- 239000002953 phosphate buffered saline Substances 0.000 description 16
- 235000018102 proteins Nutrition 0.000 description 16
- 230000004936 stimulating effect Effects 0.000 description 16
- 230000004083 survival effect Effects 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 15
- 241001465754 Metazoa Species 0.000 description 15
- 238000003384 imaging method Methods 0.000 description 15
- 238000001727 in vivo Methods 0.000 description 15
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 14
- 108020004414 DNA Proteins 0.000 description 14
- 101000643024 Homo sapiens Stimulator of interferon genes protein Proteins 0.000 description 14
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 14
- 238000002474 experimental method Methods 0.000 description 14
- 230000006870 function Effects 0.000 description 14
- 108010044426 integrins Proteins 0.000 description 14
- 102000006495 integrins Human genes 0.000 description 14
- 239000002502 liposome Substances 0.000 description 14
- 238000010899 nucleation Methods 0.000 description 14
- 229920001661 Chitosan Polymers 0.000 description 13
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical group CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 13
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 13
- 238000005415 bioluminescence Methods 0.000 description 13
- 230000029918 bioluminescence Effects 0.000 description 13
- 239000011248 coating agent Substances 0.000 description 13
- 238000000684 flow cytometry Methods 0.000 description 13
- 229920001184 polypeptide Polymers 0.000 description 13
- 230000035755 proliferation Effects 0.000 description 13
- 102000005962 receptors Human genes 0.000 description 13
- 108020003175 receptors Proteins 0.000 description 13
- 230000004044 response Effects 0.000 description 13
- 238000002560 therapeutic procedure Methods 0.000 description 13
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 description 12
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 description 12
- 230000000259 anti-tumor effect Effects 0.000 description 12
- 229940079593 drug Drugs 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- 239000000463 material Substances 0.000 description 12
- 230000005012 migration Effects 0.000 description 12
- 238000013508 migration Methods 0.000 description 12
- 230000003389 potentiating effect Effects 0.000 description 12
- 230000001225 therapeutic effect Effects 0.000 description 12
- 210000001519 tissue Anatomy 0.000 description 12
- 206010027476 Metastases Diseases 0.000 description 11
- 108091008874 T cell receptors Proteins 0.000 description 11
- 239000012636 effector Substances 0.000 description 11
- 230000004048 modification Effects 0.000 description 11
- 238000012986 modification Methods 0.000 description 11
- 210000000130 stem cell Anatomy 0.000 description 11
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 10
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 10
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 10
- 230000005809 anti-tumor immunity Effects 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 10
- 210000004443 dendritic cell Anatomy 0.000 description 10
- 239000000499 gel Substances 0.000 description 10
- 238000010362 genome editing Methods 0.000 description 10
- 238000001802 infusion Methods 0.000 description 10
- 210000001165 lymph node Anatomy 0.000 description 10
- 239000000377 silicon dioxide Substances 0.000 description 10
- 238000013268 sustained release Methods 0.000 description 10
- 239000012730 sustained-release form Substances 0.000 description 10
- 239000013598 vector Substances 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 9
- 108010010803 Gelatin Proteins 0.000 description 9
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 9
- 102100033467 L-selectin Human genes 0.000 description 9
- 108060001084 Luciferase Proteins 0.000 description 9
- 239000005089 Luciferase Substances 0.000 description 9
- 238000010459 TALEN Methods 0.000 description 9
- 108010043645 Transcription Activator-Like Effector Nucleases Proteins 0.000 description 9
- 235000001014 amino acid Nutrition 0.000 description 9
- 150000001413 amino acids Chemical class 0.000 description 9
- 238000013459 approach Methods 0.000 description 9
- 230000027455 binding Effects 0.000 description 9
- 239000012620 biological material Substances 0.000 description 9
- 230000021164 cell adhesion Effects 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 9
- 229920000159 gelatin Polymers 0.000 description 9
- 239000008273 gelatin Substances 0.000 description 9
- 235000019322 gelatine Nutrition 0.000 description 9
- 235000011852 gelatine desserts Nutrition 0.000 description 9
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 9
- 230000003902 lesion Effects 0.000 description 9
- 239000002773 nucleotide Substances 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 150000003384 small molecules Chemical class 0.000 description 9
- 125000006850 spacer group Chemical group 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 101100355609 Caenorhabditis elegans rae-1 gene Proteins 0.000 description 8
- 108091054438 MHC class II family Proteins 0.000 description 8
- 102000043131 MHC class II family Human genes 0.000 description 8
- 229940024606 amino acid Drugs 0.000 description 8
- 238000002619 cancer immunotherapy Methods 0.000 description 8
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 8
- 229960002751 imiquimod Drugs 0.000 description 8
- 230000002757 inflammatory effect Effects 0.000 description 8
- 239000010410 layer Substances 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 210000004379 membrane Anatomy 0.000 description 8
- 239000011148 porous material Substances 0.000 description 8
- 239000012646 vaccine adjuvant Substances 0.000 description 8
- 229940124931 vaccine adjuvant Drugs 0.000 description 8
- PHOQVHQSTUBQQK-SQOUGZDYSA-N D-glucono-1,5-lactone Chemical compound OC[C@H]1OC(=O)[C@H](O)[C@@H](O)[C@@H]1O PHOQVHQSTUBQQK-SQOUGZDYSA-N 0.000 description 7
- 101800001466 Envelope glycoprotein E1 Proteins 0.000 description 7
- 239000000556 agonist Substances 0.000 description 7
- 230000001093 anti-cancer Effects 0.000 description 7
- 229910000019 calcium carbonate Inorganic materials 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 230000018109 developmental process Effects 0.000 description 7
- 238000010586 diagram Methods 0.000 description 7
- 235000012209 glucono delta-lactone Nutrition 0.000 description 7
- 239000000182 glucono-delta-lactone Substances 0.000 description 7
- 229960003681 gluconolactone Drugs 0.000 description 7
- 230000012010 growth Effects 0.000 description 7
- 230000001506 immunosuppresive effect Effects 0.000 description 7
- 230000009401 metastasis Effects 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 239000013612 plasmid Substances 0.000 description 7
- 229920002451 polyvinyl alcohol Polymers 0.000 description 7
- 230000001177 retroviral effect Effects 0.000 description 7
- 150000003839 salts Chemical class 0.000 description 7
- 230000008685 targeting Effects 0.000 description 7
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 6
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 6
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 108010005774 beta-Galactosidase Proteins 0.000 description 6
- 108700010039 chimeric receptor Proteins 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 125000004122 cyclic group Chemical group 0.000 description 6
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 210000002865 immune cell Anatomy 0.000 description 6
- 210000000496 pancreas Anatomy 0.000 description 6
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 6
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 6
- 229920001610 polycaprolactone Polymers 0.000 description 6
- 238000001356 surgical procedure Methods 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 238000012546 transfer Methods 0.000 description 6
- 230000007018 DNA scission Effects 0.000 description 5
- 102100037362 Fibronectin Human genes 0.000 description 5
- 108010067306 Fibronectins Proteins 0.000 description 5
- 108090000331 Firefly luciferases Proteins 0.000 description 5
- 102000003886 Glycoproteins Human genes 0.000 description 5
- 108090000288 Glycoproteins Proteins 0.000 description 5
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 5
- 102100022297 Integrin alpha-X Human genes 0.000 description 5
- 108010002350 Interleukin-2 Proteins 0.000 description 5
- 102000000588 Interleukin-2 Human genes 0.000 description 5
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 5
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 241001529936 Murinae Species 0.000 description 5
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- 208000007660 Residual Neoplasm Diseases 0.000 description 5
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 5
- 108020004459 Small interfering RNA Proteins 0.000 description 5
- 230000006052 T cell proliferation Effects 0.000 description 5
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 5
- KUFRQPKVAWMTJO-LMZWQJSESA-N alvespimycin Chemical compound N1C(=O)\C(C)=C\C=C/[C@H](OC)[C@@H](OC(N)=O)\C(C)=C\[C@H](C)[C@@H](O)[C@@H](OC)C[C@H](C)CC2=C(NCCN(C)C)C(=O)C=C1C2=O KUFRQPKVAWMTJO-LMZWQJSESA-N 0.000 description 5
- 229920000249 biocompatible polymer Polymers 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 239000001110 calcium chloride Substances 0.000 description 5
- 229910001628 calcium chloride Inorganic materials 0.000 description 5
- 235000011148 calcium chloride Nutrition 0.000 description 5
- 239000001506 calcium phosphate Substances 0.000 description 5
- 229910000389 calcium phosphate Inorganic materials 0.000 description 5
- 235000011010 calcium phosphates Nutrition 0.000 description 5
- 239000006285 cell suspension Substances 0.000 description 5
- 230000001086 cytosolic effect Effects 0.000 description 5
- 230000005782 double-strand break Effects 0.000 description 5
- 230000002900 effect on cell Effects 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 230000008029 eradication Effects 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000003112 inhibitor Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 206010061289 metastatic neoplasm Diseases 0.000 description 5
- 230000036961 partial effect Effects 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 239000002356 single layer Substances 0.000 description 5
- 230000002195 synergetic effect Effects 0.000 description 5
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 5
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 4
- SNKAWJBJQDLSFF-NVKMUCNASA-N 1,2-dioleoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC SNKAWJBJQDLSFF-NVKMUCNASA-N 0.000 description 4
- QSPOQCXMGPDIHI-UHFFFAOYSA-N 2-amino-n,n-dipropyl-8-[4-(pyrrolidine-1-carbonyl)phenyl]-3h-1-benzazepine-4-carboxamide Chemical compound C1=C2N=C(N)CC(C(=O)N(CCC)CCC)=CC2=CC=C1C(C=C1)=CC=C1C(=O)N1CCCC1 QSPOQCXMGPDIHI-UHFFFAOYSA-N 0.000 description 4
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 4
- 241000059559 Agriotes sordidus Species 0.000 description 4
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 4
- 108010079458 CBLB502 Proteins 0.000 description 4
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 230000004568 DNA-binding Effects 0.000 description 4
- 102000016942 Elastin Human genes 0.000 description 4
- 108010014258 Elastin Proteins 0.000 description 4
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 4
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 4
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 4
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 4
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 4
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 4
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 4
- 102100022338 Integrin alpha-M Human genes 0.000 description 4
- 108010055795 Integrin alpha1beta1 Proteins 0.000 description 4
- 108010017642 Integrin alpha2beta1 Proteins 0.000 description 4
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 4
- 108010014726 Interferon Type I Proteins 0.000 description 4
- 102000002227 Interferon Type I Human genes 0.000 description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 4
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 4
- 108010073771 Soybean Proteins Proteins 0.000 description 4
- 101710196623 Stimulator of interferon genes protein Proteins 0.000 description 4
- 241000021375 Xenogenes Species 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- 150000001412 amines Chemical group 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 229910052791 calcium Inorganic materials 0.000 description 4
- CRPUJAZIXJMDBK-UHFFFAOYSA-N camphene Chemical compound C1CC2C(=C)C(C)(C)C1C2 CRPUJAZIXJMDBK-UHFFFAOYSA-N 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 235000012000 cholesterol Nutrition 0.000 description 4
- 229920002549 elastin Polymers 0.000 description 4
- 229950009493 entolimod Drugs 0.000 description 4
- 230000017188 evasion or tolerance of host immune response Effects 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 230000006801 homologous recombination Effects 0.000 description 4
- 238000002744 homologous recombination Methods 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000011068 loading method Methods 0.000 description 4
- 238000001325 log-rank test Methods 0.000 description 4
- 230000035800 maturation Effects 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 150000002739 metals Chemical class 0.000 description 4
- 230000001394 metastastic effect Effects 0.000 description 4
- 239000011859 microparticle Substances 0.000 description 4
- 210000000581 natural killer T-cell Anatomy 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 210000005259 peripheral blood Anatomy 0.000 description 4
- 239000011886 peripheral blood Substances 0.000 description 4
- 229940115272 polyinosinic:polycytidylic acid Drugs 0.000 description 4
- 229920006324 polyoxymethylene Polymers 0.000 description 4
- 229920001451 polypropylene glycol Polymers 0.000 description 4
- 230000008672 reprogramming Effects 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 4
- 229940001941 soy protein Drugs 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 238000010361 transduction Methods 0.000 description 4
- 230000026683 transduction Effects 0.000 description 4
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 3
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- 229920000936 Agarose Polymers 0.000 description 3
- 102100026189 Beta-galactosidase Human genes 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 229920002101 Chitin Polymers 0.000 description 3
- 102100031256 Cyclic GMP-AMP synthase Human genes 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 3
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 3
- 102100026720 Interferon beta Human genes 0.000 description 3
- 102100037850 Interferon gamma Human genes 0.000 description 3
- 108090000467 Interferon-beta Proteins 0.000 description 3
- 108010074328 Interferon-gamma Proteins 0.000 description 3
- 102000013462 Interleukin-12 Human genes 0.000 description 3
- 108010065805 Interleukin-12 Proteins 0.000 description 3
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 3
- 102000003735 Mesothelin Human genes 0.000 description 3
- 108090000015 Mesothelin Proteins 0.000 description 3
- 101710163270 Nuclease Proteins 0.000 description 3
- 108010039918 Polylysine Proteins 0.000 description 3
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 206010066902 Surgical failure Diseases 0.000 description 3
- 230000005867 T cell response Effects 0.000 description 3
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 239000003929 acidic solution Substances 0.000 description 3
- 208000009956 adenocarcinoma Diseases 0.000 description 3
- 239000008272 agar Substances 0.000 description 3
- 210000004102 animal cell Anatomy 0.000 description 3
- 230000005975 antitumor immune response Effects 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 150000001718 carbodiimides Chemical class 0.000 description 3
- 125000002091 cationic group Chemical group 0.000 description 3
- 239000004568 cement Substances 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 239000000470 constituent Substances 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 230000000139 costimulatory effect Effects 0.000 description 3
- 238000004132 cross linking Methods 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- MWRBNPKJOOWZPW-CLFAGFIQSA-N dioleoyl phosphatidylethanolamine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCC\C=C/CCCCCCCC MWRBNPKJOOWZPW-CLFAGFIQSA-N 0.000 description 3
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000012091 fetal bovine serum Substances 0.000 description 3
- 238000007710 freezing Methods 0.000 description 3
- 230000008014 freezing Effects 0.000 description 3
- 210000002443 helper t lymphocyte Anatomy 0.000 description 3
- 210000005260 human cell Anatomy 0.000 description 3
- 229920002674 hyaluronan Polymers 0.000 description 3
- 229960003160 hyaluronic acid Drugs 0.000 description 3
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 229960001438 immunostimulant agent Drugs 0.000 description 3
- 239000003022 immunostimulating agent Substances 0.000 description 3
- 230000001024 immunotherapeutic effect Effects 0.000 description 3
- 238000009169 immunotherapy Methods 0.000 description 3
- 239000007943 implant Substances 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 230000009545 invasion Effects 0.000 description 3
- 210000000265 leukocyte Anatomy 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 201000001441 melanoma Diseases 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 238000001000 micrograph Methods 0.000 description 3
- 239000004005 microsphere Substances 0.000 description 3
- 230000003278 mimic effect Effects 0.000 description 3
- 238000002324 minimally invasive surgery Methods 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 230000006780 non-homologous end joining Effects 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 235000005985 organic acids Nutrition 0.000 description 3
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 3
- 210000003200 peritoneal cavity Anatomy 0.000 description 3
- 230000002688 persistence Effects 0.000 description 3
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 3
- 150000003905 phosphatidylinositols Chemical class 0.000 description 3
- 229920000747 poly(lactic acid) Polymers 0.000 description 3
- 229940065514 poly(lactide) Drugs 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 229920000656 polylysine Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 230000002269 spontaneous effect Effects 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000007619 statistical method Methods 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 2
- LVNGJLRDBYCPGB-UHFFFAOYSA-N 1,2-distearoylphosphatidylethanolamine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(COP([O-])(=O)OCC[NH3+])OC(=O)CCCCCCCCCCCCCCCCC LVNGJLRDBYCPGB-UHFFFAOYSA-N 0.000 description 2
- BIABMEZBCHDPBV-MPQUPPDSSA-N 1,2-palmitoyl-sn-glycero-3-phospho-(1'-sn-glycerol) Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCCCC BIABMEZBCHDPBV-MPQUPPDSSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 2
- 102100029457 Adenine phosphoribosyltransferase Human genes 0.000 description 2
- 108010024223 Adenine phosphoribosyltransferase Proteins 0.000 description 2
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 2
- 102100037435 Antiviral innate immune response receptor RIG-I Human genes 0.000 description 2
- 101710127675 Antiviral innate immune response receptor RIG-I Proteins 0.000 description 2
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 238000011740 C57BL/6 mouse Methods 0.000 description 2
- 238000011357 CAR T-cell therapy Methods 0.000 description 2
- 101150013553 CD40 gene Proteins 0.000 description 2
- 108091033409 CRISPR Proteins 0.000 description 2
- 238000010354 CRISPR gene editing Methods 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 102000006579 Chemokine CXCL10 Human genes 0.000 description 2
- 108010008978 Chemokine CXCL10 Proteins 0.000 description 2
- 102000012422 Collagen Type I Human genes 0.000 description 2
- 108010022452 Collagen Type I Proteins 0.000 description 2
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 2
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 101150029707 ERBB2 gene Proteins 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 2
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101100166600 Homo sapiens CD28 gene Proteins 0.000 description 2
- 101001043809 Homo sapiens Interleukin-7 receptor subunit alpha Proteins 0.000 description 2
- 101000603882 Homo sapiens Nuclear receptor subfamily 1 group I member 3 Proteins 0.000 description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 2
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 2
- 102000018251 Hypoxanthine Phosphoribosyltransferase Human genes 0.000 description 2
- 108010032038 Interferon Regulatory Factor-3 Proteins 0.000 description 2
- 102100029843 Interferon regulatory factor 3 Human genes 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 102000003810 Interleukin-18 Human genes 0.000 description 2
- 108090000171 Interleukin-18 Proteins 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- 102000000704 Interleukin-7 Human genes 0.000 description 2
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- 239000000232 Lipid Bilayer Substances 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- 241000712899 Lymphocytic choriomeningitis mammarenavirus Species 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 238000000585 Mann–Whitney U test Methods 0.000 description 2
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 2
- 101001034843 Mus musculus Interferon-induced transmembrane protein 1 Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 102000016978 Orphan receptors Human genes 0.000 description 2
- 108070000031 Orphan receptors Proteins 0.000 description 2
- 102000004503 Perforin Human genes 0.000 description 2
- 108010056995 Perforin Proteins 0.000 description 2
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- PXRCIOIWVGAZEP-UHFFFAOYSA-N Primaeres Camphenhydrat Natural products C1CC2C(O)(C)C(C)(C)C1C2 PXRCIOIWVGAZEP-UHFFFAOYSA-N 0.000 description 2
- 239000012979 RPMI medium Substances 0.000 description 2
- 238000012300 Sequence Analysis Methods 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 2
- 229940124613 TLR 7/8 agonist Drugs 0.000 description 2
- 108700019146 Transgenes Proteins 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 102100026497 Zinc finger protein 654 Human genes 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- XCPQUQHBVVXMRQ-UHFFFAOYSA-N alpha-Fenchene Natural products C1CC2C(=C)CC1C2(C)C XCPQUQHBVVXMRQ-UHFFFAOYSA-N 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 229940037642 autologous vaccine Drugs 0.000 description 2
- 229920001222 biopolymer Polymers 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 238000000339 bright-field microscopy Methods 0.000 description 2
- 239000013590 bulk material Substances 0.000 description 2
- PKFDLKSEZWEFGL-MHARETSRSA-N c-di-GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=C(C(NC(N)=N5)=O)N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 PKFDLKSEZWEFGL-MHARETSRSA-N 0.000 description 2
- 229930006739 camphene Natural products 0.000 description 2
- ZYPYEBYNXWUCEA-UHFFFAOYSA-N camphenilone Natural products C1CC2C(=O)C(C)(C)C1C2 ZYPYEBYNXWUCEA-UHFFFAOYSA-N 0.000 description 2
- 238000009566 cancer vaccine Methods 0.000 description 2
- 229940022399 cancer vaccine Drugs 0.000 description 2
- 230000022534 cell killing Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- SQQXRXKYTKFFSM-UHFFFAOYSA-N chembl1992147 Chemical compound OC1=C(OC)C(OC)=CC=C1C1=C(C)C(C(O)=O)=NC(C=2N=C3C4=NC(C)(C)N=C4C(OC)=C(O)C3=CC=2)=C1N SQQXRXKYTKFFSM-UHFFFAOYSA-N 0.000 description 2
- 239000000512 collagen gel Substances 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 239000003431 cross linking reagent Substances 0.000 description 2
- 239000002577 cryoprotective agent Substances 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 238000002784 cytotoxicity assay Methods 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 2
- 229910000701 elgiloys (Co-Cr-Ni Alloy) Inorganic materials 0.000 description 2
- 108010026638 endodeoxyribonuclease FokI Proteins 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 2
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 238000012239 gene modification Methods 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 230000005017 genetic modification Effects 0.000 description 2
- 235000013617 genetically modified food Nutrition 0.000 description 2
- GVVPGTZRZFNKDS-JXMROGBWSA-N geranyl diphosphate Chemical compound CC(C)=CCC\C(C)=C\CO[P@](O)(=O)OP(O)(O)=O GVVPGTZRZFNKDS-JXMROGBWSA-N 0.000 description 2
- 229960002591 hydroxyproline Drugs 0.000 description 2
- 229940124669 imidazoquinoline Drugs 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 230000002147 killing effect Effects 0.000 description 2
- 108020001756 ligand binding domains Proteins 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 2
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 230000001613 neoplastic effect Effects 0.000 description 2
- 229910052759 nickel Inorganic materials 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N palmityl stearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 2
- 229930192851 perforin Natural products 0.000 description 2
- 150000004713 phosphodiesters Chemical class 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 229920000867 polyelectrolyte Polymers 0.000 description 2
- 108010055896 polyornithine Proteins 0.000 description 2
- 229920002714 polyornithine Polymers 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 208000011581 secondary neoplasm Diseases 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 229940071440 soy protein isolate Drugs 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 210000004988 splenocyte Anatomy 0.000 description 2
- 238000004544 sputter deposition Methods 0.000 description 2
- 230000003068 static effect Effects 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 238000010257 thawing Methods 0.000 description 2
- 229940044655 toll-like receptor 9 agonist Drugs 0.000 description 2
- 229910052723 transition metal Inorganic materials 0.000 description 2
- 150000003624 transition metals Chemical class 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- JSPNNZKWADNWHI-PNANGNLXSA-N (2r)-2-hydroxy-n-[(2s,3r,4e,8e)-3-hydroxy-9-methyl-1-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoctadeca-4,8-dien-2-yl]heptadecanamide Chemical compound CCCCCCCCCCCCCCC[C@@H](O)C(=O)N[C@H]([C@H](O)\C=C\CC\C=C(/C)CCCCCCCCC)CO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O JSPNNZKWADNWHI-PNANGNLXSA-N 0.000 description 1
- MWOGMBZGFFZBMK-LJZWMIMPSA-N (2s)-2-[[(2s)-2-[[2-[[(2s,3s)-2-[[(2s)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]-3-methylpentanoyl]amino]acetyl]amino]-3-hydroxypropanoyl]amino]-5-(diaminomethylideneamino)pentanoic acid Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 MWOGMBZGFFZBMK-LJZWMIMPSA-N 0.000 description 1
- ASWBNKHCZGQVJV-UHFFFAOYSA-N (3-hexadecanoyloxy-2-hydroxypropyl) 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(O)COP([O-])(=O)OCC[N+](C)(C)C ASWBNKHCZGQVJV-UHFFFAOYSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- FJLUATLTXUNBOT-UHFFFAOYSA-N 1-Hexadecylamine Chemical compound CCCCCCCCCCCCCCCCN FJLUATLTXUNBOT-UHFFFAOYSA-N 0.000 description 1
- VQFKFAKEUMHBLV-BYSUZVQFSA-N 1-O-(alpha-D-galactosyl)-N-hexacosanoylphytosphingosine Chemical compound CCCCCCCCCCCCCCCCCCCCCCCCCC(=O)N[C@H]([C@H](O)[C@H](O)CCCCCCCCCCCCCC)CO[C@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQFKFAKEUMHBLV-BYSUZVQFSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- XRILCFTWUCUKJR-INFSMZHSSA-N 2'-3'-cGAMP Chemical compound C([C@H]([C@H]1O)O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H]2N1C=NC2=C1NC(N)=NC2=O XRILCFTWUCUKJR-INFSMZHSSA-N 0.000 description 1
- LDGWQMRUWMSZIU-LQDDAWAPSA-M 2,3-bis[(z)-octadec-9-enoxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)C)OCCCCCCCC\C=C/CCCCCCCC LDGWQMRUWMSZIU-LQDDAWAPSA-M 0.000 description 1
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 description 1
- WALUVDCNGPQPOD-UHFFFAOYSA-M 2,3-di(tetradecoxy)propyl-(2-hydroxyethyl)-dimethylazanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCOCC(C[N+](C)(C)CCO)OCCCCCCCCCCCCCC WALUVDCNGPQPOD-UHFFFAOYSA-M 0.000 description 1
- JKNCOURZONDCGV-UHFFFAOYSA-N 2-(dimethylamino)ethyl 2-methylprop-2-enoate Chemical compound CN(C)CCOC(=O)C(C)=C JKNCOURZONDCGV-UHFFFAOYSA-N 0.000 description 1
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- LIFHMKCDDVTICL-UHFFFAOYSA-N 6-(chloromethyl)phenanthridine Chemical compound C1=CC=C2C(CCl)=NC3=CC=CC=C3C2=C1 LIFHMKCDDVTICL-UHFFFAOYSA-N 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 1
- 241000203069 Archaea Species 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 108010074708 B7-H1 Antigen Proteins 0.000 description 1
- 108060000903 Beta-catenin Proteins 0.000 description 1
- 102000015735 Beta-catenin Human genes 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108700031361 Brachyury Proteins 0.000 description 1
- 101710149858 C-C chemokine receptor type 7 Proteins 0.000 description 1
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 1
- 238000011746 C57BL/6J (JAX™ mouse strain) Methods 0.000 description 1
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 102100038078 CD276 antigen Human genes 0.000 description 1
- 101710185679 CD276 antigen Proteins 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 108010058905 CD44v6 antigen Proteins 0.000 description 1
- 108010065524 CD52 Antigen Proteins 0.000 description 1
- 210000005236 CD8+ effector T cell Anatomy 0.000 description 1
- 102100027221 CD81 antigen Human genes 0.000 description 1
- 102100035793 CD83 antigen Human genes 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 1
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 1
- 241000581364 Clinitrachus argentatus Species 0.000 description 1
- 101710118064 Cyclic GMP-AMP synthase Proteins 0.000 description 1
- 108030002637 Cyclic GMP-AMP synthases Proteins 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 102000000311 Cytosine Deaminase Human genes 0.000 description 1
- 108010080611 Cytosine Deaminase Proteins 0.000 description 1
- 108700020911 DNA-Binding Proteins Proteins 0.000 description 1
- 101710096438 DNA-binding protein Proteins 0.000 description 1
- XULFJDKZVHTRLG-JDVCJPALSA-N DOSPA trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F.CCCCCCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)CCNC(=O)C(CCCNCCCN)NCCCN)OCCCCCCCC\C=C/CCCCCCCC XULFJDKZVHTRLG-JDVCJPALSA-N 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010049003 Fibrinogen Proteins 0.000 description 1
- 102000008946 Fibrinogen Human genes 0.000 description 1
- 229920001917 Ficoll Polymers 0.000 description 1
- 108010040721 Flagellin Proteins 0.000 description 1
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 102100033365 Growth hormone-releasing hormone receptor Human genes 0.000 description 1
- 108020005004 Guide RNA Proteins 0.000 description 1
- 101710113864 Heat shock protein 90 Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 1
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 description 1
- 101000776648 Homo sapiens Cyclic GMP-AMP synthase Proteins 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101000997535 Homo sapiens Growth hormone-releasing hormone receptor Proteins 0.000 description 1
- 101001016865 Homo sapiens Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101001043594 Homo sapiens Low-density lipoprotein receptor-related protein 5 Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 1
- 101000589301 Homo sapiens Natural cytotoxicity triggering receptor 1 Proteins 0.000 description 1
- 101000589305 Homo sapiens Natural cytotoxicity triggering receptor 2 Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 1
- 101000679851 Homo sapiens Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000955999 Homo sapiens V-set domain-containing T-cell activation inhibitor 1 Proteins 0.000 description 1
- 101000621309 Homo sapiens Wilms tumor protein Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 102100030703 Interleukin-22 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 102000002698 KIR Receptors Human genes 0.000 description 1
- 108010043610 KIR Receptors Proteins 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 102000007547 Laminin Human genes 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- 102100021926 Low-density lipoprotein receptor-related protein 5 Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 208000035346 Margins of Excision Diseases 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101001016849 Mus musculus Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 101000985444 Mus musculus Heat shock protein HSP 90-beta Proteins 0.000 description 1
- 101100341510 Mus musculus Itgal gene Proteins 0.000 description 1
- 101100404853 Mus musculus Klrk1 gene Proteins 0.000 description 1
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 230000006051 NK cell activation Effects 0.000 description 1
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 1
- 108091008099 NLRP3 inflammasome Proteins 0.000 description 1
- 229920002274 Nalgene Polymers 0.000 description 1
- 102100032851 Natural cytotoxicity triggering receptor 2 Human genes 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 229910000990 Ni alloy Inorganic materials 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 108060006580 PRAME Proteins 0.000 description 1
- 102000036673 PRAME Human genes 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 102100025803 Progesterone receptor Human genes 0.000 description 1
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 1
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 1
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 101000781681 Protobothrops flavoviridis Disintegrin triflavin Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 230000037453 T cell priming Effects 0.000 description 1
- 229940124614 TLR 8 agonist Drugs 0.000 description 1
- 108091021474 TMEM173 Proteins 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 229910001069 Ti alloy Inorganic materials 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 1
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 1
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 1
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 description 1
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 102100039094 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 108010031318 Vitronectin Proteins 0.000 description 1
- 102100035140 Vitronectin Human genes 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 241000589634 Xanthomonas Species 0.000 description 1
- 101710185494 Zinc finger protein Proteins 0.000 description 1
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 1
- DSNRWDQKZIEDDB-GCMPNPAFSA-N [(2r)-3-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-2-[(z)-octadec-9-enoyl]oxypropyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C/CCCCCCCC DSNRWDQKZIEDDB-GCMPNPAFSA-N 0.000 description 1
- CWRILEGKIAOYKP-SSDOTTSWSA-M [(2r)-3-acetyloxy-2-hydroxypropyl] 2-aminoethyl phosphate Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCCN CWRILEGKIAOYKP-SSDOTTSWSA-M 0.000 description 1
- HIHOWBSBBDRPDW-PTHRTHQKSA-N [(3s,8s,9s,10r,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-3-yl] n-[2-(dimethylamino)ethyl]carbamate Chemical compound C1C=C2C[C@@H](OC(=O)NCCN(C)C)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HIHOWBSBBDRPDW-PTHRTHQKSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- VUBTYKDZOQNADH-UHFFFAOYSA-N acetyl hexadecanoate Chemical compound CCCCCCCCCCCCCCCC(=O)OC(C)=O VUBTYKDZOQNADH-UHFFFAOYSA-N 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 150000008064 anhydrides Chemical group 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 229920001586 anionic polysaccharide Polymers 0.000 description 1
- 150000004836 anionic polysaccharides Chemical class 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 150000001540 azides Chemical group 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000013602 bacteriophage vector Substances 0.000 description 1
- 210000002469 basement membrane Anatomy 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- RFCBNSCSPXMEBK-INFSMZHSSA-N c-GMP-AMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 RFCBNSCSPXMEBK-INFSMZHSSA-N 0.000 description 1
- 235000010410 calcium alginate Nutrition 0.000 description 1
- 239000000648 calcium alginate Substances 0.000 description 1
- 229960002681 calcium alginate Drugs 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000007910 cell fusion Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 239000002771 cell marker Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000017455 cell-cell adhesion Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229930183167 cerebroside Natural products 0.000 description 1
- RIZIAUKTHDLMQX-UHFFFAOYSA-N cerebroside D Natural products CCCCCCCCCCCCCCCCC(O)C(=O)NC(C(O)C=CCCC=C(C)CCCCCCCCC)COC1OC(CO)C(O)C(O)C1O RIZIAUKTHDLMQX-UHFFFAOYSA-N 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical group [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 229910052681 coesite Inorganic materials 0.000 description 1
- 239000008139 complexing agent Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010226 confocal imaging Methods 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000011340 continuous therapy Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 229910052906 cristobalite Inorganic materials 0.000 description 1
- 238000009109 curative therapy Methods 0.000 description 1
- PDXMFTWFFKBFIN-XPWFQUROSA-N cyclic di-AMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]3[C@@H](O)[C@H](N4C5=NC=NC(N)=C5N=C4)O[C@@H]3COP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 PDXMFTWFFKBFIN-XPWFQUROSA-N 0.000 description 1
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 238000011033 desalting Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- RNPXCFINMKSQPQ-UHFFFAOYSA-N dicetyl hydrogen phosphate Chemical compound CCCCCCCCCCCCCCCCOP(O)(=O)OCCCCCCCCCCCCCCCC RNPXCFINMKSQPQ-UHFFFAOYSA-N 0.000 description 1
- 229940093541 dicetylphosphate Drugs 0.000 description 1
- UMGXUWVIJIQANV-UHFFFAOYSA-M didecyl(dimethyl)azanium;bromide Chemical compound [Br-].CCCCCCCCCC[N+](C)(C)CCCCCCCCCC UMGXUWVIJIQANV-UHFFFAOYSA-M 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- ZGSPNIOCEDOHGS-UHFFFAOYSA-L disodium [3-[2,3-di(octadeca-9,12-dienoyloxy)propoxy-oxidophosphoryl]oxy-2-hydroxypropyl] 2,3-di(octadeca-9,12-dienoyloxy)propyl phosphate Chemical compound [Na+].[Na+].CCCCCC=CCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COP([O-])(=O)OCC(O)COP([O-])(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COC(=O)CCCCCCCC=CCC=CCCCCC ZGSPNIOCEDOHGS-UHFFFAOYSA-L 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- JRBPAEWTRLWTQC-UHFFFAOYSA-N dodecylamine Chemical compound CCCCCCCCCCCCN JRBPAEWTRLWTQC-UHFFFAOYSA-N 0.000 description 1
- 239000012154 double-distilled water Substances 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- 238000002296 dynamic light scattering Methods 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 229940012952 fibrinogen Drugs 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 229940084362 forane Drugs 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 230000004077 genetic alteration Effects 0.000 description 1
- 231100000118 genetic alteration Toxicity 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229940084910 gliadel Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 210000000224 granular leucocyte Anatomy 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 208000035474 group of disease Diseases 0.000 description 1
- 150000004820 halides Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical class [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- 125000001183 hydrocarbyl group Chemical group 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229940050526 hydroxyethylstarch Drugs 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000037189 immune system physiology Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 238000013394 immunophenotyping Methods 0.000 description 1
- 238000012750 in vivo screening Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 229940100994 interleukin-7 Drugs 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 238000002350 laparotomy Methods 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 229910052752 metalloid Inorganic materials 0.000 description 1
- 150000002738 metalloids Chemical class 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- NHBRUUFBSBSTHM-UHFFFAOYSA-N n'-[2-(3-trimethoxysilylpropylamino)ethyl]ethane-1,2-diamine Chemical compound CO[Si](OC)(OC)CCCNCCNCCN NHBRUUFBSBSTHM-UHFFFAOYSA-N 0.000 description 1
- 210000004296 naive t lymphocyte Anatomy 0.000 description 1
- 210000005170 neoplastic cell Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000001473 noxious effect Effects 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 230000004650 oncogenic pathway Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 238000000879 optical micrograph Methods 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 238000002638 palliative care Methods 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 108700002563 poly ICLC Proteins 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920002246 poly[2-(dimethylamino)ethyl methacrylate] polymer Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 238000010837 poor prognosis Methods 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000004537 potential cytotoxicity Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 210000004986 primary T-cell Anatomy 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 108090000468 progesterone receptors Proteins 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000008263 repair mechanism Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 230000035440 response to pH Effects 0.000 description 1
- 230000006903 response to temperature Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 108010056030 retronectin Proteins 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- WBHHMMIMDMUBKC-QJWNTBNXSA-M ricinoleate Chemical compound CCCCCC[C@@H](O)C\C=C/CCCCCCCC([O-])=O WBHHMMIMDMUBKC-QJWNTBNXSA-M 0.000 description 1
- 229940066675 ricinoleate Drugs 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- RPENMORRBUTCPR-UHFFFAOYSA-M sodium;1-hydroxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].ON1C(=O)CC(S([O-])(=O)=O)C1=O RPENMORRBUTCPR-UHFFFAOYSA-M 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000002594 sorbent Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 229910052682 stishovite Inorganic materials 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical group [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical class OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000001248 thermal gelation Methods 0.000 description 1
- 230000009258 tissue cross reactivity Effects 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 230000003614 tolerogenic effect Effects 0.000 description 1
- 238000012876 topography Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229910052905 tridymite Inorganic materials 0.000 description 1
- 108010052768 tyrosyl-isoleucyl-glycyl-seryl-arginine Proteins 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 230000004222 uncontrolled growth Effects 0.000 description 1
- 238000012762 unpaired Student’s t-test Methods 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/54—Pancreas
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1774—Immunoglobulin superfamily (e.g. CD2, CD4, CD8, ICAM molecules, B7 molecules, Fc-receptors, MHC-molecules)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2086—IL-13 to IL-16
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464429—Molecules with a "CD" designation not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6901—Conjugates being cells, cell fragments, viruses, ghosts, red blood cells or viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/04—Metals or alloys
- A61L27/06—Titanium or titanium alloys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/18—Macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/22—Polypeptides or derivatives thereof, e.g. degradation products
- A61L27/225—Fibrin; Fibrinogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/38—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells
- A61L27/3804—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells characterised by specific cells or progenitors thereof, e.g. fibroblasts, connective tissue cells, kidney cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/005—Ingredients of undetermined constitution or reaction products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/042—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/043—Proteins; Polypeptides; Degradation products thereof
- A61L31/046—Fibrin; Fibrinogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/06—Macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/10—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/146—Porous materials, e.g. foams or sponges
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/7056—Lectin superfamily, e.g. CD23, CD72
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0638—Cytotoxic T lymphocytes [CTL] or lymphokine activated killer cells [LAK]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2207/00—Modified animals
- A01K2207/12—Animals modified by administration of exogenous cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/575—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 humoral response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/252—Polypeptides, proteins, e.g. glycoproteins, lipoproteins, cytokines
- A61L2300/256—Antibodies, e.g. immunoglobulins, vaccines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/416—Anti-neoplastic or anti-proliferative or anti-restenosis or anti-angiogenic agents, e.g. paclitaxel, sirolimus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/426—Immunomodulating agents, i.e. cytokines, interleukins, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/432—Inhibitors, antagonists
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/606—Coatings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/06—Anti-neoplasic drugs, anti-retroviral drugs, e.g. azacytidine, cyclophosphamide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/998—Proteins not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/999—Small molecules not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2513/00—3D culture
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
- C12N2533/50—Proteins
- C12N2533/56—Fibrin; Thrombin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
- C12N2533/70—Polysaccharides
- C12N2533/74—Alginate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2535/00—Supports or coatings for cell culture characterised by topography
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Biomedical Technology (AREA)
- Cell Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Vascular Medicine (AREA)
- Heart & Thoracic Surgery (AREA)
- Surgery (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Mycology (AREA)
- Dermatology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Transplantation (AREA)
- Biophysics (AREA)
- Oral & Maxillofacial Surgery (AREA)
- General Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
Description
本発明は、国立衛生研究所により授与されたCA181413に基づき政府支援によって行われた。政府は、本発明において一定の権利を有する。
本出願は、2016年12月21日に出願された米国仮特許出願第62/437,572号に対する優先権を主張し、この全内容は参照により組み込まれる。
50KBのファイルサイズである、2017年11月30日に作成された又はこの付近に作成された「1QJ8796.txt(Sequence Listing.txt)」というタイトルのコンピューター可読テキストファイルは、本出願についての配列表を含み、この全体は参照により本明細書に組み込まれる。
本開示は、固形腫瘍及びエスケープバリアント(escape variant)を治療し、がん再発に対する有効なワクチン接種を提供する移植可能な足場を提供する。足場は、遺伝的に再プログラムされたリンパ球、及びリンパ球活性化部分を含む。
本開示は、改善された移植可能な足場を提供することによって、がん免疫療法を進化させ続ける。本明細書に開示される移植可能な足場には、(i)遺伝的に再プログラムされたリンパ球、及び(ii)少なくとも1つのリンパ球活性化部分が播種されている。したがって、特定の実施形態では、これらの移植可能な足場は、US2016/0008399に記載されているものよりも形態が単純であり得る。特定の実施形態では、本明細書に開示される移植可能な足場はまた、STINGアゴニストを含んでもよい。これらの実施形態は、全身性炎症毒性を伴わず、毎日の注射を必要としない、STINGアゴニストの有効な免疫賦活効果を利用する機構を提供する。
脳腫瘍(膠芽腫):米国では、1年当たり推定10,000の新たな症例が見られる。現在、利用可能な根治療法は存在しない。膠芽腫は、非常に浸潤性の成長を示し、完全に切除することはできない。腫瘍の90%は、最初に切除された腫瘍から2cmの縁内で再発する。化学療法剤を負荷した生体材料ウェハは、膠芽腫のために米国食品医薬品局(FDA)により承認されている(GLIADEL(登録商標)、MGI Pharma,Inc.、Woodcliff Lake、NJ)。しかしながら、不十分な組織透過性に起因して、生体材料インプラント送達化学療法は、ほとんど効果がない。対照的に、本明細書に開示される足場から展開される腫瘍反応性リンパ球は、罹患組織に能動的に移動することができ、残存腫瘍細胞を探し出し、破壊する。
1.(i)マイクロパターン化金属薄膜を含む足場マトリックス内に配置された遺伝的に再プログラムされたリンパ球、及び(ii)リンパ球活性化部分を含むリンパ球足場。
2.STINGアゴニストをさらに含む、実施形態1に記載のリンパ球足場。
3.STINGアゴニストが、c-diGMP、c-diAMP、c-GAMP、c-AIMP、(3’,2’)c-AIMP、(2’,2’)c-AIMP、(2’,3’)c-AIMP、c-AIMP(S)、c-(dAMP-dIMP)、c-(dAMP-2’FdIMP)、c-(2’FdAMP-2’FdIMP)、(2’,3’)c-(AMP-2’FdIMP)、c-[2’FdAMP(S)-2’FdIMP(S)]、c-[2’FdAMP(S)-2’FdIMP(S)](POM)2及び/又はDMXAAを含む、実施形態2に記載のリンパ球足場。
4.STINGアゴニストが、c-diGMPを含む、実施形態2に記載のリンパ球足場。
5.薬物溶出ポリマーをさらに含む、実施形態1~4のいずれかに記載のリンパ球足場。
6.STINGアゴニストが、薬物溶出ポリマー内に埋め込まれている、実施形態5に記載のリンパ球足場。
7.薬物溶出ポリマーがPLGAを含む、実施形態5又は6に記載のリンパ球足場。
8.リンパ球が、T細胞及び/又はナチュラルキラー細胞を含む、実施形態1~7のいずれかに記載のリンパ球足場。
9.リンパ球が、CD8+T細胞を含む、実施形態1~8のいずれかに記載のリンパ球足場。
10.少なくとも2×106個のリンパ球を含む、実施形態1~9のいずれかに記載のリンパ球足場。
11.少なくとも7×106個のリンパ球を含む、実施形態1~9のいずれかに記載のリンパ球足場。
12.リンパ球活性化部分が、IL-15、又はCD3、CD28若しくはCD137に特異的な抗体のうちの少なくとも1つを含む、実施形態1~11のいずれかに記載のリンパ球足場。
13.リンパ球活性化部分が、CD3、CD128及びCD137に特異的な抗体を含む、実施形態1~12のいずれかに記載のリンパ球足場。
14.リンパ球活性化部分が、IL-15及びCD137を含む、実施形態1~13のいずれかに記載のリンパ球足場。
15.免疫刺激剤をさらに含む、実施形態1~14のいずれかに記載のリンパ球足場。
16.免疫刺激剤が、サイトカイン、抗体、小分子、siRNA、プラスミドDNA及び/又はワクチンアジュバントである、実施形態15に記載のリンパ球足場。
17.免疫刺激剤が、(i)CpG、Cpg-28、ポリ(I:C)、α-ガラクトセラミド、MPLA、VTX-2337、EMD1201081)イミキモド、MGN1703、G100、CBLB502、ヒルトノール及びイミキモドから選択されるToll様受容体リガンド並びに/又は(ii)17-ジメチルアミノエチルアミノ-17-デメトキシゲルダナマイシン)から選択される、実施形態15に記載のリンパ球足場。
18.免疫刺激剤が、薬物溶出ポリマー内に埋め込まれている、実施形態15~17のいずれかに記載のリンパ球足場。
19.リンパ球接着部分をさらに含む、実施形態1~18のいずれかに記載のリンパ球足場。
20.リンパ球接着部分及びリンパ球活性化部分が、共有結合している、実施形態19に記載のリンパ球足場。
21.リンパ球接着部分がフィブリンを含む、実施形態19又は20に記載のリンパ球足場。
22.リンパ球接着部分が、α1β1インテグリン、α2β1インテグリン、α4β1インテグリン、α5β1インテグリン又はリンパ球機能関連抗原(LFA-1)に結合するペプチドを含む、実施形態19~21のいずれかに記載のリンパ球足場。
23.リンパ球接着部分が、GFOGER(配列番号1)ペプチドを含む、実施形態19~22のいずれかに記載のリンパ球足場。
24.リンパ球接着部分が、配列番号1又は配列番号2のGFOGER(配列番号1)ペプチドを含む、実施形態19~23のいずれかに記載のリンパ球足場。
25.リンパ球接着部分が、ICAM-1ペプチドを含む、実施形態19~24のいずれかに記載のリンパ球足場。
26.リンパ球接着部分が、配列番号3のICAM-1ペプチドを含む、実施形態19~25のいずれかに記載のリンパ球足場。
27.リンパ球接着部分が、FNIII7~10ペプチドを含む、実施形態19~26のいずれかに記載のリンパ球足場。
28.リンパ球接着部分が、配列番号4のFNIII7~10ペプチドを含む、実施形態19~27のいずれかに記載のリンパ球足場。
29.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックスと連結している、実施形態2~28のいずれかに記載のリンパ球足場。
30.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックス内に埋め込まれている、実施形態2~29のいずれかに記載のリンパ球足場。
31.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックスの表面の少なくとも一部を覆う生物活性コーティング内にある、実施形態2~30のいずれかに記載のリンパ球足場。
32.生物活性コーティングが、薬物溶出ポリマーを含む、実施形態31に記載のリンパ球足場。
33.リンパ球接着部分をさらに含み、STINGアゴニストが薬物溶出ポリマー内にあり、薬物溶出ポリマーが足場マトリックスの表面上に単層を形成し、リンパ球接着部分が薬物溶出ポリマーを直接コーティングしている、実施形態32に記載のリンパ球足場。
34.STINGアゴニスト及び/又はリンパ球活性化部分が、粒子と連結している、実施形態2~33のいずれかに記載のリンパ球足場。
35.粒子が、足場と連結しており、及び/又は足場マトリックス内に埋め込まれている、実施形態34に記載のリンパ球足場。
36.STINGアゴニスト及び/又はリンパ球活性化部分が、原細胞のリポソームと結合している、実施形態2~35のいずれかに記載のリンパ球足場。
37.原細胞と足場マトリックス内のリンパ球との比が、0.5:1、1:1、5:1又は10:1である、実施形態36のリンパ球足場。
38.7×106個~1×1010個の原細胞を含む、実施形態1~37のいずれかに記載のリンパ球足場。
39.マイクロパターン化金属薄膜が、TFNマイクロメッシュを含む、実施形態1~38のいずれかに記載のリンパ球足場。
40.足場マトリックス、遺伝的に再プログラムされたリンパ球及び3つのリンパ球活性化部分からなる、リンパ球足場。
41.足場マトリックスが、アルギネート足場、コラーゲン/アルギネート足場、キトサン足場、自己集合ペプチド足場、メソ多孔質シリカ足場、マイクロパターン化金属薄膜足場又はPLGA足場を含む、実施形態40に記載のリンパ球足場。
42.マイクロパターン化金属薄膜足場が、TFNマイクロメッシュ足場を含む、実施形態40又は41に記載のリンパ球足場。
43.足場マトリックスが、アルギネート足場を含む、実施形態40~42のいずれかに記載のリンパ球足場。
44.足場マトリックスが、ポリマーカルシウム架橋アルギネート足場を含む、実施形態40~43のいずれかに記載のリンパ球足場。
45.遺伝的に再プログラムされたリンパ球が、遺伝的に再プログラムされたT細胞及び/又はナチュラルキラー細胞である、実施形態40~44のいずれかに記載のリンパ球足場。
46.遺伝的に再プログラムされたリンパ球が、CD8+T細胞である、実施形態40~45のいずれかに記載のリンパ球足場。
47.少なくとも2×106個の遺伝的に再プログラムされたリンパ球を含む、実施形態40~46のいずれかに記載のリンパ球足場。
48.少なくとも7×106個の遺伝的に再プログラムされたリンパ球を含む、実施形態40~46のいずれかに記載のリンパ球足場。
49.リンパ球活性化部分が、CD3、CD28及び/又はCD137に特異的な抗体を含む、実施形態40~48のいずれかに記載のリンパ球足場。
50.リンパ球活性化部分が、足場と連結している、実施形態40~49のいずれかに記載のリンパ球足場。
51.リンパ球活性化部分が、足場内に埋め込まれている、実施形態40~50のいずれかに記載のリンパ球足場。
52.足場マトリックス、遺伝的に再プログラムされたリンパ球、及びリンパ球活性化部分を含むリンパ球足場。
53.STINGアゴニストをさらに含む、実施形態52に記載のリンパ球足場。
54.STINGアゴニストが、c-diGMP、c-diAMP、c-GAMP、c-AIMP、(3’,2’)c-AIMP、(2’,2’)c-AIMP、(2’,3’)c-AIMP、c-AIMP(S)、c-(dAMP-dIMP)、c-(dAMP-2’FdIMP)、c-(2’FdAMP-2’FdIMP)、(2’,3’)c-(AMP-2’FdIMP)、c-[2’FdAMP(S)-2’FdIMP(S)]、c-[2’FdAMP(S)-2’FdIMP(S)](POM)2及び/又はDMXAAを含む、実施形態53に記載のリンパ球足場。
55.STINGアゴニストが、c-diGMPを含む、実施形態52又は53に記載のリンパ球足場。
56.遺伝的に再プログラムされたリンパ球が、遺伝的に再プログラムされたT細胞及び/又はナチュラルキラー細胞である、実施形態52~55のいずれかに記載のリンパ球足場。
57.遺伝的に再プログラムされたリンパ球が、CD8+T細胞である、実施形態52~56のいずれかに記載のリンパ球足場。
58.少なくとも2×106個又は少なくとも7×106個の遺伝的に再プログラムされたリンパ球を含む、実施形態52~57のいずれかに記載のリンパ球足場。
59.リンパ球活性化部分が、IL-15並びに/又はCD3、CD28及び/若しくはCD137に特異的な抗体を含む、実施形態52~58のいずれかに記載のリンパ球足場。
60.免疫刺激剤をさらに含む、実施形態52~59のいずれかに記載のリンパ球足場。
61.免疫刺激剤が、サイトカイン、抗体、小分子、siRNA、プラスミドDNA及び/又はワクチンアジュバントを含む、実施形態60に記載のリンパ球足場。
62.免疫刺激剤が、(i)CpG、Cpg-28、ポリ(I:C)、α-ガラクトセラミド、MPLA、VTX-2337、EMD1201081)イミキモド、MGN1703、G100、CBLB502、ヒルトノール及びイミキモドから選択されるToll様受容体リガンド並びに/又は(ii)17-ジメチルアミノエチルアミノ-17-デメトキシゲルダナマイシン)を含む、実施形態60又は61に記載のリンパ球足場。
63.リンパ球接着部分をさらに含む、実施形態52~62のいずれかに記載のリンパ球足場。
64.リンパ球接着部分がフィブリンを含む、実施形態63に記載のリンパ球足場。
65.リンパ球接着部分が、α1β1インテグリン、α2β1インテグリン、α4β1インテグリン、α5β1インテグリン又はリンパ球機能関連抗原(LFA-1)に結合するペプチドを含む、実施形態63又は64に記載のリンパ球足場。
66.リンパ球接着部分が、GFOGER(配列番号1)ペプチドを含む、実施形態63~65のいずれかに記載のリンパ球足場。
67.リンパ球接着部分が、配列番号1又は配列番号2のGFOGER(配列番号1)ペプチドを含む、実施形態63~66のいずれかに記載のリンパ球足場。
68.リンパ球接着部分が、ICAM-1ペプチドを含む、実施形態63~67のいずれかに記載のリンパ球足場。
69.リンパ球接着部分が、配列番号3のICAM-1ペプチドを含む、実施形態63~68のいずれかに記載のリンパ球足場。
70.リンパ球接着部分が、FNIII7~10ペプチドを含む、実施形態63~69のいずれかに記載のリンパ球足場。
71.リンパ球接着部分が、配列番号4のFNIII7~10ペプチドを含む、実施形態63~70のいずれかに記載のリンパ球足場。
72.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックスと連結している、実施形態53~71のいずれかに記載のリンパ球足場。
73.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックス内に埋め込まれている、実施形態53~72のいずれかに記載のリンパ球足場。
74.STINGアゴニスト及び/又はリンパ球活性化部分が、足場マトリックスの表面の少なくとも一部を覆う生物活性コーティング内にある、実施形態53~73のいずれかに記載のリンパ球足場。
75.STINGアゴニスト及び/又はリンパ球活性化部分が、粒子と連結している、実施形態53~74のいずれかに記載のリンパ球足場。
76.粒子が、足場マトリックスと連結している及び/又は足場マトリックス内に埋め込まれている、実施形態75に記載のリンパ球足場。
77.STINGアゴニスト及び/又はリンパ球活性化部分が、原細胞のリポソームと結合している、実施形態53~76のいずれかに記載のリンパ球足場。
78.原細胞と足場マトリックス内のリンパ球との比が、0.5:1、1:1、5:1又は10:1である、実施形態77のリンパ球足場。
79.7×106個~1×1010個の原細胞を含む、実施形態53~78のいずれかに記載のリンパ球足場。
80.足場マトリックスが、アルギネート足場、コラーゲン/アルギネート足場、キトサン足場、自己集合ペプチド足場、メソ多孔質シリカ足場、マイクロパターン化金属薄膜足場又はPLGA足場を含む、実施形態52~79のいずれかに記載のリンパ球足場。
81.マイクロパターン化金属薄膜足場が、TFNマイクロメッシュ足場を含む、実施形態80に記載のリンパ球足場。
82.足場マトリックスが、アルギネート足場を含む、実施形態80又は81に記載のリンパ球足場。
83.足場マトリックスが、ポリマーカルシウム架橋アルギネート足場を含む、実施形態80~82のいずれかに記載のリンパ球足場。
84.(i)足場マトリックス材料、(ii)抗がん活性を有するナチュラルキラー細胞並びに(iii)IL-15、及びCD137に特異的な抗体を含むリンパ球活性化部分を含むリンパ球足場。
85.足場マトリックス材料が、マイクロパターン化金属薄膜を含む、実施形態84に記載のリンパ球足場。
86.マイクロパターン化金属薄膜が、TFNマイクロメッシュを含む、実施形態84又は85に記載のリンパ球足場。
87.STINGアゴニストをさらに含む、実施形態84~86のいずれかに記載のリンパ球足場。
88.STINGアゴニストが、c-diGMP、c-diAMP、c-GAMP、c-AIMP、(3’,2’)c-AIMP、(2’,2’)c-AIMP、(2’,3’)c-AIMP、c-AIMP(S)、c-(dAMP-dIMP)、c-(dAMP-2’FdIMP)、c-(2’FdAMP-2’FdIMP)、(2’,3’)c-(AMP-2’FdIMP)、c-[2’FdAMP(S)-2’FdIMP(S)]、c-[2’FdAMP(S)-2’FdIMP(S)](POM)2及び/又はDMXAAを含む、実施形態113に記載のリンパ球足場。
89.薬物溶出ポリマーをさらに含む、実施形態84~88のいずれかに記載のリンパ球足場。
90.薬物溶出ポリマーがPLGAを含む、実施形態89に記載のリンパ球足場。
91.STINGアゴニストが、薬物溶出ポリマー内に埋め込まれている、実施形態87又は88に記載のリンパ球足場。
92.リンパ球接着部分をさらに含む、実施形態84~91のいずれかに記載のリンパ球足場。
93.リンパ球接着部分がフィブリンを含む、実施形態92に記載のリンパ球足場。
94.リンパ球接着部分が、α1β1インテグリン、α2β1インテグリン、α4β1インテグリン、α5β1インテグリン又はリンパ球機能関連抗原(LFA-1)に結合するペプチドを含む、実施形態92又は93に記載のリンパ球足場。
95.リンパ球接着部分が、GFOGER(配列番号1)ペプチドを含む、実施形態92~94のいずれかに記載のリンパ球足場。
96.リンパ球接着部分が、配列番号1又は配列番号2のGFOGER(配列番号1)ペプチドを含む、実施形態92~95のいずれかに記載のリンパ球足場。
97.リンパ球接着部分が、ICAM-1ペプチドを含む、実施形態84~96のいずれかに記載のリンパ球足場。
98.リンパ球接着部分が、配列番号3のICAM-1ペプチドを含む、実施形態84~97のいずれかに記載のリンパ球足場。
99.リンパ球接着部分が、FNIII7~10ペプチドを含む、実施形態84~98のいずれかに記載のリンパ球足場。
100.リンパ球接着部分が、配列番号4のFNIII7~10ペプチドを含む、実施形態84~99のいずれかに記載のリンパ球足場。
101.対象におけるエスケープバリアント腫瘍細胞を含む不均一な固形腫瘍を治療する方法であって、対象における不均一な固形腫瘍の破壊を導くのに十分な不均一な固形腫瘍細胞の近位内に、実施形態1~100のいずれかに記載のリンパ球足場を対象に移植し、それによってエスケープバリアント腫瘍細胞を含む不均一な固形腫瘍を治療するステップを含む、方法。
102.がん再発の発生に対して対象にワクチン接種をする方法であって、実施形態1~100のいずれかに記載のリンパ球足場を、対象の不均一な固形腫瘍の近位内に、又は対象の固形腫瘍切除床内に移植し、それによってがん再発の発生に対して対象にワクチン接種をするステップを含む、方法。
103.腫瘍細胞の治療を必要とする対象において腫瘍細胞を治療する方法であって、実施形態1~100のいずれかに記載のリンパ球足場を、腫瘍切除床内で対象に移植し、それによって対象において腫瘍細胞を治療するステップを含む、方法。
104.治療される腫瘍細胞が、副腎がん細胞、脳がん細胞、乳がん細胞、子宮頸がん細胞、結腸がん細胞、大腸がん細胞、耳、鼻及び咽喉(ENT)がん細胞、子宮内膜がん細胞、食道がん細胞、消化管がん細胞、グリオーマ細胞、頭頸部がん細胞、腸がん細胞、腎臓がん細胞、肝臓がん細胞、肺がん細胞、リンパ節がん細胞、黒色腫細胞、神経芽腫細胞、卵巣がん細胞、膵臓がん細胞、前立腺がん細胞、直腸がん細胞、セミノーマ細胞、皮膚がん細胞、胃がん細胞、奇形腫細胞、甲状腺がん細胞又は子宮がん細胞である、実施形態103に記載の方法。
105.治療される腫瘍細胞が、膠芽腫細胞、膵臓腺がん細胞又は卵巣がん細胞である、実施形態103に記載の方法。
106.原発腫瘍の切除後、転移性再発によって引き起こされる外科治療の失敗を低減させる方法であって、実施形態1~100のいずれかに記載のリンパ球足場を対象の腫瘍切除床に投与し、それによって原発腫瘍の切除後、転移性再発によって引き起こされる外科治療の失敗を低減させるステップを含む、方法。
107.原発腫瘍が、セミノーマ細胞、黒色腫細胞、奇形腫細胞、神経芽腫細胞、グリオーマ細胞、直腸がん細胞、子宮内膜がん細胞、腎臓がん細胞、副腎がん細胞、甲状腺がん細胞、皮膚がん細胞、脳がん細胞、子宮頸がん細胞、腸がん細胞、肝臓がん細胞、結腸がん細胞、胃がん細胞、頭頸部がん細胞、消化管がん細胞、リンパ節がん細胞、食道がん細胞、大腸がん細胞、膵臓がん細胞、耳、鼻及び咽喉(ENT)がん細胞、乳がん細胞、前立腺がん細胞、子宮がん細胞、卵巣がん細胞又は肺がん細胞を含む、実施形態106に記載の方法。
108.がんについて対象を治療する方法であって、TFNマイクロメッシュ、遺伝的に修飾されたリンパ球、及びリンパ球活性化部分を含むリンパ球足場によりコーティングされた医療装置を対象に移植するステップを含む、方法。
109.移植するステップが、低侵襲性処置を含む、実施形態108に記載の方法。
110.医療装置が、ステントを含む、実施形態108に記載の方法。
111.対象における固形腫瘍を治療するためのリンパ球足場を形成するためのキットであって、(i)足場マトリックス、及び(ii)CD3、CD28及びCD137に特異的な抗体を含むリンパ球活性化部分を含む、キット。
112.多孔質粒子をさらに含む、実施形態111に記載のキット。
113.リポソームをさらに含む、実施形態111又は112に記載のキット。
114.原細胞をさらに含む、実施形態111~113のいずれかに記載のキット。
115.STINGアゴニストをさらに含む、実施形態111~114のいずれかに記載のキット。
116.STINGアゴニストが、c-diGMP、c-diAMP、c-GAMP、c-AIMP、(3’,2’)c-AIMP、(2’,2’)c-AIMP、(2’,3’)c-AIMP、c-AIMP(S)、c-(dAMP-dIMP)、c-(dAMP-2’FdIMP)、c-(2’FdAMP-2’FdIMP)、(2’,3’)c-(AMP-2’FdIMP)、c-[2’FdAMP(S)-2’FdIMP(S)]、c-[2’FdAMP(S)-2’FdIMP(S)](POM)2及び/又はDMXAAを含む、実施形態115に記載のキット。
117.STINGアゴニストが、c-diGMPを含む、実施形態115に記載のキット。
118.免疫刺激剤をさらに含む、実施形態111~117のいずれかに記載のキット。
119.免疫刺激剤が、サイトカイン、抗体、小分子、siRNA、プラスミドDNA及び/又はワクチンアジュバントを含む、実施形態118に記載のキット。
120.免疫刺激剤が、(i)CpG、Cpg-28、ポリ(I:C)、α-ガラクトセラミド、MPLA、VTX-2337、EMD1201081)イミキモド、MGN1703、G100、CBLB502、ヒルトノール及びイミキモドから選択されるToll様受容体リガンド並びに/又は(ii)17-ジメチルアミノエチルアミノ-17-デメトキシゲルダナマイシン)を含む、実施形態118又は119に記載のキット。
121.リンパ球接着部分をさらに含む、実施形態111~120のいずれかに記載のキット。
122.リンパ球接着部分がフィブリンを含む、実施形態121に記載のキット。
123.リンパ球接着部分が、α1β1インテグリン、α2β1インテグリン、α4β1インテグリン、α5β1インテグリン又はリンパ球機能関連抗原(LFA-1)に結合するペプチドを含む、実施形態121又は122に記載のキット。
124.リンパ球接着部分が、GFOGER(配列番号1)ペプチドを含む、実施形態121~123のいずれかに記載のキット。
125.リンパ球接着部分が、配列番号1又は配列番号2のGFOGER(配列番号1)ペプチドを含む、実施形態121~124のいずれかに記載のキット。
126.リンパ球接着部分が、ICAM-1ペプチドを含む、実施形態121~125のいずれかに記載のキット。
127.リンパ球接着部分が、配列番号3のICAM-1ペプチドを含む、実施形態121~126のいずれかに記載のキット。
128.リンパ球接着部分が、FNIII7~10ペプチドを含む、実施形態121~127のいずれかに記載のキット。
129.リンパ球接着部分が、配列番号4のFNIII7~10ペプチドを含む、実施形態121~128のいずれかに記載のキット。
130.7×106~1×1010個の粒子、リポソーム又は原細胞を含む、実施形態111~129のいずれかに記載のキット。
131.遺伝的に再プログラムされたリンパ球をさらに含む、実施形態111~130のいずれかに記載のキット。
132.遺伝的に再プログラムされたリンパ球が、T細胞及び/又はナチュラルキラー細胞を含む、実施形態131に記載のキット。
133.遺伝的に再プログラムされたリンパ球が、CD8+T細胞を含む、実施形態131又は132に記載のキット。
134.リンパ球が、少なくとも7×106個のリンパ球を含む、実施形態131~133のいずれかに記載のキット。
135.足場マトリックスが、アルギネート、コラーゲン、キトサン、自己集合ペプチド、メソ多孔質シリカ、TFNマイクロメッシュ又はPLGAを含む、実施形態131~134のいずれかに記載のキット。
136.足場マトリックスが、アルギネートを含む、実施形態135に記載のキット。
137.カルシウムをさらに含む、実施形態111~136のいずれかに記載のキット。
138.薬物溶出ポリマーをさらに含む、実施形態111~137のいずれかに記載のキット。
139.薬物溶出ポリマーが、足場マトリックス上にコーティングされる、実施形態138に記載のキット。
140.STINGアゴニスト又は免疫刺激剤が、薬物溶出ポリマー内に埋め込まれている、実施形態138に記載のキット。
141.薬物溶出ポリマーがPLGAを含む、実施形態111~140のいずれかに記載のキット。
142.(i)マイクロパターン化金属薄膜足場、(ii)遺伝的に再プログラムされたリンパ球、及び(iii)リンパ球活性化部分を含む、移植可能な医療装置。
143.STINGアゴニスト及び/又は免疫刺激剤をさらに含む、実施形態142に記載の移植可能な医療装置。
144.薬物溶出ポリマーをさらに含み、STINGアゴニスト及び/又は免疫刺激剤が、薬物溶出ポリマー内に埋め込まれている、実施形態143に記載の移植可能な医療装置。
145.マイクロパターン化金属薄膜足場が、三次元形状を有する、実施形態142~144のいずれかに記載の移植可能な医療装置。
146.三次元形状が円筒形である、実施形態145に記載の移植可能な医療装置。
147.ステントを含む、実施形態142~146のいずれかに記載の移植可能な医療装置。
148.低侵襲性医療装置を含む、実施形態142~147のいずれかに記載の移植可能な医療装置。
149.マイクロパターン化金属薄膜足場が、層内に積層される、実施形態142~148のいずれかに記載の移植可能な医療装置。
150.マイクロパターン化金属薄膜が、TFNマイクロメッシュを含む、実施形態142~149のいずれかに記載の移植可能な医療装置。
151.遺伝的に再プログラムされたリンパ球が、少なくとも細胞7×106個/cm3の濃度にて存在する、実施形態142~150のいずれかに記載の移植可能な医療装置。
Claims (9)
- (i)薄膜ニチノール(TFN)マイクロメッシュを含む足場マトリックス内に配置された遺伝的に再プログラムされたリンパ球、(ii)フィブリンを含むリンパ球接着部分、及び(iii)CD137に特異的な抗体を含むリンパ球活性化部分を含む、リンパ球足場。
- 遺伝的に再プログラムされたリンパ球が、T細胞を含み、リンパ球活性化部分が、CD3、CD28及びCD137に特異的な抗体を含む、請求項1に記載のリンパ球足場。
- 遺伝的に再プログラムされたリンパ球が、ナチュラルキラー(NK)細胞を含み、リンパ球活性化部分が、インターロイキン15、及びCD137に特異的な抗体を含む、請求項1に記載のリンパ球足場。
- 遺伝的に再プログラムされたリンパ球が、T細胞及びNK細胞を含み、リンパ球活性化部分が、CD137に特異的な抗体を含む、請求項1に記載のリンパ球足場。
- STINGアゴニストをさらに含む、請求項1に記載のリンパ球足場。
- STINGアゴニストが、c-diGMP、c-diAMP、c-GAMP、c-AIMP、(3’,2’)c-AIMP、(2’,2’)c-AIMP、(2’,3’)c-AIMP、c-AIMP(S)、c-(dAMP-dIMP)、c-(dAMP-2’FdIMP)、c-(2’FdAMP-2’FdIMP)、(2’,3’)c-(AMP-2’FdIMP)、c-[2’FdAMP(S)-2’FdIMP(S)]、c-[2’FdAMP(S)-2’FdIMP(S)](POM)2及び/又はDMXAAを含む、請求項5に記載のリンパ球足場。
- 請求項1に記載のリンパ球足場を含む、対象におけるエスケープバリアント腫瘍細胞を含む不均一な固形腫瘍を治療するための医薬組成物であって、請求項1に記載のリンパ球足場は、対象における不均一な固形腫瘍の破壊を導くのに十分な不均一な固形腫瘍細胞の近位内に、移植され、それによってエスケープバリアント腫瘍細胞を含む不均一な固形腫瘍を治療する、医薬組成物。
- 治療される腫瘍細胞が、副腎がん細胞、脳がん細胞、乳がん細胞、子宮頸がん細胞、結腸がん細胞、大腸がん細胞、耳、鼻及び咽喉(ENT)がん細胞、子宮内膜がん細胞、食道がん細胞、消化管がん細胞、グリオーマ細胞、頭頸部がん細胞、腸がん細胞、腎臓がん細胞、肝臓がん細胞、肺がん細胞、リンパ節がん細胞、黒色腫細胞、神経芽腫細胞、卵巣がん細胞、膵臓がん細胞、前立腺がん細胞、直腸がん細胞、セミノーマ細胞、皮膚がん細胞、胃がん細胞、奇形腫細胞、甲状腺がん細胞又は子宮がん細胞である、請求項7に記載の医薬組成物。
- 治療される腫瘍細胞が、膠芽腫細胞、膵臓腺がん細胞又は卵巣がん細胞である、請求項7に記載の医薬組成物。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022097810A JP2022130502A (ja) | 2016-12-21 | 2022-06-17 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
| JP2023012548A JP2023065362A (ja) | 2016-12-21 | 2023-01-31 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662437572P | 2016-12-21 | 2016-12-21 | |
| US62/437,572 | 2016-12-21 | ||
| PCT/US2017/067965 WO2018119274A1 (en) | 2016-12-21 | 2017-12-21 | Scaffolds to treat solid tumor cells and escape variants |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022097810A Division JP2022130502A (ja) | 2016-12-21 | 2022-06-17 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
| JP2023012548A Division JP2023065362A (ja) | 2016-12-21 | 2023-01-31 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020514280A JP2020514280A (ja) | 2020-05-21 |
| JP2020514280A5 JP2020514280A5 (ja) | 2021-02-04 |
| JP7295360B2 true JP7295360B2 (ja) | 2023-06-21 |
Family
ID=62627587
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019534814A Active JP7295360B2 (ja) | 2016-12-21 | 2017-12-21 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
| JP2022097810A Pending JP2022130502A (ja) | 2016-12-21 | 2022-06-17 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
| JP2023012548A Pending JP2023065362A (ja) | 2016-12-21 | 2023-01-31 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022097810A Pending JP2022130502A (ja) | 2016-12-21 | 2022-06-17 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
| JP2023012548A Pending JP2023065362A (ja) | 2016-12-21 | 2023-01-31 | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 |
Country Status (5)
| Country | Link |
|---|---|
| US (3) | US20190336532A1 (ja) |
| EP (2) | EP3558327A4 (ja) |
| JP (3) | JP7295360B2 (ja) |
| CN (1) | CN110167566A (ja) |
| WO (1) | WO2018119274A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014110591A1 (en) | 2013-01-14 | 2014-07-17 | Fred Hutchinson Cancer Research Center | Compositions and methods for delivery of immune cells to treat un-resectable or non-resected tumor cells and tumor relapse |
| CN111263767B (zh) * | 2017-08-30 | 2023-07-18 | 北京轩义医药科技有限公司 | 作为干扰素基因调节剂的刺激剂的环状二核苷酸 |
| CA3137119A1 (en) | 2019-05-09 | 2020-11-12 | Aligos Therapeutics, Inc. | Modified cyclic dinucleoside compounds as sting modulators |
| CN113456810A (zh) * | 2020-03-30 | 2021-10-01 | 杭州星鳌生物科技有限公司 | 一种新型抗新冠病毒治疗性疫苗及其制备方法和应用 |
| AU2021270750B2 (en) * | 2020-05-13 | 2024-06-13 | Massachusetts Institute Of Technology | Compositions of polymeric microdevices and their use in cancer immunotherapy |
| WO2024081898A1 (en) * | 2022-10-13 | 2024-04-18 | North Carolina State University | Implantable scaffolds and methods of use |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020062154A1 (en) | 2000-09-22 | 2002-05-23 | Ayers Reed A. | Non-uniform porosity tissue implant |
| US20120245706A1 (en) | 2011-03-23 | 2012-09-27 | The Regents Of The University Of California | Mesh enclosed tissue constructs |
| US20140180399A1 (en) | 2011-03-23 | 2014-06-26 | The Regents Of The University Of California | Mesh enclosed tissue constructs |
| WO2014110591A1 (en) | 2013-01-14 | 2014-07-17 | Fred Hutchinson Cancer Research Center | Compositions and methods for delivery of immune cells to treat un-resectable or non-resected tumor cells and tumor relapse |
| WO2016079899A1 (ja) | 2014-11-20 | 2016-05-26 | 国立研究開発法人医薬基盤・健康・栄養研究所 | 異なる核酸アジュバントの組み合わせによる、新規Th1誘導性アジュバントおよびその用途 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA181413A (en) | 1917-02-06 | 1918-01-01 | Frank Dyehe Law | Tire |
| US4078052A (en) | 1976-06-30 | 1978-03-07 | The United States Of America As Represented By The Secretary Of Health, Education And Welfare | Large unilamellar vesicles (LUV) and method of preparing same |
| CH621479A5 (ja) | 1977-08-05 | 1981-02-13 | Battelle Memorial Institute | |
| CH624011A5 (ja) | 1977-08-05 | 1981-07-15 | Battelle Memorial Institute | |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4241046A (en) | 1978-11-30 | 1980-12-23 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5827642A (en) | 1994-08-31 | 1998-10-27 | Fred Hutchinson Cancer Research Center | Rapid expansion method ("REM") for in vitro propagation of T lymphocytes |
| US8791073B2 (en) | 2004-05-14 | 2014-07-29 | William Marsh Rice University | Peptide-modified polyurethane compositions and associated methods |
| JP2014512409A (ja) * | 2011-04-28 | 2014-05-22 | エスティーシー. ユーエヌエム | 標的送達用の多孔性ナノ粒子に担持された脂質二重層(プロトセル)及びその使用方法 |
| CN104781789B (zh) | 2012-12-20 | 2018-06-05 | 三菱电机株式会社 | 车载装置 |
| US9108442B2 (en) | 2013-08-20 | 2015-08-18 | Ricoh Company, Ltd. | Image forming apparatus |
| EP3060176B1 (en) * | 2013-10-23 | 2018-12-05 | NSVascular, Inc | Three-dimensional thin-film nitinol devices |
| US20160287623A1 (en) * | 2013-11-19 | 2016-10-06 | The University Of Chicago | Use of sting agonist as cancer treatment |
| WO2016096577A1 (en) * | 2014-12-16 | 2016-06-23 | Invivogen | Combined use of a chemotherapeutic agent and a cyclic dinucleotide for cancer treatment |
| CR20170410A (es) * | 2015-03-10 | 2017-11-08 | Aduro Biotech Inc | Composiciones y métodos para activar la señalización dependiente del "estimulador del gen interferon" |
| GB201504502D0 (en) * | 2015-03-17 | 2015-04-29 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against pancreatic cancer and other cancers |
| WO2016161372A1 (en) * | 2015-04-01 | 2016-10-06 | President And Fellows Of Harvard College | Immunoconjugates for programming or reprogramming of cells |
-
2017
- 2017-12-21 US US16/472,764 patent/US20190336532A1/en not_active Abandoned
- 2017-12-21 EP EP17883391.9A patent/EP3558327A4/en active Pending
- 2017-12-21 JP JP2019534814A patent/JP7295360B2/ja active Active
- 2017-12-21 EP EP23215104.3A patent/EP4371584A3/en active Pending
- 2017-12-21 WO PCT/US2017/067965 patent/WO2018119274A1/en unknown
- 2017-12-21 CN CN201780079628.7A patent/CN110167566A/zh active Pending
-
2022
- 2022-06-17 JP JP2022097810A patent/JP2022130502A/ja active Pending
- 2022-06-22 US US17/846,391 patent/US20220339195A1/en active Pending
-
2023
- 2023-01-31 JP JP2023012548A patent/JP2023065362A/ja active Pending
- 2023-09-28 US US18/476,774 patent/US20240033293A1/en active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020062154A1 (en) | 2000-09-22 | 2002-05-23 | Ayers Reed A. | Non-uniform porosity tissue implant |
| US20120245706A1 (en) | 2011-03-23 | 2012-09-27 | The Regents Of The University Of California | Mesh enclosed tissue constructs |
| US20140180399A1 (en) | 2011-03-23 | 2014-06-26 | The Regents Of The University Of California | Mesh enclosed tissue constructs |
| WO2014110591A1 (en) | 2013-01-14 | 2014-07-17 | Fred Hutchinson Cancer Research Center | Compositions and methods for delivery of immune cells to treat un-resectable or non-resected tumor cells and tumor relapse |
| WO2016079899A1 (ja) | 2014-11-20 | 2016-05-26 | 国立研究開発法人医薬基盤・健康・栄養研究所 | 異なる核酸アジュバントの組み合わせによる、新規Th1誘導性アジュバントおよびその用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3558327A4 (en) | 2020-12-09 |
| CN110167566A (zh) | 2019-08-23 |
| JP2022130502A (ja) | 2022-09-06 |
| US20190336532A1 (en) | 2019-11-07 |
| EP3558327A1 (en) | 2019-10-30 |
| US20220339195A1 (en) | 2022-10-27 |
| JP2023065362A (ja) | 2023-05-12 |
| EP4371584A2 (en) | 2024-05-22 |
| WO2018119274A1 (en) | 2018-06-28 |
| JP2020514280A (ja) | 2020-05-21 |
| US20240033293A1 (en) | 2024-02-01 |
| EP4371584A3 (en) | 2024-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11890303B2 (en) | Compositions and methods for delivery of immune cells to treat un-resectable or non-resected tumor cells and tumor relapse | |
| JP7295360B2 (ja) | 固形腫瘍細胞及びエスケープバリアントを治療するための足場 | |
| Riley et al. | Delivery technologies for cancer immunotherapy | |
| Kapadia et al. | Nanoparticulate immunotherapy for cancer | |
| Ma et al. | Tumor–antigen activated dendritic cell membrane-coated biomimetic nanoparticles with orchestrating immune responses promote therapeutic efficacy against glioma | |
| Han et al. | Tumor immune microenvironment modulation-based drug delivery strategies for cancer immunotherapy | |
| Liu et al. | Injectable supramolecular hydrogel for locoregional immune checkpoint blockade and enhanced cancer chemo-immunotherapy | |
| ES2959443T3 (es) | Uso del dominio de señalización de CD2 en receptores de antígenos quiméricos de segunda generación | |
| ES2816450T3 (es) | Uso de CAR basados en ICOS para mejorar la actividad antitumoral y la persistencia del CAR | |
| JP2021523110A (ja) | 遺伝子発現のためのナノ粒子及びその使用 | |
| KR20190039597A (ko) | 세포 치료요법을 위한 항상성 활성 사이토킨 수용체 | |
| AU2016303497A1 (en) | Compositions and methods for immuno-oncology therapies | |
| CA2993478A1 (en) | Compositions and methods for immunomodulation | |
| Dunn et al. | T cell immunotherapy enhanced by designer biomaterials | |
| CN114728154A (zh) | 基于丝素蛋白的微针及其用途 | |
| Zhao et al. | Neoantigen immunotherapeutic-gel combined with TIM-3 blockade effectively restrains orthotopic hepatocellular carcinoma progression | |
| Wang et al. | Supramolecular filament hydrogel as a universal immunomodulator carrier for immunotherapy combinations | |
| Li et al. | Surgically derived cancer cell membrane-coated R837-loaded Poly (2-Oxazoline) nanoparticles for prostate cancer immunotherapy | |
| Lei et al. | Efficient tumor immunotherapy through a single injection of injectable antigen/adjuvant-loaded macroporous silk fibroin microspheres | |
| Eckman et al. | Biomaterials to enhance adoptive cell therapy | |
| Jiang et al. | Biomembrane-based nanoparticles for cancer immunotherapy | |
| Mozafari et al. | Recent Biomaterial-Assisted Approaches for Immunotherapeutic Inhibition of Cancer Recurrence | |
| Tang et al. | Elevating the potential of CAR-T cell therapy in solid tumors: exploiting biomaterials-based delivery techniques | |
| WO2020262540A1 (ja) | トランスフェクション方法 | |
| Suryaprakash et al. | Immunotherapy and Cancer Stem Cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201217 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201217 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220201 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220427 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20220627 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20221004 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230131 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20230131 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20230201 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20230221 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230323 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20230328 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230411 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20230510 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230510 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230519 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230519 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7295360 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |