JP7184792B2 - 変形性関節症の治療のための組成物 - Google Patents
変形性関節症の治療のための組成物 Download PDFInfo
- Publication number
- JP7184792B2 JP7184792B2 JP2019549671A JP2019549671A JP7184792B2 JP 7184792 B2 JP7184792 B2 JP 7184792B2 JP 2019549671 A JP2019549671 A JP 2019549671A JP 2019549671 A JP2019549671 A JP 2019549671A JP 7184792 B2 JP7184792 B2 JP 7184792B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- use according
- treatment
- clodronate
- aqueous solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 69
- 201000008482 osteoarthritis Diseases 0.000 title claims description 64
- HJKBJIYDJLVSAO-UHFFFAOYSA-L clodronic acid disodium salt Chemical compound [Na+].[Na+].OP([O-])(=O)C(Cl)(Cl)P(O)([O-])=O HJKBJIYDJLVSAO-UHFFFAOYSA-L 0.000 claims description 74
- 229960002286 clodronic acid Drugs 0.000 claims description 44
- ACSIXWWBWUQEHA-UHFFFAOYSA-N clodronic acid Chemical compound OP(O)(=O)C(Cl)(Cl)P(O)(O)=O ACSIXWWBWUQEHA-UHFFFAOYSA-N 0.000 claims description 36
- 239000007864 aqueous solution Substances 0.000 claims description 28
- 239000002552 dosage form Substances 0.000 claims description 27
- 150000003839 salts Chemical class 0.000 claims description 25
- 239000003814 drug Substances 0.000 claims description 19
- 239000008194 pharmaceutical composition Substances 0.000 claims description 18
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical group [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 17
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 15
- 208000002193 Pain Diseases 0.000 claims description 14
- 230000036407 pain Effects 0.000 claims description 14
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 10
- 229940127557 pharmaceutical product Drugs 0.000 claims description 10
- 239000011780 sodium chloride Substances 0.000 claims description 10
- 208000024891 symptom Diseases 0.000 claims description 10
- 229940079593 drug Drugs 0.000 claims description 5
- 150000004685 tetrahydrates Chemical class 0.000 claims description 3
- 241000700159 Rattus Species 0.000 description 24
- 210000000845 cartilage Anatomy 0.000 description 24
- 238000002347 injection Methods 0.000 description 21
- 239000007924 injection Substances 0.000 description 21
- 210000002966 serum Anatomy 0.000 description 18
- 239000000243 solution Substances 0.000 description 14
- 230000003442 weekly effect Effects 0.000 description 13
- 230000000694 effects Effects 0.000 description 11
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 10
- 210000003127 knee Anatomy 0.000 description 9
- 102000055007 Cartilage Oligomeric Matrix Human genes 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 101710176668 Cartilage oligomeric matrix protein Proteins 0.000 description 7
- 206010030113 Oedema Diseases 0.000 description 6
- 210000001188 articular cartilage Anatomy 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 230000003204 osmotic effect Effects 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 235000017557 sodium bicarbonate Nutrition 0.000 description 5
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 5
- 101710190440 Cytotoxin 1 Proteins 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- LOJFGJZQOKTUBR-XAQOOIOESA-N NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCC(O)=O)C)CC1=CN=CN1 Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)CCC(O)=O)C)CC1=CN=CN1 LOJFGJZQOKTUBR-XAQOOIOESA-N 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- VYVRIXWNTVOIRD-LRHBOZQDSA-N ciguatoxin CTX1B Chemical compound C([C@@]12[C@@H](C)[C@@H]([C@@H]3[C@H]([C@H]([C@H](C)[C@H]4O[C@H]5C[C@@H](C)C[C@H]6O[C@@]7(C)[C@H](O)C[C@H]8O[C@H]9C=C[C@H]%10O[C@H]%11C[C@@H]%12[C@H]([C@@H]([C@H]%13O[C@H](C=CC[C@@H]%13O%12)\C=C\[C@H](O)CO)O)O[C@@H]%11C=C[C@@H]%10O[C@@H]9C\C=C/C[C@@H]8O[C@@H]7C[C@@H]6O[C@@H]5C[C@@H]4O3)O)O2)C)[C@H](O)CO1 VYVRIXWNTVOIRD-LRHBOZQDSA-N 0.000 description 4
- 108010049937 collagen type I trimeric cross-linked peptide Proteins 0.000 description 4
- 235000012631 food intake Nutrition 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 230000002489 hematologic effect Effects 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 238000000034 method Methods 0.000 description 4
- 210000002997 osteoclast Anatomy 0.000 description 4
- 239000000902 placebo Substances 0.000 description 4
- 229940068196 placebo Drugs 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 229940122361 Bisphosphonate Drugs 0.000 description 3
- 102000000503 Collagen Type II Human genes 0.000 description 3
- 108010041390 Collagen Type II Proteins 0.000 description 3
- 150000004663 bisphosphonates Chemical class 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 230000037406 food intake Effects 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 210000000629 knee joint Anatomy 0.000 description 3
- 230000003349 osteoarthritic effect Effects 0.000 description 3
- 230000008092 positive effect Effects 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- 235000019786 weight gain Nutrition 0.000 description 3
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- 108010022452 Collagen Type I Proteins 0.000 description 2
- 102000012422 Collagen Type I Human genes 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 239000000730 antalgic agent Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 206010003246 arthritis Diseases 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000008416 bone turnover Effects 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 231100000682 maximum tolerated dose Toxicity 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 230000000010 osteolytic effect Effects 0.000 description 2
- 229940071643 prefilled syringe Drugs 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 238000011552 rat model Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- AGDSCTQQXMDDCV-UHFFFAOYSA-M sodium;2-iodoacetate Chemical compound [Na+].[O-]C(=O)CI AGDSCTQQXMDDCV-UHFFFAOYSA-M 0.000 description 2
- 238000013222 sprague-dawley male rat Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000007306 turnover Effects 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 108700005376 Cartilage Oligomeric Matrix Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108060003393 Granulin Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 208000003947 Knee Osteoarthritis Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 208000008558 Osteophyte Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 210000001264 anterior cruciate ligament Anatomy 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000013011 aqueous formulation Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 230000008355 cartilage degradation Effects 0.000 description 1
- 230000022159 cartilage development Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 230000003413 degradative effect Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 210000002414 leg Anatomy 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 231100000062 no-observed-adverse-effect level Toxicity 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- 238000002559 palpation Methods 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 239000008196 pharmacological composition Substances 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- RWPGFSMJFRPDDP-UHFFFAOYSA-L potassium metabisulfite Chemical compound [K+].[K+].[O-]S(=O)S([O-])(=O)=O RWPGFSMJFRPDDP-UHFFFAOYSA-L 0.000 description 1
- 229940043349 potassium metabisulfite Drugs 0.000 description 1
- 235000010263 potassium metabisulphite Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000009711 regulatory function Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000010378 sodium ascorbate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 1
- 229960005055 sodium ascorbate Drugs 0.000 description 1
- 229940001607 sodium bisulfite Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000013223 sprague-dawley female rat Methods 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000012430 stability testing Methods 0.000 description 1
- 210000005065 subchondral bone plate Anatomy 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 210000005222 synovial tissue Anatomy 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- UEUXEKPTXMALOB-UHFFFAOYSA-J tetrasodium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O UEUXEKPTXMALOB-UHFFFAOYSA-J 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 239000008181 tonicity modifier Substances 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 1
- 238000002562 urinalysis Methods 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/662—Phosphorus acids or esters thereof having P—C bonds, e.g. foscarnet, trichlorfon
- A61K31/663—Compounds having two or more phosphorus acid groups or esters thereof, e.g. clodronic acid, pamidronic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Inorganic Chemistry (AREA)
- Pain & Pain Management (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Vascular Medicine (AREA)
- Anesthesiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Cephalosporin Compounds (AREA)
Description
本発明は、クロドロン酸ナトリウム、または相当量の、クロドロン酸または他の薬学的に許容されるその塩を含む、変形性関節症(OA)の治療のための関節内ルート(intra-articular route)による使用のための医薬組成物に関する。
関節炎(Arthritis)または変形性関節症(steoarthritis)(OA)は、特に、腰や膝などの機械的ストレスをより受けやすい関節に影響を与える、慢性の進行性疾患である。
この条件が発生した場合、全体の関節は、最終的に、軟骨(cartilage)、軟骨下骨(subchondral bone)、および滑膜組織(synovial tissues)などのすべての関節コンポーネントに影響を与えることにより、関節自体の生体構造(anatomy)および機能を変化させる、一連の分解および修復のプロセスによって影響される。
したがって、「関節炎」の状態は、様々な病因(etiologies)の感染性および炎症性のイベントが追加される可能性がある、多数の素因的要因(predisposing factors)によって、順に調節される、全身的な要因(例えば、高齢、肥満)と局所的な要因(例えば、外傷、過度の使用)との間の一連の相互関係の結果である。
この複雑な事象において、長年、主に鎮痛薬を使用して、本質的に炎症性事象および引き起こされる痛みの管理に向けられた個々の原因過程に対処および対抗し、様々な異なる治療アプローチ(主に鎮痛剤、局所的もしくは全身的な抗炎症剤、または例えばビスホスホネート、ヒアルロン酸、アントラキノン、硫酸コンドロイチンなどの様々な薬物の関節内注射を使用して、炎症事象および引き起こされる疼痛の管理に本質的に向けられる。)に頼ることによって治療的介入が試みられてきた。
Istituto Gentiliが所有する、欧州特許EP0203649号は、例えば、ビスホスホネート、好ましくは、クロドロン酸ナトリウムを含む、関節内の経路(i.a.)によって投与される、変形性関節症における使用のための組成物を記載している。
具体的には、当該文献は、10-1から10-6Mの範囲の、低濃度で、ビスホスホネートを含有し、4.5と7.5の間に含まれるpHを有し、塩化ナトリウムまたは他の類似の賦形剤を用いて等張化されている水性製剤を開示する。
特に、この文献は、アミノ酸、好ましくはグリシンまたはリジンの添加によって解決される、これらの調製物の安定性に関連する技術的問題を記載している。
記載の製剤は、水性溶媒中、ready-to-use、または、使用時に溶媒で再構成する凍結乾燥の形態で製剤化されている。
報告された全ての実施例では、1mgまたは0.5μgの投与量のクロドロン酸ナトリウムを含む製剤に関し、グリシンは、当該溶液のための安定化剤として使用されている。
欧州特許EP0203649によって提供される教示によれば、薬学的に安定したクロドロン酸ナトリウム溶液を製剤化する可能性は、クロドロネートの析出を防止するように、安定剤の添加によって、実際には、調整されており、記載された製造法において使用されている低濃度でも顕著である。
この研究は、特に自発性疼痛および運動中(in movement)の疼痛に関して、そして特に3日目に行われた注射に対応して、疼痛症状に対する記載された治療の顕著な正の効果を証明した。
当該研究は、伝統的な治療法と比較した、当該治療の実際の利益を決定するために臨床試験を実施する必要性で終わる。
しかしながら、投薬スケジュールによれば、わずか3週で6回も患者に投与されるという注射の痛みを考慮すると、指示された治療は服薬遵守の点で、高度に侵襲的であると考えられるべきであることに留意すべきである。
実際、上記の文書から明らかなように、今日でも、OAの治療における主な治療目的は、この病状に常に伴い、そして、罹患した患者の生活の質に重要である、疼痛症状の管理および軽減であり、それは、可能な限り侵襲的でない治療的アプローチを通して、うまくいけば達成される目標である。
したがって、本研究は、高い患者のコンプライアンスを保証しつつ、OAの治療における、そして、特に、OAの疼痛症状の治療において、特異な効果を示す、新しい薬、または、既知の薬剤の、新規投薬量および/または治療体系を特定することを常に目的とする。
したがって、本発明の目的は、同時に、効果的で安全であって、および患者にとって満足な服薬遵守を持つ、OAの治療のための、そして、特に、OAの疼痛症状の治療のために、新たな治療選択肢を提供することである。
本発明の発明者らは、驚くべきことに、5から40mgのクロドロン酸ナトリウム、または、相当量のクロドロン酸または、他の薬学的に許容されるその塩を含む医薬組成物が、月1回、または隔週1回、または週1回、単位剤形として、関節内投与によって、変形性関節症(OA)の治療に用いることができることを見出した。
特に、単位剤形の形態の前記組成物は、変形性関節症(OA)の疼痛症状の治療を可能にした。
本発明によって、発明者らは、5から40mgのクロドロン酸ナトリウム、または、相当量のクロドロン酸または、他のその塩を含む、単位剤形を、月1回、隔週1回、または週1回、好ましくは、毎月、関節内投与の検証した可能性と有効性のおかげで、変形性関節症(OA)の治療、そして、特に、OA疼痛症状における、治療的アプローチの新しいタイプを実証した。
本発明の使用のための医薬組成物の好ましい実施形態では、単位剤形で投与される前記組成物は、好ましくは、5から20mg、より好ましくは、8から20mgのクロドロン酸ナトリウム、または、相当量のクロドロン酸または、他のその塩、および所望により、適切な薬理学的に許容される賦形剤を含む。
さらに好ましい実施形態において、単位剤形の形態で使用される前記薬理学的組成物は、30から40mgのクロドロン酸ナトリウム、または、相当量のクロドロン酸または、他のその塩および好ましい賦形剤を含む。
別の局面において、本発明は、バイアル、瓶、カプール(carpule)、またはプレフィルドシリンジからなる群から選択された容器と、前記容器内に収容され、そして、5から40mgのクロドロン酸ナトリウム、または、相当量のクロドロン酸または、他のその塩および所望により適切な薬理学的に許容される賦形剤を含む組成物と、からなる単回投与医薬品に関する。
さらに別の態様では、本発明は、バイアル、瓶、カプール(carpule)、またはプレフィルドシリンジからなる群から選択される容器と、前記容器内に収容され、そして、5から40mgのクロドロン酸ナトリウム、または、相当量の対応するクロドロン酸または、他のその塩、および所望により、適切な薬理学的に許容される賦形剤の単位剤形を含む組成物とからなる、1~4個、好ましくは、1~2個、さらにより好ましくは、1個の単回投与医薬品を含むキットに関する。
したがって、本発明のキットは、変形関節症の患者の治療のための、月に1回、または隔週に1回、または週に1回、関節内に投与するための、単回使用医薬品を含む。
本発明者らはまた、380~420mOsm/Kg、好ましくは、385~415mOsm/Kgの浸透圧値を得るように配合された場合、高濃度のクロドロン酸ナトリウムを有する前記組成物が水溶液中で特に安定であることを示した。
したがって、さらに別の態様では、本発明は、5~40mg/mLのクロドロン酸ナトリウム、または相当量の対応するクロドロン酸もしくは他のその塩、および適切な賦形剤を含む水溶液の形態の医薬組成物に関し、当該組成物は、380~420mOsm/Kg、好ましくは、385~415mOsm/Kgの範囲の浸透圧値を有する。
したがって、本発明は、変形性関節症(OA)の治療に使用するための医薬組成物に関し、前記組成物は、5~40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩を含み、そして、前記組成物は、月に1回、隔週に1回、または週に1回、単位剤形の形態で関節内投与される。
本発明の目的において、用語「クロドロン酸ナトリウム、またはクロドロン酸、または、他のその塩」は、「非晶質」および「結晶」の両方、ならびに共結晶、ならびに無水物、水和物、および溶媒和物の形態の、すべてのそれらの多形形態を含むことが意図されている。
好ましくは、本発明の変形性関節症(OA)の治療に使用するための組成物は、変形性関節症(OA)の疼痛症状の治療に関する。
本発明の使用のための医薬組成物の好ましい実施形態において、当該組成物は、単位剤形で投与される場合、好ましくは、5~20mg、より好ましくは、8から20mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他のその塩を含み、そして、所望により、好ましい薬学上許容される賦形剤を含む。
さらなる好ましい実施形態では、単位剤形で使用するための前記医薬組成物は、30~40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他のその塩を含む。
好ましくは、全ての実施形態において、前記クロドロン酸ナトリウムは4水和物の形態である。
関節内投与に適した薬学的に許容される賦形剤は、例えば、pH調節剤、等張調節剤、安定化剤、キレート化剤、保存剤、および抗酸化剤である。
好ましいpH調整剤は、クエン酸、クエン酸ナトリウム、酢酸ナトリウム、ホウ酸、ホウ酸ナトリウム、重炭酸ナトリウム、リン酸およびそれらの塩、さらにより好ましくは、クエン酸およびクエン酸ナトリウム(クエン酸緩衝液)、および重炭酸ナトリウムである。
等張調節剤の中では、塩化ナトリウムまたはデキストロースが好ましい。
安定剤の中では、マンニトール、デキストラン、またはそれらの混合物が好ましい。
キレート化剤のうち、例えばEDTAナトリウム等の、EDTAまたはその塩が好ましい。
抗酸化剤のうち、ナトリウム メタビサルファイト、カリウム メタビサルファイト、亜硫酸水素ナトリウム、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、アスコルビン酸、およびアスコルビン酸ナトリウムが好ましい。
防腐剤の中では、ベンジルアルコール、メチルパラベン、およびプロピルパラベンが好ましい。
好ましい実施形態では、使用のための前記医薬組成物は、クロドロン酸ナトリウム、重炭酸ナトリウム、および塩化ナトリウムを含む。
さらに好ましい実施形態において、単位剤形の前記医薬組成物は、クロドロン酸ナトリウムの5~40mg、または相当量の対応するクロドロン酸、または他のその塩、重炭酸ナトリウム、クエン酸緩衝液、および塩化ナトリウムを含む。
好ましい有利な実施形態では、本発明の使用のための組成物は、月に1回、単位剤形の形態で、関節内に投与される。
さらに好適かつ有利な実施形態では、本発明の使用のための組成物は、隔週に1回、単位剤形の形態で、関節内に投与される。
さらに別の実施形態では、本発明の使用のための組成物は、週に1回、単位剤形の形態で、関節内に投与される。
好ましくは、本発明の組成物は、1~3mLの全容量、好ましくは約1mLの全容量の水溶液の形態である。
さらにより好ましくは、水溶液の形態の前記組成物は、3.5~5.5、好ましくは、4.0~5.0、さらにより好ましくは、4.3~4.7のpH値を有する。
上記の使用のための全ての医薬組成物は、特定の投与経路に関する当該技術分野において公知の方法によって調製することができる。
別の態様では、本発明は単回投与医薬に関する。
本発明の目的において、単回投与医薬品は、バイアル、ボトル、カープル、およびプレフィルドシリンジからなる群から選択され、および、5から40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他のその塩を含み、そして、所望により、薬学上許容される賦形剤の単位剤形を含む、組成物を含有する容器を意味する。
本発明の単回投与医薬品は、変形性関節症(OA)の治療に使用するために好ましいものであり、ここで、前記医薬品は、単位投与形態で、月に1回、または2週に1回、または週に1回、単位剤形の形態で、関節内経路により、投与される。
本発明の単回投与医薬品の組成物であって、そして、容器に含まれているものは、好ましくは、水溶液の状態の「ready for use」の形態である。
より好ましくは、前記水溶液は、1~3mL、好ましくは、約1mLに等しい容量を有する。
さらにより好ましくは、そのような水溶液は、1mLの体積中、クロドロン酸ナトリウムの30~40mgを含む、「ready for use」の水溶液である。
好ましくは、前記医薬品は毎月投与される。
医薬品は、本発明の使用のための組成物を含み得るので、当該組成物の全ての好ましい態様は、単回使用医薬品についても、同様に好ましい。
したがって、本発明は、変形性関節症の治療に使用するための単回投与医薬品に関し、該医薬品は、月1回関節内に投与される。
さらに別の態様では、本発明は、1~4個、好ましくは、1~2個、さらにより好ましくは、1個の本発明の単回投与医薬品を含むキットに関する。
本発明のキットは、変形性関節症(OA)の治療に使用するのに有利であり、そのために、それは、月1回、または隔週に1回、または週に1回、同じ医薬品を関節内に投与するための1~4個の数の単回使用医薬品を含む。
本発明のキットは、医薬、したがって本発明の組成物の、使用のための例示的な説明書を、好ましくは、含み得る。
組成物にとって、好ましいおよび有利であると同定されたすべての態様は、前記単回使用の医薬品を含むキット、すなわち、バイアル、ボトル、カープル、またはプレフィルドシリンジ、およびそれらのそれぞれの用途についても、同様に好ましくおよび有利であると考えられるべきであることを理解されたい。
更なる態様において、本発明は、最終的には、5から40mg/mLのクロドロン酸ナトリウム、または、相当量のクロドロン酸または他のその塩、および適切な賦形剤を含み、浸透圧値が380~420mOsm/Kg、好ましくは385~415mOsm/Kgの範囲の値を有する、水溶液の形態の医薬組成物に関する。
浸透圧値は、USPのチャプター275の、見出し「浸透圧および浸透圧」にしたがって決定された。
示された特定の範囲の値で浸透圧を調節するために使用できる賦形剤の中で、浸透圧調節剤として一般に知られている物質、特に注射用製剤に適したもの、例えば、デキストロース、マンニトールおよび塩化ナトリウム、好ましくは、塩化ナトリウムを使用できる。
本発明の実施形態の例は、例示的かつ非限定的な実施例として以下に与えられる。
実施例1
この試験は、クロドロン酸ナトリウムの高用量、特に、各単回投与あたり、40mg/mLの値までの投与の、OAの治療における有効性を実証することを目的とした。
OA誘導の実験モデルとして、MIA(ヨード酢酸モノナトリウム)の関節内投与を含むものを使用した。
MIAの関節内注射は、軟骨劣化および関節痛の研究を可能にする急性炎症のモデルを作り出す。
ラットはイソフルランと酸素の混合ガスによって麻酔し、そして、仰臥位に維持した。
膝蓋靭帯(infrapatellar ligament)が触れることによって識別されたら、関節をわずかに屈曲させながら、その領域の皮膚を剃った後、ヨード酢酸モノナトリウム(MIA)の単関節内注射を右膝に行った。
注射したMIAの量は、投与直前に測定したところでは、約4.5のpHを有する、生理食塩水50μLに溶解した1mgに等しかった。
かわりに、左膝の関節には、食塩溶液50μL単独を注射し、そしてこれは、内部コントロールとした。
治療は、クロドロン酸ナトリウムの、週1回、4週の投与を含み、フォローアップを1週間設けた。
この研究では、8つの処置群で、それぞれ、1群、10匹の雄Sprague Dawleyラットからなり、具体的には、それぞれ、0.1、0.5、1、1.5、および2mg/ラットに対応する、2、10、20、30、および40mg/mLとなる、クロドロネートの用量を試験した、OAラットからなる5つの処置群、および、残りの3群は、未処置のOAラット、オペレートされたが未処置のシャムラット、およびpH4.5でプラセボのみ投与したラットを示す。
処置期間中、動物は、体重の増加、摂食量、および一般的な健康状態に関して定期的にチェックした。
臨床的および血液学的分析は、試験の最後に行われた。
すべての観察群について、2つの炎症を起こした膝の浮腫の大きさの相違、骨代謝回転のマーカーとしてのCTX-1(I型コラーゲンのC-テロペプチド)の最終血清濃度、および軟骨代謝回転のマーカーとしてのCTX-II(II型コラーゲンのC-テロペプチド)の最終血清濃度を調べた。
結果-左右の膝の間の浮腫の大きさの違いの評価。
左右の膝の浮腫の大きさの差(Dで示され、そして、mmで表される)の測定は、デジタルキャリパー(Digi-maxスライドキャリパーW/LCD読み取りSigmaAldrich)を使用することによって、麻酔をかけられたラットで行われた。
以下の表1は、各観察群について得られた平均値を示す。
図1は、表1の値のグラフを示す。
それは明らかなように、クロドロン酸ナトリウムによる治療を受けているすべての観察群において、試験した全ての濃度で、浮腫の減少において、活性成分の、顕著なそして統計学的に有意な効果を確認することができた。
浮腫の低減における、特に驚くべき結果は、クロドロン酸ナトリウムの30mg/mLを含む溶液で処理されたグループに特に観察された。
したがって、これらの結果は、OAの治療において、2~40mg/mLのクロドロン酸ナトリウムを含む組成物を毎週投与することの有効性を実証している。
30mg/mLの濃度での、クロドロン酸ナトリウムの毎週の治療に特に有効であった。
結果-CTX-1の最終血清濃度値の評価
CTX-I(I型コラーゲンのC-テロペプチド)が、骨代謝回転のマーカーであり、その濃度レベルは、破骨細胞の活性に比例することを考慮すると、CTX-Iの最終血清濃度値の測定は、治療効果の尺度である。
したがって、CTX-1の値が大きいほど、進行中の骨分解活性が高く、したがって、それは明らかに破骨細胞の活性の低下を齎していないので、治療があまり効果的ではなかったことを示す。
以下の表2に結果を示し、未処置のOAラットの群と比較した、7つの処置群における、CTX-I濃度を、pg/mLとして表した。
図2は、表2の値のグラフを示す。
明らかなように、CTX-1の血清レベルの減少における、活性成分の顕著な有効性は、試験した全ての濃度で、クロドロン酸ナトリウムによる治療を受けた全ての観察群において確認することができた。
とりわけ、それは統計的観点からも非常に有意であった。
別の注目すべき観察は、用量依存性の有効性の傾向が少なくとも10mg/mLを超えて仮定され、30または40mg/mLのクロドロン酸ナトリウムを含む溶液の投与の場合に最良の効果が得られるという事実である。
したがって、これらの結果は、OAの治療における、クロドロン酸ナトリウムの、10~40mg/mL、そして、好ましくは、30~40mg/mLの範囲を含む組成物の毎週投与の有効性を実証する。
結果-CTX-11の最終血清濃度値の評価
CTX-II(II型コラーゲンのC-テロペプチド)は、軟骨代謝回転のマーカーであり、その濃度レベルは、
破骨細胞活性に比例し、CTX-IIの最終血清濃度値の測定は、治療の有効性の尺度である。
したがって、CTX-IIの値が大きいほど、継続的な骨分解活性が高く、したがって、それは明らかに破骨細胞活性の低下を許容しなかったので、その治療は、あまり効果的ではなかったことを示す。
以下の表3は、研究の終了時に、未処置のOAラットの群と比較した、7つの処置群における結果を示し、CTX-II濃度を、pg/mLで表した。
図3は、表3の値のグラフを示す。
それは明らかなように、CTX-IIの血清レベルの減少における、活性成分の顕著な効果は、クロドロン酸ナトリウムによる治療を受けているすべての観察群において、試験した全ての濃度で、確認することができた。
とりわけ、10mg/mLより高い濃度を有するすべての溶液で得られた結果は、統計的観点からもが非常に有意であることがわかった。
別の注目すべき観察は、観察パラメータに関して、この試験から得られた結果もまた、既に、2mg/mLのクロドロン酸ナトリウムを有する溶液から出発して、用量依存的な有効性の傾向を推定することを可能にし、この場合においても、30または40mg/mLのクロドロン酸ナトリウムを含む溶液の投与で、最良の効果が得られるという事実である。
したがって、これらの結果は、OAの治療において、10~40mg/mL、好ましくは、30~40mg/mLの範囲のクロドロン酸ナトリウムを含む組成物を毎週投与することの有効性を確認する。
結果-COMPの最終血清濃度値の評価
血清中のCOMPの高濃度の存在は、変形性関節症疾患の進行の指標であることを考えると、COMP(軟骨オリゴマー基質タンパク質、Cartilage Oligomeric Matrix Protein)の最終血清濃度の測定は治療効果の尺度である。
実際には、COMPは、II型コラーゲン線維の組み立てに調節機能を持っており、そして、他の基質タンパク質と一緒に、コラーゲン線維のネットワークを安定させるので、関節軟骨の形成と構造に基本的な役割を果たしているようである。
変形性関節症の間に、より多くの量のこのタンパク質が血中に見出され、それ故、血清中のより高い濃度のCOMPは、より進行した段階の変形性関節症変性に対応する。
以下の表4に結果を示し、未処置のOAラットの群と比較して、7つの処置群において、COMP濃度を、ng/mLとして表した。
図4は、表4の値のグラフを示す。
明らかなように、試験した全ての濃度において、クロドロン酸ナトリウムによる治療を受けている全ての観察群において、COMPの血清レベルの減少における活性成分の顕著な有効性を確認することができた。
特に、観測パラメータの低減に特に有効であることが証明された、40mg/mLの濃度で、クロドロン酸ナトリウムを含む溶液で処理することに対応して、実験は、統計的有意性に達した。
やはり、この試験でも得られた値は、少なくとも、10mg/mLの濃度のクロドロン酸ナトリウムを含む溶液について用量依存的な有効性の傾向を示し、この場合もまた、30または40mg/mLのクロドロン酸ナトリウム、および特に40mg/mLを含む溶液の場合に、最良の効果が得られた。
したがって、これらの結果もまた、OAの治療において、クロドロン酸ナトリウム10~40mg/mL、そして、好ましくは30から40mg/mLの範囲で、クロドロン酸ナトリウムを含む、組成物の毎週の投与の有効性を確認した。
本研究では、OAの影響を受けた、「スプラーグ・ドーリー“Sprague Dawley”」ラットのオスに、クロドロン酸ナトリウムを、毎月、関節内投与により行った治療の有効性を評価した。
治療は、毎月のクロドロン酸ナトリウムの投与4回、その後の1か月の追跡調査を伴った。
実験モデルでは、両後肢の両側前十字靭帯外科的切除(bilateral anterior cruciate ligament surgical resection in both hind limbs)によって、ラットにOAが誘発された。
投与直前に測定された、約4.5のpHを有する処理液の50μLの容量は、各膝の関節腔に注入された。
研究は、それぞれ10匹の雄ラットからなる5つの処置群、具体的には、0.4および0.6mg/ラットに対応する、8および12mg/mLのクロドロネート用量で試験した、OAラットからなる2つの処置群を含んだ。
残りの3つの群は、未処置のOAラット、手術はしたが、未処置のシャム・ラット、およびプラセボのみを投与されたラットであった。
-クロドロン酸ナトリウムの0mg/mLの用量(プラセボ):5.720mLの生理食塩水+0.5%重炭酸ナトリウムの0.280mL+18μLの1N HCl;
-8mg/mLの投与量:生理食塩水の5.760mLに溶解したクロドロン酸ナトリウム60mg+0.5%重炭酸ナトリウム0.240mL;
-12mg/mLの投与量:5.640mLの生理食塩水に溶解したクロドロン酸ナトリウム90mg+0.5%重炭酸ナトリウムの0.360mL
治療期間中、動物を定期的に、体重の増加、食物摂取および一般的な健康状態に関連してチェックした。
臨床的および血液学的分析は研究の終わりに行われた。
軟骨の品質は、マンキンの方法にしたがって、0(正常な軟骨)から15(深刻な損傷を受けた軟骨)までの範囲の観測された軟骨値に帰属することにより、および、組織形態計測(histomorphometric)測定によって軟骨領域を評価することにより、組織学的研究によって(through histological studies)調査した。
結果-病理組織学的(Histopathological)評価
組織学的検査は、修正Mankin Scoring System(Gerwinら、Osteoarthritis and Cartilage 18(2010)S24-S34; Kraus VBら、Osteoarthitis and Cartilage 18(Suppl 3)(2010)S24-S34)にしたがって、パラフィンに浸し、ヘマトキシリン-エオシン(H&E)、Masson Goldner Trichrome(細胞構造用)およびサフラニン-O-ファストグリーン(軟骨構造用)で染色した、右膝の前部切片(frontal sections)の5~7μm切片について行った。
この評価尺度によれば、その値は常に0(正常軟骨)と15(重傷軟骨)の間に含まれ、この指数の低い値は軟骨の健康状態がより高いことに対応する。
以下の表5は、各観察群について、5つの観察パラメータ(すなわち、関節軟骨構造、プロテオグリカン含有量、細胞性、タイドマークのインテグリティ(integrity of tidemark)、および骨棘(osteophytes)の有無とそのサイズに関連した追加の特徴)のそれぞれにスコアを割り当てることによって、手順にしたがって評価したマンキン指数の平均値を示す。
図5は、表5の値のグラフを示す。
明らかなように、クロドロン酸ナトリウムを用いた治療を受けた両群は、マンキン指標の低い値を示し、したがって、クロドロネートの作用に起因する、軟骨における正の効果を実証した。
この効果は、12mg/mLの用量で、特に、顕著であった。
したがって、これらの結果は、少なくとも8mg/mLに等しい投与量でのクロドロネート組成物の月1回投与の有効性を確認する。
使用したクロドロン酸ナトリウムの濃度が増加すると、有効性もまた、増加することが証明された。
結果-軟骨領域の組織形態計測的評価
軟骨領域の組織形態計測的定量的測定は、ウィンドウズ用のImage-Pro Plus 4.1ソフトウェア(Media Cybernetics、Maryland、USA)を用いて行った。
画像を、Zeiss Axioskop顕微鏡(2.5倍、光=5)およびJVCカラーカメラ(TK-1280E)で調べた。
各観察群について得られた結果を、下記表6に示す:
図6は、表6の値のグラフを示す。
明らかなように、クロドロン酸ナトリウムを用いた治療を受けた両群は、軟骨領域のより高い値を示し、したがって、クロドロネートの作用に起因する、軟骨における正の効果を実証した。
この効果は、8mg/mLの用量で、特に顕著な結果だった。
これらの結果はまた、少なくとも、8mg/mLに等しい投与量での、クロドロネート組成物の毎月の投与の有効性を確認した。
この研究において、14C-クロドロネートの薬物動態をした評価し、そして、shamおよび変形性関節症のラットモデルにおいて、2mg/mLの濃度の水溶液として投与された0.1mgの14C-クロドロネートの単回関節内注射に続いて、標識化合物の膝関節での局在化を確認した。
14C-クロドロネートの薬物動態パラメータを、注射時点からの異なる時点で、採取した血液試料の放射能を測定することによって決定した。
膝関節における標識化合物の局在化は、脚のX線によって決定された。
μCi/gで表される、放射能濃度のフィッティングは(fitting)、標準曲線を用いて行われた。
この研究は、変形性関節症のラットモデルにおいて、注射からわずか30分後に、放射能は、既に主に、関節軟骨にのみ、約40μCI/gの濃度で、局在化することを示す(滑液腔(synovial cavity)および大腿(femoral)骨と脛(tibial)骨の両方で見出される濃度は、1μCI/gよりも低い濃度であることと比較して)。
さらに、注射から数時間後、血液中の14C-クロドロネートの濃度は、既に非常に控えめで、実用上無視できる。
それ故、ほとんど独占的に軟骨に集中している放射能もまた、経時的に非常にゆっくりとした減少を示した。(72時間から開始して、値は安定する傾向があり、そして注射の168時間後(すなわち、注射の7日後)、依然として約25μCi/g(すなわち、注射の30分後に見い出した値の62%をまだ超えるに等しい)の放射能平均値を見出すことができた。)
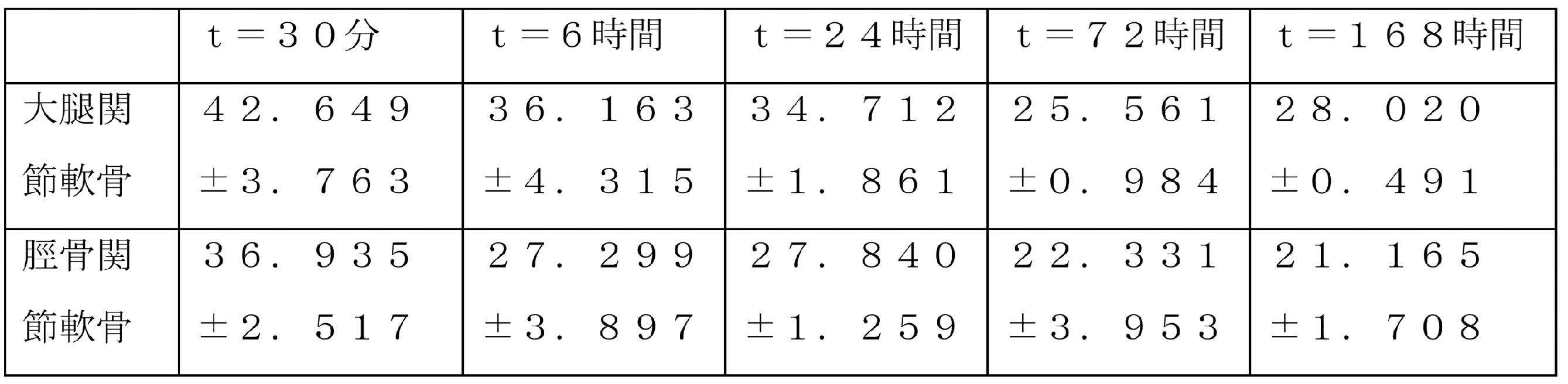
以下の表7は、14C-クロドロネートの関節内注射の時間から、異なる時点での、変形性関節症ラットの大腿および脛の軟骨で測定された放射能値を、μCi/gとして表現したものを示す。
したがって、この速度論的研究の結果は、軟骨に
対するクロドロネートの高い親和性を確認し、それは注射後1週間でさえも、その部位でかなり長い滞留時間をもたらし、大腿および脛骨関節軟骨の両方においてクロドロネートの高濃度を持続し、したがって、すくなくとも、週1回の薬物投与間隔の根拠を確認した。
さらに、注射後約2週間の時点で、一次指数関数曲線によって数学的に近似することができる、表7のデータは、μCi/gとして表したとき、大腿軟骨および脛骨軟骨の両方における14C-クロドロネートの濃度は、t=30分で測定された値より常に約40%高く、そして、特に、大腿関節軟骨に関しては、前記残留14C-クロドロネート濃度は、μCi/gとして表したとき、約18.92、すなわち、t=30分で測定された値の約44.36%に等しいことを指摘する。
驚くべきことに、注射後約1ヶ月で、14C-クロドロネートの軟骨中の濃度の残存値は、まだ両方の観測部位で有意に高かった。
大腿関節軟骨の特定の場合において、14C-クロドロネートの濃度の前記残留値は、μCi/gで表したとき、依然として、約8.78μCi/gに等しくさえあった(すなわち、30分で測定した値の約24.27%と依然として等しかった。したがって、依然として非常に顕著な残差値であった。)
したがって、これらのデータは、隔週または毎月の頻度であっても、薬を使用する可能性のさらなる証拠を提供する。
隔週または毎月、そして、好ましくは毎月、関節内に投与される、クロドロン酸ナトリウム、クロドロン酸または他のその塩の単位剤形の形態の組成物の使用は、そのような注射の固有の痛みを考えると、患者によって、より大きく受け入れられるので、特に有利であると考えられることは明らかである。
単回関節内注射で投与可能なクロドロネートの最大投与量を決定する目的で、オスおよびメスのSprague Dawleyラットの右膝に繰り返し投与した後の、クロドロン酸ナトリウムの関節内注射の局所許容性をこの研究で調べた。
5匹の雄ラットおよび5匹の雌ラットからなるグループは、それぞれ、クロドロン酸ナトリウム、4,14および40mg/mLを含む水溶液(0.2、0.7、2mg/ラットに対応)の関節内投与に供した。
各動物に、1週間に3回(月曜日、水曜日、および金曜日に)を続けて4週間、クロドロネートまたはプラセボの合計12回の関節内注射を行った。
高用量群と対照群については、主要群と同じ数の相対的な対照群も提供した。
治療期間中、動物を、体重の増加、食物摂取量および一般的な健康状態に関連して、定期的に確認した。研究の終了時に、クロドロン酸ナトリウムの治療に関連する、死亡率も、行動または臨床変化も記録しなかった。体重と摂餌量はすべての動物で正常であった。
試験終了時に、血液学的分析、化学・臨床分析、尿解析、および剖検を行った。
いかなる異常も、剖検検査で検出されなかった、そして白血球の分画(differential count)を用いた血液学的、および、尿の分析は、治療による、何らの変化も示さなかった。
最高用量を受けた雄では、クロドロン酸ナトリウムは、血清中のALPおよびALT値の有意な増加を特徴とする初期の肝臓の苦痛(suffering)状態のみを生じ、そして同じ群の女性では、電解質血清濃度の増加を伴うわずかな腎臓の苦痛(suffering)を生じさせた。
したがって、この研究の結果に基づいて、関節内反復投与はラットによって十分に許容され、そして、40mg/mLの用量は最大耐量(MTD)であり、14mg/mLの中間用量は、代わりに、NOAEL用量(副作用が観察されないレベル)と見なすことができると合理的に結論付けることができた。
このように、この研究は、単回投与で、40mg/mLまでのクロドロン酸ナトリウムを含む組成物を投与する可能性を確認した。
したがって、実施し、そして、上記した研究のおかげで、本発明者らは、クロドロン酸ナトリウムの高い単位剤形、好ましくは5~40mgの間の単位剤形は、毎週、隔週、または毎月、関節内に投与された場合、OAの治療または処置に、特に有効であることを、驚き見出した。
本発明の目的のために、前記組成物は好ましくは毎月投与される。
本発明の特定の組成物を、4水和物の形態で、クロドロン酸ナトリウムを含む、その製剤処方(quali-quantitative)の組成およびpH、浸透圧、および濃度値を以下の表8に示す、毎週、隔週または毎月の投与のための水溶液の形態で、単位剤形にて調製した。
表から明らかなように、製造した全ての組成物が、特に高い浸透圧値を有していた。
浸透圧(Osmolalities)は、GONOTEC 浸透圧計、OSMOMAT 3000-Dモデルのシリアル番号3000150264により、USPのチャプター785のタイトル「Osmolality and Osmolarity」の記載にしたがって、決定された。
前記製剤は、下記3つの特定の条件下、ICHガイドラインにしたがって安定性試験に供した:
25℃±2°C/60%RH±5%RH(長期条件)、
30℃±2°C/65%RH±5%RH(中間条件)、および
40℃±2°C/75%RH±5%RH(加速条件)。
3ヶ月のコンディショニングの後、以下のパラメータを評価した:溶液の外観、色、および透明度、pH、粒子状物質の量、クロドロン酸ナトリウムの濃度、ならびにあらゆるリン酸塩濃度および他の分解生成物。
加速試験条件下でさえも、すべての測定されたパラメータが仕様に適合していることがわかった。
安定性試験は、したがって、驚くべきことに、前記水溶液が、380~420mOsm/Kgを含む浸透圧値を有するとき、クロドロン酸ナトリウムの高い濃度で、特に、5~40mg/mLを含む濃度で、安定な水溶液の処方の可能性を確認した。
したがって、本発明者らは、本発明によって、5~40mgの範囲のクロドロン酸ナトリウム、または相当量のクロドロン酸、または他のその塩、および適当な賦形剤を、週に1回、隔週に1回、または、月に1回、そして好適には毎月投与されるべき単位剤形の関節内投与による検証された可能性および有効性のおかげで、変形性関節症(OA)、特に、OAの疼痛症状の治療および処置のための、新しいタイプの治療アプローチが、今日利用可能であることを実証した。
本発明者らは、また、380~420mOsm/Kgで、好ましくは385~415mOsm/Kgを含む、浸透圧値を得られるように、製剤化した場合、クロドロン酸ナトリウムの高濃度を有する前記組成物は、水溶液中で特に安定であることを実証した。
したがって、本発明によれば、前記組成物で予め充填された、または、水溶液の形態の、バイアル、ボトル、カープルおよび単回投与シリンジを、製造することが可能である。
好ましくは、医薬の単位剤形を含む、バイアル、ボトル、カープル(carpules)およびプレフィルド単回投与シリンジは、変形性関節症(OA)の影響を受けている患者、特に、疼痛症状の治療のために、関節内経路による、毎月、隔週または毎週投与することができる。
好ましくは、前記バイアル、ボトル、カープルまたはプレフィルドシリンジは、それらを1、2、または4個含むキットの形態で市販され得る。
Claims (20)
- 変形性関節症(OA)の治療での使用のための組成物であって、前記組成物は、5~40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩を含み、そして、前記組成物は、月に1回、関節内投与される単位剤形の形態である、組成物。
- 前記治療が、変形性関節症(OA)の疼痛症状の治療である、請求項1に記載の使用のための組成物。
- 前記組成物が、5~20mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩を含む、請求項1または2に記載の使用のための組成物。
- 前記組成物が、8~20mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩を含む、請求項3に記載の使用のための組成物。
- 前記組成物が、30~40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩を含む、請求項1または2に記載の使用のための組成物。
- 前記クロドロン酸ナトリウムが四水和物の形態である、請求項1~5のいずれか一項に記載の使用のための組成物。
- 単位剤形の形態の前記組成物が、水溶液の形態である、請求項1~6のいずれか一項に記載の使用のための組成物。
- 水溶液の形態である前記組成物が1~3mLの体積を有する、請求項7に記載の使用のための組成物。
- 水溶液の形態である前記組成物が1mLに等しい体積を有する、請求項7に記載の使用のための組成物。
- 水溶液の形態である前記組成物が、3.5~5.5のpH値を有する、請求項7~9のいずれか一項に記載の使用のための組成物。
- 水溶液の形態である前記組成物が、4.0~5.0のpH値を有する、請求項10に記載の使用のための組成物。
- 水溶液の形態である前記組成物が、4.3~4.7のpH値を有する、請求項10に記載の使用のための組成物。
- 変形性関節症(OA)の治療での使用のための単回投与医薬品であって、
バイアル、ボトル、カープル(carpule)、およびプレフィルドシリンジからなる群から選択される容器と、
該容器に含まれ、そして、5~40mgのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩、および、所望により、薬学的に許容される賦形剤を含む組成物と、
からなり、
月に1回、関節内投与される単位剤形の形態である、単回投与医薬品。 - 単回投与医薬品の組成物が、「すぐに使用できる」水溶液の形態である、請求項13に記載の使用のための単回投与医薬品。
- 前記水溶液が、1~3mLの体積を有する、請求項14に記載の使用のための単回投与医薬品。
- 前記水溶液が、1mLに等しい体積を有する、請求項15に記載の使用のための単回投与医薬品。
- 単回投与医薬品の組成物が、1mLの容量に、30~40mgのクロドロン酸ナトリウムを含む、「すぐに使用できる」水溶液の形態である請求項13~16のいずれか一項に記載の使用のための単回投与医薬品。
- 5~40mg/mLのクロドロン酸ナトリウム、または相当量のクロドロン酸、または他の薬学的に許容されるその塩、および、賦形剤を含む、水溶液の形態である医薬組成物であって、そして、380から420mOsm/Kgの範囲の浸透圧値(osmolality value)を有する、水溶液の形態の、変形性関節症(OA)の治療での使用のための医薬組成物であって、前記医薬組成物は、月に1回、関節内投与される単位剤形の形態である、医薬組成物。
- 前記浸透圧値が385から415mOsm/Kgの範囲である請求項18に記載の使用のための医薬組成物。
- 賦形剤が塩化ナトリウムである、請求項18または19に記載の使用のための医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IT102016000123773 | 2016-12-06 | ||
| IT102016000123773A IT201600123773A1 (it) | 2016-12-06 | 2016-12-06 | Composizione per il trattamento dell’osteoartrosi |
| PCT/IB2017/057685 WO2018104879A1 (en) | 2016-12-06 | 2017-12-06 | Composition for the treatment of osteoarthritis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020502265A JP2020502265A (ja) | 2020-01-23 |
| JP7184792B2 true JP7184792B2 (ja) | 2022-12-06 |
Family
ID=58545064
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019549671A Active JP7184792B2 (ja) | 2016-12-06 | 2017-12-06 | 変形性関節症の治療のための組成物 |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US11123354B2 (ja) |
| EP (1) | EP3551190B1 (ja) |
| JP (1) | JP7184792B2 (ja) |
| KR (1) | KR20190093616A (ja) |
| CN (1) | CN110167561A (ja) |
| AR (1) | AR110319A1 (ja) |
| AU (1) | AU2017371736A1 (ja) |
| BR (1) | BR112019011418A2 (ja) |
| CA (1) | CA3046116A1 (ja) |
| CL (1) | CL2019001507A1 (ja) |
| EA (1) | EA201991381A1 (ja) |
| ES (1) | ES2990150T3 (ja) |
| HU (1) | HUE069500T2 (ja) |
| IL (1) | IL267059A (ja) |
| IT (1) | IT201600123773A1 (ja) |
| MX (1) | MX393290B (ja) |
| PL (1) | PL3551190T3 (ja) |
| PT (1) | PT3551190T (ja) |
| SG (1) | SG10202105882PA (ja) |
| WO (1) | WO2018104879A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4450062A1 (en) * | 2023-04-20 | 2024-10-23 | Abiogen Pharma S.p.A. | Composition for the treatment of osteoarthrosis |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009522218A (ja) | 2005-12-29 | 2009-06-11 | アビオゲン ファルマ ソシエタ ペル アツィオーニ | 変形性骨関節炎の治療のための医薬処方物 |
| JP2016132669A (ja) | 2015-01-20 | 2016-07-25 | デピュイ・シンセス・プロダクツ・インコーポレイテッド | 関節を治療するための組成物及び方法 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1187828B (it) * | 1985-05-24 | 1987-12-23 | Gentili Ist Spa | Composizione farmaceutica a base di difosfonati per il trattamento dell aretrosi |
| DE4228552A1 (de) * | 1992-08-27 | 1994-03-03 | Boehringer Mannheim Gmbh | Diphosphonsäuren und deren Salze enthaltende Arzneimittel |
| EP1136069A1 (en) * | 2000-03-21 | 2001-09-26 | SPA SOCIETA' PRODOTTI ANTIBIOTICI S.p.A. | Pharmaceutical compositions containing clodronates for high local tolerance intramuscular administration |
| KR101102364B1 (ko) * | 2009-09-18 | 2012-01-03 | 한림제약(주) | 비스포스포네이트 유도체 및 고용량의 콜레칼시페롤을 포함하는 약학 조성물 |
| ITMI20120393A1 (it) * | 2012-03-14 | 2013-09-15 | Tiberio Bruzzese | Formulazioni acquose di bisfosfonati, vitamina d e alcol benzilico adatte all'uso intramuscolare o sottocutaneo |
-
2016
- 2016-12-06 IT IT102016000123773A patent/IT201600123773A1/it unknown
-
2017
- 2017-12-06 US US16/467,207 patent/US11123354B2/en active Active
- 2017-12-06 CN CN201780082990.XA patent/CN110167561A/zh active Pending
- 2017-12-06 WO PCT/IB2017/057685 patent/WO2018104879A1/en not_active Ceased
- 2017-12-06 ES ES17825933T patent/ES2990150T3/es active Active
- 2017-12-06 AU AU2017371736A patent/AU2017371736A1/en not_active Abandoned
- 2017-12-06 KR KR1020197019548A patent/KR20190093616A/ko not_active Ceased
- 2017-12-06 EA EA201991381A patent/EA201991381A1/ru unknown
- 2017-12-06 AR ARP170103414A patent/AR110319A1/es unknown
- 2017-12-06 HU HUE17825933A patent/HUE069500T2/hu unknown
- 2017-12-06 PL PL17825933.9T patent/PL3551190T3/pl unknown
- 2017-12-06 SG SG10202105882PA patent/SG10202105882PA/en unknown
- 2017-12-06 JP JP2019549671A patent/JP7184792B2/ja active Active
- 2017-12-06 MX MX2019006548A patent/MX393290B/es unknown
- 2017-12-06 BR BR112019011418-1A patent/BR112019011418A2/pt not_active IP Right Cessation
- 2017-12-06 PT PT178259339T patent/PT3551190T/pt unknown
- 2017-12-06 EP EP17825933.9A patent/EP3551190B1/en active Active
- 2017-12-06 CA CA3046116A patent/CA3046116A1/en active Pending
-
2019
- 2019-06-03 IL IL267059A patent/IL267059A/en unknown
- 2019-06-03 CL CL2019001507A patent/CL2019001507A1/es unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009522218A (ja) | 2005-12-29 | 2009-06-11 | アビオゲン ファルマ ソシエタ ペル アツィオーニ | 変形性骨関節炎の治療のための医薬処方物 |
| JP2016132669A (ja) | 2015-01-20 | 2016-07-25 | デピュイ・シンセス・プロダクツ・インコーポレイテッド | 関節を治療するための組成物及び方法 |
Non-Patent Citations (1)
| Title |
|---|
| Rheumatology,2008年,48(7),773-778 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20200061088A1 (en) | 2020-02-27 |
| HUE069500T2 (hu) | 2025-03-28 |
| IL267059A (en) | 2019-08-29 |
| BR112019011418A2 (pt) | 2019-11-19 |
| JP2020502265A (ja) | 2020-01-23 |
| WO2018104879A1 (en) | 2018-06-14 |
| CN110167561A (zh) | 2019-08-23 |
| EA201991381A1 (ru) | 2019-11-29 |
| PL3551190T3 (pl) | 2024-12-23 |
| MX2019006548A (es) | 2019-10-07 |
| KR20190093616A (ko) | 2019-08-09 |
| IT201600123773A1 (it) | 2018-06-06 |
| SG10202105882PA (en) | 2021-07-29 |
| AU2017371736A1 (en) | 2019-07-25 |
| CA3046116A1 (en) | 2018-06-14 |
| US11123354B2 (en) | 2021-09-21 |
| EP3551190A1 (en) | 2019-10-16 |
| EP3551190B1 (en) | 2024-08-14 |
| ES2990150T3 (es) | 2024-11-29 |
| MX393290B (es) | 2025-03-24 |
| AR110319A1 (es) | 2019-03-20 |
| CL2019001507A1 (es) | 2019-11-15 |
| PT3551190T (pt) | 2024-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12370241B2 (en) | Nasal powder formulation for treatment of hypoglycemia | |
| EP0433817B1 (en) | Combined anti-inflammatory agent | |
| WO2012060719A1 (en) | A combination composition | |
| US20240293514A1 (en) | Pharmaceutical compositions comprising glp-1r agonists | |
| US20210145850A1 (en) | Composition, for osteoarthritis treatment, comprising hydrophilized sulfasalazine and hyaluronic acid and method for preparing same | |
| JP7184792B2 (ja) | 変形性関節症の治療のための組成物 | |
| KR102285724B1 (ko) | Dna 단편 혼합물 및 히알루론산을 포함하는 연골 재생용 조성물 | |
| DE3802357A1 (de) | Parenterale suspensionen | |
| Katsumi et al. | Absorption and safety of alendronate, a nitrogen-containing bisphosphonate, after intrapulmonary administration in rats | |
| JP2018509398A5 (ja) | ||
| ES2211594T3 (es) | Medicamentos que contienen acido pantotenico para el tratamiento de enfermedades inflamatorias de las articulaciones. | |
| JP2788340B2 (ja) | 炎症治療剤 | |
| JP2007224030A (ja) | 黄斑変性および関連する眼の症状の治療方法 | |
| EP4108252A1 (en) | Pharmaceutical compositions comprising glp-1r agonists | |
| EA013616B1 (ru) | Инъекционные препараты диклофенака и его фармацевтически приемлемых солей | |
| US20200289622A1 (en) | Teriparatide-containing liquid pharmaceutical composition having excellent pharmacokinetics and/or safety | |
| US20190328755A1 (en) | Methods of treating complex regional pain syndrome (crps) or symptoms comprising administration of neridronic acid | |
| US20140235545A1 (en) | The use of HCV immunogenic peptide or a derivative thereof in the prevention or treatment of arthritis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201111 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210907 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211206 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220412 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220810 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20220810 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20220823 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220823 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20220909 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220913 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221101 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221124 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7184792 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |