JP7150707B2 - マイクロドロップを処理するためのマイクロ流体方法 - Google Patents
マイクロドロップを処理するためのマイクロ流体方法 Download PDFInfo
- Publication number
- JP7150707B2 JP7150707B2 JP2019517429A JP2019517429A JP7150707B2 JP 7150707 B2 JP7150707 B2 JP 7150707B2 JP 2019517429 A JP2019517429 A JP 2019517429A JP 2019517429 A JP2019517429 A JP 2019517429A JP 7150707 B2 JP7150707 B2 JP 7150707B2
- Authority
- JP
- Japan
- Prior art keywords
- microdrops
- microdrop
- trapping
- zone
- capture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 139
- 238000012545 processing Methods 0.000 title description 5
- 210000004027 cell Anatomy 0.000 claims description 86
- 239000012530 fluid Substances 0.000 claims description 55
- 239000007788 liquid Substances 0.000 claims description 40
- 150000001875 compounds Chemical class 0.000 claims description 31
- 239000003814 drug Substances 0.000 claims description 17
- 229940079593 drug Drugs 0.000 claims description 14
- 229920000936 Agarose Polymers 0.000 claims description 13
- 238000005259 measurement Methods 0.000 claims description 13
- 210000003494 hepatocyte Anatomy 0.000 claims description 10
- 238000001574 biopsy Methods 0.000 claims description 7
- 239000013543 active substance Substances 0.000 claims description 6
- 206010028980 Neoplasm Diseases 0.000 claims description 4
- 201000011510 cancer Diseases 0.000 claims description 4
- 239000008177 pharmaceutical agent Substances 0.000 claims description 4
- 231100000419 toxicity Toxicity 0.000 claims description 4
- 230000001988 toxicity Effects 0.000 claims description 4
- 210000004881 tumor cell Anatomy 0.000 claims description 4
- 238000011068 loading method Methods 0.000 claims description 2
- 230000003833 cell viability Effects 0.000 claims 1
- 230000004927 fusion Effects 0.000 description 50
- 239000002609 medium Substances 0.000 description 26
- 239000000499 gel Substances 0.000 description 20
- 102000004169 proteins and genes Human genes 0.000 description 17
- 108090000623 proteins and genes Proteins 0.000 description 17
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 16
- 230000015572 biosynthetic process Effects 0.000 description 16
- 239000011159 matrix material Substances 0.000 description 13
- 238000006243 chemical reaction Methods 0.000 description 12
- 239000000017 hydrogel Substances 0.000 description 12
- 239000003086 colorant Substances 0.000 description 11
- 238000002425 crystallisation Methods 0.000 description 9
- 230000008025 crystallization Effects 0.000 description 9
- 239000004094 surface-active agent Substances 0.000 description 9
- 241000894006 Bacteria Species 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 239000003921 oil Substances 0.000 description 8
- 229960005489 paracetamol Drugs 0.000 description 8
- 238000004113 cell culture Methods 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 210000004962 mammalian cell Anatomy 0.000 description 7
- 230000004048 modification Effects 0.000 description 7
- 238000012986 modification Methods 0.000 description 7
- 238000001879 gelation Methods 0.000 description 6
- 238000004062 sedimentation Methods 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 238000013459 approach Methods 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 238000004611 spectroscopical analysis Methods 0.000 description 5
- 238000011144 upstream manufacturing Methods 0.000 description 5
- 230000035899 viability Effects 0.000 description 5
- GRJRKPMIRMSBNK-UHFFFAOYSA-N 3,3,4,4,5,5,6,6,7,7,8,8,8-tridecafluorooctan-1-ol Chemical compound OCCC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F GRJRKPMIRMSBNK-UHFFFAOYSA-N 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 4
- 102000012422 Collagen Type I Human genes 0.000 description 4
- 108010022452 Collagen Type I Proteins 0.000 description 4
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 4
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 4
- 238000001069 Raman spectroscopy Methods 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 229940088710 antibiotic agent Drugs 0.000 description 4
- 229920001436 collagen Polymers 0.000 description 4
- 230000000875 corresponding effect Effects 0.000 description 4
- 210000002744 extracellular matrix Anatomy 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 238000003384 imaging method Methods 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 238000004861 thermometry Methods 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 238000004448 titration Methods 0.000 description 4
- HHBBIOLEJRWIGU-UHFFFAOYSA-N 4-ethoxy-1,1,1,2,2,3,3,4,5,6,6,6-dodecafluoro-5-(trifluoromethyl)hexane Chemical compound CCOC(F)(C(F)(C(F)(F)F)C(F)(F)F)C(F)(F)C(F)(F)C(F)(F)F HHBBIOLEJRWIGU-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000004737 colorimetric analysis Methods 0.000 description 3
- 230000000368 destabilizing effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000033001 locomotion Effects 0.000 description 3
- 238000011275 oncology therapy Methods 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 230000000717 retained effect Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000003068 static effect Effects 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 102000016359 Fibronectins Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102000051325 Glucagon Human genes 0.000 description 2
- 108060003199 Glucagon Proteins 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 238000003491 array Methods 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000013626 chemical specie Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000004581 coalescence Methods 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 238000004945 emulsification Methods 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000005558 fluorometry Methods 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 2
- 229960004666 glucagon Drugs 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 210000004153 islets of langerhan Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 108010082117 matrigel Proteins 0.000 description 2
- 230000003278 mimic effect Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 230000003076 paracrine Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000005316 response function Methods 0.000 description 2
- 239000013049 sediment Substances 0.000 description 2
- 238000004088 simulation Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- YRMCBQLZVBXOSJ-PCFSSPOYSA-N (e)-3-[(6r,6as)-4-hydroxy-6-methoxy-3-methyl-11-oxo-5,6,6a,7-tetrahydropyrrolo[2,1-c][1,4]benzodiazepin-8-yl]prop-2-enamide Chemical compound CO[C@H]1NC2=C(O)C(C)=CC=C2C(=O)N2C=C(\C=C\C(N)=O)C[C@@H]12 YRMCBQLZVBXOSJ-PCFSSPOYSA-N 0.000 description 1
- IPJDHSYCSQAODE-UHFFFAOYSA-N 5-chloromethylfluorescein diacetate Chemical compound O1C(=O)C2=CC(CCl)=CC=C2C21C1=CC=C(OC(C)=O)C=C1OC1=CC(OC(=O)C)=CC=C21 IPJDHSYCSQAODE-UHFFFAOYSA-N 0.000 description 1
- 240000001980 Cucurbita pepo Species 0.000 description 1
- 235000009852 Cucurbita pepo Nutrition 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000003376 axonal effect Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 239000011549 crystallization solution Substances 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000003113 dilution method Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000007877 drug screening Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000002073 fluorescence micrograph Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000000989 food dye Substances 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 238000011337 individualized treatment Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000005320 surfactant adsorption Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- 239000002691 unilamellar liposome Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/302—Micromixers the materials to be mixed flowing in the form of droplets
- B01F33/3021—Micromixers the materials to be mixed flowing in the form of droplets the components to be mixed being combined in a single independent droplet, e.g. these droplets being divided by a non-miscible fluid or consisting of independent droplets
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/3035—Micromixers using surface tension to mix, move or hold the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502769—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements
- B01L3/502784—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements specially adapted for droplet or plug flow, e.g. digital microfluidics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
- B01L2200/0668—Trapping microscopic beads
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0673—Handling of plugs of fluid surrounded by immiscible fluid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0893—Geometry, shape and general structure having a very large number of wells, microfabricated wells
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0688—Valves, specific forms thereof surface tension valves, capillary stop, capillary break
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Dispersion Chemistry (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Hematology (AREA)
- Clinical Laboratory Science (AREA)
- Physics & Mathematics (AREA)
- Fluid Mechanics (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Physical Or Chemical Processes And Apparatus (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
- Mixers With Rotating Receptacles And Mixers With Vibration Mechanisms (AREA)
- Extraction Or Liquid Replacement (AREA)
Description
この目的のために、本発明の第1の態様によれば、本発明は、第1の捕捉ゾーンと第2の捕捉ゾーンとを有するキャピラリトラップを備えるマイクロ流体システムにおいて少なくとも1つの第1のマイクロドロップおよび少なくとも1つの第2のマイクロドロップを操作する方法であって、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップと、からなるステップを含み、
第1および第2の捕捉ゾーンは、第1のマイクロドロップおよび第2のマイクロドロップが互いに接触するように配置され、
第1および第2の捕捉ゾーンは、第1および第2の捕捉ゾーンによって同一の第1または第2の液体マイクロドロップに及ぼされ得る捕捉力が異なるように構成されている、方法を提案する。
好ましくは、第1のマイクロドロップは、第2の捕捉ゾーンによって第1のマイクロドロップに及ぼされる捕捉力より大きい捕捉力で第1の捕捉ゾーン内に捕捉される。したがって、第1のマイクロドロップは、第1の捕捉ゾーンによって捕捉されるのが好ましい。
‐マイクロ流体システムを流れる流体の配向された流れ。特に、マイクロドロップシステムは、流体の配向された流れによってマイクロ流体システム内を移動させることができ、マイクロドロップは、好ましくは、非混和性であり、流体の流れは、特に、第1のマイクロドロップが第1の捕捉ゾーンによってのみ捕捉されるような流量および方向を有する。移動する流体が第1のドロップに及ぼす力は、第1のドロップが第2の捕捉ゾーンに捕捉されることを防止する。
‐第1のマイクロドロップが自体の重量によってマイクロ流体システムの傾斜に沿って動かされる重力。したがって、マイクロ流体システムの傾斜に起因する第1のマイクロドロップが第1の捕捉ゾーンに到達する速度に応じて、第1のマイクロドロップは第1の捕捉ゾーンによって保持されるかまたは保持されない。
‐第1のマイクロドロップの表面張力を最小にする傾向。特に、マイクロ流体システムは、第1のマイクロドロップを動かす起伏、特にキャピラリトラップに向かってより広がる溝を含むことができる。
‐キャピラリトラップの第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップであって、第1のマイクロドロップが第1のゾーンに捕捉され続けるように、第1のゾーンによって第1のマイクロドロップに及ぼされる捕捉力F4が、流れ(すなわち、マイクロドロップを運ぶ流体の配向された流れ)によって第1のマイクロドロップに及ぼされる流体力学的抗力Ft4より大きく、抗力Ft4がF4とF5との間にあり、F5がキャピラリトラップの第2の捕捉ゾーンによって第1のマイクロドロップに及ぼされる捕捉力を表す、ステップと、
‐次いで、キャピラリトラップの第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、第2のゾーンに第2のマイクロドロップを装填する間に、流れによって第2のマイクロドロップに及ぼされる流体力学的抗力Ft5がF5とF3との間にあり、F3が好ましくはF4未満であり、F3がキャピラリトラップの第2のゾーンによって第2のマイクロドロップに及ぼされる捕捉力である、ステップと、
を含む。
好ましくは、第1の捕捉ゾーンが第1のマイクロドロップに及ぼす捕捉力は、それが第2のマイクロドロップに及ぼす捕捉力とは異なり、第2の捕捉ゾーンが第2のマイクロドロップに及ぼす捕捉力は、それが第1のマイクロドロップに及ぼす捕捉力とは異なる。実際、捕捉力は捕捉ゾーンの形状と関連して捕捉されるマイクロドロップの形状にも依存する。これにより、第1および第2のマイクロドロップの順次の捕捉が容易になる。
第2の捕捉ゾーンは、1つまたは複数の第2のマイクロドロップを捕捉することができる。
‐上から見た捕捉されたときの第1のマイクロドロップの最大寸法は、上から見た第1の捕捉ゾーンの最大寸法と同等またはそれより大きく、かつ/または
‐上から見た捕捉されたときの第2のマイクロドロップの最大寸法は、上から見た第2の捕捉ゾーンの最大寸法と同等またはそれより大きく、かつ/または
‐捕捉されたときに、第1のマイクロドロップは、第1の捕捉ゾーンの体積の少なくとも70%、より好ましくは80%、さらに好ましくは90%を満たし、かつ/または
‐捕捉されたときに、第2のマイクロドロップは、第2の捕捉ゾーンの体積の少なくとも70%、より好ましくは80%、さらに好ましくは90%を満たし、かつ/または
‐捕捉されたときに、第1のマイクロドロップの体積は、第1の捕捉ゾーンの体積と同等またはそれより大きいため、第1のマイクロドロップは第1の捕捉ゾーンの外側に部分的に広がり、かつ/または
‐捕捉されたときに、第2のマイクロドロップの体積は、第2の捕捉ゾーンの体積と同等またはそれより大きいため、第2のマイクロドロップは第2の捕捉ゾーンの外側に部分的に広がる。
キャピラリトラップは複数の第2の捕捉ゾーンを含むことができ、ステップ(ii)は、第2の捕捉ゾーン当たり1つの第2のマイクロドロップを捕捉することからなり、第1および第2の捕捉ゾーンは、第2のマイクロドロップの各々が第1または第2のマイクロドロップの少なくとも1つと接触するように配置される。
「結合されている」とは、各第2のマイクロドロップが、前記第1のマイクロドロップと直接接触しているか、または前記第1のマイクロドロップとそれ自体が接触している別の第2のマイクロドロップもしくは一連の第2および/または第1のマイクロドロップと接触していることを意味する。
第2のマイクロドロップは全て、前記キャピラリトラップに捕捉された少なくとも1つの第1のマイクロドロップと接触していてもよい。
変形例として、キャピラリトラップの全ての第2の捕捉ゾーンは同一である。
マイクロ流体システムは、各々が第1の捕捉ゾーンと第2の捕捉ゾーンとを含む複数のキャピラリトラップを備えてよく、ステップ(i)は、各キャピラリトラップの第1の捕捉ゾーンに第1のマイクロドロップを捕捉することからなり、ステップ(ii)は、各キャピラリトラップの第2の捕捉ゾーンに第2のマイクロドロップを捕捉することからなり、複数のキャピラリトラップの各キャピラリトラップの第1および第2の捕捉ゾーンは、前記キャピラリトラップに捕捉された第1および第2のマイクロドロップが互いに接触するように配置される。
各キャピラリトラップは、上述の特徴のうちの1つ以上を含み得る。
ステップ(ii)は、第1の方向を有する流体の流れの影響下で、第2の捕捉ゾーンのうちの1つまたはいくつかに第2のマイクロドロップを捕捉することからなるサブステップ(ii’)と、第2の方向を有する流体の流れの影響下で、第2の捕捉ゾーンの別の1つまたはいくつかに第2のマイクロドロップを捕捉することからなるサブステップ(ii’’)とを含み得、第1および第2の流体の流れは異なる方向である。
本方法は、第1のマイクロドロップと、第2の捕捉ゾーンまたはそれらの各々に捕捉された第2のマイクロドロップまたはそれらの各々とを融合することからなるステップ(iii)を含み得る。このような融合は、特に、2つのマイクロドロップの内容物を混合することを可能にする。
変形例として、ステップ(iii)は、キャピラリトラップの外側の第2の捕捉ゾーンに捕捉された1つまたは少なくとも1つの第2のマイクロドロップを移動させることからなる。ステップ(iii’)は、1つまたは複数の第2のマイクロドロップに、第2の捕捉ゾーンの捕捉力よりも大きい連行力を及ぼすように構成された流体の方向を有する流れを印加することからなり得、前記流体の流れは、1つまたは複数の第1のマイクロドロップに第1の捕捉ゾーンの捕捉力と同等またはそれ未満の連行力を及ぼすように構成されているため、1つまたは複数の第1のマイクロドロップは第1の捕捉ゾーンに捕捉されたままである。
この方法は、ステップ(iii)または(iii’)の後に、第1および第3のマイクロドロップが互いに接触するように、第2のマイクロドロップをもはや有しない1つまたは複数の第2の捕捉ゾーンに第3のマイクロドロップを捕捉することからなるステップ(v)を含み得る。第3のマイクロドロップは、第2のマイクロドロップと同一でも異なっていてもよい。第2のマイクロドロップについて上述したように、第3のマイクロドロップは、第1の捕捉ゾーン内に捕捉されたマイクロドロップと融合されるかまたは解放され得る。ステップ(vi)は数回繰り返されてもよい。これにより、例えば以下のことが可能となる。
‐第1または第2のマイクロドロップの内容物を順に希釈する、
‐第1の捕捉ゾーンに捕捉された1つまたは複数の第1のマイクロドロップの内容物に追加の試薬を供給する、
‐第1の捕捉ゾーンに捕捉された細胞を含む1つまたは複数の第1のマイクロドロップの培地を数回更新する、
‐病原体または病気の細胞を含む1つまたは複数の第1のマイクロドロップに、所与の時間間隔で、医薬品を供給して治療のための薬量を評価する、または、
‐いくつかの細胞層を有する微小組織を形成するために、細胞を数回供給する。
本方法は、特に、マイクロドロップに及ぼされる捕捉力よりも大きい連行力を及ぼす流体の流れを用いて、キャピラリトラップ内に存在する全てのマイクロドロップをキャピラリトラップの外側に移動させることからなるステップ(vi)を含み得る。このようなステップはマイクロドロップを分析のために解放することを可能にする。
本方法は、マイクロ流体システムの状態を測定することからなるステップを含み得る。この測定は、ドロップの融合および/または解放の前および/または後に実行され得る。
上記の方法は、以下に記載されるマイクロ流体システムを用いて実施され得る。
本方法は、以下の追加のステップを含み得る:
‐インキュベーション、および/または
‐特にイメージング、比色法、蛍光法、分光法(UV、ラマン)または温度測定による観察または測定。
観察または測定のステップは、融合の前および/または後に各マイクロドロップの内容物を決定すること、および例えば融合の後に生じた変化を決定することを可能にし得る。
観察ステップは、例えば、融合の前に様々なマイクロドロップをマッピングするために異なるマイクロドロップのライブラリを使用することに関して特に有用である。
本発明はまた、特に、特許請求の範囲に記載の方法を実施するためにマイクロドロップを捕捉するためのマイクロ流体装置に関し、該装置は、第1の捕捉ゾーン内に捕捉された第1のマイクロドロップと第2の捕捉ゾーン内に捕捉された第2のマイクロドロップとがキャピラリトラップ内で互いに接触するように配置された第1の捕捉ゾーンと第2の捕捉ゾーンとを有するキャピラリトラップを含み、第1の捕捉ゾーンによって、および第2の捕捉ゾーンによって、同一の第1または第2の液体マイクロドロップに及ぼされ得る捕捉力が異なり得るように第1および第2の捕捉ゾーンが構成されている。
第1および第2のマイクロドロップが接触していることにより、それらが相互作用することまたは容易に融合することを可能にする。
第1および第2の捕捉ゾーンは好ましくは空洞である。空洞の形態の捕捉ゾーンの使用は、マイクロドロップの操作、特にそれらを捕捉および/または解放することを容易にする。
第1および第2の捕捉ゾーンは分離されていてよい。
変形例として、第1および第2の捕捉ゾーンは結合されている。
好ましくは、第1の捕捉ゾーンおよび第2の捕捉ゾーンは、上から見たときに並んで配置されている。
「捕捉ゾーンの高さ」とは、断面におけるマイクロ流体システムの捕捉ゾーンの平均高さを意味する。
好ましくは、第2の捕捉ゾーンの高さは、第1の捕捉ゾーンの最大寸法と同等またはそれ未満、より好ましくは第1の捕捉ゾーンの最大寸法の半分と同等またはそれ未満である。第2の捕捉ゾーンの高さが制限されていることによって、第2のマイクロドロップが捕捉されるのを妨げるまで第2の捕捉ゾーンによって流体の動線が乱されるのを回避することを可能にする。
キャピラリトラップは、捕捉された各第2のマイクロドロップが、キャピラリトラップ内に捕捉された第1または第2のマイクロドロップの少なくとも1つと接触するように配置された複数の第2の捕捉ゾーンを含み得る。
第1および第2の捕捉ゾーンは、第2のマイクロドロップがすべて前記キャピラリトラップ内に捕捉された少なくとも1つの第1のマイクロドロップと接触するように配置されてもよい。
変形例として、キャピラリトラップのすべての第2の捕捉ゾーンは同一である。
好ましくは、本装置は、好ましくはキャピラリトラップの第2の捕捉ゾーンに捕捉された第2のマイクロドロップが前記キャピラリトラップの第1の捕捉ゾーンに捕捉された第1のマイクロドロップと接触するように配置された第1の捕捉ゾーンおよび第2の捕捉ゾーンをそれぞれ含む複数のキャピラリトラップを備える。
装置のすべてのキャピラリトラップは、それぞれが少なくとも1つの第1の捕捉ゾーンと少なくとも1つの第2の捕捉ゾーンとを含み得る。
本装置は、捕捉チャンバを有するチャネルを備えてもよく、1つまたは複数のキャピラリトラップは捕捉チャンバ内にある。
第2の態様によれば、本発明は、少なくとも2つの異なる方向に分配された複数のキャピラリトラップを含む捕捉チャンバを有するチャネルを備えるマイクロ流体システム内の複数の第1のマイクロドロップおよび複数の第2のマイクロドロップを操作する方法に関し、各キャピラリトラップは第1の捕捉ゾーンと第2の捕捉ゾーンとを有し、前記方法は、
(i)各キャピラリトラップの第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)各キャピラリトラップの第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップと、
かなるステップを含み、1つの同じキャピラリトラップの第1および第2の捕捉ゾーンは、第1のマイクロドロップおよび第2のマイクロドロップがキャピラリトラップ内で互いに接触するように配置され、キャピラリトラップはそれぞれが異方性形状を有する。
キャピラリトラップが異方性であることにより、マイクロドロップが捕捉ゾーンによって捕捉されると、マイクロドロップは予め定められた空間的位置を有することが可能となる。
本発明の前述の態様による方法または装置に関連して上述した1つまたは複数の特徴は、本発明のこの態様による方法に適用することができる。
本発明の前述の態様によるマイクロ流体システムに関連して上述した1つまたは複数の特徴は、本発明のこの態様によるマイクロ流体システムに適用することができる。
第3の態様によれば、本発明はまた、第1の捕捉ゾーンと第2の捕捉ゾーンとを有するキャピラリトラップを備えるマイクロ流体システムにおける少なくとも1つの第1のマイクロドロップおよび少なくとも1つの第2のマイクロドロップを操作する方法に関し、第2の捕捉ゾーンは第1の捕捉ゾーンに近づくにつれて少なくとも1つの寸法が広くなり、前記方法は、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップと、
からなるステップを含み、
1つの同じキャピラリトラップの第1および第2の捕捉ゾーンは、第1のマイクロドロップおよび第2のマイクロドロップがキャピラリトラップ内で互いに接触するように配置されている。
第2の捕捉ゾーンは、10°から120°の間の発散角αで広がり得る。
第2の捕捉ゾーンは、第1の捕捉ゾーンの方向に増加する高さを有し得る。
本発明の前述の態様による方法または装置に関連して上述した1つまたは複数の特徴は、本発明のこの態様による方法に適用することができる。
本発明の前述の態様によるマイクロ流体システムに関連して上述した1つ以上の特徴は、本発明のこの態様によるマイクロ流体システムに適用することができる。
第4の態様によれば、本発明はまた、第1の捕捉ゾーンおよび第2の捕捉ゾーンを有するキャピラリトラップを備えるマイクロ流体システムにおける第1の細胞を含む少なくとも1つの第1のマイクロドロップおよび第2の細胞を含む少なくとも1つの第2のマイクロドロップの細胞アセンブリ方法に関し、前記方法は、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、1つの同じキャピラリトラップの第1および第2の捕捉ゾーンは、第1のマイクロドロップおよび第2のマイクロドロップがキャピラリトラップ内で互いに接触するように配置されている、ステップと、
(iii)第1のマイクロドロップと第2のマイクロドロップを融合させて第1および第2の細胞の接着による微小組織を形成するステップと、
からなるステップを含む。
従って得られた微小組織の構成は実験条件に依存する。
好ましくは、第1および第2の捕捉ゾーンは、同じ第1または第2の液体マイクロドロップに対して第1および第2の捕捉ゾーンが及ぼす捕捉力が異なるように構成される。
本発明の前述の態様による方法または装置に関連して上述した1つまたは複数の特徴は、本発明のこの態様による方法に適用することができる。
本方法は、前述の態様によるマイクロ流体システムの1つを使用して実行され得る。
第5の態様によれば、本発明はまた、細胞培養物を含有する少なくとも1つの第1のマイクロドロップおよび培養培地を含有する少なくとも1つの第2のマイクロドロップのマイクロ流体システムにおける細胞培養の方法に関し、マイクロ流体システムは、第1の捕捉ゾーンおよび第2の捕捉ゾーンを有するキャピラリトラップを備え、前記培養方法は、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、第1のマイクロドロップおよび第2のマイクロドロップがキャピラリトラップ内で互いに接触するように、1つの同じキャピラリトラップの第1および第2の捕捉ゾーンが配置されている、ステップと、
(iii)第1のマイクロドロップを第2のマイクロドロップと融合させて、第1のマイクロドロップで行われた細胞培養の培地を更新するステップと、
からなるステップを含む。
第2のマイクロドロップは、医薬品の投与の断続的な性質をモデル化するために試験されるべき活性成分を含み得る。例えば、哺乳動物細胞のスフェロイドを含有するドロップは、試験されるべき活性成分、特に医薬品を含有するマイクロドロップと6時間毎に融合され得る。
好ましくは、第1および第2の捕捉ゾーンは、同じ第1または第2の液体マイクロドロップに対して第1および第2の捕捉ゾーンが及ぼす捕捉力が異なるように構成される。
本方法は、前述の態様によるマイクロ流体システムの1つを使用して実行され得る。
第6の態様によれば、本発明は、第1の捕捉ゾーンおよび第2の捕捉ゾーンを有するキャピラリトラップを備えるマイクロ流体システムにおいて、液体形態である第2のゲル化培地の少なくとも1つの第2のマイクロドロップおよび第1のゲル化培地の少なくとも1つの第1のマイクロドロップの多層ゲル化マイクロドロップを形成する方法に関し、前記方法は、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第1の捕捉ゾーンにおいて第1のゲル化培地をゲル化するステップと、
(iii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、1つの同じキャピラリトラップの第1および第2の捕捉ゾーンは、第1のマイクロドロップおよび第2のマイクロドロップがキャピラリトラップ内で互いに接触するように配置されている、ステップと、
(iv)第1のマイクロドロップと第2のマイクロドロップを融合するステップと、
からなるステップを含む。
本方法は、ステップ(iv)の前または後に行われ、第2のゲル化培地をゲル化することからなるステップ(v)を含み得る。
ステップ(ii)は、第1の捕捉ゾーンに捕捉するステップ(i)の前または後に行われてもよい。
第1および第2のゲル化培地は異なってもよい。
好ましくは、第1および第2の捕捉ゾーンは、同じ第1または第2の液体マイクロドロップに対して第1および第2の捕捉ゾーンが及ぼし得る捕捉力が異なるように構成される。
本方法は、前述の態様によるマイクロ流体システムの1つを使用して実行され得る。
第7の態様によれば、本発明はまた、第1の捕捉ゾーンおよび第2の捕捉ゾーンを有するキャピラリトラップを備えるマイクロ流体システム内に少なくとも1つの第1のマイクロドロップおよび少なくとも1つの第2のマイクロドロップを封入する方法に関し、第1のマイクロドロップおよび第2のマイクロドロップの一方はゲル化培地を含み、他方は複数の細胞を含む。前記方法は、
(i)第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、第1のマイクロドロップと第2のマイクロドロップがキャピラリトラップ内で互いに接触するように、1つの同じキャピラリトラップの第1および第2の捕捉ゾーンが配置されている、ステップと、
(iii)第1のマイクロドロップを第2のマイクロドロップと融合するステップと、
(iv)ゲル中に複数の細胞を封入するためにゲル化培地をゲル化するステップと、
からなるステップを含む。
好ましくは、第1および第2の捕捉ゾーンは、同じ第1または第2の液体マイクロドロップに対して第1および第2の捕捉ゾーンが及ぼす捕捉力が異なるように構成される。
方法は、前述の態様によるマイクロ流体システムの1つを使用して実行され得る。
第8の態様によれば、本発明はまた、第1の捕捉ゾーンおよびn個の第2の捕捉ゾーンを含む第1のキャピラリトラップと、第1の捕捉ゾーンおよびp個の第2の捕捉ゾーンを含む第2のキャピラリトラップとを備えるマイクロ流体システムにおける対象化合物の希釈方法に関する。nはpとは異なり、前記方法は、
(i)各第1の捕捉ゾーンに対象化合物を含む第1のマイクロドロップを捕捉するステップであって、第1のマイクロドロップが同じ濃度の対象化合物を有する、ステップと、
(ii)各第2の捕捉ゾーンに希釈化合物の第2のマイクロドロップを捕捉するステップであって、1つのキャピラリトラップの第1および第2の捕捉ゾーンは、各第2のマイクロドロップが同じ第1または第2のキャピラリトラップの第1または第2のマイクロドロップの少なくとも1つと接触し、それにより第1および第2のキャピラリトラップの各々において、少なくとも1つの第2のマイクロドロップが同じ第1または第2のキャピラリトラップの第1のマイクロドロップと接触するように配置されている、ステップと、
(iii)第1および第2のキャピラリトラップにおいて異なる濃度のマイクロドロップを得るために、互いに接触している第1および第2のマイクロドロップを融合させるステップと、
からなるステップを含む。
本発明の前述の態様による方法または装置に関連して上述した1つまたは複数の特徴は、本発明のこの態様による方法に適用することができる。
本発明の前述の態様によるマイクロ流体システムに関連して上述した1つ以上の特徴は、本発明のこの態様によるマイクロ流体システムに適用することができる。
第9の態様によれば、本発明はまた、複数のキャピラリトラップを備えるマイクロ流体システムにおいて、複数の第1のマイクロドロップを複数の第2のマイクロドロップとスクリーニングする方法に関し、各キャピラリトラップが第1の捕捉ゾーンおよび第2の捕捉ゾーンを有し、第1のマイクロドロップが、同一であるかまたは少なくともyが異なる第1のマイクロドロップのパネルを形成し、第2のマイクロドロップが、少なくともzが異なる第2のマイクロドロップのパネルを形成し、前記方法は、
(i)各第1の捕捉ゾーンに第1のマイクロドロップを捕捉するステップと、
(ii)各第2の捕捉ゾーンに第2のマイクロドロップを捕捉するステップであって、各キャピラリトラップの第1および第2の捕捉ゾーンが、前記キャピラリトラップ内に捕捉された第1および第2のマイクロドロップがそこで互いに接触するように配置されている、ステップと、
(iii)マイクロ流体システムにおいて、第1および第2のマイクロドロップの異なる可能な組み合わせのうちの1つの組み合わせにそれぞれ対応するマイクロドロップのパネルを得るために、各第1のマイクロドロップを接触している第2のマイクロドロップを融合させるステップと、
からなるステップを含む。
マイクロドロップが反応の間に静的であるため、動的データを得ることがより容易になる。非常に少量のマイクロドロップの使用による化合物の経済的利点もある。
第2のマイクロドロップのパネルは、少なくともそれらの含有量、特に対象の第2の化合物の濃度において異なるマイクロドロップを含んでもよい。
第1および第2の化合物は、互いに反応し、その初期濃度を最適化することが望ましい化合物であり得る。したがって、最良の結果を与える化合物の初期濃度を決定するために、少量で並行していくつかの反応を実施することが可能であろう。
さらなる変形例として、第1のマイクロドロップのパネルは1つまたは複数の細胞を含み、第2のマイクロドロップはそれぞれ規定濃度でスクリーニングされる医薬品を含む。
マイクロドロップの融合から数日後の生存率の結果を分析することによって、細胞集団の半分を殺傷する濃度を決定することが可能である。
本発明の前述の態様による方法または装置に関連して上述した1つまたは複数の特徴は、本発明のこの態様による方法に適用することができる。
方法は、前述の態様によるマイクロ流体システムのうちの1つを使用して実行され得る。
マイクロ流体システム5は上壁7および下壁8を備え、それらの間にマイクロドロップの循環のためのチャネル9および少なくとも1つのキャピラリトラップ12を形成する。
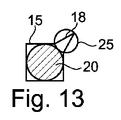
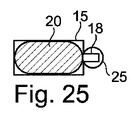
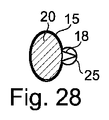
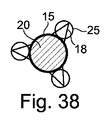
図1Aおよび図1Bに示す例では、キャピラリトラップ12は、マイクロ流体システムの断面において、マイクロドロップが収容され得る一定の高さの下壁8内に空洞を形成する。上から見ると、それは円形の第1の捕捉ゾーン15を有し、それに隣接する三角形の第2の捕捉ゾーン18を有する。
第1の捕捉ゾーン15は、第1のマイクロドロップ20が第1の捕捉ゾーンに捕捉されると、第1のマイクロドロップ20の上から見た見かけの直径D1とほぼ等しい直径aを有する。
図2に示す例では、第1のマイクロドロップ20は、第2のマイクロドロップ25の直径D2よりも大きい直径D1を有する。
図示されていない変形例として、キャピラリトラップは、第2のマイクロドロップの少なくとも1つを介して第1の捕捉ゾーンに捕捉された第1のマイクロドロップとそれ自体が接触している捕捉された一連の第2のマイクロドロップを形成するように構成される。
図示されるように、第2の捕捉ゾーン18は、第1の捕捉ゾーン15の周りに一様に分布していてもよい。しかしながら、それ以外の場合もあり得る。
図13に示される変形例として、第2の捕捉ゾーン18は、第1の捕捉ゾーン15を形成する正方形の角に融合される。
図15に示されるように、第2の捕捉ゾーン18は、第1の捕捉ゾーン15の方向に広くなり、上面図で湾曲した輪郭を有する対向する壁27および28を有し、第2の捕捉ゾーン18はその端部に向かって細くなり得る。
図17に示すように、第1の捕捉ゾーン15は五角形の形状であってよく、第2の捕捉ゾーン18は五角形の角から延びている。
第1の捕捉ゾーン15は、図19に示すように正方形でも、図20に示すように円形でもよく、第2の捕捉ゾーン18は円形でもよい。
さらなる変形例として、キャピラリトラップ12は、図33に示すように、第1の捕捉ゾーン15の対向する角に融合された2つの第2の捕捉ゾーン18を含むことができる。
図24に示すように、キャピラリトラップ12は、第1の捕捉ゾーン15の周囲に均一に分布せずそれらの間に間隔角度βを形成する2つの第2の捕捉ゾーン18を有することができる。
図28に示されるように、第1の捕捉ゾーン15は楕円形であり、第2の捕捉ゾーン18はその長辺から始まって第1の捕捉ゾーンに融合されてもよく、または図29に示されるようにその短辺によって融合されてもよい。
図31に示す例では、キャピラリトラップ12は、そのベースが第1の捕捉ゾーン15を形成し、ヘッドが第2の捕捉領域18を形成するひょうたん形の形状を有する。
図45に示す変形例として、第1の捕捉ゾーン15は、断面において、空洞の底部に向かって傾斜する縁部を有する。
図47に示すさらなる変形例として、第1および第2の捕捉ゾーンは少なくとも1つの傾斜した壁を有する。
変形例として、キャピラリトラップ12は、少なくとも部分的にマイクロ流体システムの側壁の1つの空洞によって形成される。
図47に示す変形例として、キャピラリトラップは、下壁8と上壁7の両方の空洞によって形成される。
マイクロドロップを循環させるためのチャネル9は、複数のキャピラリトラップ12を含み得る。
特に、チャネル9は、図49に示されるように、キャピラリトラップ12がテーブルまたはマトリックスにおいて2つの空間方向に従って空間的に分配されている二次元捕捉チャンバ30を含むことができる。この図において、キャピラリトラップ12は複数のアレイの形態で互いに等間隔で配置されているが、そうでなくてもよい。それらは周期的またはそうでない任意のスキームに従って配置され得る。
キャピラリトラップ12の重心間に画定される距離pは、捕捉されることが意図される最大のマイクロドロップのサイズと同等またはそれより大きく、特にキャピラリトラップの外側の壁7および8の間のチャネル内に閉じ込められた第1のドロップの上から見た見かけの直径と同等またはそれより大きいサイズであることが好ましく、例えば20μmから1cmの間である。
キャピラリトラップ12は上記の通りであり得る。
キャピラリトラップ12は全て同一であり得る。
本発明は、上述のマイクロ流体システムの形状に限定されない。マイクロ流体システムは、特に必要とされる用途に応じて、異なる形状を有することができる。
好ましくは、チャネル9は、マイクロドロップが混和しない流体で充填される。この流体は静止していても動いていてもよい。流体が動いているとき、流体の流れは好ましくは流体循環ライン(図示せず)に沿って配向され、流体入口31から流体出口32へと循環する。
好ましくは、第1および第2のマイクロドロップ20および25は、マイクロメートルのオーダー、特に20から5000μmの間の直径D1およびD2を有する。
第1のマイクロドロップ20、または第2のマイクロドロップ25は、それらの少なくとも一定数が異なるマイクロドロップのパネルを形成することができる。
第1および第2のマイクロドロップを操作する方法の例を図52に示す。
ステップ40において、第1のマイクロドロップ20が生成される。移動相においてこれらの第1のマイクロドロップを形成するための多くの方法がすでに提案されている。例えば、以下の方法の例が挙げられる:
a)例えばS.L. Anna, N. Bontoux and H.A. Stone, 「Formation of dispersions using ‘Flow-Focusing’ in microchannels」, Appl. Phys. Lett. 82, 364 (2003)(非特許文献9)に記載された「フローフォーカシング(flow-focusing)」と呼ばれる方法であって、参照により本明細書に組み込まれる。
b)例えばR. Seemann, M. Brinkmann, T. Pfohl, and S. Herminghaus, in 「Droplet based microfluidics.」 Rep. Prog. Phys., Vol. 75, No. 1, p. 016601, Jan. 2012(非特許文献10)に記載された「段階乳化(step emulsification)」と呼ばれる方法であって、参照により本明細書に組み込まれる。
c)例えばV. Chokkalingam, S. Herminghaus, and R. Seemann, in 「Self-synchronizing pairwise production of monodisperse droplets by microfluidic step emulsification,」 Appl. Phys. Lett., Vol. 93, No. 25, p. 254101, 2008(非特許文献11)に記載された「フローフォーカシング」および「段階乳化」の方法を組み合わせた方法であって、参照により本明細書に組み込まれる。
d)例えばG.F. Christopher and S.L. Anna, in 「Microfluidic methods for generating continuous droplet streams,」 J. Phys. D. Appl. Phys., Vol. 40, No. 19, pp. R319‐R336, Oct. 2007(非特許文献12)に記載された「Tジャンクション(T junction)」と呼ばれる方法であって、参照により本明細書に組み込まれる。
e)例えばR. Dangla, S.C. Kayi, and C.N. Baroud, in 「Droplet microfluidics driven by gradients of confinement,」 Proc. Natl. Acad. Sci. U.S.A., Vol. 110, No. 3, pp. 853‐8, Jan. 2013(非特許文献13)に記載された「閉込め勾配(confinement gradient)」と呼ばれる方法であって、参照により本明細書に組み込まれる。または
f)例えばA. Funfak, R. Hartung, J. Cao, K. Martin, K.H. Wiesmuller, O.S. Wolfbeis, and J.M. Kohler, in 「Highly resolved dose-response functions for drug-modulated bacteria cultivation obtained by fluorometric and photometric flow-through sensing in microsegmented flow,」 Sensors Actuators, B Chem., Vol. 142, No. 1, pp. 66‐72, 2009(非特許文献14)に記載された「マイクロ分割フロー(micro-segmented flows)」の方法であって、制御された異なる比率の2つの溶液を、マイクロ流体システムの外の機能のレベルで混合して、不混和相によって分離されたマイクロリットルのドロップを形成し、次にこれらのドロップを例えば傾斜を含むマイクロ流体システムに注入することによってマイクロドロップに分割する方法であって、参照により本明細書に組み込まれる。
1つまたは複数のキャピラリトラップ12が複数の第2の捕捉ゾーン18を有する場合、第2のマイクロドロップ25に及ぼされる連行力の方向およびセンスに対する1つまたは複数の第2の捕捉ゾーン18の位置は、選択的捕捉を実施することを可能にする。
縦軸に流体力学的抗力と比較した捕捉力の強度、横軸に時間を示す図66に示す実施形態の例では、2つの捕捉ゾーンを有するキャピラリトラップについて、方法は以下のステップを含む。
‐キャピラリトラップの第1のゾーンに第1のマイクロドロップを捕捉するステップであって、第1のマイクロドロップが第1のゾーンに捕捉され続けるように、第1のゾーンによって第1のマイクロドロップに及ぼされる捕捉力F4が、流れによって第1のマイクロドロップに及ぼされる流体力学的抗力Ft4より大きく、抗力Ft4がF4とF5の間であり、F5がキャピラリトラップの第2のゾーンによって第1のマイクロドロップに及ぼされる捕獲力を表す、ステップ、
‐次に、キャピラリトラップの第2のゾーンに第2のマイクロドロップを捕捉するステップであって、第2のゾーンに第2のマイクロドロップを入れる間の流れによって第2のマイクロドロップに及ぼされる流体力学的抗力Ft5の力がF5とF3の間であり、好ましくはF3がF4未満であり、F3が第2のゾーンによって第2のマイクロドロップに及ぼされる捕捉力である、ステップ。抗力Ft5はF4未満である。
このようにして、それぞれキャピラリトラップの2つのゾーンに2つのマイクロドロップの選択的捕捉が得られる。
同一のマイクロ流体システム内の様々なキャピラリトラップ12の第2の捕捉ゾーン18は、異なる特性、特に異なるサイズを有することができる。これにより、例えば、異なるキャピラリトラップ12内に異なる第2のマイクロドロップ25を捕捉して異なるマイクロドロップを得ることが可能になる。例えば、第2のマイクロドロップに含まれる要素の所与の濃度に関して、第2のマイクロドロップに含まれるその要素の量は、前記第2のマイクロドロップのサイズに依存する。したがって、例えば同じ捕捉チャンバ30内に異なるサイズの第2の捕捉ゾーン18を生成することによって、第2のマイクロドロップ25のサイズが第2の捕捉ゾーン18の各サイズに対応するように異なるサイズの第2のマイクロドロップ25を選択的に捕捉することが可能である。
これにより、特に化合物の濃度および/または組成に関して、それらの少なくともいくつかが異なるマイクロドロップのパネルを得ることが可能になる。
図56に示すように、ステップ46、48、および50を繰り返して、連続的融合を実行することができる。各キャピラリトラップ12において、ステップ50の後に得られたマイクロドロップは、その体積として1つまたは複数の第1のマイクロドロップ20の体積と、キャピラリトラップ12内で融合した1つまたは複数の第2のマイクロドロップ25の体積との和を有する新たな第1のマイクロドロップ80となる。1つまたは複数の第2の捕捉ゾーン18が再び空になると、初期の1つまたは複数の第2のマイクロドロップ25と同一のまたは異なる1つまたは複数の第3のマイクロドロップ58が供給され、新たな融合が実行されてそれ自体が新たな第1のマイクロドロップとなるというように、新たなマイクロドロップ90が得られる。連続する融合では、第2の捕捉ゾーン18における新たなマイクロドロップの捕捉が妨げられる程度に大きくなるまで、さまざまな体積の融合したマイクロドロップの追加により、マイクロドロップは大きくなる。同じキャピラリトラップ12内で実施され得る最大の融合の回数は、連続して融合されたマイクロドロップの体積に依存する。
捕捉チャンバ30内のキャピラリトラップ12は異なってもよく、それらの位置は制御され得る。例えば、異なる数の第2の捕捉ゾーンを有するキャピラリトラップ12を有することが可能である。
上述のようにキャピラリトラップ12を含むチャンバ内に異なる化合物および/または異なる濃度を含むマイクロドロップのパネルを注入することは、多くの用途を提供する。
捕捉チャンバ30は2cm2より大きい表面積を有してもよく、マイクロ流体システムにおいて並行して実施することができる異なる反応の数をさらに大幅に増加させる。
変形例として、第1および/または第2のマイクロドロップ20および/または25は、タンパク質、酵素、および細胞を様々な濃度で含み得る。
上記の方法は、微小組織を正確に形成するために、異なる種類の細胞であってもなくてもよい細胞を含むマイクロドロップを融合することを可能にし得る。
第2のマイクロドロップ25の細胞がスフェロイドを形成する前に融合が起こると、細胞は第1のスフェロイドの表面に沈降後に堆積する。
上記の方法はまた、多層ゲルマイクロドロップを作製するために使用され得る。
キャピラリトラップ12は、上記の通りであってよく、第1の捕捉ゾーン15および第2の捕捉ゾーン18を含み得る。
この方法はまた、生物学的ヒドロゲルに封入されたスフェロイドを得ることを可能にし得る。
キャピラリトラップは、図5Aおよび図5Bに示す通りであり得る。好ましくは、第1の捕捉ゾーン15は、図5Aに示すように、第1の捕捉ゾーン15は、捕捉された第1のマイクロドロップ20が平らではなく特に凸状の底部を有するような高さを有し、国際出願2016/059302に記載されているように、前記第1のマイクロドロップ20に含まれる細胞は、沈降する間にその界面に沿って前記第1のマイクロドロップ20内で滑動し、捕捉された第1のマイクロドロップ20の底部で凝集し、スフェロイドを形成する。この内容は参照により本明細書に組み込まれる。
以下の非限定的な実施例は、上記のような本発明の実施形態の例を説明する。
本方法の実現可能性を実証するために実験を行った。
使用した捕捉チャンバ30は2cm2のものであり、図1A、1B、および2と同様の393個の同一のキャピラリトラップを含み、以下の寸法を有する。
a=250μm
b=c=150μm
H=100m
h=50μm
キャピラリトラップ12は、図49に示すようにマトリックスに従って分布している。
別々のスフェロイドの2回の連続融合から生じるスフェロイドを得るための実験を行った。
マイクロ流体システムは、以下の寸法を有する図5Aおよび5Bに示すようなキャピラリトラップのマトリックスを有する捕捉チャンバ30を備える。
H=165μm
h1=388μm、
h2=80μm
c=200μm
a=400μm
この実験は、組織工学と関連した用途に対するこの技術の可能性を実証している。実際、同じ種類の細胞で異なる色のスフェロイドを融合するのではなく、補完的な細胞型のスフェロイドを融合して、明確に定義された構成を持つ機能的な微小組織を作成することが容易に想像できる。
単一のマイクロ流体システムにおいて、医薬品(アセトアミノフェン)が肝細胞(ラット肝細胞がん、H4IIEC3細胞)に対して毒性となる濃度を決定する実験を行った。
使用したマイクロ流体チャンバは、図5Aおよび5Bにおける2cm2上に252個の同一のトラップを含む。
15 第1の捕捉ゾーン
18、18a、18b、18c、18m、18v 第2の捕捉ゾーン
20 第1のマイクロドロップ
25、25a、25b、25c、25m、25v 第2のマイクロドロップ
30 捕捉チャンバ
Claims (25)
- 第1の捕捉ゾーン(15)および第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)を有するキャピラリトラップ(12、12a、12b、12c)を備えるマイクロ流体システムにおいて、少なくとも1つの第1の液体マイクロドロップ(20)および少なくとも1つの第2の液体マイクロドロップ(25、25a、25b、25c、25m、25v)を操作する方法であって、前記方法が、
(i)前記第1の捕捉ゾーン(15)に第1のマイクロドロップ(20)を捕捉するステップと、
(ii)前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)に第2のマイクロドロップ(25、25a、25b、25c、25m、25v)を捕捉するステップと、からなるステップを含み、
第1および第2のマイクロドロップ(20;25、25a、25b、25c、25m、25v)が互いに接触するように第1および第2の捕捉ゾーン(15;18、18a、18b、18c、18m、18v)が配置されており、
同一の第1または第2の液体マイクロドロップ(20、25a、25b、25c、25m、25v)に対して前記第1および第2の捕捉ゾーン(15;18、18a、18b、18c、18m、18v)が及ぼす捕捉力が異なるように前記第1および第2の捕捉ゾーン(15;18、18a、18b、18c、18m、18v)が構成されており、前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)が前記第1のマイクロドロップ(20)に及ぼす捕捉力より大きい捕捉力で、前記第1のマイクロドロップ(20)が前記第1の捕捉ゾーン(15)に捕捉され、
前記第2の捕捉ゾーンが前記第1のマイクロドロップ(20)に及ぼす捕捉力より大きく、前記第1の捕捉ゾーンが前記第1のマイクロドロップ(20)に及ぼす捕捉力と同等またはそれ未満である連行力によって、前記第1のマイクロドロップ(20)が、ステップ(i)において、前記マイクロ流体システム内を移動する、方法。 - 前記第2の液体マイクロドロップ(25、25a、25b、25c、25m、25v)の少なくとも1つが前記第1のマイクロドロップ(20)より小さいサイズまたは小さい体積を有する、請求項1に記載の方法。
- 前記第1および第2のマイクロドロップ(20;25、25a、25b、25c、25m、25v)が異なるものであるか、または異なる内容物を有する、請求項1または2に記載の方法。
- 前記キャピラリトラップ(12、12a、12b、12c)が複数の第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)を含み、ステップ(ii)が、第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)当たり1つの第2のマイクロドロップ(25、25a、25b、25c、25m、25v)を捕捉することからなり、各第2のマイクロドロップ(25、25a、25b、25c、25m、25v)が第1または第2のマイクロドロップ(20、25、25a、25b、25c、25m、25v)の少なくとも1つと接触するように、前記第1および第2の捕捉ゾーン(15;18、18a、18b、18c、18m、18v)が配置されている、請求項1から3のいずれか一項に記載の方法。
- ステップ(ii)が、流体の第1の方向の流れ(F1)の影響下で、第2の捕捉ゾーンの1つまたはいくつか(18m)に第2のマイクロドロップ(25m)を捕捉することからなるサブステップ(ii’)と、流体の第2の方向の流れ(F2)の影響下で、第2の捕捉ゾーンの別の1つまたはいくつかの部分(18v)に第2のマイクロドロップ(25v)を捕捉することからなるサブステップ(ii’’)とを含み、流体の第1および第2の流れは異なる向き(F1、F2)である、請求項4に記載の方法。
- 前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)またはそれらの各々に捕捉された前記第2のマイクロドロップ(25、25a、25b、25c、25m、25v)またはそれらの各々を前記第1のマイクロドロップ(20)と融合させることからなるステップ(iii)を含む、請求項1から5のいずれか一項に記載の方法。
- ステップ(iii)の後に、第1および第3のマイクロドロップ(20;85)が互いに接触するように、第2のマイクロドロップを有さない1つまたは複数の第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)に第3のマイクロドロップ(85)を捕捉することからなるステップ(v)を含む、請求項6に記載の方法。
- 前記第1および第2のマイクロドロップ(20;25、25a、25b、25c、25m、25v;85)が捕捉ゾーン(15;18、18a、18b、18c、18m、18v)に無作為に供給される、請求項1から7のいずれか一項に記載の方法。
- 前記第1の捕捉ゾーン(15)の高さ(h1)が、前記第1の捕捉ゾーンの体積が前記第1のマイクロドロップの体積と同等またはそれより大きくなるものである、請求項1から8のいずれか一項に記載の方法。
- ‐前記キャピラリトラップの前記第1の捕捉ゾーンに前記第1のマイクロドロップを捕捉するステップであって、前記第1のマイクロドロップが第1のゾーンに捕捉され続けるように、第1のゾーンによって前記第1のマイクロドロップに及ぼされる捕捉力F4が、配向された流れによって前記第1のマイクロドロップに及ぼされる流体力学的抗力Ft4より大きく、抗力Ft4がF4とF5との間にあり、F5が前記キャピラリトラップの前記第2の捕捉ゾーンによって前記第1のマイクロドロップに及ぼされる捕捉力を表す、ステップと、
‐次いで、前記キャピラリトラップの前記第2の捕捉ゾーンに前記第2のマイクロドロップを捕捉するステップであって、第2のゾーンに前記第2のマイクロドロップを装填する間に、配向された流れによって前記第2のマイクロドロップに及ぼされる流体力学的抗力Ft5がF5とF3との間にあり、F3が前記キャピラリトラップの前記第2のゾーンによって前記第2のマイクロドロップに及ぼされる捕捉力であり、F3が、F4未満であり、F5より大きい、ステップと、
を含む、請求項1から9のいずれか一項に記載の方法。 - 前記キャピラリトラップの前記第2のゾーンによって前記第2のマイクロドロップに及ぼされる前記捕捉力F3が、前記第1のゾーンによって前記第1のマイクロドロップに及ぼされる捕捉力F4未満である、請求項10に記載の方法。
- 前記マイクロ流体システムが複数のキャピラリトラップ(12、12a、12b、12c)を備え、各キャピラリトラップ(12、12a、12b、12c)が、ステップ(i)において第1のマイクロドロップ(20)の各々を捕捉するための第1の捕捉ゾーン(15)と、ステップ(ii)において第2のマイクロドロップの各々を捕捉するための第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)とを有し、前記第1の捕捉ゾーン(15)に捕捉された前記第1のマイクロドロップ(15)が、全て同一であるかまたは少なくとも2つの異なる第1のマイクロドロップを含み、前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)に捕捉された前記第2のマイクロドロップ(18、18a、18b、18c、18m、18v)が、少なくとも2つの異なる第2のマイクロドロップを含み、前記方法が、前記マイクロ流体システムにおいて、第1および第2のマイクロドロップの異なる可能な組み合わせのうちの1つの組み合わせにそれぞれ対応するマイクロドロップを得るために、各第1のマイクロドロップ(15)を接触している第2のマイクロドロップと融合させるステップを含む、請求項1から11のいずれか一項に記載の方法。
- 前記少なくとも2つの異なる第2のマイクロドロップ(18、18a、18b、18c、18m、18v)は、内容物が異なる、請求項12に記載の方法。
- 前記少なくとも2つの異なる第2のマイクロドロップ(18、18a、18b、18c、18m、18v)は、対象の第2の化合物の濃度が異なる、請求項12または13に記載の方法。
- 前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)またはそれらの各々に捕捉された前記第2のマイクロドロップ(25、25a、25b、25c、25m、25v)またはそれらの各々を前記第1のマイクロドロップ(20)と融合させることからなるステップ(iii)を含み、
ステップ(iii)の前に、観察または測定の追加のステップ(iv)を含む、請求項12から14のいずれか一項に記載の方法。 - 前記第2の捕捉ゾーン(18、18a、18b、18c、18m、18v)またはそれらの各々に捕捉された前記第2のマイクロドロップ(25、25a、25b、25c、25m、25v)またはそれらの各々を前記第1のマイクロドロップ(20)と融合させることからなるステップ(iii)を含み、
ステップ(iii)の後に、観察または測定の追加のステップ(iv)を含む、請求項12から15のいずれか一項に記載の方法。 - 前記第1のマイクロドロップ(15)の各々が細胞を含み、前記第2のマイクロドロップ(18、18a、18b、18c、18m、18v)の各々が規定濃度でスクリーニングされる医薬品を含む、請求項12から16のいずれか一項に記載の方法。
- 前記第1のマイクロドロップ(15)の各々が癌細胞を含み、前記第2のマイクロドロップ(18、18a、18b、18c、18m、18v)がスクリーニングされる異なる医薬品を含む、請求項12から16のいずれか一項に記載の方法。
- 前記第1のマイクロドロップ(15)の各々がスフェロイドの形態で培養された肝細胞を含み、毒性を評価すべき医薬品を異なる濃度で含む第2のマイクロドロップ(18、18a、18b、18c、18m、18v)が前記第2の捕捉ゾーンの各々に供給される、請求項12から16のいずれか一項に記載の方法。
- 前記第1のマイクロドロップ(15)がスフェロイドの形態で培養された肝細胞を含むアガロースマイクロドロップであり、前記方法が、肝細胞のスフェロイドを形成するステップと、アガロースをゲル化するステップとを含む、請求項19に記載の方法。
- 第1および第2のマイクロドロップ(15、18、18a、18b、18c、18m、18v)を融合するステップから数日後の各マイクロドロップにおける細胞の生存率を決定して細胞の少なくとも半分を殺傷する前記医薬品の濃度を決定するステップを含む、請求項19または20に記載の方法。
- 前記第1のマイクロドロップ(15)の各々が、生検から得られた腫瘍細胞を含む、請求項12から16のいずれか一項に記載の方法。
- 前記第1のマイクロドロップ(15)の各々が、スフェロイドの形態で培養された特定の患者の生検から得られた腫瘍細胞を含み、前記第2のマイクロドロップ(18、18a、18b、18c、18m、18v)が、複数の濃度でさまざまな活性物質を含み、前記方法が、特定の患者にとって、前記さまざまな活性物質のうちから最も有効な活性物質およびその濃度を決定することを含む、請求項12から16のいずれか一項に記載の方法。
- 前記第1のマイクロドロップおよび第2のマイクロドロップの一方がゲル化培地を含み、他方が複数の細胞を含み、前記方法が、
(iii)前記第1のマイクロドロップを前記第2のマイクロドロップと融合するステップと、
(iv)ゲル中に複数の細胞を封入するために前記ゲル化培地をゲル化するステップと、からなるステップを含む、請求項1から11のいずれか一項に記載の方法。 - ゲル化するステップ(iv)の前に、細胞のスフェロイドの形成を含む、請求項24に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022117270A JP7438280B2 (ja) | 2016-09-30 | 2022-07-22 | マイクロドロップを処理するためのマイクロ流体方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR1659418 | 2016-09-30 | ||
| FR1659418A FR3056927B1 (fr) | 2016-09-30 | 2016-09-30 | Procede microfluidique de manipulation de microgouttes |
| PCT/EP2017/074859 WO2018060471A1 (fr) | 2016-09-30 | 2017-09-29 | Procede microfluidique de manipulation de microgouttes |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022117270A Division JP7438280B2 (ja) | 2016-09-30 | 2022-07-22 | マイクロドロップを処理するためのマイクロ流体方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019532805A JP2019532805A (ja) | 2019-11-14 |
| JP2019532805A5 JP2019532805A5 (ja) | 2020-11-05 |
| JP7150707B2 true JP7150707B2 (ja) | 2022-10-11 |
Family
ID=58009902
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019517429A Active JP7150707B2 (ja) | 2016-09-30 | 2017-09-29 | マイクロドロップを処理するためのマイクロ流体方法 |
| JP2022117270A Active JP7438280B2 (ja) | 2016-09-30 | 2022-07-22 | マイクロドロップを処理するためのマイクロ流体方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022117270A Active JP7438280B2 (ja) | 2016-09-30 | 2022-07-22 | マイクロドロップを処理するためのマイクロ流体方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11179722B2 (ja) |
| EP (1) | EP3519092A1 (ja) |
| JP (2) | JP7150707B2 (ja) |
| CN (1) | CN110035825B (ja) |
| FR (1) | FR3056927B1 (ja) |
| WO (1) | WO2018060471A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3566772A1 (en) * | 2018-05-11 | 2019-11-13 | Agilent Technologies, Inc. (A Delaware Corporation) | Immobilizing fluidic sample for inhibiting spatial broadening |
| FR3098128B1 (fr) | 2019-07-05 | 2023-11-17 | Commissariat Energie Atomique | Dispositif microfluidique comportant une microgoutte présentant une matrice sol-gel. |
| EP4219685A1 (en) * | 2022-01-31 | 2023-08-02 | Institut Pasteur | In vitro generation of organized 3d cell structures including head-trunk embryo-like structures, using epigenetic remodeling factors - microfluidic platform suitable for their generation |
| US20240318134A1 (en) * | 2021-07-22 | 2024-09-26 | Institut Pasteur | In vitro generation of organized 3d cell structures including head-trunk embryo-like structures, using epigenetic remodeling factors-microfluidic platform suitable for their generation |
| DE102022202862A1 (de) * | 2022-03-24 | 2023-09-28 | Robert Bosch Gesellschaft mit beschränkter Haftung | Mikrofluidisches Aufnahmeelement, mikrofluidische Vorrichtung mit Aufnahmeelement, Verfahren zum Herstellen eines mikrofluidischen Aufnahmeelements und Verfahren zum Verwenden eines mikrofluidischen Aufnahmeelements |
| DE102022209421A1 (de) | 2022-09-09 | 2024-03-14 | Robert Bosch Gesellschaft mit beschränkter Haftung | Array für eine mikrofluidische Vorrichtung |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100190263A1 (en) | 2009-01-23 | 2010-07-29 | Advanced Liquid Logic, Inc. | Bubble Techniques for a Droplet Actuator |
| JP2010273655A (ja) | 2009-05-29 | 2010-12-09 | Canon Inc | 細胞保持方法、細胞試験方法及び細胞処理装置 |
| US20130078163A1 (en) | 2011-09-22 | 2013-03-28 | Georgia Tech Research Corporation | Deterministic High-Density Single-Cell Trap Array |
| JP2014100672A (ja) | 2012-11-20 | 2014-06-05 | Kanagawa Academy Of Science And Technology | 脂質二重膜の形成方法及びそのための器具 |
| JP2015534072A (ja) | 2012-10-08 | 2015-11-26 | エコール ポリテクニック | 複数の流体の液滴を接触させることを可能にするマイクロ流体回路および対応するマイクロ流体方法 |
| JP2017537772A (ja) | 2014-10-17 | 2017-12-21 | エコール ポリテクニック | サンプルを含むマイクロ液滴を取り扱うための方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10326607A1 (de) | 2003-06-13 | 2005-01-05 | Steag Microparts Gmbh | Vorrichtung zum Handhaben von Flüssigkeiten |
| FR2950544B1 (fr) | 2009-09-29 | 2011-12-09 | Ecole Polytech | Circuit microfluidique |
| WO2012040861A1 (en) * | 2010-10-01 | 2012-04-05 | The Governing Council Of The University Of Toronto | Digital microfluidic devices and methods incorporating a solid phase |
-
2016
- 2016-09-30 FR FR1659418A patent/FR3056927B1/fr active Active
-
2017
- 2017-09-29 JP JP2019517429A patent/JP7150707B2/ja active Active
- 2017-09-29 EP EP17777052.6A patent/EP3519092A1/fr active Pending
- 2017-09-29 US US16/338,681 patent/US11179722B2/en active Active
- 2017-09-29 WO PCT/EP2017/074859 patent/WO2018060471A1/fr unknown
- 2017-09-29 CN CN201780074354.2A patent/CN110035825B/zh active Active
-
2022
- 2022-07-22 JP JP2022117270A patent/JP7438280B2/ja active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100190263A1 (en) | 2009-01-23 | 2010-07-29 | Advanced Liquid Logic, Inc. | Bubble Techniques for a Droplet Actuator |
| JP2010273655A (ja) | 2009-05-29 | 2010-12-09 | Canon Inc | 細胞保持方法、細胞試験方法及び細胞処理装置 |
| US20130078163A1 (en) | 2011-09-22 | 2013-03-28 | Georgia Tech Research Corporation | Deterministic High-Density Single-Cell Trap Array |
| JP2015534072A (ja) | 2012-10-08 | 2015-11-26 | エコール ポリテクニック | 複数の流体の液滴を接触させることを可能にするマイクロ流体回路および対応するマイクロ流体方法 |
| JP2014100672A (ja) | 2012-11-20 | 2014-06-05 | Kanagawa Academy Of Science And Technology | 脂質二重膜の形成方法及びそのための器具 |
| JP2017537772A (ja) | 2014-10-17 | 2017-12-21 | エコール ポリテクニック | サンプルを含むマイクロ液滴を取り扱うための方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022136156A (ja) | 2022-09-15 |
| JP2019532805A (ja) | 2019-11-14 |
| FR3056927A1 (fr) | 2018-04-06 |
| CN110035825A (zh) | 2019-07-19 |
| FR3056927B1 (fr) | 2021-07-09 |
| US11179722B2 (en) | 2021-11-23 |
| CN110035825B (zh) | 2021-10-26 |
| EP3519092A1 (fr) | 2019-08-07 |
| JP7438280B2 (ja) | 2024-02-26 |
| WO2018060471A1 (fr) | 2018-04-05 |
| US20200038867A1 (en) | 2020-02-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7150707B2 (ja) | マイクロドロップを処理するためのマイクロ流体方法 | |
| Amirifar et al. | Droplet-based microfluidics in biomedical applications | |
| Mashaghi et al. | Droplet microfluidics: A tool for biology, chemistry and nanotechnology | |
| Kaminski et al. | Controlled droplet microfluidic systems for multistep chemical and biological assays | |
| Trantidou et al. | Engineering compartmentalized biomimetic micro-and nanocontainers | |
| Theberge et al. | Microdroplets in microfluidics: an evolving platform for discoveries in chemistry and biology | |
| Song et al. | Reactions in droplets in microfluidic channels | |
| Somaweera et al. | A review of chemical gradient systems for cell analysis | |
| Joensson et al. | Droplet microfluidics—A tool for single‐cell analysis | |
| KR101451955B1 (ko) | 액적 작동기 상에서의 비드 조작법 | |
| US10710077B2 (en) | Method for handling microdrops which include samples | |
| Ugrinic et al. | Microfluidic tools for bottom-up synthetic cellularity | |
| Selimovic et al. | Generating nonlinear concentration gradients in microfluidic devices for cell studies | |
| Kaminski et al. | Automated generation of libraries of nL droplets | |
| CN104492508B (zh) | 一种基于液体残留的超微量液滴操控装置及方法 | |
| US20220041967A1 (en) | Real-time monitoring of single cell or events | |
| Zeng et al. | Miniaturizing chemistry and biology using droplets in open systems | |
| Liu et al. | Rapid, simple, and inexpensive spatial patterning of wettability in microfluidic devices for double emulsion generation | |
| Moon et al. | Evaporation-driven water-in-water droplet formation | |
| Carreras et al. | A multifunctional microfluidic platform for generation, trapping and release of droplets in a double laminar flow | |
| Desmarais et al. | Microfabricated devices for biomolecule encapsulation | |
| WO2014196856A1 (en) | Methods and means for performing microdroplet-based reactions | |
| JP7135049B2 (ja) | サンプルを含むマイクロ液滴を取り扱うための方法 | |
| Vladisavljević | Droplet Microfluidics for High-Throughput Screening and Directed Evolution of Biomolecules | |
| Panchal | Tracking egress of doubly encapsulated cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190530 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200916 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200916 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210728 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211102 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220322 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220722 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20220722 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20220801 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220808 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220829 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220928 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7150707 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |