CN110035825B - 用于处理微滴的微流体方法 - Google Patents
用于处理微滴的微流体方法 Download PDFInfo
- Publication number
- CN110035825B CN110035825B CN201780074354.2A CN201780074354A CN110035825B CN 110035825 B CN110035825 B CN 110035825B CN 201780074354 A CN201780074354 A CN 201780074354A CN 110035825 B CN110035825 B CN 110035825B
- Authority
- CN
- China
- Prior art keywords
- trapping
- droplet
- droplets
- liquid droplet
- region
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/302—Micromixers the materials to be mixed flowing in the form of droplets
- B01F33/3021—Micromixers the materials to be mixed flowing in the form of droplets the components to be mixed being combined in a single independent droplet, e.g. these droplets being divided by a non-miscible fluid or consisting of independent droplets
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/3035—Micromixers using surface tension to mix, move or hold the fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502769—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements
- B01L3/502784—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements specially adapted for droplet or plug flow, e.g. digital microfluidics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
- B01L2200/0668—Trapping microscopic beads
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0673—Handling of plugs of fluid surrounded by immiscible fluid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0893—Geometry, shape and general structure having a very large number of wells, microfabricated wells
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0688—Valves, specific forms thereof surface tension valves, capillary stop, capillary break
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Health & Medical Sciences (AREA)
- Dispersion Chemistry (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Hematology (AREA)
- Clinical Laboratory Science (AREA)
- Physics & Mathematics (AREA)
- Fluid Mechanics (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Physical Or Chemical Processes And Apparatus (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
- Mixers With Rotating Receptacles And Mixers With Vibration Mechanisms (AREA)
- Extraction Or Liquid Replacement (AREA)
Abstract
用于处理微流体系统中的至少一个第一微滴(20)和至少一个第二微滴(25)的方法,所述微流体系统包括具有第一捕集区(15)和第二捕集区(18)的毛细管捕集器,所述方法包括以下步骤:(i)将第一微滴(20)捕集在第一捕集区(15)中,以及(ii)将第二微滴(25)捕集在第二捕集区(18)中,第一捕集区(15)和第二捕集区被布置为使得第一微滴(20)和第二微滴(25)相互接触,第一捕集区(15)和第二捕集区(18)被调整成使得施加在所述微滴(20)中的一者上的捕集力是不同的。
Description
技术领域
本发明涉及用于处理微流体系统的至少一个毛细管捕集器中的几个微滴的微流体方法。本发明还涉及用于进行所述方法的微流体装置。
背景技术
从专利申请FR 2950544已知,在具有近似圆形或椭圆形形状的捕集器的一个或多个微通道中流通的微滴的捕集,每个捕集区的尺寸被定为用于捕集预定数量的微滴。
在二维的并且具有多个捕集器的微流体系统的具有近似圆形形状的浅捕集器中捕集和融合具有大致相同大小或不同大小的微滴,从以下也是已知的:E.Fradet,C.McDougal,P.Abbyad,R.Dangla,D.McGloin和C.N.Baroud,“Combining rails andanchors with laser forcing for selective manipulation within2D dropletarrays.”Lab Chip,第11卷,第24期,第4228-4234页,2011年12月,以及J.Tullis,C.L.Park和P.Abbyad.“Selective Fusion of Anchored Droplets via Changes in SurfactantConcentration.”Lab Chip,2014年。在同一个捕集器中捕集的微滴是不同的。
这种捕集器不允许精确的操纵和/或控制捕集的微滴、特别是使捕集器适应于具有不同大小的微滴,也不允许以空间预定方式捕集微滴。
E.Fradet,P.Abbyad,M.H.Vos和C.N.Baroud,“Parallel measurements ofreaction kinetics using ultralow volumes.”Lab Chip,第13卷,第22期,第4326-4330页,2013年10月描述了具有两个近似圆形形状的相同区的浅捕集器,这些区部分重叠以形成护目镜形状的捕集器。两个区中的每一者都可以捕集一个微滴。捕集器的形状使得可以使两个被捕集的微滴保持相互接触,以便将它们融合成单个微滴。这种捕集器限于处理两个大小大致相同的微滴,而不适于处理大量微滴,这减少了可能的应用。
此外,用于固定和融合两个微滴的C形捕集器从以下是已知的:A.M.Huebner,C.Abell,W.T.S.Huck,C.N.Baroud和F.Hollfelder,“Monitoring a Reaction atSubmillisecond Resolution in Picoliter Volumes.”,Anal Chem.2011年2月15日;83(4):1462-1468。通过在微滴流中阻挡所述微滴的突出凸起来形成捕集器。然而,由于捕集器的形状,微滴的操纵是显著受限的,并且将微滴保留在捕集器中需要存在在精确方向上定向的流体流。
申请WO 2016/059302描述了用于处理微流体系统中的微滴的方法,所述方法包括由以下组成的步骤:将微滴捕集在毛细管捕集器中并至少部分地凝胶化所述微滴或其环境。毛细管捕集器能够在其深度接收几个微滴,所述深度大于捕集的微滴的直径。然而,微滴(特别是捕集的微滴)的深度方向地(depth-wise)操纵是有限的。
申请US 2015/0258543提出一种方法,所述方法允许使不同的流体接触以获得它们之间的反应并允许分析该反应的动力学。其中公开了微流体回路,该微流体回路能够将微滴一次一个地带入用作毛细管捕集器的腔中。可以使两个具有不同体积的微滴接触并被接收在8字形的腔中。两个捕集区的尺寸对应于待容纳在捕集区中的微滴的尺寸,每个捕集区对应于8的环。在这些不同的捕集区之间存在与腔的形状相关的能量屏障。例如,由于腔的8字形,从右侧供应的微滴将保留在右侧的捕集区中。
申请US 2010/0190263描述了液滴的致动器,其具有将两个基板分开的中空区域。这些基板包括用于将液滴输送到中空区域的电极。致动器的目的是在这些中空区域中形成并保持气泡。
文章Dangla,R.,Lee,S.&Baroud,C.N.Trapping microfluidic drops in wellsof surface energy.Phys.Rev.Lett.107,124501(1-4)(2011)以及Yamada,A.,Lee,S.,Bassereau,P.&Baroud,C.N.Trapping and release of giant unilamellar vesicles inmicrofluidic wells.Soft Matter 10,26-28(2014)描述了与在微通道中捕集经受流体流的微滴相关的物理学。捕集力可以由以下造成:捕集器的形状和大小、微通道的深度、微滴的大小、以及存在的流体的物理性质和物理化学性质(例如粘度、表面张力等)。
因此,对于允许容易地控制捕集的微滴并且以空间预定义方式捕集所述微滴的、用于处理微滴的方法存在需求。对于允许顺序操纵微滴的方法也存在需求。
发明内容
I.第一方面—操纵方法
出于此目的,根据本发明的第一方面,本发明提出用于操纵在微流体系统中的至少一个第一微滴和至少一个第二微滴的方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,以及
(ii)将所述第二微滴捕集在所述第二捕集区中,
所述第一捕集区和所述第二捕集区以这种方式布置:使得所述第一微滴和所述第二微滴相互接触,
所述第一捕集区和所述第二捕集区以这种方式配置:使得由所述第一捕集区和所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
“微流体系统”是指涉及输送至少一种产品的系统,在该系统的至少一个部分上包括截面,所述截面从一个边缘到相反边缘以直线测量的至少一个尺寸小于一毫米。
“微滴”是指体积小于或等于1μl、更好地小于或等于10nl的滴。微滴可以是液体、气体或固体。
“毛细管捕集器”是指微流体系统的空间区,其允许暂时地或永久地固定在微流体系统中流通的一个或多个微滴。毛细管捕集器可以由一个或多个凸起(特别是中空凸起)形成,和/或通过与微滴接触的表面的一种或多种局部修饰(特别是所述表面与微滴内容物的至少一部分的亲和力的一种或多种局部修饰)形成。
“由所述第一捕集区和所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的”是指如果第一微滴仅被捕集在第一捕集区中,则通过毛细管作用,它将被保留在第一捕集区中,所述毛细管作用的捕集力不同于第二捕集区自身将施加在该相同的第一微滴上的捕集力。因此,更容易从施加最小捕集力的捕集区释放第一微滴。相同的推理可以应用于第二微滴。捕集区的捕集力特别地取决于其形状、其与微滴接触的表面和/或待捕集的微滴的性质(特别是尺寸)。
毛细管捕集器具有在微滴中的一者上施加不同捕集力的两个区的事实使得可以具有捕集的微滴的选择性和空间选择性,特别是避免第一微滴占据第二捕集区,从而防止第二微滴被捕集在所述第二捕集区中。当将多个第一微滴和第二微滴引入微流体系统时,这是特别有利的。
第一微滴和第二微滴接触的事实允许它们相互作用或聚并(coalesce)。
优选地,将第一微滴捕集在第一捕集区中,所用的捕集力大于第二捕集区施加在第一微滴上的捕集力。因此,第一微滴优选地被第一捕集区捕集。
作为变型,将第二微滴捕集在第二捕集区中,所用的捕集力小于第一捕集区施加在第二微滴上的捕集力。在这种情况下,将第一微滴和第二微滴优选地顺序地引入并捕集在微流体系统中。
优选地,在第二微滴被微流体系统中的第二捕集区捕集之前,第一微滴被微流体系统中的第一捕集区捕集。因此,当引入第二微滴时,它不能占据第一捕集区,因为第一捕集区已被第一微滴占据。
可以在步骤(i)中在第一微滴上施加大于第二捕集区的捕集力并且小于或等于第一捕集区的捕集力的夹带力。例如,以这种方式选择第二捕集区的形状:使得第二区的捕集力小于夹带力。换句话说,微滴由于流体动力的夹带而受到流体动力,所述夹带与第二捕集区的捕集相反。由输送微滴的流体施加的曳力可以取决于微滴的大小和瞬时形状、流体的物理性质和物理化学性质(粘度、表面张力等)和流速。则第一滴仅被捕集在第一捕集区中。
夹带力至少部分地可以由以下施加
-在微流体系统中流动的定向的流体流。特别地,微滴可以通过定向的流体流在微流体系统中移动,其中微滴优选地是不混溶的,流体流是特别地具有使得第一微滴仅被第一捕集区捕集的流速和定向。移动流体施加在第一滴上的力防止该第一滴被捕集在第二捕集区中;
-重力,第一微滴通过其自身重量沿着微流体系统的斜面移动。因此,取决于第一微滴由于微流体系统的斜面而到达第一捕集区的速度,第一微滴被保留在第一捕集区中或不被保留在第一捕集区中;
-第一微滴最小化其表面张力的趋势。特别地,微流体系统可以包括使第一微滴移动的凸起,特别是朝向毛细管捕集器变得更宽的凹槽。
优选地,第二微滴受到如关于第一微滴所描述的夹带力,所述夹带力小于或等于第二捕集区的捕集力。在通过定向的流体流将夹带力施加在第二微滴上的情况下,流体流施加在第一捕集区中捕集的第一微滴上的力优选地不足以从第一捕集区中取出第一微滴。
在第二微滴上的夹带力由定向的流体流施加的情况下,所述流体流可以以这种方式定向:第二微滴可以仅被捕集在具有相对于流的定向的具体定向的第二捕集区中、特别是相对于流体流的方向布置在第一捕集区上游的第二捕集区中。
微滴由流体流携带到多个捕集区,所述微滴优选地随机地导入到捕集区中并且自然地占据捕集区的从能量观点来看最有利的位置。它们自己停留在捕集区中。微滴的这种随机布置使得可以同时具有大量的被捕集的微滴,并提高筛选能力。
在实施方式中,所述方法包括以下步骤:
-将第一微滴捕集在毛细管捕集器的第一捕集区中,由第一区施加在第一微滴上的捕集力F4大于由流(即输送微滴的定向流体流)施加在第一微滴上的流体动力曳力Ft4,这样使所述第一微滴保持被捕集在第一区中,曳力Ft4在F4和F5之间,F5表示由毛细管捕集器的第二捕集区施加在第一微滴上的捕集力,
-然后,将第二微滴捕集在毛细管捕集器的第二捕集区中,通过在第二区中负载所述第二微滴期间的流施加在所述第二微滴上的流体动力曳力Ft5在F5和F3之间,优选F3小于F4,F3是由所述毛细管捕集器的第二区施加在所述第二微滴上的捕集力。
微滴
优选地,第一捕集区施加在第一微滴上的捕集力不同于第一捕集区将施加在第二微滴上的捕集力,并且第二捕集区施加在第二微滴上的捕集力不同于第二捕集区将施加在第一微滴上的捕集力。实际上,捕集力还取决于待捕集的微滴的形状与捕集区的形状的关系。这有利于第一微滴和第二微滴的顺序捕集。
优选地,第一捕集区施加在第一微滴上的捕集力大于第一捕集区将施加在第二微滴上的捕集力。这使得可以防止第二次微滴移位并取代第一微滴。
第一微滴和第二微滴可以是不同的,特别是具有不同的大小和/或具有不同的内容物,尤其是第一微滴具有比第二微滴更大的大小和/或更大的体积。这保证了第一捕集区施加在第一微滴上的捕集力大于第一捕集区将施加在第二微滴上的捕集力;因此,第一捕集区中将只有一个微滴。
第一捕集区可以捕集一个或多个第一微滴。
第二捕集区可以捕集一个或多个第二微滴。
作为变型,第一微滴和第二微滴在其性质的至少一个上是不同的,特别是其粘度和/或其界面张力和/或其与捕集区的至少一者的具体涂层的亲和力。
优选地,第一捕集区仅捕集第一微滴和/或第二捕集区仅捕集第二微滴。特别地:
-第一微滴被捕集时从上方观察的最大尺寸可以大于或等于从上方观察的第一捕集区的最大尺寸,和/或
-第二微滴被捕集时从上方观察的最大尺寸可以大于或等于从上方观察的第二捕集区的最大尺寸,和/或
-被捕集时,第一微滴填充第一捕集区的体积的至少70%、更好地是80%、甚至更好地是90%,和/或
-被捕集时,第二微滴填充第二捕集区的体积的至少70%、更好地是80%、甚至更好地是90%,和/或
-被捕集时,第一微滴的体积大于或等于第一捕集区的体积,使得第一微滴部分地延伸到第一捕集区外,和/或
-被捕集时,第二微滴的体积大于或等于第二捕集区的体积,使得第二微滴部分地延伸到第二捕集区外。
第一微滴或第二微滴中的一者可以是空气微泡。
多个第二捕集区和/或第一捕集区
毛细管捕集器可以包括多个第二捕集区,步骤(ii)由以下组成:每个第二捕集区捕集一个第二微滴,第一捕集区和第二捕集区以这种方式布置:每个第二微滴与第一微滴或第二微滴中的至少一者接触。
毛细管捕集器可以包括多个第一捕集区,步骤(i)由以下组成:每个第一捕集区捕集一个第一微滴,第一捕集区和第二捕集区以这种方式布置:每个第一微滴与第二微滴或第一微滴中的至少一者接触。
优选地,每个第二微滴连接到所述第一微滴或每个第一微滴。
“连接到”是指每个第二微滴或者直接与所述第一微滴接触,或者与另一个第二微滴或第二微滴和/或第一微滴的串接触,其本身与所述第一微滴接触。
“微滴的串”是指相互接触、形成直线或曲线的多个微滴。
第二微滴可以全部与捕集在所述毛细管捕集器中的至少一个第一微滴接触。
可以配置至少两个第二捕集区,使得它们施加在所述第二液体微滴中的一者上的捕集力是不同的。被至少两个第二捕集区捕集的第二微滴可以在其性质的至少一者(特别是其最大尺寸)上是不同的。
作为变型,毛细管捕集器的所有第二捕集区是相同的。
多个毛细管捕集器
微流体系统可以包括多个毛细管捕集器,每个毛细管捕集器包括第一捕集区和第二捕集区,步骤(i)由以下组成:将第一微滴捕集在每个毛细管捕集器的第一捕集区中,步骤(ii)由以下组成:将第二微滴捕集在每个毛细管捕集器的第二捕集区中,多个毛细管捕集器中的每个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得捕集在所述毛细管捕集器中的第一微滴和第二微滴在所述毛细管捕集器中相互接触。
每个毛细管捕集器可以包括上述特征中的一个或多个。
微流体系统的所有捕集器可以各自包括以这种方式布置的第一捕集区和第二捕集区:使得捕集在所述毛细管捕集器中的第一微滴和第二微滴在所述毛细管捕集器中相互接触。
作为变型,仅微流体系统的毛细管捕集器中的一些毛细管捕集器各自包括以这种方式布置的第一捕集区和第二捕集区:使得捕集在所述毛细管捕集器中的第一微滴和第二微滴在所述毛细管捕集器中相互接触。
所述方法可以包括在第一捕集区或第二捕集区的一者中捕集气体微泡(特别是空气微泡)的步骤。这可以使有问题的捕集区失效。事实上,由于存在气体微泡,第一微滴或第二微滴不能被捕集在有问题的捕集区中。
定向的流体流
步骤(ii)可以包括子步骤(ii’)和子步骤(ii”),所述子步骤(ii’)由以下组成:在第一定向的流体流的作用下将第二微滴捕集在第二捕集区的一个捕集区或一些捕集区中,所述子步骤(ii”)由以下组成:在第二定向的流体流的作用下将第二微滴捕集在所述第二捕集区的另一个捕集区或一些其他捕集区中,第一流体流和第二流体流具有不同的定向。
步骤(ii’)和(ii”)的第二微滴可以通过其性质和/或其内容物中的至少一者而显著不同。步骤(ii’)和(ii”)的第二捕集区可以是相同的。
因此,通过选择流体流的定向,可以将微滴选择性地捕集在两个捕集区中的一者中,这允许相互接触的微滴的预定义空间定位。然后可以使第一微滴以受控方式与不同的第二微滴接触,特别是在组合化学的情况下。在包含凝胶的微滴的情况下,还可以控制毛细管捕集器中凝胶微滴的空间布置,以便在融合后获得具有受控的形状和组成的微滴。
聚并
所述方法可以包括步骤(iii),所述步骤(iii)由以下组成:将捕集在第二捕集区中或第二捕集区的每个捕集区中的第二微滴或第二微滴中的每一者与第一微滴融合。这种聚并特别地允许两种微滴的内容物混合。
所述聚并可以是选择性的,即可以选择希望与第一微滴融合的第二微滴或(几个)第二微滴与第一微滴接触,特别是通过使用红外线激光(例如以下文献中描述的:E.Fradet,P.Abbyad,M.H.Vos和C.N.Baroud,“Parallel measurements of reactionkinetics using ultralow volumes.”Lab Chip,第13卷,第22期,第4326-4330页,2013年10月,其内容通过引用并入)、布置在毛细管捕集器水平的可寻址电极、或机械波。
作为变型,微滴的聚并是非选择性的,即毛细管捕集器的所有第二微滴同时地与第一微滴融合,特别是通过将促进该聚并的产品添加到毛细管捕集器的环境或应用外部物理刺激(例如机械波、压力波、温度变化或电场)。
第二微滴的释放
作为变型,步骤(iii)由以下组成:将捕集在第二捕集区中的所述第二微滴或至少一个第二微滴排出毛细管捕集器外。步骤(iii’)可以由以下组成:应用定向的流体流,所述流体流被配置成用于在一个或多个第二微滴上施加大于第二捕集区的捕集力的夹带力,所述流体流被配置成用于在第一微滴或(几个)第一微滴上施加小于或等于第一捕集区的捕集力的夹带力,使得第一微滴或(几个)第一微滴保持被捕集在第一捕集区中。
在该步骤中,可以从第二捕集区排出一个或多个第二微滴,毛细管捕集器被配置成使得流体流由于其定向而在第二捕集区上施加不同的夹带力,所述方法优选包括步骤(iv),所述步骤(iv)由以下组成:包括改变流体流的定向,以便从至少一个其他捕集区排出至少一个或多个第二微滴。这允许第二微滴的选择性释放。因此,可以使第一微滴和一个或多个第二微滴相互接触足够的限定时间,使得特别是由于第一微滴和第二微滴或(几个)第二微滴之间的相互作用,第二微滴或(几个)第二微滴经历改变(例如内容物的改变),然后被释放以分析。这还可以允许在方案错误的情况下,在微滴聚并之前,将第二微滴改变为其他第二微滴。
第三微滴
所述方法可以包括步骤(iii)或(iii’)之后的步骤(v),所述步骤(v)由以下组成:将第三微滴捕集在不再具有第二微滴的第二捕集区或(几个)第二捕集区中,使得第一微滴和第三微滴相互接触。第三微滴可以与第二微滴相同或不同。第三微滴可以与捕集在第一捕集区中的微滴融合或被释放,如上文针对第二微滴所描述的。步骤(vi)可以重复数次。这使得可以例如:
-顺序地稀释第一微滴或第二微滴的内容物,
-为捕集在第一捕集区中的第一微滴或(几个)第一微滴的内容物提供额外的试剂,
-数次更新一个或多个第一微滴的培养基,所述第一微滴含有捕集在第一捕集区中的细胞,
-以给定的时间间隔,将药品数次供应给含有病原体或病细胞的一个或多个第一微滴以评估其用于治疗的剂量学,或者
-数次供应细胞以形成具有数个细胞层的微组织。
毛细管捕集器的释放
所述方法可以包括步骤(vi),所述步骤(vi)由以下组成:将毛细管捕集器中存在的所有微滴排空到毛细管捕集器外,特别是使用施加大于施加在微滴上的捕集力的夹带力的流体流。这种步骤可以允许微滴被释放以便分析它们。
所述方法可以包括以下步骤:测量微流体系统的状态。该测量可以在滴融合和/或释放之前和/或之后进行。
优选地,获得的最终微滴或(几个)最终微滴可以包括识别其内容物的手段,特别是通过一些珠粒或颗粒的存在来标记、通过各种颜色或形状的存在来标记和/或通过比色信号或荧光信号来标记,所述比色信号或荧光信号与第一微滴和第二微滴的一者包含的化合物的初始浓度成比例。
可以使用下文描述的微流体系统来进行上述方法。
附加步骤
所述方法可以包括以下附加步骤:
-温育,和/或
-观察或测量,特别是通过成像,通过比色测量、荧光测量、光谱测量(UV、拉曼)或温度测量。
这些步骤可以在微滴的聚并之前和/或之后进行。
观察或测量的步骤使得可以在融合之前和/或之后确定每个微滴的内容物,并且例如确定融合之后发生的变化。
观察步骤例如在使用不同微滴的库用于在融合之前形成各种微滴的地图的情况下特别有用。
II.微流体装置
本发明还涉及用于捕集微滴的微流体装置,特别是用于实施前述权利要求中任一项所述的方法,所述装置包括具有以这种方式布置的第一捕集区和第二捕集区的毛细管捕集器:使得捕集在第一捕集区中的第一微滴和捕集在第二捕集区中的第二微滴在毛细管捕集器中相互接触,第一捕集区和第二捕集区以这种方式配置:使得由第一捕集区和第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
毛细管捕集器具有在微滴的一者上施加不同捕集力的两个区的事实使得可以具有捕集的微滴的选择性和以空间预定的方式捕集微滴,特别是避免第一微滴占据第二捕集区,从而防止第二微滴被捕集在所述第二捕集区中。当将多个第一微滴和第二微滴引入微流体系统时尤其是这样。
第一微滴和第二微滴接触的事实允许它们相互作用或者能够容易地融合。
捕集区
第一捕集区和第二捕集区优选地是腔。使用腔的形式的捕集区有利于微滴的操纵并且特别是捕集微滴和/或释放微滴。
第一捕集区和第二捕集区可以是分开的。
作为变型,第一捕集区和第二捕集区连接在一起。
优选地,当从上方观察时,毛细管捕集器缺乏旋转对称性。这种各向异性使得可以以空间预定的方式捕集微滴。
优选地,当从上方观察时,第一捕集区和第二捕集区并排布置。
第一捕集区和第二捕集区优选地通过其尺寸中的至少一者而不同。特别地,第一捕集区和第二捕集区具有不同的高度,第一捕集区明显比第二捕集区更高,或者第一捕集区和第二捕集区具有不同的形状,当从上方观察时,第一捕集区显著地具有比第二捕集区更大的截面。捕集力的差异则至少部分地与捕集区的大小(特别是高度或从上方观察时的截面)相关联。
“捕集区的高度”是指,在横截面中,微流体系统的捕集区的平均高度。
第二捕集区可以至少在接近第一捕集区的一个方向上变得更宽。这使得可以引导第二微滴在第一微滴的方向上以使第二微滴与第一微滴保持接触。事实上,为了使第二微滴的表面能最小化,第二微滴倾向于沿着第二捕集区朝向具有更大尺寸的区移动。
当从上方观察时,第二捕集区在接近第一捕集区时可以变得更宽。优选地,发散角α使得第二微滴总是与限定其的两个相反壁接触。第二捕集区可以变得更宽,发散角α不为零、特别是10°至120°。第二捕集区可以具有近似三角形或截顶三角形的形状。
第二捕集区可以具有在第一捕集区的方向上增加的高度。
优选地,第二捕集区的高度小于或等于第一捕集区的最大尺寸、更好地小于或等于第一捕集区的最大尺寸的一半。第二捕集区的高度受限的事实使得可以避免流体的流动线被第二捕集区扰动到防止第二微滴被捕集的程度。
第一捕集区的高度可以使得第一捕集区的体积大于或等于第一微滴的体积。这使得可以具有捕集力高的第一捕集区,其中第一微滴稍微变形、特别是具有凹形的下界面,这可以在沉降之后促进封装元件接触以形成簇(例如细胞簇)以形成球状体。
多个第二捕集区和/或第一捕集区
毛细管捕集器可以包括以这种方式布置的多个第二捕集区:使得每个捕集的第二微滴与捕集在毛细管捕集器中的第一微滴或第二微滴中的至少一者接触。
毛细管捕集器可以包括以这种方式布置的多个第一捕集区:使得每个捕集的第一微滴与捕集在毛细管捕集器中的第二微滴或(几个)第二微滴或第一微滴中的至少一者接触。
优选地,第一捕集区和第二捕集区布置成使得每个第二微滴与所述第一微滴或每个第一微滴连接。
第一捕集区和第二捕集区可以以这种方式布置:使得第二微滴全部与捕集在所述毛细管捕集器中的至少一个第一微滴接触。
至少两个第二捕集区或第一捕集区可以配置成使得它们施加在所述第二液体微滴的一个上的捕集力是不同的。被至少两个第二捕集区捕集的第二微滴可以在其性质的至少一者(特别是其最大尺寸)上是不同的。
作为变型,毛细管捕集器的所有第二捕集区是相同的。
多个毛细管捕集器
优选地,所述装置包括多个毛细管捕集器,每个毛细管捕集器包括第一捕集区和第二捕集区、优选地以这种方式布置:使得捕集在毛细管捕集器的第二捕集区中的第二微滴与捕集在所述毛细管捕集器的第一捕集区中的第一微滴接触。
每个毛细管捕集器可以包括上述特征中的一个或多个。
所述装置的所有毛细管捕集器可以各自包括至少一个第一捕集区和至少一个第二捕集区。
作为变型,毛细管捕集器中的一些毛细管捕集器各自包括至少一个第一捕集区和至少一个第二捕集区,并且毛细管捕集器中的一些毛细管捕集器仅包括单个捕集区,仅允许捕集单个第一微滴。这些包括单个捕集区的毛细管捕集器可以在实验期间用作对照。
所述装置每平方厘米可以包括至少10个毛细管捕集器,更好地是每平方厘米至少100个毛细管捕集器。大量的毛细管捕集器显著地使得可以进行组合化学、进行药品的筛选、研究蛋白质结晶、进行化学物质的滴定、或个性化治疗(特别是在癌症治疗的情况下)。
至少两个毛细管捕集器可以是不同的。例如,所述装置包括包含n个第二捕集区的第一毛细管捕集器和包含p个第二捕集区的第二毛细管捕集器,n不同于p。在第二微滴与第一微滴聚并之后,这种毛细管捕集器可以提供捕集在第一捕集区中的、具有不同浓度和/或大小的滴的微滴。微流体系统可以具有多于两个的具有不同量的第二捕集区的毛细管捕集器,以生产几种浓度和/或大小的微滴、特别是梯度的浓度和/或大小的微滴。获得的具有不同浓度的微滴可以形成可用于组合化学领域、用于研究蛋白质结晶、进行化学物质的滴定、或个性化治疗(特别是在癌症的情况下)的一组微滴。
作为变型,毛细管捕集器都是相同的。
所述装置可以包括具有捕集室的通道,毛细管捕集器或(几个)毛细管捕集器在捕集室中。
III.第二方面—操纵方法
根据第二方面,本发明还涉及用于操纵微流体系统中的多个第一微滴和多个第二微滴的方法,所述微流体系统包括具有捕集室的通道,所述捕集室包括分布在至少两个不同方向上的多个毛细管捕集器,每个毛细管捕集器具有第一捕集区和第二捕集区,所述方法包括以下步骤:
(i)将第一微滴捕集在每个毛细管捕集器的第一捕集区中,以及
(ii)将第二微滴捕集在每个毛细管捕集器的第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触,毛细管捕集器各自具有各向异性形式。
存在多个毛细管捕集器的事实使得可以同时形成第一微滴和第二微滴的多个对。于是第一微滴和第二微滴的不同对可以是不同的或相同的。
毛细管捕集器是各向异性的事实使得一旦微滴被捕集区捕集就可以具有微滴的预定义空间定位。
优选地,每个毛细管捕集器的第一捕集区和第二捕集区被配置成使得由第一捕集区和第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
所述方法可以使用用于捕集微滴的微流体系统进行,所述微流体系统包括具有捕集室的通道,所述捕集室包括分布在至少两个不同方向上的多个毛细管捕集器,每个毛细管捕集器具有以这种方式布置的第一捕集区和第二捕集区:使得在第一捕集区中捕集的第一微滴和在相同毛细管捕集器的第二捕集区中捕集的第二微滴相互接触,毛细管捕集器各自具有各向异性形式。
优选地,每个毛细管捕集器的第一捕集区和第二捕集区被配置成使得由第一捕集区和第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的微流体系统描述的一个或多个特征可以应用于根据本发明该方面的微流体系统。
IV.第三方面—操纵方法
根据第三方面,本发明还涉及用于操纵微流体系统中的至少一个第一微滴和至少一个第二微滴的方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述第二捕集区在接近第一捕集区时在至少一个尺寸上变得更宽,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,以及
(ii)将所述第二微滴捕集在所述第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触。
第二捕集区在接近第一捕集区时在至少一个尺寸上变得更宽的事实使得可以在捕集第二微滴期间朝向第一微滴引导第二微滴,并使第二微滴保持与第一微滴接触。事实上,为了使其表面能最小化,第二微滴倾向于沿着第二捕集区朝向具有更大尺寸的区移动。
在接近第一捕集区时,从上方观察,第二捕集区优选地变得更宽。
第二捕集区可以变得更宽,发散角α为10°至120°。
第二捕集区可以具有在第一捕集区的方向上增加的高度。
优选地,第一捕集区和第二捕集区被配置为:使得由所述第一捕集区和所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
所述方法可以使用用于捕集微滴的微流体系统进行,所述微流体系统包括毛细管捕集器,所述毛细管捕集器具有以这种方式布置的第一捕集区和第二捕集区:使得捕集在第一捕集区中的第一微滴和捕集在相同毛细管捕集器的第二捕集区中的第二微滴相互接触,第二捕集区在接近第一捕集区时在至少一个尺寸上变得更宽。
优选地,第一捕集区和第二捕集区被配置为:使得由所述第一捕集区和由所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的微流体系统描述的一个或多个特征可以应用于根据本发明该方面的微流体系统。
V.第四方面—细胞组装方法
根据第四方面,本发明还涉及用于在微流体系统中包含第一细胞的至少一个第一微滴和包含第二细胞的至少一个第二微滴的细胞组装的方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,以及
(ii)将所述第二微滴捕集在所述第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触,
(iii)通过将所述第一细胞和所述第二细胞粘附在一起,将第一微滴与第二微滴融合以形成微组织。
这种方法可以允许在体外生成具有受控结构的微组织,用于非常如实地模拟体内遇到的条件。事实上,在体内,不同的细胞类型通常根据特定的结构被布置在组织中,所述特定的结构对于最佳地再生以在器官水平重建功能是重要的。这种具有受控结构的三维培养物可以用于在患者中移植。例如,可以培养产生胰高血糖素的α细胞和产生胰岛素的β细胞,以产生可以移植到患者胰腺中用于治疗糖尿病的朗格汉斯胰岛。类似地,肝细胞和星状细胞可以在肝移植的情况下组合。
步骤(ii)可以在第一细胞聚集后进行,特别是在通过第一细胞粘附在一起形成的第一球状体的形成之后进行。如果含有第一球状体的第一微滴是液体,则在两个微滴融合之后,第二细胞将与第一微滴的内容物混合,然后沉降以直接获得第一球状体。如果步骤(iii)在第二细胞有时间形成第二球状体之前发生,则它们将在最初在第一微滴中的第一球状体的表面上沉降之后沉积。
步骤(iii)可以在第二细胞聚集之后进行,特别是在通过第二细胞粘附在一起形成的第二球状体的形成之后进行。因此,第一球状体和第二球状体可以融合在一起。
因此获得的微组织的结构取决于实验条件。
所述方法可以包括第一微滴的凝胶化的附加步骤,所述步骤在步骤(iii)之前进行、优选在步骤(ii)之前进行。这使得可以使细胞分隔。事实上,如果包含球状体的第一微滴在第二微滴到达之前凝胶化,则所包含的第二细胞在聚并之后将不再能够直接与第一球状体接触,例如哺乳动物细胞不能通过0.9重量%的琼脂糖基质。则第一细胞和第二细胞仅能通过旁分泌途径相互连通。
第一细胞和第二细胞可以是不同的细胞类型。
优选地,第一捕集区和第二捕集区被配置成使得由第一捕集区和由第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
可以使用根据前述方面的微流体系统中的一者来进行所述方法。
VI.第五方面—细胞培养方法
根据第五方面,本发明还涉及用于在微流体系统中包含细胞培养物的至少一个第一微滴和包含培养基的至少一个第二微滴的细胞培养方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,以及
(ii)将所述第二微滴捕集在所述第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触,
(iii)将所述第一微滴与所述第二微滴融合以更新在所述第一微滴中进行的细胞培养的培养基。
顺序注射培养基可以使培养基更新数次,以便例如允许在第一微滴中培养细胞或(几个)细胞。
第二微滴可以包含待测试的活性成分,以模拟药品施用的间歇性特性。例如,含有哺乳动物细胞球状体的滴可以每6小时与含有待测试的活性成分(特别是药品)的微滴融合。
在步骤(iii)之后,所述方法可以包括步骤(iv),所述步骤(iv)由以下组成:重复步骤(ii)和(iii),以再次更新在第一微滴中进行的细胞培养的培养基。
优选地,第一捕集区和第二捕集区被配置为:使得由所述第一捕集区和由所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
可以使用根据前述方面的微流体系统中的一者来进行所述方法。
VII.第六方面—形成凝胶化微滴的方法
根据第六方面,本发明还涉及用于在微流体系统中形成第一可凝胶化介质的至少一个第一微滴和第二可凝胶化介质的至少一个第二微滴的液体形式的多层凝胶化微滴的方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,
(ii)使所述第一捕集区中的所述第一可凝胶化介质凝胶化,
(iii)将所述第二微滴捕集在所述第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触,
(iv)将所述第一微滴与所述第二微滴融合。
这使得可以形成具有可变形状和/或机械性质(例如孔隙率和/或刚性)和/或化学性质(例如组成和/或浓度)的复杂凝胶微滴。
所述方法可以包括步骤(v),所述步骤(v)在步骤(iv)之前或之后发生,由以下组成:使第二可凝胶化介质凝胶化。
当步骤(v)在步骤(iv)之后发生时,凝胶化使得可以在第一微滴上形成第二凝胶的外层。这使得可以形成具有径向可变机械性质和/或化学性质的复杂凝胶微滴。这些凝胶的微滴可以与干细胞一起使用,所述干细胞的分化特别受凝胶的刚性控制。具有含有不同细胞类型的不同水凝胶层的凝胶的微滴也可以在化妆品测试的情况下模拟皮肤的不同层。具有胶原核和具有足够小的孔的琼脂糖外层的微滴可以用于生产神经元的球状体,仅可以通过外层的孔提取神经元的轴突投射(projection)。
当步骤(v)在步骤(iv)之前发生时,第二可凝胶化介质在第二捕集区中凝胶化。这使得可以形成具有径向可变形状、和/或机械性质和/或化学性质的复杂凝胶微滴。然后,形成的微滴在融合之前保持第一微滴和第二微滴的形状和布置。因此,不同捕集区的布置、形状和数量允许直接控制最终微滴的形状。这种微滴可以模拟复杂的形状。微滴的受控形状也可以用作微滴的标识符。
捕集在第二捕集区中的步骤(iii)之前或之后可以进行步骤(v)。
捕集在第一捕集区中的步骤(i)之前或之后可以进行步骤(ii)。
所述方法优选包括步骤(vi),所述步骤(vi)由以下组成:重复操作(iii)至(v)。
第一可凝胶化介质和第二可凝胶化介质可以是不同的。
优选地,第一捕集区和第二捕集区被配置为:使得由所述第一捕集区和由所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
可以使用根据前述方面的微流体系统中的一者来进行所述方法。
VIII.第七方面—封装细胞的方法
根据第七方面,本发明还涉及用于在微流体系统中封装至少一个第一微滴和至少一个第二微滴的方法,所述微流体系统包括具有第一捕集区和第二捕集区的毛细管捕集器,所述第一微滴和第二微滴中的一者包含可凝胶化介质、另一者包括多个细胞,所述方法包括以下步骤:
(i)将所述第一微滴捕集在所述第一捕集区中,
(ii)将所述第二微滴捕集在所述第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得第一微滴和第二微滴在毛细管捕集器中相互接触,
(iii)将所述第一微滴与所述第二微滴融合,
(iv)使所述可凝胶化介质凝胶化以将所述多个细胞封装在所述凝胶中。
该方法显著地使得可以获得封装在生物水凝胶中的球状体。事实上,为了能够以受控方式在微滴中形成球状体,必须能够在形成球状体期间保持液滴的内容物。琼脂糖非常适合该方案,因为它是热敏性水凝胶。琼脂糖在37℃保持液态,然后在4℃下30分钟后凝固,并在返回到37℃之后保持凝固。然而,哺乳动物细胞不能粘附在琼脂糖上,也不能消化琼脂糖。因此,该基质与体内遇到的细胞外基质非常不同。为了更好地模拟自然条件,使用水凝胶,例如I型胶原、纤连蛋白、或明胶,会是优选的。然而,控制它们的凝胶化更加困难。例如,I型胶原不能长时间在用于细胞培养的良好条件(低温或酸性pH)下保持液态。如果将细胞封装在一滴胶原中,该胶原在捕集细胞之后迅速凝胶化、而不是相互粘附并形成球状体,那么细胞将粘附在胶原上并沿其纤维单独地移动。
该问题可以通过上述方法解决。事实上,细胞可以被封装在第一捕集区内的第一液体微滴中,以便形成球状体。然后可以提供第二微滴,所述第二微滴将停留在第二捕集区中并且含有(特别是高浓度的)上述生物水凝胶中的一种。一旦捕集这些第二微滴,接触的第一微滴和第二微滴立即融合,仍然是液态的生物水凝胶将与包含球状体的第一微滴混合。然后可以发生凝胶化并因此将球状体封装在代表体内遇到的生物学条件的细胞外基质中。
步骤(ii)可以在第一细胞聚集之后进行,特别是在通过第一细胞相互粘附形成的球状体的形成之后进行。
优选地,第一捕集区和第二捕集区被配置为:使得由所述第一捕集区和所述第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
可以使用根据前述方面的微流体系统中的一者来进行所述方法。
IX.第八方面—稀释方法
根据第八方面,本发明还涉及用于在微流体系统中稀释感兴趣的化合物的方法,所述微流体系统包括第一毛细管捕集器和第二毛细管捕集器,所述第一毛细管捕集器包括第一捕集区和n个第二捕集区,所述第二毛细管捕集器包括第一捕集区和p个第二捕集区,n与p不同,所述方法包括以下步骤:
(i)将包含感兴趣的化合物的第一微滴捕集在每个第一捕集区中,所述第一微滴具有相同浓度的感兴趣的化合物,然后
(ii)将稀释化合物的第二微滴捕集在每个第二捕集区中,
同一个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得每个第二微滴与相同的第一毛细管捕集器或第二毛细管捕集器的第一微滴或第二微滴中的至少一者接触,使得在第一毛细管捕集器和第二毛细管捕集器的每一者中,第二微滴中的至少一者与相同的第一毛细管捕集器或第二毛细管捕集器的第一微滴接触,然后
(iii)将相互接触的所述第一微滴和所述第二微滴融合,以便在第一毛细管捕集器和第二毛细管捕集器中获得具有不同浓度的微滴。
如果第一滴含有恒定浓度的感兴趣的化合物,则在与可以例如含有稀释剂的第二微滴聚并之后可以获得空间浓度梯度。利用这种方法,可以从具有相同浓度的微滴开始、获得具有不同的受控浓度的一组微滴。这可以例如有利于形成一组不同浓度的微滴,用于组合化学、用于蛋白质结晶研究、用于滴定化学物质的后续方法、或者用于个性化治疗(特别是在癌症的情况下)。
优选地,每个毛细管捕集器的第一捕集区和第二捕集区被配置成使得由第一捕集区和由第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
所述方法可以通过用于稀释微滴的微流体系统使用,所述微流体系统包括第一毛细管捕集器和第二毛细管捕集器,所述第一毛细管捕集器包括第一捕集区和n个第二捕集区,第二毛细管捕集器包括第一捕集区和p个第二捕集区,n不同于p,第一毛细管捕集器和第二毛细管捕集器被配置成使得捕集在每个第二捕集区中的第二微滴与捕集在相应的第一毛细管捕集器和第二毛细管捕集器中的第一捕集区中的第一微滴接触。
优选地,每个毛细管捕集器的第一捕集区和第二捕集区被配置成使得由第一捕集区和由第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的微流体系统描述的一个或多个特征可以应用于根据本发明该方面的微流体系统。
X.第九方面—筛选方法
根据第九方面,本发明还涉及用于在微流体系统中筛选多个第一微滴和多个第二微滴的方法,所述微流体系统包括多个毛细管捕集器,每个毛细管捕集器具有第一捕集区和第二捕集区,第一微滴形成相同或其中至少y是不同的第一组微滴,第二微滴形成其中至少z是不同的第二组微滴,所述方法包括以下步骤:
(i)将第一微滴捕集在每个第一捕集区中,以及
(ii)将第二微滴捕集在每个第二捕集区中,
每个毛细管捕集器的第一捕集区和第二捕集区以这种方式布置:使得捕集在所述毛细管捕集器中的第一微滴和第二微滴在所述毛细管捕集器中相互接触,
(iii)将每个第一微滴和与其接触的第二微滴融合,以便在微流体系统中获得一组微滴,每个一组微滴对应于第一微滴和第二微滴的不同可能组合中的一种组合。
这种方法允许在单个微流体系统中快速筛选大量反应条件。
微滴在反应过程中是静态的事实使得更容易获得动力学数据。通过在微滴中使用非常小的体积,还具有化合物经济性的优点。
第一组微滴可以包括至少在感兴趣的第一化合物的含量上、特别是在感兴趣的第一化合物的浓度上不同的微滴。
第二组微滴可以包括至少在感兴趣的第二化合物的含量上、特别是在感兴趣的第二化合物的浓度上不同的微滴。
可以通过根据本发明第九方面的方法获得第一微滴或第二微滴。
第一化合物和第二化合物可以是一起反应并且希望优化初始浓度的化合物。因此,可以在小体积上并行进行几个反应,以确定给出最佳结果的化合物的初始浓度。
优选地,所述方法包括在步骤(iii)之前观察或测量的附加步骤(iv),特别是通过成像、通过比色测量、荧光测量、光谱(UV、拉曼)测量或温度测量的附加步骤(iv)。这种步骤使得可以形成不同微滴的布置的地图。
优选地,所述方法包括在步骤(iii)之后观察或测量的附加步骤(v),特别是通过成像、通过比色测量、荧光测量、光谱(UV、拉曼)测量或温度测量的附加步骤(v)。
作为变型,第一组微滴包含蛋白质,第一微滴是相同的,第二组微滴包含不同浓度的允许蛋白质结晶的溶液、特别是盐水溶液。所述方法则可以使得根据结晶溶液的浓度来研究蛋白质结晶。事实上,最佳结晶条件因蛋白质而异。
作为另一变型,第一组微滴包含化合物,第一微滴是相同的,第二组微滴包括不同浓度的滴定物质。在分析昂贵或少量可得的试剂的情况下,该应用会是特别有利的。
作为另一变型,第一组微滴包含一个或多个细胞,第二微滴各自包含限定浓度的待筛选的药品。
在类似的配置中,肝细胞在第一微滴中以球状体的形式培养,并且在每个第二捕集区中提供含有不同浓度的药品的第二微滴,所述药品的毒性是希望被评价的。
通过在微滴聚并之后几天分析存活率的结果,可以确定杀死一半细胞群的浓度。
该方法还可以评估不同抗生素之间的相互作用。可以生产形成具有不同浓度的抗生素A和B的一组微滴的微滴,并将微滴与含有细菌的微滴融合。含有细菌的微滴可以形成具有不同浓度细菌的一组微滴。这使得可以在单个捕集室中改变三个不同的参数,即抗生素A的浓度、抗生素B的浓度和细菌的初始浓度。
通过使用微流体,还可以使用非常小的体积,这在稀有样品(例如从活组织检查获得的细胞)的情况下可以是非常有利的。所述系统可以例如用于个性化医疗和癌症治疗的情况中。利用该系统,可以例如在第一微滴中以球状体的形式培养来自经受活组织检查的患者的肿瘤细胞,并通过提供第二微滴使该肿瘤细胞经受多种浓度的各种活性物质。在融合含有细胞和活性物质的微滴对之后,仅使用单个芯片和从活组织检查中获得的最小数量的细胞,可以确定哪种活性物质以及什么浓度对于特定患者最有效。
优选地,同一个毛细管捕集器的第一捕集区和第二捕集区被配置成使得由第一捕集区和第二捕集区施加在相同的第一液体微滴或第二液体微滴上的捕集力是不同的。
上文结合根据本发明前述方面的方法或装置描述的一个或多个特征可以应用于根据本发明该方面的方法。
可以使用根据前述方面的微流体系统中的一个微流体系统来进行所述方法。
附图说明
参考附图,通过阅读本发明的非限制性实施方式的以下描述,可以更好地理解本发明,其中:
图1A显示根据本发明的毛细管捕集器的横截面,
图1B是图1A中毛细管捕集器沿I的俯视图,
图2是捕集两个微滴之后图1中毛细管捕集器的示意性俯视图,
图3和图4是从上方观察的具有微滴的毛细管捕集器的变型,
图5A显示毛细管捕集器的横截面变型,
图5B是图5A中毛细管捕集器沿V的俯视图,
图6至图44是从上方观察的具有微滴的毛细管捕集器的变型,
图45至图47以横截面显示具有微滴的毛细管捕集器的变型,
图48以横截面显示毛细管捕集器的变型,
图49示意性地显示从上方观察的捕集室,
图50是从上方观察的捕集室的示意图,
图51是毛细管捕集器的剖视图,
图52是根据本发明的方法的示意图,
图53示出根据本发明的操纵毛细管捕集器中的微滴的变型方法,
图54至图59示出根据本发明的操纵毛细管捕集器中的微滴的方法的变型,
图60至图62示出本发明的实施方式,
图63至图65示出从上方观察的毛细管捕集器的变型,以及
图66示出通过毛细管捕集器的实例捕集微滴,所述毛细管捕集器包括在第一微滴和第二微滴上施加不同捕集力的两个区。
具体实施方式
本发明涉及用于操纵在微流体系统中的至少一个第一微滴和至少一个第二微滴的方法。
微流体系统5包括上壁7和下壁8,在它们之间形成用于微滴流通的通道9和至少一个毛细管捕集器12。
毛细管捕集器
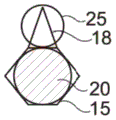
在图1A和图1B所示的示例中,毛细管捕集器12形成在微流体系统的横截面中具有恒定高度的下壁8中的腔,微滴可以在所述腔中停留。从上方观察,毛细管捕集器12具有圆形的第一捕集区15,以及与所述第一捕集区15相邻的三角形的第二捕集区18。
第一捕集区15和第二捕集区18在给定的微滴上施加不同的捕集力,特别是由于其形状不同。这里,第一捕集区15比第二捕集区18施加更大的捕集力。
当第一微滴20被引入微流体系统时,它被捕集在具有用于该微滴的最大捕集力的捕集区中,在这种情况下是第一捕集区15。当引入第二微滴25时,它被捕集在空缺的(free)捕集区,这里是第二捕集区18,如图2所示。
在图中,第一微滴20显示为黑色,第二微滴25显示为透明,但这并不表示两个微滴之间的内容物的特定差异。
第一捕集区15的直径a大约等于第一微滴20一旦被捕集在第一捕集区中时从上方观察的表观直径D1。
两个捕集的微滴20和25相互接触,特别是由于两个捕集区15和18之间相对于两个微滴20和25的直径的小的间距。此外,由于第二捕集区18的三角形形状,两个微滴20和25保持接触。事实上,第二微滴25与第二捕集区18的两个相对的壁27和28接触,壁27和28在第一捕集区15的方向上相互远离地移动,通过其自然倾向于总是最小化其表面能,使得第二微滴25在两个相对的壁27和28之间沿壁27和28的加宽方向平移(move in translation),即朝向第一捕集区15并因此朝向第一微滴20移动。
在图1A和图2中,两个壁27和28在其之间形成大致等于45°的发散角α。
在图2所示的示例中,第一微滴20的直径D1大于第二微滴25的D2。
第二捕集区18在第二微滴25上施加的捕集力大于它将在第一微滴20上施加的捕集力。实际上,尽管无论微滴的直径如何,第二捕集区的设计都是相同的,但是第二微滴25的直径相比第一微滴20的直径更好地适应第二捕集区18的形状和大小。然而,可以是其他情况,并且第二微滴25可以具有与第一微滴20相同的直径。
作为变型,第一微滴20和第二微滴25在其另一个性质(特别是其表面状态、其粘度或其重量)方面是相互不同的。
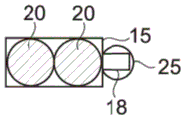
如图3和图4所示的变型,毛细管捕集器10包括两个并置的分开的腔,分别形成圆形的第一捕集区15和三角形的第二捕集区18。毛细管捕集器的两个捕集区15和18足够接近,以使两个捕集的微滴20和25相互接触。优选地,捕集区15和18的重心之间的距离e小于(如图4所示)或者等于(如图3所示)两个微滴的半径之和SR。
作为变型,如图5A和图5B所示,第一捕集区可以是六边形形状,第一捕集区15可以具有与第二捕集区18的h2不同的高度h1、特别是h1大于h2。则第一捕集区15施加比第二捕集区18更大的捕集力。
如图6中所示的变型,第二捕集区18具有长三角形的形状,其具有小的发散角α,这里大约等于10°,使得可以捕集相互接触的一串第二微滴25,这里是两个第二微滴25a和25b。则可以认为第二捕集区18实际上由两个第二捕集区18a和18b组成,使得每个捕集区能够捕集第二微滴25a和25b。在这种情况下,第二微滴25a经由第二微滴25b连接到第一微滴20。第二捕集区18a和18b施加在第二微滴25a和25b上的捕集力可以根据其位置而不同。这里,第二捕集区18b在最靠近第一捕集区15的第二微滴25b上施加更强的捕集力。然而,取决于第二捕集区18的形状,可以是其他情况。
作为未示出的变型,两个第二捕集区18a和18b可以在捕集的第二微滴25a和25b上施加相同的力。
作为未示出的变型,毛细管捕集器可以具有多于两个的第二捕集区,所述第二捕集区被配置为形成一串捕集的第二微滴,所述一串捕集的第二微滴自身通过形成其的第二微滴中的至少一个与第一捕集区中捕集的第一微滴接触。
因此可以设想包括多个捕集区的更复杂形状的毛细管捕集器,所述捕集区被配置成使得捕集的微滴全部直接地或通过其他微滴连接在一起。
如图7至图9所示的变型,毛细管捕集器12具有围绕第一捕集区15分布的多个相同的第二捕集区18,使得被第二捕集区18中的一个捕集的每个第二微滴25与第一捕集区20接触。
如图所示,第二捕集区18可以均匀地分布在第一捕集区15周围。但是,可以是其他情况。
如图10所示的变型,毛细管捕集器12具有多个第一捕集区15,所述第一捕集区15以这种方式布置:由所述第一捕集区15捕集的第一微滴各自与至少一个其他第一微滴和多个第二捕集区18接触。这里,毛细管捕集器12具有两个融合的第一捕集区15和两个第二捕集区,其中一个融合到每个第一捕集区。
如图11中所示的变型,毛细管捕集器12可以具有多个不同形状的第二捕集区18a和18b。第二捕集区可以用于接收不同的第二微滴25a和25b。例如,如图所示,毛细管捕集器具有第二捕集区18a和第二捕集区18b,所述第二捕集区18a与第一捕集区15形成单个腔,所述第二捕集区18b与第一捕集区15分开。第二捕集区18a和18b在同一个微滴上施加不同的捕集力。第二捕集区18a用于捕集第二微滴25a,所述第二微滴25a的直径大于由第二捕集区18b捕集的第二微滴25b的直径。
本发明不限于上述毛细管捕集器12的形状的示例。毛细管捕集器12可以具有各种形状,特别是根据所需的应用的各种形状。图12至图45示出可想到的形状。
例如,如图12所示,第一捕集区15可以具有多边形形状、特别是正方形,并且第二捕集区18可以具有三角形形状并且融合到正方形的一侧。
如图13所示的变型,第二捕集区18融合到形成第一捕集区15的正方形的拐角部。
如图14所示的变型,第二捕集区18具有矩形形状、特别是正方形。
如图15所示,第二捕集区18可以在第一捕集区15的方向上变得更宽,并且可以具有在俯视图中具有弯曲轮廓的相对的壁27和28,第二捕集区18朝向其端部逐渐变细。
如图16所示,毛细管收集器12可以是心形的,心形的瓣片形成两个第一捕集区15,心形的尖端形成第二捕集区18。
如图17所示,第一捕集区15可以具有五边形形状,第二捕集区18从五边形的拐角部延伸。
如图18所示,毛细管捕集器12可以具有六边形形状,第二捕集区18从六边形的侧边(side)延伸。
第一捕集区15可以具有正方形形状(如图19所示)或者具有圆形形状(如图20所示),第二捕集区18可以具有圆形形状。
作为变型,第二捕集区18具有三角形形状,但是通过其拐角部中的一个连接到第一捕集区15,如图21所示。因此,第二捕集区18向外变得更宽。
作为另一变型,第二捕集区18具有多边形形状、特别是六边形,如图22所示。
作为另一变型,毛细管捕集器12可以包括两个第二捕集区18,其在第一捕集区15的相反拐角部融合到第一捕集区15,如图33所示。
如图23所示,毛细管捕集器12可以具有椭圆形形状的第一捕集区15和三角形形状的两个第二捕集区18,所述两个第二捕集区18与第一捕集区融合并从椭圆形的较长边开始在第一捕集区的某个边彼此相反地延伸。
如图34所示的变型,第二捕集区18具有与图15中相同的形状。
如图24所示,毛细管捕集器12可以具有两个第二捕集区18,其不是均匀地分布在第一捕集区15周围,而是在两个第二捕集区18之间形成间隔角β。
第一捕集区15可以具有矩形形状,并且第二捕集区18具有正方形形状、通过矩形的短边与第一捕集区15融合。根据第一微滴20的大小,第一捕集区15则可以捕集单个第一微滴20(如图25所示)或捕集多个第一微滴20(如图26所示)。
如图27所示的变型,第二捕集区18可以通过矩形的一个长边融合到第一捕集区15。
第一捕集区15可以具有椭圆形形状,第二捕集区18可以从第一捕集区15的长边开始融合到所述第一捕集区15(如图28所示)或者通过第一捕集区15的短边融合到所述第一捕集区15(如图29所示)。
毛细管捕集器可以包括多个第二捕集区18,其中至少两个是不同的,特别地其大小是不同的,如图30所示。
在图31所示的示例中,毛细管捕集器12具有葫芦的形状,其底部形成第一捕集区15并且头部形成第二捕集区18。
如图32所示的变型,毛细管捕集器12具有三角形形状,靠近较宽底部的部分形成第一捕集区15并且顶部形成第二捕集区18。
在图35所示的示例中,第一捕集区15具有正方形形状,并且毛细管捕集器12具有相同正方形形状的两个第二捕集区18,每个第二捕集区18通过其拐角部中的一个融合到第一捕集区15的拐角部。
在图36至图41所示的示例中,毛细管捕集器12具有三个第二捕集区18,并且第一捕集区15和第二捕集区18可以各自具有上述所有形状。
在图42至图44所示的示例中,毛细管捕集器12具有多个不同形状的第二捕集区。例如,第二捕集区中的一者18a具有三角形形状,而第二捕集区中的另一者18b具有矩形形状,所述矩形足够长以形成多个第二捕集区并捕集一串第二微滴25(如图42所示),或者第二捕集区可以具有上述形状。
在横截面中,第一捕集区15和第二捕集区18在其整个宽度上可以具有恒定的高度。
如图45所示的变型,第一捕集区15在横截面中具有朝向腔的底部倾斜的边缘。
如图46所示的另一变型,第二捕集区18具有朝向第一捕集区倾斜的壁。这显著地使得可以使第二微滴25与第一微滴20保持接触。
如图47所示的另一变型,第一捕集区和第二捕集区具有至少一个倾斜的壁。
如图48所示的变型,毛细管捕集器12至少部分地由微流体系统的上壁7的腔形成。
作为变型,毛细管捕集器12至少部分地由微流体系统的侧壁中的一个侧壁的腔形成。
如图47所示的变型,毛细管捕集器由下壁8的腔和上壁7的腔形成。
如图63至图65所示的变型,毛细管捕集器是各向异性的并且包括具有相同捕集力的多个捕集区,使得毛细管捕集器在其各个区中捕集多个相同的微滴。例如,如图61和图62所示,毛细管捕集器12可以具有近似三角形的形状,并且可以根据微滴的大小捕集3个或4个相同的微滴。如图63所示的变型,毛细管捕集器12具有五臂的星形形状并且能够捕集5个或6个相同的微滴。
微流体装置
用于微滴的流通的通道9可以包括多个毛细管捕集器12。
特别地,通道9可以包括二维的捕集室30,其中毛细管捕集器12根据表格或矩阵中的两个空间方向在空间上分布,如图49所示。在该图中,毛细管捕集器12以多个阵列的形式相互以相等的距离布置,但也可以是其他情况。毛细管捕集器12可以根据任何周期性的或非周期性的方案布置。
捕集室30中的毛细管捕集器12的数量可以从每室一个到每平方厘米数千个。
在毛细管捕集器12的重心之间限定的距离p优选地大于或等于要捕集的最大微滴的大小,特别是大于或等于从上方观察到的第一滴的表观直径(例如20μm至1cm),所述第一滴限制在毛细管捕集器外部的壁7和8壁之间的通道中。
毛细管捕集器的数量可以大于或等于每平方厘米200个毛细管捕集器,更好地是每平方厘米2000个毛细管捕集器。因此,微滴的受控组合可以在相同的捕集室30中在数百个甚至数万个捕集区中并行进行。
毛细管捕集器12可以如上所述。
毛细管捕集器12可以全部相同。
作为变型,至少两个毛细管捕集器12可以是不同的,特别是通过其形状、大小、高度或定向,或者通过第一捕集区15和第二捕集区18的数量、形状、高度或定向。这使得可以根据毛细管捕集器12具有不同的条件。
作为未示出的变型,通道9可以是一维的并且包括沿其长度分布的毛细管捕集器12的阵列。
本发明不限于上述微流体系统的形状。微流体系统可以具有不同的形状,特别是根据所需的应用具有不同的形状。
微滴
优选地,通道9填充有与微滴不混溶的流体。该流体可以是静止的或移动的。当该流体移动时,该流体的流优选地沿着流体流体线(未示出)定向并且从流体入口31流通到流体出口32。
微滴是例如油性液体中的含水微滴或含水液体中的油的微滴。
优选地,第一微滴20和第二微滴25具有微米级的直径D1和D2,特别是20μm至5000μm。
第一微滴20优选地不同于第二微滴25,特别是关于其大小和/或其组成。
第一微滴20或第二微滴25可以形成一组微滴,其中至少一定数量的微滴是不同的。
第一微滴20和/或第二微滴25可以包含识别性化合物,允许在接触的第一微滴20与第二微滴25聚并之前、期间和/或之后识别它们。这种识别性化合物或这些识别性化合物可以是例如一定数量的珠粒或颗粒、各种颜色或形状的化合物、或发射与化合物在微滴中的浓度成比例的比色信号或荧光信号的化合物。在一组第一微滴和/或一组第二微滴包含不同浓度的感兴趣的化合物和/或感兴趣的不同化合物的情况下,因此可以将第一微滴和/或第二微滴在捕集室中的位置与其组成联系在一起,以形成捕集在捕集室中的微滴的地图。
作为变型,第一微滴的识别性化合物或(几个)识别性化合物与第二微滴的一种或多种识别性化合物相互作用,以允许识别融合后获得的微滴。例如,微滴的融合可以导致化学反应,其中至少一种产物可以被识别。
优选地,通道9填充有含表面活性剂的流体。表面活性剂允许微滴的稳定化及其形成的再现性。此外,表面活性剂可以防止将微滴从生产装置输送到毛细管捕集器时或在毛细管捕集器中在接触的情况下微滴的自发聚并。
对于油的微滴,表面活性剂是例如十二烷基硫酸钠。
作为变型,微滴通过一些其他方式稳定,特别是微滴可以凝胶化、或通过吸附两亲性纳米颗粒来稳定,如以下文章中描述的:Pan,M.,Rosenfeld,L.,Kim,M.,Xu,M.,Lin,E.,Derda,R.,&Tang,S.K.Y.(2014).Fluorinated Pickering Emulsions ImpedeInterfacial Transport and Form Rigid Interface for the Growth of Anchorage-Dependent Cells.Applied Materials&Interfaces,6,21446–21453,其通过引用并入。
操纵方法
图52示出操纵第一微滴和第二微滴的方法的示例。
在步骤40中生产第一微滴20。已经提出许多方法用于在流动相中形成这些第一微滴。例如,可以提到以下方法的示例:
a)在例如以下中描述的称为“流动聚焦“的方法:S.L.Anna,N.Bontoux和H.A.Stone,“”Formation of dispersions using'Flow-Focusing’in microchannels”,Appl.Phys.Lett.82,364(2003),其内容通过引用并入本文,
b)例如由以下描述的称为“步骤乳化”的方法:R.Seemann,M.Brinkmann,T.Pfohl和S.Herminghaus,“Droplet based microfluidics.”Rep.Prog.Phys.,第75卷,第1期,第016601页,2012年1月,其内容通过引用并入本文,
c)例如由以下描述的结合方法“流动聚焦”和“步骤乳化”的方法:V.Chokkalingam,S.Herminghaus,以及R.Seemann,“Self-synchronizing pairwiseproduction of monodisperse droplets by microfluidic step emulsification,”Appl.Phys.Lett.,第93卷,第25期,第254101页,2008,其内容通过引用并入本文,
d)例如由以下描述的称为“T连接”的方法:G.F.Christopher和S.L.Anna,“Microfluidic methods for generating continuous droplet streams,”J.Phys.D.Appl.Phys.,第40卷,第19期,第R319-R336页,2007年10月,其内容通过引用并入本文,
e)例如由以下描述的称为“约束梯度”的方法:R.Dangla,S.C.Kayi和C.N.Baroud,“Droplet microfluidics driven by gradients of confinement,”Proc.Natl.Acad.Sci.U.S.A.,第110卷,第3期,第853-858页,2013年1月,其内容通过引用并入本文,或
f)例如由以下描述的称为“微分段流”的方法:A.Funfak,R.Hartung,J.Cao,K.Martin,K.H.Wiesmüller,O.S.Wolfbeis,以及J.M.“Highly resolved dose-response functions for drug-modulated bacteria cultivation obtained byfluorometric and photometric flow-through sensing in microsegmented flow,”Sensors Actuators,B Chem.,第142卷,第1期,第66-72页,2009,其内容通过引用并入本文,其中,将不同受控比例的两种溶液在微流体系统外以功能水平混合,形成由不混溶相分离的微升滴,然后通过将这些微升滴例如注入到含有斜面的微流体系统中将这些滴分成微滴的方法。
这些方法特别使得可以形成具有大致相等尺寸的多个微滴。获得的微滴的尺寸可以通过改变微滴的形成参数来控制,特别是装置中流体的流通速度和/或装置的形状。
第一微滴20可以在与所述方法相同的微流体系统上或在不同的装置上生产。在后一种情况下,第一微滴20可以在注入微流体系统之前存储在一个或多个外部容器中。这些第一微滴20可以全部相同,或者它们中的一些可以具有不同的组成、浓度和/或大小。
在形成这些第一微滴20之后,所述这些第一微滴20可以通过流体流夹带和/或通过通道9的导轨形式的斜面或凸起夹带而被输送到毛细管收集器12。在两种情况下,添加导轨可以选择性地优化毛细管捕集器12的填充,例如结合使用红外线激光,如以下描述的:E.Fradet,C.McDougal,P.Abbyad,R.Dangla,D.McGloin,以及C.N.Baroud,“Combiningrails and anchors with laser forcing for selective manipulation within 2Ddroplet arrays,”Lab Chip,第11卷,第24期,第4228-4234页,2011年12月。
如果在微流体系统外部进行微滴的生产,则可以通过连接例如生产系统和捕集系统的管、或通过用注射器抽吸和注射将它们直接从储存器运输到微流体系统。
第一微滴20夹带在微流体系统中,使得它们所经受的夹带力小于第一捕集区15在第一微滴20上的捕集力。然后在步骤42中将第一微滴20捕集在毛细管捕集器12中,特别是捕集在第一捕集区15中。如果夹带流施加在第一微滴20上的第一微滴20上的夹带力大于第二捕集区18的捕集力,则第一微滴20不被捕集在保持空缺的第二捕集区18中。
否则,第一微滴20可以被捕集在第二捕集区18中,尤其是如果捕集器和滴的大小合适的话。然后可以通过增加施加到所有第一微滴20的夹带力将所述第一微滴20从第二捕集区18中除去,例如通过增加流体流的速度,或者当没有流体流时,通过在步骤44中添加流体流。
作为变型,第一微滴20可以通过例如在国际申请WO 2016/059302中描述的称为“破坏毛细管捕集器中的滴”的方法形成,其内容通过引用并入本文。在这种情况下,第一微滴20直接形成在第一捕集区15中。
在步骤46中生产第二微滴25。显示该步骤在步骤44之后,但是该步骤可以在先进行。可以产生第二微滴25并将其引入微流体系统中,如上文关于第一微滴20所描述的。
第二微滴25以这种方式夹带在微流体系统中:使得它们所经受的夹带力小于第二捕集区18在第二微滴25上的捕集力。然后在步骤48中将第二微滴25捕集在第二捕集区18中。当第二微滴25被流体流夹带时,所述流体流在第一捕集区15中捕集的第一微滴20上施加夹带力,所述夹带力优选小于或等于第一捕集区15在第一微滴20上的捕集力,使得第一微滴20保持被捕集。
在每个阶段,所述方法可以包括首先测量系统状态的步骤。该测量可以是简单的成像,或者例如比色测量、荧光测量、光谱(UV、拉曼)测量或温度测量。在使用包含如上所述的识别性化合物的不同的第一微滴和/或第二微滴20的组的情况下,该测量可以是特别有用的。
当几个微滴在同一个捕集器中接触时,可以在步骤50中以受控方式使它们融合以混合它们的内容物。该聚并可以是选择性的也可以不是选择性的。
为了融合微流体系统中、特别是在捕集室30中、接触的所有微滴,微流体系统用不含表面活性剂的流体灌注。微流体系统的流体中表面活性剂的浓度降低,这使得可以将表面活性剂在界面处的吸附平衡转变为解吸附。微滴失去其稳定作用并与它们接触的微滴自发融合。
作为变型,微流体系统用含有去稳定剂的流体灌注。在含水微滴的情况下,去稳定剂例如是氟化油中的1H,1H,2H,2H-全氟辛-1-醇。
作为另一变型,在微流体系统中、特别是在捕集室30中、接触的所有微滴通过应用外部物理刺激(例如机械波、压力波、温度变化或电场)来融合。如图50所示,电极35可以放置在捕集室的任一侧,以便融合在捕集室之间接触的所有微滴。
为了选择性地融合微滴,可以使用红外线激光,如以下描述的:E.Fradet,P.Abbyad,M.H.Vos和C.N.Baroud,“Parallel measurements of reaction kineticsusing ultralow volumes,”Lab Chip,第13卷,第22期,第4326-4330页,2013年10月,或如图51所示,可以激活在捕集区之间的微滴界面水平处的局部电极37,或者可以将机械波聚焦在一个或多个点上。
本发明不限于上述聚并的示例。任何使得可以使接触的两个微滴之间的界面不稳定的方法都可以用于融合微滴。
然后可以测量所获得的微滴的状态和/或实时观察微滴。这使得可以例如研究化学反应或生物化学反应的动力学。
选择性捕集
当毛细管捕集器12或(几个)毛细管捕集器12具有多个第二捕集区18时,第二捕集区18或(几个)第二捕集区18的与施加在第二微滴25上的夹带力的方向和感觉(sense)有关的位置可以允许进行选择性捕集。
以毛细管捕集器的情况为例,其具有布置在第一捕集区15的两侧的并且在施加的夹带力的方向上对齐的两个第二捕集区18m和18v,如图53所示。在根据步骤44将第一微滴20捕集在第一捕集区15的水平之后,根据步骤48a向第二微滴25m提供沿方向F1定向的夹带力。如果第二捕集区18m和18v中的捕集力足够低,则第二微滴25m仅被捕集在相对于方向F1位于第一捕集微滴20上游的第二捕集区18m中。即使下游的第二捕集区18v是相同的,其相对于第二微滴25m的位置也是不同的,因为在流体的情况下,第二微滴25的流通线绕过第一微滴20,避免了第二捕集区18v。此外,通过捕集的第一微滴20的存在促进了将第二微滴25m保持被捕集在上游,所述第二微滴25m可以在所述第一微滴20上静置。在上游捕集第二微滴25m之后,可以在第二微滴25v上施加沿与F1相反的方向F2定向的夹带力,以根据步骤48b将第二微滴25v中的一个捕集在仍然空缺的第二捕集区18v中。
如图54所示,还可以使用第二捕集区18或(几个)第二捕集区18的与施加在第二微滴25上的夹带力的方向和感觉有关的位置以执行选择性释放以便例如在一个或多个第二捕集区18中捕集另一个不同的第二微滴25。以前面的毛细管捕集器的情况为例,如果第二捕集区18m和18v中的捕集力各自足够强以捕集第二微滴25m,而不管步骤48a中施加在第二微滴25m上的夹带力的方向,则当施加这种夹带力时,相对于在F3方向上定向的夹带力上游的第二微滴25m比下游更好地保留的事实可以用于根据步骤52选择性地释放被捕集在下游的第二微滴25m。实际上,第一微滴25m可以变形并且可以静置在第一捕集区15中捕集的第一微滴20上,因此释放第一微滴25m所需的力比释放下游的第二微滴25m所需的力更强。然后,可以在释放的第二捕集区18v中捕集与已经在步骤48b中捕集的第二微滴25m不同的第二微滴25v。
微滴捕集的时序(chronology)实例
在图66所示的具有两个捕集区的毛细管捕集器的实施方式中,所述图66的纵坐标显示捕集力与流体动力曳力相比的强度,横坐标显示时间,所述方法包括以下步骤:
-将第一微滴捕集在毛细管捕集器的第一区中,由第一区施加在第一微滴上的捕集力F4大于由流施加在第一微滴上的流体动力曳力Ft1,使得第一微滴保持被捕集在第一区中,曳力Ft4在F4和F5之间,F5表示由毛细管捕集器的第二区施加在第一微滴上的捕集力,
-然后,将第二微滴捕集在毛细管捕集器的第二区中,在第二区中加载第二微滴期间由流施加在第二微滴上的流体动力曳力Ft5在F5和F3之间,F3优选小于F4,F3是由捕集器的第二区施加在第二微滴上的捕集力。曳力Ft5小于F4。
因此,分别在毛细管捕集器的两个区中获得两个微滴的选择性捕集。
根据微滴大小的捕集
在同一个微流体系统中的各种毛细管捕集器12的第二捕集区18可以具有不同的特性,特别是不同的大小。这使得可以例如在不同的毛细管捕集器12中捕集不同的第二微滴25,以便获得不同的微滴。例如,对于包含在第二微滴中的给定浓度的要素,第二微滴中包含的要素的量取决于所述第二微滴的大小。因此,通过在相同的捕集室30中产生例如不同大小的第二捕集区18,可以选择性地捕集不同大小的第二微滴25,其中第二微滴25的大小对应于第二捕集区18的每个大小。
图55示出三个毛细管捕集器12a、12b和12c,其具有不同大小的第二捕集区18a、18和18c。第一捕集区15填充有第一微滴20。提供都具有相同浓度但具有不同大小的第二微滴25a、25b和25c。第二捕集区18a、18b和18c各自对应于第二微滴的一个大小,然后第二微滴25a、25b和25c被捕集在与其最佳对应的第二捕集区18a、18b或18c中。
优选的是通过使第二捕集区18a、18b和18c相对于第二微滴中的最大第二微滴18a的捕集力在微流体系统中的第二微滴的夹带力的方向上(尤其是在流体流的方向上)增加,来放置毛细管捕集器12a、12b和12c。因此,第二微滴25a、25b和25c首先遇到第二捕集区18c(其中仅捕集最小的第二微滴25c),然后遇到第二捕集区18b(其中仅捕集第二微滴25b),最后遇到第二捕集区18a(其中捕集最大的第二微滴25a)。
作为变型,微滴25a、25b和25c的另一个参数不同,并且它们特别地包括不同的要素。
这使得可以获得一组微滴,其中至少一些微滴是不同的,特别是在其化合物浓度和/或其组成方面是不同的。
顺序聚并
如图56所示,可以重复步骤46、48和50以执行顺序聚并。在每个毛细管捕集器12中,在步骤50之后获得的微滴成为新的第一微滴80,所示第一微滴80具有在毛细管捕集器12中融合的第一微滴20或(几个)第一微滴20和第二微滴25或(几个)第二微滴25的体积之和作为其体积。当第二捕集区18或(几个)第二捕集区18再次空缺时,可以提供与初始第二微滴25或(几个)第二微滴25相同或不同的一个或多个第三微滴58以执行新的聚并并且获得新的微滴90,其本身成为新的第一微滴等等。随着连续的聚并,微滴将由于添加不同体积的聚并微滴而变得更大,直到它变得如此大以至于它阻止在第二捕集区18中捕集新的微滴。可以在同一个捕集毛细管12中进行的最大聚并数取决于连续聚并的微滴的体积。
注意,如果聚并步骤由以下组成:从外相除去表面活性剂或包括化学地使表面活性剂去稳定化,则在不同的聚并之间会需要稳定化步骤。在实践中,在将一个或多个新的微滴带入毛细管捕集器之前,必须用与含有表面活性剂的微滴不混溶的流体灌注捕集室。
执行顺序聚并的能力有几个应用。如果捕集在毛细管捕集器12的第一捕集区15中的第一微滴20包含细胞(例如细菌、酵母或哺乳动物细胞),则顺序聚并可以通过在预定时间依次融合含有培养基的第二微滴25来使培养基更新数次。
这也可以用于模拟药品的间歇性施用特性。例如,含有哺乳动物细胞球状体并被捕集在毛细管捕集器12中的第一微滴20每6小时与药品的第二微滴25融合。
滴的浓度梯度
捕集室30中的毛细管捕集器12可以是不同的,并且其位置是可以控制的。可以例如使毛细管捕集器12具有不同数量的第二捕集区。
如图57所示,捕集室30可以包括分别具有均匀分布在第一捕集区15周围的一个、两个、三个和四个相同的第二捕集区18的毛细管捕集器12a、12b、12c和12d。如果第一微滴20是相同的并且包含感兴趣的化合物,在与可以例如含有稀释剂的、捕集的第二微滴25聚并之后,则可以在微流体室中获得微滴100、105、110和115,形成在此由不同的灰度表示的四种浓度的感兴趣的化合物的空间梯度。
微滴组
如上所述在包含毛细管捕集器12的腔中注射包含不同化合物和/或不同浓度的微滴组提供了许多应用。
以2cm2的捕集室(每个捕集室具有1000个毛细管捕集器)为例,使得可以捕集第一微滴20和第二微滴25。第一微滴20形成一组微滴,其含有20种不同浓度的第一化合物。第二微滴25含有10种不同浓度的第二化合物。通过将第一微滴20和第二微滴25融合在毛细管捕集器12中,可以获得微滴矩阵,每个微滴矩阵在统计上对应于第一微滴20和第二微滴25的200种可能组合中的一种组合。
微滴是静态的事实也使得更容易获得动力学数据。通过在微滴中使用非常小的体积,还具有试剂经济性的优点。
捕集室30可以具有大于2cm2的表面积,使得在微流体系统中可以并行进行的不同反应的数量进一步大幅增加。
包含在第一微滴20和第二微滴25中的化合物可以是相互反应的化学分子,并且其初始浓度需要被优化。上述方法使得可以进行大规模组合化学。则微滴可以包括一个或多个识别性装置。这可以使得可以例如测量最终产物的浓度,例如通过荧光或光谱法。
作为变型,第一微滴20和/或第二微滴25可以包含各种浓度的蛋白质、酶和细胞。
上述微流体系统和方法使得可以研究蛋白质结晶。事实上,从纯化的蛋白质溶液中获得晶体是确定其三维结构的必要步骤,因为这使得可以获得X射线衍射图案。然而,蛋白质总是以非常少的量获得,并且最佳结晶条件因蛋白质而异。
例如,使用具有数个毛细管捕集器12的捕集室30,每个毛细管捕集器使得可以捕集第一微滴20和第二微滴25,得到包含不同浓度的盐水溶液的第一微滴组和包含不同浓度的感兴趣的蛋白质的第二微滴组。通过将第一微滴20和第二微滴25在毛细管捕集器12中融合,可以获得表示不同浓度的盐水溶液和蛋白质的条件的微滴矩阵,从而能够确定允许最佳蛋白质结晶的浓度。
通过在毛细管捕集器12上固定第一微滴20,所述第一微滴20包括在整个捕集室中具有相同浓度的感兴趣的要素,并且通过将第一微滴20与从包含不同浓度的滴定物质的一组微滴获得的第二微滴25融合,可以对第一微滴20中包含的感兴趣的物质进行滴定。在昂贵或少量可得的试剂的情况下,该应用可以是特别有利的。
这里介绍的方法对于筛选药品也可以是非常有用的。例如,可以在毛细管捕集器12的每个第一捕集区15中捕集的第一微滴20中以个体化的形式或以球状体的形式培养癌细胞,并且在培养几天后,可以使每个捕集器中的第一微滴20与含有待筛选的药品的第二微滴25聚并,第二微滴25从含有不同药品的一组微滴中获得。
在类似的配置中,可以想象在捕集的第一微滴20中以球状体形式培养肝细胞,并且向每个毛细管捕集器12供应含有药品的第二微滴25,所述药品的毒性是希望评估的,每个微滴都是从包含不同浓度的药品的一组微滴中获得的。通过在聚并后几天分析存活率的结果,可以例如推断出杀死一半细胞群的该药品的浓度。
该方法还可以允许评估不同抗生素之间的相互作用。可以产生一组含有一种或多种不同浓度的抗生素的第二微滴25,并将其与含有细菌的第一微滴20在捕集室30中融合。第一微滴20可以包含不同浓度的细菌。这使得可以探索具有3个参数的空间。
微流体的应用在稀有样品、例如活组织检查的情况下可以是非常有利的。微流体系统可以例如用于个性化医疗和癌症治疗的情况中。利用该系统,可以例如以捕集的第一微滴20中的球状体的形式培养来自经历活组织检查的患者的肿瘤细胞,并且通过将第二微滴25供给到捕集室30中,使所述肿瘤细胞经受多种浓度的不同药品。在将具有细胞的微滴和具有药品的微滴的对聚并之后,可以仅使用单个捕集室30和从活组织检查获得的最小数量的细胞来确定对特定患者的最有效的药品及其浓度。
组织工程
如上所述的方法可以使得含有细胞的微滴融合以精确地形成微组织,所述细胞可以具有不同的细胞类型或可以不具有不同的细胞类型。
毛细管捕集器可以如图5A和图5B所示。优选地,第一捕集区15的高度使得其体积大于第一微滴的体积,使得捕集的第一微滴20具有不平的底部、特别是凸起的底部,如图5A所示。因此,包含在所述第一微滴20中的细胞在沉降期间沿第一微滴20的界面滑动并在捕集的第一微滴20的底部聚集并形成球状体,如国际申请WO 2016/059302中所述,其通过引用并入本文。
第一微滴20可以包含在液体培养基中的第一细胞类型的细胞,并且可以被捕集在所述毛细管捕集器12的第一捕集区15中,以在固定一天后通过细胞的沉降自发形成第一球状体。优选地,微流体系统在第一球状体形成期间在毛细管捕集器附近不具有流体流,使得不引起第一微滴20的液体移动。包含在液体介质中的第二细胞类型的细胞的第二微滴25可以被捕集在第二捕集区18中。在第一微滴和第二微滴聚并之后,获得两种不同类型的细胞培养物,其结构特别取决于实验条件。
如果第一微滴20是液体的,则第二微滴25的细胞在聚并后与第一微滴20的内容物混合然后沉淀,直接提供第一细胞类型的细胞的球状体。
如果第二微滴25的细胞在聚并之前有时间形成第二球状体,则两个微滴20和25的聚并导致第一球状体和第二球状体的融合。
如果在第二微滴25的细胞有时间形成球状体之前发生聚并,则细胞将在沉降在第一球状体的表面上之后沉积。
如果现在两个微滴20或25中的一者在聚并操作之前凝胶化,则使两个细胞群区分隔。实际上,如果包含第一球状体的第一微滴20在第二微滴25到达之前凝胶化,则在微滴20和25的聚并之后,由于凝胶的存在,第二细胞类型的细胞将不再能够与第一球状体直接接触。例如,哺乳动物细胞不能通过0.9重量%的琼脂糖基质。则两组细胞只能通过旁分泌途径相互连通。
这里给出的示例是用于捕集第一微滴20和第二微滴25的毛细管捕集器12,但是可以获得其中毛细管捕集器12允许捕集超过两个的微滴的更复杂的微组织结构和/或如上所述的由通过改变或不改变流体流的定向来顺序聚并几个微滴构成的方法。还可以使用如上所述的多个毛细管捕集器来平行地形成多个微组织。
这种用于形成微组织的技术使得可以在体外产生具有受控结构的微组织,从而非常忠实地模拟体内遇到的条件。事实上,在体内,不同的细胞类型通常根据特定的结构被布置在组织中,这对于在器官水平上重建功能是重要的。
在器官水平上重建功能也可以用于在患者中移植的目的。例如,可以将产生胰高血糖素的α细胞和产生胰岛素的β细胞组合以产生旨在被移植到患者胰腺中以治疗糖尿病的朗格汉斯胰岛。类似地,肝细胞和星状细胞可以在肝移植的情况下组合。
水凝胶
如上所述的方法也可以用于产生多层凝胶微滴。
毛细管捕集器12可以如上所述,并且可以包括第一捕集区15和第二捕集区18。
如图58所示,含有第一可凝胶化介质的第一微滴20可以被捕集在第一捕集区15中,然后第一可凝胶化介质可以凝胶化以形成第一凝胶的微滴200,如步骤54所示。然后,根据步骤58,第一凝胶的微滴200可以与包含第二可凝胶化介质、并且在步骤56中捕集在第二捕集区18中的第二微滴25融合。在该聚并之后,第二可凝胶化介质可以凝胶化以在第一凝胶上构成第二凝胶的外层202。该操作可以顺序地重复数次以形成具有第一凝胶的核心和其他凝胶的多个连续外层的微滴。
如图59所示的变体,包含在第二微滴25中的第二可凝胶化介质在与第一微滴融合之前凝胶化以形成第二凝胶的微滴204。当两个微滴融合时,它们在融合之前保持其形状和位置,并形成具有取决于捕集区的形状、布置和数量的形状的凝胶化微滴210。
所述方法还可以获得封装在生物水凝胶中的球状体。
为了能够以受控方式在微滴中形成球状体,必须能够在形成球状体的过程中保持微滴液体的内容物。琼脂糖非常适合该方案,因为它是热敏性水凝胶。琼脂糖在37℃保持液态(超低凝胶化琼脂糖),然后在4℃下30分钟之后凝固,并在返回到37℃之后保持凝固。然而,哺乳动物细胞不能粘附在琼脂糖上,也不能消化琼脂糖。因此,该基质与体内遇到的细胞外基质非常不同。为了更好地模拟自然条件,优选使用水凝胶,例如I型胶原、纤连蛋白、或明胶。然而,控制它们的凝胶化更加困难。例如,I型胶原不能长时间在用于细胞培养的良好条件(低温或酸性pH)下保持液态。如果将细胞封装在胶原微滴中,所述胶原微滴在捕集之后迅速凝胶化,而不是相互粘附并形成球状体,细胞将粘附在胶原上并沿其纤维单独移动。
该问题可以用根据本发明的方法来解决。
毛细管捕集器可以如图5A和图5B所示。优选地,第一捕集区15的高度使得捕集的第一微滴20具有不平的底部、特别是凸起的底部,如图5A所示,使得包含在所述第一微滴20中的细胞在沉降过程中沿着第一微滴20的界面滑动,并且在捕集的第一微滴20的底部聚集并形成球状体,如国际申请WO2016/059302中所述,其通过引用并入本文。
第一微滴20可以包含在液体介质中的第一细胞类型的细胞,并且可以被捕集在所述毛细管捕集器12的第一捕集区15中,以在固定一天后通过细胞的沉降自发地形成球状体。优选地,微流体系统在球状体形成期间在毛细管捕集器附近不具有流体流,使得不引起第一微滴20的液体移动。含有高浓度的上述生物水凝胶中的一种的第二微滴25可以被捕集在第二捕集区18中。一旦该第二微滴被捕集,两个微滴立即融合,使得仍然是液体的生物水凝胶与包含球状体的第一微滴混合。然后发生凝胶化,并将球状体封装在代表体内遇到的生物学条件的细胞外基质中。
这种球状体封装技术可以与上述用于形成微组织的技术相结合,以允许获得更复杂的微组织结构。
以下非限制性实施例描述了如上所述的本发明的实施方式。
实施例1
进行实验以证明所述方法的可行性。
使用的捕集室30是2cm2并且包含393个相同的、与图1A、图1B和图2中相似的毛细管捕集器,并且具有以下尺寸:
a=250μm,
b=c=150μm,
H=100μm,以及
h=50μm。
毛细管捕集器12根据矩阵分布,如图49所示。
微滴包含食用染料。通过“微分段流”技术形成具有从蓝色到绿色到黄色的五种不同颜色的1μL的滴。使用斜面(在上文点f)描述的方法)将这些1μL滴分离成许多单分散纳升的第一微滴20。然后将这些各种颜色的第一微滴20混合以形成包含不同颜色的第一组微滴,然后将其注入包含毛细管捕集器12的捕集室30中。调节第一微滴20的大小,使其完全占据第一捕集区15。第二捕集区18保持是空的。
以相同的方式,形成从透明、无色到红色的五种色调的1μL的滴,然后由于有差异地设计的斜面而分离成小于第一微滴的第二微滴。将这些第二微滴混合以形成包含不同颜色的第二组微滴,然后将其注入微流体室,其在微流体室中被捕集在第二自由捕集区25中。
然后获得如图60a)所示的第一微滴20和第二微滴25的对的矩阵。因此,25种不同的对是可能的。通过用含有浓度为20体积%的1H,1H,2H,2H-全氟辛-1-醇的HFE-7500灌注捕集室30,使接触的第一微滴20和第二微滴25融合。在每个毛细管捕集器中接触的两个微滴的颜色混合并根据初始微滴的颜色呈现25种可能颜色中的一种颜色,如图60b)所示。然后获得具有25种不同颜色的微滴的矩阵。
该实验表明,在具有不同组成的对的聚并之后,可以在捕集室30中并行地在同一个捕集器内组合不同浓度的不同试剂。
实施例2
进行实验用于获得由两个连续的分离的球状体融合而得到的球状体。
微流体系统包括具有毛细管捕集器矩阵的捕集室30,如图5A和图5B所示,所述捕集室30具有以下尺寸:
H=165μm,以及
h1=388μm,
h2=80μm,
c=200μm,
a=400μm。
首先将大鼠肝细胞(H4IIEC3)封装在第一微滴20中。第一微滴20被捕集在第一捕集区15中,并且在沉降之后,细胞聚集在每个滴的底部以形成第一球状体130。在形成这些第一球状体所需的一天之后,第二微滴25被捕集在第二捕集区18中,如图61A所示。第二微滴25也含有H4IIEC3细胞,但与第一微滴20相比,所述第二微滴25用荧光标记物染成红色。将这些第一微滴20和第二微滴25的对保持原样一天,使得第二微滴25的红色细胞聚集并在每个第二微滴25的底部形成第二球状体135。然后通过在室中灌注含有浓度为20体积%的1H,1H,2H,2H-全氟辛-1-醇的HFE-7500(氟化油)来使接触的第一微滴和第二微滴融合。
在每个捕集器中的聚并之后,第二球状体135沉降并在第一微滴的底部与新的第一微滴140中的第一球状体130接触,如图61B所示。这两个接触的球状体将相互粘附并融合以形成仅单个的新的球状体,其中两个部分130和135通过荧光成像可清楚地识别(来自第二球状体的细胞将在融合的球状体中继续呈现红色)。然后用含有表面活性剂的油灌注该室,以恢复新的第一微滴的稳定性,用于该实验的其余部分。
然后重复该操作,这次用封装已经染成绿色(CellTracker )的H4IIEC3细胞的第三微滴85,如图61C所示。类似地,如图61D所示,在第三微滴85中形成第三绿色球状体145,然后将第三微滴25与新的第一微滴融合,如图61E所示。接触的第三绿色球状体145和新的球状体140将相互粘附并融合以形成具有通过荧光成像可清楚识别的三个部分的仅单个的球状体。
因此,最终获得了三色球状体的矩阵,如图62所示,在图62的每一个中可以识别出三种不同颜色的球状体。
该实验证明了该技术在与组织工程相关的应用中的潜力。事实上,可以很容易地想象融合互补细胞类型的球状体而不是融合同一种细胞类型但具有不同颜色的球状体来创建具有明确定义的结构的功能性微组织。
实施例3
进行实验以在单个微流体系统中确定超过哪个浓度、药品(对乙酰氨基酚)对肝细胞(大鼠肝癌细胞,H4IIEC3细胞)变得有毒。
在5A和图5B中使用的微流体室在2cm2上包含252个相同的捕集器。
在37℃下是液态的(超低凝胶化)琼脂糖的第一微滴20(在含有H4IIEC3细胞的培养基中稀释为0.9重量%)被捕集在第一捕集区15中,第二捕集区18保持空缺。然后将第一微滴20培养一天以使细胞相互粘附以通过第一微滴20形成球状体。然后通过应用4℃的温度30分钟使第一微滴20凝胶化。
同时,将对乙酰氨基酚以高浓度溶解在培养基中。向该溶液中加入高浓度的荧光素。将获得的溶液用纯培养基稀释至不同浓度,以形成不同浓度的1μL的滴。然后通过斜面的方式将这些滴分离成第二微滴25,然后混合,接着注入含有第一微滴20的捕集室30中。这些第二微滴25小于第一微滴20并且被捕集在第二捕集区18中。
通过在融合之前拍摄荧光图像,可以识别与第二微滴25中的药品的浓度相关的不同荧光水平。即使将这些滴随机固定在捕集器中,也可以找到在毛细管捕集器12与对应于每个球状体结合的对乙酰氨基酚的浓度。
用含有浓度为20体积%的1H,1H,2H,2H-全氟辛-1-醇的HFE-7500(氟化油)灌注该室,以使接触的微滴融合。然后,对乙酰氨基酚通过凝胶化的琼脂糖扩散并作用于细胞。在暴露于对乙酰氨基酚一天后,如国际申请WO 2016/059302中所述,用水相替换将微滴相互分离的油,以用存在于水相中的荧光存活率标记物对球状体着色。通过拍摄最终基质的图像,可以确定其存活率受影响最大的球状体。发现对乙酰氨基酚的浓度越高,存活的细胞越少。因此,关联存活率的结果和第二微滴中对乙酰氨基酚的浓度,可以确定对于1天的静态暴露,对乙酰氨基酚对这些肝细胞的毒性范围是10mmol/L至30mmol/L。
促成本发明的工作获得了欧洲研究委员会在欧盟第七框架计划(FP7/2007-2013)/ERC拨款协议第278248号的背景下的资助。
Claims (39)
1.一种用于在微流体系统中操纵至少一个第一液体微滴(20)和至少一个第二液体微滴(25、25a、25b、25c、25m、25v)的方法,所述微流体系统包括具有第一捕集区(15)和第二捕集区(18、18a、18b、18c、18m、18v)的毛细管捕集器(12、12a、12b、12c),所述方法包括以下步骤:
(i)将所述第一液体微滴(20)捕集在所述第一捕集区(15)中,以及
(ii)将所述第二液体微滴(25、25a、25b、25c、25m、25v)捕集在所述第二捕集区(18、18a、18b、18c、18m、18v)中,
所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)以这种方式布置:使得所述第一液体微滴(20)和所述第二液体微滴(25、25a、25b、25c、25m、25v)相互接触,
所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)以这种方式配置:使得将由所述第一捕集区(15)和由所述第二捕集区(18、18a、18b、18c、18m、18v)施加在相同的第一液体微滴(20)或第二液体微滴(25、25a、25b、25c、25m、25v)上的捕集力将是不同的,所述第一液体微滴(20)被捕集在所述第一捕集区(15)中,所述第一捕集区(15)施加在所述第一液体微滴(20)上的捕集力大于所述第二捕集区(18、18a、18b、18c、18m、18v)施加在所述第一液体微滴(20)上的捕集力,
所述第一液体微滴(20)在步骤(i)通过大于所述第二捕集区施加在所述第一液体微滴(20)上的捕集力并且小于或等于所述第一捕集区施加在所述第一液体微滴(20)上的捕集力的夹带力在所述微流体系统中移动。
2.根据权利要求1所述的方法,所述至少一个第二液体微滴(25、25a、25b、25c、25m、25v)具有比所述第一液体微滴(20)更小的大小或更小的体积。
3.根据权利要求1所述的方法,所述第一液体微滴(20)和所述第二液体微滴(25、25a、25b、25c、25m、25v)是不同的或具有不同的内容物。
4.根据权利要求1所述的方法,所述毛细管捕集器(12、12a、12b、12c)包括多个第二捕集区(18、18a、18b、18c、18m、18v),步骤(ii)由以下组成:每个第二捕集区(18、18a、18b、18c、18m、18v)捕集一个第二液体微滴(25、25a、25b、25c、25m、25v),所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)以这种方式布置:使得每个第二液体微滴(25、25a、25b、25c、25m、25v)与所述第一液体微滴(20)或所述第二液体微滴(25、25a、25b、25c、25m、25v)中的至少一者接触。
5.根据权利要求4所述的方法,步骤(ii)包括子步骤(ii’)和子步骤(ii’’),所述子步骤(ii’)由以下组成:在第一定向的流体流(F1)的作用下将第二液体微滴(25m)捕集在一个或多个的所述第二捕集区(18m)中,所述子步骤(ii’’)由以下组成:在第二定向的流体流(F2)的作用下将第二液体微滴(25v)捕集在另一个或多个其他部分的所述第二捕集区(18v)中,所述第一定向的流体流和所述第二定向的流体流具有不同的定向。
6.根据权利要求1所述的方法,包括步骤(iii),所述步骤(iii)由以下组成:将所述第二捕集区(18、18a、18b、18c、18m、18v)或所述第二捕集区(18、18a、18b、18c、18m、18v)中的每一者中捕集的所述第二液体微滴(25、25a、25b、25c、25m、25v)或所述第二液体微滴(25、25a、25b、25c、25m、25v)中的每一者与所述第一液体微滴(20)融合。
7.根据权利要求6所述的方法,包括在步骤(iii)之后的步骤(v),所述步骤(v)由以下组成:将第三微滴(85)捕集在不再具有第二液体微滴的一个或多个所述第二捕集区(18、18a、18b、18c、18m、18v)中,使得所述第一液体微滴(20)和所述第三微滴(85)相互接触。
8.根据权利要求7所述的方法,微滴(20,25、25a、25b、25c、25m、25v,85)被随机地供给到捕集区(15,18、18a、18b、18c、18m、18v)。
9.根据权利要求1所述的方法,所述第一捕集区(15)的高度(h1)使得所述第一捕集区(15)的体积大于或等于所述第一液体微滴的体积。
10.根据权利要求1所述的方法,包括:
- 将所述第一液体微滴捕集在所述毛细管捕集器的所述第一捕集区中,由所述第一捕集区施加在所述第一液体微滴上的捕集力F4大于由定向的流施加在所述第一液体微滴上的流体动力曳力Ft4,这样使所述第一液体微滴保持被捕集在所述第一捕集区中,所述流体动力曳力Ft4在F4和F5之间,F5表示由所述毛细管捕集器的所述第二捕集区施加在所述第一液体微滴上的捕集力,
- 然后,将所述第二液体微滴捕集在所述毛细管捕集器的所述第二捕集区中,在所述第二捕集区中加载所述第二液体微滴期间由定向的流施加在所述第二液体微滴上的流体动力曳力Ft5在F5和F3之间,F3是由所述毛细管捕集器的所述第二捕集区施加在所述第二液体微滴上的捕集力。
11.根据权利要求10所述的方法,由所述毛细管捕集器的所述第二捕集区施加在所述第二液体微滴上的捕集力F3小于由所述第一捕集区施加在所述第一液体微滴上的捕集力F4。
12.根据权利要求1所述的方法,其中,所述微流体系统包括多个毛细管捕集器(12、12a、12b、12c),每个毛细管捕集器(12、12a、12b、12c)具有用于捕集每个第一液体微滴(20)的第一捕集区(15)和用于捕集每个第二液体微滴(25、25a、25b、25c、25m、25v)的第二捕集区(18、18a、18b、18c、18m、18v),所述第一液体微滴(20)形成第一组微滴,所述第一组微滴中的微滴是相同的或所述第一组微滴中的至少第一数量的微滴是不同的,所述第二液体微滴(25、25a、25b、25c、25m、25v)形成第二组微滴,所述第二组微滴中的至少第二数量的微滴是不同的,所述方法包括将每个第一液体微滴(20)和与其接触的所述第二液体微滴(25、25a、25b、25c、25m、25v)融合,以便在所述微流体系统中获得一组微滴,每一组微滴对应于第一液体微滴和第二液体微滴的不同可能组合中的一种组合。
13.根据权利要求12所述的方法,其中,所述第二组微滴包括至少在其含量上是不同的第二液体微滴(25、25a、25b、25c、25m、25v)。
14.根据权利要求12所述的方法,其中,所述第二组微滴包括在第二化合物的浓度上是不同的第二液体微滴(25、25a、25b、25c、25m、25v)。
15.根据权利要求12所述的方法,所述方法包括步骤(iii),所述步骤(iii)由以下组成:将所述第二捕集区(18、18a、18b、18c、18m、18v)或所述第二捕集区(18、18a、18b、18c、18m、18v)中的每一者中捕集的所述第二液体微滴(25、25a、25b、25c、25m、25v)或所述第二液体微滴(25、25a、25b、25c、25m、25v)中的每一者与所述第一液体微滴(20)融合,并且所述方法包括在步骤(iii)之前观察或测量的附加步骤(iv)。
16.根据权利要求12所述的方法,所述方法包括步骤(iii),所述步骤(iii)由以下组成:将所述第二捕集区(18、18a、18b、18c、18m、18v)或所述第二捕集区(18、18a、18b、18c、18m、18v)中的每一者中捕集的所述第二液体微滴(25、25a、25b、25c、25m、25v)或所述第二液体微滴(25、25a、25b、25c、25m、25v)中的每一者与所述第一液体微滴(20)融合,并且所述方法包括在步骤(iii)之后观察或测量的附加步骤(iv)。
17.根据权利要求12所述的方法,其中,所述第一液体微滴(20)各自包含细胞,并且所述第二液体微滴(25、25a、25b、25c、25m、25v)各自包含限定浓度的待筛选的药品。
18.根据权利要求12所述的方法,其中,所述第一液体微滴(20)各自包含癌细胞,并且所述第二液体微滴(25、25a、25b、25c、25m、25v)包含待筛选的不同药品。
19.根据权利要求12所述的方法,其中,所述第一液体微滴(20)各自包含以球状体的形式培养的肝细胞,并且在每个所述第二捕集区中提供含有不同浓度的药品的第二液体微滴(25、25a、25b、25c、25m、25v),所述药品的毒性是希望被评价的。
20.根据权利要求19所述的方法,其中,所述第一液体微滴(20)是包含以球状体的形式培养的肝细胞的琼脂糖微滴,所述方法包括形成肝细胞的球状体和使琼脂糖凝胶化。
21.根据权利要求19所述的方法,包括在所述第一液体微滴(20)和所述第二液体微滴(25、25a、25b、25c、25m、25v)的融合步骤之后几天确定每个微滴中的细胞的存活率,以确定杀死至少一半所述细胞的药品浓度。
22.根据权利要求12所述的方法,其中,所述第一液体微滴(20)各自包含从活组织检查获得的肿瘤细胞。
23.根据权利要求12所述的方法,其中,所述第一液体微滴(20)各自包含以球状体的形式培养的从特定患者的活组织检查获得的肿瘤细胞,所述第二液体微滴(25、25a、25b、25c、25m、25v)包含多种浓度的各种活性物质,并且所述方法包括在所述各种活性物质中确定对于所述特定患者最有效的活性物质以及所述活性物质的浓度。
24.根据权利要求1所述的方法,其中,所述第一液体微滴和所述第二液体微滴中的一者包含可凝胶化介质,并且另一者包含多个细胞,所述方法包括以下步骤:
(iii)将所述第一液体微滴与所述第二液体微滴融合,
(iv)使所述可凝胶化介质凝胶化以将所述多个细胞封装在凝胶中。
25.根据权利要求24所述的方法,包括在凝胶化步骤(iv)之前形成细胞的球状体。
26.一种用于捕集微滴的微流体装置,包括具有以这种方式布置的第一捕集区(15)和第二捕集区(18、18a、18b、18c、18m、18v)的毛细管捕集器(12、12a、12b、12c):使得被捕集在所述第一捕集区(15)中的第一液体微滴(20)和被捕集在所述第二捕集区(18、18a、18b、18c、18m、18v)中的第二液体微滴(25、25a、25b、25c、25m、25v)在所述毛细管捕集器(12、12a、12b、12c)中相互接触,第一毛细管捕集器和第二毛细管捕集器以这种方式配置:使得将由所述第一毛细管捕集器和由所述第二毛细管捕集器施加在相同的第一液体微滴(20)或第二液体微滴(25、25a、25b、25c、25m、25v)上的捕集力将是不同的,所述装置被配置成在所述第一液体微滴(20)上施加大于所述第二捕集区施加在所述第一液体微滴(20)上的捕集力并且小于或等于所述第一捕集区施加在所述第一液体微滴(20)上的捕集力的夹带力。
27.根据权利要求26所述的装置,所述装置用于实施如权利要求1所述的方法。
28.根据权利要求26所述的装置,所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)是腔。
29.根据权利要求26所述的装置,所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)具有不同的尺寸。
30.根据权利要求26所述的装置,所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)具有不同的高度(h1、h2)。
31.根据权利要求26所述的装置,当从上方观察时,所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)具有不同的形状。
32.根据权利要求31所述的装置,所述第一捕集区(15)具有比所述第二捕集区(18、18a、18b、18c、18m、18v)更大的截面。
33.根据权利要求26所述的装置,所述第二捕集区(18、18a、18b、18c、18m、18v)至少在接近所述第一捕集区(15)的一个方向上变得更宽。
34.根据权利要求26所述的装置,所述毛细管捕集器(12、12a、12b、12c)包括以这种方式布置的多个第二捕集区(18a、18b、18c、18m、18v):使得每个被捕集的所述第二液体微滴(25a、25b、25c、25m、25v)与被捕集在所述毛细管捕集器中的所述第一液体微滴(20)或所述第二液体微滴(25a、25b、25c、25m、25v)中的至少一者接触。
35.根据权利要求26所述的装置,所述装置包括多个毛细管捕集器(12、12a、12b、12c),每个所述毛细管捕集器(12、12a、12b、12c)包括第一捕集区(15)和第二捕集区(18、18a、18b、18c、18m、18v)。
36.根据权利要求35所述的装置,所述第一捕集区(15)和所述第二捕集区(18、18a、18b、18c、18m、18v)以这样的方式布置:使得被捕集在所述毛细管捕集器(12、12a、12b、12c)的所述第二捕集区(18、18a、18b、18c、18m、18v)中的所述第二液体微滴(25、25a、25b、25c、25m、25v)与被捕集在所述毛细管捕集器(12、12a、12b、12c)的所述第一捕集区(15)中的所述第一液体微滴(20)接触。
37.根据权利要求35所述的装置,所述装置每平方厘米包括至少10个毛细管捕集器(12、12a、12b、12c)。
38.根据权利要求35所述的装置,所述装置包括第一毛细管捕集器和第二毛细管捕集器,所述第一毛细管捕集器包括n个第二捕集区(18、18a、18b、18c、18m、18v),所述第二毛细管捕集器包括p个第二捕集区(18、18a、18b、18c、18m、18v),n与p不同。
39.根据权利要求26所述的装置,所述装置包括具有捕集室(30)的通道(9),一个或多个所述毛细管捕集器(12、12a、12b、12c)在所述捕集室(30)中。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR1659418A FR3056927B1 (fr) | 2016-09-30 | 2016-09-30 | Procede microfluidique de manipulation de microgouttes |
| FR1659418 | 2016-09-30 | ||
| PCT/EP2017/074859 WO2018060471A1 (fr) | 2016-09-30 | 2017-09-29 | Procede microfluidique de manipulation de microgouttes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN110035825A CN110035825A (zh) | 2019-07-19 |
| CN110035825B true CN110035825B (zh) | 2021-10-26 |
Family
ID=58009902
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780074354.2A Active CN110035825B (zh) | 2016-09-30 | 2017-09-29 | 用于处理微滴的微流体方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11179722B2 (zh) |
| EP (1) | EP3519092A1 (zh) |
| JP (2) | JP7150707B2 (zh) |
| CN (1) | CN110035825B (zh) |
| FR (1) | FR3056927B1 (zh) |
| WO (1) | WO2018060471A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3566772A1 (en) * | 2018-05-11 | 2019-11-13 | Agilent Technologies, Inc. (A Delaware Corporation) | Immobilizing fluidic sample for inhibiting spatial broadening |
| FR3098128B1 (fr) | 2019-07-05 | 2023-11-17 | Commissariat Energie Atomique | Dispositif microfluidique comportant une microgoutte présentant une matrice sol-gel. |
| EP4219685A1 (en) * | 2022-01-31 | 2023-08-02 | Institut Pasteur | In vitro generation of organized 3d cell structures including head-trunk embryo-like structures, using epigenetic remodeling factors - microfluidic platform suitable for their generation |
| EP4373916A2 (en) * | 2021-07-22 | 2024-05-29 | Institut Pasteur | In vitro generation of organized 3d cell structures including head-trunk embryo-like structures, using epigenetic remodeling factors - microfluidic platform suitable for their generation |
| DE102022202862A1 (de) * | 2022-03-24 | 2023-09-28 | Robert Bosch Gesellschaft mit beschränkter Haftung | Mikrofluidisches Aufnahmeelement, mikrofluidische Vorrichtung mit Aufnahmeelement, Verfahren zum Herstellen eines mikrofluidischen Aufnahmeelements und Verfahren zum Verwenden eines mikrofluidischen Aufnahmeelements |
| DE102022209421A1 (de) | 2022-09-09 | 2024-03-14 | Robert Bosch Gesellschaft mit beschränkter Haftung | Array für eine mikrofluidische Vorrichtung |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9476811B2 (en) * | 2010-10-01 | 2016-10-25 | The Governing Council Of The University Of Toronto | Digital microfluidic devices and methods incorporating a solid phase |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10326607A1 (de) | 2003-06-13 | 2005-01-05 | Steag Microparts Gmbh | Vorrichtung zum Handhaben von Flüssigkeiten |
| US8877512B2 (en) * | 2009-01-23 | 2014-11-04 | Advanced Liquid Logic, Inc. | Bubble formation techniques using physical or chemical features to retain a gas bubble within a droplet actuator |
| JP2010273655A (ja) | 2009-05-29 | 2010-12-09 | Canon Inc | 細胞保持方法、細胞試験方法及び細胞処理装置 |
| FR2950544B1 (fr) | 2009-09-29 | 2011-12-09 | Ecole Polytech | Circuit microfluidique |
| US9957472B2 (en) * | 2011-09-22 | 2018-05-01 | Georgia Tech Research Corporation | Deterministic high-density single-cell trap array |
| FR2996544B1 (fr) | 2012-10-08 | 2015-03-13 | Ecole Polytech | Circuit microfluidique permettant la mise en contact de gouttes de plusieurs fluides, et procede microfluidique correspondant. |
| JP6078848B2 (ja) | 2012-11-20 | 2017-02-15 | 公益財団法人神奈川科学技術アカデミー | 脂質二重膜の形成方法及びそのための器具 |
| US10710077B2 (en) * | 2014-10-17 | 2020-07-14 | Ecole Polytechnique | Method for handling microdrops which include samples |
-
2016
- 2016-09-30 FR FR1659418A patent/FR3056927B1/fr active Active
-
2017
- 2017-09-29 EP EP17777052.6A patent/EP3519092A1/fr active Pending
- 2017-09-29 JP JP2019517429A patent/JP7150707B2/ja active Active
- 2017-09-29 WO PCT/EP2017/074859 patent/WO2018060471A1/fr unknown
- 2017-09-29 CN CN201780074354.2A patent/CN110035825B/zh active Active
- 2017-09-29 US US16/338,681 patent/US11179722B2/en active Active
-
2022
- 2022-07-22 JP JP2022117270A patent/JP7438280B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9476811B2 (en) * | 2010-10-01 | 2016-10-25 | The Governing Council Of The University Of Toronto | Digital microfluidic devices and methods incorporating a solid phase |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7438280B2 (ja) | 2024-02-26 |
| FR3056927B1 (fr) | 2021-07-09 |
| JP2022136156A (ja) | 2022-09-15 |
| FR3056927A1 (fr) | 2018-04-06 |
| US11179722B2 (en) | 2021-11-23 |
| JP2019532805A (ja) | 2019-11-14 |
| CN110035825A (zh) | 2019-07-19 |
| US20200038867A1 (en) | 2020-02-06 |
| WO2018060471A1 (fr) | 2018-04-05 |
| EP3519092A1 (fr) | 2019-08-07 |
| JP7150707B2 (ja) | 2022-10-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN110035825B (zh) | 用于处理微滴的微流体方法 | |
| US12097475B2 (en) | Microfluidic system | |
| US11853087B2 (en) | Microfluidic system | |
| Amirifar et al. | Droplet-based microfluidics in biomedical applications | |
| Trantidou et al. | Engineering compartmentalized biomimetic micro-and nanocontainers | |
| Mashaghi et al. | Droplet microfluidics: A tool for biology, chemistry and nanotechnology | |
| Atencia et al. | Controlled microfluidic interfaces | |
| Shah et al. | Designer emulsions using microfluidics | |
| Song et al. | Reactions in droplets in microfluidic channels | |
| US9637718B2 (en) | Methods and devices to control fluid volumes, reagent and particle concentration in arrays of microfluidic drops | |
| Elani et al. | Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks | |
| US20110223314A1 (en) | Efficient microencapsulation | |
| US20180311671A1 (en) | Microfluidic arrangements | |
| US20100105866A1 (en) | Microfluidic manipulation of fluids and reactions | |
| JP2017537772A (ja) | サンプルを含むマイクロ液滴を取り扱うための方法 | |
| WO2015082931A2 (en) | Controlling fluid micro-compartments | |
| Moon et al. | Evaporation-driven water-in-water droplet formation | |
| Carreras et al. | A multifunctional microfluidic platform for generation, trapping and release of droplets in a double laminar flow | |
| GB2572699A (en) | Microfluidic arrangements | |
| Desmarais et al. | Microfabricated devices for biomolecule encapsulation | |
| WO2014196856A1 (en) | Methods and means for performing microdroplet-based reactions | |
| JP7135049B2 (ja) | サンプルを含むマイクロ液滴を取り扱うための方法 | |
| Akhtar | A microsystem for on-chip droplet storage and processing | |
| Ke | Microfluidic-assisted fabrication of nanoparticles for nanomedicine application | |
| Lu | Continuous microfluidic fabrication and measurement of membrane mechanical properties of synthetic asymmetric vesicles |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |