JP6960409B2 - プロモーター - Google Patents
プロモーター Download PDFInfo
- Publication number
- JP6960409B2 JP6960409B2 JP2018545660A JP2018545660A JP6960409B2 JP 6960409 B2 JP6960409 B2 JP 6960409B2 JP 2018545660 A JP2018545660 A JP 2018545660A JP 2018545660 A JP2018545660 A JP 2018545660A JP 6960409 B2 JP6960409 B2 JP 6960409B2
- Authority
- JP
- Japan
- Prior art keywords
- polynucleotide
- nucleic acid
- seq
- acid molecule
- nucleotide sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/001—Vector systems having a special element relevant for transcription controllable enhancer/promoter combination
- C12N2830/002—Vector systems having a special element relevant for transcription controllable enhancer/promoter combination inducible enhancer/promoter combination, e.g. hypoxia, iron, transcription factor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/80—Vector systems having a special element relevant for transcription from vertebrates
- C12N2830/85—Vector systems having a special element relevant for transcription from vertebrates mammalian
Landscapes
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Virology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
(i)特異性因子は、所与のプロモーターまたはプロモーターのセットに対するRNAポリメラーゼの特異性を変化させ、それらに結合する可能性を高くするか低くする(例えば、原核生物の転写において使用されるシグマ因子)。
(ii)リプレッサーは、オペレーター(プロモーター領域に近接するかプロモーター領域と重なっているDNA鎖上のコード配列)に結合し、鎖に沿ったRNAポリメラーゼの進行を妨げ、従って、遺伝子の発現を妨げる。
(iii)転写因子は、タンパク質コード配列の開始点にRNAポリメラーゼを配置し、次いで、mRNAを転写するためにポリメラーゼを解放する。
(iv)アクチベーターは、RNAポリメラーゼと特定のプロモーターとの間の相互作用を増強し、遺伝子の発現を促進する。エンハンサーは、DNAを輪にして特定のプロモーターを開始複合体に導くためにアクチベーターによって結合されるDNAヘリックス上の部位である。
(v)サイレンサーは、特定の転写因子が結合すると、遺伝子の発現をサイレンスすることができるDNA配列の領域である。
(a)配列番号1、配列番号2または配列番号3に示されるヌクレオチド配列に対する少なくとも80%のヌクレオチド配列同一性を有する第1のポリヌクレオチド、または当該第1のポリヌクレオチドの機能的フラグメント;および
(b)配列番号4に示されるヌクレオチド配列に対する少なくとも80%のヌクレオチド配列同一性を有する第2のポリヌクレオチド、または当該第2のポリヌクレオチドの機能的フラグメント;
を含む核酸分子であって、(a)と(b)が、この順番で5’−3’に連結されており、前記核酸分子が、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である、核酸分子を提供する。
(a)配列番号1、配列番号2または配列番号3に示されるヌクレオチド配列を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;
を含み、ここで、(a)と(b)は、5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号1に示されるヌクレオチド配列を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;
を含み、ここで、(a)と(b)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号2に示されるヌクレオチド配列を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;
を含み、ここで、(a)と(b)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号3に示されるヌクレオチド配列を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;
を含み、ここで、(a)と(b)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号1、配列番号2または配列番号3に示されるヌクレオチド配列に対する少なくとも80%のヌクレオチド配列同一性を有する第1のポリヌクレオチド、または当該第1のポリヌクレオチドの機能的フラグメント;
(b)配列番号4に示されるヌクレオチド配列に対する少なくとも80%のヌクレオチド配列同一性を有する第2のポリヌクレオチド、または当該第2のポリヌクレオチドの機能的フラグメント;および
(c)配列番号5、配列番号6または配列番号7に示されるヌクレオチド配列に対する少なくとも80%のヌクレオチド配列同一性を有する第3のポリヌクレオチド、または当該第3のポリヌクレオチドの機能的フラグメント;
を含む核酸分子であって、(a)、(b)および(c)が、この順番で5’−3’に連結されており、前記核酸分子が、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である、核酸分子も提供する。
(a)配列番号1、配列番号2または配列番号3に示されるヌクレオチド配列を有する第1のポリヌクレオチド;
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;および
(c)配列番号5、配列番号6または配列番号7に示されるヌクレオチド配列を有する第3のポリヌクレオチド;
を含み、ここで、(a)、(b)および(c)は、この順番で5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号1に示されるヌクレオチド配列を有する第1のポリヌクレオチド;
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;および
(c)配列番号5に示されるヌクレオチド配列を有する第3のポリヌクレオチド;
を含み、ここで、(a)、(b)および(c)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号2に示されるヌクレオチド配列を有する第1のポリヌクレオチド;
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;および
(c)配列番号6に示されるヌクレオチド配列を有する第3のポリヌクレオチド;
を含み、ここで、(a)、(b)および(c)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(a)配列番号3に示されるヌクレオチド配列を有する第1のポリヌクレオチド;
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;および
(c)配列番号7に示されるヌクレオチド配列を有する第3のポリヌクレオチド;
を含み、ここで、(a)、(b)および(c)は、この順番で隣接して5’−3’に連結されており、前記核酸分子は、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である。
(i)ヘルパープラスミド(例えば、本発明のプロモーターの調節制御下にあるレンチウイルスのポリペプチドをコードするヌクレオチド配列を含むもの);
(ii)ウイルスゲノムプラスミド(例えば、必要とされる導入遺伝子の単純な挿入に適合していてもよいパッケージングシグナルを有するもの);
(iii)緩衝液;
(iv)制限酵素;
(v)トランスフェクション培地;および
(vi)哺乳動物細胞
からなる群より選択される1つ以上の追加の構成要素と共に、本発明の発現ベクターおよび/または宿主細胞を含むキットも提供する。
表1で特定されている配列からなる組換えプロモーターフラグメントを作製した。
ホタルルシフェラーゼアッセイで使用したレポーターベクターは、以下のように構築した。
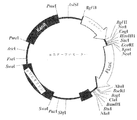
図1に示されるSnapFast(SF)ベクターを使用した。SnapFastベクターのバックボーンは、pUCの細菌の複製開始点、アンピシリン耐性遺伝子およびマルチクローニングサイトからなる。ホタルルシフェラーゼをコードする配列を、NcoI制限部位とXbaI制限部位の間でマルチクローニングサイトにクローニングした(図1を参照のこと)。ルシフェラーゼをコードする配列は、Kozakリボソーム結合部位を包含する。
材料および方法
各組換えプロモーターに由来するコロニーからプラスミドDNAを精製した。組換えプロモーターを含むレポーターベクターを、いくつかの96ウェルプレートにおいてHEK293細胞に個々にトランスフェクトした。トランスフェクトした細胞を37℃で24時間インキュベートした。Luciferase Assay Systemキット(Promega、Wisconsin、USA)を用いて各ウェルをルシフェラーゼ活性についてアッセイした。
結果を図2に示す。組換えプロモーターフラグメントp567およびp576は、このアッセイにおいてCMV(現在の至適基準)よりも良好に機能した。
経時的実験のために、3つの組換えプロモーター(p565、p567およびp576)を選択した。結果を図3に示す。
本発明の組換えプロモーターp565によって駆動されるタンパク質発現レベルを、対照として示されるCMVプロモーターでの発現と共に図4に示す。商業的に有用である4つの異なる抗原(タンパク質「W」、「X」、「Y」および「Z」)の発現について、p565プロモーターを標準的なCMVプロモーターと比較した。各抗原について、コード配列を、図1に示すものと同等のベクターにおいてCMVプロモーターまたはp565プロモーターのいずれかの下流にクローニングした。
分枝状PEI(25kDa)を用いた一過性トランスフェクションの方法によって、ヒト胎児腎臓細胞(HEK293)でCMVプロモーターまたはプロモーターP565iから様々なヒト遺伝子(表2を参照のこと)を過剰発現させた。
分枝状PEI(25kDa)を用いた一過性トランスフェクションの方法によって、CHO K1細胞でCMVプロモーターまたはプロモーターP565iから様々なヒト遺伝子(表3を参照のこと)を過剰発現させた。
分枝状PEI(25kDa)を用いた一過性トランスフェクションの方法によって、HCT116細胞でCMVプロモーター、P565iプロモーター、P565プロモーター、P576プロモーター、P567プロモーターから緑色蛍光タンパク質(GFP)を発現させた。
配列番号3
AGTAATCAATTACGGGGTCATTAGTTCATAGCCCATATATGGAGTTCCGCGTTACATAACTTACGGTAAATGGCCCGCCTGGCTGACCGCCCAACGACCCCCGCCC
配列番号2
CTACCGGGTAGGGGAGGCGCTTTTCCCAAGGCAGTCTGGAGCATGCGCTTTAGCAGCCCCGCTGGGCACTTGGCGCTACACAAGTGGCCTCTGGCCTCGCACACATTCCACATCCACCGGTAGGCGTCAATGGAAAGTCCCTATTGGCGTTACTATGGGAACATACGTCATT
配列番号1
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCACTAGTCGCCGTGAACGTCAATGGAAAGTCCCTATTGGCGTTACTATGGGAACATACGTCATTATTGACGTCAATGACGGTAAATGGCCCGCCTGGCATTATGCCCAGTACATGACCTTATGGGACTTTCCTACTTGGCAGTACATCTACGTATTAGTCATCGCTATTACCATGCTGATGCGGTTTTGGCAGTACATCAATGGGCGTGGATAGCGGTTTGACTCACGGGGATTTCCAAGTCTCCACCCC
配列番号4
ATTGACGTCAATGGGAGTTTGTTTTGGCACCAAAATCAACGGGACTTTCCAAAATGTCGTAACAACTCCGCCCCATTGACGCAAATGGGCGGTAGGCGTGTACGGTGGGAGGTCTATATAAGCAGAGCTGGTTTAGTGAACCGTCAGATC
配列番号7
GTTGTTCGCTTTGATAAACTTCCAGGATTCGGAGACAGTATTGAAGCTCAGGTACAGAAATAATTTCACCTTTCTTTCTCTTTCTATTCAGTGTGGCACATCTGTAAACGTTCACTCTTCACTTAGAGACATCCTCAACCAAATCACCAAACCAA
配列番号6
GCCCAGGAAGTACACGAGAAGCTCCGAGGATTGGCTGAAGTCCAACGTCTCTGATTGCGGTGGCTCAGAGCACCCGTATCATTTTGGAGGTGAGTGGCTTTGGTTCCCGGCTGAGGTGGAGTGGGCTGAGGACTAGACTGAGCCCTCGGACATGGAGGTGGGGATGGGGCAGACTCATCCCATTCTTGACCAAGCCCTTGTTCTGCTCCCTTCCCAGGCTCTGTGACTGGGGCAACCTGCAAGGAGCTGGCCAGCCAGCCTGACGTGGACGGCTTCCTTGTGGGTGGTGCTTCCCTCAAGCCCGAATTCGTGGACATCATCAACGCCAAACAA
配列番号5
TGAAGTTGGTGGTGAGGCCCTGGGCAGGTTGGTATCAAGGTTACAAGACAGGTTTAAGGAGACCAATAGAAACTGGGCATGTGGAGACAGAGAAGACTCTTGGGTTTCTGATAGGCACTGACTCTCTCTGCCTATTGGTCTATTTTCCCACCCTTAG
Claims (15)
- (a)配列番号1または配列番号2に示されるヌクレオチド配列に対する少なくとも95%のヌクレオチド配列同一性を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列に対する少なくとも95%のヌクレオチド配列同一性を有する第2のポリヌクレオチド;
を含む核酸分子であって、(a)と(b)が隣接してこの順番で5’−3’に連結されており、前記核酸分子が、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である、前記核酸分子。 - 前記第1のポリヌクレオチドが、配列番号1または配列番号2に示されるヌクレオチド配列のうちの1つに対する少なくとも96%、97%、98%、99%または100%のヌクレオチド配列同一性を有する、請求項1に記載の核酸分子。
- 前記第2のポリヌクレオチドが、配列番号4に示されるポリヌクレオチド配列に対する少なくとも96%、97%、98%、99%または100%のヌクレオチド配列同一性を有する、請求項1または2に記載の核酸分子。
- 前記核酸分子が、
(a)配列番号1または配列番号2に示されるヌクレオチド配列を有する第1のポリヌクレオチド;および
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;
を含む、請求項1〜3のいずれか1項に記載の核酸分子。 - 前記核酸分子が、
(c)配列番号5に示されるヌクレオチド配列に対する少なくとも95%のヌクレオチド配列同一性を有する第3のポリヌクレオチド;
をさらに含み、
(a)、(b)および(c)が隣接してこの順番で5’−3’に連結されており、前記核酸分子が、哺乳動物細胞において、機能可能に連結された異種ポリヌクレオチドの転写を促進することが可能である、
請求項1〜4のいずれか1項に記載の核酸分子。 - 前記第3のポリヌクレオチドが、配列番号5に示されるヌクレオチド配列に対する少なくとも96%、97%、98%、99%または100%のヌクレオチド配列同一性を有する、請求項5に記載の核酸分子。
- 前記核酸分子が、
(a)配列番号1に示されるヌクレオチド配列を有する第1のポリヌクレオチド;
(b)配列番号4に示されるヌクレオチド配列を有する第2のポリヌクレオチド;および
(c)配列番号5に示されるヌクレオチド配列を有する第3のポリヌクレオチド;
を含み、
(a)、(b)および(c)が隣接してこの順番で5’−3’に連結されている、
請求項5又は6に記載の核酸分子。 - 前記核酸分子が、誘導性エレメントをさらに含む、請求項1〜7のいずれか1項に記載の核酸分子。
- 哺乳動物細胞が、マウス、ラット、ハムスター、サルまたはヒトの細胞である、請求項1〜8のいずれか1項に記載の核酸分子。
- 請求項1〜9のいずれか1項に記載の核酸分子を含む、発現ベクター。
- 前記発現ベクターが、アデノウイルスベクター、pSVまたはpCMVのプラスミドベクター、ワクシニアまたはレトロウイルスのベクター、またはバキュロウイルスベクターである、請求項10に記載の発現ベクター。
- 前記核酸分子が、異種ポリヌクレオチドに機能可能に連結されている、請求項10または請求項11に記載の発現ベクター。
- 請求項10〜12のいずれか1項に記載の発現ベクターを含む、哺乳動物宿主細胞。
- そのゲノムが、請求項1〜9のいずれか1項に記載の核酸分子または請求項10〜12のいずれか1項に記載の発現ベクターを含む、非ヒト哺乳動物。
- (i)ヘルパープラスミド;
(ii)ウイルスゲノムプラスミド;
(iii)緩衝液;
(iv)制限酵素;
(v)トランスフェクション培地;および
(vi)哺乳動物細胞
からなる群より選択される1つ以上の追加の構成要素と共に、請求項10〜12のいずれか1項に記載の発現ベクターおよび/または請求項13に記載の宿主細胞を含む、キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1603577.6A GB201603577D0 (en) | 2016-03-01 | 2016-03-01 | Promoter |
| GB1603577.6 | 2016-03-01 | ||
| PCT/GB2017/050537 WO2017149292A1 (en) | 2016-03-01 | 2017-02-28 | Promoter |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019506882A JP2019506882A (ja) | 2019-03-14 |
| JP2019506882A5 JP2019506882A5 (ja) | 2020-04-09 |
| JP6960409B2 true JP6960409B2 (ja) | 2021-11-05 |
Family
ID=55807149
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018545660A Active JP6960409B2 (ja) | 2016-03-01 | 2017-02-28 | プロモーター |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US10647999B2 (ja) |
| EP (2) | EP3686282A1 (ja) |
| JP (1) | JP6960409B2 (ja) |
| KR (1) | KR20180132045A (ja) |
| CN (1) | CN109072251A (ja) |
| AU (1) | AU2017225350B2 (ja) |
| GB (3) | GB201603577D0 (ja) |
| SG (1) | SG11201806782QA (ja) |
| WO (1) | WO2017149292A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107630035A (zh) * | 2017-09-28 | 2018-01-26 | 兰州大学 | 一种大鼠防御素真核表达载体及其构建方法 |
| GB201800903D0 (en) | 2018-01-19 | 2018-03-07 | Oxford Genetics Ltd | Vectors |
| CA3090226A1 (en) * | 2018-02-01 | 2019-08-08 | Homology Medicines, Inc. | Adeno-associated virus compositions for restoring pah gene function and methods of use thereof |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007081336A1 (en) * | 2006-01-13 | 2007-07-19 | Five Prime Therapeutics, Inc. | Mammalian vectors for high-level expression of recombinant proteins |
| US7879602B2 (en) * | 2006-02-28 | 2011-02-01 | Vaxart, Inc. | Chimeric adenoviral vectors |
| WO2008051854A2 (en) * | 2006-10-20 | 2008-05-02 | Trustees Of Boston University | A tunable genetic switch for regulating gene expression |
| WO2008073303A2 (en) * | 2006-12-07 | 2008-06-19 | Switchgear Genomics | Transcriptional regulatory elements of biological pathways, tools, and methods |
| EP2477652B1 (en) * | 2009-09-16 | 2015-04-15 | Vaxart, Inc. | Immunization strategy to prevent h1n1 infection |
| EP2611915B1 (en) * | 2010-09-01 | 2015-04-15 | Cellagenics B.V. | Nucleic acid fragments from a ribosomal protein promoter for enhancing gene expression |
| WO2012112603A1 (en) * | 2011-02-14 | 2012-08-23 | University Of Utah Research Foundations | Constructs and methods for generating induced pluri potent stem ( ips) cells |
| BR112013025819A2 (pt) | 2011-04-07 | 2016-12-20 | Bayer Crospscience N V | promotor específico para semente em algodão |
| US9234197B2 (en) * | 2011-10-28 | 2016-01-12 | Arizona Board Of Regents, A Body Corporate Of The State Of Arizona For And On Behalf Of Arizona State University | Genetic element that enhances protein translation |
| EP2711426B1 (en) * | 2012-09-24 | 2015-04-08 | Lonza Biologics plc | Expression vectors comprising chimeric cytomegalovirus promoter and enhancer sequences |
| PT2971005T (pt) | 2013-03-12 | 2020-09-01 | Cmc Icos Biologics Inc | Expressão de proteína recombinante melhorada usando um promotor chef1 híbrido |
| CN104630267B (zh) * | 2014-07-17 | 2017-10-31 | 清华大学 | 利用tale转录抑制子在哺乳动物细胞中模块化构建合成基因线路的试剂盒 |
| GB201414130D0 (en) * | 2014-08-08 | 2014-09-24 | Agency Science Tech & Res | Mutants of the bacteriophage lambda integrase |
-
2016
- 2016-03-01 GB GBGB1603577.6A patent/GB201603577D0/en not_active Ceased
-
2017
- 2017-02-28 EP EP20157991.9A patent/EP3686282A1/en active Pending
- 2017-02-28 KR KR1020187024944A patent/KR20180132045A/ko not_active Application Discontinuation
- 2017-02-28 US US16/080,765 patent/US10647999B2/en active Active
- 2017-02-28 EP EP17712536.6A patent/EP3423583B1/en active Active
- 2017-02-28 GB GB2002193.7A patent/GB2578859B/en active Active
- 2017-02-28 JP JP2018545660A patent/JP6960409B2/ja active Active
- 2017-02-28 CN CN201780014321.9A patent/CN109072251A/zh active Pending
- 2017-02-28 AU AU2017225350A patent/AU2017225350B2/en active Active
- 2017-02-28 GB GB1703224.4A patent/GB2553170B/en active Active
- 2017-02-28 SG SG11201806782QA patent/SG11201806782QA/en unknown
- 2017-02-28 WO PCT/GB2017/050537 patent/WO2017149292A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| AU2017225350A1 (en) | 2018-09-06 |
| GB2578859B (en) | 2020-10-28 |
| JP2019506882A (ja) | 2019-03-14 |
| AU2017225350B2 (en) | 2023-07-20 |
| GB201603577D0 (en) | 2016-04-13 |
| SG11201806782QA (en) | 2018-09-27 |
| GB202002193D0 (en) | 2020-04-01 |
| US20190071692A1 (en) | 2019-03-07 |
| GB2553170A (en) | 2018-02-28 |
| GB201703224D0 (en) | 2017-04-12 |
| US10647999B2 (en) | 2020-05-12 |
| GB2553170B (en) | 2020-05-06 |
| KR20180132045A (ko) | 2018-12-11 |
| GB2578859A (en) | 2020-05-27 |
| EP3423583B1 (en) | 2023-05-24 |
| EP3423583A1 (en) | 2019-01-09 |
| WO2017149292A1 (en) | 2017-09-08 |
| EP3686282A1 (en) | 2020-07-29 |
| CN109072251A (zh) | 2018-12-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4489424B2 (ja) | 染色体に基くプラットホーム | |
| US20180245057A1 (en) | Systems and methods for selection of grna targeting strands for cas9 localization | |
| JP2022527017A (ja) | オリジアス由来のトランスポザーゼを用いた核酸コンストラクトの真核細胞への組み込み | |
| JP6960409B2 (ja) | プロモーター | |
| EP3730616A1 (en) | Split single-base gene editing systems and application thereof | |
| US20200087679A1 (en) | Expression cassette | |
| WO2013063348A1 (en) | Genetic element that enhances protein translation | |
| CA2939541C (en) | Hybrid proteins and uses thereof | |
| CN107893085B (zh) | 一种可用于孤核受体活性调节剂筛选的双荧光素酶报告基因质粒及其构建与应用 | |
| WO2005090562A1 (ja) | 軽度の低温により遺伝子の発現を促進させる配列 | |
| JPWO2004070030A1 (ja) | 動物細胞用高発現ベクター | |
| CN112877332A (zh) | 一种由双荧光素酶报告基因检测鸡ripk2启动子活性的方法 | |
| CN101864419B (zh) | 小鼠Miwi启动子,其载体及应用 | |
| WO2014162318A2 (en) | Methods and constructs for expressing biologically active proteins in mammalian cells | |
| CN111718929A (zh) | 利用环形rna进行蛋白翻译及其应用 | |
| CN112126645B (zh) | 一种环形rna敲低方法及其应用 | |
| CN110804626B (zh) | 高cg片段与低cg启动子联用构建高效表达载体的方法 | |
| CN109265532B (zh) | 人源调控细胞死亡的c1orf109重组蛋白及其制备方法与应用 | |
| CN112301054A (zh) | 利用k1e噬菌体rna聚合酶和启动子的双质粒系统在真核细胞表达病毒蛋白的方法 | |
| Zhang et al. | CMV/AAT promoter of MAR-based episomal vector enhanced transgene expression in human hepatic cells | |
| CN104845994A (zh) | 一种利用基因组编辑技术实现原位激活基因的表达方法及其应用 | |
| CN117721151A (zh) | 一种基于CRISPR-dcas13d-eIF4G的蛋白翻译激活系统及其应用 | |
| US8367404B2 (en) | Chimeral internal ribosomal entry site sequence and uses thereof | |
| NZ626252B2 (en) | Expression cassette |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200227 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200227 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210115 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210414 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210921 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211011 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6960409 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |