JP6913078B2 - タウの短縮型Asp421エピトープに特異的な、抗体を基にした分子、ならびにタウ異常症の診断および治療におけるそれらの使用 - Google Patents
タウの短縮型Asp421エピトープに特異的な、抗体を基にした分子、ならびにタウ異常症の診断および治療におけるそれらの使用 Download PDFInfo
- Publication number
- JP6913078B2 JP6913078B2 JP2018507018A JP2018507018A JP6913078B2 JP 6913078 B2 JP6913078 B2 JP 6913078B2 JP 2018507018 A JP2018507018 A JP 2018507018A JP 2018507018 A JP2018507018 A JP 2018507018A JP 6913078 B2 JP6913078 B2 JP 6913078B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- tau
- amino acid
- disease
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/531—Production of immunochemical test materials
- G01N33/532—Production of labelled immunochemicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/28—Neurological disorders
- G01N2800/2814—Dementia; Cognitive disorders
- G01N2800/2821—Alzheimer
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Neurosurgery (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Genetics & Genomics (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Heart & Thoracic Surgery (AREA)
- Dermatology (AREA)
- Cardiology (AREA)
- Rheumatology (AREA)
Description
本出願は、米国仮特許出願第62/204,699号(2015年8月13日に提出;係属中)および米国仮特許出願第62/211,123号(2015年8月28日に提出;係属中)に対する優先権を主張し、各出願はその全体が参照により本明細書に組み入れられる。
本発明は、米国国立衛生研究所(National Institutes of Health)(NIH)によって授与された助成金NS077239号、AG032611号およびAG020197号の下で、政府の援助を受けて行われた。米国政府は本発明において一定の権利を有する。
本出願は、米国特許法規則1.821以降の条文(37 C.F.R. 1.821 et seq.)に準じて、コンピュータ可読媒体中に開示されている1つまたは複数の配列表を含み(ファイル名:1400-0008PCT_ST25.txt、2016年8月11日に作成、サイズは170,987バイト)、このファイルはその全体が参照により本明細書に組み入れられる。
本発明は、タウの短縮型Asp421エピトープと免疫特異的かつ選択的に結合しうる、抗体を基にした分子(単一ドメイン抗体断片、scFv分子、抗体、抗体断片、ダイアボディおよびそれらのエピトープ結合ドメインを含む)に関する。そのような抗体を基にした分子は、特にアルツハイマー病または他のタウ異常症の診断および/または治療と共に、病的タウタンパク質配座異性体が生物試料中に存在する場合にそれを検出するために有用であり、それ故にアルツハイマー病および他のタウ病理に関する診断薬となる。本発明の抗体を基にした分子は、アルツハイマー病および関連するタウ異常症に関する診断マーカーとして、ならびにそのような病状の治療のための薬学的組成物として、特別の有用性がある。
アルツハイマー病は、認知症の最も多い病型であり、全世界で2000万人を超える人々が罹患している。本疾患の診断、特に早期での診断は手間がかかる上に困難であり、アルツハイマー病などのタウ異常症の正確な診断に対する需要がある。脳脊髄液中の異常タウの抗体検出について、ある程度の有望性が示されている(Blennow, K. et al. "Cerebrospinal Fluid And Plasma Biomarkers In Alzheimer Disease," Nat. Rev. Neurol. 6, 131-144 (2010)(非特許文献1)およびWeiner et al. "The Alzheimer's Disease Neuroimaging Initiative: A Review Of Papers Published Since Its Inception," Alzheimers. Dement. 9, e111-e194 (2013)(非特許文献2))。
(a)(1)SEQ ID NO:9、10、および11のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:13、14、および15のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(b)(1)SEQ ID NO:17、18、および19のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:21、22、および23のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(c)(1)SEQ ID NO:25、26、および27のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(d)(1)SEQ ID NO:29、30、および31のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
または
(e)(1)SEQ ID NO:37、38、および39のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:41、42、および43のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3。
(a)SEQ ID NO:97、98、および99のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:100、101、および102のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3。
[本発明1001]
タウの短縮型Asp421エピトープと免疫特異的に結合しうる、抗体を基にした分子であって、該エピトープが、タウ407〜421の配列
を有するペプチド上に存在する、抗体を基にした分子。
[本発明1002]
抗体1G10D2、抗体1G11A10、抗体5B3C11、および抗体5G2A3からなる群より選択される抗体と結合について競合する、本発明1001の抗体を基にした分子。
[本発明1003]
(a)(1)SEQ ID NO:9、10、および11のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:13、14、および15のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(b)(1)SEQ ID NO:17、18、および19のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:21、22、および23のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(c)(1)SEQ ID NO:25、26、および27のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(d)(1)SEQ ID NO:29、30、および31のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
または
(e)(1)SEQ ID NO:37、38、および39のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:41、42、および43のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3
を含む、本発明1001の抗体を基にした分子。
[本発明1004]
(a)SEQ ID NO:97、98、および99のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(b)SEQ ID NO:100、101、および102のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3
を含む、本発明1001の抗体を基にした分子。
[本発明1005]
レシピエントへ末梢注射されると、タウ凝集物と実質的に共局在する、本発明1001〜1004のいずれかの抗体を基にした分子。
[本発明1006]
抗体、ダイアボディ、scFvであるか、または抗体、ダイアボディ、もしくはscFvのエピトープ結合性断片を含む、本発明1001〜1005のいずれかの抗体を基にした分子。
[本発明1007]
抗体である、本発明1006の抗体を基にした分子。
[本発明1008]
ヒト化抗体であるか、またはヒト化抗体のエピトープ結合性断片を含む、本発明1006の抗体を基にした分子。
[本発明1009]
scFvである、本発明1006の抗体を基にした分子。
[本発明1010]
検出可能に標識されている、本発明1001〜1009のいずれかの抗体を基にした分子。
[本発明1011]
検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識、または酵素標識である、本発明1010の抗体を基にした分子。
[本発明1012]
レシピエント対象の脳、脳脊髄液、血液、血清、または血漿における前記短縮型タウタンパク質の存在または量を検出または測定するための、本発明1010〜1011のいずれかの抗体を基にした分子の使用。
[本発明1013]
検出または測定が、
前記短縮型タウタンパク質と結合した前記抗体を基にした分子の、インビボまたはエクスビボでのイメージング
を含む、本発明1012の使用。
[本発明1014]
検出または測定が、対象のアルツハイマー病または別のタウ異常症を診断するためである、本発明1012〜1013のいずれかの使用。
[本発明1015]
対象のアルツハイマー病または別のタウ異常症の治療のためのインビボ医薬であって、該アルツハイマー病または別のタウ異常症を治療するのに有効な量の本発明1001〜1009のいずれかの抗体を基にした分子と、1つまたは複数の担体、希釈剤、および/または安定化剤とを含む、インビボ医薬。
[本発明1016]
対象のアルツハイマー病または別のタウ異常症の治療のための、本発明1013のビボ医薬の使用。
[本発明1017]
対象がヒトである、本発明1012〜1016のいずれかの使用。
[本発明1018]
対象の脳における前記短縮型タウタンパク質の存在もしくは量を検出もしくは測定するための、または対象におけるアルツハイマー病もしくは別のタウ異常症を診断するためのキットであって、本発明1014の抗体を基にした分子を含む、キット。
[本発明1019]
タウ異常症が、前頭側頭型認知症、17番染色体に連鎖したパーキンソニズム(FTDP-17)、進行性核上性麻痺、大脳皮質基底核変性症、ピック病、進行性皮質下グリオーシス、神経原線維変化型認知症(tangle only dementia)、石灰化を伴うびまん性神経原線維変化、嗜銀顆粒性認知症、筋萎縮性側索硬化症パーキンソニズム・認知症複合、ボクサー認知症、ダウン症候群、ゲルストマン・シュトロイスラー・シャインカー病、ハラーフォルデン・シュパッツ病、封入体筋炎、クロイツフェルト・ヤコブ病、多系統萎縮症、ニーマン・ピック病C型、プリオンタンパク質脳アミロイド血管障害、亜急性硬化性全脳炎、筋強直性ジストロフィー、神経原線維変化を伴う非グアナミアン(non-guanamian)運動ニューロン疾患、脳炎後パーキンソニズム、急性外傷性脳損傷、および慢性外傷性脳症を含む群から選択される、本発明1014、1016、もしくは1017のいずれかの使用、または本発明1015の医薬、または本発明1018のキット。
本発明は、タウの短縮型Asp421エピトープと免疫特異的かつ選択的に結合しうる、抗体を基にした分子(単一ドメイン抗体断片、scFv分子、抗体、抗体断片、ダイアボディ、およびそれらのエピトープ結合ドメインを含む)に関する。そのような抗体を基にした分子は、特にアルツハイマー病または他のタウ異常症の診断および/または治療と共に、病的タウタンパク質配座異性体が生物試料中に存在する場合にそれを検出するために有用であり、それ故にアルツハイマー病および他のタウ病理に関する診断薬となる。本発明の抗体を基にした分子は、タウ異常症(特にアルツハイマー病および関連するタウ異常症)に関する診断マーカーとして、ならびにそのような病状の治療のための薬学的組成物としての特別の有用性がある。
本明細書で用いる場合、「タウ」という用語はタウタンパク質と同義であり、タウタンパク質アイソフォームのいずれか(例えばUniProtにP10636、1〜9として特定されている)を指す。タウは、細胞周期の間にキナーゼ酵素の宿主によって動的にリン酸化および脱リン酸化される可溶性微小管結合タンパク質である。微小管を安定化するタウの能力は、そのリン酸化の程度に依存する。その脱リン酸化形態では、このタンパク質はチューブリンと相互作用し、微小管を安定化してチューブリンの微小管(これは細胞の細胞骨格を形成し、有糸分裂中に真核生物染色体を引き離す紡錘体の主要な構成要素である)への集合を促進することができる。そのリン酸化形態では、タウは微小管から解離することができ、それによって有糸分裂が起こることを可能にする。タウのリン酸化はそれ故に、ニューロン内での直接的な微小管の会合-解離スイッチとして作用する(Pedersen, J.T. et al. (2015) "Tau Immunotherapy For Alzheimer's Disease," Trends Mol. Med. 2015 Apr 3. pii: S1471-4914(15)00058-1;pages 1-9、これは参照によりその全体が本明細書に組み入れられる)。
本発明の「抗体を基にした分子」は、タウのAsp421エピトープと免疫特異的かつ選択的に結合しうる抗体、ならびにそのような結合免疫特異性および選択性を呈するそれらの断片および誘導体を含む。本明細書で用いる場合、分子は、それがそのような親分子の実際の断片化を通して得られる場合に(例えば、Fabまたは(Fab)2断片)、またはそれがそのような親分子のアミノ酸配列の一部分を含むアミノ酸配列を含む場合に、別の分子の「断片」であるという。本明細書で用いる場合、分子は、それがそのような親分子もしくはその一部分の実際の化学修飾を通して得られる場合に、またはそれがそのような親分子もしくはその関連する一部分のアミノ酸配列に実質的に類似しているアミノ酸配列を含む場合に(例えば、そのような親分子もしくはそのようなその関連する一部分から30%未満、20%未満、10%未満、もしくは5%未満が、または、そのような親分子もしくはその関連する一部分から10アミノ酸残基、または10、9、8、7、6、5、4、3、もしくは2アミノ酸残基より少しが異なっている)、別の分子(またはその関連する一部分)の「誘導体」であるという。
(i)本明細書に記載の本発明の抗体の1つの可変領域または前記領域の1つの抗原結合部分、および
(ii)ヒンジ領域に対応する領域、および免疫グロブリンがIgG4サブタイプでない場合はCH領域の他の領域、例えばCH3領域が、ポリクローナルヒトIgGの存在下で同一のCH領域とのジスルフィド結合または同一のCH領域との他の共有結合もしくは安定した非共有結合による重鎖間結合を形成することができるいかなるアミノ酸残基も含まないように改変されている、免疫グロブリンのCH領域、またはCH2領域およびCH3領域を含むその断片。
(Fisher, A. et al. (2009) "Efficient Isolation Of Soluble Intracellular Single-Chain Antibodies Using The Twin-Arginine Translocation Machinery," J. Nol. Biol. 385(1):299-311;Bird, R.E. et al. (1988) "Single-Chain Antigen-Binding Proteins," Science 242:423-426;Huston, J.S. et al. (1988) "Protein Engineering Of Antibody Binding Sites: Recovery Of Specific Activity In An Anti-Digoxin Single-Chain Fv Analogue Produced In Escherichia coli," Proc. Natl. Acad. Sci. (U.S.A.) 85:5879-5883)、溶解性のためにセリンまたはトレオニンを多く含み、重鎖可変ドメインのN末端を軽鎖可変ドメインVLのC末端と接続させるか、またはその反対に接続させることができる(Huang, L. et al. (2013) "Single-Chain Fragment Variable Passive Immunotherapies For Neurodegenerative Diseases," Int. J. Mol. Sci. 14(9):19109-19127;Ahmad, Z.A. et al. (2012) "scFv Antibody: Principles And Clinical Application," Clin. Dev. Immunol. 2012:980250;Huhalov, A. et al. (2004) "Engineered Single Chain Antibody Fragments For Radioimmunotherapy," Q. J. Nucl. Med. Mol. Imaging 48(4):279-288)。そのようなリンカーの一例は、
である(Whitlow, M. et al. (1993) "An Improved Linker For Single-Chain Fv With Reduced Aggregation And Enhanced Proteolytic Stability," Protein Eng. 6:989-995)。本発明に関して特に好ましいリンカーは、アミノ酸配列
を有する。
)を含めることができる。His-Tagのヒスチジン残基のイミダゾール側鎖は、Co2+、Zn2+および特にNi+2といった、ある特定の遷移金属イオンと可逆的な配位結合で係合することができる。したがって、Hisタグで標識したscFv分子をそのような金属イオンを含有するマトリックスに適用すると、それらはマトリックスと特異的に結合するが、ほとんどの非タグ標識タンパク質は結合しない。scFvが追加的または代替的に
などの「HA-Tag」を含んでもよい。ヒトインフルエンザ血球凝集素(HA)は、ヒトウイルスの感染性のために必要とされる表面糖タンパク質である。HA-tagは、ヒトインフルエンザ血球凝集素(HA)表面糖タンパク質に由来し、抗HA-Tag抗体(Millipore)を用いてのscFvの検出を可能にする。
のアミノ酸配列を有するペプチドを使用することが好ましい。使用する免疫原は、このペプチドを含有してもよく、好ましくは、キーホールリンペットヘモシアニン(KLH)にコンジュゲートされるN末端システイン残基を含有するように改変される。遊離Asp421残基を選択的に認識する抗体をスクリーニングするために、この免疫原に対する結合を、タウ(SEQ ID NO:1)のアミノ酸残基407〜423に対応する
などの遊離Asp421残基を含有しないペプチドと比較することができる。抗体1G10D2、抗体1G11A10、抗体5B3C11、抗体5G2A3、および抗体5G2G6は、短縮型Asp421エピトープに対して免疫特異性を呈する例示的な抗体である。
そのような取り組みが、Asp421エピトープと免疫特異的に結合する、抗体1G10D2、抗体1G11A10、抗体5B3C11、抗体5G2A3、および抗体5G2G6の単離につながった。抗体1G10D2、抗体5B3C11、抗体5G2A3、および抗体5G2G6は、短縮型Asp421エピトープを標的とし、ELISAにより決定した場合に高い親和性で結合する。抗体5G2B3は、Biacore分析を用いて決定した場合に高い親和性(10-9 M)で短縮型Asp421エピトープと結合する。対照的に、抗体1G11A10は、Biacore分析を用いて決定した場合により低い親和性(10-6 M)で短縮型Asp421エピトープと結合する。配列分析時に、抗体5G2A3と抗体5G2G6は配列が同一であることが見いだされた。したがって、そのような抗体へのさらなる言及は、抗体5G2A3についてのみすることになる。
時折、複数種類の抗体配列が、同じハイブリドーマ細胞により発現されることがあり、これは、モノクローナルではないハイブリドーマ、または再編成の結果、または融合パートナーの遺伝的バックグラウンドに起因しうる。この場合は、2種の軽鎖可変ドメイン:軽鎖VL1および軽鎖VL2が、抗体5B3C11について同定された。
scFv分子は、抗体1G10D2、抗体1G11A10、抗体5B3C11、または抗体5G2A3から作製されてもよく、そのような抗体と同じ軽鎖および重鎖可変ドメインCDR1、CDR2、およびCDR3を保有することになる。そのようなscFv分子の末梢注射は、トランスジェニックタウ異常症マウスにおいて強いインビボ脳シグナルをもたらすが、野生型マウスまたはアミロイド-β斑マウスにおいてはもたらさない。イメージングシグナルは、ニューロン内タウ凝集物を伴うプローブの共局在と極めてよく相関し、かつエンドソーム、オートファゴソームおよびリソソームのマーカーと関連性があり、このことは、これらの分解経路におけるそれらの相互作用を示唆する。抗体1G10D2、抗体1G11A10、抗体5B3C11、または抗体5G2A3に由来するscFv分子は、ADおよび関連するタウ異常症に関する診断マーカーとして大きな可能性がある。
を有するN末端リーダーペプチド部分、および/またはC末端配列ペプチド部分を含む融合タンパク質として調製される。C末端配列ペプチド部分は以下を含みうる:抗体定常ドメイン、例えば
など(Hussein, A.H. et al. (2007) "Construction and Characterization of Single-Chain Variable Fragment Antibodies Directed against the Bordetella pertussis Surface Adhesins Filamentous Hemagglutinin and Pertactin," Infect. Immun. 75(11):5476-5482)、His-Tag、例えば
)など、および/またはHA-Tag、例えば
など、または任意の順序でのそれらの任意の組み合わせもしくは部分的組み合わせ。好ましいC末端ペプチド部分は、アミノ酸配列
を有し、それ故に(N末端からC末端の方向に)SEQ ID NO:45、SEQ ID NO:5、およびSEQ ID NO:6を含む。
抗体1G10D2から作製した例示的なscFv分子の全配列は、(SEQ ID NO:47)(CDR残基に下線を付している):
であり、配列中、アミノ酸残基1〜112は、抗体1G10D2の軽鎖可変ドメイン(SEQ ID NO:8)のアミノ酸残基であり、アミノ酸残基113〜130は、リンカー(SEQ ID NO:4)のアミノ酸残基であり(小文字斜体で示す)、アミノ酸残基131〜249は、抗体1G10D2の重鎖可変ドメイン(SEQ ID NO:12)のアミノ酸残基である。
抗体1G11A10から作製した例示的なscFv分子の全配列は、(SEQ ID NO:57
)(CDR残基に下線を付している):
であり、配列中、アミノ酸残基1〜112は、抗体1G11A10の軽鎖可変ドメイン(SEQ ID NO:16)のアミノ酸残基であり、アミノ酸残基113〜130は、リンカー(SEQ ID NO:4)のアミノ酸残基であり(小文字斜体で示す)、アミノ酸残基131〜250は、抗体1G11A10の重鎖可変ドメイン(SEQ ID NO:20)のアミノ酸残基である。
a.抗体5B3C11の軽鎖VL1から作製したscFv分子
VL1軽鎖可変ドメインを用いて抗体5B3C11から作製した例示的なscFv分子の全配列は、(SEQ ID NO:67)(CDR残基に下線を付している):
であり、配列中、アミノ酸残基1〜112は、抗体5B3C11のVL1軽鎖可変ドメイン(SEQ ID NO:28)のアミノ酸残基であり、アミノ酸残基113〜130は、リンカー(SEQ ID NO:4)のアミノ酸残基であり(小文字斜体で示す)、アミノ酸残基131〜251は、抗体5B3C11の重鎖可変ドメイン(SEQ ID NO:32)のアミノ酸残基である。
VL2軽鎖可変ドメインを用いて抗体5B3C11から作製した例示的なscFv分子の全配列は、(SEQ ID NO:77)(CDR残基に下線を付している):
であり、配列中、アミノ酸残基1〜108は、抗体5B3C11のVL2軽鎖可変ドメイン(SEQ ID NO:28)のアミノ酸残基であり、アミノ酸残基109〜126は、リンカー(SEQ ID NO:4)のアミノ酸残基であり(小文字斜体で示す)、アミノ酸残基127〜247は、抗体5B3C11の重鎖可変ドメイン(SEQ ID NO:32)のアミノ酸残基である。
抗体5G2A3(または同じ配列を有する抗体5G2G6)から作製した例示的なscFv分子の全配列は、(SEQ ID NO:87)(CDR残基に下線を付している):
であり、配列中、アミノ酸残基1〜112は、抗体5G2A3の軽鎖可変ドメイン(SEQ ID NO:36)のアミノ酸残基であり、アミノ酸残基113〜130は、リンカー(SEQ ID NO:4)のアミノ酸残基であり(小文字斜体で示す)、アミノ酸残基131〜251は、抗体5G2A3の重鎖可変ドメイン(SEQ ID NO:40)のアミノ酸残基である。
コンセンサスCDR配列、ならびに抗体1G10D2、抗体1G11A10、抗体5B3C11、および/または抗体5G2A3のものに類似の結合属性を提供するであろう有望な変異体CDR配列を同定するために、同定された抗体のCDRの分析を実施した。そのような変異体CDRを、表1によるBlosum62.iij分析を用いてコンピュータ計算した。表1は、Blosum62.iij置換スコアを提示する。スコアが高ければ高いほど、置換はより保存的であり、したがって置換が機能に影響を及ぼさない可能性がより高い。
本発明は、対象患者におけるアルツハイマー病またはタウ異常症を診断および/または治療するための、Asp421エピトープに対して免疫特異的である抗体を基にした分子の使用に関する。そのような診断的有用性に関して、そのような使用は、対象において(すなわち、インビボで)、好ましくは検出可能に標識された、例えば、抗体1G10D2、抗体1G11A10、抗体5B3C11もしくは抗体5G2A3、またはそれらのAsp421エピトープ結合性断片(および特にそれらのscFv断片)を用いて(そのような分子は本明細書中で本発明の診断用分子と総称される)、病的タウ配座異性体の存在を検出することを伴ってよい。または、そのような使用は、エクスビボで(例えば、生検試料または死後において)、本発明の診断用分子を用いて病的タウ配座異性体の存在を検出することを伴ってもよい。
本発明のタウ結合性分子は、好ましくは、それらの構成要素ポリペプチド鎖をコードする核酸分子の組換え発現を介して産生される。本発明はしたがって、本発明の抗体のそのような1つもしくは複数のポリペプチド鎖またはそれらの断片をコードする発現ベクターにも関する。
本発明のAsp421エピトープ特異的な抗体を基にした分子は、活性治療薬および種々の他の薬学的に許容される構成要素のうちの1つ以上を含む薬学的組成物として有利に投与される。REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (21st Edition) (2005) (Troy, D.B. et al. (Eds.) Lippincott Williams & Wilkins (Pubis.), Baltimore MD)を参照されたく、これはその全体が参照により本明細書に組み入れられる。好ましい形態は、意図する投与様式および治療的適用に依存する。組成物はまた、所望の製剤に応じて、薬学的に許容される、非毒性の担体、添加剤、希釈剤、増量剤、塩、緩衝剤、界面活性剤(例えば、Tween-20またはTween-80などの非イオン性界面活性剤)、安定化剤(例えば、糖またはタンパク質非含有アミノ酸)、保存料、組織固定剤、溶解補助剤、および/または薬学的組成物に含めるのに適する他の材料、ならびに動物またはヒトへの投与用の薬学的組成物を製剤化するために一般的に用いられる媒体も含みうる。希釈剤は、配合物の生物学的活性に影響を与えないように選択される。そのような希釈剤の例には、蒸留水、リン酸緩衝食塩水、リンゲル液、デキストロース溶液、およびハンクス溶液がある。加えて、薬学的組成物または製剤が、他の担体、または非毒性、非治療的、非免疫原性の安定剤などを含んでもよい。本発明の薬学的組成物において使用しうる適した水性および非水性の担体の例には、水、食塩水、リン酸緩衝食塩水、エタノール、デキストロース、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびそれらの適した混合物、植物油、例えばオリーブ油、トウモロコシ油、ラッカセイ油、綿実油および胡麻油など、カルボキシメチルセルロースコロイド溶液、トラガカントゴムおよび注射用有機エステル、例えばオレイン酸エチルなど、ならびに/またはさまざまな緩衝剤が含まれる。他の担体も薬学の技術分野において周知である。
本発明の分子は、予防的および/または治療的処置のための非経口的、局所的、経口的または鼻腔内手段によって投与することができる。筋肉内注射(例えば、腕または足の筋肉内)および静脈内注入が、本発明の分子の好ましい投与方法である。いくつかの方法では、そのような分子は、持続放出組成物またはデバイス、例えば、Medipad(登録商標)デバイス(Elan Pharm. Technologies, Dublin, Ireland)などとして投与される。いくつかの方法では、本発明の分子は、沈着物が蓄積している特定の組織中へ、例えば頭蓋内注射によって直接注射される。
A.診断的有用性
本発明のAsp421エピトープ特異的な抗体を基にした診断用分子を用いて、対象における病的タウ配座異性体の存在を検出することは、対象から生物試料(例えば、血液、尿、脳脊髄液)を入手すること、生物試料を前記診断用抗体と接触させること、および対象由来の試料における病的タウタンパク質配座異性体に対する診断用分子の結合を検出することによって達成しうる。本発明の診断用分子の検出に容易に適応させることができる、生体試料における病的タウタンパク質の検出を実施するためのアッセイは当技術分野において周知であり、これにはELISA、免疫組織化学、ウエスタンブロットなどが非限定的に含まれる。
以上に指摘したように、本発明の1つの局面は、対象におけるアルツハイマー病または他のタウ異常症を予防または治療する方法であって、そのようなアルツハイマー病または他のタウ異常症を予防または治療するために、本発明のAsp421エピトープ特異的な抗体を基にした分子(特に抗体1G10D2、抗体1G11A10、抗体5B3C11、抗体5G2A3、またはそれらのscFv断片)の有効量の投与を介する方法に関する。そのような投与は、対象の脳からのタウ凝集物の排除を促進する目的で提供してもよく、または対象における神経原線維変化関連の行動的表現型を緩徐化する目的で提供してもよい。加えて、そのような投与を、アルツハイマー病、または神経原線維変化と関連のある他のタウ異常症の発病を遅らせる、妨げる、弱める、または予防する目的で予防的に提供することもできる。
1.タウの短縮型Asp421エピトープと免疫特異的に結合しうる結合性分子。
2.抗体1G10D2、抗体1G11A10、抗体5B3C11、および5G2A3からなる群より選択される抗体と結合について競合する、そのような結合性分子の態様。
3.以下を含む、そのような結合性分子の態様:
(a)(1)SEQ ID NO:9、10、および11のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:13、14、および15のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(b)(1)SEQ ID NO:17、18、および19のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:21、22、および23のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(c)(1)SEQ ID NO:25、26、および27のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(d)(1)SEQ ID NO:29、30、および31のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(e)(1)SEQ ID NO:37、38、および39のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:41、42、および43のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3;
(f)(1)SEQ ID NO:45、46、および47のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:49、50、および51のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3。
4.以下を含む、そのような結合性分子の態様:
(a)SEQ ID NO:115、116、および117のアミノ酸配列をそれぞれ有する可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:118、119、および120のアミノ酸配列をそれぞれ有する可変重鎖CDR1、CDR2、CDR3。
5.レシピエントへ末梢注射されると、タウ凝集物と実質的に共局在する、いずれかのそのような結合性分子の態様。
6.抗体、ダイアボディ、scFvであるか、または抗体、ダイアボディ、もしくはscFvのエピトープ結合性断片を含む、いずれかのそのような結合性分子の態様。
7.抗体である、いずれかのそのような結合性分子の態様。
8.抗体1G10D2、抗体1G11A10、抗体5B3C11、または抗体5G2A3である、いずれかのそのような結合性分子の態様。
9.タウ407〜421ペプチド
と免疫特異的に結合する、上記の結合性分子のいずれかの態様。
10.検出可能に標識されている、上記の結合性分子のいずれかの態様。
11.検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識、または酵素標識である、上記の検出可能に標識された結合性分子のいずれかの態様。
12.(A)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための医薬の製造における使用のための、上記の検出可能に標識された結合性分子のいずれかの態様、または
(B)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための、上記の検出可能に標識された結合性分子の態様のいずれかの使用。
13.(A)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための医薬の製造における使用のための、上記の検出可能に標識された結合性分子のいずれかの態様、または
(B)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための、検出可能に標識された結合性分子の上記の態様のいずれかの使用;
ここで検出または測定は、短縮型タウタンパク質と結合した結合性分子のインビボでのイメージングを含む。
14.(A)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための医薬の製造における使用のための、上記の検出可能に標識された結合性分子のいずれかの態様、または
(B)レシピエント対象の脳または生物試料における病的タウタンパク質の存在または量を検出または測定するための、検出可能に標識された結合性分子の上記の態様のいずれかの使用;
ここで検出または測定は、短縮型タウタンパク質と結合した結合性分子のエクスビボでのイメージングを含む。
15.(A)対象のアルツハイマー病または別のタウ異常症を診断するための医薬の製造に用いるための、
(1)検出可能に標識された、上記の結合性分子のいずれかの態様;または
(2)検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、上記の検出可能に標識された結合性分子のいずれかの態様;または
(B)(1)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能に標識された結合性分子の上記の態様のいずれかの使用;または
(2)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、検出可能に標識された結合性分子の上記の態様のいずれかの使用。
16.(A)対象のアルツハイマー病または別のタウ異常症を診断するための医薬の製造に用いるための、
(1)検出可能に標識された、上記の結合性分子のいずれかの態様;または
(2)検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、上記の検出可能に標識された結合性分子のいずれかの態様;または
(B)(1)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能に標識された結合性分子の上記の態様のいずれかの使用;もしくは
(2)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、検出可能に標識された結合性分子の上記の態様のいずれかの使用;
ここで医薬は対象に投与されるインビボ医薬である。
17.(A)対象のアルツハイマー病または別のタウ異常症を診断するための医薬の製造に用いるための、
(1)検出可能に標識された、上記の結合性分子のいずれかの態様;または
(2)検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、上記の検出可能に標識された結合性分子のいずれかの態様;または
(B)(1)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能に標識された結合性分子の上記の態様のいずれかの使用;または
(2)対象のアルツハイマー病または別のタウ異常症を診断するための、検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識または酵素標識である、検出可能に標識された結合性分子の上記の態様のいずれかの使用;
ここで医薬は対象の生検試料とともにエクスビボでインキュベートされる。
18.タウ異常症が、前頭側頭型認知症、17番染色体に連鎖したパーキンソニズム(FTDP-17)、進行性核上性麻痺、大脳皮質基底核変性症、ピック病、進行性皮質下グリオーシス、神経原線維変化型認知症、石灰化を伴うびまん性神経原線維変化病、嗜銀顆粒性認知症、筋萎縮性側索硬化症パーキンソニズム・認知症複合、ボクサー認知症、ダウン症候群、ゲルストマン・シュトロイスラー・シャインカー病、ハラーフォルデン・シュパッツ病、封入体筋炎、クロイツフェルト・ヤコブ病、多系統萎縮症、ニーマン・ピック病C型、プリオンタンパク質脳アミロイド血管障害、亜急性硬化性全脳炎、筋強直性ジストロフィー、神経原線維変化を伴う非グアナミアン運動ニューロン疾患、脳炎後パーキンソニズム、急性外傷性脳損傷および慢性外傷性脳症を含む群から選択される、そのような使用のいずれかの態様。
抗体1G10D2、抗体1G11A10、抗体5B3C11、抗体5G2A3(または抗体5G2G6)のタウの短縮型Asp421エピトープに対する特異性
抗体1G10D2、抗体1G11A10、抗体5B3C11、抗体5G2A3/5G2G6の抗体の、タウの短縮型Asp421エピトープと免疫特異的に結合する能力を実証するために、抗体調製物を、タウ残基407〜421(SEQ ID NO:7)または407〜423(SEQ ID NO:105)(それぞれ、SEQ ID NO:1のそれぞれ残基407〜421および407〜423に対応する)のいずれかに対応する固定化したペプチドの存在下でインキュベートし、固定化したペプチドと結合した抗体の量を、ELISAを介して決定した。抗体1G10D2(図1A)、抗体1G11A10(図1B)、抗体5B3C11(図1C)、抗体5G2A3(図1D)、および抗体5G2G6(図1E)はそれぞれ、短縮型(タウ407〜421)ペプチド(SEQ ID NO:7)と強く結合しうるが、非短縮型エピトープを含有するペプチド(タウ407〜423;SEQ ID NO:105)には結合しえないことが見いだされた。したがって、このデータにより、抗体1G11A10、5G2A3、および5G2G6の、タウの短縮型Asp421エピトープと免疫特異的に結合する能力が確認される。
タウのAsp421エピトープを認識する抗体の病的タウを排除する能力
位置396および404にホスホセリン残基({P}Ser396および{P}SerSer404)を有するタウを含む、「{P}Ser396/{P}Ser404タウエピトープ」などのタウエピトープに対するモノクローナル抗体を用いた免疫療法は、過剰リン酸化タウレベルおよびそれと関連のある病理の低下を実証した。本発明の短縮型タウエピトープ結合性分子の治療能力をさらに実証するために、短縮型Asp421エピトープと免疫特異的に結合するモノクローナル抗体5G2A3/5G2G6および1G11A10の過剰リン酸化タウに影響を及ぼす能力を、初代ニューロン培養物を用いて検討した。加えて、抗体5G2A3および1G11A10の過剰リン酸化タウに影響を及ぼす能力を、混合皮質培養物を用いて検討した。
タウタンパク質のAsp421をターゲティングする抗体での処理は、関連がある小膠細胞症の低下とともに、病的タウの毒性を予防し、かつ排除する
タウの短縮型Asp421エピトープと免疫特異的に結合しうる抗体の効果を解明するために、混合皮質培養物および初代ニューロンを両方とも、PHF(1μg/ml)で24時間、前処理し、その後、10μg/mlの抗体5G2A3および抗体1G11A10をさらに24時間、48時間、72時間、または96時間、投与して、細胞内タウの排除に対するそのような処理の効果を評価した。
混合皮質培養物における、高用量PHF(10μg/ml)とタウの短縮型Asp421エピトープに対して免疫特異的である抗体(10μg/ml)とのコインキュベーション
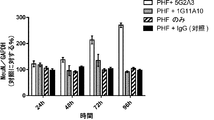
タウの短縮型Asp421エピトープと免疫特異的に結合しうる抗体の効果をさらに解明するために、生後0日目のJNPL3マウス由来の混合ニューロン培養物を、PHF(10μg/ml)および抗体5G2A3(10μg/ml)または抗体1G11A10(10μg/ml)と24時間、48時間、72時間、または96時間の持続時間にわたってコインキュベートした。ウエスタン免疫ブロットをNeuNに対して行い、無処理の細胞と比較した場合に、PHFのみで処理した細胞およびPHF+IgGコインキュベートした細胞について、48時間(27%)、72時間(37%)、および96時間(53%)でNeuNのレベルの有意な減少を示した(p<0.0001)。NeuNレベルにおけるいかなる有意な変化も、抗体5G2A3とコインキュベートした細胞について24時間から72時間まで観察されず(p=0.18)、一方、突然の増大(122%、p<0.0001)が、無処理の細胞と比較した場合に96時間で観察された。抗体1G11A10およびPHFとコインキュベートした細胞は、無処理の細胞と比較した場合に、48時間までNeuNのレベルにおけるいかなる有意な変化も示さず、その後、72時間(18%)および96時間(24%)でNeuNレベルの徐々の減少を示した。この調査の結果を図9に示す。
タウの短縮型Asp421エピトープに対して免疫特異的である抗体のタウ異常症マウスにおける組織反応性
タウの短縮型Asp421エピトープに対して免疫特異的である抗体の組織反応性を評価するために、ドットブロット分析を、JNPL3タウ異常症マウス由来(図13A)およびhTauタウ異常症マウス由来(図13B)の脳上清試料に対して実施した。
ヒト(対照)脳およびヒトAD脳から精製したPHF由来の脳上清試料における組織反応性
タウの短縮型Asp421エピトープに対して免疫特異的である抗体の組織反応性の評価をまた、ヒト(対照)脳由来およびヒトAD脳から精製したPHF由来の脳上清試料に対しても実施した。この調査の結果を図14に示す。ヒト試料において、抗体5G2A3は、アルツハイマー脳から単離したPHF物質を検出する最強のシグナルを与える。これはまた、対照脳上清(C1〜C6)において低いシグナルを有するため、最良の特異性も有する。抗体1G11A10および市販のC3抗体は、病的PHF物質を検出する、匹敵するシグナルを有するが、抗体1G11A10は、対照脳においてC3よりも低いシグナルを有するため、より良い特異性を有する。
Claims (17)
- タウの短縮型Asp421エピトープと免疫特異的に結合しうる、抗体を基にした分子であって、該エピトープが、タウ407〜421のアミノ酸配列
を含むアスパラギン酸残基含有タウペプチドを含むポリペプチド上に存在し、
(A) SEQ ID NO:7の該アスパラギン酸残基が、該ポリペプチドのC末端タウ残基であり、
(B) 該免疫特異的な結合と比較して、該抗体を基にした分子が、SEQ ID NO:7の該アスパラギン酸残基に追加のC末端タウ配列残基を含有するポリペプチドと少なくとも100倍低い結合を示し、かつ
(C) 該抗体を基にした分子が、病的タウタンパク質とさらに結合しうる、
抗体を基にした分子;
ここで該抗体を基にした分子は:
(i) 抗体、単一ドメイン抗体断片、scFv分子、ダイアボディ、または、それらのエピトープ結合ドメインである、かつ、
(ii) 以下を含む:
(a)(1)SEQ ID NO:37、38、および39のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:41、42、および43のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3;
(b)(1)SEQ ID NO:17、18、および19のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:21、22、および23のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3;
(c)(1)SEQ ID NO:9、10、および11のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:13、14、および15のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3;
(d)(1)SEQ ID NO:25、26、および27のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3;または
(e)(1)SEQ ID NO:29、30、および31のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(2)SEQ ID NO:33、34、および35のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3。 - (a)SEQ ID NO:97、98、および99のアミノ酸配列をそれぞれ含む可変軽鎖CDR1、CDR2、CDR3;ならびに
(b)SEQ ID NO:100、101、および102のアミノ酸配列をそれぞれ含む可変重鎖CDR1、CDR2、CDR3 を含む、請求項1に記載の抗体を基にした分子。 - レシピエントへ末梢注射されると、タウ凝集物と実質的に共局在する、請求項1〜2のいずれか一項に記載の抗体を基にした分子。
- 抗体である、請求項1〜3のいずれか一項に記載の抗体を基にした分子。
- ヒト化抗体であるか、またはヒト化抗体のエピトープ結合性断片を含む、請求項1〜3のいずれか一項に記載の抗体を基にした分子。
- scFvである、請求項1〜3のいずれか一項に記載の抗体を基にした分子。
- 検出可能に標識されている、請求項1〜6のいずれか一項に記載の抗体を基にした分子。
- 検出可能な標識が、蛍光標識、化学発光標識、常磁性標識、放射性同位体標識、または酵素標識である、請求項7に記載の抗体を基にした分子。
- レシピエント対象の脳、脳脊髄液、血液、血清、または血漿に由来する試料における短縮型タウタンパク質の存在または量を検出または測定するための、請求項7〜8のいずれか一項に記載の抗体を基にした分子の使用であって、該短縮型タウタンパク質がタウの短縮型Asp421エピトープを含む、使用。
- 検出または測定が、
前記短縮型タウタンパク質と結合した前記抗体を基にした分子の、エクスビボでのイメージング
を含む、請求項9に記載の使用。 - 請求項7〜8のいずれか一項に記載の抗体を基にした分子を含む、レシピエント対象の脳、脳脊髄液、血液、血清、または血漿における短縮型タウタンパク質の存在または量を検出または測定するためのインビボ医薬であって、該短縮型タウタンパク質がタウの短縮型Asp421エピトープを含む、医薬。
- (i)検出もしくは測定が、前記短縮型タウタンパク質と結合した前記抗体を基にした分子の、インビボイメージングを含む;かつ/または
(ii)検出もしくは測定が、対象のアルツハイマー病もしくは別のタウ異常症を診断するためである、
請求項11に記載の医薬。 - 対象のアルツハイマー病または別のタウ異常症の診断または治療のためのインビボ医薬であって、請求項1〜6のいずれか一項に記載の抗体を基にした分子と、1つまたは複数の担体、希釈剤、および/または安定化剤とを含む、インビボ医薬。
- 対象がヒトである、請求項9〜10のいずれか一項に記載の使用。
- 対象がヒトである、請求項11〜13のいずれか一項に記載の医薬。
- 対象の脳における前記短縮型タウタンパク質の存在もしくは量を検出もしくは測定するための、または対象におけるアルツハイマー病もしくは別のタウ異常症を診断するためのキットであって、請求項6に記載の抗体を基にした分子、および検出可能な標識を含み、かつ前記抗体を基にした分子と結合しうる第2の試薬を含む、キット。
- タウ異常症が、前頭側頭型認知症、17番染色体に連鎖したパーキンソニズム(FTDP-17)、進行性核上性麻痺、大脳皮質基底核変性症、ピック病、進行性皮質下グリオーシス、神経原線維変化型認知症(tangle only dementia)、石灰化を伴うびまん性神経原線維変化、嗜銀顆粒性認知症、筋萎縮性側索硬化症パーキンソニズム・認知症複合、ボクサー認知症、ダウン症候群、ゲルストマン・シュトロイスラー・シャインカー病、ハラーフォルデン・シュパッツ病、封入体筋炎、クロイツフェルト・ヤコブ病、多系統萎縮症、ニーマン・ピック病C型、プリオンタンパク質脳アミロイド血管障害、亜急性硬化性全脳炎、筋強直性ジストロフィー、神経原線維変化を伴う非グアナミアン(non-guanamian)運動ニューロン疾患、脳炎後パーキンソニズム、急性外傷性脳損傷、および慢性外傷性脳症を含む群から選択される、請求項9〜10、もしくは14のいずれか一項に記載の使用、または請求項11〜13、もしくは15に記載のインビボ医薬、または請求項16に記載のキット。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562204699P | 2015-08-13 | 2015-08-13 | |
| US62/204,699 | 2015-08-13 | ||
| US201562211123P | 2015-08-28 | 2015-08-28 | |
| US62/211,123 | 2015-08-28 | ||
| PCT/US2016/046513 WO2017027685A2 (en) | 2015-08-13 | 2016-08-11 | Antibody-based molecules specific for the truncated asp421 epitope of tau and their uses in the diagnosis and treatment of tauopathy |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018534236A JP2018534236A (ja) | 2018-11-22 |
| JP2018534236A5 JP2018534236A5 (ja) | 2019-09-19 |
| JP6913078B2 true JP6913078B2 (ja) | 2021-08-04 |
Family
ID=57984099
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018507018A Active JP6913078B2 (ja) | 2015-08-13 | 2016-08-11 | タウの短縮型Asp421エピトープに特異的な、抗体を基にした分子、ならびにタウ異常症の診断および治療におけるそれらの使用 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US10988528B2 (ja) |
| EP (1) | EP3334453A4 (ja) |
| JP (1) | JP6913078B2 (ja) |
| CN (1) | CN108135986B (ja) |
| WO (1) | WO2017027685A2 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SG11201907422RA (en) | 2017-02-17 | 2019-09-27 | Denali Therapeutics Inc | Anti-tau antibodies and methods of use thereof |
| CA3070446A1 (en) | 2017-07-25 | 2019-01-31 | Immutics, Inc. | Treating cancer by blocking the interaction of tim-3 and its ligand |
| JP7290645B2 (ja) * | 2017-12-13 | 2023-06-13 | エックスディーシーエクスプローラー (シャンハイ) カンパニー リミテッド | EGFRvIII抗体ならびにその複合体、製造方法および使用 |
| CN113874078B (zh) * | 2019-04-05 | 2025-05-06 | Tauc3生物制品有限公司 | 抗tauc3抗体及其应用 |
| JP2022528459A (ja) | 2019-04-05 | 2022-06-10 | ビー - ポータル バイオロジクス、インコーポレイテッド | 融合構築物及びその使用 |
| US12134655B2 (en) | 2019-04-30 | 2024-11-05 | Absci Corporation | Cancer associated antibody compositions and methods of use |
| CN110679549B (zh) * | 2019-11-05 | 2021-08-20 | 南通大学 | 一种阿尔茨海默病小鼠模型的构建方法 |
| US12281166B2 (en) | 2020-05-26 | 2025-04-22 | Truebinding, Inc. | Methods of treating inflammatory diseases by blocking Galectin-3 |
Family Cites Families (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| JPS5896026A (ja) | 1981-10-30 | 1983-06-07 | Nippon Chemiphar Co Ltd | 新規ウロキナ−ゼ誘導体およびその製造法ならびにそれを含有する血栓溶解剤 |
| US4609546A (en) | 1982-06-24 | 1986-09-02 | Japan Chemical Research Co., Ltd. | Long-acting composition |
| US4681581A (en) | 1983-12-05 | 1987-07-21 | Coates Fredrica V | Adjustable size diaper and folding method therefor |
| US4766106A (en) | 1985-06-26 | 1988-08-23 | Cetus Corporation | Solubilization of proteins for pharmaceutical compositions using polymer conjugation |
| US5776093A (en) | 1985-07-05 | 1998-07-07 | Immunomedics, Inc. | Method for imaging and treating organs and tissues |
| US5101827A (en) | 1985-07-05 | 1992-04-07 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US4735210A (en) | 1985-07-05 | 1988-04-05 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US5750172A (en) | 1987-06-23 | 1998-05-12 | Pharming B.V. | Transgenic non human mammal milk |
| US5648471A (en) | 1987-12-03 | 1997-07-15 | Centocor, Inc. | One vial method for labeling antibodies with Technetium-99m |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| DK0486622T3 (da) | 1989-08-09 | 1999-07-19 | Rhomed Inc | Direkte radiomærkning af antistoffer og andre proteiner med technetium eller rhenium |
| US5633076A (en) | 1989-12-01 | 1997-05-27 | Pharming Bv | Method of producing a transgenic bovine or transgenic bovine embryo |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| WO1994025585A1 (en) | 1993-04-26 | 1994-11-10 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| EP0814159B1 (en) | 1990-08-29 | 2005-07-27 | GenPharm International, Inc. | Transgenic mice capable of producing heterologous antibodies |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| WO1992022645A1 (en) | 1991-06-14 | 1992-12-23 | Genpharm International, Inc. | Transgenic immunodeficient non-human animals |
| DE69233254T2 (de) | 1991-06-14 | 2004-09-16 | Genentech, Inc., South San Francisco | Humanisierter Heregulin Antikörper |
| US5434050A (en) | 1991-08-13 | 1995-07-18 | Regents Of The University Of Minnesota | Labelled β-amyloid peptide and methods of screening for Alzheimer's disease |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| EP0618968B1 (en) | 1991-12-06 | 1999-10-13 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Tools for the diagnosis and treatment of alzheimer's disease |
| US5733743A (en) | 1992-03-24 | 1998-03-31 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| PT804070E (pt) | 1993-03-09 | 2000-11-30 | Genzyme Corp | Isolamento de componentes de interesse a partir do leite. |
| US5827690A (en) | 1993-12-20 | 1998-10-27 | Genzyme Transgenics Corporatiion | Transgenic production of antibodies in milk |
| US6077835A (en) | 1994-03-23 | 2000-06-20 | Case Western Reserve University | Delivery of compacted nucleic acid to cells |
| US6136548A (en) | 1994-11-22 | 2000-10-24 | Rutgers, The State University Of New Jersey | Methods for identifying useful T-PA mutant derivatives for treatment of vascular hemorrhaging |
| US5670477A (en) | 1995-04-20 | 1997-09-23 | Joseph F. Poduslo | Method to enhance permeability of the blood/brain blood/nerve bariers to therapeutic agents |
| US6265150B1 (en) | 1995-06-07 | 2001-07-24 | Becton Dickinson & Company | Phage antibodies |
| KR970029803A (ko) | 1995-11-03 | 1997-06-26 | 김광호 | 반도체 메모리장치의 프리차지 회로 |
| JP4124486B2 (ja) | 1996-05-22 | 2008-07-23 | ビベンティア バイオテック インコーポレイテッド | ガン細胞を特異的に検出する抗原結合フラグメント、このフラグメントをコードするヌクレオチド、ならびにガンの予防および検出のためのその使用 |
| AU5508798A (en) | 1996-11-19 | 1998-06-10 | Trustees Of The University Of Pennsylvania, The | Diagnostic and therapeutic reagents for alzheimer's disease |
| DE60128138T2 (de) | 2000-11-02 | 2008-01-03 | Cornell Research Foundation, Inc. | In vivo multiphoton diagnostische detektion und bilddarstellung einer neurodegenerativen erkrankung |
| AT500379B8 (de) | 2001-02-02 | 2009-08-15 | Axon Neuroscience | Tau-proteine |
| WO2002094191A2 (en) | 2001-05-23 | 2002-11-28 | New York University | Detection of alzheimer's amyloid by magnetic resonance imaging |
| WO2004006955A1 (en) | 2001-07-12 | 2004-01-22 | Jefferson Foote | Super humanized antibodies |
| EP2287198A3 (en) * | 2002-03-13 | 2011-05-25 | Biogen Idec MA Inc. | Anti-alpha V beta 6 antibodies |
| JP4885122B2 (ja) | 2004-04-15 | 2012-02-29 | ユニバーシティ オブ フロリダ リサーチ ファンデーション インコーポレーティッド | 癌、器官傷害、および筋肉リハビリテーション/運動過剰訓練についての診断の生物マーカーとしてのタンパク質分解マーカー |
| MY148646A (en) * | 2004-05-10 | 2013-05-15 | Abgenomics Cooperatief Ua | Anti-psgl-1 antibodies |
| WO2006121656A2 (en) | 2005-05-05 | 2006-11-16 | Merck & Co., Inc. | Peptide conjugate compositions and methods for the prevention and treatment of alzheimer's disease |
| WO2007059782A1 (en) | 2005-11-28 | 2007-05-31 | Genmab A/S | Recombinant monovalent antibodies and methods for production thereof |
| US8012936B2 (en) | 2006-03-29 | 2011-09-06 | New York University | Tau fragments for immunotherapy |
| US20080220449A1 (en) | 2007-02-08 | 2008-09-11 | Oligomerix, Inc. | Biomarkers and assays for Alzheimer's disease |
| WO2009033743A1 (en) | 2007-09-13 | 2009-03-19 | University Of Zurich Prorektorat Forschung | Monoclonal amyloid beta (abeta)-specific antibody and uses thereof |
| AU2010224824B2 (en) | 2009-03-18 | 2014-02-20 | Ac Immune S.A. | Method for therapeutic use |
| UA107571C2 (xx) | 2009-04-03 | 2015-01-26 | Фармацевтична композиція | |
| EP3329932A1 (en) * | 2009-06-10 | 2018-06-06 | New York University | Immunological targeting of pathological tau proteins |
| CA2768346A1 (en) | 2009-07-30 | 2011-02-03 | Pfizer Vaccines Llc | Antigenic tau peptides and uses thereof |
| MA34291B1 (fr) * | 2010-05-03 | 2013-06-01 | Genentech Inc | Compositions et méthodes de diagnostic et de traitement d'une tumeur |
| WO2012106363A2 (en) * | 2011-01-31 | 2012-08-09 | Intellect Neurosciences Inc. | Treatment of tauopathies |
| EP2832856A4 (en) * | 2012-03-29 | 2016-01-27 | Chugai Pharmaceutical Co Ltd | ANTI-LAMP5 ANTIBODIES AND USE THEREOF |
| GB201319761D0 (en) | 2013-11-08 | 2013-12-25 | Nordic Bioscience As | Biomarkers of disease progression |
| CN107073297B (zh) | 2014-07-08 | 2021-09-14 | 纽约大学 | Tau显像配体和其在Tau蛋白病的诊断和治疗中的用途 |
| US20190224339A1 (en) | 2016-04-29 | 2019-07-25 | Voyager Therapeutics, Inc. | Compositions for the treatment of disease |
-
2016
- 2016-08-11 JP JP2018507018A patent/JP6913078B2/ja active Active
- 2016-08-11 US US15/750,975 patent/US10988528B2/en active Active
- 2016-08-11 CN CN201680057687.XA patent/CN108135986B/zh active Active
- 2016-08-11 EP EP16835896.8A patent/EP3334453A4/en active Pending
- 2016-08-11 WO PCT/US2016/046513 patent/WO2017027685A2/en active Application Filing
-
2021
- 2021-02-16 US US17/176,374 patent/US11958898B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP3334453A2 (en) | 2018-06-20 |
| JP2018534236A (ja) | 2018-11-22 |
| US11958898B2 (en) | 2024-04-16 |
| WO2017027685A3 (en) | 2017-03-23 |
| EP3334453A4 (en) | 2019-02-06 |
| CN108135986A (zh) | 2018-06-08 |
| WO2017027685A2 (en) | 2017-02-16 |
| US20210198349A1 (en) | 2021-07-01 |
| US20190315841A1 (en) | 2019-10-17 |
| CN108135986B (zh) | 2022-07-29 |
| US10988528B2 (en) | 2021-04-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11519920B2 (en) | Tau imaging ligands and their uses in the diagnosis and treatment of tauopathy | |
| US11739140B2 (en) | Antibodies specific for hyperphosphorylated tau and methods of use thereof | |
| JP6913078B2 (ja) | タウの短縮型Asp421エピトープに特異的な、抗体を基にした分子、ならびにタウ異常症の診断および治療におけるそれらの使用 | |
| JP6913077B2 (ja) | タウの{p}Ser404エピトープに対し選択的な、抗体を基にした分子、ならびにタウ異常症の診断および治療におけるそれらの使用 | |
| US12365724B2 (en) | Antibodies binding to phospho-tau comprising phosphorylated Ser396 and Ser404 and methods of detecting thereof | |
| US20220041697A1 (en) | Monoclonal antibodies targeting c-terminal region of phosphorylated tau | |
| HK1235022A1 (en) | Tau imaging ligands and their uses in the diagnosis and treatment of tauopathy | |
| HK1235022B (en) | Tau imaging ligands and their uses in the diagnosis and treatment of tauopathy | |
| HK1250659A1 (en) | Antibody-based molecules specific for the truncated asp421 epitope of tau and their uses in the diagnosis and treatment of tauopathy | |
| HK1250659B (en) | Antibody-based molecules specific for the truncated asp421 epitope of tau and their uses in the diagnosis and treatment of tauopathy | |
| HK1250729B (en) | Antibody-based molecules selective for the {p}ser404 epitope of tau and their uses in the diagnosis and treatment of tauopathy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190809 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190809 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20200713 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200727 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201026 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210105 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210127 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210616 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210709 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6913078 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |