JP6801846B2 - 3dホログラフィックイメージングフローサイトメトリ - Google Patents
3dホログラフィックイメージングフローサイトメトリ Download PDFInfo
- Publication number
- JP6801846B2 JP6801846B2 JP2015556256A JP2015556256A JP6801846B2 JP 6801846 B2 JP6801846 B2 JP 6801846B2 JP 2015556256 A JP2015556256 A JP 2015556256A JP 2015556256 A JP2015556256 A JP 2015556256A JP 6801846 B2 JP6801846 B2 JP 6801846B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- light
- detected
- flow channel
- imaging system
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000003384 imaging method Methods 0.000 title claims description 55
- 238000000684 flow cytometry Methods 0.000 title claims description 13
- 238000000034 method Methods 0.000 claims description 101
- 238000001228 spectrum Methods 0.000 claims description 37
- 238000005286 illumination Methods 0.000 claims description 31
- 238000001514 detection method Methods 0.000 claims description 20
- 238000005259 measurement Methods 0.000 claims description 20
- 230000003287 optical effect Effects 0.000 claims description 18
- 238000001093 holography Methods 0.000 claims description 14
- 238000013507 mapping Methods 0.000 claims description 11
- 238000012545 processing Methods 0.000 claims description 9
- 239000000758 substrate Substances 0.000 claims description 8
- 239000012530 fluid Substances 0.000 claims description 5
- 239000012925 reference material Substances 0.000 claims description 3
- 239000012620 biological material Substances 0.000 claims description 2
- 238000004364 calculation method Methods 0.000 claims description 2
- 230000001427 coherent effect Effects 0.000 claims description 2
- 230000004044 response Effects 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 238000012360 testing method Methods 0.000 claims 1
- 239000000523 sample Substances 0.000 description 116
- 210000004027 cell Anatomy 0.000 description 95
- 230000008569 process Effects 0.000 description 17
- 238000003325 tomography Methods 0.000 description 17
- 239000011324 bead Substances 0.000 description 11
- 239000000463 material Substances 0.000 description 10
- 230000006870 function Effects 0.000 description 9
- 239000004205 dimethyl polysiloxane Substances 0.000 description 8
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 8
- 206010009944 Colon cancer Diseases 0.000 description 6
- 239000004793 Polystyrene Substances 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 229920002223 polystyrene Polymers 0.000 description 6
- 108010006886 Vitrogen Proteins 0.000 description 5
- 238000005305 interferometry Methods 0.000 description 5
- 210000003463 organelle Anatomy 0.000 description 5
- 208000029742 colonic neoplasm Diseases 0.000 description 4
- 238000002591 computed tomography Methods 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 230000010363 phase shift Effects 0.000 description 4
- 208000034578 Multiple myelomas Diseases 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 230000007547 defect Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000009499 grossing Methods 0.000 description 3
- 230000037041 intracellular level Effects 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 238000002135 phase contrast microscopy Methods 0.000 description 3
- 239000010409 thin film Substances 0.000 description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- QTENRWWVYAAPBI-YZTFXSNBSA-N Streptomycin sulfate Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@H]1[C@H](N=C(N)N)[C@@H](O)[C@H](N=C(N)N)[C@@H](O)[C@@H]1O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@H]1[C@H](N=C(N)N)[C@@H](O)[C@H](N=C(N)N)[C@@H](O)[C@@H]1O QTENRWWVYAAPBI-YZTFXSNBSA-N 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- 230000004075 alteration Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000002872 contrast media Substances 0.000 description 2
- 238000012937 correction Methods 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- -1 polydimethylsiloxane Polymers 0.000 description 2
- 210000001747 pupil Anatomy 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000012353 t test Methods 0.000 description 2
- 235000012431 wafers Nutrition 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000711 cancerogenic effect Effects 0.000 description 1
- 231100000315 carcinogenic Toxicity 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- HGAZMNJKRQFZKS-UHFFFAOYSA-N chloroethene;ethenyl acetate Chemical compound ClC=C.CC(=O)OC=C HGAZMNJKRQFZKS-UHFFFAOYSA-N 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 229940039231 contrast media Drugs 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000001739 density measurement Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000002059 diagnostic imaging Methods 0.000 description 1
- 230000010339 dilation Effects 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000000572 ellipsometry Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000010304 firing Methods 0.000 description 1
- 229920002457 flexible plastic Polymers 0.000 description 1
- 238000007667 floating Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000001215 fluorescent labelling Methods 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010860 high-resolution live-cell imaging Methods 0.000 description 1
- 238000012804 iterative process Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000028161 membrane depolarization Effects 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 238000012014 optical coherence tomography Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 229920002120 photoresistant polymer Polymers 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 230000001179 pupillary effect Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000009877 rendering Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 238000002174 soft lithography Methods 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 238000004441 surface measurement Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N15/1434—Electro-optical investigation, e.g. flow cytometers using an analyser being characterised by its optical arrangement
-
- G01N15/1433—
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/49—Scattering, i.e. diffuse reflection within a body or fluid
- G01N21/53—Scattering, i.e. diffuse reflection within a body or fluid within a flowing fluid, e.g. smoke
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H1/00—Holographic processes or apparatus using light, infrared or ultraviolet waves for obtaining holograms or for obtaining an image from them; Details peculiar thereto
- G03H1/04—Processes or apparatus for producing holograms
- G03H1/0443—Digital holography, i.e. recording holograms with digital recording means
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H1/00—Holographic processes or apparatus using light, infrared or ultraviolet waves for obtaining holograms or for obtaining an image from them; Details peculiar thereto
- G03H1/04—Processes or apparatus for producing holograms
- G03H1/08—Synthesising holograms, i.e. holograms synthesized from objects or objects from holograms
- G03H1/0866—Digital holographic imaging, i.e. synthesizing holobjects from holograms
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N15/1484—Electro-optical investigation, e.g. flow cytometers microstructural devices
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N15/1434—Electro-optical investigation, e.g. flow cytometers using an analyser being characterised by its optical arrangement
- G01N2015/144—Imaging characterised by its optical setup
- G01N2015/1445—Three-dimensional imaging, imaging in different image planes, e.g. under different angles or at different depths, e.g. by a relative motion of sample and detector, for instance by tomography
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H1/00—Holographic processes or apparatus using light, infrared or ultraviolet waves for obtaining holograms or for obtaining an image from them; Details peculiar thereto
- G03H1/0005—Adaptation of holography to specific applications
- G03H2001/0033—Adaptation of holography to specific applications in hologrammetry for measuring or analysing
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H1/00—Holographic processes or apparatus using light, infrared or ultraviolet waves for obtaining holograms or for obtaining an image from them; Details peculiar thereto
- G03H1/0005—Adaptation of holography to specific applications
- G03H2001/005—Adaptation of holography to specific applications in microscopy, e.g. digital holographic microscope [DHM]
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H1/00—Holographic processes or apparatus using light, infrared or ultraviolet waves for obtaining holograms or for obtaining an image from them; Details peculiar thereto
- G03H1/04—Processes or apparatus for producing holograms
- G03H1/0443—Digital holography, i.e. recording holograms with digital recording means
- G03H2001/0445—Off-axis recording arrangement
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03H—HOLOGRAPHIC PROCESSES OR APPARATUS
- G03H2210/00—Object characteristics
- G03H2210/10—Modulation characteristics, e.g. amplitude, phase, polarisation
- G03H2210/12—Phase modulating object, e.g. living cell
Description
[関連出願への参照]
本出願は、2013年2月5日に出願された米国仮特許出願第61/761、079号に関連し、それに基づく優先権を主張する。当該出願の全開示は、本明細書に参照により全体として組み込まれる。
本発明は、アメリカ国立衛生研究所により授けられた、付与第EB015871号の下、政府のサポートとともになされた。政府は、本発明において複数の特定の権利を有する。
[背景技術]
式中、被積分関数は、複素振幅P(λfp)および波ベクトル(p,0,w(p))を備えた平面波を表す。ここで、関数w(p)は、w(p)=((1/λ)2−p2)1/2と定義され、変数λおよびfは、それぞれ照明光の波長および円筒形レンズの焦点距離である。瞳孔関数P(x)は、円筒形レンズの光学収差、または該当する場合はアポディゼーションを表す。定量的位相イメージングでは、瞳孔関数は直接測定され得、複数のイメージから差し引かれ得る。従って、我々は以降の式において、瞳孔関数を省略する。
ここで、
ここで、
ここで、
式(5)は、測定された、標本からの散乱された複数の角スペクトルを、空間周波数領域内の標本の散乱ポテンシャルにマッピングする方法を提供する。
ここで、Is(x,y)およびIRは、それぞれ試料ビームおよび参照ビームの放射照度であり、Δφ(x,y)は、当該2つのビームの間の位相差である。ベクトル(p,q)は、参照ビームの角度に対する、検出面上の試料ビームの入射角を示す。ベクトルの大きさおよび角度は、未処理の干渉における、複数のフリンジ(図2の(i)の挿絵を参照)の間隔および向きをそれぞれ示す。図2の(ii)は、図2の(i)のフーリエ変換の大きさ、または対数尺度(底10)の式(7)を示す。点線の円内の領域は、次によって記述され得る。
ここで、
本明細書によれば、以下の各項目に記載の構成もまた開示される。
[項目1]
軸外ホログラフィのためのイメージングシステムであって、
試料ビーム経路と、参照ビーム経路と、に分割される光を放出する照明源と、
検出において、検出された参照光は、検出された散乱光に対して角度オフセットするように、前記試料ビーム経路に沿って収集された前記散乱光と、前記参照ビーム経路に沿って前記参照光と、の両方を検出する検出システムと、を備え、
前記試料ビーム経路は、
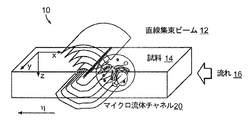
試料を直線集束ビームで照明すべく、前記試料ビーム経路に沿って、前記光の焦点を合わせる試料照明オプティクスと、
前記試料ビーム経路に沿って、試料から散乱された光を収集する収集オプティクスと、を含んでいる、イメージングシステム。
[項目2]
前記照明源は、コリメートされた照明源である、請求項1に記載のシステム。
[項目3]
前記照明源は、多波長の照明源である、請求項1に記載のシステム。
[項目4]
前記照明源から放出される前記光を、前記試料ビーム経路と、前記参照ビーム経路とに分割するためのスプリッタをさらに備える、請求項1に記載のシステム。
[項目5]
前記参照ビーム経路は、検出された前記参照光を、検出された前記散乱光に対して角度オフセットする、オフセットオプティクスを含む、請求項1に記載のシステム。
[項目6]
前記オフセットオプティクスは、傾斜ミラーを含む、請求項5に記載のシステム。
[項目7]
前記試料および前記直線集束ビームを互いに相対的に並進させる、スキャンシステムをさらに備える、請求項1に記載のシステム。
[項目8]
前記スキャンシステムは、前記試料を、前記直線集束ビームを横断して並進させる、請求項7に記載のシステム。
[項目9]
前記スキャンシステムは、懸濁培地に懸濁された試料を、直線集束ビームを横断して流す、基板で定義されたフローチャネルを含む、請求項8に記載のシステム。
[項目10]
前記試料は細胞である、請求項9に記載のシステム。
[項目11]
前記フローチャネルは、前記試料の推定された幅サイズの150〜200%の間の断面直径を含む、請求項9に記載のシステム。
[項目12]
前記断面直径は、前記フローチャネルの断面高さである、請求項11に記載のシステム。
[項目13]
(i)前記フローチャネル内の前記試料の回転を低減させる、および(ii)前記フローチャネル内の前記試料の安定性を増大させることのうち少なくとも1つのために、前記フローチャネルの(i)断面高さ、および(ii)断面幅のうち少なくとも1つが、選択される、請求項9に記載のシステム。
[項目14]
前記フローチャネルの前記断面高さは、前記フローチャネルの前記断面幅とほぼ同じであり、前記フローチャネルの前記断面高さおよび前記断面幅を選択すべく、前記フローチャネルの前記断面高さおよび前記断面幅に基づく回転推定値が使用される、請求項13に記載のシステム。
[項目15]
前記フローチャネルの(i)前記断面高さおよび(ii)前記断面幅のうち少なくとも1つが、経験データに基づいて選択される、請求項13に記載のシステム。
[項目16]
前記経験データは、複数のテストされたフローチャネルの各々の中を流れる参照物質のイメージングに基づいて、複数のテストされたフローチャネルに対する複数の回転推定値を含む、請求項15に記載のシステム。
[項目17]
前記フローチャネルの中心線と、前記収集オプティクス近傍の表面との間の前記基板の厚みは、200μm未満である、請求項9に記載のシステム。
[項目18]
前記フローチャネルの中心線と、前記収集オプティクス近傍の表面との間の前記基板の厚みは、100μm未満である、請求項9に記載のシステム。
[項目19]
当該システムはマルチモードシステムである、請求項1に記載のシステム。
[項目20]
前記マルチモードシステムは、前記試料の推定されたまたは実際の試料の回転を検出する、回転検出システムを含む、請求項19に記載のシステム。
[項目21]
前記マルチモードシステムは、共焦点顕微鏡システムを含む、請求項19に記載のシステム。
[項目22]
前記共焦点顕微鏡システムは、前記試料のための複数の体積の測定を検出する、請求項21に記載のシステム。
[項目23]
前記マルチモードシステムは、それぞれが異なる波長範囲のための複数のイメージングシステムを含む、請求項19に記載のシステム。
[項目24]
前記マルチモードシステムは、それぞれがフローチャネル沿いの異なるポイントにおける、複数の開口を含む、請求項19に記載のシステム。
[項目25]
前記マルチモードシステムは、共有された開口を含む、請求項19に記載のシステム。
[項目26]
検出された前記参照光と、検出された前記散乱光との間の前記角度オフセットは、検出された前記参照光のビーム軸と、検出された前記散乱光のビーム軸との間の角度オフセットである、請求項1に記載のシステム。
[項目27]
検出された前記参照光と、検出された前記散乱光との間の前記角度オフセットは、2.5〜4ピクセルの間の、複数の未処理の干渉イメージにおけるフリンジ周期によって特徴付けられる、請求項1に記載のシステム。
[項目28]
前記試料照明オプティクスは、円筒形レンズおよび集光レンズを含み、
前記円筒形レンズは、照明経路沿いの光の焦点を、前記集光レンズの後焦点面の線に合わせ、
前記集光レンズは、前記線の焦点を試料平面上に再度合わせる、請求項1に記載のシステム。
[項目29]
前記集光レンズは、高開口数のレンズである、請求項28に記載のシステム。
[項目30]
前記集光レンズは、0.5より多い開口数を含む、請求項29に記載のシステム。
[項目31]
前記集光レンズは、1.0より多い開口数を含む、請求項29に記載のシステム。
[項目32]
前記集光レンズは、1.3より多い開口数を含む、請求項29に記載のシステム。
[項目33]
前記収集オプティクスは、高開口数対物レンズを含む、請求項1に記載のシステム。
[項目34]
前記対物レンズは、0.5より多い開口数を含む、請求項33に記載のシステム。
[項目35]
前記対物レンズは、1.0より多い開口数を含む、請求項33に記載のシステム。
[項目36]
前記対物レンズは、1.3より多い開口数を含む、請求項33に記載のシステム。
[項目37]
前記収集オプティクスはさらに、前記対物レンズの下流側に、収集された前記散乱光の焦点を合わせるための管形レンズを含む、請求項33に記載のシステム。
[項目38]
前記収集オプティクスはさらに、前記管形レンズの下流側に、円筒形レンズを含む、請求項37に記載のシステム。
[項目39]
前記収集オプティクスはさらに、前記管形レンズの下流側に、非焦点軸に沿い4f構成を実装するための、一連の円筒形レンズを含む、請求項37に記載のシステム。
[項目40]
検出された前記散乱光は、前記試料から散乱された複数の角スペクトルを含む、請求項1に記載のシステム。
[項目41]
前記検出システムは、試料ごとに少なくとも30イメージのスキャン解像度を使用する、請求項1に記載のシステム。
[項目42]
前記検出システムは、試料ごとに少なくとも100イメージのスキャン解像度を使用する、請求項1に記載のシステム。
[項目43]
前記検出システムは、試料ごとに少なくとも200イメージのスキャン解像度を使用する、請求項1に記載のシステム。
[項目44]
少なくとも−30度から30度の検出された角度範囲で特徴付けられる、請求項1に記載のシステム。
[項目45]
少なくとも−45度から45度の検出された角度範囲で特徴付けられる、請求項1に記載のシステム。
[項目46]
少なくとも−60度から60度の検出された角度範囲で特徴付けられる、請求項1に記載のシステム。
[項目47]
少なくとも2度の検出された角解像度で特徴付けられる、請求項1に記載のシステム。
[項目48]
少なくとも1度の検出された角解像度で特徴付けられる、請求項1に記載のシステム。
[項目49]
前記試料の様々な位置ηに対する複数の角スペクトルを含む、複数の未処理の干渉イメージを取得すべく、検出された前記参照光と、検出された前記散乱光とが使用される、請求項1に記載のシステム。
[項目50]
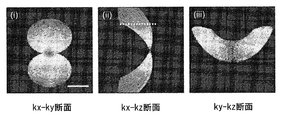
前記検出システムは、kx(空間座標xに対応する空間周波数)方向およびη方向に沿って、フーリエ変換を計算してそれにより、サイノグラムを提供し、さらに前記サイノグラムのx空間座標とy空間座標に対するフーリエ変換を計算し、それを、フーリエ回折定理を使用して、3D空間周波数領域にマッピングする、請求項49に記載のシステム。
[項目51]
前記検出システムは、データプロセッサに接続される、請求項1に記載のシステム。
[項目52]
フローサイトメトリの方法であって、
試料を、チャネルを通して移動させる段階と、
前記チャネル内で、移動する前記試料を収束光で照明する段階と、
照明光に応答して、前記試料からの光を検出する段階と、
前記試料のイメージを形成する段階と、を備える、方法。
[項目53]
前記試料の複数の位相イメージを生成する段階をさらに備える、請求項52に記載の方法。
[項目54]
前記チャネルを横断して延びる線上の前記チャネルを照明する段階をさらに備える、請求項52に記載の方法。
[項目55]
イメージデータをデータプロセッサで処理する段階をさらに備える、請求項52に記載の方法。
[項目56]
前記試料の3次元(3D)イメージを生成する段階をさらに備える、請求項52に記載の方法。
[項目57]
前記試料は、生物物質を含む、請求項52に記載の方法。
[項目58]
前記試料は、生物流体を含む、請求項52に記載の方法。
[項目59]
前記試料は、細胞を含む、請求項52に記載の方法。
[項目60]
前記試料は、癌性細胞を含む、請求項52に記載の方法。
[項目61]
前記試料の屈折率を決定する段階をさらに備える、請求項52に記載の方法。
[項目62]
前記試料のイメージを電子ディスプレイ上に表示する段階をさらに備える、請求項52に記載の方法。
[項目63]
制御システムを前記試料上で光をスキャンする複数のスキャンパラメータでプログラミングする段階をさらに備える、請求項52に記載の方法。
[項目64]
収束円筒形光学要素で、光の焦点を前記チャネル上に合わせる、請求項52に記載の方法。
[項目65]
前記チャネル内の流体の流速を調整する段階をさらに備える、請求項52に記載の方法。
[項目66]
前記試料の干渉イメージを生成する段階をさらに備える、請求項52に記載の方法。
[項目67]
前記イメージからの位相データを生成する段階をさらに備える、請求項52から66のいずれか一項に記載の方法。
[項目68]
前記イメージからの振幅データを生成する段階をさらに備える、請求項52から67のいずれか一項に記載の方法。
[項目69]
位相データおよび振幅データを3次元表示にマッピングする段階をさらに備える、請求項52から68のいずれか一項に記載の方法。
[項目70]
3次元表示は、サイノグラムである、請求項52に記載の方法。
[項目71]
マッピングされたデータの2次元フーリエ変換を形成する段階をさらに備える、請求項52から70のいずれか一項に記載の方法。
[項目72]
フーリエ変化された角スペクトルを、空間周波数領域内の前記試料の散乱ポテンシャルにマッピングする段階をさらに備える、請求項71に記載の方法。
[項目73]
計算された散乱ポテンシャルを提供すべく、反復計算を実行する段階をさらに備える、請求項72に記載の方法。
[項目74]
3次元散乱ポテンシャルを決定すべく、逆フーリエ変換を実行する段階をさらに備える、請求項71から73のいずれか一項に記載の方法。
[項目75]
前記試料の屈折率を決定する段階をさらに備える、請求項52から74のいずれか一項に記載の方法。
[項目76]
前記試料の屈折率分布を決定する段階をさらに備える、請求項52から75のいずれか一項に記載の方法。
[項目77]
照明光を前記チャネルの視野に供給する段階をさらに備える、請求項52から76のいずれか一項に記載の方法。
[項目78]
検出器において、参照光ビーム経路を、試料光ビーム経路に対し傾斜させる段階をさらに備える、請求項52から77のいずれか一項に記載の方法。
[項目79]
前記参照光ビーム経路および前記試料光ビーム経路は、ゼロより大きい角度で傾斜されている、請求項78に記載の方法。
[項目80]
検出器で干渉パターンを検出する段階をさらに備える、請求項52から79のいずれか一項に記載の方法。
[項目81]
供給オプティクスで、光源からの光を前記試料に連結する段階をさらに備える、請求項52から80のいずれか一項に記載の方法。
[項目82]
収集オプティクスで、前記試料からの光を検出器に連結する段階をさらに備える、請求項52から81のいずれか一項に記載の方法。
[項目83]
照明ビームを作動された光学素子に移動する段階をさらに備える、請求項52から82のいずれか一項に記載の方法。
[項目84]
前記作動された光学素子は、可動ミラーを含む、請求項83に記載の方法。
[項目85]
前記作動された光学素子は、スキャナを含む、請求項83に記載の方法。
[項目86]
イメージデータを平滑化制約で処理する段階をさらに備える、請求項52に記載の方法。
[項目87]
イメージデータを正制約で処理する段階をさらに備える、請求項52に記載の方法。
[項目88]
周波数空間の領域に入力するデータを生成する段階をさらに備える、請求項52に記載の方法。
[項目89]
前記試料を第1の波長および第2の波長で照明する段階をさらに備える、請求項52に記載の方法。
[項目90]
データを正規化する段階をさらに備える、請求項52に記載の方法。
[項目91]
前記チャネル内の前記試料の領域の回転を測定する段階をさらに備える、請求項52に記載の方法。
[項目92]
前記チャネル内の前記試料の共焦点イメージを取得する段階をさらに備える、請求項52に記載の方法。
[項目93]
前記試料内の蛍光を検出する段階をさらに備える、請求項52に記載の方法。
Claims (27)
- 軸外ホログラフィのためのイメージングシステムであって、
試料ビーム経路と、参照ビーム経路と、に分割される光を放出する照明源と、
検出において、検出された参照光は、検出された散乱光に対して角度オフセットして試料の角スペクトルが生成されるように、前記試料ビーム経路に沿って収集された前記散乱光と、前記参照ビーム経路に沿って収集された前記参照光と、の両方を検出する検出システムと、
前記検出システムに接続されるデータプロセッサと、を備え、
前記試料ビーム経路は、
前記試料を直線集束ビームで照明すべく、前記試料ビーム経路に沿って、前記光の焦点を合わせる照明オプティクスと、
懸濁培地に懸濁された細胞を含む試料を、前記直線集束ビームを横断して連続して流す基板で画定されたフローチャネルであり、前記フローチャネルは、前記試料ビーム経路内の前記細胞の回転を抑制する大きさを有する、フローチャネルと、
前記試料ビーム経路に沿って、試料から散乱された光を収集する収集オプティクスと、を含み、
前記データプロセッサは、検出された前記参照光と検出された前記散乱光とを使用して、前記フローチャネル内の前記試料の様々な位置ηに対する干渉イメージを取得し、前記干渉イメージを処理して前記角スペクトルの位相データおよび振幅データを3次元表示にマッピングし、前記マッピングされたデータを2次元フーリエ変換することができ、処理された前記角スペクトルを空間周波数領域内の前記試料の散乱ポテンシャルにさらにマッピングすることができる、イメージングシステム。 - 前記照明源は、コリメートされた照明源または多波長の照明源である、請求項1に記載のイメージングシステム。
- 前記照明源から放出される前記光を、前記試料ビーム経路と前記参照ビーム経路とに分割するためのスプリッタをさらに備え、
前記参照ビーム経路は、検出された前記参照光を検出された前記散乱光に対して角度オフセットする傾斜ミラーを含むオフセットオプティックスを含む、請求項1または2に記載のイメージングシステム。 - 前記試料および前記直線集束ビームを互いに相対的に並進させるスキャンシステムまたは前記試料を前記直線集束ビームを横断して並進させるスキャンシステムをさらに備え、
前記細胞は、生分解性である、請求項1から3のいずれか一項に記載のイメージングシステム。 - 前記フローチャネルは、前記試料の推定された幅サイズの150〜200%の間の断面直径を含み、前記断面直径は、前記フローチャネルの断面高さである、請求項4に記載のイメージングシステム。
- (i)前記フローチャネル内の前記試料の回転を低減させる、および(ii)前記フローチャネル内の前記試料の安定性を増大させることのうち少なくとも1つのために、前記フローチャネルの(i)断面高さ、および(ii)断面幅のうち少なくとも1つが、選択され、
任意で、前記フローチャネルの前記断面高さは、前記フローチャネルの前記断面幅とほぼ同じであり、前記フローチャネルの前記断面高さおよび前記断面幅を選択すべく、前記フローチャネルの前記断面高さおよび前記断面幅に基づく回転推定値が使用される、請求項5に記載のイメージングシステム。 - 前記フローチャネルの(i)断面高さおよび(ii)断面幅のうち少なくとも1つが、経験データに基づいて選択され、
前記経験データは、複数のテストされたフローチャネルの各々の中を流れる参照物質のイメージングに基づいて、複数のテストされた前記フローチャネルに対する複数の回転推定値を含む、請求項5または6に記載のイメージングシステム。 - 前記フローチャネルの中心線と前記収集オプティクス近傍の表面との間の前記基板の厚みは、200μm未満である、または、前記フローチャネルの中心線と前記収集オプティクス近傍の表面との間の前記基板の厚みは、100μm未満である、請求項4から7のいずれか一項に記載のイメージングシステム。
- 当該システムはマルチモードシステムであり、前記マルチモードシステムは、前記試料の推定されたまたは実際の試料の回転を検出する、回転検出システムを含む、または、前記マルチモードシステムは、前記試料のための複数の体積の測定を検出する共焦点顕微鏡システムを含む、請求項1から8のいずれか一項に記載のイメージングシステム。
- 前記マルチモードシステムは、それぞれが異なる波長範囲のための複数のイメージングシステムを含み、前記マルチモードシステムは、それぞれがフローチャネル沿いの異なるポイントにおける、複数の開口を含む、または任意で、前記マルチモードシステムは、共有された開口を含む、請求項9に記載のイメージングシステム。
- 検出された前記参照光と、検出された前記散乱光との間の前記角度オフセットは、検出された前記参照光のビーム軸と、検出された前記散乱光のビーム軸との間の角度オフセットである、または、検出された前記参照光と、検出された前記散乱光との間の前記角度オフセットは、2.5〜4ピクセルの間の、複数の未処理の干渉イメージにおけるフリンジ周期によって特徴付けられる、請求項1から10のいずれか一項に記載のイメージングシステム。
- 前記照明オプティクスは、円筒形レンズおよび集光レンズを含み、
前記円筒形レンズは、照明経路沿いの光の焦点を、前記集光レンズの後焦点面の線に合わせ、
前記集光レンズは、前記線の焦点を試料平面上に再度合わせる、請求項1から11のいずれか一項に記載のイメージングシステム。 - 前記集光レンズは、高開口数のレンズであり、開口数は0.5より大きい、または、前記開口数は1.0より大きい、または、前記開口数は1.3より大きい、請求項12に記載のイメージングシステム。
- 前記収集オプティクスは、高開口数対物レンズを含み、前記高開口数対物レンズは、0.5より大きい開口数、または、1.0より大きい前記開口数、または、1.3より大きい前記開口数を含む、請求項1から13のいずれか一項に記載のイメージングシステム。
- 前記収集オプティクスは、さらに、前記高開口数対物レンズの下流側に、収集された前記散乱光の焦点を合わせるための管形レンズを含み、前記収集オプティクスは、さらに、前記管形レンズの下流側に、円筒形レンズを含む、請求項14に記載のイメージングシステム。
- 前記検出システムは、試料ごとに少なくとも30イメージのスキャン解像度を使用し、任意で、前記検出システムは、試料ごとに少なくとも100イメージのスキャン解像度を使用する、請求項1から15のいずれか一項に記載のイメージングシステム。
- 少なくとも2度の検出された角解像度とともに、少なくとも−30度から30度の検出された角度範囲、または、少なくとも−45度から45度の検出された角度範囲、または、少なくとも−60度から60度の検出された角度範囲で特徴付けられる、請求項1から16のいずれか一項に記載のイメージングシステム。
- 前記データプロセッサは、kx(空間座標xに対応する空間周波数)方向およびη方向に沿って、フーリエ変換を計算し、それにより、サイノグラムを提供し、さらに前記サイノグラムのx空間座標とy空間座標に対するフーリエ変換を計算し、それを、フーリエ回折定理を使用して3D空間周波数領域にマッピングする、請求項1から17のいずれか一項に記載のイメージングシステム。
- 軸外ホログラフィシステムを使用するフローサイトメトリの方法であって、
試料を、基板のチャネルを通して移動させる段階であり、前記チャネルは前記試料の回転を抑制する大きさを有する、段階と、
前記チャネル内で、移動する前記試料を収束光で照明する段階と、
検出器を用いて、前記試料からの散乱光及び前記試料からの前記散乱光から角度オフセットされた参照光を検出する段階であり、前記試料からの前記散乱光及び前記参照光は光源からの照明光に応答する、段階と、
検出された前記参照光と検出された前記散乱光とを使用して、前記チャネル内の前記試料の様々な位置ηに対する干渉イメージを形成する段階と、
前記干渉イメージを処理して角スペクトルの位相データおよび振幅データを3次元表示にマッピングし、前記マッピングされたデータを2次元フーリエ変換し、処理された前記角スペクトルを空間周波数空間内の前記試料の散乱ポテンシャルにマッピングする段階と、
を備える、方法。 - イメージデータをデータプロセッサで処理する段階と、前記試料の複数の位相イメージを生成する段階と、をさらに備える、請求項19に記載の方法。
- 前記試料の3次元(3D)イメージを生成する段階をさらに備え、
前記試料は、生物流体または細胞を含む生物物質を含む、請求項19または20に記載の方法。 - 前記試料の屈折率を決定する段階と、前記試料のイメージを電子ディスプレイ上に表示する段階と、をさらに備える、請求項19から21のいずれか一項に記載の方法。
- 制御システムを前記試料上で光をスキャンする複数のスキャンパラメータでプログラミングする段階をさらに備える、請求項19から22のいずれか一項に記載の方法。
- 集束円筒形光学要素で、光の焦点を前記チャネル上に合わせる段階と、前記チャネル内の流体の流速を調整する段階をさらに備える、請求項19から23のいずれか一項に記載の方法。
- 前記干渉イメージからの位相データを生成する段階、および、前記干渉イメージからの振幅データを生成する段階をさらに備える、請求項19から24のいずれか一項に記載の方法。
- 計算された散乱ポテンシャルを提供すべく、反復計算を実行する段階をさらに備える、請求項19から25のいずれか一項に記載の方法。
- 前記試料の屈折率を決定する段階、または、前記試料の屈折率分布を決定する段階をさらに備える、請求項19から26のいずれか一項に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019040963A JP6958964B2 (ja) | 2013-02-05 | 2019-03-06 | 3dホログラフィックイメージングフローサイトメトリ |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361761079P | 2013-02-05 | 2013-02-05 | |
| US61/761,079 | 2013-02-05 | ||
| PCT/US2014/014955 WO2014124057A1 (en) | 2013-02-05 | 2014-02-05 | 3-d holographic imaging flow cytometry |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019040963A Division JP6958964B2 (ja) | 2013-02-05 | 2019-03-06 | 3dホログラフィックイメージングフローサイトメトリ |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016511435A JP2016511435A (ja) | 2016-04-14 |
| JP2016511435A5 JP2016511435A5 (ja) | 2017-03-09 |
| JP6801846B2 true JP6801846B2 (ja) | 2020-12-16 |
Family
ID=50156932
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015556256A Active JP6801846B2 (ja) | 2013-02-05 | 2014-02-05 | 3dホログラフィックイメージングフローサイトメトリ |
| JP2019040963A Active JP6958964B2 (ja) | 2013-02-05 | 2019-03-06 | 3dホログラフィックイメージングフローサイトメトリ |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019040963A Active JP6958964B2 (ja) | 2013-02-05 | 2019-03-06 | 3dホログラフィックイメージングフローサイトメトリ |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US10670510B2 (ja) |
| EP (1) | EP2954309B1 (ja) |
| JP (2) | JP6801846B2 (ja) |
| WO (1) | WO2014124057A1 (ja) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014079478A1 (en) | 2012-11-20 | 2014-05-30 | Light In Light Srl | High speed laser processing of transparent materials |
| EP2754524B1 (de) | 2013-01-15 | 2015-11-25 | Corning Laser Technologies GmbH | Verfahren und Vorrichtung zum laserbasierten Bearbeiten von flächigen Substraten, d.h. Wafer oder Glaselement, unter Verwendung einer Laserstrahlbrennlinie |
| EP2781296B1 (de) | 2013-03-21 | 2020-10-21 | Corning Laser Technologies GmbH | Vorrichtung und verfahren zum ausschneiden von konturen aus flächigen substraten mittels laser |
| US11556039B2 (en) | 2013-12-17 | 2023-01-17 | Corning Incorporated | Electrochromic coated glass articles and methods for laser processing the same |
| US9815730B2 (en) | 2013-12-17 | 2017-11-14 | Corning Incorporated | Processing 3D shaped transparent brittle substrate |
| US10293436B2 (en) | 2013-12-17 | 2019-05-21 | Corning Incorporated | Method for rapid laser drilling of holes in glass and products made therefrom |
| US9676167B2 (en) | 2013-12-17 | 2017-06-13 | Corning Incorporated | Laser processing of sapphire substrate and related applications |
| US9850160B2 (en) | 2013-12-17 | 2017-12-26 | Corning Incorporated | Laser cutting of display glass compositions |
| US20150165560A1 (en) | 2013-12-17 | 2015-06-18 | Corning Incorporated | Laser processing of slots and holes |
| US9701563B2 (en) | 2013-12-17 | 2017-07-11 | Corning Incorporated | Laser cut composite glass article and method of cutting |
| US10442719B2 (en) | 2013-12-17 | 2019-10-15 | Corning Incorporated | Edge chamfering methods |
| KR102445217B1 (ko) | 2014-07-08 | 2022-09-20 | 코닝 인코포레이티드 | 재료를 레이저 가공하는 방법 및 장치 |
| EP3169635B1 (en) | 2014-07-14 | 2022-11-23 | Corning Incorporated | Method and system for forming perforations |
| EP3552753A3 (en) * | 2014-07-14 | 2019-12-11 | Corning Incorporated | System for and method of processing transparent materials using laser beam focal lines adjustable in length and diameter |
| US10335902B2 (en) | 2014-07-14 | 2019-07-02 | Corning Incorporated | Method and system for arresting crack propagation |
| US10526234B2 (en) | 2014-07-14 | 2020-01-07 | Corning Incorporated | Interface block; system for and method of cutting a substrate being transparent within a range of wavelengths using such interface block |
| US10047001B2 (en) | 2014-12-04 | 2018-08-14 | Corning Incorporated | Glass cutting systems and methods using non-diffracting laser beams |
| FR3030749B1 (fr) * | 2014-12-19 | 2020-01-03 | Commissariat A L'energie Atomique Et Aux Energies Alternatives | Methode d'identification de particules biologiques par piles d'images holographiques defocalisees |
| EP3708548A1 (en) | 2015-01-12 | 2020-09-16 | Corning Incorporated | Laser cutting of thermally tempered substrates using the multiphoton absorption method |
| CN107922237B (zh) | 2015-03-24 | 2022-04-01 | 康宁股份有限公司 | 显示器玻璃组合物的激光切割和加工 |
| CN107666983B (zh) | 2015-03-27 | 2020-10-02 | 康宁股份有限公司 | 可透气窗及其制造方法 |
| JP7082042B2 (ja) | 2015-07-10 | 2022-06-07 | コーニング インコーポレイテッド | 可撓性基体シートに孔を連続形成する方法およびそれに関する製品 |
| EP3220130B1 (en) * | 2016-03-16 | 2023-03-01 | Siemens Healthcare GmbH | High accuracy 5-part differential with digital holographic microscopy and untouched leukocytes from peripheral blood |
| WO2017192896A1 (en) | 2016-05-06 | 2017-11-09 | Uwm Research Foundation, Inc. | Snapshot optical tomography system and method of acquiring an image with the system |
| CN109311725B (zh) | 2016-05-06 | 2022-04-26 | 康宁股份有限公司 | 从透明基材激光切割及移除轮廓形状 |
| US10410883B2 (en) | 2016-06-01 | 2019-09-10 | Corning Incorporated | Articles and methods of forming vias in substrates |
| KR101865624B1 (ko) * | 2016-06-10 | 2018-06-11 | 주식회사 토모큐브 | 파면 제어기를 이용한 초고속 3차원 굴절률 영상 촬영 및 형광 구조화 조도 현미경 시스템 및 이를 이용한 방법 |
| US10794679B2 (en) | 2016-06-29 | 2020-10-06 | Corning Incorporated | Method and system for measuring geometric parameters of through holes |
| WO2018022476A1 (en) | 2016-07-29 | 2018-02-01 | Corning Incorporated | Apparatuses and methods for laser processing |
| KR102423775B1 (ko) | 2016-08-30 | 2022-07-22 | 코닝 인코포레이티드 | 투명 재료의 레이저 가공 |
| CN109803786B (zh) | 2016-09-30 | 2021-05-07 | 康宁股份有限公司 | 使用非轴对称束斑对透明工件进行激光加工的设备和方法 |
| EP3529214B1 (en) | 2016-10-24 | 2020-12-23 | Corning Incorporated | Substrate processing station for laser-based machining of sheet-like glass substrates |
| US10752534B2 (en) | 2016-11-01 | 2020-08-25 | Corning Incorporated | Apparatuses and methods for laser processing laminate workpiece stacks |
| US10688599B2 (en) | 2017-02-09 | 2020-06-23 | Corning Incorporated | Apparatus and methods for laser processing transparent workpieces using phase shifted focal lines |
| US10983209B2 (en) * | 2017-04-12 | 2021-04-20 | Ellumen, Inc. | Accurate signal compensations for UWB radar imaging in dispersive medium |
| US11078112B2 (en) | 2017-05-25 | 2021-08-03 | Corning Incorporated | Silica-containing substrates with vias having an axially variable sidewall taper and methods for forming the same |
| US10580725B2 (en) | 2017-05-25 | 2020-03-03 | Corning Incorporated | Articles having vias with geometry attributes and methods for fabricating the same |
| EP3413033B1 (en) * | 2017-06-09 | 2020-09-23 | Roche Diagnostics GmbH | Method and apparatus for determining properties of a laboratory sample contained in a laboratory sample container |
| US10626040B2 (en) | 2017-06-15 | 2020-04-21 | Corning Incorporated | Articles capable of individual singulation |
| US11125686B2 (en) | 2017-07-06 | 2021-09-21 | Ramot At Tel-Aviv University Ltd. | System and method for three-dimensional label-free optical imaging of a biological cell sample in an environmental chamber |
| CN107271421A (zh) * | 2017-07-27 | 2017-10-20 | 深圳中科芯海智能科技有限公司 | 一种液体样品中的微粒荧光检测装置 |
| EP3672755A1 (en) * | 2017-08-25 | 2020-07-01 | Corning Incorporated | Apparatus and method for laser processing transparent workpieces using an afocal beam adjustment assembly |
| ES2837438T3 (es) | 2017-09-29 | 2021-06-30 | Siemens Healthcare Gmbh | Detección específica de malaria con microscopía óptica digital |
| EP3697533A1 (en) * | 2017-10-16 | 2020-08-26 | Scherr, Steven | Systems and methods for particulate encapsulation in microdroplets |
| US11554984B2 (en) | 2018-02-22 | 2023-01-17 | Corning Incorporated | Alkali-free borosilicate glasses with low post-HF etch roughness |
| WO2020014858A1 (zh) * | 2018-07-17 | 2020-01-23 | 深圳大学 | 一种基于光纤马赫-曾德尔干涉仪的生物传感器及其制作方法 |
| WO2020261826A1 (ja) | 2019-06-28 | 2020-12-30 | 富士フイルム株式会社 | 画像処理装置、評価システム、画像処理プログラム及び画像処理方法 |
| US20230351648A1 (en) * | 2020-05-25 | 2023-11-02 | Ramot At Tel-Aviv University Ltd. | A tomography system and a method for analysis of biological cells |
| JP2022039514A (ja) | 2020-08-28 | 2022-03-10 | 浜松ホトニクス株式会社 | 学習モデル生成方法、識別方法、学習モデル生成システム、識別システム、学習モデル生成プログラム、識別プログラム及び記録媒体 |
| RU2770567C1 (ru) * | 2021-06-26 | 2022-04-18 | федеральное государственное бюджетное образовательное учреждение высшего образования «Донской государственный технический университет», (ДГТУ) | Способ голографического анализа взвешенных частиц |
| JP2024022034A (ja) * | 2022-08-05 | 2024-02-16 | 浜松ホトニクス株式会社 | プログラムされた細胞死を起こした細胞の領域を決定する方法、決定部を備える装置及び決定ステップを含む情報処理プログラム |
| CN116540212A (zh) * | 2023-07-06 | 2023-08-04 | 中国空气动力研究与发展中心超高速空气动力研究所 | 一种三维成像装置及方法 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4293221A (en) * | 1979-04-17 | 1981-10-06 | Research Corporation | Multidimensional slit-scan flow system |
| US5633714A (en) | 1994-12-19 | 1997-05-27 | International Business Machines Corporation | Preprocessing of image amplitude and phase data for CD and OL measurement |
| US6744038B2 (en) | 2000-11-13 | 2004-06-01 | Genoptix, Inc. | Methods of separating particles using an optical gradient |
| CA2432210A1 (en) * | 2000-12-29 | 2002-08-01 | Chromagen, Inc. | Scanning spectrophotometer for high throughput fluorescence detection |
| US7365858B2 (en) | 2001-12-18 | 2008-04-29 | Massachusetts Institute Of Technology | Systems and methods for phase measurements |
| DE10254139A1 (de) | 2002-11-15 | 2004-05-27 | Carl Zeiss Jena Gmbh | Verfahren und Anordnung zur tiefenaufgelösten optischen Erfassung einer Probe |
| WO2006010253A1 (en) | 2004-07-30 | 2006-02-02 | University Of Victoria Innovation And Development Corporation | Confocal scanning holography microscope |
| EP1864112B1 (en) | 2005-03-25 | 2015-05-06 | Massachusetts Institute of Technology | Device and method for hilbert phase imaging |
| WO2007019548A2 (en) | 2005-08-08 | 2007-02-15 | Zetetic Institute | Apparatus and methods for reduction and compensation of effects of vibrations and of environmental effects in wavefront interferometry |
| WO2007116365A2 (en) | 2006-04-07 | 2007-10-18 | Ecole Polytechnique Federale De Lausanne (Epfl) | Method and apparatus to measure and compute the amplitude point spread function and associated parameters of a coherent optical imaging system |
| US7633631B2 (en) | 2007-04-04 | 2009-12-15 | Nikon Corporation | Three-dimensional microscope and method for obtaining three-dimensional image |
| WO2009009081A2 (en) * | 2007-07-10 | 2009-01-15 | Massachusetts Institute Of Technology | Tomographic phase microscopy |
| EP2409133A1 (en) | 2009-03-20 | 2012-01-25 | Bio-Rad Laboratories, Inc. | Serial-line-scan-encoded multi-color fluorescence microscopy and imaging flow cytometry |
| BR112013010262B1 (pt) * | 2010-11-12 | 2022-01-25 | Universite Libre De Bruxelles | Processo para caracterização de objetos transparentes em um meio transparente |
| US8896840B2 (en) | 2012-04-25 | 2014-11-25 | Canon Kabushiki Kaisha | Interferometric method and digital holographic microscope |
-
2014
- 2014-02-05 EP EP14706193.1A patent/EP2954309B1/en active Active
- 2014-02-05 WO PCT/US2014/014955 patent/WO2014124057A1/en active Application Filing
- 2014-02-05 JP JP2015556256A patent/JP6801846B2/ja active Active
- 2014-02-05 US US14/173,804 patent/US10670510B2/en active Active
-
2019
- 2019-03-06 JP JP2019040963A patent/JP6958964B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2016511435A (ja) | 2016-04-14 |
| JP6958964B2 (ja) | 2021-11-02 |
| US10670510B2 (en) | 2020-06-02 |
| EP2954309B1 (en) | 2019-08-28 |
| JP2019148798A (ja) | 2019-09-05 |
| US20140333929A1 (en) | 2014-11-13 |
| EP2954309A1 (en) | 2015-12-16 |
| WO2014124057A1 (en) | 2014-08-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6958964B2 (ja) | 3dホログラフィックイメージングフローサイトメトリ | |
| Nguyen et al. | Quantitative phase imaging: recent advances and expanding potential in biomedicine | |
| US11125686B2 (en) | System and method for three-dimensional label-free optical imaging of a biological cell sample in an environmental chamber | |
| US10113961B2 (en) | Apparatus and method for quantitive phase tomography through linear scanning with coherent and non-coherent detection | |
| Sung et al. | Three-dimensional holographic refractive-index measurement of continuously flowing cells in a microfluidic channel | |
| JP6130464B2 (ja) | Hilbert位相画像処理のためのシステムと方法 | |
| US9546952B2 (en) | Distribution of refractive index measurement by synthetic aperture tomography | |
| US10976532B2 (en) | Structured illumination microscopy system using digital micromirror device and time-complex structured illumination, and operation method therefor | |
| KR101855366B1 (ko) | 간세포 내 지질을 3d 비표지 영상화 및 정량화하는 방법 및 장치 | |
| Pavillon et al. | Implementation of simultaneous quantitative phase with Raman imaging | |
| JP2005337730A (ja) | 測定システム | |
| JP7228189B2 (ja) | 細胞毒性を評価する方法及び装置 | |
| JP7275849B2 (ja) | 細胞の数、形態又は形状を測定する方法及び装置 | |
| CN114324245B (zh) | 基于部分相干结构光照明的定量相位显微装置和方法 | |
| US20230351648A1 (en) | A tomography system and a method for analysis of biological cells | |
| WO2007084933A2 (en) | Systems and processes for providing endogenous molecular imaging with mid-infared light | |
| CN115096857A (zh) | 一种基于艾里光片线扫描的oct成像方法和装置 | |
| Levin et al. | An automated interference microscope for measuring dynamic objects | |
| Cairós et al. | Refractive index estimation in biological tissues by quantitative phase imaging | |
| JP7129730B2 (ja) | 映像基盤の大面積試料分析装置、媒質の特性差を用いた映像基盤の試料分析装置及びこれを用いて試料を測定して分析する方法 | |
| Hua et al. | Chemosensitivity testing of revived fresh-frozen biopsies using digital speckle holography | |
| Liu et al. | Typical Applications of Computational Phase Imaging | |
| Chaumet et al. | Quantitative phase microscopies: accuracy comparison | |
| Kandel | Gradient light interference microscopy for imaging strongly scattering samples | |
| Peruhov et al. | Applications of holographic microscopy in life sciences |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170202 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170202 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20171025 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171128 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180427 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180528 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181106 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190306 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20190306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20190308 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20190327 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20190402 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20190607 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20190611 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20191112 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20200121 |
|
| C13 | Notice of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: C13 Effective date: 20200303 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200528 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200731 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200901 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20200923 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20201027 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20201027 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20201117 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6801846 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |