[関連出願の相互参照]
本発明は、2015年10月23日出願の米国仮特許出願番号第62/245,933号、2015年11月24日出願同第62/259,326号に基づく優先権を主張するものであり、これらの特許出願の両方は参照によりその全体が本明細書に組み込まれる。
[発明の分野]
本発明は、一般に、がん治療分野に関する。
本明細書には、一態様において、がん患者から採取した腫瘍組織を含む試料を採点するためのイメージングシステムであって、イメージング領域内で試料の位置決めをするためのステージと、試料に電磁放射線を向けるための電磁放射線源と、試料からの電磁放射線を検出するように設定された検出器とを備えたイメージング装置と、コントローラとを含む、前記イメージングシステムが開示されている。コントローラは、オペレータとコントローラとの間で情報を交換するためのユーザインターフェースと、コンピュータ可読媒体に記憶された指示を実行するように設定された処理回路とを備えている。指示は、コントローラに、(i)検出された電磁放射線についての情報をイメージング装置から受信させ、(ii)検出された電磁放射線に基づいて画像データを生成させ、(iii)画像データを解析して少なくとも1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の近接を表すスコアを求めさせ、そして(iv)スコアを記録させるように設定されており、ここで、前記スコアは、閾値と比較したとき、がん患者が免疫療法に積極的に応答する可能性を示すものである。
いくつかの実施形態において、スコアは、少なくとも1対の細胞間の近接を表すものであって、1対の細胞同士が所定の近接の範囲内に存する程度を表している。いくつかの実施形態において、近接は、画素スケールに基づいて評価される。いくつかの実施形態において、1対の細胞間の所定の近接は、約1画素〜約100画素までの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約5画素〜約40画素までの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約0.5μm〜約50μmまでの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約2.5μm〜約20μmまでの範囲である。
いくつかの実施形態において、スコアは、1対の細胞の境界線間の近接を得ることによって計算される。いくつかの実施形態において、スコアは、1対の細胞の質量中心間の近接を得ることによって計算される。いくつかの実施形態において、スコアは、1対の細胞の選択された第1細胞周囲の外周に基づいて境界線ロジックを用いて計算される。いくつかの実施形態において、スコアは、1対の細胞の境界線の交点を求めることによって計算される。いくつかの実施形態において、スコアは、1対の細胞の重なり領域を求めることによって計算される。
いくつかの実施形態において、画像データを生成することは、(i)検出された電磁放射線についての情報を単純画像データに分けることと、(ii)前記データを複数のデータチャネルから提供することを含み、その場合、第1データチャネル内の単純画像データは、第1バイオマーカーに起因する蛍光信号を表現し、また、第2データチャネル内の単純画像データは、第2バイオマーカーに起因する蛍光信号を表現する。
いくつかの実施形態において、データを解析することは、(i)処理回路の拡張装置を使用して、第1データチャネルからの第1バイオマーカーに起因する蛍光信号を、第2バイオマーカーを発現する近接した細胞を取り囲むように選択された所定のマージン単位で拡張することによって、拡張された第1バイオマーカーマスクを生成することと、(ii)相互作用面積を求めることであって、前記相互作用面積が、第2バイオマーカーを発現する全細胞の第1総面積であり、かつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号に取り囲まれている、ことと、(iii)処理回路の相互作用計算機を使用して、相互作用面積を正規化因子で割って、その結果得られる商に所定の係数を掛け合わせて空間近接スコアに至ることを含む。
いくつかの実施形態において、正規化因子は、第2バイオマーカーを発現する能力を有する全細胞の総面積である。いくつかの実施形態において、正規化因子は、視野内の全細胞の総面積である。いくつかの実施形態において、相互作用面積は、拡張された第1バイオマーカーマスクを、第2データチャネルの信号から求められた第2バイオマーカーを発現する細胞を表すマスクと組み合わせることによって求められる。いくつかの実施形態において、第3データチャネルは、細胞核に起因する蛍光信号を表現し、また、第4データチャネルは、試料内の腫瘍領域に起因する蛍光信号を表現する。いくつかの実施形態において、第2バイオマーカーを発現する能力を有する全細胞の総面積は、第3データチャネルからの信号に基づく、試料内の全細胞を表す細胞マスクと、第4データチャネルからの信号に基づく、試料上の腫瘍領域を表す腫瘍領域マスクとを組み合わせることによって求められる。いくつかの実施形態において、細胞マスクと腫瘍領域マスクとを組み合わせることは、腫瘍領域マスクを細胞マスクから除去することを含む。
いくつかの実施形態において、処理回路はさらに、コントローラに、(i)画像内の第1バイオマーカー又は第2バイオマーカーの濃度を表す低倍率で画像データを獲得させ、(ii)最も高濃度の第1バイオマーカー又は第2バイオマーカーを包含する領域を特定させ、(iii)最も高濃度の第1バイオマーカー又は第2バイオマーカーを包含する所定数の領域を選択させ、(iv)イメージング装置へ指示を送って所定数の領域に対して高倍率の画像データを獲得させるように設定されており、その場合、高倍率の画像データは、分析のためにコントローラへ供給され、スコアを求めるために使用される。
いくつかの実施形態において、低倍率は、10倍以下であり、高倍率は、10倍超である。いくつかの実施形態において、低倍率は、10倍であり、高倍率は、40倍である。いくつかの実施形態において、低倍率は、10倍であり、高倍率は、20倍である。いくつかの実施形態において、低倍率は、4倍であり、高倍率は、40倍である。いくつかの実施形態において、低倍率は、4倍であり、高倍率は、20倍である。
いくつかの実施形態において、コントローラは、スコアを、試料の画像に関するメタデータと結びつける。いくつかの実施形態において、コントローラは、スコアを包含する報告を作成する。いくつかの実施形態において、コントローラは、免疫療法の方針を決定するためにオペレータにスコアを提供する。いくつかの実施形態において、コントローラは、データベースにスコアを記録する。いくつかの実施形態において、コントローラは、スコアを患者の医療記録と結び付ける。
いくつかの実施形態において、電磁放射線源は、白熱ランプ、蛍光ランプ、又はダイオードからなる群から選択されるインコヒーレント電磁放射線源である。いくつかの実施形態において、電磁放射線源は、コヒーレント電磁放射線源である。いくつかの実施形態において、システムはさらに、電磁放射線源からの電磁放射線を試料に向けるように配置された電磁放射線調整用光学系部品を備えている。いくつかの実施形態において、電磁放射線調整用光学系部品は、異なる電磁放射線波長帯域を用いて試料を照らすように設定された、調節可能な分光フィルタ素子を包含する。
いくつかの実施形態において、システムはさらに、試料から発光された電磁放射線を収容して、その発光された電磁放射線を出力電磁放射線として検出器へ向けるように設定された、磁放射線集光光学系部品を備えている。いくつかの実施形態において、電磁放射線集光光学系部品は、試料からの電磁放射線から特定の電磁放射線波長帯域を選択するように設定された、調節可能な分光フィルタ素子を包含する。
いくつかの実施形態において、検出器は、少なくとも1つのCCDセンサを備えている。いくつかの実施形態において、検出器は、光電子増倍管を備えている。いくつかの実施形態において、検出器は、試料からの電磁放射線に応じて電気信号を発生して、その電気信号をコントローラへ伝えるように設定されている。
いくつかの実施形態において、コントローラはさらに、電気信号をステージ、電磁放射線源及び検出器のうち1つ以上へ送ることによって、ステージ、電磁放射線源及び/又は検出器のうち少なくとも1つの特性を調節するように設定されている。いくつかの実施形態において、システムはさらに、情報をオペレータへ表示するためのディスプレイ装置を備えている。いくつかの実施形態において、表示される情報は、システムのパラメータ、システムの特性及び試料の取り込み画像のうち1つである。いくつかの実施形態において、コントローラは、ディスプレイ装置にスコアを表示する。
いくつかの実施形態において、イメージング装置からの検出された電磁放射線についての情報は、複数の分光画像である。いくつかの実施形態において、複数の分光画像はそれぞれ、試料から発光され検出器によって検出された様々な波長の電磁放射線に対応する。いくつかの実施形態において、試料によって発光された電磁放射線の波長はそれぞれ、試料における特異的な特徴を特定するために試料に追加された様々な蛍光色素分子に対応している。
いくつかの実施形態において、本システムは、第1バイオマーカーの発現の定量化又は第2バイオマーカーの発現の定量化と比べて優れた予測力を提供する。いくつかの実施形態において、予測力は、陽性予測値、陰性予測値、又はそれらの組み合わせとして定量される。いくつかの実施形態において、陽性予測値は、65%以上である。いくつかの実施形態において、陽性予測値は、70%以上である。いくつかの実施形態において、陽性予測値は、75%以上である。いくつかの実施形態において、陰性予測値は、65%以上である。いくつかの実施形態において、陰性予測値は、80%以上である。
別の態様において、本明細書には、(i)イメージングシステムを用いてがん患者から採取した組織試料に対する画像データを獲得することを含む、組織試料を採点する方法が開示されている。イメージングシステムは、試料をイメージング領域に位置付けるためのステージと、電磁放射線を試料に向けるための電磁放射線源と、電磁放射線出力を収集するための検出器を備えたハウジングと、メモリと画像処理モジュールを有する処理回路とを含むコントローラを備えている。前記方法はさらに、(ii)画像処理モジュールを用いて画像データを解析して、1対の細胞と、第1バイオマーカーを発現する1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する1対の細胞の第2メンバーとの間の近接を表すスコアを求めることと、(iii)スコアをメモリに記録することを含み、ここで、スコアを、閾値と比較したとき、がん患者が免疫療法に積極的に応答する可能性を示すものである。
いくつかの実施形態において、スコアは、1対の細胞間の近接を表すものであって、1対の細胞同士が所定の近接の範囲内に存する程度を表している。いくつかの実施形態において、画像データを解析することは、近接を画素スケールで評価することを含む。いくつかの実施形態において、1対の細胞間の所定の近接は、約1画素〜約100画素までの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約5画素〜約40画素までの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約0.5μm〜約50μmまでの範囲である。いくつかの実施形態において、1対の細胞間の所定の近接は、約2.5μm〜約20μmまでの範囲である。いくつかの実施形態において、スコアは、1対の細胞の境界線間の近接を獲得することによって計算される。いくつかの実施形態において、スコアは、1対の細胞の質量中心間の近接を獲得することによって計算される。いくつかの実施形態において、スコアは、1対の細胞の選択された第1細胞周囲の外周に基づいて境界線ロジックを用いて計算される。いくつかの実施形態において、スコアは、1対の細胞の境界線の交点を求めることによって計算される。いくつかの実施形態において、スコアは、1対の細胞の重なり領域を求めることによって計算される。
いくつかの実施形態において、画像データを生成することは、(i)検出された電磁放射線についての情報を単純画像データに分けることと、(ii)前記データを複数のデータチャネルから提供することと、を含み、その場合、第1データチャネル内の単純画像データは、第1バイオマーカーに起因する蛍光信号を表現し、また、第2データチャネル内の単純画像データは、第2バイオマーカーに起因する蛍光信号を表現する。
いくつかの実施形態において、画像データを解析することは、(i)処理回路の拡張装置を使用して、第1データチャネルからの第1バイオマーカーに起因する蛍光信号を、第2バイオマーカーを発現する近接した細胞を取り囲むように選択された所定のマージン単位で拡張することによって、拡張された第1バイオマーカーマスクを生成することと、(ii)相互作用面積を求めることであって、前記相互作用面積が、第2バイオマーカーを発現する全細胞の第1総面積であり、かつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号に取り囲まれている、ことと、(iii)処理回路の相互作用計算機を使用して、相互作用面積を正規化因子で割って、その結果得られる商に所定の係数を掛け合わせて空間近接スコアに至ることを含む。
いくつかの実施形態において、正規化因子は、第2バイオマーカーを発現する能力を有する全細胞の総面積である。いくつかの実施形態において、正規化因子は、視野内の全細胞の総面積である。いくつかの実施形態において、相互作用面積を求めることは、拡張された第1バイオマーカーマスクを、第2データチャネルの信号から求められた第2バイオマーカーを発現する細胞を表すマスクと組み合わせることを含む。いくつかの実施形態において、第3データチャネルは、細胞核に起因する蛍光信号を表現し、また、第4データチャネルは、試料内の腫瘍領域に起因する蛍光信号を表現する。
いくつかの実施形態において、本方法はさらに、第3データチャネルからの信号に基づく、試料内の全細胞を表す細胞マスクと、第4データチャネルからの信号に基づく、試料上の腫瘍領域を表す腫瘍領域マスクとを組み合わせることによって、第2バイオマーカーを発現する能力を有する全細胞の総面積を求めることを含む。いくつかの実施形態において、細胞マスクと腫瘍領域マスクとを組み合わせることは、腫瘍領域マスクを細胞マスクから除去することを含む。
いくつかの実施形態において、本方法はさらに、(i)画像において第1バイオマーカー又は第2バイオマーカーの濃度を表すデータを低倍率で画像化するためにイメージングシステムを使用することと、(ii)最も高濃度の第1バイオマーカー又は第2バイオマーカーを包含する領域を特定することと、(iii)最も高濃度の第1バイオマーカー又は第2バイオマーカーを包含する所定数の領域を選択することと、(iv)イメージング装置へ指示を送って所定数の領域に対して高倍率の画像データを獲得することを含み、そして(iv)その場合、高倍率の画像データは、分析のためにコントローラへ供給されて、スコアを求めるために使用される。
いくつかの実施形態において、低倍率は、10倍以下であり、高倍率は、10倍超である。いくつかの実施形態において、低倍率は、4倍であり、高倍率は、20倍である。
いくつかの実施形態において、本方法はさらに、スコアを、試料の画像に関するメタデータと結びつけることを含む。いくつかの実施形態において、本方法はさらに、スコアを包含する報告を作成することを含む。いくつかの実施形態において、本方法はさらに、免疫療法の方針を決定するために専門家にスコアを提供することを含む。いくつかの実施形態において、本方法はさらに、データベースにスコアを記録することを含む。いくつかの実施形態において、本方法はさらに、スコアを患者の医療記録と結び付けることを含む。いくつかの実施形態において、本方法はさらに、スコアをディスプレイ装置に表示することを含む。
いくつかの実施形態において、本方法は、第1バイオマーカーの発現の定量化又は第2バイオマーカーの発現の定量化と比べて優れた予測力を提供する。いくつかの実施形態において、予測力は、陽性予測値、陰性予測値、又はそれらの組み合わせとして定量される。いくつかの実施形態において、陽性予測値は、65%以上である。いくつかの実施形態において、陽性予測値は、70%以上である。いくつかの実施形態において、陽性予測値は、75%以上である。いくつかの実施形態において、陰性予測値は、65%以上である。いくつかの実施形態において、陰性予測値は、80%以上である。
別の態様において、本明細書には、組織試料採点システムであって、前記システムが、(i)がん患者から採取した組織試料の画像データを獲得するイメージング装置と、(ii)イメージング装置から画像データを受信して、データを解析することによって、1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の近接を表すスコアを求めるコントローラと、を備えており、そして(iii)その場合、スコアは、閾値と比較したとき、がん患者が免疫療法に積極的に応答する可能性を示すものである、前記システムが開示されている。
いくつかの実施形態において、イメージング装置は、試料をイメージング領域に位置付けるためのステージと、電磁放射線を試料に向けるための電磁放射線源と、試料からの電磁放射線を検出するように設定された検出器と、を備えている。
いくつかの実施形態において、電磁放射線は、可視光及び非可視光からなる群から選択される。いくつかの実施形態において、可視光は、約380nm〜約720nmの範囲の波長を有する可視光帯域を含む。いくつかの実施形態において、可視光は、約400nm〜約700nmの範囲の波長を有する可視光帯域を含む。いくつかの実施形態において、可視光は、約380nm〜約720nmの範囲の波長を有する可視光帯域を含む。
いくつかの実施形態において、発光された電磁放射線又は出力電磁放射線は、約440nm〜約480nm、約490nm〜約550nm、約505nm〜約535nm、約550nm〜約595nm、約585nm〜約630nm、約600nm〜約640nm、約650nm〜約710nmの範囲の波長を包含する帯域からなる群からの1つ以上の可視光帯域を含む。いくつかの実施形態において、電磁放射線は、可視光及び非可視光からなる群から選択される。いくつかの実施形態において、可視光は、約380nm〜約720nmの範囲の波長を有する可視光帯域を含む。いくつかの実施形態において、可視光は、約400nm〜約700nmの範囲の波長を有する可視光帯域を含む。いくつかの実施形態において、可視光は、約380nm〜約720nmの範囲の波長を有する可視光帯域を含む。
いくつかの実施形態において、本システムは、第1バイオマーカーの発現の定量化又は第2バイオマーカーの発現の定量化と比べて優れた予測力を提供する。いくつかの実施形態において、予測力は、陽性予測値、陰性予測値、又はそれらの組み合わせとして定量される。いくつかの実施形態において、陽性予測値は、65%以上である。いくつかの実施形態において、陽性予測値は、70%以上である。いくつかの実施形態において、陽性予測値は、75%以上である。いくつかの実施形態において、陰性予測値は、65%以上である。いくつかの実施形態において、陰性予測値は、80%以上である。
試料の画像データを獲得するためのイメージング装置のブロック図である。
典型的な実施形態による、がん患者から採取した腫瘍組織を含む試料を採点するように設定されたコントローラのブロック図である。
典型的な実施形態による、腫瘍組織を含む試料を採点するためのプロセスのフローチャートである。
第2の典型的な実施形態による、腫瘍組織を含む試料を採点するためのプロセスのフローチャートである。
典型的な実施形態による、腫瘍組織を含む試料を採点するのに使用される画像処理工程の作業工程図である。
イメージング及び解析のための組織試料の調製に使用される抗体及び検出試薬の概要の非限定例を示す。
画像内のDAPIで検出された全ての核の非限定例を示す。
図7aにおける全細胞の拡張されたバイナリマスクの非限定例を示す。
488染料で検出されたS100の画像の非限定例を示す。
図8aにおける全腫瘍領域のバイナリマスクの非限定例を示す。
図8aにおける全腫瘍細胞のマスクの非限定例を示す。
図8aにおける全非腫瘍細胞のマスクの非限定例を示す。
Cy(登録商標)5で検出されたPD−L1の画像の非限定例を示す。
図9aにおける全PD−L1陽性細胞のバイナリマスクの非限定例を示す。
Cy(登録商標)3.5で検出されたPD−1の画像の非限定例を示す。
図10aにおける全PD−1陽性非腫瘍細胞のバイナリマスクの非限定例を示す。
全PD−L1陽性細胞とそれと最も近接した細胞の相互作用マスクの非限定例を示す。
PD−L1陽性細胞と極接近したPD−1陽性細胞の相互作用区画の非限定例を示す。
26人の黒色腫患者から得た相互作用スコアの非限定例を示す。
図12aの26人の黒色腫患者から得た相互作用スコア最大値の非限定例を示す。
強化アルゴリズムの代わりにホールスライドイメージング法に基づいた解析結果を示す。
26人の患者の相互作用スコアと無増悪生存期間との比較を示す。注)*は未修正ログランク検定を示す。
前記患者のPD−L1発現と無増悪生存期間との比較を示す。
免疫療法に対して積極的な応答者におけるPD−L1陽性細胞(赤)、PD−1陽性細胞(黄)、全腫瘍細胞(緑)、及び全細胞(青)に対応する蛍光信号のマスクの非限定例を示す。
免疫療法に対して消極的な応答者におけるPD−L1陽性細胞(赤)、PD−1陽性細胞(黄)、全腫瘍細胞(緑)、及び全細胞(青)に対応する蛍光信号のマスクの非限定例を示す。
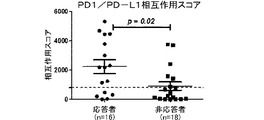
38人の非小細胞肺がん患者から得た典型的なPD−1/PD−L1相互作用スコアを示す。
前記患者の、23C3FDA認可IHCアッセイを用いたPD−L1発現と無増悪生存期間との比較を示す。注)*は、未修正ログランク検定を用いてp値を求めたことを示す。
34人の追加の黒色腫患者から得た相互作用スコアの非限定例を示す。
図20aの患者の相互作用スコアと無増悪生存期間との比較を示す。
図12a及び図12bの患者並びに図20aの患者から得た相互作用スコアを示す。
図20cの患者の相互作用スコアと無増悪生存期間との比較を示す。注)*は、未修正ログランク検定を用いてp値を求めたことを示す。
図20cの患者の相互作用スコアと全生存期間(OS)との比較を示す。注)*は、未修正ログランク検定を用いてp値を計算したことを示す。
29人の転移性黒色腫患者から得たCTLA−4/CD80相互作用スコアの非限定例を示す。
29人の精巣がん患者から得たPD−1/PD−L1相互作用スコアの非限定例を示す。
発明の詳細な説明
以降、様々な実施形態について説明する。ここで注目すべきなのは、具体的な実施形態が包括的な記述を目的とするものではなく、又は本明細書において説明される更に広い態様への限定を目的とするものではないことである。具体的な実施形態と併せて説明されるある態様は、前記実施形態に限定すべきではなくかつそれ以外の実施形態と共に実行することが可能である。
本明細書で使用するとき、「約」は、当業者に理解できるものであり、しかも使用される文脈に応じてある程度の幅がある。当業者に不明な用語が使用されている場合、使用されている文脈を考慮すれば、「約」は特定条件の最大±10%を意味する。
要素を説明する文脈における(特に、以下の請求項の文脈における)「一つの(a、an)」及び「その(the)」という用語並びに同様の指示対象の使用は、本明細書中で特に指示がない限り又は文脈から明白に矛盾するものでない限り、単数と複数の両方を網羅するものとする。本明細書における値の範囲の記載は、本明細書において特に指示がない限り、単にその範囲内の個々の数値それぞれに独立して言及する簡潔な方法として用いることを目的とするものであり、また、個々の値はそれぞれ、本明細書に独立して列挙されているかのように明細書に組み込まれる。本明細書に記載の方法はすべて、本明細書において特に指示がない限り又は文脈から明白に矛盾するものではない限り、任意の好適な順序で実行することができる。任意の及びすべての実施例並びに本明細書において規定される典型的な言葉遣い(例えば、「など」)の使用は、単に実施形態をより明確に説明することを目的とするものであって、特に断りのない限り、請求項の範囲に制限するものではない。本明細書中の言葉遣いはいずれも、クレームされていない要素を本質的要素として示すものと解釈されるべきではない。
「処置する(treating)」又は「処置(treatment)」という用語は、障害に関する状態、症状若しくはパラメータを改善するか又は障害の進行を遅らせるのに有効な量、様式又はモードで、統計的に有意な程度又は当業者が検出可能な程度まで治療を施すことを意味する。有効な量、様式又はモードは、対象によって変わる可能性があり、また、患者に合わせてもよい。
一態様において、本明細書には、がん患者から採取した腫瘍組織を含む試料の採点方法を実行するためのシステムが提示されている。
図1は、試料の分光分解された多重画像を獲得するためのイメージング装置100を示す概略図である。電磁放射線(EMR)源102は、電磁放射線を調整用光学系部品104へ供給する。いくつかの実施形態において、電磁放射線は可視光である。EMR源102は、白熱ランプ、蛍光ランプ、又はダイオードなどのインコヒーレント光源であり得る。EMR源102は、レーザ光源などのコヒーレント光源でもあり得、また、コヒーレント光源は、連続波(CW)又はパルス光を提供することができる。EMR源102は、ある波長域を有する光を発生するための多光源部品(例えば、多重ダイオード)を収容していてよい。光は、連続波(CW)又は時間ゲート式(すなわち、パルス式)光のいずれであってもよい。さらに、光は、電磁分光の選択された部分に供給されることもある。例えば、光は、紫外線、可視光、赤外線、又は他の分光領域に存する中心波長及び/又は波長分布を有することができる。いくつかの実施形態において、光は、約380nm〜約720nmの範囲に存する波長を有する。EMR源102はさらに、様々な光学部品、例えば、レンズ、鏡、波長板、及び非線形結晶を備えることも可能であり、それらはいずれも、選択された特徴を有する光を発生するために使用できる。一般に、EMR源102は、所望の分光、空間及び、いくつかの実施形態では時間特性を有する光を提供するように設定された光学部品及び光学素子を備えている。
調整用光学系部品104は、可視光などの電磁波を様々な形で変換するように設定され得る。例えば、調整用光学系部品104は、光を分光フィルタリングして、選択された分光波長域の出力光を提供することができる。あるいは、又はさらに、調整用光学系部品は、光の空間分布と光の時間特性を調節することができる。入射電磁放射線、すなわち入射光は、EMR上の調整用光学系部品104の素子の作用によって生成される。
入射光は、照明ステージ106に取り付けられた試料108に入射するように向けられる。ステージ106は、取り付けクリップ又は他の固定装置のように試料108を保護する手段を提供することができる。あるいは、ステージ106は、複数の試料108が取り付けられる可動トラック又はベルトを含むことができる。ドライバー機構は、複数の試料を一つずつステージ106上の照明領域からうまく移動させて、そのときに入射光が試料に衝突するようにトラックを動かすように設定され得る。ステージ106はさらに、移動軸と、照明ステージ106の固定位置に関連して試料108を移動させるための機構と、を含むこともできる。移動機構は、手動操作可能である(例えば、ねじ棒)か、又は電動作動によって自動で移動可能である(例えば、電動ドライバー、圧電式アクチュエータ)。
可視光などの入射電磁放射線に応答して、発光された電磁放射線が試料108から出現する。発光光は、様々な形で生成され得る。例えば、いくつかの実施形態において、発光光は、試料108を通過した入射光の一部に対応している。他の実施形態において、発光光は、試料から反射した入射光の一部に対応している。さらなる実施形態において、入射光は、試料108によって吸収される可能性があり、発光光は、入射光に応答して試料108から蛍光発光に対応している。なおさらなる実施形態において試料108は発光性でもあり得、入射光がなくても発光光を生成する可能性もある。いくつかの実施形態において、発光光としては、前述の機構のうち2つ以上によって生成された光をあげることができる。
集光光学系部品110は、試料108からの発光光などの発光された電磁放射線を収容するように配置される。集光光学系部品110は、例えば、光が発散する場合に、発光光に視準を合わせるように設定することができる。集光光学系部品110はまた、発光光を分光フィルタリングするように設定することもできる。フィルタリング操作は、例えば、上述の機構のうち一つから発生する発光光の一部を、他の処理から発生する光から分離するために有用であり得る。さらに、集光光学系部品110は、実施形態における特定の目的のために発光光の空間特性及び/又は時間特性を変更するように設定され得る。集光光学系部品110は、発光光を、検出器112に入射する出力光へ変換する。
調整用光学系部品104及び集光光学系部品110は、対象である試料へ入射する光の特性及び対象である試料から発光される光の特性を操作するために様々な光学部品を包含することができる。例えば、調整用光学系部品104及び集光光学系部品110はそれぞれ、入射光及び発光光から特定の波長帯域を選択するために分光フィルタ素子を包含することができる。分光フィルタ素子は、例えば、フィルタに取り付けられた干渉フィルタを包含することができる。いくつかの実施形態において、液晶マスクに準拠した調節可能なフィルタ素子を使用することによって、入射光又は発光光の分光特性を変えることができる。液晶系装置は、通信用インターフェース152を介してコントローラ150によって制御され得る。
調整用光学系部品104及び集光光学系部品110はさらに、試料への入射光又は試料からの発光光の空間分布を操作するために空間光マスク、空間光変調器及び光学パルス整形器などの素子も包含することができる。空間光変調器及び他の適応装置もまた、通信用インターフェース152を介してコントローラ150によって制御され得る。
最後に、調整用光学系部品104及び集光光学系部品110は、入射光又は発光光に選択された特徴を付与することを目的として設定された他の一般的な光学素子、例えば、鏡、レンズ、ビームスプリッター、波長板なども包含することができる。
一般に、検出器112は、試料によって発光された光を試料の多重画像として検出及び捕獲するように設定された1つ以上の測定装置を包含する。実施形態において、検出器112は、光の空間的特性及び/又は時間特性及び/又は分光特性を測定するように設定され得る。検出器112は、画像を獲得するためにCCD配列及び光電子増倍管などの装置をそれらの各コントロールシステムとともに包含することができる。検出器112は、出力光に対応する電気信号を発生させてコントローラ150に伝達する。検出器112内の適した光学装置は、一般に、通信用インターフェース152を介してコントローラ150によって制御され得る。
コントローラ150は、通信用インターフェース152及び処理回路156を備えている。コントローラ150は、検出器112によって検出される出力光に対応する信号を受信することに加えて、電気信号を検出器112に送ることによって、通信用インターフェース152を通じて検出器112の様々な特性を調整する。例えば、検出器112がCCDセンサを備えている場合、コントローラ150は、電気信号を検出器112へ送ることによって、CCDセンサの露光時間、活動領域、利得設定、及び他の特性を制御することができる。
コントローラ150はまた、通信用インターフェース152を介してEMR源102、調整用光学系部品104、ステージ106、及び集光光学系部品110ともつながっている。コントロールシステム114は、システム100の各素子へ電気信号を供給することによって、素子の様々な特性を調整する。例えば、光源102へ供給される電気信号を用いて、光122の強度、波長、繰り返し周波数、又はその他の特性を調整することができる。EMR源102によって生成される光がパルス式(すなわち、時間ゲート式)である場合、光パルスの様々な特性は、コントローラ150から通信用インターフェース152を介してEMR源102へ供給されるコントロール信号にしたがって操作され得る。光調整用光学系部品104及び集光光学系部品110へ供給される信号としては、例えば、光の空間的特性を調節する装置(例えば、空間光変調器)の特性を設定するための信号、及び分光フィルタ装置の特性を設定するための信号をあげることができる。照明ステージ106へ供給される信号は、例えば、ステージ106と関連して試料108を位置付けるために及び/又は試料をステージ106上の照明位置まで移動するために供給することができる。
通信用インターフェース152は、様々なシステム、装置又はネットワークとデータ通信を行うために有線インターフェース又は無線インターフェース(例えば、ジャック、アンテナ、送信機、受信機、トランシーバ、ワイヤー端子など)を包含していてもよい。例えば、通信用インターフェース152としては、イーサネット系通信ネットワークを介してデータを送受信するためのイーサネットカード及びポート、及び/又は無線通信ネットワークを介して通信するためのWi−Fiトランシーバをあげることができる。通信用インターフェース152は、ローカルエリアネットワーク又は広域ネットワーク(例えば、インターネット、構築WANなど)を介して通信するように設定されてもよく、また、様々な通信プロトコル(例えば、BACnet、IP、LONなど)を使用することもできる。
コントローラ150もまた、通信用インターフェース152を介してユーザインターフェース154とつながっていてもよい。ユーザインターフェース154は、システム特性及びパラメータを表示するため及び試料108の取り込み画像を表示するための表示装置であってよい。ユーザインターフェース154は、イメージング装置100とのオペレータ相互作用を手助けてかつコントロールするために提供される。処理回路156は、検出器112を使用して取り込んだ画像データを保存するための記憶装置、例えばメモリ160を含み、さらには、例えば、上述の及びさらに以降に記載するようなプロセッサ158に制御機能を実行させるプロセッサ158への指示を組み込むコンピュータソフトウェアも包含する。さらに、ソフトウェアの指示は、検出器112によって取り込まれた画像をプロセッサ158に数学的に操作させる。画像の処理及び計算については、本明細書にさらに詳細に記載するが、イメージング装置100のプロセッサ116、又は図2に示しかつ以降に説明されるコントローラ200などのイメージング装置100と関連する外部のコンピュータシステムのいずれかによって実行される。
多くの実施形態において、システム100は、試料108の多重分光画像を獲得するように設定されている。多重分光画像は、光の様々な選択された波長における試料108の照明に対応しており、そして試料108を透過する光又は試料108によって反射される光の強度を検出することが可能である。あるいは、多重分光画像は、同様の分光特性を有する光によって試料108を照明して、試料108の多重画像を収集することに対応している可能性もあり、画像はそれぞれ発光光の様々な波長と対応している。調整用光学系部品104及び集光光学系部品110における分光フィルタ素子は、一般に、分光分解された画像を得るために使用される。
いくつかの実施形態において、試料108の画像は、連続した取り込み画像間で光学系部品(例えば、光学フィルタ)の設定調整を行いながら順番に収集され得る。他の実施形態において、多重画像は、多重試料ビューを検出するように設定された検出システムを使用して同時に取り込むことができる。例えば、検出システムは、検出器、例えばCCDカメラなどの検出器に対する様々な照明又は発光波長に応じて試料の様々なビューを提示するように設定でき、また、多重ビューも同時に取り込むことができる。
いくつかの実施形態において、調整用光学系部品104は、フィルタホイール又は液晶分光フィルタなどの調節可能な分光フィルタ素子を包含する。フィルタ素子は、様々な光波長帯域を使用して試料108に照明を施すように設定され得る。EMR源102は、広い分光波長成分分布を有する光を提供することができる。選択された広い波長分布領域は、調整用光学系部品104内のフィルタ素子によって入射光として通過させて、試料108へ入射するように向けられる。試料108を透過した光の画像は、検出器112によって記録される。その後、調整用光学系部品104におけるフィルタ通過帯域の波長を変化させて様々な波長の入射光を提供し、そして試料108を透過した(かつ入射光の新たな波長に対応する)光の画像が記録される。同様の一連の分光分解画像はまた、様々な波長の光を発生する多重光源素子を有するEMR源102を用いることによって、あるいは様々な供給源素子のスイッチを入れたり切ったりすることによって、様々な波長の入射光を提供することによっても記録され得る。
上述の通り、試料108からの発光光はまた、試料108から反射される入射光にも対応している。さらに、発光光は、試料が蛍光化学構造を包含する場合、試料108からの蛍光発光にも対応している可能性がある。いくつかの試料では、発光光は、多重光源からの寄与因子(すなわち、透過及び蛍光発光)を包含する可能性もあり、また、光調整用光学系部品110内の分光フィルタ素子は、これら信号寄与因子を分離するために使用される可能性もある。
一般に、調整用光学系部品104と集光光学系部品110はいずれも、設定可能な分光フィルタ素子を包含する。したがって、分光分解は、試料108の励起面で(例えば、調整用光学系部品104を介して)又は試料108の発光面で(例えば、集光光学系部品110を介して)のいずれか一方あるいは両方で展開され得る。いずれにしても、試料108の多重分光分解画像の集光結果は、「画像スタック」であり、ここで、スタック中の各画像は、特定波長に対応する試料の2次元画像である。概念上、画像セットは、3次元マトリクスを形成すると視覚化でき、その場合、マトリクス次元のうちの2つは、各画像の空間長と空間幅であり、また、3つ目のマトリクス次元は、画像が対応する分光波長(発光又は励起)である。したがって、分光分解された画像セットは、画像の「スペクトラルキューブ」と称することができる。本明細書で使用するとき、このような画像セット(又は画像スタック若しくはスペクトラルキューブ)の「画素」は、各画像における一般的な空間的位置を指す。したがって、画像セットの画素は、画素に対応する空間的位置にある各画像に関する値を包含する。
当該分野において既知の分光画像を得るための他の配置が、手元にある試料の要件にしたがって使用されてもよい。
上述の各分光画像は典型的に特定の波長又は波長域(例えば、分光帯域)を意味するが、全般的に、各分光画像は、1つ以上の波長帯域を包含し得る分光指数、又はより複雑な分光分布に対応する可能性がある。例えば、このような画像は、分光くし形フィルタを使用して生成させることができる。一般に、画像キューブは、数個、例えば10以上の分光画像を包含する。また一方、いくつかの実施形態において、画像キューブは、より少ない、例えば2つ又は3つの分光画像のみを包含する可能性もある。このような例の一つは、赤−緑−青(RGB)色画像であって、その場合、各画素は、それぞれ赤色、緑色及び青色の強度に関する値を包含する。このような情報は、別個の画像のセットとしてよりも単色画像として表示され得るが、その情報量は、画像セットと同様であるため、両方の場合を意味する表現「分光画像」を用いるものとする。
イメージング装置100は、試料の画像を取り込んで、本明細書に記載の後の試料分析アルゴリズム、例えばがん患者から採取した腫瘍組織を含む試料を採点するための方法及びアルゴリズムに使用される試料の画像データ130を生成するための様々な光学系部品及び装置を包含することができる。このようなイメージング装置は、特許文献1(発明の名称「Classifying Image Features」)で説明されており、その全体が本明細書に参照として組み込まれる。
試料のイメージング処理前に、組織試料は、特異的バイオマーカーに対して親和性を持つ複数の蛍光タグを用いて染色されてよい。染色された試料のデジタル画像が取得でき、また、その画像はさらに、蛍光タグの位置に基づいて解析され得る。イメージング装置100の処理回路156は、全画像解析よりもむしろ、コントローラ150に視野選択を実行させるソフトウェアを包含してもよい。その場合、視野は、対象である第1バイオマーカーを発現する細胞数に応じて優先順位を決めてよい。所定の数の視野はさらに、蛍光信号についても解析され得る。いくつかの実施形態において、4種の異なる蛍光タグの使用は、対象である第1バイオマーカーに対応する蛍光信号の画像及び対象である第2バイオマーカーに対応する蛍光信号の画像に加えて、全細胞によって発現されるバイオマーカーに対応する蛍光信号の画像及び腫瘍細胞によって発現されるバイオマーカーに対応する蛍光信号の画像も生成する。
本明細書に記載の通り、組織試料を採点するためのイメージング装置100から得た画像データの操作は、図2に概略的に図示しているコントローラ200によって実行され得る。コントローラ200は、通信用インターフェース202及び処理回路204を備えることが分かる。処理回路204は、組織試料を採点するための工程を実行するように設定される。コントローラ200の素子及び機能は、イメージング装置100のコントローラ150に包含されてもよく、又はイメージング装置100とは別のコンピュータシステムに含まれていてもよいと想定される。
いくつかの実施形態において、蛍光信号の画像は、画像内の細胞に対応する1つ以上の蛍光信号のマスクを生じさせるように操作される。いくつかの実施形態において、1つ以上の蛍光信号のマスクは、画像内の全細胞のマスク、画像内の全腫瘍細胞のマスク、画像内の非腫瘍細胞全てのマスク、画像内の、対象である第1バイオマーカーを発現する全細胞のマスク、画像内の、対象である第2バイオマーカーを発現する全細胞のマスク、及び画像内の対象である第1バイオマーカーを発現する全細胞に加えて、対象である第2バイオマーカーを発現する近接した細胞を表す相互作用マスクからなる群から選択される1つ以上を含む。なおさらなる実施形態において、相互作用マスクは、対象である第1バイオマーカーを発現する細胞に近接していた対象である第2バイオマーカーを発現する全ての選択された視野からの細胞の相互作用区画を生じさせるのに使用される。相互作用区画の総面積は、少なくとも1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の空間的近接を表すスコアを生成するのに使用されてよい。いくつかの実施形態において、スコアは、がん患者が免疫療法に積極的に応答する可能性を示す。いくつかの実施形態において、本システムは、対象である第1バイオマーカーの発現の定量化又は対象である第2バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
図3は、がん患者から採取した腫瘍組織を含む試料を採点するための方法の一実施形態の工程を表すフローチャートである。工程301では、画像データ、例えば画像データ130が得られる。画像データは、イメージング装置、例えばイメージング装置100によって得られてよい。工程302では、画像データは純粋であることから、様々な種類の蛍光信号に特異なデータが別個のチャネルに分類される。工程303では、第1チャネルからのデータは、第1バイオマーカーに陽性を示す全細胞のマスク(第1バイオマーカーマスク)を生成するのに使用される。全細胞のマスクは次に、拡張されて(工程304)、相互作用する細胞(第2バイオマーカーに陽性)がその中に含まれ得る所定の近接を表す拡張されたマスクを生成する。いくつかの実施形態において、第1バイオマーカーマスクは、1画素〜100画素の間で拡張される。工程305では、第2チャネルからのデータは、第2バイオマーカーに陽性を示す全細胞のマスク(第2バイオマーカーマスク)を生成するのに使用される。工程306では、第1バイオマーカーマスクと第2バイオマーカーマスクを組み合わせることによって、第1バイオマーカーに陽性を示す細胞の所定の近接範囲内に存する第2バイオマーカーに陽性を示す細胞を同定する相互作用マスクを生成する。工程307では、相互作用マスクの面積に基づいて、空間的近接スコアが計算される。
図4は、がん患者から採取した腫瘍組織を含む試料を採点するための方法の第2の実施形態の工程を示す、2つ目のフローチャートである。工程401では画像データが得られ、また、工程402では、その画像データは純粋であることから、様々な種類の蛍光信号に特異なデータが別個のチャネルに分離される。工程403では、第1チャネルからのデータを使用して視野内の全細胞のマスクを生成し、また、工程404では、第2チャネルからのデータを使用して、視野内の腫瘍面積などのサブセット面積のマスクを生成する。工程405では、全細胞のマスクをサブセット面積のマスクと組み合わせることによって、サブセット細胞のマスク及び非サブセット細胞のマスクを生成する。いくつかの実施形態では、サブセット細胞は腫瘍細胞であり、非サブセット細胞は非腫瘍細胞である。工程406では、第3チャネルからのデータを用いて、第1バイオマーカーに陽性を示す全細胞のマスク(第1バイオマーカーマスク)を生成する。全陽性細胞のマスクは次に、拡張されて(工程407)、相互作用する細胞(すなわち、第2バイオマーカーに陽性の細胞)がその中に含まれ得る所定の近接を表す拡張されたマスクを生成する。いくつかの実施形態において、第1バイオマーカーマスクは、1画素〜100画素の間で拡張される。工程408において、第4チャネルからのデータを用いて、第2バイオマーカーに陽性を示す全細胞のマスク(第2バイオマーカーマスク)を生成する。工程409では、拡張された第1バイオマーカーマスクと第2バイオマーカーマスクを組み合わせることによって、第2バイオマーカーに陽性を示しかつ第1バイオマーカーに陽性を示す細胞の所定の近接範囲内に存する細胞を同定する、相互作用マスクを生成する。工程410において、空間的近接スコアは、相互作用マスクの面積を、全サブセット細胞又は全細胞の面積(どちらか一方の入力データの使用を表す図15のフローチャートにおいて点線で示されるようなもの)で割ることによって計算される。いくつかの実施形態において、サブセット細胞は、第2バイオマーカーに陽性を示し得る細胞である。いくつかの実施形態において、第2バイオマーカーに陽性を示し得る細胞は、腫瘍細胞又は非腫瘍細胞である。
いくつかの実施形態において、細胞のサブセット及び細胞の非サブセットはそれぞれ、腫瘍細胞及び非腫瘍細胞に対応し、あるいはその逆であってもよい。いくつかの実施形態において、細胞のサブセット及び細胞の非サブセットはそれぞれ、生存細胞及び非生存細胞に対応し、あるいはその逆であってもよい。いくつかの実施形態において、細胞のサブセットは、生存細胞のサブセットであり、また、細胞の非サブセットは、生存細胞のサブセットに包含されない生存細胞からなる。いくつかの実施形態において、細胞のサブセット及び細胞の非サブセットはそれぞれ、T細胞及び非T細胞に対応し、あるいはその逆であってもよい。いくつかの実施形態において、細胞のサブセット及び細胞の非サブセットはそれぞれ、骨髄性細胞及び非骨髄性細胞に対応し、あるいはその逆であってもよい。
いくつかの実施形態において、空間的近接スコアは、1対の細胞同士の近接を表す。いくつかの実施形態において、1対の細胞同士の近接は、1対の細胞の境界線間の近接であって、1対の細胞の質量中心間の近接によって求めること、1対の細胞の選択された第1細胞周囲の外周に基づいて境界線ロジックを用いること、1対の細胞の境界における相互作用を求めること、及び/又は1対の細胞の重なり領域を求めることによって求めることができる。
いくつかの実施形態において、空間的近接スコアは、試料の画像と関連したメタデータと関連しており、生成された報告に包含され、免疫療法計画を決定するためにオペレータに提供されて、データベースに記録され、患者の医療記録と関連させ、及び/又はディスプレイ装置に表示される。
いくつかの実施形態において、本システムは、対象である第1バイオマーカーの発現の定量化又は対象である第2バイオマーカーマーカーの発現の定量化と比べて優れた予測力を提供する。
本明細書に記載の方法において、デジタル画像の操作は、例えば、典型的な実施形態に従って図2のブロック図に例示されたコントローラなどのコントローラを備えたコンピュータシステムによって実行されてよい。コントローラ200は、通信用インターフェース202及び処理回路204を備えることが分かる。通信用インターフェース202は、様々なシステム、装置又はネットワークとデータ通信を行うために有線インターフェース又は無線インターフェース(例えば、ジャック、アンテナ、送信機、受信機、トランシーバ、ワイヤー端子など)を包含していてもよい。例えば、通信用インターフェース202は、イーサネット系通信ネットワークを介してデータを送受信するためのイーサネットカード及びポート、及び/又は無線通信ネットワークを介して通信するためのWi−Fiトランシーバを包含していてもよい。通信用インターフェース202は、ローカルエリアネットワーク又は広域ネットワーク(例えば、インターネット、構築WANなど)を介して通信するように設定されてもよく、また、様々な通信プロトコル(例えば、BACnet、IP、LONなど)を使用することができる。
通信用インターフェース202は、コントローラ200と様々な外部システム又は外部装置(例えば、イメージング装置100)との間で電子データ通信を促進するように設定されたネットワークインターフェースであってもよい。例えば、コントローラ200は、選択された視野に関する画像データをイメージング装置100から受信して、データを解析して空間的近接スコア(SPS)を計算することができる。
さらに図2についていえば、処理回路204は、プロセッサ206及びメモリ208を包含することが分かる。プロセッサ206は、汎用のプロセッサ若しくは特定の目的のプロセッサ、特定用途向け集積回路(ASIC)、1つ以上のフィールドプログラマブルゲートアレイ(FPGA)、処理コンポーネントのグループ、又は他の好適な処理コンポーネントであってもよい。プロセッサ506は、メモリ508に記憶された又は他のコンピュータ可読媒体(例えば、CDROM、ネットワーク記憶装置、リモートサーバ)から受信された計算機コードを実行するように設定されていてもよい。
メモリ208は、本開示において説明される様々な処理を計算及び/又は促進するためのデータ及び/又は計算機コードを記憶するための1つ以上の装置(例えば、記憶装置、メモリ素子、ストレージデバイスなど)を包含してもよい。メモリ208は、ランダムアクセスメモリ(RAM)、読み込み専用メモリ(ROM)、ハードドライブ記憶装置、一時記憶装置、不揮発性メモリ、フラッシュメモリ、光メモリ、又はソフトウェアオブジェクト及び/又はコンピュータ指示を記憶するための任意の他の好適なメモリを包含してもよい。メモリ208は、データベースコンポーネント、オブジェクトコードコンポーネント、スクリプトコンポーネント、又は本開示において説明される様々なアクティビティ及び情報構造を支援するための任意の他の種の情報構造を包含してもよい。メモリ508は、処理回路204を介してプロセッサ206と通信可能に接続されていてよく、また、本明細書に記載の1つ以上の処理を実行する(例えば、プロセッサ206によって)ためのコンピュータコードを包含してもよい。
さらに図2についていえば、コントローラ200は、イメージング装置100から入力を受信することが分かる。イメージング装置は、画像データをすべて取得して、それを説明するメタデータの全てとともにそれを記録する。イメージング装置は、その後、コントローラ200によって読み出すことができるストリームにデータをシリアル化する。データストリームは、任意のバイナリデータストリームタイプ、例えば、ファイルシステム、RDBM又はダイレクトTCP/IP通信などに対応し得る。データストリームを使用する場合、コントローラ200は、分光分離装置210を包含することが分かる。分光分離装置210は、画像データをイメージング装置100から受信することができ、そこで分光分離を行って、各波長帯域に対して独立した個別のチャネルに様々な波長を表す画像を分離する。例えば、画像データは、組織試料において対象である細胞又はタンパク質を同定するのに使用される様々な蛍光色素分子ごとに別個のチャネルへ「分離」されてよい。蛍光色素分子は、ほんの一例として、DAPI、Cy(登録商標)2、Cy(登録商標)3、Cy(登録商標)3.5、Cy(登録商標)5、FITC、TRITC、488染料、555染料、594染料、及びTexasRedからなる群のうちの1つ以上であってよい。ある例では、チャネルのうちの1つは、画像中の核を同定するように、波長461nm(DAPIに関する最高発光波長)周囲の所定の帯域内に存する画像データを包含していてもよい。その他のチャネルは、様々な波長に対する画像データを包含して、様々な蛍光色素分子を使用して組織試料の様々な部分を同定してもよい。
コントローラ200は、様々なマスカー、例えば細胞マスカー212、サブセット領域マスカー216、第1バイオマーカーマスカー22、及び第2バイオマーカーマスカー224などを包含することも分かっている。他の実施形態においてコントローラ200に包含され得るこれらマスカー又は他のマスカーを使用して単純信号を分光分離装置210から受信して、組織試料において対象である特定の特徴を同定するのに使用される蛍光色素分子に応じて、対象である特定の細胞又は領域に対してマスクを作成する。マスクを作成するために、マスカー(例えば、細胞マスカー212、サブセット領域マスカー216、第1バイオマーカーマスカー22、及び第2バイオマーカーマスカー224など)は、視野に内の各画素の強度に関連した画像データを受信する。画素強度は、試料によって発光される蛍光発光の量に正比例しており、その結果、(蛍光色素分子を使用して特有のバイオマーカーを同定する場合、)試料中のタンパク質バイオマーカーの量と正比例する。絶対閾値は、画像画素に認められる値に基づいて設定されてよい。閾値以上の画素はすべて、1.0又は「オン」にマッピングされ、また、それ以外の画素はすべて、0.0又は「オフ」にマッピングされる。この方法において、バイナリマスクは、視野内の対象である細胞部分又は組織部分を同定するために作成される。他の実施形態において、マスクは、下界を用いて作成され、その場合、下界以上の整数を有する画素はすべて認められて、マスクにおいて画素値として使用される。強度が下界未満の場合、画素値は0.0又は「オフ」に設定される。
図5に示すマスキングのための作業工程図例において、核領域及び腫瘍領域を特定する蛍光信号に関するチャネル(例えば、それぞれDAPI及び488染料チャネル)は、下界プロトコル(工程510、512、520、522)を使用するが、バイオマーカーを同定するためのチャネル(例えば、それぞれCy5およびCy3.5チャネル)は、マスク出力を提供するために閾値プロトコル(工程530、540)を使用することが示される。下界プロトコルと関連して、下界を求めるためのヒストグラム工程もある。具体的には、ヒストグラムの閾値(工程512、522)は、入力画像の閾値をもたらすが、閾値化が生じるポイントを求めるためにスライディングスケールを使用する。入力データは、現在の画像とユーザが確定した閾値パーセンテージである。後者は、閾値レベルを設定すべき合計強度のパーセントを求めるのに使用される。先ず、各画素の強度を合計して合計強度とする。閾値パーセンテージにこの合計強度を掛けると、カットオフ合計が得られる。最後に、画素全てを、(ヒストグラム中の)強度で分類して、カットオフ合計に至るまで(binごとに)あらゆる前記強度を合計する。処理中に達した最後の最高画素強度が、現在の画像における閾値である。その値よりも大きな強度を有する全ての画素は、最大値に設定し、一方、それ以外はすべて最小値に設定される。
図5において工程514、516、524、526、528、532、534、536、542、544として特定される工程は、初期マスカー、例えば細胞マスカー212、サブセット領域マスカー216、第1バイオマーカーマスカー222及び第2バイオマーカーマスカー224中で生じる中間工程を表す。これら工程は、次のように定義される。
拡張は、画像中の最高輝度の領域の面積を拡大する。拡張には、2つの入力データが必要である。1つ目は、計算上の現在の画像であり、2つ目は、拡張反復回数である。1つ目の入力データには二値画像のみが使用されると考えられる。この手順は、連続画像で操作するが、出力は有効な拡張ではない。拡張処理は、先ず、画像中の最大画素強度を見つけることによって開始する。その後、画像中の各画素を一度試験する。調査中の画素が最大強度と等しい強度を有する場合、その画素が、反復半径を有しかつ元の画素を中心とした円として出力画像に書き込まれる。円内の画素はすべて、最大強度と等しい強度を有する。それ以外の画素はすべて、変更せずに出力画像へ複写される。
穴埋め手順は、画像の「空」領域を最高強度の画素で埋めるものである。これら空領域は、最小強度を有する領域であり、また、その画素領域(サイズ)はユーザによって指定される。現在の画像とサイズは、必要な2つの入力データである。拡張と同様に、この手順は、二値画像にのみ適用されるべきである。
エロ―ジョン処理は、拡張と同じ方法で画像形成する。第1工程が画像の最小強度を測定して、最低強度と合致する画素のみを変更して、獲得した最小強度の強度をブルームするのに使用した円を最低強度値で埋めること以外は、機能性はすべて拡張と同様である。拡張と同様に、この手順は、二値画像に適用されるのみのはずである。
オブジェクトの削除。2つの入力データ、すなわち、現在の画像とオブジェクトサイズが期待される。オブジェクトの削除は、穴埋め手順とは逆のものである。入力データであるオブジェクトサイズよりも小さな面積を埋める最大強度を有する画素のみを含む任意の領域は、最小強度と設定され、したがって「削除される」。この手順は二値画像にのみ適用されるべきであり、連続画像への適用は、予想外の結果をもたらす可能性がある。
最終工程518、529、538及び546における出力はそれぞれ、結果として得られた細胞マスク、サブセット領域マスク(又は、この特定の例では、腫瘍領域マスク)、バイオマーカー1細胞マスク、及びバイオマーカー2細胞マスクである。図5はさらに、空間的近接スコアを計算するための得られたマスクの組み合わせを示している。これらの組み合わせを、図2に示すコントローラ200の組み合わせマスカーを参照して、以下に説明する。
コントローラ200は、組み合わせマスカー、例えばサブセット細胞マスカー218、非サブセット細胞マスカー220、及び相互作用マスカー230を包含することも分かっている。サブセット細胞マスカーは、図5の工程552に示すようなand演算を実行して、細胞マスカー212(画像中の全細胞を表す)の出力をサブセット領域マスカー216の出力と組み合わせる。したがって、サブセット細胞マスカーは、画像中の全サブセット細胞のマスクを生成する。いくつかの実施形態において、サブセット細胞は、腫瘍細胞である。これと同じ組み合わせは、図5の工程554で示されるような非サブセット細胞マスカー220によって実行されるout演算を用いて、試料画像中に非サブセット細胞全てのマスクを生成する。いくつかの実施形態において、非サブセット細胞は、非腫瘍細胞である。
別のマスクと組み合わせる前に、第1バイオマーカーマスク(第1バイオマーカーマスカー222から得たもの)を、拡張装置226で拡張する。拡張されたマスクは、第2バイオマーカーを発現する細胞が第1バイオマーカーを発現する細胞と相互作用するのに適した近接な範囲内に存する空間を特定するために、第1バイオマーカーを発現する前記細胞を取り囲む面積を表す。これは、図5の工程556及び558で表される。図5のフローチャートは、2つの工程556及び558において生じる拡張を表している。これは、各工程において最大反復回数に制限がある場合に必要とされる可能性がある。例えば、反復回数は最大10回(10画素増加に相当)であってよく、つまり、20画素増加する必要がある場合は、拡張を2つの後続工程に分ける必要がある。
第2バイオマーカーマスカー224内では、バイオマーカーマスクを、図5の工程560に示すように、and演算を使用して前記非サブセット細胞マスクと組み合わせて、第1バイオマーカーに陽性を示す非サブセット細胞全てのマスクを生成することができる。このマスクは、その後、相互作用マスカー230において、拡張装置226からの拡張されたマスクと組み合わせて(工程562)、相互作用マスクを生成する。相互作用マスクは、第2バイオマーカーに陽性を示しかつ相互作用面積内にも存するか又は拡張されたマスクと重なる、非腫瘍細胞を特定した。前記特定された細胞は、その後、第1バイオマーカーに陽性を示す細胞と相互作用する細胞を表すため、さらに大きな治療反応をもたらす。
空間的近接スコア(SPS)を計算するために、相互作用マスクの面積を面積評価装置232において画素で求める。いくつかの実施形態において、第2バイオマーカーを発現できる全細胞の面積は、面積評価装置234において画素で求められる。第2バイオマーカーを発現できる細胞は、腫瘍細胞又は非腫瘍細胞であってよい。いくつかの実施形態において、視野内の全細胞の面積は、面積評価装置234において画素で求められる。相互作用スコア、すなわち空間的近接スコアは、相互作用計算機236において、面積評価装置232から得た面積を面積評価装置234から得た面積で割り、それに所定の係数を掛けることによって求められる。先に説明したように、一実施形態において、相互作用計算機236で実行される式は次の通りである。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた細胞の総面積)であり、また、A
cは、正規化因子である。ここで、正規化因子は、第2特異的バイオマーカーを発現する能力を有する細胞の総面積である。いくつかの実施形態において、正規化因子は、全腫瘍細胞又は非腫瘍細胞全ての総面積である。いくつかの実施形態において、正規化因子は、全細胞の総面積である。
AND手順は、2進and演算を手本にしているが、有意手段が異なる。AND手順は、現在の画像及びユーザ選択結果を受け入れる。出力は、2つの入力画像からの画素と合致する正規化強度を掛け合わせることによって生じた画像である。いくつかの応用では、画像強度データは、すでに正規化されている。したがって、AND手順は、単に、2つの画像の画素的な掛け算である。OUT手順に必要な2つの入力データは、現在の画像とユーザ選択結果である。OUT手順は、式:A×(1−B/Bmax)に従って第1の画像から第2の画像を削除するものであり、ここで、Aは、現在の画像であり、Bは、削除すべきユーザ選択画像であり、また、Bmaxは、Bの最大強度である。ここで留意すべきは、BのBmaxによる割り算がBを正規化することである。
いくつかの実施形態において、本明細書には、がん患者から採取した腫瘍組織を含む試料を採点するためのイメージングシステムであって、イメージング領域内で試料の位置決めをするためのステージと、試料に電磁放射線を向けるための電磁放射線源と、試料からの電磁放射線を検出するように設定された検出器とを備えたイメージング装置と、コントローラと、を備える、前記イメージングシステムが提示されている。コントローラは、オペレータと電子制御システムとの間で情報を交換するためのユーザインターフェースと、コンピュータ可読媒体に記憶された指示を実行するように設定された処理回路とを備えている。指示は、画像システムの電子制御システムに、(i)イメージング装置からの検出された電磁放射線についての情報を受信させ、(ii)検出された電磁放射線に基づいて画像データを生成させ、(iii)画像データを解析して少なくとも1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の近接を表すスコアを求めさせ、そして(iv)スコアを記録させるものであるが、前記スコアは、閾値と比較したとき、がん患者が免疫療法に積極的に応答する可能性を示すものである。
いくつかの実施形態において、少なくとも1対の細胞間の近接を表すスコアは、1対の細胞同士が所定の近接の範囲内にあるという程度を表している。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、腫瘍細胞を含み、また、少なくとも1対の細胞の第2メンバーは、非腫瘍細胞を含む。いくつかの実施形態において、非腫瘍細胞は、免疫細胞である。いくつかの実施形態において、非腫瘍細胞は、間質細胞である。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバー及び第2メンバーは、免疫細胞を含む。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、腫瘍細胞、骨髄性細胞、又は間質細胞を含み、また、少なくとも1対の細胞の第2メンバーは、免疫細胞を含む。いくつかの実施形態において、腫瘍細胞、骨髄性細胞、又は間質細胞は、PD−L1を発現し、また、免疫細胞は、PD−1を発現する。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、腫瘍細胞を含み、また、少なくとも1対の細胞の第2メンバーは、免疫細胞を含む。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、骨髄性細胞を含み、また、少なくとも1対の細胞の第2メンバーは、免疫細胞を含む。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、間質細胞を含み、また、少なくとも1対の細胞の第2メンバーは、免疫細胞を含む。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーはPD−L1を発現し、また、免疫細胞はPD−1を発現する。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、PD−L1、PD−L2、B7−H3、B7−H4、HLA−DR、Galectin9、CD80、CD86、4.1BBL、ICOSL、CD40、OX40L、IDO−1、GITRL、及びそれらの組み合わせからなる群から選択される第1バイオマーカーを発現する。いくつかの実施形態において、少なくとも1対の細胞の第2メンバーは、PD−1、TIM3、LAG3、41BB、OX40、CTLA−4、CD40L、CD28、GITR、ICOS、CD28、及びそれらの組み合わせから成る群から選択される第2バイオマーカーを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、PD−L1、PD−L2、B7−H3、B7−H4、HLA−DR、Galectin9、CD80、CD86、4.1BBL、ICOSL、CD40、OX40L、IDO−1、GITRL、及びそれらの組み合わせからなる群から選択される第1バイオマーカーを発現し、また、少なくとも1対の細胞の第2メンバーは、PD−1、TIM3、LAG3、41BB、OX40、CTLA−4、CD40L、CD28、GITR、ICOS、CD28、及びそれらの組み合わせから成る群から選択される第2バイオマーカーを発現する。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、PD−L1を発現し、また、少なくとも1対の細胞の第2メンバーは、PD−1を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、PD−L1を発現し、また、少なくとも1対の細胞の第2メンバーは、CD80を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、CTLA−4を発現し、また、少なくとも1対の細胞の第2メンバーは、CD80を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、PD−L2を発現し、また、少なくとも1対の細胞の第2メンバーは、PD−1を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、CTLA−4を発現し、また、少なくとも1対の細胞の第2メンバーは、CD86を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、LAG−3を発現し、また、少なくとも1対の細胞の第2メンバーは、HLA−DRを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、TIM−3を発現し、また、少なくとも1対の細胞の第2メンバーは、Galectin9を発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、41BBを発現し、また、少なくとも1対の細胞の第2メンバーは、4.1BBLを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、OX40を発現し、また、少なくとも1対の細胞の第2メンバーは、OX40Lを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、CD40を発現し、また、少なくとも1対の細胞の第2メンバーは、CD40Lを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、ICOSを発現し、また、少なくとも1対の細胞の第2メンバーは、ICOSLを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、GITRを発現し、また、少なくとも1対の細胞の第2メンバーは、GITRLを発現する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーは、HLA−DRを発現し、また、少なくとも1対の細胞の第2メンバーは、TCRを発現する。
いくつかの実施形態において、少なくとも1対の細胞の第1メンバーによって発現される第1バイオマーカーと少なくとも1対の細胞の第2メンバーによって発現される第2バイオマーカーは、互いに相互作用する。いくつかの実施形態において、少なくとも1対の細胞の第1メンバーによって発現される第1バイオマーカーと少なくとも1対の細胞の第2メンバーによって発現される第2バイオマーカーは、互いに相互作用しない。
いくつかの実施形態において、少なくとも1対の細胞間の空間的近接は、約0.5μm〜約50μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約50μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約45μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約40μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約35μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約30μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約25μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約20μmまでの範囲である。いくつかの実施形態において、空間的近接は、約2.5μm〜約15μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約50μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約45μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約40μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約35μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約30μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約25μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約20μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm〜約15μmまでの範囲である。いくつかの実施形態において、空間的近接は、約5μm、約6μm、約7μm、約8μm、約9μm、約10μm、約11μm、約12μm、約13μm、約14μm、約15μm、約16μm、約17μm、約18μm、約19μm、約20μm、約21μm、約22μm、約23μm、約24μm、約25μm、約26μm、約27μm、約28μm、約29μm、約30μm、約31μm、約32μm、約33μm、約34μm、約35μm、約36μm、約37μm、約38μm、約39μm、約40μm、約41μm、約42μm、約43μm、約44μm、約45μm、約46μm、約47μm、約48μm、約49μm、又は約50μmである。
いくつかの実施形態において、少なくとも1対の細胞間の空間的近接は、約1画素〜約100画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約100画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約90画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約80画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約70画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約60画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約50画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約40画素までの範囲である。いくつかの実施形態において、空間的近接は、約5〜約30画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約100画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約90画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約80画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約70画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約60画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約50画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約40画素までの範囲である。いくつかの実施形態において、空間的近接は、約10〜約30画素までの範囲である。いくつかの実施形態において、空間的近接は、約1画素、約2画素、約3画素、約4画素、約5画素、約6画素、約7画素、約8画素、約9画素、約10画素、約11画素、約12画素、約13画素、約14画素、約15画素、約16画素、約17画素、約18画素、約19画素、約20画素、約21画素、約22画素、約23画素、約24画素、約25画素、約26画素、約27画素、約28画素、約29画素、約30画素、約31画素、約32画素、約33画素、約34画素、約35画素、約36画素、約37画素、約38画素、約39画素、約40画素、約41画素、約42画素、約43画素、約44画素、約45画素、約46画素、約47画素、約48画素、約49画素、約50画素、約51画素、約52画素、約53画素、約54画素、約55画素、約56画素、約57画素、約58画素、約59画素、約60画素、約61画素、約62画素、約63画素、約64画素、約65画素、約66画素、約67画素、約68画素、約69画素、約70画素、約71画素、約72画素、約73画素、約74画素、約75画素、約76画素、約77画素、約78画素、約79画素、約80画素、約81画素、約82画素、約83画素、約84画素、約85画素、約86画素、約87画素、約88画素、約89画素、約90画素、約91画素、約92画素、約93画素、約94画素、約95画素、約96画素、約97画素、約98画素、約99画素、又は約100画素である。いくつかの実施形態において、画素は、幅0.5μmである。
いくつかの実施形態において、画像データを生成することは、(i)検出された電磁放射線についての情報を単純画像データに分けることと、(ii)前記データを複数のデータチャネルから提供することを含み、その場合、第1データチャネル内の単純画像データは、第1バイオマーカーに起因する蛍光信号を表現し、また、第2データチャネル内の単純画像データは、第2バイオマーカーに起因する蛍光信号を表現する。
いくつかの実施形態において、データを解析することには、(i)がん患者から採取した腫瘍組織を含む試料から所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択は、他の視野に比べて第1バイオマーカーを発現する細胞をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を、第2バイオマーカーを発現する近接した細胞を取り囲むのに十分なマージン単位で拡張することと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号に取り囲まれた前記全細胞に関する第1の総面積を正規化因子で割り、その結果得られた商に所定の係数を掛けることによって空間的近接スコアに至ることと、を含む。
いくつかの実施形態において、データを解析することには、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を拡張して、第2バイオマーカーを発現する近接した細胞を、第1バイオマーカーを発現する細胞の細胞膜の約0.5μm〜約50μm内に取り囲むことと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号内で取り囲まれた前記全細胞に関する第1の総面積を正規化因子で割って、その結果得られる商に所定の係数を掛け合わせて空間的近接スコアに至ることを含む。
いくつかの実施形態において、データを解析することには、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞の数をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を、第2バイオマーカーを発現する近接した細胞を取り囲むために約1〜約100画素までの範囲のマージン単位で拡張することと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号で取り囲まれている前記全細胞に関して、画素単位で測定される第1の総面積を正規化因子で割って、その結果得られる商に所定の係数と掛け合わせて空間的近接スコアに至ることを含む。
いくつかの実施形態において、データを解析することには、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を約1画素〜約100画素の範囲のマージン単位で拡張して、第2バイオマーカーを発現する細胞を第1バイオマーカーを発現する細胞の細胞膜の約0.5μm〜約50μmの範囲内に取り囲むことと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号内で取り囲まれている前記全細胞に関して、画素単位で測定される第1の総面積を正規化因子で割って、その結果得られる商に所定の係数と掛け合わせて空間的近接スコアに至ることを含む。
いくつかの実施形態において、空間的近接スコアは、次の式にしたがって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因する拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
cは、第2特異的バイオマーカーを発現する能力を有する細胞の総面積(正規化因子)である。
いくつかの実施形態において、空間的近接スコア(SPS)は、次の式にしたがって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
NTは、非腫瘍細胞の総面積である。
いくつかの実施形態において、空間的近接スコアは、次の式にしたがって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
Tは、全細胞の総面積である。
いくつかの実施形態において、4つの蛍光タグは、それぞれ異なるバイオマーカーに特異のものであり、測定工程で使用される。さらなる実施形態において、第1蛍光タグは第1バイオマーカーと関連しており、第2蛍光タグは第2バイオマーカーと関連しており、第3蛍光タグは第3バイオマーカーと関連しており、また、第4蛍光タグは第4バイオマーカーと関連している。いくつかの実施形態において、第1バイオマーカーは、腫瘍及び非腫瘍マーカーを含む。いくつかの実施形態において、第2バイオマーカーは、非腫瘍マーカーを含む。いくつかの実施形態において、第1バイオマーカーは、腫瘍及び非腫瘍マーカーを含み、また、第2バイオマーカーは、非腫瘍マーカーを含む。いくつかの実施形態において、第3バイオマーカーは、全細胞によって発現される。いくつかの実施形態において、第4バイオマーカーは、腫瘍細胞でのみ発現される。いくつかの実施形態において、第3バイオマーカーは全細胞によって発現され、また、第4バイオマーカーは腫瘍細胞でのみ発現される。いくつかの実施形態において、1つ以上の蛍光タグは、特異的バイオマーカー又は別の抗体に対して結合親和性を示す抗体と共役した蛍光色素分子を含む。いくつかの実施形態において、1つ以上の蛍光タグは、特異的バイオマーカーに対して親和性を示す蛍光色素分子である。
蛍光色素分子の例としては、フルオレセイン、6ーFAM、ローダミン、TexasRed、カリフォルニアレッド、iFour594、テトラメチルローダミン、カルボキシローダミン、カルボキシローダミン6F、カルボキシロードル、カルボキシローダミン110、カスケードブルー、カスケードイエロー、クマリン、Cy2(登録商標)、Cy3(登録商標)、Cy3.5(登録商標)、Cy5(登録商標)、Cy5.5(登録商標)、Cy7(登録商標)、Cy−クローム、Dylight(登録商標)350、Dylight(登録商標)405、Dylight(登録商標)488、Dylight(登録商標)549、Dylight(登録商標)594、Dylight(登録商標)633、Dylight(登録商標)649、Dylight(登録商標)680、Dylight(登録商標)750、Dylight(登録商標)800、フィコエリトリン、PerCP(ペリジニンクロロフィル−プロテインa)、PerCPーCy5.5、JOE(6−カルボキシ−4’、5’−ジクロロ−2’、7’−ジメトキシフルオレセイン)、NED、ROX(5−(及び−6−)−カルボキシ−X−ローダミン)、HEX、ルシファーイエロー、マリーナブルー、オレゴングリーン488、オレゴングリーン500、オレゴングリーン514、AlexaFluor(登録商標)350、AlexaFluor(登録商標)430、AlexaFluor(登録商標)488、AlexaFluor(登録商標)532、AlexaFluor(登録商標)546、AlexaFluor(登録商標)568、AlexaFluor(登録商標)594、AlexaFluor(登録商標)633、AlexaFluor(登録商標)647、AlexaFluor(登録商標)660、AlexaFluor(登録商標)680、7−アミノ−4−メチルクマリン−3−酢酸、BODIPY(登録商標)FL、BODIPY(登録商標)FL−Br2、BODIPY(登録商標)530/550、BODIPY(登録商標)558/568、BODIPY(登録商標)630/650、BODIPY(登録商標)650/665、BODIPY(登録商標)R6G、BODIPY(登録商標)TMR、BODIPY(登録商標)TR、OPAL(商標)520、OPAL(商標)540、OPAL(商標)570、OPAL(商標)620、OPAL(商標)650、OPAL(商標)690、及びそれらの組み合わせが挙げられるが、これらに限定されない。いくつかの実施形態において、蛍光色素分子は、DAPI、Cy(登録商標)2、Cy(登録商標)3、Cy(登録商標)3.5、Cy(登録商標)5、Cy(登録商標)7、FITC、TRITC、488染料、555染料、594染料、TexasRed、及びクマリンから成る群から選択される。488染料の例としては、AlexaFluor(登録商標)488、DyLight(登録商標)488及びCF(商標)488Aが挙げられるが、これらに限定されない。555染料の例としては、AlexaFluor(登録商標)555が挙げられるが、これに限定されない。594染料の例としては、AlexaFluor(登録商標)594が挙げられるが、これに限定されない。
本明細書で使用するとき、「視野」は、組織試料のホールスライドデジタルイメージの一部分を意味する。いくつかの実施形態において、ホールスライドイメージは、2〜200の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10〜200の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、30〜200の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10〜150の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10〜100の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10〜50の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10〜40の所定の視野を有する。いくつかの実施形態において、ホールスライドイメージは、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、又は100(増分を含む)の所定の視野を有する。
いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号は、約1〜約100画素までの範囲のマージン単位で拡張される。いくつかの実施形態において、マージンは、約5〜約100画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約90画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約80画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約70画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約60画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約50画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約40画素までの範囲である。いくつかの実施形態において、マージンは、約5〜約30画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約100画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約90画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約80画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約70画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約60画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約50画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約40画素までの範囲である。いくつかの実施形態において、マージンは、約10〜約30画素までの範囲である。いくつかの実施形態において、マージンは、約1画素、約2画素、約3画素、約4画素、約5画素、約6画素、約7画素、約8画素、約9画素、約10画素、約11画素、約12画素、約13画素、約14画素、約15画素、約16画素、約17画素、約18画素、約19画素、約20画素、約21画素、約22画素、約23画素、約24画素、約25画素、約26画素、約27画素、約28画素、約29画素、約30画素、約31画素、約32画素、約33画素、約34画素、約35画素、約36画素、約37画素、約38画素、約39画素、約40画素、約41画素、約42画素、約43画素、約44画素、約45画素、約46画素、約47画素、約48画素、約49画素、約50画素、約51画素、約52画素、約53画素、約54画素、約55画素、約56画素、約57画素、約58画素、約59画素、約60画素、約61画素、約62画素、約63画素、約64画素、約65画素、約66画素、約67画素、約68画素、約69画素、約70画素、約71画素、約72画素、約73画素、約74画素、約75画素、約76画素、約77画素、約78画素、約79画素、約80画素、約81画素、約82画素、約83画素、約84画素、約85画素、約86画素、約87画素、約88画素、約89画素、約90画素、約91画素、約92画素、約93画素、約94画素、約95画素、約96画素、約97画素、約98画素、約99画素、又は約100画素である。いくつかの実施形態において、画素は、幅0.5μmである。
いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約0.5μm〜約50μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約50μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約45μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約40μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約35μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約30μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約25μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約20μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約2.5μm〜約15μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm〜約50μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm〜約45μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の約5μm〜約40μmの細胞膜で第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の約5μm〜約35μmの細胞膜で第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm〜約30μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の約5μm〜約25μmの細胞膜で第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm〜約20μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm〜約15μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、第1バイオマーカーに起因する蛍光信号の拡張は、第1バイオマーカーを発現する細胞の細胞膜の約5μm、約6μm、約7μm、約8μm、約9μm、約10μm、約11μm、約12μm、約13μm、約14μm、約15μm、約16μm、約17μm、約18μm、約19μm、約20μm、約21μm、約22μm、約23μm、約24μm、約25μm、約26μm、約27μm、約28μm、約29μm、約30μm、約31μm、約32μm、約33μm、約34μm、約35μm、約36μm、約37μm、約38μm、約39μm、約40μm、約41μm、約42μm、約43μm、約44μm、約45μm、約46μm、約47μm、約48μm、約49μm、又は約50μmの範囲内に第2バイオマーカーを発現する近接する細胞を取り囲んでいる。いくつかの実施形態において、近接する細胞に関する第2バイオマーカーは、第1バイオマーカーと直接接触している。
いくつかの実施形態において、選択された各視野からの、第2バイオマーカーを発現する全細胞の第1総面積は、画素単位で測定される。
いくつかの実施形態において、正規化因子は、選択された各視野からの非腫瘍細胞全ての第2総面積である。いくつかの実施形態において、第2総面積は、画素単位で測定される。いくつかの実施形態において、第1総面積と第2総面積はともに画素単位で測定される。
いくつかの実施形態において、正規化因子は、第2バイオマーカーを発現する能力を有する選択された各視野からの全細胞の第2総面積である。いくつかの実施形態において、第2総面積は、画素単位で測定される。いくつかの実施形態において、第1総面積と第2総面積はともに画素単位で測定される。
いくつかの実施形態において、正規化因子は、選択された各視野からの全細胞の第2総面積である。いくつかの実施形態において、第2総面積は、画素単位で測定される。いくつかの実施形態において、第1総面積と第2総面積はともに画素単位で測定される。
いくつかの実施形態において、閾値スコアは、約500〜約5000である。いくつかの実施形態において、閾値スコアは、約500〜約4500である。いくつかの実施形態において、閾値スコアは、約500〜約4000である。いくつかの実施形態において、閾値スコアは、約500〜約3500である。いくつかの実施形態において、閾値スコアは、約500〜約3000である。いくつかの実施形態において、閾値スコアは、約500〜約2500である。いくつかの実施形態において、閾値スコアは、約500〜約2000である。いくつかの実施形態において、閾値スコアは、約500〜約1500である。いくつかの実施形態において、閾値スコアは、約500〜約1000である。いくつかの実施形態において、閾値スコアは、約500、約550、約600、約650、約700、約750、約800、約850、約900、約950、約1000、約1100、約1200、約1300、約1400、約1500、約1600、約1700、約1800、約1900、約2000、約2100、約2200、約2300、約2400、約2500、約2600、約2700、約2800、約2900、約3000、約3100、約3200、約3300、約3400、約3500、約3600、約3700、約3800、約3900、約4000、約4100、約4200、約4300、約4400、約4500、約4600、約4700、約4800、約4900、又は約5000であり、それぞれの増分も包含する。いくつかの実施形態において、閾値スコアは、約500、約550、約600、約650、約700、約750、約800、約850、約900、約950、約1000、約1100、約1200、約1300、約1400、約1500、約1600、約1700、約1800、約1900、約2000、約2100、約2200、約2300、約2400、約2500、約2600、約2700、約2800、約2900、約3000、約3100、約3200、約3300、約3400、約3500、約3600、約3700、約3800、約3900、約4000、約4100、約4200、約4300、約4400、約4500、約4600、約4700、約4800、約4900、又は約5000であり、それぞれの増分も包含し、±100である。
いくつかの実施形態において、所定の係数は、約10〜約105である。いくつかの実施形態において、所定の係数は、約102〜約105である。いくつかの実施形態において、所定の係数は、約103〜約105である。いくつかの実施形態において、所定の係数は、約104〜約105である。いくつかの実施形態において、所定の係数は、約10、約20、約30、約40、約50、約60、約70、約80、約90、約100、約200、約300、約400、約500、約600、約700、約800、約900、約1000、約1500、約2000、約2500、約3000、約3500、約4000、約4500、約5000、約5500、約6000、約6500、約7000、約7500、約8000、約8500、約9000、約9500、約10000、約20000、約30000、約40000、約50000、約60000、約70000、約80000、約90000、又は約105であり、それぞれの増分も含む。
いくつかの実施形態において、予測力は、陽性予測値、陰性予測値、又はそれらの組み合わせとして定量される。陽性予測値は、閾値を超えるスコアで治療に反応する患者の人数を、治療に反応する患者の総人数で割ることによって計算される。陰性予測値は、閾値未満のスコアで治療に反応しない患者の人数を、治療に反応しない患者の総人数で割ることによって計算される。
いくつかの実施形態において、陽性予測値は、60%超である。いくつかの実施形態において、陽性予測値は、65%以上である。いくつかの実施形態において、陽性予測値は、70%以上である。いくつかの実施形態において、陽性予測値は、75%以上である。いくつかの実施形態において、陽性予測値は、80%以上である。いくつかの実施形態において、陽性予測値は、約50%、約51%、約52%、約53%、約54%、約55%、約56%、約57%、約58%、約59%、約60%、約61%、約62%、約63%、約64%、約65%、約66%、約67%、約68%、約69%、約70%、約71%、約72%、約73%、約74%、約75%、約76%、約77%、約78%、約79%、約80%、約81%、約82%、約83%、約84%、約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、又は約99%であり、それぞれの増分も包含する。
いくつかの実施形態において、陰性予測値は、60%以上である。いくつかの実施形態において、陰性予測値は、65%以上である。いくつかの実施形態において、陰性予測値は、70%以上である。いくつかの実施形態において、陰性予測値は、75%以上である。いくつかの実施形態において、陰性予測値は、80%以上である。いくつかの実施形態において、陰性予測値は、約50%、約51%、約52%、約53%、約54%、約55%、約56%、約57%、約58%、約59%、約60%、約61%、約62%、約63%、約64%、約65%、約66%、約67%、約68%、約69%、約70%、約71%、約72%、約73%、約74%、約75%、約76%、約77%、約78%、約79%、約80%、約81%、約82%、約83%、約84%、約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、又は約99%であり、それぞれの増分も包含する。
本明細書に開示の方法において、がん患者は哺乳動物である。いくつかの実施形態では、哺乳動物はヒトである。いくつかの実施形態では、哺乳動物はヒトではない。さらなる実施形態において、哺乳動物は、マウス、ラット、モルモット、イヌ、ネコ又はウマである。
本明細書に開示の方法において、腫瘍組織は、がん患者から採取される。がんの種類としては、限定されるものではないが、循環器系のがん、例えば、心臓のがん(肉腫[血管肉腫、線維肉腫、横紋筋肉腫、脂肪肉腫]、粘液腫、横紋筋腫、線維腫、脂肪腫及び奇形腫)、縦隔及び胸膜、並びに他の胸腔内蔵器のがん、血管腫瘍及び腫瘍が関連する維管束組織;気道のがん、例えば鼻腔及び中耳、副鼻腔、咽頭、気管、気管支、及び肺のがん、例えば小細胞肺がん(SCLC)、非小細胞肺がん(NSCLC)、気管支がん(扁平上皮がん、未分化小細胞がん、未分化大細胞がん、腺がん)、細気管支肺胞上皮(細気管支)がん、気管支腺腫、肉腫、リンパ腫、軟骨性過誤腫、中皮腫;消化器系のがん、例えば、食道がん(扁平上皮がん、腺がん、平滑筋肉腫、リンパ腫)、胃がん(細胞腫、リンパ腫、平滑筋肉腫)、胃がん、すい臓がん(導管腺がん、インスリノーマ、グルカゴン産生腫瘍、ガストリノーマ、カルチノイド腫瘍、ビポーマ)、小腸がん(腺がん、リンパ腫、カルチノイド腫瘍、カポジ肉腫、平滑筋腫、血管腫、脂肪腫、神経線維腫、線維腫)、大腸がん(腺がん、管状腺腫、絨毛構造、過誤腫、平滑筋腫);尿生殖路、例えば、腎臓がん(腺がん、腎芽細胞腫[腎芽腫])、リンパ腫、白血病)、胆のうがん及び/又は尿道がん(扁平上皮がん、移行上皮がん、腺がん)、前立腺がん(腺がん、肉腫)、精巣がん(セミノーマ、奇形腫、胎生期がん、奇形がん、絨毛腫、肉腫、間質細胞腫、線維腫、線維腺腫、類腺腫瘍、リンパ腫);肝臓がん、例えば、肝がん(肝細胞がん)、胆管がん、肝芽腫、血管肉腫、肝細胞腺腫、血管腫、膵内分泌腫瘍(褐色細胞腫、インスリノーマ、血管作動性腸管ペプチド腫瘍、島細胞腫及びグルカゴン産生腫瘍など);骨のがん、例えば、骨原性肉腫(骨肉腫)、線維肉腫、悪性線維性組織球腫、軟骨肉腫、ユーイング肉腫、悪性リンパ腫(細網肉腫)、多発性骨髄腫、悪性骨巨細胞腫、骨軟骨腫(osteochronfroma、osteocartilaginous exostoses)、良性軟骨腫、軟骨芽細胞腫、軟骨粘液線維腫、類骨骨腫及び巨細胞腫;神経系のがん、例えば、中枢神経系の腫瘍(CNC)、原発性中枢神経系リンパ腫、頭蓋骨のがん(骨腫、血管腫、肉芽腫、黄色腫、変形性骨炎)、髄膜のがん(髄膜腫、血管肉腫、神経膠腫症)、脳のがん(星状細胞腫、髄芽腫、グリオーマ、上衣腫、胚細胞腫[松果体腫]、多形性膠芽腫、乏突起膠腫、神経鞘腫、網膜芽腫、先天性腫瘍)、脊髄神経線維腫、髄膜腫、グリノーマ、肉腫);生殖器系のがん、例えば、婦人科がん、子宮がん(子宮内膜がん)、頸部がん(子宮頸がん、前腫瘍性子宮頸部異形成)、卵巣がん(卵巣がん[漿液性嚢胞腺がん、ムチン性嚢胞腺がん、分類不能大腸炎]、顆粒膜細胞腫、セルトリ・ライディッヒ細胞腫、未分化胚細胞腫、悪性奇形腫)、外陰部のがん(扁平上皮癌、上皮内がん、腺がん、線維肉腫、黒色腫)、膣がん(澄明細胞汗腺腫、扁平上皮がん、ブドウ状肉腫(胎児性横紋筋肉腫)、卵管がん(上皮性悪性腫瘍)及び女性生殖器に関する他の部位のがん;胎盤、ペニス、前立腺、睾丸、及び男性生殖器に関する他の部位のがん;血液学的系統のがん、例えば、血液(骨髄性白血病[急性及び慢性]、急性リンパ性白血病、慢性リンパ球性白血病、骨髄増殖性疾患、多発性骨髄腫、骨髄異形成症候群)、ホジキン病、非ホジキンリンパ腫[悪性リンパ腫];口腔のがん、例えば、唇、舌、歯茎、口腔底部、口蓋、及び口の他の部位、耳下腺、及び唾液腺の他の部位、扁桃腺、中咽頭、鼻咽頭、梨状陥凹、下咽頭、並びに唇、口腔及び咽頭の他の部位のがん;皮膚、例えば、悪性黒色腫、皮膚黒色腫、基底細胞がん、扁平上皮がん、カポジ肉腫、異形成母斑、リンパ腫、血管腫、皮膚線維腫、及びケロイド;副腎のがん;神経芽細胞腫;また、結合組織及び軟組織、後腹膜及び腹膜、目を包含する他の組織のがん、眼球内黒色腫、及び付属器、胸部、頭及び/又は首、肛門部、甲状腺、副甲状腺、副腎並びに他の内分泌腺及び関連構造のがん、リンパ節の続発性及び詳細不明の悪性腫、呼吸器系及び消化器官の続発性悪性新生物並びに他の部位の続発性悪性新生物、又はそれらの1つ以上の組み合わせがあげられる。
免疫療法の例としては、モノクローナル抗体(例えば、アレムツズマブ又はトラスツズマブ)、抱合型モノクローナル抗体(例えば、イブリツモマブ・チウキセタン、ブレンツキシマブ・ベドチン、又はトラスツズマブ・エムタンシン)、二重特異性モノクローナル抗体(ブリナツモマブ)、免疫チェックポイント阻害薬(例えば、イピリムマブ、ペンブロリズマブ、ニボルマブ、アテゾリズマブ又はデュルバルマブ)、サリドマイド、レナリドミド、ポマリドミド、及びイミキモド、並びにそれらの組み合わせが挙げられるが、これらに限定されない。いくつかの実施形態において、免疫療法は、免疫チェックポイント療法を含む。
別の態様において、本明細書には、イメージング装置と、腫瘍組織を含む試料から入手可能な所定数の視野に含まれる複数の細胞から選択される少なくとも1対の細胞間の空間的近接を表すスコアを求めるためのコントローラとを備えたシステムを利用する方法が開示されており、ここで、前記試料は、がん患者から採取されたものであり、前記方法は、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞の数をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1特異的バイオマーカーに起因する蛍光信号を拡張して、第2特異的バイオマーカーを発現する近接した細胞を取り囲むことと、(iii)選択された視野それぞれからの全細胞であって、第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因する拡張された蛍光信号で取り囲まれた前記全細胞に関する第1の総面積を正規化因子で割って、その結果得られる商を所定の係数と掛け合わせて空間的近接スコアに至ることを含む。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
別の態様において、本明細書には、イメージング装置と、腫瘍組織を含む試料から入手可能な所定数の視野に含まれる複数の細胞から選択される少なくとも1対の細胞間の空間的近接を表すスコアを求めるためのコントローラとを備えたシステムを利用する方法が開示されており、ここで、前記試料は、がん患者から採取されたものであり、前記方法は、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞の数をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を拡張して、第1バイオマーカーを発現する細胞の細胞膜の約0.5μm〜約50μmの範囲内に第2バイオマーカーを発現する細胞を取り囲むことと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号内で取り囲まれた前記全細胞に関する第1の総面積を、正規化因子で割って、その結果得られる商を所定の係数と掛け合わせて空間的近接スコアに至ることを含む。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
別の態様において、本明細書には、イメージング装置と、腫瘍組織を含む試料から入手可能な所定数の視野に含まれる複数の細胞から選択される少なくとも1対の細胞間の空間的近接を表すスコアを求めるためのコントローラとを備えたシステムを利用する方法が開示されており、ここで、前記試料は、がん患者から採取されたものであり、前記方法は、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料は複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞の数をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を、約1〜約100画素までの範囲のマージン単位で拡張して、第2バイオマーカーを発現する近接した細胞を取り囲むことと、(iii)選択された視野それぞれからの全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号内に取り囲まれている前記全細胞に関して、画素単位で測定される第1の総面積を、正規化因子で割って、その結果得られる商を所定の係数と掛け合わせて空間的近接スコアに至ることを含む。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
別の態様において、本明細書には、イメージング装置と、腫瘍組織を含む試料から入手可能な所定数の視野に含まれる複数の細胞から選択される少なくとも1対の細胞間の空間的近接を表すスコアを求めるためのコントローラとを備えたシステムを利用する方法が開示されており、ここで、前記試料は、がん患者から採取されたものであり、前記方法は、(i)がん患者から採取した腫瘍組織を含む試料から入手可能な所定数の視野を選択することであって、前記試料が複数の蛍光タグで染色されており、選択が、他の視野に比べて第1バイオマーカーを発現する細胞の数をより多く含有する視野を選択することに偏っている、ことと、(ii)選択された視野それぞれにおいて、第1バイオマーカーに起因する蛍光信号を約1〜約100画素までの範囲のマージン単位で拡張して、第1バイオマーカーを発現する細胞の細胞膜の約0.5μm〜約50μmの範囲内に第2バイオマーカーを発現する細胞を取り囲むことと、(iii)選択された視野それぞれから全細胞であって、第2バイオマーカーを発現しかつ第1バイオマーカーを発現する細胞に起因する拡張された蛍光信号内で取り囲まれている前記細胞に関して、画素単位で測定される第1の総面積を正規化因子で割って、その結果得られる商を所定の係数と掛け合わせて空間的近接スコアに至ることを含む。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
いくつかの実施形態において、空間的近接スコア(SPS)は、次の式にしたがって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
NTは、非腫瘍細胞の総面積である。
いくつかの実施形態において、空間的近接スコアは、次の式にしたがって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
cは、第2特異的バイオマーカーを発現する能力を有する細胞の総面積である。
いくつかの実施形態において、空間的近接スコアは、次の式によって求められる。
前記式中、A
Iは、相互作用総面積(第2特異的バイオマーカーを発現しかつ第1特異的バイオマーカーを発現する細胞に起因した拡張された蛍光信号に取り囲まれた、細胞の総面積)であり、また、A
Tは、全細胞の総面積である。
別の態様において、イメージング装置と、がん患者から得た腫瘍組織を含む試料を採点するためのコントローラであって、患者のがんを治療する方法に使用される前記コントローラとを備えたシステムを利用する方法が開示されている。いくつかの実施形態において、がん患者から得た腫瘍組織を含む試料を採点する方法は、免疫療法を施す前に実行される。
いくつかの実施形態において、本明細書には、イメージング装置と、治療する必要のある患者のがんを治療するためのコントローラとを備えたシステムを利用する方法であって、(a)患者から採取した腫瘍組織を含む試料を採点することであって、(i)患者から採取した腫瘍組織を含む試料を使用して、少なくとも1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の空間的近接を表すスコアを求めることと、(ii)スコアを記録することを含む、ことと、(b)スコアを閾値と比較することと、(b)閾値と比較したときにスコアが、がん患者が免疫療法に積極的に応答する可能性を示す場合に、患者に免疫療法を施すことを含む、前記方法が開示されている。いくつかの実施形態において、測定工程は、本明細書に説明した通りである。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
いくつかの実施形態において、本明細書には、組織試料を採点する方法であって、(i)イメージングシステムを使用してがん患者から採取した組織試料についての画像データを得る工程であって、イメージングシステムが、試料をイメージング領域に位置付けるためのステージと、電磁放射線を試料に向けるための電磁放射線源と、電磁放射線出力を収集するための検出器を備えたハウジングと、メモリと画像処理モジュールを有する処理回路とを備えた電子制御システムを含む、工程と、(ii)画像処理モジュールを用いて画像データを解析して、1対の細胞と、第1バイオマーカーを発現する1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する1対の細胞の第2メンバーとの間の近接を表すスコアを求める工程と、(iii)スコアをメモリに記録する工程と、を含み、スコアが閾値と比較したときに、がん患者が免疫療法に積極的に応答する可能性を示す、前記方法が開示されている。いくつかの実施形態において、本方法は、第1特異的バイオマーカーの発現の定量化又は第2特異的バイオマーカーの発現の定量化と比べて優れた予測力を提供する。
いくつかの実施形態において、本明細書には、がん患者から採取した組織試料の画像データを獲得するイメージング装置と、イメージング装置から画像データを受信してデータを解析することによって、1対の細胞と、第1バイオマーカーを発現する少なくとも1対の細胞の第1メンバーと、第1バイオマーカーとは異なる第2バイオマーカーを発現する少なくとも1対の細胞の第2メンバーとの間の近接を表すスコアを求めるコントローラと、を備えた組織試料採点システムであって、その場合、閾値と比較したときにスコアが、がん患者が免疫療法に積極的に応答する可能性を示す、前記システムが開示されている。
[実施例1]
ヒト患者から得た黒色腫組織試料についての試料の調製、イメージング、及びイメージングの解析
試料の調製:ホルマリン固定パラフィン包埋(FFPE)組織試料を脱脂した。次に、スライドは、キシレンからアルコールまでの一連の洗浄を経て再水和してから、蒸留水中でインキュベートした。その後、加熱抗原賦活化法を、高圧高温条件を用いて行い、冷却させて、トリス緩衝生理食塩水へ移した。次いで、染色を行ったが、そこでは、以降の工程を実行した。先ず、内在性ペルオキシダーゼを遮断した後、タンパク質ブロッキング溶液でインキュベートして非特異性抗体染色を抑えた。次にスライドを、マウス抗PD1一次抗体で染色した。スライドをその後洗浄してから、抗マウスHRP二次抗体でインキュベートした。スライドを洗浄した後、PD−1染色を、TSA+Cy(登録商標)3.5(PerkinElmer)を用いて検出した。次に、残留HRPをすべて、新たなベンズヒドラジド100mMと過酸化水素50mMの2回の洗浄を用いてクエンチした。スライドを再度洗浄してから、ウサギ抗PD−L1一次抗体で染色した。スライドを洗浄した後、488染料と4’、6’−ジアミノ−2−フェニルインドール(DAPI)で直接標識化した抗ウサギHRP二次抗体とマウス抗S100の混合液でインキュベートした。スライドを洗浄した後、PD−1染色を、TSA+Cy(登録商標)5(PerkinElmer)を用いて検出した。スライドをもう一度洗浄してから、封入剤を用いてカバーグラスで覆って、室温で一晩乾燥させた。抗体と検出試薬の概略図を図6に示す。別法として、スライドは、抗PD1一次抗体の代わりに抗CD8一次抗体で染色した。
試料イメージング及び解析:次に、Vectraソフトウェアversion2.0.8(PerkinElmer)を使用したVectra2 Intelligent Slide Analysis Systemを用いて蛍光画像を得た。先ず、スライドの白黒イメージングは、DAPIを用いて4倍で行った。自動化アルゴリズム(inFormを使用して開発されたもの)を用いて組織を含むスライドの領域を特定した。
組織を含むと特定されたスライドの領域を、DAPI(青)、FITC(緑)及びCy(登録商標)5(赤)に関するチャネルにおいて4倍で画像化してRGB画像を作成した。これらの4倍画像は、自動化強化アルゴリズム(inFormを使用して開発されたもの)を用いて視野選択装置101で処理することによって、Cy(登録商標)5最高発現に従って、考えられる20倍視野を特定して順位付けした。
上位40の視野を、DAPI、FITC、TexasRed、及びCy(登録商標)5の波長全域において20倍で画像化した。現画像の利用可能性について再調査して、ピンぼけ、腫瘍細胞不在、壊死が非常に進んでいるか、又は予測される抗体局在に関係のない高濃度の蛍光信号(すなわち、背景染色)を含む画像は、解析前に不採用とした。容認された画像は、AQUAduct(PerkinElmer)を用いて処理し、その場合、蛍光色素分子はそれぞれ、分光分離装置210によって個別のチャネルへ分光分離して、別ファイルとして保存した。
処理後のファイルをさらに、AQUAnalysis(商標)を用いて又はAQUAserve(商標)を用いた全自動処理によって解析した。以下に詳細を記す。
DAPI画像はそれぞれ細胞マスカー212で処理して、画像内の全細胞核を特定し(図7a)、また、その後、3画素ずつ拡張して細胞全体のおおよそのサイズを表した。この結果得られたマスクは、画像内の全細胞を表していた(図7b)。
488染料で検出されたS100(黒色腫に対する腫瘍細胞マスカー)(図8a)は、腫瘍マスカー216で処理して、画像内の全腫瘍面積のバイナリマスクを作成した(図8b)。前記バイナリマスクと全細胞のマスクとの重なりが、腫瘍細胞マスカー218を用いて腫瘍細胞に対する新たなマスクを作成した(図8c)。
同様に、非腫瘍細胞に対する新たなマスクを作成した核全てのマスクとの組み合わせに腫瘍細胞マーカーを含まないもの(図8d)も、非腫瘍細胞マスカー220を用いて行った。
各Cy(登録商標)5画像(図9a)は、第1バイオマーカーマスカー222によって処理し、全細胞のマスクと重ねて、PD−L1陽性の全細胞のバイナリマスクを作成した(図9b)。バイオマーカーマスクと全細胞のマスクとを重ねることによって、バイオマーカー陽性細胞としてマスク内で偽って特定される可能性のあるノイズ画素を消去した。
各Cy(登録商標)3.5画像(図10a)は、第2バイオマーカーマスカー224によって処理してPD−1陽性細胞に対するバイナリマスクを作成して、非腫瘍細胞全てのマスクと重ねて、PD−L1陽性の非腫瘍細胞全てのバイナリマスクを作成した(図10b)。バイオマーカーマスクと非腫瘍細胞全てのマスクとを重ねることによって、バイオマーカー陽性細胞としてマスク内で偽って特定される可能性のあるノイズ画素を消去した。
PD−L1陽性細胞全てのバイナリマスクは、第2拡張装置226を用いて拡張して、近接した細胞(例えば、PD−1を有する細胞)を取り囲む相互作用マスクを作成した(図11a)。この相互作用マスクは、相互作用マスカー230を用いてPD−1陽性非腫瘍細胞全てのバイナリマスクと、組み合わせることによって、PD−1がPD−L1と相互作用し得るほど十分にPD−L1陽性細胞と近接させてPD−1陽性細胞の相互作用区画を作成した(図11b)。
相互作用区画に対する容認された領域(最大40の視野)に由来する総面積と非腫瘍細胞の総面積をそれぞれ、面積評価装置232、234で計算した。相互作用区画に対する容認された視野全てに由来する総面積を非腫瘍細胞の総面積で割り、相互作用計算機236を用いて計数10,000を掛けることによって、試料ごとの相互作用スコアを表す整数がもたらされた。PD−L1測定値及びPD−1測定値は、再現性が高かった(それぞれR2=0.98及び0.97)。広域のPD−L1発現及びPD−1発現並びに相互作用スコアは、保存臨床標本(n=53)で観察された。ニボルマブ(n=5)又はペンブロリズマブ(n=21)で処置した進行性黒色腫患者26人のコホートでは、PD−1/PD−L1相互作用スコアからは、応答者と非応答者を容易に識別できる(p=0.01)が、PD−L1単独(p=0.07)又はCD8単独(p=0.23)ではできないことが分かった。さらに、高いPD−1/PD−L1相互作用スコアを発現する患者は、優れた奏効率を示した(82%対20%、p=0.01)。PD−1/PD−L1相互作用スコアの高い患者は、より大きな無増悪期間中央値(p=0.059)が認められ、PD−1/PD−L1相互作用スコアの低い患者と比べて死亡率も低かった(22%対58%)。これらの結果から、組織試料を採点してPD−1/PD−L1相互作用スコアを得る本方法は、PD−L1発現単独と比べて優れた予測力を提供する(82%陽性予測値、80%陰性予測値)ことが分かる。
患者26人からの典型的なスコアを図12aに示す。データに応じて、閾値800〜900を選択して処置への応答の可能性を示した。
別法として、個々の視野についての相互作用スコアを計算し、その患者ごとのスコア最大値を図12bに示す。スコア最大値に応じて、閾値1900を選択して処置への応答の可能性を示した。
相互作用スコアに対する強化アルゴリズムの効果を評価するために、前記手順を、強化アルゴリズムの代わりにホールスライドイメージイング法を用いて行った(図13参照)。ホールスライドイメージ解析を行ったときに、抗PD1治療に反応した患者と反応しなかった患者との間に統計学的有意差はもはや無かった。そのため、この解析では閾値を求めることができなかった。
相互作用スコアを患者の無増悪生存期間(PFS)と比較した(図14)。少なくとも803の相互作用スコアが生存期間とうまく相関していた。特に、PD−L1発現は、PFSの向上と相関を示さなかった(図15)。
図16及び図17は、PD−L1陽性細胞(赤)、PD−L陽性細胞(黄)、腫瘍細胞(S100、緑)、及び全細胞(DAPI、青)を示すオーバーレイマスクの代表的な例を示している。免疫療法に対して陽性応答者の場合、図16のマスクは、PD−L1陽性細胞(赤)、PD−1陽性細胞(黄)、及び全腫瘍細胞(緑)の存在を簡単に示している。一方、免疫療法に対して陰性応答者の場合、図17のマスクは、腫瘍細胞(S100、緑)及び全細胞(DAPI、青)の存在を示すが、PD−L1陽性細胞(赤)又はPD−1陽性細胞(黄)にはほとんどないし全く示さない。図16は、2176の相互作用スコアを表している(免疫療法に対して完全反応)。図17は、8つの相互作用スコアを表している(免疫療法に無反応)。
組織試料をさらにFDA承認方法を用いて評価して、現在は黒色腫組織試料に使用されていない抗PD−L1抗体クローン22C3を用いて非小細胞肺がんにおけるPD−L1を測定した。PD−L1発現を、患者のPFSと比較し、これを図19に示す。この方法は、相互作用スコアを使用する本明細書に記載の方法と比べると、統計学的に関連性のある診断値を示さない。
さらに34人の転移性黒色腫患者の照合コホートを検査して、PD−1/PD−L1相互作用スコアを獲得した(図20a参照)。相互作用スコアはまた、患者の無増悪生存期間(PFS)とも比較した(図20b)。統計的に有意ではないが(p=0.19)、この比較からは、PD−1/PD−L1相互作用スコアが高い患者ほどPFSが長いという傾向が分かる。統計的有意性は、クリニックでのこの治療が比較的最近であったために制限されており、そのため、前記患者の追跡期間が制限されている可能性がある。
患者26人からなる初期コホートと患者34人からなる検証コホートとの組み合わせにおけるPD−1/PD−L1相互作用スコア並びに前記スコアと患者のPFS又は患者の全生存期間(OS)との比較を、図20c〜図20eに示す。複合解析からは、PD−1/PD−L1の高い患者が抗PD−1治療に対して改善された反応を示すことがはっきりと分かる。
[実施例2]
ヒト患者から得た非小細胞肺がん組織試料についての試料の調製、イメージング、及びイメージングの解析
上皮性腫瘍細胞に関し、488染料で直接標識化したマウス抗S100を488染料で直接標識化したマウス抗パンサイトケラチンと置き換えて、実施例1と同様の手順を行った。38の試料についての相互作用スコアを図18に示す。
[実施例3]
PD−L1を発現する細胞及びCD80を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
試料の調製;ホルマリン固定パラフィン包埋(FFPE)組織試料を脱脂し、再水和して、高温条件で抗原修復を行った。次いで、染色を行ったが、そこでは、以降の工程を実行した。先ず、組織は、RNAScope(登録商標)(Advanced Cell Diagnostics)を使用して1kbのCRLA−4mRNAに及ぶ20個のハイブリッド形成プローブ対を用いてCTLA−4発現検出に付した。In situハイブリッド形成は、TSA−Cy(登録商標)3を用いて視覚化した。スライドを洗浄し、残留HRPはすべて、新たなベンズヒドラジド100mMと過酸化水素50mMの2回の洗浄を用いてクエンチした。スライドを再度洗浄してから、マウス抗CD80一次抗体で染色した。スライドを洗浄した後、抗マウスHRP二次抗体でインキュベートした。スライドを洗浄した後、CD80染色を、TSAーCy(登録商標)5(PerkinElmer)を用いて検出した。残留HRPはすべて、新たなベンズヒドラジド100mMと過酸化水素50mMの2回の洗浄を用いてクエンチした。スライドを再度洗浄してから、ウサギ抗CD3一次抗体で染色した。スライドを洗浄した後、抗ウサギHRP二次抗体と4’、6’−ジアミノ−2−フェニルインドール(DAPI)の混合液でインキュベートした。スライドを洗浄した後、CD3染色を、TSA−AlexaFluor488(登録商標)5(LifeTechnologies)を用いて検出した。スライドをもう一度洗浄してから、封入剤を用いてカバーグラスで覆って、室温で一晩乾燥させた。
実施例1と類似のイメージング及び解析手順を行ってDAPI、FITC、Cy(登録商標)3及びCy(登録商標)5の波長全域を画像化した。CTLA−4及びCD80の発現を用いて、20倍画像獲得用強化アルゴリズムを展開した。解析を実行して、CD80陽性細胞の近接範囲内にあるCTlA−4陽性細胞及びCD3陽性細胞の総面積(画素単位)を測定し、それをCD3陽性細胞の総面積(画素単位)で割り、計数10,000を掛け合わせることにより、CTLA−4/CD80相互作用スコアを求めた。結果を図21に示す。
[実施例4]
CTLA−4を発現する細胞及びCD80を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をCTLA−4及びCD80の染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例5]
PD−L2を発現する細胞及びPD−L1を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1の染色及び解析をPD−L2の染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例6]
CTLA−4を発現する細胞及びCD86を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をCTLA−4及びCD86の染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例7]
LAG−3を発現する細胞及びHLA−DRを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をLAG−3及びHLA−DRの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例8]
TIM−3を発現する細胞及びGalectin9を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をTIM−3及びGalectin9の染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例9]
41BBを発現する細胞及び4.1BBLを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析を41BB及び4.1BBLの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例10]
OX40を発現する細胞及びOX40Lを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をOX40及びOX40Lの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例11]
CD40を発現する細胞及びCD40Lを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をCD40及びCD40Lの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例12]
ICOSを発現する細胞及びICOSLを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をICOS及びICOSLの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例13]
GITRを発現する細胞及びGITRLを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をGITR及びGITRLの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例14]
HLAーDRを発現する細胞及びTCRを発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
PD−L1及びPD−1の染色及び解析をHLA−DR及びTCRの染色及び解析と置き換えて、実施例1と同様の手順を行った。
[実施例15]
PD−1を発現する細胞、PD−L1を発現する細胞及びCD3を発現する細胞を含む組織試料における、試料の調製、イメージング、及びイメージングの解析
実施例1と同様の手順を、マウス抗S100抗体を用いずに行った。その代わりに、PD−L1検出後、一次抗体及び二次抗体をマイクロ波で除去した。次に、スライドを、ウサギ抗CD3一次抗体で染色した。スライドを洗浄した後、抗ウサギHRP二次抗体と4’,6−ジアミジノ−2−フェニルインドール(DAPI)の混合液でインキュベートした。スライドを洗浄した後、CD3染色は、TSA−AlexaFluor488(登録商標)(LifeTechnologies)を用いて検出した。イメージング及び解析は、実施例1と同様であったが、空間的近接(例えば、相互作用スコア)は、画素単位で測定したPD−L1陽性領域内のPD−1陽性細胞の面積を、画素単位で測定した全有核細胞の面積で割って、計数10,000を掛け合わせることにより計算した。29の試料についての相互作用スコアを図22に示す。
特定の実施形態について例示しかつ説明してきたが、当該技術分野における通常の知識により、以下の請求項で定義された広義の態様の技術から逸脱することなく、変更及び修正が可能であると解されるべきである。
本明細書において例示的に説明される実施形態は、本明細書に具体的に開示されていない要素や限定を除外して、好適に実施することができる。したがって、例えば「comprising(含む)」、「including(包含する)」、「containing(含有する)」などの用語は、広義に解釈されるべきであって、限定されるものではない。その上、本明細書で使用される用語及び表現は、説明用語として使用されたものであって、限定用語として使用されたものではなく、しかも図示及び説明された特徴と同等のもの又はその一部以外のこのような用語及び表現の使用を意図するものではないが、請求項に記載の技術範囲内では様々な変更が可能であると考えられる。また、「consisting essentially of(から本質的になる)」という言い回しには、具体的に列挙された要素と請求項に記載の技術の基本的な新規特徴に実質上影響を及ぼさない追加要素とが包含されることが分かるであろう。「consisting of(からなる)」という言い回しは、特定されていない要素を除外する。
本開示内容は、本出願に記載の特定の実施形態について限定されるものではない。当業者には明白なように、その趣旨及び範囲を逸脱することなく多くの修正及び変更を行うことができる。本明細書に列挙されたものに加えて、本開示内容の範疇に含まれる機能的に同等の方法及び組成物も、前述の説明から当業者には明白であろう。このような修正及び変更は、添付の請求項の範疇にあるものとする。本開示内容は、添付の請求項が権利を受ける均等物のあらゆる範囲とともに、添付の請求項に関してのみ限定されるものである。本開示内容は、特定の方法、試薬、化合物、組成物又は生体系に限定されず、当然変更できるものと解されるべきである。また、本明細書で使用する専門用語は、特定の実施形態のみを説明することを目的としており、これらに限定されるものではないと解されるべきである。
その上、本開示内容の特徴又は態様がマーカッシュグループについて説明している場合、当業者には、本開示内容がそれによってマーカッシュグループの各構成員又は構成員のサブグループについても説明していることが分かるであろう。
当業者には分かるように、ありとあらゆる目的のために、書面で説明するという観点からみれば、本明細書に開示された全範囲は、ありとあらゆる考えられる部分範囲及びその部分範囲の組み合わせをも網羅する。記載した範囲は、少なくとも二等分、三等分、四等分、五等分、十等分などまで分解された同様の範囲を十分に説明しかつ有効にするものと容易に認識することができる。非限定例として、本明細書に記載の範囲はそれぞれ、下側三分の一、中央三分の一そして上側三分の一などに容易に分けることも可能である。当業者にも分かるように、「up to(最大で)」、「at least(少なくとも)」、「greater than(を超える)」、「less than(未満)」などのような言葉はいずれも、記載した数を包含し、しかも上述のように部分範囲に実質上分けることが可能な範囲を意味する。最後に、範囲が個別のメンバーをそれぞれ包含することも当業者には自明であろう。
本明細書中で引用された刊行物、特許出願、発行された特許及び他の書類はいずれも、それぞれの刊行物、特許出願、発行された特許又は他の書類はその全体が参照として組み込まれるように明確にかつ独立して表示されているかのように、本明細書に参照として組み込まれる。参照として組み込まれた原文に含まれる定義は、本開示内容における定義と矛盾する限りにおいて除外される。
上記以外の実施形態は以下の請求項に明記する。