JP6772065B2 - 免疫賦活プラスミド - Google Patents
免疫賦活プラスミド Download PDFInfo
- Publication number
- JP6772065B2 JP6772065B2 JP2016554261A JP2016554261A JP6772065B2 JP 6772065 B2 JP6772065 B2 JP 6772065B2 JP 2016554261 A JP2016554261 A JP 2016554261A JP 2016554261 A JP2016554261 A JP 2016554261A JP 6772065 B2 JP6772065 B2 JP 6772065B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- nucleic acid
- sequence
- immune response
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000003308 immunostimulating effect Effects 0.000 title claims description 70
- 239000013612 plasmid Substances 0.000 title description 116
- 239000000203 mixture Substances 0.000 claims description 134
- 108090000623 proteins and genes Proteins 0.000 claims description 96
- 150000007523 nucleic acids Chemical class 0.000 claims description 92
- 108020004707 nucleic acids Proteins 0.000 claims description 56
- 102000039446 nucleic acids Human genes 0.000 claims description 56
- 230000028993 immune response Effects 0.000 claims description 52
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 48
- 238000000034 method Methods 0.000 claims description 48
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 44
- 239000002502 liposome Substances 0.000 claims description 41
- 208000015181 infectious disease Diseases 0.000 claims description 38
- 102000004169 proteins and genes Human genes 0.000 claims description 34
- 229960005486 vaccine Drugs 0.000 claims description 33
- 241000271566 Aves Species 0.000 claims description 30
- 150000002632 lipids Chemical class 0.000 claims description 27
- 239000003981 vehicle Substances 0.000 claims description 25
- 235000012000 cholesterol Nutrition 0.000 claims description 24
- 230000003115 biocidal effect Effects 0.000 claims description 20
- 230000002163 immunogen Effects 0.000 claims description 20
- 239000003242 anti bacterial agent Substances 0.000 claims description 19
- 244000052769 pathogen Species 0.000 claims description 19
- 239000000427 antigen Substances 0.000 claims description 18
- 108091007433 antigens Proteins 0.000 claims description 18
- 102000036639 antigens Human genes 0.000 claims description 18
- 230000002458 infectious effect Effects 0.000 claims description 16
- 230000001717 pathogenic effect Effects 0.000 claims description 13
- PSLWZOIUBRXAQW-UHFFFAOYSA-M dimethyl(dioctadecyl)azanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCCCCCCCCCCCCCCCC PSLWZOIUBRXAQW-UHFFFAOYSA-M 0.000 claims description 10
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 10
- 241000124008 Mammalia Species 0.000 claims description 8
- 239000003937 drug carrier Substances 0.000 claims description 8
- 230000004936 stimulating effect Effects 0.000 claims description 7
- LDGWQMRUWMSZIU-LQDDAWAPSA-M 2,3-bis[(z)-octadec-9-enoxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)C)OCCCCCCCC\C=C/CCCCCCCC LDGWQMRUWMSZIU-LQDDAWAPSA-M 0.000 claims description 5
- KSXTUUUQYQYKCR-LQDDAWAPSA-M 2,3-bis[[(z)-octadec-9-enoyl]oxy]propyl-trimethylazanium;chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCC(=O)OCC(C[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC KSXTUUUQYQYKCR-LQDDAWAPSA-M 0.000 claims description 5
- 108091029430 CpG site Proteins 0.000 claims description 5
- 239000007921 spray Substances 0.000 claims description 5
- 230000033289 adaptive immune response Effects 0.000 claims description 4
- 230000028996 humoral immune response Effects 0.000 claims description 4
- 230000015788 innate immune response Effects 0.000 claims description 4
- 230000021633 leukocyte mediated immunity Effects 0.000 claims description 4
- 244000144974 aquaculture Species 0.000 claims description 3
- GMOJQZRQEJVUSE-AWLASTDMSA-N 2-[3-(2-hydroxyethyl)-2-[(Z)-octadec-9-enyl]imidazolidin-1-ium-1-yl]ethyl (Z)-octadec-9-enoate chloride Chemical compound [Cl-].CCCCCCCC\C=C/CCCCCCCCC1N(CCO)CC[NH+]1CCOC(=O)CCCCCCC\C=C/CCCCCCCC GMOJQZRQEJVUSE-AWLASTDMSA-N 0.000 claims 4
- 239000000443 aerosol Substances 0.000 claims 2
- 238000009360 aquaculture Methods 0.000 claims 2
- 238000007918 intramuscular administration Methods 0.000 claims 2
- 238000007912 intraperitoneal administration Methods 0.000 claims 2
- 238000001990 intravenous administration Methods 0.000 claims 2
- 238000007920 subcutaneous administration Methods 0.000 claims 2
- 230000002519 immonomodulatory effect Effects 0.000 description 72
- 241000283690 Bos taurus Species 0.000 description 33
- 241000700605 Viruses Species 0.000 description 33
- 201000010099 disease Diseases 0.000 description 27
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 27
- 239000003550 marker Substances 0.000 description 22
- 239000000126 substance Substances 0.000 description 21
- 241000193403 Clostridium Species 0.000 description 20
- 208000035473 Communicable disease Diseases 0.000 description 17
- 210000004027 cell Anatomy 0.000 description 17
- 239000012634 fragment Substances 0.000 description 17
- 238000011068 loading method Methods 0.000 description 17
- 241000894006 Bacteria Species 0.000 description 16
- 108020004414 DNA Proteins 0.000 description 16
- 241000588724 Escherichia coli Species 0.000 description 14
- 241001124537 Bovinae Species 0.000 description 13
- 239000002773 nucleotide Substances 0.000 description 13
- 125000003729 nucleotide group Chemical group 0.000 description 13
- 230000036039 immunity Effects 0.000 description 12
- 238000002255 vaccination Methods 0.000 description 12
- 239000002955 immunomodulating agent Substances 0.000 description 11
- 229940121354 immunomodulator Drugs 0.000 description 11
- 230000001939 inductive effect Effects 0.000 description 11
- 230000001105 regulatory effect Effects 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- -1 synoxacin Chemical compound 0.000 description 10
- 241000233866 Fungi Species 0.000 description 9
- 230000002584 immunomodulator Effects 0.000 description 9
- 229930027917 kanamycin Natural products 0.000 description 9
- 229960000318 kanamycin Drugs 0.000 description 9
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 9
- 229930182823 kanamycin A Natural products 0.000 description 9
- 230000002103 transcriptional effect Effects 0.000 description 9
- 241000193155 Clostridium botulinum Species 0.000 description 8
- 241000193466 Clostridium septicum Species 0.000 description 8
- 125000002091 cationic group Chemical group 0.000 description 8
- 238000011282 treatment Methods 0.000 description 8
- 102000004127 Cytokines Human genes 0.000 description 7
- 108090000695 Cytokines Proteins 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 244000045947 parasite Species 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- 239000013598 vector Substances 0.000 description 7
- 241000607142 Salmonella Species 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000002265 prevention Effects 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 230000009466 transformation Effects 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 241000287828 Gallus gallus Species 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 239000004472 Lysine Substances 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 150000001413 amino acids Chemical group 0.000 description 5
- 229960000074 biopharmaceutical Drugs 0.000 description 5
- 101150102092 ccdB gene Proteins 0.000 description 5
- 235000013330 chicken meat Nutrition 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000018109 developmental process Effects 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 238000003752 polymerase chain reaction Methods 0.000 description 5
- 230000010076 replication Effects 0.000 description 5
- 238000005507 spraying Methods 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 241001529453 unidentified herpesvirus Species 0.000 description 5
- 230000003612 virological effect Effects 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 241000725585 Chicken anemia virus Species 0.000 description 4
- 241000193468 Clostridium perfringens Species 0.000 description 4
- 108091026890 Coding region Proteins 0.000 description 4
- 241000701047 Gallid alphaherpesvirus 2 Species 0.000 description 4
- 241000711450 Infectious bronchitis virus Species 0.000 description 4
- 241000132980 Turkey adenovirus 3 Species 0.000 description 4
- 239000011543 agarose gel Substances 0.000 description 4
- 229960003022 amoxicillin Drugs 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 235000013601 eggs Nutrition 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 101150066555 lacZ gene Proteins 0.000 description 4
- 230000000241 respiratory effect Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000003053 toxin Substances 0.000 description 4
- 231100000765 toxin Toxicity 0.000 description 4
- 108700012359 toxins Proteins 0.000 description 4
- 241000251468 Actinopterygii Species 0.000 description 3
- 241000711404 Avian avulavirus 1 Species 0.000 description 3
- 241000193738 Bacillus anthracis Species 0.000 description 3
- 241000192125 Firmicutes Species 0.000 description 3
- 241000702626 Infectious bursal disease virus Species 0.000 description 3
- 208000006758 Marek Disease Diseases 0.000 description 3
- 241001138504 Mycoplasma bovis Species 0.000 description 3
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 3
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 238000009395 breeding Methods 0.000 description 3
- 230000001488 breeding effect Effects 0.000 description 3
- 101150043283 ccdA gene Proteins 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 235000013365 dairy product Nutrition 0.000 description 3
- 210000003746 feather Anatomy 0.000 description 3
- 235000019688 fish Nutrition 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 244000144972 livestock Species 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 150000003952 β-lactams Chemical class 0.000 description 3
- 241000272517 Anseriformes Species 0.000 description 2
- 241000228212 Aspergillus Species 0.000 description 2
- SPFYMRJSYKOXGV-UHFFFAOYSA-N Baytril Chemical compound C1CN(CC)CCN1C(C(=C1)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1CC1 SPFYMRJSYKOXGV-UHFFFAOYSA-N 0.000 description 2
- 241000711443 Bovine coronavirus Species 0.000 description 2
- 241000710780 Bovine viral diarrhea virus 1 Species 0.000 description 2
- 241000589875 Campylobacter jejuni Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 229930186147 Cephalosporin Natural products 0.000 description 2
- 201000006082 Chickenpox Diseases 0.000 description 2
- 206010008631 Cholera Diseases 0.000 description 2
- 241000359266 Chorioptes Species 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 108010054814 DNA Gyrase Proteins 0.000 description 2
- QMLVECGLEOSESV-RYUDHWBXSA-N Danofloxacin Chemical compound C([C@@H]1C[C@H]2CN1C)N2C(C(=CC=1C(=O)C(C(O)=O)=C2)F)=CC=1N2C1CC1 QMLVECGLEOSESV-RYUDHWBXSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- 241001646716 Escherichia coli K-12 Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 206010017533 Fungal infection Diseases 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 102000013462 Interleukin-12 Human genes 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102000003812 Interleukin-15 Human genes 0.000 description 2
- 108090000172 Interleukin-15 Proteins 0.000 description 2
- 102000003810 Interleukin-18 Human genes 0.000 description 2
- 108090000171 Interleukin-18 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 241000986227 Muellerius Species 0.000 description 2
- 241000204022 Mycoplasma gallisepticum Species 0.000 description 2
- 208000031888 Mycoses Diseases 0.000 description 2
- 108091092724 Noncoding DNA Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 208000002606 Paramyxoviridae Infections Diseases 0.000 description 2
- 241000606860 Pasteurella Species 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- 241000286209 Phasianidae Species 0.000 description 2
- 206010051497 Rhinotracheitis Diseases 0.000 description 2
- 108010006785 Taq Polymerase Proteins 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- 206010044302 Tracheitis Diseases 0.000 description 2
- 241000142711 Ureaplasma diversum Species 0.000 description 2
- 206010046980 Varicella Diseases 0.000 description 2
- 206010051511 Viral diarrhoea Diseases 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000000729 antidote Substances 0.000 description 2
- 235000015278 beef Nutrition 0.000 description 2
- 108091005948 blue fluorescent proteins Proteins 0.000 description 2
- 229940124587 cephalosporin Drugs 0.000 description 2
- 150000001780 cephalosporins Chemical class 0.000 description 2
- 229960003405 ciprofloxacin Drugs 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 108010082025 cyan fluorescent protein Proteins 0.000 description 2
- 229960004385 danofloxacin Drugs 0.000 description 2
- 210000002257 embryonic structure Anatomy 0.000 description 2
- 201000002491 encephalomyelitis Diseases 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229960000740 enrofloxacin Drugs 0.000 description 2
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 2
- 229960005542 ethidium bromide Drugs 0.000 description 2
- 229940124307 fluoroquinolone Drugs 0.000 description 2
- 230000002538 fungal effect Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 229940117681 interleukin-12 Drugs 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 210000001161 mammalian embryo Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 235000013372 meat Nutrition 0.000 description 2
- 230000002036 metaphylactic effect Effects 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 229960003702 moxifloxacin Drugs 0.000 description 2
- FABPRXSRWADJSP-MEDUHNTESA-N moxifloxacin Chemical compound COC1=C(N2C[C@H]3NCCC[C@H]3C2)C(F)=CC(C(C(C(O)=O)=C2)=O)=C1N2C1CC1 FABPRXSRWADJSP-MEDUHNTESA-N 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 230000003071 parasitic effect Effects 0.000 description 2
- 244000144977 poultry Species 0.000 description 2
- 235000013594 poultry meat Nutrition 0.000 description 2
- 229960001248 pradofloxacin Drugs 0.000 description 2
- LZLXHGFNOWILIY-APPDUMDISA-N pradofloxacin Chemical compound C12=C(C#N)C(N3C[C@H]4NCCC[C@H]4C3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 LZLXHGFNOWILIY-APPDUMDISA-N 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 208000009305 pseudorabies Diseases 0.000 description 2
- 150000007660 quinolones Chemical class 0.000 description 2
- 108010054624 red fluorescent protein Proteins 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229920002477 rna polymer Polymers 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 241000712461 unidentified influenza virus Species 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 2
- FMZXNVLFJHCSAF-DNVCBOLYSA-N (6R,7R)-3-[(4-carbamoyl-1-pyridin-1-iumyl)methyl]-8-oxo-7-[(1-oxo-2-thiophen-2-ylethyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1=CC(C(=O)N)=CC=[N+]1CC1=C(C([O-])=O)N2C(=O)[C@@H](NC(=O)CC=3SC=CC=3)[C@H]2SC1 FMZXNVLFJHCSAF-DNVCBOLYSA-N 0.000 description 1
- YWKJNRNSJKEFMK-PQFQYKRASA-N (6r,7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-methoxyiminoacetyl]amino]-8-oxo-3-(5,6,7,8-tetrahydroquinolin-1-ium-1-ylmethyl)-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound N([C@@H]1C(N2C(=C(C[N+]=3C=4CCCCC=4C=CC=3)CS[C@@H]21)C([O-])=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 YWKJNRNSJKEFMK-PQFQYKRASA-N 0.000 description 1
- QKDHBVNJCZBTMR-LLVKDONJSA-N (R)-temafloxacin Chemical compound C1CN[C@H](C)CN1C(C(=C1)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1=CC=C(F)C=C1F QKDHBVNJCZBTMR-LLVKDONJSA-N 0.000 description 1
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 1
- CVLPPWGDNNZTRW-UHFFFAOYSA-N 2-naphthalen-1-ylindene-1,3-dione Chemical compound C1=CC=C2C(C3C(C4=CC=CC=C4C3=O)=O)=CC=CC2=C1 CVLPPWGDNNZTRW-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 1
- UBGCCYGMLOBJOJ-UHFFFAOYSA-N 7-(1,4-diazabicyclo[3.2.2]nonan-4-yl)-1-ethyl-6-fluoro-4-oxoquinoline-3-carboxylic acid Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCN2CCC1CC2 UBGCCYGMLOBJOJ-UHFFFAOYSA-N 0.000 description 1
- WUWFMDMBOJLQIV-UHFFFAOYSA-N 7-(3-aminopyrrolidin-1-yl)-1-(2,4-difluorophenyl)-6-fluoro-4-oxo-1,4-dihydro-1,8-naphthyridine-3-carboxylic acid Chemical compound C1C(N)CCN1C(C(=C1)F)=NC2=C1C(=O)C(C(O)=O)=CN2C1=CC=C(F)C=C1F WUWFMDMBOJLQIV-UHFFFAOYSA-N 0.000 description 1
- GSDSWSVVBLHKDQ-UHFFFAOYSA-N 9-fluoro-3-methyl-10-(4-methylpiperazin-1-yl)-7-oxo-2,3-dihydro-7H-[1,4]oxazino[2,3,4-ij]quinoline-6-carboxylic acid Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)COC3=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-UHFFFAOYSA-N 0.000 description 1
- 241001156739 Actinobacteria <phylum> Species 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 241001492267 Alcelaphine gammaherpesvirus 1 Species 0.000 description 1
- 241000606646 Anaplasma Species 0.000 description 1
- 241000606665 Anaplasma marginale Species 0.000 description 1
- 241000204725 Ascaridia galli Species 0.000 description 1
- 241000228197 Aspergillus flavus Species 0.000 description 1
- 241001225321 Aspergillus fumigatus Species 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 241000606767 Avibacterium paragallinarum Species 0.000 description 1
- 241000223836 Babesia Species 0.000 description 1
- 108020000946 Bacterial DNA Proteins 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 241000283726 Bison Species 0.000 description 1
- 241000120506 Bluetongue virus Species 0.000 description 1
- 108030001720 Bontoxilysin Proteins 0.000 description 1
- 241001416153 Bos grunniens Species 0.000 description 1
- 241000282817 Bovidae Species 0.000 description 1
- 241001503592 Bovine calicivirus Species 0.000 description 1
- 241000714266 Bovine leukemia virus Species 0.000 description 1
- 241000701922 Bovine parvovirus Species 0.000 description 1
- 241000589567 Brucella abortus Species 0.000 description 1
- 241000589874 Campylobacter fetus Species 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 241000253350 Capillaria Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 241000283153 Cetacea Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- ZDPIZLCVJAAHHR-UHFFFAOYSA-N Clopidol Chemical compound CC1=NC(C)=C(Cl)C(O)=C1Cl ZDPIZLCVJAAHHR-UHFFFAOYSA-N 0.000 description 1
- 241000186581 Clostridium novyi Species 0.000 description 1
- 241000224483 Coccidia Species 0.000 description 1
- 241000272201 Columbiformes Species 0.000 description 1
- 241000238424 Crustacea Species 0.000 description 1
- 208000008953 Cryptosporidiosis Diseases 0.000 description 1
- 206010011502 Cryptosporidiosis infection Diseases 0.000 description 1
- 238000011238 DNA vaccination Methods 0.000 description 1
- 241000187831 Dermatophilus Species 0.000 description 1
- 208000010772 Dog disease Diseases 0.000 description 1
- 241001452550 Eimeria meleagridis Species 0.000 description 1
- 241000709661 Enterovirus Species 0.000 description 1
- 241000709691 Enterovirus E Species 0.000 description 1
- 241000186810 Erysipelothrix rhusiopathiae Species 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- 241000882760 Fascioloides Species 0.000 description 1
- UIOFUWFRIANQPC-JKIFEVAISA-N Floxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=C(F)C=CC=C1Cl UIOFUWFRIANQPC-JKIFEVAISA-N 0.000 description 1
- 241000223218 Fusarium Species 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 241000243976 Haemonchus Species 0.000 description 1
- 241000920462 Heterakis Species 0.000 description 1
- 241000948219 Histomonas Species 0.000 description 1
- 241001581234 Histophilus Species 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- XAGMUUZPGZWTRP-ZETCQYMHSA-N LSM-5745 Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1C1(N)CC1 XAGMUUZPGZWTRP-ZETCQYMHSA-N 0.000 description 1
- BPFYOAJNDMUVBL-UHFFFAOYSA-N LSM-5799 Chemical compound C1CN(C)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN3N(C)COC1=C32 BPFYOAJNDMUVBL-UHFFFAOYSA-N 0.000 description 1
- 241000283960 Leporidae Species 0.000 description 1
- 241000283986 Lepus Species 0.000 description 1
- GSDSWSVVBLHKDQ-JTQLQIEISA-N Levofloxacin Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-JTQLQIEISA-N 0.000 description 1
- OJMMVQQUTAEWLP-UHFFFAOYSA-N Lincomycin Natural products CN1CC(CCC)CC1C(=O)NC(C(C)O)C1C(O)C(O)C(O)C(SC)O1 OJMMVQQUTAEWLP-UHFFFAOYSA-N 0.000 description 1
- 208000004852 Lung Injury Diseases 0.000 description 1
- 241001502481 Meleagrid alphaherpesvirus 1 Species 0.000 description 1
- 241000771995 Melophagus Species 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- 241000237852 Mollusca Species 0.000 description 1
- 229930191564 Monensin Natural products 0.000 description 1
- GAOZTHIDHYLHMS-UHFFFAOYSA-N Monensin A Natural products O1C(CC)(C2C(CC(O2)C2C(CC(C)C(O)(CO)O2)C)C)CCC1C(O1)(C)CCC21CC(O)C(C)C(C(C)C(OC)C(C)C(O)=O)O2 GAOZTHIDHYLHMS-UHFFFAOYSA-N 0.000 description 1
- 241000588621 Moraxella Species 0.000 description 1
- 241000714177 Murine leukemia virus Species 0.000 description 1
- 241000186359 Mycobacterium Species 0.000 description 1
- 241000187482 Mycobacterium avium subsp. paratuberculosis Species 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 241001148550 Mycoplasma bovirhinis Species 0.000 description 1
- 241000006377 Mycoplasma dispar Species 0.000 description 1
- 241001148555 Mycoplasma meleagridis Species 0.000 description 1
- 241000202942 Mycoplasma synoviae Species 0.000 description 1
- 231100000678 Mycotoxin Toxicity 0.000 description 1
- 101100301239 Myxococcus xanthus recA1 gene Proteins 0.000 description 1
- 241001137882 Nematodirus Species 0.000 description 1
- 208000010359 Newcastle Disease Diseases 0.000 description 1
- QIPQASLPWJVQMH-DTORHVGOSA-N Orbifloxacin Chemical compound C1[C@@H](C)N[C@@H](C)CN1C1=C(F)C(F)=C2C(=O)C(C(O)=O)=CN(C3CC3)C2=C1F QIPQASLPWJVQMH-DTORHVGOSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 241000606856 Pasteurella multocida Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930195708 Penicillin V Natural products 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000700667 Pigeonpox virus Species 0.000 description 1
- 206010035664 Pneumonia Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 241001649229 Psoroptes Species 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 206010039101 Rhinorrhoea Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 239000004189 Salinomycin Substances 0.000 description 1
- KQXDHUJYNAXLNZ-XQSDOZFQSA-N Salinomycin Chemical compound O1[C@@H]([C@@H](CC)C(O)=O)CC[C@H](C)[C@@H]1[C@@H](C)[C@H](O)[C@H](C)C(=O)[C@H](CC)[C@@H]1[C@@H](C)C[C@@H](C)[C@@]2(C=C[C@@H](O)[C@@]3(O[C@@](C)(CC3)[C@@H]3O[C@@H](C)[C@@](O)(CC)CC3)O2)O1 KQXDHUJYNAXLNZ-XQSDOZFQSA-N 0.000 description 1
- 241000607132 Salmonella enterica subsp. enterica serovar Gallinarum Species 0.000 description 1
- 241000509416 Sarcoptes Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- 241000271567 Struthioniformes Species 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241001220313 Syngamus trachea Species 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- ZDKBAJRWBFZIBK-UHFFFAOYSA-N Tabtoxinin-beta-lactam Natural products NC1C(O)CCC(NC1=O)C(O)=O ZDKBAJRWBFZIBK-UHFFFAOYSA-N 0.000 description 1
- 241000223996 Toxoplasma Species 0.000 description 1
- 206010069363 Traumatic lung injury Diseases 0.000 description 1
- 241000589886 Treponema Species 0.000 description 1
- 241000224526 Trichomonas Species 0.000 description 1
- 241000223238 Trichophyton Species 0.000 description 1
- 241000243797 Trichostrongylus Species 0.000 description 1
- 241001489151 Trichuris Species 0.000 description 1
- 241000186064 Trueperella pyogenes Species 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- MMEWHMXMAFGQDR-UHFFFAOYSA-N [Cl-].OCC[NH+]1CCNC1 Chemical compound [Cl-].OCC[NH+]1CCNC1 MMEWHMXMAFGQDR-UHFFFAOYSA-N 0.000 description 1
- 241001509494 [Clostridium] colinum Species 0.000 description 1
- LPQOADBMXVRBNX-UHFFFAOYSA-N ac1ldcw0 Chemical compound Cl.C1CN(C)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN3CCSC1=C32 LPQOADBMXVRBNX-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000000240 adjuvant effect Effects 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 241000701792 avian adenovirus Species 0.000 description 1
- 201000008680 babesiosis Diseases 0.000 description 1
- 229940065181 bacillus anthracis Drugs 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- 239000003781 beta lactamase inhibitor Substances 0.000 description 1
- 229940126813 beta-lactamase inhibitor Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229950011614 binfloxacin Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 229940053031 botulinum toxin Drugs 0.000 description 1
- 229940056450 brucella abortus Drugs 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- PPBOKXIGFIBOGK-BDTUAEFFSA-N bvdv Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)C(C)C)[C@@H](C)CC)C1=CN=CN1 PPBOKXIGFIBOGK-BDTUAEFFSA-N 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 1
- 229960003669 carbenicillin Drugs 0.000 description 1
- QYIYFLOTGYLRGG-GPCCPHFNSA-N cefaclor Chemical compound C1([C@H](C(=O)N[C@@H]2C(N3C(=C(Cl)CS[C@@H]32)C(O)=O)=O)N)=CC=CC=C1 QYIYFLOTGYLRGG-GPCCPHFNSA-N 0.000 description 1
- 229960005361 cefaclor Drugs 0.000 description 1
- XIURVHNZVLADCM-IUODEOHRSA-N cefalotin Chemical compound N([C@H]1[C@@H]2N(C1=O)C(=C(CS2)COC(=O)C)C(O)=O)C(=O)CC1=CC=CS1 XIURVHNZVLADCM-IUODEOHRSA-N 0.000 description 1
- 229960000603 cefalotin Drugs 0.000 description 1
- OLVCFLKTBJRLHI-AXAPSJFSSA-N cefamandole Chemical compound CN1N=NN=C1SCC1=C(C(O)=O)N2C(=O)[C@@H](NC(=O)[C@H](O)C=3C=CC=CC=3)[C@H]2SC1 OLVCFLKTBJRLHI-AXAPSJFSSA-N 0.000 description 1
- 229960003012 cefamandole Drugs 0.000 description 1
- 229960001139 cefazolin Drugs 0.000 description 1
- MLYYVTUWGNIJIB-BXKDBHETSA-N cefazolin Chemical compound S1C(C)=NN=C1SCC1=C(C(O)=O)N2C(=O)[C@@H](NC(=O)CN3N=NN=C3)[C@H]2SC1 MLYYVTUWGNIJIB-BXKDBHETSA-N 0.000 description 1
- WYUSVOMTXWRGEK-HBWVYFAYSA-N cefpodoxime Chemical compound N([C@H]1[C@@H]2N(C1=O)C(=C(CS2)COC)C(O)=O)C(=O)C(=N/OC)\C1=CSC(N)=N1 WYUSVOMTXWRGEK-HBWVYFAYSA-N 0.000 description 1
- 229960005090 cefpodoxime Drugs 0.000 description 1
- 229950009592 cefquinome Drugs 0.000 description 1
- VAAUVRVFOQPIGI-SPQHTLEESA-N ceftriaxone Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC1=NC(=O)C(=O)NN1C VAAUVRVFOQPIGI-SPQHTLEESA-N 0.000 description 1
- 229960004755 ceftriaxone Drugs 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 229940106164 cephalexin Drugs 0.000 description 1
- ZAIPMKNFIOOWCQ-UEKVPHQBSA-N cephalexin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=CC=C1 ZAIPMKNFIOOWCQ-UEKVPHQBSA-N 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 150000001840 cholesterol esters Chemical class 0.000 description 1
- 229950001320 clinafloxacin Drugs 0.000 description 1
- QGPKADBNRMWEQR-UHFFFAOYSA-N clinafloxacin Chemical compound C1C(N)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN(C3CC3)C2=C1Cl QGPKADBNRMWEQR-UHFFFAOYSA-N 0.000 description 1
- 229960002227 clindamycin Drugs 0.000 description 1
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 1
- 229960000731 clopidol Drugs 0.000 description 1
- 229960003326 cloxacillin Drugs 0.000 description 1
- LQOLIRLGBULYKD-JKIFEVAISA-N cloxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=CC=CC=C1Cl LQOLIRLGBULYKD-JKIFEVAISA-N 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- YFAGHNZHGGCZAX-JKIFEVAISA-N dicloxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=C(Cl)C=CC=C1Cl YFAGHNZHGGCZAX-JKIFEVAISA-N 0.000 description 1
- 229960001585 dicloxacillin Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 229950001733 difloxacin Drugs 0.000 description 1
- NOCJXYPHIIZEHN-UHFFFAOYSA-N difloxacin Chemical compound C1CN(C)CCN1C(C(=C1)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1=CC=C(F)C=C1 NOCJXYPHIIZEHN-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229960000946 dimetridazole Drugs 0.000 description 1
- IBXPYPUJPLLOIN-UHFFFAOYSA-N dimetridazole Chemical compound CC1=NC=C(N(=O)=O)N1C IBXPYPUJPLLOIN-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 230000012173 estrus Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 229960004273 floxacillin Drugs 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 239000013505 freshwater Substances 0.000 description 1
- 229960001625 furazolidone Drugs 0.000 description 1
- PLHJDBGFXBMTGZ-WEVVVXLNSA-N furazolidone Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)OCC1 PLHJDBGFXBMTGZ-WEVVVXLNSA-N 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 229960003170 gemifloxacin Drugs 0.000 description 1
- ZRCVYEYHRGVLOC-HYARGMPZSA-N gemifloxacin Chemical compound C1C(CN)C(=N/OC)/CN1C(C(=C1)F)=NC2=C1C(=O)C(C(O)=O)=CN2C1CC1 ZRCVYEYHRGVLOC-HYARGMPZSA-N 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000009215 host defense mechanism Effects 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 201000006747 infectious mononucleosis Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229960003376 levofloxacin Drugs 0.000 description 1
- 229960005287 lincomycin Drugs 0.000 description 1
- OJMMVQQUTAEWLP-KIDUDLJLSA-N lincomycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@@H](C)O)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 OJMMVQQUTAEWLP-KIDUDLJLSA-N 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 231100000515 lung injury Toxicity 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 229960002531 marbofloxacin Drugs 0.000 description 1
- 208000004396 mastitis Diseases 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 229960005358 monensin Drugs 0.000 description 1
- GAOZTHIDHYLHMS-KEOBGNEYSA-N monensin A Chemical compound C([C@@](O1)(C)[C@H]2CC[C@@](O2)(CC)[C@H]2[C@H](C[C@@H](O2)[C@@H]2[C@H](C[C@@H](C)[C@](O)(CO)O2)C)C)C[C@@]21C[C@H](O)[C@@H](C)[C@@H]([C@@H](C)[C@@H](OC)[C@H](C)C(O)=O)O2 GAOZTHIDHYLHMS-KEOBGNEYSA-N 0.000 description 1
- 239000002636 mycotoxin Substances 0.000 description 1
- 229960000210 nalidixic acid Drugs 0.000 description 1
- MHWLWQUZZRMNGJ-UHFFFAOYSA-N nalidixic acid Chemical compound C1=C(C)N=C2N(CC)C=C(C(O)=O)C(=O)C2=C1 MHWLWQUZZRMNGJ-UHFFFAOYSA-N 0.000 description 1
- 208000010753 nasal discharge Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- CTNZOGJNVIFEBA-UPSUJEDGSA-N nocardicin A Chemical compound C1=CC(OCC[C@@H](N)C(O)=O)=CC=C1C(=N\O)\C(=O)N[C@@H]1C(=O)N([C@@H](C(O)=O)C=2C=CC(O)=CC=2)C1 CTNZOGJNVIFEBA-UPSUJEDGSA-N 0.000 description 1
- CTNZOGJNVIFEBA-SCTDSRPQSA-N nocardicin A Natural products N[C@@H](CCOc1ccc(cc1)C(=NO)C(=O)N[C@@H]2CN([C@H](C(=O)O)c3ccc(O)cc3)C2=O)C(=O)O CTNZOGJNVIFEBA-SCTDSRPQSA-N 0.000 description 1
- 108091027963 non-coding RNA Proteins 0.000 description 1
- 229960001180 norfloxacin Drugs 0.000 description 1
- OGJPXUAPXNRGGI-UHFFFAOYSA-N norfloxacin Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCNCC1 OGJPXUAPXNRGGI-UHFFFAOYSA-N 0.000 description 1
- 229960001699 ofloxacin Drugs 0.000 description 1
- 229940126578 oral vaccine Drugs 0.000 description 1
- 229960004780 orbifloxacin Drugs 0.000 description 1
- UWYHMGVUTGAWSP-JKIFEVAISA-N oxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=CC=CC=C1 UWYHMGVUTGAWSP-JKIFEVAISA-N 0.000 description 1
- 229960001019 oxacillin Drugs 0.000 description 1
- 229940051027 pasteurella multocida Drugs 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 229960002625 pazufloxacin Drugs 0.000 description 1
- FHFYDNQZQSQIAI-UHFFFAOYSA-N pefloxacin Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCN(C)CC1 FHFYDNQZQSQIAI-UHFFFAOYSA-N 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 235000019371 penicillin G benzathine Nutrition 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- 229940056367 penicillin v Drugs 0.000 description 1
- 150000002960 penicillins Chemical class 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- BPLBGHOLXOTWMN-MBNYWOFBSA-N phenoxymethylpenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)COC1=CC=CC=C1 BPLBGHOLXOTWMN-MBNYWOFBSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- IVBHGBMCVLDMKU-GXNBUGAJSA-N piperacillin Chemical compound O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC=CC=1)C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 IVBHGBMCVLDMKU-GXNBUGAJSA-N 0.000 description 1
- 229960002292 piperacillin Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 239000005015 poly(hydroxybutyrate) Substances 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 239000004632 polycaprolactone Substances 0.000 description 1
- 229920006149 polyester-amide block copolymer Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 208000037920 primary disease Diseases 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical compound OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 229960001548 salinomycin Drugs 0.000 description 1
- 235000019378 salinomycin Nutrition 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000013535 sea water Substances 0.000 description 1
- 208000037921 secondary disease Diseases 0.000 description 1
- 229920000260 silastic Polymers 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 208000003265 stomatitis Diseases 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- LPQZKKCYTLCDGQ-WEDXCCLWSA-N tazobactam Chemical compound C([C@]1(C)S([C@H]2N(C(C2)=O)[C@H]1C(O)=O)(=O)=O)N1C=CN=N1 LPQZKKCYTLCDGQ-WEDXCCLWSA-N 0.000 description 1
- 229960003865 tazobactam Drugs 0.000 description 1
- 229960004576 temafloxacin Drugs 0.000 description 1
- BVCKFLJARNKCSS-DWPRYXJFSA-N temocillin Chemical compound N([C@]1(OC)C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C(C(O)=O)C=1C=CSC=1 BVCKFLJARNKCSS-DWPRYXJFSA-N 0.000 description 1
- 229960001114 temocillin Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- UURAUHCOJAIIRQ-QGLSALSOSA-N tiamulin Chemical compound CCN(CC)CCSCC(=O)O[C@@H]1C[C@@](C)(C=C)[C@@H](O)[C@H](C)[C@@]23CC[C@@H](C)[C@]1(C)[C@@H]2C(=O)CC3 UURAUHCOJAIIRQ-QGLSALSOSA-N 0.000 description 1
- 229960004885 tiamulin Drugs 0.000 description 1
- OHKOGUYZJXTSFX-KZFFXBSXSA-N ticarcillin Chemical compound C=1([C@@H](C(O)=O)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)C=CSC=1 OHKOGUYZJXTSFX-KZFFXBSXSA-N 0.000 description 1
- 229960004659 ticarcillin Drugs 0.000 description 1
- 229950008187 tosufloxacin Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 229940038773 trisodium citrate Drugs 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- LLYYNOVSVPBRGV-MVNKZKPCSA-N valnemulin Chemical compound CC(C)[C@@H](N)C(=O)NCC(C)(C)SCC(=O)O[C@@H]1C[C@@](C)(C=C)[C@@H](O)[C@H](C)[C@@]23CC[C@@H](C)[C@]1(C)[C@@H]2C(=O)CC3 LLYYNOVSVPBRGV-MVNKZKPCSA-N 0.000 description 1
- 229950008166 valnemulin Drugs 0.000 description 1
- JATLJHBAMQKRDH-UHFFFAOYSA-N vebufloxacin Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)CCC3=C1N1CCN(C)CC1 JATLJHBAMQKRDH-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/025—Enterobacteriales, e.g. Enterobacter
- A61K39/0258—Escherichia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/245—Herpetoviridae, e.g. herpes simplex virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/543—Lipids, e.g. triglycerides; Polyamines, e.g. spermine or spermidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
- A61K9/1272—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers with substantial amounts of non-phosphatidyl, i.e. non-acylglycerophosphate, surfactants as bilayer-forming substances, e.g. cationic lipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/117—Nucleic acids having immunomodulatory properties, e.g. containing CpG-motifs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
- A61K2039/552—Veterinary vaccine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/575—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 humoral response
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16711—Varicellovirus, e.g. human herpesvirus 3, Varicella Zoster, pseudorabies
- C12N2710/16734—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/16011—Herpesviridae
- C12N2710/16711—Varicellovirus, e.g. human herpesvirus 3, Varicella Zoster, pseudorabies
- C12N2710/16771—Demonstrated in vivo effect
Description
本明細書中に記載のものなど、本発明において有用な組成物は、一般に、感染性疾患に対する、予防的治療、メタフィラキシス的な(metaphylactic)治療または処置的治療として使用することができる。このような組成物は、本明細書中で免疫調節物質組成物と呼ぶ。本免疫調節物質組成物は、少なくとも、受容対象において免疫反応を誘発可能な免疫賦活プラスミドまたは免疫賦活DNA配列を含む。いくつかの態様において、本免疫調節物質組成物は、リポソーム送達ビヒクルも含み得る。
いくつかの態様において、本発明は、感染性疾患を引き起こす病原体の処置または予防に有用な核酸分子に関する。本明細書中に記載の核酸分子は、直鎖状2本鎖または1本鎖DNA、アミノ酸配列、リボ核酸(RNA)またはそれらの組み合わせとして、免疫賦活プラスミドに含まれ得る。いくつかの態様において、本発明は、本免疫賦活プラスミドまたは免疫賦活DNA配列を含有する、核酸分子、ベクターおよび宿主細胞(インビトロ、インビボまたはエクスビボ)に関する。
本明細書中に記載の免疫賦活プラスミドとの使用に対する適切な免疫調節物質組成物は、米国特許出願公開第2012/0064151号明細書(鳥類)および同第2013/0295167号明細書(ウシ亜科)に記載されており、この両方の内容はそれらの全体において参照により本明細書によって組み込まれる。
本明細書中に記載の免疫調節物質組成物の何れも、リポソーム送達ビヒクルおよび本明細書中に記載のプラスミドの少なくとも1つに加えて、少なくとも1つの生物学的製剤をさらに含み得る。
本発明の目的は、非感染対象に対する防御免疫、感染対象に対する防御免疫、非感染対象に対する免疫向上、感染対象に対する免疫向上、感染対象に対する治療的免疫またはそれらの組み合わせを誘発する、免疫調節物質組成物、免疫賦活プラスミド(またはDNA配列)および方法を提供することである。このように、本発明の組成物は、対象において予防的に免疫付与するために使用され得るか、または対象を処置するために使用され得る。本明細書中に記載の方法には、本明細書中に記載の免疫賦活プラスミドまたはDNA配列を対象に投与することが含まれる。
本発明は、受容対象において免疫反応を誘発する方法に関する。本方法は、免疫反応を誘発するために有効量の免疫調節物質組成物を対象に投与することを含む。いくつかの態様において、免疫調節物質組成物は、単独で有効である非抗原特異的な免疫反応を誘発する。いくつかの態様において、本免疫調節物質組成物は、ワクチンなどの少なくとも1つの生物学的製剤の作用を、このようなワクチンの前に投与された場合に、ワクチンと同時投与された場合に、ワクチン接種後に投与された場合に、またはワクチンと混合して投与された場合に、促進する。いくつかの態様において、本方法は、感染性疾患から受容対象を防御し、感染性疾患を有する集団を処置するための新しい処置ストラテジーを提供する。いくつかの態様において、本方法は、ワクチンと組み合わせて本免疫調節物質を使用する場合に、本免疫調節物質組成物なしでワクチンを使用する場合と比較して、疾患に対する、より迅速で、より長く、より良好な防御を提供する。
本発明の方法は、対象が、免疫反応の誘発に適している疾患から防御されるように、対象において免疫反応を誘発する。本明細書中で使用される場合、「疾患から防御される」という句は、疾患の症状を軽減すること;疾患の発症率を低下させること;疾患の臨床または病理的な重症度を低下させること;または疾患を引き起こす病原体の脱粒(shedding)を減少させることを指す。対象を防御することは、本発明の治療用組成物が、対象に投与された場合に、疾患の発症を予防する、疾患症状、臨床徴候、病態または原因を治癒させる、および/または改善するかまたは軽減する能力を指し得る。例えば、非限定で、ウシ呼吸器疾患(BRD)の臨床徴候としては、肺損傷、体温上昇、抑うつ(例えば食欲不振、外的刺激に対する反応性低下、垂れ耳)、鼻汁および呼吸特性(例えば呼吸数、呼吸努力)が挙げられる。本明細書中に記載の免疫調節物質組成物は、BRDの上記臨床徴候を予防するかまたはその重症度を低下させるために、BRDに曝露されている疑いがあるウシに投与し得る。さらなる例として、非限定で、鳥類対象におけるマレック病の臨床徴候としては、孵化率および鳥類生存率の低下が挙げられる。本明細書中に記載の免疫調節物質組成物は、マレック病の上記の臨床徴候を予防するかまたはその重症度を低下させるためにマレック病ウイルスに曝露されている疑いがある鳥類対象に投与し得る。
様々な投与経路を利用可能である。選択される特定の方式は、当然ではあるが、選択される特定の生物学的製剤、対象の年齢および総体的健康状態、処置されている特定の状態および治療的有効性のために必要とされる投与量に依存する。本発明の方法は、臨床的に許容できない悪影響を引き起こすことなく免疫反応の有効レベルを生じさせる何れかの投与方式を用いて実施され得る。本組成物は都合よく、単位剤形で与えられ得、当技術分野で周知の方法の何れかにより調製され得る。
「有効量」という用語は、所望の生物学的効果を実現するのに必要であるかまたは十分である量を指す。例えば、感染性疾患を処置または予防するための免疫調節物質の有効量は、病原菌に曝露された際に免疫反応の発現を引き起こす、したがって対象内の病原菌の量の減少および好ましくは病原菌の根絶を引き起こすのに必要な量である。何らかの特定の適用のための有効量は、処置されている疾患もしくは状態、対象の体格または疾患もしくは状態の重症度といった要因に依存して変動し得る。当業者は、過度の実験を必要とすることなく、免疫調節物質の有効量を経験的に決定することができる。
次の非限定例は、本発明をさらに例示するために提供される。
pGCMB75.6のマップは図2で示す。pGCMB75.6において、pMB75.6のカナマイシン耐性遺伝子(図1参照)は、E.コリ(E.coli)K−12から非コード配列により置き換えられている。pGCMB75.6プラスミドを作製するために、カナマイシン耐性遺伝子の5’部位でpMB75.6にAscIシングルカッター(single cutter)制限部位を導入して、pMB75.6_AscI(配列番号3)を作製した。AscI制限部位を導入するために、pGCMB75.6の配列に存在するアデニンをグアニンに突然変異させ、それによってpGCMB75.6プラスミド中の配列AGCGCGCCをGGCGCGCCに変化させた。増幅中のライゲーションによる突然変異誘発に基づくアプローチを用いて、この修飾を完遂した。その中間でAscI制限部位を保有した単一プライマーを使用した。
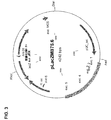
pLacZMB75.6プラスミド(図3;配列番号4)を作製するために、1307nt XhoI(CTCGAG)/DraI(TTTAAA)断片をLife Technologies GmbH(Darmstadt,Germany)により合成させた。この1307nt断片は、lacZ遺伝子(265nt)の一部を含有した。したがって、pGCMB75.6にライゲーションした場合、この断片は、XhoI制限部位の上流に位置する短縮型LacZ遺伝子を伸長させ、LacZ遺伝子を発現できるようにする(図2および図3を比較)。さらに、新たに導入されたLacZ遺伝子領域との配列相同性を削除し、組み換えを回避するために、91ntの多重クローニング部位をE.コリ(E.coli)非コード配列で置き換えた。さらに、プラスミドpGCMB75.6と同じサイズのプラスミドを作製するために、CMVプロモーターの5’領域を欠失させた(265nt)。
本免疫調節物質は、陽イオン性脂質および本明細書中に記載の非コードDNA配列を含む組成物である。直径およそ200nmのリポソームを作製するために、合成免疫調節物質脂質成分[1−[2−[9−(Z)−オクタデセノイルオキシ]]−2−[8](Z)−ヘプタデセニル]−3−[ヒドロキシエチル]イミダゾリニウムクロリド(DOTIM)および合成中性脂質コレステロールを処方する(米国特許第6,693,086号明細書参照)。DNA成分は、pGCMB75.6またはpLacZMB75.6である。負に荷電しているので、プラスミドDNAは正に荷電した(陽イオン)リポソームと会合する(米国特許第6,693,086号明細書参照)。
Claims (42)
- 核酸分子を含む免疫賦活化のための組成物であって、該核酸分子が配列番号1の配列と少なくとも89%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含み、該核酸分子は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、前記組成物。
- 前記核酸分子が、91%、92%、93%、94%、95%、96%、97%、98%および99%からなる群から選択される、配列番号1の配列との配列相同性を有する核酸配列を含む、請求項1に記載の組成物。
- 前記核酸分子が配列番号1を含む、請求項1に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項1に記載の組成物。
- 配列番号4の配列と少なくとも84%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含む核酸分子を含み、該核酸分子は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、免疫賦活化のための組成物。
- 前記核酸分子が、配列番号4の配列と少なくとも85%の配列相同性を含む、請求項5に記載の組成物。
- 前記核酸分子が、配列番号4の配列と少なくとも86%の配列相同性を含む、請求項5に記載の組成物。
- 前記核酸分子が、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%および99%からなる群から選択される、配列番号4の配列との配列相同性を有する核酸配列を含む、請求項5に記載の組成物。
- 前記核酸分子が配列番号4を含む、請求項5に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項5に記載の組成物。
- a.配列番号1の配列と少なくとも89%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含む核酸分子と;
b.リポソーム送達ビヒクルと、
を含み、前記核酸分子は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、免疫賦活化のための組成物。 - 前記核酸分子が、91%、92%、93%、94%、95%、96%、97%、98%および99%からなる群から選択される、配列番号1の配列との配列相同性を有する核酸配列を含む、請求項11に記載の組成物。
- 前記核酸分子が配列番号1を含む、請求項11に記載の組成物。
- 前記リポソーム送達ビヒクルが、N−[1−(2,3−ジオレイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA)およびコレステロール;N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTAP)およびコレステロール;1−[2−(オレオイルオキシ)エチル]−2−オレイル−3−(2−ヒドロキシエチル)イミダゾリニウムクロリド(DOTIM)およびコレステロール;ならびにジメチルジオクタデシルアンモニウムブロミド(DDAB)およびコレステロールからなる群から選択される脂質ペアを含む、請求項11に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項11に記載の組成物。
- a.配列番号4の配列と少なくとも84%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含む核酸分子と、
b.リポソーム送達ビヒクルと、
を含み、前記核酸分子は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、免疫賦活化のための組成物。 - 前記核酸分子が、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%および99%からなる群から選択される、配列番号4の配列との配列相同性を有する核酸配列を含む、請求項16に記載の組成物。
- 前記核酸分子が配列番号4を含む、請求項16に記載の組成物。
- 前記リポソーム送達ビヒクルが、N−[1−(2,3−ジオレイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA)およびコレステロール;N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTAP)およびコレステロール;1−[2−(オレオイルオキシ)エチル]−2−オレイル−3−(2−ヒドロキシエチル)イミダゾリニウムクロリド(DOTIM)およびコレステロール;ならびにジメチルジオクタデシルアンモニウムブロミド(DDAB)およびコレステロールからなる群から選択される脂質ペアを含む、請求項16に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項16に記載の組成物。
- 組成物を対象に投与することを含む、対象において免疫反応を刺激する方法に用いるための該組成物であって、配列番号1の配列と少なくとも89%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含む核酸配列と、リポソーム送達ビヒクルと、を含み、前記核酸配列は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、組成物。
- 前記リポソーム送達ビヒクルが、多重膜小胞脂質および押出脂質からなる群から選択される脂質を含む、請求項21に記載の組成物。
- 前記リポソーム送達ビヒクルが、N−[1−(2,3−ジオレイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA)およびコレステロール;N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTAP)およびコレステロール;1−[2−(オレオイルオキシ)エチル]−2−オレイル−3−(2−ヒドロキシエチル)イミダゾリニウムクロリド(DOTIM)およびコレステロール;ならびにジメチルジオクタデシルアンモニウムブロミド(DDAB)およびコレステロールからなる群から選択される脂質ペアを含む、請求項21に記載の組成物。
- 投与が、静脈内、筋肉内、皮内、腹腔内、皮下、噴霧によるもの、エアロゾルによるもの、胚内、経口、眼内、気管内および鼻腔内からなる群から選択される、請求項21に記載の組成物。
- 生物学的製剤をさらに含む、請求項21に記載の組成物。
- 前記生物学的製剤が、免疫促進物質タンパク質、免疫原、ワクチン、抗菌剤およびそれらのいずれかの組み合わせからなる群から選択される、請求項25に記載の組成物。
- 前記投与が感染性病原体への曝露前である、請求項21に記載の組成物。
- 前記投与が感染性病原体への曝露後である、請求項21に記載の組成物。
- 前記刺激される免疫反応が、非抗原特異的免疫反応、抗原特異的免疫反応、自然免疫反応、適応免疫反応、液性免疫反応、細胞性免疫反応またはそれらの組み合わせからなる群から選択される、請求項21に記載の組成物。
- 前記対象が、哺乳類、水産養殖物類および鳥類からなる群から選択される、請求項21に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項21に記載の組成物。
- 組成物を対象に投与することを含む、対象において免疫反応を刺激する方法に用いるための該組成物であって、配列番号4の配列と少なくとも84%の配列相同性を有し、少なくとも200のCpGジヌクレオチドを含む核酸配列と、リポソーム送達ビヒクルと、を含み、前記核酸配列は抗生物質耐性遺伝子を含まず、免疫原をコードしないことを特徴とする、組成物。
- 前記リポソーム送達ビヒクルが、多重膜小胞脂質および押出脂質からなる群から選択される脂質を含む、請求項32に記載の組成物。
- 前記リポソーム送達ビヒクルが、N−[1−(2,3−ジオレイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA)およびコレステロール;N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTAP)およびコレステロール;1−[2−(オレオイルオキシ)エチル]−2−オレイル−3−(2−ヒドロキシエチル)イミダゾリニウムクロリド(DOTIM)およびコレステロール;ならびにジメチルジオクタデシルアンモニウムブロミド(DDAB)およびコレステロールからなる群から選択される脂質ペアを含む、請求項32に記載の組成物。
- 投与が、静脈内、筋肉内、皮内、腹腔内、皮下、噴霧によるもの、エアロゾルによるもの、胚内、経口、眼内、気管内および鼻腔内からなる群から選択される、請求項32に記載の組成物。
- 生物学的製剤をさらに含む、請求項32に記載の組成物。
- 前記生物学的製剤が、免疫促進物質タンパク質、免疫原、ワクチン、抗菌剤およびそれらのいずれかの組み合わせからなる群から選択される、請求項36に記載の組成物。
- 前記投与が感染性病原体への曝露前である、請求項32に記載の組成物。
- 前記投与が感染性病原体への曝露後である、請求項32に記載の組成物。
- 前記刺激される免疫反応が、非抗原特異的免疫反応、抗原特異的免疫反応、自然免疫反応、適応免疫反応、液性免疫反応、細胞性免疫反応またはそれらの組み合わせからなる群から選択される、請求項32に記載の組成物。
- 前記対象が、哺乳類、水産養殖物類および鳥類からなる群から選択される、請求項32に記載の組成物。
- 医薬的に許容可能な担体をさらに含む、請求項32に記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461946372P | 2014-02-28 | 2014-02-28 | |
| US61/946,372 | 2014-02-28 | ||
| PCT/EP2015/054131 WO2015128461A1 (en) | 2014-02-28 | 2015-02-27 | Immunostimulatory plasmids |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017512202A JP2017512202A (ja) | 2017-05-18 |
| JP2017512202A5 JP2017512202A5 (ja) | 2018-04-05 |
| JP6772065B2 true JP6772065B2 (ja) | 2020-10-21 |
Family
ID=52598746
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016554261A Active JP6772065B2 (ja) | 2014-02-28 | 2015-02-27 | 免疫賦活プラスミド |
Country Status (20)
| Country | Link |
|---|---|
| US (2) | US10155950B2 (ja) |
| EP (1) | EP3110940A1 (ja) |
| JP (1) | JP6772065B2 (ja) |
| KR (1) | KR20160122849A (ja) |
| CN (1) | CN106029867B (ja) |
| AU (1) | AU2015222102B2 (ja) |
| BR (1) | BR112016019837A2 (ja) |
| CA (1) | CA2940794C (ja) |
| CL (1) | CL2016002146A1 (ja) |
| CR (1) | CR20160393A (ja) |
| DO (1) | DOP2016000223A (ja) |
| IL (1) | IL247065A0 (ja) |
| MX (1) | MX2016010993A (ja) |
| PE (1) | PE20170404A1 (ja) |
| PH (1) | PH12016501705A1 (ja) |
| RU (1) | RU2740492C2 (ja) |
| SV (1) | SV2016005263A (ja) |
| UA (1) | UA118374C2 (ja) |
| WO (1) | WO2015128461A1 (ja) |
| ZA (1) | ZA201605495B (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10155950B2 (en) * | 2014-02-28 | 2018-12-18 | Bayer Animal Health Gmbh | Immunostimulatory plasmids |
| CN106535876B (zh) | 2014-06-04 | 2020-09-11 | 埃克西奎雷股份有限公司 | 免疫调节剂通过脂质体球形核酸的多价递送以用于预防或治疗应用 |
| JP2017537619A (ja) | 2014-11-21 | 2017-12-21 | ノースウェスタン ユニバーシティ | 球状核酸ナノ粒子複合体の配列特異的細胞内取込 |
| SG10201913395VA (en) * | 2015-06-26 | 2020-03-30 | Bayer Animal Health Gmbh | Methods of modulating cytosolic dna surveillance molecules |
| DK3328423T3 (da) * | 2015-07-31 | 2021-07-26 | Bayer Animal Health Gmbh | Forbedret immunrespons hos fisk |
| BR112018002107A2 (pt) * | 2015-07-31 | 2018-09-25 | Bayer Animal Health Gmbh | resposta imune potencializada em espécies suínas |
| KR102473370B1 (ko) * | 2016-07-26 | 2022-12-05 | 바이엘 애니멀 헬스 게엠베하 | 소 종에서의 수정능 상승 |
| US11364304B2 (en) | 2016-08-25 | 2022-06-21 | Northwestern University | Crosslinked micellar spherical nucleic acids |
| WO2018209270A1 (en) | 2017-05-11 | 2018-11-15 | Northwestern University | Adoptive cell therapy using spherical nucleic acids (snas) |
| JP2021506246A (ja) * | 2017-12-15 | 2021-02-22 | バイエル・アニマル・ヘルス・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツングBayer Animal Health Gmbh | 免疫刺激性オリゴヌクレオチド |
| CN109646435B (zh) * | 2019-01-11 | 2021-08-03 | 山东省农业科学院奶牛研究中心 | 厄他培南钠在制备防治牛传染性鼻气管炎药物中的应用 |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US4675189A (en) | 1980-11-18 | 1987-06-23 | Syntex (U.S.A.) Inc. | Microencapsulation of water soluble active polypeptides |
| US4452775A (en) | 1982-12-03 | 1984-06-05 | Syntex (U.S.A.) Inc. | Cholesterol matrix delivery system for sustained release of macromolecules |
| US5075109A (en) | 1986-10-24 | 1991-12-24 | Southern Research Institute | Method of potentiating an immune response |
| US5133974A (en) | 1989-05-05 | 1992-07-28 | Kv Pharmaceutical Company | Extended release pharmaceutical formulations |
| US5407686A (en) | 1991-11-27 | 1995-04-18 | Sidmak Laboratories, Inc. | Sustained release composition for oral administration of active ingredient |
| US5427791A (en) | 1992-08-05 | 1995-06-27 | Regents Of The University Of Minnesota | Embryonal vaccine against Newcastle disease |
| US6429199B1 (en) | 1994-07-15 | 2002-08-06 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules for activating dendritic cells |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US6645933B1 (en) * | 1995-08-01 | 2003-11-11 | Helsinki University Licensing Ltd. Oy | Receptor ligand VEGF-C |
| US5830878A (en) | 1995-06-07 | 1998-11-03 | Megabios Corporation | Cationic lipid: DNA complexes for gene targeting |
| US5736152A (en) | 1995-10-27 | 1998-04-07 | Atrix Laboratories, Inc. | Non-polymeric sustained release delivery system |
| US6048535A (en) | 1997-06-12 | 2000-04-11 | Regents Of The University Of Minnesota | Multivalent in ovo avian vaccine |
| US20040247662A1 (en) | 1998-06-25 | 2004-12-09 | Dow Steven W. | Systemic immune activation method using nucleic acid-lipid complexes |
| US20030022854A1 (en) | 1998-06-25 | 2003-01-30 | Dow Steven W. | Vaccines using nucleic acid-lipid complexes |
| US6693086B1 (en) * | 1998-06-25 | 2004-02-17 | National Jewish Medical And Research Center | Systemic immune activation method using nucleic acid-lipid complexes |
| WO2000057917A2 (en) | 1999-03-26 | 2000-10-05 | Vical Incorporated | Adjuvant compositions and methods for enhancing immune responses to polynucleotide-based vaccines |
| US20040002472A1 (en) | 2000-01-21 | 2004-01-01 | Audonnet Jean-Christophe Francis | Vaccination or immunization using a prime-boost regimen |
| US6517218B2 (en) | 2000-03-31 | 2003-02-11 | Relume Corporation | LED integrated heat sink |
| EP1414942A2 (en) * | 2001-04-24 | 2004-05-06 | Innogenetics N.V. | Expression of core-glycosylated hcv envelope proteins in yeast |
| EP1521592A2 (en) | 2001-07-02 | 2005-04-13 | Pfizer Products Inc. | Mycoplasma hyopneumoniae vaccine and methods for reducing mycoplasma bovis pneumonia in cattle |
| AU2002953015A0 (en) * | 2002-12-02 | 2002-12-12 | Women's And Children's Hospital | Modified lacz gene |
| BRPI0408779A (pt) | 2003-03-26 | 2006-04-04 | Wyeth Corp | uso de composições, composição imunogênica e kit |
| EP1675614A2 (en) | 2003-10-11 | 2006-07-05 | Inex Pharmaceuticals Corp. | Methods and compositions for enhancing innate immunity and antibody dependent cellular cytotoxicity |
| US20050181035A1 (en) | 2004-02-17 | 2005-08-18 | Dow Steven W. | Systemic immune activation method using non CpG nucleic acids |
| EP1786461A4 (en) * | 2004-08-13 | 2010-03-03 | Univ Pennsylvania | ANTIBIOTICINESIS-FREE DNA VACCINES |
| US20090068223A1 (en) | 2005-11-15 | 2009-03-12 | Boehringer Ingelheim Vetmedica, Inc. | Combination vaccine comprising an attenuated bovine viral diarrhea virus |
| TWM297441U (en) | 2006-03-30 | 2006-09-11 | Cheng-Jiun Jian | LED projection light source module |
| US7663229B2 (en) | 2006-07-12 | 2010-02-16 | Hong Kong Applied Science And Technology Research Institute Co., Ltd. | Lighting device |
| ES2605020T3 (es) * | 2006-10-06 | 2017-03-10 | The Scripps Research Institute | Composición de ADN para inducir una respuesta inmunitaria contra macrófagos asociados a tumor |
| US8470560B2 (en) * | 2007-10-03 | 2013-06-25 | The United States Of America As Represented By The Secretary Of The Army | CR-2 binding peptide P28 as molecular adjuvant for DNA vaccines |
| EP2257306B1 (en) | 2008-03-25 | 2014-05-07 | Juvaris Biotherapeutics, Inc. | Enhancement of an immune response by administration of a cationic lipid-dna complex (cldc) |
| US8815255B2 (en) | 2008-10-31 | 2014-08-26 | Boehringer Ingelheim Vetmedica, Inc. | Use of Mycoplasma bovis antigen |
| AU2010246652B2 (en) * | 2009-05-14 | 2014-10-02 | Bayer Intellectual Property Gmbh | Enhanced immune response in avian species |
| UA118537C2 (uk) | 2010-12-22 | 2019-02-11 | Байєр Інтеллектуал Проперті Гмбх | Композиція імуномодулятора для лікування респіратоного захворювання у великої рогатої худоби |
| CL2011000065A1 (es) | 2011-01-11 | 2011-04-15 | Univ Concepcion | Formulacion veterinaria para la prevencion y eliminacion de infeccion por cepas de e. coli stec, que comprende un plasmido recombinante que codifica un factor de virulencia y liposoma cationico como vehiculo, uso de dicha formulacion para tratar preferentemente bovinos y porcinos. |
| US10155950B2 (en) * | 2014-02-28 | 2018-12-18 | Bayer Animal Health Gmbh | Immunostimulatory plasmids |
-
2015
- 2015-02-27 US US14/633,920 patent/US10155950B2/en active Active
- 2015-02-27 BR BR112016019837A patent/BR112016019837A2/pt not_active Application Discontinuation
- 2015-02-27 CR CR20160393A patent/CR20160393A/es unknown
- 2015-02-27 KR KR1020167026797A patent/KR20160122849A/ko unknown
- 2015-02-27 AU AU2015222102A patent/AU2015222102B2/en active Active
- 2015-02-27 JP JP2016554261A patent/JP6772065B2/ja active Active
- 2015-02-27 WO PCT/EP2015/054131 patent/WO2015128461A1/en active Application Filing
- 2015-02-27 CN CN201580010413.0A patent/CN106029867B/zh active Active
- 2015-02-27 CA CA2940794A patent/CA2940794C/en active Active
- 2015-02-27 EP EP15707606.8A patent/EP3110940A1/en not_active Ceased
- 2015-02-27 RU RU2016138321A patent/RU2740492C2/ru active
- 2015-02-27 PE PE2016001534A patent/PE20170404A1/es not_active Application Discontinuation
- 2015-02-27 UA UAA201609729A patent/UA118374C2/uk unknown
- 2015-02-27 MX MX2016010993A patent/MX2016010993A/es unknown
-
2016
- 2016-08-02 IL IL247065A patent/IL247065A0/en unknown
- 2016-08-08 ZA ZA2016/05495A patent/ZA201605495B/en unknown
- 2016-08-24 CL CL2016002146A patent/CL2016002146A1/es unknown
- 2016-08-26 PH PH12016501705A patent/PH12016501705A1/en unknown
- 2016-08-26 SV SV2016005263A patent/SV2016005263A/es unknown
- 2016-08-26 DO DO2016000223A patent/DOP2016000223A/es unknown
-
2018
- 2018-04-25 US US15/962,414 patent/US10851379B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| DOP2016000223A (es) | 2016-09-30 |
| US10155950B2 (en) | 2018-12-18 |
| AU2015222102B2 (en) | 2021-08-19 |
| US20150267201A1 (en) | 2015-09-24 |
| PH12016501705A1 (en) | 2016-10-03 |
| JP2017512202A (ja) | 2017-05-18 |
| US10851379B2 (en) | 2020-12-01 |
| US20180312842A1 (en) | 2018-11-01 |
| BR112016019837A2 (pt) | 2017-10-17 |
| MX2016010993A (es) | 2017-05-01 |
| EP3110940A1 (en) | 2017-01-04 |
| RU2740492C2 (ru) | 2021-01-14 |
| CN106029867B (zh) | 2020-02-14 |
| PE20170404A1 (es) | 2017-05-14 |
| IL247065A0 (en) | 2016-09-29 |
| RU2016138321A (ru) | 2018-03-30 |
| RU2016138321A3 (ja) | 2018-11-12 |
| ZA201605495B (en) | 2022-08-31 |
| CL2016002146A1 (es) | 2017-08-04 |
| AU2015222102A1 (en) | 2016-08-18 |
| WO2015128461A1 (en) | 2015-09-03 |
| UA118374C2 (uk) | 2019-01-10 |
| CA2940794A1 (en) | 2015-09-03 |
| CN106029867A (zh) | 2016-10-12 |
| CA2940794C (en) | 2022-05-31 |
| SV2016005263A (es) | 2018-01-16 |
| KR20160122849A (ko) | 2016-10-24 |
| CR20160393A (es) | 2017-12-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6772065B2 (ja) | 免疫賦活プラスミド | |
| RU2606855C2 (ru) | Повышение иммунного отклика у видов крупного рогатого скота | |
| EP2429581B1 (en) | Enhanced immune response in avian species | |
| WO2016207314A2 (en) | Methods of modulating cytosolic dna surveillance molecules | |
| TW201718001A (zh) | 豬物種中增強之免疫反應 | |
| EP3328423B1 (en) | Enhanced immune response in fish | |
| TWI759317B (zh) | 牛物種中增加的生育力 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180222 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180222 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190122 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190416 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190722 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20191224 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200623 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20200901 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200930 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6772065 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |