JP6294314B2 - ホスフィン配位パラジウムスルホナートパラダサイクル - Google Patents
ホスフィン配位パラジウムスルホナートパラダサイクル Download PDFInfo
- Publication number
- JP6294314B2 JP6294314B2 JP2015516006A JP2015516006A JP6294314B2 JP 6294314 B2 JP6294314 B2 JP 6294314B2 JP 2015516006 A JP2015516006 A JP 2015516006A JP 2015516006 A JP2015516006 A JP 2015516006A JP 6294314 B2 JP6294314 B2 JP 6294314B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- ion
- aryl
- certain embodiments
- precatalyst
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 title claims description 38
- 229910000073 phosphorus hydride Inorganic materials 0.000 title claims description 19
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 title description 68
- 229910052763 palladium Inorganic materials 0.000 title description 28
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 title description 4
- 239000012041 precatalyst Substances 0.000 claims description 133
- -1 alkyl sulfonate ion Chemical group 0.000 claims description 122
- 125000000217 alkyl group Chemical group 0.000 claims description 101
- 125000003118 aryl group Chemical group 0.000 claims description 86
- 239000000539 dimer Substances 0.000 claims description 66
- 125000001188 haloalkyl group Chemical group 0.000 claims description 40
- 125000003545 alkoxy group Chemical group 0.000 claims description 38
- 125000004104 aryloxy group Chemical group 0.000 claims description 27
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 23
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims description 18
- 150000002500 ions Chemical class 0.000 claims description 15
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 11
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 11
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 11
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 claims description 9
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 claims description 8
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 6
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 6
- 239000002253 acid Substances 0.000 claims 2
- 125000001475 halogen functional group Chemical group 0.000 claims 2
- 238000006243 chemical reaction Methods 0.000 description 59
- 238000000034 method Methods 0.000 description 56
- 239000002904 solvent Substances 0.000 description 47
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 44
- 150000001875 compounds Chemical class 0.000 description 39
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 37
- 150000001412 amines Chemical class 0.000 description 33
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 32
- 150000001450 anions Chemical class 0.000 description 31
- 125000005843 halogen group Chemical group 0.000 description 28
- 239000007787 solid Substances 0.000 description 27
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 25
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 23
- 238000003756 stirring Methods 0.000 description 23
- 239000003446 ligand Substances 0.000 description 22
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 21
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 20
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 20
- 150000001408 amides Chemical class 0.000 description 19
- 125000001072 heteroaryl group Chemical group 0.000 description 16
- 238000003786 synthesis reaction Methods 0.000 description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- 239000011541 reaction mixture Substances 0.000 description 14
- 125000000623 heterocyclic group Chemical group 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- ADLVDYMTBOSDFE-UHFFFAOYSA-N 5-chloro-6-nitroisoindole-1,3-dione Chemical compound C1=C(Cl)C([N+](=O)[O-])=CC2=C1C(=O)NC2=O ADLVDYMTBOSDFE-UHFFFAOYSA-N 0.000 description 12
- DMSZORWOGDLWGN-UHFFFAOYSA-N ctk1a3526 Chemical compound NP(N)(N)=O DMSZORWOGDLWGN-UHFFFAOYSA-N 0.000 description 12
- 125000004093 cyano group Chemical group *C#N 0.000 description 12
- TWBPWBPGNQWFSJ-UHFFFAOYSA-N 2-phenylaniline Chemical group NC1=CC=CC=C1C1=CC=CC=C1 TWBPWBPGNQWFSJ-UHFFFAOYSA-N 0.000 description 11
- 239000004809 Teflon Substances 0.000 description 11
- 229920006362 Teflon® Polymers 0.000 description 11
- 150000001502 aryl halides Chemical class 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 229910052786 argon Inorganic materials 0.000 description 10
- 239000003054 catalyst Substances 0.000 description 10
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 10
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 9
- 125000005907 alkyl ester group Chemical group 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 9
- 238000002390 rotary evaporation Methods 0.000 description 9
- 238000006254 arylation reaction Methods 0.000 description 8
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 8
- 125000001424 substituent group Chemical group 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 7
- 239000007858 starting material Substances 0.000 description 7
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 7
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 7
- LVEYOSJUKRVCCF-UHFFFAOYSA-N 1,3-Bis(diphenylphosphino)propane Substances C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCP(C=1C=CC=CC=1)C1=CC=CC=C1 LVEYOSJUKRVCCF-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 150000001500 aryl chlorides Chemical class 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 6
- 125000000547 substituted alkyl group Chemical group 0.000 description 6
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 5
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 5
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 5
- 125000004429 atom Chemical group 0.000 description 5
- REWLCYPYZCHYSS-UHFFFAOYSA-N ditert-butyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C(C)(C)C)C(C)(C)C REWLCYPYZCHYSS-UHFFFAOYSA-N 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 229940085991 phosphate ion Drugs 0.000 description 5
- 229910052698 phosphorus Inorganic materials 0.000 description 5
- 239000011574 phosphorus Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 5
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 4
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 4
- PQISQOHUTDZDEU-UHFFFAOYSA-N F[P](F)(F)F Chemical compound F[P](F)(F)F PQISQOHUTDZDEU-UHFFFAOYSA-N 0.000 description 4
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 4
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 4
- 229910019142 PO4 Inorganic materials 0.000 description 4
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- 150000001299 aldehydes Chemical group 0.000 description 4
- 150000008051 alkyl sulfates Chemical class 0.000 description 4
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 4
- 125000004414 alkyl thio group Chemical group 0.000 description 4
- 125000000304 alkynyl group Chemical group 0.000 description 4
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 4
- 235000010290 biphenyl Nutrition 0.000 description 4
- 229910052796 boron Inorganic materials 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 239000012043 crude product Substances 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 4
- 230000008034 disappearance Effects 0.000 description 4
- 229920001971 elastomer Polymers 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- 150000002367 halogens Chemical group 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 4
- WQYVRQLZKVEZGA-UHFFFAOYSA-N hypochlorite Inorganic materials Cl[O-] WQYVRQLZKVEZGA-UHFFFAOYSA-N 0.000 description 4
- 150000002576 ketones Chemical class 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 229940005654 nitrite ion Drugs 0.000 description 4
- 239000012454 non-polar solvent Substances 0.000 description 4
- 150000002894 organic compounds Chemical class 0.000 description 4
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Chemical compound [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 4
- CTYRPMDGLDAWRQ-UHFFFAOYSA-N phenyl hydrogen sulfate Chemical compound OS(=O)(=O)OC1=CC=CC=C1 CTYRPMDGLDAWRQ-UHFFFAOYSA-N 0.000 description 4
- 239000010452 phosphate Substances 0.000 description 4
- 239000003880 polar aprotic solvent Substances 0.000 description 4
- 125000003367 polycyclic group Chemical group 0.000 description 4
- 150000003141 primary amines Chemical class 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 125000003107 substituted aryl group Chemical group 0.000 description 4
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 4
- 0 *c(c(*)c1-c2c(*)c(*)c(*)c(*)c22)c(*)c(*)c1O[Po]2(*)I Chemical compound *c(c(*)c1-c2c(*)c(*)c(*)c(*)c22)c(*)c(*)c1O[Po]2(*)I 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- XSCHRSMBECNVNS-UHFFFAOYSA-N benzopyrazine Natural products N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 3
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 3
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 125000000392 cycloalkenyl group Chemical group 0.000 description 3
- 239000002274 desiccant Substances 0.000 description 3
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical group N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 3
- WDVGNXKCFBOKDF-UHFFFAOYSA-N dicyclohexyl-[3,6-dimethoxy-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(OC)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C1CCCCC1)C1CCCCC1 WDVGNXKCFBOKDF-UHFFFAOYSA-N 0.000 description 3
- SACNIGZYDTUHKB-UHFFFAOYSA-N ditert-butyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C(C)(C)C)C(C)(C)C SACNIGZYDTUHKB-UHFFFAOYSA-N 0.000 description 3
- CVLLAKCGAFNZHJ-UHFFFAOYSA-N ditert-butyl-[6-methoxy-3-methyl-2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane Chemical compound COC1=CC=C(C)C(C=2C(=CC(=CC=2C(C)C)C(C)C)C(C)C)=C1P(C(C)(C)C)C(C)(C)C CVLLAKCGAFNZHJ-UHFFFAOYSA-N 0.000 description 3
- 238000003818 flash chromatography Methods 0.000 description 3
- 238000003682 fluorination reaction Methods 0.000 description 3
- 238000004817 gas chromatography Methods 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 3
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 3
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- ACVYVLVWPXVTIT-UHFFFAOYSA-M phosphinate Chemical group [O-][PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-M 0.000 description 3
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical group [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- QFMZQPDHXULLKC-UHFFFAOYSA-N 1,2-bis(diphenylphosphino)ethane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CCP(C=1C=CC=CC=1)C1=CC=CC=C1 QFMZQPDHXULLKC-UHFFFAOYSA-N 0.000 description 2
- BCJVBDBJSMFBRW-UHFFFAOYSA-N 4-diphenylphosphanylbutyl(diphenyl)phosphane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCCP(C=1C=CC=CC=1)C1=CC=CC=C1 BCJVBDBJSMFBRW-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 150000001768 cations Chemical class 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 125000004475 heteroaralkyl group Chemical group 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- NJVSFOMTEFOHMI-UHFFFAOYSA-N n,2-diphenylaniline Chemical compound C=1C=CC=C(C=2C=CC=CC=2)C=1NC1=CC=CC=C1 NJVSFOMTEFOHMI-UHFFFAOYSA-N 0.000 description 2
- CARILLOXVAEKID-UHFFFAOYSA-N n-methyl-2-phenylaniline Chemical group CNC1=CC=CC=C1C1=CC=CC=C1 CARILLOXVAEKID-UHFFFAOYSA-N 0.000 description 2
- 125000005151 nonafluorobutanesulfonyl group Chemical group FC(C(C(S(=O)(=O)*)(F)F)(F)F)(C(F)(F)F)F 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 2
- 238000006464 oxidative addition reaction Methods 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000006894 reductive elimination reaction Methods 0.000 description 2
- 150000003335 secondary amines Chemical class 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 229910052723 transition metal Inorganic materials 0.000 description 2
- 150000003624 transition metals Chemical class 0.000 description 2
- 125000001889 triflyl group Chemical group FC(F)(F)S(*)(=O)=O 0.000 description 2
- 229910006400 μ-Cl Inorganic materials 0.000 description 2
- 239000001211 (E)-4-phenylbut-3-en-2-one Substances 0.000 description 1
- BATRWCBAPRELSJ-UHFFFAOYSA-N 1,1'-biphenyl methanesulfonic acid Chemical compound C1(=CC=CC=C1)C1=CC=CC=C1.CS(=O)(=O)O BATRWCBAPRELSJ-UHFFFAOYSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 1
- MCSXGCZMEPXKIW-UHFFFAOYSA-N 3-hydroxy-4-[(4-methyl-2-nitrophenyl)diazenyl]-N-(3-nitrophenyl)naphthalene-2-carboxamide Chemical compound Cc1ccc(N=Nc2c(O)c(cc3ccccc23)C(=O)Nc2cccc(c2)[N+]([O-])=O)c(c1)[N+]([O-])=O MCSXGCZMEPXKIW-UHFFFAOYSA-N 0.000 description 1
- MZFPAWGWFDGCHP-UHFFFAOYSA-N 5-diphenylphosphanylpentyl(diphenyl)phosphane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCCCP(C=1C=CC=CC=1)C1=CC=CC=C1 MZFPAWGWFDGCHP-UHFFFAOYSA-N 0.000 description 1
- GJCOSYZMQJWQCA-UHFFFAOYSA-N 9H-xanthene Chemical compound C1=CC=C2CC3=CC=CC=C3OC2=C1 GJCOSYZMQJWQCA-UHFFFAOYSA-N 0.000 description 1
- BOBMLXGAWWHHHY-UHFFFAOYSA-N C1=CC=C(C=C1)C2=CC=CC=C2CCS(=O)(=O)O Chemical compound C1=CC=C(C=C1)C2=CC=CC=C2CCS(=O)(=O)O BOBMLXGAWWHHHY-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- URLKBWYHVLBVBO-UHFFFAOYSA-N Cc1ccc(C)cc1 Chemical compound Cc1ccc(C)cc1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 229910020808 NaBF Inorganic materials 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- WBTCZXYOKNRFQX-UHFFFAOYSA-N S1(=O)(=O)NC1=O Chemical group S1(=O)(=O)NC1=O WBTCZXYOKNRFQX-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 150000001503 aryl iodides Chemical class 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- MNFORVFSTILPAW-UHFFFAOYSA-N azetidin-2-one Chemical class O=C1CCN1 MNFORVFSTILPAW-UHFFFAOYSA-N 0.000 description 1
- 150000001540 azides Chemical group 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229930008407 benzylideneacetone Natural products 0.000 description 1
- 239000012455 biphasic mixture Substances 0.000 description 1
- 125000005620 boronic acid group Chemical group 0.000 description 1
- WXMZPPIDLJRXNK-UHFFFAOYSA-N butyl(diphenyl)phosphane Chemical compound C=1C=CC=CC=1P(CCCC)C1=CC=CC=C1 WXMZPPIDLJRXNK-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- NMMPMZWIIQCZBA-UHFFFAOYSA-M chloropalladium(1+);dicyclohexyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane;2-phenylethanamine Chemical compound [Pd+]Cl.NCCC1=CC=CC=[C-]1.CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 NMMPMZWIIQCZBA-UHFFFAOYSA-M 0.000 description 1
- QZHPTGXQGDFGEN-UHFFFAOYSA-N chromene Chemical compound C1=CC=C2C=C[CH]OC2=C1 QZHPTGXQGDFGEN-UHFFFAOYSA-N 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000004966 cyanoalkyl group Chemical group 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 1
- MXFYYFVVIIWKFE-UHFFFAOYSA-N dicyclohexyl-[2-[2,6-di(propan-2-yloxy)phenyl]phenyl]phosphane Chemical compound CC(C)OC1=CC=CC(OC(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 MXFYYFVVIIWKFE-UHFFFAOYSA-N 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical class CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 1
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 1
- 150000002244 furazanes Chemical class 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- QDLAGTHXVHQKRE-UHFFFAOYSA-N lichenxanthone Natural products COC1=CC(O)=C2C(=O)C3=C(C)C=C(OC)C=C3OC2=C1 QDLAGTHXVHQKRE-UHFFFAOYSA-N 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical group CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- OFXSXYCSPVKZPF-UHFFFAOYSA-N methoxyperoxymethane Chemical compound COOOC OFXSXYCSPVKZPF-UHFFFAOYSA-N 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- JGTNAGYHADQMCM-UHFFFAOYSA-N perfluorobutanesulfonic acid Chemical compound OS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F JGTNAGYHADQMCM-UHFFFAOYSA-N 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- GJSGGHOYGKMUPT-UHFFFAOYSA-N phenoxathiine Chemical compound C1=CC=C2OC3=CC=CC=C3SC2=C1 GJSGGHOYGKMUPT-UHFFFAOYSA-N 0.000 description 1
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- 150000004040 pyrrolidinones Chemical class 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- QRUBYZBWAOOHSV-UHFFFAOYSA-M silver trifluoromethanesulfonate Chemical compound [Ag+].[O-]S(=O)(=O)C(F)(F)F QRUBYZBWAOOHSV-UHFFFAOYSA-M 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 150000008053 sultones Chemical class 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- GVIJJXMXTUZIOD-UHFFFAOYSA-N thianthrene Chemical compound C1=CC=C2SC3=CC=CC=C3SC2=C1 GVIJJXMXTUZIOD-UHFFFAOYSA-N 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- BWHOZHOGCMHOBV-BQYQJAHWSA-N trans-benzylideneacetone Chemical compound CC(=O)\C=C\C1=CC=CC=C1 BWHOZHOGCMHOBV-BQYQJAHWSA-N 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 125000002827 triflate group Chemical group FC(S(=O)(=O)O*)(F)F 0.000 description 1
- 238000006692 trifluoromethylation reaction Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System compounds of the platinum group
- C07F15/006—Palladium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B37/00—Reactions without formation or introduction of functional groups containing hetero atoms, involving either the formation of a carbon-to-carbon bond between two carbon atoms not directly linked already or the disconnection of two directly linked carbon atoms
- C07B37/04—Substitution
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System compounds of the platinum group
- C07F15/0086—Platinum compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
Description
本発明は、米国国立衛生研究所によって与えられた助成番号GM046059およびGM058160に基づく米国政府の支援により行われた。米国政府は本発明に一定の権利を有する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
R2は、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
Ryは、H、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
R2は、アルキル、ハロアルキルまたはアリールである)の二量体に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Ryは、H、アルキル、ハロアルキルまたはアリールである)の二量体に関する。
ある実施形態では、本発明はパラジウムスルホナート前触媒に関する。ある実施形態では、前触媒の合成は、市販の出発物質から容易に行うことができる。ある実施形態では、前触媒は、様々なホスフィン配位子のいずれかを組み込んでいる。ある実施形態では、前触媒は、溶液中で著しく安定である。ある実施形態では、前触媒は、約1か月より長い間、溶液中で安定である。
ある実施形態では、本発明は、式I
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
R2は、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Xは非配位性アニオンであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンである)の前触媒に関する。
Xは非配位性アニオンであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
R2は、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
Ryは、H、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Xは非配位性アニオンであり、
Lは、トリアルキルホスフィン、トリアリールホスフィン、ジアルキルアリールホスフィン、アルキルジアリールホスフィン、ビス(ホスフィン)、ホスホルアミド、アミン、ビス(アミン)またはN−複素環式カルベンであり、
Ryは、H、アルキル、ハロアルキルまたはアリールである)の前触媒に関する。
Rxが、アルキル、アラルキル、シクロアルキルまたはアリールであり、
X1が、CHまたはNであり、
R3が、Hまたはアルキルであり、
R4が、H、アルコキシまたはアルキルであり、
R5が、アルキルまたはアリールであり、
nが、1、2、3または4である、上記前触媒のいずれか1種に関する。
ある実施形態では、本発明は、式IX
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
R2は、アルキル、ハロアルキルまたはアリールである)の二量体に関する。
Xは非配位性アニオンであり、
R1は、H、アルキル、ハロアルキル、ヒドロキシ、アルコキシ、アリールオキシ、アリールまたはハロであり、
Ryは、H、アルキル、ハロアルキルまたはアリールである)の二量体に関する。
ある実施形態では、本発明は、スキーム1:
Lは、上記定義と同じであり、
Arは、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
R7は、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、アルキル、シクロアルキルである)の方法に関する。
Lは、上記定義と同じであり、
Arは、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
R7は、アルキル、アラルキル、アリールまたはヘテロアリールであり、
R8は、アルキル、アラルキル、アリールまたはヘテロアリールであるか、もしくはR7とR8は互いに結合してシクロアルキル環またはヘテロシクロアルキル環を形成する)の方法に関する。
Arは、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
Ar1は、アリールまたはヘテロアリールである)の方法に関する。
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
R9は、アラルキル、ヘテロアラルキル、アリール、ヘテロアリールまたはシクロアルキルである)の方法に関する。
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルである)の方法に関する。
前触媒は、上記前触媒のいずれか1種であり、
X2はハロであり、
Ar1は、アリールまたはヘテロアリールであり、
Ar2は、1個、2個、3個または4個のR11で置換されていてもよい、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
R11は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシ、アルキル、アルキルチオまたはシアノアルキルである)の方法に関する。
前触媒は、上記前触媒のいずれか1種であり、
X2はハロであり、
Ar1は、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルであり、
R12は、アルキルまたは置換アルキル(アラルキル、フルオロアルキルアルキルまたはシクロアルキルアルキルを含むが、これらに限定されない)である)の方法に関する。
前触媒は、上記前触媒のいずれか1種であり、
X3は、ハロ、トリフラートまたはメシラートであり、
Ar1は、アリールまたはヘテロアリールであり、
qは、0、1、2、3または4であり、
R6は、アルコキシ、アルキルエステル、アルキルカルボニル、ヒドロキシアルキル、シアノ、ハロ、アミノ、シクロアルキル、アリール、ハロアルキル、ニトロ、ヒドロキシ、アルコキシ、アリールオキシまたはアルキルである)の方法に関する。
便宜上、本発明をさらに説明する前に、明細書、実施例、および添付の特許請求の範囲において使用される特定の用語をここにまとめる。
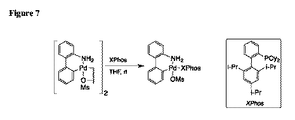
2−アミノビフェニルパラジウムメシラート二量体:磁気撹拌子を備え、ゴム栓が取り付けられた300mLの丸底フラスコに、2−アンモニウムビフェニルメシラート(7.89g、30.0ミリモル、1.00当量)および酢酸パラジウム(6.72g、30.0ミリモル、1.00当量)を入れた。フラスコを真空にし、アルゴンを充填し(この操作を3回繰り返す)、その後120mLの無水トルエンを添加した。混合液を50℃で45分間、すなわち外観がオフホワイトの乳状になるまで撹拌した。室温まで冷却した後、懸濁液を濾過し、トルエン(25mL)およびジエチルエーテル(3×25mL)で洗浄し、24時間真空乾燥し、オフホワイトから黄褐色の固体として表題化合物を得た。収率:10.2g(92%)。図2。
2−アミノビフェニルパラジウムメシラート前触媒の一般的な手順:磁気撹拌子を備え、「テフロン」製ねじ蓋が取り付けられた試験管に、2−アミノビフェニルパラジウムメシラート二量体(370mg、0.50ミリモル、0.50当量)および配位子(1.00ミリモル、1.00当量)を入れた。THFまたはDCM(5mL)を注射器で添加し、反応液を15分〜1時間撹拌した。反応の進行は31P NMRによりモニターし、遊離配位子シグナルの消失および低磁場での前触媒シグナルの出現を観察した。終了後、反応混合液をシンチレーションバイアルに移し、溶媒の約10%が残るまで室温で真空下で溶媒を除去した。その後、残留物をペンタンで研和(triturate)した。得られた固体を濾過により分離し、さらに真空乾燥した。図6。
2−アミノビフェニルパラジウムトリフラートtBuBrettPhos前触媒:撹拌子を備えた250mLの丸底フラスコに、2−アミノビフェニルパラジウムクロリド二量体(3.41g、5.5ミリモル、0.50当量)および銀トリフラート(2.82g、11ミリモル、1.00当量)を入れ、遮光した。その後、ジクロロメタン(100mL)を添加し、混合液を30分間室温で撹拌した。懸濁液は、その後、セライトの濡れたパッドを通して濾過し、tBuBrettPhos(5.33g、11ミリモル、1.00当量)を含む撹拌子を備えた500mLの丸底フラスコに入れた。追加分のジクロロメタン(50mL)を用いて、最初のフラスコをすすぎ、セライトプラグ(Celite plug)を通して混合物を溶出した。得られた混合液は、室温で2時間、深紅色になるまで撹拌した。回転蒸発によって溶媒の約90%を除去した後、ペンタン(200mL)を添加し前触媒を沈殿させた。懸濁液を30分間超音波処理し、スパチュラで破砕し、濾過した。得られた固体を一晩真空乾燥し、濃いオレンジ色の固体として表題化合を得た。収率:9.59g、96%。図9。
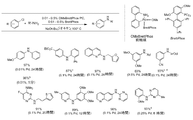
磁気撹拌子および「テフロン」栓を備えた、乾燥器で乾燥させた再封可能な管に、OMsBrettPhos前触媒(0.01〜0.5モル%)、BrettPhos(0.01〜0.5モル%)、NaOt−Bu(115mg、1.20ミリモル、1.20当量)、ハロゲン化アリール(1.00ミリモル、1.00当量)およびアミン(1.20ミリモル、1.20当量)を固体の場合に入れた。この管を真空にし、アルゴンを充填した。この操作を3回繰り返した。その後、ハロゲン化アリールおよびアミンが液体の場合添加し、次いでジオキサン(1mL)を添加した。反応液を100℃で加熱し、薄層クロマトグラフィーまたはガスクロマトグラフィーでモニターし、ハロゲン化アリールの消失を観察した。終了後、反応液を室温まで冷却し、酢酸エチルで希釈し、セライトのプラグを通して濾過した。回転蒸発によって溶媒を除去し、その後フラッシュクロマトグラフィーによって粗生成物を精製した。図14を参照のこと。
撹拌子および「テフロン」栓を備えた、乾燥器で乾燥させた再封可能な管に、OMsRuPhos前触媒(0.01〜1モル%)、RuPhos(0.01〜1モル%)、NaOtBu(115mg、1.20ミリモル、1.20当量)、ハロゲン化アリール(1.00ミリモル)およびアミン(1.20ミリモル、1.20当量)を固体の場合入れた。この管を真空にし、アルゴンを充填した。これを3回繰り返した。その後、ハロゲン化アリールおよびアミンが液体の場合添加し、次いでTHF(1mL)を添加した。反応液を85℃で加熱し、薄層クロマトグラフィーまたはガスクロマトグラフィーによってモニターし、ハロゲン化アリールの消失を観察した。終了後、反応液を室温まで冷却し、酢酸エチルで希釈し、セライトのプラグを通して濾過した。回転蒸発によって溶媒を除去し、その後フラッシュクロマトグラフィーによって粗生成物を精製した。図15を参照のこと。
磁気撹拌子および「テフロン」栓を備えた再封可能な管に、OMsXPhos前触媒(2モル%)、ハロゲン化アリール(1ミリモル)(固体の場合)およびボロン酸(1.5ミリモル)を入れた。その後、この管を真空にし、アルゴンを充填した。この操作を3回繰り返した。その後、ハロゲン化アリール(液体の場合)を添加し、次いでTHF(2mL)および脱気した0.5MのK3PO4溶液(4mL)を添加した。その後、反応液を室温または40℃で30分撹拌した。反応混合液を水(10mL)および酢酸エチル(10mL)で希釈し、層を分離させた。水層を酢酸エチルで3回抽出した。合わせた有機相を硫酸マグネシウムで乾燥し、真空下で濃縮し、カラムクロマトグラフィーにより精製した。図16を参照のこと。
磁気撹拌子および「テフロン」栓を備えた、乾燥器で乾燥させた再封可能な管に、OTf−tBuBrettPhos前触媒(9.1mg、1モル%)、K3PO4(297mg、1.40ミリモル、1.40当量)、ハロゲン化アリール(1.00ミリモル、1.00当量)およびアミド(1.20ミリモル、1.20当量)を固体の場合入れた。この管を密閉して真空にし、アルゴンを充填した。この操作を3回繰り返した。その後、ハロゲン化アリールおよびアミドが液体の場合添加し、次いでtBuOH(2mL)を添加した。反応液を110℃で加熱し、薄層クロマトグラフィーまたはガスクロマトグラフィーでモニターし、ハロゲン化アリールの消失を観察した。終了後、反応液を室温まで冷却し、酢酸エチルと水で希釈した。相を分離させ、水相を再び酢酸エチル(2×5mL)で抽出した。合わせた有機相を硫酸ナトリウムで乾燥し、回転蒸発により濃縮し、粗生成物をカラムクロマトグラフィーにより精製した。図17を参照のこと。
窒素を充填したグローブボックス内で、撹拌子を備え、乾燥器で乾燥させた再封可能な管に、CsF(2.0ミリモル、2.0当量)、OTf−tBuBrettPhos前触媒(1〜5%)、アリールトリフラート(1.0ミリモル、1.0当量)およびトルエン(5mL)を(この順に)入れた。この管を「テフロン」栓で密閉してグローブボックスから取り出し、反応混合液を120〜130℃で一晩撹拌した。その後、反応混合液を室温まで冷却し、セライトを通してEt2Oで溶出することで濾過し、回転蒸発により濃縮した。粗生成物はフラッシュクロマトグラフィーにより精製した。図18を参照のこと。
磁気撹拌子を備え、「テフロン」製ねじ蓋が取り付けられた試験管に、μ−Cl二量体(78mg、0.125ミリモル、0.50当量)およびKPF6(276mg、1.50ミリモル、3.00当量)を入れた。この管を密閉して真空にし、アルゴンを充填し(この操作を2回繰り返す)、その後アセトニトリル(3mL)およびメタノール(1mL)を添加した。30分間撹拌した後、XPhos(238mg、0.50ミリモル、1.00当量)を添加し、追加のアセトニトリルで管の側面をすすぎ、混合液を一晩撹拌した。終了後、反応混合液はセライトを通して溶出し、回転蒸発により溶媒を除去した。その後、残留物をペンタンで研和した。得られた固体を濾過により分離し、さらに真空乾燥した。図19を参照のこと。
磁気撹拌子を備え、「テフロン」製ねじ蓋が取り付けられた試験管に、μ−Cl二量体(78mg、0.125ミリモル、0.50当量)およびNaBF4(165mg、1.50ミリモル、3.00当量)を入れた。この管を密閉して真空にし、アルゴンを充填し(この操作を2回繰り返す)、その後アセトニトリル(3mL)およびメタノール(1mL)を添加した。30分間撹拌した後、XPhos(238mg、0.50ミリモル、1.00当量)を添加し、追加のアセトニトリルで管の側面をすすぎ、混合液を一晩撹拌した。終了後、反応混合液はセライトを通して溶出し、回転蒸発により溶媒を除去した。その後、残留物をペンタンで研和した。得られた固体を濾過により分離し、さらに真空乾燥した。図20を参照のこと。
N−フェニル−[1,1’−ビフェニル]−2−アンモニウムメシラート:撹拌子を備えた50mLの丸底フラスコに、2−(N−フェニル)アミノビフェニル(1.09g、4.4ミリモル、1.00当量)およびジエチルエーテル(25mL)を入れた。メタンスルホン酸(285μL、4.4ミリモル、1.00当量)を滴加し、反応混合液を30分間撹拌した。その後、回転蒸発により溶媒を除去し、さらに生成物を真空乾燥し、緑色の油として表題化合物を得た。
N−メチル−[1,1’−ビフェニル]−2−アンモニウムメシラート:撹拌子を備えた50mLの丸底フラスコに、2−(N−メチル)アミノビフェニル(600mg、3.25ミリモル、1.00当量)およびジエチルエーテル(25mL)を入れた。メタンスルホン酸(212μL、3.25ミリモル、1.00当量)を滴加し、反応混合液を30分間超音波処理し、その後、30分間撹拌した。得られた固体を濾過し、さらに真空乾燥し、白色の固体として表題化合物を得た。収率:578mg、61%。
本明細書で引用した米国特許および米国特許出願公開公報の全てが参照により本明細書に援用される。
当業者は、通常の実験を使用するだけで、本明細書に記載された本発明の特定の実施形態に対する多くの均等物を認識または確認できるであろう。このような均等物は以下の特許請求の範囲に包含されることが意図される。
Claims (32)
- Xがアルキルスルホン酸イオンであり、前記アルキルが、メチル、エチル、プロピルまたはブチルである、請求項1〜3いずれか1項記載の前触媒。
- Xがアルキルスルホン酸イオンであり、前記アルキルがメチルまたはエチルである、請求項1〜3いずれか1項記載の前触媒。
- Xがハロアルキルスルホン酸イオンである、請求項1〜3いずれか1項記載の前触媒。
- Xがフルオロアルキルスルホン酸イオンである、請求項1〜3いずれか1項記載の前触媒。
- Xがフルオロメチルスルホン酸イオンである、請求項1〜3いずれか1項記載の前触媒。
- Xがトリフルオロメチルスルホン酸イオンである、請求項1〜3いずれか1項記載の前触媒。
- Xがシクロアルキルアルキルスルホン酸イオンである、請求項1〜3いずれか1項記載の前触媒。
- R1がHまたはアルキルである、請求項1〜10いずれか1項記載の前触媒。
- R1がHである、請求項11記載の前触媒。
- Xは、アルキルスルホン酸イオン、およびアリールスルホン酸イオンからなる群より選択され、前記アルキルが置換または未置換アルキルであり、および前記アリールが置換または未置換アリールである、請求項16記載の二量体。
- Xがアルキルスルホン酸イオンであり、前記アルキルが置換または未置換アルキルである、請求項16記載の二量体。
- Xがアルキルスルホン酸イオンであり、前記アルキルが、メチル、エチル、プロピルまたはブチルである、請求項16記載の二量体。
- Xがアルキルスルホン酸イオンであり、前記アルキルがメチルまたはエチルである、請求項16記載の二量体。
- Xがハロアルキルスルホン酸イオンである、請求項16記載の二量体。
- Xがフルオロアルキルスルホン酸イオンである、請求項16記載の二量体。
- Xがフルオロメチルスルホン酸イオンである、請求項16記載の二量体。
- Xがトリフルオロメチルスルホン酸イオンである、請求項16記載の二量体。
- Xがシクロアルキルアルキルスルホン酸イオンである、請求項16記載の二量体。
- Xがアリールスルホン酸イオンであり、前記アリールが置換または未置換アリールである、請求項16記載の二量体。
- Xがフェニルスルホン酸イオンである、請求項16記載の二量体。
- Xがメチルフェニルスルホン酸イオンである、請求項16記載の二量体。
- Xがp−トルエンスルホン酸イオンである、請求項16記載の二量体。
- R1がHまたはアルキルである、請求項16〜30いずれか1項記載の二量体。
- R1がHである、請求項31記載の二量体。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261657377P | 2012-06-08 | 2012-06-08 | |
| US61/657,377 | 2012-06-08 | ||
| PCT/US2013/030779 WO2013184198A1 (en) | 2012-06-08 | 2013-03-13 | Phosphine-ligated palladium sulfonate palladacycles |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017236262A Division JP2018061956A (ja) | 2012-06-08 | 2017-12-08 | ホスフィン配位パラジウムスルホナートパラダサイクル |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015527300A JP2015527300A (ja) | 2015-09-17 |
| JP2015527300A5 JP2015527300A5 (ja) | 2016-05-12 |
| JP6294314B2 true JP6294314B2 (ja) | 2018-03-14 |
Family
ID=49712427
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015516006A Active JP6294314B2 (ja) | 2012-06-08 | 2013-03-13 | ホスフィン配位パラジウムスルホナートパラダサイクル |
| JP2017236262A Withdrawn JP2018061956A (ja) | 2012-06-08 | 2017-12-08 | ホスフィン配位パラジウムスルホナートパラダサイクル |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017236262A Withdrawn JP2018061956A (ja) | 2012-06-08 | 2017-12-08 | ホスフィン配位パラジウムスルホナートパラダサイクル |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US8889857B2 (ja) |
| EP (1) | EP2859005B1 (ja) |
| JP (2) | JP6294314B2 (ja) |
| WO (1) | WO2013184198A1 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8563573B2 (en) | 2007-11-02 | 2013-10-22 | Vertex Pharmaceuticals Incorporated | Azaindole derivatives as CFTR modulators |
| US8802868B2 (en) | 2010-03-25 | 2014-08-12 | Vertex Pharmaceuticals Incorporated | Solid forms of (R)-1(2,2-difluorobenzo[D][1,3]dioxo1-5-yl)-N-(1-(2,3-dihydroxypropyl-6-fluoro-2-(1-hydroxy-2-methylpropan2-yl)-1H-Indol-5-yl)-Cyclopropanecarboxamide |
| JP2013525371A (ja) | 2010-04-22 | 2013-06-20 | バーテックス ファーマシューティカルズ インコーポレイテッド | シクロアルキルカルボキサミド−インドール化合物の製造方法 |
| EP4223294A1 (en) | 2014-04-15 | 2023-08-09 | Vertex Pharmaceuticals Incorporated | Pharmaceutical compositions for the treatment of cystic fibrosis transmembrane conductance regulator mediated diseases |
| EP3385270A4 (en) * | 2015-12-02 | 2020-01-22 | Sumitomo Chemical Company, Ltd | PROCESS FOR PRODUCING AROMATIC COMPOUND AND PALLADIUM COMPLEX |
| CN105618144B (zh) * | 2016-03-10 | 2018-01-05 | 南京理工大学 | 一种用于吲哚二位芳基化的氟功能化介孔硅胶负载钯催化剂及其制备方法和应用 |
| GB201604970D0 (en) | 2016-03-23 | 2016-05-04 | Syngenta Participations Ag | Improvements in or relating to organic compounds |
| US10882035B2 (en) | 2016-05-10 | 2021-01-05 | Promega Corporation | Palladium catalysts with improved performance in biological environments |
| CN107537562B (zh) * | 2016-06-24 | 2020-06-19 | 中国科学院大连化学物理研究所 | 含膦-离子液体有机共聚物多相催化剂及其制备和应用 |
| CN107537575B (zh) * | 2016-06-24 | 2020-05-05 | 中国科学院大连化学物理研究所 | 一种咪唑盐有机聚合物催化剂及其制备方法和应用 |
| WO2018106337A1 (en) | 2016-12-06 | 2018-06-14 | Dow Global Technologies Llc | Mono-ligated palladium catalyts, their synthesis and use in suzuki coupling |
| WO2018106338A1 (en) | 2016-12-06 | 2018-06-14 | Dow Global Technologies Llc | Mono-ligated palladium catalysts, their synthesis and use in suzuki coupling |
| WO2018106336A1 (en) | 2016-12-06 | 2018-06-14 | Dow Global Technologies Llc | Mono-ligated palladium catalyts, their synthesis and use in suzuki coupling |
| WO2020094440A1 (en) | 2018-11-07 | 2020-05-14 | Basf Se | Process for the synthesis of aryl hydrazines |
| US11377420B2 (en) | 2019-06-24 | 2022-07-05 | Board Of Regents, The University Of Texas System | Compositions and methods for making donor-acceptor azetines |
| CN113019463B (zh) * | 2021-05-25 | 2021-09-07 | 江苏欣诺科催化剂有限公司 | 钯复合催化剂及其制备方法和应用 |
| CN114632552B (zh) * | 2022-05-19 | 2022-08-02 | 苏州欣诺科生物科技有限公司 | Buchwald预催化剂及其制备方法与应用 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080064892A1 (en) | 2004-07-30 | 2008-03-13 | Heriot-Watt University | Palladacycles, Their Preparation and Catalytic Processes Involving Their Use as Catalyst, Especially Catalytic Carbonylation Processes |
| EP2231680B1 (en) | 2007-12-12 | 2018-03-28 | Massachusetts Institute of Technology | Ligands for transition-metal-catalyzed cross-couplings, and methods of use thereof |
| US20110015401A1 (en) | 2009-07-13 | 2011-01-20 | Massachusetts Institute Of Technology | Metal-Catalyzed Carbon-Fluorine Bond Formation |
-
2013
- 2013-03-13 JP JP2015516006A patent/JP6294314B2/ja active Active
- 2013-03-13 EP EP13801013.7A patent/EP2859005B1/en active Active
- 2013-03-13 WO PCT/US2013/030779 patent/WO2013184198A1/en active Application Filing
- 2013-03-13 US US13/799,620 patent/US8889857B2/en active Active
-
2014
- 2014-10-23 US US14/521,727 patent/US8981086B2/en active Active
-
2017
- 2017-12-08 JP JP2017236262A patent/JP2018061956A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| EP2859005B1 (en) | 2018-10-31 |
| JP2018061956A (ja) | 2018-04-19 |
| US8981086B2 (en) | 2015-03-17 |
| WO2013184198A1 (en) | 2013-12-12 |
| EP2859005A1 (en) | 2015-04-15 |
| US8889857B2 (en) | 2014-11-18 |
| US20150045570A1 (en) | 2015-02-12 |
| US20130331566A1 (en) | 2013-12-12 |
| JP2015527300A (ja) | 2015-09-17 |
| EP2859005A4 (en) | 2016-02-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6294314B2 (ja) | ホスフィン配位パラジウムスルホナートパラダサイクル | |
| JP5591714B2 (ja) | 遷移金属触媒によるクロスカップリングのためのリガンド、およびその使用方法 | |
| Wong et al. | When cross-coupling partners meet indolylphosphines | |
| US8058477B2 (en) | Process for the synthesis of arylamines from the reaction of an aromatic compound with ammonia or a metal amide | |
| Touj et al. | Palladium PEPPSI complexes: Synthesis and catalytic activity on the Suzuki-Miyaura coupling reactions for aryl bromides at room temperature in aqueous media | |
| EP3122707B1 (en) | Method for coupling a first aromatic compound to a second aromatic compound | |
| Fu et al. | Preparation of a Highly Congested Carbazoyl-Derived P, N-Type Phosphine Ligand for Acetone Monoarylations | |
| Chang et al. | Preparation and application of indolyl secondary phosphine oxides in palladium complexes catalyzed Suzuki–Miyaura cross-coupling reaction | |
| CA2556850A1 (en) | Transition metal complexes of n-heterocyclic carbenes, method of preparation and use in transition metal catalyzed organic transformations | |
| KR20170070042A (ko) | 제1 화합물을 제2 화합물에 커플링시키는 방법 | |
| JP6461942B2 (ja) | 芳香族アミンのモノアリール化 | |
| WO2017193288A1 (en) | Synthesis of phosphine ligands bearing tunable linkage: methods of their use in catalysis | |
| KR20180041679A (ko) | 방향족 또는 비닐계 화합물을 붕소-함유 화합물에 커플링하는 방법 | |
| KR20170070043A (ko) | 플루오로설포네이트 화합물과 아민 화합물의 커플링 방법 | |
| KR20180032639A (ko) | 방향족 화합물을 알킨에 커플링시키는 방법 | |
| Penn | Controlled α-Halogenation of Alkyl Sulfonamides and Development of Highly Active Bifunctional (Benz) Imidazolyl-Palladium Catalysts for Application in Sustainable Cross-Coupling Reactions | |
| Hu | Transition-metal catalyzed cross-coupling reactions involving inert C-Cl and CH bonds | |
| Chen et al. | Efficient synthesis of triarylamines catalyzed by palladium/N-heterocyclic carbene | |
| WO2018106338A1 (en) | Mono-ligated palladium catalysts, their synthesis and use in suzuki coupling | |
| EP3429987A1 (en) | Method for coupling a first compound to a second compound | |
| Alsabeh | The Development of Catalysts for the Monoarylation of Ammonia and Related Challenging Cross-Coupling Reactions | |
| Schulman | Synthesis of 1, 2, 3-Triazole-Fused Heterocycles via Palladium Catalyzed Annulation of 5-Iodotriazoles | |
| Mina | A study of palladium-catalyzed amination of benzylic carbonates via η 3-benzyl metal complexes, utilizing N-heterocyclic carbene ligands and microwave acceleration | |
| Shin | Design, synthesis and Suzuki-Miyaura cross-coupling reactions of potassium organotrifluoroborates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160309 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160309 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20161208 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170321 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170808 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171208 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20171218 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180116 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180215 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6294314 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |