JP6240785B2 - サンプルの濃縮及び検出のためのシステム及び方法 - Google Patents
サンプルの濃縮及び検出のためのシステム及び方法 Download PDFInfo
- Publication number
- JP6240785B2 JP6240785B2 JP2016541219A JP2016541219A JP6240785B2 JP 6240785 B2 JP6240785 B2 JP 6240785B2 JP 2016541219 A JP2016541219 A JP 2016541219A JP 2016541219 A JP2016541219 A JP 2016541219A JP 6240785 B2 JP6240785 B2 JP 6240785B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- microcavity
- container
- filter
- sample detection
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000001514 detection method Methods 0.000 title claims description 417
- 238000000034 method Methods 0.000 title claims description 134
- 239000012141 concentrate Substances 0.000 claims description 145
- 239000012491 analyte Substances 0.000 claims description 125
- 239000006228 supernatant Substances 0.000 claims description 58
- 239000000706 filtrate Substances 0.000 claims description 57
- 230000000717 retained effect Effects 0.000 claims description 56
- 238000001914 filtration Methods 0.000 claims description 44
- 239000013049 sediment Substances 0.000 claims description 21
- 230000000712 assembly Effects 0.000 claims 1
- 238000000429 assembly Methods 0.000 claims 1
- 239000000523 sample Substances 0.000 description 605
- 235000008504 concentrate Nutrition 0.000 description 130
- 239000007788 liquid Substances 0.000 description 96
- 238000005119 centrifugation Methods 0.000 description 67
- 239000000463 material Substances 0.000 description 45
- 239000012528 membrane Substances 0.000 description 43
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 43
- 244000005700 microbiome Species 0.000 description 42
- 241000588724 Escherichia coli Species 0.000 description 41
- 239000003085 diluting agent Substances 0.000 description 39
- 101000825914 Homo sapiens Small nuclear ribonucleoprotein Sm D3 Proteins 0.000 description 38
- 102100022775 Small nuclear ribonucleoprotein Sm D3 Human genes 0.000 description 38
- -1 mercury ions Chemical class 0.000 description 36
- 230000008569 process Effects 0.000 description 31
- 101100301212 Arabidopsis thaliana RDR2 gene Proteins 0.000 description 30
- 101150030482 SMD1 gene Proteins 0.000 description 30
- 101100517192 Arabidopsis thaliana NRPD1 gene Proteins 0.000 description 29
- 101150094905 SMD2 gene Proteins 0.000 description 29
- 241000894006 Bacteria Species 0.000 description 27
- 239000000758 substrate Substances 0.000 description 27
- 239000000243 solution Substances 0.000 description 26
- 239000000203 mixture Substances 0.000 description 25
- 230000012010 growth Effects 0.000 description 19
- 230000003287 optical effect Effects 0.000 description 19
- 238000011084 recovery Methods 0.000 description 18
- 230000001580 bacterial effect Effects 0.000 description 17
- 230000006870 function Effects 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- 239000000126 substance Substances 0.000 description 16
- 239000004743 Polypropylene Substances 0.000 description 15
- 239000002609 medium Substances 0.000 description 15
- 229920001155 polypropylene Polymers 0.000 description 15
- 238000000879 optical micrograph Methods 0.000 description 14
- 239000000725 suspension Substances 0.000 description 14
- 239000004698 Polyethylene Substances 0.000 description 13
- 238000007689 inspection Methods 0.000 description 13
- 229920000573 polyethylene Polymers 0.000 description 13
- 238000011282 treatment Methods 0.000 description 13
- 238000010828 elution Methods 0.000 description 12
- 239000012530 fluid Substances 0.000 description 12
- 238000000465 moulding Methods 0.000 description 12
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 11
- 239000000975 dye Substances 0.000 description 11
- 235000013305 food Nutrition 0.000 description 11
- 230000005484 gravity Effects 0.000 description 11
- 238000005259 measurement Methods 0.000 description 11
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 11
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 10
- 102000004190 Enzymes Human genes 0.000 description 10
- 108090000790 Enzymes Proteins 0.000 description 10
- 239000000872 buffer Substances 0.000 description 10
- 210000004027 cell Anatomy 0.000 description 10
- 230000000052 comparative effect Effects 0.000 description 10
- 229920003023 plastic Polymers 0.000 description 10
- 239000004033 plastic Substances 0.000 description 10
- 239000013068 control sample Substances 0.000 description 9
- 239000002121 nanofiber Substances 0.000 description 9
- WKBPZYKAUNRMKP-UHFFFAOYSA-N 1-[2-(2,4-dichlorophenyl)pentyl]1,2,4-triazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(CCC)CN1C=NC=N1 WKBPZYKAUNRMKP-UHFFFAOYSA-N 0.000 description 8
- 229920002678 cellulose Polymers 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000002198 insoluble material Substances 0.000 description 8
- 239000004417 polycarbonate Substances 0.000 description 8
- 239000011148 porous material Substances 0.000 description 8
- 238000004062 sedimentation Methods 0.000 description 8
- 230000003068 static effect Effects 0.000 description 8
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 7
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 230000001332 colony forming effect Effects 0.000 description 7
- 239000012153 distilled water Substances 0.000 description 7
- 230000002209 hydrophobic effect Effects 0.000 description 7
- 229920000515 polycarbonate Polymers 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- 238000002145 thermally induced phase separation Methods 0.000 description 7
- 239000002033 PVDF binder Substances 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 239000012298 atmosphere Substances 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 6
- 238000003384 imaging method Methods 0.000 description 6
- 238000002329 infrared spectrum Methods 0.000 description 6
- 239000001301 oxygen Substances 0.000 description 6
- 229910052760 oxygen Inorganic materials 0.000 description 6
- 239000008188 pellet Substances 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 6
- 238000012545 processing Methods 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- 239000003053 toxin Substances 0.000 description 6
- 231100000765 toxin Toxicity 0.000 description 6
- 108700012359 toxins Proteins 0.000 description 6
- 229920000089 Cyclic olefin copolymer Polymers 0.000 description 5
- 102000002464 Galactosidases Human genes 0.000 description 5
- 108010093031 Galactosidases Proteins 0.000 description 5
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 229910052786 argon Inorganic materials 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 230000008878 coupling Effects 0.000 description 5
- 238000010168 coupling process Methods 0.000 description 5
- 238000005859 coupling reaction Methods 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000009832 plasma treatment Methods 0.000 description 5
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 5
- 229920002239 polyacrylonitrile Polymers 0.000 description 5
- 239000004926 polymethyl methacrylate Substances 0.000 description 5
- 229920000098 polyolefin Polymers 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 229920005989 resin Polymers 0.000 description 5
- 239000011347 resin Substances 0.000 description 5
- 229910000077 silane Inorganic materials 0.000 description 5
- 239000002195 soluble material Substances 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 238000003466 welding Methods 0.000 description 5
- 239000004713 Cyclic olefin copolymer Substances 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 241000233866 Fungi Species 0.000 description 4
- 102000029749 Microtubule Human genes 0.000 description 4
- 108091022875 Microtubule Proteins 0.000 description 4
- 229920002274 Nalgene Polymers 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 238000002835 absorbance Methods 0.000 description 4
- 239000013566 allergen Substances 0.000 description 4
- 239000012468 concentrated sample Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000001746 injection moulding Methods 0.000 description 4
- 210000004688 microtubule Anatomy 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 244000052769 pathogen Species 0.000 description 4
- 229920000728 polyester Polymers 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 239000008223 sterile water Substances 0.000 description 4
- 230000003746 surface roughness Effects 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 3
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 3
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 3
- 102000053187 Glucuronidase Human genes 0.000 description 3
- 108010060309 Glucuronidase Proteins 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 230000001133 acceleration Effects 0.000 description 3
- 239000000853 adhesive Substances 0.000 description 3
- 230000001070 adhesive effect Effects 0.000 description 3
- 238000013019 agitation Methods 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 235000013361 beverage Nutrition 0.000 description 3
- 230000006037 cell lysis Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 238000005530 etching Methods 0.000 description 3
- 229960002143 fluorescein Drugs 0.000 description 3
- 238000000799 fluorescence microscopy Methods 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 238000005286 illumination Methods 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 238000011081 inoculation Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 229910021645 metal ion Inorganic materials 0.000 description 3
- 235000015097 nutrients Nutrition 0.000 description 3
- 238000005191 phase separation Methods 0.000 description 3
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 239000012465 retentate Substances 0.000 description 3
- 235000015067 sauces Nutrition 0.000 description 3
- 238000007789 sealing Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000004381 surface treatment Methods 0.000 description 3
- 238000012800 visualization Methods 0.000 description 3
- XTWYTFMLZFPYCI-KQYNXXCUSA-N 5'-adenylphosphoric acid Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O XTWYTFMLZFPYCI-KQYNXXCUSA-N 0.000 description 2
- 229920000178 Acrylic resin Polymers 0.000 description 2
- 239000004925 Acrylic resin Substances 0.000 description 2
- XTWYTFMLZFPYCI-UHFFFAOYSA-N Adenosine diphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(O)=O)C(O)C1O XTWYTFMLZFPYCI-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000193830 Bacillus <bacterium> Species 0.000 description 2
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 2
- 241000193163 Clostridioides difficile Species 0.000 description 2
- 229920000742 Cotton Polymers 0.000 description 2
- 229920001780 ECTFE Polymers 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000588914 Enterobacter Species 0.000 description 2
- 239000004593 Epoxy Substances 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- 241000186781 Listeria Species 0.000 description 2
- 239000004952 Polyamide Substances 0.000 description 2
- 239000004695 Polyether sulfone Substances 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 229920000297 Rayon Polymers 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 241000607598 Vibrio Species 0.000 description 2
- 241000607734 Yersinia <bacteria> Species 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 238000010009 beating Methods 0.000 description 2
- 239000013590 bulk material Substances 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 239000000919 ceramic Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000004737 colorimetric analysis Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 238000005520 cutting process Methods 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 239000012154 double-distilled water Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 235000013601 eggs Nutrition 0.000 description 2
- 230000005670 electromagnetic radiation Effects 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 239000006260 foam Substances 0.000 description 2
- 239000000576 food coloring agent Substances 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 239000003673 groundwater Substances 0.000 description 2
- 239000003966 growth inhibitor Substances 0.000 description 2
- 229920001903 high density polyethylene Polymers 0.000 description 2
- 239000004700 high-density polyethylene Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 238000007373 indentation Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 238000003754 machining Methods 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 230000003472 neutralizing effect Effects 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 229920002492 poly(sulfone) Polymers 0.000 description 2
- 229920002037 poly(vinyl butyral) polymer Polymers 0.000 description 2
- 229920002647 polyamide Polymers 0.000 description 2
- 229920006393 polyether sulfone Polymers 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 description 2
- 229920002689 polyvinyl acetate Polymers 0.000 description 2
- 239000011118 polyvinyl acetate Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000002964 rayon Substances 0.000 description 2
- 238000004626 scanning electron microscopy Methods 0.000 description 2
- VWDWKYIASSYTQR-UHFFFAOYSA-N sodium nitrate Chemical compound [Na+].[O-][N+]([O-])=O VWDWKYIASSYTQR-UHFFFAOYSA-N 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 2
- 235000019345 sodium thiosulphate Nutrition 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 210000004215 spore Anatomy 0.000 description 2
- 238000010998 test method Methods 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- 238000003828 vacuum filtration Methods 0.000 description 2
- 239000013598 vector Substances 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- MIAKOEWBCMPCQR-YBXAARCKSA-N (2s,3r,4s,5r,6r)-2-(4-aminophenoxy)-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(N)=CC=C1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MIAKOEWBCMPCQR-YBXAARCKSA-N 0.000 description 1
- CHJAYYWUZLWNSQ-UHFFFAOYSA-N 1-chloro-1,2,2-trifluoroethene;ethene Chemical group C=C.FC(F)=C(F)Cl CHJAYYWUZLWNSQ-UHFFFAOYSA-N 0.000 description 1
- KKAJSJJFBSOMGS-UHFFFAOYSA-N 3,6-diamino-10-methylacridinium chloride Chemical compound [Cl-].C1=C(N)C=C2[N+](C)=C(C=C(N)C=C3)C3=CC2=C1 KKAJSJJFBSOMGS-UHFFFAOYSA-N 0.000 description 1
- OPIFSICVWOWJMJ-AEOCFKNESA-N 5-bromo-4-chloro-3-indolyl beta-D-galactoside Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CNC2=CC=C(Br)C(Cl)=C12 OPIFSICVWOWJMJ-AEOCFKNESA-N 0.000 description 1
- QULZFZMEBOATFS-DISONHOPSA-N 7-[(2s,3r,4s,5r,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyphenoxazin-3-one Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1OC1=CC=C(N=C2C(=CC(=O)C=C2)O2)C2=C1 QULZFZMEBOATFS-DISONHOPSA-N 0.000 description 1
- 241000238876 Acari Species 0.000 description 1
- 241000589291 Acinetobacter Species 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 102000002281 Adenylate kinase Human genes 0.000 description 1
- 108020000543 Adenylate kinase Proteins 0.000 description 1
- 229930195730 Aflatoxin Natural products 0.000 description 1
- XWIYFDMXXLINPU-UHFFFAOYSA-N Aflatoxin G Chemical compound O=C1OCCC2=C1C(=O)OC1=C2C(OC)=CC2=C1C1C=COC1O2 XWIYFDMXXLINPU-UHFFFAOYSA-N 0.000 description 1
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 241000193738 Bacillus anthracis Species 0.000 description 1
- 241000193755 Bacillus cereus Species 0.000 description 1
- 241000589876 Campylobacter Species 0.000 description 1
- 241000589875 Campylobacter jejuni Species 0.000 description 1
- 241000193403 Clostridium Species 0.000 description 1
- 241000193468 Clostridium perfringens Species 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 241000989055 Cronobacter Species 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- 208000001840 Dandruff Diseases 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 208000004232 Enteritis Diseases 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 241000194033 Enterococcus Species 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- LLQPHQFNMLZJMP-UHFFFAOYSA-N Fentrazamide Chemical compound N1=NN(C=2C(=CC=CC=2)Cl)C(=O)N1C(=O)N(CC)C1CCCCC1 LLQPHQFNMLZJMP-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 229920004142 LEXAN™ Polymers 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000589248 Legionella Species 0.000 description 1
- 239000004418 Lexan Substances 0.000 description 1
- 101000761400 Loxosceles arizonica Dermonecrotic toxin LarSicTox-alphaIB1ai Proteins 0.000 description 1
- 101000678291 Loxosceles intermedia Dermonecrotic toxin LiSicTox-alphaII1 Proteins 0.000 description 1
- 101000936511 Loxosceles intermedia Dermonecrotic toxin LiSicTox-betaIA1i Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- 241000192041 Micrococcus Species 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 241001263478 Norovirus Species 0.000 description 1
- 241000714209 Norwalk virus Species 0.000 description 1
- YJQPYGGHQPGBLI-UHFFFAOYSA-N Novobiocin Natural products O1C(C)(C)C(OC)C(OC(N)=O)C(O)C1OC1=CC=C(C(O)=C(NC(=O)C=2C=C(CC=C(C)C)C(O)=CC=2)C(=O)O2)C2=C1C YJQPYGGHQPGBLI-UHFFFAOYSA-N 0.000 description 1
- 244000131316 Panax pseudoginseng Species 0.000 description 1
- 235000005035 Panax pseudoginseng ssp. pseudoginseng Nutrition 0.000 description 1
- 235000003140 Panax quinquefolius Nutrition 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 108020005120 Plant DNA Proteins 0.000 description 1
- 108010093965 Polymyxin B Proteins 0.000 description 1
- 102000029797 Prion Human genes 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- 241000702670 Rotavirus Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241001354013 Salmonella enterica subsp. enterica serovar Enteritidis Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000607768 Shigella Species 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- 241000271897 Viperidae Species 0.000 description 1
- 238000000441 X-ray spectroscopy Methods 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229940023020 acriflavine Drugs 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000005409 aflatoxin Substances 0.000 description 1
- 239000003570 air Substances 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 238000005102 attenuated total reflection Methods 0.000 description 1
- 229960003644 aztreonam Drugs 0.000 description 1
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 1
- 229940065181 bacillus anthracis Drugs 0.000 description 1
- 210000004666 bacterial spore Anatomy 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- 238000010256 biochemical assay Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 235000008429 bread Nutrition 0.000 description 1
- 229960001506 brilliant green Drugs 0.000 description 1
- HXCILVUBKWANLN-UHFFFAOYSA-N brilliant green cation Chemical compound C1=CC(N(CC)CC)=CC=C1C(C=1C=CC=CC=1)=C1C=CC(=[N+](CC)CC)C=C1 HXCILVUBKWANLN-UHFFFAOYSA-N 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000003490 calendering Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 235000013351 cheese Nutrition 0.000 description 1
- 238000003486 chemical etching Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- CYDMQBQPVICBEU-UHFFFAOYSA-N chlorotetracycline Natural products C1=CC(Cl)=C2C(O)(C)C3CC4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-UHFFFAOYSA-N 0.000 description 1
- CYDMQBQPVICBEU-XRNKAMNCSA-N chlortetracycline Chemical compound C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-XRNKAMNCSA-N 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000009535 clinical urine test Methods 0.000 description 1
- 239000005515 coenzyme Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 235000013409 condiments Nutrition 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 235000015142 cultured sour cream Nutrition 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000000645 desinfectant Substances 0.000 description 1
- 235000011850 desserts Nutrition 0.000 description 1
- 230000014670 detection of bacterium Effects 0.000 description 1
- 230000023077 detection of light stimulus Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000000741 diarrhetic effect Effects 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 229910001882 dioxygen Inorganic materials 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 235000021186 dishes Nutrition 0.000 description 1
- BVTBRVFYZUCAKH-UHFFFAOYSA-L disodium selenite Chemical compound [Na+].[Na+].[O-][Se]([O-])=O BVTBRVFYZUCAKH-UHFFFAOYSA-L 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 238000000840 electrochemical analysis Methods 0.000 description 1
- 238000001523 electrospinning Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 231100000776 exotoxin Toxicity 0.000 description 1
- 239000002095 exotoxin Substances 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 238000007667 floating Methods 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 238000001917 fluorescence detection Methods 0.000 description 1
- 238000009615 fourier-transform spectroscopy Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 238000001730 gamma-ray spectroscopy Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 235000008434 ginseng Nutrition 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 235000011868 grain product Nutrition 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 230000005660 hydrophilic surface Effects 0.000 description 1
- 230000005661 hydrophobic surface Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000010820 immunofluorescence microscopy Methods 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 239000002917 insecticide Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000004898 kneading Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 238000000608 laser ablation Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 235000014666 liquid concentrate Nutrition 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 229940073577 lithium chloride Drugs 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 229940002712 malachite green oxalate Drugs 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 238000010907 mechanical stirring Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000005459 micromachining Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- MHWLWQUZZRMNGJ-UHFFFAOYSA-N nalidixic acid Chemical compound C1=C(C)N=C2N(CC)C=C(C(O)=O)C(=O)C2=C1 MHWLWQUZZRMNGJ-UHFFFAOYSA-N 0.000 description 1
- 229960000210 nalidixic acid Drugs 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 229960002950 novobiocin Drugs 0.000 description 1
- YJQPYGGHQPGBLI-KGSXXDOSSA-N novobiocin Chemical compound O1C(C)(C)[C@H](OC)[C@@H](OC(N)=O)[C@@H](O)[C@@H]1OC1=CC=C(C(O)=C(NC(=O)C=2C=C(CC=C(C)C)C(O)=CC=2)C(=O)O2)C2=C1C YJQPYGGHQPGBLI-KGSXXDOSSA-N 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000013110 organic ligand Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000033116 oxidation-reduction process Effects 0.000 description 1
- 239000011224 oxide ceramic Substances 0.000 description 1
- 229910052574 oxide ceramic Inorganic materials 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 235000015927 pasta Nutrition 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 229960004624 perflexane Drugs 0.000 description 1
- ZJIJAJXFLBMLCK-UHFFFAOYSA-N perfluorohexane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F ZJIJAJXFLBMLCK-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 238000001020 plasma etching Methods 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 229920006267 polyester film Polymers 0.000 description 1
- 229920005594 polymer fiber Polymers 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 229920000024 polymyxin B Polymers 0.000 description 1
- 229960005266 polymyxin b Drugs 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 1
- BFPJYWDBBLZXOM-UHFFFAOYSA-L potassium tellurite Chemical compound [K+].[K+].[O-][Te]([O-])=O BFPJYWDBBLZXOM-UHFFFAOYSA-L 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000011045 prefiltration Methods 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 235000013324 preserved food Nutrition 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 235000021067 refined food Nutrition 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 239000006254 rheological additive Substances 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- 229940081623 rose bengal Drugs 0.000 description 1
- 229930187593 rose bengal Natural products 0.000 description 1
- AZJPTIGZZTZIDR-UHFFFAOYSA-L rose bengal Chemical compound [K+].[K+].[O-]C(=O)C1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1C1=C2C=C(I)C(=O)C(I)=C2OC2=C(I)C([O-])=C(I)C=C21 AZJPTIGZZTZIDR-UHFFFAOYSA-L 0.000 description 1
- STRXNPAVPKGJQR-UHFFFAOYSA-N rose bengal A Natural products O1C(=O)C(C(=CC=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 STRXNPAVPKGJQR-UHFFFAOYSA-N 0.000 description 1
- 238000004439 roughness measurement Methods 0.000 description 1
- 238000011076 safety test Methods 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 229920003031 santoprene Polymers 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 235000014102 seafood Nutrition 0.000 description 1
- 210000002374 sebum Anatomy 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 229940082569 selenite Drugs 0.000 description 1
- MCAHWIHFGHIESP-UHFFFAOYSA-L selenite(2-) Chemical compound [O-][Se]([O-])=O MCAHWIHFGHIESP-UHFFFAOYSA-L 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- FHHPUSMSKHSNKW-SMOYURAASA-M sodium deoxycholate Chemical compound [Na+].C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 FHHPUSMSKHSNKW-SMOYURAASA-M 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 235000010344 sodium nitrate Nutrition 0.000 description 1
- 239000004317 sodium nitrate Substances 0.000 description 1
- 229940001516 sodium nitrate Drugs 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 229960001471 sodium selenite Drugs 0.000 description 1
- 239000011781 sodium selenite Substances 0.000 description 1
- 235000015921 sodium selenite Nutrition 0.000 description 1
- HAEPBEMBOAIUPN-UHFFFAOYSA-L sodium tetrathionate Chemical compound O.O.[Na+].[Na+].[O-]S(=O)(=O)SSS([O-])(=O)=O HAEPBEMBOAIUPN-UHFFFAOYSA-L 0.000 description 1
- 229940001474 sodium thiosulfate Drugs 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000014347 soups Nutrition 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 235000013599 spices Nutrition 0.000 description 1
- 230000004763 spore germination Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- IHCDKJZZFOUARO-UHFFFAOYSA-M sulfacetamide sodium Chemical compound O.[Na+].CC(=O)[N-]S(=O)(=O)C1=CC=C(N)C=C1 IHCDKJZZFOUARO-UHFFFAOYSA-M 0.000 description 1
- SEEPANYCNGTZFQ-UHFFFAOYSA-N sulfadiazine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)NC1=NC=CC=N1 SEEPANYCNGTZFQ-UHFFFAOYSA-N 0.000 description 1
- 229960004306 sulfadiazine Drugs 0.000 description 1
- 229960002135 sulfadimidine Drugs 0.000 description 1
- ASWVTGNCAZCNNR-UHFFFAOYSA-N sulfamethazine Chemical compound CC1=CC(C)=NC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 ASWVTGNCAZCNNR-UHFFFAOYSA-N 0.000 description 1
- 239000002344 surface layer Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 238000012956 testing procedure Methods 0.000 description 1
- HPQYKCJIWQFJMS-UHFFFAOYSA-L tetrathionate(2-) Chemical compound [O-]S(=O)(=O)SSS([O-])(=O)=O HPQYKCJIWQFJMS-UHFFFAOYSA-L 0.000 description 1
- 238000002076 thermal analysis method Methods 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 229920002725 thermoplastic elastomer Polymers 0.000 description 1
- 229920001187 thermosetting polymer Polymers 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000012876 topography Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 239000001974 tryptic soy broth Substances 0.000 description 1
- 108010050327 trypticase-soy broth Proteins 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 238000012211 viral plaque assay Methods 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
- 235000013618 yogurt Nutrition 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5021—Test tubes specially adapted for centrifugation purposes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
- C12Q1/10—Enterobacteria
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0848—Specific forms of parts of containers
- B01L2300/0851—Bottom walls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0848—Specific forms of parts of containers
- B01L2300/0858—Side walls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/12—Specific details about materials
- B01L2300/123—Flexible; Elastomeric
Description
本発明は一般的に、細菌などの、目的の検体の検出、特に、サンプル体積が比較的大きい場合に目的の検体を迅速に検出するためのシステム及び方法に関する。
微生物(例えば、細菌、ウイルス、菌類、胞子など)、及び/又は他の目的の検体(例えば、毒素、アレルゲン、ホルモンなど)の存在の水性サンプルを試験することは、食物及び水安全性、感染病分析、及び環境監視を含む、様々な用途において重要であり得る。例えば、大衆によって消費される、食物、飲料、及び/又は公衆飲料などの可食サンプルは、微生物又は他の検体を含有又は捕捉してもよく、これは、これらが存在する環境と関連して繁殖又は成長し得る。このような増殖により、毒素を産生したり感染可能な量にまで分裂しうる病原性生物の増殖につながりうる。更なる例として、各種の分析法を非食品試料(例えば、地下水、尿など)の試料に対して行うことによって、試料が特定の検体を含んでいるか否かを判定することができる。例えば、地下水の微生物又は化学毒素に関する検査、及び(例えば、糖尿病、妊娠などの)診断に有効である様々な診断指標に関する尿検査が可能である。
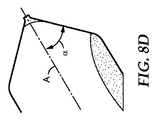
本開示のいくつかの態様は、サンプルを収容及び濃縮して、目的の検体が存在する場合にはそれを検出するように適合されたサンプル検出容器を提供する。容器は、サンプルを受容するように構成された開放端部及びマイクロキャビティを含む閉鎖端部を含み得る。マイクロキャビティは、開口上部、底部、及びマイクロキャビティの横断面に対して垂直である長手方向軸を含み得る。マイクロキャビティは、目的のサンプルを保持するための毛管力をもたらすように構成され得る。容器は、マイクロキャビティへと延在する壁部を更に含むことができ、マイクロキャビティの開口上部と隣接して位置する該壁部のうち少なくとも一部分は、マイクロキャビティの長手方向軸に対して有効角度αで配向される勾配を有する。有効角度αは45°より大きく、90°より小さくすることができ、有効角度αで配向される、マイクロキャビティの開口上部と隣接して位置する壁部のうち少なくとも前記部分は、マイクロキャビティの開口上部の横断寸法の少なくとも5倍の長さを有し得る。
V=2ga2(ρ1−ρ2)/9η (1)
式中、g=加速度(cm/s2)(すなわち、G力=gs*980cm/s2)、ρ1=検体密度(g/cm3)、ρ2=サンプル媒体の密度(例えば希釈剤)(g/cm3)、η=粘度係数(ポワズ)(g/cm/s)、及びa=検体半径(cm)(球形であることを想定する)である。いくつかの遠心分離機では、一定の遠心力を作用させることにおいて、回転速度(例えば、1分当たりの回転(RPM))、及び回転中心からのサンプルの距離によって決定され得る(すなわち、サンプルは、これがローターから離れている場合に同じ回転速度においてより高いG力を経験する)。結果として、マイクロキャビティ136から最も遠い、サンプル152中に位置し得る目的の検体を回収するために、ローターの中心とローターに最も近く位置するサンプル152の高さとの距離が計算されて、目的の検体の回収を最大化するためにサンプル152中において目的の検体を最も遠い距離で移動させるために必要なG力を推定することができる。
1.サンプルを収容及び濃縮して、目的の検体が存在する場合にはそれを検出するように適合されたサンプル検出容器であり、該容器が、
サンプルを受容するように構成された開放端部と、
マイクロキャビティを含む閉鎖端部であって、該マイクロキャビティは開口上部、底部、及びマイクロキャビティの横断面に対して垂直である長手方向軸を含み、目的のサンプルを保持するための毛管力をもたらすように構成されたマイクロキャビティである、閉鎖端部と、
マイクロキャビティまで延在する壁部であって、マイクロキャビティの開口上部と隣接して位置する該壁部のうち少なくとも一部分は、マイクロキャビティの長手方向軸に対して有効角度αで配向される勾配を有し、該有効角度αは45°より大きく、90°より小さく、有効角度αで配向される、マイクロキャビティの開口上部と隣接して位置する壁部のうち少なくとも一部分は、マイクロキャビティの開口上部の横断寸法の少なくとも5倍の長さを有する壁部と、を含む。
2.実施形態1のサンプル検出容器であって、長手方向軸はマイクロキャビティの開口上部及び底部を通過する。
3.実施形態1又2のサンプル検出容器であって、マイクロキャビティは単一のマイクロキャビティである。
4.実施形態1〜3のいずれかのサンプル検出容器であって、サンプル検出容器は10以下のマイクロキャビティを含む。
5.実施形態1〜4のいずれかのサンプル検出容器であって、サンプル検出容器は5以下のマイクロキャビティを含む。
6.実施形態1〜5のいずれかのサンプル検出容器であって、マイクロキャビティは、サンプルを含む容器が遠心力を受けるときサンプルの濃縮物を受容するように構成され、かつ該マイクロキャビティは通常の重力下でサンプルの濃縮物の少なくとも一部分を保持するように適合される。
7.実施形態1〜6のいずれかのサンプル検出容器であって、有効角度αは、遠心力下でマイクロキャビティ内にサンプルを濃縮させるのに十分でありながら、サンプル検出容器の反転時に、マイクロキャビティの開口上部によって画定される面の上方に位置する液体が過剰にならないように、上澄みを十分に排流してマイクロキャビティ内にサンプルの濃縮物を保持するのに十分な角度である。
8.実施形態1〜7のいずれかのサンプル検出容器であって、マイクロキャビティは体積を有し、マイクロキャビティ及び壁部は、マイクロキャビティの体積に対する、サンプル検出容器内に保持される濃縮物の体積の比が2以下となるように構成される。
9.実施形態1〜8のいずれかのサンプル検出容器であって、マイクロキャビティは体積を有し、マイクロキャビティ及び壁部は、マイクロキャビティの体積に対する、サンプル検出容器内に保持される濃縮物の体積の比が1.5以下となるように構成される。
10.実施形態1〜9のいずれかのサンプル検出容器であって、マイクロキャビティは体積を有し、マイクロキャビティ及び壁部は、マイクロキャビティの体積に対する、サンプル検出容器内に保持される濃縮物の体積の比が1以下となるように構成される。
11.実施形態1〜10のいずれかのサンプル検出容器であって、有効角度αは少なくとも50°である。
12.実施形態1〜11のいずれかのサンプル検出容器であって、有効角度αは少なくとも60°である。
13.実施形態1〜12のいずれかのサンプル検出容器であって、有効角度αは80°以下である。
14.実施形態1〜13のいずれかのサンプル検出容器であって、有効角度αは50°〜80°の範囲である。
15.実施形態1〜14のいずれかのサンプル検出容器であって、マイクロキャビティが更に側壁を含み、該側壁は、少なくとも10°の抜け勾配を有する。
16.実施形態1〜15のいずれかのサンプル検出容器であって、サンプル検出容器は少なくとも1種のポリオレフィン、環状オレフィンコポリマー、ポリカーボネート、アクリル樹脂、ポリスチレン、又はこれらの組み合わせから形成される。
17.実施形態1〜16のいずれかのサンプル検出容器であって、マイクロキャビティの開口上部と隣接して位置する壁部のうち少なくとも一部分は、少なくとも65°の静的な水表面接触角を有する。
18.実施形態1〜17のいずれかのサンプル検出容器であって、マイクロキャビティの開口上部と隣接して位置する壁部のうち少なくとも一部分は、少なくと25°の動的な水表面後退接触角を有する。
19.実施形態1〜18のいずれかのサンプル検出容器であって、マイクロキャビティの開口上部と隣接して位置する壁部のうち少なくとも一部分は、500nm未満の粗さ平均値(Ra)を特徴とする表面粗さを有する。
20.実施形態1〜19のいずれかのサンプル検出容器であって、マイクロキャビティは1マイクロリットル以下の容積に規定される。
21.実施形態1〜20のいずれかのサンプル検出容器であって、マイクロキャビティは100ナノリットル以下の容積に規定される。
22.実施形態1〜21のいずれかのサンプル検出容器であって、マイクロキャビティは10ナノリットル以下の容積に規定される。
23.実施形態1〜22のいずれかのサンプル検出容器であって、マイクロキャビティの底部は、マイクロキャビティの内容物がサンプル検出容器の外側から見えるように実質的に透明である。
24.実施形態23のサンプル検出容器であって、マイクロキャビティの側壁が実質的に不透明である。
25.実施形態1〜24のいずれかのサンプル検出容器であって、マイクロキャビティは試薬を含む。
26.実施形態25のサンプル検出容器であって、試薬は少なくとも1つの基質、酵素、増殖試薬、細胞溶解試薬、又はこれらの組み合わせを含む。
27.実施形態1〜26のいずれかのサンプル検出容器であって、目的の検体は少なくとも1つの大腸菌及び大腸菌類を含む。
28.実施形態1〜27のいずれかのサンプル検出容器であって、サンプルは水である。
29.サンプル中に目的の検体が存在する場合に、それを検出するためのシステムであって、該システムは、
フィルター部を含む第1の容器アセンブリであって、フィルター部はフィルターを含み、フィルターは第1の側部を有し、第1の側部上にサンプルの濾過物を含む、第1の容器アセンブリと、
実施形態1〜28のいずれかのサンプル検出容器に連結されたフィルター部を含む第2の容器アセンブリであって、フィルター部及びサンプル検出容器が、フィルターの第1の側部がサンプル検出容器のマイクロキャビティと面するように、一緒に連結される第2の容器アセンブリと、を含む。
30.サンプル中に目的の検体が存在する場合にそれを検出する方法であって、該方法は、
実施形態1〜28のいずれかのサンプル検出容器を提供する工程と、
サンプル検出容器内にサンプルを配置する工程と、
マイクロキャビティに向けてサンプル検出容器を遠心し、サンプルの沈降物及び上澄みを形成する工程と、
サンプル検出容器を遠心した後、サンプル検出容器を反転させ、サンプルの濃縮物がマイクロキャビティに保持されるように、マイクロキャビティから上澄みの少なくとも一部分をデカントする工程であって、濃縮物が沈降物を含む工程と、を含む。
31.実施形態30の方法であって、目的の検体についてマイクロキャビティ内の濃縮物を検査する工程を更に含む。
32.サンプル中に目的の検体が存在する場合にそれを検出する方法であって、該方法は、
フィルター部を含む第1の容器アセンブリを提供する工程であって、フィルター部はサンプルからの目的の検体を保持するように構成されたフィルターを含み、フィルターは第1の側部を有し、第1の側部上にサンプルの濾過物を含む、工程と、
フィルター部を実施形態1〜28のいずれかのサンプル検出容器と連結して第2の容器アセンブリを形成する工程であって、フィルターの第1の側部がサンプル検出容器のマイクロキャビティに面するように、フィルター部とサンプル検出容器とを一緒に連結する、工程と、
マイクロキャビティに向けて第2の容器アセンブリを遠心し、濾過物をフィルターからサンプル検出容器のマイクロキャビティに移動させ、サンプルの沈降物及び上澄みを形成する工程と、
第2の容器アセンブリを遠心した後、第2の容器アセンブリを反転させ、サンプルの濃縮物が第2の容器アセンブリのサンプル検出容器のマイクロキャビティに保持されるように、サンプル検出容器から上澄みの少なくとも一部分をデカントする工程であって、濃縮物が沈降物を含む、工程と、を含む。
33.実施形態32の方法であって、目的の検体についてマイクロキャビティ内の濃縮物を検査する工程を更に含む。
34.サンプル中の目的の検体の存在を検出する方法であって、存在する場合、該方法は、
サンプルを収容するように適合された貯蔵部、及び貯蔵部に取り外し可能に連結されるように適合されたフィルター部を含む第1の容器アセンブリを提供する工程であって、該フィルター部はサンプルから目的の検体を保持するように構成されたフィルターを含み、該フィルターは第1の側部を含む、工程と、
貯蔵部からフィルターの第1の側部へと第1方向にサンプルを移動させることによってサンプルを濾過し、フィルターの第1の側部にサンプルの濾過物を形成する一方でサンプルの濾液を除去する工程と、
第1の容器アセンブリの貯蔵部及びフィルター部を分離する工程と、
フィルター部を実施形態1〜28のいずれかのサンプル検出容器と連結して第2の容器アセンブリを形成する工程であって、フィルターの第1の側部がサンプル検出容器のマイクロキャビティに面するように、フィルター部とサンプル検出容器とを一緒に連結する、工程と、
第2の容器アセンブリを遠心して、フィルターから第2の容器アセンブリのサンプル検出容器のマイクロキャビティへと第2の方向に濾過物を移動させ、サンプルの沈降物及び上澄みを形成する工程であって、第2の方向は第1の方向と異なる、工程と、
第2の容器アセンブリを遠心した後、第2の容器アセンブリを反転させ、サンプルの濃縮物がサンプル検出容器のマイクロキャビティに保持されるように、サンプル検出容器からサンプルの上澄みの少なくとも一部分をデカントする工程であって、濃縮物が沈降物を含む工程と、
目的の検体に関して、マイクロキャビティの濃縮物を検査する工程と、を含む。
35.実施形態31、33及び34のいずれかの方法であって、目的の検体が存在する場合、それを3時間未満でマイクロキャビティ内で検出する。
36.実施形態31、33〜35のいずれかの方法であって、反転後及び検査前にサンプル検出容器を培養する工程を更に含む。
37.実施形態31、33〜36のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、吸収度、透過性、蛍光、化学発光、及びこれらの組み合わせのうち少なくとも1つに関して検査する工程を含む。
38.実施形態31、33〜37のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程が、マイクロキャビティ内の濃縮物を光学的に検査する工程を含む。
39.実施形態38の方法であって、光学的に検査する工程が、マイクロキャビティ内の濃縮物の蛍光性を検査する工程を含む。
40.実施形態38又は39の方法であって、光学的に検査する工程は、
マイクロキャビティ内の濃縮物に向かって第1の周波数で電磁エネルギーを向ける工程と、
マイクロキャビティ内の濃縮物から放出される、第2の周波数の電磁エネルギーを検出する工程と、を含む。
41.実施形態38の方法であって、光学的に検査する工程は、濃縮物を比色的に検査する工程を含む。
42.実施形態38又は41の方法であって、光学的に検査する工程は、
マイクロキャビティ内の濃縮物に対して、広範な周波数の電磁波を放射する工程と、
マイクロキャビティ内の濃縮物の少なくとも一部分の透過性及び吸収度の少なくとも一方を検出する工程と、を含む。
43.実施形態31、33〜42のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、目的の検体の指標である光を検出する工程を含む。
44.実施形態31、33〜43のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、吸収度、反射率及び蛍光のうち少なくとも1つによって光を検出する工程を含む。
45.実施形態31、33〜44のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、目的の検体を免疫学的に検出する工程を含む。
46.実施形態31、33〜45のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、目的の検体を遺伝学的に検出する工程を含む。
47.実施形態31、33〜46のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、サンプル中の生細胞から放出された酵素を検出する工程を含む。
48.実施形態31、33〜47のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、目的の検体を比色、蛍光定量、発光測定、又はこれらの組み合わせにより検出する工程を含む。
49.実施形態31、33〜48のいずれかの方法であって、マイクロキャビティは、サンプル検出容器の第1の側部に形成され、第1の側部は遠心中にフィルター部に面するように配置され、サンプル検出容器は第1の側部と反対側の第2の側部を更に含み、マイクロキャビティ内の濃縮物を検査する工程は、マイクロキャビティ内の濃縮物をサンプル検出容器の第2の側部から検査する工程を含む。
50.実施形態49の方法であって、検出部の第2の側部は、実質的に透明な光学窓を含む。
51.実施形態50の方法であって、光学窓は、マイクロキャビティの少なくとも一部分と同一の広がりを有する。
52.実施形態31、33〜51のいずれかの方法であって、第2の容器アセンブリのフィルター部及びサンプル検出容器が、遠心工程、反転工程、及び検査工程中に一緒に連結されたままである。
53.実施形態31、33〜52のいずれかの方法であって、マイクロキャビティ内の濃縮物を検査する工程は、第2の容器アセンブリのサンプル検出容器が第2の容器アセンブリのフィルター部に連結されたままである間に行われ、それにより上澄みが湿度リザーバとして機能する。
54.実施形態31、33〜53のいずれかの方法であって、上澄みが湿度リザーバとして機能するように、検査工程中、第2の容器アセンブリ内に位置する。
55.実施形態30〜54のいずれかの方法であって、フィルター部に溶出溶液を添加する工程を更に含み、溶出溶液はフィルターから濾過物を溶出させるように適合される。
56.実施形態30〜55のいずれかの方法であって、フィルター部に溶出溶液を添加する工程は、フィルター部をサンプル検出容器に連結して第2の容器アセンブリを形成する前に行われる。
57.実施形態30〜56のいずれかの方法であって、遠心工程の前に第2の容器アセンブリのうち少なくともフィルター部を攪拌する工程を更に含み、攪拌はフィルターから濾過物を取り除くのを助ける。
58.実施形態30〜57のいずれかの方法であって、第2の容器アセンブリを遠心する前にフィルター部に希釈剤を添加する工程を更に含む。
59.実施形態30〜58のいずれかの方法であって、第2の容器アセンブリを遠心する前に第2の容器アセンブリを攪拌する工程を更に含む。
60.実施形態30〜59のいずれかの方法であって、攪拌は第2の容器アセンブリが第1の向きにあるときに行われ、遠心は第2の向きで行われ、第2の向きは第1の向きと異なる。
61.実施形態30〜60のいずれかの方法であって、サンプル中に微生物が存在する場合にそれを増殖させるため、遠心前に容器を培養する工程を更に含む。
62.実施形態29のシステム又は実施形態30〜61のいずれかの方法であって、フィルターは、ポリオレフィン多孔質膜、エチレンクロロトリフルオロエチレンコポリマー多孔質膜、ポリアクリロニトリル多孔質膜、ポリカーボネート多孔質膜、ポリエステル多孔質膜、セルロースエステル多孔質膜、ポリアミド多孔質膜、ポリエーテルスルホン多孔質膜、ポリスルホン多孔質膜、ポリフッ化ビニリデン(PVDF)多孔質膜、ポリアクリロニトリルナノ繊維膜、PVDFナノ繊維膜、セルロースエステルナノ繊維膜、ポリビニルアセテート、又はアルコールナノ繊維膜、若しくはポリビニルブチラールナノ繊維膜、又はこれらの組み合わせのうちの少なくとも1つを含む。
63.実施形態29若しくは62のシステム又は実施形態30〜62のいずれかの方法であって、該フィルターは、
熱相分離(TIPS)プロセスによって形成される膜と、
ナノ繊維膜のうちの少なくとも一方と、を含む。
64.実施形態29、62及び63のいずれかのシステム、又は実施形態30〜63のいずれかの方法であって、フィルターは、多孔性ごとの複数のゾーンを含み、フィルターの第1の側部が最小の多孔性ゾーンを含む。
・SMD:単一マイクロキャビティのデバイス
・マイクロキャビティ:マイクロキャビティは熱可塑性又は熱硬化性材料で適切に形成される。マイクロキャビティは、開口上部、1つ以上の側壁及び底部(すなわち、底)を有する、二次元(例えば、断面)形状(例えば、正方形、六角形、円形)であることを特徴とする。マイクロキャビティの概算の体積は、以下の式で計算される:
V=1/3h(A1+A2+√A1.A2)
ここで、hは深さ/高さ、A1は底部の面積、及びA2は開口上部の面積である。
・COC−S−04−透明な環状オレフィンコポリマー、高水分バリア;Topas(登録商標)8007S−04、Topas Advanced Polymers Gmbh(Florence,KY)製
・PMMA−WF100ポリ(メチルメタクリレート)、Mitsubishi Rayon Co Ltd(Tokyo,Japan)製
・Colilert(商標)培養物−Colilert(商標)大腸菌類/大腸菌試験培養物、IDEXX Laboratories,Inc.(Westbrook,ME)製。培養物は、実施例のため、100mLの滅菌水として、100mLサンプルとしてSnap Packからの培養物を混合して調製された。
・フィルターA−使用される装置にフィットする30mm直径、PCT特許公開番号第WO 2011/156251号、表題「Filtration Methods and Devices」の実施例及び記載に従って調製されたポリエチレングリコール(R1933−7/PEG)でコーティングされた0.34μmマルチゾーンTIPS膜。膜は、PCT特許公開番号第WO 2011/153085号、表題「PROCESS FOR MAKING COATED POROUS MATERIALS」に記載の材料及び手順を使用して、ポリエチレングリコール(PEG)でコーティングされた。
・フィルターB−使用される装置にフィットする30mm直径のIsopore膜、0.40μmポリカーボネート、Millipore(Billerica,MA)製
・フィルターC−使用される装置にフィットする30mm直径、MF−Millipore Membrane(型番HAWP、0.45μm混合セルロースエステル)、Millipore(Billerica,MA)製
・多目的遠心管−双方ともEppendorf(Hauppauge NY)により製造された、スイングバケットローター(A−4−81)を備える、多目的遠心管(モデル5810R)
・イメージングシステム−照明(照明イメージャ)又は蛍光灯(蛍光イメージャ)のいずれかを使用した、照明/蛍光ステレオ顕微鏡モデルSteREO Lumar.V12、画像はAxioCam MRc 5カメラ及びAxioVision Release 4.6.3プログラムを用いて取得した(全てCarl Zeiss Microimaging,Inc.,Thornwood NJから入手)。
・真空アセンブリ−真空アセンブリ−AIR CADET真空/圧力ステーション、型番420−3901、Thermo Fisher Scientific Inc.,(Waltham,MA)製
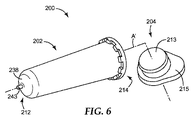
1−射出成形された単一マイクロキャビティを有する1.5mLサンプル検出容器(SMD1〜SMD2)
単一マイクロキャビティを有する1.5mLサンプル検出容器を射出成形するため、精密機械加工を使用して単一マイクロキャビティを含む挿入工具を作製した。最初に、単一マイクロキャビティ(図15A及び図15B)を有する光学的に透明な1.5mL容器を成形するための単一マイクロキャビティデバイスのコア(SMDコア1)を作製するCAD設計を行った。設計は、45°の有効角度αを有する容器の底に、円錐台状のマイクロキャビティを成形することを目的とした。容器の口縁は、標準の1.5mL微量遠心管容器のキャップを用いて閉じることができるように設計した。CADファイルを使用して、精密機械加工により鋼鉄製のコアを作製し、コアに所望の形状の反転型を形成した。成形型は、様々なマイクロキャビティ、例えばマイクロキャビティの寸法、マイクロキャビティの形状、有効角度などを有する容器を成形するために、単一マイクロキャビティを成形するための挿入工具が他の挿入工具と互換可能であるように設計した。
それぞれ有効角度45°及び60°を有する容器の底に、円錐台状のマイクロキャビティを有する10mL容器を成形するため、SMDコア3(図17A及び図17B)及びSMDコア4(図18A及び図18B)を作製するCAD設計を行った。各容器の口縁は、図1、図2、図4及び図12〜図14に関して上述したように、キャップ(例えば、図1、図2及び図4のキャップ104を参照)を用いて閉じることも、フィルターホルダー(例えば、図10〜図14のフィルターハウジング332を参照)と連結することもできるようなツイストロック機構を有するように設計した。SMDコア4(SMD4)は、図1〜図3、図4、図5及び図12〜図14のサンプル検出容器102と実質的に同様であった。成形された容器SMD3及びSMD4内の単一マイクロキャビティの特徴を表2に示す。
成形容器をマイクロキャビティ上方で切断した後、アルミニウムスタブに置き、金/パラジウムでスパッタコーティングした。JSM−7001F走査電子顕微鏡(JEOL Ltd、Tokyo,Japan)を使用して容器を検査した。初回の検査後、ディスクを液体窒素に浸しながらハンマーで叩き、横断面で切断した。断面を別のスタブに置いてスパッタコーティングし、先に述べたように検査した。スタブの表面に対して視野角70°で表面画像を撮影した。切断面の表面に対して直角な視野角で断面画像を撮影した。倍率50倍及び150倍で画像を取得した。
30mm膜フィルター(例えば、図10及び図12〜図14のフィルター312を参照)を保持するためのフィルターホルダー(図10〜図14のフィルターハウジング332を含むフィルター部308など)、フィルターホルダーに連結される、コネクタ(図10、図11、及び図14のコネクタ322など)及びガスケット(図10のガスケット324など)を含むフィルター接続アセンブリ(図10、図11及び図14のフィルター接続アセンブリ320など)、並びに膜フィルターとフィルター接続アセンブリとの間に封止を付与するガスケット(図10及び図12のガスケット335など)を作製するため、CAD設計を行った。フィルター接続アセンブリのガスケット(すなわち、図10のガスケット324)を使用すると、フィルター接続アセンブリの残部及びフィルターホルダーをサンプルボトル(例えば、図10〜図11及び図14の貯蔵部306)に連結することができる。フィルターホルダー及びコネクタは、ポリプロピレンを使用して射出成形により作製し、ガスケットは医療等級のSANTOPRENE(登録商標)181−55MED熱可塑性エラストマー(ExxonMobil Chemical Company、Houston,TX)を使用して作製した。コネクタは、焼結ポリプロピレンから形成されたプラグ(図10〜図11のプラグ330など)に嵌合する通気ポート(図10〜図11の通気ポート328など)を有し、真空濾過中の空気移動が可能である。コネクタは、(例えば、図10及び図11に関して上述したねじ式接続によって)フィルターホルダーにロックされる。フィルター接続アセンブリのガスケット(すなわち、図10のガスケット324)は、コネクタ頚部に被さるように嵌められ、サンプルボトルをフィルター接続アセンブリと接続する(更に、これをフィルターホルダー/ハウジングと接続する)ために使用される。
実施例で使用した細菌培地を表3に示す。細菌培地はAmerican Type Culture Collection(ATCC)(Manassas,VA)から入手した。
培地は5グラム(g)のトリプトース(Difco laboratories,Detroit,MI)、5gの塩化ナトリウム、1gのソルビトール、1gのトリプトファン、2.7gのリン酸二カリウム、2gのリン酸二水素カリウム及び0.1gラウリル硫酸ナトリウム塩(全て、Sigma Aldrich,St.Louis,MOから得られ得る)を、1000mLの二重蒸留水と混合することによって調製された。培地は、121℃で15分間オートクレーブされた。
a)ガラクトシダーゼ基質を使用した大腸菌の検出
糖酵素基質を有する培地は、上記の手順に従って調製され、黒い96ウェル光学底部マイクロタイタープレート(Nalgene Nunc International,Rochester,NY)に分配された。大腸菌培地は、上記のように調製され、所望の量のcfu/mLを得るために段階希釈された。96ウェルプレートの培養物が、10μLの段階希釈されたセルで接種され、各ウェル中、1cfu、10cfu、又は100cfuを含む、ウェルが得られ、各基質に関して最小3つのウェルが使用された。10μLのButterfield緩衝液により対照ウェルが調製された。プレートが37℃で培養され、Tecan Infinite 200 PROマルチモードリーダー(Tecan US,Inc.Durham,NC)を使用して、速度論式で読み取られた。蛍光強度は、時間の関数として記録された。検出までの時間は、信号が、初期読み取り値(背景データ)の50倍である時点で、画定された。結果を表5に示す。全ての試験された基質は、大腸菌の成長に際して蛍光を示し、100μL中において1cfuの大腸菌を検出するまでに、15〜17時間かかった。
培地を調製して試験し、得られたデータを大腸菌検出のための手順に従って分析したが、グルクロニダーゼ基質(Mu−GlcU又はRes−GlcU)とガラクトシダーゼ基質(Flu−di−Gal又はRes−Gal)との組み合わせを表6に示す糖染料基質として使用した。培地は、96ウェルマイクロタイタープレート内に分配され、ウェルはおよそ1cfu、10cfu、又は100cfuを得るために、段階希釈された培養物を接種された。それぞれの接種に、最低限3つのウェルを使用した。表6のデータは、2つの異なる基材の組み合わせが単一のウェルで使用される場合、グルクロニダーゼ及びガラクトシダーゼの酵素活性がそれぞれ、異なる時間(hr)において蛍光により検出され得ることを示す。反応はより高い細菌濃度においてより早く検出された。
実施例a)に概要を記載した大腸菌の検出の手順が、表7に掲載された細菌を使用して反復された。Flu−di−galで調製された培地を96ウェルマイクロタイタープレート内に配置し、段階希釈した培養液を接種し、各ウェルに約1cfu、10cfu、及び100cfuを得た。それぞれの接種に、最低限3つのウェルを使用した。表7のデータは、Flu−di−galが大腸菌類を検出するためのガラクトシダーゼにとって好適な基質であることを示している。
大腸菌及びE.エロゲネスの細菌懸濁液をそれぞれ1mLのButterfield緩衝液(Whatman)で調製し、約101〜102cfu/mLの緩衝液を得て、SMD1及びSMD2の容器に移した。各細菌懸濁液が入った6つの容器を作製し、キャップでしっかりと閉じた。キャップは、1.5mLの微量遠心管容器(Plastibrand微細管、Brand GmbH & Co.KG(Wertheim,Germany)製)から切り取り、一般的に図6〜図7に示すようなキャップ形状にした。次に、スイングアウトローター(1154)を備えるHettich Mikro 22微量遠心管(Andreas Hettich GmbH & Co.KG(Tuttlingen,Germany)製)内に容器を置き、13000RPMで10分間遠心した(18,890xg)。更にまた、固定角ローター(Rotor F−45−30−11)を備えるEppendorf 5417R遠心機(Eppendorf、Hauppauge,NY)内で、個々の容器を13,375RPMで10分間(19,000xg)回転させた。
大腸菌及びE.エロゲネスの細菌懸濁液をそれぞれ10mLのButterfield緩衝液(Whatman)で調製し、約101〜102cfu/mLの緩衝液を得て、SMD3及びSMD4の容器に移した。各細菌懸濁液が入った6つの容器を作製した。穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー上に置き(すなわち、フィルターホルダー内の開口部(図12の開口部337を参照)を密封する)、容器SMD3及びSMD4の第1の開口端を閉じるのに使用した。すなわち、フィルターホルダーを改造して、サンプル検出容器SMD3及びSMD4用の簡易なキャップ(例えば、図1、図2及び図4のキャップ104と類似)を作った。ポリエチレンキャップ(U.S.Plastic Corp(Lima,OH)製、図12のキャップ317を参照)を用いて、フィルターホルダー底部の開口部を閉じた。容器をスイングバケット遠心ローター内に配置し、多目的遠心管内で4000RPM(3220xg)にて15分間、遠心した。遠心後、容器を取り出し、各容器内の上澄みを、25mmの微粒子分析用フィルターホルダー(Millipore)を使用して、0.45μm混合セルロースエステルフィルター(HAWP02500、Millipore(Billerica,MA)製)に通して濾過した。フィルターホルダーに25mmの0.45μm混合セルロースエステルフィルターを嵌め、15mLの漏斗を取り付けた。フィルターホルダーの底部を真空アセンブリに取り付けられた真空フラスコに接続した。遠心後の容器から上澄みを漏斗に添加し、約508mm Hgの真空圧でフィルターを通して濾過した。
大腸菌の細菌懸濁液を10mLの滅菌水で調製し、約106cfu/mLを得て、SMD3及びSMD4の容器に移した。実施例2に従って、穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー上に置き、容器SMD3及びSMD4の密閉に使用した。ポリエチレンキャップ(U.S.Plastic Corp)を用いて、フィルターホルダー底部の開口部を閉じた。容器をスイングバケット遠心ローター内に配置し、多目的遠心管内で4000RPM(3220xg)にて10分間、遠心した。遠心後、容器を取り出して上澄みを除去した。容器に残った液体があれば滅菌綿棒を使用して除去し、サンプルを直ちに処理した。
101〜102cfuを含有する大腸菌懸濁液を1mLのCOLILERT(商標)培養物で調製して、SMD1及びSMD2の容器内に分配し、1.5mL微量遠心管容器(Plastibrand微細管)から切り出されたキャップを使用して容器を密閉した。対照サンプルは同様に調製されたが、10μLのButterfield緩衝液を受容した。次に、スイングアウトローター(1154)を備えるHettich Mikro 22微量遠心管(Andreas Hettich GmbH & Co.KG)又は固定角ローター(Rotor F−45−30−11)を備えるEppendorf 5417R遠心機(Eppendorf)のいずれかに容器を配置した。13000RPMで10分間(19,000xg)、容器を遠心した。遠心後、容器を取り出し、ゆっくりと反転させてマイクロキャビティから培養物(すなわち、上澄み)を排流し、37℃で培養した。容器のマイクロキャビティは、「材料及び器具」に記載したイメージャを使用して毎時間撮影した。
101〜102cfuを含有する大腸菌懸濁液を10mLのCOLILERT(商標)培養物で調製して、SMD3及びSMD4の容器内に分配した。実施例2及び3に従って、穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー上に置き、容器SMD3及びSMD4の密閉に使用した。ポリエチレンキャップ(U.S.Plastic Corp)を用いて、フィルターホルダー底部の開口部を閉じた。容器をスイングバケット遠心ローター内に配置し、多目的遠心管内で4000RPM(3220xg)にて15分間、遠心した。遠心後、容器を取り出し、ゆっくりと反転させてマイクロキャビティから培養物を排流し、37℃で培養した。容器のマイクロキャビティは、蛍光結像系を使用して毎時間撮影した。
101〜102cfuの細菌(E.エロゲネス、C.フロインディー、K.ニューモニエ)を含む細菌懸濁液を10mLのColilert(商標)培養物にて調製し、SMD4容器内に分配した。対照サンプルは同様に調製されたが、100μLのButterfield緩衝液を受容した。E.エロゲネス、C.フロインディー、又はK.ニューモニエを含む細菌懸濁液それぞれに対して、Colilert(商標)培養物に40μg/mLのMu−gal又はFlu−galを追加して、細菌株ごとに2種類のサンプルを得た。上述のように、穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー内部に置き、更に容器の密閉に使用した。ポリエチレンキャップ(U.S.Plastic Corp)を用いて、フィルターホルダー底部の開口部を閉じた。容器をスイングバケット遠心ローター内に配置し、多目的遠心管内で4000RPM(3220xg)にて15分間、遠心した。遠心後、容器を取り出し、ゆっくりと反転させてマイクロキャビティから培養物を排流し、37℃で培養した。容器のマイクロキャビティは、蛍光結像系を使用して毎時間撮影した。
100mLの蒸留水に、10mgのフルオレセインを溶解させて、フルオレセインナトリウム塩(Sigma Aldrich)の溶液を調製した。1mLの溶液をSMD1及びSMD2の容器に分配し、1.5mL微量遠心管容器(Plastibrand微細管)から切り出したキャップを使用して容器を密閉した。10mLの溶液をSMD3及びSMD4の容器に分配した。上述のように、穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー内部に置き、更に容器の密閉に使用した。ポリエチレンキャップ(U.S.Plastic Corp)を用いて、フィルターホルダー底部の開口部を閉じた。実施例1の手順に従って、スイングローターを備えた微量遠心管内でSMD1及びSMD2の容器を回転させた。実施例2の手順に従って、スイングバケットローターを備えた多目的遠心管内でSMD3及びSMD4の容器を回転させた。次に、容器をThermolyne Vari Mix rocker、モデルM8474(Barnstead Thermolyne、Dubuque,IA)内にマイクロキャビティを下にして配置し、表14に示す様々な速度で回転させた。回転角度は60°であり(反転位置において−30°、直立位置において+30°である)、完全な60°にするまでの時間に基づき、°/sとして速度が計算された。回転が完了し、容器が反転位置に来た後、蛍光イメージャを使用してマイクロキャビティを撮影し、分析した。
青色の食品着色剤溶液(McCormik & Company Inc.、Hunt Valley,MD)を100mLの蒸留水で1:100に希釈した。1mLの溶液をSMD1及びSMD2の容器に分配し、1.5mL微量遠心管容器(Plastibrand微細容器)から切り出したキャップを使用して容器を密閉した。5mLの溶液をSMD3及びSMD4の容器に分配した。上述のように、穴あけ器を使用して、直径30mmの円形ディスク(1mm厚)をポリプロピレンシートから打ち抜き、フィルターホルダー内部に置き、更に容器の密閉に使用した。ポリエチレンキャップ(U.S.Plastic Corp)を用いて、フィルターホルダー底部の開口部を閉じた。実施例1の手順に従って、スイングローターを備えた微量遠心管内でSMD1及びSMD2の容器を回転させた。実施例2の手順に従って、スイングバケットローターを備えた多目的遠心管内でSMD3及びSMD4の容器を回転させた。
30°、40°、45°、50°、55°、60°、65°、70°、75°及び80°(図24A〜図24J)の角度を有する小容器(1.5mL)をラピッドプロトタイピングにより作製した。容器は、メーカーの取扱説明書に従って、ステレオリソグラフィ機(Viper SI2 SLA(登録商標) System)にて、UV硬化型エポキシ組成物(Accura(登録商標)60プラスチック)を使用して、CAD図面から作製した。エポキシ組成物及び機器は、3D Systems Corporation(Rock Hill SC)によって製造された。マイクロキャビティはラピッドプロトタイピングでは作製できないため、マイクロキャビティであると想定される領域は先の鋭い円錐状に成形した。角度が大きくなるにつれ、円錐は平らになり、まだ先端は尖っているが、それほど鋭くはない。
1)1mLの蒸留水を様々な角度の容器に分配し、容器をゆっくりと反転させ水を排流して容器を空にした。次に、容器をKimwipeの上に上下反対に置き、容器の縁に液体があれば除去した。容器を反転位置に維持し、20μL(PR−20)又は10μL(PR−10)又は2μL(PR−2)のピペット(Rainin Instrument LLC)を使用して、容器の先端に存在する過剰な液体の量を測定した。5種類の容器(すなわち、複製)に対して測定を行い、少なくとも5回、それぞれの測定を繰り返した。平均の結果を表15に報告する。50°以上の有効角度を有する容器では測定できる液体は存在しなかったため、表15にゼロと表記した。
PMMA(WF100ポリ(メチルメタクリレート)、Mitsubishi Rayon Co Ltd,(Tokyo,Japan)製)、COC1(透明環状オレフィンコポリマー、Topas(商標)8007X10、Topas Advanced Polymers Gmbh(Florence KY)製)、COC2(透明環状オレフィンコポリマー、高水分バリア;Topas(商標)8007S−04、Topas Advanced Polymers Gmbh製)、PC(Lexanポリカーボネート、HPS1R、SABIC Americas Corp.,(Houston TX)製)、COP(透明シクロオレフィンポリマー、Zeonor(商標)1430R、Zeon Chemicals L.P.,(Louisville KY)製)から成形したディスクを、PCT特許公開番号第WO2013/003308の準備実施例「Preparation of Microstructures,3−Injection Molded Lids」に記載のように作製した。成形されたポリマーの平坦な側の静的及び動的接触角は、VCA 2500 XE Video Contact Angle Systemで、液適法を使用して測定した。VCA−2500XE画像分析ソフトウェアを使用してデータは分析された。器具及びソフトウェアは、AST Products,Inc.,Billerica MAから得られた。
成形容器SMD3及びSMD4の静的接触角を、実施例10で説明した液適法を使用して測定した。成形容器を切断し、円錐角に近接した平坦な面を試験した。加えて、容器の外側の表面も試験した。4つのサンプルを試験し、平均の結果を表18に報告する。
最初に成形容器を、本明細書において参照として全体を組み込まれる、米国特許番号第5,888,594号に詳細に記載される装置を使用して、プラズマ処理した。
成形容器SMD3及びSMD4をマイクロキャビティ上部で切断し、各サンプルの表面トポグラフィーを、(1)マイクロキャビティ近傍、(2)円錐状表面の中心(すなわち、マイクロキャビティと縁との間)、及び(3)円錐縁の近傍の3箇所で測定した。10倍の対物レンズ及び1.0倍の視野レンズを使用して、Wyko NT9800干渉計(Bruker Corporation、Tucson,AZ)にて測定を実施した。隣接するフレームを共につなぎ合わせて、デジタル処理により視野を広げ、より大きく連続した測定領域を得た。計器は、フル解像度のVSIモード、スキャン速度1倍、シングルスキャンモード、及び変調しきい値の設定が2%にて使用した。データを処理して、傾斜及び円筒状の湾曲を除去し、目的とする各領域に対して粗さ計算を実施した。Vision(登録商標)分析ソフトウェアを使用して、粗さパラメータRa及びRqを計算した。2つのサンプルについて、計算した粗さ値を表20に示す。サンプルSMD4の粗さ値は、一般にSMD3のものより低い。SMD4及びSMD3の材料構成は同じだったため、粗さの相違は成形アーティファクトに起因する可能性が高い。
フィルターホルダー(図10〜図14のフィルターホルダー332を参照)及びフィルター接続アセンブリ(図10、図11及び図14のフィルター接続アセンブリ320)を含むフィルター部(図10及び図11のフィルター部308を参照)を、複数の(すなわち、4つの同心円上に離間された)協調するツイストロックねじと突出部(図10及び図12に示す)によって互いに連結するように構成した。フィルターホルダー内にフィルターを配置し、ガスケットによりフィルター接続アセンブリのフィルターとコネクタとの間を封止した。コネクタはフィルタープラグを備える通気ポートを有した。フィルタープラグは、POREX(登録商標)疎水性ポリエチレンシートPOR−4902(Porex Technologies,Fairburn,GA)で形成され、通気ポートにフィットするように切り取られた。ガスケット(図10のガスケット324を参照)を、コネクタ(図10のコネクタ320の第1の端部321などを参照)の上部頚部を受容するように、すなわち、摩擦フィットの上部をスライドさせることによりを受容するように寸法設定して、サンプルボトルの頚部と連結されるように構成されたフィルター接続アセンブリを形成した(すなわち、ガスケットをサンプルボトル(又は貯蔵部、図10、図11及び図14の貯蔵部306などを参照)の開口部に受容されるように構成した)。本実施例のサンプルボトル(又は貯蔵部)は、1Lのポリプロピレン製サンプルボトル(Nalgene 2087 Narrow−Mouth Economy Bottle、カタログ番号2087−0032:Nalgene Nunc、Thermo Fisher Scientific(Rochester NY)製)であった。本開示に従って、サンプルボトル(貯蔵部)と第1部とを組み合わせて、サンプル検出システムの「第1の容器」(図10、図11、及び図14の第1の容器303を参照)を形成した。
大腸菌の細菌懸濁液が調製され、希釈液が100cfu/mLを含むように、段階希釈された。3つの1000mLサンプルのボトル(Nalgene)は、1000mLの減菌水を充填され、1mLの懸濁液が各ボトルに添加された。実施例14の手順に従って構成したフィルター接続アセンブリに、フィルターA、フィルターB、又はフィルターCを取り付け、ガスケットを介して充填済みサンプルボトルと接続した。フィルターホルダーの底部を、真空アセンブリに取り付けられた真空フラスコの上に配置し、サンプルを約508mm Hgの真空圧でフィルターを通して濾過した。濾過後、フィルターホルダーを真空装置から取り外し、フィルター接続アセンブリをフィルターホルダーから取り外して、フィルター膜それぞれをフィルターホルダーから無菌状態のまま取り出し、メーカーの取扱説明書に従って調製した、水和された3M(商標)PETRIFILM(商標)大腸菌/大腸菌類カウントプレート(3M Co.)上に配置して、37℃で一晩培養した。プレートは、3M(商標)PETRIFILM(商標) Plate Reader(3M Co.)を使用して読み取られ、及び/又はコロニー形成ユニット(cfu)を測定するために手作業で計測された。表21に示す結果は、細菌のうち少なくとも約87%が回収されたことを示す。
実施例15の手順に従って、大腸菌を含む3つの1000mLの水サンプルを調製し、フィルターA〜Cのそれぞれを使用して濾過した。濾過後、フィルターホルダーを真空装置から取り外し、フィルターホルダーの底部に蓋をして、フィルターホルダーからフィルター接続アセンブリを取り外した。濾過物を含むフィルターホルダーを、5mLのButterfieldリン酸緩衝液(Whatman Inc.)を含有するSMD4サンプル検出容器に連結した。得られた「第2の容器」をフィルター部を下にして、室温にて約2分間ボルテックスし(Fixed Speed Vortex Mixer、VWR Intl.LLC(Batavia,IL)製)、フィルターから細菌を溶出した。ボルテックスされたサンプルは、メーカーの取扱説明書に従って、3M(商標)PETRIFILM(商標)E.coli/Coliform Count Plates (3M Co.)上に塗布され、37℃で一晩培養された。プレートは、3M(商標)PETRIFILM(商標)Plate Reader(3M Co.)を使用して読まれ、及びコロニー形成ユニット(cfu)は判定され、各フィルターについて表22に示される。フィルターAは、大腸菌の最高回収率を示した(約72%、表22)。
実施例15の手順に従って、それぞれ10cfuの大腸菌を含む3つの1000mLの水サンプルを調製し、フィルターAを使用して濾過した。濾過後、フィルターホルダーを真空装置から取り外し、フィルターホルダーの底部に蓋をして、フィルターホルダーからフィルター接続アセンブリを取り外した。濾過物を含むフィルターホルダーを、10mLの調製済みColilert(商標)培養物を含有するSMD4サンプル検出容器に連結した。フィルターホルダーとサンプル検出容器SMD4の組み合わせは、本実施例では「第2の容器」として機能した(図12〜図14)。
実施例15の手順に従って、それぞれ10cfuの大腸菌を含む3つの1000mLの水サンプルを調製し、フィルターAを使用して濾過した。濾過後、フィルターホルダーを真空装置から取り外し、フィルターホルダーの底部に蓋をして、フィルターホルダーからフィルター接続アセンブリを取り外した。濾過物を含むフィルターホルダーを、10mLの調製済みColilert(商標)培養物を含有するSMD4サンプル検出容器に連結した。フィルターホルダーとサンプル検出容器の組み合わせは、本実施例では「第2の容器」として機能した(図12〜図14)。
Claims (4)
- サンプルを収容及び濃縮して、目的の検体が存在する場合にはそれを検出するように適合されたサンプル検出容器であって、
前記容器が、サンプルを受容するように構成された開放端部と、マイクロキャビティを含む閉鎖端部と、前記マイクロキャビティまで延在する壁部と、を含み、
前記マイクロキャビティは、開口上部、底部、及び前記マイクロキャビティの横断面に対して垂直である長手方向軸を含み、前記マイクロキャビティは、目的のサンプルを保持するための毛管力をもたらすように構成されており、
前記マイクロキャビティの開口上部と隣接して位置する前記壁部のうち少なくとも一部分は、前記マイクロキャビティの前記長手方向軸に対して有効角度αで配向される勾配を有し、前記有効角度αは45°より大きく、かつ90°より小さく、前記有効角度αで配向される、前記マイクロキャビティの前記開口上部と隣接して位置する前記壁部のうち少なくとも前記部分は、前記マイクロキャビティの前記開口上部の横断寸法の少なくとも5倍の長さを有する、サンプル検出容器。 - サンプル中に目的の検体が存在する場合に、それを検出するためのシステムであって、
フィルター部を含む第1の容器アセンブリであって、該フィルター部はフィルターを含み、該フィルターは第1の側部を有し、前記第1の側部上に前記サンプルの濾過物を含む、第1容器アセンブリと、
請求項1に記載のサンプル検出容器に連結された前記フィルター部を含む第2の容器アセンブリであって、該フィルター部及び前記サンプル検出容器が、前記フィルターの前記第1の側部が前記サンプル検出容器の前記マイクロキャビティと面するように一緒に連結されている、第2の容器アセンブリと、を含む、システム。 - サンプル中に目的の検体が存在する場合にそれを検出する方法であって、
請求項1に記載のサンプル検出容器を提供する工程と、
前記サンプル検出容器内にサンプルを配置する工程と、
前記マイクロキャビティに向けて前記サンプル検出容器を遠心し、前記サンプルの沈降物及び上澄みを形成する工程と、
前記サンプル検出容器を遠心分離した後、前記サンプル検出容器を反転させ、前記サンプルの濃縮物が前記マイクロキャビティに保持されるように、前記マイクロキャビティから上澄みの少なくとも一部をデカントする工程であって、前記濃縮物が前記沈降物を含む、工程と、を含む、方法。 - サンプル中に目的の検体が存在する場合に、それを検出する方法であって、
フィルター部を含む第1の容器アセンブリであって、前記フィルター部は前記サンプルからの目的の検体を保持するように構成されたフィルターを含み、前記フィルターは第1の側部を有し、かつ前記第1の側部上に前記サンプルの濾過物を含む、第1の容器アセンブリを提供する工程と、
前記フィルター部を請求項1に記載のサンプル検出容器と連結させて、前記フィルターの前記第1の側部が前記サンプル検出容器の前記マイクロキャビティに面するように、前記フィルター部と前記サンプル検出容器とを一緒に連結する第2の容器アセンブリを形成する工程と、
前記マイクロキャビティに向けて前記第2の容器アセンブリを遠心し、前記濾過物を前記フィルターから前記サンプル検出容器の前記マイクロキャビティに移動させ、前記サンプルの沈降物及び上澄みを形成する工程と、
前記第2の容器アセンブリを遠心した後、前記第2の容器アセンブリを反転させ、前記サンプルの濃縮物が前記第2の容器アセンブリの前記サンプル検出容器の前記マイクロキャビティに保持されるように、前記サンプル検出容器から前記上澄みの少なくとも一部をデカントする工程であって、前記濃縮物が前記沈降物を含む、工程と、を含む、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361918977P | 2013-12-20 | 2013-12-20 | |
| US61/918,977 | 2013-12-20 | ||
| PCT/US2014/070520 WO2015095142A2 (en) | 2013-12-20 | 2014-12-16 | Systems and methods for sample concentration and detection |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017503489A JP2017503489A (ja) | 2017-02-02 |
| JP2017503489A5 JP2017503489A5 (ja) | 2017-10-26 |
| JP6240785B2 true JP6240785B2 (ja) | 2017-11-29 |
Family
ID=52302371
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016541219A Active JP6240785B2 (ja) | 2013-12-20 | 2014-12-16 | サンプルの濃縮及び検出のためのシステム及び方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US10639628B2 (ja) |
| EP (1) | EP3083054A2 (ja) |
| JP (1) | JP6240785B2 (ja) |
| CN (1) | CN105828947B (ja) |
| WO (1) | WO2015095142A2 (ja) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3079822B1 (en) * | 2013-12-12 | 2019-05-08 | 3M Innovative Properties Company | Method for preparing a biological sample for analysis |
| JP2017503639A (ja) | 2013-12-20 | 2017-02-02 | スリーエム イノベイティブ プロパティズ カンパニー | 分離液を用いたサンプル濃縮及び検出のためのシステム及び方法 |
| WO2017116695A1 (en) | 2015-12-29 | 2017-07-06 | 3M Innovative Properties Company | Assembly and method for field filtration of water samples |
| EP3429741A4 (en) * | 2016-03-15 | 2019-11-27 | DOTS Technology Corp. | SYSTEMS AND METHODS FOR DETECTION OF ALLERGENS |
| CN106769668B (zh) * | 2016-12-29 | 2023-07-14 | 陕西师范大学 | 流变仪可拆卸密封测量装置 |
| CN107159334B (zh) * | 2017-06-16 | 2019-04-30 | 东南大学 | 一种微流控移液器枪头 |
| US10527171B2 (en) * | 2017-08-15 | 2020-01-07 | Cellular Research, Inc. | Gasket |
| CN107569889A (zh) * | 2017-10-12 | 2018-01-12 | 西安思坦科技有限公司 | 关于隐孢子虫和贾第鞭毛虫的过滤回收装置及其系统 |
| CN108906348B (zh) * | 2018-03-05 | 2023-10-10 | 中国标准化研究院 | 分离土壤中微塑料和纤维素结晶的分离装置及分离方法 |
| CN115069430B (zh) * | 2022-06-25 | 2023-06-16 | 烟台罗博特智能设备有限公司 | 一种酵母用离心机控制方法、系统、装置及存储介质 |
Family Cites Families (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539256A (en) | 1982-09-09 | 1985-09-03 | Minnesota Mining And Manufacturing Co. | Microporous sheet material, method of making and articles made therewith |
| US4726989A (en) | 1986-12-11 | 1988-02-23 | Minnesota Mining And Manufacturing | Microporous materials incorporating a nucleating agent and methods for making same |
| DE3722562A1 (de) | 1987-07-08 | 1989-01-19 | Andreas Szabados | Ringfoermiger filterkoerper |
| US4867881A (en) | 1987-09-14 | 1989-09-19 | Minnesota Minning And Manufacturing Company | Orientied microporous film |
| JP2854058B2 (ja) | 1987-12-01 | 1999-02-03 | ベーリンガー マンヘイム コーポレイション | アッセイを実施するための方法及び装置 |
| US4959301A (en) | 1988-04-22 | 1990-09-25 | Massachusetts Institute Of Technology | Process for rapidly enumerating viable entities |
| US5120594A (en) | 1989-11-20 | 1992-06-09 | Minnesota Mining And Manufacturing Company | Microporous polyolefin shaped articles with patterned surface areas of different porosity |
| US5260360A (en) | 1991-10-18 | 1993-11-09 | Minnesota Mining And Manufacturing Company | Oil, water and sweat repellent microporous membrane materials |
| US5716798A (en) | 1992-09-22 | 1998-02-10 | Becton Dickinson And Company | Enhanced detection of microorganisms in samples |
| CA2179364C (en) | 1995-06-27 | 1999-09-28 | Klaus W. Berndt | Method and apparatus for detecting microorganisms |
| US5833860A (en) | 1995-08-28 | 1998-11-10 | Millipore Investment Holdings Limited | Centrifugal adsorptive sample preparation device and method |
| US5888594A (en) | 1996-11-05 | 1999-03-30 | Minnesota Mining And Manufacturing Company | Process for depositing a carbon-rich coating on a moving substrate |
| US6391578B2 (en) | 1997-04-09 | 2002-05-21 | 3M Innovative Properties Company | Method and devices for partitioning biological sample liquids into microvolumes |
| US6420622B1 (en) | 1997-08-01 | 2002-07-16 | 3M Innovative Properties Company | Medical article having fluid control film |
| AU742184B2 (en) | 1998-04-29 | 2001-12-20 | 3M Innovative Properties Company | Receptor sheet for inkjet printing having an embossed surface |
| US6221655B1 (en) | 1998-08-01 | 2001-04-24 | Cytosignal | Spin filter assembly for isolation and analysis |
| US7223364B1 (en) | 1999-07-07 | 2007-05-29 | 3M Innovative Properties Company | Detection article having fluid control film |
| US6387030B1 (en) * | 2000-06-30 | 2002-05-14 | Beckman Coulter, Inc. | Internal adapter with a pellet well for a centrifuge container |
| US7781159B2 (en) | 2002-05-09 | 2010-08-24 | Nanologix, Inc. | Micromethod and device for rapid detection, enumeration and identification of entities |
| US8361783B2 (en) | 2002-05-09 | 2013-01-29 | Nanologix, Inc. | Micromethod and device for the rapid detection, enumeration and identification of microorganisms |
| US20030235677A1 (en) | 2002-06-25 | 2003-12-25 | 3M Innovative Properties Company | Complex microstructure film |
| US20030235678A1 (en) | 2002-06-25 | 2003-12-25 | Graham Paul D. | Complex microstructure film |
| CA2521999A1 (en) | 2002-12-20 | 2004-09-02 | Biotrove, Inc. | Assay apparatus and method using microfluidic arrays |
| US7524623B2 (en) | 2003-07-28 | 2009-04-28 | Nanologix, Inc. | Method and device for rapid detection of microorganisms by changing the shape of micro-colonies |
| ITTR20030002A1 (it) | 2003-07-31 | 2005-02-01 | Isrim Societa Consortile A Respon Sabilita Limit | Metodo per la rilevazione di coliformi ed in particolare |
| US7582472B2 (en) | 2003-08-26 | 2009-09-01 | Smith Kenneth E | Apparatus and method for liquid sample testing |
| US20070134784A1 (en) | 2005-12-09 | 2007-06-14 | Halverson Kurt J | Microreplicated microarrays |
| DE102006022877B4 (de) | 2006-05-15 | 2009-01-29 | Sartorius Stedim Biotech Gmbh | Verfahren zur Bestimmung der Viabilität von Zellen in Zellkulturen |
| WO2008002563A2 (en) | 2006-06-26 | 2008-01-03 | Applera Corporation | Heated cover methods and technology |
| WO2009134509A2 (en) | 2008-02-15 | 2009-11-05 | 3M Innovative Properties Company | Sample acquisition device |
| CN101566389A (zh) | 2008-04-24 | 2009-10-28 | 沈阳东方钢铁有限公司 | 卧式高温热风炉 |
| US20100015690A1 (en) * | 2008-07-16 | 2010-01-21 | Ortho-Clinical Diagnostics, Inc. | Use of fluid aspiration/dispensing tip as a microcentrifuge tube |
| BRPI0918357A2 (pt) | 2008-12-19 | 2016-07-26 | 3M Innovative Properties Co | sistema e método para processamento de amostras |
| EP2373733B1 (en) | 2008-12-19 | 2016-07-27 | 3M Innovative Properties Company | Microporous material from ethylene-chlorotrifluoroethylene copolymer and method for making same |
| CN102301220B (zh) | 2008-12-19 | 2014-06-25 | 3M创新有限公司 | 用于浓缩样品的系统和方法 |
| EP2206551B1 (en) * | 2008-12-23 | 2019-08-07 | Corning Incorporated | Microchannel reactors |
| BRPI0923737A2 (pt) | 2008-12-31 | 2016-01-19 | 3M Innovative Properties Co | "membranas porosas com múltiplas zonas que têm tamanhos de poro diferentes". |
| WO2011063332A2 (en) | 2009-11-23 | 2011-05-26 | 3M Innovative Properties Company | Microwell array articles and methods of use |
| WO2011094286A2 (en) * | 2010-01-26 | 2011-08-04 | Cymbet Corporation | Battery arrays, constructions and method |
| US8585905B2 (en) | 2010-02-26 | 2013-11-19 | Waters Technologies Corporation | Devices, kits and methods for performing chemical processing |
| CN103108689A (zh) | 2010-06-01 | 2013-05-15 | 3M创新有限公司 | 带涂层的多孔材料 |
| WO2011153085A2 (en) | 2010-06-01 | 2011-12-08 | 3M Innovative Properties Company | Process for making coated porous materials |
| EP2577299A4 (en) | 2010-06-07 | 2014-03-19 | 3M Innovative Properties Co | FILTRATION METHODS AND DEVICES |
| CN103816808B (zh) | 2010-06-07 | 2017-01-11 | 3M创新有限公司 | 过滤方法和装置 |
| CN201728123U (zh) * | 2010-06-17 | 2011-02-02 | 张柳 | 新型精密微量滴定管 |
| WO2012045754A1 (de) | 2010-10-07 | 2012-04-12 | Boehringer Ingelheim Microparts Gmbh | Verfahren zum waschen einer mikrofluidischen kavität |
| EP2726842B1 (en) | 2011-06-30 | 2016-03-16 | 3M Innovative Properties Company | Systems and methods for detecting an analyte of interest in a sample using microstructured surfaces |
| CN103620373B (zh) | 2011-06-30 | 2017-07-07 | 3M创新有限公司 | 利用过滤器和微结构化表面检测样品中所关注分析物的方法 |
| US20140227148A1 (en) * | 2011-07-05 | 2014-08-14 | Boehringer Ingelheim Microparts Gmbh | Microfluidic Structure Having Recesses |
| WO2013105204A1 (ja) * | 2012-01-12 | 2013-07-18 | パナソニック株式会社 | 検体濃縮容器とそれを用いた検体濃縮方法 |
| JP2017503639A (ja) | 2013-12-20 | 2017-02-02 | スリーエム イノベイティブ プロパティズ カンパニー | 分離液を用いたサンプル濃縮及び検出のためのシステム及び方法 |
-
2014
- 2014-12-16 JP JP2016541219A patent/JP6240785B2/ja active Active
- 2014-12-16 WO PCT/US2014/070520 patent/WO2015095142A2/en active Application Filing
- 2014-12-16 CN CN201480068834.4A patent/CN105828947B/zh active Active
- 2014-12-16 EP EP14825029.3A patent/EP3083054A2/en active Pending
- 2014-12-16 US US15/105,448 patent/US10639628B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015095142A2 (en) | 2015-06-25 |
| CN105828947B (zh) | 2017-09-29 |
| EP3083054A2 (en) | 2016-10-26 |
| CN105828947A (zh) | 2016-08-03 |
| JP2017503489A (ja) | 2017-02-02 |
| WO2015095142A3 (en) | 2015-08-13 |
| US10639628B2 (en) | 2020-05-05 |
| US20160310940A1 (en) | 2016-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6240785B2 (ja) | サンプルの濃縮及び検出のためのシステム及び方法 | |
| US9909969B2 (en) | Systems and methods for detecting an analyte of interest in a sample using microstructured surfaces | |
| US10639629B2 (en) | Systems and methods for sample concentration and detection using a separation liquid | |
| US9470612B2 (en) | Systems and methods for detecting an analyte of interest in a sample using filters and microstructured surfaces | |
| US8647574B2 (en) | Sample preparation container and method | |
| JP6782998B2 (ja) | 装置 | |
| US8535945B2 (en) | System and method for concentrating samples | |
| US8563264B2 (en) | Sample preparation for environmental sampling | |
| US9388448B2 (en) | System and method for processing samples | |
| JP2011502544A (ja) | 試料の調製容器及び方法 | |
| JP2011502545A (ja) | 試料調製容器及び方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170913 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170913 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20170913 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20170928 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171024 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20171106 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6240785 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |