JP6236086B2 - 1種以上の肺炎球菌莢膜糖類コンジュゲートとインフルエンザ菌由来のタンパク質Eおよび/またはPilAを含むタンパク質成分とを含む免疫原性組成物 - Google Patents
1種以上の肺炎球菌莢膜糖類コンジュゲートとインフルエンザ菌由来のタンパク質Eおよび/またはPilAを含むタンパク質成分とを含む免疫原性組成物 Download PDFInfo
- Publication number
- JP6236086B2 JP6236086B2 JP2015537216A JP2015537216A JP6236086B2 JP 6236086 B2 JP6236086 B2 JP 6236086B2 JP 2015537216 A JP2015537216 A JP 2015537216A JP 2015537216 A JP2015537216 A JP 2015537216A JP 6236086 B2 JP6236086 B2 JP 6236086B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- protein
- pila
- conjugated
- saccharide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 101710204837 Envelope small membrane protein Proteins 0.000 title claims description 259
- 101710088839 Replication initiation protein Proteins 0.000 title claims description 258
- 230000002163 immunogen Effects 0.000 title claims description 203
- 150000001720 carbohydrates Chemical class 0.000 title claims description 181
- 239000000203 mixture Substances 0.000 title claims description 159
- 241000606768 Haemophilus influenzae Species 0.000 title claims description 68
- 241001377010 Pila Species 0.000 title claims description 16
- 235000004252 protein component Nutrition 0.000 title claims description 14
- 150000001413 amino acids Chemical class 0.000 claims description 325
- 108090000623 proteins and genes Proteins 0.000 claims description 166
- 102000004169 proteins and genes Human genes 0.000 claims description 151
- 235000018102 proteins Nutrition 0.000 claims description 149
- 108020001507 fusion proteins Proteins 0.000 claims description 144
- 102000037865 fusion proteins Human genes 0.000 claims description 144
- 239000012634 fragment Substances 0.000 claims description 136
- 229960005486 vaccine Drugs 0.000 claims description 58
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 49
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 claims description 44
- 101710188053 Protein D Proteins 0.000 claims description 44
- 101710132893 Resolvase Proteins 0.000 claims description 44
- 229940047650 haemophilus influenzae Drugs 0.000 claims description 41
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 40
- 108010078791 Carrier Proteins Proteins 0.000 claims description 38
- 102000014914 Carrier Proteins Human genes 0.000 claims description 37
- 229960000814 tetanus toxoid Drugs 0.000 claims description 30
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 claims description 26
- 201000010099 disease Diseases 0.000 claims description 25
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 25
- 238000011282 treatment Methods 0.000 claims description 23
- -1 19F saccharide Chemical class 0.000 claims description 21
- 230000005847 immunogenicity Effects 0.000 claims description 19
- 208000035109 Pneumococcal Infections Diseases 0.000 claims description 18
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 16
- 206010035664 Pneumonia Diseases 0.000 claims description 14
- 229960003983 diphtheria toxoid Drugs 0.000 claims description 14
- 229920002704 polyhistidine Polymers 0.000 claims description 14
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 14
- 230000004927 fusion Effects 0.000 claims description 13
- 101710183389 Pneumolysin Proteins 0.000 claims description 12
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 11
- 229920001184 polypeptide Polymers 0.000 claims description 11
- 101710164918 Choline-binding protein Proteins 0.000 claims description 9
- 206010033078 Otitis media Diseases 0.000 claims description 9
- 206010061190 Haemophilus infection Diseases 0.000 claims description 8
- 108010040473 pneumococcal surface protein A Proteins 0.000 claims description 8
- 201000009906 Meningitis Diseases 0.000 claims description 7
- 208000031729 Bacteremia Diseases 0.000 claims description 6
- 101100420868 Anuroctonus phaiodactylus phtx gene Proteins 0.000 claims description 5
- 230000006806 disease prevention Effects 0.000 claims description 5
- 230000005713 exacerbation Effects 0.000 claims description 5
- 108700039582 histidine triad Proteins 0.000 claims description 5
- 230000036039 immunity Effects 0.000 claims description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 4
- 206010010741 Conjunctivitis Diseases 0.000 claims description 4
- 239000000126 substance Substances 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 3
- 102000004190 Enzymes Human genes 0.000 claims description 2
- 108090000790 Enzymes Proteins 0.000 claims description 2
- 230000002358 autolytic effect Effects 0.000 claims description 2
- 101710087657 Manganese ABC transporter substrate-binding lipoprotein Proteins 0.000 claims 2
- 235000001014 amino acid Nutrition 0.000 description 340
- 229940024606 amino acid Drugs 0.000 description 338
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 73
- 238000003752 polymerase chain reaction Methods 0.000 description 50
- 238000000034 method Methods 0.000 description 44
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 43
- 230000001580 bacterial effect Effects 0.000 description 38
- 239000011780 sodium chloride Substances 0.000 description 35
- 229920001282 polysaccharide Polymers 0.000 description 33
- 239000005017 polysaccharide Substances 0.000 description 33
- 239000013598 vector Substances 0.000 description 33
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 32
- 150000004676 glycans Chemical class 0.000 description 32
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 32
- 241000699670 Mus sp. Species 0.000 description 31
- 239000000427 antigen Substances 0.000 description 31
- 108091007433 antigens Proteins 0.000 description 31
- 102000036639 antigens Human genes 0.000 description 31
- 239000004472 Lysine Substances 0.000 description 29
- 239000000872 buffer Substances 0.000 description 29
- 241000588724 Escherichia coli Species 0.000 description 28
- 108091028043 Nucleic acid sequence Proteins 0.000 description 28
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 28
- 239000004473 Threonine Substances 0.000 description 28
- 239000000523 sample Substances 0.000 description 27
- 210000002966 serum Anatomy 0.000 description 27
- 230000027455 binding Effects 0.000 description 26
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 25
- 238000009472 formulation Methods 0.000 description 25
- 239000002953 phosphate buffered saline Substances 0.000 description 25
- 238000000746 purification Methods 0.000 description 25
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 24
- 241000699666 Mus <mouse, genus> Species 0.000 description 24
- 235000004279 alanine Nutrition 0.000 description 24
- 239000000284 extract Substances 0.000 description 24
- 239000006228 supernatant Substances 0.000 description 24
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 23
- 229920001213 Polysorbate 20 Polymers 0.000 description 23
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 23
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 22
- 210000004027 cell Anatomy 0.000 description 22
- 239000012528 membrane Substances 0.000 description 22
- 229920000136 polysorbate Polymers 0.000 description 22
- 229940068977 polysorbate 20 Drugs 0.000 description 22
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 21
- 239000000047 product Substances 0.000 description 20
- 108010031318 Vitronectin Proteins 0.000 description 19
- 102100035140 Vitronectin Human genes 0.000 description 19
- 239000000243 solution Substances 0.000 description 19
- 238000001542 size-exclusion chromatography Methods 0.000 description 18
- 238000002965 ELISA Methods 0.000 description 17
- 241000282414 Homo sapiens Species 0.000 description 17
- 238000010828 elution Methods 0.000 description 17
- 238000001914 filtration Methods 0.000 description 17
- 238000002741 site-directed mutagenesis Methods 0.000 description 17
- 238000004458 analytical method Methods 0.000 description 16
- 238000010790 dilution Methods 0.000 description 16
- 239000012895 dilution Substances 0.000 description 16
- 230000000694 effects Effects 0.000 description 16
- 230000006698 induction Effects 0.000 description 16
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 16
- 125000003277 amino group Chemical group 0.000 description 15
- 238000002360 preparation method Methods 0.000 description 15
- 238000005406 washing Methods 0.000 description 15
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 14
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 14
- 238000006243 chemical reaction Methods 0.000 description 14
- 235000013922 glutamic acid Nutrition 0.000 description 14
- 239000004220 glutamic acid Substances 0.000 description 14
- 230000003053 immunization Effects 0.000 description 14
- 238000006268 reductive amination reaction Methods 0.000 description 14
- 241000283973 Oryctolagus cuniculus Species 0.000 description 13
- 235000000346 sugar Nutrition 0.000 description 13
- 108020004414 DNA Proteins 0.000 description 12
- 230000005875 antibody response Effects 0.000 description 12
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 12
- 238000002474 experimental method Methods 0.000 description 12
- 238000011081 inoculation Methods 0.000 description 12
- 241000700199 Cavia porcellus Species 0.000 description 11
- 239000004471 Glycine Substances 0.000 description 11
- 239000007995 HEPES buffer Substances 0.000 description 11
- 210000004899 c-terminal region Anatomy 0.000 description 11
- 239000013592 cell lysate Substances 0.000 description 11
- 230000021615 conjugation Effects 0.000 description 11
- 238000010168 coupling process Methods 0.000 description 11
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 11
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 11
- 238000001597 immobilized metal affinity chromatography Methods 0.000 description 11
- 210000003928 nasal cavity Anatomy 0.000 description 11
- 239000008188 pellet Substances 0.000 description 11
- 238000001262 western blot Methods 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 229960001231 choline Drugs 0.000 description 10
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 10
- 238000005516 engineering process Methods 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 210000001989 nasopharynx Anatomy 0.000 description 10
- 230000000638 stimulation Effects 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 9
- 208000035473 Communicable disease Diseases 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 9
- 102000003992 Peroxidases Human genes 0.000 description 9
- 239000004698 Polyethylene Substances 0.000 description 9
- 229920002684 Sepharose Polymers 0.000 description 9
- 235000009582 asparagine Nutrition 0.000 description 9
- 229960001230 asparagine Drugs 0.000 description 9
- 238000005859 coupling reaction Methods 0.000 description 9
- 238000012217 deletion Methods 0.000 description 9
- 230000037430 deletion Effects 0.000 description 9
- 239000001963 growth medium Substances 0.000 description 9
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 9
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 9
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 9
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 9
- 230000028993 immune response Effects 0.000 description 9
- 238000002649 immunization Methods 0.000 description 9
- 238000007918 intramuscular administration Methods 0.000 description 9
- YFVGRULMIQXYNE-UHFFFAOYSA-M lithium;dodecyl sulfate Chemical compound [Li+].CCCCCCCCCCCCOS([O-])(=O)=O YFVGRULMIQXYNE-UHFFFAOYSA-M 0.000 description 9
- 150000002482 oligosaccharides Chemical class 0.000 description 9
- 108040007629 peroxidase activity proteins Proteins 0.000 description 9
- 230000002265 prevention Effects 0.000 description 9
- 239000000758 substrate Substances 0.000 description 9
- 241000894006 Bacteria Species 0.000 description 8
- 241000700198 Cavia Species 0.000 description 8
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 8
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 8
- 241000193998 Streptococcus pneumoniae Species 0.000 description 8
- 238000002835 absorbance Methods 0.000 description 8
- 239000002671 adjuvant Substances 0.000 description 8
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 8
- 238000003556 assay Methods 0.000 description 8
- 239000013599 cloning vector Substances 0.000 description 8
- 230000008878 coupling Effects 0.000 description 8
- 239000004643 cyanate ester Substances 0.000 description 8
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 8
- 229960000310 isoleucine Drugs 0.000 description 8
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 238000002844 melting Methods 0.000 description 8
- 230000008018 melting Effects 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 8
- 230000007704 transition Effects 0.000 description 8
- 230000003321 amplification Effects 0.000 description 7
- 235000003704 aspartic acid Nutrition 0.000 description 7
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 7
- 150000001718 carbodiimides Chemical class 0.000 description 7
- 238000002983 circular dichroism Methods 0.000 description 7
- 239000008367 deionised water Substances 0.000 description 7
- 229910021641 deionized water Inorganic materials 0.000 description 7
- 238000004925 denaturation Methods 0.000 description 7
- 230000036425 denaturation Effects 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 238000003199 nucleic acid amplification method Methods 0.000 description 7
- 101150074154 pe gene Proteins 0.000 description 7
- 150000008163 sugars Chemical class 0.000 description 7
- PMTMAFAPLCGXGK-JMTMCXQRSA-N (15Z)-12-oxophyto-10,15-dienoic acid Chemical compound CC\C=C/C[C@H]1[C@@H](CCCCCCCC(O)=O)C=CC1=O PMTMAFAPLCGXGK-JMTMCXQRSA-N 0.000 description 6
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 6
- 229920001817 Agar Polymers 0.000 description 6
- 239000004475 Arginine Substances 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 6
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 6
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 6
- 108010052285 Membrane Proteins Proteins 0.000 description 6
- 102000018697 Membrane Proteins Human genes 0.000 description 6
- PMTMAFAPLCGXGK-UHFFFAOYSA-N OPDA Natural products CCC=CCC1C(CCCCCCCC(O)=O)C=CC1=O PMTMAFAPLCGXGK-UHFFFAOYSA-N 0.000 description 6
- 101100028078 Oryza sativa subsp. japonica OPR1 gene Proteins 0.000 description 6
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 6
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 210000001744 T-lymphocyte Anatomy 0.000 description 6
- 230000004913 activation Effects 0.000 description 6
- 239000008272 agar Substances 0.000 description 6
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 6
- 238000001142 circular dichroism spectrum Methods 0.000 description 6
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 6
- 238000000502 dialysis Methods 0.000 description 6
- 239000000499 gel Substances 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 230000008782 phagocytosis Effects 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 6
- 229920000053 polysorbate 80 Polymers 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- 241000771318 Haemophilus influenzae 86-028NP Species 0.000 description 5
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 5
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 5
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 5
- 239000000020 Nitrocellulose Substances 0.000 description 5
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 5
- 239000012148 binding buffer Substances 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000018109 developmental process Effects 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 238000010172 mouse model Methods 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 229920001220 nitrocellulos Polymers 0.000 description 5
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 5
- 229940068968 polysorbate 80 Drugs 0.000 description 5
- 229940023143 protein vaccine Drugs 0.000 description 5
- 238000010791 quenching Methods 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 239000012465 retentate Substances 0.000 description 5
- 239000012723 sample buffer Substances 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- 125000006850 spacer group Chemical group 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 239000004474 valine Substances 0.000 description 5
- 239000011534 wash buffer Substances 0.000 description 5
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- 101100334784 Escherichia coli (strain K12) fimA gene Proteins 0.000 description 4
- 239000012981 Hank's balanced salt solution Substances 0.000 description 4
- 102100029083 Minor histocompatibility antigen H13 Human genes 0.000 description 4
- FSVCELGFZIQNCK-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)glycine Chemical compound OCCN(CCO)CC(O)=O FSVCELGFZIQNCK-UHFFFAOYSA-N 0.000 description 4
- 206010057249 Phagocytosis Diseases 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 239000007998 bicine buffer Substances 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 239000006285 cell suspension Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 101150049376 ftsY gene Proteins 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 230000002147 killing effect Effects 0.000 description 4
- 235000013336 milk Nutrition 0.000 description 4
- 239000008267 milk Substances 0.000 description 4
- 210000004080 milk Anatomy 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 229920001542 oligosaccharide Polymers 0.000 description 4
- 230000003204 osmotic effect Effects 0.000 description 4
- 210000001322 periplasm Anatomy 0.000 description 4
- 101150014100 pilA gene Proteins 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000000171 quenching effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 238000013207 serial dilution Methods 0.000 description 4
- 230000035939 shock Effects 0.000 description 4
- 108010031009 signal peptide peptidase Proteins 0.000 description 4
- 239000008279 sol Substances 0.000 description 4
- 230000009466 transformation Effects 0.000 description 4
- 230000032258 transport Effects 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 3
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 241000283707 Capra Species 0.000 description 3
- 241000251204 Chimaeridae Species 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 238000012286 ELISA Assay Methods 0.000 description 3
- 108010000916 Fimbriae Proteins Proteins 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 108010006519 Molecular Chaperones Proteins 0.000 description 3
- 101100498930 Mus musculus Degs1 gene Proteins 0.000 description 3
- 108010090127 Periplasmic Proteins Proteins 0.000 description 3
- 239000012505 Superdex™ Substances 0.000 description 3
- XUGUHTGSMPZQIW-UHFFFAOYSA-N [[4-(4-diazonioiminocyclohexa-2,5-dien-1-ylidene)cyclohexa-2,5-dien-1-ylidene]hydrazinylidene]azanide Chemical group C1=CC(N=[N+]=[N-])=CC=C1C1=CC=C(N=[N+]=[N-])C=C1 XUGUHTGSMPZQIW-UHFFFAOYSA-N 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 125000002843 carboxylic acid group Chemical group 0.000 description 3
- 108091016312 choline binding proteins Proteins 0.000 description 3
- 238000004140 cleaning Methods 0.000 description 3
- 235000018417 cysteine Nutrition 0.000 description 3
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 3
- 238000004090 dissolution Methods 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000003505 heat denaturation Methods 0.000 description 3
- 206010022000 influenza Diseases 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000001323 posttranslational effect Effects 0.000 description 3
- 239000001103 potassium chloride Substances 0.000 description 3
- 235000011164 potassium chloride Nutrition 0.000 description 3
- 239000011535 reaction buffer Substances 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 239000008215 water for injection Substances 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- CAAMSDWKXXPUJR-UHFFFAOYSA-N 3,5-dihydro-4H-imidazol-4-one Chemical compound O=C1CNC=N1 CAAMSDWKXXPUJR-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- QRXMUCSWCMTJGU-UHFFFAOYSA-N 5-bromo-4-chloro-3-indolyl phosphate Chemical compound C1=C(Br)C(Cl)=C2C(OP(O)(=O)O)=CNC2=C1 QRXMUCSWCMTJGU-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 101100453077 Botryococcus braunii HDR gene Proteins 0.000 description 2
- 108010034055 CRM45 fragment of diphtheria toxin Proteins 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 2
- 108020004705 Codon Proteins 0.000 description 2
- 102000012410 DNA Ligases Human genes 0.000 description 2
- 108010061982 DNA Ligases Proteins 0.000 description 2
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 2
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 2
- 108010053187 Diphtheria Toxin Proteins 0.000 description 2
- 102000016607 Diphtheria Toxin Human genes 0.000 description 2
- 241000991587 Enterovirus C Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 241000606790 Haemophilus Species 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 206010061598 Immunodeficiency Diseases 0.000 description 2
- 229940124915 Infanrix Drugs 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 239000006137 Luria-Bertani broth Substances 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 101710163270 Nuclease Proteins 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 101710105714 Outer surface protein A Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 201000005702 Pertussis Diseases 0.000 description 2
- 239000004695 Polyether sulfone Substances 0.000 description 2
- 229940124950 Prevnar 13 Drugs 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010034546 Serratia marcescens nuclease Proteins 0.000 description 2
- 108010055044 Tetanus Toxin Proteins 0.000 description 2
- 108090000190 Thrombin Proteins 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 238000005903 acid hydrolysis reaction Methods 0.000 description 2
- IBVAQQYNSHJXBV-UHFFFAOYSA-N adipic acid dihydrazide Chemical group NNC(=O)CCCCC(=O)NN IBVAQQYNSHJXBV-UHFFFAOYSA-N 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- 125000003172 aldehyde group Chemical group 0.000 description 2
- 238000000540 analysis of variance Methods 0.000 description 2
- 238000000137 annealing Methods 0.000 description 2
- 230000003497 anti-pneumococcal effect Effects 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 125000003636 chemical group Chemical group 0.000 description 2
- 238000011210 chromatographic step Methods 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000005352 clarification Methods 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 238000001212 derivatisation Methods 0.000 description 2
- 238000011026 diafiltration Methods 0.000 description 2
- 238000000113 differential scanning calorimetry Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 239000012149 elution buffer Substances 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 210000003414 extremity Anatomy 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 238000002523 gelfiltration Methods 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 2
- 150000002333 glycines Chemical class 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- 108010037896 heparin-binding hemagglutinin Proteins 0.000 description 2
- 208000002672 hepatitis B Diseases 0.000 description 2
- SYECJBOWSGTPLU-UHFFFAOYSA-N hexane-1,1-diamine Chemical compound CCCCCC(N)N SYECJBOWSGTPLU-UHFFFAOYSA-N 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 238000010191 image analysis Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 229930027917 kanamycin Natural products 0.000 description 2
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 2
- 229960000318 kanamycin Drugs 0.000 description 2
- 229930182823 kanamycin A Natural products 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 230000014207 opsonization Effects 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000010979 pH adjustment Methods 0.000 description 2
- 230000000242 pagocytic effect Effects 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 108010021711 pertactin Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 229920006393 polyether sulfone Polymers 0.000 description 2
- 230000004853 protein function Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 101150079601 recA gene Proteins 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000006722 reduction reaction Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 229940118376 tetanus toxin Drugs 0.000 description 2
- 229960004072 thrombin Drugs 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 238000000108 ultra-filtration Methods 0.000 description 2
- 238000002211 ultraviolet spectrum Methods 0.000 description 2
- 238000003260 vortexing Methods 0.000 description 2
- NKUZQMZWTZAPSN-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 2-bromoacetate Chemical compound BrCC(=O)ON1C(=O)CCC1=O NKUZQMZWTZAPSN-UHFFFAOYSA-N 0.000 description 1
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 description 1
- BQWBEDSJTMWJAE-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[(2-iodoacetyl)amino]benzoate Chemical compound C1=CC(NC(=O)CI)=CC=C1C(=O)ON1C(=O)CCC1=O BQWBEDSJTMWJAE-UHFFFAOYSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 1
- NJNWCIAPVGRBHO-UHFFFAOYSA-N 2-hydroxyethyl-dimethyl-[(oxo-$l^{5}-phosphanylidyne)methyl]azanium Chemical group OCC[N+](C)(C)C#P=O NJNWCIAPVGRBHO-UHFFFAOYSA-N 0.000 description 1
- GUPXYSSGJWIURR-UHFFFAOYSA-N 3-octoxypropane-1,2-diol Chemical compound CCCCCCCCOCC(O)CO GUPXYSSGJWIURR-UHFFFAOYSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- OTLNPYWUJOZPPA-UHFFFAOYSA-N 4-nitrobenzoic acid Chemical compound OC(=O)C1=CC=C([N+]([O-])=O)C=C1 OTLNPYWUJOZPPA-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- 108700014168 ABC-type nickel transporter activity proteins Proteins 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-J ATP(4-) Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP([O-])(=O)OP([O-])(=O)OP([O-])([O-])=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-J 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010001076 Acute sinusitis Diseases 0.000 description 1
- 229910017119 AlPO Inorganic materials 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 238000012935 Averaging Methods 0.000 description 1
- 101000971127 Bartonella henselae Autotransporter adhesin BadA Proteins 0.000 description 1
- 241000588832 Bordetella pertussis Species 0.000 description 1
- 208000004020 Brain Abscess Diseases 0.000 description 1
- MTNGROIEEUCDSK-UHFFFAOYSA-N CC[IH]N1C(=O)C1=O Chemical compound CC[IH]N1C(=O)C1=O MTNGROIEEUCDSK-UHFFFAOYSA-N 0.000 description 1
- 108010053406 CRM 107 Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 206010007882 Cellulitis Diseases 0.000 description 1
- 241000193163 Clostridioides difficile Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 102100030497 Cytochrome c Human genes 0.000 description 1
- 108010075031 Cytochromes c Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- 101000597577 Gluconacetobacter diazotrophicus (strain ATCC 49037 / DSM 5601 / CCUG 37298 / CIP 103539 / LMG 7603 / PAl5) Outer membrane protein Proteins 0.000 description 1
- 241001235200 Haemophilus influenzae Rd KW20 Species 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 108091006054 His-tagged proteins Proteins 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 238000001295 Levene's test Methods 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000004317 Lyases Human genes 0.000 description 1
- 108090000856 Lyases Proteins 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 101710145006 Lysis protein Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 101710082149 Major fimbrial subunit Proteins 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 102000005431 Molecular Chaperones Human genes 0.000 description 1
- MSFSPUZXLOGKHJ-UHFFFAOYSA-N Muraminsaeure Natural products OC(=O)C(C)OC1C(N)C(O)OC(CO)C1O MSFSPUZXLOGKHJ-UHFFFAOYSA-N 0.000 description 1
- 101000606416 Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) Acyltransferase PE Proteins 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- 241000588653 Neisseria Species 0.000 description 1
- 241000588650 Neisseria meningitidis Species 0.000 description 1
- 238000011795 OF1 mouse Methods 0.000 description 1
- 108010079246 OMPA outer membrane proteins Proteins 0.000 description 1
- 206010031252 Osteomyelitis Diseases 0.000 description 1
- 101710203379 Outer membrane porin C Proteins 0.000 description 1
- 101710168317 Outer membrane protein 26 Proteins 0.000 description 1
- 101710160101 Outer membrane protein C Proteins 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 108010013639 Peptidoglycan Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 239000012506 Sephacryl® Substances 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 238000011869 Shapiro-Wilk test Methods 0.000 description 1
- 101710084578 Short neurotoxin 1 Proteins 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 102100033130 T-box transcription factor T Human genes 0.000 description 1
- 101710182223 Toxin B Proteins 0.000 description 1
- 101710182532 Toxin a Proteins 0.000 description 1
- 101710090861 Treponemal membrane protein A Proteins 0.000 description 1
- 101710100170 Unknown protein Proteins 0.000 description 1
- 101710151579 Zinc metalloproteinase Proteins 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000009798 acute exacerbation Effects 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 235000021028 berry Nutrition 0.000 description 1
- AFYNADDZULBEJA-UHFFFAOYSA-N bicinchoninic acid Chemical compound C1=CC=CC2=NC(C=3C=C(C4=CC=CC=C4N=3)C(=O)O)=CC(C(O)=O)=C21 AFYNADDZULBEJA-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000032770 biofilm formation Effects 0.000 description 1
- 208000002352 blister Diseases 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 238000011095 buffer preparation Methods 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- CVXBEEMKQHEXEN-UHFFFAOYSA-N carbaryl Chemical compound C1=CC=C2C(OC(=O)NC)=CC=CC2=C1 CVXBEEMKQHEXEN-UHFFFAOYSA-N 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 238000012412 chemical coupling Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 210000004081 cilia Anatomy 0.000 description 1
- 208000035850 clinical syndrome Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000001332 colony forming effect Effects 0.000 description 1
- 229940001442 combination vaccine Drugs 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 150000001913 cyanates Chemical class 0.000 description 1
- OOTFVKOQINZBBF-UHFFFAOYSA-N cystamine Chemical compound CCSSCCN OOTFVKOQINZBBF-UHFFFAOYSA-N 0.000 description 1
- 229940099500 cystamine Drugs 0.000 description 1
- UFULAYFCSOUIOV-UHFFFAOYSA-N cysteamine Chemical compound NCCS UFULAYFCSOUIOV-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 229940111685 dibasic potassium phosphate Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N dihydromaleimide Natural products O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 206010014665 endocarditis Diseases 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 101150012969 flgI gene Proteins 0.000 description 1
- 101150023650 gemin2 gene Proteins 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 101150085823 hsdR gene Proteins 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 239000000815 hypotonic solution Substances 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 230000009851 immunogenic response Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011078 in-house production Methods 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 208000022760 infectious otitis media Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- JDNTWHVOXJZDSN-UHFFFAOYSA-N iodoacetic acid Chemical compound OC(=O)CI JDNTWHVOXJZDSN-UHFFFAOYSA-N 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical compound O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229960003151 mercaptamine Drugs 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- 229940031348 multivalent vaccine Drugs 0.000 description 1
- RYRIMPODRHVEIW-UHFFFAOYSA-N n-(2-phenylethyl)nitramide Chemical compound [O-][N+](=O)NCCC1=CC=CC=C1 RYRIMPODRHVEIW-UHFFFAOYSA-N 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- JPXMTWWFLBLUCD-UHFFFAOYSA-N nitro blue tetrazolium(2+) Chemical compound COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 JPXMTWWFLBLUCD-UHFFFAOYSA-N 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 230000000625 opsonophagocytic effect Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 208000008494 pericarditis Diseases 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- GNSKLFRGEWLPPA-UHFFFAOYSA-M potassium dihydrogen phosphate Chemical compound [K+].OP(O)([O-])=O GNSKLFRGEWLPPA-UHFFFAOYSA-M 0.000 description 1
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000000751 protein extraction Methods 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 108700020464 quinolinate synthase Proteins 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000012146 running buffer Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 235000017709 saponins Nutrition 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 238000009331 sowing Methods 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000012609 strong anion exchange resin Substances 0.000 description 1
- 239000012607 strong cation exchange resin Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 108010064846 tertiary amine N-oxide reductase Proteins 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- UNXRWKVEANCORM-UHFFFAOYSA-N triphosphoric acid Chemical compound OP(O)(=O)OP(O)(=O)OP(O)(O)=O UNXRWKVEANCORM-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 230000018290 type IV pilus-dependent motility Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
- A61K39/092—Streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/05—Actinobacteria, e.g. Actinomyces, Streptomyces, Nocardia, Bifidobacterium, Gardnerella, Corynebacterium; Propionibacterium
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/08—Clostridium, e.g. Clostridium tetani
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/099—Bordetella
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/102—Pasteurellales, e.g. Actinobacillus, Pasteurella; Haemophilus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55544—Bacterial toxins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6037—Bacterial toxins, e.g. diphteria toxoid [DT], tetanus toxoid [TT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/315—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Streptococcus (G), e.g. Enterococci
- C07K14/3156—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Streptococcus (G), e.g. Enterococci from Streptococcus pneumoniae (Pneumococcus)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2730/00—Reverse transcribing DNA viruses
- C12N2730/00011—Details
- C12N2730/10011—Hepadnaviridae
- C12N2730/10111—Orthohepadnavirus, e.g. hepatitis B virus
- C12N2730/10134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/32011—Picornaviridae
- C12N2770/32611—Poliovirus
- C12N2770/32634—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Mycology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Pulmonology (AREA)
- Molecular Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Urology & Nephrology (AREA)
- Pain & Pain Management (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Ophthalmology & Optometry (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Gastroenterology & Hepatology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
Description
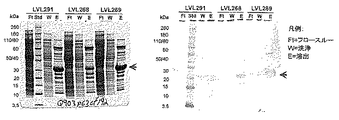
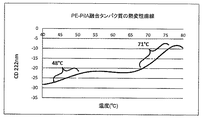
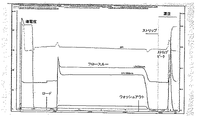
本発明者らは、肺炎球菌由来のPilA、PE(またはその断片)および糖類が、インフルエンザ菌および肺炎球菌に対する効果的な防御を提供するために免疫原性組成物中で有利に配合可能なことを見出した。
第1の態様において、本発明は、1種以上(例えば、7、8、9、10、11、12、13、14、15、16、17、18、19または20種)の肺炎球菌莢膜糖類コンジュゲートとタンパク質成分とを含み、そのタンパク質成分がインフルエンザ菌由来のタンパク質E(もしくはその免疫原性断片)および/またはPilA(もしくはその免疫原性断片)を含む免疫原性組成物に関する。
タンパク質E
本明細書で使用する場合、「タンパク質E(Protein E)」、「タンパク質E(protein E)」、「Prot E」、および「PE」は、インフルエンザ菌由来のタンパク質Eを意味する。タンパク質Eは、配列番号4(MKKIILTLSL GLLTACSAQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK)のアミノ酸配列ならびに配列番号4とその全長にわたって少なくともまたは正確に75%、77%、80%、85%、90%、95%、97%、99%もしくは100%の同一性を有する配列からなり得るか、または前記配列を含み得る。インフルエンザ菌由来のタンパク質Eの53配列(表1の配列番号5〜配列番号57)を比較したところ、配列番号4で示されるタンパク質Eとおよそ77%〜およそ100%の同一性が示された。例えば、タンパク質Eのアミノ酸配列では、アミノ酸#20はイソロイシン(I)またはトレオニン(T)であり得;アミノ酸#23はアラニン(A)またはバリン(V)であり得;アミノ酸#24はリシン(K)またはグルタミン酸(E)であり得;アミノ酸#31はアラニン(A)またはトレオニン(T)であり得;アミノ酸#32はプロリン(P)またはアラニン(A)であり得;アミノ酸#34はトレオニン(T)またはアラニン(A)であり得;アミノ酸#37はアルギニン(R)またはグルタミン(Q)であり得;アミノ酸#47はバリン(V)またはアラニン(A)であり得;アミノ酸#57はトリプトファン(W)であり得るか、または不在(−)であり得;アミノ酸#70はアラニン(A)またはトレオニン(T)であり得;アミノ酸#93はグルタミン(Q)または不在(−)であり得;アミノ酸#109はトレオニン(T)またはイソロイシン(I)であり得;アミノ酸#119はグリシン(G)またはセリン(S)であり得;アミノ酸#153はグルタミン酸(E)またはリシン(K)であり得;アミノ酸#156はセリン(S)またはロイシン(L)であり得;アミノ酸#160はリシン(K)またはアスパラギン(N)であり得;アミノ酸#161はリシン(K)、イソロイシン(I)または不在(−)であり得;アミノ酸#162〜#195は不在であり得るか、または配列番号15((−)はアミノ酸#166が不在であることを示す)で示される通り、もしくは配列番号16で示される通りであり得;またはそれらの任意の組合せであり得る。
タンパク質E−配列番号4
MKKIILTLSL GLLTACSAQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸17〜160−配列番号122
SAQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸18〜160−配列番号123
AQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸19〜160−配列番号124
QI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸20〜160−配列番号125
I QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸22〜160−配列番号126
KAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸23〜160−配列番号179
AEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸24〜160−配列番号180
EQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
一実施形態では、タンパク質Eまたはその免疫原性断片は、配列番号4を認識する免疫応答を惹起し得る。第1のタンパク質が第2のタンパク質を認識する免疫応答を惹起し得るかどうかはELISAアッセイ(例えば、実施例22の記載のELISA)を用いて判定することができる。
PilA
本明細書で使用する場合、「PilA」は、インフルエンザ菌由来のピリンAを意味する。PilAは、配列番号58(MKLTTQQTLK KGFTLIELMI VIAIIAILAT IAIPSYQNYT KKAAVSELLQ ASAPYKADVE LCVYSTNETT NCTGGKNGIA ADITTAKGYV KSVTTSNGAI TVKGDGTLAN MEYILQATGN AATGVTWTTT CKGTDASLFP ANFCGSVTQ)のタンパク質配列ならびに配列番号58と80%〜100%の同一性を有する配列からなり得るか、または前記配列を含み得る。例えば、PilAは、配列番号58と少なくとも80%、85%、90%、95%、97%または100%同一であり得る。インフルエンザ菌由来のPilAの64の配列(表2の配列番号58〜配列番号121)の全長比較によれば、配列番号58で示されるPilAとおよそ80%〜100%の同一性が示された。例えば、PilAのアミノ酸配列では、アミノ酸#6はグルタミン(Q)またはロイシン(L)であり得;アミノ酸#7はグルタミン(Q)またはトレオニン(T)であり得;アミノ酸#37はグルタミン(Q)またはリシン(K)であり得;アミノ酸#はアラニン(A)またはセリン(S)であり得;アミノ酸#57はアラニン(A)またはセリン(S)であり得;アミノ酸#67はアスパラギン(N)またはグリシン(G)であり得;アミノ酸#68はグルタミン酸(E)またはリシン(K)であり得;アミノ酸#69はトレオニン(threonine)(T)またはプロリン(P)であり得;アミノ酸#71はリシン(K)、アスパラギン(N)、セリン(S)またはトレオニン(T)であり得;アミノ酸#73はトレオニン(T)、セリン(S)またはメチオニン(M)であり得;アミノ酸#76はリシン(K)、セリン(S)またはアスパラギン(N)であり得;アミノ酸#84はトレオニン(T)またはリシン(K)であり得;アミノ酸#86はアラニン(A)またはバリン(V)であり得;アミノ酸#91はリシン(K)またはアラニン(A)であり得;アミノ酸#94はトレオニン(T)、イソロイシン(I)またはリシン(K)であり得;アミノ酸#96はセリン(S)またはグルタミン(Q)であり得;アミノ酸#97はアスパラギン(N)またはセリン(S)であり得アミノ酸#99はアラニン(A)またはグリシン(G)であり得;アミノ酸#103はアラニン(A)またはリシン(K)であり得;アミノ酸#109はアスパラギン酸(D)、アラニン(A)またはトレオニン(T)であり得;アミノ酸#110はグリシン(G)、アスパラギン(N)、またはアルギニン(R)であり得;アミノ酸#112はセリン(S)またはグルタミン酸(E)であり得;アミノ酸#114はトレオニン(T)またはイソロイシン(I)であり得;アミノ酸#116はトレオニン(T)またはグルタミン(Q)であり得;アミノ酸#118はグルタミン酸(E)、トレオニン(T)、アラニン(A)、リシン(K)またはセリン(S)であり得;アミノ酸#121はセリン(S)またはアラニン(A)であり得;アミノ酸#122はアラニン(A)またはトレオニン(T)であり得;アミノ酸#123はリシン(K)、トレオニン(T)またはアラニン(A)であり得;アミノ酸#128はリシン(K)またはトレオニン(T)であり得;アミノ酸#135はアスパラギン酸(D)またはグルタミン酸(E)であり得;アミノ酸#136はアラニン(A)またはトレオニン(T)であり得;アミノ酸#145はグリシン(G)またはアルギニン(R)であり得;アミノ酸#149はグルタミン(Q)またはリシン(K)であり得;またはそれらの任意の組合せであり得る。
MKLTTQQTLK KGFTLIELMI VIAIIAILAT IAIPSYQNYT KKAAVSELLQ ASAPYKADVE LCVYSTNETT NCTGGKNGIA ADITTAKGYV KSVTTSNGAI TVKGDGTLAN MEYILQATGN AATGVTWTTT CKGTDASLFP ANFCGSVTQL
別の実施形態では、PilAの免疫原性断片は、配列番号127とおよそ少なくとも75%、80%、85%、90%、95%、98%または99%同一である。より具体的には、一実施形態では、PilAの免疫原性断片は、配列番号127、すなわち、配列番号58のアミノ酸40〜149からなる断片である。
T KKAAVSELLQ ASAPYKADVE LCVYSTNETT NCTGGKNGIA ADITTAKGYV KSVTTSNGAI TVKGDGTLAN MEYILQATGN AATGVTWTTT CKGTDASLFP ANFCGSVTQ
別の実施形態では、PilAの免疫原性断片は、配列番号58〜配列番号121のいずれかに由来のアミノ酸40〜149からなる。さらなる実施形態では、免疫原性断片は、配列番号58〜配列番号121のいずれかに由来のアミノ酸40〜149と少なくとも95%同一である。
タンパク質E/PilA融合タンパク質
一実施形態では、タンパク質EおよびPilAは、融合タンパク質中に存在する。さらなる実施形態では、融合タンパク質は式(I):
L(X)m−(R1)n−A−(Y)o−B−(Z)p (式I)
を有し、式中、
Xは、シグナルペプチドまたはMHHHHHH(配列番号2)であり;
mは、0または1であり;
R1は、アミノ酸であり;
nは、0、1、2、3、4、5または6であり;
Aは、インフルエンザ菌由来のタンパク質Eもしくはその免疫原性断片、またはインフルエンザ菌由来のPilAもしくはその免疫原性断片であり;
Yは、GG、SG、SS、GGGおよび(G)h(ここで、hは4、5、6、7、8、9、または10である)からなる群から選択され;
oは、0または1であり;
Bは、インフルエンザ菌由来のPilAもしくはその免疫原性断片、またはインフルエンザ菌由来のタンパク質Eもしくはその免疫原性断片であり;
Zは、GGHHHHHH(配列番号3)であり;かつ
pは、0または1である。
MKKIILTLSL GLLTACSAQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸17〜160−配列番号122
SAQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸18〜160−配列番号123
AQI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸19〜160−配列番号124
QI QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸20〜160−配列番号125
I QKAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸22〜160−配列番号126
KAEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸23〜160−配列番号179
AEQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
配列番号4由来のタンパク質Eのアミノ酸24〜160−配列番号180
EQNDVKL APPTDVRSGY IRLVKNVNYY IDSESIWVDN QEPQIVHFDA VVNLDKGLYV YPEPKRYARS VRQYKILNCA NYHLTQVRTD FYDEFWGQGL RAAPKKQKKH TLSLTPDTTL YNAAQIICAN YGEAFSVDKK
別の実施形態では、Aがインフルエンザ菌由来のPilAである式(I)の融合タンパク質が定義される。別の実施形態では、Aが配列番号58、配列番号59、配列番号60、配列番号61、配列番号62、配列番号63、配列番号64、配列番号65、配列番号66、配列番号67、配列番号68、配列番号69、配列番号70、配列番号71、配列番号72、配列番号73、配列番号74、配列番号75、配列番号76、配列番号77、配列番号78、配列番号79、配列番号80、配列番号81、配列番号82、配列番号83、配列番号84、配列番号85、配列番号86、配列番号87、配列番号88、配列番号89、配列番号90、配列番号91、配列番号92、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号105、配列番号106、配列番号107、配列番号108、配列番号109、配列番号110、配列番号111、配列番号112、配列番号113、配列番号114、配列番号115、配列番号116、配列番号117、配列番号118、配列番号119、配列番号120および配列番号121;または配列番号58〜配列番号121のいずれかのサブセットからなる群から選択されるアミノ酸配列を有するインフルエンザ菌由来のPilAである式(I)の融合タンパク質が定義される。別の実施形態では、AはPilAであり、PilAは配列番号58とおよそ少なくとも75%、80%、85%、90%、92%、95%、98%または99%同一である。別の実施形態では、AはPilAであり、PilAは配列番号58〜配列番号121のいずれかと少なくとも95%同一である。特定の実施形態では、Aは配列番号58のPilAである。
MKLTTQQTLK KGFTLIELMI VIAIIAILAT IAIPSYQNYT KKAAVSELLQ ASAPYKADVE LCVYSTNETT NCTGGKNGIA ADITTAKGYV KSVTTSNGAI TVKGDGTLAN MEYILQATGN AATGVTWTTT CKGTDASLFP ANFCGSVTQL
別の実施形態では、Aは、配列番号127とおよそ少なくとも75%、80%、85%、90%、92%、95%、98%または99%同一のPilAの免疫原性断片である。より具体的には、一実施形態では、Aは、配列番号58のアミノ酸40〜149からなる断片である配列番号127である。
T KKAAVSELLQ ASAPYKADVE LCVYSTNETT NCTGGKNGIA ADITTAKGYV KSVTTSNGAI TVKGDGTLAN MEYILQATGN AATGVTWTTT CKGTDASLFP ANFCGSVTQ
別の実施形態では、Aは、配列番号58〜配列番号121のいずれか由来のアミノ酸40〜149からなるPilAの免疫原性断片である。さらなる実施形態では、Aは、配列番号58〜配列番号121のいずれかに由来のアミノ酸40〜149と少なくとも95%同一の免疫原性断片である。
肺炎球菌莢膜糖類コンジュゲート
莢膜糖類という用語には、莢膜多糖および莢膜多糖に由来するオリゴ糖が含まれる。オリゴ糖は、少なくとも4つの糖残基を含有する。コンジュゲートおよびコンジュゲートされたという用語は、担体タンパク質に共有結合されている莢膜糖類に関する。
コンジュゲーション
本発明の免疫原性組成物中に存在する糖類コンジュゲートは、任意のコンジュゲーション技術を用いて、担体タンパク質にコンジュゲートさせることができる。
A)カルボキシル(例えば、アスパラギン酸またはグルタミン酸を介する)。一実施形態では、この基は、糖類上のアミノ基に直接、またはカルボジイミド化学を用いて、例えば、EDACを用いて、リンカー上のアミノ基に連結させる。
糖類−OH+CNBrまたはCDAP−−−−−>シアン酸エステル+NH2−Prot −−−−>コンジュゲート
糖類−アルデヒド+NH2−Prot−−−−>シッフ塩基+NaCNBH3−−−−>コンジュゲート
糖類−COOH+NH2−Prot+EDAC−−−−>コンジュゲート
糖類−NH2+COOH−Prot+EDAC−−−−>コンジュゲート
スペーサー(リンカー)を介した間接的カップリング手法:
糖類−OH+CNBrまたはCDAP−−−>シアン酸エステル+NH2−−−−NH2 −−−−>糖類−−−−NH2+COOH−Prot+EDAC−−−−−>コンジュゲート
糖類−OH+CNBrまたはCDAP−−−−>シアン酸エステル+NH2−−−−−SH−−−−−>糖類−−−−SH+SH−Prot(システインが露出した天然タンパク質またはタンパク質のアミノ基の例えばSPDPによる修飾後に得られる天然タンパク質)−−−−−>糖類−S−S−Prot
糖類−OH+CNBrまたはCDAP−−−>シアン酸エステル+NH2−−−−SH −−−−−−−>糖類−−−−SH+マレイミド−Prot(アミノ基の修飾)−−−−>コンジュゲート
糖類−OH+CNBrまたはCDAP−−−>シアン酸エステル+NH2−−−−−SH −−−>糖類−SH+ハロアセチル化−Prot−−−−>コンジュゲート
糖類−COOH+EDAC+NH2−−−−−NH2−−−>糖類−−−−−−NH2+EDAC+COOH−Prot−−−−>コンジュゲート
糖類−COOH+EDAC+NH2−−−−SH−−−−−>糖類−−−−SH+SH−Prot(システインが露出した天然タンパク質またはタンパク質のアミノ基の例えばSPDPによる修飾後に得られる天然タンパク質)−−−−−>糖類−S−S−Prot
糖類−COOH+EDAC+NH2−−−−SH−−−−−>糖類−−−−SH+マレイミド−Prot(アミノ基の修飾)−−−−>コンジュゲート
糖類−COOH+EDAC+NH2−−−−SH−−−>糖類−SH+ハロアセチル化−Prot−−−−>コンジュゲート
糖類−アルデヒド+NH2−−−−−NH2−−−−>糖類−−−NH2+EDAC+COOH−Prot−−−−>コンジュゲート
注:上記のEDACの代わりに、任意の好適なカルボジイミドを使用してもよい。
非コンジュゲートまたはコンジュゲート肺炎球菌タンパク質
本発明の免疫原性組成物は、少なくとも1つの非コンジュゲートまたはコンジュゲート肺炎球菌タンパク質を含み得る。一実施形態では、少なくとも1つの非コンジュゲートまたはコンジュゲート肺炎球菌タンパク質は、ポリヒスチジントライアドファミリー(PhtX)、無毒化ニューモリシン(dPly)、コリン結合タンパク質ファミリー(CbpX)、CbpX末端切断型、LytX(自己分解酵素)ファミリー、LytX末端切断型、CbpX末端切断型−LytX末端切断型キメラタンパク質、PcpA(肺炎球菌コリン結合タンパク質A)、PspA(肺炎球菌表面タンパク質A)、PsaA(肺炎球菌表面アドヘシン タンパク質A)、Sp128、Sp101(肺炎球菌101)、Sp130(肺炎球菌130)、SP125(肺炎球菌125)およびSP133(肺炎球菌133)からなる群から選択される。
アジュバント
一実施形態では、免疫原性組成物はアジュバントを含む。
ワクチン
本発明は、本発明の免疫原性組成物を含むワクチンを提供する。本発明の「免疫原性組成物」に関する本明細書内の実施形態は、本発明の「ワクチン」に関する実施形態にも適用可能であり、逆も同じである。一実施形態では、ワクチンは、本発明の免疫原性組成物と薬学上許容される賦形剤とを含む。
さらなる定義
本明細書においてそうではないことが説明または定義されない限り、本明細書で使用する全ての技術用語および科学用語は、本開示が属する技術分野の熟練者によって一般に理解されているものと同じ意味を有する。例えば、分子生物学における一般用語の定義はBenjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (編), The Encyclopedia of Molecular Biology, Blackwell Science Ltd.出版, 1994 (ISBN 0-632-02182-9);およびRobert A. Meyers (編), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, VCH Publishers出版, Inc., 1995 (ISBN 1-56081-569-8)に見出せる。
6xhis=6ヒスチジン;
xg=遠心力(重力数);
ATP=アデノシン三リン酸;
BCA=ビシンコニン酸;
BSA=ウシ血清アルブミン;
℃=摂氏度;
CaCl2=塩化カルシウム;
CV=カラム容量;
DNA=デオキシリボ核酸;
DSC=示差走査熱量測定;
DTT=ジチオトレイトール;
dNTP=デオキシヌクレオシド三リン酸;
EDTA=エチレンジアミン四酢酸;
FT=フロースルー;
HCl=塩化水素;
His=his=ヒスチジン;
HEPES=4−(2−ヒドロキシエチル)−1−ピペラジンエタンスルホン酸;
IMAC=固定化メタルアフィニティークロマトグラフィー;
IPTG=イソプロピルβ−D−1−チオガラクトピラノシド;
KCl=塩化カリウム;
K2HPO4=第二リン酸カリウム;
KH2PO4=第一リン酸カリウム;
LDS=ドデシル硫酸リチウム;
L=リットル;
MES=2−(N−モルホリノ)エタンスルホン酸;
MgCl2=塩化マグネシウム;
ml=ミリリットル;
RPM=回転毎分
min=分;
mM=モリモル;
μL=マイクロリットル;
NaCl=塩化ナトリウム;
Na2HPO4=第二リン酸水素ナトリウム;
NaH2PO4=第一リン酸ナトリウム;
ng=ナノグラム;
nm=ナノメートル;
O/N=一晩;
PBS=リン酸緩衝生理食塩水;
PCR=ポリメラーゼ連鎖反応;
SB=サンプルバッファー;
sec=秒;
w/v=重量/容量
PS=多糖、「糖類」と互換的に使用することができる。
1.実施例
実施例1:融合タンパク質
種々のシグナルペプチドおよびアミノ酸リンカー配列との融合タンパク質を作製した。これらの融合タンパク質は、タンパク質EおよびPilA(またはそれらの断片)の両方の分泌を、単一の細菌株に限定されることなく可能とした。融合タンパク質は、シグナルペプチドペプチダーゼにより異種シグナルペプチドが取り除かれた後に周辺質に放出される。細菌から精製された融合タンパク質は、異種シグナルペプチドを含有しない。「精製された」タンパク質は、細菌から取り出され、シグナルペプチドを欠く。
シグナル配列:
融合タンパク質構築物配列:
アミノ酸配列の一本の下線を引いた箇所はHaemophilus influenzae 86−028NP株由来のPilAに由来する。アミノ酸配列の太い下線を引いた箇所はHaemophilus influenza 772株に由来するタンパク質Eに由来した。
上記配列が得られたPE及びPilAの全長配列を、配列番号4(PE)及び配列番号58(PilA)にそれぞれ示す。
実施例2:ベクター構築物及び形質転換
H.influenzae 772株由来のPEを増幅するためのプライマーをH.influenzae Hi Rd株の配列に基づいて設計した。5’プライマー配列はNTHi 772配列と比べて一つ異なるヌクレオチドを含み、これは現在報告されているNTHi 772ゲノム配列と比べて、24位に異なるアミノ酸が導入されている。融合タンパク質構築物におけるアミノ酸#24は、NTHi 772にて見出されるK(リシン)に代えて、グルタミン酸である。
ベクター構築:
LVL312、LVL291、LVL268、LVL269、LVL270、LVL702、LVL735、LVL778、LVL779、LVL780、LVL781およびLVL782を作製するために、下記の成分のポリメラーゼ連鎖反応(PCR)調製物を調製した(具体的成分を次に例示する):36.6μlの脱イオン水、5μlのバッファー#1 10×、5μlのdNTP 2mM、2μlのMgCl2 25mM、0.4μlのプライマー#1(50μM)、0.4μlのプライマー#2(50μM)、0.5μlの鋳型(100ng/μl)および0.4μlのKOD HiFi DNAポリメラーゼ2.5単位/μl(NOVAGEN(登録商標))を配合した。ポリメラーゼ連鎖反応は、98℃で15秒の変性、55℃で2秒のアニーリングおよび72℃で20秒のプライマー伸長を25サイクル含んだ。PCR産物をQIAQUICK(登録商標)PCR精製キット(QIAGEN(登録商標))を用いて精製した。この産物を、1容量のPCR調製物に対して、QIAQUICK(登録商標)PCR精製キットに提供されている5容量のバッファーPBの添加という供給者により推奨されている条件下で使用した。次に、バッファーPBを含むPCR調製物をボルテックスにより混合した。QIAQUICK(登録商標)カラムを2mlのコレクションチューブに入れた。PCR調製物中のDNAをカラムに結合させるため、混合したサンプルをQIAQUICK(登録商標)カラムに適用し、14000RPMで30〜60秒間遠心分離した。フロースルーを廃棄し、QIAQUICK(登録商標)カラムを同じチューブに戻した。結合したDNAを洗浄するために、QIAQUICK(登録商標)PCR精製キットに提供されている0.75mlのバッファーPEをQIAQUICK(登録商標)カラムに加え、このカラムを14000RPMで30〜60秒間遠心分離した。フロースルーを廃棄し、QIAQUICK(登録商標)カラムを同じチューブに戻した。残留する洗浄バッファーを除去するために、QIAQUICK(登録商標)カラムを2mlコレクションチューブ中でもう1回、1分間、遠心分離した。各QIAQUICK(登録商標)カラムを1.5 mlの透明なマイクロ遠沈管に入れた。DNAを溶出させるため、33μlの水をQIAQUICK(登録商標)膜の中央に加え、カラムを14000RPMで1分間遠心分離した。制限酵素および関連のバッファーはNew England BioLabsから入手した。例えば、およそ5μlのpET26bベクター(100ng/μl)、2μlのNEバッファー2(New England Biolabs、1×NEバッファー2:50mM NaCl、10mM Tris−HCl、10mM MgCl2、1mMジチオトレイトール、pH7.9、25℃)、1μlのNdeI(20000単位/ml)、1μlのHindIII(20000単位/ml)および11μlの脱イオン水を混合し、DNA消化のために37℃で2時間インキュベートした。その後、QIAQUICK(登録商標)PCR精製キット(QIAGEN(登録商標))を上記の手順に従って用い、第2段階の精製を行った。
大腸菌(Escherichia coli)BLR(DE3)または大腸菌HMS(DE3)細胞を、CaCl2処理細胞を用いた標準的方法に従ってプラスミドDNAで形質転換した(Hanahan D. ≪ Plasmid transformation by Simanis. ≫ In Glover, D. M. (Ed), DNA cloning. IRL Press London. (1985): p. 109-135.)。簡単に述べれば、BLR(DE3)またはHMS174(DE3)コンピテント細胞を氷上で温和に解凍した。およそ4μlのプラスミド(10〜100ng)を、50〜100μlコンピテント細胞を用いて混合した。その後、この配合物を氷上で30分間インキュベートした。形質転換反応を行うために、配合物に42℃で45秒、熱パルスをかけた後、氷上で2分間インキュベートした。およそ0.5mlのSOC培地(Super Optimal broth with Catabolite repression)を形質転換細胞に加え、細胞培養物を37℃で1時間インキュベートした後、50ug/mlのカナマイシンを含むLuria−Bertani(LB)寒天に播種した。100μl前後の形質転換細胞培養物を播種し、37℃で一晩インキュベートした。
BLR(DE3)を用いた生産およびHisタグを有する構築物の特徴を実施例3〜実施例6に記載する。
実施例3:振盪フラスコを用いたタンパク質発現
一般に、組換えプラスミドで形質転換された大腸菌BLR(DE3)を播種した1枚のコンフルエント寒天プレートを掻き取り、培養培地に再懸濁させ、これを用いて、800mlのLBブロス(Becton、Dickinson and Company)±1%(重量/容量、w/v)グルコース(Laboratoire MAT、カタログ番号:GR−0101)および50μg/mlカナマイシン(Sigma)を、O.D.600nmが0.1〜0.2となるまで播種した。培養物を、O.D.600nmが約0.8に達するまで、37℃にて250RPMの回転でインキュベートした。
実施例4:振盪フラスコ、細胞ペースト、Hisタグを有する構築物を用いたタンパク質精製
誘導後に得られた各細菌ペレットを、500mM NaCl、10mMイミダゾールおよびRoche COMPLETE(登録商標)プロテアーゼ阻害剤カクテル(1錠/500mM NaClを含有する50mlのHEPESバッファー、Roche COMPLETE(登録商標)ULTRA錠、Roche Diagnostics Corporation)を含有する20mMの4−(2−ヒドロキシエチル)−1−ピペラジンエタンスルホン酸(HEPES)バッファー(pH8.0)を再懸濁した。
実施例5:Hisタグを有する構築物のSDS−PAGEおよびウエスタンブロット分析ならびにhisタグを有さないLVL317およびLVL318構築物のSDS−PAGE分析
可溶性画分および不溶性画分の調製
例えば、誘導後の1mlの培養物(例えば、上記の実施例3参照)を14000RPMで2分間遠心分離した。ペレットを、40μlのBUGBUSTE(登録商標)タンパク質抽出試薬(NOVAGEN(登録商標)、EMD4 Biosciences、Merck)を用いて再可溶化して細胞懸濁液を作製した。この細胞懸濁液を回転プラットフォーム上、室温で10分間インキュベートした。次に、この細胞懸濁液を14000RPMで2分間遠心分離して可溶性画分を分離した。得られたペレット(不溶性画分)を、70μlの脱イオン水、5μlのジチオトレイトール(DTT)1Mおよび25μlのNUPAGE(登録商標)LDS(ドデシル硫酸リチウム)サンプルバッファー4×(INVITROGEN(商標))を用いて再可溶化した。可溶性画分(再可溶化ペレットの細胞懸濁液からの上清)を30μlの脱イオン水、5μlのDTT 1Mおよび25μlのLDSサンプルバッファー4×に加えた。
培地画分の調製
例えば、培地画分を調製するために、遠心分離後の誘導済みの全細胞培養物からの100μlの上清(例えば、上記の実施例3参照)を、500μlのRC試薬I(Bio−Rad Laboratories,Inc.)を加えることによって濃縮し、このサンプルを室温で1分間混合し、インキュベートした。次に、500μlの試薬II(Bio−Rad Laboratories,Inc.)をこのサンプルに加え、混合した。この配合物を14000RPMで10分間遠心分離した。ペレットを、28μlの脱イオン水、2μlのDTT 1Mおよび10μlのLDS SB 4×を用いて再可溶化した。
精製画分の調製
例えば、SDS−PAGE分析のために、70μlのサンプル、5μlのDTT 1Mおよび25μlのLDSサンプルバッファー4×を加えることにより、精製タンパク質(例えば、実施例4に記載の通りに得た)調製した。
SDS−PAGE分析およびニトロセルロース膜への転写
SDS−PAGE分析およびニトロセルロース膜への転写は、NUPAGE(登録商標)Bis−Tris 4−12%ゲルを用い、製造者の推奨(Invitrogen)に従って行った。サンプル、バッファーの調製および泳動条件は、供給者が推奨している条件下で行った。
LVL291の物理的特性:LVL291におけるPEおよびPilAの折り畳みおよび融点
円偏光二色性:
二次構造の解析
円偏光二色性(CD)を用いて、構造的非対称による左円偏光と右円偏光の吸収の違いを測定することによってタンパク質の二次構造組成を決定する。遠UV領域(190〜250nm)内のCDスペクトルの形状および大きさは、タンパク質がβ−シートを呈するかα−ヘリックスを呈するかまたはランダムコイル構造を呈するかによって異なる。あるタンパク質サンプルにおける各二次構造タイプの相対的存在量は、参照スペクトルとの比較によって計算することができる。
結果:
PE(構築物pRIT16762由来)、PilA(構築物pRIT16790由来)およびPE−PilAタンパク質に関して得られた遠UV CDスペクトルは、α構造とβ構造の混合物を含有する折り畳まれたタンパク質に特徴的なものであるが、PEはPilAおよびPE−PilAよりもαヘリックスが有意に豊富である(図7、PE、PilAおよびPE−PilA融合タンパク質のCDスペクトル)。
融点評価:
融合物としての発現が個々のタンパク質の熱力学的特性に影響力を持つかどうかを評価するために、PE、PilAおよびPE−PilAの融点を、温度によるαヘリックスの折り畳みの解除を円偏光二色性によってモニタリングすることにより評価した。
実施例7:発酵プロセス
本発明の融合タンパク質は、当業者に公知の方法によって作製することができる。
実施例8:PE、PilA、およびLVL317のタンパク質の精製
pRIT16762からのPEタンパク質の精製:
pRIT16762発現ベクターを作製するために、BamHIおよびNcoI制限酵素を用いてpRIT16711ベクターを消化し、シグナル配列(pelB)とPEの間の6個のアミノ酸残基を削除した。得られたベクターをpRIT16712と呼称した。このベクターでは、シグナル配列pelBとPEの間に3個のアミノ酸MDPが存在する。第2段階で、鋳型としてのpRIT16712をプライマーMnoNTHi−44およびMnoNTHi−45(表4に記載)とQuikChange II部位特異的突然変異誘発キット(Agilent Technologies、Stratagene Division)とともに用いて部位特異的突然変異誘発を行い、アミノ酸配列をMDPからQIQへ変化させた。
PE QIQで誘導したBLR(DE3)の溶解
遠心分離ボトルから遠心バッグを取り出し、開封し、ペレットをバックからビーカーに出した。8つのペレットを一緒にし、100mlの結合バッファー(20mM Hepes、10mMイミダゾール、500mM NaCl、pH8.01)に再懸濁させた。PE QIQ構築物を含有する大腸菌BLR(DE3)をConstant Systems Ltd.製のTS Series Bench Top細胞粉砕器(1×30kPsi;1×15kPsi)で粉砕した。溶解液を30分間、6000RPM、4℃で遠心分離した。上清を維持し、IMACカラムにロードした。
PE QIQのIMAC精製
IMACカラム(BioRad、Bio−Scale Mini Profinity IMACカートリッジ5ml)を5CVの結合バッファー(20mM HEPES、10mMイミダゾール、500mM NaCl、pH8.01)を5ml/分で用いて平衡化した。100mlの溶解液上清をIMACに2.5mL/分でロードした。フロースルーをさらなる分析のために50ml画分として回収した。カラムを3CVの結合バッファーで洗浄して、結合していないタンパク質を除去した。結合していないタンパク質を含有するサンプルを50mlのチューブに15mlの1アリコートとして回収した。カラムを2CVの洗浄バッファー(20mM HEPES、20mMイミダゾール、500mM NaCl、pH8.01)で洗浄し、96ウェルプレートに2ml画分として回収した。次に、結合したタンパク質を6CVの100%溶出バッファー(20mM HEPES、250mMイミダゾール、500mM NaCl、pH8.01)で溶出した。溶出されたタンパク質を96ウェルプレートに2ml画分として回収した。洗浄および溶出は5ml/分で行った。
PE QIQのIMACプールに対するサイズ排除クロマトグラフィー(SEC)
SECカラム(GE healthcare、HILOAD(商標)26/60 SUPERDEX(商標)75分取グレード分取グレード、高さ60cm 容積およそ319ml)を3CVのSECバッファー(20mM HEPES、150mM NaCl、pH8.49)で平衡化した。11mlのIMAC溶出液を2.5ml/分の流速でカラムにロードした。0.3CV〜0.9CVから2ml画分を回収した。2回実施した後に、画分をSDS−PAGEにより分析した。Prot Eタンパク質を含有する2回の実施からの画分を一緒にプールした(「SECプール」、総容量およそ48ml)。500mMのアルギニンをSECプールに加えた。
上記SECプロトコールで作製されたPE QIQプールサンプルの用量
SECプールに対して、製造者のプロトコールに従い、Bio−Rad RC DC(商標)キットからのRCDC(還元剤およびDetergent Compatible)法を行った:
各供試サンプルおよび標品について、25μLをマイクロ遠沈管に二反復で分注した。125μLのBio−Rad RC試薬Iを各遠沈管に加え、各遠沈管をボルテックスにかけ、室温で1分間インキュベートした。125μLのBio−Rad RC試薬IIを各遠沈管に加え、各遠沈管をボルテックスにかけた後、14,000xgで5分間遠心分離する。きれいな吸収性のティッシュペーパー上に遠沈管を逆さに置き、遠沈管から液体を完全に排出させることによって上清を排出する。25.4μLの試薬A(1mlの試薬Aにつき20μLの試薬Sを混合することにより予め調製)を各遠沈管に加え、各遠沈管をボルテックスにかけ、室温で5分間、または沈殿が完全に溶解するまでインキュベートする。ボルテックスにかけた後、次工程に進む。200μLのDC試薬Bを各遠沈管に加え、すぐにボルテックスにかける。室温で15分間インキュベートした。全てのサンプルを96ウェルプレートに移し、750nmでの吸光度を読み取り、各未知のタンパク質サンプルのタンパク質濃度を決定する。
PilA Hisタグを有するタンパク質の精製:
PilAは、下記の一般手順に従って精製した:
PilAまたはその断片をコードする構築物を含有する大腸菌細胞を、BUGBUSTER(登録商標)およびBENZONASE(登録商標)ヌクレアーゼ(NOVAGEN(登録商標))、例えば、10ml BUGBUSTER(登録商標)および10μl BENZONASE(登録商標)ヌクレアーゼに懸濁させる。細胞溶解液を室温にて回転プラットフォーム上で、例えば15分間混合する。細胞溶解液を4℃にて、例えば、16,000gにて20分間遠心分離する。タンパク質を含有する上清を、Ni NTA HIS・BIND(登録商標)樹脂を含むNi NTAカラムに加え、4℃で、例えば、1時間混合する。このカラムは2mlのNi NTA HIS・BIND(登録商標)樹脂(NOVAGEN(登録商標))および10ml 1×結合バッファー(NOVAGEN(登録商標)のNi−NTAバッファーキット)からなり得る。次に、カラムフロースルーを回収する。樹脂を例えば、300mM NaCl、50mM NaH2PO4、25mMイミダゾン、pH8.0を含有する1×洗浄バッファーで2回洗浄する。洗液を重力流により回収する。タンパク質をカラムから1×溶出バッファー、例えば、300mM NaCl、50mM NaH2PO4、250mMイミダゾン、pH8.0で溶出させる。タンパク質は、結合バッファーで透析し、上記のようにNi NTAカラムに再び流すことによりさらに精製することができる。
PilAのトロンビン切断
次に、PilAをトロンビン(1/50希釈)とともに室温で16時間インキュベートし、ヒスチジンタグを除去する。
トロンビンで切断したPilAに対するサイズ排除クロマトグラフィー(SEC)
SECカラム(GE healthcare、HILOAD(商標)26/60 SUPERDEX(商標)75分取グレード、高さ60cm 容積およそ319ml)を5CVのSECバッファー(20mM HEPES、150mM NaCl、pH8.52)で平衡化した。およそ10mlの切断PilAをこのカラムに流速2.5ml/分でロードした。0.3CV〜0.9CVから2ml画分を回収した。2回の流出を行った後、画分をSDS−PAGEにより分析した。切断PilAタンパク質を含有する2回の流出からの画分をプールした(「SECプール」、総容量およそ52ml)。
PilA、SECプールの量
SECプールに対して上記のようにRCDC法を行った。切断PilAの濃度は5.37mg/mlであった。
PBS 1×pH7.4によるPilA SECプールの透析(透析倍率=1600)およびRCDCによる処理
RCDCにより測定された透析後濃度は3.0mg/mlであった。
LVL317の精製
浸透圧ショック
LVL317融合タンパク質は細菌周辺質で発現されプロセシングされるので、このタンパク質は浸透圧ショックにより抽出された。
SP SEPHAROSE(商標)ファーストフロー(SP FF)クロマトグラフィー
希釈/濾過したSN2を2CVの20mM NaH2PO4/Na2HPO4バッファーpH7.0で平衡化した14cm ID(内径)×20cm長のカラム(カラム容積3100ml)中の強陽イオン交換樹脂(SP SEPHAROSE(商標)FF−GE Healthcare)にロードし、捕捉させた。カラムを5CVの20mM NaH2PO4/Na2HPO4バッファーpH7.0で洗浄した後、抗原(LVL317内に含有)を、同じ洗浄バッファー中100mMまでNaCl濃度を高めることにより溶出させた。
典型的なSP SEPHAROSE(商標)ファーストフロークロマトグラムに関しては図12を参照。
Q SEPHAROSE(商標)ファーストフロー(Q FF)クロマトグラフィー
SP FF溶出液中に存在する抗原を20mM Tris pH8.5で1:4希釈し、必要であればpHを8.5に調整し、2CVの20mM TrisバッファーpH 8.5で平衡化した14cm ID×11.8cm長のカラム(カラム容積1800ml)中の強陰イオン交換樹脂(Q SEPHAROSE(商標)FF−GE Healthcare)に通した。抗原はフロースルー画分に回収された。
濃度、ダイアフィルトレーション、ポリソルベート80の添加および濾過除菌
抗原を含有するQ FFフロースルーをクロマトグラムUVに基づいて0.7〜0.8mg/mlまで濃縮し、Pellicon−2(商標)10kDaカットオフメンブレン(Millipore)を用いて、5DVの10mM KH2PO4/K2HPO4バッファーpH6.5でダイアフィルトレーションを行った。
実施例9:ポリソルベート80の使用
滴定実験は、濾過除菌の前に精製バルクに終濃度0.04%(w/v)までポリソルベート80、具体的には、TWEEN(商標)80を加えると、微細線維粒子の形成および凝集が軽減されることを示した。
実施例10:LVL317のSDS−PAGEおよびウエスタンブロット分析
SDS−PAGEおよびウエスタンブロット分析:
NUPAGE(登録商標)、Bis−Tris 4〜12%ゲルに、95℃で5分間加熱した、50mM DTTを含有するNUPAGE(登録商標)LDSサンプルバッファー中、10μgのサンプルを下記のようにロードした(低濃度のサンプルに関しては20μLのサンプルをロードした)。泳動:NUPAGE(登録商標)MESランニングバッファー中、室温(RT)、200ボルトで35分。ゲルをインスタントブルー(Novexin cat.:ISB01L)で2時間染色し、水中で一晩脱染した。
レーン内容:
1:MW標品(10μL)
2:開始(全画分)(10μg)
3:濾過なしのSN1(10μg)
4:濾過なしのSN2(10μg)
5:抽出なし(10μg)
6:ロードSP FF(10μg)
7:フロースルーSP FF(6.9μg)
8:洗浄SP FF(20μL)
9:溶出SP FF(10μg)
10:ストリップSP FF(10μg)
11:ロードQ FF(8.9μg)
12:溶出Q FF(9.8μg)
13:ストリップQ FF(4.8μg)
14:0.04%TWEEN(商標)80添加前のTFF保持液(10μg)
15:0.04%TWEEN(商標)80添加後の濾過しない精製バルク(10μg)
16:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(10μg)
17:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(20μg+添加大腸菌細胞溶解液Rix(1μg))
18:大腸菌細胞溶解液Rix(2μg)
19:大腸菌細胞溶解液Rix(1μg)
20:大腸菌細胞駅Rix(0.5μg)
PE−PilA融合タンパク質の精製プロセスからのインプロセスサンプルのSDS−PAGEに関しては図14を参照。
レーン内容:
1:MW標品(10μL)
2:開始(全画分)(10μg)
3:濾過なしのSN1(10μg)
4:濾過なしのSN2(10μg)
5:抽出なし(10μg)
6:ロードSP FF(10μg)
7:フロースルーSP FF(6.9μg)
8:洗浄SP FF(20μL)
9:溶出SP FF(10μg)
10:ストリップSP FF(10μg)
11:ロードQ FF(8.9μg)
12:溶出Q FF(9.8μg)
13:ストリップQ FF(4.8μg)
14:0.04%TWEEN(商標)80添加前のTFF保持液(10μg)
15:0.04%TWEEN(商標)80添加後の濾過しない精製バルク(10μg)
16:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(10μg)
17:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(20μg+添加大腸菌細胞溶解液Rix(1μg))
18:大腸菌細胞溶解液Rix(2μg)
19:大腸菌細胞溶解液Rix(1μg)
20:大腸菌細胞駅Rix(0.5μg)
PE−PilA融合タンパク質からの精製プロセスのインプロセスサンプルのウエスタンブロットに関しては図16参照。ウサギポリクローナル抗大腸菌(BLR)を用いてブロットした。
レーン内容:
1:MW標品(10μL)
2:開始(全画分)(10μg)
3:濾過なしのSN1(10μg)
4:濾過なしのSN2(10μg)
5:抽出なし(10μg)
6:ロードSP FF(10μg)
7:フロースルーSP FF(6.9μg)
8:洗浄SP FF(20μL)
9:溶出SP FF(10μg)
10:ストリップSP FF(10μg)
11:ロードQ FF(8.9μg)
12:溶出Q FF(9.8μg)
13:ストリップQ FF(4.8μg)
14:0.04%TWEEN(商標)80添加前のTFF保持液(10μg)
15:0.04%TWEEN(商標)80添加後の濾過しない精製バルク(10μg)
16:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(10μg)
17:0.04%TWEEN(商標)80添加後の濾過除菌した精製バルク(20μg+添加大腸菌細胞溶解液Rix(1μg))
18:大腸菌細胞溶解液Rix(2μg)
19:大腸菌細胞溶解液Rix(1μg)
20:大腸菌細胞駅Rix(0.5μg)
SDS−PAGEおよびウエスタンブロット図の説明: PE−PilA融合タンパク質は30kDaに移動する。浸透圧ショックによる抽出は、細菌の周辺質で発現され、プロセシングされた融合タンパク質を抽出し、細菌由来のコンタミネーションを軽減した。高張処理中の融合タンパク質の損失は小さい(レーン3)。低張処理により小さな割合ながら抽出されないものがあり、細胞との結合を維持する(レーン5)。SP FFフロースルー(レーン7)および両カラムにおけるストリップ画分(レーン10および13)の損失は小さい。ストリップ画分の総容量は少ないので、融合タンパク質の損失は有意ではない。ストリップ画分には分解されたバンドが見られるが、最終産物には見られない。精製バルクには大腸菌宿主細胞タンパク質由来の有意なコンタミネーションはない(レーン16)。
実施例11:PE、PilAおよびLVL317の融点データ
PE−PilA融合Hisタグ不含タンパク質(LVL317)の温度遷移を、上記のように精製したPE hisタグ含有(実施例8に記載の通り)タンパク質および切断型PilA(実施例8に記載の通り)タンパク質の両方の温度遷移と比較した。
結果:
PE−PilA融合タンパク質およびPEおよびPilAタンパク質の温度遷移に関しては図17を参照。曲線:PilA(1)、タンパク質E(Prot E、PE)(2)、無希釈のPE−PilA PB737μg/ml(3)、およびFC濃度60μg/mlに希釈したPE−PilA PB(4)。
1−PilA Tm:53℃
2−タンパク質E Tm:63
3−無希釈のPE−PilA PB(精製バルク)737μg/ml Tm1:53.7℃およびTm2:66.1℃
4−FC濃度60μg/mlに希釈したPE−PilA PB Tm1:53.2℃およびTm2:67.6℃
精製融合タンパク質(LVL317)において2つの遷移が検出された(曲線3および4)。
実施例12:Balb/cマウスにおけるPE−PilA融合タンパク質構築物LVL291抗PilAの免疫原性応答
AS03A中に配合した精製LVL291 PE−PilA融合タンパク質(異種シグナルペプチドを含まないLVL291融合タンパク質)に対する免疫応答をBalb/cマウスにおいて評価した。0、14および28日目に、動物(マウス20個体/群)を、それぞれAS03A中に配合した10μgのPE(ベクターpRIT16762由来)、PilA(ベクターpRIT16790由来)またはPE−PilAで筋肉内により免疫した。対照群にはAS03Aのみを接種した。各抗原に対する抗体応答を、42日目に採取した個々の血清において測定した。抗体応答は陰性対照で得られた。図18に示されるように、PilAに対する抗体応答は、一価PilAで免疫したマウスにおける抗体応答に比べてPE−PilA融合物で免疫したマウスで高かった。PEに対する抗体応答は、融合タンパク質で免疫したマウスと一価PEで免疫したマウスで同等であった。GMT=幾何平均力価。WINDOWS(登録商標)(Microsoft)下で実行するSOFTMAX(登録商標)Proソフトウエア(Molecular Devices)を用いてデータを取り込んで解析し、4パラメーターロジスティック対数関数を用いて標準曲線を計算した。4パラメーターロジスティック対数関数は、濃度に対する光学密度(対数)スケール上にプロットした際に明白なS字型を示す参照血清の曲線を高精度で表す。抗体濃度は、マウス血清サンプルの各希釈において、標準曲線の補間によって計算した。品質管理血清および未知の血清サンプル中の抗体は、参照の希釈曲線の有効範囲(10〜80%)内にある全ての希釈からの値の平均を取ることによって得られる。結果は図18に示すが、これはBalb/cマウスモデルにおけるLVL291 PE−PilA融合タンパク質に対する抗体応答および一価PEおよびPilAに対する抗体応答をグラフで示したものである。
実施例13:マウス鼻咽頭定着モデル。PE−PilAによる免疫誘導。NTHi 86−028NP株およびNTHi 3224A株による抗原刺激
Balb/c雌マウス(20/群)を鼻腔内に、0日目と14日目に、LT(大腸菌(Escheria coli)の易熱性毒素)を配合した6μgの精製PE−PilA融合タンパク質(86−028NPによる抗原刺激にはLVL291;3224A株による抗原刺激にはLVL317)で、28日目にはリン酸緩衝生理食塩水(PBS)中、6μgの精製PE−PilA融合タンパク質で免疫を行った。対照マウス(20/群)にはLTのみを接種した。次に、マウスの鼻腔内を5×106 CFU(コロニー形成単位)の同種NTHi 86−028NP株および異種NTHi 3224A株で抗原刺激した。同種および異種は、マウスが免疫されたNTHi株のリファレンスにより決定される。抗原刺激の1日後および2日後に取り出した鼻腔において細菌コロニーを計数した。D1=1日目。D2=2日目。PE−PilA接種は、抗原刺激から1日後および2日後に、鼻咽頭におけるNTHi 86−028NP株および3224A株のクリアランスを高めた。
実施例14:マウス鼻咽頭定着モデル。PilAによる免疫誘導。NTHi 3219C株による抗原刺激。
実施例15:マウス鼻咽頭定着モデル。PEによる免疫誘導。NTHi 3224A株による抗原刺激。
実施例16:ビブロネクチン(vibronectin)結合。LVL317およびLVL735 PE−PilA融合タンパク質によるビブロネクチン(vibronectin)結合の阻害。
実施例17:ビブロネクチン(vibronectin)結合。LVL291 PE−PilA融合タンパク質に対する抗体によるビブロネクチン(vibronectin)の阻害。
実施例18:LVL291 PE−PilA融合タンパク質の抗原性。ELISA。
雌Balb/cマウス(n=34)をAS01EまたはAlPO4(リン酸アルミニウム)を配合していない1、0.2または0.04μgのPE−PilA融合タンパク質LVL317またはLVL735を含有する0、14および28日目に50μlのワクチン製剤で、筋肉内経路により免疫した。42日目に採取した個々の血清においてPEおよびPilAに対する抗体応答を決定し、PEおよびPilAに対するIgGレベルを測定し、μg/mlで表した。
実施例20:無莢膜型インフルエンザ菌鼻咽頭定着のマウスモデルにおけるLVL735およびLVL317融合タンパク質の防御有効性
雌Balb/cマウスの鼻腔内に0日目と14日目に0.5μgの大腸菌易熱性毒素(LT)と混合した5.8μgのLVL735またはLVL317を含有する10μlのワクチン製剤で免疫を行った。28日目に追加免疫用量5.8μgのアジュバント不含LVL735またはLVL317を投与した。対照マウスには0日目と14日目にLTのみを、28日目にはPBSを接種した。42日目に動物の鼻腔内を5×106 cfuのNTHi 3224A株で抗原刺激した。抗原刺激の1日後および2日後に取り出した鼻腔において細菌コロニーを計数した(n=10/時点)。
実施例21:PE−PilA融合タンパク質を含む多価ワクチンの調剤
3種類のワクチンを設計した:
10V: 下記の10種の肺炎球菌莢膜糖類コンジュゲート:タンパク質Dにコンジュゲートされた血清型1由来の莢膜糖類(1−PD)、タンパク質Dにコンジュゲートされた血清型4由来の莢膜糖類(4−PD)、タンパク質Dにコンジュゲートされた血清型5由来の莢膜糖類(5−PD)、タンパク質Dにコンジュゲートされた血清型6B由来の莢膜糖類(6B−PD)、タンパク質Dにコンジュゲートされた血清型7F由来の莢膜糖類(7F−PD)、タンパク質Dにコンジュゲートされた血清型9V由来の莢膜糖類(9V−PD)、タンパク質Dにコンジュゲートされた血清型14由来の莢膜糖類(14−PD)、タンパク質Dにコンジュゲートされた血清型23F由来の莢膜糖類(23F−PD)、破傷風トキソイドにコンジュゲートされた血清型18C由来の莢膜糖類(18C−TT)およびジフテリア毒素にコンジュゲートされた血清型19F由来の莢膜糖類(19F−DT)を含有する10価(10V)のワクチン。
12V: 10Vと同じ10種の肺炎球菌莢膜糖類コンジュゲートを含有し、さらに2つの肺炎球菌糖類コンジュゲート、すなわち、CRM197にコンジュゲートされた19A(19ACRM)およびCRM197にコンジュゲートされた6A(6ACRM)を含む12価(12V)のワクチン。
12V+タンパク質(12V+prot): 12Vと同じ12種の肺炎球菌莢膜糖類コンジュゲートを含有し、さらにPhtD、dPlyおよびPE−PilA融合タンパク質を含むワクチン。
dPlyの調製: 肺炎球菌ニューモリシンを調製し、ホルムアルデヒド無毒化を用い、国際公開第2004/081515号および国際公開第2006/32499号に記載の通りに無毒化した。
PhtDの発現および精製:
PhtDの発現: PhtDタンパク質は、ヒスチジントライアドの存在を特徴とする肺炎球菌ヒスチジントライアド(Pht)タンパク質ファミリーのメンバーである。PhtDは、838aaの分子であり、5つのヒスチジントライアドを有する(Medlmmune 国際公開第00/37105号 アミノ酸配列は配列番号4およびDNA配列は配列番号5)。PhtDはまた、中央(アミノ酸348〜380番)にプロリンリッチ領域を含む。PhtDは20aaのN末端シグナル配列を有する。PhtDの調製および精製は国際公開第2007/071710号(例えば、実施例1b参照)に記載されている。国際公開第00/37105号からの配列番号4のアミノ酸21〜838の配列は配列番号220に相当する。
タンパク質Dの発現
タンパク質Dは、国際公開第2007/071710号に記載の通りに発現させた。
CRM197大腸菌の発現および精製:
CRM197の生産工程の収率を高めるために、選択的発現様式を、10倍の工程収率の標的を用いて評価した。選択した構築物を大腸菌株(B834(DE3))で、大腸菌由来Flglシグナル配列(19aa)とCRM197(537aa)の間の融合物として発現させた。このシグナル配列は周辺質への輸送の際に切断される。CRM197は浸透圧ショックにより抽出された後に精製される。この精製プロセスは、Q−Sepharose−XL工程とヒドロキシアパタイト工程の間に付加的なクロマトグラフィー工程(フェニルセファロース)が追加されること、および最後のオクチル−Sepharose 4FFでのクロマトグラフィー工程が除かれること以外は、国際公開第2006/100108号に開示されているものと同様である。
コンジュゲートの調製
精製された肺炎球菌多糖をいかにして調製するかは当技術分野で周知である。これらの実施例の目的で、多糖を本質的に欧州特許第072513号に記載の通りに、または密接に関連した方法により作製した。コンジュゲーション前に、多糖は下記のような微少溶液操作によってサイズ調整してもよい。
18Cの調製:
18Cを、リンカー−アジピン酸ジヒドラジド(ADH)を介して担体タンパク質に連結した。
EDAC(2−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩)による破傷風トキソイドの誘導体化
破傷風トキソイドの誘導体化のため、精製したTTを0.2M NaCl中で25mg/mlに希釈し、ADHスペーサーを終濃度が0.2Mとなるように加えた。スペーサーの溶解が完了したところで、pHを6.2に調整した。次に、EDAC(1−エチル−3−(3−ジメチル−アミノプロピル)カルボジイミド)を終濃度が0.02Mとなるように加え、この混合物をpH調整下で1時間撹拌した。この縮合反応を、pHを25℃で少なくとも30分間9.0まで高めることによって停止させた。
TTAHのPS 18Cへの化学的カップリング
コンジュゲーションパラメーターの詳細は表1に見出すことができる。
肺炎球菌莢膜糖類−タンパク質D/TT/DT/PhtD/Plyコンジュゲートの特定の活性化/カップリング/クエンチング条件
行ヘッダーに「μfluid」とある場合は、その糖類がコンジュゲーション前に微少溶液操作によりサイズ調整されたことを示す。微少溶液操作後の糖類のサイズは表2に示す。
コンジュゲートは、0.15M NaCl(ただし、18CではS500HRをバッファーとして使用し、19Aでは1.15MNaClを含有する20mM酢酸塩pH6.2を使用した)で平衡化したSephacryl S400HRゲル濾過カラムを用いたゲル濾過により小分子(DMAPを含む)および非コンジュゲート糖類およびタンパク質を除去することで精製した。反応成分の分子サイズの違いに基づき、PS−PD、PS−TT、PS−CRM197またはPS−DTコンジュゲートが最初に溶出し、遊離PS、次いで、遊離タンパク質担体、最後にDMAPおよび他の塩(NaCl、グリシン)が続く。
ワクチンの調剤
10Vワクチンは、リン酸アルミニウム上に、1、3、1、1、1、1、1、3、3、1μgのヒト用量で吸着された肺炎球菌莢膜糖類血清型1、4、5、6B、7F、9V、14、18C、19Fおよび23Fコンジュゲートを一緒に含有する(これらの糖類はリン酸アルミニウムに個々に吸着させた後、それらを一緒に混合し、リン酸アルミニウムのレベルを500μgに調整した)。
実施例22:マウスにおける10V、12Vおよび12V+タンパク質ワクチンの免疫原性の比較
抗肺炎球菌多糖PS(多糖)ELISAの説明
マイクロプレートを、莢膜多糖(CPS)(PBS中、2.5μg/mlのPS1およびPS3、5μg/mlのPS4、5、6A、6B、7F、9Vまたは14;10μg/mlのPS19Aおよび23Fまたは40μg/mlのPS18CおよびPS19F、100μl/ウェル)で37℃にて2時間コーティングした。これらのプレートをNaCl 150mM(0.9%)−ポリソルベート20 0.05%で3回洗浄した。CPS(2.5mg/mlであった6Aおよび6B以外は(except or) 1mg CPS/mlの無希釈血清)V/Vを含有するPBS−ポリソルベート20 0.05%中に血清を希釈し(6Aおよび6Bに関しては1/2、他の血清型に関しては1/10)、CPSに対する抗体を中和させるために37℃で1時間インキュベートした。「マウスにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したマウス由来の血清または参照(ChrompureマウスIgGで較正した内部参照)をマイクロウェルに加え、PBS−ポリソルベート20 0.05%で連続希釈して100μlとした(二倍希釈工程)。これらのプレートを振盪下、室温で30分間インキュベートした。これらのプレートを上記のように洗浄し、ペルオキシダーゼにコンジュゲートされた抗マウスIgG抗体(100μl/ウェル)を加え、プレートを振盪しながら室温で30分間インキュベートした。洗浄後、基質(10mlのクエン酸塩0.1M pH4.5〜4.6および5μlのH2O2中、4mgのOPDA(オルトフェニレン−ジアミン))を各ウェルに加え(100μl)、これらのプレートを暗所で15分間インキュベートした。HCl 1N(50μl)を添加することにより反応を停止させた。分光光度計を用い、490nmまたは参照に関しては620nmで吸光度を読み取った。発色は、血清中に存在する抗体の量に正比例する。
PD、PEおよびPilA抗体を測定するためのELISAの説明
プレートを、100μl/ウェルの、炭酸バッファーpH9.6中、2μg/mlのPD(1mg/ml)、2μg/mlのPE(1500μg/ml)、2μg/mlのPilA(3660μg/ml)で4℃にて一晩コーティングした。これらのプレートをNaCl 0.9% ポリソルベート20 0.05%で4回洗浄した。PEおよびPilA ELISAに関しては、プレートを室温で30分間(振盪しながら)PBS−BSA1%で飽和させた。洗浄後、「マウスにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したマウス由来の血清または参照(ChrompureマウスIgGで較正した内部参照)をマイクロウェルに加え、PBSポリソルベート20 0.05%(PDアッセイの場合)およびPBSポリソルベート20 0.05% BSA 0.1%(PEおよびPilAアッセイの場合)で連続希釈して100μlとした(二倍希釈工程)。次に、これらのプレートを振盪しながら室温で30分間インキュベートした。洗浄後、プレートをペルオキシダーゼにコンジュゲートされた抗マウスIgG抗体とともに(100μl/ウェル)振盪しながら室温で30分間インキュベートした。次に、これらのプレートを上記のように洗浄し、基質コンジュゲート(10mlのクエン酸塩0.1M pH4.5〜4.6および5μlのH2O2中、4mgのOPDA(オルトフェニレン−ジアミン))を各ウェルに加え(100μl)、暗所で15分間置いた。HCl 1N 50μlの添加により反応を停止させ、490nm(参照に関しては620nm)で吸光度を読み取った。
PhtDおよびdPly抗体を測定するためのELISAの説明
プレートを、100μl/ウェルの1μg/mlのPhtD(1021μg/ml)または4μg/mlのPly(367μg/ml)で37℃にて2時間コーティングした。次に、これらのプレートをNaCl 0.09% ポリソルベート 0.05%で3回洗浄した。洗浄後、「マウスにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したマウス由来の血清または参照(ChrompureマウスIgGで較正した内部参照)をマイクロウェルに加え、PBSポリソルベート20 0.05%で連続希釈して100μlとした(二倍希釈工程)。次に、これらのプレートを振盪しながら室温で30分間インキュベートした。洗浄後、プレートをペルオキシダーゼにコンジュゲートされた抗マウスIgG抗体とともに(100μl/ウェル)振盪しながら室温で30分間インキュベートした。これらのプレートを上記のように洗浄し、基質コンジュゲート(10mlのクエン酸塩0.1M pH4.5および5μlのH2O2中、4mgのOPDA(オルトフェニレン−ジアミン))を各ウェルに加え(100μl)、暗所で15分間置いた。HCl 1N 50μlの添加により反応を停止させ、490nm(参照フィルターに関しては620nm)で吸光度を読み取った。
オプソニン化貪食作用アッセイ(OPA)の説明
血清サンプルを56℃で45分間加熱して残存する内因性補体を不活性化した。各1:2希釈血清サンプルの25μlのアリコートを、96ウェル丸底マイクロタイタープレートのウェル当たり25μlのOPAバッファー(HBSS(ハンクス平衡塩溶液)−14.4%不活性化FCS(ウシ胎児血清))中に二倍連続希釈した。次に、活性化HL−60細胞(1×107細胞/ml)、新たに解凍した肺炎球菌ワーキングシードおよび新たに解凍したベビーウサギ補体の例えば、4/2/1比(v/v/v)(ただし、血清型1、6Bおよび6Aの場合、その比は4/2/2とした)の混合物25μlを希釈血清に加え、最終容量を50μlとした。このアッセイプレートを、オービタルシェーカー(210rpm)を用い、37℃で2時間インキュベートし、貪食作用プロセスを促進した。マイクロプレートを氷上に少なくとも1分間置くことにより反応を停止させ、プレートは使用するまで氷上で維持した。次に、プレートの各ウェルの20μlアリコートを96ウェル平底マイクロプレートの対応するウェルに移し、50μlのTodd−Hewittブロス−0.9%寒天を各ウェルに加えた。37℃、5%CO2で一晩インキュベートした後、寒天内に現れた肺炎球菌コロニーを、自動画像解析システム(KS 400、Zeiss、オーバーコッヘン、ドイツ)を用いて計数した。血清サンプルを含まない8ウェルを細菌対照として使用し、ウェル当たりの肺炎球菌の数を決定した。対照ウェルのCFUの平均数を決定し、各血清サンプルの殺傷活性の計算に用いた。血清サンプルのOPA力価は、肺炎球菌の50%殺傷を促すことができる血清の希釈率の逆数により決定した。オプソニン化貪食作用力価は、4パラメーター曲線当てはめ解析を用いて計算した。
マウスにおける3種のワクチン製剤の免疫原性
2試験区に分配した2群の27個体雌Balb/cマウスを、0、14および28日目に1/10ヒト用量の、タンパク質単独(PhtD、dPlyおよびPEPilA)、Prevnar 13(商標)(市販の連鎖球菌ワクチン−結果は示さず)、10V、12V(DSP2A017)および12V+タンパク質(DSP2A012)GMPロットを含む種々の製剤の筋肉内(IM)注射によって免疫した。マウスの違う肢に、1/10ヒト用量のInfanrix Hexa(商標)(ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、線維状ヘマグルチニン、パータクチン、B型肝炎表面抗原、不活性化1、2および3型ポリオウイルスならびにインフルエンザ菌b糖類(PRP)を含むワクチン)を施した(臨床試験における乳幼児の異なる部位における併用投与を模倣)。
実施例23:モルモットにおける10V、12Vおよび12V+タンパク質ワクチンの免疫原性の比較
ELISA抗肺炎球菌多糖PSの説明
マイクロプレートを、100μl/ウェルの2.5μg/mlのPS1、5μg/mlのPS4、5、6A、6B、7F、9Vまたは14;10μg/mlのPS19Aおよび23F、40μg/mlのPS18CおよびPS19Fまたは参照ウェルに関してはPBS中2μg/mlに希釈したAffinipureヤギ抗モルモットIgG(2.4mg/ml)で37℃にて2時間コーティングした。これらのプレートをNaCl 150mM(0.9%)−ポリソルベート20 0.05%で3回洗浄した。各群からプールした血清を、CPS(2.5mg/mlの6Aおよび6B以外は1mg CPS/mlの無希釈血清)V/Vを含有するPBS−ポリソルベート20 0.05%中に希釈し(PS 6Aおよび6Bに関しては1/2、他の全ての血清型に関しては1/10)、CPSに対する抗体を中和させるために37℃で1時間インキュベートした。「モルモットにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したモルモット由来の血清をマイクロウェルに加え、PBS−ポリソルベート20 0.05%で連続希釈して100μlとするか(二倍希釈工程)、または参照(PBS−ポリソルベート20 0.05%で0.25μg/mlに希釈したChrompureモルモットIgG(11mg/ml)を加えた。これらのプレートを振盪下、室温で30分間インキュベートした。これらのプレートを上記のように洗浄し、ペルオキシダーゼにコンジュゲートされた抗モルモットIgG抗体(100μl/ウェル)を加え、プレートを振盪しながら室温で30分間インキュベートした。洗浄後、基質(10mlのクエン酸塩0.1M pH4.5〜4.6および5μlのH2O2中、4mgのOPDA)を各ウェルに加え(100μl)、暗所で15分間インキュベートした。HCl 1Nを添加することにより反応を停止させた。分光光度計を用い、490nm(参照に関しては620nm)で吸光度を読み取った。発色は、血清中に存在する抗体の量に正比例する。
抗PD、PE、およびPilA抗体を測定するためのELISAの説明
プレートを、100μl/ウェルの、PBS中の炭酸バッファーpH9.6中、2μg/mlのPD(1mg/ml)、2μg/mlのPE(1500μg/ml)、または2μg/mlのPilA(3660μg/ml)または参照ウェルに関してはPBS中2μg/mに希釈したAffinipureヤギ抗モルモットIgG(2.4mg/ml)で37℃にて2時間コーティングした。これらのプレートをNaCl 0.9% ポリソルベート20 0.05%で4回洗浄した。PEおよびPilA ELISAについては(この工程はPDおよびPly ELISAについては実施しなかった)、プレートを室温で30分、PBS−BSA1%で飽和させた。洗浄後、「モルモットにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したモルモット由来の血清または参照血清サンプル(ChrompureモルモットIgGで較正した内部標準)をマイクロウェルに加え、PBSポリソルベート20 0.05%(PD ELISAの場合)およびPBSポリソルベート20 0.05% BSA 0.1%(PEおよびPilA ELISAの場合)中に連続希釈して100μlとした(二倍希釈工程)。これらのプレートを室温で30分間インキュベートした。洗浄後、プレートをペルオキシダーゼにコンジュゲートされた抗モルモットIgG抗体(100μl/ウェル)とともに振盪しながら室温で30分間インキュベートした。プレートを上記のように洗浄し、基質コンジュゲート(10mlのクエン酸塩0.1M pH4.5〜4.6および5μlのH2O2中、4mgのOPDA)を各ウェルに加え(100μl)、暗所で15分間置いた。HCl 1N 50μlを添加することにより反応を停止させ、490nm(参照フィルターに関しては620nm)で吸光度を読み取る。
PhtDおよびdPly抗体を測定するためのELISAの説明
プレートを、100μl/ウェルの、PBS中1μg/mlのPhtD(1021μg/ml)または2μg/ml Ply(376μg/ml)で37℃にて2時間コーティングした。次に、これらのプレートをNaCl 0.9% ポリソルベート20 0.05%で4回洗浄した。洗浄後、「モルモットにおける3種のワクチン製剤の免疫原性」と題された節に記載の通りに免疫したモルモット由来の血清または参照(ChrompureモルモットIgGで較正した内部標準)をマイクロウェルに加え、PBSポリソルベート20 0.05%中に連続希釈して100μlとした(二倍希釈工程)。これらのプレートを振盪しながら室温で30分間インキュベートした。洗浄後、プレートをペルオキシダーゼにコンジュゲートされた抗モルモットIgG抗体(100μl/ウェル)とともに振盪しながら室温で30分間インキュベートした。プレートを上記のように洗浄し、基質コンジュゲート(10mlのクエン酸塩0.1M pH4.5〜4.6および5μlのH2O2中、4mgのOPDA)を各ウェルに加え(100μl)、暗所で15分間置いた。HCl 1N 50μlを添加することにより反応を停止させ、490nm(参照フィルターに関しては620nm)で吸光度を読み取った。
オプソニン化貪食作用アッセイ
血清サンプルを56℃で45分間加熱して残存する内因性補体を不活性化した。各1:2希釈血清サンプルの25μlのアリコートを、96ウェル丸底マイクロタイタープレートのウェル当たり25μlのOPAバッファー(HBSS(ハンクス平衡塩溶液)−14.4%不活性化FCS(ウシ胎児血清))中に二倍連続希釈した。次に、活性化HL−60細胞(1×107細胞/ml)、新たに解凍した肺炎球菌ワーキングシードおよび新たに解凍したベビーウサギ補体の例えば、4/2/1比(v/v/v)(ただし、血清型1、6Bおよび6Aの場合、その比は4/2/2とした)の混合物25μlを希釈血清に加え、最終容量を50μlとした。このアッセイプレートを、オービタルシェーカー(210rpm)を用い、37℃で2時間インキュベートし、貪食作用プロセスを促進した。マイクロプレートを氷上に少なくとも1分間置くことにより反応を停止させた(プレートはさらなる使用まで氷上で維持しなければならない)。次に、プレートの各ウェルの20μlアリコートを96ウェル平底マイクロプレートの対応するウェルに移し、50μlのTodd−Hewittブロス−0.9%寒天を各ウェルに加えた。37℃、5%CO2で一晩インキュベートした後、寒天内に現れた肺炎球菌コロニーを、自動画像解析システム(KS 400、Zeiss、オーバーコッヘン、ドイツ)を用いて計数した。血清サンプルを含まない8ウェルを細菌対照として使用し、ウェル当たりの肺炎球菌の数を決定した。対照ウェルのCFUの平均数を決定し、各血清サンプルの殺傷活性の計算に用いた。血清サンプルのOPA力価は、肺炎球菌の50%殺傷を促すことができる血清の希釈率の逆数により決定した。オプソニン化貪食作用力価は、4パラメーター曲線当てはめ解析を用いて計算した。
モルモットにおける3種の製剤の免疫原性
2試験区に分配した2群の17個体モルモットを、0、14および28日目に、1/4ヒト用量の、タンパク質単独(PhtD、dPlyおよびPEPilA)、Prevnar 13(商標)(市販の連鎖球菌ワクチン−結果は示さず)、10V、12V(DSP2A017)および12V+タンパク質(DSP2A012)GMPロットを含む種々の製剤の筋肉内(IM)注射によって免疫した。モルモットの違う肢に、ヒト用量の1/4のInfanrix Hexa(商標)(ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、線維状ヘマグルチニン、パータクチン、B型肝炎表面抗原、不活性化1、2および3型ポリオウイルス、ならびにインフルエンザ菌b糖類(PRP)を含むワクチン)を施した(臨床試験における乳幼児の異なる部位における併用投与を模倣)。
Claims (21)
- 1種以上の肺炎球菌莢膜糖類コンジュゲートとタンパク質成分とを含み、そのタンパク質成分がインフルエンザ菌由来のタンパク質Eもしくはタンパク質Eの免疫原性断片およびPilAもしくはPilAの免疫原性断片を含む、免疫原性組成物。
- 1種以上の肺炎球菌莢膜糖類コンジュゲートとタンパク質成分とを含み、そのタンパク質成分がインフルエンザ菌由来のタンパク質EおよびPilAを含む、免疫原性組成物。
- タンパク質Eまたはタンパク質Eの免疫原性断片が、配列番号4とその全長にわたって少なくとも75%、77%、80%、85%、90%、95%、97%、99%または100%の同一性を有する配列を含むポリペプチドである、請求項1または2に記載の免疫原性組成物。
- タンパク質Eの免疫原性断片が、配列番号4の少なくとも7、10、15、20、25、30、50、75または100個の連続するアミノ酸の免疫原性断片を含むポリペプチドである、請求項1〜3のいずれか一項に記載の免疫原性組成物。
- PilAまたはPilAの免疫原性断片が、配列番号58とその全長にわたって少なくとも80%、85%、90%、95%、97%または100%の同一性を有する配列を含むポリペプチドである、請求項1〜4のいずれか一項に記載の免疫原性組成物。
- PilAまたはPilAの免疫原性断片が、配列番号58の少なくとも7、10、15、20、25、30または50個の連続するアミノ酸の免疫原性断片を含むポリペプチドである、請求項1〜5のいずれか一項に記載の免疫原性組成物。
- PilAまたはPilAの免疫原性断片と共有結合により連結されて融合タンパク質を形成するタンパク質Eまたはタンパク質Eの免疫原性断片を含む、請求項1〜6のいずれか一項に記載の免疫原性組成物。
- 前記融合タンパク質が
式I:
(X)m−(R1)n−A−(Y)o−B−(Z)p (式I)
を有し、式中、
Xは、シグナルペプチドまたはMHHHHHH(配列番号2)であり;
mは、0であり;
R1は、アミノ酸であり;
nは、0であり;
Aは、タンパク質Eの免疫原性断片であり、ここでタンパク質Eが配列番号4〜配列番号57のいずれか1つから選択される;
Yは、GGであり;
oは、0または1であり;
Bは、PilAの免疫原性断片であり、ここでPilAが配列番号58〜配列番号121のいずれか1つから選択される;
Zは、GGHHHHHH(配列番号3)であり;かつ
pは、0または1である、
請求項7に記載の免疫原性組成物。 - 前記融合タンパク質が、配列番号194である、請求項7または8に記載の免疫原性組成物。
- 前記融合タンパク質が、配列番号136、配列番号138、配列番号140、配列番号142、配列番号144、配列番号146、配列番号148、配列番号150、配列番号182、配列番号184、配列番号186、配列番号188、配列番号190、配列番号192、配列番号194、配列番号196、配列番号198、配列番号200、配列番号202または配列番号204のいずれかと少なくとも95%、98%または99%同一である、請求項7または8に記載の免疫原性組成物。
- シグナルペプチドが除去されている、請求項7〜10のいずれか一項に記載の免疫原性組成物。
- 前記1種以上の肺炎球菌莢膜糖類コンジュゲートがコンジュゲートされた血清型1糖類、コンジュゲートされた血清型4糖類、コンジュゲートされた血清型5糖類、コンジュゲートされた血清型6B糖類、コンジュゲートされた血清型7F糖類、コンジュゲートされた血清型9V糖類、コンジュゲートされた血清型14糖類、コンジュゲートされた血清型18C糖類、コンジュゲートされた血清型19F糖類およびコンジュゲートされた血清型23F糖類を含む、請求項1〜11のいずれか一項に記載の免疫原性組成物。
- 前記1種以上の肺炎球菌莢膜糖類コンジュゲートがコンジュゲートされた血清型6A糖類およびコンジュゲートされた血清型19A糖類をさらに含む、請求項1〜12のいずれか一項に記載の免疫原性組成物。
- 前記1種以上の肺炎球菌莢膜糖類コンジュゲートがコンジュゲートされた血清型33F糖類およびコンジュゲートされた血清型22F糖類をさらに含む、請求項1〜13のいずれか一項に記載の免疫原性組成物。
- 前記1種以上の肺炎球菌莢膜糖類コンジュゲートが、破傷風トキソイド(TT)、TTのC断片、ジフテリアトキソイド、CRM197(交差反応物質197)、ニューモリシン、タンパク質D(インフルエンザ菌由来)、PhtD(ポリヒスチジントライアドD)、PhtDE(肺炎球菌ヒスチジントライアドDとEの間の融合物)およびN19からなる群から独立に選択される担体タンパク質にコンジュゲートされている、請求項1〜14のいずれか一項に記載の免疫原性組成物。
- 前記1種以上の肺炎球菌莢膜糖類コンジュゲートが、タンパク質Dにコンジュゲートされた血清型1糖類、タンパク質Dにコンジュゲートされた血清型4糖類、タンパク質Dにコンジュゲートされた血清型5糖類、タンパク質Dにコンジュゲートされた血清型6B糖類、タンパク質Dにコンジュゲートされた血清型7F糖類、タンパク質Dにコンジュゲートされた血清型9V糖類、タンパク質Dにコンジュゲートされた血清型14糖類、タンパク質Dにコンジュゲートされた血清型23F糖類、破傷風トキソイドにコンジュゲートされた血清型18C糖類およびジフテリアトキソイドにコンジュゲートされた血清型19F糖類を含む、請求項1〜15のいずれか一項に記載の免疫原性組成物。
- 免疫原性組成物がさらに、ポリヒスチジントライアドファミリー(PhtX)、無毒化ニューモリシン(dPly)、コリン結合タンパク質ファミリー(CbpX)、CbpX末端切断型、LytX(自己分解酵素)ファミリー、LytX末端切断型、CbpX末端切断型−LytX末端切断型キメラタンパク質、PcpA(肺炎球菌コリン結合タンパク質A)、PspA(肺炎球菌表面タンパク質A)、PsaA(肺炎球菌表面アドヘシンA)、Sp128(肺炎球菌128)、Sp101(肺炎球菌101)、Sp130(肺炎球菌130)、SP125(肺炎球菌125)およびSP133(肺炎球菌133)からなる群から選択される少なくとも1つの非コンジュゲートまたはコンジュゲート肺炎球菌タンパク質を含む、請求項1〜16のいずれか1項に記載の免疫原性組成物。
- 請求項1〜17のいずれか一項に記載の免疫原性組成物と薬学上許容される賦形剤とを含むワクチン。
- 肺炎球菌感染またはインフルエンザ菌感染により引き起こされる疾患の治療または予防において使用するための、請求項1〜17のいずれか一項に記載の免疫原性組成物または請求項18に記載のワクチンであって、該疾患が、肺炎、浸潤性肺炎球菌性疾患(IPD)、慢性閉塞性肺疾患(COPD)の増悪、中耳炎、髄膜炎、菌血症、および結膜炎からなる群から選択される少なくとも1つの疾患を含む、上記免疫原性組成物またはワクチン。
- 融合タンパク質が、シグナルペプチドが除去されている配列番号148、すなわち、配列番号177 (QIQKAEQN DVKLAPPTDV RSGYIRLVKN VNYYIDSESI WVDNQEPQIV HFDAVVNLDK GLYVYPEPKR YARSVRQYKI LNCANYHLTQ VRTDFYDEFW GQGLRAAPKK QKKHTLSLTP DTTLYNAAQI ICANYGEAFS VDKKGGTKKA AVSELLQASA PYKADVELCV YSTNETTNCT GGKNGIAADI TTAKGYVKSV TTSNGAITVK GDGTLANMEY ILQATGNAAT GVTWTTTCKG TDASLFPANF CGSVTQ)である、請求項7または8に記載の免疫原性組成物。
- 融合タンパク質が、シグナルペプチドが除去されている配列番号194、すなわち、配列番号219 (IQKAEQND VKLAPPTDVR SGYIRLVKNV NYYIDSESIW VDNQEPQ IVH FDAVVNLDKG LYVYPEPKRY ARSVRQYKIL NCANYHLTQV RTDFYDEFWG QGLRAAPKKQ KKHTLSLTPD TTLYNAAQII CANYGEAFSV DKKGGTKKAA VSELLQASAP YKADVELCVY STNETTNCTG GKNGIAADIT TAKGYVKSVT TSNGAITVKG DGTLANMEYI LQATGNAATG VTWTTTCKGT DASLFPANFC GSVTQ) である、請求項7または8に記載の免疫原性組成物。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261714956P | 2012-10-17 | 2012-10-17 | |
| US201261714942P | 2012-10-17 | 2012-10-17 | |
| GBGB1218660.7A GB201218660D0 (en) | 2012-10-17 | 2012-10-17 | Immunogenic composition |
| GB1218660.7 | 2012-10-17 | ||
| US61/714,942 | 2012-10-17 | ||
| US61/714,956 | 2012-10-17 | ||
| US13/827,203 | 2013-03-14 | ||
| US13/827,203 US20140105927A1 (en) | 2012-10-17 | 2013-03-14 | Immunogenic composition |
| US13/826,696 | 2013-03-14 | ||
| US13/826,696 US9561268B2 (en) | 2012-10-17 | 2013-03-14 | Immunogenic composition |
| US13/826,932 US20140193451A1 (en) | 2012-10-17 | 2013-03-14 | Immunogenic composition |
| US13/826,932 | 2013-03-14 | ||
| PCT/EP2013/071472 WO2014060383A1 (en) | 2012-10-17 | 2013-10-15 | Immunogenic composition comprising 1 or more streptococcus pneumoniae capsular saccharide conjugates and a protein component comprising protein e and/or pila fromhaemophilus influenzae. |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015536312A JP2015536312A (ja) | 2015-12-21 |
| JP2015536312A5 JP2015536312A5 (ja) | 2016-11-10 |
| JP6236086B2 true JP6236086B2 (ja) | 2017-11-22 |
Family
ID=53008966
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015537220A Pending JP2015534964A (ja) | 2012-10-17 | 2013-10-15 | 免疫原性組成物 |
| JP2015537216A Active JP6236086B2 (ja) | 2012-10-17 | 2013-10-15 | 1種以上の肺炎球菌莢膜糖類コンジュゲートとインフルエンザ菌由来のタンパク質Eおよび/またはPilAを含むタンパク質成分とを含む免疫原性組成物 |
| JP2015537218A Expired - Fee Related JP6412500B2 (ja) | 2012-10-17 | 2013-10-15 | 免疫原性組成物 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015537220A Pending JP2015534964A (ja) | 2012-10-17 | 2013-10-15 | 免疫原性組成物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015537218A Expired - Fee Related JP6412500B2 (ja) | 2012-10-17 | 2013-10-15 | 免疫原性組成物 |
Country Status (13)
| Country | Link |
|---|---|
| EP (3) | EP2908856B1 (ja) |
| JP (3) | JP2015534964A (ja) |
| KR (2) | KR20150058571A (ja) |
| CN (2) | CN104853768B (ja) |
| AU (2) | AU2013331781A1 (ja) |
| BR (3) | BR112015008418A2 (ja) |
| CA (3) | CA2888300A1 (ja) |
| EA (2) | EA201590491A1 (ja) |
| ES (1) | ES2640320T3 (ja) |
| IL (2) | IL238053A0 (ja) |
| MX (2) | MX2015005002A (ja) |
| SG (2) | SG11201502634TA (ja) |
| WO (3) | WO2014060383A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201218660D0 (en) | 2012-10-17 | 2012-11-28 | Glaxosmithkline Biolog Sa | Immunogenic composition |
| US11160855B2 (en) * | 2014-01-21 | 2021-11-02 | Pfizer Inc. | Immunogenic compositions comprising conjugated capsular saccharide antigens and uses thereof |
| CN104306965B (zh) * | 2014-10-31 | 2017-05-10 | 康希诺生物股份公司 | 预防肺炎链球菌感染性疾病的免疫原性组合物及制备方法 |
| TWI756893B (zh) * | 2015-07-21 | 2022-03-01 | 美商輝瑞股份有限公司 | 包含經共軛之莢膜糖抗原的致免疫性組成物、包含該致免疫性組成物之套組及彼等之用途 |
| GB201518684D0 (en) * | 2015-10-21 | 2015-12-02 | Glaxosmithkline Biolog Sa | Vaccine |
| GB201603029D0 (en) * | 2016-02-22 | 2016-04-06 | Glaxosmithkline Biolog Sa | Vaccine |
| CN106432512B (zh) * | 2016-09-30 | 2022-03-01 | 康希诺生物股份公司 | 一种增强多糖抗原免疫原性蛋白载体及其制备方法与应用 |
| CN112513066A (zh) * | 2018-01-19 | 2021-03-16 | 台湾浩鼎生技股份有限公司 | Crm197蛋白质表达 |
| CN110540597B (zh) * | 2018-12-20 | 2021-04-30 | 湖北工业大学 | 基于流感嗜血杆菌表面蛋白的乳胶微球免疫层析试纸的制备方法 |
| JP7568746B2 (ja) | 2020-05-01 | 2024-10-16 | 神州細胞工程有限公司 | タンパク質/ペプチド抗原の免疫原性を向上させる方法 |
| KR20220142219A (ko) * | 2021-04-14 | 2022-10-21 | 한국생명공학연구원 | 장내 미생물에서 단백질 분비를 유도하는 신호서열 |
| EP4169513A1 (en) | 2021-10-19 | 2023-04-26 | GlaxoSmithKline Biologicals S.A. | Adjuvant composition comprising sting agonists |
| CN117512031B (zh) * | 2023-10-16 | 2024-06-25 | 江苏金迪克生物技术股份有限公司 | 一种肺炎球菌荚膜多糖的纯化方法 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0009163B8 (pt) * | 1999-03-19 | 2021-05-25 | Glaxosmithkline Biologicals Sa | composição imunogênica e vacina que a compreende |
| GB0108364D0 (en) * | 2001-04-03 | 2001-05-23 | Glaxosmithkline Biolog Sa | Vaccine composition |
| EG24742A (en) * | 2000-06-29 | 2010-07-14 | Smithkline Beecham Biolog | Vaccine composition. |
| GB0022742D0 (en) * | 2000-09-15 | 2000-11-01 | Smithkline Beecham Biolog | Vaccine |
| GB0130215D0 (en) * | 2001-12-18 | 2002-02-06 | Glaxosmithkline Biolog Sa | Vaccine |
| CA2550455C (en) * | 2003-12-23 | 2017-01-03 | Children's Hospital, Inc. | Haemophilus influenzae type iv pili |
| DE602006018308D1 (de) * | 2005-07-08 | 2010-12-30 | Nationwide Childrens Hospital | Chimärer impfstoff für haemophilus influenzae-induzierte infektion |
| NZ569417A (en) * | 2006-01-17 | 2012-04-27 | Arne Forsgren | A novel surface exposed haemophilus influenzae protein (protein E; pE) |
| US20100183662A1 (en) * | 2007-06-26 | 2010-07-22 | Ralph Leon Biemans | Vaccine comprising streptococcus pneumoniae capsular polysaccharide conjugates |
| CN106008679A (zh) * | 2008-12-24 | 2016-10-12 | 荷兰王国卫生福利和运动部国家公共卫生和环境研究所 | 修饰的肺炎链球菌溶血素(ply)多肽 |
| SG178447A1 (en) * | 2009-09-03 | 2012-03-29 | Pfizer Vaccines Llc | Pcsk9 vaccine |
| JP5894083B2 (ja) * | 2009-12-22 | 2016-03-23 | サノフィ パストゥール リミテッドSanofi Pasteur Limited | 免疫原性組成物 |
| WO2012075428A1 (en) * | 2010-12-03 | 2012-06-07 | Sanofi Pasteur Limited | Composition for immunization against streptococcus pneumoniae |
| US9878029B2 (en) * | 2011-03-22 | 2018-01-30 | Serum Institute Of India Private Limited | Process for preparation of polysaccharides |
| TW201302779A (zh) * | 2011-04-13 | 2013-01-16 | Glaxosmithkline Biolog Sa | 融合蛋白質及組合疫苗 |
| AU2012257771C1 (en) * | 2011-05-17 | 2015-12-03 | Glaxosmithkline Biologicals S.A. | Vaccine against Streptococcus pneumoniae |
-
2013
- 2013-10-15 AU AU2013331781A patent/AU2013331781A1/en not_active Abandoned
- 2013-10-15 CA CA2888300A patent/CA2888300A1/en not_active Abandoned
- 2013-10-15 CN CN201380066113.5A patent/CN104853768B/zh not_active Expired - Fee Related
- 2013-10-15 EP EP13779191.9A patent/EP2908856B1/en active Active
- 2013-10-15 WO PCT/EP2013/071472 patent/WO2014060383A1/en active Application Filing
- 2013-10-15 CA CA2888321A patent/CA2888321A1/en not_active Abandoned
- 2013-10-15 EP EP13779190.1A patent/EP2908855B1/en active Active
- 2013-10-15 MX MX2015005002A patent/MX2015005002A/es unknown
- 2013-10-15 KR KR1020157013037A patent/KR20150058571A/ko not_active Application Discontinuation
- 2013-10-15 WO PCT/EP2013/071483 patent/WO2014060389A2/en active Application Filing
- 2013-10-15 BR BR112015008418A patent/BR112015008418A2/pt not_active IP Right Cessation
- 2013-10-15 EA EA201590491A patent/EA201590491A1/ru unknown
- 2013-10-15 EA EA201590490A patent/EA201590490A1/ru unknown
- 2013-10-15 JP JP2015537220A patent/JP2015534964A/ja active Pending
- 2013-10-15 JP JP2015537216A patent/JP6236086B2/ja active Active
- 2013-10-15 BR BR112015008419-2A patent/BR112015008419B1/pt active IP Right Grant
- 2013-10-15 SG SG11201502634TA patent/SG11201502634TA/en unknown
- 2013-10-15 CA CA2888310A patent/CA2888310C/en active Active
- 2013-10-15 JP JP2015537218A patent/JP6412500B2/ja not_active Expired - Fee Related
- 2013-10-15 SG SG11201502635SA patent/SG11201502635SA/en unknown
- 2013-10-15 CN CN201380066162.9A patent/CN104968366B/zh active Active
- 2013-10-15 WO PCT/EP2013/071477 patent/WO2014060385A1/en active Application Filing
- 2013-10-15 ES ES13779190.1T patent/ES2640320T3/es active Active
- 2013-10-15 BR BR112015008417A patent/BR112015008417A8/pt not_active Application Discontinuation
- 2013-10-15 AU AU2013333975A patent/AU2013333975A1/en not_active Abandoned
- 2013-10-15 MX MX2015004949A patent/MX365842B/es active IP Right Grant
- 2013-10-15 KR KR1020157013039A patent/KR20150072444A/ko not_active Application Discontinuation
- 2013-10-15 EP EP13776808.1A patent/EP2908854A2/en not_active Ceased
-
2015
- 2015-03-31 IL IL238053A patent/IL238053A0/en unknown
- 2015-04-01 IL IL238079A patent/IL238079A0/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6236086B2 (ja) | 1種以上の肺炎球菌莢膜糖類コンジュゲートとインフルエンザ菌由来のタンパク質Eおよび/またはPilAを含むタンパク質成分とを含む免疫原性組成物 | |
| US11198707B2 (en) | Fusion proteins and combination vaccines comprising Haemophilus influenzae Protein E and Pilin A | |
| US9561268B2 (en) | Immunogenic composition | |
| JP2018522978A (ja) | 免疫原性組成物 | |
| WO2023203238A1 (en) | Streptococcus suis vaccine composition comprising immunogenic fusion polypeptides | |
| NZ615328B2 (en) | Fusion proteins and combination vaccines comprising haemophilus influenzae protein e and pilin a |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160916 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160916 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170704 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170928 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171010 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20171027 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6236086 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |