JP6205436B2 - アンカーで固定される心臓血管弁 - Google Patents
アンカーで固定される心臓血管弁 Download PDFInfo
- Publication number
- JP6205436B2 JP6205436B2 JP2015560149A JP2015560149A JP6205436B2 JP 6205436 B2 JP6205436 B2 JP 6205436B2 JP 2015560149 A JP2015560149 A JP 2015560149A JP 2015560149 A JP2015560149 A JP 2015560149A JP 6205436 B2 JP6205436 B2 JP 6205436B2
- Authority
- JP
- Japan
- Prior art keywords
- anchor
- support member
- valve
- tissue
- growth factor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/24—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body
- A61F2/2412—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body with soft flexible valve members, e.g. tissue valves shaped like natural valves
- A61F2/2418—Scaffolds therefor, e.g. support stents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/24—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body
- A61F2/2412—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body with soft flexible valve members, e.g. tissue valves shaped like natural valves
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/24—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body
- A61F2/2427—Devices for manipulating or deploying heart valves during implantation
- A61F2/2436—Deployment by retracting a sheath
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2220/00—Fixations or connections for prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2220/0008—Fixation appliances for connecting prostheses to the body
- A61F2220/0016—Fixation appliances for connecting prostheses to the body with sharp anchoring protrusions, e.g. barbs, pins, spikes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0063—Three-dimensional shapes
- A61F2230/0095—Saddle-shaped
Description
アポトーシスの刺激または抑制、免疫応答の刺激または抑制、抗菌活性等をもたらすことができる薬剤を含む。
願は、それらの全体が参照により本明細書に組み込まれる。
用語「アンカー弁」及び「弁」は、本明細書において互換的に使用され、心臓血管への移植及びそこを通る流体流動の選択的な制限のために構成される本発明の構造、デバイスまたはシステムを意味し、含む。
スタチンは、血管壁細胞及び心血管系に多数の有利な効果をもたらす。一つの具体例は、スタチンが、Gタンパク質共役受容体、トロンボキサンA2(TXA2)の減少を促進することであり、血小板の活性化及び凝集、並びに接着分子及びケモカインが増加することを減らす。
RhoAの活性化を阻害することはまた、組織プラスミノーゲン活性化因子(t‐PA)、及び主要な線維素溶解のインヒビターであるプラスミノーゲン活性化因子インヒビタータイプ1(PAI‐1)の存在に影響を与える。スタチンによって誘発されるRhoA活性化の阻害からのt‐PAの存在の増加及びPAI‐1の減少で、フィブリンが止血栓の高分子メッシュを形成する機会が低減されるので、血栓性の作用の低減が認められる。
RhoA活性化を遮断することはまた、心血管系における一酸化窒素(NO)の存在に影響を与える。NOは、血管平滑筋の収縮及び増殖、血小板凝集、及び白血球の内皮への接着を阻害することにより、血管の恒常性に寄与する。
スタチンの投与はまた、エンドセリン及びアンジオテンシン受容体の存在を高めることができる。エンドセリン及びアンジオテンシン受容体はまた、スタチン投与に関連するRhoA活性化の順次的遮断により影響を受ける場合がある。
C反応性タンパク質(CRP)もスタチンにより低減される。CRPは、血液中に見いだされ、それらのレベルは炎症の異なるレベルに応じて逸脱する。
スタチンはまた、内皮細胞の接着分子の存在を減少させる。接着分子は細胞表面に位置し、血管内皮細胞における炎症及びトロンビン形成に関与するタンパク質である。
Rac‐1の発現もまた、スタチンによって低減される。Rac‐1は、内皮細胞遊走、細管形成、接着性、透過性に中心的な役割を果たし、ヒト細胞に見出されるタンパク質である。Rac‐1の存在の減少はまた、活性酸素種(ROS)の減少をもたらす。
、血管増殖が開始した後)、アンカー機構の機能は、位置決め及び支持機能(すなわちアンカー機構がECM支持部材、つまり生体弁を血管の宿主組織に近接して位置決めし及び支持する機能)から、補強機能(すなわち組織再生プロセス中(及びプロセス後)にアンカー機構が、アンカー生体弁及び/またはリモデリングされた組織を単に補強する機能)へと変化する。
・罹患した、または欠陥のある心臓血管弁、末梢静脈弁等を置換するために使用することができる、改良された人工生体弁の提供。
・安全、確実に、一貫して非常に効果的に心臓血管に取り付けることができる人工生体弁の提供。
・少なくとも予め決められた一時的な期間、標的組織に近接して弁を配置させる固有のアンカー機構を含む人工生体弁の提供。
・血管構造との最適な機械的適合性を示す人工生体弁の提供。
・従来の高分子弁及び金属弁に関連する血管への介入後の内膜過形成、及び厳しい生物学的応答を実質的に低減または排除する人工生体弁の提供。
・宿主組織の増殖、新たな組織の生体リモデリングと再生、及び部位特異的な構造的、機能的特性を有する組織構造を誘導する人工生体弁の提供。
・宿主組織に薬剤を投与し、それによって、所望の生物学的及び/または治療的効果をもたらすことができる人工生体弁の提供。
本発明は、以下の実施形態を含む。
[1]
アンカー心臓血管弁であって、
前記アンカー心臓血管弁は拡張可能な弁支持部材を含み、
前記支持部材は、該支持部材の心臓血管内への配置を可能にする支持部材配置前形態から、前記支持部材を前記血管の宿主組織に近接して配置可能な支持部材配置後形態に変化することができ、
前記弁支持部材は長手方向の軸線と、外面と、支持部材の内面を画成する内腔と、入口部分と出口部分とを有し、
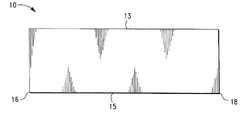
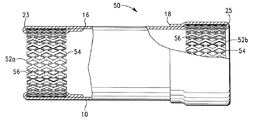
前記出口部分は前記内腔と連通する出口を画成し、前記出口部分は前記弁支持部材の外側に向かって前記弁支持部材の外面を覆うように折り返され、前記弁支持部材の外面に取り付けられて、そこに第1のアンカーポケットが形成されており、
前記入口部分は前記内腔と連通する入口を画成し、前記入口部分は前記弁支持部材の内腔内に内側に向かって折り返され、前記支持部材の内面に第1の取り付け箇所で取り付けられて、そこに第2のアンカーポケットが形成され、第1の弁葉部が前記弁支持部材の内腔内に形成されており、前記弁葉部は前記支持部材を通る流体の流れを選択的に制限するようにサイズを決められ、構成されており、
前記アンカー心臓血管弁は、
前記第1のアンカーポケット内に配置されている、拡張可能な第1のアンカー機構と、
前記第2のアンカーポケット内に配置されている、拡張可能な第2のアンカー機構と、を含み、
前記第1及び第2のアンカー機構は、前記弁支持部材を前記支持部材配置前形態に構成させるアンカー機構配置前形態から、前記弁支持部材を前記心臓血管の前記宿主組織に近接して配置させて、第1のアンカー支持期間の間、接触を維持するアンカー機構配置後形態に変化することができる、
前記アンカー心臓血管弁。
[2]
前記支持部材の入口部分が、前記支持部材の内面に二つの取り付け箇所において取り付けられており、前記弁支持部材の内腔内に第1及び第2の弁葉部が形成されている、[1]に記載されたアンカー弁。
[3]
前記支持部材の入口部分が、前記支持部材の内面に三つの取り付け箇所において取り付けられており、前記弁支持部材の内腔内に第1、第2及び第3の弁葉部が形成されている、[1]に記載されたアンカー弁。
[4]
前記三つの取り付け箇所が実質的に共通の平面内に配置されており、前記共通の平面が前記弁支持部材の前記長手方向の軸線に実質的に垂直である、[3]に記載されたアンカー弁。
[5]
前記弁支持部材が、哺乳動物組織源由来の細胞外マトリックス(ECM)材料を含む、[1]に記載されたアンカー弁。
[6]
前記組織源が、小腸粘膜下層(SIS)、膀胱粘膜下層(UBS)、胃粘膜下層(SS)、中枢神経系組織、中胚葉由来の上皮、すなわち中皮組織、真皮細胞外マトリックス、皮下細胞外マトリックス、消化管細胞外マトリックス、すなわち大腸及び小腸、成長骨の周囲の組織、胎盤細胞外マトリックス、修飾細胞外マトリックス、心臓細胞外マトリックス、例えば、心膜及び/または心筋、腎臓細胞外マトリックス、膵臓細胞外マトリックス、肺細胞外マトリックス、及びそれらの組み合わせから成る群から選択される、[1]に記載されたアンカー弁。
[7]
前記ECM材料が、追加の薬剤を含む、[1]に記載されたアンカー弁。
[8]
前記薬剤が抗炎症薬を含む、[7]に記載されたアンカー弁。
[9]
前記薬剤がスタチンを含む、[7]に記載されたアンカー弁。
[10]
前記スタチンが、アトルバスタチン、セリバスタチン、フルバスタチン、ロバスタチン、メバスタチン、ピタバスタチン、プラバスタチン、ロスバスタチン、及びシンバスタチンから成る群から選択される、[9]に記載されたアンカー弁。
[11]
前記薬剤が増殖因子を含む、[4]に記載されたアンカー弁。
[12]
前記増殖因子が、血小板由来増殖因子(PDGF)、上皮成長因子(EGF)、形質転換増殖因子アルファ(TGF‐α)、形質転換増殖因子ベータ(TGF‐β)、線維芽細胞増殖因子‐2(FGF‐2)、塩基性線維芽細胞増殖因子(bFGF)、血管内皮細胞増殖因子(VEGF)、肝細胞増殖因子(HGF)、インスリン様成長因子(IGF)、神経成長因子(NGF)、血小板由来増殖因子(PDGF)、腫瘍壊死因子アルファ(TNA‐α)、及び胎盤成長因子(PLGF)から成る群から選択される、[11]に記載されたアンカー弁。
[13]
前記薬剤が抗不整脈薬を含む、[4]に記載されたアンカー弁。
[14]
前記抗不整脈薬が、キニジン、プロカインアミド、ジソピラミド、リドカイン、フェニトイン、メキシレチン、フレカイニド、プロパフェノン、モリシジン、プロプラノロール、エスモロール、チモロール、メトプロロール、アテノロール、アミオダロン、ソタロール、イブチリド、ドフェチリド、ベラパミル、ジルチアゼム、アデノシン、及びジゴキシンから成る群から選択される、[11]に記載のアンカー弁。
Claims (14)
- アンカー心臓血管弁であって、
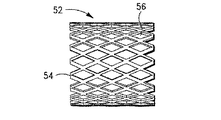
前記アンカー心臓血管弁は管状の拡張可能な弁の支持部材を含み、
前記支持部材は、該支持部材の心臓血管内への配置を可能にする支持部材配置前形態から、前記支持部材が前記心臓血管の宿主組織に近接して配置されている支持部材配置後形態に変化することができ、
前記支持部材は長手方向の軸線と、外面と、支持部材の内面を画成する内腔と、入口部分と出口部分とを有し、
前記出口部分は前記内腔と連通する出口を画成し、前記出口部分が前記支持部材の外側に向かって前記支持部材の外面を覆うように折り返され、前記支持部材の外面に取り付けられることにより第1のアンカーポケットが形成されており、
前記入口部分は前記内腔と連通する入口を画成し、前記入口部分が前記支持部材の内腔内に内側に向かって折り返され、前記支持部材の内面に第1の取り付け箇所で取り付けられることにより前記支持部材の内腔内に第2のアンカーポケット及び第1の弁葉部が形成されており、前記弁葉部は前記支持部材を通る流体の流れを選択的に制限するようにサイズを決められ、構成されており、
前記アンカー心臓血管弁は、
前記第1のアンカーポケット内に配置されている、拡張可能な第1のアンカー機構と、 前記第2のアンカーポケット内に配置されている、拡張可能な第2のアンカー機構と、を含み、
前記第1及び第2のアンカー機構は、前記支持部材を前記支持部材配置前形態に構成させるアンカー機構配置前形態から、前記支持部材を前記心臓血管の前記宿主組織に近接して配置させて、第1のアンカー支持期間の間、前記支持部材と前記宿主組織との接触を維持させるアンカー機構配置後形態に変化することができる、
前記アンカー心臓血管弁。 - 前記支持部材の入口部分が、前記支持部材の内面に二つの取り付け箇所において取り付けられており、前記支持部材の内腔内に第1及び第2の弁葉部が形成されている、請求項1に記載されたアンカー心臓血管弁。
- 前記支持部材の入口部分が、前記支持部材の内面に三つの取り付け箇所において取り付けられており、前記支持部材の内腔内に第1、第2及び第3の弁葉部が形成されている、請求項1に記載されたアンカー心臓血管弁。
- 前記三つの取り付け箇所が実質的に共通の平面内に配置されており、前記共通の平面が前記支持部材の前記長手方向の軸線に実質的に垂直である、請求項3に記載されたアンカー心臓血管弁。
- 前記支持部材が、哺乳動物組織源由来の細胞外マトリックス(ECM)材料を含む、請求項1に記載されたアンカー心臓血管弁。
- 前記組織源が、小腸粘膜下層(SIS)、膀胱粘膜下層(UBS)、胃粘膜下層(SS)、中枢神経系組織、中胚葉由来の上皮、すなわち中皮組織、真皮細胞外マトリックス、皮下細胞外マトリックス、消化管細胞外マトリックス、すなわち大腸及び小腸、成長骨の周囲の組織、胎盤細胞外マトリックス、修飾細胞外マトリックス、心臓細胞外マトリックス、例えば、心膜及び/または心筋、腎臓細胞外マトリックス、膵臓細胞外マトリックス、肺細胞外マトリックス、及びそれらの組み合わせから成る群から選択される、請求項5に記載されたアンカー心臓血管弁。
- 前記ECM材料が、追加の薬剤を含む、請求項5に記載されたアンカー心臓血管弁。
- 前記薬剤が抗炎症薬を含む、請求項7に記載されたアンカー心臓血管弁。
- 前記薬剤がスタチンを含む、請求項7に記載されたアンカー心臓血管弁。
- 前記スタチンが、アトルバスタチン、セリバスタチン、フルバスタチン、ロバスタチン、メバスタチン、ピタバスタチン、プラバスタチン、ロスバスタチン、及びシンバスタチンから成る群から選択される、請求項9に記載されたアンカー心臓血管弁。
- 前記薬剤が増殖因子を含む、請求項7に記載されたアンカー心臓血管弁。
- 前記増殖因子が、血小板由来増殖因子(PDGF)、上皮成長因子(EGF)、形質転換増殖因子アルファ(TGF‐α)、形質転換増殖因子ベータ(TGF‐β)、線維芽細胞増殖因子‐2(FGF‐2)、塩基性線維芽細胞増殖因子(bFGF)、血管内皮細胞増殖因子(VEGF)、肝細胞増殖因子(HGF)、インスリン様成長因子(IGF)、神経成長因子(NGF)、血小板由来増殖因子(PDGF)、腫瘍壊死因子アルファ(TNA‐α)、及び胎盤成長因子(PLGF)から成る群から選択される、請求項11に記載されたアンカー心臓血管弁。
- 前記薬剤が抗不整脈薬を含む、請求項7に記載されたアンカー心臓血管弁。
- 前記抗不整脈薬が、キニジン、プロカインアミド、ジソピラミド、リドカイン、フェニトイン、メキシレチン、フレカイニド、プロパフェノン、モリシジン、プロプラノロール、エスモロール、チモロール、メトプロロール、アテノロール、アミオダロン、ソタロール、イブチリド、ドフェチリド、ベラパミル、ジルチアゼム、アデノシン、及びジゴキシンから成る群から選択される、請求項13に記載のアンカー心臓血管弁。
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2013/028561 WO2014133539A1 (en) | 2013-03-01 | 2013-03-01 | Anchored cardiovascular valve |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016509880A JP2016509880A (ja) | 2016-04-04 |
| JP2016509880A5 JP2016509880A5 (ja) | 2017-08-17 |
| JP6205436B2 true JP6205436B2 (ja) | 2017-09-27 |
Family
ID=51428653
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015560149A Active JP6205436B2 (ja) | 2013-03-01 | 2013-03-01 | アンカーで固定される心臓血管弁 |
Country Status (4)
| Country | Link |
|---|---|
| EP (2) | EP3427696A1 (ja) |
| JP (1) | JP6205436B2 (ja) |
| AU (1) | AU2013379744A1 (ja) |
| WO (1) | WO2014133539A1 (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8579964B2 (en) | 2010-05-05 | 2013-11-12 | Neovasc Inc. | Transcatheter mitral valve prosthesis |
| US9554897B2 (en) | 2011-04-28 | 2017-01-31 | Neovasc Tiara Inc. | Methods and apparatus for engaging a valve prosthesis with tissue |
| US9308087B2 (en) | 2011-04-28 | 2016-04-12 | Neovasc Tiara Inc. | Sequentially deployed transcatheter mitral valve prosthesis |
| US9345573B2 (en) | 2012-05-30 | 2016-05-24 | Neovasc Tiara Inc. | Methods and apparatus for loading a prosthesis onto a delivery system |
| US9572665B2 (en) | 2013-04-04 | 2017-02-21 | Neovasc Tiara Inc. | Methods and apparatus for delivering a prosthetic valve to a beating heart |
| CN105721190B (zh) * | 2014-12-04 | 2019-06-21 | 华为技术有限公司 | 数据传输路径的故障检测方法、装置及服务器 |
| CA3007670A1 (en) | 2016-01-29 | 2017-08-03 | Neovasc Tiara Inc. | Prosthetic valve for avoiding obstruction of outflow |
| CN113893064A (zh) | 2016-11-21 | 2022-01-07 | 内奥瓦斯克迪亚拉公司 | 用于快速收回经导管心脏瓣膜递送系统的方法和系统 |
| WO2019036810A1 (en) | 2017-08-25 | 2019-02-28 | Neovasc Tiara Inc. | TRANSCATHETER MITRAL VALVULE PROSTHESIS WITH SEQUENTIAL DEPLOYMENT |
| EP3735290A2 (en) * | 2018-01-02 | 2020-11-11 | Evonik Corporation | Microneedle delivery system with anchor |
| CN110101486B (zh) * | 2018-02-01 | 2024-02-27 | 上海微创心通医疗科技有限公司 | 心脏瓣膜假体及其输送器 |
| WO2019175288A1 (en) | 2018-03-13 | 2019-09-19 | Institut Químic De Sarrià Cets Fundació Privada | Vascular repair patch |
| US11696902B2 (en) | 2018-08-14 | 2023-07-11 | AltaThera Pharmaceuticals, LLC | Method of initiating and escalating sotalol hydrochloride dosing |
| US11610660B1 (en) | 2021-08-20 | 2023-03-21 | AltaThera Pharmaceuticals LLC | Antiarrhythmic drug dosing methods, medical devices, and systems |
| AU2019374743B2 (en) | 2018-11-08 | 2022-03-03 | Neovasc Tiara Inc. | Ventricular deployment of a transcatheter mitral valve prosthesis |
| EP3946163A4 (en) | 2019-04-01 | 2022-12-21 | Neovasc Tiara Inc. | ADJUSTABLE VALVE PROSTHESIS |
| EP3952792A4 (en) | 2019-04-10 | 2023-01-04 | Neovasc Tiara Inc. | HEART VALVE PROSTHESIS WITH NATURAL BLOOD FLOW |
| CA3140925A1 (en) | 2019-05-20 | 2020-11-26 | Neovasc Tiara Inc. | Introducer with hemostasis mechanism |
| AU2020295566B2 (en) | 2019-06-20 | 2023-07-20 | Neovasc Tiara Inc. | Low profile prosthetic mitral valve |
| CN114588500B (zh) * | 2022-02-10 | 2023-04-11 | 北京航空航天大学 | 胃肠道智能化自动弹射给药装置及其制备和给药方法 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4902508A (en) | 1988-07-11 | 1990-02-20 | Purdue Research Foundation | Tissue graft composition |
| DE69523251T2 (de) * | 1994-04-22 | 2002-07-25 | Medtronic Inc | Gestützte herzklappenprothese |
| US5522881A (en) * | 1994-06-28 | 1996-06-04 | Meadox Medicals, Inc. | Implantable tubular prosthesis having integral cuffs |
| US5733337A (en) | 1995-04-07 | 1998-03-31 | Organogenesis, Inc. | Tissue repair fabric |
| GB2312485B (en) | 1996-04-24 | 1999-10-20 | Endre Bodnar | Bioprosthetic conduits |
| SK22499A3 (en) | 1996-08-23 | 1999-10-08 | Cook Biotech Inc | Graft prosthesis, materials and methods |
| JP4638562B2 (ja) | 1996-12-10 | 2011-02-23 | パーデュー・リサーチ・ファウンデーション | 脊椎動物肝臓組織由来の生物材料 |
| JP4084420B2 (ja) | 1996-12-10 | 2008-04-30 | パーデュー・リサーチ・ファウンデーション | 管状粘膜下組織移植片構成物 |
| EP0850607A1 (en) * | 1996-12-31 | 1998-07-01 | Cordis Corporation | Valve prosthesis for implantation in body channels |
| US6074419A (en) * | 1996-12-31 | 2000-06-13 | St. Jude Medical, Inc. | Indicia for prosthetic device |
| US7125418B2 (en) * | 2002-04-16 | 2006-10-24 | The International Heart Institute Of Montana Foundation | Sigmoid valve and method for its percutaneous implantation |
| US7550004B2 (en) | 2002-08-20 | 2009-06-23 | Cook Biotech Incorporated | Endoluminal device with extracellular matrix material and methods |
| EP1659992B1 (en) * | 2003-07-31 | 2013-03-27 | Cook Medical Technologies LLC | Prosthetic valve devices and methods of making such devices |
| US7261732B2 (en) * | 2003-12-22 | 2007-08-28 | Henri Justino | Stent mounted valve |
| WO2005096989A1 (en) | 2004-03-31 | 2005-10-20 | Cook Incorporated | Graft material and stent graft comprising extra collagen matrix and method of preparation |
| US7445630B2 (en) * | 2004-05-05 | 2008-11-04 | Direct Flow Medical, Inc. | Method of in situ formation of translumenally deployable heart valve support |
| US7998196B2 (en) * | 2007-04-23 | 2011-08-16 | Saint Joseph's Translational Research Institute, Inc. | Replacement heart valve, valve holder and methods of making and using same |
| US8257434B2 (en) | 2007-12-18 | 2012-09-04 | Cormatrix Cardiovascular, Inc. | Prosthetic tissue valve |
| KR20120033299A (ko) * | 2009-02-18 | 2012-04-06 | 코매트릭스 카디오바스컬라 인코포레이티드 | 심장 부정맥을 예방하기 위한 조성물 및 방법 |
| US8795354B2 (en) | 2010-03-05 | 2014-08-05 | Edwards Lifesciences Corporation | Low-profile heart valve and delivery system |
| WO2012015825A2 (en) * | 2010-07-27 | 2012-02-02 | Incept, Llc | Methods and apparatus for treating neurovascular venous outflow obstruction |
| AU2012262549B2 (en) * | 2011-05-27 | 2016-02-11 | Cormatrix Cardiovascular, Inc. | Extracellular matrix material valve conduit and methods of making thereof |
-
2013
- 2013-03-01 WO PCT/US2013/028561 patent/WO2014133539A1/en active Application Filing
- 2013-03-01 EP EP18186664.1A patent/EP3427696A1/en active Pending
- 2013-03-01 JP JP2015560149A patent/JP6205436B2/ja active Active
- 2013-03-01 AU AU2013379744A patent/AU2013379744A1/en not_active Abandoned
- 2013-03-01 EP EP13861484.7A patent/EP2797556B1/en not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| EP2797556B1 (en) | 2018-08-01 |
| EP3427696A1 (en) | 2019-01-16 |
| AU2013379744A1 (en) | 2015-09-17 |
| EP2797556A4 (en) | 2015-06-03 |
| EP2797556A1 (en) | 2014-11-05 |
| JP2016509880A (ja) | 2016-04-04 |
| WO2014133539A1 (en) | 2014-09-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6205436B2 (ja) | アンカーで固定される心臓血管弁 | |
| JP2016509880A5 (ja) | ||
| US9044319B2 (en) | Anchored cardiovascular valve | |
| US8808363B2 (en) | Vascular prosthesis | |
| US9867696B2 (en) | Systems, apparatus and methods for sealing perivalvular leaks | |
| US9681937B2 (en) | Extracellular matrix constructs for treating damaged biological tissue | |
| US20150335787A1 (en) | Extracellular Matrix Encasement Structures and Methods | |
| JP2015165892A (ja) | 細胞外マトリクスの収納構造体および収納方法 | |
| JP2016515851A (ja) | シームレスの管状細胞外マトリックス人工弁及びその形成方法 | |
| US20160143729A1 (en) | Regenerative Respiratory Tract Prostheses | |
| US20160317296A1 (en) | Prosthetic Tissue Valves | |
| WO2016094106A1 (en) | Biocompatable annular prostheses and methods for forming same | |
| US20210228346A1 (en) | Systems, Apparatus and Methods for Sealing Perivalvular Leaks | |
| JP2016512989A (ja) | ツーピース人工弁 | |
| WO2022177552A1 (en) | Prosthetic venous valves | |
| WO2015108510A1 (en) | Ecm constructs for treating damaged biological tissue |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160229 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20161101 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20161107 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20161107 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170207 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170424 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20170706 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170725 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170804 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170808 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170904 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6205436 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |