JP6149042B2 - Her3抗体およびその使用 - Google Patents
Her3抗体およびその使用 Download PDFInfo
- Publication number
- JP6149042B2 JP6149042B2 JP2014541312A JP2014541312A JP6149042B2 JP 6149042 B2 JP6149042 B2 JP 6149042B2 JP 2014541312 A JP2014541312 A JP 2014541312A JP 2014541312 A JP2014541312 A JP 2014541312A JP 6149042 B2 JP6149042 B2 JP 6149042B2
- Authority
- JP
- Japan
- Prior art keywords
- her3
- antibody
- antibodies
- cells
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Urology & Nephrology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Endocrinology (AREA)
- Analytical Chemistry (AREA)
- Cell Biology (AREA)
- Hospice & Palliative Care (AREA)
- Mycology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
本出願は、2011年11月9日に出願された米国仮特許出願第61/557,672号の利益を主張し、参照することによりその全体が本明細書に組み込まれる。
連邦政府支援の研究に関する声明
特定の実施形態では、例えば以下が提供される:
(項目1)
HER3に特異的な抗体であって、リガンド結合を阻止せず、HER3のリン酸化を阻止する、抗体。
(項目2)
前記リン酸化が、HER3へのリガンド結合に非依存的である、項目1に記載の抗体。
(項目3)
低用量かつ生体外で、HER3を発現する癌細胞内のHER3のリン酸化を阻止する、項目1に記載の抗体。
(項目4)
HER2およびEGFRのリン酸化の阻止を敏感にする、項目1に記載の抗体。
(項目5)
配列番号3、配列番号4、および配列番号5を含むポリペプチド配列を持つ軽鎖と、配列番号6、配列番号7、および配列番号8を含むポリペプチド配列を持つ重鎖とを含む抗体と同一のエピトープ特異性を有する、項目1に記載の抗体。
(項目6)
配列番号3、配列番号4、および配列番号5を含むポリペプチド配列を持つ軽鎖と、配列番号6、配列番号7、および配列番号8を含むポリペプチド配列を持つ重鎖とを含む、項目5に記載の抗体。
(項目7)
前記軽鎖が配列番号1を含み、前記重鎖が配列番号2を含む、項目6に記載の抗体。
(項目8)
対象における癌を治療する方法であって、有効な量の項目1〜7のいずれか1項に記載の抗体を前記対象に投与することを含む、方法。
(項目9)
前記対象が、HER3発現癌を有するとして選択される、項目8に記載の方法。
(項目10)
HER3へのリガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目8に記載の方法。
(項目11)
HER2へのリガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目8〜10のいずれか1項に記載の方法。
(項目12)
1つ以上の化学療法薬を前記対象に投与することをさらに含む、項目8〜11に記載の方法。
(項目13)
EGFRへのリガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目8〜11のいずれか1項に記載の方法。
(項目14)
1つ以上のチロシンキナーゼ阻害剤を前記対象に投与することをさらに含む、項目8〜11のいずれか1項に記載の方法。
(項目15)
前記1つ以上のチロシンキナーゼ阻害剤が、エルロチニブおよびラパチニブからなる群から選択される、項目14に記載の方法。
(項目16)
対象におけるチロシンキナーゼ阻害剤への耐性を防止または低減する方法であって、項目1に記載のHER3抗体を前記対象に投与することを含む、方法。
(項目17)
HER3リガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目16に記載の方法。
(項目18)
対象における化学療法薬への耐性を防止または低減する方法であって、項目1に記載のHER3抗体を前記対象に投与することを含む、方法。
(項目19)
HER3リガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目18に記載の方法。
(項目20)
生体外かつ低用量で、HER3を発現する癌細胞内のHER3へのリガンド結合を阻止する、HER3に特異的な抗体。
(項目21)
配列番号11、配列番号12、および配列番号13を含むポリペプチド配列を持つ軽鎖と、配列番号14、配列番号15、および配列番号16を含むポリペプチド配列を持つ重鎖とを含む抗体と同一のエピトープ特異性を有する、項目20に記載の抗体。
(項目22)
配列番号11、配列番号12、および配列番号13を含むポリペプチド配列を持つ軽鎖と、配列番号14、配列番号15、および配列番号16を含むポリペプチド配列を持つ重鎖とを含む、項目20に記載の抗体。
(項目23)
前記軽鎖が配列番号9を含み、前記重鎖が配列番号10を含む、項目20に記載の抗体。
(項目24)
対象における癌を治療する方法であって、項目20〜23のいずれか1項に記載の抗体を前記対象に投与することを含む、方法。
(項目25)
前記対象が、HER3発現癌を有するとして選択される、項目24に記載の方法。
(項目26)
HER3へのリガンド結合を阻止しない抗体を前記対象に投与することをさらに含み、前記はHER3のリン酸化を阻止する、項目24に記載の方法。
(項目27)
HER2へのリガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目24〜26のいずれか1項に記載の方法。
(項目28)
EGFRへのリガンド結合を阻止する抗体を前記対象に投与することをさらに含む、項目24〜27のいずれか1項に記載の方法。
(項目29)
1つ以上の化学療法薬を前記対象に投与することをさらに含む、項目24〜27のいずれか1項に記載の方法。
(項目30)
1つ以上のチロシンキナーゼ阻害剤を前記対象に投与することをさらに含む、項目24〜27のいずれか1項に記載の方法。
(項目31)
前記1つ以上のチロシンキナーゼ阻害剤が、エルロチニブおよびラパチニブからなる群から選択される、項目30に記載の方法。
(項目32)
HER3のリガンド非依存的リン酸化を阻止する薬剤をスクリーニングする方法であって、
(a) 試験される前記薬剤をHER3発現細胞に投与することと、
(b) HER3リン酸化のレベルを検出することと、を含み、未処置のHER3発現細胞または対照と比較して、HER3自己リン酸化のレベルの減少が、リガンド非依存的リ
ン酸化を阻止する薬剤を示す、方法。
(項目33)
HER3リガンドを前記HER3発現細胞に投与することをさらに含む、項目32に記載の方法。
(項目34)
前記HER3リガンドが、前記薬剤が試験される前に投与される、項目33に記載の方法。
(項目35)
項目32〜34のいずれか1項に記載の方法により識別される、薬剤。
実施例
DR5−アポトーシス耐性ヒト乳癌ZR75−1細胞株に対して行われるハイブリドーマライブラリの機能的スクリーニングにおいて、1A5抗体が識別された。1A5抗体およびTRA−8またはCTB006から選択される作動性DR5抗体の存在下で、DR5耐性ZR75−1細胞のアポトーシスが観測された。1A5抗体の標的は、1A5抗体による免疫沈降および後次の質量分析によりHER3であると識別された。
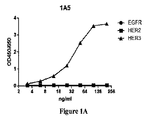
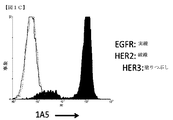
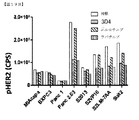
1A5および3D4抗体の結合特異性を実証するために、ELISAアッセイを行った。ELISAプレートを、1μg/mLの組み換え可溶性EGFR、HER2、またはHER3の細胞外ドメインで被覆した。ELISAプレートを、漸増濃度の1A5または3D4でインキュベートした後、二次HRP−ヤギ抗マウスIgGを用いてインキュベートし、1A5および3D4抗体結合を検出した。1A5および3D4抗体の両方がHER3に特異的に結合することが判断された(図1Aおよび1B)。確認として、1A5および3D4抗体の結合特異性は、フローサイトメトリーによっても検査した。EGFR、HER2、またはHER3でトランスフェクトしたSP2/0細胞を、1μg/mLの精製1A5または3D4抗体で染色した後、PE−ヤギ抗マウスIgGで染色し、1A5および3D4抗体結合を検出した。フローサイトメトリーを用いて、1A5および3D4抗体がHER3に特異的に結合することが確認された(図1Cおよび1D)。
QRATISCRASESVDSYGNSFMNWYQQKPGQPPKVLIYRASNLESGIPARFSGSGSRTDFTLTITPVEADDVATYYCQQSYEDPPTFGGGTKLEIK(配列番号9)および3D4重鎖の可変領域MGWSRIFLFLLSIIAGVHCQVQLQQSGPELV
KPGASVRISCKASGYTFTNYFLHWMKQRPGQGLEWIGWIYPGNVNTKYSEKFKGKATLTADKSSSTAYMQLSSLTSEDSAVYFCARSTYYSMDYWGQGTSVTVSS(配列番号10)。3D4軽鎖の可変領域のさらなる分析は、METDTLLLWVLLLWVPGSTG(配列番号27)からなるリーダーペプチド、フレームワーク領域1(FR1)のDIVLTQSPASLAVSLGQRATISC(配列番号28)、FR2のWYQQKPGQPPKVLIY(配列番号29)、FR3のGIPARFSGSGSRTDFTLTIT
PVEADDVATYYC(配列番号30)、FR4のFGGGTKLEIK(配列番号31)、相補性決定領域1(CDR1)のRASESVDSYGNSFMN(配列番号11)、CDR2のRASNLES(配列番号12)、およびCDR3のQQSYEDPPT(配列番号13)を示した。3D5重鎖の可変領域のさらなる分析は、MGWSRIFLFLLSIIAGVHC(配列番号32)からなるリーダーペプチド、フレームワーク領域1(FR1)のQVQLQQSGPELVKPGASVRISCKASGYTFT(配列番号33)、FR2のWMKQRPGQGLEWIG(配列番号34)、FR3のKATLTADKSSSTAYMQLSSL
TSEDSAVYFCAR(配列番号35)、FR4のWGQGTSVTVSS(配列番号36)、相補性決定領域1(CDR1)のNYFLH(配列番号14)、CDR2のWIYPGNVNTKYSEKFKG(配列番号15)、およびCDR3のSTYYSMDY(配列番号16)を示した。
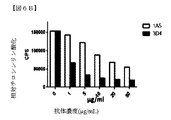
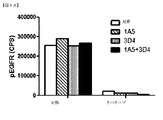
1A5抗体がHER3のリガンド非依存的活性(自己リン酸化)を阻害することができるか否かを判断するために、1A5または3D4抗体を、いくつかの癌細胞株に投与し、HER3の自己リン酸化レベルを判断した。ヒト胃癌N87細胞、乳癌BT474細胞およびZR75−30細胞、および膵癌Panc2.03細胞を、漸増濃度の1A5または3D4抗体で24時間処置した。HER3のチロシンリン酸化レベルを、2mg/mLの総細胞溶解物中でELISAアッセイを用いて判断した。ELISAプレートを、1A5および3D4抗体とは異なるエピトープを認識する3F8抗HER3抗体で被覆し、総HER3(tHER3)を捕捉した。チロシンリン酸化レベルを、HRP共役4G10抗チロシンリン酸化抗体を用いて化学発光により検出した。その1A5抗体の漸増濃度は、リガンド依存的3D4抗体より大幅にHER3の自己リン酸化を阻害することができることを判断した(図4A〜4D)。図5は、一団のヒト癌細胞内のHER3のリガンド非依存的活性化の阻害をさらに示す。チロシンリン酸化レベルは、2mg/mLの総細胞溶解物中でELISAアッセイにより判断し、チロシンリン酸化のレベルは、HRP共役4G10抗チロシンリン酸化抗体により検出した。
1A5抗体が、腫瘍成長を生体内で阻害することができるか否かを判断するために、異なる癌異種移植モデルを用いた。A549ヒト肺癌異種移植モデルを用いて、1A5または3D4抗体単独の投与が、腫瘍体積を低減させたことを示した(図11)。さらに、1A5および3D4抗体を組み合わせで投与することは、抗体がA549ヒト肺癌異種移植モデル内の腫瘍体積を相乗的に低減し得ることを実証した。同一モデルを用いて、1A5または3D4抗体を単独および組み合わせで、アービタックスを投与することが、アービタックス単独の投与よりも多く腫瘍体積を低減させたことを実証した(図12)。
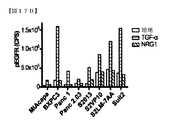
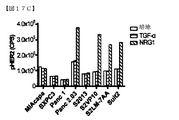
1A5および3D4抗体の効果を、いくつかの膵癌細胞株において調査した。細胞株を最初に検査して、ERBBファミリータンパク質の発現および機能を判断した。全ての細胞株が高レベルのEGFRを発現し、8つの細胞株のうち5つが可変レベルのHER2を発現し、8つの細胞株のうち7つが可変レベルのHER3を発現した(図17A)。TGF−αは、EGFR発現レベルに非依存的な差異的リン酸化反応を誘導したが、HER2またはHER3を活性化しなかった(図17B〜17D)。NRG1は、EGFR活性化を誘導しなかったが、HER3依存的様式で、HER2およびHER3の両方を活性化することができた。全てのHER3陽性細胞株は、異なるレベルのHER3自己リン酸化を有した(図17B〜17D)。
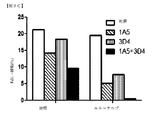
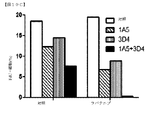
1A5および3D4抗体の効果を、乳癌および膵癌の生体内モデルにおいて調査した。これらの研究において、乳癌および膵癌同所性異種移植片を、1A5リガンド非依存的HER3抗体および3D4リガンド依存的HER3抗体の等しい混合物を単独または化学療法薬もしくはチロシンキナーゼ阻害剤(乳癌の場合アブラキサンもしくはラパチニブ、膵癌の場合ゲムシタビン)との組み合わせからなる治療周期で処置した。予想に反して、HER3抗体単独では、HCC1187基底A乳癌異種移植片の阻害を生じなかったが、アブラキサンは成長阻害を生じた。また驚くべきことに、HER3抗体とアブラキサン(図21)またはラパチニブ(図22)との組み合わせが、HCC1187およびMDA−MB−468基底A異種移植片の腫瘍成長阻害を長期化した。第3の予想外の発見は、HER3抗体単独またはゲムシタビンとの組み合わせで、ゲムシタビンもしくは無処置と比較して、MIA PaCa−2ヒト膵同所性腫瘍異種移植片を担持するマウスの生存を等しく強化したことであった(図23)。
Claims (15)
- HER3に特異的な抗体であって、リガンド結合を阻止せず、HER3のリン酸化を阻止し、前記抗体が、配列番号3のCDR1、配列番号4のCDR2および配列番号5のCDR3を含むポリペプチド配列を持つ軽鎖と、配列番号6のCDR1、配列番号7のCDR2および配列番号8のCDR3を含むポリペプチド配列を持つ重鎖とを含む、抗体。
- 前記リン酸化が、HER3へのリガンド結合に非依存的である、請求項1に記載の抗体。
- 前記重鎖が配列番号1を含み、前記軽鎖が配列番号2を含む、請求項1に記載の抗体。
- 対象における癌を治療するための組成物であって、有効な量の請求項1〜3のいずれか1項に記載の抗体を含む、組成物。
- 前記対象が、HER3発現癌を有するとして選択される、請求項4に記載の組成物。
- 前記組成物が、HER3へのリガンド結合を阻止する抗体と組み合わせて前記対象に投与されることを特徴とする、請求項4に記載の組成物。
- 前記組成物が、HER2へのリガンド結合を阻止する抗体と組み合わせて前記対象に投与されることを特徴とする、請求項4〜6のいずれか1項に記載の組成物。
- 前記組成物が、1つ以上の化学療法薬と組み合わせて前記対象に投与されることを特徴とする、請求項4〜7に記載の組成物。
- 前記組成物が、EGFRへのリガンド結合を阻止する抗体と組み合わせて前記対象に投与されることを特徴とする、請求項4〜8のいずれか1項に記載の組成物。
- 前記組成物が、1つ以上のチロシンキナーゼ阻害剤と組み合わせて前記対象に投与されることを特徴とする、請求項4〜8のいずれか1項に記載の組成物。
- 前記1つ以上のチロシンキナーゼ阻害剤が、エルロチニブおよびラパチニブからなる群から選択される、請求項10に記載の組成物。
- 対象におけるチロシンキナーゼ阻害剤への耐性を防止または低減するための組成物であって、請求項1に記載のHER3抗体を含む、組成物。
- 前記組成物が、HER3リガンド結合を阻止する抗体と組み合わせて前記対象に投与されることを特徴とする、請求項12に記載の組成物。
- 対象における化学療法薬への耐性を防止または低減するための組成物であって、請求項1に記載のHER3抗体を含む、組成物。
- 前記組成物が、HER3リガンド結合を阻止する抗体と組み合わせて前記対象に投与されることを特徴とする、請求項14に記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161557672P | 2011-11-09 | 2011-11-09 | |
| US61/557,672 | 2011-11-09 | ||
| PCT/US2012/064381 WO2013071058A1 (en) | 2011-11-09 | 2012-11-09 | Her3 antibodies and uses thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014533278A JP2014533278A (ja) | 2014-12-11 |
| JP2014533278A5 JP2014533278A5 (ja) | 2015-12-24 |
| JP6149042B2 true JP6149042B2 (ja) | 2017-06-14 |
Family
ID=48290585
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014541312A Active JP6149042B2 (ja) | 2011-11-09 | 2012-11-09 | Her3抗体およびその使用 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9637543B2 (ja) |
| EP (1) | EP2788377B1 (ja) |
| JP (1) | JP6149042B2 (ja) |
| CN (1) | CN104011079B (ja) |
| AU (1) | AU2012335543C1 (ja) |
| CA (1) | CA2855298A1 (ja) |
| WO (1) | WO2013071058A1 (ja) |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2792062T3 (es) | 2011-05-09 | 2020-11-06 | Mayo Found Medical Education & Res | Tratamientos contra el cáncer |
| CN104093743B (zh) | 2011-11-23 | 2018-04-24 | 医学免疫有限责任公司 | 特异于her3的结合分子及其用途 |
| BR112014013412A8 (pt) * | 2011-12-05 | 2021-06-08 | Novartis Ag | anticorpos para o receptor 3 do fator de crescimento epidérmico (her3), e seus usos |
| ES2899643T3 (es) | 2012-10-01 | 2022-03-14 | Mayo Found Medical Education & Res | Tratamientos para el cáncer |
| WO2015048008A2 (en) | 2013-09-24 | 2015-04-02 | Medimmune, Llc | Binding molecules specific for her3 and uses thereof |
| US10745490B2 (en) | 2014-04-11 | 2020-08-18 | Celldex Therapeutics, Inc. | Anti-ErbB antibodies and methods of use thereof |
| AU2015277494A1 (en) | 2014-06-16 | 2017-01-12 | Mayo Foundation For Medical Education And Research | Treating myelomas |
| US9446148B2 (en) | 2014-10-06 | 2016-09-20 | Mayo Foundation For Medical Education And Research | Carrier-antibody compositions and methods of making and using the same |
| WO2016059602A2 (en) * | 2014-10-16 | 2016-04-21 | Glaxo Group Limited | Methods of treating cancer and related compositions |
| TW201707725A (zh) | 2015-08-18 | 2017-03-01 | 美國馬友醫藥教育研究基金會 | 載體-抗體組合物及其製造及使用方法 |
| TW201713360A (en) | 2015-10-06 | 2017-04-16 | Mayo Foundation | Methods of treating cancer using compositions of antibodies and carrier proteins |
| US11571469B2 (en) | 2016-01-07 | 2023-02-07 | Mayo Foundation For Medical Education And Research | Methods of treating cancer with interferon wherein the cancer cells are HLA negative or have reduced HLA expression |
| AU2017217881B2 (en) | 2016-02-12 | 2022-11-17 | Mayo Foundation For Medical Education And Research | Hematologic cancer treatments |
| WO2017165440A1 (en) | 2016-03-21 | 2017-09-28 | Mayo Foundation For Medical Education And Research | Methods for reducing toxicity of a chemotherapeutic drug |
| EP3432928A4 (en) | 2016-03-21 | 2019-11-20 | Mayo Foundation for Medical Education and Research | PROCESS FOR IMPROVING THE THERAPEUTIC INDEX FOR CHEMOTHERAPEUTIC |
| US10618969B2 (en) * | 2016-04-06 | 2020-04-14 | Mayo Foundation For Medical Education And Research | Carrier-binding agent compositions and methods of making and using the same |
| EP3506950A1 (en) | 2016-09-01 | 2019-07-10 | Mayo Foundation for Medical Education and Research | Methods and compositions for targeting t-cell cancers |
| MX2019002474A (es) | 2016-09-01 | 2019-09-18 | Mayo Found Medical Education & Res | Composiciones de agente de unión de portador-ligando-1 de muerte programada y métodos de uso de las mismas para el tratamiento de cánceres. |
| AU2017324335A1 (en) | 2016-09-06 | 2019-03-28 | Mayo Foundation For Medical Education And Research | Methods of treating PD-L1 expressing cancer |
| EP3509643A1 (en) | 2016-09-06 | 2019-07-17 | Mayo Foundation for Medical Education and Research | Paclitaxel-albumin-binding agent compositions and methods for using and making the same |
| US11590098B2 (en) | 2016-09-06 | 2023-02-28 | Mayo Foundation For Medical Education And Research | Methods of treating triple-negative breast cancer using compositions of antibodies and carrier proteins |
| WO2018119425A2 (en) * | 2016-12-22 | 2018-06-28 | Icahn School Of Medicine At Mount Sinai | Anti-lilrb3 antibodies and methods of use thereof |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3040121B2 (ja) | 1988-01-12 | 2000-05-08 | ジェネンテク,インコーポレイテッド | 増殖因子レセプターの機能を阻害することにより腫瘍細胞を処置する方法 |
| ATE342283T1 (de) * | 1996-03-27 | 2006-11-15 | Genentech Inc | Erbb3 antikörper |
| AUPP380498A0 (en) * | 1998-05-29 | 1998-06-25 | Biomolecular Research Institute Limited | Egf receptor agonists and antagonists |
| BRPI0210405B8 (pt) | 2001-06-13 | 2021-05-25 | Genmab As | anticorpo monoclonal humano, molécula biespecífica, método in vitro para inibir o crescimento de uma célula expressando egfr, para induzir a citólise de uma célula expressando egfr, e para detectar a presença de antígeno egfr ou uma célula expressando egfr em uma amostra, e, vetor de expressão |
| EP1283053A1 (en) | 2001-08-09 | 2003-02-12 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Inhibitors of HER3 activity |
| UA96139C2 (uk) | 2005-11-08 | 2011-10-10 | Дженентек, Інк. | Антитіло до нейропіліну-1 (nrp1) |
| AR056857A1 (es) | 2005-12-30 | 2007-10-24 | U3 Pharma Ag | Anticuerpos dirigidos hacia her-3 (receptor del factor de crecimiento epidérmico humano-3) y sus usos |
| PT2716301T (pt) * | 2007-02-16 | 2017-07-04 | Merrimack Pharmaceuticals Inc | Anticorpos contra erbb3 e suas utilizações |
| CA2732658A1 (en) * | 2008-08-15 | 2010-02-18 | Merrimack Pharmaceuticals, Inc. | Methods and systems for predicting response of cells to a therapeutic agent |
| BR112012003809A2 (pt) | 2009-08-21 | 2019-09-24 | Merrimack Pharmaceuticals Inc | anticorpa monoclonal isolado ou porção de ligação a antígeno do mesmo, composição e, método para tratar câncer em um indivíduo. |
| CN103080134B (zh) * | 2010-08-20 | 2015-11-25 | 诺华股份有限公司 | 表皮生长因子受体3(her3)的抗体 |
| JP5995851B2 (ja) * | 2010-10-18 | 2016-09-21 | メディアファーマ エス. アール. エル.Mediapharma S. R. L. | ErbB3結合抗体 |
-
2012
- 2012-11-09 EP EP12847223.0A patent/EP2788377B1/en not_active Not-in-force
- 2012-11-09 CA CA2855298A patent/CA2855298A1/en not_active Abandoned
- 2012-11-09 CN CN201280064525.0A patent/CN104011079B/zh not_active Expired - Fee Related
- 2012-11-09 WO PCT/US2012/064381 patent/WO2013071058A1/en active Application Filing
- 2012-11-09 JP JP2014541312A patent/JP6149042B2/ja active Active
- 2012-11-09 AU AU2012335543A patent/AU2012335543C1/en not_active Ceased
- 2012-11-09 US US14/357,524 patent/US9637543B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP2788377B1 (en) | 2019-01-23 |
| AU2012335543A1 (en) | 2014-06-12 |
| CN104011079B (zh) | 2017-06-16 |
| EP2788377A4 (en) | 2015-11-18 |
| EP2788377A1 (en) | 2014-10-15 |
| US9637543B2 (en) | 2017-05-02 |
| AU2012335543C1 (en) | 2017-12-14 |
| WO2013071058A1 (en) | 2013-05-16 |
| CA2855298A1 (en) | 2013-05-16 |
| AU2012335543B2 (en) | 2017-08-24 |
| JP2014533278A (ja) | 2014-12-11 |
| CN104011079A (zh) | 2014-08-27 |
| AU2012335543A8 (en) | 2014-06-26 |
| US20140314774A1 (en) | 2014-10-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6149042B2 (ja) | Her3抗体およびその使用 | |
| US11976119B2 (en) | Anti-SIRPa antibodies and methods of use thereof | |
| TWI719970B (zh) | 針對icos之抗體 | |
| JP2020180135A (ja) | 抗pd−l1抗体およびその使用 | |
| JP2021120382A (ja) | 部位特異的抗体コンジュゲーション方法および組成物 | |
| DK2646470T3 (en) | ANTI-TRANSFERRIN RECEPTOR ANTIBODIES WITH LOW AFFINITY AND ITS USE FOR TRANSPORTING THERAPEUTIC SCFV OVER THE BLOOD-BRAIN BARRIER | |
| TWI735456B (zh) | 用於治療癌症之新穎組合 | |
| KR20190105122A (ko) | 항-cd73 항체 및 이것의 사용 | |
| CN109311997B (zh) | 抗axl拮抗抗体 | |
| TWI772326B (zh) | 抗-pd-1抗體 | |
| AU2016253681A1 (en) | Methods for improving safety of blood-brain barrier transport | |
| CN115960235A (zh) | 抗siglec-7抗体及其使用方法 | |
| CN109195991A (zh) | 对糖基化pd-l1特异的双重功能抗体及其使用方法 | |
| CN116410318A (zh) | 抗axl拮抗抗体 | |
| TW201305213A (zh) | 新穎抗原結合蛋白 | |
| EP4151652A1 (en) | Anti-cd73 antibody and use thereof | |
| WO2021017892A1 (zh) | 针对抗cd73抗体和变体的方法和组合物 | |
| JP2017526676A (ja) | がんの処置のための併用療法 | |
| WO2015161247A1 (en) | Humanized anti-c16orf54 antibodies and methods of use thereof | |
| CN114040926A (zh) | 结合cd123的多肽及其用途 | |
| AU2019331018A1 (en) | Anti-cd33 antibodies and methods of use thereof | |
| CA3106535A1 (en) | Anti-siglec-5 antibodies and methods of use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151106 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20151106 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160819 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161118 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170118 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170424 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170522 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6149042 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |