JP5749010B2 - センサ - Google Patents
センサ Download PDFInfo
- Publication number
- JP5749010B2 JP5749010B2 JP2010522454A JP2010522454A JP5749010B2 JP 5749010 B2 JP5749010 B2 JP 5749010B2 JP 2010522454 A JP2010522454 A JP 2010522454A JP 2010522454 A JP2010522454 A JP 2010522454A JP 5749010 B2 JP5749010 B2 JP 5749010B2
- Authority
- JP
- Japan
- Prior art keywords
- transducer
- sample
- reagent
- labeling reagent
- analyte
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5302—Apparatus specially adapted for immunological test procedures
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1702—Systems in which incident light is modified in accordance with the properties of the material investigated with opto-acoustic detection, e.g. for gases or analysing solids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/171—Systems in which incident light is modified in accordance with the properties of the material investigated with calorimetric detection, e.g. with thermal lens detection
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
- G01N33/54373—Apparatus specially adapted for solid-phase testing involving physiochemical end-point determination, e.g. wave-guides, FETS, gratings
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1702—Systems in which incident light is modified in accordance with the properties of the material investigated with opto-acoustic detection, e.g. for gases or analysing solids
- G01N2021/1708—Systems in which incident light is modified in accordance with the properties of the material investigated with opto-acoustic detection, e.g. for gases or analysing solids with piezotransducers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2201/00—Features of devices classified in G01N21/00
- G01N2201/06—Illumination; Optics
- G01N2201/062—LED's
Description
abelled)検体の量に反比例する。
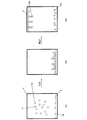
エネルギーの変化を電気的信号に変換することが可能な変換器(transducer)に、前記サンプルをさらすステップであって、前記変換器は、前記変換器上に又は前記変換器に近接して少なくとも1つの連結試薬(tethered reagent)を有し、前記少なくとも1つの連結試薬は、前記検体と結合することが可能な結合部位(binding site)を有する、ステップと、
標識化試薬(labelled reagent)を前記サンプル中に導入するステップであって、前記標識化試薬は、前記検体用又は前記連結試薬用の結合部位と、エネルギーを生成するよう、放射源により生成された電磁放射を吸収することが可能な標識とを含む、ステップと、
前記標識化試薬を、第1の期間において、前記検体又は前記連結試薬と結合させるステップであって、前記変換器は、前記標識化試薬が、少なくとも部分的に前記変換器上に定着(settle)されるよう方向付けられている、ステップと、
続いて、第2の期間において、前記標識化試薬を不安定化(unsettle)させるステップと、
前記第1及び第2の期間の間において、前記サンプルに電磁放射を照射するステップと、
前記生成されたエネルギーを電気的信号に変換するステップと、
前記電気的信号を検出するステップと、
を含む方法を提供する。
電磁放射を生成するよう適合(adapt)された放射源と、
エネルギーの変化を電気的信号に変換することが可能な変換器と、
前記変換器上の又は前記変換器に近接した少なくとも1つの連結試薬であって、前記検体と結合することが可能な結合部位を有する少なくとも1つの連結試薬と、
前記サンプルを、流体中に変換器と接して保持するためのチャンバであって、前記装置を反転、部分的に反転、又は撹拌して前記サンプルを収容するよう適合されたチャンバと、
前記変換器により生成された前記電気的信号を検出することが可能な検出器と、
を備える装置を提供する。
Claims (15)
- サンプル中の検体を検出する方法であって、
エネルギーの変化を電気的信号に変換することが可能な変換器に、前記サンプルをさらすステップであって、前記変換器は、前記変換器上に又は前記変換器に近接して少なくとも1つの連結試薬を有し、前記少なくとも1つの連結試薬は、前記検体と結合することが可能な結合部位を有する、ステップと、
標識化試薬を前記サンプル中に導入するステップであって、前記標識化試薬は、前記検体用又は前記連結試薬用の結合部位と、エネルギーを生成するよう、放射源により生成された電磁放射を吸収することが可能な標識とを含む、ステップと、
前記標識化試薬を、第1の期間において、前記検体又は前記連結試薬と結合させるステップであって、前記変換器は、前記標識化試薬が、少なくとも部分的に前記変換器上に定着されるよう方向付けられている、ステップと、
続いて、第2の期間において、前記変換器を、前記サンプルに対し反転させる又は部分的に反転させることで、前記連結試薬に直接的にも前記検体を介しても未結合の前記標識化試薬を前記変換器から分離させるステップと、
前記第1及び第2の期間の間において、前記サンプルに電磁放射を照射するステップと、
前記生成されたエネルギーを電気的信号に変換するステップと、
前記電気的信号を検出するステップと、
を含む方法。 - 前記標識化試薬は、前記サンプルよりも密度が高く、重力は、前記標識化試薬を少なくとも部分的に前記変換器上に定着させるよう、前記標識化試薬に作用する、請求項1に記載の方法。
- 前記標識化試薬は、前記サンプルよりも密度が低く、浮力は、前記標識化試薬を少なくとも部分的に前記変換器上に定着させるよう、前記標識化試薬に作用する、請求項1に記載の方法。
- 前記変換器は、焦電又は圧電素子及び複数の電極を有する焦電又は圧電変換器である、請求項1から3のいずれか1項に記載の方法。
- 前記サンプルには、電磁放射の一連のパルスが照射され、前記方法は更に、前記放射源からの電磁放射の各パルスと前記電気的信号の生成との間の時間遅延を検出するステップを含み、電磁放射の各々のパルスと前記電気的信号の生成との間の前記時間遅延は、前記変換器の表面からの距離の異なる1つ以上の任意の位置での、前記標識の位置に相当する、請求項1から4のいずれか1項に記載の方法。
- 前記少なくとも1つの連結試薬は、抗体であり、前記検体は、抗原であり、前記標識化試薬は、前記少なくとも1つの連結試薬と結合することも可能な標識化抗原、又は前記検体と結合することも可能な標識化抗体である、請求項1から5のいずれか1項に記載の方法。
- 前記少なくとも1つの連結試薬は、前記変換器上に吸着されている、請求項1から6のいずれか1項に記載の方法。
- 前記標識は、1.5から23g/mLの密度を有する粒子である、請求項1から7のいずれか1項に記載の方法。
- ベースライン測定が、前記標識化試薬を前記サンプル中に導入した後であるが、前記標識化試薬を前記変換器上に定着させる前に行われる、請求項1から8のいずれか1項に記載の方法。
- サンプル中の検体を検出する装置であって、
電磁放射を生成するよう適合された放射源と、
エネルギーの変化を電気的信号に変換することが可能な変換器と、
前記変換器上の又は前記変換器に近接した少なくとも1つの連結試薬であって、前記検体と結合することが可能な結合部位を有する少なくとも1つの連結試薬と、
前記サンプルを、流体中に変換器と接して保持するためのチャンバであって、ふたで又は毛細力により封止されたチャンバと、
前記変換器により生成された前記電気的信号を検出することが可能な検出器とを備え、
前記装置は、固定リーダー内の回転カセットを備え、前記カセットは、前記チャンバと前記変換器とを含む、装置。 - 前記変換器は、焦電又は圧電素子及び複数の電極を有する焦電又は圧電変換器である、請求項10に記載の装置。
- 前記少なくとも1つの連結試薬は、前記変換器上に吸着されている、請求項10又は11に記載の装置。
- 前記検体用又は前記連結試薬用の結合部位を有する標識化試薬と、エネルギーを生成するよう、放射源により生成された電磁放射を吸収することが可能な標識は、前記チャンバの複数の表面のうちの1つに解放可能に付着している、請求項10から12のいずれか1項に記載の装置。
- 前記少なくとも1つの連結試薬は、抗体であり、前記検体は、抗原であり、前記標識化試薬は、前記少なくとも1つの連結試薬と結合することも可能な標識化抗原、又は前記検体と結合することも可能な標識化抗体である、請求項13に記載の装置。
- 前記標識は、1.5から23g/mLの密度を有する粒子である、請求項13又は14に記載の装置。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96930907P | 2007-08-31 | 2007-08-31 | |
| GB0716968.3 | 2007-08-31 | ||
| US60/969,309 | 2007-08-31 | ||
| GBGB0716968.3A GB0716968D0 (en) | 2007-08-31 | 2007-08-31 | Sensor |
| PCT/GB2008/050699 WO2009027726A1 (en) | 2007-08-31 | 2008-08-13 | Sensor |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010538253A JP2010538253A (ja) | 2010-12-09 |
| JP2010538253A5 JP2010538253A5 (ja) | 2011-08-25 |
| JP5749010B2 true JP5749010B2 (ja) | 2015-07-15 |
Family
ID=38617072
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010522454A Expired - Fee Related JP5749010B2 (ja) | 2007-08-31 | 2008-08-13 | センサ |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8524504B2 (ja) |
| EP (1) | EP2185932B1 (ja) |
| JP (1) | JP5749010B2 (ja) |
| CN (1) | CN101815942B (ja) |
| CA (1) | CA2695213C (ja) |
| ES (1) | ES2530673T3 (ja) |
| GB (1) | GB0716968D0 (ja) |
| WO (1) | WO2009027726A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2473220A (en) * | 2009-09-03 | 2011-03-09 | Vivacta Ltd | Analysis device comprising a transducer with stiffening elements |
| GB201000643D0 (en) * | 2010-01-15 | 2010-03-03 | Vivacta Ltd | A method for sensing a chemical |
| WO2012073182A1 (en) | 2010-11-30 | 2012-06-07 | Koninklijke Philips Electronics N.V. | A sensor device for magnetically actuated particles |
| GB201105828D0 (en) * | 2011-04-06 | 2011-05-18 | Vivacta Ltd | A device for detecting an analyte |
| CN102928606B (zh) * | 2012-11-16 | 2015-10-07 | 武汉明德生物科技股份有限公司 | 多抗体标记的降钙素原快速检测试剂盒 |
| JP6566704B2 (ja) * | 2015-04-27 | 2019-08-28 | デンカ生研株式会社 | バックグラウンドノイズを低減したイムノクロマトグラフィー装置およびその低減方法 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8909701D0 (en) * | 1989-04-27 | 1989-06-14 | Health Lab Service Board | Analytical apparatus |
| CA2118522A1 (en) * | 1992-05-26 | 1993-12-09 | Robert M. Ippolito | Time dependent administration of oligosaccharides glycosides related to blood group determinants having a type i or type ii core structure in reducing inflammation in a sensitized mammal arising from exposure to an antigen |
| US5858666A (en) * | 1996-08-29 | 1999-01-12 | Biotechnology Research And Development Corporation | Apparatus and method of detection employing an AC frequency sensor array |
| US6346376B1 (en) * | 1998-06-03 | 2002-02-12 | Centre Suisse D'electronique Et De Mictotechnique Sa | Optical sensor unit and procedure for the ultrasensitive detection of chemical or biochemical analytes |
| EP1151139A2 (en) * | 1999-01-25 | 2001-11-07 | UT-Battelle, LLC | Multifunctional and multispectral biosensor devices and methods of use |
| JP2002122597A (ja) * | 2000-08-09 | 2002-04-26 | Mitsubishi Chemicals Corp | 測定対象物の測定用チップ,測定対象物の測定装置及び測定対象物の測定方法 |
| US20030170148A1 (en) * | 2001-01-31 | 2003-09-11 | Mcentee John F. | Reaction chamber roll pump |
| US6899714B2 (en) | 2001-10-03 | 2005-05-31 | Vaughan Medical Technologies, Inc. | Vertebral stabilization assembly and method |
| EP1528912A2 (en) | 2002-07-18 | 2005-05-11 | Quest International Services B.V. | Perfume compositions |
| GB0308324D0 (en) * | 2003-04-10 | 2003-05-14 | Piezoptic Ltd | A chemical sensing device |
| EP1628754A2 (en) * | 2003-06-05 | 2006-03-01 | Bioprocessors Corporation | Apparatus and method for manipulating substrates |
| JP3816502B2 (ja) | 2003-08-04 | 2006-08-30 | 博 冨安 | 超臨界水又は亜臨界水を使用した有機物の酸化方法 |
| JP2005319407A (ja) * | 2004-05-10 | 2005-11-17 | Hitachi Ltd | 圧電デバイスを用いた機器 |
| KR20070035005A (ko) | 2004-07-20 | 2007-03-29 | 슈비하크 아게 | 전철기용 조정 장치를 구비한 가로 침목 |
| US7169617B2 (en) * | 2004-08-19 | 2007-01-30 | Fujitsu Limited | Device and method for quantitatively determining an analyte, a method for determining an effective size of a molecule, a method for attaching molecules to a substrate, and a device for detecting molecules |
| WO2006134546A2 (en) * | 2005-06-17 | 2006-12-21 | Koninklijke Philips Electronics N.V. | Accurate magnetic biosensor |
| EP1906705B1 (en) | 2005-07-15 | 2013-04-03 | Panasonic Corporation | Signal processing device |
| HUP0500730A2 (en) | 2005-07-29 | 2007-02-28 | Richter Gedeon Vegyuszeti Gyar | 1,2-diaryl-heterocyclic compounds, their preparation, pharmaceutical compositions comprising thereof and their use |
| WO2007106868A2 (en) * | 2006-03-14 | 2007-09-20 | University Of Rochester | Cell culture devices having ultrathin porous membrane and uses thereof |
| CA2643169A1 (en) * | 2006-03-17 | 2007-09-27 | Vivacta Ltd | A chemical sensing device |
| JP2010533281A (ja) * | 2006-06-06 | 2010-10-21 | ビバクタ、リミテッド | 化学物質の検知方法 |
| US20080026451A1 (en) * | 2006-06-15 | 2008-01-31 | Braman Jeffrey C | System for isolating biomolecules from a sample |
-
2007
- 2007-08-31 GB GBGB0716968.3A patent/GB0716968D0/en not_active Ceased
-
2008
- 2008-08-13 WO PCT/GB2008/050699 patent/WO2009027726A1/en active Application Filing
- 2008-08-13 US US12/675,684 patent/US8524504B2/en not_active Expired - Fee Related
- 2008-08-13 JP JP2010522454A patent/JP5749010B2/ja not_active Expired - Fee Related
- 2008-08-13 CN CN2008801046876A patent/CN101815942B/zh not_active Expired - Fee Related
- 2008-08-13 EP EP08788670.1A patent/EP2185932B1/en not_active Not-in-force
- 2008-08-13 CA CA2695213A patent/CA2695213C/en not_active Expired - Fee Related
- 2008-08-13 ES ES08788670T patent/ES2530673T3/es active Active
-
2013
- 2013-07-30 US US13/954,582 patent/US9638691B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| CN101815942A (zh) | 2010-08-25 |
| GB0716968D0 (en) | 2007-10-10 |
| EP2185932A1 (en) | 2010-05-19 |
| ES2530673T3 (es) | 2015-03-04 |
| JP2010538253A (ja) | 2010-12-09 |
| WO2009027726A1 (en) | 2009-03-05 |
| EP2185932B1 (en) | 2015-01-28 |
| US20130315783A1 (en) | 2013-11-28 |
| US20100285609A1 (en) | 2010-11-11 |
| CA2695213A1 (en) | 2009-03-05 |
| US9638691B2 (en) | 2017-05-02 |
| CN101815942B (zh) | 2013-09-11 |
| US8524504B2 (en) | 2013-09-03 |
| CA2695213C (en) | 2017-01-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20090087862A1 (en) | Chemical Sensing Device | |
| JP4511522B2 (ja) | 焦電または圧電変換器を備えた光化学感知装置 | |
| US9638691B2 (en) | Sensor | |
| US20090203154A1 (en) | Method for Sensing a Chemical | |
| CA2719010C (en) | A method for sensing a chemical | |
| US8084002B2 (en) | Chemical sensing device | |
| US20110111428A1 (en) | Method for Sensing a Chemical | |
| EP2265951B1 (en) | A method for sensing a chemical |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110705 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110705 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20121121 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130614 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130913 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130924 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131015 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131022 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140328 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140526 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141003 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141112 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150417 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150513 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5749010 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |