JP5713686B2 - 有機化合物、有機発光素子及び画像表示装置 - Google Patents
有機化合物、有機発光素子及び画像表示装置 Download PDFInfo
- Publication number
- JP5713686B2 JP5713686B2 JP2011002263A JP2011002263A JP5713686B2 JP 5713686 B2 JP5713686 B2 JP 5713686B2 JP 2011002263 A JP2011002263 A JP 2011002263A JP 2011002263 A JP2011002263 A JP 2011002263A JP 5713686 B2 JP5713686 B2 JP 5713686B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- light emitting
- organic compound
- organic
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000002894 organic compounds Chemical class 0.000 title claims description 97
- 125000003118 aryl group Chemical group 0.000 claims description 34
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 28
- 125000001424 substituent group Chemical group 0.000 claims description 26
- 125000000217 alkyl group Chemical group 0.000 claims description 18
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 13
- 125000003545 alkoxy group Chemical group 0.000 claims description 11
- 125000003277 amino group Chemical group 0.000 claims description 11
- 125000005843 halogen group Chemical group 0.000 claims description 11
- 125000000623 heterocyclic group Chemical group 0.000 claims description 11
- 125000004104 aryloxy group Chemical group 0.000 claims description 9
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 9
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 8
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 8
- 125000005412 pyrazyl group Chemical group 0.000 claims description 6
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 6
- 229910052731 fluorine Inorganic materials 0.000 claims description 4
- 125000002102 aryl alkyloxo group Chemical group 0.000 claims description 2
- 125000001153 fluoro group Chemical group F* 0.000 claims description 2
- 125000004432 carbon atom Chemical group C* 0.000 claims 2
- 150000001875 compounds Chemical class 0.000 description 130
- 239000010410 layer Substances 0.000 description 92
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 30
- 239000000243 solution Substances 0.000 description 29
- -1 1-adamantyl group Chemical group 0.000 description 27
- 239000000463 material Substances 0.000 description 27
- 238000006243 chemical reaction Methods 0.000 description 26
- 230000015572 biosynthetic process Effects 0.000 description 17
- 239000000758 substrate Substances 0.000 description 17
- 238000003786 synthesis reaction Methods 0.000 description 17
- 238000000034 method Methods 0.000 description 16
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 238000000295 emission spectrum Methods 0.000 description 12
- 239000010408 film Substances 0.000 description 12
- 238000002347 injection Methods 0.000 description 12
- 239000007924 injection Substances 0.000 description 12
- 238000000859 sublimation Methods 0.000 description 12
- 230000008022 sublimation Effects 0.000 description 12
- 239000002904 solvent Substances 0.000 description 11
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 8
- 230000005525 hole transport Effects 0.000 description 8
- 230000003647 oxidation Effects 0.000 description 8
- 238000007254 oxidation reaction Methods 0.000 description 8
- 230000000903 blocking effect Effects 0.000 description 7
- 238000010438 heat treatment Methods 0.000 description 7
- 229910052751 metal Inorganic materials 0.000 description 7
- 239000002184 metal Substances 0.000 description 7
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 238000004128 high performance liquid chromatography Methods 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 238000006862 quantum yield reaction Methods 0.000 description 6
- 239000002356 single layer Substances 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 239000000470 constituent Substances 0.000 description 5
- 230000005284 excitation Effects 0.000 description 5
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 5
- 125000001624 naphthyl group Chemical group 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 238000001771 vacuum deposition Methods 0.000 description 5
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 150000002739 metals Chemical class 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 238000004544 sputter deposition Methods 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 239000007772 electrode material Substances 0.000 description 3
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 3
- 238000004770 highest occupied molecular orbital Methods 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 230000009878 intermolecular interaction Effects 0.000 description 3
- 238000000059 patterning Methods 0.000 description 3
- 238000009751 slip forming Methods 0.000 description 3
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 229940027991 antiseptic and disinfectant quinoline derivative Drugs 0.000 description 2
- 125000006267 biphenyl group Chemical group 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 229920001940 conductive polymer Polymers 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- OWFXIOWLTKNBAP-UHFFFAOYSA-N isoamyl nitrite Chemical compound CC(C)CCON=O OWFXIOWLTKNBAP-UHFFFAOYSA-N 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 2
- 229920000123 polythiophene Polymers 0.000 description 2
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 2
- 239000011241 protective layer Substances 0.000 description 2
- 125000005581 pyrene group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 150000003248 quinolines Chemical class 0.000 description 2
- 150000003252 quinoxalines Chemical class 0.000 description 2
- 239000004065 semiconductor Substances 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 239000010409 thin film Substances 0.000 description 2
- 125000005259 triarylamine group Chemical group 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 229920000178 Acrylic resin Polymers 0.000 description 1
- 239000004925 Acrylic resin Substances 0.000 description 1
- 229910000838 Al alloy Inorganic materials 0.000 description 1
- 229910001148 Al-Li alloy Inorganic materials 0.000 description 1
- YERIUYIANLAXEL-UHFFFAOYSA-N BrC(C1)C(Br)=Cc2c1c(-c1ccccc1)c(-c1ccc-3c4c1c-1ccc4-c4c5c-3cccc5ccc4)c-1c2-c1ccccc1 Chemical compound BrC(C1)C(Br)=Cc2c1c(-c1ccccc1)c(-c1ccc-3c4c1c-1ccc4-c4c5c-3cccc5ccc4)c-1c2-c1ccccc1 YERIUYIANLAXEL-UHFFFAOYSA-N 0.000 description 1
- NWPSDRPTCVEYTD-UHFFFAOYSA-N Brc(c(Br)c1)cc2c1c(-c1ccccc1)c(-c1ccc-3c4c1c-1ccc4-c4c5c-3cccc5ccc4)c-1c2-c1ccccc1 Chemical compound Brc(c(Br)c1)cc2c1c(-c1ccccc1)c(-c1ccc-3c4c1c-1ccc4-c4c5c-3cccc5ccc4)c-1c2-c1ccccc1 NWPSDRPTCVEYTD-UHFFFAOYSA-N 0.000 description 1
- FPLWLPDDQWOVNN-UHFFFAOYSA-N C(C(c1cccc2c1c1ccc2)C1=Cc1c(c(-c(cc2)c34)c5-c3ccc-3c4c2-c2c4c-3cccc4ccc2)-c2ccccc2)c1c5-c1ccccc1 Chemical compound C(C(c1cccc2c1c1ccc2)C1=Cc1c(c(-c(cc2)c34)c5-c3ccc-3c4c2-c2c4c-3cccc4ccc2)-c2ccccc2)c1c5-c1ccccc1 FPLWLPDDQWOVNN-UHFFFAOYSA-N 0.000 description 1
- WQGRAXGAXSNSDL-UHFFFAOYSA-N CC1(C)OB(c2c(cccc3)c3ccc2)OC1(C)C Chemical compound CC1(C)OB(c2c(cccc3)c3ccc2)OC1(C)C WQGRAXGAXSNSDL-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- RJQGTUPMSDNELX-UHFFFAOYSA-N Nc(c(C(O)=O)c1)cc(Br)c1Br Chemical compound Nc(c(C(O)=O)c1)cc(Br)c1Br RJQGTUPMSDNELX-UHFFFAOYSA-N 0.000 description 1
- YSOXRDQQWQNZOG-UHFFFAOYSA-N O=C(c1ccc-2c3c1c1ccc3-c3cccc4c3c-2ccc4)C1=O Chemical compound O=C(c1ccc-2c3c1c1ccc3-c3cccc4c3c-2ccc4)C1=O YSOXRDQQWQNZOG-UHFFFAOYSA-N 0.000 description 1
- JUKAACHMDKWINV-UHFFFAOYSA-N O=C1C(c2ccccc2)=C(c2ccc-3c4c2c2ccc4-c4cccc5cccc-3c45)C2=C1c1ccccc1 Chemical compound O=C1C(c2ccccc2)=C(c2ccc-3c4c2c2ccc4-c4cccc5cccc-3c45)C2=C1c1ccccc1 JUKAACHMDKWINV-UHFFFAOYSA-N 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 229920000265 Polyparaphenylene Chemical class 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 229920001807 Urea-formaldehyde Polymers 0.000 description 1
- JFBZPFYRPYOZCQ-UHFFFAOYSA-N [Li].[Al] Chemical compound [Li].[Al] JFBZPFYRPYOZCQ-UHFFFAOYSA-N 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 229920000122 acrylonitrile butadiene styrene Polymers 0.000 description 1
- 125000003670 adamantan-2-yl group Chemical group [H]C1([H])C(C2([H])[H])([H])C([H])([H])C3([H])C([*])([H])C1([H])C([H])([H])C2([H])C3([H])[H] 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 1
- 229910021417 amorphous silicon Inorganic materials 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 150000001454 anthracenes Chemical class 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- SWXVUIWOUIDPGS-UHFFFAOYSA-N diacetone alcohol Natural products CC(=O)CC(C)(C)O SWXVUIWOUIDPGS-UHFFFAOYSA-N 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 230000005283 ground state Effects 0.000 description 1
- 230000005524 hole trap Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 229910003437 indium oxide Inorganic materials 0.000 description 1
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 1
- 238000012905 input function Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000011133 lead Substances 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- SJCKRGFTWFGHGZ-UHFFFAOYSA-N magnesium silver Chemical compound [Mg].[Ag] SJCKRGFTWFGHGZ-UHFFFAOYSA-N 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 229910021421 monocrystalline silicon Inorganic materials 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- GRUMNHSVBLCRJI-UHFFFAOYSA-N octacyclo[19.7.1.17,11.02,20.04,18.06,16.025,29.015,30]triaconta-1(28),2(20),3,5,7,9,11(30),12,14,16,18,21,23,25(29),26-pentadecaene Chemical compound C1=CC2=CC=CC(C=3C4=CC5=C[C]6C7=CC=CC8=CC=CC([C]78)=C6C=C5C=3)=C2C4=C1 GRUMNHSVBLCRJI-UHFFFAOYSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 150000007978 oxazole derivatives Chemical class 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 150000005041 phenanthrolines Chemical class 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 150000004986 phenylenediamines Chemical class 0.000 description 1
- 238000005424 photoluminescence Methods 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical class N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000767 polyaniline Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920005668 polycarbonate resin Polymers 0.000 description 1
- 239000004431 polycarbonate resin Substances 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920001225 polyester resin Polymers 0.000 description 1
- 239000004645 polyester resin Substances 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 239000009719 polyimide resin Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920000128 polypyrrole Polymers 0.000 description 1
- 150000004033 porphyrin derivatives Chemical class 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000003216 pyrazines Chemical class 0.000 description 1
- 150000003220 pyrenes Chemical class 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 229920002050 silicone resin Polymers 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical class C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000005297 thienyloxy group Chemical group S1C(=CC=C1)O* 0.000 description 1
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 1
- 229910001887 tin oxide Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- 125000006617 triphenylamine group Chemical group 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 239000006097 ultraviolet radiation absorber Substances 0.000 description 1
- 229910052720 vanadium Inorganic materials 0.000 description 1
- GPPXJZIENCGNKB-UHFFFAOYSA-N vanadium Chemical compound [V]#[V] GPPXJZIENCGNKB-UHFFFAOYSA-N 0.000 description 1
- YVTHLONGBIQYBO-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O--].[Zn++].[In+3] YVTHLONGBIQYBO-UHFFFAOYSA-N 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C13/00—Cyclic hydrocarbons containing rings other than, or in addition to, six-membered aromatic rings
- C07C13/28—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof
- C07C13/32—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof with condensed rings
- C07C13/62—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof with condensed rings with more than three condensed rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/57—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton
- C07C211/61—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton with at least one of the condensed ring systems formed by three or more rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K59/00—Integrated devices, or assemblies of multiple devices, comprising at least one organic light-emitting element covered by group H10K50/00
- H10K59/10—OLED displays
- H10K59/12—Active-matrix OLED [AMOLED] displays
- H10K59/121—Active-matrix OLED [AMOLED] displays characterised by the geometry or disposition of pixel elements
- H10K59/1213—Active-matrix OLED [AMOLED] displays characterised by the geometry or disposition of pixel elements the pixel elements being TFTs
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/624—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing six or more rings
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/02—Ortho- or ortho- and peri-condensed systems
- C07C2603/54—Ortho- or ortho- and peri-condensed systems containing more than five condensed rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/90—Multiple hosts in the emissive layer
Description
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X1:4.0g(13mmol)
化合物X2:2.8g(13mmol)
エタノール:65ml
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X3:5.0g(10mmol)
化合物X4:6.1g(21mmol)
キシレン:100ml
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X5:1.0g(1.5mmol)
化合物X6:0.55g(2.2mmol)
DMF:20ml
ビス(ジベンジリデンアセトン)パラジウム(0):0.84g(1.5mmol)
1,8―ジアザビシクロ[5.4.0]ウンデセ−7−エン:0.44g(2.9mmol)
トリシクロヘキシルフォスフィン:0.81g(2.9mmol)
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X7:10g(55mmol)
化合物X2:12g(55mmol)
エタノール:200ml
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X8:10g(28mmol)
化合物X4:17g(56mmol)
キシレン:100ml
以下に示す試薬、溶媒を反応容器内に投入した。
化合物X9:2.0g(3.6mmol)
化合物X10:2.0g(5.3mmol)
DMF:40ml
ビス(ジベンジリデンアセトン)パラジウム(0):2.0g(3.6mmol)
1,8―ジアザビシクロ[5.4.0]ウンデセ−7−エン:1.1g(7.1mmol)
トリシクロヘキシルフォスフィン:2.0g(7.1mmol)
DART−TOF−MASS:M+H=563.2
実施例2(1)において、化合物X2に代えて下記に示される化合物X11を使用する以外は、実施例2と同様の方法で合成を行うことにより、例示化合物XX−5を得た。
DART−TOF−MASS:M+H=805.3
実施例2(1)において、化合物X7に代えて下記に示される化合物X12を使用する以外は、実施例2と同様の方法で合成を行うことにより、例示化合物XX−10を得た。
DART−TOF−MASS:M+H=805.3
実施例1(3)において、化合物X6の代わりに下記に示されるX13を使用する以外は、実施例1と同様の方法で合成を行うことにより、例示化合物XY−1を得た。
DART−TOF−MASS:M+H=765.3
実施例2(1)において、化合物X2の代わりに下記に示されるX14を使用する以外は、実施例2と同様の方法で合成を行うことにより、例示化合物XY−3を得た。
DART−TOF−MASS:M+H=877.5
本実施例では、基板上に、陽極、ホール注入層、ホール輸送層、発光層、ホール・エキシトンブロッキング層、電子輸送層、陰極が順次形成された有機発光素子を作製した。以下に、本実施例で使用した材料の一部を示す。
実施例7において、G−2、G−3及びゲストを、表5に示される化合物に適宜変更する以外は、実施例7と同様の方法により有機発光素子を作製した。得られた素子について実施例7と同様に素子の特性を測定・評価した。測定の結果を表5に示す。尚、表5において、G−2として使用したH2、H7、H10、H15、H17、H19、H21及びH23、並びにG−3として使用したH2、H7、H10、H17、H19、H21、H23及びH24は、それぞれ表3に示されるホストである。
本実施例では、基板上に、陽極、ホール注入層、ホール輸送層、発光層、電子輸送層、電子注入層、陰極が順次形成された有機発光素子を作製した。尚、本実施例で作製される有機発光素子は共振構造を有している。以下に、本実施例で使用した材料の一部を示す。
以上により、有機発光素子を作製した。
実施例18において、G−13、G−14及びゲストを、表7に示される化合物に適宜変更する以外は、実施例18と同様の方法により有機発光素子を作製した。得られた素子について実施例18と同様に素子の特性を測定・評価した。測定の結果を表7に示す。尚、表7において、G−13として使用したH6及びH16、並びにG−14として使用したH21及びH24は、それぞれ表3に示されるホストである。
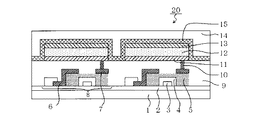
本実施例では、基板上に、陽極、ホール輸送層、第1発光層、第2発光層、ホール・エキシトンブロッキング層、電子輸送層、陰極が順次形成された有機発光素子を作製した。尚、本実施例の有機発光素子は発光層が複数あるので、各発光層に含まれるゲストが個別あるいは同時に発光する態様である。以下に、本実施例で使用した材料の一部を示す。
実施例21において、G−22、G−23、G−24及びゲストを、表9に示される化合物に適宜変更する以外は、実施例22と同様の方法により有機発光素子を作製した。得られた素子について実施例22と同様に素子の特性を測定・評価した。測定の結果を表9に示す。尚、表9において、G−22として使用したH18及びH23、G−23として使用したH18及びH23、並びにG−24として使用したH4及びH10は、それぞれ表3に示されるホストである。
Claims (12)
- 下記一般式(1)に示される構造であることを特徴とする、有機化合物。
- 前記R 1 及び前記R 10 又は前記R 2 及び前記R 9 のいずれか一方が、炭素数1乃至4のアルキル基を有してもよいアリール基、ピリミジル基及びピラジル基であって他方はいずれも水素原子であり、
前記R 3 乃至R 8 及び前記R 11 乃至R 20 のいずれかが、炭素数1乃至4のアルキル基を有してもよいアリール基であることを特徴とする、請求項1に記載の有機化合物。 - R2及びR9が、アルキル基、アラルキル基、アリール基、複素環基、アミノ基、アルコキシ基、アリールオキシ基、シアノ基又はハロゲン原子を有してもよいアリール基であり、R1、R3乃至R8及びR10乃至R20が水素原子であることを特徴とする、請求項1に記載の有機化合物。
- 分子構造中にターシャリーブチル基を2つ以上有することを特徴とする、請求項1乃至
3のいずれか一項に記載の有機化合物。 - 陽極と陰極と、
前記陽極と前記陰極との間に配置される有機化合物層と、を有する有機発光素子であって、
前記有機化合物層の少なくとも一層に、請求項1乃至4のいずれか一項に記載の有機化合物が含まれることを特徴とする、有機発光素子。 - 前記有機化合物が、発光層に含まれることを特徴とする、請求項5に記載の有機発光素
子。 - 黄色発光することを特徴とする、請求項6に記載の有機発光素子。
- 複数の画素を有する表示装置であって、
前記複数の画素が、請求項5乃至7のいずれか一項に記載の有機発光素子と、前記有機発光素子に電気接続されるTFT素子と、をそれぞれ有することを特徴とする、表示装置。 - 画像情報を入力するための入力部と、画像を出力するための表示部と、を有する画像入力装置であって、
前記表示部が複数の画素を有し、
前記複数の画素が、請求項5乃至7のいずれか一項に記載の有機発光素子と、前記有機発光素子に電気接続されるTFT素子と、をそれぞれ有することを特徴とする、画像入力装置。 - 請求項5乃至7のいずれか一項に記載の有機発光素子を有することを特徴とする、照明
装置。 - 露光光源を有する電子写真方式の画像形成装置であって、
前記露光光源が、請求項5乃至7のいずれか一項に記載の有機発光素子を有することを特徴とする、画像形成装置。 - 電子写真方式の画像形成装置に設けられる露光光源であって、
前記露光光源は、請求項5乃至7のいずれか一項に記載の有機発光素子を有することを特徴とする、露光光源。
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011002263A JP5713686B2 (ja) | 2011-01-07 | 2011-01-07 | 有機化合物、有機発光素子及び画像表示装置 |
| PCT/JP2011/079261 WO2012093578A1 (en) | 2011-01-07 | 2011-12-09 | Organic compound, organic light-emitting device, and image display device |
| KR1020137020177A KR101555110B1 (ko) | 2011-01-07 | 2011-12-09 | 유기 화합물, 유기 발광 디바이스, 및 화상 표시 디바이스 |
| EP11855218.1A EP2661418A4 (en) | 2011-01-07 | 2011-12-09 | ORGANIC CONNECTION, ORGANIC LIGHT-EMITTING DEVICE AND IMAGE DISPLAY DEVICE |
| CN201180063852XA CN103313957A (zh) | 2011-01-07 | 2011-12-09 | 有机化合物、有机发光器件和图像显示装置 |
| US13/978,058 US9397298B2 (en) | 2011-01-07 | 2011-12-09 | Organic compound, organic light-emitting device, and image display device |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011002263A JP5713686B2 (ja) | 2011-01-07 | 2011-01-07 | 有機化合物、有機発光素子及び画像表示装置 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2012144459A JP2012144459A (ja) | 2012-08-02 |
| JP2012144459A5 JP2012144459A5 (ja) | 2014-02-20 |
| JP5713686B2 true JP5713686B2 (ja) | 2015-05-07 |
Family
ID=46457438
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011002263A Active JP5713686B2 (ja) | 2011-01-07 | 2011-01-07 | 有機化合物、有機発光素子及び画像表示装置 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9397298B2 (ja) |
| EP (1) | EP2661418A4 (ja) |
| JP (1) | JP5713686B2 (ja) |
| KR (1) | KR101555110B1 (ja) |
| CN (1) | CN103313957A (ja) |
| WO (1) | WO2012093578A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6084001B2 (ja) | 2011-12-06 | 2017-02-22 | キヤノン株式会社 | 新規有機化合物、有機発光素子及び画像表示装置 |
| JP5674707B2 (ja) * | 2012-05-22 | 2015-02-25 | 株式会社東芝 | 表示装置 |
| US9299959B2 (en) | 2012-06-06 | 2016-03-29 | Panasonic Intellectual Property Management Co., Ltd. | Inkjet device and manufacturing method for organic el device |
| US9266324B2 (en) | 2012-07-05 | 2016-02-23 | Panasonic Intellectual Property Management Co., Ltd. | Inkjet apparatus and method for manufacturing organic EL device |
| CN104488359B (zh) * | 2012-07-23 | 2018-01-23 | 默克专利有限公司 | 2‑二芳基氨基芴的衍生物和含有所述2‑二芳基氨基芴衍生物的有机电子复合体 |
| WO2016204150A1 (ja) * | 2015-06-16 | 2016-12-22 | 出光興産株式会社 | 化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3824417B2 (ja) | 1997-04-04 | 2006-09-20 | 三井化学株式会社 | 炭化水素化合物および有機電界発光素子 |
| JP3781517B2 (ja) | 1997-07-22 | 2006-05-31 | 三井化学株式会社 | 有機電界発光素子 |
| US6866947B1 (en) * | 1999-12-28 | 2005-03-15 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device emitting white light |
| JP4255610B2 (ja) * | 1999-12-28 | 2009-04-15 | 出光興産株式会社 | 白色系有機エレクトロルミネッセンス素子 |
| JP4467170B2 (ja) * | 2000-11-22 | 2010-05-26 | 三井化学株式会社 | 炭化水素化合物および有機電界発光素子 |
| US6841267B2 (en) * | 2002-04-24 | 2005-01-11 | Eastman Kodak Company | Efficient electroluminescent device |
| TWI314947B (en) * | 2002-04-24 | 2009-09-21 | Eastman Kodak Compan | Organic light emitting diode devices with improved operational stability |
| US20040126617A1 (en) * | 2002-12-31 | 2004-07-01 | Eastman Kodak Company | Efficient electroluminescent device |
| JP4059822B2 (ja) * | 2003-08-26 | 2008-03-12 | 三井化学株式会社 | ベンゾフルオランテン化合物、および該ベンゾフルオランテン化合物を含有する有機電界発光素子 |
| JP5080143B2 (ja) * | 2007-06-19 | 2012-11-21 | 三井化学株式会社 | 芳香族炭化水素化合物、および該芳香族炭化水素化合物を含有する有機電界発光素子 |
| US8129039B2 (en) * | 2007-10-26 | 2012-03-06 | Global Oled Technology, Llc | Phosphorescent OLED device with certain fluoranthene host |
| JP2009267135A (ja) | 2008-04-25 | 2009-11-12 | Mitsui Chemicals Inc | 有機トランジスタ |
| JP2009302470A (ja) * | 2008-06-17 | 2009-12-24 | Mitsui Chemicals Inc | 有機トランジスタ |
| JP5911377B2 (ja) * | 2011-08-04 | 2016-04-27 | キヤノン株式会社 | 有機化合物およびこれを有する有機発光素子 |
-
2011
- 2011-01-07 JP JP2011002263A patent/JP5713686B2/ja active Active
- 2011-12-09 CN CN201180063852XA patent/CN103313957A/zh active Pending
- 2011-12-09 EP EP11855218.1A patent/EP2661418A4/en not_active Withdrawn
- 2011-12-09 WO PCT/JP2011/079261 patent/WO2012093578A1/en active Application Filing
- 2011-12-09 US US13/978,058 patent/US9397298B2/en active Active
- 2011-12-09 KR KR1020137020177A patent/KR101555110B1/ko not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| JP2012144459A (ja) | 2012-08-02 |
| EP2661418A1 (en) | 2013-11-13 |
| EP2661418A4 (en) | 2016-02-24 |
| CN103313957A (zh) | 2013-09-18 |
| US20130292662A1 (en) | 2013-11-07 |
| KR101555110B1 (ko) | 2015-09-22 |
| US9397298B2 (en) | 2016-07-19 |
| KR20130112933A (ko) | 2013-10-14 |
| WO2012093578A1 (en) | 2012-07-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5791445B2 (ja) | 新規有機化合物、それを有する有機発光素子及び表示装置 | |
| EP2243761B1 (en) | Phenanthrene derivatives, light-emitting device and image display apparatus using the same | |
| KR101555111B1 (ko) | 유기 화합물, 유기 전계발광 소자, 및 화상 표시 디바이스 | |
| JP5618647B2 (ja) | 新規有機化合物およびそれを有する有機発光素子 | |
| JP5713686B2 (ja) | 有機化合物、有機発光素子及び画像表示装置 | |
| KR101490575B1 (ko) | 신규한 유기 화합물 및 이를 포함하는 유기 발광 소자 | |
| WO2010071223A1 (en) | Novel organic compound | |
| JP5627300B2 (ja) | 新規有機化合物およびそれを有する有機発光素子 | |
| JP4750893B1 (ja) | 新規有機化合物および有機発光素子 | |
| JP5578934B2 (ja) | 新規有機化合物 | |
| JP5704940B2 (ja) | 有機化合物、有機発光素子及び表示装置 | |
| JP5586981B2 (ja) | 新規有機化合物および有機発光素子 | |
| JP5495665B2 (ja) | 有機化合物及びこれを用いた有機発光素子 | |
| JP2012188355A (ja) | 新規有機化合物およびそれを有する有機発光素子 | |
| JP2012148987A (ja) | 有機化合物、有機発光素子及び表示装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131226 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20131226 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141111 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150109 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150210 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150310 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 5713686 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |