JP5020249B2 - 血液等の生体液を分析するモジュラー装置 - Google Patents
血液等の生体液を分析するモジュラー装置 Download PDFInfo
- Publication number
- JP5020249B2 JP5020249B2 JP2008534050A JP2008534050A JP5020249B2 JP 5020249 B2 JP5020249 B2 JP 5020249B2 JP 2008534050 A JP2008534050 A JP 2008534050A JP 2008534050 A JP2008534050 A JP 2008534050A JP 5020249 B2 JP5020249 B2 JP 5020249B2
- Authority
- JP
- Japan
- Prior art keywords
- function module
- fluid
- preparation
- module
- modular device
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
- G01N15/1404—Handling flow, e.g. hydrodynamic focusing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/38—Diluting, dispersing or mixing samples
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N2035/00178—Special arrangements of analysers
- G01N2035/00326—Analysers with modular structure
Landscapes
- Chemical & Material Sciences (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Analytical Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Dispersion Chemistry (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measurement Of The Respiration, Hearing Ability, Form, And Blood Characteristics Of Living Organisms (AREA)
Description
細胞計数として知られている主な血液検査は、血液中の細胞成分を計数することを含む。主な成分は、赤血球、白血球、および、血小板である。これは、医師や獣医にとって重要な診断ツールである。
有利な実施形態では、注入機能モジュールの支持部は、注入機能モジュールの並んで組み立てられた二枚の板の外面における端面の一つを介して調製機能モジュールの支持部に対して略垂直に取り付けられる。
本願で使用される「配管」といった用語は、通常プラスチック材料よりなり、機能モジュールの外側に延在し、上記機能モジュールの支持部に存在するチャネルとは異なる管状の要素を意味する。
有利には、調製機能モジュールの一方の支持板を貫通する少なくとも一つのオリフィスは、注入機能モジュールを上記板に略垂直に接続するために設けられる。
有利には、少なくとも一つのオリフィスは、調製機能モジュールのスルーオリフィスへの接続のために注入機能モジュールの外面における端面に設けられる。
有利な実施形態では、少なくとも一つの機能モジュールは、上記支持部の外側に流体部品が取り付けられるようになっている。
本願で使用される「取り付ける」といった用語は、二つの機能モジュールの支持部間、または、流体部品と機能モジュールの支持部との間の直接的且つ着脱可能な機械的接続を示す。流体部品を支持部の外側に取り付けることで、その個数および特性を引き続き変えることができ、追加的な配管の使用が回避される。
更に、取り替え可能なファスナや接続インタフェースを有するように流体部品が構成されていると有利である。
一実施形態では、本発明のモジュラー装置は、複数の機能モジュールを並列接続するための複数の接続インタフェースを有する少なくとも一つの調製機能モジュールであって、上記機能モジュールそれぞれが調製機能モジュールの上記接続インタフェースと補完的な接続インタフェースを有し、上記各接続インタフェースが調製機能モジュール内の少なくとも一つのチャネルの配列に接続されている、調製機能モジュールを更に備える。
本発明の他の特徴および利点は、限定的な参照符号を含まない実施形態を示す添付の図面を参照して、以下の説明から明らかとなるであろう。
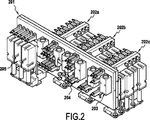
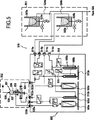
図1は、本発明のモジュラー装置100の斜視図である。
このために、調製機能モジュール101は希釈を実施するに必要な手段を備え、該手段はモジュラー装置が動作すべき範囲内のレベルに応じて提供される。
機能モジュールの外側に流体部品を取り付けることで、それぞれの機能的能力を調節することが簡単になる。特に、特定の調製モジュール101で実施され得る希釈回数を増減するために、調製機能モジュール上で希釈容器103を追加または除去することができる。
本発明の簡単な実施形態では、配管およびコネクタ108を用いて調製機能モジュール101と注入機能モジュール102とを接続することが想定される。
例として、分析されるパラメータは、計数した赤血球のみでなく、計数した単球、リンパ球、および、顆粒球も含む。このような状況下では、一つの容器で十分足りる。好中球、好塩基球、および、好酸球の量に関連する余分な分析が顆粒球に含まれる場合、少なくとも二つの容器が必要となる。
これら二つの方法では、希釈容器で行われる混合が非常に正確でなくてはならない。試薬に対して最も幅広く使用される測定要素はシリンジであり、その容積は測定されるべき量に適合される。
血液と試薬との反応が完全に行われることを確実にすると共に、正確な反応温度を確実にするためにいわゆる培養時間に準じることがしばしば必要である。本発明によると、当該段階は、他の段階とは独立して調製機能モジュールで実施される。
注入を可能にするためには、希釈容器303は、調製機能モジュール301に接続される注入機能モジュール302につながるチャネル324に接続される。混合物323は、以下に説明する方法により注入機能モジュール302によって上記チャネル324を介して取り込まれる。
分析ユニットは、本発明の原理が適用される測定機能モジュールであることが好ましいが、配管を用いて本発明のモジュラー装置に接続される測定装置でもよい。
発明者の名前にちなんでコールター(Coulter)方法として知られている、1966年7月5日に特許を受けた米国特許第3259842号明細書に記載されるインピーダンス変化によって測定する方法は、細胞を食塩水に混ぜ、一般的には50マイクロメートル(μm)乃至100μmの範囲の直径を有し、かつ電流が中を流れる小サイズの目盛り付きオリフィスを通じて吸引することを含む。オリフィスを通過する各細胞は、絶縁体のように作用して電流を変更し、それにより、細胞の体積に比例し、且つ、計数、測定することができる一連のパルスが生成される。該方法は、本発明の調製機能モジュールに取り付けられる希釈容器に対して直接的に実行されるか、希釈液が注入される測定ユニットで実行される。
当業者には公知のシージング方法は、測定オリフィスを通過する際に細胞の経路を集中させる。この改善の効果は、混合物の濃度および測定オリフィスの直径に対する細胞の小サイズにより対になって通過する細胞の影響を制限することである。電気信号の質は改善され、電子機器により後に実施される処理が良好になる。
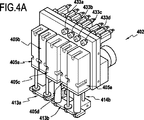
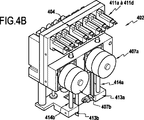
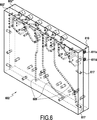
図4A及び4Bに示すように、注入機能モジュール402は、注入機能モジュール402を形成する板の外側に取り付けられる各種流体部品を組み合わせて、接続インタフェース410を介して接続される調製機能モジュールの希釈容器からの分析用の流体を、コネクタ433a、433b、433c、433dに接続され、かつ細胞を計数することで分析を実施するユニットに注入する。接続インタフェース410は、注入機能モジュール402の端面(図示せず)に設けられるオリフィス411a、411b、411c、411dを有する。有利には、コネクタは、本発明の定義では接続インタフェースのオリフィスである。五本のシリンジ405a、405b、405c、405d、および、405eと、複数の弁404と、二つのモータ407が注入機能モジュール402に取り付けられる。流体手段の中でもこれら流体部品は、流体集束された細胞を細胞計数ユニットに注入するために必要である。
本発明の原理によると、光学容器は、独立しており、少なくとも上記測定用光学容器と光学ベンチとを支持する光学測定機能モジュールに設置されることが好ましい。
注入機能モジュール502は、コネクタ533a、533b、533c、533dを介して光学測定容器531に接続され、コネクタ533a、533b、533c、533dによって、配管を用いることなく図5に破線で示され、かつ分析ユニットを構成する光学測定機能モジュール532に好ましくは直接的に接続することが可能となる。測定組立体の大きさが小さい場合に本発明のモジュール502に直接的に接続される測定機能モジュールを構成することが可能である。
シリンジ505eは、廃棄物を排出するオリフィス538を通って細胞が排出される前に光学測定手段(図示せず)の前を通過するよう測定チャンバ539に第2のシースを形成する役割を有する。
排出されるべき廃棄物、特に、注入機能モジュールのチャネル中に存在する廃棄物は、調製機能モジュール501の方向にシリンジ505cによって出口511cから押し出される。
注入機能モジュール502は、独立しており、当該目的のために調製される一つ以上の希釈物から様々なファミリーの細胞を計数するに好適な測定状態を作るに必要な全ての流体段階を管理することができる。二つの異なる容器から分析用の細胞を取り込むことができ、一つのシリンジを選択するか二つのシリンジの容積を組み合わすことで分析に容積の範囲を適応することができる。
回路609は、一方のおよび/または他方の板を貫通するオリフィスを通じて開口される。オリフィスは、流体部品を接続するか、または、調製機能モジュール等の機能モジュールを接続するために設けられる。
このため、本発明は、少なくとも一つの注入モジュールを含む機能モジュールが接続される調製機能モジュールの中心的な使用に基づいてモジュラー装置の周りに分析システムを形成することができる。
調製機能モジュールは、電子的構成要素が取り付けられた電子カードと同様の効果を発揮する。ここでは、構成要素は流体部品または機能モジュールである。調製機能モジュールは、分析システム全体の小型支持部として機能し、分析用のサンプルを調製することができる「インテリジェント・ベース」として機能する。可能な限り標準的な流体部品および機能モジュールは、簡単且つ直接的な方法で接続される。本発明の原理によると、非常に少ない数の異なる部品で全種類のシステムを生産するために、調製機能モジュールを少なくとも一つの注入機能モジュールと関連付けることで様々なモジュラー装置を構成することができる。
Claims (13)
- 生体液分析システムに実装されるモジュラー装置(100)であって、流体部品(103、104、105)を支持する支持部をそれぞれ有する複数の機能モジュール(101、102)を備え、前記支持部が少なくとも二枚の板(101’、101”、102’、102”)であって、並んで組み立てられるとチャネルを画成する回路が内部にエッチングされた少なくとも二枚の板を含み、前記複数の機能モジュールは、分析用の流体を調製し、かつ少なくとも一つの希釈容器(103)を支持する調製第1機能モジュール(101)と、前記希釈容器(103)で調製された前記流体を分析ユニットに注入する注入第2機能モジュール(102)とを少なくとも含み、前記第1および第2機能モジュール(101、102)が互いに接続されており、前記注入機能モジュール(102)の支持部は、前記注入機能モジュール(102)の並んで組み立てられた前記二枚の板(102’、102”)の外面における端面の一つを介して前記調製機能モジュール(101)の支持部に対して略垂直に取り付けられている、モジュラー装置(100)。
- 請求項1に記載のモジュラー装置(100)において、前記調製および注入機能モジュール(101、102)は配管を用いることなく互いに接続されている、モジュラー装置。
- 請求項1に記載のモジュラー装置(100)において、前記調製機能モジュールの一方の支持板を貫通する少なくとも一つのオリフィスは、前記注入機能モジュールを前記板に略垂直に接続するために設けられる、モジュラー装置。
- 請求項2または3に記載のモジュラー装置において、少なくとも一つのオリフィス(611a)が、前記調製機能モジュールのスルーオリフィスへの接続のために前記注入機能モジュール(602)の外面における端面に設けられている、モジュラー装置。
- 請求項1乃至4のうちいずれか一項に記載のモジュラー装置において、少なくとも一つの機能モジュールは、前記支持部の外側に前記流体部品(103、104、105)が取り付けられるようになっている、モジュラー装置。
- 請求項5に記載のモジュラー装置において、前記流体部品は、弁(104)、シリンジ(105)、希釈容器(103)、および、サンプル弁の構成要素から選択される、モジュラー装置。
- 請求項1乃至6のうちいずれか一項に記載のモジュラー装置において、複数の機能モジュール(202a、202b、202c)を並列接続するための複数の接続インタフェースを有する少なくとも一つの調製機能モジュール(201)を備え、前記少なくとも一つの調製機能モジュールのそれぞれが前記調製機能モジュール(201)の前記接続インタフェースと補完的な接続インタフェースを有し、前記各接続インタフェースが前記調製機能モジュール(201)内の少なくとも一つのチャネルの配列に接続されている、モジュラー装置(200)。
- 請求項1乃至7のうちいずれか一項に記載のモジュラー装置において、前記調製機能モジュールは、希釈容器に導入される一つの試薬当たりに一つの流体入口オリフィスと、前記モジュラー装置に対して単一のオリフィスである一つの廃棄出口オリフィスとを含む、モジュラー装置。
- 請求項1乃至8のうちいずれか一項に記載のモジュラー装置で使用可能な調製機能モジュール(301)であって、流体部品(303、328、327)を支持する支持部を備え、該支持部は、回路が内部にエッチングされる少なくとも二枚の板を含み、前記二枚の板が並んで組み立てられるとチャネルを画成し、前記調製機能モジュール(301)は、少なくとも一つの希釈容器(303)を支持し、かつ前記希釈容器(303)で調製された流体(323)を分析ユニットに注入する注入第2機能モジュールに接続されるのに好適である、調製機能モジュール(301)。
- 請求項9に記載の調製機能モジュール(201)において、少なくとも一つの調製機能モジュールを含む複数の機能モジュール(202a、202b、202c)を直列または並列接続するための複数の接続インタフェースを含み、前記各機能モジュールは前記調製機能モジュール(201)の前記接続インタフェースと補完的な接続インタフェースを有し、前記各接続インタフェースは前記調製機能モジュール(201)内の少なくとも一つのチャネルの配列に接続されている、調製機能モジュール。
- 請求項9または10に記載の調製機能モジュール(302)において、希釈容器(303)に導入される一つの試薬当たりに一つの流体入口オリフィス(321)と、前記モジュラー装置(301)に対して単一のオリフィスである一つの廃棄出口オリフィス(326)とを含む、調製機能モジュール。
- 生体液分析システムを形成する方法であって、請求項1乃至8のうちいずれか一項に記載のモジュラー装置(100)を構成するステップを備え、該ステップでは、分析されるべき流体を調製する少なくとも一つの第1機能モジュール(101)が、前記調製された流体を分析ユニットに注入する第2機能モジュール(102)に接続され、前記各機能モジュールは流体部品(103、104、105)を支持する支持部を含み、前記支持部は少なくとも二枚の板(101’、101”、102’、102”)であって、並んで組み立てられるとチャネルを画成する回路が内部にエッチングされた少なくとも二枚の板を含み、前記注入機能モジュール(102)の支持部は、前記注入機能モジュール(102)の並んで組み立てられた前記二枚の板(102’、102”)の外面における端面の一つを介して前記調製機能モジュール(101)の支持部に対して略垂直に取り付けられている、方法。
- 生体液分析システムの製造において請求項9乃至11のうちいずれか一項に記載の少なくとも一つの調製機能モジュール(101)を利用する方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0510286A FR2891911B1 (fr) | 2005-10-07 | 2005-10-07 | "dispositif modulaire destine a l'analyse d'un fluide biologique, notamment sanguin" |
| FR0510286 | 2005-10-07 | ||
| PCT/FR2006/050904 WO2007042691A1 (fr) | 2005-10-07 | 2006-09-19 | Dispositif modulaire destine a l'analyse d'un fluide biologique, notamment sanguin |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009511869A JP2009511869A (ja) | 2009-03-19 |
| JP5020249B2 true JP5020249B2 (ja) | 2012-09-05 |
Family
ID=36129827
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008534050A Expired - Fee Related JP5020249B2 (ja) | 2005-10-07 | 2006-09-19 | 血液等の生体液を分析するモジュラー装置 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US7963152B2 (ja) |
| EP (1) | EP1941255B1 (ja) |
| JP (1) | JP5020249B2 (ja) |
| CN (1) | CN101283261B (ja) |
| AT (1) | ATE472723T1 (ja) |
| BR (1) | BRPI0616991A2 (ja) |
| CA (1) | CA2625220A1 (ja) |
| DE (1) | DE602006015214D1 (ja) |
| DK (1) | DK1941255T3 (ja) |
| ES (1) | ES2348178T3 (ja) |
| FR (1) | FR2891911B1 (ja) |
| WO (1) | WO2007042691A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101563614A (zh) * | 2006-10-31 | 2009-10-21 | 波凯特有限及两合公司 | 用于液体分析和合成的实验室模块装置及液体分析和合成方法 |
| JP5888885B2 (ja) * | 2010-06-23 | 2016-03-22 | アークレイ株式会社 | 測定装置、測定方法、測定プログラム、および測定システム |
| JP5559096B2 (ja) * | 2011-05-10 | 2014-07-23 | 株式会社堀場製作所 | 血球計数用試薬、及び血液検査方法 |
| US9067189B2 (en) * | 2012-03-30 | 2015-06-30 | General Electric Company | Microfluidic device and a related method thereof |
| FR2991055B1 (fr) | 2012-05-22 | 2014-06-13 | C2 Diagnostics | Dispositif de connexion fluidique pour appareils d'analyse biologique, composant fluidique adapte et appareil d'analyse biologique ainsi equipe; |
| CN103543192B (zh) * | 2012-12-06 | 2016-03-09 | 理邦(美国)诊断有限公司 | 一种用于诊断装置的试剂包 |
| CN104122404A (zh) * | 2014-08-01 | 2014-10-29 | 江苏英诺华医疗技术有限公司 | 一种新型快速的多参数血小板功能分析仪及检测方法 |
| CN114112806B (zh) * | 2020-09-01 | 2025-09-12 | 深圳迈瑞生物医疗电子股份有限公司 | 细胞分析仪及其检测方法 |
| CN116106525B (zh) * | 2023-04-13 | 2023-09-15 | 深圳市帝迈生物技术有限公司 | 血液分析仪 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05306976A (ja) * | 1992-05-01 | 1993-11-19 | Olympus Optical Co Ltd | 希釈装置 |
| US5580523A (en) * | 1994-04-01 | 1996-12-03 | Bard; Allen J. | Integrated chemical synthesizers |
| US5595712A (en) * | 1994-07-25 | 1997-01-21 | E. I. Du Pont De Nemours And Company | Chemical mixing and reaction apparatus |
| US5788927A (en) | 1996-07-30 | 1998-08-04 | Bayer Corporation | Unified fluid circuit assembly for a clinical hematology instrument |
| US6453257B1 (en) * | 1998-12-18 | 2002-09-17 | Larson Testing Laboratories | Apparatus for testing the ability of a filter to filter contaminants |
| JP2001194373A (ja) * | 2000-01-06 | 2001-07-19 | Olympus Optical Co Ltd | 超小型化学操作装置 |
| US7485454B1 (en) * | 2000-03-10 | 2009-02-03 | Bioprocessors Corp. | Microreactor |
| US6536477B1 (en) * | 2000-10-12 | 2003-03-25 | Nanostream, Inc. | Fluidic couplers and modular microfluidic systems |
| JP2003222633A (ja) * | 2002-01-30 | 2003-08-08 | Nippon Sheet Glass Co Ltd | マイクロチップ |
| FR2841653B1 (fr) * | 2002-06-26 | 2005-05-27 | Abx Sa | Procede et dispositif d'analyse d'un echantillon de sang |
| JP3610349B2 (ja) * | 2002-08-06 | 2005-01-12 | キヤノン株式会社 | 液体搬送装置 |
| AU2003264734A1 (en) * | 2002-09-06 | 2004-03-29 | Epigem Limited | Modular microfluidic system |
| US6994245B2 (en) * | 2003-10-17 | 2006-02-07 | James M. Pinchot | Micro-reactor fabrication |
| FR2862387B1 (fr) | 2003-11-18 | 2006-06-09 | C2 Diagnostics | Bloc seringues pour automate d'analyse de liquides, notamment pour l'analyse sanguine |
| CA2549367A1 (en) * | 2003-12-23 | 2005-07-21 | Fastraq, Inc. | Point of care diagnostic platform |
| JP2005274405A (ja) * | 2004-03-25 | 2005-10-06 | Kawamura Inst Of Chem Res | マイクロ流体デバイス及び微量試料の導入方法 |
| TWI251079B (en) * | 2004-06-15 | 2006-03-11 | Univ Nat Cheng Kung | Inspection chip and the manufacturing method thereof |
| DE102004046685B3 (de) * | 2004-09-24 | 2006-06-29 | Concentris Gmbh | Messzelle und Verfahren für die Flüssigkeitsanalyse |
-
2005
- 2005-10-07 FR FR0510286A patent/FR2891911B1/fr not_active Expired - Fee Related
-
2006
- 2006-09-19 CN CN200680037341XA patent/CN101283261B/zh not_active Expired - Fee Related
- 2006-09-19 US US12/088,904 patent/US7963152B2/en not_active Expired - Fee Related
- 2006-09-19 JP JP2008534050A patent/JP5020249B2/ja not_active Expired - Fee Related
- 2006-09-19 BR BRPI0616991-0A patent/BRPI0616991A2/pt not_active IP Right Cessation
- 2006-09-19 ES ES06831193T patent/ES2348178T3/es active Active
- 2006-09-19 AT AT06831193T patent/ATE472723T1/de not_active IP Right Cessation
- 2006-09-19 DE DE602006015214T patent/DE602006015214D1/de active Active
- 2006-09-19 WO PCT/FR2006/050904 patent/WO2007042691A1/fr not_active Ceased
- 2006-09-19 EP EP06831193A patent/EP1941255B1/fr not_active Not-in-force
- 2006-09-19 DK DK06831193.5T patent/DK1941255T3/da active
- 2006-09-19 CA CA002625220A patent/CA2625220A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007042691A1 (fr) | 2007-04-19 |
| EP1941255B1 (fr) | 2010-06-30 |
| DE602006015214D1 (de) | 2010-08-12 |
| CA2625220A1 (en) | 2007-04-19 |
| ES2348178T3 (es) | 2010-12-01 |
| EP1941255A1 (fr) | 2008-07-09 |
| BRPI0616991A2 (pt) | 2011-07-05 |
| US20080250849A1 (en) | 2008-10-16 |
| ATE472723T1 (de) | 2010-07-15 |
| DK1941255T3 (da) | 2010-10-25 |
| FR2891911A1 (fr) | 2007-04-13 |
| CN101283261A (zh) | 2008-10-08 |
| CN101283261B (zh) | 2012-03-07 |
| FR2891911B1 (fr) | 2008-04-25 |
| US7963152B2 (en) | 2011-06-21 |
| JP2009511869A (ja) | 2009-03-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230185070A1 (en) | Automated microscopic cell analysis | |
| US7431883B2 (en) | Clinical analysis system | |
| CN108139418B (zh) | 受试体处理芯片、受试体处理装置及受试体处理方法 | |
| RU2604622C2 (ru) | Измерительный кристалл, микрофлюидное устройство и способ | |
| Luo et al. | White blood cell counting at point‐of‐care testing: A review | |
| JP5020249B2 (ja) | 血液等の生体液を分析するモジュラー装置 | |
| EP1817568A2 (en) | Unitary cartridge for particle processing | |
| CN107101932B (zh) | 一种微量全自动血细胞与血红蛋白计量装置的使用方法 | |
| CN111650168A (zh) | 全自动微流控分析仪 | |
| US3570314A (en) | Valving arrangement for automated materials analysis | |
| JP2003302330A (ja) | 平板状フローセル装置 | |
| CN212379420U (zh) | 样本分析仪 | |
| JP7455827B2 (ja) | 高い再現性を提供するマイクロ流体サンプル調製デバイス | |
| EP4004521B1 (en) | Differential dispensing method | |
| KR101048858B1 (ko) | 개방형 그루브 채널 칩 | |
| CN218938279U (zh) | 一种用于血球分析的反应池 | |
| KR102763319B1 (ko) | 마이크로 펌프를 구비하는 혈액 분석용 카트리지 | |
| US20220381021A1 (en) | Analytical Toilet with Microfluidic Chip | |
| JPS6373150A (ja) | 液体の顕微鏡分析系 | |
| WO2020030090A1 (en) | Systems for automated handling of fluid samples into microfluidic droplets for in vitro diagnostic | |
| CN118874567A (zh) | 一种集成化的微波-微流体芯片及其制备方法和检测方法 | |
| WO2025136489A1 (en) | Automated system for clone selection based on antibody production and measurement of cell health parameters | |
| CN117092015A (zh) | 一种基于声学微流控的特异性细胞计数装置及方法 | |
| AU2012202515A1 (en) | Unitary cartridge for particle processing | |
| JPH04161836A (ja) | 微量定量希釈装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090730 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110621 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110921 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110928 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110929 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120105 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120425 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120522 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120612 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150622 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |