JP4709383B2 - Ucp4 - Google Patents
Ucp4 Download PDFInfo
- Publication number
- JP4709383B2 JP4709383B2 JP2000574252A JP2000574252A JP4709383B2 JP 4709383 B2 JP4709383 B2 JP 4709383B2 JP 2000574252 A JP2000574252 A JP 2000574252A JP 2000574252 A JP2000574252 A JP 2000574252A JP 4709383 B2 JP4709383 B2 JP 4709383B2
- Authority
- JP
- Japan
- Prior art keywords
- ucp4
- polypeptide
- dna
- sequence
- molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Hematology (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Diabetes (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Obesity (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Child & Adolescent Psychology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
(発明の分野)
本発明は一般に、或る種のヒト脱共役タンパク質との相同性を有する新規なDNAの同定及び単離、並びに、ここに「脱共役タンパク質4」又は「UCP4」と命名する新規なポリペプチドの組換え生産に関する。
【0002】
(発明の背景)
脱共役タンパク質又は「UCPs」は、代謝プロセスにおいて役割を担うと考えられており、文献に報告されている。UCPはクマなどの冬眠動物の褐色脂肪細胞で最初に見出され記載された。UCPはそのような冬眠を助け、他の寒冷気候適応動物は、それらの身体の代謝速度を上げることにより寒冷気候でも中心体温を維持する。ヒトは比較的少量の褐色脂肪組織を持つので、UCPは最初ヒト代謝では副次的な役割を担うものと考えられた。
幾つかの異なるヒト脱共役タンパク質が現在までに記載されている[一般的には、Gura, Science, 280: 1369-1370 (1998)参照]。UCP1と呼ばれるヒト脱共役タンパク質はNicholls等によって同定された。Nicholls等は、褐色脂肪細胞ミトコンドリアの内膜が非常にタンパク質透過性であり、実験者はミトコンドリア膜で観察されたUCP1と呼ばれるタンパク質透過性を追跡した。Nicholls等は、UCP1が、組織因子のような透過性により、食物源からなされる多数のATPを減らし、身体代謝を上昇させて熱を発生させると報告した[Nichols等, Physiol. Rev., 64: 1-64 (1984)]。
後にUCP1は褐色脂肪組織のみで発現されることが見出された[Bouillaud等, Proc. Natl. Acad. Sci., 82: 445-448 (1985); Jacobsson等, J. Biol. Chem., 260: 16250-16254 (1985)]。遺伝子マッピング研究により、ヒトUCP1遺伝子は染色体4に位置することが示された[Cassard等, J. Cell. Biochem., 43: 255-264 (1990)]。
【0003】
UCPH又はUCP2と呼ばれる他のヒトUCPも記載されている。[Gimeno等, Diaberes, 46: 900-906 (1997); Fleury等, Nat. genet., 15: 269-272 (1997); Boss等, FEBS Letters, 408-: 39-42 (1997); またWolf, Nutr. Rev., 55: 178-179 (1997)も参照]。Fleury等は、UCP2タンパク質がUCP1と59%のアミノ酸配列同一性を有し、UCP2は高インシュリン血症及び肥満と関連するヒト染色体11の領域にマッピングされることを教示した[Fleury等, 上掲]。また、UCP2は、脳及び筋肉などの種々の成人組織及び脂肪細胞で発現されることも報告された[Gimeno等, 上掲, 及びFleury等, 上掲]。
第3のヒトUCPであるUCP3は、Boss等, 上掲; Vidal-Puig等, Biochem. Biophys. Res. Comm., 235: 79-82 (1997); Solanes等, J. Biol. Chem., 272: 25433-25436 (1997); 及び Gong等, J. Biol. Chem., 272: 24129-24132 (1997)に記載された[英国特許第9716886も参照]。Solanes等は、UCP1及びUCP2とは異なり、UCP3は主にヒト骨格筋で発現され、UCP3遺伝子は及び染色体11にUCP2に隣接してマッピングされることを報告した[Soalens等, 上掲]。Gong等は、UCP3発現が甲状腺ホルモン、ベータ3-アンドレン性アゴニスト及びレプチンといった公知の発熱性刺激によって調節できることを記載している[Gong等, 上掲]。
【0004】
(発明の概要)
本出願で「UCP4」と命名される新規なポリペプチドをコードし、幾つか公知の脱共役タンパク質と所定の相同性を持つcDNAクローン(DNA77568−1626)が同定された。
一実施態様では、本発明はUCP4ポリペプチドをコードするDNAを含む単離された核酸分子を提供する。
一態様では、単離された核酸分子は、(a)Fig1(配列番号:1)のアミノ酸残基約1〜約323の配列を含むUCP4ポリペプチドをコードするDNA分子、又は(b)(a)のDNA分子の相補鎖に対して少なくとも約80%配列同一性、好ましくは少なくとも約85%の配列同一性、より好ましくは少なくとも約90%の配列同一性、最も好ましくは少なくとも約95%の配列同一性を有するDNAを含む。
他の態様では、本発明は、Fig2(配列番号:2)の約40〜約1011のヌクレオチドを含む核酸の相補鎖にハイブリッド形成するDNAを含むUCP4ポリペプチドをコードするDNA単離された核酸分子に関する。好ましくは、ハイブリッド形成は緊縮性ハイブリッド形成及び洗浄条件下で起こる。
【0005】
さらなる態様では、本発明は、(a)ATCC寄託番号203134のcDNAにコードされるのと同じ成熟ポリペプチドをコードするDNA分子、又は(b)(a)のDNA分子の相補鎖に対して少なくとも約80%配列同一性、好ましくは少なくとも約85%の配列同一性、より好ましくは少なくとも約90%の配列同一性、最も好ましくは少なくとも約95%の配列同一性を有するDNAを含んでなる単離された核酸分子に関する。好ましい実施態様では、核酸はATCC寄託番号203134のcDNAにコードされるのと同じ成熟ポリペプチドをコードするDNA分子を含む。
またさらなる態様では、本発明は、(a)Fig1(配列番号:1)の約1〜約323のアミノ酸残基の配列と少なくとも約80%配列同一性、好ましくは少なくとも約85%の配列同一性、より好ましくは少なくとも約90%の配列同一性、最も好ましくは少なくとも約95%の配列同一性を有するポリペプチドをコードするDNA、又は(b)(a)のDNA分子の相補鎖を含んでなる単離された核酸分子に関する。
他の態様では、本発明は、Fig1(配列番号:1)の約1〜323の残基のアミノ酸配列と比較したとき少なくとも約80%ポジティブ、好ましくは少なくとも約85%ポジティブ、より好ましくは少なくとも約90%ポジティブ、最も好ましくは少なくとも約95%ポジティブのスコアをつけられるポリペプチドをコードするDNA、又は(b)(a)のDNA分子の相補鎖を含んでなる単離された核酸分子に関する。
【0006】
本発明のさらなる実施態様は、ハイブリッド形成プローブとして使用するのに十分長い、UCP4コード化配列の断片に係る。好ましくは、このような断片はFig2(配列番号:2)の配列における少なくとも約20〜約80の連続した塩基を含む。場合によっては、これらの断片は、Fig2(配列番号:2)の配列のN-末端又はC-末端を含む。
他の実施態様では、本発明はUCP4又はその変異体をコードするDNAを含むベクターを提供する。このベクターは、上記で定義した単離された核酸分子の任意のものを含んでいてよい。
このようなベクターを含む宿主細胞も提供される。例として、宿主細胞はCHO細胞、大腸菌、又は酵母菌であってよい。さらに、宿主細胞をUCP4ポリペプチドの発現に適した条件下で培養し、細胞培地からUCP4ポリペプチドを回収することを含んでなるUCP4ポリペプチドの製造方法が提供される。
他の実施態様では、本発明は、上記で定義した単離された核酸配列の任意のものによってコードされる単離されたUCP4ポリペプチドを提供する。
特別な実施態様では、本発明は単離された天然配列UCP4ポリペプチドを提供し、一実施態様では、Fig1(配列番号:1)の残基1〜323を含むアミノ酸配列を含む。
他の態様では、本発明はFig1(配列番号:1)のアミノ酸残基1〜約323の配列と少なくとも約80%配列同一性、好ましくは少なくとも約85%の配列同一性、より好ましくは少なくとも約90%の配列同一性、最も好ましくは少なくとも約95%の配列同一性を有するアミノ酸配列を含んでなる単離されたUCP4ポリペプチドに関する。
【0007】
さらなる態様では、本発明は、Fig1(配列番号:1)の残基1〜323のアミノ酸配列と比較したとき少なくとも約80%ポジティブ、好ましくは少なくとも約85%ポジティブ、より好ましくは少なくとも約90%ポジティブ、最も好ましくは少なくとも約95%ポジティブのスコアをつけられるアミノ酸配列を含んでなる単離されたUCP4ポリペプチドに関する。
さらに他の態様では、本発明は、Fig1(配列番号:1)のアミノ酸残基1〜約323の配列、又は抗-UCP4抗体に対する結合部位を提供するのに十分なその断片を含んでなる単離されたUCP4ポリペプチドに関する。好ましくは、UCP4断片は天然UCP4ポリペプチドの生物学的活性の少なくとも1つを保持している。
またさらなる態様では、本発明は、(i)試験DNA分子を、緊縮性条件下で、(a)Fig1(配列番号:1)の約1〜約323のアミノ酸残基の配列含むUCP4ポリペプチドをコードするDNA、又は(b)(a)のDNA分子の相補鎖にハイブリッド形成させ、前記試験DNA分子が(a)又は(b)と少なくとも約80%配列同一性、好ましくは少なくとも約85%の配列同一性、より好ましくは少なくとも約90%の配列同一性、最も好ましくは少なくとも約95%の配列同一性を有する場合、(ii)前記DNA分子を含む宿主細胞を当該ポリペプチドの発現に適した条件下で培養し、(iii)当該ポリペプチドを細胞培地から回収することにより製造されるポリペプチドを提供する。
他の実施態様では、本発明は、異種ポリペプチド又はアミノ酸配列に融合したUCP4ポリペプチドを含んでなるキメラ分子を提供する。このようなキメラ分子の例は、エピトープタグ配列又は免疫グロブリンのFc領域に融合したUCP4ポリペプチドを含む。
【0008】
他の実施態様では、本発明は、UCP4ポリペプチドに特異的に結合する抗体を提供する。場合によっては、抗体はモノクローナル抗体であってよい。
さらに他の実施態様では、本発明は天然UCP4ポリペプチドのアゴニスト及びアンタゴニストに関する。特別な実施態様では、アゴニスト又はアンタゴニストは抗-UCP4抗体である。
さらなる実施態様では、本発明は、天然UCP4ポリペプチドを候補分子と接触させ、所定の活性を監視することを含む天然UCP4ポリペプチドのアゴニスト又はアンタゴニストの同定方法に関する。また本発明は、UCP4を用いた治療方法及び診断方法も提供する。
またさらなる実施態様では、本発明は、UCP4ポリペプチド、又は上記で定義したアゴニスト又はアンタゴニストを、担体とともに含んでなる組成物にも関する。
【0009】
(好適な実施態様の詳細な説明)
I.定義
ここで使用される際の「UCP4ポリペプチド」、「UCP4タンパク質」及び「UCP4」という用語は、天然配列UCP4及びUCP4変異体(ここで更に詳細に定義する)を含む。UCP4は、ヒト組織型又は他の供給源といった種々の供給源から単離してもよく、組換え及び/又は合成方法によって調製してもよい。
「天然配列UCP4」は、天然由来のUCP4と同じアミノ酸配列を有するポリペプチドを含んでいる。このような天然配列UCP4は、自然から単離することもできるし、組換え及び/又は合成手段により生産することもできる。「天然配列UCP4」という用語には、特に、UCPの自然に生じる切断又は可溶化形態、自然に生じる変異形態(例えば、選択的にスプライシングされた形態)及び自然に生じる対立遺伝子変異体が含まれる。本発明の一実施態様において、天然配列UCP4は、Fig1(配列番号:1)のアミノ酸1〜323を含有する成熟又は全長天然配列UCP4である。
「UCP4変異体」とは天然配列UCP4以外の任意のものを意味し、以下に定義されるように、全長天然配列UCP4ポリペプチド又はUCP4ECD配列についてFig1(配列番号:1)に示すUCP4ポリペプチド配列の残基1〜323を含むアミノ酸配列と少なくとも約80%のアミノ酸配列同一性を有するUCP4を含む。このようなUCP4変異体には、例えば、Fig1(配列番号:1)の配列のN-又はC-末端、並びに一又は複数の内部ドメインにおいて一又は複数のアミノ酸残基が付加、又は欠失されたUCP4ポリペプチドが含まれる。通常、UCP4ポリペプチド変異体は、Fig1(配列番号:1)の残基1〜323を含むアミノ酸配列と、少なくとも約80%のアミノ酸配列同一性、好ましくは少なくとも約85%のアミノ酸配列同一性、より好ましくは少なくとも約90%のアミノ酸配列同一性、最も好ましくは少なくとも約95%のアミノ酸配列同一性のアミノ酸配列同一性を有している。
【0010】
UCP4配列に対してここで同定される「パーセント(%)アミノ酸配列同一性」は、配列を整列させ、最大のパーセント配列同一性を得るために必要ならば間隙を導入し、如何なる保存的置換も配列同一性の一部と考えないとした、UCP4配列のアミノ酸残基と同一である候補配列中のアミノ酸残基のパーセントとして定義される。%同一性は[Altschul等, Methods in Enzymology 266: 460-480 (1996); http://blast.wustl/edu/blast/README.htm]から得られるWU-BLAST-2によって決定できる。WU-BLAST-2は、幾つかの検索パラメータを使用するが、その殆どは初期値に設定される。調節可能なパラメータは以下の値に設定する:オーバーラップスパン=1、オーバーラップフラクション=0.125、ワード閾値(T)=11。HSP SとHSP S2パラメータは動的な値であり、特定の配列の組成及び検索される対象の配列を含む特定のデータベースの組成に応じてプログラム自身により確立される;しかしながら、値は感度を向上させるように調節してよい。%アミノ酸配列同一性値は、整列した領域における「より長い」配列の残基総数で同一一致した残基数を除することにより決定される。「より長い」配列は、整列領域において最も実際の残基を有しているものである(アラインメントスコアを最大にするためにWU-Blast-2で導入された間隙は無視される)。
上記のように実施される配列比較の文脈における、「ポジティブ(陽性)」という用語は、比較された配列において、(例えば、保存的置換の結果として)同一ではないが類似の特性を持つ残基を含む。ポジティブの%値は、上記で定義したような、より長い配列中の残基の総数でBLOSUM62マトリクスにおいてポジティブ値とスコアされる残基を除した分率により決定される。
【0011】
同様にして、「パーセント(%)核酸配列同一性」は、UCP4コード化配列におけるヌクレオチド残基と同一な候補配列中のヌクレオチド残基のパーセントとして定義される。同一性の値は、オーバーラップスパン及びオーバーラップフラクションを各々1及び0.125にし、初期パラメータに設定したWU-BLAST-2のBLASTNモジュールによって算出される。
「単離された」とは、ここで開示された種々のポリペプチドを記述するために使用するときは、その自然環境の成分から同定され分離され及び/又は回収されたポリペプチドを意味する。その自然環境の汚染成分とは、そのポリペプチドの診断又は治療への使用を典型的には妨害する物質であり、酵素、ホルモン、及び他のタンパク質様又は非タンパク質様溶質が含まれる。好ましい実施態様において、ポリペプチドは、(1)スピニングカップシークエネーターを使用することにより、少なくとも15残基のN-末端あるいは内部アミノ酸配列を得るのに充分なほど、あるいは、(2)クーマシーブルーあるいは好ましくは銀染色を用いた非還元あるいは還元条件下でのSDS-PAGEによる均一性まで精製される。単離されたポリペプチドには、UCP4ポリペプチドの自然環境の少なくとも1つの成分が存在しないため、組換え細胞内のインサイツのタンパク質が含まれる。しかしながら、通常は、単離されたポリペプチドは少なくとも1つの精製工程により調製される。
「単離された」UCP4ポリペプチドをコードする核酸分子は、同定され、UCP4コード化核酸の天然源に通常付随している少なくとも1つの汚染核酸分子から分離された核酸分子である。単離されたUCP4コード化核酸分子は、天然に見出される形態あるいは設定以外のものである。ゆえに、単離された核酸分子は、天然の細胞中に存在するUCP4コード化核酸分子とは区別される。しかし、単離されたUCP4ポリペプチドをコードする核酸分子は、例えば、核酸分子が天然細胞のものとは異なった染色体位置にある通常はUCP4を発現する細胞に含まれるUCP4コード化核酸分子を含む。
【0012】
「コントロール配列」という用語は、特定の宿主生物において作用可能に結合したコード化配列を発現するために必要なDNA配列を指す。原核生物に好適なコントロール配列は、例えば、プロモーター、場合によってはオペレータ配列、及びリボソーム結合部位を含む。真核生物の細胞は、プロモーター、ポリアデニル化シグナル及びエンハンサーを利用することが知られている。
核酸は、他の核酸配列と機能的な関係にあるときに「作用可能に結合し」ている。例えば、プレ配列あるいは分泌リーダーのDNAは、ポリペプチドの分泌に参画するプレタンパク質として発現されているなら、そのポリペプチドのDNAに作用可能に結合している;プロモーター又はエンハンサーは、配列の転写に影響を及ぼすならば、コード配列に作用可能に結合している;又はリボソーム結合部位は、もしそれが翻訳を容易にするような位置にあるなら、コード配列と作用可能に結合している。一般的に、「作用可能に結合している」とは、結合したDNA配列が近接しており、分泌リーダーの場合には近接していて読みフェーズにあることを意味する。しかし、エンハンサーは必ずしも近接している必要はない。結合は簡便な制限部位でのライゲーションにより達成される。そのような部位が存在しない場合は、従来の手法に従って、合成オリゴヌクレオチドアダプターあるいはリンカーが使用される。
「抗体」という用語は最も広い意味において使用され、特に抗-UCP4モノクローナル抗体(アゴニスト、アンタゴニスト、及び中和抗体を含む)、及び多エピトープ特異性を持つ抗-UCP4抗体組成物を包含している。ここで使用される「モノクローナル抗体」という用語は、実質的に均一な抗体の集団、すなわち、構成する個々の抗体が、少量存在しうる自然に生じる可能性のある突然変異を除いて同一である集団から得られる抗体を称する。
【0013】
ハイブリッド形成反応の「緊縮性」は、当業者によって容易に決定され、一般的にプローブ長、洗浄温度、及び塩濃度に依存する経験的な計算である。一般に、プローブが長くなると適切なアニーリングのための温度が高くなり、プローブが短くなると温度は低くなる。ハイブリッド形成は、一般的に、相補的鎖がその融点に近いがそれより低い環境に存在する場合における変性DNAの再アニールする能力に依存する。プローブとハイブリッド形成可能な配列との間の所望の相同性の程度が高くなると、使用できる相対温度が高くなる。その結果、より高い相対温度は、反応条件をより緊縮性にするが、低い温度は緊縮性を低下させる。さらに、緊縮性は塩濃度に逆比例する。ハイブリッド形成反応の緊縮性の更なる詳細及び説明は、Ausubel等, Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995)を参照のこと。
ここで定義される「緊縮性条件」は、(1)洗浄のために低イオン強度及び高温度、例えば、50℃において0.015Mの塩化ナトリウム/0.0015Mのクエン酸ナトリウム/0.1%のドデシル硫酸ナトリウムを用いるもの;(2)ハイブリッド形成中にホルムアミド等の変性剤、例えば、42℃において50%(vol/vol)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%のポリビニルピロリドン/50mMのpH6.5のリン酸ナトリウムバッファー、及び750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いるもの;(3)42℃における50%ホルムアミド、5xSSC(0.75MのNaCl、0.075Mのクエン酸ナトリウム)、50mMのリン酸ナトリウム(pH6.8)、0.1%のピロリン酸ナトリウム、5xデンハード液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、及び10%のデキストラン硫酸と、42℃における0.2xSSC(塩化ナトリウム/クエン酸ナトリウム)中の洗浄及び55℃でのホルムアミド、次いで55℃におけるEDTAを含む0.1xSSCからなる高緊縮性洗浄を用いるものによって同定される。
「中程度の緊縮性条件」は、Sambrook等, Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989)に記載されているように同定され、上記の緊縮性より低い洗浄溶液及びハイブリッド形成条件(例えば、温度、イオン強度及び%SDS)の使用を含む。中程度の緊縮性条件は、20%ホルムアミド、5xSSC(150mMのNaCl、15mMのクエン酸三ナトリウム)、50mMリン酸ナトリウム(pH7.6)、5xデンハード液、10%デキストラン硫酸、及び20mg/mLの変性剪断サケ精子DNAを含む溶液中の37℃での終夜インキュベーション、次いで1xSSC中37−50℃でのフィルターの洗浄といった条件である。当業者であれば、プローブ長などの因子に適合させる必要に応じて、どのようにして温度、イオン強度等を調節するかを認識するであろう。
【0014】
「エピトープタグ」なる用語は、ここで用いられるときは、「タグポリペプチド」に融合したUCP4ポリペプチドを含んでなるキメラポリペプチドを指す。タグポリペプチドは、その抗体が産生され得るエピトープを提供するに十分な残基を有しているが、それが融合されるポリペプチドの活性を阻害しないような短かさである。また、タグポリペプチドは、好ましくは、抗体が他のエピトープと実質的に交差反応をしないようにかなり独特である。好適なタグポリペプチドは、一般に、少なくとも6のアミノ酸残基、通常は約8−50のアミノ酸残基(好ましくは約10−20のアミノ酸残基)を有する。
ここで用いられる「イムノアドヘシン」なる用語は、異種性タンパク質(「アドヘシン」)の結合特異性を免疫グロブリン定常ドメインのエフェクター機能と組み合わせた抗体様分子を指す。構造的には、イムノアドヘシンは、所望の結合特異性を持ち、抗体の抗原認識及び結合部位以外である(すなわち「異種性」)アミノ酸配列と、免疫グロブリン定常ドメイン配列との融合物を含む。イムノアドヘシン分子のアドへシン部分は、典型的には少なくともレセプター又はリガンドの結合部位を含む隣接アミノ酸配列である。イムノアドヘシンの免疫グロブリン定常ドメイン配列は、IgG-1、IgG-2、IgG-3又はIgG-4サブタイプ、IgA(IgA-1及びIgA-2を含む)、IgE、IgD又はIgMなどの任意の免疫グロブリンから得ることができる。
【0015】
ここで意図している「活性な」又は「活性」とは、天然又は自然に生じるUCP4の生物学的及び/又は免疫学的活性を保持するUCP4の形態を意味する。好ましい活性は、ミトコンドリア膜電位に、代謝速度及び/又は熱発生のアップ-又はダウン-レギュレーションをもたらすような方法で影響を与える能力である。そのような活性の一つは、代謝速度における増大をもたらすミトコンドリア膜におけるプロトン漏出の発生を含む。
「アンタゴニスト」なる用語は最も広い意味に使用され、ここに開示される天然UCP4ポリペプチドの生物学的及び/又は免疫学的活性を部分的又は全体的に阻止、阻害、又は中和する任意の分子を含む。同様に、「アゴニスト」なる用語は最も広い意味に使用され、ここに開示される天然UCP4ポリペプチドの生物学的及び/又は免疫学的活性を模倣する任意の分子を含む。好適なアゴニスト又はアンタゴニスト分子は特にアゴニスト又はアンタゴニスト抗体又は抗体断片、UCP4ポリペプチドのイムノアドヘシン、天然UCP4ポリペプチドの断片又はアミノ酸配列変異体を含む。
「治療」とは、目的物が標的とする病理的症状又は疾患を防止又は遅延させる(少なくする)予防的又は防止的手段を意味する。治療を必要とするものには、既に疾患を患っているもの並びに疾患を患う傾向があるもの又は疾患が防止されるべきものが含まれる。
「慢性」投与とは、初期の治療効果(活性)を長期間にわたって維持するようにするように、急性態様とは異なり連続的な態様で薬剤を投与することを意味する。「間欠」投与とは、中断無く連続的になされるのではなく、むしろ本質的に周期的になされる処理である。
治療の目的とされる「哺乳動物」とは、ヒト、家庭及び農場用動物、及び動物園、スポーツ又はペット用動物、例えばイヌ、ネコ、ウシ、ウマ、ヒツジ、ブタ等を含む、哺乳類として分類されるあらゆる動物を意味する。好ましくは哺乳動物はヒトである。
一又は複数の更なる治療剤「と組み合わせて」の投与には、同時(同時間)及び任意の順序の連続投与が含まれる。
【0016】
II. 本発明の組成物と方法
A.全長UCP4
本発明は、本出願においてUCP4と称されるポリペプチドをコードする、新規に同定され単離されたヌクレオチド配列を提供する。特に、以下の実施例で更に詳細に開示するように、UCP4ポリペプチドをコードするcDNAを同定し単離した。単純化するために、本発明の明細書においては、DNA77568−1626によってコードされるタンパク質並びに上記のUCP4の定義に包含される天然相同体及び変異体を、それらの起源又は調製方法に関わらず「UCP4」と呼ぶものとする。
下記の実施例で開示されるように、クローンDNA77568−1626はATCCに寄託された。クローンの実際のヌクレオチド配列は、この分野で日常的な方法を用いて寄託されたクローンの配列決定をすることにより、当業者によって容易に決定される。予測されるアミノ酸配列は、常套的技量を用いてヌクレオチド配列から決定できる。ここでUCP4について、出願人は、何れがこの出願時に入手可能な配列情報と最も一致するリーディングフレームと考えられるかを同定した。
Megaling DNASTARコンピュータプログラム(及び製造者によって設定されたこのソフトウェアのアルゴリズム及びパラメータ)(Oxford Molecular Group, Inc.)を用いて、全長天然配列UCP4(Fig1及び配列番号:1に示す)が、UCP3と約34%のアミノ酸配列同一性、UCP2と約33%のアミノ酸配列同一性、及びUCP1と約29%のアミノ酸配列同一性を有することが見出された。従って、現在では、本出願で開示されるUCP4が新たに同定されたヒト脱共役タンパク質ファミリーのメンバーであり、このタンパク質ファミリーに典型的な活性及び/又は特性、例えばミトコンドリア膜電位に影響を与えることにより代謝速度を向上又は抑制する能力を有すると考えられている。
【0017】
B.UCP4変異体
ここに記載した全長天然配列UCP4ポリペプチドに加えて、UCP4変異体も調製できると考えられる。UCP4変異体は、UCP4DNAに適当なヌクレオチド変化を導入することにより、及び/又は所望のUCP4ポリペプチドを合成することにより調製できる。当業者は、グリコシル化部位の数又は位置の変化あるいは膜固着特性の変化などのアミノ酸変化がUCP4の翻訳後プロセスを変えうることを理解するであろう。
天然全長配列UCP4又はここに記載したUCP4の種々のドメインにおける変異は、例えば、米国特許第5,364,934号に記載されている保存的及び非保存的変異についての任意の技術及び指針を用いてなすことができる。変異は、結果として天然配列UCP4と比較してUCP4のアミノ酸配列が変化するようなUCP4をコードする一又は複数のコドンの置換、欠失又は挿入であってよい。場合によっては、変異は、少なくとも1つのアミノ酸のUCP4の一又は複数のドメインの任意の他のアミノ酸での置換による。いずれのアミノ酸残基が所望の活性に悪影響を与えることなく挿入、置換又は欠失されるかの指針は、UCP4の配列を相同性の知られたタンパク質分子の配列と比較し、相同性の高い領域内でなされるアミノ酸配列変化を最小にすることによって見出される。アミノ酸置換は、一のアミノ酸を類似した構造及び/又は化学特性を持つ他のアミノ酸で置換した結果、例えばロイシンのセリンでの置換、即ち保存的アミノ酸置換とすることができる。挿入及び欠失は、場合によっては1から5のアミノ酸の範囲内とすることができる。許容される変異は、配列においてアミノ酸の挿入、欠失又は置換を系統的に作成し、必要ならば、得られた変異体を当該分野で知られた又はここに記載するようなアッセイにおいて活性について試験することにより決定される。
【0018】
本発明の一実施態様は、全長UCP4の断片であるUCP4変異体に係る。好ましくは、その断片は全長UCP4の所望の活性又は特性を保持している。
変異は、オリゴヌクレオチド媒介(部位特異的)突然変異誘発、アラニンスキャンニング、及びPCR突然変異誘発といった当該分野で知られた方法を用いてなすことができる。部位特異的突然変異誘発[Carter等, Nucl. Acids Res., 13: 4331 (1986); Zoller等, Nucl. Acids Res., 10: 6487 (1987)]、カセット突然変異誘発[Wells等, Gene, 34: 315 (1985)]、制限的選択突然変異誘発[Wells等, Philos. Trans. R. Soc. London SerA, 317: 415 (1986)]又は他の知られた技術をクローニングしたDNAに実施して、UCP4変異体DNAを作成することもできる。
また、隣接配列に沿って一又は複数のアミノ酸を同定するのにスキャンニングアミノ酸分析を用いることができる。好ましいスキャンニングアミノ酸は比較的小さく、中性のアミノ酸である。そのようなアミノ酸は、アラニン、グリシン、セリン、及びシステインを含む。アラニンは、ベータ炭素を越える側鎖を排除し変異体の主鎖構造を変化させにくいので、この群の中で典型的に好ましいスキャンニングアミノ酸である[Cunningham及びWells, Science, 244: 1081-1085 (1989)]。また、アラニンは最もありふれたアミノ酸であるため典型的には好ましい。さらに、それは埋もれた及び露出した位置の両方に見られることが多い[Creighton, The Proteins, (W.H. Freeman & Co., N.Y.); Chothia, J. Mol. Biol., 150: 1 (1976)]。アラニン置換が十分な量の変異体を生じない場合は、アイソテリック(isoteric)アミノ酸を用いることができる。
【0019】
C.UCP4の修飾
UCP4ポリペプチドの共有結合的修飾は本発明の範囲内に含まれる。共有結合的修飾の一型は、UCP4ポリペプチドのアミノ酸残基を標的として、UCP4の選択された側鎖又はN-又はC-末端残基と反応できる有機誘導体化試薬と反応させることである。二官能性試薬での誘導体化が、例えばUCP4を水不溶性支持体マトリクスあるいは抗-UCP4抗体の精製方法又はその逆で用いるための表面に架橋させるのに有用である。通常用いられる架橋剤は、例えば、1,1-ビス(ジアゾアセチル)-2-フェニルエタン、グルタルアルデヒド、N-ヒドロキシスクシンイミドエステル、例えば4-アジドサリチル酸、3,3’-ジチオビス(スクシンイミジルプロピオネート)等のジスクシンイミジルエステルを含むホモ二官能性イミドエステル、ビス-N-マレイミド-1,8-オクタン等の二官能性マレイミド、及びメチル-3-[(p-アジドフェニル)-ジチオ]プロピオイミダート等の試薬を含む。
他の修飾は、グルタミニル及びアスパラギニル残基の各々対応するグルタミル及びアスパルチル残基への脱アミド化、プロリン及びリシンのヒドロキシル化、セリル又はスレオニル残基のヒドロキシル基のリン酸化、リシン、アルギニン、及びヒスチジン側鎖のα-アミノ基のメチル化[T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp.79-86 (1983)]、N-末端アミンのアセチル化、及び任意のC-末端カルボキシル基のアミド化を含む。
本発明の範囲内に含まれるUCP4ポリペプチドの共有結合的修飾の他の型は、ポリペプチドの天然グリコシル化パターンの変更を含む。「天然グリコシル化パターンの変更」とは、ここで意図されるのは、天然配列UCP4に見られる1又は複数の炭水化物部分の欠失(存在するグリコシル化部位の除去あるいは化学的又は酵素的手段によるグリコシル化の除去による)、及び/又は天然配列UCP4ポリペプチドに存在しない1又は複数のグリコシル化部位の付加を意味する。さらに、この表現は、存在する種々の炭化水素部分の性質及び特性における変化を含む天然タンパク質のグリコシル化の定性的変化を含む。
【0020】
UCP4ポリペプチドへのグリコシル化部位の付加はアミノ酸配列の変更によって達成される。この変更は、例えば、1又は複数のセリン又はトレオニン残基の天然配列UCP4(O-結合グリコシル化部位)への付加、又は置換によってなされてもよい。UCP4アミノ酸配列は、場合によっては、DNAレベルでの変化、特に、UCP4ポリペプチドをコードするDNAを予め選択された塩基において変異させ、所望のアミノ酸に翻訳されるコドンを生成させることを通して変更されてもよい。
UCP4ポリペプチド上に炭水化物部分の数を増加させる他の手段は、グリコシドのポリペプチドへの化学的又は酵素的結合による。このような方法は、この技術分野において、例えば、1987年9月11日に発行されたWO 87/05330、及びAplin及びWriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981)に記載されている。
UCP4ポリペプチド上に存在する炭水化物部分の除去は、化学的又は酵素的に、あるいはグルコシル化の標的として提示されるアミノ酸残基をコードするコドンの変異的置換によってなすことができる。化学的脱グリコシル化技術はこの分野で知られており、例えば、Hakimuddin等, Arch. Biochem. Biophys., 259:52 (1987)により、及びEdge等, Anal. Biochem., 118: 131 (1981)により記載されている。ポリペプチド上の炭水化物部分の酵素的切断は、Thotakura等, Meth. Enzymol. 138:350 (1987)に記載されているように、種々のエンド及びエキソグリコシダーゼを用いることにより達成される。
UCP4の共有結合的修飾の他の型は、UCP4ポリぺプチドの、種々の非タンパク質様ポリマー、例えばポリエチレングリコール(PEG)、ポリプロピレングリコール、又はポリオキシアルキレンの一つへの、米国特許第4,640,835号;第4,496,689号;第4,301,144号;第4,670,417号;第4,791,192号又は第4,179,337号に記載された方法での結合を含む。
【0021】
また、本発明のUCP4は、他の異種ポリペプチド又はアミノ酸配列に融合したUCP4ポリペプチドを含むキメラ分子を形成する方法で修飾してもよい。
一実施態様では、このようなキメラ分子は、抗-タグ抗体が選択的に結合できるエピトープを提供するタグポリペプチドとUCP4との融合物を含む。エピトープタグは、一般的にはUCP4のアミノ-又はカルボキシル-末端に位置する。このようなUCP4のエピトープタグ形態の存在は、タグポリペプチドに対する抗体を用いて検出することができる。また、エピトープタグの提供は、抗-タグ抗体又はエピトープタグに結合する他の型の親和性マトリクスを用いたアフィニティ精製によってUCP4を容易に精製できるようにする。種々のタグポリペプチド及びそれら各々の抗体はこの分野で良く知られている。例としては、ポリ-ヒスチジン(poly-his)又はポリ-ヒスチジン-グリシン(poly-his-gly)タグ;flu HAタグポリペプチド及びその抗体12CA5[Field等, Mol. Cell. Biol., 8:2159-2165 (1988)];c-mycタグ及びそれに対する8F9、3C7、6E10、G4、B7及び9E10抗体[Evan等, Molecular and Cellular Biology, 5:3610-3616 (1985)];及び単純ヘルペスウイルス糖タンパク質D(gD)タグ及びその抗体[Paborsky等, Protein Engineering, 3(6):547-553 (1990)]を含む。他のタグポリペプチドは、フラッグペプチド[Hopp等, BioTechnology, 6:1204-1210 (1988)];KT3エピトープペプチド[Martin等, Science, 255:192-194 (1992)];α-チューブリンエピトープペプチド[Skinner等, J. Biol. Chem., 266:15163-15166 (1991)];及びT7遺伝子10タンパク質ペプチドタグ[Lutz-Freyermuth等, Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)]を含む。
【0022】
もう一つの実施態様において、キメラ分子はUCP4の免疫グロブリン又は免疫グロブリンの特定領域との融合体を含む。キメラ分子の二価形態(「イムノアドヘシンとも呼ぶ」)には、このような融合はIgG分子のFc領域であり得る。Ig融合体は、好ましくはIg分子無いの少なくとも一つの可変領域に換えたUCP4ポリペプチドの可溶化(膜貫通ドメイン欠失又は不活性化)形態の置換を含む。特に好ましい実施態様では、免疫グロブリン融合体は、ヒンジ、CH2及びCH3、あるいはIgG1分子のヒンジ、CH1、CH2及びCH3領域を含む。免疫グロブリン融合体の調製のためには、1995年6月27日発行の米国特許第5,428,130号も参照。
本発明のUCP4は、ロイシンジッパーに融合したUCP4を含むキメラ分子を形成する方法で修飾してもよい。種々のロイシンジッパーポリペプチドがこの分野で記載されている。例えば、Landschulz等, Science, 240: 1759 (1988); WO 94/10308; Hoppe等, FEBS Letters, 344: 1991 (1994); Maniatis等, Nature, 341: 24 (1989)を参照。当業者は、ロイシンジッパーがUCP4分子の5'-又は3'-末端のいずれかに融合することを認めるであろう。
【0023】
D.UCP4の調製
以下の説明は、主として、UCP4核酸を含むベクターで形質転換又は形質移入された細胞を培養することによりUCP4を生産する方法に関する。もちろん、当該分野においてよく知られている他の方法を用いてUCP4を調製することはできると考えられる。例えば、UCP4配列、又はその一部は、固相技術を用いた直接ペプチド合成によって生産してもよい[例えば、Stewart等, Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969);Merrifield, J. Am. Chem. Soc., 85:2149-2154 (1963)参照]。手動技術又は自動によるインビトロタンパク質合成を行ってもよい。自動合成は、例えば、アプライド・バイオシステムズ・ペプチド合成機(Foster City, CA)を用いて、製造者の指示により実施してもよい。UCP4ポリペプチドの種々の部分は、別々に化学的に合成され、化学的又は酵素的方法を用いて結合させて全長UCP4を生産してもよい。
【0024】
1.UCP4をコードするDNAの単離
UCP4をコードするDNAは、UCP4mRNAを保有し、それを検出可能なレベルで発現すると考えられる組織から調製された任意のcDNAライブラリから得ることができる。従って、ヒトUCP4DNAは、実施例に記載されるような、ヒトの組織から調製されたcDNAライブラリから簡便に得ることができる。またUCP4コード化遺伝子は、ゲノムライブラリから又はオリゴヌクレオチド合成により得ることもできる。
ライブラリは、対象となる遺伝子あるいはその遺伝子によりコードされるタンパク質を同定するために設計された(UCP4に対する抗体又は少なくとも約20−80塩基のオリゴヌクレオチド等の)プローブによってスクリーニングできる。選択されたプローブによるcDNA又はゲノムライブラリのスクリーニングは、例えばSambrook等, Molecular Cloning: A Laboratory Manual(New York: Cold Spring Harbor Laboratory Press, 1989)に記載されているような標準的な手法を使用して実施することができる。UCP4をコードする遺伝子を単離する他の手段はPCR法を使用することである[Sambrook等,上掲;Dieffenbach等, PCR Primer:A Laboratory Manual(Cold Spring Harbor Laboratory Press, 1995)]。
【0025】
下記の実施例には、cDNAライブラリのスクリーニング技術を記載している。プローブとして選択されたオリゴヌクレオチド配列は充分な長さであり、疑陽性が最小化されるよう充分に明瞭でなければならない。オリゴヌクレオチドは、スクリーニングされるライブラリ内のDNAとのハイブリッド形成時に検出可能であるように標識されていることが好ましい。標識化の方法は当該分野において良く知られており、32P標識されたATPのような放射線標識、ビオチン化あるいは酵素標識の使用が含まれる。中程度の厳密性及び高度の厳密性を含むハイブリッド形成条件は、上掲のSambrook等に与えられており、上記のI欄に記載されている。
このようなライブラリースクリーニング法において同定された配列は、Genbank等の公共データベース又は個人の配列データベースに寄託され公衆に利用可能とされている公知の他の配列と比較及びアラインメントすることができる。分子の決定された領域内又は全長に渡っての(アミノ酸又は核酸レベルのいずれかでの)配列同一性は、BLAST、BLAST2、ALIGN、DNAstar、及びINHERIT等の配列比較についての同一性又はポジティブを測定するための公衆に利用可能なコンピュータソフトウェアプログラム(初期パラメータに設定)を用いた配列アラインメントを通して決定することができる。
タンパク質コード化配列を有する核酸は、初めに開示される推定アミノ酸配列を使用し、また必要ならば、cDNAに逆転写されなかったmRNAの生成中間体及び先駆物質を検出するための上掲のSambrook等に記述されているような従来のプライマー伸展法を使用して、選択されたcDNA又はゲノムライブラリをスクリーニングすることにより得られる。
【0026】
2.宿主細胞の選択及び形質転換
宿主細胞を、ここに記載したUCP4産生のための発現又はクローニングベクターで形質移入又は形質転換し、プロモーターを誘導し、形質転換体を選択し、又は所望の配列をコードする遺伝子を増幅するために適当に変性された常套的栄養培地で培養する。培養条件、例えば培地、温度、pH等々は、過度の実験をすることなく当業者が選ぶことができる。一般に、細胞培養の生産性を最大にするための原理、プロトコール、及び実用技術は、Mammalian Cell Biotechnology: a Practical Approach, M.Butler編 (IRL Press, 1991)及びSambrook等, 上掲に見出すことができる。
形質移入の方法、例えば、CaPO4及びエレクトロポレーションは当業者に知られている。用いる宿主細胞に応じて、その細胞に対して適した標準的な方法を用いて形質転換はなされる。前掲のSambrook等に記載された塩化カルシウムを用いるカルシウム処理又はエレクトロポレーションが、原核生物又は実質的な細胞壁障壁を含む他の細胞に対して用いられる。アグロバクテリウム・トゥメファシエンスによる感染が、Shaw等, Gene, 23:315 (1983)及び1989年6月29日公開のWO 89/05859に記載されているように、或る種の植物細胞の形質転換に用いられる。このような細胞壁のない哺乳動物の細胞に対しては、Graham及びvan der Eb, Virology, 52:456-457 (1978)のリン酸カルシウム沈降法を使用できる。哺乳動物細胞の宿主系形質転換の一般的な態様は米国特許第4,399,216号に記載されている。酵母菌中への形質転換は、典型的には、Van solingen等, J. Bact., 130:946 (1977)及びHsiao等, Proc. Natl. Acad. Sci. USA, 76:3829 (1979)の方法に従って実施される。しかしながら、DNAを細胞中に導入する他の方法、例えば、核マイクロインジェクション、エレクトロポレーション、無傷の細胞、又はポリカチオン、例えばポリブレン、ポリオルニチン等を用いる細菌プロトプラスト融合もまた用いることもできる。哺乳動物細胞を形質転換するための種々の技術については、Keown等, Methods in Enzymology, 185:527-537 (1990)及び Mansour等, Nature, 336:348-352 (1988)を参照のこと。
【0027】
ここでのベクターにDNAをクローニングあるいは発現するために適切な宿主細胞は、原核生物、酵母菌、又は高等真核生物細胞である。適切な原核生物は、限定するものではないが、真正細菌、例えばグラム陰性又はグラム陽性生物体、例えば大腸菌のような腸内細菌科を含む。種々の大腸菌株が公衆に利用可能であり、例えば、大腸菌K12株MM294(ATCC31,446);大腸菌X1776(ATCC31,537);大腸菌株W3110(ATCC27,325)及びK5772(ATCC53,635)である。
原核生物に加えて、糸状菌又は酵母菌のような真核微生物は、UCP4コード化ベクターのための適切なクローニング又は発現宿主である。サッカロミセス・セレヴィシアは、通常用いられる下等真核生物宿主微生物である。
グリコシル化UCP4の発現に適切な宿主細胞は多細胞生物から誘導される。無脊椎動物細胞の例としては、ショウジョウバエS2及びスポドスペラSf9等の昆虫細胞並びに植物細胞が含まれる。有用な哺乳動物宿主系細胞の例は、チャイニーズハムスター卵巣(CHO)及びCOS細胞を含む。より詳細な例は、SV40によって形質転換されたサル腎臓CV1系 (COS-7, ATCC CRL 1651);ヒト胚腎臓系(293又は懸濁培養での増殖のためにサブクローン化された293細胞、Graham等, J. Gen Virol., 36:59 (1977));チャイニーズハムスター卵巣細胞/-DHFR(CHO, Urlaub及びChasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980));マウスのセルトリ細胞(TM4, Mather, Biol. Reprod., 23:243-251 (1980))ヒト肺細胞 (W138, ATCC CCL 75); ヒト肝細胞 (Hep G2, HB 8065); 及びマウス乳房腫瘍 (MMT 060562, ATTC CCL51)を含む。適切な宿主細胞の選択は、この分野の技術常識内にある。
【0028】
3.複製可能なベクターの選択及び使用
所望のUCP4をコードする核酸(例えば、cDNA又はゲノムDNA)は、クローニング(DNAの増幅)又は発現のために複製可能なベクター内に挿入される。様々なベクターが公的に入手可能である。ベクターは、例えば、プラスミド、コスミド、ウイルス粒子、又はファージの形態とすることができる。適切な核酸配列が、種々の手法によってベクターに挿入される。一般に、DNAはこの分野で周知の技術を用いて適当な制限エンドヌクレアーゼ部位に挿入される。ベクター成分としては、一般に、これらに制限されるものではないが、一又は複数のシグナル配列、複製開始点、一又は複数のマーカー遺伝子、エンハンサーエレメント、プロモーター、及び転写終結配列を含む。これらの成分の一又は複数を含む適当なベクターの作成には、当業者に知られた標準的なライゲーション技術を用いる。
UCP4は直接的に組換え手法によって生産されるだけではなく、シグナル配列あるいは成熟タンパク質あるいはポリペプチドのN-末端に特異的切断部位を有する他のポリペプチドである異種性ポリペプチドとの融合ペプチドとしても生産される。一般に、シグナル配列はベクターの成分であるか、ベクターに挿入されるUCP4コード化DNAの一部である。シグナル配列は、例えばアルカリホスファターゼ、ペニシリナーゼ、lppあるいは熱安定性エンテロトキシンIIリーダーの群から選択される原核生物シグナル配列であってよい。酵母菌の分泌に関しては、シグナル配列は、酵母菌インベルターゼリーダー、アルファ因子リーダー(酵母菌属(Saccharomyces)及びクルイベロマイシス(Kluyveromyces)α因子リーダーを含み、後者は米国特許第5,010,182号に記載されている)、又は酸ホスフォターゼリーダー、白体(C.albicans)グルコアミラーゼリーダー(1990年4月4日発行のEP362179)、又は1990年11月15日に公開されたWO 90/13646に記載されているシグナルであり得る。哺乳動物細胞の発現においては、哺乳動物シグナル配列は、同一あるいは関連ある種の分泌ポリペプチド由来のシグナル配列並びにウイルス分泌リーダーのようなタンパク質の直接分泌に使用してもよい。
【0029】
発現及びクローニングベクターは共に一又は複数の選択された宿主細胞においてベクターの複製を可能にする核酸配列を含む。そのような配列は多くの細菌、酵母菌及びウイルスに対してよく知られている。プラスミドpBR322に由来する複製開始点は大部分のグラム陰性細菌に好適であり、2μmプラスミド開始点は酵母菌に適しており、様々なウイルス開始点(SV40、ポリオーマ、アデノウイルス、VSV又はBPV)は哺乳動物細胞におけるクローニングベクターに有用である。
発現及びクローニングベクターは、典型的には、選べるマーカーとも称される選択遺伝子を含む。典型的な選択遺伝子は、(a)アンピシリン、ネオマイシン、メトトレキセートあるいはテトラサイクリンのような抗生物質あるいは他の毒素に耐性を与え、(b)栄養要求性欠陥を補い、又は(c)例えばバシリに対する遺伝子コードD-アラニンラセマーゼのような、複合培地から得られない重要な栄養素を供給するタンパク質をコードする。
哺乳動物細胞に適切な選べるマーカーの他の例は、DHFRあるいはチミジンキナーゼのように、UCP4コード化核酸を取り込むことのできる細胞成分を同定することのできるものである。野生型DHFRを用いた場合の好適な宿主細胞は、Urlaub 等により, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)に記載されているようにして調製され増殖されたDHFR活性に欠陥のあるCHO細胞系である。酵母菌中での使用に好適な選択遺伝子は酵母菌プラスミドYRp7に存在するtrp1遺伝子である[Stinchcomb等, Nature, 282:39(1979);Kingsman等, Gene, 7:141(1979);Tschemper等, Gene, 10:157(1980)]。trp1遺伝子は、例えば、ATCC第44076号あるいはPEP4-1のようなトリプトファン内で成長する能力を欠く酵母菌の突然変異株に対する選択マーカーを提供する[Jones, Genetics, 85:12 (1977)]。
【0030】
発現及びクローニングベクターは、通常、UCP4コード化核酸配列に作用可能に結合し、mRNA合成を指示するプロモーターを含む。種々の潜在的な宿主細胞により認識される好適なプロモーターが知られている。原核生物宿主での使用に好適なプロモーターはβ-ラクタマーゼ及びラクトースプロモーター系[Cahng等, Nature, 275:615 (1978); Goeddel等, Nature, 281:544 (1979)]、アルカリホスファターゼ、トリプトファン(trp)プロモーター系[Goeddel, Nucleic Acids Res., 8:4057 (1980); EP 36,776]、及びハイブリッドプロモーター、例えばtacプロモーター[deBoer 等, Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]を含む。細菌系で使用するプロモータもまたUCP4ポリペプチドをコードするDNAと作用可能に結合したシャイン・ダルガーノ(S.D.)配列を有する。
酵母菌宿主と共に用いて好適なプロモーター配列の例としては、3-ホスホグリセラートキナーゼ[Hitzeman 等, J. Biol. Chem., 255:2073 (1980)]又は他の糖分解酵素[Hess 等, J. Adv. Enzyme Reg., 7:149 (1968);Holland, Biochemistry, 17:4900(1987)]、例えばエノラーゼ、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ、ヘキソキナーゼ、ピルビン酸デカルボキシラーゼ、ホスホフルクトキナーゼ、グルコース-6-リン酸イソメラーゼ、3-ホスホグリセレートムターゼ、ピルビン酸キナーゼ、トリオセリン酸イソメラーゼ、ホスホグルコースイソメラーゼ、及びグルコキナーゼが含まれる。
他の酵母菌プロモーターとしては、成長条件によって転写が制御される付加的効果を有する誘発的プロモーターであり、アルコールデヒドロゲナーゼ2、イソチトクロムC、酸ホスファターゼ、窒素代謝と関連する分解性酵素、メタロチオネイン、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ、及びマルトース及びガラクトースの利用を支配する酵素のプロモーター領域がある。酵母菌での発現に好適に用いられるベクターとプロモータはEP 73,657に更に記載されている。
哺乳動物の宿主細胞におけるベクターからのUCP4転写は、例えば、ポリオーマウィルス、伝染性上皮腫ウィルス(1989年7月5日公開のUK 2,211,504)、アデノウィルス(例えばアデノウィルス2)、ウシ乳頭腫ウィルス、トリ肉腫ウィルス、サイトメガロウィルス、レトロウィルス、B型肝炎ウィルス及びサルウィルス40(SV40)のようなウィルスのゲノムから得られるプロモーター、異種性哺乳動物プロモーター、例えばアクチンプロモーター又は免疫グロブリンプロモーター、及び熱衝撃プロモーターから得られるプロモーターによって制御されるが、このようなプロモーターが宿主細胞系に適合し得る場合に限られる。
【0031】
より高等の真核生物によるUCP4をコードするDNAの転写は、ベクター中にエンハンサー配列を挿入することによって増強され得る。エンハンサーは、通常は約10から300塩基対で、プロモーターに作用してその転写を増強するDNAのシス作動要素である。哺乳動物遺伝子由来の多くのエンハンサー配列が現在知られている(グロビン、エラスターゼ、アルブミン、α-フェトプロテイン及びインスリン)。しかしながら、典型的には、真核細胞ウィルス由来のエンハンサーが用いられるであろう。例としては、複製起点の後期側のSV40エンハンサー(100−270塩基対)、サイトメガロウィルス初期プロモーターエンハンサー、複製起点の後期側のポリオーマエンハンサー及びアデノウィルスエンハンサーが含まれる。エンハンサーは、UCP4コード化配列の5'又は3'位でベクター中にスプライシングされ得るが、好ましくはプロモーターから5'位に位置している。
また真核生物宿主細胞(酵母菌、真菌、昆虫、植物、動物、ヒト、又は他の多細胞生物由来の有核細胞)に用いられる発現ベクターは、転写の終結及びmRNAの安定化に必要な配列も含む。このような配列は、真核生物又はウィルスのDNA又はcDNAの通常は5'、ときには3'の非翻訳領域から取得できる。これらの領域は、UCP4をコードするmRNAの非翻訳部分にポリアデニル化断片として転写されるヌクレオチドセグメントを含む。
組換え脊椎動物細胞培養でのUCP4の合成に適応化するのに適切な他の方法、ベクター及び宿主細胞はGething等, Nature, 293:620-625 (1981); Mantei等, Nature, 281:40-46 (1979); EP 117,060; 及びEP 117,058に記載されている。
【0032】
4.遺伝子増幅/発現の検出
遺伝子の増幅及び/又は発現は、ここで提供された配列に基づき、適切に標識されたプローブを用い、例えば、従来よりのサザンブロット法、mRNAの転写を定量化するノーザンブロット法[Thomas, Proc. Natl. Acad. Sci. USA,77:5201-5205 (1980)]、ドットブロット法(DNA分析)、又はインサイツハイブリッド形成法によって、直接的に試料中で測定することができる。あるいは、DNA二重鎖、RNA二重鎖及びDNA−RNAハイブリッド二重鎖又はDNA-タンパク質二重鎖を含む、特異的二重鎖を認識することができる抗体を用いることもできる。ついで、抗体を標識し、アッセイを実施することができ、ここで二重鎖は表面に結合しており、その結果表面での二重鎖形成の時点でその二重鎖に結合した抗体の存在を検出することができる。
あるいは、遺伝子の発現は、遺伝子産物の発現を直接的に定量する免疫学的な方法、例えば細胞又は組織切片の免疫組織化学的染色及び細胞培養又は体液のアッセイによって、測定することもできる。試料液の免疫組織化学的染色及び/又はアッセイに有用な抗体は、モノクローナルでもポリクローナルでもよく、任意の哺乳動物で調製することができる。簡便には、抗体は、天然配列UCP4ポリペプチドに対して、又はここで提供されるDNA配列をベースとした合成ペプチドに対して、又はUCP4DNAに融合した特異的抗体エピトープをコードする外因性配列に対して調製され得る。
【0033】
5.ポリペプチドの精製
UCP4の形態は、培地又は宿主細胞の溶菌液から回収することができる。膜結合性であるならば、適切な洗浄液(例えばトリトン-X100)又は酵素的切断を用いて膜から引き離すことができる。UCP4の発現に用いられる細胞は、凍結融解サイクル、超音波処理、機械的破壊、又は細胞溶解剤などの種々の化学的又は物理的手段によって破壊することができる。
UCP4を、組換え細胞タンパク質又はポリペプチドから精製することが望ましい。適切な精製手順の例である次の手順により精製される:すなわち、イオン交換カラムでの分画;エタノール沈殿;逆相HPLC;シリカ又はカチオン交換樹脂、例えばDEAEによるクロマトグラフィー;クロマトフォーカシング;SDS-PAGE;硫酸アンモニウム沈殿;例えばセファデックスG-75を用いるゲル濾過;IgGのような汚染物を除くプロテインAセファロースカラム;及びUCP4のエピトープタグ形態を結合させる金属キレート化カラムである。この分野で知られ、例えば、Deutcher, Methodes in Enzymology, 182 (1990);Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982)に記載された多くのタンパク質精製方法を用いることができる。選ばれる精製過程は、例えば、用いられる生産方法及び特に生産されるUCP4ポリペプチドの性質に依存する。
【0034】
E.UCP4の用途
UCP4をコードする核酸配列(又はそれらの相補鎖)は、ハイブリッド形成プローブとしての使用を含む分子生物学の分野において、染色体及び遺伝子マッピングにおいて、及びアンチセンスRNA及びDNAの生成において種々の用途を有している。また、UCP4核酸は、ここに記載される組み換え技術によるUCP4ポリペプチドの調製にも有用であろう。
全長天然配列UCP4遺伝子(実施例1に記載;配列番号:2)、又はその断片は、その他のものの中で、全長UCP4遺伝子の単離又はFig1(配列番号:1)に開示されたUCP4配列に対して所望の配列同一性を持つ更に他の遺伝子(例えば、UCP4の天然発生変異体又は他の種からのUCP4をコードするもの)の単離のためのcDNAライブラリ用のハイブリッド形成プローブとして使用できる。
場合によっては、プローブの長さは約20〜約80塩基である。ハイブリッド形成プローブは、Fig2のヌクレオチド配列から、又は天然配列UCP4コード化DNAのプロモーター、エンハンサー成分及びイントロンを含むゲノム配列から誘導され得る。例えば、スクリーニング法は、UCP4遺伝子のコード化領域を周知のDNA配列を用いて単離して約40塩基の選択されたプローブを合成することを含む。ハイブリッド形成プローブは、32P又は35S等の放射性ヌクレオチド、又はアビジン/ビオチン結合系を介してプローブに結合したアルカリホスファターゼ等の酵素標識を含む種々の標識で標識されうる。本発明のUCP4遺伝子に相補的な配列を有する標識されたプローブは、ヒトcDNA、ゲノムDNA又はmRNAのライブラリーをスクリーニングし、そのライブラリーの何れのメンバーがプローブにハイブッド形成するかを決定するのに使用できる。ハイブリッド形成技術は、以下の実施例において更に詳細に記載する。
【0035】
本発明で考慮されるUCP4DNAの断片は、配列番号:2のDNAの少なくとも約20〜30の連続したヌクレオチドを含む配列を含む。好ましくは、これらの配列は配列番号:2のDNAの少なくとも約50の連続したヌクレオチドを含む。
また、プローブは、PCR技術に用いて、密接に関連したUCP4コード化配列の同定のための配列のプールを作成することができる。
また、UCP4をコードするヌクレオチド配列は、そのUCP4をコードする遺伝子のマッピングのため、及び遺伝子疾患を持つ個体の遺伝子分析のためのハイブリッド形成プローブの作成にも用いることができる。ここに提供されるヌクレオチド配列は、インサイツハイブリッド形成、既知の染色体マーカーに対する結合分析、及びライブラリーでのハイブリッド形成スクリーニング等の周知の技術を用いて、染色体及び染色体の特定領域にマッピングすることができる。
【0036】
UCP4のコード化配列が他のタンパク質に結合するタンパク質をコードする場合、UCP4は、結合性相互作用に含まれる他のタンパク質又は分子を同定するアッセイに用いることができる。このような方法によって、レセプター/リガンド結合性相互作用の阻害剤を同定することができる。このような結合性相互作用に含まれるタンパク質も、ペプチド又は小分子阻害剤又は結合性相互作用のアゴニストのスクリーニングに用いることができる。また、レセプターUCP4は、下記の実施例2に記載するリガンド以外の他の関連するリガンドの単離に使用できる。スクリーニングアッセイは、天然UCP4又はUCP4のレセプターの生物学的活性に似たリード化合物の発見のために設計される。このようなスクリーニングアッセイは、化学的ライブラリーの高スループットスクリーニングにも用いられ、小分子候補薬剤の同定に特に適したものとする。考慮される小分子は、合成有機又は無機化合物を含む。アッセイは、この分野で良く知られ特徴付けられているタンパク質−タンパク質結合アッセイ、生物学的スクリーニングアッセイ、免疫検定及び細胞ベースのアッセイを含む種々の型式で実施される。
また、UCP4又はその任意の修飾形態をコードする核酸は、トランスジェニック動物又は「ノックアウト」動物を産生するのにも使用でき、これらは治療的に有用な試薬の開発やスクリーニングに有用である。トランスジェニック動物(例えばマウス又はラット)とは、出生前、例えば胚段階で、その動物又はその動物の祖先に導入された導入遺伝子を含む細胞を有する動物である。導入遺伝子とは、トランスジェニック動物が発生する細胞のゲノムに組み込まれたDNAである。一実施形態では、UCP4をコードするcDNAは、確立された技術によりUCP4をコードするゲノムDNAをクローン化するために使用することができ、ゲノム配列を、UCP4をコードするDNAを発現する細胞を有するトランスジェニック動物を産生するために使用することができる。トランスジェニック動物、特にマウス又はラット等の特定の動物を産生する方法は当該分野において常套的になっており、例えば米国特許第4,736,866号や第4,870,009号に記述されている。典型的には、特定の細胞を組織特異的エンハンサーでのUCP4導入遺伝子の導入の標的にする。胚段階で動物の生殖系列に導入されたUCP4をコードする導入遺伝子のコピーを含むトランスジェニック動物はUCP4をコードするDNAの増大した発現の影響を調べるために使用できる。このような動物は、例えばその過剰発現を伴う病理学的状態に対して保護をもたらすと思われる試薬のテスター動物として使用できる。本発明のこの態様においては、動物を試薬で処理し、導入遺伝子を有する未処理の動物に比べて病理学的状態の発症が低ければ、病理学的状態に対する治療的処置の可能性が示される。
【0037】
あるいは、UCP4の非ヒト相同体は、動物の胚性細胞に導入されたUCP4をコードする変更ゲノムDNAと、UCP4をコードする内在性遺伝子との間の相同的組換えによって、UCP4をコードする欠陥又は変更遺伝子を有するUCP4「ノックアウト」動物を作成するために使用できる。例えば、UCP4をコードするcDNAは、確立された技術に従い、UCP4をコードするゲノムDNAのクローニングに使用できる。UCP4をコードするゲノムDNAの一部を欠失したり、組み込みを監視するために使用する選択可能なマーカーをコードする遺伝子等の他の遺伝子で置換することができる。典型的には、ベクターは無変化のフランキングDNA(5'と3'末端の両方)を数キロベース含む[例えば、相同的組換えベクターについてはThomas及びCapecchi, Cell, 51:503(1987)を参照のこと]。ベクターは胚性幹細胞に(例えばエレクトロポレーションによって)導入し、導入されたDNAが内在性DNAと相同的に組換えられた細胞が選択される[例えば、Li等, Cell, 69:915(1992)参照]。選択された細胞は次に動物(例えばマウス又はラット)の胚盤胞内に注入されて集合キメラを形成する[例えば、Bradley, Teratocarcinomas and Embryonic Stem Cells: A Practical Approach, E. J. Robertson, ed. (IRL, Oxford, 1987), pp. 113-152参照]。その後、キメラ性胚を適切な偽妊娠の雌性乳母に移植し、期間をおいて「ノックアウト」動物をつくり出す。胚細胞に相同的に組換えられたDNAを有する子孫は標準的な技術により同定され、それらを利用して動物の全細胞が相同的に組換えられたDNAを含む動物を繁殖させることができる。ノックアウト動物は、UCP4ポリペプチドが不在であることによるある種の病理的状態及びその病理的状態の進行に対する防御能力によって特徴付けられる。
【0038】
また、UCP4ポリペプチドをコードする核酸は遺伝子治療にも使用できる。遺伝子治療用途においては、例えば欠陥遺伝子を置換するため、治療的有効量の遺伝子産物のインビボ合成を達成するために遺伝子が導入される。「遺伝子治療」とは、1回の処理により継続的効果が達成される従来の遺伝子治療と、治療的に有効なDNA又はmRNAの1回又は繰り返し投与を含む遺伝子治療薬の投与の両方を含む。アンチセンスRNA及びDNAは、ある種の遺伝子のインビボ発現を阻止する治療薬として用いることができる。短いアンチセンスオリゴヌクレオチドを、細胞膜による制限された取り込みに起因する低い細胞内濃度にもかかわらず、それが阻害剤として作用する細胞中に移入できることは既に示されている(Zamecnik等, Proc. Natl. Acad. Sci. USA 83: 4143-4146 [1986])。オリゴヌクレオチドは、それらの負に荷電したリン酸ジエステル基を非荷電基で置換することによって取り込みを促進するように修飾してもよい。
生存可能な細胞に核酸を導入するための種々の技術が存在する。これらの技術は、核酸が培養細胞にインビトロで、あるいは意図する宿主の細胞においてインビボで移入されるかに応じて変わる。核酸を哺乳動物細胞にインビトロで移入するのに適した方法は、リポソーム、エレクトロポレーション、マイクロインジェクション、細胞融合、DEAE-デキストラン、リン酸カルシウム沈殿法などを含む。現在好ましいインビボ遺伝子移入技術は、ウイルス(典型的にはレトロウイルス)ベクターでの形質移入及びウイルス被覆タンパク質-リポソーム媒介形質移入である(Dzau等, Trends, in Biotechnology 11, 205-219)。幾つかの状況では、核酸供給源を、細胞表面膜タンパク質又は標的細胞に特異的な抗体、標的細胞上のレセプターに対するリガンド等の標的細胞を標的化する薬剤とともに提供するのが望ましい。リポソームを用いる場合、エンドサイトーシスを伴って細胞表面膜タンパク質に結合するタンパク質、例えば、特定の細胞型向性のカプシドタンパク質又はその断片、サイクルにおいて内部移行を受けるタンパク質に対する抗体、細胞内局在化を標的とし細胞内半減期を向上させるタンパク質が、標的化及び/又は取り込みの促進のために用いられる。レセプター媒介エンドサイトーシスは、例えば、Wu等, J. Biol. Chem. 262, 4429-2232 (1987); 及びWagner等, Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990)によって記述されている。遺伝子作成及び遺伝子治療のプロトコールの概説については、Anderson等, Science 256, 808-813 (1992)を参照のこと。
【0039】
UCP4遺伝子治療は、例えば、代謝状態の治療における用途を持つと考えられる。これは、例えば、上記の技術を用いて及びUCP4遺伝子を含むウイルス性ベクターを或る種の組織(筋肉又は脂肪)に導入することによりこれらの標的組織における代謝速度を上昇させ、よってエネルギー消費を上げることにより達成される。
一般的に、UCP4を用いる治療方法が本発明で考慮される。燃料の燃焼、電子移動、プロトンポンプ及びO2消費(集合的に代謝速度と呼んでもよい)はATP合成と関係している。代謝速度の一部(20%を越えることもある)が、ATP合成の無いマトリクス空間へのH+の「漏れ」戻りに帰するような哺乳動物における「非能率」があり得る。
UCP4はH+漏れの触媒に含まれ、それによりインビボでのエネルギー的非能率において役割を担うと考えられる。従って、哺乳動物(特に、代謝的に重要な組織)におけるUCP4活性又はUCP4の量(存在)を変更することは、同時にH+漏れ、代謝速度及び熱発生を変調させる。哺乳動物における代謝速度を(アップレギュレーション又はダウンレギュレーションの何れかの方式で)変調させることは種々の治療的用途を有し、肥満、発作に関連した徴候、外傷(火傷外傷など)、敗血症及び感染の治療を含む。
【0040】
肥満の治療において、当業者は、ミトコンドリア膜電位の変調が身体代謝速度を上昇させ、よって個体の体重減少の可能性を増大させるのに使用できることを認めるであろう。CP4の発現又は活性(脱共役など)をアップレギュレートする分子を同定するためにスクリーニングアッセイを実施してもよい。このように同定された分子は、次いで代謝速度を上昇させ体重減少を促進するために用ることができる。UCP4ポリペプチドは、UCP4の発現又は活性を変調させる治療的活性剤についてのリード化合物を同定するアッセイにおいて有用である。候補分子又は化合物は、候補分子又は化合物のUCP4発現又は活性に対する効果を決定するために、哺乳動物の細胞又は組織とともに検定される。このようなスクリーニングアッセイは、化学的ライブラリの高スループットスクリーニングに適用でき、特に小分子薬剤候補の同定に適している。小分子は、限定されないが、合成有機又は無機化合物を含む。アッセイは、タンパク質-タンパク質結合アッセイ、生化学的スクリーニングアッセイ、イムノアッセイ、細胞ベースのアッセイなどを含む種々の方式で実施できる。これらのアッセイ方式は、この分野で良く知られている。
従って、一実施態様では、UCP4の発現を促進又はアップレギュレートする分子の同定するスクリーニングアッセイを実施する方法が提供され、それは、UCP4を含むと考えられる哺乳動物細胞又は組織試料を候補分子に暴露し、続いて前記試料中でのUCP4の発現を分析する工程を含む。この方法において、試料はミトコンドリア膜電位について更に分析される。場合によっては、UCP4はFig1(配列番号:1)のアミノ酸残基1から323を含むポリペプチドである。分析される試料は種々の哺乳動物細胞又は組織を含んでよく、限定されないが、ヒト脳組織を含む。スクリーニングアッセイで用いられる候補分子は、合成有機又は無機化合物を含む小分子であってよい。これに換わる実施態様では、スクリーニングアッセイは、UCP4の発現を低下又はダウンレギュレートする分子を同定するために実施される。これらの候補分子がUCP4の発言及び/又は活性に対して持ちうる効果は、例えば、同様の哺乳動物において観察されるUCP4の発現又は活性といった対照又は参照試料と比較される。
【0041】
またUCP4は診断方法においても用いられる。例えば、個体の細胞又は組織におけるUCP4の存在又は不存在、あるいはUCP4の過剰-又は過小-発現は、下記の実施例に記載するものを含む当該分野で知られたアッセイを用いて検出できる。よって、本発明は、哺乳動物細胞又は組織試料におけるUCP4の発現を検出する方法が提供され、それは、哺乳動物細胞又は組織試料をDNAプローブと接触させ、前記試料中でのUCP4mRNA転写物の発現を分析することを含む。試料は種々の哺乳動物細胞又は組織を含んでよく、限定されないが、ヒト脳組織を含む。熟練実務者は、このような検出アッセイから得た情報を、代謝状態又は肥満発症の危険性の予測における補助に使用できる。例えば、患者におけるUCP4活性が異常に高い又は低いことが測定された場合、ホルモン治療などの治療を施してUCP4活性を生理学的に許容できる状態に戻すことができる。
また、哺乳動物における異常なUCP4機能の検出は、異常な神経活性又は神経変性の診断における補助に使用できる。現在は、UCP4が正常な脳機能(及び関連する神経活性)に必要な脳温度又は代謝速度の調節に含まれると考えられている。また現在は、cpが反応性酸素種の生成を制御し、従って神経変性に寄与していると考えられている。スクリーニングアッセイにおいて同定され、UCP4発現又は機能を抑制することが見出された分子は、UCP4が発熱の発症中にアップレギュレートされると考えられるため、発熱の治療にも用いられる。
【0042】
F.抗UCP4抗体
本発明は、さらに抗-UCP4抗体を提供するものである。抗体の例としては、ポリクローナル、モノクローナル、ヒト化、二重特異性及びヘテロ抱合体抗体が含まれる。
1.ポリクローナル抗体
本発明の抗-UCP4抗体はポリクローナル抗体を含む。ポリクローナル抗体の調製方法は当業者に知られている。哺乳動物においてポリクローナル抗体は、例えば免疫化剤、及び所望するのであればアジュバントを、一又は複数回注射することで発生させることができる。典型的には、免疫化剤及び/又はアジュバントを複数回皮下又は腹腔内注射により、哺乳動物に注射する。免疫化剤は、UCP4ポリペプチド又はその融合タンパク質を含みうる。免疫化剤を免疫化された哺乳動物において免疫原性が知られているタンパク質に抱合させるのが有用である。このような免疫原タンパク質の例は、これらに限られないが、キーホールリンペットヘモシアニン、血清アルブミン、ウシサイログロブリン及び大豆トリプシンインヒビターが含まれる。使用され得るアジュバントの例には、フロイント完全アジュバント及びMPL-TDMアジュバント(モノホスホリル脂質A、合成トレハロースジコリノミコラート)が含まれる。免疫化プロトコールは、過度の実験なく当業者により選択されるであろう。
【0043】
2.モノクローナル抗体
あるいは、抗-UCP4抗体はモノクローナル抗体であってもよい。モノクローナル抗体は、Kohler及びMilstein, Nature, 256:495 (1975)に記載されているようなハイブリドーマ法を使用することで調製することができる。ハイブリドーマ法では、マウス、ハムスター又は他の適切な宿主動物を典型的には免疫化剤により免疫化することで、免疫化剤に特異的に結合する抗体を生成するかあるいは生成可能なリンパ球を誘発する。また、リンパ球をインビトロで免疫化することもできる。
免疫化剤は、典型的にはUCP4ポリペプチド又はその融合タンパク質を含む。一般にヒト由来の細胞が望まれる場合には末梢血リンパ球(「PBL」)が使用され、あるいは非ヒト哺乳動物源が望まれている場合は、脾臓細胞又はリンパ節細胞が使用される。次いで、ポリエチレングリコール等の適当な融合剤を用いてリンパ球を不死化細胞系と融合させ、ハイブリドーマ細胞を形成する[Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp. 59-103]。不死化細胞系は、通常は、形質転換した哺乳動物細胞、特に齧歯動物、ウシ、及びヒト由来の骨髄腫細胞である。通常、ラット又はマウスの骨髄腫細胞系が使用される。ハイブリドーマ細胞は、好ましくは、未融合の不死化細胞の生存又は成長を阻害する一又は複数の物質を含有する適切な培地で培養される。例えば、親細胞が、酵素のヒポキサンチングアニンホスホリボシルトランスフェラーゼ(HGPRT又はHPRT)を欠いていると、ハイブリドーマの培地は、典型的には、ヒポキサチン、アミノプチリン及びチミジンを含み(「HAT培地」)、この物質がHGPRT欠乏性細胞の増殖を阻止する。
【0044】
好ましい不死化細胞系は、効率的に融合し、選択された抗体産生細胞による安定した高レベルの抗体発現を支援し、HAT培地のような培地に対して感受性である。より好ましい不死化株化細胞はマウス骨髄腫株であり、これは例えばカリフォルニア州サンディエゴのSalk Institute Cell Distribution Centerやバージニア州マナッサスのアメリカン・タイプ・カルチャー・コレクションより入手可能である。ヒトモノクローナル抗体を生成するためのヒト骨髄腫及びマウス-ヒト異種骨髄腫細胞系も開示されている[Kozbor, J. Immunol., 133:3001 (1984)、Brodeur等, Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, (1987) pp. 51-63]。
次いでハイブリドーマ細胞が培養される培養培地を、UCP4に対するモノクローナル抗体の存在について検定する。好ましくは、ハイブリドーマ細胞によって生成されたモノクローナル抗体の結合特異性は免疫沈降又はラジオイムノアッセイ(RIA)や酵素結合免疫測定法(ELISA)等のインビトロ結合検定法によって測定する。このような技術及びアッセイは、当該分野において公知である。モノクローナル抗体の結合親和性は、例えばMunson及びPollard, Anal. Biochem., 107:220 (1980)によるスキャッチャード分析法によって測定することができる。
所望のハイブリドーマ細胞が同定された後、クローンを制限希釈工程によりサブクローニングし、標準的な方法で成長させることができる[Goding, 上掲]。この目的のための適当な培地には、例えば、ダルベッコの改変イーグル培地及びRPMI-1640倍地が含まれる。あるいは、ハイブリドーマ細胞は哺乳動物においてインビボで腹水として成長させることもできる。
【0045】
サブクローンによって分泌されたモノクローナル抗体は、例えばプロテインAセファロース法、ヒドロキシルアパタイトクロマトグラフィー法、ゲル電気泳動法、透析法又はアフィニティークロマトグラフィー等の従来の免疫グロブリン精製方法によって培養培地又は腹水液から単離又は精製される。
また、モノクローナル抗体は、組換えDNA法、例えば米国特許第4,816,567号に記載された方法により作成することができる。本発明のモノクローナル抗体をコードするDNAは、常套的な方法を用いて(例えば、マウス抗体の重鎖及び軽鎖をコードする遺伝子に特異的に結合可能なオリゴヌクレオチドプローブを使用して)、容易に単離し配列決定することができる。本発明のハイブリドーマ細胞はそのようなDNAの好ましい供給源となる。ひとたび単離されたら、DNAは発現ベクター内に配することができ、これが宿主細胞、例えばサルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、あるいは免疫グロブリンタンパク質を生成等しない骨髄腫細胞内に形質移入され、組換え宿主細胞内でモノクローナル抗体の合成をすることができる。また、DNAは、例えば相同マウス配列に換えてヒト重鎖及び軽鎖定常ドメインのコード配列を置換することにより[US. Patent No.4,816,567;Morrison等, 上掲]、又は免疫グロブリンコード配列に非免疫グロブリンポリペプチドのコード配列の一部又は全部を共有結合することにより修飾することができる。このような非免疫グロブリンポリペプチドは、本発明の抗体の定常ドメインの代わりに置換するか、本発明の抗体の一つの抗原結合部位の可変ドメインの代わりに置換し、キメラ性二価抗体を産生することができる。このような非免疫グロブリンポリペプチドは、本発明の抗体の定常ドメインに置換でき、あるいは本発明の抗体の1つの抗原結合部位の可変ドメインに置換でき、キメラ性二価抗体を生成する。
抗体は一価抗体であってもよい。一価抗体の調製方法は当該分野においてよく知られてる。例えば、一つの方法は免疫グロブリン軽鎖と修飾重鎖の組換え発現を含む。重鎖は一般的に、重鎖の架橋を防止するようにFc領域の任意のポイントで切断される。あるいは、関連するシステイン残基を他のアミノ酸残基で置換するか欠失させて架橋を防止する。
一価抗体の調製にはインビトロ法がまた適している。抗体の消化による、その断片、特にFab断片の生成は、当該分野において知られている慣用的技術を使用して達成できる。
【0046】
3.ヒト及びヒト化抗体
本発明の抗-UCP4抗体は、さらにヒト化抗体又はヒト抗体を含む。非ヒト(例えばマウス)抗体のヒト化形とは、キメラ免疫グロブリン、免疫グロブリン鎖あるいはその断片(例えばFv、Fab、Fab'、F(ab')2あるいは抗体の他の抗原結合性サブ配列)であって、非ヒト免疫グロブリンに由来する最小配列を含むものである。ヒト化抗体はレシピエントの相補性決定領域(CDR)の残基が、マウス、ラット又はウサギのような所望の特異性、親和性及び能力を有する非ヒト種(ドナー抗体)のCDRの残基によって置換されたヒト免疫グロブリン(レシピエント抗体)を含む。幾つかの例では、ヒト免疫グロブリンのFvフレームワーク残基は、対応する非ヒト残基によって置換されている。また、ヒト化抗体は、レシピエント抗体にも、移入されたCDRもしくはフレームワーク配列にも見出されない残基を含んでいてもよい。一般に、ヒト化抗体は、全てあるいはほとんど全てのCDR領域が非ヒト免疫グロブリンのものに対応し、全てあるいはほとんど全てのFR領域がヒト免疫グロブリンコンセンサス配列のものである、少なくとも1つ、典型的には2つの可変ドメインの実質的に全てを含む。ヒト化抗体は、最適には免疫グロブリン定常領域(Fc)、典型的にはヒトの免疫グロブリンの定常領域の少なくとも一部を含んでなる[Jones等, Nature, 321:522-525 (1986); Riechmann等, Nature, 332:323-329 (1988); 及びPresta, Curr. Op Struct. Biol., 2:593-596 (1992)]。
【0047】
非ヒト抗体をヒト化する方法はこの分野でよく知られている。一般的に、ヒト化抗体には非ヒト由来の一又は複数のアミノ酸残基が導入される。これら非ヒトアミノ酸残基は、しばしば、典型的には「移入」可変ドメインから得られる「移入」残基と称される。ヒト化は基本的にウィンター(winter)及び共同研究者[Jones等, Nature, 321:522-525 (1986);Riechmann等, Nature, 332:323-327 (1988);Verhoeyen等, Science, 239:1534-1536 (1988)]の方法に従って、齧歯類CDR又はCDR配列をヒト抗体の対応する配列に置換することにより実施される。よって、このような「ヒト化」抗体は、無傷のヒト可変ドメインより実質的に少ない分が非ヒト種由来の対応する配列で置換されたキメラ抗体(米国特許第4,816,567号)である。実際には、ヒト化抗体は典型的には幾つかのCDR残基及び場合によっては幾つかのFR残基が齧歯類抗体の類似する部位からの残基によって置換されたヒト抗体である。
また、ヒト抗体は、ファージ表示ライブラリ[Hoogenboom及びWinter, J. Mol. Biol., 227:381 (1992);Marks等, J. Mol. Biol., 222:581 (1991)]を含むこの分野で知られた種々の方法を用いて作成することもできる。また、Cole等及びBoerner等の方法も、ヒトモノクローナル抗体の調製に利用することができる(Cole等, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss. p.77(1985)及びBoerner等, J. Immunol., 147(1):86-95(1991) )。同様に、ヒト抗体はヒト免疫グロブリン座位をトランスジェニック動物、例えば内在性免疫グロブリン遺伝子は部分的又は完全に不活性化されたマウスに導入することにより産生することができる。投与の際に、遺伝子再配列、組立、及び抗体レパートリーを含むあらゆる観点においてヒトに見られるものに非常に類似しているヒト抗体の生産が観察される。このアプローチは、例えば米国特許第5,545,807号;同第5,545,806号;同第5,569,825号;同第5,625,126号;同第5,633,425号;同第5,661,016号、及び次の科学文献:Marks等, Bio/Technology 10, 779-783 (1992); Lonberg等, Nature 368 856-859 (1994); Morrison, Nature 368, 812-13 (1994); Fishwild等, Nature Biotechnology 14, 845-51 (1996); Neuberger, Nature Biotechnology 14, 826 (1996); Lonberg及びHuszar, Intern. Rev. Immunol. 13 65-93 (1995)に記載されている。
【0048】
4.二重特異性抗体
二重特異性抗体は、少なくとも2つの異なる抗原に対して結合特異性を有するモノクローナル抗体、好ましくはヒトもしくはヒト化抗体である。本発明の場合において、結合特異性の一方はUCP4に対してであり、他方は任意の他の抗原、好ましくは細胞表面タンパク質又はレセプター又はレセプターサブユニットに対してである。
二重特異性抗体を作成する方法は当該技術分野において周知である。伝統的には、二重特異性抗体の組換え生産は、二つの重鎖が異なる特異性を持つ二つの免疫グロブリン重鎖/軽鎖対の同時発現に基づく[Milstein及びCuello, Nature, 305:537-539 (1983)]。免疫グロブリンの重鎖と軽鎖を無作為に取り揃えるため、これらハイブリドーマ(クアドローマ)は10種の異なる抗体分子の潜在的混合物を生成し、その内一種のみが正しい二重特異性構造を有する。正しい分子の精製は、アフィニティークロマトグラフィー工程によって通常達成される。同様の手順が1993年5月13日公開のWO 93/08829、及びTraunecker等, EMBO J.,10:3655-3656 (1991)に開示されている。
所望の結合特異性(抗体-抗原結合部位)を有する抗体可変ドメインを免疫グロブリン定常ドメイン配列に融合できる。融合は、好ましくは少なくともヒンジ部、CH2及びCH3領域の一部を含む免疫グロブリン重鎖定常ドメインとのものである。少なくとも一つの融合には軽鎖結合に必要な部位を含む第一の重鎖定常領域(CH1)が存在することが望ましい。免疫グロブリン重鎖融合をコードするDNA、及び望むのであれば免疫グロブリン軽鎖を、別々の発現ベクターに挿入し、適当な宿主生物に同時形質移入する。二重特異性抗体を作成するための更なる詳細については、例えばSuresh等, Methods in Enzymology, 121:210(1986)を参照されたい。
【0049】
5.ヘテロ抱合体抗体
ヘテロ抱合抗体もまた本発明の範囲に入る。ヘテロ抱合抗体は、2つの共有結合した抗体からなる。このような抗体は、例えば、免疫系細胞を不要な細胞に対してターゲティングさせるため[米国特許第4,676,980号]及びHIV感染の治療のために[WO 91/00360; WO 92/200373; EP 03089]提案されている。この抗体は、架橋剤に関連したものを含む合成タンパク化学における既知の方法を使用して、インビトロで調製することができると考えられる。例えば、ジスルフィド交換反応を使用するか又はチオエーテル結合を形成することにより、免疫毒素を作成することができる。この目的に対して好適な試薬の例には、イミノチオレート及びメチル-4-メルカプトブチリミデート、及び例えば米国特許第4,6767,980号に開示されているものが含まれる。
【0050】
G.抗-UCP4抗体の用途
本発明の抗UCP4抗体は様々な有用性を有している。例えば、抗-UCP4抗体は、UCP4の診断アッセイ、例えばその特定細胞又は組織での発現の検出に用いられる。競合的結合アッセイ、直接又は間接サンドウィッチアッセイ及び不均一又は均一相で行われる免疫沈降アッセイ[Zola, Monoclonal Antibodies: A Manual of Techniques, CRC Press, Inc. (1987) pp. 147-158]等のこの分野で知られた種々の診断アッセイ技術が使用される。診断アッセイで用いられる抗体は、検出可能な部位で標識される。検出可能な部位は、直接又は間接に検出可能なシグナルを発生しなければならない。例えば、検出可能な部位は、3H、14C、32P、35S又は125I等の放射性同位体、フルオレセインイソチオシアネート、ローダミン又はルシフェリン等の蛍光又は化学発光化合物、あるいはアルカリホスファターゼ、ベータ-ガラクトシダーゼ又はセイヨウワサビペルオキシダーゼ等の酵素であってよい。Hunter等 Nature, 144:945 (1962);David等, Biochemistry, 13: 1014 (1974);Pain等, J. Immunol. Meth., 40:219 (1981) ;及びNygren, J. Histochem. and Cytochem., 30:407 (1982)に記載された方法を含む、抗体を検出可能な部位に抱合するためにこの分野で知られた任意の方法が用いられる。
また、抗-UCP4抗体は、組換え細胞培養又は天然供給源からのUCP4のアフィニティー精製にも有用である。この方法においては、UCP4に対する抗体を、当該分野でよく知られている方法を使用して、セファデックス樹脂や濾紙のような適当な支持体に固定化する。次に、固定化された抗体を、精製するUCP4を含む試料と接触させた後、固定された抗体に結合したUCP4以外の試料中の物質を実質的に全て除去する適当な溶媒で支持体を洗浄する。最後に、UCP4を抗体から離脱させる他の適当な溶媒で支持体を洗浄する。
【0051】
以下の実施例は例示するためにのみ提供されるものであって、本発明の範囲を決して限定することを意図するものではない。
本明細書で引用した全ての特許及び参考文献の全体を、出典明示によりここに取り込む。
(実施例)
実施例で言及されている全ての他の市販試薬は、特に示さない限りは製造者の使用説明に従い使用した。ATCC登録番号により以下の実施例及び明細書全体を通して特定されている細胞の供給源はアメリカン・タイプ・カルチャー・コレクション、マナッサス、バージニアである。
【0052】
実施例1
ヒトUCP4をコードするcDNAクローンの単離
公的なESTデータベース(例えばGenBank)及び個人的なESTデータベース(LIFESEQ(商品名)、Incyte Pharmaceuticals、Palo Alto, CA)を含むESTデータベースをヒトUCP3と相同性を持つ配列について検索した。検索は、コンピュータプログラムBLAST又はBLAST2[Altschul等, Methods in Enzymology, 266:460-480 (1996)]を用いて、EST配列の6フレーム翻訳物に対するUCP3反配列の比較として実施した。
BLASTスコアが70(90の場合もある)又はそれ以上となり、周知のタンパク質をコードしない比較物を集団化し、プログラムAssemblyLIGN及びMacVector(Oxford Molecular Group, Inc.)でコンセンサスDNA配列に組み立てた。
DNA配列(「from DNA」)をAssemblyLIGNソフトウェアを用いて他のEST配列に対して組み立てた(Fig7;配列番号:5)。IncyteデータベースからのESTは、以下の登録番号を持つ配列を含んでいた:3468504;3369262;4220747;1254733;5016160;3770189;2265329;928717;3715961;3528102;961523;1863723;382533;918252;918404;4313009;3801604;c-swh06;3464955;c-1sh09;090424;1316891;1342069;1435593;16014011;1669098;1668103;222248;243244;246984;272663;305678;305871;3369262;3464955;及び3715961。さらに、fromDNA配列をBLAST及びAssemblyLIGNの繰り返しサイクルを用いて伸長させ、上記のEST配列の供給源を用いて可能な限り伸長させた。
このDNA配列に基づいて、PCRによりUCP4の全長コード化配列のクローンを単離するためにオリゴヌクレオチドを合成した。正及び逆のPCRプライマーは一般的に20から30ヌクレオチドの範囲であり、しばしば約100−1000bpの長さのPCR産物を与えるように設計される。プローブ配列は典型的には40−55bpの長さである。或る場合には、コンセンサス配列が約1−1.5kbpを越えるときに更なるオリゴヌクレオチドが合成される。
【0053】
PCRプライマーの対(正及び逆)を合成した:
正方向PCRプライマー
CGCGGATCCCGTTATCGTCTTGCGCTACTGC(U401)(配列番号:3)
逆方向PCRプライマー
GCGGAATTCTTAAAATGGACTGACTCCACTCATC(U406)(配列番号:4)
NH2-末端Flagタグを持つUCP4もpcDNA3にBamHI及びEcoRI制限部位の間にクローニングした(pcDNA3Flag-UCP4;Invitrogen)。以下の正方向及び逆方向プライマーを合成した。
正方向PCRプライマー
CGCGGATCCGAAATGGACTACAAGGACGACGATGACAAGTCCGTCCCGGAGGAGGAGG(U410)(配列番号:6)
逆方向PCRプライマー
GCGGAATTCTTAAAATGGACTGACTCCACTCATC(U406)(配列番号:4)
cDNAライブラリー作成のためのRNAは、ヒト脳組織から単離した。cDNAクローンを単離するために用いられるcDNAライブラリーは、Invitrogen, San Diego, CA からのもの等の市販試薬を用いて標準的方法によって作成した。cDNAは、NotI部位を含むオリゴdTでプライムし、SalIヘミキナーゼアダプターの平滑末端で結合させ、NotIで切断し、ゲル電気泳動でおよそのサイズ分割をし、決められた方向で適当なクローニングベクター(pRKB又はpRKDなど;pRK5Bは、SfiI部位を持たないpRK5Dの前駆体である;Holmes等, Science, 253:1278-1280 (1991)参照)に独特のXhol及びNotI部位においてクローン化した。
上記のように単離したクローンのDNA配列は、UCP4の全長DNA配列(ここで、DNA77568−1626と命名される[Fig2、配列番号:2])及びUCP4の誘導タンパク質配列を与えた。
【0054】
UCP4の全核酸配列をFig2(配列番号:2)に示す。クローンDNA77568−1626は単一のオープンリーディングフレームを含み、ヌクレオチド位置40−42に見かけの翻訳開始部位、及びヌクレオチド位置1009−1011に見かけの停止コドンを有する(Fig2;配列番号:2参照)。予測されたポリペプチド前駆体は323アミノ酸長である。現在は、UCP4は膜結合タンパク質であり、少なくとも6つの膜貫通領域を含むと考えられている。UCP4のアミノ酸配列における推定膜貫通領域はFig3に例示した。pcDNA3ベクター(Invitrogen)に含まれる、DNA77568−1626と称されるクローンDNA77568はATCCに寄託され、ATCC寄託番号203229番号203134が付与されている。UCP4ポリペプチドは、寄託されたATCC203229ベクターのcDNA挿入物によってコードされる分子を発現させることにより得られ又は得られうる。寄託されたATCC203134ベクターのBamHI及びEcoRI制限酵素での消化は、約972プラス34塩基対の挿入物を生じる。Fig1に示した全長UCP4タンパク質は、約36,061ダルトンの見積もられた分子量及び約9.28のpIを持つ。
UCP4とUCP1、2及び3との配列のアラインメントをFig3に例示する。幾つかの特記すべき相違がUCP1とUCP4との間に特定された。UCP1がその推定ヌクレオチド結合部位を欠く場合、それはヌクレオチドによる阻害に耐性であり、UCP1のPhe-267がTyr残基で置換されている場合、UCP1は向上した脱共役活性を有する。[Gonzalez-Barroso等, Eur. J. Biochem., 239: 445-450 (1996); Mayinger等, Biochem., 31: 10536-10543 (1992)]。さらに、UCP2及びUCP3と同様に、UCP4はこの位置にTyr残基を持つ(Fig3参照)。さらに、UCP1のカルボキシ末端は、遊離脂肪酸(FFA)によるその脱共役活性の活性化に関係していた。Cys-305のAla又はSer残基による置換は、FFAによる活性化の低下又は向上を各々もたらした。[Gonzalez-Barroso等, 上掲]。UCP2はAla-307を持ち、UCP3はSer-298を持ち、そしてUCP4はSer-321を持つので、UCP4及び他のUCPsの脱共役活性はヌクレオチド及びFFAによって異なる調節がなされると思われる。
ヒトUCP4遺伝子は、遺伝子マーカーSHGC-34952に近接した染色体位置6p11.2-q12にマッピングされた。
【0055】
実施例2
ノーザンブロット分析
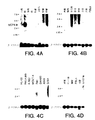
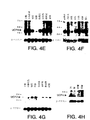
ヒト組織におけるUCP4 mRNAの発現をノーザンブロット分析によって試験した。ヒトRNAブロットを、全長UCP4cDNAに基づく1キロベースの32P標識DNAプローブにハイブリッド形成させた;プローブは、pcDNA3UCP4を消化し、UCP4cDNA挿入物を精製することにより作成した。ヒト成人RNAブロットMTN-II(Clontech)(Fig4A、4B、4D、4E、及び4F)、ヒト胎児組織ブロット(Fig4D及び4H)、PBL(Fig4B及び4D)、及び癌細胞(Fig4C)を、DNAプローブとともにインキュベートした。Fig4Cに見られるように、プローブされた癌細胞は、HL-60(前骨髄球性白血病)、HeLa細胞、K562(慢性骨髄性白血病)、MOLT-4(リンパ芽球性白血病)、Raji(バーキットのリンパ腫)、SW480(結腸直腸腺癌)、A549(肺癌)、及びG361(黒色腫)を含む。また、UCP2の発現もヒト脳多重組織ブロットをヒトUCP2cDNAでプローブすることにより試験した(Fig4G)。全てのブロットを、次いでβ-アクチンcDNAでプローブした。
ノーザン分析は、製造者(Clontech)の指示に従って実施した。ブロットは、x-線に終夜暴露した後に現像した。
Fig4A-4Hに示すように、UCP4mRNA転写物が検出された。発現は、脳組織、脊髄、髄質、脳梁、及び黒質に見られたが、試験した他のヒト組織又は癌細胞系には見られなかった。UCP4転写レベルは、脊髄、髄質、脳梁、及び黒質より脳組織において高かったが(Fig4A、4E、及び4F)、UCP4転写レベルは脊髄及び髄質においてより高かった(Fig4G)。ヒト胎児組織ブロットにおいては、UCP4転写は脳においてのみ見られた(Fig4H)。
【0056】
実施例3
ハイブリッド形成プローブとしてのUCP4の使用
以下の方法は、UCP4をコードするヌクレオチド配列のハイブリッド形成プローブとしての使用を記載する。
全長又は成熟UCP4(Fig2、配列番号:2に示す)のコード化配列を含むDNAは、ヒト組織cDNAライブラリ又はヒト組織ゲノムライブラリにおける同種DNA類(UCP4の天然発生変異体をコードするものなど)のスクリーニングのためのプローブとして使用される。
いずれかのライブラリDNAを含むフィルターのハイブリッド形成及び洗浄は、以下の高い緊縮条件で実施した。放射性標識UCP4ポリペプチド誘導プローブのフィルターへのハイブリッド形成は、50%ホルムアルデヒド、5xSSC、0.1%SDS、0.1%ピロリン酸ナトリウム、50mMリン酸ナトリウム、pH6.8、2xデンハード溶液、及び10%デキストラン硫酸の溶液中で、42℃において20時間行った。フィルターの洗浄は、0.1xSSC及び0.1%SDSの水溶液中、42℃で行った。
次いで、全長天然配列UCP4をコードするDNAと所望の配列同一性を有するDNAは、この分野で知られた標準的な方法を用いて同定できる。
【0057】
実施例4:大腸菌におけるUCP4の発現
この実施例は、大腸菌における組み換え発現による、UCP4ポリペプチドの調製を例示する。
全長UCP4をコードするDNA配列(配列番号:2)は、選択されたPCRプライマーを用いて最初に増幅した。プライマーは、選択された発現ベクターの制限酵素部位に対応する制限酵素部位を持たなければならない。種々の発現ベクターが用いられる。好適なベクターの例は、pBR322(大腸菌から誘導されたもの;Bolivar等, Gene, 2:95 (1977)参照)であり、アンピシリン及びテトラサイクリン耐性についての遺伝子を含む。ベクターは制限酵素で消化され脱リン酸される。PCR増幅した配列は、次いで、ベクターに結合させる。ベクターは、場合によっては抗生物質耐性遺伝子、trpプロモーター、polyhisリーダー(最初の6つのSTIIコドン、polyhis配列、及びエンテロキナーゼ切断部位を含む)、UCP4コード化領域、ラムダ転写終結区、及びargU遺伝子を含む。
ライゲーション混合物は、次いで、上掲のSambrook等に記載された方法を用いた選択した大腸菌の形質転換に使用される。形質転換体は、それらのLBプレートにおいて成長する能力により同定され、次いで抗生物質耐性クローンが選択される。プラスミドDNAが単離され制限分析及びDNA配列分析で確認される。
選択されたクローンは、抗生物質を添加したLBブロスなどの液体培地で終夜成長させることができる。終夜培地は、続いて大規模培地の播種に用いられる。次に細胞を最適密度で成長させ、その間に発現プロモーターが作動する。
さらに数時間の培養の後、細胞を採集して遠心分離できる。シグナル配列が存在せず、発現されたUCP4が細胞内である場合、遠心分離で得られた細胞ペレットは、この分野で知られた種々の試薬を用いて可溶化され、次いで可溶化UCP4タンパク質を金属キレート化カラムを用いてポリペプチドを緊密に結合させる条件下で精製した。シグナル配列が存在する場合、発現されたUCP4は細胞の周辺質又は培養培地から得ることができる。UCP4ポリペプチドの抽出及び/又は可溶化は、この分野で知られた試薬及び技術を用いて実施できる(例えば、米国特許第5,663,304号;第5,407,810号参照)。
【0058】
実施例5
哺乳動物細胞におけるUCP4の発現
この実施例は、哺乳動物細胞における組み換え発現によるUCP4の調製を例示する。
発現ベクターとして、ベクターpRK5(1989年3月15日発行のEP 307,247参照)を用いた。場合によっては、UCP4DNAを選択した制限酵素でpRK5に結合させ、上掲のSambrook等に記載されたような結合方法を用いてUCP4DNAを挿入させる。得られたベクターは、pRK5-UCP4と呼ばれる。
一実施態様では、選択された宿主細胞は293細胞とすることができる。ヒト293細胞(ATCC CCL 1573)は、ウシ胎児血清及び場合によっては滋養成分及び/又は抗生物質を添加したDMEMなどの媒質中で組織培養プレートにおいて成長させて集密化した。約10μgのpRK5-UCP4DNAを約1μgのVA RNA遺伝子をコードするDNA[Thimmappaya等, Cell, 31:543 (1982)]と混合し、500μlの1mMトリス-HCl、0.1mMEDTA、0.227MCaCl2に溶解させた。この混合物に、滴状の、500μlの50mMHEPES(pH7.35)、280mMのNaCl、1.5mMのNaPO4を添加し、25℃で10分間析出物を形成させた。析出物を懸濁し、293細胞に加えて37℃で約4時間定着させた。培養培地を吸引し、2mlのPBS中20%グリセロールを30分間添加した。293細胞は、次いで無血清培地で洗浄して新鮮な培地を添加し、細胞を約5日間インキュベートした。
形質移入の約24時間後、培養培地を除去し、培養培地(のみ)又は200μCi/mlの35S-システイン及び200μCi/mlの35S-メチオニンを含む培養培地で置換した。12時間のインキュベーションの後、条件培地を回収し、スピンフィルターで濃縮し、15%SDSゲルに添加した。処理したゲルを乾燥させ、UCP4ポリペプチドの存在を現す選択された時間にわたってフィルムにさらした。形質転換した細胞を含む培地は、更なるインキュベーションを施し(無血清培地で)、培地を選択されたバイオアッセイで試験した。
【0059】
これに換わる技術において、UCP4は、Somparyac等, Proc. Natl. Acad. Sci., 12:7575 (1981)に記載されたデキストラン硫酸法を用いて293細胞に一過的に導入される。293細胞は、スピナーフラスコ内で最大密度まで成長させ、700μgのpRK5-UCP4DNAを添加する。細胞は、まずスピナーフラスコから遠心分離によって濃縮し、PBSで洗浄した。DNA−デキストラン沈殿物を細胞ペレット上で4時間インキュベートした。細胞を20%グリセロールで90秒間処理し、組織培養培地で洗浄し、組織培養培地、5μg/mlウシインシュリン及び0.1μg/mlウシトランスフェリンを含むスピナーフラスコに再度導入した。約4日後に、条件培地を遠心分離して濾過し、細胞及び細胞片を除去した。次いで発現されたUCP4を含む試料を濃縮し、透析及び/又はカラムクロマトグラフィー等の選択した方法によって精製した。
他の実施態様では、UCP4はCHO細胞で発現させることができる。pRK5-UCP4は、CaPO4又はDEAE-デキストランなどの公知の試薬を用いてCHO細胞に形質移入することができる。上記したように、細胞培地をインキュベートし、培地を培養培地(のみ)又は35S-メチオニン等の放射性標識を含む培地に置換することができる。UCP4ポリペプチドの存在を同定した後、培養培地を無血清培地に置換してもよい。好ましくは、培地を約6日間インキュベートし、次いで条件培地を収集する。次いで、発現されたUCP4を含む培地を濃縮して、選択した方法にとって精製することができる。
また、エピトープタグUCP4は、宿主CHO細胞において発現させてもよい。UCP4はpRK5ベクターからサブクローニングした。サブクローン挿入物は、次いで、PCRを施してバキュロウイルス発現ベクター中のpoly-hisタグ等の選択されたエピトープタグを持つ枠に融合できる。poly-hisタグUCP4挿入物は、次いで、安定なクローンの選択のためのDHFR等の選択マーカーを含むSV40誘導ベクターにサブクローニングできる。最後に、CHO細胞をSV40誘導ベクターで(上記のように)形質移入した。発現を確認するために、上記のように標識化を行ってもよい。発現されたpoly-hisタグUCP4を含む培養培地は、次いで濃縮し、Ni2+-キレートアフィニティクロマトグラフィー等の選択された方法により精製できる。
これに換わる方法では、UCP4は細胞内に発現させてもよい(シグナル配列無しが用いられる場合)。この細胞内発現、それに続く抽出又は可溶化及び精製は、この分野で知られた技術及び試薬を用いて実施してよい。
【0060】
実施例6
酵母菌でのUCP4ポリペプチドの発現
以下の方法は、酵母菌中でのUCP4の組換え発現を記載する。
第1に、ADH2/GAPDHプロモーターからのUCP4の細胞内生産又は分泌のための酵母菌発現ベクターを作成する。UCP4をコードするDNA及びプロモーターを選択したプラスミドの適当な制限酵素部位に挿入してUCP4の細胞内発現を指示する。分泌のために、UCP4をコードするDNAを選択したプラスミドに、ADH2/GAPDHプロモーターをコードするDNA、天然UCP4シグナルペプチド又は他の哺乳動物シグナルペプチド、又は、例えば、酵母菌アルファ因子又はインベルターゼ分泌シグナル/リーダー配列、及び(必要ならば)UCP4の発現のためのリンカー配列とともにクローニングすることができる。あるいは、UCP4の天然シグナル配列が用いられる。
S.Cerevisiae酵母菌株AB110等の酵母菌は、次いで上記の発現プラスミドで形質転換し、例えば米国特許第4,775,662号及び第5,010,00号に記載されたような選択された発酵培地中で培養できる。形質転換した酵母菌上清は、10%トリクロロ酢酸での沈降及びSDS-PAGEによる分離、次いでクマシーブルー染色でゲルの染色により分析することができる。
続いて組み換えUCP4は、発酵培地から遠心分離により酵母菌細胞を除去し、次いで選択されたカートリッジフィルターを用いて培地を濃縮することによって単離及び精製できる。UCP4を含む濃縮物は、選択されたカラムクロマトグラフィー樹脂を用いてさらに精製してもよい。これに換わる方法では、UCP4は細胞内に発現させてもよい(シグナル配列無しが用いられる場合)。この細胞内発現、それに続く抽出又は可溶化及び精製は、この分野で知られた技術及び試薬を用いて実施してよい。
【0061】
実施例7
バキュロウイルス感染昆虫細胞でのUCP4の発現
以下の方法は、バキュロウイルス感染昆虫細胞中におけるUCP4の組換え発現を記載する。
UCP4をコードする配列は、発現ベクター内に含まれるエピトープタグの上流に融合させた。このようなエピトープタグは、poly-hisタグ及び免疫グロブリンタグ(IgGのFc領域など)を含む。pVL1393(Navogen)などの市販されているプラスミドから誘導されるプラスミドを含む種々のプラスミドを用いることができる。簡単には、UCP4コード化配列又はUCP4コード化配列の所定部分が、5'及び3'領域に相補的なプライマーでのPCRにより増幅される。5'プライマーは、隣接する(選択された)制限酵素部位を包含していてもよい。生産物は、次いで、選択された制限酵素で消化され、発現ベクターにサブクローニングされる。ベクターは、分泌が望まれる場合には、UCP4の天然シグナル配列を含んでもよい。
組換えバキュロウイルスは、上記のプラスミド及びBaculoGold(商品名)ウイルスDNA(Pharmingen)を、Spodoptera frugiperda(「Sf9」)細胞(ATCC CRL 1711)中にリポフェクチン(GIBCO-BRLから市販)を用いて同時形質移入することにより作成される。28℃で4〜5日インキュベートした後、放出されたウイルスを回収し、更なる増幅に用いた。ウイルス感染及びタンパク質発現は、O'Reilley等, Baculovirus expression vectors: A laboratory Manual, Oxford: Oxford University Press (1994)に記載されているように実施した。
【0062】
次に、発現されたpoly-hisタグUCP4は、例えばNi2+-キレートアフィニティクロマトグラフィーにより次のように精製される。抽出は、Rupert等, Nature, 362:175-179 (1993)に記載されているように、ウイルス感染した組み換えSf9細胞から調製した。簡単には、Sf9細胞を洗浄し、超音波処理用バッファー(25mLHepes、pH7.9;12.5mMMgCl2;0.1mMEDTA;10%グリセロール;0.1%NP−40;0.4MKCl)中に再懸濁し、氷上で2回20秒間超音波処理した。超音波処理物を遠心分離で透明化し、上清を負荷バッファー(50mMリン酸塩、300mMNaCl、10%グリセロール、pH7.8)で50倍希釈し、0.45ミクロンフィルターで濾過した。Ni2+-NTAアガロースカラム(Qiagenから市販)を5mLの総容積で調製し、25mLの水で洗浄し、25mLの負荷バッファーで平衡させた。濾過した細胞抽出物は、毎分0.5mLでカラムに負荷した。カラムを、分画回収が始まる点であるA280のベースラインまで負荷バッファーで洗浄した。次に、カラムを、結合タンパク質を非特異的に溶離する二次洗浄バッファー(50mMリン酸塩;300mMNaCl、10%グリセロール、pH6.0)で洗浄した。A280のベースラインに再度到達した後、カラムを二次洗浄バッファー中で0から500mMイミダゾール勾配で展開した。1mLの分画を回収し、SDS-PAGE及び銀染色又はアルカリホスファターゼ(Qiagen)に複合したNi2+-NTAでのウェスタンブロットで分析した。溶離したHis10-タグUCP4を含む分画をプールし、負荷バッファーに対して透析した。
あるいは、IgGタグ(又はFcタグ)UCP4の精製は、例えば、プロテインA又はプロテインGカラムクロマトグラフィーを含む公知のクロマトグラフィー技術を用いて実施できる。
【0063】
実施例8
UCP4によって誘発されたミトコンドリア膜電位変化の測定
UCP4のミトコンドリア膜電位に対する効果を決定するためにアッセイを実施した。
ヒト胚腎臓293細胞(ATCC CRL 1573)を培養培地(DMEM、10%ウシ胎児血清、2mML-グルタミン、100単位/mlペニシリン、100マイクログラム/mlストレプトマイシン)中で、6-ウェルプレートにおいて60%-80%の集密度まで増殖させFuGene(商品名)6形質移入試薬(Boehringer Mannheim;製造者の指示通り)を用いて、UCP発現作成物(pcDNA3UCP4又はpcDNAUCP3)、NH2-末端Flagタグを持つUCP発現作成物(pcDNA3Flag-UCP4又はpcDNAFlag-UCP3)、又はベクター対照物(pcDNA3;Invitrogenから市販)で一過性形質移入させた。
UCP4コード化cDNAのNH2-末端Flagタグ有無での発現作成物は、実施例1に従って調製した。UCP3コード化cDNAの発現作成物は、最初に黒色腫cDNAライブラリからPCRによってヒトUCP3コード化cDNAを得ることにより調製した。PCRプライマー(正方向及び逆方向)を合成した:
正方向PCRプライマー
GCGAAGCTTGCCATGGTTGGACTGAAGCCTTCAGA(U301)(配列番号:7)
逆方向PCRプライマー
CGCGAATTCTCAAAACGGTGATTCCCGTAACAT(U302)(配列番号:8)
NH2-末端Flagタグを持つUCP3コード化cDNAの発現作成物は、以下のPCRプライマーによって調製した。
正方向PCRプライマー
GCGAAGCTTGCCATGGACTACAAGGACGACGATGACAAGGTTGGACTGAAGCCTTCAGACG(U303)(配列番号:9)
逆方向PCRプライマー
CGCGAATTCTCAAAACGGTGATTCCCGTAACAT(U302)(配列番号:8)
NH2-末端Flagタグを持つ又は持たないUCP3は、pcDNA3(pcDNA3UCP3又はpcDNA3Flag-UCP3)に、HindIIIとEcoRI部位との間にクローニングし、DNA配列決定により確認した。293細胞で発現されたFlag-タグUCP3及びUCP4は、抗-FlagM2モノクローナル抗体(Kodak)及びECL検出キット(Pietce)を用いたウェスタンブロット分析により検出した。
【0064】
ミトコンドリア膜電位は、この分野で公知の方法に従って分析した。[Salvioli等, FEBS Lett., 411: 77-82 (1997); Smiley等, Proc. Natl. Acad. Sci. USA, 88: 3671-3675 (1991)]。形質移入の約24-36時間後、細胞をトリプシン処理し、1.5x106を遠心分離によってペレット化した。ペレット化細胞を0.5mlのJC-1染料溶液中に再懸濁し、50μmのCCCP(カルボニルシアニドm-クロロフェニルヒドラゾン;Sigma)の存在下又は不存在下で、暗中37℃で30分間インキュベートした。JC-1(5,5',6,6'-テトラクロロ-1,1',3,3'-テトラエチルベンズイミダゾールカルボシアニンヨウ化物;Moleculara Probes, Eugene, OR)は、膜電位感受性の蛍光染料である。染料溶液を調製するために、JC-1を最初に5mg/mlの濃度のジメチルスルホキシド(DMSO;Sigma)中のストック溶液として調製した。ストック溶液をDMSOで1mg/mlまで希釈し、次いで37℃に予熱した培養培地で10μg/mlまで更に希釈し、.45μm及び.2μmフィルター両方を通して濾過して凝集したJC-1を除去した。
染色した細胞を洗浄し、1.0mlの培養培地中に再懸濁した。培養培地中に再懸濁した細胞を分光蛍光分析(RF5000U分光蛍光光度計;SHIMADZU, Japan)によって試験した。細胞のサブセットをフローサイトメトリー(Coulter EPICS Elite ESP, Hialeah, FL)によって分析した。分光蛍光分析のために、励起は488nmであり、放射は525nm及び590nmで測定した。フローサイトメトリー分析は、単一の488nm励起のアルゴンレーザー、FL1チャンネルで525+-20nm透過するフィルター、及びFL2チャンネルで590nmより上を透過するフィルターで実施した。試料当たり10,000細胞の最小値で分析した。
統計的分析も行った。分光蛍光分析からの赤色(593nm)対緑色(532nm)蛍光強度ピークの平均比率を処理間で比較した。処理当たり9の独立した形質移入が存在した。相違は、フィッシャーの保護された最少有意差(protected least significant difference)を用いて分析した。
結果をFig5A及び5Bに例示する。293細胞におけるUCP3の発現は、ミトコンドリア膜電位の低下を示す対照ベクター形質移入細胞に比較して、蛍光ピーク値時チル(593λ/532λ)を約15%減少させた(n=3)(Fig5A)。UCP44で形質移入した細胞では、膜電位低下を示す蛍光強度は、対照ベクター形質移入細胞に比較して19%減少した(n=6)(Fig5A及び5B)。NH2-末端Flag-タグは、UCP3又はUCP4の活性に影響を与えなかった。
またFACs分析は、同様のミトコンドリア膜電位の低下を示した。FACs分析において、積分した赤色-対-緑色強度比率は、UCP3形質移入細胞で18%、UCP4形質移入細胞で24%低下した。化学的脱共役剤、CCCPで処理した細胞も、赤色-対-緑色強度比率の低下を示した(Fig5A及び5B)。
これらのデータは、UCP3と同様に、UCP4が脱共役活性を持つことを示唆している。
【0065】
実施例9
UCP4に結合する抗体の調製
この実施例は、UCP4に特異的に結合できるモノクローナル抗体の調製を例示する。
モノクローナル抗体の生産のための技術は、この分野で知られており、例えば、上掲のGodingに記載されている。用いられ得る免疫原は、精製UCP4、UCP4を含む融合タンパク質、及び細胞表面に組換えUCP4を発現する細胞を含む。免疫原の選択は、当業者が過度の実験をすることなくなすことができる。
Balb/c等のマウスを、完全フロイントアジュバントに乳化して皮下又は腹腔内に1-100マイクログラムで注入したUCP4免疫原で免疫化する。あるいは、免疫原をMPL-TDMアジュバント(Ribi Immunochemical Researh, Hamilton, MT)に乳化し、動物の後足蹠に注入してもよい。免疫化したマウスは、次いで10から12日後に、選択したアジュバント中に乳化した付加的免疫源で追加免疫する。その後、数週間、マウスをさらなる免疫化注射で追加免疫してもよい。抗-UCP4抗体の検出のためのELISAアッセイで試験するために、レトロオービタル出血によりマウスから血清試料を周期的に採取してもよい。
適当な抗体力価が検出された後、抗体に「ポジティブ」な動物に、UCP4静脈内注射の最後の注入をすることができる。3から4日後にマウスを屠殺して脾臓細胞を取り出した。次いで脾臓細胞を(35%ポリエチレングリコールを用いて)、ACTTから番号CRL1597で入手可能なP3X63AgU.1等の選択されたマウス骨髄腫細胞系に融合させた。融合によりハイブリドーマ細胞が生成され、次いでそれをHAT(ヒポキサンチン、アミノプテリン、及びチミジン)培地を含む96ウェル組織培養プレートに蒔き、非融合細胞、骨髄腫ハイブリッド、及び脾臓細胞ハイブリッドの増殖を阻害させた。
ハイブリドーマ細胞は、UCP4に対する反応性についてのELISAでスクリーニングされる。UCP4に対する所望のモノクローナル抗体を分泌する「ポジティブ」ハイブリドーマ細胞の決定は技術常識の範囲内である。
ポジティブハイブリドーマ細胞を同系のBalb/cマウスに腹腔内注入し、抗-UCP4モノクローナル抗体を含む腹水を生成させる。あるいは、ハイブリドーマ細胞を、組織培養フラスコ又はローラーボトルで増殖させることもできる。腹水中に生成されたモノクローナル抗体の精製は、硫酸アンモニウム沈降、それに続くゲル排除クロマトグラフィーを用いて行うことができる。あるいは、抗体のプロテインA又はプロテインGへの親和性に基づくアフィニティクロマトグラフィーを用いることもできる。
【0066】
実施例10
細胞下局在化
UCP4の細胞下局在化を試験するために、ヒト乳癌MCF7細胞(ATCC HTB 22)を、pcDNA3Flag-UCP3(実施例8に従って調製)又はpcDNA3Flag-UCP4(実施例1に従って調製)の何れかで、FuGene形質移入試薬(Boehrineger Mannheim)を用いて形質移入した。形質移入細胞を、3%ホルムアルデヒド中で室温において15分間固定し、1%のトリトンX-100で15分間透明化した。細胞を抗-Flagモノクローナル抗体(10μg/ml;Kodak)及び抗-チトクロムCオキシダーゼ抗体(ミトコンドリア性マーカー)(3ng/ml)とともに20分間インキュベートした。次いで細胞を洗浄し、Cy3(商品名)-抱合(ロバ抗-マウス;Jackson Laboratories)及びFITC-抱合(ロバ抗-ウサギ;Jackson Laboratories)二次抗体とともにインキュベートした。次いで細胞を蛍光顕微鏡で検査した。
Fig6A-6Fは、UCP3及びUCP4がミトコンドリア性マーカーと共存することを示す。
【0067】
実施例11
食物及び温度ストレスを受けたマウスにおけるUCP4mRNAの発現
UCP4が代謝において重要なその場での脱共役活性を有するか否かを評価するために、食物及び温度ストレス、即ち代謝的負荷を受けたマウスの組織で生成されるUCP4mRNAの量を測定した。UCP4が代謝において持ちうる役割に応じて、組織で生成されるUCP4mRNAの量は、絶食、脂肪消費、及び室温未満の温度への暴露といった代謝に対するストレスで変化しうる。
この実験におけるマウスは、特に記さない限り、通常の齧歯類固形飼料(Purina Rodent Chow 5010; Purina, St. Louis, MO)及び水を適宜に与えた。実験したマウスの型は、実験マウスの代謝に負荷するのに用いた条件に応じて変化し、以下に記載される。
一般的に、実験したマウスは、1日に午前6:00から午後6:00まで12時間日光にさらし、続く12時間は暗中にさらした。
組織を取り出す直前にマウスをCO2下で犠牲にし、それは特に記さない限り午前8:00から12:00の朝方に行った。組織を取り出し、全組織RNAをBiotecx Lab, Houston, TXからの試薬及びプロトコールを用いて調製した。各マウスから多くの組織が回収されたが、実験は脳におけるUCP4mRNAの発生量の測定に集中した(脳は高いUCP4遺伝子発現を有するため)。実験には少なくとも5マウス/処理を使用した。
【0068】
収集した組織中のUCP4mRNA量の測定のために、定量的逆転写酵素-ポリメラーゼ連鎖反応(RT-PCR)を用いた。RT-PCRはmRNA試料を用いて実施した[Heid等, Genome Research, 6: 986-994 (1996); Gibson等, Genome Research, 6: 995-1001 (1996)]。一般的に、定量的RT-PCRを実施するために、UCP4に特異的なプライマー及びプローブを使用した(TaqMan Instrument, PE Biosciences, Foster City, California)。値は、β-アクチンmRNA発生量を負荷対照として用いてmRNA負荷について補正した。以下のプライマー及びプローブを使用した:
UCP4について:
正方向プライマー:5'AAT GCC TAT CGC CGA GGA G3'(配列番号:10);
逆方向プライマー:5'GTA GGA ACT TGC TCG TCC GG3'(配列番号:11);
プローブ:5'(FAM)TGC TCG CGC TCA CGC AGA GAT G 3'(配列番号:12)(TAMARA)3'。
ベータ-アクチンについて:
正方向プライマー:5'GAA ATC GTG CGT GAC ATC AAA GAG3'(配列番号:13);
逆方向プライマー:5'CTC CTT CTG CAT CCT GTC AGC AA3'(配列番号:14);
プローブ:5'(FAM):CGG TTC CGA TGC CCT GAG GCT C 3'(配列番号:15)(TAMARA)3'。
【0069】
UCP4mRNA発現に対する食物消費の影響
第1の実験では、実験マウスにおけるUCP4mRNAに対する絶食及び食餌の影響を評価するために7週齢の雄マウス(C57BL/6J; BarHarbor, ME)を実験した。マウスを7週齢で得て、7週目に3つの群:自由に食餌させる対照マウス、24時間絶食させるマウス、及び24時間絶食させた後に24時間自由に食餌させるマウスに割り当てた。
第1群ついては自由に食餌させた後、第2群については24時間絶食させた後、そして第3群については最初に絶食させた後自由に食餌させた48時間後に上記のようにしてマウスを犠牲にした。上記のようにして組織を収集した。
上記の方法に従って脳組織に対して定量的RT-PCRを実施し、脳で生成されたUCP4mRNAの量を定量化した。群間にある統計学的相違は、保護されたフィッシャーの最小有意差分析(L. Ott, An Introduction to Statistical Methods and Data Analysis, 3rd Ed., Boston: PWS-Kent Publishing Co., 1988)を用いて決定した。Fig8Aから8Cに提示したデータは、平均+/-SEMを示す。
Fig8Aは、24時間自由に食餌させたマウスからの脳組織におけるUCP4mRNAの発生率を例示する。Fig8Bは、絶食させたマウスからの脳組織におけるUCP4mRNAの発生率を例示する。Fig8Cは、24時間絶食させ、次いで24時間自由に食餌させたマウスからの脳組織におけるUCP4mRNAの発生率を例示する。
典型的には、絶食及び食物消費の制限は代謝速度を低下させ、絶食させたマウスでは自由に食餌させたマウスに比較してUCP4mRNAの発現が減少することを示唆している。しかし、Fig8Bは、Fig8Aに示した自由に食餌させたマウスに比較して、絶食させたマウスの脳組織におけるUCP4mRNA発現の現象を示していない。
【0070】
UCP4mRNA発現に対する脂肪消費の影響
第2の実験では、実験マウスにおけるUCP4mRNAに対する高及び低脂肪食餌の影響を評価するために4週齢の雄マウス(A/J又はC57BL/6J; Jackson Labs, BarHarbor, ME)を実験した。「肥満傾向の」C57BL6/Jに比較して、A/Jマウスは高脂肪食餌でも「肥満耐性」であることが示されている(上掲のSurwit等参照)。これは、A/J株における代謝効率の低さ、即ちそれらが明らかに摂取したカロリー当たりに身につけるカロリーが少ないことによる。
マウスを4週齢で得て、各々11%及び58%脂肪(%カロリー)を含むSurwit等, Metabolism, 44(5): 645-651 (1995)によって製剤された高脂肪肪食餌又は高脂肪食餌(Research Diets, Inc., Nwe Brunswick, New Jersey)をパターン化した後に即座にその何れかに配置した。動物を、約3週間自由に食餌させた(22-23日食餌)。ついでそれらを犠牲にし、それらの組織を上記のようにして収集した。上記の方法に従って脳組織に対して定量的RT-PCRを実施し、脳で生成されたUCP4mRNAの量を定量化した。群間にある統計学的相違は、保護されたフィッシャーの最小有意差分析(L. Ott, An Introduction to Statistical Methods and Data Analysis, 3rd Ed., Boston: PWS-Kent Publishing Co., 1988)を用いて決定した。Fig9A〜9Dに提示したデータは平均+/-SEMを示す。
Fig9Aは、低脂肪食餌を与えたA/Jマウスからの脳組織におけるUCP4mRNAの発生率を例示し、Fig9Bは、高脂肪食餌を与えたA/Jマウスからの脳組織におけるUCP4mRNAの発生率を例示する。Fig9Cは、低脂肪食餌を与えたC57BL6/Jマウスからの脳組織におけるUCP4mRNAの発生率を例示し、Fig9Dは、高脂肪食餌を与えたC57BL6/Jマウスからの脳組織におけるUCP4mRNAの発生率を例示する。
【0071】
UCP4に対する温度ストレスの影響
第3の実験では、マウスを温度ストレスにさらす影響を評価するために雄マウス(FVB-NJ; Gemantown, New York)を実験した。典型的には、齧歯類の寒冷暴露は代謝速度の上昇を誘発する。この代謝の向上が安定した体温を維持する。しかし、マウスの温熱中間帯(約30-35℃)内の温度への慢性的な暴露として定義される温暖順応は代謝速度を低下させる[Klaus等, Am. J. Physiol., 274: R287-R293 (1998)]。
この実験におけるマウスは、ケージ当たり2匹を収納し、無作為に次の群に割り当てた:対照群(22℃で3週間収納)、温暖順応群(33℃で3週間収納)、食物制限群(22℃で3週間収納したが、温暖順応マウスが前日に食した食物の平均量を毎日入手できるようにした)、寒冷負荷群(22℃で3週間収納した後、4℃への暴露を開始)。寒冷負荷マウスについては、早朝にマウスを4℃室に1、6、24、又は48時間配置することにより4℃に暴露し、その後マウスを犠牲にして組織を収集した。
上記のように6週齢においてマウスを犠牲にして組織を収集した。上記の方法に従って脳組織に対して定量的RT-PCRを実施し、脳で生成されたUCP4mRNAの量を定量化した。群間にある統計学的相違は、保護されたフィッシャーの最小有意差分析(L. Ott, An Introduction to Statistical Methods and Data Analysis, 3rd Ed., Boston: PWS-Kent Publishing Co., 1988)を用いて決定した。Fig8Aから8Cに提示したデータは、平均+/-SEMを示す。星印は少なくともp<0.05の統計学的な相違を示す。
Fig10Aは、対照群のマウスにおけるUCP4mRNAの発生率を例示する。Fig10B〜10Eは、各々1、6、24、及び48時間の寒冷負荷をしたマウスの群におけるUCP4mRNAの発生率を例示する。Fig10Fは、食物制限群のマウスにおけるUCP4mRNAの発生率を例示し、Fig10Gは、温暖順応群のマウスにおけるUCP4mRNAの発生率を例示する。
Fig10Bから10Eは全て、Fig10Aに示した対照群に比較して、寒冷負荷マウスにおけるUCP4mRNAの発現の増加を示している。Fig10F及び10Gは、各々食物制限マウス及び温暖順応マウスについては、Fig10Aに示した対照群に比較して、同様のUCP4mRNAの増加が見られないことを示している。
【0072】
材料の寄託
次の細胞系をアメリカン・タイプ・カルチャー・コレクション,10801 University Boulevard., Manassas, VA, USA(ATCC)に寄託した:
材料 ATCC寄託番号 寄託日
DNA77568-1626 203134 1998年8 月18日
この寄託は、特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約及びその規則(ブダペスト条約)の規定に従って行われた。これは、寄託の日付から30年間、寄託の生存可能な培養が維持されることを保証するものである。寄託物はブダペスト条約の条項に従い、またジェネンテク社とATCCとの間の合意に従い、ATCCから入手することができ、これは、どれが最初であろうとも、関連した米国特許の発行時又は任意の米国又は外国特許出願の公開時に、寄託培養物の後代を永久かつ非制限的に入手可能とすることを保証し、米国特許法第122条及びそれに従う特許庁長官規則(特に参照番号886OG638の37CFR第1.14条を含む)に従って権利を有すると米国特許庁長官が決定した者に子孫を入手可能とすることを保証するものである。
【0073】
本出願の譲受人は、寄託した培養物が、適切な条件下で培養されていた場合に死亡もしくは損失又は破壊されたならば、材料は通知時に同一の他のものと即座に取り替えることに同意する。寄託物質の入手可能性は、特許法に従いあらゆる政府の権限下で認められた権利に違反して、本発明を実施するライセンスであるとみなされるものではない。
上記の文書による明細書は、当業者に本発明を実施できるようにするために十分であると考えられる。寄託した態様は、本発明のある側面の一つの説明として意図されており、機能的に等価なあらゆる作成物がこの発明の範囲内にあるため、寄託された作成物により、本発明の範囲が限定されるものではない。ここでの物質の寄託は、ここに含まれる文書による説明が、そのベストモードを含む、本発明の任意の側面の実施を可能にするために不十分であることを認めるものではないし、それが表す特定の例証に対して請求の範囲を制限するものと解釈されるものでもない。実際、ここに示し記載したものに加えて、本発明を様々に改変することは、前記の記載から当業者にとっては明らかなものであり、添付の請求の範囲内に入るものである。
【図面の簡単な説明】
【Fig1】 天然配列UCP4の誘導アミノ酸配列を示す図である。
【Fig2】 天然配列UCP4をコードするcDNAのヌクレオチド配列を示す図である。
【Fig3】 UCP4と他の脱共役タンパク質、UCP1(配列番号:16)、UCP2(配列番号:17)、及びUCP3(配列番号:18)とのアミノ酸配列アラインメントを示す図である。6つの推定膜貫通ドメインは下線で示した(各々I〜VIと標識した)。タンパク質配列の下に示した星印(*)は、3つの(3)推定ミトコンドリア担体タンパク質モチーフを示す。推定ヌクレオチド結合ドメインは二本線を付した。
【Fig4A−H】 ノーザンブロット分析の結果を示す図である。末梢血白血球(PBLs)、癌細胞、及び胎児組織に加えてヒト成人脳組織(Clontech)をUCP4cDNAでプローブした。図は、UCP4転写物がヒト脳組織、脊髄、髄質、脳梁、及び黒質で検出されたことを示す。
【Fig5A−B】 ミトコンドリア膜電位に対するUCP4発現の影響し測定するために実施したインビトロアッセイの結果を示す図である。
【Fig6A−F】 UCP4の細胞下局在化を測定するために実施したインビトロアッセイの結果を示す図である。
【Fig7】 選択したEST配列から構築した「fromDNA」配列を示す図である。
【Fig8A−C】 UCP4mRNA発現に対する食物摂取量の影響を測定するために実施したインビトロアッセイの結果を示す図である。
【Fig9A−D】 UCP4mRNA発現に対する脂肪摂取量の影響を測定するために実施したインビトロアッセイの結果を示す図である。
【Fig10A−G】 UCP4mRNA発現に対する温度ストレスの影響を測定するために実施したインビトロアッセイの結果を示す図である。
【配列表】
Claims (39)
- (a)配列番号:1に示すアミノ酸残基1〜323の配列を含むUCP4ポリペプチドをコードするDNA分子、又は(b)(a)のDNA分子の相補鎖に対して少なくとも90%の配列同一性を有するDNAを含んでなり;該DNAによりコードされるポリペプチドが哺乳動物におけるミトコンドリア膜電位を変調させる単離された核酸分子。
- 配列番号:2に示す40〜1011のヌクレオチド配列を含む請求項1に記載の単離された核酸分子。
- 配列番号:2に示すヌクレオチド配列を含む請求項1に記載の単離された核酸分子。
- UCP4ポリペプチドをコードするDNAを含んでなり、配列番号:2に示す40〜1011のヌクレオチドを含む核酸の相補鎖に緊縮性条件下でハイブリッド形成し;コードされたUCP4ポリペプチドが哺乳動物におけるミトコンドリア膜電位を変調させる単離された核酸分子。
- (a)ATCC寄託番号203134のcDNA(DNA77568−1626)にコードされるのと同じ成熟ポリペプチドをコードするDNA分子、又は(b)(a)のDNA分子の相補鎖に対して少なくとも90%の配列同一性を有するDNAを含んでなり;該DNAによりコードされるポリペプチドが哺乳動物におけるミトコンドリア膜電位を変調させる単離された核酸分子。
- (a)ATCC寄託番号203134のcDNA(DNA77568−1626)にコードされるのと同じ成熟ポリペプチドをコードするDNA分子を含む請求項5に記載の単離された核酸分子。
- (a)配列番号:1に示す1〜323のアミノ酸残基の配列と少なくとも90%の配列同一性を有するポリペプチドをコードするDNAであって、該ポリペプチドが哺乳動物におけるミトコンドリア膜電位を変調させるDNA、又は(b)(a)のDNA分子の相補鎖を含んでなる単離された核酸分子。
- (a)配列番号:1に示す1〜323のアミノ酸残基の配列を含むポリペプチドをコードするDNA、又は(b)(a)のDNA分子の相補鎖を含んでなる請求項7に記載の単離された核酸分子。
- 請求項1に記載の核酸を含んでなるベクター。
- 当該ベクターで形質転換された宿主細胞に認識されるコントロール配列に作用可能に結合した請求項9に記載のベクター。
- 請求項10に記載のベクターを含んでなる宿主細胞。
- 前記細胞がCHO細胞である請求項11に記載の宿主細胞。
- 前記細胞が大腸菌細胞である請求項11に記載の宿主細胞。
- 前記細胞が酵母菌細胞である請求項11に記載の宿主細胞。
- 請求項11に記載の宿主細胞を、前記UCP4ポリペプチドの発現に適した条件下で培養し、細胞培養物から前記UCP4ポリペプチドを回収することを含んでなるUCP4ポリペプチドの製造方法。
- 請求項1に記載のDNAによってコードされる単離されたUCP4ポリペプチド。
- 配列番号:1に示す1〜323のアミノ酸残基の配列と少なくとも90%の配列同一性を有するポリペプチドを含んでなり;該ポリペプチドが哺乳動物におけるミトコンドリア膜電位を変調させる単離されたUCP4ポリペプチド。
- 配列番号:1に示す1〜323のアミノ酸残基を含んでなる請求項17に記載の単離されたUCP4ポリペプチド。
- 配列番号:1に示す1〜323のアミノ酸残基の配列を含んでなる単離されたUCP4ポリペプチド。
- ATCC寄託番号203134として寄託されたベクターのcDNA挿入物(DNA77568−1626)にコードされる単離されたUCP4ポリペプチド。
- 配列番号:1に示すアミノ酸残基1〜323からなる単離されたUCP4ポリペプチド。
- 異種アミノ酸配列に融合した請求項16ないし21の何れか一項に記載のポリペプチドを含んでなるキメラ分子。
- 前記異種アミノ酸配列がエピトープタグ配列である請求項22に記載のキメラ分子。
- 前記異種アミノ酸配列が免疫グロブリンのFc領域である請求項22に記載のキメラ分子。
- 請求項16ないし21の何れか一項に記載のポリペプチドに特異的に結合する抗体。
- 前記抗体がモノクローナル抗体である請求項25に記載の抗体。
- 請求項9に記載のベクター、または、請求項1ないし8の何れか一項に記載の核酸に対するアンチセンスを含む、哺乳動物における代謝速度を変調させるための薬剤。
- 前記ベクターが肥満哺乳動物における代謝速度の増加を刺激する請求項27に記載の薬剤。
- 請求項1ないし8の何れか一項に記載の核酸分子または請求項16ないし21の何れか一項に記載のポリペプチドを含む哺乳動物細胞又は組織試料を候補分子と接触させ、続いて前記試料における前記核酸分子またはポリペプチドの発現を分析することを含んでなる、前記核酸分子またはポリペプチドの発現を促進又はアップレギュレートする分子を同定するためのスクリーニングアッセイの実施方法。
- 前記試料におけるミトコンドリア膜電位を分析することをさらに含む請求項29に記載の方法。
- 前記ポリペプチドが、配列番号:1に示すアミノ酸残基1〜323を含むポリペプチドである請求項29に記載の方法。
- 前記試料がヒト脳組織を含む請求項29に記載の方法。
- 前記候補分子が、合成有機又は無機化合物を含む小分子である請求項29に記載の方法。
- 請求項1ないし8の何れか一項に記載の核酸分子または請求項16ないし21の何れか一項に記載のポリペプチドを含む哺乳動物細胞又は組織試料を候補分子と接触させ、続いて前記試料における前記核酸分子またはポリペプチドの発現を分析することを含んでなる、前記核酸分子またはポリペプチドの発現を低下又はダウンレギュレートする分子を同定するためのスクリーニングアッセイの実施方法。
- 前記試料におけるミトコンドリア膜電位を分析することをさらに含む請求項34に記載の方法。
- 前記ポリペプチドが、配列番号:1に示すアミノ酸残基1〜323を含むポリペプチドである請求項34に記載の方法。
- 前記試料がヒト脳組織を含む請求項34に記載の方法。
- 哺乳動物細胞又は組織試料をDNAプローブと接触させ、続いて前記試料における請求項16ないし21の何れか一項に記載のポリペプチドのmRNA転写物の発現を分析することを含んでなる、哺乳動物細胞又は組織試料中の前記ポリペプチドの発現を検出する方法。
- 前記試料がヒト脳組織である請求項38に記載の方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10127998P | 1998-09-22 | 1998-09-22 | |
| US60/101,279 | 1998-09-22 | ||
| US11422398P | 1998-12-30 | 1998-12-30 | |
| US60/114,223 | 1998-12-30 | ||
| US12967499P | 1999-04-16 | 1999-04-16 | |
| US60/129,674 | 1999-04-16 | ||
| PCT/US1999/021194 WO2000017353A1 (en) | 1998-09-22 | 1999-09-15 | Ucp4 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002526075A JP2002526075A (ja) | 2002-08-20 |
| JP2002526075A5 JP2002526075A5 (ja) | 2009-12-03 |
| JP4709383B2 true JP4709383B2 (ja) | 2011-06-22 |
Family
ID=27379161
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000574252A Expired - Lifetime JP4709383B2 (ja) | 1998-09-22 | 1999-09-15 | Ucp4 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US8067229B2 (ja) |
| EP (1) | EP1115863B1 (ja) |
| JP (1) | JP4709383B2 (ja) |
| AU (1) | AU6041399A (ja) |
| CA (1) | CA2344467C (ja) |
| DE (1) | DE69937644T2 (ja) |
| DK (1) | DK1115863T3 (ja) |
| ES (1) | ES2297947T3 (ja) |
| PT (1) | PT1115863E (ja) |
| WO (1) | WO2000017353A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6670138B2 (en) | 2000-11-01 | 2003-12-30 | Agy Therapeutics, Inc. | Method of diagnosing ischemic stroke via UCP-2 detection |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1998031396A1 (en) * | 1997-01-15 | 1998-07-23 | Duke University | Respiration uncoupling protein |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4775662A (en) | 1983-03-07 | 1988-10-04 | Smithkline Beckman Corporation | Leukotriene antagonists |
| US5010010A (en) | 1986-10-22 | 1991-04-23 | Selmer-Sande, A.S. | Production of human parathyroid hormone from microorganisms |
| IL87737A (en) | 1987-09-11 | 1993-08-18 | Genentech Inc | Method for culturing polypeptide factor dependent vertebrate recombinant cells |
| US5407810A (en) | 1993-08-20 | 1995-04-18 | Genentech, Inc. | Aqueous multiple-phase isolation of polypeptide |
| US5663304A (en) | 1993-08-20 | 1997-09-02 | Genentech, Inc. | Refolding of misfolded insulin-like growth factor-I |
| CA2219361C (en) * | 1995-04-27 | 2012-02-28 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US7001742B1 (en) * | 1997-05-20 | 2006-02-21 | Merck & Co., Inc. | Human uncoupling protein 3 |
| EP1012155A4 (en) | 1997-05-20 | 2002-11-04 | Merck & Co Inc | HUMAN ORIGIN DECOUPLING PROTEIN 3 |
| NZ531664A (en) * | 1998-09-01 | 2005-07-29 | Genentech Inc | Pro1317 polypeptides and sequences thereof with homology to the semaphorin B glycoprotein family |
| US7375184B2 (en) | 1998-09-01 | 2008-05-20 | Genentech, Inc. | PRO1382 polypeptides |
-
1999
- 1999-09-15 DE DE69937644T patent/DE69937644T2/de not_active Expired - Lifetime
- 1999-09-15 DK DK99969439T patent/DK1115863T3/da active
- 1999-09-15 PT PT99969439T patent/PT1115863E/pt unknown
- 1999-09-15 JP JP2000574252A patent/JP4709383B2/ja not_active Expired - Lifetime
- 1999-09-15 ES ES99969439T patent/ES2297947T3/es not_active Expired - Lifetime
- 1999-09-15 AU AU60413/99A patent/AU6041399A/en not_active Abandoned
- 1999-09-15 CA CA2344467A patent/CA2344467C/en not_active Expired - Lifetime
- 1999-09-15 EP EP99969439A patent/EP1115863B1/en not_active Expired - Lifetime
- 1999-09-15 WO PCT/US1999/021194 patent/WO2000017353A1/en active IP Right Grant
-
2005
- 2005-11-03 US US11/265,966 patent/US8067229B2/en not_active Expired - Fee Related
-
2011
- 2011-09-19 US US13/236,459 patent/US8313927B2/en not_active Expired - Fee Related
-
2012
- 2012-11-08 US US13/672,232 patent/US8648174B2/en not_active Expired - Fee Related
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1998031396A1 (en) * | 1997-01-15 | 1998-07-23 | Duke University | Respiration uncoupling protein |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1115863B1 (en) | 2007-11-28 |
| DE69937644D1 (en) | 2008-01-10 |
| WO2000017353A1 (en) | 2000-03-30 |
| US8313927B2 (en) | 2012-11-20 |
| EP1115863A1 (en) | 2001-07-18 |
| US8067229B2 (en) | 2011-11-29 |
| US20060068439A1 (en) | 2006-03-30 |
| US8648174B2 (en) | 2014-02-11 |
| ES2297947T3 (es) | 2008-05-01 |
| AU6041399A (en) | 2000-04-10 |
| US20130066052A1 (en) | 2013-03-14 |
| DK1115863T3 (da) | 2008-03-31 |
| PT1115863E (pt) | 2008-03-07 |
| DE69937644T2 (de) | 2008-10-30 |
| CA2344467A1 (en) | 2000-03-30 |
| US20120041176A1 (en) | 2012-02-16 |
| JP2002526075A (ja) | 2002-08-20 |
| CA2344467C (en) | 2011-01-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2006206587A (ja) | 新規なポリペプチド及びそれをコードする核酸 | |
| JP2009219492A (ja) | Gdnfrと配列類似性を有する新規ポリペプチド及びこれをコードする核酸 | |
| JP4709383B2 (ja) | Ucp4 | |
| US20090182126A1 (en) | Guanylate-binding protein | |
| EP1294881B1 (en) | Control of metabolism with compositions of the human 2-oxoglutarate carrier | |
| KR20010085816A (ko) | 면역 관련 질환 치료용 조성물 및 치료 방법 | |
| US20080166763A1 (en) | Human toll homologues | |
| US7342102B2 (en) | Uncoupling protein 5 (UCP5) | |
| US6967245B2 (en) | Ucp5 | |
| WO1999053058A1 (en) | Vertebrate patched-2 protein | |
| JP2002533062A5 (ja) | ||
| EP1659131B1 (en) | Polypeptides and nucleic acids encoding the same | |
| US20080299610A1 (en) | Human toll homologue | |
| EP1209168B1 (en) | PRO243 polypeptides and nucleic acids encoding the same | |
| EP1475439A2 (en) | Control of metabolism with compositions of the human 2-oxoglutarate carrier |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060907 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090707 |
|
| A524 | Written submission of copy of amendment under section 19 (pct) |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20091007 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100907 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101201 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110222 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110318 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4709383 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |