JP4477403B2 - 生体光計測装置 - Google Patents
生体光計測装置 Download PDFInfo
- Publication number
- JP4477403B2 JP4477403B2 JP2004115474A JP2004115474A JP4477403B2 JP 4477403 B2 JP4477403 B2 JP 4477403B2 JP 2004115474 A JP2004115474 A JP 2004115474A JP 2004115474 A JP2004115474 A JP 2004115474A JP 4477403 B2 JP4477403 B2 JP 4477403B2
- Authority
- JP
- Japan
- Prior art keywords
- measurement
- dementia
- waveform
- light
- point
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/40—Detecting, measuring or recording for evaluating the nervous system
- A61B5/4076—Diagnosing or monitoring particular conditions of the nervous system
- A61B5/4088—Diagnosing of monitoring cognitive diseases, e.g. Alzheimer, prion diseases or dementia
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Pathology (AREA)
- Biophysics (AREA)
- Developmental Disabilities (AREA)
- Hospice & Palliative Care (AREA)
- Child & Adolescent Psychology (AREA)
- Psychiatry (AREA)
- Psychology (AREA)
- Neurosurgery (AREA)
- Physiology (AREA)
- Measurement Of The Respiration, Hearing Ability, Form, And Blood Characteristics Of Living Organisms (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
Description
本発明の生体光計測装置は、痴呆症、特にアルツハイマー病の診断に好適である。
また信号波形のモデル化手法として最適化手法、特にSimplex法を用いた方法を採用することによりモデル化の精度を高め、信頼性の高い診断結果を得ることができる。
図1は本発明が適用される生体光計測装置の全体概要を示す図である。図示するようにこの生体光計測装置は、主として、生体に光を照射するとともに生体を透過した光を検出する光計測部101と、光計測部101からの信号を用いて血中ヘモグロビン量など生体内情報を計算し、表示するための信号処理部108とからなる。
図2は、本発明の生体光計測装置における動作の流れの一実施形態を示す図であり、基本動作は(1)生体光計測(201)、(2)計測データの前処理(202)、(3)痴呆症診断に用いるデータ選択(203)、(4)主成分解析(204)、(5)計測チャンネル数補正(205)、(6)計測データのモデル化(206)、(7)特徴量算出(207)、(8)各症例のデータベースとの比較(208)、(9)結果の表示(209)からなる。以下、各ステップについて詳述する。
プローブ104を被検者に装着した状態で、光の照射と受光を行いながら、発語能力(Word Fluency)テスト等のタスクを与え、その際のヘモグロビン変化量を測定する。計測部位は、前頭部、左側頭部、右側頭部とし、プローブの種類により、同時にあるいは4箇所を別々に計測する。プローブの計測点毎に計測されたヘモグロビン変化信号は、横軸を時間、縦軸をヘモグロビン変化量とするタイムコースのグラフで与えられ、酸素化ヘモグロビン量、脱酸素化ヘモグロビン量、ヘモグロビン総量のそれぞれについて得られる。所定のタスクを一定の繰り返し時間で繰り返すことにより、繰り返しの間隔毎のヘモグロビン変化量が得られる。
前処理は、主としてタスク前後における変化量を算出するためのフィッティング処理と、計測結果のSNを向上させるための加算処理とからなる。フィッティング処理では、照射光の波長をλとしたとき、照射光量R0(λ)、タスクを実行する前(非実行時)の検出光量RS(λ)、タスク実行時の検出光量R(λ)、波長λにおける酸素化及び脱酸素化ヘモグロビンの分子吸光係数を用いて、酸素化及び脱酸素化ヘモグロビンの濃度変化を算出する。算出方法の詳細は、例えば特許文献5に記載されている。加算処理は、複数回の結果を加算平均する処理である。
前処理後の酸素化ヘモグロビン量データ、脱酸素化ヘモグロビン量データ及びヘモグロビン総量データのうち、臨床上必要なデータを選択する。これは、ユーザーがモニタ112に表示されたグラフから判断してもよいし、診断対象が痴呆症である場合には、自動的に例えば酸素化ヘモグロビン量を選択するようにしてもよい。
一つの解析対象データが選択されたならば、計測部位毎に主成分解析を行ない、各計測部位における典型的反応を抽出する。具体的には、次の手順を行なう。
(a)各チャンネルで得られたヘモグロビン変化信号fm(n)(mは計測したチャンネル番号でチャンネル数をMとするとき1≦m≦M、nは計測された経時データ番号で、データ数をNとするとき1≦n≦N)の集合F(行列)に対しその転置行列FTを重畳し、正方行列W(=FFT)を作成する。
(b)この正方行列Wについて、固有値λ(固有値行列Λ)及び固有ベクトルWを次式(1)及び(2)により求める。
Λ=W-1XW (1)
(X−Λ)W=0 (2)
(c)固有ベクトルWは、第1主成分から第M主成分までの固有ベクトルv1を列とするM列の行列であり、この固有ベクトルの転置行列v1 Tをヘモグロビン変化信号f1(n)にかけることにより、各チャンネル毎に、第1主成分波形G(m)(=√(λ)・v1)を得る。
(d)各チャンネルについて、それぞれ得られた第1主成分波形G(m)を重畳させることにより、その計測部位についての代表波形を得る。
以上のような主成分分析により得られた代表波形401を図4に示す。図4において縦軸はヘモグロビン変化量、横軸は時間でタスク開始時点を0として示している。
上記ステップ204において、各計測部位(前頭部、左側頭部、右側頭部)ごとに代表波形が算出されるが、計測部位によって計測チャンネル数が異なるので、まず計測チャンネル数の違いを補正する。このため、各計測部位について得られた第1主成分波形について、固有値λをチャンネル数kで除したものを固定値として各計測部位における代表波形(G’=√(λ/k)・v1)とする。チャンネル数を補正した後の波形501を図5に示す。図5においても縦軸はヘモグロビン、横軸は時間であり、タスク開始時点とタスク終了時点をそれぞれ2本の線503、505で示している。2本の線の間隔がタスク持続時間504に相当する。また以下説明するパラメータ(特徴量)算出に必要な波形501上の点、計測開始時点506、タスク開始時点507、タスク終了時点508及び計測終了時点509を示している。これらの点の座標は、次のモデル化における自動計算に用いられる。
各計測部位について求められた代表波形に対し、痴呆症の診断上重要なパラメータを求める目的で、モデル化を行なう。モデル化には生体信号に対応していると考えられる多角形等のいくつかのモデルを用いることもできるが、本実施形態では台形モデルによるモデル化を図6を参照して説明する。
Nelder, J. A. and R. Mead, "A Simplex Method for Function Minimization,"Computer Journal,Vol. 7, p. 308-313, 1965.
tA*=tX1 (3)
tF*=tX6 (4)
まだ推定値の定まっていない変数tB,tC,tD,tE,yA,yC,yEの値を定める目的で、変数tB,tC,tD,tE,yA,yC,yE及び定数tA*,tF*により構成される台形モデル波形と、モデル化の対象としている代表波形との二乗誤差を表す評価関数を、次式のように定める。
変数がtB,tC,tD,tE,yA,yC,yEの7個あるので、8種類の変数の組み合わせを表す点P1〜P8を用いて、1つのSimplexを構成する。
まず、初期値の設定(ステップ701)で設定した点A〜Fの初期値を用いて、下記のように初期Simplexの初期値を表す点P1,start〜P8,startを設定する。
上記の初期Simplexの設定(ステップ704)で設定した初期Simplexを用いて、以下のアルゴリズムの実行を開始する。図8に最適化計算のフローを示す。
(e−1)
まず評価関数fを用いて1つのSimplexを構成する点P1〜P8の各々の点における評価関数値fP1〜fP8を求める(ステップ801)。点P1〜P8はそれぞれ7の変数を持つベクトルで表される。
点P1〜P8のうちその点における評価関数値fP1〜fP8が、最小の値を持つ点を点S、最大の値を持つ点を点Hとする(ステップ802)。そして、点Sを表すベクトルをSV(ここでSVは文字「S」の上に右矢印が付いた文字と同義である、以下同じ)、評価関数値fP1〜fP8のうち最小値となる点Sにおける評価関数値をf(SV)、点Hを表すベクトルをHV(ここでHVは文字「H」の上に右矢印が付いた文字と同義である、以下同じ)、評価関数値fP1〜fP8のうち最大値となる点Hにおける評価関数値をf(HV)とする。
点P1〜P8から点Hを除いた7点の重心位置を表す点Oを求める(ステップ803)。重心点Oを表すベクトルは次式で表すことができる。
評価関数値をより小さくする可能性のある改善値の探索を行なう(ステップ804)。
このため、まず、鏡像パラメータα(αは0より大きい任意の値。ここではα=0.1とする)を用いて、鏡像点Rを表すベクトルを次式のように求める。
収束条件のチェックを行なう(ステップ805)。
まず更新された新しいシンプレックスを構成する8点のうち、評価関数値が最小となる点S2を求める。そしてこの点S2を表すベクトルと、点S2における評価関数値を求める。
条件1:ステップ801〜804までの計算処理の繰り返し回数が一定の回数(例えば2000回)を超えている。
条件2:点S2における評価関数値が一定の値(例えば0.05)以下となっている。
条件1及び条件2を満たしていない場合には、ステップ804で更新された新しいシンプレックスを用いてステップ801の計算処理に戻る。条件1もしくは条件2を満たしている場合は、繰り返し計算を終了し、点S2を最適なパラメータを表す組み合わせとして採用する。
最後に採用された点S2の値(式(5))及びステップ701で決定された値(式(3)、(4))により、tA *,tB *tC *,tD *tE *,tF *yA *,yC *yE *の値が定まり、図6(b)に示す台形波形701の点A*〜F*の座標が求められる。即ち、これら6点の座標は
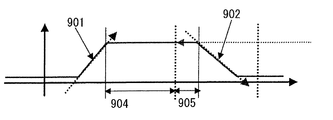
こうして各計測部位についてモデル化がなされたならば、痴呆症の診断に用いる特徴量を算出する。痴呆症の診断に用いることが可能な特徴量を図9に例示する。図示するように、モデル化波形のタスク中の傾き901、モデル化波形のタスク終了後の傾き902、モデル化波形の最大平坦部分の高さ903、モデル化波形の最大平坦部分のタスク中の継続時間904、モデル化波形の最大平坦部分のタスク終了後の継続時間905などが特徴量として用いることができ、さらに代表波形の大きさ(√(λ/n))も用いることができる。特にアルツハイマー病の診断には、モデル化波形の最大平坦部分の高さ903が有効である。
本実施の形態の生体光計測装置は、各症例の特徴量がデータベースとして蓄積されており、このデータベースとの比較から被検者の症例を診断する。データベースは、予め別の診断方法によって診断が確定された痴呆症の患者及び健常者について、光計測を行い、その結果を以上述べた手順で処理することによって得ることができる。図10に「モデル化波形の最大平坦部の高さ」の例を示す。図示するように、健常者、軽度認知障害、アルツハイマー病、血管性痴呆症、アルコール性痴呆症、前頭葉側頭葉性痴呆症の各々について、各計測部位の平均値μ1002及び分散σ1003が格納されている。図11は、これをグラフィカルに示したものであり、(a)は前頭部、(b)は左側頭部、(c)は右側頭部を示している。図中、縦軸は波形の最大平坦部の高さで、平均値1102とその上下に分散1103が棒状に示されている。横軸は健常者を含む6種類の症例に対応する。
最終的な結果は、被検者の名前、年令、性別、計測年月日等の被検者情報とともにモニタ112に表示される。図12に表示例1201を示す。図示する例では、被検者情報表示部1202と、計測部位毎の計測結果表示部1208、1209・・・があり、計測結果表示部には、計測部位1203、各チャンネルの計測結果1204、主成分解析処理結果1205、モデル化波形1206、特徴量1206が表示される。特徴量表示部1206は、算出した特徴量のほかにデータベースの平均値及び分散や、それに基づく危険率や判定結果などを合わせて表示する。
Claims (4)
- 被検体に装着されるプローブと、前記プローブを介して得られる複数の計測点からの光信号を受信し、ヘモグロビン変化信号に変換する手段、前記複数の計測点のヘモグロビン変化信号を解析し、痴呆症特有の特徴量を抽出する特徴量抽出手段、痴呆症の種類毎の特徴量をデータベースとして格納する記憶手段と、前記特徴量抽出手段によって抽出された特徴量とデータベースとして蓄積された痴呆症の特徴量とを比較し、特定痴呆症の判定を行なう判定手段とを備え、
前記特徴量抽出手段は、前記ヘモグロビン変化信号の信号波形をモデル化し、モデル化した計測信号波形から自動的に特徴量を算出することを特徴とする生体光計測装置。 - 前記特徴量抽出手段は、前記信号波形のモデルとして台形モデルを用いることを特徴とする請求項1記載の生体光計測装置。
- 前記特徴量抽出手段が行なうモデル化は、前記信号波形上の所定の点の既知座標値をモデルの対応する点の座標に代入しモデル波形とし、前記モデル波形と前記信号波形との二乗誤差を表す評価関数を定め、未知座標値の複数種の組み合わせを表す点を用いてシンプレックスを構成し、前記評価関数を最小とする組み合わせを見出す手順を繰り返すことを含むことを特徴とする請求項1または2に記載の生体光計測装置。
- 前記判定手段が判定する特定痴呆症は、アルツハイマー病であることを特徴とする請求項1ないし3いずれか1項記載の生体光計測装置。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004115474A JP4477403B2 (ja) | 2004-04-09 | 2004-04-09 | 生体光計測装置 |
| PCT/JP2005/005709 WO2005096951A1 (ja) | 2004-04-09 | 2005-03-28 | 生体光計測装置 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004115474A JP4477403B2 (ja) | 2004-04-09 | 2004-04-09 | 生体光計測装置 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005296231A JP2005296231A (ja) | 2005-10-27 |
| JP2005296231A5 JP2005296231A5 (ja) | 2007-05-31 |
| JP4477403B2 true JP4477403B2 (ja) | 2010-06-09 |
Family
ID=35124790
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004115474A Expired - Fee Related JP4477403B2 (ja) | 2004-04-09 | 2004-04-09 | 生体光計測装置 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP4477403B2 (ja) |
| WO (1) | WO2005096951A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI638641B (zh) | 2017-07-26 | 2018-10-21 | 鼎博康生物科學有限公司 | 生理特徵感測系統 |
| KR20220096272A (ko) * | 2020-12-30 | 2022-07-07 | 광주과학기술원 | 근적외선 및 뇌전도 신호를 이용한 치매 진단장치 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4517111B2 (ja) * | 2004-06-07 | 2010-08-04 | 独立行政法人情報通信研究機構 | 脳機能測定装置、脳機能測定方法及び脳機能測定プログラム |
| WO2007144977A1 (ja) * | 2006-06-15 | 2007-12-21 | Hitachi Medical Corporation | 生体光計測装置 |
| JP5248758B2 (ja) * | 2006-09-08 | 2013-07-31 | 株式会社島津製作所 | 光計測装置 |
| JP5319058B2 (ja) * | 2006-09-29 | 2013-10-16 | 山本 勝美 | 疾患の診断方法 |
| US20100256468A1 (en) * | 2007-05-21 | 2010-10-07 | Hitachi Medical Corporation | Apparatus for measuring biological light |
| JPWO2010029832A1 (ja) * | 2008-09-10 | 2012-02-02 | 株式会社日立メディコ | 生体光計測装置 |
| WO2012165602A1 (ja) * | 2011-05-31 | 2012-12-06 | 国立大学法人名古屋工業大学 | 認知機能障害判別装置、認知機能障害判別システム、およびプログラム |
| JP6008099B2 (ja) * | 2012-07-30 | 2016-10-19 | 学校法人日本大学 | 脳活動状態解析装置、脳活動状態解析方法、及び脳活動状態解析プログラム |
| JP6477280B2 (ja) * | 2015-06-16 | 2019-03-06 | 株式会社島津製作所 | 認知脳活動計測システムおよび認知脳活動計測方法 |
| JP6702836B2 (ja) * | 2016-09-28 | 2020-06-03 | ハルメク・ベンチャーズ株式会社 | 認知症判定得点算出装置及びそのプログラム |
| US11399765B2 (en) | 2017-02-16 | 2022-08-02 | Panasonic Intellectual Property Management Co., Ltd. | Dementia information output system and recording medium |
| KR102305828B1 (ko) * | 2019-09-27 | 2021-09-30 | 주식회사 엔서 | 치매 진단장치 및 시스템 |
| KR102319336B1 (ko) * | 2020-02-12 | 2021-10-29 | 주식회사 엔서 | 치매 진단장치 및 치매진단시스템 |
| JP7109499B2 (ja) * | 2020-05-07 | 2022-07-29 | 一般社団法人脳と心の健康科学研究所 | 認知症判定得点算出装置及びそのプログラム |
| CN113876320B (zh) * | 2021-09-29 | 2024-06-25 | 天津用恒医疗科技有限公司 | 血红蛋白浓度确定方法、装置、电子设备和存储介质 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3916985B2 (ja) * | 2002-03-26 | 2007-05-23 | 株式会社日立メディコ | 生体光計測装置 |
-
2004
- 2004-04-09 JP JP2004115474A patent/JP4477403B2/ja not_active Expired - Fee Related
-
2005
- 2005-03-28 WO PCT/JP2005/005709 patent/WO2005096951A1/ja active Application Filing
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI638641B (zh) | 2017-07-26 | 2018-10-21 | 鼎博康生物科學有限公司 | 生理特徵感測系統 |
| KR20220096272A (ko) * | 2020-12-30 | 2022-07-07 | 광주과학기술원 | 근적외선 및 뇌전도 신호를 이용한 치매 진단장치 |
| KR102507788B1 (ko) * | 2020-12-30 | 2023-03-08 | 광주과학기술원 | 근적외선 및 뇌전도 신호를 이용한 치매 진단장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2005096951A1 (ja) | 2005-10-20 |
| JP2005296231A (ja) | 2005-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4477403B2 (ja) | 生体光計測装置 | |
| Pinti et al. | A review on the use of wearable functional near‐infrared spectroscopy in naturalistic environments | |
| US20200375465A1 (en) | Super-pixel detection for wearable diffuse optical tomography | |
| JP3916985B2 (ja) | 生体光計測装置 | |
| JP4555230B2 (ja) | 生体光計測装置 | |
| JP4474145B2 (ja) | 光計測装置 | |
| WO2013190678A1 (ja) | 生体状態評価装置およびそのためのプログラム | |
| KR102487983B1 (ko) | 질병 예측 모델 구축 장치 및 방법과 질병 예측 장치 | |
| KR102099214B1 (ko) | 생체정보 및 영상정보 연계를 통한 인공지능 질환 진단 시스템 | |
| US20120215114A1 (en) | Non-Invasive Optical Imaging for Measuring Pulse and Arterial Elasticity in the Brain | |
| US20140107439A1 (en) | Biological optical measurement device, stimulus presentation method, and stimulus presentation program | |
| JP2007289224A (ja) | 生体計測装置および生体計測方法 | |
| US7890270B2 (en) | Optical system for measuring metabolism in a body, method and program | |
| JP6404162B2 (ja) | 脳機能指標演算装置および脳機能指標演算方法 | |
| EP4199811A1 (en) | Systems, devices, and methods for developing a fetal oximetry model for use to determine a fetal oximetry value | |
| EP2642910B1 (en) | Device and method for determining a disease activity | |
| US20080273174A1 (en) | Method for evaluating longitudinal optic disc-retinal health | |
| JP3952275B2 (ja) | 生体光計測装置 | |
| JPWO2015141423A1 (ja) | 生体光計測装置及び生体光計測方法 | |
| JP7444003B2 (ja) | 気分障害測定装置および気分障害測定方法 | |
| US20240055091A1 (en) | Method for calculating a degree of fatigue | |
| JP2013017494A (ja) | 生体光計測装置、波形解析方法 | |
| CN118845001A (zh) | 基于近红外数据的性早熟评估系统和性早熟评估装置 | |
| JP2023020340A (ja) | 学習装置及び推定装置 | |
| JP4946847B2 (ja) | 光脳機能イメージング装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070406 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070406 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100302 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100311 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130319 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140319 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |