JP4346248B2 - Method for producing aragonite crystalline calcium carbonate - Google Patents
Method for producing aragonite crystalline calcium carbonate Download PDFInfo
- Publication number
- JP4346248B2 JP4346248B2 JP2001030184A JP2001030184A JP4346248B2 JP 4346248 B2 JP4346248 B2 JP 4346248B2 JP 2001030184 A JP2001030184 A JP 2001030184A JP 2001030184 A JP2001030184 A JP 2001030184A JP 4346248 B2 JP4346248 B2 JP 4346248B2
- Authority
- JP
- Japan
- Prior art keywords
- calcium carbonate
- reaction
- aragonite
- reaction tank
- concentration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Compounds Of Alkaline-Earth Elements, Aluminum Or Rare-Earth Metals (AREA)
- Pigments, Carbon Blacks, Or Wood Stains (AREA)
- Paper (AREA)
Description
【0001】
【発明の属する技術分野】
本発明は硫酸塩法もしくはソーダ法によるパルプ製造工程またはソーダ灰を用いた水酸化ナトリウム製造工程の苛性化工程において製紙用填料及び、塗工用顔料として有用な性能を与えるアラゴナイト結晶の炭酸カルシウムの製造方法に関するものであり、さらに詳しくは生石灰及び消石灰からなる群から選択される物質から調製される石灰乳と緑液又はソーダ灰由来の炭酸ナトリウム水溶液を2つ以上の反応槽が連続した反応装置の第1番目の反応槽に連続的に導入し、該反応槽の水酸化ナトリウム・炭酸ナトリウム濃度を規定することにより製紙用填料及び、塗工用顔料として有用な性能を与えるアラゴナイト結晶の炭酸カルシウムの製造方法に関するものである。
【0002】
【従来の技術】
紙には白色度、不透明度、平滑性、印刷適性等の改良を目的として、炭酸カルシウム、タルク、クレー、二酸化チタン等を填料として内添もしくは、顔料として塗工するの一般的である。これらの中でも炭酸カルシウムは近年、填料・顔料としての使用量が増加している。
【0003】
炭酸カルシウムの特徴としては(1)安価・(2)高白色度・(3)種々の形状を有する、等が挙げられるが、特定の形状を有したものを紙の内添填料・塗工用顔料として用いると、紙の白色度が向上するだけではなく、不透明度も向上することが一般的に知られている。市販されている炭酸カルシウムの形状には紡錘状・立方状・針状・柱状・イガグリ状などがあるが、アスペクト比が大きい針状・柱状・イガグリ状は填料として紙に内添した場合に光を最も散乱する0.2〜0.5μmの範囲に粒子の短径を制御しやすく、結果として紙の不透明度を向上させることができると言われている。また、適切な粒子径をもった針状・柱状粒子を塗工用顔料として用いれば塗工紙の光沢や印刷品質を改善できることが知られている。これらの針状・柱状・イガグリ状のような形状を示す炭酸カルシウムの結晶多形(化学組成が同一でありながら結晶構造が異なるもの)はアラゴナイト結晶であり、これを安価に効率よく製造することができれば高品質の紙を安価に提供することができる。
【0004】
一般に炭酸カルシウムの製造方法として、天然石灰石を乾式あるいは湿式で機械粉砕して得られる重質炭酸カルシウムと、化学的方法によって得られる沈降性炭酸カルシウム(合成炭酸カルシウム)があるがアラゴナイト結晶は天然では貝殻などに一部存在するだけで大量に利用しようとする場合、後者の化学的方法によって製造するしかない。アラゴナイト結晶系炭酸カルシウムの化学的な製造方法としては、(1)尿素とカルシウム塩との反応による尿素加水分解法、(2)炭酸ガスと石灰乳との反応による炭酸ガス法、(3)炭酸ナトリウムと石灰乳との反応による苛性化法などの反応が知られている。これらの方法のうち、(1)は非常に高純度のアラゴナイト結晶を合成することができるが、炭酸カルシウムの生成に時間がかかることと、生産量がすくないため、工業化されていない。一方(2)は、様々な形状のものを製造する方法についても広く研究されており、針状、柱状、イガグリ状の形状を示すアラゴナイト結晶系炭酸カルシウムの製造方法に関する特許も数多く出されている。(特開平4-295010、特開平4-224110)
しかしながら、炭酸ガス法は炭酸カルシウムが唯一の生産物であるためコストが高くなってしまい、結果としてこれを填料・顔料として利用すると安価な紙を提供することができない問題がある。そこで(3)の方法と基本的に同じである硫酸塩法又はソーダ法によるパルプ製造工程の蒸解薬品の回収・再生を行う苛性化工程もしくはソーダ灰を用いた水酸化ナトリウム製造工程の苛性化工程で副生する炭酸カルシウムをアラゴナイト結晶系の炭酸カルシウムとして取り出す方法が考えられる。すでに硫酸塩法又はソーダ法によるパルプ製造工程の苛性化工程において反応条件を制御することによって副生する炭酸カルシウムを上記のような針状・柱状・イガグリ状のアラゴナイト結晶を生成させるという特許が出願されている。(特開平10-226974)しかしながら、この方法は安価に製造できる反面、バッチ反応であるため、大量に製造する場合には効率が悪い製造方法であり、填料・顔料として大量に提供することができない問題点があった。
【0005】
【発明が解決しようとする課題】
以上のような状況に鑑み、製紙用填料及び塗工用顔料として用いて紙の白色度・不透明度が高く、印刷品質等の優れた上質紙や塗工紙を提供するために、苛性化工程を利用して、アラゴナイト結晶の炭酸カルシウムを効率よく得ることを本発明の課題とした。
【0006】
【課題を解決するための手段】
本発明者らは、硫酸塩法又はソーダ法によるパルプ製造工程の苛性化工程を利用して、生石灰の濃度が1〜60重量%になるように、生石灰及び消石灰からなる群から選択される物質に生石灰換算で1 molに対して0.25 mol以下の炭酸イオンを含むアルカリ水溶液を添加し、攪拌させて石灰乳を調製した後、緑液を連続的に添加し、その添加速度及び反応温度を制御することによってアラゴナイト結晶が得られることを見出した。しかし、この方法は1つの反応槽内で石灰乳を調製した後に、この反応槽に緑液を添加するバッチ反応であるため、生産性が悪い欠点があった。そこで本発明者らはさらに鋭意研究を進めた結果、アルカリが存在する条件下でアラゴナイト結晶が生成しやすいことを突き止め、アラゴナイトが生成しやすいアルカリ条件を常に一定に維持できる連続法がアラゴナイト生成には有利であること、さらにこの連続法によって生産性も大幅に向上させることを見出し、この知見に基づいて本発明をなすに至った。本発明の方法により、高アラゴナイト結晶含有の炭酸カルシウムを効率的に製造することが可能となり、粒子の短径が0.1〜0.5μmで、長径が0.5〜20μmの針状、柱状、イガグリ状の炭酸カルシウムが調製されることが分かった。これらは製紙用填料として、白色度、不透明度、嵩等に優れ、さらに製紙用塗工用顔料として用いると塗工紙の白色度、不透明度、光沢度、印刷品質等に優れる。しかもこれらは従来の炭酸ガス法で得られる炭酸カルシウムに比べて大幅に低コストで製造することができる。
【0007】
【発明の実施の形態】
本発明の石灰乳の調製において使用する生石灰は、炭酸カルシウムを主成分とする石灰石、及び硫酸塩法またはソーダ法によるパルプ製造の苛性化工程において炭酸ナトリウムを水酸化ナトリウムに転化する際に生成する炭酸カルシウムを焼成したものであればよい。なお、その際の焼成装置に関しては、ベッケンバッハ炉、メルツ炉、ロータリーキルン、国井式炉、KHD(カーハーディー)炉、コマ式炉、カルマチック炉、流動焼成炉、混合焼き立炉等、炭酸カルシウムを生石灰(酸化カルシウム)に転化する装置であれば特に制限されない。
【0008】
また石灰乳の調製において使用する消石灰は前記生石灰を湿式及び乾式で消和されたものでよいが、乾式で消和された消石灰の方が生成する炭酸カルシウムの形状にとってはより好ましい。
【0009】
石灰乳の調製において添加する液としては石灰乳の調製の際に用いる生石灰1 molに対して炭酸イオンが0.25 mol以下になるような中性からアルカリ性の水溶液を利用することが好ましい。ここで、使用するアルカリ性水溶液は硫酸塩法又はソーダ法によるパルプ製造工程の苛性化工程の場合、苛性化工程で生成する白液を水で希釈した水溶液、あるいは緑液や白液中の沈殿物(ドレッグス、炭酸カルシウムスラッジ)を洗浄した上澄液である弱液を利用することが好ましい。ソーダ灰を用いた水酸化ナトリウム製造工程の場合、苛性化工程によって生成してきた水酸化ナトリウム水溶液を一部循環させて利用することが好ましい。さらに高品質のアラゴナイト結晶の炭酸カルシウムを得ようとするならば炭酸イオンを含まないアルカリ性水溶液を用いた方がより好ましい。しかし、石灰乳の調製において添加する液中の炭酸イオンが生石灰1 molに対して0.25 molより多くなると生成する炭酸カルシウムは米粒状、紡錘状もしくは塊状のカルサイト結晶になる。
【0010】
石灰乳の調製時の石灰乳濃度は生石灰換算で10〜60重量%、好ましくは20〜40重量%の条件で行う必要がある。ここで石灰乳濃度が60重量%を超えると石灰乳粘度が高すぎて現実的に攪拌が困難となり、さらに第1番目の反応槽への移送も困難となる。一方、石灰乳濃度が10重量%未満では生産性が悪く、実用的ではない。
【0011】
生石灰の消和および消石灰の溶解での混合には、一般的な攪拌羽根式、ポンプ式、押し出し機類、捏和機類、混練機類の中から、混合時の液あるいはスラリーの粘度にあわせて適宜選定して使用すれば良い。
【0012】
本発明の苛性化反応における緑液は、一般的な硫酸塩法又はソーダ法の苛性化工程から発生した緑液を用いることができる。さらに高品質な炭酸カルシウムを得ようとするならば緑液を冷却もしくは加熱濃縮によって結晶化させた炭酸ナトリウムをそのままか水または弱液で希釈した後の溶液を利用するのが好ましい。ソーダ灰を用いた水酸化ナトリウム製造工程の苛性化工程の場合、炭酸ナトリウム含量が高いソーダ灰が好ましく、副生する炭酸カルシウムの色が問題となる場合は、Fe、Mnなどの不純物が少ないソーダ灰を選択する必要がある。
【0013】
炭酸ナトリウムの固体を用いる場合、適宜添加すれば良いが、炭酸ナトリウム水溶液を用いる場合はNa2CO3濃度が20〜230g/L(Na2O換算、以下同じ)、好ましくはNa2CO3濃度が60〜180g/L、より好ましくは80〜120g/Lで行う必要がある。Na2CO3濃度が20g/Lより低い場合では、最終白液又は水酸化ナトリウムの濃度が下がりそれぞれ蒸解、精製工程での負荷が大きくなってしまう。一方、230 g/Lの濃度の溶液は飽和濃度に近いため、これ以上の高濃度の溶液を調製することは困難である。
【0014】
前記石灰乳と緑液又はソーダ灰由来の炭酸ナトリウム水溶液は2つ以上の連続した反応槽装置の第1番目の反応槽に連続的に導入するが、この反応装置はほぼ現状の硫酸塩法又はソーダ法によるパルプ製造工程の苛性化工程を利用することができる。この時、石灰乳と緑液又はソーダ灰由来の炭酸ナトリウム水溶液を添加する第1番目の反応槽内の水酸化ナトリウム濃度が0.1〜2.5 mol/l、好ましくは0.5〜2.0 mol/lであり、かつ炭酸ナトリウム濃度が0.5 mol/l以下、好ましくは0.25 mol/l以下で行う必要がある。第1番目の反応槽内の水酸化ナトリウム濃度を0.1mol/l以下の濃度にするには石灰乳及び/又は緑液・ソーダ灰由来の炭酸ナトリウム水溶液の濃度を低下させるか、緑液又はソーダ灰由来の炭酸ナトリウム水溶液の流量だけを極端に低下させる必要があり、苛性化工程が白液又は水酸化ナトリウムの製造工程であることを考慮すると実用的ではない。また水酸化ナトリウム濃度が2.5mol/l以上では求めるアラゴナイト結晶が得られない。一方、該反応槽の炭酸ナトリウム濃度は低い方がアラゴナイト結晶は生成しやすく、0.5 mol/lより高い濃度ではカルサイト結晶が生成しやすく、求めるようなアラゴナイト結晶が得られない。この該反応槽の水酸化ナトリウム濃度、炭酸ナトリウム濃度を調整する一つの手段として、石灰乳は第1番目の反応槽に全量を直接導入する一方、緑液・ソーダ灰由来の炭酸ナトリウム水溶液を導入すべき量の一部を第1番目の反応槽に導入し、残る量は第1番目の反応槽からオーバーフロー等で移送してきたスラリーと共に第2番目の反応槽に導入するような分割添加方法が考えられる。
【0015】
前記石灰乳と緑液又はソーダ灰由来の炭酸ナトリウム水溶液は2つ以上の連続した反応装置の反応槽に連続的に導入する前に該反応槽にアラゴナイト結晶の種晶を添加すると連続製造のはじめから効率的にアラゴナイト結晶を製造することができる。種晶はバッチ法もしくは連続法によって製造したアラゴナイト結晶を再循環させて利用することができる。
【0016】
苛性化反応温度については20〜105℃、好ましくは40〜90℃で行う必要がある。105℃以上より高くする場合には、大気圧下での沸騰点を超えるため、加圧型の苛性化装置等を必要とするため不経済である。また、一方、20℃より低い場合には、求めるアラゴナイト結晶が得られない。
【0017】
苛性化反応時の攪拌には、一般的な攪拌羽根式、ポンプ式、押し出し機類、捏和機類、混練機類の中から、生石灰の消和および消石灰の溶解により調製された石灰乳と緑液が均一に混合できるもの、好ましくはできるだけすばやく混合できるものを適宜選定して使用すれば良い。
【0018】
以上のような条件下において、粒子の短径が0.1〜0.5μmで、長径が0.5〜20μmの針状、柱状、イガグリ状の炭酸カルシウムが調整可能となる。
本発明によって得られるアラゴナイト結晶の炭酸カルシウムは、バッチ反応による苛性化工程で得られた炭酸カルシウムに比べて、生産性に優れ、大量に製造することが可能となる。また、これを製紙用填料として内添することで上質紙・塗工紙の白色度、不透明度、平滑性、印刷適性等に優れた特徴を与える。さらに各種顔料に用いることで、光沢、不透明度、平滑性、印刷的性等に優れた特徴を与える。また、製紙用のほか、ゴム、プラスチック、ペイント、シーリング剤、粘着剤、肥料等にも使用可能である。
【0019】
【作用】
本発明のメカニズムについては充分に解明されていないが、アルカリ存在下での消石灰と炭酸ナトリウムの反応ではアラゴナイト結晶が多く析出しやすい環境にあるものと思われる。しかし、この時に過剰の炭酸イオンが溶液内に存在するとカルサイト結晶が生成しやすい。従って石灰乳の調製の際に炭酸ナトリウムが多い水溶液を使用した場合や連続反応時の緑液の添加速度を高めた場合、アラゴナイト結晶の割合が低下する傾向にある。
【0020】
【実施例】
以下に本発明を実施例および比較例をあげてより詳細に説明するが、当然ながら、本発明は実施例のみに限定されるものではない。
[試験法]
1. アルカリの測定:TAPPI624hm−85、 TAPPI625hm−85、あるいはこれに準じて測定した。
2. 軽カル平均粒子径:生成物を水洗濾過し、水で希釈後、レーザー回折式粒度分布計(シーラス社製モデル715)で平均粒子径を測定した。
3. 形態観察:生成物を水洗濾過し、乾燥後走査型電子顕微鏡(日本電子(株)製 JSA-840A)で形態を観察した。ここで観察をもとに50個の粒子について短径、長径を測定した。
4. 結晶構造:島津製作所製 X線回折XD−D1により測定した。
[実施例1]
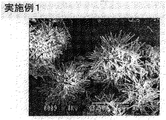
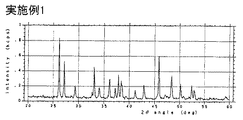
250mlと1000mlの丸底フラスコが側壁の配管を通して接続されている反応装置において(以下の実施例・比較例についても同じ容器使用)に、消石灰と水を用いて、生石灰濃度として30重量%になる割合で混合した石灰乳と緑液(組成:Na2O換算値でNa2CO3=100 g/l、Na2S=30 g/l;以下の実施例・比較例について同じ)を用いて温度60℃、攪拌速度600rpm(KYOEI POWER STIRRER TYPE PS-2N使用、以下の実施例・比較例について同じ攪拌機使用)、第1番目と第2番目の反応槽への緑液の分割比率を1:2として連続反応を行わせ、第1番目の反応槽の水酸化ナトリウム濃度を1.6mol/l、炭酸ナトリウム濃度を0.2mol/lになるように石灰乳および緑液の流量を調整して苛性化反応を行わせた。生成反応物の平均粒子径および形態観察を行った結果、平均粒子径10.8μm、その構成一次粒子は平均長径8.0μm、平均短径0.2μmであるアラゴナイト結晶の針状炭酸カルシウムが認められた。実験条件および結果を表1に示す。
[実施例2]
消石灰と水を用いて、生石灰濃度として20重量%になる割合で混合した石灰乳とソーダ灰由来の炭酸ナトリウム水溶液(100g/l as Na2O)を用いて温度50℃で第1番目と第2番目の反応槽への炭酸ナトリウム水溶液の分割比率を5:1として連続反応を行わせ、第1番目の反応槽の水酸化ナトリウム濃度を1.6mol/l、炭酸ナトリウム濃度を0.1mol/lになるようにし、さらに連続反応前に種晶34g(アラゴナイト含有率70%)を添加した以外は実施例1と同様に苛性化反応を行わせた。生成反応物の平均粒子径および形態観察を行った結果、平均粒子径16.0μm、その構成一次粒子は平均長径9.2μm、平均短径0.2μmであるアラゴナイト結晶の針状炭酸カルシウムが認められた。実験条件および結果を表1に示す。
[比較例1]
消石灰と白液を用いて生石灰濃度として10重量%になる割合で混合した石灰乳と緑液を用いて第1番目の反応槽だけに緑液を導入し、温度90℃で連続反応を行わせ、第1番目の反応槽の水酸化ナトリウム濃度を1.8mol/l、炭酸ナトリウム濃度を0.6mol/lになるようにした以外は実施例1と同様に苛性化反応を行わせた。生成反応物の平均粒子径および形態観察を行った結果、平均粒子径14.5μmであるカルサイト結晶の炭酸カルシウムが認められた。実験条件および結果を表1に示す。
[比較例2]
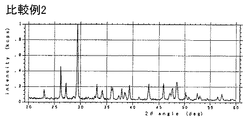
第1番目の反応槽だけに緑液を導入し、温度50℃で連続反応を行わせ、第1番目の反応槽の水酸化ナトリウム濃度を1.5mol/l、炭酸ナトリウム濃度を0.6mol/lになるようにした以外は実施例1と同様に苛性化反応を行わせた。生成反応物の平均粒子径および形態観察を行った結果、平均粒子径20.4μmであるカルサイトとアラゴナイト結晶が混合した炭酸カルシウムが認められた。実験条件および結果を表1に示す。
【0021】
【表1】
【図面の簡単な説明】
【図1】 実施例1で得られたアラゴナイト結晶系炭酸カルシウムの結晶粒子構造を示す走査型電子顕微鏡写真である。
【図2】 実施例1で得られた生成物についてのX線回折の結果を示す図である。
【図3】 実施例2で得られたアラゴナイト結晶系炭酸カルシウムの結晶粒子構造を示す走査型電子顕微鏡写真である。
【図4】 比較例2で得られた炭酸カルシウムの結晶粒子構造を示す走査型電子顕微鏡写真である。
【図5】 比較例2で得られた生成物についてのX線回折の結果を示す図である。[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a calcium carbonate of aragonite crystal which provides useful performance as a paper filler and a coating pigment in a causticizing process of a pulp manufacturing process by a sulfate method or a soda method or a sodium hydroxide manufacturing process using soda ash. More specifically, a reaction apparatus in which two or more reaction tanks are made of lime milk prepared from a substance selected from the group consisting of quicklime and slaked lime and a sodium carbonate aqueous solution derived from green liquor or soda ash. Aragonite crystal calcium carbonate, which is continuously introduced into the first reaction tank and gives useful performance as a paper filler and coating pigment by regulating the sodium hydroxide / sodium carbonate concentration in the reaction tank It is related with the manufacturing method.
[0002]
[Prior art]
For the purpose of improving whiteness, opacity, smoothness, printability, and the like, it is common to add calcium carbonate, talc, clay, titanium dioxide or the like as a filler to paper, or as a pigment. Among these, calcium carbonate has been used in recent years as a filler / pigment.
[0003]
Features of calcium carbonate include (1) low cost, (2) high whiteness, (3) various shapes, etc., but those with specific shapes are used for paper fillers and coatings. When used as a pigment, it is generally known that not only the whiteness of paper is improved, but also the opacity is improved. Commercially available calcium carbonate shapes include spindles, cubes, needles, columns, and burrs, but needles, columns, and burrs with a large aspect ratio are light when added internally to paper as a filler. It is said that the minor axis of the particles can be easily controlled in the range of 0.2 to 0.5 μm that most scatters, and as a result, the opacity of the paper can be improved. It is also known that the gloss and print quality of coated paper can be improved by using needle-like or columnar particles having an appropriate particle size as a coating pigment. These crystal polymorphs of calcium carbonate (shaped with the same chemical composition but different crystal structure) that have a needle-like, columnar, or tiger-like shape are aragonite crystals, which must be produced efficiently at low cost. If it is possible, high-quality paper can be provided at low cost.
[0004]
Generally, there are heavy calcium carbonate obtained by mechanically pulverizing natural limestone dry or wet, and precipitated calcium carbonate (synthetic calcium carbonate) obtained by chemical methods, but aragonite crystals are not naturally produced. When it is intended to be used in large quantities just by being partially present in shells, etc., it can only be produced by the latter chemical method. The chemical production method of aragonite crystalline calcium carbonate includes (1) urea hydrolysis method by reaction of urea and calcium salt, (2) carbon dioxide method by reaction of carbon dioxide and lime milk, (3) carbon dioxide Reactions such as a causticizing method by the reaction between sodium and lime milk are known. Among these methods, (1) is capable of synthesizing very high purity aragonite crystals, but is not industrialized because it takes time to produce calcium carbonate and the production amount is short. On the other hand, (2) has also been extensively studied for methods for producing various shapes, and many patents relating to methods for producing aragonite-based calcium carbonate exhibiting needle-like, columnar, and crab-like shapes have been issued. . (Japanese Patent Laid-Open No. 495010, Japanese Patent Laid-Open No. 4-224110)
However, the carbon dioxide gas method is expensive because calcium carbonate is the only product, and as a result, there is a problem that inexpensive paper cannot be provided if this is used as a filler or pigment. Therefore, a causticizing process for recovering and regenerating cooking chemicals in the pulp manufacturing process by the sulfate method or soda method, which is basically the same as the method in (3), or a causticizing process in the sodium hydroxide manufacturing process using soda ash. It is conceivable to extract calcium carbonate by-produced as aragonite crystalline calcium carbonate. Already filed a patent to produce acicular, columnar, and crab-shaped aragonite crystals as a by-product of calcium carbonate by controlling reaction conditions in the causticizing step of the pulp manufacturing process by the sulfate method or soda method Has been. However, although this method can be manufactured at a low cost, it is a batch reaction, so it is an inefficient manufacturing method when it is manufactured in large quantities and cannot be provided in large quantities as a filler / pigment. There was a problem.
[0005]
[Problems to be solved by the invention]
In view of the above situation, a causticizing process is used to provide high-quality paper and coated paper with high whiteness and opacity, and excellent print quality, etc., as a paper filler and coating pigment. It is an object of the present invention to efficiently obtain calcium carbonate of aragonite crystals using
[0006]
[Means for Solving the Problems]
The present inventors use a causticizing step of a pulp manufacturing process by a sulfate method or a soda method, and a substance selected from the group consisting of quick lime and slaked lime so that the concentration of quick lime is 1 to 60% by weight. After adding an aqueous alkaline solution containing 0.25 mol or less carbonate ion to 1 mol in terms of quick lime, stirring to prepare lime milk, adding green liquor continuously, controlling the addition rate and reaction temperature It was found that an aragonite crystal can be obtained by doing so. However, since this method is a batch reaction in which lime milk is prepared in one reaction tank and then green liquor is added to the reaction tank, there is a disadvantage that productivity is poor. Therefore, as a result of further diligent research, the present inventors have found that aragonite crystals are likely to be formed under the presence of alkali, and that a continuous process that can always maintain the alkaline conditions at which aragonite is likely to be generated is a continuous method for producing aragonite. Was found to be advantageous, and the productivity was also greatly improved by this continuous method, and the present invention was made based on this finding. By the method of the present invention, it becomes possible to efficiently produce calcium carbonate containing high aragonite crystals, and needle-like, columnar, and corn-like carbonates having a minor axis of 0.1 to 0.5 μm and a major axis of 0.5 to 20 μm. It has been found that calcium is prepared. These are excellent in whiteness, opacity, bulk and the like as a filler for papermaking, and are excellent in whiteness, opacity, glossiness, printing quality and the like of the coated paper when used as a coating pigment for papermaking. Moreover, they can be produced at a significantly lower cost than calcium carbonate obtained by the conventional carbon dioxide method.
[0007]
DETAILED DESCRIPTION OF THE INVENTION
The quicklime used in the preparation of the lime milk of the present invention is formed when limestone mainly composed of calcium carbonate and when sodium carbonate is converted to sodium hydroxide in the causticizing step of pulp production by the sulfate method or the soda method. What baked calcium carbonate should just be. Regarding the firing equipment at that time, Beckenbach furnace, Melz furnace, rotary kiln, Kunii-type furnace, KHD (Kerhardy) furnace, Koma-type furnace, Kalmatic furnace, fluidized firing furnace, mixed baking stand, etc., calcium carbonate If it is an apparatus which converts lime into quicklime (calcium oxide), it will not be restricted in particular.
[0008]
Further, the slaked lime used in the preparation of lime milk may be one obtained by dehydrating the quick lime by wet and dry methods, but is more preferable for the shape of calcium carbonate produced by dry slaked lime.
[0009]
As a liquid to be added in the preparation of lime milk, it is preferable to use a neutral to alkaline aqueous solution in which carbonate ions are 0.25 mol or less with respect to 1 mol of quick lime used in the preparation of lime milk. Here, the alkaline aqueous solution to be used is an aqueous solution obtained by diluting the white liquor produced in the causticizing step with water, or a precipitate in the green liquor or white liquor in the case of the causticizing step of the pulp manufacturing process by the sulfate method or the soda method. It is preferable to use a weak liquid which is a supernatant obtained by washing (Dreggs, calcium carbonate sludge). In the case of the sodium hydroxide production process using soda ash, it is preferable to use the sodium hydroxide aqueous solution generated by the causticizing process by partially circulating it. Furthermore, it is more preferable to use an alkaline aqueous solution that does not contain carbonate ions to obtain high-quality aragonite crystal calcium carbonate. However, when the amount of carbonate ions in the liquid added in the preparation of lime milk exceeds 0.25 mol with respect to 1 mol of quicklime, the calcium carbonate that is produced becomes rice-like, spindle-like or massive calcite crystals.
[0010]
It is necessary to carry out the lime milk density | concentration at the time of preparation of lime milk on the conditions of 10-60 weight% in conversion of quick lime, Preferably 20-40 weight%. Here, when the lime milk concentration exceeds 60% by weight, the viscosity of the lime milk is too high, so that stirring is actually difficult, and further, transfer to the first reaction tank becomes difficult. On the other hand, if the lime milk concentration is less than 10% by weight, the productivity is poor and it is not practical.
[0011]
For mixing with quick lime slaked and slaked lime dissolved, use the general stirring blade type, pump type, extruders, kneaders, and kneaders to match the viscosity of the liquid or slurry during mixing. Can be selected and used as appropriate.
[0012]
As the green liquor in the causticizing reaction of the present invention, the green liquor generated from the causticizing step of a general sulfate method or soda method can be used. In order to obtain higher-quality calcium carbonate, it is preferable to use a solution obtained by diluting sodium carbonate obtained by cooling or concentrating the green liquor with water or weak liquid as it is. In the case of the causticizing process of sodium hydroxide production process using soda ash, soda ash with a high sodium carbonate content is preferable. If the color of calcium carbonate by-product becomes a problem, soda with less impurities such as Fe and Mn It is necessary to select ash.
[0013]
When using a solid sodium carbonate, it may be added as appropriate, but when using an aqueous sodium carbonate solution, the Na 2 CO 3 concentration is 20 to 230 g / L (converted to Na 2 O, the same shall apply hereinafter), preferably the Na 2 CO 3 concentration Needs to be carried out at 60 to 180 g / L, more preferably 80 to 120 g / L. When the Na 2 CO 3 concentration is lower than 20 g / L, the concentration of the final white liquor or sodium hydroxide decreases and the load on the cooking and refining processes increases respectively. On the other hand, since a solution having a concentration of 230 g / L is close to a saturated concentration, it is difficult to prepare a solution having a higher concentration.
[0014]
The lime milk and the sodium carbonate aqueous solution derived from green liquor or soda ash are continuously introduced into the first reaction tank of two or more continuous reaction tank apparatuses. The causticizing process of the pulp manufacturing process by the soda method can be used. At this time, the sodium hydroxide concentration in the first reaction vessel to which the sodium carbonate aqueous solution derived from lime milk and green liquor or soda ash is added is 0.1 to 2.5 mol / l, preferably 0.5 to 2.0 mol / l, The sodium carbonate concentration must be 0.5 mol / l or less, preferably 0.25 mol / l or less. In order to reduce the concentration of sodium hydroxide in the first reaction tank to 0.1 mol / l or less, the concentration of sodium carbonate aqueous solution derived from lime milk and / or green liquor / soda ash is reduced, or green liquor or soda Only the flow rate of the ash-derived sodium carbonate aqueous solution needs to be drastically reduced, which is not practical considering that the causticizing process is a white liquor or sodium hydroxide manufacturing process. Further, when the sodium hydroxide concentration is 2.5 mol / l or more, the desired aragonite crystal cannot be obtained. On the other hand, when the sodium carbonate concentration in the reaction vessel is lower, aragonite crystals are more likely to be formed. When the concentration is higher than 0.5 mol / l, calcite crystals are likely to be formed, and the desired aragonite crystals cannot be obtained. As one means of adjusting the sodium hydroxide concentration and sodium carbonate concentration in the reaction tank, lime milk is directly introduced into the first reaction tank, while a sodium carbonate aqueous solution derived from green liquor / soda ash is introduced. A divided addition method in which a part of the amount to be introduced is introduced into the first reaction tank and the remaining amount is introduced into the second reaction tank together with the slurry transferred from the first reaction tank due to overflow or the like. Conceivable.
[0015]
If the sodium carbonate aqueous solution derived from lime milk and green liquor or soda ash is continuously introduced into the reaction tanks of two or more continuous reactors, seeds of aragonite crystals are added to the reaction tanks to start the continuous production. Thus, aragonite crystals can be efficiently produced. Seed crystals can be used by recirculating aragonite crystals produced by a batch method or a continuous method.
[0016]
The causticizing reaction temperature should be 20 to 105 ° C, preferably 40 to 90 ° C. When the temperature is higher than 105 ° C., it exceeds the boiling point under atmospheric pressure, which requires a pressurized causticizer and the like, which is uneconomical. On the other hand, if it is lower than 20 ° C., the desired aragonite crystal cannot be obtained.
[0017]
For stirring during the causticizing reaction, lime milk prepared by calcification of quick lime and dissolution of slaked lime from general stirring blade type, pump type, extruders, kneaders, kneading machines and What can mix green liquid uniformly, Preferably what can mix as quickly as possible should just be selected suitably.
[0018]
Under the conditions as described above, acicular, columnar, and rugged calcium carbonates having a minor axis of 0.1 to 0.5 μm and a major axis of 0.5 to 20 μm can be adjusted.
The calcium carbonate of the aragonite crystal obtained by the present invention is excellent in productivity and can be produced in a large amount as compared with the calcium carbonate obtained in the causticizing step by batch reaction. Moreover, by adding this as a filler for papermaking, it gives excellent characteristics such as whiteness, opacity, smoothness, and printability of high-quality paper / coated paper. Furthermore, when used for various pigments, it gives excellent characteristics such as gloss, opacity, smoothness, and printability. In addition to papermaking, it can also be used for rubber, plastic, paint, sealing agents, adhesives, fertilizers and the like.
[0019]
[Action]
Although the mechanism of the present invention has not been fully elucidated, it seems that the reaction between slaked lime and sodium carbonate in the presence of alkali tends to precipitate a large amount of aragonite crystals. However, if excessive carbonate ions are present in the solution at this time, calcite crystals are likely to be formed. Accordingly, when an aqueous solution containing a large amount of sodium carbonate is used in the preparation of lime milk or when the rate of addition of green liquor during continuous reaction is increased, the ratio of aragonite crystals tends to decrease.
[0020]
【Example】
The present invention will be described in more detail below with reference to examples and comparative examples, but the present invention is not limited to the examples.
[Test method]
1. Alkali measurement: TAPPI 624hm-85, TAPPI 625hm-85 or similar measurement.
2. Light cal mean particle size: The product was washed with water, diluted with water, and then measured with a laser diffraction particle size distribution meter (Model 715, manufactured by Cirrus).
3. Morphological observation: The product was washed with water and filtered, and after drying, the morphology was observed with a scanning electron microscope (JSA-840A manufactured by JEOL Ltd.). Based on the observation, the short diameter and long diameter of 50 particles were measured.
4. Crystal structure: Measured by X-ray diffraction XD-D1 manufactured by Shimadzu Corporation.
[Example 1]
In a reaction apparatus in which 250 ml and 1000 ml round bottom flasks are connected through a side wall pipe (use the same container for the following examples and comparative examples), slaked lime and water are used, resulting in a quick lime concentration of 30% by weight. milk of lime and green liquor in a mixing ratio (composition: Na 2 O converted value in Na 2 CO 3 = 100 g / l, Na 2 S = 30 g / l; the same for the following examples and Comparative examples) using
[Example 2]
First and second at 50 ° C using sodium carbonate aqueous solution (100g / l as Na 2 O) derived from lime milk and soda ash mixed with slaked lime and water at a ratio of 20% by weight as quick lime concentration Let the division ratio of the aqueous sodium carbonate solution to the second reaction tank be 5: 1 and let the continuous reaction occur, so that the sodium hydroxide concentration in the first reaction tank is 1.6 mol / l and the sodium carbonate concentration is 0.1 mol / l Then, a causticizing reaction was carried out in the same manner as in Example 1 except that 34 g of seed crystals (aragonite content 70%) was added before the continuous reaction. As a result of observing the average particle diameter and morphology of the product reaction product, aragonite crystal acicular calcium carbonate having an average particle diameter of 16.0 μm and the constituent primary particles having an average major axis of 9.2 μm and an average minor axis of 0.2 μm was observed. The experimental conditions and results are shown in Table 1.
[Comparative Example 1]
Introduce green liquor only to the first reaction tank using lime milk and green liquor mixed with slaked lime and white liquor at a rate of 10% by weight as quick lime concentration, and allow continuous reaction at a temperature of 90 ° C. The causticizing reaction was carried out in the same manner as in Example 1 except that the sodium hydroxide concentration in the first reaction tank was 1.8 mol / l and the sodium carbonate concentration was 0.6 mol / l. As a result of observing the average particle size and morphology of the product reaction product, calcium carbonate of calcite crystal having an average particle size of 14.5 μm was observed. The experimental conditions and results are shown in Table 1.
[Comparative Example 2]
The green liquor is introduced only into the first reaction tank, and the continuous reaction is performed at a temperature of 50 ° C., so that the sodium hydroxide concentration in the first reaction tank is 1.5 mol / l and the sodium carbonate concentration is 0.6 mol / l. A causticizing reaction was carried out in the same manner as in Example 1 except that the above conditions were satisfied. As a result of observing the average particle size and morphology of the product reaction product, calcium carbonate in which calcite having an average particle size of 20.4 μm and aragonite crystals were mixed was observed. The experimental conditions and results are shown in Table 1.
[0021]
[Table 1]
[Brief description of the drawings]
1 is a scanning electron micrograph showing the crystal grain structure of aragonite crystal-based calcium carbonate obtained in Example 1. FIG.
2 is a graph showing the results of X-ray diffraction for the product obtained in Example 1. FIG.
3 is a scanning electron micrograph showing the crystal grain structure of aragonite-based calcium carbonate obtained in Example 2. FIG.
4 is a scanning electron micrograph showing the crystal particle structure of calcium carbonate obtained in Comparative Example 2. FIG.
5 is a graph showing the results of X-ray diffraction for the product obtained in Comparative Example 2. FIG.
Claims (4)
生石灰及び消石灰からなる群から選択される物質から調製された生石灰換算で10〜60重量%の濃度を有する石灰乳と、緑液又はソーダ灰由来の炭酸ナトリウム水溶液を、2つ以上の連続した反応槽の第1番目の反応槽に連続的に導入して20〜105℃の反応温度で苛性化反応を行わせ、該第1番目の反応槽の水酸化ナトリウム濃度が0.5〜2.0mol/l、炭酸ナトリウム濃度が0.25mol/l以下に維持される、上記製造方法。In causticizing process the sodium hydroxide production process using a pulp production process or soda ash by the sulfate process or the soda process, a method for producing by a continuous process of calcium carbonate aragonite crystal system,
A milk of lime having a concentration of 10 to 60% by weight quicklime terms prepared from materials selected from the group consisting of quick lime and hydrated lime, a green liquor or aqueous solution of sodium carbonate derived from soda ash, two or more consecutive reaction A causticizing reaction is carried out at a reaction temperature of 20 to 105 ° C. by continuously introducing into the first reaction tank of the tank, and the sodium hydroxide concentration in the first reaction tank is 0.5 to 2.0. mol / l, sodium carbonate concentration is maintained below 0.25 mol / l, the production method.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001030184A JP4346248B2 (en) | 2001-02-06 | 2001-02-06 | Method for producing aragonite crystalline calcium carbonate |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001030184A JP4346248B2 (en) | 2001-02-06 | 2001-02-06 | Method for producing aragonite crystalline calcium carbonate |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002234725A JP2002234725A (en) | 2002-08-23 |
| JP2002234725A5 JP2002234725A5 (en) | 2006-06-15 |
| JP4346248B2 true JP4346248B2 (en) | 2009-10-21 |
Family
ID=18894432
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001030184A Expired - Fee Related JP4346248B2 (en) | 2001-02-06 | 2001-02-06 | Method for producing aragonite crystalline calcium carbonate |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4346248B2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104695270A (en) * | 2015-02-14 | 2015-06-10 | 浙江理工大学 | Method for controlling silicon in non-wood pulping alkali recovery green liquor low-temperature causticizing process |
| WO2022110127A1 (en) * | 2020-11-27 | 2022-06-02 | 广西华纳新材料科技有限公司 | Method for preparing cube-like nano calcium carbonate |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1321243C (en) * | 2004-07-20 | 2007-06-13 | 上海东升新材料有限公司 | Method for recovering superfine calcium carbonate by clean causticization of green liquor |
| JP4565074B2 (en) * | 2004-09-03 | 2010-10-20 | 地方独立行政法人北海道立総合研究機構 | Chalk |
| JP4813075B2 (en) * | 2005-03-30 | 2011-11-09 | 日本製紙株式会社 | Method for producing aragonite acicular calcium carbonate |
| CN100400719C (en) * | 2005-11-03 | 2008-07-09 | 福建师范大学 | A kind of preparation method of whisker calcium carbonate |
| JP5767556B2 (en) * | 2011-10-18 | 2015-08-19 | 三菱製紙株式会社 | Method for producing calcium carbonate |
| CN103708522A (en) * | 2014-01-03 | 2014-04-09 | 三三环保科技(北京)有限公司 | Causticization method for producing high-quality calcium carbonate by recycling green liquor by alkali |
-
2001
- 2001-02-06 JP JP2001030184A patent/JP4346248B2/en not_active Expired - Fee Related
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104695270A (en) * | 2015-02-14 | 2015-06-10 | 浙江理工大学 | Method for controlling silicon in non-wood pulping alkali recovery green liquor low-temperature causticizing process |
| WO2022110127A1 (en) * | 2020-11-27 | 2022-06-02 | 广西华纳新材料科技有限公司 | Method for preparing cube-like nano calcium carbonate |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002234725A (en) | 2002-08-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6623555B1 (en) | Composite precipitated calcium carbonate/silicon compound pigment and method of making same | |
| US7097819B2 (en) | Method for producing calcium carbonate | |
| JP2010524813A (en) | PCC manufacturing method | |
| JP4346248B2 (en) | Method for producing aragonite crystalline calcium carbonate | |
| EP0953544B1 (en) | Processes for preparing calcium carbonate | |
| JP3874978B2 (en) | Method for producing calcium carbonate and sodium hydroxide | |
| JP4375842B2 (en) | Method for producing calcium carbonate and method for whitening precipitated calcium carbonate from limestone | |
| JP2010077009A (en) | Method for producing calcium carbonate | |
| US6123855A (en) | Dewatering of calcium carbonate | |
| JP4339528B2 (en) | Method for producing calcium carbonate | |
| JP3902718B2 (en) | Method for producing aragonite crystalline calcium carbonate | |
| JP4191943B2 (en) | Method for producing calcium carbonate whisker | |
| JP3872611B2 (en) | Method for producing calcium carbonate | |
| JP4236818B2 (en) | Method for producing calcium carbonate whisker | |
| JP4273561B2 (en) | Method for producing aragonite acicular calcium carbonate | |
| JP4761791B2 (en) | Method for producing whisker-like calcium carbonate | |
| JP2002234725A5 (en) | ||
| JPH10226517A (en) | Production of calcium carbonate | |
| JPH0433730B2 (en) | ||
| JP3872610B2 (en) | Method for producing calcium carbonate | |
| JPH10292283A (en) | Production of calcium carbonate | |
| JP3874958B2 (en) | Method for producing calcium carbonate | |
| JP4813075B2 (en) | Method for producing aragonite acicular calcium carbonate | |
| JP4663816B2 (en) | Method for producing causticized calcium carbonate using burned scallop shell |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060428 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060428 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20081216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090403 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090601 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090615 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090714 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120724 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120724 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150724 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |